Изобретение относится к самоусиливающейся конструкции на основе нуклеиновой кислоты, которая содержит по крайней мере одну регуляторную последовательность, связанную с по крайней мере одним структурным геном и по крайней мере одним геном белка фактора транскрипции.
Несмотря на многочисленные попытки, предпринятые в области генной терапии, полученные к настоящему времени результаты предклинических и клинических исследований показывают, что остаются нерешенными две фундаментальные проблемы. Одна из этих проблем заключается в недостаточной трансгенной экспрессии в клетках-мишенях in vitro или in vivo, связанной с прекращением внутриклеточных процессов. Второй проблемой является неадекватный контроль трансгенной экспресии.
Предпринимая попытки исправления недостатков известных способов, Rivera с сотр. (Nature Med., 2, 1028 (1996)), Belshaw с сотр. (PSNA, США 93, 4604 (1996)) и Но с сотр. (Nature, 382, 822 (1996)) разработали первые методы внешнего контроля трансгенной экспрессии. Такие подходы основаны на добавлении активного соединения, представляющего собой рапамицин, который соединяет две субъединицы друг с другом. Полученный в результате продукт сшивания действует как фактор транскрипции. Первая субъединица представляет собой слитый белок, образовавшийся из ДНК-связывающего белка и FК506-связывающего белка (FKBP), причем такой белок также связывает рапамицин. Вторая субъединица представляет собой слитый белок, образовавшийся из белкового FRAP, который также связан с рапамицином, и активационной последовательности IIFkB белка фактора транскрипции NF-kB.
Функциональный белок фактора транскрипции, полученный сшиванием двух таких субъединиц с помощью рапамицина, в свою очередь активирует последовательность в трансгене, предназначенном для активации структурного гена.
Преимущество такого внешнего подхода состоит в том, что экспрессия структурного гена может включаться или выключаться путем введения или удаления соответственно активного соединения - рапамицина. Однако такой подход не решает проблемы, связанной с неадекватной экспрессией структурного гена. В соответствии с этим остается необходимость в разработке подхода, обеспечивающего повышение трансгенной экспрессии.
Настоящее изобретение удовлетворяет потребности данной области техники, обеспечивая конструкции на основе нуклеиновой кислоты, композиции, содержащие такие конструкции, и способы их применения, направленные на достижение высокой трансгенной экспрессии. В соответствии с изобретением решение такой проблемы достигается введением системы с положительной обратной связью в саму конструкцию на основе нуклеиновой кислоты. Полученная в результате система обозначается в тексте как "самоусиливающаяся экспрессионная система".
В соответствии с одним из воплощений изобретения предлагается конструкция на основе нуклеиновой кислоты, включающая
по крайней мере один первый структурный ген, кодирующий активное соединение;
по крайней мере один второй структурный ген, кодирующий белок фактора транскрипции, и
по крайней мере одну активационную последовательность, состоящую из по крайней мере одной последовательности, которая связывается с белком фактора транскрипции, и по крайней мере одной промоторной последовательности;
причем каждая активационная последовательность активирует экспрессию структурного гена и экспрессию белка фактора транскрипции.
В соответствии с другим воплощением изобретения предусматривается конструкция на основе нуклеиновой кислоты, включающая по крайней мере один первый структурный ген, кодирующий активное соединение, по крайней мере один второй структурный ген, кодирующий белок фактора транскрипции, и по крайней мере одну активационную последовательность, состоящую из по крайней мере одной последовательности, которая связывается с указанным белком фактора транскрипции, и по крайней мере одного модуля фармакологического контроля, который содержит в названном порядке по крайней мере один промотор, по крайней мере один ген слитого белка, кодирующий активационный домен белка фактора транскрипции и кодирующий белок сшивающего вещества, по крайней мере один промотор, по крайней мере один ген слитого белка, кодирующий ДНК-связывающий белок и кодирующий белок второго сшивающего вещества, а также по крайней мере одну активационную последовательность, содержащую сайт для ДНК-связывающего белка, причем каждая активационная последовательность активирует экспрессию структурного гена и экспрессию белка фактора экспрессии.
Согласно еще одному воплощению настоящего изобретения предлагается конструкция на основе нуклеиновой кислоты, которая содержит по крайней мере один первый структурный ген, который кодирует активное соединение, по крайней мере один второй структурный ген, который кодирует по крайней мере один первый слитый белок, содержащий активационный домен белка фактора транскрипции, и последовательность, связывающую сшивающее вещество, по крайней мере один третий структурный ген, кодирующий по крайней мере один второй слитый белок, содержащий белок, который связывает сшивающее вещество и ДНК-связывающий белок, по крайней мере одну активационную последовательность, состоящую из по крайней мере одной последовательности, которая связывает указанный второй слитый белок, сшитый с указанным первым слитым белком, с помощью сшивающего вещества, и по крайней мере одной промоторной последовательности, причем каждая активационная последовательность активирует экспрессию по крайней мере одного из указанных структурных генов.
Другие воплощения могут быть легко поняты специалистом в данной области из прочтения описания и прилагаемой формулы изобретения.
Самоусиливающаяся экспрессионная система
В соответствии с простейшим воплощением новая самоусиливающаяся экспрессионная система содержит следующие компоненты:
a) по крайней мере одну последовательность а) и/или а') для связывания белка фактора транскрипции d),
b) по крайней мере одну промоторную последовательность b) и/или b')
c) по крайней мере один структурный ген с), кодирующий активное соединение, и
d) по крайней мере один ген, кодирующий белок фактора транскрипции а), который связывается компонентом а).
В соответствии с настоящим изобретением компоненты а) и/или а') и b) и/или b') составляют последовательность для активации транскрипции структурного гена с) и для активации экспрессии белка фактора транскрипции d).
В соответствии с предпочтительной формой изобретения компоненты могут быть расположены, как показано на фиг.1.
Связывающие последовательности а) и а') могут быть одинаковыми или различными и они связывают фактор транскрипции d).
Промоторные последовательности [компоненты b) и b')] могут быть различными или одинаковыми. Низкий уровень активации промоторных последовательностей b) и b') приводит к низкому уровню экспрессии структурного гена [компонент с)] и гена белка фактора транскрипции d) [компонент d)]. Полученный таким образом белок фактора транскрипции d) в свою очередь связывается со связывающими последовательностями [компоненты а) и а')]. В свою очередь такое связывание активирует промоторные последовательности b) и b'), вызывая усиленную экспрессию как структурного гена, так и гена белка фактора транскрипции d). Такая усиленная экспрессия дает в результате повышенное количество белка фактора транскрипции d), который функционирует по принципу обратной связи и дополнительно стимулирует такую систему.
В соответствии с настоящим изобретением расположение компонентов, показанное на фиг.1, может быть дополнено (т.е. осуществлено "добавление" на конце в направлении, обратном транскрипции) генами, кодирующими ядерный экспортный сигнал (NES) и ядерный экспортный сигнал (NEF) на 3' конце структурного гена. Экспрессия NEF находится под контролем дополнительного промотора (компонент b'''). Такая дополнительная промоторная последовательность может быть идентичной или отличной от любой части активационных последовательностей [компоненты а) и b') и/или а') и b')], показанных на фиг.2.
Ядерный экспортный сигнал (NES) представляет собой нуклеотидную последовательность, которая препятствует транспорту преинформационной РНК, связанной с ней, через ядерную мембрану. Следовательно, NES сам по себе представляет ядерный сигнал удерживания (NRS). Однако в том случае, когда NRS связывает экспортный белок, обозначенный в тексте как "ядерный фактор экспорта" или "NEF", NRS выполняет функцию NES. Поэтому ядерный фактор экспорта (NEF) опосредует транспорт NES-содержащей преинформационной или информационной РНК из ядра клетки в цитоплазму. Следовательно, NES-содержащая преинформационная или информационная РНК секретируется из ядра клетки в результате его связывания с NEF, как это описано Fisher с сотр., Cell, 82, 475 (1995).
В соответствии с настоящим изобретением компоненты с) и d) также могут быть связаны друг с другом (т.е. "взаимно связаны") с помощью сайта внутреннего входа рибосомы (IRES) вместо соединения с компонентами а') и b'). Такие IRES приводят к экспрессии двух ДНК-последовательностей, которые связаны друг с другом с помощью IRES.
Связывание с помощью IRES может осуществляться, например, так, как показано на фиг.3.
Такое расположение в той же степени гарантирует, что при слабой активации промоторной последовательности ген белка фактора транскрипции [компонент d)] также будет экспрессирован с помощью IRES последовательности. Такая экспрессия осуществляется при экспрессии структурного гена [компонент с)]. Кроме этого, белок фактора транскрипции соединяется со связующей последовательностью а), которая усиливает активацию промоторной последовательности b), усиливает экспрессию структурного гена с) и еще раз через последовательность IRES также усиливает экспрессию гена белка фактора транскрипции d).
Расположение в соответствии с изобретением индивидуальных компонентов, показанное на фиг.1-3, представляет собой самоусиливающуюся экспрессионную систему, которая действует так, как показано на фиг.4. Самоусиливающаяся экспрессионная система может быть расширена связыванием вместе нескольких идентичных или различных последовательностей для структурных генов [компоненты с), с') и с'')]. Такие структурные гены связаны друг с другом с помощью идентичных или различных IRES последовательностей или через связывающую последовательность а), промоторную последовательность b') и промоторную последовательность b''). Пример такого расположения приведен на фиг.5. Самоусиливающаяся экспрессионная система также может быть расширена совместным связыванием нескольких идентичных или различных генов белка фактора транскрипции d) [компоненты d), d') и d'')]. Один из характерных примеров показан на фиг.6, где изображено связывание с помощью IRES последовательностей. Такие IRES последовательности, необязательно, могут быть одинаковыми.
Во всех активационных последовательностях связывающая последовательность а) предпочтительно относится к одному типу последовательностей. Все белки фактора транскрипции d), d') и d'') должны связываться с такой связывающей последовательностью. В том случае когда связывающие последовательности не относятся к одному и тому же типу (например, в том случае, когда компонент а) имеет значение отличное от значения компонента а'), белки фактора транскрипции (компоненты d), d') и d'')) должны связываться со всеми связывающими последовательностями. Предпочтительно активационные последовательности конструируются или отбираются таким образом, что они распознаются всеми продуктами белков фактора транскрипции d), d') и d'').
Тем же способом, что показан на фиг.2, компоненты, изображенные на фиг. 3, могут быть дополнены генами, кодирующими ядерный экспортный сигнал (NES) и ядерный экспортный фактор. Такое расположение с NES геном на 3' конце структурного гена [компонент с)] и NEF-геном показано на фиг.7. В последнем примере NEF активируется отдельно через компонент b'''), представляющий собой дополнительную промоторную последовательность. Последовательность компонента b''' может быть идентичной или неидентичной последовательностям компонентов а) и b).
Фармакологически контролируемый промоторный модуль.
В наипростейшем виде новый фармакологически контролируемый промоторный модуль ("фармакологический контрольный модуль") включает следующие компоненты:
e) по крайней мере одну промоторную последовательность,
f) по крайней мере один ген, кодирующий слитый белок f), который содержит активационный домен белка фактора транскрипции и сшивающее вещество [компонент j)] связывающий белок А,
g) по крайней мере одну дополнительную промоторную последовательность [идентичную или неидентичную компоненту е)] или по крайней мере одну IRES,
h) по крайней мере один ген, кодирующий слитый белок h), который содержит ДНК-связывающий домен и сшивающее вещество [компонент j)] - связывающий белок В,
i) по крайней мере одну активационную последовательность, имеющую сайт связывания слитого протеина h), и
j) по крайней мере одно сшивающее вещество j), которое содержит как сайт А) для связывания белка А в слитом белке f) [продукт экспрессии компонента f)], так и сайт В) для связывания белка В) в слитом белке h) [продукт экспрессии компонента h)].
Компоненты e-i) могут быть расположены, например, в таком порядке, который изображен в схеме, приведенной на фиг.8. Такое расположение обеспечивает экспрессию слитых белков f) и h) [компоненты f) и h)] при активации промоторных последовательностей е) и g). В присутствии сшивающего вещества [компонент j)] два таких слитых белка связываются друг с другом ("взаимно связываются") с образованием функционального белка фактора транскрипции, предназначенного для активации активационной последовательности [компонент i)]. При таком воплощении изобретения промоторный модуль, состоящий из индивидуальных компонентов, функционирует в присутствии такого сшивающего вещества, как компонент j). Такой модуль становится функциональным при добавлении сшивающего вещества компонента j). Пример такого технического решения представлен на фиг.9.
Самоусиливающаяся, фармакологически контролируемая экспрессионная система.
Самоусиливающаяся экспрессионная система может быть объединена фармакологически контролируемым промоторным модулем. Такая комбинация может быть осуществлена, например, путем вставки фармакологически контролируемого промоторного модуля [компоненты e)-i)] в самоусиливающуюся экспрессионную систему (см. фиг.1, 2, 3 или 7) вместо промоторной последовательности [компонент b) и/или b')]. Пример конструкции такой комбинированной нуклеотидной последовательности проиллюстрирован на фиг.10. В таком примере структурный ген транскрибируется лишь в том случае, когда слитые белки f) и h) [продукты экспрессии компонентов f) и h)] связаны с помощью сшивающего вещества компонента j) с образованием белка фактора транскрипции.
С другой стороны, или кроме этого, фармакологически контролируемый промоторный модуль может быть вставлен в самоусиливающуюся экспрессионную систему вместо гена белка фактора транскрипции [компонент d)], последовательности для связывания белка фактора транскрипции а) [компонент а)] и промоторной последовательности b)[компонент b)]. В этом случае сайт связывающего компонента h) должен быть присоединен, по крайней мере, его 5' концом, к одной из промоторных последовательностей е) и g). Пример конструкции такой объединенной нуклеотидной последовательности приведен на фиг.11.
Самоусиливающаяся система может соединяться с фармакологически контролируемым промоторным модулем и другими способами. Так, например, фиг.8 показывает, что промоторная последовательность [компонент b''')] NEF (см. фиг.2 или 7) может быть заменена на фармакологически контролируемый промоторный модуль. Один из путей конструирования нуклеотидной последовательности показан на фиг.12.
Нуклеиново-кислотные конструкции изобретения преимущественно состоят из ДНК. Термин "конструкция на основе нуклеиновой кислоты" обозначает искусственную структуру, содержащую нуклеиновую кислоту, которая может транскрибироваться в клетке-мишени. Конструкцию на основе нуклеиновой кислоты преимущественно вставляют в вектор. В этом контексте особенно желательны плазмидный вектор или вирусный вектор.
В зависимости от выбора промоторной последовательности новая конструкция на основе нуклеиновой кислоты может использоваться для неспецифической экспрессии структурного гена [компонент с)]. С другой стороны, экспрессия дополнительно контролируется специфичностью клетки, специфичностью вируса, конкретными условиями или природой клеточного цикла. Структурный ген предпочтительно кодирует фармакологически активное соединение или энзим, который расщепляет неактивный предшественник лекарства с образованием активного лекарства. Дополнительно структурный ген может быть предназначен для экспрессии энзим-лигандного слитого белка. В этом случае лиганд может быть связан с поверхностью клетки. В этом контексте наиболее предпочтительным является лиганд, связанный с поверхностью пролиферирующей эндотелиальной клетки или опухолевой клетки.
Настоящее изобретение также относится к клеткам, особенно к дрожжам или клеткам млекопитающего, которые содержат новую конструкцию на основе нуклеиновой кислоты. Согласно особенно предпочтительному воплощению конструкцию на основе нуклеиновой кислоты вводят в клеточную линию, которая трансфицирована добавлением или введением сшивающего вещества [компонент j)]. Введение сшивающего вещества стимулирует экспрессию структурного гена. Клетки, содержащие такие конструкции, могут применяться для приготовления фармакологической композиции. Вместе с тем такие клетки также могут быть введены пациенту в качестве терапевтического агента или фармацевтической композиции для лечения болезни. С другой стороны, новая конструкция на основе нуклеиновой кислоты может быть встроена в вектор и непосредственно, местно или парентерально введена пациенту. При применении такая конструкция предназначается для конкретного заболевания, и при этом она экспрессирует один или более белков или нуклеиновую кислоту, которые предотвращают или улучшают один или более симптомов заболевания. Как известно специалисту в данной области, количество конструкции на основе нуклеиновой кислоты, подлежащее применению в данном контексте, определяется посредством пути введения, состоянием пациента и природой заболевания.
В случае непосредственного введения пациенту может быть дополнительно введено сшивающее вещество [компонент j)] с целью экспрессии структурного гена. Сшивающее вещество вызывает образование полного белка фактора транскрипции путем связывания слитого белка f) со слитым белком h) в трансфекцированных клетках, как это показано на фиг.9. Следовательно, трансфицированные клетки экспрессируют структурный ген лишь во время присутствия в организме сшивающего вещества. Длительность и эффективность экспрессии могут контролироваться применением сшивающего вещества.
Предпочтительное применение новой конструкции на основе нуклеиновой кислоты заключается в лечении заболевания с помощью лекарственного средства, основанного на введении конструкции на основе нуклеиновой кислоты в клетку-мишень и экспрессии такой конструкции, осуществляемой неспецифическим, вирус-специфическим или клетка-мишень специфическим, и/или клеточный цикл - специфическим способом, посредством введения сшивающего вещества.
Нуклеиново-кислотные конструкции настоящего изобретения могут использоваться для получения фармацевтической композиции путем синтеза в клетке. В этом контексте клетка трансформируется под действием ДНК-конструкции настоящего изобретения. Затем трансформированные клетки культивируют с целью получения клона клеток, в результате чего создаются множественные копии ДНК-конструкции. Предпочтительно использовать амплификацию гена для увеличения числа копий ДНК-конструкции в каждой клетке. После культивирования трансформированной клетки для получения множественных копий ДНК-конструкции такая ДНК-конструкция может быть очищена из культивируемых клеток. Предпочтительной культивируемой клеткой для получения множественных копий ДНК-конструкции является E.coli. Очищенную ДНК используют в качестве компонента фармацевтической композиции путем смешивания с такими другими веществами, как буфер, соли или другие экципиенты, известные в данной области техники.
Новые конструкции на основе нуклеиновой кислоты не существуют в природе в такой форме, т. е. структурный ген активного соединения, энзима или лиганд/энзим слитого белка, искусственно комбинируют с новыми нуклеиново-кислотными последовательностями с образованием самоусиливающейся экспрессионной системы. Такую систему также искусственно комбинируют с фармакологически контролируемым промоторным модулем.
Предпочтительно структурные гены, которые вводятся в самоусиливающуюся, фармакологически контролируемую экспрессионную систему, кодируют фармакологически активные соединения. Такие активные соединения представляют собой белки и гликопротеины, которые выбирают из группы, состоящей из цитокинов, факторов роста, рецепторных цитокинов или факторов роста, антител или их фрагментов, белков, обладающих антипролиферативным или цитостатическим действием, ингибиторов ангиогенеза, тромбозиндуцирующих белков, ингибиторов коагуляции, белков плазмы крови, комплементактивирующих белков, веществ вирусной и бактериальной оболочек, гормонов, пептидов, оказывающих влияние на кровообращение, нейропептидов, энзимов и медиаторов, а также слитых белков, содержащих по крайней мере два из таких белков или гликопротеинов.
Подробное описание компонентов самоусиливающейся, фармакологически контролируемой экспрессионной системы
1) Активационные последовательности и белки фактора транскрипции для самоусиливающихся экспрессионных систем.
В соответствии с настоящим изобретением белок фактора транскрипции d) [генный продукт компонента d)] специфически связывается с соответствующей связывающей последовательностью а) [компонент а)], которая, со своей стороны, активирует 3'-соседнюю промоторную последовательность b) (или b', либо b'').
Следовательно, компоненты а) и b) составляют активационную последовательность, которая содержит последовательность для связывания соответствующего белка фактора транскрипции d).
С другой стороны, белок фактора транскрипции d) должен содержать связывающий домен, являющийся специфичным в отношении соответствующей связывающей последовательности активаторной последовательности [компонент а)], а также трансактивационный домен. Дополнительный сигнал ядерной локализации (NLS) промотирует взаимодействие с активационной последовательностью а).
Примерами конструкций на основе нуклеиновой кислоты, удовлетворяющих такой предпосылке, являются:
Воплощение А), включающее
1. активационную последовательность, содержащую компонент а), имеющий по крайней мере одну последовательность (например, нуклеотидную последовательность: 5'-CGGACAACTGTT-GACCG-3') для связывания белка Gal4 (Chasman и Kornberg, Mol. Cell. Biol., 10, 2916 (1990)) и, на ее 3'-конце, компонент b), который содержит:
основной промотор SV40
(нуклеиновые кислоты 48-5191; Tooze (изд. ), DNA Tumor Viruses (Cold Spring Harbor, New York, (1980), New-York; Colg Spring Harbor Laboratory),
c-fos-промотор (Das с сотр., Nature, 374, 657 (1995)) и на его 3' конце HSVI VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Treizenberg с сотр., Genes Developm. 2, 718 (1988); Treizenberg, Curr. Opin. Gen. Developm. 5, 190 (1995)),
U2sn РНК-промотор и (на его 3' конце) HSVI VP16 TAD или по крайней мере последовательность активационного домена Oct-2 (аминокислоты 438-479; Tanaka с сотр. , Mol. Cell Biol., 14, 6046 (1994); Das с сотр., Nature, 374, 657 (1995)) или
HSV ТК промотор (Papavassiliou с сотр. , J. Biol. Chem., 265, 9402) (1990); Park с сотр., Molec. Endocrinol., 7, 319 (1993)) или
другой неспецифический, клеточно-специфический, вирус-специфический или клеточный цикл - специфический либо метаболически активируемый промотор,
и
2. ген релевантного белка фактора транскрипции d) [компонент d)], содержащий кДНК ДНК-связывающего домена Са14-белка (аминокислоты 1-147; Chasman & Kornberg, Mol. Cell Biol., 10, 2916 (1990)) к 3' концу которого присоединен ядерный локализационный сигнал SV40 (NLS) (SV40 большой Т; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр., TIBS, 16, 478 (1991)), к 3' концу которого присоединен HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm. , 2, 718, (1988); Triezenberg, Curr. Opin. Gen.Developm., 5, 190 (1995)).
Воплощение В), включающее
1. активационную последовательность, включающую компонент а), содержащий по крайней мере одну последовательность (например, нуклеотидную последовательность 5'-TACTGTATGTACATACAGTA-3') для связывания Lexa белка (Lexa оператор; Brent с сотр., Nature, 612, 312 (1984)) и на ее 3' конце компонент b), который содержит главный промотор SV40 (нуклеиновые кислоты 48-5191; Tooze (ред.), DNA Tumor Viruses (Cold Spring Harbor New York, (1980) New York; Cold Spring Harbor Laboratory) или другой промотор (см. Воплощение А),
и
2. ген присоединенного белка фактора транскрипции d) (компонент d)), содержащий кДНК ДНК-связывающего домена Lexa белка (аминокислоты 1-81; Kim с сотр. , Science, 255, 203 (1992)) или полный Lexa белок (аминокислоты 1-202; Brent с сотр., Cell, 43, 729 (1985)), к 3' концу которого присоединен ядерный локализационный сигнал SV40 (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр., TIBS 16, 478 (1991)), к 3' концу которого присоединены HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm., 2, 718, (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)).
Воплощение С, включающее
1. активационную последовательность, содержащую компонент а), включающий по крайней мере одну lac операторную последовательность (например, нуклеотидную последовательность 5'-GAATTGTGAGCTCACAATTC-3') для связывания lac 1 репрессорного белка (Fuerst с сотр. , PNAS США 86, 2549 (1989); Simons с сотр. , PNAS США 81, 1624 (1984) и на ее 3' конце компонент b), который содержит главный промотор SV40
(нуклеиновые кислоты 48-5191; Tooze (изд. DNA Tumor Viruses (Cold Spring Harbor New York (1980) New York; Cold Spring Harbor Lab.) или другой промотор (см. Воплощение А),
и
2. ген присоединенного белка фактора транскрипции d) (компонент d)), содержащий кДНК lac репрессорного (lac 1) белка (Brown с сотр., Cell 49, 603 (1987); Fuerst с сотр., PNAS США 86, 2549 (1989)), к 3' концу которого присоединен ядерный локализационный сигнал SV40 (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр., TIBS, 16, 478 (1991)), к 3' концу которого присоединены HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm., 2, 718, (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)).
Воплощение D, включающее
1. активационную последовательность, содержащую компонент а), включающий по крайней мере одну тетрациклиновую операторную (tet 0) последовательность (например, нуклеотидную последовательность: 5'-TCGAGTTTACCACTCCCTATCAGTGATAGAGAAAAGTGAAAG-3') для связывания тетрациклинового репрессорного (tet R) белка и на ее 3' конце компонент b), который содержит главный промотор SV40 (нуклеиновые кислоты 48-5191; Tooze (ред.) DNA Tumor Viruses (Cold Spring Harbor New York, (1980) New York, Cold Spring Harbor Lab.) или другой промотор (см. Воплощение А),
и
2. ген присоединенного белка фактора транскрипции d) (компонент d)), содержащий кДНК тетрациклинового репрессорного (tet R) белка (Gossen с сотр. , PNAS США, 89, 5547 (1992); Dingermann с сотр., ЕМВО J., 11, 1487 (1992)) и на его 3'-конце сигнал ядерной локализации SV40 (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр. , TIBS, 16, 478 (1991)) и на его 3' конце HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm., 2, 718, (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)).
Воплощение Е, включающее
1. активационную последовательность, содержащую компонент а), содержащий по крайней мере одну последовательность (например, нуклеотидную последовательность 5'-TAATGAT(GGGCG-3') для связывания ZFHD-1 белка (Pomerantz с сотр. , Science, 267, 93 (1995)) и на ее 3'-конце компонент b), который содержит главный промотор SV40
(нуклеиновые кислоты 48-5191; Tooze (ред.) DNA Tumor Viruses (Cold Spring Harbor New York, (1980) New York, Cold Spring Harbor Lab.) или другой промотор (см. Воплощение А),
и
2. ген присоединенного белка фактора транскрипции d) (компонент d)), содержащий кДНК ZFHDI-белка (Pomerantz с сотр., Science, 267, 93 (1995)) и на его 3' конце ядерный локализационный сигнал SV40 (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр., TIBS, 16, 478 (1991)) и на его 3' окончании HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm., 2, 718, (1988); Triezenberg, Curr. Opin.Gen.Developm., 5, 190 (1995)).
2) Фармакологически контролируемые промоторные модули
В соответствии с настоящим изобретением следующие гены являются специфическими компонентами фармакологически контролируемых промоторных модулей (см. также фиг.8 и 9):
для слитого белка f) [компонент f)]
- ген активационного домена белка фактора транскрипции и
- по крайней мере один ген белка А, который связывает сшивающее вещество j) при необходимости,
- дополненный сигналом ядерной локализации (NLS)
для слитого белка h) [компонент h)]:
- по крайней мере один ген белка В, который связывает сшивающее вещество j) и
- ген белка, который связывается с ДНК активационной последовательности [компонент i)]
для сшивающего вещества
- компонент j), имеющий по крайней мере один сайт для связывания белка А и для связывания белка В
и активационную последовательность, содержащую сайт для связывания слитого белка h) [компонент h)] и промоторный элемент
для компонента i).
Выбор сшивающего вещества [компонент j)] неизбежно определяет природу компонент j) - связывающих белков А и В в компонентах f) и h) соответственно. В таком контексте компонент j)-связывающие белки А и В в компонентах f) и h) могут быть одинаковыми или различными. Идентичные компонент j) - связывающие белки А и В могут использоваться, главным образом, в том случае, когда сшивающее вещество [компонент j)] обладает несколькими идентичными связывающими сайгами. Однако в соответствии с настоящим изобретением неидентичные компонент j)- связывающие белки А и В являются предпочтительными в компонентах f) и h).
Это означает, что сшивающее вещество [компонент j)] связано слитым белком f) [компонент f)] на сайте, который отличен от сайта, на котором это вещество связано слитым белком h) [компонент h)], в результате чего слитые белки f) и h) не конкурируют друг с другом за связывание со сшивающим веществом.
Могут использоваться такие сшивающие вещества, которые, как уже известно, способны связываться с конкретными клеточными белками, гены которых могут использоваться в компонентах f) и h) фармакологически контролируемого промотора.
Однако настоящее изобретение, в частности, также относится к использованию моноклональных антител, а также их производных - рекомбинантных антител или их фрагментов, которые связываются с сшивающим соединением j). Вставка моноклональных антител, особенно их рекомбинантных Fv фрагментов, в слитые белки f) и h) [компоненты f) и h)] представляет собой особый отличительный признак настоящего изобретения. В этом контексте рекомбинантные Fv фрагменты, которые распознают различные сайты связывания (эпитопы А и В-связывающих сайтов соответственно) на сшивающем веществе [компонент j)] особенно предпочтительны для использования в литых белках [компоненты f) и h)].
В соответствии с настоящим изобретением могут использоваться как мышиные, так и человеческие моноклональные антитела. Мышиные моноклональные антитела предпочтительно используются в гуманизированной форме. Гуманизация осуществляется в соответствии со способом, описанным Winter с сотр., (Nature, 349, 293 (1991)) и Hoogenbooms с сотр., (Rev. Tr. Transfus. Hemobiol., 36, 19 (1993)).
Фрагменты антител получают в соответствии с уровнем техники, например с помощью способа, описанного Winter с сотр., Nature, 349, 293 (1991); Hoogenbooms с сотр., Rev. Tr. Transfus. Hemobiol., 36, 19 (1993); Girol, Mol.Immunol., 28, 1379 (1991) и Huston с сотр., Int. Rev. Immunol., 3_0, 195 (1993).
Фрагменты рекомбинантных антител получают непосредственно из существующих гибридом или выделяют из библиотек фрагментов мышиных или человеческих антител (Winter с сотр., Annu. Rev. Immunol., 12, 433 (1994)) с использованием фаг-идентификационной технологии (Smith, Science, 228, 1315 (1985)). Затем такие фрагменты антител используют непосредственно на генетическом уровне для слияния с другими белками или пептидами (с активационным доменом белка фактора транскрипции (компонент f) или с ДНК-связывающим белком (компонент h)).
Для получения фрагментов рекомбинантного антитела из гибридом генетическую информацию, которая кодирует антиген-связывающие домены (VH и VL) антител получали путем выделения мРНК, обратной транскрипции РНК в кДНК и последующей амплификации кДНК с помощью полимеразной цепной реакции (Saiki с сотр., Science, 230, 1350 (1985)) с использованием олигонуклеотидов, являющихся комплементарными к 5' и 3' концам соответственно вариабельных фрагментов (Orlandi с сотр., PNAS-США 86, 3833 (1989). VH и VL-фрагменты затем клонировали в векторы бактериальной экспрессии, например, в виде Fv-фрагментов (Skerra и  , Science, 240, 1038 (1988), одно-цепочечных Fv-фрагментов (scFv) (Bird с сотр. Science, 242, 423 (1988); Huston с сотр., PNAS-США 85, 5879 (1988) или Fab-фрагментов (Better с сотр., Science, 240, 1041 (1988)).
, Science, 240, 1038 (1988), одно-цепочечных Fv-фрагментов (scFv) (Bird с сотр. Science, 242, 423 (1988); Huston с сотр., PNAS-США 85, 5879 (1988) или Fab-фрагментов (Better с сотр., Science, 240, 1041 (1988)).
Новые фрагменты антител могут быть также выделены непосредственно из библиотек антител (иммунные библиотеки или простые библиотеки) мышиного или человеческого происхождения с использованием фаг-индикационной технологии. В фаговой индикации фрагментов антител, антигенсвязывающие домены подвергают клонированию либо в фаговый геном (McCafferty с сотр., Nature, 348, 522 (1990)), или в фагмидные векторы (Breitling с сотр., Gene, 104, 147 (1991)), в виде scFv фрагментов (McCafferty с сотр., Nature, 348, 522 (1990)), или Fab-фрагментов (Hoogenboom с сотр., Nucl. Acid Res., 19, 4133 (1991); Barbas с сотр., PNAS США 88, 7978 (1991)) как слитые белки совместно с g3P оболочечным белком нитчатых бактериофагов. Антигенсвязывающие фаги подвергали селекции на пластиковых подложках с загруженным антигеном (отмывка) (Marks с сотр. , J. Mol. Biol., 22, 581 (1991)), на парамагнитных гранулах с конъюгированным антигеном (Hawkins с сотр., J. Мо1. Biol., 226, 889 (1992)) или путем связывания с поверхностью клеток (Marks с сотр., Bio/Technol., 11, 1145 (1993)).
Иммунные библиотеки готовили PCR-амплификацией вариабельных фрагментов антител из В лимфоцитов иммунизированных животных (Sastry с сотр., PNAS-США 86, 5728 (1989); Ward с сотр., Nature, 341, 544 (1989); Clackson с сотр., Nature, 352, 624 (1991)) или пациентов (Mullinax с сотр., PNAS-США 87, 8095 (1990); Barbas с сотр., PNAS-США 88, 7978 (1991). Для этой цели использовали комбинации олигонуклеотидов, специфичных к мышиным (Orlandi с сотр., PNAS-США 86, 3833 (1989); Sastry с сотр., PNAS-США 86, 5728 (1989)) или человеческим иммуноглобулиновым генам (Larrick с сотр., BBRC, 160, 1250 (1989)), или специфичным к семействам человеческих иммуноглобулиновых генов (Marks с сотр., Eur. J. Immunol., 21, 985 (1991)).
Простые библиотеки могут быть приготовлены с использованием неиммунизированных доноров в качестве источника иммуноглобулиновых генов (Marks с сотр. , J. Мо1. Biol., 222, 581 (1991)). С другой стороны, гены иммуноглобулиновой зародышевой линии могут использоваться для получения полусинтетических спектров антител, причем гипервариабельный участок 3 вариабельных фрагментов амплифицируют с помощью PCR с использованием вырожденных праймеров (Hoogenboom и Winter, J. Mol. Biol., 227, 381 (1992); Barbas с сотр., PNAS-США 89, 4457 (1992); Nissim с сотр., ЕМВО J., 13, 692 (1994); Griffiths с сотр. , ЕМВО J., 13, 3245 (1994)). По сравнению с иммунными библиотеками так называемые "однососудные" (single-pot) библиотеки обладают тем преимуществом, что фрагменты антител против большого числа антигенов могут быть выделены из одной единственной библиотеки Nissim с сотр., ЕМВО J., 13, 692 (1994).
Аффинность фрагментов антител может быть дополнительно повышена с использованием фаг-индикационной технологии, с помощью новых библиотек, полученных из фрагментов предсуществующих антител с помощью неспецифического (Hawkins с сотр., J. Mol. Biol., 226, 889 (1992); Gram с сотр., PNAS-США 89, 3576 (1992)), основанного на кодонах (Glaser с сотр., J. Immunol., 149, 3903 (1992)) или сайтнаправленного мутагенеза (Balint & Larrick, Gene, 137, 109 (1993), путем перестановки цепей индивидуальных доменов и цепей фрагментов из нативных наборов (Marks с сотр., Bio/Technol., 10, 779 (1992)) или путем использования бактериальных мутаторных штаммов (Low с сотр., J. Mol. Biol., 260, 359 (1996)) и выделения фрагментов антител, обладающих улучшенными свойствами путем повторной селекции в строгих условиях (Hawkins с сотр., J. Mol. Biol., 226, 889 (1992)). Кроме этого, фрагменты мышиного антитела могут быть гуманизированы путем ступенчатой замены одного из вариабельных доменов на человеческий набор и последующей селекции с использованием оригинального антигена (управляемая селекция) (Jespers с сотр., Bio/Technol., 12, 889 (1994)). С другой стороны, мышиные антитела гуманизируют путем специфической замены гипервариабельных участков человеческих антител на соответствующие участки мышиного антитела (Jones с сотр., Nature, 321, 522 (1987)).
Таким образом, в рамках настоящего изобретения сшивающие вещества по существу охватывают все вещества, которые способны проникать в клетку. В соответствии с настоящим изобретением особое предпочтение отдается тем сшивающим веществам, которые уже использовались в качестве фармацевтических агентов независимо от генной терапии. Так, например, такие сшивающие вещества включают следующие сшивающие вещества (компонент j)) совместно с присоединенными белками, которые связываются с конкретным сшивающим веществом и гены которых подлежат вставке в компоненты f) и h) с целью экспрессии слитых белков f) и h) соответственно:
Сшивающее вещество: рапамицин или такие аналоги рапамицина, как L 685818 (Becker с сотр., J. Biol. Chem., 268, 11335 (1993)), совместно со следующими связывающими белками (и их генами);
- FК506-связывающий белок (FKBP; Bierer с сотр., Ргос. Natl. Acad. Sci, 87, 9231 (1990))
- FKBP/рапамицин-ассоциированный белок, который связывается с комплексом рапамицин/FKBP или его неполная последовательность, которая связывается с комплексом рапамицин/FKBP (FRAP; Brown с сотр., Nature, 369, 756 (1994); Chiu с сотр., Ргос. Natl. Acad. Sci. USA, 91, 12574 (1994); Sabatini с сотр. , Cell, 78, 35 (1994); Sabers с сотр., J. Biol. Chem., 270, 815 (1995)).
Вместо использования генов FKBP и FRAP, можно использовать гены рекомбинантного Fv-фрагмента, который связывается с рапамицином и/или ингибирует связывание FKBP или FRAP с рапамицином.
Сшивающее вещество: димеры (FK1012) FK506 (Spencer с сотр., Science, 262, 1019 (1993); Pruschy с сотр., Chem. Biol., 1, 163 (1994)) вместе со следующими связывающими белками (и их генами):
- ГК506-связывающий белок (FKBP, см. выше);
- калцинейрин (Lin с сотр. , Cell, 66, 807 (1991)) или его неполная последовательность, которая связывается с FK506 комплексом (Clipstone с сотр., J.Biol. Chem., 269, 26431 (1994)); и
- ген рекомбинантного Fv-фрагмента, который ингибирует связывание FK506 с калцинейрином (Но с сотр., Nature, 382, 822 (1996) и может быть вставлен вместо калцинейринового гена.
Сшивающее вещество: димеры циклоспорина А (Belshaw с сотр., Proc. Natl. Acad. Sci. USA, 93, 4604 (1996)) вместе со следующими связывающими белками и их генами:
- циклофилин ((Belshaw с сотр., Proc. Natl. Acad. Sci. USA, 93, 4604 (1996))
- кальцинейрин или его неполная последовательность, которая связывается с комплексом циклоспорин А/циклофилин (см. выше); и
- ген рекомбинантного Fv-фрагмента, который ингибирует связывание циклоспорина А с циклофилином и может быть вставлен вместо гена для циклофилина.
Сшивающее вещество: мономеры циклоспорина А вместе со следующими связывающими белками (и их генами):
- циклофилин
- ген рекомбинантного Fv-фрагмента, который связывается с циклоспорином А в комплексе циклофилин/циклоспорин A (Cacalano с сотр., Molec. Immunol., 29, 107 (1992));
- в качестве альтернативы циклофилину можно использовать гены различных рекомбинантных Fv-фрагментов, которые связываются с различными эпитопами циклоспорина A (Vix с сотр., Proteins, 15, 339 (1993); (Cacalano с сотр., Molec. Immunol. , 29, 107 (1992); Rauffer с сотр., Molec. Immunol., 31, 913 (1994)).
Сшивающее вещество: метотрексат совместно со следующими связывающими белками (и их генами):
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против метотрексата (Pimm с сотр., Brit. J. Cancer, 61, 508 (1990); Kato с сотр., J. Immunol. Methods, 67, 321 (1984));
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против пептидной группы (Cot с сотр., Hybridoma, 6, 87 (1987));
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против бензольной группы (Cot с сотр., Hybridoma, 6, 87 (1987));
и
- дигидрофосфолатредуктаза (Masters с сотр., Gene, 21, 59 (1983); Swift с сотр. , Mol. Gen. Genetics, 181, 441 (1981); Goldsmith с сотр., Mol. Cell Biol., 6, 878 (1986)).
Сшивающее вещество: гентамицин совместно со следующими связывающими белками (и их генами):
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против гентамицина (Sierra-Madero с сотр., J. Clin. Microbiol., 26, 1904 (1988)).
Сшивающее вещество: цефтазидим совместно со следующими связывающими белками (и их генами):
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против цефтазидима (Shimizu с сотр., Int. Arch. Allergy Immunol., 98, 392 (1992). - Сшивающее вещество: цефалексин совместно со следующими связывающими белками (и их генами):
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против ацильной боковой цепи в С7-положении цефема (Nagakura с сотр., Int. Arch. Allergy Applied Immunol., 93, 126 (1990)).
Сшивающее вещество: фолиевая кислота совместно со следующими связывающими белками (и их генами):
- белок, связывающий фолиевую кислоту (Ratnam с сотр., Biochem., 28, 8249 (1989); Elwood, J.Biol. Chem., 264, 14893 (1989); Sadasivan с сотр., Biochem. Biophys. Acta., 1131, 91 (1992))
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против фолиевой кислоты (Rayburn с сотр., Clin. Chem., 30, 1007 (1984).
Сшивающее вещество: ретиноевая кислота совместно со следующими связывающими белками (и их генами):
- связывающий ретиноевую кислоту домен клеточного белка, связывающего ретиноевую кислоту (Stoner с сотр., Cancer Res., 49, 1497 (1989); Eller с сотр., Clin. Res., 39, 560A (1991); и
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против ретиноевой кислоты (Twal с сотр., Developm. Biol., 168, 225 (1995); Zhou с сотр., J. Immunol. Methods, 138, 211 (1991)).
Сшивающее вещество: пенициллин совместно со следующими связывающими белками (и их генами):
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против амоксициллина (Мауоrgа с сотр., Toxicol, 97, 225 (1995); Мауогда с сотр., Int. Arch. Allergy Applied Immunol., 99, 443 (1992));
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против бензилпенициллоильной группы (de Haan с сотр., Int. Arch. Allergy Applied Immunol. , 76, 42 (1985); Fukushima с сотр., Clin. Exp. Immun., 68, 427 (1987));
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против пенициллина (Sierra-Madero с сотр., J. Clin. Microbiol., 26, 1904 (1988); и
- пенициллинсвязывающий белок (Popham с сотр., J. Bacteriol., 177, 326 (1995); J. Bacteriol., 176, 7197 (1994)).
Сшивающее вещество: 4-гидрокситамоксифен или тамоксифен совместно со следующими связывающими белками (и их генами):
- эстрогенсвязывающий домен эстрогенового рецепторного белка (Spreafico с сотр. , Eur. J. Pharmocol., 227, 353 (1992); Green с сотр., Nature, 320, 134 (1986)); и
- антитела или фрагменты антител (рекомбинантные Fv-фрагменты) против комплекса эстрогеновый рецептор/эстроген или 4-гидрокситамоксифен (Giambiagi с сотр. , J. Steroid Biochem., 30, 213 (1988); Biochim. Biophys. Acta, 883, 559 (1986); Katzenellenbogen с сотр. , Biochem., 26, 2364 (1987); Tate с сотр., Breast Cancer Res. Treatm., 3, 267 (1983)).
Сшивающее вещество: тетрациклин совместно со следующими связывающими белками (и их генами):
- белок-репрессор тетрациклина (Gossen с сотр. , PNAS USA, 89, 5547 (1992)); и
- антитела и фрагменты антител против тетрациклина.
Сшивающее вещество: конъюгат тетрациклина и изопропил-β-D-тиогалактозида совместно со следующими связывающими белками (и их генами):
- белок-репрессор тетрациклина (Gossen с сотр. , PNAS USA, 89, 5547 (1992)); и
- lac репрессорный (lac 1) белок (Brow с сотр., Cell, 49, 603 (1987)).
В соответствии с настоящим изобретением гены сшивающего вещества [компонент j)] - связывающих белков А и В соединены - в слитом белке f) [компонент f)], белок А/, с геном активационного домена белка фактора транскрипции, и
- в слитом белке h) [компонент h)], белок BV, с геном ДНК-связывающего белка, причем такой ДНК-связывающий белок выбирают таким образом, чтобы он специфически связывался с активационной последовательностью [компонент i)] (см. фиг. 8 и 9). В данном контексте фраза "встречающийся в природе белок" обозначает белок, обнаруженный в природных условиях. Так, связывающий домен из "встречающегося в природе белка" отличается от связывающего домена, сконструированного человеком. Встречающийся в природе белок обнаружен и выделен из естественной среды. Информация последовательности нуклеиновой кислоты для "связывающегося домена" может использоваться отдельно или совместно с информацией другой последовательности с образованием связывающего домена из встречающегося в природе белка.
В соответствии с настоящим изобретением следующие объекты могут использоваться, например, в качестве нуклеотидной последовательности для активационного домена в компоненте f):
- трансактивационный домен герпесного вируса VP16 (Greaves с сотр., J. Virol., 64, 2716 (1990); 65, 6705 (1991);
- р65 субъединица белка фактора транскрипции NF-xB (Schmitz с сотр., ЕМВО J., 10, 3805 (1991); и
богатый глутамином N-концевой домен Oct-2, который непосредственно или косвенно (например, с помощью Gal4-связывающего белка) связан с богатым пролином С-концевым доменом Oct-2 (Tanaka с сотр., Mol. Cell Biol., 14, 6046 (1994)).
Следующие объекты могут, например, использоваться в качестве нуклеотидной последовательности ДНК-связывающего белка в слитом белке h) [компонент h)] и в качестве присоединенной активационной последовательности [компонент i)]:
Воплощение F), включающее
1. нуклеотидную последовательность ДНК-связывающего белка в слитом белке h), содержащую:
- кДНК ДНК-связывающего домена Gal 4 белка (аминокислоты 1-147; Chasman и Kornberg, Mol. Cell Biol., 10, 2916 (1990)) и на ее 3'-конце SV40 ядерный локализационный сигнал (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр. , TIBS, 36, 478 (1991)), и на ее 3'-конце HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm., 7, 718, (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)).
и
2. присоединенную активационную последовательность [компонент i)] , включающую
- по крайней мере одну последовательность (например, нуклеотидную последовательность: 5'-CGGACAACTGTTCACCG-3') для связывания Gal4 белка (Chasman и Kornberg, Mol. Cell. Biol., 10, 2916 (1990)) и на ее 3'-конце
- главный промотор SV40 (нуклеиновые кислоты 48-5191; Tooze (ред.), DNA Tumor Viruses (Cold Spring Harbor New York, New-York; Colg Spring Harbor Laboratory), или
- c-fos-промотор (Das с сотр., Nature, 374, 657 (1995)) и на его 3'-конце HSVI VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр. , Genes Development, 2, 718 (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)), или
- U2sn РНК-промотор и на его 3'-конце HSVI VP16 TAD или по крайней мере последовательность Oct-2 активационного домена (аминокислоты 438-479; Tanaka с сотр. , Mol. Cell Biol., 14, 6046 (1994); Das с сотр., Nature, 374, 657 (1995)) или
- HSV ТК промотор (Papavassiliou с сотр., J. Biol. Сhem., 265, 9402, (1990); Park с сотр., Molec. Endocrinol., 7, 319 (1993)) или
- любой другой промотор, который способен активироваться неспецифически, клеточно-специфически, вирус-специфически и/или клеточный цикл - специфически.
Воплощение G), включающее
1. нуклеотидную последовательность ДНК-связывающего белка в слитом белке h), содержащую:
- кДНК ДНК-связывающего домена LexA белка (аминокислоты 1-81; Kim с сотр. , Science, 255, 203 (1992)) или полный LexA белок А (аминокислоты 1-202; Brent с сотр., Cell, 43., 729 (1985)) и на ее 3' конце ядерный локализационный сигнал SV40 (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр., TIBS U), 478 (1991)), и, на его 3' конце, HSV-1 VP16 кислые трансактивационные домены (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm., 2, 718, (1988); Triezenberg, Curr. Opin.Gen. Developm., 5, 190 (1995))
и
2. присоединенную активационную последовательность [компонент i)]:
- последовательность (например, нуклеотидная последовательность 5'-TACTGTATGTACATACAGTA-3') для связывания LexA белка (LexA оператор; Brent с сотр. , Nature, 612, 312 (1984)), к 3' концу которой присоединен главный промотор SV40 (нуклеиновые кислоты 48-5191; Tooze (ред.), ДНКового опухолевого вируса (Cold Spring Harbor New York (1980) New York; Cold Spring Harbor Laboratory) или другой промотор (см. Воплощение F).
Воплощение H), включающее
1. нуклеотидную последовательность для ДНК-связывающего белка в слитом белке h), содержащую
- кДНК lac репрессорного (lac 1) белка (Brown с сотр., Cell, 49, 603 (1987); Fuerst с сотр., PNAS США 86, 2549 (1989)) и на ее 3'-конце ядерный локализационный сигнал SV40 (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр., TIBS 16, 478 (1991)) и на ее 3'-конце HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр. , Genes Developm., 7, 718, (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)),
и
2. присоединенную активационную последовательность [компонент i)]
- содержащую по крайней мере lac операторную последовательность (например, нуклеотидную последовательность 5'-GAATTGTGAGCGCTCACAATTC-3') для связывания lac 1 репрессорного белка (Fuerst с сотр., PNAS США 86, 2549 (1989); Simons с сотр., PNAS США 81, 1624 (1984) и на ее 3'-конце главный промотор SV40 (нуклеиновые кислоты 48-5191; Tooze (ред.) DNA Tumor Viruses (Cold Spring Harbor New York N.Y.; Cold Spring Harbor Laboratory) или другой промотор (см. Воплощение F).
Воплощение I), включающее
1. нуклеотидную последовательность ДНК-связывающего белка в слитом белке h), содержащую
- кДНК тетрациклинового репрессорного (tet R) белка (Gossen с сотр., PNAS США, 89, 5547 (1992); Dingermann с сотр., ЕМВО J., 11, 1487 (1992)) и на ее 3'-конце ядерный локализационный сигнал SV40 (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр., TIBS 16, 478 (1991)) и на его 3'-конце HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 405-488; Triezenberg с сотр., Genes Developm., 2, 718, (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)),
и
2. присоединенную активационную последовательность [компонент i)]
- содержащую по крайней мере тетрациклиновую операторную (tet 0) последовательность (например, нуклеотидную последовательность: 5'-TCGAGTTTACCACTCCCTATCAGTGATAGAGAAAAGTGAAAG-3') для связывания тетрациклинового репрессорного (tet R) белка и на ее 3' конце главный промотор SV40 (нуклеиновые кислоты 48-5191; Tooze (ред.) DNA Tumor Viruses (Cold Spring Harbor New York (1980) New York; Cold Spring Harbor Laboratory) или другой промотор (см. Воплощение F).
Воплощение J), включающее
1. нуклеотидную последовательность ДНК-связывающего белка в слитом белке h), содержащую
- кДНК ZFHDI-белка (Pomerantz с сотр., Science, 267, 93 (1995)) и на ее 3'-конце ядерный локализационный сигнал SV40 (NLS) (большой Т SV40; аминокислоты 126-132: например, PKKKRKV; Dingwall с сотр., TIBS 16, 478 (1991)) и на его 3'-окончании HSV-1 VP16 кислый трансактивационный домен (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm., 2, 718, (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)),
и
2. присоединенную активационную последовательность [компонент i)], содержащую
- по крайней мере одну последовательность (например, нуклеотидную последовательность 5'-TAATGATGGGCG-3') для связывания ZFHD-1 белка (Pomerantz с сотр. , Science, 267, 93 (1995)) и на ее 3' конце главный промотор SV40 (нуклеиновые кислоты 48-5191; Tooze (ред.), DNA Tumor Viruses (Cold Spring Harbor New York, New York; Cold Spring Harbor Laborat.) или другой промотор (см. Воплощение F).
3) Промоторные последовательности
В соответствии с настоящим изобретением нуклеотидные последовательности, которые после связывания с белками фактора транскрипции активируют транскрипцию структурного гена, который находится в соседнем положении на 3'-конце, используют в качестве промоторных последовательностей [компоненты b), е), g) и i)]. Выбор промоторных последовательностей зависит от природы заболевания, подвергаемого лечению, и типа клетки-мишени, подвергаемой трансдукции. Таким образом, промоторная последовательность может активироваться способом без ограничений, способом, специфичным к клетке-мишени, в конкретных метаболических условиях, способом, специфичным к клеточному циклу или вирус-специфичным образом. Кроме этого, в компонентах b), е) и/или g) и в компоненте i) могут использоваться одинаковые или различные промоторные последовательности. Примерами таких промоторных последовательностей помимо промоторных последовательностей, уже упомянутых в Воплощениях A)-J), являются промоторы и активаторные последовательности, которые могут активироваться способом без ограничений
- промотор РНК полимеразы III
- промотор РНК полимеразы II
- CMV-промотор и CMV-энхансер
- промотор SV40
такие вирусные промоторные последовательности и активаторные последовательности, как
- HBV
- HCV
- HSV
- HPV
- EBV
- HTLV
- HIV
При использовании HIV-промотора в качестве вирус-специфичного промотора применяют полную LTR последовательность, включающую TAR последовательность (положение ≤-453 до ≥+80, Rosen с сотр., Cell, 41, 813 (1985).
Промоторные последовательности или энхансерные последовательности, способные к метаболической активации, например энхансер или промоториндуцируемые гипоксией.
Промоторы, способные активироваться способом, специфичным к клеточному циклу, например cdc25C генный промотор, промотор гена циклина A, cdc2 генный промотор, B-myb генный промотор, DHFR генный промотор или E2F-I промотор, или другие связывающие последовательности для белков фактора транскрипции, которые возникают или активируются в ходе клеточной пролиферации. Такие связывающие последовательности включают, например, связывающие последовательности для с-mус-белков. Такие связывающие последовательности включают также мономеры или мультимеры нуклеотидной последовательности, обозначаемой как myc E бокс, например [5'-GGAAGCAGACCACGTGGTCTGCTTCC-3', Blackwood и Eisenmann, Science, 251, 1211 (1991)].
Промоторы, способные активироваться тетрациклином, например тетрациклиновый оператор в комбинации с соответствующим репрессором.
Химерные промоторы.
Химерный промотор представляет собой комбинацию активаторной последовательности в направлении, обратном транскрипции, которая способна к клеточно-специфической, метаболически- или вирус-специфической активации под действием промоторного модуля в направлении транскрипции, который способен связываться с белками фактора транскрипции CDF и СНF или E2F и СНF семейств и вследствие этого способен ингибировать активацию активаторной последовательности, расположенной в направлении, обратном транскрипции, в GO и G1 фазах клеточного цикла.
Гибридные промоторы, например, в такой форме, в которой ТАТА-бокс промотора является мутированным, причем такая мутация компенсируется соответствующей мутацией а гене ТАТА-связывающего белка, а такой ТАТА-связующий белок находится под контролем дополнительного промотора.
Промоторы, способные активироваться клеточно-специфическим способом.
Такие промоторы предпочтительно включают промоторы или активаторные последовательности генов, которые предпочтительно кодируют белки в выбранных клетках.
Так, например, в соответствии с настоящим изобретением предпочтительно используются промоторы для следующих белков в следующих клетках:
Промоторные последовательности или активаторные последовательности, которые активируются в эндотелиальных клетках:
- мозг-специфической, эндотелиальной глюкозы-1-переносчик
- эндоглин
- VEGF рецептор I (flt-1)
- VEGF рецептор 2 (flt-1, KDR)
- til-1 или til-2
- В61 рецептор (Eck рецептор)
- В61
- эндотелин, особенно
- эндотелин В
- эндотелин-1
- эндотелиновые рецепторы, особенно рецептор эндотелина В
- IL-1α, IL-1β
- IL-1 рецептор
- фактор адгезии клетки сосуда (VCAM-1)
- синтетические активаторные последовательности
В качестве альтернативы природным эндотелиально-специфическим промоторам можно также использовать синтетические активаторные последовательности, которые содержат олигомеризованные связывающие сайты для белков фактора транскрипции, являющихся преимущественно или селективно активными в эндотелиальных клетках. Примером таких белков фактора транскрипции может служить белок фактора транскрипции GATA-2, сайт связывания которого в гене эндотелина-1 представляет собой, например, 5'-ТТАТСТ-3'.
Промоторы или активаторные последовательности, которые активируются в клетках вблизи от активированных эндотелиальных клеток
- VEGF
- Ген-регуляторные последовательности для VEGF гена представляют собой
- 5' фланкирующую область, или
- 3' фланкирующую область, или
- c-Src ген, или
- v-Scr ген
- Рецепторы стероидных гормонов и их промоторные элементы (Truss и Beato, Endocr. Rev., 14, 459 (1993)), особенно промотор вируса опухоли молочной железы мышей
Промоторы или активаторные последовательности, которые активируются в мышечных клетках, особенно в клетках гладкой мышцы
- тропомиозин
- α-актин
- α-миозин
- рецептор для PDGF
- рецептор для FGF
- MRF-4
- фосфофруктокиназа А
- фосфоглицератмутаза
- тропонин С
- миогенин
- рецепторы для эндотелия А
- десмин
- VEGF
Ген-регуляторные последовательности для VEGF гена уже перечислялись в разделе "Промоторы, которые активируются в клетках вблизи от активированных эндотелиальных клеток" (см. выше).
- "Искусственные" промоторы
Имеются сообщения о том, что факторы семейства спираль-петля-спираль (HLH) (MyoD, Myf-5, миогены и MRF4) являются активаторами мышечно-специфической транскрипции. Активаторы мышечно-специфической транскрипции также включают цинковый фингер-белок GATA-4 и группы фактора транскрипции MEF.
HLH белки, а также GATA-4 демонстрируют мышечно-специфическую транскрипцию не только в присутствии промоторов мышечно-специфических генов, но и в гетерологическом контексте, что справедливо также и в отношении искусственных промоторов. Примерами таких искусственных промоторов являются:
- множественные копии ДНК-сайта для связывания мышечно-специфических HLH белков, таких как Е-бокс (Myo D) (например, 4xAGCAGGTGTTGGGAGGC)
- множественные копии ДНК-сайта для связывания GATA-4 генов тяжелой цепи α-миозина (например, 5'-GGCCGATGGGCAGATAGAGGGGGCCGATGGGCAGATAGAGG3')
Промоторы и активаторные последовательности, которые активируются в глиоцитах. Они, главным образом, включают ген-регуляторные последовательности или элементы соответственно из генов, которые, например, кодируют следующие белки:
- Schwann клеточно-специфический белковый периаксин
- глутаминсинтетазу
- глиоцит-специфический белок
(глиальный фибриллярный кислый белок = GFAP)
- глиоцитный белок S100b
- IL-6 (CNTF)
- 5-НТ рецепторы
- TNFα
- IL-10
- рецептор I и II инсулино-подобного фактора роста
- VEGF
Ген-регуляторные последовательности VEGF-гена уже были перечислены выше.
Промоторы и активаторные последовательности, которые активируются в кроветворных клетках.
Такие ген-регуляторные последовательности включают промоторные последовательности генов цитокина или его рецептора и такие гены экспрессируют в кроветворных клетках или в таких соседних клетках, как строма.
Такие последовательности включают промоторные последовательности, например, следующих цитокинов и их рецепторов:
- рецептор стволового клеточного фактора
- стволовой клеточный фактор
- IL-Iα
- IL-I рецептор
- IL-3
- IL-3 рецептор (α-субъединица)
- IL-3 рецептор (β-субъединица)
- IL-6
- IL-6 рецептор
- GM-CSF
- GM-CSF рецептор (α-цепь)
- регуляторный фактор 1 интерферона (IRF-I)
Промотор IRF-I активируется с помощью IL-6 в той же степени, что и с помощью IFN-α, IFN-β и IFN-γ.
- эритропоэтин
- эритропоэтиновый рецептор
Промоторы и активаторные последовательности, которые активируются в лимфоцитах и/или макрофагах.
Такие объекты включают, например, промоторные последовательности и активаторные последовательности генов цитокинов, цитокиновых рецепторов и факторов адгезии, а также рецепторов для Fc фрагмента антител.
Примерами последних могут служить:
- IL-1 рецептор
- IL-Iα
- IL-Iβ
- IL-2
- IL-2 рецептор
- IL-3
- IL-3 рецептор (α-субъединица)
- IL-3 рецептор (β-субъединица)
- IL-4
- IL-4 рецептор
- IL-5
- IL-6
- интерфероновый регуляторный фактор 1 (IRF-1) (Промотор IRF-1 активируется с помощью IL-6 в той же степени, что и с помощью IFN-α или IFN-β)
- IFN-γ-чувствительный промотор
- IL-7
- IL-8
- 11-10
- IL-11
- IFN-γ
- GM-CSF
- GM-CSF рецептор (α-цепь)
- IL-13
- LIF
- рецептор макрофаг-колониестимулирующего фактора (М-CSF)
- акцепторные макрофаговые рецепторы типа I и II
- МАС-1 (антиген лейкоцитной функции)
- LFA-1 (антиген лейкоцитной функции)
- р150, 95 (антиген лейкоцитной функции)
Промоторные последовательности и активаторные последовательности, которые активируются в синовиальных клетках.
Они включают промоторные последовательности для матричных металлопротеиназ (ММР), например, таких как
- ММР-1 (интерстициальная коллагеназа)
- ММР-3 (стромовый лизин/транзин)
Кроме этого, они также включают промоторные последовательности для тканевых ингибиторов металлопротеиназ (TIMP), например:
- TIMP-1
- TIMP-2
- TIMP-3
Промоторы и активаторные последовательности, которые активируются в лейкозных клетках.
Они включают, например, промоторы для
- с-mус
- HSP-70
- bcI-1/ циклин D-1
- bcI-2
- IL-6
- 11-10
- NF-α, TNF β
- НОХ-11
- ВСБ-АbI
- Е2А-РВХ-1
- PML-RARA
(рецептор системы промиелоцитный лейкоз-ретиноевая кислота)
- с-mус
с-mус белки связываются с и активируют мультимеры нуклеотидной последовательности, которая обозначается как myc E бокс (например, 5'-GGAAGCAGACCACGTGGTCTGCTTCC-3')
Промоторы и активаторные последовательности для опухолевых клеток
Ген-регуляторная нуклеотидная последовательность, с которой взаимодействуют белки фактора транскрипции, которые образовались или активировались в опухолевых клетках, рассматривается как промоторная последовательность или активаторная последовательность.
В рамках настоящего изобретения предпочтительные промоторы или активаторные последовательности включают ген-регуляторные последовательности или элементы соответственно из генов, которые кодируют белки, которые образовались, главным образом, в раковых клетках или клетках саркомы. Так, например, в случае мелкоклеточных бронхиальных карцином, предпочтение отдается использованию промотора N-CAM белка, а в случае карцином яичника - использованию промотора рецептора фактора роста гепатита или L-пластина, и в случае карцином поджелудочной железы - использованию промотора L-пластина или полиморфного эпителиального муцина (РЕМ).
4) Сигналы ядерного экспорта и факторы ядерного экспорта
В рамках настоящего изобретения ядерные экспортные сигналы (NES) предпочтительно представляют собой последовательности ретровирусного rev-реактивного элемента (RRE). В случае HIV-1 такой RRE представляет собой последовательность из 243 нуклеотидов (нуклеотиды 7362-7595; Muesing с сотр., Nature, 313, 450 (1985))в env гене (Malim с сотр., Nature, 338, 254 (1989); Kjems с сотр., PNAS 88, 683 (1991)). Однако в соответствии с настоящим изобретением ядерный экспортный сигнал (NES) может быть также любой гомологичной и/или функционально подобной (аналогичной) нуклеотидной последовательностью, например, такой как HBV вирусный RRE-эквивалентный элемент (Huang с сотр., Mol. Cell Biol., 13, 7476 (1993)).
В новых нуклеиновокислотных конструкциях ядерный экспортный фактор (NEF) представляет собой нуклеотидную последовательность, которая кодирует белок, который связан с мРНК NRS и регулирует транспорт NRS-содержащей прединформационной РНК и информационной РНК из клеточных ядер в цитоплазму (или из цитоплазмы в клеточные ядра). В соответствии с настоящим изобретением главным образом используют rev-ген из ретровирусов, особенно из HIV-1 или HIV-2 вируса (Daly с сотр. , Nature, 342, 816 (1989); Erner man с сотр., Cell, 57, 1155 (1989); Felber с сотр., PNAS 86, 1495 (1989); Fisher с сотр., EMBO J., 13, 4105 (1994)).
Rev-Белок ретровирусного rev-гена своим N-терминальным доменом связан (Zapp с сотр. , Nature, 342, 7154 (1989); Malim с сотр., Cell, 65, 241 (1991)) с RRE в пред-мРНК (Iwai с сотр. , Nucl. Acids. Res., 20, 6465 (1992)). Связывание между RRE и rev-белком облегчает транспорт несплайтсированной прединформационной РНК, а также любой другой РНК, содержащей RRE, из клеточных ядер в цитоплазму (Fisher с сотр., EMBO J., 13, 4105 (1994); Fisher с сотр. , Cell, 82, 475 (1995)) и вследствие этого существенно усиливает трансляцию.
В соответствии с настоящим изобретением в качестве NEF можно также использовать нуклеотидные последовательности, которые кодируют белки, являющиеся гомологичными и функционально подобными HIV-1 rev-белку (Bogerd с сотр., Cell, 82, 485 (1995)), например, rev ген вируса visna-maedi (VMV; Tiley с сотр. , J. Virol., 65, 3877 (1991)) или rev ген капринового артритно-энцефалитного вируса (CAEV; Tiley с сотр., J. Virol., 65, 3877 (1991)).
Однако в соответствии с настоящим изобретением можно также использовать такие гены, которые кодируют белки, которые несмотря на отсутствие гомологии или незначительную гомологию с rev-белком, функционально подобны HIV-1 rev-белку.
Такие гены включают, например, HTLV-1 rev-ген (Cullen, Microbiol. Rev., 56, 375 (1992)), а также rev-ген вируса лошадиной инфекционной анемии (EIAV) и вируса кошачьего иммунодефицита (FIV) (Manusco с сотр., J. Virol., 60, 1988 (1994)).
В соответствии с альтернативным воплощением, NEF могут также представлять собой нуклеотидные последовательности для белков, которые осуществляют секрецию РНК из ядер даже без сохранения такой РНК в ядрах с помощью NPS. Такие белки включают, например, TFIIIA белок фактора транскрипции (Gaddat с сотр., Cell, 60, 619 (1990); Drew с сотр., Gene, 159, 215 (1995)) или гетерогенный ядерный рибонуклеопротеин AI (hnRNPAl белок; Pinol-Roma с сотр., Nature, 355, 730 (1992)).
В более широком смысле ядерные транспортные белки также включают хитшоковый белок 70 (hsp 70; Mandell с сотр., J. Cell. Biol., 111, 1775 (1990)) или протеин-киназный ингибитор CPKI (Fantozzi с сотр., J. Biol. Chem., 269, 2676 (1994); Wen с сотр., J. Biol. Chem., 269, 32214 (1994)).
Общими отличительными признаками NEF и его гомологов, а также аналогичных белков являются наличие более аминотерминально локализованного домена для связывания мономерного белка с NRS РНК (J. Virol., 64, 881 (1990); Kjems с сотр., ЕМВО J., 11, 119 (1992)) и домена, который обычно обогащен лейцином (hnRn PA1 является исключением из правила) и который необходим для транспортной функции NEF (Wen с сотр., Cell, 82, 463 (1995); Fisher с сотр., Cell, 82, 475 (1995); Malim с сотр., J. Virol., 65, 4248 (1991); Venkatesh с сотр. , Virol., 178, 327 (1990)).
В соответствии с настоящим изобретением экспрессия NEF гена находится под контролем промоторной последовательности [компонент b''')], которая расположена в обратном направлении на 5' конце NEF гена (см. фиг.2 и 7 и упомянутый выше текст) или фармакологически контролируемого промоторного модуля (см. фиг.8 и 9).
5) Внутренний рибосомный входной сайт (IRES)
Внутренний рибосомный входной сайт делает возможной экспрессию двух ДНК-последовательностей, которые связаны друг с другом ("взаимно связаны") с помощью пути IRES.
IRES такой природы описаны, например, Montford и Smith, TIG 11, 179 (1995); Kaufman с сотр., Nucl. Acids Res., 19, 4485 (1991); Morgan с сотр., Nucl. Acids Res. , 20, 1293 (1992); Dirks с сотр., Gene 128, 247 (1993); Pelletier и Sonenberg, Nature, 334, 320 (1988) и Sugitomo с сотр., BioTechn. , 12, 694 (1994).
Так, например, кДНК полиовирусной IRES последовательности [положение ≤ 140 до ≥ 630 5' UTR [Pelletier и Sonenberg, Nature, 334, 320 (1988)]] может использоваться для связывания ДНК компонента с) с ДНК компонента d).
6) Структурные гены
В соответствии с настоящим изобретением структурные гены [компонент с)] кодируют активное соединение, предназначенное для профилактики и/или терапии заболевания. Структурные гены и промоторные последовательности следует выбирать с учетом природы терапии заболевания и принимая во внимание тип клетки-мишени, подлежащий трансдукции.
Так, например, следующие комбинации промоторных последовательностей и структурных генов следует выбирать в связи со следующими заболеваниями:
а) Терапия опухолей
Клетки-мишени:
- пролиферирующие эндотелиальные клетки, или
- клетки стромы и мышечные клетки, находящиеся по соседству с эндотелиальной клеткой, или
- опухолевые клетки, или лейкозные клетки
Промоторы:
- специфичные к эндотелиальным клеткам и специфичные к клеточному циклу, или
- клеточно неспецифичные или специфичные к мышечным клеткам и специфичные к клеточному циклу, или
- специфичные к опухолевым клеткам (твердые опухоли и лейкозы)
Структурные гены ингибиторов клеточной пролиферации, например, для
- белка ретинобластомы (pRb=p110) или родственных р107 и р130 белков
- р53 белка
- р21 (WAF-1) белка
- р16 белка
- других cdk ингибиторов
- GADD45 белка
- bak белка
- Белок ретинобластомы (pRb/p110) и родственные р107 и р130 белки инактивируются фосфорилированием.
Предпочтение отдается использованию тех генов для таких ингибиторов клеточного цикла, которые проявляют мутации на сайтах инактивации экспрессированных белков без нарушения вследствие этого функции таких белков. Примеры таких мутаций описаны для случая использования р110.
ДНК-последовательность для р107 белка и р130 белка мутирована аналогичным образом.
- В клетках р53 белок инактивируется путем связывания с такими специальными белками, как MDM2, или путем олигомеризации р53 и c помощью дефосфорилированного С-терминального серина 392. В связи с этим предпочтение отдается использованию ДНК-последовательности для р53 белка, которая укорочена на С-конце путем удаления серина 392.
Структурные гены факторов индукции коагуляции и ингибиторов ангиогенеза, например:
- ингибитор-1 активатора плазминогена (PAI-1)
- PAI-2
- PAI-3
- ангиостатин
- интерфероны, особенно IFNα, IFNβ, IFNγ
- тромбоцитный фактор 4
- I1-12
- TIMP-1
- TIMP-2
- TIMP-3
- фактор ингибирования лейкоза (LIF)
- тканевый фактор (TF) и его коагуляционно-активные фрагменты
Структурные гены цитостатических и цитотоксических белков, например, для
- перфорина
- гранзима
- IL-2
- Il-4
- Il-12
- таких интерферонов, как IFNα, IFNβ, IFNγ
- TNF, особенно TNFα, TNFβ
- онкостатина М
- сфингомиелиназы
- магаинина и производных магаинина
Структурные гены для цитостатических или цитотоксических антител и для слитых белков, состоящих из фрагментов антигенсвязывающего антитела и цитостатических, цитотоксических и индуцирующих воспаление белков и энзимов
- Цитостатические или цитотоксические антитела включают такие антитела, которые направлены против мембранных структур эндотелиальных клеток, как описано, например, Burrows с сотр., (Pharmac. Ther., 64, 155 (1994)), Hughes с сотр., (Cancer Res., 49, 6214 (1989)) и Maruyama с сотр., (PNAS ASA 87, 5744 (1990)). Такие антитела включают, главным образом, антитела против VEGF рецепторов.
- Кроме этого, такие антитела включают цитостатические или цитотоксические антитела, которые направлены против мембранных структур на опухолевых клетках. Антитела такой природы описаны, например, в обзоре Sedlacek с сотр. , Contrib. to Oncol., 32, Karger Verlag, Munich (1988) и Contrib. to Oncol., 43, Karger Verlag, Munich (1992). Другими примерами являются антитела против
- сиалила Льюиса (Lewis)
- пептидов на опухолях, которые распознаются Т клетками
- белков, экспрессируемых онкогенами
- таких ганглинозидов, как GD3, GD2, GM2, 9-0-ацетил-GD3, фукозил GM1
- антигенов группы крови и их предшественников
- антигенов на полиморфном эпителиальном муцине
- антигенов на хитшоковых белках
- Кроме этого, такие антитела включают антитела, которые направлены против мембранных структур лейкозных клеток. Большое число моноклональных антител такой природы уже было описано для диагностических и терапевтических методов (обзоры в Kristensen, Danish Medical Bulletin, 41, 52 (1994); Schranz, Therapia Hungariсa 38, 3 (1990); Drexler с сотр., Leuk. Res., 10, 279 (1986); Naeim, Dis. Markers 7, 1 (1989); Stickney с сотр., Curr. Opin. Oncol., 4, 847 (1992); Drexler с сотр., Blut 57, 327 (1988); Freedman с сотр., Cancer Invest. 9, 69 (1991)). В зависимости от типа лейкоза следующие моноклональные антитела или фрагменты их антигенсвязывающего антитела подходят, например, для использования в качестве лигандов: см. таблицу.
Гуманизацию мышиных антител, а также приготовление и оптимизацию генов для fab и рекомбинантных Fv-фрагментов осуществляют по аналогии со способами, которые уже были описаны для получения рекомбинантных Fv-фрагментов. Рекомбинантные Fv-фрагменты сливают с генами для цитостатических, цитотоксических или индуцирующих воспаление белков или энзимов, в соответствии с уровнем техники, который известен специалистам.
Структурные гены для слитых белков, состоящих из лигандов, связывающих клетку-мишень, и цитостатических и цитотоксических белков.
Такие объекты включают все вещества, которые связываются с мембранными структурами или мембранными рецепторами на эндотелиальных клетках. Так, например, они включают IL-I или факторы роста, или их фрагменты, или их неполные последовательности, которые связаны с рецепторами, экспрессируемыми эндотелиальными клетками, такими как PDGF, bFGF, VEGF и TGFβ (Pusztain с сотр. , J. Pathol., 169, 191 (1993)).
Кроме этого, они включают факторы адгезии, связанные с активированными и/или пролиферирующими эндотелиальными клетками. Факторы адгезии такого типа, например, Slex, LFA-1, MAC-1, LECAM-1, VLA-4 или витронектин, уже были описаны ранее (обзоры в Augustin-Voss с сотр., J. Cell Biol., 119, 483 (1992), Pauli с сотр. , Cancer Metast. Rev, 9, 175 (1990), Honn с сотр., Cancer Metast. Rev., 11, 353 (1992) и Varner с сотр., Cell Adh. Commun., 3, 367 (1995)).
Кроме этого, они также включают вещества, которые связываются с мембранными структурами или мембранными рецепторами опухолевых клеток или лейкозных клеток. Так например, они включают факторы роста или их фрагменты либо их неполные последовательности, которые связываются с рецепторами, экспрессируемыми лейкозными клетками или опухолевыми клетками.
Факторы роста такого типа уже были описаны ранее (обзоры Cross с сотр., Cell 64, 271 (1991), Aulitzky с сотр., Drugs 48, 667 (1994), Moore, Clin. Cancer. Res. , 1, 3 (1995) и Van Kooten с сотр., Leuk. Lymph., 12, 27 (1993)).
Гены для таких лигандов, которые связываются с клеткой-мишенью, сливают с генами для цитостатических, цитотоксических или индуцирующих воспаление белков или энзимов в соответствии с уровнем техники, с использованием способов, которые известны специалистам в данной области.
Структурные гены для индукторов воспалительных состояний, например, для
- RANTES (МСР-2)
- моноцитного хемотаксического и активирующего фактора (MCAF)
- IL-8
- макрофагового воспалительного белка -I (MIP-Iα, -β)
- нейтрофил-активирующего белка-2 (NAP-2)
- IL-3
- IL-5
- фактора ингибирования человеческого лейкоза (LIF)
- IL-7
- IL-11
- IL-13
- GM-CSF
- G-CSF
- M-CSF
- фактора яда кобры (CVF), или неполных последовательностей CVF, которые функционально соответствуют человеческому фактору СЗb комплемента, т.е. которые способны связываться фактором В комплемента и которые составляют СЗ конвертазу после расщепления фактором D
- человеческого фактора СЗ комплемента или его неполной последовательности СЗb.
- продуктов расщепления человеческого фактора СЗ комплемента, которые функционально и структурно похожи на CVF
- бактериальных белков, которые активируют комплемент или вызывают воспаления, таких как порины Salmonella typhimurium, факторы аглютинации Staphylococcus aureus, модулины, особенно грам-отрицательных бактерий, главный внешний мембранный белок легионелл или Haemophilus influenza типа В, или клебсиелл, или М молекулы стрептококков группы G.
Структурные гены для энзимов, предназначенных для активирующих предшественников цитостатических агентов, например для энзимов, которые расщепляют неактивные вещества-предшественники (пролекарства) в результате чего образуются активные цитостатические агенты (лекарства).
Вещества такой природы, а также пролекарства и лекарства, с которыми они связаны в каждом случае, уже были описаны в обзорах Deonarain с сотр., (Br. J. Cancer, 70, 786 (1994)), Mullen (Phannac. Ther., 63, 199 (1994)) и Harris с сотр. , (Gene Ther., 1, 170 (1994)). Так, например, может использоваться ДНК-последовательность для одного из следующих энзимов:
- тимидинкиназы вируса простого герпеса
- тимидинкиназы вируса опоясывающего лишая и ветряной оспы
- бактериальной нитроредуктазы
- бактериальной β-глюкуронидазы
- растительной β-глюкуронидазы из злаковых культур Secale
- человеческой β-глюкуронидазы
- человеческой карбоксипептидазы (СВ), например тучной клетки СВ-А, панкреатической СВ-В, бактериальной карбоксипептидазы, бактериальной β-лактамазы, бактериальной цитозиндеаминазы
- человеческой каталазы или пероксидазы
- фосфатазы, особенно человеческой щелочной фосфатазы, человеческой кислой фосфатазы простаты, кислой фосфатазы типа 5
- оксидазы, особенно человеческой лизилоксидазы, человеческой кислой D-аминооксидазы
- пероксидазы, особенно человеческой глютатионпероксидазы, человеческой эозинофильной пероксидазы, человеческой тиреоидной пероксидазы
- β-галактозидазы
b) Терапия аутоиммунных заболеваний и воспалений
Клетки-мишени:
- пролиферирующие эндотелиальные клетки, или
- макрофаги и/или лимфоциты, или
- синовиальные клетки
Промоторы:
- специфичные к эндотелиальным клеткам и клеточному циклу или
- макрофаг-специфические, и/или лимфоцит-специфические, и/или специфичные к клеточному циклу
- специфичные к клеточному циклу и/или к синовиальным клеткам
Структурные гены для терапии аллергий, например
- IFN-β
- IFN-γ
- IL-10
- антител или фрагментов антител против IL-4
- растворимых IL-4 рецепторов
- IL-12
- TGF-β
- Структурные гены для предотвращения отторжения трансплантированных органов, например,
- IL-10
- TGFβ
- рецепторов растворимого IL-1
- рецепторов растворимого IL-2
- антагонистов рецептора IL-1
- рецепторов растворимого IL-6
- иммуносупрессорных антител или их VH-и VL- содержащих фрагментов, или их VH и VL-фрагментов, соединенных с помощью линкера, которые получают, например, в соответствии со способом, описанным Marasco с сотр., (Proc. Natl. Acad. Sci. USA 90, 7889 (1993)). Примерами иммуносупрессорных антител могут служить антитела
- которые являются специфическими в отношении рецептора Т клеток или его CDS комплекса
- которые направлены против CD4 или CD8, и, кроме этого,
- которые направлены против IL-2 рецептора, IL-1 рецептора или IL-4 рецептора, или
- которые направлены против факторов адгезии Cd2, LFA-1, CD28 или CD40.
- Структурные гены для терапии антитело-опосредованных аутоиммунных заболеваний, например,
- TGF-β
- IFN-α
- IFN-β
- IFN-γ
- IL-12
- рецепторов растворимого IL-4
- рецепторов растворимого IL-6
- иммуносупрессорных антител или их VH- и VL- содержащих фрагментов
Структурные гены для терапии клеточно-опосредованных аутоиммунных заболеваний, например,
- IL-6
- IL-9
- IL-10
- IL-13
- TNF-α
- IL-4
- TNF-β
- иммуносупрессорного антитела или его VН- и VL-содержащих фрагментов
Структурные гены для ингибиторов клеточной пролиферации, цитостатических или цитотоксических белков и энзимов для активирующих предшественников цитостатических агентов.
Примеры генов, кодирующих белки такого типа, уже были приведены в разделе "Структурные гены для терапии опухолей"
В соответствии с настоящим изобретением можно использовать, в той же форме, что уже была описана в этой связи, структурные гены, которые кодируют слитые белки, содержащие антитела или Fab фрагменты, или рекомбинантные Fv фрагменты таких антител, или другие лиганды, являющиеся специфичными к клетке-мишени, а также упомянутые выше цитокины, факторы роста, рецепторы, цитостатические или цитотоксические белки и энзимы.
Структурные гены для терапии артрита
В соответствии с настоящим изобретением выбирают структурные гены, экспрессированный белок которых непосредственно или косвенно ингибирует воспаление, например, в суставе и/или промотирует реконструкцию межклеточного материала (хрящ и соединительная ткань) в суставе.
Примерами таких белков могут служить
- IL-1 рецепторный антагонист (IL-1-RA);
IL-1-RA ингибирует связывание IL-1α и IL-1β
- рецептор растворимого IL-1
рецептор растворимого IL-1 связывает и инактивирует IL-1
- IL-6
IL-6 повышает секрецию TIMP и супероксидов и уменьшает секрецию IL-1 и TNFα синовиальными клетками и хондроцитами.
- рецептор растворимого TNF;
рецептор растворимого TNF связывает и инактивирует TNF
- IL-4
IL-4 ингибирует образование и секрецию IL-1, TNF-α и ММР
- IL-10
IL-10 ингибирует образование и секрецию IL-1, TNF-α и ММР и повышает секрецию TIMP
- инсулиноподобный фактор роста (IGF-1)
IGF-1 стимулирует синтез межклеточного материала.
- TGFβ, особенно TGFβ1 и TGFβ2
- TGFβ стимулирует синтез межклеточного материала
- супероксидисмутаза
- TIMP (тканевые ингибиторы металлопротеиназ) особенно TIMP-1, TIMP-2, TIMP-3
С) Терапия дефицитного гемопоэза
Клетки-мишени
- пролиферирующие, незрелые клетки кроветворной системы или
- клетки стромы, находящиеся по соседству с кроветворными клетками.
Промоторы
- специфичные к кроветворным клеткам и/или специфичные к клеточному циклу
- клеточно неспецифические
Структурные гены для терапии анемии, например, для
- эритропоэтина
Структурные гены для терапии лейкопении, например,
- G-CSF
- GM-CSF
Структурные гены для терапии тромбоцитопении, например,
- IL-3
- фактора ингибирования лейкоза (LIF)
- IL-II
- тромбопоэтина
d) Терапия нарушений нервной системы
Клетки-мишени
- глиоциты или
- пролиферирующие эндотелиальные клетки
Промоторы
- глиоцит-специфические, или
- специфичные к эндотелиальным клеткам и специфичные к клеточному циклу, или
- неспецифичные и специфичные к клеточному циклу
Структурные гены для нейрональных факторов роста, например,
- FGF
- фактор роста нерва (NGF)
- мозговой нейротрофический фактор (BDNF)
- нейротрофин-3 (NT-3)
- нейротрофин-4 (NNT-4)
- мерцательный нейротрофический фактор (CNTF)
- Структурные гены для энзимов, например, для
- тирозингидроксилазы
- дофа-декарбоксилазы
Структурные гены для цитокинов и их ингибиторов, которые ингибируют или нейтрализуют нейротоксический эффект TNFα, например, для
- TGFβ
- рецепторов растворимого TNF
- TNF рецепторы нейтрализуют TNFα
- IL-10;
- IL-10 ингибирует образование IFN-гамма, TNFα, IL-2 и IL-4
- рецепторов растворимого IL-1
- рецептора I IL-I
- рецептора II IL-I
Рецепторы растворимого IL-I нейтрализуют активность IL-I
- антагониста рецептора IL-I
- рецепторов растворимого IL-6
е) Терапия нарушений системы свертывания крови и системы кровообращения
Клетки-мишени
- эндотелиальные клетки, или
- пролиферирующие эндотелиальные клетки, или
- соматические клетки вблизи эндотелиальных клеток и клетки гладкой мышцы, или
- макрофаги
Промоторы
- клеточно неспецифические или
- клеточно неспецифические и специфичные к клеточному циклу, или
- специфичные к эндотелиальным клеткам, клеткам гладкой мышцы или макрофагам, или
- специфические к эндотелиальным клеткам, клеткам гладкой мышцы или макрофагам и специфичные к клеточному циклу
Структурные гены для ингибирования свертывания или для промотирования фибринолиза, например,
- активатора тканевого плазминогена (tPA)
- активатора плазминогена урокиназного типа (uРА)
- гибридов tPA и UPA
- белка С
- гирудина
- таких ингибиторов серинпротеиназы (серинов), как C-1S ингибитор, - α1-антитрипсин, антитромбин III
- ингибитора пути метаболизма тканевого фактора (TFPI)
Структурные гены для промотирования свертывания, например, для
- FVIII
- FIX
- фактора Виллебранда (von Willebrand.)
- FXIII
- PAI-I
- PAI-2
Структурные гены для факторов ангиогенеза, например,
- VEGF
- FGF
Структурные гены для снижения кровяного давления, например,
- калликреина
- оксид азота-синтазы эндотелиальных клеток
Структурные гены для ингибирования вызванного пролиферацией клеток гладкой мышцы повреждения эндотелиального слоя, например, антипролиферативного, цитостатического или цитотоксического белка или энзима, расщепляющих предшественники цитостатических агентов, в результате чего образуются цитостатические агенты, как уже отмечалось выше (в отношении опухоли), и слитые белки таких активных соединений совместно с антителами или фрагментами антител, которые специфичны в отношении мышечных клеток.
Структурные гены для других белков плазмы крови, например, для
- альбумина
- Сl инактиватора
- сывороточной холинэстеразы
- трансферина
- α1-антитрипсина
f) Терапия метаболических заболеваний и генетического заболевания
Клетки-мишени
- эндотелиальные клетки
- мышечные клетки
- клетки печени
- клетки бронхиального эпителия
- клетки стромы или
- макрофаги
Промоторы
- не обладающие специфичностью к клеткам-мишеням или
- клетка-мишень - специфичные
Структурные гены, например,
- регулятора трансмембранной проводимости (CFTCR), связанного с цистическим фиброзом
- гена анемии Fanconi
- уропорфириноген III синтетазы
- идуронат 2-сульфатазы (мукополисахаридоз типа II)
- β-глюкуронидазы (мукополисахаридоз VIII)
- глюкоцереброзидазы (болезнь Gaucher)
- фенилаланин гидроксилазы
- дистрофина (мышечная дистрофия Duchenne-типа)
- инсулинового рецептора
- человеческого ростового гормона
- поверхностно активный SP-A и SP-B - связанного белка
- LDL рецептора
- мРНК-редактирующего белка аполипопротеина В
- аденозиндеаминазы g) Инокуляции
Клетки-мишени
- мышечные клетки или
- макрофаги
Промоторы
- неспецифичные к клетке-мишени или
- специфичные к клетке-мишени или специфичные к клетке-мишени и специфичные к клеточному циклу
Структурные гены для профилактики инфекционных заболеваний
Возможности получения эффективных вакцин обычно являются ограниченными (Brown, Int. J. Technol. Assessm. Health Care, 10, 161 (1994), Ellis, Adv. Exp. Med. Biol., 327, 263 (1992), Arnon с сотр., FASEB J., 6, 3265 (1992)).
В связи с этим была разработана технология получения ДНК вакцин. Однако в связи с такими ДНК-вакцинами возникают вопросы, касающиеся эффективности их действия (Fynan с сотр., Int. J. Immunopharm., 17, 79 (1995); Donnelly с сотр., Inimunol, 2, 20 (1994)).
В соответствии с настоящим изобретением самоусиливающаяся экспрессионная система повышает эффективность ДНК вакцин.
ДНК, которую следует выбирать в качестве активного соединения, представляет собой ДНК для белка, который образуется под действием инфекционного агента и который, вызывая иммунную реакцию, например, с помощью связывающего антитела и/или с помощью цитотоксических Т-лимфоцитов, обеспечивает нейтрализацию и/или деструкцию такого агента. Так называемые нейтрализующие антигены такой природы уже использовались в качестве вакцинирующих антигенов (см. обзоры в статье Ellis, Adv. Exp. Med. Biol., 327, 263 (1992)). Результаты последующих исследований позволяют привести примеры ДНК-последовательностей, кодирующих нейтрализующие антигены:
- антиген вируса гриппа А
(Ulmer с сотр. , Science, 259, 1745 (1993), Robinson с сотр., Vaccine, 11, 957 (1993), Fynan с сотр., Int. J. Immunopharmac., 17, 79 (1995)).
- HIV-антигены
(Wang с сотр., PNAS USA 90, 4156 (1993))
- антиген вируса бешенства
(Donnelly с сотр., Immunol., 2/1, 20 (1994))
- антиген HSV (вирус простого герпеса) (Fleckenstein с сотр., Nature, 274, 57 (1978))
- антиген RSV (респираторный синцитиальный вирус) (Du с сотр., Bio/Tech, 12, 813 (1994), Hall, Science, 265, 1393 (1993))
- антиген вируса парагриппа (Du с сотр., Bio/Tech, 12, 813 (1994))
- антиген ротавируса
(Albert с сотр., J. Clin. Microbiol., 25, 183 (1987), Anderson с сотр., J. Infect. Dis., 153, 823 (1986), Battaglia. с сотр., J. Infect. Dis., 155, 140 (1987), Chanock с сотр., J. Infect. Dis., 148, 49 (1983), Dyall-Smith с сотр., J.Virol., 38, 1099 (1981), Glass с сотр., Science, 265, 1389 (1994))
- антиген VZV (вирус ветряной оспы и опоясывающего лишая)
(Straus с сотр., Ann. Intern. Med., 109, 438 (1988), Gershon, Pediatr. Infect. Dis., 2, 171 (1991), Kinchington с сотр., J.Virol., 64, 4540 (1990))
- антиген CMV (цитомегаловируса) (Plotkin, Science, 265, 1383 (1994))
- антиген вируса кори (Katz и Kellin, Science, 265, 1391 (1994)).
- антиген HPV (человеческого папиломавируса) (Tindl и Frazer, Curr. Topics Microbiol. Immunol., 186, 217 (1994))
- антиген HBV (вирус гепатита В)
(Valenzuela с сотр., Nature, 280, 815 (1979), Heerman с сотр., J. Virol. , 52, 396 (1984))
- антиген HCV (вирус гепатита С)
(Сеrnу с сотр., Curr. Topics Microbiol. Immunol., 189, 169 (1994), Esteban с сотр., Progr. Liver. Dis., 10, 253 (1992), Jung с сотр., Eur. J. Clin. Invest., 24, 641 (1994))
- антиген HDV (вирус гепатита D)
(Iwarson, Scand. J. Infect. Dis., 24, 129 (1992), Console с сотр., Nephron., 61, 251 (1992)
- антиген HEV (вирус гепатита Е)
(Iwarson, Scand. J. Infect. Dis., 24, 129 (1992), Console с сотр., Nephron., 61, 251 (1992)
- антиген HAV (вирус гепатита А)
(d'Hondt, Vaccine, 10, 48 (1992), Andre, J. Infect. Dis., 171, 33 (1995), Lemon с сотр., Vaccine, 10, 40 (1992), Melnick с сотр., Vaccine, 10, 24 (1992), Flehmig, Baillieres Clin. GastroenteroL. 4, 707 (1990))
- антиген холерного вибриона
(Levine и Kaper, Vaccine, 11, 207 (1993))
- антиген Borrelia burgdorferi (Schaible с сотр., Immunol. Letters, 36, 219 (1993), Wallich с сотр., Lab. Med., 17, 669 (1993))
- антиген Helicobacter pylori (Crabtree с сотр. , Lancet, 338, 332 (1991), Blaser, J. Infect. Dis., 161, 626 (1990), Cover & Blaser, J. Biol. Chem. , 267, 10570 (1993), Cover с сотр., Infect. Immunol, 58, 603 (1990), Dunn с сотр. , J. Biol. Chem., 265, 9464 (1990), Dunn с сотр., Infect. Immunol., 60, 1946 (1992), Lage с сотр., Acta Gastroenterol. Belg., 56 (доп.), 61 (1993), Mobley с сотр., Scand. J. Gastroent, 26 (доп.187), 39 (1991)
- антиген малярии
(Nussenzweig & Long, Science, 265, 1381 (1994), Maurice, Science, 267, 320 (1995), Enders с сотр., Vaccines, 10, 920 (1992), Knapp с сотр., Infect. Imun., 60, 2397 (1992)).
Однако в соответствии с настоящим изобретением активные вещества такого типа включают ДНК для антиидиотипического антитела или его антигенсвязывающих фрагментов, антигенсвязывающие структуры (гипервариабельные участки) которых составляют копии белковой структуры или карбогидратной структуры нейтрализующего антигена инфекционного агента.
Антиидиотипические антитела такой природы могут главным образом заменять карбогидратные антигены в случае бактериальных инфекционных агентов.
Антиидиотипические антитела такой природы, а также продукты их расщепления были описаны Hawkins с сотр., (J.Immunother., 14, 273 (1993)) и Westerink и Apicella (Springer Seminars in Immunopathol., 15, 227 (1993)).
Структурные гены для "опухолевых вакцин"
Эти объекты включают антитела на опухолевых клетках. Антигены такой природы описаны, например, Sedlacek с сотр., Contrib. to Oncol., 32, Karger Verlag, Munich (1988) и Contrib. to Oncol. , 43, Karger Verlag, Munich (1992).
Другие примеры составляют гены следующих антигенов или антиидиотипических антител, соответствующих следующим антигенам:
- сиалил Льюиса (Lewis)
- пептиды на опухолях, распознаваемые Т-клетками
- белки, экспрессированные онкогенами
- антигены группы крови и их предшественники
- антигены на полиморфном эпителиальном муцине и другие опухоль-связанные муцины
- антигены на хитшоковых белках
- ганглиозиды
h) Терапия хронических инфекционных заболеваний
Клетки-мишени
- клетки печени
- лимфоцит и/или макрофаг
- эпителиальная клетка
- эндотелиальная клетка
Промоторы
- вирус-специфичные
- клетка-специфичные
- вирус-специфичные или клетка-специфичные и специфичные к клеточному циклу
Структурные гены, например,
- белка, проявляющего цитостатические или цитотоксические эффекты
(Примеры цитотоксических или цитостатических белков уже приводились в разделе "Терапия опухолей")
- энзима (в этой связи см. раздел "Терапия опухолей"), который расщепляет предшественник антивирусного или цитотоксического вещества, образуя в результате активное вещество.
Структурные гены для антивирусных белков
- цитокины и факторы роста, обладающие антивирусной активностью.
Их примерами могут служить
- IFN-α
- IFN-β
- IFN-γ
- TNF-β
- TNF-α
- IL-l
- TGF-β
- антитело, обладающее специфичностью, которая инактивирует релевантный вирус или его VH- и VL-содержащие фрагменты, или его VH- и VL фрагменты, которые связаны посредством линкера, причем такие фрагменты могут быть получены, как уже описано в Разделе 2). Примерами антител против вирусных агентов могут служить: анти-HBV, анти-HCV, анти-HSV, анти-HPV, анти-HIV, анти-EBV, анти-HTLV, анти-Coxsackie вирус, анти-Hantaan вирус
- rev-связывающий белок. Такие белки связаны с rev РНК и ингибируют rev-зависимые посттранскрипционные стадии в ретровирусной генной экспрессии. Примерами rev-связывающих белков являются: RBP9-27, RBP1-8U, RBP1-8D, псевдогены RBP1-8
- для рибозимов, которые переваривают мРНК генов для белков контроля клеточного цикла или мРНК вирусов. Рибозимы, обладающие каталитическим действием в отношении HIV, были описаны, например, Christoffersen с сотр., J. Med. Chem., 38, 2033 (1995).
- Структурные гены антибактериальных белков
Примерами антибактериальных белков являются антитела, которые нейтрализуют бактериальные токсины или которые опсонизируют бактерии.
Примерами таких антител являются антитела против
- С или В менингококков
- Е coli.
- Borrelia
- Pseudomonas
- Heliobacter pylori
- Staphylococcus aureus
7) Комбинация одинаковых или различных структурных генов
Кроме того, настоящее изобретение относится к самоусиливающейся, когда необходимо, фармакологически контролируемой, экспрессионной системе, в которой ДНК-последовательности двух идентичных или различных структурных генов [компоненты с) и с')] соединены друг с другом. С целью экспрессии двух таких ДНК-последовательностей кДНК сайта внутреннего рибосомного входа (IRES) предпочтительно вставляют в качестве регулирующего элемента между двумя такими структурными генами.
Примеры IRES последовательностей такого типа уже были описаны в Разделе С5).
В соответствии с настоящим изобретением далее приведены примеры предпочтительных комбинаций структурных генов, для
терапии опухолей
- различные антипролиферативные, цитостатические, цитотоксические, индуцирующие воспаление белки или
- идентичные энзимы для расщепления предшественника цитостатического агента
терапии аутоиммунных заболеваний
- различные цитокины или рецепторы, проявляющие синергический эффект в ингибировании клеточной и/или гуморальной иммунной реакции, или
- различные или идентичные ТIMP
- терапии недостаточного гемопоэза
- различные, иерархически последовательные цитокины, такие как IL-1, IL-3, IL-6 или GM-CSF и эритропоэтин, G-CSF или тромбопоэтин
терапии поражения нервной клетки
- фактор нейронального роста и цитокин или ингибитор цитокина
терапии нарушений системы свертывания крови и системы кровообращения
- антитромботический агент и фибринолитический агент (tPA или uРА) или
- антипролиферативный, цитостатический или цитотоксический белок (или энзим) и антитромботический агент или фибринолитический агент
вакцинации
- антиген- и иммунитетстимулирующий цитокин, например, IL-1α, IL-1β, IL-2, GM-CSF, IL-3 или рецептор IL-4
- различные антигены одного инфекционного агента или различных инфекционных агентов или одного опухолевого типа или различных опухолевых типов
терапии вирусных заболеваний
- антивирусный белок и цитостатический или цитотоксический белок
- антитела против различных поверхностных антигенов одного вируса или нескольких вирусов
- терапии бактериальных инфекционных заболеваний
- антитела против различных поверхностных антигенов и/или токсинов организма
8) Вставка сигнальных последовательностей и трансмембранных доменов
С целью облегчения секреции продукта экспрессии структурного гена гомологическая сигнальная последовательность, которая может присутствовать в ДНК-последовательности структурного гена, может быть заменена гетерологической сигнальной последовательностью, улучшающей внеклеточную секрецию.
Так, например, могут быть вставлены сигнальная последовательность для иммуноглобулина (положение ДНК ≤ 63 до ≥ 107; Riechmann с сотр., Nature, 332, 323 (1988)) или сигнальная последовательность для СЕА (позиция ДНК ≤ 33 до ≥ 134; Schrewe с сотр., Mol. Cell Biol., 10, 2738 (1990); Berling с сотр. , Cancer Res. , 50, 6534 (1990)) или сигнальная последовательность гликопротеина человеческого респираторного синцитиального вируса (кДНК для аминокислот ≤ 38 до ≥ 50; или 48-65; Lichtenstein с сотр., J. Gen. Virol., 77, 109 (1996)).
С другой стороны, или в дополнение к такой сигнальной последовательности может быть вставлена последовательность для трансмембранного домена с целью прикрепления активного соединения к клеточной мембране трансдукцированной клетки, образующей активное соединение.
Так, например, трансмембранная последовательность человеческого фактора стимуляции колоний макрофага (положение ДНК ≤ 1485 до ≥ 1554; Cosman с сотр. , Behring. Inst. Mitt., 83, 15 (1988)) или ДНК последовательность для сигнального и трансмембранного участков гликопротеина
человека G человеческого респираторного синцитиального вируса (RSV) (аминокислоты 1-63 или их неполные последовательности, аминокислоты 38-63; Vijaya с сотр., Мо1. Cell. Biol., 8, 1709 (1988); Lichtenstein с сотр., J. Gen. Virol. , 77, 109 (1996)), или ДНК последовательность сигнального или трансмембранного участков нейроаминидазы вируса гриппа (аминокислоты 7-35 или аминокислоты неполной последовательности 7-27; Brown с сотр., J. Virol., 62, 3824 (1988)) могут быть вставлены между промоторной последовательностью и последовательностью структурного гена.
С целью усиления трансляции нуклеотидная последовательность GCCACC или GCCGCC может, например, быть вставлена на 3' конце промоторной последовательности и непосредственно на 5' конце старт-сигнала (ATG) сигнальной последовательности или трансмембранной последовательности (Kozak, J. Cell Biol. , 108, 209 (1989)).
Однако нуклеотидная последовательность для гликофосфолипидного якоря также может быть вставлена с целью закрепления активного соединения в клеточной мембране трансдукцированных клеток, образующих активное соединение.
Гликофосфолипидный якорь вставляют на 3' конце нуклеотидной последовательности для структурного гена, причем такую инсерцию можно осуществлять в дополнение к инсерции сигнальной последовательности.
Гликофосфолипидные якоря были описаны, например, для СЕА (ДНК позиции ≤ 893 до ≥ 1079; Berling с сотр., Cancer Res., 50, 6534 (1990), для N-CAM (Cunningham с сотр., Science, 236, 799 (1987)) и для других мембранных белков, таких как Thy-1 (Clissold, Biochem, 281, 129 (1992)) или CD16 (Selvary с сотр., Nature, 333, 565 (1988)).
Ferguson с сотр., (Ann. Rev. Biochem., 57, 285 (1988)) опубликовали обзор по гликофосфолипид-закрепленным мембранным белкам.
Другой выбор закрепления активных соединений на клеточной мембране в соответствии с настоящим изобретением заключается в использовании ДНК-последовательности для слитого белка лиганд/активное соединение. Специфичность лиганда такого слитого белка направлена против мембранной структуры на клеточной мембране выбранной клетки-мишени.
Примерами лигандов, которые связаны с поверхностью клеток, являются антитела или фрагменты антител, которые направлены против структур на поверхности, например:
- эндотелиальных клеток, включающие главным образом антитела против VEGF рецепторов,
- или мышечных клеток, например, антитела против актина, или антитела против рецепторов ангиотензина II, или антитела против рецепторов факторов роста, например, против рецепторов EGF, или против рецепторов PDGF, или против рецепторов FGF, или антитела против рецепторов эндотелина А.
Мышиные моноклональные антитела предпочтительно использовать в гуманизированной форме. Fab фрагменты и рекомбинантные Fv-фрагменты, а также продукты их слияния получают в соответствии с описанными выше способами.
Лиганды, кроме этого, включают все такие активные соединения, как цитокины или факторы адгезиии, факторы роста, их фрагменты или их неполные последовательности, или медаторы, которые связаны с мембранными структурами или мембранными рецепторами на конкретной выбранной клетке. Примерами таких лигандов могут служить такие лиганды для эндотелиальных клеток, как IL-1, PDGF, bFGF, VEGF, TGGβ (Pusztain с сотр., J. Pathol, 169, 191 (1993)) или кинин, а также производные или аналоги кинина. Кроме того, лиганды включают адгезионные молекулы. Адгезионные молекулы такого типа, например Slex, LFA-I, MAC-1, LeCAM-I, VLA-4 или витронектин, а также производные или аналоги витронектина уже были описаны ранее для эндотелиальных клеток (обзоры Augustin-Voss с сотр., J. Cell Biol., 119, 483 (1992); Pauli с сотр., Cancer Met. Rev., 9, 175 (1990); Honn с сотр., Cancer Metast. Rev., 11, 353 (1992); Varner с сотр., Cell Adh. Commun., 3, 36 7 (1995)).
Лиганды также включают антитела или их фрагменты, которые направлены против опухоль-специфических или опухоль-связанных антигенов на мембране опухолевой клетки. Антитела такой природы уже были описаны в разделе С6а.
Настоящее изобретение также относится к композиции, которая содержит новую нуклеиново-кислотную конструкцию и сшивающее вещество j), имеющее сайт связывания для белка А компонента f) и для белка В компонента h). Сшивающее вещество j) предпочтительно представляет собой фармацевтическую композицию, особенно вещество, способное проникать через клеточную мембрану в клетку, особенно рапамицин, FK506, циклоспорин А. метотрексат, фолиевую кислоту, ретиноевую кислоту, пенициллин, 4-гидрокситамоксифен, тамоксифен или тетрациклин или тетрациклин/изопропил-β-D-тиогалактозидный конъюгат.
Настоящее изобретение также относится к клеткам, особенно к дрожжевым клеткам или клеткам млекопитающих, которые содержат новую нуклеиново-кислотную конструкцию, а также к способу получения новой конструкции на основе нуклеиновой кислоты, в которой индивидуальные компоненты соединены друг с другом.
Настоящее изобретение также относится к использованию новых нуклеиново-кислотных конструкций для получения лекарства для местного, например трансдермального, назального, орального, желудочно-кишечного, интрабронхиального, внутрипузырного, внутривагинального, внутриматочного, подкожного, внутримышечного, внутрикожного, околосуставного или внутрисуставного применения, для введения в спинно-мозговую жидкость, в мозг, в печень, в почки, в кишечник или в язык, или для внутрибрюшинного, внутриплеврального или системного, например внутривенного, внутриартериального, интрапортального или интракардиального применения для профилактики и/или терапии опухолей, лейкозов, аутоиммунных заболеваний, воспалений, нарушений нервной системы, нарушений системы свертывания крови и системы кровообращения, метаболических заболеваний, генетических повреждений, вирусных или бактериальных заболеваний, и/или недостаточного гемопоэза, и/или для вакцинирования против вирусных, бактериальных или паразитарных инфекций, и/или против опухолей, а также к использованию клетки согласно изобретению для получения лекарства местного или системного применения для профилактики и/или терапии заболеваний.
На фиг.1 представлена диаграмма новой нуклеиново-кислотной конструкции в ее простейшей форме.
На фиг.2 изображена диаграмма нуклеиновокислотной конструкции, представленной на фиг.1, после ее дополнения геном, кодирующим ядерный экспортный сигнал (NES), и геном, кодирующим ядерный экспортный фактор (NEF).
На фиг. 3 изображена диаграмма соединения компонентов с) и d) с помощью IRES.
На фиг.4 изображена диаграмма схемы, по которой реагируют индивидуальные компоненты, изображенные на фиг.1-3.
На фиг.5 приведена диаграмма расширения нуклеиновокислотной конструкции с помощью дополнительных структурных генов.
На фиг. 6 изображена диаграмма расширения конструкции на основе нуклеиновой кислоты с помощью дополнительных генов белка фактора транскрипции.
На фиг.7 изображена диаграмма нуклеиновокислотной конструкции, представленной на фиг.3, после дополнения генами, кодирующими NES и NEF.
На фиг. 8 изображена диаграмма фармакологически контролируемого промоторного модуля в его простейшем виде.
На фиг.9 изображена диаграмма схемы реакции индивидуальных компонентов, представленных на фиг.8.
На фиг.10 изображена диаграмма самоусиливающейся, фармакологически контролируемой экспрессионной системы.
На фиг.11 изобажена диаграмма замены компонентов а) и b) компонентом i) и замены компонента d), совместно с IRES участком, на фармацевтически контролируемый промоторный модуль, содержащий компоненты е), f), g) и h).
На фиг.12 изображена диаграмма замены компонентов b''') фармацевтически контролируемым промоторным модулем, содержащим компоненты е), f), g), h) и i).
На фиг.13 изображена диаграмма самоусиливающейся экспрессионной системы для специфичной к клеточному циклу и клеточно-специфической экспрессии β-глюкуронидазы.
На фиг.14 и 15 изображены диаграммы экспрессионных систем, не являющихся самоусиливающимися.
На фиг.16 изображена диаграмма самоусиливающейся, фармакологически контролируемой экспрессионной системы для специфической к клеточному циклу и фармакологически контролируемой экспрессии β-глюкуронидазы.
Настоящее изобретение более подробно поясняется с помощью следующих примеров.
Примеры
1. Конструирование самоусиливающейся экспрессионной системы.
Самоусиливающуюся экспрессионную систему в соответствии со схемой, изображенной на фиг.13, получали с целью осуществления специфической к клеточному циклу и клеточно-специфичной экспресии β-глюкуронидазы.
ДНК-последовательности индивидуальных компонентов соединяли друг с другом в 5' и 3'направлении следующим образом:
компонент а):
- последовательность (нуклеотидная последовательность 5'-CGGACAACTGTTGACCG3') для связывания Gal4 белка (Chasman и Kornberg, Mol. Cell Biol., ИЗ, 2916 (1990))
компонент b):
- промоторная последовательность cdc25C гена (Нуклеиновые кислоты -290 - + 121; Lucibello с сотр., EMBO J., 14, 132 (1995); Zwicker с сотр., Nucl. Acid. Res., 23, 3822 (1995); EMBO J., 14, 4514 (1995))
компонент с):
- последовательность GCCACC (Kodak, J. Cell. Biol., 108, 229 (1989))
- кДНК иммуноглобулинового сигнального пептида (нуклеотидная последовательность ≤ 63 до ≥ 107; Riechmann с сотр., Nature, 332, 323 (1988))
- кДНК человеческой β-глюкуронидазы (нуклеотидная последовательность ≤ 93 до ≥ 1982; Oshima с сотр., PNAS USA, 84, 685 (1987)
компонент а'):
- последовательность для связывания Gal4 белка (Chasman и Kornberg, Mol. J. Cell Biol., 10, 2916 (1990))
компонент b'):
- промоторная последовательность VEGF рецепторного гена (нуклеиновые кислоты -1195 - + ≥ 100; Morishita с сотр., J. Biol. Chem., 270, 27948 (1995))
компонент d):
- кДНК ДНК-связывающего домена Gal4 белка (аминокислоты 1-147; Chasman и Kornberg, Mol. J. Cell Biol., 10, 2916 (1990))
- кДНК ядерного локализационного сигнала SV40 (NLS) (большой TSV40; аминокислоты 126-132; PKKKRKV; Dingwall с сотр., TIBS, 16, 478 (1991))
- кДНК HSV-1 VP16 кислого трансактивационного домена (TAD) (аминокислоты 406-488, Triezenberg с сотр., Genes Developm., 2, 718 (1988); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)).
Индивидуальные компоненты конструкции связаны с помощью подходящих сайтов рестрикции, которые попутно вводятся на окончания различных элементов в ходе PCR амплификации. Такие компоненты связаны с помощью энзимов, которые специфичны к сайтам рестрикции, и ДНК-лигаз, известных специалистам в данной области. Такие энзимы могут быть получены коммерческим путем.
Эндотелиальные клетки человеческой пуповины и фибропласты (Wi-38), которые сохраняли в культуре, подвергали трансфекции в присутствии описанных плазмид с использованием метода, хорошо известного специалистам (Lucibello с сотр. , EMBO J., 14, 132 (1995), и количество β-глюкуронидазы, которая продуцируется эндотелиальными клетками, измеряли с использованием 4-метилумбеллиферил-β-глюкуронида в качестве субстрата.
С целью проверки специфичности к клеточному циклу эндотелиальные клетки синхронизировали в GO/GI путем удаления метионина в течение 48 часов. Содержание ДНК в клетках определяли в флуоресцентно-активированном клеточном сортере с последующим окрашиванием с помощью Hoechst 33258 (Hoechst AG, Frankfurt) (Lucibello с сотр., EMBO J., 14, 132 (1995).
Были получены следующие результаты
Оказалось невозможным установить какое-либо увеличение количества β-глюкуронидазы в трансфекцированных фибропластах по сравнению с нетрансфицированными фибропластами.
Трансфицированные эндотелиальные клетки экспрессируют заметно большее количество β-глюкуронидазы, чем нетрансфицированные эндотелиальные клетки.
Пролиферирующие эндотелиальные клетки (ДНК > 2S) секретируют заметно большее количество β-глюкуронидазы, чем эндотелиальные клетки, которые синхронизированы в GO/G1 (ДНК=2S).
Следовательно, самоусиливающаяся экспрессионная система, описанная выше, приводит к клеточно-специфичной, клеточной циклзависимой экспрессии β-глюкуронидазы структурного гена.
Эффективность экспрессии, вызванной новой самоусиливающейся экспрессионной системой, становится сравнимой с эффективностью двух экспрессионных систем, не являющихся самоусиливающимися. Такие последние системы получают в соответствии со схемами, изображенными на фиг.14 и 15.
В этом случае компоненты b), b') и с) имеют идентичные составы, как уже было описано для схемы, изображенной на фиг.13.
Индивидуальные компоненты конструкции связаны с помощью подходящих сайтов рестрикции, которые попутно вводятся на окончания различных элементов в ходе PCR амплификации. Такие компоненты соединены с использованием энзимов, которые специфичны к сайтам рестрикции, и ДНК-лигаз, которые известны специалистам. Эти энзимы могут быть получены коммерческим путем.
Нуклеотидную конструкцию, полученную таким образом, клонируют в pUC18/19 или Bluescript-производные плазмидные векторы.
Эндотелиальные клетки человеческой пуповины, которые сохраняются в культуре, трансфицировали описанными плазмидами с использованием способа, известного специалистам (Lucibello с сотр., EMBO J., 14, 132 (1995)), и количество β-глюкуронидазы, которое продуцируется эндотелиальными клетками, измеряли с использованием 4-метилумбеллиферил-β-глюкуронида в качестве субстрата.
Были получены следующие результаты.
Пролиферирующие эндотелиальные клетки, которые трансфицировали плазмидой, содержащей нуклеиновокислотную конструкцию, изображенную на фиг.14 и 15, экспрессируют заметно меньше β-глюкуронидазы, чем пролиферирующие эндотелиальные клетки, которые трансфицировали плазмидой, содержащей нуклеиново-кислотную конструкцию, изображенную на фиг.13.
Самоусиливающаяся экспрессионная система, описанная выше, вызывает заметно усиленную экспрессию β-глюкуронидазы структурного гена.
2. Конструирование самоусиливающейся фармакологически контролируемой экспрессионной системы.
Самоусиливающуюся, фармакологически контролируемую экспрессионную систему, соответствующую структуре, показанной на диаграмме фиг.11, получали для специфичной к клеточному циклу и фармакологически контролируемой экспрессии β-глюкуронидазы, как показано на фиг.16.
ДНК-последовательности индивидуальных компонентов соединяли друг с другом в направлении 5' к 3' следующим образом:
компонент i):
- последовательность (нуклеотидная последовательность 5'-CGGACAACTGTTGACCG-3') для связывания Gal4 белка (Chasman и Kornberg, Mol. Cell Biol., 10, 2916 (1990), главный промотор SV40 (нуклеотиды 48-5191; Tooze (ред.), DNA Tumor Viruses/ Cold Spring Harbor New York, N.Y., Cold Spring Harbor Laboratory)
компонент с):
- последовательность GCCACC (Kodak, J. Cell. Biol., 108, 229 (1989))
- кДНК иммуноглобулинового сигнального пептида (нуклеотидная последовательность ≤ 63 - ≥107; Riechmann с сотр., Nature, 332, 323 (1988))
- кДНК человеческой β-глюкуронидазы (нуклеотидная последовательность ≤ 93 - ≥1982; Oshima с сотр., PNAS USA 84, 685 (1987))
компонент е):
- последовательность для связывания Gal белка (Chasman и Kornberg, Mol. Cell Biol., 10, 2916 (1990),
- промоторная последовательность cdc25C гена (нуклеотиды -290-+121; Lucibello с сотр., ЕМВО J., 14, 132 (1995); Zwicker с сотр., Nuckl. Acids Res., 23, 3822 (1995) EMBO J, 14, 4514 (1995))
компонент f):
- кДНК активационного домена вируса герпеса VP16 (Greaves с сотр., J. Virol., 64, 2716 (1990); 65, 6705 (1991))
- кДНк рекомбинантного антициклоспорина A Fv (A) (белок А)
компонет g):
- соответствует компоненту е)
компонент h):
- кДНК рекомбинантного антициклоспорина А Fv (В) (белок В)
- кДНК ДНК-связывающего домена белка Gal4 (аминокислоты 1-147; Chasman и Kornberg, Mol. Cell Biol., 10, 2916 (1990))
- кДНК ядерного локализационного сигнала SV40 (NLS) (большой Т SV40; аминокислоты 126-132: PKKKRKV; Dingwall с сотр., TIBS 16, 478 (1991))
- кДНК для HSV-1 VP16 кислого трансактивационного домена (TAD) (аминокислоты 406-488; Triezenberg с сотр., Genes Developm., 2, 718 (1998); Triezenberg, Curr. Opin. Gen. Developm., 5, 190 (1995)).
Антитела против циклоспорина А получали по методу Cacalano с сотр., Mol. J. Immunol. , 29, 107 (1992). Для этой цели циклоспорин А сшивали с бычьим сывороточным альбумином с использованием 4-бензоилбензойной кислоты и УФ-освещения. Продукт сшивания несколько раз подкожно применяли на мышах Balb/c. Через 14 дней после последней иммунизации выделяли клетки селезенки. МРНК экстрагировали из таких клеток с использованием набора для экстракции мРНК (от фирмы Pharmacia, Freiburg). Затем применяли обратную транскрипцию для транскрибирования такой мРНК в кДНК с помощью набора для синтеза кДНК и рандомизированных гексаолигонуклеотидов (полученных от фирмы Pharmacia, Freiburg). Такая кДНК служила исходным материалом для амплификации вариабельной тяжелой цепи или вариабельной легкой цепи иммуноглобулинов с помощью полимеразной цепной реакции (Saiki с сотр., Science, 230, 1350 (1985)), с использованием специальных праймеров (Clackson с сотр., Nature, 352, 624 (1991); Sastry с сотр. , PNAS USA 86, 5728 (1989); Ward с сотр., Nature, 341, 544 (1989); Orlandi с сотр., PNAS USA 86, 3833, (1989)).
В то же время такие праймеры используются для введения сайтов рестрикционного расщепления, предназначенных для клонирования фрагментов в бактериальном экспрессионном векторе pHENIS (являющийся производным PHEN1; Hoogenboom с сотр. , Nucl. Acads. Res., 19, 4133 (1991); см. фиг.1). Такой вектор содержит pelB сигнальную последовательность для периплазмической секреции, myc tag для детекции с помощью моноклонального антитела 9Е10, гистидиновый tag для очистки с помощью иммобилизованной металл-аффинной хроматографии (IMAC), а также участок клонирования для тяжелой цепи и легкой цепи и короткую последовательность, которая кодирует глицин-сериновый линкер длиной в 14 аминокислот. Также осуществляли слияние с белком гена 3 (g3Р) в целях индикации на поверхности бактериофагов. Тяжелые и легкие цепи переваривали соответствующими рестрикционными энзимами (VH-Sfil и Shol; VL - ApaL I и NotI) и последовательно клонировали в вектор. В результате этого получали рекомбинантный одноцепочечный FV фрагмент, содержащий вариабельную тяжелую цепь и вариабельную легкую цепь, которые ковалентно соединены с помощью короткой пептидной последовательности.
В соответствии с фаг-индикацией фрагментов антитела антигенсвязывающие домены клонировали в виде scFv фрагментов (McCafferty с сотр., Nature, 34 8, 552 (1990)), как слитые белки с оболочкой дЗР нитчатого бактериофага, а фагмидные векторы (Breitling с сотр., Gene, 104, 147 (1994)). Антигенсвязывающие фаги подвергали селекции на загруженных циклоспорином А пластиковых подложках (panning) (Marks с сотр., J. Mol. Biol., 22, 581 (1991)).
Фаги, которые связывались с циклоспорином А клонировали и размножали и затем еще раз селекционировали на загруженных циклоспорином А пластиковых подложках. После четырехкратного селекционирования выбирали два клона (белки А и В), которые не ингибируют связывание каждого из них с циклоспорином А.
Мышиные рекомбинантные Fv фрагменты (белки А и В) гуманизировали специальной заменой гипервариабельных участков человеческих антител соответствующими участками мышиного рекомбинантного Fv фрагмента (Jones с сотр., Nature, 321, 522 (1987)).
Конструкцию соединяли с помощью подходящих рестрикционных сайтов, которые вводили в окончания различных элементов в ходе PCR амплификации. Такое соединение осуществляли с использованием энзимов, являющихся специфическими в отношении сайтов рестрикции, и ДНК лигаз, известных специалистам. Такие энзимы могут быть получены коммерческим образом.
Полученную таким образом нуклеотидную конструкцию клонировали в pUC18/19-производные или Bluescript-производные плазмидные векторы.
Эндотельные клетки человеческой пуповины, которые сохраняли в культуре, подвергали трансфекции описанной плазмидой с использованием способа, известного специалисту в данной области (Lucibello с сотр., EMBO J., 14, 132 (1995)), и количество β-глюкуронидазы, продуцируемое эндотелиальными клетками при добавлении и без добавления циклоспорина А (0,01-1,0 мкг/мл культурной среды), измеряли с использованием 4-метилумбеллиферил-β-глюкуронида в качестве субстрата.
В целях проверки специфичности к клеточному циклу эндотелиальные клетки синхронизировали в GO/G1 путем удаления метионина в течение 48 часов. Содержание ДНК в клетках определяли в флуоресцентно-активированном клеточном сортере с последующим окрашиванием с помощью Hoechst 33258 (Hoechst AG, Frankfurt) (Lucibello с сотр., ЕМВО J., 14, 132 (1995)).
Были получены следующие результаты
В отсутствие добавленного циклоспорина А не удается зарегистрировать какое-либо увеличение количества β-глюкуронидазы в трансфекцированных эндотелиальных клетках по сравнению с нетрансфицированными эндотелиальными клетками.
После добавления циклоспорина А, трансфицированные эндотелиальные клетки экспрессируют заметно больше β-глюкуронидазы, чем нетрансфицированные эндотелиальные клетки.
Пролиферирующие эндотелиальные клетки (ДНК>2S) секретируют заметно большее количество β-глюкуронидазы, чем эндотелиальные клетки, синхронизированные в GO/G1 (ДНК=2S).
Самоусиливающаяся экспрессионная система, описанная выше, обеспечивает экспрессию β-глюкуронидазы структурного гена, которая зависима от клеточного цикла и может контролироваться добавлением циклоспорина А.
Интенсивность экспрессии, достигаемая с помощью новой самоусиливающейся, фармакологически контролируемой экспрессионной системы, выше той, что достигается с помощью несамоусиливающейся экспрессионной системы, которая была получена в Примере 1) в соответствии с диаграммой, изображенной на фиг.14.
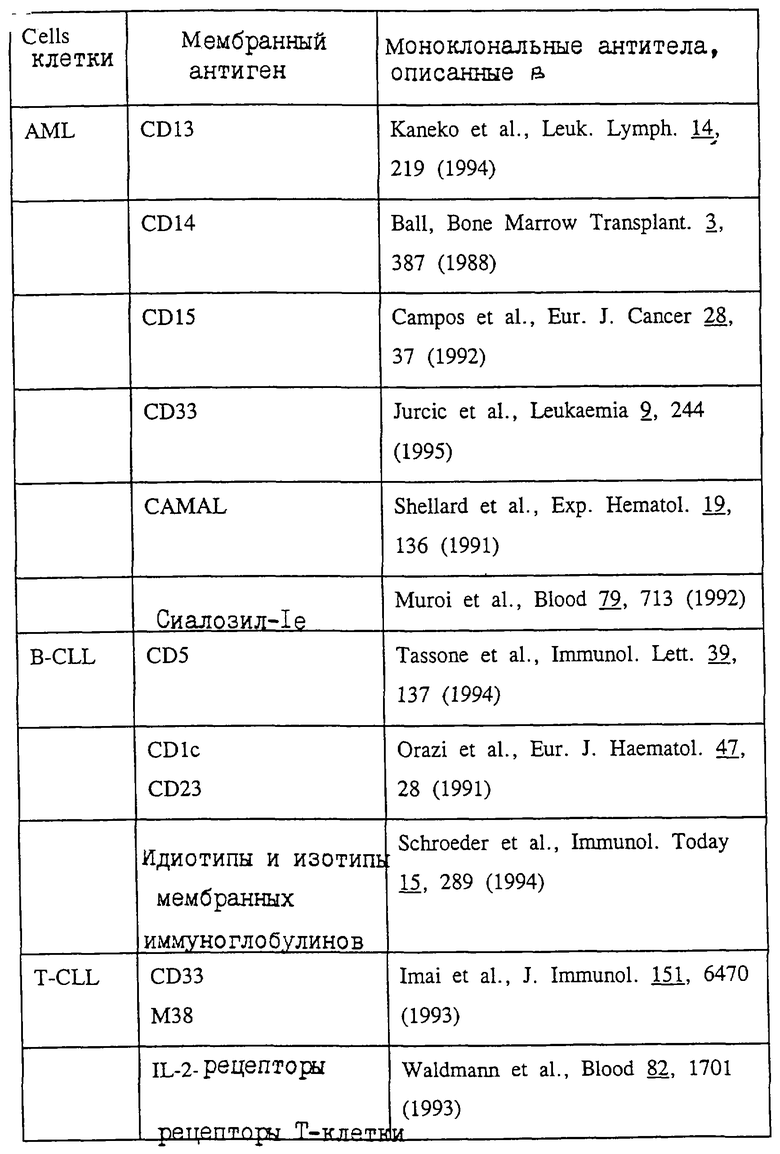

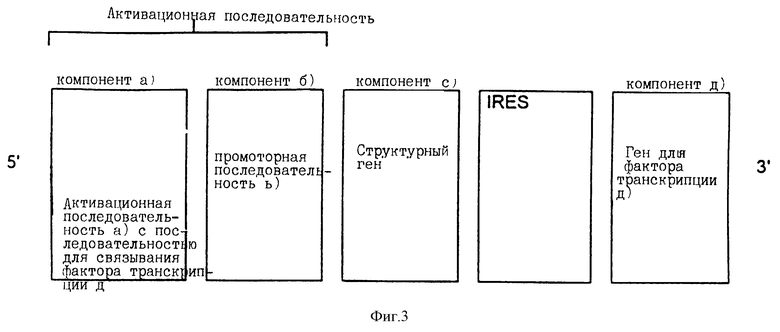
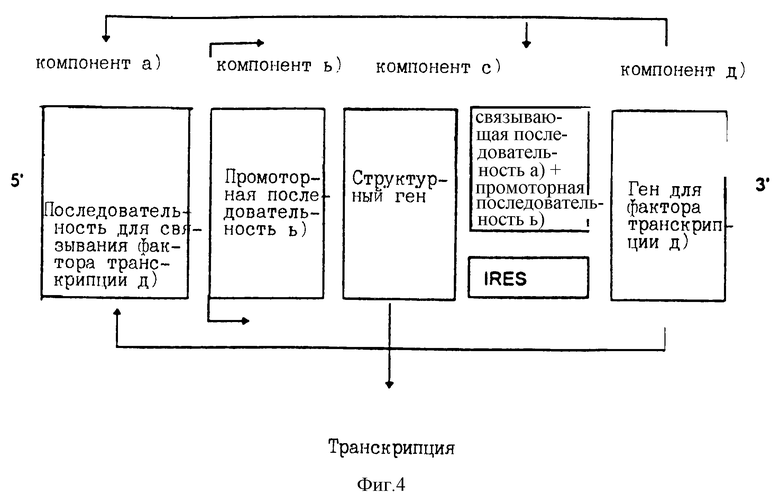
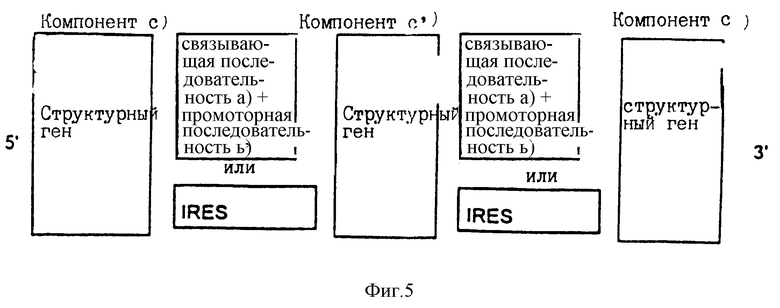
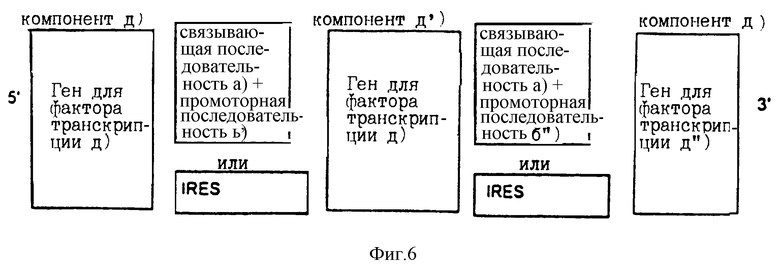
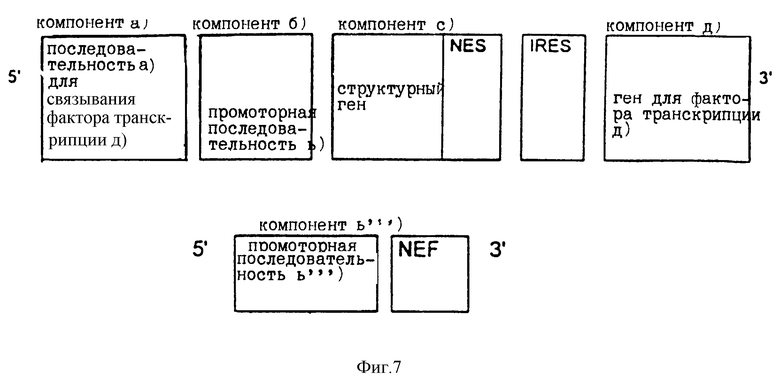
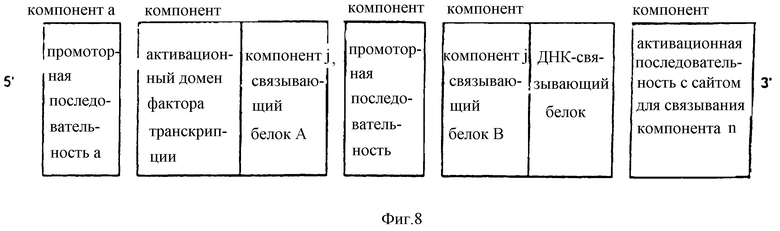
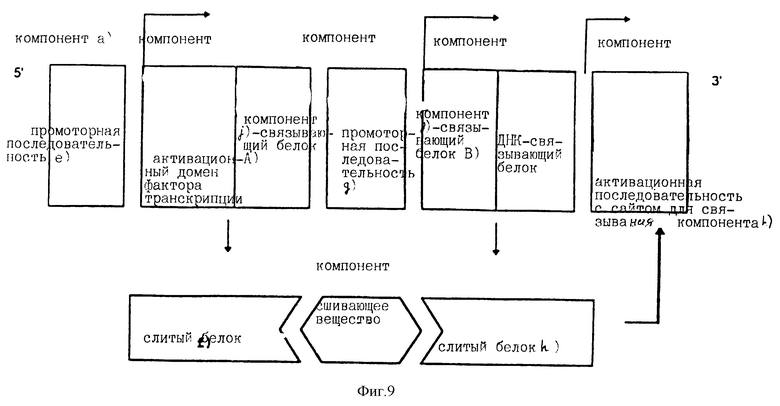
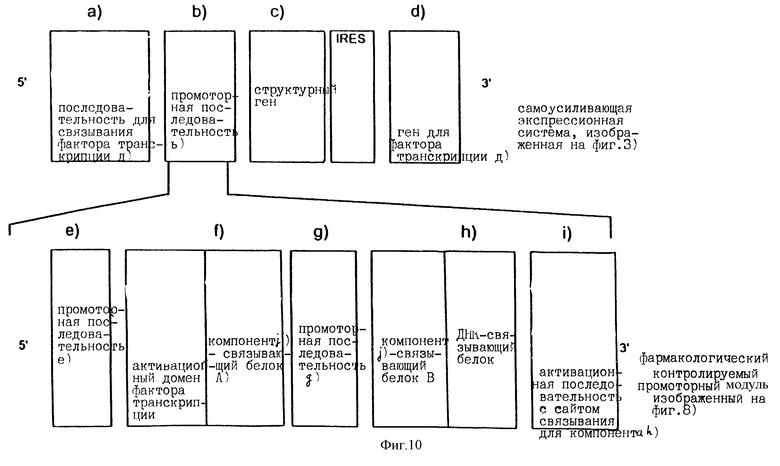
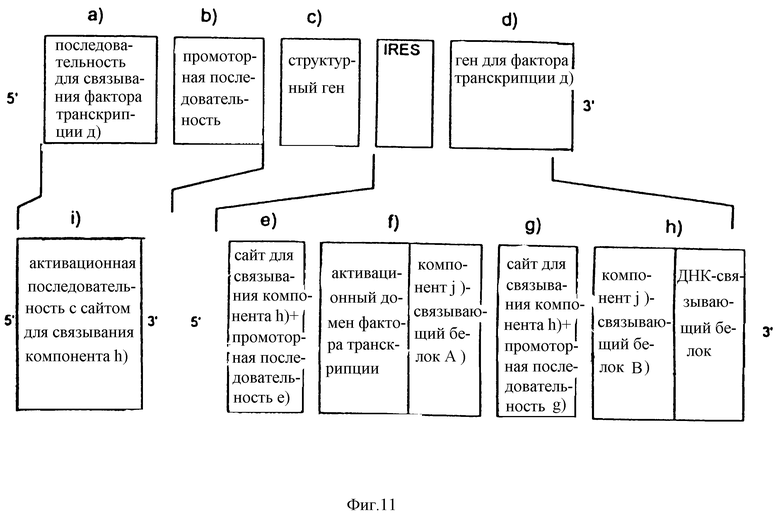
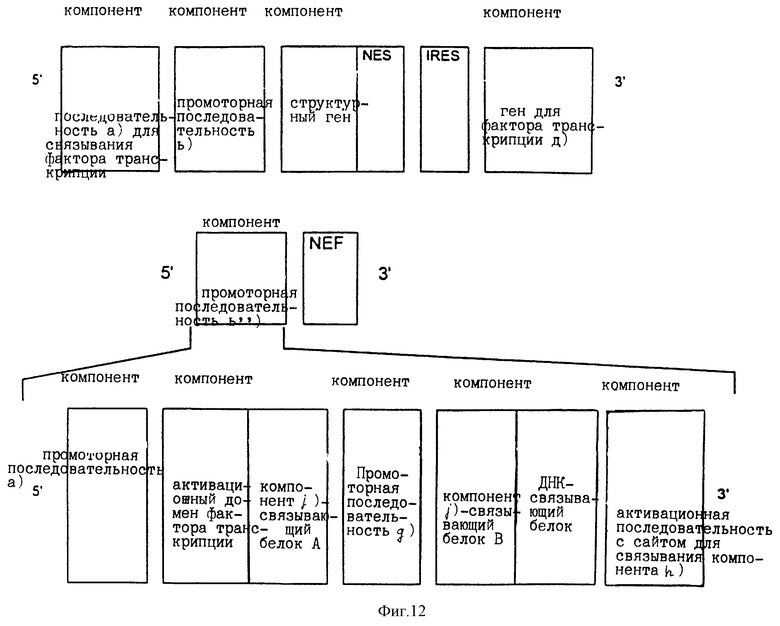
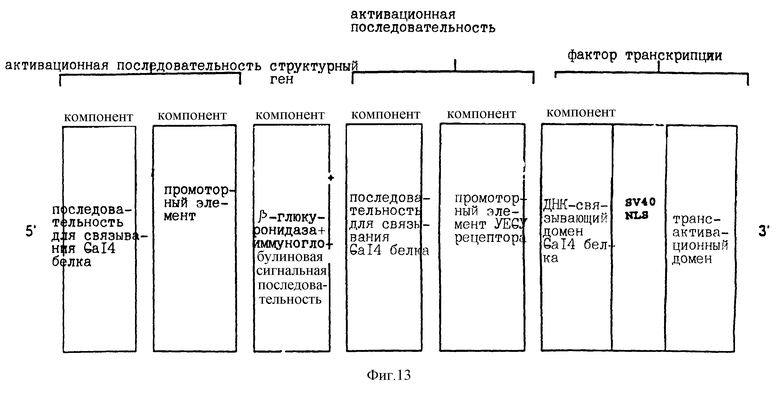
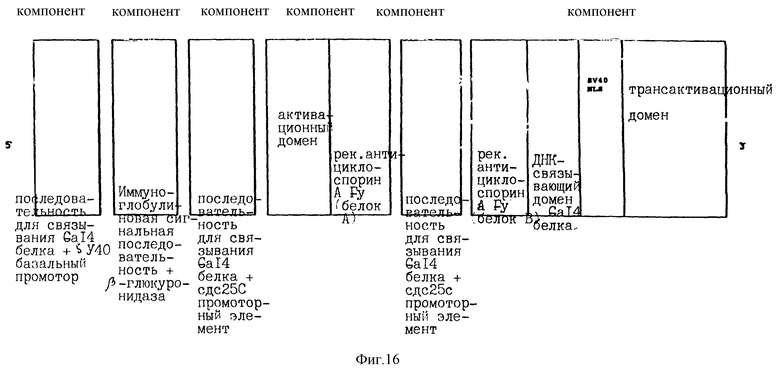
Изобретение относится к нуклеиново-кислотной конструкции, составляющей самоусиливающуюся экспрессионную систему. Сущность изобретения: система включает по крайней мере один первый структурный ген, кодирующий активное соединение, по крайней мере один второй структурный ген, кодирующий белок фактора транскрипции и по крайней мере одну активационную последовательность, состоящую из по крайней мере одной последовательности, связывающей белок фактора транскрипции, и по крайней мере одной промоторной последовательности, причем каждая активационная последовательность активирует экспрессию структурного гена и экспрессию белка фактора транскрипции. Предлагается применение нуклеиново-кислотной конструкции для получения лекарства для лечения заболеваний. Преимущество изобретения заключается в разработке подхода, обеспечивающего повышение трансъемной экспрессии. 5 с. и 29 з.п. ф-лы, 1 табл., 16 ил.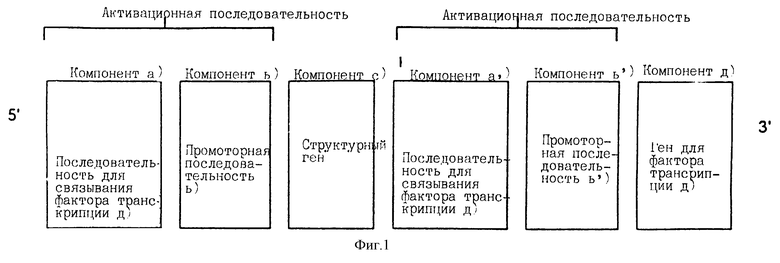
| ЕР 0485701 А, 20.05.1992 | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| COOK D.N., O`BRIEN D.A., HEARST J.E | |||
| Analysis of the promoter and regulatory seguences оf an oxygen-regulated brh operon in Rhodobacter capsulated by Site-directed mutagenesis | |||
| Bacteriology | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| Ручной прибор для загибания кромок листового металла | 1921 |
|
SU175A1 |
| Телефон | 1924 |
|
SU2037A1 |
Авторы
Даты
2003-02-10—Публикация
1997-12-10—Подача