РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по условной заявке США No. 61/252638, поданной 16 октября 2009 года. Содержание указанной выше заявки включено в настоящий документ в качестве ссылки в полном объеме.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДОСТАВЛЕННЫЙ ЧЕРЕЗ EFS-WEB
Эта заявка была подана в электронной форме через сервер USPTO EFS-WEB, что разрешено и указано в MPEP § 1730 II.B.2.(a)(A), и эти поданные в электронной форме документы включают представленный в электронной форме список последовательностей (SEQ ID); полное содержание этого списка последовательностей включено в настоящий документ в качестве ссылки для любых целей. Список последовательностей обозначен на поданном в электронном виде файле.txt следующим образом:
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, главным образом, к ферментам фосфолипазам, полинуклеотидам, кодирующим эти ферменты, способам получения и применения этих полинуклеотидов и полипептидов. В альтернативных вариантах осуществления изобретение относится к ферментам фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), нуклеиновым кислотам, кодирующим их, антителам, которые специфично связываются с ними и способам их получения и применения. Предусматриваются промышленные способы и продукты, включающие применение этих фосфолипаз. Также в настоящем документе предусматриваются способы гидратации негидратируемых фосфолипидов (NHP) в липидной матрице.
Способы обеспечивают миграцию NHP к поверхности контакта масло-вода, тем самым позволяя проведение реакции или удаление NHP из липидов. В определенных вариантах осуществления предусматриваются способы удаления NHP, гидратируемых фосфолипидов и лецитинов (в совокупности, известных как "камеди") из растительных масел с получением продукта в виде рафинированного масла или жира, который можно использовать для производства продуктов питания и/или непищевых применений. В определенных вариантах осуществления в настоящем документе предусмотрены способы гидратации NHP с последующей ферментативной обработкой и удалением различных фосфолипидов и лецитинов. Способы, представленные в настоящем документе, можно применять на практике либо для неочищенных, либо для рафинированных гидратацией масел. В определенном варианте осуществления в настоящем документе предусмотрены способы получения фосфолипидов из пищевого масла.
УРОВЕНЬ ТЕХНИКИ
Неочищенные растительные масла, получаемые способами либо прессования, либо экстракции растворителем, представляют собой комплексную смесь триацилглицеринов, фосфолипидов, стеринов, токоферолов, свободных жирных кислот, металлических микроэлементов и других менее значительных соединений. Является желательным удаление фосфолипидов, свободных жирных кислот и металлических микроэлементов для получения качественного салатного масла с мягким вкусом, светлым цветом и длительным сроком годности, или масла, пригодного для преобразования в сырье, готовое для химической или ферментативной конверсии в биотопливо (метиловые или этиловые сложные эфиры), биопластик (эпоксидированное масло) и другие традиционные материалы на основе нефти.
Удаление фосфолипидов обуславливает практически все потери, связанные с очисткой растительных масел. Большинство молекул фосфолипидов обладают как гидрофильной функциональной группой, так и липофильными цепями жирных кислот, они обычно являются превосходными природными эмульгаторами. Функциональная группа в фосфолипидах может представлять собой любую или несколько из множества известных типов, некоторые из которых проиллюстрированы на схеме 1 ниже.
Схема 1: Функциональные группы в фосфолипидах
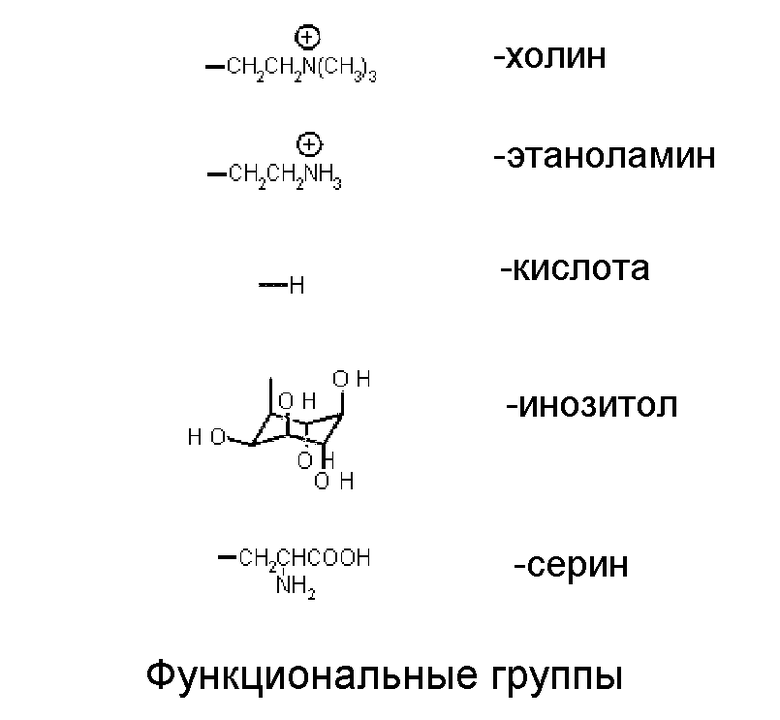
Фосфолипиды, содержащие функциональные группы: -холин, -инозитол и -этаноламин, обладают наилучшей аффинностью к воде, в то время как кислоты, соли кислот (с кальцием (Ca), магнием (Mg) и железом (Fe)) и соли -этаноламина (Ca, Mg и Fe) обладают значительно более низкой аффинностью к воде. Фосфатидная кислота и соли фосфатидной кислоты широко известны как "негидратируемые фосфолипиды" или NHP. Таблица 1 содержит относительные степени гидратации различных фосфолипидов, как описано в Sen Gupta, A. K., Fette Seifen Anstrichmittel 88, pages 79-86 (1986), и позднее в Segers, J.C., et al., "Degumming-Theory and Practice", опубликованной American Oil Chemists's Society в "Edible fats and Oils processing: basic principals and modern practices: World conference proceedings" / edited by David Erickson, (1990) pages 88-93.
Относительные степени гидратации
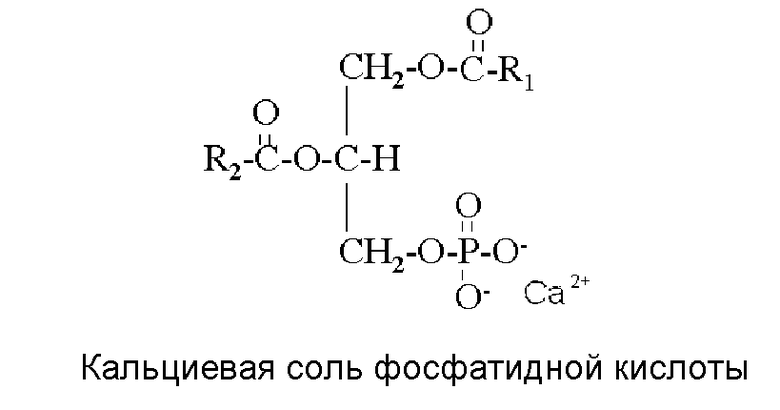
Соли фосфолипидов с кальцием, магнием и железом образуются ферментом, присутствующим в масличных семенах, фосфолипазой D (PLD). Фермент остается бездействующим в зрелом семени до тех пор, пока не повреждается защитное покрытие семени в ходе хранения или "подготовки" семян перед извлечением масла. Реакция PLD в семени приводит к отщеплению -холина, -инозитола, -серина или -этаноламина от фосфатной группы с образованием Фосфатидной кислоты (PA). Кроме того, поскольку отщепление происходит в присутствии избытка двухвалентных металлов (Ca, Mg и Fe), образуются NHP. Комплекс фосфатидной кислоты с ионами кальция представлен ниже:
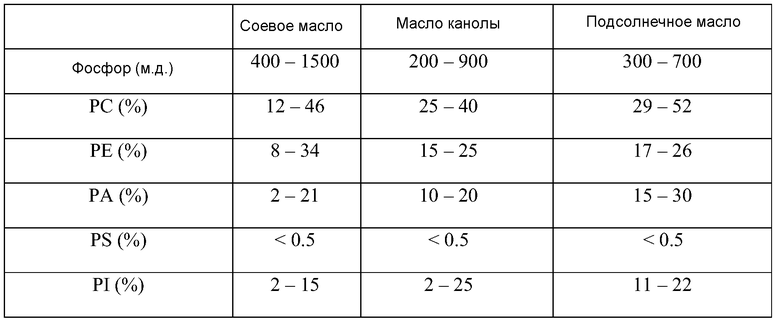
Фосфолипиды обычно измеряют в масле в качестве "содержания фосфора" в миллионных долях. В таблице 2 представлены типичные количества фосфолипидов, присутствующих в основных масличных культурах, и распределение различных функциональных групп в качестве процента фосфолипидов, присутствующих в масле.
Типичные уровни и распределение фосфолипидов для основных масличных семян
В таблице 3 ниже представлены типичные количества и распределения фосфолипидов для соевых камедей. В таблице 3, "как есть" означает типичную композицию фосфолипидов, удаленных из растительного масла, с удерживаемым маслом (2 молекулы фосфолипидов и 1 молекула масла), дающую содержание нерастворимых в ацетоне веществ, равное 67%. "Нормализованная" означает композицию фосфолипидов без какого-либо присутствующего масла, дающую содержание нерастворимых в ацетоне веществ, равное 100%.
Типичные количества фосфолипидов и распределения для соевых камедей
Конверсия фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерин, фосфатидилинозитола и фосфатидной кислоты в их лизо- или фосфо- формы значительно изменяет экономические показатели рафинирования в современном промышленном процессе очистки. Конверсия всех фосфолипидов в их лизо-формы, устраняющая потерю нейтральных масел, соответствует увеличению выхода вплоть до 1,4%, в то время как конверсия всех фосфолипидов в их фосфо-формы соответствует увеличению выхода масла вплоть до 3,0% для неочищенного масла с содержанием фосфора 1000 м.д. на протяжении рафинирования гадратацией.
Фосфолипиды можно частично или полностью удалять из растительных масел несколькими различными известными способами. Наиболее широко используемыми процессами в промышленности является рафинирование гидратацией, рафинирование кислотой, очистка щелочью и ферментативное рафинирование. Иллюстративные способы описаны в патентах США No. 4049686; 4698185; 5239096; 5264367; 5286886; 5532163; 6001640; 6103505; U.S. 6127137; 6143545; 6172248; 6548633; 7494676 и 7226771, и публикациях США no. 2007/0134777, 2005/0059130, 2008/0182322 и 2009/0069587.
Существующие способы не являются достаточными для удаления или реакции негидратируемых фосфолипидов, присутствующих в масле, поскольку NHP не доступны для гидратации или реакции для обеспечения их удаления.
Существует потребность в экономичных и эффективных способах удаления NHP, гидратируемых фосфолипидов и лецитинов (в совокупности известных как "камеди") из растительных масел для получения продукта в виде рафинированного масла или жира, который можно использовать для производства продуктов питания и/или непищевых применений.
Фосфолипазы представляют собой ферменты, которые гидролизуют сложноэфирные связи фосфолипидов. В соответствии с их значением в метаболизме фосфолипидов, эти ферменты широко распространены среди прокариот и эукариот. Фосфолипазы влияют на метаболизм, конструирование и реорганизацию биологических мембран и вовлечены в каскады передачи сигнала. Известно несколько типов фосфолипаз, которые отличаются их специфичностью в зависимости от положения связи, на которую осуществляется воздействие в молекуле фосфолипида.
Ферменты фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) представляют собой семейство эукариотических внутриклеточных ферментов, которые играют важную роль в процессах передачи сигнала. Катализируемая PI-PLC реакция представляет собой:
1-фосфатидил-1D-миоинозитол 4,5-бифосфат (также называемый PIP2, фосфатидилинозитолбифосфатом) + H2O↔1D-миоинозитол 1,4,5-трифосфат (также называемый IP3, инозитолтрифосфатом) + диацилглицерин.
Семейства ферментов фосфолипазы C (PLC) идентифицированы в бактериях и в эукариотических трипаносомах. Ферменты PLC относятся к семейству гидролаз и фосфодиэстераз. PLC участвуют в метаболизме фосфатидилинозитол-4,5-бифосфата (PIP2) и каскадах липидной передачи сигнала зависимым от кальция образом. Изоформы PLC могут отличаться их способом активации, уровнями экспрессии, каталитической регуляцией, локализацией в клетке, авидностью связывания с мембранами и распределением в тканях. Все они способны катализировать гидролиз PIP2 на две важных молекулы вторичных посредников, которые продолжают каскад для изменения клеточных ответов, таких как пролиферация, дифференцировка, апоптоз, ремоделирование цитоскелета, везикулярный транспорт, проводимость ионных каналов, эндокринная функция и нейротрансмиссия. PLC описаны, например, в Carmen G., J. Biol. Chem. 270 (1995) 1871 1-18714, Jianag Y., J. Biol. Chem, 271 (1996) 29528-29532, Waggoner D., J. Biol. Chem. 270 (1995) 19422-19429, Molecular Probes Product Sheet 2001, и Sano et al, Am. J. Physiol. Lung Cell Mol. Physiol. 281: 844-851, 2001.
Ферменты фосфолипазы A1 (PLA1) удаляют жирную кислоту в 1 положении с образованием свободной жирной кислоты и 1-лизо-2-ацилфосфолипида. Ферменты фосфолипазы A2 (PLA2) удаляют жирную кислоту во 2 положении с образованием свободной жирной кислоты и 1-ацил-2-лизофосфолипида. Ферменты PLA1 и PLA2 могут быть внутри- или внеклеточными, мембраносвязанными или растворимыми. Внутриклеточная PLA2 встречается практически в каждой клетке млекопитающих. Ферменты фосфолипазы C (PLC) удаляют фосфатную группу с образованием 1,2-диацилглицерина и фосфатного сложного эфира. Ферменты фосфолипазы D (PLD) образуют 1,2-диацилглицерофосфат и основную группу.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе предусматриваются полипептиды и полинуклеотиды, кодирующие полипептиды, имеющие активность фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) или эквивалентного фермента, и/или активность другой фосфолипазы, включая активность фосфолипазы A, B, C, D, пататина, фосфатазы фосфатидной кислоты (PAP) и/или ацилгидролазы липидов (LAH) или эквивалентного фермента, и способы получения и применения этих полинуклеотидов и полипептидов. В одном аспекте в настоящем документе предусматриваются полипептиды, например, ферменты, обладающие активностью фосфолипазы, например, активностью фосфолипазы A, B, D или C, например, активностью фосфатидилинозитол-специфической фосфолипазы C (PI-PLC). Ферментативная активность полипептидов и пептидов, представленных в настоящем документе, включает (содержит или состоит из) активность фосфолипазы, активность фосфолипазы C или активность фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), включая гидролиз липидов, реакции ацидолиза (например, замена этерифицированной жирной кислоты свободной кислотой), реакции трансэтерификации (например, обмен жирными кислотами между триацилглицеридами), синтез сложных эфиров, реакции переэтерификации, и активность ацилгидролазы липидов (LAH). В другом аспекте полипептиды, представленные в настоящем документе, используют для синтеза энантиомерно чистых хиральных продуктов. Полипептиды, представленные в настоящем документе, можно использовать в различных фармацевтических, сельскохозяйственных и промышленных контекстах, включая производство косметических средств и нутрицевтиков.
Кроме того, полипептиды, представленные в настоящем документе, можно использовать в пищевой промышленности, пиоварении, добавках для ванн, производстве спирта, синтезе пептидов, энантиоселективности, получении шкур в кожевенной промышленности, обработке отходов и деградации животных отходов, регенерации серебра в фотопромышленности, медицинском обслуживании, обесклеивании шелка, деградации биопленки, конверсии биомассы в этанол, биологической защите, противомикробных средствах и дезинфицирующих средствах, средствах для персонального ухода и косметических средствах, биотехнологических реагентах, в увеличении выхода крахмала в процессе влажного измельчения кукурузы, и в качестве фармацевтических средств, таких как способствующие пищеварению средства и противовоспалительные (антифлогистонные) средства.
В определенных вариантах осуществления в настоящем документе предусматриваются композиции (например, фосфолипаза, фосфолипаза C, фосфатидилинозитол-специфическая фосфолипаза C (PI-PLC)) и способы получения масел с низким содержанием фосфолипидов, например, масел с более низким содержанием фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилинозитола и/или фосфатидной кислоты. Композицией или способом, предусмотренными в настоящем документе, можно обрабатывать любое масло, например, растительное масло, например, масло канолы, соевое масло или животное масло или жир, например, сало. Любые продукты питания, готовые в пищу продукты, или продукты выпекания, жарки или варки (например, соусы, маринады, приправы, распыляемые масла, маргарины, масла для выпекания, майонез, кулинарные жиры, салатные масла, черпаемые ложкой и наливаемые приправы, и т.п., и продукты, изготовленные с ними) могут содержать растительное масло или животный жир, обработанные композицией или способом, предусмотренными в настоящем документе. Растительные масла, модифицированные в масла с более низким содержанием фосфолипидов, можно применять в любых продуктах питания, годных в пищу продуктах или продуктах выпекания или варки, например, соусах, маринадах, приправах, распыляемых маслах, маргаринах, маслах для выпекания, майонезе, кулинарных жирах, салатных маслах, черпаемых ложкой и наливаемых приправах и т.п. В одном варианте осуществления в настоящем документе предусмотрены масла, такие как растительные масла, например, масло канолы или соевое масло, и продукты питания или продукты выпекания или варки, включая соусы, маринады, приправы, распыляемые масла, маргарины, масла для выпекания, майонез, кулинарные жиры, салатные масла, черпаемые ложкой и наливаемые приправы и т.п., где масло или продукт питания, продукт выпекания или варки модифицированы с использованием фермента, представленного в настоящем документе. В одном аспекте эти растительные масла, например, масло канолы, касторовое масло, кокосовое масло, кориандровое масло, кукурузное масло, хлопковое масло, масло лесного ореха, конопляное масло, льняное масло, масло пенника лугового, оливковое масло, пальмовое масло, пальмоядровое масло, арахисовое масло, рапсовое масло, рисовое масло, сафлоровое масло, масло сасанквы, соевое масло, подсолнечное масло, таловое масло, масло камелии, различные виды "природных" масел, имеющих измененный состав жирных кислот, полученных с помощью генетически модифицированных организмов (GMO) или традиционной "селекции", такие как высокоолеиновое, низколиноленовое или низконасыщенное масло (высокоолеиновое масло канолы, низколиноленовое соевое масло или высокостеариновые подсолнечные масла), животные жиры (таловый жир, сало, жир масла и куриный жир), рыбий жир (жир тихоокеанской корюшки, жир печени трески, жир хоплостета, жир сардин, жир сельди и жир менхадена), или смеси любых из указанных выше, и продукты питания или продукты выпекания, жарки или варки, содержат масла с более низким содержанием жирных кислот, включая масла с низким содержанием пальмитиновой кислоты, миристиновой кислоты, лауриновой кислоты, стеариновой кислоты, каприловой кислоты (октановая кислота) и т.д., переработанные с использованием композиции или способ, представленных в настоящем документе.
В одном аспекте в настоящем документе предусмотрены полипептиды, например, ферменты и каталитические антитела, обладающие активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), термостабильными и термоустойчивыми видами ферментативной активности, и специфическими к жирным кислотам или селективными к жирным кислотам видами активности, и видами ферментативной активности, устойчивыми к низким или высоким значениям pH, и полинуклеотиды, кодирующие эти полипептиды, включая векторы, клетки-хозяева, трансгенные растения и не являющихся человеком животных, и способы получения и применения этих полинуклеотидов и полипептидов.
В другом аспекте в настоящем документе предусматриваются выделенные, синтетические или рекомбинантные нуклеиновые кислоты (a), кодирующие полипептид, обладающий ферментативной активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), и
(i) обладающие по меньшей мере приблизительно 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, или 100% идентичностью последовательности с SEQ ID NO: 5 и кодирующие полипептид, имеющий по меньшей мере одно, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать одно, двадцать два, двадцать три, двадцать четыре, двадцать пять, двадцать шесть, двадцать семь, двадцать восемь, двадцать девять или тридцать или более, или все из аминокислотных изменений (мутаций), состоящих из изменений, описанных в таблице 12, таблице 13, таблице 14 и/или таблице 15, или эквивалентных аминокислотных замен или мутаций, или любую их комбинацию,
и необязательно идентичность последовательностей определяют с помощью анализа с алгоритмом сравнения последовательностей или визуальным исследованием,
и необязательно алгоритм сравнения последовательностей представляет собой алгоритм BLAST версии 2.2.2, где установлены параметры фильтрования: blastall-p blastp-d "nr pataa" -F F, и все другие параметры установлены как параметры по умолчанию;
(ii) кодирующие полипептид, обладающий аминокислотной последовательностью, как указано в SEQ ID NO: 6 и имеющий по меньшей мере одно, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать одно, двадцать два, двадцать три, двадцать четыре, двадцать пять, двадцать шесть, двадцать семь, двадцать восемь, двадцать девять или тридцать или более, или все из аминокислотных изменений (мутаций), состоящих из изменений, описанных в таблице 12, таблице 13, таблице 14 и/или таблице 15, или эквивалентных аминокислотных изменений или замен (мутаций), или любую их комбинацию.
(iii) гибридизующиеся в жестких условиях с нуклеиновой кислотой, содержащей SEQ ID NO: 5 и кодирующей полипептид, имеющий по меньшей мере одно, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать одно, двадцать два, двадцать три, двадцать четыре, двадцать пять, двадцать шесть, двадцать семь, двадцать восемь, двадцать девять или тридцать или более, или все из аминокислотных изменений (мутаций), состоящих из изменений, описанных в таблице 12, таблице 13, таблице 14 и/или таблице 15, или эквивалентных аминокислотных изменений или замен (мутаций), или любую их комбинацию,
где жесткие условия включают стадию промывания, включающую промывание в 0,2X SSC при температуре приблизительно 65°C в течение приблизительно 15 минут;
(iv) представляющие собой нуклеиновую кислоту, содержащую последовательность SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 10 или состоящую из них; или
(v) имеющие по меньшей мере приблизительно 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, или 100% идентичность последовательности с SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 10;
(b) последовательность нуклеиновой кислоты согласно (a), кодирующая полипептид, имеющий ферментативную активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), но лишенная нативной сигнальной последовательности или аминокислотной последовательности пробелка;
(c) последовательность нуклеиновой кислоты согласно (a) или (b), кодирующая полипептид, обладающий ферментативной активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), но лишенная нативной промоторной последовательности;
(d) нуклеиновая кислота согласно (c), кроме того, содержащая гетерологичную промоторную последовательность или другую последовательность регуляции транскрипции;
(e) последовательность нуклеиновой кислоты по любому из (a)-(d), кроме того, содержащая нуклеиновую кислоту, кодирующую гетерологичную аминокислотную последовательность, или, кроме того, содержащую гетерологичную нуклеотидную последовательность;
(f) нуклеиновая кислота согласно (e), где нуклеиновая кислота, кодирующая гетерологичную аминокислотную последовательность, содержит или состоит из последовательности, кодирующей гетерологичную (лидерную) сигнальную последовательность, или метку или эпитоп, или гетерологичная нуклеотидная последовательность содержит гетерологичную промоторную последовательность;
(g) нуклеиновая кислота согласно (d), (e) или (f), где гетерологичная нуклеотидная последовательность кодирует гетерологичную (лидерную) сигнальную последовательность, содержащую или состоящую из N-концевого и/или C-концевого удлинения для направления в эндоплазматическую сеть (ER) или эндомембрану, или в растительную эндоплазматическую сеть (ER) или эндомембранную систему, или гетерологичная последовательность кодирует участок рестрикции;
(h) нуклеиновая кислота согласно (d), (e) или (f), где гетерологичная промоторная последовательность содержит или состоит из конститутивного или индуцибельного промотора, или специфического для типа клеток промотора или специфического для растения промотора или специфического для бактерий промотора;
(i) нуклеиновая кислота согласно любому из (a)-(h), где активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), является термостабильной;
(j) нуклеиновая кислота согласно любому из (a)-(h), где активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), является термоустойчивой;
(k) последовательность нуклеиновой кислоты, полностью комплементарная нуклеотидной последовательности согласно любому из (a)-(j).
В одном аспекте выделенная, синтетическая или рекомбинантная нуклеиновая кислота кодирует полипептид или пептид, обладающий активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), которая является термостабильной. Полипептиды и пептиды, кодируемые нуклеиновыми кислотами, представленными в настоящем документе, или любой полипептид или пептид, представленный в настоящем документе, могут сохранять ферментативную или связывающую активность (например, связывание субстрата) в условиях, включающий диапазон температур от приблизительно -100°C до приблизительно -80°C, от приблизительно -80°C до приблизительно -40°C, от приблизительно -40°C до приблизительно -20°C, от приблизительно -20°C до приблизительно 0°C, от приблизительно 0°C до приблизительно 5°C, от приблизительно 5°C до приблизительно 15°C, от приблизительно 15°C до приблизительно 25°C, от приблизительно 25°C до приблизительно 37°C, от приблизительно 37°C до приблизительно 45°C, от приблизительно 45°C до приблизительно 55°C, от приблизительно 55°C до приблизительно 70°C, от приблизительно 70°C до приблизительно 75°C, от приблизительно 75°C до приблизительно 85°C, от приблизительно 85°C до приблизительно 90°C, от приблизительно 90°C до приблизительно 95°C, от приблизительно 95°C до приблизительно 100°C, от приблизительно 100°C до приблизительно 105°C, от приблизительно 105°C до приблизительно 110°C, от приблизительно 110°C до приблизительно 120°C, или 95°C, 96°C, 97°C, 98°C, 99°C, 100°C, 101°C, 102°C, 103°C, 104°C, 105°C, 106°C, 107°C, 108°C, 109°C, 110°C, 111°C, 112°C, 113°C, 114°C, 115°C или более. В настоящем документе предусмотрены термостабильные полипептиды, которые сохраняют активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), при температуре в диапазонах, описанных выше, при приблизительно pH 3,0, приблизительно pH 3,5, приблизительно pH 4,0, приблизительно pH 4,5, приблизительно pH 5,0, приблизительно pH 5,5, приблизительно pH 6,0, приблизительно pH 6,5, приблизительно pH 7,0, приблизительно pH 7,5, приблизительно pH 8,0, приблизительно pH 8,5, приблизительно pH 9,0, приблизительно pH 9,5, приблизительно pH 10,0, приблизительно pH 10,5, приблизительно pH 11,0, приблизительно pH 11,5, приблизительно pH 12,0 или более.
В одном аспекте полипептиды, представленные в настоящем документе, могут быть термоустойчивыми и могут сохранять активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) после воздействия температуры в диапазоне от приблизительно -100°C до приблизительно -80°C, от приблизительно -80°C до приблизительно -40°C, от приблизительно -40°C до приблизительно -20°C, от приблизительно -20°C до приблизительно 0°C, от приблизительно 0°C до приблизительно 5°C, от приблизительно 5°C до приблизительно 15°C, от приблизительно 15°C до приблизительно 25°C, от приблизительно 25°C до приблизительно 37°C, от приблизительно 37°C до приблизительно 45°C, от приблизительно 45°C до приблизительно 55°C, от приблизительно 55°C до приблизительно 70°C, от приблизительно 70°C до приблизительно 75°C, от приблизительно 75°C до приблизительно 85°C, от приблизительно 85°C до приблизительно 90°C, от приблизительно 90°C до приблизительно 95°C, от приблизительно 95°C до приблизительно 100°C, от приблизительно 100°C до приблизительно 105°C, от приблизительно 105°C до приблизительно 110°C, от приблизительно 110°C до приблизительно 120°C, или 95°C, 96°C, 97°C, 98°C, 99°C, 100°C, 101°C, 102°C, 103°C, 104°C, 105°C, 106°C, 107°C, 108°C, 109°C, 110°C, 111°C, 112°C, 113°C, 114°C, 115°C или более.
В некоторых вариантах осуществления термоустойчивые полипептиды сохраняют активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) после воздействия температуры в диапазонах, описанных выше, при приблизительно pH 3,0, приблизительно pH 3,5, приблизительно pH 4,0, приблизительно pH 4,5, приблизительно pH 5,0, приблизительно pH 5,5, приблизительно pH 6,0, приблизительно pH 6,5, приблизительно pH 7,0, приблизительно pH 7,5, приблизительно pH 8,0, приблизительно pH 8,5, приблизительно pH 9,0, приблизительно pH 9,5, приблизительно pH 10,0, приблизительно pH 10,5, приблизительно pH 11,0, приблизительно pH 11,5, приблизительно pH 12,0 или более.
В другом аспекте в настоящем документе предусмотрены зонды нуклеиновой кислоты или праймеры для амплификации для выделения, получения и/или идентификации нуклеиновой кислоты, кодирующей полипептид, обладающий активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC). В одном варианте осуществления зонд нуклеиновой кислоты, например, зонд для идентификации нуклеиновой кислоты, кодирующей полипептид, обладающий активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), включает зонд, содержащий или состоящий из по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000 или более последовательно расположенных оснований последовательности, представленной в настоящем документе, или ее фрагментов или подпоследовательностей, где зонд идентифицирует нуклеиновую кислоту путем связывания или гибридизации. Зонд может содержать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50, приблизительно от 20 до 60, приблизительно от 30 до 70, приблизительно от 40 до 80, или приблизительно от 60 до 100 последовательно расположенных оснований последовательности, содержащей последовательность, представленную в настоящем документе, или ее фрагменты или подпоследовательности. Зонд может содержать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50, приблизительно от 20 до 60, приблизительно от 30 до 70, приблизительно от 40 до 80, или приблизительно от 60 до 100 последовательно расположенных оснований последовательности нуклеиновой кислоты, представленной в настоящем документе, или ее подпоследовательности.
В одном варианте осуществления последовательности пары праймеров для амплификации нуклеиновой кислоты, кодирующей полипептид, обладающий активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), содержат пару праймеров, содержащую или состоящую из пары праймеров, способной амплифицировать нуклеиновую кислоту, содержащую последовательность, представленную в настоящем документе, или ее фрагменты или подпоследовательности. Один или каждый представитель последовательностей пары праймеров для амплификации может содержать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50 последовательно расположенных оснований последовательности.
В одном варианте осуществления способы амплификации нуклеиновой кислоты, кодирующей полипептид, обладающий активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), включают амплификацию матричной нуклеиновой кислоты с помощью последовательностей пары праймеров для амплификации, способной амплифицировать последовательность нуклеиновой кислоты, представленной в настоящем документе, или ее фрагменты или подпоследовательности.
В одном варианте осуществления векторы, экспрессирующие кассеты, экспрессирующие векторы, плазмиды, или носители для клонирования содержат нуклеиновую кислоту, представленную в настоящем документе, или ее подпоследовательность. В одном аспекте вектор, экспрессирующая кассета, экспрессирующий вектор, плазмида или носитель для клонирования могут содержать или содержатся в вирусном векторе, фаге, фагмиде, космиде, фосмиде, бактериофаге, искусственной хромосоме, аденовирусном векторе, ретровирусном векторе или аденоассоциированном вирусном векторе; или бактериальной искусственной хромосоме (BAC), происходящем из бактериофага PI векторе (PAC), искусственной хромосоме дрожжей (YAC), или искусственной хромосоме млекопитающих (MAC).
В одном аспекте экспрессирующая кассета содержит нуклеиновую кислоту, представленную в настоящем документе, которая функционально связана с промотором. Промотор может представлять собой вирусный, бактериальный промотор, промотор млекопитающих или растений. В одном аспекте промотор растений может представлять собой промотор картофеля, риса, кукурузы, пшеницы, табака или ячменя. Промотор может представлять собой конститутивный промотор. Конститутивный промотор может включать CaMV35S. В другом аспекте промотор может представлять собой индуцибельный промотор. В одном аспекте промотор может представлять собой тканеспецифичный промотор или промотор, регулируемый окружающей средой, или промотор, регулируемый в зависимости от стадии развитии. Таким образом, промотор может представлять собой, например, промотор, специфичный для семян, специфичный для листьев, специфичный для корней, специфичный для стебля, или промотор, индуцируемый опаданием листвы. В одном аспекте экспрессирующая кассета может дополнительно содержать экспрессирующий вектор растений или вирусов растений.
В одном варианте осуществления клетка-хозяин или трансформированная клетка содержит нуклеиновую кислоту, представленную в настоящем документе. В одном аспекте клетка-хозяин или трансформированная клетка может представлять собой бактериальную клетку, клетку млекопитающего, клетку гриба, дрожжевую клетку, клетку насекомых или клетку растений. В одном аспекте клетка растений может представлять собой клетку картофеля, пшеницы, риса, кукурузы, табака или ячменя. Трансформированная клетка может представлять собой любую из клеток-хозяев, известных специалистам в данной области, включая прокариотические клетки, эукариотические клетки, такие как бактериальные клетки, клетки грибов, клетки дрожжей, клетки млекопитающих, клетки насекомых или клетки растений. Иллюстративные клетки бактерий включают клетки любого вида из рода Escherichia, Bacillus, Streptomyces, Salmonella, Pseudomonas и Staphylococcus, включая, например, Escherichia coli, Lactococcus lactis, Bacillus subtilis, Bacillus cereus, Salmonella typhimurium, Pseudomonas fluorescens. Иллюстративные клетки грибов включают клетки любого вида Aspergillus. иллюстративные клетки дрожжей включают клетки любого вида из Pichia, Saccharomyces, Schizosaccharomyces или Schwanniomyces, включая Pichia pastoris, Saccharomyces cerevisiae или Schizosaccharomyces pombe. Иллюстративные клетки насекомых включают любой вид Spodoptera или Drosophila, включая Drosophila S2 и Spodoptera Sf9. Иллюстративные клетки животных включают клетки CHO, COS или меланомы Bowes или любую клеточную линию мыши или человека.
В другом варианте осуществления трансгенные не являющиеся человеком животные содержат нуклеиновую кислоту, представленную в настоящем документе, или вектор, экспрессирующую кассету, экспрессирующий вектор, плазмиду или носитель для клонирования, представленные в настоящем документе. Трансгенным не являющимся человеком животным может быть мышь, крыса, коза, кролик, овца, свинья или корова.
В одном варианте осуществления трансгенное растение или семя содержит нуклеиновую кислоту, представленную в настоящем документе, или вектор, экспрессирующую кассету, экспрессирующий вектор, плазмиду или носитель для клонирования, представленные в настоящем документе. В одном варианте осуществления растение представляет собой растение кукурузы, растение сорго, растение картофеля, растение томата, растение пшеницы, масличное растение, растение рапса, растение сои, растение риса, растение ячменя, траву, семя хлопчатника, пальму, растение кунжута, растение арахиса, растение подсолнуха или растение табака; трансгенное семя. В одном варианте осуществления семя представляет собой кукурузное семя, пшеничное зерно, масличное семя, семя рапса, семя сои, ядро кокосового ореха, семя подсолнуха, семя кунжута, рис, ячмень, арахис, семя хлопчатника, семя пальмы, арахис, семя кунжута, семя подсолнуха или семя растения табака.
В одном аспекте в настоящем документе предусмотрены антисмысловой олигонуклеотид или ингибиторная РНК, содержащие нуклеиновую кислоту, представленную в настоящем документе или состоящие из них.
В другом аспекте в настоящем документе предусмотрен способ ингибирования трансляции содержащей информацию последовательности фосфолипазы (транскрипт, мРНК) в клетке, включающий введение в клетку или экспрессию в клетке антисмыслового олигонуклеотида или ингибиторной РНК, содержащих последовательность нуклеиновой кислоты, представленную в настоящем документе, или состоящих из них.
В одном варианте осуществления выделенные, синтетические или рекомбинантные полипептиды обладают активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), или представляют собой полипептиды, способные индуцировать иммунный ответ, специфичный для фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) (например, эпитоп); и в альтернативных аспектах пептиды и полипептиды, представленные в настоящем документе, содержат последовательность:
(a) содержащую аминокислотную последовательность:
(i) обладающую по меньшей мере 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, или 100% идентичностью последовательности с SEQ ID NO: 6, и имеющую по меньшей мере одно, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать, пятнадцать, шестнадцать, семнадцать, восемнадцать, девятнадцать, двадцать, двадцать одно, двадцать два, двадцать три, двадцать четыре, двадцать пять, двадцать шесть, двадцать семь, двадцать восемь, двадцать девять или тридцать или более, или все из аминокислотных изменений (мутаций), состоящих из изменений, описанных в таблице 12, таблице 13, таблице 14 и/или таблице 15, или эквивалентных аминокислотных изменений или замен (мутаций), или любую их комбинацию,
где необязательно идентичность последовательностей определяют с помощью анализа с алгоритмом сравнения последовательностей или визуальным исследованием;
(ii) кодируемую нуклеиновой кислотой, представленной в настоящем документе;
(iii) имеющую по меньшей мере приблизительно 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, или 100% идентичность последовательности с SEQ ID NO: 8;
(b) полипептид согласно (a), но лишенный нативной сигнальной последовательности и/или последовательности пробелка;
(c) полипептид согласно (a) или (b), кроме того, содержащий гетерологичную аминокислотную последовательность или гетерологичную часть;
(d) полипептид согласно (c), где гетерологичная аминокислотная последовательность или гетерологичная часть содержит гетерологичную (лидерную) сигнальную последовательность, маркер, поддающуюся детекции метку или эпитоп, или состоит из них;
(e) полипептид согласно (d), где гетерологичная (лидерная) сигнальная последовательность содержит N-концевое и/или C-концевое удлинение для нацеливания на эндоплазматическую сеть (ER) или эндомембрану, или на растительную эндоплазматическую сеть (ER) или систему эндомембран, или состоит из них;
(f) полипептид по любому из (a)-(e), где фосфолипаза, например, фосфолипаза C, например, фосфатидилинозитол-специфическая фосфолипаза C (PI-PLC) катализирует реакцию, включающую:
1-фосфатидил-1D-миоинозитол 4,5-бифосфат (также называемый PIP2, фосфатидилинозитолбифосфатом)+H2O↔1D-миоинозитол 1,4,5-трифосфат (также называемый IP3, инозитолтрифосфатом) + диацилглицерин.
(g) полипептид согласно (a)-(f), где активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) является термостабильной;
(h) полипептид согласно (a)-(f), где активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), является термоустойчивой;
(i) полипептид согласно любому из (a)-(h), где: (i) полипептид является гликозилированным или полипептид содержит по меньшей мере один участок гликозилирования, (ii) полипептид согласно (i) где гликозилирование представляет собой N-связанное гликозилирование или O-связанное гликозилирование; (iii) полипептид согласно (i) или (ii), где полипептид является гликозилированным после экспрессии в клетках дрожжей; или (iv) полипептид согласно (iii), где клетка дрожжей представляет собой P. pastoris или S. pombe;
(j) полипептид согласно любому из (a)-(i), кроме того, содержащий композицию, содержащую по меньшей мере один второй фермент, или по меньшей мере один второй фермент фосфолипазы, или содержащийся в ней; или
(k) полипептид согласно (j), где по меньшей мере один второй фермент фосфолипаза содержит полипептид, имеющий последовательность, как указано в SEQ ID NO: 2 и/или SEQ ID NO: 4, или по меньшей мере один из их вариантных ферментов, как описано в таблицах 8 и 9.
В одном аспекте выделенный, синтетический или рекомбинантный полипептид может содержать полипептид, представленный в настоящем документе, который лишен сигнальной (пептидной) последовательности, например, лишен его гомологичной сигнальной последовательности, и в одном аспекте содержит гетерологичную сигнальную (пептидную) последовательность. В одном аспекте выделенный, синтетический или рекомбинантный полипептид может содержать полипептид, представленный в настоящем документе, содержащий гетерологичную сигнальную последовательность, такую как гетерологичная сигнальная последовательность фосфолипазы или не фосфолипазы (например, не фосфолипазы, не фосфолипазы C или не фосфатидилинозитол-специфической фосфолипазы C (PI-PLC)). В одном аспекте химерные белки содержат первый домен, содержащий сигнальную последовательность, представленную в настоящем документе, и по меньшей мере второй домен. Белок может представлять собой слитый белок. Второй домен может содержать фермент. Фермент может представлять собой фосфолипазу, например, фосфолипазу C, например, фосфатидилинозитол-специфическую фосфолипазу C (PI-PLC), представленную в настоящем документе, или другой фермент.
В одном аспекте активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) включает удельную активность при приблизительно 37°C в диапазоне от приблизительно 100 до приблизительно 1000 единиц на миллиграмм белка. В другом аспекте активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) включает удельную активность от приблизительно 500 до приблизительно 750 единиц на миллиграмм белка. Альтернативно активность фосфолипазы включает удельную активность при 37°C в диапазоне от приблизительно 500 до приблизительно 1200 единиц на миллиграмм белка. В одном аспекте активность фосфолипазы включает удельную активность при 37°C в диапазоне от приблизительно 750 до приблизительно 1000 единиц на миллиграмм белка. В другом аспекте термоустойчивость включает сохранение по меньшей мере половины удельной активности фосфолипазы 37°C после нагревания до повышенной температуры. Альтернативно, термоустойчивость может включать сохранение удельной активности при 37°C в диапазоне от приблизительно 500 до приблизительно 1200 единиц на миллиграмм белка после нагревания до повышенной температуры.
В одном варианте осуществления выделенные, синтетические или рекомбинантные полипептиды, представленные в настоящем документе, содержат по меньшей мере один участок гликозилирования. В одном аспекте гликозилирование может представлять собой N-связанное гликозилирование. В одном аспекте полипептид может быть гликозилированным после экспрессии в P. pastoris или S. pombe или в растениях, таких как продуцирующие масло растения, например, соя, канола, рис, подсолнух или генетически-модифицированные (GMO) варианты этих растений.
В одном аспекте полипептид может сохранять активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) в условиях, включающих приблизительно pH 6,5, pH 6, pH 5,5, pH 5, pH 4,5 или pH 4,0 или ниже. В другом аспекте полипептид может сохранять активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) в условиях, включающих приблизительно pH 7, pH 7,5, pH 8,0, pH 8,5, pH 9, pH 9,5, pH 10, pH 10,5, pH 11, pH 11,5, pH 12,0 или более.
В одном варианте осуществления препараты белка содержат полипептид, представленный в настоящем документе, где препарат белка содержит жидкость, твердое вещество или гель.
В одном аспекте гетеродимеры, представленные в настоящем документе, содержат полипептид и второй домен. В одном аспекте второй домен может представлять собой полипептид, и гетеродимер может представлять собой слитый белок. В одном аспекте второй домен может представлять собой эпитоп или метку. В одном аспекте гомодимеры, представленные в настоящем документе, содержат полипептид, представленный в настоящем документе.
В одном варианте осуществления иммобилизованные полипептиды, представленные в настоящем документе, обладают активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), где полипептид содержит полипептид, представленный в настоящем документе, полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе, или полипептид, содержащий полипептид, представленный в настоящем документе, и второй домен. В одном аспекте полипептид, представленный в настоящем документе, может быть иммобилизован на клетке, везикуле, липосоме, пленке, мембране, металле, смоле, полимере, керамике, стекле, микроэлектроде, графитовой частице, грануле, геле, пластине, кристалле, таблетке, пилюле, капсуле, порошке, агломерате, поверхности, пористой структуре, чипе или капиллярной трубке, или материалах, таких как зерна, шелуха, кора, кожа, волосы, эмаль, кость, скорлупа и материалы, происходящие из них. Полинуклеотиды, полипептиды и ферменты, представленные в настоящем документе, можно изготавливать в твердой форме, такой как порошок, лиофилизированный препарат, гранулы, таблетка, плитка, кристалл, капсула, пилюля, драже, или в жидкой форме, такой как водный раствор, аэрозоль, гель, паста, взвесь, водная/масляная эмульсия, крем, капсула или суспензия везикул или мицелл.
В одном аспекте в настоящем документе предусмотрены выделенные, синтетические или рекомбинантные антитела, которые специфично связываются с полипептидом, представленным в настоящем документе. В другом аспекте выделенные, синтетические или рекомбинантные антитела представляют собой моноклональные или поликлональные антитела, или их антигенсвязывающие фрагменты. В одном аспекте в настоящем документе предусмотрена гибридома. содержащая антитело, представленное в настоящем документе.
В одном варианте осуществления в настоящем документе предусмотрен чип, содержащий иммобилизованный полипептид, иммобилизованную нуклеиновую кислоту или антитело, представленные в настоящем документе, или их комбинацию.
В одном варианте осуществления добавки в корм для животного содержат полипептид, представленный в настоящем документе, например, полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе. В одном аспекте полипептид в пищевой добавке может быть гликозилированным. В одном варианте осуществления съедобные матрицы для доставки фермента содержат полипептид, представленный в настоящем документе, например, полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе. В одном аспекте матрица для доставки включает драже. В одном аспекте полипептид может быть гликозилированным. В одном аспекте активность фосфолипазы является термоустойчивой. В другом аспекте активность фосфолипазы является термостабильной.
В одном варианте осуществления способы выделения или идентификации полипептида, имеющего активность фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), включают стадии: (a) предоставления антитела, представленного в настоящем документе; (b) предоставления образца, содержащего полипептиды; и (c) контактирования образца стадии (b) с антителом стадии (a) в условиях, где антитело может специфично связываться с полипептидом, тем самым выделяя или идентифицируя полипептид, обладающий активностью фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC).
В одном варианте осуществления способы получения антител против фосфолипазы включают введение не являющемуся человеку животному нуклеиновой кислоты, представленной в настоящем документе, или полипептида, представленного в настоящем документе, или их подпоследовательности в количестве, достаточном для индуцирования гуморального иммунного ответа, тем самым получая антитело против фосфолипазы. В настоящем документе предусмотрены способы получения антитела против фосфолипазы, включающие введение не являющемуся человеку животному нуклеиновой кислоты, представленной в настоящем документе, или полипептида, представленного в настоящем документе, или их подпоследовательностей в количестве, достаточном для индуцирования иммунного ответа.
В одном варианте осуществления способы получения рекомбинантного полипептида включают стадию: (A) (a) предоставления нуклеиновой кислоты, представленной в настоящем документе, где нуклеиновая кислота необязательно связана с промотором, где нуклеиновая кислота содержит нуклеиновую кислоту, представленную в настоящем документе; и (b) экспрессии нуклеиновой кислоты стадии (a) в условиях, которые позволяют экспрессию полипептида, тем самым получая рекомбинантный полипептид; или (B) способ согласно (A), кроме того, включающий трансформацию клетки-хозяина нуклеиновой кислотой стадии (a) с последующей экспрессией нуклеиновой кислоты стадии (a), тем самым получая рекомбинантный полипептид в трансформированной клетке.
В одном варианте осуществления способы идентификации полипептида, обладающего активностью фосфолипазы, включают стадии: (a) предоставление полипептида, представленного в настоящем документе; (b) предоставление субстрата фосфолипазы; и (c) контактирование полипептида с субстратом стадии (b) и детекция уменьшения количества субстрата или увеличения количества продукта реакции, где снижение количества субстрата или увеличение количества продукта реакции выявляет полипептид, обладающий активностью фосфолипазы.
В другом варианте осуществления способы идентификации субстрата фосфолипазы включают стадии: (a) предоставление полипептида, представленного в настоящем документе; (b) предоставление тестируемого субстрата; и (c) контактирование полипептида стадии (a) с тестируемым субстратом стадии (b) и детекция уменьшения количества субстрата или увеличения количетва продукта реакции, где уменьшение количества субстрата или увеличение количества продукта реакции идентифицирует тестируемый субстрат в качестве субстрата фосфолипазы.
В другом аспекте способы определения того, связывается ли специфично тестируемое соединение с полипептидом, включают стадии: (a) экспрессия нуклеиновой кислоты или вектора, содержащего нуклеиновую кислоту, в условиях, позволяющих трансляцию нуклеиновой кислоты в полипептид, где нуклеиновая кислота содержит нуклеиновую кислоту, представленную в настоящем документе; (b) предоставление тестируемого соединения; (c) контактирование полипептида с тестируемым соединением; и (d) определение того, связывается ли специфично тестируемое соединение стадии (b) с полипептидом.
В другом аспекте способы определения того, связывается ли специфично тестируемое соединение с полипептидом, включают стадии: (a) предоставление полипептида, представленного в настоящем документе; (b) предоставление тестируемого соединения; (c) контактирование полипептида с тестируемым соединением; и (d) определение того, связывается ли специфично тестируемое соединение стадии (b) с полипептидом.
В одном варианте осуществления способы идентификации модулятора активности фосфолипазы включают стадии: (A) (a) предоставление полипептида, представленного в настоящем документе; (b) предоставление тестируемого соединения; (c) контактирование полипептида стадии (a) с тестируемым соединением стадии (b) и измерение активности фосфолипазы, где изменение активности фосфолипазы, измеренной в присутствии тестируемого соединения, по сравнению с активностью в отсутствие тестируемого соединения, обеспечивает определение того, что тестируемое соединение модулирует активность фосфолипазы; (B) способ согласно (A), где активность фосфолипазы измеряют путем предоставления субстрата фосфолипазы и детекции уменьшения количества субстрата или увеличения количества продукта реакции, или, увеличения количества субстрата или уменьшения количества продукта реакции; (c) способ согласно (B), где снижение количества субстрата или увеличение количества продукта реакции с тестируемым соединением по сравнению с количеством субстрата или продукта реакции без тестируемого соединения идентифицирует тестируемое соединение в качестве активатора активности фосфолипазы; или, (d) способ согласно (B), где увеличение количества субстрата или уменьшение количества продукта реакции с тестируемым соединением по сравнению с количеством субстрата или продукта реакции без тестируемого соединения идентифицирует тестируемое соединение в качестве ингибитора активности фосфолипазы.
В одном аспекте способы выделения или извлечения нуклеиновой кислоты, кодирующей полипептид с активностью фосфолипазы, из образца, включают стадии: (A) (a) предоставление полинуклеотидного зонда, содержащего нуклеиновую кислоту, представленную в настоящем документе; (b) выделение нуклеиновой кислоты из образца или обработку образца так, чтобы нуклеиновая кислота в образце была доступна для гибридизации с полинуклеотидным зондом стадии (a); (c) комбинирование выделенной нуклеиновой кислоты или обработанного образца стадии (b) с полинуклеотидным зондом стадии (a); и (d) выделение нуклеиновой кислоты, которая специфично гибридизуется с полинуклеотидным зондом стадии (a), тем самым выделяя или извлекая из образца нуклеиновую кислоту, кодирующую полипептид с активностью фосфолипазы; (B) способ согласно (A), где образец представляет собой или содержит образец из окружающей среды; (C) способ согласно (B), где образец из окружающей среды представляет собой или содержит образец воды, образец жидкости, образец почвы, образец воздуха или биологический образец; или (D) способ согласно (C), где биологический образец получен из бактериальной клетки, клетки простейших, клетки насекомых, клетки дрожжей, клетки растений, клетки грибов или клетки млекопитающих.
В одном варианте осуществления способы выделения или извлечения нуклеиновой кислоты, кодирующей полипептид, обладающий активностью фосфолипазы из образца, включают стадии: (a) предоставление последовательностей пары праймеров для амплификации нуклеиновой кислоты, кодирующей полипептид, обладающий активностью фосфолипазы, где пара праймеров способна амплифицировать нуклеиновую кислоту, представленную в настоящем документе; (b) выделение нуклеиновой кислоты из образца или обработку образца, так чтобы нуклеиновая кислота в образце была доступна для гибридизации с парой праймеров для амплификации; и, (c) объединение нуклеиновой кислоты стадии (b) с парой праймеров для амплификации стадии (a) и амплификация нуклеиновой кислоты из образца, тем самым, выделяя или извлекая нуклеиновую кислоту, кодирующую полипептид, обладающий активностью фосфолипазы, из образца. В одном варианте осуществления образец представляет собой образец из окружающей среды, например, образец воды, образец жидкости, образец почвы, образец воздуха или биологический образец, например, бактериальную клетку, клетку простейших, клетку насекомых, клетку дрожжей, клетку растений, клетку грибов или клетку млекопитающих. Один или каждый член пары праймеров для амплификации может включать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50 или более последовательно расположенных оснований последовательности, представленной в настоящем документе.
В одном варианте осуществления способы увеличения термоустойчивости или термостабильности полипептида фосфолипазы включают гликозилирование полипептида фосфолипазы, где полипептид содержит по меньшей мере тридцать последовательно расположенных аминокислот полипептида, представленного в настоящем документе; или полипептида, кодируемого последовательностью нуклеиновой кислоты, представленной в настоящем документе, тем самым увеличивая термоустойчивость или термостабильность полипептида фосфолипазы. В одном аспекте специфическая активность фосфолипазы может быть термостабильной или термоустойчивой при температуре в диапазоне от более чем приблизительно 37°C до приблизительно 95°C.
В одном варианте осуществления способы сверхэкспрессии рекомбинантного полипептида фосфолипазы, например, фосфолипазы C, например, фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) в клетке включают экспрессию вектора, содержащего нуклеиновую кислоту, представленную в настоящем документе, или последовательность нуклеиновой кислоты, представленную в настоящем документе, где идентичность последовательностей определяют с помощью анализа с алгоритмом сравнения последовательностей или визуальным исследованием, где сверхэкспрессию обеспечивают с использованием высокоактивного промотора, бицистронного вектора или амплификации гена в векторе.
В одном варианте осуществления способы получения варианта нуклеиновой кислоты, кодирующей полипептид с активностью фосфолипазы, включают стадии: (A) (a) предоставление матричной нуклеиновой кислоты, содержащей нуклеиновую кислоту, представленную в настоящем документе; и (b) модификация, делеция или вставка одного или нескольких нуклеотидов в матричной последовательности, или их комбинации, с получением варианта матричной нуклеиновой кислоты; (B) способ согласно (A), кроме того, включающий экспрессию варианта нуклеиновой кислоты с получением варианта полипептида фосфолипазы; (C) способ согласно (A) или (B), где модификации, вставки или делеции вносят способом, включающим ПЦР с пониженной точностью, шаффлинг, олигонуклеотид-направленный мутагенез, объединяющую ПЦР, мутагенез с помощью половой ПЦР, мутагенез in vivo, кассетный мутагенез, возвратно-множественный мутагенез, экспоненциально-множественный мутагенез, сайт-специфический мутагенез, повторную сборку гена, мутагенез с насыщением сайтов гена (GSSM), синтетическую повторную сборку лигированием (SLR) или их комбинацию; (D) способ согласно любому из (A)-(C), где модификации, вставки или делеции вносят способом, включающим рекомбинацию, рекомбинацию возвратной последовательности, мутагенез с модификацией ДНК фосфотиоатом, мутагенез с содержащей урацил матрицей, мутагенез с содержащими разрывы дуплексами, мутагенез с репарацией точек несоответствия, мутагенез с дефектом репарации штамма-хозяина, химический мутагенез, мутагенез радиогенного происхождения, мутагенез с делецией, мутагенез с рестрикцией и селекцией, мутагенез с рестрикцией и исправлением ошибок, синтез искусственного гена, множественный мутагенез, получение химерного мультимера нуклеиновой кислоты и их комбинацию; (E) способ согласно любому из (A)-(D), где способ многократно повторяют до тех пор, пока не получают (вариантную) фосфолипазу, обладающую измененной или отличающейся (вариантной) активностью, или измененной или отличающейся (вариантной) стабильностью по сравнению с полипептидом, кодируемым матричной нуклеиновой кислотой, или измененной или отличающейся (вариантной) вторичной структурой по сравнению с полипептидом, кодируемым матричной нуклеиновой кислотой, или с измененной или отличающейся (вариантной) посттрансляционной модификаций по сравнению с полипептидом, кодируемым матричной нуклеиновой кислотой; (F) способ согласно (E), где вариант полипептида фосфолипазы является термоустойчивым и сохраняет некоторую активность после воздействия увеличенной температуры; (G) способ согласно (E), где полипептид варианта фосфолипазы обладает увеличенным гликозилированием относительно гликозилирования фосфолипазы, кодируемой матричной нуклеиновой кислотой; (H) способ согласно (E), где полипептид варианта фосфолипазы обладает активностью фосфолипазы при высокой температуре, где фосфолипаза, кодируемая матричной нуклеиновой кислотой, не является активной при высокой температуре; (I) способ согласно любому из (A)-(H), где способ многократно повторяют до тех пор, пока не получат фосфолипазу, кодирующую последовательность, в которой используются кодоны, измененные по сравнению с кодонами матричной нуклеиновой кислоты; или (J) способ согласно любому (A)-(H), где способ многократно повторяют до тех пор, пока не получают ген фосфолипазы, обладающий повышенным или пониженным уровнем экспрессии транскрипта или повышенной или пониженной стабильностью относительно уровня экспрессии и стабильности матричной нуклеиновой кислоты.
В одном аспекте предусмотрены способы модификации кодонов в нуклеиновой кислоте, кодирующей полипептид фосфолипазы, причем способы включают стадии: (a) предоставления нуклеиновой кислоты, кодирующей полипептид с активностью фосфолипазы, содержащей нуклеиновую кислоту, представленную в настоящем документе; и, (b) идентификации кодона в нуклеиновой кислоте стадии (a) и замены его отличающимся кодоном, кодирующим ту же аминокислоту, что и замененный кодон, тем самым модифицируя нуклеиновую кислоту, кодирующую фосфолипазу.
В одном варианте осуществления предусмотрены способы получения библиотеки нуклеиновых кислот, кодирующих множество модифицированных активных центров фосфолипазы или участков связывания субстрата, где модифицированные активные центры или участки связывания субстрата происходят из первой нуклеиновой кислоты, содержащей последовательность, кодирующую первый активный центр или первый участок связывания субстрата, причем способ включает стадии: (A) (a) предоставление первой нуклеиновой кислоты, кодирующей первый активный центр или первый участок связывания субстрата, где первая последовательность нуклеиновой кислоты содержит нуклеиновую кислоту, представленную в настоящем документе, и нуклеиновая кислота кодирует активный центр фосфолипазы или участок связывания субстрата фосфолипазы; (b) предоставление набора мутагенных олигонуклеотидов, которые кодируют встречающиеся в природе варианты аминокислот во множестве из выбранных для нацеливания кодонов в первой нуклеиновой кислоте; и, (c) использование набора мутагенных олигонуклеотидов для получения набора кодирующих активный центр или связывающий субстрат участок вариантов нуклеиновых кислот, кодирующих ряд вариантов аминокислот в каждом кодоне аминокислоты, который был подвергнут мутагенезу, тем самым получая библиотеку нуклеиновых кислот, кодирующих множество модифицированных активных центров фосфолипазы или участков связывания субстрата; (B) способ согласно (A), включающий мутагенез первой нуклеиновой кислоты стадии (a) способом, включающим оптимизированную систему направленных изменений, мутагенез с насыщением сайтов гена (GSSM), синтетическую повторную сборку лигированием (SLR); (C) способ согласно (A) или (B), включающий мутагенез первой нуклеиновой кислоты стадии (a) или ее вариантов способом, включающим ПЦР с пониженной точностью, шаффлинг, олигонуклеотид-направленный мутагенез, объединяющую ПЦР, мутагенез посредством половой ПЦР, мутагенез in vivo, кассетный мутагенез, возвратно-множественный мутагенез, экспоненциально-множественный мутагенез, сайт-специфический мутагенез, повторную сборку гена, мутагенез с насыщением сайтов гена (GSSM), синтетическую повторную сборку лигированием (SLR)и их комбинацию; или (D) способ согласно (A) или (B), включающий мутагенез первой нуклеиновой кислоты стадии (a) или ее вариантов способом, включающим рекомбинацию, рекомбинацию возвратной последовательности, мутагенез с модификацией ДНК фосфотиоатом, мутагенез с содержащей урацил матрицей, мутагенез с содержащими разрывы дуплексами, мутагенез с репарацией точек несоответствия, мутагенез с дефектом репарации штамма-хозяина, химический мутагенез, мутагенез радиогенного происхождения, мутагенез с делецией, мутагенез с рестрикцией и селекцией, мутагенез с рестрикцией и исправлением ошибок, синтез искусственного гена, множественный мутагенез, получение химерного мультимера нуклеиновой кислоты и их комбинации.
В одном аспекте способы получения низкомолекулярного соединения включают стадии: (a) предоставление множества биосинтетических ферментов, способных синтезировать или модифицировать низкомолекулярное соединение, где один из ферментов содержит фермент фосфолипазу, кодируемую нуклеиновой кислотой, представленной в настоящем документе; (b) предоставление субстрата по меньшей мере для одного из ферментов стадии (a); и (c) реакция субстрата стадии (b) с ферментами в условиях, которые облегчают множество биокаталитических реакций, с получением низкомолекулярного соединения с помощью серии биокаталитических реакций.
В другом аспекте способы модификации низкомолекулярного соединения включают стадии: (A) (a) предоставление фермента фосфолипазы, где фермент содержит полипептид, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе; (b) предоставление низкомолекулярного соединения; и (c) реакция фермента стадии (a) с низкомолекулярным соединением стадии (b) в условиях, которые облегчают ферментативную реакцию, катализируемую ферментом фосфолипазой, тем самым, модифицируя низкомолекулярное соединение ферментативной реакцией фосфолипазы; (B) способ согласно (A), включающий множество низкомолекулярных субстратов для фермента стадии (a), тем самым получая библиотеку модифицированных низкомолекулярных соединений, получаемых с помощью по меньшей мере одной ферментативной реакции, катализируемой ферментом фосфолипазой; (C) способ согласно (A) или (B), кроме того, включающий множество дополнительных ферментов в условиях, которые облегчают множество биокаталитических реакций ферментами, с получением библиотеки модифицированных низкомолекулярных соединений, получаемых множеством ферментативных реакций; (D) способ согласно (C), кроме того, включающий стадию тестирования библиотеки для определения того, присутствует ли в библиотеке конкретное модифицированное низкомолекулярное соединение, которое проявляет желаемую активность; или (E) способ согласно (D), где стадия тестирования библиотеки, кроме того, включает стадии систематического удаления всех, кроме одной, биокаталитических реакций используемых для получения части из множества модифицированных низкомолекулярных соединений из библиотеки, с тестированием части модифицированных низкомолекулярных соединений на наличие или отсутствие конкретного модифицированного низкомолекулярного соединения с желаемой активностью, и идентификации по меньшей мере одной конкретной биокаталитической реакции, в результате которой образуется модифицированное низкомолекулярное соединение с желаемой активностью.
В другом аспекте способы определения функционального фрагмента фермента фосфолипазы включают стадии: (A) (a) предоставление фермента фосфолипазы, где фермент содержит полипептид, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе; и (b) удаление множества аминокислотных остатков из последовательности стадии (a) и тестирование оставшейся подпоследовательности в отношении активности фосфолипазы, тем самым определяя функциональный фрагмент фермента фосфолипазы; или, (B) способ согласно (A), где активность фосфолипазы измеряют путем предоставления субстрата фосфолипазы и тестирования уменьшения количества субстрата или увеличения продукта реакции.
В одном аспекте способы предусмотрен способ инженерии цельных клеток с новыми или модифицированными фенотипами с использованием анализа метаболических изменений в режиме реального времени, причем способ включает стадии: (a) получение модифицированной клетки посредством модификации генетического набора клетки, где генетический набор модифицирован добавлением в клетку нуклеиновой кислоты, представленной в настоящем документе; (b) культивирование модифицированной клетки с получением множества модифицированных клеток; (c) измерение по меньшей мере одного параметра метаболизма клетки посредством контроля клеточной культуры стадии (b) в режиме реального времени; и (d) анализ данных стадии (с) для определения наличия отличий измеренного параметра от сравнительного измерения в немодифицированной клетке в аналогичных условиях, тем самым идентифицируя полученный с помощью способов инженерии фенотип клетки с использованием анализа метаболических изменений в режиме реального времени; (B) согласно (A), где генетический набор клетки модифицируют способом, включающим делецию последовательности или модификацию последовательности в клетке, или, нокаут экспрессии гена; (C) способ согласно (A) или (B), кроме того, включающий селекцию клетки, содержащей новый полученный способами инженерии фенотип; или (D) способ согласно (C), кроме того, включающий культивирование отобранной клетки, тем самым, получая новый штамм, содержащий новый полученный способами инженерии фенотип.
В одном варианте осуществления способы получения трансгенного растения включают следующие стадии: (a) введение гетерологичной последовательности нуклеиновой кислоты в растительную клетку, где гетерологичная последовательность нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, представленную в настоящем документе, тем самым получая трансформированную клетку растений; и (b) получение трансгенного растения из трансформированной клетки. В одном аспекте стадия (a) может дополнительно включать введение гетерологичной последовательности нуклеиновой кислоты электропорацией или микроинъекцией в протопласты клеток растений. В другом аспекте стадия (a) может дополнительно включать введение гетерологичной последовательности нуклеиновой кислоты непосредственно в ткань растений бомбардировкой частицами с ДНК. Альтернативно стадия (a) может дополнительно включать введение гетерологичной последовательности нуклеиновой кислоты в ДНК клетки растения с использованием хозяина Agrobacterium tumefaciens. В одном аспекте клетка растения может представлять собой клетку картофеля, кукурузы, риса, пшеницы, табака или ячменя.
В одном варианте осуществления способы экспрессии гетерологичной последовательности нуклеиновой кислоты в растительной клетке включают следующие стадии: (а) трансформация клетки растений гетерологичной последовательностью нуклеиновой кислоты, функционально связанной с промотором, где гетерологичная последовательность нуклеиновой кислоты содержит нуклеиновую кислоту, представленную в настоящем документе; (b) выращивание растения в условиях, при которых гетерологичная последовательность нуклеиновой кислоты экспрессируется в клетке растений.
В одном аспекте в настоящем документе предусмотрены детергентные композиции, содержащие полипептид фосфолипазы, представленный в настоящем документе, или полипептид фосфолипазы, кодируемый нуклеиновой кислотой, представленной в настоящем документе. В одном аспекте фосфолипаза представляет собой не поверхностно-активную фосфолипазу или поверхностно-активную фосфолипазу. В другом аспекте фосфолипаза включена в состав неводной жидкой композиции, отлитого твердого тела, лиофилизированного порошка, гранулированной формы, формы в виде частиц, прессованной таблетки, драже, формы геля, пасты, аэрозоля или формы взвеси.
В одном аспекте способы мытья предмета включают стадии: (a) предоставление композиции, содержащей полипептид фосфолипазы, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе; (b) предоставление предмета; и (c) контактирование полипептида стадии (a) и предмета стадии (b) в условиях, где композиция может отмыть предмет.
В одном варианте осуществления в настоящем документе предусмотрены композиции, содержащие полипептид фосфолипазы, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе.
В одном аспекте способы смягчения, лечения или предупреждения опосредуемой липополисахаридом (LPS) токсичности включат введение пациенту фармацевтической композиции, содержащей полипептид, представленный в настоящем документе, или полипептид, кодируемый последовательностью нуклеиновой кислоты, представленной в настоящем документе.
В другом аспекте в настоящем документе предусмотрены фармацевтические препараты, предшественники фармацевтических препаратов и фармацевтические композиции, содержащие полипептид, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе. В другом аспекте в настоящем документе предусмотрены способы изготовления фармацевтического препарата, предшественника фармацевтического препарата или фармацевтической композиции, включающие добавление полипептида, кодируемого нуклеиновой кислотой, представленной в настоящем документе, в фармацевтический препарат, предшественник фармацевтического препарата или фармацевтическую композицию. В одном аспекте фармацевтическую композицию применяют для предупреждения, лечения или смягчения опосредуемой липополисахаридом (LPS) токсичности, или для детоксикации эндотоксина или деацилирования 2'- или 3'-цепи жирной кислоты от липида A.
В одном варианте осуществления способы детоксикации эндотоксина включают контактирование эндотоксина с полипептидом, представленным в настоящем документе, или полипептидом, кодируемым нуклеиновой кислотой, представленной в настоящем документе.
В другом варианте осуществления способы получения варианта кодирующей фосфолипазу последовательности, имеющего увеличенную экспрессию в клетке-хозяине включают модификацию нуклеиновой кислоты, представленной в настоящем документе, так чтобы один, несколько или все мотивы, кодирующие участки N-связанного гликозилирования, были модифицированы в мотив, не кодирующий участки гликозилирования.
В одном варианте осуществления в настоящем документе предусмотрены композиции, содержащие смесь ферментов фосфолипаз, содержащие: (a)(i) полипептид фосфолипазы, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе, и (ii) по меньшей мере один второй фермент; (b) композиция согласно (a), где по меньшей мере один фермент представляет собой фермент фосфолипазу; или (c) композиция согласно (b), где по меньшей мере один второй фермент фосфолипазы содержит полипептид, как указано в SEQ ID NO: 2 и/или SEQ ID NO: 4, или по меньшей мере один вариант ферментов PLC, как описано в таблицах 8 и 9.
В одном аспекте способы получения биотоплива, например, биодизеля, включают стадии: (A) (a) предоставление полипептида фосфолипазы, представленного в настоящем документе, или фермента фосфолипазы, кодируемого нуклеиновой кислотой, представленной в настоящем документе, или композиции, содержащей полипептид, представленный в настоящем документе; (b) предоставление композиции, содержащей липид или алкиловый сложный эфир; (c) контактирование полипептида фосфолипазы согласно (a) с композицией согласно (b); (B) способ согласно (A), где композиция, содержащая липид или алкиловый сложный эфир представляет собой, или содержит, масло и/или жир; или (C) способ согласно (A) или (B), где композиция, содержащая липид или алкиловый сложный эфир, представляет собой или содержит водоросли, растительное масло, растительное масло прямой перегонки, растительное масло холодного прессования, отработанное растительное масло, животный жир, топленое сало, жир, сало или желтый жир. В другом аспекте в настоящем документе предусмотрены топлива, например, биотоплива, например, биодизель, изготовленные способами, которые включают стадии: (A) (a) предоставление полипептида фосфолипазы, представленного в настоящем документе, или фермента фосфолипазы, кодируемого нуклеиновой кислотой, представленной в настоящем документе, или композиции, содержащей полипептид, представленный в настоящем документе; b) предоставление композиции, содержащей липид или алкиловый сложный эфир; (c) контактирование полипептида фосфолипазы согласно (a) с композицией согласно (b); (B) способ согласно (A), где композиция, содержащая липид или алкиловый сложный эфир, представляет собой или содержит масло и/или жир; или (C) способ согласно (A) или (B), где композиция, содержащая липид или алкиловый эфир, представляет собой или содержит водоросли, растительное масло, растительное масло прямой перегонки, растительное масло холодного прессования, отработанное растительное масло, животный жир, топленое сало, жир, сало или желтый жир.
В другом аспекте сухой экстракт барды (DDS), сухая барда (DDS), конденсированный экстракт барды (CDS), влажный экстракт барды (DWG) или сухая гранулированная барда (DDGS) содержат полипептид, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе или композицией, представленной в настоящем документе.
В другом варианте осуществления в настоящем документе предусматривается биомасса, содержащая (a) полипептид, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе, или композицию, предоставленную в настоящем документе; (b) биомассу согласно (a), где биомасса представляет собой или содержит биомассу животных, водорослей и/или растений, или содержащую липиды или лигноцеллюлозную биомассу или материал отходов.
В другом варианте осуществления в настоящем документе предусмотрен продукт на основе нефти, содержащий: (a) полипептид, представленный в настоящем документе, или полипептид, кодируемый нуклеиновой кислотой, представленной в настоящем документе, или композицию, представленную в настоящем документе; (b) полученный способом, включающим применение полипептида, представленного в настоящем документе, или полипептида, кодируемого нуклеиновой кислотой, представленной в настоящем документе, или композиции, представленной в настоящем документе; или (c) продукт на основе нефти согласно (a) или (b), содержащий масло, биодизель или бензин, или биоэтанол, биобутанол, биопропанол или биометанол; или смесь биоэтанола, биобутанола, биопропанола, биометанола и/или биодизеля и газолина.
В одном варианте осуществления в настоящем документе предусмотрен способ гидратации негидратируемых фосфолипидов (NHP) в липидной матрице путем обеспечения миграции их к поверхности контакта масло-вода. Затем NHP подвергают реакции и/или удаляют из липидов. В одном варианте осуществления способ включает a) смешение водной кислоты с пригодным в пищу маслом с получением кислотной смеси, имеющей pH менее чем приблизительно 4; и b) смешение основания с кислотной смесью с получением прореагировавшей смеси, имеющей pH приблизительно 6-9. В определенных вариантах осуществления смешение на стадиях a) и/или b) приводит к эмульсии, которая содержит водную фазу со средним размером капель от приблизительно 15 мкм до приблизительно 45 мкм. В определенных вариантах осуществления смешение на стадиях a) и/или b) приводит к эмульсии, которая содержит по меньшей мере приблизительно 60% водной фазы по объему с размером капель от приблизительно 15 мкм до приблизительно 45 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления смешение на стадиях a) и/или b) приводит к эмульсии, которая содержит по меньшей мере приблизительно 60, 70, 80, 90, 93, 95, 96, 97, 98 или 99% водной фазы по объему с размером капель от приблизительно 20 мкм до приблизительно 45 мкм. В определенных вариантах осуществления способ дополнительно включает рафинирование реакционной смеси водой или ферментом с получением рафинированного масла. В определенных вариантах осуществления смешение на стадиях a) и/или b) проводят с помощью смесителя с высокими сдвиговыми усилиями со скоростью лопасти по меньшей мере приблизительно 1400 см/c, 1600 см/с, 1800 см/с, 2000 см/с, 2100 см/с, 2300 см/с, 2500 см/с, 3000 см/с или 3500 см/с.
В способах, предоставленных в настоящем документе, можно использовать любую кислоту, которую сочтет пригодной специалист в данной области. В определенных вариантах осуществления кислота выбрана из группы, состоящей из фосфорной кислоты, уксусной кислоты, лимонной кислоты, виннокаменной кислоты, янтарной кислоты и их смеси. В способах, предоставленных в настоящем документе можно использовать любую кислоту, которую сочтет пригодной специалист в данной области. В определенных вариантах осуществления основание выбрано из группы, состоящей из гидроксида натрия, гидроксида калия, силиката натрия, карбоната натрия, карбоната кальция и их комбинации.
В определенных вариантах осуществления способ гидратации негидратируемых фосфолипидов в годном в пищу масле, кроме того, включает стадию рафинирования гидратацией или ферментативного рафинирования для получения рафинированного масла. В одном варианте осуществления в настоящем документе предусмотрен способ, где после гидратации NHP следует ферментативная обработка и удаление различных фосфолипидов и лецитинов. Такие способы можно осуществлять на практике либо на неочищенных, либо на рафинированных гидратацией, маслах.
В определенных вариантах осуществления способ рафинирования масла, представленный в настоящем документе, включает a) смешение водного раствора кислоты с пищевым маслом с получением кислотной смеси, имеющей pH приблизительно от 1 до 4, b) смешение основания с кислотной смесью с получением прореагировавшей смеси, имеющей pH приблизительно 6-9, и c) рафинирование прореагировавшей смеси водой или ферментом с получением рафинированного масла. В определенных вариантах осуществления смешение на стадии a) и/или b) приводит к эмульсии, которая содержит водную фазу со средним размером капель от приблизительно 15 мкм до приблизительно 45 мкм. В определенных вариантах осуществления смешение на стадиях a) и/или b) приводит к эмульсии, которая содержит по меньшей мере приблизительно 60% водной фазы по объему с размером капель от приблизительно 15 до приблизительно 45 мкм, где процент водной фазы основан на объеме водной фазы.
В одном варианте осуществления в настоящем документе предусмотрен способ удаления NHP, гидратируемых фосфолипидов и лецитинов (в совокупности известных как "камеди") из растительных масел с получением продукта в виде рафинированного масла или жира, который можно использовать для производства пищевых продуктов и/или непищевых применений. В определенных вариантах осуществления в способах рафинирования, предоставленных в настоящем документе, используется вода, различные кислоты и/или различные основания или их комбинация.
В другом аспекте в настоящем документе предусмотрен способ увеличения скорости реакции фосфолипазы, используемой в способе ферментативного рафинирования, так чтобы ферментативная реакция имела длительность менее приблизительно одного часа.
В другом аспекте в настоящем документе предусмотрен способ рафинирования композиции на основе масла, в котором как гидратируемые, так и негидратируемые, фосфолипиды можно обрабатывать в едином процессе, где ферментативная реакция завершается в течение менее приблизительно одного часа.
В одном варианте осуществления в настоящем документе предусмотрен способ гидролиза, расщепления или разрушения содержащей фосфолипид композиции, включающий:
(A) (a) предоставление полипептида фосфолипазы; (b) предоставление композиции, содержащей фосфолипид; и (c) контактирование полипептида стадии (a) с композицией стадии (b) в условиях, где фосфолипаза гидролизует, расщепляет или разрушает содержащую фосфолипид композицию;
(B) способ согласно (A), где композиция содержит содержащий фосфолипид липидный бислой или мембрану; или
(C) способ согласно любому из (A) или (B), где композиция содержит клетку растения, бактериальную клетку, клетку дрожжей, клетку насекомых или клетку животных.
В одном варианте осуществления в настоящем документе предусмотрен способ разжижения или удаления содержащей фосфолипид композиции, включающий:
(a) предоставление полипептида фосфолипазы;
(b) предоставление композиции, содержащей фосфолипид; и
(c) контактирование полипептида стадии (a) с композицией стадии (b) в условиях, где фосфолипаза удаляет или разжижает содержащую фосфолипид композицию.
В одном варианте осуществления в настоящем документе предусмотрен способ очистки фитостерина или тритерпена, включающий:
A1) (AIa) предоставление композиции, содержащей полипептид фосфолипазы;
(AIb) предоставление композиции, содержащей фитостерин или тритерпен; и
(AIc) контактирование полипептида стадии (a) с композицией стадии (b) в условиях, где полипептид может катализировать гидролиз фосфолипида в композиции;
(BI) способ согласно (AI), где фитостерин или тритерпен содержит растительный стерин;
(CI) способ согласно (BI), где растительный стерин происходит из растительного масла;
(DI) способ согласно (CI), где растительное масло включает кокосовое масло, масло канолы, масло какао, кукурузное масло, хлопковое масло, льняное масло, оливковое масло, пальмовое масло, арахисовое масло, масло, полученное из рисовой шелухи, сафлоровое масло, кунжутное масло, соевое масло или подсолнечное масло;
(EI) способ согласно любому из (AI)-(DI), кроме того, включающий применение неполярных растворителей для количественной экстракции свободных фитостеринов и фитостериловых эфиров жирных кислот; или
(FI) способ согласно (EI), где фитостерин или тритерпен включает β-ситостерин, кампестерин, стигмастерин, стигмастанол, β-ситостанол, ситостанол, десмостерин, халинастерин, пориферастерин, клионастерин или брассикастерин.
В одном варианте осуществления в настоящем документе предусмотрен способ рафинирования масла или жира, включающий:
(A1) (A1a) предоставление композиции, содержащей полипептид фосфолипазы;
(A1b) предоставление композиции, содержащей масло или жир, содержащие фосфолипид; и
(A1c) контактирование полипептида стадии (A1a) с композицией стадии (A1b) в условиях, где полипептид может катализировать гидролиз фосфолипида в композиции;
(B1) способ согласно (A1), где полипептид находится в водном растворе, который добавляют в композицию;
(C1) способ согласно (B1), где уровень воды составляет приблизительно от 0,5 до 5%;
(D1) способ согласно любому из (A1)-(C1), где длительность процесса составляет менее чем приблизительно 2 часа;
(E1) способ согласно любому из (A1)-(C1), где длительность процесса составляет менее чем приблизительно 60 минут;
(F1) способ согласно любому из (A1)-(C1), где длительность процесса составляет менее чем приблизительно 30 минут, менее чем приблизительно 15 минут или менее чем приблизительно 5 минут;
(G1) способ согласно любому из (A1)-(F1), где условия гидролиза включают температуру приблизительно от 25°C до 70°C;
(H1) способ согласно любому из (AI)-(GI), где условия гидролиза включают применение щелочей;
(I1) способ согласно любому из (A1)-(H1), где условия гидролиза включают pH приблизительно от pH 3 до pH 10;
(J1) способ согласно любому из (A1)-(I1), где условия гидролиза включают добавление эмульгаторов и/или смешение после контактирования стадии (A1)(A1c);
(K1) способ согласно любому из (A1)-(J1), включающий добавление реагента для расслоения эмульсии и/или нагревание или охлаждение для обеспечения отделения водной фазы;
(L1) способ согласно любому из (A1)-(K1), включающий рафинирование перед стадией контактирования для сбора лецитина центрифугированием, а затем добавление PLC, PLC и/или PLA для удаления негидратируемых фосфолипидов;
(M1) способ согласно любому из (A1)-(L1), включающий рафинирование гидратацией неочищенного масла до менее чем 10 м.д. фосфора для пищевых масел и дополнительную физическую очистку до менее чем приблизительно 50 м.д. фосфора для биодизельных масел; или
(N1) способ согласно любому из (A1)-(M1), включающий добавление кислоты для обеспечения гидратации негидратируемых фосфолипидов.
В одном варианте осуществления в настоящем документе предусмотрен способ рафинирования масла или жира, включающий:
(a1) предоставление композиции, содержащей полипептид фосфолипазы;
(b1) предоставление композиции, содержащей содержащий фосфолипид жир или масло; и
(c1) контактирование полипептида стадии (a1) и композиции стадии (b1) в условиях, где полипептид может катализировать гидролиз фосфолипида в композиции.
В одном варианте осуществления в настоящем документе предусмотрен способ физической очистки содержащей фосфолипид композиции, включающий:
(A-1) (A-1a) предоставление композиции, содержащей полипептид фосфолипазы;
(A-1b) предоставление композиции, содержащей фосфолипид; и
(A-1c) контактирование полипептида стадии (A-1a) с композицией стадии (A-1b) до, в процессе или после физической очистки;
(B-1) способ согласно (A-1), где полипептид добавляют до физической очистки, и композиция, содержащая фосфолипид, содержит растение, и полипептид экспрессируется трансгенно в растении, причем полипептид добавляют в процессе дробления семян или другой части растения или полипептид добавляют после дробления или перед очисткой;
(C-1) способ согласно (A-1), где полипептид добавляют в процессе физической очистки;
(D-1) способ согласно (A-1), где полипептид добавляют после физической очистки: в интенсивном смесителе или ретенционном смесителе; после стадии нагревания; в центрифуге; в соапсток; в смывную воду; или на стадии отбеливания или дезодорирования; или
(E-1) способ согласно любому из (A-1)-(D-1), кроме того, включающий добавление фермента фосфолипазы A (PLA), фосфолипазы B (PLB), фосфолипазы C (PLC), фосфолипазы D (PLD) или фосфатазы, или их комбинации.
В одном варианте осуществления в настоящем документе предусмотрен способ щелочной очистки содержащей фосфолипид композиции, включающий:
(A1) (A1a) предоставление композиции, содержащей полипептид, обладающий активностью фосфолипазы;
(A1b) предоставление композиции, содержащей фосфолипид; и
(A1e) контактирование полипептида стадии (A1a) с композицией стадии (A1b) до, в процессе или после щелочной очистки;
(B1) способ согласно (A1), где полипептид добавляют до добавления кислоты или щелочи;
(C1) способ согласно любому из (A1)-(B1), где полипептид добавляют в процессе щелочной очистки и различные уровни кислоты и щелочи добавляют, в зависимости от уровней фосфора и уровней свободных жирных кислот; или
(D1) способ согласно любому из (A1)-(B1), где полипептид добавляют после щелочной очистки: в интенсивном смесителе или ретенционном смесителе; после стадии нагревания; в центрифуге; в соапсток; в смывную воду; или на стадии отбеливания или дезодорирования; или
(E1) способ согласно любому из (A1)-(D1), где условия щелочной очистки обеспечивают добавлением концентрированного раствора щелочи, или где условия щелочной очистки включают применение концентрированного раствора щелочи - более концентрированного, чем промышленный стандарт 11%, или где условия щелочной очистки включают применение концентрированного раствора щелочи, который является концентрированным на 12-50%;
(F1) способ согласно любому из (A1)-(E1), где композиция, содержащая фосфолипид, содержит растение;
(G1) способ согласно любому из (F1), где полипептид экспрессируется в растении трансгенно;
(H1) способ согласно любому из (A1)-(G1), где полипептид добавляют в процессе дробления семени или другой части растения или полипептид добавляют после дробления или перед очисткой; или
(I1) способ согласно любому из (A1)-(H1), включающий процесс, указанный на фигуре 10; или процесс, указанный на фигуре 10, в котором добавляют достаточное количество кислоты для обеспечения снижения содержания металлического кальция и магния.
В одном варианте осуществления в настоящем документе предусмотрен способ деацилирования 2'- или 3'-цепи жирной кислоты из липида A, включающий контактирование липида A с полипептидом фосфолипазы.
В одном варианте осуществления в настоящем документе предусмотрен способ уменьшения массы камеди и увеличения содержания нейтрального масла (триглицериды) путем снижения удержания масла включающий:
(A1) (A1a) предоставление композиции, содержащей полипептид фосфолипазы;
(A1b) предоставление композиции, содержащей фосфолипид жир или масло; и
(A1e) контактирование полипептида стадии (A1a) и композиции стадии (Alb) в условиях, где полипептид может катализировать гидролиз фосфолипида в композиции в течение времени, достаточного для снижения массы камеди и увеличения количества нейтральных масел;
(B1) препарат белка согласно (A1), где препарат белка содержит состав, содержащий неводную жидкую композицию, отлитое твердое тело, порошок, лиофилизированный порошок, гранулярную форму, форму в виде частиц, прессованную таблетку, драже, пилюлю, форму геля, гидрогель, пасту, аэрозоль, спрей, лосьон, состав взвеси, водную/масляную эмульсию, крем, капсулу, везикулу, или мицеллярную суспензию; или
(C1) способ согласно (A1) или (B1), включающий применение смешение композиции с высоким сдвиговым усилием с последующим смешением без сдвигового усилия или с низким сдвиговым усилием по меньшей мере с одним полипептидом по изобретению, обладающим активностью фосфолипазы, для обеспечения надлежащего контактирования фосфолипидного субстрата с фосфолипазой.
В одном варианте осуществления в настоящем документе предусмотрено масло или жир, продуцируемые способами, предоставленными в настоящем документе.
Ферменты для применения в способах, предоставленных в настоящем документе, включают ферменты, обладающие активностью фосфолипазы. Активность фосфолипазы включает, например, активность фосфолипазы C (PLC), активность фосфолипазы A (PLA), активность фосфолипазы A1 или активность фосфолипазы A2, активность фосфолипазы B (PLB), включая активность фосфолипазы B 1 или фосфолипазы B2, активность фосфолипазы D (PLD), включая активность фосфолипазы D1 или активность фосфолипазы D2. В одном варианте осуществления ферменты для применения в настоящем документе включают полипептиды, обладающие активностью фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) или эквивалентного фермента, и/или активностью другой фосфолипазы, включая активность фосфолипазы A, B, C, D, пататина, фосфатаз фосфатидной кислоты (PAP) и/или ацилгидролазы липидов (LAH) или эквивалентного фермента.
В определенных вариантах осуществления фермент для применения в способах, представленных в настоящем документе, выбран из фосфолипазы A, фосфолипазы C, фосфатидилинозитол-специфической фосфолипазы C или их комбинации. В определенных вариантах осуществления фермент для применения в способах, предоставленных в настоящем документе, выбран из фосфолипазы C, фосфатидилинозитол-специфической фосфолипазы C или их комбинации. В определенных вариантах осуществления фермент для применения в способах, предоставленных в настоящем документе, представляет собой фермент фосфатидилинозитол-специфическую фосфолипазу C, как описано в настоящем документе. В определенных вариантах осуществления фермент для применения в способах, предоставленных в настоящем документе, выбран из фосфолипазы C, и фермента, содержащего SEQ ID NO: 8. В определенных вариантах осуществления фермент для применения в способах, предоставленных в настоящем документе, представляет собой фермент, содержащий SEQ ID NO: 8.
В другом варианте осуществления в настоящем документе предусмотрен способ получения фосфолипида из пищевого масла. В определенном варианте осуществления фосфолипиды, получаемые способами, предоставленными в настоящем документе, включают множество фосфолипидов, включая, но не ограничиваясь ими, фосфатидилхолин (PC), фосфатидилэтаноламин (PE), фосфатидилсерин (PS), фосфатидилинозитол (PI), фосфатидную кислоту (PA), лизофосфатидилхолин (LPC), лизофосфатидилэтаноламин (LPE), лизофосфатидилсерин (LPS), лизофосфатидилинозитол (LPI), лизофосфатидную кислоту (LPA), холин (C), этаноламин (E), серин (S) и инозитол (I).
В другом варианте осуществления в настоящем документе предусмотрен способ получения холина (C), этаноламина (E), серина (S) или инозитола (I) из пищевого масла.
Подробное описание одного или нескольких вариантов осуществления данного изобретения представлено далее на прилагаемых ниже чертежах и описании. Другие свойства, цели и преимущества изобретения будут очевидны из описания и чертежей, и из формулы изобретения.
Все публикации, патенты, патентные заявки, последовательности из GenBank и материалы АТСС, цитированные в данном описании для любых целей, таким образом, полностью включены в данное описание в качестве ссылок.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Описанные ниже чертежи иллюстрируют варианты осуществления изобретения, и не подразумевается, что они ограничивают объем изобретения, охватываемый формулой изобретения.
На фиг. 1 схематично проиллюстрирован иллюстративный способ очистки растительного масла с использованием фосфолипаз по изобретению.
На фиг. 2 схематично проиллюстрирован иллюстративный процесс рафинирования по изобретению для физически очищенных масел, как подробно рассмотрено ниже.
На фиг. 3 схематично проиллюстрирован гидролиз фосфатидов фосфолипазой C по изобретению, как подробно рассмотрено ниже.
На фиг. 4 схематично проиллюстрирован иллюстративный процесс щелочной очистки по изобретению, и проиллюстрирован альтернативный вариант осуществления, включающий применение фосфолипазы C по изобретению в качестве "добавки для щелочной очистки" (щелочная очистка с длительным перемешиванием), как подробно рассмотрено ниже.
На фиг. 5 схематично проиллюстрировано применение фосфолипазы C по изобретению в качестве добавки для рафинирования, как подробно рассмотрено ниже.
На фиг. 6 схематично проиллюстрирован иллюстративный процесс щелочной очистки по изобретению, и проиллюстрирован альтернативный вариант осуществления, включающий применение фосфолипазы C по изобретению в качестве "добавки для щелочной очистки" (щелочная очистка с длительным перемешиванием), как подробно рассмотрено ниже.
На фиг. 7 проиллюстрирован другой вариант способов по изобретению, где в способе используют две стадии центрифугирования, как подробно рассмотрено ниже.
На фиг. 8 проиллюстрирован другой вариант способов по изобретению, где в способе используют три стадии центрифугирования, как подробно рассмотрено ниже.
На фиг. 9 проиллюстрирован другой иллюстративный вариант этого процесса, в котором используется обработка кислотой и имеется стадия центрифугирования перед стадией рафинирования, как подробно рассмотрено ниже.
На фиг. 10 проиллюстрирована массовая доля отдельных типов фосфолипидов (PL): фосфатидной кислоты (PA), фосфатидилэтаноламина (PE), фосфатидилинозитола (PI), фосфатидилхолина (PC) относительного общего содержания PL, остающегося после обработки мутантными фосфолипазами по изобретению.
На фиг. 11 проиллюстрированы улучшенные мутанты, полученные способом "мутагенеза с насыщением сайтов гена" или "GSSM", отобранные для включения в библиотеку повторной сборки генов, которая включает иллюстративные фосфолипазы по изобретению.
На фиг. 12 проиллюстрирован спиртовой процесс, который может включать ферменты по изобретению.
На фиг. 13 представлена композиция фосфолипидов в извлеченных влажных камедях в контрольных примерах.
На фиг. 14 представлено сравнение фосфолипидов согласно контрольным примерам против примеров с использованием способов, представленных в настоящем документе, где pH на стадии b) доводят до pH 7,0.
На фиг. 15 сравнивается потеря нейтрального масла в фазу камеди в контрольных реакциях с нейтральным pH против реакций с доведенным pH при pH 7,0, параллельно.
На фиг. 16 сравнивается потеря нейтрального масла в фазу камеди в условиях различных pH, где используется фосфолипаза A1.
На фиг. 17 представлено распределение капель в водной фазе, полученной способом согласно примеру 17A.
На фиг. 18 представлено распределение капель в водной фазе, полученной способом согласно примеру 17B.
На фиг. 19 представлено распределение капель в водной фазе, полученной способом согласно примеру 17C.
На фиг. 20 представлено распределение капель в водной фазе, полученной способом согласно примеру 17D.
На фиг. 21 представлено сравнительное распределение капель в водной фазе, полученной способами согласно примерам 17A, 17B, 17C и 17D.
Подобные символы на различных чертежах указывают на подобные элементы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к полипептидам, обладающим активностью фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) или эквивалентного фермента, и/или активностью другой фосфолипазы, включая активность фосфолипазы A, B, C, D, пататина, фосфатаз фосфатидной кислоты (PAP) и/или ацилгидролаз липидов (LAH) или активностью эквивалентного фермента, к полинуклеотидам, кодирующим их, антителам, которые специфично связываются с ними, и способам их получения и применения.
В одном варианте осуществления активность фермента фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) у полипептидов по изобретению включает:
1-фосфатидил-1D-миоинозитол 4,5-бифосфат (также называемый PIP2, фосфатидилинозитолбифосфатом)+H2O↔1D-миоинозитол 1,4,5-трифосфат (также называемый IP3, инозитолтрифосфатом) + диацилглицерин
В альтернативных вариантах осуществления ферменты по изобретению могут эффективно расщеплять глицеринфосфатную сложноэфирную связь в маслах, таких как растительные масла, например, фосфолипиды масличных семян, с образованием экстрагируемого водой фосфорилированного основания и диглицерида.
В альтернативных вариантах осуществления фосфолипазы по изобретению обладают активностью ацилгидролазы липидов (LAH); или могут расщеплять глицеринфосфатные сложноэфирные связи в фосфатидилхолине (PC), фосфатидилэтаноламине (PE), фосфатидилсерине (PS), фосфатидилинозитоле (PI), фосфатидной кислоте и/или сфингомиелине, или они обладают комбинацией этих видов активности. Например, в одном аспекте фосфолипаза по изобретению является специфичной к одному или нескольким специфическим субстратам, например, фермент по изобретению может обладать специфичностью действия в отношении PE и PC; PE и PI; PE и PS; PS и PC; PS и PI; PI и PC; PS, PI и PC; PE, PI и PC; PC, PE и PS; PE, PS и PI; или PE, PS, PI и PC.
В альтернативных вариантах осуществления фосфолипазу по изобретению (например, фермент фосфатидилинозитол-специфическую фосфолипазу C (PI-PLC) или фермент с эквивалентной активностью) можно использовать для ферментативного рафинирования масел, например, неочищенных масел, поскольку фосфатная группа растворима в воде и ее легко удалять. Диглицеридный продукт остается в масле и, таким образом, потери снижаются. PLC по изобретению можно применять в дополнение к или вместо PLA1 и PLA2 в коммерческом рафинировании масла, таком как способ ENZYMAX®, где фосфолипиды гидролизуют с помощью PLA1 и PLA2.
В альтернативных вариантах осуществления фосфолипазы по изобретению являются активными при высокой и/или при низкой температуре, или на протяжении широкого диапазона температур, например, они могут быть активными при температурах в диапазоне от 20°C до 90°C, от 30°C до 80°C, или от 40°C до 70°C. Также изобретение относится к фосфолипазам, которые обладают активностью при щелочных pH или кислых pH, например, при низкой кислотности воды. В альтернативных аспектах фосфолипазы по изобретению могут обладать активностью в кислых pH, таких как pH 6,5, pH 6,0, pH 5,5, pH 5,0, pH 4,5, pH 4,0, pH 3,5, pH 3,0, pH 2,5, pH 2,0 или при более кислых pH (т.е. <pH 2,0). В альтернативных аспектах фосфолипазы по изобретению могут обладать активностью при щелочных pH, таких как pH 7,5, pH 8,0, pH 8,5, pH 9,0, pH 9,5, pH 10,0 или более щелочные pH (т.е. >pH 10,0). В одном аспекте фосфолипазы по изобретению являются активными в диапазоне температур от приблизительно 40°C до приблизительно 70°C, 75°C или 80°C, или более, в условиях низкой водной активности (низкого содержания воды).
Также изобретение относится к способам получения PLC и/или модификации активности иллюстративных фосфолипаз по изобретению для получения ферментов с альтернативными желаемыми свойствами, например, с активностью фермента фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), имеющего альтернативные субстраты, или с видами активности в различных условиях окружающей среды, например, при различных температурах, pH и т.п. Например, фосфолипазы, полученные способами по изобретению, могут обладать измененной субстратной специфичностью, специфичностью связывания субстрата, характером расщепления субстрата, термической стабильностью, pH/профилем активности, pH/профилем стабильности (таким как увеличенная стабильность при низких, например, pH<6 или pH<5, или высоких, например, pH>9, значениях pH), устойчивостью к окислению, зависимостью от Ca2+, удельной активностью и т.п. Изобретение относится к изменению любого представляющего интерес свойства. Например, изменение может приводить к варианту, который, по сравнению с исходной фосфолипазой, обладает измененным pH- и температурным профилем активности.
В альтернативных вариантах осуществления фосфолипазы по изобретению применяют на различных стадиях переработки масел, таких как экстракция масла, например, при удалении "фосфолипидных камедей", в процессе, называемом "рафинирование масла", как описано в настоящем документе. Изобретение относится к композициям (например, содержащим ферменты по изобретению) и способам обработки масел, например, неочищенных масел, и производства масел, например, растительных масел, из различных источников, таких как масло из рисовой шелухи, сои, рапса, арахиса, кунжута, подсолнуха и кукурузы. Ферменты фосфолипазы по изобретению можно применять вместо PLA, например, фосфолипазы A2, на любой стадии переработки растительного масла.
В определенных вариантах осуществления пригодные ферменты для применения в способах, предоставленных в настоящем документе, включают один или несколько ферментов фосфолипазы A (PLA), ферментов фосфолипаза C (PLC), ферментов фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) или их комбинации. Ферменты PLA включают фосфолипазу A1 (PLA1) и/или фосфолипазу A2 (PLA2).
Как используют в настоящем документе, "неочищенное масло" относится к (также называемому нерафинированным маслом) прессованному или экстрагированному маслу или их смеси из, например, растительных источников, включая, но не ограничиваясь ими, масло асаи, миндальное масло, масло бабассу, масло семян черной смородины, масло семян огуречника, масло канолы, масло кешью, касторовое масло, кокосовое масло, кориандровое масло, кукурузное масло, хлопковое масло, масло крамбе, масло льняного семени, масло виноградных зерен, масло из лесного ореха, конопляное масло, масло ятрофы, масло хохобы, льняное масло, масло ореха макадамия, масло ядра манго, масло пенника лугового, горчичное масло, костяное масло, оливковое масло, пальмовое масло, пальмоядровое масло, пальмовый олеин, арахисовое масло, масло американского ореха, кедровое масло, фисташковое масло, маковое масло, рапсовое масло, рисовое масло, сафлоровое масло, масло камелии, кунжутное масло, масло из семян ши, соевое масло, подсолнечное масло, таловое масло, масло тсубаки, ореховое масло, типы "природных" масел, обладающих измененным составом жирных кислот, полученных с помощью генетически модифицированных организмов (GMO) или традиционной "селекции", такие как высокоолеиновое, низколиноленовое или низконасыщенное масло (высокоолеиновое масло канолы, низколиноленовое соевое масло или высокостеариновые подсолнечные масла). Дополнительные иллюстративные масла, пригодные для применения в способах, предоставленных в настоящем документе, описаны в настоящем документе. В определенном варианте осуществления общее содержание фосфатидов в неочищенном масле может варьировать в пределах 0,5-3% масс./масс., что соответствует содержанию фосфора в диапазоне 200-1200 м.д. или 250-1200 м.д.
Как используют в настоящем документе, "рафинированное масло" относится к маслу, полученному после удаления NHP, гидратируемых фосфолипидов и лецитинов (в совокупности известных как "камеди") из масла с получением продукта в виде рафинированного масла или жира, который можно использовать для производства пищи и/или непищевых применений. Различные способы рафинирования известны в данной области и описаны выше. В определенных вариантах осуществления рафинированное масло обладает содержанием фосфолипидов менее чем приблизительно 200 м.д. фосфора, менее чем приблизительно 150 м.д. фосфора, менее чем приблизительно 100 м.д. фосфора, менее чем приблизительно 50 м.д. фосфора, менее чем приблизительно 40 м.д. фосфора, менее чем приблизительно 30 м.д. фосфора, менее чем приблизительно 20 м.д. фосфора, менее чем приблизительно 15 м.д. фосфора, менее чем приблизительно 10 м.д. фосфора, менее чем приблизительно 7 м.д. фосфора, менее чем приблизительно 5 м.д. фосфора, менее чем приблизительно 3 м.д. фосфора или менее чем приблизительно 1 м.д. фосфора.
Как используют в настоящем документе, термин "негидратируемые фосфолипиды" или "NHP" относится к фосфатидной кислоте и солям фосфатидной кислоты, например, солям фосфатидной кислоты с кальцием, магнием и железом; и солям этаноламина с кальцием, магнием и железом.
Как используют в настоящем документе, "рафинированное гидратацией масло" относится к маслу, полученному после процесса рафинирования гидратацией. В определенных вариантах осуществления рафинированное гидратацией масло получают перемешиванием 1-3% масс./масс. горячей воды с теплым (60-90°C) неочищенным маслом в течение 30-60 минут. В определенных вариантах осуществления стадия рафинирования гидратацией удаляет фосфатиды и клейкие камеди, которые становятся нерастворимыми в масле после гидратации. Гидратированные фосфатиды и камеди можно отделять от масла осаждением, фильтрацией или центрифугированием.
Получение нуклеиновых кислот и манипулирование ими
Изобретение относится к выделенным, синтетическим и рекомбинантным нуклеиновым кислотам (например, иллюстративная последовательность SEQ ID NO: 5 и нуклеиновые кислоты, кодирующие SEQ ID NO: 6), содержащим (и имеющим) одно или несколько изменений аминокислотных остатков (например, мутаций) как указано в таблицах 12-15, включая экспрессирующие кассеты, такие как экспрессирующие векторы, кодирующие полипептиды и фосфолипазы по изобретению. Также изобретение включает способы выявления новых последовательностей фосфолипазы с использованием нуклеиновых кислот по изобретению. Также предусмотрены способы модификации нуклеиновых кислот по изобретению, например, посредством синтетической повторной сборки лигированием, оптимизированной системы направленных изменений и/или мутагенеза с насыщением.
Нуклеиновые кислоты по изобретению могут быть получены, выделены и/или обработаны, например, посредством клонирования и экспрессии библиотек кДНК, амплификации транскрипта или геномной ДНК посредством ПЦР и т.п. Для применения на практике способов по изобретению гомологичные гены могут быть модифицированы воздействием на матричную нуклеиновую кислоту, как описано в данном описании. Изобретение можно применять на практике совместно с любым способом или протоколом, или устройством, известными в данной области, которые полностью описаны в научной и патентной литературе.
В альтернативных вариантах осуществления последовательности генов по изобретению, или гены, используемые для применения на практике изобретения, включают сегмент ДНК, вовлеченный в образование полипептидной цепи, включая, среди прочего, области, предшествующие и следующие после кодирующей области, такие как лидерная и концевая часть, промоторы и энхансеры, а также, где это применимо, последовательности (интроны), встроенные между отдельными кодирующими сегментами (экзонами).
В альтернативных вариантах осуществления нуклеиновые кислоты или последовательности нуклеиновых кислот по изобретению, или используемые для применения изобретения на практике, могут содержать олигонуклеотид, нуклеотид, полинуклеотид или фрагмент любого из них, ДНК или РНК (например, мРНК, рРНК, тРНК, иРНК) геномного или синтетического происхождения, которая может быть одноцепочечной или двухцепочечной и может быть представлена смысловой или антисмысловой (комплементарной) цепью, пептидно-нуклеиновую кислоту (PNA) или любое ДНК-подобное или РНК-подобное вещество природного или синтетического происхождения, включая, например, иРНК, рибонуклеопротеины (например, двухцепочечные иРНК, например, иРНП). Термин охватывает нуклеиновые кислоты, т.е. олигонуклеотиды, содержащие известные аналоги природных нуклеотидов. В альтернативных вариантах осуществления нуклеиновые кислоты или последовательности нуклеиновых кислот по изобретению, или используемые для применения на практике изобретения, также охватывают подобные нуклеиновым кислотам структуры с синтетическими каркасами, см. например, Mata (1997) Toxicol. Appl. Pharmacol. 144: 189-197; Strauss-Soukup (1997) Biochemistry 36:8692-8698; Samstag (1996) Antisense Nucleic Acid Drug Dev 6: 153-156.
Общие способы
Нуклеиновые кислоты, используемые для осуществления данного изобретения, любые из РНК, iPHK, антисмысловой нуклеиновой кислоты, кДНК, геномной ДНК, векторов, вирусов или их гибридов, можно выделять из множества источников, можно получать способами генной инженерии, можно амплифицировать и/или экспрессировать/получать рекомбинантными способами. Рекомбинантные полипептиды, полученные из этих нуклеиновых кислот, можно индивидуально выделять или клонировать и можно тестировать в отношении желаемой активности. Можно использовать любые рекомбинантные экспрессирующие системы, включая экспрессирующие системы клеток бактерий, млекопитающих, дрожжей, насекомых или растений.
Альтернативно, такие нуклеиновые кислоты можно синтезировать in vitro хорошо известными способами химического синтеза, как описано, например, в Adams (1983) J. Am. Chem. Soc., 105:661; Belousov (1997) Nucleic Acids. Res., 25:3440-3444; Frenkel (1995) Free Radic. Biol. Med., 19:373-380; Blommers (1994) Biochemistry, 33:7886-7896; Narang (1979) Meth. Enzymol., 68:90; Brown (1979) Meth. Enzymol., 68:109; Beaucage (1981) Terra. Lett., 22:1859; в патенте США No. 4458066.
Способы для манипулирования с нуклеиновыми кислотами, такие как, например, субклонирование, введение зонда (например, мечение со случайными праймерами с использованием полимеразы Кленова, ник-трансляция, амплификация), секвенирование, гибридизация и т.п. полностью описаны в научной и патентной литературе, см., например, Sambrook, ed., MOLECULAR CLONING: A LABORATORY MANUAL (2ND ED.), v. 1-3, Cold Spring Harbor Laboratory, (1989); CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, Ausubel, ed. John Wiley & Sons, Inc., New York (1997); LABORATORY TECHNIQUES IN BIOCHEMISTRY AND MOLECULAR BIOLOGY: HYBRIDIZATION WITH NUCLEIC ACID PROBES, Part I. Theory and Nucleic acid Preparation, Tijssen, ed. Elsevier, N.Y. (1993).
Другими подходящими способами получения и манипулирования с нуклеиновыми кислотами, используемыми для осуществления способов по изобретению, являются клонирование из геномных образцов и, если желательно, скрининг и повторное клонирование вставок, выделенных или амплифицированных из, например, геномных клонов или клонов кДНК. Источники нуклеиновой кислоты, используемой в способах по изобретению, включают геномные библиотеки или библиотеки кДНК, содержащиеся, например, в искусственных хромосомах млекопитающих (MAC), см., например, патенты США No. 5721118; 6025155; искусственных хромосомах человека, см., например, Rosenfeld (1997) Nat. Genet. 15:333-335; искусственных хромосомах дрожжей (YAC); искусственных хромосомах бактерий (ВАС); искусственных хромосомах Р1, см., например, Woon (1998) Genomics, 50:306-316; векторах, полученных на основе P1 (PACs), см., например, Kern (1997) Biotechniques, 23:120-124; космидах, рекомбинантных вирусах, фагах или плазмидах.
В одном аспекте нуклеиновая кислота, кодирующая полипептид по изобретению, соединена в соответствующем участке с лидерной последовательностью, способной направлять секрецию транслируемого полипептида или его фрагмента.
Изобретение относится к слитым белкам и нуклеиновым кислотам, кодирующим их. Полипептид по изобретению можно подвергать слиянию с гетерологичным пептидом или полипептидом, таким как N-концевые идентификационные пептиды, которые придают желаемые свойства, такие как повышение стабильности или упрощение очистки. Пептиды и полипептиды по изобретению также можно синтезировать и экспрессировать в качестве слитых белков с одним или несколькими дополнительными доменами, связанными с ними, например, для получения более иммуногенного пептида, для упрощения выделения рекомбинантного синтезированного пептида, для идентификации и выделения антител и экспрессирующих антитела В-клеток и т.п. Облегчающие определение и очистку домены включают, например, пептиды, хелатирующие металлы, такие как полигистидиновые участки и молекулы гистидин-триптофана, которые делают возможной очистку на иммобилизованных металлах, домены белка А, которые делают возможной очистку на иммобилизованных иммуноглобулинах, и домен, используемый в системе очистки удлинения/аффинности FLAGS (Immunex Corp., Seattle WA). Добавление расщепляемых линкерных последовательностей, таких как фактор Ха или энтерокиназа (Invitrogen, San Diego CA), между доменом для очистки и пептидом или полипептидом, содержащим мотив, облегчает очистку. Например, экспрессирующий вектор может включать кодирующую эпитоп последовательность нуклеиновой кислоты, связанную с шестью остатками гистидина с последующим тиоредоксином и участком расщепления энтерокиназой (см., например, Williams (1995) Biochemistry, 34:1787-1797; Dobeli (1998) Protein Expr. Purif., 12:404-414). Остатки гистидина облегчают определение и очистку, в то время как участок расщепления энтерокиназой обеспечивает средство очистки эпитопа от остального слитого белка. Технология, относящаяся к векторам, кодирующим слитые белки, и применение слитых белков полностью описаны в научной и патентной литературе, см., например, Kroll (1993) DNA Cell. Biol., 12:441-53.
Последовательности контроля транскрипции и трансляции
Изобретение относится к последовательностям нуклеиновых кислот (например, ДНК) по изобретению, функционально связанным с последовательностью(ями) для контроля экспрессии (например, транскрипционными или трансляционными), например, с промоторами или энхансерами, для управления и модулирования синтеза/экспрессии РНК. Последовательность для контроля экспрессии может находиться в экспрессирующем векторе. Иллюстративные бактериальные промоторы включают lacI, lacZ, Т3, T7, gpt, lambda PR, PL и trp. Иллюстративные эукариотические промоторы включают предранний промотор CMV, промотор HSV тимидинкиназы, ранний и поздний промотор SV40, LTR ретровирусов и промотор мышиного металлотионеина I.
Промоторы, пригодные для экспрессии полипептида в бактериях, включают промоторы lac или trp E. coli, промотор lacI, промотор lacZ, промотор Т3, промотор Т7, промотор gpt, промотор lambda PR, промотор lambda PL, промоторы из оперонов, кодирующих гликолитические ферменты, такие как промотор 3-фосфоглицераткиназы (PGK) и кислой фосфатазы. Эукариотические промоторы включают предранний промотор CMV, промотор HSV тимидинкиназы, промоторы теплового шока, ранний и поздний промотор SV40, LTR ретровирусов и промотор металотионеина-1 мыши. Также могут быть использованы другие промоторы, известные тем, что они контролируют экспрессию генов в прокариотических или эукариотических клетках или их вирусах.
Экспрессирующие кассеты, векторы и носители для клонирования
Изобретение относится к экспрессирующим векторам и носителям для клонирования, содержащим нуклеиновые кислоты по изобретению, например, последовательности, кодирующие фосфолипазы по изобретению. Экспрессирующие векторы и носители для клонирования по изобретению могут содержать частицы вирусов, бакуловирус, фаг, плазмиды, фагмиды, космиды, фосмиды, искусственные бактериальные хромосомы, вирусную ДНК (например, ДНК вируса осповакцины, аденовируса, поксвируса птиц, вируса псевдобешенства и производных SV40), искусственные хромосомы на основе Р1, дрожжевые плазмиды, искусственные хромосомы дрожжей и любые другие векторы, специфические для конкретных представляющих интерес хозяев (таких как Bacillus, Aspergillus и дрожжи). Векторы по изобретению могут включать хромосомные, нехромосомные последовательности и синтетические последовательности ДНК. Большое количество подходящих векторов известно специалистам в данной области, и они являются коммерчески доступными. Иллюстративные векторы включают бактериальные: векторы pQE (Qiagen, San Diego, CA), плазмиды pBluescript (Stratagene, San Diego, CA), векторы pNH, (векторы lambda-ZAP (Stratagene); ptrc99a, pKK223-3, pDR540, pRIT2T (Pharmacia); эукариотические: pXT1, pSG5 (Stratagene), pSVK3, pBPV, pMSG, pSVLSV40 (Pharmacia). Однако можно использовать любую другую плазмиду или другой вектор при условии, что они способны реплицироваться и являются устойчивыми в хозяине. В соответствии с настоящим изобретением могут быть использованы векторы с низкой копийностью или с высокой копийностью.
В альтернативных вариантах осуществления термин "экспрессирующая кассета" включает нуклеотидную последовательность, которая способна влиять на экспрессию структурного гена (т.е. кодирующей белок последовательности, такой как фосфолипаза по изобретению) в хозяине, совместимом с такими последовательностями. Экспрессирующие кассеты могут включать по меньшей мере промотор, функционально связанный с кодирующей полипептид последовательностью; и, необязательно, с другими последовательностями, например, с сигналами терминации транскрипции. Также могут быть использованы дополнительные факторы, например, энхансеры. В альтернативных вариантах осуществления "функционально связанный" относится к расположению промотора выше последовательности ДНК, так чтобы промотор опосредовал транскрипцию последовательности ДНК. В альтернативных вариантах осуществления экспрессирующие кассеты включают плазмиды, экспрессирующие векторы, рекомбинантные вирусы, любую форму рекомбинантного вектора с "депроинизированной ДНК", и т.п.
В альтернативных вариантах осуществления векторы по изобретению содержат нуклеиновую кислоту, которая может инфицировать, трансфицировать, временно или постоянно трансдуцировать клетку. В альтернативных вариантах осуществления вектор может представлять собой депротеинизированную нуклеиновую кислоту или нуклеиновую кислоту в комплексе с белком или липидом. Вектор необязательно содержит вирусные или бактериальные нуклеиновые кислоты и/или белки, и/или мембраны (например, клеточную мембрану, вирусную липидную оболочку и т.д.). Векторы включают, но не ограничиваются ими, репликоны (например, РНК-репликоны, бактериофаги), с которыми можно соединять фрагменты ДНК и делать их реплицирующимися. Таким образом, векторы включают, но не ограничиваются ими, РНК, автономную самореплицирующуюся кольцевую или линейную ДНК или РНК (например, плазмиды, вирусы и т.п., см., например, патент США No. 5217879), и включают как экспрессирующие, так и неэкспрессирующие плазмиды. Если рекомбинантный микроорганизм или клеточная культура описаны как содержащие "экспрессирующий вектор", то в этом случае включается как экстрахромосомную кольцевую, так и линейную ДНК, и ДНК, которая встраивается в хромосому(ы) хозяина. В случае если вектор поддерживается в клетке-хозяине, вектор может либо стабильно реплицироваться клетками в процессе митоза в качестве автономной структуры, либо он является встроенным в геном хозяина.
В альтернативных вариантах осуществления изобретение относится к плазмидам, которые могут быть обозначены с помощью строчной буквы "p", которой предшествуют и/или за которой следуют прописные буквы и/или числа. В альтернативных вариантах осуществления "исходная" плазмида является коммерчески доступной, общедоступной без ограничений или она может быть сконструирована на основе доступных плазмид в соответствии с опубликованными методиками. В альтернативных вариантах осуществления плазмиды, эквивалентные описанным в данном описании плазмидам, известны в данной области и будут очевидны среднему специалисту в данной области.
В альтернативных вариантах осуществления экспрессирующий вектор может содержать промотор, участок связывания рибосомы для инициации трансляции и терминатор транскрипции. Также вектор может включать соответствующие последовательности для усиления экспрессии. Экспрессирующие векторы млекопитающих могут содержать ориджин репликации, любые необходимые участки связывания рибосом, участок полиаденилирования, доноры сплайсированных фрагментов и акцепторные участки, последовательности терминации транскрипции и фланкирующие 5'-конец нетранскрибируемые последовательности. В некоторых аспектах для получения требуемых нетранскрибируемых генетических элементов можно использовать последовательности ДНК, полученные из участков сплайсинга иполиаденилирования SV40.
В одном аспекте экспрессирующие векторы содержат один или несколько генов селективных маркеров для обеспечения селекции клеток-хозяев, содержащих вектор. Такие селективные маркеры включают гены, кодирующие дигидрофолатредуктазу, или гены, придающие устойчивость к неомицину, для культур эукариотических клеток, гены, придающие устойчивость к тетрациклину или ампициллину для Е. coli, и ген TRP1 S. cerevisiae. Могут быть выбраны промоторные участки из любых других желаемых генов с использованием векторов с хлорамфениколтрансферазой (CAT) или других векторов с селективными маркерами.
Также для повышения уровня экспрессии векторы для экспрессии полипептида или его фрагмента в эукариотических клетках могут содержать энхансеры. Энхансеры представляют собой цис-регуляторные элементы ДНК длиной, как правило, приблизительно от 10 до приблизительно 300 п.о., которые воздействуют на промотор и повышают его транскрипцию. Примеры включают энхансер SV40 на поздней стороне ориджина репликации с 100-270 п.о., энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы на поздней стороне ориджина репликации и энхансеры аденовирусов.
Последовательность ДНК можно встраивать в вектор различными методами. Как правило, последовательность лигируют с вектором в желаемом положении после расщепления вставки и вектора соответствующими эндонуклеазами рестрикции. Альтернативно, можно лигировать тупые концы вставки и вектора. В данной области известно множество технологий клонирования, например, как описано Ausubel и Sambrook. Такие методики и другие входят в компетенцию специалистов в данной области.
Вектор может быть в форме плазмиды, вирусной частицы или фага. Другие векторы включают хромосомные, нехромосомные и синтетические последовательности ДНК, производные SV40; бактериальные плазмиды, фаговую ДНК, бакуловирус, плазмиды дрожжей, векторы, полученные из комбинаций плазмидной и фаговой ДНК, вирусную ДНК, такую как ДНК вируса осповакцины, аденовируса, поксвируса птиц и вируса псевдобешенства. Различные векторы для клонирования и экспрессирующие векторы для использования в прокариотических и эукариотических хозяевах описаны, например, Sambrook.
Конкретные бактериальные векторы, которые могут быть использованы, включают коммерчески доступные плазмиды, содержащие генетические элементы хорошо известного вектора для клонирования pBR322 (ATCC 37017), pKK223-3 (Pharmacia Fine Chemicals, Uppsala, Швеция), GEM1 (Promega Biotec, Madison, WI, USA) pQE70, pQE60, pQE-9 (Qiagen), pD10, psiX174 pBluescript II KS, pNH8A, pNH16a, pNH18A, pNH46A (Stratagene), ptrc99a, pKK223-3, pKK233-3, DR540, pRIT5 (Pharmacia), pKK232-8 и рСМ7. Конкретные эукариотические векторы включают pSV2CAT, pOG44, pXT1, pSG (Stratagene) pSVK3, pBPV, pMSG и pSVL (Pharmacia). Однако можно использовать любой другой вектор при условии, что он способен реплицироваться и является устойчивым в клетке-хозяине.
Клетки-хозяева и трансформированные клетки
Также изобретение относится к трансформированной клетке, содержащей последовательность нуклеиновой кислоты по изобретению, например, последовательность, кодирующую фосфолипазу по изобретению, вектор по изобретению. Клетка-хозяин может представлять собой любую из клеток-хозяев, известных специалистам в данной области, включая прокариотические клетки, эукариотические клетки, такие как клетки бактерий, клетки грибов, клетки дрожжей, клетки млекопитающих, клетки насекомых или клетки растений. Ферменты по изобретению можно экспрессировать в любой клетке-хозяине, например, в любой клетке бактерий, любой клетке дрожжей, например, Pichia pastoris, Saccharomyces cerevisiae или Schizosaccharomyces pombe. Иллюстративные клетки бактерий включают любой вид рода Escherichia, Bacillus, Streptomyces, Salmonella, Pseudomonas и Staphylococcus, включая, например, Escherichia coli, Lactococcus lactis, Bacillus subtilis, Bacillus cereus, Salmonella typhimurium, Pseudomonas fluorescens. Иллюстративные клетки грибов включают любой вид Aspergillus. Иллюстративные клетки дрожжей включают любой вид Pichia, Saccharomyces, Schizosaccharomyces или Schwanniomyces, включая Pichia pastoris, Saccharomyces cerevisiae или Schizosaccharomyces pombe. Иллюстративные клетки насекомых включают любой вид Spodoptera или Drosophila, включая Drosophila S2 и Spodoptera Sf9. Иллюстративные клетки животных включают клетки CHO, COS или меланомы Bowes или любую клеточную линию мыши или человека. Выбор подходящего хозяина находится в пределах квалификации специалистов в данной области.
Вектор может быть введен в клетку-хозяина с использованием любой из различных технологий, включая трансформацию, трансфекцию, трансдукцию, вирусную инфекцию, генные пушки или Ti-опосредованный перенос генов. Конкретные способы включают трансфекцию с фосфатом кальция, трансфекцию, опосредуемую DEAE-декстраном, липофекцию или электропорацию (Davis L., Dibner М., Battey L. Basic Methods in Molecular Biology (1986)).
Когда это целесообразно, клетки-хозяева, полученные способами инженерии, можно культивировать на общепринятых питательных средах, модифицированных соответствующим образом для активации промоторов, селекции трансформантов или амплификации генов по изобретению. После трансформации подходящего штамма клеток-хозяев и выращивания штамма клеток-хозяев до приемлемой плотности клеток выбранный промотор можно индуцировать индуцирован соответствующими способами (например, сменой температуры или химическим индуцированием) и клетки можно культивировать в течение дополнительного периода времени для того, чтобы получить возможность продуцировать желаемый полипептид или его фрагмент.
Клетки можно собирать центрифугированием, разрушать физическими или химическими способами, и полученный неочищенный экстракт можно сохранять для дальнейшей очистки. Микробные клетки, используемые для экспрессии белков, можно разрушать любым общепринятым способом, включая циклы замораживания и оттаивания, разрушение ультразвуком, механическое разрушение или использование средств для лизиса клеток. Такие способы хорошо известны специалистам в данной области.
Экспрессированный полипептид или его фрагмент можно извлекать и очищать из культур рекомбинантных клеток методами, включающими осаждение сульфатом аммония или этанолом, экстрагирование кислотой, анионную или катионную обменную хроматографию, хроматографию с фосфоцеллюлозой, хроматографию гидрофобного взаимодействия, аффинную хроматографию, хроматографию с гидроксилапатитом и хроматографию с лектином. Если необходимо, для завершения конфигурации полипептида можно использовать стадии рефолдинга. Если необходимо, для конечной стадии очистки можно использовать высокоэффективную жидкостную хроматографию (ВЭЖХ).
Также для экспрессии рекомбинантного белка можно использовать различные системы клеточных культур млекопитающих. Примеры систем экспрессии млекопитающих включают линии фибробластов почки обезьяны COS-7 и другие клеточные линии, способные экспрессировать белки совместимого вектора, такие как клеточные линии С127, 3Т3, СНО, HeLa и BHK.
Конструкции в клетках-хозяевах можно использовать общепринятым образом для продуцирования продукта гена, кодируемого рекомбинантной последовательностью. В зависимости от хозяина, используемого в процессе рекомбинантного продуцирования, полипептиды, продуцируемые клеткой-хозяином, содержащей вектор, могут быть гликозилированными или могут быть негликозилированными. Полипептиды по изобретению также могут включать начальный аминокислотный остаток метионина или не включать его.
Также для получения полипептида по изобретению можно использовать бесклеточные системы трансляции. В бесклеточных системах трансляции можно использовать мРНК, транскрибированные с конструкции ДНК, содержащей промотор, функционально связанный с нуклеиновой кислотой, кодирующей полипептид или его фрагмент. В некоторых аспектах перед проведением реакции транскрипции in vitro конструкция ДНК может быть линеаризована. Затем транскрибированную мРНК инкубируют с соответствующим бесклеточным экстрактом для трансляции, таким как экстракт ретикулоцитов кролика, с получением желаемого полипептида или его фрагмента.
Экспрессирующие векторы могут содержать один или несколько генов селективных маркеров для обеспечения фенотипического признака для селекции трансформированных клеток-хозяев, такого как дигидрофолатредуктаза или устойчивость к неомицину для культур эукариотических клеток, или такого как устойчивость к тетрациклину или ампициллину в E. coli.
Иллюстративный фермент PI-PLC (обладающий последовательностью, указанной в SEQ ID NO: 6, содержащий (и имеющий) одно или более изменений аминокислотных остатков (например, мутаций), как указано в таблицах 12-15) был сверхэкспрессирован в активной форме в различных хозяйских системах, включая грамотрицательные бактерии, такие как E. coli, грамположительные бактерии, такие как любые Bacillus sp. (например, Bacillus subtilis, Bacillus cereus), дрожжевые клетки-хозяева (включая, например, Pichia pastoris, Saccharomyces sp., такие как S. cerevisiae и S. pombe) и Lactococcus lactis, или клетки млекопитающих, грибов, растений или насекомых. Активный фермент экспрессируется в каждой хозяйской системе с различных конструкций. Эти экспрессирующие конструкции нуклеиновой кислоты могут содержать нуклеотиды, кодирующие полноразмерную открытую рамку считывания (состоящую из сигнальной последовательности, пропоследовательности и кодирующей зрелый белок последовательности) или они могут содержать эти генетические элементы либо отдельно, либо в комбинации с гетерологичными генетическими элементами, которые служат в качестве сигнальной последовательности и/или пропоследовательности для открытой рамки считывания зрелого белка. Каждая из этих систем может служить в качестве коммерческого продуцирующего хозяина для экспрессии PLC для применения в ранее описанных ферментативных процессах рафинирования масла.
Амплификация нуклеиновых кислот
При осуществлении изобретения на практике, нуклеиновые кислоты, кодирующие полипептиды по изобретению, или модифицированные нуклеиновые кислоты, можно воспроизводить, например, путем амплификации. Изобретение относится к последовательностям пары праймеров для амплификации нуклеиновых кислот, кодирующих полипептиды с активностью фосфолипазы. В одном аспекте пары праймеров способны амплифицировать последовательности нуклеиновых кислот по изобретению. Специалист в данной области может конструировать последовательности пары праймеров для амплификации для любой части или для полной длины этих последовательностей.
Изобретение относится к последовательностям пары праймеров для амплификации нуклеиновой кислоты, кодирующей полипептид, обладающий активностью фосфолипазы, где пара праймеров способна амплифицировать нуклеиновую кислоту, содержащую последовательность по изобретению, или ее фрагменты или подпоследовательности. Один или каждый член последовательностей пары праймеров может содержать олигонуклеотид, содержащий по меньшей мере приблизительно от 10 до 50 последовательно расположенных оснований последовательности или приблизительно 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 последовательно расположенных оснований последовательности.
Изобретение относится к паре праймеров для амплификации, где пара праймеров включает первый член, имеющий последовательность, как указано, из приблизительно первых (5') 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 остатков нуклеиновой кислоты по изобретению, и второй член, имеющий последовательность, как указано, из приблизительно первых (5') 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 остатков цепи, комплементарной цепи для первого члена. Изобретение относится фосфолипазам, полученным амплификацией, например, с помощью полимеразной цепной реакции (ПЦР), с использованием пары праймеров для амплификации по изобретению. Изобретение относится к способам получения фосфолипаз амплификацией, например, с помощью полимеразной цепной реакции (ПЦР), с использованием пары праймеров для амплификации по изобретению. В одном аспекте пара праймеров для амплификации амплифицирует нуклеиновую кислоту из библиотеки, например, из библиотеки генов, такой как библиотека окружающей среды.
Реакции амплификации также можно использовать для определения количества нуклеиновой кислоты в образце (такого как количество транскрипта в клеточном образце), внесения метки в нуклеиновую кислоту (например, для использования на матрицах или в блотах), обнаружения нуклеиновой кислоты или определения количества конкретной нуклеиновой кислоты в образце. В одном аспекте изобретения амплифицируют транскрипт, выделенный из клетки или библиотеки кДНК. Специалист в данной области может выбрать и разработать приемлемые олигонуклеотидные праймеры для амплификации. Способы амплификации также хорошо известны в данной области и включают, например, полимеразную цепную реакцию, ПЦР (см., например, PCR protocols, A guide to methods and applications, ed. Innis, Academic Press, N.Y. (1990) и PCR strategies (1995), ed. Innis, Academic Press, Inc., N.Y.), лигазную цепную реакцию (ЛЦР) (см., например, Wu (1989) Genomics, 4:560; Landegren (1988) Science 241:1077; Barringer (1990) Gene, 89:117); транскрипционную амплификацию (см., например, Kwoh (1989) Proc. Natl. Acad. Sci., USA, 86:1173) и самоподдерживающуюся репликацию последовательности (см., например, Guatelli (1990) Proc. Natl. Acad. Sci., USA, 87:1874); амплификацию с репликазой Q Beta (см., например, Smith (1997) J. Clin. Microbiol., 35:1477-1491), автоматизированный анализ амплификацией с репликазой Q-beta (см., например, Burg (1996) Mol. Cell. Probes, 10:257-271) и другие технологии, опосредуемые РНК-полимеразой (например, NASBA, Cangene, Mississauga, Ontario); см. также Berger (1987) Methods Enzymol., 152:307-316; Sambrook; Ausubel; патенты США No. 4683195 и 4683202; Sooknanan (1995) Biotechnology, 13:563-564.
Определение степени идентичности последовательностей
Изобретение относится к выделенным и рекомбинантным нуклеиновым кислотам, содержащим последовательности, обладающие по меньшей мере приблизительно 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, или полной (100%) идентичностью последовательности с иллюстративной нуклеиновой кислотой по изобретению (например, SEQ ID NO: 5 и кодирующая одну или несколько мутаций, указанных в таблицах 12-15, как рассмотрено в примере 3, или ее ферментативно активный фрагмент, и нуклеиновые кислоты, кодирующие SEQ ID NO: 6 и кодирующие одну или несколько мутаций, указанных в таблицах 12-15, как рассмотрено в примере 3, или ее ферментативно активный фрагмент) на протяжении области по меньшей мере приблизительно 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150, 1200, 1250, 1300, 1350, 1400, 1450, 1500, 1550 или более остатков. Изобретение относится к полипептидам, содержащим последовательности, обладающие по меньшей мере приблизительно 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более или полной (100%) идентичностью последовательности с иллюстративным полипептидом по изобретению. Степень идентичности (гомологии) последовательностей можно определять с использованием любой компьютерной программы и связанных с ней параметров, включая программы, описанные в настоящем документе, такие как BLAST 2.2.2. или FASTA версии 3.0t78, с параметрами по умолчанию. В альтернативных вариантах осуществления идентичность последовательностей может быть на протяжении области по меньшей мере приблизительно 5, 10, 20, 30, 40, 50, 100, 150, 200, 250, 300, 350, 400 последовательно расположенных остатков или полной длины нуклеиновой кислоты или полипептида. Степень идентичности (гомологии) последовательностей можно определять с использованием любой компьютерной программы связанных с ней параметров, включая программы, описанные в настоящем документе, такие как BLAST 2.2.2. или FASTA версии 3.0t78, с параметрами по умолчанию.
Гомологичные последовательности также включают последовательности РНК, в которых остатки уридина замещают остатки тимина в последовательности нуклеиновой кислоты. Гомологичные последовательности могут быть получены с использованием любой из методик, описанных в данном описании, или могут быть получены в результате коррекции ошибок при секвенировании. Следует понимать, что последовательности нуклеиновых кислот, указанные в настоящем документе, могут отображаться в традиционном формате отдельных символов (см., например, Stryer, Lubert. Biochemistry, 3rd Ed., W.H. Freeman & Co., New York) или в любом другом формате, в котором записывается название нуклеотидов в последовательности.
Различные программы для сравнения последовательностей, указанные в настоящем документе, используются в этом аспекте изобретения. Идентичность (гомологию) белков и/или последовательностей нуклеиновых кислот можно оценивать с использованием любого из различных алгоритмов сравнения последовательностей и программ, известных в данной области. Такие алгоритмы и программы включают, но не ограничиваются ими, TBLASTN, BLASTP, FASTA, TFASTA и CLUSTALW (Pearson and Lipman, Proc. Natl. Acad. Sci., USA, 85 (8):2444-2448, 1988; Altschul et al., J. Mol. Biol., 215 (3):403-410, 1990; Thompson et al., Nucleic Acid. Res., 22(2):4673-4680, 1994; Higgins et al., Methods Enzymol., 266:383-402, 1996; Altschul et al., J. Mol. Biol., 215 (3):403-410, 1990; Altschul et al., Nature Genetics, 3:266-272, 1993).
Гомологию или идентичность можно определять с использованием программного обеспечения для анализа последовательностей (например, Sequence Analysis Software Package, Genetics Computer Group, University, Wisconsin Biotechnology Center, 1710 University Avenue, Madison, WI 53705). Такое программное обеспечение сопоставляет сходные последовательности, присваивая степени гомологии различным делециям, заменам и другим модификациям. Термины "гомология" и "идентичность" в контексте двух или более последовательностей нуклеиновых кислот или полипептидов относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или обладают точно определенным процентным количеством аминокислотных остатков или нуклеотидов, которые оказываются одинаковыми при сравнении и выравнивании для максимального соответствия в пределах окна сравнения или обозначенной области, которое измеряется с использованием любого количества алгоритмов сравнения последовательностей или выравниванием вручную и визуальным исследованием. При сравнении последовательностей одна последовательность может выступать в качестве эталонной последовательности, с которой сравнивают анализируемые последовательности. При использовании алгоритма сравнения последовательностей анализируемую и эталонную последовательности вносят в компьютер, координаты подпоследовательностей обозначают, если необходимо, и определяют параметры программы алгоритма для последовательностей. Можно использовать параметры по умолчанию или можно назначить альтернативные параметры. Затем на основании параметров программы алгоритм сравнения последовательностей вычисляет процентную идентичность последовательностей для анализируемой последовательности относительно эталонной последовательности.
Как используют в настоящем документе, "окно сравнения" относится к сегменту любого из числа последовательно расположенных остатков. Например, в альтернативных аспектах изобретения, последовательно расположенные остатки с любой длиной в диапазоне от 20 до полной длины иллюстративной последовательности по изобретению сравнивают с эталонной последовательностью из того же числа последовательно расположенных положений после оптимального выравнивания двух последовательностей. Если эталонная последовательность обладает требуемой идентичностью последовательности с иллюстративной последовательностью по изобретению, например, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичностью последовательности с последовательностью по изобретению, то эта последовательность находится в объеме изобретения. В альтернативных вариантах осуществления подпоследовательности в диапазоне приблизительно от 20 до 600, приблизительно от 50 до 200, и приблизительно от 100 до 150 сравнивают с эталонной последовательностью того же числа последовательно расположенных положений после оптимального выравнивания двух последовательностей. Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Оптимальное выравнивание последовательностей для сравнения может быть проведено, например, посредством алгоритма локальной гомологии Smith & Waterman, Adv. Appl. Math., 2:482, 1981, посредством алгоритма выравнивания по гомологии Needleman & Wunsch, J. Mol. Biol., 48:443, 1970, посредством поиска сходства способом Person & Lipman, Proc. Nat'l. Acad. Sci., USA, 85:2444, 1988, посредством компьютеризованного использования этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI), или посредством выравнивания вручную и визуального исследования. Другие алгоритмы для определения гомологии и идентичности включают, например, помимо программы BLAST (Basic Local Alignment Search Tool в National Center for Biological Information), ALIGN, AMAS (Analysis of Multiply Aligned Sequence), AMPS (Protein Multiple Sequence Alignment), ASSET (Aligned Segment Statistical Evaluation Tool), BANDS, BESTSCOR, BIOSCAN (Biological Sequence Comparative Analysis Node), BLIMPS (BLocks IMProved Searcher), FASTA, Intervals & Points, BMB, CLUSTAL V., CLUSTAL W., CONSENSUS, LCONSENSUS, WCONSENSUS, алгоритм Smith-Waterman, DARWIN, алгоритм Las Vegas, FNAT (Forced Nucleotide Alignment Tool), Framealign, Framesearch, DYNAMIC, FILTER, FSAP (Fristensky Sequence Analysis Package), GAP (Global Alignment Program), GENAL, GIBBS, GenQuest, ISSC (Sensitive Sequence Comparison), LALIGN (Local Sequence Alignment), LCP (Local Content Program), MACAW (Multiple Alignment Construction & Analysis Workbench), MAP (Multiple Alignment Program), MBLKP, MBLKN, PIMA (Pattern-Induced Multi-sequence Alignment), SAGA (Sequence Alignment by Genetic Algorithm) и WHAT-IF. Такие программы для выравнивания также могут быть использованы для скрининга геномных баз данных для идентификации полинуклеотидных последовательностей, по существу, с идентичными последовательностями. Доступным является ряд геномных баз данных, например, основная часть генома человека доступна в качестве части проекта секвенирования генома человека (Gibbs, 1995). Было отсеквенировано несколько геномов, например, М. genitalium (Fraser et al., 1995), M. jannaschii (Bult et al., 1996), H. influenzae (Fleischmann et al., 1995), E. coli (Blattner et al., 1997) и дрожжи (S. cerevisiae) (Mewes et al., 1997) и D. melanogaster (Adams et al., 2000). Значительный прогресс также был достигнут в секвенировании геномов моделей организмов, таких как мышь, С. elegans и Arabadopsis sp. Базы данных, содержащие информацию геномов, снабженных некоторой функциональной информацией, поддерживаются различными организациями и являются доступными через Интернет.
Также для осуществления изобретения на практике используют алгоритмы BLAST, BLAST 2.0 и BLAST 2.2.2. Они описаны, например, в Altschul (1977) Nuc. Acids Res., 25: 3389-3402, и Altschul (1990), J. Mol. Biol., 215:403-410, соответственно. Программное обеспечение для осуществления анализов BLAST является общедоступным через National Center for Biotechnology Information. Этот алгоритм включает первичную идентификацию пар последовательностей с максимальным сходством (HSP) посредством идентификации коротких слов с длиной W в представляющей интерес последовательности, которые либо совпадают, либо удовлетворяют некоторому оцениваемому положительно порогу значения Т при выравнивании со словом такой же длины в последовательности из базы данных. Т определяется как порог значений для соседних слов (Altschul (1990) выше). Эти изначальные совпадения соседних слов выступают в роли предшественников для начала поиска при обнаружении более длинных HSP, содержащих их. Поиск совпадений слов распространяется в обоих направлениях вдоль каждой последовательности до тех пор, пока суммарное значение для выравнивания может повышаться. Суммарные значения вычисляются с использованием для нуклеотидных последовательностей параметров M (значение компенсации за пару совпавших остатков; всегда >0). Для аминокислотных последовательностей для вычисления суммарного значения используется оценочная матрица. Продолжение поиска совпадений слов в каждом направлении останавливают, если суммарное значение для выравнивания снижается по величине X ниже максимально достижимого значения; суммарное значение снижается до нуля или ниже при накоплении одного или нескольких выровненных остатков с отрицательным значением или если достигнут конец любой последовательности. Параметры алгоритма BLAST W, Т и X определяют чувствительность и скорость выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует в качестве параметров по умолчанию длину слова (W) 11, ожидаемое значение (Е) 10, М=5, N=-4 и сравнение обеих цепей. Для аминокислотных последовательностей программа BLASTP использует в качестве параметров по умолчанию длину слова 3 и ожидаемые значения (Е) 10 и оценочную матрицу BLOSUM62 (см. Henikoff & Henikoff (1989) Proc. Natl. Acad. Sci., USA, 89:10915), фрагменты для выравнивания (В) 50, ожидаемое значение (Е) 10, М=5, N=-4 и сравнение обеих цепей.
Алгоритм BLAST также осуществляет статистический анализ сходства между двумя последовательностями (см., например, Karlin & Altschul (1993) Proc. Natl. Acad. Sci., USA, 90:5873). Один способ определения сходства, обеспечиваемый алгоритмом BLAST, представляет собой наименьшую суммарную вероятность (P(N)), которая предполагает указание вероятности, с которой совпадение между двумя нуклеотидными или аминокислотными последовательностями может произойти случайным образом. Например, нуклеиновая кислота рассматривается как сходная с контрольной последовательностью, если наименьшая суммарная вероятность при сравнении анализируемой нуклеиновой кислоты с контрольной нуклеиновой кислотой составляет менее чем приблизительно 0,2, более предпочтительно менее чем приблизительно 0,01 и предпочтительно менее чем приблизительно 0,001. В одном аспекте гомологию последовательности белка и нуклеиновой кислоты оценивают с использованием Basic Local Alignment Search Tool ("BLAST"). Например, для осуществления следующих задач используют пять конкретных программ BLAST: (1) BLASTP и BLAST3 сравнивают представляющую интерес аминокислотную последовательность с базой данных последовательностей белков; (2) BLASTN сравнивает представляющую интерес нуклеотидную последовательность с базой данных нуклеотидных последовательностей; (3) BLASTX сравнивает концептуальные продукты трансляции с шести рамок представляющей интерес нуклеотидной последовательности (обе нити) с базой данных белковых последовательностей; (4) TBLASTN сравнивает представляющую интерес белковую последовательность с базой данных нуклеотидных последовательностей, транслируемых со всех шести рамок считывания (обе цепи); и (5) TBLASTX сравнивает продукты трансляции с шести рамок представляющей интерес нуклеотидной последовательности с продуктами трансляции с шести рамок базы данных нуклеотидных последовательностей. Программы BLAST идентифицируют гомологичные последовательности посредством идентификации сходных сегментов, которые в данном описании называются "парами сегментов с максимальным сходством" между представляющей интерес последовательностью аминокислоты или нуклеиновой кислоты и анализируемой последовательностью, которая предпочтительно получена из последовательности белка или нуклеиновой кислоты из базы данных. Пары сегментов с максимальным сходством предпочтительно идентифицируются (т.е. выравниваются) посредством оценочных матриц, многие из которых известны в данной области. В одном аспекте оценочная матрица представляет собой матрицу BLOSUM62 (Gonnet et al., Science, 256:1443-1445, 1992; Henikoff and Henikoff, Poteins, 17:49-61, 1993). В меньшей степени предпочтительно также могут быть использованы матрицы РАМ или РАМ250 (см., например, Schwartz and Dayhoff, eds., 1978, Matrices for Detecting Distance Relationships: Atlas of Protein Sequence and Structure, Washington: National Biomedical Research Foundation).
В одном аспекте изобретения для определения того, обладает ли нуклеиновая кислота требуемой идентичностью последовательности, чтобы находиться в объеме изобретения, используют программы NCBI BLAST 2.2.2, параметры по умолчанию для blastp. В программе BLAST 2.2.2 существует приблизительно 38 устанавливаемых параметров. В этом иллюстративном аспекте изобретения используют все величины по умолчанию, за исключением параметра фильтрации по умолчанию (т.е., все параметры установлены по умолчанию за исключением фильтрации, которая установлена на OFF); вместо него используют параметр "-F F", который выключает фильтрацию. Применение фильтрации по умолчанию часто приводит к противоречиям Karlin-Altschul вследствие короткой длины последовательности.
Величины по умолчанию, используемые в этом иллюстративном аспекте изобретения, как рассмотрено выше, включают:
"Filter for low complexity: ON
> Word Size: 3
> Matrix: Blosum62
> Gap Costs: Existence: 11
> Extension: 1"
Другие параметры по умолчанию представляют собой: фильтр низкой комплексности OFF, размер слова 3 для белка, матрицу BLOSUM62, штраф за внесение пропуска -11 и штраф за продолжение делеции -1.
Иллюстративные параметры программы NCBI BLAST 2.2.2 указаны в примере 1, ниже. Следует отметить, что параметр по умолчанию "-W" принимает значение 0. Это означает, что если он не установлен, размер слова принимает значение по умолчанию, равное 3 для белков и 11 для нуклеотидов.
Гибридизация нуклеиновых кислот
Изобретение относится к выделенным, синтетическим или рекомбинантным нуклеиновым кислотам, которые в жестких условиях гибридизуются с иллюстративной последовательностью по изобретению, например, с последовательностью, указанной в SEQ ID NO: 5 и имеющей одну или несколько мутаций, указанных в таблицах 12-15, как описано в примере 3, или с нуклеиновой кислотой, которая кодирует полипептид, содержащий последовательность, указанную SEQ ID NO: 6 и которая кодирует одну или несколько мутаций, указанных в таблицах 12-15, как описано в примере 3, или их ферментативно активный фрагмент.
Жесткие условия могут представлять собой высоко жесткие условия, умеренно жесткие условия и/или условия с низкой жесткостью, включая условия с высокой и сниженной жесткостью, описанные в данном описании. В альтернативных аспектах длина нуклеиновых кислот по изобретению, определенных по их способности гибридизоваться в жестких условиях, может составлять приблизительно от пяти остатков до полной длины нуклеиновой кислоты по изобретению, например, иллюстративной нуклеиновой кислоты по изобретению. Например, их длина может составлять по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 50, 55, 60, 65, 70, 75, 80, 90, 100, 150, 200, 250, 300, 350, 400 или более остатков. Нуклеиновые кислоты, которые короче полной длины, также включены. Эти нуклеиновые кислоты могут быть пригодны, например, в качестве зондов для гибридизации, зондов для мечения, олигонуклеотидных зондов для ПЦР, iPHK (одноцепочечной или двухцепочечной), антисмысловой последовательности или последовательности, кодирующей пептиды, связывающиеся с антителами (эпитопами), мотивов, активных центров, связывающих доменов, регуляторных доменов и т.п.
В одном аспекте нуклеиновые кислоты по изобретению определяются по их способности гибридизоваться в условиях высокой жесткости, включающих условия приблизительно с 50% формамидом при температуре от 37 до 42°С. В одном аспекте нуклеиновые кислоты по изобретению определяются по их способности гибридизоваться в условиях пониженной жесткости, включающих условия приблизительно с 35-25% формамидом при температуре приблизительно от 30 до 35°С. Альтернативно, нуклеиновые кислоты по изобретению определяются по их способности гибридизоваться в условиях высокой жесткости, включающих условия с температурой 42°С в 50% формамиде, 5Х SSPE, 0,3% SDS и с нуклеиновой кислотой, блокирующей повторяющиеся последовательности, такие как cot-1 или ДНК спермы лосося (например, 200 нг/мл расщепленной и денатурированной ДНК спермы лосося). В одном аспекте нуклеиновые кислоты по изобретению определяются по их способности гибридизоваться в условиях пониженной жесткости, включающих 35% формамид при температуре от пониженной до 35°С.
После гибридизации фильтр можно промывать 6X SSC, 0,5% SDS при 50°C. Эти условия считаются "умеренными" условиями при концентрации формамида выше 25% и "низкими" условиями при концентрации формамида ниже 25%. Конкретный пример "умеренных" условий гибридизации представляет собой условия, когда описанную выше гибридизацию проводят при концентрации формамида 30%. Конкретный пример условий гибридизации "низкой жесткости" представляет собой условия, когда описанную выше гибридизацию проводят при концентрации формамида 10%.
Диапазон температур, соответствующий конкретному уровню жесткости, можно далее сужать путем вычисления соотношения пуринов и пиримидинов в представляющей интерес нуклеиновой кислоте и коррекции температуры соответствующим образом. Нуклеиновые кислоты по изобретению также определяются их способностью гибридизоваться в условиях высокой, умеренной и низкой жесткости, как указано в Ausubel и Sambrook. Варьирование указанных выше диапазонов и условий можно использовать для осуществления изобретения на практике, и они хорошо известны в данной области. Условия гибридизации рассмотрены ниже.
Олигонуклеотидные зонды и способы их использования
Изобретение относится к зондам нуклеиновых кислот для идентификации и/или выделения нуклеиновой кислоты, кодирующей полипептид, обладающий активностью фосфолипазы. В одном аспекте зонд содержит или состоит из нуклеиновой кислоты по изобретению, например, нуклеиновой кислоты, имеющей последовательность, указанную в SEQ ID NO: 5 и имеющую одно или несколько изменений оснований (мутаций), как указано в таблицах 12-15, как описано в примере 3 ниже, или нуклеиновой кислоты, которая кодирует полипептид, содержащий последовательность, указанную в SEQ ID NO: 6, и кодирующей одно или несколько изменений аминокислот (мутаций), как указано в таблицах 12-15, или ее ферментативно активный фрагмент. Альтернативно, зонд по этому изобретению может представлять собой по меньшей мере приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или 150 или приблизительно от 10 до 50, приблизительно от 20 до 60, приблизительно от 30 до 70 последовательно расположенных оснований последовательности нуклеиновой кислоты по изобретению.
Зонды идентифицирует нуклеиновую кислоту путем связывания или гибридизации. В альтернативных вариантах осуществления гибридизация включает процесс, в котором цепь нуклеиновой кислоты связывается с комплементарной цепью путем спаривания оснований. Реакции гибридизации могут быть чувствительными и селективными, так чтобы конкретную представляющую интерес последовательность можно было идентифицировать даже в образцах, в которых она присутствует в низких концентрациях. Пригодные жесткие условия могут определяться, например, концентрациями соли или формамида в растворах для предгибридизации и гибридизации, или температурой гибридизации, и хорошо известны в данной области. Например, жесткость можно увеличивать путем уменьшения концентрации соли, увеличения концентрации формамида, или увеличения температуры гибридизации, изменения времени гибридизации, как подробно описано ниже. В альтернативных аспектах нуклеиновые кислоты по изобретению определяются их способностью гибридизоваться в условиях различной жесткости (например, высокой, средней и низкой), как указано в настоящем документе.
Зонды можно использовать в матрицах по изобретению, см. обсуждение ниже, включая, например, капиллярные матрицы. Зонды по изобретению также можно использовать для выделения и/или идентификации других кодирующих фосфолипазу нуклеиновых кислот или полипептидов, обладающих активностью фосфолипазы.
Зонды по изобретению можно использовать для определения того, содержит ли биологический образец, такой как образец почвы, организм с последовательностью нуклеиновой кислоты по изобретению. По таким методикам получают биологический образец, потенциально содержащий организм, из которого была выделена нуклеиновая кислота, и из образца получают нуклеиновые кислоты. Нуклеиновые кислоты подвергают контактированию с зондом в условиях, которые делают возможной специфичную гибридизацию зонда с любой комплементарной последовательностью, которая представлена в них.
При необходимости условия, которые делают возможной специфическую гибридизацию зонда с комплементарной последовательностью, можно определять контактированием образца с комплементарными последовательностями из образцов, о которых известно, что они содержат комплементарную последовательность, а также с контрольными последовательностями, которые не содержат комплементарной последовательности. Условия гибридизации, такие как концентрация соли в буфере для гибридизации, концентрация формамида в буфере для гибридизации или температура гибридизации, можно варьировать для идентификации условий, которые дают возможность зонду специфично гибридизоваться с комплементарными нуклеиновыми кислотами (см. обсуждение конкретных условий гибридизации).
Если образец содержит организм, из которого нуклеиновая кислота была выделена, тогда определяют наличие специфической гибридизации зонда. Наличие гибридизации может быть определено путем мечения зонда поддающимся детекции веществом, таким как радиоактивный изотоп, флуоресцентный краситель или фермент, способный катализировать образование детектируемого продукта. Специалистам в данной области известны различные способы использования меченых зондов для определения наличия комплементарных нуклеиновых кислот в образце. Они включают анализы саузерн-блот, нозерн-блот, методы гибридизации колоний и дот-блот анализ. Протоколы для каждого из указанных методов представлены в Ausubel и Sambrook.
Альтернативно, более одного зонда (по меньшей мере один из которых способен специфично гибридизоваться с любой комплементарной последовательностью, которая присутствует в образце нуклеиновой кислоты) можно использовать в реакции амплификации для определения, содержит ли образец организм, содержащий последовательность нуклеиновой кислоты по изобретению (например, организм, из которого нуклеиновая кислота была выделена). В одном аспекте, зонды включают олигонуклеотиды. В одном аспекте реакция амплификации может включать реакцию ПЦР. Протоколы ПЦР описаны в Ausubel и Sambrook (см. обсуждение реакций амплификации). По таким методикам нуклеиновые кислоты в образце контактируют с олигонуклеотидными зондами, проводят реакцию амплификации и определяют любой полученный продукт амплификации. Продукт амплификации можно определять проведением гель-электрофореза продуктов реакции и окрашиванием геля интеркалирующим красителем, таким как бромистый этидий. Альтернативно, один или несколько зондов можно метить радиоактивным изотопом, и наличие радиоактивного продукта амплификации можно определять радиоавтографией после гель-электрофореза.
Зонды, полученные из последовательностей вблизи 3'- и 5'-концов последовательностей по изобретению, также можно использовать в методах "прогулки по хромосоме" для идентификации клонов, содержащих дополнительные, например, геномные последовательности. Такие методы дают возможность выделить из организма хозяина гены, которые кодируют дополнительные белки.
В одном аспекте последовательности нуклеиновых кислот по изобретению используют в качестве зондов для идентификации и выделения родственных нуклеиновых кислот. В некоторых аспектах идентифицированные таким образом родственные нуклеиновые кислоты могут представлять собой кДНК или геномную ДНК из организмов, отличных от организма, из которых нуклеиновая кислота по изобретению была впервые выделена. В таких способах образец нуклеиновой кислоты контактируют с зондом в условиях, которые позволяют зонду специфично гибридизоваться с родственными последовательностями. Затем проводят детекцию гибридизации зонда с нуклеиновыми кислотами из родственного организма с использованием любого из способов, описанных выше.
В реакциях гибридизации нуклеиновых кислот условия, используемые для достижения конкретного уровня жесткости, будут варьировать в зависимости от природы гибридизуемой нуклеиновой кислоты. Например, при выборе условий гибридизации могут рассматриваться длина, степень комплементарности, состав нуклеотидной последовательности (например, содержание GC относительно AT) и тип нуклеиновой кислоты (например, РНК или ДНК) в гибридизуемых участках нуклеиновых кислот. В альтернативных вариантах осуществления нуклеиновая кислота иммобилизована, например, на фильтре. Гибридизация может быть проведена в условиях низкой жесткости, умеренной жесткости или высокой жесткости. В качестве примера гибридизации нуклеиновой кислоты сначала проводят прегибридизацию полимерной мембраны, содержащей иммобилизованные денатурированные нуклеиновые кислоты в течение 30 мин при 45°С в растворе, состоящем из 0,9М NaCl, 50 мМ NaH2PO4, рН 7,0, 5,0 мМ Na2EDTA, 0,5% SDS, 10X Denhardt и 0,5 мг/мл полирибоадениловой кислоты. Затем в раствор добавляют приблизительно 2×107 cpm (имп.мин) (удельная активность 4-9×108 cpm/мкг) меченого на конце 32Р олигонуклеотидного зонда. В альтернативных вариантах осуществления через 12-16 ч инкубации мембрану промывают в течение 30 мин при комнатной температуре в IX SET (150 мМ NaCl, 20 мМ гидрохлорида Tris, рН 7,8, 1 мМ Na2EDTA), содержащем 0,5% SDS, с последующим промыванием в течение 30 свежим 1X SET при Tm-10°С для олигонуклеотидного зонда. Мембрану затем подвергают воздействию пленки для радиоавтографии для определения сигналов гибридизации.
Варьируя жесткость условий гибридизации, используемых для идентификации нуклеиновых кислот, таких как кДНК или геномные ДНК, которые гибридизуются с детектируемым зондом, можно идентифицировать и выделять нуклеиновые кислоты с различными уровнями гомологии. Жесткость можно варьировать проведением гибридизации при различных температурах ниже температуры плавления зонда. Температура плавления, Tm, представляет собой температуру (при определенной ионной силе и рН) при которой 50% последовательности-мишени гибридизуется с абсолютно комплементарным зондом. Очень жесткие условия выбирают из условий, равных или приблизительно на 5°С ниже, чем Tm для конкретного зонда. Температура плавления зонда может быть вычислена с использованием следующих формул. Для зондов длиной от 14 до 70 нуклеотидов температуру плавления (Tm) вычисляют с использованием формулы
Tm = 81,5+16,6(log[Na+])+0,41(фракция G+C)-(600/N),
где N означает длину зонда.
Если гибридизацию проводят в растворе, содержащем формамид, температура плавления может быть вычислена с использованием формулы
Tm = 81,5+16,6(log[Na+])+0,41(фракция G+C)-(0,63% формамида)-(600/N),
где N означает длину зонда.
Прегибридизацию можно проводить в 6Х SSC, 5X реагенте Denhardt, 0,5% SDS, 100 мкг денатурированной фрагментированной ДНК спермы лосося или в 6Х SSC, 5X реагенте Denhardt, 0,5% SDS, 100 мкг денатурированной фрагментированной ДНК спермы лосося, 50% формамиде. Формулы для растворов SSC и Denhardt и других растворов приведены, например, в Sambrook.
Гибридизацию проводят с добавлением детектируемого зонда в растворы для прегибридизации, перечисленные выше. В случае если зонд содержит двухцепочечую ДНК, его денатурируют перед добавлением раствора для гибридизации. Фильтр контактируют с раствором для гибридизации на достаточный период времени для того, чтобы дать возможность зонду гибридизоваться с кДНК или с геномными ДНК, содержащими последовательности, комплементарные ему или гомологичные ему. Для зондов с длиной более 200 нуклеотидов гибридизацию можно проводить при температуре на 15-25°С ниже Tm. Для более коротких зондов, таких как олигонуклеотидные зонды, гибридизацию можно проводить при температуре на 5-10°C ниже Tm. В одном аспекте для гибридизации в 6Х SSC, гибридизацию проводят при приблизительно 68°С. В одном аспекте для гибридизации в растворах, содержащих 50% формамид, гибридизацию проводят при приблизительно 42°С. Все из указанных выше способов гибридизации можно считать проводимыми в условиях высокой жесткости.
После гибридизации для удаления любых неспецифично связанных детектируемых зондов фильтр промывают. Жесткость, используемая для промывания фильтров, также может варьировать в зависимости от природы гибридизуемых нуклеиновых кислот, длины гибридизуемых нуклеиновых кислот, степени комплементарности, состава нуклеотидиой последовательности (например, содержание GC относительно АТ) и типа нуклеиновой кислоты (например, РНК или ДНК). Примеры постепенно повышающихся условий жесткости состоят в следующем: 2Х SSC, 0,1% SDS при комнатной температуре в течение 15 мин (низкая жесткость); 0,1Х SSC, 0,5% SDS при комнатной температуре в течение от 30 мин до 1 ч (умеренная жесткость); 0,1Х SSC, 0,5% SDS в течение от 15 до 30 мин при температуре от температуры гибридизации до 68°С (высокая жесткость) и 0,15 М NaCl в течение 15 мин при 72°С (очень высокая жесткость). Конечное промывание с низкой жесткостью может быть проведено в 0,1X SSC при комнатной температуре. Приведенные выше примеры являются только иллюстрацией одного набора условий, который может быть использован для промывания фильтров или матриц. Специалисту в данной области известно, что существует множество способов промывания с различной жесткостью, все из которых можно использовать для осуществления изобретения на практике.
Нуклеиновые кислоты, которые гибридизовались с зондом, идентифицируют посредством радиоавтографии или других общепринятых способов. Приведенную выше методику можно модифицировать для идентификации нуклеиновых кислот с пониженным уровнем гомологии с последовательностью образца. Например, для получения нуклеиновых кислот со сниженной гомологией с образцом для определения можно использовать менее жесткие условия. Например, температуру гибридизации можно снижать на интервал 5°С в диапазоне от 68 до 42°С в буфере для гибридизации с концентрацией Na+ приблизительно 1М. После гибридизации фильтр можно промывать 2Х SSC, 0,5% SDS при температуре гибридизации. Эти условия рассматриваются как "умеренные" условия при температуре выше 50°C и "низкие" условия при температуре ниже 50°С. Конкретный пример "умеренных" условий гибридизации представляет собой пример, где представленную выше гибридизацию проводят при 55°С. Пример условий гибридизации "низкой жесткости" представляет собой пример, где представленную выше гибридизацию проводят при 45°С.
В альтернативных вариантах осуществления гибридизацию можно проводить в буферах, таких как 6Х SSC, содержащий формамид при температуре 42°С. В этом случае концентрацию формамида в буфере для гибридизации можно снижать на 5% интервал в диапазоне от 50 до 0% для идентификации клонов со сниженным уровнем гомологии с образцом. После гибридизации фильтр можно промывать 6Х SSC, 0,5% SDS при 50°С. Эти условия рассматриваются как "умеренные" условия при концентрации формамида выше 25% и "низкие" условия при концентрации формамида ниже 25%. В альтернативных вариантах осуществления "умеренные" условия гибридизаций представляют собой условия, где представленную выше гибридизацию проводят в 30% формамиде. В альтернативных вариантах осуществления условия гибридизации "низкой жесткости" представляют собой условия, где представленную выше гибридизацию проводят в 10% формамиде.
Эти зонды и способы по изобретению можно использовать для выделения нуклеиновых кислот, имеющих последовательность по меньшей мере с приблизительно 99%, приблизительно 98%, приблизительно 97%, приблизительно 96%, по меньшей мере 95%, по меньшей мере 90%, по меньшей мере 85%, по меньшей мере 80%, по меньшей мере 75%, по меньшей мере 70%, по меньшей мере 65%, по меньшей мере 60%, по меньшей мере 55% или по меньшей мере 50% гомологией с последовательностью нуклеиновой кислоты по изобретению, содержащей по меньшей мере приблизительно 10, 15, 20, 25, 30, 35, 40, 50, 75, 100, 150, 200, 250, 300, 350, 400 или 500 ее последовательно расположенных оснований и последовательностей, комплементарных им. Гомологию можно определять с использованием алгоритма выравнивания. Например, гомологичные полинуклеотиды могут обладать кодирующей последовательностью, которая является природным аллельным вариантом одной из описанных в настоящем документе кодирующих последовательностей. Такие аллельные варианты могут иметь замену, делецию или вставку одного или нескольких нуклеотидов по сравнению с нуклеиновыми кислотами по изобретению.
Кроме того, приведенные выше методики можно использовать для выделения нуклеиновых кислот, которые кодируют полипептиды, имеющие по меньшей мере приблизительно 99, по меньшей мере 95%, по меньшей мере 90%, по меньшей мере 85%, по меньшей мере 80%, по меньшей мере 75%, по меньшей мере 70%, по меньшей мере 65%, по меньшей мере 60%, по меньшей мере 55% или по меньшей мере 50% идентичность (гомологию) с полипептидом по изобретению или фрагментами, содержащими по меньшей мере 5, 10, 15, 20, 25, 30, 35, 40, 50, 75, 100 или 150 его последовательно расположенных аминокислот, которая определяется с использованием алгоритма выравнивания последовательностей (например, таких как алгоритм FASTA версии 3.0t78 с параметрами по умолчанию или программа BLAST 2.2.2 с иллюстративными параметрами, указанными в настоящем документе).
Ингибирование экспрессии фосфолипаз
Кроме того, изобретение относится к нуклеиновым кислотам, комплементарным (например, антисмысловые последовательности к) нуклеиновым кислотам по изобретению, например, кодирующим фосфолипазу нуклеиновым кислотам. Антисмысловые последовательности способны ингибировать транспорт, сплайсинг или транскрипцию кодирующих фосфолипазу генов. Ингибирование можно осуществлять путем нацеливания на геномную ДНК или матричную RНК (мРНК, транскрипт). Транскрипцию или функцию нуклеиновой кислоты-мишени можно ингибировать, например, гибридизацией и/или расщеплением. Одна особенно пригодная группа ингибиторов, предусматриваемых настоящим изобретением, включает олигонуклеотиды, которые способны связывать либо ген, либо транскрипт, в любом случае, предотвращая или ингибируя продукцию или функцию фермента фосфолипазы. Связывание может происходить путем специфичной к последовательности гибридизации. Другой пригодный класс ингибиторов включает олигонуклеотиды, которые вызывают инактивацию или расщепление транскрипта фосфолипазы. Олигонуклеотид может обладать ферментативной активностью, которая вызывает такое расщепление, как например, рибозимы. Олигонуклеотид может быть химически модифицированным или конъюгированным с ферментом или композицией, способной расщеплять комплементарную нуклеиновую кислоту. Группу из множества различных подобных олигонуклеотидов можно подвергать скринингу в отношении олигонуклеотидов с желаемой активностью.
Ингибирование экспрессии фосфолипазы может иметь множество промышленных применений. Например, ингибирование экспрессии фосфолипазы может замедлить или предотвратить порчу продукта. Порча продукта может происходить, когда липиды или полипептиды, например, структурные липиды или полипептиды, подвергаются ферментативной деградации. Это может повредить к порче или гниению фруктов и овощей. В одном аспекте композиции по изобретению, которые ингибируют экспрессию и/или активность фосфолипазы, например, антител, антисмысловых олигонуклеотидов, рибозимов и РНКi, используют для замедления или предотвращения порчи. Таким образом, в одном аспекте изобретение относится к способам и композициям, включающим нанесение на растение или растительный продукт (например, плод, семя, корень, лист и т.д.) антител, антисмысловых олигонуклеотидов, рибозимов и РНКi по изобретению для замедления или предотвращения порчи. Эти композиции также могут экспрессироваться растением (например, трансгенным растением) или другим организмом (например, бактерией или другими микроорганизмом, трансформированными геном фосфолипазы по изобретению).
Композиции по изобретению для ингибирования экспрессии фосфолипазы (например, антисмысловые молекулы, iRNA, рибозимы, антитела) можно использовать в качестве фармацевтических композиций.
Антисмысловые олигонуклеотиды
Изобретение относится к антисмысловым олигонуклеотидам, способным связывать транскрипт, которые могут ингибировать активность фосфолипазы путем нацеливания на мРНК. Стратегии для разработки антисмысловых олигонуклеотидов полностью описаны в научной и патентной литературе, и специалист в данной области может сконструировать такие олигонуклеотиды для фосфолипазы с использованием новых реагентов по изобретению. Например, протоколы "прогулок по гену"/картирования РНК для поиска эффективных антисмысловых олигонуклеотидов хорошо известны в данной области, см., например, Но (2000) Methods Enzymol., 314:168-183, где описан анализ для картирования РНК, который основан на стандартных молекулярных технологиях, для обеспечения легкого и достоверного способа эффективного выбора антисмысловой последовательности. См. также Smith (2000) Eur. J. Pharm. Sci., 11:191-198.
В качестве антисмысловых олигонуклеотидов используются природные нуклеиновые кислоты. Антисмысловые олигонуклеотиды могут иметь любую длину; например, в альтернативных аспектах длина антисмысловых олигонуклеотидов составляет приблизительно от 5 и 100, приблизительно от 10 до 80, приблизительно от 15 до 60, приблизительно от 18 до 40. Оптимальная длина может быть определена общепринятым скринингом. Антисмысловые олигонуклеотиды могут быть представлены в любой концентрации. Оптимальная концентрация может быть определена общепринятым скринингом. Известно большое множество синтетических, неприродных аналогов нуклеотидов и нуклеиновых кислот, которые могут решить эту потенциальную проблему. Например, можно использовать пептидно-нуклеиновые кислоты (PNA), содержащие неионные каркасы, такие как элементы N-(2-аминоэтил)глицина. Также могут быть использованы антисмысловые олигонуклеотиды с фосфоротиоатными связями, как описано в WO 97/03211; 96/39154; Mata (1997) Toxicol Appl. Pharmacol., 144:189-197; Antisence Therapeutics, ed. Agrawal (Humana Press, Totowa, NJ, 1996). Антисмысловые олигонуклеотиды с синтетическими аналогами каркаса ДНК, относящиеся к данному изобретению, также могут включать нуклеиновые кислоты с фосфородитиоатом, метилфосфонатом, фосфорамидатом, алкилфосфотриэфиром, сульфаматом, 3'-тиоацеталем, метилен(метилимино), 3'-N-карбаматом и морфолинокарбаматом, как описано выше.
Для создания большого количества олигонуклеотидов, которые можно быстро исследовать на наличие конкретных олигонуклеотидов, которые обладают соответствующей аффинностью связывания и специфичностью к любой мишени, такой как смысловые и антисмысловые последовательности фосфолипазы по изобретению, можно использовать комбинаторные химические методы (см., например, Gold (1995) J. of Biol. Chem., 270:13581-13584).
Ингибиторные рибозимы
Изобретение относится к рибозимам, способным связывать транскрипт фосфолипазы, которые могут ингибировать активность фермента фосфолипазы путем нацеливания на РНК. Стратегии для разработки рибозимов и селекции специфичной к фосфолипазе антисмысловой последовательности для воздействия полностью описаны в научной и патентной литературе, и специалист в данной области может разработать такие рибозимы с использованием новых реагентов по изобретению. Рибозимы действуют посредством связывания РНК-мишени с помощью связывающего РНК-мишень участка рибозима, который находится в непосредственной близости от ферментативного участка РНК, который расщепляет РНК-мишень. Таким образом, рибозим распознает и связывает РНК-мишень посредством комплементарного спаривания оснований и после связывания с соответствующим участком действует, ферментативно расщепляя и инактивируя РНК-мишень. Расщепление РНК-мишени подобным образом нарушает ее способность направлять синтез кодируемого белка, если расщепление происходит в кодирующей последовательности. После того как рибозим связался и расщепил свою РНК-мишень, он обычно высвобождается из этой РНК и, таким образом, может связывать и расщеплять новые мишени.
В некоторых случаях ферментативная природа рибозима может давать преимущества по сравнению с другими технологиями, такими как технологии антисмысловых последовательностей (где молекула нуклеиновой кислоты просто связывается с нуклеиновой кислотой-мишенью для блокирования ее транскрипции, трансляции или ассоциации с другой молекулой), поскольку эффективная концентрация рибозима, необходимая для осуществления обработки лекарственных средств, может быть ниже, чем концентрация антисмыслового олигонуклеотида. Это потенциальное преимущество отражает способность рибозима действовать ферментативно. Таким образом, единичная молекула рибозима способна расщеплять множество молекул РНК-мишеней. Кроме того, рибозим, как правило, представляет собой высокоспецифичный ингибитор со специфичностью ингибирования, зависящей не только от механизма связывания спариванием оснований, но также от механизма, посредством которого молекула ингибирует экспрессию РНК, с которой она связывается. Значит, ингибирование, происходит вследствие расщепления РНК-мишени и, таким образом, специфичность определяется как соотношение скорости расщепления РНК-мишени и скорости расщепления РНК, которая не является мишенью. Этот механизм расщепления зависит от факторов, которые являются дополнительными для факторов, вовлеченных в спаривание оснований. Таким образом, специфичность действия рибозима может быть более высокой, чем специфичность антисмыслового олигонуклеотида, связывающего тот же участок РНК.
Молекула РНК ферментативного рибозима может находиться в форме мотива в виде головки молотка, но также она может находиться в форме мотива в виде шпильки, мотива вируса гепатита дельта, мотива интрона группы I или в форме РНК, подобной РНКазе Р (в ассоциации со вспомогательной последовательностью РНК). Примеры таких мотивов в виде головки молотка описаны Rossi (1992) Aids Research and Human Retroviruses 8: 183; мотивов в виде шпильки в Hampel (1989) Biochemistry 28:4929, и Hampel (1989) Biochemistry 28:4929 и Hampel (1990) Nuc. Acids Res., 18:299; мотива вируса гепатита дельта в Perrotta (1992) Biochemistry 31:16; мотив РНКазы Р в Guerrier-Takada (1983) Cell. 35:849 и интрона группы I в патенте США No 4987071, выданном Cech. Перечисление этих конкретных мотивов не предназначено для ограничения. Специалистам в данной области будет понятно, что ферментативная молекула РНК по изобретению обладает специфичным участком связывания субстрата, комплементарным одному или нескольким участкам РНК гена-мишени и имеет нуклеотидную последовательность в этом участке связывания субстрата или рядом с ним, которая придает молекуле активность в отношении расщепления РНК.
Интерференция РНК (PHKi)
В одном аспекте изобретение относится к ингибиторной молекуле РНК, так называемой молекуле "PHKi", содержащей последовательность фосфолипазы по изобретению. Молекула PHKi содержит двухцепочечную молекулу РНК (dsPHK). PHKi может ингибировать экспрессию гена фосфолипазы. В одном аспекте длина PHKi составляет приблизительно 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более дуплексных нуклеотидов. Поскольку изобретение не ограничивается конкретным механизмом действия, PHKi может проникать в клетку и вызывать деградацию одноцепочечной РНК (ssPHK) со сходными или идентичными последовательностями, включая эндогенные мРНК. Если клетка подвергается воздействию двухцепочечной РНК (dsPHK), мРНК гомологичного гена селективно деградируется в процессе, называемом интерференцией РНК (PHKi). Возможный основной механизм, помимо PHKi, представляет собой разрушение двухцепочечной РНК (dsPHK), совпадающей со специфичной последовательностью гена на короткие фрагменты, называемые короткими интерферирующими РНК, которые запускают деградацию мРНК, которая совпадает с их последовательностью. В одном аспекте PHKi по изобретению используется в лекарственных средствах для подавления генов, см., например, Shuey (2002) Drug Discov. Today, 7:1040-1046. В одном аспекте изобретение относится к способам селективной деградации РНК с использованием PHKi по изобретению. Способ может быть осуществлен in vitro, ex vivo или in vivo. В одном аспекте молекулы PHKi по изобретению могут быть использованы для получения мутации с потерей функции в клетке, органе или животном. Способы получения и использования молекул PHKi для селективной деградации РНК хорошо известны в данной области, см., например, патенты США No. 6506559; 6511824; 6515109; 6489127.
Модификация нуклеиновых кислот
Изобретение относится к способам получения вариантов нуклеиновых кислот по изобретению, например, нуклеиновых кислот, кодирующих фермент фосфолипазу. В альтернативном варианте осуществления изобретение относится к способам модификации фермента по изобретению, например, мутацией его кодирующей последовательности случайными или стохастическими способами, или нестохастическим или "направленным изменением", таким как мутагенез с насыщением сайта генаTM (GSSM), для изменения pH-диапазона активности фермента или диапазона оптимальной активности, температурного диапазона активности активность или диапазона оптимальной активности, специфичности, активности (кинетики); использования в ферменте гликозилирования, фосфорилирования или металлов (например, Ca, Mg, Zn, Fe, Na), например, для влияния на pH/температурную стабильность. Изобретение относится к способам модификации фермента по изобретению, например, мутацией его кодирующей последовательности, например, посредством GSSM, для увеличения его устойчивости к активности протеаз. Изобретение относится к способам модификации фермента по изобретению, например, путем мутации его кодирующей последовательности, например, посредством GSSM, для модификации использования в ферменте хелаторов металлов для Ca, Mg, Na, которые не хелатируют Zn. Изобретение относится к способам модификации фермента по изобретению, например, мутацией его кодирующей последовательности, например, посредством GSSM, чтобы он имел желаемую комбинацию видов активности, например, специфичные к PI, PA и PC/PE PLC.
В одном варианте осуществления "мутагенез с насыщением сайта гена" (GSSM) или "GSSM" включает способ, в котором используются вырожденные олигонуклеотидные праймеры для введения точковых мутаций в полинуклеотид, как подробно описано ниже. В одном варианте осуществления "оптимизированная система направленных изменений" или "оптимизированные направленные изменения" включает способ повторной сборки фрагментов сходных последовательностей нуклеиновых кислот, например, сходных генов, и подробно пояснен ниже. В одном варианте осуществления "синтетическая повторная сборка лигированием" или "SLR" включает способ лигирования фрагментов олигонуклеотидов нестохастическим образом и подробно объяснен ниже.
В альтернативных вариантах осуществления изобретение относится к "вариантам" иллюстративных нуклеиновых кислот и полипептидов по изобретению, включая например, SEQ ID NO: 8, кодируемую, например, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9. В альтернативных вариантах осуществления варианты полинуклеотидов или полипептидов по изобретению представляют собой нуклеиновые кислоты или полипептиды, модифицированные в одной или нескольких парах оснований, кодонах, интронах, экзонах или аминокислотных остатках (соответственно), но, тем не менее, сохраняют биологическую активность фосфолипазы. Варианты можно получать любым из множества способов, например, таких как ПЦР с пониженной точностью, шаффлинг, олигонуклеотид-направленный мутагенез, объединяющая ПЦР, мутагенез с помощью половой ПЦР, мутагенез in vivo, кассетный мутагенез, возвратно-множественный мутагенез, экспоненциально-множественный мутагенез, сайт-специфический мутагенез, повторная сборка гена, GSSM, и любая их комбинация. Способы получения вариантов фосфолипаз, обладающих активностью при pH или температуре, например, которые отличаются от фосфолипазы дикого типа, включены в эти способы.
Эти способы можно повторять или использовать в различных комбинациях для получения ферментов фосфолипаз с измененной или отличающейся активностью или с измененной или отличающейся стабильностью относительно активности и стабильности фосфолипазы, кодируемой матричной нуклеиновой кислотой. Эти способы также можно повторять или использовать в различных комбинациях, например, для получения изменений в экспрессии гена/транскрипта, трансляции транскрипта или стабильности транскрипта. В другом аспекте генетический набор клетки изменяют, например, посредством модификации гомологичного гена ex vivo с последующим повторным встраиванием в клетку.
Нуклеиновую кислоту по изобретению можно изменять любыми способами, например, случайными или стохастическими способами, или неслучайными способами, или способами "направленных изменений".
Способы случайных мутаций в генах хорошо известны в данной области, см., например, патент США No. 5830696. Например, для случайной мутации в гене можно использовать мутагены. Мутагены включают, например, облучение ультрафиолетовым светом или гамма-облучение, или химический мутаген, например, митомицин, азотистую кислоту, фотоактивируемые псоралены, отдельно или в сочетании, для индуцирования повреждений ДНК, поддающихся репарации посредством рекомбинации. Другие химические мутагены включают, например, бисульфит натрия, азотистую кислоту, гидроксиламин, гидразин или муравьиную кислоту. Другие мутагены представляют собой аналоги нуклеотидных предшественников, например, нитрозогуанидин, 5-бромурацил, 2-аминопурин или акридин. Эти вещества можно добавлять в реакцию ПЦР вместо нуклеотидных предшественников, вызывая, таким образом, мутации в последовательности. Также можно использовать интеркалирующие вещества, такие как профлавин, акрифлавин, хинакрин и т.п.
Можно использовать любую технологию молекулярной биологии, например, случайный мутагенез посредством ПЦР, см., например, Rice (1992) Proc. Natl. Acad. Sci., USA, 89:5467-5471; или комбинаторный множественный кассетный мутагенез, см., например, Crameri (1995) Biotechniques, 18:194-196. Альтернативно, нуклеиновые кислоты, например, гены, могут быть повторно собраны после случайной или "стохастической" фрагментации, см., например, патенты США No. 6291242; 6287862; 6287861; 5955358; 5830721; 5824514; 5811238; 5605793. В альтернативных аспектах модификации, вставки или делеции вносят с помощью ПЦР с пониженной точностью, шаффлинга, олигонуклеотид-направленного мутагенеза, объединяющей ПЦР, мутагенеза с помощью половой ПЦР, мутагенеза in vivo, кассетного мутагенеза, возвратно-множественного мутагенеза, экспоненциально-множественного мутагенеза, сайт-специфического мутагенеза, повторной сборки гена, мутагенеза с насыщением сайтов гена (GSSM), синтетической повторной сборки лигированием (SLR), рекомбинации, рекомбинации возвратной последовательности, мутагенеза модификацией ДНК фосфотиоатом, мутагенеза с содержащей урацил матрицей, мутагенеза с содержащими разрывы дуплексами, мутагенеза с репарацией точек несоответствия, мутагенеза с дефектом репарации цепи хозяина, химического мутагенеза, мутагенеза радиогенного происхождения, мутагенеза с делецией, мутагенеза с рестрикцией и селекцией, мутагенеза с рестрикцией и исправлением ошибок, синтеза искусственного гена, множественного мутагенеза, получением химерного мультимера нуклеиновой кислоты и/или сочетанием этих и других способов.
В следующих ниже публикациях описаны различные возвратные рекомбинационные методики и/или способы, которые могут быть включены в способы по изобретению: Stemmer (1999) Molecular breeding of viruses for targeting and other clinical properties, Tumor Targeting, 4:1-4; Ness (1999) Nature Biotechnology, 17:893-896; Chang (1999) Evolution of a cytokine using DNA family shuffling, Nature Biotechnology, 17:793-797; Minshull (1999) Protein evolution by molecular breeding, Current Opinion in Chemical Biology, 3:284-290; Christians (1999) Directed evolution of thymidine kinase for AZT phosphorylation using DNA family shuffling, Nature Biotechnology, 17:259-264; Crameri (1998) DNA shuffling of a family of genes from diverse species accelerates directed evolution, Nature, 391:288-291; Crameri (1997) Molecular evolution of an arsenate detoxification pathway by DNA shuffling, Nature Biotechnology, 15:436-438; Zhang (1997) Directed evolution of an effective fucosidase from a galactosidase by DNA shuffling and screening, Proc. Natl. Acad. Sci., USA, 94:4504-4509; Patten et al. (1997) Applications of DNA Shuffling to Pharmaceuticals and Vaccines, Current Opinion in Biotechnology, 8:724-733; Crameri et al. (1996) Construction and evolution of antibody-phage libraries by DNA shuffling, Nature Medicine, 2:100-103; Crameri et al. (1996) "Improved green fluorescent protein by molecular evolution using DNA shuffling" Nature Biotechnology 14:315-319; Gates et al. (1996) Affinity selective isolation of ligands from peptide libraries through display on a lac repressor "headpiece dimmer, Journal of Molecular Biology, 255:373-386; Stemmer (1996) Sexual PCR and Assembly PCR, In: The Encyclopedia of Molecular Biology. VCH Publishers, New York, p. 447-457; Crameri and Stemmer (1995) Combinatorial multiple cassette mutagenesis creates all the permutations of mutant and wildtype cassettes, BioTechniques, 18:194-195; Stemmer et al. (1995) Single-step assembly of a gene and entire plasmid form large numbers of oligodeoxyribonucleotides, Gene, 164:49-53; Stemmer (1995) The Evolution of Molecular Computation, Science, 270: 1510; Stemmer (1995) Searching Sequence Space, Bio/Technology, 13:549-553; Stemmer (1994) Rapid evolution of a protein in vitro by DNA shuffling, Nature 370:389-391 и Stemmer (1994) DNA shuffling by random fragmentation and reassembly: In vitro recombination for molecular evolution., Proc. Natl. Acad. Sci., USA, 91:10747-10751.
Способы внесения мутаций для получения разнообразия включают, например, сайт-направленный мутагенез (Ling et al. (1997) Approaches to DNA mutagenesis: an overview, Anal. Biochem., 254(2):157-178; Dale et al. (1996) Oligonucleotide-directed random mutagenesis using the phosphorothioate method, Methods Mol. Biol., 57:369-374; Smith (1985) In vitro mutagenesis, Ann. Rev. Genet., 19:423-462; Botstein & Shortle (1985) Strategies and applications of in vitro mutagenesis, Science, 229:1193-1201; Carter (1986) Site-directed mutagenesis, Biochem. J., 237:1-7 и Kunkel (1987) The efficiency of oligonucleotide directed mutagenesis, in Nucleic Acids & Molecular Biology (Eckstein F. and Lilley D.M.J. eds., Springer Verlag, Berlin)); мутагенез с содержащими урацил матрицами (Kunkel (1985) Rapid and efficient site-specific mutagenesis without phenotypic selection, Proc. Natl. Acad. Sci., USA, 82:488-492; Kunkel et al. (1987) Rapid and efficient site-specific mutagenesis without phenotypic selection, Methods in Enzymol., 154,367-382 и Bass et al. (1988) Mutant Trp repressors with new DNA-binding specificities, Science, 242:240-245); олигонуклеотид-направленный мутагенез (Methods in Enzymol., 100:468-500 (1983); Methods in Enzymol., 154:329-350 (1987); Zoller & Smith (1982) Oligonucleotide-directed mutagenesis using M13-derived vectors: an efficient and general procedure for the production of point mutations in any DNA fragment, Nucleic Acids. Res. 10:6487-6500; Zoller & Smith (1983) Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13 vectors, Methods in Enzymol., 100:468-500 и Zoller & Smith (1987) Oligonucleotide-directed mutagenesis: a simple method using two oligonucleotide primers and a single-stranded DNA template, Methods in Enzymol., 154:329-350); мутагенез с модификацией ДНК фосфоротиоатом (Taylor et al. (1985) The use of phosphorothioate-modified DNA in restriction enzyme reactions to prepare nicked DNA, Nucl. Acids. Res., 13:8749-8764; Taylor et al. (1985) The rapid generation of oligonucleotide-directed mutations at high frequency using phosphorothioate-modified DNA, Nucl. Acids Res., 13:8765-8787 (1985); Nakamaye (1986) Inhibition of restriction endonuclease Nci I cleavage by phosphorothioate groups and its application to oligonucleotide-directed mutagenesis, Nucl. Acids Res., 14:9679-9698; Sayers et al. (1988) Y-T Exonucleases in phosphorothioate-based oligonucleotide-directed mutagenesis, Nucl. Acids. Res., 16:791-802 и Sayers et al. (1988) Strand specific cleavage of phosphorothioate-containing DNA by reaction with restriction endonucleases in the presence of ethidium bromide, Nucl. Acids. Res., 16:803-814); мутагенез с использованием разрывов в дуплексе ДНК (Kramer et al. (1984) The gapped duplex DNA approach to oligonucleotide-directed mutation construction, Nucl. Acids. Res., 12:9441-9456; Kramer & Fritz (1987) Methods in Enzymol. Oligonucleotide-directed construction of mutations via gapped duplex DNA, 154:350-367; Kramer et al. (1988) Improved enzymatic in vitro reactions in the gapped duplex DNA approach to oligonucleotide-directed construction of mutations, Nucl. Acids. Res., 16:7207 и Fritz et al. (1988) Oligonucleotide-directed construction of mutations: a gapped duplex DNA procedure without enzymatic reactions in vitro, Nucl. Acids. Res. 16:6987-6999).
Дополнительные протоколы, используемые в способах по изобретению, включают репарацию ошибочно спаренных оснований (Kramer (1984) Point Mismatch Repair, Cell. 38:879-887), мутагенез с использованием штаммов-хозяев с дефектной репарацией (Carter et al. (1985) Improved oligonucleotide site-directed mutagenesis using M13 vectors, Nucl. Acids. Res., 13:4431- 4443 и arter (1987) Improved oligonucleotide-directed mutagenesis using M13 vectors, Methods in Enzymol., 154:382-403), мутагенез с делециями (Eghtedarzadeh (1986) Use of oligonucleotides to generate large deletions, Nucl. Acids Res., 14:5115), рестрикцию с селекцией, и рестрикцию с селекцией и рестрикцией с исправлением ошибок (Wells et al. (1986) Importance of hydrogen-bond formation in stabilizing the transition state of subtilisin, Phil. Trans. R. Soc. Lond., A 317:415-423), мутагенез посредством синтеза целого гена (Nambiar et al. (1984) Total synthesis and cloning of a gene coding for the ribonuclease S protein, Science, 223:1299-1301; Sakamar and Khorana (1988) Total synthesis and expression of a gene for the a-subunit of bovine rod outer segment guanine nucleotide-binding protein (transducin), Nucl. Acids. Res., 14:6361-6372; Wells et al. (1985) Cassette mutagenesis: an efficient method for generation of multiple mutations at defined sites, Gene, 34:315-323 и Grundstrom et al. (1985) Oligonucleotide-directed mutagenesis by microscale 'shot-gun' gene synthesis, Nucl. Acids. Res., 13:3305-3316), репарацию двухцепочечных разрывов (Mandecki (1986); Arnold (1993) Protein engineering for unusual environments, Current Opinion in Biotechnology, 4:450-455; Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis, Proc. Natl. Acad. Sci., USA, 83:7177-7181). Дополнительные детали многих из приведенных выше методов можно найти в Methods in Enzymology, v.154, где также описаны приемлемые способы контроля проблем поиска повреждений при различных способах мутагенеза.
Также см. патент США No. 5605793, выданный Stemmer (25 февраля 1997 года), Methods for In Vitro Recombination; патент США No. 5811238, выданный Stemmer et al. (22 сентября 1998 года), Methods for Generating Polynucleotides having Desired Characteristics by Iterative Selection and Recombination; патент США No. 5830721, выданный Stemmer et al. (3 ноября 1998 года), DNA Mutagenesis by Random Fragmentation and Reassembly; патент США No. 5834252, выданный Stemmer et al. (10 ноября 1998 года), End-Complementary Polymerase Reaction; в патенте США No. 5837458, выданном Minshull et al. (17 ноября 1998 года), Methods and Compositions for Cellular and Metabolic Engineering; WO 95/22625, Stemmer и Crameri, Mutagenesis by Random Fragmentation and Reassembly; WO 96/33207, Stemmer и Lipschutz, End Complementary Polymerase Chain Reaction; WO 97/20078, Stemmer и Crameri, Methods for Generating Polynucleotides having Desired Characteristics by Iterative Selection and Recombination; WO 97/35966, Minshull и Stemmer, Methods and Compositions for Cellular and Metabolic Engineering; WO 99/41402 Punnonen et al., Targeting of Genetic Vaccine Vectors; WO 99/41383, Punnonen et al., Antigen Library Immunization; WO 99/41369, Punnonen et al., Genetic Vaccine Vector Engineering; WO 99/41368, Punnonen et al., Optimization of Immunomodulatory Properties of Genetic Vaccines; EP 752008, Stemmer и Crameri, DNA Mutagenesis by Random Fragmentation and Reassembly; EP 0932670, Stemmer Evolving Cellular DNA Uptake by Recursive Sequence Recombination; WO 99/23107, Stemmer et al., Modification of Virus Tropism and Host Range by Viral Genome Shuffling; WO 99/21979, Apt et al., Human Papillomavirus Vectors; WO 98/31837 del Cardayre et al., Evolution of Whole Cells and Organisms by Recursive Sequence Recombination; WO 98/27230, Patten and Stemmer, Methods and Compositions for Polypeptide Engineering; WO 98/27230, Stemmer et al., Methods for Optimization of Gene Therapy by Recursive Sequence Shuffling and Selection, WO 00/00632, Methods for Generating Highly Diverse Libraries, WO 00/09679, Methods for Obtaining in Vitro Recombined Polynucleotide Sequence Banks and Resulting Sequences, WO 98/42832, Arnold et al., Recombination of Polynucleotide Sequences Using Random or Defined Primers, WO 99/29902, Arnold et al., Method for Creating Polynucleotide and Polypeptide Sequences, WO 98/41653, Vind, An in Vitro Method for Construction of a DNA Library, WO 98/41622, Borchert et al., Method for Constructing a Library Using DNA Shuffling и WO 98/42727, Pati и Zarling, Sequence Alterations using Homologous Recombination.
В определенных заявках США предоставлены дополнительные детали, касающиеся различных способов внесения разнообразия, включая "SHUFFLING OF CODON ALTERED GENES", Patten et al., поданную 28 сентября 1999 года, (серийный номер США No. 09/407,800); "EVOLUTION OF WHOLE CELLS AND ORGANISMS BY RECURSIVE SEQUENCE RECOMBINATION", del Cardayre et al, поданную 15 июля 1998 года (серийный номер США No. 09/166188), и 15 июля 1999 года (серийный номер США No. 09/354,922); "OLIGONUCLEOTIDE MEDIATED NUCLEIC ACID RECOMBINATION", Crameri et al., поданную 28 сентября 1999 года (серийный номер США No. 09/408392) и "OLIGONUCLEOTIDE MEDIATED NUCLEIC ACID RECOMBINATION", Crameri et al., поданную 18 января 2000 года (PCT/US 00/01203); "USE OF CODON-VARIED OLIGONUCLEOTIDE SYNTHESIS FOR SYNTHEHTIC SHUFFLING", Welch et al., поданную 28 сентября 1999 года (серийный номер США No. 09/408,393); "METHODS FOR MAKING CHARACTER STRINGS, POLYNUCLEOTIDES & POLYPEPTIDES HAVING DESIRED CHARACTERISTICS", Selifonov et al, поданную 18 января 2000 года, (PCT/US 00/01202) и, например, "METHODS FOR MAKING CHARACTER STRINGS, POLYNUCLEOTIDES & POLYPEPTIDES HAVING DESIRED CHARACTERISTICS", Selifonov et al., поданную 18 июля 2000 года (серийный номер США No. 09/618,579); "METHODS OF POPULATING DATA STRUCTURES FOR USE IN EVOLUTIONARY SIMULATIONS", Selifonov и Stemmer, поданную 18 января 2000 года (PCT/US 00/01138); и "SINGLE-STRANDED NUCLEIC ACID TEMPLATE-MEDIATED RECOMBINATION AND NUCLEIC ACID FRAGMENT ISOLATION", Affholter, поданную 6 сентября 2000 года (серийный номер США No. 09/656549).
Нестохастические способы или способы "направленных изменений" включают, например, мутагенез с насыщением (например, GSSM), синтетическую повторную сборку лигированием (SLR) или их комбинации, и используются для модификации нуклеиновых кислот по изобретению для получения фосфорилаз с новыми или измененными свойствами (например, активность в высоко кислых или щелочных условиях, при высоких температурах и т.п.). Для полипептидов, кодируемых модифицированными нуклеиновыми кислотами, можно проводить скрининг в отношении активности перед тестированием на активность фосфорилазы или другую активность. Можно использовать любые приемы или протоколы, например, использование капиллярной платформы для матрицы. См., например, патенты США No. 6280926; 5939250.
Мутагенез с насыщением или GSSM
В одном аспекте изобретения для получения фосфолипаз с новыми или измененными свойствами используют нестохастическую модификацию генов, "процесс направленных изменений". Варианты этого способа были названы "мутагенезом сайта гена", "мутагенезом с насыщением сайта", "мутагенезом с насыщением сайта гена" или просто "GSSM". Его можно использовать с другими процессами мутагенеза. См., например, патенты США No. 6171820; 6238884. В одном аспекте GSSM включает предоставление матричного полинуклеотида и множества олигонуклеотидов, где каждый олигонуклеотид содержит последовательность, гомологичную матричному полинуклеотиду, тем самым осуществляя нацеливание на конкретную последовательность матричного полинуклеотида, и последовательность, которая представляет собой вариант гомологичного гена; получение потомков полинуклеотидов, содержащих нестохастические варианты последовательности путем репликации матричного полинуклеотида с олигонуклеотидами, тем самым, получая полинуклеотиды, содержащие гомологичные варианты последовательности гена.
В одном аспекте используют праймеры с кодонами, содержащие вырожденную последовательность N,N,G/T, для внесения точковых мутаций в полинуклеотид, так чтобы получить ряд производных полипептидов, в которых в каждом положении аминокислоты представлен полный диапазон единичных аминокислотных замен, например, для модификации выбирают аминокислотный остаток в активном центре фермента или участке связывания лиганда. Эти олигонуклеотиды могут содержать смежную первую гомологичную последовательность, вырожденную последовательность N,N,G/T, и необязательно вторую гомологичную последовательность. Расположенные ниже производные продукты трансляции, полученные в результате применения таких олигонуклеотидов, включают все возможные замены аминокислот в любом положении аминокислоты на протяжении полипептида вследствие того, что вырожденные последовательности N,N,G/T включают кодоны для всех 20 аминокислот. В одном аспекте один такой вырожденный олигонуклеотид (содержащий, например, одну вырожденную кассету N,N,G/T) используется для того, чтобы подвергать любой исходный кодон исходной полинуклеотидной матрицы полному диапазону замен кодонов. В другом аспекте используют по меньшей мере две кассеты - либо в одном и том же олигонуклеотиде, либо в разных, для того, чтобы подвергать по меньшей мере два исходных кодона в исходной полинуклеотидной матрице полному диапазону замен кодонов. Например, можно получать более одной последовательности N,N,G/T в одном олигонуклеотиде для внесения аминокислотных мутаций более чем в одно положение. В этом множестве последовательностей N,N,G/T могут быть непосредственно смежными или отделенными одной или несколькими дополнительными нуклеотидными последовательностями. В другом аспекте можно использовать олигонуклеотиды, подходящие для внесения вставок или делеций либо отдельно, либо в комбинации с кодонами, содержащими последовательность N,N,G/T, для внесения любой комбинации или перестановки аминокислотных вставок, делеций и/или замен.
В одном аспекте одновременный мутагенез в двух или более смежных положениях аминокислот проводят с использованием олигонуклеотида, который содержит смежные триплеты N,N,G/T, т.е. вырожденную последовательность (N,N,G/T)n. В другом аспекте используются вырожденные кассеты с вырожденностью, меньшей чем вырожденность последовательности N,N,G/T. Например, может быть желательно в некоторых случаях использовать (например, в олигонуклеотиде) вырожденную триплетную последовательность, содержащую только один N, где указанный N может находиться в первом, втором или в третьем положении триплета. В остальных двух положениях триплета можно использовать любые другие основания, включая любые их комбинации или перестановки. Альтернативно, в некоторых случаях может быть желательно использовать (например, в олигонуклеотидах) вырожденную триплетную последовательность N,N,N.
В одном аспекте использование вырожденных триплетов (например, триплетов N,N,G/T) делает возможным систематическое и легкое получение полного диапазона возможных природных аминокислот (всего 20 аминокислот) в любом положении аминокислоты в полипептиде (в альтернативных аспектах способы также включают получение менее чем всех возможных замен в положении аминокислотного остатка или кодона). Например, для полипептида из 100 аминокислот может быть получено 2000 различных образцов (т.е. 20 возможных аминокислот на одно положение X 100 положений аминокислот). Используя олигонуклеотид или набор олигонуклеотидов, содержащих вырожденный триплет N,N,G/T, все 20 возможных природных аминокислот могут кодироваться 32 отдельными последовательностями. Таким образом, в реакционном сосуде, в котором исходная полинуклеотидная последовательность подвергается мутагенезу с насыщением, при использовании по меньшей мере одного такого олигонуклеотида образуются 32 различных производных полинуклеотида, кодирующих 20 различных полипептидов. Напротив, использование невырожденного олигонуклеотида при сайт-направленном мутагенезе приводит к получению только одного производного полипептидного продукта в реакционном сосуде. Невырожденные олигонуклеотиды необязательно можно использовать в комбинации с описанными вырожденными праймерами; например, можно использовать невырожденные олигонуклеотиды для получения конкретных точковых мутаций в функционирующем полинуклеотиде. Это обеспечивает один из способов получения конкретных "молчащих" точковых мутаций, точковых мутаций, приводящих к соответствующему изменению аминокислоты, и точковых мутаций, которые приводят к образованию стоп-кодонов и соответствующей экспрессии полипептидных фрагментов.
В одном аспекте в каждом реакционном сосуде для мутагенеза с насыщением содержатся полинуклеотиды, кодирующие по меньшей мере 20 молекул производных полипептидов (например, фосфолипазы), так чтобы все 20 природных аминокислот были представлены в одном конкретном положении аминокислоты, соответствующем положению кодона, в который в исходном полинуклеотиде была внесена мутация (в других аспектах используется менее чем все 20 природных комбинаций). Вырожденные 32-кратно производные полипептиды, полученные из реакционного сосуда после каждого мутагенеза с насыщением, можно подвергать клональной амплификации (например, можно клонировать в подходящем хозяине, например, в хозяине Е. coli, с использованием, например, экспрессирующего вектора) и можно подвергать анализу экспрессии. Если при анализе идентифицируют, что отдельный производный полипептид проявляет положительные изменения свойств (таких как повышенная активность фосфорилазы в щелочных или кислых условиях при сравнении с исходным полипептидом), его можно секвенировать для идентификации соответствующей положительной аминокислотной замены, находящейся в нем.
В одном аспекте при внесении мутации в любое положение аминокислоты исходного полипептида с использованием мутагенеза с насыщением, как описано в данном описании, положительные изменения аминокислот могут быть идентифицированы в более чем одном положении аминокислоты. Можно получить одну или несколько новых производных молекул, которые содержат комбинацию всех или части из этих положительных аминокислотных замен. Например, если 2 конкретных положительных изменения аминокислот идентифицировано в каждом из 3 положений аминокислот в полипептиде, перестановки включают 3 возможности в каждом положении (без изменений по сравнению с исходной аминокислотой, и в каждом из двух положений) и в 3 положениях. Таким образом, существует 3×3×3 или 27 конечных возможностей, включая 7, которые были ранее рассмотрены - 6 единичных точковых мутаций (т.е. по 2 в каждом из трех положений) и без изменений во всех положениях.
В другом аспекте мутагенез с насыщением сайта можно использовать совместно другим стохастическим или нестохастическим способом варьирования последовательности, например, синтетической повторной сборкой лигированием (см. ниже), шаффлингом, химеризацией, рекомбинацией и другими способами внесения мутаций и средствами для осуществления мутагенеза. Настоящее изобретение относится к многократному использованию любого способа(ов) внесения мутаций, включая мутагенез с насыщением.
Синтетическая повторная сборка лигированием (SLR)
Изобретение относится к системе нестохастической модификации гена, называемой "синтетической повторной сборкой лигированием" или просто "SLR", "метод направленных изменений", для получения фосфолипаз с новыми или измененными свойствами. SLR представляет собой способ нестохастического лигирования олигонуклеотидных фрагментов друг с другом. Этот способ отличается от стохастического олигонуклеотидного шаффлинга тем, что структурные блоки нуклеиновой кислоты не перемещаются, соединяются или химеризуются случайным образом, а предпочтительно собираются нестохастически. См., например, патентную заявку США No. (USSN) 09/332835 с названием "Synthetic Ligation Reassembly in Directed Evolution", и поданную 14 июня 1999 года ("USSN 09/332835"). В одном аспекте SLR включает следующие стадии: (а) получение матричного полинуклеотида, где матричный полинуклеотид содержит последовательность, кодируемую гомологичным геном; (b) получение множества полинуклеотидов структурных блоков, где полинуклеотиды структурных блоков разработаны для перекрестной повторной сборки с матричным полинуклеотидом в предопределенной последовательности, и полинуклеотид структурного блока содержит последовательность, которая представляет собой вариант гомологичного гена, и последовательность, гомологичную матричному полинуклеотиду, фланкирующую последовательность варианта; (с) комбинирование полинуклеотида структурного блока с матричным полинуклеотидом, так чтобы полинуклеотид структурного блока перекрестно повторно собирался с матричным полинуклеотидом, с получением полинуклеотидов, содержащих варианты последовательностей гомологичного гена.
SLR не зависит от наличия высокого уровня гомологии между перемещающимися полинуклеотидами. Таким образом, этот способ можно использовать для нестохастического получения библиотек (или наборов) производных молекул, содержащих свыше 10100 различных химер. SLR можно использовать для получения библиотек, содержащих свыше 101000 различных производных химер. Таким образом, аспекты по настоящему изобретению включают нестохастические способы получения набора окончательных химерных молекул нуклеиновых кислот с итоговым порядком сборки, который выбирают в соответствии с замыслом. Этот способ включает стадии получения в соответствии с замыслом множества конкретных структурных блоков нуклеиновых кислот, имеющих подходящие взаимно совместимые лигируемые концы, и сборки этих структурных блоков нуклеиновых кислот, так чтобы полностью достигался разработанный порядок сборки.
Взаимно совместимые лигируемые концы структурных блоков нуклеиновых кислот, предназначенных для сборки, рассматриваются как "пригодные" для этого типа упорядоченной сборки, если они способны соединять структурные блоки в предопределенном порядке. Таким образом, весь порядок сборки, в котором структурные блоки нуклеиновых кислот могут быть соединены, определяется конструкцией лигируемых концов. Если используется более одной стадии сборки, тогда весь порядок сборки, в котором структурные блоки нуклеиновых кислот могут быть соединены, также определяется последовательным порядком стадии(ий) сборки. В одном аспекте соединенные структурные фрагменты обрабатывают ферментом, таким как лигаза (например, ДНК-лигаза Т4), для достижения ковалентного связывания структурных фрагментов.
В одном аспекте конструкцию олигонуклеотидных структурных блоков получают с помощью анализа набора матриц с исходной последовательностью нуклеиновой кислоты, которые служат основой для получения набора конечных производных химерных полинуклеотидов. Эти исходные олигонуклеотидные матрицы, таким образом, служат в качестве источника информации в последовательности, которая облегчает разработку структурных блоков нуклеиновых кислот, которые предназначены для внесения мутаций, например, химеризации или шаффлинга.
В одном аспекте данного способа последовательности множества исходных матриц нуклеиновых кислот выравнивают, для того чтобы выбрать одну или несколько пограничных точек. Пограничные точки могут быть локализованы в области гомологии, и они содержат один или несколько нуклеотидов. Эти пограничные точки предпочтительно являются общими по меньшей мере для двух исходных матриц. Таким образом, пограничные точки можно использовать для обозначения границ олигонуклеотидных структурных блоков, предназначенных для образования в целях перегруппировки исходных полинуклеотидов. Пограничные точки, идентифицированные и выбранные в исходных молекулах, служат в качестве потенциальных точек химеризации при сборке конечных производных химерных молекул. Пограничная точка может представлять собой область гомологии (содержащую по меньшей мере одно гомологичное нуклеотидное основание), общую по меньшей мере для двух исходных полинуклеотидных последовательностей. Альтернативно, пограничная точка может представлять собой область гомологии, которая является общей по меньшей мере для половины исходных полинуклеотидных последовательностей, или она может представлять собой область гомологии, которая является общей по меньшей мере для двух третей исходных полинуклеотидных последовательностей. Более того, в одном аспекте пригодные пограничные точки представляют собой область гомологии, которая является общей по меньшей мере для трех четвертей полинуклеотидных последовательностей, или она может быть общей для почти всех исходных полинуклеотидных последовательностей. В одном аспекте пограничная точка представляет собой область гомологии, которая является общей для всех исходных полинуклеотидных последовательностей.
В одном аспекте повторную сборку лигированием осуществляют тщательно, чтобы получить исчерпывающую библиотеку производных химерных полинуклеотидов. Другими словами, все возможные упорядоченные комбинации структурных блоков нуклеиновых кислот представляются в виде набора конечных химерных молекул нуклеиновых кислот. В то же время, в другом варианте осуществления порядок сборки (т.е. порядок присоединения каждого структурного блока в последовательности от 5' к 3' каждой конечной химерной нуклеиновой кислоты) в каждой комбинации является запрограммированным (или нестохастическим), как описано выше. Вследствие нестохастической природы данного изобретения вероятность нежелательных побочных продуктов значительно снижается.
В другом аспекте способ повторной сборки лигированием осуществляют систематически. Например, способ осуществляют с целью получения систематически разделенной библиотеки производных молекул с отделами, в которых систематически может быть проведен скрининг, например, друг за другом. Другими словами изобретение предусматривает, чтобы посредством селективного и целесообразного использования структурных блоков нуклеиновых кислот, соединенных при селективном и целесообразном использовании последовательных постадийных реакций сборки, мог быть осуществлен замысел, где конкретный набор производных продуктов получают в любом из нескольких реакционных сосудов. Это делает возможным осуществление систематического исследования и скрининга. Таким образом, эти способы дают возможность систематически исследовать потенциально очень большое количество производных молекул в уменьшенных группах. Вследствие способности осуществлять химеризацию таким образом, что он является универсальным и в то же время исчерпывающим и систематическим, особенно при наличии низкого уровня гомологии среди исходных молекул, такие способы обеспечивают получение библиотеки (или набора), содержащей большое количество производных молекул. Вследствие нестохастической природы повторной сборки лигированием в соответствии с настоящим изобретением полученные производные молекулы предпочтительно включают библиотеку конечных химерных молекул нуклеиновых кислот с таким порядком сборки, в целом, который выбран при разработке. Способы мутагенеза с насыщением и оптимизированного направленного изменения также могут быть использованы для получения различных молекулярных производных образцов. Следует понимать, что изобретение предусматривает свободу выбора и контроля в отношении пограничных точек, размера и количества структурных блоков нуклеиновых кислот и размера и конструкции соединенных элементов. Более того, следует понимать, что требование наличия межмолекулярной гомологии не являются особо строгими для удобства использования по изобретению. Более того, пограничные точки могут быть выбраны даже в областях небольшой межмолекулярной гомологии и при ее отсутствии. Например, вследствие качания кодонов, т.е. вырожденности кодонов, в структурный блок нуклеиновой кислоты можно вносить нуклеотидные замены без изменения аминокислоты, которая изначально кодируется в соответствующей исходной матрице. Альтернативно, может быть изменен кодон, так чтобы код для исходной аминокислоты изменялся. Изобретение предусматривает, что такие замены могут быть внесены в структурный блок нуклеиновой кислоты для повышения частоты межмолекулярных гомологичных пограничных точек и, таким образом, сделать возможным повышение количества соединений, которые происходят между структурными блоками, которые, в свою очередь, делают возможным получение большего количества производных химерных молекул.
В другом аспекте синтетический характер стадии, на которой образуются структурные блоки, дает возможность сконструировать и внести нуклеотиды (например, один или несколько нуклеотидов, которые могут представлять собой, например, кодоны или интроны, или регуляторные последовательности), которые позднее могут быть необязательно удалены в процессе in vitro (например, посредством мутагенеза) или в процессе in vivo (например, используя способность к сплайсингу генов в организме хозяина). Следует понимать, что во множестве примеров введение этих нуклеотидов также может быть желательно по другим причинам, в дополнение к потенциальной пользе в виде получения подходящей пограничной точки.
В одном аспекте структурный блок нуклеиновой кислоты используют для внесения интрона. Таким образом, функциональные интроны вносят в искусственный ген, полученный способами, описанными в настоящем документе. Искусственно внесенный интрон(ы) может быть функциональным в клетках-хозяевах для сплайсинга генов, аналогично тому, как встречающиеся в природе интроны функционально служат в сплайсинге генов.
Оптимизированная система направленных изменений
Изобретение относится к нестохастической системе модификации генов, называемой "оптимизированной системой направленных изменений" для получения фосфолипаз с новыми или измененными свойствами. Оптимизированные направленные изменения направлены на использование повторяющихся циклов редуктивной перестройки, рекомбинации и селекции, которые делают возможными направленные молекулярные изменения нуклеиновых кислот посредством рекомбинации. Оптимизированные направленные изменения позволяют получать большую группу измененных химерных последовательностей, где полученная группа значительно обогащена последовательностями, которые имеют заданное число случаев кроссинговера.
Элемент кроссинговера представляет собой точку в химерной последовательности, где происходит переключение последовательностей с одного исходного варианта на другой исходный вариант. Такая точка обычно находится в точке соединения, где олигонуклеотиды из двух источников лигируются совместно с образованием единой последовательности. Этот способ дает возможность вычислять точные концентрации олигонуклеотидных последовательностей, так что конечная химерная группа последовательностей обогащена на выбранное количество элементов кроссинговера. Это обеспечивает больший контроль над выбранными химерными вариантами с заданным числом случаев кроссинговера.
Кроме того, данный способ относится к удобным способам исследования огромного количества возможных вариантов участков белка по сравнению с другими системами. Ранее, если получалось, например, 1013 химерных молекул в ходе реакции, было чрезвычайно сложно тестировать такое большое количество химерных вариантов в отношении конкретной активности. Более того, значительная часть группы производных имеет очень большое число случаев кроссинговера, что приводит к белку, который с меньшей вероятностью обладает повышенным уровнем конкретной активности. При использовании этих способов группа химерных молекул может быть обогащена такими вариантами, которые имеют конкретное число случаев кроссинговера. Таким образом, несмотря на то, что все еще образуется 1013 химерных молекул в ходе реакции, каждая из молекул, выбранная для дальнейшего анализа, с большей вероятностью будет иметь, например, только три случая кроссинговера. Вследствие того, что получающаяся в результате группа из производных может быть изменена так, чтобы иметь предопределенное число случаев кроссинговера, границы функционального множества среди химерных молекул уменьшается. Это обеспечивает более контролируемое количество переменных при вычислении олигонуклеотида, который из оригинальных исходных полинуклеотидов может быть ответственным за влияние на конкретное свойство.
Один способ получения химерной полинуклеотидной последовательности производного представляет собой создание олигонуклеотидов, соответствующих фрагментам или участкам каждой исходной последовательности. Каждый олигонуклеотид в одном аспекте включает уникальный участок, который перекрывается, так что смешение вместе олигонуклеотидов приводит к новому варианту, который обладает каждым олигонуклеотидным фрагментом, собранным в правильном порядке. Дополнительную информацию также можно найти, например, в USSN 09/332835; патенте США No. 6361974.
Число олигонуклеотидов, полученных для каждого исходного варианта, соответствует суммарному числу полученных кроссинговеров в химерной молекуле, которая в конечном итоге образуется. Например, можно получить три исходных варианта нуклеотидных последовательностей для проведения реакции лигирования, чтобы найти химерный вариант, например, с более высокой активностью при высокой температуре. В качестве одного примера может быть получен набор из 50 олигонуклеотидных последовательностей, соответствующих каждому участку каждого исходного варианта. Таким образом, в ходе процесса повторной сборки лигированием может произойти вплоть до 50 случаев кроссинговера в каждой химерной последовательности. Вероятность того, что каждый из полученных химерных полинуклеотидов будет содержать олигонуклеотиды из каждого исходного варианта в переменном порядке очень низка. Если каждый олигонуклеотидный фрагмент представлен в реакции лигирования в том же молярном количестве, тогда вероятно, что в некоторых положениях олигонуклеотиды из одного и того же исходного полинуклеотида будут лигироваться друг с другом и, таким образом, не приведут к случаю кроссинговера. Если концентрация каждого олигонуклеотида из каждого источника сохраняется постоянной в ходе любой стадии лигирования в этом примере, тогда существует вероятность 1/3 (в случае 3 источников) того, что олигонуклеотид из того же исходного варианта будет лигироваться в химерную последовательность и не приведет к получению кроссинговера.
Таким образом, плотность распределения вероятностей (PDF) может быть определена для предсказания количества случаев кроссинговера, которые могут произойти в ходе каждой стадии реакции лигирования, с учетом определенного количества исходных вариантов, количества олигонуклеотидов, соответствующих каждому варианту, и концентрации каждого варианта в ходе каждой стадии реакции лигирования. Статистические и математические способы помимо определения PDF описаны ниже. Используя такие способы, можно вычислить такую плотность распределения вероятностей и, таким образом, обогатить группу химерных производных предопределенным количеством случаев кроссинговера, получаемых в результате конкретной реакции лигирования. Более того, можно определить число мишеней для случаев кроссинговера, и систему затем запрограммировать на вычисление исходных количеств каждого исходного олигонуклеотида в ходе каждой стадии реакции лигирования для вычисления плотности распределения вероятностей, которая зависит от предопределенного количества случаев кроссинговера. Эти способы направлены на использование повторяющихся циклов редуктивной перестройки, рекомбинации и селекции, которые делают возможными направленные молекулярные изменения нуклеиновой кислоты, кодирующей полипептид, посредством рекомбинации. Эта система дает возможность получить большую группу измененных химерных последовательностей, где полученная группа значительно обогащена последовательностями, которые имеют заданное число случаев кроссинговера. Элемент кроссинговера представляет собой точку в химерной последовательности, где происходит переключение последовательностей с одного исходного варианта на другой исходный вариант. Такая точка обычно находится в точке соединения, где олигонуклеотиды из двух источников лигируются совместно с образованием единичной последовательности. Способ дает возможность вычислять точные концентрации олигонуклеотидных последовательностей, так что конечная химерная группа последовательностей обогащена выбранным числом случаев кроссинговера. Это обеспечивает больший контроль над выбранными химерными вариантами с предопределенным числом случаев кроссинговера.
Кроме того, эти способы относятся к удобным способам исследования огромного количества возможных вариантов участков белка по сравнению с другими системами. Используя эти способы, описанные в данном описании, группа химерных молекул может быть обогащена такими вариантами, которые имеют конкретное число случаев кроссинговера. Таким образом, несмотря на то, что в ходе реакции может образоваться 1013 химерных молекул, причем каждая из молекул, выбранная для дальнейшего анализа, с большой вероятностью будет иметь, например, только три случая кроссинговера. Вследствие того что образовавшаяся в результате группа из производных может быть изменена, чтобы иметь заданное число случаев кроссинговера, границы функционального множества среди химерных молекул будут уменьшаться. Это обеспечивает более контролируемое число переменных при вычислении олигонуклеотида, который из оригинальных исходных полинуклеотидов может быть ответственным за влияние на конкретное свойство.
В одном аспекте способ дает возможность получить химерную полинуклеотидную последовательность производного посредством получения олигонуклеотидов, соответствующих фрагментам или участкам каждой исходной последовательности. Каждый олигонуклеотид в одном аспекте включает уникальную область перекрывания, так что смешивание олигонуклеотидов вместе приводит к новому варианту, который имеет каждый олигонуклеотидный фрагмент, присоединенный в правильном порядке. См. также USSN 09/332835.
Количество олигонуклеотидов, полученное для каждого исходного варианта взаимосвязано с общим числом конечных кроссинговеров в химерной молекуле, которая образуется в конечном итоге. Например, могут быть предоставлены три исходных варианта нуклеотидной последовательности для проведения реакции лигирования в целях нахождения химерного варианта, обладающего, например, наибольшей активностью при высокой температуре. В качестве одного примера может быть получен набор из 50 олигонуклеотидных последовательностей, соответствующих каждому участку каждого исходного варианта. Таким образом, в ходе процесса повторной сборки лигированием может произойти вплоть до 50 случаев кроссинговера в каждой химерной последовательности. Вероятность того, что каждый из полученных химерных полинуклеотидов будет содержать олигонуклеотиды из каждого исходного варианта в переменном порядке, очень низка. Если каждый олигонуклеотидный фрагмент представлен в реакции лигирования в том же молярном количестве, тогда вероятно, что в некоторых положениях олигонуклеотиды из одного и того же исходного полинуклеотида будут лигироваться друг с другом и, таким образом, не приведут к случаю кроссинговера. Если концентрация каждого олигонуклеотида из каждого источника сохраняется постоянной в ходе любой стадии лигирования в этом примере, тогда существует вероятность 1/3 (в случае 3 источников) того, что олигонуклеотид из того же исходного варианта будет лигироваться в химерную последовательность и не приведет к получению кроссинговера.
Таким образом, плотность распределения вероятностей (PDF) может быть определена для предсказания количества случаев кроссинговера, которые могут произойти в ходе каждой стадии реакции лигирования, с учетом определенного количества исходных вариантов, количества олигонуклеотидов, соответствующих каждому варианту, и концентрации каждого варианта в ходе каждой стадии реакции лигирования. Статистические и математические способы помимо определения PDF описаны ниже. Используя такие способы, можно вычислить такую плотность распределения вероятностей и, таким образом, обогатить группу химерных производных предопределенным количеством случаев кроссинговера, получаемых в результате конкретной реакции лигирования. Более того, можно определить число мишеней для случаев кроссинговера, и затем систему запрограммировать на вычисление исходных количеств каждого исходного олигонуклеотида в ходе каждой стадии реакции лигирования для вычисления плотности распределения вероятностей, которая зависит от предопределенного количества случаев кроссинговера.
Определение случаев кроссинговера
Варианты осуществления изобретения включают систему и программное обеспечение, которые дают возможность получить требуемую плотность распределения вероятностей (PDF) для кроссинговера, с числом исходных генов, предназначенных для повторной сборки, и числом фрагментов при повторной сборке в качестве входных данных. Выходные данные этой программы представляют собой "фрагментую PDF", которая может быть использована для определения способа получения повторно собранных генов и для определения PDF кроссинговера этих генов. Обработку, описанную в настоящем документе, предпочтительно осуществляют в MATLAB® (The Mathworks, Natick, Massachusetts), языке программирования и средстве проектирования для технической обработки данных.
Повторяющиеся способы
При применении на практике данного изобретения эти способы могут быть многократно повторены. Например, некоторую нуклеиновую кислоту (или конкретную нуклеиновую кислоту), ответственную за измененный фенотип фосфолипазы, идентифицируют, повторно выделяют, снова модифицируют, повторно тестируют на наличие активности. Эти способы могут многократно повторяться до тех пор, пока не будет сконструирован желаемый фенотип. Например, в клетку способами инженерии может быть внедрен целый биохимический анаболический или катаболический путь, включая, например, активность фосфолипазы.
Аналогично, если определено, что конкретный олигонуклеотид совсем не влияет на желательное свойство (например, новый фенотип фосфолипазы), тогда он может быть удален в качестве переменной при синтезе более крупных исходных олигонуклеотидов, которые включают удаляемую последовательность. Поскольку встраивание последовательности в более крупную последовательность предотвращает любые случаи кроссинговера, то не будет больше существовать никаких вариантов этих последовательностей в производных полинуклеотидах. Эта повторяющаяся практика определения олигонуклеотидов, которые более всего соответствуют желаемому свойству и которые не соответствуют, делает возможным более эффективное исследование всех возможных вариантов белков, которые могут обеспечивать конкретное свойство или активность.
Шаффлинг in vivo
В способах по изобретению используется шаффлинг молекул in vivo, который обеспечивает получение вариантов полипептидов по изобретению, например, антител, ферментов фосфолипазы и т.п. Может быть осуществлен шаффлинг in vivo, где используется природное свойство клеток осуществлять рекомбинацию мультимеров. Несмотря на то что рекомбинация in vivo обеспечивает главный природный путь молекулярного разнообразия, генетическая рекомбинация остается относительно сложным способом, который включает 1) распознавание наличия гомологии; 2) расщепление цепи, вытеснение цепи и метаболические стадии, приводящие к продукции рекомбинантной хиазмы и, наконец, 3) разрешение хиазмы на отдельные рекомбинированые молекулы. Для формирования хиазмы необходимо распознавание гомологичных последовательностей.
В одном аспекте изобретение относится к способу получения гибридного полинуклеотида по меньшей мере из первого полинуклеотида и второго полинуклеотида. Изобретение можно использовать для получения гибридного полинуклеотида посредством введения по меньшей мере первого полинуклеотида и второго полинуклеотида, у которых общим является по меньшей мере один участок частичной гомологии последовательностей, в подходящую клетку-хозяина. Участки частичной гомологии последовательностей обеспечивают процесс, который приводит к реорганизации последовательностей с получением гибридного полинуклеотида. "Гибридный полинуклеотид", как используют в настоящем документе, представляет собой любую нуклеотидную последовательность, которая получена способом по настоящему изобретению и содержит последовательность по меньшей мере из двух исходных полинуклеотидных последовательностей. Такие гибридные полинуклеотиды могут быть получены в результате случаев межмолекулярной рекомбинации, которые обеспечивают интеграцию последовательности между молекулами ДНК. Кроме того, такие гибридные полинуклеотиды могут быть результатом внутримолекулярной редуктивной перестройки, в которой повторяющиеся последовательности используют для изменения нуклеотидной последовательности в молекуле ДНК.
Получение вариантов последовательностей
Также изобретение относится к способам получения вариантов последовательностей нуклеиновой кислоты и последовательностей фосфолипазы по изобретению или выделения фермента фосфолипазы, например, фосфолипазы с измененной последовательностью, с использованием нуклеиновых кислот и полипептидов по изобретению. В одном аспекте изобретение относится к вариантам гена фосфолипазы по изобретению, которые могут быть изменены любыми способами, включая, например, случайные или стохастические способы, или нестохастические способы, или способы "направленных изменений", которые описаны выше.
Выделенные варианты могут быть вариантами природного происхождения. Вариант также может быть получен in vitro. Варианты можно получать с использованием способов генной инженерии, таких как сайт-направленный мутагенез, случайный химический мутагенез, делеции с экзонуклеазой III и стандартные методы клонирования. Альтернативно, такие варианты, фрагменты, аналоги или производные можно получать с использованием химического синтеза или модификаций. Другие способы получения вариантов также известны специалистам в данной области. Они включают способы, в которых последовательности нуклеиновых кислот, полученные из природных изолятов, модифицируют с получением нуклеиновых кислот, которые кодируют полипептиды, обладающие свойствами, которые повышают их ценность для промышленного или лабораторного применения. По таким методикам получают и охарактеризовывают большое количество вариантов последовательностей с одним или несколькими различиями в нуклеотидах относительно последовательности, полученной из природного изолята. Эти различия в нуклеотидах могут приводить к замене аминокислот относительно полипептидов, кодируемых нуклеиновыми кислотами из природных изолятов.
Например, варианты можно получать с использованием ПЦР с пониженной точностью. При ПЦР с пониженной точностью ПЦР осуществляют в условиях, где точность копирования ДНК-полимеразы низкая, так что по всей длине продукта ПЦР образуется большое число точковых мутаций. ПЦР с пониженной точностью описана, например, Leung, D.W. et al., в Technique, 1:11-15, 1989) и Caldwell R.C. & Joyce G.F., PCR Methods Applic., 2:28-33, 1992. В кратком изложении, по таким методикам нуклеиновые кислоты, предназначенные для внесения в них мутаций, смешивают с праймерами для ПЦР, буфером для реакции, MgCl2, MnCl2, Taq-полимеразой и с dNTP в соответствующей концентрации для достижения большого количества точковых мутаций вдоль всей длины продукта ПЦР. Например, реакцию можно проводить с использованием 20 пмоль нуклеиновой кислоты, предназначенной для внесения в нее мутаций, 30 пмоль каждого праймера для ПЦР, буфера для реакции, содержащего 50 мМ KCl, 10 мМ Tris HCl (рН 8,3) и 0,01% желатин, 7 мМ MgCl2, 0,5 мМ MnCl2, 5 единиц Taq-полимеразы, 0,2 мМ dGTP, 0,2 мМ dATP, 1 мМ dCTP и 1 мМ dTTP. ПЦР проводят в течение 30 циклов, состоящих из 94°С в течение 1 мин, 45°С в течение 1 мин и 72°C в течение 1 мин. Однако следует понимать, что эти параметры могут быть изменены в соответствующих случаях. Нуклеиновые кислоты с внесенными в них мутациями клонируют в соответствующий вектор и оценивают активность полипептидов, кодируемых нуклеиновыми кислотами с внесенными в них мутациями.
Варианты также можно получать с использованием олигонуклеотид-направленного мутагенеза с получением сайт-специфических мутаций в любой представляющей интерес клонированной ДНК. Мутагенез посредством олигонуклеотидов описан, например, в Reidhaar-Olson (1988) Science 241:53-57. В кратком изложении, по таким методикам множество двухцепочечных олигонуклеотидов с одной или несколькими мутациями, предназначенными для внесения в клонированную ДНК, синтезируют и встраивают в клонированную ДНК, предназначенную для внесения в нее мутаций. Клоны, содержащие ДНК с внесенными в нее мутациями, выделяют и оценивают активность полипептидов, которые она кодирует.
Другим способом получения вариантов является объединяющая ПЦР. Объединяющая ПЦР включает сборку продуктов ПЦР из смеси небольших фрагментов ДНК. Большое количество различных реакций ПЦР происходит параллельно в одной и той же пробирке с продуктами одной реакции, являющимися затравками для продуктов другой реакции. Объединяющая ПЦР описана, например, в патенте США No. 5965408.
Еще одним способом получения вариантов является мутагенез с помощью половой ПЦР. При мутагенезе с помощью половой ПЦР ускоряется искусственная гомологичная рекомбинация in vitro между молекулами ДНК с различными, но высоко сходными последовательностями ДНК, вследствие случайной фрагментации молекулы ДНК, основанной на гомологии последовательностей, с последующим закреплением продуктов кроссинговера посредством удлинения праймеров в реакции ПЦР. Мутагенез с помощью половой ПЦР описан, например, в Stemmer (1994) Proc. Natl. Acad. Sci., USA, 91:10747-10751. В кратком изложении, по таким методикам множество нуклеиновых кислот, предназначенных для рекомбинации, расщепляют ДНКазой с получением фрагментов со средним размером 50-200 нуклеотидов. Фрагменты с желательным средним размером очищают и ресуспендируют в смеси для ПЦР. ПЦР проводят в условиях, которые облегчают рекомбинацию между фрагментами нуклеиновых кислот. Например, ПЦР может быть проведена при ресуспендировании очищенных фрагментов в концентрации 10-30 нг/мкл в растворе с 0,2 мМ каждого dNTP, 2,2 мМ MgCl2, 50 мМ KCL, 10 мМ Tris HCl, рН 9,0 и 0,1% Triton X-100. Добавляют 2,5 ед. Taq-полимеразы на 100:1 реакционной смеси и проводят ПЦР с использованием следующего режима: 94°С в течение 60 с, 94°С в течение 30 с, 50-55°С в течение 30 с, 72°С в течение 30 с (30-45 раз) и 72°С в течение 5 мин. Однако следует понимать, что эти параметры могут быть изменены соответствующим образом. В некоторых аспектах в реакции ПЦР могут быть включены олигонуклеотиды. В других аспектах может быть использован фрагмент Кленова ДНК-полимеразы I в первой группе реакций ПЦР, и Taq-полимераза может быть использована в следующей группе реакций ПЦР. Рекомбинантные последовательности выделяют и оценивают активность полипептидов, которые они кодируют.
Варианты также могут быть получены посредством мутагенеза in vivo. В некоторых вариантах осуществления создают случайные мутации в представляющей интерес последовательности посредством воспроизведения представляющей интерес последовательности в бактериальном штамме, таком как штамм Е. coli, который осуществляет мутации посредством одного или нескольких путей репарации ДНК. Такие штаммы-"мутаторы" обладают увеличенным количеством случайных мутаций по сравнению с родительским организмом дикого типа. Воспроизведение ДНК в одном из этих штаммов приведет со временем к образованию случайных мутаций в ДНК. Штаммы мутаторов, пригодные для использования в мутагенезе in vivo, описаны, например, в публикации РСТ No. WO 91/16427.
Варианты также можно получать с использованием кассетного мутагенеза. В кассетном мутагенезе небольшой участок двухцепочечной молекулы ДНК замещается синтетической олигонуклеотидной "кассетой", которая отличается от нативной последовательности. Олигонуклеотид часто содержит полностью и/или частично отобранную случайным образом нативную последовательность.
Также для получения вариантов можно использовать возвратно-множественный мутагенез. Возвратно-множественный мутагенез представляет собой алгоритм для белковой инженерии (белковый мутагенез), разработанный для получения различных групп фенотипически сходных мутантов, члены которых отличаются по аминокислотной последовательности. Для данного способа используют механизм с обратной связью для контроля успешных циклов комбинаторного кассетного мутагенеза. Возвратно-множественный мутагенез описан Arkin (1992) Proc. Natl. Acad. Sci. USA 89:7811-7815.
В некоторых вариантах осуществления варианты получают с использованием экспоненциально-множественного мутагенеза. Экспоненциально-множественный мутагенез представляет собой способ получения комбинаторных библиотек с большим процентным содержанием уникальных и функциональных мутантов, где небольшие группы остатков случайным образом отбираются параллельно для идентификации в каждом измененном положении аминокислот, которые приводят к функциональным белкам. Экспоненциально-множественный мутагенез описан, например, Delegrave S. (1993) Biotechnology Res., 11:1548-1552, 1993. Случайный и сайт-направленный мутагенез описаны, например, в Arnold F.H. (1993) Current Opinion in Biotechnology, 4:450-455.
В некоторых вариантах осуществления варианты создают с использованием методов шаффлинга, где часть из множества нуклеиновых кислот, которые кодируют различные полипептиды, соединяются вместе с получением химерных последовательностей нуклеиновых кислот, которые кодируют химерные полипептиды, как описано, например, в патентах США No. 5965408; 5939250.
Изобретение также относится к вариантам полипептидов по изобретению, содержащим последовательности, в которых один или несколько аминокислотных остатков (например, иллюстративного полипептида по изобретению) заменены консервативным или неконсервативным аминокислотным остатком (например, консервативным аминокислотным остатком), и такие замененные аминокислотные остатки могут быть или не могут быть кодируемыми генетическим кодом. Консервативные замены представляют собой замены, при которых происходит замена данной аминокислоты в полипептиде другой аминокислотой со сходными свойствами. Таким образом, полипептиды по изобретению включают полипептиды с консервативными заменами в последовательностях по изобретению, включая, но не ограничиваясь ими, следующие замены: замена алифатической аминокислоты, такой как аланин, валин, лейцин и изолейцин, другой алифатической аминокислотой; замена серина треонином или наоборот; замена кислых остатков, таких как аспарагиновая кислота и глутаминовая кислота, другим кислым остатком; замена остатка, несущего амидную группу, такого как аспарагин и глутамин, другим остатком несущим амидную группу; замена основного остатка, такого как лизин и аргинин, другим основным остатком; и замена ароматического остатка, такого как фенилаланин, тирозин, другим ароматическим остатком. Другие варианты представляют собой варианты, в которых один или несколько аминокислотных остатков полипептидов по изобретению включают заместитель.
Другие варианты, находящиеся в объеме изобретения, представляют собой варианты, в которых полипептид ассоциирован с другим соединением, таким как соединение, увеличивающее время полужизни полипептида, например, полиэтиленгликоль.
Дополнительные варианты, находящиеся в объеме изобретения, представляют собой варианты, в которых к полипептиду присоединены дополнительные аминокислоты, такие как лидерная последовательность, секреторная последовательность, пробелковая последовательность или последовательность, которая облегчает очистку, обогащение или стабилизацию полипептида.
В некоторых аспектах варианты, фрагменты, производные и аналоги полипептидов по изобретению сохраняют такую же биологическую функцию или активность, что и у иллюстративных полипептидов, например, активность фосфолипазы, как описано в настоящем документе. В других аспектах вариант, фрагмент, производное или аналог включает пробелок, так что вариант, фрагмент, производное или аналог может быть активирован при отщеплении участка пробелка с получением активного полипептида.
Оптимизация кодонов для достижения высокого уровня экспрессии белка в клетке-хозяине
Изобретение относится к способам модификации кодирующих фосфолипазу нуклеиновых кислот для модификации использования кодонов. В одном аспекте изобретение относится к способам модификации кодонов в нуклеиновой кислоте, кодирующей фосфолипазу, для повышения или снижения экспрессии в клетке-хозяине. Изобретение также относится к нуклеиновым кислотам, кодирующим фосфолипазу, модифицированным для повышения их экспрессии в клетке-хозяине, к ферментам фосфолипазам, модифицированным таким образом, и к способам получения модифицированных ферментов фосфолипаз. Способ включает идентификацию "непредпочтительного" или "менее предпочтительного" кодона в кодирующей фосфолипазу нуклеиновой кислоте и замену одного или нескольких из непредпочтительных или менее предпочтительных кодонов "предпочтительным кодоном", кодирующим ту же аминокислоту, что и замененный кодон, так чтобы по меньшей мере один непредпочтительный кодон или менее предпочтительный кодон в нуклеиновой кислоте был заменен предпочтительным кодоном, кодирующим туже аминокислоту. Предпочтительный кодон представляет собой кодон, часто встречающийся в кодирующих последовательностях генов в клетке-хозяине, и непредпочтительный или менее предпочтительный кодон представляет собой кодон, редко встречающийся в кодирующих последовательностях генов в клетке-хозяине.
Клетки-хозяева для экспрессии нуклеиновых кислот, экспрессирующих кассет и векторов по изобретению, включают клетки бактерий, дрожжей, грибов, клетки растений, клетки насекомых и клетки млекопитающих. Таким образом, изобретение относится к способам оптимизации использования кодонов во всех указанных клетках, где нуклеиновые кислоты и полипептиды с измененными кодонами получают с помощью нуклеиновых кислот с измененными кодонами. Иллюстративные клетки-хозяева включают грамотрицательные бактерии, такие как Escherichia coli; грамположительные бактерии, такие как любые Bacillus (например, B. cereus) Streptomyces, Lactobacillus gasseri, Lactococciis lactis, Lactococcus cremoris, Bacillus subtilis. Иллюстративные клетки-хозяева также включают эукариотические организмы, например, различные дрожжи, такие как Saccharomyces sp., включая Saccharomyces cerevisiae, Schizosaccharomyces pombe, Pichia pastoris и Kluyveromyces lactis, Hansenula polymorpha, Aspergillus niger, и клетки и клеточные линии млекопитающих, и клетки и клеточные линии насекомых. Таким образом, изобретение также относится к нуклеиновым кислотам и полипептидам, оптимизированным для экспрессии в указанных организмах и видах.
Например, кодоны кодирующей фосфолипазу нуклеиновой кислоты, выделенной из бактериальной клетки, модифицируют таким образом, чтобы нуклеиновая кислота оптимально экспрессировалась в бактериальной клетке, отличной от бактерий, из которых фосфолипаза происходит, в клетке дрожжей, грибов, в клетке растений, клетке насекомых или клетке млекопитающих. Способы оптимизации кодонов хорошо известны в данной области, см., например, патент США No. 5795737; Васа (2000) Int. J. Parasitol., 30:113-118; Hale (1998) Protein Expr. Purif., 12:185-188; Narum (2001) Infect. Immun., 69:7250-7253. См. also Narum (2001) Infect. Immun., 69:7250-7253, где описаны оптимизированные кодоны в мышиных системах; Outchkourov (2002) Protein Expr. Purif., 24:18-24, где описаны оптимизированные кодоны у дрожжей; Feng (2000) Biochemistry, 39:15399-15409, где описаны оптимизированные кодоны в Е. coli; Humphreys (2000) Protein Expr. Purif., 20:252-264, где описано использование оптимизированных кодонов, которые влияют на секрецию в Е. coli.
Трансгенные животные, не относящиеся к человеку
Изобретение относится к трансгенным животным, не относящимся к человеку, содержащим нуклеиновую кислоту, полипептид, экспрессирующую кассету или вектор, или трансфицированную или трансформированную клетку по изобретению. Трансгенные животные, не относящиеся к человеку, могут представлять собой, например, коз, кроликов, овец, свиней, коров, крыс и мышей, содержащих нуклеиновые кислоты по изобретению. Эти животные могут быть использованы, например, в качестве моделей in vivo для исследования активности фосфолипазы или в качестве моделей для скрининга модуляторов активности фосфолипазы. Кодирующие последовательности полипептидов, предназначенные для экспрессии в трансгенных животных, не относящихся к человеку, могут быть сконструированы конститутивными или находящимися под контролем тканеспецифичных, специфичных для стадий развития или индуцибельных факторов регуляции транскрипции. Трансгенные животные, не относящиеся к человеку, могут быть разработаны и получены с использованием любого способа, известного в данной области; см., например, патенты США No. 6211428; 6187992; 6156952; 6118044; 6111166; 6107541; 5959171; 5922854; 5892070; 5880327; 5891698; 5639940; 5573933; 5387742; 5087571, где описано получение и использование трансформированных клеток и яйцеклеток, и трансгенных мышей, крыс, кроликов, овец, свиней и коров. См. также, например, Pollock (1999) J. Immunol. Methods, 231:147-157, где описано получение рекомбинантных белков в молоке у трансгенных молочных животных; Baguisi (1999) Nat. Biotechnol., 17:456-461, где демонстрируется получение трансгенных коз. В патенте США No. 6211428 описано получение и использование трансгенных млекопитающих, не относящихся к человеку, в головном мозге которых экспрессируется конструкция нуклеиновой кислоты, содержащая последовательность ДНК. В патенте США No. 5387742 описана инъекция клонированных рекомбинантных или синтетических последовательностей ДНК в оплодотворенную мышиную яйцеклетку, имплантация инъецированных яйцеклеток в ложнобеременных самок и выращивание до рождения трансгенных мышей, клетки которых экспрессируют белки, связанные с патологией при болезни Альцгеймера. В патенте США No. 6187992 описано получение и использование трансгенной мыши, геном которой содержал поломку в гене, кодирующем белок-предшественник амилоида (АРР).
Для осуществления способов по изобретению также можно использовать "животных с нокаутом". Например, в одном аспекте трансгенные или модифицированные животные по изобретению включают "животное с нокаутом" например, "мышь с нокаутом", полученную способами инженерии, для того, чтобы не происходило экспрессии или чтобы они не были способны экспрессировать фосфолипазу.
Трансгенные растения и семена
Изобретение относится к трансгенным растениям и семенам, содержащим нуклеиновую кислоту, полипептид (например, фосфолипазу), экспрессирующую кассету или вектор, или трансфецированную или трансформированную клетку по изобретению. Изобретение также относится к растительным продуктам, например, маслам, семенам, листьям, экстрактам и т.п., содержащим нуклеиновую кислоту и/или полипептид (например, фосфолипазу) по изобретению. Трансгенное растение может быть двудольным (dicot) или однодольным растением (monocot). Изобретение также относится к способам получения и использования указанных трансгенных растений и семян. Трансгенное растение или клетка растения, экспрессирующие полипептид по изобретению, могут быть сконструированы в соответствии с любым способом, известным в данной области. См., например, патент США No. 6309872.
Нуклеиновые кислоты и экспрессирующие конструкции по изобретению можно вводить в клетку растений любыми способами. Например, нуклеиновые кислоты или экспрессирующие конструкции могут встраиваться в геном желаемого растительного хозяина, или нуклеиновые кислоты или экспрессирующие конструкции могут представлять собой эписомы. Встраивание в геном желаемого растения может быть таким, чтобы продуцирование фосфолипазы регулировалась эндогенными элементыми контроля транскрипции и/или трансляции хозяина. Изобретение также относится к "растениям с нокаутом", где вставка последовательности гена, например, посредством гомологичной рекомбинации, нарушает экспрессию эндогенного гена. Способы получения растений с "нокаутом" хорошо известны в данной области, см., например, Strepp (1998) Proc. Natl. Acad. Sci., USA, 95:4368-4373; Miao (1995) Plant J., 7:359-365. См. описание трансгенных растений ниже.
Нуклеиновые кислоты по изобретению можно использовать для придания желаемых свойств, по существу, любому растению, например, растениям, содержащим масличные семена, таким как рис, соя, рапс, подсолнух, кунжут и арахис. Нуклеиновые кислоты по изобретению можно использовать для управления метаболическими путями растений в целях оптимизации или изменения экспрессии фосфолипазы. Это может изменять активность фосфолипазы в растении. Альтернативно, фосфолипазу по изобретению можно использовать для получения трансгенного растения для продуцирования соединения, которое в природе растением не продуцируется. Это может привести к снижению стоимости продукции или к получению нового продукта.
В одном аспекте первая стадия получения трансгенного растения включает получение экспрессирующей конструкции для экспрессии в клетке растений. Эти технологии хорошо известны в данной области. Они могут включать выбор и клонирование промотора кодирующей последовательности для облегчения связывания рибосом с мРНК и выбор подходящей последовательности терминатора гена. Одним иллюстративным конститутивным промотором является CaMV35S из вируса мозаики цветной капусты, который, как правило, вызывает высокий уровень экспрессии в растениях. Другие промоторы являются более специфичными и отвечают на сигнал из внутренней и наружной окружающей среды растения. Иллюстративным индуцируемым светом промотором является промотор гена cab, кодирующего основной связывающий хлорофилл а/b белок.
В одном аспекте нуклеиновую кислоту модифицируют для достижения более высокой экспрессии в клетке растений. Например, последовательность по изобретению может иметь более высокое процентное содержание нуклеотидных пар А-Т по сравнению с содержанием, которое обнаруживается в растении, в некоторых из которых преобладают нуклеотидные пары G-C. Таким образом, нуклеотиды А-Т в кодирующей последовательности можно заменять нуклеотидами G-C без значительного изменения аминокислотной последовательности для повышения продуцирования продукта гена в клетках растений.
Для идентификации клеток растений или ткани, в которых успешно интегрировался трансген в конструкцию гена, может быть добавлен ген селективного маркера. Это может быть необходимым, поскольку достижение встраивания и экспрессии генов в клетках растений является редким случаем, происходящим только в нескольких процентах тканей-мишеней или клеток-мишеней. Гены селективных маркеров кодируют белки, которые придают устойчивость к средствам, которые обычно токсичны для растений, таким как противомикробные средства или гербициды. Только те клетки растений, которые обладают встроенным геном селектируемого маркера, выживают при выращивании на среде, содержащей соответствующее противомикробное средство или гербицид. Как и в случае других встраиваемых генов, для правильного функционирования маркерных генов также необходимы промоторная и терминаторная последовательности.
В одном аспекте получение трансгенных растений или семян включает встраивание последовательности по изобретению и, необязательно, маркерных генов в выбранную экспрессирующую конструкцию (например, плазмиду) совместно с внесением промоторной и терминаторной последовательностей. Это может включать перенос модифицированного гена в растение с помощью приемлемого способа. Например, конструкция можно встраивать непосредственно в геномную ДНК клетки растений с использованием способов, таких как электропорация и микроинъекция в протопласты клетки растений, или конструкции можно вводить непосредственно в ткань растения с использованием баллистических способов, таких как бомбардировка частицами ДНК. Например, см., например, Christou (1997) Plant Mol. Biol., 35:197-203; Pawlowski (1996) Mol. Biotechnol., 6:17-30; Klein (1987) Nature, 327:70-73; Takumi (1997) Genes Genet. Syst., 72:63-69, где обсуждается использование бомбардировки частицами для введения трансгенов в пшено; и Adam (1997) выше использования бомбардировки частицами для введения YAC в клетки растений. Например, Rinehart (1997) выше использовал бомбардировку частицами для получения трансгенных хлопковых растений. Устройство для ускорения частиц описано в патенте США No. 5015580; и коммерчески доступным является устройство для ускорения частиц BioRad (Biolistics) PDS-2000; см. также John, патент США No. 5608148 и Ellis, патент США No. 5681730, где описана опосредуемая частицами трансформация голосемянных.
В одном аспекте протопласты можно иммобилизовывать и инъецировать нуклеиновыми кислотами, например, экспрессирующей конструкцией. Несмотря на то что регенерация из протопластов не является легкой для зерновых, регенерация растений возможна в бобовых с использованием соматического эмбриогенеза из каллюса, полученного из протопласта. Сформированные можно трансформировать депротеинизированной ДНК с использованием технологии с генной пушкой, где ДНК покрывают вольфрамовыми быстролетящими микрочастицами, пробивающими 1/100 размера клетки, что приводит к переносу ДНК глубоко в клетки и органеллы. Затем в трансформированной ткани индуцируется регенерация, как правило, посредством соматического эмбриогенеза. Этот способ оказался успешным для некоторых видов зерновых, включая маис и рис.
Нуклеиновые кислоты, например, экспрессирующие конструкции, также можно вводить в клетки растений с использованием рекомбинантных вирусов. Клетки растений можно трансформировать с использованием вирусных векторов, таких как, например, векторы, полученные из вируса табачной мозаики (Rouwendal (1997) Plant Mol. Biol., 33:989-999), см. Porta (1996) Use of viral replicons for the expression of genes in plants, Mol. Biotechnol., 5:209-221.
Альтернативно, нуклеиновые кислоты, например, экспрессирующие конструкции, можно комбинировать с подходящими фланкирующими участками Т-ДНК и вводить в традиционный вектор-хозяин Agrohacterium tumefaciens. Функция вирулентности хозяина Agrobacterium tumefaciens направляет вставку конструкции и соседнего маркера в ДНК клетки растения при инфицировании клетки бактериями. Способ трансформации, опосредованный Agrobacterium tumefaciens, включая нейтрализацию и использование бинарных векторов, подробно описан в научной литературе. См., например, Horsch (1984) Science, 233:496-498; Fraley (1983) Proc. Natl. Acad. ScL, USA, 80:4803 (1983); Gene Transfer to Plants, Potrykus, ed. (Springer-Verlag, Berlin 1995). ДНК в клетке A. tumefaciens находится в бактериальной хромосоме, а также в другой структуре, известной как Ti-плазмида (индуцирующая опухоль). Ti-плазмида содержит участок ДНК, называемый Т-ДНК (длина ~20 т.п.н.), который переносится в клетку растений в процессе инфекции, и набор генов vir (вирулентность), которые управляют процессом инфекции. А. tumefaciens может инфицировать растение только через повреждения: при повреждении корня или стебля оно подает определенные химические сигналы, в ответ на которые активируются гены vir A. Tumefaciens, и они направляют ряд событий по переносу Т-ДНК из Ti-плазмиды в хромосому растения. Затем Т-ДНК проникает в клетку растений через повреждение. Существует предположение, что Т-ДНК ждет репликации и транскрипции ДНК растения, а затем встраивается в доступную ДНК растения. Для того чтобы использовать A. tumefaciens в качестве трансгенного вектора, необходимо удалить индуцирующий опухоль фрагмент Т-ДНК при сохранении краевых участков Т-ДНК и генов vir. Затем встраивают трансген между краевыми участками Т-ДНК, где он перемещается в клетку растений и встраивается в хромосомы растений.
Изобретение относится к трансформации однодольных растений с использованием нуклеиновых кислот по изобретению, включая основные злаковые, см. Hiei (1997) Plant Mol. Biol., 35:205-218. См. также, например, Horsch, Science (1984) 233:496; Fraley (1983) Proc. Natl. Acad. Sci, USA, 80:4803; Thykjaer (1997) выше; Park (1996) Plant Mol. Biol., 32:1135-1148, где описано встраивание Т-ДНК в геномную ДНК. См. также D'Halluin, патент США No. 5712135, где описан способ стабильного встраивания ДНК, содержащей ген, который является функциональным в клетке зерновых или других однодольных растений.
В одном аспекте третья стадия может включать селекцию и регенерацию всех растений, способных передавать встроенный целевой ген следующему поколению. Такие способы регенерации основаны на методиках с определенными фитогормонами в среде для выращивания культуры ткани, как правило, на основе биоцидного и/или гербицидного маркера, который вводится вместе с желательными нуклеотидными последовательностями. Регенерация растений из культивированных протопластов описана Evans et al., в Protoplasts Isolation and Culture, Handbook of Plant Cell. Culture, p. 124-176, MacMillilan Publishing Company, New York, 1983 и Binding, Regeneration of Plants, Plant Protoplasts, p. 21-73, CRC Press, Boca Raton, 1985. Регенерации также можно добиться из каллюса растений, эксплантатов, органов или их частей. Такие способы регенерации описаны, главным образом, Klee (1987) в Ann. Rev. of Plant Phys., 38:467-486. Для получения целых растений из трансгенных тканей, таких как незрелые зародыши, они могут быть выращены под контролем окружающих условий на ряде сред, содержащих пищевые добавки и гормоны, по способу, известному как культура тканей. После получения целого растения и получения семян начинается оценка потомства.
После того как экспрессирующая кассета стабильно встроена в трансгенные растения, ее можно вводить в другие растения посредством полового скрещивания. Можно использовать любой из различных стандартных способов выведения в зависимости от вида, предназначенного для скрещивания. Поскольку трансгенная экспрессия нуклеиновых кислот по изобретению приводит к изменениям фенотипа, то можно осуществить половое скрещивание растений, содержащих рекомбинантные нуклеиновые кислоты по изобретению, со вторым растением для получения конечного продукта. Таким образом, семя по изобретению может быть получено при скрещивании двух трансгенных растений по изобретению или при скрещивании растения по изобретению и другого растения. Желаемые эффекты (например, экспрессия полипептидов по изобретению с получением растения, в котором изменен характер цветения) могут быть усилены, если оба родительских растения экспрессируют полипептиды (например, фосфолипазу) по изобретению. Желаемые эффекты могут быть переданы последующим поколениям растений стандартными способами размножения.
Нуклеиновые кислоты и полипептиды по изобретению экспрессируются в любом растении или семени или встроены в него. Трансгенные растения по изобретению могут представлять собой двудольные или однодольные растения. Примерами однодольных трансгенных растений по изобретению являются травы, такие как мятлик луговой (мятлик, Роа), кормовая трава, такая как овсянница, райграс, медленно растущая трава, такая как Agrostis, и зерновые, например, пшеница, овес, рожь, ячмень, рис, сорго и маис (кукуруза). Примерами двудольных трансгенных растений по изобретению являются табак, бобовые, такие как люпины, картофель, свекла сахарная, горох, фасоль и соя, и крестоцветные растения (семейство Brassicaceae), такие как цветная капуста, рапс и близко родственная модель организма Arabidopsis thaliana. Таким образом, трансгенные растения и семена по изобретению включают широкий диапазон растений, включая, но, не ограничиваясь ими, виды из родов Anacardium, Arachis, Asparagus, Atropa, Avena, Brassica, Citrus, Citrullus, Capsicum, Carthamus, Cocos, Coffea, Cucumis, Cucurbita, Daucus, Elaeis, Fragaria, Glycine, Gossypium, Helianthus, Heterocallis, Hordeum, Hyoscyamus, Lactuca, Linum, Lolium, Lupinus, Lycopersicon, Malus, Manihot, Majorana, Medicago, Nicotiana, Olea, Oryza, Panieum, Pannisetum, Persea, Phaseolus, Pistachia, Pisum, Pyrus, Prunus, Raphanus, Ricinus, Secale, Senecio, Sinapis, Solarium, Sorghum, Theobromus, Trigonella, Triticum, Vicia, Vitis, Vigna и Zea.
В альтернативных вариантах осуществления нуклеиновые кислоты по изобретению экспрессируются в растениях (например, в трансгенных растениях), таких как растения, содержащие масличные семена, например, рис, соя, рапс, подсолнух, кунжут и арахис. Нуклеиновые кислоты по изобретению можно экспрессировать в растениях, которые содержат волокнистые клетки, включая, например, хлопок, хлопковое дерево (капок, Ceiha pentandra), иву пустынную, креозотовый куст, терескен шерстистый, бальзу, рами, кенаф, коноплю, розель, джут, сизаль, абаку и лен. В альтернативных вариантах осуществления трансгенные растения по изобретению могут являться членами рода Gossypium, включая члены любого из видов Gossypium, такие как G. arboreum; G. herbaceum, G. barbadense и G. hirsutum.
Изобретение также относится к трансгенным растениям, предназначенным для использования при получении больших количеств полипептидов (например, фосфолипазы или антител) по изобретению. Например, см. Palmgren (1997) Trends Genet., 13:348; Chong (1997) Transgenic Res., 6:289-296 (где продуцируется человеческий белок молока бета-казеин в трансгенных растениях картофеля с использованием ауксин-индуцируемого двунаправленного промотора маннопин-синтеназы (mas1',2') с опосредуемыми Agrobacterium tumefaciens способами трансформации в пластинке листа).
Используя известные методики, специалист в данной области может проводить отбор растений по изобретению, определяя повышение или снижение количества трансгенной мРНК или белка в трансгенном растении. Средства для определения и количественной оценки мРНК или белков хорошо известны в данной области.
Полипептиды и пептиды
Изобретение относится к выделенным, синтетическим или рекомбинантным полипептидам, обладающим идентичностью последовательностей (например, по меньшей мере приблизительно 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, или полной (100%) идентичностью последовательностей) с иллюстративной последовательностью по изобретению, например, SEQ ID NO: 6, имеющей одно или несколько изменений последовательности (например, мутаций), как указано в таблицах 12-15, как рассмотрено в примере 3 ниже, или их ферментативно активным фрагментам.
Как рассмотрено выше, идентичность может быть на протяжении всей длины полипептида, или идентичность может быть на протяжении ее подпоследовательности, например, области по меньшей мере приблизительно из 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700 или более остатков. Полипептиды по изобретению также могут быть короче, чем полная длина иллюстративных полипептидов. В альтернативном варианте осуществления изобретение относится к полипептидам (пептидам, фрагментам) с размером в диапазоне от 5 остатков до полной длины полипептида, например, фермента, такого как фосфолипаза, например, фосфолипаза; иллюстративные размеры составляют приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 100, 125, 150, 175, 200, 250, 300, 350, 400 или более остатков, например, последовательно расположенных остатков иллюстративных фосфолипаз. Пептиды по изобретению могут быть пригодны, например, в качестве зондов для мечения, антигенов, толерогенов, мотивов, активных центров фосфолипазы, связывающих доменов, регуляторных доменов и т.п.
В одном аспекте изобретение относится к полипептидам, имеющим последовательности, как указано в SEQ ID NO: 6, содержащим (и имеющим) одно или несколько изменений аминокислот (например, мутаций), как указано в таблицах 12-15, и их подпоследовательности, например, их активные центры ("каталитические домены"), обладающие активностью фосфолипазы, например, активностью фосфолипазы C (PLC), например, активностью PI-PLC. В одном аспекте полипептид обладает активностью фосфолипазы, но лишен активности гидролиза нейтралных масел (триглицеридов). Например, в одном аспекте полипептид обладает активностью фосфолипазы, но лишен какой-либо активности, которая влияет на фракцию нейтральных масел (триглицеридов). В одном аспекте изобретение относится к процессу рафинирования, включающему применение полипептида по изобретению, обладающего активностью фосфолипазы, но не активностью липазы.
Как используют в настоящем документе, термины "аминокислота" или "аминокислотная последовательность" относятся к олигопептиду, пептиду, полипептиду или белковой последовательности, или к фрагменту, участку или субъединице любого из них, и к природным или синтетическим молекулам.
Как используют в настоящем документе, термины "полипептид" и "белок" относятся к аминокислотам, соединенным друг с другом пептидными связями или модифицированными пептидными связями, т.е. к изостерическим пептидам, и может содержать модифицированные аминокислоты, отличные от 20 кодируемых генами аминокислот. Термин "полипептид" также включает пептидные и полипептидные фрагменты, мотива и т.п. Также термин включает гликозилированные полипептиды. Пептиды и полипептиды по изобретению также включают все формы "миметиков" и "пептидомиметиков", как подробнее описано ниже.
Как используют в настоящем документе, термин "выделенный" означает, что материал извлечен из его естественного окружения (например, из природного окружения, если он является встречающимся в природе). Например, встречающийся в природе полинуклеотид или полипептид, находящийся в живом животном, не является выделенным, но тот же полинуклеотид или полипептид, отделенный от некоторых или всех сосуществующих веществ в природной системе, является выделенным. Такие полинуклеотиды могут являться частью вектора и/или такие полинуклеотиды или полипептиды могут являться частью композиции и все-таки быть выделенными, поскольку такой вектор или композиция не являются частью их природного окружения. Как используют в настоящем документе, термин "очищенный" не подразумевает абсолютной чистоты; скорее, он подразумевается как относительное определение. Отдельные нуклеиновые кислоты, полученные из библиотеки, традиционно очищают до электрофоретической гомогенности. В альтернативных аспектах изобретение относится к нуклеиновым кислотам, очищенным от остальной геномной ДНК или от других последовательностей в библиотеке или другой окружающей среде по меньшей мере на один, два, три, четыре, пять или более порядков величины.
Полипептиды и пептиды по изобретению можно выделять из природных источников, они могут быть синтетическими или они могут представлять собой полученные рекомбинантными способами полипептиды. Пептиды и белки можно рекомбинантно экспрессировать in vitro или in vivo. Пептиды и полипептиды по изобретению можно получать и выделять с использованием любого способа, известного в данной области. Полипептид и пептиды по изобретению также можно синтезировать, целиком или частично, с использованием химических способов, хорошо известных в данной области. См. например, Caruthers (1980) Nucleic Acid. Res. Symp. Ser., 215-223; Horn (1980) Nucleic Acid Res. Symp. Ser., 225-232; Banga A.K., Therapeutic Peptides and Proteins, Formulation, Processing and Delivery Systems (1995) Technomic Publishing Co., Lancaster, PA. Например, синтез пептида можно проводить с использованием различных твердофазных способов (см., например, Roberge (1995) Science 269:202; Merrifield (1997) Methods Enzymol., 289:3-13) и можно применять автоматический синтез, например, с использованием ABI 431 A Peptide Synthesizer (Perkin Elmer) в соответствии с инструкциями, предоставляемыми изготовителем.
Пептиды и полипептиды по изобретению также могут быть гликозилированными. Гликозилирование может быть добавлено посттрансляционно либо химически, либо клеточными биосинтетическими механизмами, где последние включают использование известных мотивов гликозилирования, которые могут быть нативными в последовательности или могут быть добавлены в виде пептида, или могут быть добавлены в кодирующую последовательность нуклеиновой кислоты. Гликозилирование может представлять собой О-гликозилирование или N-гликозилирование.
Пептиды и полипептиды по изобретению, как определено выше, включают все формы "миметиков" и "пептидомиметиков". Термины "миметик" и "пептидомиметик" относятся к синтетическому химическому соединению, которое обладает, по существу, такими же структурными и/или функциональными характеристиками, что и полипептиды по изобретению. Миметик может либо целиком состоять из синтетических, неприродных аналогов аминокислот, либо он представляет собой химерную молекулу частично с аминокислотами природных пептидов и частично с аналогами аминокислот. Миметик также может включать любое количество консервативных замен природных аминокислот, поскольку такие замены также по существу не изменяют структуру и/или активность миметика. Как в случае полипептидов по изобретению, которые представляют собой консервативные варианты, общепринятые способы экспериментирования позволяют определить, что миметик входит в объем данного изобретения, т.е. что его структура и/или функция по существу не изменены. Таким образом, в одном аспекте композиция миметика находится в объеме изобретения, если он обладает активностью фосфолипазы.
Композиции миметиков полипептидов по изобретению могут содержать любую комбинацию неприродных структурных компонентов. В альтернативном аспекте композиции миметиков по изобретению включают одну или все из следующих трех структурных групп: а) группы со связью с остатками, отличной от природной амидной связи ("пептидная связь"); b) неприродные остатки вместо природных аминокислотных остатков или с) остатки, которые приводят к вторичной структурной мимикрии, т.е. к индуцированию или стабилизации вторичной структуры, например, конформации бета-петли, гамма-петли, бета-слоя, альфа-спирали и т.п. Например, полипептид по изобретению может быть охарактеризован как миметик, если все или некоторые его остатки присоединены химическими способами, отличными от природных пептидных связей. Отдельные остатки пептидомимика могут быть соединены пептидными связями, другими химическими связями или способами конденсации, такими как, например, в случае глутаральдегида, сложных эфиров N-гидроксисукцинимида, бифункциональных малеинимидов, N,N'-дициклогексилкарбодиимида (DCC) или N,N'-диизопропилкарбодиимида (DIC). Присоединенные группы, которые могут быть альтернативными традиционной амидной связи ("пептидной связи"), включают, например, кетометилен (например, -С(=О)-СН2- для -C(=O)-NH-), аминометилен (СН2-NH), этилен, олефин (СН=СН), простой эфир (СН2-О), тиоэфир (CH2-S), тетразол (CN4-), тиазол, ретроамид, тиоамид или сложный эфир (см., например, Spatola (1983) в Chemistry and Biochemistry of Amino acids, Peptides and Proteins, vol. 7, p. 267-357, "Peptide Backbone Modifications," Marcell Dekker, NY).
Полипептид по изобретению также может быть охарактеризован в качестве миметика по наличию всех или нескольких неприродных остатков на месте природных аминокислотных остатков. Неприродные остатки полностью описаны в научной и патентной литературе; некоторые иллюстративные неприродные композиции, подходящие в качестве миметиков природных аминокислотных остатков и руководства, описаны ниже. Миметики ароматических аминокислот могут быть получены заменой, например, D- или L-нафтилаланином; D- или L-фенилглицином; D- или L-2-тиенилаланином; D- или L-1, -2,3- или 4-пиренилаланином; D- или L-3-тиенилаланином; D- или L-(2-пиридинил)аланином; D- или L-(3-пиридинил)аланином; D- или L-(2-пиразинил)аланином; D- или L-(4-изопропил)фенилглицином; D-(трифторметил)фенилглицином; D-(трифторметил)фенилаланином; D-п-фторфенилаланином; D- или L-п-бифенилфенилаланином; D- или L-п-метоксибифенилфенилаланином; D- или L-2-индол(алкил)аланинами; и D- или L-алкиламинами, где алкил может представлять собой замещенный или незамещенный метил, этил, пропил, гексил, бутил, пентил, изопропил, изобутил, вторичный изобутил, изопентил или некислотные аминокислоты. Ароматические кольца неприродных аминокислот включают, например, ароматические кольца тиазолила, тиофенила, пиразолила, бензимидазолила, нафтила, фуранила, пирролила и пиридила.
Миметики кислых аминокислот можно получать заменой, например, некарабоксилатными аминокислотами при сохранении отрицательного заряда; (фосфоно)аланином; сульфатированным треонином. Карбоксильные боковые группы (например, аспартильная или глутамильная) также могут быть селективно модифицированными посредством реакции с карбоимидами (R'-N-C-N-R'), такими как, например, 1-циклогексил-3-(2-морфолинил-(4-этил)карбодиимид или 1-этил-3-(4-азоний-4,4-диметилпентил)карбодиимид. Аспартил или глутамил также могут быть превращены в остатки аспарагинила и глутаминила реакцией с ионами аммония. Миметики основных аминокислот могут быть получены заменой, например, (в дополнение к лизину и аргинину) аминокислот орнитином, цитруллином или гуанидинуксусной кислотой, или гуанидиналкилуксусной кислотой, где алкил определен выше. Производным нитрила (например, содержащим CN-группу вместо СООН) можно заменить аспарагин или глутамин. Остатки аспарагинила и глутаминила могут быть дезаминированы до соответствующих остатков аспартила или глутамила. Миметики аргининовых остатков могут быть получены реакцией аргинила, например, с одним или несколькими общепринятыми реагентами, включая, например, фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион или нингидрин, предпочтительно в щелочных условиях. Миметики остатка тирозина могут быть получены реакцией тирозила, например, с ароматическими соединениями диазония или тетранитрометаном. N-ацетилимидазол и тетранитрометан могут быть использованы для образования О-ацетилтирозильных продуктов и 3-нитропроизводных соответственно. Миметики остатка цистеина могут быть получены реакцией остатков цистеинила, например, с альфа-галоацетатами, такими как 2-хлоруксусная кислота или хлорацетамид, и соответствующими аминами; с получением карбоксиметильных или карбоксиамидометильных производных. Миметики цистеиновых остатков также могут быть получены реакцией остатков цистеинила, например, с бромтрифторацетоном, альфа-бром-бета-(5-имидозоил)пропионовой кислотой; хлорацетилфосфатом, N-алкилмилеинимидами, 3-нитро-2-пиридилдисульфидом; метил-2-пиридилдисульфидом; п-хлорртутьбензоатом; 2-хлорртуть-4-нитрофенолом или хлор-7-нитробензоокса-1,3-диазолом. Миметики лизина могут быть получены (и N-концевые остатки могут быть изменены) реакцией лизинила, например, с ангидридом янтарной или другой карбоновой кислоты. Лизин и другие альфа-аминосодержащие остатки также могут быть получены реакцией с имидоэфирами, такими как метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлорборгидрид, тринитробензолсульфоновая кислота, О-метилизомочевина, 2,4-пентандион, и реакцией с глиоксилатом, катализируемой трансамидазой. Миметики метионина могут быть получены реакцией, например, с сульфоксидом метионина. Миметики пролина включают, например, пипеколиновую кислоту, тиазолидинкарбоновую кислоту, 3- или 4-гидроксипролин, дегидропролин, 3- или 4-метилпролин или 3,3-диметилпролин. Миметики гистидиновых остатков могут быть получены реакцией гистидила, например, с диэтилпрокарбонатом или парабромфенацилбромидом. Другие миметики включают, например, миметики, полученные гидроксилированием пролина и лизина; фосфорилированием гидроксильных групп остатков серила или треонила; метилированием альфа-аминогрупп лизина, аргинина и гистидина; ацетилированием N-концевого амина; метилированием остатков амида главной цепи или заменой N-метиламинокислотами; или амидированием С-концевых карбоксильных групп.
Остаток полипептида, например, аминокислота, по изобретению также может быть заменен аминокислотой (или остатком пептидомиметика) с противоположной хиральностью. Таким образом, любая аминокислота, встречающаяся в природе в L-конфигурации (которая также может называться R или S в зависимости от целостной химической структуры), может быть заменена аминокислотой такого же структурного типа или пептидомиметиком, но с противоположной хиральностью, называемой D-аминокислотой, но также может называться R- или S-формой.
Изобретение также относится к способам модификации полипептидов по изобретению либо посредством природных процессов, таких как посттрансляционный процессинг (например, фосфорилирование, ацилирование и т.д.), либо посредством способов химической модификации и полученных модифицированных полипептидов. Модификации можно осуществлять на любом участке полипептида, включая остов пептида, боковые цепи аминокислот и N- или С-концы. Следует понимать, что один и тот же тип модификации может быть выражен в той же или другой степени в разных участках данного полипептида. Также данный полипептид может иметь многие типы модификаций. Модификации включают ацетилирование, ацилирование, ADP-рибозилирование, амидирование, ковалентное присоединение флавина, ковалентное присоединение группы гема, ковалентное присоединение нуклеотида или производного нуклеотида, ковалентное присоединение липида или производного липида, ковалентное присоединение фосфатидилинозитола, циклизацию с образованием поперечных связей, образование дисульфидной связи, деметилирование, образование ковалентных поперечных связей, образование цистеина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, образование GPI-якоря, гидроксилирование, иодинирование, метилирование, миристоилирование, оксидирование, пегилирование, протеолитический процессинг, фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфатацию и опосредуемую транспортной РНК вставку аминокислоты в белок, такую как аргинилирование. См., например, Creighton Т.Е. Proteins -Structure and Molecular Properties 2nd Ed., W.H. Freeman and Company, New York (1993); Posttranslational Covalent Modification of Proteins, B.C. Johnson, Ed., Academic Press, New York, p. 1-12 (1983).
Также для синтеза полипептида или фрагментов по изобретению можно использовать твердофазные способы химического синтеза пептидов. Такой способ известен в данной области с начала 1960-х (Merrifield R.B., J. Am. Chem. Soc., 85:2149-2154, 1963) (См. также Stewart J.M. and Young J.D., Solid Phase Peptide Synthesis, 2nd Ed., Pierce Chemical Co., Rockford, 111, p. 11-12)) и в последнее время используется в коммерчески доступных лабораторных наборах для разработки и синтеза пептидов (Cambridge Research Biochemicals). В таких коммерчески доступных лабораторных наборах, главным образом, используются идеи Н.М. Geysen et al., Proc. Natl. Acad. Set., USA, 81:3998 (1984) и они обеспечивают синтез пептидов от концов множества "стержней" или "булавок", все из которых соединены в едином планшете. При использовании такой системы планшет со стержнями или булавками переворачивают и вставляют во второй планшет с соответствующими лунками или резервуарами, которые содержат растворы для присоединения или заякоривания соответствующей аминокислоты на концах стержней или шпилек. При повторении этой стадии процесса, т.е. переворачивание и помещение концов стержней и булавок в соответствующие растворы, из аминокислот выстраиваются желаемые пептиды. Кроме того, является доступным ряд доступных систем для синтеза пептидов FMOC. Например, сборку полипептида или фрагмента можно осуществить на твердой подложке с использованием устройства для автоматического синтеза пептидов Applied Biosystems, Inc. Model 431 ATM. Такое оборудование обеспечивает легкую доступность пептидов по изобретению либо непосредственным синтезом, либо синтезом ряда фрагментов, которые связывать с использованием других известных способов.
Ферменты фосфолипазы
Изобретение относится к полипептидам, имеющим активность фосфолипазы, к нуклеиновым кислотам, кодирующим их, антителам, которые связывают их, пептидам, соответствующим антигенным участкам фермента (эпитопам) и активным центрам, регуляторным и связывающим доменам, и к способам их получения и применения. В одном аспекте полипептиды по изобретению обладают активностью фосфолипазы или любой комбинацией видов активности фосфолипазы, как описано в настоящем документе (например, активность фермента фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), и т.д.). В альтернативных аспектах фосфолипазы по изобретению обладают активностью, модифицированной относительно активности иллюстративных фосфолипаз, описанных в настоящем документе.
Как используют в настоящем документе, термин "фосфолипаза" охватывает ферменты, обладающие любой активностью фосфолипазы, например, активностью расщепления глицеринфосфатной сложноэфирной связи (катализ гидролиза глицеринфосфатной сложноэфирной связи), например, в масле, таком как неочищенное масло или растительное масло. Активность фосфолипазы по изобретению может обеспечивать образование экстрагируемого водой фосфорилированного основания и диглицерида. Термин "активность фосфолипазы" охватывает гидролиз глицеринфосфатных сложноэфирных связей при высоких температурах, низких температурах, щелочных значениях pH и кислотных значениях pH, расщепление глицеринфосфатного сложного эфира с образованием экстрагируемого водой фосфорилированного основания и диглицерида, расщепление сложноэфирных связей между глицерином и фосфорной кислотой в фосфолипиах, и другие виды активности, такие как способность связывать и гидролизовать субстрат, такой как масло, например, неочищенное масло или растительное масло, при этом субстрат также включает растительные и животные фосфатидилхолины, фосфатидилэтаноламины, фосфатидилсерины и сфингомиелины. Активность фосфолипазы может включать активность фосфолипазы C (PLC); активность PI-PLC, активность фосфолипазы A (PLA), такую как активность фосфолипазы A1 или фосфолипазы A2; активность фосфолипазы B (PLB), такую как активность фосфолипазы B1 или фосфолипазы B2, включая активность лизофосфолипазы (LPL) и/или активность лизофосфолипазы-трансацилазы (LPT A); активность фосфолипазы D (PLD), такую как активность фосфолипазы D1 или фосфолипазы D2; и/или активность пататина, или любую их комбинацию. Активность фосфолипазы может включать гидролиз гликопротеина, например, такого как гликопротеин, встречающийся в клубнях картофеля или любом растении рода Solatium, например, Solatium tuberosum. В альтернативных вариантах осуществления активность фосфолипазы может включать ферментативную активность пататина, такую как эстеразная активность пататина (см., например, Jimenez (2002) Biotechnol. Prog. 18:635-640). В определенных вариантах осуществления активность фосфолипазы может включать активность ацилгидролазы (LAH) липидов.
В альтернативных вариантах осуществления фосфолипазы PLC по изобретению используют (например, катализируют гидролиз) различные фосфолипидные субстраты, включая фосфатидилхолин (PC), фосфатидилэтаноламин (PE), фосфатидилсерин (PS), фосфатидилинозитол (PI) и/или фосфатидную кислоту (PA) или их комбинацию. Кроме того, эти ферменты могут обладать различными степенями активности в отношении лизофосфолипидных форм этих фосфолипидов. В различных аспектах ферменты PLC по изобретению могут демонстрировать предпочтение к фосфатидилхолину и фосфатидилэтаноламину в качестве субстратов.
В альтернативных вариантах осуществления фосфатидилинозитол-фосфолипазы PLC по изобретению используют множество фосфолипидных субстратов, включая фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол и фосфатидную кислоту или их комбинацию. В альтернативных вариантах осуществления эти ферменты могут обладать различными степенями активности в отношении лизофосфолипидных форм этих фосфолипидов. В различных аспектах ферменты фосфатидилинозитол-PLC по изобретению могут демонстрировать предпочтение к фосфатидилинозитолу в качестве субстрата.
В альтернативных вариантах осуществления активность фосфолипазы может включать специфичность в отношении одного или нескольких специфических субстратов, например, фермент по изобретению может обладать специфичностью действия в отношении PE и PC; PE и PI; PE и PS; PS и PC; PS и PI; PI и PC; PS, PI и PC; PE, PI и PC; PC, PE и PS; PE, PS и PI; или, PE, PS, PI и PC, или любой их комбинации.
В альтернативных вариантах осуществления фосфолипаза по изобретению может обладать полифункциональной активностью, например, комбинацией одного или нескольких видов ферментативной активности, описанных в настоящем документе. Например, в одном аспекте полипептид по изобретению является ферментативно активным, но лишен активности липазы или лишен какой-либо ферментативной активности, которая влияет на нейтральную фракцию масел (триглицеридом). Может быть желательным использовать такой полипептид в конкретном процессе, например, в процессе рафинирования, где важно, чтобы фракция нейтрального масла не была повреждена (уменьшена в количестве, деградирована, например, гидролизована). Таким образом, в одном аспекте изобретение относится к процессу рафинирования, включающему применение полипептида по изобретению, обладающего активностью фосфолипазы, но не активностью липазы.
В альтернативных вариантах осуществления полипептиды по изобретению, обладающие ферментативной активностью пататина, могут использовать множество фосфолипидных субстратов, включая фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол и фосфатидную кислоту, или их комбинацию. Кроме того, эти ферменты могут обладать различными степенями активности в отношении лизофосфолипидных форм этих фосфолипидов. В различных аспектах пататины по изобретению основаны на консервативности сходства аминокислотной последовательности. В различных аспектах эти ферменты обладают разнообразным набором биохимических свойств и могут выполнять реакции, характерные для классов ферментов PLA1, PLA2, PLC или PLD.
В альтернативных вариантах осуществления полипептиды по изобретению, включающие фосфолипазы PLD по изобретению, могут использовать множество фосфолипидных субстратов, включая фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол и фосфатидную кислоту, или их комбинацию. Кроме того, эти ферменты могут обладать различными степенями активности в отношении лизофосфолипидных форм этих фосфолипидов. В одном аспекте эти ферменты пригодны для осуществления реакций переэтерификации с образованием структурированных фосфолипидов.
В альтернативных вариантах осуществления полипептиды по изобретению обладают активностью, включающей расщепление глицеринфосфатной сложноэфирной связи, способность гидролизовать фосфатные сложноэфирные связи, включая активность пататина, ацилгидролазы липидов (LAH), фосфолипазы A, B, C и/или фосфолипазы D, или любую их комбинацию.
Как используют в настоящем документе, 1 единица фермента представляет собой количество фермента, требуемого для обеспечения переработки реакцией 1 микромоль субстрата в минуту в определенных условиях.
В альтернативных вариантах осуществления изобретение относится к полипептидам с сигнальными последовательностями или без них, и к самим сигнальным последовательностям (например, выделенные пептиды сигнальных последовательностей). Изобретение относится к фрагментам или подпоследовательностям ферментов по изобретению, например, пептидам или полипептидам, содержащим или состоящим из каталитических доменов ("активных центров"), участков связывания, регуляторных доменов, эпитопов, сигнальных последовательностей, препродоменов и т.п. Также изобретение включает иммобилизованные фосфолипазы, антитела против фосфолипазы и их фрагменты. Изобретение относится к гетерокомплексам, например, слитым белкам, гетеродимерам и т.д., содержащим фосфолипазы по изобретению. Определение пептидов, соответствующим антигенным центрам фермента (эпитопам), активным центрам, участкам связывания, сигнальным последовательностям, и т.п. можно проводить с помощью общепринятых протоколов скрининга.
Эти ферменты и способы по изобретению можно использовать для достижения более полного рафинирования масел с высоким содержанием фосфора, в частности, масел риса, сои, кукурузы, канолы и подсолнечного масла. Например, в одном аспекте при расщеплении посредством PI-PLC, фосфатидилинозитол конвертируется в диацилглицерин и фосфоинозитол. Диацилглицерин распределяется в водную фазу (увеличение выхода масла) и фосфоинозитол распределяется в водную фазу, где он удаляется в качестве компонента тяжелой фазы в процессе центрифугирования. Фермент по изобретению, например, PI-PLC по изобретению, можно включать в процесс либо химической, либо физической очистки.
В альтернативных аспектах ферменты по изобретению обладают активностью фосфатидилинозитол-специфической фосфолипазы C (PI-PLC), активностью фосфатидилхолин-специфической фосфолипазы C, активностью фосфатазы фосфатидной кислоты, активностью фосфолипазы A и/или активностью родственной пататину фосфолипазы. Эти ферменты можно использовать отдельно или в комбинации друг с другом или с другими ферментами по изобретению, или с другими ферментами. В одном аспекте изобретение относится к способам, где эти ферменты (включая фосфатидилинозитол-специфическую фосфолипазу C (PIPLC), фосфатидилхолин-специфическую фосфолипазу C, и/или фосфолипазу D (совместно с фосфатазой), фосфатазу фосфатидной кислоты, фосфолипазу A, родственные пататину фосфолипазы по изобретению) используют отдельно или в комбинации при рафинировании масел, например, растительных масел, например, масел с высоким содержанием фосфора, таких как соевое масло, кукурузное масло, масло канолы, рисовое и подсолнечное масло. Эти ферменты и способы по изобретению можно использовать для достижения более полного рафинирования масел с высоким содержанием фосфора, в частности, соевого масла, кукурузного масла, масла канолы, рисового и подсолнечного масла. При расщеплении посредством PI-PLC, фосфатидилинозитол конвертируется в диацилглицерин и фосфоинозитол. Диацилглицерин распределяется в водную фазу (увеличение выхода масла) и фосфоинозитол распределяется в водную фазу, где он удаляется в качестве компонента тяжелой фазы в процессе центрифугирования. Фермент по изобретению, например, PI-PLC по изобретению, можно включать в процесс либо химической, либо физической очистки.
В одном аспекте изобретение относится к композициям, например, растворам, содержащим цитрат натрия при нейтральных pH для гидратации негидратируемых веществ. Например, изобретение относится к растворам цитрата натрия в диапазоне pH приблизительно от 4 до 9, или от 5 до 8, или от 6 до 7, которые можно использовать для гидратации негидратируемых фосфолипидов (включая ферменты по изобретению) в маслах с высоким содержанием фосфора. В одном аспекте гидратацию негидратируемых фосфолипидов проводят хелатированием кальция и магния, ассоциированных с фосфолипидами, тем самым позволяя ранее нерастворимым солям фосфолипидов более легко распределяться в водную фазу. В одном аспекте после перемещения фосфолипидов к поверхности контакта вода/масло или в водную фазу, фосфолипаза по изобретению (например, фосфолипаза-специфическая фосфогидролаза по изобретению), или другая фосфолипаза, конвертирует фосфолипид в диацилглицерин и фосфатный сложный эфир. В одном аспекте содержания кальция и магния снижают добавлением кислоты или щелочи (см. обсуждение щелочных процессов).
Ферменты по изобретению являются высоко селективными катализаторами. Как и в случае других ферментов, они катализируют реакции с высокой стерео-, регио- и хемо-селективностью, которые не имеют себе равных в общепринятой синтетической химии. Более того, ферменты по изобретению являются в высокой степени универсальными. Они могут быть адаптированы для функционирования в органических растворителях, действия при крайних значениях pH (например, высоких pH и низких pH), крайних температурах (например, высоких температурах и низких температурах), крайних уровнях содержания солей (например, высоком и низком содержании солей), и катализируют реакции с соединениями, которые являются структурно неродственными их природным физиологическим субстратам. Ферменты по изобретению могут быть предназначены для того, чтобы они реагировали с широким диапазоном природных и неприродных субстратов, таким образом, обеспечивая модификацию практически любых основных органических соединений. Ферменты по изобретению также могут быть предназначены для того, чтобы они были высоко энантио- и региоселективными. Высокая степень специфичности к функциональным группам, проявляемая этими ферментами, позволяет отслеживать каждую реакцию в синтетической последовательности, что приводит к новому активному соединению. Ферменты по изобретению также могут быть предназначены для катализа многих разнообразных реакций, несвойственных их нативной физиологической функции в природе.
В соответствии с настоящим изобретением используют уникальные каталитические свойства ферментов. В то время как использование биокатализаторов (т.е. очищенных или неочищенных ферментов, неживых или живых клеток) в химических превращениях обычно требует идентификации конкретного биокатализатора, который взаимодействует с конкретным исходным соединением. В соответствии с настоящим изобретением используют подобранные биокатализаторы, т.е. ферменты по изобретению, и условия реакции, которые являются особыми для функциональных групп, которые находятся в различных исходных соединениях, таких как низкомолекулярные соединения. Каждый биокатализатор специфичен для одной функциональной группы или нескольких сходных функциональных групп и может взаимодействовать с различными исходными соединениями, содержащими эту функциональную группу. Биокаталитические реакции приводят к получению группы производных из единственного исходного соединения. Эти производные можно подвергать подвергнуты другому циклу биокаталитических реакций с получением второй группы производных соединений. При каждом повторе биокаталитического получения производных может быть получено тысячи вариантов исходных соединений.
Настоящее изобретение относится к способам идентификации единичного активного фермента PLC в библиотеке, где библиотека характеризуется рядом биокаталитических реакций, используемых для ее получения, так называемой "биосинтетической историей". Один вариант осуществления включает скрининг библиотеки на виды биологической активности и прослеживание биосинтетической истории дает возможность идентифицировать конкретную последовательность реакций получения активного соединения. Последовательность реакций можно повторять и определять структуру синтезированного соединения. В этом варианте осуществления для этого способа идентификации не требуются технологии иммобилизации; и соединения можно синтезировать и анализировать в свободной форме в растворе с использованием практически любого типа скрининга. В этом варианте осуществления высокая степень специфичности ферментативных реакций для функциональных групп дает возможность "проследить" конкретные ферментативные реакции, посредством которых была создана биокаталитически полученная библиотека.
Также изобретение относится к способам выявления новых фосфолипаз с использованием нуклеиновых кислот, полипептидов и антител по изобретению. В одном аспекте проводят скрининг библиотек фага лямбда для выявления фосфолипаз на основе экспрессии. Применение библиотек фага лямбда в скрининге позволяет определение токсичных клонов; улучшение доступа к субстрату; снижение необходимости в получении способами инженерии хозяина, обход потенциальных любых ошибок, возникающих вследствие множественных удалений в библиотеках; и ускорение роста при низких плотностях клонов. Скрининг библиотек фага лямбда можно проводить в жидкой фазе или в твердой фазе. Скрининг в жидкой фазе обеспечивает большую универсальность условий анализа; дополнительную универсальность субстрата; повышенную чувствительность для слабых клонов и легкость автоматизации по сравнению с твердофазным анализом.
В альтернативных вариантах осуществления методические стадии проводят с использованием роботизации, например, для обеспечения выполнения тысяч биокаталитических реакций и скрининга за короткий период времени, например, за сутки, а также для обеспечения высокого уровня точности и воспроизводимости (см. описание матриц ниже). В результате, библиотека производных соединений может быть получена всего за несколько недель. Для других описаний модификаций молекул, включая низкомолекулярные соединения, см. PCT/US 94/09174.
Сигнальные последовательности фосфолипаз
Изобретение относится к сигнальным последовательностям фосфолипазы (например, сигнальные пептиды (SP)), например, пептидам, содержащим сигнальные последовательности, и/или химерным полипептидам, где пептиды или химеры имеют сигнальную последовательность, как описано в настоящем документе. Изобретение относится к нуклеиновым кислотам, кодирующим эти сигнальные последовательности (SP, например, пептид, обладающий последовательностью, содержащей/состоящий из N-концевых остатков полипептида по изобретению). В одном аспекте изобретение относится к сигнальной последовательности, содержащей пептид, содержащий/состоящий из последовательности, как указано в остатках 1-20, 1-21, 1-22, 1-23, 1-24, 1-25, 1-26, 1-27, 1-28, 1-28, 1-30, 1-31, 1-32 или 1-33 полипептида по изобретению, например, полипептида, содержащего последовательность, как указано в SEQ ID NO: 6, и имеющего одну или несколько мутаций, как указано в таблицах 12-15, или его ферментативно активного фрагмента. Любой из этих пептидов может быть часть химерного белка, например, рекомбинантного белка. Пептид сигнальной последовательности можно приспосабливать к другому ферменту по изобретению (например, фосфолипазе по изобретению, из которой он не происходит) или к другой фосфолипазе или к любому полипептиду, как рассмотрено ниже.
Иллюстративные сигнальные последовательности включают остатки 1-37 SEQ ID NO: 4 и остатки 1-23 SEQ ID NO: 6.
В некоторых аспектах фосфолипазы по изобретению не обладают сигнальными последовательностями. В одном аспекте изобретение относится к фосфолипазам по изобретению, лишенным всей сигнальной последовательности или ее части. В одном аспекте изобретение относится к последовательности нуклеиновой кислоты, кодирующей сигнальную последовательность из одной фосфолипазы, функционально связанную с последовательностью нуклеиновой кислоты отличающейся фосфолипазы или, необязательно, может быть желательной сигнальная последовательность из белка, не являющегося фосфолипазой.
Препродомены фосфолипазы, связывающие домены и каталитические домены
В дополнение к сигнальным последовательностям (например, сигнальным пептидам (SP)), как рассмотрено выше, изобретение относится к препродоменам, связывающим доменам (например, связывающему субстрат домену) и каталитическим доменам (CD). Домены SP, связывающие домены, препродомены и/или CD по изобретению могут представлять собой выделенные, синтетические или рекомбинантные пептиды или они могут быть частью слитого белка, например, в качестве гетерологичного домена в химерном белке. Изобретение относится к нуклеиновым кислотам, кодирующим эти каталитические домены (CD) (например, "активные центры"), препродомены, связывающие домены и сигнальные последовательности (SP, например, пептид, имеющий последовательность, содержащую/ состоящую из N-концевых остатков полипептида по изобретению).
Сигнальные последовательности (SP), связывающие домены, каталитические домены (CD) и/или препропоследовательности фосфолипазы по изобретению могут представлять собой выделенные пептиды или последовательности, связанные с другой фосфолипазой или полипептидом, не являющимся фосфолипазой, например, в виде слитого (химерного) белка. В одном аспекте полипептиды, содержащие сигнальные последовательности SP и/или препропоследовательности фосфолипазы по изобретению, содержат последовательности, гетерологичные фосфолипазам по изобретению (например, слитый белок, содержащий SP и/или препропоследовательность по изобретению и последовательности из другой фосфолипазы или не являющегося фосфолипазой белка). В одном аспекте изобретение относится к фосфолипазам по изобретению с гетерологичными CD, SP и/или препропоследовательностями, например, последовательностями с сигнальной последовательностью дрожжей. Фосфолипаза по изобретению может содержать гетерологичные CD, SP и/или препропоследовательность в векторе, например, векторе серии pPIC (Invitrogen, Carlsbad, CA).
В одном аспекте SP, CD и/или препропоследовательности по изобретению идентифицируют после идентификации новых полипептидов фосфолипазы. Пути, посредством которых белки сортируются и транспортируются в нужные отделы клетки, часто называются путями направления белков. Одним из наиболее важных элементов во всех из указанных направляющих систем является короткая аминокислотная последовательность на N-конце вновь синтезированного полипептида, называемая сигнальной последовательностью. Эта сигнальная последовательность направляет белок в соответствующий ему отдел клетки, и она удаляется в процессе транспорта или при достижении белком пункта назначения. Большинство лизосомальных, мембранных или секретируемых белков обладают N-концевой сигнальной последовательностью, которая маркирует их для транспорта в просвет эндоплазматической сети. Сигнальные последовательности могут варьировать в длину от 13 до 45 или более аминокислотных остатков. Различные способы распознавания сигнальных последовательностей известны специалистам в данной области. Например, в одном аспекте новые сигнальные пептиды гидролазы идентифицируют способом, называемым SignalP. В SignalP используется комбинированная нейронная сеть, которая распознает как сигнальные пептиды, так и их участки расщепления. (Nielsen et al., Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites., Protein Engineering, vol. 10, No. 1, p. 1-6 (1997).
В некоторых аспектах фосфолипаза по изобретению может не обладать SP и/или препропоследовательностями и/или каталитическими доменами (CD). В одном аспекте изобретение относится к фосфолипазам, лишенным всех или части SP, CD и/или препродомена. В одном аспекте изобретение относится к последовательности нуклеиновой кислоты, кодирующей сигнальную последовательность (SP), CD и/или препропоследовательность из одной фосфолипазы, функционально связанную с последовательностью нуклеиновой кислоты отличающейся фосфолипазы или, необязательно, могут быть желательными сигнальная последовательность (SP), CD и/или препродомен из не являющегося фосфолипазой белка.
Изобретение также относится к выделенным, синтетическим или рекомбинантным полипептидам, содержащим сигнальные последовательности (SP), препродомен и/или каталитические домены (CD) по изобретению и гетерологичные последовательности. Гетерологичные последовательности представляют собой последовательности, искусственно ассоциированные (например, в случае фосфолипазы) с SP, препродоменом и/или CD. Последовательность, с которой SP, препродомен и/или CD могут быть искусственно ассоциированы, может находиться на N-конце, С-конце SP, препродомена и/или CD, и/или на обоих концах SP и/или CD. В одном аспекте изобретение относится к выделенному, синтетическому или рекомбинантному полипептиду, содержащему (или состоящему из) полипептид, содержащий сигнальную последовательность (SP), препродомен и/или каталитический домен (CD) по изобретению, при условии, что он не ассоциирован с любой последовательностью, с которой он ассоциирован в природе (например, последовательностью фосфолипазы). Аналогично, в одном аспекте изобретение относится к выделенным или рекомбинантным нуклеиновым кислотам, кодирующим эти полипептиды. Таким образом, в одном аспекте выделенная, синтетическая или рекомбинантная нуклеиновая кислота по изобретению содержит кодирующую последовательность для сигнальной последовательности (SP), препродомена и/или каталитического домена (CD) по изобретению, и гетерологичную последовательность (т.е. последовательность, искусственно ассоциированную с сигнальной последовательностью (SP), препродоменом и/или каталитическим доменом (CD) по изобретению). Гетерологичная последовательность может находиться на 3'-конце, 5'-конце и/или на обоих концах последовательности, кодирующей SP, препродомен и/или CD.
Полипептиды по изобретению включают фосфолипазы в активной и неактивной форме. Например, полипептиды по изобретению включают пробелки перед "созреванием" или процессингом препропоследовательностей, например, ферментом процессинга пробелка, таким как конвертаза пробелка, с получением "активного" зрелого белка. Полипептиды по изобретению включают ферменты, неактивные по другим причинам, например, перед "активацией" посредством событий посттрансляционного процессинга, например, воздействия эндо- и экзопептидаз или протеаз, событий фосфорилирования, амидирования, гликозилирования или сульфатации, событий димеризации и т.п. Способы идентификации последовательностей "препро"-домена и сигнальных последовательностей хорошо известны в данной области, см., например, Van de Ven (1993) Crit. Rev. Oncog., 4 (2): 115-136; двухгибридный скрининг дрожжей для идентификации белок-белковых взаимодействий, описанный, например, в Miller (2004) Methods Mol. Biol. 261:247-62; Heyninck (2004) Methods Mol. Biol. 282:223-41, USPN 6617122; 6190874. Например, для идентификации препропоследовательности белок очищают от внеклеточного окружения и N-концевую белковую последовательность определяют и сравнивают с непроцессированной формой.
Полипептиды по изобретению могут быть изготовлены в виде белкового препарата в жидкой, твердой, полутвердой или гелеобразоной форме. Например, препарат белка по изобретению может содержать состав, содержащий неводную жидкую композицию, отлитое твердое тело, порошок, лиофилизированный порошок, гранулированную форму, форму в виде частиц, прессованную таблетку, драже, пилюлю, форму геля, гидрогель, пасту, аэрозоль, спрей, лосьон или состав взвеси.
Полипептиды по изобретению включают все активные формы, включая активные подпоследовательности, например, каталитические домены (CD) или активные центры фермента по изобретению. В одном аспекте изобретение относится к каталитическим доменам или активным центрам, как указано ниже. В одном аспекте изобретение относится к пептиду или полипептиду, содержащему или состоящему из домена активного центра, как предсказано с использованием базы данных, такой как Pfam (которая представляет собой большую коллекцию множества выровненных последовательностей и скрытых моделей Маркова, охватывающих многие семейства белков, The Pfam protein families database, A. Bateman, E. Birney, L. Cerruti, R. Durbin, L. Etwiller, S.R. Eddy, S. Griffiths- Jones, K.L. Howe, M. Marshall, and E.L.L. Sonnhammer, Nucleic Acids Research, 30(1):276-280, 2002) или ее эквивалент.
Изобретение относится к слитым N-концевым или C-концевым подпоследовательностям ферментов по изобретению (например, сигнальным последовательностям, препропоследовательностям) с другими полипептидами, активными белками или фрагментами белков. Получение фермента по изобретению (например, фермента фосфолипазы C) также можно проводить путем экспрессии фермента в качестве неактивного слитого белка, который впоследствии активируется протеолитическим расщеплением (с использованием активности либо эндогенной, либо экзогенной протеазы, например, трипсина), которое приводит к разделению партнера слитого белка и зрелого фермента, например, фермента фосфолипазы C. В одном аспекте слитый белок по изобретению экспрессируется из гибридной нуклеотидной конструкции, которая кодирует одну открытую рамку считывания, содержащую следующие элементы: нуклеотидная последовательность для слитого белка, линкерная последовательность (определяемая как нуклеотидная последовательность, которая кодирует гибкую аминокислотную последовательность, которая связывает два менее подвижных белковых домена), участок, распознаваемый протеазой для расщепления, и последовательность зрелого фермента (например, любой фермент по изобретению, например, фосфолипаза). В альтернативных аспектах, слитый белок может содержать последовательность пептатлиазы, последовательность ксиланазы, последовательность фосфатазы фосфатидной кислоты или другую последовательность, например, последовательность, для которой ранее было показано, что она экспрессируется в представляющей интерес хозяйской системе.
Можно использовать любую хозяйскую систему (см. обсуждение выше), например, любые бактерии, например, грамположительные бактерии, такие как Bacillus, или грамотрицательные бактерии, такие как E. coli, или любые дрожжи, например, Pichia pastoris. Расположение нуклеотидных последовательностей в химерной нуклеотидной конструкции можно определять, исходя из уровней экспрессии белка, достигаемых с помощью каждой слитой конструкции. В направлении от 5'-конца нуклеотидной конструкции к 3'-концу конструкции, в одном аспекте нуклеотидные последовательности собирают следующим образом: сигнальная последовательность/слитый белок/линкерная последовательность/участок расщепления, распознаваемый протеазой/ зрелый фермент (например, любой фермент по изобретению, например, фосфолипаза) или сигнальная последовательность/пропоследовательность/зрелый фермент/ линкерная последовательность/слитый белок. Экспрессия фермента (например, любого фермента по изобретению, например, фосфолипазы) в качестве неактивного слитого белка может увеличить общую экспрессию последовательности фермента, может снизить какую-либо потенциальную токсичность, ассоциированную со сверхпродукцией активного фермента и/или может увеличить срок годности фермента перед применением, поскольку фермент является неактивным до тех пор, пока слитый белок, например, пептатлиаза, не отделится от фермента, например, белка фосфолипазы.
В различных аспектах изобретение относится к специализированным составам для активации фосфолипазы по изобретению, экспрессируемой в качестве слитого белка. В одном аспекте активацию активности фосфолипазы, первоначально экспрессируемой в качестве неактивного слитого белка, осуществляют с использованием протеолитической активности или потенциально протеолитической активности в комбинации с N-концевой или С-концевой пептидазой. Эту активацию можно проводить различными путями и в различные моменты процесса производства/хранения перед применением в рафинировании масла. Иллюстративные способы по изобретению включают: расщепление с помощью эндогенной активной молекулы, экспрессируемой продуцирующим хозяином, при секреции слитой конструкции в ферментационную среду; расщепление с помощью активности эндогенной протеазы, которая активируется или приходит в контакт с внутриклеточно экспрессируемой слитой конструкции при разрушении клеток-хозяев; пропускание неочищенной или очищенной слитой конструкции через колонку с иммобилизованной активной протеазой для осуществления расщепления, и активацию фермента (например, фосфолипазы по изобретению, например, фосфолипазы C) перед включением фермента в состав; обработку неочищенной или очищенной слитой конструкции растворимым источником протеолитической активности; активацию фосфолипазы (например, фосфолипазы по изобретению, например, фосфолипазы C) на предприятии, осуществляющем рафинирование масла, с использованием либо растворимого, либо нерастворимого источника протеолитической активности непосредственно перед применением в процессе; и/или активацию активности фосфолипазы (например, фосфолипазы по изобретению, например, фосфолипазы C) путем непрерывной циркуляции состава слитой конструкции через колонку с иммобилизованной активной протеазой при пониженной температуре (например, любая температура приблизительно от 4°C до 20°C). Эту активацию можно проводить перед доставкой на предприятие для применения или ее можно проводить на рафиновочном предприятии.
Гликозилирование
Пептиды и полипептиды по изобретению (например, гидролазаы, антитела) также могут быть гликозилированными, например, в одном аспекте, содержащими по меньшей мере один участок гликозилирования, например, N-связанного или O-связанного гликозилирования. В одном аспекте полипептид может быть гликозилирован после экспрессии в P. pastoris или S. pombe. Гликозилирование можно быть добавлено посттрансляционно либо химически, либо с помощью клеточных биосинтетических механизмов, где последние из них включают использование известных мотивов гликозилирования, которые могут быть нативными для последовательности или могут быть добавлены в качестве пептида или добавлены в нуклеиновую кислоту, кодирующую последовательность.
Анализы активности фосфолипазы
Изобретение относится к выделенным, синтетическим или рекомбинантным полипептидам (например, ферментам, антителам), обладающим активностью фосфолипазы или любой комбинацией видов активности фосфолипазы, и к нуклеиновым кислотам, кодирующим их. Для определения того, обладает ли полипептид активностью фосфолипазы, можно использовать любые из множества анализов активности фосфолипазы, известных в данной области, и они входят в объем изобретения. Общепринятые протоколы определения активности фосфолипазы A, B, D и C, пататина и ацилгидролазы липидов или активности липазы, хорошо известны в данной области.
Иллюстративные анализы активности включают анализы мутности, анализы (флуоресцентные) с метилумбеллиферил-фосфохолином, анализы (флуоресцентные) с фосфолипаой Amplex red, анализы способом тонкослойной хроматографии (TLC), цитолитические анализы и анализы с п-нитрофенилфосфорилхолином. С использованием этих анализов полипептиды, пептиды или антитела можно быстро подвергать скринингу в отношении активности фосфолипазы.
Активность фосфолипазы может включать активность ацилгидролазы липидов (LAH). См., например, Jimenez (2001) Lipids 36: 1169-1174, где описан анализ смешанных мицелл на основе монододецил-простого эфира октаэтиленгликоля для определения активности ацилгидролазы липидов у пататина. В Pinsirodom (2000) J. Agric. Food Chem. 48: 155-160, описана иллюстративная активность ацилгидролазы липидов (LAH) у пататина.
Анализы мутности для определения активности фосфолипазы. описаны, например, в Kauffmann (2001) "Conversion of Bacillus thermocatenulatus lipase into an efficient phospholipase with increased activity towards long-chain fatty acyl substrates by directed evolution and rational design", Protein Engineering 14:919-928; Ibrahim (1995) "Evidence implicating phospholipase as a virulence factor of Candida albicans", Infect. Immun. 63: 1993-1998.
Анализы (флуоресцентные) с метилумбеллиферил-фосфохолином для определения активности фосфолипазы описаны, например, в Goode (1997) "Evidence for cell surface and internal phospholipase activity in ascidian eggs", Develop. Growth Differ. 39:655-660; Diaz (1999) "Direct fluorescence-based lipase activity assay", BioTechniques 27:696-700.
Анализы фосфолипазы (флуоресцентные) Amplex Red для определения активности фосфолипазы доступны с помощью наборов, например, детекция фосфатидилхолин-специфической фосфолипазы с использованием набора для анализа фосфатидилхолин-специфической фосфолипазы с Amplex Red от Molecular Probes Inc. (Eugene, OR), согласно инструкциям изготовителя. Флуоресценцию измеряют на флуоресцентном устройстве для считывания микропланшетов с использованием возбуждения при 560±10 нм и детекции флуоресценции при 590±10 нм. Анализ является чувствительным при очень низких концентрациях фермента.
Анализы способом тонкослойной хроматографии (TLC) для определения активности фосфолипазы описаны, например, в Reynolds (1991) Methods in Enzymol. 197:3-13; Taguchi (1975) "Phospholipase from Clostridium novyi type A.I", Biochim. Biophys. Acta 409:75-85. Тонкослойная хроматография (TLC) представляет собой широко используемый способ для детекции активности фосфолипазы. Различные модификации этого способа используют для экстракции фосфолипидов из водных анализируемых смесей. В некоторых анализах PLC гидролиз останавливают добавлением смеси хлороформ/метанол (2:1) к реакционной смеси. Не вступивший в реакцию исходный материал и диацилглицерин экстрагируют в органическую фазу и его можно фракционировать с помощью TLC, в то время как коневая группа остается в водной фазе. Для более точного измерения расщепления фосфолипидов можно использовать радиоактивно меченные субстраты (см., например, Reynolds (1991) Methods in Enzymol. 197:3-13). Соотношения продуктов и реактантов можно использовать для вычисления истинного количества моль субстрата, гидролизуемого в единицу времени. Если все компоненты экстрагируются в равной степени, любые потери при экстракции влияют на все компоненты в равной степени. Отделения продуктов расщепления фосфолипидов можно проводить с помощью TLC на силикагеле со смесью хлороформ/метанол/вода (65:25:4), используемой в качестве системы растворителей (см., например, Taguchi (1975) Biochim. Biophys. Acta 409:75-85).
Анализы с п-нитрофенилфосфорилхолином для определения активности фосфолипазы описаны, например, в Korbsrisate (1999) J. Clin. Microbiol. 37:3742-3745; Berka (1981) Infect. Immun. 34: 1071-1074. Этот анализ основан на ферментативном гидролизе аналога субстрата п-нитрофенилфосфорилхолина с высвобождением желтого хромогенного соединения п-нитрофенола, поддающегося детекции при 405 нм. Этот субстрат удобен для высокопроизводительного скрининга.
Цитолитический анализ может осуществлять детекцию фосфолипаз с цитолитической активностью на основе лизиса эритроцитов. Токсические фосфолипазы могут взаимодействовать с мембранами эукариотических клеток и гидролизовать фосфатидилхолин и сфингомиелин, вызывая лизис клеток. См., например, Titball (1993) Microbiol. Rev. 57:347-366.
Гибридные (химерные) фосфолипазы и библиотеки пептидов
В одном аспекте изобретение относится к гибридным фосфолипазам и слитым белкам, включая пептидные библиотеки, содержащие последовательности по изобретению. Пептидные библиотеки по изобретению можно использовать для выделения модуляторов (например, активаторов или ингибиторов) пептидов-мишеней, таких как субстраты фосфолипазы, рецепторы, ферменты и т.д. Пептидные библиотеки по изобретению можно использовать для идентификации соответствующих партнеров для связывания мишеней, таких как лиганды, например, цитокины, гормоны и т.п.
В одном аспекте изобретение относится к гибридным фосфолипазам и слитым белкам, включающим пептидные библиотеки, содержащие последовательности по изобретению. Пептидные библиотеки по изобретению можно использовать для выделения пептидных модуляторов (например, активаторов или ингибиторов) мишеней, таких как субстраты фосфолипазы, рецепторы, ферменты. Пептидные библиотеки по изобретению можно использовать для идентификации формальных связывающих партнеров мишеней, таких как лиганды, например, цитокины, гормоны и т.п. В одном аспекте изобретение относится к химерным белкам, содержащим сигнальную последовательность (SP) и/или каталитический домен (CD) по изобретению и гетерологичную последовательность (см. выше).
Также изобретение относится к способам получения "усовершенствованных" и гибридных фосфолипаз с использованием нуклеиновых кислот и полипептидов по изобретению. Например, изобретение относится к способам получения ферментов, которые обладают активностью, например, активностью фосфолипазы (например, такой как активность фосфолипазы A, B, C или D, эстеразная активность пататина, расщепление глицеринфосфатной сложноэфирной связи, расщепление сложноэфирной связи в фосфолипиде в растительном масле) при крайних щелочных pH и/или кислотных pH, высоких и низких температурах, осмотических условиях и т.п. Изобретение относится к способам получения гибридных ферментов (например, гибридных фосфолипаз).
В одном аспекте способами по изобретению продуцируются новые гибридные полипептиды с использованием клеточных процессов, которые встраивают последовательность первого полинуклеотида, так чтобы полученные гибридные полинуклеотиды кодировали полипептиды, демонстрирующие активность, происходящую из первых биологически активных полипептидов. Например, первые полинуклеотиды могут представлять собой иллюстративную последовательность нуклеиновой кислоты, кодирующую иллюстративную фосфолипазу по изобретению. Первая нуклеиновая кислота может кодировать фермент из одного организма, который эффективно функционирует в конкретных окружающих условиях, например, при высоком содержании соли. Она может быть "встроена" с помощью фермента, кодируемого вторым полинуклеотидом из отличающегося организма, который функционирует эффективно в других окружающих условиях, таких как крайне высокие температуры, например, когда две нуклеиновые кислоты могут продуцировать гибридную молекулу, например, путем рекомбинации и/или редуктивной перестройки. Гибридный полинуклеотид, содержащий последовательности из первого и второго исходных полинуклеотидов, может кодировать фермент, который обладает характеристиками обоих ферментов, кодируемых исходными полинуклеотидами. Таким образом, фермент, кодируемый гибридным полинуклеотидом, может эффективно функционировать в условиях окружающей среды, общих для каждого из ферментов кодируемых первым и вторым полинуклеотидами, например, при высоком процентном содержании соли и предельных температурах.
Альтернативно, гибридный полипептид, полученный этим способом по изобретению, может проявлять специализированную ферментативную активность, не проявляемую исходными ферментами. Например, после рекомбинации и/или редуктивной перестройки полинуклеотидов, определяющих виды активности фосфолипазы, можно проводить скрининг полученного гибридного полипептида, кодируемого гибридным полинуклеотидом, в отношении специализированных видов активности, полученных из каждого из исходных ферментов, т.е. в отношении типа связи, на которую действует фосфолипаза, и температуры, при которой фосфолипаза функционирует. Таким образом, например, можно проводить скрининг фосфолипазы для определения тех химических функциональных свойств, которые отличают гибридную фосфолипазу от исходных фосфолипаз, таких как: (a) амидные (пептидные) связи, т.е. фосфолипазы; (b) сложноэфирные связи, т.е. фосфолипазы и липазы; (c) ацетали, т.е. гликозидазы и, например, температуры, pH или концентрации соли, при которых функционирует гибридный полипептид.
Источники полинуклеотидов, предназначенных для "объединения" с нуклеиновыми кислотами по изобретению, могут быть выделены из отдельных организмов ("изолятов"), коллекций организмов, которые были выращены на определенных средах ("обогащенные культуры"), или некультивированных организмов ("образцы из окружающей среды"). Использование независимого от культивирования подхода для получения полинуклеотидов, кодирующих новые виды биологической активности из образцов из окружающей среды, является наиболее предпочтительным, поскольку оно обеспечивает доступ к неизмененным источникам биологического разнообразия. "Библиотеки окружающей среды" получают из образцов из окружающей среды и представляют собой совокупные геномы природных организмов, сохраненные в клонирующих векторах, которые могут быть воспроизведены в подходящих прокариотических хозяевах. Вследствие того, что клонированную ДНК исходно выделяют непосредственно из образцов из окружающей среды, библиотеки не ограничиваются небольшой фракцией прокариот, которые могут быть выращены в монокультуре. Кроме того, упорядочивание ДНК из окружающей среды, представленной в этих образцах, может обеспечить более единообразную репрезентацию ДНК из всех видов, представленных в исходном образце. Это может привести к резкому повышению эффективности поиска представляющих интерес генов из менее представленных компонентов образца, который на несколько порядков значимости может быть более редко встречающимся по сравнению с доминантными видами.
Например, библиотеки генов, полученные из одного или нескольких некультивированных микроорганизмов, анализируют в отношении представляющей интерес активности. Потенциальные пути, кодирующие представляющие интерес биологически активные молекулы, сначала переносят в прокариотические клетки в форме библиотек для экспрессии генов. Полинуклеотиды, определяющие представляющие интерес виды активности, выделяют из библиотек и вводят в клетку-хозяина. Клетку-хозяина выращивают в условиях, которые обеспечивают рекомбинацию и/или редуктивную перестройку, с получением потенциально активных биологических молекул с новыми или усиленными видами активности.
Микроорганизмы, из которых могут быть получены гибридные полинуклеотиды, включают прокариотические микроорганизмы, такие как Eubacteria и Archaebacteria, и низшие эукариотические микроорганизмы, такие как грибы, некоторые водоросли и простейшие. Полинуклеотиды можно выделять из образцов из окружающей среды. Нуклеиновую кислоту можно выделять без культивирования организма или ее можно выделять из одного или нескольких культивированных организмов. В одном аспекте такие микроорганизмы могут быть экстремофилами, такими как гипертермофилы, психрофилы, психротрофы, галофилы, барофилы и ацидофилы. В одном аспекте для получения гибридных ферментов могут быть использованы полинуклеотиды, кодирующие ферменты фосфолипазы, выделенные из экстремофильных микроорганизмов. Такие ферменты могут функционировать при температурах свыше 100°С, например, в горячих источниках на суше и в термических кратерах на больших глубинах при температурах ниже 0°С, например, в арктических водах, в окружающей среде Мертвого моря, насыщенной солью, при значениях рН приблизительно 0, например, в месторождениях угля и геотермических богатых серой источниках, или при значениях рН свыше 11, например, в осадках сточных вод. Например, фосфолипазы, клонированные и экспрессированные из экстремофильных организмов, могут проявлять высокую активность в широком диапазоне температур и рН.
Полинуклеотиды, выбранные и выделенные, как описано в настоящем документе, включая по меньшей мере одну нуклеиновую кислоту по изобретению, вводят в подходящую клетку-хозяина. Подходящая клетка-хозяин представляет собой любую клетку, способную обеспечивать рекомбинацию и/или редуктивную перестройку. Выбранные полинуклеотиды могут находиться в векторе, который включает соответствующие последовательности контроля. Клетка-хозяин может представлять собой клетку высших эукариот, такую как клетка млекопитающих, или клетку низших эукариот, такую как клетка дрожжей, или предпочтительно клетка-хозяин может представлять собой прокариотическую клетку, такую как бактериальная клетка. Введение конструкции в клетку-хозяина можно обеспечивать трансфекцией с фосфатом кальция, трансфекцией, опосредуемой DEAE-декстраном, или электропорацией (Davis et al., 1986).
Иллюстративными подходящими хозяевами могут быть любые из клеток-хозяев, известных специалистам в данной области, включая прокариотические клетки, эукариотические клетки, такие как клетки бактерий, клетки грибов, клетки дрожжей, клетки млекопитающих, клетки насекомых или клетки растений. Иллюстративные клетки бактерий включают любые виды родов Escherichia, Bacillus, Streptomyces, Salmonella, Pseudomonas и Staphylococcus, включая, например, Escherichia coli, Lactococcus lactis, Bacillus subtilis, Bacillus cereus, Salmonella typhimurium, Pseudomonas fluorescens. Иллюстративные клетки грибов включают любые виды Aspergillus. Иллюстративные клетки дрожжей включают любые виды Pichia, Saccharomyces, Schizosaccharomyces или Schwanniomyces, включая Pichia pastoris, Saccharomyces cerevisiae или Schizosaccharomyces pombe. Иллюстративные клетки насекомых включают любые виды Spodoptera или Drosophila, включая Drosophila S2 и Spodoptera Sf9. Иллюстративные клетки животных включают клетки CHO, COS или меланомы Bowes или любую клеточную линию мыши или человека. Выбор соответствующего хозяина находится в пределах квалификации специалистов в данной области. Предполагается, что селекция соответствующего хозяина для рекомбинации и/или редуктивной перестройки или только для экспрессии рекомбинантного белка находится в пределах квалификации специалистов в данной области, исходя из указаний, приведенных в настоящем документе. Системы клеточных культур млекопитающих, которые можно использовать для рекомбинации и/или редуктивной перестройки или только для экспрессии рекомбинантного белка включают, например, линии фибробластов почки обезьяны COS-7, описанные в "SV40-transformed simian cells support the replication of early SV40 mutants" (Gluzman, 1981), C127, 3Т3, СНО, HeLa и BHK. Экспрессирующие векторы млекопитающих должны содержать ориджин репликации, подходящий промотор и энхансер, а также любые необходимые участки связывания рибосом, участки полиаденилирования, доноры сплайсированного фрагмента и акцепторные участки, последовательности терминации транскрипции и фланкирующие 5'-конец нетранскрибируемые последовательности. Для получения требуемых нетранскрибируемых генетических элементов можно использовать последовательности ДНК, полученные из участков сплайсинга и полиаденилирования SV40.
Клетки-хозяева, содержащие представляющие интерес полинуклеотиды (для рекомбинации и/или редуктивной перестройки или только для экспрессии рекомбинантного белка) можно культивировать в общепринятых питательных средах, модифицированных соответствующим образом для активации промоторов, селекции трансформантов или амплификации генов. Условия культивирования, такие как температура, pH и т.п., представляют собой условия, ранее использованные для клетки-хозяина, выбранной для экспрессии, и они будут понятны специалисту в данной области. Затем клоны, которые идентифицированы как обладающие специфической ферментативной активностью можно секвенировать для идентификации полинуклеотидной последовательности, кодирующей фермент, обладающий увеличенной активностью.
В другом аспекте нуклеиновые кислоты и способы по настоящему изобретению можно использовать для получения новых полинуклеотидов для биохимических каскадов, например, каскадов из одного или нескольких оперонов или кластеров генов или их фрагментов. Например, бактерии и множество эукариот обладают координированным механизмом регуляции генов, продукты которых вовлечены в сходные процессы. Гены образуют группы в структурах, называемых "кластерами генов", на одной хромосоме и транскрибируются вместе под контролем единой регуляторной последовательности, включая единый промотор, который инициирует транскрипцию целого кластера. Таким образом, кластер генов представляет собой группу соседних генов, которые, как правило, либо идентичны, либо являются родственными в отношении их функции.
ДНК кластера генов можно выделять из различных организмов и лигировать в векторы, в частности, в векторы, содержащие регуляторные последовательности для экспрессии, которые могут контролировать и регулировать продукцию детектируемого белка или совокупную активность, связанную с белком, в лигированном кластере генов. Использование векторов, которые обладают исключительно высокой способностью к встраиванию экзогенной ДНК, является особенно подходящим для таких кластеров генов и описано в данном описании в качестве примера, включая f-фактор (или фактор фертильности) Е. coli. f-Фактор Е. coli представляет собой плазмиду, которая инициирует самоперенос с высокой частотой в процессе конъюгации и является идеальной для получения и стабильного воспроизведения крупных фрагментов ДНК, таких как кластеры генов из смешанных микробных образцов. В качестве векторов для клонирования можно использовать "фосмиды", космиды или векторов с искусственной бактериальной хромосомой (ВАС). Их получают из f-фактора Е. coli, который способен стабильно встраивать большие сегменты геномной ДНК. В случае интеграции с ДНК из смешанного некультивированного образца из окружающей среды, это делает возможным получать большие геномные фрагменты в форме "ДНК библиотеки из окружающей среды". Космидные векторы изначально были разработаны для клонирования и воспроизведения крупных сегментов геномной ДНК. Клонирование в космидные векторы подробно описано Sambrook et al., в Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press (1989). После лигирования в соответствующий вектор два или более векторов, содержащих различные гены синтетазы поликетида, могут быть введены в подходящую клетку-хозяина. Участки частичной гомологии последовательностей, общие для кластеров генов, будут промотировать процессы, которые приведут к реорганизации последовательностей, приводящей к гибридному кластеру генов. Может быть проведен скрининг нового гибридного кластера генов на наличие усиленной активности, не обнаруживаемой в исходных кластерах генов.
Таким образом, в одном аспекте изобретение относится к способу получения биологически активного гибридного полипептида с использованием нуклеиновой кислоты по изобретению и к скринингу такого полипептида на наличие активности (например, усиленной активности) посредством:
1) введения в подходящую клетку-хозяина по меньшей мере первого функционально связанного полинуклеотида (например, нуклеиновой кислоты по изобретению) и второго функционально связанного полинуклеотида, где по меньшей мере первый полинуклеотид и второй полинуклеотид имеют по меньшей мере один общий участок частичной гомологии последовательностей;
2) выращивания клетки-хозяина в условиях, которые обеспечивают реорганизацию последовательностей, приводящую к функционально связанному гибридному полинуклеотиду;
3) экспрессии гибридного полипептида, кодируемого гибридным полинуклеотидом;
4) скрининга гибридного полипептида в условиях, которые обеспечивают идентификацию желаемой биологической активности (например, усиленной биологической активности); и
5) выделения полинуклеотида, кодирующего гибридный полипептид.
Методы анализа на наличие различных видов ферментативной активности известны специалистам в данной области и описаны в настоящем описании. Такие способы можно использовать при выделении полипептидов иполинуклеотидов по изобретению.
Перестройка in vivo может быть направлена на "межмолекулярный" процесс, в совокупности называемый "рекомбинацией". В бактериях она, как правило, рассматривается как "RecA-зависимый" феномен. Изобретение может основываться на процессе рекомбинации в клетке-хозяине для рекомбинации и перестройки последовательностей или способности клеток обеспечивать редуктивные процессы для снижения комплексности псевдоповторяющихся последовательностей в клетке посредством делеции. Этот процесс "редуктивной перестройки" осуществляется посредством "внутримолекулярного", RecA-независимого процесса. Таким образом, в одном аспекте изобретения новые полинуклеотиды можно получать способом редуктивной перестройки. Способ включает получение конструкций, содержащих последовательности (исходные кодирующие последовательности), их вставку в соответствующий вектор и их последующее введение в соответствующую клетку-хозяина. Перестройка отдельных молекулярных элементов происходит посредством комбинаторных процессов между последовательностями в конструкции, обладающей участками гомологии, или между псевдоповторяющимися единицами. В ходе перестройки происходит рекомбинация и/или снижение комплексности и протяженности повторяющихся последовательностей, и она приводит к получению новых молекулярных образцов.
Для повышения скорости перестройки можно использовать различные способы обработки. Они могут включать обработку ультрафиолетовым светом или повреждающими ДНК химическими веществами, и/или использование линий клеток-хозяев, проявляющих повышенный уровень "генетической нестабильности". Таким образом, способ рекомбинации может включать гомологичную рекомбинацию или природное свойство псевдоповторяющихся последовательностей направлять свои собственные изменения.
Повторяющиеся или "псевдоповторяющиеся" последовательности участвуют в генетической нестабильности. "Псевдоповторы" представляют собой повторы, которые не ограничиваются их структурой оригинальной единицы. Псевдоповторяющиеся единицы могут быть представлены в виде набора последовательностей в конструкции; последовательно расположенных единиц сходных последовательностей. После лигирования соединения между последовательностями становятся, по существу, незаметными, и псевдоповторяющаяся природа конечной конструкции становится постоянной на молекулярном уровне. Делеция в клетке происходит для снижения комплексности полученной конструкции посредством взаимодействий между псевдоповторяющимися последовательностями. Псевдоповторяющиеся единицы обеспечивают практически безграничный набор матриц, с помощью которых могут происходить случаи переноса. Конструкции, содержащие псевдоповторы, таким образом, эффективно обеспечивают достаточную молекулярную гибкость, чтобы случаи делеций (и, возможно, вставок) могли происходить, по существу, в любом месте в пределах псевдоповторяющихся единиц. В случае если все псевдоповторяющиеся последовательности лигированы в одинаковой ориентации, например, голова к хвосту или наоборот, клетка не может различить отдельные единицы. Следовательно, редуктивный процесс может произойти по всей последовательности. Напротив, если, например, единицы представлены в ориентации голова к голове, в большей степени чем голова к хвосту, инверсия определяет конечную точку соседней единицы, так что формирование делеций способствует потере отдельных единиц. Таким образом, для настоящего способа предпочтительно, чтобы последовательности находились в одинаковой ориентации. Случайная ориентация псевдоповторяющихся последовательностей приведет к потере эффективности рекомбинации, в то время как постоянная ориентация последовательностей обеспечит наибольшую эффективность. Однако несмотря на то что наличие непрерывных последовательностей в одинаковой ориентации снижает эффективность, оно, тем не менее, может обеспечить достаточную гибкость для эффективного получения новых молекул. Могут быть получены конструкции с псевдоповторяющимися последовательностями в одинаковой ориентации для обеспечения более высокой эффективности.
Последовательности могут быть собраны в ориентации голова к хвосту с использованием любого из различных способов, включая следующие: a) можно использовать праймеры, которые включают поли-А-головной конец и поли-Т-хвост, которые, в случае если получены одноцепочечными, будут обеспечивать ориентацию; это дополняется наличием первых нескольких оснований в праймерах, полученных из РНК и, таким образом, они легко удаляются РНКазой Н; b) можно использовать праймеры, которые включают уникальные участки для расщепления рестриктазами; могут потребоваться множественные участки, ряд уникальных последовательностей и повторяющиеся стадии синтеза и лигирования; c) внутренние несколько оснований праймера можно тиолировать и можно использовать экзонуклеазу для получения молекул с правильными хвостами.
Выделение повторно собранных последовательностей основано на идентификации клонирующих векторов с уменьшенным индексом повторов (RI). Повторно собранные кодирующие последовательности затем можно выделять посредством амплификации. Продукты повторно клонируют и экспрессируют. Выделение клонирующих векторов со сниженным RI может быть достигнуто: 1) использованием векторов только стабильно поддерживаемых в случае, если в конструкции снижена комплексность; 2) физическим получением укороченных векторов физическими методами; в этом случае может быть получен клонирующий вектор с использованием стандартных способов выделения плазмид и разделения по размеру либо в агарозном геле, либо на колонке с низкомолекулярным порогом с использованием стандартных методик; 3) получением векторов, содержащих разделенные гены, которые могут быть отобраны при уменьшении размера вставки; 4) использованием технологий направленной селекции с экспрессирующим вектором и соответствующей селекцией.
Кодирующие последовательности (например, гены) из родственных организмов могут демонстрировать высокую степень гомологии и кодировать совершенно разные белковые продукты. Эти типы последовательностей особенно полезны в настоящем изобретении в качестве псевдоповторов. Однако этот способ не ограничивается такими практически идентичными повторами.
Следующий пример демонстрирует способ по изобретению. Описаны кодирующие последовательности нуклеиновых кислот (псевдоповторы), полученные из трех (3) уникальных образцов. Каждая последовательность кодирует белок с различным набором свойств. Каждая из последовательностей отличается единственной или несколькими парами оснований в определенном положении в последовательности. Псевдоповторяющиеся последовательности отдельно или совместно амплифицируют и лигируют в случайные объединенные последовательности, так чтобы в группе лигируемых молекул были возможны различные перестановки и комбинации. Количества псевдоповторяющихся единиц может контролироваться условиями сборки. Среднее количество псевдоповторяющихся единиц в конструкции определяют как индекс повторов (RI). После формирования конструкции могут быть или не могут быть разделены по размеру в агарозном геле в соответствии с опубликованными протоколами, встроены в клонирующий вектор и трансфецированы в соответствующую клетку-хозяина. Затем клетки размножаются и происходит "редуктивная перестройка". Если желательно, скорость редуктивной перестройки можно увеличивать путем внесения повреждений в ДНК. Является ли снижение RI опосредованным образованием делеции между повторяющимися последовательностями по "внутримолекулярному" механизму или оно опосредуется случаями, подобными рекомбинации по "межмолекулярным" механизмам, несущественно. Конечным результатом является перестройка молекул во всех возможных комбинациях. В одном аспекте способ необязательно включает дополнительную стадию скрининга членов библиотеки из перестроенной группы для идентификации индивидуальных перестроенных членов библиотеки, обладающих способностью связываться или иначе взаимодействовать, или катализировать конкретную реакцию (например, таких как каталитические домены фермента) с предопределенной макромолекулой, такой как, например, белковый рецептор, олигосахарид, вирион или другое предопределенное соединение или структура. Полипептиды, например, фосфолипазы, которые идентифицируют с помощью таких библиотек, можно использовать для различных целей, например, в промышленных способах, описанных в настоящем документе, и/или можно подвергать одному или нескольким дополнительным циклам шаффлинга и/или селекции.
В другом аспекте предусматривается, что перед или в ходе рекомбинации или перестройки, полинуклеотиды, полученные способом по изобретению, можно подвергать воздействию средств или способов, которые обеспечивают внесение мутаций в исходные полинуклеотиды. Внесение таких мутаций может повышать разнообразие конечных гибридных полинуклеотидов и полипептидов, кодируемых ими. Средства или способы, которые обеспечивают мутагенез, могут включать, но не ограничиваться ими: (+)-СС-1065 или синтетический аналог, такой как (+)-СС-1065-(N3-аденин) (см. Sun and Hurley, (1992)); N-ацетилированный или деацетилированный 4'-фтор-4-аминобифенильный аддукт, способный ингибировать синтез ДНК (см., например, van de Poll et al. (1992)); или N-ацетилированный или деацетилированный 4-аминобифенильный аддукт, способный ингибировать синтез ДНК (см. также van de Poll et al. (1992), p. 751-758); трехвалентный хром, трехвалентную соль хрома, ДНК-аддукты на основе полициклических ароматических углеводородов (РАН), способные ингибировать репликацию ДНК, такие как 7-бромметилбенз[а]антрацен ("ВМА"), трис(2,3-дибромпропил)фосфат ("Tris-BP"), 1,2-дибром-3-хлорпропан ("DBCP"), 2-бромакролеин (2ВА), бензо[а]пирен-7,8-дигидродиол-9-10-эпоксид ("BPDE"), галогеновая соль платины(II), N-гидрокси-2-амино-3-метилимидазо[4,5-f]хинолин ("N-гидрокси-IQ") и N-гидрокси-2-амино-1-метил-6-фенилимидазо[4,5-f]пиридин ("N-гидрокси-PhIP"). Иллюстративные способы замедления или остановки амплификации ПЦР включают УФ-свет, (+)-СС-1065 и (+)-СС-1065-(N3-аденин). В частности, включенные средства представляют собой ДНК-аддукты или полинуклеотиды, содержащие ДНК-аддукты из полинуклеотидов или группы полинуклеотидов, которые могут быть удалены методом, включающим нагревание раствора, содержащего полинуклеотиды, перед дальнейшей обработкой.
Способы скрининга и устройство для исследования "on-line"
В осуществлении на практике способов по изобретению могут быть использованы различные устройства и способы в отношении полипептидов и нуклеиновых кислот по изобретению, например, для скрининга полипептидов в отношении активности фосфолипазы, для скрининга соединений в качестве потенциальных модуляторов активности (например, усиление или ингибирование активности фермента), для антител, которые связываются с полипептидом по изобретению, для нуклеиновых кислот, которые гибридизуются с нуклеиновой кислотой по изобретению и т.п.
Твердые подложки с иммобилизованным ферментом
Ферменты фосфолипазы, их фрагменты и нуклеиновые кислоты, которые кодируют ферменты и фрагменты, можно прикреплять к твердой подложке. Это часто является экономичным и эффективным при применении фосфолипаз в промышленных процессах. Например, a набор или коктейль ферментов фосфолипаз (или их активных фрагментов), которые используют в конкретной химической реакции, можно связывать с твердой подложкой и окунать в бак для переработки. Может происходить ферментативная реакция. Затем твердую подложку можно извлекать из бака вместе с ферментами, прикрепленными к ней, для повторного применения. В одном варианте осуществления изобретения с твердой подложкой связывается выделенная нуклеиновая кислота по изобретению. В другом варианте осуществления изобретения твердая подложка выбрана из группы из геля, смолы, полимера, керамики, стекла, микроэлектрода и любой их комбинации.
Например, твердые подложки, пригодные для этого изобретения, включают гели. Некоторые примеры гелей включают Sepharose, желатин, глутаральдегид, обработанный хитозаном глутаральдегид, альбумин-глутаральдегид, хитозан-ксантан, гель Toyopearl (полимерный гель), альгинат, альгинат-полилизин, каррагенан, агарозу, глиоксилагарозу, магнитную агарозу, декстран-агарозу, поли(карбамоилсульфонатный) гидрогель, BSA-PEG гидрогель, фосфорилированный поливиниловый спирт (PVA), моноаминоэтил-N-аминоэтил (MANA) амин или любую их комбинацию.
Другие твердые подложки, пригодные для настоящего изобретения, представляют собой смолы или полимеры. Некоторые примеры смол или полимеров включают целлюлозу, акриламид, нейлон, вискозу, полиэфир, анионообменную смолу, AMBERLITETM XAD-7, AMBERLITETM XAD-8, AMBERLITETM IRA-94, AMBERLITETM IRC-50, поливинил, полиакриловый полиметакрилат, или любую их комбинацию.
Другим типом твердой подложки, пригодным в настоящем изобретении, является керамика. Некоторые примеры включают непористую керамику, пористую керамику, SiO2, Al2O3. Другим типом твердой подложки, пригодным для настоящего изобретения, является стекло. Некоторые примеры включают непористое стекло, пористое стекло, аминопропиловое стекло или любую их комбинацию. Другим типом твердой подложки, который можно использовать, является микроэлектрод. Примером является покрытый полиэтиленимином магнетит. В качестве твердой подложки можно использовать графитовые частицы.
Другие иллюстративные твердые подложки, используемые для осуществления изобретения на практике, включают продукты на основе диатомитовой земли и силикаты. Некоторые примеры включают диатомиты CELITE®, KENITE®, DIACTIV®, PRIMISIL®, DIAFIL®, и синтетические силикаты кальция и магния MICRO-CEL®, CALFLO®, SILASORBTM и CELKATE®. Другим примером твердой подложки является клетка, такая как эритроцит.
Способы иммобилизации
Существует множество способов, которые могут быть известны специалисту в данной области, для иммобилизации ферментов или фрагментов, или нуклеиновых кислот, на твердую подложку. Некоторые примеры таких способов включают, например, электростатическое формирование капель, электромеханические способы, путем адсорбции, путем ковалентного присоединения, путем перекрестного сшивания, путем химической реакции или процесса, путем инкапсулирования, путем окружения, с помощью альгината кальция или с помощью поли(2-гидроксиэтилметакрилата). Подобные способы описаны в Methods in Enzymology, Immobilized Enzymes and Cells, Part C. 1987. Academic Press. Edited by S. P. Colowick and O. Kaplan. Volume 136; и Immobilization of Enzymes and Cells. 1997. Humana Press. Edited by G. F. Bickerstaff. Series: Methods in Biotechnology, Edited by J. M. Walker.
Капиллярные матрицы
В способах по изобретению можно использовать капиллярные матрицы, такие как GIGAMATRIXTM, Diversa Corporation, San Diego, CA. Нуклеиновые кислоты или полипептиды по изобретению можно имммобилизовывать или наносить на матрицу, в том числе на капиллярную матрицу. Матрицы можно использовать для скрининга или исследования библиотек композиций (например, низкомолекулярных соединений, антител, нуклеиновых кислот и т.д.) в отношении их способности связываться с нуклеиновой кислотой или полипептидом по изобретению или модулировать их активность. Капиллярные матрицы относятся к другой системе для хранения и скрининга образцов. Например, устройство для скрининга образцов может включать множество капилляров, составляющих матрицу из смежных капилляров, где каждый капилляр содержит по меньшей мере одну стенку, определяющую просвет для хранения образца. Кроме того, устройство может включать промежуточный материал, расположенный между соседними капиллярами в матрице, и одну или несколько эталонных шкал в промежуточном материале. Капилляр для скрининга образца, где капилляр адаптирован для того, чтобы быть связанным в матрице капилляров, может включать первую стенку, определяющую просвет для удержания образца, и вторую стенку, образованную из фильтрующего материала, для фильтрации энергии возбуждения, передаваемой в просвет для возбуждения образца.
Полипептид или нуклеиновая кислота, например, лиганд, можно вводить в первом компоненте по меньшей мере в одну часть капилляра капиллярной матрицы. Каждый капилляр капиллярной матрицы может содержать по меньшей мере одну стенку, определяющую просвет для хранения первого компонента. После первого компонента в капилляр могут подаваться пузырьки воздуха. В капилляр можно подавать второй компонент, где второй компонент отделен от первого компонента пузырьком воздуха. Представляющий интерес образец можно подавать в качестве первой жидкости, меченной поддающимися детекции частицами, в капилляр капиллярной матрицы, где каждый капилляр капиллярной матрицы содержит по меньшей мере одну стенку, определяющую просвет для хранения первой жидкости и поддающихся детекции частиц, и где по меньшей мере одна стенка покрыта связывающим материалом для связывания поддающейся детекции частицы по меньшей мере с одной стенкой. Кроме того, способ может включать удаление первой жидкости из капиллярной трубки, где связанные поддающиеся детекции частицы остаются в капилляре, и подачу второй жидкости в капиллярную трубку.
Капиллярная матрица может включать множество отдельных капилляров, содержащих по меньшей мере одну стенку, определяющую просвет. Внешняя стенка капилляра может представлять собой одну или несколько стенок, сплавленных вместе. Аналогично, стенка может определять просвет цилиндрической, квадратной, шестиугольной или любой другой геометрической формы, при условии, что стенки формируют просвет для хранения жидкости или образца. Капилляры капиллярной матрицы могут находиться вместе в непосредственной близости с формированием плоскостной структуры. Капилляры могут быть связаны друг с другом, посредством сплавления (например, если капилляры изготовлены из стекла), склеивания, связывания или они могут быть скрепленными стенка к стенке. Капиллярная матрица может быть образована любым количеством отдельных капилляров, например, в диапазоне от 100 до 4000000 капилляров. Капиллярная матрица может формировать микропланшет для титрования, имеющий приблизительно 100000 или более отдельных капилляров, связанных вместе.
Матрицы или "биочипы"
Нуклеиновые кислоты или полипептиды по изобретению могут быть иммобилизованы или нанесены на матрицу. Матрицы можно использовать для скрининга или анализа библиотек композиций (например, низкомолекулярных соединений, антител, нуклеиновых кислот и т.д.) в отношении их способности связываться с нуклеиновой кислотой или полипептидом по изобретению или модулировать их активность. Например, в одном аспекте данного изобретения анализируемым параметром является экспрессия транскрипта гена фосфолипазы. Один или несколько, или все транскрипты клетки можно определять гибридизацией образца, содержащего транскрипты клетки, или нуклеиновые кислоты, репрезентативные или комплементарные транскриптам клетки, гибридизацией с иммобилизованными нуклеиновыми кислотами на матрице, или "биочипе". С использованием "матрицы" нуклеиновых кислот на микрочипе некоторые или все транскрипты клетки могут быть одновременно определены количественно. Альтернативно, можно использовать матрицы, содержащие геномные нуклеиновые кислоты, для определения генотипа вновь полученного способами инженерии штамма, полученного способами по изобретению. Также для одновременного количественного определения множества белков можно использовать "полипептидные матрицы".
В альтернативных вариантах осуществления изобретение относится к "матрицам" или "микроматрицам" или "биочипам", или "чипам", содержащим множество элементов-мишеней, где каждый элемент-мишень может содержать определенное количество одного или нескольких полипептидов (включая антитела) или нуклеиновых кислот, иммобилизованных на определенной площади поверхности с субстратом, и по меньшей мере одна нуклеиновая кислота и/или полипептид представляет собой нуклеиновую кислоту и/или полипептид по этому изобретению.
Настоящее изобретение может быть осуществлено на практике с, или может содержать, любой известной "матрицей", также называемой "микроматрицей" или "матрицей нуклеиновых кислот", или "полипептидной матрицей", или "матрицей антител", или "биочипом", или их вариантами. Матрицы представляют собой, в общем, множество "пятен" или "элементов-мишеней", где каждый элемент-мишень содержит определенное количество одной или нескольких биологических молекул, например, олигонуклеотидов, иммобилизованных на определенной площади поверхности с субстратом для специфического связывания молекулы образца, например, транскриптов мРНК.
В осуществлении на практике способов по изобретению можно использовать любую известную матрицу и/или способ получения и использования матриц, в целом или частично, или их варианты, как описано, например, в патентах США No. 6277628; 6277489; 6261776; 6258606; 6054270; 6048695; 6045996; 6022963; 6013440; 5965452; 5959098;5856174; 5830645; 5770456; 5632957; 5556752; 5143854; 5807522; 5800992; 5744305; 5700637; 5556752; 5434049; см. также, например, WO 99/51773; 99/09217; 97/46313; 96/17958; см. также, например, Johnston (1998) Curr. Biol., 8:R171-R174; Schummer (1997) Biotechniques, 23:1087-1092; Kern (1997) Biotechniques, 23:120-124; Solinas-Toldo (1997) Genes, Chromosomes & Cancer, 20:399-407; Bowtell (1999) Nature Genetics Supp., 21:25-32. См. также опубликованные патентные заявки США No. 20010018642; 20010019827; 20010016322; 20010014449; 20010014448; 20010012537; 20010008765.
Антитела и способы скрининга на основе антител
Изобретение относится к выделенным, синтетическим или рекомбинантным антителам, которые специфично связываются с фосфолипазой по изобретению. Эти антитела можно использовать для выделения, идентификации и количественного определения фосфолипаз по изобретению или сходных полипептидов. Эти антитела можно использовать для ингибирования активности фермента по изобретению. Эти антитела можно использовать выделения полипептидов, родственных полипептидам по изобретению, например, родственных ферментов фосфолипаз.
"Антитело" по изобретению может включать пептид или полипептид, полученный из, смоделированный после или, по существу, кодируемый геном иммуноглобулинов или генами иммуноглобулинов, или его фрагменты, способные специфически связываться с антигеном или эпитопом, см., например, Fundamental Immunology, Third Edition, W.E. Paul, ed., Raven Press, N.Y. (1993); Wilson (1994) J. Immunol. Methods, 175:267-273; Yarmush (1992) J. Biochem. Biophys. Methods, 25:85-97. Термин "антитело" включает антигенсвязывающие фрагменты, т.е. "антигенсвязывающие участки" (например, фрагменты, подпоследовательности, гипервариабельные участки (CDR)), которые сохраняют способность связывать антиген, включая (i) Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2 фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH на одном плече антитела, (v) dAb-фрагмент (Ward et al. (1989) Nature, 341:544-546), который состоит из домена VH; и (vi) отдельного гипервариабельного участка (CDR). Одноцепочечные антитела также входят в понятие термина "антитело".
Антитела можно использовать в иммунопреципитации, окрашивании (например, FACS), в иммуноаффинных колонках и т.п. Если желательно, последовательности нуклеиновых кислот, кодирующие специфические антигены, можно получать путем иммунизации с последующим выделением полипептида или нуклеиновой кислоты, амплификацией или клонированием и иммобилизацией полипептида на матрице по изобретению.
Альтернативно, способы по изобретению можно использовать для модификации структуры антител, продуцируемых клеткой, предназначенной для модификации, например, аффинность антител можно повышать или снижать. Более того, способность получать или модифицировать антитела может представлять собой полученный способами инженерии фенотип в клетке посредством способов по изобретению.
Способы иммунизации, получения и выделения антител (поликлональных и моноклональных) известны специалистам в данной области и описаны в научной и патентной литературе, см., например, Coligan, CURRENT PROTOCOLS IN IMMUNOLOGY, Wiley/Greene, NY (1991); Stites (eds.) BASIC AND CLINICAL IMMUNOLOGY (7th ed.) Lange Medical Publications, Los Altos, CA ("Stites"); Goding, MONOCLONAL ANTIBODIES: PRINCIPLES AND PRACTICE (2d ed.) Academic Press, New York, NY (1986); Kohler (1975) Nature 256:495; Harlow (1988) ANTIBODIES, A LABORATORY MANUAL, Cold Spring Harbor Publications, New York. В дополнение к традиционным способам in vivo с использованием животных антитела также можно получать in vitro, например, с использованием демонстрационных библиотек фагов, экспрессирующих рекомбинантные участки связывания антител. См., например, Hoogenboom (1997) Trends Biotechnol., 15:62-70; Katz (1997) Annu. Rev. Biophys. Biomol. Struct., 26:27-45.
Полипептиды можно использовать для получения антител, которые специфично связываются с полипептидами или фрагментами. Полученные в результате антитела могут быть использованы в методах иммуноаффинной хроматографии для выделения или очистки полипептида, или для определения наличия полипептида в биологическом образце. В таких методиках препарат белка, такой как экстракт или биологический образец, контактируют с антителами, способными специфично связываться с одним из полипептидов по изобретению.
В иммуноаффинных методиках антитела присоединяют к твердой подложке, такой как гранулы или другая матрица колонки. Препарат белка контактируют с антителами в условиях, при которых антитела специфично связываются с одним из полипептидов по изобретению. После промывания для удаления неспецифично связанных белков элюируют специфично связавшиеся полипептиды.
Способность белков в биологическом образце связываться с антителами можно определять с использованием любой из различных методик, известных специалистам в данной области. Например, связывание может быть определено мечением антител детектируемой меткой, такой как флуоресцентное вещество, ферментативная метка или радиоизотоп. Альтернативно, связывание антител с образцом может быть определено с использованием вторичных антител с такой детектируемой меткой на них. Конкретные способы анализа включают анализы ELISA, "сэндвич"-анализы, радиоиммунные анализы и вестерн-блот-анализы.
Поликлональные антитела, полученные против полипептидов по изобретению можно получать путем непосредственной инъекции полипептидов животному или введения полипептидов животному, например, не относящемуся к человеку. Полученные таким образом антитела будут затем связывать сам полипептид. Таким образом, даже последовательность, кодирующая только фрагмент полипептида, может быть использована для получения антител, которые могут связываться с целым нативным полипептидом. Такие антитела затем можно использовать для выделения полипептида из клеток, экспрессирующих данный полипептид.
Для получения моноклональных антител можно использовать любой способ, который обеспечивает получение антител, продуцируемых непрерывными культурами клеточных линий. Примеры включают способы с гибридомами, способ с триомами, способ В-клеточной гибридомы и способ EBV-гибридомы (Cole, et al., 1985, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., p. 77-96).
Способы, описанные для получения одноцепочечных антител (патент США No. 4946778), можно адаптировать для получения одноцепочечных антител против полипептидов по изобретению. Альтернативно, для экспрессии гуманизированных антител против указанных полипептидов или их фрагментов можно использовать трансгенных мышей.
Антитела, полученные против полипептидов по изобретению, можно использовать для скрининга аналогичных полипептидов из других организмов и образцов. В таких способах полипептиды из организма контактируют с антителами и определяют те полипептиды, которые специфически связываются с антителами. Для определения антител могут быть использованы любые из описанных выше методик.
Наборы
Изобретение относится к наборам, содержащим композиции, например, нуклеиновые кислоты, экспрессирующие кассеты, векторы, клетки, полипептиды (например, набор, имеющий по меньшей мере одну фосфолипазу по изобретению) и/или антитела по изобретению (например, набор, имеющий по меньшей мере одно антитело по изобретению). Наборы могут содержать ферменты для переработки (получения) биотоплив, детергентов, или для обработки или переработки пищевых продуктов, кормов, биомассы, добавок в пищу или в корма или питательных добавок, и т.п. Наборы также могут содержать учебный материал, обучающий методикам и промышленному использованию изобретения, как описано в данном описании.
Промышленное и медицинское применение ферментов по изобретению
Изобретение относится ко многим промышленным применениям и медицинским применениям с использованием полипептидов по изобретению, например, фосфолипазы и других ферментов по изобретению, например, фосфолипаз A, B, C и D, пататинов, включая конвертирование негидратируемого фосфолипида в гидратируемую форму, получение биотоплив и переработку биомассы, рафинирование масла, переработку масел из растений, рыб, водорослей и т.п., среди многих других применений. В любых из этих альтернативных промышленных применений и медицинских применений ферменты можно добавлять в конкретном порядке, например, фосфолипазы с отличающейся специфичностью добавляют в конкретном порядке, например, сначала добавляют фермент с активностью гидролиза PC и PE (или добавляют два фермента, один с активностью гидролиза PC, а другой с активностью гидролиза PE), затем добавляют фермент с активностью гидролиза PI (например, активностью PLC или PI-PLC), или любая их комбинация.
Любые или все из способов по изобретению можно применять в "производственном масштабе", например, в переработке или очистке масла в масштабе приблизительно от 15000; 25000; 50000; 75000 или 100000 фунтов (6,8, 11,3, 22,7, 34,0, 45,4 т) очищенного масла/сутки до приблизительно 1, 2, 3, 4, 5 или 6 или более миллионов фунтов (454, 907, 1361, 1814, 2268, 2722 т) очищенного масла/сутки.
Способы применения ферментов фосфолипаз в промышленных применениях хорошо известны в данной области. Например, фосфолипазы и способы по изобретению можно применять для переработки жиров и масел, как описано, например, в публикации патентной заявки JP H6-306386, в которой описана конверсия фосфолипидов, присутствующих в маслах и жирах, в растворимые в воде вещества, содержащие группы фосфорной кислоты.
Фосфолипазы по изобретению можно использовать для переработки растительных масел и фосфолипидов, таких как растительные масла и фосфолипиды, происходящие или выделенные из рисовой шелухи, сои, канолы, пальмы, семян хлопчатника, кукурузы, ядра косточек пальм, кокоса, арахиса, кунжута, подсолнуха. Фосфолипазы по изобретению можно использовать для переработки эфирных масел, например, эфирных масел из масел семян плодов, например, виноградных косточек, абрикоса, огуречника и т.д. Фосфолипазы по изобретению можно использовать для переработки масел и фосфолипидов в различных формах, включая неочищенные формы, рафинированные формы, камеди, смывную воду, глину, кремнизем, соапсток и т.п. Фосфолипиды по изобретению можно использовать для переработки масел с высоким содержанием фосфора, рыбьих жиров, животных масел, растительных масел, масел из водорослей и т.п. Во многих аспектах изобретения, каждый раз можно использовать фосфолипазу C, альтернативно можно использовать фосфолипазу D по изобретению и фосфатазу (например, с использованием комбинации PLD/фосфатаза для увеличения выхода масла с высоким содержанием фосфора, такого как соевое масло).
Фосфолипазы по изобретению можно использовать для переработки и получения пищевых масел, биодизельных масел, липосом для фармацевтических средств и косметических средств, структурированных фосфолипидов и структурированных липидов. Фосфолипазы по изобретению можно использовать в экстракции масел. Фосфолипазы по изобретению можно использовать для переработки и получения различных мыл.
В другом варианте осуществления в настоящем документе предусмотрен способ получения фосфолипида из пищевого масла. В определенном варианте осуществления фосфолипиды, полученные способами, предоставленными в настоящем документе, включают различные фосфолипиды, включая, но не ограничиваясь ими, фосфатидилхолин (PC), фосфатидилэтаноламин (PE), фосфатидилсерин (PS), фосфатидилинозитол (PI), фосфатидную кислоту (PA), лизофосфатидилхолин (LPC), лизофосфатидилэтаноламин (LPE), лизофосфатидилсерин (LPS), лизофосфатидилинозитол (LPI), лизофосфатидную кислоту (LPA), холин (C), этаноламин (E), серин (S) и инозитол (I).
Переработка пищевых масел: получение 1,3-диацилглицерина (1,3-DAG)
Изобретение относится к способам использования фермента(ов) по изобретению для получения 1,3-диацилглицерина (1,3-DAG). В одном аспекте фосфолипаза C или фосфолипаза D вместе с фосфатазой образуют 1,2-диацилглицерин; это повышает выход масла в ходе очистки пищевых масел. При использовании в способе, который включает стадию нейтрализации щелочью, например, в качестве добавки для щелочной очистки, вплоть до 70% 1,2-диацилглицерида (1,2-DAG) подвергается миграции ацильной группы и конвертируется в 1,3-DAG. 1,3-DAG обладает повышенной пользой для здоровья и, таким образом, применение PLC в качестве добавки при щелочной очистке обеспечивает масло с увеличенной пищевой ценностью.
Изобретение относится к способам использования фермента(ов) по изобретению для получения и обработки пищевых масел, включая получение пищевых масел с увеличенными количествами 1,3-DAG. Диацилглицерины представляют собой природные соединения, встречающиеся во многих пищевых маслах. В одном аспекте способа по изобретению, например, способа рафинирования масла, основание (щелочь) вызывает изомеризацию 1,2-DAG, продуцируемого с помощью PLC, до 1,3-DAG, что обеспечивает питательную пользу для здоровья относительно 1,2-DAG, например, 1,3-DAG сжигается в качестве энергии вместо запасания в качестве жира (как в случае 1,2-DAG). Путем добавления PLC в начале процесса щелочного рафинирования (и кислоты и щелочи впоследствии), способы по изобретению обеспечивают увеличенный уровень 1,3-DAG (снижение 1,2-DAG). C точки зрения пищевой ценности, 1,3-DAG лучше для потребителя, чем 1,2-DAG. В альтернативных аспектах изобретение включает способ рафинирования масла с использованием PLC по изобретению, тем самым конечный продукт в виде рафинированного масла содержит не менее чем 0,5%, 1,0%, 2,0% или 3,0% или более 1,3-DAG.
Таким образом, изобретение относится к способу получения (путем переэтерификации) очищенного масла (например, диацилглицеринового маслса), включая пищевые масла, содержащего увеличенные уровни 1,3-диацилглицерина (1,3-DAG), где фосфолипазу, такую как фермент по изобретению, "добавляют первоначально" или добавляют до добавления кислоты или щелочи. Получение DAG ферментативным гидролизом из триглицерида обеспечивают переэтерификацией 1,3-DAG из 1,2-DAG. Содержащее 1,3-DAG пищевое масло демонстрирует отличающиеся метаболические эффекты по сравнению с обычными пищевыми маслами. Различия в метаболических каскадах между 1,3-DAG и либо 1,2-DAG, либо триглицеридами, позволяет большей части жирных кислот из 1,3 диацилглицерина сжигаться в качестве энергии, а не запасаться в качестве жира. Клинические испытания показали, что регулярное употребление масла с DAG в качестве части продуманной диеты может помочь индивидуумам контролировать их массу тела и телесный жир. Кроме того, метаболизм 1,3-DAG снижает циркулирующие в кровотоке триглицериды после приема пищи. Поскольку ожирение и повышенный уровень липидов в крови ассоциированы в качестве факторов риска с хроническими заболеваниями, включая сердечнососудистые заболевания и диабет типа II, на эти связанные с образом жизни состояния здоровья можно повлиять благоприятным образом путем регулярного употребления масел с DAG.
Употребление содержащего DAG масла может происходить различными способами. Таким образом, в одном аспекте изобретение относится к способу использования фермента по изобретению для получения продукта питания, например, выпекаемого продукта, обладающего увеличенными уровнями диацилглицерина 1,3-DAG и хлебобулочных изделий, содержащих масла с диацилглицерином. В одном аспекте хлебобулочные изделия представляют собой печенья, кексы и сходные хлебобулочные изделия.
В альтернативных вариантах осуществления комбинация ферментов, которые можно использовать в способах по изобретению, включая переработку пищевых масел, включает (где один, несколько или все из ферментов в композиции содержат фермент по настоящему изобретению):
- PLC+PI-PLC+PLA (PLA добавляют после завершения реакций PLC);
- PLD+фосфатаза+PI-PLC, а затем PLA; или,
- PLC или (PLC+PI-PLC)+PLA, специфичная к фосфатидной кислоте (все ферменты добавляют вместе или последовательно).
Рафинирование масла и переработка растительного масла
Ферменты по изобретению (например, полипептиды по изобретению, облагающие активностью липазы, фосфолипазы, эстеразы и/или гликозидазы или эквивалентной активностью) можно использовать на различных стадиях переработки растительного масла, например, при экстракции растительного масла, в частности, при удалении "фосфолипидных камедей" в процессе, называемом "рафинирование масла".
Эти способы по изобретению можно использовать в "производственном масштабе", например, в масштабе приблизительно от 15000; 25000; 50000; 75000 или 100000 фунтов (6,8, 11,3, 22,7, 34,0, 45,4 т) очищенного масла/сутки до приблизительно 1, 2, 3, 4, 5 или 6 или более миллионов фунтов (454, 907, 1361, 1814, 2268, 2722 т) очищенного масла/сутки.
В одном аспекте изобретение относится к способу рафинирования масла, включающему применение фосфолипазы по изобретению, например, PLC, например, PI-PLC по изобретению. В одном аспекте способ, кроме того, включает добавление другой фосфолипазы (которая также может представлять собой фосфолипазу по изобретению), например, другой PLC, PLA, PLB, PLB или пататина по изобретению, или фермента (который также может представлять собой фермент по изобретению), имеющего активность лизофосфолипазы-трансацилазы (LPTA) или активность лизофосфолипазы (LPL) и активность лизофосфолипазы-трансацилазы (LPTA), или их комбинацию, и/или пататин-подобной фосфолипазы (которая также может быть ферментом по изобретению). В одном аспекте все ферменты добавляют вместе, или, альтернативно, ферменты добавляют в конкретном порядке, например, после добавления PLC добавляют PLA и/или пататин; или сначала добавляют фермент или ферменты по изобретению, имеющие активность PC и PE, а затем добавляют PI-PLC.
В одном аспекте этот способ обеспечивает улучшение выхода в результате обработки фосфолипазой (например, PLC по изобретению). В одном аспекте этот способ обеспечивает дополнительное снижение содержания фосфора в масле в результате обработки фосфолипазой (например, PLA по изобретению).
В одном аспекте изобретение относится к способам, включающим применение фосфолипазы по изобретению, например, PLC или PI-PLC по изобретению, для снижения массы камеди и увеличения содержания нейтрального масла (триглицерида) путем снижения удержания масла. В одном аспекте изобретение относится к способам, включающим применение фосфолипазы по изобретению, например, PLC по изобретению, например, PI-PLC по изобретению, для увеличения продукции нейтральных масел и диацилглицерина (DAG) в масляной фазе. В альтернативных аспектах способы по изобретению (например, способы рафинирования) могут включать один или несколько других ферментов, таких как протеаза, амилаза, липаза, кутиназа, другая фосфолипаза (включая, например, фермент по изобретению), карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, например, лактаза и/или пероксидаза, или полипептидов с эквивалентной активностью или их комбинации.
Фосфолипазы по изобретению можно использовать на различных стадиях переработки растительного масла, например, таких как экстракция растительного масла, в частности, удаление "фосфолипидных камедей" в процессе, называемом "рафинирование масла", как описано в настоящем документе. Изобретение относится к способам переработки растительных масел из различных источников, таких как рисовая шелуха, соевые бобы, семена рапса, арахис и другие орехи, кунжут, подсолнух, пальма и кукуруза. Способы можно использовать совместно со способами, основанными на экстракции гексаном, с последующим рафинированием неочищенных экстрактов в пищевые масла, включая применение способов и ферментов по изобретению. Первой стадией в последовательности очистки является так называемый процесс "рафинирования", который служит для отделения фосфатидов путем добавления воды. Материал, осаждаемый рафинированием, отделяют и далее обрабатывают в смесь лецитинов. Коммерческие лецитины, такие как соевый лецитин и лецитин подсолнуха, представляют собой полутвердые или очень вязкие материалы. Они состоят из смеси полярных липидов, главным образом, фосфолипидов, и масла, главным образом, триглицеридов.
Фосфолипазы по изобретению можно использовать в любой методике "рафинирования" включая рафинирование гидратацией, рафинирование масла ALCON (например, для соевых бобов), рафинирование масла safinco, "суперрафинирование", УФ-рафинирование, рафинирование TOP, унирафинирование, сухое рафинирование и рафинирование ENZYMAXTM. См., например, патенты США No. 6355693; 6162623; 6103505; 6001640; 5558781; 5264367. Различные методики "рафинирования", охватываемые способами по изобретению, описаны в Bockisch, M. (1998), Fats and Oils Handbook, The extraction of Vegetable Oils (глава 5), 345-445, AOCS Press, Champaign, Illinois. Фосфолипазы по изобретению можно использовать в промышленном применении ферментативного рафинирования триглицеридных масел, как описано, например, в EP 513 709.
В одном аспекте фосфолипазы по изобретению используют для обработки растительных масел, например, неочищенных масел, таких как масло рисовой шелухи, сои, канолы, цветочные масла и т.п. В одном аспекте это увеличивает эффективность процесса рафинирования. В одном аспекте изобретение относится к способам ферментативного рафинирования в условиях низкого содержания воды, например, в диапазоне приблизительно от 0,1% до 20% воды, или от 0,5% до 10% воды. В одном аспекте это приводит к улучшенному отделению тяжелой фазы от масляной фазы в ходе центрифугирования. Улучшенное разделение этих фаз может приводить к более эффективному удалению фосфолипидов из масла, включая как гидратируемые, так и негидратируемые масла. В одном аспекте это может обеспечить фракцию камеди, которая содержит меньше удерживаемого нейтрального масла (триглицеридов), тем самым увеличивая общий выход масла в процессе рафинирования.
В одном аспекте фосфолипазы по изобретению, например, полипептид, обладающий активностью PLC, например, активностью PI-PLC, используют для обработки масел (например, растительных масел, включая неочищенные масла, такие как масла рисовой шелухи, сои, канолы, цветочные масла и т.п.), например, в процессах рафинирования, для уменьшения массы камеди и увеличения прироста нейтральных масел путем сниженного удержания масла. В одном аспекте фосфолипазы по изобретению, например, полипептид, обладающий активностью PLC, используют для получения диацилглицерина (DAG) и увеличения его содержания в масляной фазе.
Фосфолипазы по изобретению можно использовать в промышленном применении ферментативного рафинирования, как описано, например, в CA 1102795, в котором описан способ выделения полярных липидов из липидов злаков путем добавления по меньшей мере 50% по массе воды. Этот способ представляет собой модифицированное рафинирование в том смысле, что в нем используется принцип добавления воды к неочищенной смеси масел.
В одном аспекте изобретение относится к ферментативным процессам, включающим применение фосфолипаз по изобретению (например, PLC, например, PI-PLC), включающее гидролиз гидратированных фосфолипидов в масле при температуре приблизительно от 20°C до 40°C при щелочных значениях pH, например, при pH приблизительно от pH 8 до pH 10, с использованием времени реакции приблизительно от 3 до 10 минут. Это может приводить к конечным уровням фосфора в масле менее чем 10 м.д. Изобретение также относится к ферментативным способам, включающим применение фосфолипаз по изобретению (например, PI-PLC), включающее гидролиз гидратируемых и негидратируемых фосфолипидов в масле при температуре приблизительно от 50°C до 60°C при pH немного ниже нейтрального, например, приблизительно от pH 5 до pH 6,5, с использованием времени реакции приблизительно от 30 до 60 минут. Это может приводить к конечным уровням фосфора в масле менее 10 м.д.
В одном аспекте изобретение относится к ферментативным способам, в которых используется фермент фосфолипаза C, для гидролиза глицерилфосфоэфирной связи и, тем самым, обеспечения возвращения диацилглицеридной части фосфолипидов обратно в масло, например, растительное масло, рыбий жир или масло из водорослей ("фосфолипаза C (PLC), добавка для щелочной очистки"); и снижения содержания фосфолипидов на стадии рафинирования до уровней, достаточно низких, чтобы происходила физическая очистка масел с высоким содержанием фосфора ("фосфолипаза C (PLC), добавка для рафинирования"). Эти два подхода могут обеспечивать различные уровни и обладают различными конечными применениями.
В различных иллюстративных способах по изобретению, ряд различных стадий включают процесс рафинирования, предшествующий главным процессам отбеливания и дезодорирования. Эти стадии включают нагревание, смешение, выдерживание, разделение и высушивание. После стадии нагревания добавляют воду и часто кислоту и перемешивают для обеспечения агломерации нерастворимой фосфолипидной "камеди" в частицы, которые можно отделять. Хотя вода отделяет многие из фосфатидов при рафинировании, части фосфолипидов являются негидратируемыми фосфатидами (NHP), присутствующими в качестве солей кальция или магния. Способы рафинирования нацелены на эти NHP посредством добавления кислоты. После гидратации фосфолипидов масло перемешивают, выдерживают и разделяют центрифугированием. Наконец, масло сушат и хранят, транспортируют или очищают, как проиллюстрировано на фигуре 1. Полученные камеди либо далее перерабатывают в продукты на основе лецитина, либо обратно добавляют в пищу.
В одном варианте осуществления в настоящем документе предусмотрен способ гидратации негидратируемых фосфолипидов в липидной матрице путем обеспечения миграции их к поверхности контакта масло-вода. Затем негидратируемые фосфолипиды подвергают реакции и/или удаляют из липидов. В одном варианте осуществления способ включает a) смешение водного раствора кислоты с пищевым маслом с получением кислотной смеси, имеющей pH менее чем приблизительно 4; и b) смешение основания с кислотной смесью с получение прореагировавшей смеси, имеющей pH приблизительно 6-9, где смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит водную фазу со средним размером капель от приблизительно 15 мкм до приблизительно 45 мкм. В определенных вариантах осуществления смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60% водной фазы по объему с размером капель от приблизительно 15 мкм до приблизительно 45 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенном варианте осуществления способы, представленные в настоящем документе, позволяют негидратируемым фосфолипидам в липидной матрице мигрировать в поверхность контакта масло-вода.
В определенных вариантах осуществления смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит водную фазу со средним размером капель между приблизительно 15-40 мкм, 15-35 мкм, 17-40 мкм, 20-40 мкм, 20-30 мкм, 25-30 мкм, 25-40 мкм или 25-35 мкм. В определенных вариантах осуществления смешение на стадии a) обеспечивает эмульсию, которая содержит водную фазу со средним размером капель между приблизительно 15-40 мкм, 15-35 мкм, 17-40 мкм, 20-40 мкм, 20-30 мкм, 25-30 мкм, 25-40 мкм или 25-35 мкм. В определенных вариантах осуществления смешение на стадии b) обеспечивает эмульсию, которая содержит водную фазу со средним размером капель между приблизительно 15-40 мкм, 15-35 мкм, 17-40 мкм, 20-40 мкм, 20-30 мкм, 25-30 мкм, 25-40 мкм или 25-35 мкм. В определенных вариантах осуществления средний размер капель составляет приблизительно 15 мкм, 17 мкм, 19 мкм, 20 мкм, 22 мкм, 25 мкм, 27 мкм, 30 мкм, 35 мкм или 40 мкм. В определенных вариантах осуществления средний размер капель составляет приблизительно 20 мкм.
В определенных вариантах осуществления смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60% водной фазы по объему с размером капель от приблизительно 20 мкм до приблизительно 40 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления стадия смешения обеспечивает эмульсию, которая содержит приблизительно 60-95%, 60-90%, 60-80%, 70-95%, 80-95% водной фазы по объему с размером капель между приблизительно 20-40 мкм, 20-35 мкм, 25-40 мкм, 30-40 мкм, 35-40 мкм или 25-45 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60, 70, 80, 90, 93, 95, 96, 97, 98 или 99% водной фазы по объему с размером капель между приблизительно 15-45 мкм, 20-40 мкм, 20-45 мкм, 25-40 мкм, 20-35 мкм, 30-40 мкм, 35-40 мкм или 25-45 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления стадия смешения a) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60, 70, 80, 90, 93, 95, 96, 97, 98 или 99% водной фазы по объему с размером капель приблизительно 15-45 мкм, 20-40 мкм, 20-45 мкм, 25-40 мкм, 20-35 мкм, 30-40 мкм, 35-40 мкм или 25-45 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления стадия смешения b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60, 70, 80, 90, 93, 95, 96, 97, 98, или 99% водной фазы по объему с размером капель между приблизительно 15-45 мкм, 20-40 мкм, 20-45 мкм, 25-40 мкм, 20-35 мкм, 30-40 мкм, 35-40 мкм или 25-45 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления, смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 10-30% водной фазы по объему с размером капель менее чем приблизительно 10 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 20-25% водной фазы по объему с размером капель менее чем приблизительно 10 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60-95% водной фазы по объему с размером капель более чем приблизительно 10 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 70-80% водной фазы по объему с размером капель более чем приблизительно 10 мкм, где процент водной фазы основан на общем объеме водной фазы. В определенных вариантах осуществления смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 90% водной фазы по объему со средним размером капель приблизительно 20 мкм, где процент водной фазы основан на общем объеме водной фазы.
Без связи с какой-либо конкретной теорией, полагают, что на стадии a) соли фосфатидной кислоты и фосфатидилэтаноламина с кальцием, магнием и железом диссоциируют. Свободные катионы кальция, магния и железа реагируют, например, с цитратными, ацетатными или фосфатными анионами из кислоты, с образованием солей металлов. На стадии b), катионы металлов из основания, например, ионы натрия или калия, образуют комплексы с фосфатидной кислотой или фосфатидилэтаноламином. В определенных вариантах осуществления, способ дополнительно включает добавление воды с последующим перемешиванием с высокими сдвиговыми усилиями с образованием механической эмульсии. Затем эмульгированные фосфолипиды удаляют химическим рафинированием или подвергают реакции в ферментативном рафинировании.
В способах, предоставленных в настоящем документе, можно использовать любое устройство для приложения сдвигового усилия и/или смешения. В определенных вариантах осуществления смешение включает приложение сдвигового усилия и перемешивание. В определенном варианте осуществления устройство для смешения представляет собой подвесной смеситель, включая цифровой смеситель IKA RW 20 с плоской лопастью с лезвием. В определенных вариантах осуществления устройство для смешения действует при приблизительно 50 об./мин., 100 об./мин., 150 об./мин. или 200 об./мин. для нормального перемешивания и приблизительно 250 об./мин., 300 об./мин., 350 об./мин., 400 об./мин. или более для интенсивного перемешивания. В определенном варианте осуществления перемешивание со сдвиговым усилием проводят с помощью гомогенизатора IKA Ultra-Turrax T-50 basic с диспергирующим элементом S 50 N-G 45 G при 10000 об./мин.
В определенных вариантах осуществления смеситель представляет собой роторный/статорный смеситель с высоким сдвиговым усилием со скоростью лопасти (радиальная скорость в камере смесителя) по меньшей мере приблизительно 1400 см/с. В определенных вариантах осуществления, и мощность, потребляемая смесителем, составляет по меньшей мере 1,0 кВт/метрическая тонна продукта/ч. В определенных вариантах осуществления эмульсии масло/вода в промышленном масштабе получают со скоростями лопасти в диапазоне приблизительно от 1400 см/с до 2300 см/с, или даже выше. В определенных вариантах осуществления скорость лопасти составляет приблизительно 1400 см/с, 1600 см/с, 1800 см/с, 2000 см/с, 2100 см/с, 2300 см/с, 2500 см/с, 3000 см/с или 3500 см/с. В определенных вариантах осуществления скорость лопасти составляет приблизительно 2300 см/с. В определенных вариантах осуществления и мощность, потребляемая смесителем, составляет от приблизительно 1,0 до приблизительно 2,0 кВт/метрическая тонна продукта/ч. В определенных вариантах осуществления и мощность, потребляемая смесителем, составляет приблизительно 2,0 кВт/метрическая тонна продукта/ч. В определенных вариантах осуществления для непрерывного процесса для смесителя с высоким сдвиговым усилием требуется эффективное потребление мощности 10 кВт для переработки 10 метрических тонн масла в час.
В определенных вариантах осуществления примешивание кислоты включает применение сдвигового усилия в течение менее чем приблизительно 1 минуты. В определенных вариантах осуществления примешивание кислоты включает применение сдвигового усилия в течение приблизительно 1 секунды, 3 секунд, 5 секунд, 8 секунд, 10 секунды, 20 секунд, 30 секунд, 40 секунд, 50 секунд или 60 секунд. В определенных вариантах осуществления примешивание кислоты включает применение сдвигового усилия в течение по меньшей мере приблизительно 1 минуты. В определенных вариантах осуществления примешивание кислоты включает применение сдвигового усилия в течение по меньшей мере приблизительно 1 секунды вплоть до приблизительно 10 минут, от по меньшей мере приблизительно 1 секунды вплоть до приблизительно 10 минут, от по меньшей мере приблизительно 1 секунды вплоть до приблизительно 7 минут, от по меньшей мере приблизительно 1 секунды вплоть до приблизительно 5 минут, от по меньшей мере приблизительно 1 секунды вплоть до приблизительно 3 минут или от по меньшей мере приблизительно 1 секунды вплоть до приблизительно 2 минут. В определенных вариантах осуществления примешивание кислоты включает применение сдвигового усилия в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 минут.
В определенных вариантах осуществления примешивание кислоты включает применение сдвигового усилия путем встряхивания от приблизительно 1 минуты до приблизительно 5 часов. В определенных вариантах осуществления кислотную смесь встряхивают в течение по меньшей мере приблизительно 1 минуты. В определенных вариантах осуществления перемешивание кислоты продолжают от приблизительно 10 минут до приблизительно 5 часов или более. В определенных вариантах осуществления встряхивание кислоты продолжают от приблизительно 30 минут до приблизительно 5 часов или более. В определенных вариантах осуществления встряхивание кислоты продолжают от приблизительно 30 минут до приблизительно 3 часов или более. В определенных вариантах осуществления встряхивание кислоты продолжают от приблизительно 30 минут до приблизительно 2 часов или более. В определенных вариантах осуществления встряхивание кислоты продолжают в течение приблизительно 1, 10, 20, 30, 40, 50, 60, 70, 80, 90, 120, 150 или 180 минут.
В определенных вариантах осуществления кислота, используемая на стадии a), выбрана из группы, состоящей из фосфорной кислоты, уксусной кислоты, лимонной кислоты, виннокаменной кислоты, янтарной кислоты и их смесей. В одном варианте осуществления кислота представляет собой лимонную кислоту.
В определенных вариантах осуществления pH кислотной смеси на стадии a) составляет от приблизительно 1 до приблизительно 4. В определенных вариантах осуществления pH кислотной смеси на стадии a) составляет приблизительно 1, 1,5, 2, 2,5, 3, 3,5 или 4.
В определенных вариантах осуществления примешивание кислоты продолжают до тех пор, пока не диссоциируют соли фосфатидной кислоты и фосфатидилэтаноламина с кальцием, магнием и железом.
В определенных вариантах осуществления водный раствор кислоты, используемый в способе, содержит по меньшей мере приблизительно 5% по массе кислоты в расчете на общую массу кислоты и воды. В определенных вариантах осуществления водный раствор кислоты, используемый в способе, содержит от по меньшей мере приблизительно 5 вплоть до приблизительно 90%, от приблизительно 5 вплоть до приблизительно 80%, от приблизительно 5 вплоть до приблизительно 70%, от приблизительно 10 вплоть до приблизительно 90%, от приблизительно 20 вплоть до приблизительно 60%, от приблизительно 30 вплоть до приблизительно 60%, или от приблизительно 40 вплоть до приблизительно 60% по массе кислоты в расчете на общую массу кислоты и воды. В определенных вариантах осуществления водный раствор кислоты, используемый в способе, включает по меньшей мере приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 70, 80, 85, 90% по массе кислоты в расчете на общую массу кислоты и воды. В определенных вариантах осуществления водный раствор кислоты, используемый в способах, содержит по меньшей мере приблизительно 5% по массе лимонной кислоты в расчете на общую массу лимонной кислоты и воды.
В определенных вариантах осуществления водный раствор кислоты, используемый в способах, содержит по меньшей мере приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60% по массе лимонной кислоты в расчете на общую массу лимонной кислоты и воды. В определенных вариантах осуществления водный раствор кислоты, используемый в способах, содержит по меньшей мере приблизительно 40, 45, 50, 55 или 60% по массе лимонной кислоты в расчете на общую массу лимонной кислоты и воды. В одном варианте осуществления водный раствор кислоты, используемый в способе, содержит приблизительно 50% по массе лимонной кислоты в расчете на общую массу лимонной кислоты и воды. В определенных вариантах осуществления водный раствор кислоты, используемый в способах, содержит по меньшей мере приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 70, 80, 85, 90% по массе фосфорной кислоты в расчете на общую массу фосфорной кислоты и воды.
В определенных вариантах осуществления водный раствор кислоты используют в количестве по меньшей мере приблизительно 0,01% по массе в расчете на общую массу масла. В определенных вариантах осуществления водный раствор кислоты используют в количестве по меньшей мере приблизительно 0,05% по массе в расчете на общую массу масла. В определенных вариантах осуществления водный раствор кислоты используют в количестве от по меньшей мере приблизительно 0,01 вплоть до приблизительно 10%, от приблизительно 0,01 вплоть до приблизительно 5%, от приблизительно 0,05 вплоть до приблизительно 5%, от приблизительно 0,05 вплоть до приблизительно 3%, от приблизительно 0,05 вплоть до приблизительно 2% или от приблизительно 0,1 вплоть до приблизительно 2% по массе в расчете на общую массу масла. В определенных вариантах осуществления водный раствор кислоты используют в количестве приблизительно 0,01, 0,05, 0,1, 0,15, 0,2, 0,25, 0,3, 0,5, 1, 2, 5, 7 или 10% по массе в расчете на общую массу масла.
Основание смешивают с кислотной смесью для получения прореагировавшей смеси, имеющей pH приблизительно 6-9 в водной фазе. Смешение продолжают, чтобы позволить негидратируемым фосфолипидам в липидной матрице мигрировать к поверхности контакта масло-вода. На стадии b) можно использовать любое основание, которое специалист в данной области сочтет пригодным. В определенных вариантах осуществления основание выбрано из группы, состоящей из гидроксида натрия, гидроксида калия, силиката натрия, карбоната натрия, карбоната кальция, и их комбинации. В одном варианте осуществления основание представляет собой гидроксид натрия. В определенных вариантах осуществления основание добавляют в качестве разбавленного водного раствора, так что основание не омыляет никакое нейтральное масло. В определенных вариантах осуществления основание добавляют в качестве от приблизительно 0,1 вплоть до приблизительно 8 M, от приблизительно 1 вплоть до приблизительно 4 M, от приблизительно 1 вплоть до приблизительно 3 M, или от приблизительно 0,5 вплоть до приблизительно 3 M водного раствора. В определенных вариантах осуществления основание добавляют в качестве приблизительно 0,1 M, 0,5 M, 1 M, 2 M, 3 M, 4 M, 5 M, 6 M, 7 M или 8 M водного раствора. В одном варианте осуществления минимальное эффективное количество основания, предназначенное для применения в целях удаления NHP, является таким, что pH водной фазы увеличивается до по меньшей мере приблизительно 6. В определенных вариантах осуществления используемое количество основания является достаточным для увеличения pH водной фазы до приблизительно 6, 6,5, 7, 7,5 или 8. В определенных вариантах осуществления примешивание основания продолжают в течение по меньшей мере приблизительно 1 минуты. В определенных вариантах осуществления примешивание основания продолжают в течение от приблизительно 1 минуты до приблизительно 5 часов или более. В определенных вариантах осуществления примешивание основание продолжают в течение приблизительно 1, 10, 20, 30, 40, 50, 60, 70, 80, 90, 120, 150 или 180 минут.
Способы, представленные в настоящем документе, можно проводить при любой температуре, которую сочтет пригодной специалист в данной области. В определенных вариантах осуществления температура в ходе процесса находится в диапазоне от приблизительно 20°C до приблизительно 100°C, от приблизительно 20°C до приблизительно 90°C, от приблизительно 40°C до приблизительно 80°C, или от приблизительно 40°C до приблизительно 70°C. В определенных вариантах осуществления температура в ходе процесса составляет приблизительно 20, 30, 40, 50, 60, 70, 80, 90 или 100°C.
В определенных вариантах осуществления после реакции с основанием добавляют воду в количестве приблизительно от 0,1 до 5% или более в расчете на общий объем реакционной смеси с последующим перемешиванием с высоким сдвиговым усилием с образованием механической эмульсии, позволяющей фосфолипидам либо эмульгироваться при химическом рафинировании, либо реагировать при ферментативном рафинировании. В определенных вариантах осуществления воду впоследствии добавляют в количестве приблизительно 0,1, 0,5, 1, 2, 3, 4, 5% или более в расчете на общий объем реакционной смеси.
В одном варианте осуществления в настоящем документе предусмотрен способ, где после гидратации NHP следует ферментативная обработка для удаления различных фосфолипидов и лецитинов. Такие способы можно осуществлять на практике либо на неочищенных, либо на рафинированных гидратацией маслах.
В определенных вариантах осуществления способ рафинирования масла, представленный в настоящем документе, включает: a) смешение водного раствора кислоты с пищевым маслом с получением кислотной смеси, имеющей pH приблизительно от 1 до 4; b) смешение основания с кислотной смесью с получением прореагировавшей смеси, имеющей pH приблизительно 6-9; и c) рафинирование прореагировавшей смеси водой или ферментом с получением рафинированного масла, где смешение на стадиях a) и/или b) проводят с помощью смесителя с высоким сдвиговым усилием.
В вариантах осуществления, где фермент используют на стадии рафинирования, один или несколько ферментов можно добавлять в масло либо по отдельности, либо вместе. Параметры ферментативной реакции, включающие температуру, pH, и концентрацию фермента можно контролировать для оптимизации реакции для конкретной комбинации ферментов в конкретной системе масел. В способах, предоставленных в настоящем документе, пригодны многие разновидности ферментов и их эквиваленты, включая семейства фосфолипазы A и фосфолипазы C, которые являются коммерчески доступными. Иллюстративные ферменты описаны в других местах в настоящем документе.
В определенных вариантах осуществления различные фосфолипазы, используемые на стадии ферментативного рафинирования, смешивают вместе перед добавлением в масло, подлежащее обработке. Альтернативно ферменты добавляют в масло по отдельности, либо последовательно, либо одновременно.
Количество фермента, используемого в способах, предоставленных в настоящем документе, зависит от условий реакции, типа масла и типа используемого фермента. В определенных вариантах осуществления количество находится в диапазоне от 10 до 20000 единиц, от 20 до 10000 единиц, от 50 до 5000 единиц, или от 100 до 2000 единиц на 1 кг масла.
В одном варианте осуществления в настоящем документе предусмотрен способ удаления NHP, гидратируемых фосфолипидов и лецитинов (в совокупности известных как "камеди") из растительных масел с получением продукта в виде рафинированного масла или жира, который можно использовать для производства пищевых продуктов и/или непищевых применений. В определенных вариантах осуществления в способах рафинирования, предоставленных в настоящем документе, используется вода, различные кислоты и/или различные основания или их комбинация.
В одном варианте осуществления способы, представленные в настоящем документе, пригодны для удаления солей фосфатидной кислоты и фосфатидилэтаноламина из растительных масел. В определенных вариантах осуществления, на стадии a) образуются цитратные соли кальция и магния. Способы, представленные в настоящем документе, устраняют проблемы, ассоциированные с загрязнением оборудования вследствие отложения цитратных солей кальция и магния на послереакционном оборудовании. Цитратные соли кальция и магния растворимы при pH, при которых проводят ферментативную реакцию и дальнейшую переработку в способах, представленных в настоящем документе.
В определенных вариантах осуществления в настоящем документе предусматриваются способы увеличения скорости реакции фосфолипазы, используемой в ферментативном рафинировании, так чтобы ферментативная реакция имела продолжительность менее чем приблизительно шесть, пять, четыре, три, два или один час. В определенных вариантах осуществления увеличения скорости реакции достигают путем смешения с высоким сдвиговым усилием прореагировавшей смеси стадии b) с образованием механической эмульсии, которую затем подвергают реакции с ферментом.
В другом аспекте в настоящем документе предусмотрен способ рафинирования композиции растительного масла, в котором как гидратируемые, так и негидратируемые фосфолипиды можно обрабатывать в одном процессе, где ферментативная реакция завершается в течение менее чем приблизительно одного часа.
В определенном варианте осуществления масло включает масло Neochloris oleoabundans, масло Scenedesmus dimorphus, масло Euglena gracilis, масло Phaeodactylum tricornutum, масло Pleurochrysis carterae, масло Prymnesium parvum, масло Tetraselmis chui, масло Tetraselmis suecica, масло Isochrysis galbana, масло Nannochloropsis salina, масло Botryococcus braunii, масло Dunaliella tertiolecta, масло Nannochloris species, масло Spirulina species, масло Chlorophycease, масло Bacilliarophy, масло асаи, миндальное масло, масло бабассу, масло семян черной смородины, масло семян огуречника, масло канолы, масло кешью, касторовое масло, кокосовое масло, кориандровое масло, кукурузное масло, хлопковое масло, масло крамбе, масло льняного семени, масло виноградных зерен, масло из лесного ореха, конопляное масло, масло ятрофы, масло хохобы, льняное масло, масло ореха макадамия, масло ядра манго, масло пенника лугового, горчичное масло, костяное масло, оливковое масло, пальмовое масло, пальмоядровое масло, пальмовый олеин, арахисовое масло, масло американского ореха, кедровое масло, фисташковое масло, маковое масло, рапсовое масло, рисовое масло, сафлоровое масло, масло камелии, кунжутное масло, масло из семян ши, соевое масло, подсолнечное масло, таловое масло, масло тсубаки, ореховое масло, типы "природных" масел, обладающих измененным составом жирных кислот, полученных с помощью генетически модифицированных организмов (GMO) или традиционной "селекции", такие как высокоолеиновое, низколиноленовое или низконасыщенное масло (высокоолеиновое масло канолы, низколиноленовое соевое масло или высокостеариновые подсолнечные масла) или их смеси. В одном варианте осуществления масла, которые можно подвергать обработке, включают, но не ограничиваются ими следующие: масло канолы, касторовое масло, кокосовое масло, кориандровое масло, кукурузное масло, хлопковое масло, масло лесного ореха, конопляное масло, льняное масло, масло ядра манго, масло пенника лугового, косточковое масло, оливковое масло, паломовое масло, пальмоядровое масло, пальмовый олеин, арахисовое масло, рапсовое масло, рисовое масло, сафлоровое масло, масло камелии, соевое масло, подсолнечное масло, таловое масло, масло тсубаки и растительное масло.
В определенных вариантах осуществления способы, представленные в настоящем документе, снижают содержание фосфолипидов в масле до менее чем приблизительно 30 м.д. фосфора, менее чем приблизительно 20 м.д. фосфора, менее чем приблизительно 15 м.д. фосфора, менее чем приблизительно 10 м.д. фосфора, менее чем приблизительно 7 м.д. фосфора, менее чем приблизительно 5 м.д. фосфора или менее чем приблизительно 3 м.д. фосфора. В определенных вариантах осуществления способы, представленные в настоящем документе, снижают содержание фосфолипидов в масле до приблизительно 10 м.д. фосфора, приблизительно 7 м.д. фосфора, приблизительно 5 м.д. фосфора или приблизительно 3 м.д. фосфора.
После стадии рафинирования, рафинированное масло можно отделять от камедей и подвергать дальнейшим стадиями переработки, известным в данной области, включая отбеливание или дезодорирование, которые могут быть необходимыми или желательными, в зависимости от конечного применения, предполагаемого для продукта в виде рафинированного масла.
В определенном варианте осуществления в настоящем документе предусмотрены способы получения фосфолипидов, включающие:
a) смешение водного раствора кислоты с пищевым маслом с получением кислотной смеси, имеющей pH менее чем приблизительно 4;
b) смешение основания с кислотной смесью с получением прореагировавшей смеси, имеющей pH приблизительно 6-9, где смешение на стадиях a) и/или b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60% водной фазы по объему с размером капель приблизительно 15 мкм до приблизительно 45 мкм;
c) смешение фермента, выбранного из фосфолипазы A, фосфолипазы C, фосфатидил-инозитол-специфической фосфолипазы C, или их комбинации; и
d) выделение фосфолипидов.
В различных иллюстративных процессах по изобретению уровни фосфора снижаются достаточно низко для физической очистки. Процесс разделения может приводить потенциально к более высоким снижениям выхода, чем щелочная очистка. Кроме того, способы рафинирования могут обеспечивать побочные продукты, которые не могут быть проданы в качестве коммерческого лецитина, см., например, фигуру 2 для иллюстративного процесса рафинирования физически очищенных масел. Таким образом, эти процессы не достигают существенной доли рынка и процессы щелочной очистки продолжают доминировать в промышленности в случае рисовой шелухи, сои, канолы и подсолнуха. Однако следует отметить, что фермент фосфолипаза C, используемый в специализированном способе рафинирования, может снизить образование камеди и вернуть диглицеридную часть фосфолипидов обратно в масло.
В одном аспекте изобретение относится к способам использования PI-PLC по изобретению во фракции камеди. В одном аспекте этого способа масло добавляют к неочищенному маслу с получением эмульсии, которая приводит к перемещению фосфатидилхолина, фосфатидил-этаноламина и фосфатидилинозитола в водную фазу (рафинирование гидратацией).
После центрифугирования эти фосфолипиды являются основными компонентами водной фракции камеди. Фосфолипиды во фракции камеди можно обрабатывать фосфолипазой C или фосфолипазой D вместе с фосфатазой (или другими комбинациями, указанными ниже) с получением диацилглицерина (DAG) и фосфатного сложного эфира. В этот момент DAG можно экстрагировать из других компонентов камедей и обрабатывать липазой в условиях, пригодных для переэтерификации DAG, с получением желаемого триацилглицерина (структурированный липид).
В другом аспекте большую часть 1,2-DAG можно конвертировать в 1,3-DAG путем увеличения pH камеди после реакции с PLC, например, путем добавления щелочи. Затем 1,3-DAG можно экстрагировать из камеди и подвергать реакции с липазой в подходящих условиях для переэтерификации 1,3-DAG в sn2-положении для образования желаемого структурированного триацилглицерина.
В альтернативных аспектах жирные кислоты, используемые в реакции переэтерификации, могут происходить из различных источников, включая свободные жирные кислоты, находящиеся в неочищенном масле.
В одном аспекте фосфолипиды после рафинирования гидратацией используют в комбинации с PLC по изобретению для образования структурированных липидов. Рафинированное гидратацией масло можно подвергать воздействию PLC и/или PLD (любой или оба из них могут представлять собой ферменты по изобретению) вместе с фосфатазой или одной из этих комбинаций, с последующим воздействием PLA (может быть ферментом по изобретению) для снижения уровней фосфора, пригодных для щелочной или физической очистки.
В альтернативных вариантах осуществления комбинация ферментов, которые можно использовать в способах по изобретению, включая эти способы рафинирования, включает (где один, несколько или все из ферментов в комбинации включают фермент по настоящему изобретению):
- PLC+PI-PLC+PLA (PLA добавляют после завершения реакций PLC);
- PLD+фосфатаза+PI-PLC, а затем PLA; или
- PLC или (PLC+PI-PLC)+PLA, специфичные к фосфатидной кислоте (все ферменты добавляют вместе или последовательно).
Щелочная очистка
Изобретение относится к способам использования фосфолипаз (включая ферменты по изобретению) в щелочной очистке, где ферменты используют в качестве добавок для щелочной очистки. В альтернативных аспектах, PLC или PLD и/или фосфатазу используют в способах в качестве добавки до, в ходе или после процесса очистки нейтрализацией щелочью (либо непрерывной, либо периодической очистки). Количество добавляемого фермента может варьировать, в зависимости от способа. Уровень воды, используемый в способе, может быть низким, например, приблизительно от 0,5 до 5%.
Альтернативно щелочь добавляют в способе несколько раз. Кроме того, способ можно проводить при различных температурах (от 25°C до 70°C), с различными кислотами или щелочами и при различных pH (4-12). Можно использовать концентрированные растворы щелочи, например, более концентрированные, чем промышленный стандарт 11%, для уменьшения массы камеди. В альтернативных аспектах концентрированный раствор щелочи является концентрированным на приблизительно 12-50%, например, приблизительно на 20%, 30%, 40%, 50% или 60% или более концентрированным.
В одном аспекте фермент фосфолипаза C по изобретению гидролизует фосфатид по глицерилфосфоэфирной связи с образованием диглицерида и растворимого в воде фосфатного соединения. Гидролизованный фосфатид перемещается в водную фазу, оставляя диглицерид в масляной фазе, как проиллюстрировано на фигуре 3. Одной из задач "добавки для щелочной очистки" PLC является конвертирование фосфолипидных камедей, образованных в ходе нейтрализации, в диацилглицерид, который мигрирует обратно в масляную фазу. Напротив, одной из задач "добавки для рафинирования PLC" является снижение количества фосфолипидов в неочищенном масле до эквивалента фосфора менее 10 миллионных долей (м.д.).
Кислоты, которые можно использовать в способе щелочной очистки, включают, но не ограничиваются ими, фосфорную, лимонную, аскорбиновую, серную, фумаровую, малеиновую, хлористоводородную и/или уксусную кислоты. Кислоты используют для гидратации негидратируемых фосфолипидов. Щелочи, которые можно использовать, включают, но не ограничиваются ими, KOH и NaOH. Щелочи используют для нейтрализации свободных жирных кислот. Альтернативно фосфолипазы, или более конкретно PLC или PLD и фосфатазу, используют для очистки фитостеринов из камеди/соапстока.
В варианте осуществления изобретения, альтернативном относительно добавления фосфолипазы до щелочной очистки, фосфолипазу экспрессируют в растении. В другом варианте осуществления фосфолипазу добавляют в ходе измельчения растения, семян или другой части растения.
Альтернативно фосфолипазу добавляют после измельчения, но до очистки (т.е. в емкостях для выдерживания). Кроме того, фосфолипазу добавляют в качестве предварительной обработки в процессе очистки, либо с кислотой, либо без нее.
Другим вариантом осуществления изобретения, уже описанным, являемся добавление фосфолипазы в процессе щелочной очистки. В этом способе уровни кислоты и щелочи варьируют, в зависимости от уровня фосфора и уровня свободных жирных кислот. Кроме того, в этом способе используют широкие диапазоны температуры и pH, в зависимости от типа используемого фермента.
В другом варианте осуществления изобретения фосфолипазу добавляют после щелочной очистки (фигура 5). В одном примере фосфолипазу добавляют в интенсивный смеситель или в ретенционный смеситель перед разделением. Альтернативно фосфолипазу добавляют после стадии нагревания. В другом варианте осуществления фосфолипазу добавляют на стадии центрифугирования. В дополнительном варианте осуществления фосфолипазу добавляют соапстоку. Альтернативно фосфолипазу добавляют к смывной воде. В другом примере фосфолипазу добавляют в ходе стадий отбеливания и/или дезодорирования.
В одном аспекте фермент фосфолипазы, например, фосфолипаза C, по изобретению гидролизует фосфатид как из гидратируемых, так и из негидратируемых фосфолипидов в нейтрализованных неочищенных и рафинированных маслах до отбеливания и дезодорирования. Иллюстративные способы "щелочной очистки" по изобретению проиллюстрированы на фигуре 4 и фигуре 6. Фигура 4 включает иллюстративное время воздействия, температуру и pH для статического смесителя (от 30 до 60 мин, от 50 до 60°C, pH от 5 до 6,5) и ретенционного смесителя (от 3 до 10 мин, от 20 до 40°C). Заданный фермент можно применять в качестве добавки в имеющемся способе щелочной нейтрализации, как проиллюстрировано на фигуре 4. В этом аспекте не требуется, чтобы фермент выдерживал крайние уровни pH, если его добавляют после добавления щелочи. Как проиллюстрировано на фигуре 6 (иллюстративный процесс с "предварительным добавлением" фермента), в процессе рафинирования неочищенного масла можно использовать любую фосфолипазу, включая, например, фосфолипазу по изобретению, такую как PLC, PI-PLC, PLB, PLA и/или PLC, как описано, например, в Bailey's Industrial Oil & Fat Products v.4 (ed. Y. H. Hui). На фигуре 7 и фигуре 8 проиллюстрированы варианты способов по изобретению, где в способе, который можно использовать для переработки любого масла, например, растительного масла, такого как неочищенное соевое масло, используют две или три стадии центрифугирования, как показано на фигуре. Иллюстративный способ, представленный на фигуре 8, имеет стадию центрифугирования перед щелочной очисткой (в дополнение к стадии центрифугирования после щелочной очистки и до стадии промывания, и после промывания водой), в то время как иллюстративный способ, представленный на фигуре 7, не имеет стадию центрифугирования перед щелочной очисткой. На фигуре 9 проиллюстрирован другой иллюстративный вариант этого способа, в котором используется обработка кислотой и имеется стадия центрифугирования перед стадией рафинирования; этот иллюстративный способ можно использовать для переработки любого масла, например, растительного масла, такого как неочищенное соевое масло, как представлено на фигуре.
В одном аспекте фосфолипаза по изобретению обеспечивает удаление фосфора до низких уровней, приемлемых в физической очистке. В одном аспекте PLC по изобретению гидролизует фосфатиды как гидратируемых, так и негидратируемых фосфолипидов, в неочищенных маслах перед отбеливанием и дезодорированием. Заданный фермент можно применять в качестве добавки в имеющийся процесс рафинирования, см., например, фигуру 5. Учитывая неоптимальное перемешивание в коммерческом оборудовании, вероятно, что потребуется кислота для контактирования негидратируемых фосфолипидов с ферментом на поверхности контакта масло/вода. Таким образом, в одном аспекте используют устойчивую к кислотам PLC по изобретению.
В одном аспекте способ рафинирования с добавкой PLC по изобретению может устранять потери в одной, или всех трех, из областей, указанных в таблице 4. Соответствующие потери в процессе с PLC могут быть оценены как приблизительно 0,8% против 5,2% в расчете на массу вследствие удаления фосфатида.
Потери, на снижение которых направлены продукты PLC
Дополнительные потенциальные преимущества этого способа по изобретению включают следующие:
- Сниженное количество адсорбентов - требуется меньше адсорбентов с более низким (<5 м.д.) содержанием фосфора
- Сниженное использование химических реагентов - затраты на химические реагенты и переработку, связанные с гидратацией негидратируемых фосфолипидов
- Меньшее образование отходов - меньше воды требуется для удаления фосфора из масла
Масла, переработанные (например, "рафинированные") способами по изобретению, включают масла семян масличных растений, например, соевое масло, рапсовое масло, рисовое масло и подсолнечное масло. В одном аспекте "добавка PLC для щелочной очистки" по изобретению может экономить 1,2% относительно существующих способов щелочной очистки. Применение добавки для очистки направлено на соевое масло, которое было рафинировано для получения лецитина, и это также исключают из вычислений величина/нагрузка.
Мишени для эффективности способов по изобретению могут варьировать, в зависимости от применений и, более конкретно, в зависимости от момента добавления фермента, см. таблицу 5.
Мишени для эффективности по применению
† Целевые уровни, достигаемые в предыдущей стадии нейтрализации щелочью, но должны сохраняться
‡ 1-2 часа существования
‡‡ Рафинирование кислотой требует фермента, который является стабильным при значительно более кислых условиях: pH 2,3 для 5% лимонной кислоты. (~Roehm USPN 6001640)
‡‡‡ pH нейтрализованного масла не является нейтральным. Тестирование в POS указывает на то, что pH находится в щелочном диапазоне от 6,5-10 (9 декабря 2002 года). Типичный диапазон pH необходимо определять
Другие способы, которые можно использовать с фосфолипазой по изобретению, например, фосфолипазой A1, могут конвертировать негидратируемые нативные фосфолипиды в гидратируемую форму. В одном аспекте фермент является чувствительным к нагреванию. Это может быть желательным, поскольку нагревание масла может разрушить фермент. Однако pH реакции рафинирования необходимо доводить до pH 4-5 и 60°C для приспосабливания к этому ферменту. При насыщающей дозировке масла 300 единиц/кг, этот иллюстративный способ является успешным в отношении снижения содержания фосфора в ранее рафинированном гидратацией масла до ≤10 м.д. P. Преимущества могут состоять в сниженном содержании H2O и полученной экономии с точки зрения использования, хранения и утилизации. В таблице 6 приведены иллюстративные промышленные применения ферментов по изобретению:
Иллюстративное применение
В дополнение к этим различным способам "рафинирования", фосфолипазы по изобретению можно использовать на любой стадии переработки растительных масел. Например, ферменты фосфолипазы по изобретению можно использовать вместо PLA, например, фосфолипазы A2, на любой стадии переработки растительного масла. Масла, которые "перерабатывают" или "рафинируют" способами по изобретению, включают соевое масло, рапсовое масло, кукурузное масло, пальмоядровое масло, масло канолы, подсолнечное масло, кунжутное масло, арахисовое масло, рисовое масло и т.п. Основные продукты этого способа включают триглицериды.
В одном иллюстративном способе, когда фермент добавляют к и подвергают реакции с неочищенным маслом, используемое количество фосфолипазы составляет приблизительно 10-10000 единиц или альтернативно приблизительно 100-2000 единиц на 1 кг неочищенного масла. Обработку ферментом проводят в течение от 5 мин до 10 часов при температуре от 30°C до 90°C или альтернативно приблизительно от 40°C до 70°C. Условия могут варьировать, в зависимости от оптимальной температуры фермента. Количество воды, добавляемой для растворения фермента, составляет 5-1000 масс. частей на 100 масс. частей неочищенного масла или альтернативно приблизительно от 10 до 200 масс. частей на 100 масс. частей неочищенного масла.
После завершения такой обработки ферментами, жидкость с ферментом отделяют с помощью соответствующего устройства, например, центробежного сепаратора, и получают переработанное масло. Содержащие фосфор соединения, продуцируемые расщеплением ферментом камедеобразных веществ в таком способе, практически все переходят в водную фазу и удаляются из масляной фазы. После завершения обработки ферментом необходимо, чтобы переработанное масло дополнительно промыли водой или органической или неорганической кислотой, например, такой как уксусная кислота, лимонная кислота, фосфорная кислота, янтарная кислота и эквивалентные кислоты, или солевыми растворами.
В одном иллюстративном способе рафинирования с ультрафильтрацией фермент связывают с фильтром или фермент добавляют в масло перед фильтрацией или фермент используют для периодической очистки фильтров.
В одном иллюстративном способе опосредуемой добавкой фосфолипазы физической очистки воду и фермент добавляют к неочищенному маслу (например, неочищенному растительному маслу). В одном аспекте в способе используют PLC или PLD по изобретению и фосфатазу. В опосредуемой фосфолипазой физической очистке уровень воды может быть низким, т.е. 0,5-5%, и время процесса должно быть коротким (менее 2 часов, или менее 60 минут, или менее 30 минут, или менее 15 минут, или менее 5 минут). Способ можно выполнять при различных температурах (от 25°C до 70°C), с использованием различных кислот и/или щелочей, при различных pH (например, 3-10).
В альтернативных аспектах сначала проводят рафинирование гидратацией для сбора лецитина центрифугированием, а затем добавляют PLC или PLC и PLA по изобретению для удаления негидратируемых фосфолипидов (способ следует выполнять при низкой концентрации воды). В другом аспекте проводят рафинирование гидратацией неочищенного масла до менее чем 10 м.д. (пищевые масла) и последующую физическую очистку (менее 50 м.д. для биодизеля). В одном аспекте добавляют эмульгатор и/или неочищенное масло перемешивают в интенсивном смесителе. Альтернативно добавляют реагент для расслоения эмульсии и/или неочищенное масло нагревают для обеспечения отделения водной фазы. В другом аспекте добавляют кислоту для обеспечения гидратации негидратируемых фосфолипидов. Кроме того, фосфолипазы можно использовать для обеспечения очистки фитостеринов из камеди/соапстока.
В одном аспекте изобретение относится к композициям и способам (которые могут включать применение фосфолипаз по изобретению) для рафинирования масла, включающим применение различных количеств кислоты и основания формирования соапстока. С использованием этого аспекта изобретения для рафинирования масла можно использовать кислоту (включая фосфорную и/или лимонную кислоту) для гидратации негидратируемых фосфолипидов в маслах с высоким содержанием фосфора (включая масла сои, канолы и подсолнуха). После гидратации фосфолипидов pH водной фазы можно увеличивать с использованием добавления щелочи: количество добавляемой щелочи может обеспечить благоприятное значение pH для ферментативной активности, но не приведет к образованию в масле существенной фракции соапстока. Поскольку соапсток не образуется, свободные жирные кислоты в масле можно удалять позднее, после стадии рафинирования, в ходе отбеливания и дезодорирования.
Ферменты по изобретению используют для усовершенствования экстракции масла и рафинирования масла (например, растительных масел). В одном аспекте в способе по изобретению используют PLC по изобретению и по меньшей мере одно средство для разрушения клеточной стенки растений (например, целлюлазу, гемицеллюлазу или сходные с ними, для размягчения стенок и увеличения выхода при экстракции). В этом иллюстративном подходе применения ферментов по изобретению для усовершенствования экстракции масла и рафинирования масла фосфолипазу C по изобретению, а также другие гидролазы (например, целлюлазу, гемицеллюлазу, эстеразу, протеазу и/или фосфатазу) используют на стадиях измельчения, связанных с производством масла (включая, но не ограничиваясь ими, соевое масло, масло канолы, подсолнечное масло, рисовое масло). Используя ферменты до или вместо экстракции растворителем, можно увеличить выход масла и снизить количество гидратируемых и негидратируемых фосфолипидов в неочищенном масле. Снижение количества негидратируемых фосфолипидов может быть результатом конверсии потенциально негидратируемых фосфолипидов в диацилглицерин и соответствующий фосфатный сложный эфир перед образованием комплексов с кальцием или магнием. Общее снижение количества фосфолипидов в неочищенном масле обеспечивает увеличенные выхода в процессе очистки с потенциальным устранением необходимости отдельной стадии рафинирования перед отбеливанием или дезодорированием.
В одном аспекте изобретение относится к способам использования фосфолипазы по изобретению (например, фосфолипаза-специфической фосфогидролазы по изобретению), или другой фосфолипазы в модифицированном "способе органической очистки", который может включать добавление фермента (например, PI-PLC) в емкость для хранения лимонной кислоты.
Ферменты по изобретению можно использовать в любом способе переработки масла, например, в способах рафинирования или эквивалентных способах. Например, ферменты по изобретению можно использовать в способах, описанных в патентах США No. 5558781; 5264367; 6001640. В способе, описанном в USPN 5558781, используется любая из фосфолипазы A1, A2 или B, по существу разрушающие лецитин в масле, которые выступают в качестве эмульгатора.
Ферменты и способы по изобретению можно использовать в способах снижения содержания фосфорсодержащих компонентов в пищевых маслах, включающих высокое количество негидратируемого фосфора, с использованием фосфолипазы по изобретению, например, полипептида, обладающего активностью фосфолипазы A и/или B, как описано, например, в патенте EP под номером: EP 0869167. В одном аспекте пищевое масло представляет собой неочищенное масло, так называемое "нерафинированное масло". В одном аспекте способом перерабатывают нерафинированное масло, включая прессованные масла или экстрагированные масла, или их смесь, из, например, рапса, соевых бобов, кунжута, арахиса, кукурузы, рисовой шелухи или подсолнуха. Содержание фосфатидов в неочищенном масле может варьировать от 0,5 до 3% масс./масс., что соответствует содержанию фосфора в диапазоне от 200 до 1200 м.д. или в диапазоне от 250 до 1200 м.д. Помимо фосфатидов, неочищенное масло также может содержать небольшие концентрации углеводов, соединений сахаров и комплексов металл/фосфатидная кислота с Ca, Mg и Fe. В одном аспекте способ включает обработку фосфолипида или лизофосфолипида фосфолипазой по изобретению, чтобы гидролизовать жирные ацильные группы. В одном аспекте фосфолипид или лизофосфолипид содержит лецитин или лизолецитин. В одном аспекте способа пищевое масло имеет содержание фосфора приблизительно от 50 до 250 м.д., и способ включает обработку масла фосфолипазой по изобретению, так чтобы гидролизовать основную часть фосфолипида, и отделение водной фазы, содержащей гидролизованный фосфолипид, от масла. В одном аспекте перед способом ферментативного рафинирования масло рафинируют гидратацией. В одном аспекте предусмотрены способы производства корма для животных, включающие смешение фосфолипазы по изобретению с кормовым материалом и по меньшей мере одним фосфолипидом.
Ферменты и способы по изобретению можно использовать в способах рафинирования масла, как описано, например, в WO 98/18912. Фосфолипазы по изобретению можно использовать для уменьшения содержания фосфолипида в пищевом масле. Способ может включать обработку масла фосфолипазой по изобретению для гидролиза основной части фосфолипида и отделения водной фазы, содержащей гидролизованный фосфолипид, от масла. Этот способ применим для очистки любого пищевого масла, которое содержит фосфолипид, например, растительных масел, таких как соевое масло, рисовое масло, рапсовое масло и подсолнечное масло, рыбьего жира, водорослей и животных жиров и т.д. Перед ферментативной обработкой растительное масло предпочтительно предварительно удаляют для удаления ила (слизистое вещество), например, влажной очисткой. Масло может содержать приблизительно от 50 до 250 м.д., или от 50 до приблизительно 1500 м.д. или более фосфора в качестве фосфолипида в начале обработке фосфолипазой, и способ по изобретению может снижать эту величину до менее чем приблизительно от 5 до 10 м.д.
Ферменты по изобретению можно использовать в способах, описанных в заявке JP No.: H5-132283, поданной 25 апреля 1993 года, которая включает способ очистки масел и жиров, включающий стадию конвертирования фосфолипидов, присутствующих в маслах и жирах, в растворимые в воде вещества, содержащие группы фосфорной кислоты, и удаление их в качестве растворимых в воде веществ. Действие фермента используют для конвертирования в растворимые в воде вещества. Предпочтительно в качестве фермента используют фермент, обладающий активностью фосфолипазы C.
Ферменты по изобретению можно использовать в способах, описанных в качестве "способа органической очистки", (ORP) (IPH, Omaha, NE), который представляет собой способ очитки масел семян. ORP может иметь преимущества относительно традиционной химической очистки, включая увеличенный выход рафинированного масла, дополнительную стоимость совместно образующихся продуктов, сниженные капитальные затраты и более низкие затраты, связанные с охраной окружающей среды.
Ферменты по изобретению можно использовать в способах обработки масла или жира, животного или растительного, необработанного, полуобработанного или очищенного, включающих добавление к такому маслу или жиру по меньшей мере одного фермента по изобретению, который обеспечивает гидролиз и/или деполимеризацию неглицеридных соединений, содержащихся в масле, как описано, например, в заявке EP под номером: 82870032.8. Иллюстративные способы по изобретению для гидролиза и/или деполимеризации неглицеридных соединений в маслах представляют собой:
1) Добавление и примешивание к маслам и жирам фермента по изобретению или ферментных комплексов, ранее растворенных в небольшом количестве подходящего растворителя (например, воды). Возможно определенное количество растворителей, но выбирают нетоксический и пригодный для фермента растворитель. Это добавление можно проводить в способах с последовательным добавлением, а также в непрерывных способах. Количество фермента(ов), которое необходимо добавлять к маслам и жирам, согласно этому способу, может варьировать, в зависимости от ферментов и продуктов, подлежащих переработке, приблизительно от 5 до 400 м.д., или приблизительно от 20 до 400 м.д.; например, от 0,005 кг до 0,4 кг фермента на 1000 кг масла или жира, и предпочтительно от 5 до 100 м.д., т.е. от 0,005 до 0,1 кг фермента на 1000 кг масла, эти величины приведены для концентрированных ферментов, т.е. без разбавителя или растворителя.
2) Пропускание масла или жира через фиксированный или нерастворимый фильтрующий слой фермента(ов) по изобретению на твердых или полутвердых подложках, предпочтительно представляющих собой пористую или волокнистую структуру. В этом способе ферменты улавливаются в микрополости пористой или волокнистой структуры подложек. Они состоят, например, из смол или синтетических полимеров, карбонатов целлюлозы, гелей, таких как агароза, волокон полимеров или сополимеров с пористой структурой, улавливающих небольшие капли фермента в растворе в их полости. Что касается концентрации фермента, она может доходить вплоть до насыщения подложек.
3) Диспергирование масел и жиров в форме мелких капель в разбавленном растворе фермента, в альтернативных аспектах, содержащем приблизительно от 0,05 до 4%, или содержащем приблизительно от 0,2 до 4%, по объему фермента по изобретению. Этот способ описан, например, в патенте Бельгии No. 595219. Цилиндрическую колонну высотой несколько метров с конической крышкой заполняют разбавленным раствором фермента. Для этой цели выбирают растворитель, который является нетоксическим и не смешивающимся с маслом или жиром, подлежащим переработке, предпочтительно воду. Дно колонны оборудуют распределительной системой, в которой масло или жир инжектируются в высокой степени разделенной форме (приблизительно 10000 единиц потока на м2). Таким образом, образуется бесконечное количество капель масла или жира, которые медленно поднимаются в растворе фермента и встречаются на поверхности, непрерывно откачиваясь сверху конической крышки реактора.
Перед обработкой ферментом по изобретению пальмовое масло можно предварительно обрабатывать. Например, приблизительно 30 кг необработанного пальмового масла нагревают при +50°C. Приготавливают 1% растворы в дистиллированной воде с целлюлазами и пектиназами. 600 г каждого из них добавляют к водным растворам масла при энергичном встряхивании в течение нескольких минут. Затем масло выдерживают при +50°C при умеренном встряхивании в течение общего времени реакции два часа. Затем, температуру увеличивают до +90°C для инактивации ферментов и получения смеси для фильтрации и дальнейшей переработки. Масло сушат в вакууме и фильтруют с помощью фильтрующей добавки.
Ферменты по изобретению можно использовать в способах, описанных в патенте EP 0 513 709 B2. Например, изобретение относится к способу уменьшения содержания содержащих фосфор компонентов в животных и растительных маслах путем ферментативного расщепления с использованием фосфолипазы по изобретению. В альтернативных аспектах животные и растительные масла с предварительно удаленным слизистым слоем с содержание фосфора приблизительно от 50 до 1500 м.д. или приблизительно от 50 до 250 м.д., встряхивают с органической карбоновой кислотой и величину pH полученной смеси доводят приблизительно до pH 4-pH 6, к смеси добавляют раствор фермента, который содержит фосфолипазу A1, A2 или B по изобретению в емкости для смешения при вихревом перемешивании и с образованием мелких капель, где образуется эмульсия с от 0,5 до 5% по массе относительно масла, где указанную эмульсию пропускают по меньшей мере через одну последующую реакционную емкость при вихревом перемешивании в течение времени реакции от 0,1 до 10 часов при температурах в диапазоне от 20 до 80°C и где обработанное масло после отделения от водного раствора имеет содержание фосфора менее 5 м.д.
Способ органической очистки применим как для неочищенного, так и для рафинированного масла. В способе используется добавление в ходе выполнения этого способа органической кислоты в контролируемых условиях процесса, совместно с общепринятым разделением центрифугированием. Воду, отделенную естественным образом от фосфолипидов растительных масел ("VOP"), возвращают в процесс и повторно используют. Общее использование воды может быть существенно снижено в результате способа органической очистки.
Фосфолипазы и способы по изобретению также можно использовать в ферментативной обработке пищевых масел, как описано, например, в патенте США No. 6162623. В этих иллюстративных способах изобретение относится к амфифильному ферменту. Он может быть иммобилизован, например, путем приготовления эмульсии, содержащей непрерывную гидрофобную фазу и диспергированную водную фазу, содержащую фермент и носитель для фермента, и удаления воды из диспергированной фазы до тех пор, пока эта фаза не превратиться в твердые покрытые ферментом частицы. Фермент может представлять собой липазу. Иммобилизованную липазу можно использовать для реакций, катализируемых липазой, таких как переэтерификация моно-, ди- или триглицеридов, снижение кислотности триглицеридного масла или удаление фосфолипидов из триглицеридного масла, когда липаза представляет собой фосфолипазу. Водная фаза может содержать жидкость для ферментации, пищевое триглицеридное масло может представлять собой гидрофобную фазу, и носители включают сахара, крахмал, декстран, растворимые в воде производные целлюлозы и остатки после ферментации.
Этот иллюстративный способ можно использовать для переработки триглицеридов, диглицеридов, моноглицеридов, глицерина, фосфолипидов, гликолипидов или жирных кислот, которые могут быть в гидрофобной фазе. В одном аспекте предусмотрен способ удаления фосфолипидов из триглицеридного масла, включающий смешение триглицеридного масла, содержащего фосфолипиды, с препаратом, содержащим фосфолипазу по изобретению; гидролиз фосфолипидов до лизофосфолипида; отделение гидролизованных фосфолипидов от масла, где фосфолипаза представляет собой иммобилизованную фосфолипазу.
Фосфолипазы и способы по изобретению также можно использовать в ферментативной обработке пищевых масел, как описано, например, в патенте США No. 6127137. В этом иллюстративном способе осуществляется гидролиз обеих жирных ацильных групп в неизмененном фосфолипиде. Фосфолипаза по изобретению, используемая в этом иллюстративном способе, не обладает активностью липазы и является активной при очень низких значениях pH. Эти свойства делают ее в высокой степени пригодной для применения в рафинировании масла, поскольку может снижаться как ферментативный, так и щелочной гидролиз (сапонификация) масла. В одном аспекте изобретение относится к способу гидролиза жирных ацилных групп в фосфолипиде или лизофосфолипиде, включающему обработку фосфолипида или лизофосфолипида фосфолипазой, которая гидролизует обе жирные ацильные группы в фосфолипиде и по существу свободна от активности липазы. В одном аспекте фосфолипаза по изобретению имеет оптимальную температуру при приблизительно 50°C, измеренную при от pH 3 до pH 4 в течение 10 минут, и оптимальное значение pH 3, измеренное при 40°C в течение приблизительно 10 минут. В одном аспекте фосфолипид или лизофосфолипид содержит лецитин или лизолецитин. В одном аспекте после гидролиза основной части фосфолипида, водную фазу, содержащую гидролизованный фосфолипид, отделяют от масла. В одном аспекте изобретение относится к способу удаления фосфолипида из пищевого масла, включающему обработку масла при pH 1,5-3 дисперсией водного раствора фосфолипазы по изобретению, и отделение водной фазы, содержащей гидролизованный фосфолипид, от масла. В одном аспекте перед обработкой фосфолипазой масло обрабатывают для удаления слизистого материала. В одном аспекте перед обработкой фосфолипазой масло содержит фосфолипид в количестве, соответствующем от 50 до 250 м.д. фосфора. В одном аспекте обработку фосфолипазой проводят при от 30°C до 45°C в течение от 1 до 12 часов при дозировке фосфолипазы от 0,1 до 10 мг/л в присутствии 0,5-5% воды.
Фосфолипазы и способы по изобретению также можно испоюльзовать в ферментативной обработке пищевых масел, как описано, например, в патенте США No. 6025171. В этих иллюстративных способах ферменты по изобретению иммобилизуют путем приготовления эмульсии, содержащей непрерывную гидрофобную фазу, такую как триглицеридное масло, и диспергированную водную фазу, содержащую амфифильный фермент, такой как липаза или фосфолипаза по изобретению, и носитель, который частично растворен и частично не растворен в водной фазе, и удаление воды из водной фазы до тех пор, пока фаза не превратиться в твердые покрытые ферментом частицы носителя. Нерастворенная часть носителя может представлять собой материал, который нерастворим в воде и масле, или растворимый в воде материал в нерастворенной форме, поскольку водная фаза уже насыщена растворимым в воде материалом. Водная фаза может быть образована неочищенной жидкостью для ферментации липазой, содержащей остатки ферментации и биомассу, которая служит в качестве носителя. Иммобилизованная липаза пригодна для перегруппировки сложных эфиров и снижения кислотности масел. После реакции иммобилизованный фермент можно регенерировать для последующей реакции путем добавления воды для обеспечения частичного растворения носителя, и, когда полученная водная фаза, содержащая фермент и носитель, диспергируется в гидрофобной фазе, упариванием воды, вновь формируя покрытые ферментом частицы носителя.
Фосфолипазы и способы по изобретению также можно использовать в ферментативной обработке пищевых масел, как описано, например, в патенте США No. 6143545. Этот иллюстративный способ используют для снижения содержания фосфорсодержащих компонентов в пищевом масле, содержащем высокое количество негидратируемых фосфорсодержащих компонентов, с использованием фосфолипазы по изобретению. В одном аспекте способ используют для снижения содержания фосфорсодержащих компонентов в пищевом масле, имеющем содержание негидратируемых фосфорсодержащих компонентов по меньшей мере 50 м.д., измеренное путем предварительной обработки пищевого масла при 60°C, добавления раствора, содержащего моногидрат лимонной кислоты в воде (добавление воды относительно масла составляет 4,8% масс./масс.; (лимонная кислота) в водной фазе = 106 мМ, в эмульсии вода/масло эмульсия = 4,6 мМ) в течение 30 минут; переноса 10 мл предварительно обработанной воды в масляной эмульсии в пробирку; нагревания эмульсии на кипящей водяной бане в течение 30 минут; центрифугирования при 5000 об./мин. в течение 10 минут, переноса приблизительно 8 мл верхней (масляной фазы) в новую пробирку и оставляя для осаждения на 24 часа; и отбора 2 г из верхней прозрачной фазы для измерения содержания негидратируемых фосфорсодержащих компонентов (м.д.) в пищевом масле. Также способ может включать контактирование масла при pH приблизительно от pH 5 до 8 с водным раствором фосфолипазы A или B по изобретению (например, PLA1, PLA2 или PLB), который эмульгируют в масле до тех пор, пока содержание фосфора в масле не снизится до менее чем 11 м.д., а затем отделение водной фазы от обработанного масла.
Фосфолипазы и способы по изобретению также можно использовать в ферментативной обработке пищевых масел, как описано, например, в патенте США No. 5532163. Изобретение относится к способам очистки масла и жира, посредством которых фосфолипиды в масле и жире, подлежащие обработке, можно эффективно расщеплять и удалять. В одном аспекте изобретение относится к способу очистки масла и жира, который включает реакцию в эмульсии масла и жира с ферментом по изобретению, например, ферментом, обладающим активностью расщепления сложноэфирных связей глицерин-жирная кислота в глицерофосфолипидах (например, PLA2 по изобретению); и к другому способу, в котором обработанные ферментом масло и жир промывают водой или водным раствором кислоты. В одном аспекте водный раствор кислоты, предназначенный для применения на стадии промывания, представляет собой раствор по меньшей мере одной кислоты, например, лимонной кислоты, уксусной кислоты, фосфорной кислоты и их солей. В одном аспекте эмульгированное состояние обеспечивают с использованием 30 частей по массе или более воды на 100 частей по массе масла и жира. Поскольку масло и жир можно очищать без применения общепринятой стадии щелочной очистки, может быть снижено образование сточной промывочной воды и промышленных отходов. Кроме того, выход масла увеличивается, поскольку в способе по изобретению не происходит потеря нейтрального масла и жира вследствие их включения в эти отходы. В одном аспекте изобретение относится к способу очистки масла и жира, содержащего приблизительно от 100 до 10000 м.д. фосфолипидов, который включает: реакцию в эмульгированном состоянии указанного масла и жира с ферментом по изобретению, имеющим активность расщепления сложноэфирных связей глицерин-жирная кислота в глицерофосфолипидах. В одном аспекте изобретение относится к способам очистки масла и жира, содержащих приблизительно от 100 до 10000 м.д. фосфолипидов, которые включают реакцию в эмульгированном состоянии масла и жира с ферментом по изобретению, имеющим активность расщепления сложноэфирных связей глицерин-жирная кислота в глицерофосфолипидах; а затем промывание обработанного масла и жира промывочной водой.
Фосфолипазы и способы по изобретению также можно использовать в ферментативной обработке пищевых масел, как описано, например, в патенте США No. 5264367. Содержание фосфорсодержащих компонентов и содержание железа в пищевом растительном или животном масле, например, таком как масло, например, соевое масло, которое подвергнуто влажной очистке для удаления клейкого материала, снижают ферментативным расщеплением путем контактирования масла с водным раствором фермента по изобретению, например, фосфолипазой A1, A2 или B, а затем отделения водной фазы от обработанного масла. В одном аспекте изобретение относится к ферментативному способу снижения содержания содержащих фосфор и железо компонентов в масле, очищенном для удаления клейкого материала. Масло, очищенное для удаления клейкого материала, можно обрабатывать ферментом по изобретению, например, фосфолипазой C, A1, A2 или B. Можно достигать содержания фосфора менее 5 м.д. и содержания железа менее 1 м.д. Низкое содержание железа может быть преимущественным для стабильности масла.
Фосфолипазы и способы по изобретению также можно использовать для получения переэтерифицированных масел, как описано, например, в патенте США No. 5288619. Изобретение относится к способам ферментативной переэтерификации для получения маргарина, имеющего низкое содержание транс-кислот и низкое содержание жирных кислот средней цепи. Способ включает стадии обеспечения переэтерификации реакционной смеси, содержащей источник стеариновой кислоты и пищевое жидкое растительное масло, переэтерификацию источника стеариновой кислоты и растительного масла с использованием специфичной к 1-, 3-положениям липазы, и, наконец, гидрогенизацию смеси жирных кислот с получением рециклированного источника стеариновой кислоты для повторного использования в реакции с растительным маслом. Изобретение также относится к противоточному способу получения переэтерифицированного масла. Способ включает стадии предоставления зоны реакции переэтерификации, содержащей специфичную к 1-, 3-положениям липазу, подачи растительного масла в зону переэтерификации, подачу источника стеариновой кислоты, подачу противоточной жидкости сверхкритического газа или сверхкритического сжиженного газа, проведение реакции переэтерификации потока триглицеридов с потоком стеариновой кислоты или сложного моноэфира стеариновой кислоты в зоне реакции, отведение потока переэтерифицированного триглициридного маргарина, отведение противоточной жидкой фазы, гидрогенизацию переэтерифицированной стеариновой кислоты или сложного моноэфира стеариновой кислоты для обеспечения гидрогенизированного рециклированного источника стеариновой кислоты, и подачу гидрогенизированного рециклированного источника стеариновой кислоты в зону реакции.
В одном аспекте в высокой степени ненасыщенное фосфолипидное соединение можно конвертировать в триглицерид путем соответствующего применения фосфолипазы C по изобретению для удаления фосфатной группы в sn-3 положении, с последующим синтезом 1,3-липазой ацилэфиров. 2-замещенный фосфолипид можно использовать в качестве функционального пищевого ингредиента, или его можно впоследствии селективно гидролизовать в реакторе 160 с использованием иммобилизованной фосфолипазы C по изобретению с получением 1-диглицерида, с последующей ферментативной этерификацией, как описано в настоящем документе, с образованием триглицеридного продукта, имеющего компонент в виде 2-замещенной полиненасыщенной жирной кислоты.
Фосфолипазы и способы по изобретению также можно использовать в способе ферментативного рафинирования, как описано, например, в патенте США No. 6001640. Этот способ по изобретению включает стадию рафинирования при производстве пищевых масел. Растительные масла, из которых удалены гидратируемые фосфатиды путем предшествующего способа рафинирования гидратацией, освобождают от негидратируемых фосфатидов путем ферментативной обработки с использованием фосфолипазы по изобретению. Способ может быть мягким, благоприятным с экономической точки зрения и с точки зрения воздействия на окружающую среду. В этом способе рафинирования используют фосфолипазы, которые гидролизуют только лизолецитин, но не лецитин.
В одном аспекте для обеспечения действия фермента по изобретению, обе фазы: масляная фаза и водная фаза, которые содержат фермент, должны быть смешаны в однородную смесь. Может быть недостаточно только перемешать их. Хорошую дисперсию фермента в масле обеспечивают, если ее растворяют в небольшом количестве воды, например, 0,5-5 масс.% (относительно масла), и эмульгируют в масле в этой форме, с образованием капель диаметром (средневзвешенным) менее 10 микрометров. Капли могут иметь размер менее 1 микромера. Можно проводить вихревое перемешивание с радиальной скоростью более 100 см/с. Также масло можно циркулировать в реакторе с использованием внешнего ротационного насоса. Водную фазу, содержащую фермент, также можно превращать в тонкую дисперсию под действием ультразвука. Можно использовать устройство для диспергирования.
Ферментативная реакция, вероятно, происходит при более широкой поверхности масляной и водной фазы. Целью всех этих мер по перемешиванию является обеспечение наибольшей возможной поверхности для водной фазы, которая содержит фермент. Добавление поверхностно-активных веществ увеличивает микродиспергирование водной фазы. Таким образом, в некоторых случаях, в раствор фермента добавляют поверхностно-активные вещества с величинами HLB более 9, такие как Na-додецилсульфат, как описано, например, в EP-A 0513709. Сходным эффективным способом усиления эмульгирования является добавление лизолецитина. Добавляемые количества могут находиться в диапазоне от 0,001% до 1% относительно масла. Температура в ходе обработки ферментом не является важной. Можно использовать температуры от 20°C до 80°C, однако последнюю из них можно использовать только в течение короткого периода времени. В этом аспекте используют фосфолипазу по изобретению, имеющую высокую температурную устойчивость и/или устойчивость к низким pH. Применение температур от 30°C до 50°C является оптимальным. Период обработки зависит от температуры, и он может уменьшаться при увеличении температуры. Обычно являются достаточными периоды времени от 0,1 до 10 часов, или от 1 до 5 часов. Реакцию проводят в реакторе для рафинирования, который может быть разделен на ступени, как описано, например, в DE-A 4339556. Таким образом, возможно непрерывное действие, а также периодическое действие. Реакцию можно проводить в ступенях с различной температурой. Например, инкубацию можно проводить в течение 3 часов при 40°C, затем в течение 1 часа при 60°C. Если реакция протекает в ступенях, это также дает возможность коррекции различных величин pH на отдельных ступенях. Например, на первой ступени pH раствора можно доводить до 7, например, и на второй ступени до 2,5, путем добавления лимонной кислоты. Однако по меньшей мере в одной ступени значение pH раствора фермента должно быть ниже 4 или ниже 3. Если pH впоследствии довести до уровня ниже этого, может произойти ухудшение эффекта. Таким образом, лимонную кислоту можно добавлять к раствору фермента до того, как последний примешивают к маслу.
После завершения обработки ферментом раствор фермента вместе с продуктами расщепления NHP, содержащимися в нем, можно отделять от масляной фазы, партиями или непрерывно, например, путем центрифугирования. Поскольку ферменты характеризуются высоким уровнем стабильности и количество продуктов расщепления, содержащихся в растворе, является небольшим (они могут выпадать в осадок в виде шлама) одну и ту же водную фазу фермента можно использовать несколько раз. Также существует возможность высвобождения фермента из шлама, см., например, DE-A 4339556, так чтобы раствор фермента, который по существу свободен от шлама, можно было использовать вновь. В одном аспекте этого способа рафинирования получают масла, которые содержат менее 15 м.д. фосфора. Одной из целей является содержание фосфора менее 10 м.д. или менее 5 м.д. В случае содержания фосфора менее 10 м.д. является вполне возможной дальнейшая переработка масла способом дистилляционного снижения кислотности. Из масла можно удалять ряд других ионов, таких как ионы магния, кальция, цинка, а также железа, например, до уровня менее 0,1 м.д. Таким образом, этот продукт обладает идеальными предпосылками для высокой устойчивости к окислению в ходе дальнейшей переработки и хранения.
Фосфолипазы и способы по изобретению также можно использовать для снижения количества фосфорсодержащих компонентов в растительных и животных маслах, как описано, например, в патенте EP 0513709. В этом способе содержание фосфорсодержащих компонентов, особенно фосфатидов, таких как лецитин и содержание железа в растительных и животных маслах, из которых ранее был удален клейкий материал, например, соевое масло, снижают ферментативным расщеплением с использованием фосфолипазы A1, A2 или B по изобретению.
Фосфолипазы и способы по изобретению также можно использовать для очистки жиров или масел, как описано, например, в JP 06306386. Изобретение относится к способам очистки жира или масла, включающим стадию превращения фосфолипида в жире или масле в растворимое в воде содержащее группу фосфора вещество и удаления этого вещества. Действие фермента по изобретению (например, PI-PLC) используют для превращения фосфолипида в это вещество. Таким образом, возможно очистить жир или масло без проведения стадии щелочной очистки, в которой образуются промышленные отходы, содержащие щелочную сточную воду и большое количество масла. Можно достигать увеличения выхода, поскольку потери нейтрального жира или масла с отходами можно снижать до нуля. В одном аспекте камедеобразные вещества конвертируют в растворимые в воде вещества и удаляют в качестве растворимых в воде веществ путем добавления фермента по изобретению, обладающего активностью фосфолипазы C, на стадии рафинирования неочищенного масла и проведения ферментативной обработки. В одном аспекте фосфолипаза C по изобретению обладает активностью, которая расщепляет фосфоэфирные связи глицерина и фосфорной кислоты в фосфолипидах. Если необходимо, способ может включать промывание обработанного ферментом масла водой или водным раствором кислоты. В одном аспекте фермент по изобретению добавляют к и подвергают реакции с неочищенным маслом. Используемое количество фосфолипазы C может составлять от 10 до 10000 единиц или приблизительно от 100 до 2000 единиц на 1 кг неочищенного масла.
Фосфолипазы и способы по изобретению также можно использовать для способов рафинирования гидратацией, как описано, например, в Dijkstra, Albert J., et al, Oleagineux, Corps Gras, Lipides (1998), 5(5), 367-370. В этом иллюстративном способе способ рафинирования гидратацией используют для получения лецитина и способов сухого рафинирования с использованием осуществляющей рафинирование кислоты и отбеливающей земли. Этот способ может быть экономически обоснованным только для масел с низким содержанием фосфатидов, например, пальмового масла, лауриновых масел и т.д. Для масел семян, имеющих высокое содержание NHP, используют способ рафинирования кислотой, причем этот способ проводят в маслобойке для обеспечения удаления камеди через муку. В одном аспекте на этом очищенное кислотой масло можно проводить "полирующее" действие перед физической очисткой.
Фосфолипазы и способы по изобретению также можно использовать для способов рафинирования, описанных, например, в Dijkstra, et al, Res. Dev. Dep., N.V. Vandemoortele Coord. Cent, Izegem, Belg. JAOCS, J. Am. Oil Chem. Soc. (1989), 66: 1002-1009. В этом иллюстративном способе общий процесс рафинирования вовлекает диспергирование кислоты, такой как H3PO4 или лимонная кислота, в соевом масле, обеспечение времени контакта, а затем примешивание основания, такого как каустическая сода или силикат Na, в эмульсию кислоты в масле. Это поддерживает степень нейтрализации, достаточно низкую, чтобы избежать образования мыл, поскольку это привело бы к увеличению потерь масла. Затем масло подают в центробежный сепаратор, где основная часть камедей удаляется из потока масла с образованием фазы камеди с минимальным содержанием масла. Затем поток масла подают во второй центробежный сепаратор для удаления всех оставшихся камедей с получением разбавленной фазы камеди, которую рециклируют. Промывание и высушивание или включенная в процесс очистка щелочью завершают этот процесс. После внедрения процесса общего рафинирования, по сравнению с классическим процессом щелочной очистки, достигают общего улучшения выхода приблизительно 0,5%. В целом рафинированное масло можно далее подвергать щелочной очистке, отбеливать и дезодорировать, или отбеливать и подвергать физической очистке.
Фосфолипазы и способы по изобретению также можно использовать для удаления негидратируемых фосфолипидов из растительного масла, например, соевого масла, как описано, например, в Hvolby, et al., Sojakagefabr., Copenhagen, Den., J. Amer. Oil Chem. Soc. (1971) 48:503-509. В этом иллюстративном способе рафинированное гидратацией масло смешивают при различных фиксированных значениях pH с буферными растворами с Ca++, Mg/Ca-связывающими реагентами и поверхностно-активными веществами или без них. Негидратируемые фосфолипиды можно удалять в неконвертированном состоянии в качестве компонента мицелл или смешанных эмульгаторов. Более того, негидратируемые фосфолипиды можно удалять конвертированием в диссоциированные формы, например, путем удаления Mg и Ca из фосфатидов, которое можно проводить путем подкисления или путем обработки образующими комплексы с Mg/Ca или осаждающими Mg/Ca реагентами. Удаление или химическая конверсия негидратируемых фосфолипидов может приводить к уменьшенному образованию эмульсии и увеличенному отделению масла со сниженным содержанием кислотности от слоя эмульсии и соапстока.
Фосфолипазы и способы по изобретению также можно использовать для рафинирования растительных масел, как описано, например, Buchold, et al, Frankfurt/Main, Germany. Fett Wissenschaft Technologie (1993), 95(8), 300-304. В этом иллюстративном способе по изобретению для рафинирования пищевых растительных масел, используют водные суспензии фермента по изобретению, например, фосфолипазы A2, для гидролиза жирной кислоты, связанной с sn2-положением фосфолипида, с образованием 1-ациллизофосфолипидов, которые нерастворимы в масле и, таким образом, более подвержены физическому отделению. Даже добавление небольших количеств, соответствующих приблизительно 700 единиц лецитазы/кг масла, приводит к остаточной концентрации P менее 10 м.д., так что химическую очистку можно заменять физической очисткой, устраняя необходимость в нейтрализации, расщеплении соапстока и обработке отработанной воды.
Фосфолипазы и способы по изобретению также можно использовать для рафинирования растительных масел, как описано, например, EnzyMax, Dahlke, Klaus, Dept. G-PDO, Lurgi Ol-Gas, Chemie, GmbH, Frankfurt, Germany. Oleagineux, Corps Gras, Lipides (1997), 4(1), 55-57. Этот иллюстративный способ представляет собой способ рафинирования для физической очистки практически любого типа масла. Путем ферментативно катализируемого гидролиза фосфатиды конвертируют в растворимые в воде лизофосфатиды, которые отделяют от масла центрифугированием. Остаточное содержание фосфора в ферментативно рафинированном масле может составлять только 2 м.д. P.
Фосфолипазы и способы по изобретению также можно использовать для рафинирования растительных масел, как описано, например, Cleenewerck, et al, N.V. Vamo Mills, Izegem, Belg. Fett Wissenschaft Technologie (1992), 94:317-22; и, Clausen, Kim; Nielsen, Munk. Novozymes A/S, Den. Dansk Kemi (2002) 83(2):24-27. фосфолипазы и способы по изобретению могут включать предварительную очистку растительных масел кислотами, как описано, например, Nilsson-Johansson, et al, Fats Oils Div., Alfa-Laval Food Eng. AB, Tumba, Swed. Fett Wissenschaft Technologie (1988), 90(11), 447-51; и, Munch, Ernst W. Cereol Deutschland GmbH, Mannheim, Germany. Editor(s): Wilson, Richard F. Proceedings of the World Conference on Oilseed Processing Utilization, Cancun, MX, Nov. 12-17, (2001), Meeting Date 2000, 17-20.
Фосфолипазы и способы по изобретению также можно использовать для рафинирования растительных масел, как описано, например, Jerzewska, et al, Inst. Przemyslu Miesnego i Tluszczowego, Warsaw, Pol, Tluszcze Jadalne (2001), 36(3/4), 97-110. В этом способе по изобретению, ферментативное рафинирование гидратированного рапсового масла с низким содержанием эруковой кислоты проводят с использованием фосфолипазы A2 по изобретению. Фермент может катализировать гидролиз сложноэфирных связей жирных кислот с центральным атомом углерода глицериновой части в фосфолипидах. Он может гидролизовать негидратируемые фосфолипиды до их соответствующих гидратируемых лизосоединений. В случае неочищенного препарата ферментов, лучших результатов можно достигать добавлением 2% препарата на 4 часа (удаление 87% P).
В другом иллюстративном способе по изобретению для рафинирования масла (или способ рафинирования масла с использованием фермента по изобретению), добавляют кислый полимер, например, альгинат или пектин. В этом способе рафинирования масла по изобретению кислый полимер (например, альгиновую кислоту или пектин или более растворимую солевую форму) добавляют к неочищенному маслу с низким содержанием воды (например, в диапазоне приблизительно от 0,5 до 5%). В этом аспекте кислые полимеры могут восстанавливать и/или разрушать комплексы фосфолипид-металл путем связывания кальция и/или магния в неочищенном масле, тем самым повышая растворимость негидратируемых фосфолипидов. В альтернативных аспектах эти фосфолипиды перемещаются на поверхность контакта масло/вода или входят в водную фазу и либо их конвертируют в диацилглицерин и соответствующую боковую цепь, либо неизмененный фосфолипид удаляют путем последующего центрифугирования в качестве компонента тяжелой фазы. Присутствие кислого полимера в водной фазе также может увеличивать плотность водной фазы и приводит к увеличенному отделению тяжелой фазы от масляной (масляной) фазы.
В одном иллюстративном способе по изобретению для рафинирования масла (или способ рафинирования масла с использованием фермента по изобретению) изменена методика дезодорирования для получения фракции диацилглицеринов (DAG). В альтернативном аспекте, если необходимо или желательно, после обуславливаемого ферментом рафинирования условия дезодорирования (температуру, давление, конфигурацию устройства для дистилляции) можно модифицировать для увеличения отделения свободных жирных кислот (FFA) от фракции диацилглицеринов/триацилглицеринов или далее модифицировать для отделения диацилглицеринов от фракции триацилглицеринов. В результате этих модификаций с использованием этого способа по изобретению возможно получить FFA и диацилглицерин пищевой категории, если использовать фермент по изобретению (например, фосфатазу или PLC или комбинацию PLC и фосфатаз) для рафинирования пищевого масла способом физической очистки.
В различных аспектах осуществление на практике способов по изобретению, как описано в настоящем документе (или с использованием ферментов по изобретению), имеет преимущества, такие как: снижение или устранение растворителя и повторное использование растворителя; более низкие капитальные затраты; снижение затрат на последующую очистку, снижение использования химических реагентов, использования оборудования, длительности обработки, использования энергии (теплоты) и воды/образования отработанной воды; получение более высококачественного масла; отжатое на шнековом прессе масло можно использовать без очистки в некоторых применениях для варки или жарки (это прессованное масло может обладать более высокой стабильностью, характеристиками цвета и запаха и высоким содержанием токоферола); получение более высококачественной муки; получение муки с более низким содержанием жиров (в настоящее время, мука, получаемая с помощью механического пресса, взывает проблемы с пищеварением у жвачных животных); получение улучшенных питательных свойств - сниженных уровней глюкозинолятов, танинов, синапина, фитиновой кислоты (как описано, например, в Technology and Solutions for Extracting Oilseeds and Nonpetroleum Oils, AOCS 1997).
В одном аспекте изобретение относится к способам очистки растительных масел (например, соевого масла, кукурузного масла, хлопкового масла, пальмового масла, арахисового масла, рапсового масла, сафлорового масла, подсолнечного масла, кунжутного масла, рисового масла, кокосового масла или масла канолы) и их побочных продуктов и к способам дезодорирования лецитина, например, как описано в патенте США No. 6172248 или 6172247, где способы включают применение по меньшей мере одного фермента по изобретению, например, фосфолипазы C по изобретению. Таким образом, изобретение относится к лецитину и растительным маслам, содержащим по меньшей мере один фермент по изобретению. В иллюстративном способе очистки органической кислотой растительное масло комбинируют с разбавленным водным раствором органической кислоты и подвергают воздействию сдвигового усилия для получения тонкой дисперсии раствора кислоты в масле. Полученную смесь кислоты и масла смешивают при низком сдвиговом усилии в течение времени, достаточного для изолирования примесей в гидратированную фазу примесей, с образованием очищенной фазы растительного масла. В этом иллюстративном способе можно использовать смеситель или рециркуляционную систему (например, рецирукляционную емкость с водой) и/или емкость для хранения фосфатидов или лецитина, например, как описано в патентах США No. 4240972, 4049686, 6172247 или 6172248. Эти способы можно выполнять путем периодического или непрерывного процесса. Неочищенное или рафинированное растительное масло можно подавать из емкости для хранения (например, через насос) и можно нагревать. Растительное масло, подлежащее очистке, может представлять собой либо неочищенное, либо "рафинированное" масло.
В одном аспекте ферменты фосфатидилинозитол-PLC (PI-PLC) по изобретению используют для рафинирования растительного масла. Ферменты PI-PLC по изобретению можно использовать отдельно или в комбинации с другими ферментами (например, PLC, PLD, ферментами фосфатазами по изобретению) для увеличения выхода масла в процессе рафинирования растительных масел (включая масло сои, канолы и подсолнуха). PI-PLC предпочтительно может конвертировать фосфатидилинозитол в 1,2-диацилглицерин (DAG) и фосфоинозитол, но также она может демонстрировать активность в отношении других фосфолипидов, включая фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин или фосфатидную кислоту, или их комбинацию. Увеличение выхода может быть достигнуто в качестве увеличения количества DAG в обработанном ферментом растительном масле и увеличения содержания нейтрального масла вследствие снижения количества масла, удерживаемого в меньшей фракции камеди, которая образуется в результате обработки растительного масла ферментом.
Ферментативная обработка масличных семян
Изобретение относится к композициям (например, ферментам) и способам ферментативной обработки масличных семян, включая сою, канолу, кокос, авокадо и оливковую пасту. В одном аспекте эти способы по изобретению могут увеличивать выход масла и улучшать питательные качества полученной муки. В некоторых аспектах ферментативная обработка масличных семян с использованием ферментов и способов по изобретению обеспечивает экономическую пользу и пользу для окружающей среды, а также альтернативные технологии для экстракции масла и обработки пищевых продуктов для употребления человеком и животными. В альтернативных аспектах способы по изобретению включают применение фосфолипаз по изобретению, других фосфолипаз, протеаз, фосфатаз, фитаз, ксиланаз, амилаз (например, α-амилаз), глюканаз (например, β-глюканаз), полигалактуроназ, галактолипаз, целлюлаз, гемицеллюлаз, пектинах и других ферментов, деградирующих клеточную стенку растений, а также смешанных препаратов ферментов и клеточных лизатов.
В альтернативных аспектах способы по изобретению можно осуществлять на практике применительно к другим способам, например, ферментативным обработкам, например, карбогидразами, включая целлюлазу, гемицеллюлазу и ферменты с другими неосновными видами деградирующей активности, или к химическим способам, например, экстракции гексаном соевого масла. Ферментативная обработка может увеличивать возможность экстракции масла на 8-10%, когда перед экстракцией растворителем проводят ферментативную обработку.
В альтернативных аспектах способы по изобретению можно применять на практике со способами водной экстракции. Способы водной экстракции могут представлять собой более экологически чистые альтернативные технологии экстракции масла. Низкий выход экстракции водного способа можно преодолеть с использованием ферментов, которые гидролизуют структурные полисахариды, образующие клеточную стенку масличных семян, или которые гидролизуют белки, которые образуют клеточные мембраны и мембраны липидных телец, например, с использованием расщепления, включающего расщепление целлюлазой, гемицеллюлазой и/или протопктиназой для экстракции масла из клеток сои. В одном аспекте способы применяют на практике с ферментом по изобретению, как описано Kasai (2003) J. Agric. Food Chem. 51:6217-6222, где описано, что наиболее эффективным ферментом для расщепления клеточной стенки является целлюлаза.
В одном аспекте в комбинации со способами по изобретению используют протеазы. Был оценен комбинированный эффект операционных переменных и активности фермента протеазы и целлюлазы на выход экстракции масла и белка, в комбинации с другими параметрами процесса, такими как концентрация фермента, время гидролиза, размер частиц и соотношение твердого вещества и жидкости. В одном аспекте способы осуществляют на практике с помощью фермента по изобретению, как описано Rosenthal (2001) Enzyme and Microb. Tech. 28:499-509, где описано, что применение протеазы может приводить к значительно более высоким выходам масла и белка относительно контроля, когда используют обработанную нагреванием муку.
В одном аспекте в комбинации со способами по изобретению используют полную экстракцию белков, пектина и гемицеллюлозы. Растительная клетка состоит из набора полисахаридов, часто связанных с белками или фенольными соединениями, или замещенных ими. Большинство из этих углеводов только частично расщепляются или плохо расщепляются расщепляющими ферментами. Разрушение этих структур путем переработки или деградации ферментами может повысить их питательную доступность. В одном аспекте способы осуществляют на практике с ферментом по изобретению, как описано Ouhida (2002) J. Agric. Food Chem. 50: 1933-1938, где описано, что существенной деградации целлюлозы клеточной стенки сои (вплоть до 20%) достигали после полной экстракции белка, пектина и гемицеллюлозы.
В одном аспекте способы по изобретению, кроме того, включают включение различных ферментативных обработок в обработку семян, например, семян канолы, причем эти обработки включают применение протеаз, целлюлаз и гемицеллюлаз (в различных комбинациях друг с другом и с одним или несколькими ферментами по изобретению). Например, способы могут включать ферментативные обработки семян канолы при влажности от 20 до 40 в ходе инкубации с ферментами перед выполнением общепринятого способа; как описано, Sosulski (1990) Proc. Can. Inst. Food Sci. Technol. 3:656. Кроме того, способы по изобретению могут включать включение протеаз, амилаз, полигалактуроназ (в различных комбинациях друг с другом и с одним или несколькими ферментами по изобретению) для гидролиза клеточного материала в кокосовой муке и высвобождения кокосового масла, которое можно выделять центрифугированием, как описано, например, McGlone (1986) J. of Food Sci. 51: 695-697. Кроме того, способы по изобретению могут включать включение пектиназ, амилаз, протеаз, целлюлаз в различных комбинациях (друг с другом и с одним или несколькими ферментами по изобретению), обеспечивая существенное увеличение выхода (~70% в лучшем случае) в процессе ферментативной экстракции масла авокадо, как описано, например, Buenrostro (1986) Biotech. Letters 8(7): 505-506. В способах по изобретению для экстракции оливкового масла, оливковую пасту обрабатывают целлюлазой, гемицеллюлазой, полигалактуроназой, пектин-метилтрансферазой, протеазой и их комбинациями (друг с другом и с одним или несколькими ферментами по изобретению), как описано, например, Montedoro (1976) Acta Vitamin. Enzymol. (Milano) 30: 13.
Очистка фитостеринов из растительных масел
Изобретение относится к способам очистки фитостеринов и тритерпенов или растительных стеринов из растительных масел. Фитостерины, которые можно очищать с использованием фосфолипаз и способов по изобретению, включают β-ситостерин, кампестерин, стигмастерин, стигмастанол, β-ситостанол, ситостанол, десмостерин, халинастерин, пориферастерин, клионастерин или брассикастерин. Растительные стерины являются важными сельскохозяйственными продуктами для промышленности здравоохранения и пищевой промышленности. Таким образом, фосфолипазы и способы по изобретению используют для получения эмульгаторов для производителей косметических средств и стероидных промежуточных соединений и предшественников для получения гормональных фармацевтических средств.
Фосфолипазы и способы по изобретению используют для получения (например, очистки) аналогов фитостеринов и их сложных эфиров для применения в качестве средств, снижающих уровень холестерина, с кардиологической пользой для здоровья. Фосфолипазы и способы по изобретению используют для очистки стеринов растений для снижения уровней холестерина в сыворотке путем ингибирования всасывания холестерина в просвете кишечника. Фосфолипазы и способы по изобретению используют для очистки растительных стеринов, которые обладают иммуномодиулирующими свойствами в чрезвычайно низких концентрациях, включая усиленный клеточный ответ T-лимфоцитов и цитотоксическую способность естественных киллерных клеток против злокачественной клеточной линии. Фосфолипазы и способы по изобретению используют для очистки растительных стеринов для лечения туберкулеза легких, ревматоидного артрита, управления течением заболевания у ВИЧ-инфицированных пациентов и ингибирования иммунного стресса, например, у участников марафонов.
Фосфолипазы и способы по изобретению используют для очистки стериновых компонентов, присутствующих в стериновых фракциях продовольственных растительных масел (например, кокосового масла, масла канолы, масла какао, кукурузного масла, хлопкового масла, льняного масла, оливкового масла, пальмового масла, арахисового масла, рисового масла, сафлорового масла, кунжутного масла, сои, подсолнечного масла), таких как ситостерин (40,2-92,3%), кампестерин (2,6-38,6%), стигмастерин (0-31%) и 5-авенастерин (1,5-29%).
Способы по изобретению могут включать выделение происходящих из растений стеринов из масличных семян путем экстракции растворителем хлороформ-метанолом, гексаном, метиленхлоридом или ацетоном, с последующей сапонификацией и хроматографической очисткой полученных обогащенных общих стеринов. Альтернативно растительные образцы можно экстрагировать сверхкритической жидкостной экстракцией со сверхкритическим диоксидом углерода с получением экстрактов общих липидов, которые можно обогащать стеринами, и стерины выделять. Для последующей охарактеризации и количественного определения стериновых соединений, неочищенный изолят можно очищать и разделять широким множеством хроматографических способов, включая колоночную хроматографию (CC), газовую хроматографию, тонкослойную хроматографию (TLC), нормально-фазовую высокоэффективную жидкостную хроматографию (ВЭЖХ), обращенно-фазовую ВЭЖХ и капиллярную электрохроматографию. Из всех способов хроматографического выделения и разделения, использование методик CC и TLC является наиболее удобным, доступным и пригодным для извлечения, очистки, количественных анализов и предварительной оценки стеринов в тестируемых образцах.
Фитостерины утрачиваются из растительных масел в качестве побочных продуктов в способах очистки масла. Фосфолипазы и способы по изобретению используют фитостерины, выделенные из таких побочных продуктов, для образования обогащенных фитостерином продуктов, выделенных из таких побочных продуктов. В способах выделения и очистки фитостеринов по изобретению могут использоваться побочные продукты маслоперерабатывающей промышленности, и они могут включать действия, такие как молекулярная дистилляция, экстракция жидкости жидкостью и кристаллизация.
Способы по изобретению могут включать способы экстракции липидов для экстракции фитостеринов. Например, в способах по изобретению могут использоваться неполярные растворители, такие как гексан (широко используемый для экстракции большинства типов растительных масел) в количественном отношении для экстракции свободных фитостеринов и фитостериловых эфиров жирных кислот. Стерилгликозиды и ацилированные жирной кислотой стерилгликозиды только частично экстрагируются гексаном, и увеличение полярности растворителя обеспечивает более высокий процент экстракции. Одним из способов, который можно использовать, является способ с хлороформ-метанолом Bligh и Dyer для экстракции всех классов стериновых липидов, включая фосфолипиды. Один из иллюстративных способов как для количественного разделения, так и для количественного анализа фитостериновых классов липидов включает инжектирование экстракта липидов в систему ВЭЖХ.
Фосфолипазы и способы по изобретению можно использовать для удаления стеринов из жиров и масел, как описано, например, в патенте США No. 6303803. Этот способ представляет собой способ снижения содержания стерина в содержащих стерин жирах и маслах. Он является эффективным и экономичным способом на основе аффинности холестерина и других стеринов к амфипатическим молекулам, которые формируют гидрофобные, текучие бислои, такие как фосфолипидные бислои.
Агрегаты фосфолипидов контактируют, например, с содержащим стерин жиром или маслом в водной среде, а затем перемешивают. Молекулярная структура этой агрегированной смеси фосфолипидов имеет высокую аффинность к холестерину и другим стеринам, и может селективно удалять такие молекулы из жиров и масел. Смесь для водного разделения перемешивают в течение периода времени, достаточного для селективного снижения содержания стеринов в продукте в виде жира/масла путем распределения стерина в часть фосфолипидных агрегатов. Жир или масло со сниженным содержанием стеринов отделяют от водной смеси для разделения. Альтернативно соответственно обогащенную стерином фракцию также можно выделять из водной смеси для разделения. Эти стадии можно проводить при температуре окружающей среды: минимизируются затраты на нагревание, а также возможность термической деградации продукта. Кроме того, требуется минимальное количество оборудования, и, поскольку все требуемые материалы представляют собой материалы пищевой категории, способы не требуют специальных мер предосторожности, связанных с хранением, удалением отходов, или загрязнением конечного продукта(ов).
Фосфолипазы и способы по изобретению можно использовать для удаления стеринов из жиров и масел, как описано, например, в патенте США No. 5880300. Фосфолипидные агрегаты контактируют, например, с содержащим стерин жиром или маслом в водной среде, а затем перемешивают. После надлежащего перемешивания, жир или масло со сниженным содержанием стеринов отделяют от водной смеси для разделения. Альтернативно соответственно обогащенный стерином фосфолипид также можно выделять из водной смеси для разделения. Растительные (например, плодовые) масла содержат растительные стерины (фитостерины), которые также можно удалять с использованием способов по настоящему изобретению. Этот способ применим для продукта в виде жира/масла на любой стадии цикла коммерческой переработки. Например, способ по изобретению можно применять для рафинированных, отбеленных и дезодорированных масел ("масел RBD"), или на любой стадии переработки перед достижением статуса RBD. Хотя масло RBD может обладать измененной плотностью по сравнению с маслом в состоянии до RBD, способы по изобретению легко адаптировать как для масел RBD, так и для масел в состоянии до RBD, или для различных других продуктов в виде жира/масла, варьируя содержание фосфолипидов, состав фосфолипидов, соотношения фосфолипид:вода, температуру, давление, условия перемешивания и условия разделения, как описано ниже.
Альтернативно ферменты и способы по изобретению можно использовать для выделения фитостеринов или других стеринов на промежуточных стадиях переработки масла. Например, известно, что фитостерины утрачиваются в процессе дезодорирования растительных масел. Содержащую стерин фракцию дистиллята, например, из промежуточной стадии переработки, можно подвергать способам экстракции стерина, описанным выше. Это обеспечивает обогащенный стерином лецитин или другой фосфолипидный материал, который можно далее перерабатывать для выделения экстрагированных стеринов.
Детергентные композиции
Изобретение относится к детергентным композициям, содержащим одну или несколько фосфолипаз по изобретению, и к способам получения и применения этих композиций. Изобретение охватывает се способы получения и применения детергентных композиций, см., например, патент США No. 6413928; 6399561; 6365561; 6380147. Детергентные композиции могут представлять собой водную композицию из одной и двух частей, неводную жидкую композицию, отлитое твердое тело, гранулярную форму, форму частиц, прессованную таблетку, гель и/или пасту и форму взвеси. Изобретение также относится к способам, способным быстро удалять крупные пищевые загрязнения, пленки остатков пищи и другие незначительные пищевые композиции с использованием этих детергентных композиций. Фосфолипазы по изобретению могут способствовать удалению пятен с помощью каталитического гидролиза фосфолипидов. Фосфолипазы по изобретению можно использовать в детергентах для мытья посуды и в детергентах для стирки тканей.
Истинное содержание активного фермента зависит от способа изготовления детергентной композиции, и не являются критически важным, при условии что детергентный раствор обладает желаемой ферментативной активностью. В одном аспекте количество фосфолипазы, присутствующее в конечном растворе, находится в диапазоне приблизительно от 0,001 мг до 0,5 мг на грамм детергентной композиции.
Конкретный фермент, выбираемый для применения в способе и продуктах по этому изобретению, зависит от условий конечного применения, включая физическую форму продукта, применение pH, применение температуры и типы почвы, подлежащие деградации или изменению. Фермент можно выбирать для обеспечения оптимальной активности и стабильности для любого данного набора условий применения. В одном аспекте полипептиды по настоящему изобретению являются активными в диапазонах pH от приблизительно 4 до приблизительно 12 и в диапазоне температур от приблизительно 20°C до приблизительно 95°C. Детергенты по изобретению могут содержать катионные, полуполярные неионные или цвиттерионные поверхностно-активные вещества или их смеси.
Фосфолипазы по настоящему изобретению можно включать в состав порошковых и жидких детергентов, имеющих pH от 4,0 до 12,0, на уровнях от приблизительно 0,01 до приблизительно 5% (предпочтительно от 0,1% до 0,5%) по массе. Эти детергентные композиции также могут включать другие ферменты, такие как известные протеазы, целлюлазы, липазы или эндогликозидазы, а также моющие компоненты и стабилизаторы. Добавление фосфолипаз по изобретению в общепринятые моющие композиции не приводит к какому-либо специальному ограничению применения. Иными словами, любая температура и pH, пригодные для детергента, также пригодны для настоящих композиций, при условии, что pH находится в указанном выше диапазоне и температура является меньшей, чем описанная температура денатурации фермента. Кроме того, полипептиды по изобретению можно использовать в моющей композиции без детергентов, вновь либо отдельно, либо в комбинации с моющими компонентами и стабилизаторами.
Настоящее изобретение относится моющим и дезинфицирующим композициям, включая детергентные и/или дезинфицирующие композиции для очистки и/или дезинфекции твердых поверхностей, детергентные композиции для очистки и/или дезинфекции тканей, композиции для мытья посуды, очищающие композиции для полости рта, очищающие композиции для зубов и/или растворы для очистки контактных линз.
В одном аспекте изобретение относится к способу мытья объекта, включающему контактирование объекта с фосфолипазой по изобретению в условиях, достаточных для мытья. Фосфолипаза по изобретению может быть включена в качестве детергентной добавки. Детергентная композиция по изобретению, например, может быть изготовлена в качестве детергентной композиции для ручной или машинной стирки, содержащей фосфолипазу по изобретению. Добавка для стирки, пригодная для предварительной обработки окрашенных тканей, может содержать фосфолипазу по изобретению. Композиция смягчителя для тканей может содержать фосфолипазу по изобретению. Альтернативно фосфолипазу по изобретению можно изготавливать в качестве детергентной композиции для применения в основных действиях по очистке бытовых поверхностей. В альтернативных аспектах детергентные добавки и детергентные композиции по изобретению могут содержать один или несколько других ферментов, таких как протеаза, липаза, кутиназа, другая фосфолипаза, карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, например, лактаза и/или пероксидаза. Свойства фермента(ов) по изобретению выбирают так, чтобы они были совместимыми с выбранным детергентом (т.е. оптимальное значение pH, совместимость с другими ферментативными и неферментативными ингредиентами, и т.д.) и фермент(ы) присутствовал в эффективных количествах. В одном аспекте ферменты фосфолипазы по изобретению используют для удаления из тканей материалов с неприятным запахом. Различные детергентные композиции и способы их получения, которые можно использовать для применения изобретения на практике, описаны, например, в патентах США No. 6333301; 6329333; 6326341; 6297038; 6309871; 6204232; 6197070; 5856164.
Обработка отходов
Фосфолипазы по изобретению можно использовать для обработки отходов. В одном аспекте изобретение относится к способу расщепления твердых отходов с использованием фосфолипаз по изобретению. Способы могут включать уменьшение массы и объема по существу необработанных твердых отходов. Твердые отходы можно обрабатывать способом ферментативного расщепления в присутствии ферментативного раствора (включая фосфолипазы по изобретению) при контролируемой температуре. Твердые отходы можно конвертировать в разжиженные отходы и любые остаточные твердые отходы. Полученные разжиженные отходы можно отделять от каких-либо остаточных твердых отходов. См. например, патент США No. 5709796.
Детоксикация
Фосфолипазы (например, PI-PLC по изобретению) можно использовать в способах детоксикации, например, для детоксикации эндотоксинов, например, композиций, содержащих липополисахариды (LPS), и изобретение относится к способам детоксикации с использованием по меньшей мере одного фермента по изобретению, например, полипептида, содержащего последовательность, указанную в SEQ ID NO: 6 и имеющую одну или несколько мутаций, как указано в таблицах 12-15, или его ферментативно активного фрагмента.
В одном аспекте фосфолипазу по изобретению используют для детоксикации липополисахарида (LPS). В одном аспекте эту детоксикацию проводят путем деацилирования 2'- и/или 3'-цепей жирных кислот из липида A. В одном аспекте фосфолипазу (например, PI-PLC) по изобретению используют для гидролиза 2'-лауроиловой и/или 3'-миристоиловой цепи из липида, например, липида A (например, из бактериального эндотоксина). В одном аспекте способ по изобретению используют для разрушения эндотоксина, например, токсина из грамотрицательных бактерий, например, из E. coli.
В одном аспекте фосфолипазу (например, PI-PLC) по изобретению используют для смягчения эффектов отравления токсинами (например, при текущей инфекции грамотрицательными бактериями) или для профилактического предупреждения эффектов эндотоксинов в ходе инфекции (например, инфекции у животного или человека). Таким образом, изобретение относится к фармацевтической композиции, содержащей фосфолипазу (например, PI-PLC) по изобретению, и к способу применения гидролазы по изобретению для смягчения или предупреждения токсических эффектов липополисахарида (LPS), например, в ходе сепсиса.
Переработка продуктов питания
Фосфолипазы по изобретению можно использовать для переработки продуктов питания, например, для изменения их стабильности, времени полужизни, вкуса, консистенции, улучшения из статуса питательности и т.п. Например, в одном аспекте фосфолипазы по изобретению используют для получения кислых фосфолипидов для регулирования горького вкуса в продуктах питания.
В одном аспекте изобретение относится к способам сыроварения с использованием фосфолипаз по изобретению (и, таким образом, изобретение также относится к сырам, содержащим фосфолипазы по изобретению). В одном аспекте ферменты по изобретению (например, фосфолипаза A, лизофосфолипаза или их комбинацию) используют для обработки сыров для усиления вкуса, для увеличения выхода и/или для "стабилизации" сыров, например, путем снижения тенденции к "обезжириванию" или в одном аспекте ферменты по изобретению используют для получения сыра из молока для сыроварения. Эти способы по изобретению могут включать любой способ или протокол, например, как описано, например, в патентах США No. 6551635 и 6399121, WO 03/070013, WO 00/054601. Например, в одном аспекте фосфолипазы по изобретению используют для стабилизации жировой эмульсии в молоке или содержащих молоко композициях, например, сливках, и используют для стабилизации композиций молока, например, для изготовления сливок или сливочных напитков. В одном аспекте изобретение относится к способам усиления вкуса сыра с использованием по меньшей мере одного фермента по изобретению, причем способ включает инкубацию белка, жира и протеазы и липазы в водной среде в условиях, которые обеспечивают усиление вкуса сыра (например, уменьшенную горечь) например, как описано в WO 99/66805. В одном аспекте фосфолипазы по изобретению используют для усиления вкуса сыра (например, сычужной закваски) путем смешения с водой, протеазой и липазой (по изобретению) при повышенной температуре, например, приблизительно от 75°C до 95°C, как описано, например, в патенте США No. 4752483. В одном аспекте фосфолипазы по изобретению используют для ускорения вызревания сыра путем добавления фермента по изобретению (например, липазы или фосфолипазы) к сыру (например, молоку для сыроварения) перед добавлением к молоку коагулянта, или путем добавления фермента по изобретению к сычужной закваске с солью до прессования, например, как описано в патенте США No. 4707364. В одном аспекте липазу по изобретению используют для деградации триглицеридов в жире молока для высвобождения свободных жирных кислот, обеспечивая усиление вкуса. Также в любом из этих способов по изобретению можно использовать протеазу, см., например, Brindisi (2001) J. of Food Sci. 66: 1100-1107. В другом аспекте в этих способах или в любом из способов по изобретению можно использовать комбинацию эстераз, липаз, фосфолипаз и/или протеаз.
В одном аспекте фосфолипазу по изобретению используют для снижения содержания фосфорсодержащих компонентов в продукте питания, например, в масле, таком как растительное масло, имеющее высокое содержание негидратируемых фосфорсодержащих компонентов, например, как описано в WO 98/26057.
Конверсия биомассы и получение чистых биотоплив
Изобретение относится к полипептидам, включая ферменты (фосфолипазы (PL), например, PLA, PLC или PLD по изобретению) и антитела по изобретению, и к способам конверсии биомассы или любого лигноцеллюлозного материала (например, любой композиции, содержащей целлюлозу, гемицеллюлозу и лигнин), в топливо (например, биоэтанол, биопропанол, биобутанол, биопропанол, биометанол, биодизель), в дополнение кормам, к продуктам питания и химическим реагентам. Например, в альтернативном варианте осуществления фермент(ы) по изобретению, используемые для конверсии биомассы и для продукции биотоплив, могут обладать активностью одной или нескольких фосфолипаз, включая активность фосфолипазы C (PLC); активность PI-PLC, активность фосфолипазы A (PLA), такую как активность фосфолипазы A1 или фосфолипазы A2; активность фосфолипазы D (PLD), такую как активность фосфолипазы D1 или фосфолипазы D2; активность фосфолипазы B (PLB), например, активность фосфолипазы и лизофосфолипазы (LPL) или активность фосфолипазы и лизофосфолипазы-трансацилазы (LPT A) или активность фосфолипазы и лизофосфолипазы (LPL) и активность лизофосфолипазы-трансацилазы (LPTA); или активность пататина или их комбинацию.
Таким образом, композиции и способы по изобретению обеспечивают эффективные и надежные альтернативы или дополнения применению продуктов на основе нефти, например, в качестве смеси биотоплив, таких как биометанол, биоэтанол, биопропанол, биобутанол и т.п., с дизельным топливом, бензином, керосином и т.п. Изобретение относится к организмам, экспрессирующим ферменты по изобретению, для участия в химических циклах, вовлекающих конверсию природной биомассы. В одном аспекте ферменты и способы конверсии биомассы используют в наборе ферментов для переработки фосфолипидов. Изобретение относится к способам выявления и внедрения наиболее эффективных ферментов для обеспечения этих важных новых процессов "конверсии биомассы" и альтернативных процессов энергетической промышленности.
Композиции и способы по изобретению можно использовать для предоставления эффективных и надежных альтернатив или дополнений применению продуктов на основе нефти, например, в качестве смеси биоэтанола, биопропанола, биобутанола, биопропанола, биометанола и/или биодизеля и бензина. Изобретение относится к организмам экспрессирующим ферменты по изобретению для участия в химических циклах, вовлекающих конверсию природной биомассы. Изобретение относится к способам выявления и внедрения наиболее эффективных ферментов для обеспечения этих важных новых процессов "конверсии биомассы" и альтернативных процессов энергетической промышленности.
Изобретение относится к способам, ферментам и смесям ферментов или "коктейлям" по изобретению, для перереботки материала, например, материала биомассы, содержащего целлоолигосахарид, олигомер арабиноксилана, лигнин, лигноцеллюлозу, ксилан, глюкан, целлюлозу и/или ферментируемый сахар, включающим контактирование композиции с полипептидом по изобретению, или полипептидом, кодируемым нуклеиновой кислотой по изобретению, где необязательно материал происходит из сельскохозяйственной культуры (например, пшеницы, ячменя, картофеля, проса, древесины топлива), представляет собой побочный продукт производства продуктов питания или кормов, представляет собой лигноцеллюлозные отходы производства, или представляет собой растительные остатки или бумажные отходы или отходы производства бумаги, и необязательно растительные остатки включают стебли, листья, скорлупу, шелуху, кукурузу или сердцевины кукурузных початков, кукурузную солому, кукурузное волокно, сено, солому (например, рисовую солому или пшеничную солому), жмых сахарного тростника, свекловичную пульпу, цитрусовую пульпу и кожуру цитрусовых, древесину, древесные щепки, древесную стружку, древесную пульпу, отходы в виде пульпы, древесные отходы, древесные опилки и муку, отходы строительства и/или демонтажа и лом (например, древесина, древесная стружка и мука), и необязательно бумажные отходы включают выброшенную или использованную бумагу для фотокопирования, компьютерную бумагу для принтера, бумагу тетрадей, бумагу записных книжек, машинописную бумагу, газеты, журналы, картон и бумажные упаковочные материалы, и переработанную бумагу из макулатуры. Кроме того, можно использовать городские отходы, например, бумажную фракцию городских твердых отходов, городских древесных отходов и городских отходы озеленения, совместно с другими материалами, содержащими сахар, крахмал и/или целлюлозу. В альтернативных аспектах переработка материала, например, материала биомассы, приводит к образованию биоспирта, например, биоэтанола, биометанола, биобутанола или биопропанола.
Альтернативно полипептид по изобретению может сам экспрессироваться в материале растительной биомассы или сырье.
Способы по изобретению также включают получение переработанной или "конвертированной" (например, способом, включающим применение фермента по изобретению) биомассы или растительного материала, например, содержащего липиды или лигноцеллюлозного материала (обработанного, например, ферментами по изобретению) и преобразования его в топливо (например, биоспирт, например, биоэтанол, биометанол, биовбутанол или биопропанол или биодизель) путем ферментации (например, дрожжами) и/или химического синтеза. В одном аспекте продуцированные сахара ферментируют и/или неферментированные продукты газифицируют.
Способы по изобретению также включают конверсию водорослей, растительного масла, такого как растительные масла холодного прессования или отработанные растительные масла, животные жиры и сала (например, топленое сало, жир, или желтый жир), или сточные воды, с использованием ферментов по изобретению, и преобразования их в топливо (например, биоспирт, например, биоэтанол, биометанол, биобутанол или биопропанол или биодизель) ферментацией и/или химическим синтезом или конверсией.
Ферменты по изобретению (включая, например, организмы, такие как микроорганизмы, например, грибы, дрожжи или бактерии, образующие и в некоторых аспектах секретирующие рекомбинантные ферменты по изобретению) можно использовать в или включать/ внедрять на любой стадии процесса конверсии биомассы, например, на любой одной стадии, нескольких стадиях, или включать на всех стадиях, или во все из следующих способов процесса конверсии биомассы, или во все из этих альтернатив биотоплива:
- Прямое сжигание: сжигание материала путем прямого нагревания, является наиболее простой технологией переработки биомассы; может быть очень экономичным, если источник биомассы находится близко.
- Пиролиз: представляет собой термическую деградацию биомассы нагреванием в отсутствие кислорода. В одном аспекте биомассу нагревают до температуры приблизительно от 800 до 1400 градусов Фаренгейта (от 427 до 760 градусов Цельсия), но не подают кислород для поддержания горения, приводящего к образованию газа, жидкого топлива и угля.
- Газификация: биомассу можно использовать для выработки метана путем нагревания или анаэробного расщепления. Из биомассы можно получать сингаз, смесь монооксида углерода и водорода.
- Газ из органических отходов: получают разложением (анаэробным расщеплением) находящегося под землей мусора на свалках. Когда органические отходы разлагаются, они образуют газ, состоящий из приблизительно 50% метана, основного компонента природного газа.
- Анаэробное расщепление: конвертирует органическое вещество в смеси метана, основного компонента природного газа, и диоксида углерода. В одном аспекте биомассу, такую как смывные воды (сточные воды), компост или отходы пищевой промышленности, смешивают с водой и подают в емкость биореактора для ферментативного гидролиза без воздуха.
- Ферментация
- Спиртовая ферментация: топливный спирт получают конверсией целлюлозной массы и/или крахмала в сахар, ферментацией сахара в спирт, затем разделением смеси спирта и воды дистилляцией. Сырье, такое как специально предназначенные для этого культуры (например, пшеницу, ячмень, картофель, просо, древесину тополя), сельскохозяйственные остатки и отходы (например, рисовую шелуху, кукурузную солому, пшеничную солому, жмых сахарного тростника, рисовую шелуху, кукурузное волокно, свекловичную пульпу, цитрусовую пульпу и кожуру цитрусовых), отходы лесничества (например, щепки твердой древесины и мягкой древесины, остатки пиломатериалов из твердой и мягкой древесины, деревянную стружку и древесную муку), городские отходы (например, бумажную фракцию городских твердых отходов, городские древесные отходы, городские отходы озеленения), древесные отходы (например, отходы лесопилки, отходы целлюлозного производства, строительные отходы, отходы демонтажа, древесную стружку и древесную пыль) и бумажные отходы или другие материалы, содержащие сахар, крахмал и/или целлюлозу, можно конвертировать в сахара, а затем в спирт, ферментацией дрожжами. Альтернативно материалы, содержащие сахара, можно конвертировать непосредственно в спирт ферментацией.
- Переэтерификация: Иллюстративную реакцию конверсии масла в биодизель называют переэтерификацией. Процесс переэтерификации осуществляет реакцию спирта (такого как метанол) с триглицеридными маслами, содержащимися в растительных маслах, животных жирах или рециклированных жирах, с образованием алкиловых эфиров жирных кислот (биодизеля) и глицерина. Реакция требует нагревания и катализатора в виде сильного основания, такого как гидроксид натрия или гидроксид калия.
- Биодизель: Биодизель представляет собой смесь аклиловых сложных эфиров жирных кислот, полученную из растительных масел, животных жиров или рециклированных жиров. Биодизель можно использовать в качестве топлива для транспортных средств в его чистой форме, но обычно его используют в качестве добавки к нефтяному дизелю для снижения уровней вещества в форме частиц, монооксида углерода, углеводородов и токсических веществ в воздухе вследствие дизельных автомобилей.
- Гидролиз: включает гидролиз соединения, например, биомассы, такой как лигноцеллюлозный материал, катализируемый с использованием фермента по настоящему изобретению.
- Когенерация: представляет собой одновременное получение более чем одной формы энергии с использованием одного топлива и установки. В одном аспекте когенерация биомассы имеет большее потенциальное развитие, чем образование биомассы отдельно, поскольку когенерация обеспечивает образование как тепла, так и электричества.
В одном аспекте полипептиды по изобретению обладают активностью гидролазы, например, фосфолипазы, пататина, и/или другой сходной ферментативной активностью для получения топлива (например, биоспирта, например, биоэтанола, биометанола, биобутанола или биопропанола или биодизеля) из органического материала, например, биомассы, такой как композиции, происходящие из растений и животных, включая любую сельскохозяйственную культуру или другое обновляемое сырье, сельскохозяйственный остаток или отходы животноводства, органические компоненты городских и промышленных отходов, или отходы или лом строительства или демонтажа, или микроорганизмы, такие как водоросли или дрожжи.
В одном аспекте полипептиды по изобретению используют в способах конверсии любой биомассы, например, биомассы животных, водорослей и/или растений, включая содержащую липиды или лигноцеллюлозную биомассу, в топливо (например, биоспирт, например, биоэтанол, биометанол, биобутанол или биопропанол или биодизель), или в ином случае используют в способах гидролиза или расщепления биоматериалов, так чтобы их можно было использовать в качестве топлива (например, биоспирт, например, биоэтанол, биометанол, биобутанол или биопропанол или биодизель), или чтобы упростить переработку биомассы в топливо.
Ферменты по изобретению, включающие смесь ферментов или "коктейли" по изобретению, также можно использовать в очистке глицерина. Побочный продукт в виде глицерина содержит непрореагировавший катализатор и мыла, которые нейтрализуют кислотой. Воду и спирт удаляют с получением 50-80% неочищенного глицерина. Остальные примеси включают не вступившие в реакцию жиры и масла, которые можно обрабатывать с использованием полипептидов по изобретению. На больших биодизельных установках по изобретению, глицерин можно далее очищать, например, до 99% или более высокой чистоты, для фармацевтической и косметической промышленности.
Топлива (включая биоспирты, такие как биоэтанолы, биометанолы, биобутанолы или биопропанолы или биодизели), полученные с использованием полипептидов по изобретению, включая смесь ферментов или "коктейли" по изобретению, можно использовать с топливными оксигенатами для улучшения характеристик горения. Добавление кислорода приводит к более полному сгоранию, что снижает выделение монооксида углерода. Это является другим экологическим преимуществом замены нефтяных топлив биотопливами (например, топливом по изобретению). Биотопливо, полученное с использованием композиций и/или способов по этому изобретению, можно смешивать с бензином с получением смеси E10 (приблизительно 5-10% этанол и приблизительно 90-95% бензин), однако его можно использовать в более высоких концентрациях, таких как E85 или в чистой форме. Биотопливо, полученное с использованием композиций и/или способов по изобретению, можно смешивать с нефтяным дизелем с получением смеси B20 (20% биодизель и 80% нефтяной дизель), хотя можно использовать и другие уровни смешения вплоть до B100 (чистый биодизель).
Изобретение также относится к способам получения биотоплив (включая биоспирты, такие как биоэтанолы, биометанолы, биобутанолы или биопропанолы или биодизели) из композиций, содержащих любую биомассу, например, биомассу животных, водорослей и/или растений, включая содержащую липиды или лигноцеллюлозную биомассу. Материал биомассы можно получать из сельскохозяйственных культур в качестве побочного продукта производства продуктов питания или кормов, или в качестве лигноцеллюлозных отходов производства, таких как растительные остатки, бумажные отходы или отходы или лом строительства и/или демонтажа. Примеры пригодных растительных источников или растительных остатков для обработки полипептидами по изобретению включают бурые водоросли, морские водоросли, зерна, семена, стебли, листья, скорлупу, шелуху, стержни кукурузных початков, кукурузную солому, сено, травы (например, аира голубая, такая как Sorghastrum nutans; или просто, например, виды Panicum, такие как Panicum virgatum) и т.п., а также древесину, древесную стружку, древесную пульпу и древесную муку. Примеры бумажных отходов, пригодных для обработки полипептидами по изобретению, включают выброшенную бумагу для фотокопирования, компьютерную бумагу для принтера, бумагу тетрадей, бумагу записных книжек, машинописную бумагу и т.п., а также газеты, журналы, картон и бумажные упаковочные материалы. Примеры отходов и лома строительства и демонтажа включают древесину, древесные опилки, древесную стружку и древесную муку.
В одном варианте осуществления ферменты, включающие смесь ферментов или "коктейли" по изобретению, и способы по изобретению можно использовать совместно с более "традиционными" способами получения этанола, метанола, пропанола, бутанола, пропанола и/или дизеля из биомассы, например, такими как способы, включающие гидролиз липидов и/или лигноцеллюлозных материалов, подвергая любую высушенную биомассу, например, биомассу животных, водорослей и/или растений, включая содержащий липиды или лигноцеллюлозный материал биомассы в реакторе воздействию катализатора, состоящего из разбавленного раствора сильной кислоты и соли металла; это может снижать энергию активации или температуру гидролиза целлюлозы с получением более высоких выходов сахаров; см., например, патенты США No. 6660506 и 6423145.
Другой иллюстративный способ, который охватывает применение ферментов по изобретению, включая смесь ферментов или "коктейли" по изобретению, включает гидролиз любой биомассы, например, биомассы животных, водорослей и/или растений, включая содержащую липиды или лигноцеллюлозную биомассу, содержащую гемицеллюлозу, целлюлозу и лигнин, или любой другой полисахарид, который можно гидролизовать ферментом по этому изобретению, подвергая материал стадии гидролиза первой ступени в водной среде при температуре и давлении, выбранных для обеспечения, в основном, деполимеризации гемицеллюлозы без существенной деполимеризации целлюлозы до глюкозы. Эта стадия приводит к взвеси, в которой жидкая водная фаза содержит растворенные моносахариды, образовавшиеся при деполимеризации гемицеллюлозы и твердую фазу, содержащую целлюлозу и лигнин. Стадия гидролиза второй ступени может включать условия, так чтобы по меньшей мере основная часть целлюлоза деполимеризовалась, причем такая стадия приводит к жидкой водной фазе, содержащей растворенные/растворимые продукты деполимеризации целлюлозы. См., например, патент США No. 5536325. Ферменты по изобретению (включая смеси ферментов по изобретению или "коктейли") можно добавлять на любой ступени этого иллюстративного способа.
Другой иллюстративный способ, охватывающий применение ферментов по изобретению, включая смесь ферментов или "коктейли" по изобретению, включает обработку любой биомассы, например, биомассы животных, водорослей и/или растений, включающей содержащий липиды или лигноцеллюлозный материал биомассы, с помощью одной или нескольких стадий гидролиза сильной кислотой, разбавленной до приблизительно от 0,4% до 2%; и обработку непрореагировавшего лигноцеллюлозного компонента гидролизованного кислотой материала биомассы щелочной делигнификацией с образованием предшественников биодеградируемых термопластмасс и производных. См., например, патент США No. 6409841. Ферменты по изобретению можно добавлять на любой стадии этого иллюстративного способа.
Другой иллюстративный способ, охватывающий применение ферментов по изобретению, включая смесь ферментов или "коктейли" по изобретению, включает предварительный гидролиз любой биомассы, например, биомассы животных, водорослей и/или растений, содержащей липиды или лигноцеллюлозный материал биомассы, в реакторе для предгидролиза; добавление кислотной жидкости к твердому материалу (например, лигноцеллюлозному материалу) с получением смеси; нагревание смеси до температуры реакции; поддержание температуры реакции в течение периода времени, достаточного для фракционирования лигноцеллюлозного материала на солюбилизированную часть, содержащую по меньшей мере приблизительно 20% лигнина из лигноцеллюлозного материала, и твердую фракцию, содержащую целлюлозу; удаление солюбилизированной части из твердой фракции при температуре реакции или приблизительно при температуре реакции, где целлюлоза в твердой фракции становится более подверженной ферментативному расщеплению; и выделение солюбилизированной части. См., например, патент США No. 5705369. Ферменты по изобретению можно добавлять на любой стадии этого иллюстративного способа.
Изобретение относится к способам получения композиций моторного топлива (например, для двигателей с искровым зажиганием) на основе жидких углеводородов, смешанных со спиртом топливной категории, полученным с использованием фермента или способа по изобретению. В одном аспекте топлива, произведенные с использованием фермента по изобретению, включают, например, смеси жидкий угольный газ- или жидкие природные газы-этанол. В одном аспекте сорастворителем является происходящий из биомассы 2-метилтетрагидрофуран (MTHF). См., например, патент США No. 6712866.
В одном аспекте способы по изобретению для ферментативной деградации любой биомассы, например, биомассы животных, водорослей и/или растений, включая содержащую липиды или лигноцеллюлозную биомассу, например, для производства биотоплив (включая биоспирты, такие как биоэтанолы, биометанолы, биобутанолы или биопропанолы, или биодизели) из любого органического материала, также могут включать применение ультразвуковой обработки материала биомассы; см., например, патент США No. 6333181.
В другом аспекте способы по изобретению производства биотоплив (включая биоспирты, такие как биоэтанолы, биометанолы, биобутанолы или биопропанолы, или биодизели) из целлюлозного субстрата включают предоставление реакционной смеси в форме взвеси, содержащей целлюлозный субстрат, фермент по этому изобретению и агент для ферментации (например, в реакционной емкости, такой как биореактор с полунепрерывной подпиткой твердыми веществами), и реакционную смесь подвергают реакции в условиях, достаточных для начала и поддержания реакции ферментации (как описано, например, в патентной заявке США No. 20060014260). В одном аспекте с помощью экспериментальных или теоретических вычислений можно определить оптимальную частоту подпитки. В одном аспекте дополнительные количества целлюлозного субстрата и фермента предоставляют в реакционную емкость с интервалом(ами) согласно оптимизированной частоте подпитки.
Один иллюстративный способ получения биотоплив (включая биоспирты, такие как биоэтанолы, биометанолы, биобутанолы или биопропанолы или биодизели) по изобретению описан в публикациях патентных заявок США No. 20050069998; 20020164730; и в одном аспекте он включает стадии измельчения любой биомассы, например, биомассы животных, водорослей и/или растений, включая содержащую липиды или лигноцеллюлозную биомассу (например, до размера 15-30 мм), воздействие на полученный продукт предварительной обработки путем парового взрыва (например, при температуре 190-230°C) в течение от 1 до 10 минут в реакторе; сбор предварительно обработанного материала в циклон или сходное устройство; и разделение жидкой и твердой фракций фильтрацией в фильтрационном прессе, подачу твердой фракции в емкость для ферментации и добавление одного или нескольких ферментов по изобретению, например, фермента целлюлазы и/или бета-глюкозидазы (например, растворенного в цитратном буфере при pH 4,8).
Другой иллюстративный способ получения биотоплив (включая биоспирты, такие как биоэтанолы, биометанолы, биобутанолы или биопропанолы или биодизели) по изобретению, содержащих биоэтанолы, биометанолы, биобутанолы или биопропанолы, с использованием ферментов по изобретению, включает предварительную обработку исходного материала, содержащего любую биомассу, например, биомассу животных, водорослей и/или растений, включая сырье содержащей липиды или лигноцеллюлозной биомассы, содержащее по меньшей мере гемицеллюлозу и целлюлозу. В одном аспекте исходный материал включает картофель, сою (рапс), ячмень, рис, кукурузу, рожь, пшеницу, свеклу или сахарный тростник или компонент или отходы или побочный продукт производства пищевых продуктов и кормов. Исходный материал ("сырье") подвергают реакции в условиях, которые разрушают структуру растительных волокон для обеспечения по меньшей мере частичного гидролиза гемицеллюлозы и целлюлозы. Разрушающие условия могут включать, например, воздействие на исходный материал средней температуры от 180°C до 270°C при pH от 0,5 до 2,5 в течение периода приблизительно от 5 секунд до 60 минут; или температуры от 220°C до 270°C, при pH от 0,5 до 2,5 в течение периода от 5 секунд до 120 секунд, или эквивалентных условий. Это приводит к сырью с увеличенной доступностью для расщепления ферментом, например, ферментом целлюлазой по изобретению. Патент США No. 6090595.
Иллюстративные условия для применения ферментов по изобретению в гидролизе любой биомассы, например, биомассы животных, водорослей и/или растений, включая содержащую липиды или лигноцеллюлозную биомассу, включают реакции при температурах приблизительно от 30°C до 48°C, и/или pH приблизительно от 4,0 до 6,0. Другие иллюстративные условия включают температуру приблизительно от 30°C до 60°C и pH приблизительно от 4,0 до 8,0.
Глюканазы (или целлюлазы), маннаназы, ксиланазы, амилазы, ксантаназы и/или гликозидазы, например, целлобиогидролазы, маннаназы и/или бета-глюкозидазы по изобретению можно применять для конверсии биомассы в топлива, и в производстве этанола, например, как описано в заявках PCT No. WO 0043496 и WO 8100857. Глюканазы (или целлюлазы), маннаназы, ксиланазы, амилазы, ксантаназы и/или гликозидазы, например, целлобиогидролазы, маннаназы и/или бета-глюкозидазы по изобретению можно использовать для производства ферментируемых сахаров и глюкан-содержащей биомассы, которую можно превращать в топливный этанол.
Биодизели - применение ферментов по изобретению для их получения
Изобретение относится к композициям, включающим ферменты по изобретению, и способам получения биодизельных топлив, включая любое биотопливо, например, биодизель, содержащих алкиловые сложные эфиры, полученные переэтерификацией растительных масел и/или животных жиров.
Например, в альтернативных аспектах полипептиды по изобретению, включая смесь ферментов или "коктейли" по изобретению, используют в способах переэтерификации путем реакции спирта (такого как этанол, пропанол, бутанол, пропанол, метанол) с триглицеридным маслом, содержащимся в растительном масле, животном жире или рециклированных жирах, с образованием алкиловых сложных эфиров жирных кислот - включая биодизель - и глицерина. В одном аспекте биодизель получают из соевого масла или использованных кулинарных жиров. Животные жиры, другие растительные масла и другие использованные масла также можно использовать (и перерабатывать с помощью ферментов, например, фосфолипаз, по изобретению) для получения биодизеля, в зависимости от их стоимости и доступности. В другом аспекте для получения биодизельного топлива с использованием ферментов по изобретению используют смеси всех типов жиров и масел.
Изобретение относится к композициям, включая ферменты по изобретению, и к способам переработки "желтого жира" - термин, первоначально присвоенный в утилизационной промышленности. Желтый жир, который можно перерабатывать с использованием композиций и способов по изобретению, включает жир из масел для жарения, например, из фритюрниц или жироуловителей из ресторанов, или из различных (например, низкокачественных) категорий сала из утилизационных предприятий. Таким образом, изобретение также относится к масла, жирам, маслам для жарения, растительным маслам, отработанным жирам из ресторанов и жирам технологической категории, содержащим по меньшей мере один фермент по этому изобретению.
Желтый жир, переработанный с использованием композиций по изобретению, включая ферменты, и способы по изобретению, можно использовать для напыления на дороги, например, для борьбы с запылением, или для добавок в корма для животных или кормов, или пищевых добавок.
В другом аспекте композиции по изобретению, включающие ферменты, и способы по изобретению, можно использовать для переработки липидов, например, жиров, таких как отработанные жиры ресторанов, для получения биотоплива, например, биодизельного топлива, например, для автомобилей, автобусов, грузовых автомобилей или лодок. В одном аспекте биодизель, изготовленный с использованием композиции или способа по изобретению, можно получать из любого обновляемого растительного источника, например, соевых бобов, и/или из жира, такого как "желтый жир".
Композиции по изобретению, включающие ферменты, и способы по изобретению, можно использовать для переработки "SVO", или "растительного масла прямой перегонки", включая любое растительное масло, которое может заправлять дизельный двигатель, например, где переработка включает переэтерификацию липидов в топливе, например, для применения при более низких температурах.
Композиции по изобретению, включая ферменты, и способы по изобретению, можно использовать для переработки "WVO", или отработанного растительного масла, для получения, например, желтого жира, включая жир из ресторанов; в одном аспекте жир необходимо фильтровать для удаления частиц пищи. Желтый жир, переработанный с помощью композиций по изобретению, включая ферменты, и способов по изобретению, может относиться к категории SVO/WVO, включающей любой жир, например, отработанный жир ресторанов, который может содержать топленое говяжье сало и другие животные продукты.
Переработка сухого экстракта барды
В другом аспекте ферменты (например, фосфолипазы) по изобретению можно использовать для обработки/переработки "сухого экстракта барды (DDS)", "сухой барды (DDS)", "конденсированного экстракта барды (CDS)", "влажного экстракта барды (DWG)" и "сухой гранулированной барды (DDGS)"; сухая барда может представлять собой злаковый побочный продукт процесса перегонки, и может включать растворимые вещества. Эти способы могут включать сухое измельчение растительных побочных продуктов, например, для применения в кормах, например, для птиц, крупного рогатого скота, свиней и других домашних животных. Таким образом, ферменты по изобретению можно использовать для обработки/переработки зерна, например, злаков, которые являются побочным продуктами любого процесса перегонки, включая способы с использованием любого источника зерна, например, традиционных источников из пивоварен, или альтернативно из предприятия по производству этанола (завод, мельница или сходные с ними). Ферменты по изобретению можно использовать для обработки/ переработки высушенной пульпы из перегонных предприятий; затем эту пульпу можно использовать для различных целей, например, в качестве кормов для животных, особенно жвачных животных; таким образом, изобретение относится к способам переработки кормов для животных, таких как жвачные животные, и к переработанному ферментом корму, содержащему фитазы по этому изобретению.
Ферменты по изобретению изобретение можно использовать отдельно или с другими ферментами для переработки "сухого экстракта барды (DDS)", "сухой барды (DDS)", "конденсированного экстракта барды (CDS)", "влажного экстракта барды (DWG)" и "сухой гранулированной барды (DDGS)". Например, ферменты по изобретению можно использовать на любой стадии процесса производства спирта, проиллюстрированного на фигуре 12. Ферменты по изобретению можно использовать для увеличения биодоступности фосфора в любом биотопливе, или потенциальном биотопливе, включая фосфор, находящийся в "сухом экстракте барды (DDS)", "сухой барде (DDS)", "конденсированном экстракте барды (CDS)", "влажном экстракте барды (DWG)" и "сухой гранулированной барде (DDGS)" (см., например, C. Martinez Amezcua, 2004 Poultry Science 83:971-976).
Производство алкоголя или питьевого спирта
Ферменты по изобретению также можно применять в переработке сухой барды для производства спирта - спирта как в "алкоголе", например, для производства пива или виски (в дополнение к применению в переработке биомассы для получения биотоплив). Ферменты по изобретению этому изобретению могут быть использованы на предприятиях по производству этанола, например, для переработки зерен, таких как кукуруза. Сухую барду можно изготавливать, сначала перемалывая зерно (например, кукурузу) до крупной консистенции, и добавляя его в горячую воду. После охлаждения добавляют дрожжи, и смесь ферментируют в течение от нескольких суток до недели. Твердые вещества, остающиеся после ферментации, представляют собой сухую барду. Фитазы по изобретению можно использовать на любой стадии этого процесса.
Составы
Изобретение относится к новым составам, содержащим ферменты по изобретению, и к составам фосфолипаз по изобретению, включая составы, которые включают новые ферменты по изобретению. Ферменты по изобретению можно применять или включать в состав отдельно или в качестве смеси фосфолипаз по изобретению, или других фосфолипаз, или других ферментов, таких как ксиланазы, целлюлазы, протеазы, липазы, амилазы, или окислительно-восстановительные ферменты, такие как лакказы, пероксидазы, каталазы, оксидазы или редуктазы. Их можно использовать в виде состава в твердой форме, такого как порошок, лиофилизированный препарат, гранула, таблетка, брусок, кристалл, капсула, пилюля, драже, или в жидкой форме, как например, форма водного раствора, аэрозоля, геля, пасты, взвеси, эмульсии вода/масло, крема, капсулы, или везикулярная или мицеллярная суспензия. Составы по изобретению могут содержать любой или комбинацию из следующих ингредиентов: полиолы, такие как полиэтиленгликоль, поливиниловый спирт, глицерин, сахар, такой как сахароза, сорбит, трегалоза, глюкоза, фруктоза, мальтоза, манноза, гелеобразующее средство, такое как гуаровая камедь, каррагенан, альгинат, декстраны, производное целлюлозы, пектин, соль, такая как хлорид натрия, сульфат натрия, сульфат аммония, хлорид кальция, хлорид магния, хлорид цинка, сульфат цинка, соль жирной кислоты и производного жирной кислоты, хелатор металлов, такой как EDTA, EGTA, цитрат натрия, противомикробное средство, такое как жирная кислота или производное жирной кислоты, парабен, сорбат, бензоат, дополнительное модулирующее соединение для блокирования воздействия фермента, такого как протеаза, белки-наполнители, такие как BSA, гидролизат пшеницы, боратовое соединение, аминокислота или пептид, подходящее модулирующее pH или температуру соединение, эмульгатор, такой как неионный и/или ионный детергент, окислительно-восстановительный агент, такой как цистин/цистеин, глутатион, окисленный глутатион, восстановитель или антиоксидантное соединение, такое как аскорбиновая кислота, или диспергирующий агент.
Для увеличения стабильности фермента можно использовать сшивание и модификацию белка, такую как пегилирование, модификация жирной кислотой, гликозилирование.
Другие применения фосфолипаз по изобретению
Фосфолипазы по изобретению также можно использовать для исследования системы передачи сигнала фосфоинозитида (PI); для диагностики, прогнозирования и разработки способов лечения биполярных нарушений (см., например, Pandey (2002) Neuropsychopharmacology 26:216-228); в качестве антиоксидантов; в качестве модифицированных фосфолипидов; в качестве пенообразующих и гелеобразующих средств; для получения ангиогенных липидов для васкуляризации тканей; для идентификации модуляторов фосфолипазы, например, PLA, PLB, PLC, PLD и/или пататина (агонистов или антагонистов), например, ингибиторов для применения в качестве антинеопластических средств, противовоспалительных средств и в качестве болеутоляющих средств. Их можно использовать для получения кислых фосфолипидов для регулирования горького вкуса в продуктах питания и фармацевтических средствах. Их можно использовать для очистки жиров. Их можно использовать для идентификации пептидных ингибиторов для лечения вирусных, воспалительных, аллергических и сердечно-сосудистых заболеваний. Их можно использовать для получения вакцин. Их можно использовать для получения глицеридов жирных кислот и фосфатидилглицеринов.
Фосфолипазы по изобретению, например, ферменты PLC, используют для получения иммунотоксинов и различных лекарственных средств для терапии злокачественной опухоли.
Фосфолипазы по изобретению можно использовать вместе с другими ферментами для обесцвечивания (т.е. удаления хлорофилла) и в детергентах (см. выше), например, вместе с другими ферментами (например, липазами, протеазами, эстеразами, фосфатазами). Например, в любом примере, где используют PLC, можно использовать PLD и фосфатазу в комбинации, для получения того же результата, что и в случае PLC отдельно.
В таблице 7 ниже обобщенно представлены иллюстративные способы и составы по изобретению:
Инактивация и модулирование активности ферментов путем гликозилирования
Это изобретение относится к способам, включающим применение рекомбинантной технологии для получения и экспрессии ферментов или других белков с биологической активностью, например, вредоносных или токсических ферментов, (где ферменты или другие белки обычно не гликозилированы) в неактивной или менее активной, но реактивируемой, форме. Способ включает добавление одного или нескольких участков гликозилирования (например, N-связанного или O-связанного гликозилирования) в ферменты или другие белки с биологической активностью (например, фермент по настоящему изобретению) путем конструирования кодирующей последовательности, включающей новый участок(участки) гликозилирования; экспрессии кодирующей вариант последовательности в эукариотических клетках или эквивалентной сконструированной системе или системе in vitro, способной к посттрансляционному гликозилированию. Например, последовательность из 3 аминокислот NXS/T представляет собой участок гликозилирования в эукариотических клетках, прокариотические клетки не осуществляют гликозилирования. Таким образом, изобретение включает добавление по меньшей мере одной последовательности из 3 аминокислот NXS/T к белку, так чтобы его активность снижалась или инактивировалась вследствие посттрансляционного гликозилирования.
Гликозилирование может приводить к добавлению 2 молекул N-ацетилглюкозамина (NGlucNac) к остатку N. Последующее добавление может быть специфическим для организма. В большинстве видов затем к NGlucNac добавляются сахара маннозы (Mann), причем количество остатков Mann находится в диапазоне от 10 до 100. Также в некоторых видах может добавляться сиаловая кислота. В Pichia после добавления NGlucNac может добавляться от 10 до 25 остатков Mann.
Эти способы включают применение любого дегликозилирующего фермента или набора ферментов, многие из которых были идентифицированы и/или являются коммерчески доступными. Например, фермент эндогликозидаза H осуществляет расщепление последнего NGlucNac, оставляя один NGlucNac, присоединенный к остатку N. Фермент PNGaseF отщепляет все сахара и конвертирует амино-боковую цепь остатка N в гидроксильную группу, приводя к тому, что аминокислота N в ферменте становится аспартатом (D). Таким образом, способы включают применение эндогликозидазы H и/или PNGaseF или эквивалентных ферментов in vivo или in vitro для реактивации частично или полностью сконструированных "временно инактивированных" белков.
Способ включает нацеливание ферментов или других полипептидов на секреторный путь хозяина, так чтобы произошло гликозилирование фермента. Новые участки гликозилирования конструируют так, чтобы гликозилирование инактивировало фермент или модифицировало его активность, например, снижало его активность или иным образом модифицировало активность, например, блокировало участок связывания субстрата. Поскольку фермент является неактивным или менее активным, вредоносные или токсические ферменты могут экспрессироваться на более высоких уровнях, поскольку отрицательные эффекты их активности более не являются ограничением для того, сколько белка может накапливаться в клетках-хозяевах. Неактивный гликозилированный фермент можно реактивировать (частично или полностью) путем удаления сахаров, например, с использованием коммерчески доступных дегликозилирующих ферментов, например, путем удаления сахаров in vitro, или удаления сахаров in vivo с использованием подходов инженерии цельных клеток.
В одном аспекте к любому белку, например, ферменту по изобретению, добавляют участок-мишень, такой как NXS/T, для эукариотического гликозилирования. Это позволяет специалисту в данной области добавить участки гликозилирования к представляющему интерес белку, ожидая его конвертирования в белок, который является временно неактивным после гликозилирования при экспрессии этого белка в эукариотической клетке-хозяине, и направления белка на секреторный путь клетки-хозяина.
Таким образом, изобретение относится к способам получения ферментов, которые обычно являются чрезмерно вредоносными или токсичными, чтобы клетка-хозяин могла выдерживать их в больших количествах. Эффект может быть временным, поскольку является возможной регенерация активного фермента (дегликозилированием, например, посттрансляционной модификацией/дегликозилированием) для последующей работы, требующей активного фермента.
В одном аспекте изобретение относится к способам получения и экспрессии белка, имеющего биологическую активность, активность которого временно инактивирована гликозилированием, включающим: (a) предоставление нуклеиновой кислоты, кодирующей белок, обладающий биологической активностью, где белок не является природным образом гликозилированным; (b) встраивание по меньшей мере одной кодирующей мотив гликозилирования последовательности в кодирующую белок нуклеиновую кислоту, где гликозилированная форма белка является неактивной; (c) встраивание нацеливающей последовательности в белок, так чтобы он направлялся на секреторный путь клетки-хозяина, где клетка-хозяин способна распознавать мотив гликозилирования и гликозилировать белок; и (d) экспрессию модифицированной нуклеиновой кислоты в клетке-хозяине. В одном аспекте способ дополнительно включает дегликозилирование экспрессированного белка, тем самым, реактивируя активность белка, например, фермента, такого как фермент по изобретению. В одном аспекте клетка-хозяин представляет собой эукариотическую клетку. В одном аспекте инактивированный экспрессированный рекомбинантный белок реактивируют дегликозилированием in vitro, либо химическим, либо ферментативным.
Определение встраивания одного или нескольких мотивов гликозилирования для временной инактивации белка вовлекает только общепринятые способы получения кодирующих вариант нуклеиновых кислот, например, путем GSSM, и общепринятые протоколы скрининга, например, анализы активности или связывания.
Фермент, активность которого является вредоносной для клетки-хозяина, инактивировали путем гликозилирования. Поскольку он являлся неактивным, он мог накапливаться на значительно более высоких уровнях в эукариотических клетках-хозяевах. Поскольку он более не был активен, он более не был способен оказывать его отрицательные эффекты. Инактивация токсического фермента являлась временной, благодаря дегликозилированию с использованием EndoH или PNGase F, что приводило к полному восстановлению нормальной активности фермента. Большое количество гликозилированного неактивного фермента, накопленного в среде, указывало на то, что он хорошо переносился хозяином в неактивной форме.
Понятно, что представленное выше подробное описание и прилагаемые примеры являются только иллюстративными, и их не следует истолковывать как ограничение объема объекта. Различные изменения и модификации описанным вариантам осуществления будут понятны специалистам в данной области. Такие изменения и модификации, включая, но не ограничиваясь ими, изменения и модификации, касающиеся способов применения, предоставленных в настоящем документе, можно вносить без отклонения от их сущности и объема. Патенты, патентные публикации и другие публикации, на которые в настоящем документе представлены ссылки, включены в качестве ссылок.
Изобретение далее описано с помощью представленных ниже примеров; однако, следует понимать, что изобретение не ограничивается такими примерами.
ПРИМЕРЫ
ПРИМЕР 1: Программа BLAST, использованная для определения профиля идентичности последовательностей
В этом примере описана иллюстративная программа для установления идентичности последовательностей для определения того, относится ли нуклеиновая кислота к объему изобретения. Используют программу NCBI BLAST 2.2.2, параметры по умолчанию для blastp. Использовали все величины по умолчанию, за исключением параметров фильтрации по умолчанию (т.е., все параметры, установленные как параметры по умолчанию, за исключением фильтрации, которая была установлена на OFF); вместо ее использовали параметр "-F F", которой выключает фильтрацию. Применение фильтрации по умолчанию часто приводит к противоречиям Karlin-Altschul вследствие короткой длины последовательности. Величины по умолчанию, используемые в этом примере, включают:
"Filter for low complexity: ON
> Word Size: 3
> Matrix: Blosum62
> Gap Costs: Existence: 11
> Extension: 1"
Другие параметры по умолчанию представляют собой: фильтр низкой комплексности OFF, размер слова 3 для белка, матрицу BLOSUM62, штраф за внесение пропуска -11 и штраф за продолжение делеции -1. Параметр "-W" был установлен на значение по умолчанию, равное 0. Это означает, что если он не установлен, размер слова принимает значение по умолчанию, равное 3 для белков и 11 для нуклеотидов. Параметры являются следующими:




ПРИМЕР 2: Модификации фермента PLC (ePLC)
В этом примере описаны иллюстративные протоколы для получения ферментов PLC по изобретению, включая ферменты PI-PLC по изобретению. В этом примере описаны ферменты, которые можно использовать для осуществления на практике этого изобретения, например, использовать в комбинации с ферментами PLC по изобретению (например, фермент, обладающий последовательностью, как указано в SEQ ID NO: 8, или как описано в таблице 12-15). Ферменты, которые можно использовать для осуществления на практике этого изобретения, например, в комбинациях или смесях, содержащих ферменты PLC по изобретению, включают любой фермент фосфолипазу, включая фермент, обладающий последовательностью, как указано в таблице 8 или таблице 9, или как описано в WO 2008/036863. В альтернативных вариантах осуществления ферменты, которые можно использовать для осуществления на практике этого изобретения, включают полипептиды, обладающие последовательностью, как указано в SEQ ID NO: 2 и/или SEQ ID NO: 4, и их варианты, как описано в таблицах 8 и 9, ниже.
Фермент фосфолипаза C, обладающий последовательностью, как указано в SEQ ID NO: 2 (кодируемой, например, SEQ ID NO: 1) является ферментативно активной подпоследовательностью более длинной последовательности SEQ ID NO: 4 (кодируемой, например, SEQ ID NO: 3). SEQ ID NO: 4 имеет лидерную последовательность из остатков 1-37 (полужирным шрифтом) SEQ ID NO: 2. SEQ ID NO: 4, кодируемый SEQ ID NO: 3, использовали в качестве матрицы для дальнейшей модификации с использованием технологии GSSM.
Положения пронумерованы, начиная с N-концевого метионина. Мутации подчеркнуты и выделены полужирным шрифтом (пронумерованы здесь как N100D, N168S и N171D).



Мутации единичных остатков проводили с использованием способов мутагенеза с насыщением сайта гена (GSSM) и анализировали в отношении активности фосфолипазы. Для целей скрининга экспрессирующий вектор представлял собой pASK в хозяине E. coli Top10. Лучшие результаты GSSM отбирали после первичного скрининга, для которого в качестве субстрата использовали PA/PI, и образцы анализировали с помощью LCMS. Затем эти первичные лучшие результаты подтверждали на соевом масле и анализировали с помощью 31P-ЯМР и ВЭЖХ.
Анализ с соевым маслом и методика приготовления образцов для анализа способом ЯМР являются следующими:
Детергент NMR приготавливали растворением 25 г дезоксихолевой кислоты, 5,84 г ЭДТА, 5,45 г основания Tris в 900 мл воды, затем доведением pH до 10,5 с использованием гранул KOH. Внутренний стандарт ЯМР представлял собой 50 мМ TIP и 12,5 мМ TBP в изопропаноле категории ВЭЖХ. Оксид дейтерия (D, 99,9%), низкопарамагнитный, был от Cambridge Isotope Laboratories Inc. (DLM-11-100). Контроль ЯМР представлял собой лецитин Avanti Lecithin (International Lecithin & Phospholipids Society mixed soy phospholipids reference Standard oil), Avanti Polar Lipids Inc, # 95309.
Стандарты и образцы приготавливали следующим образом:
Тщательно перемешать партию неочищенного соевого масла.
Распределить 1 мл масла в 2-мл пробирку. Добавить 60 мкл очищенного фермента (для контролей, 18 единиц) или чистого клеточного лизата (для скрининга мутантов); перемешать в течение 15 секунд. Единицы определяют как гидролиз 1 мкмоль PC в минуту при 37°C при pH 7,3.
Инкубировать при 60°C в течение 48 часов в термосмесителе с качанием при 14000 об./мин, периодически встряхивать на устройстве для встряхивания.
После инкубации перемешать образцы тщательно с использованием устройства для встряхивания.
Отвесить 250 мг (+/-0,2 мг) каждого образца в 2-мл пробирку и отвесить контроль для ЯМР, состоящий из 10 мг (+/-0,1 мг) Avanti Lecithin.
К каждому образцу добавить 900 мкл детергента для ЯМР, а затем добавить 100 мкл D2O.
Перемешать образцы тщательно встряхиванием на устройстве для встряхивания и качанием в термосмесителе Eppendorf Thermomixer, при 30-37°C и 14000 об./мин. в течение 30 минут.
Центрифугировать при 13000 об./мин. в течение 10 минут.
Осторожно удалить верхний маслянистый слой.
К каждому образцу добавить 750 мкл гексана и осторожно встряхнуть на устройстве для встряхивания*.
Центрифугировать при 13000 об./мин. в течение 10 минут.
Осторожно удалить 600 мкл нижнего водного слоя и перенести в новую пробирку.
Добавить 25 мкл внутреннего стандарта, хорошо перемешать.
Перенести 500 мкл в 5-мм пробирку для ЯМР.
Высвобождение DAG измеряли с помощью количественной ВЭЖХ согласно следующему протоколу:
Раствор образца представлял собой приблизительно 50 мкл образцов масла и 950 мкл смеси гексан/изопропанол (9:1) до 1 мл. Стандартные растворы представляли собой, например, 0,25 мг/мл, 0,5 мг/мл, 1 мг/мл, 2 мг/мл, и 4 мг/мл масле ENOVATM (Kao Corporation, Itasca, IL). Масло Enova представляет собой масло с высоким содержанием DAG, которое имеет распределение жирных кислот, сходное с обычным растительным маслом (1,3-DAG и 1,2-DAG).
Параметры ВЭЖХ:
Колонка: ChromegasphereTM SI-60, 15 см × 4,6 мм
Температура: 40°C
Скорость потока: 2 мл/мин
Объем инжекции: 20 мкл
Подвижная фаза A: гексан
Подвижная фаза B: Гексан/изопропанол/этилацетат/муравьиная кислота=800: 100: 100: 1
Градиентное элюирование:

Параметры испарительного детектора рассеяния света (ELSD): Иллюстративные параметры представляли собой температуру 40°C, приращение 5, и давление газообразного азота 3,5 бар (350 кПа). Пик DAG идентифицировали путем сравнения времени удержания со временем удержания стандарта. Количественное определение было основано на взаимосвязи между ответом детектора (площадь пика) и концентрацией анализируемого образца.
В таблице 8 описаны последовательности, которые можно использовать для осуществления на практике этого изобретения, например, в комбинации с полипептидами по изобретению (см., например, таблицы 12-15), например, в качестве смесей или комбинаций ферментов.
На основе данных ЯМР и ВЭЖХ были отобраны мутации, представленные в таблице 8 ниже. В таблице 8 ниже указана исходная аминокислота, номер положения аминокислотного изменения и измененная аминокислота (для SEQ ID NO: 4). В таблице 8 также указан исходный кодон, замещающий кодон и другие кодоны для той же измененной аминокислоты. Например, во второй строке "E41A" указывает на то, что аминокислота в положении 41 исходно представляла собой "E" (глутаминовую кислоту), но была заменена на "A" (аланин). Исходный кодон для замены E41A представлял собой "GAG", но был заменен на "GCA". Однако также можно было использовать кодоны "GCG", "GCC" или "GCT". В таблице 8 указаны варианты кодонов, которые приводили к вариантам (SEQ ID NO: 4) с наилучшим варьированием или "улучшением" относительно "дикого типа" (SEQ ID NO: 4) для гидролиза PA. Изобретение относится к нуклеиновым кислотам и полипептидам, которые кодируют их, содержащим один или все из вариантов, или эквиваленты всех вариантов, указаны в таблице 8.
На фигуре 10 массовая доля отдельных видов фосфолипидов (PL) приведена относительно общего PL, остающегося после реакции, отражая специфичность мутантов в конкретному виду. Здесь, виды представляли собой фосфатидную кислоту (PA), фосфатидилэтаноламин (PE), фосфатидилинозитол (PI), фосфатидилхолин (PC). "TIP" относится к внутреннему стандарту ЯМР. "Высвобожденный DAG" измеряли способом ВЭЖХ и он отражает относительные величины между образцами и контролями для общих 1,3-DAG и 1,2-DAG.
Положительный контроль представлял собой очищенный образец мутанта E41A, ранее описанного в Tan et al, Biochemistry 37:4275-4279 (1998). Результаты указывают на то, что мутанты хорошо высвобождают DAG и обладают хорошей активностью в отношении различных видов, включая фосфатидилхолин (PC) и фосфатидилэтаноламин (PE), сравнимой или лучшей, чем у матрицы (SEQ ID NO: 4). Например, D100L и D100M демонстрируют конкретную активность в отношении PA. Q265R демонстрирует конкретную активность в отношении PI. Эти мутации можно комбинировать для обеспечения ферментов, обладающих желаемой активностью в отношении различных субстратов.
Лучшие результаты в GSSM
В альтернативных вариантах осуществления изобретение относится к комбинациям (смесям) ферментов PLC, или нуклеиновых кислот, которые кодируют их, содержащих последовательность нуклеиновой кислоты SEQ ID NO: 3 (кодирующую полипептид SEQ ID NO: 4) и/или последовательность нуклеиновой кислоты SEQ ID NO: l (кодирующую полипептид SEQ ID NO: 2); или комбинациям (смесям) ферментов PLC, содержащих SEQ ID NO: 2 и/или SEQ ID NO: 4.
В альтернативных вариантах осуществления изобретение относится к комбинациям (смесям) ферментов PLC, или нуклеиновым кислотам, которые кодируют их, содержащим последовательность нуклеиновой кислоты SEQ ID NO: 3 (кодирующую полипептид SEQ ID NO: 4) и/или последовательность нуклеиновой кислоты SEQ ID NO: l (кодирующую полипептид SEQ ID NO: 2), имеющим одну, две или более или все из мутаций нуклеиновых кислот, которые кодируют аминокислотные мутации, приведенные выше в таблице 8, включая, например, изменения кодонов, описанные в настоящем документе. В альтернативных вариантах осуществления изобретение относится к комбинациям (смесям) ферментов PLC, кодируемых этими нуклеиновыми кислотами, например, к комбинациям (смесям) ферментов PLC, кодируемых одной, несколькими или всеми из вариантов последовательности нуклеиновой кислоты SEQ ID NO: 3 и/или SEQ ID NO: 1, как описано в таблице 8.
После скрининга лучших результатов GSSM и отбора наилучших результатов (см. таблицу 8 выше) проводили дальнейшую охарактеризацию на планшетах с яичным желтком для сужения количества мутантов GSSM, для включения в дальнейшее исследование с использованием технологии повторной сборки гена. В таблице 10 представлены данные анализа с яичным желтком (анализ с яичным желтком описан ниже), вместе с результатами анализа масла и определения термической устойчивости по остаточной активности. На фигуре 11 проиллюстрированы единичные улучшенные мутанты GSSM, которые были отобраны для включения в процесс повторной сборки гена. Повторную сборку гена проводили, как описано в настоящем документе.
В таблице 9, ниже, приведены 288 полипептидных последовательностей, которые можно использовать для применения на практике этого изобретения, например, в комбинации с полипептидами по этому изобретению (см., например, таблице 12-15), например, в качестве смесей или комбинаций ферментов. В таблице 9 представлены последовательности, которые были получены комбинированием путем повторной сборки гена выбранных единичных улучшенных мутантов GSSM. Все они представляют собой варианты исходной аминокислотной последовательности SEQ ID NO: 4 (последовательность "дикого типа" или "WT").
Для облегчения прочтения таблицы 9, например, для фосфолипазы, охарактеризованной как "измененная" фосфолипаза 1 (вторая строка таблицы):
- аминокислотный остаток дикого типа "E", или глутаминовая кислота (glu), в положении остатка 41 (SEQ ID NO: 4) модифицирована в остаток "Y", или тирозина (tyr); аминокислотый остаток дикого типа "N", или аспарагин (asp) в положении остатка 100 (SEQ ID NO: 4) модифицирован на остаток "M", или метионина (met);
- аминокислотный остаток дикого типа "N", или аспарагин (asp), в положении остатка 168 (SEQ ID NO: 4) модифицирован в остаток "S" или серина (ser); аминокислотный остаток дикого типа "N", или аспарагин (asp), в положении остатка 171 (SEQ ID NO: 4) остается "N"; и,
- аминокислотный остаток дикого типа "M" или метионин (met) в положении остатка 176 (SEQ ID NO: 4) остается "M".
Библиотека фосфолипаз, полученная комбинированием путем повторной сборки гена единичных улучшенных мутантов GSSM
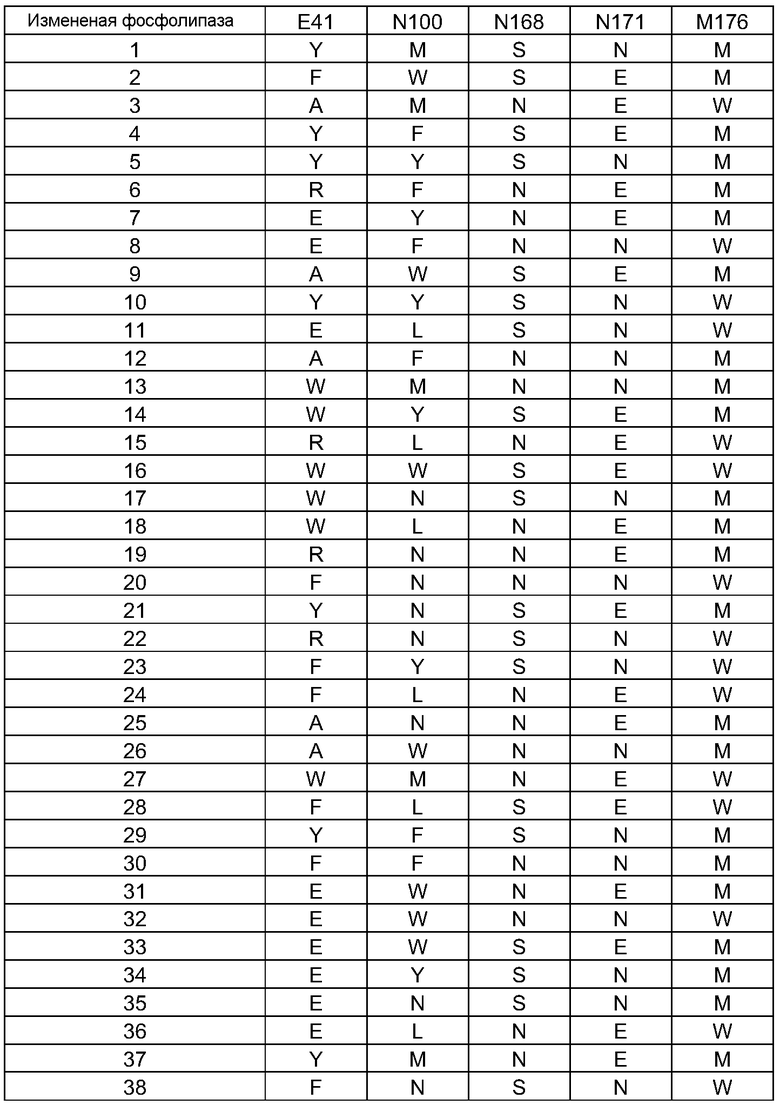
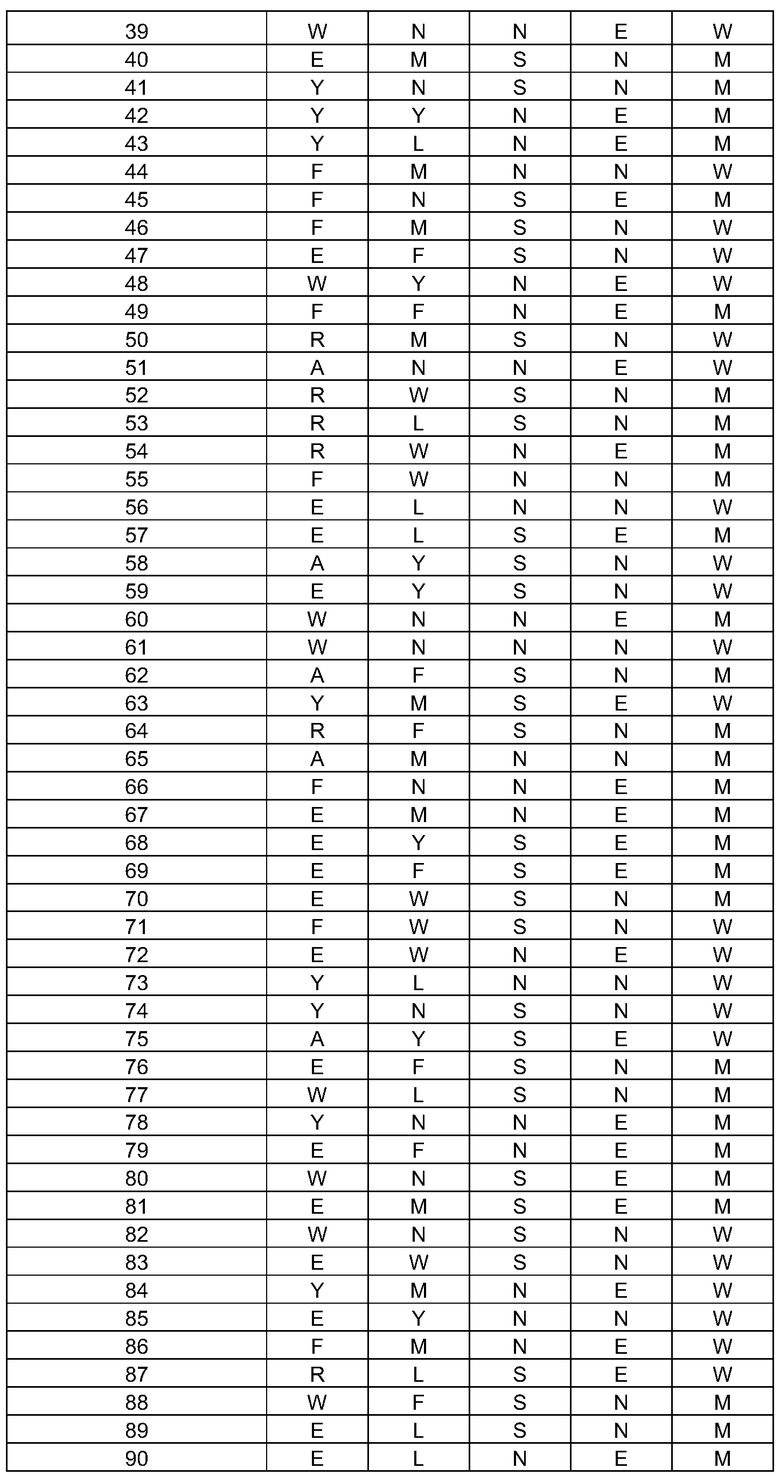
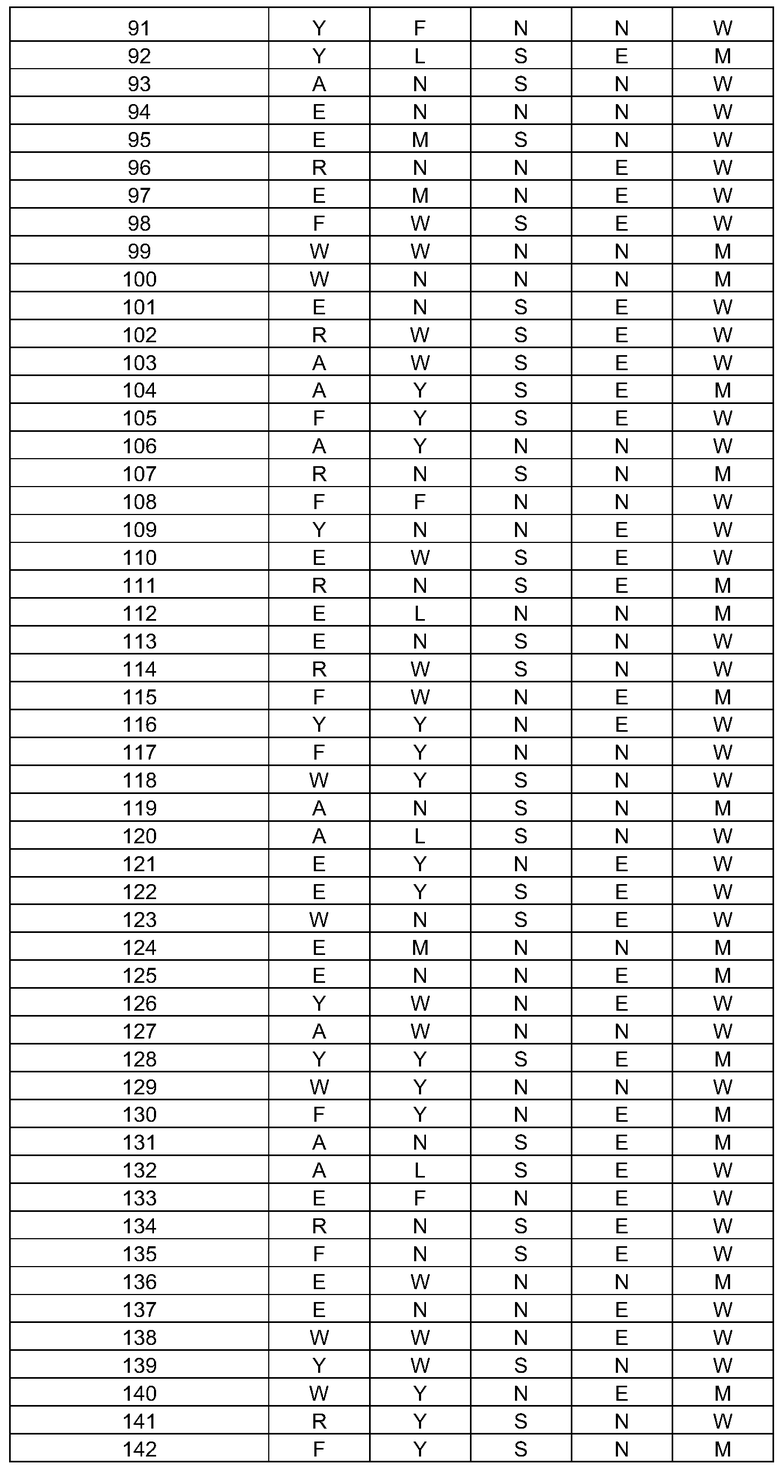
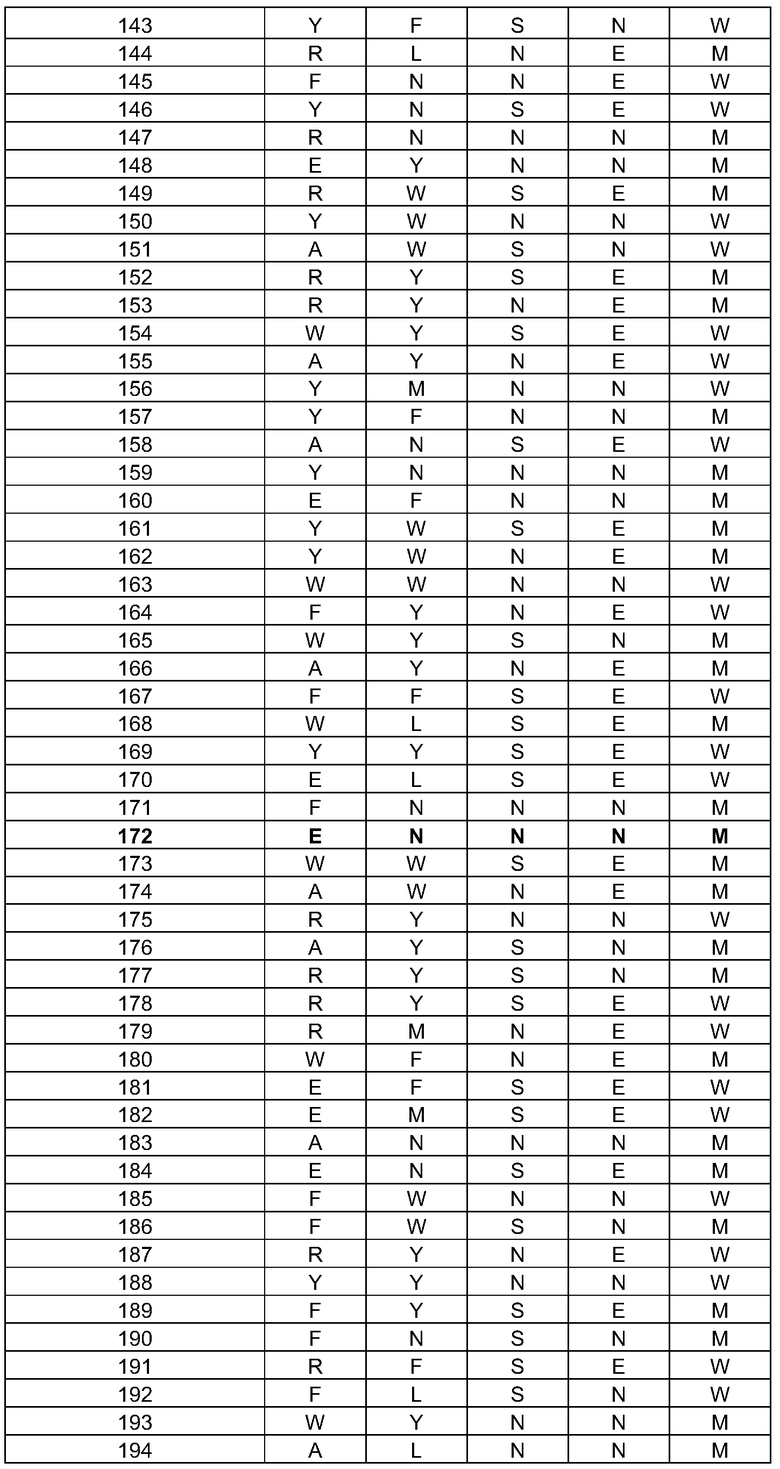
В таблице 10 обобщенно представлены результаты анализов, анализирующих различную ферментативную активность, и характеристики экспрессирующей системы, для иллюстративных ферментов по изобретению (и в случае экспрессирующей системы Pichia Pastoris - активность экспрессии нуклеиновых кислот, которые кодируют их), все из полипептидов по изобретению представляют собой варианты исходной последовательности фосфолипазы с SEQ ID NO: 4 (кодируемой, например, последовательностью нуклеиновой кислоты SEQ ID NO: 3).
АНАЛИЗ АКТИВНОСТИ И ОБОБЩЕНИЕ
24 ч
Анализ с яичным желтком проводят следующим образом:
Планшеты с яичным желтком получают добавлением 0,5% (по масс.) фосфатидилхолина яичного желтка в среду перед автоклавированием. Планшеты являются более единообразными, если фосфатидилхолин диспергируют смесителем с высоким сдвиговым усилием перед автоклавированием среды.
В лунки наносят агар и в лунки добавляют равные объемы (например, 2 мл) серийных разведений образцов, включая положительный контроль.
Планшеты оставляют на 3-12 часов при 37°C, и в ходе этого времени фермент диффундирует из лунок, гидролизует лецитин яичного желтка и формирует зоны преципитации вследствие образования диацилглицерина.
Площадь в пределах кольца преципитации, измеренную как диаметр кольца или интегрированная величина плотности (IDV), наносят на график против стандартной кривой для положительного контроля для определения активности фосфолипазы образца. Весь процесс можно использовать для определения неизвестной активности PLC в образце. Способ является полуколичественным.
Фосфатидилхолин (PC): от Sigma, каталожный номер No. P 5394
PC из высушенного яичного желтка, тип X-E, приблизительно 60% PC согласно TLC.
В альтернативных вариантах осуществления изобретение относится к комбинациям или смесям ферментов по изобретению и ферментов, описанных в примере 2, включая например, все варианты ферментов, описанные в таблице 8 и в таблице 9, и в WO 2008/036863.
ПРИМЕР 3: Получение иллюстративных ферментов фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) по изобретению
В этом примере описаны иллюстративные ферменты фосфатидилинозитол-специфической фосфолипазы C (PI-PLC) по изобретению, включая полипептид, имеющий последовательность, как указано в SEQ ID NO: 8, и полипептиды, имеющие активность PI-PLC, как описано в таблицах 12-15; и иллюстративные способы их получения и применения, и анализы для определения их активности фосфолипазы.
В альтернативных вариантах осуществления изобретение относится к полипептидам, имеющим активность фермента PI-PLC. В некоторых вариантах осуществления эти полипептиды конструировали следующими способами:
Для этой серии вариантов осуществления, полипептид, имеющий аминокислотную последовательность SEQ ID NO: 6 (кодируемую, например, SEQ ID NO: 5) отбирали в качестве "исходной" последовательности или последовательности "дикого типа" для дальнейшей модификации (или "эволюции"); в частности, использовали подчеркнутую (см. ниже) подпоследовательность SEQ ID NO: 6 (или SEQ ID NO: 5) с добавлением начального метионина (например, MASSINV…), в качестве "исходной" или первоначальной последовательности для "эволюции" или изменения последовательности для получения вариантов ферментов. Следует отметить, что "исходная" или первоначальная последовательность для "эволюции" лишена первых 30 аминокислот, которые включают сигнальную последовательность (курсив), или MNNKKFILKLFICSMVLSAFVF, кодируемую, например, посредством:
ATGAACAATAAGAAGTTTATTTTGAAGTTATTCATATGTAGTATGGTACTTAGCGCCTTTGTATTT
"Исходная" или первоначальная последовательности для "эволюции" также лишена предсказанного участка расщепления (полужирный шрифт, курсив) GCTTTC (нуклеиновая кислота) или AF (аминокислотные остатки).
"Эволюцию" (изменение последовательности, или "мутацию") проводили с использованием "мутагенеза с насыщением сайта гена" (GSSM) и повторной сборки гена (см. выше для описания GSSM и повторной сборки гена) на SEQ ID NO: 5 с использованием подчеркнутых последовательностей, ниже, с добавлением нуклеиновой кислоты, кодирующей исходный "M" или метионин (например, для кодируемой аминокислотной последовательности, MASSINV...), в качестве исходной или первоначальной последовательности для "эволюции":
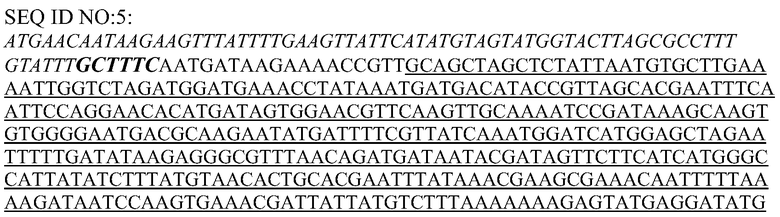

Таким образом, исходная последовательность для GSSM представляла собой нуклеиновую кислоту, кодирующую:

"Измененные" варианты нуклеиновой кислоты (новые последовательности нуклеиновой кислоты, полученные проведением GSSM для SEQ ID NO: 5) субклонировали для экспрессии либо в E. coli (для фазы GSSM), либо в P. fluorescens (для фазы повторной сборки генов).
GSSM проводили, как описано, например, в патентах США No. 6171820; 6238884 (также см. объяснение в настоящем документе). Также см. WO 2008/036863.
Полученные новые "варианты" или "измененные" последовательности нуклеиновых кислот и полипептидов анализировали с использованием высокопроизводительного анализа следующим образом:
SOP для высокопроизводительного анализа термической стабильности
В скрининге GSSM использовали хозяина E. coli, XL 1 Blue (Stratagene, San Diego, CA), с вектором pASK (IBA GmbH, Gottingen, Германия). В скрининге повторной сборки гена использовали хозяина Pseudomonas fluorescens (Dow Global Technologies Inc., публикация патентной заявки США NO. 20050130160, публикация патентной заявки США NO. 20050186666 и публикация патентной заявки США NO. 20060110747) с вектором pDOW1169 (Dow Global Technologies Inc., публикация патентной заявки США NO. 20080058262) и проводили отбор по росту в минимальной среде M9 (Dow Global Technologies Inc., публикация патентной заявки США NO. 20050186666).
Основные планшеты
1. Основные планшеты создавали путем отбора колоний вариантов, полученных GSSM или повторной сборкой генов, в 384-луночный планшет, содержавший 50 мкл среды на лунку.
a. Среда, использованная для выращивания вариантов, полученных GSSM, представляла собой LB, и для вариантов, полученных повторной сборкой генов, среда представляла собой M9 (-урацил).
2. Основные планшеты выращивали в течение ночи при 30°C в инкубаторе с увлажнением, а затем добавляли 20% глицерин перед хранением планшетов при -80°C.
Планшеты для экспрессии
1. Основные планшеты размораживали при комнатной температуре или 30°C перед дублированием.
2. Основные планшет дублировали с использованием инструмента с иглами для 384-луночных планшетов для инокуляции планшетов для экспрессии, содержавших 60 мкл среды. Для планшетов для экспрессии использовали ту же среду, что и для основных планшетов.
3. Планшеты для экспрессии выращивали в течение ночи (приблизительно 16 ч) при 30°C в инкубаторе с увлажнением.
4. Планшеты для экспрессии, предназначенные для скрининга GSSM, индуцировали с помощью 200 нг/мл безводного тетрациклина (AHT) и планшеты для повторной сборки генов индуцировали IPTG в конечной концентрация 0,3 мМ.
5. Планшеты для экспрессии инкубировали для выращивания в течение ночи в увлажненном инкубаторе при 30°C.
6. Затем планшеты для экспрессии хранили при -20°C до замораживания, как правило, в течение ночи, для лизиса клеток-хозяев.
7. Перед анализом планшетов для экспрессии, их размораживали при комнатной температуре или 30°C.
Роботизированный скрининг термической устойчивости
1. Автомат программировали для переноса 10 мкл из планшетов для экспрессии в планшет для анализа при RT и в планшет для анализа при нагревании.
2. Планшет для анализа при RT оставляли при комнатной температуре, а планшет для анализа при нагревании инкубировали при повышенной температуре в течение 1 часа. В ходе обработке нагреванием планшеты для анализа при нагревании накрывали крышкой из пенопласта. Температуры для обработки нагреванием приведены в таблице 11 ниже:
Температуры для первичного и вторичного роботизированных скринингов
3. После обработки нагреванием добавляли 40 мкл субстрата метилумбеллиферилмиоинозитолфосфата (MUPI) с использованием titertek. Субстрат приготавливали в концентрации 3 мМ, так чтобы конечная концентрация в планшетах для анализа составляла 2,5 мМ.
4. Планшеты для анализа инкубировали при комнатной температуре в течение 5 мин. Затем измеряли флуоресценцию в качестве относительных единиц флуоресценции (RFU) на флуоресцентном устройстве для считывания при длине волны возбуждения 360 нм и длине волны испускания 465 нм.
Вычисление % остаточной активности
1. Каждый планшет для анализа содержал 12 положительных и 12 отрицательных контролей. Положительные контроли содержали фермент дикого типа и отрицательные контроли содержали только вектор в организме-хозяине.
2. Флуоресценцию отрицательных контролей усредняли для каждого 384-луночного планшета и вычитали из флуореценции вариантов, полученных GSSM или повторной сборкой гена, для анализа планшетов при RT и анализа планшетов при нагревании.
3. Затем результат для каждой лунки планшета для анализа при нагревании делили на результат для соответствующей лунки планшета для анализа при RT, получая процентную остаточную активность (% RA) для каждого варианта.
4. % RA использовали для ранжирования наиболее термоустойчивых вариантов при высокопроизводительном роботизированном скрининге. Эти лучшие варианты подтверждали в дополнительных анализах.
Вторичный скрининг
1. Улучшенную температурную устойчивость подтверждали с использованием вторичного скрининга отдельных лучших вариантов. Лучшие варианты отбирали из основных планшетов для первичного скрининга в новые основные планшеты и анализировали при повышенных температурах, приведенных в таблице 11. Протокол анализа был таким же, как протокол, подробно описанный выше для первичного скрининга.
Обобщенно представлены последовательности и процентная (%) остаточная активность лучших термоустойчивых вариантов GSSM, отобранных для конструирования библиотеки для повторной сборки генов
Мутанты с точковыми мутациями и ассоциированные с ними данные для таблицы 12 представлены ниже в таблице 13. Следует отметить, что в таблице 13, нумерация положений аминокислот начинается с добавленного исходного метионина (например, аминокислота "M" представляет собой положение 1, аминокислота "A" представляет собой положение 2, аминокислота "S" представляет собой положение 3, аминокислота "S" представляет собой положение 4, аминокислота "I" представляет собой положение 5, аминокислота "N" представляет собой положение 6 и т.д.). Важно пояснить: для вариантов SEQ ID NO: 6, нумерация аминокислотных изменений начинается с аминокислоты 31 SEQ ID NO: 6, где аминокислота 31 ("A") заменена метионином ("M").
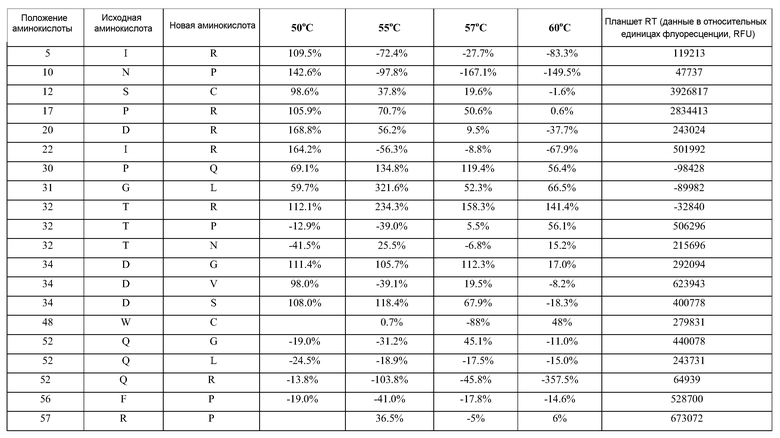

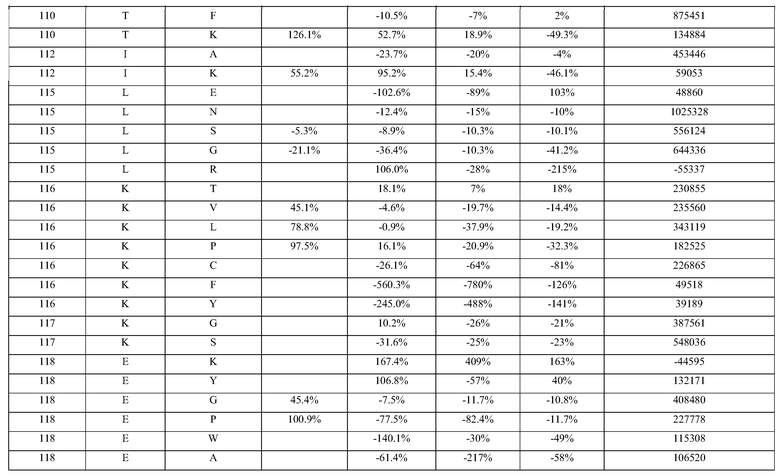
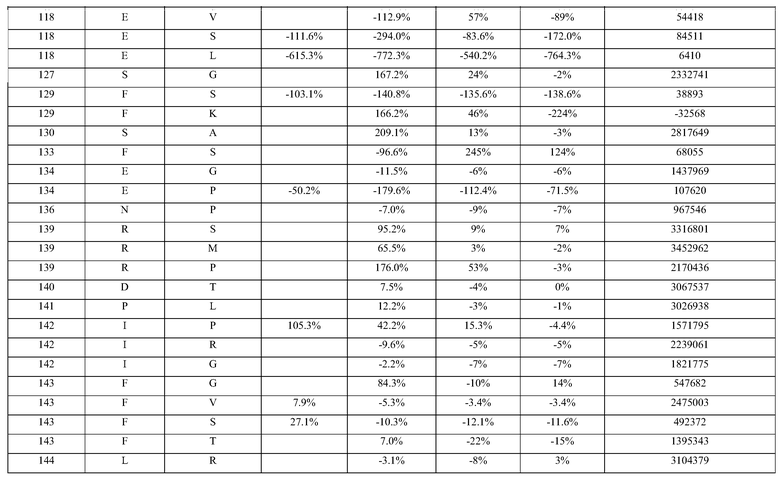
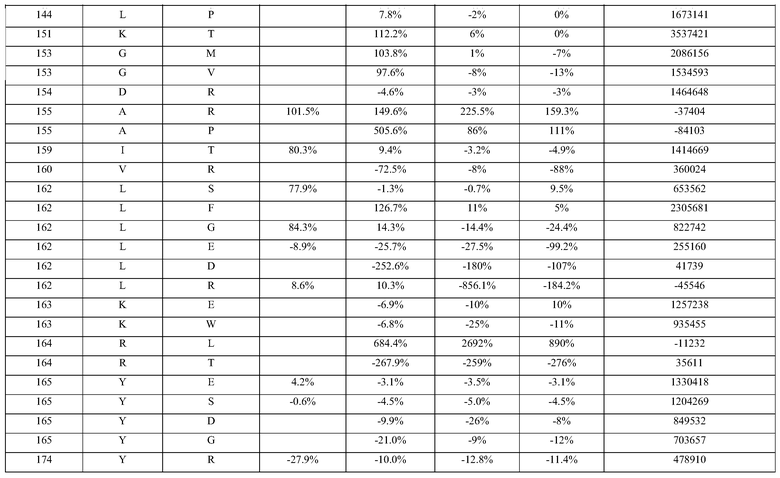
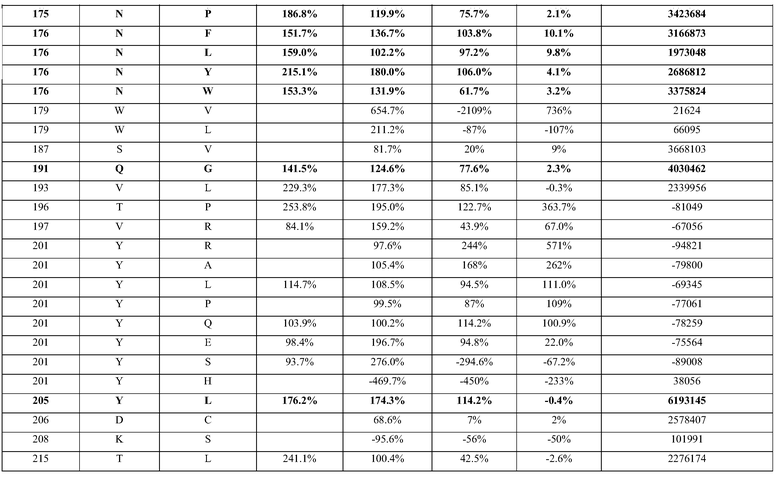
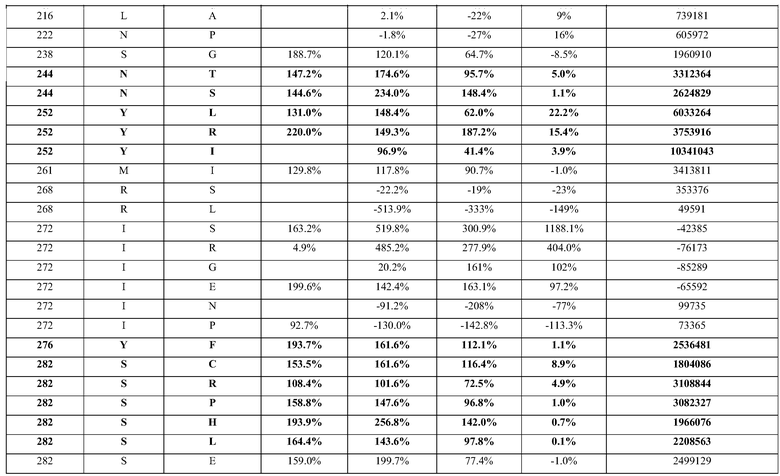

Повторную сборку гена проводили для нуклеиновых кислот, как описано в настоящем документе, с использованием наилучших термостабильных мутантов из фазы GSSM; и условий для вариантов повторной сборки генов, описанных выше в разделе под названием "SOP для высокопроизводительного анализа термической стабильности", этого примера выше. (Для повторения: нуклеиновые кислоты, кодирующие тридцать одну (31) аминокислоту SEQ ID NO: 6 (кодируемой, например, SEQ ID NO: 5) удаляли, и нуклеотиды, кодирующие исходный метионин, добавляли с получением нуклеиновой кислоты, которая была "изменена" в GSSM и повторной сборке гена).
Наилучшая комбинация вариантов фермента после повторной сборки гена (для термостабильных мутантов из фазы GSSM) указана в таблице 14, ниже. Изобретение относится к ферментам, и нуклеиновым кислотам, кодирующим их, содержащим одно, несколько или все из аминокислотных изменений, описанных в таблице 14. Например, из первой строки таблицы 14, один иллюстративный фермент по изобретению представляет собой фермент, содержащий аминокислотную последовательность, указанную в SEQ ID NO: 6, но со следующими аминокислотными изменениями: N176F, Q191G, Y205L, N244T, Y252R, Y276F, S282H, L284F и/или R291N.
Данные по активности для этих иллюстративных ферментов по изобретению указаны в таблице 15 ниже.
Наилучшая комбинация вариантов ферментов для повторной сборки генов
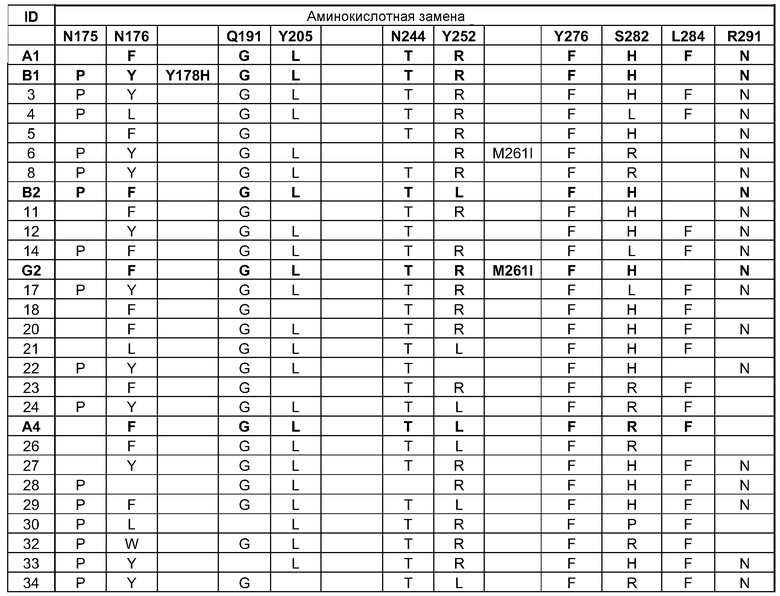
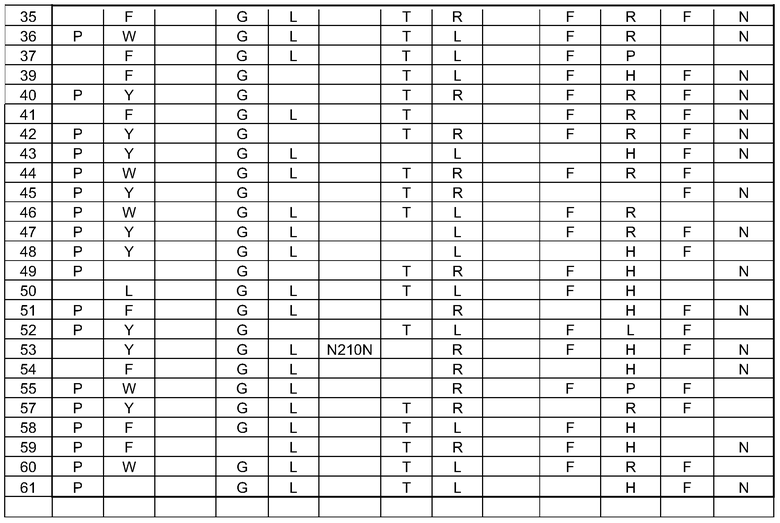
Данные для вариантов, полученных повторной сборкой гена, представляют собой:
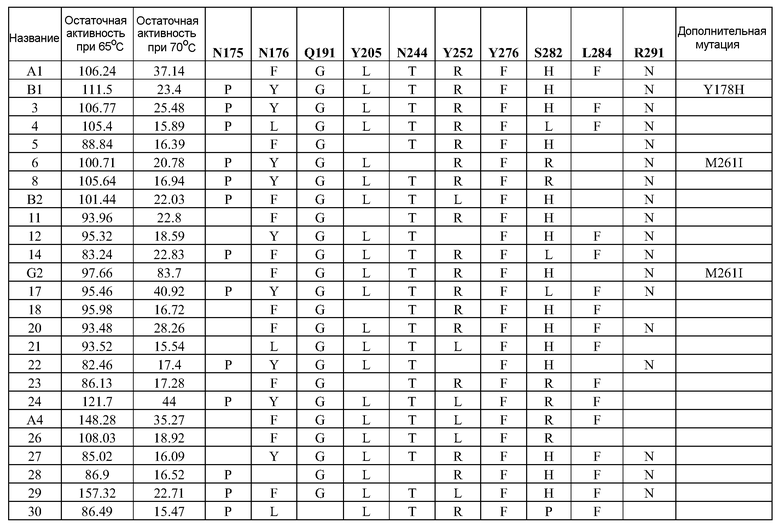
Главный лучший вариант, полученный повторной сборкой гена, = "G2", или SEQ ID NO: 8, кодируемой SEQ ID NO: 7:


Данные скрининга в масле: мелкомасштабный скрининг на содержание фосфолипидов для лучших вариантов, полученных повторной сборкой гена, обобщен в таблице ниже. Масла обрабатывали (или не обрабатывали, в случае контроля) ферментом, как описано в протоколе под названием "методика мелкомасштабного скрининга масла", ниже. Затем образцы анализировали в отношении содержания фосфолипидов с помощью ЯМР с использованием следующего протокола:
Методика мелкомасштабного скрининга в масле
Задача: Исследовать активность ePLC и PI-PLC в неочищенном соевом масле в моменты времени в ходе ферментативной реакции.
Масло:
Неочищенное соевое масло
FFA: 0,24%
pH: 6,97
DAG: 0,27% 1,2+0,24% 1,3=0,51% общего DAG
PL: 0,21% PA, 0,43% PE, 0,25% PI, 0,44% PC (1,34% общие PL);
Без LPA, 0,01% LPE, без LPI, 0,02% LPC, без 1-LPL; 0,01% A, без E, I или C; общее содержание фосфора 661 м.д., из которых 628,6 м.д. из PL
CP: 742 м.д. P, 73,8 м.д. Ca, 69,8 м.д. Mg, 0,0 м.д. Fe
Ферменты:
Измененная фосфолипаза 8 (пример 2, таблица 9) - 11,5 единиц/мг
Требуется 5,5 единиц × 15 образцов = всего 82,5 единиц/ 11,5 единиц/мг ~ 7 мг
Взвесить 12,1 мг × 11,5 Е/мг = 139,15 единиц, ресуспендированных в 120 мкл 20 мМ Hepes pH 7,4, 1 мМ ZnSO4 = 1,16 единиц/мкл
Требуется 5,5 единиц в 10 мкл
5,5 единиц/(1,16 единиц/мкл) = 4,7 мкл + 5,3 мкл = 10 мкл
Приготовить исходный раствор 94 мкл, 1,16 единиц/мкл, и 106 мкл 20 мМ Hepes, pH 7,4, 1 мМ ZnSO4. Добавить 10 мкл в реакционную смесь
SEQ ID NO: 8-4,2 единиц/мг
Требуется 0,02 единиц x 15 образцов = всего 0,3 единицы/ 4,2 единиц/мг ~ 1 мг
Взвесить 4,2 мг × 4,2 Е/мг = 17,64 единиц, ресуспендировать в 120 мкл 20 мМ Hepes pH 7,4, 1 мМ ZnSO4 = 0,147 единиц/мкл
Требуется 0,02 единиц в 10 мкл
0,02 единиц/(0,147 единиц/мкл) = 0,14 мкл + 9,86 мкл = 10 мкл
Приготовить исходный раствор: 3 мкл, 0,147 единиц/мкл и 197 мкл 20 мМ Hepes pH 7,4, 1 мМ ZnSO4. Добавить 10 мкл в реакционную смесь
Условия реакции:
1 мл масла разделяли на аликвоты в 2-мл пробирки с использованием Glison distriman.
Масло предварительно нагревали при 60°C, качая при 1400 об./мин. в термосмесителе в течение ~30 минут, а затем добавляли фермент.
Фермент добавляли к каждому образцу, затем гомогенизировали в течение 30 секунд и инкубировали при 60°C при непрерывном качании.
Образцы удаляли в определенные моменты времени.
Непосредственно после удаления образцов в определенные моменты времени, образцы приготавливали для анализа ЯМР. Добавление детергента для ЯМР, pH 10,5, должно было остановить ферментативную реакцию.
Приготовление реагентов, стандартов и образцов определения с помощью 31 P-ЯМР фосфолипидов и продуктов:
Использовали два внутренних стандарта 31P либо TMP (2,2,6,6-тетраметилпиперидин)/трибутилфосфат (TBP), либо TMP/ триметилпсорален (TIP) при pH 10,5. TIP является наименее подверженным спектральному перекрыванию, однако он обладает более длительным временем релаксации (2,76 с) по сравнению с 1,02 с для TBP. TBP соответствует величинам T1 для PC, PE и PI, в то время как TIP более соответствует PA. Коэффициенты насыщения вычисляли из данных, полученных с нормальной задержкой цикла повторения, составляющей 1,74 с против цикла повторения 21,6 с, с использованием угла наконечника 58 градусов для оптимального отношения S/N на единицу времени с использованием TIP. Это, вероятно, является предпочтительным способом. Хотя TBP и является более эффективным вследствие короткого T1, он имеет промежуточное значение химического сдвига между PI и PC и является высоко зависимым от температуры и имеет проблему перекрывания.
Это обеспечивает следующие преимущества:
(i) pH 10,5 точно отделяет LPI от PE (они перекрываются при pH 8,6, и 9,5),
(ii) внутренние стандарты TBP и TIP позволяют более быстрые задержки цикла повторения ЯМР с улучшением S/N приблизительно 2,8 в единицу времени,
(iii) обеспечивает внутреннюю проверку обоих эталонов, как 2 мМ TBP/TIP, так и 2 мМ TMP,
(iv) позволяет выбирать различные условия ЯМР, исходя из потребностей (PL или продукты, например).
Приготовление реагентов
1. 5% дезоксихолевая кислота (DOC): растворить 5,0 г соли Na дезоксихолевой кислоты в 100 мл воды категории ВЭЖХ.
2. 50 мМ ЭДТА/112,5 мМ TRIS: к 100 мл воды категории ВЭЖХ добавить 1,46 г кислоты EDTA и 1,3624 г основания TRIS.
3. Детергент 5:4 DOC/(EDTA/TRIS), pH 10,5: смешать 50 мл DOC Na и 40 мл EDTA/TRIS. Добавлять порционно гранулы KOH до pH 10,5 (несколько гранул). Этот детергент содержит 50 мМ TRIS для забуферивания pH.
4. В общем, для получения 900 мл детергента: 25 г DOC, 5,84 г EDTA, 5,45 г основания Tris, 900 мл H2O, довести pH до 10,5 с использованием гранул KOH.
5. Внутренний стандарт 50 мМ TMP и 50 мМ TBP в изопропаноле категории ВЭЖХ (IPA): сначала приготовить 100 мМ TMP (MW 140,08) и 100 мМ TBP (MW 266,32) в IPA соответственно, а затем перемешать их при соотношении 1:1. Приготавливать свежий исходный раствор каждую неделю анализа и хранить его при 4°C для поддержания стабильности.
Приготовление стандартов и образцов
6. Калибровочный раствор PL: точно отвесить (+/-0,1 мг) приблизительно 10 мг лецитина Avanti Lecithin (PA 5,9%, PE 10,4%, PI 8,3%, PC 14,0%, LPC 0,5%) в 2-мл колбу. Добавить 40 мкл внутреннего стандарта 50 мМ TMP/50 мМ TBP, 100 мкл D2O, и 860 мкл детергента и тщательно перемешать встряхиванием в течение полуаса, и отобрать 500 мкл прозрачного водного раствора в стандартную 5-мм пробирку для ЯМР после центрифугирования в течение некоторого времени*. Концентрации TMP и TBP составляют 2000 мкМ и 2000 мкМ соответственно; молекулярные массы PA, PE, PI, PC и PLC составляют приблизительно 697, 716, 857, 758 и 496, соответственно, таким образом, для лецитина Avanti Lecithin концентрация составляет 10,0 мг/мл, для PA она составляет 0,846 мМ, для PE она составляет 1,453 мМ, для PI она составляет 0,968 мМ, для PC она составляет 1,847 мМ, и для LPC она составляет 0,101 мМ.
7. Раствор образца неочищенного соевого масла: встряхнуть масло и аккуратно отвесить (+/-0,2 мг) приблизительно 100 мг масла в 2-мл колбу. Добавить 100 мкл D2O, и 900 мкл детергента и тщательно перемешать встряхиванием в течение получаса. После центрифугирования в течение некоторого периода времени, отобрать 600 мкл прозрачного водного раствора в колбу* и добавить 24 мкл внутреннего стандарта 50 мМ TMP/50 мМ TBP и тщательно перемешать, затем отобрать 500 мкл прозрачного водного раствора в стандартную 5-мм пробирку для ЯМР.
8. Раствор образца рафинированного масла: встряхнуть масло и аккуратно отвесить (+/-0,2 мг) приблизительно 250 мг масла в 2-мл колбу. Добавить 100 мкл D2O, и 900 мкл детергента и смесь тщательно перемешать встряхиванием в течение получаса. После центрифугирования в течение некоторого периода времени, отобрать 600 мкл прозрачного водного раствора в колбу* и добавить 24 мкл внутреннего стандарта 50 мМ TMP/50 мМ TBP и тщательно перемешать, а затем отобрать 500 мкл прозрачного водного раствора в стандартную 5-мм пробирку для ЯМР.
9. Раствор образца камеди: отвесить приблизительно 10 мг камеди (+/-0,1 мг) (не более 11 мг) в 2-мл колбу. Добавить 40 мкл внутреннего стандарта 50 мМ TMP/12,5 мМ TBP, 100 мкл D2O, и 860 мкл детергента и тщательно перемешать встряхиванием в течение получаса, и отобрать 500 мкл прозрачного водного раствора в стандартную 5-мм пробирку для ЯМР после центрифугирования в течение некоторого периода времени*.
*Раствор образца становится двухслойным после центрифугирования. Для переноса нижнего слоя прозначного раствора в пробирку для ЯМР используют шприц и иглой. Использовать осторожно, чтобы не повредить верхний слой.
10. Раствор образца неочищенного масла канолы: встряхнуть масло и аккуратно отвесить (+/-0,2 мг) приблизительно 250 мг масла в 2-мл колбу. Добавить 100 мкл D2O, и 900 мкл детергента и тщательно перемешать встряхиванием в течение получаса. После центрифугирования в течение некоторого периода времени, отобрать 600 мкл прозрачного водного раствора в флакон* и добавить 24 мкл внутреннего стандарта 50 мМ TMP/50 мМ TBP и тщательно перемешать, затем отобрать 500 мкл прозрачного водного раствора в стандартную 5-мм пробирку для ЯМР.
11. Раствор образца отработанной воды: оценить % об. масла в отработанной воде. Встряхнуть отработанную воду и отобрать 0,5 мл в 2-мл колбу и аккуратно ее взвесить (приблизительно 500 мг). Добавить 100 мкл D2O и приблизительно 400 мкл детергента для получения 1 мл раствора (исключая масло, удерживаемое отработанной водой) и тщательно перемешать встряхиванием. После центрифугирования в течение некоторого времени, отобрать 600 мкл прозрачного водного раствора в колбу* и добавить 24 мкл внутреннего стандарта 50 мМ TMP/50 мМ TBP и тщательно перемешать, затем отобрать 500 мкл прозрачного водного раствора в стандартную 5-мм пробирку для ЯМР.
* Раствор образца становится двухслойным после центрифугирования. Для переноса нижнего слоя прозначного раствора в пробирку для ЯМР используют шприц и иглой. Использовать осторожно, чтобы не повредить верхний слой.
Сбор данных для определения с помощью 31 P-ЯМР фосфолипидов и продуктов
Набор параметров для данных установить для автоматизированной работы ICONNMRTM (Bruker BioSpin Corporation, Fremont, CA) с углом наконечника 58 градусов, означающим высокую мощность по умолчанию. Поместить образец в пробоотборник с помощью команд "ej"/"ij". Проверить edte = 300,0. В TopSpin сначала применить действие "rpar" и считать набор параметров P31-TBP-TMP-std. Перейти в окно получения информации посредством "acqu" и настроить пробоотборник QNP как для 31P, так и для 1H с использованием команды "wobb". Выбрать "ej", а затем продолжать с помощью автоматики IconNMR с использованием той же таблицы параметров. При автоматизации образцы выстраиваются в очередь и анализируются по очереди путем предварительного заклинивания. Редактируемыми параметрами являются NS и D1. Для отведенного времени NS=512-2048 обеспечить надлежащее S/N. Коэффициенты масштабирования для учета различного времени релаксации аккумулировались и должны были быть проверены анализом образца лецитина Avanti с любыми образцами.
Данные скрининга в масле (малый масштаб, содержание фосфолипидов) для лучших вариантов, полученных повторной сборкой генов:
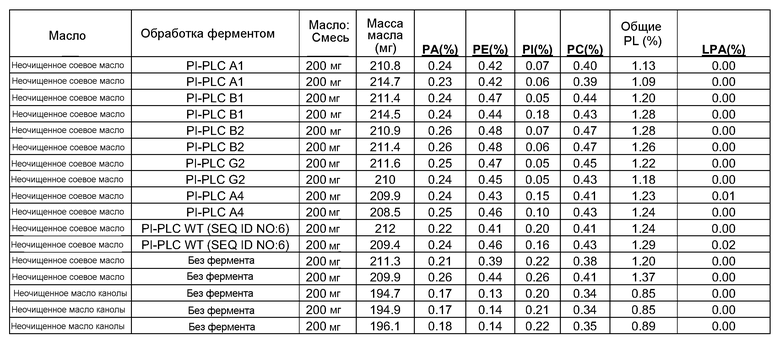
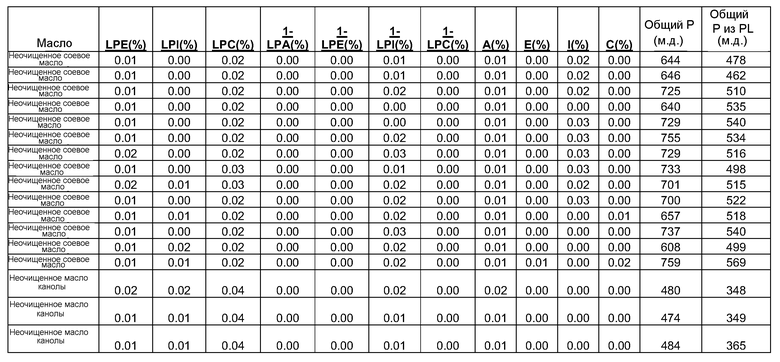
Усредненные данные
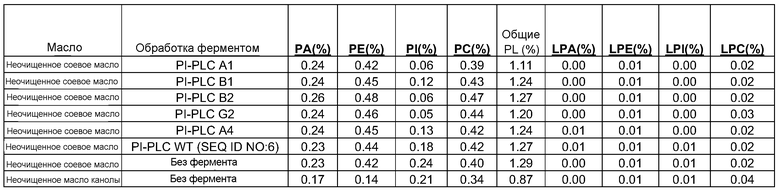
Усредненные данные
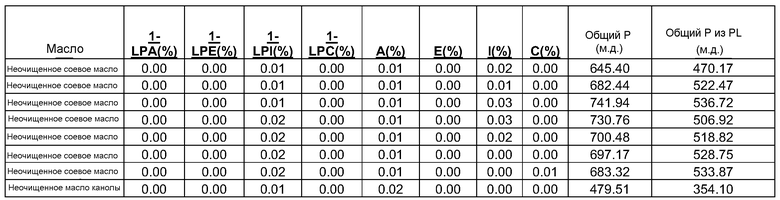
Крупномасштабное рафинирование с помощью PI-PLC и ePLC или PI-PLC с PLC (SEQ ID NO: 2), результаты обобщенно представлены в таблицах 20, 21 и 22, ниже. Масла обрабатывали (или не обрабатывали, в случае контроля) ферментом с использованием этой "методики крупномасштабного скрининга в масле":
Методика крупномасштабного скрининга в масле
Задача: сравнить активность PLC, PI-PLC, "измененных" PLC (или "ePLC") согласно примеру 2, выше, в 2 кг неочищенного соевого масла.
Масло:
Неочищенное соевое масло
FFA: 0,24%
pH: 6,97
DAG: 0,27% 1,2+0,24% 1,3=0,51% общего DAG
PL: 0,21% PA, 0,43% PE, 0,25% PI, 0,44% PC (1,34% общие PL);
Без LPA, 0,01% LPE, без LPI, 0,02% LPC, без 1-LPL; 0,01% A, без E, I или C; общее содержание фосфора 661 м.д., из которых 628,6 м.д. из PL
CP: 742 м.д. P, 73,8 м.д. Ca, 69,8 м.д. Mg, 0,0 м.д. Fe
Ферменты:
PLC (SEQ ID NO: 2)
Требуется 5,5 единиц = 200 м.д.=0,4 г/2000 г масла
Предварительно нагреть масло до 60°C при непрерывном перемешивании при 200 об./мин.
Перенести предварительно нагретое масло в смеситель с высоким сдвиговым усилием.
Начать перемешивание при низкой скорости.
К предварительно нагретому маслу при перемешивании добавить 0,4 г PLC (SEQ ID NO: 2)+60 г воды при комнатной температуре.
Довести смеситель с высоким сдвиговым усилием до уровня 6 (наиболее высокая скорость) на 1 минуту.
Перенести образец обратно в лопастную мешалку и непрерывно перемешивать при 200 об./мин. при 60°C в течение 2 часов. Довести температуру до 80°C. Собрать нецентрифугированный образец масла и хранить при RT для анализа.
После достижения температуры масла 80°C, центрифугировать с использованием центрифуги Gyro tester.
Измененная фосфолипаза 8 (пример 2, таблица 9) - 11,5 Е/мг
Требуется 5,5 единиц/г масла, на реакцию 2 кг или 2000 г = всего 11000 единиц
Требуется 11000 единиц/ 11,5 Е/мг = 957 мг
Неочищенное масло: отвесить 958,6 мг × 11,5 Е/мг = 11024 Единиц. Ресуспендировать образцы в 60 г воды непосредственно перед добавлением к неочищенному маслу.
Измененная фосфолипаза 156 (пример 2, таблица 9)-17,2 Е/мг
Требуется 5,5 единиц/г масла, на реакцию 2 кг или 2000 г = всего 11000 единиц
Требуется 11000 единиц/ 17,2 Е/мг = 640 мг
Неочищенное масло: отвесить 642,49 мг × 17,2 Е/мг = 11,049 единиц. Ресуспендировать образцы в 60 г воды непосредственно перед добавлением в неочищенное масло.
SEQ ID NO: 8-4,2 Е/мг
Требуется 0,02 единиц/г масла, на реакцию 2 кг или 2000 г = всего 40 единиц
Требуется 40 единиц/ 4,2 Е/мг = 9,5 мг
Неочищенное масло: Отвесить 9,6 мг × 4,2 Е/мг = 40,32 единиц. Ресуспендировать образцы в 60 г воды непосредственно перед добавлением к неочищенному маслу.
Измененная фосфолипаза 8 + SEQ ID NO: 8 -2 ч: Отвесить 959,2 мг измененной фосфолипазы 8 PH045×11,5 Е/мг = 11031 единиц. Отвесить 9,8 мг SEQ ID NO: 8×4,2 Е/мг= 41,16 единиц
Измененная фосфолипаза 8 + SEQ ID NO: 8 -4 ч: Отвесить 959,1 мг измененной фосфолипазы 8 PH045×11,5 Е/мг = 11030 единиц. Отвесить 9,8 мг SEQ ID NO: 8×4,2 Е/мг = 41,16 единиц
Ресуспендировать образцы в 60 г воды непосредственно перед добавлением к неочищенному маслу и измененной фосфолипазе 8+SEQ ID NO: 8 одновременно.
Условия реакции:
2000 г масла отвешивали в 4-л стакан. Масло предварительно нагревали до 60°C на электрической плите с контролем температуры с обратной связью (Barnstead/Themolyne mirak).
Перед добавлением фермента масло предварительно нагревали при 60°C при непрерывном перемешивании при ~200 об./мин.
Образцы помещали в высокоскоростной смеситель, к предварительно нагретому маслу добавляли фермент + 60 г воды комнатной температуре при перемешивании на низкой скорости, а затем сразу перемешивали с высоким сдвиговым усилием (максимальная скорость) в течение 1 минуты.
Перенести образец обратно в лопастной смеситель и непрерывно перемешивать при 200 об./мин. при 60°C в течение 2 часов. Довести температуру до 80°C. Собрать нецентрифугированный образец масла и хранить при -20°C для анализа.
После достижения температуры масла 80°C, центрифугировать с использованием высокоскоростной центрифуги.
% теоретического максимально получаемого DAG = (суммарный DAG/теоретический максимальный DAG)*100
неочищенное соевое масло 06 17 08: PC=0,47, PE=0,46, PA=0,22, PI=0,27
* Теоретический максимальный DAG из величин для PL PC, PE и PA в ЯМР=(%PC*0,78)+(%PE*0,83)+(%PA*0,89)=0,94
** Теоретический максимальный DAG из величины для PL PI в ЯМР=(%PI*0,72)=0,194
*** Теоретический максимальный DAG из величин для PL PC, PE, PA и PI в ЯМР=(%PC*0,78)+(%PE*0,83)+(%PA*0,89)+(%PI*0,72)=1,14
LPA(%)
LPE(%)
LPI(%)
LPC(%)
Затем образцы анализировали в отношении содержания фосфолипидов (данные PL) с использованием ЯМР, как описано выше. Образцы также анализировали в отношении содержания DAG (DAG FFA) с использованием следующих протоколов ВЭЖХ:
Определение диацилглицерина в растительном масле высокоэффективной жидкостной хроматографией с испарительным детектором рассеяния света
Этот способ основан на способе AOCS Cd11d-96, как описано для определения моно- и диглицеридов с помощью ВЭЖХ-ELSD (официальный способ AOCS Cd11d-96), с некоторыми модификациями. Одним существенным изменением является принятие масла ENOVATM в качестве стандарта для целей количественного определения. В способе AOCS используется дипальмитин (C16:0) в качестве стандарта. Однако в растительном масле C16:0 составляет только ~10%, в то время как C18:0, C18:1 и C18:2 составляют приблизительно 90%. НА хроматограмме ВЭЖХ, не только форма пика дипальмитина отличается от формы истинных диацилглицеринов (DAG) в растительном масле, также отличается ответ детектора на пальмитин относительно C18 DAG. Оба фактора влияют на результат количественного определения, поскольку испарительный детектор рассеяния света (ELSD) представляет собой нелинейный детектор. Масло ENOVATM представляет собой масло с высоким содержанием DAG, изготавливаемое запатентованным способом ADM с использованием соевого масла и масла канолы в качестве исходных материалов, которые имеют распределение жирных кислот, сходное с обычным растительным маслом и, таким образом, являются лучшим стандартом для количественного определения DAG в растительном масле. Количество DAG в масле ENOVATM можно определять с использованием официального способа AOCS Cd11b-91 (2) и способа 31P-ЯМР (3, 4).
Приготовление образца и стандартных растворов:
1. Раствор образца: точно взвесить приблизительно 50 мкл образцов масла и добавить 950 мкл смеси гексан/изопропанол = 9:1 с получением 1 мл раствора.
2. Стандартные растворы: диапазон 1,2-DAG и 1,3-DAG в стандартных растворах должен охватывать истинную концентрацию DAG в растворе образца. Одним примером являются 5 растворов масла ENOVATM с концентрацией 0,25 мг/мл, 0,5 мг/мл, 1 мг/мл, 2 мг/мл и 4 мг/мл соответственно.
Параметры ВЭЖХ:
Колонка: Chromegasphere SI-60, 15 см × 4,6 мм
Температура: 40°C
Скорость потока: 2 мл/мин
Объем инжекции: 20 мкл
Подвижная фаза A: Гексан
Подвижная фаза B: Гексан/изопропанол/этилацетат/муравьиная кислота = 800:100:100:1
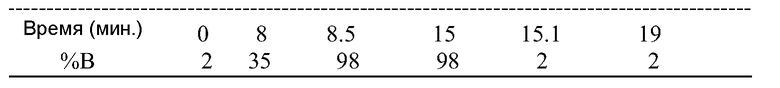
Параметры ELSD:
Параметры Sedex 75 ELSD необходимо оптимизировать для максимизации чувствительности. Они включают температуру, прирост, давление газа в распылителе, и положение стеклянной ячейки. Типичным примером является температура 40°C, приращение 5, и давление газообразного азота 3,5 бар (350 кПа).
Идентификация и количественное определение пиков
Идентификацию пика DAG проводят путем сравнения времени удержания со временем стандарта. Количественное определение основано на взаимосвязи между ответом детектора I (площадь пика) и концентрацией анализируемого вещества C: I=K*CM, здесь K и M представляют собой связанные с экспериментальными условиями константы.
Ссылки:
1. Mono- and Diglycerides Determination by HPLC-ELSD (AOCS Official Method Cd 11d-96).
2. Determination of Mono- and Diglycerides by Capillary Gas Chromatography (AOCS Official Method Cd 11b-91).
3. Spyros, A.; Dais, P. Application of31P NMR Spectroscopy in Food Analysis. 1. Quantitative Determination of the Mono- and Diglyceride Composition of Olive Oils, J. Agric. Food Chem. 2000, 48, 802-805.
4. Vigli, G.; Philippids, A.; Spyros, A.; Dais, P. Classification of Edible Oils by Employing 31P and 1H NMR Spectroscopy in Combination with Multivariate Statistical Analysis. A Proposal for the Detection of Seed Oil Adulteration in Virgin Olive Oils, J. Agric. Food Chem. 2003, 51, 5715-5722.
Основной лучший вариант согласно GR "G2" подвергали оптимизации кодонов:
Оптимизацию кодонов проводили двумя различными путями на субклонированной ORF (G2 codon opt VI и G2 codon opt V2), причем второй способ обеспечил значительно более высоко экспрессируемый вариант. Для G2 codon opt VI, исходные кодоны, использование которых в субклонированной ORF было снижено ниже 15-25% для P. fluorescens заменяли на кодоны в P. fluorescens с использованием >30%. Кроме того использовали два стоп-кодона TGA на 3'-конце ORF.


Для G2 codon opt V2, кодоны P. fluorescens были выбраны так, чтобы их использование (%) наибольшим образом соответствовало использованию (%) каждого кодона в исходной ORF. Этот способ называют переносом используемых кодонов. Кроме того предсказанную вторичную структуру мРНК транскрипта минимизировали для предотвращения образования структур "стебель-петля" и шпилек в области начала трансляции (фрагмент из нуклеотидов в мРНК от -65 до +65, где трансляция начинается в положении +1 с нуклеотида "A" в "ATG", который кодирует первый остаток метионина в белке). В этой минимизации использовали синонимические кодоны со сходным использованием (%) для снижения нежелательных образований пар нуклеотид-нуклеотид. Как и ранее, использовали два стоп-кодона TGA на 3'-конце ORF.

Данные, сравнивающие ферментации в объеме 30 л для G2 (SEQ ID NO: 8) и его кодон-оптимизированных вариантов (SEQ ID NO: 9 и SEQ ID NO: 10) обобщенно представлены в таблице 24. Ферментации проводили в системе P. fluorescence, описанной ранее. Данные, сравнивающие термоустойчивость между кодон-оптимизированной SEQ ID NO: 10 и SEQ ID NO: 8 обобщенно представлены в таблице 25. Термоустойчивость измеряли, как описано ранее.
Данные, сравнивающие активность G2 (SEQ ID NO: 8) и его кодон-оптимизированного версии (SEQ ID NO: 10) обобщенно представлены в таблице 26. Анализы проводили с использованием методики мелкомасштабного скрининга масла, как описано выше.
Дозировка
Дозировка фермента может определяться количеством "единиц" фермента, подлежащего добавлению, на грамм масла, подлежащего обработке, где одну единицу (Е) определяют как количество фермента, требуемое для высвобождения 1 мкмоль 4-метилумбеллиферона из 4,5 мМ 4-метилумбеллиферилимоинозитол-1-фосфата, соли N-метилморфолина в одну минуту при pH 7,5 и 30°C. В одном варианте осуществления дозировка PLC (например, с использованием SEQ ID NO: 2) или ePLC находится в диапазоне 1-50 Е/г масла, в то время как PI PLC находится в диапазоне 0,05-20 Е/г масла. В другом варианте осуществления используют дозировки в диапазоне 1-20 Е/г масла для PLC или ePLC и 0,05-2 Е/г масла для PI-PLC. В другом варианте осуществления используют дозировки в диапазоне 2-10 Е/г масла для PLC или ePLC и 0,1-1 Е/г масла для PI-PLC. В альтернативном варианте осуществления дозировка PLC (например, с использованием SEQ ID NO: 2) или ePLC составляет 5,5 Е/г масла и для PI-PLC составляет 0,2 Е/г масла.
Альтернативно дозировка может определяться с использованием удельной активности фермента для конвертирования количества единиц фермента, требуемого на грамм масла в массу фермента (мкг), требуемого на грамм масла. В частности, требуемое количество единиц делят на удельную активность (Е/мг) фермента, получая требуемое количество мкг фермента. Например, доза 0,2 Е фермента/грамм масла, деленная на удельную активность 90,1 Е/мг дает дозу 2,22 мкг фермента/г масла. Таким образом, в одном варианте осуществления доза PI PLC находится в диапазоне 0,55-222 мкг фермента/г масла. В другом варианте осуществления используют дозировки в диапазоне 0,55-22,2 мкг фермент/г масла для PI-PLC. В другом варианте осуществления используют дозировки в диапазоне 1,11-11,1 мкг фермента/г масла для PI-PLC. В альтернативном варианте осуществления дозировка PI-PLC составляет 2,22 мкг фермент/г масла.
В альтернативных вариантах осуществления изобретение также относится к комбинациям или смесям ферментов, содержащим PI-PLC по изобретению и по меньшей мере один другой фермент, например, фермент фосфолипазу фермент, например, описанный в таблице 8 или таблице 9, или в WO 2008/036863. Например, в альтернативных вариантах осуществления изобретение также относится к комбинациям или смесям ферментов, содержащим PI-PLC по изобретению и SEQ ID NO: 2, не имеющую сигнальную последовательность, кодируемую например, SEQ ID NO: 1; или SEQ ID NO: 4, имеющую сигнальную последовательность (эквивалентна SEQ ID NO: 2 с сигнальной последовательностью), кодируемую, например, SEQ ID NO: 3; или включая любые из ферментов ePLC, описанных в примере 2 (например, см. таблицы 8 и 9), и в WO 2008/036863, где описаны варианты SEQ ID NO: 4 (кодируемой, например, SEQ ID NO: 3). В альтернативных вариантах осуществления изобретение также относится к комбинациям или смесям ферментов, содержащих PI-PLC по изобретению, например, вариант SEQ ID NO: 6 (кодируемый, например, SEQ ID NO: 5), как описано в настоящем документе, или варианты SEQ ID NO: 8 (кодируемые, например, SEQ ID NO: 7, и кодон-оптимизированными SEQ ID NO: 9 и SEQ ID NO: 10).
Примеры 4-9 представляют собой контрольные примеры. В примерах 10-16 описаны иллюстративные способы, предоставленные в настоящем документе.
В каждом из примеров ниже, подвесной смеситель представлял собой IKA's RW 20 digital с плоской лопастью с лезвием; действующий при 200 об./мин. для нормального встряхивания и 350 об./мин. для интенсивного встряхивания. Центрифуга представляла собой De Laval Gyro - Tester, установленную с "The Bowl Unit" для непрерывного разделения. Ротор центрифуги был закрыт установленными запорными винтами. Смешение с высоким сдвиговым усилием проводили с помощью гомогенизатора IKA's Ultra-Turrax T-50 basic с диспергирующим элементом S 50 N - G 45 G при 10000 об./мин. Фермент PLA1 представлял собой Lecitase® Ultra (номер партии LYN05015A, содержащий 11,7 единиц/мг), продаваемый Novozymes A/S, Дания. Фермент PLC представлял собой Purifine® PLC (номер партии 90BU006A1 или 190DU001A1, содержащий 26,0 или 28,6 единиц/мг соответственно) и PI-PLC (SEQ ID NO: 8), содержащий 4 единиц/мг был предоставлен Verenium Corporation, San Diego, California. Реакцию проводили в стакане объемом 4 литра и его накрывали пластиковой оберткой для снижения или устранения какой-либо потери воды. Количество фосфолипидов, остающееся в обработанном масле, измеряли в качестве м.д. P в соответствии со способом American Oil Chemists' Society Official Method Ca 20-99, "Analysis of Phosphorus in Oil by Inductively Coupled Plasma Optical Emission Spectroscopy". Свободные жирные кислоты (FFA) измеряли с использованием American Oil Chemists' Society Official Method Ca 5a-40. Содержание влаги измеряли с использованием American Oil Chemists' Society Official Method Ca 2c-25. Содержание нейтрального масла измеряли с использованием способа, указанного в приложении ниже. Нерастворимый в ацетоне материал, включавший фосфолипиды, измеряли с использованием American Oil Chemists' Society Official Method Ja 4-46. Кислотное число измеряли с использованием American Oil Chemists' Society Official Method Ja 6-55. Способы P-31 ЯМР и измерения диацилглицерина (DAG) в высокоэффективной жидкостной хроматографии с испарительным детектором рассеяния света (ВЭЖХ-ELSD) проводили способами, описанными Verenium Corporation (тогда известной как Diversa Corporation), "Analytical Profiling of Small Scale Reactions of Phospholipase-C mediated Vegetable Oil Degumming," at the American Oil Chemists Society 2007 meeting.
ПРИМЕР 4: Контроль - рафинирование гидратацией при нейтральном значении pH
2001,2 грамм неочищенного соевого масла, содержавшего 696,3 м.д. фосфора, нагревали до 70-74°C при нормальном встряхивании с использованием подвесного смесителя. Для нагревания масла добавляли 60,0 грамм деионизированной воды. Смесь масло/вода встряхивали при 450 об./мин. в течение 1 минуты. Устройство для встряхивания замедляли до 100 об./мин. на 30 минут для образования хлопьев и гидратации камедей. Затем обработанное водой масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в рафинированном гидратацией масле составил 80,0 м.д., FFA составили 0,22 %, и DAG составили 0,34%. Собранные влажные камеди весили 108,5 грамм.
ПРИМЕР 5: Контроль - Рафинирование PLC при нейтральном значении pH
2003,8 грамм неочищенного соевого масла, содержавшего 696,3 м.д. фосфора нагревали до 60°C при нормальном встряхивании с использованием подвесного смесителя. При поддержании температуры при 60°C добавляли 0,50 грамм липазы PLC Verenium Purifine® (номер партии 90BU006A1), а затем 60 грамм деионизированной воды, и всю смесь перемешивали со сдвиговым усилием в течение 60 минут. Масляную смесь встряхивали при нормальной скорости в течение 120 минут при температуре 60°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в обработанном PLC при нейтральном значении pH обеспечивал рафинированное масло с остаточным фосфором 47,0 м.д. Содержание FFA составляло 0,20% и содержание DAG составляло 0,61%. Собранные влажные камеди весили 85,5 грамм.
ПРИМЕР 6: Контроль - PI-PLC (SEQ ID NO: 8), рафинирование при нейтральном значении pH
2001,8 грамм неочищенного соевого масла, содержавшего 696,3 м.д. фосфора нагревали до 60°C при нормальном встряхивании с использованием подвесного смесителя. При поддержании температуры при 60°C, в 10-мл стакан добавляли 0,0110 грамм PI-PLC (SEQ ID NO: 8), предоставленной Verenium, и растворяли в 1 мл деионизированной воды. После растворения белка в воде к маслу добавляли раствор фермента. Стакан промывали три раза приблизительно 1 мл воды для обеспечения того, что добавили весь фермент. Добавляли остальную часть воды, чтобы общее количество добавленной воды составило 60 грамм. Смесь масла, фермента и воды перемешивали с помощью сдвигового усилия в течение 60 секунд. Масляную смесь встряхивали при нормальной скорости в течение 120 минут при температуре 60°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Содержание остаточного фосфора в рафинированном масле, полученном в реакции с обработкой PI-PLC при нейтральном значении pH, составило 50,3 м.д. Было выявлено, что содержание FFA составляло 0,18% и содержание DAG составляло 0,49%. Собранные влажные камеди весили 102,5 грамм.
ПРИМЕР 7: Контроль - PLC вместе с PI-PLC (SEQ ID NO: 8), рафинирование при нейтральном значении pH
2000,2 грамм неочищенного соевого масла, содержавшего 696,3 м.д. фосфора нагревали до 60°C при нормальном встряхивании с использованием подвесного смесителя. При поддержании температуры при 60, в масло добавляли 0,50 грамм липазы PLC Verenium Purifine® (номер партии 90BU006A1), а затем в 10-мл стакан добавляли 0,0104 грамм PI-PLC (SEQ ID NO: 8), предоставленной Verenium и растворяли в 1 мл деионизированной воды. После растворения белка в масло добавляли раствор фермента. Стакан промывали три раза приблизительно 1 мл воды для обеспечения добавления в масло всего фермента. Добавляли остальную часть воды, чтобы общий объем воды составил 60 грамм. Масляную смесь встряхивали при нормальной скорости в течение 120 минут при температуре 45°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в реакции с обработкой PLA1-PI-PLC при нейтральном значении pH обеспечивал в рафинированное масло с остаточным фосфором 50,0 м.д. Содержание FFA составляло 0,24% и содержание DAG составляло 0,85%. Собранные влажные камеди весили 84,2 грамм.
ПРИМЕР 8: Контроль - PLA1, рафинирование при нейтральном значении pH
2000,6 грамм неочищенного соевого масла, содержавшего 694,1 м.д. фосфора, нагревали до 45°C при нормальном встряхивании с использованием подвесного смесителя. При поддержании температуры при 45°C, добавляли 0,10 грамм Novozymes Lecitase® Ultra (липаза PLA1, номер партии LYN05015), а затем 60 грамм деионизированной воды, и всю смесь перемешивали со сдвиговым усилием в течение 60 минут. Смесь масла встряхивали при нормальной скорости в течение 240 минут при температуре 45°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор реакции с обработкой PLA1 при нейтральном значении pH обеспечивал в рафинированное масло с остаточным фосфором 27,2 м.д. Содержание FFA составило 0,60% и содержание DAG составило 0,33%. Собранные влажные камеди весили 90,0 грамм.
ПРИМЕР 9: Контроль - рафинирование с PLA1 при pH 4,5
2001,2 грамм неочищенного соевого масла, содержавшего 641,6 м.д. фосфора нагревали до 70°C при нормальном встряхивании с использованием подвесного смесителя. Добавляли 2,0 грамм 50% масс./масс. раствора лимонной кислоты и перемешивали с усилием сдвига в течение 1 минуты. Масло подвергали нормальному встряхиванию в течение 1 часа с помощью подвесного смесителя. Маслу позволяли остыть при встряхивании при нормальной скорости до тех пор, пока температура не составила 45°C, затем в масло добавляли 1,8 миллилитра 4 молярного раствора гидроксида натрия и перемешивали. Добавляли 0,10 грамм Novozymes Lecitase® Ultra (липаза PLA1, номер партии LY05015), а затем всего 60 грамм деионизированной воды, и всю смесь перемешивали со сдвиговым усилием в течение 60 минут. Смесь масла встряхивали при нормальной скорости в течение 240 минут при температуре 45°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в масле, обработанном PLA1 при pH 4,5, обеспечивал рафинированное масло с остаточным фосфором 0,5 м.д. Содержание FFA составляло 0,54% и содержание DAG составляло 0,33%. Собранные влажные камеди весили 91,4 грамм.
Способ рафинирования, описанный в примерах 4-10, не обеспечил удаление и/или реакцию всех фосфолипидов, присутствовавших в неочищенном масле, о чем свидетельствовал остаточный фосфор, за исключением эксперимента 6. Эксперимент 6 отражает рафинирование в нормальных условиях реакции для фермента Lecitase® Ultra. В таблице 27 приведены профили фосфолипидов собранных влажных камедей.
Аналитические результаты контрольных примеров в нейтральных условиях
Как видно из таблицы 29, рафинирование гидратацией демонстрирует способность к эмульгированию гидратируемых фосфолипидов, обеспечивающую удаление всех типов фосфолипидов, даже некоторые из негидратируемых типов. Однако в масле оставалась большая часть NHP, о чем свидетельствовал остаточный фосфор, кальций, магний и железо в рафинированном масле (см. таблицу 29). Рафинирование с использованием фосфолипазы C было способно осуществить реакцию по существу всего фосфатидилхолина и существенного количества фосфатидилэтаноламина. Фосфатидилинозитол и фосфатидная кислота не вступили в реакцию. Количество собранных камедей было значимо ниже, чем в примере с рафинированием гидратацией (85,5 грамм против 108,5 грамм), однако в масле оставалось большое количество NHP, о чем свидетельствовал остаточный фосфор приблизительно 50 м.д. и оставшиеся в масле Ca, Mg и Fe. Как видно из таблицы 29, рафинирование специфичной к фосфатидилинозитолу фосфолипазой обеспечивало влажную камедь с наиболее высоким количеством PC и PE из всех контрольных примеров. Фосфолипидный состав выделенных влажных камедей согласно примерам 4-10 также представлен на фигуре 13.
Фосфолипидный состав выделенных камедей
(%)
(%)
С помощью фосфолипазы C, образующей фосфоинозитол прореагировал весь PI. Подобно примерам 4 и 5, большие количества NHP оставались в масле, о чем свидетельствует анализ микроэлементов, описанный в таблице 29.
Результаты по элементам для контрольных примеров в нейтральных условиях
Содержание влаги и нейтрального масла в выделенных камедях, описаны в таблице 29a.
Содержание влаги и нейтрального масла в выделенных камедях
В примере 7, рафинирование с помощью как PLC, так и PI-PLC, продемонстрировало существенный ферментативный гидролиз PC, PE и PI (таблица 27 и фигура 13), но не настолько же хороший, как один фермент, добавляемый отдельно в примере 5 или 6. Кроме того, остаточный фосфор в масле оставался на уровне приблизительно 50 м.д. вследствие неспособности способа гидролизовать соли фосфатидной кислоты и фосфатидилэтаноламина. В примере 8 рафинирование с помощью PLA1 гидролизовало практически все фосфолипиды, присутствовавшие во влажных камедях, в их лизоформы, как видно на фигуре 13, о чем свидетельствует значительное количество присутствующих лизофосфолипидов (таблица 28). Однако даже через 4 часа в масле оставались существенные количества PA, поскольку NHP были не доступны для фермента.
В контрольном эксперименте 6, обработанное PLA1 масло при pH 4,5 демонстрирует способность фосфолипазы A1 реагировать во всеми типами фосфолипидов, с образованием рафинированного масла с менее чем 1 м.д. остаточного фосфора и по существу все камеди конвертировались в их растворимые в воде лизо-соединения, как очевидно из фигуры 13 и таблиц 30 и 31. Катионы кальция, магния и железа более не были связаны с NHP, но находились в водной фазе. Катионы кальция, магния и железа диссоциировали от солей фосфатидной кислоты и фосфатидилэтаноламина. Вследствие этого, двухвалентные элементы могли теперь реагировать с лимонной кислотой, присутствующей в водной фазе, с образованием цитрата кальция, магния или железа, которые нерастворимы в водной фазе при pH реакции в водной фазе. Эти нерастворимые соли выпадали из раствора с образованием "жесткой воды", покрывая весь трубопровод, теплообменники и даже центрифугу, до тех пор, пока тяжелую фазу, содержащую смесь прореагировавших камедей, воды и солей, не удалили способом центрифугирования. Dayton et al. в U.S. 2007/0134777 описывает усовершенствованный способ ферментативного рафинирования, где pH слабо забуференной ферментативной реакции снижают от 4,5 до, например, диапазоне от 3,5 до 4,2 после завершения ферментативной реакции, диссоциируя соли цитрата, тем самым, устраняя загрязнение оборудования, в частности теплообменников и разделяющей центрифуге, которое происходило в результате выпадения в осадок солей кальция и магния при оптимальном значении pH, требуемом для активности фермента.
Как продемонстрировано в следующих примерах, способы, представленные в настоящем документе, включают обработку масла кислотой до более низкого значения pH, составляющего менее трех, обеспечивая диссоциацию фосфатидной кислоты и фосфатидилэтаноламина (NHP), затем доведение pH водной фазы обратно до нейтрального значения pH 7, до того, как гидратация фосфолипидов при рафинировании гидратацией или реакция фосфолипидов с фосфолипазой позволяет мигрировать NHP на поверхность контакта масла и воды, обеспечивая лучшую гидратацию и лучшую доступность субстрата (NHP) для фосфолипаз. В таблице 30 ниже обобщенно представлены примеры способов, проводимых, как описано ниже.
Аналитические результаты примеров со скорректированным
значением pH
ПРИМЕР 10: Рафинирование гидратацией при доведенном значении pH 7,0
2002,2 грамм неочищенного соевого масла, содержавшего 640,1 м.д. фосфора, нагревали до 70°C при нормальном встряхивании с использованием подвесного смесителя. Добавляли 2,0 грамм 50% об./об. раствора лимонной кислоты и перемешивали со сдвигающим усилием в течение 1 минуты. Масло подвергали нормальному встряхиванию в течение 1 часа с помощью подвесного смесителя. В масло добавляли 3,65 миллилитра 4 молярного раствора гидроксида натрия и перемешивали. Для нагревания масла добавляли 56,0 грамм деионизированной воды (всего 60 грамм воды, включая лимонную кислоту и гидроксид натрия). Смесь масло/вода встряхивали при 450 об./мин. в течение 1 минуты. Устройство для встряхивания замедляли до 100 об./мин. на 30 минут для образования хлопьев и гидратации камедей. Затем обработанное водой масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в рафинированном гидратацией масле составил 26,9 м.д., содержание FFA составляло 0,24%, и содержание DAG составляло 0,39%. Собранные влажные камеди весили 112,0 грамм.
Остаточный фосфор в примере 10, где pH доводили до 7 (26,9 м.д. P) по сравнению с примером с исходным нейтральным значением pH (80,0 м.д. P) продемонстрировал, что больше фосфолипидов были доступны либо для гидратации, либо для механического улавливания.
Кроме того, концентрации как фосфатидной кислоты, так и фосфатидилэтаноламина (HP) были увеличены в выделенных камедях, как видно из таблицы 31.
Фосфолипидный состав извлеченных камедей примеров 10-16
PE (%)
Содержание влаги и нейтрального масла в выделенных камедях из примеров 10-16, описано в таблице 31a.
Содержание влаги и нейтрального масла в выделенных камедях
ПРИМЕР 11: Рафинирование с помощью PLC при скорректированном значении pH 7,0
2002,0 грамм неочищенного соевого масла, содержавшего 640,1 м.д. фосфора, нагревали до 70°C при нормальном встряхивании с использованием подвесного смесителя. Добавляли 2,0 грамм 50% об./об. раствора лимонной кислоты и перемешивали со сдвигающим усилием в течение 1 минуты. Масло подвергали нормальному встряхиванию в течение 1 часа с помощью подвесного смесителя. Маслу позволяли остыть до 60°C, после чего в масло добавляли 3,65 миллилитра 4 молярного раствора гидроксида натрия и перемешивали. При поддержании температуры при 60°C, добавляли 0,50 грамма липазы PLC Verenium Purifine® (номер партии 190DU001A1), а затем остальные 60 грамм деионизированной воды и всю смесь перемешивали со сдвиговым усилием в течение 60 минут. Масляную смесь встряхивали при нормальной скорости в течение 120 минут при температуре 60°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в масле, обработанном PLC при доведенном кислотой/основании pH до 7,0, обеспечил рафинированное масло с остаточным фосфором 14,4 м.д. Содержание FFA составляло 0,21% и содержание DAG составляло 1,11%. Собранные влажные камеди весили 80,0 грамм.
Результаты этого эксперимента демонстрируют как удаление фосфолипидов из масла, так и способность фосфолипазы конвертировать фосфолипиды в диацилглицерины в масле. Содержание диацилглицеринов возрастала по сравнению с исходным маслом (0,31%) или 0,34% в контрольном эксперименте по рафинированию гидратацией до 1-1,11% в эксперименте по рафинированию ферментом при доведенном значении pH до 7,0. Содержание остаточного фосфора в масле было снижено от 47,0 м.д. в контрольном эксперименте до 14,4 м.д. в эксперименте с доведением pH. Содержание других металлических микроэлементов также было значительно снижено, как продемонстрировано в таблице 32.
Результаты по элементам для примеров 10-16
Важно признать, что количество собранных камедей было снижено до наиболее низкого уровня из всех экспериментов, представленных в заявке (80,0 грамм). Фосфолипидный состав демонстрирует, что практически все из PC и PE конвертировались в фосфохолин и фосфоэтаноламин (таблица 31) с образованием диацилглицеринов, найденных в выделенном масле. Количество фосфатидной кислоты также было снижено в собранных камедях, далее демонстрируя увеличенную доступность субстрата для гидратации/механического "улавливания" или доступность для ферментативной реакции.
ПРИМЕР 12: Рафинирование PI-PLC при pH, доведенном до 7,0
2000,0 грамм неочищенного соевого масла, содержавшего 694,1 м.д. фосфора, нагревали до 70°C при нормальном встряхивании с использованием подвесного смесителя. Добавляли 2,0 грамм 50% масс./масс. раствора лимонной кислоты и перемешивали со сдвигающим усилием в течение 1 минуты. Масло подвергали нормальному встряхиванию в течение 1 часа с помощью подвесного смесителя. Маслу позволяли остыть до 60°C, после чего в масло добавляли 3,65 миллилитра 4 молярного раствора гидроксида натрия и перемешивали. При поддержании температуры при 60°C, в 10-мл стакан добавляли 0,0108 грамм PI-PLC (SEQ ID NO: 8), предоставленной Verenium и растворяли в 1 мл деионизированной воды. После растворения белка в воде в масло добавляли раствор фермента. Стакан промывали три раза приблизительно 1 мл воды, чтобы обеспечить добавление всего фермента. Добавляли остальную часть воды, чтобы общее количество добавленной воды составило 60 грамм. Всю смесь перемешивали со сдвиговым усилием в течение 60 минут. Масляную смесь встряхивали при нормальной скорости в течение 120 минут при температуре 60°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в обработанном PI-PLC масле с доведенным кислотой/основанием pH до 7,0 обеспечил рафинированное масло с остаточным фосфором 13,5 м.д. Содержание FFA составило 0,22% и содержание DAG составило 0,61%. Собранные влажные камеди весили 100,8 грамм.
Как и в двух предшествующих примерах, количество PA, присутствующего в собранных камедях, было увеличено в экспериментах с доведенным pH относительно контрольных экспериментов. Кроме того, наибольшее количество PC и PE присутствовало в собранных камедях, отсюда 100,8 грамм влажных камедей. Поскольку фосфатидилинозитол-специфическая фосфолипаза преимущественно реагирует только с PI, увеличение DAG было меньшим, чем в реакции фосфолипазы в эксперименте 8, и фосфо-инозитол был преобладающим фосфосоединением, присутствовавшим в собранных камедях (таблица 31).
ПРИМЕР 13: PLC вместе с PI-PLC, рафинирование при pH, доведенном 7,0
2003,8 грамм неочищенного соевого масла, содержавшего 641,6 м.д. фосфора, нагревали до 70°C при нормальном встряхивании с использованием подвесного смесителя. Добавляли 2,0 грамм 50% масс./масс. раствора лимонной кислоты и перемешивали со сдвигающим усилием в течение 1 минуты. Масло подвергали нормальному встряхиванию в течение 1 часа с помощью подвесного смесителя. Маслу позволяли остыть до 60°C, после чего в масло добавляли 3,65 миллилитра 4 молярного раствора гидроксида натрия и перемешивали. При поддержании температуры при 60°C, в масло добавляли 0,50 грамм липазы PLC Verenium Purifine® (номер партии 190DU001A1), а затем в 10-мл стакан добавляли 0,0094 грамм PI-PLC (SEQ ID NO: 8), предоставленной Verenium, и растворяли в 1 мл деионизированной воды. После растворения белка раствор фермента добавляли в масло. Стакан промывали три раза приблизительно 1 мл воды, чтобы обеспечить добавление всего фермента. Добавляли остальную часть воды, чтобы общее количество добавленной воды составило 60 грамм. Всю смесь перемешивали со сдвиговым усилием в течение 1 минуты. Масляную смесь встряхивали при нормальной скорости в течение 120 минут при температуре 60°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в PLC-PI-PLC в обработанном масле при pH, доведенном до 7,0, обеспечивал рафинированное масло с остаточным содержанием фосфора 18,7 м.д. Содержание FFA составляло 0,21% и содержание DAG составляло 1,04%. Собранные влажные камеди весили 84,4 грамм.
Ограниченные количества собранных PC, PE и PI в камедях (таблица 31); большое количество фосфохолина, фосфоэтаноламина и фосфоинозитола в камедях (таблица 31); и высокий уровень диацилглицерина, присутствовавшего в выделенном масле, отчетливо демонстрирует ферментативную реакцию как PLC, так и PI-PLC, в неочищенном масле. Содержание извлеченного PA в камедях также было больше, чем в случае контрольной комбинации ферментов согласно примеру 7.
ПРИМЕР 14: Рафинирование с помощью PLA 1 при pH, доведенном до 5,5
2001,2 грамм неочищенного соевого масла, содержавшего 641,6 м.д. фосфора, нагревали до 70°C при нормальном встряхивании с использованием подвесного смесителя. Добавляли 2,0 грамм 50% масс./масс. раствора лимонной кислоты и перемешивали со сдвигающим усилием в течение 1 минуты. Масло подвергали нормальному встряхиванию в течение 1 часа с помощью подвесного смесителя. Маслу позволяли остыть при встряхивании при нормальной скорости до тех пор, пока температура не составила 45°C, затем в масло добавляли 2,55 миллилитров 4 молярного раствора гидроксида натрия и перемешивали. Добавляли 0,10 грамм Novozymes Lecitase® Ultra (липаза PLA1, номер партии LY 05015), а затем всего 60 грамм деионизированной воды и всю смесь перемешивали со сдвиговым усилием в течение 60 минут. Смесь масла встряхивали при нормальной скорости в течение 240 минут при температуре 45°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в масле, обработанном PLA1 при pH 5,5, обеспечивал рафинированное масло с остаточным фосфором 1,6 м.д. Содержание FFA составляло 0,54% и содержание DAG составляло 0,33%. Собранные влажные камеди весили 91,7 грамм.
ПРИМЕР 15: Рафинирование с помощью PLA 1 при pH, доведенном до 6,5
2001,6 грамм неочищенного соевого масла, содержавшего 641,6 м.д. фосфора, нагревали до 70°C при нормальном встряхивании с использованием подвесного смесителя. Добавляли 2,0 грамм 50% масс./масс. раствора лимонной кислоты и перемешивали со сдвигающим усилием в течение 1 минуты. Масло подвергали нормальному встряхиванию в течение 1 часа с помощью подвесного смесителя. Маслу позволяли остыть при встряхивании при нормальной скорости до тех пор, пока температура не составила 45°C, а затем в масло добавляли 3,31 миллилитров 4 молярного раствора гидроксида натрия и перемешивали. Добавляли 0,10 грамм Novozymes Lecitase® Ultra (липаза PLA1, номер партии LYN05015), а затем всего 60 грамм деионизированной воды, и всю смесь перемешивали со сдвиговым усилием в течение 60 минут. Смесь масла встряхивали при нормальной скорости в течение 240 минут при температуре 45°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в масле, обработанном PLA1 при pH 6,5, обеспечил рафинированное масло с остаточным фосфором 3,4 м.д. Содержание FFA составило 0,51% и содержание DAG составило 0,33%. Собранные влажные камеди весили 88,7 грамм.
Пример 16: Рафинирование с помощью PLA 1 при pH, доведенном до 7,0
2001,6 грамм неочищенного соевого масла, содержавшего 641,6 м.д. фосфора нагревали до 70°C при нормальном встряхивании с использованием подвесного смесителя. Добавляли 2,0 грамм 50% масс./масс. раствора лимонной кислоты и перемешивали со сдвигающим усилием в течение 1 минуты. Масло подвергали нормальному встряхиванию в течение 1 часа с помощью подвесного смесителя. Маслу позволяли остыть при встряхивании при нормальной скорости до тех пор, пока температура не составила 45°C, а затем в масло добавляли 3,31 миллилитров 4 молярного раствора гидроксида натрия и перемешивали. Добавляли 0,10 грамм Novozymes Lecitase® Ultra (липаза PLA1, номер партии LYN05015), а затем всего 60 грамм деионизированной воды, и всю смесь перемешивали со сдвиговым усилием в течение 60 минут. Смесь масла встряхивали при нормальной скорости в течение 240 минут при температуре 45°C. Затем обработанное ферментом масло центрифугировали; и разделенные масло и влажные камеди собирали. Остаточный фосфор в масле, обработанном PLA1 при pH 7,0, обеспечивал рафинированное масло с остаточным фосфором 3,4 м.д. Содержание FFA составляло 0,52% и содержание DAG составляло 0,39%. Собранные влажные камеди весили 93,1 грамм.
В примерах 14, 15, и 16 продемонстрирован эффект увеличения pH от оптимальных условий для фермента, составляющих 4,5, до pH, доведенного до 5,5, 6,5 и 7,0 соответственно, для фермента фосфолипазы A. Способность осуществлять реакцию при нейтральном pH 7,0 вместо 4,5, могла бы увеличить рентабельность промышленного процесса благодаря используемым для конструирования материалам и стоимости снижения pH до 3,5-4,2 для предупреждения загрязнения промышленного оборудования. В общем, эксперимент 13 отчетливо демонстрирует, что можно получить низкий остаточный фосфор в масле, все еще при наличии способности к реакции всех фосфолипидов, присутствующих камедей, с образованием их лизоформ, таким образом, максимально увеличивая выход масла для этого типа ферментативной реакции.
На фигуре 14 сравниваются фосфолипидные составы контрольных реакционных смесей при нейтральных значениях pH относительно реакционных смесей с доведенным pH при pH 7,0, параллельно. Можно отчетливо видеть, что во всех реакционные смеси, где после обработки кислотой следовала обработка разбавленной щелочью для доведения водной фазы до нейтрального значения pH, возрастает уровень NHP в собранных камедях и/или обеспечивается конвертирование NHP либо в их лизоформы, либо в их фосфоформы, тем самым увеличивая общий выход и минимизируя какие-либо отходы, образующиеся в этом процессе.
На фигуре 15 сравнивается потеря нейтрального масла в фазу камеди в контрольных реакционных смесях при нейтральных pH, относительно реакционных смесей с доведенным pH при pH 7,0, параллельно. Можно отчетливо видеть, что во всех реакционных смесях, где после обработки кислоты следовала обработка разбавленной щелочью для доведения водной фазы до нейтрального значения pH, уровень потери нейтрального масла в фазу камеди снизился.
На фигуре 16 сравнивается потеря нейтрального масла в фазу камеди при условиях различных pH, где используют фосфолипазу A1. Во всех реакционных смесях pH доводили, за исключением "нейтральной" реакции. Продемонстрировано, что количество нейтрального масла является наименьшим, когда pH, был доведен до 7,0, относительно даже нейтральной реакционной смеси без доведения, без добавления какой-либо кислоты или основания для способствования доступности NHP процессу рафинирования.
ПРИМЕР 17: Исследования распределения размера частиц
В этом примере исследовали среднее распределение размера капель и преобладающий размер капель при обработке со сдвиговым усилием, применяемой в способах, предоставленных в настоящем документе, и способах, доступных в данной области (например, патенты США 4698185 и 6103505).
Размер частиц в этом исследовании анализировали с использованием анализатора размера частиц (капель) Malvern Mastersizer модели 2000, с вычислением распределения частиц и объема с помощью программного обеспечения, дополняющего оборудование.
ПРИМЕР 17A: 300 г рафинированного соевого масла нагревали до 90°C в 600-мл стакане при нормальном встряхивании с использованием магнитной мешалки. К нему добавляли 1,8 г деионизированной воды, а затем 0,565 г фосфорной кислоты 85%. Затем смесь перемешивали со сдвигающим усилием в течение 30 секунд с использованием гомогенизатора Ultra-Turrax T-50 basic с диспергирующим элементом S 50 N-G 45 G при 10000 (поставщик полагает, что этот гомогенизатор эквивалентен Ultra Turrax T-45, использованному в патентах США 4698185).
Затем образец образовавшейся эмульсии анализировали в Malvern 2000. Средний размер капель в водной фазе составлял 3,963 мкм и 90% водной фазы оказалась каплями с диаметром менее 6,675 мкм (таблица 33). Распределение капель представлено на фигуре 17.
ПРИМЕР 17B: 2000 г рафинированного соевого масла нагревали до 90°C в 4000-мл стакане при нормальном перемешивании с использованием магнитной мешалки. К маслу добавляли 12 г деионизированной воды, а затем 3,767 г фосфорной кислоты 85%. Затем смесь перемешивали со сдвиговым усилием в течение 30 секунд с использованием гомогенизатора Ultra-Turrax T-50 basic с диспергирующим элементом S 50 N - G 45 G при 10000.
Затем образец образовавшейся эмульсии анализировали в Malvern 2000. Средний размер капель в водной фазе составлял 3,905 мкм, и 90% водной фазы оказалась каплями с диаметром менее 6,405 мкм (таблица 33). Распределение капель представлено на фигуре 18.
ПРИМЕР 17C: 2000,3 г неочищенного соевого масла нагревали до 60°C в 4000-мл стакане при нормальном перемешивании с использованием магнитной мешалки. Добавляли 2,0 грамм 50% масс./масс. раствора лимонной кислоты и перемешивали со сдвигающим усилием в течение 1 минуты. Добавляли 3,650 миллилитров 4 молярного раствора гидроксида натрия и перемешивали. Добавляли 0,50 грамм фермента Purifine PLC, а затем всего 60 грамм деионизированной воды и всю смесь перемешивали со сдвигающим усилием в течение 30 секунд с использованием гомогенизатора Ultra-Turrax T-50 basic с диспергирующим элементом S 50 N-G 45 G при 10000 об./мин.
Затем образец образовавшейся эмульсии анализировали в Malvern 2000. Средний размер капель в водной фазе составлял 19,957 мкм, и 90% водной фазы оказалась каплями с диаметром менее 36,998 мкм (таблица 33). Распределение капель представлено на фигуре 19.
ПРИМЕР 17D: 0,6 л (приблизительно 560 г) рафинированного соевого масла нагревали до 40°C в 600-мл стакане при рециркуляции с помощью смесителя Silverson. Смеситель охлаждали на водяной бане, чтобы избежать увеличения температуры в ходе эксперимента. Добавляли 0,6 г 50% об./об. раствора лимонной кислоты, а затем 1,095 миллилитров 4 молярного раствора гидроксида натрия. Добавляли 0,028 г (50 м.д.) фермента PLA Lecitase Ultra, а затем всего 16,8 г деионизированной воды.
Затем через 15 мин для обеспечения уравновешивания системы, отбирали образец образовавшейся эмульсии. Затем образец образовавшейся эмульсии анализировали в Malvern 2000. Средний размер капель в водной фазе составлял 12,691 мкм, и 90% водной фазы оказалась каплями с диаметром менее 20,333 мкм (таблица 33). Распределение капель представлено на фигуре 20. Являясь встроенным смесителем Silverson продолжал снижать размер капель, в конечном итоге обеспечивая средний размер частиц 9 мкм.
На фигуре 21 представлено наложение размеров капель (частиц) из примеров 17A, 17B, 17C и 17B.
В таблице 34 предоставлены данные для сравнительного размера частиц для примеров 17A, 17B, 17C и 17D.
Как видно из данных, пример 17C обеспечивал очень отчетливый профиль распределения капель с наиболее высоким средним размером частиц. Было выявлено, что средний размер частиц согласно примеру 17C был приблизительно в 5 раз больше, чем согласно примерам 17A и 17B, и в 1,6 раз больше, чем согласно примеру 17D.
Как видно из данных, для примера 17C, выявлено, что более 76% водной фазы находится в каплях с диаметром более 10 мкм, в то время как для примера 17A было выявлено, что 52% водной фазы находится в каплях с диаметром более 10 мкм, и для примера 17D было выявлено, что менее 0,65% водной фазы находится в каплях диаметром более 10 мкм.
ПРИМЕР 18: Сравнительное исследование камедей, полученных различными способами
В этом примере предоставлены сравнительные данные для обработки масла способами, описанными в патенте США no. 4698185 и способом, описанным в примерах 4-16 выше.
Различные масла (приведенные в таблице 35) обрабатывают согласно следующему протоколу, как описано в патенте США no. 4698185:
- нагревают масло до более чем 75°C
- добавляют воду для увеличения концентрации до 0,6% масс.%
- к рафинированному гидратацией маслу добавляют приблизительно 20-60 масс.% фосфорной кислоты
- кислоту диспергируют в течение 30 секунд
- перемешивание продолжают в течение трех минут
- добавляют раствор щелочи в количестве приблизительно 2% по объему
- смесь центрифугируют в течение 30 минут при 5000 об./мин.
- масляную фазу отделяют и промывают 2 масс.% деминерализованной воды
- промывочную воду удаляют центрифугированием в течение 30 минут при 5000 об./мин.
- содержание камедей в масле анализируют
В таблице 35 предоставлены данные для состава камедей, отделенных от обработанных образцов масла:
В таблице 36 ниже представлены данные для фосфолипидов в образцах масла, обработанных согласно примерам 10, 11, 12, 13 и 16 выше:
В таблице 37 ниже обобщенно представлены используемые ферменты, pH реакционной смеси и данные для фосфолипидов в образцах масла, обработанных согласно примерам 4, 5, 6, 7, 8, 10, 11, 12, 13 и 16 выше.
Как видно из данных, фосфолипиды, полученные способами, описанными в настоящем документе, обладают уникальным составом.
Варианты осуществления заявленного объекта, описанные выше, являются только иллюстративными, и специалистам в данной области будет понятно или они будут способны установить, с использованием не более чем обычного экспериментирования, многочисленные эквиваленты конкретных соединений, материалов и методик. Все такие эквиваленты считаются находящимися в объеме заявленного объекта и охватываемыми прилагаемой формулой изобретения.
Хотя изобретение подробно описано применительно к его определенным иллюстративным аспектам, будет понятно, что модификации и варианты находятся в пределах сущности и объема, который описан и заявлен.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УДАЛЕНИЯ СМОЛИСТЫХ ВЕЩЕСТВ ИЗ РАСТИТЕЛЬНОГО МАСЛА И ЕГО РАФИНИРОВАНИЯ | 2018 |
|
RU2772452C2 |
| Полипептид, обладающий активностью фосфолипазы С, и его применение | 2019 |
|
RU2819269C2 |
| Мутант фосфолипазы С с высокой ферментативной активностью | 2019 |
|
RU2818353C2 |
| ПОЛУЧЕНИЕ ТРИАЦИЛГЛИЦЕРОЛОВ ИЗ КАМЕДЕЙ | 2009 |
|
RU2456338C2 |
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОНАСЫЩЕННЫХ МАСЕЛ | 2013 |
|
RU2646057C2 |
| ПРИМЕНЕНИЕ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ | 2005 |
|
RU2406759C2 |
| ЛИПОЛИТИЧЕСКИЕ ФЕРМЕНТЫ, ИХ ПРИМЕНЕНИЕ ПРИ ИСПОЛЬЗОВАНИИ ПИЩЕВЫХ ПРОДУКТОВ | 2010 |
|
RU2538144C2 |
| ПОЛУЧЕНИЕ ЛИЗОГЛИКОЛИПИДА И БИОКОНВЕРСИЯ ГЛИКОЛИПИДОВ С ИСПОЛЬЗОВАНИЕМ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА | 2005 |
|
RU2548805C2 |
| КЛОНИРОВАНИЕ, ЭКСПРЕССИЯ И ПРИМЕНЕНИЕ КИСЛЫХ ФОСФОЛИПАЗ | 2010 |
|
RU2567659C2 |
| ФЕРМЕНТАТИВНОЕ ОБЕССМОЛИВАНИЕ С ИСПОЛЬЗОВАНИЕМ СМЕСИ ФОСФОЛИПАЗ PLA И PLC | 2008 |
|
RU2477746C2 |






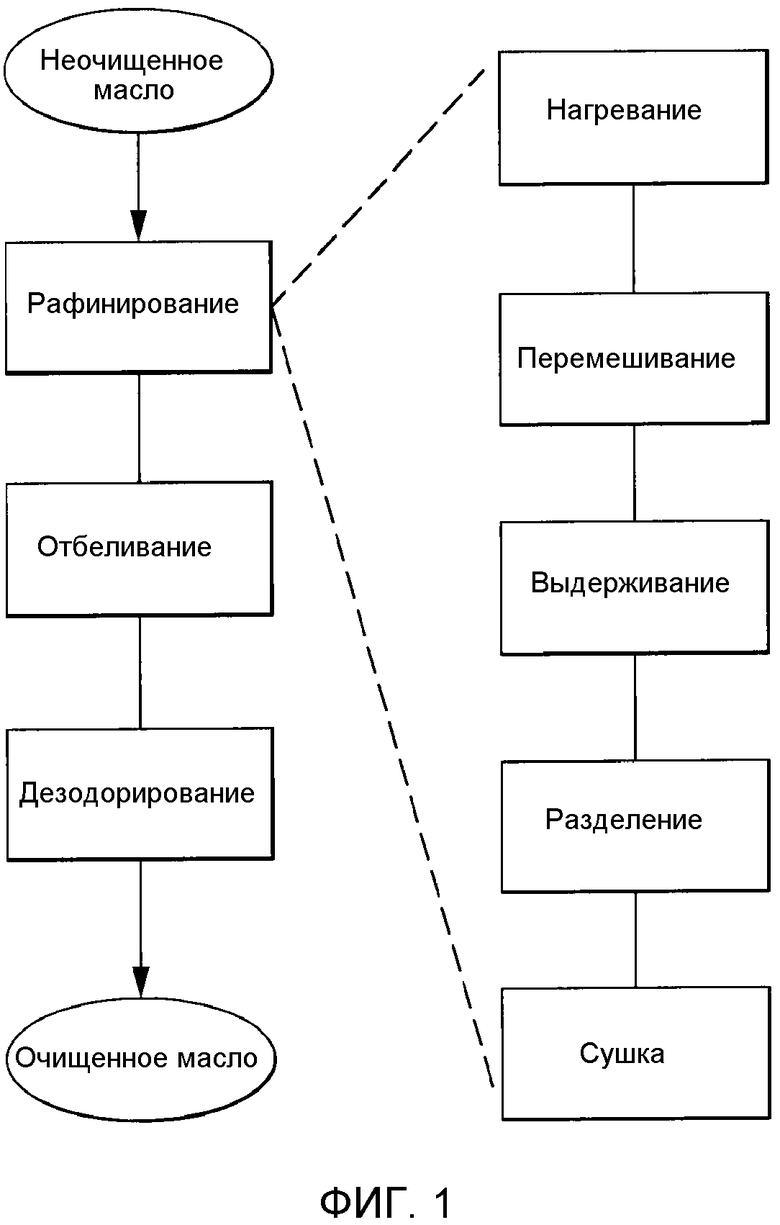
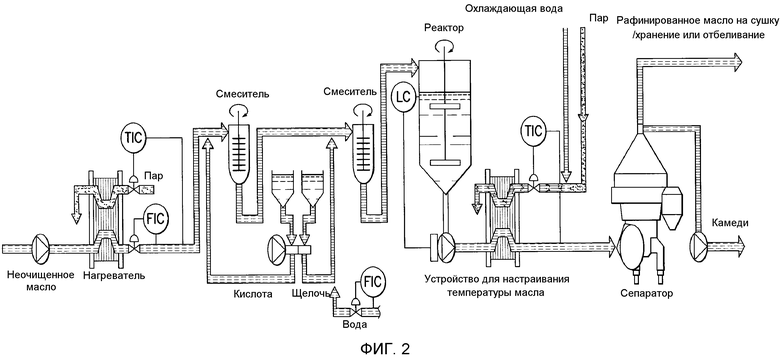
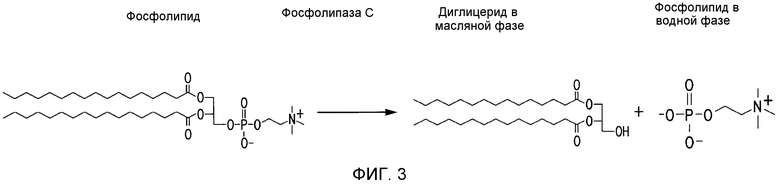
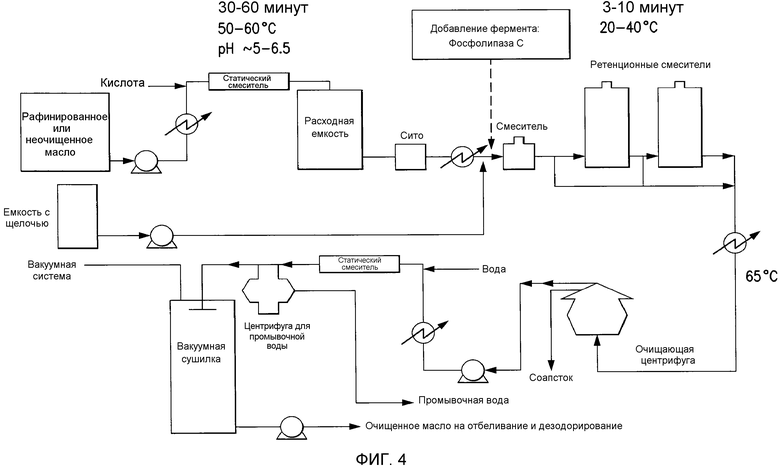
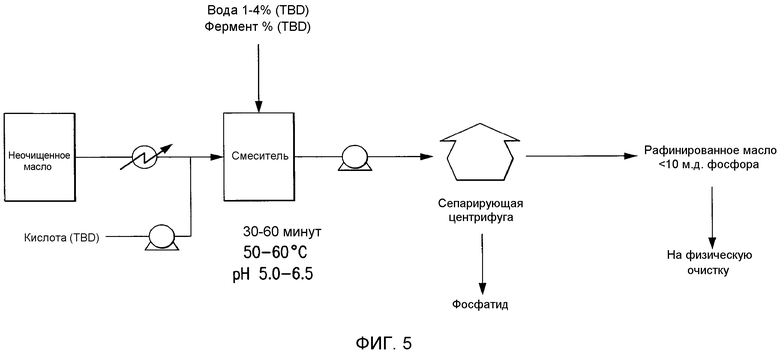
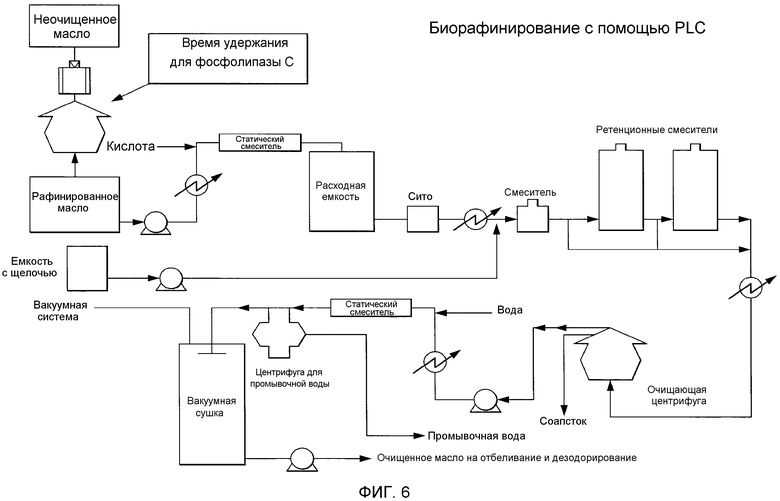
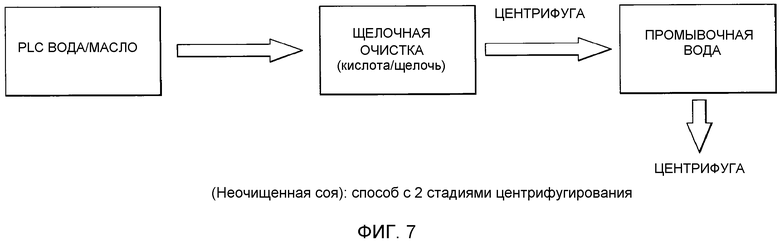
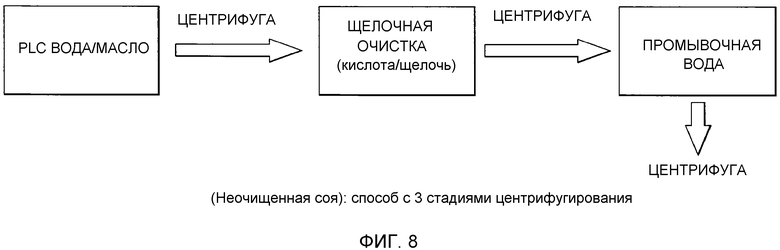
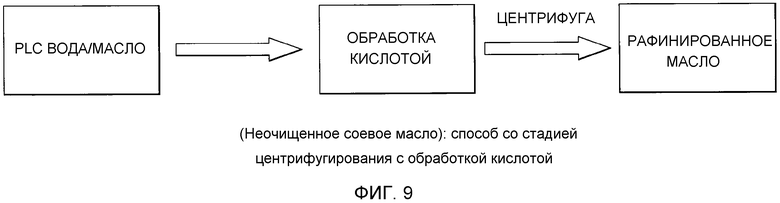
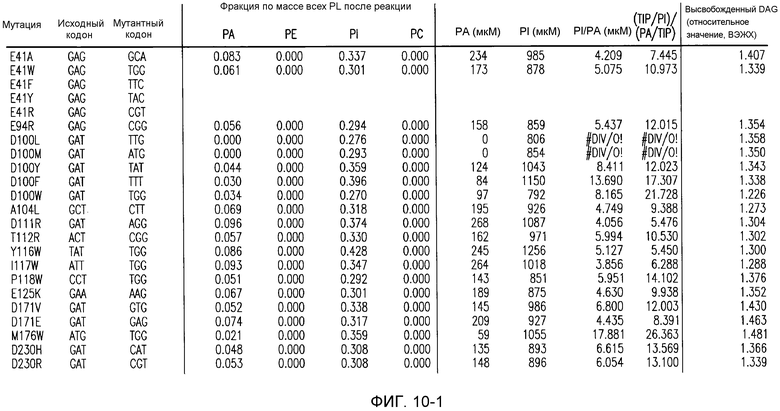
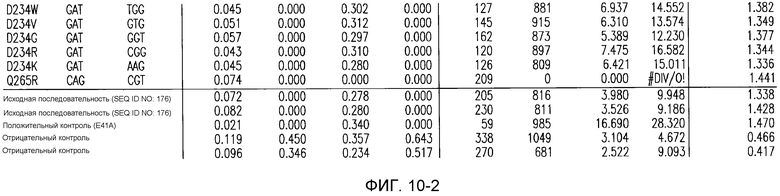
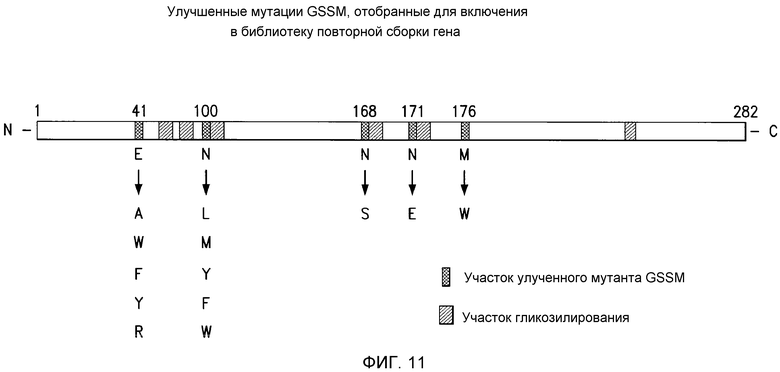
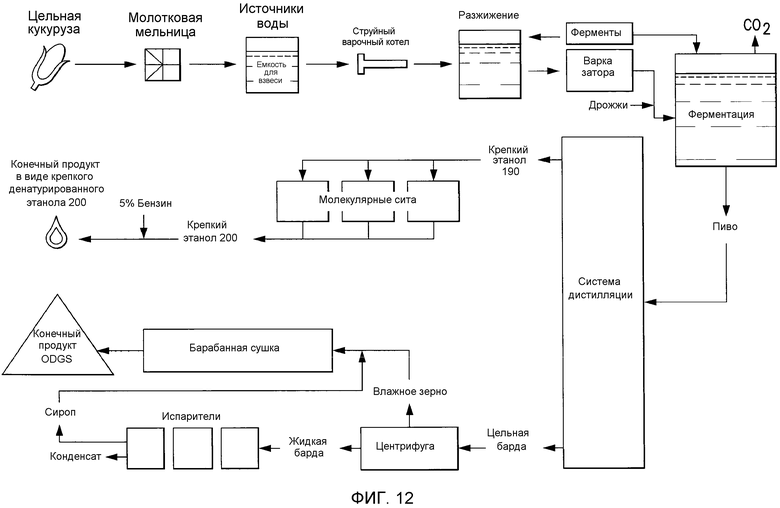
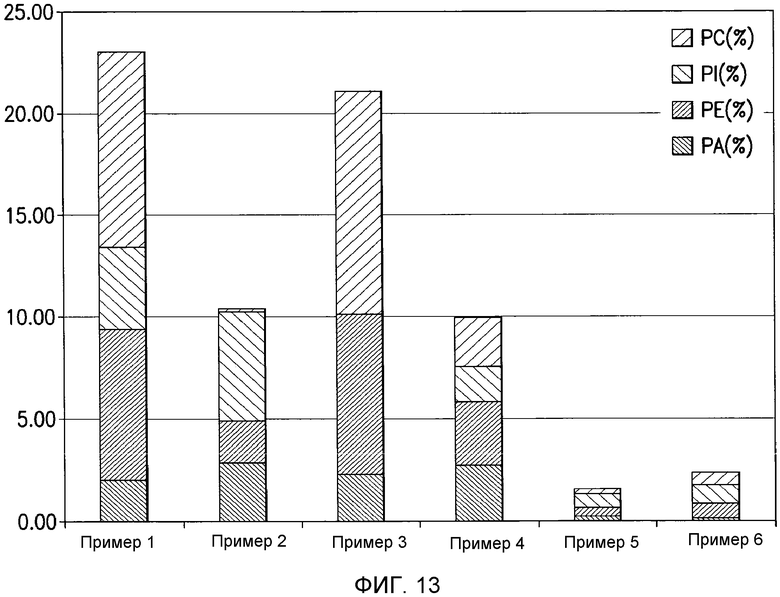
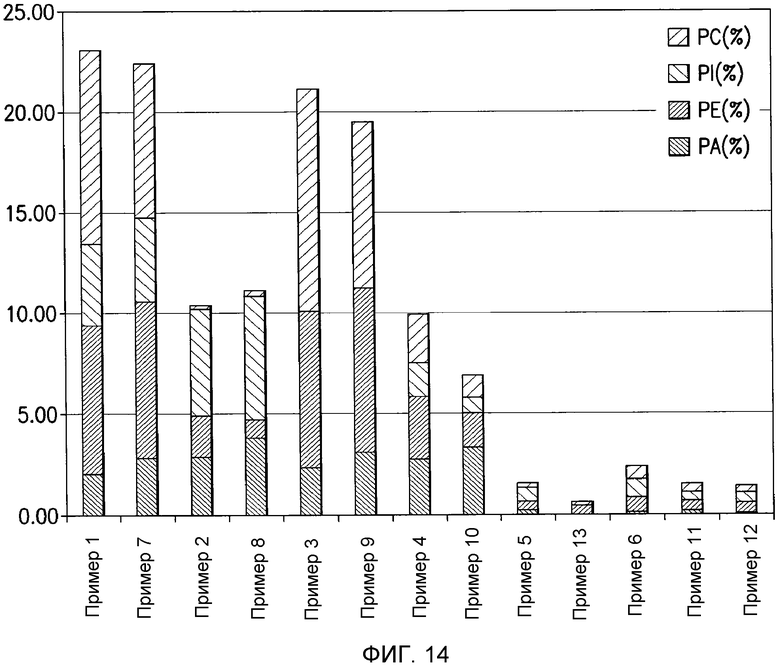
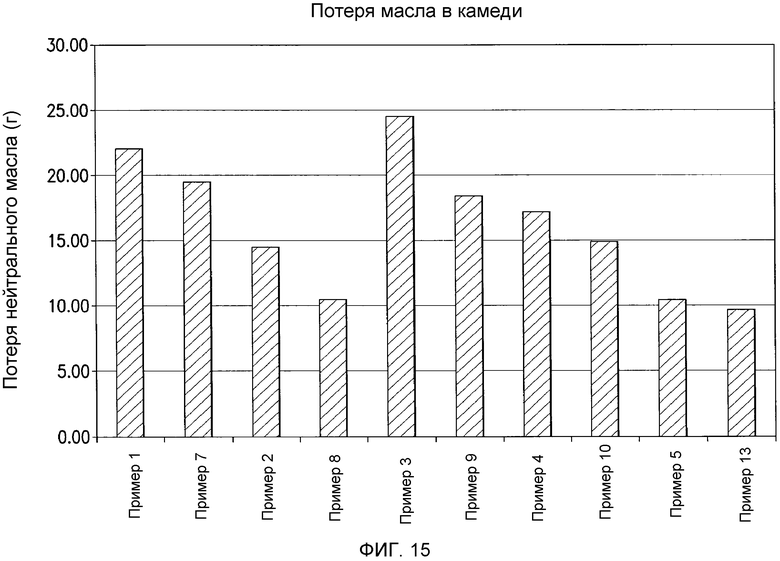
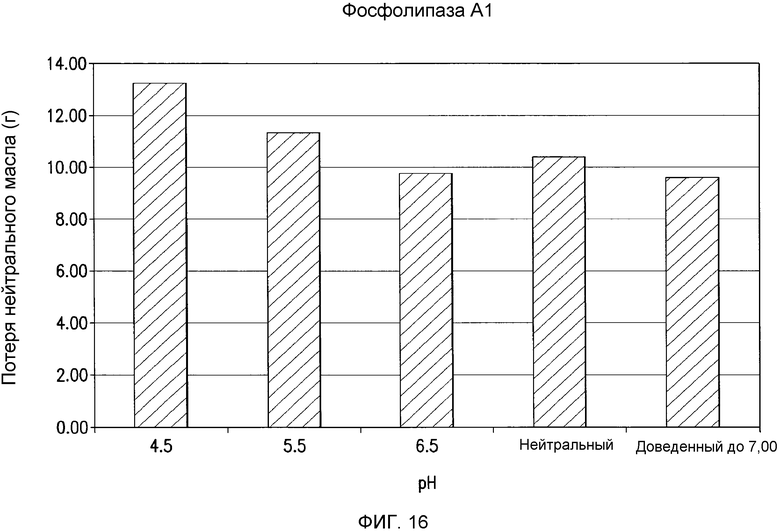
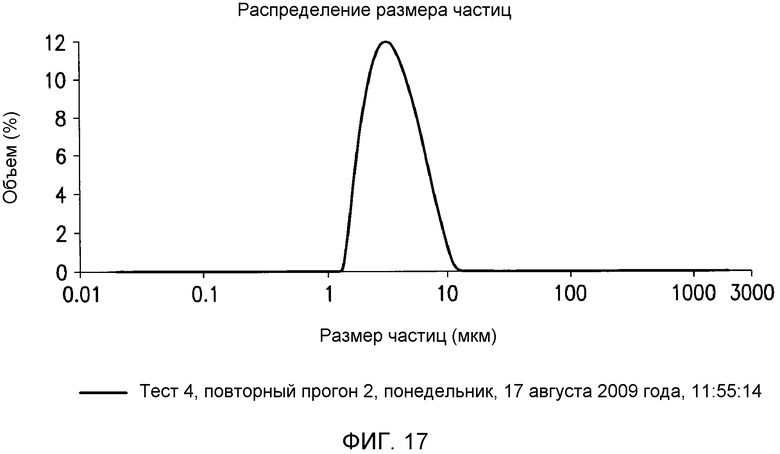
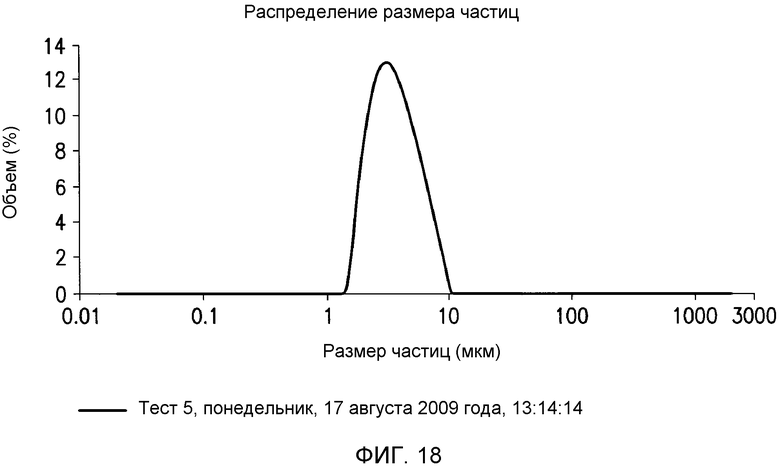
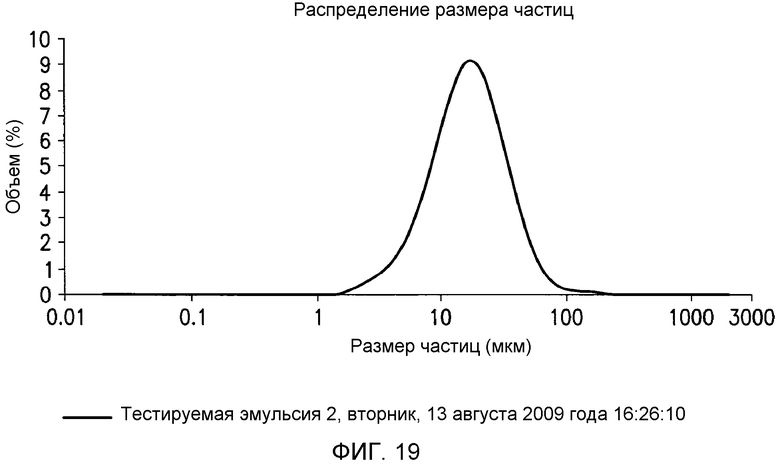
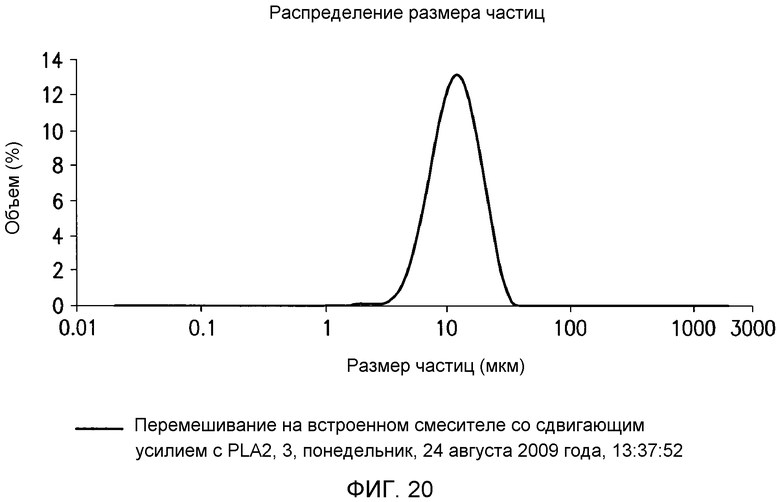
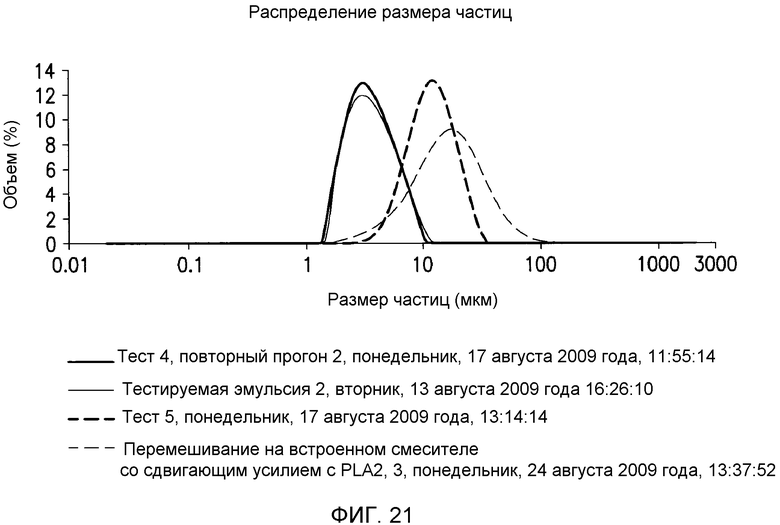
Настоящее изобретение относится к биохимии и раскрывает способ рафинирования масла. Для осуществления способа сначала смешивают водный раствор кислоты с маслом с получением смеси, имеющей рН 1-4, затем добавляют в указанную смесь основания с получением смеси, имеющей рН 6-8. В результате получается эмульсия, которая содержит более 60% водной фазы по объему с размером капель около 15-45 мкм. В указанную эмульсию добавляют рекомбинантную фосфатидилинозитол-специфическую фосфолипазу C (PI-PLC), которая имеет аминокислотную последовательность SEQ ID NO:8. После осуществления описанных стадий способа может быть выделен инозитолтрифосфат. Благодаря использованию новой рекомбинантной фосфолипазы настоящее изобретение позволяет эффективно удалять из масла при его рафинировании негидратируемые фосфолипиды (NHP). 4 н. и 7 з.п. ф-лы, 21 ил., 39 табл., 18 пр.
1. Способ рафинирования масла, включающий:
i-a) смешение водного раствора кислоты с маслом с получением кислотной смеси, имеющей pH приблизительно 1-4, где кислота выбрана из фосфорной кислоты, уксусной кислоты, лимонной кислоты, виннокаменной кислоты, янтарной кислоты и их смесей;
i-b) смешение основания с кислотной смесью с получением прореагировавшей смеси, имеющей pH приблизительно 6-8, где смешение на стадиях i-a) и/или i-b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60% водной фазы по объему с размером капель от приблизительно 15 мкм до приблизительно 45 мкм, где основание выбрано из гидроксида натрия, гидроксида калия, силиката натрия, карбоната натрия, карбоната кальция и их комбинации; и
i-c) смешение фермента фосфолипазы с эмульсией стадии i-b), где фермент фосфолипаза имеет аминокислотную последовательность, указанную в SEQ ID NO: 8.
2. Способ по п. 1, в котором эмульсия содержит по меньшей мере приблизительно 90% водной фазы по объему с размером капель приблизительно 15-40 мкм.
3. Способ по п. 1, в котором кислота представляет собой лимонную кислоту.
4. Способ по п. 1, в котором основание представляет собой гидроксид натрия.
5. Способ по п. 1, в котором pH реакционной смеси на стадии i-b) составляет приблизительно 7.
6. Способ рафинирования масла, включающий:
i-a) смешение водного раствора кислоты с маслом с получением смеси, имеющей pH приблизительно 1-4, где кислота выбрана из фосфорной кислоты, уксусной кислоты, лимонной кислоты, виннокаменной кислоты, янтарной кислоты и их смесей;
i-b) смешение основания с кислотной смесью с получением прореагировавшей смеси, имеющей pH приблизительно 6-8, где смешение на стадиях i-a) и/или i-b) обеспечивает эмульсию, которая содержит водную фазу со средним размером капель приблизительно 15-35 мкм, где основание выбрано из гидроксида натрия, гидроксида калия, силиката натрия, карбоната натрия, карбоната кальция и их комбинации; и
i-c) смешение фермента фосфолипазы с эмульсией стадии i-b), где фермент фосфолипаза имеет аминокислотную последовательность, указанную в SEQ ID NO: 8.
7. Способ получения инозитолтрифосфата, включающий:
i-a) смешение водного раствора кислоты с маслом с получением кислотной смеси, имеющей pH приблизительно 1-4;
i-b) смешение основания с кислотной смесью с получением прореагировавшей смеси, имеющей pH приблизительно 6-8, где смешение на стадиях i-a) и/или i-b) обеспечивает эмульсию, которая содержит по меньшей мере приблизительно 60% водной фазы по объему с размером капель приблизительно 15 мкм до приблизительно 45 мкм, где кислота выбрана из фосфорной кислоты, уксусной кислоты, лимонной кислоты, виннокаменной кислоты, янтарной кислоты и их смесей;
i-c) примешивание фермента фосфолипазы; и
i-d) выделение инозитолтрифосфата, где
фермент фосфолипаза имеет аминокислотную последовательность, указанную в SEQ ID NO: 8.
8. Способ получения инозитолтрифосфата, включающий:
i-a) смешение водного раствора кислоты с маслом с получением кислотной смеси, имеющей pH приблизительно 1-4;
i-b) смешение основания с кислотной смесью с получением прореагировавшей смеси, имеющей pH приблизительно 6-8, где смешение на стадиях i-a) и/или i-b) обеспечивает эмульсию, которая содержит водную фазу со средним размером капель приблизительно 15-35 мкм, где кислота выбрана из фосфорной кислоты, уксусной кислоты, лимонной кислоты, виннокаменной кислоты, янтарной кислоты и их смесей;
i-c) примешивание фермента фосфолипазы; и
i-d) выделение инозитолтрифосфата, где
фермент фосфолипаза имеет аминокислотную последовательность, указанную в SEQ ID NO: 8.
9. Способ по п. 6, 7 или 8, в котором основание представляет собой гидроксид натрия.
10. Способ по п. 6, 7 или 8, в котором кислота представляет собой лимонную кислоту.
11. Способ по п. 6, 7 или 8, в котором pH реакционной смеси на стадии i-b) составляет приблизительно 7.
Авторы
Даты
2016-01-27—Публикация
2010-10-08—Подача