Область изобретения
В настоящем изобретении предложен полипептид, обладающий активностью фосфолипазы С, и его применение.
Предшествующий уровень техники
Дегуммирование является важной стадией в очистке масел и жиров. Традиционное дегуммирование путем гидратации подразумевает большие финансовые затраты, большой расход материалов и энергии и серьезное загрязнение окружающей среды. В последние годы много усилий было приложено для применения ферментативного дегуммирования в процессе дегуммирования при очистке масел и жиров. По сравнению с традиционным способом способ дегуммирования с помощью фермента имеет огромные преимущества в отношении защиты окружающей среды, экономической целесообразности и качества и так далее, поскольку он может увеличивать экономическую выгоду, уменьшать энергетические затраты и выбросы и уменьшать экологическое загрязнение окружающей среды. Одним типом ферментов, используемых в дегуммировании масел и жиров, является фосфолипаза. Фосфолипаза С (PLC) обладает существенными преимуществами, такими как увеличение выхода диацилглицеринов (DAG) и уменьшение потерь выхода масел, по сравнению с другими ферментами для дегуммирования.
Специфичная к фосфатидилхолину фосфолипаза С из Bacillus cereus (ВС-РС-PLC) представляет собой фосфолипазу С, изученную ранее. Полная длина BC-PC-PLC составляет 283 аминокислоты, включая сигнальный пептид из 24 аминокислот и лидерный пептид из 14 аминокислот. Зрелый пептид состоит из 245 аминокислот (см., например, Johansen, Т., Holm,T, Guddal, P.H., Sletten, К., Haugli, F.B., Little, С.(1988). "Cloning and sequencing of the gene encoding the phosphatidylcholine-preferring phospholipase С of Bacillus cereus." Gene 65(2):293-304).
Известно, что активные сайты BC-PC-PLC дикого типа представляют собой Glu4, Asp55, Tyr56, Glul46, Ser64, Thr65, Phe66, Phe70, Ile80, Thrl33, Asnl34, Leul35, Serl43 (см., например, Hough, е., Hansen, L.K., birknes, В., jynge, K., Hansen, S., hordvik, A., little, С., Dodson, е., derewenda, Z. (1989) "High-resolution (1.5 A) crystal structure of phospholipase С from Bacillus cereus." Nature. 338:357-60).
Известна кристаллическая структура BC-PC-PLC, которая состоит из множественных спиральных доменов и по меньшей мере трех сайтов связывания Zn2+ с каталитическим сайтом на аспарагиновой кислоте в положении 55 (см., например, Hough, е., Hansen, L.K., birknes, В., jynge, К., Hansen, S., hordvik, A., little, C., Dodson, е., derewenda, Z. (1989) "High-resolution (1.5 A) crystal structure of phospholipase С from Bacillus cereus." Nature. 338:357-60). Гетерологичная экспрессия BC-PC-PLC менее изучена. Сообщали, что BC-PC-PLC экспрессируется в Bacillus subtilis и Pichia pastoris (см. например, Durban, М.А., silbersack, J., schweder, Т., Schauer, F., bornscheuer, U.T. (2007) High level expression of a recombinant phospholipase С from Bacillus cereus in Bacillus subtilis. Appl Microbiol Biotechnol 74(3):634-639; и Seo, К.H, Rhee J.I. (2004) High-level expression of recombinant phospholipase С from Bacillus cereus in Pichia pastoris and its characterization. Biotechnol Lett 26(19): 1475-1479).
Однако, термостабильность известной фосфолипазы С является низкой, причем она не может выдерживать температуру более 60°С. Следовательно, необходимо поддерживать оптимальную температуру дегуммирования при 50°С, что ограничивает применимость в промышленности. Если термостабильность фосфолипазы С можно эффективно улучшить, это благоприятно для промышленной применимости фосфолипазы С по следующим причинам: во-первых, более высокая температура во время дегуммирования может уменьшать вязкость масла, улучшать разделение масла и фосфолипидов, уменьшать количество масла, захватываемого фосфолипидами, и дополнительно увеличивать выход масла; во-вторых, в настоящее время PLC и PLA1 (фосфолипаза А1) используют в комбинации для более глубокого дегуммирования. В CN201480017114.5 раскрыта новая PLA1 с оптимальной температурой дегуммирования 65°С, таким образом более термостабильная PLC предпочтительна для дегуммирования вместе с PLA1. Кроме того, иногда температура неочищенного масла может превышать 50°С во время хранения, особенно в погодных условиях с высокой температурой, поэтому если оптимальная температура реакции PLC ниже 50°С, больше холодной воды требуется для охлаждения неочищенного масла, что приводит к большему потреблению энергии. Следовательно, разработка нового полипептида с термостабильной активностью фосфолипазы С имеет огромную практическую и экономическую ценность.
Краткое изложение сущности изобретения
В первом аспекте настоящего изобретения предложен полипептид с активностью фосфолипазы С, где указанный полипептид: (1) имеет аминокислотную последовательность, изложенную в SEQ ID NO: 2, с аминокислотными заменами в одном или более чем одном положении, выбранном из группы, состоящей из: положения 6, 8, 10, 104, 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, или любой их комбинации; или
(2) имеет идентичность последовательности (1) по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98%, более предпочтительно по меньшей мере на 99%, и по меньшей мере в одном из положений 6, 8, 10, 104 и 205 отличается от положений 6, 8, 10, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2.
В некоторых воплощениях аминокислотные замены присутствуют во всех положениях 6, 8, 10, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2.
В некоторых воплощениях аминокислота лизин в положении 6 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на пролин, глицин, гидроксипролин, серии или треонин.
В некоторых воплощениях лизин в положении 6 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменен на пролин.
В некоторых воплощениях аминокислота лизин в положении 8 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на изолейцин, лейцин, валин, метионин, аланин, фенилаланин или н-лейцин.
В некоторых воплощениях лизин в положении 8 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменен на изолейцин.
В некоторых воплощениях аминокислота глицин в положении 10 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на треонин или серии.
В некоторых воплощениях глицин в положении 10 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменен на треонин.
В некоторых воплощениях аминокислота лизин в положении 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на глицин или пролин.
В некоторых воплощениях лизин в положении 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменен на глицин.
В некоторых воплощениях аминокислота серии в положении 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на тирозин, триптофан, фенилаланин или треонин.
В некоторых воплощениях серии в положении 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменен на тирозин.
В некоторых воплощениях аминокислотная последовательность полипептида содержит аминокислотную последовательность, изложенную в SEQ ID NO: 4.
В некоторых воплощениях аминокислотная последовательность полипептида состоит из аминокислотной последовательности, изложенной в SEQ ID NO: 4.
Во втором аспекте настоящего изобретения предложен выделенный полипептид, имеющий идентичность аминокислотной последовательности, изложенной в SEQ ID NO: 4, на 80%, предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98% и более предпочтительно по меньшей мере на 99%, и выделенный полипептид имеет пролин, изолейцин, треонин, глицин и тирозин в положениях аминокислотных остатков, соответствующих положениям 6, 8, 10, 104 и 205 в SEQ ID NO: 4, соответственно. Предпочтительно полипептид получен из Bacillus subtilis.
В третьем аспекте настоящего изобретения предложена молекула нуклеиновой кислоты, кодирующая полипептид, описанный в первом или втором аспектах.
В некоторых воплощениях молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, изложенную в SEQ ID NO: 3.
В некоторых воплощениях последовательность молекулы нуклеиновой кислоты является такой, как изложено в SEQ ID NO: 3.
В четвертом аспекте настоящего изобретения предложен вектор, содержащий молекулу нуклеиновой кислоты, как она описана в третьем аспекте.
В некоторых воплощениях вектор представляет собой экспрессионный вектор.
В некоторых воплощениях вектор сконструирован для экспрессии в эукариотических или прокариотических клетках.
В некоторых воплощениях вектор сконструирован для экспрессии в бактериальных клетках, клетках грибов, дрожжевых клетках, клетках млекопитающих, клетках насекомых или растительных клетках.
В пятом аспекте настоящего изобретения предложена клетка, содержащая молекулу нуклеиновой кислоты, как она описана в третьем аспекте, или вектор, как он описан в четвертом аспекте.
В некоторых воплощениях клетка представляет собой эукариотическую клетку или прокариотическую клетку.
В некоторых воплощениях клетка представляет собой бактериальную клетку, клетку грибов, дрожжевую клетку, клетку млекопитающих, клетку насекомых или растительную клетку.
В шестом аспекте настоящего изобретения предложена фосфолипаза С, продуцируемая клеткой, как она описана в пятом аспекте.
В седьмом аспекте настоящего изобретения предложено применение полипептида, как он описан в первом или втором аспекте, или полипептида, кодируемого молекулой нуклеиновой кислоты, как она описана в третьем аспекте, или полипептида, кодируемого вектором, как он описан в четвертом аспекте, или ферментативного бульона, концентрата или полипептида, экспрессируемого клеткой, как она описана в пятом аспекте, или фосфолипазы С, как она описана в шестом аспекте, в качестве фосфолипазы С.
В некоторых воплощениях применение представляет собой применение в дегуммировании масел и жиров.
В восьмом аспекте настоящего изобретения предложена ферментативная композиция, содержащая полипептид, как он описан в первом или втором аспекте, или полипептид, кодируемый молекулой нуклеиновой кислоты, как она описана в третьем аспекте, или полипептид, кодируемый вектором, как он описан в четвертом аспекте, или полипептид, экспрессируемый клеткой, как она описана в пятом аспекте, или фосфолипазу С, как она описана в шестом аспекте, и по меньшей мере один фермент дегуммирования.
В некоторых воплощениях по меньшей мере один фермент дегуммирования выбран из группы, состоящей из: фосфолипазы A1, фосфолипазы А2, фосфолипазы В, фосфолипазы D, пектиназы и маннаназы.
В девятом аспекте настоящего изобретения предложено применение полипептида, как он описан в первом или втором аспекте, или молекулы нуклеиновой кислоты, как она описана в третьем аспекте, или вектора, как он описан в четвертом аспекте, или клетки, как она описана в пятом аспекте, или ферментативной композиции, как она описана в восьмом аспекте, в изготовлении фермента для дегуммирования.
Краткое описание графических материалов
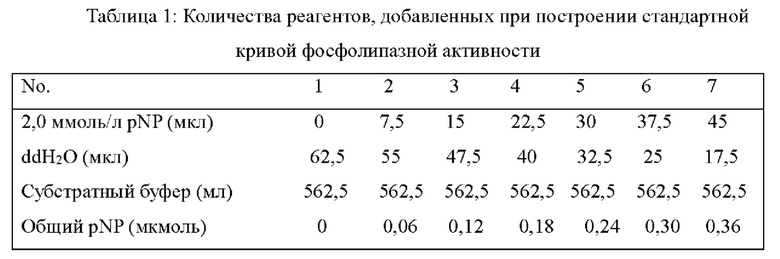
На Фиг. 1 представлена стандартная кривая активности фосфолипазы.
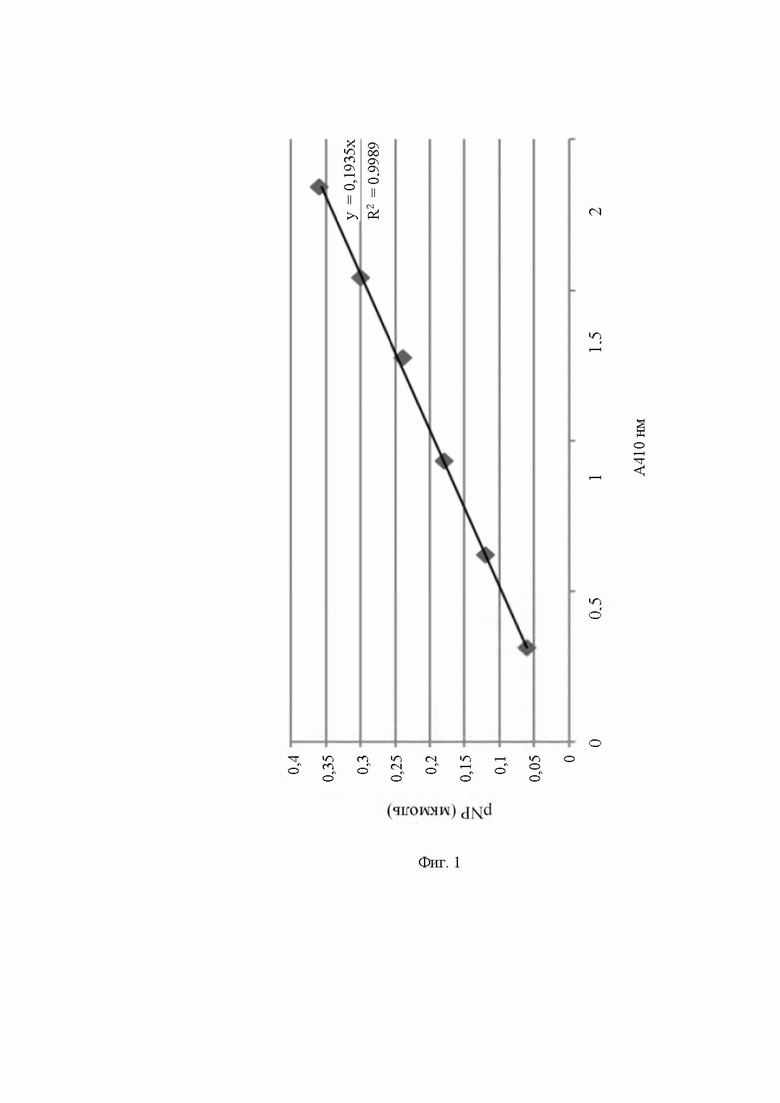
На Фиг. 2 показано сравнение термостабильности между PLC-9-49 и PLC-N63DN131SN134D-Y56H, где кружками обозначена PLC-9-49, а треугольниками обозначена PLC-N63DN131SN134D-Y56H.
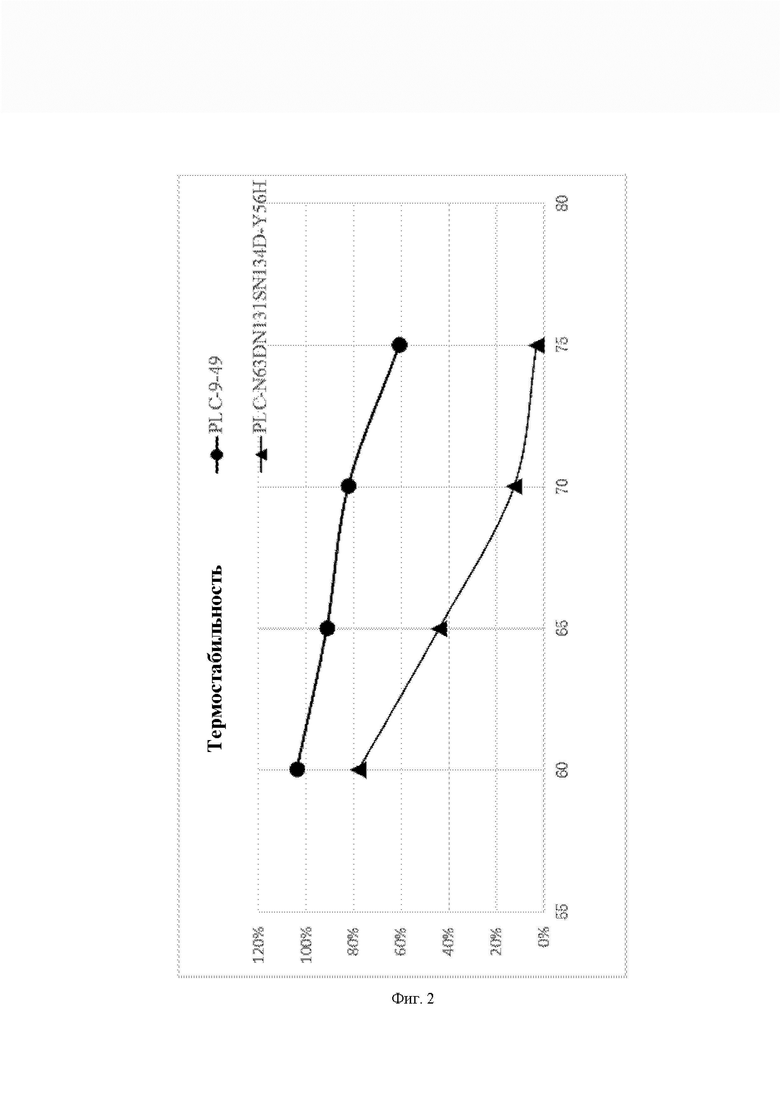
На Фиг. 3 показан прирост DAG при дегуммировании PLC-9-49 и PLC-N63DN131SN134D-Y56H при 55°С и 60°С, соответственно, по сравнению с неочищенным маслом.
Перечень последовательностей
SEQ ID NO: 1 представляет собой последовательность нуклеиновой кислоты, кодирующую PLC-N63DN131SN134D-Y56H.
SEQ ID NO: 2 представляет собой аминокислотную последовательность PLC-N63DN131SN134D-Y56H.
SEQ ID NO: 3 представляет собой последовательность нуклеиновой кислоты, кодирующую PLC-9-49.
SEQ ID NO: 4 представляет собой аминокислотную последовательность PLC-9-49.
Подробное описание изобретения Определения
Как их используют здесь, термины «специфичная к фосфатидилхолину фосфолипаза С» и «фосфолипаза С с предпочтением фосфатидилхолина» имеют одно и то же значение и хорошо понятны специалистам в данной области техники. Как ее используют здесь, аббревиатура «РС-PLC» предназначена для обозначения специфичной к фосфатидилхолину фосфолипазы С или фосфолипазы С с предпочтением фосфатидилхолина.
Как используют здесь, пример специфичной к фосфатидилхолину фосфолипазы С представляет собой специфичную к фосфатидилхолину фосфолипазу С Bacillus cereus, которая здесь обозначена аббревиатурой «ВС-PC-PLC». Следует понимать, что «ВС-PC-PLC» может обозначать не только специфичную к фосфатидилхолину фосфолипазу С Bacillus cereus дикого типа, но также обозначает мутант, полученный здесь на основе такой специфичной к фосфатидилхолину фосфолипазы С дикого типа.
В случае, когда положение аминокислоты обозначено здесь номерами, такие номера относятся к положению аминокислоты в SEQ ID NO: 2. SEQ ID NO: 2 представляет собой аминокислотную последовательность мутантной специфичной к фосфатидилхолину фосфолипазы С Bacillus cereus PLC-N63DN131SN134D-Y56H.
Здесь используют международные однобуквенные или трехбуквенные аббревиатуры аминокислот.
Применяемые здесь термины «полипептид», «пептид» и «белок» можно использовать взаимозаменяемо для обозначения полимера, образуемого соединением множества аминокислот посредством пептидных связей. Аминокислоты могут представлять собой существующие в природе аминокислоты или искусственно синтезированные аналоги.
Применяемые здесь термины «нуклеиновая кислота» и «полинуклеотид» можно использовать взаимозаменяемо, включая ДНК, РНК и так далее, но не ограничиваясь ими. Нуклеотиды могут представлять собой существующие в природе нуклеотиды или искусственно синтезированные аналоги.
Термин «клетки», как его используют здесь, может означать эукариотические клетки или прокариотические клетки, например, бактериальные клетки, клетки грибов, дрожжевые клетки, клетки млекопитающих, клетки насекомых или растительные клетки, но не ограничиваясь ими.
Термин «консервативная замена», как его используют здесь, относится к изменению в аминокислотном составе белка, которое существенно не изменяет активность белка. Следовательно, термин «консервативная замена» в отношении данной аминокислотной последовательности относится к замене таких аминокислот, которые не являются ключевыми для активности белка, или к замене аминокислот на другие аминокислоты с похожими свойствами (такими как кислотность, основность, положительный или отрицательный заряд, полярность или ее отсутствие и так далее), так что даже замена ключевых аминокислот не будет существенно изменять активность.
Термин «случайный насыщающий мутагенез», используемый здесь, относится к процессу использования NNK вырожденных кодонов в ПЦР-праймерах для введения мутаций в сайт, который может охватывать все 20 аминокислот для достижения насыщающего мутагенеза. Между тем, поскольку множественные сайты выбраны для мутагенеза, комбинация является случайной. В настоящем описании этот способ обозначают как случайный насыщающий мутагенез.
В данной области техники хорошо известно как обеспечить консервативные замены на аминокислоты, имеющие сходные функции. Например, альтернативные консервативные аминокислотные замены для каждой аминокислоты перечислены ниже:
консервативной заменой аланина (ALA) является его замена на валин (Val)*, лейцин (Leu) и изолейцин (Ilе);
консервативной заменой аргинина (Arg) является его замена на лизин (Lys)*, глутамин (Gln) и аспарагин (Asn);
консервативной заменой аспарагина (Asn) является его замена на глутамин (Gln)*, гистидин (His), лизин (Lys), аргинин (Arg) и аспарагиновую кислоту (Asp);
консервативной заменой аспарагиновой кислоты (Asp) является ее замена на глутаминовую кислоту (Glu)* и аспарагин (Asn);
консервативной заменой цистеина (Cys) является его замена на серии (Ser);
консервативной заменой глутамина (Gln) является его замена на аспарагин (Asn)*, гистидин (His) и лизин (Lys);
консервативной заменой глутаминовой кислоты (Glu) является ее замена на аспарагиновую кислоту (Asp)*, γ-гидроксиглутаминовую кислоту (Gla);
консервативной заменой глицина (Gly) является его замена на пролин (Pro);
консервативной заменой гистидина (His) является его замена на аспарагин (Asn), глутамин (Gln), лизин (Lys), аргинин (Arg)*;
консервативной заменой изолейцина (Ilе) является его замена на лейцин (Leu)*, валин (Val), метионин (Met), аланин (Ala), фенилаланин (Phe) и н-лейцин (Nle);
консервативной заменой лейцина (Leu) является его замена на н-лейцин (Nle), изолейцин (Ilе)*, валин (Val), метионин (Met), аланин (Ala), фенилаланин (Phe);
консервативной заменой лизина (Lys) является его замена на аргинин (Arg)*, глутамин (Gln), аспарагин (Asn) и орнитин (Оrn);
консервативной заменой метионина (Met) является его замена на лейцин (Leu)*, изолейцин (Ilе), фенилаланин (Phe) и н-лейцин (Nle);
консервативной заменой фенилаланина (Phe) является его замена на лейцин (Leu)*, валин (Val), изолейцин (Ilе) и аланин (Ala);
консервативной заменой пролина (Pro) является его замена на глицин (Gly)*, гидроксипролин (Hyp), серии (Ser), треонин (Thr);
консервативной заменой серина (Ser) является его замена на треонин (Thr);
консервативной заменой треонина (Thr) является его замена на серии (Ser);
консервативной заменой триптофана (Тrр) является его замена на тирозин (Туr);
консервативной заменой тирозина (Туr) является его замена на триптофан (Тrр), фенилаланин (Phe)*, треонин (Thr) и серии (Ser);
консервативной заменой валина (Val) является его замена на изолейцин (Ilе), лейцин (Leu)*, метионин (Met), фенилаланин (Phe), Аланин (Ala) и н-лейцин (Nle);
где «*» обозначает предпочтительную консервативную замену.
Дополнительно см. Creighton, Proteins: Structures and Molecular Properties, W.H. Freeman and company, New York (2nd ed., 1992).
Описание воплощений
В предыдущей заявке CN201510946696.1 авторов настоящего изобретения четыре аминокислоты BC-PC-PLC (а именно, аминокислоты в положениях 56, 63, 131 и 134) изменены на гистидин (Y56H), аспарагиновую кислоту (N63D), серии (N131S) и аспарагиновую кислоту (N134D), соответственно. Мутированная аминокислотная последовательность изложена в SEQ ID NO: 2, и кодирующая последовательность изложена в SEQ ID NO: 1, которую здесь также называют «PLC-N63DN131SN134D-Y56H». Специфическая ферментативная активность PLC-N63DN131SN134D-Y56H выше, чем таковая BC-PC-PLC дикого типа, но такой мутант не стабилен и не может выдерживать температуру более 60°С, при том что оптимальная температура дегуммирования составляет 50°С, что ограничивает использование этого мутанта в промышленности.
Во-первых, более высокая температура во время дегуммирования может уменьшать вязкость масла, улучшать разделение масла и фосфолипида, уменьшать количество масла, захваченного фосфолипидом, и дополнительно увеличивать выход масла; во-вторых, в настоящее время PLC и PLA1 используют в комбинации для глубокого дегуммирования. В CN201480017114.5 раскрыта новая PLA1 с оптимальной температурой дегуммирования 65°С (см. абзац [0173] в CN105073985A), поэтому более термоустойчивая PLC является желательной для совместного действия при такой температуре дегуммирования при дегуммировании вместе с PLA1. Дополнительно, иногда температура неочищенного масла может превышать 50°С во время хранения, особенно в погодных условиях с высокой температурой, поэтому если оптимальная температура реакции PLC ниже 50°С, много холодной воды требуется для охлаждения неочищенного масла, приводя к большому потреблению энергии. Следовательно, для улучшения термостабильности и/или применимости фосфолипазы С авторы настоящего изобретения улучшили PLC-N63DN131SN134D-Y56H и создали различные воплощения настоящего изобретения.
В первом аспекте настоящего изобретения предложен полипептид с активностью фосфолипазы С. Данный полипептид: (1) имеет аминокислотную последовательность, изложенную в SEQ ID NO: 2 с заменой аминокислот в одном или более чем одном положении, выбранном из группы, состоящей из положений 6, 8, 10, 104, 205 или любой их комбинации в аминокислотной последовательности, изложенной в SEQ ID NO: 2, или (2) имеет идентичность последовательности (1) по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98%, более предпочтительно по меньшей мере на 99%, и по меньшей мере одно из положений 6, 8, 10, 104 и 205 отличается от положений 6, 8, 10, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2.
В некоторых воплощениях аминокислотные замены присутствуют во всех положениях 6, 8, 10, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2.
В некоторых воплощениях аминокислота в положении 6 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на другую аминокислоту.
В некоторых воплощениях аминокислота в положении 8 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на другую аминокислоту.
В некоторых воплощениях аминокислота в положении 10 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на другую аминокислоту.
В некоторых воплощениях аминокислота в положении 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на другую аминокислоту.
В некоторых воплощениях аминокислота в положении 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на другую аминокислоту.
В некоторых воплощениях аминокислоты в положениях 6 и 8 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6 и 10 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6 и 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 8 и 10 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 8 и 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 8 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 10 и 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 10 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 8 и 10 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 8 и 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 8 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 10 и 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 10 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 8, 10 и 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 8, 10 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 8, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 10, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 8, 10 и 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 8, 10 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 8, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 6, 10, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислоты в положениях 8, 10, 104 и 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменены на другие аминокислоты.
В некоторых воплощениях аминокислота лизин в положении 6 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на пролин, глицин, гидроксипролин, серии или треонин.
В некоторых воплощениях лизин в положении 6 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменен на пролин.
В некоторых воплощениях аминокислота лизин в положении 8 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на изолейцин, лейцин, валин, метионин, аланин, фенилаланин или н-лейцин.
В некоторых воплощениях лизин в положении 8 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменен на изолейцин.
В некоторых воплощениях аминокислота глицин в положении 10 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на треонин или серии.
В некоторых воплощениях аминокислота глицин в положении 10 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на треонин.
В некоторых воплощениях аминокислота лизин в положении 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на глицин или пролин.
В некоторых воплощениях аминокислота лизин в положении 104 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на глицин.
В некоторых воплощениях аминокислота серии в положении 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменена на тирозин, триптофан, фенилаланин или треонин.
В некоторых воплощениях серии в положении 205 аминокислотной последовательности, изложенной в SEQ ID NO: 2, заменен на тирозин.
В некоторых воплощениях аминокислотная последовательность полипептида содержит аминокислотную последовательность, изложенную в SEQ ID NO: 4.
В некоторых воплощениях аминокислотная последовательность полипептида состоит из аминокислотной последовательности, изложенной в SEQ ID NO: 4.
В настоящем изобретении также предусмотрены функциональные варианты полипептида, как он описан в первом аспекте. В некоторых воплощениях функциональный вариант представляет собой вариант с консервативной заменой.
Во втором аспекте настоящего изобретения предложен выделенный полипептид, имеющий идентичность аминокислотной последовательности, изложенной в SEQ ID NO: 4, по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98%, более предпочтительно по меньшей мере на 99%, и этот выделенный полипептид имеет пролин, изолейцин, треонин, глицин и тирозин в положениях аминокислот, соответствующих положениям 6, 8, 10, 104 и 205 SEQ ID NO: 4, соответственно.
В некоторых воплощениях полипептид получен из Bacillus subtilis.
В некоторых воплощениях полипептид имеет идентичность аминокислотной последовательности, изложенной в SEQ ID NO: 4, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или более.
В некоторых воплощениях полипептид имеет идентичность аминокислотной последовательности, изложенной в SEQ ID NO: 4, по меньшей мере на 97,2%, по меньшей мере на 97,6%, по меньшей мере на 98%, по меньшей мере на 98,4%, по меньшей мере на 98,8%, по меньшей мере на 99,2%, по меньшей мере на 99,6% или более.
В некоторых воплощениях аминокислотный остаток выделенного полипептида, соответствующий положению 6 в SEQ ID NO: 4, представляет собой пролин.
В некоторых воплощениях аминокислотный остаток выделенного полипептида, соответствующий положению 8 в SEQ ID NO: 4, представляет собой изолейцин.
В некоторых воплощениях аминокислотный остаток выделенного полипептида, соответствующий положению 10 в SEQ ID NO: 4, представляет собой треонин.
В некоторых воплощениях аминокислотный остаток выделенного полипептида, соответствующий положению 104 в SEQ ID NO: 4, представляет собой глицин.
В некоторых воплощениях аминокислотный остаток выделенного полипептида, соответствующий положению 205 в SEQ ID NO: 4, представляет собой тирозин.
В некоторых воплощениях аминокислотный остаток выделенного полипептида, соответствующий положению 6 в SEQ ID NO: 4, представляет собой пролин, и/или аминокислотный остаток выделенного полипептида, соответствующий положению 8 в SEQ ID NO: 4, представляет собой изолейцин, и/или аминокислотный остаток выделенного полипептида, соответствующий положению 10 в SEQ ID NO: 4, представляет собой треонин, и/или аминокислотный остаток выделенного полипептида, соответствующий положению 104 в SEQ ID NO: 4, представляет собой глицин, и/или аминокислотный остаток выделенного полипептида, соответствующий положению 205 в SEQ ID NO: 4, представляет собой тирозин.
В третьем аспекте настоящего изобретения предложена молекула нуклеиновой кислоты, кодирующая полипептид, как он описан в первом или втором аспекте. В настоящем изобретении предусмотрены различные молекулы нуклеиновых кислот, которые можно получить на основе вырожденности генетических кодонов или предпочтения различных видов по кодонам.
В некоторых воплощениях молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, изложенную в SEQ ID NO: 3.
В некоторых воплощениях последовательность молекулы нуклеиновой кислоты изложена в SEQ ID NO: 3.
В четвертом аспекте настоящего изобретения предложен вектор, содержащий молекулу нуклеиновой кислоты, как она описана в третьем аспекте.
В некоторых воплощениях вектор представляет собой экспрессионный вектор.
В некоторых воплощениях вектор сконструирован для экспрессии в эукариотической или прокариотической клетке.
В некоторых воплощениях вектор сконструирован для экспрессии в бактериальной клетке, клетке гриба, дрожжевой клетке, клетке млекопитающего, клетке насекомого или растительной клетке.
В некоторых воплощениях вектор представляет собой плазмиду.
Подходящие векторы для эукариотической клетки или прокариотической клетки хорошо известны специалистам в данной области техники, и множество оригинальных векторов доступны в продаже. Примеры векторов включают ряд векторов, используемых в примерах настоящего изобретения, но не ограничены ими.
В пятом аспекте настоящего изобретения предложена клетка, содержащая молекулу нуклеиновой кислоты, как она описана в третьем аспекте, или вектор, как он описан в четвертом аспекте.
В некоторых воплощениях клетка представляет собой эукариотическую клетку или прокариотическую клетку.
В некоторых воплощениях клетка представляет собой бактериальную клетку, клетку гриба, дрожжевую клетку, клетку млекопитающего, клетку насекомого или растительную клетку.
В некоторых воплощениях клетка представляет собой клетку Pichia pastoris.
В некоторых воплощениях клетка представляет собой клетку Bacillus subtilis.
В некоторых воплощениях клетка представляет собой клетку Escherichia coli.
В отношении клетки, содержащей молекулу нуклеиновой кислоты по настоящему изобретению, данная молекула нуклеиновой кислоты может быть локализована вне хромосом (например, в векторе) или интегрирована в хромосому клетки-хозяина. Специалистам в данной области техники хорошо известно как интегрировать молекулу нуклеиновой кислоты в хромосомы клетки-хозяина и как ввести вектор в клетку-хозяина путем трансформации или трансфекции.
В шестом аспекте настоящего изобретения предложена фосфолипаза С, продуцированная клеткой, как она описана в пятом аспекте. Специалистам в данной области техники хорошо известно как продуцировать целевой пептид или белок с помощью генетически сконструированной клетки-хозяина.
В седьмом аспекте настоящего изобретения предложено применение полипептида, как он описан в первом или втором аспекте, или полипептида, кодируемого молекулой нуклеиновой кислоты, как она описана в третьем аспекте, или полипептида, кодируемого вектором, как он описан в четвертом аспекте, или ферментативного бульона, концентрата или полипептида, экспрессируемого клеткой, как она описана в пятом аспекте, или фосфолипазы С, как она описана в шестом аспекте, в качестве фосфолипазы С.
В некоторых воплощениях применение представляет собой применение в процессе дегуммирования масел и жиров.
Применение специфичной к фосфатидилхолину фосфолипазы С в процессе дегуммирования масел и жиров известно в данной области техники. Фосфолипаза С может гидролизовать фосфолипиды глиального компонента в масле с получением гидрофильной фосфатной части и липофильного DAG. Глиальная часть удаляется, поскольку гидрофильная часть вымывается водой. DAG увеличивает выход масла. Например, процесс ферментативного дегуммирования включает нагревание неочищенного масла до 60°С, добавление раствора фосфолипазы С, перемешивание в реакторе в течение 2 ч после высокоскоростного смешивания со сдвигом и затем центрифугирование для разделения водной фазы и масляной фазы.
В восьмом аспекте настоящего изобретения предложена ферментативная композиция, содержащая полипептид, как он описан в первом или втором аспекте, или полипептид, кодируемый молекулой нуклеиновой кислоты, как она описана в третьем аспекте, или полипептид, кодируемый вектором, как он описан в четвертом аспекте, или полипептид, экспрессируемый в клетке, как она описана в пятом аспекте, или фосфолипазу С, как она описана в шестом аспекте, и по меньшей мере один фермент дегуммирования.
В некоторых воплощениях по меньшей мере один фермент дегуммирования выбран из группы, состоящей из: фосфолипазы A1, фосфолипазы А2, фосфолипазы В, фосфолипазы D, пектиназы и манназы.
В некоторых воплощениях ферментативная композиция содержит полипептид, как он описан в первом или втором аспекте, и по меньшей мере один фермент дегуммирования.
В некоторых воплощениях ферментативная композиция содержит полипептид, кодируемый молекулой нуклеиновой кислоты, как она описана в третьем аспекте, и по меньшей мере один фермент дегуммирования.
В некоторых воплощениях ферментативная композиция содержит полипептид, кодируемый вектором, как он описан в четвертом аспекте, и по меньшей мере один фермент дегуммирования.
В некоторых воплощениях ферментативная композиция содержит полипептид, экспрессируемый клеткой, как она описана в пятом аспекте, и по меньшей мере один фермент дегуммирования.
В некоторых воплощениях ферментативная композиция содержит фосфолипазу С, как она описана в шестом аспекте, и по меньшей мере один фермент дегуммирования.
В некоторых воплощениях ферментативная композиция содержит полипептид, как он описан в первом или втором аспекте, и/или полипептид, кодируемый молекулой нуклеиновой кислоты, как она описана в третьем аспекте, и/или полипептид, кодируемый вектором, как он описан в четвертом аспекте, и/или полипептид, экспрессируемый клеткой, как она описана в пятом аспекте, и/или фосфолипазу С, как она описана в шестом аспекте, и по меньшей мере один фермент дегуммирования.
В девятом аспекте настоящего изобретения предложено применение полипептида, как он описан в первом или втором аспекте, или молекулы нуклеиновой кислоты, как она описана в третьем аспекте, или вектора, как он описан в четвертом аспекте, или клетки, как она описана в пятом аспекте, или ферментативной композиции, как она описана в восьмом аспекте, в изготовлении фермента для дегуммирования.
Следует понимать, что подробное описание изобретение, изложенное выше, предназначено только для ясного понимания содержания настоящего изобретения специалистами в данной области техники и не предназначено ограничивать его в каком-либо аспекте. Специалистам в данной области техники понятны различные изменения, которые можно применять к воплощениям изобретения.
Примеры
Следующие примеры предложены для дополнительного описания настоящего изобретения, без какого-либо ограничения. Экспериментальные материалы
Основные материалы, использованные в примерах настоящего изобретения, представляют собой следующие:
1. Штамм
Pichia pastoris SMD1168 (Invitrogen, номер по каталогу No. С17500), Escherichia coli DH5a (TAKARA, номер по каталогу No. D9057A).
2. Культуральная среда и раствор
Жидкая среда LB: 0,5% дрожжевого экстракта, 1% триптона, 1% NaCl, рН 7,0.
Твердая среда LB: жидкая среда LB с добавлением агара 1,5%.
Жидкая среда YPD: 1% дрожжевого экстракта, 2% пептона, 2% глюкозы.
Твердая среда YPD: жидкая среда LB с добавлением агара 2%.
Твердая среда MGYS: 1,34% основы азотного агара для дрожжей (YNB) (содержащей сульфат аммония и не содержащая аминокислоты), 1% глицерина, 1М сорбита, 4×10-5% D-биотина, 2% агара.
Среда ВММ для скрининга на основе фосфолипидов соевых бобов: 1,34% основы азотного агара для дрожжей (YNB) (содержащей сульфат аммония, не содержащей аминокислоты), 4×10-5% D-биотина, 0,5% метанола (добавленный после стерилизации), 2% эмульсии лецитина соевых бобов, 0,1М буфер лимонная кислота-цитрат натрия (рН равен 6,6), 2% агара и с добавлением 10 мкМ ZnSO4⋅7 Н2О.
Получение 2% эмульсии фосфолипидов соевых бобов: 2 г фосфолипидов соевых бобов и 100 мл Н2О взвешивали и гомогенизировали при 8000 об/мин в высокоскоростном гомогенизаторе в течение 1 мин.
Жидкая среда BMGY: 1% дрожжевого экстракта, 2% пептона, 1,34% основы азотного агара для дрожжей (YNB) (содержащей сульфат аммония и не содержащей аминокислоты), 1% глицерина, 4×10-5% D-биотина, 0,1 М буфер дигидрофосфат калия гидроортофосфат калия (рН=6,0).
Жидкая среда BMMY: 1% дрожжевого экстракта, 2% пептона, 1,34% основы азотного агара для дрожжей (YNB) (содержащей сульфат аммония и не содержащей аминокислоты), 0,3% ZnSO4*7Н2О, 0,5% метанола (добавленного после стерилизации), 4×10-5% D-биотина (добавленного после стерилизации), 0,1 М буфер лимонная кислота-цитрат натрия (рН=6,6).
3. Определение ферментативной активности: метод pNPPC
3.1 Построение стандартной кривой для определения активности фосфолипазы 0,01391 г пара-нитрофенола взвешивали и растворяли в 50 мл стерильной воды
для получения 2 ммоль/л рабочего раствора. Добавляли различные реагенты, см. Таблицу 1, строили стандартную кривую, и полученная стандартная кривая представлена на Фиг. 1. Условия для определения ферментативной активности образца соответствовали таковым для построения стандартной кривой.
После перемешивания вышеописанных растворов их обрабатывали при 37°С в течение 15 минут, затем добавляли 500 мкл 0,5 н. NaOH. Измеряли поглощение при 410 нм.
3.2 Получение реакционного буфера
0,1 М буфер борная кислота-борат натрия (рН=7,6), содержащий 20 мм pNPPC.
Брали 600 мкл вышеописанного буфера, добавляли 25 мкл и проводили реакцию при 37°С в течение 15 мин, затем добавляли 500 мкл 0,5 н. NaOH. Реакцию останавливали и измеряли поглощение при 410 нм.
4. Расчет ферментативной активности
Ферментативную активность рассчитывали по следующей формуле: Ферментативная активность образца (Ед/мл)=А (поглощение при 410 нм)×0,1935×фактор разведениях 10/15
5. Реагенты для измерения концентрации белков:
Набор реактивов для определения концентрации белка по модифицированному методу Брэдфорда (доступен от Shanghai Sangon Bioengineering Co., Ltd.).
6. Ферменты, используемые в эксперименте:
Sal I (доступна от New England Biotechnology (Beijing) Co., Ltd.); ДНК-полимераза: ДНК-полимераза PrimeSTAR®HS (доступна от Takara (Dalian) Co., Ltd.);
T4 ДНК-лигаза (доступна от Fermentas Co., Ltd.).
Пример 1: Конструирование и скрининг библиотеки мутантной фосфолипазы С
Вектор pmAO-PLC-N63DN131SN134D-Y56H получали согласно способу, описанному в CN 201510946696.1.
Вектор pmAO-PLC-N63DN131SN134D-Y56H использовали в качестве матрицы, библиотека аминокислот в положениях 6, 8, 10, 104 и 205 для случайного насыщающего мутагенеза была сконструирована Synbio Technologies (Suzhou) Co., Ltd. Плазмидной библиотекой трансформировали Е. coli DH5a и все полученные клоны Е. coli промывали жидкой средой LB (содержащей 100 мкг/мл ампициллина), культивировали при 37°С в течение 4 ч. Плазмиды экстрагировали и линеаризовали Sail, и выделяли фрагмент примерно 8,5 т.н. Брали 500 нг вектора и трансформировали им компетентные клетки штамма Pichia pastoris М314 путем электропорации. Трансформанты высевали на чашки MGYS и инкубировали при 30°С в течение трех суток для получения библиотеки Pichia pastoris, мутантных по PLC-N63DN131SN134D-Y56H. Моноклоны собирали с чашки и высевали на чашку со средой ВММ для скрининга на основе фосфолипидов соевых бобов. Отбирали клоны с большим белым кольцом преципитации. Мутантные штаммы получали и обозначали как PLC-9-49.
Пример 2: Анализ последовательности мутантной фосфолипазы С
Штамм PLC-9-49 инокулировали в 3 мл жидкой среды YPD при 30°С в течение ночи и затем экстрагировали геномную ДНК. Геномную ДНК штамма PLC-9-49 использовали в качестве матрицы. Амплификацию ПЦР проводили с помощью ДНК-полимеразы PrimeSTAR®HS и пары праймеров АОХ1-5/АОХ1-3 для получения последовательности ДНК штамма PLC-9-49, где
последовательность праймера АОХ1-5 представляла собой 5'-GACTGGTTCC AATTGAC AACG-3';
последовательность праймера АОХ1-3 представляла собой 5'-GGC AAATGGCATTCTG АС АТССТС-3'.
Полученные последовательности отправляли в Shanghai Sangon Bioengineering Co., Ltd. и секвенировали с парой праймеров АОХ1-5/АОХ1-3. Результаты секвенирования ДНК PLC-9-49 представлены в SEQ ID NO: 3. После выравнивания, в сравнении с SEQ ID NO: 1, несколько оснований в SEQ ID NO: 3 подверглись мутациям, так лизин в положении 6 был заменен на пролин, лизин в положении 8 был заменен на изолейцин, глицин в положении 10 был заменен на треонин, лизин в положении 104 был заменен на глицин, и серии в положении 205 был заменен на тирозин. Аминокислотная последовательность PLC-9-49 представлена в SEQ ID NO: 4.
Пример 3: Анализ термостабильности мутантной PLC-9-49
Брали штамм PLC-9-49 и штамм PLC-N63DN131SN134D-Y56H и активировали в жидкой YPD и затем инокулировали в среду BMGY при 30°С на ночь при 220 об/мин. Культуру переносили в среду BMMY, где начальная OD600 составляла 6.
Сначала проводили индукцию 2% метанолом с добавлением 1% метанола через 48 ч и 56 ч, соответственно, и отбирали образцы через 72 ч. Полученные образцы концентрировали в 40 раз путем обессоливания ультрафильтрацией с помощью ультрафильтрационных трубок с порогом отсечения молекулярной массы 40 кДа. Обработанные образцы добавляли в буфер (20 мМ буфер лимонная кислота-цитрат натрия (рН 6,6), 10 мкМ ZnSO4).
Ферментативный бульон, сконцентрированный путем ультрафильтрации, хранили при 60°С, 65°С, 70°С и 75°С в течение 2 ч, и 0,5 мкл концентрата ферментативного бульона добавляли в 600 мкл реакционного буфера pNPPC и подвергали взаимодействию при 37°С в течение 15 мин, затем добавляли 500 мкл 0,5 н. NaOH для остановки реакции и измеряли поглощение при 410 нм. Активность фосфолипазы С для каждого ферментативного образца рассчитывали по стандартной кривой.
Термостабильность PLC-9-49 и PLC-N63DN131SN134D-Y56H показана на Фиг. 2. После обработки при 60°С в течение 2 ч мутантные PLC-9-49 сохраняли жизнеспособность на 91%, в то время как жизнеспособность PLC-N63DN131SN134D-Y56H уменьшалась до 44%. После обработки при 70°С в течение 2 ч мутантные PLC-9-49 сохраняли жизнеспособность на 83%, в то время как жизнеспособность PLC-N63DN131SN134D-Y56H уменьшалась до 13%. После обработки при 75°С в течение 2 ч мутантные PLC-9-49 сохраняли жизнеспособность на 61%, в то время как жизнеспособность PLC-N63DN131SN134D-Y56H уменьшалась до 3%.
Можно видеть, что термостабильность PLC-9-49 значительно выше, чем таковая у PLC-N63DN131SN134D-Y56H.
Пример 4: Тест дегуммирования PLC-9-49
100 г неочищенного соевого масла нагревали до 55°С и 60°С, соответственно, для дегуммирования. Образцы по 50 миллионных долей (м.д.) PLC-9-49 и PLC-N63DN131SN134D-Y56H добавляли соответственно для получения водной фазы 3% в системе, и центрифугировали в течение 1 мин с помощью высокоскоростной центрифуги (10000 об/мин), перемешивали при 55°С и 60°С (750 об/мин) в течение 2 ч, нагревали до 85°С и выдерживали при этой температуре в течение 5 мин. Образцы центрифугировали при 12000 об/мин в течение 10 мин и брали примерно 10 г верхнего образца масла. Уровень DAG определяли методом HPLC (высокоэффективная жидкостная хроматография). Прирост DAG в образце PLC-9-49 и образце PLC-N63DN131SN134D-Y56H относительно неочищенного масла показан на Фиг. 3. Дегуммирование с использованием PLC-9-49 при 60°С увеличивает прирост DAG примерно на 10% по сравнению с 55°С, в то время как дегуммирование с использованием PLC-N63DN131SN134D-Y56H при 60°С уменьшает прирост DAG на 9,4% по сравнению с 55°С.
Видно, что температура дегуммирования PLC-9-49 примерно на 5°С выше, чем таковая для PLC-N63DN131SN134D-Y56H. Следовательно, промышленная применимость PLC-9-49 лучше.
--->
Sequence Listing
<110> WILMAR (SHANGHAI) BIOTECHNOLOGY RESEARCH & DEVELOPMENT CENTER
CO., LTD
<120> POLYPETIDE HAVING PHOSPHOLIPASE C ACTIVITY AND USE THEREOF
<130> 19A592
<150> CN 201811625457.6
<151> 2018-12-28
<160> 4
<170> SIPOSequenceListing 1.0
<210> 1
<211> 738
<212> DNA
<213> Artificial Sequence
<220>
<223> Последовательность нуклеиновой кислоты, кодирующая
PLC-N63DN131SN134D-Y56H
<400> 1
tggtcagctg aggacaagca taaggaaggt gtgaatagtc acttatggat cgtgaaccgt
60
gccattgata taatgtctag gaatacaact ctggttaagc aagatagagt tgctcaattg
120
aatgaatggc gtacagagct agagaatggc atctacgctg ctgatcatga aaacccctat
180
tacgatgaca gtaccttcgc ttctcacttt tacgatccag acaacggaaa gacatatatc
240
ccattcgcca agcaagctaa ggagactgga gctaagtact tcaagttggc tggagagtca
300
tacaagaata aagacatgaa gcaggccttc ttttatcttg ggttgtcatt gcattatttg
360
ggcgatgtca accaacctat gcatgccgca tcctttacgg acctgtccta tccacagggt
420
tttcactcca agtacgagaa ctttgtcgat actattaaag acaactacaa agttaccgat
480
gggaacggat attggaattg gaaaggcacc aaccctgaag aatggattca cggtgcagca
540
gtagttgcaa aacaggacta ctctggaatt gtcaatgaca ataccaaaga ttggtttgtg
600
aaagccgcag tctcccagga atatgcagat aaatggagag ctgaagttac acctatgact
660
ggtaaacgac taatggatgc ccaaagagtt actgctggtt acattcaatt atggttcgac
720
acttacggtg acaggtaa
738
<210> 2
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность PLC-N63DN131SN134D-Y56H
<400> 2
Trp Ser Ala Glu Asp Lys His Lys Glu Gly Val Asn Ser His Leu Trp
1 5 10 15
Ile Val Asn Arg Ala Ile Asp Ile Met Ser Arg Asn Thr Thr Leu Val
20 25 30
Lys Gln Asp Arg Val Ala Gln Leu Asn Glu Trp Arg Thr Glu Leu Glu
35 40 45
Asn Gly Ile Tyr Ala Ala Asp His Glu Asn Pro Tyr Tyr Asp Asp Ser
50 55 60
Thr Phe Ala Ser His Phe Tyr Asp Pro Asp Asn Gly Lys Thr Tyr Ile
65 70 75 80
Pro Phe Ala Lys Gln Ala Lys Glu Thr Gly Ala Lys Tyr Phe Lys Leu
85 90 95
Ala Gly Glu Ser Tyr Lys Asn Lys Asp Met Lys Gln Ala Phe Phe Tyr
100 105 110
Leu Gly Leu Ser Leu His Tyr Leu Gly Asp Val Asn Gln Pro Met His
115 120 125
Ala Ala Ser Phe Thr Asp Leu Ser Tyr Pro Gln Gly Phe His Ser Lys
130 135 140
Tyr Glu Asn Phe Val Asp Thr Ile Lys Asp Asn Tyr Lys Val Thr Asp
145 150 155 160
Gly Asn Gly Tyr Trp Asn Trp Lys Gly Thr Asn Pro Glu Glu Trp Ile
165 170 175
His Gly Ala Ala Val Val Ala Lys Gln Asp Tyr Ser Gly Ile Val Asn
180 185 190
Asp Asn Thr Lys Asp Trp Phe Val Lys Ala Ala Val Ser Gln Glu Tyr
195 200 205
Ala Asp Lys Trp Arg Ala Glu Val Thr Pro Met Thr Gly Lys Arg Leu
210 215 220
Met Asp Ala Gln Arg Val Thr Ala Gly Tyr Ile Gln Leu Trp Phe Asp
225 230 235 240
Thr Tyr Gly Asp Arg
245
<210> 3
<211> 738
<212> DNA
<213> Artificial Sequence
<220>
<223> Последовательность нуклеиновой кислоты, кодирующая PLC-9-49
<400> 3
tggtcagctg aggaccctca tattgaaact gtgaatagtc acttatggat cgtgaaccgt
60
gccattgata taatgtctag gaatacaact ctggttaagc aagatagagt tgctcaattg
120
aatgaatggc gtacagagct agagaatggc atctacgctg ctgatcatga aaacccctat
180
tacgatgaca gtaccttcgc ttctcacttt tacgatccag acaacggaaa gacatatatc
240
ccattcgcca agcaagctaa ggagactgga gctaagtact tcaagttggc tggagagtca
300
tacaagaatg gggacatgaa gcaggccttc ttttatcttg ggttgtcatt gcattatttg
360
ggcgatgtca accaacctat gcatgccgca tcctttacgg acctgtccta tccacagggt
420
tttcactcca agtacgagaa ctttgtcgat actattaaag acaactacaa agttaccgat
480
gggaacggat attggaattg gaaaggcacc aaccctgaag aatggattca cggtgcagca
540
gtagttgcaa aacaggacta ctctggaatt gtcaatgaca ataccaaaga ttggtttgtg
600
aaagccgcag tctatcagga atatgcagat aaatggagag ctgaagttac acctatgact
660
ggtaaacgac taatggatgc ccaaagagtt actgctggtt acattcaatt atggttcgac
720
acttacggtg acaggtaa
738
<210> 4
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<223> Аминокислотная последовательность PLC-9-49
<400> 4
Trp Ser Ala Glu Asp Pro His Ile Glu Thr Val Asn Ser His Leu Trp
1 5 10 15
Ile Val Asn Arg Ala Ile Asp Ile Met Ser Arg Asn Thr Thr Leu Val
20 25 30
Lys Gln Asp Arg Val Ala Gln Leu Asn Glu Trp Arg Thr Glu Leu Glu
35 40 45
Asn Gly Ile Tyr Ala Ala Asp His Glu Asn Pro Tyr Tyr Asp Asp Ser
50 55 60
Thr Phe Ala Ser His Phe Tyr Asp Pro Asp Asn Gly Lys Thr Tyr Ile
65 70 75 80
Pro Phe Ala Lys Gln Ala Lys Glu Thr Gly Ala Lys Tyr Phe Lys Leu
85 90 95
Ala Gly Glu Ser Tyr Lys Asn Gly Asp Met Lys Gln Ala Phe Phe Tyr
100 105 110
Leu Gly Leu Ser Leu His Tyr Leu Gly Asp Val Asn Gln Pro Met His
115 120 125
Ala Ala Ser Phe Thr Asp Leu Ser Tyr Pro Gln Gly Phe His Ser Lys
130 135 140
Tyr Glu Asn Phe Val Asp Thr Ile Lys Asp Asn Tyr Lys Val Thr Asp
145 150 155 160
Gly Asn Gly Tyr Trp Asn Trp Lys Gly Thr Asn Pro Glu Glu Trp Ile
165 170 175
His Gly Ala Ala Val Val Ala Lys Gln Asp Tyr Ser Gly Ile Val Asn
180 185 190
Asp Asn Thr Lys Asp Trp Phe Val Lys Ala Ala Val Tyr Gln Glu Tyr
195 200 205
Ala Asp Lys Trp Arg Ala Glu Val Thr Pro Met Thr Gly Lys Arg Leu
210 215 220
Met Asp Ala Gln Arg Val Thr Ala Gly Tyr Ile Gln Leu Trp Phe Asp
225 230 235 240
Thr Tyr Gly Asp Arg
245
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Мутант фосфолипазы С с высокой ферментативной активностью | 2019 |
|
RU2818353C2 |
| Новые гибридные ActRIIB белки-ловушки лигандов для лечения заболеваний, связанных с мышечной атрофией | 2016 |
|
RU2834707C1 |
| СПОСОБ УДАЛЕНИЯ СМОЛИСТЫХ ВЕЩЕСТВ ИЗ РАСТИТЕЛЬНОГО МАСЛА И ЕГО РАФИНИРОВАНИЯ | 2018 |
|
RU2772452C2 |
| НОВЫЙ ПОЛИПЕПТИД И СПОСОБ ПОЛУЧЕНИЯ L-ЛЕЙЦИНА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2021 |
|
RU2811433C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2731156C1 |
| АНТИТЕЛЬНЫЕ АГЕНТЫ, СПЕЦИФИЧНЫЕ К CD19 ЧЕЛОВЕКА, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2773317C2 |
| КОМПОЗИЦИИ ДЛЯ УВЕЛИЧЕНИЯ ПЕРИОДА ПОЛУЖИЗНИ ТЕРАПЕВТИЧЕСКОГО СРЕДСТВА У СОБАК И СПОСОБЫ ПРИМЕНЕНИЯ | 2020 |
|
RU2828219C2 |
| ВАРИАНТЫ СКВАЛЕНГОПЕНЦИКЛАЗЫ (SHC) | 2020 |
|
RU2829857C1 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К ММР9 | 2015 |
|
RU2714043C2 |
| Вариант глутамат-цистеинлигазы и способ получения глутатиона с его использованием | 2021 |
|
RU2821273C1 |
Изобретение относится к области биотехнологии, конкретно к рекомбинантным полипептидам с активностью фосфолипазы С, и может быть использовано для дегуммирования масел и жиров. Предложен мутантный полипептид фосфолипазы С, аминокислотная последовательность которого по меньшей мере на 95% идентична SEQ ID NO: 4 и характеризуется при этом наличием пролина, изолейцина, треонина, глицина и тирозина в положениях аминокислотных остатков, соответствующих положениям 6, 8, 10, 104 и 205 в SEQ ID NO: 4, соответственно. Изобретение обеспечивает получение мутантной фосфолипазы C с повышенной термостабильностью. 7 н. и 3 з.п. ф-лы, 3 ил., 1 табл., 4 пр.
1. Выделенный полипептид с активностью фосфолипазы C, характеризующейся повышенной термостабильностью, где указанный полипептид имеет идентичность аминокислотной последовательности, изложенной в SEQ ID NO: 4, по меньшей мере на 95%, и где указанный выделенный полипептид имеет пролин, изолейцин, треонин, глицин и тирозин в положениях аминокислотных остатков, соответствующих положениям 6, 8, 10, 104 и 205 в SEQ ID NO: 4, соответственно.
2. Выделенный полипептид по п. 1, где полипептид получен из Bacillus subtilis.
3. Выделенный полипептид по п. 1, где полипептид имеет аминокислотную последовательность, изложенную в SEQ ID NO: 4.
4. Молекула нуклеиновой кислоты, кодирующая полипептид по любому из пп. 1-3.
5. Молекула нуклеиновой кислоты по п. 4, где молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, изложенную в SEQ ID NO: 3, или последовательность молекулы нуклеиновой кислоты представляет собой последовательность, изложенную в SEQ ID NO: 3.
6. Вектор, содержащий молекулу нуклеиновой кислоты по п. 4 или 5, сконструированный для экспрессии в эукариотической клетке или прокариотической клетке.
7. Клетка для экспрессии мутантной фосфолипазы С с повышенной термостабильностью, содержащая молекулу нуклеиновой кислоты по п. 4 или 5 или вектор по п. 6, где клетка представляет собой эукариотическую клетку или прокариотическую клетку.
8. Применение полипептида по любому из пп. 1-3, или молекулы нуклеиновой кислоты по п. 4 или 5, или вектора по п. 6, или клетки по п. 7 для дегуммирования масел и жиров.
9. Ферментативная композиция, характеризующаяся термостабильной активностью фосфолипазы С, содержащая полипептид по любому из пп. 1-3 и по меньшей мере один фермент дегуммирования, выбранный из группы, состоящей из фосфолипазы A1, фосфолипазы A2, фосфолипазы B, фосфолипазы D, пектиназы и маннаназы.
10. Применение полипептида по любому из пп. 1-3, или молекулы нуклеиновой кислоты по п. 4 или 5, или вектора по п. 6, или клетки по п. 7 в изготовлении фермента дегуммирования.
| US 2013011887 A1, 10.01.2013, CN 106459934 A, 22.02.2017, WO 2015140275 A1, 24.09.2015, EA 200401407 A1, 24.02.2006, БД UniProt последовательность под номером A0A2B1YF47_BACCE, размещена 12.09.2018, CN 106884009 A, 23.06.2017, RU 2500811 C1, 10.12.2013, YAMPOLSKY L.Y | |||
| et al., The exchangeability of amino acids in proteins, Genetics, 2005, v.170, |
Авторы
Даты
2024-05-16—Публикация
2019-12-27—Подача