Изобретение относится к химико-фармацевтической промышленности и касается разработки нового инъекционного раствора противовирусного препарата Триазавирина - 2-метилтио-6-нитро-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7(4I′)-она.
Применяемые парентеральные инфузионные растворы относятся, главным образом, к растворам антибиотиков и средствам дезинтоксикации и обеспечения контроля над нарушениями водно-солевого обмена.
Известен инфузионный раствор метронидазола на основе 2-(2-метил-5-нитро-1Н-имидазол-1-ил)этанола, который относится к азот-содержащим гетероциклическим соединениям и поэтому по физико-химическим свойствам наиболее близким к 2-метилтио-6-нитро-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7(4I′)-она (триазавирину) и аналогам на основе 5-метил-6-нитро-1,2,4-триазоло[1,5-а]пиримидин-7-она, дигидрата [В.Л. Русинов, О.Н. Чупахин, Е.Н. Уломский и др. Патент РФ 2345080 от 27.01.2009), а также 4-((Z)-4′-Гидроксибутен-2′-ил)-2-R-6-фенил-1,2,4-триазоло[5,1-с][1,2,4]триазин-7-онов (О.Н. Чупахин, В.Л. Русинов, Е.Н. Уломский и др. Патент РФ 2376307 от 20.12.2009 г.; В.Л. Русинов, Е.Н. Уломский, О.Н. Чупахин, В.Н. Чарушин. Азоло [5.1-c]-1,2,4 триазины - новый класс противовирусных соединений. Известия АН. Серия химическая, 2008, №5, с. 967-995). Противовирусным действием в отношении вирусов гриппа типов А и В также обладают 2-R-6-нитро-4-аллилоксиметил-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7(4Н)-оны, R=Н, СН3, SCH3 (В.Л. Русинов, Е. Н. Уломский, С.Л. Деев. и др. Патент РФ 2340614 от 10.12.2008; В.Л. Русинов, О.Н. Чупахин, С.Л. Деев, Т.С. Шестакова, Е.Н. Уломский, Л.И. Русинова, О.И. Киселев, Э.Г. Деева. «Синтез и противовирусная активность аналогов нуклеозидов на основе 1,2,4-триазоло[3,2-c][1,2,4]триазин-7(4Н)-онов» // Известия АН, Серия химическая, 2010, №1, с. 135-142].
Известны и широко используются в лечебной практике водные инъекционные или инфузионные растворы для лечения больных в палатах интенсивной терапии при различных терминальных состояниях: растворы реамбирина, цитофлавина, антибиотиков из группы фторхинолонов и простые водно-солевые растворы [Громова Л.И., Бурякина А.В., Кузьмина Ю.А., Авенирова Е.Л. Инфузионный раствор для восполнения объема циркулирующей крови, восстановления водно-электролитного баланса и нормализации процессов кроветворения. 2009149813/15, 31.12.2009] для восполнения дефицита жидкости в кровотоке [http://mi.aup.ru/res/79/562949980667179.html)].
Метронидазол по химическому строению представляет собой 2-(2-метил-5-нитро1Н-имидазол-1-ил)этанол и является ингибитором роста анаэробных инфекций. Широкое применение данный препарат получил в медицинской практике для лечения обширного круга бактериальных и протозойных инфекций [Freeman C.D., Klutman N.E., Lamp K.C. Metronidazole. A therapeutic review and update. Drugs. 1997 Nov; 54(5):679-708, Löfmark S., Edlund C, Nord C.E.. Metronidazole is still the drug of choice for treatment of anaerobic infections. Clin Infect Dis. 2010, Vol. 50, Suppl 1:S16-23]. Механизм действия этого препарата заключается в биохимическом восстановлении 5-нитрогруппы метронидазола внутриклеточными транспортными системами окислительного фосфорилирования анаэробных микроорганизмов и простейших. Восстановленная 5-нитрогруппа метронидазола взаимодействует с фосфатными группами ДНК клетки микроорганизмов, ингибируя синтез их нуклеиновых кислот, что ведет к гибели микроорганизмов. Однако нитрогруппа до восстановления в аминогруппу в аэробных условиях способна проявлять самостоятельную реакционную активность, что характерно для нитропроизводных триазоло-триазинов. В отношении химической структуры и свойств реакционных групп (нитро-группа в 5 положении имидазольного цикла) он близок к нитросодержащим триазоло-триазинам, в частности к противовирусным препаратам на их основе [В.Л. Русинов, О.Н. Чупахин, С.Л. Деев, Т.С Шестакова, Е.Н. Уломский, Л.И. Русинова, О.И. Киселев, Э.Г. Деева. Синтез и противовирусная активность аналогов нуклеозидов на основе 1,2,4-триазоло[3,2-с][1,2,4]триазин-7(4Н)-онов. Известия АН, Серия химическая, 2010, №1, с. 135-142].
В качестве прототипа выбран инъекционный или инфузионный раствор энрофлоксацина [патент РФ 2147225].
Растворы ципрофлоксацина делаются на основе молочнокислых солей с избытком кислоты [Бонзе Г., Хамм М., Мюллер Х.-П.], и др., которые могут оказать неблагоприятное влияние на метаболизм и тканевое дыхание при тяжелых инфекционных заболеваниях, характеризующихся ацидозом и гипоксией, сопровождающейся генерированием свободных радикалов. Эти процессы играют ключевую роль в патогенезе острых вирусных инфекций, включая грипп, вызванный высокопатогенными вирусами гриппа типа А, и вирусные геморрагические лихорадки. Поэтому необходимо учитывать, что при создании инфузионных растворов, в первую очередь, принимаются во внимание физико-химические свойства основного лекарственного компонента.
Инъекционные и инфузионные растворы противовирусных препаратов в медицинской практике, фактически, отсутствуют [С.Г. Решетников, А.В. Бабаянц, Д.Н. Проценко, Б.Р. Гельфанд. «Инфузионная терапия в периоперационном периоде» (обзор литературы). 2008 г., №1б стр. 29-44]. Только в период пандемии гриппа 2009/2011 были специально для лечения больных на терминальных стадиях с осложненными формами гриппозной инфекции разработаны инъекционные формы препарата перамивир [http://www.clinicaltrials.gov/]. Препарат перамивир относится к селективным ингибиторам нейраминидазы [Киселев О.И. Химиопрепараты и химиотерапия гриппа. СПб, Изд. «Росток», 2012, С. 268]. Позднее применение этой группы препаратов для лечения осложненного гриппа представляется достаточно сомнительным в связи с невозможностью проявления их терапевтического потенциала. Поэтому разработка новых подходов в создании высокоэффективной инфузионной терапии крайне актуальна для снижения смертности от гриппа и других острых вирусных инфекций. Разработка комплексных инфузионных растворов, обеспечивающих не только специфическое (этиотропное) действие на репродукцию инфекционных агентов, но и оказывающих определенное влияние на патологические процессы, сопутствующие инфекции, является основой повышения эффективности терапии тяжелых состояний в интенсивной терапии инфекционных заболеваний. В период пандемии гриппа 2009/11 гг. проведение дезинтоксикационной терапии традиционными инфузионными растворами показало, что у большинства больных это усиливало угрозу развития отека легких и мозга. В результате МЗ РФ быстро издало рекомендации с отказом от такой тактики лечения [Киселев О.И., Покровский В.И. Грипп при беременности: сочетание функциональной и инфекционной иммуносупрессии. СПб, Изд. «Принт», 2012. С. 148].
При разработке инфузионного (инъекционного) раствора, содержащего противовирусные препараты, необходимо учитывать и необходимость введения дополнительных компонентов, оказывающих влияние на метаболизм лекарственного препарата и патологические сдвиги в тканевом дыхании, включая гипоксию и избыточное образование свободных радикалов кислорода. В этих условиях наблюдаются значительные изменения метаболизма лекарственных препаратов и их фармакодинамики, что необходимо учитывать при разработке композиционных инъекционных и инфузионных растворов. Дополнительные или вспомогательные компоненты инфузионных и инъекционных растворов в определенной степени влияют как на внутритканевое распределение и диффузию в тканях фармакологически активного компонента, так и на скорость его выведения с мочой (Бонзе Г., Хамм М., Мюллер Х.-П., и др. Инъекционный и инфузионный раствор энрофлоксацина [патент РФ №2147225]).
Изобретение направлено на разработку лекарственной композиции инъекционной или инфузионной формы препарата Триазавирин и позволяет обеспечить высокую метаболическую стабильность и доступность при максимальной эффективности в противовирусном действии на репликацию вируса.
Инъекционный и инфузионный раствор согласно изобретению содержит биологически активное вещество триазавирин [В.Л. Русинов, О.Н. Чупахин, Е.Н. Уломский и др. Патент РФ 2345080 от 27.01.2009; Karpenko I., Deev S., Kiselev О., Charushin V. et al. Antiviral Properties, Metabolism, and Pharmacokinetics of a Novel Azolo-1,2,4-Triazine-Derived Inhibitor of Influenza A and В Virus Replication Antimicrob. Agents Chemother. 2010, Vol. 54, p. 2017-2022] в концентрациях предпочтительно 0,05-4%, особенно предпочтительно 0,1-1,0%, считая на общий вес раствора.
В качестве аминокислот и их производных используются аргинин, гистидин, цистеин, N-ацетилцистеин и другие компоненты химического и биологического происхождения. Дополнительные компоненты и, в частности, аминокислоты могут присутствовать в 0,1-5-кратном молярном избытке относительно количества триазавирина в растворе. Предпочтительным является избыток 0,2-2 моль, особенно предпочтителен избыток кислоты 0,1-1 моль.
Водные растворы для инъекций могут в качестве жидкости-носителя, наряду с водой, содержать, например, глицерин, пропиленгликоль, полиэтиленгликоль и триэтиленгликоль. Для установления величины pH по возможности в диапазоне от 3 до 7,25 могут применяться различные вещества, такие как трис, соли аскорбиновой, янтарной, винной, молочной, фумаровой и глюконовых кислот. Величина pH водных композиций согласно изобретению составляет от 4,5-7,25, предпочтительно 4,5-7,0. Осмолярность водных композиций составляет 400-510 м осм/л.
Также могут применяться вспомогательные средства для композиций, такие как загустители (например, метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, натрийкарбоксиметилцеллюлоза, желатин и др.), средства, способствующие всасыванию, светостабилизаторы, ингибиторы кристаллизации, комплексообразующие средства (например, натриевая соль этилендиамин-тетрауксусной кислоты, фосфаты, нитраты, ацетаты, цитраты и др.), антиоксиданты (аскорбиновая кислота, сульфитные соединения, L-цистеин, тиодипропионовая кислота, тиомолочная кислота, монотиоглицерин, пропилгаллат и др.), а также доступные консерванты (хлорбутанол, бензиловый спирт, этанол, бутанол, 1,3-бутандиол, соли хлоргексидина, бензойная кислота и ее соли, сорбиновая кислота и др.).
В отдельных случаях существует необходимость в добавлении к растворам согласно изобретению местно-анестезирующие вещества, как, например, прокаингидрохлорид, лидокаингидрохлорид и другие. Возможна комбинация с кислотами, например янтарной кислотой, сахарами, включая глюкозу, маннозу, спирты, например маннит или сорбит. Для ускорения растворения раствор нагревают на водяной бане до 50-60°C. Сразу после получения соли в композицию при перемешивании до или после охлаждения растворяют остальные составные части или в нее вносят. После добавления остального количества растворителя композицию стерилизуют фильтрованием через бактериальный фильтр и/или нагреванием.
Показания к применению должны учитывать мочегонный эффект препарата и, следовательно, в случае заболевания, сопровождающегося обезвоживанием, применение должно сочетаться с инфузионными растворами, способствующими удержанию жидкости. При угрозе развития тканевых отеков и тем более отека легких и мозга, использовать мочегонные средства с учетом вклада инфузии растворов триазавирина.
Комбинированное применение инъекционных и инфузионных растворов триазавирина сопровождается пероральным и парентеральным применением антиоксидантов типа темпола, кверцетина, дигидрокверцетина, рибофлавина и других известных средств снижения токсичности активных форм кислорода.
Изобретение реализуется следующим образом.
Пример 1. Получение растворов триазавирина
В приготовлении инъекционных и инфузионных растворов триазавирина авторы руководствовались:
1. Определением порога растворимости для достижения оптимальной концентрации инъекционного и инфузионного раствора.
2. Определением условий повышения растворимости, биодоступности и метаболической стабильности.
3. Достижением условия сочетания с другими субстанциями, требующимися для повышения терапевтической противовирусной эффективности препарата Триазавирин.
Исследование растворимости триазавирина было проведено двумя способами.
По первому способу во взвешенный стакан объемом 250 мл поместили якорь магнитной мешалки, 100 г воды (по весу), 8 г препарата и перемешивали 8 ч при комнатной температуре. Предел измерения весов составил 0,2 г. После перемешивания смесь отфильтровали в приборе, состоящем из взвешенной круглодонной колбы объемом 250 мл, перехода с отводом и взвешенной воронки со шлифом. После фильтрования взвесили по отдельности фильтрат и влажный осадок. Осадок оставили сушиться, фильтрат упарили из колбы полностью на ротационном испарителе при остаточном давлении в приборе 10÷15 мм рт.ст., температуре в бане 40÷50°C и также оставили сушиться в течение ночи при комнатной температуре. Установлено, что масса раствора перед упариванием составила 104,2 г, масса сухого препарата - 4,2 г. Таким образом, растворимость триазавирина в воде составила 4%. Таким же образом проведено исследование растворимости триазавирина в физиологическом растворе.
Во втором способе определения растворимости триазавирина были проведены следующие операции.
В круглодонную колбу объемом 250 мл, снабженную обратным шариковым холодильником с водяным охлаждением, поместили 100 мл воды, 10 г триазавирина, нагрели смесь до кипения и кипятили 10 мин. После кипячения раствор охлаждают до комнатной температуры и выдерживают 2 ч. Смесь фильтруют, фильтрат помещают во взвешенную колбу объемом 500 мл, определяют массу раствора взвешиванием и упаривают полностью на ротационном испарителе при остаточном давлении в приборе 10÷15 мм рт.ст., температуре в бане 40÷50°C. Остаток оставляют сушиться в течение ночи при комнатной температуре. Установлено, что растворимость триазавирина в воде составила 4%.
Таким образом, вне зависимости от условий растворения растворимость триазавирина в воде составляет 4%, что достаточно для получения инъекционного или инфузионного раствора для внутримышечного или внутривенного введения.
Пример 2. Исследование токсичности растворов триазавирина при внутривенном введении.
В опытах на кроликах и грызунах исследована острая токсичность образцов субстанции триазавирина, синтезированных в институте органического синтеза УрО РАН.
По данным исследования острой и хронической токсичности триазавирина на грызунах, средняя смертельная доза триазавирина при внутрибрюшинном введении крысам составляет 1320 (950-1840) мг/кг. Абсолютная смертельная доза при внутрибрюшинном введении составила 2520 мг/кг. При введении триазавирина крысам внутрь, животные переносили препарат в дозах до 9000 мг/кг без каких-либо видимых признаков интоксикации. Среднюю смертельную дозу в этих опытах установить не представлялось возможным из-за введения животным больших объемов препарата. По данным исследований, проведенных в НИИ токсикологии, при пероральном введении крысам ЛД50=8320±480 мг/кг. Сведения о токсичности препарата представлены в таблицах 1-2.

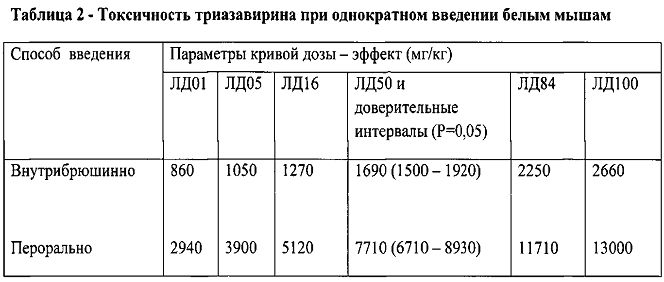
В процессе проведения этих экспериментов было осуществлено патоморфологическое исследование органов павших мышей и крыс, получавших триазавирин в больших дозах (внутрибрюшинно и перорально). Установлено, что характер токсического действия аналогичен в исследованиях на мышах и крысах. Гистологически установлено, что способ введения препарата не влияет на вид и характер поражений вследствие воздействия токсических доз препарата.
В острых экспериментах на кроликах проведено изучение токсичности и переносимости субстанции триазавирина при внутривенном пути введения. Раствор триазавирина для внутривенного введения готовили с использованием биполярного растворителя диметилсульфоксида (ДМСО) и 0,9%-ного раствора хлорида натрия, подогретого до температуры 38-39°C. Необходимость использования ДМСО обусловлена ограничением растворимости триазавирина. Так, при комнатной температуре растворимость триазавирина в воде составляет 4%, при 100 градусах - 39%.
Изучение острой токсичности триазавирина при внутривенном способе введении проведено на кроликах с массой тела от 3,5 кг до 4,7 кг, содержащихся в виварии НИИ гриппа. Триазавирин вводили в возрастающих дозировках от 700 мг/кг до 1500 мг/кг. Гибели животных при этом не наблюдалось. Ввиду ограниченной растворимости триазавирина пришлось прибегнуть к увеличению допустимого объема внутривенного введения кроликам. "Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ" ограничивает объем растворов, вводимых внутривенно кроликам при токсикологическом исследовании 20 мл. В экспериментах триазавирин вводили внутривенно как струйным, так и капельным способом в объеме 100 мл, что в 5 раз превышает рекомендуемый объем. При этом удавалось ввести дозу 1500 мг/кг. Несмотря на гиперволемические сдвиги, обусловленные введением избыточного количества жидкости, животные не погибали. Лишь при струйном введении раствора триазавирина кролики закрывали глаза, не оказывали сопротивления, однако рефлексы оставались сохранными. Последующее наблюдение за животными в течение 7 дней не позволило выявить изменений в их поведении, интенсивности и характере двигательной активности, координации движений, потреблении корма и воды.
При капельном введении кроликам раствора триазавирина в дозе 1000 мг/кг через 45 минут после постановки отмечено обильное мочеиспускание с окрашиванием пеленки в ярко-желтый цвет, характерный для раствора триазавирина. При этом в процессе вливания не наблюдалось даже минимальных признаков интоксикации, животные были активны. Увеличение дозы триазавирина до 1500 мг/кг не привело к гибели животных и также сопровождалось усилением диуреза. Дальнейшее увеличение дозы технически затруднено вследствие ограничений растворимости препарата и допустимых объемов введения. Инициацию диуреза следует отнести к полезным свойствам препарата, так как при токсическом гриппе применение диуретиков для профилактики отека легких является обязательным. Поэтому в композициях инфузионных растворов триазавирина отсутствует необходимость сочетания с препаратами - диуретиками.
Таким образом, среднесмертельную дозу при внутривенном введении у кроликов определить не удалось. Триазавирин может быть отнесен к практически нетоксичным соединениям.
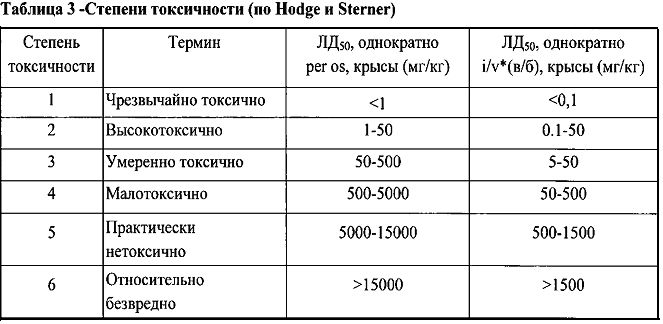
* Градации степеней токсичности при внутривенном пути введения определяются посредством умножения значений стандартных доз для оценки токсичности препарата при пероральном пути введения на коэффициент 0,1.
Инъекционная (инфузионная) лекарственная форма препарата Триазавирин должна соответствовать концентрации раствора триазавирина, который в определенном объеме введения обеспечит его эффективную концентрацию в крови, а именно 0,5-10 мкг/мл, предпочтительно 2-4 мкг/мл.
Диапазон эффективных доз для человека при парентеральном способе введения составляет 1,5-25 мг/кг. Оптимальной формой выпуска для инфузионных растворов триазавирина являются флаконы по 100 мл с содержанием субстанции триазавирина до 500 мг/флакон или 5 мг/мл. Для лечения клинически тяжелых форм гриппа с развитием гриппозной пневмонии и угрозой отека легких рекомендуется введение препарата до 3 раз в день по 1 флакону с дозой по 500 мг на одно внутривенное введение.
Для лечения гриппа в период пандемии 2009/11, вызванной свиным штаммом вируса H1N1, в США был зарегистрирован инъекционный и инфузионный препарат Перамивир (http://www.biocryst.corn/peramivir). Препарат используется в водном растворе в дозах от 6 до 10 мг/кг и выпускается в виде порошка во флаконах по 300 или 600 мг для растворения в растворе хлорида натрия 0,9 или 0, 45%. Практика применения показала, что оптимальная скорость введения составляет 40 мг/мин.
Вместе с тем, такое применение противовирусного препарата неизбежно приводит к необходимости использования других инфузионных растворов, обеспечивающих дезинтоксикацию. Для этих целей используются различные растворы и композиции. Однако избыточное использование известных инфузионных растворов при гриппе и гриппозной пневмонии в больших объемах совершенно недопустимо по причине угрозы развития отека легких. Так, реамбирин на основе янтарной кислоты в силу низкой концентрации основного компонента рекомендуется в дозах до 800 мл/день. Спорным является и заключение разработчиков об антиоксидантном действии препарата: стимуляция тканевого дыхания в условиях ацидоза может только стимулировать продукцию активных форм кислорода. Кислородная поддержка на фоне острой дыхательной недостаточности становится губительной.
Более адекватно в этом случае в относительно небольших объемах использовать мексидол, который может быть совместим с инфузиями триазавирина.
Однако наиболее оптимальным является сочетание триазавирина с известными антиоксидантами. Поэтому в нижеприведенных примерах предлагаются композиции инфузионных растворов триазавирина, основанные на этих выводах и известных рекомендациях по терапии неотложных состояний в инфекционных клиниках [http://www.drrobertamorgan.com/intravenous-therapies-and-infections.htm].
Пример 3. Состав инъекционных или инфузионных растворов препарата Триазавирин для терапии острых вирусных инфекций.
№1
Триазавирин - 500 мг
Натрия хлорид - 900 мг
Вода д./инъек. до 100 мл
pH 5,5-7,0
осмолярность 400-410 м осм/л
№2
Триазавирин - 500 мг
Аргинин - 1000 мг - 2500 мг
Натрия хлорид - 900 мг
Вода д./инъек. до 100 мл
pH 5,5-7,0
осмолярность 400-410 м осм/л
№3
Триазавирин - 500 мг
Аргинина гидрохлорид - 1000 мг
Натрия хлорид - 900 мг
Вода д./инъек. до 100 мл
pH - 5,5-6,5
осмолярность 350 м осм/л
№4
Триазавирин - 500 мг
Цистеин - 1000 мг
Натрия хлорид - 900 мг
Вода д./инъек. до 100 мл
pH - 5,5-7,0
осмолярность 400-410 м осм/л
№5
Триазавирин - 100 мг - 200 мг
Натрия хлорид - 90 мг
Вода для инъекций до 10 мл.
pH - от 4,5 до 6,5
№6
Триазавирин - 100 мг - 200 мг
Аргинин - 100-200 мг
Натрия хлорид - 90 мг
Вода для инъекций до 10 мл
pH 5,5-6,5
№7 - г/100 мл
Триазавирин - 0,5
Глюконолактон - 4,000
Глутаминовая кислота - 2,670
Бензиловый спирт - 1,400
Сульфит натрия - 0,100
Вода для инъекций - 87,300-100 мл = 105,500
pH 5,2-6,5
Осмолярность 450-500 м осм/л
№8 - г/100 мл
Триазавирин - 0,5
Бетаин гидрохлорид - 4,000
Глутатион (восстан.) - 2,000
Сульфит натрия - 0,100
Вода для инъекций - 87,300-100 мл = 105,500
pH 5,5-6,5
Осмолярность 410-470 м осм/л
№9 - г/100 мл
Триазавирин - 0,5
Цистеин - 2,0
Глутатион - 2,0
Карнозин - 1,0-2,0
Воды для инъекций до 100 мл
pH 5,0-6,0
Осмолярность 450-500 м осм/л
Из приведенных данных следует, что содержание триазавирина в композиции составляет 0,05-4,0%, считая на общий вес раствора, в форме солей с основаниями или аминокислотами и пептидами или их смесей, а вспомогательных веществ - 0,1-30,0 вес.%.
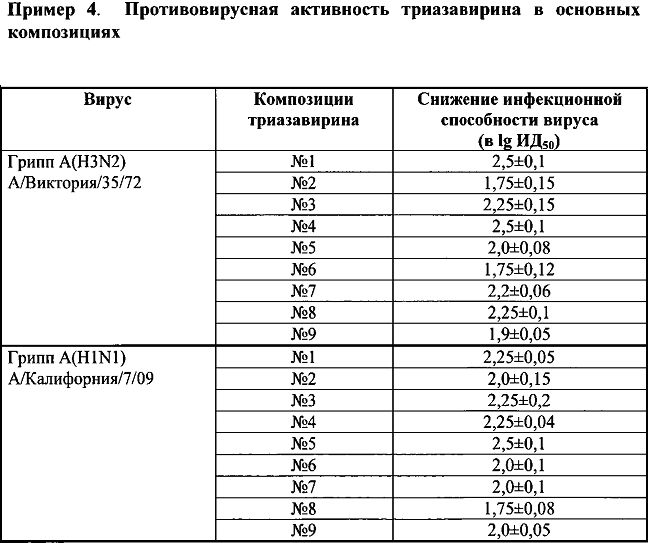
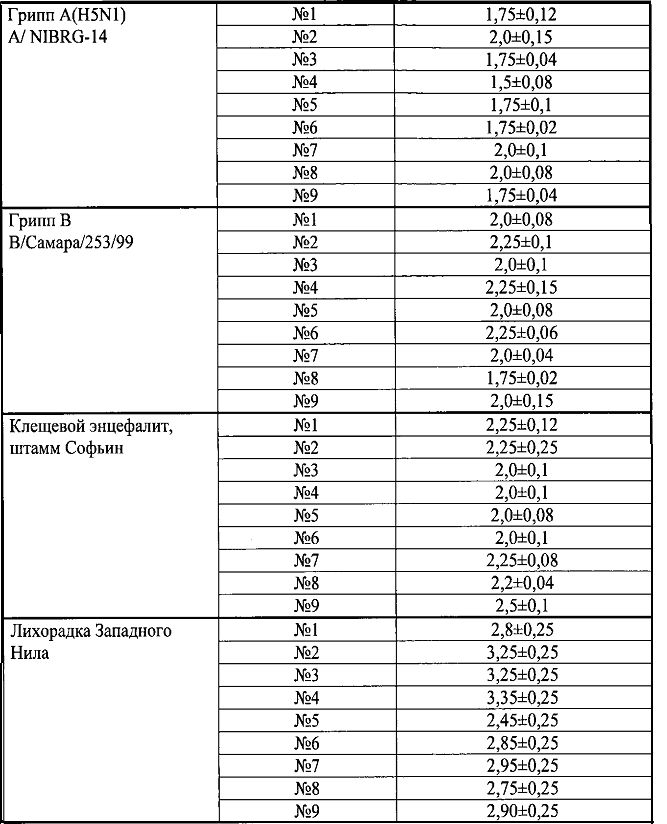
Исследование противовирусной активности инъекционных или инфузионных растворов, полученных в примерах №1-9, проводили на клеточных культурах MDCK и Vero, инфицированных вирусами гриппа H1N1, H3N2, H5N1, клещевого энцефалита, и лихорадки Западного Нила. Результаты скрининга приведены в таблице в системе in vitro.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНЪЕКЦИОННЫЙ ИЛИ ИНФУЗИОННЫЙ РАСТВОР L-АРГИНИНИЕВОЙ СОЛИ 5-МЕТИЛ-6-НИТРО-1,2,4-ТРИАЗОЛО[1,5-а]ПИРИМИДИН-7-ОНА МОНОГИДРАТА ДЛЯ ТЕРАПИИ ГРИППА И ДРУГИХ ВИРУСНЫХ ИНФЕКЦИЙ | 2014 |
|
RU2586283C1 |
| КОНЪЮГАТЫ 2-МЕТИЛТИО-6-НИТРО-1,2,4-ТРИАЗОЛО[5,1-c]-1,2,4-ТРИАЗИН-7(4I')-ОНА С ГЛУТАТИОНОМ И ДРУГИМИ ПЕПТИДАМИ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2516936C2 |
| 5-МЕТИЛ-6-НИТРО-7-ОКСО-4,7-ДИГИДРО-1,2,4-ТРИАЗОЛО[1,5-АЛЬФА]ПИРИМИДИНИД L-АРГИНИНИЯ МОНОГИДРАТ | 2013 |
|
RU2529487C1 |
| НАТРИЕВАЯ СОЛЬ 2-МЕТИЛТИО-6-ЦИАНО-1,2,4-ТРИАЗОЛО[5,1-с]-1,2,4-ТРИАЗИН-7(4Н)-ОНА, ТРИГИДРАТ | 2015 |
|
RU2607628C1 |
| НАТРИЕВАЯ СОЛЬ 2-МЕТИЛ-6-ФТОР-1,2,4-ТРИАЗОЛО[5,1-с]-1,2,4-ТРИАЗИН-7(4Н)-ОНА ДИГИДРАТ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНЫМ ДЕЙСТВИЕМ | 2009 |
|
RU2493158C2 |
| НАТРИЕВАЯ СОЛЬ 2-МЕТИЛТИО-6-НИТРО-1,2-4-ТРИАЗОЛО[5,1-C]-1,2,4-ТРИАЗИН-7(4H)-ОНА, ДИГИДРАТ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2294936C1 |
| 6-(2'-АМИНО-2'-КАРБОКСИЭТИЛТИО)-2-МЕТИЛТИО-4-ПИВАЛОИЛОКСИМЕТИЛ-1,2,4-ТРИАЗОЛО[5,1-c]1,2,4-ТРИАЗИН-7(4Н)-ОН | 2011 |
|
RU2455304C1 |
| 3-Нитро-4-гидрокси-7-пропаргилтио-[1,2,4]триазоло[5,1c][1,2,4]триазин и 3-нитро-4-гидрокси-7-этилтио-[1,2,4]триазоло[5,1c][1,2,4]триазин, обладающие противовирусной активностью | 2019 |
|
RU2775551C2 |
| АЗОЛОАЗИНИЕВЫЕ СОЛИ ФТОРХИНОЛОНОВ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНЫМ И ПРОТИВОВИРУСНЫМ ДЕЙСТВИЕМ | 2014 |
|
RU2547835C1 |
| НАТРИЕВАЯ СОЛЬ 2-ЭТИЛТИО-6-НИТРО-1,2,4-ТРИАЗОЛО[5,1-c]-1,2,4-ТРИАЗИН-7-ОНА ДИГИДРАТ | 2008 |
|
RU2404182C2 |
Изобретение относится к химико-фармацевтической промышленности и представляет собой инъекционный раствор для лечения вирусных заболеваний, выбранных из гриппа H1N1, H3N2, H5N1, клещевого энцефалита и лихорадки Западного Нила, содержащий триазавирин в количестве 0,05-4,0 вес.%, вспомогательные вещества в количестве 0,1-30,0 вес.% и воду до 100 вес.%. Изобретение обеспечивает высокую метаболическую стабильность и доступность при максимальной эффективности в противовирусном действии на репликацию вируса. 3 з.п. ф-лы, 4 табл., 4 пр.
1. Инъекционный раствор для лечения вирусных заболеваний, выбранных из гриппа H1N1, H3N2, H5N1, клещевого энцефалита и лихорадки Западного Нила, содержащий триазавирин в количестве 0,05-4,0 вес.%, вспомогательные вещества в количестве 0,1-30,0 вес.% и воду до 100 вес.%.
2. Инъекционный раствор по п. 1, отличающийся тем, что дополнительно содержит аминокислоту, выбранную из группы: аргинин, аргинин гидрохлорид, глутаминовая кислота, гистидин, цистеин и его производное N-ацетилцистеин, которые могут присутствовать в 0,1-5-кратном молярном избытке относительно количества триазавирина в растворе.
3. Инъекционный раствор по п. 1, отличающийся тем, что дополнительно содержит пептид карнозин в количестве 1,0-2,0 вес.%.
4. Инъекционный раствор по п. 1, отличающийся тем, что может представлять раствор для инфузий.
| ИНЪЕКЦИОННЫЙ ИЛИ ИНФУЗИОННЫЙ РАСТВОР ЭНРОФЛОКСАЦИНА | 1995 |
|
RU2147225C1 |
| RU 2012112128 A, 10.10.2013 | |||
| НАТРИЕВАЯ СОЛЬ 2-МЕТИЛТИО-6-НИТРО-1,2-4-ТРИАЗОЛО[5,1-C]-1,2,4-ТРИАЗИН-7(4H)-ОНА, ДИГИДРАТ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2294936C1 |
| Karpenko I | |||
| et | |||
| all "Antiviral properties, metabolism, and pharmacokinetics of a novel azolo-1,2,4-triazine-derived inhibitor of influenza A and B virus replication",Antimicrob Agents Chemother | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| WO 2011011519 A1,27.01.2011. | |||
Авторы
Даты
2016-01-27—Публикация
2013-10-16—Подача