Изобретение относится к области медицины и может быть использовано для лечения вегето-сосудистой дистонии.
Из уровня техники известно нейротропное лекарственное средство на основе антисыворотки к мозгоспецифическому белку S-100 (RU 2156621 C1, A61K 39/395, 27.09.2000), которое может быть недостаточно эффективно в ряде случаев при лечении вегето-сосудистой дистонии.
Изобретение направлено на повышение эффективности лечения вегето-сосудистой дистонии и расширение арсенала лекарственных средств, предназначенных для лечения вегето-сосудистой дистонии.
Решение поставленной задачи обеспечивается тем, что лекарственное средство, содержащее активированную-потенцированную форму антител к мозгоспецифическому белку S-100, согласно изобретению, выполнено в виде фармацевтической композиции и дополнительно содержит в качестве усиливающего компонента активированную-потенцированную форму антител к эндотелиальной NO-синтазе.
При этом активированную-потенцированную форму антител к эндотелиальной NO-синтазе и активированную-потенцированную форму антител к мозгоспецифическому белку S-100 используют в виде активированного-потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Фармацевтическая композиция может быть выполнена в твердой лекарственной форме и содержать эффективное количество частиц нейтрального носителя, насыщенного смесью водных или водно-спиртовых растворов активированной-потенцированной формы антител к эндотелиальной NO-синтазе и активированной-потенцированной формы антител к мозгоспецифическому белку S-100, и фармацевтически приемлемые добавки, которые включают лактозу, целлюлозу микрокристаллическую и магния стеарат. При этом водные или водно-спиртовые растворы активированных-потенцированных форм антител к эндотелиальной NO-синтазе и к мозгоспецифическому белку S-100 получены путем многократного последовательного разведения и внешнего воздействия - вертикального встряхивания каждого разведения из матричных растворов, соответственно, аффинно очищенных антител к эндотелиальной NO-синтазе и к мозгоспецифическому белку S-100 с концентрацией 0,5÷5,0 мг/мл.
Причем каждый из компонентов сверхмалых доз аффинно очищенных антител используют в виде смеси различных, преимущественно сотенных, разведений, приготовленных по гомеопатической технологии.
Решение поставленной задачи обеспечивается также тем, что в способе лечения путем введения в организм активированной-потенцированной формы антител к мозгоспецифическому белку S-100, согласно изобретению, дополнительно (одновременно и сочетано) вводят активированную-потенцированную форму сверхмалых доз аффинно очищенных антител к эндотелиальной NO-синтазе.
При этом активированную-потенцированную форму антител к эндотелиальной NO-синтазе и активированную-потенцированную форму антител к мозгоспецифическому белку S-100 используют в виде активированного-потенцированного водного или водно-спиртового раствора каждого компонента, активность которого обусловлена процессом последовательного многократного разведения в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Кроме того, используют приготовленные в виде единого лекарственного препарата - одной лекарственной формы - смесь различных разведений по гомеопатической технологии антител к эндотелиальной NO-синтазе в сочетании со смесью различных разведений к мозгоспецифическому белку S-100, приготовленных по гомеопатической технологии антител.
Кроме того, лекарственный препарат содержит действующие компоненты в объемном соотношении 1:1, при этом каждый компонент используют в виде смеси трех матричных растворов, разведенных, соответственно, в 10012, 10030, и 100200 раз, что эквивалентно сотенным разведениям С12, С30, С200, приготовленным по гомеопатической технологии.
Заявленную фармацевтическую композицию рекомендуется принимать, предпочтительно, по 1-2 таблетке 2-4 раза в день.
При лечении патологических состояний различного генеза возможно раздельное, но сочетанное и одновременное применение (введение в организм) заявленной фармацевтической композиции в виде двух отдельно приготовленных препаратов как в виде растворов, так и в твердых лекарственных формах (таблеток), каждый из которых содержит активированную-потенцированную форму сверхмалых доз аффинно очищенных антител к мозгоспецифическому белку S-100 и, соответственно, активированную-потенцированную форму сверхмалых доз аффинно очищенных антител к эндотелиальной NO-синтазе.
Предложенное сочетание активированных-потенцированных форм антител к мозгоспецифическому белку S-100 и к эндотелиальной NO-синтазе в фармацевтической композиции, т.е. форм антител к мозгоспецифическому белку S-100 и к эндотелиальной NO-синтазе, приготовленных по гомеопатической технологии потенцирования путем многократного последовательного разведения и внешнего воздействия - неоднократного встряхивания каждого разведения (см., например, В. Швабе "Гомеопатические лекарственные средства", М., 1967 г., с.14-29), которые обладают активностью, обусловленной технологией потенцирования, в фармакологических моделях и/или клинических методах лечения обеспечивает получение неожиданного синергетического терапевтического эффекта, подтвержденного на адекватных (валидных) экспериментальных моделях и клинических исследованиях, который заключается в повышении эффективности лечения. Указанный технический результат обусловлен усилением нейропротекторной активности антител к белку S-100, усилением вегето-стабилизирующего эффекта, нормализацией вегетативного статуса, синергическим влиянием обоих компонентов на нейрональную пластичность, и, вследствие этого, повышением устойчивости мозга к токсическим воздействиям, что улучшает интегративную деятельность и восстанавливает межполушарные связи головного мозга, способствует устранению когнитивных нарушений, стимулирует репаративные процессы и ускоряет восстановление функций ЦНС, повышает умственную работоспособность, восстанавливает процессы обучения и памяти, нормализует соматовегетативные проявления, увеличивает мозговой кровоток, и, соответственно, обеспечивает расширение терапевтического диапазона лекарственного средства и повышение эффективности лечения вегето-сосудистой дистонии (ВСД). При этом заявленное лекарственное средство, как и составляющие ее компоненты, не обладают седативным и миорелаксантным действием, не вызывают пристрастия и привыкания. В том числе, заявленное лекарственное средство может быть использовано в составе комплексной терапии при лечении ВСД.
Кроме того, заявленное лекарственное средство расширяет арсенал препаратов, предназначенных для лечения ВСД.
Лекарственное средство приготовляют, преимущественно, следующим образом.
Для приготовления активированной-потенцированной формы действующих компонентов используют моноклональные или, преимущественно, поликлональные антитела, которые могут быть получены по известным технологиям - методикам, описанным, например, в книге: Иммунологические методы, под ред. Г. Фримеля, М., «Медицина», 1987, с.9-33; или, например, в статье Laffly E., Sodoyer R. Hum. Antibodies. Monoclonal and recombinant antibodies, 30 years after. - 2005 - Vol.14. - N 1-2. P.33-55.
Моноклональные антитела получают, например, с помощью гибридомной технологии. Причем начальная стадия процесса включает иммунизацию, основанную на принципах, уже разработанных при приготовлении поликлональных антисывороток. Дальнейшие этапы работы предусматривают получение гибридных клеток, продуцирующих клоны одинаковых по специфичности антител. Их выделение в индивидуальном виде проводится теми же методами, что и в случае поликлональных антисывороток.
Поликлональные антитела могут быть получены активной иммунизацией животных. Для этого по специально разработанной схеме животным делают серию инъекций требуемыми в соответствии с изобретением веществами - антигенами: мозгоспецифическим белком S-100 и эндотелиальной NO-синтазой. В результате проведения такой процедуры получают моноспецифические антисыворотки с высоким содержанием антител, которые используют для получения активированных потенцированных форм компонентов. При необходимости проводят очистку антител, присутствующих в антисыворотке, например, методом аффинной хроматографии, путем применения фракционирования солевым осаждением или ионообменной хроматографии.
Предпочтительным для приготовления заявленной фармацевтической композиции является использование поликлональных антител к мозгоспецифическому белку S-100 и к эндотелиальной NO-синтазе, которые в качестве матричного (первичного) раствора с концентрацией 0,5÷5,0 мг/мл, используют для последующего приготовления активированной-потенцированной формы.
Предпочтительным для приготовления каждого компонента является использование смеси трех водно-спиртовых разведений первичного матричного раствора антител, разведенных, соответственно, в 10012, 10030 и 100200 раз, что соответствует сотенным разведениям С12, С30 и С200, приготовленным по гомеопатической технологии. При выполнении заявленного лекарственного средства в твердой лекарственной форме на нейтральный носитель - лактозу - может наноситься смесь указанных компонентов в объемном соотношении 1:1.
Предпочтительным для приготовления заявленного лекарственного препарата является использование поликлональных антител к эндотелиальной NO-синтазе и к мозгоспецифическому белку S-100, которые могут быть получены иммунизацией кроликов следующим образом.
Для проведения экспериментальных исследований были использованы антитела, приготовленные по заказу специализированной биотехнологической фирмой.
Поликлональные антитела к эндотелиальной NO-синтазе получают, используя в качестве иммуногена (антигена) для иммунизации кроликов адъювант и цельную молекулу эндотелиальной NO-синтазы следующей последовательности:


Возможно для получения поликлональных антител к эндотелиальной NO-синтазе использование в качестве иммуногена (антигена) цельной молекулы эндотелиальной NO-синтазы следующей последовательности:



Возможно для получения поликлональных антител к эндотелиальной NO-синтезе использование в качестве иммуногена (антигена) синтетического пептида эндотелиальной NO-синтазы, выбранного, например, из следующих аминокислотных последовательностей:

Перед отбором крови за 7-9 дней проводят 1-3 внутривенных инъекций для повышения уровня антител. В процессе иммунизации у кроликов отбирают небольшие пробы крови для оценки количества антител. Максимальный уровень иммунного ответа на введение большинства растворимых антигенов достигается через 40-60 дней после первой инъекции. После окончания первого цикла иммунизации кроликов в течение 30 дней дают восстановить здоровье и проводят реиммунизацию, включающую 1-3 внутривенные инъекции. Для получения антисыворотки из иммунизированных кроликов собирают кровь в центрифужную пробирку объемом 50 мл. С помощью деревянного шпателя удаляют со стенок пробирки образовавшиеся сгустки и помещают палочку в сгусток, образовавшийся в центре пробирки. Кровь помещают в холодильник (температура 4°C) на ночь. На следующий день удаляют сгусток, прикрепившийся к шпателю, и центрифугируют оставшуюся жидкость при 13000 g в течение 10 мин. Супернатант (надосадочная жидкость) является антисывороткой. Полученная антисыворотка должна быть желтого цвета. Добавляют к антисыворотке 20% (весовая концентрация) NaN3 до конечной концентрации 0,02% и хранят до использования в замороженном состоянии при температуре -20°C. Для выделения из антисыворотки антител к эндотелиальной NO-синтазе производят абсорбцию на твердой фазе в следующей последовательности:
1. 10 мл антисыворотки кролика разбавляют в 2 раза 0,15 М NaCl, добавляют 6,26 г Na2SO4, перемешивают и инкубируют 12-16 ч при 4°C;
2. выпавший осадок удаляют центрифугированием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре;
3. после удаления осадка центрифугированием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером;
4. фракцию антител определяют, измеряя оптическую плотность элюата при 280 нм.
Затем производят очистку антител методом аффинной хроматографии путем прикрепления полученных антител к эндотелиальной NO-синтазе, который находится на нерастворимом матриксе с последующим элюированием концентрированными растворами соли.
Полученный, таким образом, буферный раствор поликлональных кроличьих антител к эндотелиальной NO-синтазе, очищенных на антигене, с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл, используют в качестве матричного (первичного) раствора для последующего приготовления активированной-потенцированной формы по гомеопатической технологии.
Для получения поликлональных антител к мозгоспецифическому белку S-100 используют мозгоспецифический белок S-100, физико-химические свойства которого описаны в статье М.В. Старостина, С.М. Свиридов, Нейроспецифический белок S-100, Успехи современной биологии, 1977 г., т.5, с.170-178; книге М.Б. Штарк, Мозгоспецифические белки /антигены/ и функции нейрона, М., "Медицина", 1985 г.; с.12-14, выделенный из ткани головного мозга быка по следующей методике:
- замороженную в жидком азоте ткань растирают в порошок на специальной мельнице;
- экстракцию белков проводят в соотношении 1:3 (вес/объем) в экстрагирующем буфере при гомогенизации;
- гомогенат прогревают в течение 10 мин при 60°C и охлаждают до 4°C на ледяной бане;
- термолабильные белки удаляют центрифугированием;
- проводят ступенчатое фракционирование сульфатом аммония с последующим удалением выпадающих в осадок примесных белков;
- содержащую белок S-100 фракцию осаждают 100% насыщенным сульфатом аммония при снижении pH до 4,0 и собирают центрифугированием;
- осадок растворяют в минимальном объеме буфера, содержащего ЭДТА и меркаптоэтанол, диализируют против деионизованной воды и лиофильно высушивают;
- фракционирование кислых белков продолжают хроматографией на ионообменных носителях - ДЭАЭ целлюлозе ДЕ-52 и затем ДЭАЭ-сефадексе А-50;
- собранные и отдиализованные фракции, содержащие белок S-100, разделяют по молекулярному весу гель-фильтрацией на сефадексе G-100;
- очищенный белок S-100 диализируют и лиофильно высушивают.
Молекулярный вес очищенного мозгоспецифического белка S-100 составляет - 21000 д.
Благодаря высокому содержанию аспарагиновой и глутаминовой кислот мозгоспецифический белок S-100 является сильнокислым и занимает крайнее анодное положение при электрофорезе в прерывистой буферной системе в полиакриламидном геле, что облегчает его идентификацию.
Для получения мозгоспецифической антисыворотки к выделенному мозгоспецифическому белку S-100 готовят смесь очищенного белка S-100 (антигена) в комплексе с метилированным бычьим сывороточным альбумином в качестве носителя с полным адъювантом Фрейнда, которую вводят подкожно лабораторному животному - кролику, в область спины в количестве 1-2 мл. На 8-й, 15-й день проводят повторную иммунизацию. Забор крови производят (например, из вены уха) на 26-й и 28-й день.
Полученная антисыворотка имеет титр 1:500-1:1000, образует единственную полосу преципитации с экстрактом из нервной ткани, но не реагирует с экстрактами гетерологичных органов и формирует единственный пик преципитации как с чистым белком S-100, так и с экстрактом нервной ткани, что свидетельствует о моноспецифичности полученной антисыворотки.
Активированную-потенцированную форму каждого компонента готовят путем равномерного уменьшения концентрации в результате последовательного разведения 1 части упомянутого матричного раствора в 9 частях (для десятичного разведения D) или в 99 частях (для сотенного разведения С) или в 999 частях (для тысячного разведения М) нейтрального растворителя в сочетании с многократным (не менее 10 раз) вертикальным встряхиванием ("динамизацией") каждого полученного разведения и использованием отдельных емкостей для каждого последующего разведения до получения требуемой потенции - кратности разведения по гомеопатической технологии (см., например, В. Швабе "Гомеопатические лекарственные средства", М., 1967 г., с.14-29).
Например, для приготовления 12-го сотенного разведения С12 одну часть упомянутого матричного раствора антител к NO-синтазе (или к мозгоспецифическому белку S-100) с концентрацией 2,5 мг/мл разводят в 99 частях нейтрального водного или водно-спиртового растворителя (преимущественно 15% этилового спирта) и многократно (10 и более раз) вертикально встряхивают - потенцируют полученное 1-е сотенное С1 разведение. Из 1-го сотенного С1 разведения приготовляют 2-е сотенное разведение С2. Данную операцию повторяют 11 раз, получая 12-е сотенное разведение С12. Таким образом, 12-е сотенное разведение С12 представляет собой раствор, полученный разбавлением последовательно в разных емкостях 12 раз 1-й части исходного матричного раствора антител к NO-синтазе с концентрацией 2,5 мг/мл в 99-ти частях нейтрального растворителя, т.е. раствор, приготовленный разведением матричного раствора в 10012 раз. Аналогичные операции с соответствующей кратностью разведения проводят для получения разведений С30 и С200.
При использовании в качестве компонента (например, активированной - потенцированной формы антител к мозгоспецифическому белку S-100) смеси различных, преимущественно сотенных, разведений, каждое разведение компонента (например, С12, С30, С200) приготовляют раздельно по описанной выше технологии до их предпоследнего разведения (соответственно, до получения С11, С29, С199) и затем вносят в одну емкость по одной части каждого полученного предпоследнего разведения и смешивают с требуемым количеством растворителя (соответственно, с 97 частями для сотенного разведения). При этом получают активированную-потенцированную форму антител к мозгоспецифическому белку S-100 в сверхмалой дозе, приготовленную сверхразведением матричного раствора, соответственно, в 100, 100 и 100 раз, эквивалентной смеси сотенных разведений C12, C30 и C200, по гомеопатической технологии.
Возможно использование каждого компонента в виде смеси других различных разведений по гомеопатической технологии, например десятичных и или сотенных, (С12, С30, С100; D20, С30, С100 или D20, С30, М100 и т.д.), эффективность которых определяют экспериментально.
При потенцировании вместо встряхивания в процессе уменьшения концентрации также можно осуществлять внешнее воздействие ультразвуком, электромагнитным или иным физическим воздействием.
Для получения заявленной фармацевтической композиции водные или водно-спиртовые растворы действующих компонентов смешивают, преимущественно, в объемном соотношении 1:1 и используют в жидкой лекарственной форме.
Заявленная фармацевтическая композиция может быть использована и в твердой лекарственной форме, которая содержит эффективное количество частиц нейтрального носителя - лактозы, насыщенного путем пропитывания до насыщения смесью водных или водно-спиртовых растворов активированной-потенцированной формой антител к эндотелиальной NO-синтазе и активированной-потенцированной формой антител мозгоспецифическому белку S-100, и фармацевтически приемлемые добавки, включающие, преимущественно, лактозу, целлюлозу микрокристаллическую и магния стеарат.
Для получения твердой оральной формы заявленного лекарственного средства производят в установке кипящего слоя (например, типа «Hüttlin Pilotlab» производства компании Hüttlin GmbH) орошение до насыщения вводимых в псевдоожиженный - кипящий слой частиц нейтрального вещества - лактозы (молочного сахара) с размером частиц 150÷300 мкм, предварительно полученным водным или водно-спиртовым раствором активированных-потенцированных форм антител к эндотелиальной синтазе оксида азота (NO-синтазе) и к мозгоспецифическому белку S-100, преимущественно, в соотношении 1 кг раствора антител на 5 или 10 кг лактозы (1:5-1:10) с одновременной сушкой в потоке подаваемого под решетку нагретого воздуха при температуре не выше 40°C. Расчетное количество 0,17÷0,34 от массы твердой оральной формы высушенных частиц, насыщенных активированной-потенцированной формой антител, загружают в смеситель и смешивают с микрокристаллической целлюлозой, вводимой в количестве 3÷8 масс. частей от общей массы загрузки - от массы твердой оральной формы. Затем в эту смесь добавляют 25÷45 масс. частей от общей массы загрузки «ненасыщенной» чистой лактозы (для снижения стоимости и некоторого упрощения и ускорения технологического процесса без снижения эффективности лечебного воздействия) и стеарат магния в количестве 0,1÷0,3 масс. частей от общей массы загрузки. Полученную таблеточную массу равномерно перемешивают и таблетируют прямым сухим прессованием (например, в таблет - прессе Korsch - XL 400) с формированием круглых таблеток массой 150÷500 мг, преимущественно массой 300 мг. После таблетирования получают таблетки, пропитанные водно-спиртовым раствором активированной-потенцированной формы антител к NO-синтазе и к мозгоспецифическому белку S-100 в сверхмалой дозе, каждого компонента, приготовленной из матричного раствора, разведенного, соответственно, в 10012, в 10030 в 100200, что эквивалентно смеси сотенных разведений С12, С30 и С200, приготовленных по гомеопатической технологии.
Предпочтительно заявленную фармацевтическую композицию рекомендуется принимать по 1-2 таблетке 2-4 раза в день.
Пример 1
Исследование влияния комплексного препарата, в состав которого входят активированные-потенцированные формы поликлональных аффинно очищенных кроличьих антител к мозгоспецифическому белку S-100 (анти-S100) и к эндотелиальной NO-синтазе (анти-eNOS) в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 10030, 100200 раз, эквивалентных смеси сотенных гомеопатических разведений С12, С30, С200, в соотношении 1:1 (СМД анти-S100 + анти-eNOS), а также компонентов, входящих в его состав - активированной-потенцированной формы поликлональных кроличьих антител к мозгоспецифическому белку S-100, очищенных на антигене, в сверхмалой дозе (СМД анти-S100), полученной сверхразведением исходного матричного раствора в 10012, 10030, 100200 раз, эквивалентной смеси сотенных гомеопатических разведений С12, С30, С200 и активированной-потенцированной формы поликлональных кроличьих антител к эндотелиальной NO-синтазе, очищенных на антигене, в сверхмалой дозе (СМД анти-eNOS), полученной сверхразведением исходного матричного раствора в 10012,10030, 100200 раз, эквивалентной смеси сотенных гомеопатических разведений С12, С30, С200, проводили in vitro на связывание стандартного лиганда [3Н]пентазоцина с рекомбинантным сигма-1 рецептором человека оценивали радиолигандным методом.
Сигма-1 рецептор - внутриклеточный рецептор, локализованный в клетках центральной нервной системе, клетках большинства периферических тканей и иммунокомпетентных клетках. Рецепторы демонстрируют уникальную способность транслоцироваться, которая вызывается множеством психотропных препаратов. Динамика сигма-1 рецепторов непосредственно связана с различными влияниями, осуществляемыми препаратами при действии на сигма-1 рецепторы. Эти влияния включают регуляцию каналов активности, экоцитоз, передачу сигналов, ремоделирование плазменной мембраны (формирование рафтов) и транспортировку липидов/метаболизм. Все это может способствовать развитию пластичности нейронов в мозге. Имеются доказательные данные, что сигма-1 рецепторы оказывают модулирующее влияние на все основные нейромедиаторные системы: норадренергическую, серотонинергическую, дофаминергическую, холинергическую системы и NMDA-регулируемые глутаматные эффекты. Сигма-1 рецептор играет важную роль в патофизиологии нейроденегенративных заболеваний, психических и аффективных расстройств, участвует в процессах обучения и памяти. В связи с этим способность лекарственных средств оказывать влияние на эффективность взаимодействия лигандов с сигма-1 рецептором указывает на наличие нейропротекторного, противоишемического, анксиолитического, антидепрессивного, антиастенического компонентов в спектре их фармакологической активности, что позволяет рассматривать данные препараты в качестве эффективных лекарственных средств для лечения цереброваскулярных заболеваний.
В качестве контроля тестируемых препаратов была протестирована потенцированная дистиллированная вода (смесь гомеопатических разведений С12 + С30 + С200).
В опыте (для измерения общего связывания) в инкубационную среду вносили 20 мкл комплексного препарата СМД анти-S100 + анти-eNOS или по 10 мкл СМД AT к S100 или 10 мкл СМД AT к NOS. Таким образом, количество СМД анти-S100 + анти-eNOS, вносимых в экспериментальную лунку при тестировании комплексного препарата, было идентично количеству СМД AT к S100 и СМД AT к NOS тестируемых в качестве монопрепаратов, что позволяет провести сравнение эффективности комплексного препарата с его отдельными компонентами, входящими в его состав. Потенцированную дистиллированную воду вносили в инкубационную среду в объеме 20 мкл и 10 мкл.
Затем вносили 160 мкл (~200µg белка) гомогената мембран клеток линии Jurkat (линия лейкемических Т-лимфоцитов человека), и в последнюю очередь 20 мкл радиолиганда меченого тритием [3Н]пентазоцин (15 нМ).
Для измерения неспецифического связывания вместо препаратов или потенцированной воды в инкубационную среду вносили 20 мкл немеченого лиганда - галоперидол (10 мкМ).
Радиоактивность измеряли на сцинтилляционном счетчике (Topcount, Packard) с использованием сцинтилляционной смеси (Microscint 0, Packard) после инкубации в течение 120 минут при температуре 22°C в 50 мМ Tris-HCl буфере (pH=7,4) и фильтрации на стекловолоконных фильтрах (GF/B, Packard). Специфическое связывание (в опыте или контроле) рассчитывали как разницу между общим (в опыте или контроле) и неспецифическим связыванием.
Результаты представлены в виде процента ингибирования специфического связывания в контроле (в качестве контроля использовали дистиллированную воду) (Таблица 1).
Результаты, отражающие ингибирование выше 50%, представляют собой значительные эффекты исследуемых соединений; ингибирование от 25% до 50%, свидетельствуют об эффектах от слабого до умеренного; ингибирование менее 25% считаются незначительными эффектами исследуемого соединения и находятся в пределах уровня фона.
Таким образом, в условиях данной экспериментальной модели показано, что: комплексный препарат СМД анти-S100 + анти-eNOS более эффективно, чем отдельные его компоненты (СМД анти-S100 и СМД анти-eNOS), ингибирует связывание стандартного радиолиганда [3Н]пентазоцина с рекомбинантным сигма 1 рецептором человека; СМД анти-S100, внесенные в экспериментальную лунку в объеме 10 мкл, ингибируют связывание стандартного радиолиганда [3H]пентазоцина с рекомбинантным сигма 1 рецептором человека, но выраженность эффекта уступает выраженности эффекта комплексного препарата СМД анти-S100 + анти-eNOS; СМД анти-eNOS, внесенные в экспериментальную лунку в объеме 10 мкл, не оказывали влияния на связывание стандартного радиолиганда [3Н]пентазоцина с рекомбинантным сигма 1 рецептором человека; потенцированная вода, внесенная в экспериментальную лунку в объеме 10 мкл или 20 мкл, не оказывала влияния на связывание стандартного радиолиганда [3Н]пентазоцина с рекомбинантным сигма 1 рецептором человека.
Пример 2
Были исследованы лекарственное средство в виде таблеток массой 300 мг, пропитанных водно-спиртовым раствором (3 мг/табл.) активированной -потенцированной формы поликлональных кроличьих антител к мозгоспецифическому белку S-100, очищенных на антигене, в сверхмалой дозе (СМД анти-S100), полученной сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 10030, 100200 раз, эквивалентной смеси сотенных гомеопатических разведений С12, С30, С200; лекарственное средство в виде таблеток массой 300 мг, пропитанных фармацевтической композицией, содержащей водно-спиртовые растворы (6 мг/табл.) активированных-потенцированных форм поликлональных аффинно очищенных кроличьих антител к мозгоспецифическому белку S-100 (анти-S100) и к эндотелиальной NO-синтазе (анти-eNOS) в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (с концентрацией 2,5 мг/мл) в 10012, 10030, 100200 раз, эквивалентных смеси сотенных гомеопатических разведений С12, С30, С200 (СМД анти-S100 + анти-eNOS); лекарственное средство в виде таблеток массой 300 мг, пропитанных водно-спиртовым раствором (3 мг/табл.) активированной-потенцированной формы поликлональных кроличьих антител к эндотелиальной NO-синтазе, очищенных на антигене, в сверхмалой дозе (СМД анти-eNOS), полученной сверхразведением исходного матричного раствора (с концентрацией 2,5 мг/мл) в 10012,10030, 100200 раз, эквивалентной смеси сотенных гомеопатических разведений С12, С30, С200. В качестве плацебо были использованы таблетки массой 300 мг, содержащие вспомогательные вещества: лактозу (моногидрат лактозы) - 267 мг, целлюлозу микрокристаллическую - 30 мг, магний стеарат - 3 мг.
Эффективность изучаемых лекарственных средств в терапии головокружения (vertigo) и других симптомов укачивания оценивали на модели кинетоза, или болезни движения/укачивания, которая проявляется различными вестибуло-вегетативными нарушениями. Головокружение - это типичный признак поражения вестибулярного анализатора различного генеза, включая нарушения функции вестибулярного нерва и вестибулярной кохлеарной системы, нарушения кровообращения в вертебрально-базилярной системе, патологию центральной нервной системы (ЦНС) и др. Головокружение как проявление кинетоза сопровождается другими вестибуло-вегетативными расстройствами, включающими три типа реакций: вестибуло-моторные (нистагм и реакции отклонения), вестибуло-сенсорные (помимо головокружения, это нистагм (или реакция поствращения), защитные движения) и вегетативные (тошнота, рвота, потливость, сердцебиение, чувство жара, колебание пульса и артериального давления).
Двойное слепое плацебоконтролируемое сравнительное клиническое исследование в параллельных группах эффективности противоукачивающих свойств композиции СМД анти-S100 + анти-eNOS, препарата СМД анти-S100, и препарата анти-eNOS, проводили с участием 15 соматически здоровых добровольцев - мужчин и женщин в возрасте от 15 до 60 лет (средний возраст 33,3±0,75 лет) с низкой (n=5; 33%) или средней (n=10; 67%) степенью устойчивости к укачиванию.
Для моделирования состояния укачивания и оценки эффективности исследуемых препаратов использовали наиболее адекватную и общепризнанную модель кинетозов - пробу с непрерывным кумулятивным воздействием ускорений Кориолиса (НКУК). Исходная переносимость пробы НКУК у всех участников исследования была не более 5 минут. Вестибуло-вегетативные расстройства, вызываемые кинетическим воздействием (НКУК), регистрировали с использованием комплекса диагностических методов, включающих осмотр пациента, количественную оценку расстройств вестибуло-вегетативной чувствительности (Шкала Галле), анализ вариабельности сердечного ритма (ВСР), самооценку функционального состояния (САН - самочувствие, активность, настроение). В качестве критериев эффективности проводимой терапии оценивали динамику переносимости и длительности периода восстановления при кинетическом воздействии, изменение выраженности сенсорно-моторных реакций (нистагм), показателей ВСР (с использованием системы Biocom Wellness Scan, разработанной AWS, LLC в соответствие с Международным стандартом Европейской ассоциации кардиологов и Северо-Американской ассоциацией Электрофизиологии) и данных САН. Критериями безопасности были характер, выраженность и сроки появления возможных нежелательных явлений (НЯ) в период терапии, связанных с приемом препарата; влияние изучаемых лекарственных средств на показатели, характеризующие функцию ЦНС (реакцию на движущийся объект [РДО], время простой двигательной реакции [ВПДР]); динамика физикальных и функциональных показателей (частоты сердечных сокращений [ЧСС], систолического [САД] и диастолического [ДАД] артериального давления, пробы Штанге, пробы Генча); переносимость физической нагрузки (индекс Гарвардского степ-теста). Безопасность оценивалась как при приеме тестовой дозы препаратов, так и при курсовом приеме в течение 7 дней.
Все участники в течение 1 месяца до включения в исследование не принимали каких-либо лекарственных средств. После визита скрининга участники рандомизировались в 4 группы в зависимости от принимаемого препарата (1 - СМД анти-S100 + анти-eNOS, 2 - СМД анти-S100; 3 - СМД анти-eNOS; 4 - плацебо).
В первый день исследования (Визит 1) регистрировалось исходное функциональное и психофизиологическое состояние добровольцев, затем осуществлялся 5-кратный тестовый прием препарата, после чего выполнялась проба НКУК, фиксировалась длительность выполнения теста, с помощью комплексного диагностического обследования выявлялись связанные с укачиванием вегетативно-вестибулярные расстройства и НЯ. В последующие 2-6 дней доброволец получал назначенный препарат по 1 таблетке 3 раза в день. В 7 день (Визит 2) пациент принимал препарат по схеме первого дня, проводили повторный комплекс диагностических исследований до и после пробы НКУК. Исследование было организовано таким образом, чтобы исследовательская бригада работала только с одним испытуемым. Исследование было параллельным и проводилось в первой половине дня, с участием, как правило, 4 человек в день, по одному человеку на препарат или плацебо. Следующие 3 недели был отмывочный период, к исходу которых пациентам каждой подгруппы назначали новый препарат/плацебо, цикл исследования повторялся (Визит 1, курсовой прием препарата; Визит 2). Таким образом, в ходе исследования каждый доброволец участвовал в четырех циклах исследования. При этом отслеживали, чтобы все испытуемые приняли участие в оценке каждого из трех препаратов и плацебо, что позволило нивелировать влияние индивидуальных особенностей испытуемого на эффект терапии. Анализ эффективности лекарственного средства проводился по данным всех испытуемых, завершивших полный курс приема исследуемых препаратов в соответствии с протоколом исследования (n=15).
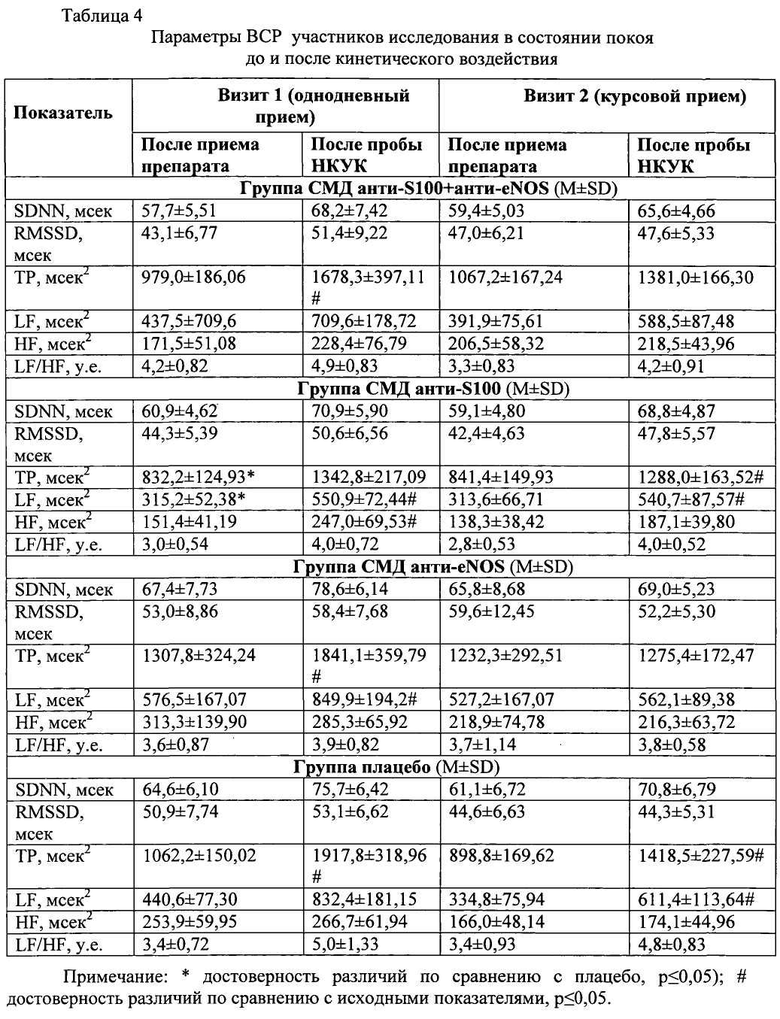
Показатели выраженности симптомов укачивания (головокружения, тошноты, вялости, бледности кожи, потливости и др.) после кинетического воздействия (НКУК) на фоне однодневного приема исследуемых препаратов свидетельствовали о том, что все участники исследования достигали примерно одинакового состояния укачивания, поскольку выраженность оцениваемых врачом-исследователем по шкале Галле симптомов вегетативной дисфункции достоверно не различалась во всех группах (Таблица 2, Визит 1). Однако время кинетического воздействия, которое вызывало сходные симптомы укачивания, различалось в четырех группах и зависело от лекарственного средства, которое принимали участники исследования (Таблица 3, Визит 1). Однодневный прием препарат СМД анти-S100 + анти-eNOS приводил к наиболее отчетливому противоукачивающему эффекту, что проявлялось не только в значимо большем времени переносимости пробы НКУК (104,10±13,14 сек против 68,50±6,57 сек - в группе СМД анти-S100; 75,00±6,79 сек - в группе СМД анти-eNOS и 61,30±3,15 сек - в группе плацебо), но и в наименьшем времени нистагма (9,90±1,20 сек против 13,50±1,51; 16,10±1,68 и 13,30±1,12 сек соответственно) и максимально быстром восстановлении (96,90±13,54 сек против 194,20±18,45; 202,50±21,72 и 241,70±38,41 сек соответственно).
Примерно сходные показатели были зарегистрированы на Визите 2 после курсового приема лекарственных средств. Для достижения сходных симптомов укачивания (Таблица 2, Визит 2) дольше всего кинетическое воздействие применяли к добровольцам, получавшим в течение 7 дней композицию СМД анти-S100 + анти-eNOS (Таблица 3, Визит 2). Наиболее выраженный противоукачивающий эффект композиции СМД анти-S100 + анти-eNOS выражался также в значимо меньшем времени нистагма (9,50±1,38 сек; p<0,01) и длительности периода восстановления (117,90±15,65 сек; p<0,01). Противоукачивающим действием обладал монокомпонентный препарат СМД анти-S100, о чем свидетельствовали лучшие, чем в группе плацебо, показатели переносимости пробы НКУК, времени нистагма и восстановления (Таблица 3, Визиты 1 и 2), однако по эффективности препарат СМД анти-S100 уступал композиции СМД анти-S100 + анти-eNOS. Монокомпонентный препарат СМД анти-eNOS не демонстрировал противоукачивающего эффекта, поскольку результаты пробы НКУК и последующего восстановительного периода не имели значимых отличий от группы плацебо (Таблица 3, Визиты 1 и 2).
Сравнительный анализ показателей пробы НКУК в группах СМД анти-S100 + анти-eNOS и СМД анти-S100 при однодневном приеме лекарственных средств показал, что добавление СМД анти-eNOS повышало переносимость кинетического воздействия на 52%, уменьшало время нистагма на 27% и способствовало сокращению периода восстановления после окончания кинетического воздействия на 50%, в том числе длительности головокружения - на 49%. Однако наибольший вклад компонент СМД анти-eNOS вносил в эффективность комбинированного препарата (композиции СМД анти-S100 + анти-eNOS) при курсовом приеме, что выражалось в превышении на 30% результата, достигнутого в группе СМД анти-S100 по показателям переносимости кинетического воздействия и длительности нистагма (по каждому из параметров). Кроме того, прирост эффекта на Визите 2 по показателям переносимости пробы НКУК и длительности нистагма относительно данных Визита 1 при приеме композиции СМД анти-S100 + анти-eNOS по сравнению с монокомпонентным препаратом СМД анти-S100 был выражен в большей степени, что подтверждалось изменением данных показателей на 30% и 4% (против 21% и 0% в группе СМД анти-S100).
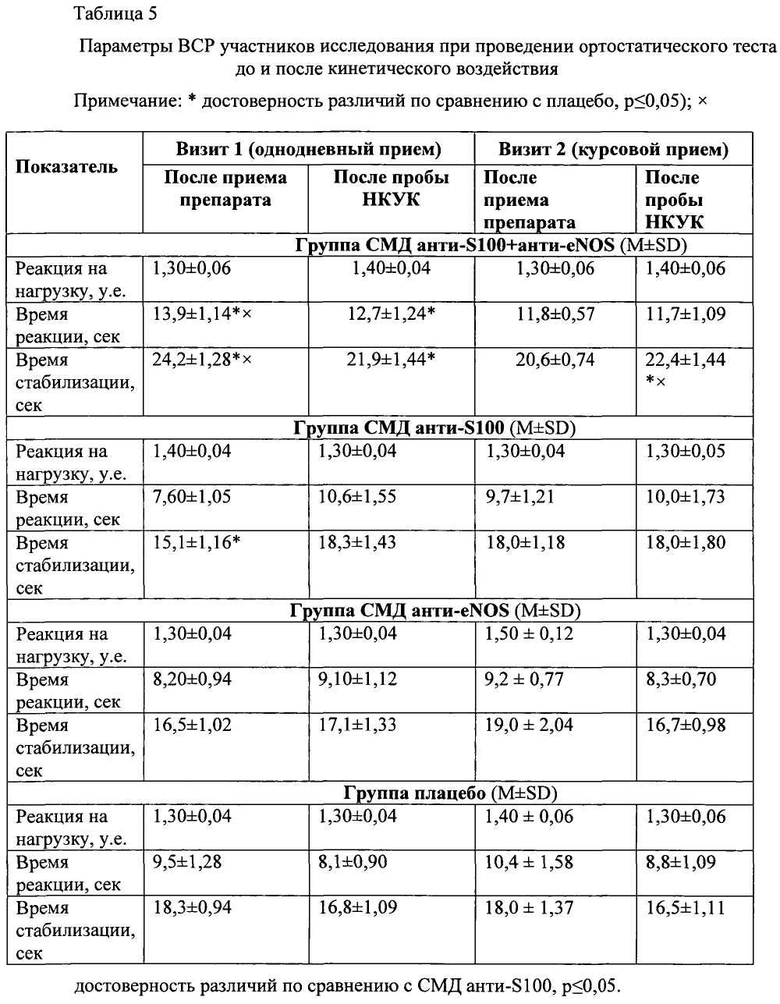
При оценке эффективности противоукачивающих свойств лекарственных средств особенное внимание было уделено возможному влиянию препаратов на стабильность вегетативной нервной системы (ВНС), в частности, изменение баланса между ее симпатическим и парасимпатическим отделами. С этой целью на каждом визите анализировали показатели ВСР в состоянии покоя и при выполнении функциональных проб (дыхательного и ортостатического тестов).
Анализ ВСР в покое (в положении сидя) до и после проведения пробы НКУК (Таблица 4) установил, что на фоне приема исследуемых препаратов имела место тенденция к возрастанию показателя SDNN, что свидетельствовало об увеличении вариабельности ЧСС за счет парасимпатического влияния на ритм сердца. В ответ на кинетическое воздействие во всех исследуемых группах возрастала величина RMS-SD, характеризующая активность парасимпатической составляющей вегетативной регуляции. В группах приема композиции СМД анти-S100 + анти-eNOS и СМД анти-S100 отмечалось увеличение HF, что также свидетельствовало о смещении вегетативного баланса в сторону парасимпатического звена. Таким образом, после проведения пробы НКУК во всех исследуемых группах происходило нарастание парасимпатических влияний на сердечный ритм.
Анализ ВСР при переходных состояниях показал, что однодневный прием композиции СМД анти-S100 + анти-eNOS увеличивал время реакции (13,9±1,14; р≤0,05) и время стабилизации (24,2±1,28; р≤0,05) по сравнению с СМД анти-S100 и плацебо (Таблица 5). Эти же показатели превосходили значения группы плацебо и после кинетического воздействия, что демонстрировало позитивное влияние комбинированного препарата на реактивность ВНС (повышение толерантности к изменениям положения тела). Наименьшая разница между максимальной и минимальной ЧСС в дыхательном тесте (Таблица 6) подтверждала лучшую сбалансированность двух отделов ВНС после однодневного приема композиции СМД анти-S100 + анти-eNOS (25,1±2,66 уд/мин; р≤0,05). К концу недельного курса терапии стабилизирующее воздействие на баланс ВНС после пробы НКУК (при ортостатическом и дыхательном тесте) также отмечено в группе приема композиции СМД анти-S100 + анти-eNOS (Таблицы 5, 6).
Результаты самооценки функционального состояния (самочувствие-активность-настроение) добровольцев, которую участники исследования проводили после моделирования укачивания (пробы НКУК) в начале и конце курса терапии, свидетельствовали о том, что испытуемые всех исследуемых групп дали «средние» баллы каждому из параметров (Таблица 7). Таким образом, на фоне приема препаратов переносимость пробы НКУК была удовлетворительной. Наибольший прирост показателей по сравнению с данными группы плацебо к окончанию 7-дневного приема (более 10%) отмечался в группе композиции СМД анти-S100 + анти-eNOs.
В анализ безопасности были включены данные всех добровольцев, участвовавших в исследовании. В течение всего периода наблюдения отмечалась хорошая переносимость исследуемых препаратов. Нежелательных явлений, связанных с приемом препаратов, не выявлено. Все добровольцы исследуемых групп завершили лечение в сроки, установленные протоколом исследования, досрочно выбывших из исследования не было.
По результатам физикального осмотра, включая показатели ЧСС, САД и ДАД, а также по данным Гарвардского степ-теста, у испытуемых не регистрировалось каких-либо патологических отклонений во время проведения исследования (Таблица 8). Все выявленные изменения не выходили за рамки нормальных значений. При этом субъективно все испытуемые отмечали удовлетворительное самочувствие.
Наряду с гемодинамическими показателями для оценки безопасности изучаемых препаратов, их возможного негативного влияния на высшие нервные функции, у добровольцев исследовали психофизиологические показатели (РДО, ВПДР, УВ, ОВ, КУВ). Кроме того, проводили пробы Штанге и Генча для оценки толерантности к гипоксии.
Согласно полученным результатам (Таблица 9), ни однодневный, ни курсовой прием препаратов не оказывали существенного влияния на оцениваемые параметры. Показатели сенсомоторной координации (ВПДР, РДО) не отличались от результатов группы плацебо до и после пробы НКУК на обоих визитах. Данные по исследованию такой сложной функции как объем и устойчивость внимания свидетельствовали о том, что изучаемые лекарственные средства, как до, так и после пробы НКУК, не изменяли степень концентрации и переключаемости внимания, не отличаясь от группы плацебо.
Анализ показателей стандартных нагрузочных проб с задержкой дыхания показал тенденцию к повышению переносимости испытуемыми гипоксии (Таблица 9). При задержке дыхания на вдохе длительность пробы Штанге возрастала после приема всех исследуемых препаратов, но только прием композиции СМД анти-S100 + анти-eNOS позволял значимо дольше не возобновлять дыхание после кинетического воздействия (68,1±18,8 сек исходно и 91,7±27,4 сек после пробы НКУК; р<0,05). Увеличение переносимости гипоксии также отмечалось при выполнении пробы Генча (задержка дыхания на выдохе; р>0,05).
Таким образом, проведенное исследование с использованием экспериментальной болезни движения продемонстрировало противоукачивающую эффективность композиции СМД анти-S100 + анти-eNOS и монокомпонентного препарата СМД анти-S100. Изучаемые препараты повышают устойчивость испытуемых к кинетическому воздействию после воспроизведения клинико-физиологических эффектов болезни движения, способствуя более легкому течению клиники укачивания и более раннему восстановлению испытуемых после прекращения воздействия. Кроме того, было показано, что противоукачивающее действие комбинированного препарата (композиции СМД анти-S100 + анти-eNOS) превышает эффективность отдельных компонентов. Эффективность композиции СМД анти-S100 + анти-eNOS в контроле вестибуло-вегетативных и сенсорных реакций организма при экспериментальной болезни движения возрастает при курсовом приеме. Следует отметить, что СМД анти-eNOS в виде монопрепарата не обладает протективным в отношении укачивания действием, но при сочетании с СМД анти-S100 значимо усиливает противоукачивающий эффект последнего, что проявляется как при однодневном, так и при коротком курсовом приеме лекарственного средства. Наилучшая способность корректировать переходные процессы, то есть воздействовать на реактивность парасимпатического и симпатического отделов ВНС, а также адаптационные возможности ВНС в состоянии укачивания (повышать толерантность к резким изменениям положения тела), отмечена у композиции СМД анти-S100 + анти-eNOS, что является важной составляющей противоукачивающих свойств лекарственного средства. Композиция СМД анти-S100 + анти-eNOS и монокомпонентный препарат СМД анти-S100 при применении их в качестве противоукачивающего средства, в том числе при выполнении операторских функций, безопасны и не оказывают отрицательного влияния на физикальные и психофизиологические показатели.
Композиция СМД анти-S100 + анти-eNOS может быть рекомендована для профилактики и купирования головокружений, вызванных вегето-сосудистой дистонией.
Препараты отличаются высокой безопасностью и не оказывают негативного влияния на качество профессиональной деятельности.

В процессе проведения исследования были использованы следующие методики и определялись следующие параметры состояния.
- Проба с непрерывным кумулятивным воздействием ускорений Кориолиса (НКУК) (Маркарян С.С., Юганов Е.М., Сидельников И.А. Вестибулярный отбор методом непрерывной кумуляции ускорений Кориолиса // Воен. мед. журн. 1966. №9. С.59-62; Методики исследований в целях врачебно-летной экспертизы. - М.: Воениздат, 1972).
Проба позволяет выявить устойчивость человека к воздействию ускорений Кориолиса и таким образом может свидетельствовать о степени подверженности данного субъекта укачиванию.
Порядок выполнения пробы. Испытуемый, сидя в кресле Барани или на электровращающемся кресле, принимает такое положение туловища и головы, чтобы ось вращения проходила вдоль туловища. Глаза закрыты. На фоне постоянного равномерного вращения кресла со скоростью 180 град/сек. (один оборот за две секунды) обследуемый в конце пятого оборота начинает выполнять наклоны головой от правого плеча к левому или от левого к правому и обратно на угол не менее 30 град, в каждую сторону от вертикали. Наклоны осуществляются непрерывно, без излишнего напряжения мышц шеи и поворотов головы в течение всего периода вращения. Каждое движение головой от плеча к плечу выполняется плавно за 2 сек без остановок в крайних и среднем положениях. Скорость наклонов контролируется с помощью метронома или временем произнесения цифр 21 и 22, что должно соответствовать 2 сек. Отсчет времени выполнения пробы необходимо начинать с момента первого качательного движения головой.
Перед испытанием обследуемого инструктируют, в частности указывают, что он должен сообщить врачу о появлении иллюзии качания, чувства тепла, жара, саливации, тошноты, которые могут возникнуть в процессе испытания. До начала испытания выполняется несколько пробных движений головой с тем, чтобы обследуемый получил навык контроля за скоростью качательных движений и усвоил правильное положение головы в момент движения.
Появление выраженных вестибуло-вегетативных расстройств (бледность, гипергидроз, тошнота, позывы на рвоту) в течение непрерывного выполнения пробы НКУК являются критериями предельной переносимости воздействия ускорений Кориолиса. Регистрируется время появления вестибуло-вегетативных реакций от начала выполнения пробы НКУК и время их прекращения после окончания выполнения пробы НКУК. Испытания на переносимость ускорений Кориолиса проводились в первой половине дня, не раньше чем через 2 часа после принятия пищи и только один раз в день. В день испытания обследуемый больше не подвергался другим воздействиям (в барокамере, на центрифуге и др.).
Методика количественной оценки расстройств вестибуло-вегетативной чувствительности (Шкала Галле) (Количественная оценка расстройств вестибуло-вегетативной чувствительности // Космическая биология и авиакосмическая медицина, 1981. - №3. - С.72-75). На основании оценки выраженности (в баллах) вестибуло-вегетативных симптомов (головокружения, тошноты, потливости, бледности кожи, сонливости и др.) возникающих при проведении пробы НКУК, методика позволяет выявить степень переносимости человеком ускорений Кориолиса (плохая, удовлетворительная, хорошая, отличная).
- Исследование вариабильности сердечного ритма (ВСР) (Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart Rate Variability standards of measurement, physiological interpretation, and clinical use. Cir. 1996; 93:1043 1065).
Для сбора данных ВСР использована Biocom Wellness Scan система, разработанная AWS, LLC. Она была создана в соответствие с Международным стандартом Европейской ассоциации кардиологов и Северо-Американской ассоциацией Электрофизиологии (International Task Force consisting of the European Society of Cardiology and the North American Society for Pacing and Electrophysiology, 1996).
Система содержит следующие компоненты:
1. Персональный компьютер (ПК) с операционной системой Windows.
2. Фотоплетизмограф HRM-02 (PPG).
3. Ушной датчик (PPG ear-clip).
4. Программное обеспечение Biocom Wellness Scan Software на CD.
5. Руководство по использованию в электронном формате (PDF).
Исследование по созданию базы данных пациента включала проведение трех тестов оценки автономного баланса: 5-минутная запись ВСР в покое; дыхательный тест; ортостатический тест.
Этапы исследования ВСР
1. Исследователь дает субъекту краткое описание каждого теста до начала старта.
2. Субъект комфортно сидит, находясь в расслабленном состоянии.
3. Ушной датчик протирается спиртовым раствором и размещается на мочке уха. Серьги, если имеются, необходимо снять перед тестом.
4. Исследователь выбирает 5-минутную запись ВСР в покое (Short-term Resting HRV Test) для выполнения.
5. Исследователь следует инструкциям по выполнению теста.
6. Сразу как тест закончен и данные записаны в базу данных, исследователь выбирает дыхательный (Metronome Breathing Test) или ортостатический тест (Orthostatic Test).
7. Исследователь следует инструкциям по выполнению дыхательного или ортостатического теста.
8. Сразу как тест закончен и данные записаны в базу данных, исследователь просматривает результаты всех проведенных тестов, чтобы определить являются ли они приемлемыми. Если какие-то из данных не удовлетворяют требованиям исследования, исследователь повторяет тестирование.
9. По окончанию просмотра данных, тестирование заканчивается, и ушной датчик снимается с уха субъекта.
Описание 5-минутной записи ВСР в покое
Кратковременный тест ВСР используется для оценки баланса между симпатической и парасимпатической ветвями автономной нервной системы. Он представляет собой 5-минутную запись ФПГ в сидячем положении без провокационных маневров. В течение теста участник исследования дышит произвольно с частотой дыхания не менее 9 дыханий в минуту для получения валидных параметров ВСР. Вычисляются следующие параметры ВСР:
1. Параметры во временной области:
1. HR
2. Mean NN
3. SDNN
4. RMS-SD
2. Параметры в частотной области:
5. Total Power
6. VLF
7. LF
8. HF
9. LF/HF Ratio
10. LF Norm
11. HF Norm
Все параметры ВСР во временной области вычисляются на нормальных межбитовых интервалах (NN), вызванных нормальным синусовым сокращением сердца, записанных в течение теста.
Частотные параметры ВСР вычисляются из плотности спектра мощности (PSD), рассчитанного методом быстрого преобразования Фурье (FFT).
Параметры во временной области:
HR - это среднее значение частоты сердечных сокращений, вычисленное по всей записи ритма сердца. HR измеряется в ударах в минуту (ВРМ).
Mean NN - это среднее значение межбитового интервала по всей записи. Mean NN измеряется в миллисекундах.
SDNN - это стандартное оклонение NN интервалов, которое является квадратным корнем из разброса NN. Поскольку величина под корнем математически эквивалентна общей мощности в спектральном анализе, SDNN отражает все циклические компоненты, ответственные за вариабельность. Действительное значение SDNN зависит от длины записи - чем длиннее запись, тем выше значение SDNN. Таким образом, в практике нельзя сравнивать значения SDNN, вычисленные на разных временных интервалах. SDNN измеряется в миллисекундах.
RMS-SD - это квадратный корень различий между последовательными NN интервалами. Этот показатель оценивает высокочастотный компонент вариабельности сердечного ритма, который связан с парасимпатической регуляцией сердца. RMS-SD измеряется в миллисекундах.
Параметры в частотной области:
Total Power (TP) - это оценка плотности спектра мощности в диапазоне от 0 до 0.4 Hz. Этот показатель отражает общую активность автономной нервной системы, причем симпатическая активность вносит наибольший вклад. Total Power вычисляется в миллисекундах в квадрате (ms2).
Very Low Frequency (VLF) - плотность спектра мощности в диапазоне между 0.0033 и 0.04 Hz. Физиологическая сущность этого показателя заключается в том, что он является индикатором общей активности различных медленных механизмов регуляции. VLF вычисляется в миллисекундах в квадрате (ms2).
Low Frequency (LF) - плотность спектра мощности в диапазоне между 0.04 и 0.15 Hz. Этот показатель отражает как симпатическую, так и парасимпатическую активность. Он является хорошим индикатором симпатической активности в долговременных записях BCP. Парасимпатическле влияние представлено в LF, когда частота дыхания меньше чем 9 дыханий в минуту. LF вычисляется в миллисекундах в квадрате (ms2).
High Frequency (HF) - плотность спектра мощности в диапазоне между 0.15 и 0.4 Hz. Этот показатель отражает парасимпатическую активность. HF также известен как «дыхательный» компонент, так как соответствует вариации NN интервалов, вызванных дыханием (этот феномен известен как респираторная синусовая аритмия (RSA)). Частота сердечных сокращений увеличивается в течение вдоха и уменьшается в течение выдоха. HF вычисляется в миллисекундах в квадрате (ms).
LF/HF Ratio - это соотношение между плотностью спектра мощности в диапазоне LF и HF. Этот показатель отражает общий баланс между симпатической и парасимпатической активностью. Высокие значения этого показателя являются индикатором доминирования симпатической активности, в то время как низкие - парасимпатической. LF/HF Ratio вычисляется в нормализованных единицах.
Normalized Low Frequency (LF norm) - это отношение между абсолютным значением LF и ТР без учета VLF. Этот показатель минимизирует эффект влияния VLF в общем спектре мощности и выделяет изменения в симпатической регуляции. LF Norm вычисляется в процентах.
Normalized High Frequency (HF norm) - это отношение между абсолютным значением HF и ТР без учета VLF. Этот показатель минимизирует эффект влияния VLF в общем спектре мощности и выделяет изменения в парасимпатической регуляции. HF norm вычисляется в процентах.
- Дыхательный тест
Этот тест предназначен для оценки парасимпатической ветви автономной нервной системы. Тест дает положительную стимуляцию парасимпатической регуляции сердечного ритма.
В течение этого теста субъект дышит глубоко и равномерно с частотой дыхания 6 дыханий в минуту. Во время теста очень важно исключить любые события, которые могут повлиять на произвольное дыхание, например разговор, кашель, вздохи и т.п. Эти помехи могут вызвать нежелательные флуктуации сердечного ритма и могут исказить результаты. Субъект был проинструктирован дышать 1 минуту, следуя движению пейсера, изображенного на экране компьютера. Вычисляются следующие параметры теста:
1. Minimal HR (bpm)
2. Maximal HR (bpm)
3. Standard Deviation of HR (bpm)
4. Mean ratio of HR max / HR min (E/I Ratio)
5. Maximal Variance of HR during test (bpm)
- Ортостатический тест
Этот тест используется для оценки влияния парасимпатической регуляции на ритм сердца. Тест основан на изменении положения тела субъекта. Субъекту необходимо находиться в расслабленном состоянии в положении сидя. После минутной записи сердечного ритма, субъекту дается команда встать, избегая любых резких движений. Субъект остается в положении стоя еще одну минуту. Мониторинг ритма сердца продолжается в течение всего теста. Цель записи базовой линии и маневра вставания - оценить нестационарный переходный процесс в ритме сердца, вызванный изменением положения тела. ЧСС мониторируется до тех пор, пока новое стационарное состояние ритма сердца не будет детектировано. Вычисляются следующие параметры теста:
1. 30:15 Ratio (соотношение между максимальным значение ЧСС в течение первых 15 секунд после вставания к минимальному значению ЧСС в течение первых 30 сек после вставания, или реакция на нагрузку, у.е.).
2. Время достижения максимального значения ЧСС после вставания (или время реакции, сек).
3. Время достижения ЧСС 75% уровня базовой линии (или время стабилизации, сек).
4. Минимальное значение ЧСС (уд/сек).
5. Максимальное значение ЧСС (уд/сек).
- Самооценка функционального состояния (САН) (Доскин В.А., Лаврентьева Н.А., Мирошников Н.П., Шарай В.Б. Тест дифференцированной самооценки функционального состояния // Вопросы психологии, 1973. - №6. - С.141-145).
Методика позволяет количественно выразить показатели субъективного состояния, характеризующие три категории признаков: самочувствие, активность и настроение (САН), которые определяются с помощью специального бланка. На бланке имеются 30 пар слов противоположного значения и между ними оценочная шкала. В зависимости от субъективной оценки своего состояния испытуемый отмечает степень выраженности того или иного признака по семибалльной шкале. Признаки по номерам характеризуют: 1-2, 7-8, 13-14, 19-20, 25-26 - самочувствие; 3-4, 9-10, 15-16, 21-22, 27-28 - активность; 5-6, 11-12, 17-18, 23-24, 29-30 - настроение. При обработке результатов самочувствия и настроения оценки перекодируются от 7 до 1 слева - направо, а активности - справа-налево.
Для каждого признака (самочувствия, активности, настроения) подсчитываются средняя арифметическая величина, ее ошибка и среднеквадратическое отклонение. Это дает возможность интегрально оценить субъективное состояние. Средняя арифметическая величина является непосредственной субъективной характеристикой функционального состояния и работоспособности, а по величине разброса оценок внутри одной группы признаков (среднеквадратического отклонения) можно судить о достоверности полученных результатов.
- Психометрические тесты
Выполнялись на компьютерах по программе «ОКО» (оперативный контроль оператора), разработанной для такого рода исследований специалистами управления «Обитаемости и медицинского обеспечения личного состава ВМФ» Центрального научно-исследовательского института кораблестроения Минобороны России, под руководством профессора Рыбникова В.Ю.
Определяли следующие психофизиологические показатели:
- реакция на движущийся объект (РДО);
- время простой двигательной реакции (ВПДР);
- объем внимания (ОВ);
- устойчивость внимания (УВ).
Вследствие высокой вариабельности психофизиологических показателей их измерение проводили по нескольку раз и затем рассчитывали среднее арифметическое из всей серии значений. В частности, оценку ВПДР повторяли 50 раз, РДО - 20 раз, ОВ и УВ по 5 раз. В тесте РДО также из 20 значений подсчитывали число попаданий в цель и затем рассчитывали процент точных попаданий. В тесте У В исследовали среднее время выполнения теста, количество правильных ответов в процентах к их общему числу, выполненному добровольцем.
Для интеграции этих показателей определяли коэффициент устойчивости внимания (КУВ), который рассчитывался путем деления процента правильных ответов на среднее время выполнения теста.
- Реакция на движущийся объект (РДО) (Сохранение работоспособности плавающего состава Военно-Морского Флота. Руководство для врачей // Под общей редакцией Жеглова В.В., Сапова И.А., Щеголева B.C. - М.: Воениздат.- 1990. - 192 с.).
Реакция на движущийся объект позволяет определить точность реагирования испытуемого на раздражитель и судить об уравновешенности процессов возбуждения и торможения в коре головного мозга. Суть реакции заключается в необходимости останавливать быстрое движение объекта в заранее фиксированной точке. Для этого может быть использован включаемый дистанционно экспериментатором электросекундомер, стрелку которого испытуемый должен остановить точно на отметке «0» нажатием кнопки на своем пульте. Данный тест может также выполняться с помощью специальной компьютерной программы на ПЭВМ. Ответная реакция испытуемого может быть преждевременной - стрелка электросекундомера не достигла отметки «0», запаздывающей - стрелка проскочила отметку «0», точной - стрелка остановлена на отметке «0». Каждая преждевременная или запаздывающая реакция имеет количественную характеристику в абсолютных единицах. Для оценки результатов выполненной пробы высчитывается относительная точность ответов (в % от общего количества реакций), а также средняя арифметическая и средняя алгебраическая величины отклонений из всех предъявленных реакций.
- Простая сенсомоторная реакция на световой сигнал или время простой двигательной реакции (ВПДР) (Сохранение работоспособности плавающего состава Военно-Морского Флота. Руководство для врачей // Под общей редакцией Жеглова В.В., Сапова И.А., Щеголева B.C. - М.: Воениздат, 1990. - 192 с.).
Время простой двигательной реакции является одной из информативных методик для характеристики силы нервных процессов. В простой сенсомоторной реакции можно выделить два психических акта: акт восприятия (сенсорный момент реакции) и ответное движение (моторный компонент). Оценку ВПДР можно производить традиционным способом (с помощью хронорефлексометров), а также с использованием специальных компьютерных программ. Испытуемому предварительно объясняют содержание и правила проведения теста. Затем он садится на стул, кладет руки на стол перед хронорефлексометром, палец ведущей руки располагает на его соответствующей кнопке. После готовности испытуемого врач-исследователь подает команду и в течение 3-10 сек после нее включает устройство. Задача испытуемого, как можно быстрее после возникновения сигнала, отреагировать нажатием на кнопку и погасить лампочку. Время простой двигательной реакции измеряется (в миллисекундах) с момента появления на экране монитора специального объекта до нажатия испытуемым кнопки на манипуляторе (клавиатуре или мыши). ВПДР измеряется, как правило, 50 раз, после чего определяется среднеарифметическое значение показателя.
- Гарвардский степ-тест (Методы исследования в физиологии военного труда. Руководство / Под редакцией B.C. Новикова. - М.: Воениздат, 1993. - 240 с.).
В качестве функциональной пробы, позволяющей выявить реакцию сердечнососудистой системы на неблагоприятное воздействие и, в частности, воздействие ускорений Кориолиса использовали 2-минутный Гарвардский степ-тест (Карпман В.Л. и соавт., 1988).
Методика основана на оценке вегетативных сдвигов при выполнении физической нагрузки субмаксимальной мощности и восстановительных возможностей организма по нормализации частоты сердечных сокращений.
Величина степ-теста характеризует скорость восстановительных процессов после достаточно напряженной мышечной работы. Чем быстрее восстанавливается пульс, тем меньше величина (Р2+Р3+Р4) и, следовательно, тем выше индекс степ-теста.
У спортсменов этот показатель, как правило, выше, чем у нетренированных людей. При токсическом воздействии препаратов следует ожидать его снижения. В тоже время его увеличения свидетельствует, что препарат повышает функциональные резервы организма и способность переносить неблагоприятные воздействия окружающей среды, в том числе и кинетические воздействия.
Процедура проведения теста заключается в том, что обследуемый в течение 2 минут с частотой 30 раз в минуту приседает. Сразу после нагрузки у него на 2, 3 и 4-й минутах подсчитывают пульс за первые 30 сек каждой минуты. Индекс степ-теста рассчитывали по формуле:
Индекс гарвардского степ-теста = Т*100/(Р2+Р3+Р4)*2,
где Т - время нагрузки в сек; Р2, Р3, Р4 - частота пульса на 2-й, 3-й, 4-й минутах периода восстановления, * - знак умножения.
В связи с тем, что препараты предназначены лицам, подверженным укачиванию, в том числе и водителям, оценивалась их безопасность при выполнении человеком ответственных операторских функций. С этой целью были исследованы основные предикторы качества деятельности операторского типа, для чего детально исследовали функциональное состояние ЦНС (в частности, состояние систем координации и реагирования, систем обеспечивающих высокую эффективность тонких моторных компонентов деятельности, а также систем внимания).
- Проба Штанге (Сохранение работоспособности плавающего состава Военно-Морского Флота. Руководство для врачей // Под общей редакцией Жеглова В.В., Сапова И.А., Щеголева B.C. - М.: Воениздат.- 1990. - 192 с.).
Суть выполнения пробы заключается в задержке дыхания после трех дыханий на 3/4 глубины полного вдоха. До проведения пробы обследуемому на нос одевается зажим или же обследуемый зажимает нос пальцами. Время задержки регистрируется по секундомеру. Проба может быть проведена дважды с интервалами в 3-5 мин между определениями. По длительности задержки дыхания проба оценивается следующим образом:
- менее 39 сек - неудовлетворительно;
- 40-9 сек - удовлетворительно;
- свыше 50 сек - хорошо.
- Проба Генча (Сохранение работоспособности плавающего состава Военно-Морского Флота. Руководство для врачей // Под общей редакцией Жеглова В.В., Сапова И.А., Щеголева B.C. - М.: Воениздат.- 1990. - 192 с.).
Суть выполнения пробы заключается в задержке дыхания на выдохе после трех дыханий. При проведении пробы Генча в положении лежа длительность задержки дыхания у здоровых людей равняется 25-30 сек. При ее повторении после дозированной ходьбы (44 м в течение 30 сек) длительность задержки дыхания уменьшается до 17-22 сек, а при функциональной недостаточности организма - до 5-15 сек. Оценка пробы проводилась следующим образом:
- менее 34 сек - неудовлетворительно;
- 3 5-3 9 сек - удовлетворительно;
- свыше 40 сек - хорошо.
Пример 3
Для исследования эффективности лечения пациентов с Синдром Вегетативной Дисфункции (СВД) психофизиологического и дисгормонального генеза заявленным лекарственным средством были использованы таблетки массой 300 мг, пропитанные фармацевтической композицией, содержащей водно-спиртовые растворы (6 мг/табл.) активированных-потенцированных форм поликлональных аффинно очищенных кроличьих антител к мозгоспецифическому белку S-100 (анти-S100) и к эндотелиальной NO-синтазе (анти-eNOS) в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (с концентрацией 2,5 мг/мл) в 10012, 10030, 100200 раз, эквивалентных смеси сотенных гомеопатических разведений С12, С30, С200 (СМД анти-S100 + анти-eNOS).
В качестве контрольной группы использовалась группа пациентов, получающих препарат в виде таблеток массой 300 мг, пропитанных водно-спиртовым раствором (3 мг/табл.) активированной-потенцированной формы поликлональных кроличьих антител к мозгоспецифическому белку S-100, очищенных на антигене, в сверхмалой дозе (СМД анти-S100), полученной сверхразведением исходного матричного раствора (концентрацией 2,5 мг/мл) в 10012, 10030, 100200 раз, эквивалентной смеси сотенных гомеопатических разведений С12, С30, С200
По дизайну исследование представляло из себя одноцентровое открытое рандомизированное сравнительное клиническое исследование эффективности и безопасности применения препаратов СМД анти-S100 + анти-eNOS и СМД анти-S100, применяемых в качестве монотерапии, при лечении пациентов с Синдром Вегетативной Дисфункции (СВД) психофизиологического и дисгормонального генеза.
В исследование были включены 12 пациентов с диагнозом «СВД психофизиологического генеза» и «СВД дисгормонального генеза», в возрасте от 23 до 61 года. Средний возраст пациентов составил 49,25±12,63 года.
После определения соответствия пациента критериям включения и исключения протокола, пациенты были рандомизированы в одну из двух исследуемых групп: группа СМД анти-S100 + анти-eNOS - 6 пациентов (3 пациента с СВД психофизиологического и 3 пациента СВД дисгормонального генеза). Средний возраст пациентов группы СМД анти-S100 + анти-eNOS составил 41,33±12,5 года (17,7% мужчин и 82,3% женщин); группа СМД анти-S100 - 6 пациентов (3 пациента с СВД психофизиологического и 3 пациента СВД дисгормонального генеза). Средний возраст пациентов группы СМД анти-S100 составил 57,16±4,35 года (17,7% мужчин и 82,3% женщин).
В ходе данного исследования было проведено 4 визита в исследовательский центр. Фаза лечения продолжалась с Визита 1 до Визита 3. Визит 3 (День 56±5) являлся первой конечной точкой исследования, после чего начиналась фаза катамнестического наблюдения. Фаза катамнестического наблюдения продолжалась до Визита 4 (День 84±5).
В анализ безопасности были включены данные всех пациентов, участвовавших в исследовании (n=12). В течение всего периода наблюдения за пациентами отмечалась хорошая переносимость препарата. Нежелательные явления отсутствовали. Одна пациентка не явилась на второй визит, контакт с ней утерян. Пациентка не включалась в анализ. Все пациенты исследуемых групп завершили лечение в сроки, установленные протоколом исследования, досрочно выбывших пациентов не было.
При оценке действия препарата СМД анти-S100 + анти-eNOS на основные проявления СВД, а также тревожно-депрессивные расстройства (опросник депрессии Бека), было выявлено улучшение качества жизни пациентов, выражавшееся в статистически-достоверном увеличении общего балла опросника SF-36 (подписала «физическое здоровье» с 38,04±2,44 до 47,84±1,27, р=0,005, подшкала «психическое здоровье» - с 57,88±3,94 до 72,75±1,64, р<0,01), а также статистически-достоверное снижение общего балла по опроснику депрессии Бека (с 11,0±1,4 до 5,5±1,37, р<0,02)
При оценке действия препарата СМД анти-S100 на основные проявления СВД, а также тревожно-депрессивные расстройства пациента (опросник депрессии Бека), было выявлено улучшение качества жизни пациентов, выражавшееся в статистически-достоверном увеличении общего балла опросника SF-36 (подшкала «психическое здоровье» - с 56,107±1,36 до 70,7±1,39, р<0,001). Тенденций увеличения общего балла по подшкале «физическое здоровье» в данной группе выявлено не было.
При анализе динамики тревожно-депрессивных расстройств в группе СМД анти-S100 выявлено статистически-достоверное снижение общего балла по опроснику депрессии Бека (с 10,5±1,04 до 5,33±1,5, р<0,02) (Таблица 10).
Достоверных межгрупповых различий после лечения по этим показателям не выявлено. При планировании исследования и наборе пациентов, группы были разделены на следующие подгруппы:
1. пациенты с диагнозом Синдром Вегетативной Дисфункции психофизиологического генеза (хронический стресс), которые будут получать препарат СМД анти-S100 + анти-eNOS в качестве монотерапии;
2. пациенты с диагнозом Синдром Вегетативной Дисфункции психофизиологического генеза (хронический стресс), которые будут получать препарат СМД анти-S100 в качестве монотерапии;
3. Пациенты с диагнозом Синдром Вегетативной Дисфункции дисгормонального (климактерического) генеза, которые будут получать препарат СМД анти-S100 + анти-eNOS в качестве монотерапии;
4. Пациенты с диагнозом Синдром Вегетативной Дисфункции дисгормонального (климактерического) генеза, которые будут получать препарат СМД анти-S100 в качестве монотерапии.
При анализе полученных данных подгрупповые тенденции соответствовали таковым при общегрупповом анализе, хотя и имели меньшую степень достоверности, что, вероятно, связано с небольшим количеством наблюдений (Таблица 11, 12).
При межгрупповом и внутригрупповом анализе динамики артериального давления, интегративных вегетативных показателей, показателей вариационной пульсометрии, статистически-достоверных тенденций выявлено не было, за исключением тенденции к уменьшению Индекса Вегетативного Равновесия (ИВР). Скорее всего, это обусловлено недостаточным количеством наблюдений.
ИВР - интегративный показатель, вычисляемый как отношение амплитуды Мо (число кардиоинтервалов, соответствующее диапазону моды) к Вариационному Размаху (разница между максимальным и минимальным значениями R-R). Уменьшение этого показателя свидетельствует о смещении вегетативного равновесия от симпатикотонии к нормо- и ваготонии, т.е. об увеличении влияния парасимпатических отделов вегетативной нервной системы (ВНС).
В группе дисгормональной СВД отмечена статистически-достоверная тенденция к уменьшению ИВР в подгруппе СМД анти-S100 + анти-eNOS. При этом выявлена статистически-достоверная (р<0,05) разница между подгруппой СМД анти-S100 + анти-eNOS и подгруппой СМД анти-S100 (Таблица 13).
Таким образом, в проведенном клиническом исследовании заявленного лекарственного средства СМД анти-S100 + анти-eNOS показано положительное влияние на качество жизни пациентов с Синдром Вегетативной Дисфункции (СВД) психофизиологического и дисгормонального генеза, положительное влияние на тревожно-депрессивные расстройства пациентов. Продемонстрировано положительное влияние препарата на вегетативную нервную систему. Кроме того, подтверждена высокая переносимость заявленного лекарственного препарата. Нежелательные явления отсутствовали.
Пример 4
Для исследования свойств заявленного лекарственного средства для лечения пациентов с ВСД, которая является одной из причин развития синдрома дефицита внимания и гиперактивности (СДВГ), были использованы таблетки массой 300 мг, пропитанные фармацевтической композицией, содержащей водно-спиртовые растворы (6 мг/табл.) активированных-потенцированных форм поликлональных аффинно очищенных на антигене кроличьих антител к мозгоспецифическому белку S-100 (анти-S100) и к эндотелиальной NO-синтазе (анти-eNOS) в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора (с концентрацией 2,5 мг/мл) в 10012, 10030, 100200 раз, эквивалентных смеси сотенных гомеопатических разведений С12, С30, С200 (СМД анти-S100 + анти-eNOS). Для пациентов группы сравнения были использованы таблетки массой 300 мг, пропитанные водно-спиртовым раствором (3 мг/табл.) активированной-потенцированной формы поликлональных кроличьих антител к мозгоспецифическому белку S-100, очищенных на антигене, в сверхмалой дозе (СМД анти-S100), полученной сверхразведением исходного матричного раствора в 10012, 10030, 10050 раз, эквивалентной смеси сотенных гомеопатических разведений С12, С30, С50. Для пациентов контрольной группы (плацебо) были использованы таблетки массой 300 мг, содержащие вспомогательные вещества (лактозы моногидрат - 267 мг, целлюлоза микрокристаллическая - 30 мг, магния стеарат - 3 мг).
Оценку эффективности активного препарата СМД анти-S100 + анти-eNOS в лечении пациентов с синдромом дефицита внимания и гиперактивности (СДВГ) проводили в ходе сравнительного двойного слепого плацебоконтролируемого исследования с участием 146 детей в возрасте от 6 до 12 лет (средний возраст 9,3±0,24 лет), которые были рандомизированы в три группы в зависимости от назначенной терапии. В течение 12 недель пациенты группы активного препарата №1 (п=46) получали композицию СМД анти-S100 + анти-eNOS по 2 таблетки 2 раза в день; участники группы сравнения №2 (n=50) получали СМД анти-S100 по 2 таблетки 2 раза в день; пациенты контрольной группы №3 (n=50) получали плацебо по 2 таблетки 2 раза в день. Все пациенты, включенные в исследование, имели клинически выраженные проявления СДВГ, что подтверждалось высокими баллами по шкале оценки симптомов СДВГ (ADHDRS-IV-Home Version): 33,8±0,92 в группе №1; 32,5±1,14 в группе №2 и 33,6±0,91 в группе №3. Большинство детей характеризовалось умеренной степенью тяжести СДВГ в соответствии с опросником CGI-ADHD-Severity. Суммарный балл по данной шкале составил 4,0±0,02 балла в группе №1, 4,0±0,03 балла в группе №2, 4,0±0,00 балла в группе №3. Таким образом, исходно пациенты трех групп имели сопоставимые показатели степени тяжести СДВГ. По результатам неврологического, клинико-лабораторного и инструментального обследования на момент включения в исследование у пациентов не регистрировалось каких-либо патологических отклонений. В процессе лечения пациенты наносили врачу 6 визитов в течение 12 недель, в ходе которых врач-исследователь регистрировал динамику выраженности клинических проявлений СДВГ (суммарный балл по шкале ADHDRS-IV-Home Version) и тяжести заболевания (по шкале CGI-ADHD-Severity), осуществлял контроль назначенной и сопутствующей терапии, оценивал безопасность проводимого лечения.
Анализ эффективности 12-недельной терапии в трех группах показал снижение более чем на 25% от исходного суммарного балла по шкале ADHDRS-IV-Home Version у 75% (n=36) детей, принимавших композицию СМД анти-S100 + анти-eNOS; у 66% (n=33) пациентов, принимавших СМД анти-S100 и у 56% (n=28) детей, принимавших плацебо. Различия эффективности между группами, установленные при более детальной оценке с учетом трехуровневой градации улучшения состояния (снижение суммарного балла по шкале ADHDRS-IV на <25%; 25-49,9% или ≥50% от исходного значения), представлены в таблице 14. Значительное улучшение со снижением суммарного балла на 50 и более процентов от исходного отмечалось у 52% детей группы №1, принимавших СМД анти-S100 + анти-eNOS, и у 34% детей группы №2, принимавших СМД анти-S100 (против 8% пациентов группы №3, принимавших плацебо).
Динамика уменьшения выраженности симптомов СДВГ в течение периода лечения (значения суммарного балла по шкале ADHDRS-IV-Home Version на каждом из шести визитов) представлена в таблице 15. Значимое снижение (р<0,001) клинических проявлений СДВГ по сравнению с исходным состоянием происходило уже через 2 недели терапии во всех трех группах наблюдения. Положительная динамика оказалась более существенной у пациентов №1 и №2 групп, поскольку у них выявлялись значимые отличия суммарного балла ADHDRS-IV-Home Version не только при сопоставлении с визитом скрининга, но и при сравнении с показателями группы №3 плацебо. В последующие недели терапии эффективность лечения композицией СМД анти-S100 + анти-eNOS и монокомпонентным препаратом СМД анти-S100 нарастала, наиболее значимо в группе активного препарата (р<0,05). Итоговое снижение суммарного балла по шкале ADHDRS-IV-Home Version у детей группы №1 СМД анти-S100 + анти-eNOS составило 16,5 баллов, у пациентов группы №2 СМД анти-S100 - 12,4 баллов (против 6,3 баллов в группе №3 плацебо). В результате 12-недельного лечения выраженность клинических проявлений СДВГ у детей, лечившихся композицией СМД анти-S100 + анти-eNOS, снизилась почти на половину (-48,8%), а у пациентов, получавших СМД анти-S100, более чем на треть (-38,2%), по сравнению с исходным состоянием.
Прием композиции СМД анти-S100 + анти-eNOS либо СМД анти-S100 оказывал влияние на оба кластера симптомов СДВГ, что подтверждалось динамикой оценок по двум разделам шкалы с ADHDRS-IV-Home Version (Таблица 15). Причем, лечение композицией СМД анти-S100 + aHTH-eNOS значимо превышало эффективность терапии монопрепаратом СМД анти-S100 по степени воздействия на выраженность проявлений и дефицита внимания, и гиперактивности/импульсивности.
Положительный терапевтический эффект активного препарата СМД анти-S100 + анти-eNOS и препарата сравнения СМД анти-S100 продемонстрирован также при оценке результатов лечения пациентов по шкале оценки тяжести СДВГ (CGI-ADHR-Severity) (Таблица 20). Почти у четвертой части пациентов группы СМД анти-S100 + анти-eNOS тяжесть заболевания от умеренной снизилась до легкой и даже минимальной, что подтверждалось уменьшением среднего показателя по шкале CGI-ADHR-Severity на 15% через 3 месяца терапии (с 4,0±0,02 до 3,4±0,06; р<0,001). Эффект терапии монопрепаратом СМД анти-S100 был несколько меньше и составил -10% по шкале CGI-ADHR-Severity за 3 месяца (против - 5% в группе плацебо).
В анализ безопасности были включены данные всех пациентов, участвовавших в исследовании. В течение всего периода наблюдения отмечалась хорошая, сопоставимая с плацебо, переносимость и активного препарата СМД анти-S100 + анти-eNOS, и препарата сравнения СМД анти-S100. Нежелательные явления были зарегистрированы у одного пациента группы СМД анти-S100 (преходящие в течение четвертой недели исследования головные боли) и у одного пациента группы плацебо (снохождение в течение второго месяца наблюдения). Перечисленные нежелательные явления не были связаны с проводимой терапией. Кроме того, в ходе лечения наблюдались единичные случаи острых респираторных заболеваний, также не связанные с проводимой терапией. Все пациенты исследуемых групп завершили лечение в сроки, установленные протоколом исследования, досрочно выбывших пациентов не было. Отсутствие патологических изменений по данным физикального осмотра пациентов и в ходе повторных анализов лабораторных показателей подтверждали безопасность исследуемой терапии.
По результатам физикального осмотра (ЧСС, САД, ДАД, температура тела) у пациентов не регистрировалось каких-либо патологических изменений во время лечения. Различия в анализируемых показателях по визитам и в сравниваемых группах не достигали статистической значимости и не выходили за рамки физиологически допустимых отклонений. Высокие показатели приверженности терапии дополнительно свидетельствовали как об эффективности, так и безопасности изучаемых препаратов. К концу 3-го месяца приверженность к лечению составила 99,8±1,15% и 98,8±2,25% в группах №1 СМД анти-S100 + анти-eNOS и №2 СМД анти-S100 соответственно (против 74,6±2,54% в группе №3 плацебо).
Таким образом, проведенное исследование продемонстрировало эффективность и безопасность композиции СМД анти-S100 + анти-eNOS и монокомпонентного препарата СМД анти-S100 в лечении детей с СДВГ. Наиболее выраженный терапевтический эффект в результате 12-недельного курса отмечен у комплексного лекарственного средства (СМД анти-S100 + анти-eNOS), что проявлялось положительной динамикой клинических симптоматики у большинства (75%) детей. Композиция СМД анти-S100 + анти-eNOS оказывала корригирующее влияние на оба кластера симптомов СДВГ, в результате чего отмечалась значимая редукция нарушений внимания и проявлений гиперактивности у пациентов с СДВГ.
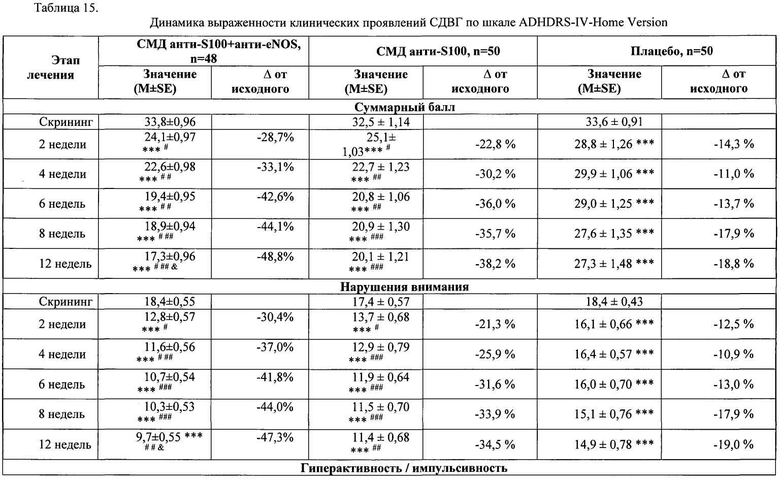
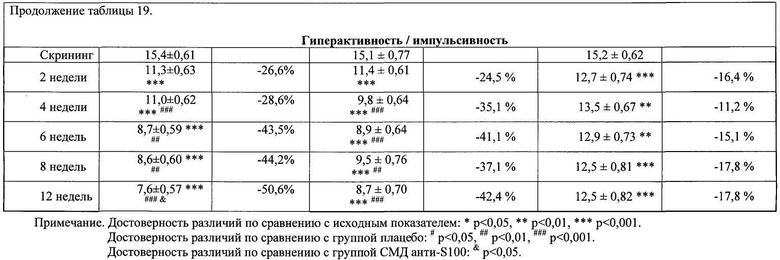
В процессе проведения исследования были использованы следующие методики и определялись следующие параметры состояния:


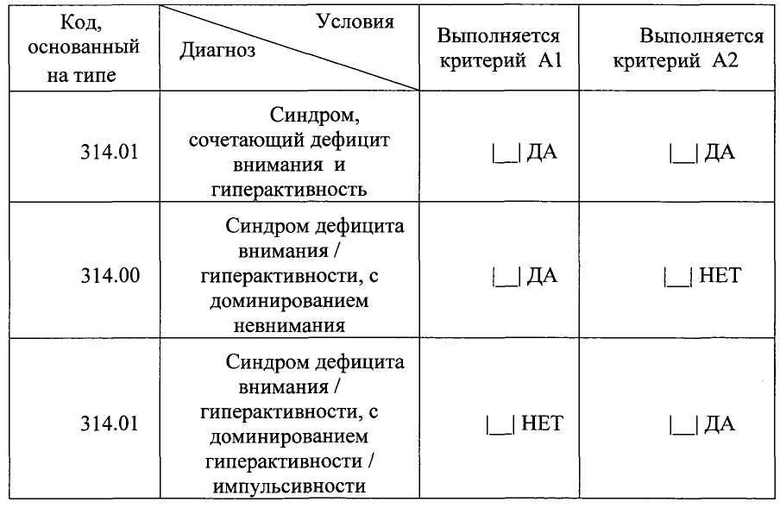
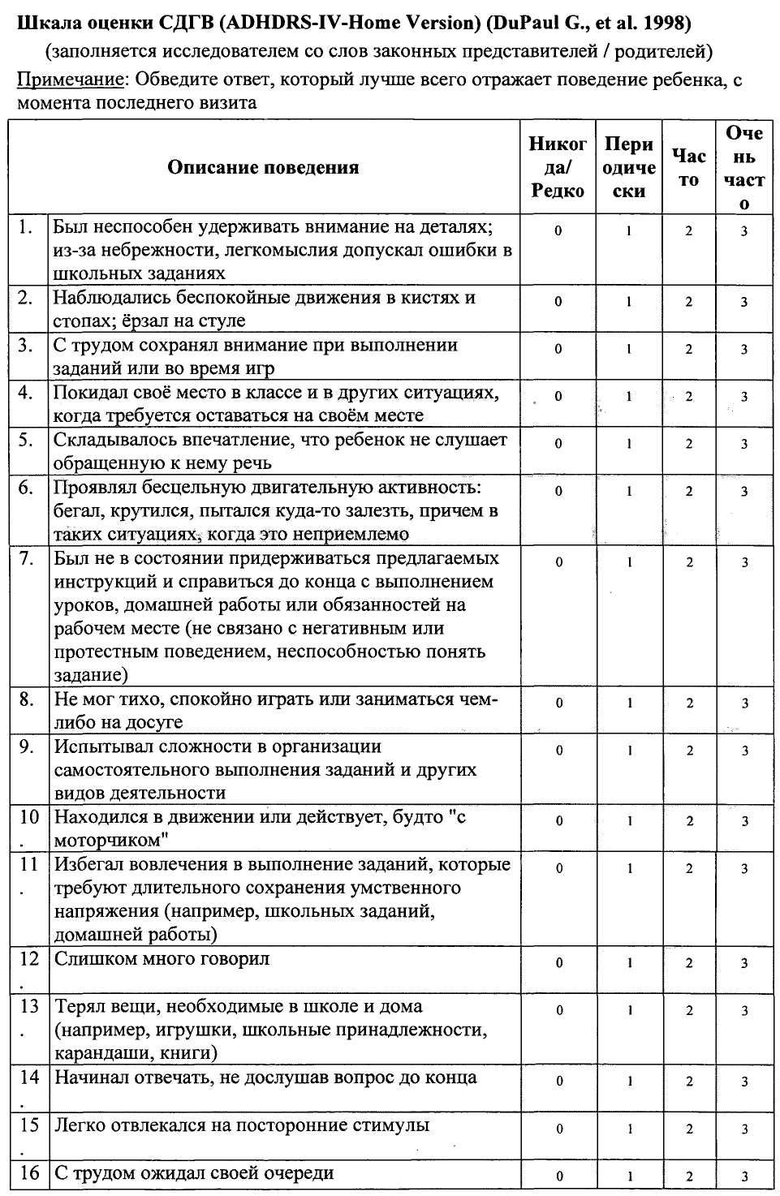

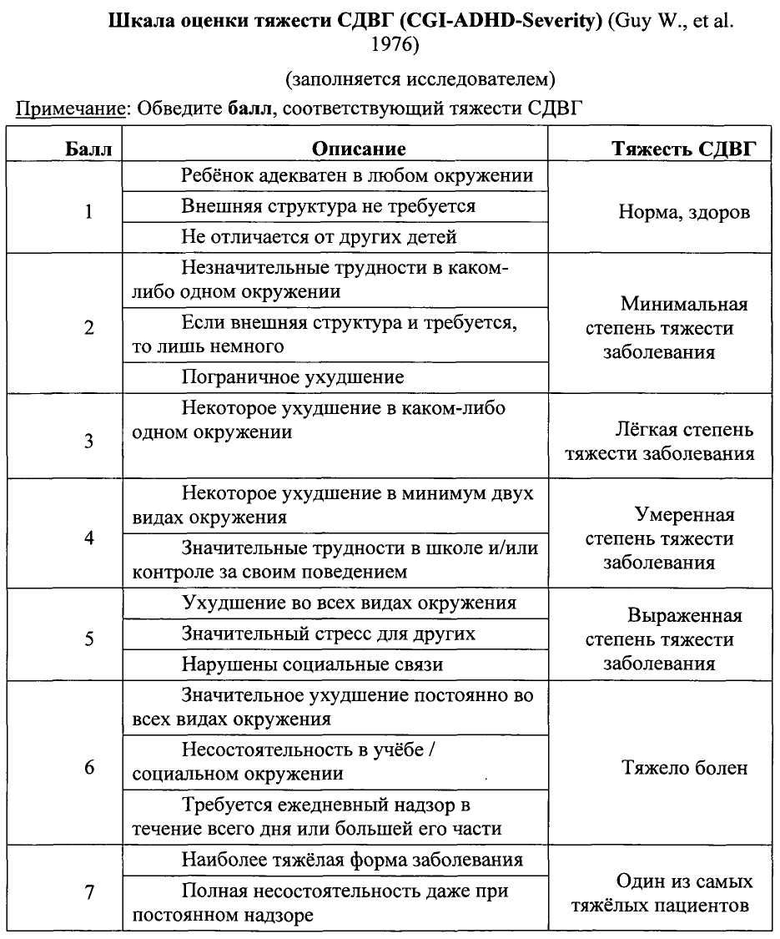
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Эпштейн, Олег Ильич
<120> Способ лечения вегето-сосудистой дистонии и лекарственное средство
<140> RU2013154070
<141> 2013-12-06
<150> RU2010130356
<151> 2010-07-21
<150> RU2010130353
<151> 2010-07-01
<150> RU2010130355
<151> 2010-07-01
<150> RU. 2010130358
<151> 2010-07-01
<160> 8
<170> BiSSAP 1.0
<210> 1
<211> 1205
<212> PRT
<213> Bos taurus
<220>
<221> SOURCE
<222> 1..1205
<223> /mol_type="protein"
/organism="Bos taurus"
<400> 1
Met Gly Asn Leu Lys Ser Val Gly Gln Glu Pro Gly Pro Pro Cys Gly
1 5 10 15
Leu Gly Leu Gly Leu Gly Leu Gly Leu Cys Gly Lys Gln Gly Pro Ala
20 25 30
Ser Pro Ala Pro Glu Pro Ser Arg Ala Pro Ala Pro Ala Thr Pro His
35 40 45
Ala Pro Asp His Ser Pro Ala Pro Asn Ser Pro Thr Leu Thr Arg Pro
50 55 60
Pro Glu Gly Pro Lys Phe Pro Arg Val Lys Asn Trp Glu Leu Gly Ser
65 70 75 80
Ile Thr Tyr Asp Thr Leu Cys Ala Gln Ser Gln Gln Asp Gly Pro Cys
85 90 95
Thr Pro Arg Cys Cys Leu Gly Ser Leu Val Leu Pro Arg Lys Leu Gln
100 105 110
Thr Arg Pro Ser Pro Gly Pro Pro Pro Ala Glu Gln Leu Leu Ser Gln
115 120 125
Ala Arg Asp Phe Ile Asn Gln Tyr Tyr Ser Ser Ile Lys Arg Ser Gly
130 135 140
Ser Gln Ala His Glu Glu Arg Leu Gln Glu Val Glu Ala Glu Val Ala
145 150 155 160
Ser Thr Gly Thr Tyr His Leu Arg Glu Ser Glu Leu Val Phe Gly Ala
165 170 175
Lys Gln Ala Trp Arg Asn Ala Pro Arg Cys Val Gly Arg Ile Gln Trp
180 185 190
Gly Lys Leu Gln Val Phe Asp Ala Arg Asp Cys Ser Ser Ala Gln Glu
195 200 205
Met Phe Thr Tyr Ile Cys Asn His Ile Lys Tyr Ala Thr Asn Arg Gly
210 215 220
Asn Leu Arg Ser Ala Ile Thr Val Phe Pro Gln Arg Ala Pro Gly Arg
225 230 235 240
Gly Asp Phe Arg Ile Trp Asn Ser Gln Leu Val Arg Tyr Ala Gly Tyr
245 250 255
Arg Gln Gln Asp Gly Ser Val Arg Gly Asp Pro Ala Asn Val Glu Ile
260 265 270
Thr Glu Leu Cys Ile Gln His Gly Trp Thr Pro Gly Asn Gly Arg Phe
275 280 285
Asp Val Leu Pro Leu Leu Leu Gln Ala Pro Asp Glu Ala Pro Glu Leu
290 295 300
Phe Val Leu Pro Pro Glu Leu Val Leu Glu Val Pro Leu Glu His Pro
305 310 315 320
Thr Leu Glu Trp Phe Ala Ala Leu Gly Leu Arg Trp Tyr Ala Leu Pro
325 330 335
Ala Val Ser Asn Met Leu Leu Glu Ile Gly Gly Leu Glu Phe Ser Ala
340 345 350
Ala Pro Phe Ser Gly Trp Tyr Met Ser Thr Glu Ile Gly Thr Arg Asn
355 360 365
Leu Cys Asp Pro His Arg Tyr Asn Ile Leu Glu Asp Val Ala Val Cys
370 375 380
Met Asp Leu Asp Thr Arg Thr Thr Ser Ser Leu Trp Lys Asp Lys Ala
385 390 395 400
Ala Val Glu Ile Asn Leu Ala Val Leu His Ser Phe Gln Leu Ala Lys
405 410 415
Val Thr Ile Val Asp His His Ala Ala Thr Val Ser Phe Met Lys His
420 425 430
Leu Asp Asn Glu Gln Lys Ala Arg Gly Gly Cys Pro Ala Asp Trp Ala
435 440 445
Trp Ile Val Pro Pro Ile Ser Gly Ser Leu Thr Pro Val Phe His Gln
450 455 460
Glu Met Val Asn Tyr Ile Leu Ser Pro Ala Phe Arg Tyr Gln Pro Asp
465 470 475 480
Pro Trp Lys Gly Ser Ala Thr Lys Gly Ala Gly Ile Thr Arg Lys Lys
485 490 495
Thr Phe Lys Glu Val Ala Asn Ala Val Lys Ile Ser Ala Ser Leu Met
500 505 510
Gly Thr Leu Met Ala Lys Arg Val Lys Ala Thr Ile Leu Tyr Ala Ser
515 520 525
Glu Thr Gly Arg Ala Gln Ser Tyr Ala Gln Gln Leu Gly Arg Leu Phe
530 535 540
Arg Lys Ala Phe Asp Pro Arg Val Leu Cys Met Asp Glu Tyr Asp Val
545 550 555 560
Val Ser Leu Glu His Glu Ala Leu Val Leu Val Val Thr Ser Thr Phe
565 570 575
Gly Asn Gly Asp Pro Pro Glu Asn Gly Glu Ser Phe Ala Ala Ala Leu
580 585 590
Met Glu Met Ser Gly Pro Tyr Asn Ser Ser Pro Arg Pro Glu Gln His
595 600 605
Lys Ser Tyr Lys Ile Arg Phe Asn Ser Val Ser Cys Ser Asp Pro Leu
610 615 620
Val Ser Ser Trp Arg Arg Lys Arg Lys Glu Ser Ser Asn Thr Asp Ser
625 630 635 640
Ala Gly Ala Leu Gly Thr Leu Arg Phe Cys Val Phe Gly Leu Gly Ser
645 650 655
Arg Ala Tyr Pro His Phe Cys Ala Phe Ala Arg Ala Val Asp Thr Arg
660 665 670
Leu Glu Glu Leu Gly Gly Glu Arg Leu Leu Gln Leu Gly Gln Gly Asp
675 680 685
Glu Leu Cys Gly Gln Glu Glu Ala Phe Arg Gly Trp Ala Lys Ala Ala
690 695 700
Phe Gln Ala Ser Cys Glu Thr Phe Cys Val Gly Glu Glu Ala Lys Ala
705 710 715 720
Ala Ala Gln Asp Ile Phe Ser Pro Lys Arg Ser Trp Lys Arg Gln Arg
725 730 735
Tyr Arg Leu Ser Thr Gln Ala Glu Gly Leu Gln Leu Leu Pro Gly Leu
740 745 750
Ile His Val His Arg Arg Lys Met Phe Gln Ala Thr Val Leu Ser Val
755 760 765
Glu Asn Leu Gln Ser Ser Lys Ser Thr Arg Ala Thr Ile Leu Val Arg
770 775 780
Leu Asp Thr Ala Gly Gln Glu Gly Leu Gln Tyr Gln Pro Gly Asp His
785 790 795 800
Ile Gly Ile Cys Pro Pro Asn Arg Pro Gly Leu Val Glu Ala Leu Leu
805 810 815
Ser Arg Val Glu Asp Pro Pro Pro Pro Thr Glu Ser Val Ala Val Glu
820 825 830
Gln Leu Glu Lys Gly Ser Pro Gly Gly Pro Pro Pro Ser Trp Val Arg
835 840 845
Asp Pro Arg Leu Pro Pro Cys Thr Leu Arg Gln Ala Leu Thr Phe Phe
850 855 860
Leu Asp Ile Thr Ser Pro Pro Ser Pro Arg Leu Leu Arg Leu Leu Ser
865 870 875 880
Thr Leu Ala Glu Glu Pro Ser Glu Gln Gln Glu Leu Glu Thr Leu Ser
885 890 895
Gln Asp Pro Arg Arg Tyr Glu Glu Trp Lys Trp Phe Arg Cys Pro Thr
900 905 910
Leu Leu Glu Val Leu Glu Gln Phe Pro Ser Val Ala Leu Pro Ala Pro
915 920 925
Leu Leu Leu Thr Gln Leu Pro Leu Leu Gln Pro Arg Tyr Tyr Ser Val
930 935 940
Ser Ser Ala Pro Asn Ala His Pro Gly Glu Val His Leu Thr Val Ala
945 950 955 960
Val Leu Ala Tyr Arg Thr Gln Asp Gly Leu Gly Pro Leu His Tyr Gly
965 970 975
Val Cys Ser Thr Trp Leu Ser Gln Leu Lys Thr Gly Asp Pro Val Pro
980 985 990
Cys Phe Ile Arg Gly Ala Pro Ser Phe Arg Leu Pro Pro Asp Pro Tyr
995 1000 1005
Val Pro Cys Ile Leu Val Gly Pro Gly Thr Gly Ile Ala Pro Phe Arg
1010 1015 1020
Gly Phe Trp Gln Glu Arg Leu His Asp Ile Glu Ser Lys Gly Leu Gln
1025 1030 1035 1040
Pro Ala Pro Met Thr Leu Val Phe Gly Cys Arg Cys Ser Gln Leu Asp
1045 1050 1055
His Leu Tyr Arg Asp Glu Val Gln Asp Ala Gln Glu Arg Gly Val Phe
1060 1065 1070
Gly Arg Val Leu Thr Ala Phe Ser Arg Glu Pro Asp Ser Pro Lys Thr
1075 1080 1085
Tyr Val Gln Asp Ile Leu Arg Thr Glu Leu Ala Ala Glu Val His Arg
1090 1095 1100
Val Leu Cys Leu Glu Arg Gly His Met Phe Val Cys Gly Asp Val Thr
1105 1110 1115 1120
Met Ala Thr Ser Val Leu Gln Thr Val Gln Arg Ile Leu Ala Thr Glu
1125 1130 1135
Gly Asp Met Glu Leu Asp Glu Ala Gly Asp Val Ile Gly Val Leu Arg
1140 1145 1150
Asp Gln Gln Arg Tyr His Glu Asp Ile Phe Gly Leu Thr Leu Arg Thr
1155 1160 1165
Gln Glu Val Thr Ser Arg Ile Arg Thr Gln Ser Phe Ser Leu Gln Glu
1170 1175 1180
Arg His Leu Arg Gly Ala Val Pro Trp Ala Phe Asp Pro Pro Gly Pro
1185 1190 1195 1200
Asp Thr Pro Gly Pro
1205
<210> 2
<211> 1203
<212> PRT
<213> Homo sapiens
<220>
<221> SOURCE
<222> 1..1203
<223> /mol_type="protein"
/organism="Homo sapiens"
<400> 2
Met Gly Asn Leu Lys Ser Val Ala Gln Glu Pro Gly Pro Pro Cys Gly
1 5 10 15
Leu Gly Leu Gly Leu Gly Leu Gly Leu Cys Gly Lys Gln Gly Pro Ala
20 25 30
Thr Pro Ala Pro Glu Pro Ser Arg Ala Pro Ala Ser Leu Leu Pro Pro
35 40 45
Ala Pro Glu His Ser Pro Pro Ser Ser Pro Leu Thr Gln Pro Pro Glu
50 55 60
Gly Pro Lys Phe Pro Arg Val Lys Asn Trp Glu Val Gly Ser Ile Thr
65 70 75 80
Tyr Asp Thr Leu Ser Ala Gln Ala Gln Gln Asp Gly Pro Cys Thr Pro
85 90 95
Arg Arg Cys Leu Gly Ser Leu Val Phe Pro Arg Lys Leu Gln Gly Arg
100 105 110
Pro Ser Pro Gly Pro Pro Ala Pro Glu Gln Leu Leu Ser Gln Ala Arg
115 120 125
Asp Phe Ile Asn Gln Tyr Tyr Ser Ser Ile Lys Arg Ser Gly Ser Gln
130 135 140
Ala His Glu Gln Arg Leu Gln Glu Val Glu Ala Glu Val Ala Ala Thr
145 150 155 160
Gly Thr Tyr Gln Leu Arg Glu Ser Glu Leu Val Phe Gly Ala Lys Gln
165 170 175
Ala Trp Arg Asn Ala Pro Arg Cys Val Gly Arg Ile Gln Trp Gly Lys
180 185 190
Leu Gln Val Phe Asp Ala Arg Asp Cys Arg Ser Ala Gln Glu Met Phe
195 200 205
Thr Tyr Ile Cys Asn His Ile Lys Tyr Ala Thr Asn Arg Gly Asn Leu
210 215 220
Arg Ser Ala Ile Thr Val Phe Pro Gln Arg Cys Pro Gly Arg Gly Asp
225 230 235 240
Phe Arg Ile Trp Asn Ser Gln Leu Val Arg Tyr Ala Gly Tyr Arg Gln
245 250 255
Gln Asp Gly Ser Val Arg Gly Asp Pro Ala Asn Val Glu Ile Thr Glu
260 265 270
Leu Cys Ile Gln His Gly Trp Thr Pro Gly Asn Gly Arg Phe Asp Val
275 280 285
Leu Pro Leu Leu Leu Gln Ala Pro Asp Glu Pro Pro Glu Leu Phe Leu
290 295 300
Leu Pro Pro Glu Leu Val Leu Glu Val Pro Leu Glu His Pro Thr Leu
305 310 315 320
Glu Trp Phe Ala Ala Leu Gly Leu Arg Trp Tyr Ala Leu Pro Ala Val
325 330 335
Ser Asn Met Leu Leu Glu Ile Gly Gly Leu Glu Phe Pro Ala Ala Pro
340 345 350
Phe Ser Gly Trp Tyr Met Ser Thr Glu Ile Gly Thr Arg Asn Leu Cys
355 360 365
Asp Pro His Arg Tyr Asn Ile Leu Glu Asp Val Ala Val Cys Met Asp
370 375 380
Leu Asp Thr Arg Thr Thr Ser Ser Leu Trp Lys Asp Lys Ala Ala Val
385 390 395 400
Glu Ile Asn Val Ala Val Leu His Ser Tyr Gln Leu Ala Lys Val Thr
405 410 415
Ile Val Asp His His Ala Ala Thr Ala Ser Phe Met Lys His Leu Glu
420 425 430
Asn Glu Gln Lys Ala Arg Gly Gly Cys Pro Ala Asp Trp Ala Trp Ile
435 440 445
Val Pro Pro Ile Ser Gly Ser Leu Thr Pro Val Phe His Gln Glu Met
450 455 460
Val Asn Tyr Phe Leu Ser Pro Ala Phe Arg Tyr Gln Pro Asp Pro Trp
465 470 475 480
Lys Gly Ser Ala Ala Lys Gly Thr Gly Ile Thr Arg Lys Lys Thr Phe
485 490 495
Lys Glu Val Ala Asn Ala Val Lys Ile Ser Ala Ser Leu Met Gly Thr
500 505 510
Val Met Ala Lys Arg Val Lys Ala Thr Ile Leu Tyr Gly Ser Glu Thr
515 520 525
Gly Arg Ala Gln Ser Tyr Ala Gln Gln Leu Gly Arg Leu Phe Arg Lys
530 535 540
Ala Phe Asp Pro Arg Val Leu Cys Met Asp Glu Tyr Asp Val Val Ser
545 550 555 560
Leu Glu His Glu Thr Leu Val Leu Val Val Thr Ser Thr Phe Gly Asn
565 570 575
Gly Asp Pro Pro Glu Asn Gly Glu Ser Phe Ala Ala Ala Leu Met Glu
580 585 590
Met Ser Gly Pro Tyr Asn Ser Ser Pro Arg Pro Glu Gln His Lys Ser
595 600 605
Tyr Lys Ile Arg Phe Asn Ser Ile Ser Cys Ser Asp Pro Leu Val Ser
610 615 620
Ser Trp Arg Arg Lys Arg Lys Glu Ser Ser Asn Thr Asp Ser Ala Gly
625 630 635 640
Ala Leu Gly Thr Leu Arg Phe Cys Val Phe Gly Leu Gly Ser Arg Ala
645 650 655
Tyr Pro His Phe Cys Ala Phe Ala Arg Ala Val Asp Thr Arg Leu Glu
660 665 670
Glu Leu Gly Gly Glu Arg Leu Leu Gln Leu Gly Gln Gly Asp Glu Leu
675 680 685
Cys Gly Gln Glu Glu Ala Phe Arg Gly Trp Ala Gln Ala Ala Phe Gln
690 695 700
Ala Ala Cys Glu Thr Phe Cys Val Gly Glu Asp Ala Lys Ala Ala Ala
705 710 715 720
Arg Asp Ile Phe Ser Pro Lys Arg Ser Trp Lys Arg Gln Arg Tyr Arg
725 730 735
Leu Ser Ala Gln Ala Glu Gly Leu Gln Leu Leu Pro Gly Leu Ile His
740 745 750
Val His Arg Arg Lys Met Phe Gln Ala Thr Ile Arg Ser Val Glu Asn
755 760 765
Leu Gln Ser Ser Lys Ser Thr Arg Ala Thr Ile Leu Val Arg Leu Asp
770 775 780
Thr Gly Gly Gln Glu Gly Leu Gln Tyr Gln Pro Gly Asp His Ile Gly
785 790 795 800
Val Cys Pro Pro Asn Arg Pro Gly Leu Val Glu Ala Leu Leu Ser Arg
805 810 815
Val Glu Asp Pro Pro Ala Pro Thr Glu Pro Val Ala Val Glu Gln Leu
820 825 830
Glu Lys Gly Ser Pro Gly Gly Pro Pro Pro Gly Trp Val Arg Asp Pro
835 840 845
Arg Leu Pro Pro Cys Thr Leu Arg Gln Ala Leu Thr Phe Phe Leu Asp
850 855 860
Ile Thr Ser Pro Pro Ser Pro Gln Leu Leu Arg Leu Leu Ser Thr Leu
865 870 875 880
Ala Glu Glu Pro Arg Glu Gln Gln Glu Leu Glu Ala Leu Ser Gln Asp
885 890 895
Pro Arg Arg Tyr Glu Glu Trp Lys Trp Phe Arg Cys Pro Thr Leu Leu
900 905 910
Glu Val Leu Glu Gln Phe Pro Ser Val Ala Leu Pro Ala Pro Leu Leu
915 920 925
Leu Thr Gln Leu Pro Leu Leu Gln Pro Arg Tyr Tyr Ser Val Ser Ser
930 935 940
Ala Pro Ser Thr His Pro Gly Glu Ile His Leu Thr Val Ala Val Leu
945 950 955 960
Ala Tyr Arg Thr Gln Asp Gly Leu Gly Pro Leu His Tyr Gly Val Cys
965 970 975
Ser Thr Trp Leu Ser Gln Leu Lys Pro Gly Asp Pro Val Pro Cys Phe
980 985 990
Ile Arg Gly Ala Pro Ser Phe Arg Leu Pro Pro Asp Pro Ser Leu Pro
995 1000 1005
Cys Ile Leu Val Gly Pro Gly Thr Gly Ile Ala Pro Phe Arg Gly Phe
1010 1015 1020
Trp Gln Glu Arg Leu His Asp Ile Glu Ser Lys Gly Leu Gln Pro Thr
1025 1030 1035 1040
Pro Met Thr Leu Val Phe Gly Cys Arg Cys Ser Gln Leu Asp His Leu
1045 1050 1055
Tyr Arg Asp Glu Val Gln Asn Ala Gln Gln Arg Gly Val Phe Gly Arg
1060 1065 1070
Val Leu Thr Ala Phe Ser Arg Glu Pro Asp Asn Pro Lys Thr Tyr Val
1075 1080 1085
Gln Asp Ile Leu Arg Thr Glu Leu Ala Ala Glu Val His Arg Val Leu
1090 1095 1100
Cys Leu Glu Arg Gly His Met Phe Val Cys Gly Asp Val Thr Met Ala
1105 1110 1115 1120
Thr Asn Val Leu Gln Thr Val Gln Arg Ile Leu Ala Thr Glu Gly Asp
1125 1130 1135
Met Glu Leu Asp Glu Ala Gly Asp Val Ile Gly Val Leu Arg Asp Gln
1140 1145 1150
Gln Arg Tyr His Glu Asp Ile Phe Gly Leu Thr Leu Arg Thr Gln Glu
1155 1160 1165
Val Thr Ser Arg Ile Arg Thr Gln Ser Phe Ser Leu Gln Glu Arg Gln
1170 1175 1180
Leu Arg Gly Ala Val Pro Trp Ala Phe Asp Pro Pro Gly Ser Asp Thr
1185 1190 1195 1200
Asn Ser Pro
<210> 3
<211> 4
<212> PRT
<213> Bos taurus
<220>
<221> SOURCE
<222> 1..4
<223> /mol_type="protein"
/organism="Bos taurus"
<400> 3
Pro Trp Ala Phe
1
<210> 4
<211> 4
<212> PRT
<213> Bos taurus
<220>
<221> SOURCE
<222> 1..4
<223> /mol_type="protein"
/organism="Bos taurus"
<400> 4
Gly Ala Val Pro
1
<210> 5
<211> 21
<212> PRT
<213> Bos taurus
<220>
<221> SOURCE
<222> 1..21
<223> /mol_type="protein"
/organism="Bos taurus"
<400> 5
Arg His Leu Arg Gly Ala Val Pro Trp Ala Phe Asp Pro Pro Gly Pro
1 5 10 15
Asp Thr Pro Gly Pro
20
<210> 6
<211> 12
<212> PRT
<213> Bos taurus
<220>
<221> SOURCE
<222> 1..12
<223> /mol_type="protein"
/organism="Bos taurus"
<400> 6
Ala Phe Asp Pro Pro Gly Pro Asp Thr Pro Gly Pro
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Bos taurus
<220>
<221> SOURCE
<222> 1..11
<223> /mol_type="protein"
/organism="Bos taurus"
<400> 7
His Leu Arg Gly Ala Val Pro Trp Ala Phe Asp
1 5 10
<210> 8
<211> 20
<212> PRT
<213> Bos taurus
<220>
<221> SOURCE
<222> 1..20
<223> /mol_type="protein"
/organism="Bos taurus"
<400> 8
His Leu Arg Gly Ala Val Pro Trp Ala Phe Asp Pro Pro Gly Pro Asp
1 5 10 15
Thr Pro Gly Pro
20
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ ГОЛОВОКРУЖЕНИЙ | 2013 |
|
RU2577136C2 |
| АНТИ-PD-L1 АНТИТЕЛО ДЛЯ ДЕТЕКЦИИ PD-L1 | 2018 |
|
RU2758723C2 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2020 |
|
RU2835543C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО АНТИ-EGFR/АНТИ-4-1ВВ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831836C2 |
| АНТИ-PCSK9 АНТИТЕЛО, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2739208C2 |
| ВЫСОКОАФФИННЫЕ АНТИ-PD-1 И АНТИ-LAG-3 АНТИТЕЛА И ПОЛУЧЕННЫЕ ИЗ НИХ БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2782381C2 |
| БИФУНКЦИОНАЛЬНЫЕ БЕЛКИ, КОМБИНИРУЮЩИЕ БЛОКАДУ КОНТРОЛЬНОЙ ТОЧКИ, ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ | 2019 |
|
RU2756899C1 |
| МОНОСПЕЦИФИЧЕСКИЕ И БИСПЕЦИФИЧЕСКИЕ БЕЛКИ С РЕГУЛИРОВАНИЕМ ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2793167C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ АНТИТЕЛАМИ, КОТОРЫЕ СВЯЗЫВАЮТСЯ С РЕЦЕПТОРОМ КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА 1 (CSF1R) | 2013 |
|
RU2718751C2 |
Настоящая группа изобретений относится к медицине, а именно к терапии, и касается лечения вегето-сосудистой дистонии. Для этого вводят активированную потенцированную форму антител к мозгоспецифическому белку S-100 в сочетании с активированной потенцированной формой антител к эндотелиальной NO-синтазе. Такое сочетанное введение обеспечивает эффективное лечение вегето-сосудистой дистонии за счет синергетического действия вводимых соединений. 2 н. и 8 з.п. ф-лы, 16 табл., 4 пр.
1. Способ лечения вегето-сосудистой дистонии, характеризующийся тем, что в организм вводят активированную-потенцированную форму антител к мозгоспецифическому белку S-100 одновременно и сочетано с активированной-потенцированной формой антител к эндотелиальной NO-синтазе.
2. Способ по п.1, характеризующийся тем, что активированную-потенцированную форму антител к мозгоспецифическому белку S-100 и активированную-потенцированную форму антител к эндотелиальной NO-синтазе используют в виде активированного-потенцированного водного или водно-спиртового раствора каждого компонента, активность которого обусловлена процессом последовательного многократного разведения в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
3. Способ лечения по п.1 или 2, характеризующийся тем, что используют приготовленные в виде единого лекарственного препарата - одной лекарственной формы смесь различных разведений антител к мозгоспецифическому белку S-100 в сочетании со смесью различных разведений антител к эндотелиальной NO-синтазе, приготовленных по гомеопатической технологии.
4. Способ лечения по п.1 или 2, характеризующееся тем, что используют активированную-потенцированную форму антител к мозгоспецифическому белку S-100 и активированную-потенцированную форму антител к эндотелиальной NO-синтазе в твердой лекарственной форме, которая содержит эффективное количество гранул нейтрального носителя, насыщенного смесью водных или водно-спиртовых растворов активированной-потенцированной формы антител к мозгоспецифическому белку S-100, активированной-потенцированной формы антител к эндотелиальной NO-синтазе и фармацевтически приемлемые добавки, включающие лактозу, целлюлозу микрокристаллическую и магния стеарат.
5. Лекарственное средство для лечения вегето-сосудистой дистонии, характеризующееся тем, что выполнено в виде фармацевтической композиции и содержит активированную-потенцированную форму антител к мозгоспецифическому белку S-100 и активированную-потенцированную форму антител к эндотелиальной NO-синтазе.
6. Лекарственное средство по п.5, характеризующееся тем, что активированную-потенцированную форму антител к мозгоспецифическому белку S-100 и активированную-потенцированную форму антител к эндотелиальной NO-синтазе используют в виде активированного-потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
7. Лекарственное средство по п.5, характеризующееся тем, что фармацевтическая композиция выполнена в твердой лекарственной форме и содержит эффективное количество гранул нейтрального носителя, насыщенного смесью водных или водно-спиртовых растворов активированной-потенцированной формы антител к мозгоспецифическому белку S-100 и активированной-потенцированной формы антител к эндотелиальной NO-синтазе, и фармацевтически приемлемые добавки.
8. Лекарственное средство по п.6, характеризующееся тем, что водные или водно-спиртовые растворы активированных-потенцированных форм антител к мозгоспецифическому белку S-100 и к эндотелиальной NO-синтазе получены путем многократного последовательного разведения в сочетании с внешним воздействием - встряхиванием каждого разведения из матричных растворов аффинно очищенных антител к мозгоспецифическому белку S-100 и к эндотелиальной NO-синтазе с концентрацией 0,5÷5,0 мг/мл.
9. Лекарственное средство по п.6, характеризующееся тем, что каждый из компонентов используют в виде смеси различных, преимущественно сотенных, разведений, приготовленных по гомеопатической технологии.
10. Лекарственное средство по п.7, характеризующееся тем, что фармацевтически приемлемые добавки включают лактозу, целлюлозу микрокристаллическую и магния стеарат.
Авторы
Даты
2016-03-10—Публикация
2013-12-06—Подача