Область техники
[001] Предлагаются способы лечения патологических состояний антителами, которые связываются с рецептором колониестимулирующего фактора 1 (CSF1R). Подобные способы включают, в частности, способы лечения воспалительных и аутоиммунных состояний, таких как ревматоидный артрит, рассеянный склероз и системная красная волчанка.
Уровень техники
[002] Ревматоидный артрит (РА) представляет собой системное воспалительное заболевание, которое характеризуется симметричным полиартритом, поражающим, в первую очередь, малые суставы рук и ног, хотя поражаются также другие суставы. Пациенты с более агрессивным - обычно, положительным по ревматоидному фактору (РФ) - заболеванием могут иметь внесуставные проявления, такие как ревматоидные узелки, васкулит, склерит, перикардит и синдром Фелти. Большинство пациентов с РА испытывают прогрессирующее разрушение хряща и кости в пораженных суставах, что, в конечном итоге, может привести к постоянной инвалидности. По имеющимся сведениям, долгосрочный прогноз РА является неблагоприятным, при этом приблизительно 50% пациентов испытывают серьезную функциональную недееспособность в пределах 10 лет с момента установления диагноза. РА также связан со снижением продолжительности жизни примерно на 3-10 лет.
[003] Рецептор колониестимулирующего фактора 1 (называемый в данном документе CSF1R; также известный в данной области техники как рецептор FMS, FIM2, C-FMS, M-CSF и CDU5) представляет собой однопроходный трансмембранный рецептор с N-концевым внеклеточным доменом (ECD) и C-концевым внутриклеточным доменом с тирозинкиназной активностью. Связывание лиганда CSF1 или лиганда интерлейкин 34 (называемый в данном документе IL-34; Lin и соавт., Science 320: 807-11 (2008)) с CSF1R приводит к димеризации рецептора, положительной регуляции активности протеин-тирозин киназы CSF1R, фосфорилированию остатков тирозина CSF1R и событиям нисходящих сигналов. Как CSF1, так и IL-34, стимулируют выживание моноцитов, пролиферацию, дифференциацию в макрофаги, а также другие клеточные линии моноцитов, таких как остеокласты, дендритные клетки и микроглия.
[004] Было обнаружено, что многие опухолевые клетки секретируют CSF1, который активирует моноциты/макрофаги с помощью CSF1R. Уровень CSF1 в опухолях, как было показано, коррелирует с уровнем ассоциированных с опухолью макрофагов (ТАМ) в опухоли. Более высокие уровни ТАМ, как было обнаружено, коррелируют с неблагоприятными прогнозами пациентов. Кроме того было показано, что CSF1 способствует росту опухоли и прогрессированию метастазирования у, например, ксенотрансплантатов рака молочной железы человека у мышей. Смотри, например, Paulus и соавт., Cancer Res. 66: 4349-56 (2006). Кроме того, CSF1R играет важную роль в остеолитической деструкции костной ткани при метастазировании в кости. Смотри, например, Ohno и соавт., Mol. CancerTher. 5: 2634-43 (2006).
[005] CSF1 и его рецептор, как было показано, участвуют в различных воспалительных и аутоиммунных заболеваниях. Смотри, например, Hamilton, Nat. Rev. 8: 533-44 (2008). Например, синовиальные клетки эндотелия из суставов, пораженных ревматоидным артритом, как было показано, получают CSF1, что свидетельствует о роли CSF1 и его рецептора в этом заболевании. Блокирование активности CSF1R антителом приводит к положительным клиническим эффектам в мышиных моделях артрита, в том числе подавление деструкции кости и хряща и сокращение числа макрофагов. Смотри, например, Kitaura и соавт., J. Clin. Invest. 115: 3418-3427 (2005).
[006] Зрелые дифференцированные клетки миелоидного ряда, такие как макрофаги, клетки микроглии и остеокласты, способствуют патологии различных заболеваний, таких как ревматоидный артрит, рассеянный склероз и остеопороз. Дифференцированные клетки миелоидного ряда получают из интермедиатов моноцитов периферической крови. Стимуляция CSF1R способствует развитию моноцитов из предшественников костного мозга, пролиферации моноцитов и выживаемости и дифференциации моноцитов периферической крови в дифференцированные клетки миелоидного ряда, такие как макрофаги, микроглиальные клетки и остеокласты. Таким образом, стимуляция CSF1R, способствует пролиферации, выживаемости, активации и созреванию клеточных линий дифференцированных миелоидных клеток, а в случае патологии стимуляция CSF1R обеспечивает способность клеточных линий дифференцированных клеток миелоидного ряда опосредовать патологию заболевания.
Краткое описание изобретения
[007] В некоторых вариантах реализации изобретения предлагаются способы снижения у субъекта уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти, по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9. В некоторых вариантах реализации изобретения способ включает введение субъекту эффективного количества антитела, которое связывается с рецептором колониестимулирующего фактора 1 (CSF1R), причем антитело блокирует связывание колониестимулирующего фактора 1 (CSF1) с CSF1R и блокирует связывание IL-34 с CSF1R. В некоторых вариантах реализации изобретения субъект имеет воспалительный процесс. В некоторых вариантах реализации изобретения субъект имеет патологическое состояние, выбранное из ревматоидного артрита, ювенильного идиопатического артрита, болезни Кастлемана, псориаза, псориатического артрита, анкилозирующего спондилита, болезни Крона, язвенного колита, системной красной волчанки, воспалительного заболевания кишечника, воспалительного артрита и нарушений CD16+.
[008] В некоторых вариантах реализации изобретения способ включает снижение уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или четырех факторов, выбранных из IL-6, IL-1β, TNF-α и CXCL10. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-6. В некоторых подобных вариантах реализации изобретения субъект имеет патологическое состояние, выбранное из ревматоидного артрита, ювенильного идиопатического артрита и заболевания Кастлемана. В некоторых вариантах реализации изобретения способ включает снижение уровня TNF-α. В некоторых подобных вариантах реализации изобретения субъект имеет состояние, выбранное из ревматоидного артрита, ювенильного идиопатического артрита, псориаза, псориатического артрита, анкилозирующего спондилита, болезни Крона и язвенного колита. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-1β. В некоторых подобных вариантах реализации изобретения субъект имеет патологическое состояние, выбранное из ревматоидного артрита и ювенильного идиопатического артрита. В некоторых вариантах реализации изобретения способ включает снижение уровня CXCL10.
[009] В некоторых вариантах реализации изобретения способ включает снижение уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или четырех факторов, выбранных из IL-6, IL-1β, TNF-α и CXCL10. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-6; или способ включает снижение уровня TNF-α; или способ включает снижение уровня IL-1β; или способ включает снижение уровня CXCL10; или способ включает снижение уровней IL-6 и TNF-α; или способ включает снижение уровней IL-6 и IL-1β; или способ включает снижение уровней IL-6 и CXCL10; или способ включает снижение уровней TNF-α и IL-1β; или способ включает снижение уровней TNF-α и CXCL10; или способ включает снижение уровней IL-1β и CXCL10; или способ включает снижение уровней IL-6, TNF-α и IL-1β; или способ включает снижение уровней IL-6, TNF-α и CXCL10; или способ включает снижение уровней TNF-α, IL-1β и CXCL10; или способ включает снижение уровней IL-6, IL-1β и CXCL10; или способ включает снижение уровней IL-6, IL-1β, TNF-α и CXCL10.
[010] В некоторых вариантах реализации изобретения предлагаются способы лечения патологических состояний, связанных с повышенным уровнем по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9. В некоторых вариантах реализации изобретения способ включает введение субъекту с патологическим состоянием эффективного количества антитела, которое связывается с рецептором колониестимулирующего фактора 1 (CSF1R), причем антитело блокирует связывание колониестимулирующего фактора 1 (CSF1) с CSF1R и блокирует связывание IL-34 с CSF1R. В некоторых вариантах реализации изобретения антитело снижает уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9. В некоторых вариантах реализации изобретения субъект имеет патологическое состояние, выбранное из ревматоидного артрита, ювенильного идиопатического артрита, заболевания Кастлемана, псориаза, псориатического артрита, анкилозирующего спондилита, болезни Крона, язвенного колита, системной красной волчанки и воспалительного заболевания кишечника. В некоторых вариантах реализации изобретения патологическое состояние связано с повышенным уровнем по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или четырех факторов, выбранных из IL-6, IL-1β, TNF-α и CXCL10. В некоторых вариантах реализации изобретения патологическое состояние связывают с повышенным уровнем IL-6. В некоторых подобных вариантах реализации изобретения патологическое состояние выбирают из ревматоидного артрита, ювенильного идиопатического артрита и заболевания Кастлемана. В некоторых вариантах реализации изобретения патологическое состояние связывают с повышенным уровнем TNF-α. В некоторых подобных вариантах реализации изобретения патологическое состояние выбирают из ревматоидного артрита, ювенильного идиопатического артрита, псориаза, псориатического артрита, анкилозирующего спондилита, болезни Крона и язвенного колита. В некоторых вариантах реализации изобретения патологическое состояние связывают с повышенным уровнем IL-1β. В некоторых подобных вариантах реализации изобретения патологическое состояние выбирают из ревматоидного артрита и ювенильного идиопатического артрита. В некоторых вариантах реализации изобретения патологическое состояние связывают с повышенным уровнем CXCL10.
[011] В некоторых вариантах реализации изобретения предлагается способ лечения воспалительного артрита. В некоторых вариантах способ включает введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R, и при этом антитело снижает уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9. В некоторых подобных вариантах реализации изобретения воспалительный артрит выбирают из ревматоидного артрита, псориатического артрита, анкилозирующего спондилита и ювенильного идиопатического артрита.
[012] В некоторых вариантах реализации изобретения предлагаются способы лечения воспалительного процесса. В некоторых вариантах реализации изобретения способ включает введение субъекту с воспалительным процессом эффективного количества антитела, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R, и при этом антитело снижает уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или, по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9. В некоторых вариантах реализации изобретения воспалительное состояние выбирают из ревматоидного артрита, ювенильного идиопатического артрита, заболевания Кастлемана, псориаза, псориатического артрита, анкилозирующего спондилита, болезни Крона, язвенного колита, системной красной волчанки и воспалительного заболевания кишечника.
[013] В некоторых вариантах реализации изобретения предлагаются способы лечения нарушения CD16+. В некоторых вариантах реализации изобретения способ включает введение субъекту с нарушением CD16+ эффективного количества антитела, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R, и при этом антитело снижает уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9. В некоторых вариантах реализации изобретения антитело снижает уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или четырех факторов, выбранных из IL-6, IL-1β, TNF-α и CXCL10. В некоторых вариантах реализации изобретения нарушение CD16+ выбирают из ревматоидного артрита, ювенильного идиопатического артрита, заболевания Кастлемана, псориаза, псориатического артрита, анкилозирующего спондилита, болезни Крона, язвенного колита, системной красной волчанки и воспалительного заболевания кишечника. В некоторых вариантах реализации изобретения антитело значительно уменьшает количество CD16+ моноцитов. В некоторых вариантах реализации изобретения количество CD16- моноцитов существенно не изменяется после введения антитела.
[014] В любом из вариантов реализации изобретения, описанных в данном документе, антитело может снизить уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9 in vitro.
[015] В любом из вариантов реализации изобретения, описанных в данном документе, субъект может иметь повышенный уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, перед введением антитела.
[016] В некоторых вариантах реализации изобретения способ дополнительно содержит введение по меньшей мере одного дополнительного терапевтического средства, выбранного из метотрексата, анти-TNF средства, глюкокортикоида, циклоспорина, лефлуномида, азатиоприна, ингибитора JAK, ингибитора SYK, анти-IL-6 средства, анти-CD20 средства, анти-CD19 средства, анти-GM-CSF средства, анти-IL-1 средства и средства CTLA4. В некоторых вариантах реализации изобретения по меньшей мере одно дополнительное терапевтическое средство выбирают из метотрексата, анти-TNF-α антитела, растворимого рецептора TNF, глюкокортикоида, циклоспорина, лефлуномида, азатиоприна, ингибитора JAK, ингибитора SYK, анти-IL-6-антитела, антитела анти-IL-6 рецептора, анти-CD20 антитела, анти-CD19 антитела, анти-GM-CSF антитела и антитела анти-GM-CSF рецептора, анти-IL-1 антитела, антагониста рецептора IL-1 и слитой молекулы CTLA4-Ig. В некоторых вариантах реализации изобретения патологическое состояние является устойчивым к метотрексату.
[017] В некоторых вариантах реализации изобретения предлагается способ лечения воспалительного состояния, причем способ включает (а) определение у субъекта с воспалительным процессом уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9; и (b) при условии, что у субъекта повышается уровень по меньшей мере одного из факторов, введение субъекту эффективного количества антитела, которое связывается с CSF1R и блокирует связывание IL-34 с CSF1R, причем антитело снижает уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и MMP-9.
[018] В некоторых вариантах реализации изобретения предлагается способ лечения воспалительного состояния, причем способ включает (а) определение у субъекта с воспалительным процессом повышенного уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9; и (b) введение субъекту эффективного количества антитела, которое связывается с CSF1R и блокирует связывание IL-34 с CSF1R, причем антитело снижает уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9.
[019] В любом из способов, описанных в данном документе, антитело может снижать уровень IL-6; или антитело может снижать уровень TNF-α; или антитело может снижать уровень IL-1β; или антитело может снижать уровень CXCL10; или антитело может снижать уровень IL-6 и TNF-α; или антитело может снижать уровень IL-6 и IL-1β; или антитело может снижать уровень IL-6 и CXCL10; или антитело может снижать уровень TNF-α и IL-1β; или антитело может снижать уровень TNF-α и CXCL10; или антитело может снижать уровень IL-1β и CXCL10; или антитело может снижать уровень IL-6, TNF-α и IL-1β; или антитело может снижать уровни IL-6, TNF-а, и CXCL10; или антитело может снижать уровень TNF-α, IL-1β и CXCL10; или способ включает снижение уровней IL-6, IL-1β и CXCL10; или антитело может снижать уровень IL-6, IL-1β, TNF-α и CXCL10.
[020] В некоторых вариантах реализации изобретения предлагается способ идентификации субъекта, который может получить лечебно-профилактический эффект от антитела, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R, включающий определение у субъекта уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, при этом повышенный уровень по меньшей мере одного фактора у субъекта указывает на то, что указанный субъект могут получить лечебно-профилактический эффект от антитела, которое связывается с CSF1R. В некоторых вариантах реализации изобретения субъект имеет нарушение CD16+. В некоторых вариантах реализации изобретения субъект имеет ревматоидный артрит. В некоторых вариантах реализации изобретения субъект имеет повышенный уровень CD16+ моноцитов.
[021] В некоторых вариантах реализации изобретения предлагается способ идентификации субъекта, который может получить лечебно-профилактический эффект от антитела, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R, включающий определение у субъекта уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, при этом повышенный уровень по меньшей мере одного фактора у субъекта указывает на то, что субъект, скорее всего, отвечает на антитело, которое связывается с CSF1R. В некоторых вариантах реализации изобретения субъект имеет нарушение CD16+. В некоторых вариантах реализации изобретения субъект имеет ревматоидный артрит. В некоторых вариантах реализации изобретения субъект имеет повышенный уровень CD16+ моноцитов.
[022] В любом из вариантов реализации изобретения, описанных в данном документе, патологическое состояние может быть устойчивым к метотрексату и/или субъект может быть субъектом с неадекватным ответом на метотрексат. В любом из вариантов реализации изобретения, описанных в данном документе, патологическое состояние может быть устойчивым к ингибитору TNF и/или субъект может быть субъектом с неадекватным ответом на ингибитор TNF.
[023] В некоторых вариантах реализации изобретения предлагается способ лечения субъекта с неадекватным ответом на метотрексат, включающий введение субъекту с неадекватным ответом на метотрексат эффективного количества антитела, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R. В некоторых вариантах реализации изобретения предлагается способ лечения субъекта с неадекватным ответом на ингибитор TNF, включающий введение субъекту с неадекватным ответом на ингибитор TNF эффективного количества антитела, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R. В некоторых вариантах реализации изобретения субъект с неадекватным ответом имеет нарушение CD16+. В некоторых вариантах реализации изобретения нарушение CD16+ представляет собой ревматоидный артрит. В некоторых вариантах реализации изобретения антитело значительно уменьшает количество CD16+ моноцитов. В некоторых вариантах реализации изобретения количество CD16- моноцитов существенно не изменяется после введения антитела. В некоторых вариантах реализации изобретения уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, у субъекта с неадекватным ответом на метотрексат и/или TNF-ингибитор снижается после введения антитела.
[024] В любом из способов, описанных в данном документе, антитело может быть введено в дозе 0,2 мг/кг, 1 мг/кг, 3 мг/кг или 10 мг/кг. В любом из способов, описанных в данном документе, эффективное количество антитела может составлять 0,2 мг/кг, 1 мг/кг, 3 мг/кг или 10 мг/кг. В некоторых вариантах реализации изобретения предлагается способ лечения ревматоидного артрита, включающий введение субъекту эффективного количества антитела, которое связывается с рецептором колониестимулирующего фактора 1 (CSF1R), причем антитело блокирует связывание колониестимулирующего фактора 1 (CSF1) с CSF1R и блокирует связывание IL-34 с CSF1R, при этом эффективное количество составляет 0,2 мг/кг, 1 мг/кг, 3 мг/кг или 10 мг/кг.
[025] В некоторых вариантах реализации изобретения предлагается способ снижения резорбции костной ткани у субъекта с ревматоидным артритом, включающий введение субъекту эффективного количества антитела, которое связывается с рецептором колониестимулирующего фактора 1 (CSF1R), причем антитело блокирует связывание колониестимулирующего фактора 1 (CSF1) с CSF1R и блокирует связывание IL-34 с CSF1R. В некоторых вариантах реализации изобретения эффективное количество составляет 0,2 мг/кг, 1 мг/кг, 3 мг/кг или 10 мг/кг. В некоторых вариантах реализации изобретения снижение резорбции костной ткани измеряют путем определения уровня одного или более из TRAP5b, NTx и СТх, причем снижение уровня одного или более из TRAP5b, NTx и СТх указывает на снижение резорбции костной ткани. В некоторых вариантах реализации изобретения уровень TRAP5b определяют в сыворотке или плазме крови. В некоторых вариантах реализации изобретения уровень NTx определяют в моче. В некоторых вариантах реализации изобретения уровень СТх определяют в сыворотке крови.
[026] В любом из вариантов реализации изобретения, описанных в данном документе, измерение фактора после введения антитела, которое связывается с CSF1R, могут осуществлять в течение 6 часов, в течение 8 часов, в течение 12 часов, в течение 18 часов, в течение 1 дня, в течение 2 дней, в течение 3 дней, в течение 1 недели или в течение 2 недель после введения антитела.
[027] В некоторых вариантах реализации изобретения после введения эффективной дозы антитела, которое связывается с CSF1R, причем антитело блокирует связывание колониестимулирующего фактора 1 (CSF1) с CSF1R и блокирует связывание IL-34 с CSF1R, уровень AST и/или ALT в сыворотке крови субъекта не превышает 8-кратную верхнюю границу нормы (ULN). В некоторых вариантах реализации изобретения после введения уровень креатинкиназы (СК) в образце сыворотки субъекта не превышает 10-кратную ULN. В некоторых вариантах реализации изобретения после введения уровень аспартатаминотрансферазы (AST) и/или аланинаминотрансферазы (ALT) в образце сыворотки субъекта не превышает 3-кратную ULN, а общий билирубин в образце сыворотки субъекта не превышает 2-кратную ULN. В некоторых вариантах реализации изобретения уровень AST, ALT, СК и/или билирубина определяют в течение 6 часов, в течение 8 часов, в течение 12 часов, в течение 18 часов, в течение 1 дня, в течение 2 дней, в течение 3 дней, в течение 1 недели или в течение 2 недель после введения антитела, которое связывается с CSF1R.
[028] В любом из способов, описанных в данном документе, тяжелая цепь антитела и/или легкая цепь антитела могут иметь структуру, описанную ниже.
[029] В любом из способов, описанных в данном документе, тяжелая цепь антитела может содержать последовательность, которая по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45. В любом из способов, описанных в данном документе, легкая цепь антитела может содержать последовательность, которая по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52. В любом из способов, описанных в данном документе, тяжелая цепь антитела может содержать последовательность, которая по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45, а легкая цепь антитела может содержать последовательность, которая по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52.
[030] В любом из способов, описанных в данном документе, HCCDR1, HCCDR2 и HCCDR3 могут содержать набор последовательностей, выбранных из: (а) SEQ ID NO: 15, 16 и 17; (b) SEQ ID NO: 21, 22 и 23; и (с) SEQ ID NO: 27, 28 и 29. В любом из способов, описанных в данном документе, LCCDR1, LCCDR2 и LCCDR3 могут содержать набор последовательностей, выбранных из: (a) SEQ ID NO: 18, 19 и 20; (b) SEQ ID NO: 24, 25 и 26; и (с) SEQ ID NO: 30, 31 и 32.
[031] В любом из способов, описанных в данном документе, тяжелая цепь может содержать HCCDR1, HCCDR2 и HCCDR3, причем HCCDR1, НС CDR2 и HCCDR3 содержат набор последовательностей, выбранных из: (a) SEQ ID NO: 15, 16 и 17; (b) SEQ ID NO: 21, 22 и 23; и (с) SEQ ID NO: 27, 28 и 29; а легкая цепь может содержать LCCDR1, LCCDR2 и LCCDR3, причем LCCDR1, LCCDR2 и LCCDR3 содержат набор последовательностей, выбранных из: (a) SEQ ID NO: 18, 19 и 20; (b) SEQ ID NO: 24, 25 и 26; и (с) SEQ ID NO: 30, 31 и 32.
[032] В любом из способов, описанных в данном документе, антитело, которое связывается с CSF1R, может содержать: (а) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 9, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 10; (b) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 11, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 12; (с) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 13, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или на 100% идентична SEQ ID NO: 14; (d) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или на 100% идентична SEQ ID NO: 39, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 46; (е) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 40, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 46; (f) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 41, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 46; (g) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 39, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 47; (h) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 40, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 47; (i) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 41, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 47; и (j) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 42, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 48; (k) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 42, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 49; (l) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 42, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 50; (m) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 43, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 48; (n) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 43, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 49; (о) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 43, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 50; (p) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 44, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 51; (q) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 44, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 52; (r) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 45, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 51; или (s) тяжелую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 45, и легкую цепь, содержащую последовательность, которая по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 99% или 100% идентична SEQ ID NO: 52.
[033] В любом из способов, описанных в данном документе, антитело может содержать: (а) тяжелую цепь, содержащую CDR1 тяжелой цепи (НС), которая имеет последовательность SEQ ID NO: 15, HCCDR2, которая имеет последовательность SEQ ID NO: 16, и HCCDR3, которая имеет последовательность SEQ ID NO: 17, и легкую цепь, содержащую CDR1 легкой цепи (LC), которая имеет последовательность SEQ ID NO: 18, LCCDR2, которая имеет последовательность SEQ ID NO: 19, и LCCDR3, которая имеет последовательность SEQ ID NO: 20; (b) тяжелую цепь, содержащую CDR1 тяжелой цепи (НС), которая имеет последовательность SEQ ID NO: 21, HCCDR2, которая имеет последовательность SEQ ID NO: 22, и HCCDR3, которая имеет последовательность SEQ ID NO: 23, и легкую цепь, содержащую CDR1 легкой цепи (LC), которая имеет последовательность SEQ ID NO: 24, LCCDR2, которая имеет последовательность SEQ ID NO: 25, и LCCDR3, которая имеет последовательность SEQ ID NO: 26; или (с) тяжелую цепь, содержащую (НС) CDR1 тяжелой цепи, которая имеет последовательность SEQ ID NO: 27, HCCDR2, которая имеет последовательность SEQ ID NO: 28, и HCCDR3, которая имеет последовательность SEQ ID NO: 29, и легкую цепь, содержащую CDR1 легкой цепи (LC), которая имеет последовательность SEQ ID NO: 30, LCCDR2, которая имеет последовательность SEQ ID NO: 31, и LCCDR3, которая имеет последовательность SEQ ID NO: 32.
[034] В любом из способов, описанном в данном документе, антитело может содержать: (а) тяжелую цепь, содержащую последовательность SEQ ID NO: 53, и легкую цепь, содержащую последовательность SEQ ID NO: 60; (b) тяжелую цепь, содержащую последовательность SEQ ID NO: 53, и легкую цепь, содержащую последовательность SEQ ID NO: 61; или (с) тяжелую цепь, содержащую последовательность SEQ ID NO: 58, и легкую цепь, содержащую последовательность SEQ ID NO: 65. В некоторых вариантах реализации изобретения антитело содержит тяжелую цепь и легкую цепь, причем антитело содержит: (а) тяжелую цепь, состоящую из последовательности SEQ ID NO: 53, и легкую цепь, состоящую из последовательности SEQ ID NO: 60; (b) тяжелую цепь, состоящую из последовательности SEQ ID NO: 53, и легкую цепь, состоящую из последовательности SEQ ID NO: 61; или (с) тяжелую цепь, состоящую из последовательности SEQ ID NO: 58 и легкую цепь, состоящую из последовательности SEQ ID NO: 65.
[035] В любом из способов, описанном в данном документе, антитело может быть гуманизированным антителом. В любом из способов, описанном в данном документе, антитело может быть выбранным из Fab, Fv, scFv, Fab' и (Fab')2. В любом из способов, описанном в данном документе, антитело может быть химерным антителом. В любом из способов, описанном в данном документе, антитело может быть выбранным из IgA, IgG, и IgD. В любом из способов, описанном в данном документе, антитело может представлять собой IgG. В любом из способов, описанном в данном документе, антитело может представлять собой IgG4. В любом из способов, описанном в данном документе, антитело может представлять собой IgG4, содержащий мутацию S241P в по меньшей мере одной константной области тяжелой цепи IgG4.
[036] В любом из способов, описанном в данном документе, антитело может связываться с CSF1R человека и/или связываться с CSF1R макаки-крабоеда. В любом из способов, описанном в данном документе, антитело может блокировать связывание лиганда с CSF1R. В любом из способов, описанном в данном документе, антитело может блокировать связывание CSF1 и/или IL-34 с CSF1R. В любом из способов, описанном в данном документе, антитело может блокировать связывание и CSF1, и IL-34 с CSF1R. В любом из способов, описанном в данном документе, антитело может ингибировать лиганд-индуцированное фосфорилирование CSF1R. В любом из способов, описанном в данном документе, антитело может ингибировать CSF1- и/или IL-34-индуцированное фосфорилирование CSF1R. В любом из способов, описанном в данном документе, антитело может связываться с CSF1R человека с аффинностью (KD) менее 1 нМ. В любом из способов, описанном в данном документе, антитело может ингибировать пролиферацию моноцита и/или выживаемость в присутствии CSF1 или IL-34.
[037] В некоторых вариантах реализации изобретения предлагается фармацевтическая композиция, содержащая антитело, которое связывается с CSF1R. В некоторых вариантах реализации изобретения предлагаются антитела, которые связываются с CSF1R и композиции, содержащие антитела, которые связываются с CSF1R, предназначенные для использования по любому из способов лечения, представленных в данном документе.
Краткое описание графических материалов
[038] ФИГ. 1А-С иллюстрирует выравнивание гуманизированных вариабельных областей тяжелой цепи каждого из гуманизированных антител huAb1-huAb16, как описано в Примере 1. Выделенные прямоугольником остатки представляют собой аминокислоты в последовательности акцептора человека, которые были изменены на соответствующий остаток мыши.
[039] ФИГ. 2А-С иллюстрирует выравнивание гуманизированных вариабельных областей легкой цепи каждого из гуманизированных антител huAb1-huAb16, как описано в Примере 1. Выделенные прямоугольником остатки представляют собой аминокислоты в последовательности акцептора человека, которые были изменены на соответствующий остаток мыши.
[040] ФИГ. 3 иллюстрирует концентрацию цитокина IL-6, определенную с помощью ELISA на культуральной среде ткани интактных синовиальных эксплантов (n=6 пациентов с ревматоидным артритом), обработанной в течение 4 дней с 1 мкг/мл huAb1 или изотопическим контролем IgG4, как описано в Примере 2.
[041] ФИГ. 4A-L иллюстрирует концентрации цитокинов и матриксных металлопротеиназ, определенные с помощью мультиплексного анализа Luminex® на культуральной среде ткани интактных синовиальных эксплантов (n=4 пациентов с ревматоидным артритом), обработанной в течение 4 дней с huAb1 или изотипичным контролем IgG4, как описано в Примере 2.
[042] ФИГ. 5 иллюстрирует уровни (A) CXCL7, (В) CXCL11 и (С) CXCL12, определенные с помощью мультиплексного анализа Luminex® на культуральной среде ткани интактных синовиальных эксплантов (n=6 пациентов с ревматоидным артритом), обработанной в течение 4 дней с huAb1 или изотипическим контролем IgG4, как описано в Примере 2.
[043] ФИГ. 6 иллюстрирует количество макрофагов в (А) передних лапах и (В) коленях у мышей с коллаген-индуцированным артритом, профилактически обработанных анти-CSF1R антителом, как описано в Примере 3.
[044] ФИГ. 7 иллюстрирует количество макрофагов в (А) передних лапах и (В) коленях у мышей с коллаген-индуцированным артритом, терапевтически обработанных анти-CSF1R антителом, как описано в Примере 3.
Подробное описание
[045] Предлагаются способы снижения у субъекта уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, включающие введение антител, которые связываются с CSF1R и блокируют связывание лиганда CSF1 и IL-34. Как описано в данном документе, антитела, которые связываются с CSF1R и блокируют связывание CSF1 и IL-34, являются эффективными для снижения уровней одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, и лечения патологических состояний, связанных с повышенными уровнями этих факторов. Примеры подобных патологических состояний содержат, в частности, ревматоидный артрит, ювенильный ревматоидный артрит, заболевание Кастлемана, псориаз, псориатический артрит, анкилозирующий спондилит, болезнь Крона, язвенный колит, системная красная волчанка и воспалительное заболевание кишечника. Авторами настоящего изобретения было обнаружено, что контакт синовиальных биопсийных образцов, полученных от пациентов с ревматоидным артритом, с антителом, которое связывается с CSF1R, снижает уровни IL-6, IL-1β, IL-8, CCL2 (также упоминается как МСР-1), CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9.
[046] Заголовки разделов, используемые в данном документе, предназначены только для организационных целей и не должны быть истолкованы как ограничивающие описанный предмет изобретения. Все ссылки, приведенные в данном документе, в том числе патентные заявки и публикации, включены в данный документ путем ссылки во всей их полноте для любых целей. Определения
[047] Если не указано иное, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понятны специалисту среднего уровня компетентности в данной области техники. Кроме того, если иное не требуется по контексту, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число.
[048] Иллюстративные способы, используемые вместе с технологией рекомбинантной DNA, синтезом олигонуклеотидов, культурой ткани и трансформацией (например, электропорацией, липофекцией), ферментативными реакциям и способами очистки, известны в данной области техники. Многие подобные способы и процедуры описывают, например, в Sambrook и соавт. Molecular Cloning: A Laboratory Manual (2nd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)), помимо других источников. Кроме того, в данной области техники известны также иллюстративные способы химического синтеза, химических анализов, фармацевтического препарата, состава и доставки и лечения пациентов.
[049] В этой заявке использование "или" означает "и/или", если не указано иное. В контексте пункта патентной формулы, зависящего от другого зависимого пункта, использование "или" отсылает к более чем одному предыдущему независимому или зависимому пункту формулы изобретения только в качестве альтернативы. Кроме того, такие термины, как "элемент" или "компонент" охватывают как элементы и компоненты, содержащие одно целое, так и элементы и компоненты, которые содержат более одной субъединицы, если специально не указано иное.
[050] Как используют согласно настоящему изобретению, следующие термины, если не указано иное, следует понимать как имеющие следующие значения:
[051] Термины "молекула нуклеиновой кислоты" и "полинуклеотид" могут быть использованы взаимозаменяемо и относятся к полимеру нуклеотидов. Такие полимеры нуклеотидов могут содержать природные и/или искусственные нуклеотиды, и включают в себя, в частности, DNA, RNA и PNA. "Нуклеотидная последовательность" относится к линейной последовательности нуклеотидов, которые содержат молекулу нуклеиновой кислоты или полинуклеотида.
[052] Термины "полипептид" и "белок" используют взаимозаменяемо для обозначения полимера из аминокислотных остатков и не ограничены минимальной длиной. Такие полимеры аминокислотных остатков могут содержать остатки природных или искусственных аминокислот и включают, в частности, пептиды, олигопептиды, димеры, тримеры и мультимеры аминокислотных остатков. И полноразмерные белки, и их фрагменты охватываются определением. Термины также включают пост-экспрессионные модификации полипептида, например, гликозилирование, сиалилирование, ацетилирование, фосфорилирование и т.п. роме того, для целей настоящего изобретения, "полипептид" относится к белку, который содержит модификации, такие как делеции, добавления и замены (обычно консервативные в природе), к нативной последовательности, при условии, что белок сохраняет желаемую активность. Эти модификации могут быть преднамеренными, с помощью сайт-направленного мутагенеза, или могут быть случайными, например, с помощью мутаций хозяев, которые продуцируют белки, или ошибки из-за PCR-амплификации.
[053] Термин "CSF1R" в данном документе относится к полной длине CSF1R, которая содержит N-концевую ECD, трансмембранный домен и внутриклеточный домен тирозинкиназы, с или без N-концевой лидерной последовательности. В некоторых вариантах реализации изобретения CSF1R представляет собой CSF1R человека, имеющий аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 2.
[054] Термин "внеклеточный домен CSF1R" ("ECDCSF1R"), как используют в данном документе, относится к полипептиду CSF1R, который не содержит внутриклеточных и трансмембранных доменов. ECDCSF1R содержат полноразмерные фрагменты ECDCSF1R и ECDCSF1R, которые способны связывать CSF1 и/или IL-34. Полноразмерный ECDCSF1R человека определяют в данном документе как содержащий либо аминокислоты от 1 до 512 (то есть содержащий лидерную последовательность), либо от 20 до 512 аминокислот (то есть не содержащий лидерную последовательность) из SEQ ID NO: 2. В некоторых вариантах реализации изобретения фрагмент ECDCSF1R человека содержит аминокислоты от 20 до 506 SEQ ID NO: 2 (смотри SEQ ID NO: 5). В некоторых вариантах реализации изобретения фрагмент CSF1R человека заканчивается на аминокислоте 507, 508, 509, 510 или 511. В некоторых вариантах реализации изобретения ECDCSF1R макаки-крабоеда содержит последовательность SEQ ID NO: 7 (с лидерной последовательностью) или аминокислоты от 20 до 506 SEQ ID NO: 7 (без лидерной последовательности).
[055] Со ссылкой на анти-CSF1R антитела термин "блокирует связывание" лиганда, такого как CSF1 и/или IL-34, и его грамматические варианты, которые используются для обозначения способности ингибировать взаимодействие между CSF1R и лигандом CSF1R, таким как CSF1 и/или IL-34. Подобное ингибирование может происходить с помощью любого механизма, в том числе прямого вмешательства связывания лиганда, например, ввиду перекрывания связывающих сайтов на CSF1R и/или конформационных изменений в CSF1R, индуцированных с помощью антитела, которые изменяют аффинность лиганда и т.д. Антитела и фрагменты антител, указанные как "функциональные", характеризуются наличием подобных свойств.
[056] "Иммунологическая" активность относится только к способности индуцировать получение антитела против антигенного эпитопа, который имеет нативный или встречающийся в природе полипептид CSF1R.
[057] Термин "антитело", как используют в данном документе, относится к молекуле, содержащей по меньшей мере гипервариабельную область (CDR) 1, CDR2 и CDR3 тяжелой цепи и по меньшей мере CDR1, CDR2 и CDR3 легкой цепи, причем молекула способна связываться с антигеном. Термин антитело содержит, в частности, фрагменты, которые способны связывать антиген, такие как Fv, одноцепочечные Fv (scFv), Fab, Fab' и (Fab')2. Термин антитело также содержит, в частности, химерные антитела, гуманизированные антитела и антитела различных видов, таких как мышь, человек, макака-крабоеда и т.д.
[058] В некоторых вариантах реализации изобретения антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи. В некоторых вариантах реализации изобретения антитело содержит по меньшей мере одну тяжелую цепь, содержащую вариабельную область тяжелой цепи и по меньшей мере часть константной области тяжелой цепи, и по меньшей мере одну легкую цепь, содержащую переменную область легкой цепи и по меньшей мере часть константной области легкой цепи. В некоторых вариантах реализации изобретения антитело содержит две тяжелые цепи, причем каждая тяжелая цепь содержит вариабельную область тяжелой цепи и по меньшей мере часть константной области тяжелой цепи и две легкие цепи, причем каждая легкая цепь содержит вариабельную область легкой цепи и по меньшей мере константную область легкой цепи. Как используют в данном документе, одноцепочечный Fv (ScFv) или любое другое антитело, которое содержит, например, одноцепочечный полипептид, содержащий все шесть CDR (три CDR тяжелой цепи и три CDR легкой цепи), как считается, имеет тяжелую цепь и легкую цепь. В некоторых подобных вариантах реализации изобретения тяжелая цепь представляет собой область антитела, которая содержит три CDR тяжелой цепи и легкую цепь в области антитела, которое содержит три CDR легкой цепи.
[059] Термин "вариабельная область тяжелой цепи", как используют в данном документе, относится к области, содержащей CDR1 тяжелой цепи, остовные (FR) 2, CDR2, FR3 и CDR3. В некоторых вариантах реализации изобретения вариабельная область тяжелой цепи также содержит по меньшей мере часть FR1 и/или по меньшей мере часть FR4. В некоторых вариантах реализации изобретения CDR1 тяжелой цепи соответствует остаткам по Kabat с 26 по 35; CDR2 тяжелой цепи соответствует остаткам по Kabat с 50 до 65; и CDR3 тяжелой цепи соответствует остаткам по Kabat с 95 до 102. Смотри, например, Kabat Sequences of Proteins of Immunological Interest (1987 и 1991, NIH, Bethesda, Md.); и Фигуру 1. В некоторых вариантах реализации изобретения CDR1 тяжелой цепи соответствует остаткам по Kabat с 31 по 35; CDR2 тяжелой цепи соответствует остаткам по Kabat с 50 до 65; и CDR3 тяжелой цепи соответствует остаткам по Kabat с 95 до 102. Смотри идентификатор.
[060] Термин "константная область тяжелой цепи", как используют в данном документе, соответствует области, содержащей по меньшей мере три константные домены тяжелой цепи, CH1, CH2 и CH3. Неограничивающие иллюстративные константные области тяжелой цепи содержат γ, δ и α. Неограничивающие иллюстративные константные области тяжелой цепи также содержат ε и μ. Каждая константная область тяжелой цепи соответствует изотипу антитела. Например, антитело, содержащее константную область γ, представляет собой антитело IgG, антитело, содержащее константную область δ, представляет собой антитело IgD, а антитело, содержащее константную область α, представляет собой антитело IgA. Кроме того, антитело, содержащее константную область μ, представляет собой антитело IgM, а антитело, содержащее константную область ε, представляет собой антитело IgE. Некоторые изотипы могут быть дополнительно подразделены на подклассы. Например, антитела IgG содержат, в частности, антитела IgG1 (содержащие константную область γ1), IgG2 (содержащие константную область γ2), IgG3 (содержащие константную область γ3) и IgG4 (содержащие константную область γ4); антитела IgA содержат, но без ограничения ими, антитела IgA1 (содержащие константную область α1) и IgA2 (содержащие константную область α2); a антитела IgM содержат, в частности, IgM1 и IgM2.
[061] В некоторых вариантах реализации изобретения константная область тяжелой цепи содержит одну или несколько мутаций (или замен), присоединений или делеций, которые придают антителу желаемую характеристику. Неограничивающая иллюстративная мутация S241P в области петли IgG4 (между константными доменами CH1 и CH2), которая изменяет мотив CPSCPIgG4 на СРРСР, который похож на соответствующий мотив в IgG1. Эта мутация в некоторых вариантах реализации изобретения приводит к более стабильному антителу IgG4. Смотри, например, Angal и соавт., Mol. Immunol. 30: 105-108 (1993); Bloom и соавт., Prot. Sci. 6: 407-415 (1997); Schuurman и соавт., Mol. Immunol. 38: 1-8 (2001).
[062] Термин "тяжелая цепь" как используют в данном документе, относится к полипептиду, содержащему по меньшей мере вариабельную область тяжелой цепи, с или без лидерной последовательности. В некоторых вариантах реализации изобретения тяжелая цепь содержит по меньшей мере часть константной области тяжелой цепи. Термин "полноразмерная тяжелая цепь" как используют в данном документе, относится к полипептиду, содержащему вариабельную область тяжелой цепи и константную область тяжелой цепи, с или без лидерной последовательности.
[063] Термин "вариабельная область легкой цепи" как используют в данном документе, относится к области, содержащей CDR1 легкой цепи, остов (FR)2, CDR2, FR3 и CDR3. В некоторых вариантах реализации изобретения вариабельная область легкой цепи также содержит FR1 и/или FR4. В некоторых вариантах реализации изобретения CDR1 легкой цепи соответствует остаткам по Kabat с 24 по 34; CDR2 легкой цепи соответствует остаткам по Kabat с 50 до 56; и CDR3 легкой цепи соответствует остаткам по Kabat с 89 до 97. Смотри, например, Kabat Sequences of Proteins of Immunological Interest (1987 и 1991, NIH, Bethesda, Md.); и Фигуру 1.
[064] Термин "константная область легкой цепи", как используют в данном документе, относится к области, содержащей константный домен легкой цепи, CL. Неограничивающие иллюстративные константные области легкой цепи также содержат λ и κ.
[065] Термин "легкая цепь", как используют в данном документе, относится к полипептиду, содержащему по меньшей мере вариабельную область легкой цепи, с или без лидерной последовательности. В некоторых вариантах реализации изобретения легкая цепь содержит по меньшей мере часть константной области легкой цепи. Термин "полноразмерная легкая цепь", как используют в данном документе, относится к полипептиду, содержащему вариабельную область легкой цепи и константную область легкой цепи, с или без лидерной последовательности.
[066] "Химерное антитело", как используют в данном документе, относится к антителу, содержащему по меньшей мере одну вариабельную область первого вида (например, мыши, крысы, макаки-крабоеда и т.д.) и по меньшей мере одну константную область второго вида (например, человека, макаки-крабоеда и т.д.). В некоторых вариантах реализации изобретения химерное антитело содержит по меньшей мере одну вариабельную область мыши и по меньшей мере одну константную область человека. В некоторых вариантах реализации изобретения химерное антитело содержит по меньшей мере одну вариабельную область макаки-крабоеда и по меньшей мере одну константную область человека. В некоторых вариантах реализации изобретения химерное антитело содержит по меньшей мере одну вариабельную область мыши и по меньшей мере одну константную область мыши. В некоторых вариантах реализации изобретения все вариабельные области химерного антитела являются областями первого вида, а все константные области химерного антитела являются областями второго вида.
[067] "Гуманизированное антитело", как используют в данном документе, относится к антителу, в котором по меньшей мере одну аминокислоту в области остова вариабельной области отличного от человека субъекта заменяют на соответствующую аминокислоту из вариабельной области человека. В некоторых вариантах реализации изобретения гуманизированное антитело содержит по меньшей мере одну константную область человека или ее фрагмент. В некоторых вариантах реализации изобретения гуманизированное антитело представляет собой Fab, scFv, (Fab')2, и т.д.
[068] "Привитое CDR антитело", как используют в данном документе, относится к гуманизированному антителу, в котором определяющие комплементарность области (CDR) первых (отличного от человека) видов прививают на остовные области (FR) второго вида (человека).
[069] "Антитело человека", как используют в данном документе, относится к антителам, полученным у человека, антителам, продуцируемым у отличных от человека животных, которые содержат гены иммуноглобулина человека, таким как XenoMouse®, и антителам, выбранным с помощью in vitro способов, например, фаговое отображение, причем спектр антител основывают на последовательностях иммуноглобулина человека.
[070] Термин "лидерная последовательность" относится к последовательности аминокислотных остатков, расположенных на N-конце полипептида, который облегчает секрецию полипептида из клетки млекопитающего. Лидерная последовательность может быть расщеплена при выделении полипептида из клетки млекопитающего, с образованием зрелого белка. Лидерные последовательности могут быть природными или синтетическими, и они могут быть гетерологичным или гомологичными белку, к которому они присоединены. Иллюстративные лидерные последовательности содержат, в частности, лидерные последовательности антитела, такие, как, например, аминокислотные последовательности SEQ ID NO: 3 и 4, которые соответствуют легкой и тяжелой цепи лидерных последовательностей человека, соответственно. Неограничивающие иллюстративные лидерные последовательности также содержат лидерные последовательности из гетерологичных белков. В некоторых вариантах реализации изобретения в антителах отсутствует лидерная последовательность. В некоторых вариантах реализации изобретения антитело содержит по меньшей мере одну лидерную последовательность, которая может быть выбрана из нативных лидерных последовательностей антитела и гетерологичных лидерных последовательностей.
[071] Термин "вектор" используют для описания полинуклеотида, который может быть получен для того, чтобы содержать клонированный полинуклеотид или полинуклеотиды, которые могут быть размножены в клетке-хозяине. Вектор может содержать один или более из следующих элементов: точка начала репликации, одна или более регуляторные последовательности (такие как, например, промоторы и/или энхансеры), которые регулируют экспрессию полипептида, представляющего интерес, и/или одного или более выбираемых маркерных генов (таких как, например, гены устойчивости к антибиотикам и гены, которые могут быть использованы в колориметрических анализах, например, β-галактозидазы). Термин "вектор экспрессии" относится к вектору, который используют для того чтобы экспрессировать представляющий интерес полипептид в клетке-хозяине.
[072] "Клетка-хозяин" относится к клетке, которая может быть или была, реципиентом вектора или выделенного полинуклеотида. Клетки-хозяева могут быть прокариотическими или эукариотическими клетками. Иллюстративные эукариотические клетки содержат клетки млекопитающих, таких как приматы, или клетки отличных от приматов животных; клетки грибков, таких как дрожжи; растительные клетки; и клетки насекомых. Неограниченные иллюстративные примеры клеток млекопитающих включают, в частности, клетки NSO, клетки PER.C6® (Crucell) и клетки 293 и CHO, и их производные, такие как клетки 293-6Е и DG44, соответственно.
[073] Термин "выделенный", как используют в данном документе, относится к молекуле, которая была выделена из по меньшей мере некоторых компонентов, с которыми он обычно встречается в природе. Например, полипептид упоминается как "изолированный", если он выделен из по меньшей мере некоторых компонентов клетки, в которой он был получен. При условии, что полипептид секретируется клеткой после экспрессии, физическое разделение супернатанта, содержащего полипептид из клетки, которая его произвела, считается "выделением" полипептида. Аналогичным образом, полинуклеотид упоминают как "выделенный", если он не является частью большего полинуклеотида (такого как, например, геномная DNA или митохондриальная DNA в случае полинуклеотида DNA), в котором он обычно встречается в природе, или выделен из по меньшей мере некоторых из компонентов клетки, в которой он был получен, например, в случае полинуклеотида RNA. Таким образом, полинуклеотид DNA, который содержится в векторе внутри клетки-хозяина может упоминаться как "выделенный" при условии, что полинуклеотид не найден в этом векторе в природе.
[074] Термин "повышенный уровень" означает более высокий уровень белка, такого как цитокин или матричная металлопротеиназа, в частности, ткань субъекта по отношению к той же ткани контроля, такого как индивидуум или индивидуумы, которые не страдают воспалительным состоянием или другого патологического состояния, описанного в данном документе. Повышенный уровень может быть результатом какого-либо механизма, например, повышенной экспрессией, повышенной стабильности, сниженной деградации, усиленной секреции, сниженного клиренса и т.д., белка.
[075] Термин "снизить" или "уменьшить" означает понижение уровня белка, такого как цитокин или матриксная металлопротеиназа, в отдельной ткани субъекта, на по меньшей мере 10%. В некоторых вариантах реализации изобретения средство, такое как антитело, которое связывается с CSF1R, снижает уровень белка, такого как цитокин или матриксная металлопротеиназа, в отдельной ткани субъекту по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90%. В некоторых вариантах реализации изобретения уровень белка снижается по сравнению с уровнем белка до контакта со средством, таким как антитело, которое связывается с CSF1R.
[076] Термин "устойчивый," при использовании в контексте устойчивости к терапевтическому средству, означает пониженную реакцию или отсутствие реакции на стандартную дозу терапевтического средства по отношению к реакции субъекта на стандартную дозу терапевтического средства в прошлом, или по отношению к ожидаемому отклику аналогичного субъекта с аналогичным нарушением при стандартной дозе терапевтического средства. Таким образом, в некоторых вариантах реализации изобретения субъект может быть устойчивым к терапевтическому средству, хотя субъекту ранее не было дано терапевтическое средство, или субъект может вырабатывать устойчивость к терапевтическому средству после того, как ответ на средство одной или нескольких отборов проб.
[077] Термины "субъект" и "пациент" используют в данном документе взаимозаменяемо для обозначения человека. В некоторых вариантах реализации изобретения также предлагаются способы лечения других млекопитающих, в частности, грызунов, обезьян, кошачьих, собак, животных семейства лошадиных, крупного рогатого скота, свиней, овец, коз, лабораторных животных млекопитающих, сельскохозяйственных животных млекопитающих, спортивных животных млекопитающих, а также домашних животных млекопитающих.
[078] Термин "образец,", как используют в данном документе, относится к композиции, которую производят или получают из субъекта, который содержит клеточный и/или другой молекулярный объект, который должен быть охарактеризован, измерен количественно и/или определен, например, на основе физических, биохимических, химических и/или физиологических характеристик. Иллюстративный образец представляет собой образец ткани. Другой иллюстративный образец представляет собой образец сыворотки или плазмы.
[079] Термин "образец ткани" соответствует сбору подобных клеток, полученных из ткани субъекта. Источник образца ткани могут представлять собой твердую ткань, например свежий, замороженный и/или консервированный орган или образец ткани или биопсии или аспирации; кровь или любую составную часть крови; жидкости тела, такими как спинно-мозговая жидкость, амниотическая жидкость, жидкость брюшной полости, синовиальную жидкость или межклеточную жидкость; клетки в любой момент беременности или развития субъекта. В некоторых вариантах реализации изобретения образец ткани представляет собой синовиальный образец биопсии ткани и/или синовиальный жидкий образец. В некоторых вариантах реализации изобретения представляет собой синовиальный жидкий образец. Образец ткани также может быть первичными или культивируемыми клетками или клеточными линиями. Необязательно, образец ткани получают из ткани/органа, пораженных заболеванием. Образец ткани может содержать соединения, которые, естественно, не смешивались с тканью в природе, такие как консерванты, антикоагулянты, буферы, фиксаторы, питательные вещества, антибиотики и тому подобные. "Контрольный образец" или "контрольная ткань", как используют в данном документе, относится к образцу, клетке или ткани, полученной из известного источника, или, как предполагают, не являются пораженными заболеванием, относительно которых субъект проходит лечение.
[080] Для целей данного изобретения "срез" образца ткани означает часть или кусок образца ткани, например, тонкий срез ткани или клетки, вырезанные из твердого образца ткани.
[081] Как используют в данном документе, "ревматоидный артрит" или "РА" относится к распознанному болезненному состоянию, который может быть диагностирован в соответствии с 1987, 2000 или 2010 критерием для классификации PA (AmericanRheumatismAssociation или AmericalCollegeofRheumatology) или другим схожим критерием. В некоторых вариантах реализации изобретения термин "ревматоидный артрит" соответствует хроническому аутоиммунному заболеванию, характеризующемуся в первую очередь воспалением синовиальной оболочки (накладки) суставов, который может привести к повреждению суставов, что приводит к хронической боли, потери функции и недееспособности. Ввиду того, что РА может влиять на многие органы тела, в том числе кожу, легкие и глаза, он упоминается в качестве системных заболеваний.
[082] Термин "ревматоидный артрит" включает не только активный и ранний РА, но также и начальный РА, как определено ниже. Физиологические показатели РА включают симметричный отек суставов, что является характерным, хотя и не остается неизменным при РА. Как правило, проксимальные межфаланговые (PIP) суставы рук, а также пястно-фаланговые суставы (МСР), запястья, локти, колени, лодыжки и плюснефаланговые (МТР) суставы поражаются фузиформной опухолью и отек легко обнаруживается. Боль при пассивном движении является самым чувствительным тестом на воспаление суставов, а воспаление и структурная деформация часто ограничивает диапазон движения пораженного сустава. Типичные видимые изменения включают ульнарную девиацию пальцев на уровне суставов МСР, гиперэкстензию или гиперфлексию суставов МСР и РГР, контрактуры сгибание локтей и подвывих костей запястья и ног. Субъект с РА может быть устойчивым к модифицирующему заболевание противоревматическому лекарственному средству (DMARD) и/или нестероидному противовоспалительному лекарственному средству (NSAID). Неограничивающие иллюстративные "DMARD" включают гидроксихлорохин, сульфасалазин, метотрексат (МТХ), лефлуномид, этанерцепт, инфликсимаб (плюс пероральный и подкожный МТХ), азатиоприн, D-пеницилламин, соли золота (пероральные), соли золота (внутримышечные), миноциклин, циклоспорин, в том числе циклоспорин А и наружный циклоспорин, стафилококковый белок A (Goodyear и Silverman, J. Exp. Med., 197(9): 1125-1139 (2003)), в том числе соли и их производные, и т.д. Дополнительные кандидаты для терапии согласно настоящему изобретению включают тех, кто имел опыт неадекватного ответа на предыдущее или текущее лечение ингибиторами TNF, такими как этанерцепт, инфликсимаб, голимумаб, цертолизумаб и/или адалимумаб, ввиду токсичности, недостаточной эффективности и/или устойчивости.
[083] Пациент с "активным ревматоидным артритом" означает пациента с активными, а не скрытыми симптомами РА. Субъекты с "ранним активным ревматоидным артритом" представляют собой такие субъекты с активным РА, диагностированными в течение по меньшей мере 8 недель, но не более чем четырех лет, в соответствии с пересмотренным 1987, 2000 или 2010 критерием классификации PA (AmericanRheumatismAssociation или AmericalCollegeofRheumatology).
[084] Субъекты с "ранним ревматоидным артритом" представляют собой такие субъекты с РА, диагностированным в течение по меньшей мере 8 недель, но не более чем четырех лет, в соответствии с пересмотренным 1987, 2000 или 2010 критерием классификации PA (AmericanRheumatismAssociation или AmericalCollegeofRheumatology). РА включает, например, юношеский РА, ювенильный идиопатический артрит (ЮИА) или ювенильный РА (ЮРА).
[085] Пациенты с "ранним РА" имеют ранний полиартрит, что не в полной мере соответствует критерию ACR для диагностики РА, в связи с наличием РА-специфических прогностических биомаркеров, таких как анти-ССР и общий эпитоп. Они включают пациентов с положительными анти-ССР антителами, которые присутствуют при полиартрите, но еще не имеют диагноз РА, и имеют высокий риск развития критерия РА истинного ACR (95% вероятности).
[086] Термин "воспалительный артрит" охватывает любой артрит, вызванный аутоиммунным состоянием. Неограничивающие примеры воспалительного артрита и аутоиммунных состояний, которые могут включать воспалительный артрит, в том числе ревматоидный артрит (в том числе юношеский РА, ювенильный идиопатический артрит (ЮИА) и ювенильный ревматоидный артрит (ЮРА)), анкилозирующий спондилит, смешанное заболевание соединительной ткани (MCTD), псориатический артрит, реактивный артрит, склеродермию, болезнь Стилла, системную красную волчанку, острый и хронический артрит, ревматоидный синовит, подагру или подагрический артрит, острый иммунологический артрит, хронические воспалительные артриты, дегенеративный артрит, коллаген-индуцированный артрит типа II, инфекционный артрит, септический артрит, артрит Лайма, пролиферативный артрит, позвоночный артрит, остеоартрит, хронический прогрессирующий артрит, деформирующий артрит, первичный хронический полиартрит, реактивный артрит, климактерический артрит, артрит при дефиците эстрогенов, синдром Фелти и ревматическое аутоиммунное заболевание, отличное от Ra.
[087] "Поражение сустава" используют в самом широком смысле и относят к повреждению или частичному или полному разрушению в какой-либо части одного или нескольких суставов, в том числе соединительной ткани и хрящевой ткани, причем повреждение содержит структурное и/или функциональное повреждение по какой-либо причине, и может или не может привести к боли в суставах/артралгии. Поражение включает, в том числе повреждение сустава, связанное с или возникающее вследствие воспалительного заболевания сустава, а также невоспалительного заболевания сустава. Это повреждение может быть вызвано любым патологическим состоянием, таким как аутоиммунное заболевание, особенно воспалительный артрит, главным образом ревматоидный артрит. Для целей настоящего изобретения, суставы представляют собой точки соприкосновения между элементами скелета (позвоночного, например, животного) с частями, которые окружают и поддерживают его и содержат, в частности, например, бедра, суставы между позвонками позвоночника, суставы между позвоночником и тазом (крестцово-подвздошные суставы), суставы, в которых сухожилия и связки прикрепляются к костям, суставы между ребрами и позвоночником, плечи, колени, ноги, локти, руки, пальцы, лодыжки и ноги, а особенно суставы рук и ног.
[088] Термин "волчанка", как используют в данном документе, представляет собой аутоиммунное заболевание или нарушение, которое, в целом, содержит антитела, которые атакуют соединительную ткань. Основной формой волчанки является системная, системная красная волчанка (SLE), в том числе кожная SLE и подострая кожная красная волчанка SLE, а также другие виды волчанки (в том числе нефропатическая, экстраренальная, энцефалитная, педиатрическая, непочечная, дискоидная и алопеции). В некоторых вариантах реализации изобретения термин "системная красная волчанка" относится к хроническому аутоиммунному заболеванию, которое может привести к патологическим изменениям кожи, боли в суставах и отеку, заболеванию почек (волчаночному нефриту), жидкости вокруг сердца и/или легких, воспалению сердца и другим различным системным заболеваниям. В некоторых вариантах реализации изобретения термин "волчаночный нефрит" относится к воспалению почек, которое происходит у пациентов с SLE. Волчаночный нефрит может содержать, например, гломерулонефрит и/или интерстициальный нефрит, и может привести к гипертензии, протеинурии и почечной недостаточности. Волчаночный нефрит может быть классифицирован на основе тяжести и степени заболевания, например, как определяет InternationalSocietyofNephrology/Renal/PathologySociety. Классы волчаночного нефрита имеют класс I (минимальный мезангиальный волчаночный нефрит), класс II (мезангиальный пролиферативный волчаночный нефрит), класс III (фокальный волчаночный нефрит), класс IV (диффузный сегментарный (IV-S) или диффузный глобальный (IV-G) волчаночный нефрит), класс V (мембранный волчаночный нефрит) и класс VI (расширенный склерозирующий волчаночный нефрит). Термин "волчаночный нефрит" охватывает все эти классы.
[089] Термин "рассеянный склероз" ("MS") относится к хроническому заболеванию центральной нервной системы, которое характеризуется прогрессирующей деструкцией миелина и часто приводит к инвалидизации. "Демиелинизация" происходит при условии, что миелиновая оболочка воспаляется, повреждается и отделяется от нервного волокна. Существуют четыре признанные на международном уровне формы MS, а именно, первично-прогрессирующий рассеянный склероз (PPMS), ремиттирующий рассеянный склероз (RRMS), вторичный прогрессирующий рассеянный склероз (SPMS) и прогрессирующий рецидивирующий рассеянный склероз (PRMS).
[090] "Первично-прогрессирующий рассеянный склероз" или "PPMS" характеризуют постепенным прогрессированием заболевания от его начала при полном отсутствии сопутствующих рецидивов и ремиссий. Могут существовать периоды выравнивания активности заболевания и могут быть хорошие и плохие дни или недели. PPMS отличается от RRMS и SPMS временем наступления, как правило, к концу четвертого десятка или в начале пятого, у мужчин развивается чаще, чем у женщин, а первичный очаг заболевания часто начинается в спинном мозге, а не в мозгу. PPMS часто мигрирует в мозг, но, с меньшей вероятностью повреждает участки мозга, чем RRMS или SPMS; например, люди с PPMS менее склонны к развитию когнитивных проблем. PPMS является подтипом MS, который, с наименьшей вероятностью, способен демонстрировать воспалительные (помеченные гадолинием) поражения при сканировании МРТ. Основная прогрессивная форма заболевания наблюдается между 10 и 15% всех людей с рассеянным склерозом. PPMS может быть определен в соответствии с критериями в McDonald и соавт. AnnNeurol 50: 121-7 (2001). Субъект с PPMS, который подвергается лечению в данном документе, как правило, является субъектом с вероятным или окончательным диагнозом PPMS.
[091] "Рецидивирующе-ремиттирующий рассеянный склероз" или "RRMS" характеризуется рецидивами (также известными как обострения), во время которых могут появиться новые симптомы, а старые появляются снова или усугубляются. Рецидивы сменяются периодами ремиссии, во время которых человек полностью или частично восстанавливается от дефектов, приобретенных в течение рецидива. Рецидивы могут длиться в течение нескольких дней, недель или месяцев, а восстановление может быть медленным и постепенным или почти мгновенным. Подавляющему большинству пациентов, имеющих MS, впервые диагностировали RRMS. Обычно это происходит, когда они находятся в возрасте от двадцати до тридцати, хотя известны случаи более ранней или поздней постановки диагноза. Этот подтип MS в два раза чаще встречается у женщин, чем у мужчин. Во время рецидивов, миелин, защитная изолирующая оболочка вокруг нервных волокон (нейронов) в областях белого вещества центральной нервной системы (ЦНС), может быть поврежден в результате воспалительного ответа на собственную иммунную систему организма. Это вызывает широкий спектр неврологических симптомов, которые, в значительной степени, зависят от того, какие области ЦНС повреждены. Сразу после рецидива, воспалительная реакция стихает, а особый тип глиальных клеток в ЦНС (так называемые олигодендроциты) способствуют ремиелинизации - процессу, в котором миелиновая оболочка вокруг аксонов может быть восстановлена. Это именно та ремиелинизация, которая может быть ответственной за ремиссии. Примерно 50% пациентов с RRMS переходят к SPMS в течение 10 лет с момента начала заболевания. После 30 лет эта цифра возрастает до 90%. В любой момент времени, ремиттирующая форма заболевания насчитывает около 55% всех людей с MS.
[092] "Вторичный прогрессирующий рассеянный склероз" или "SPMS" характеризуется устойчивым прогрессированием клинических неврологических повреждений с или без сопутствующих рецидивов, незначительных ремиссий и плато. Люди, у которых развивается SPMS, могут иметь ранее пережитый период RRMS, который, возможно, продолжался от двух до сорока и более лет. Любые сопутствующие рецидивы и ремиссии, как правило, с течением времени сокращаются. С самого начала фазе вторичного прогрессирующего заболевания, недееспособность начинает развиваться гораздо быстрее, чем это было во время RRMS, хотя у отдельных индивидуумов прогресс все еще может быть довольно медленным. SPMS, как правило, связан с более низким уровнем образования воспалительного поражения, чем в случае RRMS, но совокупный показатель уровня заболеваемости продолжает прогрессировать. В любой момент времени на SPMS приходится около 30% всех людей с рассеянным склерозом.
[093] "Прогрессирующий рецидивирующий рассеянный склероз" или "PRMS" характеризуется устойчивым прогрессированием клинических неврологических повреждений с сопутствующими рецидивами и ремиссиями. Сразу после рецидива наблюдается значительное восстановление, но между рецидивами наблюдается постепенное ухудшение симптомов. PRMS страдает около 5% всех людей с рассеянным склерозом. Некоторые неврологи считают, что PRMS представляет собой вариант PPMS.
[094] Термин "нарушение CD16+" означает заболевание, при котором CD16+ моноциты млекопитающего являются причиной, медиируют или иным образом способствуют заболеваемости млекопитающего. Также содержатся заболевания, при которых сокращение количества CD16+ моноцитов имеет благоприятный эффект на прогрессирование заболевания. Под этим термином существуют CD16+ воспалительные заболевания, инфекционные заболевания, иммунодефицитные заболевания, новообразования, и т.д. В некоторых вариантах реализации изобретения CD16+ воспалительные заболевания содержат воспалительные заболевания, которые не реагируют на терапию метотрексатом. В некоторых вариантах реализации изобретения CD16+ воспалительные заболевания содержат метотрексат-устойчивый ревматоидный артрит, метотрексат-устойчивый рассеянный склероз, метотрексат-устойчивую волчанку, метотрексат-устойчивое воспалительное заболевание кишечника, метотрексат-устойчивую болезнь Крона, метотрексат-устойчивую астму и метотрексат-устойчивый псориаз. В некоторых вариантах реализации изобретения пациенты, имеющие метотрексат-устойчивые заболевания, такие как метотрексат-устойчивый ревматоидный артрит, называют субъектами с неполным ответом на метотрексат или субъектами с неадекватным ответом на метотрексат. В некоторых вариантах реализации изобретения субъект с нарушением CD16+ представляет собой субъект с неадекватным ответом на метотрексат. В некоторых вариантах реализации изобретения пациентов, имеющих устойчивые к ингибитору TNF заболевания, такие как устойчивый к ингибитору TNF ревматоидный артрит, называют субъектами с неполным ответом на ингибитор TNF или субъектами с неадекватным ответом на ингибитор TNF. В некоторых вариантах реализации изобретения субъект с нарушением CD16+ является субъектом с неадекватным ответом на ингибитор TNF.
[095] Примеры нарушений CD16+, которые могут быть вылечены по настоящему изобретению, содержат, в частности, системную красную волчанку, волчаночный нефрит, ревматоидный артрит, ювенильный хронический артрит, ювенильный идиопатический артрит (ЮИА) (в том числе системный ЮИА и полиартикулярное течение ЮИА), псориатический артрит, ревматическую полимиалгию, остеоартрит, приобретенную болезнь Стилла, спондилоартропатии, анкилозирующий спондилит, системный склероз (склеродермию), идиопатические воспалительные миопатии (дерматомиозит, полимиозит), синдром Шегрена, системный васкулит, саркоидоз, аутоиммунную гемолитическую анемию (иммунную панцитопению, пароксизмальную ночную гемоглобинурию), аутоиммунную тромбоцитопению (идиопатическую тромбоцитопеническую пурпуру, иммунную тромбоцитопению), увеит, тиреоидит (болезнь Грейвса, тиреоидит Хашимото, ювенильный лимфоцитарный тиреоидит, атрофический тиреоидит, хронический тиреоидит), сахарный диабет, иммунно-опосредованное заболевание почек (гломерулонефрит, тубулоинтерстициальный нефрит), нефрит (например, пролиферативный нефрит мезангия), остеопороз, кахексию (в том числе раковую кахексию), опухоли, рак предстательной железы, хориоидальную неоваскуляризацию (например, возрастную макулярную дегенерацию, идиопатическую хориоидальную неоваскуляризацию, миопическую хориоидальную неоваскуляризацию, идиопатическую хориоидальную неоваскуляризацию), воспалительное заболевание глаза (например, панувеит, передний увеит, промежуточный увеит, склерит, кератит, орбитальное воспаление, неврит зрительного нерва, сухость глаз, диабетическую ретинопатию, пролиферативную витреоретинопатию, послеоперационные воспаления), атрофию мышц, демиелинизирующие заболевания центральной и периферической нервной системы, такие как рассеянный склероз, идиопатическую демиелинизирующую полинейропатию или синдром Гийена-Барре и хроническую воспалительную демиелинизирующую полинейропатию, гепатобилиарные заболевания, такие как инфекционный гепатит (гепатит А, В, С, D, Ε и другие негепатотропные вирусы), аутоиммунный хронический активный гепатит, первичный билиарный цирроз печени, гранулематозный гепатит и склерозирующий холангит, воспалительное заболевание кишечника (IBD), в том числе неспецифический язвенный колит, болезнь Крона, глютен-чувствительную энтеропатию и болезнь Уиппла, панкреатит, трансплантацию островковых клеток (например, трансплантацию островковых клеток поджелудочной железы), аутоиммунное или опосредуемое иммунной системой заболевания кожи, в том числе буллезные заболевания кожи, эритему и контактный дерматит, псориаз, аллергические заболевания, такие как астма, аллергический ринит, атопический дерматит, гиперчувствительность замедленного типа, пищевую гиперчувствительность и крапивницу, иммунологические заболевания легких, такие как эозинофильная пневмония, идиопатический легочный фиброз и аллергический пневмонит, связанный с трансплантацией заболевания, в том числе отторжение трансплантата и реакция трансплантат против хозяина, хроническое отторжение; фиброз, в том числе фиброз почек и печени, фиброз сердечно-сосудистых заболеваний, в том числе атеросклероз и ишемическая болезнь сердца, гигантоклеточный артериит (GCA), артериит Такаясу (ТА), узелковый периартериит, сердечно-сосудистые заболевания, связанные с хроническим заболеванием почек, инфаркт миокарда, аритмию, вызванную тяжелой ишемией и застойную сердечную недостаточность, диабет, в том числе диабет типа II, облитерирующий бронхиолит с пневмосклерозом (ВООР), гемофагоцитарный синдром, синдром активации макрофагов, саркоидоз и периодонтит. Инфекционные заболевания, в том числе вирусные заболевания, такие как СПИД (ВИЧ-инфекция), гепатит А, В, C, D и Ε, герпес и т.д., бактериальные инфекции, грибковые инфекции, протозойные инфекции и паразитарные инфекции.
[096] Термин "субъект с неадекватным ответом на метотрексат" как используют в данном документе, относится к субъекту, который пережил или испытывает неадекватный ответ на лечение метотрексатом, например, ввиду токсичности и/или ненадлежащей эффективности в стандартных дозах. В некоторых вариантах реализации изобретения субъект с неадекватным ответом на метотрексат пережил или испытывает неадекватный ответ на метотрексат после получения стандартной дозы в течение по меньшей мере двух недель, по меньшей мере трех недель, по меньшей мере четырех недель, по меньшей мере шести недель или по меньшей мере двенадцати недель.
[097] Термин "субъект с неадекватным ответом на ингибитор TNF" как используют в данном документе, относится к субъекту, который пережил или испытывает неадекватный ответ на лечение ингибитором TNF, например, ввиду токсичности и/или ненадлежащей эффективности в стандартных дозах. В некоторых вариантах реализации изобретения субъект с неадекватным ответом на ингибитор TNF пережил или переживает неадекватный ответ на ингибитор TNF после получения стандартной дозы в течение по меньшей мере двух недель, по меньшей мере трех недель, по меньшей мере четырех недель, по меньшей мере шести недель или по меньшей мере двенадцати недель. В некоторых вариантах реализации изобретения субъект с неадекватным ответом на ингибитор TNF пережил или переживает неадекватную реакцию на ингибитор TNF, выбранный из инфликсимаба, адалимумаба, цертолизумаба пегола, голимумаба и этанерцепта. В некоторых вариантах реализации изобретения ингибитор TNF представляет собой ингибитор TNF-α.
[098] Термин "существенно схожий" и "существенно не изменившийся" и его грамматические варианты, при использовании для обозначения уровня белка или типа клеток, таких как CD16- моноциты, обозначает достаточно высокую степень сходства между уровнями сравниваемых, например, как указано с помощью числовых значений, например, если специалист в данной области техники будет считать разницу между уровнями слишком малой или вообще не биологической и/или статистической значимости.
[099] Термин "существенно сниженный" и "существенно уменьшенный" и его грамматические варианты, при использовании для обозначения уровня белка или типа клеток, таких как CD16+ моноцитов, обозначает достаточно высокую степень разности между уровнями сравниваемых, например, как указано с помощью числовых значений, например, если специалист в данной области техники будет считать разницу между уровнями не биологической и/или статистической значимости.
[0100] "Анти-[фактор] средство" или "ингибитор [фактора]", используемые в данном документе, относятся к средству, которое противодействует фактором активности, например, с помощью связывания с фактором или рецептором фактора (если таковые имеются) или специфическое ингибирование экспрессии фактора или рецептора фактора (если таковые имеются). Иллюстративные анти-[фактор] средства содержат, в частности, анти-[фактор] антитела, антитела анти-[фактор] рецептора, растворимые рецепторы [фактора], которые связываются с фактором, небольшие молекулы, которые связываются с [фактором] или рецептором [фактора], антисмысловые олигонуклеотиды, которые комплементарны [фактору] или рецептору pre-mRNA или mRNA [фактора] и т.д. Неограничивающие иллюстративные факторы содержат TNF-α, IL-1, IL-6, CD20, CD19 и GM-CSF.
[0101] Средство "противодействует" активности фактора, если средство нейтрализует, блокирует, ингибирует, отменяет, уменьшает и/или мешает активности фактора, в том числе его связыванию с одним или несколькими рецепторами, если коэффициент является лигандом.
[0102] "Лечение," как используют в данном документе, соответствует как терапевтическому лечению, так и профилактическим или превентивным мерам, в котором объект существует для того, чтобы предотвратить или замедлить (уменьшить) целевое патологическое состояние или нарушение. В некоторых вариантах реализации изобретения термин "лечение" охватывает любое введение или применение терапевтического средства в случае заболевания у млекопитающего, в том числе человека, и включает ингибирование, замедление заболевания или прогрессирование заболевания; частичное или полное облегчение заболевания, например, с помощью вызывания регрессии, восстановления или реконструкция потерянной, отсутствующей или неисправной функции; стимулирование неэффективного способа; или выведение заболевания на плато для того, чтобы добиться снижения степени тяжести. Термин "лечение" также включает снижение степени тяжести любой фенотипической характеристики и/или уменьшение распространенности, степени или вероятности этой характеристики. Те, кто нуждается в лечении, включают тех, кто уже имеет нарушения, а также тех, кто склонен к нарушениям или тех, у кого должно быть предотвращено нарушение.
[0103] "Хроническое" введение относится к введению средства в непрерывном режиме, в отличие от острого режима, с тем, чтобы сохранить первоначальный терапевтический эффект (активность) в течение продолжительного периода времени. "Прерывистое" введение представляет собой лечение, которое является непоследовательно сделанным без перерыва, и скорее является циклическим по природе.
[0104] Термин "эффективное количество" или "терапевтически эффективное количество" относится к количеству лекарственного средства, эффективному для лечения заболевания или нарушения у субъекта. В некоторых вариантах реализации изобретения эффективное количество относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого терапевтического или профилактического результата. Терапевтически эффективное количество анти-CSF1R антитела по настоящему изобретению может изменяться в зависимости от таких факторов, как состояние заболевания, возраст, пол и вес индивидуума, и способность анти-CSF1R антитела вызывать желаемый ответ у индивидуума. Терапевтически эффективное количество содержит количество, в котором любые токсические или вредные эффекты анти-CSF1R антитела перевешиваются терапевтически полезными эффектами. В некоторых вариантах реализации изобретения "эффективное количество" экспрессии относится к количеству антитела, которое является эффективным для лечения нарушения CD16+. Если нарушение представляет собой РА, подобное эффективное количество может привести к одному или более из следующих последствий: ослабление признаков или симптомов РА (например, достижение ответа ACR20, ACR50 или ACR70 на 24-й неделе и/или 48-й неделе), снижение активности заболевания (например, Disease Activity Score, DAS28), замедление прогрессирования структурного повреждения суставов, улучшение физической функции и т.д.
[0105] "Профилактически эффективное количество" относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Как правило, но не обязательно, так как профилактическую дозу используют у субъектов до или на ранней стадии болезни, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
[0106] Введение "в комбинации с" одним или несколькими дополнительными терапевтическими средствами содержит одновременное (параллельное) и последовательное введение в любом порядке.
[0107] "Фармацевтически приемлемый носитель" относится к нетоксичным твердым, полутвердым или жидким наполнителю, разбавителю, материалу для инкапсулирования, вспомогательному препарату или носителю, обычному в данной области техники для использования с терапевтическим средством, которые вместе составляют "фармацевтическую композицию" для введения субъекту. Фармацевтически приемлемый носитель нетоксичен для реципиентов в применяемых дозах и концентрациях и совместим с другими ингредиентами состава. Фармацевтически приемлемый носитель является подходящим для используемого состава. Например, если терапевтическое средство должно быть введено перорально, носитель может представлять собой желатиновую капсулу. Если терапевтический агент должен быть введен подкожно, носитель, в идеале, не раздражает кожу и не вызывает реакции в месте инъекции. Анти-CSF1R антитела
[0108] Анти-CSF1R антитела содержат, в частности, гуманизированные антитела, химерные антитела, антитела мыши, антитела человека и антитела, содержащие CDR тяжелой цепи и/или легкой цепи, обсуждаемые в данном документе.
Иллюстративные гуманизированные антитела
[0109] В некоторых вариантах реализации изобретения предлагаются гуманизированные антитела, которые связываются с CSF1R. Гуманизированные антитела могут быть использованы в качестве терапевтических молекул, поскольку гуманизированные антитела снижают или исключают иммунный ответ человека на антитела нечеловеческого происхождения (например, ответ антимышиного антитела человека (НАМА)), что может привести к иммунному ответу на терапевтическое средство с антителом и снизить эффективность терапевтического средства.
[0110] Неограничивающие иллюстративные гуманизированные антитела содержат от huAb1 до huAb16, описанные в данном документе. Неограничивающие иллюстративные гуманизированные антитела также содержат антитела, содержащие вариабельную область тяжелой цепи антитела, выбранного от huAb1 до huAb16 и/или вариабельной области легкой цепи антитела, выбранного от huAb1 до huAb16. Неограничивающие иллюстративные гуманизированные антитела содержат антитела, содержащие вариабельную область тяжелой цепи, выбранную из SEQ ID NO: 39-45 и/или вариабельную область легкой цепи, выбранную из SEQ ID NO: 46-52. Иллюстративные гуманизированные антитела, также содержат, в частности, гуманизированные антитела, содержащие CDR1, CDR2 и CDR3 тяжелой цепи и/или CDR1, CDR2 и CDR3 легкой цепи антитела, выбранного из 0301, 0302 и 0311.
[0111] В некоторых вариантах реализации изобретения гуманизированные анти-CSF1R антитела содержат CDR1, CDR2 и CDR3 тяжелой цепи и/или CDR1, CDR2 и CDR3 легкой цепи антитела, выбранного из 0301, 0302 и 0311. Неограничивающие иллюстративные гуманизированные анти-CSF1R антитела содержат антитела, содержащие наборы CDR1, CDR2 и CDR3 тяжелой цепи, выбранные из: SEQ ID NO: 15, 16 и 17; SEQ ID NO: 21, 22 и 23; и SEQ ID NO: 27, 28 и 29. Неограничивающие иллюстративные гуманизированные анти-CSF1R антитела содержат антитела, содержащие наборы CDR1, CDR2 и CDR3 легкой цепи, выбранные из: SEQ ID NO: 18, 19 и 20; SEQ ID NO: 24, 25 и 26; и SEQ ID NO: 30, 31 и 32.
[0112] Неограничивающие иллюстративные гуманизированные анти-CSF1R антитела содержат антитела, содержащие наборы CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи в таблице 1 (показаны SEQ ID NO, смотри Таблицу 8 для последовательностей). Каждая строка Таблицы 1 иллюстрирует CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи иллюстративного антитела.
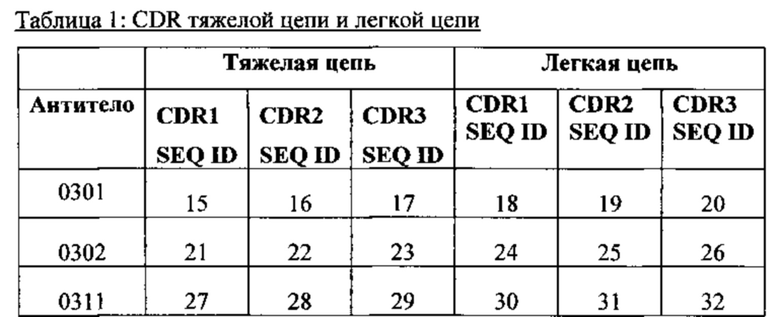
Дополнительные иллюстративные гуманизированные антитела [0113] В некоторых вариантах реализации изобретения гуманизированное анти-CSF1R антитело содержит тяжелую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере на 99% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45, и при этом антитело связывается с CSF1R. В некоторых вариантах реализации изобретения гуманизированное анти-CSF1R антитело содержит легкую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере на 99% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52, при этом антитело связывается с CSF1R. В некоторых вариантах реализации изобретения гуманизированное анти-CSF1R антитело содержит тяжелую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере на 99% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45; и легкую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере на 99% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52; причем антитело связывается с CSF1R.
[0114] Как используют в данном документе, является ли специфический полипептид, например, на по меньшей мере 95% идентичным аминокислотной последовательности, может быть определено с помощью, например, компьютерной программы. При определении того, является ли специфическая последовательность, например, на 95% идентичной стандартной последовательности, процент идентичности рассчитывают по всей длине стандартной аминокислотной последовательности.
[0115] В некоторых вариантах реализации изобретения гуманизированное анти-CSF1R антитело содержит по меньшей мере одну из CDR, обсуждаемую в данном документе. Это означает, что в некоторых вариантах реализации изобретения гуманизированное анти-CSF1R антитело содержит по меньшей мере одну CDR, выбранную из CDR1 тяжелой цепи, описанной в данном документе, CDR2 тяжелой цепи, описанной в данном документе, CDR3 тяжелой цепи, описанной в данном документе, CDR1 легкой цепи, описанной в данном документе, CDR2 легкой цепи, описанной в данном документе, и CDR3 легкой цепи, описанной в данном документе. Дополнительно, в некоторых вариантах реализации изобретения гуманизированное анти-CSF1R антитело содержит по меньшей мере одну мутировавшую CDR на основе CDR, описанной в данном документе, причем мутировавшая CDR содержит 1, 2, 3 или 4 аминокислотные замены относительно описанной в данном документе CDR. В некоторых вариантах реализации изобретения одна или более из аминокислотных замен являются консервативными аминокислотными заменами. Специалист в данной области техники может выбрать одну или несколько подходящих консервативных аминокислотных замен для конкретной последовательности CDR, причем подходящие консервативные аминокислотные замены, не предсказанные для существенного изменения связывающих свойств антитела, содержащего мутировавшую CDR.
[0116] Иллюстративные гуманизированные анти-антитела CSF1R также содержат антитела, которые конкурируют за связывание с CSF1R с антителом, описанным в данном документе. Таким образом, в некоторых вариантах реализации изобретения предлагаются гуманизированное анти-CSF1R антитело, которое конкурирует за связывание с CSF1R с антителом, выбранным из Fab 0301, 0302 и 0311; и двухвалентными (т.е. имеющие две тяжелые цепи и две легкие цепи) вериантами антитела этих Fab.
Иллюстративные константные области гуманизированного антитела
[0117] В некоторых вариантах реализации изобретения гуманизированное антитело, описанное в данном документе, содержит одну или несколько константных областей человека. В некоторых вариантах реализации изобретения константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах реализации изобретения константную область легкой цепи человека имеет изотип, выбранный из κ и λ. В некоторых вариантах реализации изобретения гуманизированное антитело, описанное в данном документе, содержит константную область IgG человека. В некоторых вариантах реализации изобретения гуманизированное антитело, описанное в данном документе, содержит константную область тяжелой цепи IgG4 человека. В некоторых подобных вариантах реализации изобретения гуманизированное антитело, описанное в данном документе, содержит мутацию S241P в константной области IgG4 человека. В некоторых вариантах реализации изобретения гуманизированное антитело, описанное в данном документе, содержит константную область IgG4 человека и легкую цепь к человека.
[0118] Выбор константной области тяжелой цепи может определить, будет ли антитело иметь эффекторную функцию in vivo. Подобная эффекторная функция, в некоторых вариантах реализации изобретения содержат антитело-зависимую клеточную цитотоксичность (ADCC) и/или комплемент-зависимую цитотоксичность (CDC) и может привести к гибели клетки, с которой связано антитело. В некоторых способах лечения, в том числе способах лечения некоторых видов рака, гибель клеток может быть желательной, например, при условии, что антитело связывается с клеткой, поддерживающей сохранение или рост опухоли. Иллюстративные клетки, которые могут поддерживать сохранение или рост опухоли, содержат, в частности, сами опухолевые клетки, клетки, которые помогают в рекрутинге сосудистой системы к опухоли, и клетки, которые обеспечивают лиганды, факторы роста или контррецепторы, которые поддерживают или стимулируют рост опухоли или выживание опухоли. В некоторых вариантах реализации изобретения при условии, что эффекторная функция является желательной, выбирают анти-CSF1R антитело, содержащее тяжелую цепь IgG1 человека или тяжелую цепь IgG3 человека.
[0119] В некоторых способах лечения, эффекторная функция не может быть желательной. Например, в некоторых вариантах реализации изобретения может быть желательным, чтобы антитела, используемые для лечения волчанки и/или MS и/или РА и/или остеолиза, не имели эффекторной функции. Таким образом, в некоторых вариантах реализации изобретения анти-CSF1R антитела, разработанные для лечения рака, не могут быть пригодными для использования при лечении волчанки и/или MS и/или РА и/или остеолиза. Соответственно, в некоторых вариантах реализации изобретения анти-CSF1R антитело, которое не имеет важную эффекторную функцию, используют при лечении волчанки и/или MS и/или РА и/или остеолиза. В некоторых вариантах реализации изобретения анти-CSF1R антитело для лечения волчанки и/или MS и/или РА и/или остеолиза содержит IgG4 человека или константную область тяжелой цепи IgG2. В некоторых вариантах реализации изобретения константная область IgG4 содержит мутацию S241P.
[0120] Антитело могут быть гуманизированым любым способом. Неограничивающие иллюстративные способы гуманизации включают способы, описанные, например, в патентах США №№5530101; 5585089; 5693761; 5693762; 6180370; Jones и соавт., Nature 321: 522-525 (1986); Riechmann и соавт., Nature 332: 323-27 (1988); Verhoeyen и соавт., Science 239: 1534-36 (1988); и публикации патента США 2009/0136500.
[0121] Как отмечалось выше, гуманизированное антитело представляет собой антитело, в котором по меньшей мере одну аминокислоту в остовной области вариабельной области отличного от человека субъекта заменяют на аминокислоту из соответствующего месторасположения в остовной области человека. В некоторых вариантах реализации изобретения по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере семь, по меньшей мере восемь, по меньшей мере девять, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 15 или по меньшей мере 20 аминокислот в остовных областях вариабельной области отличного от человека субъекта заменяют на аминокислоту в одном или нескольких соответствующих месторасположениях в одной или нескольких остовных областях человека.
[0122] В некоторых вариантах реализации изобретения некоторые из соответствующих аминокислот человека, используемые для замещения, являются аминокислотами из остовных областях различных генов иммуноглобулина человека. То есть в некоторых подобных вариантах реализации изобретения одна или несколько аминокислот отличного от человека субъекта, могут быть заменены соответствующими аминокислотами из остовной области человека первого антитела человека или кодируемую первым геном иммуноглобулина человека, одна или несколько аминокислот отличного от человека субъекта могут быть заменены соответствующими аминокислотами из каркасной области человека второго антитела человека или кодируемую вторым геном иммуноглобулина человека, одна или несколько аминокислот отличного от человека субъекта могут быть заменены соответствующей аминокислотой от каркасной области человека третьего антитела человека или кодируемой третьим геном иммуноглобулина человека и т.д. Дополнительно, в некоторых вариантах реализации изобретения все из соответствующих аминокислот человека используют для замены в одной каркасной области, например, FR2, не обязательно должны быть из того же остова человека. В некоторых вариантах реализации изобретения, однако, все из соответствующих аминокислот человека, используемых для замены, представляют собой аминокислоты из того же антитела человека или кодированные с помощью того же гена иммуноглобулина человека.
[0123] В некоторых вариантах реализации изобретения гуманизированные антитела получены с помощью замены одного или нескольких целых остовных областей с соответствующими остовными областями человека. В некоторых вариантах реализации изобретения каркасную область человека выбирают таким образом, что заменяют остовную область отличного от человека субъекта с самым высоким уровнем гомологии. В некоторых вариантах реализации изобретения гуманизированное антитело, например, представляет собой привитое CDR антитело.
[0124] В некоторых вариантах реализации изобретения после CDR-прививки, одна или несколько аминокислот остова изменяют на соответствующую аминокислоту в остовной области мыши. Осуществляют подобные "обратные мутации" в некоторых вариантах реализации изобретения, для того, чтобы сохранить одну или несколько остовных аминокислот мыши, которые существуют для того, чтобы внести свой вклад в структуру одной или нескольких CDR и/или тех, которые могут быть вовлечены в контакты антигена и/или существуют для того, чтобы участвовать в общей структурной целостности антитела. В некоторых вариантах реализации изобретения осуществляют десять или меньше, девять или меньше, восемь или меньше, семь или меньше, шесть или меньше, пять или меньше, четыре или меньше, три или меньше, две или меньше, одну или ноль обратных мутаций в остовных областях антитела после CDR прививки.
[0125] В некоторых вариантах реализации изобретения гуманизированное антитело также содержит константную область тяжелой цепи человека и/или константную область легкой цепи человека.
Иллюстративные химерные антитела
[0126] В некоторых вариантах реализации изобретения анти-CSF1R антитело представляет собой химерное антитело. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит по меньшей мере одну вариабельную область отличного от человека субъекта и по меньшей мере одну константную область человека. В некоторых подобных вариантах реализации изобретения все вариабельные области анти-CSF1R антитела представляют собой вариабельные области отличного от человека субъекта и все константные области анти-CSF1R антитела представляют собой константные области человека. В некоторых вариантах реализации изобретения одна или несколько вариабельных областей химерного антитела представляют собой вариабельные области мыши. Константная область человека химерного антитела не обязательно должна быть одного и того же изотипа с константной областью отличного от человека субъекта, если таковые имеются, которую она заменяет. Обсуждаются химерные антитела, например, в патенте США 4816567; и Morrison и соавт. Proc. Natl. Acad. Sci. USA 81: 6851-55 (1984).
[0127] Неограничивающие иллюстративные химерные антитела содержат химерные антитела, содержащие вариабельную область тяжелой и/или легкой цепи областей переменной антитела, выбранного из 0301, 0302 и 0311. Дополнительные неограничивающие иллюстративные химерные антитела содержат химерные антитела, содержащие тяжелую цепь CDR1, CDR2 и CDR3 и/или CDR1, CDR2 и CDR3 легкой цепи антитела, выбранного из 0301, 0302 и 0311.
[0128] Неограничивающие иллюстративные химерные анти-CSF1R антитела содержат антитела, содержащие следующие пары вариабельных областей тяжелых и легких цепей: SEQ ID NO: 9 и 10; SEQ ID NO: 11 и 12; и SEQ ID NO: 13 и 14.
[0129] Неограничивающие иллюстративные анти-CSF1R антитела содержат антитела, содержащие набор CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи, показанные выше в Таблице 1.
Дополнительные иллюстративные химерные антитела
[0130] В некоторых вариантах реализации изобретения химерное анти-CSF1R антитело содержит тяжелую цепь, содержащую последовательность вариабельного региона, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере на 99% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45, причем антитело связывается CSF1R. В некоторых вариантах реализации изобретения химерное анти-CSF1R антитело содержит легкую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере на 99% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52, при этом антитело связывается с CSF1R. В некоторых вариантах реализации изобретения химерное анти-CSF1R антитело содержит тяжелую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере на 99% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45; и легкую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере на 99% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52; причем антитело связывается с CSF1R.
[0131] В некоторых вариантах реализации изобретения химерное анти-CSF1R антитело содержит по меньшей мере одну из CDR, обсуждаемых в данном документе. Это означает, что в некоторых вариантах реализации изобретения химерное анти-CSF1R антитело содержит по меньшей мере одну CDR, выбранную из CDR1 тяжелой цепи, описанной в данном документе, CDR2 тяжелой цепи, описанной в данном документе, CDR3 тяжелой цепи, описанной в данном документе, CDR1 легкой цепи, описанной в данном документе, CDR2 легкой цепи, описанной в данном документе, и CDR3 легкой цепи, описанной в данном документе. Дополнительно, в некоторых вариантах реализации изобретения химерное анти-CSF1R антитело содержит по меньшей мере одну мутировавшую CDR на основе CDR, описанной в данном документе, причем мутировавшая CDR содержит 1, 2, 3 или 4 аминокислотные замены относительно описанной в данном документе CDR. В некоторых вариантах реализации изобретения одна или более из аминокислотных замен являются консервативными аминокислотными заменами. Специалист в данной области техники может выбрать одну или несколько подходящих консервативных аминокислотных замен для конкретной последовательности CDR, причем подходящие консервативные аминокислотные замены, не предсказанные для существенного изменения связывающих свойств антитела, содержащего мутировавшую CDR.
[0132] Иллюстративные химерные анти-антитела CSF1R также содержат химерные антитела, которые конкурируют за связывание с CSF1R с антителом, описанным в данном документе. Таким образом, в некоторых вариантах реализации изобретения химерное анти-CSF1R антитело при условии, что конкурирует за связывание с CSF1R с антителом, выбранным из Fab 0301, 0302 и 0311; и двухвалентных (т.е. имеющих две тяжелые цепи и две легкие цепи) версий антитела этих Fab.
Иллюстративные химерные константные области антитела
[0133] В некоторых вариантах реализации изобретения химерное антитело, описанное в данном документе, содержит одну или несколько константных областей человека. В некоторых вариантах реализации изобретения константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах реализации изобретения константную область легкой цепи человека имеет изотип, выбранный из κ и λ. В некоторых вариантах реализации изобретения химерное антитело, описанное в данном документе, содержит константную область IgG человека. В некоторых вариантах реализации изобретения химерное антитело, описанное в данном документе, содержит константную область тяжелой цепи IgG4 человека. В некоторых подобных вариантах реализации изобретения химерное антитело, описанное в данном документе, содержит мутацию S241P в константной области IgG4 человека. В некоторых вариантах реализации изобретения химерное антитело, описанное в данном документе, содержит константную область IgG4 человека и легкую цепь к человека.
[0134] Как было отмечено выше, является эффекторная функция желательной или нет, может зависеть от конкретного способа лечения с применением антитела. Таким образом, в некоторых вариантах реализации изобретения, если эффекторная функция является желательной, выбирают химерное анти-CSF1R антитело, содержащее константную область тяжелой цепи IgG1 или константную область тяжелой цепи IgG3 человека. В некоторых вариантах реализации изобретения при условии, что если эффекторная функция не является желательной, выбирают химерное анти-CSF1R антитело, содержащее IgG4 человека или константную область тяжелой цепи IgG2.
Иллюстративные антитела человека
[0135] Антитела человека могут быть получены любым подходящим способом. Неограничивающие иллюстративные способы содержат получения антитела человека у трансгенных мышей, которые содержат локусы человеческого иммуноглобулина. Смотри, например, Jakobovits и соавт., Proc. Natl. Acad. Sci. USA 90: 2551-55 (1993); Jakobovits и соавт., Nature 362: 255-8 (1993); Lonberg и соавт., Nature 368: 856-9 (1994); и патенты США №№5545807; 6713610; 6673986; 6162963; 5545807; 6300129; 6255458; 5877397; 5874299; и 5545806.
[0136] Неограничивающие иллюстративные способы также содержат получение антител человека с использованием библиотек фаговых отображений. Смотри, например, Hoogenboom и соавт., J. Mol. Biol. 227: 381-8 (1992); Marks и соавт., J. Mol. Biol. 222: 581-97 (1991); и публикации РСТ № WO 99/10494.
[0137] В некоторых вариантах реализации изобретения анти-CSF1R антитело человека связывается с полипептидом, который имеет последовательность SEQ ID NO: 1. Иллюстративные анти-CSF1R антитела человека также содержат антитела, которые конкурируют за связывание с CSF1R с антителом, описанным в данном документе. Таким образом, в некоторых вариантах реализации изобретения предлагается гуманизированное анти-CSF1R антитело при условии, что конкурирует за связывание с CSF1R с антителом, выбранным из Fab 0301, 0302 и 0311; и двухвалентные (т.е. имеющие две тяжелые цепи и две легкие цепи) версии антитела этих Fab.
[0138] В некоторых вариантах реализации изобретения анти-CSF1R антитело человека содержит одну или несколько константных областей человека. В некоторых вариантах реализации изобретения константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах реализации изобретения константную область легкой цепи человека имеет изотип, выбранный из κ и λ. В некоторых вариантах реализации изобретения антитело человека, описанное в данном документе, содержит константную область IgG человека. В некоторых вариантах реализации изобретения антитело человека, описанное в данном документе, содержит константную область тяжелой цепи IgG4 человека. В некоторых подобных вариантах реализации изобретения антитело человека, описанное в данном документе, содержит мутацию S241P в константной области IgG4 человека. В некоторых вариантах реализации изобретения антитело человека, описанное в данном документе, содержит константную область IgG4 человека и легкую цепь к человека.
[0139] В некоторых вариантах реализации изобретения, если эффекторная функция является желательной, выбирают анти-CSF1R антитело человека, содержащее константную область тяжелой цепи IgG1 или константную область тяжелой цепи IgG3 человека. В некоторых вариантах реализации изобретения если эффекторная функция не является желательной, выбирают анти-CSF1R антитело человека, содержащее IgG4 человека или константную область тяжелой цепи IgG2.
Дополнительные иллюстративные анти-CSF1R антитела
[0140] Иллюстративные анти-CSF1R антитела также содержат, в частности, мышиные, гуманизированные, человеческие, химерные и сконструированные антитела, которые содержат, например, одну или несколько последовательностей CDR, описанных в данном документе. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит вариабельную область тяжелой цепи, описанную в данном документе. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит вариабельную область тяжелой цепи, описанную в данном документе. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, описанную в данном документе. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит CDR1, CDR2 и CDR3 тяжелой цепи, описанные в данном документе. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит CDR1, CDR2 и CDR3 легкой цепи, описанные в данном документе. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит CDR1, CDR2 и CDR3 тяжелой цепи, описанные в данном документе, и CDR1, CDR2 и CDR3 легкой цепи, описанные в данном документе.
[0141] В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит вариабельную область тяжелой цепи антитела, выбранного из Fab 0301, 0302 и 0311. Неограничивающие иллюстративные анти-CSF1R антитела также содержат антитела, содержащие вариабельную область тяжелой цепи антитела, выбранного из huAb1-huAb16. Неограничивающие иллюстративные анти-CSF1R антитела содержат антитела, содержащие вариабельную область тяжелой цепи, которая содержит последовательность, выбранную из SEQ ID NO: 9, 11, 13 и 39-45.
[0142] В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит вариабельную область легкой цепи антитела, выбранного из Fab 0301, 0302 и 0311. Неограничивающие иллюстративные анти-CSF1R антитела также содержат антитела, содержащие вариабельную область легкой цепи антитела, выбранного из гуманизированных антител huAb1-huAb16. Неограничивающие иллюстративные анти-CSF1R антитела содержат антитела, содержащие вариабельную область легкой цепи, которая содержит последовательность, выбранную из SEQ ID NO: 10, 12, 14 и 46-52.
[0143] В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи антитела, выбранного из Fab 0301, 0302 и 0311. В некоторых вариантах реализации изобретения анти-CSF1R антитела также содержат антитела, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи антитела, выбранного из гуманизированных антител huAb1-huAb16. Неограничивающие иллюстративные анти-CSF1R антитела содержат антитела, содержащие следующие пары вариабельных областей тяжелой и легкой цепи: SEQ ID NO: 9 и 10; SEQ ID NO: 11 и 12; и SEQ ID NO: 13 и 14; SEQ ID NO: 39 и 40; SEQ ID NO: 41 и 42; SEQ ID NO: 43 и 44; SEQ ID NO: 45 и 46; SEQ ID NO: 47 и 48; SEQ ID NO: 49 и 50; и SEQ ID NO: 51 и 52. Неограничивающие иллюстративные анти-CSF1R антитела также содержат антитела, содержащие следующие пары тяжелых и легких цепей: SEQ ID NO: 33 и 34; SEQ ID NO: 35 и 36; и SEQ ID NO: 37 и 38.
[0144] В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит CDR1, CDR2 и CDR3 тяжелой цепи антитела, выбранного из Fab 0301, 0302 и 0311. Неограничивающие иллюстративные анти-CSF1R антитела содержат антитела, содержащие наборы CDR1, CDR2 и CDR3 тяжелой цепи, выбранные из: SEQ ID NO: 15, 16 и 17; SEQ ID NO: 21, 22 и 23; и SEQ ID NO: 27, 28 и 29.
[0145] В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит CDR1, CDR2 и CDR3 легкой цепи антитела, выбранного из Fab 0301, 0302 и 0311. Неограничивающие иллюстративные анти-CSF1R антитела содержат антитела, содержащие наборы CDR1, CDR2 и CDR3 тяжелой цепи, выбранные из: SEQ ID NO: 18, 19 и 20; SEQ ID NO: 24, 25 и 26; и SEQ ID NO: 30, 31 и 32.
[0146] В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи антитела, выбранного из Fab 0301, 0302 и 0311.
[0147] Неограничивающие иллюстративные анти-CSF1R антитела содержат антитела, содержащие указанные наборы CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи, приведенные выше в Таблице 1.
Дополнительные иллюстративные антитела
[0148] В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит тяжелую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98 меньшей мере 99% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45, причем антитело связывается с CSF1R. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит легкую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52, причем антитело связывается с CSF1R. В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит тяжелую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45; и легкую цепь, содержащую последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52; причем антитело связывается с CSF1R.
[0149] В некоторых вариантах реализации изобретения анти-CSF1R антитело содержит по меньшей мере одну из CDR, описанных в данном документе. Это означает, что в некоторых вариантах реализации изобретения анти-CSF1R антитело содержит по меньшей мере одну CDR, выбранную из CDR1 тяжелой цепи, описанной в данном документе, CDR2 тяжелой цепи, описанной в данном документе, CDR3 тяжелой цепи, описанной в данном документе, CDR1 легкой цепи, описанной в данном документе, CDR2 легкой цепи, описанной в данном документе, и CDR3 легкой цепи, описанной в данном документе. Дополнительно, в некоторых вариантах реализации изобретения анти-CSF1R антитело содержит по меньшей мере одну мутировавшую CDR на основе CDR, описанной в данном документе, причем мутировавшая CDR содержит 1, 2, 3 или 4 аминокислотные замены относительно описанной в данном документе CDR. В некоторых вариантах реализации изобретения одна или более из аминокислотных замен являются консервативными аминокислотными заменами. Специалист в данной области техники может выбрать одну или несколько подходящих консервативных аминокислотных замен для конкретной последовательности CDR, причем подходящие консервативные аминокислотные замены, не предсказанные для существенного изменения связывающих свойств антитела, содержащего мутировавшую CDR.
[0150] Иллюстративные анти-антитела CSF1R также содержат антитела, которые конкурируют за связывание с CSF1R с антителом, описанным в данном документе. Таким образом, в некоторых вариантах реализации изобретения анти-CSF1R антитело при условии, что конкурирует за связывание с CSF1R с антителом, выбранным из Fab 0301, 0302 и 0311; и двухвалентных (т.е. имеющих две тяжелые цепи и две легкие цепи) версий антитела этих Fab.
Иллюстративные константные области антитела
[0151] В некоторых вариантах реализации изобретения антитело, описанное в данном документе, содержит одну или несколько константных областей человека. В некоторых вариантах реализации изобретения константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах реализации изобретения константную область легкой цепи человека имеет изотип, выбранный из κ и λ. В некоторых вариантах реализации изобретения антитело, описанное в данном документе, содержит константную область IgG человека. В некоторых вариантах реализации изобретения антитело, описанное в данном документе, содержит константную область тяжелой цепи IgG4 человека. В некоторых подобных вариантах реализации изобретения антитело, описанное в данном документе, содержит мутацию S241P в константной области IgG4 человека. В некоторых вариантах реализации изобретения антитело, описанное в данном документе, содержит константную область IgG4 человека и легкую цепь к человека.
[0152] Как было отмечено выше, является эффекторная функция желательной или нет, может зависеть от конкретного способа лечения с применением антитела. Таким образом, в некоторых вариантах реализации изобретения, если эффекторная функция является желательной, выбирают анти-CSF1R антитело, содержащее константную область тяжелой цепи IgG1 или константную область тяжелой цепи IgG3 человека. В некоторых вариантах реализации изобретения при условии, что эффекторная функция не является желательной, выбирают анти-CSF1R антитело, содержащее IgG4 человека или константную область тяжелой цепи IgG2.
Иллюстративные вариабельные области тяжелой цепи анти-CSF1R
[0153] В некоторых вариантах реализации изобретения предлагаются вариабельные области тяжелой цепи анти-CSF1R антитела. В некоторых вариантах реализации изобретения вариабельная область тяжелой цепи анти-CSF1R антитела представляет собой вариабельную область мыши, вариабельную область человека или гуманизированную вариабельную область.
[0154] Вариабельная область тяжелой цепи анти-CSF1R антитела содержит CDR1, FR2, CDR2, FR3 и CDR3 тяжелой цепи. В некоторых вариантах реализации изобретения вариабельная область тяжелой цепи анти-CSF1R антитела дополнительно содержит FR1 и/или FR4 тяжелой цепи. Неограничивающие иллюстративные вариабельные области тяжелой цепи содержат, в частности, вариабельные области тяжелой цепи, имеющие аминокислотную последовательность, выбранную из SEQ ID NO: 9, 11,13 и 39-45.
[0155] В некоторых вариантах реализации изобретения вариабельная область тяжелой цепи анти-CSF1R антитела содержит CDR1, содержащую последовательность, выбранную из SEQ ID NO: 15, 21 и 27.
[0156] В некоторых вариантах реализации изобретения вариабельная область тяжелой цепи анти-CSF1R антитела содержит CDR2, содержащую последовательность, выбранную из SEQ ID NO: 16, 22 и 28.
[0157] В некоторых вариантах реализации изобретения вариабельная область тяжелой цепи анти-CSF1R антитела содержит CDR3, содержащую последовательность, выбранную из SEQ ID NO: 17, 23 и 29.
[0158] Неограничивающие иллюстративные вариабельные области тяжелой цепи содержат, в частности, вариабельные области тяжелой цепи, содержащие наборы CDR1, CDR2 и CDR3, выбранные из: SEQ ID NO: 15, 16 и 17; SEQ ID NO: 21, 22 и 23; и SEQ ID NO: 27, 28 и 29.
[0159] В некоторых вариантах реализации изобретения тяжелая цепь анти-CSF1R антитела содержит последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична последовательности, выбранной из SEQ ID NO: 9, 11, 13 и 39-45, причем тяжелая цепь, вместе с легкой цепью, способна образовывать антитело, которое связывается с CSF1R.
[0160] В некоторых вариантах реализации изобретения тяжелая цепь анти-CSF1R антитела содержит по меньшей мере одну из CDR, описанных в данном документе. То есть в некоторых вариантах реализации изобретения тяжелая цепь анти-CSF1R антитела содержит по меньшей мере одну CDR, выбранную из CDR1 тяжелой цепи, обсуждаемой в данном документе, CDR2 тяжелой цепи обсуждаемой в данном документе, и CDR3 тяжелой цепи, обсуждаемой в данном документе. Кроме того, в некоторых вариантах реализации изобретения тяжелая цепь анти-CSF1R антитела содержит по меньшей мере одну мутировавшую CDR на основе CDR, обсуждаемой в данном документе, причем мутировавшая CDR содержит 1, 2, 3 или 4 аминокислотные замены по сравнению с CDR, обсуждаемой в данном документе. В некоторых вариантах реализации изобретения одна или более из аминокислотных замен являются консервативными аминокислотными заменами. Специалист в данной области техники может выбрать одну или несколько подходящих консервативных аминокислотных замен для конкретной последовательности CDR, причем подходящие консервативные аминокислотные замены, не предсказанные для существенного изменения связывающих свойств тяжелой цепи, содержащей мутировавшую CDR.
[0161] В некоторых вариантах реализации изобретения тяжелая цепь содержит константную область тяжелой цепи. В некоторых вариантах реализации изобретения тяжелая цепь содержит константную область тяжелой цепи человека. В некоторых вариантах реализации изобретения константная область тяжелой цепи человека имеет изотип, выбранный из IgA, IgG и IgD. В некоторых вариантах реализации изобретения константную область тяжелой цепи человека представляет собой константную область IgG. В некоторых вариантах реализации изобретения тяжелая цепь содержит константную область тяжелой цепи igG4 человека. В некоторых подобных вариантах реализации изобретения константная область тяжелой цепи IgG4 человека содержит мутацию S241P.
[0162] В некоторых вариантах реализации изобретения, если эффекторная функция является желательной, тяжелая цепь содержит константную область тяжелой цепи IgG1 или IgG3 человека. В некоторых вариантах реализации изобретения, если эффекторная функция является желательной, тяжелая цепь содержит константную область тяжелой цепи IgG4 или IgG2 человека.
Иллюстративные вариабельные области легкой цепи анти-CSF1R
[0163] В некоторых вариантах реализации изобретения предлагаются вариабельные области легкой цепи анти-CSF1R антитела. В некоторых вариантах реализации изобретения вариабельная область легкой цепи анти-CSF1R антитела представляет собой вариабельную область мыши, вариабельную область человека или гуманизированную вариабельную область.
[0164] Вариабельная область легкой цепи анти-CSF1R антитела содержит CDR1, FR2, CDR2, FR3 и CDR3 легкой цепи. В некоторых вариантах реализации изобретения вариабельная область легкой цепи анти-CSF1R антитела дополнительно содержит FR1 и/или FR4 легкой цепи. Неограничивающие иллюстративные вариабельные области легкой цепи содержат вариабельные области легкой цепи, имеющие аминокислотную последовательность, выбранную из SEQ ID NO: 10, 12, 14 и 46-52.
[0165] В некоторых вариантах реализации изобретения вариабельная область легкой цепи анти-CSF1R антитела содержат CDR1, содержащую последовательность, выбранную из SEQ ID NO: 18, 24 и 30.
[0166] В некоторых вариантах реализации изобретения вариабельная область легкой цепи анти-CSF1R антитела содержат CDR2, содержащую последовательность, выбранную из SEQ ID NO: 19, 25 и 31.
[0167] В некоторых вариантах реализации изобретения вариабельная область легкой цепи анти-CSF1R антитела содержат CDR3, содержащую последовательность, выбранную из SEQ ID NO: 20, 26 и 32.
[0168] Неограничивающие иллюстративные вариабельные области легкой цепи содержат, в частности, вариабельные области легкой цепи, содержащие наборы CDR1, CDR2 и CDR3, выбранные из: SEQ ID NO: 18, 19 и 20; SEQ ID NO: 24, 25 и 26; и SEQ ID NO: 30, 31 и 32.
[0169] В некоторых вариантах реализации изобретения легкая цепь анти-CSF1R антитела содержит последовательность вариабельной области, которая на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентична последовательности, выбранной из SEQ ID NO: 10, 12, 14 и 46-52, причем тяжелая цепь, вместе с легкой цепью, способна образовывать антитело, которое связывается с CSF1R.
[0170] В некоторых вариантах реализации изобретения легкая цепь анти-CSF1R антитела содержит по меньшей мере одну из CDR, описанных в данном документе. То есть в некоторых вариантах реализации изобретения легкая цепь анти-CSF1R антитела содержит по меньшей мере одну CDR, выбранную из CDR1 легкой цепи, обсуждаемой в данном документе, CDR2 легкой цепи, обсуждаемой в данном документе, и CDR3 легкой цепи, обсуждаемой в данном документе. Дополнительно, в некоторых вариантах реализации изобретения легкая цепь анти-CSF1R антитела содержит по меньшей мере одну мутировавшую CDR на основе CDR, обсуждаемой в данном документе, причем мутировавшая CDR содержит 1, 2, 3 или 4 аминокислотные замены по сравнению с CDR, обсуждаемой в данном документе. В некоторых вариантах реализации изобретения одна или несколько аминокислотных замен являются консервативными аминокислотными заменами. Специалист в данной области техники может выбрать одну или несколько подходящих консервативных аминокислотных замен для конкретной последовательности CDR, причем подходящие консервативные аминокислотные замены не предсказаны для существенного изменения связывающих свойств легкой цепи, содержащей мутировавшую CDR.
[0171] В некоторых вариантах реализации изобретения легкая цепь содержит константную область легкой цепи человека. В некоторых вариантах реализации изобретения константную область легкой цепи человека выбирают из константной области легкой цепи κ человека и λ человека.
Иллюстративные дополнительные молекулы, связывающие CSF1R
[0172] В некоторых вариантах реализации изобретения предлагаются дополнительные молекулы, которые связываются с CSF1R. Подобные молекулы содержат, в частности, неканонические каркасы, такие как антикалины, аднектины, анкириновых повторы и т.д. Смотри, например, Hosse и соавт., Prot. Sci. 15:14 (2006); Fiedler, M. and Skerra, Α., "Non-AntibodyScaffolds," pp.467-499 inHandbookofTherapeuticAntibodies, Dubel, S., ed., Wiley-VCH, Weinheim, Germany, 2007.
Иллюстративные свойства анти-CSF1R антител
[0173] В некоторых вариантах реализации изобретения антитело, имеющее структуру, описанную выше, связывается с CSF1R с аффинностью связывания (KD) менее 1 нМ, блокирует связывание CSF1 и/или IL-34 с CSF1R и ингибирует фосфорилирование CSF1R, индуцированное с помощью CSF1 и/или IL-34.
[0174] В некоторых вариантах реализации изобретения анти-CSF1R антитело связывается с внеклеточным доменом CSF1R (CSF1R-ECD). В некоторых вариантах реализации изобретения анти-CSF1R антитело имеет аффинность связывания (KD) с CSF1R менее 1 нМ, менее 0,5 нМ, менее 0,1 нМ или менее 0,05 нМ. В некоторых вариантах реализации изобретения анти-CSF1R антитело имеет KD в пределах от 0,01 до 1 нМ, от 0,01 до 0,5 нМ, от 0,01 до 0,1 нМ, от 0,01 до 0,05 нМ или от 0,02 до 0,05 нМ.
[0175] В некоторых вариантах реализации изобретения анти-CSF1R антитело блокирует связывание лиганда с CSF1R. В некоторых вариантах реализации изобретения анти-CSF1R антитело блокирует связывание CSF1 с CSF1R. В некоторых вариантах реализации изобретения анти-CSF1R антитело блокирует связывание IL-34 с CSF1R. В некоторых вариантах реализации изобретения анти-CSF1R антитело блокирует связывание и CSF1, и IL-34 с CSF1R. В некоторых вариантах реализации изобретения антитело, которое блокирует связывание лиганда, связывается с внеклеточным доменом CSF1R. В некоторых вариантах реализации изобретения антитело блокирует связывание лиганда с CSF1R, если он уменьшает количество детектируемого связывания лиганда с CSF1R по меньшей мере на 50%, с помощью анализа, описанного, например, в патенте США №8206715 В2, Примере 7, который содержится в данном документе в виде ссылки для любых целей. В некоторых вариантах реализации изобретения антитело уменьшает количество детектируемого связывания лиганда с CSF1R на по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90%. В некоторых подобных вариантах реализации изобретения антитело, как полагают, блокирует связывание лиганда на по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, и т.д.
[0176] В некоторых вариантах реализации изобретения анти-CSF1R антитело ингибирует лиганд-индуцированное фосфорилирование CSF1R. В некоторых вариантах реализации изобретения анти-CSF1R антитело ингибирует CSF1-индуцированное фосфорилирование CSF1R. В некоторых вариантах реализации изобретения анти-CSF1R антитело ингибирует IL-34-индуцированное фосфорилирование CSF1R. В некоторых вариантах реализации изобретения анти-CSF1R антитело ингибирует и CSF1-индуцированное, и IL-34-индуцированное фосфорилирование CSF1R. В некоторых вариантах реализации изобретения антитело, как полагают, "ингибирует лиганд-индуцированное фосфорилирование CSF1R", если оно уменьшает количество обнаруживаемого лиганд-индуцированного фосфорилирования CSF1R на по меньшей мере 50%, с помощью анализа, описанного, например, в патенте США. №8206715 В2, Примера 6, который содержится в данном документе в виде ссылки для любых целей. В некоторых вариантах реализации изобретения антитело уменьшает количество обнаруживаемого лиганд-индуцированного фосфорилирования CSF1R по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90%. В некоторых подобных вариантах реализации изобретения антитело, как полагают, ингибирует лиганд-индуцированное фосфорилирования CSF1R на по меньшей мере по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, и т.д.
[0177] В некоторых вариантах реализации изобретения антитело ингибирует пролиферацию моноцитов и/или ответов на выживаемость в присутствии CSF1 и/или IL-34. В некоторых вариантах реализации изобретения антитело, как полагают, "ингибирует пролиферацию моноцитов и/или ответов на выживаемость", если он уменьшает количество пролиферации моноцитов и/или ответов на выживаемость в присутствии CSF1 и/или IL-34 на по меньшей мере 50%, с помощью анализа, описанного, например, в патенте США №8206715 В2, Примере 10, который содержится в данном документе в виде ссылки для любых целей. В некоторых вариантах реализации изобретения антитело уменьшает количество пролиферации моноцитов и/или ответов на выживаемость в присутствии CSF1 и/или IL-34 на по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90%. В некоторых подобных вариантах реализации изобретения антитело ингибирует пролиферацию моноцитов и/или ответов на выживаемость на по меньшей мере по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, и т.д. Иллюстративные конъюгаты антитела
[0178] В некоторых вариантах реализации изобретения анти-CSF1R антитело конъюгируют с меткой и/или цитотоксическим средством. Как используют в данном документе, метка представляет собой фрагмент, который облегчает обнаружение антитела и/или облегчает обнаружение молекулы, с которой связывается антитело. Неограничивающие иллюстративные метки содержат, в частности, радиоизотопы, флуоресцентные группы, ферментативные группы, хемилюминесцентные группы, биотин, эпитопные метки, связывающие металл метки, и т.д. Специалист в данной области техники может выбрать соответствующую метку в соответствии с предполагаемым применением.
[0179] Как используют в данном документе, цитотоксическое средство представляет собой фрагмент, который уменьшает пролиферативную способность одной или нескольких клеток. Клетка имеет уменьшенную пролиферативную способность, при условии, что клетка становится менее способной к пролиферации, например, ввиду того, что клетка подвергается апоптозу или иным образом умирает, клетка не может пройти через клеточный цикл и/или не способна разделиться, дифференцировать клетку и т.д. Неограничивающие иллюстративные цитотоксические средства содержат, в частности, радиоизотопы, токсины и химиотерапевтические средства. Специалист в данной области техники может выбрать подходящее цитотоксическое средство в соответствии с предполагаемым применением.
[0180] В некоторых вариантах реализации изобретения метку и/или цитотоксическое средство конъюгируют с антителом с помощью химических способов in vitro. Неограниченные иллюстративные химические способы сопряжения известны в данном уровне техники и содержат приборы, способы и/или реагенты, коммерчески доступные от, например, ThermoScientificLifeScienceResearchProduces (ранее Pierce; Rockford, IL), Prozyme (Hayward, CA), SACRI AntibodyServices (Calgary, Canada), AbDSerotec (Raleigh, NC) и т.д. В некоторых вариантах реализации изобретения при условии, что метка и/или цитотоксическое средство представляют собой полипептид, метка и/или цитотоксическое средство могут быть экспрессированы в тот же вектор экспрессии с по меньшей мере одной цепочкой антитела для получения полипептида, содержащего метку, и/или цитотоксическое средство, слитое с цепочкой антитела. Специалист в данной области техники может выбрать соответствующий способ конъюгации метки и/или цитотоксического средства с антителом в соответствии с предполагаемым применением. Иллюстративные лидерные последовательности
[0181] Для того, чтобы отдельные секретируемые белки экспрессировались и секретировались в больших количествах, может быть желательной лидерная последовательность гетерологичного белка. В некоторых вариантах реализации изобретения лидерную последовательность выбирают из SEQ ID NO: 3 и 4, которые являются лидерными последовательностями легкой цепи и тяжелой цепи, соответственно. В некоторых вариантах реализации изобретения применение гетерологичных лидерных последовательностей может быть выгодным для того, чтобы в результате этого зрелый полипептид мог оставаться неизменным, тогда как лидерную последовательность удаляют в ER во время процесса секреции. Добавление гетерологичной лидерной последовательности может потребоваться для того, чтобы экспрессировать и секретировать некоторые белки.
[0182] Отдельные иллюстративные последовательности лидерных последовательностей описаны, например, в онлайн базе данных лидерных последовательностей, поддерживаемой DepartmentofBiochemistry, NationalUniversityofSingapore. Смотри Choo и соавт., BMC Bioinformatics, 6: 249 (2005); и публикацию PCT № WO 2006/081430.
Молекулы нуклеиновой кислоты, кодирующие анти-CSF1R антитела
[0183] Предлагаются молекулы нуклеиновых кислот, содержащие полинуклеотиды, которые кодируют одну или несколько цепей анти-CSF1R антител. В некоторых вариантах реализации изобретения молекула нуклеиновой кислоты содержит полинуклеотид, который кодирует тяжелую цепь или легкую цепь анти-CSF1R антитела. В некоторых вариантах реализации изобретения молекула нуклеиновой кислоты содержит как полинуклеотид, который кодирует тяжелую цепь, так и полинуклеотид, который кодирует легкую цепь, анти-CSF1R антитела. В некоторых вариантах реализации изобретения первая молекула нуклеиновой кислоты содержит первый полинуклеотид, который кодирует тяжелую цепь, а вторая молекула нуклеиновой кислоты содержит второй полинуклеотид, который кодирует легкую цепь.
[0184] В некоторых подобных вариантах реализации изобретения тяжелую цепь и легкую цепь экспрессируют из одной молекулы нуклеиновой кислоты или из двух отдельных молекул нуклеиновых кислот, в виде двух отдельных полипептидов. В некоторых вариантах реализации изобретения например, если антитело представляет собой scFv, один полинуклеотид кодирует один полипептид, содержащий как тяжелую цепь, так и легкую цепь, связанные между собой.
[0185] В некоторых вариантах реализации изобретения полинуклеотид, кодирующий тяжелую цепь или легкую цепь анти-CSF1R антитела, содержит нуклеотидную последовательность, которая кодирует лидерную последовательность, которая, при трансляции, находится на N-конце тяжелой или легкой цепи. Как обсуждалось выше, лидерная последовательность может быть нативной лидерной последовательностью тяжелой или легкой цепи или может быть отличной гетерологичной лидерной последовательностью.
[0186] Молекулы нуклеиновой кислоты могут быть сконструированы с использованием способов рекомбинантных DNA, общепринятых в данной области техники. В некоторых вариантах реализации изобретения молекула нуклеиновой кислоты представляет собой вектор экспрессии, который подходит для экспрессии в выбранной клетке-хозяине.
Экспрессия и получение анти-CSF1R антитела Векторы
[0187] Предлагаются векторы, содержащие полинуклеотиды, которые кодируют анти-CSF1R тяжелые цепи и/или анти-CSF1R легкие цепи. Также предлагаются векторы, содержащие полинуклеотиды, которые кодируют анти-CSF1R тяжелые цепи и/или анти-CSF1R легкие цепи. Подобные векторы содержат, в частности, векторы DNA, фаговые векторы, вирусные векторы, ретровирусные векторы и т.д. В некоторых вариантах реализации изобретения вектор содержит первый полинуклеотидную последовательность, кодирующую тяжелую цепь, и вторую полинуклеотидную последовательность, кодирующую легкую цепь. В некоторых вариантах реализации изобретения тяжелую цепь и легкую цепь экспрессируют из вектора в виде двух отдельных полипептидов. В некоторых вариантах реализации изобретения тяжелую цепь и легкую цепь экспрессируют в качестве части одного полипептида, такого как, например, если антитело представляет собой scFv.
[0188] В некоторых вариантах реализации изобретения первый вектор содержит полинуклеотид, который кодирует тяжелую цепь, а второй вектор содержит полинуклеотид, который кодирует легкую цепь. В некоторых вариантах реализации изобретения первый вектор и второй вектор трансфицируют в клетки-хозяева в одинаковых количествах (например, одинаковые молярные количества или одинаковые массовые количества). В некоторых вариантах реализации изобретения в клетки-хозяева трансфицируют первый вектор и второй вектор в молярном или массовом соотношении между 5:1 и 1:5. В некоторых вариантах реализации изобретения используют массовое отношение между 1:1 и 1:5 в случае вектора, кодирующего тяжелую цепь и вектора, кодирующего легкую цепь. В некоторых вариантах реализации изобретения используют массовое отношение 1:2 в случае вектора, кодирующего тяжелую цепь и вектора, кодирующего легкую цепь.
[0189] В некоторых вариантах реализации изобретения выбирают вектор, который оптимизирован для экспрессии полипептидов в СНО или CHO-производных клетках или в клетках NSO. Многие подобные векторы описывают, например, в RunningDeer и соавт., Biotechnol. Prog. 20:880-889 (2004).
[0190] В некоторых вариантах реализации изобретения вектор выбирают для in vivo экспрессии анти-CSF1R тяжелых цепей и/или анти-CSF1R легких цепей у животных, в том числе человека. В некоторых подобных вариантах реализации изобретения экспрессия полипептида находится под контролем промотора, который функционирует ткани-специфическим образом. Например, печень-специфические промоторы описаны, например, в публикации РСТ № WO 2006/076288. Клетки-хозяева
[0191] В различных вариантах реализации изобретения анти-CSF1R тяжелые цепи и/или анти-CSF1R легкие цепи могут быть экспрессированы в прокариотических клетках, таких как бактериальные клетки; или в эукариотических клетках, таких как клетки грибов (например, дрожжей), растительные клетки, клетки насекомого и клетки млекопитающего. Подобная экспрессия может быть осуществлена, например, в соответствии со способами, известными в данной области техники. Иллюстративные эукариотические клетки, которые могут быть использованы для экспрессии полипептидов, содержат, в частности, клетки COS, в том числе клетки COS 7; клетки 293, в том числе клетки 293-6Е; клетки СНО, в том числе клетки СНО-S и DG44; клетки PER.C6® (Crucell); и клетки NSO. В некоторых вариантах реализации изобретения анти-CSF1R тяжелые цепи и/или анти-CSF1R легкие цепи могут быть экспрессированы в дрожжах. Смотри, например, публикацию патента США №2006/0270045 A1. В некоторых вариантах реализации изобретения специфическую эукариотическую клетку-хозяина выбирают на основе ее способности осуществлять желаемые посттрансляционные модификации с анти-CSF1R тяжелыми цепями и/или анти-CSF1R легкими цепями. Например, в некоторых вариантах реализации изобретения клетки СНО получают полипептиды, которые имеют более высокий уровень сиалилирования того же полипептида, полученного в клетках 293.
[0192] Введение одного или нескольких нуклеиновых кислот в нужную клетку-хозяина может быть осуществлено любым способом, в частности, трансфекцией фосфатом кальция, опосредованной DEAE-декстраном трансфекцией, катионной липид-опосредованной трансфекцией, электропорацией, трансдукцикей, инфекцией и т.д. Неограничивающие иллюстративные способы описаны, например, в Sambrook и соавт., MolecularCloning, ALaboratoryManual, 3rd ed. ColdSpringHarborLaboratoryPress (2001). Нуклеиновые кислоты могут быть временно или стабильно трансфицироваными в желаемые клетки-хозяева, в соответствии с любым подходящим способом.
[0193] В некоторых вариантах реализации изобретения один или несколько полипептидов могут быть получены in vivo у животного, которое было рекомбинировано или трансфицировано одной или несколькими молекулами нуклеиновой кислоты, кодирующими полипептиды, в соответствии с любым подходящим способом.
Очистка анти-CSF1R антител
[0194] Анти-CSF1R антитела могут быть очищены любым подходящим способом. Такие способы содержат, в частности, использование аффинных матриц или хроматографии с гидрофобным взаимодействием. Подходящие аффинные лиганды содержат ECDCSF1R и лиганды, которые связывают константные области антитела. Например, белок А, белок G, белок A/G или колонка с иммобилизованными антителами могут быть использованы для связывания константной области и очистки анти-антитело CSF1R. Гидрофобная интерактивная хроматография, например, бутиловая или фенильная колонка, могут также быть подходящими для очистки отдельных полипептидов. В данной области техники известны многие способы очистки полипептидов.
Бесклеточное получение анти-CSF1R антител
[0195] В некоторых вариантах реализации изобретения анти-CSF1R антитело получают в бесклеточной системе. Неограничивающие иллюстративные бесклеточные системы описывают, например, в Sitaraman и соавт., Methods Mol. Biol. 498: 229-44 (2009); Spirin, Trends Biotechnol. 22: 538-45 (2004); Endo и соавт., Biotechnol. Adv. 21: 695-713 (2003).
Способы определения факторов
[0196] Настоящее изобретение относится к способам снижения уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, MMP-7, MMP-2 и ММР-9. В некоторых вариантах реализации изобретения субъект имеет повышенный уровень одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, MMP-7, MMP-2 и ММР-9, перед обработкой антителами, описанными в данном документе. В некоторых вариантах реализации изобретения уровень фактора определяют с помощью определения уровня белка. Неограничивающие иллюстративные аминокислотные последовательности IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, MMP-7, ММР-9 и MMP-2 человека проиллюстрированы в SEQ ID NO: 96-108, соответственно. Любые нативные формы этих белков, в том числе встречающиеся природе вариантов, такие как варианты, содержащие замены и/или делеции (например, укорочения), варианты, содержащие посттрансляционные модификации, варианты сплайсинга и аллельные варианты, которые предполагают определенным образом.
[0197] В некоторых вариантах реализации изобретения уровень фактора определяют с помощью определения уровня mRNA. В данной области техники известны иллюстративные нуклеотидные последовательности IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9 mRNA человека (или ее комплемента, cDNA). В некоторых случаях, уровень mRNA может коррелировать с уровнем кодируемого белка, таким образом, что определение уровня mRNA может быть использовано для определения, является ли уровень белка, например, повышенным перед обработкой, или был уменьшен после лечения. В некоторых вариантах реализации изобретения определяют уровень белка. Следует отметить, однако, что это не является необходимым для определения уровня фактора(ов) до или после лечения антителом для того, чтобы выполнять описанные в данном документе способы. Можно предположить, в некоторых случаях, что конкретное патологическое состояние содержит повышенный уровень одного или более из указанных факторов и, следовательно, о том, что субъекту с указанным патологическим состоянием, было бы полезно лечение, которое снижает один или более из перечисленных факторов. Таким образом, если явно не указано, определение уровня одного или нескольких факторов, до или после обработки, для того, чтобы осуществлять заявленные способы, не требуется.
[0198] Рассматривают любой способ определения уровня белка в образце. Специалист в данной области техники может выбрать соответствующий способ в зависимости от типа анализируемого образца и идентичности и количества белков, которые определяют. Неограничивающие примеры подобных способов включают иммуногистохимию, ELISA, вестерн-блоттинг, определение множественных исследуемых веществ (с использованием, например, технология Luminex®), масс-спектрометрию и т.д.
[0199] Кроме того, рассматривают любой способ определения уровня mRNA в образце. Специалисту в данной области техники может выбрать подходящий способ в зависимости от типа анализируемого образца и идентичности и количества mRNA, которую определяют. Неограничивающие примеры подобных способов включают RT-PCR, количественную RT-PCR и способы на основе микрочипов и т.д.
[0200] Рассматривают любой способ определения уровней CD16+ и/или CD16- моноцитов. Специалист в данной области техники может выбрать соответствующий способ в зависимости от типа анализируемого образца. Неограничивающие примеры способов определения уровня CD16+ и/или CD16- моноцитов включают способы, предлагаемые в виде коммерческих наборов, таких, как CD16+ MoncytelsolationKit (MiltenylBiotec, BergischGladbach, Germany). Терапевтические композиции и способы
Способы лечения заболеваний с помощью анти-CSF1R антител
[0201] Предлагаются способы снижения у субъекта уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9,включающие введение эффективного количества антитела, которое связывается с CSF1R и блокирует CSF1 и связывание лиганда IL-34. В некоторых вариантах реализации изобретения способ включает снижение уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или четырех факторов, выбранных из IL-6, IL-1β, TNF-α и CXCL10.
[0202] Аминокислотные последовательности иллюстративных зрелых IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, MMP-9 и ММР-2 человека приведены в Таблице 9 (Таблица последовательностей; SEQ ID NO: 96-108, соответственно). Также могут существовать дополнительные нативные зрелые последовательности. В некоторых вариантах реализации изобретения нативные зрелые последовательности имеют от 1 до 10 или более аминокислот, удаленных с амино-конца зрелых последовательностей, приведенных в Таблице 9. В некоторых вариантах реализации изобретения нативные зрелые последовательности имеют одну или несколько аминокислотных присоединений, делеций и/или замен по отношению к зрелым последовательностям, приведенным в Таблице 9. В данный документ могут быть включены все нативные зрелые формы каждого фактора.
[0203] Предлагаются способы лечения патологических состояний, связанных с повышенными у субъекта уровнями одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, включающие введение антител, которые связываются с CSF1R и блокируют связывание лиганда CSF1 и IL-34. Примеры патологических состояний, которые связаны с повышенным уровнем одного или более из этих факторов, содержат, в частности, ревматоидный артрит, ювенильный ревматоидный артрит, болезнь Кастлемана, псориаз, псориатический артрит, анкилозирующий спондилит, болезнь Крона, язвенный колит, системную красную волчанку и воспалительное заболевание кишечника. В некоторых вариантах реализации изобретения антитело, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34 выбирают из huAb1-huAb16, описанных в данном документе. В некоторых вариантах реализации изобретения антитело представляет собой huAb1.
[0204] В некоторых вариантах реализации изобретения способ снижения уровня IL-6 у субъекта, включающий введение субъекту антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34. Снижение уровня IL-6 является имеющим практическую значимость в некоторых вариантах реализации изобретения при лечении патологического состояния, связанного с повышенным IL-6, такого как ревматоидный артрит, ювенильный идиопатический артрит и заболевание Кастлемана. В некоторых вариантах реализации изобретения предлагается способ снижения уровня TNF-α у субъекта, включающий введение субъекту антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34. Снижение уровня TNF-α является имеющим практическую значимость в некоторых вариантах реализации изобретения при лечении патологического состояния, связанного с повышенным TNF-α, такого как ревматоидный артрит, ювенильный идиопатический артрит, псориаз, псориатический артрит, анкилозирующий спондилит, болезнь Крона и неспецифический язвенный колит. В некоторых вариантах реализации изобретения способ снижения уровня IL-1β у субъекта включает введение субъекту антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34. Снижение уровня IL-1β является имеющим практическую значимость в некоторых вариантах реализации изобретения при лечении патологического состояния, связанного с повышенным IL-1β, такого как ревматоидный артрит и ювенильный идиопатический артрит. В любом из вариантов реализации изобретения в данном документе, антитело, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, может быть выбрано из huAb1-huAb16, описанных в данном документе. В любом из вариантов реализации изобретения в данном документе, антитело может представлять собой huAb1.
[0205] В некоторых вариантах реализации изобретения способ включает снижение уровня IL-6 и IL-1β. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-6 и TNF-α. В некоторых вариантах реализации изобретения способ включает снижение IL-6 и CXCL10. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-1β и TNF-α. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-1β и CXCL10. В некоторых вариантах реализации изобретения способ включает снижение уровня TNF-α и CXCL10. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-6, IL-1β и TNF-α. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-6, IL-1β и CXCL10. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-6, TNF-α и CXCL10. В некоторых вариантах реализации изобретения способ включает снижение уровня TNF-α, IL-1β и CXCL10. В некоторых вариантах реализации изобретения способ включает снижение уровня IL-6, IL-1β, TNF-α и CXCL10.
[0206] Предлагаются способы лечения воспалительного состояния, включающие введение субъекту с воспалительным процессом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34. В некоторых вариантах реализации изобретения способ лечения воспалительного процесса включает снижение у субъекта, имеющего воспалительный процесс, уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, в том числе введение антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34. В некоторых вариантах реализации изобретения способ включает снижение уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или четырех факторов, выбранных из IL-6, IL-1β, TNF-α и CXCL10. В некоторых вариантах реализации изобретения антитело, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, выбирают из huAb1-huAb16, описанных в данном документе. В некоторых вариантах реализации изобретения антитело представляет собой huAb1. Неограничивающие иллюстративные воспалительные состояния содержат ревматоидный артрит, ювенильный ревматоидный артрит, болезнь Кастлмана, псориаз, псориатический артрит, анкилозирующий спондилит, болезнь Крона, язвенный колит, системную красную волчанку, воспалительное заболевание кишечника, воспалительный артрит и нарушения CD16+.
[0207] Предлагаются способы лечения воспалительного артрита, включающие введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34. В некоторых вариантах реализации изобретения способ лечения воспалительного артрита включает снижение у субъекта, имеющего воспалительный артрит, уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, в том числе введение антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34. В некоторых вариантах реализации изобретения способ включает снижение уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или четырех факторов, выбранных из IL-6, IL-1β, TNF-α и CXCL10. В некоторых вариантах реализации изобретения антитело, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, выбирают из huAb1-huAb16, описанных в данном документе. В некоторых вариантах реализации изобретения антитело представляет собой huAb1.
[0208] В некоторых вариантах реализации изобретения, в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например, huAb1-huAb16, уменьшает воспаление, уменьшает образование паннуса, уменьшает повреждение хряща, уменьшает резорбцию костной ткани, снижает количество макрофагов в суставах, уменьшает образование аутоантител и/или уменьшает остеопороз.
[0209] В некоторых вариантах реализации изобретения в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например, huAb1-huAb16, уменьшает воспаление. Уменьшение воспаления в некоторых вариантах реализации изобретения содержит восстановление скорости оседания эритроцитов и/или снижение уровня C-реактивного белка в крови. Если у субъекта наблюдается воспаление, скорость оседания эритроцитов увеличивается, возможно, в связи с повышением уровня фибриногена в крови. Скорость оседания эритроцитов может быть определена с помощью любого способа в данной области техники, включая, в частности, расчет скорости с помощью измерения изменения высоты антикоагулированных эритроцитов в течение одного часа в трубке Вестергрена. Смотри также Procedures for the Erythrocyte Sedimentation Rate Test; Approved Standard-Fifth Edition. CLSI document H02-A5. Wayne, PA: Clinical and Laboratory Standards Institute; 2011. Уровни C-реактивного белка в крови могут быть определены с помощью любых способов в данной области, в частности, с использованием набора для анализа RAPITEX® CRP (Siemens).
[0210] Ослабление воспаления в некоторых вариантах реализации изобретения содержит уменьшение периферических отеков, которые представляют собой отек тканей за счет накопления жидкости. Периферические отеки могут возникнуть в некоторых случаях, в лодыжках, стопах, ногах и/или лодыжках субъекта с ревматоидным артритом. Ослабление воспаления в некоторых вариантах реализации изобретения содержит уменьшение инфильтрации воспалительных клеток в синовиальной оболочке одного или нескольких пораженных суставов. Синовиальная жидкость может быть собрана в некоторых вариантах реализации изобретения с помощью артроцентеза.
[0211] В некоторых вариантах реализации изобретения в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например, huAb1-huAb16, подавляет образование паннуса. Подавление образования паннуса в некоторых вариантах реализации изобретения включает подавление инфильтрации паннуса в хрящ и/или субхондриальную кость и/или подавление разрушения твердых тканей в результате инфильтрации паннуса. Образование паннуса может быть измерено любым способом в данной области, в частности, путем визуализации одного или нескольких пораженных суставов. Неограниченные иллюстративные способы визуализации для обнаружения образования паннуса включают магнитно-резонансную томографию (МРТ), компьютерную томографию (КТ), артроскопию, ультразвуковое исследование, дуплексное ультразвуковое исследование и визуализацию с помощью энергетической доплерографии. В некоторых вариантах реализации изобретения прогрессирование образования паннуса замедляется после введения антитела и/или в течение определенного интервала времени, в течение которого субъект проходит лечение с антителом. Лечение может быть с однократным введением препарата или с многократным введением препарата.
[0212] В некоторых вариантах реализации изобретения в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и EL-34, например, huAb1-huAb16, уменьшает повреждение хряща. Уменьшение повреждения хряща в некоторых вариантах реализации изобретения содержит снижение потери хондроцитов, уменьшение разрушение коллагена и/или уменьшение потери хряща. Повреждение хряща может быть измерено любым способом в данной области, в частности, визуализацией одного или нескольких пораженных суставов. Неограниченные иллюстративные способы визуализации для обнаружения повреждения хряща включают MPT, КТ сканирование, артроскопию и рентгенологическое исследование. В некоторых вариантах реализации изобретения прогрессирование повреждения хряща замедляется после введения антитела и/или в течение определенного интервала времени, в течение которого субъект проходит лечение антителом. Лечение может быть с однократным введением препарата или с многократным введением препарата.
[0213] В некоторых вариантах реализации изобретения в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например, huAb1-huAb16, уменьшает резорбцию костной ткани. Уменьшение резорбции костной ткани в некоторых вариантах реализации изобретения содержит сокращение количества остеокластов в суставах, вызванное ревматоидным артритом.
[0214] В некоторых вариантах реализации изобретения резорбция костной ткани может быть измерена с помощью определения уровня TRAP5b в сыворотке или плазме субъекта, в котором повышенный уровень TRAP5b указывает на повышенную резорбцию костной ткани у субъекта. Таким образом, в некоторых вариантах реализации изобретения сниженный уровень TRAP5b указывает на снижение резорбции костной ткани. Уровни TRAP5b могут быть определены, в некоторых случаях, до и после лечения антителом, которое связывается с CSF1R, и/или могут определяться периодически в течение курса лечения, для того, чтобы контролировать эффективность лечения в уменьшении остеопороза. Уровни TRAP5b могут быть определены с использованием любого способа в данной области техники, в частности, ELISA (в том числе FAICEA, или ферментативный анализ с захватом поглощаемых фрагментов; смотри, например, анализ Quidel® TRAP5b, TECO medicalGroup, Sissach, Switzerland).
[0215] В некоторых вариантах реализации изобретения резорбция кости может быть измерена с помощью определения уровня N-концевого телопептида (NTx) в моче субъекта, причем повышенный уровень NTx указывает на повышенную резорбцию костной ткани у субъекта. Таким образом, в некоторых вариантах реализации изобретения сниженный уровень NTx указывает на снижение резорбции костной ткани. Уровни NTx могут быть определены, в некоторых случаях, до и после лечения антителом, которое связывается с CSF1R, и/или могут определяться периодически в течение курса лечения, для того, чтобы контролировать эффективность лечения в уменьшении остеопороза. Уровни NTx могут быть определены с помощью любого способа в данной области техники, в частности, ELISA. Неограниченные иллюстративные анализы для определения уровней NTx содержат Osteomark® NTxUrineELISA (Alerelnc, Waltham, MA) и различные анализы, предоставляемые лабораториями, такими как QuestDiagnostics, MayoMedicalLaboratories, и т.д.
[0216] В некоторых вариантах реализации изобретения резорбция костной ткани может быть измерена с помощью определения уровня С-концевого телопептида (СТх) в сыворотке субъекта, причем повышенный уровень СТх указывает на повышенную резорбцию костной ткани у субъекта. Таким образом, в некоторых вариантах реализации изобретения сниженный уровень СТх указывает на снижение резорбции костной ткани. Уровни СТх могут быть определены, в некоторых случаях, до и после лечения антителом, которое связывается с CSF1R, и/или могут определяться периодически в течение курса лечения, для того, чтобы контролировать эффективность лечения в уменьшении остеопороза. Уровни СТх могут быть определены с помощью любого способа в данной области техники, в том числе ELISA. Неограниченные иллюстративные анализы для определения уровней СТх содержат SerumCrossLaps® (СТх-1) ELISA (ImmunodiagnosticSystems, Inc., Scottsdale, AZ), и различные анализы, предоставляемые лабораториями, такими как QuestDiagnostics, MayoMedicalLaboratories, и т.д.
[0217] В некоторых вариантах реализации изобретения в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например, huAb1-huAb16, уменьшает остеопороз. Потеря костной массы может быть определена с использованием любого способа в данной области техники, в частности, рентгенографией, MPT, КТ, костной денситометрией, одно- и двухфотонной абсорбциометрией (SPA, DPA), одно- и двухэнергетической рентгеновской абсорбциометрией (SXA, DXA), ультразвуковым исследованием, сцинтиграфией и с помощью измерения уровней сывороточных маркеров формирования и резорбции кости. Неограничивающие иллюстративные сывороточные маркеры образования костной ткани и резорбции костной ткани приведены в Таблице 2.
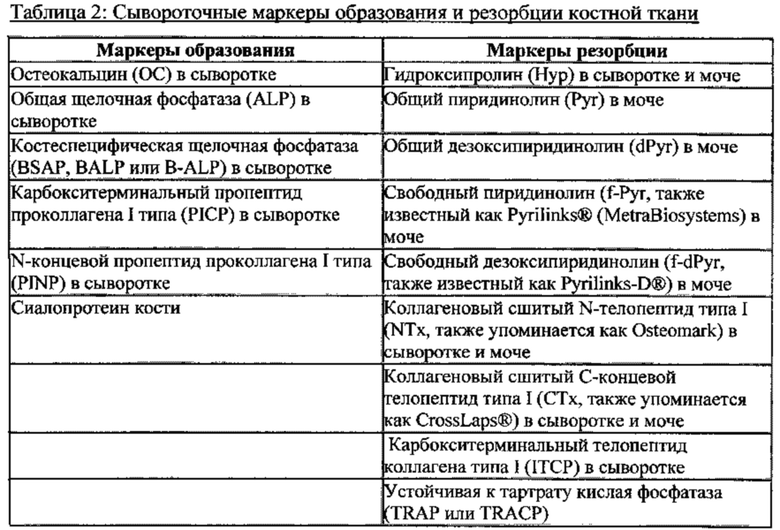
[0218] В некоторых вариантах реализации изобретения прогрессирование остеопороза замедляется после введения антитела и/или в течение определенного интервала времени, в течение которого субъект проходит лечение антителом. Лечение может быть с однократным введением препарата или с многократным введением препарата.
[0219] В некоторых вариантах реализации изобретения в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например, huAb1-huAb16, уменьшает уровни аутоантител. Уровни аутоантител могут быть определены любым способом в данной области техники. В некоторых вариантах реализации изобретения уровни аутоантител определяют с помощью уровня ревматоидного фактора (РФ) и/или анти-цитруллинированных белковых антител (АСРА) и/или анти-ядерных антител (ANA).
[0220] В некоторых вариантах реализации изобретения в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и MMP-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например, huAb1-huAb16, существенно уменьшает количество моноцитов клеток, таких как макрофаги и/или CD16+ моноциты, в суставах (в том числе синовиальной жидкости), пораженных воспалительным артритом.
[0221] В некоторых вариантах реализации изобретения в дополнение к снижению уровня одного или нескольких факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9, введение субъекту с воспалительным артритом эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например, huAb1-huAb16, снижает количество CD16+ моноцитов. В некоторых вариантах реализации изобретения субъект аутоиммунное заболевание выбирают из ревматоидного артрита и SLE (волчанки). В некоторых вариантах реализации изобретения с последующим введением эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, количество CD16- моноцитов существенно не изменяется. В некоторых вариантах реализации изобретения CD16+ моноциты снижаются в большей степени, нежели снижаются CD16- моноциты, если субъекту вводят антитело, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34. В некоторых вариантах реализации изобретения CD16+ моноциты снижаются на по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90%. В некоторых вариантах реализации изобретения CD16- моноциты снижаются на менее 30%, менее 20% или менее 10%. В некоторых вариантах реализации изобретения CD16+моноциты представляют собой CD16+ моноциты периферической крови. В некоторых вариантах реализации изобретения CD16- моноциты представляют собой CD16- моноциты периферической крови.
[0222] В некоторых вариантах реализации изобретения предлагаются способы лечения нарушения CD16+, включающие введение субъекту с нарушением CD16+ эффективного количества антитела, которое связывается с CSF1R и блокирует связывание лиганда CSF1 и IL-34, например huAb1-huAb16, причем антитело снижает уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, MMP-7, ММР-2 и ММР-9. Неограничивающие иллюстративные нарушения CD16+ содержат ревматоидный артрит, ювенильный ревматоидный артрит, заболевание Кастлемана, псориаз, псориатический артрит, анкилозирующий спондилит, болезнь Крона, язвенный колит, системная красная волчанка и воспалительное заболевание кишечника. В некоторых вариантах реализации изобретения субъект с нарушением CD16+ имеет повышенный уровень CD16+ моноцитов, по сравнению с уровнем CD16+ моноцитов здорового человека или группы здоровых людей. В некоторых вариантах реализации изобретения субъект с нарушением CD16+ имеет повышенный уровень CD16+ моноцитов по сравнению с уровнем CD16+ моноцитов у субъекта перед развитием нарушения CD16+ (например, в некоторых вариантах реализации изобретения существенно перед развитием каких-либо симптомов нарушения CD16+, тогда как субъект будет, в ретроспективе, рассматриваться как "здоровый" на данный момент).
[0223] В некоторых вариантах реализации изобретения предлагаются способы идентификации субъектов, которые могут извлечь пользу из антитела, связывающего CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R (например, huAb1-huAb16). В некоторых подобных вариантах реализации изобретения способ включает определение у субъекта уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9. В некоторых вариантах реализации изобретения повышенный уровень по меньшей мере одного из факторов у субъекта указывает на то, что субъект может извлечь выгоду из антитела, которое связывается с CSF1R. B некоторых вариантах реализации изобретения субъект имеет нарушение CD16+. В некоторых вариантах реализации изобретения субъект имеет ревматоидный артрит. В некоторых вариантах реализации изобретения субъект имеет повышенный уровень CD16+ моноцитов.
[0224] В некоторых вариантах реализации изобретения предлагаются способы прогнозирования отклика у субъекта, страдающего от воспалительного состояния, на антитело, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R (например, huAb1-huAb16). В некоторых подобных вариантах реализации изобретения, способ включает определение у субъекта уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9. В некоторых вариантах реализации изобретения повышенный уровень по меньшей мере одного из факторов у субъекта указывает на то, что субъект, скорее всего, отвечает на антитело, которое связывается с CSF1R. В некоторых вариантах реализации изобретения субъект имеет нарушение CD16+. В некоторых вариантах реализации изобретения субъект имеет ревматоидный артрит. В некоторых вариантах реализации изобретения субъект имеет повышенный уровень CD16+ моноцитов.
[0225] Многие пациенты имеют неадекватный ответ на метотрексат, отдельно или в комбинации с ингибитором TNF. В некоторых вариантах реализации способов, описанных в данном документе, субъект имеет патологическое состояние, которое является устойчивым к метотрексату (например, субъект представляет собой субъект с неадекватным ответом на метотрексат). Субъект с патологическим состоянием, которое является устойчивым к метотрексату, например, субъект, который представляет собой субъект с неадекватным ответом на метотрексат, возможно, ранее ответил на метотрексат, но, возможно, стал устойчивым к метотрексату или субъект никогда не отвечал на метотрексат. Устойчивость к метотрексату означает, что аспекты патологического состояния, для которых ожидается улучшение после стандартной дозы метотрексата, не улучшаются и/или улучшение происходит только если вводят дозу метотрексата больше, чем стандартная доза. В некоторых вариантах реализации изобретения субъект с неадекватным ответом на метотрексат пережил или испытывает неадекватный ответ на метотрексат после получения стандартной дозы в течение по меньшей мере двух недель, по меньшей мере трех недель, по меньшей мере четырех недель, по меньшей мере шести недель или по меньшей мере двенадцати недель. "Стандартную" дозу определяет профессиональный врач и она может зависеть от возраста, веса субъекта, истории болезни, тяжести заболевания, частоты дозирования и т.д.
[0226] В некоторых вариантах реализации способов, описанных в данном документе, субъект является субъектом с неадекватным ответом на ингибитор TNF. Субъектом, который представляет собой субъект с неадекватным ответом на ингибитор TNF, возможно, ранее отвечал на ингибитор TNF, но, возможно, стал менее чувствительными к ингибитору TNF или субъект, возможно, никогда не отвечал на ингибитор TNF. Неадекватный ответ на ингибитор TNF означает, что аспекты патологического состояния, для которых ожидается улучшение после стандартной дозы ингибитора TNF, не улучшаются и/или улучшение происходит только тогда, когда вводят дозу ингибитора TNF большую, чем стандартная. В некоторых вариантах реализации изобретения субъект с неадекватным ответом на ингибитор TNF пережил или переживает неадекватный ответ на ингибитор TNF после получения стандартной дозы в течение по меньшей мере двух недель, по меньшей мере трех недель, по меньшей мере четырех недель, по меньшей мере шести недель или по меньшей мере двенадцати недель. "Стандартную" дозу определяет профессиональный врач и она может зависеть от возраста, веса субъекта, истории болезни, тяжести заболевания, частоты дозирования и т.д. В некоторых вариантах реализации изобретения субъект с неадекватным ответом на ингибитор TNF пережил или переживает неадекватную реакцию на ингибитор TNF, выбранный из инфликсимаба, адалимумаба, цертолизумаба пегола, голимумаба и этанерцепта.
[0227] В некоторых вариантах реализации изобретения предлагаются способы лечения субъекта с неадекватным ответом на метотрексат. В некоторых вариантах реализации изобретения способ включает введение субъекту с неадекватным ответом на метотрексат антитела, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R, например huAb1-huAb16. В некоторых вариантах реализации изобретения субъект с неадекватным ответом имеет нарушение CD16+. В некоторых вариантах реализации изобретения нарушение CD16+ выбирают из ревматоидного артрита, ювенильного идиопатического артрита, заболевания Кастлемана, псориаза, псориатического артрита, анкилозирующего спондилита, болезни Крона, язвенного колита, системной красной волчанки и воспалительного заболевания кишечника. В некоторых вариантах реализации изобретения нарушение CD16+ представляет собой ревматоидный артрит. В некоторых вариантах реализации изобретения антитело значительно уменьшает количество CD16+ моноцитов. В некоторых вариантах реализации изобретения количество CD16- моноцитов существенно не изменяется после введения антитела. В некоторых вариантах реализации изобретения уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9 у субъекта с неадекватным ответом уменьшается после введения антитела. В некоторых вариантах реализации изобретения субъект с неадекватным ответом имеет повышенный уровень CD16+ моноцитов, например, по сравнению с уровнем CD16+ моноцитов у здорового человека или группы здоровых людей. В некоторых вариантах реализации изобретения антитело значительно уменьшает количество CD16+ моноцитов. В некоторых вариантах реализации изобретения количество CD16- моноцитов существенно не изменяется после введения антитела.
[0228] В некоторых вариантах реализации изобретения предлагаются способы лечения субъекта с неадекватным ответом на ингибитор TNF. В некоторых вариантах реализации изобретения способ включает введение субъекту с неадекватным ответом на ингибитор TNF антитела, которое связывается с CSF1R, причем антитело блокирует связывание CSF1 с CSF1R и блокирует связывание IL-34 с CSF1R, например huAb1-huAb16. В некоторых вариантах реализации изобретения субъект с неадекватным ответом имеет нарушение CD16+. В некоторых вариантах реализации изобретения нарушение CD16+ выбирают из ревматоидного артрита, ювенильного идиопатического артрита, заболевания Кастлемана, псориаза, псориатического артрита, анкилозирующего спондилита, болезни Крона, язвенного колита, системной красной волчанки и воспалительного заболевания кишечника. В некоторых вариантах реализации изобретения нарушение CD16+ представляет собой ревматоидный артрит.
В некоторых вариантах реализации изобретения антитело значительно уменьшает количество CD16+ моноцитов. В некоторых вариантах реализации изобретения количество CD16- моноцитов после введения антитела существенно не изменяется. В некоторых вариантах реализации изобретения уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех или по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или по меньшей мере десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, ММР-7, ММР-2 и ММР-9 у субъекта с неадекватным ответом уменьшается после введения антитела. В некоторых вариантах реализации изобретения субъект с неадекватным ответом имеет повышенный уровень CD16+ моноцитов, например, по сравнению с уровнем CD16+ моноцитов у здорового человека или пула здоровых людей. В некоторых вариантах реализации изобретения антитело значительно уменьшает количество CD16+ моноцитов. В некоторых вариантах реализации изобретения количество CD16- моноцитов существенно не изменяется после введения антитела. Пути введения и носители
[0229] В различных вариантах реализации изобретения анти-CSF1R антитела могут быть введены in vivo различными путями, в частности, пероральным, внутриартериальным, парентеральным, интраназальным, внутримышечным, внутрисердечным, интравентрикулярным, внутритрахиальным, трансбуккальным, ректальным, внутрибрюшинным, внутрикожным, местным, трансдермальным и интратекальным или иным путем с помощью имплантации или ингаляции. Рассматриваемые композиции могут быть приготовлены в виде препаратов в твердой, полутвердой, жидкой или газообразной формах; в частности, таблеток, капсул, порошков, гранул, мазей, растворов, суппозиториев, клизм, инъекций, средств для ингаляции и аэрозолей. Молекула нуклеиновой кислоты, кодирующая анти-CSF1R антитело, может быть нанесена на микрочастицы золота и доставлена внутрикожно с помощью устройства для бомбардировки частицами устройства, или "генной пушки", как описано в литературе (смотри, например, Tang и соавт., Nature 356: 152-154 (1992)). Соответствующий состав и путь введения могут быть выбраны в соответствии с предполагаемым применением.
[0230] В различных вариантах реализации изобретения композиции, содержащие анти-CSF1R антитела, предлагаются в составах с широким спектром фармацевтически приемлемых носителей (смотри, например, Gennaro, Remington: TheScienceandPracticeofPharmacywithFactsandComparisons: Drugfacts Plus, 20th ed. (2003); Ansel и соавт., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th ed., Lippencott Williams and Wilkins (2004); Kibbe и соавт., Handbook of Pharmaceutical Excipients, 3rd ed., Pharmaceutical Press (2000)). Доступны различные фармацевтически приемлемые носители, в том числе растворители, вспомогательные вещества и разбавители. Кроме того, также доступны различные фармацевтически приемлемые вспомогательные вещества, например, регулирующие рН и буферные средства, средства, регулирующие тоничность, стабилизаторы, смачивающие средства и тому подобные. Неограничивающие иллюстративные носители содержат солевой раствор, забуференный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации.
[0231] В различных вариантах реализации изобретения композиции, содержащие анти-CSF1R антитела, могут быть приготовлены для инъекции, в том числе подкожного введения с помощью растворения, суспендирования или эмульгирования их в водном или неводном растворителе, например, растительном или ином масле, синтетические глицериды алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоль; и, если является желательным, с обычными добавками, например, солюбилизаторами, изотоническими средствами, суспендирующими средствами, эмульгирующими средствами, стабилизаторами и консервантами. В различных вариантах реализации изобретения композиции могут быть приготовлены для ингаляции, например, с использованием приемлемых пропеллентов под давлением, например, дихлордифторметана, пропана, азота и т.п. Композиции могут быть также составлены, в различных вариантах реализации изобретения, в микрокапсулах с пролонгированным высвобождением, например, с биоразлагаемыми или не биоразлагаемыми полимерами. Неограничивающий иллюстративный биоразлагаемый состав содержат сополимер молочной и гликолевой кислот. Неограничивающий иллюстративные небиоразлагаемый состав содержит сложный эфир полиглицерина и жирной кислоты. Некоторые способы получения подобных составов описаны, например, в ЕР 1125584 A1.
[0232] Помимо этого предлагаются фармацевтические упаковки и наборы, в том числе с одним или несколькими контейнерами, каждый из которых содержит одну или несколько доз анти-CSF1R антитела. В некоторых вариантах реализации изобретения предлагается единица дозирования, причем единица дозирования содержит заданное количество композиции, содержащей анти-CSF1R антитела, с или без одного или нескольких дополнительных средств. В некоторых вариантах реализации изобретения подобная единица дозирования поставляется в одноразовом предварительно заполненном шприце для инъекции. В различных вариантах реализации изобретения композиция, содержащаяся в единице дозирования может содержать физиологический раствор, сахарозу или тому подобное; буфер, например фосфат или тому подобное; и/или быть составленной в пределах стабильного и эффективного диапазона Ph. С другой стороны, в некоторых вариантах реализации изобретения композиция может быть в виде лиофилизированного порошка, который может быть разведен при добавлении соответствующей жидкости, например, стерильной воды. В некоторых вариантах реализации изобретения композиция содержит одно или несколько веществ, которые ингибируют агрегацию белка, в частности, сахарозу и аргинин. В некоторых вариантах реализации изобретения композиция по настоящему изобретению содержит гепарин и/или протеогликан.
[0233] Фармацевтические композиции вводят в количестве, эффективном для лечения или профилактики особых показаний. Терапевтически эффективное количество, как правило, зависит от веса субъекта, которого лечат, его или ее физического состояния или нарушения здоровья, обширности состояния, подлежащего лечению, или возраста субъекта, которого лечат. В общем, анти-CSF1R антитела могут быть введены в количестве в диапазоне от около 10 мкг/кг массы тела до около 100 мг/кг массы тела на дозу. В некоторых вариантах реализации изобретения анти-CSF1R антитела могут быть введены в количестве в диапазоне от около 50 мкг/кг массы тела до около 5 мг/кг массы тела на дозу. В некоторых вариантах реализации изобретения анти-CSF1R антитела могут быть введены в количестве в диапазоне от около 100 мкг/кг массы тела до около 10 мг/кг массы тела на дозу. В некоторых вариантах реализации изобретения анти-CSF1R антитела могут быть введены в количестве в диапазоне от около 100 мкг/кг массы тела до около 20 мг/кг массы тела на дозу. В некоторых вариантах реализации изобретения анти-CSF1R антитела могут быть введены в количестве в диапазоне от около 0,5 мг/кг массы тела до около 20 мг/кг массы тела на дозу. В некоторых вариантах реализации изобретения анти-CSF1R антитела могут быть введены в количестве 0,2 мг/кг, 1 мг/кг, 3 мг/кг или 10 мг/кг массы тела.
[0234] Путем соответствующего дозирования анти-CSF1R антитела (например huAb1), эффективное лечение может быть достигнуто при минимизации определенных неблагоприятных событий, в частности, повышения креатинкиназы (СК) и/или повышения одной или нескольких печеночных трансаминаз, например, аспартатаминотрансферазы (AST) и аланинаминотрансферазы (ALT) и/или повышения общего билирубина. В некоторых вариантах реализации изобретения дозу анти-CSF1R антитела (например huAb1) выбирают таким образом, что уровни СК составляют менее 10х верхней границы нормы (ULN). В некоторых вариантах реализации изобретения дозу анти-CSF1R антитела (например huAb1) выбирают таким образом, что уровни CK составляют менее 8х верхней границы нормы (ULN). В некоторых вариантах реализации изобретения дозу анти-CSF1R антитела (например huAb1) выбирают таким образом, что уровни AST и/или ALT составляют менее 3xULN, а общего билирубина меньше, чем 2xULN. Уровни CK, билирубина, AST и/или ALT могут быть определены с помощью любого способа в данной области техники. Способы определения уровней CK, AST, ALT и билирубина, и в случае определения верхней границы нормы, известны в данной области техники. В некоторых вариантах реализации изобретения исходный уровень CK, AST, ALT и/или билирубина определяют для субъекта перед началом лечения. В некоторых вариантах реализации изобретения уровни CK, AST, ALT и/или билирубина определяют во время лечения, например, для обнаружения возможной гепатотоксичности.
[0235] Способы определения уровней CK, AST, ALT и билирубина известны в данной области техники. В некоторых вариантах реализации изобретения уровни AST и ALT определяются с помощью сочетания ферментативной реакции и измерения падения NADH. В некоторых вариантах реализации изобретения уровень СК определяют с помощью сочетания ферментативной реакции и измерения образования NADH. В некоторых вариантах реализации изобретения уровень билирубина определяют с помощью взаимодействия билирубина в образце с диазотированной сульфаниловой кислотой и фотометрического измерения азобилирубина. Анализы для определения уровней CK, AST, ALT и билирубина доступны во (и/или осуществляются) многих лабораториях, например QuestDiagnostics, MayoMedicalLaboratories, и т.д. В некоторых вариантах реализации изобретения исходный уровень и уровень CK, AST, ALT и/или билирубина при лечении определяют с помощью той же лаборатории. Как правило, каждая лаборатория, которая анализирует уровни CK, AST, ALT и/или билирубина определяет нормальный диапазон и ULN для анализов CK, AST, ALT и/или билирубина в этой лаборатории. В различных вариантах реализации изобретения уровни CK, AST, ALT и/или билирубина определяют в сыворотке, плазме или цельной крови. В некоторых вариантах реализации изобретения уровни CK, AST, ALT и/или билирубина определяют в сыворотке или плазме. Информация о повреждении печени, индуцированном лекарственным средством, можно найти, например, в "Guidance for Industry: Drug-Induced Liver Injury: Permarketing Climical Evaluation," U.S. Department of Health and Human Sevices, Food and Drug Administration, Center for Drug Evaluation and Research (CDER) и Center for Biologies Evaluation and Research (CBER), July 2009. See also Watkins и соавт., 2011, DrugSaf. 34(3): 243-252.
[0236] Композиции анти-CSF1R антител могут быть введены субъектам по мере необходимости. Определение частоты введения может быть сделано специалистами в данной области техники, например лечащим врачом, на основе соображений относительно патологического состояния, подлежащего лечению, возраста субъекта, подлежащего лечению, тяжести состояния, подлежащего лечению, общего состояния здоровья субъекта, подлежащего лечению, и тому подобного. В некоторых вариантах реализации изобретения эффективную дозу анти-CSF1R антитела вводят субъекту один или несколько раз. В различных вариантах реализации изобретения эффективную дозу анти-CSF1R антитела вводят субъекту один раз в месяц, менее одного раза в месяц, так, например, раз в два месяца или раз в три месяца. В дополнительных вариантах реализации изобретения эффективную дозу анти-CSF1R антитела вводят более чем один раз в месяц, так, например, каждые три недели, каждые две недели или каждую неделю. Эффективную дозу анти-CSF1R антитела вводят субъекту по меньшей мере один раз. В некоторых вариантах реализации изобретения эффективная доза анти-CSF1R антитела может быть введена несколько раз, в том числе в течение периодов в по меньшей мере месяц, по меньшей мере шесть месяцев или по меньшей мере год.
Комбинированная терапия
[0237] Анти-CSF1R антитела могут быть введены отдельно или вместе с другими видами лечения. Они могут быть предложены раньше, практически одновременно с или после других видов лечения, например, хирургии, химиотерапии, лучевой терапии или введения биологического препарата, например, другого терапевтического антитела. Для лечения воспалительного артрита (в том числе ревматоидного артрита, ювенильного идиопатического артрита, анкилозирующего спондилита и т.д.), анти-CSF1R антитела могут быть введены с другими терапевтическими средствами, например, метотрексатом, анти-TNF средствами, в том числе анти-TNF антителами, например Remicade® (инфликсимаб), Humira® (адалимумаб), Simponi® (голимумаб) и цертолизумабом пегола и растворимыми рецепторами TNF, например, Enbrel® (этанерсепт); глюкокортикоидами, например, преднизолоном; лефлуномидом; азатиоприном; ингибиторами JAK, например, CP 590690; ингибиторами SYK, например, R788; анти-IL-6 средствами, в том числе анти-IL-6-антителами, например, элсилимомабом, силтуксимабом и сирукумабом и анти-IL-6R антителами, например Actermra® (тоцилизумаб); анти-CD-20 средствами, в том числе aHTH-CD20 антителами, например, Rituxin® (ритуксимаба), ибритутомабом тиуксетаном, офатумумабом, окрелизумабом, велтузумабом и тозитумомабом; анти-CD19 средствами, например, анти-CD19 антителами; анти-GM-CSF средствами, например, анти-GM-CSF антителами и анти-GM-CSFR антителами; анти-IL-1 средствами, например, антагонистами рецепторов IL-1, в том числе анакинрой; CTLA-4 агонистами, например, слияниями CTLA4-Ig, в том числе абатацептом и белатацептом; иммунодепрессантами, например, циклоспорином.
[0238] Для лечения системной красной волчанки, анти-CSF1R антитела могут быть введены с другими терапевтическими средствами, например, гидроксихлорохином (Plaquenil®); кортикостероидами, например, преднизоном, метилпреднизоном и преднизолоном; иммунодепрессантами, например, циклофосфамидом (Cytoxan®), азатиоприном (Imuran®, Azasan®), микофенолятом (Cellcept®), лефлуномидом (Arava®), метотрексатом (Trexall™) и белимумабом (Benlysta®).
[0239] Для лечения рассеянного склероза, анти-CSF1R антитела могут быть введены с другими терапевтическими средствами, например, интерфероном альфа; интерфероном бета; преднизолоном; антителами анти-альфа4 интегрина, например, Tysabri®; анти-CD20 антителами, например, Rituxan®; FTY720 (финголимод; Gilenya®); и кладрибином (Leustatin®).
ПРИМЕРЫ
[0240] Примеры, обсуждаемые ниже, предназначены исключительно с целью иллюстрации настоящего изобретения и не должны рассматриваться как ограничения настоящего изобретения каким-либо образом. Примеры не предназначены для представления того, что эксперименты, приведенные ниже, представляют собой все или только проведенные эксперименты. Были предприняты усилия, чтобы обеспечить точность в отношении используемых чисел (например, количества, температуры и т.д.), но должны учитываться некоторые экспериментальные ошибки и отклонения. Если не указано иное, части являются массовыми частями, молекулярная масса представляет собой средневесовую молекулярную массу, температура приведена в градусах Цельсия, а давление равно или близко к атмосферному.
Пример 1: гуманизированные анти-CSF1R антитела
[0241] Различные гуманизированные анти-CSF1R антитела были разработаны ранее. Смотри, например, публикацию РСТ № WO 2011/140249.
[0242] Последовательности каждой из гуманизированных вариабельных областей тяжелой цепи и гуманизированных вариабельных областей легкой цепи, выровненных с последовательностями вариабельных областей родительского химерного антитела и последовательностями остовных областей переменного акцептора человека, проиллюстрированы на Фигурах 1 (тяжелые цепи) и 2 (легкие цепи). Изменения в гуманизированных последовательностей вариабельных областей по сравнению с вариабельными последовательностями остовной области акцептора человека заключены в рамку. Каждая из CDR каждой из вариабельных областей показана в области, заключенной в рамку, и помечена как "CDR" над последовательностями, заключенными в рамку.
[0243] Таблица 9, ниже, приводит полные последовательности гуманизированных тяжелых цепей и гуманизированных легких цепей антител huAb1-huAb16. Название и SEQ ID No гуманизированной тяжелой цепи и гуманизированной легкой цепи каждого из этих антител приведены в Таблице 3.
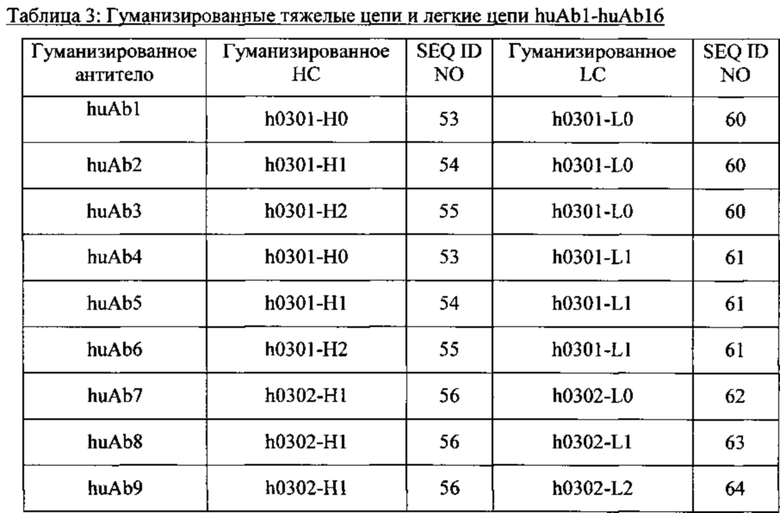
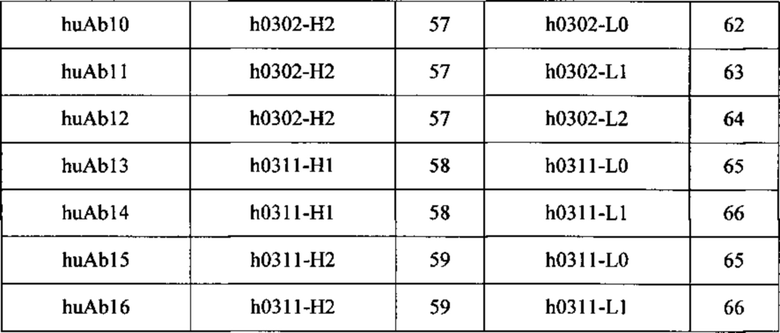
[0244] 16 гуманизированных антител проверяют на связывание с ECDCSF1R человека, макаки-крабоеда и мыши, как описано выше. Смотри, например, публикацию РСТ № WO 2011/140249. Антитела, как было обнаружено, связываются с ECDCSF1R как человека, так и макаки-крабоеда, но не с ECDCSF1R мыши. Гуманизированные антитела, как также было обнаружено, блокируют связывание CSF1 и IL-34 в CSF1R как человека, так и мыши, и ингибируют CSF1-индуцированное и IL-34-индуцированное фосфорилирование CSF1R человека, экспрессированного в клетках СНО. Смотри, например, публикацию РСТ № WO 2011/140249.
[0245] ka, kd и KD в случае связывания с ECDCSF1R человека были ранее определены и приведены в Таблице 4. Смотри, например, публикацию РСТ № WO 2011/140249.
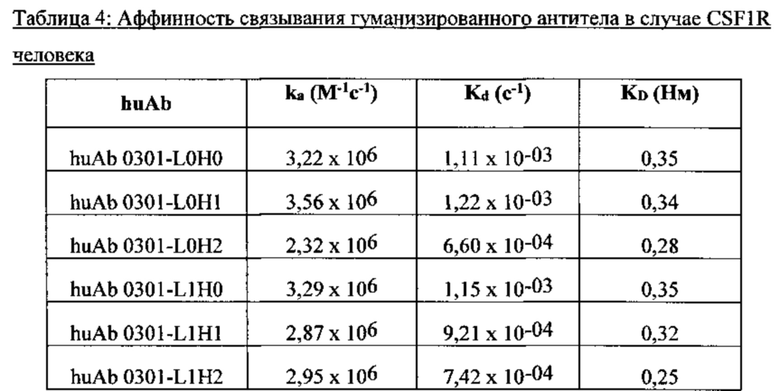
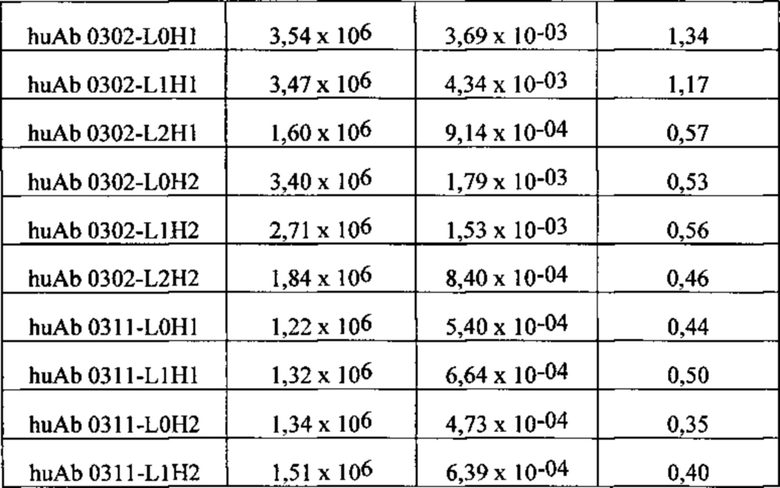
Пример 2: HuAb1 изменяет цитокин и получение отдельной матричной металлопротеиназы в синовиальных биопсийных эксплантах
[0246] Образцы синовиальной ткани получают из суставов пациентов с ревматоидным артритом. Пациенты имеют клинически активное заболевание, а ткань получают из клинически активных суставов. Все пациенты дали письменное информированное согласие, а эти исследования были одобрены MedicalEthicsCommittee oftheAcademicMedicalCenter (АМС) в UniversityoiAmsterdam.
Клинические характеристики шести пациентов, у которых были взяты биопсийные образцы, приведены в Таблице 5.
[0247] Синовиальные биопсийные образцы с объемом около 5 мм3 культивируют в трех повторах в полной среде, содержащей DMEM (LifeTechnologies, Grandlsland, NY) с 2 Мм L-глутамина, 100 ед/мл пенициллина, 50 мг/мл гентамицина, 20 Мм HEPES буфера и 10%FCS. Культуры держат при 37°C во влажной среде 5% CO2/95% воздуха. Синовиальные образцы культивируют в течение 4 дней в отсутствие или в присутствии возрастающих концентраций huAb1 или контрольного ЕТ904 антитела IgG4 (EurekaTherapeutics, Emeryville, СА). Бесклеточные супернатанты собирают и хранят при -80°C двумя отдельными порциями. Одну аликвоту оценивают на получение IL-6 с помощью ELISA. Другую аликвоту оценивают на мультиплексный анализ цитокинов и получение матричных металлопротеиназы с помощью технологии Luminex® (Millipore, Billerica, MA). Три фрагмента ткани собирают в каждом условии культивирования, быстро замораживают и сохраняют для анализа экспрессии Мгла. Некоторые биопсии показали цитокин и/или уровни металлопротеиназы ниже предела обнаружения, однако такие данные также приведены в таблицах и на графических материалах, обсуждаемых ниже.
[0248] Результаты анализа получения IL-6 с помощью ELISA представлены в Таблице 6.

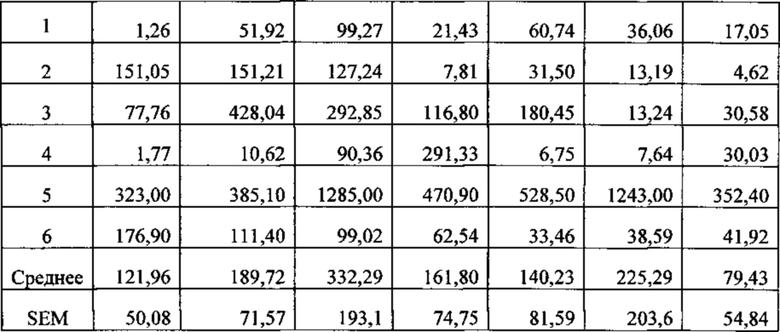
[0249] Получение IL-6 снижено во всех образцах после культивирования в течение 4 дней в присутствии 1 мкг/мл или 10 мкг/мл huAb1, по сравнению с инкубацией в одной и той же концентрации контрольного антитела. Получение IL-6 снижено во всех образцах после культивирования в течение 4 дней в присутствии 0,1 мкг/мл huAb1, по сравнению с инкубацией в 0,1 мкг/мл контрольного антитела. Фигура 3 иллюстрирует график снижения получения IL-6 в четырех образцах после культивирования в течение 4 дней в присутствии 1 мкг/мл контрольного антитела или 1 мкг/мл huAb1. Среднее снижение получения IL-6 было статистически значимым как при 1 мкг/мл, так и при 10 мкг/мл huAb1 (р=0,0313 для каждой дозы).
[0250] Фигура 4 иллюстрирует результаты мультиплексного анализа после культивирования четырех синовиальных биопсийных эксплантов в 1 мкг/мл huAb1 или контрольного антитела в течение 4 дней. Уровни IL-6, IL-1β, IL-8, CCL2 (также упоминается как МСР-1), CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6 и ММР-9 были снижены во всех четырех образцах после инкубации с 1 мкг/мл huAb1, по сравнению с инкубацией с 1 мкг/мл контрольного антитела. Уровни ММР-7 были снижены в двух образцах с измеримыми уровнями ММР-7 в контрольных группах, обработанных антителом.
[0251] Ниже, в Таблице 7, приведены результаты мультиплексного анализа четырех синовиальных биопсийных эксплантов, проиллюстрированных на Фиг. 4. В Таблице 7 приведен средний уровень цитокинов в четырех эксплантов после инкубации только в среде, 0,1 мкг/мл, 1 мкг/мл или 10 мкг/мл контрольного IgG4 или 0,1 мкг/мл, 1 мкг/мл или 10 мкг/мл huAb1.
[0252] Мультиплексный анализ уровней IL-8, CCL2 (также упоминается как МСР-1), CCL7 (также упоминается как МСР3), CXCL5, CXCL6, CXCL9 (также упоминается как MIG), CXCL10 (также упоминается как IP-10), TNF-α, ММР-2, ММР-7 и ММР-9 после культивирования двух дополнительных синовиальных биопсийных эксплантов в присутствии только среды, 0,1 мкг/мл, 1 мкг/мл или 10 мкг/мл контрольного IgG4 или 0,1 мкг/мл, 1 мкг/мл или 10 мкг/мл huAb1 осуществляют, по существу, как описано выше. Кроме этого, мультиплексный анализ уровней CXCL7, CXCL11 и CXCL12 после культивирования всех шести синовиальных биопсийных эксплантов в присутствии только среды, 0,1 мкг/мл, 1 мкг/мл или 10 мкг/мл контрольного IgG4 или 0,1 мкг/мл, 1 мкг/мл или 10 мкг/мл huAb1 осуществляют, по существу, как описано выше. Ниже в Таблице 8 показаны результаты мультиплексного анализа всех шести проанализированных синовиальных биопсийных эксплантов. Фигура 5 иллюстрирует результаты мультиплексного анализа (A) CXCL7, (В) CXCL11 и (С) CXCL12 после культивирования четырех синовиальных биопсийных эксплантов в 1 мкг/мл huAb1 или контрольного антитела в течение 4 дней.
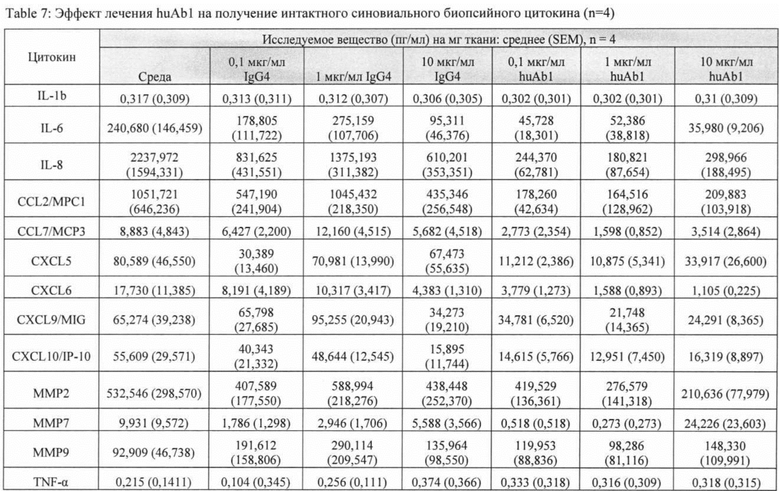
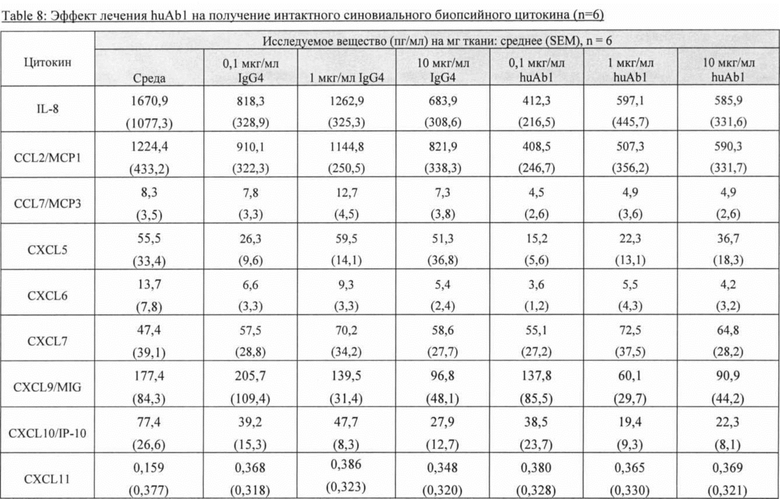
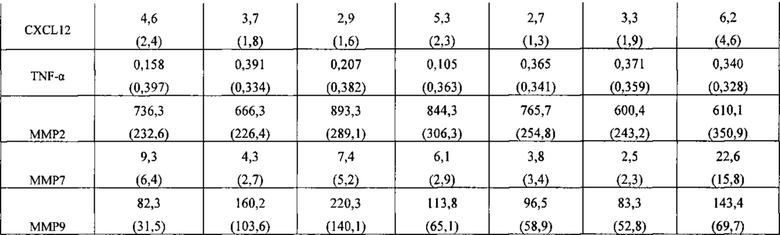
Пример 3: лечение анти-CSF1R антителом уменьшает количество тканевых макрофагов в суставах мышиных моделей ревматоидного артрита
[0253] Самцов DBA/1 мыши инъецируют внутрикожно в основании хвоста на 0 день и 21 день 150 мкл бычьего коллагена типа II (2 мг/мл), эмульгированного в полном адъюванте Фрейнда. Для профилактического дозирования, мышам начиная с дня 0 вводят растворитель, анти-CSF1R антитело (химерное антимышиное моноклональное антитело CSF1R крысы, содержащее область FcIgG1 мыши) при 30 мг/кг или Enbrel® при 10 мг/кг. Лечение продолжают 3 раза в неделю до 32 дня. Для терапевтического дозирования, мыши были рандомизированы в лечебные группы, после того, как сразу был создан отек по меньшей мере в одной лапе. Групповые средние результаты отека лапы составляют 0,5-1 (из возможных максимальных 5 баллов) во время регистрации. Мышам вводят дозы 3 раза в неделю с растворителем, анти-CSF1R антителом при 30 мг/кг или с Enbrel® при 10 мг/кг. Мышей умерщвляют на 23 день артрита.
[0254] И для профилактических, и для терапевтических моделей, 4 животных из каждой дозовой группы выбирают в качестве репрезентативных животных на основе оценки артрита, сравнимых со средней суммой баллов в пределах группы. При умерщвлении лапы и колени помещают в формалин, парафин, делают срезы и окрашивают на F4/80, чтобы определить тканевой макрофаг. Клетки F4/80 подсчитывают на всей периартикулярной мягкой ткани и дерме каждой лапы или колена наблюдаемого среза. Р4/80-позитивные клетки в костном мозге не подсчитывают. Общее количество затем нормализуют по отношению к количествам на пяти 200х полях. Это было сделано для учета мультифокальной природы F4/80-позитивного клеточного инфильтрата. Ткани, как правило, имеют подобные размеры с небольшими вариациями, учитываемыми при преобразовании. Статистическую значимость определяют с помощью однофакторного дисперсионного анализа с послеэкспериментальным критерием Тьюки, при сравнении групп между собой.
[0255] Результаты профилактического лечения анти-CSF1R антителом проиллюстрированы на Фигуре 6. Профилактическое лечение мышей с коллаген-индуцированным артритом анти-CSF1R антителом приводит к значительному уменьшению количества макрофагов в передних лапах (А) и коленях (В) и в обоих случаях уменьшение было больше, чем уменьшение после обработки Enbrel® (***=p≤0,001; *=p≤0,05; нз = незначительно).
[0256] Результаты терапевтического лечения анти-CSF1R антителом проиллюстрированы на Фигуре 7. Терапевтическое лечение мышей с коллаген-индуцированным артритом анти-CSF1R антителом приводит к значительному уменьшению количества макрофагов в передних лапах (А) и коленях (В) и в обоих случаях уменьшение было больше, чем уменьшение после обработки Enbrel® (***=p≤0,001; **=p≤0,01; нз = незначительно).
Таблица последовательностей
[0257] В Таблице 9 приведены некоторые последовательности, описанные в данном документе. Все последовательности полипептидов и антител приведены без лидерных последовательностей, если не указано иное.

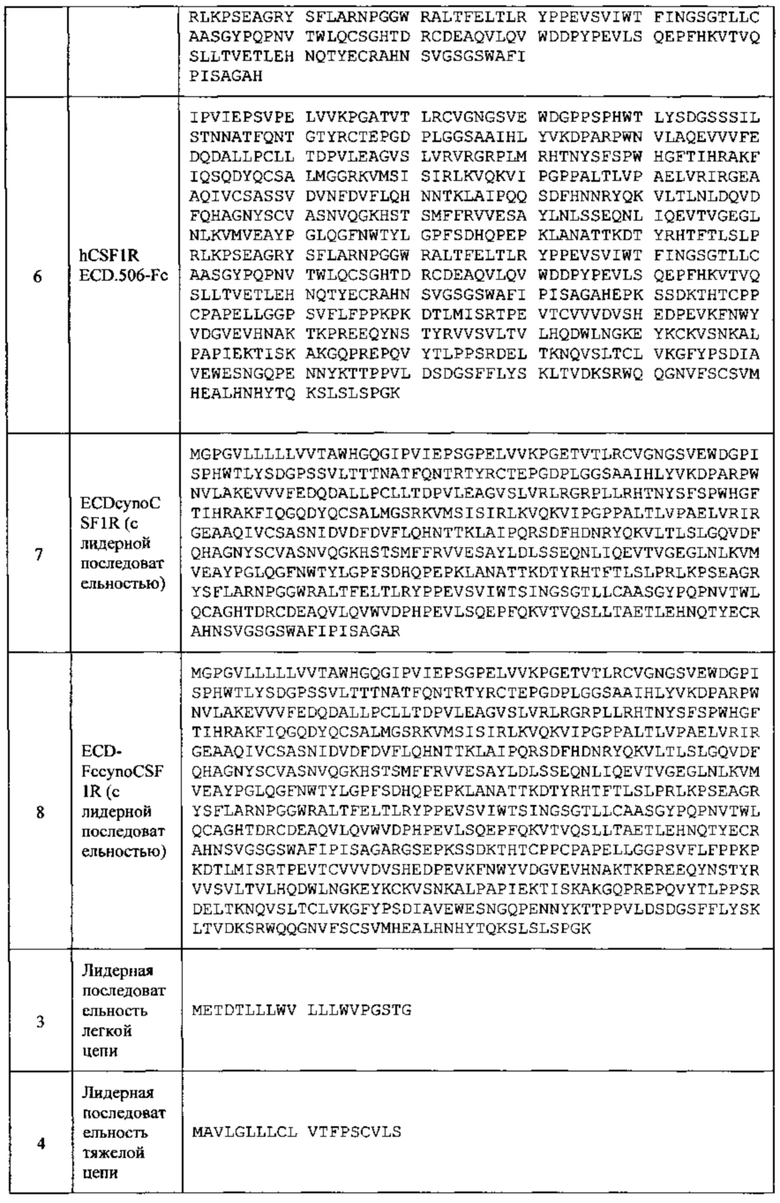
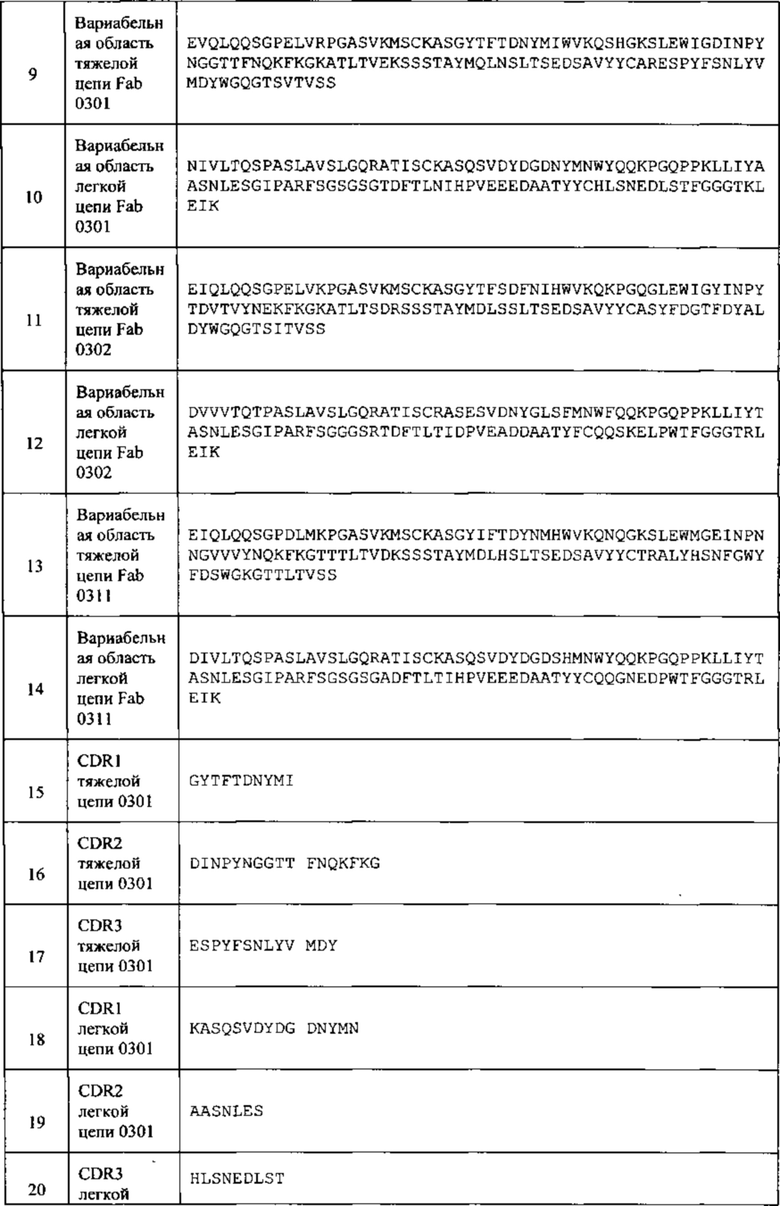

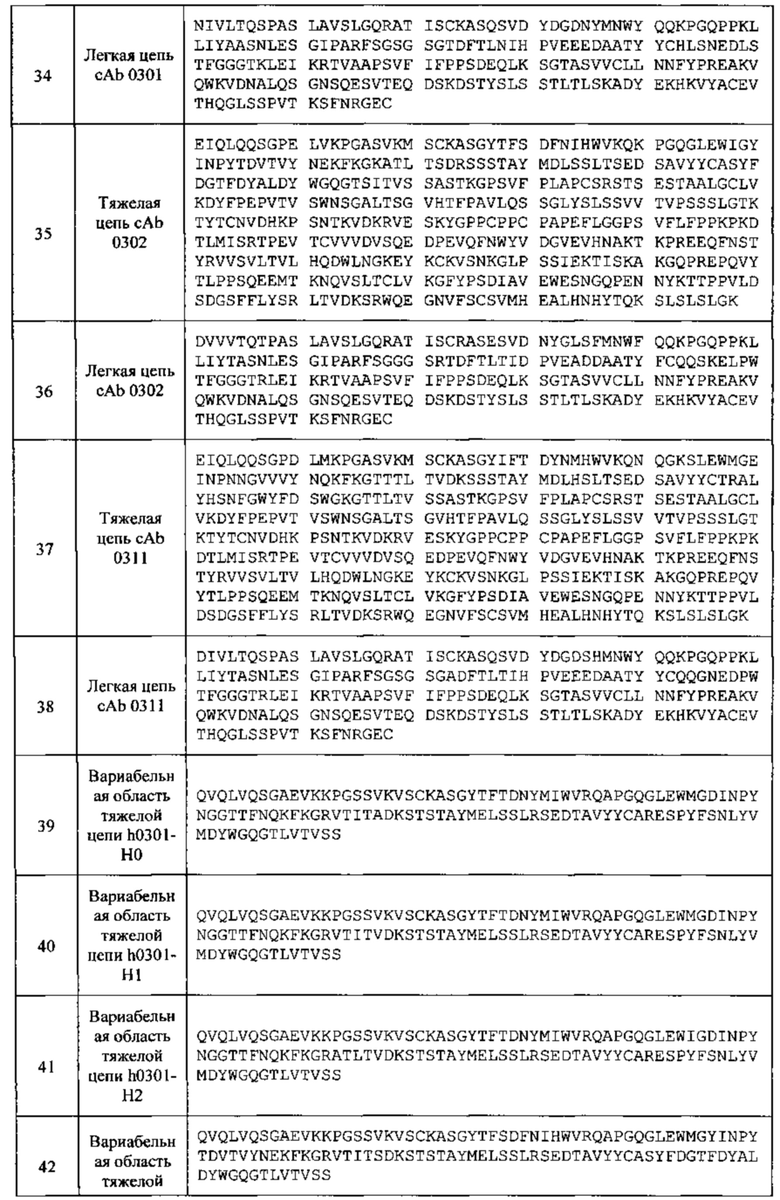
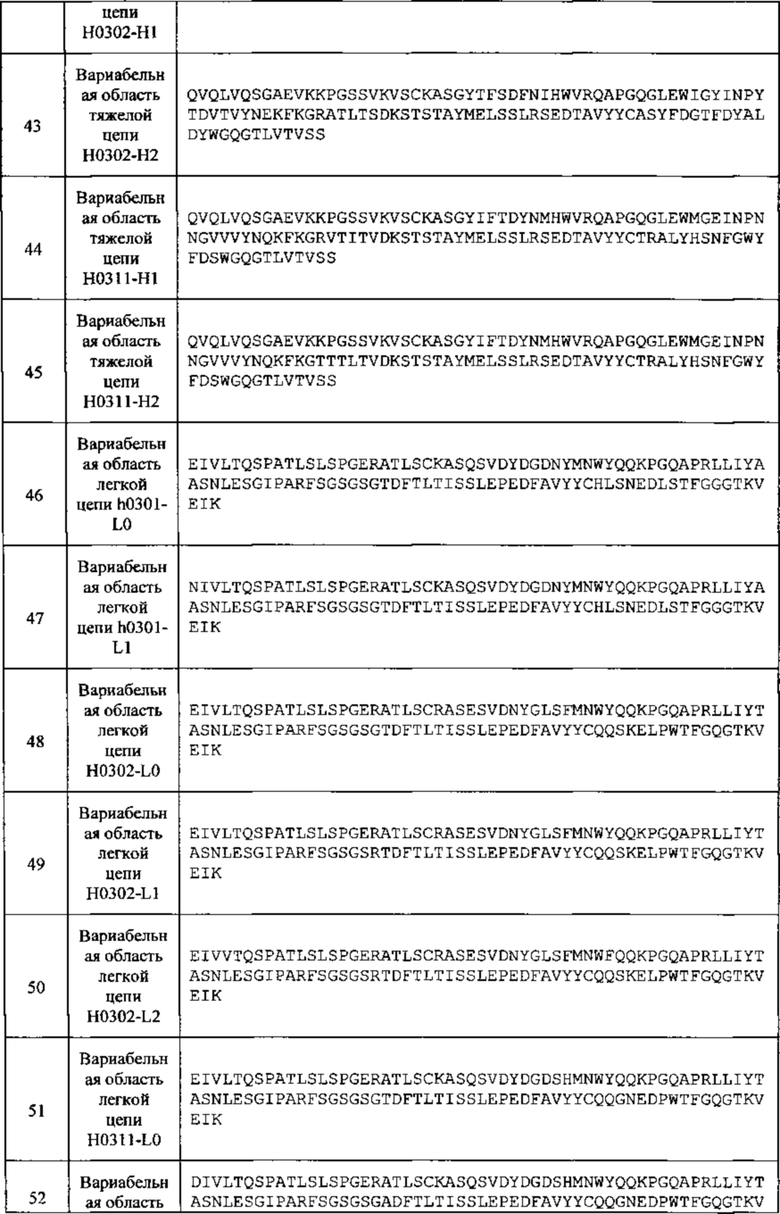

--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Five Prime Therapeutics, Inc.
<120> СПОСОБЫ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ С АНТИТЕЛАМИ,
КОТОРЫЕ СВЯЗЫВАЮТ РЕЦЕПТОР КОЛОНИЕСТИМУЛИРУЮЩЕГО
ФАКТОРА 1 (CSF1R)
<130> FPT-32814/WO-1/ORD
<150> US 61/778,706
<151> 2013-03-13
<150> US 61/767,989
<151> 2013-02-22
<150> US 61/695,641
<151> 2012-08-31
<160> 108
<170> PatentIn версия 3.5
<210> 1
<211> 953
<212> Белок
<213> Homo sapiens
<400> 1
Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val Lys Pro Gly
1 5 10 15
Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val Glu Trp Asp
20 25 30
Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly Ser Ser Ser
35 40 45
Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly Thr Tyr Arg
50 55 60
Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala Ile His Leu
65 70 75 80
Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala Gln Glu Val
85 90 95
Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu Leu Thr Asp
100 105 110
Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg Gly Arg Pro
115 120 125
Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His Gly Phe Thr
130 135 140
Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln Cys Ser Ala
145 150 155 160
Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg Leu Lys Val
165 170 175
Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val Pro Ala Glu
180 185 190
Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala Ser
195 200 205
Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn Asn Thr Lys
210 215 220
Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg Tyr Gln Lys
225 230 235 240
Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His Ala Gly Asn
245 250 255
Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser Thr Ser Met
260 265 270
Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser Ser Glu Gln
275 280 285
Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn Leu Lys Val
290 295 300
Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp Thr Tyr Leu
305 310 315 320
Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala Asn Ala Thr
325 330 335
Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu Pro Arg Leu
340 345 350
Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg Asn Pro Gly
355 360 365
Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro Glu
370 375 380
Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr Leu Leu Cys
385 390 395 400
Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu Gln Cys Ser
405 410 415
Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln Val Trp Asp
420 425 430
Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His Lys Val Thr
435 440 445
Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn Gln Thr Tyr
450 455 460
Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp Ala Phe Ile
465 470 475 480
Pro Ile Ser Ala Gly Ala His Thr His Pro Pro Asp Glu Phe Leu Phe
485 490 495
Thr Pro Val Val Val Ala Cys Met Ser Ile Met Ala Leu Leu Leu Leu
500 505 510
Leu Leu Leu Leu Leu Leu Tyr Lys Tyr Lys Gln Lys Pro Lys Tyr Gln
515 520 525
Val Arg Trp Lys Ile Ile Glu Ser Tyr Glu Gly Asn Ser Tyr Thr Phe
530 535 540
Ile Asp Pro Thr Gln Leu Pro Tyr Asn Glu Lys Trp Glu Phe Pro Arg
545 550 555 560
Asn Asn Leu Gln Phe Gly Lys Thr Leu Gly Ala Gly Ala Phe Gly Lys
565 570 575
Val Val Glu Ala Thr Ala Phe Gly Leu Gly Lys Glu Asp Ala Val Leu
580 585 590
Lys Val Ala Val Lys Met Leu Lys Ser Thr Ala His Ala Asp Glu Lys
595 600 605
Glu Ala Leu Met Ser Glu Leu Lys Ile Met Ser His Leu Gly Gln His
610 615 620
Glu Asn Ile Val Asn Leu Leu Gly Ala Cys Thr His Gly Gly Pro Val
625 630 635 640
Leu Val Ile Thr Glu Tyr Cys Cys Tyr Gly Asp Leu Leu Asn Phe Leu
645 650 655
Arg Arg Lys Ala Glu Ala Met Leu Gly Pro Ser Leu Ser Pro Gly Gln
660 665 670
Asp Pro Glu Gly Gly Val Asp Tyr Lys Asn Ile His Leu Glu Lys Lys
675 680 685
Tyr Val Arg Arg Asp Ser Gly Phe Ser Ser Gln Gly Val Asp Thr Tyr
690 695 700
Val Glu Met Arg Pro Val Ser Thr Ser Ser Asn Asp Ser Phe Ser Glu
705 710 715 720
Gln Asp Leu Asp Lys Glu Asp Gly Arg Pro Leu Glu Leu Arg Asp Leu
725 730 735
Leu His Phe Ser Ser Gln Val Ala Gln Gly Met Ala Phe Leu Ala Ser
740 745 750
Lys Asn Cys Ile His Arg Asp Val Ala Ala Arg Asn Val Leu Leu Thr
755 760 765
Asn Gly His Val Ala Lys Ile Gly Asp Phe Gly Leu Ala Arg Asp Ile
770 775 780
Met Asn Asp Ser Asn Tyr Ile Val Lys Gly Asn Ala Arg Leu Pro Val
785 790 795 800
Lys Trp Met Ala Pro Glu Ser Ile Phe Asp Cys Val Tyr Thr Val Gln
805 810 815
Ser Asp Val Trp Ser Tyr Gly Ile Leu Leu Trp Glu Ile Phe Ser Leu
820 825 830
Gly Leu Asn Pro Tyr Pro Gly Ile Leu Val Asn Ser Lys Phe Tyr Lys
835 840 845
Leu Val Lys Asp Gly Tyr Gln Met Ala Gln Pro Ala Phe Ala Pro Lys
850 855 860
Asn Ile Tyr Ser Ile Met Gln Ala Cys Trp Ala Leu Glu Pro Thr His
865 870 875 880
Arg Pro Thr Phe Gln Gln Ile Cys Ser Phe Leu Gln Glu Gln Ala Gln
885 890 895
Glu Asp Arg Arg Glu Arg Asp Tyr Thr Asn Leu Pro Ser Ser Ser Arg
900 905 910
Ser Gly Gly Ser Gly Ser Ser Ser Ser Glu Leu Glu Glu Glu Ser Ser
915 920 925
Ser Glu His Leu Thr Cys Cys Glu Gln Gly Asp Ile Ala Gln Pro Leu
930 935 940
Leu Gln Pro Asn Asn Tyr Gln Phe Cys
945 950
<210> 2
<211> 972
<212> Белок
<213> Homo sapiens
<400> 2
Met Gly Pro Gly Val Leu Leu Leu Leu Leu Val Ala Thr Ala Trp His
1 5 10 15
Gly Gln Gly Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val
20 25 30
Lys Pro Gly Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val
35 40 45
Glu Trp Asp Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly
50 55 60
Ser Ser Ser Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly
65 70 75 80
Thr Tyr Arg Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala
85 90 95
Ile His Leu Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala
100 105 110
Gln Glu Val Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu
115 120 125
Leu Thr Asp Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg
130 135 140
Gly Arg Pro Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His
145 150 155 160
Gly Phe Thr Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln
165 170 175
Cys Ser Ala Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg
180 185 190
Leu Lys Val Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val
195 200 205
Pro Ala Glu Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys
210 215 220
Ser Ala Ser Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn
225 230 235 240
Asn Thr Lys Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg
245 250 255
Tyr Gln Lys Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His
260 265 270
Ala Gly Asn Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser
275 280 285
Thr Ser Met Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser
290 295 300
Ser Glu Gln Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn
305 310 315 320
Leu Lys Val Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp
325 330 335
Thr Tyr Leu Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala
340 345 350
Asn Ala Thr Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu
355 360 365
Pro Arg Leu Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg
370 375 380
Asn Pro Gly Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr
385 390 395 400
Pro Pro Glu Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr
405 410 415
Leu Leu Cys Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu
420 425 430
Gln Cys Ser Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln
435 440 445
Val Trp Asp Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His
450 455 460
Lys Val Thr Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn
465 470 475 480
Gln Thr Tyr Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp
485 490 495
Ala Phe Ile Pro Ile Ser Ala Gly Ala His Thr His Pro Pro Asp Glu
500 505 510
Phe Leu Phe Thr Pro Val Val Val Ala Cys Met Ser Ile Met Ala Leu
515 520 525
Leu Leu Leu Leu Leu Leu Leu Leu Leu Tyr Lys Tyr Lys Gln Lys Pro
530 535 540
Lys Tyr Gln Val Arg Trp Lys Ile Ile Glu Ser Tyr Glu Gly Asn Ser
545 550 555 560
Tyr Thr Phe Ile Asp Pro Thr Gln Leu Pro Tyr Asn Glu Lys Trp Glu
565 570 575
Phe Pro Arg Asn Asn Leu Gln Phe Gly Lys Thr Leu Gly Ala Gly Ala
580 585 590
Phe Gly Lys Val Val Glu Ala Thr Ala Phe Gly Leu Gly Lys Glu Asp
595 600 605
Ala Val Leu Lys Val Ala Val Lys Met Leu Lys Ser Thr Ala His Ala
610 615 620
Asp Glu Lys Glu Ala Leu Met Ser Glu Leu Lys Ile Met Ser His Leu
625 630 635 640
Gly Gln His Glu Asn Ile Val Asn Leu Leu Gly Ala Cys Thr His Gly
645 650 655
Gly Pro Val Leu Val Ile Thr Glu Tyr Cys Cys Tyr Gly Asp Leu Leu
660 665 670
Asn Phe Leu Arg Arg Lys Ala Glu Ala Met Leu Gly Pro Ser Leu Ser
675 680 685
Pro Gly Gln Asp Pro Glu Gly Gly Val Asp Tyr Lys Asn Ile His Leu
690 695 700
Glu Lys Lys Tyr Val Arg Arg Asp Ser Gly Phe Ser Ser Gln Gly Val
705 710 715 720
Asp Thr Tyr Val Glu Met Arg Pro Val Ser Thr Ser Ser Asn Asp Ser
725 730 735
Phe Ser Glu Gln Asp Leu Asp Lys Glu Asp Gly Arg Pro Leu Glu Leu
740 745 750
Arg Asp Leu Leu His Phe Ser Ser Gln Val Ala Gln Gly Met Ala Phe
755 760 765
Leu Ala Ser Lys Asn Cys Ile His Arg Asp Val Ala Ala Arg Asn Val
770 775 780
Leu Leu Thr Asn Gly His Val Ala Lys Ile Gly Asp Phe Gly Leu Ala
785 790 795 800
Arg Asp Ile Met Asn Asp Ser Asn Tyr Ile Val Lys Gly Asn Ala Arg
805 810 815
Leu Pro Val Lys Trp Met Ala Pro Glu Ser Ile Phe Asp Cys Val Tyr
820 825 830
Thr Val Gln Ser Asp Val Trp Ser Tyr Gly Ile Leu Leu Trp Glu Ile
835 840 845
Phe Ser Leu Gly Leu Asn Pro Tyr Pro Gly Ile Leu Val Asn Ser Lys
850 855 860
Phe Tyr Lys Leu Val Lys Asp Gly Tyr Gln Met Ala Gln Pro Ala Phe
865 870 875 880
Ala Pro Lys Asn Ile Tyr Ser Ile Met Gln Ala Cys Trp Ala Leu Glu
885 890 895
Pro Thr His Arg Pro Thr Phe Gln Gln Ile Cys Ser Phe Leu Gln Glu
900 905 910
Gln Ala Gln Glu Asp Arg Arg Glu Arg Asp Tyr Thr Asn Leu Pro Ser
915 920 925
Ser Ser Arg Ser Gly Gly Ser Gly Ser Ser Ser Ser Glu Leu Glu Glu
930 935 940
Glu Ser Ser Ser Glu His Leu Thr Cys Cys Glu Gln Gly Asp Ile Ala
945 950 955 960
Gln Pro Leu Leu Gln Pro Asn Asn Tyr Gln Phe Cys
965 970
<210> 3
<211> 20
<212> Белок
<213> Mus musculus
<400> 3
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly
20
<210> 4
<211> 19
<212> Белок
<213> Mus musculus
<400> 4
Met Ala Val Leu Gly Leu Leu Leu Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser
<210> 5
<211> 487
<212> Белок
<213> Homo sapiens
<400> 5
Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val Lys Pro Gly
1 5 10 15
Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val Glu Trp Asp
20 25 30
Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly Ser Ser Ser
35 40 45
Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly Thr Tyr Arg
50 55 60
Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala Ile His Leu
65 70 75 80
Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala Gln Glu Val
85 90 95
Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu Leu Thr Asp
100 105 110
Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg Gly Arg Pro
115 120 125
Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His Gly Phe Thr
130 135 140
Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln Cys Ser Ala
145 150 155 160
Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg Leu Lys Val
165 170 175
Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val Pro Ala Glu
180 185 190
Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala Ser
195 200 205
Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn Asn Thr Lys
210 215 220
Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg Tyr Gln Lys
225 230 235 240
Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His Ala Gly Asn
245 250 255
Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser Thr Ser Met
260 265 270
Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser Ser Glu Gln
275 280 285
Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn Leu Lys Val
290 295 300
Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp Thr Tyr Leu
305 310 315 320
Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala Asn Ala Thr
325 330 335
Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu Pro Arg Leu
340 345 350
Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg Asn Pro Gly
355 360 365
Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro Glu
370 375 380
Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr Leu Leu Cys
385 390 395 400
Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu Gln Cys Ser
405 410 415
Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln Val Trp Asp
420 425 430
Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His Lys Val Thr
435 440 445
Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn Gln Thr Tyr
450 455 460
Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp Ala Phe Ile
465 470 475 480
Pro Ile Ser Ala Gly Ala His
485
<210> 6
<211> 719
<212> Белок
<213> Homo sapiens
<400> 6
Ile Pro Val Ile Glu Pro Ser Val Pro Glu Leu Val Val Lys Pro Gly
1 5 10 15
Ala Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val Glu Trp Asp
20 25 30
Gly Pro Pro Ser Pro His Trp Thr Leu Tyr Ser Asp Gly Ser Ser Ser
35 40 45
Ile Leu Ser Thr Asn Asn Ala Thr Phe Gln Asn Thr Gly Thr Tyr Arg
50 55 60
Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala Ile His Leu
65 70 75 80
Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala Gln Glu Val
85 90 95
Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu Leu Thr Asp
100 105 110
Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Val Arg Gly Arg Pro
115 120 125
Leu Met Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His Gly Phe Thr
130 135 140
Ile His Arg Ala Lys Phe Ile Gln Ser Gln Asp Tyr Gln Cys Ser Ala
145 150 155 160
Leu Met Gly Gly Arg Lys Val Met Ser Ile Ser Ile Arg Leu Lys Val
165 170 175
Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val Pro Ala Glu
180 185 190
Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala Ser
195 200 205
Ser Val Asp Val Asn Phe Asp Val Phe Leu Gln His Asn Asn Thr Lys
210 215 220
Leu Ala Ile Pro Gln Gln Ser Asp Phe His Asn Asn Arg Tyr Gln Lys
225 230 235 240
Val Leu Thr Leu Asn Leu Asp Gln Val Asp Phe Gln His Ala Gly Asn
245 250 255
Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser Thr Ser Met
260 265 270
Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asn Leu Ser Ser Glu Gln
275 280 285
Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn Leu Lys Val
290 295 300
Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp Thr Tyr Leu
305 310 315 320
Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala Asn Ala Thr
325 330 335
Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu Pro Arg Leu
340 345 350
Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg Asn Pro Gly
355 360 365
Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro Glu
370 375 380
Val Ser Val Ile Trp Thr Phe Ile Asn Gly Ser Gly Thr Leu Leu Cys
385 390 395 400
Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu Gln Cys Ser
405 410 415
Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln Val Trp Asp
420 425 430
Asp Pro Tyr Pro Glu Val Leu Ser Gln Glu Pro Phe His Lys Val Thr
435 440 445
Val Gln Ser Leu Leu Thr Val Glu Thr Leu Glu His Asn Gln Thr Tyr
450 455 460
Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp Ala Phe Ile
465 470 475 480
Pro Ile Ser Ala Gly Ala His Glu Pro Lys Ser Ser Asp Lys Thr His
485 490 495
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
500 505 510
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
515 520 525
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
530 535 540
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
545 550 555 560
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
565 570 575
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
580 585 590
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
595 600 605
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
610 615 620
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
625 630 635 640
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
645 650 655
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
660 665 670
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
675 680 685
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
690 695 700
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
705 710 715
<210> 7
<211> 506
<212> Белок
<213> Macaca cynomolgus
<400> 7
Met Gly Pro Gly Val Leu Leu Leu Leu Leu Val Val Thr Ala Trp His
1 5 10 15
Gly Gln Gly Ile Pro Val Ile Glu Pro Ser Gly Pro Glu Leu Val Val
20 25 30
Lys Pro Gly Glu Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val
35 40 45
Glu Trp Asp Gly Pro Ile Ser Pro His Trp Thr Leu Tyr Ser Asp Gly
50 55 60
Pro Ser Ser Val Leu Thr Thr Thr Asn Ala Thr Phe Gln Asn Thr Arg
65 70 75 80
Thr Tyr Arg Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala
85 90 95
Ile His Leu Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala
100 105 110
Lys Glu Val Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu
115 120 125
Leu Thr Asp Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Leu Arg
130 135 140
Gly Arg Pro Leu Leu Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His
145 150 155 160
Gly Phe Thr Ile His Arg Ala Lys Phe Ile Gln Gly Gln Asp Tyr Gln
165 170 175
Cys Ser Ala Leu Met Gly Ser Arg Lys Val Met Ser Ile Ser Ile Arg
180 185 190
Leu Lys Val Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val
195 200 205
Pro Ala Glu Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys
210 215 220
Ser Ala Ser Asn Ile Asp Val Asp Phe Asp Val Phe Leu Gln His Asn
225 230 235 240
Thr Thr Lys Leu Ala Ile Pro Gln Arg Ser Asp Phe His Asp Asn Arg
245 250 255
Tyr Gln Lys Val Leu Thr Leu Ser Leu Gly Gln Val Asp Phe Gln His
260 265 270
Ala Gly Asn Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser
275 280 285
Thr Ser Met Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asp Leu Ser
290 295 300
Ser Glu Gln Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn
305 310 315 320
Leu Lys Val Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp
325 330 335
Thr Tyr Leu Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala
340 345 350
Asn Ala Thr Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu
355 360 365
Pro Arg Leu Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg
370 375 380
Asn Pro Gly Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr
385 390 395 400
Pro Pro Glu Val Ser Val Ile Trp Thr Ser Ile Asn Gly Ser Gly Thr
405 410 415
Leu Leu Cys Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu
420 425 430
Gln Cys Ala Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln
435 440 445
Val Trp Val Asp Pro His Pro Glu Val Leu Ser Gln Glu Pro Phe Gln
450 455 460
Lys Val Thr Val Gln Ser Leu Leu Thr Ala Glu Thr Leu Glu His Asn
465 470 475 480
Gln Thr Tyr Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp
485 490 495
Ala Phe Ile Pro Ile Ser Ala Gly Ala Arg
500 505
<210> 8
<211> 740
<212> Белок
<213> Macaca cynomolgus
<400> 8
Met Gly Pro Gly Val Leu Leu Leu Leu Leu Val Val Thr Ala Trp His
1 5 10 15
Gly Gln Gly Ile Pro Val Ile Glu Pro Ser Gly Pro Glu Leu Val Val
20 25 30
Lys Pro Gly Glu Thr Val Thr Leu Arg Cys Val Gly Asn Gly Ser Val
35 40 45
Glu Trp Asp Gly Pro Ile Ser Pro His Trp Thr Leu Tyr Ser Asp Gly
50 55 60
Pro Ser Ser Val Leu Thr Thr Thr Asn Ala Thr Phe Gln Asn Thr Arg
65 70 75 80
Thr Tyr Arg Cys Thr Glu Pro Gly Asp Pro Leu Gly Gly Ser Ala Ala
85 90 95
Ile His Leu Tyr Val Lys Asp Pro Ala Arg Pro Trp Asn Val Leu Ala
100 105 110
Lys Glu Val Val Val Phe Glu Asp Gln Asp Ala Leu Leu Pro Cys Leu
115 120 125
Leu Thr Asp Pro Val Leu Glu Ala Gly Val Ser Leu Val Arg Leu Arg
130 135 140
Gly Arg Pro Leu Leu Arg His Thr Asn Tyr Ser Phe Ser Pro Trp His
145 150 155 160
Gly Phe Thr Ile His Arg Ala Lys Phe Ile Gln Gly Gln Asp Tyr Gln
165 170 175
Cys Ser Ala Leu Met Gly Ser Arg Lys Val Met Ser Ile Ser Ile Arg
180 185 190
Leu Lys Val Gln Lys Val Ile Pro Gly Pro Pro Ala Leu Thr Leu Val
195 200 205
Pro Ala Glu Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys
210 215 220
Ser Ala Ser Asn Ile Asp Val Asp Phe Asp Val Phe Leu Gln His Asn
225 230 235 240
Thr Thr Lys Leu Ala Ile Pro Gln Arg Ser Asp Phe His Asp Asn Arg
245 250 255
Tyr Gln Lys Val Leu Thr Leu Ser Leu Gly Gln Val Asp Phe Gln His
260 265 270
Ala Gly Asn Tyr Ser Cys Val Ala Ser Asn Val Gln Gly Lys His Ser
275 280 285
Thr Ser Met Phe Phe Arg Val Val Glu Ser Ala Tyr Leu Asp Leu Ser
290 295 300
Ser Glu Gln Asn Leu Ile Gln Glu Val Thr Val Gly Glu Gly Leu Asn
305 310 315 320
Leu Lys Val Met Val Glu Ala Tyr Pro Gly Leu Gln Gly Phe Asn Trp
325 330 335
Thr Tyr Leu Gly Pro Phe Ser Asp His Gln Pro Glu Pro Lys Leu Ala
340 345 350
Asn Ala Thr Thr Lys Asp Thr Tyr Arg His Thr Phe Thr Leu Ser Leu
355 360 365
Pro Arg Leu Lys Pro Ser Glu Ala Gly Arg Tyr Ser Phe Leu Ala Arg
370 375 380
Asn Pro Gly Gly Trp Arg Ala Leu Thr Phe Glu Leu Thr Leu Arg Tyr
385 390 395 400
Pro Pro Glu Val Ser Val Ile Trp Thr Ser Ile Asn Gly Ser Gly Thr
405 410 415
Leu Leu Cys Ala Ala Ser Gly Tyr Pro Gln Pro Asn Val Thr Trp Leu
420 425 430
Gln Cys Ala Gly His Thr Asp Arg Cys Asp Glu Ala Gln Val Leu Gln
435 440 445
Val Trp Val Asp Pro His Pro Glu Val Leu Ser Gln Glu Pro Phe Gln
450 455 460
Lys Val Thr Val Gln Ser Leu Leu Thr Ala Glu Thr Leu Glu His Asn
465 470 475 480
Gln Thr Tyr Glu Cys Arg Ala His Asn Ser Val Gly Ser Gly Ser Trp
485 490 495
Ala Phe Ile Pro Ile Ser Ala Gly Ala Arg Gly Ser Glu Pro Lys Ser
500 505 510
Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
515 520 525
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
530 535 540
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
545 550 555 560
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
565 570 575
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
580 585 590
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
595 600 605
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
610 615 620
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
625 630 635 640
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
645 650 655
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
660 665 670
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
675 680 685
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
690 695 700
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
705 710 715 720
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
725 730 735
Ser Pro Gly Lys
740
<210> 9
<211> 122
<212> Белок
<213> Mus musculus
<400> 9
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Tyr Met Ile Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Glu Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 10
<211> 111
<212> Белок
<213> Mus musculus
<400> 10
Asn Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Asn Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys His Leu Ser Asn
85 90 95
Glu Asp Leu Ser Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 11
<211> 121
<212> Белок
<213> Mus musculus
<400> 11
Glu Ile Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Phe
20 25 30
Asn Ile His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Thr Asp Val Thr Val Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Tyr Phe Asp Gly Thr Phe Asp Tyr Ala Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Ile Thr Val Ser Ser
115 120
<210> 12
<211> 111
<212> Белок
<213> Mus musculus
<400> 12
Asp Val Val Val Thr Gln Thr Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Leu Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Gly Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Leu Pro Trp Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 13
<211> 122
<212> Белок
<213> Mus musculus
<400> 13
Glu Ile Gln Leu Gln Gln Ser Gly Pro Asp Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Lys Gln Asn Gln Gly Lys Ser Leu Glu Trp Met
35 40 45
Gly Glu Ile Asn Pro Asn Asn Gly Val Val Val Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Thr Thr Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu His Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ala Leu Tyr His Ser Asn Phe Gly Trp Tyr Phe Asp Ser Trp
100 105 110
Gly Lys Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 14
<211> 111
<212> Белок
<213> Mus musculus
<400> 14
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser His Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Asn
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 15
<211> 10
<212> Белок
<213> Mus musculus
<400> 15
Gly Tyr Thr Phe Thr Asp Asn Tyr Met Ile
1 5 10
<210> 16
<211> 17
<212> Белок
<213> Mus musculus
<400> 16
Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 17
<211> 13
<212> Белок
<213> Mus musculus
<400> 17
Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr
1 5 10
<210> 18
<211> 15
<212> Белок
<213> Mus musculus
<400> 18
Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Asn Tyr Met Asn
1 5 10 15
<210> 19
<211> 7
<212> Белок
<213> Mus musculus
<400> 19
Ala Ala Ser Asn Leu Glu Ser
1 5
<210> 20
<211> 9
<212> Белок
<213> Mus musculus
<400> 20
His Leu Ser Asn Glu Asp Leu Ser Thr
1 5
<210> 21
<211> 10
<212> Белок
<213> Mus musculus
<400> 21
Gly Tyr Thr Phe Ser Asp Phe Asn Ile His
1 5 10
<210> 22
<211> 17
<212> Белок
<213> Mus musculus
<400> 22
Tyr Ile Asn Pro Tyr Thr Asp Val Thr Val Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 23
<211> 12
<212> Белок
<213> Mus musculus
<400> 23
Tyr Phe Asp Gly Thr Phe Asp Tyr Ala Leu Asp Tyr
1 5 10
<210> 24
<211> 15
<212> Белок
<213> Mus musculus
<400> 24
Arg Ala Ser Glu Ser Val Asp Asn Tyr Gly Leu Ser Phe Met Asn
1 5 10 15
<210> 25
<211> 7
<212> Белок
<213> Mus musculus
<400> 25
Thr Ala Ser Asn Leu Glu Ser
1 5
<210> 26
<211> 9
<212> Белок
<213> Mus musculus
<400> 26
Gln Gln Ser Lys Glu Leu Pro Trp Thr
1 5
<210> 27
<211> 10
<212> Белок
<213> Mus musculus
<400> 27
Gly Tyr Ile Phe Thr Asp Tyr Asn Met His
1 5 10
<210> 28
<211> 17
<212> Белок
<213> Mus musculus
<400> 28
Glu Ile Asn Pro Asn Asn Gly Val Val Val Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 29
<211> 13
<212> Белок
<213> Mus musculus
<400> 29
Ala Leu Tyr His Ser Asn Phe Gly Trp Tyr Phe Asp Ser
1 5 10
<210> 30
<211> 15
<212> Белок
<213> Mus musculus
<400> 30
Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Ser His Met Asn
1 5 10 15
<210> 31
<211> 7
<212> Белок
<213> Mus musculus
<400> 31
Thr Ala Ser Asn Leu Glu Ser
1 5
<210> 32
<211> 9
<212> Белок
<213> Mus musculus
<400> 32
Gln Gln Gly Asn Glu Asp Pro Trp Thr
1 5
<210> 33
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 33
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Tyr Met Ile Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Glu Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 34
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 34
Asn Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Asn Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys His Leu Ser Asn
85 90 95
Glu Asp Leu Ser Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 35
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 35
Glu Ile Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Phe
20 25 30
Asn Ile His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Thr Asp Val Thr Val Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Tyr Phe Asp Gly Thr Phe Asp Tyr Ala Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Ile Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 36
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 36
Asp Val Val Val Thr Gln Thr Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Leu Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Gly Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Leu Pro Trp Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 37
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 37
Glu Ile Gln Leu Gln Gln Ser Gly Pro Asp Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Lys Gln Asn Gln Gly Lys Ser Leu Glu Trp Met
35 40 45
Gly Glu Ile Asn Pro Asn Asn Gly Val Val Val Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Thr Thr Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu His Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ala Leu Tyr His Ser Asn Phe Gly Trp Tyr Phe Asp Ser Trp
100 105 110
Gly Lys Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 38
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 38
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser His Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Gly Asn
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 39
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 39
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Tyr Met Ile Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 40
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 40
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Tyr Met Ile Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 41
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Tyr Met Ile Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 42
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 42
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Phe
20 25 30
Asn Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asn Pro Tyr Thr Asp Val Thr Val Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ser Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Tyr Phe Asp Gly Thr Phe Asp Tyr Ala Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 43
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Phe
20 25 30
Asn Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Thr Asp Val Thr Val Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ser Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Tyr Phe Asp Gly Thr Phe Asp Tyr Ala Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 44
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 44
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Asn Pro Asn Asn Gly Val Val Val Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ala Leu Tyr His Ser Asn Phe Gly Trp Tyr Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 45
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 45
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Asn Pro Asn Asn Gly Val Val Val Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Thr Thr Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ala Leu Tyr His Ser Asn Phe Gly Trp Tyr Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 46
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 46
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Asn Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys His Leu Ser Asn
85 90 95
Glu Asp Leu Ser Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 47
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 47
Asn Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Asn Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys His Leu Ser Asn
85 90 95
Glu Asp Leu Ser Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 48
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 48
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Leu Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 49
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 49
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Leu Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 50
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 50
Glu Ile Val Val Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Leu Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 51
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 51
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser His Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Gly Asn
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 52
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 52
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser His Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Gly Asn
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 53
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 53
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Tyr Met Ile Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 54
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 54
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Tyr Met Ile Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 55
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 55
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Tyr Met Ile Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Tyr Asn Gly Gly Thr Thr Phe Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Pro Tyr Phe Ser Asn Leu Tyr Val Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 56
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 56
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Phe
20 25 30
Asn Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asn Pro Tyr Thr Asp Val Thr Val Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ser Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Tyr Phe Asp Gly Thr Phe Asp Tyr Ala Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 57
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 57
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Phe
20 25 30
Asn Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Thr Asp Val Thr Val Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ser Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Tyr Phe Asp Gly Thr Phe Asp Tyr Ala Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly
210 215 220
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 58
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 58
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Asn Pro Asn Asn Gly Val Val Val Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ala Leu Tyr His Ser Asn Phe Gly Trp Tyr Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 59
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 59
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Asn Pro Asn Asn Gly Val Val Val Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Thr Thr Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ala Leu Tyr His Ser Asn Phe Gly Trp Tyr Phe Asp Ser Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 60
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 60
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Asn Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys His Leu Ser Asn
85 90 95
Glu Asp Leu Ser Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 61
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 61
Asn Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Asn Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys His Leu Ser Asn
85 90 95
Glu Asp Leu Ser Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 62
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 62
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Leu Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 63
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 63
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Leu Ser Phe Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 64
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 64
Glu Ile Val Val Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Leu Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 65
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 65
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser His Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Gly Asn
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 66
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 66
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser His Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Thr Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Ala Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Gly Asn
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 67
<211> 158
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 67
Glu Glu Val Ser Glu Tyr Cys Ser His Met Ile Gly Ser Gly His Leu
1 5 10 15
Gln Ser Leu Gln Arg Leu Ile Asp Ser Gln Met Glu Thr Ser Cys Gln
20 25 30
Ile Thr Phe Glu Phe Val Asp Gln Glu Gln Leu Lys Asp Pro Val Cys
35 40 45
Tyr Leu Lys Lys Ala Phe Leu Leu Val Gln Asp Ile Met Glu Asp Thr
50 55 60
Met Arg Phe Arg Asp Asn Thr Pro Asn Ala Ile Ala Ile Val Gln Leu
65 70 75 80
Gln Glu Leu Ser Leu Arg Leu Lys Ser Cys Phe Thr Lys Asp Tyr Glu
85 90 95
Glu His Asp Lys Ala Cys Val Arg Thr Phe Tyr Glu Thr Pro Leu Gln
100 105 110
Leu Leu Glu Lys Val Lys Asn Val Phe Asn Glu Thr Lys Asn Leu Leu
115 120 125
Asp Lys Asp Trp Asn Ile Phe Ser Lys Asn Cys Asn Asn Ser Phe Ala
130 135 140
Glu Cys Ser Ser Gln Gly His Glu Arg Gln Ser Glu Gly Ser
145 150 155
<210> 68
<211> 222
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 68
Asn Glu Pro Leu Glu Met Trp Pro Leu Thr Gln Asn Glu Glu Cys Thr
1 5 10 15
Val Thr Gly Phe Leu Arg Asp Lys Leu Gln Tyr Arg Ser Arg Leu Gln
20 25 30
Tyr Met Lys His Tyr Phe Pro Ile Asn Tyr Lys Ile Ser Val Pro Tyr
35 40 45
Glu Gly Val Phe Arg Ile Ala Asn Val Thr Arg Leu Gln Arg Ala Gln
50 55 60
Val Ser Glu Arg Glu Leu Arg Tyr Leu Trp Val Leu Val Ser Leu Ser
65 70 75 80
Ala Thr Glu Ser Val Gln Asp Val Leu Leu Glu Gly His Pro Ser Trp
85 90 95
Lys Tyr Leu Gln Glu Val Gln Thr Leu Leu Leu Asn Val Gln Gln Gly
100 105 110
Leu Thr Asp Val Glu Val Ser Pro Lys Val Glu Ser Val Leu Ser Leu
115 120 125
Leu Asn Ala Pro Gly Pro Asn Leu Lys Leu Val Arg Pro Lys Ala Leu
130 135 140
Leu Asp Asn Cys Phe Arg Val Met Glu Leu Leu Tyr Cys Ser Cys Cys
145 150 155 160
Lys Gln Ser Ser Val Leu Asn Trp Gln Asp Cys Glu Val Pro Ser Pro
165 170 175
Gln Ser Cys Ser Pro Glu Pro Ser Leu Gln Tyr Ala Ala Thr Gln Leu
180 185 190
Tyr Pro Pro Pro Pro Trp Ser Pro Ser Ser Pro Pro His Ser Thr Gly
195 200 205
Ser Val Arg Pro Val Arg Ala Gln Gly Glu Gly Leu Leu Pro
210 215 220
<210> 69
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 69
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser
20 25
<210> 70
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 70
Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
1 5 10
<210> 71
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 71
Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr Met Glu
1 5 10 15
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 72
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 72
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 73
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 73
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser
20 25
<210> 74
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 74
Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
1 5 10
<210> 75
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 75
Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr Met Glu
1 5 10 15
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 76
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 76
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 77
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 77
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser
20 25
<210> 78
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 78
Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
1 5 10
<210> 79
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 79
Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr Met Glu
1 5 10 15
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 80
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 80
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 81
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 81
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys
20
<210> 82
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 82
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
1 5 10 15
<210> 83
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 83
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys
20 25 30
<210> 84
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 84
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 85
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 85
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys
20
<210> 86
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 86
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
1 5 10 15
<210> 87
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 87
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys
20 25 30
<210> 88
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 88
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 89
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 89
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys
20
<210> 90
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 90
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
1 5 10 15
<210> 91
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 91
Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys
20 25 30
<210> 92
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 92
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 93
<211> 719
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 93
Ala Pro Val Ile Glu Pro Ser Gly Pro Glu Leu Val Val Glu Pro Gly
1 5 10 15
Glu Thr Val Thr Leu Arg Cys Val Ser Asn Gly Ser Val Glu Trp Asp
20 25 30
Gly Pro Ile Ser Pro Tyr Trp Thr Leu Asp Pro Glu Ser Pro Gly Ser
35 40 45
Thr Leu Thr Thr Arg Asn Ala Thr Phe Lys Asn Thr Gly Thr Tyr Arg
50 55 60
Cys Thr Glu Leu Glu Asp Pro Met Ala Gly Ser Thr Thr Ile His Leu
65 70 75 80
Tyr Val Lys Asp Pro Ala His Ser Trp Asn Leu Leu Ala Gln Glu Val
85 90 95
Thr Val Val Glu Gly Gln Glu Ala Val Leu Pro Cys Leu Ile Thr Asp
100 105 110
Pro Ala Leu Lys Asp Ser Val Ser Leu Met Arg Glu Gly Gly Arg Gln
115 120 125
Val Leu Arg Lys Thr Val Tyr Phe Phe Ser Pro Trp Arg Gly Phe Ile
130 135 140
Ile Arg Lys Ala Lys Val Leu Asp Ser Asn Thr Tyr Val Cys Lys Thr
145 150 155 160
Met Val Asn Gly Arg Glu Ser Thr Ser Thr Gly Ile Trp Leu Lys Val
165 170 175
Asn Arg Val His Pro Glu Pro Pro Gln Ile Lys Leu Glu Pro Ser Lys
180 185 190
Leu Val Arg Ile Arg Gly Glu Ala Ala Gln Ile Val Cys Ser Ala Thr
195 200 205
Asn Ala Glu Val Gly Phe Asn Val Ile Leu Lys Arg Gly Asp Thr Lys
210 215 220
Leu Glu Ile Pro Leu Asn Ser Asp Phe Gln Asp Asn Tyr Tyr Lys Lys
225 230 235 240
Val Arg Ala Leu Ser Leu Asn Ala Val Asp Phe Gln Asp Ala Gly Ile
245 250 255
Tyr Ser Cys Val Ala Ser Asn Asp Val Gly Thr Arg Thr Ala Thr Met
260 265 270
Asn Phe Gln Val Val Glu Ser Ala Tyr Leu Asn Leu Thr Ser Glu Gln
275 280 285
Ser Leu Leu Gln Glu Val Ser Val Gly Asp Ser Leu Ile Leu Thr Val
290 295 300
His Ala Asp Ala Tyr Pro Ser Ile Gln His Tyr Asn Trp Thr Tyr Leu
305 310 315 320
Gly Pro Phe Phe Glu Asp Gln Arg Lys Leu Glu Phe Ile Thr Gln Arg
325 330 335
Ala Ile Tyr Arg Tyr Thr Phe Lys Leu Phe Leu Asn Arg Val Lys Ala
340 345 350
Ser Glu Ala Gly Gln Tyr Phe Leu Met Ala Gln Asn Lys Ala Gly Trp
355 360 365
Asn Asn Leu Thr Phe Glu Leu Thr Leu Arg Tyr Pro Pro Glu Val Ser
370 375 380
Val Thr Trp Met Pro Val Asn Gly Ser Asp Val Leu Phe Cys Asp Val
385 390 395 400
Ser Gly Tyr Pro Gln Pro Ser Val Thr Trp Met Glu Cys Arg Gly His
405 410 415
Thr Asp Arg Cys Asp Glu Ala Gln Ala Leu Gln Val Trp Asn Asp Thr
420 425 430
His Pro Glu Val Leu Ser Gln Lys Pro Phe Asp Lys Val Ile Ile Gln
435 440 445
Ser Gln Leu Pro Ile Gly Thr Leu Lys His Asn Met Thr Tyr Phe Cys
450 455 460
Lys Thr His Asn Ser Val Gly Asn Ser Ser Gln Tyr Phe Arg Ala Val
465 470 475 480
Ser Leu Gly Gln Ser Lys Gln Glu Pro Lys Ser Ser Asp Lys Thr His
485 490 495
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
500 505 510
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
515 520 525
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
530 535 540
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
545 550 555 560
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
565 570 575
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
580 585 590
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
595 600 605
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
610 615 620
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
625 630 635 640
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
645 650 655
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
660 665 670
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
675 680 685
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
690 695 700
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
705 710 715
<210> 94
<211> 327
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 94
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 95
<211> 107
<212> Белок
<213> Homo sapiens
<400> 95
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 96
<211> 183
<212> Белок
<213> Homo sapiens
<400> 96
Val Pro Pro Gly Glu Asp Ser Lys Asp Val Ala Ala Pro His Arg Gln
1 5 10 15
Pro Leu Thr Ser Ser Glu Arg Ile Asp Lys Gln Ile Arg Tyr Ile Leu
20 25 30
Asp Gly Ile Ser Ala Leu Arg Lys Glu Thr Cys Asn Lys Ser Asn Met
35 40 45
Cys Glu Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro
50 55 60
Lys Met Ala Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu Glu
65 70 75 80
Thr Cys Leu Val Lys Ile Ile Thr Gly Leu Leu Glu Phe Glu Val Tyr
85 90 95
Leu Glu Tyr Leu Gln Asn Arg Phe Glu Ser Ser Glu Glu Gln Ala Arg
100 105 110
Ala Val Gln Met Ser Thr Lys Val Leu Ile Gln Phe Leu Gln Lys Lys
115 120 125
Ala Lys Asn Leu Asp Ala Ile Thr Thr Pro Asp Pro Thr Thr Asn Ala
130 135 140
Ser Leu Leu Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln Asp Met
145 150 155 160
Thr Thr His Leu Ile Leu Arg Ser Phe Lys Glu Phe Leu Gln Ser Ser
165 170 175
Leu Arg Ala Leu Arg Gln Met
180
<210> 97
<211> 153
<212> Белок
<213> Homo sapiens
<400> 97
Ala Pro Val Arg Ser Leu Asn Cys Thr Leu Arg Asp Ser Gln Gln Lys
1 5 10 15
Ser Leu Val Met Ser Gly Pro Tyr Glu Leu Lys Ala Leu His Leu Gln
20 25 30
Gly Gln Asp Met Glu Gln Gln Val Val Phe Ser Met Ser Phe Val Gln
35 40 45
Gly Glu Glu Ser Asn Asp Lys Ile Pro Val Ala Leu Gly Leu Lys Glu
50 55 60
Lys Asn Leu Tyr Leu Ser Cys Val Leu Lys Asp Asp Lys Pro Thr Leu
65 70 75 80
Gln Leu Glu Ser Val Asp Pro Lys Asn Tyr Pro Lys Lys Lys Met Glu
85 90 95
Lys Arg Phe Val Phe Asn Lys Ile Glu Ile Asn Asn Lys Leu Glu Phe
100 105 110
Glu Ser Ala Gln Phe Pro Asn Trp Tyr Ile Ser Thr Ser Gln Ala Glu
115 120 125
Asn Met Pro Val Phe Leu Gly Gly Thr Lys Gly Gly Gln Asp Ile Thr
130 135 140
Asp Phe Thr Met Gln Phe Val Ser Ser
145 150
<210> 98
<211> 79
<212> Белок
<213> Homo sapiens
<400> 98
Glu Gly Ala Val Leu Pro Arg Ser Ala Lys Glu Leu Arg Cys Gln Cys
1 5 10 15
Ile Lys Thr Tyr Ser Lys Pro Phe His Pro Lys Phe Ile Lys Glu Leu
20 25 30
Arg Val Ile Glu Ser Gly Pro His Cys Ala Asn Thr Glu Ile Ile Val
35 40 45
Lys Leu Ser Asp Gly Arg Glu Leu Cys Leu Asp Pro Lys Glu Asn Trp
50 55 60
Val Gln Arg Val Val Glu Lys Phe Leu Lys Arg Ala Glu Asn Ser
65 70 75
<210> 99
<211> 76
<212> Белок
<213> Homo sapiens
<400> 99
Gln Pro Asp Ala Ile Asn Ala Pro Val Thr Cys Cys Tyr Asn Phe Thr
1 5 10 15
Asn Arg Lys Ile Ser Val Gln Arg Leu Ala Ser Tyr Arg Arg Ile Thr
20 25 30
Ser Ser Lys Cys Pro Lys Glu Ala Val Ile Phe Lys Thr Ile Val Ala
35 40 45
Lys Glu Ile Cys Ala Asp Pro Lys Gln Lys Trp Val Gln Asp Ser Met
50 55 60
Asp His Leu Asp Lys Gln Thr Gln Thr Pro Lys Thr
65 70 75
<210> 100
<211> 77
<212> Белок
<213> Homo sapiens
<400> 100
Val Pro Leu Ser Arg Thr Val Arg Cys Thr Cys Ile Ser Ile Ser Asn
1 5 10 15
Gln Pro Val Asn Pro Arg Ser Leu Glu Lys Leu Glu Ile Ile Pro Ala
20 25 30
Ser Gln Phe Cys Pro Arg Val Glu Ile Ile Ala Thr Met Lys Lys Lys
35 40 45
Gly Glu Lys Arg Cys Leu Asn Pro Glu Ser Lys Ala Ile Lys Asn Leu
50 55 60
Leu Lys Ala Val Ser Lys Glu Arg Ser Lys Arg Ser Pro
65 70 75
<210> 101
<211> 157
<212> Белок
<213> Homo sapiens
<400> 101
Val Arg Ser Ser Ser Arg Thr Pro Ser Asp Lys Pro Val Ala His Val
1 5 10 15
Val Ala Asn Pro Gln Ala Glu Gly Gln Leu Gln Trp Leu Asn Arg Arg
20 25 30
Ala Asn Ala Leu Leu Ala Asn Gly Val Glu Leu Arg Asp Asn Gln Leu
35 40 45
Val Val Pro Ser Glu Gly Leu Tyr Leu Ile Tyr Ser Gln Val Leu Phe
50 55 60
Lys Gly Gln Gly Cys Pro Ser Thr His Val Leu Leu Thr His Thr Ile
65 70 75 80
Ser Arg Ile Ala Val Ser Tyr Gln Thr Lys Val Asn Leu Leu Ser Ala
85 90 95
Ile Lys Ser Pro Cys Gln Arg Glu Thr Pro Glu Gly Ala Glu Ala Lys
100 105 110
Pro Trp Tyr Glu Pro Ile Tyr Leu Gly Gly Val Phe Gln Leu Glu Lys
115 120 125
Gly Asp Arg Leu Ser Ala Glu Ile Asn Arg Pro Asp Tyr Leu Asp Phe
130 135 140
Ala Glu Ser Gly Gln Val Tyr Phe Gly Ile Ile Ala Leu
145 150 155
<210> 102
<211> 76
<212> Белок
<213> Homo sapiens
<400> 102
Gln Pro Val Gly Ile Asn Thr Ser Thr Thr Cys Cys Tyr Arg Phe Ile
1 5 10 15
Asn Lys Lys Ile Pro Lys Gln Arg Leu Glu Ser Tyr Arg Arg Thr Thr
20 25 30
Ser Ser His Cys Pro Arg Glu Ala Val Ile Phe Lys Thr Lys Leu Asp
35 40 45
Lys Glu Ile Cys Ala Asp Pro Thr Gln Lys Trp Val Gln Asp Phe Met
50 55 60
Lys His Leu Asp Lys Lys Thr Gln Thr Pro Lys Leu
65 70 75
<210> 103
<211> 78
<212> Белок
<213> Homo sapiens
<400> 103
Ala Gly Pro Ala Ala Ala Val Leu Arg Glu Leu Arg Cys Val Cys Leu
1 5 10 15
Gln Thr Thr Gln Gly Val His Pro Lys Met Ile Ser Asn Leu Gln Val
20 25 30
Phe Ala Ile Gly Pro Gln Cys Ser Lys Val Glu Val Val Ala Ser Leu
35 40 45
Lys Asn Gly Lys Glu Ile Cys Leu Asp Pro Glu Ala Pro Phe Leu Lys
50 55 60
Lys Val Ile Gln Lys Ile Leu Asp Gly Gly Asn Lys Glu Asn
65 70 75
<210> 104
<211> 103
<212> Белок
<213> Homo sapiens
<400> 104
Thr Pro Val Val Arg Lys Gly Arg Cys Ser Cys Ile Ser Thr Asn Gln
1 5 10 15
Gly Thr Ile His Leu Gln Ser Leu Lys Asp Leu Lys Gln Phe Ala Pro
20 25 30
Ser Pro Ser Cys Glu Lys Ile Glu Ile Ile Ala Thr Leu Lys Asn Gly
35 40 45
Val Gln Thr Cys Leu Asn Pro Asp Ser Ala Asp Val Lys Glu Leu Ile
50 55 60
Lys Lys Trp Glu Lys Gln Val Ser Gln Lys Lys Lys Gln Lys Asn Gly
65 70 75 80
Lys Lys His Gln Lys Lys Lys Val Leu Lys Val Arg Lys Ser Gln Arg
85 90 95
Ser Arg Gln Lys Lys Thr Thr
100
<210> 105
<211> 77
<212> Белок
<213> Homo sapiens
<400> 105
Gly Pro Val Ser Ala Val Leu Thr Glu Leu Arg Cys Thr Cys Leu Arg
1 5 10 15
Val Thr Leu Arg Val Asn Pro Lys Thr Ile Gly Lys Leu Gln Val Phe
20 25 30
Pro Ala Gly Pro Gln Cys Ser Lys Val Glu Val Val Ala Ser Leu Lys
35 40 45
Asn Gly Lys Gln Val Cys Leu Asp Pro Glu Ala Pro Phe Leu Lys Lys
50 55 60
Val Ile Gln Lys Ile Leu Asp Ser Gly Asn Lys Lys Asn
65 70 75
<210> 106
<211> 173
<212> Белок
<213> Homo sapiens
<400> 106
Tyr Ser Leu Phe Pro Asn Ser Pro Lys Trp Thr Ser Lys Val Val Thr
1 5 10 15
Tyr Arg Ile Val Ser Tyr Thr Arg Asp Leu Pro His Ile Thr Val Asp
20 25 30
Arg Leu Val Ser Lys Ala Leu Asn Met Trp Gly Lys Glu Ile Pro Leu
35 40 45
His Phe Arg Lys Val Val Trp Gly Thr Ala Asp Ile Met Ile Gly Phe
50 55 60
Ala Arg Gly Ala His Gly Asp Ser Tyr Pro Phe Asp Gly Pro Gly Asn
65 70 75 80
Thr Leu Ala His Ala Phe Ala Pro Gly Thr Gly Leu Gly Gly Asp Ala
85 90 95
His Phe Asp Glu Asp Glu Arg Trp Thr Asp Gly Ser Ser Leu Gly Ile
100 105 110
Asn Phe Leu Tyr Ala Ala Thr His Glu Leu Gly His Ser Leu Gly Met
115 120 125
Gly His Ser Ser Asp Pro Asn Ala Val Met Tyr Pro Thr Tyr Gly Asn
130 135 140
Gly Asp Pro Gln Asn Phe Lys Leu Ser Gln Asp Asp Ile Lys Gly Ile
145 150 155 160
Gln Lys Leu Tyr Gly Lys Arg Ser Asn Ser Arg Lys Lys
165 170
<210> 107
<211> 614
<212> Белок
<213> Homo sapiens
<400> 107
Met Arg Thr Pro Arg Cys Gly Val Pro Asp Leu Gly Arg Phe Gln Thr
1 5 10 15
Phe Glu Gly Asp Leu Lys Trp His His His Asn Ile Thr Tyr Trp Ile
20 25 30
Gln Asn Tyr Ser Glu Asp Leu Pro Arg Ala Val Ile Asp Asp Ala Phe
35 40 45
Ala Arg Ala Phe Ala Leu Trp Ser Ala Val Thr Pro Leu Thr Phe Thr
50 55 60
Arg Val Tyr Ser Arg Asp Ala Asp Ile Val Ile Gln Phe Gly Val Ala
65 70 75 80
Glu His Gly Asp Gly Tyr Pro Phe Asp Gly Lys Asp Gly Leu Leu Ala
85 90 95
His Ala Phe Pro Pro Gly Pro Gly Ile Gln Gly Asp Ala His Phe Asp
100 105 110
Asp Asp Glu Leu Trp Ser Leu Gly Lys Gly Val Val Val Pro Thr Arg
115 120 125
Phe Gly Asn Ala Asp Gly Ala Ala Cys His Phe Pro Phe Ile Phe Glu
130 135 140
Gly Arg Ser Tyr Ser Ala Cys Thr Thr Asp Gly Arg Ser Asp Gly Leu
145 150 155 160
Pro Trp Cys Ser Thr Thr Ala Asn Tyr Asp Thr Asp Asp Arg Phe Gly
165 170 175
Phe Cys Pro Ser Glu Arg Leu Tyr Thr Gln Asp Gly Asn Ala Asp Gly
180 185 190
Lys Pro Cys Gln Phe Pro Phe Ile Phe Gln Gly Gln Ser Tyr Ser Ala
195 200 205
Cys Thr Thr Asp Gly Arg Ser Asp Gly Tyr Arg Trp Cys Ala Thr Thr
210 215 220
Ala Asn Tyr Asp Arg Asp Lys Leu Phe Gly Phe Cys Pro Thr Arg Ala
225 230 235 240
Asp Ser Thr Val Met Gly Gly Asn Ser Ala Gly Glu Leu Cys Val Phe
245 250 255
Pro Phe Thr Phe Leu Gly Lys Glu Tyr Ser Thr Cys Thr Ser Glu Gly
260 265 270
Arg Gly Asp Gly Arg Leu Trp Cys Ala Thr Thr Ser Asn Phe Asp Ser
275 280 285
Asp Lys Lys Trp Gly Phe Cys Pro Asp Gln Gly Tyr Ser Leu Phe Leu
290 295 300
Val Ala Ala His Glu Phe Gly His Ala Leu Gly Leu Asp His Ser Ser
305 310 315 320
Val Pro Glu Ala Leu Met Tyr Pro Met Tyr Arg Phe Thr Glu Gly Pro
325 330 335
Pro Leu His Lys Asp Asp Val Asn Gly Ile Arg His Leu Tyr Gly Pro
340 345 350
Arg Pro Glu Pro Glu Pro Arg Pro Pro Thr Thr Thr Thr Pro Gln Pro
355 360 365
Thr Ala Pro Pro Thr Val Cys Pro Thr Gly Pro Pro Thr Val His Pro
370 375 380
Ser Glu Arg Pro Thr Ala Gly Pro Thr Gly Pro Pro Ser Ala Gly Pro
385 390 395 400
Thr Gly Pro Pro Thr Ala Gly Pro Ser Thr Ala Thr Thr Val Pro Leu
405 410 415
Ser Pro Val Asp Asp Ala Cys Asn Val Asn Ile Phe Asp Ala Ile Ala
420 425 430
Glu Ile Gly Asn Gln Leu Tyr Leu Phe Lys Asp Gly Lys Tyr Trp Arg
435 440 445
Phe Ser Glu Gly Arg Gly Ser Arg Pro Gln Gly Pro Phe Leu Ile Ala
450 455 460
Asp Lys Trp Pro Ala Leu Pro Arg Lys Leu Asp Ser Val Phe Glu Glu
465 470 475 480
Arg Leu Ser Lys Lys Leu Phe Phe Phe Ser Gly Arg Gln Val Trp Val
485 490 495
Tyr Thr Gly Ala Ser Val Leu Gly Pro Arg Arg Leu Asp Lys Leu Gly
500 505 510
Leu Gly Ala Asp Val Ala Gln Val Thr Gly Ala Leu Arg Ser Gly Arg
515 520 525
Gly Lys Met Leu Leu Phe Ser Gly Arg Arg Leu Trp Arg Phe Asp Val
530 535 540
Lys Ala Gln Met Val Asp Pro Arg Ser Ala Ser Glu Val Asp Arg Met
545 550 555 560
Phe Pro Gly Val Pro Leu Asp Thr His Asp Val Phe Gln Tyr Arg Glu
565 570 575
Lys Ala Tyr Phe Cys Gln Asp Arg Phe Tyr Trp Arg Val Ser Ser Arg
580 585 590
Ser Glu Leu Asn Gln Val Asp Gln Val Gly Tyr Val Thr Tyr Asp Ile
595 600 605
Leu Gln Cys Pro Glu Asp
610
<210> 108
<211> 631
<212> Белок
<213> Homo sapiens
<400> 108
Ala Pro Ser Pro Ile Ile Lys Phe Pro Gly Asp Val Ala Pro Lys Thr
1 5 10 15
Asp Lys Glu Leu Ala Val Gln Tyr Leu Asn Thr Phe Tyr Gly Cys Pro
20 25 30
Lys Glu Ser Cys Asn Leu Phe Val Leu Lys Asp Thr Leu Lys Lys Met
35 40 45
Gln Lys Phe Phe Gly Leu Pro Gln Thr Gly Asp Leu Asp Gln Asn Thr
50 55 60
Ile Glu Thr Met Arg Lys Pro Arg Cys Gly Asn Pro Asp Val Ala Asn
65 70 75 80
Tyr Asn Phe Phe Pro Arg Lys Pro Lys Trp Asp Lys Asn Gln Ile Thr
85 90 95
Tyr Arg Ile Ile Gly Tyr Thr Pro Asp Leu Asp Pro Glu Thr Val Asp
100 105 110
Asp Ala Phe Ala Arg Ala Phe Gln Val Trp Ser Asp Val Thr Pro Leu
115 120 125
Arg Phe Ser Arg Ile His Asp Gly Glu Ala Asp Ile Met Ile Asn Phe
130 135 140
Gly Arg Trp Glu His Gly Asp Gly Tyr Pro Phe Asp Gly Lys Asp Gly
145 150 155 160
Leu Leu Ala His Ala Phe Ala Pro Gly Thr Gly Val Gly Gly Asp Ser
165 170 175
His Phe Asp Asp Asp Glu Leu Trp Thr Leu Gly Glu Gly Gln Val Val
180 185 190
Arg Val Lys Tyr Gly Asn Ala Asp Gly Glu Tyr Cys Lys Phe Pro Phe
195 200 205
Leu Phe Asn Gly Lys Glu Tyr Asn Ser Cys Thr Asp Thr Gly Arg Ser
210 215 220
Asp Gly Phe Leu Trp Cys Ser Thr Thr Tyr Asn Phe Glu Lys Asp Gly
225 230 235 240
Lys Tyr Gly Phe Cys Pro His Glu Ala Leu Phe Thr Met Gly Gly Asn
245 250 255
Ala Glu Gly Gln Pro Cys Lys Phe Pro Phe Arg Phe Gln Gly Thr Ser
260 265 270
Tyr Asp Ser Cys Thr Thr Glu Gly Arg Thr Asp Gly Tyr Arg Trp Cys
275 280 285
Gly Thr Thr Glu Asp Tyr Asp Arg Asp Lys Lys Tyr Gly Phe Cys Pro
290 295 300
Glu Thr Ala Met Ser Thr Val Gly Gly Asn Ser Glu Gly Ala Pro Cys
305 310 315 320
Val Phe Pro Phe Thr Phe Leu Gly Asn Lys Tyr Glu Ser Cys Thr Ser
325 330 335
Ala Gly Arg Ser Asp Gly Lys Met Trp Cys Ala Thr Thr Ala Asn Tyr
340 345 350
Asp Asp Asp Arg Lys Trp Gly Phe Cys Pro Asp Gln Gly Tyr Ser Leu
355 360 365
Phe Leu Val Ala Ala His Glu Phe Gly His Ala Met Gly Leu Glu His
370 375 380
Ser Gln Asp Pro Gly Ala Leu Met Ala Pro Ile Tyr Thr Tyr Thr Lys
385 390 395 400
Asn Phe Arg Leu Ser Gln Asp Asp Ile Lys Gly Ile Gln Glu Leu Tyr
405 410 415
Gly Ala Ser Pro Asp Ile Asp Leu Gly Thr Gly Pro Thr Pro Thr Leu
420 425 430
Gly Pro Val Thr Pro Glu Ile Cys Lys Gln Asp Ile Val Phe Asp Gly
435 440 445
Ile Ala Gln Ile Arg Gly Glu Ile Phe Phe Phe Lys Asp Arg Phe Ile
450 455 460
Trp Arg Thr Val Thr Pro Arg Asp Lys Pro Met Gly Pro Leu Leu Val
465 470 475 480
Ala Thr Phe Trp Pro Glu Leu Pro Glu Lys Ile Asp Ala Val Tyr Glu
485 490 495
Ala Pro Gln Glu Glu Lys Ala Val Phe Phe Ala Gly Asn Glu Tyr Trp
500 505 510
Ile Tyr Ser Ala Ser Thr Leu Glu Arg Gly Tyr Pro Lys Pro Leu Thr
515 520 525
Ser Leu Gly Leu Pro Pro Asp Val Gln Arg Val Asp Ala Ala Phe Asn
530 535 540
Trp Ser Lys Asn Lys Lys Thr Tyr Ile Phe Ala Gly Asp Lys Phe Trp
545 550 555 560
Arg Tyr Asn Glu Val Lys Lys Lys Met Asp Pro Gly Phe Pro Lys Leu
565 570 575
Ile Ala Asp Ala Trp Asn Ala Ile Pro Asp Asn Leu Asp Ala Val Val
580 585 590
Asp Leu Gln Gly Gly Gly His Ser Tyr Phe Phe Lys Gly Ala Tyr Tyr
595 600 605
Leu Lys Leu Glu Asn Gln Ser Leu Lys Ser Val Lys Phe Gly Ser Ile
610 615 620
Lys Ser Asp Trp Leu Gly Cys
625 630
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМЕРНЫЕ БЕЛКИ НА ОСНОВЕ CSF1R | 2018 |
|
RU2792239C2 |
| Новые варианты интерлейкина-2 для лечения рака | 2020 |
|
RU2833537C2 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
| Анти-PD-L1 и IL-2 цитокины | 2017 |
|
RU2769282C2 |
| PD-L1 специфические антитела | 2017 |
|
RU2756236C2 |
| АНТИТЕЛА К IL-6 И ИХ СЛИТЫЕ КОНСТРУКЦИИ И КОНЪЮГАТЫ | 2019 |
|
RU2810777C2 |
| АНТИТЕЛА, СОДЕРЖАЩИЕ ПОЛИПЕПТИД, ВСТРОЕННЫЙ В УЧАСТОК КАРКАСНОЙ ОБЛАСТИ 3 | 2019 |
|
RU2796254C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ИНТЕРЛЕЙКИНА-33 (IL-33) | 2015 |
|
RU2829846C2 |
| АНТИТЕЛА К СОБАЧЬЕМУ АЛЬФА-РЕЦЕПТОРУ ИНТЕРЛЕЙКИНА-4 | 2020 |
|
RU2840044C1 |
| АКТИВИРУЕМЫЕ ПОЛИПЕПТИДЫ ИНТЕРЛЕЙКИНА-2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2826454C2 |

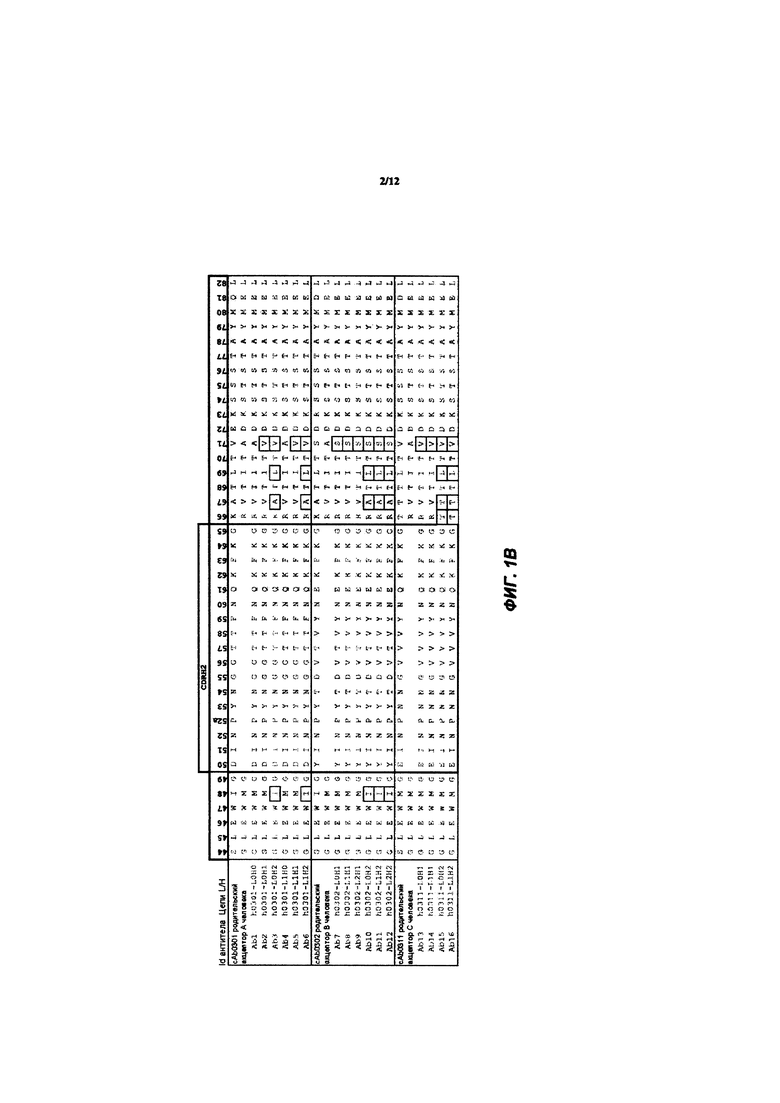
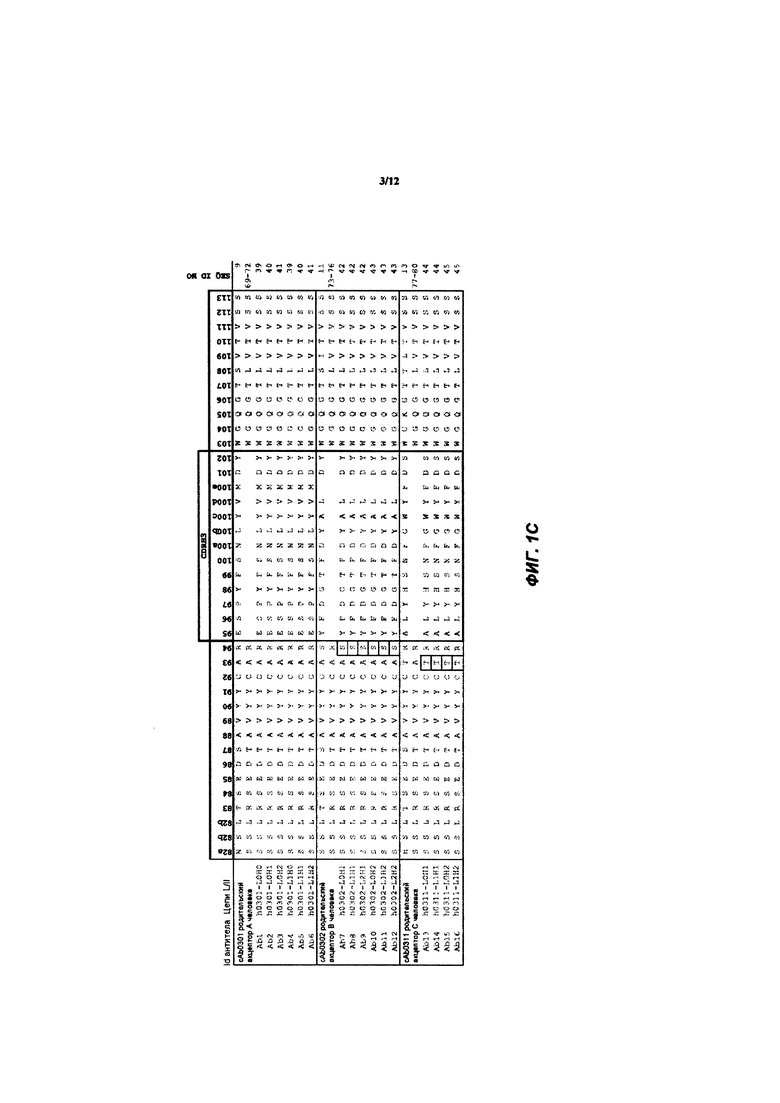
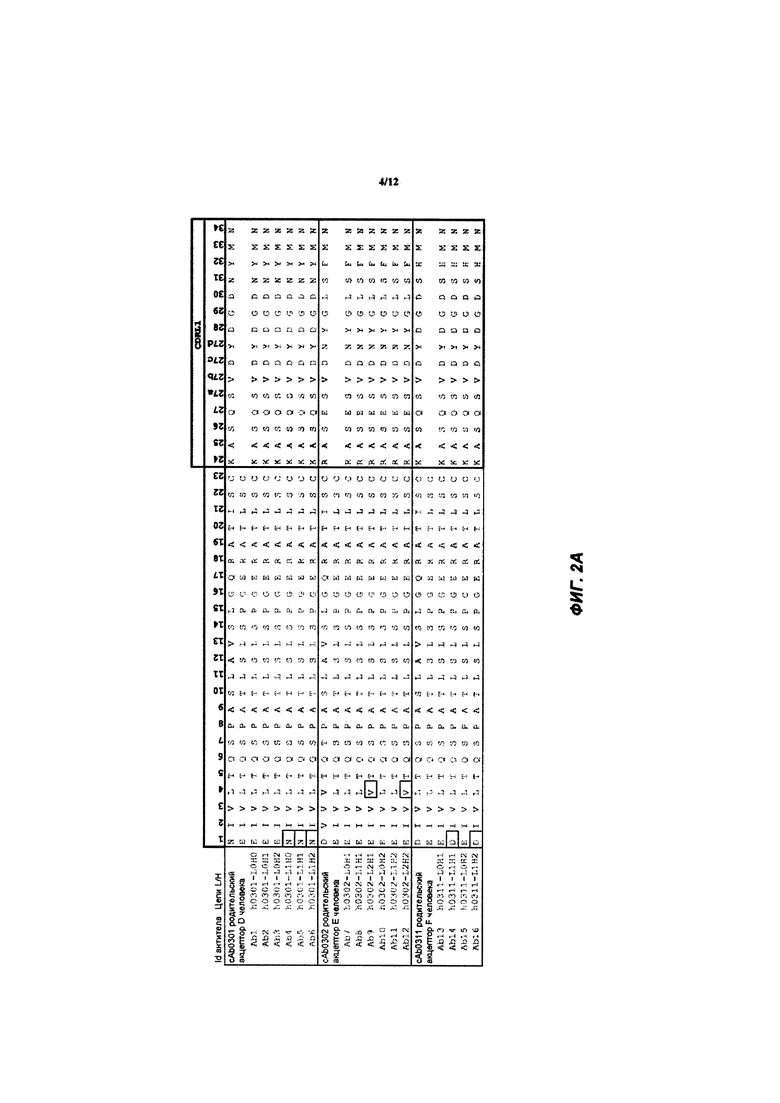

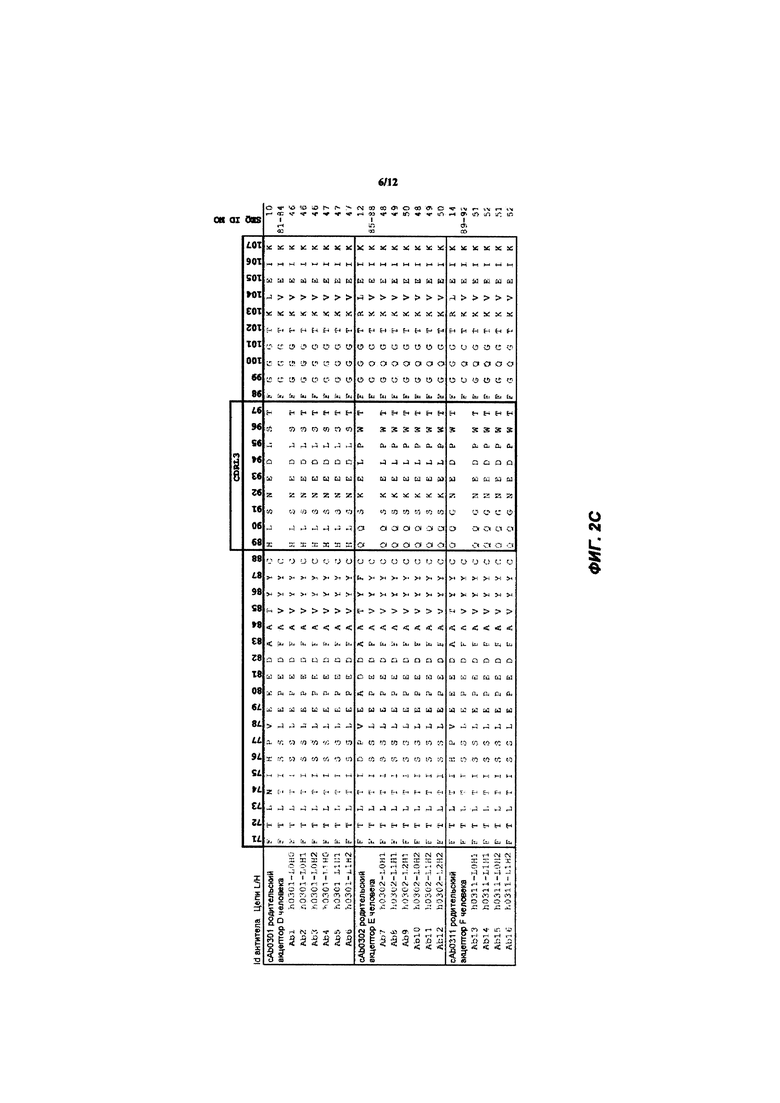
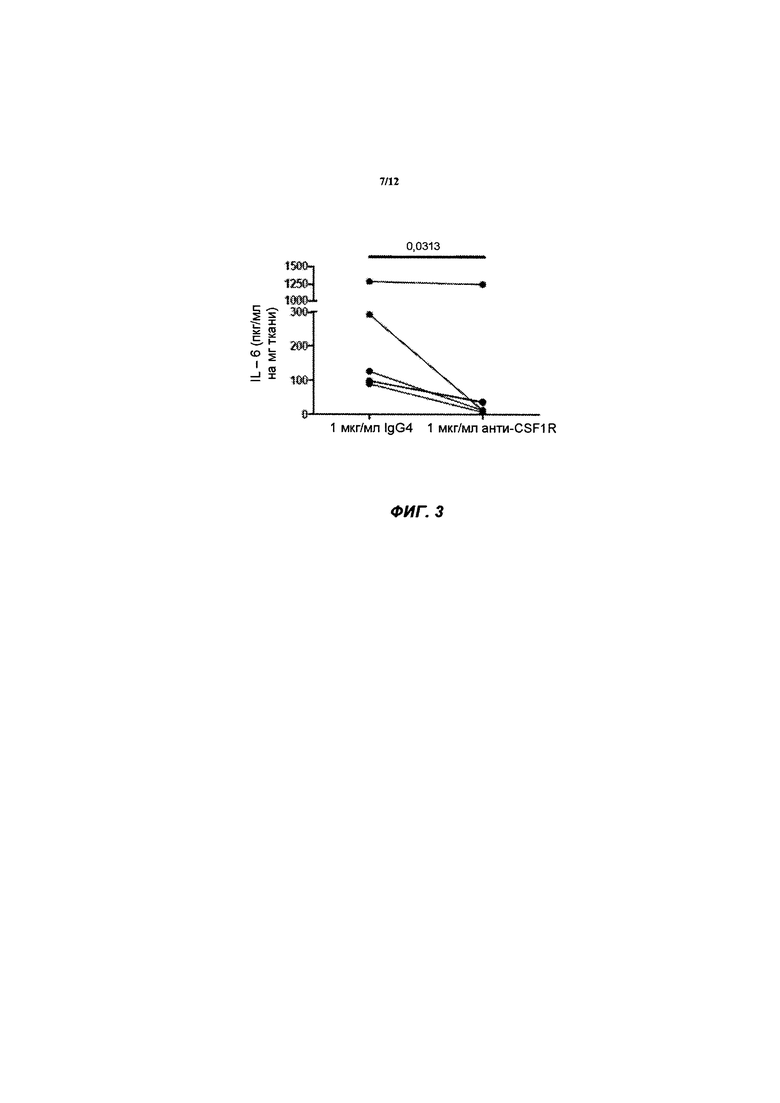
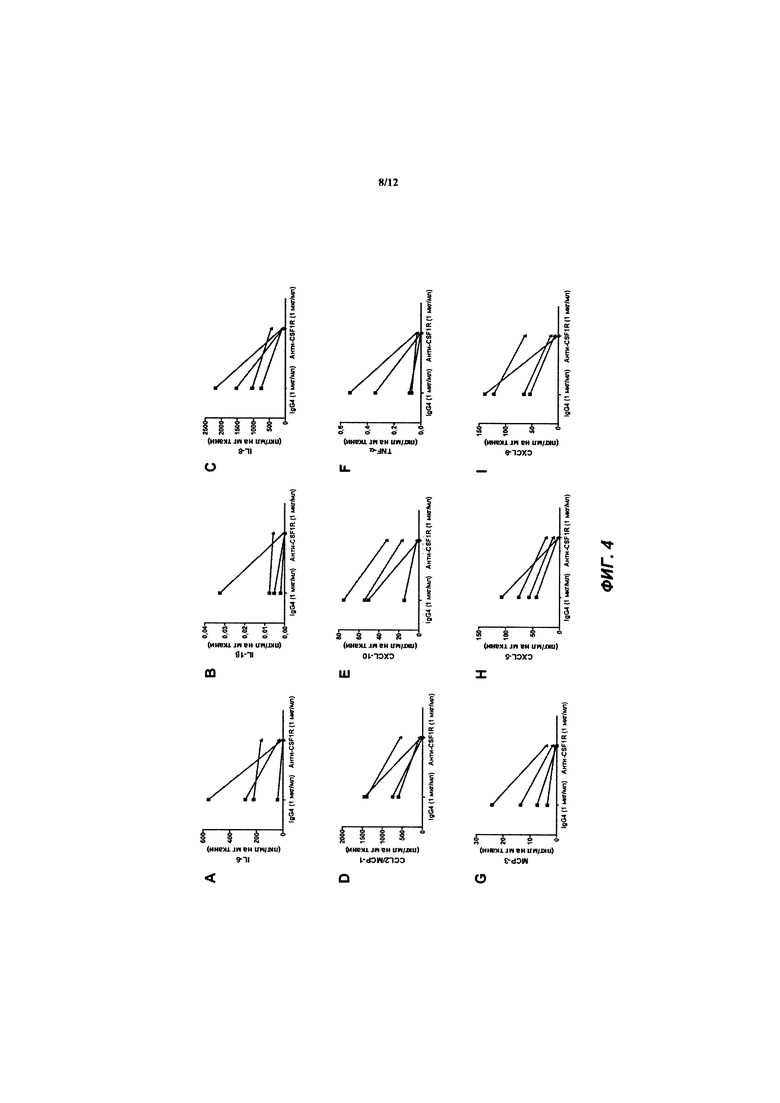
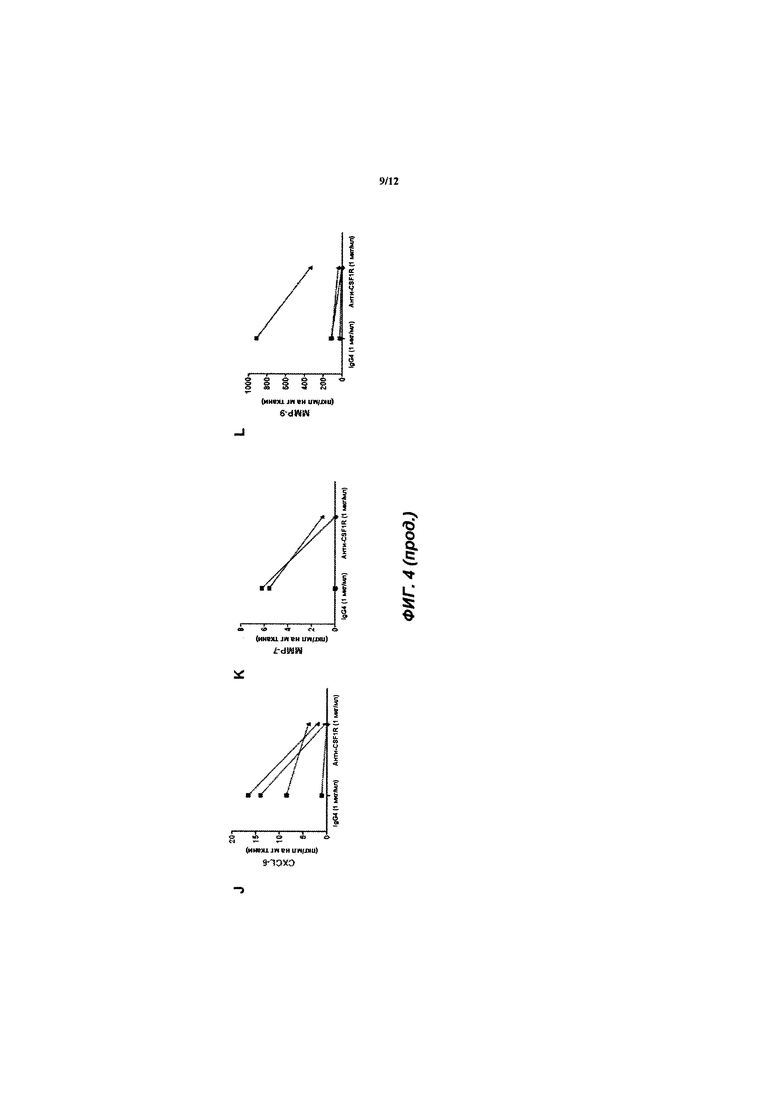
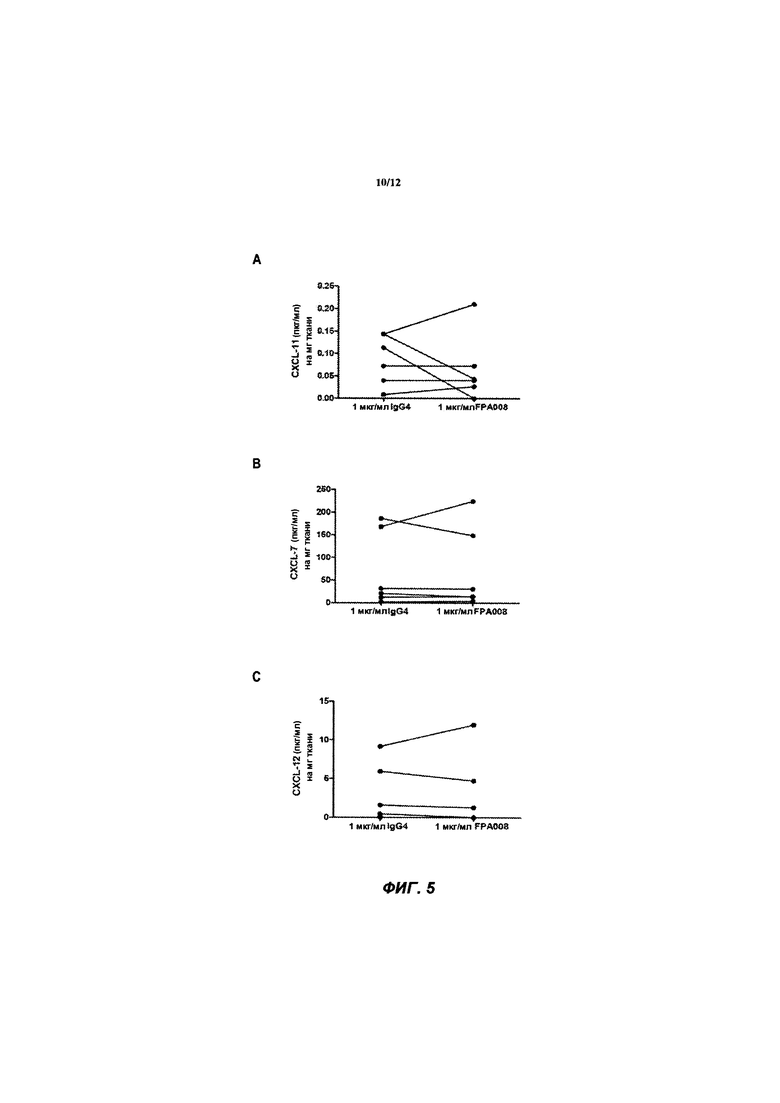
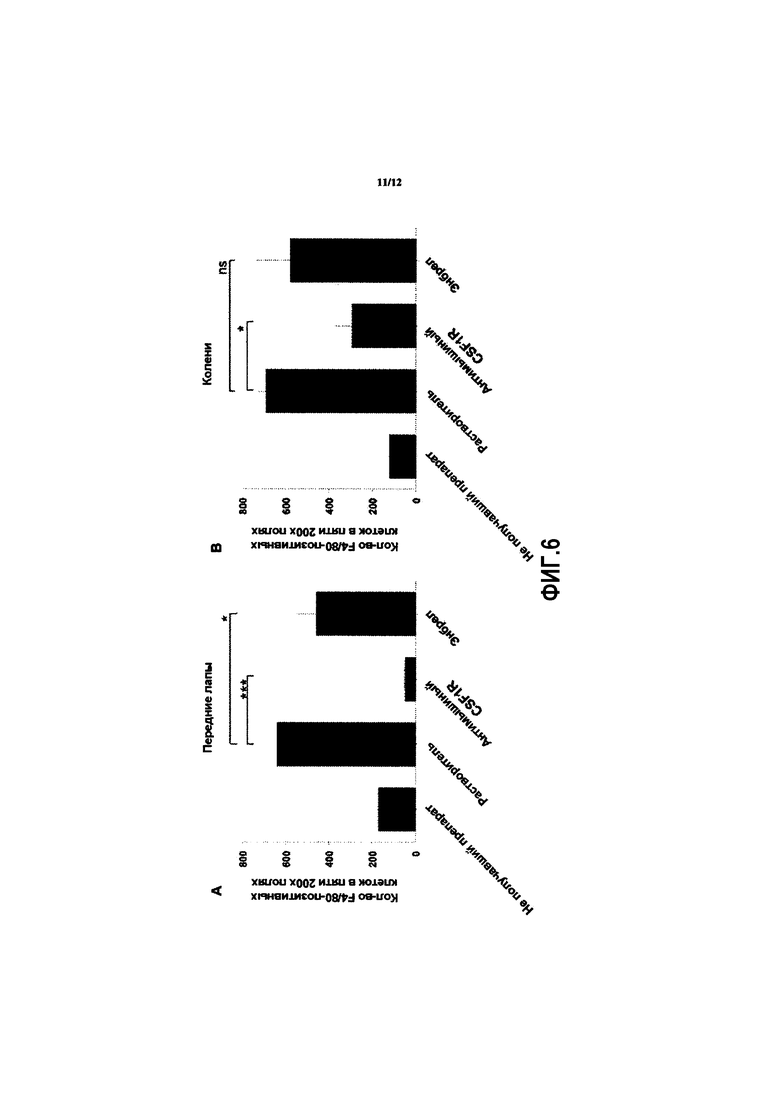
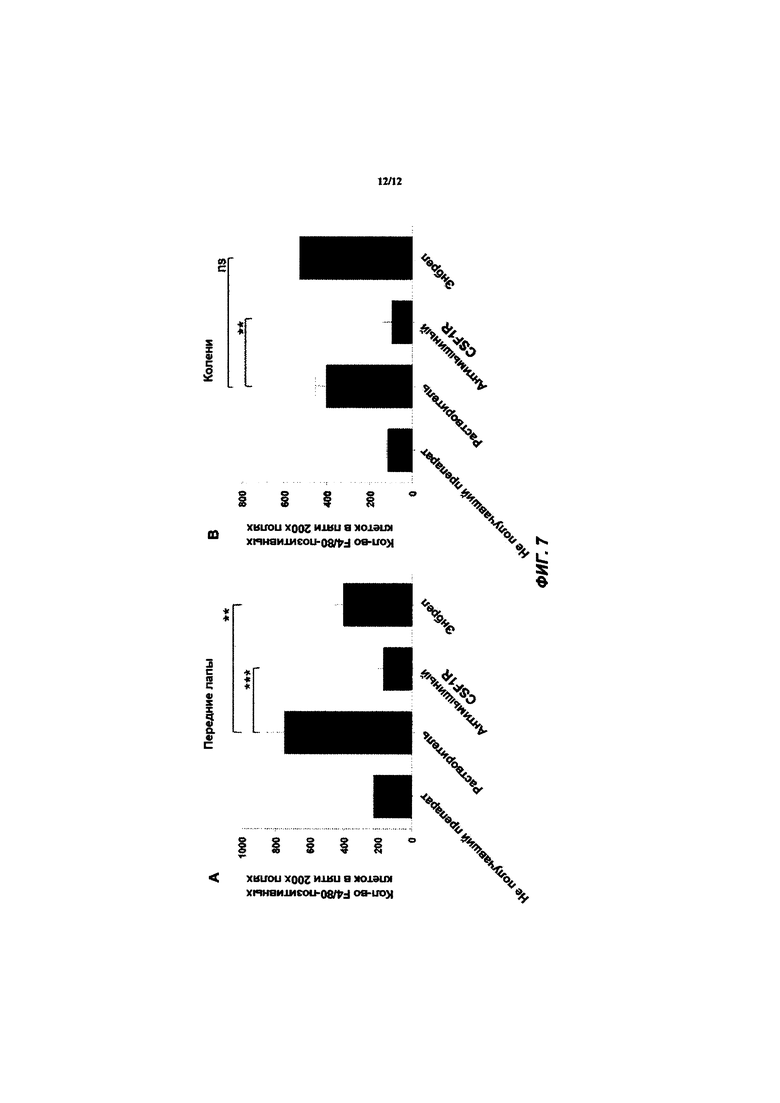
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для снижения уровня цитокинов у индивида с неоплазией. Для снижения уровня цитокинов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, MMP-7, MMP-2 и MMP-9, у индивида с неоплазией вводят эффективное количество антитела, которое связывается с рецептором колониестимулирующего фактора 1 (CSF1R) человека, где антитело блокирует связывание колониестимулирующего фактора 1 (CSF1) человека с CSF1R человека и блокирует связывание IL-34 человека с CSF1R человека. Антитело выбрано из: a) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:39, и легкую цепь, содержащую последовательность SEQ ID NO:46; и b) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:53, и легкую цепь, содержащую последовательность SEQ ID NO:60. Группа изобретений относится также к способу лечения неоплазии у субъекта с повышенным уровнем указанных цитокинов. Использование данной группы изобретений позволяет понизить повышенный уровень IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, MMP-7, MMP-2 и MMP-9 у индивида с неоплазией, снижая количество моноцитарных клеток. 4 н. и 24 з.п. ф-лы, 9 табл., 7 ил.
1. Способ снижения уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CXCL10, TNF-α, CCL7, CXCL5, CXCL9, CXCL6, MMP-7, MMP-2 и MMP-9, у индивида с неоплазией, включающий введение пациенту количества антитела, эффективного для снижения уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9,
где антитело связывается с рецептором колониестимулирующего фактора 1 (CSF1R) человека,
где антитело блокирует связывание колониестимулирующего фактора 1 (CSF1) человека с CSF1R человека и блокирует связывание IL-34 человека с CSF1R человека, и
где антитело выбрано из:
a) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:39, и легкую цепь, содержащую последовательность SEQ ID NO:46; и
b) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:53, и легкую цепь, содержащую последовательность SEQ ID NO:60.
2. Способ по п.1, включающий снижение уровня IL-6 и/или IL-1β.
3. Способ по п.2, включающий снижение уровня IL-6.
4. Способ по п.2, включающий снижение уровня IL-1β.
5. Способ лечения неоплазии, связанной с повышенным уровнем по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, включающий введение индивиду количества антитела, эффективного для снижения уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9,
где антитело связывается с рецептором колониестимулирующего фактора 1 (CSF1R) человека,
где антитело блокирует связывание CSF1 человека с CSF1R человека и блокирует связывание IL-34 человека с CSF1R человека,
где антитело выбрано из:
a) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:39, и легкую цепь, содержащую последовательность SEQ ID NO:46; и
b) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:53, и легкую цепь, содержащую последовательность SEQ ID NO:60.
6. Способ по п.5, в котором неоплазия связана с повышенным уровнем IL-6 и/или IL-β.
7. Способ по п.6, в котором неоплазия связана с повышенным уровнем IL-6.
8. Способ по п.6, в котором неоплазия связана с повышенным уровнем IL-1β.
9. Способ по любому из пп.1-8, дополнительно включающий определение у индивида уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, после введения антитела для определения снижения указанного уровня.
10. Способ по любому из пп.1-8, в котором антитело уменьшает количество CD16+ моноцитов.
11. Способ по любому из пп.1-8, в котором антитело представляет собой гуманизированное антитело.
12. Способ по любому из пп.1-8, в котором антитело выбрано из Fab, Fv, scFv, Fab’ и (Fab’)2.
13. Способ по любому из пп.1-8, в котором антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO:39, и легкую цепь, содержащую последовательность SEQ ID NO:46, и представляет собой IgG антитело.
14. Способ по п.13, где антитело представляет собой IgG4 антитело с заменой S241P по меньшей мере в одной константной области тяжелой цепи.
15. Способ снижения уровня по меньшей мере одного фактора, выбранного из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, у индивида c неоплазией, включающий:
(а) определение уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, у индивида с неоплазией; и
(b) если уровень по меньшей мере одного из факторов у индивида повышен, введение индивиду антитела, которое связывается с CSF1R человека и блокирует связывание CSF1 человека с CSF1R человека и блокирует связывание IL-34 человека с CSF1R человека,
где антитело вводят в количестве, эффективном для снижения уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9,
где антитело выбрано из:
a) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:39, и легкую цепь, содержащую последовательность SEQ ID NO:46; и
b) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:53, и легкую цепь, содержащую последовательность SEQ ID NO:60.
16. Способ по п.15, дополнительно включающий (c) определение у индивида уровня по меньшей мере одного фактора, выбранного из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, после введения антитела для определения снижения указанного уровня.
17. Способ по п.15, в котором антитело представляет гуманизированное антитело.
18. Способ по п.15, в котором антитело выбрано из Fab, Fv, scFv, Fab’ и (Fab’)2.
19. Способ по п.15, в котором антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO:39, и легкую цепь, содержащую последовательность SEQ ID NO:46, и представляет собой IgG антитело.
20. Способ по п.18, где антитело представляет собой IgG4 антитело с заменой S241P по меньшей мере в одной константной области тяжелой цепи.
21. Способ снижения уровня по меньшей мере одного фактора, выбранного из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, у индивида с неоплазией, включающий:
(а) определение повышенного уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, у индивида с неоплазией; и
(b) введение индивиду антитела, которое связывается с CSF1R человека и блокирует связывание CSF1R человека с CSF1R человека и блокирует связывание IL-34 человека с CSF1R,
где антитело вводят в количестве, эффективном для снижения уровня по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9,
где антитело выбрано из:
a) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:39, и легкую цепь, содержащую последовательность SEQ ID NO:46; и
b) антитела, содержащего тяжелую цепь, содержащую последовательность SEQ ID NO:53, и легкую цепь, содержащую последовательность SEQ ID NO:60.
22. Способ по п.21, дополнительно включающий (c) определение у индивида уровня по меньшей мере одного фактора, выбранного из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, после введения антитела для определения снижения указанного уровня.
23. Способ по п.21, в котором антитело представляет гуманизированное антитело.
24. Способ по п.21, в котором антитело выбрано из Fab, Fv, scFv, Fab’ и (Fab’)2.
25. Способ по п.21, в котором антитело содержит тяжелую цепь, содержащую последовательность SEQ ID NO:39, и легкую цепь, содержащую последовательность SEQ ID NO:46, и представляет собой IgG антитело.
26. Способ по п.25, где антитело представляет собой IgG4 антитело с заменой S241P по меньшей мере в одной константной области тяжелой цепи.
27. Способ по п.15 или 21, в котором определенный или детектированный уровень по меньшей мере одного, по меньшей мере двух, по меньшей мере трех, по меньшей мере четырех, по меньшей мере пяти, по меньшей мере шести, по меньшей мере семи, по меньшей мере восьми, по меньшей мере девяти или десяти факторов, выбранных из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, является уровнем белка.
28. Способ по п.15 или 21, в котором уровень по меньшей мере одного фактора, выбранного из IL-6, IL-1β, IL-8, CCL2, CCL7, CXCL5, CXCL6, MMP-7, MMP-2 и MMP-9, определяют в образце крови индивида.
| WO2011140249 A2, 10.11.2011 | |||
| WO2012082573 A1, 21.06.2012 | |||
| Kelli P | |||
| A.et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-04-14—Публикация
2013-08-30—Подача