Способ переработки прокорродировавших изделий из меди или ее сплава
Изобретение относится к использованию прокорродировавшей меди и бронзы в качестве вторичного сырья для получения химической продукции, а также к оценке устойчивости этих, содержащих на своей поверхности продукты коррозии материалов при попадании в кислые среды и может быть использовано в различных областях практической деятельности, в аналитическом контроле, научных исследованиях и в диагностике.
Известен способ получения хлорокиси меди (II) путем обработки металлической меди соляной и азотной кислотами при перемешивании воздухом при 20-35°C с отделением полученного осадка от маточного раствора с последующей обработкой раствором аммиака в присутствии каталитических количеств хроматов щелочных металлов или хромата аммония, при этом такую обработку ведут при перемешивании смесью воздуха с оксидом азота (IV) в соотношении 8:1, а оксид азота (IV) получают окислением образующейся при взаимодействии меди с кислотами NO кислородом воздуха (Усачев А.И. Патент РФ 2161128, 27.12.2000).
Недостатками такого способа являются:
1. Использование концентрированных соляной (35%-ной) и азотной (56%-ной) кислот при перемешивании воздухом.
2. Необходимость в утилизации образовавшегося при окислении меди оксида азота (II) путем окисления воздухом в NO2 и превращением последнего в азотную кислоту за счет окисления кислородом воздуха и поглощения водой.
3. Требуют утилизации и отработанные растворы хлорида меди (II) в растворах-суспензиях неизрасходованных кислот и меди.
Известен способ получения хлороксида меди (II) растворением меди в 20%-ном растворе хлорида меди (II) в присутствии 150 г/л хлорида натрия (патент RO 121423 от 05.03.2007). Брутто-стехиометрическое уравнение следующее:
4CuCl+3H2O+3/2O2+Cu → CuCl2 · 3Cu(OH)2+CuCl2 (1)
2CuCl2+2Cu → 4CuCl (2)
6CuCl+3H2O+3/2O2 → CuCl2 · 3Cu(OH)2+2CuCl2 (3)
Недостатками данного способа являются:
1. Использование концентрированных растворов в качестве объемной фазы, причем не только CuCl2, но и NaCl, что предопределяет учет этого обстоятельства как при организации абсорбции кислорода, так и в выборе материала для аппаратурного оформления процесса.
2. Необходимость применения хлорида натрия, который в химических взаимодействиях формально не представлен, причем в довольно больших количествах. Как следствие необходимость в утилизации этого компонента, что может существенно осложнить пооперационную, а в дальнейшем и технологическую схему процесса.
3. Совсем не очевидно, что в таком процессе медь можно заменить на прокорродировавший в различной степени и в разных условиях металл и тем более его сплав (например бронзу), причем не в раздробленном виде, а как какой-либо объект, вышедшая из употребления деталь и т.д.
Известен способ окисления меди хлоридом меди (II). Процесс ведут в колонне, заполненной медным скрапом и орошаемой смесью растворов CuCl2 и 15%-ной соляной кислоты. Соотношение CuCl2:НCl выбирают таким, чтобы в колонне образовалось концентрированное соединение Н2[CuCl3], в котором растворяется CuCl. Температура 75-95°С. При разбавлении обозначенного раствора водой выпадают кристаллы CuCl2, которые отфильтровывают, промывают 2%-ной соляной кислотой, содержащей добавку декстрина или желатина, рекультивируют этиловым спиртом и сушат. Процесс ведут в токе инертного газа (N2, CO2) (Фурман А.А. Неорганические хлориды (химия и технология). - М.: Химия, 1980, 416 с. С.60).
Недостатками данного способа являются:
1. Использование концентрированных растворов хлорида меди (II) и НCl в таком соотношении, чтобы гарантированно образовался промежуточный комплекс Н2[CuCl3], что требует повышенного контроля по ходу процесса.
2. Необходимость в сложной процедуре разложения комплекса Н2[CuCl3], последующего выделения и очистки целевого продукта CuCl.
3. Необходимость поддержания температурного режима в указанном интервале за счет преднамеренного теплообмена.
4. Большое количество незадействованных непосредственно в химической реакции веществ (соляная кислота, этиловый спирт, желатин и т.д.), что затрудняет и усложняет утилизационные процессы.
5. Создание условий для проведения процесса в инертной атмосфере.
Наиболее близким к заявленному является способ окисления меди и бронзы соединениями меди (II) в кислых водных растворах и в растворах-суспензиях продуктов окисления при интенсивном механическом перемешивании и барботаже воздуха (С.Д. Пожидаева, А.М. Иванов, Д.А. Сотникова, А.Ю. Елисеева. Циклические макростадии в механизмах окисления металлов в кислых средах в присутствии металлсодержащих и иных окислителей. Известия Юго-Западного государственного университета. Курск: 2012, №4(43), Ч. 2. С. 196-203). В соответствии с ним медь или бронзу в раздробленном виде или же в виде конкретной детали помещают в бисерную мельницу с приподнятой над днищем мешалкой на высоту лежащей на днище детали с зазором 1-1,5 мм. В реактор предварительно вводят водный раствор минеральной или органической кислоты и соединение меди (II) в качестве окислителя. Включают механическое перемешивание, подают воздух на барботаж и проводят процесс с контролем методом отбора проб объемной фазы и анализа в них соединений меди (II), меди (I) и кислоты. При обнаружении интенсивного загустевания реакционной смеси процесс прекращают, отделяют непрореагировавшую медь или бронзу, разделяют суспензию на жидкую и твердую фазы, металл или сплав направляют на очистку от поверхностных отложений, твердую и жидкую составляющие суспензии анализируют, при необходимости разделяют на составляющие либо используют как единые целые. Приводится 29 вариантов соединений меди (II) в качестве окислителей, среди которых есть средние и основные соли, гидроксид и оксид меди, а также искусственно созданные из индивидуальных компонентов смеси. При этом требования обязательной полной или определенной частичной растворимости окислителя не выдвигаются.
Недостатками данного способа являются:
1. Цитируемый процесс, несмотря на приведенную в тексте пооперационную схему, недостаточно организован как способ, в частности, не приведены диапазоны численных характеристик проводимых операций применительно конкретного реакционного аппарата и размеров исходных загрузок реактивов.
2. Во взаимодействие брались металл и его сплав, предварительно очищенные от продуктов коррозии и других поверхностных отложений.
3. Хотя оксид и гидроксид меди (II) входят в составы продуктов коррозии, нет никаких оснований считать, что продукты коррозии способны выполнить роль окислителей металла с такой же эффективностью как оксид или гидроксид меди (II) как индивидуальные вещества.
4. По прототипу окислителей в виде соединений меди (II) берется намного больше, чем можно ввести с продуктами коррозии, даже если металл (сплав) прокорродировал очень сильно.
5. В цитируемом способе нет сведений о возможности продолжения окислительно-восстановительного процесса, если из объемной фазы, т.е. суспензии продуктов, удалить твердую фазу путем фильтрования, а фильтрат ввести в повторный контакт с непрореагировавшим металлом или сплавом.
Задачей предлагаемого решения является подобрать такие условия, в которых находящиеся на металле или его сплаве продукты коррозии оказались бы эффективными и способными регенерироваться по ходу процесса окислителями металла, способными не только начать окислительно-восстановительный процесс с технологически приемлемыми скоростями, но и устойчиво обеспечить его протекание как до промежуточного прекращения с целью отделения мешающей дальнейшему развитию процесса твердой фазы продуктов, так и при дальнейшем возобновлении контакта отделенной жидкой фазы с непрореагировавшим изделием не только с соизмеримыми и даже более высокими скоростями, причем такое отделение твердых продуктов проводить многократно вплоть до полного расходования взятого на разрушение исходного и добавленного по ходу изделия, тем самым расширить функциональные возможности процесса, и сделать его более независимым от изменения массы и формы изделия по мере его расходования.
Поставленная задача достигается тем, что изделие, содержащее продукты коррозии, вводят в контакт с разбавленной соляной кислотой при интенсивном механическом перемешивании и барботаже воздуха и ведут процесс при саморазогреве и контроле за накоплением соединений меди (II) и расходованием кислоты до превращения в загущенную суспензию, после чего перемешивание и барботаж воздуха прекращают, объемную фазу отделяют от непрореагировавшей меди или ее сплава и разделяют на твердую и жидкую фазы, осветленную жидкую фазу доводят до исходных содержаний кислоты и воды и осуществляют повторное введение в контакт с непрореагировавшей медью или ее сплавом, запуск и проведение процесса проводят указанными приемами не менее 5-7 раз до переработки всей меди или ее сплава.
Характеристики используемого сырья:
Медь марки М1к по ГОСТ 859-2001
Бронза марки ОЦС 3-12-5 по ГОСТ 613-79
Соляная кислота по ГОСТ3118-77
или некондиционная
Дистиллированная вода по ГОСТ 6709-72.
Поверхностные отложения продуктов коррозии на меди и бронзе естественного происхождения при хранении изделий из этих материалов в контакте с воздухом и влагой длительное время.
Проведение процесса заявляемым способом сводится к следующему. В реактор с необходимым объемом и конфигурацией помещают металл или его сплав, содержащий на своей поверхности продукты коррозии, после чего вводят расчетное количество разбавленного водного раствора соляной кислоты. Включают механическое перемешивание и барботаж воздуха и начинают процесс, наблюдая за ходом его протекания методом отбора проб и анализа их на содержание соединений меди (II), меди (I) и остаточной кислоты. Спустя несколько минут поверхность металла приобретает цвет «чистой меди», а раствор становится окрашенным в сине-зеленоватые цвета, что свидетельствует о превращении продуктов коррозии в растворимые в кислых средах соединения меди (II), собственно и являющиеся окислителями металла в данных условиях. Вскоре появляются и суспендированные в жидкой фазе твердые продукты. Постепенно их количество возрастает, что, начиная с определенного момента, приводит к быстро нарастающему загустеванию объемной фазы. После того, как накопится более 1 моль/кг продуктов, суспензия становится довольно вязкой, постепенно превращаясь в малотекучую пасту. Это сопровождается значительным уменьшением скорости протекания окислительно-восстановительного процесса, в том числе и скорости расходования металла или сплава. Чтобы не допустить сильного падения скорости твердую фазу нужно своевременно удалить. Для этого перемешивание и барботаж воздуха прекращают, реакционную смесь аккуратно сливают в вакуум-фильтр; осадок на фильтре промывают небольшим количеством воды, фильтрат вместе с промывной водой взвешивают, анализируют на содержание соединений меди (II) и остаточной кислоты возвращают в реактор с оставшимся металлом или сплавом, одновременно проводя компенсацию израсходованной кислоты и жидкой фазы, до первоначальной массы дистиллированной водой. Включают механическое перемешивание и барботаж воздуха и по описанной схеме продолжают окислительно-восстановительный процесс до превращения объемной фазы снова в загущенную суспензию, с последующими отделением из нее твердых продуктов, промывкой их дистиллированной водой, возвратом фильтрата и промывной воды в реактор с оставшимся металлом (сплавом), подпитками израсходованной кислоты и убыли массы, возобновлением окислительно-восстановительного процесса с повторением описанного 5-7, а возможно и более раз. Если масса реагирующего металла (сплава) становится менее 2-3% от массы исходной жидкой фазы, возможна и промежуточная подпитка металла или сплава. При этом нет никаких требований в части наличия на подпитываемом материале продуктов коррозии, поверхностных отложений иного происхождения или практически полного их отсутствия.
Все описанные операции проводят в отсутствие подвода внешнего тепла. Но по ходу процесса реакционная смесь периодически может разогреваться до разной температуры за счет тепла экзотермических стадий. Поэтому при больших исходных загрузках необходимо предусматривать охлаждение по ходу процесса в целях недопущения закипания жидкой фазы.
Пример №1.
В стеклянный сосуд емкостью 0,97 л и внутренним диаметром 81 мм, с высокооборотной (1560 об/мин) мешалкой с пластиной 75×25×3,5 мм из текстолита в качестве лопасти, барботером для воздуха с выходом над верхней кромкой лопастной мешалки с зазором 1,1 мм вводят 250 г стеклянного бисера, 300 мл раствора соляной кислоты с концентрацией 0,49 моль/кг и 66 г сильно прокорродировавшего, лишенного оплетки и порезанного на цилиндрики с линейным размером до 5 мм многожильного провода грязно-черно-коричневого цвета. По анализу содержание продуктов коррозии в такой меди составляло 9,8% по массе. Включают механическое перемешивание и барботаж воздуха с расходом 0,41 л/(мин · кгРС). По ходу процесса отбирают пробы реакционной смеси (РС), которые анализируют на содержание соединений меди (I), меди (II) и кислоты. Через 10 мин медь практически полностью очистилась от продуктов коррозии, а жидкая фаза приобрела синий цвет. Спустя 20 мин от начала процесса появляется суспендированная твердая фаза продуктов (плохо растворимых основных солей брутто-формул Cu(ОН)Cl·mCu(OH)2 и CuCl2 nCu(OH)2, где m=0÷2 и n=1÷3). Процесс экзотермический, что приводит к росту температуры в разные моменты по ходу до 35-60°С (в зависимости от скорости протекания и температуры окружающей среды). Необходимость использования принудительного удержания температуры в определенном диапазоне отсутствует.
По мере накопления твердых продуктов процесса вязкость суспензии (объемной фазы реакционной смеси) возрастает сначала медленно, а затем с явно выраженным автоускорением. Особенно сильно и быстро после накопления продуктов в количестве более 1 моль/кг. При этом с ростом вязкости объемной фазы скорость расходования металла начинает падать. При достижении 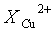
Суспензию фильтруют, тщательно отжимают осадок на фильтре, после чего его промывают 20 г дистиллированной воды. После высушивания получают 28,24 г сухого продукта. В фильтрат в количестве 262 г в совокупности с промывной водой добавляют 12,3 г 9,8 моль/кг соляной кислоты, 6,2 г дистиллированной воды, взвешивают и в количестве 301 г вводят в бисерную мельницу с оставшейся непрореагировавшей медью. В полученной объемной фазе содержание соединений меди (II) 0,319 моль/кг, меди (I) 0,037 моль/кг, соляной кислоты 0,511 моль/кг.
Средняя скорость расходования изделия составила 29,03 гмеди/(час·кг объемной фазы).
Включают механическое перемешивание, подают воздух на барботаж с прежним расходом и начинают второй этап проведения процесса, его прекращения и удаления накапливающейся твердой фазы из реакционной смеси. Поскольку все основные соли индивидуально и вместе друг с другом являются довольно эффективными окислителями меди (хотя и разной эффективности), процесс начинается сразу же после включения перемешивания и подачи воздуха на барботаж.
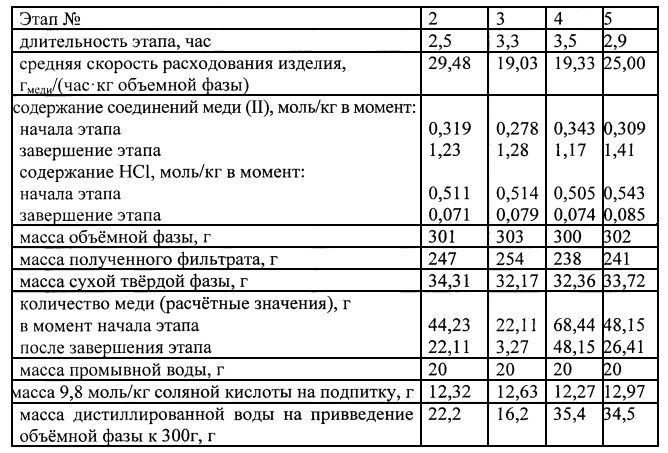
За вторым этапом по описанной схеме следует третий, четвертый и пятый. При этом на четвертом этапе производят подпитку меди в количестве 65,17 г. Характеристики второго - пятого этапов сведены в таблицу 1:
Пример №2.
Последовательность проведения операций и характеристика барботажа воздуха аналогичны, описанным в примере 1.
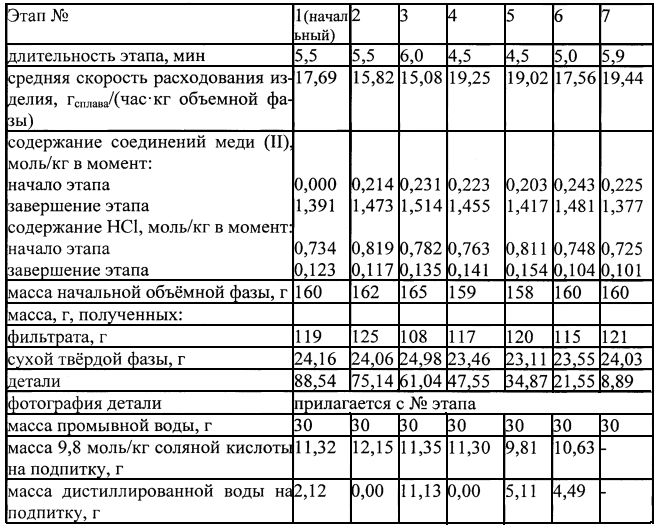
Реактор представляет собой пластмассовый стакан внутренним диаметром 72 мм и высотой 150 мм с крышкой, в которой расположены сальниковая коробка для высокооборотной (3000 об/мин) механической мешалки, ввод погружного барботера, выход отработанного воздуха и гнезда для отбора пробы и установки рабочего датчика для измерения температуры. В этот реактор помещают корпус сантехнического фильтра из бронзы с максимальным линейным размером 67 мм и массой с учетом находящихся на поверхностях продуктов коррозии 104,15 г. Проведенным анализом установлено, что вносимые с деталью продукты коррозии превращаются в соединения меди(II) в количестве 0,0274 моль. Вводят 160 г водного раствора соляной кислоты с концентрацией 0,734 моль/кг, опускают мешалку с размерами лопасти из текстолита 65×16×2,5 мм таким образом, чтобы зазор между нижней кромкой лопасти и верхней точкой лежащей на днище детали составлял 1,2 мм, устанавливают погружной барботер и датчик для измерения температуры, включают механическое перемешивание и барботаж воздуха и это момент принимают за начало проводимого процесса. В отобранных через 20 мин пробах содержание соединений меди (II) составило 0,171 моль/кг, а жидкая фаза приобрела сильно сине-зеленый цвет. Продолжают процесс с контролем методом отбора проб объемной фазы и фиксацией температуры. На 67 мин она оказалась равной 30°С, а на 175 достигла 65°С. По истечении 5,5 часа содержание соединений меди (II) в объемной фазе достигло 1,391 моль/кг. Перемешивание и барботаж воздуха прекращают, отсоединяют корпус реактора от стационарно закрепленной крышки, вынимают деталь и аккуратно ополаскивают 30 мл дистиллированной воды, собирая промывную воду в специальную емкость. Деталь подсушивают на воздухе, фотографируют, взвешивают и возвращают в корпус реактора, предварительно освобожденный от суспензии реакционной смеси, отправленной на вакуум-фильтрование (промывку корпуса после удаления суспензии не проводят). Обработку слитой и корпуса реактора суспензии, операции с твердой фазой и фильтратом, а также подпитками последнего кислотой и водой для превращения последующего этапа в объемную фазу последующего этапа аналогично описанному в примере 1. Число этапов и их характеристики приведены в таблице 2:
Положительный эффект предлагаемого решения состоит:
1. Процесс спонтанный при попадании меди или бронзы с продуктами коррозии в кислую среду независимо от ее происхождения, но при наличии незатрудненного контакта этой системы с атмосферой. В таких условиях продукты коррозии превращаются в соединения меди (II) - окислители металла (сплава). Поскольку и продукты окисления также соединения меди (II), то начавшийся процесс может протекать вплоть до расходования всего металла или сплава.
2. Этот процесс следует исключать, если металл (сплав) нужно сохранять в работоспособном состоянии и, наоборот, использовать, если металл или сплав предназначен для переработки в качестве вторичного сырья.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ ПОВЕРХНОСТЕЙ МЕДИ И ЕЕ СПЛАВОВ ОТ ПРОДУКТОВ КОРРОЗИИ И ОКИСЛЕНИЯ СОЕДИНЕНИЯМИ МЕДИ (II) | 2014 |
|
RU2604162C2 |
| Способ получения бензоата и замещенных бензоатов олова (IV) из вторичного сырья | 2017 |
|
RU2673470C1 |
| Двухстадийный способ получения карбоксилатов олова (II) из металла | 2017 |
|
RU2678092C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСАЛАТА ЖЕЛЕЗА (II) | 2008 |
|
RU2376277C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА ЖЕЛЕЗА (II) | 2004 |
|
RU2269509C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ЖЕЛЕЗА (III) С ОДНИМ АНИОНОМ САЛИЦИЛОВОЙ КИСЛОТЫ | 2006 |
|
RU2307118C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОРМИАТА ЖЕЛЕЗА (II) В ВОДНОЙ СРЕДЕ | 2005 |
|
RU2292330C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕНЗОАТА ЖЕЛЕЗА (III) | 2006 |
|
RU2326107C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТАЛАТА ЖЕЛЕЗА (II) | 2007 |
|
RU2357950C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОСНОВНОГО АЦЕТАТА ЖЕЛЕЗА (III) | 2004 |
|
RU2268874C2 |

Изобретение относится к переработке прокорродировавшей меди и бронзы в качестве вторичного сырья для получения химической продукции, а также к оценке устойчивости материалов при попадании в кислые среды и может быть использовано в различных областях практической деятельности, в аналитическом контроле, научных исследованиях и в диагностике. Способ включает введение изделия, содержащего продукты коррозии, в контакт с разбавленной соляной кислотой при интенсивном механическом перемешивании и барботаже воздуха, проведение процесса при саморазогреве и контроле за накоплением соединений меди (II) и расходованием кислоты до превращения в загущенную суспензию, после чего перемешивание и барботаж воздуха прекращают, объемную фазу отделяют от непрореагировавшей меди или ее сплава и разделяют на твердую и жидкую фазы, осветленную жидкую фазу доводят до исходных содержаний кислоты и воды и осуществляют повторное введение в контакт с непрореагировавшей медью или ее сплавом, запуск и проведение процесса проводят указанными приемами не менее 5-7 раз. Изобретение позволяет увеличить скорость переработки и расширить ее функциональные возможности. 2 табл., 2 пр., 1 ил.
Способ переработки прокорродировавших изделий из меди или ее сплава, отличающийся тем, что изделие, содержащее продукты коррозии, вводят в контакт с разбавленной соляной кислотой при интенсивном механическом перемешивании и барботаже воздуха и ведут процесс при саморазогреве и контроле за накоплением соединений меди (II) и расходованием кислоты до превращения в загущенную суспензию, после чего перемешивание и барботаж воздуха прекращают, объемную фазу отделяют от непрореагировавшей меди или ее сплава и разделяют на твердую и жидкую фазы, осветленную жидкую фазу доводят до исходных содержаний кислоты и воды и осуществляют повторное введение в контакт с непрореагировавшей медью или ее сплавом, запуск и проведение процесса проводят указанными приемами не менее 5-7 раз.
Авторы
Даты
2016-03-20—Публикация
2014-02-19—Подача