Изобретение относится к области экспериментальной медицины, общей токсикологии и нанотоксикологии и касается критериев диагностики токсического действия наночастиц серебра, инкапсулированных в природную полимерную матрицу арабиногалактана.
Использование медицинских и диагностических препаратов на основе наночастиц металлов и, в частности, серебра, для целенаправленного специфического воздействия, и изучаемых чаще всего in vitro, сдерживается научными данными о неблагоприятных биологических эффектах на целостный организм. В литературе описаны свойства и влияние на организм наночастиц серебра. Установлено, что они обладают способностью осаждаться в печени, проникать в результате аксонального транспорта в обонятельную луковицу головного мозга [1]. Установлена высокая стабильность наночастиц серебра в окружающей среде и способность сохранять токсические свойства на протяжении длительного времени [2]. Наночастицы серебра размером 5-50 нм обладают сильной антибактериальной и цитотоксической активностью in vitro по отношению к гепатоцитам крыс [3]. Выяснено, что механизм развития токсичности связан с окислительным стрессом, нарушением функций митохондрий и увеличением проницаемости мембраны [4]. В США установлена предельно допустимая концентрация наночастиц серебра в воздухе - 2,16·106 частиц/см3 [1].
В настоящее время с целью уменьшения токсических эффектов и в связи с необходимостью адресной доставки наночастицы серебра заключают в матрицы различного происхождения [5]. В частности, в качестве наностабилизирующей матрицы используют природный полимер арабиногалактан (АГ), выделяемый из лиственницы сибирской (Larix sibirica L.) по оригинальной технологии [6, 7]. Считается, что АГ обладает высокой гепатотропностью, способностью образовывать конъюгаты с различными функциональными группами, уменьшать интенсивность свободнорадикальных процессов, активировать фагоцитоз, обладает мембранопротекторным действием, а также проявляет свойства антиоксиданта и иммуномодулятора [8]. Перспективность широкого внедрения таких нанобиокомпозитов требует углубленного изучения биологических эффектов наночастиц серебра, инкапсулированных в полимерную матрицу. Актуальность исследования определяется возможным риском здоровью людей, имеющих непосредственный контакт с нанобиокомпозитами, содержащими наносеребро.
Значительное число научных коллективов, оценивающих биологическое действие наночастиц серебра в доклинических исследованиях, чаще всего проводят острые или субхронические опыты с оценкой токсического действия нанокомпозитов на печень и почки с использованием обзорной микроскопии [9]. Тогда как возможность возникновения отдаленных эффектов действия наночастиц на ткань головного мозга практически не изучена. Отсутствие унифицированных подходов к медико-биологической оценке экспозиции нанобиокомпозитами не позволяет разрабатывать эффективные профилактические программы для сохранения здоровья.
Известен способ диагностики ртутной энцефалопатии у мелких лабораторных животных, включающий проведение обзорной микроскопии срезов головного мозга животных с определением соотношения количества измененных и неизмененных нейронов и электронной микроскопии с определением степени увеличения площади ядра нейронов на препаратах животных опытной и контрольной групп. Данный способ предназначен для определения изменений в клетках животных, подвергавшихся воздействию ртути [4].
Задачей изобретения является разработка технологии оценки отдаленных последствий воздействия нанобиокомпозитов, содержащих наносеребро, у экспериментальных животных, расширение арсенала методов оценки патологических нарушений у экспериментальных животных.
Поставленная задача решается путем иммуногистохимического анализа экспрессии проапоптотического белка каспазы 3 в ткани головного мозга белых крыс через 6 месяцев после воздействия наночастиц серебра, инкапсулированных в полимерную матрицу арабиногалактана, с последующей морфометрической обработкой и интерпретации полученного результата.
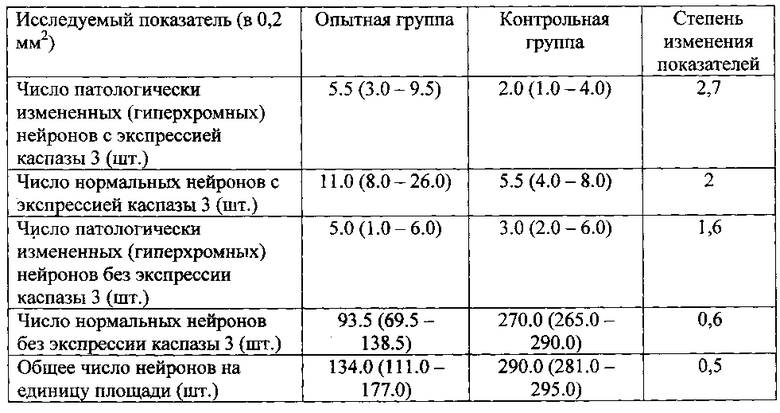
Способ осуществляется следующим образом: лабораторным животным внутрижелудочно вводят наночастицы серебра, инкапсулированного в полимерную матрицу арабиногалактана (АГ). Животным из контрольной группы вместо препарата с серебром вводили внутрижелудочно дистиллированную воду. Через 6 месяцев животных опытной и контрольной групп забивают, готовят срезы тканей коры головного мозга, окрашивают их на антитела к белку caspase-3, и при обзорной микроскопии определяют количество патологически измененных нейронов без экспрессии каспазы 3, число патологически измененных нейронов с экспрессией каспазы 3, количество нормальных нейронов с экспрессией каспазы 3, количество нормальных нейронов без экспрессии каспазы 3 и общее количество нейронов на единицу площади среза. Патологически измененными считались гиперхромные нейроны без четко отделенного ядра и цитоплазмы. Вычисляют изменение количества патологически измененных нейронов с экспрессией каспазы 3 и без экспрессии в препаратах опытной группы относительно аналогичных показателей в препаратах контрольной группы; изменение нормальных нейронов с экспрессией и без экспрессии каспазы 3 в препаратах опытной группы по сравнению с аналогичными характеристиками в препаратах контрольной группы и изменение общего числа нейронов на единицу площади в препаратах опытной группы по сравнению с аналогичными признаками в препаратах контрольной группы. При увеличении числа патологически измененных нейронов с экспрессией каспазы 3 на препаратах опытной группы в 2,7 раза в сравнении с контрольной группой, увеличении числа патологически измененных нейронов без экспрессии каспазы 3 в 1,6 раза в сравнении с контрольной группой, увеличении числа нормальных нейронов с экспрессией каспазы 3 в 2 раза в сравнении с контрольной группой, снижении числа нормальных нейронов без экспрессии каспазы 3 в 0,6 раз в сравнении с контрольной группой, а также снижении общего числа нейронов на единицу площади в 0,5 раз в сравнении с контрольной группой делают заключение о развитии патологического процесса с преобладанием повреждений нейронов по типу апоптоза в ткани головного мозга в отдаленном периоде воздействия наночастиц серебра, инкапсулированного в полимерную матрицу арабиногалактана.
Таким образом, заявленное изобретение соответствует критериям изобретения «новизна» и «изобретательский уровень», так как оно явным образом не следует для специалиста из уровня техники. Предлагаемое изобретение соответствует критерию «промышленная применимость», так как оно может использоваться в экспериментальной медицине (токсикологии, фармакологии, патологической физиологии, патологической анатомии) для верификации моделирования патологических состояний центральной нервной системы животных. Технология оценки безопасности нанопрепаратов, основанная на морфологическом анализе структурных изменений внутренних органов и тканей организма и молекулярной диагностике экспрессии внутриклеточных белков, позволит не допускать к производству и применению лекарственные формы и диагностические препараты, способные вызывать отдаленные последствия воздействия.
Пример осуществления способа
Предлагаемый способ был применен на 48 особях беспородных белых крыс-самцов в трехмесячном возрасте и массой от 240 до 280 грамм. Животным опытной группы (24 особи) внутрижелудочно через зонд на протяжении 9 дней вводили водный раствор АГ с наночастицами серебра (нано-Ag-АГ) из расчета 100 мкг серебра на килограмм массы в 0,5 мл дистиллированной воды. После окончания воздействия животные были оставлены на дожитие на 6 месяцев, что соответствует примерно 15 годам жизни человека (отдаленный срок обследования). Животные контрольной группы (24 особи) получали на протяжении 9 дней внутрижелудочно 0,5 мл дистиллированной воды и были забиты через 6 месяцев.
После декапитации головной мозг от каждого исследуемого животного был извлечен и фиксирован в нейтральном буферном растворе формалина (10%), обезвожен этанолом восходящей концентрации (70, 80, 90, 95 и 100%) и помещен в гомогенизированную парафиновую среду для гистологических исследований HistoMix (BioVitrum, Россия). Далее, с помощью микротома HM 400 (Microm, Германия), изготавливались срезы толщиной 4-5 мкм. Для исследования биологического ответа организма на субклеточном уровне применяли имунногистохимический метод определения активности проапоптотического белка caspase 3. Полученные на микротоме срезы были помещены на полизиновые стекла (Menzel, Германия) и окрашены на антитела к белку caspase-3 (Monosan, Нидерланды) в соответствии с протоколом, предложенным производителем. Дополнительно для визуализации нервных клеток проводили окраску по Нисслю. Окрашенные срезы фиксировались полистиролом и накрывались покровным стеклом. После высыхания полистирола полученные микропрепараты просматривали на светооптическом исследовательском микроскопе. Исследование полученных срезов осуществляли при помощи светооптического исследовательского микроскопа Olympus BX 51 (Япония) с вводом микроизображений в компьютер при помощи камеры Olympus.
Далее при помощи системы микроскопии и анализа Image Scope S были проанализированы заранее выбранные параметры анализа полученных фотоматериалов: общее количество нейронов на единицу площади, количество гиперхромных нейронов с экспрессией и без экспрессии проапоптотического белка caspase 3, количество нормальных нейронов с экспрессией и без экспрессии проапоптотического белка caspase 3. Изменение показателя выражалось в отношении количественного показателя образца опытной группы к значению аналогичного показателя из контрольной группы. Статистическую обработку результатов проводили с помощью пакета прикладных программ «Statistica 6.0» (Statsoft Inc., США). Статистическую значимость различий в независимых выборках определяли по методу Манна-Уитни. Достигнутый уровень значимости признаков - при p<0,05.
Показатели морфометрии нервной ткани животных опытной и контрольной групп. Med (Q2 5-Q7 5) n=12
Предлагаемый способ диагностики позволяет оценить воздействие нанобиокомпозитов, содержащих наносеребро, у экспериментальных животных в отдаленный период, расширяет арсенал методов оценки действия токсических веществ на организм лабораторных животных, повышает точность верификации токсической энцефалопатии, так как при оценке ткани коры головного мозга выявляют не только структурные повреждения, но непосредственно и функциональные изменения по морфометрической характеристике нейронов головного мозга, учитывая точки-мишени и механизм развития патологического процесса по типу апоптоза.
Литература
1. Sahoo S.K., Parveen S., Panda J.J. // Nanomedicine: Nanotechnology, Biology and Medicine, 2007. №3. P. 20-31.
2. Prozorova G.F., Pozdnyakov A.S., Kuznetsova N.P. et al. // International Journal of Nanomedicine, 2014. №9. 1883.
3. Allsopp. M., Walters A., Santino D. // Greenpeace research laboratories. December 2007. 22 p.
4. Способ диагностики ртутной энцефалопатии у мелких лабораторных животных: Пат. 2471247 RU: МПК G09B /23/28; А61В 5/107 / Е.А. Титов, Л.М. Соседова. Заявлено 19.07.2011; Опубл. 27.12.2012, Бюл. №36.
5. Lewinski N., Colvin V., Drezek R. // Small-journal 2008,4, No. 1, 26-49.
6. Ji J.H. // Inhalation Toxicology 2007. Vol. 19. Iss. 10. P. 857-71.
7. Дубровина В.И., Медведева C.A. и др. Иммуномодулирующие свойства арабиногалактана лиственницы сибирской. - М.: Фармация, 2001. С. 26-27.
8. Дубровина В.И., Голубинский Е.П. и др. Изучение влияния арабиногалактана на протективные свойства YERSINIA PESTIS EV // Сибирь-Восток. 2002. №3. С. 8-9.
9. Abdelhalim and Jarrar // Journal of Nanobiotechnology, 10:5, 2012.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки процесса апоптоза в ткани головного мозга лабораторных животных | 2016 |
|
RU2621122C1 |
| Способ оценки токсического действия биметаллического феррум-гадолиниевого нанокомпозита, инкапсулированного в природную полимерную матрицу арабиногалактана, на лабораторных животных | 2019 |
|
RU2733504C1 |
| Способ оценки токсичности микро- и наночастиц по их морфологическим признакам | 2020 |
|
RU2756524C1 |
| СПОСОБ ДИАГНОСТИКИ РТУТНОЙ ЭНЦЕФАЛОПАТИИ У МЕЛКИХ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2011 |
|
RU2471247C1 |
| СПОСОБ ОЦЕНКИ БЕЗОПАСНОСТИ ВВЕДЕНИЯ НАНОЧАСТИЦ МЕДИ В ОРГАНИЗМ | 2011 |
|
RU2477485C2 |
| ПРИМЕНЕНИЕ (2-ИМИДАЗОЛИН-2-ИЛАМИНО) ХИНОКСАЛИНОВ ДЛЯ ЛЕЧЕНИЯ ДЕМЕНЦИИ И БОЛЕЗНИ ПАРКИНСОНА | 2003 |
|
RU2332218C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2555335C9 |
| Генно-клеточный везикулярный терапевтический препарат и способ терапии рассеянного склероза посредством трансплантации генно-клеточного везикулярного терапевтического препарата | 2021 |
|
RU2762855C1 |
| Средство для лечения хронической венозной недостаточности | 2022 |
|
RU2797950C1 |
| СПОСОБ ВЫЯВЛЕНИЯ НАЛИЧИЯ СИСТЕМНОЙ РЕАКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ, ОБУСЛОВЛЕННОЙ РАЗВИТИЕМ СИНДРОМА СОЧЕТАННЫХ ДИСТРОФИЧЕСКИ-ДЕГЕНЕРАТИВНЫХ ИЗМЕНЕНИЙ МЕЗЕНХИМАЛЬНЫХ ПРОИЗВОДНЫХ ПРИ ЛОКАЛЬНОМ ХРОНИЧЕСКОМ ВОСПАЛИТЕЛЬНОМ ПРОЦЕССЕ | 2012 |
|
RU2493777C1 |
Изобретение относится к экспериментальной медицине, общей токсикологии и нанотоксикологии и касается критериев диагностики токсического действия наночастиц серебра, инкапсулированных в природную полимерную матрицу арабиногалактана (АГ), на ткань головного мозга крыс в отдаленном периоде. Способ включает воздействие на животных опытной группы токсикантом путем внутрижелудочного введения водного раствора АГ с наночастицами серебра (нано-Ag-АГ) из расчета 100 мкг серебра на килограмм массы в 0,5 мл дистиллированной воды на протяжении 9 дней. Животным контрольной группы осуществляют внутрижелудочное введение 0,5 мл дистиллированной воды также на протяжении 9 дней. Через 6 месяцев проводят изготовление срезов тканей коры головного мозга животных обеих групп. Окрашивают их на антитела к белку caspase-3 и проводят обзорную микроскопию полученных препаратов. При этом подсчитывают количество патологически измененных нейронов без экспрессии каспазы 3, число патологически измененных нейронов с экспрессией каспазы 3, количество нормальных нейронов без экспрессии каспазы 3, количество нормальных нейронов с экспрессией каспазы 3, общее количество нейронов на единицу площади среза. Вычисляют отношения этих показателей на препаратах опытной группы к аналогичным показателям на препаратах контрольной группы. При увеличении числа патологически измененных нейронов без экспрессии каспазы 3 в 1,6 раза по отношению к контрольной группе, увеличении числа патологически измененных нейронов с экспрессией каспазы 3 в 2,7 раз по отношению к контрольной группе, снижении числа нормальных нейронов без экспрессии каспазы 3 в 0,6 раз по отношению к контрольной группе, увеличении числа нормальных нейронов с экспрессией каспазы 3 в 2 раза по отношению к контрольной группе, а также снижении общего числа нейронов на единицу площади в 0,5 раз по отношению к контрольной группе делают заключение о развитии патологического процесса с преобладанием повреждений нейронов по типу апоптоза в ткани головного мозга в отдаленном периоде воздействия нано-Ag-АГ. Способ повышает точность верификации токсической энцефалопатии, в т.ч. за счет регистрации функциональных изменений по морфометрической характеристике нейронов. 1 табл., 1 пр.
Способ оценки токсического действия наночастиц серебра, инкапсулированных в полимерную матрицу арабиногалактана (АГ), на ткань головного мозга крыс в отдаленном периоде, включающий воздействие на животных опытной группы токсикантом путем внутрижелудочного введения водного раствора АГ с наночастицами серебра (нано-Ag-АГ) из расчета 100 мкг серебра на килограмм массы в 0,5 мл дистиллированной воды на протяжении 9 дней и внутрижелудочное введение животным контрольной группы 0,5 мл дистиллированной воды также на протяжении 9 дней, после чего через 6 месяцев изготовление срезов тканей коры головного мозга животных контрольной и опытной групп, окрашивание их на антитела к белку caspase-3 и проведение обзорной микроскопии полученных препаратов, при которой подсчитывают количество патологически измененных нейронов без экспрессии каспазы 3, число патологически измененных нейронов с экспрессией каспазы 3, количество нормальных нейронов без экспрессии каспазы 3, количество нормальных нейронов с экспрессией каспазы 3, общее количество нейронов на единицу площади среза, вычисляют отношения этих показателей на препаратах опытной группы к аналогичным показателям на препаратах контрольной группы, и при увеличении числа патологически измененных нейронов без экспрессии каспазы 3 в 1,6 раза по отношению к контрольной группе, увеличении числа патологически измененных нейронов с экспрессией каспазы 3 в 2,7 раз по отношению к контрольной группе, снижении числа нормальных нейронов без экспрессии каспазы 3 в 0,6 раз по отношению к контрольной группе, увеличении числа нормальных нейронов с экспрессией каспазы 3 в 2 раза по отношению к контрольной группе, а также снижении общего числа нейронов на единицу площади в 0,5 раз по отношению к контрольной группе делают заключение о развитии патологического процесса с преобладанием повреждений нейронов по типу апоптоза в ткани головного мозга в отдаленном периоде воздействия нано-Ag-АГ.
| СПОСОБ ДИАГНОСТИКИ РТУТНОЙ ЭНЦЕФАЛОПАТИИ У МЕЛКИХ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2011 |
|
RU2471247C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ | 2004 |
|
RU2278669C1 |
| КЛАТРАТНЫЙ КОМПЛЕКС ЦИКЛОДЕКСТРИНА ИЛИ АРАБИНОГАЛАКТАНА С 9-ФЕНИЛ-СИММ-ОКТАГИДРОСЕЛЕНОКСАНТЕНОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2011 |
|
RU2451680C1 |
| US 6534267 B1, 18.03.2003 | |||
| ФАТХУТДИНОВА Л.М | |||
| И др | |||
| Токсичность искусственных наночастиц | |||
| Казанский медицинский журнал, 2009, том 90 | |||
| ГРИЩЕНКО Л А | |||
| Металлосодержащие нанокомпозиты на основе арабиногалактана | |||
| автореф.дисс.канд | |||
| хим | |||
| наук, Иркутск, 2007 | |||
| KATO K et al. | |||
Авторы
Даты
2016-03-27—Публикация
2015-01-12—Подача