Изобретение относится к аналитической химии, а именно к способам стандартизации лекарственных препаратов, лекарственного растительного сырья, изделий пищевой, химической и косметологической промышленности по содержанию глутаминовой кислоты, и может быть использовано в фармацевтической, химической и косметологической промышленности.
В настоящее время тонкослойная хроматография (ТСХ) в фармацевтическом анализе применяется для оценки подлинности и чистоты глутаминовой кислоты в субстанции и в лекарственных формах. ТСХ, обладая всеми преимуществами хроматографических методов, находит широкое применение в виду своей экспрессности, доступности, достаточной чувствительности, селективности и простоте выполнения анализа. Тем более, что разработанные в последнее десятилетие новые неподвижные фазы, оборудование для нанесения проб, новые методы элюирования пластинок и количественного определения с использованием сканирующих денситометров способны обеспечить более низкое разрешение, лучшее детектирование и воспроизводимость результатов качественного и количественного хроматографического анализа (ТСХ) аминокислот [10].
Известны способы разделения и детектирования аминокислот в нативном или модифицированном высшими жирными кислотами виде в биологических жидкостях, лекарственном растительном сырье и других объектах [1-11].
Известен способ разделения аминокислот в биологических жидкостях с помощью тонкослойной хроматографии [10], включающий нанесение пробы и стандартной смеси аминокислот на пластину силикагелем, помещение пластины в хроматографическую камеру с водно-органической системой растворителей, детектирование аминокислот нингидриновым реагентом и идентификацию аминокислот путем сравнения полученной хроматограммы анализируемой смеси аминокислот с хроматограммой стандартной смеси аминокислот. При этом разделение аминокислот проводят одновременно на двух пластинах, помещенных в две камеры, в одной из которых для разделения аминокислот с коэффициентом подвижности ≅ 0,3 используют систему растворителей при следующем соотношении компонентов по объему пропанол : водный раствор аммиака (24-425%) : вода как (3,3-4,1) : (0,9-1,5) : (7,5-9,0), а в другой для разделения аминокислот с коэффициентом подвижности > 10,3 используют систему растворителей при следующем соотношении компонентов по объему хлороформ : этанол : уксусная кислота : вода как (52,5-54,0) : (26,0-27,5) : (8,9-9,6) : (3,5-4,2). Интерпретацию результатов разделения аминокислот биологической жидкости пациентов по хроматограммам проводят в сравнении с хроматограммой, полученной на стандартной смеси аминокислот или при анализе биологической жидкости здорового человека. Полуколичественный или количественный анализ биологической жидкости на аминокислоты проводят с помощью сканирующего денситометра. Данный способ не лишен недостатков. Используемое в способе двумерное элюирование значительно увеличивает время одного анализа, а также экономически менее эффективно в виду затраты большего количества реактивов. Кроме того, даже незначительный выход за рамки заявляемого соотношения ингредиентов двух систем растворителей и концентрации раствора аммиака приводит к резкому снижению эффективности разделения, что также можно отнести к недостаткам данного способа - аналога.
Известен способ разделения и детектирования аминокислот в биологических жидкостях (моча, кровь) с использованием двумерной тонкослойной хроматографии [9], включающий нанесение пробы на пластинки со слоем силикагеля фирмы «Merck», «Силуфол» и «Сорбфил» размером 10×10 или 10×15 см. Хроматографию осуществляют восходящим способом последовательно в двух хроматографических камерах размером 29,0×22,5×16,0 см. Камеры для ТСХ предварительно заряжают системой растворителей и насыщают в течение 12-16 ч под плотно притертой крышкой. Пластину с нанесенным образцом погружают нижним краем в хроматографическую камеру с системой растворителей изопропиловый спирт - ацетон - 25%-ный раствор аммиака - вода (26,0-22,0:4,2:8,5) (по объему) и хроматографируют на расстояние примерно 60 мм от линии старта. После высушивания на воздухе пластину поворачивают на 90° (так, чтобы точка нанесения образца находилась в нижнем правом углу пластинки) и опускают в хроматографическую камеру с системой растворителей хлороформ-этанол-уксусная кислота-вода (24,5:13,5:4,0:2,2) (по объему), и хроматографируют на расстояние примерно 60 мм от линии старта. Пластинку высушивают на воздухе. Время ТСХ 2-2,5 ч. Детектирование хроматограмм производят нингидриновым реактивом при помощи пульверизатора или методом окунания. Проявление окраски происходит в термостате при 45°С (5 мин). Для детектирования триптофана используют реактив Эрлиха. Для детектирования серина и треонина используют реактив Несслера. Параллельно в аналогичных условиях осуществляют хроматографирование 0,5 мкл раствора смеси 22 стандартной аминокислоты в 25%-ном этаноле в концентрации 1 мг/мл. Идентификацию аминокислот осуществляют по характерным значениям Rf в сравнении с достоверными стандартными образцами. Указанный способ по решаемой задаче является близким аналогом к заявляемому. Однако данный способ имеет следующие недостатки. Во-первых, способ не предусматривает проведение количественного определения глутаминовой кислоты и других аминокислот в пробе. Способ применим только для установления качественного состава аминокислот в различных объектах. Во-вторых, применяемое в способе двумерное элюирование значительно увеличивает время одного анализа, а также экономически менее эффективно в виду затраты большего количества реактивов. Для проявления хроматограмм используется три детектирующих реагента, что также увеличивает стоимость одного анализа. И, наконец, даже незначительный выход за рамки заявляемого соотношения ингредиентов двух систем растворителей и концентрации раствора аммиака приводит к резкому снижению эффективности разделения, что также можно отнести к недостаткам данного способа - прототипа.
В научно-фармацевтической, медицинской и патентной литературе способов, позволяющих проводить определение подлинности, степени чистоты и количественного содержания глутаминовой кислоты, разделение сложных смесей и отделение глутаминовой кислоты от других биологически активных веществ (в том числе аминокислот) с применением ТСХ, не обнаружено.
Задача изобретения заключается в разработке способа определения подлинности, степени чистоты и количественного содержания субстанции глутаминовой кислоты, разделения сложных смесей и отделение глутаминовой кислоты от других биологически активных веществ (в том числе аминокислот) и стандартизации лекарственных препаратов, лекарственного растительного сырья, изделий пищевой, химической и косметологической промышленностей по содержанию глутаминовой кислоты методом высокоэффективной тонкослойной хроматографии (ВЭТСХ). В задачи изобретения также входило обоснование теоретического подхода к выбору оптимальных условий хроматографического определения глутаминовой кислоты методом ВЭТСХ.
Технический результат - повышение точности, а также возможность одновременного определения подлинности, степени чистоты и количественного определения глутаминовой кислоты, разделения сложных смесей и отделения глутаминовой кислоты от других биологически активных веществ достигается тем, что навеску исследуемого препарата растворяют в воде с последующим хроматографированием с использованием силикагелевых пластинок марки «Sorbfil» с алюминиевой или полимерной подложкой ПТСХ-П-А или ПТСХ-АФ-А. При этом в качестве элюента используют систему в составе н-бутанол-ледяная уксусная кислота-вода (4:1:1), а в качестве проявителя - 1% спиртовый раствор нингидрина. Оптимальный объем пробы - 1 мкл водного раствора с содержанием глутаминовой кислоты 1 мг/мл, причем время насыщения камеры парами элюента - 40 мин, время элюирования - 55 мин, время выдерживания пластинки в термостате после проявления при t°=103±2°С - 3-5 минут. Сразу же после проявления хроматографических зон пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO (разрешение не менее 300 dpi), а полученные изображения (фиг. 4) обрабатывают компьютерной программой «Sorbfil Videodensitometer». В результате получают треки в координатах Rf - интенсивность (фиг. 5), а содержание глутаминовой кислоты (с, мкг) в пробе, нанесенной на хроматограмму, рассчитывают по формуле

где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer».
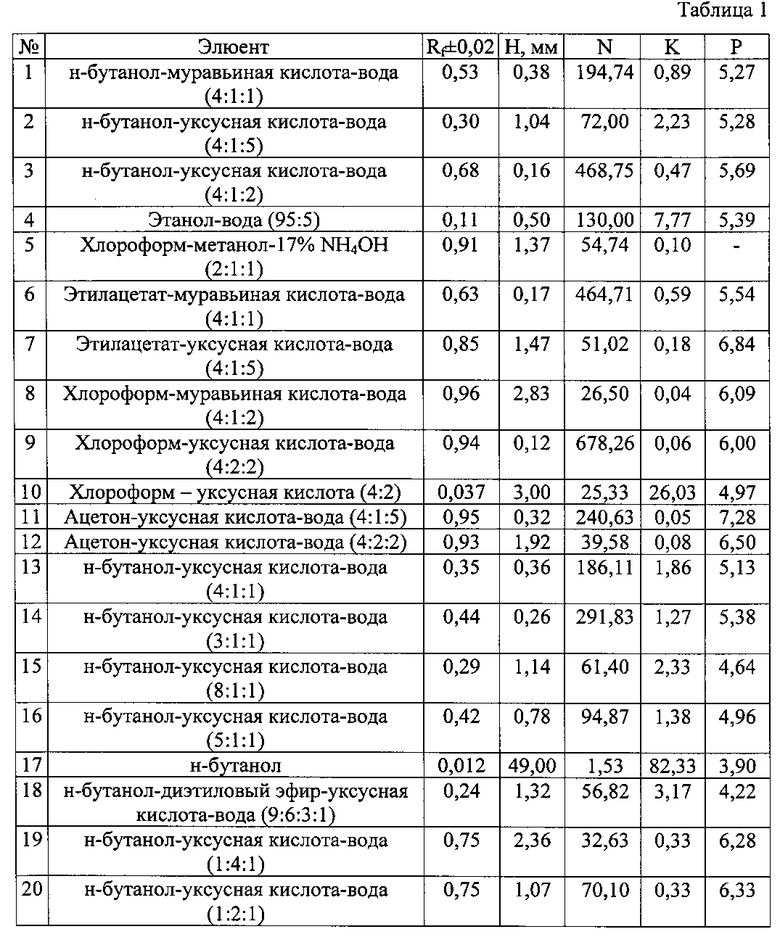
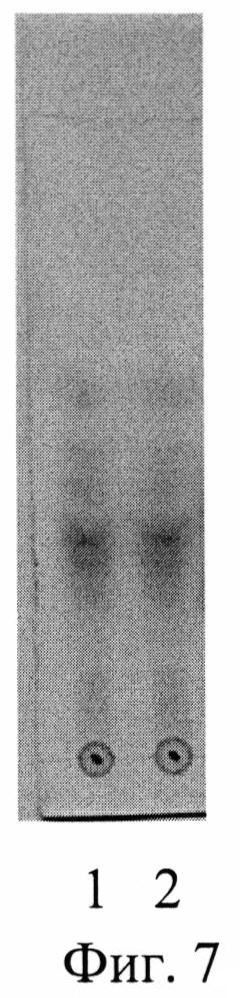
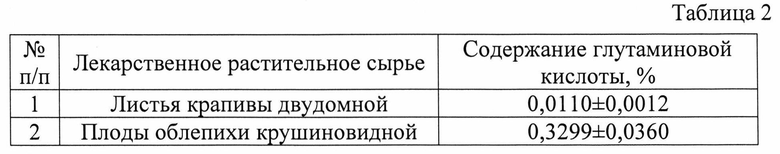
Изобретение проиллюстрировано графиками, чертежами, схемами, таблицами, где в таблице 1 представлены хроматографические параметры кислоты глутаминовой в различных элюирующих системах. На фиг. 1 показана зависимость значения относительной подвижности глутаминовой кислоты от полярности элюента. На фиг. 2 изображена линейная зависимость величины Rf от значения полярности элюента. Фиг. 3 демонстрирует зависимость относительной скорости перемещения глутаминовой кислоты от содержания компонентов в подвижной фазе (неподвижная фаза - силикагель). На фиг. 4 представлена калибровочная хроматограмма с серией стандартных растворов (0,05-0,35%) глутаминовой кислоты (проявитель - 1% спиртовый раствор нингидрина): 1-0,5 мкг; 2-1 мкг; 3-1,5 мкг; 4-2 мкг; 5-2,5 мкг; 6-3 мкг; 7-3,5 мкг. Объем пробы 1 мкл. На фиг. 5 показана аналоговая кривая стандартного раствора глутаминовой кислоты. Градуировочный график для определения содержания глутаминовой кислоты в области концентраций (0,05-0,35%) продемонстрирован на фиг. 6. На фиг. 7 приведен вид хроматограммы извлечения из листьев крапивы двудомной (трек 1 и 2-10 мкл извлечения). На фиг. 8 изображен вид хроматограммы извлечения из плодов облепихи крушиновидной (5 мкл извлечения). В таблице 2 представлены результаты количественного определения глутаминовой кислоты в лекарственном растительном сырье (в пересчете на абсолютно сухое сырье). Метрологическая оценка предложенной методики на примере плодов облепихи крушиновидной представлена в таблице 3.
Способ идентификации и количественного определения глутаминовой кислоты реализуется следующим образом.
Навеску исследуемого препарата растворяют в воде с последующим хроматографированием в камере с использованием силикагелевых пластинок марки «Sorbfil» 5×10 см с алюминиевой или полимерной подложкой ПТСХ-П-А или ПТСХ-АФ-А; элюент-н-бутанол-ледяная уксусная кислота-вода (4:1:1); проявитель - 1% спиртовый раствор нингидрина. Оптимальный объем пробы - 1 мкл водного раствора с содержанием глутаминовой кислоты 1 мг/мл; время насыщения камеры парами элюента - 40 мин, время элюирования - 55 мин, время выдерживания пластинки в термостате после проявления при t°=103±2°С - 3-5 минут.
В способе проведено обоснование подхода к выбору элюента для определения глутаминовой кислоты в тонком слое сорбента. Были исследованы элюенты, предложенные в литературе [1-11], а также изучены новые хроматографические системы. Эффективность хроматографического процесса определяется величинами N (число теоретических тарелок) и Н (высота, эквивалентная теоретической тарелке). Для каждой элюирующей системы были рассчитаны полярность (Р) [12]; относительная скорость перемещения глутаминовой кислоты (величина Rf); коэффициент распределения (К); Н и N. Результаты и элюенты представлены в табл. 1.
Оптимальным для практической ТСХ является интервал значений Rf от 0,3 до 0,6. Как видно из данных табл. 1, оптимальная величина Rf получена в системах №1, 2, 13-16; N - в системах №1, 3, 4, 6, 9, 11, 13 и 14; Н - в системах №1, 3, 4, 6, 9, 11, 13, 14 и 16. Следовательно, эффективность хроматографического процесса достигается при использовании элюентов №1, 13, 14 и 16 (табл. 1). Важной характеристикой любого хроматографического процесса является изотерма сорбции. Вид изотермы сорбции зависит от формы хроматографической зоны. В практической работе нелинейность изотерм является нежелательным фактором, поскольку приводит к изменению формы зон и влияет на эффективность хроматографического процесса. Однако только в системе №13 зоны имели округлую форму, что свидетельствует о линейной изотерме сорбции глутаминовой кислоты в данных условиях. В результате, по совокупности представленных параметров и качеству хроматографической картины разделения для определения глутаминовой кислоты в тонком слое сорбента была выбрана система №13. Рассчитав величину полярности подвижных фаз (Р), представленных в литературе, получали зависимость значения относительной подвижности рутина от полярности элюента (фиг. 1).
При детальном изучении влияния полярности системы на величину Rf в диапазоне от 4 до 7 ед., был выбран интервал значений Р элюента, в котором данная зависимость становится линейной (от 5 до 6 ед. полярности системы) (фиг. 2).
С помощью предложенной зависимости можно подбирать различные системы для определения глутаминовой кислоты в тонком слое сорбента, чтобы величина Rf укладывалась в оптимальные значения [13]. Таким образом, интервал полярностей элюента может варьировать от 4,99 до 5,48.
При варьировании содержанием н-бутанола, уксусной кислоты и воды в трехкомпонентной подвижной фазе, были получены кривые зависимости величины относительной скорости перемещения вещества от процентного содержания каждого компонента в элюенте (фиг. 3). Полученные зависимости позволили установить, что для достижения оптимальной величины Rf содержание н-бутанола, уксусной кислоты и воды в системе должно быть от 57 до 80; от 10 до 30 и от 10 до 40 об.% соответственно.
В результате, по совокупности полученных данных в способе экспериментально обоснованы оптимальные условия определения глутаминовой кислоты методом высокоэффективной тонкослойной хроматографии и показана возможность теоретического подхода к выбору условий определения данной аминокислоты в тонком слое сорбента: хроматографические пластинки марки «Sorbfil» размером 5×10 см с алюминиевой или полимерной подложкой; элюент:н-бутанол-ледяная уксусная кислота-вода (4:1:1); проявитель - 1% спиртовый раствор нингидрина; оптимальный объем пробы - 1 мкл водного раствора с содержанием глутаминовой кислоты 1 мг/мл; время насыщения камеры парами элюента - 40 мин; время элюирования - 55 мин; время выдерживания пластинки в термостате после проявления при t°=103±2°С - 3-5 минут.
Сразу же после проявления хроматографических зон, пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO (разрешение не менее 300 dpi), а полученные изображения (фиг. 4) обрабатывают компьютерной программой «Sorbfil Videodensitometer». В результате получают треки в координатах Rf - интенсивность (фиг. 5).
Установлена линейная зависимость между содержанием глутаминовой кислоты и площадью хроматографической зоны (фиг. 6) в диапазоне изучаемых концентраций (0,05-0,35%). По полученным результатам построен градуировочный график, иллюстрирующий эту зависимость (фиг. 6).
Данный способ позволяет не только получать на хроматограммах четкие зоны глутаминовой кислоты округлой формы с оптимальным значением величины Rf, но и проводить разделение сложных смесей глутаминовой кислоты с другими биологически активными веществами (в том числе аминокислотами), а также оценивать ее количественное содержание в образцах.
Наличие в регрессионном уравнении y=ax+b коэффициента b, отличного от нуля и равного 13560, говорит о постоянной систематической ошибке, обусловленной влиянием яркости фона пластины на оценку яркости окрашенной хроматографической зоны при обработке хроматограммы компьютерной программой «Sorbfil Videodensitometer».
Способ позволяет проводить определение подлинности, степени чистоты и количественного содержания субстанции глутаминовой кислоты и стандартизировать лекарственные препараты, лекарственное растительное сырье, изделия пищевой, химической и косметологической промышленностей по содержанию глутаминовой кислоты и отличается достаточной чувствительностью (2·10-7 г), экономичностью, доступностью и экспрессностью. Способ позволяет также теоретически подбирать элюент таким образом, чтобы на хроматограмме получать величину Rf глутаминовой кислоты с требуемым значением.
Способ иллюстрируется следующими конкретными примерами.
Пример 1. Разработанный способ идентификации и количественного определения глутаминовой кислоты был апробирован на лекарственном растительном сырье листьев крапивы двудомной.
Получение извлечения: Около 2,5 г измельченного сырья (точная навеска) с размером частиц, проходящих сквозь сито с диаметром отверстий 0,5 мм, помешают в коническую колбу вместимостью 100 мл, прибавляют 30 мл воды очищенной (с учетом коэффициента водопоглощения сырья). Колбу присоединяют к обратному холодильнику, нагревают на кипящей водяной бане в течение 30 мин, периодически встряхивая для смывания частиц сырья со стенок. Затем колбу с содержимым охлаждают до комнатной температуры. Извлечение фильтруют через несколько слоев марли, отжимая частицы сырья, в мерную колбу вместимостью 25 мл. При необходимости доводят объем до метки водой очищенной. Полученную суммарную вытяжку в количестве 10 мкл наносили на стартовую линию хроматографической пластинки и хроматографировали восходящим способом в условиях предлагаемого способа на пластинах размером 10×15 см. Высота пробега элюента не менее 13 см. Вид хроматограммы представлен на фиг. 7. На хроматограммах извлечений из исследуемого сырья обнаружены зоны аминокислот, среди которых идентифицирована кислота глутаминовая по характерному значению величины Rf в сравнении с достоверным стандартным образцом. Сразу же после проявления хроматограмм, пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO (разрешение не менее 300 dpi), а полученные изображения (фиг. 7) обрабатывают компьютерной программой «Sorbfil Videodensitometer». Результаты количественного определения глутаминовой кислоты в извлечении из листьев крапивы двудомной представлены в табл. 2.
Пример 2. Разработанный способ идентификации и количественного определения глутаминовой кислоты был апробирован на лекарственном растительном сырье плодов облепихи крушиновидной.
Получение извлечения: Около 10,0 г (точная навеска) свежих или высушенных измельченных плодов облепихи крушиновидной помещают в колбу вместимостью 100 мл, заливают 50 мл воды очищенной. Колбу присоединяют к обратному холодильнику, нагревают на кипящей водяной бане в течение 60 мин, периодически встряхивая для смывания частиц сырья со стенок. Затем колбу с содержимым охлаждают до комнатной температуры. Извлечение фильтруют через несколько слоев марли, отжимая сырье, в мерную колбу вместимостью 50 мл. При необходимости доводят объем до метки водой очищенной. Полученную суммарную вытяжку в количестве 5 мкл наносили на стартовую линию хроматографической пластинки и хроматографировали восходящим способом на пластинах размером 10×15 см. Высота пробега элюента не менее 13 см. Вид хроматограммы представлен на фиг. 8. На хроматограммах извлечений из исследуемого сырья обнаружены зоны аминокислот, среди которых идентифицирована кислота глутаминовая по характерному значению величины Rf в сравнении с достоверным стандартным образцом. Сразу же после проявления хроматограмм, пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO (разрешение не менее 300 dpi), а полученные изображения (фиг. 8) обрабатывают компьютерной программой «Sorbfil Videodensitometer». Результаты количественного определения глутаминовой кислоты в извлечении из плодов облепихи крушиновидной представлены в табл. 2.
Способ идентификации, определения степени чистоты и количественного содержания глутаминовой кислоты с использованием высокоэффективной тонкослойной хроматографии, характеризующийся тем, что навеску исследуемого препарата растворяют в воде с последующим хроматографированием с применением силикагелевых пластинок марки «Sorbfil» с алюминиевой или полимерной подложкой ПТСХ-П-А или ПТСХ-АФ-А, в качестве элюента используют систему в составе н-бутанол - ледяная уксусная кислота - вода (4:1:1), а в качестве проявителя - 1% спиртовый раствор нингидрина; оптимальный объем пробы - 1 мкл водного раствора с содержанием глутаминовой кислоты 1 мг/мл, причем время насыщения камеры парами элюента - 40 мин, время элюирования - 55 мин, время выдерживания пластинки в термостате после проявления при t°=103±2°С - 3-5 минут, после проявления хроматографических зон, пластины сканируют с помощью планшетного сканера EPSON PERFECTION 2480 PHOTO (разрешение не менее 300 dpi), а полученные изображения обрабатывают известной компьютерной программой «Sorbfil Videodensitometer». В результате получают треки в координатах Rf - интенсивность (фиг. 5). На хроматограммах выявляют зону глутаминовой кислоты, которую идентифицируют по характерному значению величины Rf в сравнении с достоверным стандартным образцом. Содержание глутаминовой кислоты (с, мкг) в пробе, нанесенной на хроматограмму, рассчитывают по формуле:

где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer».
13560 и 18190 - коэффициенты «а» и «b» в уравнении линейной зависимости (фиг. 6). Разработанный способ, в зависимости от целей анализа, позволяет проводить определение подлинности, доброкачественности и количественного содержания субстанции глутаминовой кислоты, разделение сложных смесей данной аминокислоты с другими биологически активными веществами (в том числе аминокислотами). Способ отличается, во-первых, обоснованием теоретического подхода к выбору оптимальных условий хроматографического определения глутаминовой кислоты методом ВЭТСХ, во-вторых, возможностью количественной интерпретации данных ТСХ аминокислоты на офисном компьютере.
Источники информации
1. Круглова М.Ю., Круглов Д.С., Ханина М.А., Фурса Н.С. Полисахаридный и аминокислотный состав наиболее распространенных видов лабазника. Электронный журнал «Медицина и образование в сибири». - №5. - 2011.
2. Буркина Н.А., Калинкина Г.И., Фоминых Л.В., Курдюкова Л.В. Исследование аминокислотного состава сфагнума бурого. Химия растительного сырья. - №1. - 2000. - С. 81-83.
3. Никифоров Л.А., Белоусов М.В., Фурса Н.С. Изучение аминокислотного состава ряски малой (Lemna minor L.). Бюллетень сибирской медицины. - №5. - 2011. - С. 74-77.
4. Анчеева Е.Ю. Сравнительный анализ состава свободных аминокислот некоторых видов рода Stellaria L. Электронный журнал «Современные проблемы образования и науки». - №2. - 2013.
5. Губин К.В., Ханина М.А. Анализ аминокислотного и элементного состава надземной части и сухого экстракта Urtica cannabina L. Электронный журнал «Медицина и образование в сибири». - №5. - 2011.
6. Вялых Е.А., Иларионов С.А., Жданова А.В. Исследование аминокислотного состава гуминовых кислот. Вестник Пермского университета. - Вып. 2(6). - 2012. - С. 66-72.
7. Соболева В.А., Чушенко В.Н., Коломиец А.А. Исследование аминокислотного состава гомеопатической матричной настойки каштана конского. Электронный журнал «Провизор». - №17. - 2010. - http://www.provisor.com.ua/
8. Симонян А.В., Саламатов А.А., Покровская Ю.С., Аванесян А.А. Использование нингидриновой реакции для количественного определения α-аминокислот в различных объектах: метод, реком. - Волгоград, 2007. - 106 с.
9. Малахова И.И., Красиков В.Д., Тяглов Б.В., Дегтерев Е.В. Способ разделения и детектирования аминокислот. Патент РФ №2095808 от 10.11.1997 г. Патентообл. Товарищество с ограниченной ответственностью «Научно-производственный центр «Ленхром». Класс МКП: G01N 30/94.
10. Тяглов Б.В., Дегтерев Е.В., Малахова И.И., Красиков В.Д., Помазанов В.В. Способ разделения аминокислот в биологических жидкостях. Патент РФ №2078342 от 27.04.1997 г. Патентообл. Товарищество с ограниченной ответственностью «Научно-производственный центр «Ленхром». Класс МКП: G01N 30/94.
11. Голованов В.Г., Петровский А.А., Кельник Н.В., Ковалева Н.Г., Балыкина Л.В., Куранова И.Л. Способ определения аминокислот, модифицированных высшими жирными кислотами. Патент SU №1642373 от 03.05.89 г. Бюл. N 14 (71). Патентообл. Ленинградский государственный университет и Производственное объединение «Апатит» им. С.М. Кирова. Класс МКП: G01N 30/94.
12. О.Б. Рудаков, И.А. Востров, С.В. Федоров и др. Спутник хроматографиста. Методы жидкостной хроматографии. Воронеж: «Водолей», 2004, 528 с.
13. Гейсс Ф. Основы тонкослойной хроматографии. Москва: Мир, 1999, 405 с.
Способ идентификации и количественного определения глутаминовой кислоты
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИДЕНТИФИКАЦИИ И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АСКОРБИНОВОЙ КИСЛОТЫ | 2014 |
|
RU2581456C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РУТИНА МЕТОДОМ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ | 2011 |
|
RU2469316C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОЛИФЕНОЛЬНЫХ СОЕДИНЕНИЙ МЕТОДОМ СТУПЕНЧАТОГО ЭЛЮИРОВАНИЯ В ТОНКОМ СЛОЕ СОРБЕНТА | 2015 |
|
RU2597661C1 |
| Способ определения простых сахаров в тонком слое сорбента | 2016 |
|
RU2642264C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЖИРОРАСТВОРИМЫХ ВИТАМИНОВ А, D2, Е И В-КАРОТИНА ПРИ СОВМЕСТНОМ ПРИСУТСТВИИ МЕТОДОМ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ | 2013 |
|
RU2530620C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АЛЬФА-ТОКОФЕРОЛА В РАСТИТЕЛЬНЫХ МАСЛАХ | 2007 |
|
RU2349913C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО АНКСИОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2460534C1 |
| СПОСОБ РАЗДЕЛЕНИЯ И ОПРЕДЕЛЕНИЯ СОЕДИНЕНИЙ МЕТОДОМ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2410680C2 |
| СПОСОБ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ В ЗАКРЫТОМ ТОНКОМ СЛОЕ СОРБЕНТА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2483303C2 |
| СПОСОБ МНОГОМЕРНОЙ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИИ | 2010 |
|
RU2435162C1 |






Изобретение относится к аналитической химии, а именно к способам стандартизации лекарственных препаратов, лекарственного растительного сырья, изделий пищевой, химической и косметологической промышленности по содержанию глутаминовой кислоты, и может быть использовано в фармацевтической, химической и косметологической промышленности. Способ идентификации, определения степени чистоты и количественного содержания глутаминовой кислоты с использованием высокоэффективной тонкослойной хроматографии заключается в том, что навеску исследуемого препарата растворяют в воде с последующим хроматографированием с применением силикагелевых пластинок марки «Sorbfil» с алюминиевой или полимерной подложкой ПТСХ-П-А или ПТСХ-АФ-А. В качестве элюента используют систему в составе н-бутанол - ледяная уксусная кислота - вода (4:1:1), а в качестве проявителя - 1% спиртовый раствор нингидрина. При этом оптимальный объем пробы - 1 мкл водного раствора с содержанием глутаминовой кислоты 1 мг/мл. Причем время насыщения камеры парами элюента - 40 мин, время элюирования - 55 мин, время выдерживания пластинки в термостате после проявления при t°=103±2°C - 3-5 минут. После проявления хроматографических зон, пластины сканируют с помощью планшетного сканера, а полученные изображения обрабатывают известной компьютерной программой «Sorbfil Videodensitometer», зона глутаминовой кислоты идентифицируется по характерному значению величины Rf в сравнении с достоверным стандартным образцом, а количественное содержание глутаминовой кислоты (с, мкг) в пробе, нанесенной на хроматограмму, рассчитывают по формуле 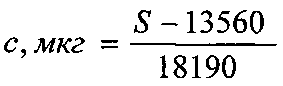 , где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer». Техническим результатом является повышение точности, а также возможность одновременного определения подлинности, степени чистоты и количественного определения глутаминовой кислоты в лекарственных препаратах, лекарственном растительном сырье, изделиях пищевой, химической и косметологической промышленностей, а также возможность разделения сложных смесей и отделения глутаминовой кислоты от других биологически активных веществ. 8 ил., 3 табл.
, где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer». Техническим результатом является повышение точности, а также возможность одновременного определения подлинности, степени чистоты и количественного определения глутаминовой кислоты в лекарственных препаратах, лекарственном растительном сырье, изделиях пищевой, химической и косметологической промышленностей, а также возможность разделения сложных смесей и отделения глутаминовой кислоты от других биологически активных веществ. 8 ил., 3 табл.
Способ идентификации, определения степени чистоты и количественного содержания глутаминовой кислоты с использованием высокоэффективной тонкослойной хроматографии, отличающийся, во-первых, обоснованием теоретического подхода к выбору оптимальных условий хроматографического определения глутаминовой кислоты в тонком слое сорбента, во-вторых, возможностью количественной интерпретацией данных ТСХ аминокислоты на офисном компьютере и характеризующийся тем, что навеску исследуемого препарата растворяют в воде с последующим хроматографированием с применением силикагелевых пластинок марки «Sorbfil» с алюминиевой или полимерной подложкой ПТСХ-П-А или ПТСХ-АФ-А, в качестве элюента используют систему в составе н-бутанол - ледяная уксусная кислота - вода (4:1:1), а в качестве проявителя - 1% спиртовый раствор нингидрина; оптимальный объем пробы - 1 мкл водного раствора с содержанием глутаминовой кислоты 1 мг/мл, причем время насыщения камеры парами элюента - 40 мин, время элюирования - 55 мин, время выдерживания пластинки в термостате после проявления при t°=103±2°C - 3-5 минут; после проявления хроматографических зон, пластины сканируют с помощью планшетного сканера, а полученные изображения обрабатывают известной компьютерной программой «Sorbfil Videodensitometer», зона глутаминовой кислоты идентифицируется по характерному значению величины Rf в сравнении с достоверным стандартным образцом, а количественное содержание глутаминовой кислоты (с, мкг) в пробе, нанесенной на хроматограмму, рассчитывают по формуле:
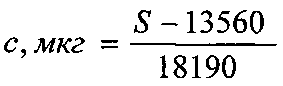
где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer».
| СПОСОБ РАЗДЕЛЕНИЯ АМИНОКИСЛОТ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 1993 |
|
RU2078342C1 |
| СПОСОБ РАЗДЕЛЕНИЯ И ДЕТЕКТИРОВАНИЯ АМИНОКИСЛОТ | 1994 |
|
RU2095808C1 |
| Устройство для обработки морковного коагулята маслом при получении препарата каротина | 1949 |
|
SU88021A1 |
| Haedbbook of thin-layer chromatography, ed | |||
| by J | |||
| Sherma and B.Fried, Chromatographic Science Skries, V.55, p.353-388, 1991. | |||
Авторы
Даты
2016-04-20—Публикация
2014-10-10—Подача