ОБЛАСТЬ ТЕХНИКИ
Изобретение касается нацеленных средств связывания против DLL4 и применения таких средств. Более конкретно, изобретение относится к полностью человеческим моноклональным антителам, направленным на DLL4. Описанные нацеленные средства связывания пригодны для лечения заболеваний, связанных с активностью и/или чрезмерной выработкой DLL4, и в качестве диагностических средств.
УРОВЕНЬ ТЕХНИКИ
Сигнальный каскад Notch представляет собой эволюционно сохранившийся путь, используемый при определении метаболического пути клетки, сохранении и дифференциации стволовых клеток во многих тканях в период их развития. На сегодняшний день у млекопитающих идентифицированы четыре лиганда рецептора Notch (Notch1-4) и пять лигандов (Jagged-1/2 и Delta-подобный лиганд (Dll) 1/3/4).Рецепторы Notch существуют в виде гетеродимеров, состоящих из двух нековалентно связанных внеклеточной и трансмембранной субъединиц. Связывание лиганда с внеклеточной субъединицей представляет собой пусковой механизм протеолитического расщепления, осуществляемого такими ферментами, как фермент преобразования TNFα (TACE) и гамма-секретаза, что приводит к образованию внеклеточных доменов Notch (NICD), которые перемещаются в ядро и связываются с факторами транскрипции, что, в конечном счете, приводит к активации целевых генов, расположенных по ходу транскрипции (см. Bray, 2006, Nat. Rev. Mol. Cell. Biol., 7, 678).
Имеющиеся доказательства свидетельствуют о том, что множественные компоненты пути метаболизма Notch экспрессируются в сосудистой сети, и что аберрации при нормальном проведении сигнала Notch могут привести к сосудистым фенотипам. Например, мутации в Jagged 1 и Notch 3 приводят к синдрому Алажиля и церебральной аутосомно-доминантной артериопатии с субкортикальными инфарктами и лейкодистрофией, соответственно, двум заболеваниям, которые влекут за собой сосудистые расстройства. Более того, генетическая делеция Notch 1 и DLL4 у мышей всегда приводит к смертности эмбриона с сосудистыми нарушениями. Кроме того, делеция одного аллеля DLL4 у мышей приводит к смертности эмбриона с тяжелым нарушениями сосудистой системы, как указывается во многих опубликованных генетических исследованиях (Duarte et al., 2004, Genes Dev., 18, 2474; Gale et al., 2004, Proc. Nat. Acad. Sci., 101, 15949). Данный фенотип описывали ранее для VEGF-A, и это свидетельствует о том, что DLL4 может играть важную роль в развитии сосудистой системы.
Зарегистрированы также сообщения об экспрессии DLL4 на сосудистую сеть опухолей светлоклеточного рака почек, глиобластом, рака молочной железы и мочевого пузыря человека (Mailhos et al., 2001, Differentiation, 69, 135; Patel et al., 2005, Cancer Res., 65, 8690; Patel et al., 2006, Clin. Cancer Res., 12, 4836; Li et al., 2007, Cancer Res., 67, 11244). В недавно проведенном исследовании сделано также предположение, что DLL4 можно экспрессировать на небольшой части опухолевых клеток глиобластомы человека (Li et al., 2007, Cancer Res., 67, 11244). Эффект блокирования проведения сигнала DLL4 на рост опухоли также оценивали на нескольких доклинических моделях рака, в которых линии раковых клеток выращивали подкожно у мышей с иммунодефицитом (Ridgway et al., 2006, Nature, 444, 1083; Noguera-Troise et al., Nature, 444, 1032). В данных исследованиях сообщали об сокращении роста опухоли. Данные противоопухолевые эффекты были связаны с увеличением плотности плохо функционирующих сосудов в опухолях одновременно с повышением гипоксии. Все выше упомянутые данные свидетельствуют о том, что кроме своей основной роли в сосудистом развитии DLL4 также может играть определенную роль в развитии сосудистой сети опухоли.
Кроме влияния на ангиогенез проведение сигнала Notch также использовали в стволовых клетках опухоли множественных типов рака (Dontu et al., 2004, Breast Can. Res., 6, R605; Wilson & Radtke, 2006, FEBS Lett., 580, 2860). Раковые стволовые клетки изолировали из различных гемопоэтических и солидных опухолей (Al-Hajj et al., 2003, Proc. Nat. Acad. Sci., 100, 3983; Lapidot et al., 1994, Nature, 17, 645; Tan et al., 2006, Laboratory Investigation, 86, 1203), и наличие DLL4 в небольших популяциях клеток опухоли дополнительно свидетельствует о том, что DLL4 может также быть вовлечен в биологию раковых стволовых клеток, а антагонисты DLL4 могут частично опосредовать противоопухолевые эффекты через взаимодействие с данными типами клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к нацеленным средствам связывания, которые специфически связываются с DLL4 и ингибируют биологическую активность DLL4. Варианты изобретения относятся к нацеленным средствам связывания, которые специфически связываются с DLL4 и ингибируют связывание DLL4 с рецептором Notch (например, Notch 1, 2, 3 или 4).
Варианты изобретения относятся к нацеленным средствам связывания, которые специфически связываются с DLL4 и ингибируют связывание DLL4 с рецептором Notch (например, Notch 1 или 4). В одном из вариантов изобретения нацеленное средство связывания специфически связывается с DLL4 и ингибируют связывание DLL4 с рецептором Notch, например, Notch 1. В одном из вариантов изобретения нацеленное средство связывания ингибирует, по меньшей мере, на 5%, по крайней мере, на 10%, по крайней мере, на 15%, по крайней мере, на 20%, по крайней мере, на 25%, по крайней мере, на 30%, по крайней мере, на 35%, по крайней мере, на 40%, не менее, на 45%, по крайней мере, на 50%, по крайней мере, на 55%, по крайней мере, на 60%, по крайней мере, на 65%, по крайней мере, на 70%, по крайней мере, на 75%, по крайней мере, на 80%, по крайней мере, на 85%, по крайней мере, на 90%, по крайней мере, на 95% связывание DLL4 с рецептором Notch (например, Notch 1), по сравнению со связыванием, которое имело бы место в отсутствие нацеленного средства связывания.
В некоторых вариантах изобретения нацеленное средство связывания связывается с DLL4 со сродством связывания (KD) менее 5 наномоль (нМ). В других вариантах нацеленное средство связывания связывается с KD менее 4 нМ, 3 нМ, 2 нМ или 1 нМ. В некоторых вариантах изобретения нацеленное средство связывания связывается с DLL4 с KD менее 950 пикомоль (пМ). В некоторых вариантах изобретения нацеленное средство связывания связывается с DLL4 с KD менее чем 900 пМ. В других вариантах нацеленное средство связывания связывается с KD менее чем 800 пМ, 700 пМ или 600 пМ. В некоторых вариантах изобретения нацеленное средство связывания связывается с DLL4 с KD менее 500 пМ. В других вариантах нацеленное средство связывания связывается с KD менее 400 пМ. В других вариантах нацеленное средство связывания связывается с KD менее 300 пМ. В некоторых других вариантах нацеленное средство связывания связывается с KD менее 200 пМ. В некоторых других вариантах нацеленное средство связывания связывается с KD менее 150 пМ. В другом варианте нацеленное средство связывания связывается с KD менее 100 пМ. В другом варианте нацеленное средство связывания связывается с KD менее 50 пМ. В одном из конкретных вариантов нацеленное средство связывания по данному изобретению может связываться с DLL4 человека с KD менее 10 пМ. В другом конкретном варианте нацеленное средство связывания по данному изобретению может связываться с DLL4 человека с KD менее 1 пМ. KD может быть определена способом, описанным в настоящем документе, или каким-нибудь другим, известным специалисту в данной области (например, BIAcore анализ, ELISA, FACS) (Biacore International AB, Уппсала, Швеция).
Связывающие свойства нацеленного средства связывания или антитела по данному изобретению также могут быть измерены, ссылаясь на скорость диссоциации или ассоциации (koff и kon соответственно).
В одном из вариантов данного изобретения нацеленное средство связывания или антитело может демонстрировать скорость kon (антитело (Ab) + антиген 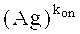
В другом варианте данного изобретения нацеленное средство связывания или антитело может демонстрировать скорость koff (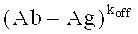
Нацеленное средство связывания по данному изобретению связывается с DLL4 человека. В некоторых примерах нацеленное средство связывания по данному изобретению перекрестно реагирует на другие белки DLL4 других видов. В одном из вариантов нацеленное средство связывания по данному изобретению перекрестно реагирует с DLL4 яванской макаки. В другом варианте нацеленное средство связывания по изобретению перекрестно реагирует с DLL4 яванской макаки, но лишь слабо перекрестно реагирует с белками DLL4 других видов, например, лишь слабо перекрестно реагирует с DLL4 мыши, например, нацеленное средство связывания связывается с DLL4 мыши с KD более 360 нМ, как было оценено при помощи технологии BIAcore.
В другом варианте нацеленное средство связывания по данному изобретению обладает почти эквивалентным сродством к белкам DLL4 других видов. В одном конкретном примере нацеленное на DLL4 человека средство связывания по данному изобретению обладает почти эквивалентным сродством с DLL4 яванской макаки. Под эквивалентным уровнем сродства подразумевается, что, если сродство по отношению к DLL4 человека равно 1, то сродство антитела по отношению к DLL4 яванской макаки находится в интервале 0,2-5 или в интервале 0,2-2.
В другом варианте нацеленное средство связывания по данному изобретению является специфическим по отношению к DLL4 человека, но не связывается с другими лигандами Notch. В одном из вариантов нацеленное средство связывания по данному изобретению является специфическим по отношению к DLL4 человека, но не связывается значительно с DLL1, например, соотношение DLL1/имитация составляет менее 2,5, как установлено при помощи испытания способности нацеленного средства связывания, как описано в данном описании (15-300 мкг/мл), относительно связывания с клетками 293Т, кратковременно трансфицированными с помощью DLL1 человека, или с клетками HEK293, постоянно трансфицированными с помощью Dll1. В другом примере нацеленное средство связывания по данному изобретению является специфичным по отношению к DLL4 человека, но не связывается значительно с Jagged 1, например, соотношение DLL1/имитация составляет менее 1,5, как установлено при помощи испытания способности нацеленного средства связывания, как описано в данном описании (5 мкг/мл), при связывании с клетками 293Т, кратковременно трансфицированных с помощью Jagged 1 человека, или с клетками HEK293, постоянно трансфицированных Jagged 1 человека.
В еще одном варианте нацеленное средство связывания по данному изобретению ингибирует связывание DLL4-рецептор Notch-лиганд. В одном из примеров, активность нацеленного средства связывания может быть продемонстрирована при концентрации IC50 (концентрация для достижения 50% ингибирования) ниже 10 мкМ. В качестве другого примера нацеленное средство связывания по данному изобретению может демонстрировать концентрацию IC50 менее 50, 40, 30, 20, 10, 5, 4, 2, 1, 0,8, 0,7, 0,6, 0,5 или 0,4 нМ.
В еще одном варианте нацеленное средство связывания по данному изобретению может обладать активностью как in vitro, так и in vivo. В одном конкретном примере нацеленное средство связывания полностью изменяет направление ингибирования пролиферации клеток HUVEC, стимулированного DLL4, в культуре 2D. В одном примере антитела по данному изобретению могут менять направление ингибирования пролиферации клеток HUVEC, стимулированного DLL4, на 70% или более, например 75%, 80%, 85%, 90% или 95% по сравнению с контролем (при помощи анализа, приведенного в примере 9, без добавления DLL4).
В другом варианте данного изобретения нацеленные средства связывания, например, антитела по данному изобретению, могут ингибировать образование клеточных трубок в клетках HUVEC в культуре 2D. Например, антитела по данному изобретению могут проявлять более 50% ингибирования, например 50%, 60%, 70%, 80%, 90% или 95% ингибирования при концентрации 0,08 мкг/мл по сравнению с контролем (контролем считается максимальный ингибиторный эффект, который определяют с применением 20 мкг/мл того же самого антитела).
В другом варианте настоящего изобретения нацеленные средства связывания по данному изобретению могут проявлять интернационализацию менее чем на 50%, например, 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10% или 5%, через четыре часа по сравнению с контролем t=0. В другом варианте настоящего изобретения нацеленные средства связывания по данному изобретению могут проявлять интернационализацию от 5 до 50%, от 10 до 40% или от 20 до 40% через четыре часа по сравнению с контролем t=0 (см. пример 15).
В одном варианте настоящего изобретения нацеленные средства связывания по данному изобретению, которые специфически связываются с DLL4, могут проявлять одно или более из следующих свойств, включая то, что они связываются с DLL4 человека с KD менее 200 пМ; перекрестно реагируют с DLL4 яванской макаки; слабо перекрестно реагируют с DLL4 мыши; связываются с DLL4 яванской макаки с приблизительно эквивалентным сродством; не связываются значительно с DLL1 или Jagged 1; демонстрируют изменение направления более чем на 85% ингибирования пролиферации клеток HUVEC, стимулированного DLL4, в культуре 2D по сравнению с контролем; демонстрируют ингибирование более чем на 50% образования клеточных трубок в клетках HUVEC в культуре 2D при концентрации 0,08 мкг/мл по сравнению с контролем; и демонстрируют интернационализацию менее чем на 50% через четыре часа по сравнению с контролем t=0.
В другом варианте по данному изобретению нацеленные белки связывания, описанные в данном описании, обладают полезными эффективными метаболическими и/или фармакодинамическими свойствами.
В другом варианте данного изобретения нацеленное средство связывания конкурирует с любым из моноклональных антител человека 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21H3, 1E4, 3A7, 4B3, 1D4 или 21H3RX за связывание с Notch 1.
В некоторых вариантах данного изобретения нацеленное средство связывания подавляет рост опухоли и/или метастазов у млекопитающих. В другом варианте данного изобретения нацеленное средство связывания может лечить состояние, связанное с ангиогенезом.
В некоторых вариантах данного изобретения нацеленное средство связывания является антителом. В некоторых вариантах настоящего изобретения нацеленное средство связывания является моноклональным антителом. В одном из вариантов данного изобретения нацеленное средство связывания является полностью человеческим моноклональным антителом. В другом варианте данного изобретения нацеленное средство связывания является полностью моноклональным антителом человека изотипов IgG1, IgG2, IgG3 или IgG4. В другом варианте настоящего изобретения нацеленное средство связывания является полностью человеческим моноклональным антителом изотипа IgG2. Данный изотип обладает пониженным потенциалом эффекторной функции по сравнению с другими изотипами, что может привести к уменьшению токсичности. В другом варианте данного изобретения нацеленное средство связывания является полностью человеческим моноклональным антителом изотипа IgG1. Изотип IgG1 обладает повышенной способностью вызывать ADCC (антителозависимую цитотоксичность) по сравнению с другими изотипами, что может привести к повышению эффективности. Изотип IgG1 обладает повышенной стабильностью по сравнению с другими изотипами, например, IgG4, что может привести к улучшению биодоступности или улучшению технологичности или удлинению периода полувыведения. В одном из вариантов изотип IgG1 полностью человеческого моноклонального антитела является z, za или f аллотипом.
Еще один вариант представляет собой нацеленное средство связывания или антитело, которое специфично связывается с DLL4, и включает последовательность, содержащую одну из последовательностей определяющих комплементарность участков (CDR), показанных в табл.2. Варианты данного изобретения включают нацеленное средство связывания или антитело, включающие последовательность, содержащую: последовательность любого из участков CDR1, CDR2 или CDR3, как показано в табл.2. Еще один вариант представляет собой нацеленное средство связывания или антитело, которое специфично связывается с DLL4, и включает последовательность, содержащую последовательности двух участков CDR, как показано в табл.2. В другом варианте нацеленное средство связывания или антитело включает последовательность, содержащую последовательности участков CDR1, CDR2 и CDR3, как показано в табл.2. В другом варианте нацеленное средство связывания или антитело включает последовательность, содержащую последовательность одного из участков CDR, как показано в табл.2. Варианты данного изобретения включают нацеленное средство связывания или антитело, включающее последовательность, содержащую: последовательность любого из участков CDR1, CDR2 или CDR3, как показано в табл.2. В другом варианте нацеленное средство связывания или антитело включает последовательность, содержащую последовательности двух участков CDR, как показано в табл.2. В другом варианте нацеленное средство связывания или антитело включает последовательность, содержащую последовательности участков CDR1, CDR2 и CDR3, как показано в табл.2. В другом варианте нацеленное средство связывания или антитело может содержать последовательность, включающую последовательность участков CDR1, CDR2 и CDR3 вариабельной последовательности тяжелой цепи или вариабельной последовательности легкой цепи, как показано в табл.2. В некоторых вариантах нацеленное средство связывания является антителом. В некоторых вариантах нацеленное средство связывания является полностью человеческим моноклональным антителом. В некоторых других вариантах нацеленное средство связывания является фрагментом связывания полностью человеческого моноклонального антитела.
В другом варианте нацеленное средство связывания содержит VH CDR1, как показано в табл.2, где последовательность VH CDR1 включает последовательность аминокислот, которая идентична или включает 1, 2 или 3 замены аминокислотных остатков по сравнению с VH CDR1, как показано в табл.2; VH CDR2, как показано в табл.2, включающую последовательность аминокислот, которая идентична или включает 1, 2 или 3 замены аминокислотных остатков по сравнению с VH CDR2, как показано в табл.2; VH CDR3, как показано в табл.2, последовательность аминокислот, которая идентична или включает 1, 2 или 3 замены аминокислотных остатков по сравнению с VH CDR3, как показано в табл.2; VL CDR1, как показано в табл.2, последовательность аминокислот, которая идентична или включает 1, 2 или 3 замены аминокислотных остатков по сравнению с VL CDR1, как показано в табл.2; VL CDR2, как показано в табл.2, последовательность аминокислот, которая идентична или включает 1, 2 или 3 замены аминокислотных остатков по сравнению с VL CDR2, как показано в табл.2; и VL CDR3, как показано в табл.2, последовательность аминокислот, которая идентична или включает 1, 2 или 3 замены аминокислотных остатков по сравнению с VL CDR3, как показано в табл.2.
В одном варианте нацеленное средство связывания содержит VH CDR1, CDR2 и CDR3, как показано в табл.2, и VL CDR1 CDR2 и CDR3, как показано в табл.2.
В еще одном варианте нацеленное средство связывания связывается иммуноспецифично с DLL4 и содержит домен вариабельного участка тяжелой цепи, как показано в табл.2, идентичный, по меньшей мере, на 90% последовательности аминокислот, как показано в табл.2, и содержит домен вариабельного участка тяжелой цепи, как показано в табл.2, идентичный, по меньшей мере, на 90% последовательности аминокислот, как показано в табл.2, где указанное антитело обладает активностью связывания с DLL4.
В другом варианте нацеленное средство связывания может включать последовательность, содержащую последовательности любого из CDR1, CDR2 или CDR3 вариабельных участков тяжелой цепи, кодируемые полинуклеотидом в плазмиде, обозначенной Mab2H10VHOP, Mab9G8VH, Mab21H3VH и Mab4B4VH, которые депонированы Американской коллекции типовых культур (АТСС) под номером РТА-9502, РТА-9517, РТА-9501, или РТА-9508 17 сентября 2008 г. В другом варианте нацеленное средство связывания может включать последовательность, содержащую последовательности любого из CDR1, CDR2 или CDR3 вариабельных участков легкой цепи, которые кодируются полинуклеотидом в плазмиде, обозначенной Mab9G8VLOPT1, Mab21H3VLOP и Mab4B4VL, которые депонированы в Американской коллекции типовых культур (АТСС) под номером РТА-9516, РТА-9500 или РТА-9520 17 сентября 2008 г., и Mab2H10VLOP, которая депонирована 7 июля 2009 г. под номером РТА-10181.
В одном из вариантов нацеленное средство связывания или антитело по изобретению содержит аминокислотную последовательность вариабельной тяжелой цепи, включающую участок CDR3, который кодируется полинуклеотидом в плазмиде, обозначенной Mab2H10VHOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9502 17 сентября 2008 г.
В одном из вариантов нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую участок CDR3, который кодируется полинуклеотидом в плазмиде, обозначенной Mab2H10VHOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9502 17 сентября 2008 г., и последовательность аминокислот вариабельной легкой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной Mab2H10VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-10181 7 июля 2009 г.
В другом варианте нацеленное средство связывания или антитело по изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab2H10VHOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9502 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по изобретению содержит последовательность аминокислот вариабельной легкой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab2H10VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-10181 7 июля 2009 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab2H10VHOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9502 17 сентября 2008 г., и последовательность аминокислот вариабельной легкой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab2H10VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-10181 7 июля 2009 г.
В одном из вариантов нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной Mab9G8VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9517.
В одном из вариантов нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной Mab9G8VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9517 17 сентября 2008 г., и последовательность аминокислот вариабельной легкой цепи, включающую участок CDR3, кодируемый полинуклеотидом в плазмиде, обозначенной Mab9G8VLOPT1, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9516 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab9G8VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9517 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной легкой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab9G8VLOPT1, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9516 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab9G8VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9517 17 сентября 2008 г., и последовательность аминокислот вариабельной легкой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab9G8VLOPT1, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9516 17 сентября 2008 г.
В одном из вариантов нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной Mab21H3VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9501 17 сентября 2008 г.
В одном из вариантов нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной Mab21H3VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9501 17 сентября 2008 г., и последовательность аминокислот вариабельной легкой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной, Mab21H3VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9500 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab21H3VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9501 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной легкой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab21H3VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9500 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab21H3VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9501 17 сентября 2008 г., и последовательность аминокислот вариабельной легкой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначено Mab21H3VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9500 17 сентября 2008 г.
В одном из вариантов нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной Mab4B4VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9508 17 сентября 2008 г.
В одном из вариантов нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной Mab4B4VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9508 17 сентября 2008 г., и последовательность аминокислот вариабельной легкой цепи, включающую участок CDR3 антитела, кодируемый полинуклеотидом в плазмиде, обозначенной Mab4B4VL, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9520 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab4B4VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9508 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной легкой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab4B4VL которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9520 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит последовательность аминокислот вариабельной тяжелой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab4B4VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9508 17 сентября 2008 г., и последовательность аминокислот вариабельной легкой цепи, включающую, по крайней мере, один, по крайней мере, два, или, по крайней мере, три участка CDR антитела, кодируемых полинуклеотидом в плазмиде, обозначенной Mab4B4VL, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9520 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную тяжелую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab2H10VHOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9502 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную тяжелую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab9G8VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9517 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную тяжелую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab21H3VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9501 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную тяжелую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab4B4VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9508 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab2H10VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-10181 7 июля 2009 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab9G8VLOPT1, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9516 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab21H3VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9500 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab4B4VL, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9520 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную тяжелую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab2H10VHOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9502 17 сентября 2008 г., и вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab2H10VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-10181 7 июля 2009 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab9G8VLOPT1, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9516 17 сентября 2008 г., и вариабельную тяжелую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab9G8VH, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9517 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную тяжелую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab21H3VH которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9501 17 сентября 2008 г., и вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab21H3VLOP, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9500 17 сентября 2008 г.
В другом варианте нацеленное средство связывания или антитело по данному изобретению содержит вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab4B4VL которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9520 17 сентября 2008 г., и вариабельную легкую цепь антитела, кодируемую полинуклеотидом в плазмиде, обозначенной Mab4B4VL, которая депонирована в Американской коллекции типовых культур (АТСС) под номером РТА-9520 17 сентября 2008 г.
Специалисты в данной области констатировали, что можно легко выполнить определение участков CDR. См., например, Kabat et al, Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. Kabat предоставил сравнительный анализ первичной структуры цепей иммуноглобулина для многочисленных изотипов антител. Расположенные на одной линии последовательности нумеруются в соответствии с единой нумерацией системы, системой нумерации Kabat. Последовательности Kabat были обновлены в 1991 г. и доступны в электронной базе последовательностей (последняя загружаемая версия 1997). Любая последовательность иммуноглобулина может быть пронумерована соответственно системе Kabat для выполнения сравнительного анализа первичной структуры по Kabat. Соответственно, система нумерации Kabat обеспечивает единую систему нумерации цепей иммуноглобулина.
В одном из вариантов нацеленное средство связывания или антитело включает последовательность, содержащую любую из последовательностей тяжелых цепей, как показано в табл.2. В другом варианте нацеленное средство связывания или антитело включает последовательность, содержащую любую из последовательностей тяжелых цепей антител 20G8, 21Н3, 14В1, 18В7, 17В6, 17F3, 12А1, 17G12, 19G9, 21F7, 20D6, 1D4, 4 В4, 2Н10 или 21H3RK или любую из оптимизированных версий последовательностей тяжелых цепей данных антител, как показано в табл.5, 7, 9, 11 или 13. Неидентичные легкие цепи хорошо известны в данной области; таким образом, нацеленное средство связывания или антитело включает последовательность, содержащую любую из последовательностей легкой цепи антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK или любую оптимизированную версию последовательностей легких цепей антител, как показано в табл.6, 8, 10, 12 или 13, или другого антитела, рассматриваемого в данном описании. В одном из вариантов нацеленное средство связывания или антитело включает последовательность, содержащую любую последовательность тяжелой цепи, как показано в табл.2, или любую оптимизированную версию последовательностей тяжелых цепей данных антител, как показано в табл.5, 7, 9, 11 или 13, или может дополнительно содержать любую последовательность легкой цепи, как показано в табл.6, 8, 10, 12 или 13, другого антитела, рассматриваемого в данном описании. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В некоторых вариантах нацеленным средством связывания является моноклональное антитело, выбранное из группы, состоящей из 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK. В одном из вариантов нацеленное средство связывания содержит одно или несколько полностью человеческих моноклональных антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK. В конкретных вариантах нацеленным средством связывания является моноклональное антитело 4В4. В конкретных вариантах нацеленным средством связывания является моноклональное антитело 21Н3. В конкретных вариантах нацеленным средством связывания является моноклональное антитело 2Н10. В конкретных вариантах нацеленным средством связывания является моноклональное антитело 9G8. А в некоторых других вариантах нацеленным средством связывания является моноклональное антитело 21H3RK.
В одном из вариантов нацеленное средство связывания или антитело может включать последовательность, содержащую любой из участков CDR1, CDR2 и CDR3 тяжелой цепи, выбранный из последовательностей, показанных в табл.2.
В одном из вариантов нацеленное средство связывания или антитело может включать последовательность легкой цепи, содержащую любой из участков CDR1, CDR2 и CDR3 легкой цепи, выбранный из последовательностей, показанных в табл.2. В одном из вариантов нацеленное средство связывания или антитело может содержать последовательность, включающую участки CDR1, CDR2 и CDR3 тяжелой цепи, выбранные как любой из участков CDR антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4ВЗ, 1D4 или 21H3RK. В одном из вариантов нацеленное средство связывания или антитело может содержать последовательность, включающую CDR1, CDR2 и CDR3 легкой цепи, выбранные как любой из участков CDR антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK.
В другом варианте нацеленное средство связывания или антитело может содержать последовательность, включающую любой из участков CDR1, CDR2 или CDR3 последовательности вариабельного участка тяжелой цепи любого из полностью человеческих моноклональных антител 4В4 или 21Н3, 2Н10, 9G8 или 21H3RK, как показано в табл.2. В другом варианте нацеленное средство связывания или антитело может содержать последовательность, включающую любой из участков CDR1, CDR2 или CDR3 последовательности вариабельного участка легкой цепи любого из полностью человеческих моноклональных антител 4В4 или 21Н3, 2Н10, 9G8 или 21H3RK, как показано в табл.2. В другом варианте нацеленное средство связывания или антитело может содержать последовательность, включающую любой из участков CDR1, CDR2 или CDR3 из полностью человеческих моноклональных антител 4В4 или 21Н3, 2Н10, 9G8 или 21H3RK, как показано в табл.2, и последовательность, содержащую участки CDR1, CDR2 и CDR3 полностью человеческого моноклонального антитела 4В4 или 21Н3, 2Н10, 9G8 или 21H3RK, как показано в табл.2. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В другом варианте нацеленное средство связывания или антитело включает последовательность, содержащую последовательность CDR1, CDR2 и CDR3 из полностью человеческих моноклональных антител 4В4, как показано в табл.2, и последовательность CDR1, CDR2 и CDR3 из полностью человеческих моноклональных антител 4В4, как показано в табл.2. Еще в одном варианте нацеленное средство связывания или антитело включает последовательность, содержащую последовательность CDR1, CDR2 и CDR3 из полностью человеческих моноклональных антител 21Н3, как показано в табл.2, и последовательность CDR1, CDR2 и CDR3 из полностью человеческих моноклональных антител 21Н3 как показано в табл.2. Еще в одном варианте нацеленное средство связывания или антитело включает последовательность, содержащую последовательность CDR1, CDR2 и CDR3 из полностью человеческих моноклональных антител 2Н10, как показано в табл.2, и последовательность CDR1, CDR2 и CDR3 из полностью человеческих моноклональных антител 2Н10, как показано в табл.2. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В дальнейшем варианте по данному изобретению нацеленное средство связывания или антитело включает последовательность, содержащую смежные последовательности, охватывающие каркасные участки и участки CDR, в частности, последовательности от FR1 до FR4 или от CDR1 до CDR3 любой из последовательностей, как показано в табл.2 или табл.13. В одном из вариантов нацеленное средство связывания или антитело включает последовательность, содержащую смежные последовательности, охватывающие каркасные участки и участки CDR, в частности, последовательности от FR1 до FR4 или от CDR1 до CDR3 любой из последовательностей моноклональных антител 4В4 или 21Н3, 2Н10, 9G8 или 21H3RK, как показано в табл.2 или табл.13. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В другом варианте средство или антитело, или его антигенсвязывающий участок, включает полипептид тяжелой цепи, содержащий последовательность SEQ ID NO:2. В одном из вариантов средство или антитело, или его антигенсвязывающий участок дополнительно включает полипептид легкой цепи, содержащий последовательность SEQ ID NO:4. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
Один из вариантов предусматривает нацеленное средство связывания или антитело, или его антигенсвязывающий участок, в котором средство или антитело, или его антигенсвязывающий участок включает полипептид тяжелой цепи, содержащий последовательность SEQ ID NO:6. В одном из вариантов средство или антитело, или его антигенсвязывающий участок дополнительно включает полипептид легкой цепи, содержащий последовательность SEQ ID NO:8. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В другом варианте средство или антитело, или его антигенсвязывающий участок включает полипептид тяжелой цепи, содержащий последовательность SEQ ID NO:22. Еще в одном варианте средство или антитело, или его антигенсвязывающий участок дополнительно включает полипептид легкой цепи, содержащий последовательность SEQ ID NO:24. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В другом варианте средство или антитело, или его антигенсвязывающий участок включает полипептид тяжелой цепи, содержащий последовательность SEQ ID NO:30. Еще в одном варианте средство или антитело, или его антигенсвязывающий участок дополнительно включает полипептид легкой цепи, содержащий последовательность SEQ ID NO:32. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В другом варианте средство или антитело, или его антигенсвязывающий участок включает полипептид тяжелой цепи, содержащий последовательность SEQ ID NO:30. Еще в одном варианте средство или антитело, или его антигенсвязывающий участок дополнительно включает полипептид легкой цепи, содержащий последовательность SEQ ID NO:50. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В одном из вариантов нацеленное средство связывания или антитело включает целых двадцать, шестнадцать, десять, девять или менее, например, одно, два, три, четыре или пять добавлений, замен, делений и/или вставок аминокислот в пределах раскрытых участков CDR или последовательностей тяжелых или легких цепей. Такие модификации потенциально могут быть осуществлены для любого остатка CDR. В некоторых вариантах антитело представляет собой полностью человеческое моноклональное антитело.
В одном из вариантов нацеленное средство связывания или антитело включает варианты или производные CDR, раскрытые в данном описании, где смежные последовательности охватывают каркасные участки и участки CDR (в частности, от FR1 до FR4 или от CDR1 до CDR3), последовательностей легкой или тяжелой цепи, раскрытых в данном описании, или антител, раскрытых в данном описании. Варианты включают нацеленное средство связывания или антитело, состоящее из последовательности, которая содержит целых двадцать, шестнадцать, десять, девять или менее, например, одно, два, три, четыре, пять или шесть добавлений, замен, делений и/или вставок аминокислот в пределах любого из участков CDR1, CDR2 или CDR3, как показано в табл.2 или табл.13, где смежные последовательности охватывают каркасные участки и участки CDR (в частности, от FR1 до FR4 или от CDR1 до CDR3), как показано в табл.2 или табл.13, последовательностей легких или тяжелых цепей, раскрытых в данном описании, или моноклональных антител, раскрытых в данном описании. Варианты включают нацеленное средство связывания или антитело, включающее последовательность, идентичную, по меньшей мере, на 60, 70, 80, 85, 90, 95, 98 или около 99% аминокислотной последовательности любого из участков CDR1, CDR2 или CDR3, как показано в табл.2 или табл.13, где смежные последовательности охватывают каркасные участки и участки CDR (в частности, от FR1 до FR4 или от CDR1 до CDR3), как показано в табл.2 или табл.13, последовательностей легких или тяжелых цепей, раскрытых в данном описании, или моноклональных антител, раскрытых в данном описании. Процентная идентичность двух последовательностей аминокислот может быть определена любым способом, известным специалистам в данной области, в том числе, не ограничиваясь ими, попарный сравнительный анализ первичной структуры белков. Одна из модификаций варианта включает изменение последовательностей CDR или полипептидов легких или тяжелых цепей, раскрытых в данном описании, а именно естественным путем или путем введения последовательности, созданной in vitro с помощью рекомбинантной ДНК или мутагенеза. Естественные варианты включают те, которые генерируют in vivo соответственные нуклеотидные последовательности генеративной линии во время образования антитела к чужеродному антигену. В одном из вариантов производным может быть гетероантитело, являющееся антителом, в котором два или несколько антител связаны между собой. Производные включают антитела, которые были модифицированы химически. Примеры включают ковалентное присоединение одного или нескольких полимеров, таких как водорастворимые полимеры, N-связанные или O-связанные углеводы, сахара, фосфаты и/или другие подобные молекулы. Производные модифицированы способом, отличающимся от природных или исходных антител, типом или расположением присоединенных молекул. Производные дополнительно включают делению одного или нескольких радикалов, которые естественно присутствуют в антителе.
В одном из вариантов нацеленным средством связывания является биспецифичное антитело. Биспецифичное антитело представляет собой антитело, которое обладает специфичностью связывания, по крайней мере, с двумя различными эпитопами. Способы создания биспецифичных антител известны в данной области. (См., например, Millstein et al, Nature, 305:537-539 (1983); Traunecker et al, EMBO J, 10:3655-3659 (1991); Suresh et al, Methods in Enzymology, 121:210 (1986); Kostelny et al, J. Immunol, 148(5):1547-1553 (1992); Hollinger et al, Proc. Natl Acad. Sci. USA, 90:6444-6448 (1993); Gruber et al, J. Immunol, 152:5368 (1994); патенты США №№4,474,893; 4,714,681; 4,925,648; 5,573,920; 5,601,81; 95,731,168; 4,676,980; и 4,676,980, WO 94/04690; WO 91/00360; WO 92/200373; WO 93/17715; WO 92/08802; и ЕР 03089).
В некоторых вариантах данного изобретения последовательность нацеленного средства связывания или антитела оптимизирована мутацией остатков, не принадлежащих к ее генеративной линии, до остатков генеративной линии, и/или удалением структурных дефектов. В одном варианте данное изобретение включает последовательность, содержащую SEQ ID NO:6. В конкретных вариантах SEQ ID NO:6 включает любую из комбинаций остатков генеративной линии и остатков, не принадлежащих к генеративной линии, как свидетельствует каждая строка табл.7. В некоторых вариантах SEQ ID NO:6 включает любой один, любые два, любые три, любые четыре, любые пять, любые шесть или все шесть остатка генеративной линии, как указано в табл.7. В конкретных вариантах SEQ ID NO:6 включает любую из уникальных комбинаций остатков генеративной линии и остатков, не принадлежащих к генеративной линии, как свидетельствует каждая строка табл.7.
В других вариантах нацеленное средство связывания или антитело получают из генеративной последовательности с доменами VH3-33, 6-13 и JH4, в которой один или несколько остатков мутировали, давая соответствующую генеративную линию в этом положении. В конкретных вариантах последовательность SEQ ID NO.:24 может включать дополнительные модификации, которые включают удаление структурных дефектов. Например, кроме генеративной линии С33 могут мутировать до S. Таким образом, последовательность SEQ ID NO.:24 может включать любую из уникальных комбинаций остатков генеративной линии и остатков, не принадлежащих к генеративной линии, как свидетельствует каждая строка табл.10, и дополнительно включать мутации С33 до S.
Дальнейшим вариантом данного изобретения является нацеленное средство связывания или антитело, которое конкурирует за связывание с DLL4. В другом варианте данное изобретение направлено на нацеленное средство связывания или антитело, которое конкурирует с нативным DLL4 за связывание с рецептором Notch 1 или Notch 4. Другим вариантом настоящего изобретения является антитело, которое конкурирует за связывание с Notch 1 с любым из полностью человеческих моноклональных антител 4В4 или 21Н3, 2Н10, 9G8 или 21H3RK. "Конкурирует" означает, что нацеленное средство связывания или антитело соперничает за связывание с Notch 1 с любым из полностью человеческих моноклональных антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK, т.е. конкуренция является однонаправленной.
Варианты данного изобретения включают нацеленное средство связывания или антитело, которое перекрестно конкурирует с любым из полностью человеческих моноклональных антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK за связывание с DLL4. "Перекрестно конкурирует" означает, что нацеленное средство связывания или антитело конкурирует за связывание с Notch 1 с любым из полностью человеческих моноклональных антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK, и наоборот, т.е. конкуренция является двунаправленной.
Дальнейшим вариантом настоящего изобретения является нацеленное средство связывания или антитело, которое связывается с тем же эпитопом DLL4, что и нацеленное средство связывания или антитело по данному изобретению. Варианты настоящего изобретения также включают нацеленное средство связывания или антитело, которое связывается с тем же эпитопом DLL4 что и любое из полностью человеческих моноклональных антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK. Из анализа перекрестной конкуренции ясно, что антитела по данному изобретению имеют различные или частично перекрывающиеся эпитопы. Например, 4В4 перекрестно конкурирует с 21H3RK и 21Н3. Также 4В4 и 21Н3 не связываются с DLL4 в условиях восстановления и денатурации, в то время как 9G8 и 2Н10 свидетельствуют о связывании с различными эпитопами.
В конкретных вариантах эпитоп включает не менее одной внеклеточной части DLL4. Не менее чем один специфический эпитоп (например, для 21Н3 или 21H3RK или 4В4) может включать любое сочетание не менее одной последовательности аминокислот не менее 3 аминокислотных остатков до целой специфической части заменимых аминокислот, находящихся в DLL4 между аминокислотами 147-224, т.е., ICSDNYYGDNCSRLCKKRNDHFGHYVCQPDGNLSCLPGWTGEYCQQPICLSGCHEQNG YCSKPAECLCRPGWQGRLC (SEQ ID NO:90). В одном из вариантов эпитоп состоит из не менее 4 остатков аминокислот, не менее 5 остатков аминокислот, не менее 6 остатков аминокислот, не менее 7 остатков аминокислот, не менее 8 остатков аминокислот или не менее 9 остатков аминокислот, не менее 10 остатков аминокислот, не менее 15 остатков аминокислот, не менее 20 остатков аминокислот, не менее 25 остатков аминокислот, не менее 30 остатков аминокислот, не менее 40 остатков аминокислот или не менее 50 остатков аминокислот, не менее 60 остатков аминокислот, не менее 70 остатков аминокислот, не менее 75 остатков аминокислот, не менее 76 остатков аминокислот или 77 остатков аминокислот SEQ ID NO:90. В другом варианте эпитоп находится в аминокислоте 187-201 DLL4 человека, TGEYCQQPICLSGCH (SEQ ID NO:91). В одном из вариантов эпитоп состоит из не менее 4 остатков аминокислот, не менее 5 остатков аминокислот, не менее 6 остатков аминокислот, не менее 7 остатков аминокислот, не менее 8 остатков аминокислот или не менее 9 остатков аминокислот, не менее 10 остатков аминокислот, не менее 11 остатков аминокислот, не менее 12 остатков аминокислот, не менее 13 остатков аминокислот, не менее 14 остатков аминокислот или 15 остатков аминокислот SEQ ID NO:91.
В одном из вариантов данное изобретение включает перекрестно реагирующие антитела мыши антител, рассматриваемых в данном описании. В одном из вариантов вариабельные участки антител изменяют таким образом, что антитела могут связываться с DLL4 мыши. Обычно перекрестно реагирующие антитела мыши обладают похожими свойствами с антителами, рассматриваемыми в данном описании, например, могут связываться с DLL4 и могут ингибировать связывание DLL4 с рецептором Notch. В одном из примеров вариабельный участок антитела 21H3RK изменяют таким образом, что он может связываться с DLL4 мыши, например, в тяжелой цепи проводят следующие замены: Н31 Asn на Lys, Н52а Ala на Pro, H97 Val на Thr, H100b Val на Trp и H100e Glu на Ala (см. SEQ ID NO:84), а в легкой цепи проводят следующие замены: L30 Ser на Asn и L93 Asp на Ser (см. SEQ ID NO:85). В другом варианте в тяжелой цепи проводят следующие замены: H30Thr на Ile, H31Asn на Met, H52a Ala на Pro, H100b Val на Trp и H100e Glu на Ala (см. SEQ ID NO:86), а в легкой цепи проводят следующие замены: L93 Asp на Ser (см. SEQ ID NO:87). В другом варианте в тяжелой цепи проводят следующие замены: Н30 Thr на Ile, Н31 Asn на His, H100b Val на Trp и H100e Glu на Ala (см. SEQ ID NO:88), а в легкой цепи проводят следующие замены: L30 Ser на Asn и L93 Asp на Ser. (см. SEQ ID NO:89).
Другие варианты настоящего изобретения включают выделенные молекулы нуклеиновых кислот, кодирующие любое из нацеленных средств связывания или антител, рассматриваемых в данном описании, векторы, содержащие выделенные молекулы нуклеиновых кислот, кодирующие нацеленные средства связывания или антитела, рассматриваемые в данном описании, или клетку-хозяина, трансформированную любой из таких молекул нуклеиновых кислот. Варианты данного изобретения включают молекулу нуклеиновой кислоты, кодирующую полностью человеческие выделенные нацеленные средства связывания, которые специфически связываются с DLL4 и ингибируют связывание DLL4 с рецептором Notch. Настоящее изобретение также включает полинуклеотиды, которые гибридизуются в жестких или мягких условиях, как описано в данном описании, с полинуклеотидами, которые кодируют любое из нацеленных средств связывания или антител, рассматриваемых в данном описании. Варианты изобретения также включают применение вектора, содержащего молекулу нуклеиновой кислоты, кодирующую средства связывания. Дополнительные варианты включают клетку-хозяина, содержащую вектор с молекулой нуклеиновой кислоты.
Как известно из уровня техники, антитела предпочтительно могут быть, например, поликлональными, олигоклональными, моноклональными, химерными, гуманизированными и/или полностью человеческими антителами.
Следует иметь в виду, что варианты изобретения не ограничиваются каким-либо конкретным видом антител или способом их получения или производства. В некоторых вариантах настоящего изобретения нацеленным средством связывания является фрагмент связывания полностью человеческого моноклонального антитела. Например, нацеленное средство связывания может быть полноразмерным антителом (например, с интактным участком Fc человека) или связывающим фрагментом антитела (например, Fab, Fab' или F(ab')2, FV или dAb). Кроме того, антитела могут быть однодоменными антителами, например, верблюда или человека, с одним доменом VH или VL, которые связываются с DLL4, как например фрагмент dAb.
Варианты данного изобретения, рассматриваемые в данном описании, также включают клетки для продуцирования таких антител. Примеры клеток включают гибридомы или полученные рекомбинантным способом клетки, такие, как клетки яичника китайского хомячка (СНО), модификации клеток СНО (например, DG44) и клетки NS0, которые продуцируют антитела против DLL4. Дополнительную информацию о вариантах клеток СНО можно найти у Andersen and Reilly (2004) Current Opinion in Biotechnology 15, 456-462, которая включена в данное описание в полном объеме путем ссылки. Антитело может быть произведено из гибридомы, секретирующей антитело, или при помощи рекомбинантной инженерии клетки, которая трансфомируется или трансфицируется геном или генами, кодирующим антитело.
Кроме того, одним из вариантов настоящего изобретения является способ получения антител по данному изобретению путем культивирования клеток-хозяев в условиях, когда молекула нуклеиновой кислоты экспрессируется с целью выработки антитела с последующим извлечением антитела. Следует понимать, что варианты данного изобретения также включают любую молекулу нуклеиновой кислоты, которая кодирует антитело или фрагмент антитела по данному изобретению, в том числе последовательности нуклеиновых кислот, оптимизированные для повышения выхода антител или их фрагментов, такие последовательности трансфицируются в клетки хозяина для продуцирования антитела.
Еще один вариант данного изобретения включает способ получения антител, которые специфично связываются с DLL4 и ингибируют биологическую активность DLL4, путем иммунизации млекопитающих клетками, экспрессирующими DLL4 человека, выделенными клеточными мембранами, содержащими DLL4 человека, очищенным DLL4 человека или его фрагментом, и/или одной или несколькими ортологическими последовательностями или их фрагментами.
В других вариантах данного изобретения предлагаются композиции, содержащие нацеленное средство связывания или антитело по данному изобретению или его фрагмент связывания и фармацевтически приемлемый носитель или разбавитель.
Дальнейшие варианты данного изобретения включают способы эффективного лечения животного, страдающего от пролиферативного, ангиогенного заболевания, путем введения животному терапевтически эффективной дозы нацеленного средства связывания, специфично связывающегося с DLL4. В конкретных вариантах данный способ дополнительно включает выбор животного, нуждающегося в лечении опухоли, рака и/или пролиферативного расстройства, а также введение животному терапевтически эффективной дозы нацеленного средства связывания, специфично связывающегося с DLL4.
Дальнейшие варианты данного изобретения включают способы эффективного лечения животного, страдающего от опухолевого заболевания, путем введения животному терапевтически эффективной дозы нацеленного средства связывания, специфично связывающегося с DLL4. В конкретных вариантах данный способ дополнительно включает выбор животного, нуждающегося в лечении опухолевого заболевания, а также введение животному терапевтически эффективной дозы нацеленного средства связывания, специфично связывающегося с DLL4.
Дальнейшие варианты данного изобретения включают способы эффективного лечения животного, страдающего от злокачественной опухоли, путем введения животному терапевтически эффективной дозы нацеленного средства связывания, специфично связывающегося с DLL4. В конкретных вариантах данный способ дополнительно включает выбор животного, нуждающегося в лечении злокачественной опухоли, а также введение животному терапевтически эффективной дозы нацеленного средства связывания, специфично связывающегося с DLL4.
Дальнейшие варианты данного изобретения включают способы эффективного лечения животного, страдающего от заболевания или состояния, связанного с экспрессией DLL4, путем введения животному терапевтически эффективной дозы нацеленного средства связывания, специфично связывающегося с DLL4. В конкретных вариантах данный способ дополнительно включает выбор животного, нуждающегося в лечении заболевания или состояния, связанного с экспрессией DLL4, и введение животному терапевтически эффективной дозы нацеленного средства связывания, специфично связывающегося с DLL4.
Злокачественная опухоль может быть выбрана из группы, состоящей из: меланомы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, глиомы, гепатоцеллюлярного рака (печени), опухоли щитовидной железы, рака желудка, рака предстательной железы, рака молочной железы, рака яичника, рака мочевого пузыря, рака легких, глиобластомы, рака эндометрия, рака почек, рака толстого кишечника, рака поджелудочной железы, рака пищевода, рака головы и шеи, мезотелиомы, саркомы, рака желчных путей (холангиокарциномы), аденокарциномы тонкого кишечника, детских злокачественных новообразований и плоскоклеточной карциномы.
Поддающиеся лечению пролиферативные или ангиогенные заболевания включают опухолевые заболевания, такие как меланома, мелкоклеточный рак легкого, немелкоклеточный рак легкого, глиома, гепатоцеллюлярный рак (печени), опухоль щитовидной железы, рак желудка, рак желчного пузыря, рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря, рак легкого, глиобластома, рак эндометрия, рак почки, рак толстой кишки, рак поджелудочной железы, карцинома яичника, карцинома пищевода, рак головы и шеи, мезотелиома, саркома, рак желчных путей (холангиокарцинома), аденокарцинома тонкого кишечника, детские злокачественные новообразования, плоскоклеточная карцинома и лейкоз, включая хронический миелолейкоз.
В одном из вариантов настоящее изобретение является пригодным для применения с целью ингибирования DLL4 у пациентов с опухолью, которая зависит, полностью или частично, от DLL4.
Дальнейшие варианты данного изобретения включают применение нацеленного средства связывания или антитела по данному изобретению для приготовления лекарственного средства для лечения животного, страдающего от пролиферативного или ангиогенного заболевания. Некоторые варианты применения дополнительно включают выбор животного, нуждающегося в лечении связанного с пролиферацией или ангиогенезом заболевания.
Дальнейшие варианты данного изобретения включают применение нацеленного средства связывания или антитела по данному изобретению для приготовления лекарственного средства для лечения животного, страдающего от опухолевого заболевания. Некоторые варианты применения дополнительно включают выбор животного, нуждающегося в лечении опухолевого заболевания.
Дальнейшие варианты данного изобретения включают применение нацеленного средства связывания или антитела по изобретению для приготовления лекарственного средства для лечения животного, страдающего от неопухолевого заболевания. Некоторые варианты применения дополнительно включают выбор животного, нуждающегося в лечении неопухолевого заболевания.
Дальнейшие варианты данного изобретения включают применение нацеленного средства связывания или антитела по данному изобретению для приготовления лекарственного средства для лечения животного, страдающего от злокачественной опухоли. Некоторые варианты применения дополнительно включают выбор животного, нуждающегося в лечении злокачественной опухоли.
Дальнейшие варианты данного изобретения включают применение нацеленного средства связывания или антитела по данному изобретению для приготовления лекарственного средства для лечения животного, страдающего от заболевания или состояния, связанного с экспрессией DLL4. Некоторые варианты применения дополнительно включают выбор животного, нуждающегося в лечении болезни или состояния, связанного с экспрессией DLL4.
Дальнейшие варианты настоящего изобретения включают нацеленное средство связывания или антитело по данному изобретению для применения в качестве лекарственного средства для лечения животного, страдающего от заболевания, связанного с пролиферацией или ангиогенезом.
Дальнейшие варианты данного изобретения включают нацеленное средство связывания или антитело по данному изобретению для применения в качестве лекарственного средства для лечения животного, страдающего от опухолевого заболевания.
Дальнейшие варианты данного изобретения включают нацеленное средство связывания или антитело по данному изобретению для применения в качестве лекарственного средства для лечения животного, страдающего от злокачественной опухоли.
Дальнейшие варианты данного изобретения включают нацеленное средство связывания или антитело по данному изобретению для применения в качестве лекарственного средства для лечения животного, страдающего от заболевания или состояния, связанного с экспрессией DLL4.
Дальнейшие варианты данного изобретения включают нацеленное средство связывания или антитело по данному изобретению для применения в качестве лекарственного средства для лечения животного, страдающего от индуцированного DLL4 заболевания.
В одном из вариантов лечение
- пролиферативного или ангиогенетического заболевания;
- опухолевого заболевания;
- злокачественной опухоли или
- заболеваний или состояния, связанного с экспрессией DLL4, или
включает контроль, облегчение, предупреждение любого из вышеупомянутых заболеваний или состояний.
В одном из вариантов лечение опухолевых заболеваний включает подавление роста опухоли, задержку роста опухоли, регрессию опухоли, уменьшение опухоли, увеличение времени до возобновления роста опухоли после прекращения лечения, увеличение времени до возникновения рецидива опухоли, замедление прогрессирования заболевания.
В некоторых вариантах данного изобретения вместо животного лечению подлежит человек.
В некоторых вариантах данного изобретения нацеленным средством связывания является полностью человеческое моноклональное антитело.
В некоторых вариантах данного изобретения нацеленное средство связывания выбрано из группы, состоящей из полностью человеческих моноклональных антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK.
Варианты данного изобретения включают конъюгаты, содержащие нацеленное средство связывания, рассматриваемое в данном описании, и терапевтическое средство. В некоторых вариантах данного изобретения терапевтическое средство является токсином. В других вариантах терапевтическое средство является радиоизотопом. В других вариантах терапевтическое средство является фармацевтической композицией.
В другом аспекте предлагается способ избирательного уничтожения раковой клетки у пациента. Данный способ включает введение конъюгата полностью человеческого антитела пациенту. Конъюгат полностью человеческого антитела содержит антитело, которое может связываться с DLL4, и средство. Средством является токсин, радиоизотоп или другое вещество, которое вызывает гибель раковой клетки. Конъюгат антитела при этом выборочно вызывает гибель раковых клеток.
В одном из аспектов предлагается конъюгат полностью человеческого антитела, которое специфично связывается с DLL4. Прикрепление к антителу средства и связывание антитела с клеткой приводит к доставке средства в клетку. В одном из вариантов конъюгат полностью человеческого антитела связывается с внеклеточным доменом DLL4. В другом варианте антитело и конъюгированный токсин интернализируются клеткой, экспрессирующей DLL4. Еще в одном варианте средством является цитотоксическое средство. В другом варианте средством является, например, сапорин или ауристатин, экзотоксин Pseudomonas, гелонин, рицин, калихеамицин или иммуноконъюгаты на основе майтансина, и т.п. В еще одном варианте средством является радиоизотоп.
Нацеленное средство связывания или антитело по данному изобретению может вводиться отдельно или может вводиться в сочетании с дополнительным антителом или химиотерапевтическим препаратом или лучевой терапией. Например, смесь моноклональных, олигоклональных или поликлональных антител против DLL4, блокирующих адгезию, инвазию, ангиогенез или пролиферацию клетки, можно вводить в сочетании с лекарственным средством, вызывающим ингибирование пролиферации опухолевой клетки.
Другой вариант данного изобретения включает способ диагностики заболеваний или состояний, в которых антитело, описанное в данном описании, применяется для выявления уровня DLL4 в организме пациента или в образцах пациента. В одном из вариантов образцом пациента является кровь, сыворотка крови или моча. В других вариантах представлены способы выявления факторов риска, диагностики заболеваний и определения стадии заболевания, которые включают определение экспрессии и/или чрезмерной экспрессии DLL4 с применением анти-DLL4 антител. В некоторых вариантах способы включают введение пациенту конъюгата полностью человеческого антитела, избирательно связывающегося с DLL4 клетки. Конъюгат антитела включает антитело, которое специфично связывается с DLL4 и меткой. Данные способы дополнительно включают наблюдение за наличием метки у пациента. Относительно большое количество метки указывает на относительно высокий риск заболевания, а относительно небольшое количество метки указывает на сравнительно низкий риск заболевания. В одном из вариантов меткой является белок, дающий зеленую флуоресценцию.
В настоящем изобретении также предлагаются способы анализа уровня DLL4 в образце пациента, включающие обеспечение контакта антител, описанных в данном описании, с биологическим образцом пациента, и выявление уровня связывания между указанным антителом и DLL4 указанного образца. В более конкретных вариантах биологическим образцом является кровь, плазма или сыворотка крови.
Другой вариант данного изобретения включает способ диагностики состояния, связанного с экспрессией DLL4 в клетке путем обеспечения контакта сыворотки или клетки с антителом, рассматриваемым в данном описании, с обнаружением таким образом наличия DLL4. В одном из вариантов состояние может быть пролиферативным, ангиогенетическим заболеванием, а также заболеванием, связанным с адгезией или инвазией клеток, в том числе, но не ограничиваясь им, опухолевым заболеванием.
Другой вариант данного изобретения включает набор для обнаружения DLL4 в тканях, клетках или других биологических жидкостях млекопитающих для выявления DLL4-зависимых заболеваний. Комплект содержит антитела, рассматриваемые в данном описании, и средства для индикации реакции антител с DLL4, если она происходит. В одном из вариантов антителом является моноклональное антитело. В одном из вариантов антитело, которое связывается с DLL4, является меченым. В другом варианте антителом является немеченое первичное антитело, и набор также включает средство для обнаружения первичных антител. В одном из вариантов средство для обнаружения включает меченое вторичное антитело, которое является антителом против иммуноглобулина. Антитела могут быть мечены маркером, выбранным из группы, состоящей из флуорохрома, фермента, радионуклида и контрастного вещества.
В некоторых вариантах нацеленное средство связывания или антитело, рассматриваемое в данном описании, может быть модифицировано, чтобы повысить его возможности фиксировать комплемент и участвовать в комплемент-зависимой цитотоксичности (CDC). В других вариантах нацеленное средство связывания или антитело может быть модифицировано, чтобы повысить его возможности активировать эффекторные клетки и участвовать в антителозависимой цитотоксичности (ADCC). В других вариантах нацеленное средство связывания или антитело, рассматриваемое в данном описании, может быть изменено как для повышения его способности активировать эффекторные клетки и участвовать в антителозависимой цитотоксичности (ADCC), так и для повышения его способности фиксировать комплемент и участвовать в комплемент-зависимой цитотоксичности (CDC).
В некоторых вариантах нацеленные средства связывания или антитела, рассматриваемые в данном описании, могут быть модифицированы, чтобы уменьшить их возможности фиксировать комплимент и участвовать в комплемент-зависимой цитотоксичности (CDC). В других вариантах нацеленные средства связывания или антитела можно модифицировать для уменьшения их возможности активировать эффекторные клетки и участвовать в антителозависимой цитотоксичности (ADCC). В других вариантах нацеленные средства связывания или антитела, рассматриваемые в данном описании, можно модифицировать как для снижения их способности активировать эффекторные клетки и участвовать в антителозависимой цитотоксичности (ADCC), так и для уменьшения их возможности фиксировать комплемент и участвовать в комплемент-зависимой цитотоксичности (CDC).
В некоторых вариантах период полувыведения нацеленного средства связывания или антитела, рассматриваемого в данном описании, и композиций по данному изобретению составляет, по крайней мере, от 4 до 7 дней. В конкретных вариантах средний период полувыведения нацеленного средства связывания или антитела, рассматриваемого в данном описании, и композиций по рассматриваемого изобретению составляет, по крайней мере, от 2 до 5 дней, от 3 до 6 дней, от 4 до 7 дней, от 5 до 8 дней, от 6 до 9 дней, от 7 до 10 дней, от 8 до 11 дней, от 8 до 12, от 9 до 13, от 10 до 14, от 11 до 15, от 12 до 16, от 13 до 17, от 14 до 18, от 15 до 19 или от 16 до 20 дней. В других вариантах средний период полувыведения нацеленного средства связывания или антитела, рассматриваемого в данном описании, и композиций по данному изобретению составляет, по крайней мере, от 17 до 21 дня, от 18 до 22 дней, от 19 до 23 дней, от 20 до 24 дней, от 21 до 25 дней, от 22 до 26 дней, от 23 до 27 дней, от 24 до 28 дней, от 25 до 29 дней или от 26 до 30 дней. В большинстве вариантов период полувыведения нацеленного средства связывания или антитела, рассматриваемого в данном описании, и композиций по данному изобретению может составлять до 50 дней. В конкретных вариантах период полувыведения антител и композиций по данному изобретению может быть продлен способами, известными в данной области. Такое продление может, в свою очередь, уменьшить количество и/или частоту введения композиций антител. Антитела с улучшенным периодом полураспада in vivo и способы их получения раскрыты в патенте США №6277375; и Международных публикациях WO 98/23289 и WO 97/3461.
В другом варианте настоящего изобретения предлагается изделие, в том числе емкость. Данная емкость содержит композицию с нацеленным средством связывания или антителом, рассматриваемым в данном описании, и листок-вкладыш или этикетку, где указано, что данная композиция может быть применена для лечения связанных с клеточной адгезией, инвазией, ангиогенезом и/или пролиферацией заболеваний, в том числе, но не ограничиваясь ими, характеризующихся экспрессией или чрезмерной экспрессией DLL4.
В других вариантах настоящего изобретения предлагается набор, включающий композицию, содержащую нацеленное средство связывания или антитело, рассматриваемое в данном описании, и инструкцию по введению композиции субъекту, нуждающемуся в лечении.
В настоящем изобретении предлагается формула белков, включающих модификацию участка Fc. Это означает неприродный участок Fc, например, участок Fc, содержащий один или несколько не встречаемых в природе аминокислотных остатков. Также варианты участков Fc по настоящему изобретению охватывают участки Fc, которые включают делеции, вставки и/или модификации аминокислот.
Период полувыведения из сыворотки белков, содержащих участки Fc, может быть увеличен путем увеличения сродства связывания участка Fc с FcRn. В одном из вариантов модификация белка Fc демонстрирует увеличенный период полувыведения из сыворотки по сравнению с молекулой сравнения.
В другом варианте настоящего изобретения предлагается модификация Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, в одном или нескольких положениях, выбранных из группы, состоящей из 239, 330 и 332, где нумерация соответствует индексу ЕС, изложенному Kabat. В конкретном варианте настоящего изобретения предлагается модификация Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 239D, 330L и 332Е, где нумерация соответствует индексу ЕС, изложенному Kabat. При желании участок Fc может дополнительно содержать дополнительные не встречающиеся в природе аминокислоты в одном или несколько положениях, выбранных из группы, состоящей из 252, 254 и 256, где нумерация соответствует индексу ЕС, изложенному Kabat. В конкретном варианте настоящего изобретения предлагается модификация Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 239D, 330L и 332Е, где нумерация соответствует индексу ЕС, изложенному Kabat, и, по крайней мере, одну не встречающуюся в природе аминокислоту, в одном или нескольких положениях, выбранных из группы, состоящей из 252Y, 254Т и 256Е, где нумерация соответствует индексу ЕС, изложенному Kabat.
В другом варианте настоящего изобретения предлагается модификация Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, в одном или нескольких положениях, выбранных из группы, состоящей из 234, 235 и 331, где нумерация соответствует индексу ЕС, изложенному Kabat. В конкретном варианте настоящего изобретения предлагается модификация Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 234F, 235F, 235Y и 331S, где нумерация соответствует индексу ЕС, изложенному Kabat. В дальнейшем конкретном варианте модификация Fc по данному изобретению содержит не встречающиеся в природе аминокислотные остатки 234F, 235F, 331S, где нумерация соответствует индексу ЕС, изложенному Kabat. В другом конкретном варианте модификация Fc по данному изобретению содержит не встречающиеся в природе аминокислотные остатки 234F, 235Y и 331S, где нумерация соответствует индексу ЕС, изложенному Kabat. При желании область Fc может дополнительно содержать дополнительную не встречающуюся в природе аминокислоту в одном или несколько положениях, выбранных из группы, состоящей из 252, 254, и 256, где нумерация соответствует индексу ЕС, изложенному Kabat. В конкретном варианте настоящего изобретения предлагается модификация Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 234F, 235F, 235Y и 331S, где нумерация соответствует индексу ЕС, изложенному Kabat; и, по крайней мере, одну не встречающуюся в природе аминокислоту, в одном или несколько положениях, выбранных из группы, состоящей из 252Y, 254Т и 256Е, где нумерация соответствует индексу ЕС, изложенному Kabat.
В другом варианте настоящего изобретения предлагается формула белка с модификацией Fc, при которой участок Fc содержит, по крайней мере, не встречающуюся в природе аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 239, 330 и 332, где нумерация соответствует индексу ЕС, изложенному Kabat. В конкретном варианте настоящего изобретения предлагается формула белка с модификацией Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 239D, 330L и 332Е, где нумерация соответствует индексу ЕС, изложенному Kabat. При желании участок Fc может дополнительно содержать дополнительную не встречающуюся в природе аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 252, 254, и 256, где нумерация соответствует индексу ЕС, изложенному Kabat. В конкретном варианте настоящего изобретения предлагается формула белка с модификацией Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 239D, 330L и 332Е, где нумерация соответствует индексу ЕС, изложенному Kabat, и, по крайней мере, одну не встречающуюся в природе аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 252Y, 254Т и 256Е, где нумерация соответствует индексу ЕС, изложенному Kabat.
В другом варианте настоящего изобретения предлагается формула белка с модификацией Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту в одном или несколько положениях, выбранных из группы, состоящей из 234, 235 и 331, где нумерация соответствует индексу ЕС, изложенному Kabat. В конкретном варианте настоящего изобретения предлагается формула белка с модификацией Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 234F, 235F, 235Y, и 331S, где нумерация соответствует индексу ЕС, изложенному Kabat. При желании участок Fc может дополнительно содержать дополнительную не встречающуюся в природе аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 252, 254 и 256, где нумерация соответствует индексу ЕС, изложенному Kabat. В конкретном варианте настоящего изобретения предлагается формула белка с модификацией Fc, при которой участок Fc содержит, по крайней мере, одну не встречающуюся в природе аминокислоту, выбранную из группы, состоящей из 234F, 235F, 235Y, и 331S, где нумерация соответствует индексу ЕС, изложенному Kabat; и, по крайней мере, одну не встречающуюся в природе аминокислоту в одном или нескольких положениях, выбранных из группы, состоящей из 252Y, 254Т и 256Е, где нумерация соответствует индексу ЕС, изложенному Kabat.
Способы генерации не встречающихся в природе участков Fc известны в данной области. Так, например, замены и/или делеции аминокислот могут быть порождены методами мутагенеза, в том числе, не ограничиваясь ими, сайт-направленным мутагенезом (Kunkel, Proc. Natl. Acad. Sci. USA 82:488-492 (1985)), ПЦР мутагенезом (Higuchi, в "PCR Protocols: A Guide to Methods and Applications", Academic Press, San Diego, pp.177-183 (1990)), и кассетным мутагенезом (Wells et al, Gene 34:315-323 (1985)). Предпочтительно осуществлять сайт-направленный мутагенез методом ПЦР с амплификацией перекрывающихся фрагментов (Higuchi, в "PCR Technology: Principles and Applications for DNA Amplification", Stockton Press, New York, pp.61-70 (1989)). Технология амплификации перекрывающихся фрагментов ПЦР (Higuchi, там же) также может быть использована для введения любой желаемой мутации(ий) в последовательность мишени (стартовая ДНК). Например, первый цикл метода амплификации перекрывающихся фрагментов ПЦР включает амплификацию последовательности мишени с внешним праймером (праймер 1) и внутренним праймером мутагенеза (праймер 3), и отдельно с вторым внешним праймером (праймер 4) и внутренним праймером (праймер 2), что дает два ПЦР сегмента (сегменты А и В). Внутренний праймер мутагенеза (праймер 3) предназначен для размещения модификации в последовательность мишени указанной желаемой мутации(ий). Во втором цикле ПЦР продукты первого цикла ПЦР (сегменты А и В) амплифицируют методом ПЦР с использованием двух внешних праймеров (праймеров 1 и 4). В результате полноразмерный ПЦР сегмент (сегмент С) обрабатывается рестриктазой, и полученный фрагмент рестрикции клонируют в соответствующий вектор. Как первый шаг мутагенеза, стартовая ДНК (например, кодированный слитый белок Fc, антитело или просто участок Fc) функционально клонируют в вектор мутагенеза. Праймеры предназначены для отражения желаемой замены аминокислот. Другие методы, пригодные для генерации модификаций участка Fc, известны в данной области (см., например, патенты США №№5624821; 5885573; 5677425; 6165745; 6277375; 5869046; 6121022; 5624821; 5648260; 6528624; 6194551; 6737056; 6821505; 6277375; публикации патентов США №№2004/0002587 и публикации РСТ WO 94/29351; WO 99/58572; WO 00/42072; WO 02/060919; WO 04/029207; WO 04/099249; WO 04/063351).
В некоторых вариантах настоящего изобретения гликозилирование примеров антител, приведенных в данном описании, приводит к увеличению ADCC и CDC эффекторной функции. См. Shields RL et al, (2002) JBC. 277:26733; Shinkawa T et al, (2003) JBC. 278:3466 и Okazaki A et al, (2004) J. Mol. Biol., 336: 1239. В некоторых вариантах модификация белка Fc включает одну или несколько инженерных гликоформ, то есть состав углеводов, ковалентно связанных с молекулой, включающей участок Fc. Инженерная гликоформа может быть пригодна для различных целей, включая как минимум увеличение или снижение эффекторной функции. Инженерные гликоформы могут быть получены любым способом, известным специалистам в данной области, например, с помощью экспрессии инженерных или модифицированных штаммов, коэкспрессии одного или нескольких ферментов, например DI N-ацетилглюкозаминилтрансферазы III (GnTI11), экспрессией молекулы, включающей участок Fc различных организмов или клеточных линий из различных организмов, или с помощью модификации углевода(ов) с последующей экспрессией молекулы, включающей участок Fc. Способы создания инженерных гликоформ известны в данной области и включают, как минимум, описанные у Umana et al, 1999, Nat. Biotechnol 17:176-180; Davies et al, 20017 Biotechnol Bioeng 74:288-294; Shields et al, 2002, J Biol Chem 277:26733-26740; Shinkawa et al, 2003, J Biol Chem 278:3466-3473); патент США №6,602,684; серийный номер США 10/277,370; серийный номер США 10/113,929; РСТ WO 00/61739A1; РСТ WO 01/292246А1; РСТ WO 02/311140А1; РСТ WO 02/30954A1; технология Potillegent™ (Biowa, Inc. Princeton, N.J.); технология инженерного гликозилирования GlycoMAb™ (GLYCART biotechnology AG, Zurich, Switzerland). См., например, WO 00061739; EA01229125; US 20030115614; Okazaki et al, 2004, JMB, 336:1239-49.
Также в данной области известно, что гликозилирование участки Fc можно модифицировать для увеличения или уменьшения эффекторной функции (см., например, Umana et al, 1999, Nat. Biotechnol 17:176-180; Davies et al, 2001, Biotechnol Bioeng 74:288-294; Shields et al, 2002, J Biol Chem 277:26733-26740; Shinkawa et al, 2003, J Biol Chem 278:3466-3473; патент США №6,602,684; серийный номер США 10/277,370; серийный номер США 10/113,929; РСТ WO 00/61739A1; РСТ WO 01/292246A1; РСТ WO 02/311140А1; РСТ WO 02/30954A1; технологию Potillegent™ (Biowa, Inc. Princeton, N.J.); технологию инженерного гликозилирования GlycoMAb™ (GLYCART biotechnology AG, Цюрих, Швейцария). Соответственно, в одном из вариантов участок Fc антитела по данному изобретению включает измененное гликозилирование аминокислотных остатков. В другом варианте изменение гликозилирования аминокислотных остатков приводит к снижению эффекторной функции. Еще в одном варианте изменение гликозилирования аминокислотных остатков приводит к увеличению эффекторной функции. В конкретном варианте в участке Fc уменьшено фукозилирование. В другом варианте участок Fc является афукозилированным (см. например, публикацию патентной заявки США №2005/0226867).
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 изображена гистограмма, показывающая влияние антител DLL4 IgG1 на ингибирование пролиферации HUVEC, стимулированное DLL4. Данные представлены по независимым экспериментам n>2.
На фиг.2 изображена гистограмма, показывающая влияние антител DLL4 IgG2/4 на образование в пробирке HUVEC in vitro, которое оценивали при помощи измерения длины сосуда (мм) и количества бифуркаций.
На фиг.3 изображена гистограмма, показывающая влияние немеченых антител анти-DLL4 на замещение связывания Alexa-647, меченного 21H3RK в концентрации 0,1 мкг/мл, как определяли при помощи анализа FACS.
На фиг.4 изображен линейный график, показывающий 12 химерных вариантов DLL4/DLL1. Все варианты кодируют внеклеточные домены DLL4 человека с заменой отдельных субдоменов DLL1 человека или комбинированных сегментов доменов, как описано.
На фиг.5 изображены линейные графики, показывающие связывание 21H3RK с химерными «выбитыми» ("KO") вариантами, которые кодируют DLL4, с заменой сегментов внеклеточного домена на соответствующие домены DLL1.
На фиг.6 изображены линейные графики, показывающие связывание 21H3RK с химерными «выбитыми» ("KO") вариантами, которые кодируют DLL4, с заменой сегментов внеклеточного домена на соответствующие домены DLL1 и химерными «вбитыми» ("KI") вариантами, которые кодируют DLL4, с заменой участков на дубликаты DLL4.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ
Варианты настоящего изобретения относятся к новому набору молекул, блокирующих DLL4, таких как, например, антитела, ингибирующие передачу сигнала рецептором Notch. Такие молекулы можно применять в качестве монотерапии, или альтернативно, в сочетании с другими связывающимися антителами/средствами. Их также можно применять в сочетании с любыми стандартными или новыми противораковыми средствами.
Варианты по данному изобретению относятся к нацеленным средствам связывания, которые связываются с DLL4. В некоторых вариантах нацеленные средства связывания связываются с DLL4 и ингибируют связывание DLL4 с рецептором Notch (например, Notch 1, Notch 2, Notch 3 и/или Notch 4). В некоторых вариантах такое связывание может в некотором отношении нейтрализовать, блокировать, подавлять, отменять или препятствовать результатам связывания с DLL4. В одном из вариантов нацеленные средства связывания являются моноклональными антителами или их фрагментами связывания. Такие моноклональные антитела могут быть названы в данном описании анти-DLL4 антителами.
Другие варианты настоящего изобретения включают полностью человеческие анти-DLL4 антитела и препараты антител, пригодные с терапевтической точки зрения. В одном из вариантов препараты анти-DLL4 антитела по данному изобретению обладают желаемыми лечебными свойствами, в том числе высоким сродством связывания с DLL4, способностью блокировать взаимодействия рецептора DLL4 и лиганда, способностью блокировать проведение сигнала, опосредованного DLL4, способностью стимулировать пролиферацию эндотелиальных клеток и образование нефункциональных кровяных сосудов, способностью модулировать рекрутмент перицитов в сосуды, способностью ингибировать рост опухоли, способностью усиливать гипоксию/некроз опухоли, способностью изменять путь метаболизма эндотелиальных верхушечных/стебельковых клеток и способностью модулировать уровень выживаемости клеток опухоли или уровень выживаемости раковых стволовых клеток и самовосстановления.
Кроме того, варианты по данному изобретению включают способы применения антител, рассматриваемых в данном описании, для лечения заболеваний. Анти-DLL4 антитела по данному изобретению пригодны для предотвращения DLL4-опосредованного онкогенеза и инвазии опухоли в здоровой ткани. Кроме того, антитела DLL4 могут быть полезными для лечения заболеваний, связанных с ангиогенезом, таких как глазные заболевания, такие как ВДМ, воспалительных заболеваний, таких как ревматоидный артрит, и сердечнососудистых заболеваний и сепсиса, а также онкологических заболеваний. Любое заболевание, которое характеризуется любым типом злокачественной опухоли, включая метастатический рак, лимфатическую опухоль и рак крови, можно также лечить по данному механизму ингибирования. Типичный рак у людей включает опухоли мочевого пузыря, молочной железы, предстательной железы, базально-клеточный рак, рак желчных путей, рак мочевого пузыря, рак кости, рак головного мозга и ЦНС (например, глиома), рак шейки матки, хориокарциному, рак толстой кишки и прямой кишки, рак соединительной ткани, рак пищеварительной системы; рак эндометрия, карцинома пищевода, рак глаза, рак головы и шеи; рак желудка; эпителиому; рак почки, рак гортани, лейкемию; рак печени, рак легких (например, мелкоклеточный и немелкоклеточный рак); лимфому, включая лимфому Ходжкина и неходжкинскую лимфому, меланому; миелому, нейробластому, рак ротовой полости (например, губ, языка, рта и глотки); рак яичника, рак поджелудочной железы, ретинобластому; рабдомиосаркому, рак прямой кишки, рак почки, рак дыхательных путей; саркому, рак кожи, рак желудка, рак яичка, рак щитовидной железы; рак матки, рак мочевых путей, а также другие виды карциномы и саркомы. Онкологические заболевания, обычно диагностированные у собак, кошек и других домашних животных, включают, не ограничиваясь ими, лимфосаркому, остеосаркому, опухоли молочной железы, мастоцитому, опухоль мозга, меланому, аденосквамозный рак, карциноидную опухоль легкого, опухоль бронхиальной железы, бронхиолярную карциному, фиброму, миксохондрому, легочную саркому, нейросаркому, остеому, аденопапиллярную опухоль, ретинобластому, саркому Юинга, опухоль Вильма, лимфому Беркитта, микроглиому, нейробластому, остеокластому, оральную неоплазию, фибросаркому, остеосаркому и рабдомиосаркому, генитальный плоскоклеточный рак, опухоли, передаваемые половым путем, опухоль яичка, семиному, опухоль клеток Сертоли, гемангиоперицитому, гистиоцитому, хлорому (например, гранулоцитарную саркому), корнеальную папиллому, корнеальный плоскоклеточный рак, гемангиосаркому, мезотелиому плевры, опухоль базальных клеток, тимому, опухоли желудка, карциному надпочечников, оральный папилломатоз, гемангиоэндотелиому и цистоаденому, фолликулярную лимфому, кишечную лимфосаркому, фибросаркому и плоскоклеточный рак легкого. У грызунов, таких как хорек, типичные опухоли включают инсулиному, лимфому, саркому, невриному, опухоль островковых клеток поджелудочной железы, желудочную лимфому MALT и аденокарциному желудка. Новообразования, поражающие сельскохозяйственных животных, включают лейкемию, гемангиоперицитому и глазную неоплазию жвачных животных (у крупного рогатого скота); препуциальную фибросаркому, язвенный плоскоклеточный рак, препуциальную карциному, неоплазию соединительной ткани и мастоцитому (у лошадей); гепатоцеллюлярную карциному (у свиней); лимфому и аденоматоз легких (у овец); легочную саркому, лимфому, саркому Рауса, ретикулоэндотелиоз, фибросаркому, нефробластому, лимфому В-клеток и лимфоидный лейкоз (у птиц); ретинобластому, печеночную неоплазию, лимфосаркому (лимфобластную лимфому), плазмоцитоидный лейкоз и саркому плавательного пузыря (у рыб), казеозный лимфаденит (CLA): хронические, инфекционные, заразные болезни овец и коз, вызванные бактериями Corynebacterium pseudotuberculosis, и инфекционные опухоли легких овец, вызванные эпизоотическим легочным аденоматозом овец.
Другие варианты настоящего изобретения включают диагностические тесты для определения, в частности, количества DLL4 в биологическом образце. Набор реактивов может включать нацеленное средство связывания или антитело, описанное в данном описании, вместе с необходимыми метками для обнаружения таких антител. Эти диагностические тесты являются пригодными для анализа зависимых от адгезии, инвазии, ангиогенеза или пролиферации клеток заболеваний, в том числе, не ограничиваясь ими, опухолевые заболевания.
Другим аспектом данного изобретения является антагонист биологической активности DLL4, где антагонист связывается с DLL4. В одном из вариантов антагонистом является нацеленное средство связывания, такое как антитело. Антагонист может быть выбран из антител, рассматриваемых в данном описании, например, антитело 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK.
В одном из вариантов антагонист биологической активности DLL4 может связываться с DLL4 и тем самым ингибировать или подавлять связывание лиганда с Notch, ингибируя адгезию и/или инвазию и/или ангиогенез и/или пролиферацию клеток.
Одним из вариантов является нацеленное средство связывания, которое связывается с тем же эпитопом или эпитопами, что и полностью человеческое моноклональное антитело 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK.
Одним из вариантов является антитело, которое связывается с тем же эпитопом или эпитопами, что и полностью человеческое моноклональное антитело 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK.
Одним из вариантов является гибридома, которая продуцирует нацеленное средство связывания, описанное выше. Одним из вариантов является гибридома, которая продуцирует легкую цепь и/или тяжелую цепь антитела, описанного выше. В одном из вариантов гибридома продуцирует легкую цепь и/или тяжелую цепь полностью человеческого моноклонального антитела. В другом варианте гибридома продуцирует легкую цепь и/или тяжелую цепь полностью человеческого моноклонального антитела 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK. Альтернативно, гибридома может продуцировать антитело, которое связывается с тем же эпитопом или эпитопами, что и полностью человеческое моноклональное антитело 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK.
Другим вариантом является молекула нуклеиновой кислоты, кодирующая нацеленное средство связывания, описанное выше. Одним из вариантов является молекула нуклеиновой кислоты, кодирующая легкую цепь или тяжелую цепь антитела, описанного выше. В одном из вариантов молекула нуклеиновой кислоты кодирует легкую цепь или тяжелую цепь полностью человеческого моноклонального антитела. Еще одним вариантом является молекула нуклеиновой кислоты, кодирующая легкую цепь или тяжелую цепь полностью человеческого моноклонального антитела, выбранного из антител 4В4, 2Н10, 21F7, 12А1, 17F3, 9G8, 20G8, 21Н3, 1Е4, 3А7, 4В3, 1D4 или 21H3RK.
Другим вариантом данного изобретения является вектор, содержащий молекулу или молекулы нуклеиновой кислоты, описанные выше, где вектор кодирует нацеленное средство связывания, охарактеризованное выше. Одним из вариантов изобретения является вектор, содержащий молекулу или молекулы нуклеиновой кислоты, описанные выше, где вектор кодирует легкую цепь и/или тяжелую цепь антитела, охарактеризованного выше.
Еще одним вариантом изобретения является клетка-хозяин, содержащая вектор, описанный выше. Альтернативно, клетка-хозяин может содержать более одного вектора.
Кроме того, одним из вариантов настоящего изобретения является способ получения нацеленного средства связывания по данному изобретению путем культивирования клеток-хозяев в условиях, при которых молекула нуклеиновой кислоты экспрессируется для получения нацеленного средства связывания, с последующим выделением нацеленного средства связывания. Одним из вариантов настоящего изобретения является способ получения антител по данному изобретению путем культивирования клеток-хозяев в условиях, когда молекула нуклеиновой кислоты экспрессируется для получения антитела, с последующим выделением антитела.
Один из вариантов изобретения включает способ получения нацеленного средства связывания путем трансфекции, по крайней мере, одной клетки-хозяина, по крайней мере, одной молекулой нуклеиновой кислоты, кодирующей нацеленное средство связывания, описанное выше, экспрессии молекулы нуклеиновой кислоты в клетке-хозяине и выделения нацеленного средства связывания. Один из вариантов настоящего изобретения включает способ получения антитела путем трансфекции, по крайней мере, одной клетки-хозяина, по крайней мере, одной молекулой нуклеиновой кислоты, кодирующей антитело, описанное выше, экспрессии молекулы нуклеиновой кислоты в клетке-хозяине и выделения антитела.
Согласно другому аспекту, данное изобретение включает способ обеспечения антагонизма биологической активности DLL4 путем введения антагониста, рассматриваемого в данном описании. Данный способ может включать выбор животного, нуждающегося в лечении заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией, и введение животному терапевтически эффективной дозы антагониста биологической активности DLL4.
Другой аспект данного изобретения включает способ обеспечения антагонизма биологической активности DLL4 путем введения нацеленного средства связывания, описанного выше. Данный способ может включать выбор животного, нуждающегося в лечении заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией, и введение животному терапевтически эффективной дозы нацеленного средства связывания, обеспечивающего антагонизм биологической активности DLL4.
Другой аспект настоящего изобретения включает способ обеспечения антагонизма биологической активности DLL4 путем введения антител, описанных выше. Данный способ может включать выбор животного, нуждающегося в лечении заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией, и введение животному терапевтически эффективной дозы антитела, которое обеспечивает антагонизм биологической активности DLL4.
Соответственно, другим аспектом является описанный способ лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией, у животного путем введения терапевтически эффективного количества антагониста биологической активности DLL4. Данный способ может включать выбор животного, нуждающегося в лечении заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией клеток, и введение животному терапевтически эффективной дозы антагониста биологической активности DLL4.
Соответственно, еще одним аспектом является описанный способ лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией, у животного путем введения терапевтически эффективного количества нацеленного средства связывания, которое обеспечивает антагонизм биологической активности DLL4. Данный способ может включать выбор животного, нуждающегося в лечении заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией, и введение животному терапевтически эффективной дозы нацеленного средства связывания, которое вызывает антагонизм биологической активности DLL4. Нацеленное средство связывания может быть введено отдельно или может быть введено в сочетании с дополнительными антителами или химиотерапевтическими препаратами или в сочетании с лучевой терапией.
Соответственно, другим аспектом является описанный способ лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией, у животного путем введения терапевтически эффективного количества антитела, которое обеспечивает антагонизм биологической активности DLL4. Данный способ может включать выбор животного, нуждающегося в лечении заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией клеток, и введение животному терапевтически эффективной дозы антитела, которое обеспечивает антагонизм биологической активности DLL4. Антитело может быть введено отдельно или может быть введено в сочетании с дополнительными антителами или химиотерапевтическими препаратами или в сочетании с лучевой терапией.
Соответственно еще одним аспектом является описанный способ лечения рака у животного путем введения терапевтически эффективного количества антагониста биологической активности DLL4. Данный способ может включать выбор животного, нуждающегося в лечении рака, а также введение животному терапевтически эффективной дозы антагониста, который обеспечивает антагонизм биологической активности DLL4. Антагонист может быть введен отдельно или может быть введен в сочетании с дополнительными антителами или химиотерапевтическими препаратами или в сочетании с лучевой терапией.
Соответственно, еще одним аспектом является описанный способ лечения рака у животного путем введения терапевтически эффективного количества нацеленного средства связывания, которое вызывает антагонизм биологической активности DLL4. Данный способ может включать выбор животного, нуждающегося в лечении рака, а также введение животному терапевтически эффективной дозы нацеленного средства связывания, которое обеспечивает антагонизм биологической активности DLL4. Нацеленное средство связывания может быть введено отдельно или может быть введено в сочетании с дополнительными антителами или химиотерапевтическими препаратами или в сочетании с лучевой терапией.
Соответственно, еще одним аспектом является описанный способ лечения рака у животного путем введения терапевтически эффективного количества антитела, которое обеспечивает антагонизм биологической активности DLL4. Данный способ может включать выбор животного, нуждающегося в лечении рака, а также введение животному терапевтически эффективной дозы антитела, которое вызывает антагонизм биологической активности DLL4. Антитело может быть введено отдельно или может быть введено в сочетании с дополнительными антителами или химиотерапевтическими препаратами или в сочетании с лучевой терапией.
Соответственно, другим аспектом является описанный способ уменьшения или подавления пролиферации, адгезии, инвазии и/или ангиогенеза клеток опухоли у животного путем введения терапевтически эффективного количества антитела, которое обеспечивает антагонизм биологической активности DLL4. Данный способ может включать выбор животного, нуждающегося в уменьшении или подавлении пролиферации, адгезии, инвазии и/или ангиогенеза клеток, и введение животному терапевтически эффективной дозы антитела, которое обеспечивает антагонизм биологической активности DLL4. Антитело может быть введено отдельно или может быть введено в сочетании с дополнительными антителами или химиотерапевтическими препаратами или в комбинации с лучевой терапией.
Соответственно, еще одним аспектом является описанный способ подавления роста опухоли и/или метастазов у животного путем введения терапевтически эффективного количества антитела, которое обеспечивает антагонизм биологической активности DLL4. Данный способ может включать выбор животного, нуждающегося в подавлении роста опухоли и/или метастазов, и введение животному терапевтически эффективной дозы антитела, которое вызывает антагонизм биологической активности DLL4. Антитело может быть введено отдельно или может быть введено в сочетании с дополнительными антителами или химиотерапевтическими препаратами или в комбинации с лучевой терапией.
В соответствии с другим аспектом настоящего изобретения предлагается применение антагониста биологической активности DLL4 для изготовления лекарственного средства для лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией. В одном из вариантов антагонистом биологической активности DLL4 является нацеленное средство связывания по данному изобретению. В одном из вариантов антагонистом биологической активности DLL4 является антитело по данному изобретению.
Соответственно, другим аспектом настоящего изобретения является антагонист биологической активности DLL4 для применения в качестве лекарственного средства для лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией. В одном из вариантов антагонистом биологической активности DLL4 является нацеленное средство связывания по данному изобретению. В одном из вариантов антагонистом биологической активности DLL4 является антитело по данному изобретению.
Соответственно другому аспекту настоящего изобретения предлагается применение нацеленного средства связывания или антитела, которое обеспечивает антагонизм биологической активности DLL4, для изготовления лекарственного средства для лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией.
Соответственно другому аспекту настоящего изобретения предлагается нацеленное средство связывания или антитело, которое обеспечивает антагонизм биологической активности DLL4 для применения в качестве лекарственного средства для лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией.
Соответственно другому аспекту настоящего изобретения предлагается применение нацеленного средства связывания или антитела, которое обеспечивает антагонизм биологической активности DLL4, для изготовления лекарственного средства для лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией.
Соответственно другому аспекту настоящего изобретения предлагается антитело, которое обеспечивает антагонизм биологической активности DLL4 для применения в качестве лекарственного средства для лечения заболеваний, связанных с клеточной адгезией и/или инвазией и/или ангиогенезом и/или пролиферацией.
Соответственно еще одному аспекту данного изобретения предлагается применение антагониста биологической активности DLL4 для изготовления лекарственного средства для лечения рака у млекопитающих. В одном из вариантов антагонистом биологической активности DLL4 является нацеленное средство связывания по данному изобретению. В одном из вариантов антагонистом биологической активности DLL4 является антитело по данному изобретению.
Соответственно другому аспекту настоящего изобретения предлагается антагонист биологической активности DLL4 для применения в качестве лекарственного средства для лечения рака у млекопитающих. В одном из вариантов антагонистом биологической активности DLL4 является нацеленное средство связывания по данному изобретению. В одном из вариантов антагонистом биологической активности DLL4 является антитело по данному изобретению.
Соответственно еще одному аспекту данного изобретения предлагается применение нацеленного средства связывания, которое обеспечивает антагонизм биологической активности DLL4, для изготовления лекарственного средства для лечения рака у млекопитающего.
Соответственно другому аспекту данного изобретения предлагается нацеленное средство связывания, которое обеспечивает антагонизм биологической активности DLL4, для применения в качестве лекарственного средства для лечения рака у млекопитающего.
Соответственно еще одному аспекту данного изобретения предлагается применение антитела, которое обеспечивает антагонизм биологической активности DLL4, для изготовления лекарственного средства для лечения рака у млекопитающего.
Соответственно другому аспекту изобретения предлагается антитело, которое обеспечивает антагонизм биологической активности DLL4 для применения в качестве лекарственного средства для лечения рака у млекопитающего.
Соответственно еще одному аспекту настоящего изобретения предлагается применение нацеленного средства связывания или антитела, которое обеспечивает антагонизм биологической активности DLL4, для изготовления лекарственного средства для уменьшения или подавления пролиферации, адгезии, инвазии и/или ангиогенеза клеток у животного.
Соответственно другому аспекту настоящего изобретения предлагается нацеленное средство связывания или антитело, которое обеспечивает антагонизм биологической активности DLL4, для применения в качестве лекарственного средства для уменьшения или подавления пролиферации, адгезии, инвазии и/или ангиогенеза клеток у животного.
Соответственно еще одному аспекту настоящего изобретения предлагается применение нацеленного средства связывания или антитела, которое обеспечивает антагонизм биологической активности DLL4, для изготовления лекарственного средства для подавления роста опухоли и/или метастазов у животного.
Соответственно другому аспекту настоящего изобретения предлагается нацеленное средство связывания или антитело, которое обеспечивает антагонизм биологической активности DLL4, для применения в качестве лекарственного средства для подавления роста опухоли и/или метастазов у животного.
В одном из вариантов данное изобретение является особенно подходящим для применения с целью антагонизма DLL4 у пациентов с опухолью, которая зависит полностью или частично от DLL4.
Соответственно, в другом аспекте настоящего изобретения предлагается фармацевтическая композиция, содержащая антагонист биологической активности DLL4 и фармацевтически приемлемый носитель. В одном из вариантов антагонист включает антитело. Соответственно другому аспекту настоящего изобретения предлагается фармацевтическая композиция, содержащая антагонист биологической активности DLL4 и фармацевтически приемлемый носитель. В одном из вариантов антагонист включает антитело.
В некоторых вариантах после введения антитела, которое специфично связывается с DLL4, вводится средство для удаления избытка циркулирующих антител из крови.
Анти-DLL4 антитела пригодны для выявления DLL4 в клинических образцах и, соответственно, могут применяться в качестве диагностического средства при патологических состояниях, рассматриваемых в данном описании. Кроме того, исходя из их способности значительно подавлять DLL4-опосредованную активность сигнальной системы (как показано в примерах ниже), анти-DLL4 антитела оказывают терапевтический эффект при лечении симптомов и патологических состояний, являющихся результатом экспрессии DLL4. В конкретных вариантах антитела и способы по данному изобретению имеют отношение к лечению симптомов в результате DLL4-индуцированной клеточной адгезии, инвазии, ангиогенеза, пролиферации и/или внутриклеточного проведения сигнала. Другие варианты включают применение антител и способов, рассматриваемых в данном описании, для лечения заболеваний, связанных с клеточной адгезией, инвазией, ангиогенезом и/или пролиферацией, включая онкологические заболевания, такие как меланома, мелкоклеточный рак легкого, немелкоклеточный рак легкого, глиома, гепатоцеллюлярный рак (печени), опухоли щитовидной железы, рак желудка, рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря, рак легкого, глиобластому, рак эндометрия, рак почки, рак толстой кишки и рак поджелудочной железы. Данные антитела также можно применять для лечения клеточной адгезии и/или инвазии при артрите, атеросклерозе и заболеваний, включающих ангиогенез,
В одном конкретном варианте анти-DLL4 антитела или нацеленные средства связывания могут обладать терапевтическим действием при лечении солидных опухолей, развитие которых происходит на небольшой популяции стволовых клеток со способностью к пролиферации и эффективному образованию дополнительных стволовых клеток опухоли, например острой миелоидной лейкемии (ОМЛ) и рака молочной железы.
Другой вариант настоящего изобретения включает набор реактивов для обнаружения DLL4 в тканях, клетках или других биологических жидкостях млекопитающих с целью скрининга на опосредованные адгезией, инвазией, ангиогенезом или пролиферацией клеток заболевания. Данный набор содержит нацеленное средство связывания, которое связывается с DLL4, и средство для индикации реакции нацеленного средства связывания с DLL4, если таковая происходит. В одном из вариантов нацеленное средство связывания, которое связывается с DLL4, является меченым. В другом варианте нацеленное средство связывания является немеченым, и набор также содержит средство для обнаружения нацеленного средства связывания. Предпочтительно, нацеленное средство связывания мечено маркером, выбранным из группы, состоящей из флуорохрома, фермента, радионуклида и рентгеноконтрастного вещества.
Другой вариант данного изобретения включает набор реактивов для обнаружения DLL4 в тканях, клетках или других биологических жидкостях млекопитающих с целью скрининга на опосредованные клеточной адгезией, инвазией, ангиогенезом или пролиферацией заболевания. Данный набор содержит антитело, которое связывается с DLL4, и средство для индикации реакции антитела с DLL4, если таковая происходит. Антитело может быть моноклональным антителом. В одном из вариантов антитело, которое связывается с DLL4, является меченым. В другом варианте антитело является немеченым первичным антителом, и набор также содержит средство для обнаружения первичного антитела. В одном из вариантов средства включают меченое вторичное антитело, которое является антителом против иммуноглобулина. Предпочтительно, антитело мечено маркером, выбранным из группы, состоящей из флуорохрома, фермента, радионуклида и рентгеноконтрастного вещества.
Дальнейшие варианты, особенности, и т.п. в отношении антител, рассматриваемых в данном описании, дополнительно описаны ниже.
Перечень последовательностей
Варианты настоящего изобретения включают специфичные антитела, перечисленные в табл.1 ниже. В этой таблице представлен идентификационный номер каждого анти-DLL4 антитела, а также номер SEQ ID вариабельного участка соответствующих генов и полипептидов тяжелой цепи и легкой цепи, соответственно. Каждому антителу присвоен идентификационный номер.
Табл. 2 представляет собой сравнительную таблицу участков тяжелой цепи антитела с родственным участком тяжелой цепи генеративной линии, и участков легкой цепи антитела с родственным участком легкой цепи генеративной линии.
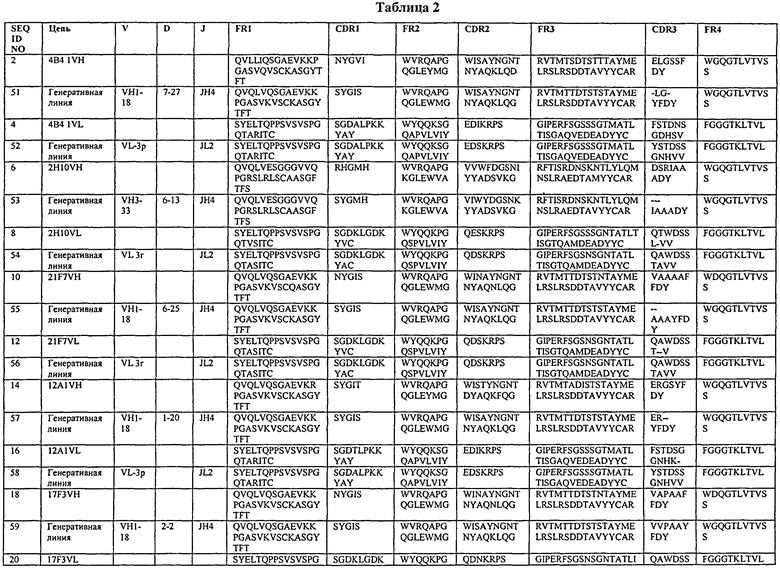
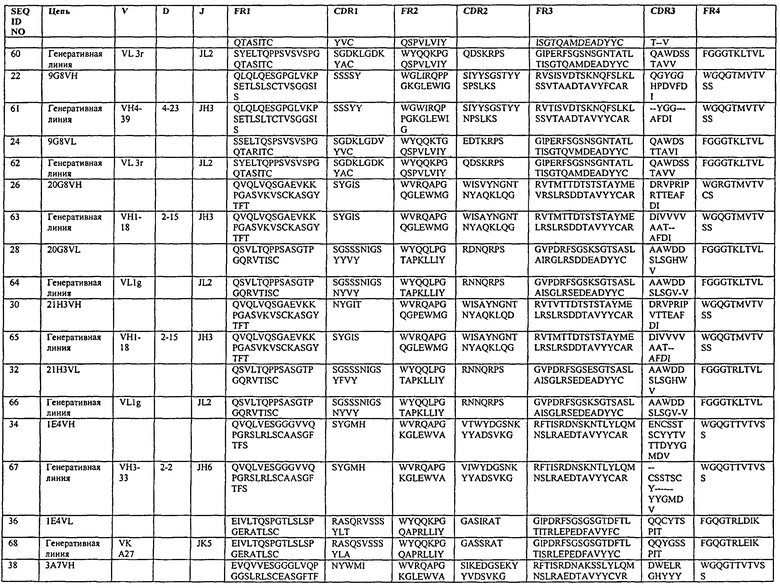
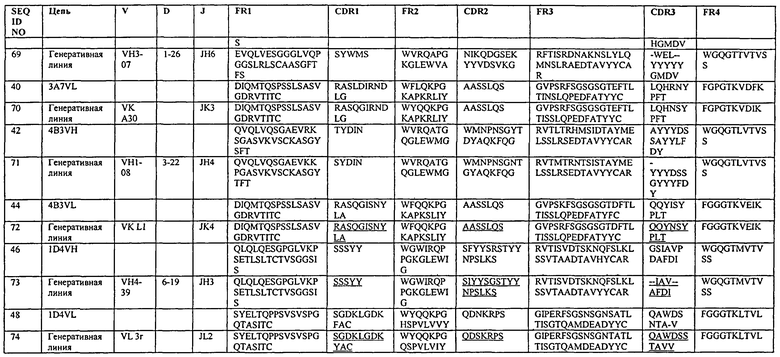
Определения
Если не указано иное, научные и технические термины, используемые в данном описании, имеют те значения, которые часто используются специалистами в данной области. Кроме того, если иное не диктуется контекстом, термины в единственном числе будут включать множественное число, и термины во множественном числе будут включать единственное число. Как правило, терминология, используемая в связи с этим, и технические приемы культуры клеток и культуры ткани, молекулярной биологии и химии белка, олиго- или полинуклеотидной химии и гибридизации, рассматриваемые в данном описании, хорошо известны и широко используются в данной области.
Стандартные технические приемы используются для рекомбинантных ДНК, синтеза олигонуклеотидов, культуры тканей, и трансформации (например, электропорация, липофекция). Ферментные реакции и технические приемы очистки осуществляются в соответствии со спецификациями завода-изготовителя, или осуществляются, как обычно принято в данной области или как описано в данном описании. Вышеизложенные технические приемы и процедуры, как правило, осуществляются в соответствии с обычными способами, хорошо известными в данной области, и как описано в различных общих и более конкретных ссылках, которые цитируются и обсуждаются в настоящем описании. См., например, Sambrook et al. Molecular Cloning: A Laboratory Manual (3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001)), которая включена в данное описание путем ссылки. Терминология, используемая в связи с этим, лабораторные процедуры и технические приемы аналитической химии, синтетической органической химии, а также медицинской и фармацевтической химии, рассматриваемые в данном описании, хорошо известны и широко используются в данной области. Стандартные технические приемы используются для химического синтеза, химического анализа, в сфере фармацевтических препаратов, композиций и введения, а также лечения больных.
Следующие термины, если не указано иное, следует понимать как имеющие следующие значения в соответствии с данным описанием.
Антагонистом или ингибитором может быть полипептид, нуклеиновая кислота, углевод, липид, низкомолекулярное соединение, олигонуклеотид, олигопептид, интерференционная РНК (RNAi), антисмысловой, рекомбинантный белок, антитело, или их фрагменты, или их конъюгаты или гибридные белки. Для ознакомления с RNAi см. Milhavet О, Gary DS, Mattson MP. (Pharmacol Rev. 2003 Dec; 55(4):629-48. Review), a относительно антисмысловых подходов см. Opalinska JB, Gewirtz AM. (Sci STKJE. 2003 Oct 28;2003 (206):p.47.)
Соединение относится к любому низкомолекулярному соединению с молекулярной массой менее чем приблизительно 2000 Да.
Термин "DLL4" относится к молекуле, которая является белком DLL4, также известного как белок-прекурсор Delta-like 4, гомолог Drosophila Delta 4, hdelta2, MGC 126344 или UNQ1895/PR04341. Термины "нейтрализующий" или "ингибирующий", которые относятся к нацеленному средству связывания, например антителу, относятся к способности антител к элиминации, уменьшению или существенному уменьшению активности целевого антигена. Соответственно, "нейтрализующее" анти-DLL4 антитело по данному изобретению способно устранять или существенно уменьшать активность DLL4. Нейтрализующее антитело против DLL4 может, например, действовать, блокируя связывание нативного DLL4 с его рецептором Notch, например. Notch 1 или Notch 4. Путем блокирования такого связывания, опосредованная сигналом DLL4 активность значительно или полностью устраняется. В идеале, антагонизм нейтрализующего антитела против DLL4 способствует пролиферации ЕС. Нейтрализующее антитело против DLL4 может, например, усиливать ангиогенез посредством образования нефункциональных сосудов.
"Антагонист биологической активности DLL4" способен устранять, уменьшать или существенно уменьшать активность DLL4. "Антагонист биологической активности DLL4" способен устранять, уменьшать или существенного уменьшать проведение сигнала DLL4. "Антагонист биологической активности DLL4" может устранять или существенного уменьшать ангиогенез и/или пролиферацию.
"Уменьшение проведения сигнала DLL4" включает уменьшение проведения сигнала DLL4, по крайней мере, на 5%, по крайней мере, на 10%, по крайней мере, на 15%, по крайней мере, на 20%, по крайней мере, на 25%, по крайней мере, на 30%, по крайней мере, на 35%, по крайней мере, на 40%, по крайней мере, на 45%, по крайней мере, на 50%, по крайней мере, на 55%, по крайней мере, на 60%, по крайней мере, на 65%, по крайней мере, на 70%, по крайней мере, на 75%, по крайней мере, на 80%, по крайней мере, на 85%, по крайней мере, на 90%, по крайней мере, на 95% по сравнению с уровнем проведения сигнала в отсутствии нацеленного средства связывания, антитела или антагониста по данному изобретению.
"Оптимизированная" последовательность представляет собой последовательность антитела (вариабельной тяжелой или легкой цепи любого из антител, рассматриваемых в данном описании), которая изменена мутацией таким образом, что последовательность не принадлежащая к генеративной линии изменена мутацией в обратном направлении в одном или более остатках, и может также включать устранение из последовательности структурных дефектов, например сайтов гликозилирования или непарных остатков цистеина.
Термин "полипептид" используется в данном описании как общий термин для обозначения нативного белка, фрагментов или аналогов полипептидной последовательности. Следовательно, нативный белок, фрагменты и аналоги являются разновидностью полипептидного рода. Предпочтительные полипептиды в соответствии с данным изобретением содержат тяжелую цепь молекулы человеческого иммуноглобулина и легкую каппа цепь молекулы человеческого иммуноглобулина, а также молекулы антитела, образованные путем комбинации тяжелой цепи молекулы иммуноглобулина с легкой цепью молекулы иммуноглобулина, такой, как каппа или лямбда легкая цепь молекул иммуноглобулина, и наоборот, а также их фрагменты и аналоги. Предпочтительные полипептиды в соответствии с данным изобретением могут также содержать исключительно тяжелую цепь молекул человеческого иммуноглобулина или ее фрагменты.
Термины "нативный" или "природный" в данном описании, примененные к объекту, обозначают, что объект может быть найден в природе. Например, последовательность полипептида или полинуклеотида, присутствующих в организме (включая вирусы), которые могут быть выделены из природного источника и, которые не были умышленно модифицированы человеком в лаборатории или иным способом, являются природными.
Термин "функционально связанный" в данном описании относится к такому расположению описанных компонентов, когда они взаимосвязаны, и это позволяет им функционировать надлежащим образом. Например, контрольная последовательность, "функционально связанная" с кодирующей последовательностью, связана с ней таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с контрольной последовательностью.
Термин "полинуклеотид" в данном описании обозначает полимерную форму нуклеотидов длиной не менее 10 оснований, т.е. рибонуклеотидов или дезоксирибонуклеотидов, или модифицированную форму того или другого нуклеотида, или РНК-ДНК гетеродуплексы. Этот термин включает одно- и двухцепочечные формы ДНК.
Термин "олигонуклеотид" в данном описании включает природные и модифицированные нуклеотиды, связанные между собой природными и не природными связями. Олигонуклеотиды представляют собой подмножество полинуклеотидов, обычно длинной 200 оснований или меньше. Предпочтительно, олигонуклеотиды содержат от 10 до 60 оснований и, наиболее предпочтительно, от 12, 13, 14, 15, 16, 17, 18, 19 или 20 до 40 оснований. Олигонуклеотиды, как правило, являются одноцепочечными, например, для зондов, хотя олигонуклеотиды могут быть двухцепочечными, например, для использования в создании мутантного гена. Олигонуклеотиды могут быть смысловыми или антисмысловыми олигонуклеотидами.
Термин "природные нуклеотиды" в данном описании, включает дезоксирибонуклеотиды и рибонуклеотиды. Термин "модифицированные нуклеотиды" в данном описании включает нуклеотиды с модифицированными или замещенными сахарными группами, и т.п. Термин "олигонуклеотидные связи" в данном описании включает олигонуклеотидные связи, такие как фосфоротиоат, фосфородитиоат, фосфороселеноат, фосфородиселеноат, фосфороанилотиоат, фосфороаниладат, фосфороамидат, и т.п. См., например, LaPlanche et al. Nucl. Acids Res. 14:9081 (1986); Stec et al. J. Am. Chem. Soc. 106:6077 (1984); Stein et al. Nucl. Acids Res. 16:3209 (1988); Zon et al. Anti-Cancer Drug Design 6:539 (1991); Zon et al. Oligonucleotides and Analogues: A Practical Approach, pp.87-108 (F. Eckstein, Ed, Oxford University Press, Oxford England (1991)); Stec et al., патент США №5,151,510; Uhlmann and Peyman Chemical Reviews 90:543 (1990), которые включены в данное описание в полном объеме путем ссылки. Олигонуклеотид может включать метку для обнаружения, если это необходимо.
Термин "выборочно гибридизироваться" в данном описании обозначает обнаружимое и специфическое связывание. Полинуклеотиды, олигонуклеотиды и их фрагменты выборочно гибридизируются с нитями нуклеиновой кислоты в условиях гибридизации и отмывки, которые в значительной степени минимизируют количество обнаружимого связывания с неспецифическими нуклеиновыми кислотами. Жесткие условия могут быть использованы для обеспечения условий селективной гибридизации, как известно в данной области и обсуждается в данном описании. Как правило, гомологичность последовательностей нуклеиновой кислоты между полинуклеотидами, олигонуклеотидами или фрагментами антител и целевой последовательностью нуклеиновой кислоты будет составлять, по меньшей мере, 80%, причем более типично желательна возрастающая гомология, по меньшей мере, 85%, 90%, 95%, 99% и 100%.
Жесткие условия гибридизации, включают, не ограничиваясь ими, гибридизацию ДНК, связанную с фильтром, в 6х стандартном цитратно-солевом буфере (ЦСБ) (0,9 М NaCl, 90 мМ цитрата Na, pH 7,0) приблизительно при 45°С, с последующей отмывкой один или несколько раз в 0,2х ЦСБ, 0,1% натрия лаурилсульфата (НЛС) при 50-65°С, сверхжесткие условия включают гибридизацию ДНК, связанную с фильтром, в 6х ЦСБ при 45°С, с последующей отмывкой один или несколько раз в 0,1х ЦСБ, 0,2% НЛС при 60°С, или любые другие жесткие условия гибридизации, известные специалистам в данной области (см., например, Ausubel, F.M. et al, eds. 1989 Current Protocols in Molecular Biology, vol. 1, Green Publishing Associates, Inc. and John Wiley and Sons, Inc. NY, стр.6.3.1-6.3.6 и 2.10.3). Две аминокислотные последовательности являются "гомологичными", если есть частичное или полное тождество между ними. Например, 85% гомологии означает, что 85% аминокислот являются идентичными, когда две последовательности, выстроенные в одну линию для максимального соответствия. Пробелы (в любой из двух соответствующих последовательностей) позволяются для максимального соответствия; предпочтительно, разрыв длиной 5 или менее пробелов, более предпочтительно, 2 или менее пробелов. Альтернативно и, как правило, две белковые последовательности (или полученные из них последовательности полипептидов длиной как минимум приблизительно 30 аминокислот) являются гомологичными, как используется в данном описании, если они оценка выравнивания для них составляет более 5 (в единицах допустимого отклонения), с использованием программы ALIGN с матрицей данных мутации и штрафом за пропуск в последовательности 6 или больше. См. Dayhoff, M.O, в Atlas of Protein Sequence and Structure, pp.101-110 (Volume 5, National Biomedical Research Foundation (1972)) и Приложение 2 к данному тому, стр.1-10. Две последовательности или их части, более предпочтительно, являются гомологичными, если их аминокислоты не меньше, чем на 50% идентичны при оптимальном выравнивании с помощью программы ALIGN. Следует учесть, что могут существовать участки с различной степенью гомологии в двух ортологических последовательностях. Например, функциональные участки ортологических молекул мыши и человека могут иметь более высокую степень гомологии, чем нефункциональные участки.
Термин "соответствует" в данном описании означает, что полинуклеотидная последовательность гомологична (т.е., совпадает, а не строго эволюционно связана) всей или части контрольной полинуклеотидной последовательности, или что полипептидная последовательность совпадает с контрольной полипептидной последовательностью.
В противоположность этому, термин "комплементарная" в данном описании обозначает, что дополняющая последовательность гомологична всей или части контрольной полинуклеотидной последовательности. Для пояснения, нуклеотидная последовательность "ТАТАС" соответствует контрольной последовательности "ТАТАС" и является комплементарной к контрольной последовательности "GTATA".
Термин "идентичность последовательностей" означает, что две полинуклеотидные или аминокислотные последовательности тождественны (т.е., нуклеотид тождественен нуклеотиду или остаток тождественен остатку) в промежутках сравнения. "Процент идентичности последовательностей" рассчитывается путем сравнения двух оптимально выровненных последовательностей относительно промежутков сравнения, путем определения количества положений, в которых идентичные основания нуклеиновой кислоты (например, А, Т, С, G, U или I) или остатки аминокислот, встречаются в обеих последовательностях, для получения числа совпадающих положений, путем деления количества совпадающих положений на общее количество положений в промежутке сравнения (т.е., размер промежутка), и умножения результата на 100, с получением процента идентичности последовательностей. Термин "существенная идентичность" в данном описании указывает на характеристику полинуклеотидной или аминокислотной последовательности, при которой полинуклеотид или последовательность аминокислот включают последовательность, которая, по крайней мере, на 85% идентична последовательности, предпочтительно, по меньшей мере, на 90-95% идентична, более предпочтительно, по меньшей мере, на 99% идентична контрольной последовательности при сравнении промежутков, по крайней мере, в 18 положениях нуклеотидов (6 аминокислот), часто в промежутке длиной, по крайней мере, 24-48 положений нуклеотидов (8-16 аминокислот), при этом процент идентичности последовательности рассчитывается путем сравнения контрольной последовательности с последовательностью, которая может включать делеции или дополнения в общем количестве 20% или менее контрольной последовательности в промежутке сравнения. Контрольная последовательность может быть подмножеством последовательности большего размера.
В данном описании обычно используются 20 обычных аминокислот и их аббревиатуры. См. Immunology - A Synthesis (2nd Edition, E.S. Golub and D.R. Gren, Eds., Sinauer Associates, Sunderland, Mass. (1991)), которая включена в данное описание путем ссылки. Стереоизомеры (например, D-аминокислоты) 20 обычных аминокислот, не встречающиеся в природе аминокислоты, такие как α,α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие нетрадиционные аминокислоты, также могут быть подходящим компонентом полипептидов по настоящему изобретению. Примеры нетрадиционных аминокислот включают: 4-гидроксипролин, γ-карбоксиглютамат, ε-N,N,N-триметиллизин, ε-N-ацетиллизин, O-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистадин, 5-гидроксилизин, σ-N-метиларгинин и другие подобные аминокислоты и иминокислоты (например, 4-гидроксипролин). В номенклатуре полипептидов, используемой в данном описании, левая область является аминоконцевой областью, а правая область является карбоксиконцевой областью, в соответствии со стандартом использования и конвенцией.
Аналогично, если не указано иное, левый конец одноцепочечных полинуклеотидных последовательностей является 5' концом; левая область двухцепочечных полинуклеотидных последовательностей называется 5' областью. Направление от 5' к 3' увеличения растущей цепи РНК транскриптов именуется транскрипционным направлением; участки последовательности нитей ДНК имеют такую же последовательность, что и РНК, и те, которые идут от 5' к 5' концу транскрипта РНК, называют "по ходу транскрипции последовательности"; участки последовательности нитей ДНК имеют такую же последовательность, что и РНК, и, которые идут от 3' к 3' концу транскрипта РНК, называют "против хода транскрипции последовательности".
Применительно к полипептидам, термин "существенная идентичность" означает, что две пептидные последовательности при оптимальном выравнивании, например, с помощью программ GAP или BESTFIT, с использованием значения пробелов по умолчанию, демонстрируют не менее 80% идентичности последовательностей, предпочтительно, по меньшей мере, 90% идентичности последовательностей, более предпочтительно, по меньшей мере, 95% идентичности последовательностей, и наиболее предпочтительно, по крайней мере, 99% идентичности последовательностей. Как правило, положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами. Консервативные аминокислотные замены относятся к взаимозаменяемости остатков с подобными боковыми цепями. Например, группа аминокислот, содержащих алифатические боковые цепи, состоит из глицина, аланина, валина, лейцина и изолейцина; группа аминокислот, содержащая алифатические-гидроксильные боковые цепи, состоит из серина и треонина; группа аминокислот, содержащая амидные боковые цепи, состоит из аспарагина и глутамина; группа аминокислот, содержащая ароматические боковые цепи, состоит из фенилаланина, тирозина и триптофана; группа аминокислот, содержащая основные боковые цепи, состоит из лизина, аргинина и гистидина; и группа аминокислот с серосодержащими боковыми цепями, состоит из цистеина и метионина. Предпочтительные группы для консервативных замен аминокислот включают: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутаминовая кислота-аспарагиновая кислота и аспарагин-глутамин.
Как уже обсуждалось в данном описании, незначительные изменения в аминокислотных последовательностях антител или молекул иммуноглобулина рассматриваются, как входящие в настоящее изобретение, при условии, что измененные аминокислотные последовательности содержат последовательность, по крайней мере, на 75%, более предпочтительно, по меньшей мере, на 80%, 90%, 95%, и наиболее предпочтительно, на 99% тождественную последовательности антител или молекул иммуноглобулина, описанных в данном описании. В частности, предусмотрены консервативные аминокислотные замены. Консервативные замены - это такие замены, которые возникают в семействе аминокислот со сходными боковыми цепями. Генетически кодируемые аминокислоты, как правило, разделены на семейства: (1) кислотные = аспартат, глутамат; (2) основные = лизин, аргинин, гистидин, (3) неполярные = аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан и (4) незаряженные полярные = глицин, аспарагин, глутамин, цистеин, серии, треонин, тирозин. Более предпочтительные семейства: серии и треонин, принадлежащие к алифатическому-гидроксильному семейству; аспарагин и глутамин, принадлежащие к амидсодержащему семейству; аланин, валин, лейцин и изолейцин принадлежащие к алифатическому семейству; и фенилаланин, триптофан и тирозин принадлежащие к ароматическому семейству. Например, разумно ожидать, что обособленная замена лейцина изолейцином или валином, аспартата глутаматом, треонина серином или аналогичные замены аминокислот структурно сходными аминокислотами не будут оказывать существенного влияния на функцию связывания или на свойства полученной молекулы, особенно, если замена не касается аминокислоты в рамках сайта связывания. Приводит ли аминокислотная замена к образованию функционального пептида, легко определяется путем анализа специфической активности полипептидного производного. Анализы подробно описаны в данном описании. Фрагменты или аналоги антител или молекул иммуноглобулина могут быть легко получены специалистами в данной области. Предпочтительные амино- и карбокси-концы фрагментов или аналогов встречаются вблизи границ функциональных доменов. Структурные и функциональные домены могут быть определены путем сравнения нуклеотидных и/или аминокислотных последовательностей с последовательностью из открытой или платной базы данных. Предпочтительно, компьютеризированные способы сравнения применяются для определения мотивов последовательности или прогнозируемых доменов конформации белка, которые встречаются в других белках с известной структурой и/или функциями. Способы определения белковых последовательностей, свернутых в известную трехмерную структуру, известны. Bowie et al. Science 253:164 (1991). Таким образом, вышеприведенные примеры показывают, что специалисты в данной области могут распознать мотивы последовательности и структурные конформации, которые могут быть использованы для определения структурных и функциональных доменов в соответствии с антителами, рассматриваемыми в данном описании.
Остатки глутаминила и аспарагинила часто дезамидируют до соответствующих остатков глутамила и аспартила соответственно. Эти остатки дезамидируют в нейтральных или щелочных условиях. Дезамидирование указанных остатков находится в рамках данного изобретения.
В основном, остатки цистеина в белках соединены цистеин-цистеиновыми дисульфидными связями или пространственно защищены от образования дисульфидных связей, когда они являются частью свернутого участка белка. Образование дисульфидных связей в белках представляет собой сложный процесс, который определяется окислительно-восстановительным потенциалом среды и специализированными ферментами, регулирующими тиол-дисульфидный обмен (Creighton, Methods Enzymol. 107, 305-329, 1984; Houee-Levin, Methods Enzymol. 353, 35-44,2002). Если остаток цистеина не имеет пары в структуре белка и не является пространственно защищенным в этой структуре, он может образовывать дисульфидные связи со свободным цистеином из раствора в ходе процесса, известного, как дисульфидная перетасовка. В ходе другого процесса, известного, как дисульфидная перестановка, свободный цистеин может также нарушать природные дисульфидные связи (например, присутствующие в структурах антител) и быть причиной низкого связывания, низкой биологической активности и/или низкой стабильности.
Предпочтительными аминокислотными заменами являются такие, которые: (1) уменьшают чувствительность к протеолизу, (2) уменьшают чувствительность к окислению, (3) модифицируют сродство связывания для формирования белковых комплексов, (4) модифицируют сродство связывания, и (4) обеспечивают или модифицируют другие физико-химические и функциональные свойства таких аналогов. Аналоги могут включать различные мутации последовательности, помимо природной пептидной последовательности. Например, одна или несколько аминокислотных замен (желательно консервативных аминокислотных замен) могут быть введены в природную последовательность (предпочтительно, в участке полипептида, находящемся за пределами домена(ов), участвующих в межмолекулярных контактах). Консервативная аминокислотная замена не должна существенно изменять структурные характеристики исходной последовательности (например, замена аминокислоты, как правило, не должна вести к разрыву спирали, присутствующей в исходной последовательности, или нарушать другие типы вторичной структуры, которыми характеризуется исходная последовательность). Примеры вторичной и третичной структуры полипептидов, признанной в данной области, описаны в Proteins, Structures and Molecular Principles (Creighton, Ed, W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds, Garland Publishing, New York, N.Y. (1991)); и Thornton et al. Nature 354:105 (1991), каждая из которых включена в данное описание путем ссылки.
Кроме того, такие способы могут быть применены для осуществления в вариабельных участках аминокислотных замен или делеций одного или нескольких остатков цистеина, участвующих в образовании внутрицепочечных дисульфидных связей, для создания молекул антител, не содержащих одной или нескольких внутрицепочечных дисульфидных связей.
Термин "участок CDR" или "CDR" предназначен для указания гипервариабельных участков тяжелых и легких цепей антител, которые обеспечивают специфичность связывания антител с антигеном. CDR могут быть определены в соответствии с системой Kabat (Kabat, E.A. et al. (1991) Sequences of Proteins of Immunological Interest, 5th Edition. US Department of Health and Human Services, Public Service, NIH, Washington), и последующие издания. Антитела обычно содержит 3 CDR тяжелой цепи и 3 CDR легкой цепи. Термин CDR используется в данном описании для того, чтобы указать согласно конкретному случаю, один или несколько из этих участков, или все участки, содержащие большинство аминокислотных остатков, ответственных за сродство связывания антитела с антигеном или эпитопом, которые оно распознает.
Третий CDR тяжелой цепи (HCDR3) обладает большей вариабельностью (большее разнообразие в основном связано с механизмами расположения генов, которые приводят к этому). Он может быть коротким - длиной 2 аминокислоты, хотя известны участки большего размера - 26 аминокислот. Длина CDR может также варьироваться в зависимости от длины, которая может быть согласована с конкретным базовым каркасом. В отношении функции, HCDR3 отчасти играет роль в определении специфичности антител (Segal et al., PNAS, 71:4298-4302, 1974, Amit et al., Science, 233:747-753, 1986, Chothia et al., J. Mol. Biol, 196:901-917, 1987, Chothia et al., Nature, 342:877-883, 1989, Caton et al, J. Immunol., 144:1965-1968, 1990. Sharon et al., PNAS, 87:4814-4817, 1990, Sharon et al, J. Immunol., 144:4863-4869, 1990, Kabat et al. J. Immunol., 147:1709-1719, 1991).
Термин "группа CDR" в данном описании включает CDR1, CDR2 и CDR3. Таким образом, к группе HCDR относятся HCDR1, HCDR2 и HCDR3, и к группе LCDR относятся LCDR1, LCDR2 и LCDR3.
Варианты доменов VH и VL и CDR по настоящему изобретению включают такие, для которых аминокислотные последовательности определены в данном описании, и которые могут быть использованы в нацеленных средствах и антителах против DLL4, которые могут быть получены с помощью способов изменения последовательности или мутаций и скрининга для поиска нацеленных средств с желаемыми характеристиками. Примеры желаемых характеристик включают, не ограничиваясь ими: увеличение сродства связывания с антигеном по сравнению с известными антителами, которые являются специфичными в отношении антигена; увеличение степени нейтрализации антигенной активности по сравнению с известными антителами, которые являются специфичными в отношении антигена, если активность известна; специфической способностью конкурировать с известным антителом или лигандом за связывание с данным антигеном в конкретном молярном соотношении; способность образовать иммунопреципитат «лиганд-рецепторный комплекс»; способность связываться с указанным эпитопом; линейным эпитопом, например, пептидной последовательностью, определенной с использованием пептид-связывающего сканирования, например, с помощью скрининга пептидов с линейной и/или ограниченной конформацией; конформационные эпитопы, образованные перемежающимися остатками; способность модулировать новый вид биологической активности DLL4, или молекулы, расположенной ниже в биохимическом пути; способность связываться и/или нейтрализовать DLL4, и/или любое другое необходимое свойство.
Технические приемы, необходимые для введения замены в аминокислотной последовательности CDR, доменов VH или VL антитела и сайтов связывания с антигеном, известны в данной области. Варианты молекул антитела, рассматриваемые в данном описании, могут быть получены и использованы в настоящем изобретении. Следуя примеру вычислительной химии в применении анализа проверки многомерных данных для взаимоотношения «структура-свойства/активность» (Wold, et al. Multivariate data analysis in chemistry. Chemometrics - Mathematics and Statistics in Chemistry (Ed.: B. Kowalski), D. Reidel Publishing Company, Dordrecht, Holland, 1984), количественные соотношения «свойства-активность» для антител могут быть получены с использованием хорошо известных математических методов, таких как статистическая регрессия, распознавание структур и классификация (Norman et al. Applied Regression Analysis. Wiley-Interscience; 3rd edition (April 1998); Kandel, Abraham & Backer, Eric. Computer-Assisted Reasoning in Cluster Analysis. Prentice Hall PTR, (May 11, 1995); Krzanowski, Wojtek. Principles of Multivariate Analysis: A User's Perspective (Oxford Statistical Science Series, No 22 (Paper)). Oxford University Press; (December 2000); Witten, Ian H. & Frank, Eibe. Data Mining: Practical Machine Learning Tools and Techniques with Java Implementations. Morgan Kaufmann; (October 11, 1999); Denison David G. T. (Editor), Christopher C. Holmes, Bani K. Mallick, Adrian F. M. Smith. Bayesian Methods for Nonlinear Classification and Regression (Wiley Series in Probability and Statistics). John Wiley & Sons; (July 2002); Ghose, Arup K. & Viswanadhan, Vellarkad N. Combinatorial Library Design and Evaluation Principles, Software, Tools, and Applications in Drug Discovery). В некоторых случаях, свойства антитела могут быть получены из эмпирических и теоретических моделей (например, анализа вероятного связывания остатков или рассчитанных физико-химические свойств) последовательностей антител, функциональных и трехмерных структур, и эти свойства могут рассматриваться отдельно и в комбинации.
Антиген-связывающийся участок антитело состоит из домена VH и домена VL, как правило, образованных 6 полипептидными петлями: 3 из вариабельной области легкой цепи (VL) и 3 из вариабельной области тяжелой цепи (VH). Анализ антител известной атомарной структуры объясняет связь последовательности и трехмерной структуры комбинированных сайтов антитела. Эта связь означает, что, за исключением третьего участка (петля) в доменах VH, петли сайта связывания имеют одну из небольшого числа конформаций главной цепи: канонические структуры. Было показано, что каноническая структура, образованная в той или иной петле, определяется размерами и наличием определенных остатков в ключевых сайтах обеих петель и каркасной области.
Данное исследование взаимоотношения «последовательность-структура» может быть использовано для предсказания таких остатков в антителе с известной последовательностью, но с неизвестной трехмерной структурой, которые имеют важное значение в поддержании трехмерной структуры указанных петель CDR и, следовательно, обеспечивают специфичность связывания. Такое прогнозирование может быть подтверждено сравнением прогнозов с результатами экспериментов по оптимизации. В структурном подходе может быть создана модель молекулы антитела с помощью любого бесплатного или коммерческого пакета, такого как WAM. Программное обеспечение для визуализации и анализа белков, такое как Insight II (Accelrys, Inc) или Deep View может быть использовано в дальнейшем для оценки возможных замен в каждом положении CDR. Эта информация может затем быть использована для введения замен, оказывающих минимальное или положительное влияние на активность или обеспечивающих другие желательные свойства.
Термин "полипептидный фрагмент" в данном описании относится к полипептиду, который содержит аминоконцевую и/или карбоксиконцевую делецию, но при этом остальная часть аминокислотной последовательности совпадает с соответствующими положениями природной последовательности, например, из полноразмерной последовательности кДНК. Фрагменты обычно содержат, по крайней мере, 5, 6, 8 или 10 аминокислот, предпочтительно, по меньшей мере, 14 аминокислот, более предпочтительно, по меньшей мере, 20 аминокислот, как правило, не менее 50 аминокислот, и даже более предпочтительно, по меньшей мере, 70 аминокислот. Термин "аналог" в данном описании относится к полипептидам, которые состоят из сегментов длиной не менее 25 аминокислот, которые с существенной мере тождественны некоторой части расшифрованной аминокислотной последовательности и, которые обладают, по крайней мере, одним из следующих свойств: (1) специфично связываются с DLL4 при соответствующих условиях связывания, (2) способны блокировать надлежащее связывание VEGF/DLL4, или (3) способны подавлять активность тирозинкиназы рецептора DLL4. Как правило, полипептидные аналоги включают консервативные аминокислотные замены (или вставки или делеции) по отношению к природной последовательности. Аналоги, как правило, содержат не менее 20 аминокислот, предпочтительно, по меньшей мере, 50 аминокислот или больше, и могут быть такой же длины, как полноразмерный природный полипептид.
Аналоги пептидов широко применяются в фармацевтической промышленности непептидных препаратов со свойствами аналогичных матричных пептидов. Такие типы непептидных соединений называются "пептидными миметиками" или "пептидомиметиками" (Fauchere, J. Adv. Drug Res. 15:29 (1986); Veber and Freidinger TINS p.392 (1985); и Evans et al. J. Med. Chem. 30:1229 (1987), которые включены в данное описание путем ссылки). Такие соединения часто разрабатываются с помощью компьютеризированного молекулярного моделирования. Пептидомиметики, которые структурно сходны с терапевтически пригодными пептидами, могут применяться для получения эквивалентного терапевтического или профилактического эффекта. Как правило, пептидомиметики структурно сходны с эталонным полипептидом (т.е., полипептидом, который обладает биохимическими свойствами или фармакологической активностью), таким, как человеческое антитело, но в них одна или несколько пептидных связей дополнительно заменены связью, выбранной из группы, состоящей из: --CH2NH--, --CH2S--, --СН2-СН2--, --СН=СН-- (цис и транс), --СОСН2--, --СН(ОН)СН2--, и --CH2SO-- способами, хорошо известными в данной области. Систематическая замена одной или нескольких аминокислот консенсусной последовательности D-аминокислотой того же типа (например, D-лизин вместо L-лизина) может быть использована для создания более стабильного пептида. Кроме того, ограниченные пептиды, содержащие консенсусную последовательность, или практически тождественную вариацию консенсусной последовательности, могут быть получены способами, известными в данной области (Rizo and Gierasch Ann. Rev. Biochem. 61:387 (1992), включена в данное описание путем ссылки); например, путем добавления встроенных остатков цистеина, способных образовывать внутримолекулярные дисульфидные мостики, которые циклизируют пептид.
Антитело может быть олигоклональным, поликлональным антителом, моноклональным антителом, химерным антителом, CDR-привитым антителом, полиспецифичным антителом, биспецифичным антителом, каталитическим антителом, химерным антителом, гуманизированным антителом, полностью человеческим антителом, антиген-специфичным антителом и антителом, в которое может быть введена метка, в растворимой или связанной форме, а также его фрагментами, модификациями или производным, самостоятельными или в сочетании с другими аминокислотными последовательностями, обеспеченными известными техническими приемами. Антитело может происходить из любого биологического вида.
В данном описании термины "антитело" и "антитела" (иммуноглобулины) охватывают моноклональные антитела (в том числе полноразмерные моноклональные антитела), поликлональные антитела, антитела верблюда и химерные антитела. В данном описании термин "антитело" или "антитела" относится к полипептиду или группе полипептидов, которые включают, по крайней мере, один домен связывания, образованный путем фолдинга полипептидных цепей с трехмерными пространствами связывания, где форма внутренней поверхности и распределение заряда комплементарны к свойствам антигенных детерминант цепи антигена. Нативные антитела являются, как правило, гетеротетрамерными гликопротеинами с молекулярной массой приблизительно 150000 Да, состоящими из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью; кроме того, количество дисульфидных связей различается для тяжелых цепей различных изотипов иммуноглобулина. Каждая тяжелая и легкая цепь также содержит регулярно расположенные дисульфидные мостики внутри цепи. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), за которым следуют несколько константных доменов. Каждая легкая цепь содержит вариабельный домен на одном конце (VL), и константный домен на другом конце; константный домен легкой цепи совмещен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи совмещен с вариабельным доменом тяжелой цепи. Легкие цепи классифицируются как лямбда цепи или каппа цепи, исходя из аминокислотной последовательности константного домена легких цепей. Вариабельный домен легкой цепи каппа может также быть обозначен в данном описании, как VK. Термин "вариабельный домен" также может быть использован для описания вариабельного домена тяжелой цепи или легкой цепи. Специфические аминокислотные остатки являются, как полагают, выражением взаимодействия между вариабельным доменом легкой и тяжелой цепи. Вариабельные домены каждой легкой/тяжелой цепи образуют пары антигенсвязывающих сайтов. Такие антитела могут быть получены из организма любого млекопитающего, в том числе, не ограничиваясь ими, человека, обезьян, свиней, лошадей, кроликов, собак, кошек, мышей, и т.д.
Термин "антитело" или "антитела" включает фрагменты связывания антител по данному изобретению, типичные фрагменты включают одноцепочечные Fvs (scFv), одноцепочечные антитела, однодоменные антитела, доменные антитела, Fv фрагменты, Fab фрагменты, F(ab') фрагменты, F(ab')2 фрагменты, фрагменты антител, которые проявляют желаемую биологическую активность, стабилизированный дисульфидными связями вариабельный участок (dsFv), димерный вариабельный участок (диатело), антиидиотипические (анти-Id) антитела (включая, например, анти-Id антитела к антителам по данному изобретению), интраантитела, линейные антитела, молекулы одноцепочечных антител и полиспецифичные антитела, образованные из фрагментов антител и эпитопсвязывающих фрагментов любых из вышеупомянутых. В частности, антитела включают молекулы иммуноглобулина и иммунологически активные фрагменты молекул иммуноглобулина, т.е. молекулы, содержащие антигенсвязывающие сайты. Молекулы иммуноглобулина могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
Расщепление антител ферментом папаин дает два идентичных антигенсвязывающих фрагмента, известных также как фрагменты "Fab", и фрагмент "Fc", не обладающий антигенсвязывающей активностью, но обладающий способностью кристаллизоваться. Расщепление антител ферментом пепсин дает фрагмент F(ab')2, в котором две цепи молекулы антитела остаются связанными между собой и включают два антигенсвязывающих сайта. Фрагмент F(ab')2 обладает способностью перекрестно связываться с антигеном.
"Fv" используется в данном описании для обозначения минимального фрагмента антитела, сохраняющего как антигенраспознающий, так и антигенсвязывающий сайты. Этот участок состоит из димера вариабельного участка одной тяжелой и одной легкой цепи с устойчивой нековалентной или ковалентной связью. Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют для определения антигенсвязывающего сайта на поверхности димера VH-VL. Коллективно, шесть CDR обеспечивают антигенсвязывающую специфичность антитела. Однако, даже один вариабельный домен (или половина Fv, включающая только три CDR, специфичных в отношении антигена) обладает способностью распознавать и связываться с антигеном, хотя и с меньшим сродством, чем весь сайт связывания.
"Fab" используется в данном описании для обозначения фрагмента антитела, включающего константный домен легкой цепи и домен СН1 тяжелой цепи.
"dAb" используется в данном описании для обозначения фрагмента антитела, который является наименьшей функциональной единицей связывания человеческих антител. "dAb" является однодоменным антителом и включает вариабельный домен тяжелой цепи (VH домен) антитела или вариабельный домен легкой цепи (VL домен) антитела. Каждый dAb содержит 3 из 6 природных CDR (Ward et a. I, Binding activities of a repertoire of single immunoglobulin variable domains secreted from Escherichia coli. Nature 341, 544-546 (1989); Holt, et al., Domain antibodies: protein for therapy. Trends Biotechnol. 21, 484-49 (2003)). С молекулярной массой от 11 до 15 кДа, он в четыре раза меньше, чем фрагмент связывания с антигеном (Fab)2 и в два раза меньше одноцепочечной молекулы Fv (scFv).
"Верблюжий" используется в данном описании для обозначения молекулы антитела, состоящей из димеров тяжелых цепей, которые лишены легких цепей, но, тем не менее, обладают обширным спектром антигенсвязывающим свойств (Hamers-Casterman С, Atarhouch Т, Muyldermans S, Robinson G, Hamers C, Songa EB, Bendahman N, Hamers R (1993) Naturally occurring antibodies devoid of light chains. Nature 363:446-448).
Термин "диатела" обозначает небольшие фрагменты антител с двумя антигенсвязывающими участками, которые включают вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). При использовании линкера, слишком короткого, чтобы позволить спаривание между двумя доменами на одной цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих участка. Диатела более подробно описаны, например, в ЕР 404,097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
Было показано, что фрагменты целого антитела могут выполнять функцию связывания с антигенами. Примерами фрагментов связывания являются (Ward, E.S. et al., (1989) Nature 341, 544-546) фрагмент Fab, состоящий из VL, VH, CL и СН1 доменов; (McCafferty et al (1990) Nature, 348, 552-554) фрагмент Fd, состоящий из VH и СН1 доменов; (Holt et al (2003) Trends in Biotechnology 21, 484-490) фрагмент Fv, состоящий из VL и VH доменов одного антитела; (iv) фрагмент dAb (Ward, E.S. et al., Nature 341, 544-546 (1989), McCafferty et al (1990) Nature, 348, 552-554, Holt et а1 (2003) Trends in Biotechnology 21, 484-490), который состоит из VH или VL домена; (v), изолированные участки CDR; (vi) фрагмент F(ab')2, - двухвалентный фрагмент, включающий два связанных фрагмента Fab (vii) одноцепочечной молекулы Fv (ScFv), в котором VH домен и VL домен связаны пептидным линкером, что позволяет этим двум доменам взаимодействовать с образованием антигенсвязывающего сайта (Bird et al, (1988) Science, 242, 423-426, Huston et al, (1988) PNAS USA, 85, 5879-5883)); (viii) биспецифичные димеры одноцепочечных Fv (PCT/US92/09965) и (ix) "диатела", поливалентные или полиспецифичные фрагменты, созданные путем слияния генов (WO94/13804; Holliger, Р. (1993) et al, Proc. Natl. Acad. Sci. USA 90 6444-6448). Молекулы Fv, ScFv или диател могут быть стабилизированы включением дисульфидных мостиков, соединяющих VH и VL домены (Reiter, Y. et al, Nature Biotech, 14, 1239-1245, 1996). Миниантетела, включающие ScFv, соединенный с доменом СН3, также могут быть созданы (Hu, S. et al, (1996) Cancer Res, 56,3055-3061). Другим примером фрагментов связывания являются Fab', который отличается от фрагментов Fab добавлением нескольких остатков на карбоксильном конце тяжелой цепи домена СН1, включая один или несколько остатков цистеина шарнирной области антитела, и Fab'-SH, являющийся фрагментом Fab', в котором остаток(ки) цистеина константных доменов содержит свободную тиольную группу.
Термин "вариабельный" относится к тому факту, что определенные участки вариабельных доменов существенно различаются в последовательности антител и отвечают за специфичность связывания каждого конкретного антитела с определенным антигеном. Однако вариабельность неравномерно распределяется по вариабельным доменам антител. Она сосредоточена в сегментах, названных гипервариабельными участками (CDR, Complementarity Determining Regions, участки, определяющие комплементарность), обоих вариабельных доменов легкой цепи и тяжелой цепи. Более часто консервативную часть вариабельных доменов называют каркасным участком (FR, framework region). Вариабельные домены нативных тяжелых и легких цепей состоят из четырех участков FR каждый, в основном принимают β-складчатую конфигурацию, соединены тремя CDR, которые формируют петли связывания, а в некоторых случаях образуют часть β-складчатой структуры. CDR в каждой цепи удерживаются вместе в непосредственной близости от участков FR и, вместе с CDR другой цепи, способствуют формированию антигенсвязывающего сайта антител (см., Kabat et al, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Константные домены, как правило, не участвуют непосредственно в связывании с антигеном, но могут влиять на сродство связывания и могут осуществлять различные эффекторные функции, такие как участие антител в ADCC, CDC и/или апоптозе.
Термин "гипервариабельный участок" в данном описании, обозначает аминокислотные остатки антитела, которые ответственны за его связывание с антигеном. Гипервариабельные участки включают аминокислотные остатки "гипервариабельных участков" или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) вариабельного домена легкой цепи и остатки 31-35 (H1), 50-65 (Н2) и 95-102 (Н3) вариабельного домена тяжелой цепи; Kabat et al, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)) и/или те остатки "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3), в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia and Lesk, J. Mol. Biol, 196:901-917 (1987)). "Каркасные" или "FR" остатки являются остатками вариабельного домена фланкирующего CDR. FR остатки находятся в химерных, гуманизированных, человеческих, доменных антителах, диателах, ваккителах, линейных антителах и биспецифичных антителах.
В данном описании нацеленное средство связывания, нацеленный белок связывания, специфически связывающийся белок и подобные термины относятся к антителу или фрагменту связывания, который преимущественно связывается с целевым сайтом. В одном из вариантов нацеленное средство связывания является специфичным только для одного целевого сайта. В других вариантах нацеленное средство связывания является специфичным для более чем одного целевого сайта. В одном из вариантов нацеленное средство связывания может быть моноклональным антителом, и целевой сайт может быть эпитопом.
"Фрагменты связывания" антитела продуцируются с помощью рекомбинантной ДНК или с помощью ферментативного или химического расщепления интактных антител. Фрагменты связывания включают Fab, Fab', F(ab')2, Fv, dAb и одноцепочечные антитела. Антитела, за исключением "биспецифичных" или "бифункциональных" антител, подразумевают, что каждый из сайтов связывания идентичен. Антитело существенно подавляет адгезию рецептора с контр-рецептором, когда избыток антитела уменьшает количество связанного рецептора с контррецептором, по крайней мере, на 20%, 40%, 60% или 80%, и обычно, больше, чем на 85% (при измерении конкурентного связывания in vitro).
Термин "эпитоп" включает любой белок, определяющий способность специфично связываться с иммуноглобулином или Т-клеточным рецептором. Детерминанты эпитопа обычно состоят из молекул химически активных поверхностных групп, таких как боковые цепи аминокислот или Сахаров, и могут, но не всегда, обладать специфическими трехмерными структурными характеристиками, а также специфическими характеристики заряда. Говорят, что антитело специфично связывается с антигеном, если константа диссоциации равна ≤1 мкМ, предпочтительно, ≤100 нМ, и наиболее предпочтительно ≤10 нМ.
Термин "средство" используется в данном описании для обозначения химического соединения, смеси химических соединений, биологических макромолекул или экстракта, полученного из биологических материалов.
"Активный" или "активность" относительно DLL4 полипептида относится к части полипептида DLL4, обладающей биологической и/или иммунологической активностью природного полипептида DLL4. "Биологический" в данном описании обозначает биологическую функцию, которая является результатом активности нативного полипептида DLL4. Предпочтительная DLL4 биологическая активность включает, например, индуцированную DLL4 адгезию и инвазию и/или ангиогенез и/или пролиферацию клеток.
"Млекопитающее" в данном описании, относится к любому животному, которое считается млекопитающим. Предпочтительно млекопитающее является человеком.
"Животное" в данном описании охватывает животных, считающихся млекопитающими. Предпочтительно, животное является человеком.
Термин" mAb " относится к моноклональному антителу.
"Липосома" в данном описании относится к небольшой везикуле, которая может быть пригодна для доставки лекарственных средств, которые могут включать DLL4 полипептид по данному изобретению или антитело к такому полипептиду DLL4, млекопитающему.
Термины "метка" или "меченый" в данном описании относятся к введению обнаружимой метки в полипептид, например, радиоактивной, флуоресцентной метки, ферментной метки с введенной хемилюминесцентной меткой или биотинильной группой. Радиоизотопы или радионуклиды могут включать 3H, 14С, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I, флуоресцентные метки могут включать родамин, лантаноидный фосфор или ФИТЦ (FITC, флуоресцеин изотиоцианат), и ферментные метки могут включать пероксидазу хрена, β-галактозидазу, люциферазу, щелочную фосфатазу.
Дополнительные метки включают, посредством примеров и без ограничений,: ферменты, такие как глюкозо-6-фосфатдегидрогеназаза ("G6PDH"), альфа-D-галактозидаза, глюкозооксидаза, глюкозоамилаза, карбоангидраза, ацетилхолинэстераза, лизоцим, малатдегидрогеназа и пероксидаза; красители; дополнительные люминесцентные метки или флуорофоры включают, например, флуоресцеин и его производные, флуорохром, GFP (GFP для "зеленого флуоресцентного белка" (Green Fluorescent Protein)), дансил, умбеллиферон, фикоэритрин, фикоцианин, аллофикоцианин, о-фталевый альдегид и флуорескамин; флуорофоры, такие как криптальные лантаноиды и хелаты, например, европий и т.д. (Perkin Elmer и Cis Biointernational); хемолюминесцентные метки или хемолюминофоры, такие как изолюминол, люминол и диокситан; сенсибилизаторы; коферменты; субстраты ферментов; частицы, такие как латексные или углеродные частицы; металлический золь; кристаллит, липосомы, клетки и т.д., которые могут быть мечены красителем, катализатором и другой обнаружимой группой; молекулы, такие как биотин, дигоксигенин или 5-бромдезоксиуридин; фрагменты токсинов, такие как, например, фрагмент токсина, выбранный из группы: экзотоксин Pseudomonas (РЕ или цитотоксический фрагмент или его мутант), дифтерийный токсин или его цитотоксический фрагмент или мутант, ботулинический токсин А, В, С, D, Е или F, рицин или его цитотоксический фрагмент, например, рицин, абрин или его цитотоксический фрагмент, сапорин или его цитотоксический фрагмент, противовирусный токсин фитолакки американской или его цитотоксический фрагмент, и бредин 1 или его цитотоксический фрагмент.
Термин "фармацевтическое средство или лекарственное средство" в данном описании относится к химическим соединениям или композициям, способным вызывать желаемый терапевтический эффект при правильном введении пациенту. Другие химические термины используются в данном описании в соответствии с обычным использованием в данной области, о чем свидетельствует The McGraw-Hill Dictionary of Chemical Terms (Parker, S, Ed, McGraw-Hill, San Francisco (1985)) (включена в данное описание путем ссылки).
В данном описании термин "практически чистый" обозначает состояние, когда целевые молекулы являются преобладающим видом молекул (т.е., в молярном исчислении их больше, чем любые других видом молекул в композиции), и предпочтительно, в существенной мере очищенная фракция представляет собой композицию, в которой целевые молекулы составляют, по меньшей мере, около 50% (по молярности) от всех представленных высокомолекулярных частиц. В целом, практически чистая композиция будет содержать более чем 80% всех высокомолекулярных частиц, присутствующих в композиции, предпочтительно, более 85%, 90%, 95% и 99%. Наиболее предпочтительно, целевые молекулы являются очищенными до необходимой гомогенности (молекулы примесей не могут быть обнаружены в композиции традиционными способами обнаружения), при которой композиция состоит в основном из одних высокомолекулярных частиц.
Термин "пациент" включает в себя человека и субъекты ветеринарии.
"Антителозависимая клеточно-опосредованная цитотоксичность" и "ADCC" относятся к клеточной реакции, в ходе которой неспецифические цитотоксические клетки, которые экспрессируют Ig Fc рецепторы (FcRs) (например, природные клетки-киллеры (NK), моноциты, нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени, а затем вызывают лизис клетки-мишени. Первичные клетки, опосредующие ADCC, NK клетки, экспрессируют FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR в гемопоэтических клетках представлена в табл.3 на стр.464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оценки ADCC активности целевых молекул, может быть выполнен анализ ADCC in vitro, как описано в патентах США №5500362 или 5821337. Пригодные эффекторные клетки для таких анализов включают моноядерные клетки периферической крови (РВМС) и природные клетки-киллеры (NK). Альтернативно или дополнительно, ADCC активность целевых молекул может быть оценена in vivo, например, на модели животного, как это показано в Clynes et al. PNAS (USA) 95:652-656 (1988). "Комплементзависимая цитотоксичность" и "CDC" относятся к механизмам, посредством которых антитела выполняют свои функции уничтожения клеток. Она инициируется связыванием C1q, составляющего первого компонента комплемента, с Fc доменом Igs, IgG или IgM, который находится в комплексе с антигеном (Hughs-Jones, N.C, and В. Gardner. 1979. Mol. Immunol. 16:697). C1q является большим структурным комплексом гликопротеина размером ~410 кДа, присутствующим в сыворотке крови человека в концентрации 70 мкг/мл (Cooper, N.R. 1985. Adv. Immunol. 37:151). Вместе с двумя серинпротеазами - C1r и C1s - C1q образует комплекс С1 первого компонента комплемента. По крайней мере, два из N-терминальных шарообразных витков C1q должны быть связаны с Fc Igs для активации С1, и таким образом, для инициации каскада реакций комплемента (Cooper, N.R. 1985. Adv. Immunol. 37:151).
Термин "период полувыведения антитела" в данном описании обозначает фармакокинетическое свойство антитела, которое является мерой средней продолжительности жизни молекул антитела после введения. Период полувыведения антитела может быть выражен как время, необходимое для выведения 50% от известного количества иммуноглобулинов из организма пациента или конкретного его отсека, например, по данным измерения в сыворотке или плазме крови, т.е. период полувыведения из кровотока, или в других тканях. Период полувыведения может варьироваться от одного иммуноглобулина или класса иммуноглобулинов к другому. В целом, увеличение периода полувыведения антитела приводит к увеличению среднего времени удерживания (МРТ) в кровотоке для введенного антитела.
Термин "изотип" относится к классификации константного участка тяжелой или легкой цепи антитела. Константные участки антитела не участвуют в связывании с антигеном, но осуществляют различные эффекторные функции. В зависимости от аминокислотной последовательности константного участка тяжелой цепи, конкретные человеческие антитела или иммуноглобулины могут быть отнесены к одному из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM. Некоторые из этих классов могут быть дополнительно разделены на подклассы (изотипы), например, IgG1 (гамма-1), IgG2 (гамма-2), IgG3 (гамма-3), и IgG4 (гамма-4), IgA1 и IgA2. Константные участки тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и µ соответственно. Структура и пространственная конфигурация различных классов иммуноглобулинов хорошо известны. Из различных классов человеческих иммуноглобулинов, только человеческие IgG1, IgG2, IgG3, IgG4 и IgM, как известно, активируют комплемент. Человеческие IgG1 и IgG3, как известно, выполняют функцию медиатора у людей. Константные участки легкой цепи человека можно разделить на два основных класса, каппа и лямбда.
При желании, изотип антитела, которое специфически связывается с DLL4, может быть изменен, например, чтобы воспользоваться биологическими свойствами различных изотипов. Например, в некоторых случаях это может быть желательным в связи с генерацией антител в качестве лекарственного средства на основе моноклональных антител против DLL4, чтобы антитела были способны фиксировать комплемент и участвовать в комплементзависимой цитотоксичности (CDC). Существует ряд изотипов антител, которые способны это делать, в том числе, не ограничиваясь ими, следующие: мышиный IgM, мышиный IgG2a, мышиный IgG2b, мышиный IgG3, человеческий IgM, человеческий IgA, человеческий IgG1 и человеческий IgG3. В других вариантах это может быть желательным в связи с генерацией антител в качестве лекарственного средства на основе моноклональных антител против DLL4, чтобы антитела были способны связываться с рецепторами Fc на эффекторных клетках и участвовать в антителозависимой цитотоксичности (ADCC). Существует ряд изотипов антител, которые способны это делать, в том числе, не ограничиваясь ими, следующие: мышиный IgG2a, мышиный IgG2b, мышиный IgG3, человеческий IgG1 и человеческий IgG3. Следует отметить, что антитела, которые синтезируются, не должны изначально принадлежать к таким изотипам, а, скорее синтезированные антитела могут принадлежать к любому изотипу, и затем изотип антител может быть изменен с использованием обычных технических приемов, которые хорошо известны в данной области. Такие технические приемы включают, среди прочих, использование прямых рекомбинантных технических приемов (см., например, патент США №4,816,397), технические приемы слияния клеток (см., например, патенты США №№5,916,771 и 6,207,418).
В качестве примера, анти-DLL4 антитела, обсуждаемые в данном описании, являются полностью человеческими антителами. Если антитело обладает желаемой способностью связываться с DLL4, можно легко изменить его изотип таким образом, чтобы генерировать изотип человеческого IgM, человеческого IgG1 или человеческого IgG3, при сохранении такого же вариабельного участка (который определяет специфичность антитела и отчасти его сродство). Такая молекула в дальнейшем будет способна фиксировать комплемент и участвовать в CDC и/или будет способна связываться с рецепторами Fc на эффекторных клетках и участвовать в ADCC.
"Общий анализ крови" - это использование нефракционированной крови в качестве источника природных эффекторов. Кровь содержит комплемент в плазме, вместе с FcR-экспрессирующими клеточными эффекторами, такими как полиморф неядерные клетки (ПМЯ) и моноядерные клетки (МНК). Таким образом, общий анализ крови позволяет одновременно оценить синергизм эффекторных механизмов ADCC и CDC in vitro.
"Терапевтически эффективное" количество в данном описании, обозначает количество, которое обеспечивает некоторое улучшение или пользу субъекту. Другими словами, "терапевтически эффективное" количество обозначает количество, которое обеспечивает некоторое облегчение, смягчение последствий и/или уменьшение, по крайней мере, одного клинического симптома. Клинические симптомы, связанные с нарушениями, которые можно лечить способами по данному изобретению, хорошо известны специалистам в данной области. Кроме того, специалистам в данной области будет понятно, что терапевтический эффект не должен быть полным или вести к излечению, если какая-либо польза приносится субъекту.
Термин "и/или" в данном описании следует трактовать как конкретное раскрытие каждого из двух указанных признаков или компонентов, с другим или без него. Например, "А и/или Б" следует трактовать как конкретное раскрытие каждого из (i) А, (ii) Б и (iii) А и Б, таким же образом, как если бы каждый был описан индивидуально в данном описании.
Структура антитела
Известно, что основная структурная единица антитела включает тетрамер. Каждый тетраметр состоит из двух идентичных пар полипептидных цепей, каждая пара содержит одну «легкую» (приблизительно 25 кДа) и одну «тяжелую» цепь (приблизительно 50-70 кДа). Амино-концевая часть каждой цепи включает вариабельный участок длиной от приблизительно 100 до 110 или больше аминокислот, главным образом, ответственных за распознавание антигена. Карбокси-концевая часть каждой цепи определяет константный участок, главным образом, ответственный за эффекторную функцию. Человеческие легкие цепи классифицируются как легкие цепи каппа и лямбда. Тяжелые цепи классифицируются, как мю, дельта, гамма, альфа или ипсилон и определяют изотип антитела, как иммуноглобулин М, иммуноглобулин D, иммуноглобулин А и иммуноглобулин Е соответственно. Внутри легких и тяжелых цепей, вариабельный и константный участок соединены участком «J» из 12 или больше аминокислот, причем тяжелая цепь также включает участок "D" длиной приблизительно 10 или больше аминокислот. В общем, см. Fundamental Immunology Ch. 7 (Paul, W, ed., 2nd ed. Raven Press, N.Y. (1989)) (включена посредством ссылки в полном объеме для всех целей). Вариабельные участки каждой пары легкой/тяжелой цепей формируют сайт связывания с антителом.
Таким образом, интактное антитело содержит два сайта связывания. За исключением бифункциональных или биспецифичных антител, два сайта связывания одинаковы.
Все цепи демонстрируют одинаковую общую структуру относительно консервативных каркасных участков, соединенных посредством трех гипервариабельных участков, также именуемых CDR (участки, определяющие комплементарность). CDR от двух цепей каждой пары выровнены каркасными участками, что позволяет связывание со специфическим эпитопом. От N-конца к С-концу легкая и тяжелая цепи включают домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Отнесение аминокислот к каждому домену происходит в соответствии с определениями Kabat Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987 и 1991)) или Chothia & Lesk J. Mol. Biol. 196:901-917 (1987); Chothia et al. Nature 342:878-883 (1989).
Биспецифичное или бифункциональное антитело является искусственным гибридным антителом, содержащим две разные пары тяжелых/легких цепей и два разных сайта связывания. Биспецифичные антитела могут быть получены различными способами, включающими слияние гибридом или соединение Fab'-фрагментов. См., например, Songsivilai & Lachmann Clin. Exp. Immunol. 79:315-321 (1990), Kostelny et al. J. Immunol. 148:1547-1553 (1992). Биспецифные антитела не существуют в форме фрагментов с единственным сайтом связывания (например, Fab, Fab' и Fv)
Типично, VH-домен спаривают с VL-доменом для получения антигенсвязывающего сайта антитела, хотя VH- и VL-домен по отдельности могут быть использован! для связывания с антигеном. VH-домен (см. табл.2) может быть спарен с VL-доменом (см. табл.2) таким образом, что формируется антигенсвязывающий сайт антитела, включающий оба домена - VH и VL.
Человеческие антитела и гуманизация антител
Человеческие антитела позволяют избежать некоторых проблем, связанных с антителами, содержащими мышиный или крысиный вариабельный и/или константный участки. Присутствие таких мышиных или крысиных белков может вести к быстрому выведению антител или может вести в генерации иммунной реакции против антитела в организме пациента. Для того, чтобы избежать применения мышиных или крысиных антител, полностью человеческие антитела могут быть генерированы путем введения функциональных локусов человеческого антитела в организм грызуна, другого млекопитающего или животного таким образом, чтобы грызун, другое млекопитающее или животное продуцировало полностью человеческие антитела.
Один из способов генерации полностью человеческих антител состоит в использовании пород мышей XenoMouse®, которые были созданы для того, чтобы содержать конфигурированные фрагменты локуса человеческой тяжелой цепи и локуса каппа легкой цепи зародышевой линии размером до, но менее чем 1000 тысяч пар оснований. См. Mendez et al. Nature Genetics 15:146-156 (1997) и Green and Jakobovits J. Exp. Med. 188:483-495 (1998). Породы XenoMouse® доступны от Amgen, Inc. (Фремонт, Калифорния, США).
Такие мыши способны к продуцированию молекул человеческого иммуноглобулина и антител и неспособны к продуцированию молекул мышиного иммуноглобулина и антител. Технологии, примененные для достижения такого же результата раскрыты в Патентной заявке США №08/759,620, поданной 3.12.1996, и Международных патентных заявках WO 98/24893, опубликованной 11.06.1998, и WO 00/76310, опубликованной 21.12.2000, раскрытие которых, таким образом, включено в данное описание путем ссылки. См. также Mendez et al. Nature Genetics 15:146-156 (1997), раскрытие которой таким образом включено в данное описание путем ссылки.
Получение пород мышей XenoMouse® дополнительно рассмотрено и очерчено в Патентных заявках США с серийным номером 07/466,008, поданной 12.01.1990, 07/610.515 поданной 8.11.1990, 07/919,297, поданной 24.07.1992, 07/922,649, поданной 30.07.1992, 08/031,801, поданной 15.03.1993, 08/112,848, поданной 27.08.1993, 08/234,145, поданной 28.04.1994, 08/376,279, поданной 20.01.1995, 08/430, 938, поданной 27.04.1995, 08/464,584, поданной 5.06.1995, 08/464,582, поданной 5.06.1995, 08/463,191, поданной 5.06.1995, 08/462,837, поданной 5.06.1995, 08/486,853, поданной 5.06.1995, 08/486,857, поданной 5.06.1995, 08/486,859, поданной 5.06.1995, 08/462,513, поданной 5.06.1995, 08/724,752, поданной 2.10.1996, 08/759,620, поданной 3.12.1996, Публикации США 2003/0093820, поданной 30.11.2001, патентах США №№6,162,963, 6,150,584, 6,114,598, 6,075,181 и 5,939,598 и патентах Японии №№3068180 В2, 3068506 В2, и 3068507 В2. См. также Европейский патент № ЕР 0463151 В1, выданный и опубликованный 12.06.1996, Международную патентную заявку № WO 94/02602, опубликованную 3.02.1994, Международную патентную заявку № WO 96/34096, опубликованную 31.10.1996, WO 98/24893, опубликованную 11.06.1998, WO 00/76310, опубликованную 21.12.2000. Раскрытие каждого из вышеприведенных патентов, заявок или ссылок, таким образом, включено в данное описание путем ссылки в полном объеме.
В альтернативном подходе другие, включая GenPharm International, Inc, использовали подход «минилокуса». В подходе минилокуса, экзогенный Ig локус имитируется путем включения частей (отдельных генов) из Ig локуса. Таким образом, один или больше VH-генов, один или больше DH-генов, один или больше JH-генов, константный участок мю, и обычно второй константный участок (предпочтительно, константный участок гамма) формируют конструкцию для вставки в организм животных. Этот подход описан в патенте США №5,545,807, выданном Surani et al., и патентах США №№5,545,806, 5,625,825, 5,625,126, 5,633,425, 5,661,016, 5,770,429, 5,789,650, 5,814,318, 5,877,397, 5,874,299 и 6,255,458, выданных Lonberg и Kay, патентах США №№5,591,669 и 6,023.010, выданных Krimpenfort и Bems, патентах США №№5,612,205, 5,721,367 и 5,789,215, выданных Berns et al., патенте США №. 5,643,763, выданном Choi и Dunn, Международных патентных заявках США GenPharm, №07/574,748, подана 29.09.1990, 07/575,962, подана 31.19.1990, 07/810,279, подана 17.12.1991, 07/853,408, подана 18.03.1992, 07/904,068. подана 23.06.1992, 07/990,860, подана 16.12.1992, 08/053,131, подана 26.04.1993, 08/096,762, подана 22.07.1993, 08/155,301, подана 18.11.1993, 08/161,739, подана 3.12.1993, 08/165,699, подана 10.12.1993, 08/209,741, подана 9.03.1994, раскрытие которых таким образом включено посредством ссылки. См. также Европейский патент №0546073 В1, Международные патентные заявки № WO 92/03918, WO 92/22645, WO 92/22647, WO 92/22670, WO 93/12227, WO 94/00569, WO 94/25585, WO 96/14436, WO 97/13852 и WO 98/24884, a также патент США №5,981,175, раскрытие которых, таким образом, включено посредством ссылки. Далее см. Taylor et al., 1992, Chen et al., 1993, Tuaillon et al., 1993, Choi et al., 1993, Lonberg et al., (1994), Taylor et al., (1994) и Tuaillon et al., (1995), Fishwild et al., (1996), раскрытие которых, таким образом, включено посредством ссылки в полном объеме.
Kirin также продемонстрировал генерацию человеческих антител мышами, в организм которых путем микроклеточного слияния были введены большие части хромосом или целые хромосомы. См. Европейские патентные заявки №773 288 и 843 961, раскрытие которых таким образом включено посредством ссылки. Кроме того, были созданы мыши КМ™ как результат кроссбридинга мышей Tc Kirin с мышами, несущими минилокус Medarex (Humab). Эти мыши несут человеческие IgH трансхромосомы мышей Kirin и трансген каппа цепи мышей Genpharm (Ishida et al, Cloning Stem Cells, (2002) 4:91-102).
Человеческие антитела могут также быть получены методами in vitro. Подходящие примеры включают, не ограничиваясь ими, показ фага (MedImmune, Morphosys, Dyax, Biosite/Medarex, Xoma, Symphogen, Alexion (ранее Proliferon), Affimed), показ рибосомы (MedImmune), показ дрожжей и пр.
Получение антител
Антитела, рассматриваемые в данном описании, были получены с использованием технологии XenoMouse®, описанной ниже. Такие мыши способны продуцировать молекулы человеческого иммуноглобулина и антитела и неспособны к продуцированию мышиных молекул иммуноглобулина и антител. Технологии, применяемые для достижения такого же результата, раскрыты в патентах, заявках и ссылках, приведенных в разделе первоисточников в данном описании. В частности, предпочтительный вариант трансгенной выработки у мышей и соответствующих антител раскрыт в Патентной заявке США с серийным номером 08/759,620, поданной 3.12.1996, и Международных патентных заявках № WO 98/24893, опубликованной 11.06.1998, и WO 00/76310, опубликованной 21.12.2000, раскрытие которых, таким образом, включено посредством ссылки. См. также Mendez et al. Nature Genetics 15:146-156 (1997), раскрытие которой, таким образом, включено посредством ссылки.
Посредством использования такой технологии были продуцированы полностью человеческие моноклональные антитела против различных антигенов. Главным образом, линии мышей XenoMouse® иммунизируют целевым антигеном (например, DLL4), лимфатические клетки (такие как В-клетки) получают от гипериммунизированых мышей, и осуществляют слияние полученных лимфоцитов с линией миелоидных клеток для создания бессмертных линий гибридомных клеток. Такие линии гибридомных клеток отделяют и селекционируют, чтобы идентифицировать линии гибридомных клеток, которые вырабатывают специфические антитела к целевым антигенам. В данном изобретении предложены способы продуцирования линий мультигибридомных клеток, которые вырабатывают антитела, специфические к DLL4. Далее, в данном изобретении предложена характеристика продуцированных такими клеточными линиями антител, включающая анализ нуклеотидной и аминокислотной последовательности тяжелых и легких цепей таких антител.
Альтернативно, вместо слияния с клетками миеломы для генерации гибридом, В-клетки могут быть напрямую проанализированы. Например, В-клетки CD19+ могут быть выделены от гипериммунизированых мышей XenoMouse®, и может быть позволена их пролиферация и дифференциация до антитело-секретирующих клеток плазмы. Антитела из клеточного супернатанта далее подвергают скринингу, например, методом ELISA, FACS или FMAT, на предмет способности реагировать с иммуногеном DLL4. Супернатант также может быть подвергнут скринингу на предмет иммунореактивности в отношении фрагментов DLL4 для дальнейшего картирования с целью различения антител на предмет связывания с целевыми функциональными доменами DLL4. Антитела могут быть также подвергнуты скринингу против других родственных человеческих DLL4 и против ортологов DLL4 крысы, мыши и обезьяны, такой как яванская макака, в последнем случае - для определения перекрестной реактивности различных видов. В-Клетки из лунок, содержащих изучаемые антитела, могут быть иммортализированы различными методами, включая слияние с получением гибридом антител из отдельных или смешанных лунок, или инфицирование вирусом Эпштейн-Барр или трансфекцию известными иммортализированными генами, и далее посев на подходящую среду. В качестве альтернативы, единичные клетки плазмы, секретирующие антитела с требуемой специфичностью, далее выделяют, используя анализ DLL4-специфичной гемолитической бляшки (см., например, Babcook et al., Proc. Natl. Acad. Sci. USA 93:7843-48 (1996)). В качестве целевых клеток для лизиса предпочтительны красные кровяные клетки овцы, покрытые антигеном DLL4.
В присутствии культуры В-клеток, содержащей клетки плазмы, выделяющие целевой иммуноглобулин и комплемент, формирование бляшки указывает на специфичный, опосредованный DLL4 лизис красных кровяных клеток овцы, окружающих целевые клетки плазмы. Одиночная антиген-специфичная клетка плазмы в центре бляшки может быть выделена, и генетическую информацию, кодирующую специфичность антитела, выделяют из одиночной клетки плазмы. ДНК, кодирующая тяжелую и легкую цепь вариабельного участка антитела, может быть клонирована с использованием обратной транскрипции с последующей ПЦР (ОТ-ПЦР). Такая клонированная ДНК может далее быть вставлена в соответствующий вектор экспрессии, предпочтительно кассетный вектор, такой как pcDNA, более предпочтительно, вектор pcDNA, содержащий константные участки тяжелой и легкой цепи иммуноглобулина. Созданный вектор может далее быть трансфицирован в клетку-хозяина, например, клетки НЕК293, клетки СНО, с культивацией на стандартной питательной среде, модифицированной соответствующим образом для индукции транскрипции, селекции трансформантов или амплификации генов, кодирующих желательные последовательности.
Предусматривается, что антитела, специфически связывающиеся с DLL4, могут быть экспрессированы в клеточных линиях, отличные от гибридомных клеточных линий. Кодирующие последовательности конкретных антител могут быть использованы для трансформации подходящих клеток млекопитающих в качестве хозяев. Провести трансформацию можно любым известным методом для введения полинуклеотидов в клетку-хозяина, включая, например, упаковку полинуклеотида в вирус (или вирусный вектор) и трансдукцию клетки-хозяина вирусом (или вектором), или процедурой трансфекции, как представлено в патентах США №№4,399,216, 4,912,040, 4,740,461 и 4,959,455 (раскрытие которых таким образом включено в данное описание посредством ссылки). Применяемая процедура трансформации зависим от трансформируемого хозяина. Методы введения гетерогенных полинуклеотидов в клетки млекопитающих хорошо известны в данной области и включают опосредованную декстраном трансфекцию, осаждение кальция фосфатом, опосредованную полибреном трансфекцию, слияние протопластов, электропорацию, инкапсуляцию полинуклеотида(ов) в липосомы и прямую микроинъекцию ДНК в ядро.
Клеточные линии млекопитающих, пригодные в качестве хозяев для экспрессии, хорошо известны в данной области и включают множество бессмертных линий клеток, доступных в Американской коллекции типовых культур (АСТС), включая, но не ограничиваясь ими, клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почки новорожденного хомяка, клетки почки обезьяны, клетки злокачественной гепатомы человека (например, Hep G2), эпителиальные клетки почки человека 293 и другие линии клеток. Особенно предпочтительные линии клеток селекционируют путем определения линий клеток с высоким уровнем экспрессии, вырабатывающих антитела с конститутивными свойствами связывания с DLL4.
В технологии слияния клеток получают клетку миеломы, клетку СНО или клетку другой линии, которые содержат тяжелую цепь любого желательного изотипа, и получают другую клетку миеломы, клетку СНО или клетку другой линии, которые содержат легкую цепь. Такие клетки могут впоследствии быть подвергнуты слиянию, и может быть выделена линия клеток, экспрессирующая интактные антитела.
Следовательно, если генерируется потенциальное антитело, содержащее желательные структурные характеристики, как обсуждалось выше, оно может быть в общем снабжено, по крайней мере, желательными «функциональными» характеристиками через переключение изотипов.
Терапевтическое введение и препараты.
Варианты данного изобретения включают стерильные фармацевтические препаратов анти-DLL4 антител, которые пригодны для лечения заболеваний. Такие препараты должны ингибировать связывание природного DLL4 с Notch 1 или Notch 4, посредством чего эффективно лечатся патологические состояния, при которых, например, сывороточная или тканевая DLL4 экспрессия аномально повышена. Анти-DLL4 антитела предпочтительно обладают достаточным сродством для выраженного ингибирования связывания природного DLL4 с рецептором Notch 1 или Notch 4 и, предпочтительно, обладают достаточной продолжительностью действия, чтобы стало возможным не очень частое введение человеку. Пролонгированная длительность действия будет позволять меньшую частоту и более подходящий график введения путем чередования способов парентерального введения, таких как подкожная или внутримышечная инъекция.
Стерильные препараты могут быть получены, например, фильтрацией через мембрану для стерилизующей фильтрации, перед или после лиофилизации, и разведением антитела. Антитело обычно будет храниться в лиофилизированной форме или в растворе. Композиции терапевтических антител в основном упаковываются в контейнер, обеспечивающий стерильный доступ, например, пакет или флакон с внутривенным раствором, оборудованный адаптером, который позволяет извлекать препарат, например, пробка, позволяющая прокалывание гиподермальной инъекционной иглой.
Способ введения антитела соответствует известным способам, например, внутривенная, интраперитонеальная, интрацеребральная, внутримышечная, внутриглазная, внутриартериальная, внутриоболочечная инъекция или инфузия, ингаляции и введение внутрь пораженных тканей, прямая инъекция в область опухоли или системы замедленного высвобождения, как упоминается ниже. Антитело предпочтительно вводится длительной инфузией или инъекцией болюса.
Эффективное количество антитела, которое применяется терапевтически, будет зависеть, например, от терапевтических целей, способа введения и состояния пациента. Соответственно, предпочтительным является титрование дозы и модификация способа введения терапевтом, если это требуется для оптимального терапевтического эффекта. Типично, клиницист будет вводить антитело, увеличивая дозу до достижения желаемого эффекта. Прогресс такой терапии легко контролировать стандартными методами или методами, описанными в данном описании.
Антитела, как описано в данном описании, могут быть подготовлены смешиванием с фармацевтически приемлемым носителем. Такая терапевтическая композиция может быть введена внутривенно или через нос или легкое, предпочтительно, как жидкость или в виде порошка (лиофилизированного). Композиция может также быть введена парентерально или подкожно, по желанию. При системном введении, терапевтическая композиция должна быть стерильной, апирогенной, в пригодном для патентерального введения растворе с приемлемым значением рН, изотонической и стабильной. Эти условия известны специалистам в данной области. Если коротко, лекарственные формы соединений, рассматриваемых в данном описании, готовят для хранения или введения путем смешивания соединения, имеющего желаемый уровень чистоты, с фармацевтически приемлемым носителями, наполнителями или стабилизаторами. Такие материалы нетоксичны для реципиента в применяемой дозировке или концентрации, и включают буферные растворы, такие как ТРИС HCl, фосфат, цитрат, ацетат и другие соли органических кислот; антиоксиданты, такие как аскорбиновая кислота; пептиды с низкой молекулярной массой (меньше 10 остатков), такие как полиаргинин, белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидинон; аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин; моносахариды, дисахариды или другие углеводы, включающие целлюлозу или ее производные, глюкозу, маннозу или декстрины; хелатные агенты, такие как ЭДТА; сахарные спирты, такие как маннитол или сорбитол; противоионы, такие как натрий, и/или неионогенное ПАВ, например, Твин, Плуроник или полиэтиленгликоль.
Стерильные композиции для инъекций могут быть составлены в соответствии со стандартной фармацевтической практикой, как описано в Remington: The Science and Practice of Pharmacy (20th ed., Lippincott Williams & Wilkens Publishers (2003)). Например, растворение или суспендирование активного состава в фармацевтически приемлемом носителе, таком как вода или растительное масло природного происхождения, например, кунжутное, арахисовое, масло семян хлопчатника, или синтетическом жирном носителе, таком как этилолеат. Буферы, консерванты, антиоксиданты и прочие ингредиенты могут быть введены в соответствии с общепринятой фармацевтической практикой.
Приемлемые образцы препарата с пролонгированным действием включают полупроницаемую матрицу из твердого гидрофобного полимера, содержащего полипептид, где матрица имеет форму профилированных изделий, пленок или микрокапсул. Примеры матрицы с пролонгированным действием включают полиэстеры, гидрогели (например поли(2-гидроксиэтил-метакрилат), как описано у Langer et al, J. Biomed Mater. Res, (1981) 15:167-277 и Langer, Chem. Tech, (1982) 12:98-105, или поли(виниловый спирт)), полилактиды (патент США №3,773,919, Европейский патент 58,481), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman et al, Biopolymers, (1983) 22:547-556), неразлагаемый этилен-винилацетат (Langer et al, выше), разлагаемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON Depot™ (инъекционные микрогранулы, содержащие сополимер молочной кислоты-гликолевой кислоты и лейпролида ацетат), и поли-D-(-)-3-гидроксимасляная кислота (Европейский патент 133,988).
Хотя полимеры, такие как этилен-винилацетат или молочная кислота-гликолевая кислота, позволяют высвобождение молекул в течение свыше 100 дней, некоторые гидрогели высвобождают белки за меньший период времени, если инкапсулированные белки остаются в организме в течение длительного периода, они могут подвергаться денатурации или объединяться в агрегаты, как результат воздействия влажности при 37°С, что приводит к потере биологической активности или возможным изменениям иммуногенности. Могут разрабатываться рациональные стратегии для стабилизации белка, в зависимости от вовлеченных механизмов. Например, если обнаружится, что механизм агрегации состоит в образовании внутримолекулярной связи S-S через дисульфидный обмен, стабилизация может быть достигнута модификацией сульфгидрильных остатков, лиофилизацией из кислотных растворов, контролем содержания влаги, использованием подходящих добавок и разработкой специфических композиций с полимерной матрицей.
Композиции с пролонгированным действием включают также препараты кристаллов антитела, суспендированных в соответствующих составах, способных поддерживать кристаллы в суспензии. Эти препараты во время подкожного или внутрибрюшного введения могут создавать эффект замедленного высвобождения. Другие композиции также содержат включенные в липосомы антитела. Липосомы, содержащие такие антитела, готовят по сути известными методами: патент США № DE 3,218,121; Epstein et al., Proc. Natl. Acad. Sci. USA, (1985) 82:3688-3692; Hwang et al., Proc. Natl. Acad. Sci. USA, (1980) 77:4030-4034; EP 52,322; EP 36,676; EP 88,046; EP 143,949; 142,641; заявка на патент Японии 83-118008; патенты США №№4,485,045 и 4,544,545; и EP 102,324.
Доза композиции антитела для данного пациента будет определяться лечащим врачом, принимая во внимание различные известные факторы модификации действия препаратов, включающие тяжесть и тип заболевания, массу тела, пол, рацион, длительность и способ введения, другие медикаменты и другие клинически релевантные факторы. Терапевтически эффективные дозы могут быть определены in vitro или in vivo методами.
Эффективное количество антител, описанных в данном описании, применяемое терапевтически, будет зависеть, например, от терапевтических целей, способы введения и состояния пациента. Таким образом, предпочтительным является титрование дозы и модификация способа введения терапевтом, если это требуется для достижения оптимального терапевтического эффекта. Типичная суточная доза может находиться в диапазоне около 0,0001 мг/кг, 0,001 мг/кг, 0,01 мг/кг, 0,1 мг/кг, 1 мг/кг, 10 мг/кг, и до 100 мг/кг, 1000 мг/кг, 10000 мг/кг или больше на кг массы тела пациента, в зависимости от факторов, приведенных выше. Доза может составлять от 0,0001 мг/кг до 20 мг/кг, от 0,0001 мг/кг до 10 мг/кг, от 0,0001 мг/кг до 5 мг/кг, от 0,0001 до 2 мг/кг, от 0,0001 до 1 мг/кг, от 0,0001 мг/кг до 0,75 мг/кг, от 0,0001 мг/кг до 0,5 мг/кг, от 0,0001 мг/кг до 0,25 мг/кг, от 0,0001 до 0,15 мг/кг, от 0,0001 до 0,10 мг/кг, от 0,001 до 0,5 мг/кг, от 0,01 до 0,25 мг/кг или от 0,01 до 0,10 мг/кг массы тела пациента, в зависимости от факторов, приведенных выше. Типично, клиницист будет увеличивать дозу терапевтического антитела до достижения желаемого эффекта. Прогресс такой терапии легко контролируется стандартными анализами или как описано в данном описании.
Дозы антител по данному изобретению могут вводиться повторно, и введение может производиться с интервалом, по крайней мере, 1 день, 2 дня, 3 дня, 5 дней, 10 дней, 15 дней, 30 дней, 45 дней, 2 месяца, 75 дней, 3 месяца или, по крайней мере, 6 месяцев.
Следует понимать, что введение терапевтических средств в соответствии с композициями и способами в данном описании будет осуществляться с приемлемыми носителями, наполнителями и другими агентами, которые вводят в рецептуры для улучшения переноса, доставки, переносимости и пр. Такие рецептуры включают, например, порошки, пасты, мази, гели, воски, масла, липиды, липидсодержащие (катионные или анионные) пузырьки (такие как Lipofectin™), конъюгаты ДНК, безводные абсорбционные пасты, эмульсии «масло-в-воде» и «вода-в-масле», эмульсии карбовакс (полиэтиленгликоль различной молекулярной массы), полужидкие гели и полужидкие смеси, содержащие карбовакс. Любая из вышеизложенных смесей должна быть пригодной для лечения в соответствии с настоящим изобретением, при условии, что активный ингредиент в рецептуре не инактивируется при приготовлении, и рецептура физиологически совместима и пригодна для способа введения. См. также Baldrick P. "Pharmaceutical excipient development: the need for preclinical guidance." Regul. Toxicol. Pharmacol. 3 2(2):210-8 (2000), Wang W. "Lyophilization and development of solid protein pharmaceuticals." Int. J. Pharm. 203 (1-2):1-60 (2000), Charman WN "Lipids, lipophilic drugs, and oral drug delivery-some emerging concepts." V Pharm Sci. 89(8):967-78 (2000), Powell et al. "Compendium of excipients for parenteral formulations" PDA J Pharm Sci Technol. 52:238-311 (1998) и ссылки, приведенные в этих источниках, для дополнительной информации относительно препаратов, вспомогательных веществ и носителей, хорошо известных химикам-фармацевтам.
Дизайн и разработка других терапевтических средств
В соответствии с настоящим изобретением и базируясь на активности антител, которые продуцированы и охарактеризованы в данном описании, по отношению к DLL4, облегчается дизайн других схем терапевтического воздействия помимо фрагментов антител. Такие схемы включают, на ограничиваясь ими, улучшенные терапевтические средства на основе антител, такие как биспецифичные антитела, иммунотоксины и терапевтические средства с радиоактивной меткой, однодоменные антитела, фрагменты антител, такие как Fab, Fab', F(ab')2, Fv или dAb, создание пептидных терапевтических средств, связывающиеся с DLL4 домены на новых платформах, средства генной терапии, в особенности интраантитела, антисмысловые терапевтические средства и низкомолекулярные средства.
Антиген-связывающий сайт может быть обеспечен посредством расположения CDR на не относящихся к антителам белковых каркасах, таких как фибронектин или цитохром В, и т.д. (Haan & Maggos (2004) BioCentury, 12(5): A1-A6; Koide et al. (1998) Journal of Molecular Biology, 284:1141-1151; Nygren et al. (1997) Current Opinion in Structural Biology, 7:463-469), рандомизацией или мутацией аминокислотных остатков в петле белкового каркаса для наделения связывающей специфичностью с целевой мишенью. Каркасы для конструирования новых сайтов связывания в белках рассмотрены в деталях в Nygren et al. (Nygren et al. (1997) Current Opinion in Structural Biology, 7:463-469). Белковые каркасы для имитации антител раскрыты в WO/0034784, которая включена посредством ссылки в полном объеме для всех целей, где изобретатели описывают белки (имитирующие антитела), включающий домен фибронектина типа III, содержащий по крайней мере одну рандомизированную петлю. Подходящий каркас, в который пересажены один или больше CDR, например ряд HCDR, может быть обеспечен любым доменом-членом надсемейства генов иммуноглобулина. Каркас может быть человеческим или не человеческим белком. Преимущество белкового каркаса, не относящегося к антителам, состоит в том, что может быть обеспечен антигенсвязывающий сайт в молекуле каркаса, который имеет меньший размер и/или проще с точки зрения производства, чем, по меньшей мере, некоторые молекулы антител. Маленький размер связывающегося члена может обеспечивать полезные физиологические свойства, такие как возможность проникновения в клетку, глубоко в ткань или достигать мишени без помощи других структур, или связываться в белковых карманах целевого антигена. Использование антигенсвязывающих сайтов в белковых каркасах, не относящихся к антителам, рассмотрено в Wess, 2004 (Wess, L. In: BioCentury, The Bernstein Report on BioBusiness, 12(42), A1-A7, 2004). Типично, белки содержат стабильный каркас и одну или больше вариабельных петель, в которых осуществляют направленную и случайную мутацию аминокислотной последовательности петли или петель для создания антигенсвязывающего сайта, связывающегося с целевым антигеном. Такие белки включают IgG-связывающиеся домены протеина A S.aureus, трансферрин, альбумин, тетранектин, фибронектин (например 10-й домен фибронектина типа III), липокалины, а также гамма-кристаллин и другие каркасы Affilin™ (Scil Proteins). Примеры других подходов включают синтетические «микротела», основанные на циклотидах - низкомолекулярных белках, содержащих внутримолекулярные дисульфидные связи, микробелки (Versabodies™, Amunix) и белки с анкириновым повтором (DARPins, Molecular Partners)
В дополнение к последовательности антитела и/или антигенсвязывающего сайта, целевой связывающий агент в соответствии с данным изобретением может включать другие аминокислоты, например формирующие пептид или полипептид, такие как свернутый домен, или придавать молекуле другие функциональные характеристиками в дополнение к возможности связываться с антигеном. Нацеленные агенты связывания по данному изобретению могут переносить обнаружимую метку или быть конъюгированы с токсинами или нацеливающим фрагментом или ферментом (например, посредством пептидильной связи или линкера). Например, нацеленный агент связывания может включать в себя каталитический участок (например, в ферментном домене), а также участок связывания с антигеном, где участок связывания с антигеном связывается с антигеном и, таким образом, нацеливает каталитический участок на антиген. Каталитический участок может ингибировать биологическую функцию антигена, например, посредством расщепления.
В связи с генерацией усовершенствованных терапевтических средств на основе антител, где фиксация комплемента является желательным свойством, может быть возможным обходить зависимость от комплемента для гибели клеток путем использования биспецифичных антител, анатоксинов или радиоактивных меток.
Например, биспецифичные антитела могут быть сформированы таким образом, что они содержат (i) два антитела со специфичностью в отношении DLL4 и второй молекуле, соединенные вместе, (ii) одинарное антитело, содержащее одну цепь, специфичную в отношении DLL4, и вторую цепь, специфичную в отношении второй молекулы, или (iii) одноцепочечное антитело, обладающей специфичностью в отношении DLL4 и второй молекулы. Такие биспецифичные антитела могут быть образованы с использованием хорошо известных технологий; например, в связи с (i) и (ii) см., например, Fanger et al. Immunol Methods 4:72-81 (1994) и Wright and Harris, выше, и в связи с (in) см., например, Traunecker et al. Int. J. Cancer (Suppl.) 7:51-52 (1992). В каждом случае, вторая специфичность может быть введена для рецепторов активации тяжелой цепи, в том числе, не ограничиваясь ими, CD16 или CD64 (см., например, Deo et al. Immunol. Today 18:127 (1997)) или CD89 (см., например, Valerius et al. Blood 90:4485-4492 (1997)).
Антитела также могут быть модифицированы для действия в качестве анатоксинов, с применением хорошо известных в данной области технологий. См., например, Vitetta Immunol Today 14:252 (1993). См. также патент США №5,194,594. В связи с получением антител с радиоактивной меткой, такие модифицированные антитела могут также быть легко изготовлены с применением хорошо известных в данной области технологий. См. например, Junghans et al. в Cancer Chemotherapy and Biotherapy 655-686 (2d edition, Chafner and Longo, eds, Lippincott Raven (1996)). См. также патенты США №№4,681,581, 4,735,210, 5,101,827, 5,102,990 (RE 35,500), 5,648,471 и 5,697,902. Каждый анатоксин или молекула с радиоактивной меткой могли бы, вероятно, вызывать гибель клеток, экспрессирующих домен олигомеризации субъединиц целевого мультимерного фермента.
Если антитело соединено с агентом (например, радиоизотоп, фармацевтическая композиция или токсин), предполагается, что агент обладает фармацевтическим свойством, выбранным из группы антимитотических, алкилирующих, антиметаболических, антиангиогенных апоптических, алкалоидных, ЦОГ-2 и антибиотических агентов и их комбинацией. Препарат может быть выбран из группы хлорметинов, производных этиленимина, алкилсульфонатов, производных нитрозомочевины, триазинов, аналогов фолиевой кислоты, антрациклинов, таксанов, ингибиторов ЦОГ-2, аналогов пиримидина, аналогов пурина, антиметаболитов, антибиотиков, ферментов, эпиподофиллотоксинов, координационных комплексов платины, алкалоидов барвинка, замещенных аналогов мочевины, производных метилгидразина, средств, угнетающих кору надпочечников, антагонистов, эндостатинов, таксолов, камптотецинов, оксалиплатина, доксорубицинов и их аналогов, а также комбинаций.
Примеры токсинов дополнительно включают гелонин, экзотоксин Pseudomonas (РЕ), РЕ40, РЕ38, токсин дифтерии, рицин, абрин, альфа-токсин, сапорин, рибонуклеазу (РНКазу), ДНКазу I, стафилококковый энтеротоксин-А, противовирусный белок фитолакки американской, гелонин, эндотоксины Pseudomonas, члены энединового семейства молекул, такие как калихимицин и эсперамицин, а также производные, комбинации и модификации. Химические токсины могут также быть выбраны из группы, состоящей из дуокармицина (см. например, патент США №5,703,080 и патент США №4,923,990) метотрексата, доксорубицина, мелфалана, хлорамбуцила, цитарабина, виндезина, митомицина С, цисплатина, этопозида, блеомицина и 5-фторурацила. Примеры химиотерапевтических агентов также включают адриамицин, доксорубицин, 5-фторурацил, цитозина арабинозид (Ara-С), циклофосфамид, тиотепа, Таксотер (доцетаксел), бусульфан, цитоксин, таксол, метотрексат, цисплатин, мелфалан, винбластин, блеомицин, этопозид, ифосфамид, митомицин С, митоксантрон, винкристин, винорелбин, карбоплатин, тенипозид, дауномицин, карминомицин, аминопретин, дактиномицин, митомицины, эсперамицины (см. патент США №4,675,187) мелфалан и другие родственные хлорметины. Соответствующие токсины и химиотерапевтические средства описаны в Remington's Pharmaceutical Sciences, 19th Ed. (Mack Publishing Co. 1995), и в Goodman And Gilman's The Pharmacological Basis of Therapeutics, 7th Ed. (MacMillan Publishing Co. 1985). Другие подходящие токсины и/или химиотерапевтические агенты известны специалистам в данной области.
Примеры радиоизотопов включают гамма-излучатели, излучатели позитроном и излучатели рентгеновских лучей, которые могут быть применены для локализации и/или терапии, и бета-излучатели и альфа-излучатели, которые могут быть применены для терапии. Радиоизотопы, описанные ранее как пригодные для диагностики, прогнозирования и определения стадии, также пригодны для лечения.
Неограничивающие примеры противораковых или антилейкемических средств включают антрациклины, такие как доксорубицин (адриамицин), даунорубицин (дауномицин), идарубицин, деторубицин, карминомицин, эпирубицин, эзорубицин, морфолино- и замещенные производные, их комбинации и модификации. Примеры фармацевтических средств включают цисплатин, таксол, калихеамицин, винкристин, цитарабин (Ara-С), циклофосфамид, преднизон, даунорубицин, идарубицин, флудабарин, хлорамбуцил, интерферон альфа, гидроксикарбамид, темозоломид, талидомид и блеомицин, а также их производные, комбинации и модификации. Предпочтительно, противораковыми или антилейкемическими средствами являются доксорубицин, морфолинодоксорубицин или морфолинодаунорубицин.
Антитела по данному изобретению также охватывают антитела, у которых период полувыведения (например, период полувыведения из сыворотки) у млекопитающих, предпочтительно, человека, больше чем период полувыведения немодифицированного антитела. Вышеупомянутый период полувыведения антитела может составлять более 15 дней, 20 дней, 25 дней, 30 дней, 35 дней, 40 дней, 45 дней, 2 месяцев, 3 месяцев, 4 месяцев или более 5 месяцев. Увеличение периода полувыведения антител по настоящему изобретению или их фрагментов у млекопитающих, предпочтительно, у человека, приводит к более высокому сывороточному титру вышеупомянутых антител или фрагментов антител у млекопитающих, что позволяет уменьшить частоту введения вышеупомянутых антител или фрагментов антител и/или уменьшить концентрацию введенных вышеупомянутых антител или фрагментов антител. Антитела или их фрагменты с увеличенным периодом полувыведения in vivo могут быть произведены по известным технологиям. Например, антитела или их фрагменты с увеличенным периодом полувыведения могут быть произведены модификацией (например, замещение, делеция или добавление) определенных аминокислотных остатков, идентифицированных как принимающие участие во взаимодействии между доменом Fc и рецептором FcRn (см., например, международные публикации №№ WO 97/34631 и WO 02/060919, которые включены посредством ссылки в полном объеме для всех целей). Антитела или их фрагменты с увеличенным периодом полувыведения могут быть произведены присоединением к вышеупомянутым антителам или фрагментам антител полимерных молекул, таких как полиэтиленгликоль с высокой молекулярной массой (ПЭГ). ПЭГ может быть присоединен к вышеупомянутым антителам или фрагментам антител с или без мультифункционального линкера, или посредством сайт-специфичной конъюгации ПЭГ к N- или С-концам упомянутых антител или фрагментов антител, или через эпсилон-аминогруппы, присутствующие в остатках лизина. Будет применяться дериватизация с помощью линейного или разветвленного полимера, что приводит к минимальной потере биологической активности. Степень конъюгации будет тщательно контролироваться методом электрофореза в полиакриламидном геле с додецилсульфатом натрия и масс-спектрометрией для обеспечения надлежащей конъюгации молекул полиэтиленгликоля с антителами. Непрореагировавший полиэтиленгликоль может быть отделен от конъюгатов антитело-полиэтиленгликоль с помощью, например, гель-хроматографии или ионообменной хроматографии.
Как будет понятно специалистам в данной области, в вышеупомянутых модификациях, наряду с тем, что значения сродства могут быть важными, другие факторы могут быть настолько же или более важны, в зависимости от конкретной функции антитела. Например, для иммунотоксина (токсин, связанный с антителом) может быть подходящим процесс связывания антитела с мишенью; тем не менее, в некоторых модификациях, целевым конечным результатом является интернализация токсина в клетку. Антитела с высоким процентом интернационализации могут быть желательными в таких ситуациях. Таким образом, в одном из вариантов предусматриваются антитела с высокой эффективностью интернализации, которая может быть определена, как процент интернализированных антител, и может находиться в диапазоне от низкого значения до 100%. Например, в различных модификациях, 0,1-5, 5-10, 10-20, 20-30, 30-40, 40^5, 45-50, 50-60, 60-70, 70-80, 80-90, 90-99 и 99-100% может быть высокой эффективностью. Как будет понятно специалисту в данной области, желательная эффективность может быть различной в различных вариантах, в зависимости, например, от присоединенного средства, количества антитела, которое может быть введено в зону, побочных эффектов комплекса «антитело-средство», типа (например, вид рака) и сложности проблемы, которую необходимо лечить.
В других вариантах антител, раскрытых в данном описании, предлагается набор реактивов для определения экспрессии DLL4 в тканях или клетках млекопитающих, с целью осуществления скрининга на наличие заболевания или нарушения, связанного с изменениями экспрессии DLL4. Набор реактивов включает антитело, которое связывается с DLL4, и средства для индикации реакции антитела с антигеном, если таковая присутствует.
Комбинации
Нацеленный агент связывания или антитело, описанное в данном описании, может применяться в качестве монотерапии или может включать, в дополнение к соединениям по данному изобретению, обычное хирургическое вмешательство, лучевую терапию или химиотерапию. Такая химиотерапия может включать одну или больше следующих категорий противораковых средств:
(i) другие антипролиферативные/антибластомные препараты или их комбинации, применяемые в медицинской онкологии, такие как алкилирующие средства (например, цисплатин, оксалиплатин, карбоплатин, циклофосфамид, хлорметин, мелфалан, хлорамбуцил, бусульфан, темозоломид и нитрозомочевина); антиметаболиты (например, гемцитабин, и антифолаты, такие как фторпиримидины, например, 5-флорурацил и тегафур, ралтитрексед, метотрексат, цитозина арабинозид и гидроксимочевина); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-С, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин, таксаны, такие как таксол и таксотер, и ингибиторы поликиназы); и ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие как этопозид и тенипозид, амсакрин, топотекан и камптотецин);
(ii) цитостатические средства, такие как антиэстрогены (например, тамоксифен, фульвестрант, торемифен, ралоксифен, дролоксифен и йодоксифен), антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротерона ацетат), антагонисты или агонисты рилизинг-фактора лютеинизирующего гормона (например, гозерелин, лейпрорелин и бусерелин), прогестогены (например, мегестрола ацетат), ингибиторы ароматазы (например, анастрозол, летрозол, воразол и экземестан) и ингибиторы 5α-редуктазы, такие как финастерид;
(iii) антиинвазивные агенты (например, семейство ингибиторов c-Src киназы, таких как 4-(6-хлор-2,3-метилендиоксианалино)-7-[2-(4-метилпиперазин-1-ил)этокси]-5-тетрагидропирен-4-илоксихиназолин (AZD0530; международная патентная заявка WO 01/94341), N-(2-хлор-6-метилфенил)-2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метилпирамидин-4-имамино}триазол-5-карбоксиамид (дазатиниб, BMS-354825; J. Med. Chem., 2004, 47, 6658-6661) и ингибиторы металлопротеиназы, такие как маримастат, ингибиторы рецепторной функции урокиназного активатора плазминогена или ингибиторы катепсинов, ингибиторы серин-протеазы, например, матриптаза, гепсин, урокиназа, ингибиторы гепариназы);
(iv) цитотоксические средства, такие как флударабин, 2-хлордезоксиаденозин, хлорамбуцил или доксорубицин, и их комбинации, такие как флударабин + циклофосфамид, CVP: циклофосфамид + винкристин + преднизон, ACVBP: доксорубицин + циклофосфамид + виндезин + блеомицин + преднизон, CHOP: циклофосфамид + доксорубицин + винкристин + преднизон, CNOP: циклофосфамид + митоксантрон + винкристин + преднизон, m-BACOD: метотрексат + блеомицин + доксорубицин + циклофосфамид + винкристин + дексаметазон + лейковорин, МАСОР-В: метотрексат + доксорубицин + циклофосфамид + винкристин + фиксированная доза преднизона + блеомицин + лейковорин, или ProMACE CytaBOM: преднизон + доксорубицин + циклофосфамид + этопозид + цитарабин + блеомицин + винкристин + метотрексат + лейковорин;
(v) ингибиторы функции фактора роста, например, такие ингибиторы включают антитела против фактора роста и антитела против рецепторов фактора роста (например, анти-erbB2 антитело трастузумаб [Herceptin™], анти-EGFR антитело панитумумаб, анти-erbB1 антитело цетуксимаб [Erbitux, C225] и любые антитела против фактора роста или рецептора фактора роста, раскрытые Stern et al. Critical reviews in oncology/haematology, 2005, Vol.54, pp11-29); такие ингибиторы также включают ингибиторы тирозинкиназы, например, ингибиторы семейства эпидермального фактора роста (например ингибиторы тирозинкиназы семейства EGFR, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефинитиб, ZD1839) N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)-хиназолин-4-амин (CI 1033), ингибиторы тирозинкиназы erbB2, такие как лапатиниб, ингибиторы семейства фактора роста гепатоцитов, ингибиторы семейства тромбоцитарного фактора роста, такие как иматиниб, ингибиторы серин/треонинкиназы (например ингибиторы системы сигналов Ras/Raf, такие как ингибиторы фарнезилтрансферазы, например, сорафениб (BAY 43-9006)), ингибиторы системы проведения клеточных сигналов с помощью митоген-активируемой протеинкиназы и/или протеинкиназы В, ингибиторы семейства фактора роста гепатоцитов, ингибиторы c-kit, ингибиторы abl киназы, ингибиторы киназы рецептора инсулиноподобного фактора роста, ингибиторы киназы аврора (например AZD1152, РН739358, VX-680, MLN8054, R763, МР235, МР529, VX-528 и АХ39459), ингибиторы циклин-зависимой киназы, такие как ингибиторы CDK2 и/или CDK4, и ингибиторы белков проведения сигнала выживания, такие как Bcl-2, Bel-XL, например, АВТ-737;
(vi) антиангиогенные средства, такие как ингибиторы эффектов фактора роста эндотелия сосудов, [например антитело против фактора роста эндотелиальных клеток сосудов бевацизумаб (Avastin™), ингибиторы ангиопоиэтина-2 и ингибиторы тирозинкиназы рецепторов фактора роста эндотелия сосудов, такие как 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474; Пример 2 описания WO 01/32651), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171; Пример 240 описания WO 00/47212), ваталабин (PTK787; WO 98/35985) и SU11248 (зунитиниб; WO 01/60814; Sutent™), зорафениб (Nexxavar™), соединения, раскрытые в Международных патентных заявках WO97/22596, WO 97/30035, WO 97/32856, WO 98/13354, WO00/47212 и WO01/32651, и соединения, которые действуют по другим механизмам (например, линомид, ингибиторы функции интегрина αvβ3 и ангиостатин)] или колониестимулирующий фактор 1 (CSF1) или рецептор CSF1;
(vii) средства, повреждающие сосуды, такие как комбретастатин А4 и соединения, описанные в Международных патентных заявках WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213;
(viii) антисмысловые терапевтические средства, например, нацеленные на мишени, перечисленные выше, такие как G-3139 (Genasense), антисмысловой анти-bcl2;
(ix) подходы генной терапии, включая, например, подходы замещения аберрантных генов, таких как аберрантный р53 или аберрантные BRCA1 или BRCA2, GDEPT (ферментная терапия пролекарствами, нацеленными на ген), например, применение цитозиндезаминазы, тимидинкиназы или бактериального фермента нитроредуктазы, и подходы для повышения переносимости пациентом химиотерапии или лучевой терапии, такие как генная терапия резистентности ко многим лекарственным средствам; и
(х) методы иммунотерапии, включая, например, лечение алемтузумабом (campath-1H™, моноклональное антитело, направленное на CD52), или лечение антителами, направленными на CD22, ex vivo и in vivo способу увеличения иммуногенности раковых клеток пациента, трансфекция цитокинами, такими как интерлейкин 2, интерлейкин 4 или гранулоцитарно-моноцитарный колониестимулирующий фактор, методы уменьшения Т-клеточной анергии, какие как лечение моноклональными антителами, ингибирующими функцию CTLA-4, способы с применением трансфицированных иммуноцитов, таких как трансфицированные цитокинами дендритные клетки, способы с применением линий трансфицированных цитокинами опухолевых клеток и способы с применением антиидиотипических антител;
(xi) ингибиторы разложения белка, такие как ингибитор протеосомы, такой как Velcade (бортезомиб);
(xii) биотерапевтические методы, например те, в которых применяются пептиды или белки (такие как антитела или растворимые конструкции домена внешнего рецептора), секвестрирующие лиганды рецептора, связывание блокирующего лиганда с рецептором или снижение проведения рецептором сигнала (например, в результате повышенного разложения рецептора или снижения уровней экспрессии).
В одном из вариантов противораковое лечение, рассматриваемое в данном описании, может включать, в дополнение к соединением по данному изобретению, лечение другими антипролиферативными/антибластомными препаратами и их комбинациями, применяемыми в медицинской онкологии, такими как алкилирующие средства (например, цисплатин, оксалиплатин, карбоплатин, циклофосфамид, хлорметин, мелфалан, хлорамбуцил, бусульфан, темозоломид и нитрозомочевина); антиметаболиты (например, гемцитабин, и антифолаты, такие как фторпиримидины, например, 5-флорурацил и тегафур, ралтитрексед, метотрексат, цитозина арабинозид и гидроксимочевина); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-С, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды барвинка, такие как винкристин, винбластин, виндезин и винорелбин, таксаны, такие как таксол и таксотер, и ингибиторы поликиназы); и ингибиторы топоизомеразы (например, эпиподофиллтоксины, такие как этопозид и тенипозид, амсакрин, топотекан и камптотецин);
В одном из вариантов противораковое лечение, рассматриваемое в данном описании, может включать, в дополнение к соединением по данному изобретению, лечение гемцитабином.
Такое совместное лечение может осуществляться путем одновременного, последовательного или раздельного введения отдельных компонентов схемы лечения. В таких комбинированных продуктах применяются соединения по данному изобретению или их фармацевтически приемлемые соли, в диапазоне доз, описанных выше в данном описании, и другое фармацевтически активное средство в зарегистрированном для него диапазоне доз.
ПРИМЕРЫ
Следующие примеры, включая проведенные эксперименты и полученные результаты, приведены только с иллюстративной целью и не должны быть истолкованы, как ограничивающие, в рамках данного описания.
ПРИМЕР 1
ИММУНИЗАЦИЯ И ТИТРОВАНИЕ
Иммуногены
Внеклеточный домен DLL4 человека (аминокислоты 1-524) и рекомбинантный DLL4 человека, транзиторно экспрессированный в клетках яичника китайского хомячка (СНО), использовали в роли антигенов для иммунизации. Для генерации трансфектантов СНО в вектор pcDNA 3.1 вставили кДНК полноразмерных DLL4 человека (Yoneya et al., 2001, J. Biochem., 129, 27-34) и липофицировали в клетки СНО (Американская коллекция типовых культур, кат. № CCL-61). Экспрессию DLL4 человека на клеточной поверхности на уровне, соответствующем цели иммунизации, подтвердили при помощи анализа сортировки флюоресцентно-активированных клеток (FACS). Внеклеточный домен DLL4 человека субклонировали из полноразмерного DLL4 при помощи прямого 5'-AAGCTGGCTAGCGCGAATGGCGGCAGCGTCCCGGAG и обратного 5'-CAGCCTCGAGCGGCCGCCCAGGGGAAGCTGGGCGGCAAGC праймеров. Продут PCR очистили и дотировали в вектор экспрессии pSecTag от Invitrogen. Клон впоследствии трансфицировали в клетки 293Т при помощи реагента трансфекции 293fectin. Через 7 дней супернатанты клеток, содержащие целевой белок, собрали и обработали на предварительно уравновешенной колонке HisTrap (GE Healthcare, кат. №17-5247) в течение ночи. Колонку промыли связывающим буфером, содержащим 20 мМ натрия фосфата, 500 мМ натрия хлорида и 5 мМ имидазола, рН 7,4 перед тем, как his-меченый белок элюировали в буфере, содержащем 20 мМ натрия фосфата, 500 мМ натрия хлорида и 500 мМ имидазола, рН 7,4. Образец белка подвергали диализу в связывающем буфере в течение 1 часа при температуре 4°С перед последующим диализом в ФБР, рН 7,4 в течение 2 часов до стерилизации фильтра, количественного определения и оценки чистоты при помощи электрофореза в полиакриламидном геле с додецилсульфатом натрия с последующим окрашиванием Gelcode (Pierce, кат. №24950).
Иммунизация
Моноклональные антитела против DLL4 были получены последовательной иммунизацией мышей породы XenoMouse® (линия XenoMouse: XMG2 (IgG2 каппа/лямбда) и XMG4 (IgG4 каппа/лямбда) лаборатории Amgen, Inc. Ванкувер, Британская Колумбия, Канада) с внеклеточным доменом DLL4 или клеток СНО с повышенной экспрессией рекомбинантного DLL4 человека, как описано в примере 1. Мышей породы XenoMouse иммунизировали внутрибрюшинно и у основания хвоста для всех инъекций традиционными способами. Адьюванты включали Titermax Gold™ (Sigma, кат. № Т2684), гелевый адъювант алюминия фосфата, HCL Biosector, (кат. №1452-250) и мышиный адъювант ImmuneEasy (qCpG, Qiagen кат. №303105). Для растворимого иммуногена первую инъекцию 10 мкг внеклеточного домена DLL4 вводили с Titermax Gold™ (0-й день) и поочередные введения проводили с гелевым адъювантом алюминия фосфата и qCpG или Titremax Gold™ вместе с 5 мкг внеклеточного домена DLL4. Для иммуногена, основанного на клетке, первую инъекцию вводили с гелевым адъювантом алюминия фосфата и клетками 2Е6. Во время последующих введений клетки 1Е6 вводили при помощи того же адъюванта. Для обеих кампаний иммунизации введение проводили на 2-й, 6-й, 10-й, 16-й, 23-й, 30-й, 37-й, 44-й, 50-й, 64-й, 71-й, 75-й, 89-й, 104-й и 108-й день.
Отбор животных для наблюдения титра
Титры антител против человеческого DLL4 исследовали с целью проверки связывания с DLL4 человека и мыши, экспрессированного в клетках 293Т, с помощью метода клеточного выявления технологии флуориметрического микроанализа (FMAT) (Applied Biosystems). Данный анализ продемонстрировал у некоторых мышей наличие титров, специфических для DLL4. Таким образом, в конце программы иммунизации отобрали для наблюдения 17 мышей, и из селезенки и лимфатических узлов иммунизированных мышей изолировали лимфоциты, как описано в примере 2 ниже.
ПРИМЕР 2
ВЫХОД ЛИМФОЦИТОВ, ВЫДЕЛЕНИЕ В-КЛЕТОК, СЛИЯНИЕ И ГЕНЕРАЦИЯ ГИБРИДОМ
Иммунизированные мыши были умерщвлены смещением шейных позвонков, и от каждой когорты собирали и объединяли в пул дренирующие лимфатические узлы. Лимфоидные клетки отделяли растиранием в модифицированной по способу Дульбекко среде Игла (МДСИ) для высвобождения клеток из тканей, и клетки суспендировали в МДСИ. В-клетки обогатили положительным отбором при помощи бусин Dynal, меченых CD19. Слияние проводили смешиванием промытых обогащенных В-клеток, описанных выше, с клетками несекреторной миеломы P3X63Ag8.653, приобретенными у АТСС (кат. № CRL 1580) (Kearney et al., J. Immunol. 123, 1979, 1548-1550) в соотношении 1:1. Смесь клеток осторожно гранулировали центрифугированием при 800 х г. После полного удаления супернатанта клетки обрабатывали 2-4 мл раствора проназы (CalBiochem, кат. №53702; 0,5 мг/мл в ФБР) не более 2 мин. Затем 3-5 мл сыворотки телячьего эмбриона добавляли для остановки активности фермента, и суспензию откорректировали до общего объема 40 мл при помощи раствора электрического слияния клеток, (ECFS) (0,3 М сахароза, Sigma, кат. №S7903, 0,1 мМ магния ацетат, Sigma, кат. № М2545, 0,1 мМ кальция ацетат, Sigma, кат. № С4705). Супернатант удалили после центрифугирования, и клетки повторно суспендировали в 40 мл ECFS. Данную стадию промывания повторили, и клетки еще раз повторно суспендировали в ECFS до концентрации 2Е6 клеток/мл. Электрическое слияние клеток проводили при помощи генератора слияния, модель ЕСМ2001, Genetronic, Inc., Сан-Диего, Калифорния. Размер используемой камеры слияния составлял 2,0 мл, использовали следующие настройки инструмента: условия выравнивания: электрическое напряжение: 50 В, время: 50 с; разрушение мембраны при следующих условиях: электрическое напряжение: 3000 В, время: 30 мкс; время удерживания после слияния: 3 с. После проведения электрического слияния клеток клеточные суспензии аккуратно удаляли из камеры слияния при условиях стерильности и помещали в стерильную пробирку, содержащую такой же объем питательной среды гибридомы (DMEM (JRH Biosciences), 15% СТЭ (Hyclone) с добавлением 2 мМ L-глутамина (Sigma, кат. №02150), 10 Ед/мл пенициллина/0,1 мг/мл стрептомицина (Sigma, кат. №Р7539), 1 флакон/л ОПИ (оксалоацетат, пируват, бычий инсулин; Sigma кат. №05003) и 10 Е/мл рекомбинантного человеческого IL-6 (Boehringer Mannheim, кат. №1131567). Клетки инкубировали в течение 15-30 минут при температуре 37°С, а затем центрифугировали 400 х г в течение 5 мин. Клетки аккуратно повторно суспендировали в небольшом объеме селекционной среды гибридомы (питательная среда для гибридомы с добавлением 0,5х НА (Sigma, кат. № А96б6)), и скорректировали объем соответствующим образом при помощи дополнительного количества селекционной среды гибридомы, основываясь на конечном культивировании общего количества 5Е6 В-клеток на 96-луночный планшет и 200 мкл на лунку. Клетки аккуратно перемешали, с помощью пипетки переносили на 96-луночный планшет и выращивали. Собирали истощающие супернатанты клеток, которые потенциально продуцируют антитела против DLL4, и исследовали в последующих скрининговых анализах, как описано в примерах ниже.
ПРИМЕР 3
СВЯЗЫВАНИЕ С КЛЕТКАМИ, КОТОРЫЕ СВЯЗЫВАЮТСЯ С DLL4 ЧЕЛОВЕКА И ЯВАНСКОЙ МАКАКИ И JAGGED 1 ЧЕЛОВЕКА
Супернатанты, собранные от клеток, выращенных в культуре, исследовали с целью оценить их способность секретировать антитела для связывания с клетками 293Т, которые кратковременно повышенно экспрессируют полноразмерные DLL4 человека или яванской макаки или Jagged 1 человека. Линию клеток 293Т, трансфицированную имитацией, использовали как отрицательный контроль. Клетки, разбавленные ФБР, содержащим 2% сыворотки телячьего эмбриона, высевали при плотности 3000 экспрессирующих клеток и 15000 клеток, трансфицированных имитацией, на лунку на 384-луночные планшеты (Coming Costar, кат. №3712). Непосредственно после посева добавляли 15 или 20 мкл/лунку супернатантов гибридомы и 10 мкл/лунку вторичного антитела (козьего против человека IgG Fc Cy5, конечная концентрация 750 нг/мл) и инкубировали планшеты в течение 3 часов при комнатной температуре до чтения флуоресценции при помощи инструмента FMAT 8200 (Applied Biosystems). Связывание химер человеческого Notch 1/Fc (R&D systems, кат. №3647-TK), разбавленных в соотношении 1:2 от 2,86 мкг/мл использовали как положительный контроль для DLL4, а химеры человеческого Notch3/Fc, разбавленные от 10 мкг/мл использовали как положительный контроль для связывания с Jagged 1. Результаты для 12 супернатантов гибридом, которые демонстрируют связывание супернатантов гибридом с DLL4 человека или яванской макаки или Jagged 1 человека, приведены в табл.3.
ПРИМЕР 4
ИНГИБИРОВАНИЕ СВЯЗЫВАНИЯ РЕЦЕПТОРА NOTCH1-DLL4-ЛИГАНД
С целью определения относительной активности антитела, содержащего супернатанты, оценивали их способность ингибировать связывание Notch 1/Fc человека с DLL4 человека, кратковременно повышенно экспрессированные в клетках 293Т. Трансфицированные и нетрансфицированные клетки 23 9Т восстанавливали в ФБР, содержащем 2% сыворотку телячьего эмбриона, и 5000 Трансфицированные и 17500 нетрансфицированные клетки сеяли в 20 мкл в лунки 384-луночного планшета культуры ткани (Corning Costar, кат. №3712). Впоследствии добавляли 20 мкл супернатанта гибридомы, и инкубировали планшеты при температуре 4°С в течение 1 часа, после чего добавляли 20 мкл Notch 1/Fc человека, меченного Alexa-647, при конечной концентрации 6,7 нг/мл. Спустя еще 3 часа инкубирования при температуре 4°С, определяли количество связанного Notch1/Fc посредством чтения флуоресценции в каждой лунке при помощи инструмента FMAT 8200 (Applied Biosystems). Результаты для 12 супернатантов гибридом приведены в табл.4. Результаты представлены в виде % ингибирования с минимальным ингибированием в анализе, которое определяли по эффектам супернатантов связывания HC-DLL4, приготовленных аналогичным способом, описанным в примере 2, и максимальным ингибированием, которое определяли как сигнал, полученный в присутствии насыщающей концентрации немеченого Notch1/Fc. N.T. = испытание не проводилось.
ПРИМЕР 5
СТРУКТУРНЫЙ АНАЛИЗ АНТИ-DLL4 АНТИТЕЛ
Вариабельные тяжелые и легкие цепи антител секвенировали для определения последовательности ДНК. Полная информация о последовательности для анти-DLL4 антител предоставлена в перечне последовательностей, где приведены нуклеотидные и аминокислотные последовательности для каждой комбинации цепей гамма и каппа. Вариабельные последовательности тяжелых цепей были проанализировали для определения VH семейства, последовательности D- и J-участков. Последовательности транслировали для определения первичной аминокислотной последовательности и сравнивали с VH генеративной линии, последовательностью D и J-участков, чтобы оценить соматическую гипермутацию.
Табл.2 представляет собой сравнительную таблицу участков тяжелой цепи антитела с родственным участком тяжелой цепи генеративной линии, и участков легкой цепи каппа с родственным участком легкой цепи генеративной линии. Вариабельные (V) участки цепей иммуноглобулина кодируются множественными сегментами генеративной линии ДНК, которые объединяются в функциональные Вариабельные участки (VHDJH или VKJK) во время онтогенеза В-клеток. Подробно исследовали молекулярное и генетическое разнообразие реакций антитела на DLL4.
Следует также принять во внимание, что там, где конкретное антитело отличается от соответствующей последовательности генеративной линии на аминокислотном уровне, в последовательность антитела может быть введена мутация, восстанавливающая последовательность генеративной линии. Такие корректирующие мутации могут быть введены в одном, двух, трех или больше положениях или комбинации любых положений мутации, с использованием стандартных техник молекулярной биологии. В качестве неограничивающих примеров, табл.8 показывает, что последовательность легкой цепи 2Н10 (SEQ ID NO.:6) отличается от соответствующей последовательности генеративной линии (см. табл.2) мутацией от V до А в положении 18 (мутация 1), мутацией от V до А в положении 32 (мутация 2), мутацией от Е до D в положении 50 (мутация 3), мутацией от S до N в положении 65 (мутация 4), мутацией от Т до А в положении 89 (мутация 5) и мутацией от L до Т в положении 94 (мутация 6). Таким образом, аминокислотная или нуклеотидная последовательность, кодирующая легкую цепь 2Н10, может быть модифицирована в любом из указанных или всех указанных сайтах. Табл.2-9 ниже иллюстрируют положения таких вариаций из генеративной линии для 2Н10, 9G8, 21Н3 и 4В4. Каждый ряд показывает уникальную комбинацию генеративной линии или не относящихся к генеративной линии остатков в положении, выделенном полужирным начертанием шрифта.
В другом варианте, настоящее изобретение включает замену любых структурных дефектов в последовательности, которые могут повлиять на гетерогенность антител по данному изобретению. Такие дефекты включают сайты гликозилирования, неспаренные остатки цистеина, контактирующие с поверхностью остатки, и т.д. Для уменьшения риска подобной гетерогенности предлагается ввести изменения для устранения одного или больше таких структурных дефектов.
В одном из примеров неспаренные остатки цистеина могут быть заменены отдельно или в сочетании с другими структурными изменениями. Пример неспаренного остатка цистеина можно наблюдать в легкой цепи CDR1 антитела 2Н10 или 9G8 в положении 33. Данный неспаренный остаток цистеина может мутировать до подходящей аминокислоты, обладающей сравнимыми свойствами боковой цепи, такой как серин. В другом примере, неспаренный остаток цистеина встречается в тяжелой цепи FR4 антитела 20G8 в положении 203. Данный неспаренный остаток цистеина может мутировать подобным образом до подходящей аминокислоты, обладающей сравнимыми свойствами боковой цепи, такой как серин.
В некоторых вариантах данного изобретения, нацеленный агент связывания или антитело содержит последовательность, включающую SEQ ID NO.:30. В конкретных вариантах SEQ ID NO.:30 включает любую из комбинаций остатков генеративной линии и не принадлежащих к генеративной линии, указанных в каждом ряду табл.5. В некоторых вариантах SEQ ID NO:30 содержит любые 1, 2, 3, 4, 5, 6, или все 6 остатков генеративной линии, как указано в табл.5. В конкретных вариантах SEQ ID NO.:30 любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.5. В других вариантах, нацеленный агент связывания или антитело является производным последовательности генеративной линии с VH1-18, D2-15 и JH3 доменами, где один или больше остатков мутировали до соответствующих остатков генеративной линии в указанном положении. В конкретных примерах вариабельного домена тяжелой цепи 21Н3 мутировавшего до конкретной последовательности генеративной линии, последовательность включает 21H3VHOP (оптимизированный, где не принадлежащий к генеративной линии участок мутировал до L в положении 45 и до М в положении 70), как показано в табл.13.
В некоторых вариантах данного изобретения, нацеленный агент связывания или антитело содержит последовательность, включающую SEQ ID NO.:32. В конкретных вариантах SEQ ID NO.:32 включает любую из комбинаций остатков генеративной линии и не принадлежащих к генеративной линии, указанных в каждом ряду табл.6. В некоторых вариантах SEQ ID NO:32 содержит любые 1, 2, 3, 4, 5 или все 5 остатков генеративной линии, как указано в табл.6. В других вариантах нацеленный агент связывания или антитело является производным последовательности генеративной линии с VL, 1g, JL2 доменами, где один или больше остатков мутировали до соответствующих остатков генеративной линии в указанном положении. Конкретные примеры вариабельного домена легкой цепи 21Н3, который мутировал до конкретных последовательностей генеративной линии, включают 21Н3 VLOP1 (оптимизированный, где не принадлежащий к генеративной линии участок мутировал до K в положении 107) и 21Н3 VLOP2 (оптимизированный, где не принадлежащий к генеративной линии участок мутировал до K в положениях 67 и 107). См. табл.13.
В некоторых вариантах данного изобретения, нацеленный агент связывания или антитело содержит последовательность, включающую SEQ ID NO.:2. В конкретных вариантах SEQ ID NO.:2 включает любую из комбинаций остатков генеративной линии и не принадлежащих к генеративной линии, указанных в каждом ряду табл.7. В некоторых вариантах SEQ ID NO:2 содержит любой 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или все 11 остатков генеративной линии, как указано в табл.7. В конкретных вариантах SEQ ID NO.:2 содержит любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.7. В других вариантах нацеленный агент связывания или антитело является производным последовательности генеративной линии с VH1-18, D7-27 и JH4 доменами, где один или больше остатков мутировали до соответствующих остатков генеративной линии в указанном положении.
В некоторых вариантах настоящего изобретения нацеленный агент связывания или антитело содержит последовательность, включающую SEQ ID NO.:4. В конкретных вариантах SEQ ID NO.:4 включает любую из комбинаций остатков генеративной линии и не принадлежащих к генеративной линии, указанных в каждом ряду табл.8. В некоторых вариантах SEQ ID NO:4 содержит любой 1, 2, 3, 4, 5 или все 5 остатков генеративной линии, как указано в табл.8. В конкретных вариантах SEQ ID NO.:4 содержит любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.8. В других вариантах нацеленный агент связывания или антитело является производным последовательности генеративной линии с VL, 3p и JL2 доменами, где один или больше остатков мутировали до соответствующих остатков генеративной линии в указанном положении.
Еще один вариант. В некоторых вариантах данного изобретения нацеленный агент связывания или антитело содержит последовательность, включающую SEQ ID NO.:6. В конкретных вариантах SEQ ID NO.:6 включает любую из комбинаций остатков генеративной линии и не принадлежащих к генеративной линии, указанных в каждом ряду табл.9. В некоторых вариантах SEQ ID NO:6 содержит любой 1, 2, 3, 4, 5, 6 или все 6 остатков генеративной линии, как указано в табл.9. В конкретных вариантах SEQ ID NO.:6 содержит любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.9. В других вариантах нацеленный агент связывания или антитело является производным последовательности генеративной линии с Vh3-33, D6-13 и JH4 доменами, где один или больше остатков мутировали до соответствующих остатков генеративной линии в указанном положении. Примером последовательности, которая подверглась мутации, является 2Н10 VHOP, где М в положении 93 мутировал до V. См. табл.13.
Еще один вариант. В некоторых вариантах данного изобретения нацеленный агент связывания или антитело содержит последовательность, включающую SEQ ID NO.:8. В конкретных вариантах SEQ ID NO.:8 включает любую из комбинаций остатков генеративной линии и не принадлежащих к генеративной линии, указанных в каждом ряду табл.10. В некоторых вариантах SEQ ID NO:8 содержит любые 1, 2, 3, 4, 5, 6 или все 6 остатков генеративной линии, как указано в табл.10. В конкретных вариантах SEQ ID NO.:8 содержит любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.10. В других вариантах нацеленный агент связывания или антитело является производным последовательности генеративной линии с VL, 3r и JL2 доменами, где один или больше остатков мутировали до соответствующих остатков генеративной линии в указанном положении. В конкретных вариантах SEQ ID NO.:8 может содержать дополнительные модификации, которые включают удаление структурных дефектов. Например, кроме генеративной линии С33 может мутировать до S - см., например, 2Н10 VLOP1 в табл.13. Таким образом, SEQ ID NO.:8 может содержать любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.10, и дополнительно включать мутации С33 до S. Примером последовательности, где легкая цепь подвергалась мутации для удаления структурного дефекта в С33 и далее подвергалась обратной мутации до последовательности генеративной линии, является 2Н10 VLOP2, как показано в табл.13, где С33 мутировал до S, V в положении 18 мутировал до А, а S в положении 65 мутировал до N.
В некоторых вариантах настоящего изобретения нацеленный агент связывания или антитело содержит последовательность, включающую SEQ ID NO.:22. В конкретных вариантах SEQ ID NO.:22 включает любую из комбинаций остатков генеративной линии и не принадлежащих к генеративной линии, указанных в каждом ряду табл.11. В некоторых вариантах SEQ ID NO:22 содержит любые 1, 2, 3, 4, 5, 6, 7 или все 7 остатков генеративной линии, как указано в табл.11. В конкретных вариантах SEQ ID NO.:22 содержит любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.11. В других вариантах нацеленный агент связывания или антитело является производным последовательности генеративной линии с VH4-39, D4-23 and JH3 доменами, где один или больше остатков мутировали до соответствующих остатков генеративной линии в указанном положении. Примером последовательности, где тяжелая цепь мутировала обратно до последовательности генеративной линии, является 9G8 VHOP1, приведенная в табл.13, где L в положении 38 мутировал до W. Другим примером последовательности, где тяжелая цепь мутировала обратно до последовательности генеративной линии, является 9G8 VHOP2, приведенная в табл.13, где S в положении 21 мутировал до Т, L в положении 38 мутировал до W, S в положении 70 мутировал до Т, a F в положении 96 мутировал до Y.
Еще один вариант. В некоторых вариантах данного изобретения нацеленный агент связывания или антитело содержит последовательность, включающую SEQ ID NO.:8. В конкретных вариантах SEQ ID NO.:24 включает любую из комбинаций остатков генеративной линии и не принадлежащих к генеративной линии, указанных в каждом ряду табл.12. В некоторых вариантах SEQ ID NO:24 содержит любые 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или все 11 остатков генеративной линии, как указано в табл.12. В конкретных вариантах SEQ ID NO.:24 содержит любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.12. В других вариантах нацеленный агент связывания или антитело является производным последовательности генеративной линии с VL, 3r и JL2 доменами, где один или больше остатков мутировали до соответствующих остатков генеративной линии в указанном положении. В конкретных вариантах SEQ ID NO.:24 может содержать дополнительные модификации, которые включают удаление структурных дефектов. Например, SEQ ID NO.:24 может содержать любую одну из уникальных комбинаций остатков генеративной линии или не принадлежащих к генеративной линии, указанных в каждом ряду табл.12, и дополнительно включать мутацию С33 до S. Примером является 9G8 VLOP1, где легкую цепь подвергали мутации для удаления структурного дефекта в С33, и дополнительно подвергали обратной мутации до последовательности генеративной линии в положении 7, где S мутировала до Р, и V в положении 79 мутировала до А. Другим примером является 9G8 VLOP2, где С33 мутировала до S, S в положении 2 мутировала до Y, S в положении 7 мутировала до Р, R в положении 19 мутировала до S, Т в положении 39 мутировала до Р, и V в положении 79 мутировала до А. Подробнее см. табл.13.
Специалисту будет понятно, что существуют альтернативные методы определения границ CDR. Все границы CDR в табл.2 и 13 определены в соответствии с определением Kabat.
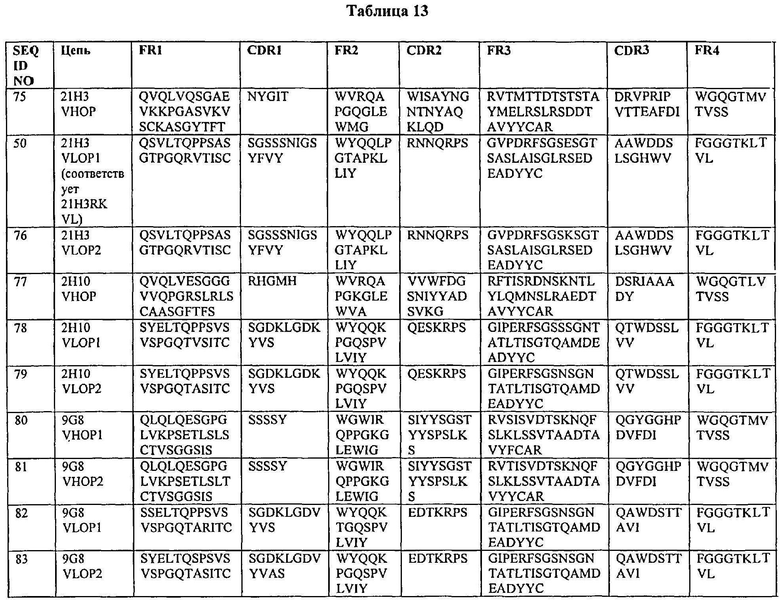
ПРИМЕР 6
ОПРЕДЕЛЕНИЕ АКТИВНОСТИ АНТИТЕЛ ПРОТИВ DLL4 ОТНОСИТЕЛЬНО ИНГИБИРОВАНИЯ СВЯЗЫВАНИЯ РЕЦЕПТОРА DLL4 NOTCH1-ЛИГАНД
Для того, чтобы установить разницу между очищенными антителами, основываясь на их способности предотвращать взаимодействие между полноразмерным рекомбинантным DLL4 и растворимым Notch1/Fc, проводили следующие анализы. Трансфицированные и нетрансфицированные клетки 23 9Т восстанавливали в ФБР, содержащем 2% сыворотку телячьего эмбриона, и 5000 трансфицированных и 17500 нетрансфицированных клеток сеяли в 30 мкл в лунки 384-луночного планшета культуры ткани (Corning Costar, кат. №3712). Впоследствии добавляли 30 мкл очищенных антител, серийно разбавленных от супернатанта гибридомы в концентрации 5 мкг/мл, и инкубировали планшеты при температуре 4°С в течение 1 часа, после чего добавляли 20 мкл 100 нг/мл Notch1/Fc человека, меченного Alexa-647. Спустя еще 3 часа инкубирования при температуре 4°С, определяли количество связанного Notch1/Fc посредством чтения флуоресценции в каждой лунке при помощи инструмента FMAT 8200 (Applied Biosystems). Результаты для 12 очищенных антител приведены в табл.14, которая демонстрирует способность очищенных антител ингибировать взаимодействия между рекомбинантного полноразмерным DLL4 человека и химерами Notch1/Fc.
Дополнительно проводили подобные эксперименты и вычисления с применением инструмента FACSCalibur (BD Biosciences). Для данных экспериментов материнские клетки 293Т или клетки, кратковременно Трансфицированные DLL4 человека восстанавливали в ФБР, содержащем 2% сыворотку телячьего эмбриона, и добавляли в концентрации 25000 клеток/лунку в лунки, содержащие очищенные антитела в конечной концентрации 10 мкг/мл, 1 мкг/мл или 0,1 мкг/мл. После инкубирования в течение 1 часа при температуре 4°С добавляли Notch1/Fc человека, меченного Alexa-647 в конечной концентрации 227 нг/мл, и инкубировали планшеты в течение 2 часов при температуре 4°С. После промывания с применением ФБР, содержащем 2% сыворотку телячьего эмбриона, определяли количество связанных Notch1/Fc при помощи прочтения флуоресценции в каждой лунке с использованием инструмента FACSCalibur. При указанных условиях способность 20 очищенных антител ингибировать взаимодействия DLL4-Notch1 была подобна способности, наблюдавшейся при использовании инструмента FMAT (данные не приведены). Аналогичные результаты также получали при проведении экспериментов в формате ELISA с использованием растворимого DLL4 человека и растворимого Notch1 человека (данные не приведены).
Дальнейшие эксперименты проводили по отбору антител с применением клеток HEK293, которые устойчиво трансфицировали с DLL4 человека, мыши или яванской макаки при помощи ретровирусных констрактов. В данных экспериментах антитела анти-DLL4 (конечная концентрация: 10-0,01 мкг/мл), разбавленные в ФБР, содержащем 2% сыворотку телячьего эмбриона, добавляли к DLL4-экспрессирующим клеткам HEK293 (50000 клеток/лунку, разбавленные в ФБР, содержащем 2% сыворотку телячьего эмбриона) и инкубировали в течение 1 часа при температуре 4°С. Впоследствии добавляли Notch1/Fc человека, крысы, меченый Alexa-647, или Notch1/Fc мыши, меченый АРС (например, R&D Systems, кат. №3647-TK-050, 1057-TK-050, 5267-TK-050, соответственно) в конечной концентрации 0,01-0,5 мкг/мл, а планшеты дополнительно инкубировали в течение 2 часов при температуре 4°С до промывания и чтения на инструменте FACSCalibur. Табл.15 демонстрирует способность очищенных антител различных изотипов ингибировать взаимодействия между химерами рекомбинантного полноразмерного DLL4 человека, яванской макаки и мыши и 0,1 или 0,25 мкг/мл Notch1/Fc человека, крысы или 0,5 мкг/мл Notch1/Fc мыши, как установлено при помощи анализа FACS.
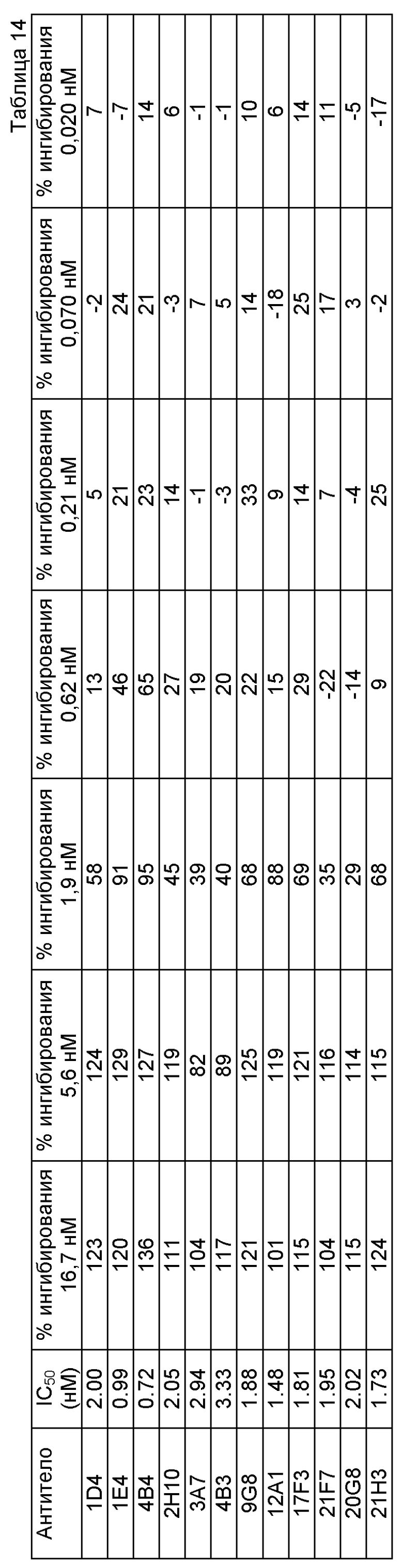
ПРИМЕР 7
ПЕРЕКРЕСТНАЯ РЕАКТИВНОСТЬ АНТИТЕЛ ПРОТИВ DLL4 С JAGGED1 ЧЕЛОВЕКА И DLL1 ЧЕЛОВЕКА
Способность очищенных антител связываться с Jagged1 человека и Dll1 человека определяли с применением анализа FACS. Краткое описание состоит в том, что, клетки 293Т трансфицировали имитацией или кратковременно трансфицировали с Jagged1 человека (доступ №: НМ_000214) или Dll1 человека (доступ №: НМ_005618) с применением Lipofectamine 2000. Клетки повторно суспендировали в ФБР, содержащем 2% сыворотку телячьего эмбриона, и сеяли в концентрации 50000 клеток/лунка на V-донные планшеты. Антитела анти-DLL4, разбавленные в ФБР, содержащем 2% сыворотку телячьего эмбриона, добавляли в конечной концентрации 5 или 15 мкг/мл, и инкубировали планшеты в течение 1 часа при температуре 4°С. После промывания с применением ФБР, содержащим 2% сыворотку телячьего эмбриона, добавляли вторичные антитела (козьи против человека Fc Cy5, Jackson Immunoresearch, кат. №109-175-098, 5 мкг/мл) и 7-AAD (5 мкг/мл), и инкубировали планшеты в течение 15 мин при температуре 4°С до промывания с применением ФБР, содержащем 2% сыворотку телячьего эмбриона, и чтения на инструменте FACSCalibur. Антитела мыши против Jagged 1 человека (R&D systems, кат. № mAB1277, выявленные при помощи вторичных антител против мыши Fc Cy5 (5 мкг/мл), Jackson Immunoresearch кат. №115-175-164), химеры Notch3/Fc человека (R&D systems, кат. №1559-NT-050, выявленные при помощи антитела козы против человека Fc Cy5, описанного выше)) или антитело козы против человека Dll1 (R&D systems, кат. № AF1818, выявленные при помощи антитела против козы Fc Cy5, Jackson Immunoresearch, кат. №305-175-046 (5 мкг/мл)) использовали в качестве контроля для подтверждения трансфекции. Данные анализировали путем сравнения смещения среднегеометрического показателя флуоресценции в трансфицированных имитацией клетках со смещением, которое наблюдалось в Jagged1- или Dll1-трансфицированных клетках, и они приведены в табл.16 и 17. Табл.16 демонстрирует способность очищенных антител (5 мг/мл) связываться с клетками 293Т, кратковременно трансфицированными с Jagged1 человека. Табл.17 демонстрирует способность очищенных антител (5 мкг/мл) связываться с клетками 293Т, кратковременно трансфицированными с Dll1 человека. Дополнительные исследования связывания FACS с применением 21H3RK, 4В4, 9G8 или 2Н10 при концентрациях вплоть до 300 мкг/мл продемонстрировали минимальное (<2,5 раз по сравнению с фоновым) связывание с клетками HEK-293, которые устойчиво чрезмерно экспрессируются Jagged1 человека или Dll1 человека.
ПРИМЕР 8
ОПРЕДЕЛЕНИЕ ВЛИЯНИЯ АНТИТЕЛ ПРОТИВ DLL4 НА DLL4-ОПОСРЕДОВАННУЮ ПРОЛИФЕРАЦИЮ HUVEC
Оценивали способность антител DLL4 блокировать ингибирование пролиферации HUVEC, стимулированное DLL4. Внеклеточный домен DLL4 (R&D systems, кат. №1506-D4/CF) готовили как 50 мкг/мл исходного раствора в ФБР, содержащего 0,1% бычий сывороточный альбумин. После разбавления до концентрации 1 мкг/мл в бикарбонатном буфере (Sigma № С3041-50САР) добавляли 100 мкл/лунку на 96-луночные планшеты с черными стенками (Perkin Elmer, кат. №6005182) и инкубировали планшеты в течение ночи при температуре 4°С. Контрольные лунки также покрывали имитацией при помощи ФБР, содержащем 0,1% бычий сывороточный альбумин. После промывания с применением ФБР, 100 мкл клеток HUVEC в концентрации 4Е4 клеток/мл в MCDB 113 (Gibco кат. №10372), содержащем 10% сыворотки телячьего эмбриона, и 2 мМ глутамина добавляли в каждую лунку. Непосредственно после этого серийно разбавленные антитела анти-DLL4 (20-0,027 мкг/мл) добавляли в лунки, покрытые DLL4/имитацией, в трех экземплярах и инкубировали клетки в течение 96 часов при температуре 37°С (5% CO2). После завершения инкубации в указанных условиях 15 мкл набора для подсчета клеток Cell Counting Kit 8 (CCK8, NBS, кат. № CK-04-11) добавляли в каждую лунку и инкубировали планшеты в течение 4 час при температуре 37°С (5% CO2). Для определения относительного количества клеток в каждой лунке измеряли оптическую плотность на длине волны 450 нМ на устройстве для чтения планшетов (Tecan Ultra). Детальное описание действий антител анти-DLL4 приведено в табл.18. Кроме того, 4В4, 21Н3 и 21H3RK также являются эффективными ингибиторами DLL4-опосредованных действий при форматировании в качестве антител IgG1 (фиг.1).
Кроме того, способности антител анти-DLL4 (10 мкг/мл) ингибировать проведение сигнала Notch оценивали с применением Вестерн-блоттинга. Коротко, DLL4-His (R&D systems, кат. №1506-D4-050/CF) разбавляли до концентрации 50 мкг/мл в ФБР, содержащем 0,1% бычий сывороточный альбумин. Данный раствор дополнительно разбавляли до концентрации 1 мкг/мл в 50 мМ бикарбонатном буфере, рН 9,6 (Sigma кат. № С-3041), и добавляли 1 мл/лунку на 12-луночные планшеты и инкубировали в течение ночи при температуре 4°С. Дополнительные лунки, не содержащие DLL4, были покрыты имитацией с применением той же самой процедуры. После промывания с использованием ФБР клетки HUVEC, приготовленные в среде MCDB 131, сеяли в концентрации 12000 клеток/лунку. Немедленно после посева добавляли соответствующую обработку (например, антитела анти-DLL4 10 мкг/мл) и инкубировали планшеты в течение 24 часов при температуре 37°С (5% СО2). После завершения инкубации клетки собирали для анализа в буфер RIPA. После этого добавляли 4Х образец буфера, содержащий В-меркаптоэтанол и бромфеноловый синий, и образцы кипятили в течение 5 мин при температуре 70°С до загрузки на 4-12% гели NuPAGE в буфер MOPS (Invitrogen кат. № NP0001). После электрофоретического переноса в нитроцеллюлозу блоттинг блокировали в течение 1 час в ФБР-Т, содержащем 5% молоко, после чего проводили инкубацию с расщепленным антителом анти-Notch1 (Cell signaling technology, кат. №2421) или антителом GAPDH (Advanced Immunochemical, клон 6С5, кат. №2-RGM2), разбавленных в соотношении 1:1000 или 1:10000, соответственно, в ФБР, содержащем 5% молоко. После инкубирования на орбитальном шейкере в течение ночи при температуре 4°С, блоттинг промывали с использованием ФБРТ и инкубировали с вторичным антителом анти-HRP мыши (Cell Signaling Technology, кат. №7072) в концентрации 1:2000 в ФБР, содержащем 5% молоко, в течение 1 часа при комнатной температуре. После промывания с использованием ФБРТ, блоттинг проявляли с применением реагентов субстрата Pierce Pico (кат. №34080; GAPDH) или Femto (кат. №34075; расщепленный Notch1) и результаты анализировали на инструменте ChemiGenius. Результаты, полученные в данных исследованиях, демонстрируют, что антитела анти-DLL4 могут блокировать проведение сигнала Notch в клетках HUVEC, стимулированное DLL4 (данные не приведены).
ПРИМЕР 9
ВЛИЯНИЕ АНТИТЕЛ ПРОТИВ DLL4 НА ОБРАЗОВАНИЕ ТРУБОК HUVEC IN VITRO
Ингибиторные антитела против DLL4 испытывали на способность снижать образование трубок эндотелиальных клеток в анализе совместного культивирования in vitro (например, TCS Cell Works, кат. № ZHA-1000). Эндотелиальные клетки пупочной вены человека (HUVEC) и диплоидные фибробласты человека получили как совместные культуры на 24-луночных, планшетах (TCS Cell works кат. № ZHA-1000), или планшеты готовили следующим образом: 24-луночные планшеты с культурой ткани покрывали коллагеном (разбавление в дистиллированной воде в соотношении 1:10; Sigma, кат. № С8919) при температуре 37°С (5% СО2) в течение 4 часов. После промывания с применением ФБР добавляли фибробласты (например, Promocell № С-12300) в концентрации 15000 клеток/лунку в FGM (Promocell № С-23010). После инкубирования в течение 3 дней при температуре 37°С (5% CO2) среду удаляли из планшета и добавляли клетки HUVEC в концентрации 30000 клеток/лунку в EGM2 (Promocell № С-22111). После инкубирования в течение еще 4 дней при температуре 37°С (5% СО2) планшеты считали готовыми для использования, а этот день считался 1-м днем анализа. Антитела, блокирующие DLL4, вводили в культуру в 1-й день и с регулярными интервалами в течение 11-дневного периода в концентрациях, которые варьировались от 20 до 0,027 мкг/мл. Среду пополняли на 4-й, 7-й и 9-й день. Модель совместного культивирования поддерживали в оптимизированной среде TCS Optimised (которая поставляется с анализом совместного культивирования) или в среде MCDB 131 с добавлением 2% сыворотки телячьего эмбриона (СТЭ), 1% глутамина и 1% пенициллина/стрептомицина (которая далее упоминается как среда 2% FS MCDB 131). Модель совместного культивирования поддерживали при температуре 37°С в увлажненной атмосфере, содержащей 5% CO2 и 95% воздуха. Образование трубочек изучали на 11-й день после фиксирования и окрашивания трубочек для CD31 с применением набора для окрашивания трубочек согласно инструкций производителей (TCS Cell Works кат. № ZHA-1225). Коротко, клетки фиксировали с применением ледяного 70% этанола в течение 30 мин при комнатной температуре (КТ). Клетки блокировали, после чего обрабатывали CD31 против человека в течение 60 мин при КТ. Планшеты промывали и обрабатывали с использованием козьего против мыши IgG, конъюгированного со щелочной фосфатазой (АР) в течение 60 мин при КТ. После инкубирования АР-конъюгированным вторичным антителом планшеты промывали и добавляли субстрат 5-бромо-4-хлоро-3-индолил фосфат/нитро тетразолиевый голубой (BCIP/NBT) в течение приблизительно 10 мин. Появление темно-пурпурного цвета в течение 10 мин отображало образование трубочек. Планшеты впоследствии промывали и оставляли сушиться на воздухе. Количественное определение роста трубочек проводили при помощи метода анализа изображения целых лунок с применением анализатора изображения Zeiss KS400 3.0. Морфологическим параметром, измерение которого проводили методом количественного определения, была общая длина трубок. В некоторых экспериментах также оценивали количество бифуркаций в трубках. Все образования трубок в пределах каждой из 24 лунок измеряли, исключая край глубиной 100 мкм для того, чтобы избежать артефакта ретракции края.
Как проиллюстрировано на фиг.2, было обнаружено, что антитела являются эффективными в ингибировании образования трубок эндотелиальных клеток in vitro. Более того, определяли активность некоторых антител в данном анализе. Эти данные кратко приведены в табл.19. Вместе взятые, данные свидетельствуют о том, что антитела являются активными в функциональном анализе, который моделирует процесс ангиогенеза.
ПРИМЕР 10
ОПРЕДЕЛЕНИЕ СРОДСТВА СВЯЗЫВАНИЯ ОЧИЩЕННЫХ АНТИТЕЛ
Сродство связывания очищенных антител относительно DLL4 измеряли при помощи техник FACS и BIAcore. Для определения сродства при помощи FACS клетки HEK293, которые повышенно экспрессируют DLL4 человека или яванской макаки, сеяли в концентрации приблизительно 85000-104000 клеток/лунку и инкубировали с титрованиями очищенного антитела в течение 5 часов при температуре 4°С. Затем клетки промывали и инкубировали с козьим анти-человеческим IgG-Fc-Cy5 + 5 мкг/мл 7-амино-актиномицина (7AAD) в течение 30 мин при температуре 4°С. Связанные DLL4 определяли при помощи анализа FACS, данные вносили в приведенное ниже уравнение (см. Drake & Klakamp, 2007, J. Immunol. Methods, 318, 157-162 относительно вывода уравнения):
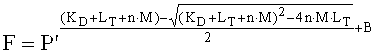
В данном уравнении F = средняя флуоресценция, LT = общая молекулярная концентрация mAb, P' = константа пропорциональности, которая связывает произвольные единицы флуоресценции со связанным mAb, M = клеточная концентрация в молярности, n = количество рецепторов на клетку, B = фоновый сигнал и KD = равновесная константа диссоциации. Для каждой кривой титрования mAb оценку KD получают как P', n, B, и KD дают свободно перемещаться в нелинейном анализе. В табл.20 приведены оценки сродства для антитела анти-DLL4 для DLL4 человека и яванской макаки, вычисленные с применением методики, описанной выше.
Для анализа Biacore каждое очищенное антитело против DLL4 иммобилизировали на сенсорном чипе СМ5 в пределах Т100, используя стандартную химию сочетания аминов. Уровни иммобилизации поддерживали ниже 200 резонансных единиц. Концентрацию DLL4 определяли при помощи спектрофотометрического анализа в видимой и ультрафиолетовой областях света, используя молярную поглощающую способность на длине волны 280 нМ 110, 440 M-1см-1, вычисленные для последовательности белков, при помощи метода, разработанного Расе et al. (G.R. Grimsley and С.N. Расе (2003) in Current Protocols in Protein Science (John Wiley & Sons, Inc.), 3.1.1-3.1.9). Антиген DLL4 (R&D systems; человека, кат. №1056-D4-050, или мыши, кат. №1389-D4-050) разбавили до начальной концентрации 32-64 нМ и провели испытание в сериях 3-кратного разбавления в трех экземплярах. Подвижный буфер содержал HBS-P с 0,1 мг/мл бычьего сывороточного альбумина, отклики связывания собирали при температуре 23°С. Связанные комплексы регенерировали с пульсом 15 с 10 мМ натрия гидрохлорида. Данные откликов главным образом подходили в простую модель взаимодействия 1:1, и в табл.20 приведены оценки ka, kd и KD, полученные для антител против DLL4 при оценке связывания с растворимым DLL4 человека. Кроме того, оценки связывания с растворимым DLL4 мыши также генерировали для 21Н3, 21H3RK и 4В4 с применением BIAcore: все антитела в формате IgG обладали сродством 360 нМ или менее для растворимого DLL4 мыши.
ПРИМЕР 11
ОПРЕДЕЛЕНИЕ ПЕРЕКРЕСТНОГО КОНКУРИРОВАНИЯ ДЛЯ DLL4 ПРИ ПОМОЩИ АНАЛИЗА FACS
Способность очищенных антител DLL4 ингибировать связывание других антител DLL4 с DLL4 человека оценивали при помощи анализа FACS. Коротко, антитела непосредственно метили при помощи Alexa-647, используя коммерчески доступный набор для мечения (например. Molecular Probes кат. № А30009, А-20186) в соответствии с инструкциями производителя. Для определения уровня перекрестного конкурирования немеченые антитела против DLL4 (в конечной концентрации: 10-0,01 мкг/мл) разбавляли в ФБР, содержащем 2% сыворотку телячьего эмбриона, добавляли к клеткам HEK293, экспрессирующим DLL4 (как описано в примере 6; 50000 клеток/лунку разбавляли в ФБР, содержащем 2% сыворотку телячьего эмбриона), и инкубировали в течение 1 часа при температуре 4°С. Впоследствии добавляли антитела против DLL4, меченые при помощи Alexa-647, в конечной концентрации 0,1 мкг/мл, и планшеты инкубировали еще в течение 1 часа при температуре 4°С до промывания и чтения с применением инструмента FACSCalibur. Данные, показывающие способность немеченых антител (10, 1, 0,1 мкг/мл) конкурировать с меченым 21H3RK за связывание с DLL4 человека, включены в фиг.3. Дополнительные данные, которые иллюстрируют способность немеченых антител конкурировать с меченым 21H3RK и 4В4 за связывание с DLL4 человека, включены в табл.22.
Кроме того, способность антител выявлять рекомбинантный DLL4 (R&D systems, кат. №1506-D4-050/CF) и нативный DLL4, экспрессируемый в клетках HEK293 (см. пример 3) также определяли при помощи Вестерн-блоттинга, используя стандартные техники. Коротко, клетки HEK293, которые экспрессируют DLL4, собирали для анализа в буфер RIPA (Thermo, кат. №89900), содержащий 1 таблетку коктейля ингибитора протеазы (Roche, кат. №11873580001), и проводили количественное определение белка с применением анализа белка ВСА (Pierce, кат. №23227) в соответствии с инструкциями производителя. Для проведения Вестерн-блоттинга образцы белка растопили на льду и инкубировали при температуре 100°С в течение 2 мин перед тем, как добавить 10Х Nupage восстановитель образца (Invitrogen, кат. № NP0004) и 4Х буфер образца перед загрузкой в предварительно вылитые 4-12% NuPage BisTris гели (Invitrogen, кат. № НР0321В0Х) в буфер MES (Invitrogen, кат. № НР0002). После электрофоретического переноса в нитроцеллюлозу блоттинг блокировали в течение 1 часа в трис-буферизованном солевом растворе (100 мМ трис-HCl, 150 мМ NaCl, pH 7,5), содержащем 0,05% Твин 20 (TBST), содержащий 5% молоко, с последующим инкубированием с применением 9G8, 2Н10, 21Н3, 4В4 или 20G8 (все в концентрации по 2 мкг/мл) или коммерчески доступных антител против DLL4 (R&D Systems, кат. № МАВ1389; Abcam, кат. № ab7280, оба в концентрации 1 мкг/мл) в TBST, содержащем 5% молоко. После инкубирования на орбитальном шейкере в течение ночи при температуре 4°С блоттинг промывали с применением TBST и инкубировали с HRP-конъюгированными вторичными антителами против крысы, против кролика или против человека (Jackson Immunochemicals, кат. №112-035-003 и 111-035-003, разбавление в соотношении 1:20000, или KPL, кат. №074-1006, разбавление в соотношении 1:10000) в TBST, содержащем 5% молоко в течение 1 часа при КТ. Избыточное антитело удаляли при помощи промывания, как указано выше, и визуализировали иммунокомплексы посредством выявления повышенной хемилюминесценции в соответствии с инструкциями производителя (Pierce, кат. №34076) и выявляли на пленке Hyperfilm ECL (Amersham, кат. №28906839) или Biomax MR (Kodak, кат. №8952855). Результаты демонстрируют, что при данных условиях как рекомбинантный, так и нативный DLL4, могут быть выявлены с применением коммерческих антител и 9G8/2H10, но не могут быть выявлены с применением 21H3/20G8 или 4В4, что свидетельствует о том, что данные антитела могут взаимодействовать с различными эпитопами на DLL4 (данные не приведены).
ПРИМЕР 12
МОДИФИКАЦИИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ 9G8 И 2Н10
Гены иммуноглобулинов подвергали различным модификациям в ходе дозревания иммунной реакции, включая рекомбинацию между V, D и J генными сегментами, переключение изотипа и гипермутацию в различных областях. Рекомбинантная и соматическая гипермутация - основа для генерации разнообразных антитела и дозревания сродства, но они также могут генерировать дефекты последовательности, которые могут усложнять промышленное производство таких иммуноглобулинов в качестве терапевтических средств, или увеличивать риск иммуногенности антитела. В общем, мутации в участках CDR, вероятно, способствуют улучшению сродства и функции, в то время как мутации в каркасном участке могут увеличивать риск иммуногенности. Такой риск может быть снижен возвращением к исходному состоянию генеративной линии каркасных мутаций, наряду с гарантией отсутствия отрицательного влияния на активность антитела. Некоторые структурные дефекты могут быть сформированы процессами диверсификации, или они могут существовать в последовательностях генеративной линии, использованной для вариабельных доменов тяжелых и легких цепей. Несмотря на источник, может быть желательным устранение потенциального структурного дефекта, который может вести к нестабильности, агрегации, гетерогенности продукта или увеличению иммуногенности. Примеры нежелательных дефектов включают непарные остатки цистеина (которые могут вести к перестановке дисульфидных связей или образованию вариабельного сульфгидрильного аддукта), N-концевые сайты гликозилирования (приводящие к гетерогенности структуры и активности), а также сайты дезамидирования (например, NG, NS), изомеризация (DG), окисления (доступного метионина) и гидролиза (DP). С целью снизить риск иммуногенности и улучшить фармацевтические свойства основных антител генерировали определенные варианты и провели испытание на связывание и активность. Мутагенез, нацеленный на сайт, проводили с применением набора Stratagene Quick Change II в соответствии с описанием производителя. Вариантные последовательности экспрессировали в системе InVitrogen Freestyle с применением кратковременной трансфекции (в соответствии с протоколами, рекомендованными производителем), и очистили с применением хроматографии сродства белка А.
Активность антител, подвергавшихся мутации, оценивали двумя способами: сначала определяли способность антител блокировать связывание растворимого Notch1/Fc с полноразмерным DLL4 человека, который стабильно экспрессируется в клетках HEK293, как описано в примере 3, а затем определяли связывание антител с теми же самими линиями клеток, которые использовали в исследованиях конкуренции рецептор-лиганд. Для исследований связывания клетки HEK293, которые стабильно излишне экспрессируют DLL4 человека, повторно суспендировали в ФБР, содержащем 2% сыворотки телячьего эмбриона, в концентрации 50000 клеток/лунку и инкубировали с титрованиями антитела (конечная концентрация 0,01-10 мкг/мл) в течение 1 часа при температуре 4°С. Далее клетки промывали и инкубировали с 0,31 мкг/мл против человека IgG-Fc-FITC (BD Pharmingen, кат. №555786) в течение 30 мин при температуре 4°С. Связанный DLL4 выявляли с применением анализа FACS. Результаты данных анализов приведены в табл.23, они демонстрируют влияние специфических мутаций последовательности 9G8 и 2Н10 на способность антител конкурировать с Notch1 за связывание с DLL4 человека или связываться с DLL4 человека относительно антител, не подвергавшихся мутации.
ПРИМЕР 13
ОЦЕНКА ПРОТИВОАНГИОГЕНЕТИЧЕСКОЙ ЭФФЕКТИВНОСТИ В АНАЛИЗЕ АНГИОГЕНЕЗИСА, ОСНОВАНОМ НА СФЕРОИДАХ, IN VIVO
Сфероиды эндотелиальных клеток пупочной вены человека (HUVEC) приготовили, как описано ранее (Korff and Augustin: J. Cell. Biol. 143:1341-52, 1998), с переносом при помощи пипетки 100 эндотелиальных клеток (ЭК) в висящей капле на пластиковые планшеты и оставили на ночь для образования сфероидов. На следующий день с применением ранее описанного метода (Alajati et al., Nature Methods 5:439-445, 2008) сфероиды ЭК собирали для анализа и перемешивали в растворе Мартигеля/фибрина с отдельными HUVEC для достижения конечного количества, составляющего 100000 ЭК в виде стероидов и 200000 отдельных ЭК на впрыскиваемую пробку. Добавляли VEGF-А и FGF-2 в конечной концентрации 1000 нг/мл. Самцам мышей породы SCID (в возрасте 5-8 недель) подкожно вводили 500 мкл суспензии клеток/матрикс. На следующий день (1-й день) начинали лечение. На 21-й день исследование прерывали. Пробки матрикса удаляли и фиксировали в 4% ПФА. Все пробки матрикса заливали парафином и разрезали на куски толщиной 8-10 мкм для гистологического исследования. Кровеносные сосуды визуализировали окрашиванием для CD34 человека и актина гладкой мышцы (SMA) и определяли плотность сосудов и покрытие перицита. Антитела как IgG1, так и IgG2 являются эффективными в модулировании образования сосудов и ингибировании рекрутмента перицитов in vivo. Полученные данные свидетельствуют о том, что лечение с применением антител против DLL4 (21H3RK или 4В4) индуцирует у людей повышение образования сосудов, составляющее не менее 100% по сравнению с контрольными группами, не подвергавшимися лечению, при таких низких концентрациях антител как 1 мг/кг. Кроме того, данные повышения уровня образования сосудов у людей связывали со снижением покрытия перицитов (как было оценено по процентному соотношению положительных сосудов CD34 человека, что также связывали с клетками, положительными относительно экспрессии aSMA), составляющем не менее 50% при дозах антител 5 мг/кг. Краткое описание данных относительно влияния доз 21H3RK IgG1, вводимых два раза в неделю интраперитонеально в дозировке 1, 0,2 и 0,04 мг/кг, приведено в табл.24. Вместе взятые, данные указывают на то, что антитела являются активными в анализе ангиогенеза in vivo.
ПРИМЕР 14
КАРТИРОВАНИЕ ЭПИТОПА 21H3RK
Моноклональное 21H3RK специфически связывается с DLL4 человека, но не распознает DLL1 человека. Данную специфическую черту используют для отслеживания связывания эпитопа Mab 21H3RK с DLL4 человека. Создавали химерные варианты с заменой частей внеклеточного домена DLL4 на соответствующие сегменты DLL1. DLL4 человека (Yoneya et al., 2001, J. Biochem., 129, 27-34, клонирован в лаборатории компании) и DLL1 человека (доступ № НМ_005618, Origene, MD) использовали в качестве шаблонов в перекрытии расширения PCR для конструирования серий вариантов, которые включают трансмембранный домен DLL4 для поверхностной экспрессии рекомбинантных белков. Полученные в результате варианты клонировали в вектор экспрессии млекопитающего, который кодирует энхансер основного предраннего цитомегаловируса человека (hCMVie), промотор и 5'-нетранслированный участок для кратковременной экспрессии у млекопитающего. Химерные варианты кратковременно экспрессировали в клетках HEK293F как связанные с мембраной белки для характеристики проточной цитометрии с Mab 21H3RK. Через 48 час после трансфекции трансфектанты HEK293F инкубировали с 1 мкг/мл Mab 21H3RK в течение 1 часа на льду в ФБР, промывали, а затем инкубировали с козьим против человека IgG-FITC (Jackson ImmunoResearch Laboratories, PA) и анализировали с применением проточного цитометрического анализатора LSRII (BD Biosciences, CA). Уровни экспрессии всех химерных вариантов наблюдали при помощи инкубирования со смесью поликлональных антител как козьего против человека DLL4 (который также распознает DLL4 человека), так и козьего против человека DLL1 (оба от R&D Systems., MN), затем отслеживали с применением свиного против козы IgG-PE (Invitrogen, CA).
Несмотря на то, что Dll1 и Dll4 человека обладают 53% идентичностью на уровне аминокислот, Mab 21H3RK связывается специфически с Dll4, но не распознает Dll1. Химерные варианты Dll4 человека, которые кодируют небольшие части Dll1 человека, конструировали для идентификации участка, ответственного за данную специфическую черту. 12 химерных «выбитых» вариантов конструировали при помощи замещения субдоменов Dll4 человека на соответствующие остатки Dll1 человека. Фиг.4 иллюстрирует, как внеклеточную часть DLL4 разделили на структурно определенные субдомены. Большой амино-конец (N-конец) зрелого белка DLL4 разделяли на два более мелких сегмента. Вариант N-конец 1 KO замещает первые 86 аминокислот (АК) зрелого белка DLL4 на DLL1 человека, а вариант N-конец 2 KO замещает аминокислоты 87-146 на DLL1 человека. «Выбитые» варианты, представленные на фиг., включают замещение Dll1: всего домена N-конца (АК 1-146), домена DSL (АК 147-191), домена EGF1 (АК 192-224), доменов EGF1 и 2 (АК 192-255), доменов EGF3 и 4 (АК 256-333) и четырех доменов EGF5-8 (АК 334-503). Дополнительно создали варианты замещения объединенных доменов: доменов N-конца и DSL (АК 1-191), домена N-конца плюс доменов DSL и EGF1-2 (АК 1-255), доменов DSL и EGF1-2 (АК 147-255) и доменов DSL и EGF1 (АК 147-224). Все рекомбинантные белки хорошо экспрессировались на клеточной поверхности, как наблюдали с помощью поликлональных антител против Dll4 и Dll1 (фиг.5, верхние части обоих рядов), тем не менее, Mab 21H3RK не распознавал ни одну из конструкций, которая включала домены Dll1 человека как DSL, так и EGF1 (фиг.5, нижняя часть). Кроме того, конструкция Dll1, кодируемая доменами Dll4 DSL и EGF1 («вбитые» мутанты), предоставляет связывание Mab 21H3RK с Dll1 (фиг.6). Таким образом, эпитоп связывания 21H3RK расположен в пределах доменов DSL и EGF1.
Для дальнейшей очистки эпитопа связывания в пределах данного сегмента белка и идентификации критических остатков, ответственных за специфичность связывания Mab 21H3RK, создали три дополнительных варианта. 3, 15 сегментов аминокислот в пределах домена DSL и/или домена EGF1 Dll4 заменяли на соответствующие остатки Dll1: фрагмент А (АК 187-201), фрагмент В (АК 200-214) и фрагмент С (АК 210-224) кодируют только несколько замен аминокислот, где последовательности Dll1 и Dll4 не являются консервированным. Фрагмент А охватывает последние 5 аминокислот домена DSL, 4 аминокислоты линкера между доменами DSL и EGF1 и 6 аминокислот домена EGF1. Замещение 15 данных аминокислот на остатки Dll1 привело к потере связывания Mab 21H3RK. Эффекта не наблюдали, когда остатки Dll4 во фрагментах В и С замещали на Dll1. Приведенные данные свидетельствуют о том, что 15 аминокислот (АК 187-201), в том числе и С-конец DSL и N-конец EGF1, являются важными для связывания, эпитоп к 21H3RK картировали к доменам DSL и EGF1 (АК 147-224) с расположением критического участки в С-конце DSL и N-конце EGF1 (АК 187-201).
ПРИМЕР 15
ОПРЕДЕЛЕНИЕ АНТИТЕЛ ПРОТИВ DLL4, КОТОРЫЕ ВЫЗЫВАЮТ ИНТЕРНАЛИЗАЦИЮ DLL4, С ПРИМЕНЕНИЕМ АНАЛИЗА FACS
Способность очищенных антител индуцировать интернализацию DLL4 исследовали с применением анализа FACS. Клетки HEK293, которые стабильно повышенно экспрессировали DLL4, диссоциировали и промывали в буфере FACS (ФБР + 2% сыворотка телячьего эмбриона) перед посевом в концентрации 50000-100000 клеток на лунку на V-донных планшетах. Первичные антитела (против DLL4 или соответствующий контроль изотипа) разбавляли до конечной концентрации 10 мкг/мл в теплом (37°С) буфере FACS и добавляли к клеткам в течение 30, 60, 120 или 240 мин в инкубаторе культуры ткани (37°С/5% CO2). В соответствующие временные точки клетки вращали на 500 г в центрифуге, предварительно охлажденной до температуры 4°С, и промывали в холодном буфере FACS до инкубации с вторичным антителом против IgG человека, меченным FITC (1 мкг/мл, Jackson Labs, кат. №109-096-098) в течение 10 мин на льду. После инкубации клетки вращали в обратном направлении на 500 г в предварительно охлажденной центрифуге, промывали в холодном буфере FACS и фиксировали с применением 2% параформальдегида в течение 20 мин. Интернализацию оценивали чтением на FACSCalibur. При данных условиях анализа интернализация 21H3RK, составляющая <10%, происходила в указанных выше временных точках. Интернализацию также можно определить при помощи инкубирования с не конкурирующим перекрестно антителом относительно DLL4 вместо вторичного антитела против IgG человека. В некоторых экспериментах первичное антитело (10 мкг/мл), разбавленное в буфере FACS, предварительно инкубировали с клетками, повышено экспрессирующими DLL4, как описано выше, в течение 30 мин на льду до промывания в теплом (37°С) буфере FACS и инкубированием клеток в инкубаторе культуры ткани (37°С/5% СО2) в течение 30, 60, 120 или 240 мин. После указанного инкубирования клетки промывали и инкубировали с вторичным антителом и фиксировали, как описано выше, до чтения на FACSCalibur. При указанных условиях наблюдали интернализацию, которая составляла <15% и <35% относительно контроля t=0, для 21H3RK и 4В4 при t=60 и 240 мин, соответственно. Интернализацию при указанных условиях также можно определить при помощи инкубирования с не конкурирующим перекрестно антителом относительно DLL4 вместо вторичного антитела против IgG человека.
ПРИМЕР 16
АКТИВНОСТЬ АНТИТЕЛ ПРОТИВ DLL4 НА МОДЕЛИ АНГИОГЕНЕЗА МЫШИ В ПРОБКАХ МАТРИГЕЛЯ
Способность антител против DLL4 модулировать ангиогенез может быть оценена с применением анализа пробок матригеля. В данном анализе компоненты, индуцирующие ангиогенез, такие как bFGF, VEGF или раковые клетки, можно вводить в жидкий матригель, который после введения в виде подкожной инъекции затвердевает и позволяет проводить инфильтрацию при помощи эндотелиальных и сосудистых клеток гладкой мышцы, он также позволяет образовывать новые кровяные сосуды. Коротко, матригель в жидкой форме при температуре 4°С можно смешивать с носителем (например, ФБР) или факторами роста/ опухолевыми клетками (например, LL2, MCF7, А431, Colo205, KNRK, Calu-6, SW620, Panel) и вводить 0,5 мл подкожно в нижнюю брюшную область самок мышей породы 129s1/Sv1mJ (в возрасте 6-8 недель, n=5 в группе). Антитела против DLL4 можно вводить два раза в неделю путем интраперитонеальной инъекции. Через 5-10 дней животных можно подвергать эвтаназии гуманным путем, и восстанавливать пробки для оценки ангиогенеза, которую можно проводить гистологическим подсчетом плотности сосудов и муральным покрытием клеток с применением, например, оценки иммуноокрашивания CD31 и альфа актина гладкой мышцы (αSMA), измерением содержания гемоглобина и измерением перфузии сосудов, например, FITC-декстран. Таким образом, устанавливают способность антител против DLL4 модулировать ангиогенез.
ПРИМЕР 17
АКТИВНОСТЬ АНТИТЕЛ ПРОТИВ DLL4 В МОДЕЛЯХ КСЕНОТРАНСПЛАНТАТОВ ОПУХОЛЕЙ ЧЕЛОВЕКА, ПОЛУЧЕННЫХ ИЗ ОБРАЗЦОВ ПАЦИЕНТОВ С ПЕРВИЧНОЙ ОПУХОЛЬЮ
Данный пример описывает применение антител против DLL4 с целью ингибирования или предотвращения роста опухоли, полученной из образцов пациентов с первичной опухолью, при выращивании в качестве ксенотрансплантов у мышей. Коротко, реципиент-мышь можно анестезировать с применением ингаляции фторированного простого эфира до тех пор, пока он не достигнет хирургического уровня анестезии. Клетки первичной опухоли можно затем промывать с применением RPMI с добавлением антибиотиков и 10% FCSi перед измельчением с целью получения "жидкой смеси" при помощи скальпелей и разделения на соответствующие части для имплантации (например, опухоль 300 мг может быть имплантирована 4 мышам). Смеси опухолевых клеток можно поместить в троакары имплантата рака 13-го размера. Стержень троакаров можно полностью наполнить смесью опухолевых клеток и ввести подкожно в правый бок, затем распределить содержимое под дорсальным скоплением жировой ткани. Мышь можно вернуть в клетку и наблюдать за ее восстановлением.
Во время первой пересадки обычно 3-5 мышам имплантируют смесь клеток первичной опухоли. Когда опухоль достигает размера 800-1000 мм3, ее измельчают на фрагменты размером приблизительно 3х3х3 мм, и проводят суб-пересадку 5 мышам - по 1 фрагменту на мышь. Оставшийся материал опухоли архивируют в среде замораживания культуры клеток Recovery™ Cell Culture Freezing (Gibco, кат. №12648-010) дополнительно к окрашиванию Н&Е и экстракции ДНК/РНК. Опухоли после 2-й пересадки можно использовать для имплантации с целью изучения эффективности. В экспериментах по изучению эффективности 1 фрагмент опухоли имплантируют в каждое животное.
За ростом опухоли следят при помощи измерения 2 перпендикулярных диаметров. Размеры опухоли и массу тела регистрируют два раза в неделю в течение 2 недель после начала лечения. Формула расчета объема опухоли следующая: (LxW2)/2.
Антитела-антагонисты DLL4 можно вводить в форме раствора. Лечение можно начинать, когда средний объем опухоли достигает приблизительно 100-200 мм3, или одновременно с имплантацией опухоли. Период лечения может длиться до 28 дней. Антитела-антагонисты DLL4 можно вводить в дозе, например, 5, 10 или 20 мг/кг/день (интраперитонеально, один раз в день, в течение 2 недель) как отдельный агент или в сочетании с другими агентами. Размеры опухоли и массу тела регистрируют два раза в неделю в течение 4 недель после начала лечения. Таким образом, определяют способность антител против DLL4 ингибировать рост опухоли, полученной из образцов пациентов с первичной опухолью отдельно или в комбинации.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО, ОБЛАДАЮЩЕЕ ПОВЫШЕННОЙ АКТИВНОСТЬЮ, АЛЬТЕРНАТИВНОЙ ФУНКЦИИ КОФАКТОРА FVIII | 2017 |
|
RU2821642C2 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2570639C2 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2011 |
|
RU2605928C2 |
| РЕКОМБИНАНТНОЕ ОПУХОЛЕСПЕЦИФИЧНОЕ АНТИТЕЛО (ВАРИАНТЫ) И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2306320C9 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА НЕРВОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2012 |
|
RU2640254C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-T-КЛЕТКИ | 2020 |
|
RU2762942C1 |
| СКОНСТРУИРОВАННЫЕ АНТИ-TGF-БЕТА АНТИТЕЛА И АНТИГЕН-СВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ | 2014 |
|
RU2681502C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-NK-КЛЕТКИ | 2020 |
|
RU2795443C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА РОСТА НЕРВОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2012 |
|
RU2644235C2 |
| НОВЫЕ АНТИ-PD-1 АНТИТЕЛА | 2016 |
|
RU2729830C2 |
















































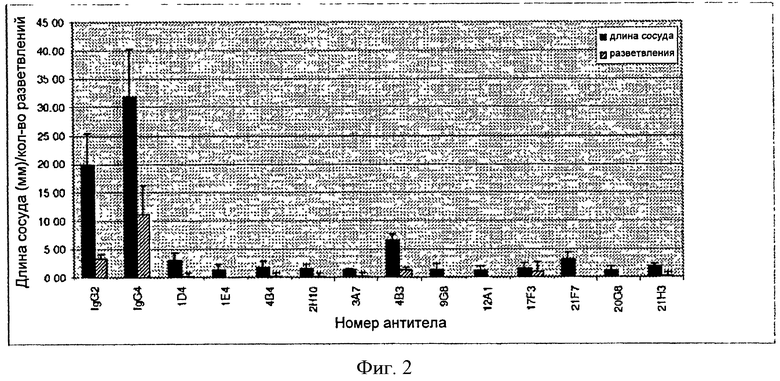
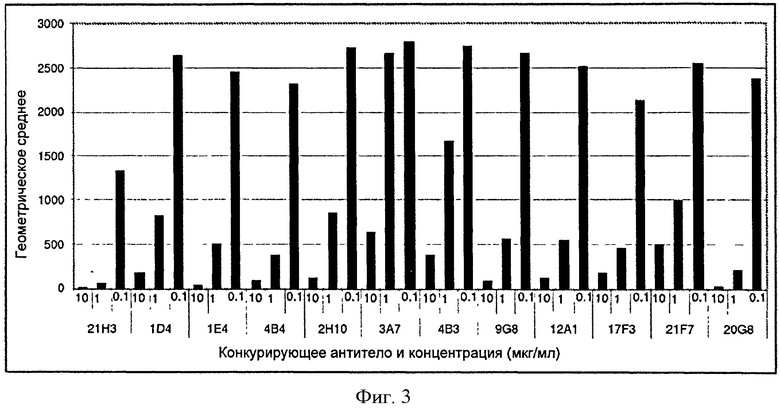
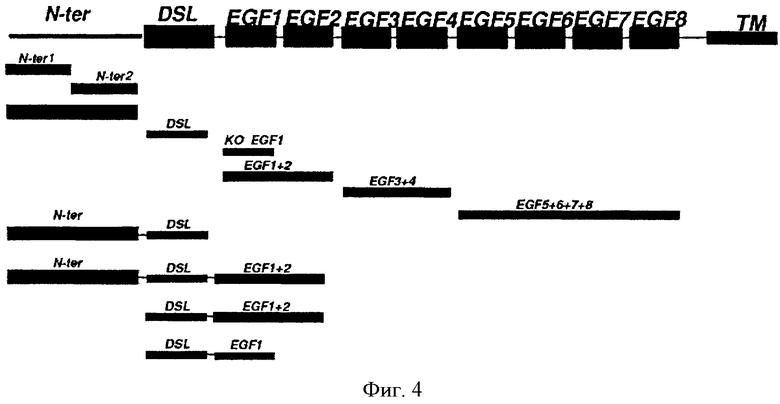
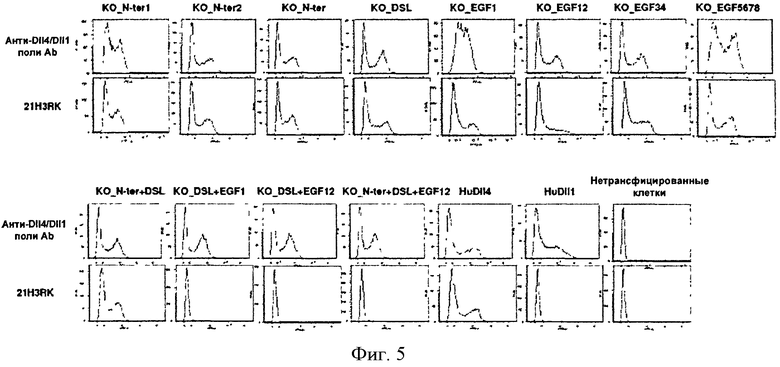
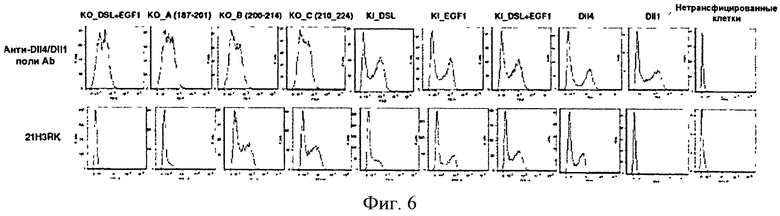
Изобретение относится к биохимии. Раскрыто антитело или его связывающий фрагмент, которое(ый) специфически связывается с дельта-подобным лигандом 4 (DLL4) и включает: VH CDR 1, которая содержит аминокислотную последовательность NYGIT (аминокислотные остатки 31-35 SEQ ID NO: 30), и VH CDR 2, которая содержит аминокислотную последовательность WISAYNGNTNYAQKLQD (аминокислотные остатки 50-66 SEQ ID NO: 30), VH CDR 3, которая содержит аминокислотную последовательность DRVPRIPVTTEAFDI (аминокислотные остатки 99-113 SEQ ID NO: 30), и VL CDR 1, которая содержит аминокислотную последовательность SGSSSNIGSYFVY (аминокислотные остатки 23-35 SEQ ID NO: 32), VL CDR 2, которая содержит аминокислотную последовательность RNNQRPS (аминокислотные остатки 51-57 SEQ ID NO: 32), VL CDR 3, которая содержит аминокислотную последовательность AAWDDSLSGHWV (аминокислотные остатки 90-101 SEQ ID NO: 32). Представлены композиции, содержащие раскрытое антитело, и способ лечения, включающий введение раскрытого антитела. Изобретение позволяет лечить заболевания или состояния, связанные с DLL4. 6 н. и 10 з.п. ф-лы, 6 ил., 24 табл., 17 пр.
1. Выделенное антитело или его связывающий фрагмент, которое(ый) специфически связывается с дельта-подобным лигандом 4 (DLL4), где антитело или связывающий фрагмент включает: (а) вариабельную (VH), определяющую комплементарность область тяжелой цепи (CDR) 1, которая содержит аминокислотную последовательность NYGIT (аминокислотные остатки 31-35 SEQ ID NO: 30), и VH CDR 2, которая содержит аминокислотную последовательность WISAYNGNTNYAQKLQD (аминокислотные остатки 50-66 SEQ ID NO: 30), VH CDR 3, которая содержит аминокислотную последовательность DRVPRIPVTTEAFDI (аминокислотные остатки 99-113 SEQ ID NO: 30), и (б) вариабельную область (VL) легкой цепи CDR 1, которая содержит аминокислотную последовательность SGSSSNIGSYFVY (аминокислотные остатки 23-35 SEQ ID NO: 32), VL CDR 2, которая содержит аминокислотную последовательность RNNQRPS (аминокислотные остатки 51-57 SEQ ID NO: 32), VL CDR 3, которая содержит аминокислотную последовательность AAWDDSLSGHWV (аминокислотные остатки 90-101 SEQ ID NO: 32).
2. Антитело или его связывающий фрагмент по п. 1, где антитело является полностью человеческим моноклональным антителом или связывающим фрагментом полностью человеческого антитела.
3. Антитело или его связывающий фрагмент по п. 1, где антитело или его фрагмент является Fab, Fab′, F(ab′)sub.2, Fv или dAb.
4. Фармацевтическая композиция для лечения заболеваний, связанных с DLL4, содержащая антитело или его фрагмент по п. 1 в терапевтически эффективном количестве и фармацевтически приемлемые эксципиенты.
5. Выделенное антитело или его связывающий фрагмент, которое специфически связывается с дельта-подобным лигандом 4 (DLL4), где антитело или связывающий фрагмент включает: вариабельную последовательность тяжелой цепи (VH), которая содержит аминокислотную последовательность SEQ ID NO: 30; вариабельную последовательность легкой цепи (VL), которая содержит аминокислотную последовательность SEQ ID NO: 32.
6. Антитело или его связывающий фрагмент по п. 5, где VH последовательность включает аминокислотную последовательность, как показано в SEQ ID NO: 30.
7. Антитело или его связывающий фрагмент по п. 5, где VL последовательность включает аминокислотную последовательность, как показано в SEQ ID NO: 32.
8. Антитело или его связывающий фрагмент по п. 7, где антитело является полностью человеческим моноклональным антителом или связывающим фрагментом полностью человеческого антитела.
9. Антитело или его связывающий фрагмент по п. 7, где антитело или его фрагмент является Fab, Fab′, F(ab′)sub.2, Fv или dAb.
10. Композиция для диагностики заболеваний или состояний, опосредованных DLL4, включающая эффективное количество антитела или его фрагмент согласно п. 5.
11. Фармацевтическая композиция для лечения заболеваний или состояний, опосредованных DLL4, включающая терапевтически эффективное количество антитела или его фрагмента согласно п. 5.
12. Способ лечения для лечения заболеваний или состояний, опосредованных DLL4, у животного, которое нуждается в этом, включающий введение этому животному терапевтически эффективной дозы антитела или его антигенсвязывающего фрагмента, которое(ый) специфически связывается с дельта-подобным лигандом 4 (DLL4), где антитело или его антигенсвязывающий фрагмент включает: (а) вариабельную область тяжелой цепи (VH), которая содержит CDR1, CDR2 и CDR3 SEQ ID NO: 30, и (б) вариабельную область легкой цепи (VL), которая содержит CDR1, CDR2 и CDR3 SEQ ID NO: 32 или CDR1, CDR2 и CDR3 SEQ ID NO: 50.
13. Способ по п. 12, где указанное животное является человеком.
14. Способ по п. 13, где указанная злокачественная опухоль выбрана из группы, состоящей из меланомы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, глиомы, карциномы печени (гепатоцеллюлярную), опухоли щитовидной железы, рака желудка, рака предстательной железы, рака молочной железы, рака яичников, рака мочевого пузыря, рака легкого, глиобластомы, рака эндометрия, рака почки, рака толстой кишки, рака поджелудочной железы, карциномы пищевода, рака головы и шеи, мезотелиомы, саркомы, холангиокарциномы, аденокарциномы тонкого кишечника, злокачественных опухолей у детей и плоскоклеточной карциномы.
15. Способ по п. 13, где антитело или его антигенсвязывающий фрагмент включает: (а) VH, которая содержит CDR1, CDR2 и CDR3 SEQ ID NO: 30, и (б) VL, которая содержит CDR1, CDR2 и CDR3 SEQ ID NO: 32.
16. Способ по п. 13, где антитело или его антигенсвязывающий фрагмент включает: (а) VH, которая содержит CDR1, CDR2 и CDR3 SEQ ID NO: 30, и (б) VL, которая содержит CDR1, CDR2 и CDR3 SEQ ID NO: 50.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| RU 2008152435 A, 20.07.2010. | |||
Авторы
Даты
2016-04-20—Публикация
2009-09-18—Подача