ССЫЛКА НА СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ТАБЛИЦУ ИЛИ КОМПЬЮТЕРНУЮ ПРОГРАММУ
Список последовательностей вместе с описанием представлен в виде текстового файла в формате ASCII, названного Sequence Listing.txt и созданного 13 января 2020 г. размером 4 килобайта, через EFS-Web. Список последовательностей, поданный через EFS-Web, является частью описания и полностью включен в него посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к гуманизированным антителам к ВСМА (PMC306) и ВСМА-CAR-T-клеткам, специфически снижающим рост опухоли множественной миеломы, которые применимы в области генной терапии опухолей с участием адаптивного иммунитета.
УРОВЕНЬ ТЕХНИКИ
Иммунотерапия становится очень многообещающим методом лечения рака. Т-клетки или Т-лимфоциты, основные защитные компоненты нашей иммунной системы, находятся в постоянном поиске чужеродных антигенов и отделяют аномальные (раковые или инфицированные клетки) от нормальных клеток. Генетическая модификация Т-клеток с помощью конструкций CAR (химерного рецептора антигена) является наиболее распространенным подходом к созданию опухолеспецифических Т-клеток. CAR-T-клетки, нацеленные на опухоль-ассоциированные антигены (TAA), могут быть введены пациентам (так называемый адаптивный перенос клеток или ACT), что является эффективным подходом иммунотерапии [1, 2]. Преимущество CAR-T-технологии по сравнению с химиотерапией или антителами состоит в том, что перепрограммированные сконструированные Т-клетки могут пролиферировать и персистировать в организме пациента («живое лекарство») [1, 2].
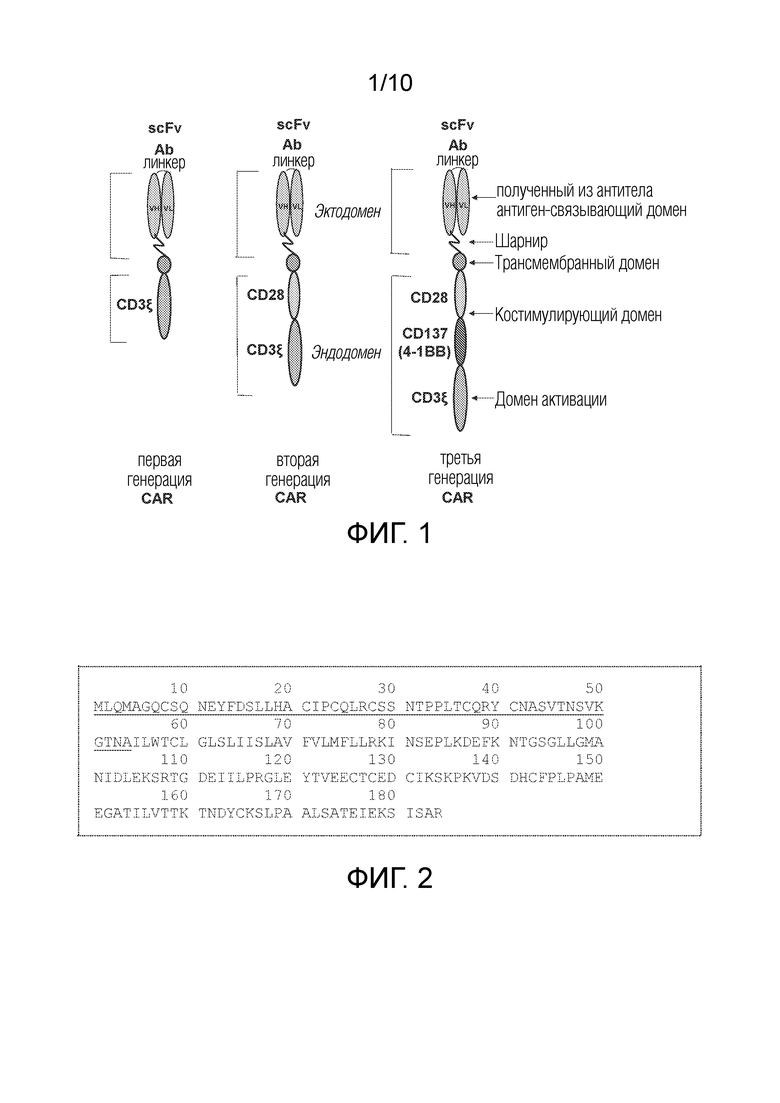
CAR обычно состоят из одноцепочечного вариабельного фрагмента (scFv), полученного из моноклонального антитела, расположенного в N-концевой части, шарнирной части, трансмембранного домена и ряда внутриклеточных доменов коактивации: (i) CD28, (ii) CD137 (4-1BB), CD27 или других костимулирующих доменов в тандеме с доменом активации CD3-дзета (фиг. 1). Эволюция CAR шла от первого поколения (без костимулирующих доменов) через второе поколение (с одним костимулирующим доменом) к CAR третьего поколения (с несколькими костимулирующими доменами). Создание CAR с двумя костимулирующими доменами (так называемый CAR 3-го поколения) привело к усилению цитолитической активности CAR-T-клеток, повышению их устойчивости, что привело к их усиленной противоопухолевой активности.
BCMA
Антиген созревания В-клеток (ВСМА) представляет собой рецептор клеточной поверхности, также известный как CD269 и член 17 суперсемейства рецепторов фактора некроза опухоли (TNFRSF17), который кодируется геном TNFRSF17. Этот рецептор экспрессируется в основном в зрелых В-лимфоцитах и, в большинстве случаев, сверхэкспрессируется при множественной миеломе (ММ) [4]. Современные методы лечения, направленные на нацеливание на BCMA при ММ включают моноклональные антитела, биспецифические антитела и Т-клеточную иммунотерапию, CAR-T терапию [4, 5].
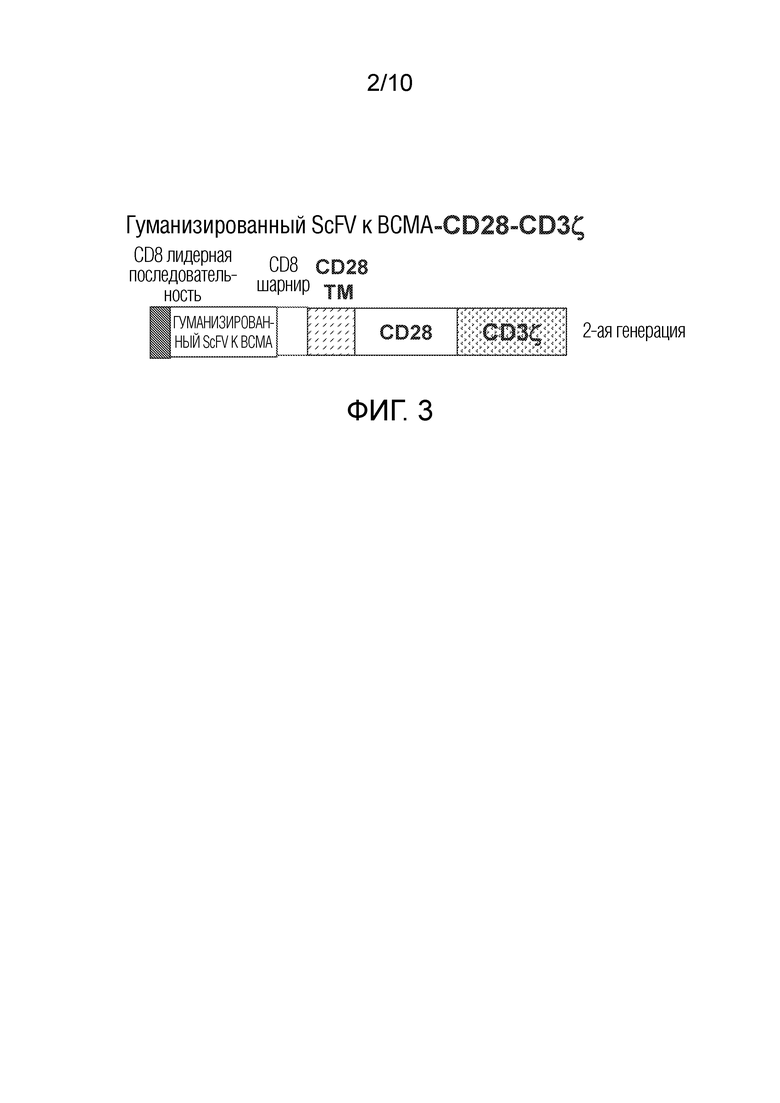
Человеческий белок BCMA состоит из 184 аминокислот: 1-54-внеклеточный домен; 55-77-трансмембранный домен; 78-184-цитоплазматический домен. Аминокислотная последовательность ВСМА показана на фиг. 2. В BCMA отсутствует сигнальный пептид, и сам он похож на другие рецепторы: рецептор BAFF и трансмембранный активатор, а также интерактор лиганда циклофилина и кальциевый модулятор (TACI) [4]. Эти рецепторы играют важную роль в созревании В-клеток и дифференцировке в плазматические клетки. Их лиганды включают BAFF и APRIL, экспрессия которых увеличена у пациентов с ММ [4].
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг. 1 показаны структуры CAR [3]. На левой панели показана структура первого поколения (без костимулирующих доменов). На средней панели показана структура второго поколения (один костимулирующий домен CD28 или 4-BB). На правой панели показана структура третьего поколения (два или более костимулирующих доменов).
На фиг. 2 показана аминокислотная последовательность белка ВСМА (SEQ ID NO: 1). Внеклеточный домен подчеркнут.
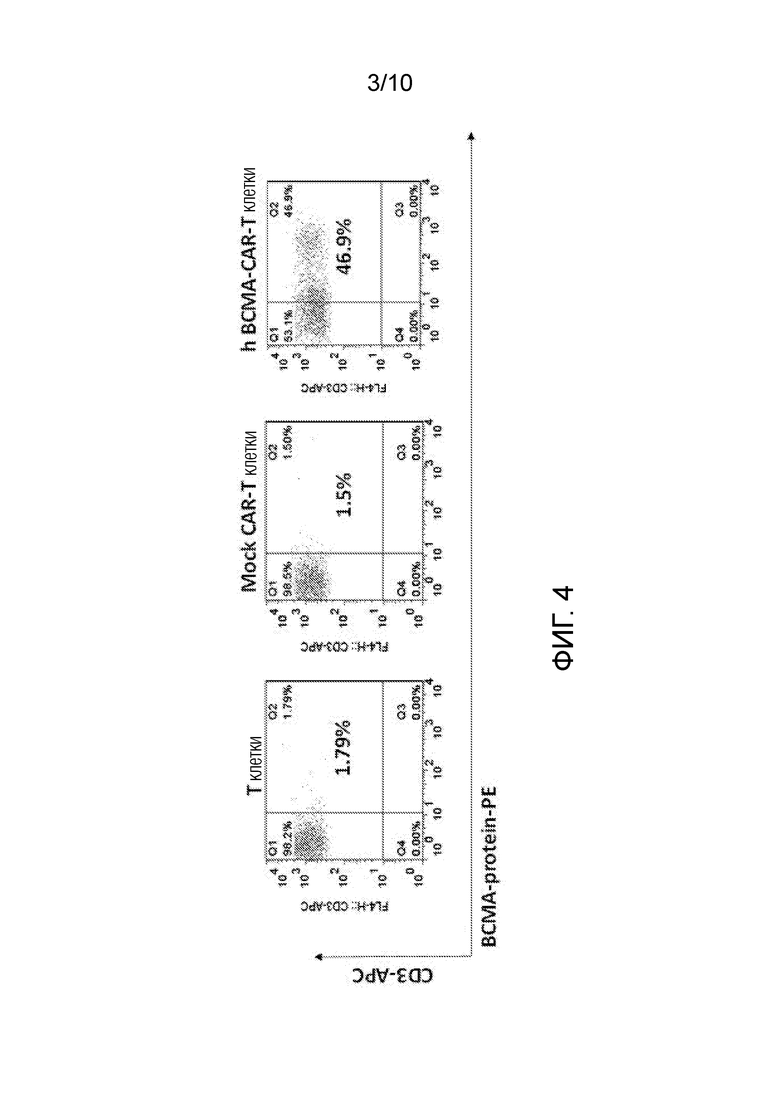
На фиг. 3 показана структура конструкции гуманизированного ВСМА-CAR.
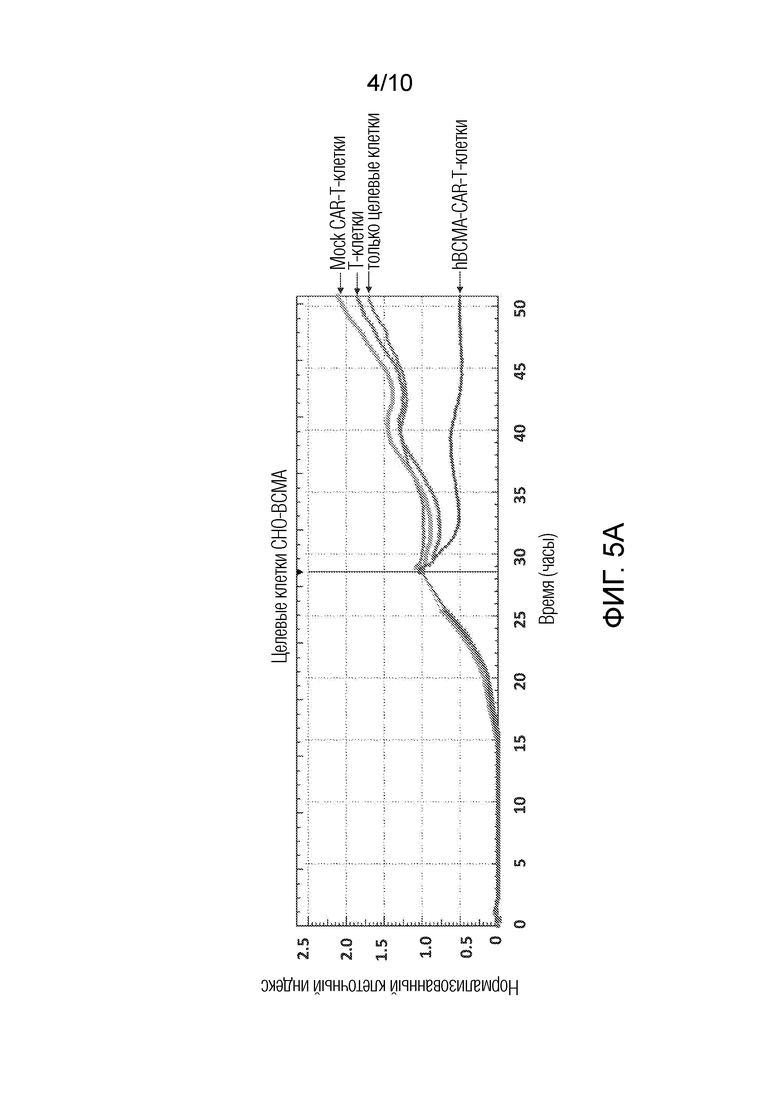
На фиг. 4 показано детектирование конструкции гуманизированного BCMA-CAR с помощью анализа FACS с флуоресцентно меченным рекомбинантным белком BCMA. Клетки, положительные в отношении гуманизированного BCMA-CAR, детектировали после трансдукции в Т-клетки лентивирусного вектора, несущего гуманизированный BCMA-CAR.
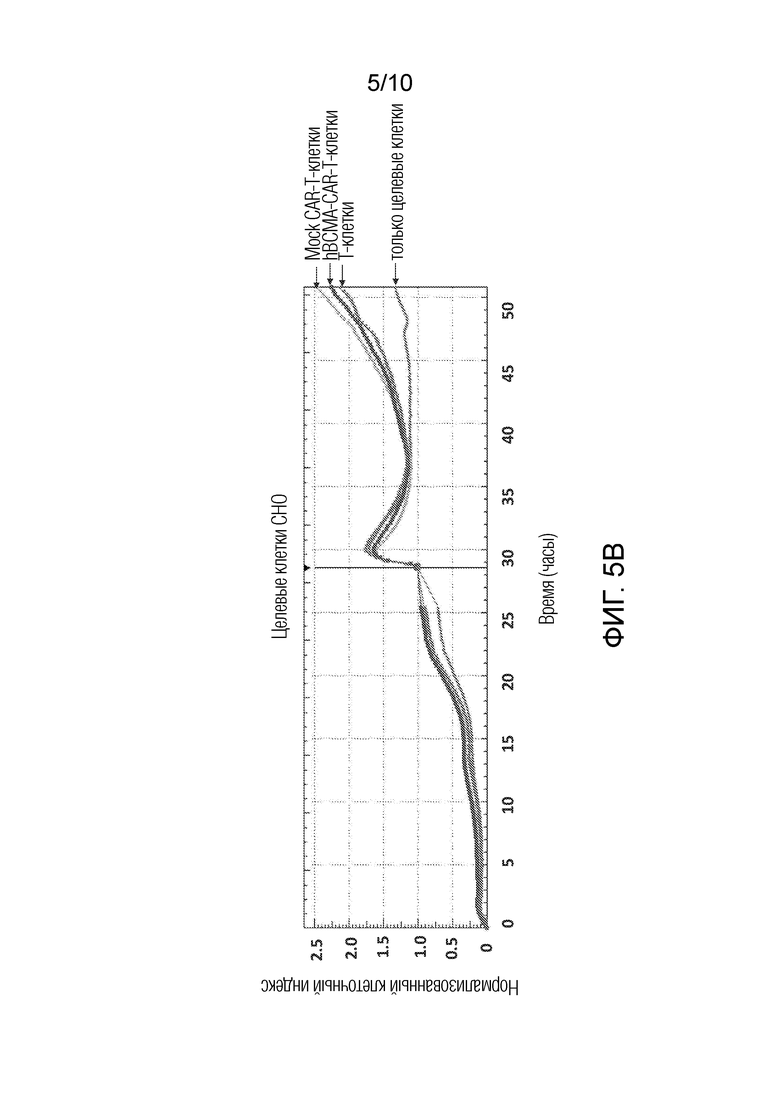
На фиг. 5A-5B показано, что гуманизированные BCMA-CAR-T-клетки, убивают CHO-BCMA клетки, но не клетки CHO. Для детектирования цитотоксичности гуманизированных BCMA-CAR-T-клеток использовали XCelligence анализ цитотоксичности в реальном времени. Нормализованный индекс клеток показан на оси Y, а время показано на оси X. На фиг. 5A показаны клетки-мишени CHO-BCMA. Справа, сверху вниз: Mock CAR-T-клетки, T-клетки, только клетки-мишени и гуманизированные CAR-T-клетки. На фиг. 5B показаны клетки-мишени CHO. Справа, сверху вниз: Mock CAR-T-клетки, гуманизированные BCMA-CAR-Т-клетки, T-клетки и только клетки-мишени.
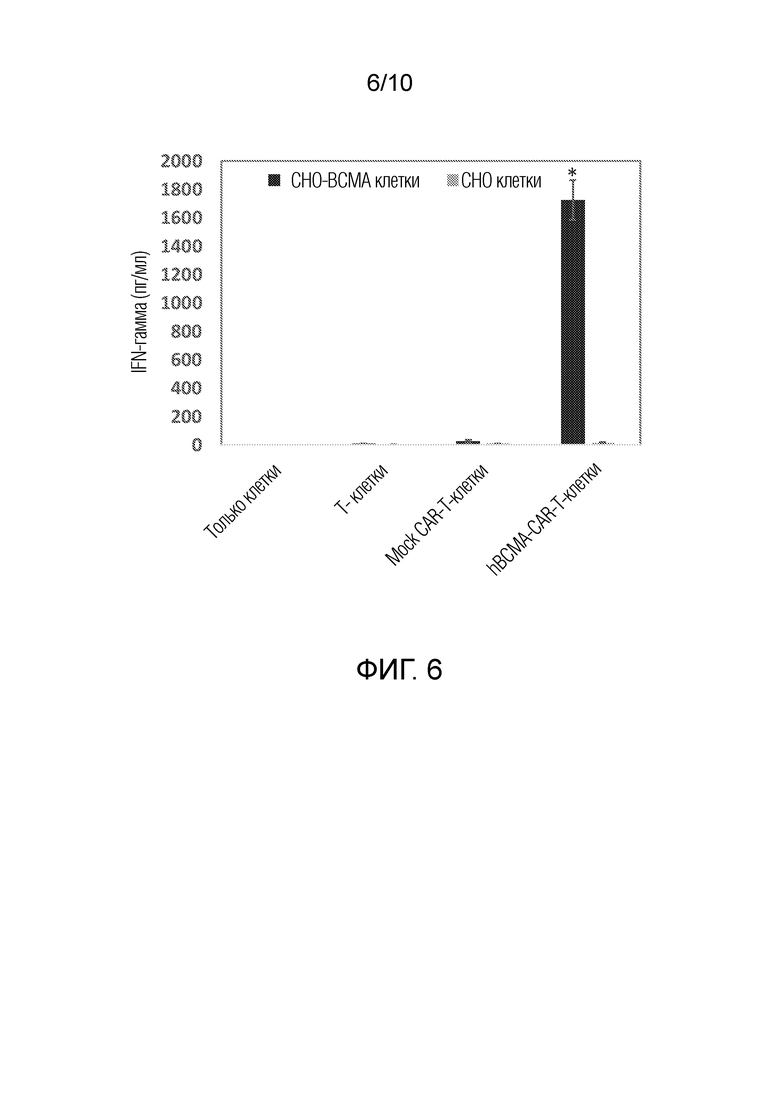
На фиг. 6 показано, что гуманизированные BCMA-CAR-Т-клетки секретируют высокий уровень IFN-гамма с BCMA-положительными клетками CHO, но не BCMA-отрицательными контрольными клетками CHO. p<0,05 секреция IFN-гамма BCMA-CAR-T-клетками в присутствии CHO-BCMA клеток относительно T-клеток и Mock-CAR-T-клеток.
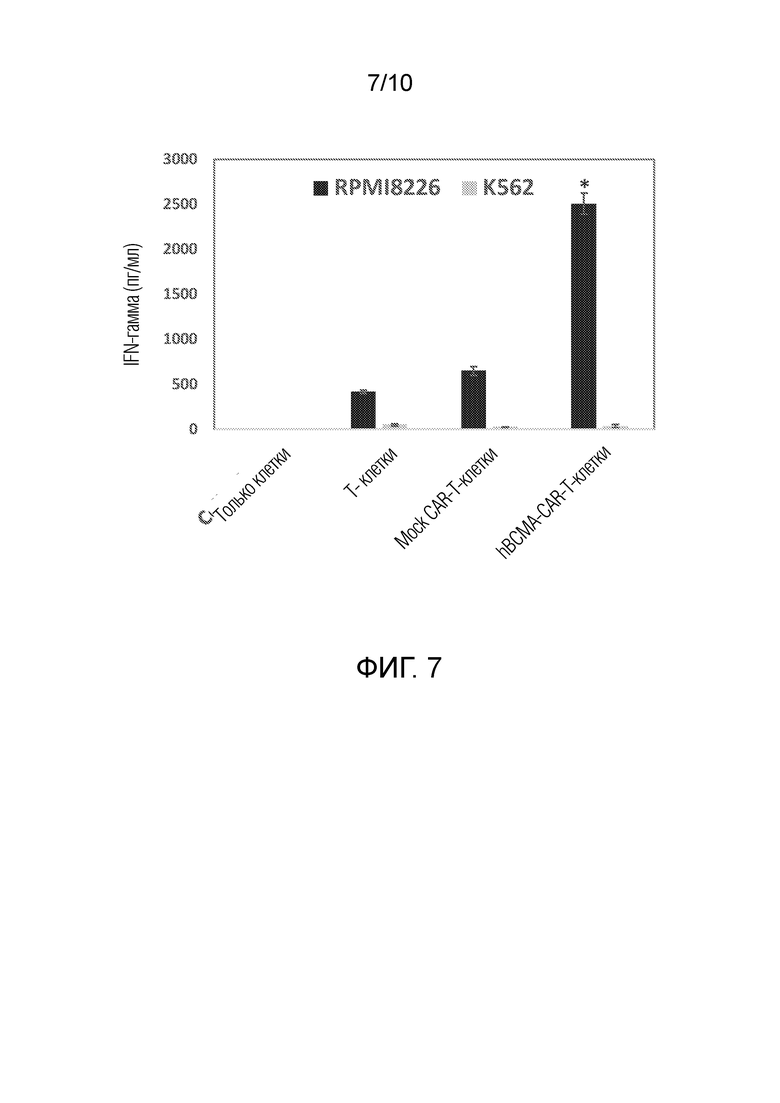
На фиг. 7 показаны гуманизированные BCMA-CAR-Т-клетки, секретирующие высокий уровень IFN-гамма, направленные на клетки множественной миеломы, но не на BCMA-отрицательные контрольные клетки K562. *p<0,05, секреция IFN-гамма BCMA-CAR-T-клетками в присутствии клеток множественной миеломы относительно T-клеток и Mock-CAR-T-клеток.
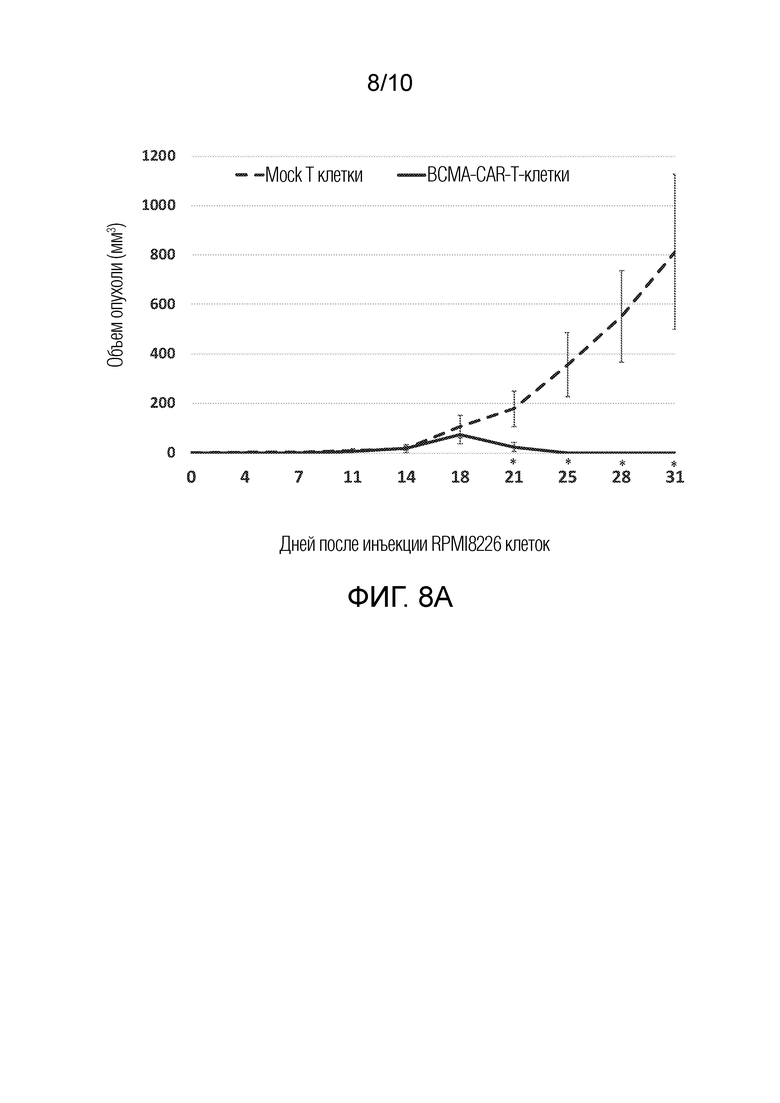
На фиг. 8A показано, что гуманизированные BCMA-CAR-Т-клетки существенно снижают рост опухоли в модели ксенотрансплантата RPMI8226. CAR-T клетки вводили в дни 7 и 20 внутривенно в количестве 1×107 клеток/мышь. Столбики показывают средний объем опухоли +/- стандартные ошибки. *p<0,05, BCMA-CAR-T-клетки относительно Mock T-клеток.
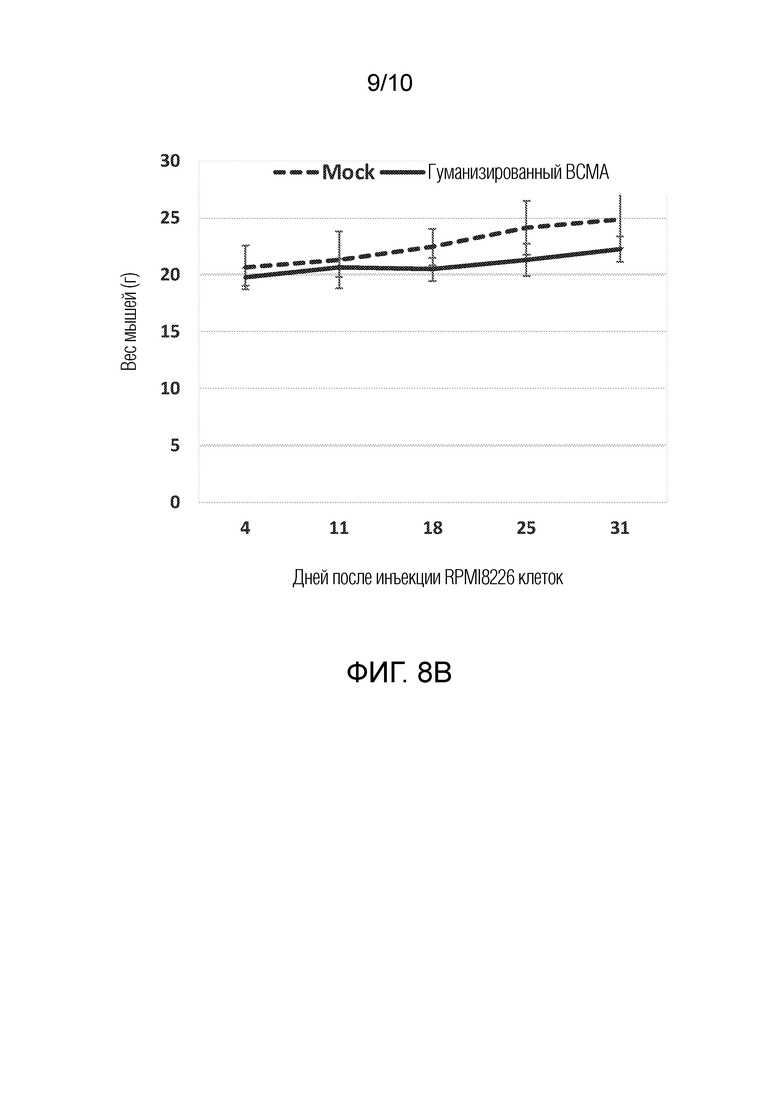
На фиг. 8B показано, что гуманизированные BCMA-CAR-Т-клетки не приводили к уменьшению массы тела мыши. Столбики показывают среднюю массу тела мышей +/- стандартные отклонения.
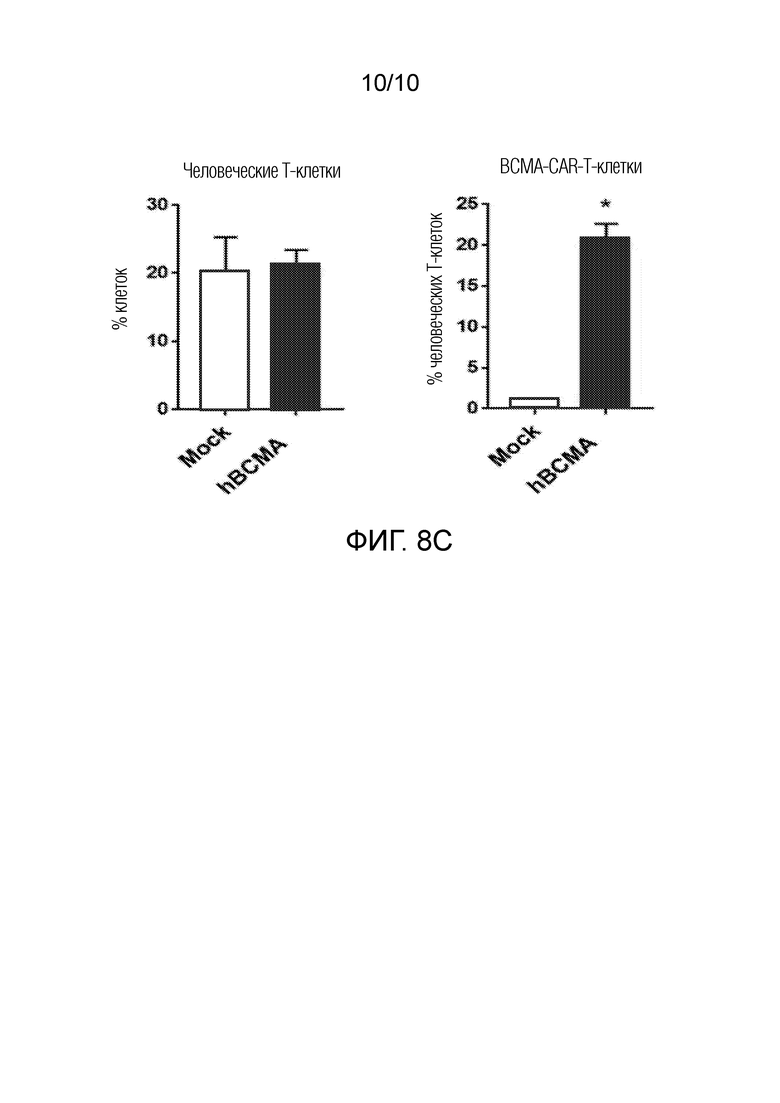
На фиг. 8C показано обнаружение методом FACS гуманизированных BCMA-CAR-Т-клеток, но не Mock-CAR-T-клеток в крови мышей с помощью рекомбинантного белка BCMA. Клетки периферической крови анализировали проточной цитометрией в конце исследования на связывание с человеческим белком BCMA и антителами, специфичными к человеческим (CD4+/CD8+) Т-клеткам. Процент связывания клеток с CD4 антителом показан на левой панели фиг. 8C, а процент тех человеческих Т-клеток, которые также связаны с белком ВСМА, показан на правой панели фиг. 8C.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В контексте настоящего описания термин «химерный рецептор антигена (CAR)» представляет собой рецепторный белок, который сконструирован для придания Т-клеткам новой способности нацеливаться на конкретный белок. Рецептор является химерным, потому что в одном рецепторе объединены две функции: антигенсвязывающая функция и функция активации Т-клеток. CAR представляет собой слитый белок, содержащий внеклеточный домен, способный связываться с антигеном, трансмембранный домен и по меньшей мере один внутриклеточный домен. «Химерный рецептор антигена (CAR)» иногда называют «химерным рецептором», «Т-телом» или «химерным иммунным рецептором (CIR)». «Внеклеточный домен, способный связываться с антигеном» означает любой олигопептид или полипептид, который может связываться с определенным антигеном. «Внутриклеточный домен» означает любой олигопептид или полипептид, о котором известно, что он функционирует в качестве домена, который передает сигнал, вызывающий активацию или ингибирование биологического процесса в клетке.
В контексте настоящего описания термин «домен» означает одну область в полипептиде, которая свернута в конкретную структуру независимо от других областей.
В контексте настоящего описания «гуманизированные антитела» представляют собой антитела, происходящие от видов, не относящихся к человеку, белковые последовательности которых модифицированы для увеличения их сходства с вариантами антител, вырабатываемыми естественным образом у людей. Например, после разработки мышиного антитела можно секвенировать ДНК, кодирующую это антитело. Затем можно определить последовательность ДНК, соответствующую CDR антитела. Последовательности CDR могут быть вставлены в конструкцию, содержащую ДНК варианта человеческого антитела, для получения гуманизированных антител.
В контексте настоящего описания «одноцепочечный вариабельный фрагмент (scFv)» означает одноцепочечный полипептид, полученный из антитела, которое сохраняет способность связываться с антигеном. Пример scFv включает полипептид антитела, который образован методом рекомбинантной ДНК и в котором Fv-области фрагментов тяжелой цепи (H-цепь) и легкой цепи (L-цепь) иммуноглобулина связаны через спейсерную последовательность. Специалистам в данной области известны различные методы конструирования scFv.
В контексте настоящего описания «опухолевый антиген» означает биологическую молекулу, обладающую антигенностью, экспрессия которой вызывает рак.
Авторами изобретения был сконструирован гуманизированный анти-ВСМА scFv из вариабельных областей тяжелой и легкой цепей мышиного моноклонального антитела, полученного из мышиного моноклонального антитела клона 4C8A. Мышиное антитело 4C8A демонстрирует сильное и избирательное связывание с человеческим ВСМА [6]. На основе гуманизированного антитела к ВСМА получали ВСМА-CAR-Т-клетки для нацеливания на раковые клетки, сверхэкспрессирующие опухолевый антиген ВСМА. BCMA-CAR-T-клетки по настоящему изобретению обладают высокой цитотоксической активностью в отношении нескольких линий раковых клеток.
Настоящее изобретение относится к гуманизированному антителу к человеческому ВСМА, содержащему VH, имеющую аминокислоту SEQ ID NO: 3, и VL, имеющую аминокислоту SEQ ID NO: 5.
В одном из вариантов осуществления гуманизированное антитело к человеческому ВСМА представляет собой одноцепочечный вариабельный фрагмент (scFv). ScFv может представлять собой VH-линкер-VL или VL-линкер-VH.
Настоящее изобретение также относится к слитому белку химерного рецептора антигена, содержащему, в направлении от N-конца к C-концу: (i) одноцепочечный вариабельный фрагмент (scFv) к BCMA, в котором VH имеет аминокислотную последовательность SEQ ID NO 3, и VL имеет аминокислоту SEQ ID NO: 5, (ii) трансмембранный домен, (iii) по меньшей мере один костимулирующий домен и (iv) домен активации.
В одном из вариантов осуществления структура CAR показана на фиг. 2.
В одном из вариантов осуществления костимулирующий домен выбирают из группы, состоящей из CD28, 4-1BB, GITR, ICOS-1, CD27, OX-40 и DAP10. Предпочтительным костимулирующим доменом является CD28.
Предпочтительным доменом активации является CD3-дзета (CD3 Z или CD3ξ).
Трансмембранный домен может быть получен из природного полипептида или может быть создан искусственно. Трансмембранный домен, полученный из природного полипептида, может быть получен из любого мембранно-связывающего или трансмембранного белка. Например, можно использовать трансмембранный домен α- или β-цепи рецептора Т-клеток, дзета-цепь CD3, CD28, CD3ε., CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, ICOS, CD154 или GITR. Искусственно созданный трансмембранный домен представляет собой полипептид, в основном содержащий гидрофобные остатки, такие как лейцин и валин. Предпочтительно, чтобы на каждом конце синтетического трансмембранного домена находился триплет, состоящий из фенилаланина, триптофана и валина. Между трансмембранным доменом и внутриклеточным доменом необязательно может быть расположен короткий олигопептидный линкер или полипептидный линкер, например линкер, имеющий длину от 2 до 10 аминокислот. В одном из вариантов осуществления может использоваться линкерная последовательность, имеющая непрерывную глицин-сериновую последовательность.
Настоящее изобретение относится к нуклеиновой кислоте, кодирующей BCMA-CAR. Нуклеиновая кислота, кодирующая CAR, может быть получена из аминокислотной последовательности указанного CAR обычным способом. Последовательность оснований, кодирующая аминокислотную последовательность, может быть получена из вышеупомянутых RefSeq ID NCBI или номеров доступа в GenBank для аминокислотной последовательности каждого домена, а нуклеиновая кислота по настоящему изобретению может быть получена с помощью стандартных молекулярно-биологических и/или химических процедур. Например, на основе последовательности оснований может быть синтезирована нуклеиновая кислота, и нуклеиновая кислота по настоящему изобретению может быть получена путем объединения фрагментов ДНК, полученных из библиотеки кДНК, с помощью полимеразной цепной реакции (ПЦР).
Нуклеиновая кислота, кодирующая CAR по настоящему изобретению, может быть вставлена в вектор, и вектор может быть введен в клетку. Например, можно использовать вирусный вектор, такой как ретровирусный вектор (включая онкоретровирусный вектор, лентивирусный вектор и вектор псевдотипа), аденовирусный вектор, вектор аденоассоциированного вируса (AAV), вектор обезьяньего вируса, вектор вируса осповакцины или вектор вируса Сендаи, вектор вируса Эпштейна-Барра (EBV) и вектор HSV. Предпочтительно используют вирусный вектор, не обладающий способностью к репликации с тем, чтобы он не самореплицировался в инфицированной клетке.
Например, когда используется ретровирусный вектор, подходящая упаковывающая клетка может быть выбрана на основе последовательности LTR и последовательности сигнала упаковки, содержащиеся в векторе, для получения ретровирусной частицы с использованием упаковывающей клетки. Примеры упаковывающей клетки включают PG13 (ATCC CRL-10686), PA317 (ATCC CRL-9078), GP+E-86 и GP+envAm-12 и Psi-Crip. Ретровирусную частицу также можно получить с использованием клетки 293 или клетки 293Т, которые демонстрируют высокую эффективность трансфекции. Многие виды ретровирусных векторов, полученные на основе ретровирусов и упаковывающих клеток, которые можно использовать для упаковки ретровирусных векторов, можно приобрести у многих компаний.
CAR-T-клетка связывается со специфическим антигеном через CAR, таким образом передавая сигнал в клетку, в результате чего клетка активируется. Активация клетки, экспрессирующей CAR, меняется в зависимости от типа клетки-хозяина и внутриклеточного домена CAR, и может быть подтверждена, например, высвобождением цитокина, улучшением скорости пролиферации клеток, изменением в молекуле клеточной поверхности или т.п., в качестве показателя. Например, высвобождение цитотоксического цитокина (фактора некроза опухоли, лимфотоксина и т.д.) из активированной клетки вызывает разрушение клетки-мишени, экспрессирующей антиген. Кроме того, высвобождение цитокина или изменение в молекуле клеточной поверхности стимулирует другие иммунные клетки, например В-клетку, дендритную клетку, NK-клетку и макрофаг.
Клетка, экспрессирующая CAR, может использоваться в качестве терапевтического агента при заболевании. Терапевтический агент содержит экспрессирующую CAR клетку в качестве активного ингредиента, и дополнительно может содержать подходящее вспомогательное вещество.
Авторами изобретения были созданы CAR-T-клетки на основе гуманизированной последовательности анти-BCMA ScFv, специфически нацеливаемые на BCMA. Были получены гуманизированные BCMA-CAR-T-клетки для нацеливания на раковые клетки, сверхэкспрессирующие опухолевый антиген BCMA. Гуманизированные BCMA-CAR-T-клетки по настоящему изобретению секретируют высокий уровень цитокинов против клеток множественной миеломы и уничтожают BCMA-положительные клетки-мишени CHO, но не контрольные родительские клетки CHO.
Преимущества гуманизированного анти-BCMA ScFv по настоящему изобретению относительно соответствующего мышиного ScFv заключается в более низкой иммуногенности по отношению к человеку благодаря гуманизированной последовательности анти-BCMA scFv. Таким образом, гуманизированное антитело к ВСМА по настоящему изобретению является очень эффективным и полезным в качестве терапевтического агента во многих клинических применениях.
Гуманизированный анти-BCMA ScFv по настоящему изобретению можно использовать для применения в иммунотерапии: антитело, конъюгированное с токсином/лекарственным средством, моноклональное терапевтическое антитело и иммунотерапия CAR-T-клетками.
Гуманизированные BCMA-CAR-T-клетки, в которых используется гуманизированный анти-BCMA ScFv по настоящему изобретению эффективно воздействуют на антиген BCMA в линиях BCMA-положительных раковых клеток, таких как клетки яичника, толстой кишки, поджелудочной железы, меланомы, рака шейки матки и других BCMA-положительных раковых клеток.
Гуманизированные BCMA-CAR-T-клетки можно использовать в комбинации с разными химиотерапевтическими препаратами: ингибиторами контрольных точек, таргетной терапией, низкомолекулярными ингибиторами и антителами.
Гуманизированные BCMA-CAR-T-клетки могут найти клиническое применение против BCMA-положительных раковых клеток.
Модификации доменов коактивации, таких как CD28, 4-1BB и других, могут быть использованы для увеличения эффективности CAR-T-клеток. Гуманизированный анти-BCMA scFv, конъюгированный с меткой, можно использовать для создания CAR.
Гуманизированные BCMA-CAR-T-клетки можно использовать с различными переключателями безопасности, такими как t-EGFR, RQR (ритуксимаб-CD34-ритуксимаб), индуцибельная каспаза-9 и другие.
CAR-T третьего поколения или другие сигнальные домены коактивации можно использовать с гуманизированным анти-BCMA scFv для получения BCMA-CAR-T.
Гуманизированный ВСМА-CAR можно комбинировать с CAR, нацеленными на другие опухолевые антигены или микроокружение опухоли, например, VEGFR-1-3, PDL-1. Для терапии могут быть созданы биспецифические антитела к BCMA и CD3 или другим антигенам.
Гуманизированный BCMA-CAR можно использовать для создания других типов клеток, таких как CAR-естественные киллерные (NK) клетки, BCMA-CAR-макрофаги, аллогенные CAR-T-клетки, генно-редактируемые T-клетки и другие BCMA-CAR гематопоэтические клетки, которые могут таргетировать BCMA-положительные раковые образования.
Настоящее изобретение относится к Т-клеткам, NK-клеткам, макрофагам или гемопоэтическим клеткам, модифицированным для экспрессии BCMA-CAR.
BCMA-CAR-T-клетки можно использовать против раковых стволовых клеток и циркулирующих опухолевых стволовых клеток, которые наиболее устойчивы к химиотерапии и образуют агрессивные опухоли.
BCMA-CAR-T-клетки, BCMA-NK-клетки, BCMA-макрофаги и другие клетки могут быть использованы для нацеливания на различные типы рака.
BCMA-CAR-T-клетки могут быть доставлены внутрь опухоли пациентов для повышения безопасности.
Приведенные ниже примеры дополнительно иллюстрируют настоящее изобретение. Эти примеры предназначены исключительно для иллюстрации настоящего изобретения и не должны рассматриваться как ограничивающие.
ПРИМЕРЫ
Пример 1. Гуманизированные последовательности VH, VL BCMA и scFv.
scFv к BCMA получали из клонов гибридомы 4C8A (WO2019/195017). Определяли последовательности вариабельных областей тяжелой и легкой цепей мышиного клона 4C8A и использовали для конструирования гуманизированного scFv.
Структура гуманизированного анти-BCMA scFv (PMC306) является следующей: VH-линкер-VL. Линкер представляет собой G4Sx3.
Жирным шрифтом выделена нуклеотидная последовательность гуманизированного клона ScFv к BCMA PMC306: VH; подчеркнутым шрифтом выделена нуклеотидная последовательность VL; между ними (выделена курсивом) находится нуклеотидная последовательность, кодирующая линкер.
caggtgcagctggtgcagagcggcgcggaagtgaaaaaaccgggcagcagcgtgaaagtg
agctgcaaagcgagcggctatacctttaccagctatgtgatgcattgggtgcgccaggcg
ccgggccagggcctggaatggatgggctatattattccgtataacgatgcgaccaaatat
aacgaaaaatttaaaggccgcgtgaccattaccgcggataaaagcaccagcaccgcgtat
atggaactgagcagcctgcgcagcgaagataccgcggtgtattattgcgcgcgctataac
tatgatggctattttgatgtgtggggccagggcaccctggtgaccgtgagcagcggcggc
ggcggcagcggcggcggcggcagcggcggcggcggcagcgaaattgtgctgacccagagc
ccggcgaccctgagcctgagcccgggcgaacgcgcgaccctgagctgccgcgcgagccag
agcattagcgattatctgcattggtatcagcagaaaccgggccaggcgccgcgcctgctg
atttattatgcgagccagagcattaccggcattccggcgcgctttagcggcagcggcagc
ggcaccgattttaccctgaccattagcagcctggaaccggaagattttgcggtgtattat
tgccagaacggccatagctttccgccgacctttggcggcggcaccaaagtggaaattaaa
(SEQ ID NO: 2)
Аминокислотная последовательность VH PMC306: (SEQ ID NO: 3)
QVQLVQSGAEVKKPGSSVKVSCKASGYTFTSYVMHWVRQAPGQGLEWMGYIIPYNDATKYNEKFKGRVTITADKSTSTAYMELSSLRSEDTAVYYCARYNYDGYFDVWGQGTLVTVSS
Аминокислотная последовательность линкера (SEQ ID NO: 4)
GGGGSGGGGSGGGGS
Аминокислотная последовательность VL PMC306: (SEQ ID NO: 5)
EIVLTQSPATLSLSPGERATLSCRASQSISDYLHWYQQKPGQAPRLLIYYASQSITGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQNGHSFPPTFGGGTKVEIK
Гуманизированный белок scFv к BCMA (PMC306): (SEQ ID NO: 6)
Q V Q L V Q S G A E V K K P G S S V K V S C K A S G Y T F T S Y V M H W V R Q A P G Q G L E W M G Y I I P Y N D A T K Y N E K F K G R V T I T A D K S T S T A Y M E L S S L R S E D T A V Y Y C A R Y N Y D G Y F D V W G Q G T L V T V S S G G G G S G G G G S G G G G S E I V L T Q S P A T L S L S P G E R A T L S C R A S Q S I S D Y L H W Y Q Q K P G Q A P R L L I Y Y A S Q S I T G I P A R F S G S G S G T D F T L T I S S L E P E D F A V Y Y C Q N G H S F P P T F G G G T K V E I K
Пример 2. Гуманизированные BCMA-CAR последовательности.
Схема гуманизированной конструкции (PMC306) BCMA-CAR показана на фиг. 3. Для клонирования гуманизированных последовательностей scFv-CAR использовали лентивирусный вектор с промотором EF1a.
Структура BCMA-CAR включает сигнальный пептид человеческого CD8, гуманизированный анти-BCMA scFv (VH-линкер-VL), шарнирный домен CD8, трансмембранный домен CD28, домены активации CD3-дзета (фиг. 3).
Нуклеотидные последовательности и некоторые аминокислотные последовательности сигнальных CD8-scFv к BCMA (VH-линкер-VL)-шарнир CD8-TM CD28-CD28-CD3-дзета показаны ниже.
<Лидерная последовательность CD8>
Нуклеотидная последовательность
ATGGCCTTACCAGTGACCGCCTTGCTCCTGCCGCTGGCCTTGCTGCTCCACGCCGCCAGGCCG (SEQ ID NO: 7)
Аминокислотная последовательность
MALPVTALLLPLALLLHAARP (SEQ ID NO: 8)
<Участок Nhe I>
gctagc
<Гуманизированный BCMA, PMC 306 scFv>
VH-линкер-VL, см. пример 1 для последовательностей нуклеиновых кислот и аминокислотных последовательностей.
<Рестрикционный сайт XhoI>
CTCGAG
<Шарнир CD8>
Нуклеотидная последовательность
AAGCCCACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGAGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCAGTGAT (SEQ ID NO: 9)
Аминокислотная последовательность
KPTTTPAPRPPTPAPTIASQPLSLRPEASRPAAGGAVHTRGLDFASD (SEQ ID NO: 10)
<aagccc>
<Трансмембранный домен CD28>
Нуклеотидная последовательность
TTTTGGGTGCTGGTGGTGGTTGGTGGAGTCCTGGCTTGCTATAGCTTGCTAGTAACAGTGGCCTTTATTATTTTCTGGGTG (SEQ ID NO: 11)
Аминокислотная последовательность
FWVLVVVGGVLACYSLLVTVAFIIFWV (SEQ ID NO: 12)
<Костимулирующий домен CD28>
Нуклеотидная последовательность
AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 13)
Аминокислотная последовательность
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS (SEQ ID NO: 14)
<CD3-дзета> стоп-кодоны подчеркнуты
Нуклеотидная последовательность
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGCAGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGCTAAtag (SEQ ID NO: 15)
Аминокислотная последовательность
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR (SEQ ID NO: 16)
<Рестрикционный сайт EcoRI>
gaattc
Транслируемая аминокислотная последовательность гуманизированного BCMA-CAR белка (SEQ ID NO: 17)
M A L P V T A L L L P L A L L L H A A R P A S Q V Q L V Q S G A E V K K P G S S V K V S C K A S G Y T F T S Y V M H W V R Q A P G Q G L E W M G Y I I P Y N D A T K Y N E K F K G R V T I T A D K S T S T A Y M E L S S L R S E D T A V Y Y C A R Y N Y D G Y F D V W G Q G T L V T V S S G G G G S G G G G S G G G G S E I V L T Q S P A T L S L S P G E R A T L S C R A S Q S I S D Y L H W Y Q Q K P G Q A P R L L I Y Y A S Q S I T G I P A R F S G S G S G T D F T L T I S S L E P E D F A V Y Y C Q N G H S F P P T F G G G T K V E I K L E K P T T T P A P R P P T P A P T I A S Q P L S L R P E A S R P A A G G A V H T R G L D F A S D K P F W V L V V V G G V L A C Y S L L V T V A F I I F W V R S K R S R L L H S D Y M N M T P R R P G P T R K H Y Q P Y A P P R D F A A Y R S R V K F S R S A D A P A Y Q Q G Q N Q L Y N E L N L G R R E E Y D V L D K R R G R D P E M G G K P Q R R K N P Q E G L Y N E L Q K D K M A E A Y S E I G M K G E R R R G K G H D G L Y Q G L S T A T K D T Y D A L H M Q A L P P R (SEQ ID NO: 17)
Пример 3. Получение CAR-лентивируса.
Лентивирус получали стандартным способом с использованием клеток 293T, как описано в [7]. Создавали конструкции гуманизированного BCMA-ScFv-CAR внутри лентивирусного вектора, клонированные по сайтам рестрикции Xba I и Eco RI лентивирусного вектора. Конструкция лентивирусного CAR-pCD510-FMC63-28z содержала вставку гуманизированный анти-BCMA ScFv-CD28-CD3-дзета между сайтами клонирования Xba I и Eco RI.
Лентивирусы получали в клетках 293Т, и титры устанавливали с помощью ОТ-ПЦР. Затем равную дозу лентивирусов использовали для трансдукции Т-клеток.
Пример 4. Выделение мононуклеарных клеток периферической крови (PBMC) из цельной крови.
Цельную кровь (Стэнфордский госпитальный центр крови (Stanford Hospital Blood Center), Стэнфорд, Калифорния) собирали у отдельных или смешанных доноров (в зависимости от необходимого количества крови) в 10 мл вакутейнеры с гепарином (Becton Dickinson). Приблизительно 10 мл цельной антикоагулированной крови смешивали со стерильным фосфатно-солевым буфером (PBS) до общего объема 20 мл в 50 мл центрифужной пробирке (PBS, pH 7,4, без Ca2+ и Mg2+). Кровь/PBS (20 мл) аккуратно вносили в 15 мл Ficoll-Paque PLUS (GE Healthcare) коническую центрифужную пробирку, и образец центрифугировали при 400g в течение 30-40 минут при комнатной температуре. Слой клеток, содержащий мононуклеарные клетки периферической крови (PBMC) на границе раздела разбавленная плазма/фиколл, удаляли, промывали и центрифугировали при 200×g в течение 10 минут при комнатной температуре. Клетки подсчитывали с помощью гемоцитометра. PBMC промывали один раз средой для CAR-T (AIM V-AlbuMAX (BSA) (Life Technologies) с 5% сывороткой AB и 1,25 мкг/мл амфотерицина B (Gemini Bioproducts, Woodland, CA), 100 Ед/мл пенициллина, и 100 мкг/мл стрептомицина) и использовали для экспериментов или замораживали при -80°C.
Пример 5. Активация Т-клеток из PBMC.
Выделенные клетки PBMC ресуспендировали в среде CAR-T с 300 ед./мл huIL2 (из 1000x исходного материала; Invitrogen) и смешивали с CD3-CD28 гранулами при соотношении гранул к клеткам 1:1. Клетки инкубируют при 37°C в присутствии CO2 в течение 24 часов перед вирусной трансдукцией.
Пример 6. Трансдукция и размножение Т-клеток.
После активации PBMC клетки инкубировали в течение 24 часов при 37°C, 5% CO2. В каждую лунку с 1×106 клеток добавляли 5×106 лентивирусов и 2 мкл/мл среды Transplus (Alstem, Richmond, CA) (конечное разведение 1:500). Клетки инкубировали в течение дополнительных 24 часов перед повторным добавлением вируса. Затем клетки выращивали при постоянном присутствии IL-2 в 300 Ед/мл свежей среды для IL-2 в течение 12-14 дней (общее время инкубации зависело от конечного количества требуемых CAR-T-клеток). Концентрации клеток анализировали каждые 2-3 дня, при этом в это время добавляли среду для разбавления суспензии клеток до 1×106 клеток/мл.
Пример 7. Гуманизированные BCMA-CAR-T-клетки экспрессировали scFv к BCMA.
Конструировали гуманизированные BCMA-CAR-T-клетки с использованием конструкции гуманизированного BCMA-CAR, описанного в примере 2. Использовали Mock scFv с неродственным ScFv и создавали Mock-CAR-T клетки в качестве отрицательного контроля. Гуманизированные BCMA-CAR-положительные клетки детектировали после трансдукции лентивирусного гуманизированного BCMA-CAR в Т-клетки (Фиг.4).
Пример 8. Гуманизированные BCMA-CAR-T-клетки уничтожали BCMA-клетки CHO, но не клетки CHO.
Гуманизированные BCMA-CAR-T-клетки инкубировали с целевыми BCMA-клетками CHO и контрольными клетками CHO (отрицательными по BCMA). Гуманизированные BCMA-CAR-Т-клетки специфически уничтожали BCMA-клетки CHO (фиг. 5A), но не клетки CHO (фиг. 5B). Результаты свидетельствуют о высокой специфичности гуманизированных BCMA-CAR-T-клеток по отношению к BCMA антигену и уничтожению BCMA-положительных клеток.
Пример 9. Гуманизированные CAR-T-клетки секретировали высокие уровни IFN-гамма против целевых BCMA-клеток CHO, но не против клеток CHO.
После совместной инкубации гуманизированных BCMA-CAR-Т-клеток с целевыми BCMA-клетками CHO и родительскими клетками CHO собрали супернатант и выполнили анализ IFN-гамма. BCMA-CAR-Т-клетки секретировали IFN-гамма в присутствии ВСМА-клеток СНО, но не в присутствии клеток СНО, служащих в качестве отрицательного контроля (фиг. 6). Результаты подтверждают специфичность гуманизированных BCMA-CAR-Т-клеток.
Пример 10. Гуманизированные CAR-T-клетки секретировали высокие уровни IFN-гамма против BCMA-положительных клеток множественной миеломы RPMI8226, но не против BCMA-отрицательных лейкозных клеток K562.
BCMA-CAR-Т-клетки инкубировали с клетками множественной миеломы RPMI8266 и BCMA-отрицательными клетками K562 (клетки хронического миелогенного лейкоза) и выполняли анализ ELISA по определению IFN-гамма с помощью набора от Fisher, в соответствии с протоколом производителя. Гуманизированные BCMA-CAR-Т-клетки секретировали высокий уровень IFN-гамма против BCMA-положительных раковых клеток множественной миеломы, но не против BCMA-отрицательных клеток K562 (фиг. 7). Уровень гибели клеток и секреции IFN-гамма был значительно выше в присутствии BCMA-CAR-Т-клеток, чем в присутствии Т-клеток и Mock CAR-T-клеток. Это подтверждает специфичность гуманизированных BCMA-CAR-Т-клеток в отношении гематологических BCMA-положительных клеток.
Пример 11. Гуманизированные BCMA-CAR-Т-клетки существенно снижали рост опухоли в мышиной модели ксенотрансплантата RPMI8226 in vivo.
Клетки множественной миеломы RPMI8226 вводили подкожно мышам NSG (1×107 клеток/мышь), а затем дважды внутривенно вводили Т-клетки с гуманизированным BCMA-CAR (1×107 CAR-T-клеток/мышь). Т-клетки с гуманизированным BCMA-CAR существенно снижали рост опухоли RPMI8226 у мышей (фиг. 8A). Мыши, обработанные гуманизированными BCMA-CAR-Т-клетками не вызывали снижения массы тела у мышей, что позволяет предположить, что CAR-T-клетки не являются токсичными для мышей (фиг. 8B). Во время исследования не наблюдали никаких поведенческих или визуальных изменений.
В конце исследования клетки периферической крови анализировали методом проточной цитометрии на связывание с человеческим белком BCMA и антителами, специфичными к человеческим (CD4+/CD8+) Т-клеткам. Процент связывания клеток с анти-CD4 mAb показан на левой панели фиг. 8C, а процент человеческих Т-клеток, которые также были связаны с белком ВСМА, показан на правой панели фиг. 8C. Согласно полученным результатам, FACS анализ с рекомбинантным белком BCMA выявил наличие в крови мышей гуманизированных BCMA-CAR-Т-клеток, но не Mock CAR-T-клеток.
Литература
1. Maus, M.V., Haas, A.R., Beatty, G.L., Albelda, S.M., Levine, B.L., Liu, X., Zhao, Y., Kalos, M., and June, C.H. (2013). T cells expressing chimeric antigen receptors can cause anaphylaxis in humans. Cancer Immunol Res 1, 26-31.
2. Maus, M.V., Grupp, S.A., Porter, D.L., and June, C.H. (2014). Antibody-modified T cells: CARs take the front seat for hematologic malignancies. Blood 123, 2625-2635.
3. Golubovskaya V, Wu L. (2016) Different Subsets of T Cells, Memory, Effector Functions, and CAR-T Immunotherapy. Cancers, 15, 8 (3). PMID: 26999211
4. Ali, S.A., Shi, V., Maric, I., Wang, M., Stroncek, D.F., Rose, J.J., Brudno, J.N., Stetler-Stevenson, M., Feldman, S.A., Hansen, B.G., et al. (2016). T cells expressing an anti-B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma. Blood 128, 1688-1700.
5. Tai, Y.T., and Anderson, K.C. (2015). Targeting B-cell maturation antigen in multiple myeloma. Immunotherapy. 7(11):1187-99. doi: 10.2217/imt.15.77. Epub 2015 Sep 15. Review. PMID: 26370838
6. WO2019/195017
7. Berahovich R, Xu S, Zhou H, Harto H, Xu Q, Garcia A, Liu F, Golubovskaya VM, Wu L. FLAG-tagged CD19-specific CAR-T cells eliminate CD19-bearing solid tumor cells in vitro and in vivo. Front Biosci (Landmark Ed). 2017 Jun 1;22: 1644-1654
--->
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Caribou Biosciences, Inc.
<120> ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-T-КЛЕТКИ
<130> CBI038.10
<150> PCT/US20/13662
<151> 2020-01-15
<150> US 62/793,274
<151> 2019-01-16
<160> 17
<170> PatentIn version 3.5
<210> 1
<211> 184
<212> Белок
<213> Homo sapiens
<400> 1
Met Leu Gln Met Ala Gly Gln Cys Ser Gln Asn Glu Tyr Phe Asp Ser
1 5 10 15
Leu Leu His Ala Cys Ile Pro Cys Gln Leu Arg Cys Ser Ser Asn Thr
20 25 30
Pro Pro Leu Thr Cys Gln Arg Tyr Cys Asn Ala Ser Val Thr Asn Ser
35 40 45
Val Lys Gly Thr Asn Ala Ile Leu Trp Thr Cys Leu Gly Leu Ser Leu
50 55 60
Ile Ile Ser Leu Ala Val Phe Val Leu Met Phe Leu Leu Arg Lys Ile
65 70 75 80
Asn Ser Glu Pro Leu Lys Asp Glu Phe Lys Asn Thr Gly Ser Gly Leu
85 90 95
Leu Gly Met Ala Asn Ile Asp Leu Glu Lys Ser Arg Thr Gly Asp Glu
100 105 110
Ile Ile Leu Pro Arg Gly Leu Glu Tyr Thr Val Glu Glu Cys Thr Cys
115 120 125
Glu Asp Cys Ile Lys Ser Lys Pro Lys Val Asp Ser Asp His Cys Phe
130 135 140
Pro Leu Pro Ala Met Glu Glu Gly Ala Thr Ile Leu Val Thr Thr Lys
145 150 155 160
Thr Asn Asp Tyr Cys Lys Ser Leu Pro Ala Ala Leu Ser Ala Thr Glu
165 170 175
Ile Glu Lys Ser Ile Ser Ala Arg
180
<210> 2
<211> 720
<212> ДНК
<213> Homo sapiens
<400> 2
caggtgcagc tggtgcagag cggcgcggaa gtgaaaaaac cgggcagcag cgtgaaagtg 60
agctgcaaag cgagcggcta tacctttacc agctatgtga tgcattgggt gcgccaggcg 120
ccgggccagg gcctggaatg gatgggctat attattccgt ataacgatgc gaccaaatat 180
aacgaaaaat ttaaaggccg cgtgaccatt accgcggata aaagcaccag caccgcgtat 240
atggaactga gcagcctgcg cagcgaagat accgcggtgt attattgcgc gcgctataac 300
tatgatggct attttgatgt gtggggccag ggcaccctgg tgaccgtgag cagcggcggc 360
ggcggcagcg gcggcggcgg cagcggcggc ggcggcagcg aaattgtgct gacccagagc 420
ccggcgaccc tgagcctgag cccgggcgaa cgcgcgaccc tgagctgccg cgcgagccag 480
agcattagcg attatctgca ttggtatcag cagaaaccgg gccaggcgcc gcgcctgctg 540
atttattatg cgagccagag cattaccggc attccggcgc gctttagcgg cagcggcagc 600
ggcaccgatt ttaccctgac cattagcagc ctggaaccgg aagattttgc ggtgtattat 660
tgccagaacg gccatagctt tccgccgacc tttggcggcg gcaccaaagt ggaaattaaa 720
<210> 3
<211> 118
<212> Белок
<213> Homo sapiens
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Ile Pro Tyr Asn Asp Ala Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asn Tyr Asp Gly Tyr Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 4
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 4
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 5
<211> 107
<212> Белок
<213> Homo sapiens
<400> 5
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Asp Tyr
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Gln Ser Ile Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Asn Gly His Ser Phe Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 6
<211> 240
<212> Белок
<213> Homo sapiens
<400> 6
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Ile Pro Tyr Asn Asp Ala Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asn Tyr Asp Gly Tyr Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu
130 135 140
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln
145 150 155 160
Ser Ile Ser Asp Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala
165 170 175
Pro Arg Leu Leu Ile Tyr Tyr Ala Ser Gln Ser Ile Thr Gly Ile Pro
180 185 190
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
195 200 205
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Asn Gly
210 215 220
His Ser Phe Pro Pro Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
225 230 235 240
<210> 7
<211> 63
<212> ДНК
<213> Homo sapiens
<400> 7
atggccttac cagtgaccgc cttgctcctg ccgctggcct tgctgctcca cgccgccagg 60
ccg 63
<210> 8
<211> 21
<212> Белок
<213> Homo sapiens
<400> 8
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 9
<211> 141
<212> ДНК
<213> Homo sapiens
<400> 9
aagcccacca cgacgccagc gccgcgacca ccaacaccgg cgcccaccat cgcgtcgcag 60
cccctgtccc tgcgcccaga ggcgagccgg ccagcggcgg ggggcgcagt gcacacgagg 120
gggctggact tcgccagtga t 141
<210> 10
<211> 47
<212> Белок
<213> Homo sapiens
<400> 10
Lys Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
1 5 10 15
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Ser Arg Pro Ala
20 25 30
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Ser Asp
35 40 45
<210> 11
<211> 81
<212> ДНК
<213> Homo sapiens
<400> 11
ttttgggtgc tggtggtggt tggtggagtc ctggcttgct atagcttgct agtaacagtg 60
gcctttatta ttttctgggt g 81
<210> 12
<211> 27
<212> Белок
<213> Homo sapiens
<400> 12
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 13
<211> 123
<212> ДНК
<213> Homo sapiens
<400> 13
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 14
<211> 41
<212> Белок
<213> Homo sapiens
<400> 14
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 15
<211> 345
<212> ДНК
<213> Homo sapiens
<400> 15
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgcag agaaggaaga accctcagga aggcctgtac 180
aatgaactgc agaaagataa gatggcggag gcctacagtg agattgggat gaaaggcgag 240
cgccggaggg gcaaggggca cgatggcctt taccagggtc tcagtacagc caccaaggac 300
acctacgacg cccttcacat gcaggccctg ccccctcgct aatag 345
<210> 16
<211> 113
<212> Белок
<213> Homo sapiens
<400> 16
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
50 55 60
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
65 70 75 80
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
85 90 95
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
100 105 110
Arg
<210> 17
<211> 495
<212> Белок
<213> Homo sapiens
<400> 17
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ala Ser Gln Val Gln Leu Val Gln Ser Gly Ala
20 25 30
Glu Val Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser
35 40 45
Gly Tyr Thr Phe Thr Ser Tyr Val Met His Trp Val Arg Gln Ala Pro
50 55 60
Gly Gln Gly Leu Glu Trp Met Gly Tyr Ile Ile Pro Tyr Asn Asp Ala
65 70 75 80
Thr Lys Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp
85 90 95
Lys Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu
100 105 110
Asp Thr Ala Val Tyr Tyr Cys Ala Arg Tyr Asn Tyr Asp Gly Tyr Phe
115 120 125
Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Ile Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Asp Tyr Leu His Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Tyr Ala Ser
195 200 205
Gln Ser Ile Thr Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Asn Gly His Ser Phe Pro Pro Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Leu Glu Lys Pro Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Ser Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Ser Asp Lys Pro Phe Trp Val Leu Val Val
305 310 315 320
Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe
325 330 335
Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp
340 345 350
Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr
355 360 365
Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Arg Val
370 375 380
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
385 390 395 400
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
405 410 415
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Gln
420 425 430
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
435 440 445
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
450 455 460
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
465 470 475 480
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К BCMA И BCMA-CAR-NK-КЛЕТКИ | 2020 |
|
RU2795443C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ К BCMA | 2015 |
|
RU2747457C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ BCMA И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2785658C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ BCMA, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2812322C2 |
| АНТИТЕЛО, НАЦЕЛЕННОЕ НА ВСМА, И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2799655C2 |
| АНТИ-BCMA АНТИТЕЛА, СОДЕРЖАЩИЕ ТОЛЬКО ТЯЖЁЛУЮ ЦЕПЬ | 2017 |
|
RU2781301C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| Антитело к BCMA, его антигенсвязывающий фрагмент и их медицинское применение | 2020 |
|
RU2819660C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ CD3E/BCMA И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800164C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2829097C2 |
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая одноцепочечный вариабельный фрагмент (scFv), специфически связывающийся с человеческим антигеном созревания В-клеток (человеческий ВСМА), химерный рецептор антигена (CAR) к человеческому ВСМА, молекулу нуклеиновой кислоты, кодирующую вышеуказанный химерный рецептор антигена, экспрессионный вектор, CAR-T-клетка для уничтожения BCMA-положительных раковых клеток, способ уничтожения BCMA-положительных раковых клеток, способ получения CAR-T-клетки к человеческому ВСМА. В одном из вариантов реализации одноцепочечный вариабельный фрагмент содержит вариабельную область (VH) тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 3; и вариабельную область (VL) легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 5. 7 н. и 7 з.п. ф-лы, 11 ил., 11 пр.
1. Одноцепочечный вариабельный фрагмент (scFv), специфически связывающийся с человеческим антигеном созревания В-клеток (человеческий ВСМА), содержащий:
вариабельную область (VH) тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 3; и
вариабельную область (VL) легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 5,
где указанный одноцепочечный вариабельный фрагмент к человеческому ВСМА содержит линкер между VH и VL, где линкер имеет аминокислотную последовательность SEQ ID NO: 4.
2. Химерный рецептор антигена (CAR) к человеческому ВСМА, содержащий:
одноцепочечный вариабельный фрагмент (scFv) к человеческому ВСМА, содержащий вариабельную область (VH) тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 3; и вариабельную область (VL) легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 5,
трансмембранный домен,
костимулирующий домен, и
домен активации.
3. Химерный рецептор антигена (CAR) по п.2, где трансмембранный домен представляет собой трансмембранный домен, выбранный из группы, состоящей из α-цепи рецептора Т-клеток, β-цепи рецептора Т-клеток, дзета-цепи CD3, CD28, CD3ε, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, ICOS, CD154 и GITR, где предпочтительно трансмембранный домен включает трансмембранный домен CD8.
4. Химерный рецептор антигена (CAR) по п.2, где костимулирующий домен представляет собой костимулирующий домен, выбранный из группы, состоящей из CD28, 4-1BB, GITR, ICOS-1, CD27, OX-40 и DAP10, где предпочтительно костимулирующий домен включает костимулирующий домен 4-1BB.
5. Химерный рецептор антигена (CAR) по п.2, где домен активации включает домен активации CD3-дзета.
6. Химерный рецептор антигена (CAR) по п.2, имеющий аминокислотную последовательность SEQ ID NO: 17.
7. Молекула нуклеиновой кислоты, кодирующая химерный рецептор антигена (CAR) по п.2, где указанная молекула имеет 5’-конец, 3’-конец, и нуклеотидную последовательность, кодирующую химерный рецептор антигена (CAR) по п.2.
8. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п.7, где предпочтительно вектор представляет собой вирусный вектор.
9. CAR-T-клетка для уничтожения BCMA-положительных раковых клеток, содержащая химерный рецептор антигена (CAR) по п.2, предпочтительно химерный рецептор антигена (CAR) по п.6.
10. Способ уничтожения BCMA-положительных раковых клеток, включающий:
приведение в контакт BCMA-положительных раковых клеток с гуманизированной CAR-T-клеткой, содержащей химерный рецептор антигена (CAR) к человеческому ВСМА, содержащий:
одноцепочечный вариабельный фрагмент (scFv) к человеческому ВСМА, содержащий вариабельную область (VH) тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 3; и вариабельную область (VL) легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 5,
трансмембранный домен,
костимулирующий домен, и
домен активации,
где предпочтительно приведение в контакт представляет собой доставку внутрь опухоли.
11. Способ по п. 10, где BCMA-положительные раковые клетки включают клетки множественной миеломы.
12. Способ получения CAR-T-клетки к человеческому ВСМА, включающий:
введение в T-клетку нуклеиновой кислоты, кодирующей химерный рецептор антигена (CAR) к человеческому ВСМА, содержащий:
одноцепочечный вариабельный фрагмент (scFv) к человеческому ВСМА, содержащий вариабельную область (VH) тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 3; и вариабельную область (VL) легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 5,
трансмембранный домен,
костимулирующий домен, и
домен активации.
13. Способ по п. 12, где нуклеиновую кислоту вводят в T-клетку с помощью вирусного вектора.
14. Способ по п. 13, где вирусный вектор выбирают из группы, состоящей из ретровирусного вектора, аденовирусного вектора, вектора аденоассоциированного вируса (AAV), вектора обезьяньего вируса, вектора вируса осповакцины или вектора вируса Сендаи, вектора вируса Эпштейна-Барра (EBV) и вектора вируса простого герпеса (HSV).
| WO 2013154760 A1, 17.10.2013 | |||
| WO 2019195017 A1, 10.10.2019 | |||
| RU 2016146486 A, 01.06.2018. |
Авторы
Даты
2021-12-24—Публикация
2020-01-15—Подача