Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам, которые обладают повышенной замещающей функцию кофактора FVIII активностью, фармацевтическим композициям, который содержат указанные антитела в качестве действующих веществ, способам получения указанных антител и т.п. Более конкретно, настоящее изобретение относится к биспецифическим антителам, которые обладают замещающей функцию кофактора FVIII активностью, более высокой, чем активность АСЕ910 (эмицизумаб).
Предпосылки создания изобретения
Гемофилия А представляет собой геморрагическое заболевание, вызываемое врожденным снижением или недостаточностью функции фактора свертывания крови VIII (FVIII). При кровотечении пациентам с гемофилией А, как правило, вводят препараты FVIII (лечение по требованию). В последние годы препараты FVIII вводят также в профилактических целях для предупреждения случаев кровотечения (NPL 1 и 2) (профилактическое лечение). Время полужизни препаратов FVIII в крови составляет примерно 12-16 ч. Следовательно, для непрерывного предупреждения препараты FVIII вводят пациентам три раза в неделю (NPL 3 и 4). В случае лечения по требованию при необходимости также осуществляют дополнительное введение препаратов FVIII через регулярные интервалы времени для предупреждения повторного кровотечения. Кроме того, препараты FVIII вводят внутривенно. Следовательно, существует выраженная необходимость в фармацевтических средствах, менее обременительных при их введении, чем препараты FVIII.
Иногда у пациентов с гемофилией А вырабатываются антитела к FVIII (ингибиторы). Такие ингибиторы препятствуют действиям препаратов FVIII. В случае кровотечения у пациентов, у которых образовались ингибиторы (пациенты, имеющие ингибиторы), им вводят агенты «шунтирующего действия». Их механизмы действия не зависят от функции FVIII, т.е. от каталитической функции в отношении активации фактора свертывания крови X (FX) активированным фактором свертывания крови IX (FIXa). Поэтому в некоторых случаях агенты «шунтирующего действия» не позволяют в достаточной степени прекращать кровотечение. Следовательно, существует выраженная необходимость в фармацевтических средствах, на которые не влияет присутствие ингибиторов и которые могут замещать функцию FVIII. В качестве средств решения указанных проблем были описаны антитела, замещающие функцию FVIII, и их применение (PTL 1, 2, 3 и 4). Биспецифические антитела против FIXa и FX могут замещать функцию FVIII и обладать замещающей функцию кофактора FVIII активностью благодаря позиционированию двух факторов в непосредственной близости (NPL 5). Замещающая функцию кофактора FVIII активность биспецифических антител против FIXa и FX означает активность, рассчитанную при оценке реакции активации FX с помощью FIXa с использованием колориметрических методов определения и анализа образования тромбина, с использованием плазмы пациентов с гемофилией А. Известны данные о том, что замещающую функцию кофактора FVIII активность антител можно повышать путем оптимизации аффинности к FIXa и FX (NPL 6). Кроме того, известно, что на замещающую функцию кофактора FVIII активность антител влияет изотип IgG, модель дисульфидной связи, аминокислотная последовательность шарнирной области и присутствие или отсутствие сахарных цепей в Fc-области (NPL 7). Установлено, что АСЕ910 (эмицизумаб), который является одним из указанных антител и обладает высокой замещающей функцию кофактора FVIII активностью, проявляет гемостатические действия на созданных на обезьянах моделях гемофилии (NPL 8 и 9). Кроме того, в клинических испытаниях на здоровых индивидуумах подтверждены очень хорошие фармакокинетические (длительность полужизни) характеристики и переносимость АСЕ910 (эмицизумаба) (NPL 10), а в клинических испытаниях на пациентах с гемофилией А с наличием ингибиторов или без ингибиторов обнаружено, что введение АСЕ910 (эмицизумаба) значительно снижало количество эпизодов кровотечения по сравнению с ситуацией до введения АСЕ910 (эмицизумаба) (NPL 11).
Как описано выше, в клинических условиях обнаружено подавляющее воздействие АСЕ910 (эмицизумаба) на количество эпизодов кровотечения. Однако в связи с тем, что улучшающие воздействия АСЕ910 (эмицизумаба), оцененные по максимальному количеству образовавшегося тромбина (высота пика) в анализах образования тромбина in vitro с использованием плазмы с дефицитом FVIII, оказались ниже, чем при нормальном уровне активности FVIII, составляющем 100 ед./дл (NPL 8), требуется дополнительное повышение эффективности лекарственного средства. Кроме того, существует необходимость в биспецифических антителах, которое позволяют дополнительно снижать вводимую дозу в результате повышения специфической активности и т.п.
АСЕ910 (эмицизумаб) представляет собой биспецифическое антитело, обладающее высокой замещающей функцию кофактора FVIII активностью, которое получали следующим образом: антитело к FIX и/или антитело к FIXa и антитело к FX, полученные путем иммунизации животных, гуманизировали с получением hBS1 в качестве «лидерного» антитела; и интродуцировали ряд аминокислотных замен в «лидерное» антитело для его многосторонней оптимизации (NPL 6 и PTL 4). Для повышения эффективности лекарственного средства и повышения специфической активности существует необходимость в биспецифическом антителе, замещающем функцию FVIII, которое обладает более высокой максимальной активностью (максимальная замещающая функцию кофактора FVIII активность), чем АСЕ910 (эмицизумаб) и может также проявлять замещающую функцию кофактора FVIII активность в концентрациях, более низких, чем АСЕ910 (эмицизумаб). Кроме того, к настоящему времени отсутствуют данные о биспецифических антителах, которые обладают замещающей функцию кофактора FVIII активностью, более высокой, чем активность АСЕ910 (эмицизумаб), касательно концентрации и максимальной активности.
Перечень ссылок
Патентная литература
[PTL 1] WO 2005/035754.
[PTL 2] WO 2005/035756.
[PTL 3] WO 2006/109592.
[PTL 4] WO 2012/067176.
Непатентная литература
[NPL 1] Blood 58, 1981, сс. 1-13.
[NPL 2] Nature 312, 1984, сс. 330-337.
[NPL 3] Nature 312, 1984, сс. 337-342.
[NPL 4] Biochim. Biophys. Acta 871, 1986, cc. 268-278.
[NPL 5] Nat Med. 18(10), октябрь 2012 г., сс. 1570-1574.
[NPL 6] PLoS One. 8(2), 2013, e57479.
[NPL 7] MAbs. 7(1), 2015, cc. 120-128.
[NPL 8] J Thromb Haemost. 12(2), февраль 2014 г., cc. 206-213.
[NPL 9] Blood. 124(20), 13 ноября 2014 г., cc. 3165-3171.
[NPL 10] Blood. 127(13), 31 марта 2-16 г., cc. 1633-1641.
[NPL 11] New Eng J Med 374(21), 26 мая 2016 г., cc 2044-2053.
Краткое изложение сущности изобретения
Задачи, положенные в основу изобретения
В настоящем изобретении решены задачи, поставленные выше. Целью настоящего изобретения было разработать антитела, обладающие повышенной замещающей функцию кофактора FVIII активностью, фармацевтические композиции, содержащие указанные антитела в качестве действующих веществ, и способы их получения. Более конкретно, целью настоящего изобретения было введение мутаций в сайты вариабельных областей тяжелых цепей и легких цепей или получение новых CDR-последовательностей легких цепей, отличных от тех, которые присутствуют в АСЕ910 (эмицизумаб), для получения биспецифических антител, которые обладают замещающей функцию кофактора FVIII активностью, более высокой, чем у АСЕ910 (эмицизумаб), биспецифических антител, которые имеют указанные мутации или указанные CDR-последовательности и распознают FIX и/или FIXa и FX, разработка способов получения указанных антител, фармацевтических композиций, содержащих указанные антитела в качестве действующих веществ, и способов лечения гемофилии А с использованием указанных фармацевтических композиций.
Средства решения указанных задач
Для решения указанных выше задач при создании изобретения получали варианты АСЕ910 (эмицизумаба) путем интродукции аминокислотных замен в различные сайты его вариабельных областей легких цепей и при этом удалось обнаружить аминокислотные замены, которые повышали замещающую функцию кофактора FVIII активность. При создании изобретения также были достигнуты успехи в получении из библиотек человеческих антител новых легких цепей, имеющих последовательности, отличные от последовательностей АСЕ910, которые обладали замещающей функцию кофактора FVIII активностью, и в идентификации аминокислотных замен в легких цепях, которые повышали замещающую функцию кофактора FVIII активность. Кроме того, при создании вариантов биспецифических антител, полученных с использованием указанных легких цепей, путем интродукции аминокислотных замен в различные сайты в вариабельных областях тяжелых цепей, при создании изобретения были достигнуты успехи в обнаружении аминокислотных замен, которые повышали замещающую функцию кофактора FVIII активность. Настоящее изобретение базируется на указанных открытиях и конкретно в нем предложены:
[1] полипептид, содержащий вариабельный домен легкой цепи антитела, где полипептид содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2, и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в которой одна или несколько аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[2] биспецифическое антитело, которое распознает FIX и/или FIX и FX, где антитело содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2, и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в которой одна или несколько аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[3] биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, в котором первый полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 45, а второй полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 46, в котором либо третий, либо четвертый полипептид содержит аминокислотную последовательность вариабельного домена легкой цепи антитела SEQ ID NO: 47, а другой полипептид содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2, и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, и в котором в другом полипептиде одна или несколько аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[4] полипептид, содержащий вариабельный домен тяжелой цепи антитела, где полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, в которой одна или несколько аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, 134, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[5] биспецифическое антитело, которое распознает FIX и/или FIXa и FX, где антитело содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, в которой одна или несколько аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[6] полипептид, содержащий вариабельный домен тяжелой цепи антитела, где полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, в которой одна или несколько аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, N52, Т52а, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[7] биспецифическое антитело, которое распознает FIX и/или FIXa и FX, где антитело содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, в которой одна или несколько аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, N52, Т52а, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[8] биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, в котором второй полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, третий полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 42, и четвертый полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 44, и первый полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, и в котором в первом полипептиде одна или несколько аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[9] биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, в котором первый полипептид содержит аминокислотную последовательность тяжелой цепи антитела SEQ ID NO: 45, третий полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 43 и четвертый полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 44, и второй полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, и в котором во втором полипептиде одна или несколько аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, Т52а, N52, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
[10] легкая цепь антитела, которая содержит любую одну из аминокислотных последовательностей, выбранных из указанных в подпунктах (a1)-(a6), (б1)-(б23) и (в1)-(в3):
(a1) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 13 (QNK131);
(а2) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 14 (QNK284);
(а3) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 15 (QNK315);
(а4) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 16 (QNL182);
(а5) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 17 (QNL492);
(а6) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 18 (QNL576);
(б1) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 19 (JNK131);
(б2) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 20 (JNK163);
(б3) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 21 (JNK252);
(б4) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 22 (JNK263);
(б5) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 23 (JNK339);
(б6) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 24 (JNK348);
(б7) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 25 (JNK351);
(б8) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 26 (JNK360);
(б9) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 27 (JNK378);
(б10) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 28 (JNK382);
(б11) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 29 (JNL036);
(б12) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 30 (JNL072);
(б13) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 31 (JNL095);
(б14) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 32 (JNL176);
(б15) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 33 (JNL208);
(б16) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 34 (JNL224);
(б17) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 35 (JNL260);
(б18) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 36 (JNL056);
(б19) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 37 (JNL059);
(б20) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 38 (JNL226);
(б21) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 39 (JNL250);
(б22) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 40 (JNL263);
(б23) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 41 (JNL281);
(в1) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 42 (QAL187);
(в2) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 43 (QAL201); и
(в3) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 44 (JYL280);
[11] биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид (г) и третий полипептид (е) образуют пару, второй полипептид (д) и четвертый полипептид (ж) образуют пару и в котором каждый из полипептидов представляет собой следующий полипептид: (г) первый полипептид, указанный в подпункте (г1) или (г2):
(г1) полипептид, который содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45;
(г2) полипептид, который содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, в которой одна или несколько аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
(д) второй полипептид, указанный в подпункте (д1) или (д2):
(д1) полипептид, который содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46;
(д2) полипептид, который содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, в которой одна или несколько аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, Т52а, N52, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и E102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
(е) третий полипептид, указанный в подпункте (e1), (е2) или (е3):
(e1) полипептид, который содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47;
(е2) полипептид, который содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в которой одна или несколько аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
(е3) полипептид по любому одному из подпунктов (a1)-(a6) и (в1)-(в2), которые указаны в пункте [10]; и
(ж) четвертый полипептид, указанный в подпункте (ж1), (ж2) или (ж3):
(ж1) полипептид, который содержит вариабельный домен легкой цепи
антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47;
(ж2) полипептид, который содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в которой одна или несколько аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
(ж3) полипептид по любому одному из подпунктов (б1)-(б23) и (в3), которые указаны в пункте [10];
[12] способ получения варианта эмицизумаба, который включает следующую стадию (а), на которой:
(а) осуществляют одну или несколько из следующих замен (I)-(III), где нумерация соответствует системе нумерации по Кэботу:
(I) замена одной или нескольких аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, в вариабельном домене легкой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно;
(II) замена одной или нескольких аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, в вариабельном домене тяжелой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно; и
(III) замена одной или нескольких аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, Т52а, N52, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, в вариабельном домене тяжелой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно;
[13] способ выделения варианта эмицизумаба, который включает указанные ниже стадии (а)-(в), на которых:
(а) получают вариант эмицизумаба, осуществляя одну или несколько из следующих замен (I)-(III), где нумерация соответствует системе нумерации по Кэботу:
(I) замена одной или нескольких аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, в вариабельном домене легкой цепи антитела, содержащем аминокислотные последовательности CDR 1,2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно;
(II) замена одной или нескольких аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, в вариабельном домене тяжелой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно; и
(III) замена одной или нескольких аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, Т52а, N52, R53, S54, G55, G56, S57, 158, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, в вариабельном домене тяжелой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно;
(б) оценивают замещающую функцию кофактора FVIII активность варианта, полученного на стадии (а); и
(в) отбирают вариант эмицизумаба, который обладает повышенной замещающей функцию кофактора FVIII активностью по сравнению с эмицизумабом.
Кроме того, в изобретении предложены субстанции, указанные ниже в пунктах [14]-[26]:
[14] полипептид по одному из п.п. [1], [4] и [6], который представляет собой антитело;
[15] антитело по одному из п.п. [2], [3], [5], [7]-[9], [11] и [14], которое представляет собой гуманизированное антитело или человеческое антитело;
[16] антитело по одному из п.п. [2], [3], [5], [7] to [9], [11], [14] и [15], которое представляет собой антитело, выбранное из группы, которая состоит из Fv, Fab, Fab', Fab'-SH, F(ab')2, димерного антитела (диабоди), линейного антитела, одноцепочечной молекулы антитела и мультиспецифического антитела, образованного из фрагментов антител;
[17] нуклеиновая кислота, кодирующая антитело по одному из п.п. [2], [3], [5], [7]-[9], [11] и [14]-[16];
[18] вектор, в который встроена нуклеиновая кислота по п. [17];
[19] клетка, которая содержит нуклеиновую кислоту по п. [17] или вектор по п. [18];
[20] фармацевтическая композиция, которая содержит антитело по одному из п.п. [2], [3], [5], [7]-[9], [11] и [14]-[16] и фармацевтически приемлемый носитель;
[21] фармацевтическая композиция по п. [20], которую применяют для предупреждения и/или лечения кровотечения, болезни, сопровождающейся кровотечением, или болезни, вызываемой кровотечением, где болезнь представляет собой заболевание, которое развивается и/или прогрессирует вследствие снижения или дефицита активности фактора свертывания крови VIII и/или активированного фактора свертывания крови VIII;
[22] фармацевтическая композиция по п. [21], где болезнь, которая развивается и/или прогрессирует вследствие снижения или дефицита активности фактора свертывания крови VIII и/или активированного фактора свертывания крови VIII, представляет собой гемофилию А;
[23] фармацевтическая композиция по п. [22], где болезнь, которая развивается и/или прогрессирует вследствие снижения или дефицита активности фактора свертывания крови VIII и/или активированного фактора свертывания крови VIII, представляет собой болезнь, характеризующуюся появлением ингибитора фактора свертывания крови VIII и/или активированного фактора свертывания крови VIII;
[24] фармацевтическая композиция по п. [21], где болезнь, которая развивается и/или прогрессирует вследствие снижения или дефицита активности фактора свертывания крови VIII и/или активированного фактора свертывания крови VIII, представляет собой приобретенную гемофилию;
[25] фармацевтическая композиция по п. [21], где болезнь, которая развивается и/или прогрессирует вследствие снижения или дефицита активности фактора свертывания крови VIII и/или активированного фактора свертывания крови VIII, представляет собой болезнь фон Виллебранда; и
[26] поступающая в продажу упаковка терапевтического продукта, предназначенного для применения в способе предупреждения и/или лечения кровотечения, болезни, сопровождающейся кровотечением, или болезни, вызываемой кровотечением, которая содержит по меньшей мере антитело по одному из п.п. [2], [3], [5], [7]-[9], [11] и [14]-[16].
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - график, демонстрирующий замещающую функцию кофактора FVIII активность биспецифических антител, содержащих новые L-цепи;
на фиг. 2 - график, демонстрирующий замещающую функцию кофактора FVIII активность Q499/QAL201//J327/JYL280 и Q499/L404//J327/L404.
Варианты осуществления изобретения
В контексте настоящего описания понятие «антитело» используется в его наиболее широком смысле и относится к различным структурам антител, включая (но, не ограничиваясь только ими) моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они обладают требуемой антигенсвязывающей активностью.
Понятие «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающуюся с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают (но, не ограничиваясь только ими) Fv, Fab, Fab', Fab'-SH, F(ab')2; димерные антитела; линейные антитела; молекулы одноцепочечных антител (например, scFv) и мультиспецифические антитела, образованные из фрагментов антител.
Понятие «класс» антитела относится к типу константного домена или константной области, который/которая входит в его тяжелую цепь. Известно пять основных классов антител: IgA, IgD, IgE, IgG и IgM и некоторые из них можно подразделять дополнительно на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулина, обозначают как альфа, дельта, эпсилон, гамма и мю (α, δ, ε, γ и μ) соответственно.
Понятие «эффективное количество» агента, например, фармацевтической композиции, означает количество, эффективное в дозах и в течение периода времени, необходимых для достижения требуемого терапевтического или профилактического результата.
Понятие «Fc-область» в контексте настоящего описания относится к С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Понятие включает нативную последовательность Fc-областей и вариант Fc-областей. В одном из вариантов осуществления изобретения Fc-область тяжелой цепи человеческого IgG простирается с Cys226 или с Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) или глицин-лизин (остатки 446-447) Fc-области может присутствовать или отсутствовать. Если специально не указано иное, то нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, которую обозначают также как EU-индекс, описанной у Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
«Каркасный участок» или «FR», означает остатки вариабельного домена, отличные от остатков гипервариабельного участка (HVR). FR вариабельного домена, как правило, состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, имеют следующее расположение в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Понятия «полноразмерное антитело», «интактное антитело» и «цельное антитело» в контексте настоящего описания используют взаимозаменяемо для обозначения антитела, имеющего структуру, практически сходную с нативной структурой антитела, или имеющего тяжелые цепи, которые содержат представленную в настоящем описании Fc-область.
Понятия «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используют взаимозаменяемо, и они относятся к клеткам, в которые интродуцирована экзогенная нуклеиновая кислота, включая потомство указанных клеток. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», которые включают первично трансформированную клетку и полученное из нее потомство безотносительно к количеству пересевов. Потомство может не быть полностью идентичным по составу нуклеиновых кислот родительской клетке, но может содержать мутации. Под объем изобретения подпадает мутантное потомство, которое обладает такой же функцией или биологической активностью, которая обнаружена в результате скрининга или отобрана у исходной трансформированной клетки.
«Человеческое антитело» представляет собой антитело, имеющее аминокислотную последовательность, которая соответствует последовательности антитела, продуцируемого в организме человека или человеческими клетками, или происходящее из нечеловеческого источника, в котором использован спектр человеческих антител или другие кодирующие человеческое антитело последовательности. Из указанного определения человеческого антитела специально исключено гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
Понятие «гуманизированное» антитело относится к химерному антителу, которое содержит аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых вариантах осуществления изобретения гуманизированное антитело может содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все HVR (например, CDR) соответствуют участкам нечеловеческого антитела, а все или практически все FR соответствуют участкам человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. Понятие «гуманизированная форма» антитела, например, нечеловеческого антитела, относится к антителу, которое подвергали гуманизации.
Понятие «гипервариабельный участок» или «HVR» в контексте настоящего описания относится к каждому из участков вариабельного домена антитела, последовательности которых являются гипервариабельными («определяющие комплементарность участки» или «CDR») и/или формируют петли определенной структуры («гипервариабельные петли»), и/или содержат контактирующие с антигеном остатки («контакты с антигеном»). Как правило, антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). Согласно настоящему описанию примеры HVR включают
(а) гипервариабельные петли, включающие аминокислотные остатки 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia и Lesk, J. Mol. Biol. 196, 1987, cc. 901-917);
(б) CDR, включающие аминокислотные остатки 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (Н2) и 95-102 (Н3) (Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991, публикация NIH 91-3242);
(в) области контакта с антигеном, включающие аминокислотные остатки 27 с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum и др., J. Mol. Biol. 262, 1996, сс. 732-745); и
(г) комбинации остатков, указанных в подпунктах (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
Если специально не указано иное, то остатки в HVR и другие остатки в вариабельном домене (например, остатки в FR) нумеруют согласно Kabat и др., выше.
«Выделенное» антитело представляет собой антитело, которое отделено от компонента его естественного окружения. В некоторых вариантах осуществления изобретения антитело очищают до чистоты, превышающей 95% или 99% по данным, например, электрофоретических анализов (таких, например, как ДСН-ПААГ, изоэлектрическое фокусирование (ИЭФ), капиллярный электрофорез) или хроматографических анализов (таких, например, как ионообменная хроматография или ЖХВР с обращенной фазой). Обзор методов оценки чистоты антител см., например, у Flatman и др., J. Chrom. В 848, 2007, сс. 79-87.
«Выделенная» нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, которая отделена от компонента ее естественного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетке, которая в норме включает молекулу нуклеиновой кислоты, но в которой молекула нуклеиновой кислоты присутствует вне хромосомы или в которой ее локализация на хромосоме отличается от ее встречающейся в естественных условиях локализации на хромосоме.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов антител, например, содержащих мутации, встречающиеся в естественных условиях или возникающие в процессе производства препарата моноклонального антитела, указанные варианты, как правило, присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты антигена. Таким образом, прилагательное «моноклональный» определяет особенность антитела, характеризуя его как полученное из практически гомогенной популяции антител, а не сконструированное в соответствии с требованиями к получению антитела с помощью какого-либо конкретного метода. Например, моноклональные антитела, которые можно применять согласно настоящему изобретению, можно создавать с помощью различных технологий, включая (но, не ограничиваясь только ими) метод гибридом, методы рекомбинантной ДНК, методы фагового дисплея и методы, основанные на использовании трансгенных животных, которые содержат все или часть локусов человеческого иммуноглобулина, указанные методы и другие, приведенные в качестве примера методы получения моноклональных антител, представлены в настоящем описании.
Понятие «нативные антитела» относится к встречающимся в естественных условиях молекулам иммуноглобулинов с различными структурами. Например, нативные антитела в виде IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Да, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными мостиками. В направлении от N-конца к С-концу, каждая тяжелая цепь имеет вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следует три константных домена (CH1, СН2 и СН3). Аналогично этому, в направлении от N-конца к С-концу, каждая легкая цепь имеет вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкая цепь антитела в зависимости от аминокислотной последовательности ее константного домена может принадлежать к одному из двух типов, которые обозначают каппа (κ) и лямбда (λ).
Понятие «листовка-вкладыш в упаковку» относится к инструкциям, которые обычно входят в поступающие в продажу упаковки терапевтических продуктов, содержащим информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности, которые связаны с применением указанных терапевтических продуктов.
Понятие «фармацевтическая композиция» относится к препарату, который находится в такой форме, что он обеспечивает биологическую активность входящего в его состав действующего вещества, которое должно обладать эффективностью, и который не содержит дополнительных компонентов, обладающих неприемлемой токсичностью для индивидуума, которому следует вводить композицию.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для индивидуума. Фармацевтически приемлемые носители включают (но, не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант.
Понятия «FIX», «FIXa» и «FX» в контексте настоящего описания относятся в любому нативному FIX, FIXa и FX из любого позвоночного животного, включая млекопитающих, таких как приматы (например, человек) и грызуны (например, мыши и крысы), если не указано иное. Понятие относится к «полноразмерным» непроцессированным FIX, FIXa и FX, а также к любой форме FIX, FIXa и FX, которая образуется в результате процессинга в клетке. Под понятие подпадают также встречающиеся в естественных условиях варианты FIX, FIXa и FX, например, сплайсинговые варианты или аллельные варианты.
В контексте настоящего описания понятие «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики, либо в процессе развития клинической патологии. Требуемыми действиями лечения являются (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезненного состояния и ремиссия или улучшение прогноза. В некоторых вариантах осуществления изобретения антитела, предлагаемые в изобретении, применяют для задержки развития болезни или замедления прогрессирования болезни.
Понятие «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела, как правило, имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR) (см., например, Kindt и др., Kuby Immunology, 6-ое изд., изд-во W.H. Freeman and Co., 2007, с. 91). Одного VH- или VL-домена может быть достаточно для обеспечения специфичности связывания антигена. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделять, используя VH- или VL-домен из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов соответственно (см., например, Portolano и др., J. Immunol. 150, 1993, сс. 880-887; Clarkson и др., Nature 352, 1991, сс. 624-628).
Понятие «вектор» в контексте настоящего описания относится к молекуле нуклеиновой кислоты, которая обладает способностью к размножению другой нуклеиновой кислоты, с которой она связана. Понятие включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он интродуцирован. Некоторые векторы обладают способностью контролировать экспрессию нуклеиновых кислот, с которыми они функционально связаны. Указанные векторы в контексте настоящего описания обозначают как «экспрессионные векторы».
Эмицизумаб (АСЕ910) представляет собой биспецифическое антитело, которое замещает функцию FVIII и связывается как с FIX и/или FIXa, так и с FX, что будет описано ниже. В биспецифическом антителе (Q499-z121/J327-z119/L404-k) первый полипептид и третий полипептид образуют пару и второй полипептид, и четвертый полипептид образуют пару, и первый полипептид содержит Н-цепь, содержащую аминокислотные последовательности CDR 1, 2, и 3 Н-цепи SEQ ID NO: 1, 2 и 3 (CDR Н-цепи Q499) соответственно, второй полипептид содержит Н-цепь, содержащую аминокислотные последовательности CDR 1, 2, и 3 Н-цепи SEQ ID NO: 4, 5 и 6 (CDR Н-цепи J327) соответственно, а третий и четвертый полипептид содержат общую L-цепь, содержащую аминокислотные последовательности CDR 1, 2, 3 L-цепи SEQ ID NO: 7, 8 и 9 (CDR L-цепи L404) соответственно.
Более конкретно, описанное выше биспецифическое антитело представляет собой биспецифическое антитело (Q499-z121/J327-z119/L404-k), в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, и в котором первый полипептид содержит Н-цепь, содержащую аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 45, второй полипептид содержит Н-цепь, содержащую аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 46, а третий и четвертый полипептид содержат общую L-цепь, содержащую аминокислотную последовательность вариабельного домена легкой цепи антитела SEQ ID NO: 47.
Более конкретно, описанное выше биспецифическое антитело представляет собой биспецифическое антитело (Q499-z121/J327-z119/L404-k), в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, и в котором первый полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, второй полипептид содержит Н-цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, а третий и четвертый полипептид содержат общую L-цепь, содержащую аминокислотную последовательность SEQ ID NO: 12.
Указанное антитело можно получать, например, следуя методам, описанным в WO 2005/035756, WO 2006/109592, WO 2012/067176 и т.п. Ниже в контексте настоящего описания эмицизумаб является синонимом АСЕ910.
В одном из объектов изобретения «вариант эмицизумаба» согласно настоящему изобретению относится к полипептиду или антителу, в котором по меньшей мере одна или несколько аминокислотных последовательностей вариабельных областей тяжелых цепей или вариабельных областей легких цепей эмицизумаба отличается(ются) от аминокислотных последовательностей эмицизумаба, и понятие включает любые варианты, если они позволяют достигать цели настоящего изобретения. В одном из вариантов осуществления изобретения, даже, если все вариабельные области тяжелых цепей или легких цепей, которые являются частью варианта, отличаются от вариабельных областей эмицизумаба, указанный вариант может быть отнесен к вариантам, предлагаемым в настоящем изобретении.
Например, вариантами эмицизумаба являются указанные ниже полипептиды и антитела (но, не ограничиваясь только ими).
Одним из объектов настоящего изобретения является полипептид, содержащий вариабельный домен легкой цепи антитела, полипептид, содержащий вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в которой одна или несколько аминокислот, выбранных из группы, которая состоит из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, антитело, содержащее вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в которой одна или несколько аминокислот, выбранных из группы, которая состоит из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, и в котором первый полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 45, а второй полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 46, либо третий, либо четвертый полипептид содержит аминокислотную последовательность вариабельного домена легкой цепи антитела SEQ ID NO: 47, а другой полипептид содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2, и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, и в котором в другом полипептиде одна или несколько аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является полипептид, содержащий вариабельный домен тяжелой цепи антитела, полипептид, содержащий вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, в которой одна или несколько аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, антитело, содержащее вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, в которой одна или несколько аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является полипептид, содержащий вариабельный домен тяжелой цепи антитела, полипептид, содержащий вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, в которой одна или несколько аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, N52, Т52а, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, антитело, содержащее вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, в которой одна или несколько аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, N52, Т52а, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, в котором второй полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, третий полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 42, и четвертый полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 44, и первый полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, и в котором в первом полипептиде одна или несколько аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, в котором первый полипептид содержит аминокислотную последовательность тяжелой цепи антитела SEQ ID NO: 45, третий полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 43 и четвертый полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 44, и второй полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, и в котором во втором полипептиде одна или несколько аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, Т52а, N52, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина.
Другим объектом настоящего изобретения является легкая цепь антитела, которая представляет собой новую легкую цепь антитела, содержащую любую одну из аминокислотных замен, выбранных из указанных в подпунктах (a1)-(a6) и (б1)-(б23). Легкие цепи можно использовать в качестве легкой цепи, которой заменяют общую легкую цепь, входящую в эмицизумаб. Указанные ниже в подпунктах (a1)-(a6) легкие цепи являются примерами легких цепей, которые связываются с FIX и/или FIXa, а L-цепи, указанные в подпунктах (б1)-(б23), являются примерами легких цепей, которые связываются с FX:
(a1) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 13 (QNK131);
(а2) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 14 (QNK284);
(а3) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 15 (QNK315);
(а4) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 16 (QNL182);
(а5) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 17 (QNL492);
(а6) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 18 (QNL576);
(б1) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 19 (JNK131);
(б2) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 20 (JNK163);
(б3) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 21 (JNK252);
(б4) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 22 (JNK263);
(б5) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 23 (JNK339);
(б6) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 24 (JNK348);
(б7) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 25 (JNK351);
(б8) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 26 (JNK360);
(б9) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 27 (JNK378);
(б10) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 28 (JNK382);
(б11) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 29 (JNL036);
(б12) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 30 (JNL072);
(б13) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 31 (JNL095);
(б14) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 32 (JNL176);
(б15) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 33 (JNL208);
(б16) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 34 (JNL224);
(б17) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 35 (JNL260);
(б18) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 36 (JNL056);
(б19) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 37 (JNL059);
(б20) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 38 (JNL226);
(б21) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 39 (JNL250);
(б22) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 40 (JNL263);
(б23) легкая цепь антитела, содержащая аминокислотную последовательность SEQ ID NO: 41 (JNL281).
Конкретными вариантами осуществления настоящего изобретения являются варианты указанных выше L-цепей антитела, которые представлены в подпунктах (a1)-(a6) и (б1)-(б23).
Одним из вариантов осуществления изобретения являются следующие варианты L-цепи антитела:
(в1) легкая цепь антитела (QAL187), имеющая аминокислотную последовательность SEQ ID NO: 42, которая является вариантом легкой цепи антитела, имеющей SEQ ID NO: 13;
(в2) L-цепь антитела (QAL201), имеющая аминокислотную последовательность SEQ ID NO: 43, которая является вариантом легкой цепи антитела, имеющей SEQ ID NO: 13; и
(в3) L-цепь антитела (JYL280), имеющая аминокислотную последовательность SEQ ID NO: 44, которая является вариантом легкой цепи антитела, имеющей SEQ ID NO: 31.
Другим объектом настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид (г) и третий полипептид (е) образуют пару, второй полипептид (д) и четвертый полипептид (ж) образуют пару и в котором соответствующие полипептиды представляют собой следующие полипептиды:
(г) первый полипептид, указанный в подпункте (г1) или (г2):
(г1) полипептид, который содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45;
(г2) полипептид, который содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, в которой одна или несколько аминокислот, выбранных из группы, состоящей из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
(д) второй полипептид, указанный в подпункте (д1) или (д2):
(д1) полипептид, который содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46; или
(д2) полипептид, который содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, в которой одна или несколько аминокислот, выбранных из группы, состоящей из D31, N32, N33, М34, D35, D50, I51, Т52а, N52, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и E102, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина;
(е) третий полипептид, указанный в подпункте (e1), (е2) или (е3): (e1) полипептид, который содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47;
(е2) полипептид, который содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в которой одна или несколько аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина; или
(е3) полипептид по одному из подпунктов (a1)-(a6) и (в1)-(в2), которые указаны в настоящем описании; и
(ж) четвертый полипептид, указанный в подпункте (ж1), (ж2) или (ж3):
(ж1) полипептид, который содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47;
(ж2) полипептид, который содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в которой одна или несколько аминокислот, выбранных из группы, состоящей из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, которые пронумерованы согласно системе нумерации по Кэботу, заменены на произвольные аминокислоты, отличные от цистеина; или
(ж3) полипептид по одному из подпунктов (б1)-(б23) и (в3), указанный в настоящем описании.
Одним из объектов настоящего изобретения является полипептид или антитело, в котором по меньшей мере один или несколько аминокислотных остатков в указанных ниже положениях в вариабельном домене легкой цепи антитела, который имеет аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или по меньшей один или несколько аминокислотных остатков в указанных ниже положениях в вариабельном домене легкой цепи антитела, имеющем SEQ ID NO: 47, представляют собой любой из указанных ниже аминокислотных остатков.
В вышеуказанном полипептиде или антителе количество аминокислотных остатков, отличных от остатков в вариабельном домене легкой цепи антитела, который имеет аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или количество аминокислотных остатков, отличных от остатков в вариабельном домене легкой цепи антитела, имеющем SEQ ID NO: 47, составляет один или более, предпочтительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20, и более предпочтительно 21 или более. Положение, в котором осуществлена замена, обозначено как положение, пронумерованное согласно системе нумерации по Кэботу.
K24: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, R, F, W, Y
А25: I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
S26: A, I, L, М, Р, V, G, N, Q, Т, D, Е, Н, K, R, F, W, Y
R27: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, F, W, Y
N28: A, I, L, М, Р, V, G, Q, S, Т, D, Е, Н, K, R, F, W, Y
I29: A, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
Е30: A, I, L, М, Р, V, G, N, Q, S, Т, D, Н, K, R, F, W, Y
R31: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, К, F, W, Y
Q32: A, I, L, М, Р, V, G, N, S, Т, D, Е, Н, K, R, F, W, Y
L33: A, I, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
А34: I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
Q50. A, I, L, М, Р, V, G, N, S, Т, D, Е, Н, K, R, F, W, Y
А51: I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
S52: A, I, L, М, Р, V, G, N, Q, Т, D, Е, Н, K, R, F, W, Y
R53: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, F, W, Y
K54: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, R, F, W, Y
Е55: A, I, L, М, Р, V, G, N, Q, S, Т, D, Н, K, R, F, W, Y
S56: A, I, L, М, Р, V, G, N, Q, Т, D, Е, Н, K, R, F, W, Y
Q89: A, I, L, М, Р, V, G, N, S, Т, D, Е, Н, K, R, F, W, Y
Q90: A, I, L, М, Р, V, G, N, S, Т, D, Е, Н, K, R, F, W, Y
Y91: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W
S92: A, I, L, М, Р, V, G, N, Q, Т, D, Е, Н, K, R, F, W, Y
D93: A, I, L, М, Р, V, G, N, Q, S, Т, Е, Н, K, R, F, W, Y
Р94: A, I, L, М, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
Р95: A, I, L, М, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
L96: A, I, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
Т97: A, I, L, М, Р, V, G, N, Q, S, D, Е, Н, K, R, F, W, Y
Одним из объектов настоящего изобретения является полипептид или антитело, в котором по меньшей мере один или несколько аминокислотных остатков в указанных ниже положениях в вариабельном домене тяжелой цепи антитела, который имеет аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или по меньшей один или несколько аминокислотных остатков в указанных ниже положениях в вариабельном домене тяжелой цепи антитела, имеющем SEQ ID NO: 45, представляют собой любой из указанных ниже аминокислотных остатков.
В вышеуказанном полипептиде или антителе количество аминокислотных остатков, отличных от остатков в вариабельном домене тяжелой цепи антитела, который имеет аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или количество аминокислотных остатков, отличных от остатков в вариабельном домене тяжелой цепи антитела, имеющем SEQ ID NO: 45, составляет один или более, предпочтительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20, и более предпочтительно 21 или более. Положение, в котором осуществлена замена, обозначено как положение, пронумерованное согласно системе нумерации по Кэботу.
Y31: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W
Y32: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W
D33: A, I, L, М, Р, V, G, N, Q, S, Т, Е, Н, K, R, F, W, Y
I34: A, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
Q35: A, I, L, М, Р, V, G, N, S, Т, D, Е, Н, K, R, F, W, Y
S50: A, I, L, М, Р, V, G, N, Q, Т, D, Е, Н, K, R, F, W, Y
I51: A, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
S52: A, I, L, М, Р, V, G, N, Q, Т, D, Е, Н, K, R, F, W, Y
Р52а: A, I, L, М, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
S53: A, I, L, М, Р, V, G, N, Q, Т, D, Е, Н, K, R, F, W, Y
G54: A, I, L, М, Р, V, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
Q55: A, I, L, М, Р, V, G, N, S, Т, D, Е, Н, K, R, F, W, Y
S56: A, I, L, М, Р, V, G, N, Q, Т, D, Е, Н, K, R, F, W, Y
Т57: A, I, L, М, Р, V, G, N, Q, S, D, Е, Н, K, R, F, W, Y
Y58: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W
Y59: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, R, F, W
R60: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, F, W, Y
R61: A, I, L, М, Р, V, G, N, Q, S, Т, D, Е, Н, K, F, W, Y
Е62: A, I, L, М, Р, V, G, N, Q, S, Т, D, Н, K, R, F, W, Y
V63: A, I, L, М, Р, G, N, Q, S, Т, D, Е, Н, K, R, F, W, Y
K64: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, R, F, W, Y
G65: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W, Y
R95: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, F, W, Y
T96: A, I, L, M, P, V, G, N, Q, S, D, E, H, K, R, F, W, Y
G97: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W, Y
R98: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, F, W, Y
E99: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W, Y
Y100: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W
G100a: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W, Y
G100b: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W, Y
G100c: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W, Y
W100d: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, Y
Y100e: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W
F100f: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, W, Y
D101: A, I, L, M, P, V, G, N, Q, S, T, E, H, K, R, F, W, Y
Y102: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W
Одним из объектов настоящего изобретения является полипептид или антитело, в котором по меньшей мере один или несколько аминокислотных остатков в указанных ниже положениях в вариабельном домене тяжелой цепи антитела, который имеет аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или по меньшей один или несколько аминокислотных остатков в указанных ниже положениях в вариабельном домене тяжелой цепи антитела, имеющем SEQ ID NO: 46, представляют собой любой из указанных ниже аминокислотных остатков.
В вышеуказанном полипептиде или антителе количество аминокислотных остатков, отличных от остатков в вариабельном домене тяжелой цепи антитела, который имеет аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или количество аминокислотных остатков, отличных от остатков в вариабельном домене тяжелой цепи антитела, имеющем SEQ ID NO: 46, составляет один или более, предпочтительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20, и более предпочтительно 21 или более. Положение, в котором осуществлена замена, обозначено как положение, пронумерованное согласно системе нумерации по Кэботу.
D31: A, I, L, M, P, V, G, N, Q, S, T, E, H, K, R, F, W, Y
N32: A, I, L, M, P, V, G, Q, S, T, D, E, H, K, R, F, W, Y
N33: A, I, L, M, P, V, G, Q, S, T, D, E, H, K, R, F, W, Y
M34. A, I, L, P, V, G, N, Q, S, T, D, E, H, K, R, F, W, Y
D35: A, I, L, M, P, V, G, N, Q, S, T, E, H, K, R, F, W, Y
D50: A, I, L, M, P, V, G, N, Q, S, T, E, H, K, R, F, W, Y
I51: A, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W, Y
N52: A, I, L, M, P, V, G, Q, S, T, D, E, H, K, R, F, W, Y
T52a: A, I, L, M, P, V, G, N, Q, S, D, E, H, K, R, F, W, Y
R53: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, F, W, Y
S54: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W, Y
G55: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W, Y
G56: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W, Y
S57: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W, Y
I58: A, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W, Y
Y59: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W
N60: A, I, L, M, P, V, G, Q, S, T, D, E, H, K, R, F, W, Y
E61: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W, Y
E62: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W, Y
F63. A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, W, Y
Q64: A, I, L, M, P, V, G, N, S, T, D, E, H, K, R, F, W, Y
D65: A, I, L, M, P, V, G, N, Q, S, T, E, H, K, R, F, W, Y
R95: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, F, W, Y
K96: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, R, F, W, Y
S97: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W, Y
Y98: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W
G99: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W, Y
Y100: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W
Y100a: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W
L100b: A, I, M, P, V, G, N, Q, S, T, D, E, H, K, R, F, W, Y
D101: A, I, L, M, P, V, G, N, Q, S, T, E, H, K, R, F, W, Y
E102: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W, Y.
Одним из вариантов осуществления настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, и в котором первый полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 45, второй полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 46, четвертый полипептид содержит аминокислотную последовательность вариабельного домена легкой цепи антитела SEQ ID NO: 47, и третий полипептид содержит легкую цепь антитела, содержащую любую одну из аминокислотных последовательностей, указанных выше в подпунктах (a1)-(a6).
Другим вариантом осуществления настоящего изобретения является биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, и в котором первый полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 45, третий полипептид содержит аминокислотную последовательность вариабельного домена легкой цепи антитела SEQ ID NO: 47, второй полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 46, и четвертый полипептид содержит легкую цепь антитела, содержащую любую одну из аминокислотных последовательностей, указанных выше в подпунктах (б1)-(б23).
Конкретным вариантом осуществления настоящего изобретения являются варианты полипептидов и антител, указанных в настоящем описании.
В конкретных вариантах осуществления изобретения варианты, указанные в настоящем описании, включают варианты, подвергнутые делециям аминокислотных остатков в аминокислотной последовательности и/или инсерциям аминокислотных остатков в аминокислотную последовательность, и/или заменам аминокислотных остатков в аминокислотной последовательности. Для того чтобы конечная конструкция обладала повышенной замещающей функцию кофактора FVIII активностью, при создании конечной конструкции можно использовать произвольные комбинации делеций, инсерций и замен.
А. Примеры анти-FIX(a)/FX биспецифических антител
Примеры биспецифических антител, которые распознают FIX и/или FIXa и FX (ниже в контексте настоящего описания обозначены как «анти-FIX(a)/FX биспецифические антитела»), предложенных в настоящем описании, указаны ниже; указанное применимо аналогичным образом к другим антителам и полипептидам, указанным в настоящем описании. В настоящем описании FIX(a) означает FIX и/или FIXa.
1. Фрагменты антител
В некоторых вариантах осуществления изобретения антитело, указанное в настоящем описании, представляет собой фрагмент антитела. Фрагменты антител включают (но, не ограничиваясь только ими) такие фрагменты как Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv и другие описанные ниже фрагменты. Обзор некоторых фрагментов антител см., у Hudson и др., Nat. Med. 9, 2003, сс. 129-134. Обзор scFv-фрагментов см., например, у Plueckthun в: The Pharmacology of Monoclonal Antibodies, под ред. Rosenburg и Moore, изд-во Springer, New York, т. 113, 1994, cc. 269-315; см. также WO 93/16185; и US №№5571894 и 5587458. Обсуждение, касающееся Fab- и Р(ab’)2-фрагментов, которые содержат остатки эпитопа, связывающегося с рецептором спасения, и обладают удлиненным временем полужизни in vivo, см. в US №5869046.
Димерные антитела представляют собой фрагменты антител с двумя антигенсвязывающими центрами, которые могут быть двухвалентными или биспецифическими (см., например, ЕР 0404097; WO 1993/01161; Hudson и др., Nat. Med. 9, 2003, сс. 129-134; и Holliger и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc. 6444-6448). Тримерные и тетрамерные антитела описаны также у Hudson и др., Nat. Med. 9, 2003, сс. 129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (фирма Domantis, Inc., Уолтхэм, шт. Массачусетс; см., например, US №6248516).
Фрагменты антител можно создавать различными методиками, включая (но, не ограничиваясь только ими) протеолитическое расщепление интактного антитела, а также получать с помощью рекомбинантных клеток-хозяев (например, Е. coli или фаг), указанных в настоящем описании. 2. Человеческие антитела
В некоторых вариантах осуществления изобретения антитело, указанное в настоящем описании, представляет собой человеческое антитело. Человеческие антитела можно получать, используя различные методики, известные в данной области. Человеческие антитела описаны в целом у van Dijk и van de Winkel, Curr. Opin. Pharmacol. 5, 2001, cc. 368-374 и Lonberg, Curr. Opin. Immunol. 20, 2008, cc. 450-459.
Человеческие антитела можно получать путем введения иммуногена трансгенному животному, модифицированному таким образом, чтобы оно продуцировало интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном. Указанные животные, как правило, содержат все или часть локусов человеческого иммуноглобулина вместо эндогенных иммуноглобулиновых локусов, которые либо присутствуют вне хромосом, либо интегрированы произвольно в хромосомы животного. У таких трансгенных мышей эндогенные иммуноглобулиновые локусы, как правило, инактивированы. Обзор методов получения человеческих антител в трансгенных животных см. у Lonberg, Nat. Biotech. 23, 2005, сс. 1117-1125 (см., например, также в US №6075181 и US №6150584 описание технологии XENOMOUSE™; в US №5770429 описание технологии HuMab®; в US №7041870 описание технологии К-М MOUSE® и в публикации заявки на патент США 2007/0061900 описание технологии VelociMouse®). Человеческие вариабельные области из интактных антител, полученных с помощью указанных животных, можно дополнительно модифицировать, например, путем объединения с другой человеческой константной областью.
Человеческие антитела можно создавать с помощью методов на основе гибридом. Описаны клеточные линии человеческой миеломы и мышиной-человеческой гетеромиеломы, предназначенные для получения человеческих моноклональных антител (см., например, Kozbor, J. Immunol. 133, 1984, сс. 3001-3005; Brodeur и др., Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc. 51-63 и Boerner и др., J. Immunol. 147, 1991, сс. 86-95). Человеческие антитела, созданные с использованием технологии на основе человеческих В-клеточных гибридом, описаны также у Li и др., Proc. Natl. Acad. Sci. USA 103, 2006, cc. 3557-3562. Дополнительные методы включают методы, описанные, например, в US №7189826 (описание получения моноклональных человеческих антител типа IgM из клеточных линий гибридом), и у Ni, Xiandai Mianyixue 26, 2006, сс. 265-268 (описание человеческих-человеческих гибридом). Технология человеческих гибридом (технология Trioma) описана также у Vollmers и Brandlein, Histology and Histopathology 20, 2005, cc. 927-937 и Vollmers и Brandlein, Methods and Findings in Experimental and Clinical Pharmacology 27, 2005, cc. 185-191.
Человеческие антитела можно создавать также путем выделения последовательностей вариабельных доменов Fv-клонов, выбранных из фаговых дисплейных библиотек, для создания которых использовали человеческие антитела. Указанные последовательности вариабельных доменов затем можно объединять с требуемым человеческим константным доменом. Методики отбора человеческих антител из библиотек антител описаны ниже.
3. Антитела, полученные из библиотек
Антитела, предлагаемые в изобретении, можно выделять путем скрининга комбинаторных библиотек антител с требуемой активностью или видами активности. Например, в данной области известны разнообразные методы для создания фаговых дисплейных библиотек и скрининга указанных библиотек в отношении антител, обладающих требуемыми характеристиками связывания. Указанные методы обобщены, например, у Hoogenboom и др., Methods in Molecular Biology 178, 2001, cc. 1-37, и описаны также, например, у McCafferty и др., Nature 348, 1990, сс. 552-554; Clackson и др., Nature 352, 1991, сс. 624-628; Marks и др., J. Mol. Biol. 222, 1992, сс. 581-597; Marks и Bradbury, Methods in Molecular Biology 248, 2003, cc. 161-175; Sidhu и др., J. Mol. Biol. 338, 2004, cc. 299-310; Lee и др., J. Mol. Biol. 340, 2004, cc. 1073-1093; Fellouse, Proc. Natl. Acad. Sci. USA 101, 2004, cc. 12467-12472 и Lee и др., J. Immunol. Methods 284, 2004, cc. 119-132.
При осуществлении некоторых методов фагового дисплея популяции VH- и VL-генов клонируют по отдельности с помощью полимеразной цепной реакции (ПЦР) и рекомбинируют произвольно в фаговых библиотеках, которые затем подвергают скринингу в отношении антигенсвязывающего фага согласно методу, описанному у Winter и др., Ann. Rev. Immunol. 12, 1994, сс. 433-455. Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv-фрагментов (scFv), либо в виде Fab-фрагментов. Библиотеки, полученные из иммунизированных источников, включают антитела, обладающие высокой аффинностью к иммуногену, при этом отсутствует необходимость в создании гибридом. Альтернативно этому, можно клонировать необработанную («наивную») популяцию (например, из организма человека), получая один источник антител к широкому спектру чужих, а также своих антигенов без какой-либо иммунизации, что описано у Griffiths и др., EMBO J, 12, 1993, сс. 725-734. И, наконец, «наивные» библиотеки можно получать также методами синтеза путем клонирования неперегруппированных сегментов V-гена из стволовых клеток и с помощью ПЦР-праймеров, содержащих случайную последовательность, для кодирования гипервариабельных CDR3-участков и для осуществления перегруппировки in vitro согласно методу, описанному у Hoogenboom и Winter, J. Mol. Biol. 227, 1992, cc. 381-388. Фаговые библиотеки человеческих антител описаны, например, в следующих патентных публикациях: US №5750373 и публикациях заявок на патент США 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, рассматриваются как человеческие антитела или фрагменты человеческих антител.
Методики создания мультиспецифических антител включают (но, не ограничиваясь только ими) рекомбинантную совместную экспрессию двух пар тяжелых цепей-легких цепей иммуноглобулинов, обладающих различными специфичностями (см. Milstein и Cuello, Nature 305, 1983, с. 537, WO 93/08829 и Traunecker и др., EMBO J. 10,1991, с. 3655), и технологию «knob-in-hole» (обеспечение взаимодействия по типу «выступ-во впадину», см., например, US №5731168). Мультиспецифические антитела можно получать также путем создания регулируемых электростатических воздействий для получения молекул антитела с гетеродимерными Fc (WO 2009/089004); перекрестного связывания двух или большего количества антител или фрагментов (см., например, US №4676980 и Brennan и др., Science 229, 1985, с. 81); применения лейциновых молний для получения биспецифических антител (см., например, Kostelny и др., J. Immunol. 148, 1992, сс. 1547-1553); применения технологии «димерных антител (диабоди)» для создания фрагментов биспецифических антител (см., например, Holliger и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc. 6444-6448); и применения димеров одноцепочечных Fv (sFv) (см., например, Gruber и др., J. Immunol. 152, 1994, сс. 5368-5374); и получения триспецифических антител согласно методу, описанному, например, у Tutt и др., J. Immunol. 147, 1991, с. 60).
а) Полученные путем замены, инсерции и делеции варианты Некоторыми вариантами осуществления изобретения являются варианты антител, которые имеют одну или несколько аминокислотных замен. Сайты, представляющие интерес для замещающего мутагенеза, включают HVR и FR. Консервативные замены представлены ниже в таблице 1 под заголовком «предпочтительные замены», и они описаны ниже со ссылкой на классы боковых цепей аминокислот. Более важные замены представлены ниже в таблице 1 под заголовком «приведенные в качестве примера замены», и они описаны ниже со ссылкой на классы боковых цепей аминокислот. Аминокислотные замены можно интродуцировать в представляющее интерес антитело и продукты подвергать скринингу в отношении требуемой активности, например, сохранения/повышения способности к связыванию антигена, пониженной иммуногенности, повышенной замещающей функцию кофактора FVIII активности, ADCC или CDC.

Аминокислоты можно группировать на основе общих свойств боковых цепей следующим образом: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gin; (3) кислотные: Asp, Glu; (4) основные: His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; (6) ароматические: Trp, Tyr, Phe. Под неконсервативными заменами подразумевают замену представителя одного из указанных классов на представителя из другого класса.
Один из типов полученного в результате замены варианта включает замену одного или нескольких остатков гипервариабельного участка родительского антитела (например, гуманизированного или человеческого антитела). Как правило, полученный(ые) в результате вариант(ы), отобранный(ые) для дополнительного исследования, должен(ы) иметь модификации (например, улучшения) некоторых биологических свойств (например, повышенную замещающую функцию кофактора FVIII активность или аффинность, пониженную иммуногенность) относительно родительского антитела, и/или должен(ы) иметь практически сохраненные определенные биологические свойства родительского антитела.
В некоторых вариантах осуществления изобретения замены, инсерции или делеции могут затрагивать один или несколько HVR, если указанные изменения не снижают существенно способность антитела связываться с антигеном. Например, в HVR могут быть сделаны консервативные изменения (например, консервативные замены, указанные в настоящем описании), которые не снижают существенно повышенную замещающую функцию кофактора FVIII активность.
Ценным методом идентификации остатков или областей антитела, которые можно подвергать мутагенезу, является так называемый «аланин-сканирующий мутагенез», описанный у Cunningham и Wells, Science 244, 1989, сс. 1081-1085. При осуществлении этого метода остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) идентифицируют и заменяют на нейтральную или отрицательно заряженную аминокислоту (например, аланин или полиаланин) для решения вопроса о том, будет ли это влиять на взаимодействие антитела с антигеном. Дополнительные замены можно интродуцировать в те положения аминокислот, для которых продемонстрирована функциональная чувствительность к начальным заменам. В альтернативном или дополнительном варианте изучают кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Указанные контактирующие остатки и соседние остатки можно рассматривать в качестве мишеней или исключать из рассмотрения в качестве кандидатов для замены. Варианты можно подвергать скринингу для решения вопроса о том, обладают ли они требуемыми свойствами.
Инсерции в аминокислотные последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или большее количество остатков, а также инсерции одного или нескольких аминокислотных остатков внутрь последовательности. Примером результата осуществления концевых инсерций является антитело с N-концевым метионильным остатком. Другие инсерционные варианты молекул антител включают слияние N- или С-концов антитела с ферментом (например, для ADEPT (антитело-направляемый фермент пролекарственной терапии) или полипептидом, который удлиняет время полужизни антитела в сыворотке.
б) Варианты гликозилирования
В некоторых вариантах осуществления изобретения антитело, указанное в настоящем описании, изменяют с целью повышения или понижения степени гликозилирования антитела. Добавление или делецию сайтов гликозилирования в антителе можно легко осуществлять путем такого изменения аминокислотной последовательности, которое позволяет создавать или удалять один или несколько сайтов гликозилирования.
Если антитело содержит Fc-область, то можно изменять присоединенный к ней углевод. Нативные антитела, которые продуцируются клетками млекопитающих, как правило, содержат разветвленный биантенный олигосахарид, который, как правило, присоединен с помощью N-связи к Asn297 СН2-домена Fc-области (см., например, Wright и др., TIBTECH 15, 1997, сс. 26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантенной олигосахаридной структуры. В некоторых вариантах осуществления изобретения модификации олигосахарида в антителе, предлагаемом в изобретении, можно осуществлять для создания вариантов антитела с определенными улучшенными свойствами. Одним из вариантов осуществления изобретения являются варианты антитела, имеющие углеводную структуру, в которой снижено содержание фукозы, присоединенной (прямо или косвенно) к Fc-области. Например, содержание фукозы в указанной Fc-области может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Содержание фукозы определяют путем расчета среднего содержания фукозы в сахарной цепи на Asn297 относительно суммы всех гликоструктур, присоединенных к Asn297 (например, комплексных, гибридных структур и структур с высоким содержанием маннозы), которое измеряют с помощью MALDI-TOF-масс-спектрометрии согласно методу, описанному, например, в WO 2008/077546. Asn297 обозначает остаток аспарагина, присутствующий примерно в положении 297 в Fc-области (EU-нумерация остатков Fc-области); однако вследствие минорных вариаций последовательности антитела Asn297 может располагаться также в положении, находящемся на расстоянии примерно +3 аминокислоты в прямом или обратном направлении от положения 297, т.е. между положениями 294 и 300. Указанные фукозилированные варианты могут обладать улучшенной ADCC-функцией (см., например, US 2003/0157108 (Presta L.); US 2004/0093621 (фирма Kyowa Hakko Kogyo Co., Ltd). Примерами публикаций, касающихся «дефукозилированных» вариантов антител или вариантов антител «с дефицитом фукозы» являются: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki и др., J. Mol. Biol. 336, 2004, cc. 1239-1249; Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, cc. 614-622). Примерами клеточных линий, которые обладают способностью продуцировать дефукозилированные антитела, являются Lec13 СНО-клетки с дефицитом белкового фукозилирования (Ripka и др., Arch. Biochem. Biophys. 249, 1986, сс. 533-545; US 2003/0157108 (Presta L.) и WO 2004/056312 (Adams и др., см., прежде всего, пример 11), и клеточные линии с «выключенным» геном, например, СНО-клетки с «выключенным» геном альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, сс. 614-622); Kanda и др., Biotechnol. Bioeng., 94(4), 2006, сс. 680-688; и WO 2003/085107).
Кроме того, описаны варианты антител с бисекционными олигосахаридами, например, в которых биантенный олигосахарид, присоединенный к Fc-области антитела, бисекционнируется с помощью GlcNAc. Указанные варианты антител могут отличаться пониженным фукозилированием и/или повышенной ADCC-функцией. Примеры указанных вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet и др.); US №6602684 (Umana и др.) и US 2005/0123546 (Umana и др.). Предложены также варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, присоединенном к Fc-области. Указанные варианты антител могут обладать повышенной CDC-функцией. Указанные варианты антител описаны, например, в WO 1997/30087 (Patel и др.); WO 1998/58964 (Raju S.); и WO 1999/22764 (Raju S.).
в) Варианты Fc-области
Согласно конкретным вариантам осуществления изобретения можно интродуцировать в Fc-область антитела, представленного в настоящем описании, одну или несколько аминокислотных модификаций, создавая тем самым вариант Fc-области. Вариант Fc-области может содержать последовательность человеческой Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4), включающую аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях.
Некоторые варианты осуществления изобретения относятся к варианту антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его перспективным кандидатом для путей применения, для которых является важным время полужизни антитела in vivo, однако некоторые эффекторные функции (такие как комплементзависимая активность и ADCC) не являются необходимыми или являются вредными. Можно осуществлять анализы цитотоксичности in vitro и/или in vivo для подтверждения снижения/истощения CDC- и/или ADCC-активности. Например, можно осуществлять анализы связывания Fc-рецептора (FcR) для гарантии того, что у антитела отсутствует способность к связыванию с Fc-гамма R (и поэтому, вероятно, отсутствует ADCC-активность), но сохраняется способность связываться с FcRn. Первичные клетки, опосредующие ADCC, т.е. NK-клетки, экспрессируют только Fc-гамма RIII, в то время как моноциты экспрессируют Fc-гамма RI, Fc-гамма RII и Fc-гамма RIII. Данные об экспрессии FcR на гематопоэтических клетках обобщены в таблице 3 на с. 464 у Ravetch и Kinet, Annu. Rev. Immunol. 9, 1991, cc. 457-492. Примерами анализов in vitro ADCC-активности представляющей интерес молекулы являются (но, не ограничиваясь только ими) анализы, описанные в US №5500362 (см., например, Hellstrom I. и др., Proc. Natl. Acad. Sci. USA 83, 1986, cc. 7059-7063 и Hellstrom I. и др., Proc. Nat'l Acad. Sci. USA 82, 1985, cc. 1499-1502); US №5821337 (см. Bruggemann M. и др., J. Exp. Med. 166, 1987, cc. 1351-1361). В альтернативном варианте можно применять нерадиоактивные методы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ на основе проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и нерадиоактивный анализ цитотоксичности CytoTox 96® (фирма Promega, Мэдисон, шт. Висконсин). Пригодными для таких анализов эффекторными клетками являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, на животной модели, например, как описано у Clynes и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc. 652-656. Можно осуществлять также анализы связывания C1q для подтверждения того, что антитело не может связывать C1q и поэтому у него отсутствует CDC-активность (см., например, описание ELISA для оценки связывания C1q и С3с в WO 2006/029879 и WO 2005/100402). Для оценки активации комплемента можно осуществлять анализ CDC (см., например, Gazzano-Santoro и др., J. Immunol. Methods 202, 1996, сс. 163-171; Cragg M.S. и др., Blood 101, 2003, сс. 1045-1052; и Cragg M.S. и M.S. Glennie, Blood 103, 2004, cc. 2738-2743). Определение FcRn-связывания и клиренса/времени полужизни in vivo можно осуществлять также с использованием методов, известных в данной области (см., например, Petkova SB. и др., Int'l. Immunol. 18(12), 2006, сс. 1759-1769).
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или нескольких следующих остатков Fc-области, таких как 238, 265, 269, 270, 297, 327 и 329 (см., например, US №6737056). К указанным мутантам Fc относятся мутанты Fc с заменами в двух или большем количестве из следующих аминокислотных положений: 265, 269, 270, 297 и 327, включая так называемый мутант «DANA» Fc-области, несущий замену остатков 265 и 297 на аланин (US №7332581).
Описаны некоторые варианты антител с повышенной или пониженной способностью связываться с FcR (см., например, US №6737056; WO 2004/056312 и Shields и др., J. Biol. Chem. 9(2), 2001, сс. 6591-6604).
В некоторых вариантах осуществления изобретения в Fc-области осуществляют изменения, которые приводят к измененной (т.е. либо повышенной, либо пониженной) способности связывать C1q и/или комплементзависимой цитотоксичности (CDC), что описано, например, в US №6194551, WO 1999/51642 и у Idusogie и др., J. Immunol. 164, 2000, сс. 4178-4184.
Антитела с удлиненным временем полужизни и повышенной способностью к связыванию с неонатальным Fc-рецептором (FcRn), который ответствен за перенос материнских IgG эмбриону (Guyer и др., J. Immunol. 117, 1976, сс. 587-593 и Kim и др., J. Immunol. 24, 1994, сс. 2429-2434), описаны в US 2005/0014934 А1 (Hinton и др.). Эти антитела содержат Fc-область с одной или несколькими заменами, которые повышают связывание Fc-области с FcRn.Указанные варианты Fc-области включают варианты с заменами одного или нескольких следующих остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 в Fc-области (US №7371826).
Кроме того, варианты Fc-области, обладающие пониженным способностью связываться с ревматоидным фактором, можно применять в качестве антител, предлагаемых в настоящем изобретении. Указанные варианты описаны в WO 2013/046704, и их примеры включают варианты, имеющие комбинацию мутаций, обозначенную как Q438R/S440E, Q438R/S440D, Q438K/S440E или Q438K/S440D, в их обеих Н-цепях.
Кроме того, варианты Fc-области, обладающие повышенной способностью связываться с FcRn и пониженной способностью связываться с ревматоидным фактором, можно применять в качестве антител, предлагаемых в настоящем изобретении. Более конкретно, их примеры включают варианты Fc-области, которые имеют в обеих их Н-цепях комбинацию мутаций, указанную в одном из подпунктов а)-е).
а) N434A/Y436T/Q438R/S440E,
б) N434A/Y436V/Q438R/S440E,
в) M428L/N434A/Y436T/Q438R/S440E,
г) M428L/N434A/Y436V/Q438R/S440E,
д) M428L/N434A/Q438R/S440E,
е) N434A/Q438R/S440E.
Дополнительные примеры, касающиеся других вариантов Fc-области, описаны также у Duncan, Nature 322, 1988, сс. 738-740; в US №№5648260 и 5624821 и в WO 1994/29351.
г) Производные антител
В некоторых вариантах осуществления изобретения антитело, представленное в настоящем описании, можно дополнительно модифицировать таким образом, чтобы оно содержало дополнительные небелковые фрагменты, известные в данной области и легко доступные. Фрагменты, пригодные для дериватизации антитела, включают (но, не ограничиваясь только ими) водорастворимые полимеры. Примерами водорастворимых полимеров являются (но, не ограничиваясь только ими) полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо статистические сополимеры) и декстран- или поли(н-винилпиролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликольпропиональдегид может иметь преимущество при производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, присоединенных к антителу, может варьироваться и, если присоединено более одного полимера, то они могут представлять собой одинаковые или различные молекулы. В целом, количество и/или тип полимеров, применяемых для дериватизации, можно определять с учетом таких особенностей (но, не ограничиваясь только ими), как конкретные свойства или функции антитела, подлежащие усовершенствованию, предполагается ли применение производного антитела в терапии в определенных условиях, и т.д.
Б. Методы рекомбинации и композиции
Антитела можно получать, используя методы рекомбинации и композиции, например, описанные в US №4816567. Одним из вариантов осуществления изобретения является выделенная нуклеиновая кислота, кодирующая анти-FIX(a)/FX биспецифическое антитело, указанное в настоящем описании. Указанная нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкие и/или тяжелые цепи антитела). Следующим вариантом осуществления изобретения является(ются) один или несколько векторов (например, экспрессионных векторов), который(е) содержит(та) указанную нуклеиновую кислоту. Еще одним вариантом осуществления изобретения является клетка-хозяин, которая содержит указанную нуклеиновую кислоту. В одном из указанных вариантов осуществления изобретения клетка-хозяин содержит (например, в результате трансформации указанными векторами): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (СНО) или лимфоидную клетку (например, Y0-, NS0-, Sp20-клетку). Одним из вариантов осуществления изобретения является способ получения анти-FIX(a)/FX биспецифического антитела, включающий культивирование клетки-хозяина, содержащей нуклеиновую кислоту, которая кодирует антитело, описанное выше, в условиях, пригодных для экспрессии антитела, и необязательно выделяют антитело из клетки-хозяина (или среды для культивирования клетки-хозяина).
Для рекомбинантного получения анти-FIX(a)/FX биспецифического антитела нуклеиновую кислоту, кодирующую антитело, например, описанное выше, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Указанную нуклеиновую кислоту легко можно выделять и секвенировать с использованием общепринятых процедур (например, путем использования олигонуклеотидных зондов, которые обладают способностью специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Приемлемые клетки-хозяева для клонирования или экспрессии кодирующих антитело векторов включают прокариотические или эукариотические клетки, представленные в настоящем описании. Например, антитела можно получать в бактериях, в частности, когда не требуется гликозилирование и связанная с Fc эффекторная функция. Сведения об экспрессии фрагментов антитела и полипептидов в бактериях см. например, в US №№5648237, 5789199 и 5840523 (см. также у Charlton в: Methods in Molecular Biology, под ред. Lo В.K.С, изд-во Humana Press, Totowa, NJ, т. 248, 2003, cc. 245-254 описание экспрессии фрагментов антител в Е. coli.) После экспрессии антитело можно выделять из пасты бактериальных клеток в виде растворимой фракции и можно дополнительно очищать.
Помимо прокариотических организмов в качестве хозяев, пригодных для клонирования или экспрессии плазмид, которые кодируют антитела, можно использовать эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были «гуманизированы», что позволяет получать антитело с частично или полностью человеческой схемой гликозилирования (см. Gerngross, Nat. Biotech. 22, 2004, сс.1409-1414 и Li и др., Nat. Biotech. 24, 2006, сс. 210-215).
Клетки-хозяева, которые можно использовать для экспрессии гликозилированного антитела, получают также из многоклеточных организмов (беспозвоночных и позвоночных животных). Примерами клеток беспозвоночных являются клетки насекомых, а также можно применять клетки растений. Были выявлены многочисленные штаммы бакуловирусов и соответствующие пригодные для них в качестве хозяев клетки насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев можно применять также культуры растительных клеток (см., например, US №№5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIES™ для получения антител в трансгенных растениях).
В качестве хозяев можно применять также клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, которые адаптированы к росту в суспензии. Другими примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CVI, трансформированная с помощью ОВ40 (COS-7); линия клеток почки эмбриона человека (HEK 293-клетки или клетки линии 293, описанные, например, у Graham и др., J. Gen. Virol., 36, 1977, сс. 59-74); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (ТМ4-клетки, описанные, например, у Mather, Biol. Reprod., 23, 1980, сс. 243-251); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76,); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени бычьей крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, у Mather и др., Annals N.Y. Acad. Sci., 383, 1982, сс. 44-68); клетки MRC 5 и клетки FS4. Другими ценными линиями клеток-хозяев млекопитающих являются клетки яичника китайского хомячка (СНО), включая DHFR- -СНО-клетки (Urlaub и др., Proc. Natl. Acad. Sci. USA, 77, 1980, cc. 4216-4220); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор конкретных линий клеток-хозяев млекопитающих, которые можно применять для производства антител, см., например, у Yazaki и Wu, в: Methods in Molecular Biology под ред. В.K.С. Lo, изд-во Humana Press, Totowa, NJ, т. 248, 2003, cc. 255-268.
В. Анализы
Анти-FIX(a)/FX биспецифические антитела, указанные в настоящем описании, можно идентифицировать, осуществлять их скрининг или характеризовать их физические/химические свойства и/или виды биологической активности с помощью различных анализов, известных в данной области.
1. Анализы связывания и другие анализы
Согласно одному из объектов изобретения антитело, предлагаемое в изобретении, тестируют в отношении антигенсвязывающей активности с использованием известных методов, таких как ELISA, Вестерн-блоттинг и др.
2. Анализы активности
Одним из объектов изобретения являются анализы для идентификации анти-FIX(a)/FX биспецифических антител, обладающих биологической активностью. Биологическая активность может включать, например, замещающую функцию кофактора FVIII активность. Предложены также антитела, обладающие указанной биологической активностью in vivo и/или in vitro.
В некоторых вариантах осуществления изобретения тестируют указанную биологическую активность антитела, предлагаемого в изобретении.
В настоящем изобретения понятия «замещающая функцию кофактора FVIII активность» и «FVIII-замещающая активность» и «активность замещения функции FVIII» используют в качестве синонимов, и они относятся к активности распознавания FIX и/или FIXa и FX и повышения активации FX (повышение производства FXa).
«Замещающая функцию кофактора FVIII активность» в настоящем изобретении означает, например, активность, рассчитанную с помощью анализа опосредуемой FIXa реакции активации FX с использованием колориметрического метода определения и с помощью анализа образования тромбина с использованием плазмы пациентов с гемофилией А. Более конкретно активность можно подтверждать, осуществляя оценки с использованием антитела, предлагаемого в настоящем изобретении, и, например, измерительной системы, содержащей FIXa, FX, синтетический субстрат S-2222 (синтетический субстрат для FXa) и фосфолипиды. Такая измерительная система позволяет продемонстрировать корреляцию между серьезностью заболевания и клиническими симптомами в случаях гемофилии A (Rosen S., Andersson М., Blomba'ck М. и др., Clinical applications of a chromogenic substrate method for determination of FVIII activity, Thromb Haemost; 54, 1985, cc. 811-823).
Г. Фармацевтические композиции
Фармацевтические композиции анти-FIX(a)/FX биспецифического антитела, представленного в настоящем описании, получают путем смешения указанного антитела, имеющего необходимую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences, 16-е изд. под ред. Osol А., 1980) в форме лиофилизированных композиций или водных растворов.
Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях, они включают (но, не ограничиваясь только ими): буферы, такие как фосфатный, цитратный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и жедаа-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). В контексте настоящего описания примеры фармацевтически приемлемых носителей включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rHuPH20, описаны в публикациях патентов США №№2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Действующие вещества можно включать также в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, 16-е изд., под ред. Osol А., 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие антитело или конъюгат, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы.
Композиции, предназначенные для применения in vivo, как правило, должны быть стерильными. Стерильность можно легко обеспечивать, например, путем фильтрации через стерильные фильтрующие мембраны.
Д. Терапевтические способы и композиции
Любое из анти-FIX(a)/FX биспецифических антител, представленных в настоящем описании, можно применять в терапевтических способах.
Одним из объектов изобретения является анти-FIX(a)/FX биспецифическое антитело, предназначенное для применения в качестве лекарственного средства. Другими объектами изобретения является анти-FIX(a)/FX биспецифическое антитело, предназначенное для применения при лечении кровотечения, болезней, сопровождающихся кровотечением, или болезней, вызываемых кровотечением. Некоторые варианты осуществления изобретения относятся к анти-FIX(a)/FX биспецифическому антителу, предназначенному для применения в способе лечения. Некоторые варианты осуществления изобретения относятся к анти-FIX(a)/FX биспецифическому антителу, предназначенному для применения в способе лечения индивидуума, имеющего кровотечение, болезни, сопровождающиеся кровотечением, или болезни, вызываемые кровотечением, который включает введение индивидууму в эффективном количестве анти-FIX(a)/FX биспецифического антитела. В одном из указанных вариантов осуществления изобретения способ включает также введение индивидууму в эффективном количестве по меньшей мере одного дополнительного терапевтического средства, например, указанного ниже. Другие варианты осуществления изобретения относятся к анти-FIX(a)/FX биспецифическому антителу, предназначенному для замещения функции FVIII. Некоторые варианты осуществления изобретения относятся к анти-FIX(a)/FX биспецифическому антителу, предназначенному для применения в способе замещения функции FVIII у индивидуума, включающему введение индивидууму в эффективном количестве анти-FIX(a)/FX биспецифического антитела для замещения функции FVIII. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Согласно одному из вариантов осуществления изобретения ожидается, что антитела, предлагаемые в настоящем изобретении, поскольку антитела, предлагаемые в настоящем изобретении, обладают функцией замещения кофактора FVIII, могут являться эффективными фармацевтическими агентами против болезней, являющихся результатом снижения активности (функции) указанного кофактора. Примеры вышеуказанных болезней включают кровотечение, болезни, сопровождающиеся кровотечением, или болезни, вызываемые кровотечением, и предпочтительными примерами являются болезни, которые развиваются и/или прогрессируют из-за снижения или дефицита активности FVIII и/или активированного фактора свертывая крови VIII (FVIIIa). Указанные болезни включают, например, гемофилию А, болезни, при которых появляются ингибиторы FVIII/FVIIIa, приобретенную гемофилию, болезнь фон Виллебранда и т.п.(но, не ограничиваясь только ими).
Следующим объектом изобретения является применение анти-FIX(a)/FX биспецифического антитела для приготовления или получения лекарственного средства. В одном из вариантов осуществления изобретения лекарственное средство предназначено для лечения кровотечения, болезней, сопровождающихся кровотечением, или болезней, вызываемых кровотечением. В другом варианте осуществления изобретения лекарственное средство предназначено для применения в способе лечения кровотечения, болезней, сопровождающихся кровотечением, или болезней, вызываемых кровотечением, который включает введение индивидууму, имеющему кровотечение, болезни, сопровождающиеся кровотечением, или болезни, вызываемые кровотечением, в эффективном количестве лекарственного средства. В одном из указанных вариантов осуществления изобретения способ включает также введение индивидууму в эффективном количестве по меньшей мере одного дополнительного терапевтического средства, например, указанного ниже. В другом варианте осуществления изобретения лекарственное средство предназначено для замещения функции FVIII. В другом варианте осуществления изобретения лекарственное средство предназначено для применения в способе замещения функции FVIII у индивидуума, включающем введение индивидууму в эффективном количестве лекарственного средства для замещения функции FVIII. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Следующим объектом изобретения является способ лечения кровотечения, болезней, сопровождающихся кровотечением, или болезней, вызываемых кровотечением. В одном из вариантов осуществления изобретения способ включает введение индивидууму, имеющему указанное кровотечение, болезни, сопровождающиеся кровотечением, или болезни, вызываемые кровотечением, в эффективном количестве анти-FIX(a)/FX биспецифического антитела. В одном из указанных вариантов осуществления изобретения способ включает также введение индивидууму в эффективном количестве по меньшей мере одного дополнительного терапевтического средства, например, указанного ниже. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Следующим объектом изобретения является способ замещения функции FVIII у индивидуума. В одном из вариантов осуществления изобретения способ включает введение индивидууму в эффективном количестве анти-FIX(a)/FX биспецифического антитела для замещения функции FVIII. В одном из вариантов осуществления изобретения «индивидуум» представляет собой человека.
Следующим объектом изобретения являются фармацевтические композиции, содержащие любое из анти-FIX(a)/FX биспецифических антител, представленных в настоящем описании, например, для применения в терапевтических способах. В одном из вариантов осуществления изобретения фармацевтическая композиция содержит любое из анти-FIX(a)/FX биспецифических антител, представленных в настоящем описании, и фармацевтически приемлемый носитель. В другом варианте осуществления изобретения фармацевтическая композиция содержит любое из анти-FIX(a)/FX биспецифических антител, представленных в настоящем описании, и по меньшей мере одно дополнительное терапевтическое средство, например, указанное ниже.
Антитела, предлагаемые в изобретении, можно применять при осуществлении терапии либо индивидуально, либо в сочетании с другими средствами. Например, антитело, предлагаемое в изобретении, можно вводить совместно по меньшей мере с одним дополнительным терапевтическим средством. В некоторых вариантах осуществления изобретения дополнительное терапевтическое средство представляет собой композицию, содержащую FVIII.
Такие указанные выше комбинированные терапии включают совместное введение (при котором два или большее количество терапевтических средств включают в одни и те же или разные композиции) и раздельное введение, в этом случае введение антитела, предлагаемого в изобретении, можно осуществлять до, одновременно и/или совместно с введением дополнительного(ых) терапевтического(их) агента или агентов. В одном из вариантов осуществления изобретения введение анти-FIX(a)/FX биспецифического антитела и введение дополнительного терапевтического агента можно осуществлять в пределах примерно одного месяца или в пределах примерно 1, 2 или 3 недель или в пределах примерно 1, 2, 3, 4, 5 или 6 дней относительно друг друга.
Антитело, предлагаемое в изобретении (и любое дополнительное терапевтическое средство) можно вводить любыми приемлемыми путями, включая парентеральный, внутрилегочный и интраназальный и при необходимости применять для местной обработки, введения в повреждение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование можно осуществлять любым приемлемым путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости, в том числе, от того, является ли лечение кратковременным или хроническим. Можно применять различные схемы дозирования, включая (но, не ограничиваясь только ими) однократное введение или несколько введений в различные моменты времени, болюсное введение и пульсирующую инфузию.
Антитела, предлагаемые в изобретении, можно включать в состав композиций, дозировать и вводить в соответствии с надлежащей клинической практикой. Рассматриваемые в этом контексте факторы включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину нарушения, область введения агента, метод введения, схему введения и другие факторы, известные практикующим медикам. Антитело можно, но это не является обязательным, включать в композицию в сочетании с одним или несколькими другими средствами, которые в настоящее время применяют для профилактики и лечения рассматриваемого нарушения. Эффективное количество указанных других средств зависит от количества антитела, присутствующего в композиции, типа нарушения или лечения и других указанных выше факторов. Их, как правило, применяют в таких же дозах и с использованием таких же путей введения, которые указаны в настоящем описании, или в количестве, составляющем от 1 до 99% от дозы, указанной в настоящем описании, или в любой дозе и с помощью любого пути, которые по данным эмпирической/клинической оценки являются пригодными.
Для предупреждения или лечения заболевания приемлемая доза антитела, предлагаемого в изобретении (при его применении индивидуально или в сочетании с одним или несколькими другими дополнительными терапевтическими средствами), должна зависеть от типа заболевания, подлежащего лечению, типа антитела, серьезности и течения болезни, применяют ли антитело для превентивных или терапевтических целей, предшествующей терапии, истории болезни пациента и ответа на антитело, а также предписания лечащего врача. Антитело можно вводить пациенту однократно или в виде серий обработок. В зависимости от типа и серьезности заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,5-10 мг/кг) антитела может представлять собой начальную возможную дозу для введения пациенту, например, с помощью одной или нескольких отдельных обработок или с помощью непрерывной инфузии. Одним из примеров типичных суточных доз может являться доза, составляющая от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. При использовании повторных введений в течение нескольких дней или более длительного периода времени, в зависимости от состояния, лечение, как правило, следует продолжать до достижения подавления симптомов заболевания. Одним из примеров доз антитела является доза, составляющая от примерно 0,05 до примерно 10 мг/кг. Так, пациенту можно вводить одну или несколько следующих доз: примерно 0,5, 2,0, 4,0 или 10 мг/кг (или любую их комбинацию). Указанные дозы можно вводить дробно, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати, например, примерно шесть доз антитела. Можно применять начальную повышенную ударную дозу с последующим введением одной или нескольких более низких доз. С помощью общепринятых методов и анализов можно легко осуществлять мониторинг действия указанной терапии.
Е. Изделия
Другим объектом изобретения является изделие, которое содержит продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которые размещены на контейнере или вложены в него. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для IV-раствора и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет собой антитело, предлагаемое в изобретении. На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния. Кроме того, изделие может включать (а) первый контейнер с находящейся в нем композицией, где композиция содержит антитело, предлагаемое в настоящем изобретении; и (б) второй контейнер с находящейся в нем композицией, где композиция содержит дополнительное цитотоксическое или иное терапевтическое средство. Согласно этому варианту осуществления изобретения изделие может содержать листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния. В альтернативном или дополнительном варианте изделие может дополнительно включать второй (или третий) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
Одним из объектов настоящего изобретения является способ получения варианта эмицизумаба, включающий указанную ниже стадию (а), на которой:
(а) осуществляют одну или несколько замен, указанных в подпунктах (I)-(III), где нумерация соответствует системе нумерации по Кэботу:
(I) замена одной или нескольких аминокислот, выбранных из группы, которая состоит из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, в вариабельном домене легкой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно;
(II) замена одной или нескольких аминокислот, выбранных из группы, которая состоит из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, в вариабельном домене тяжелой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно; и
(III) замена одной или нескольких аминокислот, выбранных из группы, которая состоит из D31, N32, N33, М34, D35, D50, I51, Т52а, N52, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, в вариабельном домене тяжелой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно.
Указанные выше сайты замен могут представлять собой один или несколько сайтов, или они могут представлять собой комбинацию (I) и (II), комбинацию (I) и (III), комбинацию (II) и (III) или комбинацию (I), (II) и (III).
Одним из объектов настоящего изобретения является способ выделения варианта эмицизумаба, включающий указанные ниже стадии (а)-(в), на которых: (а) получают вариант эмицизумаба путем осуществления одной или нескольких замен, указанных ниже в подпунктах (I)-(III), где нумерация соответствует системе нумерации по Кэботу:
(I) замена одной или нескольких аминокислот, выбранных из группы, которая состоит из K24, А25, S26, R27, N28, I29, Е30, R31, Q32, L33, А34, Q50, А51, S52, R53, K54, Е55, S56, Q89, Q90, Y91, S92, D93, Р94, Р95, L96 и Т97, в вариабельном домене легкой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно;
(II) замена одной или нескольких аминокислот, выбранных из группы, которая состоит из Y31, Y32, D33, I34, Q35, S50, I51, S52, Р52а, S53, G54, Q55, S56, Т57, Y58, Y59, R60, R61, Е62, V63, K64, G65, R95, Т96, G97, R98, Е99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, в вариабельном домене тяжелой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно; и
(III) замена одной или нескольких аминокислот, выбранных из группы, которая состоит из D31, N32, N33, М34, D35, D50, I51, Т52а, N52, R53, S54, G55, G56, S57, I58, Y59, N60, Е61, Е62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и Е102, в вариабельном домене тяжелой цепи антитела, содержащем аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно;
(б) измеряют замещающую функцию кофактора FVIII активность варианта антитела, полученного на стадии (а); и
(в) отбирают вариант эмицизумаба, который обладает повышенной замещающей функцию кофактора FVIII активностью по сравнению с эмицизумабом.
Указанные выше сайты замен могут представлять собой один или несколько сайтов, или они могут представлять собой комбинацию (I) и (II), комбинацию (I) и (III), комбинацию (II) и (III) или комбинацию (I), (II) и (III).
Примеры
Ниже приведены примеры методов и композиций, предлагаемых в изобретении. Как должно быть очевидно, различные другие варианты осуществления изобретения можно применять на практике с учетом общего описания изобретения, представленного выше.
Хотя выше изобретение описано с приведенными с целью иллюстрации некоторыми деталями и на примерах, которые даны для лучшего понимания, описание и примеры не следует рассматривать как ограничивающие объем изобретения. Описания всех патентов и научной литературы, которые процитированы в настоящем описании, полностью включены в него в качестве ссылки.
Пример 1: Скрининг вариантов антител в отношении повышенной замещающей функцию кофактора FVIII активности
АСЕ910 представляет собой гуманизированное антитело IgG4-изотипа, обладающее замещающей функцию кофактора FVIII активностью и содержащее домены анти-FIX(a) и анти-FX, антитело состоит из двух типов тяжелых цепей (Q499 и J327), которые распознают FIX(a) и FX соответственно, общих L-цепей (L404) (тяжелые цепи имеют последовательности SEQ ID NO: 45 и 46 и легкая цепь имеет последовательность SEQ ID NO: 47). При создании настоящего изобретения осуществляли всестороннюю интродукцию аминокислотных модификаций в L404 с использованием методов, известных специалистам в данной области, таких как ПЦР для интродукции мутаций, и осуществляли широкомасштабный скрининг замещающей функцию кофактора FVIII активности, при этом обнаружены аминокислотные замены в L-цепи, которые повышают замещающую функцию кофактора FVIII активность антитела АСЕ910.
Полученные в результате замены варианты создавали путем модификации аминокислот во всех CDR L404 (SEQ ID NO: 47) в L-цепи в анти-FX-плече антитела АСЕ910 (SEQ ID NO: 46 тяжелой цепи и SEQ ID NO: 47 легкой цепи) на аминокислоты, отличные от цистеина, при этом L-цепь анти-FIX(а)-плеча антитела АСЕ910 (SEQ ID NO: 45 тяжелой цепи и SEQ ID NO: 47 легкой цепи) продолжала полностью соответствовать L404 АСЕ910. Кроме того, полученные в результате замены варианты создавали путем модификации аминокислот во всех CDR L404 в L-цепи анти-FIX(а)-плеча антитела на аминокислоты, отличные от цистеина, при этом L-цепь анти-FX-плеча антитела АСЕ910 (SEQ ID NO: 45 тяжелой цепи и SEQ ID NO: 47 легкой цепи) продолжала полностью соответствовать L404 АСЕ910. Экспрессию и очистку биспецифических антител осуществляли с помощью методов, известных специалистам в данной области.
Замещающую функцию кофактора FVIII активность различных очищенных биспецифических антител оценивали с помощью метода, известного специалистам в данной области. В частности, измерения осуществляли с помощью описанного ниже метода. Все реакции проводили при комнатной температуре. Смешивали 5 мкл раствора антитела, разведенного в забуференном Трис соляном растворе, содержащем 0,1% бычьего сывороточного альбумина (далее в контексте настоящего описания обозначен как TBSB), с 5 мкл (600 нг/мл) человеческого фактора IXa бета (фирма Enzyme Research Laboratories), а затем инкубировали в 384-луночном планшете при комнатной температуре в течение 30 мин. Ферментативную реакцию в этой смеси инициировали, добавляя 5 мкл (24,7 мкг/мл) человеческого фактора X (фирма Enzyme Research Laboratories), и через 4 мин добавляли 5 мкл 0,5М ЭДТА для прекращения реакции. Цветную реакцию инициировали, добавляя 5 мкл раствора субстрата для окрашивания (S-2222, фирма SEKISUI MEDICAL). После 30-минутной цветной реакции измеряли изменение в абсорбции при 405 нм с помощью устройства SpectraMax 340РС384 (фирма Molecular Devices).
В результате установлено, что некоторые аминокислотные замены, указанные ниже в таблице 2, обладали способностью повышать замещающую функцию кофактора FVIII активность по сравнению с родительским антителом АСЕ910. В таблице 2 представлены положения, в которых осуществлены мутации, обозначенные в соответствии с нумерацией по Кэботу (число в самой левой колонке, обозначенной «Положение»), аминокислоты АСЕ910 (аминокислоты (обозначены с помощью однобуквенного кода) во второй колонке слева), аминокислоты после мутации (обозначены с помощью однобуквенного кода) в самом верхнем ряду) и величины (каждая из численных величин в таблице), полученные путем расчета специфической активности относительно АСЕ910 (очищенное антитело), и с учетом коррекции с использованием величины специфической активности АСЕ910 (супернатант культуры). В таблице 2 символ (-) обозначает, что уровень экспрессии антитела является низким, а символ "/" обозначает, что антитело не представляет собой созданное антитело, поскольку представленная аминокислота является такой же, что и в АСЕ910.
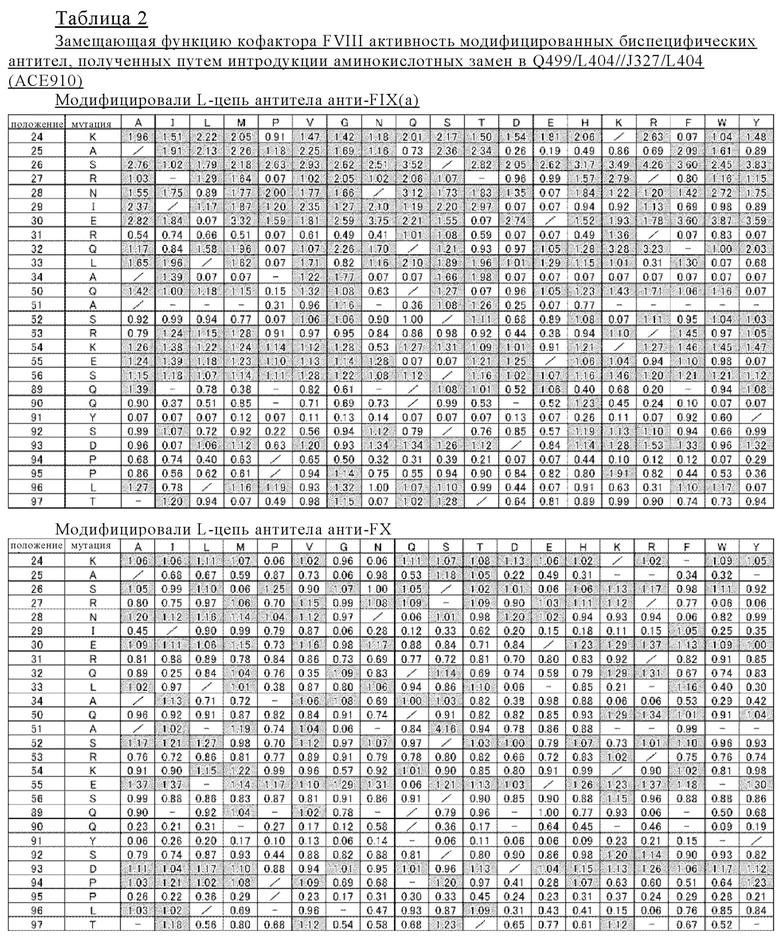
Пример 2: Получение новых L-цепей, совместимых с каждой Н-цепью АСЕ910
Как продемонстрировано в примере 1, замещающую функцию кофактора FVIII активность можно повышать путем всесторонней модификации аминокислот в L404, которая представляет собой общую L-цепь АСЕ910. Другой приемлемый метод повышения замещающей функцию кофактора FVIII активности АСЕ910 остоит в том, что получают из человеческих библиотек антител новые L-цепи, имеющие последовательности, которые являются полностью отличными от общей L-цепи, которые должны спариваться с соответствующими Н-цепями антитела анти-FIX(а) и антитела анти-FX (Q499 и J327).
С помощью указанных методов, известных специалистам в данной области, в частности метода, описанного в Biochemical and Biophysical Research Communications, 275, 2, 2000, cc. 553-557 и т.п., при создании настоящего изобретения получали библиотеку антител, в которой часть L-цепи антитела АСЕ910 была заменена на область из библиотеки человеческих L-цепей, затем осуществляли процедуры пэннинга с использованием биотинилированного человеческого FIXa или биотинилированного человеческого FX, и таким образом, добиваясь успеха в получении антител, содержащих новые L-цепи и обладающих замещающей функцию кофактора FVIII активностью.
В результате в качестве биспецифических антител, обладающих замещающей функцию кофактора FVIII активностью, были открыты следующие конструкции, используемые в качестве L-цепей антитела к человеческому FIX(a): QNK131 (последовательность тяжелой цепи SEQ ID NO: 45 и последовательность легкой цепи SEQ ID NO: 13), QNK284 (последовательность тяжелой цепи SEQ ID NO: 45 и последовательность легкой цепи SEQ ID NO: 14), QNK315 (последовательность тяжелой цепи SEQ ID NO: 45 и последовательность легкой цепи SEQ ID NO: 15), QNL182 (последовательность тяжелой цепи SEQ ID NO: 45 и последовательность легкой цепи SEQ ID NO: 16), QNL492 (последовательность тяжелой цепи SEQ ID NO: 45 и последовательность легкой цепи SEQ ID NO: 17), и QNL576 (последовательность тяжелой цепи SEQ ID NO: 45 и последовательность легкой цепи SEQ ID NO: 18); ив качестве L-цепей антитела к человеческому FX: JNK131 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 19), JNK163 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 20), JNK252 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 21), JNK263 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 22), JNK339 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 23), JNK348 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 24), JNK351 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 25), JNK360 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 26), JNK378 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 27), JNK382 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 28), JNL036 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 29), JNL072 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 30), JNL095 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 31), JNL176 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 32), JNL208 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 33), JNL224 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 34), JNL260 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 35), JNL056 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 36), JNL059 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 37), JNL226 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 38), JNL250 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 39), JNL263 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 40), и JNL281 (последовательность тяжелой цепи SEQ ID NO: 46 и последовательность легкой цепи SEQ ID NO: 41).
Различные биспецифические антитела, содержащие указанные новые L-цепи, экспрессировали и очищали с помощью методов, известных специалистам в данной области. Полученные антитела представлены в таблице 3 (представлены названия клонов, SEQ ID NO: тяжелых цепей и SEQ ID NO: легких цепей анти-FIX(а) или SEQ ID NO: легких цепей анти-FX). Новую L-цепь применяли только в одном плече, a L404, которая представляет собой общую L-цепь АСЕ910, применяли в другом плече. Результаты измерения замещающей функцию кофактора FVIII активности различных очищенных биспецифических антител представлены на фиг. 1. Для всех содержащих новые L-цепи биспецифических антител подтверждено наличие замещающей функцию кофактора FVIII активности.
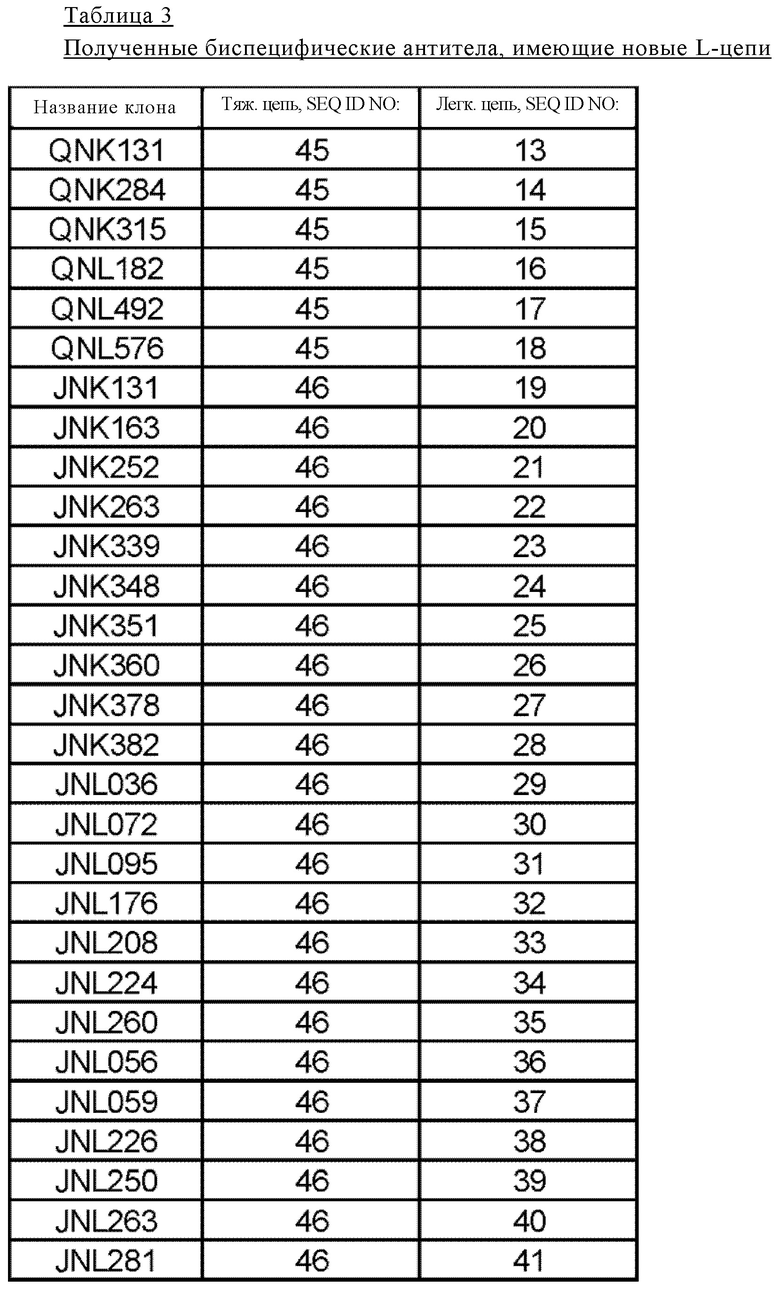
Пример 3: Получение вариантов содержащих новые L-цепи биспецифических антител
Для повышения замещающей функцию кофактора FVIII активности содержащих новые L-цепи биспецифических антител, полученных согласно методу, описанному в примере 2, интродуцировали модификации, представляющие собой аминокислотные замены, в QNK131 (последовательность легкой цепи SEQ ID NO: 13), которая представляет собой новую L-цепь антитела aHTH-FIX(a), с получением QAL187 (последовательность легкой цепи SEQ ID NO: 42) и QAL201 (последовательность легкой цепи SEQ ID NO: 43). Аналогично этому, модификации, представляющие собой аминокислотные замены, интродуцировали в JNL095 (последовательность легкой цепи SEQ ID NO: 31), которая представляет собой новую L-цепь антитела анти-FX, с получением JYL280 (последовательность легкой цепи SEQ ID NO: 44). В одном из примеров биспецифическое антитело (Q499/QAL201//J327/JYL280), состоящее из антитела анти-FIX(а), которое содержит тяжелую цепь Q499 и легкую цепь QAL201, антитело анти-FX, которое содержит тяжелую цепь J327 и легкую цепь JYL280, экспрессировали и очищали с помощью метода, известного специалистам в данной области, и результаты измерения его замещающей функцию кофактора FVIII активности представлены на фиг. 2.
Пример 4: Получение вариантов Н-цепи содержащих новые L-цепи биспецифических антител
При создании изобретения с использованием содержащего новые L-цепи (QAL187 для антитела анти-FIX(а) и JYL280 для антитела анти-FX) с повышенной замещающей функцию кофактора FVIII активностью интродуцировали всесторонние аминокислотные мутации в Q499 и J327 и осуществляли широкомасштабный скрининг замещающей функцию кофактора FVIII активности для выявления аминокислотных замен, которые повышают замещающую функцию кофактора FVIII активность.
Тяжелую цепь и легкую цепь плеча, представляющего собой антитело анти-FIX(a), фиксировали в виде Q499 и QAL201 соответственно, а легкую цепь плеча, представляющего собой антитело анти-FX, фиксировали в виде JYL280, создавая полученные в результате замен варианты, в которых все аминокислоты в CDR J327 были модифицированы на аминокислоты, отличные от цистеина.
Тяжелую цепь и легкую цепь плеча, представляющего собой антитело анти-FX, фиксировали в виде J327 и JYL280 соответственно, а легкую цепь плеча, представляющего собой антитело анти-FIX(а), фиксировали в виде QAL187, создавая полученные в результате замен варианты, в которых все аминокислоты CDR Q499 модифицированы на любые аминокислоты, отличные от цистеина. Экспрессию и очистку биспецифических антител осуществляли с помощью методов, известных специалистам в данной области.
Замещающую функцию кофактора FVIII активность оценивали с помощью методов, известных специалистам в данной области, используя различные очищенные биспецифические антитела.
В результате установлено, что несколько из аминокислотных замен, указанных ниже в таблице 4, могут повышать замещающую функцию кофактора FVIII активность по сравнению с родительским биспецифическим антителом Q499/QAL187//J327/JYL280 или Q499/QAL201//J327/JYL280. В таблице 4 представлены положения, в которых осуществлены мутации, обозначенные в соответствии с нумерацией по Кэботу (число в самой левой колонке, обозначенной «положение»), аминокислоты в родительском антителе (аминокислоты (обозначены с помощью однобуквенного кода) во второй колонке слева), аминокислоты после мутации (обозначены с помощью однобуквенного кода) в самом верхнем ряду) и величины (каждая из численных величин в таблице), полученные путем расчета специфической активности относительно АСЕ910 (очищенное антитело). В таблице 4 символ (-) обозначает, что уровень экспрессии антитела является низким, а символ "/" обозначает, что антитело не представляет собой созданное антитело, поскольку представленная аминокислота является такой же, что и в родительском антителе.
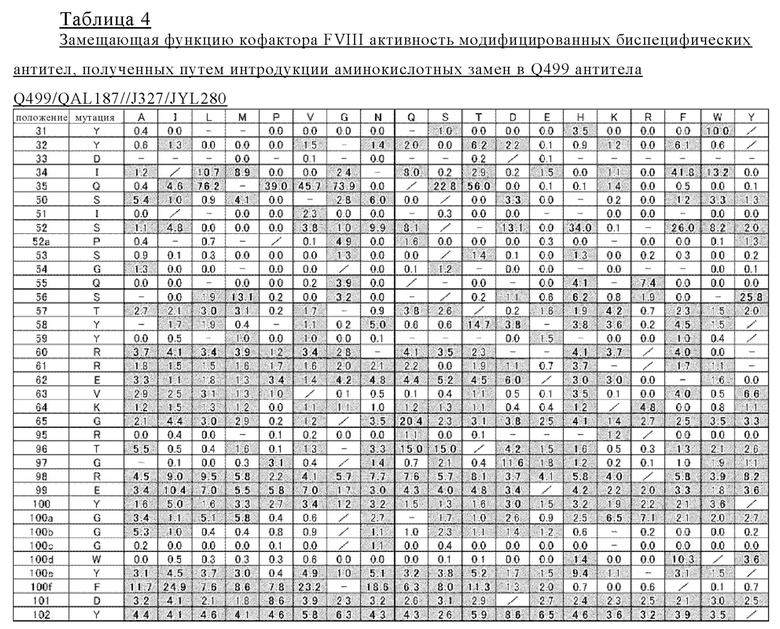

Промышленная применимость
При создании настоящего изобретения были обнаружены замены аминокислот в легких цепях, которые повышали замещающую функцию кофактора FVIII активность АСЕ910 (эмицизумаба), новые легкие цепи, обладающие повышенной замещающей функцию кофактора FVIII активностью, и замены аминокислот в тяжелых цепях, которые повышали замещающую функцию кофактора FVIII активность содержащих новые легкие цепи биспецифических антител. Указанные аминокислотные замены и новые легкие цепи можно использовать для получения биспецифических антител, имеющих замещающую функцию кофактора FVIII активность, более высокую по сравнению с активностью АСЕ910 (эмицизумаба).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЧУГАИ СЕЙЯКУ КАБУСИКИ КАЙСЯ
<120> БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО, ОБЛАДАЮЩЕЕ ПОВЫШЕННОЙ АКТИВНОСТЬЮ,
АЛЬТЕРНАТИВНОЙ ФУНКЦИИ КОФАКТОРА FVIII
<130> C1-A1609P
<150> JP 2016-150769
<151> 2016-07-29
<160> 47
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 1
Tyr Tyr Asp Ile Gln
1 5
<210> 2
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 2
Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg Arg Glu Val Lys
1 5 10 15
Gly
<210> 3
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 3
Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr Phe Asp Tyr
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 4
Asp Asn Asn Met Asp
1 5
<210> 5
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 5
Asp Ile Asn Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe Gln
1 5 10 15
Asp
<210> 6
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 6
Arg Lys Ser Tyr Gly Tyr Tyr Leu Asp Glu
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 7
Lys Ala Ser Arg Asn Ile Glu Arg Gln Leu Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 8
Gln Ala Ser Arg Lys Glu Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 9
Gln Gln Tyr Ser Asp Pro Pro Leu Thr
1 5
<210> 10
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 10
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Tyr
20 25 30
Asp Ile Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg Arg Glu Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Lys Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn Arg Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 11
<211> 444
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 11
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Asn Met Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe
50 55 60
Gln Asp Arg Val Ile Met Thr Val Asp Lys Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr His Cys
85 90 95
Ala Arg Arg Lys Ser Tyr Gly Tyr Tyr Leu Asp Glu Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Glu Ser Leu Ser Leu Ser Pro
435 440
<210> 12
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15 30
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Arg Asn Ile Glu Arg Gln
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Asp Pro Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 13
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 13
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Lys Arg Pro Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 14
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 14
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ser Tyr Leu Gly
85 90 95
Ile Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 15
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 15
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Val Ser Cys Lys Ser Ser Gln Ser Leu Leu Arg Thr
20 25 30
Asp Gly Lys Ala Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Glu Val Ser Lys Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Arg
85 90 95
Ile Gln Ala Leu Ser Phe Gly Gly Gly Thr Lys Val Asp Ile Lys
100 105 110
<210> 16
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 16
Ser Ser Gly Leu Thr Gln Pro Pro Ser Leu Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly His Lys Val Gly Asp Lys Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Ser Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Ala Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Val
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Leu Ala Trp Val Pro Asn Ser Gly Tyr
85 90 95
Val Phe Gly Thr Gly Thr Gln Val Thr Val Val
100 105
<210> 17
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 17
Gln Ser Val Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Ser Tyr
20 25 30
Asn Leu Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Cys Ser Tyr Ala Gly Ser
85 90 95
Ser Thr Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 18
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 18
Gln Ser Ala Leu Thr Gln Pro Pro Ser Leu Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly His Lys Val Gly Asp Lys Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Ser Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Ala Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Val
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Leu Ala Trp Val Pro Asn Ser Gly Tyr
85 90 95
Val Phe Gly Thr Gly Thr Gln Val Thr Val Val
100 105
<210> 19
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 19
Asn Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Thr Val Thr Ile Thr Cys Arg Ala Ser Gln Tyr Ile Ser Asp Arg
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Arg Pro Pro Lys Val Leu Ile
35 40 45
Tyr Arg Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Arg Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Ile Tyr Tyr Cys Gln Gln Ala Lys Asn Phe Pro Trp
85 90 95
Ala Phe Gly Gln Gly Thr Lys Val Glu Phe Lys
100 105
<210> 20
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 20
Asn Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Arg Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Phe Thr Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Ala Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr His Cys Gln Gln Ser Tyr Arg Ile Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 21
Asn Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Lys Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Gly Thr Ser
20 25 30
Leu Asn Trp Tyr Gln Gln Arg Pro Gly Thr Ala Pro Lys Leu Leu Ile
35 40 45
Phe Asp Thr Ser Asn Leu Glu Lys Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Lys Ser Glu Thr Tyr Phe Thr Phe Ala Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Asn Ile Pro Trp
85 90 95
Thr Phe Gly Arg Gly Thr Lys Val Glu Ile Thr
100 105
<210> 22
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 22
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15 15
Asp Ser Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Phe Thr Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Leu Gln Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Gly Gly Ser Gly Ala Glu Tyr Thr Leu Thr Ile Ser Asn Leu Gln Pro
65 70 75 80
Asp Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 23
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Tyr Ile Gly Thr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Asn Ser Val Ser Arg Leu Gln Thr Gly Val Pro Ser Arg Phe Thr Gly
50 55 60
Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Arg Val Glu Ile Lys
100 105
<210> 24
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 24
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Arg Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Gln Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45 5
Pro Gln Leu Leu Ile Tyr Glu Val Ser Ser Arg Phe Ser Gly Val Pro
50 55 60
Glu Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Glu Ile
65 70 75 80
Ser Arg Val Glu Ala Asp Asp Val Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Leu His Leu Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Val Lys
100 105 110
<210> 25
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 25
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15 35
Glu Ser Gly Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Asn Thr Arg
20 25 30
Tyr Leu Ala Trp Tyr Tyr Gln Arg Pro Gly Gln Val Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Thr Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Gly Asp Ser Gly Val Tyr Tyr Cys Gln Gln Ser Arg Ser Ser Gln
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 26
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 26
Val Ile Trp Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asn Ser Arg
20 25 30
Leu Val Trp Tyr Gln Gln Lys Pro Gly Thr Ala Pro Lys Val Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Val Lys
100 105
<210> 27
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 27
Asn Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Thr Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln His Lys Pro Gly Arg Ala Pro Arg Ser Leu Ile
35 40 45
Tyr Thr Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Asn Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala His Ser Phe Pro Trp
85 90 95
Ser Phe Gly Pro Gly Thr Asn Val Glu Ile Lys
100 105
<210> 28
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 28
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Lys Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Asp Ser Ala Thr Asn Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Leu Ala Phe Tyr Tyr Cys Gln Gln Gly Lys Ser Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 29
Gln Ser Val Val Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Gln
65 70 75 80
Thr Gly Asp Glu Ala Asp Tyr Tyr Cys Gly Thr Trp Asp Ser Ser Leu
85 90 95
Ser Ala Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 30
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 30
Ser Tyr Glu Leu Thr Gln Pro Leu Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Pro Cys Gly Gly Asn Asn Ile Gly Asn Lys Asn Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Arg Asp Thr Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly His Thr Ala Thr Leu Thr Ile Ser Gly Ala Gln Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Gly Thr Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 31
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 31
Ser Tyr Val Leu Thr Gln Pro Val Ser Val Ser Val Ala Arg Gly Gln
1 5 10 15
Thr Ala Thr Ile Thr Cys Glu Gly Asn His Ile Gly Asp Lys His Val
20 25 30
His Trp Tyr His Gln Arg Pro Gly Gln Ala Pro Ile Leu Val Met Phe
35 40 45
Arg Asp Ala Arg Arg Pro Ser Gly Ile Pro Glu Arg Leu Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Ala Gln Ala Gly
65 70 75 80
Asp Glu Gly Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Ala Val
85 90 95
Val Phe Gly Gly Gly Thr Lys Val Thr Val Val
100 105
<210> 32
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 32
Ser Val Leu Thr Gln Pro Pro Ser Leu Ser Ala Ala Pro Gly Gln Arg
1 5 10 15
Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn His Leu
20 25 30
Val Ser Trp His Gln Gln Phe Pro Gly Thr Ala Pro Lys Ala Leu Ile
35 40 45
Tyr Asp Asn Asp Arg Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Lys Ser Gly Thr Ser Ala Thr Leu Asp Ile Thr Gly Leu Gln Thr
65 70 75 80
Gly Asp Glu Ala Asp Tyr Tyr Cys Ala Thr Trp Asp Ala Ser Leu Arg
85 90 95
Ala Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 33
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 33
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Val Ser Cys Asn Gly Gly Ser Ser Asn Ile Gly Thr Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Ile
35 40 45
Val Ile Phe Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Gly Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Val Ile Ala Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Ser
85 90 95
Leu Ser Gly Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 34
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 34
Ser Tyr Val Leu Thr Gln Pro Arg Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Arg Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln Arg Pro Gly Lys Ala Pro Lys Val
35 40 45
Met Ile Tyr Asp Val Ile Lys Arg Pro Ser Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Pro Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ala
85 90 95
Ser Ser Phe Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 35
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 35
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Asn Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Ala Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Gln His Leu Pro Gly Thr Val Pro Lys Val Leu
35 40 45
Ile Ser Asp Asn Asp Gln Arg Ser Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Arg Met
85 90 95
Arg Gly Phe Val Phe Gly Ser Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 36
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 36
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15 30
Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Gln
65 70 75 80
Thr Gly Asp Glu Ala Asp Tyr Tyr Cys Gly Thr Trp Asp Ser Ser Leu
85 90 95
Ser Ala Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 37
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 37
Asn Phe Met Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Arg
20 25 30
Ala Val Ser Trp Tyr Gln His Val Pro Gly Lys Pro Pro Arg Leu Ile
35 40 45
Val Tyr His Asp Asp Val Leu Ser Ser Gly Val Ser Gly Arg Phe Ser
50 55 60
Ala Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Phe Cys Ala Ala Trp Asp Ala Arg Leu
85 90 95
Asn Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 38
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 38
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 39
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 39
Gln Ser Val Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Thr Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Ser Ser Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Thr Ser
85 90 95
Gly Thr Tyr Val Phe Gly Thr Gly Thr Thr Val Thr Val Leu
100 105 110
<210> 40
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 40
Gln Ser Ala Leu Thr Gln Pro Arg Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30 45
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Cys Ser Tyr Ala Gly Arg
85 90 95
Arg Gly Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 41
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 41
Gln Ser Ala Leu Thr Gln Pro Arg Ser Val Ser Ala Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Phe Tyr
20 25 30
Lys Tyr Val Ser Trp Tyr Gln Gln Tyr Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Cys Ser Tyr Ala Gly Ser
85 90 95
Asn Thr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105
<210> 42
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 42
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Arg Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Lys Ser Pro Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 43
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 43
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Arg Arg Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Lys Ser Pro Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 44
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 44
Ser Tyr Val Leu Thr Gln Pro Val Ser Val Ser Val Ala Arg Gly Gln
1 5 10 15
Thr Ala Thr Ile Thr Cys Glu Gly Asn His Ile Gly Asp Lys His Val
20 25 30
His Trp Tyr His Gln Arg Pro Gly Gln Ala Pro Ile Leu Val Met Phe
35 40 45
Arg Asp Ala Arg Arg Pro Ser Gly Ile Pro Glu Arg Leu Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Ala Gln Ala Gly
65 70 75 80
Asp Glu Gly Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Tyr Thr
85 90 95
Val Phe Gly Gly Gly Thr Lys Val Thr Val Val
100 105
<210> 45
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 45
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Tyr
20 25 30
Asp Ile Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg Arg Glu Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 46
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 46
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Asn Met Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe
50 55 60
Gln Asp Arg Val Ile Met Thr Val Asp Lys Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr His Cys
85 90 95
Ala Arg Arg Lys Ser Tyr Gly Tyr Tyr Leu Asp Glu Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 47
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> An artificially synthesized peptide sequence
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Arg Asn Ile Glu Arg Gln
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Asp Pro Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО, КОТОРОЕ ОБЛАДАЕТ СПОСОБНОСТЬЮ НЕЙТРАЛИЗОВАТЬ СУБСТАНЦИЮ, ОБЛАДАЮЩУЮ АКТИВНОСТЬЮ, АЛЬТЕРНАТИВНОЙ ФУНКЦИИ ФАКТОРА СВЕРТЫВАНИЯ VIII (FVIII) | 2015 |
|
RU2737145C2 |
| МУЛЬТИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, ОБЛАДАЮЩАЯ ЗАМЕЩАЮЩЕЙ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТЬЮ КОФАКТОРА КОАГУЛИРУЮЩЕГО ФАКТОРА КРОВИ VIII, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ МОЛЕКУЛУ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2018 |
|
RU2812909C2 |
| СПОСОБ ИЗМЕРЕНИЯ РЕАКТИВНОСТИ FVIII | 2015 |
|
RU2752595C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| ВАРИАНТЫ И ИЗОФОРМЫ АНТИТЕЛ С ПОНИЖЕННОЙ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2813990C2 |
| ПРЕПАРАТ, СОДЕРЖАЩИЙ АНТИТЕЛО | 2017 |
|
RU2748046C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ FC-РЕЦЕПТОР-ПОДОБНОГО БЕЛКА 5, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2774158C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2788531C2 |
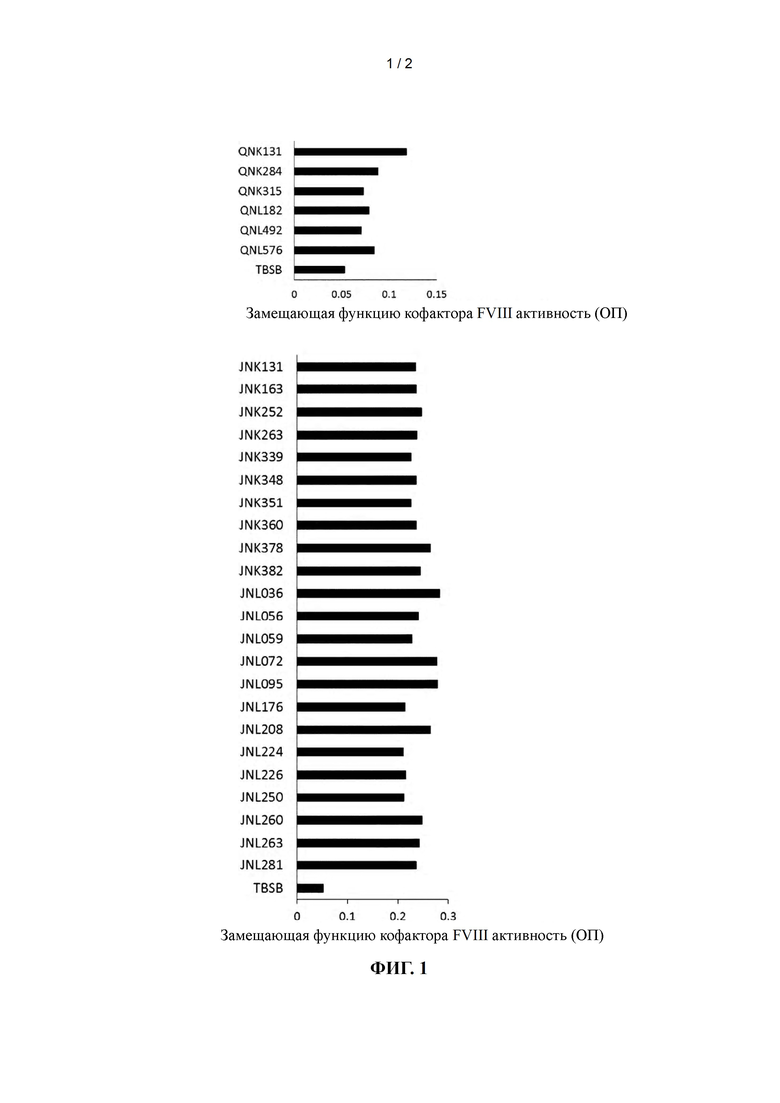
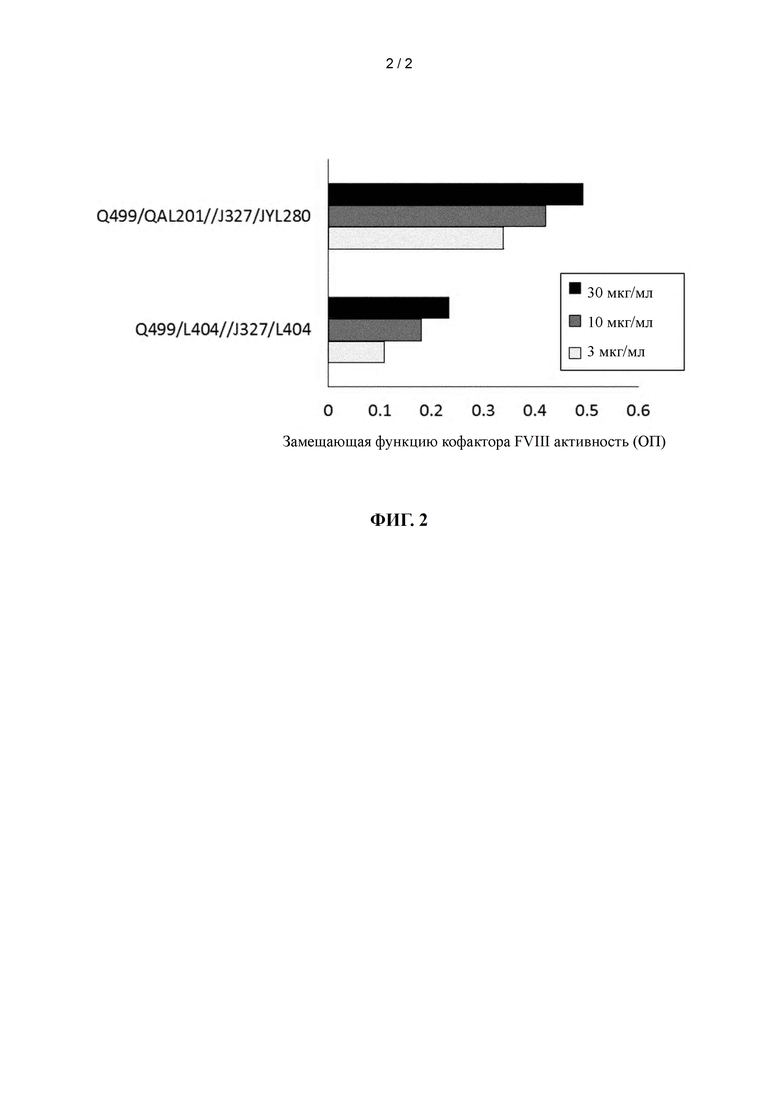
Изобретение относится к области биотехнологии. Предложены биспецифические антитела, которые распознают FIX и/или FIXa и FX, и способы их получения. Антитела включают аминокислотные замены в CDR-последовательностях легкой или тяжелой цепи, которые повышают замещающую функцию кофактора FVIII активность антитела по сравнению с АСЕ910 (эмицизумабом). 6 н.п. ф-лы, 2 ил., 4 табл., 4 пр.
1. Биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, в котором первый полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 45, а второй полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 46, в котором либо третий, либо четвертый полипептид содержит аминокислотную последовательность вариабельного домена легкой цепи антитела SEQ ID NO: 47, а другой полипептид содержит вариабельный домен легкой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, или вариабельный домен легкой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 47, в котором в другом полипептиде одна аминокислота, выбранная из группы, состоящей из K24, A25, S26, R27, N28, I29, E30, R31, Q32, L33, A34, Q50, A51, S52, R53, K54, E55, S56, Q89, Q90, S92, D93, P94, P95, L96 и T97, которые пронумерованы согласно системе нумерации по Кэботу, заменена другой аминокислотой, где другой аминокислотой является одна из следующих аминокислот, когда третий полипептид является другим полипептидом:
K24: A, I, L, M, V, G, N, Q, S, T, D, E, H, R, W или Y;
A25: I, L, M, P, V, G, N, S, T, F или W;
S26: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W или Y;
R27: A, L, M, V, G, N, Q, S, H, K, W или Y;
N28: A, I, M, P, V, G, Q, S, T, D, H, K, R, F, W или Y;
I29: A, L, M, P, V, G, N, Q, S, T или R;
E30: A, I, M, P, V, G, N, Q, S, D, H, K, R, F, W или Y;
R31: Q, S или K;
Q32: A, L, M, V, G, N, S, E, H, K, R или Y;
L33: A, I, M, V, N, Q, S, T, D, E, H, K или F;
A34: I, V, G, S или T;
Q50: A, L, M, V, G, S, E, H, K, R, F или W;
A51: G, S или T;
S52: V, G, T, H, R, W или Y;
R53: I, L, M, K, F или Y;
K54: A, I, L, M, P, V, G, Q, S, T, D, H, R, F, W или Y;
E55: A, I, L, M, P, V, G, N, T, D, H, K или F;
S56: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W или Y;
Q89: A, S, T, E или Y;
Q90: H;
S92: I, N, H, K или R;
D93: L, M, V, N, Q, S, T, H, K, R, F или Y;
P95: G или K;
L96: A, M, P, G, Q, S, F или W; и
T97: I, G, Q или S и
где другой аминокислотой является одна из следующих аминокислот, когда четвертый полипептид является другим полипептидом:
K24: A, I, L, M, V, Q, S, T, D, E, H, R, W или Y;
A25: S или T;
S26: A, L, P, G, Q, T, D, H, K, R или W;
R27: M, V, N, Q, T, E, H или K;
N28: A, I, L, M, P, V, S, D или E;
I29: F;
E30: A, I, L, M, V, N, H, K, R, F или W;
Q32: M, G, S, K или R;
L33: A, M, N, T или F;
A34: I, V, G или S;
Q50: K, R, F или Y;
A51: I, M, V или S;
S52: A, I, L, V, N, T, H, R или F;
R53: K;
K54: L, M, Q или F;
E55: A, I, M, P, V, G, N, S, T, D, H, K, R, F или Y;
S56: K;
Q89: M или V;
S92: K или R;
D93: A, I, L, M, G, Q, T, E, H, K, R, F, W или Y;
P94: A, I, L, M, V, S, H или Y;
L96: A, I или T; и
T97: I, V, S или K.
2. Биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, в котором второй полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, третий полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 42 и четвертый полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 44, и первый полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 45, и в котором в первом полипептиде одна аминокислота, выбранная из группы, состоящей из Y31, Y32, I34, Q35, S50, I51, S52, P52a, S53, G54, Q55, S56, T57, Y58, Y59, R60, R61, E62, V63, K64, G65, R95, T96, G97, R98, E99, Y100, G100a, G100b, G100c, W100d, Y100e, F100f, D101 и Y102, которые пронумерованы согласно системе нумерации по Кэботу, заменена на любую из следующих аминокислот:
Y31: H или W;
Y32: I, V, N, Q, T, D, K или F;
I34: A, L, M, G, Q, T, E, K, F или W;
Q35: I, L, P, V, G, S, T или K;
S50: A, M, G, N, D, F, W или Y;
I51: V;
S52: A, I, V, N, Q, D, H, F, W или Y;
P52a: G, Q или Y;
S53: G, T или H;
G54: A или S;
Q55: G, H или R;
S56: L, M, G, D, H, R или Y;
T57: A, I, L, M, V, Q, S, E, H, K, F, W или Y;
Y58: I, L, V, N, T, D, H, K, F или W;
Y59: E;
R60: A, I, L, M, P, V, G, Q, S, T, H, K или F;
R61: A, I, L, M, P, V, G, N, Q, T, D, H, F или W;
E62: A, I, L, M, P, V, G, N, Q, S, T, D, H, K или W;
V63: A, I, L, M, T, H, F или Y;
K64: A, I, L, M, V, G, Q, S, T, H, R или Y;
G65: A, I, L, M, V, N, Q, S, T, D, E, H, K, R, F, W или Y;
R95: Q или K;
T96: A, M, V, N, Q, S, D, E, H, F, W или Y;
G97: P, N, S, D, E, H, W или Y;
R98: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, F, W или Y;
E99: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W или Y;
Y100: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F или W;
G100a: A, I, L, M, N, S, T, D, H, K, R, F, W или Y;
G100b: A, N, S, T, D или E;
G100c: N;
W100d: H, F или Y;
Y100e: A, I, L, M, V, N, Q, S, T, D, E, H, K, F или W;
F100f: A, I, L, M, P, V, N, Q, S, T, D или E;
D101: A, I, L, M, P, V, G, N, Q, S, T, E, H, K, R, F, W или Y; и
Y102: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F или W.
3. Биспецифическое антитело, которое распознает FIX и/или FIXa и FX, в котором первый полипептид и третий полипептид образуют пару и второй полипептид и четвертый полипептид образуют пару, в котором первый полипептид содержит аминокислотную последовательность тяжелой цепи антитела SEQ ID NO: 45, третий полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 43 и четвертый полипептид содержит аминокислотную последовательность легкой цепи антитела SEQ ID NO: 44, и второй полипептид содержит вариабельный домен тяжелой цепи антитела, имеющий аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, или вариабельный домен тяжелой цепи антитела, имеющий аминокислотную последовательность SEQ ID NO: 46, и в котором во втором полипептиде одна аминокислота, выбранная из группы, состоящей из D31, N32, N33, M34, D35, D50, I51, T52a, N52, R53, S54, G55, G56, S57, I58, Y59, N60, E61, E62, F63, Q64, D65, R95, K96, S97, Y98, G99, Y100, Y100a, L100b, D101 и E102, которые пронумерованы согласно системе нумерации по Кэботу, заменена на любую из следующих аминокислот:
D31: I, L, M, V, G, N, Q, S, T, E, H, K, R, F, W или Y;
N32: A, M, V, G, Q, S, T, H, K, R, F, W или Y;
N33: I, L, M, V, G, Q, S или K;
M34: A, I, L, V, T, H, F, W или Y;
D35: A, I, L, M, V, G, N, Q, S, E, H, F, W или Y;
D50: A, V, G, N, Q, S, T или E;
I51: A, L, M, V, G, Q, S, T, K, F или Y;
N52: A, S или H;
T52a: A, I, L, M, P, V, G, S, F или W;
R53: A, I, L, M, P, V, G, N, Q, S, D, E, H, K, F, W или Y;
S54: A, I, L, M, V, G, N, Q, T, D, E, H, K, R, F, W или Y;
G55: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W или Y;
G56: A, I, L, M, V, N, Q, S, T, D, E, H, K, R, F, W или Y;
S57: A, I, L, M, P, V, G, N, Q, T, D, H или W;
I58: A, L, M, V, G, N, Q, S, T, E, H, K, R, F, W или Y;
Y59: A, I, L, M, V, G, N, Q, S, T, D, E, H, K, R, F или W;
N60: A, I, L, M, P, V, G, Q, S, T, D, E, H, K, R, F, W или Y;
E61: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W или Y;
E62: A, I, L, M, P, V, G, N, Q, S, T, H, K, R, F, W или Y;
F63: A, I, L, M, V, G, N, Q, S, D, E, H, K, R, W или Y;
Q64: A, I, L, M, P, V, G, N, S, T, D, E, H, K, R, F, W или Y;
D65: A, L, M, P, G, N, Q, S, T, E, H, K, R, F, W или Y;
R95: L, H или K;
K96: A, I, L, M, V, G, Q, S, T, H, R, F, W или Y;
S97: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, F, W или Y;
Y98: A, I, L, M, V, G, N, Q, S, H, K, R, F или W;
G99: A, M, N, Q, S, T, D, E, H, K, R, F, W или Y;
Y100: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F или W;
Y100a: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F или W;
L100b: A, I, M, V, N, Q, S, T, D, H, F, W или Y;
D101: A, I, L, M, P, V, G, N, Q, S, T, E, H, K или R; и
E102: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W или Y.
4. Биспецифическое антитело, которое распознает FIX и/или FIXa и FX, где первый полипептид и третий полипептид образуют пару, и второй полипептид и четвертый полипептид образуют пару, где первый полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 45, второй полипептид содержит аминокислотную последовательность вариабельного домена тяжелой цепи антитела SEQ ID NO: 46, третий полипептид содержит легкую цепь антитела, содержащую аминокислотную последовательность SEQ ID NO: 43, а четвертый полипептид содержит легкую цепь антитела, содержащую аминокислотную последовательность SEQ ID NO: 44.
5. Способ получения варианта эмицизумаба, который включает следующую стадию (a), на которой:
(a) осуществляют одну из следующих замен (i)-(ii), где нумерация соответствует системе нумерации по Кэботу:
(i) замена одной аминокислоты, выбранной из группы, состоящей из K24, A25, S26, R27, N28, I29, E30, R31, Q32, L33, A34, Q50, A51, S52, R53, K54, E55, S56, Q89, Q90, S92, D93, P95, L96 и T97, в вариабельном домене легкой цепи на поверхности анти-FIX(a) антитела, содержащей аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, на одну из следующих аминокислот:
K24: A, I, L, M, V, G, N, Q, S, T, D, E, H, R, W или Y;
A25: I, L, M, P, V, G, N, S, T, F или W;
S26: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W или Y;
R27: A, L, M, V, G, N, Q, S, H, K, W или Y;
N28: A, I, M, P, V, G, Q, S, T, D, H, K, R, F, W или Y;
I29: A, L, M, P, V, G, N, Q, S, T или R;
E30: A, I, M, P, V, G, N, Q, S, D, H, K, R, F, W или Y;
R31: Q, S или K;
Q32: A, L, M, V, G, N, S, E, H, K, R или Y;
L33: A, I, M, V, N, Q, S, T, D, E, H, K или F;
A34: I, V, G, S или T;
Q50: A, L, M, V, G, S, E, H, K, R, F или W;
A51: G, S или T;
S52: V, G, T, H, R, W или Y;
R53: I, L, M, K, F или Y;
K54: A, I, L, M, P, V, G, Q, S, T, D, H, R, F, W или Y;
E55: A, I, L, M, P, V, G, N, T, D, H, K или F;
S56: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W или Y;
Q89: A, S, T, E или Y;
Q90: H;
S92: I, N, H, K или R;
D93: L, M, V, N, Q, S, T, H, K, R, F или Y;
P95: G или K;
L96: A, M, P, G, Q, S, F или W; и
T97: I, G, Q или S, или
(ii) замена аминокислоты, выбранной из группы, состоящей из K24, A25, S26, R27, N28, I29, E30, Q32, L33, A34, Q50, A51, S52, R53, K54, E55, S56, Q89, S92, D93, P94, L96 и T97, в вариабельном домене легкой цепи на поверхности анти-FX антитела, содержащей аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, на одну из следующих аминокислот:
K24: A, I, L, M, V, Q, S, T, D, E, H, R, W или Y;
A25: S или T;
S26: A, L, P, G, Q, T, D, H, K, R или W;
R27: M, V, N, Q, T, E, H или K;
N28: A, I, L, M, P, V, S, D или E;
I29: F;
E30: A, I, L, M, V, N, H, K, R, F или W;
Q32: M, G, S, K или R;
L33: A, M, N, T или F;
A34: I, V, G или S;
Q50: K, R, F или Y;
A51: I, M, V или S;
S52: A, I, L, V, N, T, H, R или F;
R53: K;
K54: L, M, Q или F;
E55: A, I, M, P, V, G, N, S, T, D, H, K, R, F или Y;
S56: K;
Q89: M или V;
S92: K или R;
D93: A, I, L, M, G, Q, T, E, H, K, R, F, W или Y;
P94: A, I, L, M, V, S, H или Y;
L96: A, I или T; и
Т97: I, V, S или K.
6. Способ выделения варианта эмицизумаба, который включает указанные ниже стадии (a)-(в), на которых:
(a) получают вариант эмицизумаба, осуществляя одну или несколько из следующих замен (i)-(iv), где нумерация соответствует системе нумерации по Кэботу:
(i) замена одной аминокислоты, выбранной из группы, состоящей из K24, A25, S26, N28, I29, L33, A34, A51, S56, Q89, Q90, L96 и T97, в вариабельном домене легкой цепи на поверхности анти-FIX(а) антитела, содержащей аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, на одну из следующих аминокислот:
K24: A, I, L, M, V, G, N, Q, S, T, D, E, H, R, W или Y;
A25: I, L, M, P, V, G, N, S, T, F или W;
S26: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W или Y;
N28: A, I, M, P, V, G, Q, S, T, D, H, K, R, F, W или Y;
I29: A, L, M, P, V, G, N, Q, S, T или R;
L33: A, I, M, V, N, Q, S, T, D, E, H, K или F;
A34: I, V, G, S или T;
A51: G, S или T;
S56: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, R, F, W или Y;
Q89: A, S, T, E или Y;
Q90: H;
L96: A, M, P, G, Q, S, F или W; и
T97: I, G, Q или S;
(ii) замена аминокислоты, выбранной из группы, состоящей из K24, A25, S26, N28, I29, L33, A34, А51, S56, Q89, L96 и T97, в вариабельном домене легкой цепи поверхности анти-FX антитела, содержащей аминокислотные последовательности CDR 1, 2 и 3 легкой цепи SEQ ID NO: 7, 8 и 9 соответственно, на одну из следующих аминокислот:
K24: A, I, L, M, V, Q, S, T, D, E, H, R, W или Y;
A25: S или T;
S26: A, L, P, G, Q, T, D, H, K, R или W;
N28: A, I, L, M, P, V, S, D или E;
I29: F;
L33: A, M, N, T или F;
A34: I, V, G, Q или S;
A51: I, M, V или S;
S56: K;
Q89: M или V;
L96: A, I или T; и
T97: I, V, S или K;
(iii) замена одной аминокислоты, выбранной из группы, состоящей из Y31, Y32, S50, I51, S52, P52a, S53, G54, Q55, S56, T57, Y58, Y59, R60, V63, K64, G65, R95, G97, E99, G100a, G100c, W100d, Y100e, F100f, D101 и Y102, в вариабельном домене тяжелой цепи на поверхности анти-FIX(a) антитела, содержащей аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 1, 2 и 3 соответственно, на одну из следующих аминокислот:
Y31: S, H или W;
Y32: I, V, N, Q, T, D, K или F;
S50: A, I, M, G, N, D, F, W или Y;
I51: V;
S52: A, I, V, G, N, Q, D, H, F, W или Y;
P52a: G, Q или Y;
S53: G, T или H;
G54: A или S;
Q55: G, H или R;
S56: L, M, G, D, H, R или Y;
T57: A, I, L, M, V, Q, S, E, H, K, F, W или Y;
Y58: I, L, V, N, T, D, H, K, F или W;
Y59: M, V, E или F;
R60: A, I, L, M, P, V, G, Q, S, T, H, K или F;
V63: A, I, L, M, P, T, H, F или Y;
K64: A, I, L, M, V, G, Q, S, T, H, R или Y;
G65: A, I, L, M, V, N, Q, S, T, D, E, H, K, R, F, W или Y;
R95: Q или K;
G97: P, N, S, D, E, H, W или Y;
E99: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W или Y;
G100a: A, I, L, M, N, S, T, D, H, K, R, F, W или Y;
G100c: N;
W100d: H, F или Y;
Y100e: A, I, L, M, V, G, N, Q, S, T, D, E, H, K, F или W;
F100f: A, I, L, M, P, V, N, Q, S, T, D или E;
D101: A, I, L, M, P, V, G, N, Q, S, T, E, H, K, R, F, W или Y; и
Y102: A, I, L, M, P, V, G, N, Q, S, T, D, E, H, K, R, F или W; и
(iv) замена одной аминокислоты, выбранной из группы, состоящей из D31, N32, N33, M34, D50, I51, T52a, N52, S54, G55, G56, S57, I58, Y59, N60, E61, E62, F63, Q64, D65, R95, S97, G99, L100b, D101 и E102, в вариабельном домене тяжелой цепи на поверхности анти-FX антитела, содержащей аминокислотные последовательности CDR 1, 2 и 3 тяжелой цепи SEQ ID NO: 4, 5 и 6 соответственно, на одну из следующих аминокислот:
D31: I, L, M, V, G, N, Q, S, T, E, H, K, R, F, W или Y;
N32: A, M, V, G, Q, S, T, H, K, R, F, W или Y;
N33: I, L, M, V, G, Q, S или K;
M34: A, I, L, V, T, H, F, W или Y;
D50: A, V, G, N, Q, S, T или E;
I51: A, L, M, V, G, Q, S, T, K, F или Y;
N52: A, S или H;
T52a: A, I, L, M, P, V, G, S, F или W;
S54: A, I, L, M, V, G, N, Q, T, D, E, H, K, R, F, W или Y;
G55: A, I, L, M, P, V, N, Q, S, T, D, E, H, K, R, F, W или Y;
G56: A, I, L, M, V, N, Q, S, T, D, E, H, K, R, F, W или Y;
S57: A, I, L, M, P, V, G, N, Q, T, D, H или W;
I58: A, L, M, V, G, N, Q, S, T, E, H, K, R, F, W или Y;
Y59: A, I, L, M, V, G, N, Q, S, T, D, E, H, K, R, F или W;
N60: A, I, L, M, P, V, G, Q, S, T, D, E, H, K, R, F, W или Y;
E61: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W или Y;
E62: A, I, L, M, P, V, G, N, Q, S, T, H, K, R, F, W или Y;
F63: A, I, L, M, V, G, N, Q, S, D, E, H, K, R, W или Y;
Q64: A, I, L, M, P, V, G, N, S, T, D, E, H, K, R, F, W или Y;
D65: A, L, M, P, G, N, Q, S, T, E, H, K, R, F, W или Y;
R95: L, M, V, H или K;
S97: A, I, L, M, P, V, G, N, Q, T, D, E, H, K, F, W или Y;
G99: A, M, N, Q, S, T, D, E, H, K, R, F, W или Y;
L100b: A, I, M, V, N, Q, S, T, D, H, F, W или Y;
D101: A, I, L, M, P, V, G, N, Q, S, T, E, H, K или R; и
E102: A, I, L, M, P, V, G, N, Q, S, T, D, H, K, R, F, W или Y;
(б) оценивают замещающую функцию кофактора FVIII активность варианта, полученного на стадии (а); и
(в) отбирают вариант эмицизумаба, который обладает повышенной замещающей функцию кофактора FVIII активностью по сравнению с эмицизумабом.
| US 2013330345 A1, 12.12.2013 | |||
| WO 2015194233 A1, 23.12.2015 | |||
| WO 2016001810 A1, 07.01.2016 | |||
| MUTO A | |||
| et al., Anti-factor IXa/X bispecific antibody (ACE910): hemostatic potency against ongoing bleeds in a hemophilia A model and the possibility of routine supplementation, Journal of Thrombosis and Haemostasis, 2014, Volume 12, Issue 2, pp.206-213 |
Авторы
Даты
2024-06-25—Публикация
2017-07-27—Подача