Данное изобретение относится, в целом, к области молекулярной биологии и касается способа изменения различных аспектов роста и/или развития растения путем модулирования в растении экспрессии нуклеиновой кислоты, кодирующей Убиквитин-Специфичную Протеазу (UBiquitin-Specific Protease (UBP)) из подсемейства UBP15 или ее гомолог. Данное изобретение также касается растений с модулированной экспрессией нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог, такие растения изменили рост и/или развитие по сравнению с соответствующими растениями дикого типа или другими контрольными растениями. Изобретение также описывает конструкции, применимые в способах по изобретению.
Постоянно растущая мировая популяция и сокращение запасов пахотных земель, пригодных для сельскохозяйственных культур, заставляют ученых искать пути улучшения эффективности сельского хозяйства. Обычными способами улучшения сельскохозяйственных и садовых культур является использование методов селективного разведения для идентификации растений, имеющих желаемые характеристики. Однако такие методы селективного разведения имеют несколько недостатков, а именно такие методы являются, как правило, трудоемкими, а полученные в результате растения часто содержат гетерогенные генетические компоненты, которые при передаче от родительских растений могут не всегда приводить к желаемым признакам. Достижения в молекулярной биологии позволили человечеству изменять идиоплазму животных и растений. Генная инженерия растений включает выделение и манипуляции генетическим материалом (как правило, в виде ДНК или РНК) и последующее введение этого генетического материала в растение. Такая технология способна произвести сельскохозяйственные культуры или растения, имеющие различные улучшенные экономические, агрономические и садоводческие признаки.
Обнаружили, что рост и/или развитие растения могут быть изменены путем модулирования в растении экспрессии нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог.
Уровень техники
Убиквитин-Специфичные Протеазы (UBPs) являются консервативным семейством белков эукариот, которые играют важнейшие роли в деубиквитинилировании белков. Ковалентная модификация белков убиквитином играет центральную роль в различных клеточных процессах, таких как прогрессия клеточного цикла, сигнальная трансдукция, регуляция транскрипции, репарация ДНК, реакции на стресс, эндоцитоз и апоптоз (Hochstrasser, 1996; Varshavsky, 1997; Hershko and Ciechanover, 1998; Weissman, 2001; Pickart, 2004). Убиквитинилирование белков катализирует каскад из трех ферментов. Сначала убиквитин активируется с помощью убиквитин-активирующего фермента (Е1), который образует тиоэфирную связь с С-концом убиквитина. Затем убиквитин переносится на транспортный фермент (Е2) (убиквитин-связывающий фермент). Несмотря на то что некоторые Е2 ферменты могут катализировать связывание С-конца убиквитина с лизиновым остатком белков-мишеней с помощью убиквитинлигаз (Е3), другие ферменты Е2 переносят конъюгированный с ними убиквитин на ферменты Е3 перед связыванием с субстратами. Субстратный белок-мишень может быть моноубиквитинилирован или мультиубиквитинилирован путем последовательного конъюгирования С-конца убиквитина с лизиновым остатком предыдущего убиквитина посредством нескольких возможных связываний. Судьба убиквитинилированных субстратных белков зависит отчасти от количества конъюгированных убиквитинов и от способа связи в цепочке убиквитинов. Наиболее часто убиквитинилирование представлено мультиубиквитиновой цепочкой (количество убиквитинов >=4), связанной через Lys48, действующей как сигнал для деградации белка в 26S протеосоме.
Отщепление убиквитина от белков с помощью деубиквитинилирующих ферментов (DUBs) также может влиять на активность и судьбу убиквитинилированных субстратных белков (Wilkinson, 1997; Amerik and Hochstrasser, 2004; Crosas et al., 2006; Hanna et al., 2006). Эти DUBs являются протеазами, специфически расщепляющими пептидные связи между убиквитинами или между С-концом убиквитина и ковалентно связанными полипептидами. В настоящее время известно, что DUBs одновременно выполняют четыре типа основных биохимических функций: во-первых, они образуют зрелый убиквитин из предшественников убиквитина (пришитых к рибосомному белку) и полиубиквитиновых продуктов гена; во-вторых, они спасают белки, которые были ошибочно убиквитинилированы; в-третьих, они отщепляют убиквитин (цепочки) от связанных субстратных белков; и, в-четвертых, высвобождают мономеры убиквитина из мультиубиквитиновых цепочек. Последние три роли сопровождаются расщеплением изопептидных связей между Gly С-конца убиквитина и аминокислотным остатком Lys белка-мишени.
Цистеиновые протеазы и металлопротеазы представляют две большие группы суперсемейства DUB, вместе с цистеиновыми протеазами являются наиболее многочисленными в эукариотах (Nijman et al., 2005). Все известные металлопротеазы для каталитической активности имеют домен JAMM (Verma et al., 2002). Цистеиновые протеазы из семейства DUB могут быть разделены на четыре группы на основе организации структуры каталитического центра убиквитин-протеазы и организации (Wilkinson, 1997; Amerik and Hochstrasser, 2004; Nijman et al., 2005). Убиквитин-Специфичные Протеазы (UBP или USPs, как они были названы у млекопитающих) содержат каталитическую триаду остатков в высоко консервативном цистеиновом боксе и гистидиновом боксе (Ни et al., 2002). С-концевые Убиквитин Гидралазы (UCHs), со сходной каталитической триадой остатков в двух консервативных цистеиновых и гистидиновых боксах (Johnston et al., 1997; Johnston et al., 1999), имеют меньший размер, а также структурные ограничения каталитической поверхности, которые ограничивают их способность к гидролизу только небольшими амидами и эфирами на С-конце убиквитина (Amerik and Hochstrasser, 2004). Протеазы из опухолей яичек (OTUs) имеют каталитическую триаду, аналогичную вышеуказанным двум группам в Цистеиновом и Гистединовом боксах, но содержат OTU-родственный мотив и рассматриваются как часть UBP семейства (Balakirev et al., 2003; Nanao et al., 2004). Наконец, Протеин Доменные Протеазы болезни Мачадо-Джозефа (MJDs) содержат домены, похожие на гистидиновый и цистеиновый боксы, но с довольно низким сходством последовательностей с остальными тремя группами (Burnett et al., 2003; Scheel et al., 2003). Семейство UBP составляет основную часть цистеиновых протеаз. Все четыре типа упомянутых выше биохимических функций DUB найдены в семействе UBPs, в то время как UCHs выполняют свои функции только на маленьких белках и предшественнике убиквитина.
На модели растения Арабидопсис Таля (Arabidopsis Thaliana) анализ in silico полной последовательности генома, основанный на наличии консервативных Cys и His боксов, выявил в общей сложности 27 UBPs; эти 27 UBPs были затем разделены на 14 подсемейств (Yan et al., 2000). Предыдущие сообщения показали, что UBP3 и UBP4 составляют одно подсемейство, обладают UBP активностью in vitro и присутствуют в ядре (Chandler et al., 1997; Rao-Naik et al., 2000). Было показано, что другой член, UBP5, также обладает деубиквитинилирующей активностью in vitro (Rao-Naik et al., 2000). Сообщалось, что генетический анализ UBP1 и UBP2, членов другого подсемейства, показал их необходимость для устойчивости к аналогу аминокислоты канаванину (Yan et al., 2000). Кроме того, было показано, что мутация, вызывающая потерю функции UBP14, приводит к летальному исходу на стадии раннего эмбриогенеза (Doelling et al., 2001).
Краткое описание изобретения
Удивительно, но в настоящее время было установлено, что модулирование экспрессии нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог, дает растениям измененный рост и/или развитие по сравнению с контрольными растениями.
В соответствии с одним вариантом выполнения изобретения, в данном изобретении описан способ изменения роста и/или развития растения по сравнению с контрольными растениями, содержащий модулирование в растении экспрессии нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог.
Определение
Полипетид(ы)/Белок (белки)
Термины "полипептид" и "белок" используются в этом документе взаимозаменяемо и относятся к аминокислотам в полимерной форме любой длины, соединенным пептидными связями.
Полинуклеотид(ы)/Нуклеиновая кислота(ы)/Последовательность(и) нуклеиновых кислот/последовательность(и) нуклеотидов
Термины "полинуклеотид(ы)", "последовательность(и) нуклеиновых кислот", "последовательность(и) нуклеотидов", "нуклеиновая кислота(ы)", "молекула нуклеиновой кислоты" используются в этом документе взаимозаменяемо и относятся к нуклеотидам, либо рибонуклеотидам, или дезоксирибонуклеотидам, или к комбинации обоих в неразветвленной полимерной форме любой длины.
Контрольное(ые) растение(я)
Выбор подходящих контрольных растений является обычной частью постановки эксперимента и может включать соответствующие растения дикого типа или соответствующие растения без гена, представляющего интерес. Контрольное растение является, как правило, растением того же вида или даже того же сорта, как и опытное растение. Контрольное растение также может быть нулевой гомозиготой (нульзиготой) опытного растения. Нульзиготами являются особи, потерявшие трансген путем сегрегации. "Контрольное растение", как используется в этом документе, относиться не только к целым растениям, но также к частям растения, включая семена и части семян.
Гомолог(и)
"Гомолог(и)" белка охватывает(ют) пептиды, олигопептиды, полипептиды, белки и ферменты, имеющие аминокислотные замены, делеции и/или вставки, по сравнению с немодифицированным исследуемым белком, и имеющие сходную с немодифицированным белком, из которого они получены, биологическую и функциональную активность.
Делеция относится к удалению из белка одной или более аминокислот.
Вставка относится к внедрению одной или нескольких аминокислот в заданный участок белка. Вставки могут содержать N-концевые и/или С-концевые слияния, также как вставки одной или нескольких аминокислот внутри последовательности. Как правило, вставки внутри последовательности аминокислот будут меньше, чем N- или С-концевые слияния, примерно от 1 до 10 остатков. Примеры N- или С-концевых слитых белков или пептидов включают связывающий домен или активирующий домен активатора транскрипции, как используют в двухгибридной системе в дрожжах, белки оболочки фага, гистидин-6 метку, глутатион-8-трансферазную метку, А белок, мальтоз-связывающий белок, дигидрофолатредуктазу, эпитоп Tag·100, эпитоп с-myc, FLAG®-эпитоп, lacZ, CMP (кальмодулин-связывающий пептид), НА эпитоп, эпитоп С-белка и VSV эпитоп.
Замена относится к замещению аминокислот белка другими аминокислотами, имеющими схожие свойства (такие как сходную гидрофобность, гидрофильность, антигенность, склонность к образованию или разрыванию α-спиральных структур или структур β-листа). Обычно замещают один аминокислотный остаток, но могут быть кластерные замены, в зависимости от функциональных ограничений, наложенных на полипептид; обычно вставки будут примерно от 1 до 10 аминокислотных остатков. Вставки аминокислот являются предпочтительно заменами консервативных аминокислот. Таблицы консервативных замен общеизвестны в данной области техники (см., например, Creighton (1984) Proteins. W.H.Freeman and Company (Eds) и Таблицу А ниже).
Аминокислотные замены, делеции и/или вставки могут быть легко сделаны с помощью методики пептидного синтеза, общеизвестной в данной области техники, такой как твердофазный пептидный синтез и тому подобное, или манипуляциями с рекомбинантной ДНК. Способы манипуляции последовательностями ДНК для производства вариантов белка с заменой, вставкой или делецией общеизвестны в данной области техники. Например, методы получения мутаций с помощью замены в заданных участках ДНК общеизвестны специалистам в данной области техники и включают мутагенез с использованием фага М13, мутагенез in vitro с помощью T7-Gen (USB, Cleveland, ОН), QuickChange сайт-направленный мутагенез (Stratagene, San Diego, СА), сайт-направленный мутагенез методом ПЦР или другие протоколы сайт-направленного мутагенеза.
Производные
"Производные" включают пептиды, олигопептиды, полипептиды, которые могут содержать замены аминокислот на аминокислотные остатки, не встречающиеся в природе (искусственного происхождения), или добавление аминокислотных остатков, не встречающихся в природе, по сравнению с аминокислотной последовательностью, встречающейся в природе формы белка, такой как белок, представляющий интерес. "Производные" белка также охватывают пептиды, олигопептиды, полипептиды, которые содержат встречающиеся в природе измененные (гликозилированные, ацилированные, пренилированные, фосфорилированные, миристоилированные, сульфатированные и т.д.) или не встречающиеся в природе измененные аминокислотные остатки по сравнению с аминокислотной последовательностью встречающейся в природе формы полипептида. Производные также могут содержать один или более не аминокислотных заменителей или присоединений по сравнению с аминокислотной последовательностью, из которой они получены, например репортерная молекула или другой лиганд, ковалентно или нековалентно связанные с аминокислотной последовательностью, такие как репортерная молекула, которую присоединяют для облегчения ее обнаружения, и не встречающиеся в природе аминокислотные остатки по сравнению с аминокислотной последовательностью встречающегося в природе белка. Кроме того, "производные" также включают слияния встречающейся в природе формы белка с мечеными пептидами, такими как FLAG, HIS6 или тиоредоксин (для обзора меченых пептидов см. Terpe, Appl. Microbiol. Biotechnol. 60, 523-533, 2003).
Ортолог(и)/Паралог(и)
Ортологи или паралоги охватывают эволюционные концепции, используемые для описания родственных отношений генов. Паралоги являются генами в пределах одного вида, которые возникли путем дублирования генов-предшественников, ортологи являются генами из разных видов организмов, которые возникли путем видообразования, и также происходят из общего гена-предшественника.
Домен
Термин "домен" относится к набору аминокислот, сохраняющихся на определенной позиции при сравнении линейной последовательности эволюционно родственных белков. Хотя аминокислоты в других позициях могут варьировать между гомологами, высоко консервативные аминокислоты в определенных позициях указывают на аминокислоты, которые, вероятно, являются необходимыми для структуры, стабильности или функции белка. Выявленные по их высокой степени консервативности в линейных последовательностях семейства гомологов белков, они могут быть использованы в качестве маркеров для определения принадлежности исследуемого полипептида к ранее определенному семейству полипептидов.
Мотив/Консенсусная последовательность/Сигнатура
Термины "мотив", или "консенсусная последовательность", или "сигнатура" относятся к короткому консервативному участку последовательности эволюционно родственных белков. Мотивы часто являются высоко консервативными частями доменов, но могут также включать только часть домена, или быть расположены вне консервативного домена (если все аминокислоты мотива расположены вне определенного домена).
Гибридизация
Термин "гибридизация", как определено в этом документе, является процессом, где в значительной степени гомологичные комплементарные нуклеотидные последовательности отжигаются друг на друга. Процесс гибридизации может происходить полностью в растворе, т.е. обе комплементарные нуклеиновые кислоты находятся в растворе. Процесс гибридизации также может происходить, когда одна из комплементарных нуклеиновых кислот иммобилизована на матриксе, таком как магнитные шарики, гранулы Сефарозы или любой другой смолы. Кроме того, процесс гибридизации может происходить, когда одна из комплементарных нуклеиновых кислот иммобилизована на твердом носителе, таком как нитроцеллюлоза или нейлоновая мембрана, или иммобилизована, например, методом фотолитографии на, например, подложке из силиконового стекла (последние известны как матрицы нуклеиновых кислот или микропанели или как чипы нуклеиновых кислот). Для того чтобы гибридизация произошла, молекулы нуклеиновых кислот, как правило, термически или химически денатурируют для плавления двухцепочечной ДНК на две отдельные цепи и/или для удаления шпилек или других вторичных структур на одноцепочечных нуклеиновых кислотах.
Термин "жесткость" относится к условиям, при которых происходит гибридизация. Жесткость гибридизации зависит от таких условий, как температура, концентрация соли, ионной силы и состава буфера для гибридизации. Как правило, условия низкой жесткости выбираются так, чтобы температура была ниже, чем температура плавления (Tm) конкретной последовательности при определенной ионной силе и рН, примерно на 30°С. Условия средней жесткости, когда температура ниже Tm на 20°С, и условия высокой жесткости, когда температура ниже Tm на 10°С. Условия гибридизации высокой жесткости используют, как правило, для выделения гибридизуемых последовательностей, которые имеют высокую степень сродства последовательности с изучаемой последовательностью нуклеиновых кислот. Однако из-за вырожденности генетического кода нуклеиновые кислоты могут варьировать в последовательности и при этом кодировать в значительной степени одинаковый полипептид, поэтому иногда могут быть необходимы условия гибридизации средней жесткости для выявления таких молекул нуклеиновых кислот.
Tm - это температура, при определенной ионной силе и рН, при которой 50% последовательности-мишени гибридизуется с идеально подходящим зондом. Tm зависит от условий раствора, и нуклеотидного состава, и длины зонда. Например, более длинные последовательности гибридизуются специфически при более высоких температурах. Максимальная степень гибридизации достигается от около 16°С до 32°С ниже Тm. Присутствие моновалентных катионов в растворе для гибридизации уменьшает электростатическое отталкивание двух цепей нуклеиновых кислот, тем самым способствуя образованию гибрида; этот эффект виден при концентрации натрия выше 0,4 М (при более высоких концентрациях этим эффектом можно пренебречь). Формамид уменьшает температуру плавления ДНК-ДНК и ДНК-РНК дуплексов на 0,6-0,7°С на каждый процент формамида, и добавление 50% формамида позволяет проводить гибридизацию от 30 до 45°С, хотя степень гибридизации будет ниже. Ошибки спаривания оснований (мисматчи оснований) уменьшают степень гибридизации и температурную стабильность дуплекса. В среднем и для больших зондов Tm уменьшается на примерно 1°С на % ошибок спаривания оснований. Tm может быть рассчитана с помощью следующего уравнения, в зависимости от типа гибридов:
1) ДНК-ДНК гибриды (Meinkoth and Wahl, Anal. Biochem., 138: 267-284, 1984):
Tm=81.5°C+16.6×log10[Na+]a+0.41×%[G/Cb]-500×[Lc]-1-0.61×% формамида
2) ДНК-РНК или РНК-РНК гибриды:
Tm=79.8+18.5(log10[Na+]a)+0.58(%G/Cb)+11.8(%G/Cb)2-820/Lc
3) Олиго-ДНК или олиго-PHKd гибриды:
Для <20 нуклеотидов: Tm=2 (ln)
Для 20-35 нуклеотидов: Tm=22+1.46 (ln)
аили для других моновалентных катионов, но только точно в диапазоне 0,01-0,4 М.
bтолько точно для %GC в 30%-75% диапазоне.
сL=длина дуплекса в парах оснований.
dолиго, олигонуклеотид; ln,=эффективная длина праймера=2×(кол-во G/С)+(кол-во А/T).
Неспецифическое связывание можно контролировать, используя любой из ряда известных методов, таких как, например, блокирование мембраны раствором, содержащим белок, добавление гетерологичной РНК, ДНК и СДС в буфер для гибридизации, и обработка РНКазой. Для негомологичных проб может быть выполнена серия гибридизаций путем изменения одного из (i) постепенное снижение температуры отжига (например, с 68°С до 42°С) или (ii) постепенное снижение концентрации формамида (например, с 50% до 0%). Специалистам в данной области известны различные параметры, которые могут быть изменены в процессе гибридизации и которые либо поддержат, либо изменят условия жесткости.
Кроме условий гибридизации, специфичность гибридизации, как правило, также зависит от этапа постгибридизационных отмывок. Для удаления фона, являющегося результатом неспецифической гибридизации, образцы отмывают в разбавленными солевыми растворами. Критическими факторами таких отмывок являются ионная сила и температура последнего промывающего раствора: чем ниже концентрация соли и выше температура отмывки, тем выше жесткость отмывки. Как правило, отмывку осуществляют в условиях на уровне или ниже гибридизационной жесткости. Положительная гибридизация дает сигнал, по меньшей мере, в два раза сильнее фона. Как правило, для гибридизации нуклеиновых кислот или выявления амплификации генов подходящими условиями жесткости являются вышеизложенные условия. Также могут быть выбраны более или менее жесткие условия. Специалистам в данной области известны различные параметры, которые могут быть изменены в процессе отмывки и которые либо поддержат, либо изменят условия жесткости.
Например, типичные условия гибридизации высокой жесткости для гибридов ДНК длиной более 50 нуклеотидов охватывают гибридизацию при 65°С в 1×SSC или при 42°С в 1×SSC и 50% формамида с последующей отмывкой при 65°С в 0,3×SSC. Примеры условий гибридизации средней жесткости для гибридов ДНК длиной более 50 нуклеотидов охватывают гибридизацию при 50°С в 4×SSC или при 40°С в 6×SSC и 50% формамида с последующей отмывкой при 50°С в 2×SSC. Длина гибрида является ожидаемой длиной гибридизации нуклеиновых кислот. Когда гибридизуются известные последовательности нуклеиновых кислот, длина гибрида может быть определена путем сравнения последовательностей и выявления консервативных участков, описанных в этом документе. 1×SSC в 0,15М NaCl и 15 мМ цитрате натрия; раствор для гибридизации и отмывающий раствор могут дополнительно содержать 5× раствор Денхардта, 0,5-1,0% СДС, 100 мкг/мл денатурированной, фрагментированной ДНК из спермы лосося, 0,5% фосфат натрия.
Для целей определения уровней жесткости можно сослаться на Молекулярное клонирование Sambrook и др. (2001): лабораторный справочник, 3-е издание, Cold Spring Harbor Laboratory Press, CSH, New York, или на Современные протоколы в Молекулярной биологии, John Wiley & Sons, N.Y. (1989 и ежегодные обновления).
Варианты сплайсинга
Термин "варианты сплайсинга", как применяется в этом документе, охватывает варианты последовательностей нуклеиновых кислот, в которых выявленные интроны или экзоны были вырезаны, заменены, перемещены или добавлены или в которых интроны были укорочены или удлинены. Такими вариантами будут те, в которых в значительной степени сохранилась биологическая активность белка; это может быть достигнуто путем выборочного сохранения функциональных сегментов белка. Такие варианты сплайсинга могут быть найдены в природе или могут быть сделаны человеком. Способы прогнозирования и выделения таких вариантов сплайсинга хорошо известны в данной области техники (см., например, Foissac and Schiex (2005) BMC Bioinformatics 6:25).
Аллельный вариант
Аллели или аллельные варианты это альтернативные формы данного гена, расположенные в одинаковой хромосомной позиции. Аллельные варианты охватывают полиморфизмы Одного Нуклеотида (SNPs), так же как Полиморфизм Маленьких Вставок/Делеций (INDELs). Размер INDELs обычно меньше чем 100 п.о. SNPs и INDELs формируют большой набор вариантов последовательностей в полиморфных штаммах большинства организмов, встречающихся в природе.
Перестановка генов/Направленная эволюция
Перестановка генов или направленная эволюция состоит из повторов перестановок генов с последующим скринингом и/или селекцией с целью создания вариантов нуклеиновых кислот или их участков, кодирующих белки, имеющие измененную биологическую активность (Castle et al., (2004) Science 304 (5674): 1151-4; US patents 5,811,238 and 6,395,547).
Регуляторные элементы/Управляющая последовательность/Промотор
Все термины "регуляторный элемент", "управляющая последовательность" и "промотор" используются в этом документе взаимозаменяемо и должны быть приняты в широком контексте для обозначения нуклеиновых последовательностей, способных влиять на экспрессию последовательностей, к которым они привязаны. Термин "промотор" обычно относится к управляющей последовательности, расположенной перед началом транскрипции гена, которая вовлечена в узнавание и связывание РНК полимеразы и других белков, тем самым направляя транскрипцию функционально связанной нуклеиновой кислоты. Элементы, охваченные вышеупомянутыми терминами, являются транскрипционными регуляторными последовательностями, происходящими из классических геномных генов эукариот (включая ТАТА бокс, который необходим для точной инициации транскрипции, с или без последовательности ССААТ), и дополнительными регуляторными элементами (т.е. вышестоящими активирующими последовательностями, энхансерами и сайленсерами), которые изменяют экспрессию генов в ответ на стимуляцию развития и/или внешнее воздействие, или тканеспецифичным образом. Также включена в этот термин транскрипционная регуляторная последовательность классического прокариотического гена, которая в этом случае может содержать "-35нп" бокс и/или "-10нп" бокс транскрипционных регуляторных последовательностей. Термин "регуляторный элемент" также охватывает синтетическую слитую молекулу или производное, которое передает, активирует или усиливает экспрессию молекулы нуклеиновой кислоты в клетке, ткани или органе.
"Растительный промотор" содержит регуляторные элементы, которые опосредуют экспрессию части кодирующей последовательности в клетках растений. Соответственно, растительный промотор не должен быть растительного происхождения, но может происходить из вирусов или микроорганизмов, например из вирусов, которые поражают растительные клетки. "Растительный промотор" также может происходить из растительной клетки, например из растения, трансформированного последовательностью нуклеиновой кислоты, которая будет представлена в процессе изобретения и описана в этом документе. Это также относится к другим "растительным" регуляторным сигналам, таким как "растительные" терминаторы. Промоторы, перед нуклеотидными последовательностями, которые применимы в способах по данному изобретению, могут быть изменены одной или более нуклеотидными заменой(ами), вставкой(ами) и/или делецией(ями) без вмешательства в функциональные свойства или активность либо промоторов, открытых рамок считывания (ОРС), или 3'-регуляторных участков, таких как терминаторы или другие 3'-регуляторные участки, расположенные на расстоянии от ОРС. Кроме того, возможно, что активность промоторов увеличена изменением их последовательности или что они полностью заменены более активными промоторами, даже промоторами из гетерологичных организмов. Для экспрессии в растениях, как описано выше, молекула нуклеиновой кислоты должна быть функционально связана с или содержать подходящий промотор, который приводит к экспрессии гена в нужный момент времени и с требуемым пространственным паттерном экспрессии.
Для идентификации функционально эквивалентных промоторов сила промотора и/или паттерн экспрессии кандидата в промоторы могут быть проанализированы, например, путем функционального связывания промотора с репортерным геном и оценки уровня экспрессии и паттерна репортерного гена в различных тканях растения. Подходящие, хорошо известные, репортерные гены включают, например, бета-глюкуронидазу или бета-галактозидазу. Активность промотора оценивают измерением ферментативной активности бета-глюкуронидазы или бета-галактозидазы. Сила промотора и/или паттерн экспрессии могут быть затем сравнены с таковыми референсного промотора (такого, как используется в способах по данному изобретению). Кроме того, сила промотора может быть оценена путем количественного определения уровней мРНК или сравнения уровней мРНК нуклеиновой кислоты, используемой в способах по данному изобретению, с уровнями мРНК конститутивных генов, таких как 18S рРНК, с применением способов, известных в данной области техники, таких как нозерн-блот с денситометрическим анализом ауторадиограмм, количественный ПЦР в реальном времени или ОТ-ПЦР (ПЦР с обратной транскрипцией, RT-PCR) (Heid et al., 1996 Genome Methods 6: 986-994). Как правило, под "слабым промотором" подразумевают промотор, который вызывает низкий уровень экспрессии кодируемой последовательности. Под "низким уровнем" подразумевают уровни от около 1/10.000 транскриптов до около 1/100.000 транскриптов, до около 1/500.000 транскриптов на клетку. И наоборот, "сильный промотор" вызывает высокий уровень экспрессии кодируемой последовательности, или от около 1/10 транскриптов до около 1/100 транскриптов, до около 1/1000 транскриптов на клетку.
Функционально связанный
Термин "функционально связанный", как применяется в этом документе, относится к функциональной связи между промоторной последовательностью и геном, представляющим интерес, такой, что промоторная последовательность способна инициировать транскрипцию гена, представляющего интерес.
Конститутивный промотор
"Конститутивный промотор" относится к промотору, который является транскрипционно активным в течение большинства, но не обязательно всех, фаз роста и развития и в большинстве условий окружающей среды в по меньшей мере одной клетке, ткани или органе. Таблица В ниже приводит примеры конститутивных промоторов.
Универсальный промотор
Универсальный промотор является активным практически во всех тканях и клетках организма.
Промотор, регулируемый развитием
Промотор, регулируемый развитием (developmentally-regulated promoter), активен в течение определенных стадий развития или в частях растений, которые подвергаются изменениям в развитии.
Индуцибельный промотор
Индуцибельный промотор индуцирует или увеличивает транскрипцию в ответ на химические (для обзора см. Gatz 1997, Annu. Rev. Plant Physiol. Plant Mol. Biol., 48:89-108), окружающие или физические стимулы, или могут быть "стресс-индуцируемые", т.е. активируемые, когда растение подвергается воздействию различных стрессовых условий, или "патоген-индуцируемые", т.е. активируемые, когда растение подвергается воздействию различных патогенов.
Органспецифичный/Тканеспецифичный промотор
Органспецифичный или тканеспецифичный промотор это промотор, который способен предпочтительно инициировать транскрипцию в определенных органах или тканях, таких как листья, корни, ткани семени и др. Например, "кореньспецифичный промотор" это промотор, который транскрипционно активен преимущественно в корнях растения, практически исключая любые другие части растения, хотя все же допуская некоторую утечку экспрессии в этих других частях растения. Промоторы, способные инициировать транскрипцию только в определенных клетках, относятся к "клеточно-специфичным" в этом документе.
Семяспецифичный промотор транскрипционно активен преимущественно в тканях семени, но не обязательно исключительно в тканях семени (в случаях утечки экспрессии). Семяспецифичный промотор может быть активен в течение развития семени и/или в течение прорастания. Семяспецифичный промотор может быть эндосперм, и/или алейрон, и/или эмбрионспецифичным.
Терминатор
Термин "терминатор" охватывает управляющую последовательность, которая является последовательностью ДНК в конце единицы транскрипции, которая дает сигнал к 3' процессингу, и полиаденилированию первичного транскрипта, и окончанию транскрипции. Терминатор может быть получен из природного гена из ряда других растительных генов или из Т-ДНК. Терминатор, который необходимо добавить, может быть получен из, например, генов нопалин синтазы, или октопин синтазы, или же из другого гена растения, или менее предпочтительно из любого другого эукариотического гена.
Модуляция
Термин "модуляция" означает, в отношении экспрессии или экспрессии гена, процесс, в котором уровень экспрессии изменен указанной экспрессией гена, в сравнении с контрольным растением, уровень экспрессии может быть увеличен или уменьшен. Исходная, немодулированная экспрессия может быть любого рода экспрессией структурной РНК (рРНК, тРНК) или мРНК с последующей трансляцией.
Экспрессия
Термин "экспрессия" или "экспрессия гена" означает транскрипцию определенного гена, или определенных генов, или определенных генных конструкций. Термин "экспрессия" или "экспрессия гена", в частности, означает транскрипцию гена, или генов, или генных конструкций в структурную РНК (рРНК, тРНК) или мРНК с или без последующей трансляцией последнего в белок. Процесс включает транскрипцию ДНК и процессинг полученного в результате продукта мРНК.
Увеличенная экспрессия/сверхэкспрессия
Термин "увеличенная экспрессия" или "сверхэкспрессия", как применяется в этом документе, означает любую форму экспрессии, дополнительную к исходному уровню экспрессии дикого типа.
Способы увеличения экспрессии генов или продуктов генов хорошо задокументированы в данной области техники и включают, например, сверхэкспрессию, запускаемую соответствующими промоторами, применение энхансеров транскрипции или энхансеров трансляции. Изолированные нуклеиновые кислоты, которые служат промоторными или энхансерными элементами, могут быть введены в соответствующее положение (как правило, перед) в негетерологичную форму полинуклеотида так, чтобы активировать экспрессию нуклеиновой кислоты, кодирующей полипептид, представляющий интерес. Например, эндогенные промоторы могут быть изменены in vivo с помощью мутации, делеции и/или замены (см. Kmiec, US 5,565,350; Zarling et al., WO 9322443), или в растительную клетку могут быть введены изолированные промоторы в надлежащем положении и расстоянии от гена по данному изобретению так, чтобы управлять экспрессией гена.
Если экспрессия полипептида желательна, то в большинстве случаев желательно включить полиаденилированный участок на 3' конце полинуклеотидного кодирующего участка. Полиаденилированный участок может быть получен из природного гена, из ряда других растительных генов или из Т-ДНК. 3' концевая последовательность, которую добавляют, может быть получена, например, из генов нопалин синтетазы, или октопин синтетазы, или же из другого растительного гена, или менее предпочтительно из любого другого эукариотического гена.
Последовательность интрона также может быть добавлена к 5' нетранслируемому участку (UTR) или к кодирующей последовательности частично кодирующей последовательности для увеличения количества зрелой мРНК, которая накапливается в цитозоле. Было показано, что включение сплайсируемого интрона в транскрипционную единицу в обеих растительных и животных экспрессионных конструкциях увеличивает экспрессию гена и на уровне мРНК, и на уровне белка до 1000 раз (Buchman and Berg (1988) Mol. Cell biol. 8: 4395-4405; Callis et al. (1987) Genes Dev 1: 1183-1200). Такое интронное усиление экспрессии гена, как правило, наибольшее, когда расположено около 5' конца транскрибируемой единицы. Применение интронов кукурузы интрон Adh1-S 1, 2, и 6, интрон Bronze-1 хорошо известно в данной области техники. Для получения общей информации смотри: The Maize Handbook, Chapter 116, Freeling and Walbot, Eds., Springer, N.Y. (1994).
Эндогенный ген
В данном документе ссылка на "эндогенный ген" относится не только к исследуемому гену, как обнаруженному в растении в его естественной форме (то есть без какого-либо вмешательства человека), но также относится к тому же гену (или в значительной степени гомологичной нуклеиновой кислоте/гену) в изолированной форме, в дальнейшем введенному (повторно) в растение (трансген). Например, трансгенное растение, содержащее такой трансген, может столкнуться с существенным уменьшением экспрессии трансгена и/или существенным уменьшением экспрессии эндогенного гена. Изолированный ген может быть получен из организма или может быть искусственно сделан, например методом химического синтеза.
Уменьшенная экспрессия
В данном документе ссылка на "уменьшенная экспрессия" или "снижение или существенная элиминация" экспрессии означает уменьшение экспрессии эндогенного гена, и/или уровней полипептида, и/или активности полипептида относительно контрольных растений. Снижение или существенная элиминация составляет в порядке возрастания предпочтения по меньшей мере 10%, 20%, 30%, 40% или 50%, 60%, 70%, 80%, 85%, 90% или 95%, 96%, 97%, 98%, 99% или большее сокращение в сравнении с таковым контрольных растений.
Для снижения или существенной элиминации экспрессии эндогенного гена в растении требуется последовательность нуклеиновой кислоты достаточной длины и высокой степени комплементарности. С целью достижения молчания гена это могут быть всего 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10 или менее нуклеотидов, альтернативно это может быть такой же длины нуклеотид, как целый ген (включая 5' и/или 3' UTR, частично либо полностью). Отрезок нуклеотидов высокой степени комплементарности может быть получен из нуклеиновой кислоты, кодирующей белок, представляющий интерес (ген-мишень), или из любой нуклеиновой кислоты, способной кодировать ортолог, паралог или гомолог белка, представляющего интерес. Предпочтительно, отрезок нуклеотидов высокой степени комплементарности способен формировать водородные связи с геном-мишенью (либо со смысловой, либо с антисмысловой цепью), более предпочтительно, отрезок нуклеотидов высокой степени комплементарности имеет, в порядке возрастания предпочтения, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%, 100% идентичность последовательности с последовательностью гена-мишени (либо со смысловой, либо с антисмысловой цепи). Кодирование последовательностью нуклеиновой кислоты (функционального) полипептида не является обязательным требованием для различных способов, обсуждаемых в этом документе, снижения или существенной элиминации экспрессии эндогенного гена.
Это снижение или существенная элиминация экспрессии может достигаться с помощью применения обычных инструментов и методов. Предпочтительным способом снижения или существенной элиминации экспрессии эндогенного гена являются введение и экспрессия в растении генетической конструкции, в которой нуклеиновая кислота (в этом случае отрезок нуклеотидов высокой степени комплементарности, полученный из гена, представляющего интерес, или из любой нуклеиновой кислоты, способной кодировать ортолог, паралог или гомолог любого белка, представляющего интерес) клонирована в виде инвертированного повтора (частично или полностью) разделенного спейсером (некодирующая ДНК).
В таком предпочтительном способе, экспрессия эндогенного гена снижается или существенно элиминируется через РНК-опосредованное выключение, с применением инвертированного повтора, нуклеиновой кислоты или ее части (в этом случае отрезок нуклеотидов высокой степени комплементарности получен из гена, представляющего интерес, или из любой нуклеиновой кислоты, способной кодировать ортолог, паралог или гомолог белка, представляющего интерес), предпочтительно способного формировать шпилечные структуры. Инвертированный повтор клонирован в вектор экспрессии, содержащий управляющие последовательности. Некодирующая ДНК последовательность нуклеиновых кислот (спейсер, например, фрагмент участка прикрепления к матриксу (MAR), интрон, полилинкер, и т.д.) расположена между двумя инвертированными нуклеиновыми кислотами, формирующими инвертированный повтор. После транскрипции инвертированного повтора формируется химерная РНК с самокомплементарной структурой (частично или полностью). Эта двухцепочечная структура РНК называется РНК-шпилькой (hpRNA). РНК-шпилька перерабатывается растением в миРНК (малые интерферирующие РНК, siRNAs), которые включены в РНК-индуцируемый комплекс выключения гена (комплекс сайленсинга) (RNA-induced silencing complex, RISC). RISC далее расщепляет транскрипты мРНК, таким образом существенно снижая количество транскриптов мРНК, транслируемых в полипептиды. Для дальнейшего ознакомления с основными деталями смотри, например, Grierson et al. (1998) WO 98/53083; Waterhouse et al. (1999) WO 99/53050.
Выполнение способов по данному изобретению не зависит от введения или экспрессии в растении генетической конструкции, в которой нуклеиновая кислота клонирована в виде инвертированного повтора, но любой один или более из нескольких хорошо известных способов "молчания генов" ("gene silencing") могут быть использованы для достижения тех же эффектов.
Один из таких способов снижения экспрессии эндогенного гена является РНК-опосредованным выключением экспрессии гена (отрицательная регуляция). Выключение гена в растении в этом случае вызвано последовательностью двухцепочечной РНК (dsRNA) , которая обладает большим сходством с эндогенным геном-мишенью. Эта двухцепочечная РНК далее перерабатывается растением в около 20 до около 26 нуклеотидов, называемых короткие (малые) интерферирующие РНК (short/small interfering RNAs, siRNA) (миРНК). миРНК включены в РНК-индуцируемый комплекс выключения гена (комплекс сайленсинга) (RISC), который расщепляет транскрипты мРНК эндогенного гена-мишени, тем самым существенно снижая количество транскриптов мРНК, транслируемых в полипептиды. Предпочтительно, двухцепочечная последовательность РНК соответствует гену-мишени.
Другой пример способа РНК-опосредованного выключения гена включает в себя введение последовательности нуклеиновой кислоты или ее части в смысловой ориентации в растение (в этом случае отрезок нуклеотидов высокой степени комплементарности получен из гена, представляющего интерес, или из любой нуклеиновой кислоты, способной кодировать ортолог, паралог или гомолог белка, представляющего интерес). "Смысловая ориентация" относится к последовательности ДНК, гомологичной транскрипту его мРНК. В растение должна быть введена по меньшей мере одна копия нуклеиновой кислоты. Дополнительная последовательность нуклеиновой кислоты снизит экспрессию эндогенного гена, давая толчок к развитию феномена, известного как ко-супрессия. Снижение экспрессии гена будет более явным, если в растение введены несколько дополнительных копий последовательности нуклеиновой кислоты, поскольку есть положительная корреляция между высоким уровнем транскриптов и запуском косупрессии.
Другой пример способа РНК-опосредованного выключения гена включает в себя применение антисмысловых последовательностей нуклеиновой кислоты. Антисмысловая последовательность нуклеиновой кислоты содержит последовательность нуклеотидов, которые комплементарны "смысловой" последовательности нуклеиновой кислоты, кодирующей белок, т.е. комплементарна кодирующей цепи двухцепочечной молекулы кДНК или комплементарна последовательности транскрипта мРНК. Антисмысловая последовательность нуклеиновой кислоты предпочтительно комплементарна эндогенному гену, который должен молчать. Комплементарность может быть расположена в "кодирующем участке" и/или в "некодирующем участке" гена. Термин "кодирующий участок" относиться к 5' и 3' последовательностям, которые примыкают по бокам (фланкируют) к кодирующему участку, которые транскрибируются, но не транслируются в аминокислоты (также относятся к 5' и 3' нетранслируемым участкам).
Антисмысловая последовательность нуклеиновой кислоты может быть рассчитана в соответствии с комплементарностью пар оснований Уотсона и Крика. Антисмысловая последовательность нуклеиновой кислоты может быть комплементарна всей последовательности нуклеиновой кислоты (в этом случае отрезок нуклеотидов высокой степени комплементарности получен из гена, представляющего интерес, или из любой нуклеиновой кислоты, способной кодировать ортолог, паралог или гомолог белка, представляющего интерес), но также может быть олигонуклеотид, который является анстисмысловым только к части последовательности нуклеиновой кислоты (включая мРНК 5' и 3' UTR). Например, антисмысловая олигонуклеотидная последовательность может быть комплементарна участку, окружающему стартовый кодон трансляции в транскрипте мРНК, кодирующей полипептид. Длина подходящей антисмысловой последовательности олигонуклеотида известна в данной области техники и может начинаться с около 50, 45, 40, 35, 30, 25, 20, 15 или 10 нуклеотидов в длину или менее. Антисмысловая последовательность нуклеиновой кислоты, в соответствии с данным изобретением, может быть синтезирована путем химического синтеза и ферментными реакциями лигирования, с использованием способов, известных в данной области техники. Например, антисмысловая последовательность нуклеиновой кислоты (например, антисмысловая последовательность олигонуклеотида) может быть химически синтезирована с использованием встречающихся в природе нуклеотидов или разным образом модифицированных нуклеотидов, сконструированных для увеличения биологической стабильности молекул или для увеличения физической стабильности дуплексов, формируемых между антисмысловой и смысловой последовательностями нуклеиновой кислоты, например, могут быть использованы производные фосфотиоата и акридин замещенные нуклеотиды. В данной области техники хорошо известны примеры модифицированных нуклеотидов, которые могут быть использованы для синтеза антисмысловой последовательности нуклеиновой кислоты. Известные модификации нуклеотидов включают метилирование, циклизацию, кеппирование и замену одного или более встречающихся в природе нуклеотидов аналогами, такими как инозин. Другие модификации нуклеотидов хорошо известны в данной области техники.
Антисмысловая последовательность нуклеиновой кислоты может быть получена биологическим путем, используя вектор экспрессии, в который была клонирована последовательность нуклеиновой кислоты в антисмысловой ориентации (т.е. РНК, транскрибируемая с клонированной нуклеиновой кислоты, будет в антисмысловой ориентации к заданной нуклеиновой кислоте, представляющей интерес). Предпочтительно, производство антисмысловых последовательностей нуклеиновой кислоты в растении происходит посредством стабильно интегрированной конструкции нуклеиновой кислоты, содержащей промотор, функционально связанный антисмысловой олигонуклеотид и терминатор.
Молекулы нуклеиновой кислоты, используемые для выключения гена в способах по изобретению (или введенные в растение, или синтезированные in situ), гибридизуются с или связываются с транскриптом мРНК и/или геномной ДНК, кодирующей полипептид, чтобы таким образом ингибировать экспрессию белка, например, ингибированием транскрипции или трансляции. Гибридизация может быть обусловлена обычной способностью комплементарных нуклеотидов формировать стабильный дуплекс, или, например, в случае антисмысловой последовательности нуклеиновой кислоты, которая связывается с ДНК дуплексом, посредством специфичного связывания с большой бороздкой двойной спирали. Антисмысловые последовательности нуклеиновой кислоты могут быть введены в растение путем трансформации или прямой инъекцией в определенный участок ткани. Кроме того, антисмысловые последовательности нуклеиновой кислоты могут быть изменены для поражения выбранных клеток и затем введены системно. Например, для системного введения, антисмысловые последовательности нуклеиновой кислоты могут быть изменены так, что они специфически связываются с рецепторами или антигенами, экспрессированными на поверхности выбранных клеток, например, путем соединения антисмысловой последовательности нуклеиновой кислоты с пептидами или антителами, которые связываются с поверхностными клеточными рецепторами или антигенами. Антисмысловые последовательности нуклеиновой кислоты также могут быть доставлены в клетку с помощью вектора, как описано в этом документе.
Согласно следующему объекту, антисмысловая последовательность нуклеиновой кислоты является а-аномерной последовательностью нуклеиновой кислоты. А-аномерная последовательность нуклеиновой кислоты формирует специфичные двуцепочечные гибриды с комплементарной РНК, в которой, в отличие от обычных b-единиц, цепи идут параллельно друг другу (Gaultier et al. (1987) Nucl Ac Res 15: 6625-6641). Антисмысловая последовательность нуклеиновой кислоты может также содержать 2'-о-метилрибонуклеотид (Inoue et al. (1987) Nucl Ac Res 15, 6131-6148) или химерный РНК-ДНК аналог (Inoue et al. (1987) FEBS Lett. 215, 327-330).
Снижение или существенная элиминация экспрессии эндогенного гена также может быть выполнена с использованием рибозимов. Рибозимы являются каталитическими молекулами РНК с рибонуклеазной активностью, которые способны расщеплять одноцепочечную последовательность нуклеиновой кислоты, такую как мРНК, к которой у них есть комплементарный участок. Так, рибозимы (например, рибозимы акулы-молота, описанные в Haselhoff and Gerlach (1988) Nature 334, 585-591) могут быть использованы для каталитического расщепления транскриптов мРНК, кодирующих полипептид, тем самым, существенно снижая количество транскриптов мРНК, транслируемых в полипептиды. Могут быть созданы специфичные к последовательности нуклеиновой кислоты рибозимы (см., например: Cech et al. U.S. Patent No.4,987,071; and Cech et al. U.S. Patent No.5,116,742). Кроме того, для отбора каталитических РНК, имеющих специфичную рибонуклеазную активность, из пула молекул РНК, могут быть использованы транскрипты мРНК, соответствующие последовательности нуклеиновой кислоты (Bartel and Szostak (1993) Science 261, 1411-1418). Использование рибозимов для выключения генов в растениях известно в данной области техники art (e.g., Atkins et al. (1994) WO 94/00012; Lenne et al. (1995) WO 95/03404; Lutziger et al. (2000) WO 00/00619; Prinsen et al. (1997) WO 97/13865 and Scott et al. (1997) WO 97/38116).
Выключение генов также может быть достигнуто с помощью инсерционного мутагенеза (например, вставка Т-ДНК или транспозона) или с применением стратегий, как описано, среди других, Angell and Baulcombe ((1999) Plant J 20 (3): 357-62), (Amplicon VIGS WO 98/36083), или Baulcombe (WO 99/15682).
Выключение генов также может произойти, если есть мутация в эндогенном гене и/или мутация в выделенном гене/последовательности нуклеиновой кислоты, введенном в клетку. Снижение или существенная элиминация может быть вызвана нефункциональным полипептидом. Например, полипептид может связываться с различными взаимодействующими белками; одна или более мутация(й) и/или усечение(й) могут, следовательно, обеспечить полипептид, который все еще способен связывать взаимодействующие белки (такие как рецепторные белки), но не может выполнять свою обычную функцию (такую как сигнальный лиганд).
Следующий подход к выключению гена состоит в направленном воздействии комплементарными последовательностями нуклеиновой кислоты на регуляторный участок гена (например, на промотор и/или энхансеры) с формированием структуры тройной спирали, которая предотвращает транскрипцию гена в клетках-мишенях. See Helene, С., Anticancer Drug Res. 6, 569-84, 1991; Helene et al., Ann. N.Y. Acad. Sci. 660, 27-36 1992; and Maher, L.J. Bioassays 14, 807-15, 1992.
Другие методы, такие как применение антител, направленных на эндогенный полипептид, для ингибирования его функции in planta (в полевых условиях), или вмешательство в пути передачи сигнала, в которые вовлечен полипептид, будут хорошо известны специалистам в данной области техники. В особенности, можно предвидеть, что искусственно сделанные молекулы могут быть применены для ингибирования биологической функции полипептида-мишени или для вмешательства в пути передачи сигнала, в которые вовлечен полипептид-мишень.
Кроме того, программа скрининга может быть настроена на выявление в популяции растений природных вариантов гена, которые кодируют полипептиды со сниженной активностью. Такие природные варианты также могут быть применены, например, для выполнения гомологичной рекомбинации.
Искусственные и/или природные микроРНК (miRNAs) могут быть использованы для нокаута экспрессии гена и/или трансляции мРНК. Эндогенные микроРНК являются одноцепочечными маленькими РНК, обычно длиной 19-24 нуклеотида. Их функция главным образом в регуляции экспрессии генов и/или трансляции мРНК. Большинство растительных микроРНК (miRNAs) полностью или почти полностью комплементарны последовательности, с которой они связываются. Однако есть природные мишени, содержащие до пяти некомплементарных оснований. Они процессируются из более длинных некодирующих РНК с характерными структурами обращенных повторов с помощью РНКаз из Дайсер семейства, специфичных к двухцепочечной РНК. После процессинга они встраиваются в РНК-индуцируемый комплекс выключения гена (RISC) путем связывания с его основным компонентом, белком Argonaute. МикроРНК служат компонентом RISC, обеспечивающим специфичность его действия, так как они комплементарны нуклеиновым кислотам-мишеням, в основном мРНК, в цитоплазме. Последующие этапы регуляции включают расщепление и уничтожение мРНК-мишени и/или ингибирование трансляции. Эффект сверхэкспрессии микроРНК, таким образом, часто выражается в уменьшении уровня мРНК генов-мишеней.
Искусственные микроРНК (amiRNAs), которые обычно 21 нуклеотид в длину, могут быть созданы генетически специально для обратной регуляции экспрессии одного или нескольких генов, представляющих интерес. Факторы, определяющие направленный выбор растительных микроРНК хорошо известны в данной области техники. Были определены эмпирические параметры направленного распознавания, которые могут использоваться как помощь в конструировании специфичных искусственных микроРНК (amiRNAs) (Schwab et al., Dev. Cell 8, 517-527, 2005). Удобные инструменты для конструирования и создания искусственных микроРНК и их предшественников также доступны для общего пользования (Schwab et al., Plant Cell 18, 1121-1133, 2006).
Для оптимальной работы, методы выключения генов, используемые для снижения экспрессии эндогенных генов в растении, требуют использование последовательностей нуклеиновой кислоты из однодольных растений для трансформации однодольных растений и из двудольных растений для трансформации двудольных растений. Предпочтительно, последовательность нуклеиновой кислоты из любого данного вида растений вводится в растение того же вида. Например, последовательность нуклеиновой кислоты из риса вводится в растение риса. Тем не менее, не является абсолютно необходимым условием, чтобы вводимая последовательность нуклеиновой кислоты происходила из того же вида растения, что и растение, в которое будет введена. Достаточно того, что есть существенная гомология между эндогенным геном-мишенью и вводимой нуклеиновой кислотой.
Вышеописанное является примерами различных способов снижения или существенной элиминации экспрессии эндогенных генов в растении. Специалисты в данной области техники легко смогут адаптировать вышеуказанные способы выключения генов для достижения снижения экспрессии эндогенных генов в целом растении или его части, например, с помощью использования соответствующего промотора.
Селективный маркер (ген)/Репортерный ген
"Селективный маркер", "селективный маркерный ген" или " репортерный ген" включают любой ген, который придает клетке, в которой он экспрессируется, фенотип для облегчения идентификации и/или селекции клеток, трансфицированных или трансформированных конструкцией нуклеиновой кислоты по изобретению. Эти маркерные гены дают возможность идентифицировать успешную передачу молекулы нуклеиновой кислоты через серию различных характеристик. Подходящие маркеры могут быть выбраны из маркеров, которые придают устойчивость к антибиотикам или гербицидам, которые вводят новый метаболический признак или позволяют визуальную селекцию. Примеры селективных маркерных генов включают гены, придающие устойчивость к антибиотикам (таким как nptll, который фосфорилирует неомицин и канамицин, или hpt, фосфорилирование гигромицина, или гены, придающие устойчивость, например, к блеомицину, стрептомицину, тетрациклину, хлорамфениколу, ампицилину, гентамицину, генетицину (G418), спектиномицину или бластицидину), к гербицидам (например, бар (bar), который обеспечивает устойчивость к Basta®; aroA или gox, обеспечивая устойчивость к глифосату, или гены, придающие устойчивость, например, к имидазолинону, фосфинотрицину или сульфонилмочевине) или гены, которые обеспечивают метаболический признак (такой как manА, который позволяет растениям использовать маннозу, как единственный источник углерода, или ксилозизомеразу для утилизации ксилозы, или антипитательные маркеры, такой как устойчивость к 2-дезоксиглюкозе). Экспрессия визуального гена маркера проявляется в окраске (например, β-глюкоронидаза, GUS или β-галактозидаза с их окрашенными субстратами, например, X-Gal), люминесценции (такой как система люциферин/люцефераза) или флуоресценции (зеленый флуоресцентный белок GFP и его производные). Этот перечень представляет только малую часть возможных маркеров. Квалифицированный специалист хорошо знаком с такими маркерами. Различные маркеры являются предпочтительными в зависимости от организма и методов селекции.
Известно, что при стабильной или временной интеграции нуклеиновой кислоты в растительные клетки только меньшая часть клеток захватывает чужеродную ДНК и, при желании, интегрирует ее в свой геном, в зависимости от использованного вектора экспрессии и использованного метода трансфекции. Для идентификации и селекции этих интегрантов, ген, кодирующий селективный маркер (такой как один из описанных выше), обычно вводится в клетки хозяина вместе с геном, представляющим интерес. Такие маркеры могут, например, использоваться в мутантах, в которых эти гены не функциональны, например из-за делеции, обычными способами. Кроме того, молекулы нуклеиновой кислоты, кодирующие селективный маркер, могут быть введены в клетку хозяина в том же векторе, что содержит последовательность, кодирующую полипептиды по изобретению, или использован в способах по изобретению, или в другом векторе. Клетки, которые были стабильно трансфицированы введенной нуклеиновой кислотой, могут быть идентифицированы, например, селекцией (например, клетки, которые интегрировали селективный маркер, выживают, в то время как другие клетки погибают).
Так как маркерные гены, в частности гены устойчивости к антибиотикам и гербицидам, более не нужны или не желательны в трансгенной клетке хозяина, как только нуклеиновые кислоты были успешно введены, процесс введения нуклеиновых кислот в соответствии с данным изобретением преимущественно использует методы, которые дают возможность удаление или вырезание этих маркерных генов. Один такой способ известен как ко-трансформация. Способ ко-трансформации использует два вектора одновременно для трансформации, один вектор несет нуклеиновую кислоту в соответствии с данным изобретением и второй несет маркерный ген(ы). Большая часть трансформантов получает или, в случае растений, содержит оба вектора (до 40% или более трансформантов). В случае трансформации с агробактерией (Agrobacteria), трансформанты обычно получают только часть вектора, то есть последовательность, фланкированную Т-ДНК, которая обычно представлена в кассете для экспрессии. Маркерные гены могут быть успешно удалены из трансформированных растений путем скрещиваний. В другом способе, маркерные гены, интегрированные в транспозон, использовались для трансформации вместе с желаемой нуклеиновой кислотой (известный как метод Ac/Ds). Трансформанты могут быть скрещены с источником транспозазы или трансформанты трансформируют конструкцией нуклеиновой кислоты, обеспечивающей временную или постоянную экспрессию транспозазы. В некоторых случаях (примерно 10%), транспозоны, как только трансформация прошла успешно, выпрыгивают из генома клетки хозяина и теряются. В следующих случаях, транспозон прыгает в разные места. В этих случаях маркерный ген должен быть удален путем скрещивания. В микробиологии были разработаны методы, которые делают возможным, или облегчают, обнаружение таких событий. Следующий предпочтительный способ основан на том, что известно как система рекомбинации; чье преимущество состоит в том, что можно обойтись без элиминации путем скрещивания. Наиболее известной системой этого типа является система, известная как Cre/lox. Cre1 является рекомбиназой, которая удаляет последовательности, расположенные между последовательностями loxP. Если маркерный ген вставлен между последовательностями loxP, он удаляется, как только трансформация успешно произошла, путем экспрессии рекомбиназы. Дополнительными системами рекомбинации являются HIN/HIX, FLP/FRT и REP/STB система (Tribble et al., J. Biol. Chem, 275, 2000: 22255-22267; Velmurugan et al., J. Cell Biol., 149, 2000: 553-566). В соответствии сданным изобретением возможна сайт-специфическая интеграция в геном растения последовательностей нуклеиновой кислоты. Естественно, эти способы могут также быть применены к микроорганизмам, таким как дрожжи, грибы или бактерии.
Трансгенный/Трансген/Рекомбинантный
В целях изобретения, "трансгенный", "трансген" или "рекомбинантный" означают в отношении, например, последовательности нуклеиновой кислоты, кассету для экспрессии, генную конструкцию или вектор, содержащий последовательность нуклеиновой кислоты, или организм, трансформированный последовательностями нуклеиновой кислоты, кассетами для экспрессии или векторами в соответствии с данным изобретением, все эти конструкции получены рекомбинантными способами, в которых либо
(а) последовательности нуклеиновой кислоты, кодирующие белок, применимый в способах по изобретению, или
(b) генетические управляющие последовательности(ь), которые функционально связаны с последовательностью нуклеиновой кислоты в соответствии сданным изобретением, например, промотором, или
(c) а) и b)
не находятся в их естественном генетическом окружении или были модифицированы рекомбинантными способами, возможно модификация состояла, например, в замене, добавлении, делеции, инверсии или вставке одного или более нуклеотидных остатков. Естественное генетическое окружение понимается как обозначение естественного геномного или хромосомного локуса в исходном растении или нахождение в геномной библиотеке. В случае геномной библиотеки, естественное генетическое окружение последовательности нуклеиновой кислоты предпочтительно сохранено, по меньшей мере, частично. Естественное окружение примыкает к последовательности нуклеиновой кислоты по меньшей мере с одной стороны и имеет последовательность длиной по меньшей мере 50 п.о., предпочтительно по меньшей мере 500 п.о., особенно предпочтительно по меньшей мере 1000 п.о., наиболее предпочтительно по меньшей мере 5000 п.р. Встречающиеся в природе кассеты для экспрессии, например, встречающееся в природе сочетание естественного промотора последовательностей нуклеиновой кислоты с соответствующей последовательностью нуклеиновой кислоты, кодирующей полипептид, применимый в способах по изобретению, как определено выше, становятся трансгенными кассетами для экспрессии, когда эта кассета для экспрессии изменена неестественными, синтетическими ("искусственными") способами, такими как, например, обработка мутагенами. Подходящие способы описаны в патентах US 5,565,350 или WO 00/15815.
Таким образом, трансгенное растение в целях данного изобретения понимается, как и выше, в том значении, что использованные в способах по изобретению нуклеиновые кислоты не находятся в их природном локусе в геноме указанного растения, при этом нуклеиновые кислоты могут быть экспрессированы гомологично или гетерологично. Однако, как упомянуто, трансгенное также означает, что хотя нуклеиновые кислоты в соответствии с данным изобретением или использованные в способах изобретения находятся в их природном положении в геноме растения, последовательность была изменена по сравнению с природной последовательностью и/или что регуляторные последовательности природной последовательности были изменены. Трансгенное, в соответствии с данным изобретением, предпочтительно понимается в значении экспрессии нуклеиновых кислот в природном локусе генома, т.е. имеет место гомологичная или, предпочтительно, гетерологичная экспрессия нуклеиновых кислот. В данном документе упомянуты предпочтительные трансгенные растения.
Трансформация
Термин "введение" или "трансформация", как изложено в данном документе, охватывает перенос экзогенного полинуклеотида в клетку хозяина, независимо от примененного метода переноса. Ткань растения, способная к последующему развитию клона, либо органогенезу, либо эмбриогенезу, может быть трансформирована генетической конструкцией по данному изобретению и из нее регенерировано целое растение. Выбор конкретной ткани будет меняться, в зависимости от имеющихся в наличии систем развития клона и, среди них, наиболее пригодных для трансформации конкретных видов. Типичные ткани-мишени включают листовые диски, пыльцу, эмбрион, семядоли, гипокотиль, мегагаметофиты, каллюсную ткань, существующую меристематическую ткань (например, меристема семядоли и меристема гипокотиля). Полинуклеотид может быть временно или постоянно введен в клетку хозяина и может сохраняться в неинтегрированном виде, как плазмида. Или же он может быть интегрирован в геном хозяина. Полученная в результате трансформированная растительная клетка затем может быть использована для регенерирования трансформированного растения способом, известным специалистам в данной области.
Перенос чужеродных генов в геном растения называется трансформацией. Трансформация видов растений теперь достаточно стандартная методика. Преимущественно, любой из ряда способов трансформации может быть использован для введения гена, представляющего интерес, в подходящую первичную клетку. Способы, описанные для трансформации и регенерации растений из растительных тканей или растительных клеток, могут быть использованы для временной или постоянной трансформации. Способы трансформации включают использование липосом, электропорации, химических реагентов, которые увеличивают захват свободной ДНК, прямую инъекцию ДНК в растение, биобаллистическую пушку, трансформацию с применением вирусов или пыльцы и микроинъекций. Способы могут быть выбраны из кальций-полиэтиленгликолевого способа для протопластов (Krens, F.A. et al., (1982) Nature 296, 72-74; Negrutiu I et al. (1987) Plant Mol Biol 8: 363-373); электропорации протопластов (Shillito R.D. et al. (1985) Bio/Technol 3, 1099-1102); микроинъекций в растительный материал (Crossway A et al., (1986) Mol. Gen Genet 202: 179-185); бомбардировки ДНК или РНК-несущими частицами (Klein TM et al., (1987) Nature 327: 70) инъекции с (интегрирующимися) вирусами и тому подобное. Трансгенные растения, включая трансгенные сельскохозяйственные культуры, предпочтительно получают путем трансформации, с помощью агробактерий. Предпочтительным способом трансформации является трансформация in planta. Для этого возможно, например, позволить агробактерии воздействовать на семена растения или инокулировать меристему растения агробактериями. Особенно целесообразным в соответствии с изобретением оказалось позволить суспензии агробактерии воздействовать на целое растение или, по меньшей мере, на завязь цветка. Растение далее растет до тех пор, пока не получены семена обработанных растений (Clough and Bent, Plant J. (1998) 16, 735-743). Способы трансформации риса с помощью агробактерий включают хорошо известные способы трансформации риса, такие как описанные в любом из последующих документов: European patent application ЕР 1198985 А1, Aldemita and Hodges (Planta 199: 612-617, 1996); Chan et al. (Plant Mol Biol 22 (3): 491-506, 1993), Hiei et al. (Plant J 6 (2): 271-282, 1994), раскрытая в них информация приведена в виде ссылки, как будто она полностью изложена в данном документе. В случае трансформации кукурузы, предпочтительным способом является способ, описанный либо в Ishida et al. (Nat. Biotechnol 14 (6): 745-50, 1996) или Frame et al. (Plant Physiol 129 (1): 13-22, 2002), раскрытая в них информация приведена в виде ссылки, как будто она полностью изложена в данном документе. Указанные способы далее описаны в виде примера в В.Jenes et al., Techniques for Gene Transfer, in: Transgenic Plants, Vol. 1, Engineering and Utilization, eds. S.D.Kung and R.Wu, Academic Press (1993) 128-143 and in Potrykus Annu. Rev. Plant Physiol. Plant Molec. Biol. 42 (1991) 205-225). Нуклеиновые кислоты или конструкции, которые должны быть экспрессированы, предпочтительно клонированы в вектор, пригодный для трансформации Agrobacterium tumefaciens, например pBin19 (Bevan et al., Nucl. Acids Res. 12 (1984) 8711). Агробактерия, трансформированная таким вектором, затем может быть использована известным способом для трансформации растений, таких как растения, использованные в качестве модели, как Арабидопсис (Arabidopsis) (Арабидопсис Таля или Резуховидка Таля в рамках данного изобретения не рассматривается как сельскохозяйственная культура), или сельскохозяйственные культуры, такие как, в качестве примера, растения табака, например погружением мятых листьев или рубленных листьев в раствор агробактерий и затем культивированием их в подходящих условиях. Трансформация растений с помощью Agrobacterium tumefaciens описана, например, Hofgen and Willmitzer in Nucl. Acid Res. (1988) 16, 9877 и известна inter alia из F.F.White, Vectors for Gene Transfer in Higher Plants; in Transgenic Plants, Vol.1, Engineering and Utilization, eds. S.D.Kung and R.Wu, Academic Press, 1993, pp.15-38.
В дополнение к трансформации соматических клеток, которые затем должны быть регенерированы в целое растение, также возможно трансформировать клетки меристемы растений и особенно клетки, которые развиваются в гаметы. В этом случае, трансформированные гаметы следуют пути развития природного растения, давая начало трансгенным растениям. Так, например, семена Арабидопсис, обработанные агробактериями, и семена, полученные из развивающихся растений, среди которых определенная доля является трансформированными, и таким образом трансгенными Feldman, KA and Marks MD (1987). Mol Gen Genet 208:274-289; Feldmann К (1992). In: С Koncz, N-H Chua and J Shell, eds, Methods in Arabidopsis Research. Word Scientific, Singapore, pp.274-289]. Другие способы основаны на повторяющихся удалениях соцветий и инкубации места среза в центре розетки с трансформированными агробактериями, посредством чего могут быть аналогично получены трансформированные семена в более поздний период времени time (Chang (1994). Plant J. 5: 551-558; Katavic (1994). Mol Gen Genet, 245: 363-370). Однако особенно эффективным является метод вакуумной инфильтрации с его модификациями, такими как способ "floral dip" (погружение цветка). В случае вакуумной инфильтрации Арабидопсис, целые растения в условиях пониженного давления обрабатывают суспензией агробактерий [Bechthold, N (1993). С R Acad Sci Paris Life Sci, 316: 1194-1199], в то время как в случае способа "floral dip" развивающаяся ткань цветка быстро инкубируется с суспензией агробактерий, обработанных сурфактантом [Clough, SJ and BentAF (1998) The Plant J. 16, 735-743]. Определенные пропорции трансгенных семян собирают в обоих случаях, и эти семена можно отличить от нетрансгенных семян по росту в ранее описанных селективных условиях. Кроме того, стабильная трансформация плазмид имеет преимущество, так как плазмиды наследуются по материнской линии в большинстве сельскохозяйственных культур, уменьшая и элиминируя риск потока трансгенов через пыльцу. Трансформация генома хлоропластов в целом достигается процессом, который был схематично показан Klaus et al., 2004 [Nature Biotechnology 22 (2), 225-229]. Коротко, последовательности, которые должны быть трансформированы, клонируются вместе с селективным геном-маркером между фланкирующими последовательностями, гомологичными геному хлоропластов. Эти гомологичные фланкирующие последовательности направляют сайт специфичную интеграцию в пластом. Пластидная трансформация была описана для многих различных видов растений и обзор дан в Bock (2001) Transgenic plastids in basic research and plant biotechnology. J Mol Biol. 2001 Sep 21; 312 (3): 425-38 or Maliga, P (2003) Progress towards commercialization of plastid transformation technology. Trends Biotechnol. 21, 20-28. Недавно были опубликованы новые достижения в биотехнологии, в форме пластидных трансформантов без маркера, которые могут быть получены путем временной коинтеграцией маркерного гена (Klaus et al., 2004, Nature Biotechnology 22 (2), 225-229).
Мечение активацией Т-ДНК
Мечение активацией Т-ДНК (Hayashi et al. Science (1992) 1350-1353) включает вставку Т-ДНК, обычно содержащую промотор (также может быть энхансер трансляции или интрон), в участок генома, где расположен ген, представляющий интерес, или на 10 kb выше или ниже кодирующего участка гена в такой конфигурации, что промотор управляет экспрессией целевого гена. Обычно, регуляция экспрессии целевого гена его природным промотором нарушена, и ген попадает под контроль вновь введенного промотора. Промотор, как правило, включен в Т-ДНК. Эта Т-ДНК случайным образом вставляется в геном растения, например, через заражение агробактерией и ведет к изменению экспрессии генов, расположенных рядом со вставкой Т-ДНК. Получаемое в результате трансгенное растение обладает доминантным фенотипом благодаря измененной экспрессии генов, близких к введенному промотору.
ТИЛЛИНГ (TILLING)
Термин ТИЛЛИНГ (TILLING) является аббревиатурой "Направленные Индуцированные Местные Повреждения в Геноме" ("Targeted Induced Local Lesions In Genomes") и относится к технологии мутагенеза, применимой для генерирования и/или идентификации нуклеиновых кислот, кодирующих белки с измененной экспрессией и/или активностью. ТИЛЛИНГ также позволяет выбирать растения, несущие такие мутантные варианты. Эти варианты мутаций могут проявлять измененную экспрессию, или по силе, или по месту, или по времени (если мутация затрагивает, например, промотор). Эти варианты мутаций могут проявлять высокую активность, чем та, которую проявляет ген в его природной форме. ТИЛЛИНГ сочетает в себе высокую плотность мутагенеза с высокой пропускной способностью методов скрининга. Обычная последовательность шагов в ТИЛЛИНГе составляет: (a) EMS мутагенез Redei GP and Koncz С (1992) In Methods in Arabidopsis Research, Koncz C, Chua NH, Schell J, eds. Singapore, World Scientific Publishing Co, pp.16-82; Feldmann et al., (1994) In Meyerowitz EM, Somerville CR, eds, Arabidopsis. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp 137-172; Lightner J and Caspar Т (1998) In J Martinez-Zapater, J Salinas, eds, Methods on Molecular Biology, Vol.82. Humana Press, Totowa, NJ, pp 91-104); (b) подготовку ДНК и объединение объектов; (с) амплификацию, методом ПЦР, участка, представляющего интерес; (d) денатурацию и отжиг для образования гетеродуплексов; (е) ДВЭЖХ (DHPLC), где определяется присутствие гетеродуплекса в пуле в виде дополнительного пика на хроматографии; (f) идентификацию мутантных объектов; и (g) секвенирование мутантного ПЦР продукта. Способы, применяемые в ТИЛЛИНГе, хорошо известны в данной области техники (McCallum et al., (2000) Nat Biotechnol 18: 455-457; reviewed by Stemple (2004) Nat Rev Genet 5 (2): 145-50).
Гомологичная рекомбинация
Гомологичная рекомбинация позволяет вводить в геном выбранные нуклеиновые кислоты в определенную выбранную позицию. Гомологичная рекомбинация является стандартной технологией, используемой рутинно в биологических науках для низших организмов, таких как дрожжи или мох Physcomitrella. Способы выполнения гомологичной рекомбинации в растениях были описаны не только для модели растений (Offringa et al. (1990) EMBO J 9 (10): 3077-84), но также для сельскохозяйственных культур, например риса (Terada et al. (2002) Nat Biotech 20 (10): 1030-4; lida and Terada (2004) Curr Opin Biotech 15 (2): 132-8), и существуют подходы, которые, в целом, применяются не зависимо от выбранного организма (Miller et al., Nature Biotechnol. 25, 778-785, 2007).
Увеличение/Улучшение/Усиление
Термины "увеличение", "улучшение" или "усиление" взаимозаменяемы и должны означать в смысле применения, по меньшей мере, на 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10%, предпочтительно, по меньшей мере, на 15% или 20%, более предпочтительно на 25%, 30%, 35% или 40% больше рассматриваемого фактора по сравнению с любым контролем.
Растение
Термин "растение", как используется в этом документе, охватывает целые растения, предков и потомков растений и части растений, включая семена, побеги, ствол, листья, корни (в том числе клубни), цветы, и ткани, и органы, где каждый вышеупомянутый включает ген/нуклеиновую кислоту, представляющую интерес. Термин "растение" также охватывает растительные клетки, суспензию культур, каллюсную ткань, эмбрионы, меристематические участки, гаметофиты, спорофиты, пыльцу и микроспоры, где снова каждый вышеупомянутый включает ген/нуклеиновую кислоту, представляющую интерес.
Растения, особенно применимые в способах по изобретению, включают все растения, которые относятся к надсемейству Viridiplantae, особенно однодольные и двудольные растения, включая кормовые растения и кормовые бобовые растения, декоративные растения, сельскохозяйственные растения, деревья и кустарники, выбранные из перечня, содержащего Acer spp., Actinidia spp., Abelmoschus spp., Agave sisalana, Agropyron spp., Agrostis stolonifera, Allium spp., Amaranth us spp., Ammophila arenaria, Ananas comosus, Annona spp., Apium graveolens, Arachis spp, Artocarpus spp., Asparagus officinalis, Avena spp. (например, Avena sativa, Avena fatua, Avena byzantina, Avena fatua var. sativa, Avena hybrida), Averrhoa carambola, Bambusa sp., Benincasa hispida, Bertholletia excelsea, Beta vulgaris, Brassica spp. (например, Brassica napus, Brassica rapa ssp. [канола, масличный рапс, масличная репа]), Cadaba farinosa, Camellia sinensis, Canna indica, Cannabis sativa, Capsicum spp., Carex elata, Carica papaya, Carissa macrocarpa, Carya spp., Carthamus tinctorius, Castanea spp., Ceiba pentandra, Cichorium endivia, Cinnamomum spp., Citrullus lanatus, Citrus spp., Cocos spp., Coffea spp., Colocasia esculenta, Cola spp., Corchorus sp., Coriandrum sativum, Corylus spp., Crataegus spp., Crocus sativus, Cucurbita spp., Cucumis spp., Cynara spp., Daucus carota, Desmodium spp., Dimocarpus longan, Dioscorea spp., Diospyros spp., Echinochloa spp., Elaeis (например, Elaeis guineensis, Elaeis oleifera), Eleusine coracana, Erianthus sp., Eriobotrya japonica, Eucalyptus sp., Eugenia uniflora, Fagopyrum spp., Fagus spp., Festuca arundinacea, Ficus carica, Fortunella spp., Fragan'a spp., Ginkgo biloba, Glycine spp. (например, Glycine max, Soja hispida or Soja max), Gossypium hirsutum, Helianthus spp. (например, Helianthus annuus), Hemerocallis fulva, Hibiscus spp., Hordeum spp. (например, Hordeum vulgare), Ipomoea batatas, Juglans spp., Lactuca sativa, Lathyrus spp., Lens culinaris, Linum usitatissimum, Litchi chinensis, Lotus spp., Luffa acutangula, Lupinus spp., Luzula sylvatica, Lycopersicon spp. (например, Lycopersicon esculentum, Lycopersicon lycopersicum, Lycopersicon pyriforme), Macrotyloma spp., Malus spp., Malpighia emarginata, Mammea americana, Mangifera indica, Manihot spp., Manilkara zapota, Medicago sativa, Melilotus spp., Mentha spp., Miscanthus sinensis, Momordica spp., Morus nigra, Musa spp., Nicotiana spp., Olea spp., Opuntia spp., Ornithopus spp., Oryza spp. (например, Oryza sativa, Oryza latifolia), Panicum miliaceum, Panicum virgatum, Passiflora edulis, Pastinaca sativa, Pennisetum sp., Persea spp., Petroselinum crispum, Phalaris arundinacea, Phaseolus spp., Phleum pratense, Phoenix spp., Phragmites australis, Physalis spp., Pinus spp., Pistacia vera, Pisum spp., Poa spp., Populus spp., Prosopis spp., Prunus spp., Psidium spp., Punica granatum, Pyrus communis, Quercus spp., Raphanus sativus, Rheum rhabarbarum, Ribes spp., Ricinus communis, Rubus spp., Saccharum spp., Salix sp., Sambucus spp., Secale cereale, Sesamum spp., Sinapis sp., Solarium spp. (например, Solanum tuberosum, Solanum integrifolium or Solanum lycopersicum), Sorghum bicolor, Spinacia spp., Syzygium spp., Tagetes spp., Tamarindus indica, Theobroma cacao, Trifolium spp., Triticosecale rimpaui, Tiiticum spp. (например, Triticum aestivum, Triticum durum, Triticum turgidum, Triticum hybemum, Triticum macha, Triticum sativum or Triticum vulgare), Tropaeolum minus, Tropaeolum majus, Vaccinium spp., Vicia spp., Vigna spp., Viola odorata, Vitis spp., Zea mays, Zizania palustris, Ziziphus spp., среди других.
Подробное описание изобретения
Удивительно, но в настоящее время было обнаружено, что моделирование в растении экспрессии нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог, дает растения с измененным ростом и/или развитием относительно контрольных растений. В соответствии с первым вариантом выполнения изобретения, настоящее изобретение описывает способ изменения роста и/или развития растения относительно контрольных растений, содержащий модулирование экспрессии нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог, в растении.
Предпочтительным способом модулирования (желательно, увеличения) экспрессии нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог, является введение и экспрессия в растении нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог.
Любая ссылка в дальнейшем в этом документе на "белок, применимый в способах по изобретению" означает UBP полипептид подсемейства UBP15 или его гомолог, как определено в этом документе. Любая ссылка в дальнейшем в этом документе на "нуклеиновую кислоту, применимую в способах по изобретению" означает нуклеиновую кислоту, способную кодировать такой UBP полипептид. Нуклеиновая кислота для введения в растение (и поэтому применимая в выполнении способов по изобретению) является любой нуклеиновой кислотой, кодирующей тип белка, который теперь будет описан, в дальнейшем в этом документе также именуемый "нуклеиновая кислота UBP15" или "ген UBP15".
"Полипептид UBP15", как определено в этом документе, относится к любому полипептиду, содержащему любое из последующего:
(i) Цистеиновый бокс Cys box; и
(ii) Гистидиновый бокс His box; и
(iii) ZnMYND домен "цинковый палец".
Cys и His боксы два высококонсервативных мотива найдены в консервативном каталитическом домене, называемом UBP домен (см. Фиг.1). Cys и His боксы содержат каталитическую триаду остатков (Cys в Cys боксе, His и Asp/Asn в His боксе) (Amerik and Hochstrasser, 2004). Длина UBP домена варьирует от 300 до 900 аминокислот в длину, и, несмотря на иногда низкую консервативность всей последовательности, они обычно демонстрируют консервативную трехмерную структуру. В пределах UBP доменов, Цистеин в Cys боксе играет существенную роль в каталитической активности, и специфичная мутация по Цистеину может прекратить деубиквитинилирующую активность UBP доменов (Papa and Hochstrasser, 1993; Chandler et al., 1997; Rao-Naik et al., 2000; Yan et al., 2000; Baek et al., 2001; Doelling et al., 2001; Hanna et al., 2006).
Подсемейство UBP15 включает UBP15, UBP16, UBP17, UBP18 и UBP19. Члены этого подсемейства и их гомологи содержат характерный признак MYND тип домена "цинковый палец", который, как сообщалось, является доменом белок-белкового взаимодействия у млекопитающих (Gross and McGinnis, 1996; Lutterbach et al., 1998a; Lutterbach et al., 1998b; Masselink and Bernards, 2000).
Генетический анализ взаимодействий между членами подсемейства UBP15 выявил, что UBP15 и UBP16, но не UBP17, обладают функциональной избыточностью, даже если UBP16 и UBP17 одинаково взаимодействуют с UBP15. Мутация в другом члене подсемейства, UBP19, приводит к эмбриональной летальности, в то время как потеря активности самого близкого члена их подсемейства, UBP18, не приводит к видимым дефектам.
Последовательности UBP, применимые в выполнении способов по изобретению, также могут быть идентифицированы путем включения запрашиваемой последовательности в филогенетическое дерево UBP, такое, как описанное в Фиг.1. Полипептиды UBP15 или их гомологи будут группироваться с подсемейством UBP15, а не с любым другим подсемейством.
Кроме того, полипептиды UBP15 и их гомологи, как правило, имеют UBP активность In vitro.
Полипептиды UBP15 или их гомологи, применимые в способах по изобретению, как правило, имеют, в порядке возрастания предпочтения, по меньшей мере, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичности всей последовательности к любому из UBP15 (SEQ ID NO:2), UBP16 (SEQ ID NO:4), UBP17 (SEQ ID NO:6), UBP18 (SEQ ID NO:8) или UBP19 (SEQ ID NO:10) из Арабидопсиса Таля. Идентичность всей последовательности может быть определена с использованием глобального алгоритма выравнивания, такого как алгоритм Needleman Wunsch в программе GAP (GCG Wisconsin Package, Accelrys), предпочтительно с параметрами по умолчанию. В сравнении с идентичностью всей последовательности, идентичность последовательности, как правило, бывает выше, когда рассматривают только консервативные домены или мотивы.
Термин "домен" или "мотив" определен в разделе "определения" в этом документе. Для идентификации доменов существуют специальные базы данных, например SMART (Schultz et al. (1998) Proc. Natl. Acad. Sci. USA 95, 5857-5864; Letunic et al. (2002) Nucleic Acids Res 30, 242-244), InterPro (Mulder et al., (2003) Nucl. Acids. Res. 31, 315-318), Prosite (Bucher and Bairoch (1994), A generalized profile syntax for biomolecular sequences motifs and its function in automatic sequence interpretation. (In) ISMB-94; Proceedings 2nd International Conference on Intelligent Systems for Molecular Biology. Altman R., Brutlag D., Karp P., Lathrop R., Searls D., Eds., pp 53-61, AAAI Press, Menio Park; Hulo et al., Nucl. Acids. Res. 32: D134-D137, (2004)), или Pfam (Bateman et al., Nucleic Acids Research 30 (1): 276-280 (2002)). Набор инструментов для анализа белковых последовательностей in silico доступен на сервере протеомики ExPASy (Swiss Institute of Bioinformatics (Gasteiger et al., ExPASy: the proteomics server for in-depth protein knowledge and analysis, Nucleic Acids Res. 31: 3784-3788 (2003)). Домены и мотивы также могут быть идентифицированы с помощью стандартных методов, таких как выравнивание последовательности (сравнительный анализ линейных последовательностей).
Способы сравнения (выравнивания) линейных последовательностей хорошо известны в данной области техники, такие способы включают GAP, BESTFIT, BLAST, FASTA и TFASTA. GAP использует алгоритм Needleman and Wunsch ((1970) J Mol Biol 48: 443-453) для обнаружения глобальной (т.е. охватывающей полные последовательности) линейной последовательности в двух последовательностях, которая максимизирует количество совпадений и минимизирует количество расхождений. Алгоритм BLAST (Altschul et al. (1990) J Mol Biol 215: 403-10) вычисляет процент идентичности последовательности и выполняет статистический анализ подобия между двумя последовательностями. Программное обеспечение для выполнения BLAST анализа публично доступно через Национальный Центр Биотехнологической Информации (NCBI). Гомологи могут быть легко идентифицированы с использованием, например, алгоритма множественного сравнения (выравнивания) и парных совпадений по умолчанию и способа оценки в процентах. Общий процент подобия и идентичности может быть также определен с использованием одного из методов, доступного в пакете программного обеспечения MatGAT (Campanella et al., BMC Bioinformatics. 2003 Jul 10; 4: 29. MatGAT: приложение, которое создает матрицу подобия/идентичности, используя последовательности белков или ДНК). Незначительное ручное редактирование может быть выполнено для оптимизации выравнивания (линейного сравнения) между консервативными мотивами, с точки зрения специалиста в данной области техники. Более того, вместо того чтобы использовать последовательности полной длины для идентификации гомологов, могут быть также использованы специфичные домены. Степень идентичности последовательностей может быть определена по полной последовательности нуклеиновой кислоты или полной аминокислотной последовательности или по выбранным доменам или по консервативному мотиву(ам), с использованием вышеупомянутых программ с использованием параметров по умолчанию. Для частичных сравнений линейных последовательностей особенно применим алгоритм Smith-Waterman (Smith TF, Waterman MS (1981) J. Mol. Biol 147 (1); 195-7).
Примеры нуклеиновых последовательностей, кодирующих членов подсемейства UBP15, представлены последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 и 44. Такие нуклеиновые кислоты применимы в выполнении способов по изобретению. Нуклеотидная последовательность, представленная последовательностью SEQ ID NO:11, кодирует полипептидную последовательность, представленную последовательностью SEQ ID NO:12, UBP из риса (Nipponbare strain), который очень близок к AtUBP15, и имеет 53% идентичности на нуклеотидном уровне, 40% идентичности на белковом уровне и 54% подобия на белковом уровне. Нуклеотидная последовательность, представленная последовательностью SEQ ID NO:13, кодирует полипептидную последовательность, представленную последовательностью SEQ ID NO:14, UBP из риса (Nipponbare strain), который очень близок к AtUBP16, и имеет 44% идентичности cAtUBP16 на нуклеотидном уровне, 30% идентичности на белковом уровне и 44% подобия на белковом уровне с АtUВР16. Нуклеотидная последовательность, представленная последовательностью SEQ ID NO:15, кодирует полипептидную последовательность, представленную последовательностью SEQ ID NO:16, UBP из риса (Nipponbare strain), который очень близок AtUBP17, и имеет 40% идентичности AtUBP17 на нуклеотидном уровне, 33% идентичности на белковом уровне и 45% подобия на белковом уровне с AtUBP17. Нуклеотидная последовательность, представленная последовательностью SEQ ID NO:17, кодирует полипептидную последовательность, представленную последовательностью SEQ ID NO:18, UBP из риса (Nipponbare strain), который очень близок к AtUBP18, и имеет 34% идентичности с AtUBP17 на нуклеотидном уровне, 30% идентичности на белковом уровне и 39% подобия на белковом уровне с AtUBP18. SEQ ID NO:19 является нуклеотидной последовательностью из кукурузы (Zea mays), демонстрирующей некоторое подобие последовательности SEQ ID NO:11. SEQ ID NO:19 является самой длинной последовательностью кДНК кукурузы, полученной путем сборки экспрессируемых ярлыков (ESTs= Expressed Sequence Tags) последовательностей SEQ ID NOs 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37 и 38. Последовательность SEQ ID NO:39 была собрана из экспрессируемых ярлыков (ESTs) последовательностей SEQ ID NOs 40, 41, 42 и 43. SEQ ID NO:44 является другой нуклеотидной последовательностью из кукурузы, демонстрирующей некоторое подобие последовательности SEQ ID NO:11. SEQ ID NO:44 была собрана из экспрессируемых ярлыков (ESTs) последовательностей SEQ ID NOs 45, 46, 47, 48, 49, 50 и 51.
Последовательности SEQ ID NOs 12, 14, 16 и 18 являются примерами ортологов полипептидов UBP, представленных последовательностями SEQ ID NOs: 2, 4, 6 и 8 соответственно. Термин "ортолог" и "паралог" такие, как определено в данном документе. Следующие ортологи и паралоги могут быть легко идентифицированы путем выполнения так называемого реципрокного бласт-поиска. Как правило, он включает первый BLAST, включающий бластинг (BLASTing) изучаемой последовательности (запрос) (например, использование любой из последовательностей (SEQ ID NOs 2, 4, 6, 8 или 10), против любой последовательности базы данных, такой как доступная публично база данных NCBI. BLASTN или TBLASTX (с использованием стандартных параметров по умолчанию) обычно используются, когда начинают с нуклеотидной последовательности, и BLASTP или TBLASTN (с использованием стандартных параметров по умолчанию), когда начинают с белковой последовательности. Результаты BLAST могут быть необязательно отфильтрованы. Последовательности полной длины из отфильтрованных результатов или нефильтрованных результатов затем обратно бластируются (BLASTed back) (второй BLAST) против последовательностей из организма, из которого получена изучаемая последовательность (где изучаемая последовательность является SEQ ID NO:1 по SEQ ID NO:10, поэтому второй BLAST будет против последовательностей Arabidopsis). Затем сравнивают результаты первого и второго blastob. Паралог определяется, если последовательность с высоким уровнем совпадений из первого бласта происходит из того же вида, что и изучаемая последовательность, и затем обратный BLAST выдает изучаемую последовательность среди самых больших совпадений; ортолог определяется, если последовательность с высоким уровнем совпадений в первом BLAST (бласте) происходит не из того же вида, что и исследуемая последовательность, и предпочтительно при обратном BLAST выдает исследуемую последовательность среди самых больших совпадений.
Последовательность с высоким уровнем совпадений имеет низкую величину Е. Чем ниже величина Е, тем более достоверно выравнивание (сравнение) (или другими словами тем меньше шанс, что совпадение случайно). Вычисление величины Е хорошо известно в данной области техники. Дополнительно к величине Е, сравнения также оцениваются по проценту идентичности. Процент идентичности относится к числу идентичных нуклеотидов (или аминокислот) между двумя сравниваемыми нуклеотидными (или полипептидными) последовательностями по фиксированной длине. В случае больших семейств, может быть использован ClustalW, с последующим построением филогенетического дерева, для помощи в визуализации кластеров родственных генов и идентификации ортологов и паралогов.
Варианты нуклеиновых кислот также могут быть пригодны в применении на практике способов по изобретению. Примеры таких вариантов включают нуклеиновые кислоты, кодирующие гомологи и производные любой из аминокислотных последовательностей, представленных последовательностями SEQ ID NOs 2, 4, 6, 8 или 10, где термины "гомолог" и "производное" определяются, как описано в этом документе. Также применимы в способах по изобретению нуклеиновые кислоты, кодирующие гомологи и производные ортологов и паралогов любой из аминокислотных последовательностей, представленных последовательностями SEQ ID NOs 2, 4, 6, 8 или 10. Гомологи и производные, применимые в способах по данному изобретению, имеют по существу такую же биологическую и функциональную активность, как и немодифицированный белок, из которого они происходят.
Следующие варианты нуклеиновых кислот, пригодные для применении на практике способов по изобретению, включают участки нуклеиновых кислот, кодирующих полипептиды UBP15 или их гомологи, нуклеиновые кислоты, гибридизующиеся с нуклеиновыми кислотами, кодирующими полипептиды UBP 15 или их гомологи, варианты сплайсинга нуклеиновых кислот, кодирующих полипептиды UBP 15 или их гомологи, аллельные варианты нуклеиновых кислот, кодирующих полипептиды UBP 15 или их гомологи, и варианты нуклеиновых кислот, кодирующих полипептиды UBP 15, полученные перестановкой генов. Термины гибридизующиеся последовательности, варианты сплайсинга, аллельные варианты и перестановка генов определяются, как описано в данном документе.
Нуклеиновые кислоты, кодирующие полипептиды UBP15 или их гомологи, не должны быть полноразмерными нуклеиновыми кислотами, поскольку выполнение способов по изобретению не зависит от использования полноразмерных последовательностей нуклеиновых кислот. В соответствии с настоящим изобретением, здесь представлен способ изменения роста и развития растения, содержащий введение и экспрессию в растениях участка любой из последовательностей нуклеиновых кислот, представленных последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или участка нуклеиновой кислоты, кодирующей ортолог, паралог или гомолог любой из аминокислотных последовательностей, представленных последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18.
Участок нуклеиновой кислоты может быть подготовлен, например, выполнением одной или более делеций в нуклеиновой кислоте. Участки могут быть использованы в изолированном виде, или они могут быть слиты с другими кодирующими (или некодирующими) последовательностями, например, с целью получения белка, который сочетает несколько активностей. В случае сшивания с другой кодирующей последовательностью, конечный полипептид, полученный после трансляции, может быть больше, чем предполагаемый для участка белка.
Участки, применимые в способах по изобретению, кодируют полипептид UBP15 или его гомолог, как определено в этом документе, и имеют по существу такую же биологическую активность, как и последовательности аминокислот, представленные последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18. Предпочтительно, участок является участком любой из перечисленных нуклеиновых кислот, представленных последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или является участком нуклеиновой кислоты, кодирующей ортолог или паралог любой из аминокислотных последовательностей, представленных последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18. Предпочтительно участок имеет в длину, по меньшей мере, 1000, 1050, 1100, 1150, 1200, 1250, 1300, 1350, 1400, 1450, 1500, 1550, 1600, 1650, 1700, 1750, 1800, 1850, 1900, 1950, 2000, 2050, 2100, 2150, 1200, 2250, 2300, 2350, 2400, 2450, 2500, 2550, 2600, 2650, 2700, 2750, 2800, 2850, 2900, 2950, 3000, 3050, 3100, 3150 или более последовательных нуклеотидов, последовательные нуклеотиды, являющиеся любой из последовательностей нуклеиновых кислот, представленных последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или нуклеиновой кислотой, кодирующей ортолог или паралог любой из аминокислотных последовательностей, представленных последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18. Наиболее предпочтительно, участок является фрагментом нуклеиновой кислоты любой из последовательностей SEQ ID NOs 1, 3, 5, 7 или 9. Предпочтительно, участок кодирует фрагмент аминокислотной последовательности, которая при использовании в построении филогенетического дерева, такого как описано в Фиг.1, группируется с подсемейством белков UBP15 более, чем с любым другим подсемейством UBP.
Другой вариант нуклеиновой кислоты, применимый в способах по изобретению, является нуклеиновой кислотой, способной гибридизоваться в условиях пониженной жесткости, предпочтительно в жестких условиях, с нуклеиновой кислотой, кодирующей полипептид UBP15 или его гомолог, как определено в данном документе, или с его участком, как определено в данном документе.
В соответствии с настоящим изобретением, здесь представлен способ изменения роста и/или развития растения, содержащий введение и экспрессию в растении нуклеиновой кислоты, способной гибридизоваться с любой из нуклеиновых кислот, представленных последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или содержащий введение и экспрессию в растении нуклеиновой кислоты, способной гибридизоваться с нуклеиновой кислотой, кодирующей ортолог, паралог или гомолог любой из последовательностей нуклеиновой кислоты, представленных последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18.
Гибридизуемые последовательности, применимые в способах по изобретению, кодируют полипептид UBP15, как определено в этом документе, имея по существу такую же биологическую активность, как и аминокислотные последовательности, представленные любой из последовательностей SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18. Предпочтительно, гибридизуемая последовательность способна гибридизоваться с любой из нуклеиновых кислот, представленных последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или с участком любой из этих последовательностей, где участок определяется, как указано выше, или гибридизуемая последовательность способна гибридизоваться с последовательностью нуклеиновой кислоты, кодирующей ортолог или паралог любой из аминокислотных последовательностей, представленных последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18. Наиболее предпочтительно, гибридизуемая последовательность способна гибридизоваться с нуклеиновой кислотой, представленной последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15 или 17 или их участком.
Предпочтительно, гибридизуемая последовательность кодирует полипептид с аминокислотной последовательностью, который при полной длине в построении филогенетического дерева UBP, такого как показан на Фиг.1, группируется с подсемейством полипептидов UBP15 более, чем с любым другим подсемейством UBP.
Другой вариант нуклеиновой кислоты, применимый в способах по изобретению, является вариантом сплайсинга, кодирующим полипептид UBP15 или его гомолог, как определено выше в этом документе, где вариант сплайсинга определяется, как указано в этом документе.
В соответствии с настоящим изобретением, здесь представлен способ изменения роста и/или развития растения, содержащий введение и экспрессию в растении варианта сплайсинга любой из последовательностей нуклеиновой кислоты, представленной последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или вариантом сплайсинга нуклеиновой кислоты, кодирующей ортолог, паралог или гомолог любой из аминокислотных последовательностей, представленных последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18.
Предпочтительные варианты сплайсинга являются вариантами сплайсинга нуклеиновой кислоты, представленной любой из последовательностей SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15 или 17, или вариантом сплайсинга нуклеиновой кислоты, кодирующей ортолог или паралог последовательностей SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16 или 18. Предпочтительно, аминокислотная последовательность, кодируемая вариантом сплайсинга, при построении филогенетического дерева UBP, такого, как показан на Фиг.1, группируется с подсемейством полипептидов UBP15 более, чем с любым другим подсемейством UBP.
Другой вариант нуклеиновой кислоты, применимый в исполнении способов по изобретению, является аллельным вариантом нуклеиновой кислоты, колирующим полипептид UBP15 или его гомолог, как определено выше в этом документе, где аллельный вариант определяется, как указано в этом документе.
В соответствии с настоящим изобретением, здесь представлен способ изменения роста и/или развития растения, содержащий введение и экспрессию в растении аллельного варианта любой из нуклеиновых кислот, представленных последовательностями SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или содержащий введение и экспрессию в растении аллельного варианта нуклеиновой кислоты, кодирующей ортолог, паралог или гомолог любой из аминокислотных последовательностей, представленных последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18.
Аллельные варианты, применимые в способах по изобретению, имеют по существу такую же биологическую активность, как и любой полипептид подсемейства UBP15, представленный последовательностями SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18. Аллельные варианты существуют в природе и, охваченные в пределах способов по данному изобретению, являются применением этих природных аллелей. Предпочтительно, аллельный вариант является аллельным вариантом любой их последовательностей SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или аллельным вариантом нуклеиновой кислоты, кодирующей ортолог или паралог последовательностей SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16 или 18. Предпочтительно, аминокислотная последовательность, кодируемая аллельным вариантом, при построении филогенетического дерева UBP, такого, как показано на Фиг.1, группируется с подсемейством UBP15 более, чем с любым другим подсемейством UBP.
Перестановка генов или направленная эволюция также могут быть использованы для создания вариантов нуклеиновых кислот, кодирующих полипептиды UBP15 или их гомологи, как определено выше; термин "перестановка генов" определяется, как указано в этом документе.
В соответствии с настоящим изобретением, здесь представлен способ изменения роста и/или развития растения в растениях, содержащий введение и экспрессию в растении варианта любой из последовательностей нуклеиновой кислоты, представленных любой последовательностью SEQ ID NOs 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 39 или 44, или содержащий введение и экспрессию в растении варианта нуклеиновой кислоты, кодирующей ортолог, паралог или гомолог любой из аминокислотных последовательностей, представленных любой из последовательностей SEQ ID NOs 2, 4, 6, 8, 10, 12, 14, 16 или 18, где вариант нуклеиновой кислоты получен перестановкой генов.
Предпочтительно, аминокислотная последовательность, кодируемая вариантом нуклеиновой кислоты, полученным перестановкой генов, при построении филогенетического дерева UBP, такого, как показано на Фиг.1, группируется с подсемейством UBP15 более, чем с любым другим подсемейством UBP.
Кроме того, варианты нуклеиновой кислоты могут также быть получены с помощью сайт-специфического мутагенеза. Несколько способов доступны для достижения сайт-специфического мутагенеза, наиболее распространенным является способ, основанный на ПЦР (Current Protocols in Molecular Biology. Wiley Eds.).
Нуклеиновые кислоты, кодирующие полипептиды UBP15, могут происходить из любого природного или искусственного источника. Нативная форма нуклеиновой кислоты может быть изменена по составу и/или генетическому окружению преднамеренными манипуляциями человека. Предпочтительно, нуклеиновая кислота, кодирующая полипептид UBP, происходит из растения, далее предпочтительно из двудольного растения, более предпочтительно из семейства Brassicaceae, наиболее предпочтительно нуклеиновая кислота из Арабидопсиса Таля.
Выполнение способов по изобретению создает растения, имеющие измененный рост и/или развитие.
Измененное развитие может присутствовать в любой части растения, в любой клетке, ткани или органе, особенно в листьях. Измененное развитие может быть измененным репродуктивным развитием. Измененное развитие может являться причиной измененного фенотипа растения, такого как измененная форма листа (особенно более узкие, и/или зубчатые, и/или плоские листья); и измененные фенотипы (такие как измененное цветение, и/или изменения в апикальном доминировании, и/или измененная урожайность). Измененное развитие или фенотип могут являться причиной изменений в пролиферации клеток.
Настоящее изобретение охватывает растения или их части (включая семена), которые можно получить способами в соответствии с настоящим изобретением. Растения или их части содержат трансгены нуклеиновой кислоты, кодирующие полипептид UBP15 или его гомологи, как описано выше.
В изобретении также описаны генетические конструкции и вектора для упрощения введения и/или экспрессии в растении нуклеиновых кислот, кодирующих полипептид UBP15 или его гомологи. Генетические конструкции могут быть введены в вектора, которые могут быть коммерчески доступны, пригодны для трансформации в растениях и для экспрессии гена, представляющего интерес, в трансформированных клетках. В изобретении также описано использование генетических конструкций, как определено в этом документе, в способах по изобретению.
Более конкретно, в данном изобретении описаны конструкции, содержащие:
(а) нуклеиновую кислоту, кодирующую полипептид, который является членом подсемейства UBP15 или его гомолога, как определено выше;
(б) одну или более управляющие последовательности, способные запускать экспрессию последовательности нуклеиновой кислоты по (а); и необязательно
(с) последовательность терминации трансляции.
Предпочтительно, нуклеиновая кислота, кодирующая полипептид UBP15 или его гомолог, такова, как определено выше. Термин "управляющая последовательность" и "последовательность терминации" такие, как определено выше.
Растения трансформированы вектором, содержащим любую из нуклеиновых кислот, описанных выше. Специалисту в данной области хорошо известны генетические элементы, которые должны присутствовать в векторе для успешных трансформации, отбора и размножения клеток хозяина, содержащих последовательность, представляющую интерес. Последовательность, представляющая интерес, функционально связана с одной или более управляющими последовательностями (по меньшей мере, с промотором).
Преимущественно, любой тип промотора или естественный, или синтетический, может быть использован для запуска экспрессии последовательности нуклеиновой кислоты. Конститутивный промотор является особенно применимым в способах. Предпочтительно конститутивный промотор является универсальным промотором. Смотри раздел "Подробное описание изобретения" в этом документе для определения различных типов промоторов.
Конститутивный промотор является предпочтительно промотором CaMV35S. Далее предпочтительно конститутивный промотор представлен последовательностью нуклеиновой кислоты, в значительной степени сходной с последовательностью SEQ ID NO:52, наиболее предпочтительно конститутивный промотор является таковым, как представлено в последовательности SEQ ID NO:52. Для дополнительных примеров конститутивных промоторов смотри Таблицу В в "Подробном описании изобретения" в этом документе.
Необязательно, одна или более терминирующих последовательностей могут быть использованы в конструкции, введенной в растение. Дополнительные регуляторные элементы могут включать транскрипционные, так же как и трансляционные, энхансеры. Специалистам в данной области техники хорошо известны терминирующие и энхансерные последовательности, которые могут быть пригодны к применению для выполнения изобретения. Также могут быть добавлены последовательности интронов в 5' нетранслируемом регионе (UTR) или в кодирующую последовательность для увеличения количества зрелых мРНК, накапливаемых в цитозоле, как описано в разделе "подробное описание изобретения". Другие регулирующие последовательности (кроме промотора, энхансера, сайленсера, последовательностей интронов, 3'UTR и/или 5'UTR участков) могут быть элементами, стабилизирующими белок и/или РНК. Такие последовательности должны быть хорошо известны или могут быть легко получены специалистом в данной области техники.
Генетические конструкции по изобретению могут кроме того включать последовательность инициации репликации, которая необходима для сохранения и/или репликации в определенном типе клетки. Один из примеров, когда генетическая конструкция нуждается в эписомальном генетическом элементе (например, плазмиде или космиде) для сохранения в бактериальной клетке. Предпочтительные инициаторы репликации включают, но не ограничиваются, f1-ori и colE1.
Для определения успешного переноса последовательностей нуклеиновой кислоты, как используется в способах по изобретению, и/или выбора трансгенных растений, содержащих эти нуклеиновые кислоты, удобно использовать гены-маркеры (или репортерные гены). Поэтому генетические конструкции могут необязательно содержать селективные гены-маркеры. Селективные маркеры более подробно описаны в разделе "Подробное описание изобретения" в этом документе. Гены-маркеры могут быть удалены или вырезаны из трансгенной клетки как только они перестают быть нужны. Методы удаления маркеров известны в данной области техники, применимые методы описаны выше в разделе "Подробное описание изобретения".
В изобретении также описан способ получения трансгенных растений, имеющих измененный рост и/или развитие по сравнению с контрольными растениями, содержащий введение и экспрессию в растении любой нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог, как определено выше в этом документе.
Более конкретно, в настоящем изобретении описан способ получения трансгенных растений, имеющих измененный рост и/или развитие, который содержит:
(i) введение и экспрессию в растении или в растительной клетке нуклеиновой кислоты, кодирующей полипептид UBP15; и
(ii) культивирование растительной клетки в условиях стимулирования роста и развития растения.
Нуклеиновая кислота (i) может быть любой нуклеиновой кислотой, способной кодировать полипептид UBP15 или его гомолог, как определено в этом документе.
Нуклеиновая кислота может быть введена непосредственно в растительную клетку, или в само растение, или, включая введение в ткань, орган, или любую другую часть растения. В соответствии с предпочтительным признаком настоящего изобретения, нуклеиновая кислота, предпочтительно вводится в растение путем трансформации. Термин "трансформация" детально описан в разделе "Подробное описание изобретения" в этом документе.
Генетически измененные растительные клетки могут быть созданы всеми способами, с которыми знаком специалист в данной области техники. Подходящие способы могут быть найдены в вышеуказанных публикациях S.D.Kung and R.Wu, Potrykus or Hofgen and Willmitzer.
Как правило, после трансформации, растительные клетки или группировки клеток отбирают по факту наличия одного или более маркеров, которые кодируются экспрессирующимися в растении генами, ко-трансфицированными совместно с геном, представляющим интерес, после чего из трансформированного материала регенерируют целое растение. Для отбора трансформированных растений, растительный материал, полученный в процессе трансформации, как правило, подвергают воздействию селективных условий так, чтобы трансформированные растения можно было отличить от не трансформированных растений. Например, семена, полученные вышеописанным способом, могут быть высажены и, после начального периода роста, подвергнуты подходящему отбору путем распыления. Дополнительная возможность состоит в выращивании семян, при необходимости после стерилизации, на чашках с агаром с использованием подходящего селективного агента, так что только трансформированные семена могут вырасти в растения. Кроме того, трансформированные растения скринируются на наличие селективного маркера, такого, как описан выше.
После переноса ДНК и регенерации, предположительно трансформированные растения могут быть охарактеризованы, например, с помощью Саузерн-Блотт анализа на наличие гена, представляющего интерес, количество копий и/или геномную организацию. Альтернативно или дополнительно, уровни экспрессии недавно введенной ДНК могут быть измерены с помощью Нозерн- и/или Вестерн-Блотт анализов, оба метода хорошо известны специалистам в данной области техники.
Полученные трансформированные растения могут быть размножены рядом способов, таких как развитие клона или классические методы разведения. Например, первое поколение (или Т1) трансформированного растения может быть самоопылено и отобраны гомозиготные трансформанты второго поколения (или Т2), и затем Т2 растения могут быть далее размножены с помощью классических методов разведения. Полученные трансформированные организмы могут принимать различные формы. Например, они могут быть химерами трансформированных клеток и нетрансформированных клеток; кленовыми трансформантами (например, все клетки трансформированы и содержат кассету для экспрессии); привоями трансформированных и нетрансформированных тканей (например, в растениях, трансформированный подвой привит на нетрансформированный привой).
Настоящее изобретение, безусловно, распространяется на любую растительную клетку или растение, полученное любым описанным с этом документе способом, и на все части растений и их пропагулы. Настоящее изобретение распространяется далее, охватывая потомство первично трансформированной или трансфицированной клетки, ткани, органа или целого растения, которое было получено любым из ранее упомянутых методов, единственное требование состоит в том, что потомство проявляет ту же генотипическую и/или фенотипическую характеристику(и), что и родитель, в способах по данному изобретению.
Изобретение также включает клетки хозяина, содержащие изолированную нуклеиновую кислоту, кодирующую полипептид UBP15 или его гомолог, как определено выше в этом документе. Предпочтительные клетки хозяина по изобретению являются растительными клетками. Теоретически, предпочтительно все растения, которые способны синтезировать полипептиды, используемые в методах изобретения, являются растениями-хозяевами для нуклеиновых кислот или вектора, используемого в способах по изобретению, кассеты для экспрессии, или конструкции, или вектора.
Способы по изобретению предпочтительно применимы к любому растению. Растения, которые особенно применимы в способах по изобретению, включают все растения, которые относятся к суперсемейству Зеленые растения (Viridiplantae), в особенности однодольные и двудольные растения, включая кормовые или кормовые бобовые растения, декоративные растения, продовольственные культуры, деревья и кустарники. По предпочтительному варианту выполнения настоящего изобретения, растение является сельскохозяйственным растением. Примеры сельскохозяйственных растений включают соевые бобы, подсолнечник, канолу, люцерну, рапс, хлопок, томаты, картофель и табак. Далее предпочтительно растение является однодольным растением. Примеры однодольных растений включают сахарный тростник. Более предпочтительно, растение является злаком. Примеры злаков включают рис, маис, пшеницу, ячмень, просо, рожь, тритикале, сорго и овес.
Изобретение также распространяется на части растений, собираемые в виде урожая, такие как, но не ограничиваясь, семена, листья, фрукты, цветы, стебли, корни, подземные побеги, клубни и луковицы. Более того, изобретение относится к продуктам, происходящим, предпочтительно непосредственно происходящим, из собираемых в виде урожая частей таких растений, как сухие кормовые гранулы или порошки, масло, жир и жирные кислоты, крахмал или белки.
В соответствии с предпочтительным признаком изобретения, модулированная экспрессия является увеличенной экспрессией. Способы увеличения экспрессии нуклеиновых кислот, или генов, или продуктов генов хорошо задокументированы в данной области техники, и примеры представлены в разделе "Подробное описание изобретения".
Как упомянуто выше, предпочтительным способом модуляции экспрессии нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог, является введение и экспрессия в растении нуклеиновой кислоты, кодирующей полипептид UBP15 или его гомолог; однако результат исполнения способа, то есть измененный рост и/или развитие растения, может быть также достигнут использованием других хорошо известных методов, включая, но не ограничиваясь, мечение активацией Т-ДНК, ТИЛЛИНГ, гомологичную рекомбинацию. Описания этих методов представлены в разделе "Подробное описание изобретения".
Настоящее изобретение также охватывает использование нуклеиновых кислот, кодирующих полипептид UBP15 или его гомологи, как описано в этом документе, и использование этих UBP15 полипептидов в изменении роста и/или развития растений.
Нуклеиновые кислоты, кодирующие полипептид UBP15, описанные в этом документе, или сам полипептид UBP15 могут найти применение в программах разведения, в которых определен ДНК маркер, который может быть генетически связан с геном, кодирующим полипептид UBP15. Нуклеиновые кислоты/гены или сам полипептид UBP15 могут быть использованы для установления молекулярного маркера. Этот ДНК или белковый маркер может затем быть использован в программах разведения для селекции растений, имеющих измененный рост и/или развитие, как определено выше в этом документе в способах по изобретению.
Аллельные варианты нуклеиновой кислоты/гена, кодирующей полипептид UBP15, также могут найти применение в программах разведения с помощью маркеров. Такие программы разведения иногда требуют введения аллельных вариаций с помощью мутагенной обработки растений с использованием, например, ЕМС мутагенеза; кроме того, программы могут начинаться с создания коллекции аллельных вариантов так называемого "природного" происхождения, полученных непреднамеренно. Затем осуществляют идентификацию аллельных вариантов, например, с помощью ПЦР. Следующий шаг состоит в отборе лучших аллельных вариантов изучаемой последовательности и которые дают измененный рост и/или развитие. Отбор обычно заключается в измерении характеристик роста растений, содержащих различные аллельные варианты изучаемой последовательности. Характеристики роста могут измеряться в оранжерее или в поле. Следующие необязательные стадии включают скрещивание растений, в которых был идентифицирован лучший аллельный вариант, с другим растением. Это может быть использовано, например, для получения комбинаций интересных фенотипических особенностей.
Нуклеиновые кислоты, кодирующие полипептиды UBP15 или их гомологи, могут также быть использованы в качестве зондов для генетического и физического картирования генов, частью которых они являются, и как маркеры признаков, сцепленных с этими генами. Такая информация может быть полезна в разведении растений с целью создания линий с желаемыми фенотипами. Такое применение нуклеиновых кислот, кодирующих полипептид UBP15, требует только последовательность нуклеиновой кислоты, по меньшей мере, в 15 нуклеотидов в длину. Нуклеиновые кислоты, кодирующие полипептид UBP15, могут быть использованы как маркеры полиморфизма длин рестрикционных фрагментов (ПДРФ). Саузерн-Блотты (Sambrook J, Fritsch EF and Maniatis Т (1989) Molecular Cloning, A Laboratory Manual) рестрикционных фрагментов геномной ДНК растения могут быть обработаны зондами нуклеиновых кислот, кодирующих UBP15. Полученные в результате отпечатки связывания могут быть подвергнуты генетическому анализу с помощью таких компьютерных программ, как MapMaker (Lander et al. (1987) Genomics 1: 174-181), для построения генетической карты. Дополнительно, нуклеиновые кислоты могут быть использованы в качестве зондов в Саузерн-Блоттах, содержащих эндонуклеазные рестрикционные фрагменты геномной ДНК ряда особей, представляющих родителей и потомство заданного генетического скрещивания. Сегрегация полиморфизмов ДНК описана и использована для вычисления положения нуклеиновой кислоты, кодирующей полипептид UBP15, на ранее полученной генетической карте этой популяции (Botstein et al. (1980) Am. J. Hum. Genet. 32: 314-331).
Производство и использование зондов из генов растений для применения в генетическом картировании описано в Bernatzky and Tanksley (1986) Plant Mol. Biol. Reporter 4: 37-41. Многочисленные публикации описывают генетическое картирование специфичных клонов кДНК с использованием метода, описанного в общих чертах выше, или его вариантов. Например, F2 популяции перекрестного скрещивания, популяция реципрокного скрещивания, свободно скрещенная популяция, близкие изогенные линии и другие множества особей могут быть использованы для картирования. Такие методики хорошо известны специалистам в данной области техники.
Зонды нуклеиновых кислот также могут быть использованы для физического картирования (т.е. положение последовательности на физических картах, см. Hoheisel et al. In: Non-mammalian Genomic Analysis: A Practical Guide, Academic press 1996, pp.319-346 и приведенный в документе список ссылок).
В другом варианте выполнения изобретения, зонды нуклеиновых кислот могут быть использованы в картировании с помощью прямой флуоресцентной гибридизации in situ (FISH) (Trask (1991) Trends Genet. 7: 149-154). Хотя современные методы FISH картирования поддерживают использование больших зондов (от нескольких kb до нескольких сотен kb; смотри Laan et al. (1995) Genome Res. 5: 13-20), улучшение чувствительности может допустить выполнение FISH картирования с применением более коротких зондов.
Ряд способов, основанных на амплификации нуклеиновой кислоты, для генетического и физического картирования могут быть выполнены с использованием нуклеиновых кислот. Примеры включают аллель-специфичную амплификацию (Kazazian (1989) J. Lab. Clin. Med 11: 95-96), полиморфизм амплифицированных с помощью ПЦР фрагментов (CAPS; Sheffield et al. (1993) Genomics 16: 325-332), аллель-специфичное лигирование (Landegren et al. (1988) Science 241: 1077-1080), реакции нуклеотидной элонгации (Sokolov (1990) Nucleic Acid Res. 18: 3671), картирование с помощью облученных гибридов (Walter et al. (1997) Nat. Genet. 7: 22-28) и картирование HAPPY (Dear and Cook (1989) Nucleic Acid Res. 17: 6795-6807). Для этих способов последовательность нуклеиновой кислоты используется для конструирования и производства пар праймеров для применения в реакции амплификации или в реакциях элонгации праймера. Конструирование таких праймеров хорошо известно специалистам в данной области техники. В способах, использующих генетическое картирование, основанное на ПЦР, может быть необходимо определить различия в последовательностях ДНК у родителей, которых использовали в скрещивании для картирования, в участке, соответствующем рассматриваемой в данный момент последовательности нуклеиновой кислоты. Это, тем не менее, не является необходимым для способов картирования.
Способы по настоящему изобретению дают в результате растения с измененным ростом и/или развитием, описанными ранее в данном документе. Эти признаки также могут быть объединены с другими экономически выгодными признаками, такими как признаки повышения урожайности, устойчивости к абиотическим и биотическим факторам, признаки изменения различных декоративных особенностей и/или биохимических и/или физиологических особенностей.
Примеры
Теперь настоящее изобретение будет описано со ссылкой на следующие примеры, которые являются только иллюстрацией. Следующие примеры не предназначены для полного определения или иного ограничения области изобретения.
1. Растительный материал и условия роста
Растения дикого типа Арабидопсиса Таля, использованные в этом исследовании, были Columbia-0 экотипа. Инсерционные линии 38 Т-ДНК (включая ubp15-1, ubp15-2 и ubp19-1 эти три линии с наблюдаемыми фенотипами), приведенные в Таблице 1, были получены из коллекции SALK. UBP15 (или UBP15C447A/S)-сверхэкспрессирующие трансгенные растения были получены путем трансформации PUBP15:UBP15 (или PUBP15:UBP15C447A/S) в генетическое окружение дикого типа. UBP15 комплементарные (или UBP15C447A/S) трансгенные растения были получены путем трансформации PUBP15:UBP15 (или PUBP15:UBP15C447A/S) в ubp15-1 генетическое окружение. PUBP19:GUS трансгенные растения были получены путем трансформации PUBP19:GUS конструкции в генетическое окружение дикого типа. ubp15 ubp16, ubp15 ubp17 и ubp16 ubp17 двойные мутанты были получены путем скрещивания ubp15-1 (или ubp15-2) с ubp16-1 или ubp17-1, или путем скрещивания ubp16-1 с ubp17-1; гомозиготы поколения F2 были подтверждены ПЦР анализом. Тройные мутанты ubp15 ubp16 ubp17 были получены путем скрещивания ubp15 с двойными мутантами ubp16 ubp17; гомозиготы поколения F2 были подтверждены ПЦР анализом.
Семена были поверхностно стерилизованы 15% (об./об.) NaOCl. После 48 часов при 4°С яровизации семена были помещены на чашки с 1× кратной средой Мурасиге-Скуга (MS) (содержащие 1% сахарозу и 0,3% Phytagel) и помещены в инкубатор при 22°С в условиях непрерывного освещения на 7 дней перед переносом в грунт. Затем растения росли в условиях стандартного дня (16 часов света/8 часов темноты) в вегетационных домиках. Семена, выращенные в условиях короткого дня (78 часов света/16 часов темноты), были высеяны в грунт и выращены в вегетационных домиках в условиях короткого дня.
2. Выравнивание линейных последовательностей и филогенетический анализ
Поиск общих доменов среди 27 белков UBP был выполнен с помощью TAIR и NCBI CDART. Консервативные домены в каждом белке были объединены путем удаления вариабельных участков и выравниванием фрагментов с использованием ClustalW (Thompson et al., 1994) с последующим выравниванием вручную.
Филогенетическое дерево строилось с помощью программы MAGA версия 3.1 (Kumar et al., 2004) на основе консервативных позиций в линейной последовательности с использованием алгоритма объединения соседей с "bootstrap" анализом 1000 репликантов.
3. Измерение длины саженцев, корней, стручка и ширины и длины листьев розетки
Для получения длины корней рассады дикий тип, ubp15-1 и ubp15-2 были выращены вертикально на чашках. Была измерена длина корней 20 случайно выбранных саженцев либо дикого типа, либо мутантов. Были измерены 20 случайно выбранных зрелых стручков (старше 8 дней после опыления) дикого типа или мутантов. Зрелые листья розетки дикого типа или ubp15-1 с первого до последнего настоящего листа были отрезаны и измерена ширина и длина листьев.
4. Измерение времени цветения и количество листьев в розетке
Время цветения дикого типа, ubp15-1, UBP15-сверхэкспрессирующие линии измеряли как число дней от прорастания семени до раскрытия первого цветка. Количество листьев в розетке считали во время стрелкования.
5. Выделение РНК и ПЦР в реальном времени и ОТ-ПЦР
РНК выделяли с помощью тризола (Invitrogen). Перед выполнением ОТ-ПЦР, 4 мкг РНК обработали РНК-свободной ДНКазой (Premega) для предотвращения контаминации ДНК, с последующей экстракцией хлороформ:фенолом (1:1) для предотвращения влияния ионов. Часть РНК затем использовали для ПЦР с At3g04120/GAPDH праймерами для подтверждения отсутствия ДНК. Оставшийся образец был подвергнут реакции обратной транскрипции с использованием набора Superscript™ II RNase H- Reverse Transcriptase (Invitrogen) и случайных праймеров. Реакционную смесь развели в 10 раз и 1 мкл был подвергнут ПЦР с использованием rTaq ДНК полимеразы (TaKaRa). At3g04120/G4PDH использовали как внутренний контроль. Линейность ПЦР реакции контролировали путем сравнения относительных количеств продуктов ПЦР через 22, 30 и 35 циклов. Последовательности прямых и обратных праймеров, использованных для определения транскриптов генов, были следующие At3g04120/GAPDH, 5'-CACTTGAAGGGTGGTGCCAAG-3' и 5'-CCTGTTGTCGCCAACGAAGTC-3'; UBP15, 5'-TCGAGAGGCAACAGTTATGCTG-3' и 5'-CTCAGGCCTCCAGTAACTGTAAGTTCTATCCTG-3'.
6. Блотт-анализ РНК в геле
Блотт РНК выполняли, как описано ранее (Yang et al., 2005). Выделяли общую РНК из различных участков листьев, и 20 мкг общей РНК каждого выделения разделяли на агарозном геле, переносили на мембрану Hybond-N+ (Amersham Biosciences) и гибридизовали с UBP15-специфичным зондом. В качестве контроля нагрузки использовали 18S рРНК. Праймеры были следующие: UBP15, 5'-TCGAGAGGCAACAGTTATGCTG-3' и 5'-CTCAGGCCTCCAGTAACTGTAAGTTCTATCCTG-3'.
7. Временная экспрессия в эпидермальных клетках лука
Процедуру временной экспрессии в эпидермальных клетках живого лука (Allium сера) с использованием бомбардировки частицами выполняли, как описано (Ang et al., 1998). После бомбардировки слои клеток лука инкубировали 24 часа при 22°С на свету. Слои клеток затем исследовали с помощью конфокальной микроскопии.
8. Создание трансгенных линий
Для получения растений с UBP15-сверхэкпрессией и UBP15 комплементарных растений фрагмент промотора UBP15, полученный HindIII/Xbal-расщеплением (1,8 kb выше ATG), и фрагмент XbaI/StuI UBP15 CDS (2,8 kb) были вставлены в бинарный вектор pCAMBIA1300. Полученная в результате конструкция была затем трансформирована в дикий тип и ubp15-1 посредством трансформации, с помощью агробактерий. Конструкции с мутацией по Cys сайту PUEP15:UBP15C447A и PUBP15:UBP15C447S были получены аналогичным путем и трансформированы в дикий тип и ubp15-1. Трансгенные растения отбирали с помощью гидромицина (20 мкг/мл; Roche) на MS чашках.
Для создания 35S:GFP-UBP15 (или 35S:UBP15-GFP) конструкций, 35S, так же как GFP-сшитый полноразмерный UBP15 CDS (или полноразмерный UBP15 CDS сшитый с GFP), были субклонированы в XbaI/SphI сайты вектора pCAMBIA1300.
Для определения тканевого паттерна экспрессии UBP19 использовали окрашивание GUS, BamHI/KpnI фрагменты промотора UBP19 (1,2 kb) были вставлены в pCAMBIA1381Z и трансформированы в окружение дикого типа посредством трансформации с помощью агробактерий. Трансгенные линии отбирали с помощью гидромицина (20 мкг/мл; Roche).
9. Тест активности DUB In vitro
Способность UBP15 расщеплять убиквитин, связанный через α-амино связь, был выполнен в E. coli, с использованием his-меченных субстратов полиубиквитина UBQ10 и убиквитинилированным белком UBQ1. Каждый из двух α-амино субстратов (UBQ1 в рЕТ28а и UBQ10 в pACYCDuet-1) были ко-экспрессированы либо с GST, либо с GST-UBP15, либо с GST-UBP15C447A/S в pGEX4T-3 в линии Е. coll. NovaBlue (DE3) при стандартных условиях (индукция при 22°С) (Novagen). Лизаты анализировали Вестерн-блоттом с антиубиквитин антителами (Sigma) или анти-his антителами (Sigma). Для определения использовали ECL хемилюминесцентную систему (Amersham).
10. Фиксация ткани и парафинирование для гистологических срезов
Для наблюдения поперечной структуры образцы были зафиксированы более чем на 24 часа в FAA (50% этанол, 5% уксусная кислота и 5% формальдегид) при комнатной температуре, обезвоженные в ступенчатых сериях смеси H2O:95% спирта:третбутиловый спирт (4:5:1, 3:5:2, 1.5:5:3.5, 0:5:5, 0:2.5:7.5, 100% третбутиловый спирт дважды) с 2-часовой инкубацией в каждом растворе и затем пропитывали, постепенно добавляя парафин (третбутиловый спирт:парафин как 3:1, 2:2, 1:3, 0:4, 0:4). Парафинированные ткани были разрезаны на 8 мкм срезы с помощью цитохрома (Leica RM2255). Срезы поместили на покрытые поли-L лизином предметные стекла, депарафинированы и регидратированы с помощью этаноловых серий (этанол:N2O как 1:0, 1:0, 9.5:0.5, 9:1, 8:2, 7:3, и 1:1) с 5-минутной инкубацией в каждом растворе. Срезы затем были окрашены 1% сафранином О и 0,02% зеленым прочным. Покровные стекла были прикреплены на предметные стекла смолой. Количество адаксиальных эпидермальных и столбчатых клеток подсчитывали под микроскопом.
11. Анализ на микропанелях и количественная ОТ-ПЦР
Процедуры, использованные в экспериментах на микропанелях, и анализ данных были описаны ранее (Ма et al., 2002). Рано появившиеся 9-е листья розетки дикого типа и ubp15-1 были использованы в качестве образцов. Общую РНК выделяли с помощью реагента RNAwiz (Ambion) и очищали набором RNeasy (Qiagen). Для каждого образца, 50 мкг общей РНК метили аминоаллил-dUTP (aa-dUTP, Sigma-Aldrich) с помощью обратной транскрипции. кДНК, меченные аминоаллил-dUTP, были очищены с помощью фильтра Microcon YM-30 (Millipore) и ресуспендированы в 0,1 М NaHCO3. Очищенные кДНК затем были флуоресцентно мечены путем конъюгирования монофункциональных красителей Cy3 или Cy5 (Amersham) с аминоаллил функциональными группами. Попарное комбинирование двух выбранных образцов использовали для одновременного исследования одного предметного стекла, и были выполнены четыре независимых биологических повтора (два повтора со сменой красок). Гибридизированные покровные стекла сканировали сканером GenePix 4000B (Axon), и независимые TIFF изображения для Cy3 и Cy5 каналов использовали для последующего анализа программным обеспечением GenePix Pro 5.0.
Для подтверждения результатов на микропанелях, была проведена ПЦР в реальном времени с использованием мастер смеси ABI SYBR Green PCR в объеме 20 мкл на системе ABI 7900. ПЦР смесь состояла из 0,3 мкл кДНК, 0,6 мкл праймеров и 4-кратной мастер смеси. В каждой ПЦР в реальном времени в качестве внутреннего контроля использовали At1g42970/GAPDH для нормализации разбросов в количестве матрицы кДНК. Результаты теста подтвердили, что это конститутивно экспрессированный ген.
Последовательности праймеров были следующие: At1g42970/GAPDH, 5'-TCTTTCCCTGCTCAATGCTCCTC-3' и 5'-TTTCGCCACTGTCTCTC СТСТААС-3'. 7 подавленных генов и 2 активированных гена были отобраны с помощью теста количественной ОТ-ПЦР. Праймеры, использованные для определения количества этих генов, были At1g71030/MYB, 5'-CATTTGCCTGACCTAAACATTG-3' и 5'-AAGCGTTTCTTGACCTGTTGA-3'; At5g57660/TRANSCRIPT FACTOR, 5'-GGCTCATCCACCACCGTT-3' и 5'-GGGAGAGGCTCTGTTTTCGTC-3'; At5g67030/ABA1, 5'-GGGCTTGGTCCTCTGTCTT-3' и 5-GTGAGTCTGCAACTAGGTGGC3'; M5g35970/HELICASE-LIKE, 5'-CCACAGGGCTCGGAGGTAT-3' и 5'-TCGTAAGTAAGGGCATCGGC-3'; At3g49160/PYRWATE KINASE FAMILY PROTEIN, 5'-TCCAGCAGGTCTCACATAAACAA-3' и 5'-CTGCTGCTAAGAGATGTGACCG-3'; WQ73480/HYDROLASE, 5'-AATGGCGGTGGAAACAATG-3' и 5'-ACGACGCGAAACGGAAGGAG-3'; At5g24470MPW?5, 5-TACCCTACGCCAACCCCTAT-3' и 5'-ATGTGATTGCCTATTGCACTATGT-3'; At3g20810/TRANSCRIPTION FACTOR, 5'-CCTCAATGCTGTTGCTGGTAA-3' и 5'-TGGGCAAGATAAGTAGGCTCC-3'; At4g21990MPR3, 5'-CTGTCAACACGCTTCACGC-3' и 5'-TCTTTCCGGTTCTCTAACTTCATC-3'. Для определения специфичности этих праймеров, амплифицированные продукты были подвергнуты анализу кривой плавления с использованием стандартного машинного метода. Условия циклов были следующие: 2 мин 50°С, 10 мин 95°С, 40 циклов по 15 с при 95°С, 30 с 60°С и 1 мин 72°С. Полученные значения были средними из шести независимых опытов (два биологических повтора и три технических повтора). Относительные уровни экспрессии были вычислены следующим образом. Уровни транскрипции этих генов были нормализованы относительно Стандарта (GAPDH) с помощью формулы
ΔCT=CT(ген X) посредством технических повторов-CT(GAPDH) посредством технических повторов или в диком типе, или в ubp15-1. Затем были получены ΔCt (дикий тип) и ΔCt (ubp15-1) каждого гена. Дикий тип использовали в качестве стандарта для сравнения уровней экспрессии. Относительный уровень экспрессии затем был подсчитан с помощью уравнения 2
[ΔCT (ubp 15-1)-ΔСТ (дикий тип)].
Далее было подсчитано среднее значение СТ 2-х биологических повторов.
12. Определение активности GUS
PUBP19:GUS трансгенные линии были выращены на MS чашках. Рассаду осторожно промыли 100 мМ натрий фосфатным буфером, рН 7,0, и затем красили 4 часа при 37°С в 2 мМ Х-глюкорониде, разведенном в 0,1 мМ ферроцианиде калия, 0,1 мМ ферроцианиде калия, 10% Тритон Х-100, 100 мкг/мл хлорамфеникола и 500 мМ натрий фосфатном буфере, рН 7,0 (Weigel and GIazebrook, 2002; Byrne et al., 2003). Затем ткани отмывали в 100 мМ натрий фосфатном буфере с последующей обработкой 95% и 70% этанолом при комнатной температуре. Микроскопию осуществляли на диссекционном микроскопе (Leica MZFLIII) с 10х объективом, и изображения были сняты цифровой камерой Canon (Power Shot S70).
13. Номера образцов
Идентификаторы инициативных локусов генома Арабидопсис (Arabidopsis Genome Initiative locus) для генов, упомянутых в этой статье, перечислены в Таблице 1.
14. Гены UBP проявили не одинаковые профили экспрессии
Для получения паттернов экспрессии генов UBP было изучено покрытие ранее описанным тестом на микропанелях 18 различных органов Арабидопсис, включая стеблевые листья, листья розетки, пестик за день до опыления, пестик через день после опыления, стручок через 3 дня после опыления, стручок через 8 дней после опыления, стебель, чашелистик, тычинка, лепесток, семя, культивированная клетка, темный корень, светлый корень, гипокотиль темный, гипокотиль светлый, семядоля темная и семядоля светлая (Ма et al., 2005; Дополнительная Таблица 1). В этом описанном исследовании, 24 из 27 генов UBP были покрыты использованной микропанелью, и экспрессия всех 24 генов была определена в одной или более тканях. Среди этих 24 генов UBP9 и UBP10 оказались, по сути, идентичны, и их олигонуклеотидные зонды перекрестно гибридизовались друг с другом, таким образом, непозволяя окончательно определить экспрессию обоих генов. Экспрессия трех генов, не покрытых этой микропанелью, UBP13, UBP14 и UBP20, была описана в предварительном исследовании (Yan et al., 2000). Как типовой случай, профили тканеспецифичной экспрессии для 5 генов подсемейства UBP15 представлены в Дополнительной Фиг.2. 5 генов имеют разные профили экспрессии.
15. Выделение полного генома и анализ Т-ДНК инсерционных мутантов генов UBP
В качестве первого шага функционального анализа семейства генов была проанализирована база данных Ресурсного Центра Арабидопсис Северной Америки (the North America Arabidopsis Resource Center database) на все доступные Т-ДНК инсерционные линии для членов семейства генов UBP. Всего 38 Т-ДНК инсерционных линий, соответствующих 25 генам UBP, были получены и проверены, как суммарно показано в Таблице 1, с локализацией места вставки Т-ДНК для каждой линии. После генотипирования с помощью ПЦР, были сконструированы прямой и обратные праймеры (Дополнительная Таблица 2). Изучение возможных фенотипов этих отдельных гомозиготных мутантных линий показало, что только 5 мутантных линий с потерей функции в 3 генах из 2 подсемейств проявляют видимые фенотипы (Таблица 1). Два независимых Т-ДНК аллелей UBP14 проявляли рецессивную летальность эмбриона, похожую на ранее описанную (Doelling et al., 2001). Другие три мутантные линии, принадлежащие подсемейству UBP15, с двумя аллелями UBP15, проявляли фенотип морфологии листа, и один аллель UBP19 проявлял летальность эмбриона. 5 генов в этом подсемействе были ранее охарактеризованы и поэтому были отобраны для детального анализа.
Был проведен поиск гомологичных генов подсемейства АtUР15 в рисе (priza Sativa) для выяснения, имеют ли они аналогичные функции. Были найдены четыре гена с высоким уровнем сходства, и были сравнены их первичные последовательности с 5 генами подсемейства AtUBP15. Полученное в результате филогенетическое дерево показано на Дополнительной Фиг.3. Один из генов риса был даже более схож с AtUBP15, чем другие гены Арабидопсис.
16. Два мутантных аллеля ubp15 проявляются в схожих дефектах развития листа
Две Т-ДНК инсерционные линий для UBP15, Salk_018601 и Salk_015611, названные ubp15-1 и ubp15-2, были идентифицированы в коллекции Salk и имели вставки Т-ДНК в 12-й и 8-й экзоны гена UBP15 соответственно (Фиг.2А). Полуколичественный ОТ-ПЦР показал, что ни в одном из двух мутантов не может быть определен уровень экспрессии мРНК (Фиг.2В), что означает, что оба аллеля нулевые. Обе линии при расщеплении давали единственный, рецессивный признак по Менделю (описанный ниже), схожий друг с другом, ко-расщепляемый с Т-ДНК, что указывает на то, что признак был вызван единичной вставкой в UBP15. По сравнению с диким типом, оба мутанта давали более мелкие растения и узкие, зубчатые листья с более выраженным фенотипом листа в поздних листьях розетки (Фиг.2С). Мутанты также проявляли более короткие корни на стадии рассады (Фиг.2D), более мелкие цветы (Фиг.2Е), более короткие стручки (Фиг.2F), так же как и более короткие и тонкие стебли. Эти морфометрические изменения (длина стручка, длина корня, длина основного стебля и диаметр основного стебля) суммированы в Таблице 2. Далее была проанализирована морфология листьев розетки с использованием ubp15-1. Листья розетки дикого типа Арабидопсис, выращенные в условиях длинного дня (16 ч света/8 ч темноты), постепенно изменяют свой общий рисунок, начиная с круглых и плоских настоящих листьев, постепенно становятся более овальной формы и немного закрученными вниз, в итоге становясь длинными и с выраженным закрученным вниз краем. В то время как листья розетки у мутантов ubp15-1 более плоские даже в более поздней стадии, и постоянно образуется меньше листьев в розетке (10,8 против 12,6 дикого типа) до стрелкования (Фиг.2С). Соотношение длины и ширины ubp15-1 и дикого типа было отображено на графике, и определено как значение индекса листа (Tsukaya, 2006), и выявило значительно более сильное уменьшение ширины, чем длины листовой пластинки листьев розетки у мутантов (Фиг.2G). Напротив, стеблевые листья ubp15-1 не показали какой-либо видимой разницы в сравнении с диким типом.
В соответствии с уменьшением количества вегетативных листьев, ubp15-1 также проявляет фенотип раннего цветения, с средним сроком цветения 39,1 (±2,02) дней против 41,5 (±3,79) дней дикого типа (Таблица 2). Даже в условиях короткого дня (8 ч света/16 ч темноты), ubp15-1 также цвел немного раньше (Таблица 2). Также было отмечено, что листья розетки ubp15-1 имели меньший вес (Таблица 2) и были тоньше, предполагая изменение клеточной структуры.
17. UBP15 имеет высокий уровень экспрессии в листьях розетки и репродуктивных тканях и локализован и в цитозоле, и в ядре
Наличие дефектов в листьях розетки и цветках у ubp15-1 предполагает вовлеченность UBP15 в регуляцию вегетативного и репродуктивного развития. Для подтверждения этого и для проверки ранее проведенного анализа на микропанелях, был использован полуколичественный ОТ-ПЦР для изучения тканеспецифичной экспрессии UBP15. Как показано на Фиг.3А, уровень мРНК UBP15 был сильно аккумулирован в листьях розетки и соцветиях, в то время как мало было в корнях, стручках и семядолях, средний уровень в стебле и стеблевых листьях. Этот паттерн экспрессии в значительной степени согласуется с данными анализа на микропанели (Дополнительная Таблица 1 и Дополнительная Фиг.2).
Далее был исследован пространственный паттерн экспрессии UBP15 в листьях розетки. Как на Фиг.3В, были выбраны листья розетки на ранних, средних и поздних стадиях и разрезаны в областях центра и края для выделения РНК отдельно из каждой области (Фиг.3В верхняя часть, показано черными линиями) и проведения Блотт-анализа (Фиг.3В, низ). Уровень мРНК UBP15 увеличивается от ранних листьев к поздним листьям, вместе с более очевидным высоким уровнем экспрессии в краях листа в поздней стадии. Этот паттерн экспрессии в листьях в процессе развития согласуется с ролью UBP15 в определении формы листа и очертаний краев, таких как зазубренность и закрученность.
Для изучения внутриклеточного распределения UBP15, конструкции, содержащие либо 35S:GFP-UBP15, или 35S:UBP15-GFP, были трансформированы в эпидермальные клетки лука. Временная экспрессия показала, что слитый белок присутствует повсеместно и в цитозоле, и в ядре, и результат экспрессии 35S:GFP-UBP15 показан на Фиг.3С.
18. UBP15 обладает деубиквитинилирущей активностью in vitro и эта биохимическая активность необходима для функции in vivo
Для проверки того, является ли UBP15 настоящим деубиквитинилирующим ферментом, UBP15, так же как две мутантные формы (изменен остаток Цистеина447 в консервативном каталитическом центре на Аланин или Серин), были ко-экспрессированы как GST слитые белки в Е. coli. His меченные полиубиквитинилированные белки UBQ1 или UBQ10 были использованы в качестве субстратов для теста in vitro на деубиквитинилирующую (DUB) активность рекомбинантного GST-UBP15 белка дикого типа или мутантной формы белков. Иммуноблотт-анализ с антителами к убиквитину показал, что UBP15 способен расщеплять два субстрата и что Цистеине447 необходим для DUB активности (Фиг.4А и 4В соответственно).
Чтобы проверить степень необходимости DUB активности UBP15 в развитии растения, мы ввели дикий тип UBP15 и две его Цистеин447 мутантные формы под контроль нативного промотора UBP15 в дикий тип Арабидопсис и в генетическое окружение ubp15-1 посредством трансформации с помощью агробактерий. Для трансгенных линий с генетическим окружением дикого типа мы получили всего 36 независимых растений То поколения для трансгенов UBP15 дикого типа. Половина линий (18 из 36) не проявили никаких фенотипических изменений, в то время как другая половина показала интересные отличия от дикого типа, противоположные фенотипам мутантов ubp15 (Фиг.4С, слева посередине). Для тех линий с трансгенами дикого типа в генетическом окружении ubp15-1, 5 независимых линий показали фенотип дикого типа (Фиг.4С, справа посередине), таким образом, функционально компенсировав мутантный дефект. Блот-анализ РНК в геле двух репрезентативных линий из каждой группы (Фиг.4D) показал, что высокий уровень экспрессии трансгена в генетическом окружении дикого типа отвечал за ненормальный фенотип, противоположный мутанту ubp15-1, в то время как уровень экспрессии, схожий с экспрессией эндогенного гена, приводит к удалению мутантного фенотипа в ubp15-1 и не приводит к изменению фенотипа в генетическом окружении дикого типа. Там, где трансген дикого типа не смог удалить мутантный фенотип ubp15-1, в этих трансгенных линиях экспрессировался только усеченный вариант мРНК ubp15 и не экспрессировалась мРНК дикого типа.
Введение UBP15C447A или UBP15C447S мутантных трансгенов под контроль нативного промотора UBP15 в диком типе и ubp15-1 не вызвало сверхпроявления фенотипа в генетическом окружении дикого типа и комплементации мутантного фенотипа в генетическом окружении ubp15-1, в то время как блотт-анализ РНК в геле показал нормальный или даже повышенный уровень экспрессии мутантных генов (Фиг.4С и 4Е). Напротив, некоторые линии с UBP15C447A в диком типе показали фенотип, схожий с мутантом ubp15-1 (Фиг.4С, слева внизу, и 4Е), который был противоположен UPB15-сверхэекспрессии в генетическом окружении дикого типа, как произошло в трансгенных линиях дикого типа со сверхэкспрессией UBP15C447S (данные не приведены). Те линии, которые имели тенденцию к высокому уровню экспрессии мутантного трансгена, вероятно вызвали доминантную негативную интерференцию функции эндогенного белка. Эти результаты означают, что активность DUB является необходимой для функционирования UBP15 in vivo.
19. Сверхэкспрессия UBP15 демонстрирует фенотипы, противоположные мутантам ubp15-1
Далее мы исследовали фенотипы линий со сверхэкспрессией UBP15 (трансгены дикого типа в генетическом окружении дикого типа), описанных выше. Один очевидный фенотип это большой общий статус растений, так же как каждого листа розетки. Листья розетки этих линий со сверхэкспрессией были более круглые, чем дикого типа, начиная с очень ранних стадий, и были сильно закручены вниз в середине поздней стадии (Фиг.4С, слева и посередине). Листья розетки позднего развития, такие как девятый лист розетки, были не только закручены вниз, но также иногда демонстрировали утолщение в области верхушки листа (стрелка на Фиг.5В, сравнение 5А и 5В), возможно вызванное неравномерной пролиферацией клеток в различных областях листа. Кроме того, линии со сверхэкспрессией UBP15 были также поздноцветущими с большим количеством листьев в розетке (16,2) до стрелкования, чем в диком типе, и с задержкой во времени цветения при условии длинного светового дня (Таблица 2). В линиях со сверхэкспрессией UBP15 был также увеличен вес свежих листьев розетки на единицу площади по сравнению с диким типом (Таблица 2).
У линий со сверхэкспрессией UBP15 был также выраженный фенотип цветов. В сравнении с диким типом линии со сверхэкспрессией UBP15 проявляли более крупные цветки (сравните Фиг.5I и 5J) с высокой долей аномального количества лепестков и тычинок (91,3%, 40 из 46 в одном растении) в ранних цветах (Фиг.5С и 5D, 5Е, 5К). Однако это аномальный паттерн цветков был менее частый в поздних цветах. Также линии со сверхэкспрессией имели более крупные стручки, чем у дикого типа (Фиг.5L), в противоположность мутантам ubp15-1. Аномальности цветка и стручка не влияли на фертильность, не считая крайних случаев, когда повреждения органов размножения предотвращали опыление (Фиг.5Н и 5М). Было видно усиление апикального доминирования в линиях со сверхэкспрессией по сравнению с уменьшением апикального доминирования в мутантах ubp15 (Таблица 2 и Дополнительная Фиг.4). В некоторых крайних случаях растений со сверхэкспрессией UBP15, позиции ожидаемых вторичных стрелок только в главной стрелке переродились в цветки, но не в стручки (Фиг.5G) в отличие от дикого типа (Фиг.5Р).
20. Мутанты с потерей функции ubp15 и растения со сверхэкспрессией UBP15 проявляли противоположные аномалии в пролиферации клеток листа
Для продолжения оценки роли UBP15 в развитии листьев в Арабидопсис, сравнили морфогенетический паттерн всех листьев, от семядолей, настоящих листьев, до стеблевых листьев из мутантов с потерей функции, растений со сверхэкспрессией и дикого типа. Как показано на Фиг.6А, растения дикого типа имеют около 11 листьев в розетке, в то время как оба мутанта ubp15 имеют около 9 листьев в розетке. Напротив, линии со сверхэкспрессией UBP15 производят около 14 листьев в розетке. Листья в розетке обоих мутантов были узкие, зазубренные и плоские, но в растениях со сверхэкспрессией UBP15 были более круглые в ранних листьях и более закрученные вниз в поздних листьях. Среди оцененных линий не проявлялось видимой разницы в стеблевых листьях, за исключением двух мутантов, имевших слегка более узкие листья.
Для изучения причин малых размеров растении и узкой листовой пластины мутантов ubp15 на клеточном уровне, были сравнены поперечные сечения листьев мутантов, так же как линий со сверхэкспрессией UBP15 с растениями дикого типа. Рисунок справа на Фиг.6В иллюстрирует места типичных разрезов, сделанных и проанализированных по стандартной методике, которые были в середине листа. Рисунок слева на Фиг.5В модель разреза в середине листа дикого типа. Шесть листьев (листья с нечетными номерами на Фиг.6А) были выбраны для измерений от первой семядоли до первого, третьего, пятого, девятого настоящего листа и первого выросшего стеблевого листа. Настоящие листья после девятого листа не включали для достижения единообразия, потому что два мутанта образовывали только 9~10 настоящих листьев. Было подсчитано под микроскопом количество адаксиальных эпидермальных клеток и столбчатых клеток в серии разрезов в каждой линии (3~4).
Для адаксиальных эпидермальных клеток количество клеток в каждом листе для каждой линии показано на Фиг.6С. На начальном этапе развития листьев, количество адаксиальных эпидермальных клеток поперек листовой пластины было схоже среди этих линий и составляло ~30 клеток в семядоле каждой линии, но различие увеличилось с развитием листьев, и серьезное различие было в девятом листе розетки, где количество клеток поперек листовой пластины составило ~290 в диком типе, ~180 в двух мутантах (уменьшено на ~40%) и ~400 в линии со сверхэкспрессией UBP15 (увеличено на ~40%). Это согласуется с наблюдаемым фенотипом, где различия становятся заметны на поздних стадиях развития. Количество адаксиальных эпидермальных клеток стеблевого листа было выше, чем в любых листьях розетки. Это возможно может быть вызвано более высокой плотностью в количестве адаксиальных эпидермальных клеток поперек стеблевого листа. Схожие результаты были получены при измерении количества столбчатых клеток (Дополнительная Фиг.5). Мутация в UBP15 дает уменьшение в количестве адаксиальных эпидермальных и столбчатых клеток в латеральном направлении, в то время как сверхэкспрессия UBP15 приводит к обратному.
21. UBP15 в Арабидопсис вовлечен в организацию клеточных слоев листа
Для расширения сведений о изменении количества клеток были изучены структуры клеток листьев этих линий. Основываясь на результатах того, что листья розетки позднего развития проявляют выраженный фенотип, полностью раскрывшийся девятый лист розетки был выбран для сравнения клеточной структуры поперечного сечения в срединной части листа разных линий (Фиг.6В). На Фиг.7А слева первым показан дикий тип, лист имеет организованную внутреннюю структуру, содержащую слой вертикально упакованных столбчатых клеток под адаксиальной поверхностью, и ~4 слоя клеток губчатой паренхимы, вперемежку с воздушным пространством, были свободно расположены ниже слоя столбчатых клеток. ubp15-1 и ubp15-2 также проявляли схожую структуру, но количество слоев губчатых клеток в мутантах было меньше, чем в диком типе, тогда как их было больше в линиях со сверхэкспрессией UBP15 (Фиг.7А слева со второго по четвертый). В диком типе было в среднем ~4 слоя губчатых клеток, но в двух мутантах было ~3 слоя губчатых клеток, тогда как в линиях со сверхэкспрессией UBP15 количество слоев губчатых клеток достигало ~5. Дефекты в структуре слоев клеток в ubp15-1 были компенсированы экспрессией соответствующим ему диким типом UBP15, подтверждая этим, что фенотип ubp15-1 был вызван прямым нарушением гена UBP15 (данные не приведены). Эти результаты согласуются с результатами измерения веса свежих листьев, где меньший вес соответствует меньшему количеству клеточных слоев (Таблица 2), больший вес результат большего количества слоев (смотри выше). Было обнаружено небольшое увеличение размера клеток у мутантов, предполагая частичную компенсацию в потере количества клеток.
Также были сравнены структура срединной жилки и периферийная структура этих линий. Сосудистый пучок дикого типа был составлен из нескольких слоев ксилемы и флоэмы, окруженных слоями паренхимальных клеток (Фиг.7В, первый слева). Напротив, два мутанта показали уменьшение толщины. Сосудистый пучок двух мутантов был тоньше, чем в диком типе, за счет уменьшения количества клеток в ксилеме и флоэме. Кроме того, количество паренхимальных клеток вокруг сосудистых пучков двух мутантов было также уменьшено. В линии со сверхэкспрессией UBP15 были получены противоположные результаты, показывая развитый сосудистый пучок, сильный и в ксилеме, и в флоэме (Фиг.7В, слева со второго по четвертый).
22. Анализ транскриптоном показал влияние UBP15 на уровень экспрессии 804 генов (достоверность Р<0,15)
Для изучения влияния на клеточные циклы в ubp15-1 и изучения возможной роли UBP15 в регуляции транскрипции других генов, мы выполнили тест на микропанелях для широкого геномного анализа экспрессии в только что появившемся девятом листе розетки. Анализ на микропанелях также подтвердил отсутствие экспрессии мРНК UBP15 в ubp15-1 (Дополнительная Таблица 3). Статистический анализ показал, что всего 804 из 20000 генов экспрессировались по-разному в ubp15-1 в сравнении с диким типом с достоверностью Р<0,15 (4% экспрессируемых генов), среди которых 406 (50,5%) были активированы и 398 (49,5%) были ингибированы с разбросом кратности изменения экспрессии от 1,72 до 8,35 и 0,09 до 0,56 соответственно (Дополнительная Таблица 3). Для подтверждения тренда, полученного при анализе транскриптомов, мы выбрали случайным образом 9 генов, из которых 7 ингибировались и 2 активировались, и провели ПЦР в реальном времени. Уровни экспрессии этих генов соответствовали результатам, полученным при анализе на микропанелях, на 100% (Фиг.8), что свидетельствует, что тест на микропанелях был достоверным. At1g42970/GAPDH служил внутренним контролем.
Для изучения вовлеченных биологических процессов, типичные представители тех генов, которые находятся под влиянием мутанта ubp15, были проанализированы с точки зрения онтологии генов (GO) (Maere et al., 2005) (Таблица 3). Два гена, относящихся к клеточному циклу, были экспрессированы по-разному в ubp15-1 (Таблица 3). Так как время цветения также было изменено в ubp15-1, то гены, контролирующие цветение, тоже были в поле внимания. Гомеотический ген цветка CAL, позитивно регулирующий развитие цветка, был активирован в 1,98 раза в генетическом окружении ubp15-1, в то время как другой ген, MAF5, негативно регулирующий развитие цветка, был ингибирован в 0,31 раза (Таблица 3).
Другие категории генов, находящихся под влиянием мутанта ubp15, содержали гены, вовлеченные в биосинтетический метаболизм, биосинтез хлорофилла, фотосинтез, сигнальную трансдукцию, и также содержали большое количество факторов транскрипции (Таблица 3). Таким образов, кроме влияния на некоторые гены, связанные с фенотипом, такие как контролирующие клеточный цикл и цветение, мутант ubp15-1 был в целом дефектным по различным путям метаболизма на уровне транскрипции, что предполагает вторичное и не только первичное влияние на наблюдаемые дефекты роста.
23. UBP15 и UBP16 частично избыточны, но не по отношению к UBP17
UBP16 и UBP17 два близко родственных белка (Фиг.1), что предполагает, что они могут иметь функциональную избыточность. Нокаутные линии этих двух генов (ubp16-1, ubp17-1 и ubp17-2) (Фиг.9А) не проявили выраженного фенотипа. ubp16-1 был скрещен с ubp17-1 или ubp17-2 для изучения возможных дефектов в двойных мутантах. Гомозиготы F2 поколения скрещенных линий не показали заметного фенотипа, указывая на то, что возможно наличие других избыточных белков. В дальнейшем были скрещены мутанты ubp15 с двойными мутантами ubp16 ubp17. В F2 поколении, были получены три генетических типа двойных мутантов ubp15 ubp16, ubp15 ubp17 и ubp16 ubp17, так же как тройные мутанты ubp15 ubp16 ubp17 (Фиг.9В и 9С, ubp16 ubp17 не показаны). Двойные мутанты ubp15 ubp16 проявили схожий, но более выраженный фенотип с мутантом ubp15, указывая, что может быть функциональная избыточность этих двух генов, ubp15 ubp16 проявлялись в карликовости растений и абортивных стручках, листьях розетки, которые были уже, чем у мутантов ubp15 (Фиг.9С). Было также заметно изменение на клеточном уровне, только 2 слоя губчатых клеток (Фиг.7А, первый справа) и удивительно вырожденный сосудистый пучок (Фиг.7В, первый справа). В случае девятого листа, количество адаксиальных эпидермальных клеток в разрезе листовой пластины уменьшилось на 60% по сравнению с диким типом (Дополнительная Фиг.6), так же как количество столбчатых клеток (данные не показаны). Напротив, ubp15 ubp17 усилил дефекты мутантов ubp15, предполагая, что эти два гена могут быть задействованы в двух различных путях регуляции клеточных функций. Тройной мутант ubp15 ubp16 ubp17 был похож на двойной мутант ubp15 ubp16, дополнительно подтверждая, что UBP17 вовлечен в другой путь регуляции, чем UBP15 и UBP16, не смотря на высокий уровень гомологии с последовательностью UBP16.
Данные свидетельствуют о том, что мутация в UBP15 нарушает развитие листьев розетки, и этот эффект был более заметным в сочетании с UBP16. Влияние UBP16 было заметно только в присутствии UBP15. Не наблюдалось заметного эффекта мутации UBP17 на этот процесс. Эти результаты показывают, что UBP15 является основным регулятором формы листьев розетки и развития в целом растений. UBP16 также вовлечен в эти процессы, хотя его вклад менее значителен, чем вклад UBP15.
24. UBP19 может быть вовлечен в развитие эмбриона, в то время как функция UBP18 не известна
На Фиг.9А показана структура генов UBP18 и UBP19 в двух Т-ДНК мутантах каждая. ubp19-1, со вставкой Т-ДНК в 5'UTR участке 195 п.о. выше ATG, проявлял рецессивную летальность эмбриона, с ~1/4 (13/47) абортивных эмбрионов в одном гетерозиготном стручке (Фиг.9В, стрелка указывает на желтые эмбрионы). Дальнейший статистический анализ в среднем 10 стручков в каждой гетерозиготной линии показал, что соотношение нормальный:аномальный было ~3:1 (372/136), подтверждая, что это была линия с рецессивной летальностью эмбрионов. Было изучено развитие эмбриона в конкретном гетерозиготном стручке от стадии зрелости обратно до глобулярной стадии. Было установлено, что ubp19-1 останавливает развитие на глобулярной стадии (Фиг.10С).
Поэтому было предположено, что UBP19 вовлечен в раннюю стадию развития эмбриона. Была создана конструкция GUS под управлением 1,2kb промотора UBP19 для трансформации дикого типа и изучения тканевого паттерна экспрессии. Было установлено, что UBP19 экспрессирован повсеместно, включая в целом молодые саженцы, за исключением меристемной области корня (Фиг.11А) (увеличение на Фиг.11А - детальная демонстрация концевого участка корня), в тканях сосудистого пучка и в устьицах зрелых листьев розетке (Фиг.11В), так же как и в соцветиях. Детальное изучение установило, что GUS экспрессируется в чашелистиках и сосудистых тканях чашелистика, также в пыльниках и рыльцах пестика (Фиг.11С). GUS был обнаружен в концевом и базальном участках стручков, но едва в эмбрионах (Фиг.11D).
Другой мутант ubp19, 205bp выше ATG, не показал видимого фенотипа, указывая, что участок между 195bp и 205bp выше ATG является необходимым для функции UBP19.
Ни один из двух мутантов, полученных вставкой в экзон и интрон UBP18, не проявил никакого видимого фенотипа, указывая на возможную функциональную избыточность между UBP18 и другими белками этого семейства.
25. UBP15 вовлечен в развитие листьев розетки
Фенотип ubp15 мутантов и линий со сверхэкспрессией UBP15 предоставил основание для дальнейшего изучения роли этих генов в развитии листьев растения. Оба мутанта ubp15 показали более узкие, зазубренные и плоские листья розетки, в то время как линии со сверхэкспрессией UBP15 воспроизводили противоположный фенотип с круглыми (ранняя стадия развития) и закрученными вниз (поздняя стадия развития) листьями в розетке (Фиг.2А и Фиг.5В). Количество клеток в поперечном сечении (и столбчатых, и адаксиальных эпидермальных клеток поперек листовой пластины) мутантов ubp15 уменьшено, в то время как таковое в линиях со сверхэкспрессией UBP15 сильно увеличено в сравнении с диким типом. Это показывает, что UBP15 изменяет форму листьев за счет пролиферации клеток, возможно путем регулирования белков клеточного цикла. Недавно было установлено, что hub1 проявляется в узких листьях розетки, причиной чего является уменьшение количества клеток, и тест на микропанелях показал, что количество генов, связанных с клеточным циклом и цитокинезом, было изменено (Fleury et al., 2007). В этом исследовании, хотя результаты теста на микропанелях показали, что было только два гена, связанных с измененным клеточным циклом (ICK1 и белок, содержащий Циклин-подобный F бокс домен), их уровень экспрессии согласовывался с уменьшением количества клеток. Листья розетки в мутантах стали плоскими, в то время как они были закручены вниз в линиях со сверхэкспрессией UBP15. Уровень экспрессии UBP15 в листьях розетки увеличивается по краям с развитием растений (Фиг.3В), предполагая, что UBP15 специфично (по меньшей мере, частично) определяет край листьев розетки. Это схоже с iamt1-D, который демонстрирует существенно искривленные фенотипы листьев, вызванные увеличенным уровнем экспрессии гена IAMT1, и, как было установлено тестом на GUS экспрессию, специфически экспрессирован в краях листьев розетки (Qin et al., 2005).
Индекс листа увеличен в мутантах ubp15-1 из-за более узких листьев розетки (хотя длина листа была короче, но менее измененная, что привело к большому показателю индекса листа). Поляризованный рост листовой пластины в направлении ширины листа определяется полярной элонгацией клеток листа или полярной пролиферацией клеток (Tsukaya, 2006). Генами, изменяющими пролиферацию клеток в направлении ширины листа, до настоящего времени являются GIF1 (также называемый AN3) (Kim and Kende, 2004), GRF5 (Horiguchi et al., 2005), и HUB1 (Kim and Kende, 2004; Horiguchi et al., 2005; Fleury et al., 2007). Они все важны для позитивного контроля количества клеток в направлении ширины листа. Мутанты ubp15 имеют измененное количество адаксиальных эпидермальных и столбчатых клеток в направлении ширины листа, но тест на микропанелях не показал никаких изменений в уровне экспрессии GIF1 (AN3), GRF5 или HUB1 в генетическом окружении ubp15-1. Это может быть обусловлено тем, что UBP15 и эти гены вовлечены в разные пути передачи сигнала.
26. Аминокислота цистеин является критически важной для функции UBP15 in vitro и in vivo
Тест на ко-экспрессию in vitro показал, что UBP15 является истинной убиквитин специфической протеазой и Cys447 является критически важным для этой активности. Было установлено, что UBP15 может расщеплять только α-связанные пептиды (полиубиквитин и убиквитинилированный ген) (Фиг.5А), но не ε-связанный изопептид (мультиубиквитиновая цепь, связанная через изопептидную связь) (данные не показаны), предполагая, что это может работать только на α-связанных пептидах или может узнавать только сайт на проксимальном конце цепи субстрата. Сообщалось, что белки UBP3, 4 и 5 содержат сигнал ядерной локализации и был сделан вывод, что они работают только на субстратах, связанных изопептидной связью (Chandler et al., 1997; Rao-Naik et al., 2000). Внутриклеточная локализация UBP15, экспрессированного повсеместно в клетке, позволяет предположить, что этот фермент может узнавать более одного субстрата для выполнения своих разнообразных функций; или он выполняет другие функции в дополнение к деубиквитинилированию.
В этом исследовании мы сначала доказали in vivo функцию Cys447 UBP15 в развитии листа. В то время как экспрессия конструкции дикого типа UBP15 в ubp15-1 может удалить мутантный фенотип, ни сверхэкспрессия UBP15C447A, ни UBP15C447S не продемонстрировали комплементацию мутантной недостаточности. Это подразумевает, что Цистеин447 является функциональным остатком UBP15. С другой стороны, трансгенные линии дикого типа, содержащие конструкции с диким типом UBP15, проявлялись закрученными вниз зрелыми листьями розетки, в то время как таковые с конструкциями, содержащими мутацию Cys447Ala или Cys447Ser, продемонстрировали мутантный фенотип ubp15-1. Эти результаты подтверждают, что фенотип листьев розетки был обусловлен сверхэкспрессией UBP15 и что Cys447 играет критическую роль в этой функции. Это также означает, что именно деубиквитинилирующая активность, а не другие домены (такие как цинковый палец MYND), является причиной анормальности. Недавно установлено, что ген HUB1 (Fleury et al., 2007), Е3 лигаза моноубиквитинилированного Н2В, со схожим с мутантным ubp15 фенотипом, возможно, участвует в том же сигнальном пути, что и UBP15.
Существует также другой результат, трансгенные линии с конструкцией, содержащей UBP15 под 35S промотором в генетическом окружении дикого типа, не показали никакого фенотипа и не могут компенсировать мутантный фенотип (данные не показаны). Это предполагает, что нативный промотор может обеспечивать лучшую пространственную структуру для лучшего выполнения функций эндогенными белками.
27. UBP15 регулирует транскрипцию многих генов
Тест на микропанелях был выполнен для изучения возможной роли UBP15 в регуляции других генов на уровне транскрипции. Было установлено, что два гена, связанных с клеточным циклом, были изменены, что могут быть прямой причиной изменения в количестве клеток в ubp15-1, хотя и не так как HUB1, который изменяет белки клеточного цикла по всему геному (24 гена).
Мы также установили, что два гена, контролирующие цветение, были изменены, и это изменение вызвало наблюдаемый нами фенотип. MAF5 и гомеотический ген цветка CAL противоположно регулируют цветение, оба продемонстрировали изменения в ubp15-1 и стали причиной фенотипа раннего цветения.
Хотя множество других генов было активировано и ингибировано в ubp15-1, кажется, что они являются вторично измененными, а не прямыми целями воздействия.
28. Функциональная избыточность среди членов подсемейства UBP15
Члены подсемейства UBP15 кодируют белки, содержащие домен цинкового пальца MYND. Далее они могут быть разделены на три группы на основе сходства последовательностей. UBP16 и UBP17 имеют 50% аминокислотную идентичность в их двух консервативных доменах, в то время как UBP18 и UBP19 имеют 68% идентичности по всей длине. Но UBP15 менее схож с другими четырьмя (UBP15 с UBP16 имеет 37% сходства в UBP домене и с UBP18 45% сходства по всей длине), и это объясняет ubp15 мутантный фенотип. Чтобы убедиться, что UBP16 и UBP17 имеют функциональную избыточность, два мутанта двух генов были скрещены для получения двойных мутантов. Гомозиготы двойных мутантов не показали никакого фенотипа, что предполагает, что они могут работать в различных сигнальных путях. В дальнейшем, двойной мутант был скрещен с мутантом ubp15, чтобы проверить, будет ли какое-либо изменение. В F2 поколении, только ubp15 ubp16, но не другие, усилил фенотип ubp15 мутантов. Это показывает, что UBP15 и UBP16 могут иметь функциональную избыточность. Тройной мутант ubp15 ubp16 ubp17 проявил схожий с ubp15 ubp16 фенотип. Что предполагает, что UBP17 не вовлечен в функцию, разделяемую другими двумя. С другой стороны, ubp16 мутант не показал никакого видимого фенотипа, но усилил фенотип ubp15 мутантов, что предполагает, что в Арабидопсис UBP15 является основным регулятором этого сигнального пути. Функциональная избыточность также наблюдалась в другом подсемействе UBP1 и UBP2, чьи двойные мутанты, но не мутант каждого гена, были чувствительны к Канаванину (Yan et al., 2000).
Гомология последовательностей UBP18 и UBP19 также подразумевает функциональную избыточность. Тем не менее, только один мутант из четырех (ubp19-1) показал рецессивную летальность эмбриона. Более того, вставка в 195bp выше UBP19 5'UTR вызывает фенотип, в то время как вставка в 205bp выше UBP19 5'UTR не показывает никакого фенотипа. Это предполагает, что участок от 195bp до 205bp выше UBP19 5'UTR является критичным для функции UBP19.
С другой стороны, хотя UBP16 и UBP17 более близки друг к другу, чем к UBP15 по белковой последовательности, проявленный фенотип ubp15 ubp16 близок к мутанту ubp15, предполагая, что UBP16 более близок по функции к UBP15, а не к UBP17. Это также относится к группе UBP18 и UBP19, так как фенотип мог быть определен только в мутанте ubp19, но не в мутантах ubp18. Это показывает, что белки, близкородственные на уровне последовательности, не всегда функционально дублируют друг друга.
Описание фигур
Настоящее изобретение далее будет описано со ссылкой на следующие Фигуры, на которых:
Фиг.1 - филогенетиечский анализ 27 семейств UBP из Арабидопсис.
Филогенетическое дерево 27 UBP. Длина ветвей дерева пропорциональна дивергенции. 0,1 шкалы представляет 10% изменения. Значения анализа Bootstrap показаны в процентах от ветвлений. 27 белков могут быть разделены на 14 подсемейств, окрашенных в различные цвета, на основании сходства доменов. Множественное выравнивание, примененное для анализа, показано на Дополнительной Фиг.1
Белки с консервативными доменами нанесены на схематическую шкалу. Каждый окрашенный блок представляет домен. Черные линии представляют длину UBP белков, в то время как длина доменов может быть оценена по связывающим черным линиям, аа, аминокислоты; UBP, убиквитинспецифичная протеаза; ZnF, цинковый палец; MYND, миелоидный, Nervy, и DEAF-1; DUSP, домен убиквитинспецифичных протеаз; UBQ, гомологи убиквитина; MATH, меприн и TRAF гомология; UBA, убиквитинсвязанные.
Фиг.2. - характеристика гена убиквитинспецифичной протеазы UBP15.
(A) Структура гена UBP15. Есть 14 экзонов, распределенных в пределах участка генома, размером 4,37 kb. Черные блоки представляют экзоны, в то время как линии между этими экзонами являются интронами. Белые блоки на двух концах обозначают 5' и 3' UTRы. Две Т-ДНК нокаутные линии со вставками с 8 м и 12 м экзонах соответственно, в каждом случае разрушен UBP домен.
(B) Экспрессия UBP15 в диком типе и в гомозиготных линиях ubp15-1 и ubp15-2 с помощью ОТ-ПЦР с праймерами UBP15FP и UBP15RP. At3g04120/GAPDH служит внутренним контролем.
(C)1-месячные растения дикого типа, гомозиготное по ubp15-1 и гомозиготное по ubp15-2. Черта = 1 см.
(D)12-дневные саженцы дикого типа, гомозиготные по ubp15-1 и гомозиготные по ubp15-2. Черта = 1 см.
(Е) Цветы дикого типа, гомозиготные по ubp15-1 и гомозиготные по ubp15-2. Черта = 1 мм.
(F) Стручки дикого типа, гомозиготные по ubp15-1 и гомозиготные по ubp15-2. Черта = 1 см. Все приведенные растения растут в условиях 16 ч свет/8 ч темнота.
(G) Соотношение длины и ширины листьев розетки дикого типа и ubp15-1 в условиях короткого дня (8 ч свет/16 ч темнота). Планки погрешностей представляют стандартные отклонения 7 повторов.
Фиг.3. - тканевый и связанный с развитием паттерн экспрессии UBP15 и внутриклеточная локализация UBP15 в эпидермальных клетках лука.
(А) Анализ с помощью ОТ-ПЦР паттерна экспрессии UBP15. At3g04120/GAPDH в качестве внутреннего контроля.
(A) Нозерн-блотт анализ паттерна экспрессии UBP15 в центральных и краевых участках листа в трех стадиях развития, Р1, Р2 и Р3. Листья были разделены на две части: центр и края, как показано линиями на рисунке. Использовали равные количества общей РНК из различных образцов, и блотт в геле гибридизовали и метили с пробами, специфичными к гену UBP15. Маркеры рРНК использовали для демонстрации равной нагрузки. С, центральный участок; М, участок края. Черта = 1 см.
(B) Внутриклеточная локализация UBP15 в эпидермальных клетках лука. Черта = 100 мкм.
Фиг.4. - UBP15 кодирует функциональный деубиквитинилирующий фермент, способный расщеплять полипептиды, и его Cys 447 необходим для выполнения функции in vitro и in vivo.
(А) UBP15 может расщеплять субстрат UBQ1 (убиквитинилированный белок). Коэкспрессия плазмид в Е. coli. Novablue (DE3) штамм (Novagen) был UBQ1 с вектором GST (линия 1), GST-UBP15 (линия 2), GST-UBP15C447A (линия 3) и GST-UBP15C447S (линия 4). Продукты расщепления определяли методом иммуноблотта с антителами к убиквитину.
(B) UBP15 может расщеплять субстрат UBQ10 (гексамерный полиубиквитин). Коэкспрессия плазмид в Е. coli. Novablue (DE3) штамм (Novagen) был UBQ10 с вектором GST (линия 1), GST-UBP15 (линия 2), GST-UBP15C447A (линия 3) и GST-UBP15C447S (линия 4). Продукты расщепления определяли методом иммуноблотта с антителами к убиквитину. Продукты расщепления показаны белыми стрелками.
(C) Экспрессия UBP15 в ubp15-1 повторяет его функцию дикого типа, в то время как сверхэкспрессия UBP15, но не UBP15C447A или UBP15C447S, вызывает фенотип с круглыми (раннее развитие) и закрученными вниз (зрелые) листьями розетки, что противоположно мутантам ubp15-1. Образцы, возрастом 1 месяц, слева направо и сверху вниз: дикий тип, ubp15-1, линия со сверхэкспрессией UBP15, UBP15-комплементированная линия, линия со сверхэкспрессией UBP15C447A и сверхэкспрессия UBP15C447A в линии ubp15-1. Черта = 1 см.
(D) Блотт-анализ РНК в геле для определения экспрессии гена UBP15 в трансгенных линиях. Был проанализирован уровень РНК в растениям дикого типа (1), ubp15-1 (2), дикого типа с трансгеном UBP15 (3-6) и ubp15-1 с трансгеном UBP15 (7-9). Из листьев розетки, возрастом 4 недели, выделяли общую РНК. Использовали равные количества общей РНК из различных образцов растений, и блотт в геле гибридизовали и метили с пробами, специфичными к гену UBP15. Маркеры рРНК использовали для демонстрации равной нагрузки. Верхняя полоса (верхняя стрелка) была мРНК UBP15 полной длины, в то время как нижняя полоса (нижняя стрелка) представляла усеченную мРНК. Линии 3, 4 были образцами фенотипа со сверхэкспрессией UBP15, тогда как линии 5, 6 были похожи на дикий тип, очевидно без фенотипа со сверхэкспрессией UBP15. Линии 7, 8, но не 9, были компенсированными образцами, так как они не показывали мутантный фенотип, а нормальный, как дикий тип. Линия 9 - образец показал мутантный ubp15-1 фенотип.
(Е) Блотт-анализ РНК в геле для определения экспрессии гена UBP15C447A в трансгенных линиях.
Фиг.5. - сравнение дикого типа и линии со сверхэкспрессией UBP15.
(A) Девятый лист розетки дикого типа. Черта = 1мм.
(B) Девятый лист розетки линии со сверхэкспрессией UBP15. Черта = 1 мм.
(C) Вид сверху на цветок дикого типа. Черта = 1 мм.
(D) (Е) (К) Эктопические цветки линии со сверхэкспрессией UBP15. Черта = 1 мм.
(I) Вид сбоку на цветок дикого типа.Черта=1мм.
(J) Вид сбоку на цветок линии со сверхэкспрессией UBP15. Черта = 1 мм.
(F) Вторичный стебель дикого типа. Черта = 1 см.
(G) Вырожденный вторичный стебель линии со сверхэкспрессией UBP15. Черта = 1 см.
(Н) Стручки дикого типа. Черта = 1 см.
(М) Анормальные стручки линии со сверхэкспрессией UBP15. Черта = 1 см.
(L) Сравнение нормальных стручков дикого типа (слева) и линии со сверхэкспрессией UBP15 (справа). Черта = 1 см.
Фиг.6. - сравнение поперечного сечения через листовую пластину листьев розетки в четырех линиях.
(A) Сверху вниз: дикий тип, ubp15-1, ubp15-2 и линия со сверхэкспрессией UBP15. В каждой панели, две семядоли листья розетки от первого до последнего, так же как два первых стеблевых листа расположены слева направо. Стрелки показывают положение стеблевых листьев. Черта = 1 см.
(B) Модели показывают положение поперечного сечения.
(Н) Сравнение количества адаксиальных эпидермальных клеток в поперечном сечении через листовую пластину листьев розетки. Планки погрешностей представляют стандартные отклонения трех биологических повторов.
Фиг.7. - гистологическое сравнение поперечного сечения серединного участка девятого листа розетки.
(A) Сравнение слоев клеток в поперечном сечении дикого типа, ubp15-1, ubp15-2, линии со сверхэкспрессией UBP15 и ubp15 ubp16. ad, адаксиальные; ра, столбчатые; sm, губчатый мезофил; ab, абаксиальный; х, ксилема; р, флоэма. Черта = 0,1 мм.
(B) Сравнение структуры срединной жилки в поперечных сечениях дикого типа, ubp15-1, ubp15-2, линии со сверхэкспрессией UBP15 и ubp15 ubp16. Черта = 0,1 мм.
Фиг.8. - ПЦР в реальном времени подтверждает результаты теста на микропанелях.
7 ингибированных генов и 2 активированных гена были выбраны случайным образом для анализа с помощью ПЦР в реальном времени, которая подтверждает результаты теста на микропанелях.
Фиг.9. - характеристика UBP16 и UBP17.
(A) Структура гена UBP16 (слева) и UBP17 (справа).
(B) 12-дневные саженцы дикого типа, ubp15-1, ubp15 ubp17, ubp15 ubp16 и ubp15 ubp16 ubp17. Черта = 1 см.
(C) 2-месячные растения дикого типа, ubp15-1, ubp15 ubp17, ubp15 ubp16 и ubp15 ubp16 ubp17. Черта = 1 см.
Фиг.10. - характеристика UBP18 и UBP19.
(A) Структура гена UBP18 (верхняя панель) и UBP19 (нижняя панель).
(B) ubp19 проявляет рецессивную летальность эмбриона. Верхний стручок является гетерозиготой ubp19 и нижний является диким типом. Стрелки указывают на анормальные гомозиготные эмбрионы. Черта=1мм.
(C) Изучение под микроскопом эмбрионов дикого типа (слева) и гомозиготы ubp19 (справа). bup19 гомозигота останавливается в развитии на стадии глобулы. Черта = 20 мкм.
Фиг.11. - тканевый паттерн экспрессии UBP19. Паттерн экспрессии UBP19 определяли с использованием PUBP19:GUS трансгенных линий.
(A) 12-дневные саженцы линии PUBP19:GUS. Черта = 1 мм. Изображение справа внизу 6х кратное увеличение концевого участка корня.
(B) Зрелые листья розетки линии PUBP19:GUS. Черта = 1 мм.
(C) Соцветие линии PUBP19:GUS line. Изображение слева внизу 2-кратное увеличение цветка. Черта = 1 мм.
(D) Стручок линии PUBP19:GUS line. Черта = 1 мм.
38 Т-ДНК нокаутных линий, соответствующих 24 из 27 генов UB, были разделены по фенотипам. Только 5 линий, принадлежащих 3 генам, проявляют видимый фенотип.
Дополнительная Фиг.1. - сравнение (выравнивание) последовательностей 27 UBP белков.
Высоконсервативные аминокислоты закрашены черным цветом, а менее консервативные закрашены серым цветом. Цифры над последовательностью указывают на позицию аминокислоты в последовательности.
Дополнительная Фиг.2. - паттерн экспрессии генов подсемейства UBP15.
Элементы с 1 по 18 стеблевые листья, листья розетки, пестик один день до опыления, пестик один день после опыления, стручок 3 дня после опыления, стручок 8 дней после опыления, стебель, чашелистик, тычинка, лепесток, семя, культивируемая клетка, темный корень, светлый корень, темный гипокотиль, светлый гипокотиль, темная семядоля и светлая семядоля.
Дополнительная Фиг.3. - филогенетический анализ подсемейства AIUBP15 и их гомологов в Рисе.
Филогенетическое дерево 9 UBPs в Арабидопсис или рисе. Значения анализа Bootstrap показаны в процентах от ветвлений.
Дополнительная Фиг.4. - двухмесячные линии дикого типа, два мутанта ubp15 и линия со сверхэкспрессией UBP15.
Двухмесячный дикий тип, ubp15-1, ubp15-2, линия со сверхэкспрессией UBP15 и компенсированная линия. Мутанты слабые, с ранним временем цветения и большим количеством вторичных стеблей, тогда как линии со сверхэкспрессией UBP15 демонстрируют противоположный фенотип с поздним цветением и сильным апикальным доминированием. Черта = 1 см.
Дополнительная Фиг.5. - сравнение количества столбчатых клеток в поперечном сечении через листовую пластину листьев розетки.
Планки погрешностей представляют стандартные отклонения трех биологических повторов.
Дополнительная Фиг.6. - сравнение девятого листа розетки дикого типа и мутантов, а также трансгенных линий.
(A) Зрелые девятые листья розетки дикого типа, ubp15-1, ubp15-2, линии со сверхэкспрессией UBP15 и ubp15 ubp16. Черта = 1 см.
(B) Сравнение количества адаксиальных эпидермальных клеток в поперечном сечении трех участков девятого листа розетки.
Дополнительные Таблицы
Дополнительная таблица 1. Данные теста на микропанелях экспрессии 27 UBP генов в разных органах
Ссылки
Amerik, A.Y., and Hochstrasser, M. (2004). Mechanism and function of deubiquitinating enzymes. BBA 1695, 189-207.
Ang, L.H., Chattopadhyay, S., Wei, N., Oyama, Т., Okada, K., Batschauer, A., and Deng, X.W. (1998). Molecular interaction between COP1 and HY5 defines a regulatory switch for light control of Arabidopsis development. Mol Cell 1,213-222.
Baek, K.H., Mondoux, M.A., Jaster, R., Fire-Levin, E., and D'Andrea, A.D. (2001). DUB-2A, a new member of the DUB subfamily of hematopoietic deubiquitinating enzymes. Blood 98, 636-642.z767
Balakirev, M.Y., Tcherniuk, S.O., Jaquinod, M., and Chroboczek, J. (2003). Otubains: a new family of cysteine proteases in the ubiquitin pathway. EMBO Rep 4, 517-522.
Burnett, В., Li, F., and Pittman, R.N. (2003). The polyglutamine neurodegenerative protein ataxin-3 binds polyubiquitylated proteins and has ubiquitin protease activity. Hum Mol Genet 12, 3195-3205.
Byrne, M.E., Groover, A.T., Fontana, J.R., and Martienssen, R.A. (2003). Phyllotactic pattern and stem cell fate are determined by the Arabidopsis homeoboxgene BELLRINGER. Development 130, 3941-3950.
Chandler, J.S., McArdle, В., and Callis, J. (1997). AtUBP3 and AtUBP4 are two closely related Arabidopsis thaliana ubiquitin-specific proteases present in the nucleus. Mol Gen Genet 255, 302-310.
Crosas, В., Hanna, J., Kirkpatrick, D.S., Zhang, D.P., Tone, Y., Hathaway, N.A., Buecker, C., Leggett, D.S., Schmidt, M., King, R.W., Gygi, S.P., and Finley, D. (2006). Ubiquitin chains are remodeled at the proteasome by opposing ubiquitin ligase and deubiquitinating activities. Cell 127, 1401-1413.
Doelling, J.H., Yan, N., Kurepa, J, Walker, J, and Vierstra, R.D. (2001). The ubiquitin-specific protease UBP14 is essential for early embryo development in Arabidopsis thaliana. Plant J 27, 393-405.
Fleury, D., Himanen, K., Cnops, G., Nelissen, H., Boccardi, T.M., Maere, S., Beemster, G.T, Neyt, P., Anami, S., Robles, P., Micol, J.L, Inze, D., and Van Lijsebettens, M. (2007). The Arabidopsis thaliana Homolog of Yeast BRE1 Has a Function in Cell Cycle Regulation during Early Leaf and Root Growth. Plant Cell.
Gross, C.T., and McGinnis, W. (1996).,DEAF-1, a novel protein that binds an essential region in a Deformed response element. EMBO J. 15, 1961-1970.
Hanna, J., Hathaway, N.A., Tone, Y., Crosas, В., Elsasser, S., Kirkpatrick, D.S., Leggett, D.S., Gygi, S.P., King, R.W., and Finley, D. (2006). Deubiquitinating enzyme Ubp6 functions noncatalytically to delay proteasomal degradation. Cell 127,99-111.
Hershko, A., and Ciechanover, A. (1998). The ubiquitin system. Annu. Rev. Biochem. 67, 425-479.
Hochstrasser, M. (1996). Ubiquitin-dependent protein degradation. Annu. Rev. Genet. 30, 405-439.
Hofmann, К., and Bucher, P. (1996). The DBA domain: a sequence motif present in multiple enzyme classes of the ubiquitination pathway. Trends Biochem Sci 21, 172-173.
Horiguchi, G., Kirn, G.T., and Tsukaya, H. (2005). The transcription factor AtGRF5 and the transcription coactivator AN3 regulate cell proliferation in leaf primordia of Arabidopsis thaliana. Plant J 43, 68-78.
Hu, M., Li, P., Li, M., Li, W, Yao, Т., Wu, J.W., Gu, W., Cohen, R.E-, and Shi, Y. (2002). Crystal structure of a UBP-family deubiquitinating enzyme in isolation and in complex with ubiquitin aldehyde. Cell 111, 1041-1054.
Johnston, S.C., Riddle, S.M., Cohen, R.E., and Hill, C.P. (1999). Structural basis for the specificity of ubiquitin C-terminal hydrolases. Embo J 18, 3877-3887.
Johnston, S.C., Larsen, C.N., Cook, W.J, Wilkinson, K.D., and Hill, C.P. (1997). Crystal structure of a deubiquitinating enzyme (human UCH-L3) at 1.8 A resolution. Embo J 16, 3787-3796.
Kim, J.H., and Kende, H. (2004). A transcriptional coactivator, AtGIFI, is involved in regulating leaf growth and morphology in Arabidopsis. Proc NatI Acad Sci U S A 101, 13374-13379.
Kumar, S., Tamura, K., and Nei, M. (2004). MEGA3: Integrated software for Molecular Evolutionary Genetics Analysis and sequence alignment. Brief Bioinform5, 150-163.
Lutterbach, В., Sun, D, Schuetz, J., and Hiebert, S.W. (1998a). The MYND motif is required for repression of basal transcription from the multidrug resistance 1 promoter by the t (8; 21) fusion protein. Mol. Cell. Biol. 18, 3604-3611.
Lutterbach, В., Westendorf, J.J., Linggi, В., Patten, A., Moniwa, M., Davie, J.R., Huynh, K.D., Bardwell, V.J., Lavinsky, R.M., Rosenfeld, M.G., Glass, C., Seto, E., and Hiebert, S.W. (1998b). ETO, a target of t (8; 21) in acute leukemia, interacts with the N-CoR and mSin3 corepressors. Mol. Cell Biol. 18, 7176-7184.
Ma, L., Sun, N, Liu, X., Jiao, Y., Zhao, H., and Deng, X.W. (2005). Organ-specific expression of Arabidopsis genome during development. Plant Physiol 138,80-91.
Ma, L., Gao, Y., Qu, L, Chen, Z., Li, J., Zhao, H., and Deng, X.W. (2002). Genomic evidence for COP1 as a represser of light-regulated gene expression and development in Arabidopsis. Plant Cell 14, 2383-2398.
Maere, S., Heymans, K., and Kuiper, M. (2005). BiNGO: a Cytoscape plugin to assess overrepresentation of gene ontology categories in biological networks. Bioinformatics21, 3448-3449.
Masselink, H., and Bernards, R. (2000). The adenovirus E1A binding protein BS69 is a corepressor of transcription through recruitment of N-CoR. Oncogene 19, 1538-1546.
Mueller, T.D., and Feigon, J. (2002). Solution structures of UBA domains reveal a conserved hydrophobic surface for protein-protein interactions. J Mol Biol 319, 1243-1255.
Nanao, M.H., Tcherniuk, S.O., Chroboczek, J., Dideberg, O., Dessen, A., and Balakirev, M.Y. (2004). Crystal structure of human otubain 2. EMBO Rep 5, 783-788.
Nijman, S.M., Luna-Vargas, M.P., Velds, A., BruMMelkamp, T.R., Dirac, A.M., Sixma, Т.К., and Bernards, R. (2005). A genomic and functional inventory of deubiquitinating enzymes. Cell 123, 773-786.
Papa, F.R., and Hochstrasser, M. (1993). The yeast DOA4 gene encodes a deubiquitinating enzyme related to a product of the human tre-2 oncogene. Nature 366, 313-319.
Park, Y.C., Burkitt, V., Villa, A.R., Tong, L., and Wu, H. (1999). Structural basis for self-association and receptor recognition of human TRAF2. Nature 398, 533-538.
Pickart, C.M. (2004). Back to the future with ubiquitin. Cell 116, 181-190.
Qin, G., Gu, H., Zhao, Y., Ma, Z., Shi, G., Yang, Y., Pichersky, E., Chen, H., Liu, M., Chen, Z., and Qu, L.J. (2005). An indole-3-acetic acid carboxyl methyltransferase regulates Arabidopsis leaf development. Plant Cell 17, 2693-2704.
Rao-Naik, С., Chandler, J.S., McArdle, В., and Callis, J. (2000). Ubiquitin-specific proteases from Arabidopsis thaliana: cloning of AtUBP5 and analysis of substrate specificity ofAtUBP3, AtUBP4, and AtUBP5 using Escherichia coli in vivo and in vitro assays. Arch Biochem Biophys 379, 198-208.
Scheel, H., Tomiuk, S., and Hofmann, K. (2003). Elucidation of ataxin-3 and ataxin-7 function by integrative bioinformatics. Hum Mol Genet 12, 2845-2852.
Sunnerhagen, M., Pursglove, S., and Fladvad, M. (2002). The new MATH: homology suggests shared binding surfaces in meprin tetramers and TRAF trimers. FEBS Lett 530, 1-3.
Thompson, J.D., Higgins, D.G., and Gibson, T.J. (1994). CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res 22, 4673-4680.
Tsukaya, H. (2006). Mechanism of leaf-shape determination. Annu. Rev. Plant Biol. 57, 477-496.
Varshavsky, A. (1997). The ubiquitin system. TIBS 22, 383-387.
Verma, R., Aravind, L, Oania, R., McDonald, W.H., Yates, J.R., 3rd, Koonin, E.V., and Deshaies, R.J. (2002). Role of Rpn11 metalloprotease in deubiquitination and degradation by the 26S proteasome. Science 298, 611-615.
Weigel, D., and Glazebrook, J. (2002). Arabidopsis A laboratory Manual. (New York: Cold Spring Harbor Laboratory Press).
Weissman, A.M. (2001). Themes and variations on ubiquitylation. Nat. Rev. Mol. Cell Biol. 2, 169-177.
Wilkinson, K.D. (1997). Regulation of ubiquitin-dependent processes by deubiquitinating enzymes. FASEB J. 11, 1245-1256.
Wilkinson, K.D. (1999). Ubiquitin-dependent signaling: the role of ubiquitination in the response of cells to their environment. J Nutr 129, 1933-1936.
Yan, N, Doelling, J.H, Falbel, T.G., Durski, A.M., and Vierstra, R.D. (2000). The ubiquitin-specific protease family from Arabidopsis. AtUBPI and 2 are required for the resistance to the amino acid analog canavanine. Plant Physiol 124, 1828-1843.
Yang, J., Lin, R., Sullivan, J-, Hoecker, U., Liu, В., Xu, L., Deng, X.W., and Wang, H. (2005). Light regulates COP1-mediated degradation of HFR1, a transcription factor essential for light signaling in Arabidopsis. Plant Cell 17, 804-821.
Ye, H., Park, Y.C, Kreishman, M., Kieff, E., and Wu, H. (1999). The structural basis for the recognition of diverse receptor sequences by TRAF2. Mol Cell 4, 321-330.





























































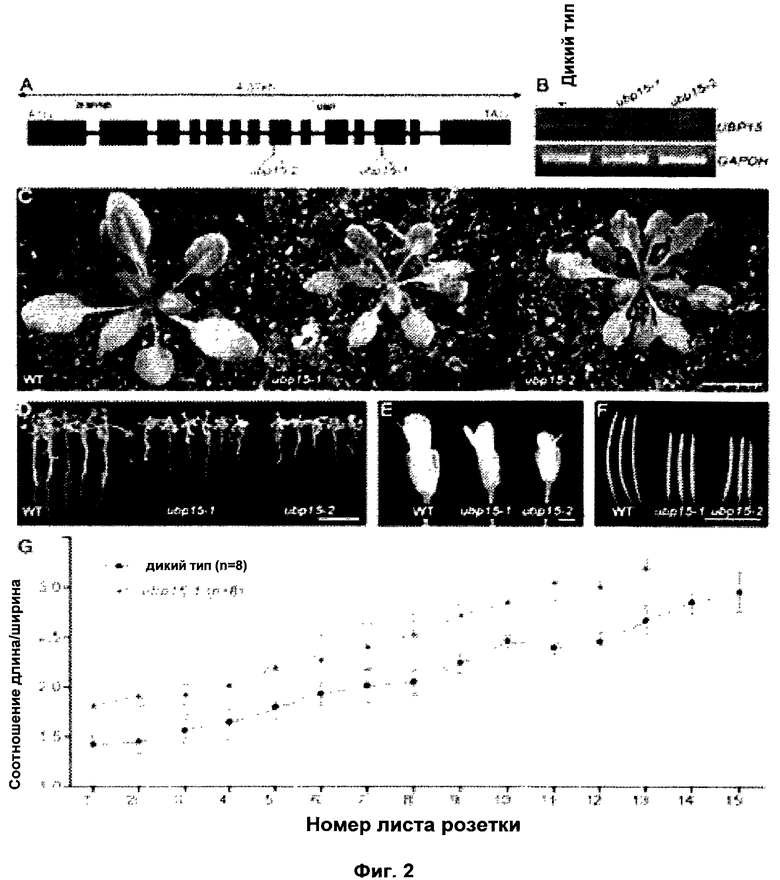
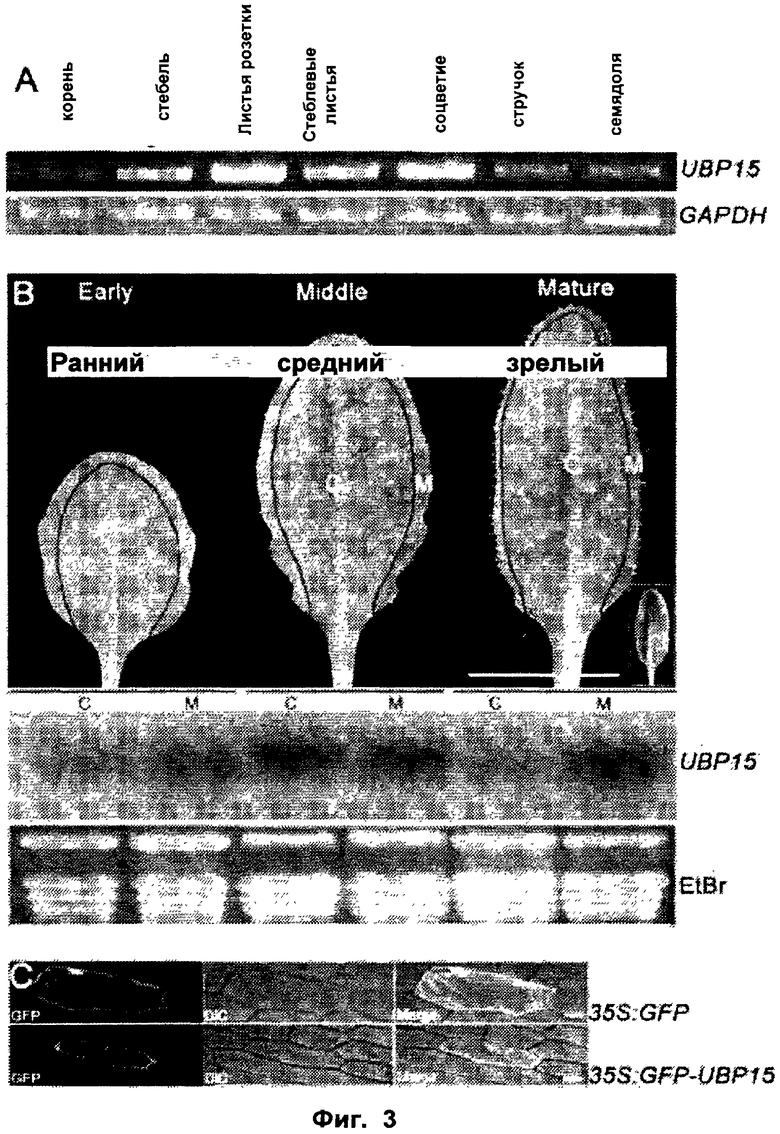
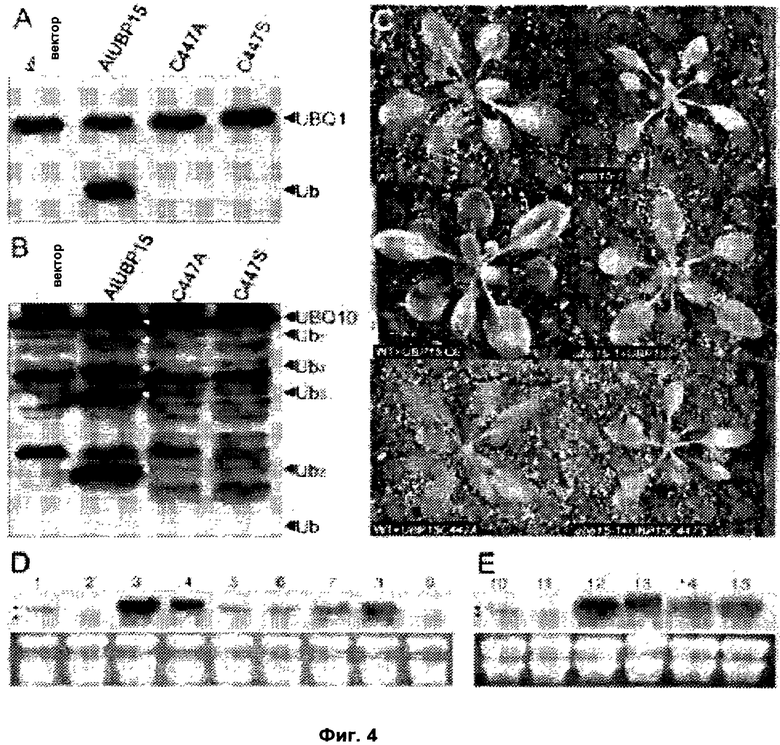
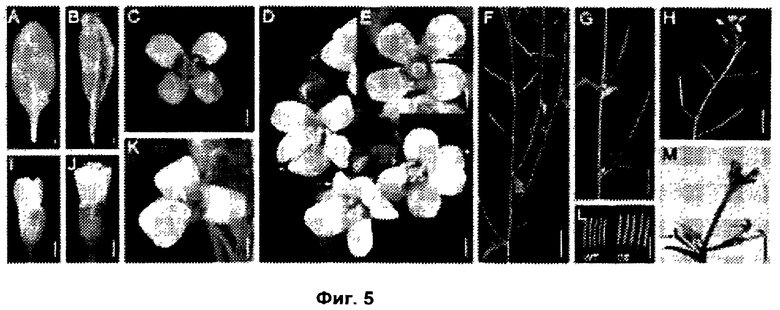
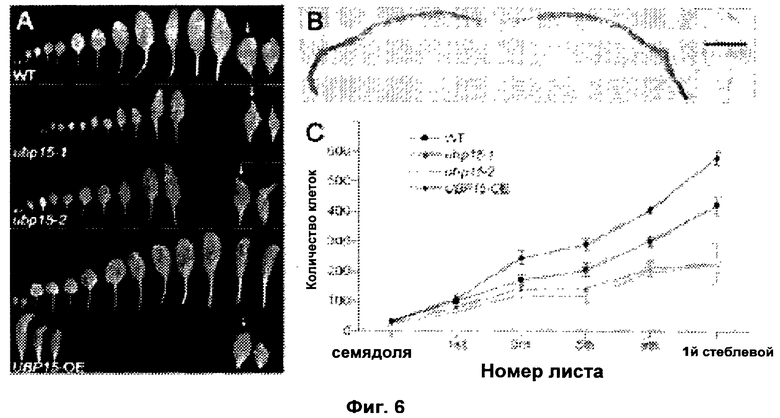
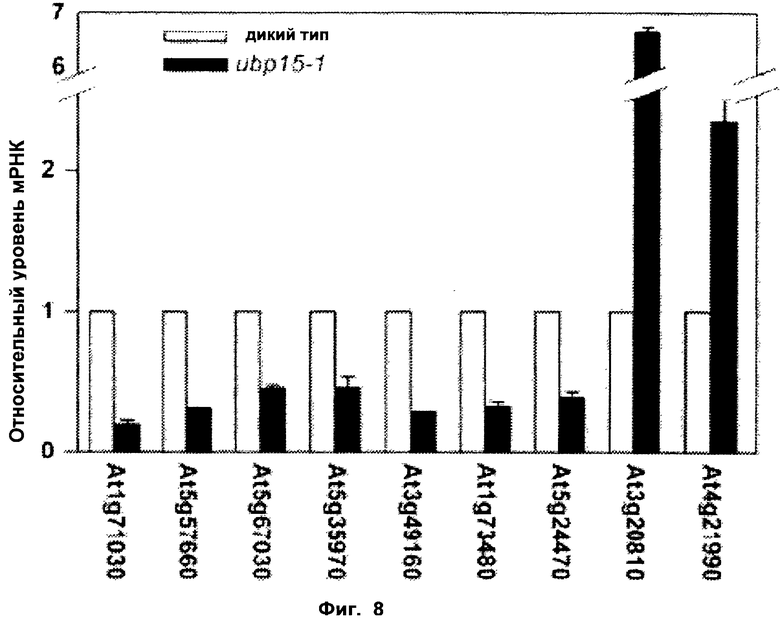
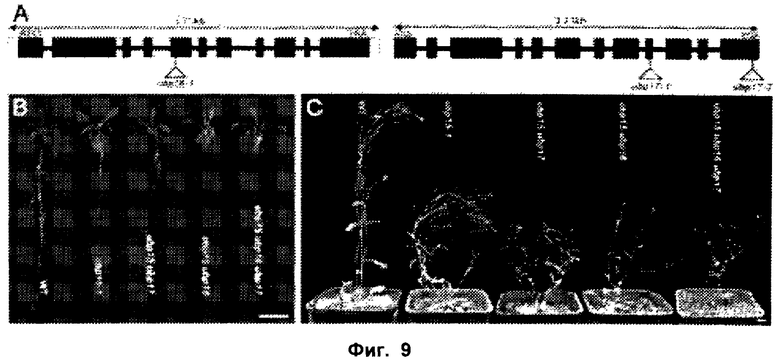
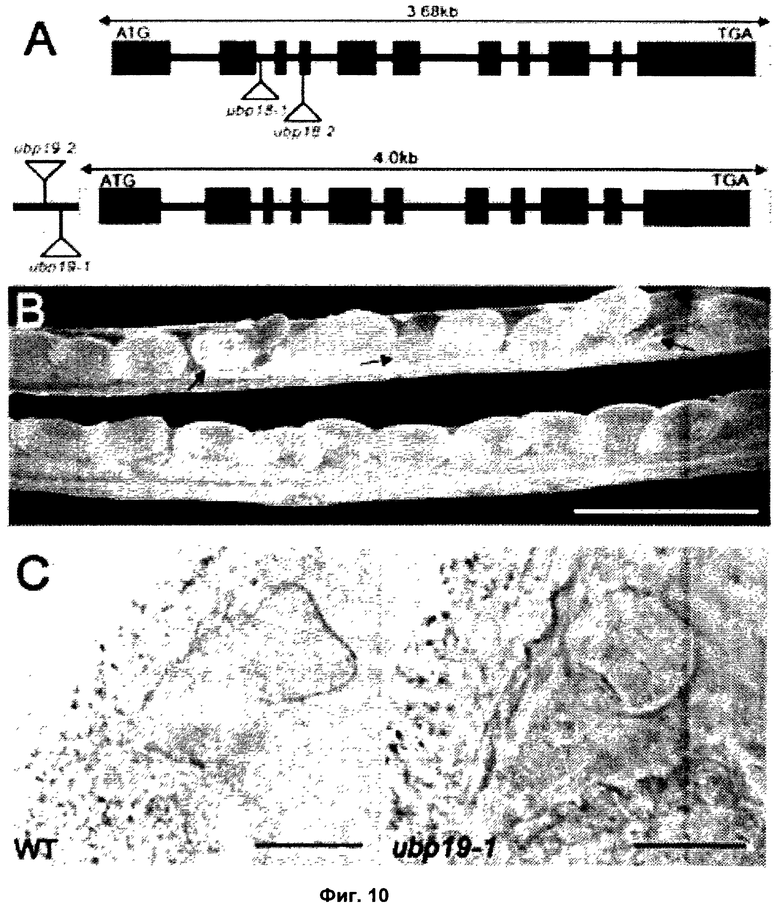































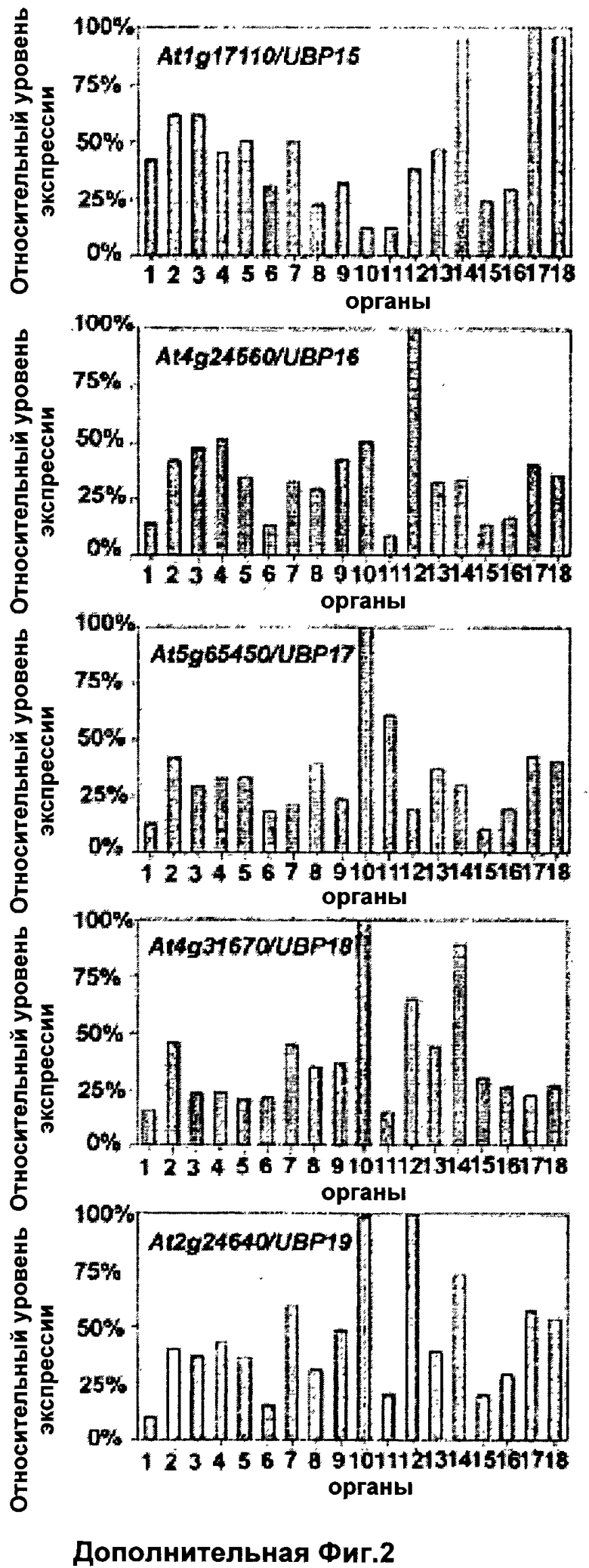
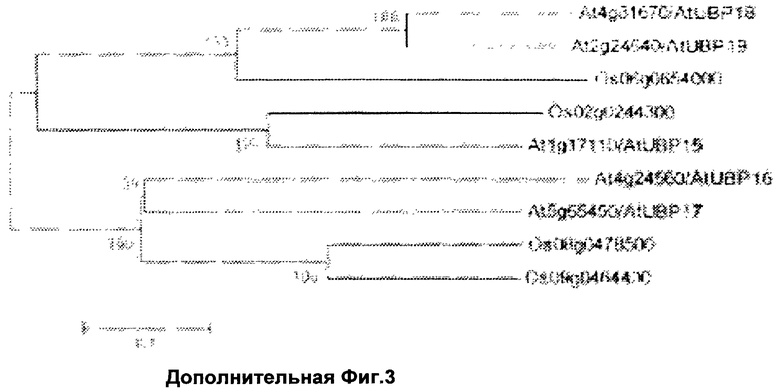

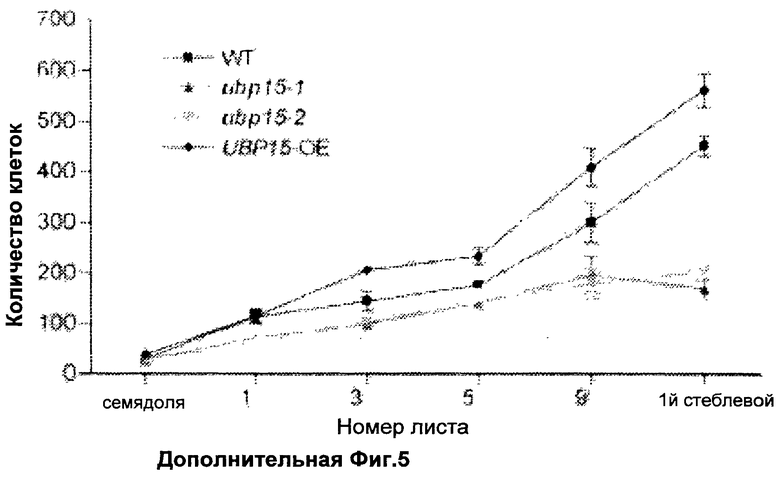
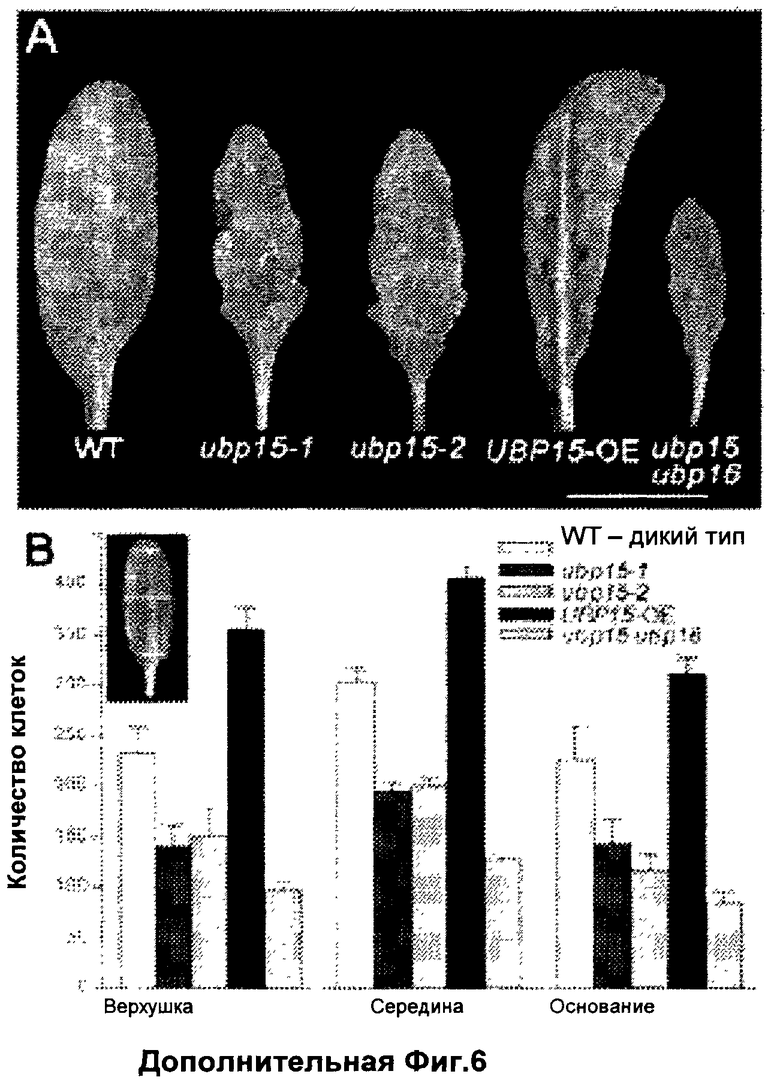
Изобретение относится к области биохимии, в частности к способу увеличения биомассы или улучшения пролиферации клеток, развития листа и/или репродуктивного развития растения, содержащему увеличение в растении экспрессии нуклеиновой кислоты, кодирующей Убиквитин-Специфичную Протеазу, а также к растению, части растения и семени растения, биомасса которых увеличена или пролиферация клеток, развитие листа и/или репродуктивное развитие которых улучшены указанным способом. Описаны вектор для применения в способе получения растений с увеличенной биомассой или улучшенной пролиферацией клеток, развитием листа и/или репродуктивным развитием, а также растение и часть растения, трансформированные указанным вектором. Раскрыто применение нуклеиновой кислоты, кодирующей Убиквитин-Специфическую Протеазу. Также раскрыт способ получения трансгенного растения с увеличенной биомассой или улучшенными пролиферацией клеток, развитием листа и/или репродуктивным развитием, а также трансгенное растение с увеличенной биомассой или улучшенными пролиферацией клеток, развитием листа и/или репродуктивным развитием по сравнению с контрольными растениями, полученное в результате увеличенной экспрессии нуклеиновой кислоты, кодирующей Убиквитин-Специфическую Протеазу. Изобретение позволяет эффективно получать растение, биомасса которого увеличена или пролиферация клеток, развитие листа и/или репродуктивное развитие которого улучшены. 11 н. и 6 з.п. ф-лы, 11 ил., 3 табл., 28 пр.
1. Способ увеличения биомассы или улучшения пролиферации клеток, развития листа и/или репродуктивного развития растения, содержащий увеличение в растении экспрессии нуклеиновой кислоты, кодирующей Убиквитин-Специфичную Протеазу (
UB
iquitin-Specific
P
rotease (UBP)), содержащую следующие мотивы:
(i) Cys box;
(ii) His box; и
(iii) ZnMYND домен "цинковый палец",
и где указанная UBP представлена нуклеиновой кислотой, кодирующей белок с аминокислотной последовательностью с SEQ ID NO:2 или SEQ ID NO:12, или представляет собой последовательность, имеющую по меньшей мере 90% идентичности к SEQ ID NO:2 или SEQ ID NO:12, и/или где указанная нуклеиновая кислота представлена любой из последовательностей SEQ ID NOs 1, 11, 19, 39 или 44 или является нуклеиновой кислотой, способной гибридизоваться с такой нуклеиновой кислотой при следующих условиях гибридизации:
гибридизация при 65 °С в 1хSSC или при 42 °С в 1хSSC и 50% формамида с последующей отмывкой при 65 °С в 0.3хSSC, где указанная способная гибридизоваться нуклеиновая кислота способна изменить развитие растения.
2. Способ по п.1, где указанная увеличенная экспрессия осуществляется путем введения и экспрессии в растении нуклеиновой кислоты, как определено в п.1.
3. Способ по п.1, где указанная нуклеиновая кислота функционально связана с конститутивным промотором, предпочтительно с промотором CaMV35S.
4. Способ по любому из пп.1-3, где указанная нуклеиновая кислота имеет растительное происхождение, предпочтительно из двудольного растения, предпочтительно из семейства Крестоцветных или Капустных (Brassicaceae), более предпочтительно из рода Арабидопсис (Arabidopsis), наиболее предпочтительно из Арабидопсиса Таля (Arabidopsis thaliana).
5.Растение, биомасса которого увеличена или пролиферация клеток, развитие листа и/или репродуктивное развитие которого улучшены способом по одному из пп.1-4, где указанное растение содержит рекомбинантную нуклеиновую кислоту, кодирующую Убиквитин-Специфическую Протеазу (
UB
iquitin-Specific
P
rotease (UBP)), содержащую следующие мотивы:
(i) Cys box;
(ii) His box; и
(iii) ZnMYND домен "цинковый палец",
и где указанная UBP представлена нуклеиновой кислотой, кодирующей белок с аминокислотной последовательностью с SEQ ID NO:2 или SEQ ID NO:12, или представляет собой последовательность, имеющую по меньшей мере 90% идентичности к SEQ ID NO:2 или SEQ ID NO:12, и/или где указанная нуклеиновая кислота представлена любой из последовательностей SEQ ID NOs 1, 11, 19, 39 или 44 или является нуклеиновой кислотой, способной гибридизоваться с такой нуклеиновой кислотой при следующих условиях гибридизации:
гибридизация при 65 °С в 1хSSC или при 42 °С в 1хSSC и 50% формамида с последующей отмывкой при 65 °С в 0.3хSSC, где указанная способная гибридизоваться нуклеиновая кислота способна изменить развитие растения.
6. Часть растения, биомасса которого увеличена или пролиферация клеток, развитие листа и/или репродуктивное развитие которого улучшены способом по одному из пп.1-4, где указанная часть растения содержит рекомбинантную нуклеиновую кислоту, кодирующую Убиквитин-Специфическую Протеазу (
UB
iquitin-Specific
P
rotease (UBP)), содержащую следующие мотивы:
(i) Cys box;
(ii) His box; и
(iii) ZnMYND домен "цинковый палец",
и где указанная UBP представлена нуклеиновой кислотой, кодирующей белок с аминокислотной последовательностью с SEQ ID NO:2 или SEQ ID NO:12, или представляет собой последовательность, имеющую по меньшей мере 90% идентичности к SEQ ID NO:2 или SEQ ID NO:12, и/или где указанная нуклеиновая кислота представлена любой из последовательностей SEQ ID NOs 1, 11, 19, 39 или 44 или является нуклеиновой кислотой, способной гибридизоваться с такой нуклеиновой кислотой при следующих условиях гибридизации:
гибридизация при 65 °С в 1хSSC или при 42 °С в 1хSSC и 50% формамида с последующей отмывкой при 65 °С в 0.3хSSC, где указанная способная гибридизоваться нуклеиновая кислота способна изменить развитие растения.
7. Семя для получения растения, биомасса которого увеличена или пролиферация клеток, развитие листа и/или репродуктивное развитие которого улучшены способом по одному из пп.1-4, где указанное семя содержит рекомбинантную нуклеиновую кислоту, кодирующую Убиквитин-Специфическую Протеазу (
UB
iquitin-Specific
P
rotease (UBP)), содержащую следующие мотивы:
(i) Cys box;
(ii) His box; и
(iii) ZnMYND домен "цинковый палец",
и где указанная UBP представлена нуклеиновой кислотой, кодирующей белок с аминокислотной последовательностью с SEQ ID NO:2 или SEQ ID NO:12, или представляет собой последовательность, имеющую по меньшей мере 90% идентичности к SEQ ID NO:2 или SEQ ID NO:12, и/или где указанная нуклеиновая кислота представлена любой из последовательностей SEQ ID NOs 1, 11, 19, 39 или 44 или является нуклеиновой кислотой, способной гибридизоваться с такой нуклеиновой кислотой при следующих условиях гибридизации:
гибридизация при 65 °С в 1хSSC или при 42 °С в 1хSSC и 50% формамида с последующей отмывкой при 65 °С в 0.3хSSC, где указанная способная гибридизоваться нуклеиновая кислота способна изменить развитие растения.
8. Вектор для применения в способе получения растений с увеличенной биомассой или улучшенными пролиферацией клеток, развитием листа и/или репродуктивным развитием, содержащий:
(i) нуклеиновую кислоту, кодирующую Убиквитин-Специфическую Протеазу, содержащую следующие мотивы:
a) Cys box;
b) His box; и
c) ZnMYND домен "цинковый палец",
и где указанная UBP представлена последовательностью нуклеиновой кислоты, соответствующей SEQ ID NO:2 или SEQ ID NO:12, или представляет собой последовательность, имеющую по меньшей мере 90% идентичности к SEQ ID NO:2 или SEQ ID NO:12, и/или где указанная нуклеиновая кислота представлена любой из последовательностей SEQ ID NOs 1, 11, 19, 39 или 44 или является нуклеиновой кислотой, способной гибридизоваться с такой нуклеиновой кислотой при следующих условиях гибридизации:
гибридизация при 65 °С в 1хSSC или при 42 °С в 1хSSC и 50% формамида с последующей отмывкой при 65 °С в 0.3хSSC;
(ii) одну или более управляющих последовательностей, способных стимулировать экспрессию последовательности нуклеиновой кислоты из (i); и необязательно
(iii) последовательность терминации транскрипции.
9. Вектор по п.8, где одна из указанных управляющих последовательностей является конститутивным промотором, предпочтительно промотором CaMV35S.
10. Применение нуклеиновой кислоты, кодирующей Убиквитин-Специфическую Протеазу (
UB
iquitin-Specific
P
rotease (UBP)), содержащую следующие мотивы:
(i) Cys box;
(ii) His box; и
(iii) ZnMYND домен "цинковый палец",
и где указанная UBP представлена нуклеиновой кислотой, кодирующей белок с аминокислотной последовательностью с SEQ ID NO:2 или SEQ ID NO:12, или представляет собой последовательность, имеющую по меньшей мере 90% идентичности к SEQ ID NO:2 или SEQ ID NO:12, и/или где указанная нуклеиновая кислота представлена любой из последовательностей SEQ ID NOs 1, 11, 19, 39 или 44 или является нуклеиновой кислотой, способной гибридизоваться с такой нуклеиновой кислотой при следующих условиях гибридизации:
гибридизация при 65 °С в 1хSSC или при 42 °С в 1хSSC и 50% формамида с последующей отмывкой при 65 °С в 0.3хSSC, где указанная способная гибридизоваться нуклеиновая кислота способна изменить развитие растения для увеличения биомассы или улучшения пролиферации клеток, развития листа и/или репродуктивного развития растения по сравнению с контрольными растениями.
11. Способ получения трансгенного растения с увеличенной биомассой или улучшенными пролиферацией клеток, развитием листа и/или репродуктивным развитием, содержащий:
(i) введение в растение и экспрессию нуклеиновой кислоты, кодирующей Убиквитин-Специфическую Протеазу (
UB
iquitin-Specific
P
rotease (UBP)), содержащую следующие мотивы:
(i) Cys box;
(ii) His box; и
(iii) ZnMYND домен "цинковый палец",
и где указанная UBP представлена нуклеиновой кислотой, кодирующей белок с аминокислотной последовательностью с SEQ ID NO:2 или SEQ ID NO:12, или представляет собой последовательность, имеющую по меньшей мере 90% идентичности к SEQ ID NO:2 или SEQ ID NO:12, и/или где указанная нуклеиновая кислота представлена любой из последовательностей SEQ ID NOs 1, 11, 19, 39 или 44 или является нуклеиновой кислотой, способной гибридизоваться с такой нуклеиновой кислотой при следующих условиях гибридизации:
гибридизация при 65 °С в 1хSSC или при 42 °С в 1хSSC и 50% формамида с последующей отмывкой при 65 °С в 0.3хSSC, где указанная способная гибридизоваться нуклеиновая кислота способна изменить развитие растения; и
(ii) культивирование растительной клетки в условиях стимуляции биомассы или пролиферации клеток, развитие листа и/или репродуктивного развития растения.
12. Трансгенное растение с увеличенной биомассой или улучшенными пролиферацией клеток, развитием листа и/или репродуктивным развитием по сравнению с контрольными растениями, полученное в результате увеличенной экспрессии нуклеиновой кислоты, кодирующей Убиквитин-Специфическую Протеазу (
UB
iquitin-Specific
P
rotease (UBP)), содержащую следующие мотивы:
(i) Cys box;
(ii) His box; и
(iii) ZnMYND домен "цинковый палец",
и где указанная UBP представлена нуклеиновой кислотой, кодирующей белок с аминокислотной последовательностью с SEQ ID NO:2 или SEQ ID NO:12, или представляет собой последовательность, имеющую по меньшей мере 90% идентичности к SEQ ID NO:2 или SEQ ID NO:12, и/или где указанная нуклеиновая кислота представлена любой из последовательностей SEQ ID NOs 1, 11, 19, 39 или 44 или является нуклеиновой кислотой, способной гибридизоваться с такой нуклеиновой кислотой при следующих условиях гибридизации:
гибридизация при 65 °С в 1хSSC или при 42 °С в 1хSSC и 50% формамида, с последующей отмывкой при 65 °С в 0.3хSSC, где указанная способная гибридизоваться нуклеиновая кислота способна изменить развитие растения.
13. Растение, трансформированное вектором по пп.8 или 9 с увеличенной биомассой или улучшенными пролиферацией клеток, развитием листа и/или репродуктивным развитием по сравнению с контрольными растениями.
14. Часть растения, трансформированная вектором по пп.8 или 9 с увеличенной биомассой или улучшенными пролиферацией клеток, развитием листа и/или репродуктивным развитием по сравнению с контрольными растениями.
15. Собираемая в виде урожая часть растения, трансформированная вектором по пп.8 или 9 с увеличенной биомассой или улучшенными пролиферацией клеток, развитием листа и/или репродуктивным развитием по сравнению с контрольными растениями.
16. Собираемая в виде урожая часть по п.15, где указанная часть является предпочтительно биомассой побегов и/или семенами.
17. Трансгенное растение по п.5 или 12, где указанное растение является сельскохозяйственной культурой, или однодольным, или зерновым, таким как рис, кукуруза, пшеница, ячмень, просо, рожь, тритикале, сорго или овес.
| YAN N | |||
| Et al., The ubiquitin-specific protease family from Arabidopsis | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Аппарат для радиометрической съемки | 1922 |
|
SU124A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| US 2005210544 A1, 22.09.2005 | |||
| YANG P | |||
| et al., Ubiquitin C-terminal hydrolases 1 and 2 affect shoot architecture in | |||
Авторы
Даты
2014-07-20—Публикация
2009-01-30—Подача