ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] Данная заявка заявляет приоритет предварительной заявки США № 62/410355, поданной 19 октября 2016 г., и предварительной заявки США № 62/411408, поданной 21 октября 2016 г., которые обе в полном объеме включены в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[2] Данное изобретение относится к композициям и способам для модуляции флорального развития и вегетативного роста посредством генетической модификации культурных растений для повышения урожайности.
ВКЛЮЧЕНИЕ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[3] Перечень последовательностей, содержащийся в файле под названием P34461WO00_SEQ.txt, имеющий размер 177799 байтов (определенный в MS-Windows®) и созданный 18 октября 2017 г., содержит 110 нуклеотидных последовательностей и был подан вместе с данным документом в электронной форме, и в полном объеме включен посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[4] Переход от вегетативного роста к цветению является важным процессом во время развития растения, который необходим для получения урожая зерна в культурных растениях. Существует несколько основных путей регуляции времени цветения у наземных растений, которые реагируют на связанные с окружающей средой и развитием стимулы, включая фотопериодизм (т. е. длину дня), яровизацию (т. е. ответ на зимний холод) и растительные гормоны (например, гиббереллины или ГК), в дополнение к автономным (независимым от условий окружающей среды) путям. Молекулярные сети, регулирующие время цветения у растений, включают пути яровизации и фотопериодизма. В индуктивных фотопериодических условиях активность гена CONSTANS (CO) в первичных листьях повышает экспрессию гена FLOWERING LOCUS T (FT), который транслоцируется в меристему, запуская экспрессию нижележащих активирующих цветение генов LEAFY (LFY), APETALA1 (AP1) и SUPPRESSOR OF OVEREXPRESSION OF CO 1 (SOC1). Действие других генов, таких как FLOWERING LOCUS C (FLC) и TERMINAL FLOWER 1 (TFL1), ингибирует экспрессию или активность этих генов.
[5] За исключение нейтральных в отношении длины дня растений, большинство цветущих растений восприимчивы к суточным фотопериодическим циклам и могут быть классифицированы как растения короткого дня (КД) или длинного дня (ДД) на основании фотопериодических условий, необходимых для индукции цветения. Фотопериод относится к относительной длине или длительности светлых и темных периодов в 24-часовом цикле. В общем случае растения длинного дня демонстрируют тенденцию к цветению, когда длина дня превышает некий пороговый фотопериод (например, когда дни становятся длиннее весной), тогда как растения короткого дня демонстрируют тенденцию к цветению, когда длина дня опускается ниже порогового фотопериода (например, когда дни становятся короче после летнего солнцестояния). Другими словами, растения КД цветут, когда дни становятся короче, тогда как растения ДД цветут, когда дни становятся длиннее. Соя является примером растения короткого дня (КД), цветение которого индуцируется, когда растения помещают в условия более короткого светового дня.
[6] Растениеводы всегда находятся в поиске новых способов влияния на урожайность растений, в особенности повышения урожая семян важных сельскохозяйственных культур. Таким образом, в данной области техники существует постоянная необходимость в улучшении композиций и способов для повышения урожайности различных культурных растений. В данном документе сделано предположение, что улучшение урожайности культур можно обеспечить, повышая агрономические характеристики, связанные с цветением и генеративным развитием.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[7] В соответствии с одним аспектом в данном изобретении предложена рекомбинантная ДНК-конструкция, содержащая первую экспрессионную кассету и вторую экспрессионную кассету, причем первая экспрессионная кассета содержит полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с первым промотором пригодным для экспрессии в растениях, а вторая экспрессионная кассета содержит последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам полинуклеотидной последовательности первой экспрессионной кассеты, и при этом последовательность ДНК пригодная для транскрипции функционально связана со вторым промотором пригодным для экспрессии в растениях.
[8] В соответствии с одним аспектом в данном изобретении предложена рекомбинантная ДНК-конструкция, содержащая полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с первым промотором пригодным для экспрессии в растениях, причем полинуклеотидная последовательность содержит последовательность, которая кодирует целевой сайт или сенсор в мРНК-транскрипте, кодируемом полинуклеотидной последовательностью, и при этом целевой сайт мРНК-транскрипта является по меньшей мере на 80% комплементарным эндогенной молекуле РНК, такой как эндогенная молекула микроРНК или миРНК.
[9] В соответствии с одним аспектом в данном изобретении предложена рекомбинантная ДНК-конструкция, содержащая последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам полинуклеотидной последовательности, кодирующей флоригенный белок FT, причем последовательность ДНК пригодная для транскрипции функционально связана с промотором пригодным для экспрессии в растениях.
[10] В соответствии с одним аспектом в данном изобретении предложены трансгенные растения, клетки растений, ткани растений и фрагменты растений, содержащие вставку рекомбинантной ДНК-конструкции согласно данному изобретению в геноме таких растений, клеток растений, тканей растений и фрагментов растений.
[11] В соответствии с одним аспектом в данном изобретении предложены способы получения трансгенного растения, включающие (a) трансформацию по меньшей мере одной клетки эксплантата рекомбинантной ДНК-конструкцией согласно данному изобретению; и (b) регенерацию или выращивание трансгенного растения из трансформированного эксплантата. Эти способы могут дополнительно включать (c) отбор трансгенного растения, имеющего один или более из следующих признаков или фенотипов: более раннее цветение, более длительный генеративный период или период цветения, увеличенное число цветков на узел, увеличенное число цветочных кистей на узел, увеличенное число бобов, семенных коробочек, стручков, фруктов или орехов на узел и увеличенное число семян на узел, по сравнению с контрольным растением, не содержащим рекомбинантную ДНК-конструкцию.
[12] В соответствии с одним аспектом в данном изобретении предложены способы посадки трансгенного культурного растения, включающие посадку трансгенного культурного растения с повышенной плотностью в поле, при этом трансгенное культурное растение содержит вставку рекомбинантной ДНК-конструкции согласно данному изобретению.
[13] В соответствии с одним аспектом в данном изобретении предложено трансгенное растение, содержащее полинуклеотидную последовательность, кодирующую полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с первым промотором пригодным для экспрессии в растениях, а вторая экспрессионная кассета содержит последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам полинуклеотидной последовательности первой экспрессионной кассеты, и при этом последовательность ДНК пригодная для транскрипции функционально связана со вторым промотором пригодным для экспрессии в растениях. В соответствии с одним аспектом в данном изобретении предложено трансгенное растение, содержащее последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам полинуклеотидной последовательности, кодирующей флоригенный белок FT, причем последовательность ДНК пригодная для транскрипции функционально связана с промотором пригодным для экспрессии в растениях.
[14] В соответствии с одним аспектом в данном изобретении предложено трансгенное растение, которое может в среднем иметь больше семян, стручков, семенных коробочек, плодов, фруктов, орехов или клубней на узел, чем нетрансгенное контрольное растение, например, в среднем по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше семян, бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел, чем нетрансгенное контрольное растение. В соответствии с одним аспектом трансгенное растение может в среднем иметь на по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9 или по меньшей мере на 10 больше семян, бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел, чем нетрансгенное контрольное растение. В соответствии с одним аспектом трансгенное растение может в среднем иметь на 2-10, 2-9, 2-8, 2-7, 2-6, 2-5, 2-4, 2-3, 3-10, 3-9, 3-8, 3-7, 3-6, 3-5, 3-4, 4-10, 4-9, 4-8, 4-7, 4-6 или 4-5 больше семян, бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел, чем нетрансгенное контрольное растение. В соответствии с одним аспектом трансгенное растение может в среднем иметь по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9 или по меньшей мере на 10 больше семян, бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел по сравнению с контрольным растением дикого типа или нетрансгенным контрольным растением. В соответствии с одним аспектом трансгенное растение может зацветать по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 20, по меньшей мере на 25, по меньшей мере на 30, по меньшей мере на 35, по меньшей мере на 40 или по меньшей мере на 45 дней раньше, чем нетрансгенное контрольное растение.
[15] В соответствии с одним аспектом в данном изобретении предложено трансгенное растение, содержащее полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором вегетативной стадии, при этом экспрессия флоригенного белка FT подавляется в поздней вегетативной и/или генеративной ткани.
[16] В соответствии с одним аспектом в данном изобретении предложена рекомбинантная ДНК-конструкция, содержащая полинуклеотидную последовательность, кодирующую флоригенный белок FT и функционально связанную с промотором вегетативной стадии, и по меньшей мере одну последовательность, кодирующую РНК-нацеливающую последовательность, которая является комплементарной по меньшей мере части полинуклеотидной последовательности.
[17] В соответствии с одним аспектом в данном изобретении предложено трансгенное растение, содержащее рекомбинантную полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором вегетативной стадии, при этом экспрессия полинуклеотидной последовательности пространственно и временно ограничена малой молекулой РНК.
[18] В соответствии с одним аспектом в данном изобретении предложена рекомбинантная ДНК-конструкция, содержащая экспрессионную кассету, причем экспрессионная кассета содержит полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором, при этом промотор содержит полинуклеотидную последовательность, которая по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична полинуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53 или 54, или ее функциональной части.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[19] Фиг. 1A иллюстрирует матричную таблицу, в которой приведено сравнение нуклеотидных последовательностей для каждой комбинации различных генов FT, включая процент их идентичности.
[20] Фиг. 1B иллюстрирует матричную таблицу, в которой приведено сравнение белковых последовательностей для каждой комбинации различных белков FT, включая процент их идентичности.
[21] Фиг. 1C иллюстрирует множественное выравнивание последовательностей CLUSTAL 2.0.9 для различных белков FT, идентифицированных как Gm.FT2a с SEQ ID NO: 2, Gm.FT2b с SEQ ID NO: 6, Le.FT с SEQ ID NO: 12, Pt.FT с SEQ ID NO: 20, Os.HD3a с SEQ ID NO: 18, At.FT с SEQ ID NO: 14, At. TSF с SEQ ID NO: 16, Nt.FT с SEQ ID NO: 10, Gm.FT5a с SEQ ID NO: 4 и Zm.ZCN8 с SEQ ID NO: 8.
[22] Фиг. 2 иллюстрирует общие уровни транскрипта FT в в тканях листьев и верхушек сои, собранных на 1, 3 и 5 дни после выращивания в условиях короткого или длинного светового дня.
[23] Фиг. 3A-3O и Фиг. 4A-4O иллюстрируют профиль экспрессии промотора pAt.Erecta посредством отслеживания активности GUS на ранних стадиях развития сои. Фиг. 3A-3O представляют собой набор черно-белых изображений окрашенных тканей, а изображения на Фиг. 4A-4O соответствуют Фиг. 3A-3O, но отобраны по синему окрашиванию GUS. Фиг. 3A-3C и 4A-4C иллюстрируют экспрессию в 3-дневных ростках; Фиг. 3D-3I и 4D-4I иллюстрируют экспрессию в 10-дневных вегетативных побегах (выращиваемых в условиях 14 часов светлого/ 10 часов темного фотопериода); Фиг. 3J-3L и 4J-4L иллюстрируют экспрессию в 16-дневных генеративных побегах; а Фиг. 3M-3O и 4M-4O иллюстрируют экспрессию в 30-дневных зрелых и незрелых листьях генеративного побега. Планки соответствуют 100 мкм.
[24] Фиг. 5A-5F и Фиг. 6A-6F иллюстрируют профиль экспрессии GUS с промотором pAT.Erecta во время R1 и цветочной стадий развития (35-40 дней после прорастания). Фиг. 5A-5F представляют собой набор черно-белых изображений окрашенных тканей, а изображения на Фиг. 6A-6F соответствуют Фиг. 5A-5F, но отобраны по синему окрашиванию GUS. Фиг. 5A и 6A иллюстрируют экспрессию в стеблях или стебельках соцветий (стрелки), а Фиг. 5B и 6B иллюстрируют экспрессию в цветоножках (стрелки). Также проиллюстрирована экспрессия в сосудистых и паренхиматозных клетках (Фиг. 5C и 6C), в тычиночных нитях (Фиг. 5D и 6D; стрелка) и в неопыленных семяпочках (Фиг. 5E, 5F, 6E и 6F; стрелки). Планки соответствуют 1 мм.
[25] Фиг. 7 иллюстрирует изображения срезов апикальной меристемы побегов (АМП) из растений дикого типа и GmFT2a-экспрессирующих трансгенных растений через 7 дней после посадки, полученные методом сканирующей электронной микроскопии (СЭМ).
[26] Фиг. 8 проиллюстрированы полученные методом сканирующей электронной микроскопии (СЭМ) микрофотографии аксиллярного примордия соцветия из растения дикого типа (собранного через 27 дней после посадки) в сравнении с аксиллярным примордием соцветия из трансгенного растения, экспрессирующего Gm.FT2a (собранного через 9 дней после посадки).
[27] Фиг. 9A-9C иллюстрируют эффекты экспрессии Gm.FT2a под управлением промотора At.Erecta в сое. Фиг. 9A иллюстрирует нулевой сегрегант, демонстрирующий нормальные пазушные почки, тогда как Фиг. 9B и Фиг. 9C (соответствующие растениям, гомозиготным или гемизиготным в отношении трансгена Gm.FT2a, соответственно) раннее цветение и увеличенное количество бобов на узел по сравнению с нулевым сегрегантом.
[28] Фиг. 10 иллюстрирует изображение целого растения нулевого сегреганта дикого типа рядом с растениями, гемизиготными и гомозиготными в отношении трансгена Gm.FT2a, как указано.
[29] Фиг. 11 иллюстрирует изображение основного стебля растений, которые являются гомозиготными или гемизиготными в отношении трансгена pAt.Erecta-Gm.FT2a по сравнению с нулевым сегрегантом, как указано.
[30] Фиг. 12 иллюстрирует изображения целых растений, трансформированных pAt.Erecta::Gm.FT2a или pAt.Erecta::Gm.FT2a/pAP1::miRNA-FT2a::T-Apx.
[31] Фиг. 13 иллюстрирует изображения целых растений, трансформированных только pAt.Erecta::Gm.FT2a или pAt.Erecta::Gm.FT2a+целевой сайт miR172.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[32] Цель улучшения урожайности является обычной для всех культурных растений в сельском хозяйстве. Данное изобретение включает способы и композиции для улучшения урожайности цветущих (покрытосеменных) или семенных растений путем модификации характеристик, связанных с временем цветения, генеративным развитием и вегетативным ростом, для улучшения одной или более характеристик или одного или более фенотипов, связанных с цветением и/или урожайностью, таких как число цветков, семян и/или бобов на растение и/или число цветков, семян и/или бобов на узел (и/или на главный стебель) растения. Не ограничиваясь какой-либо теорией, считается, что композиции и способы согласно данному изобретению можно применять для улучшения урожайности растения за счет увеличения числа флоральных меристем, повышения синхронизации появления латеральной меристемы и/или увеличения периода времени для развития боба или семени в растении (например, длительности генеративного периода).
[33] Ранее было обнаружено, что выращивание растений короткого дня, таких как соя, в условиях длинного дня (например, около 14-16 часов света на сутки), а затем кратковременное помещение этих растений в условия роста с коротким световым днем (например, около 9-11 часов света на сутки в течение около 3-21 дней) перед возвращением растений в условия роста с длинным световым днем (неиндуктивные), позволяет получить растения, имеющие большее число бобов/семян на растение (и бобов/семян на узел и/или на ветку). Смотрите, например, патент США № 8935880 и патентную заявку США № 2014/0259905, полное содержание которых включено в данный документ посредством ссылки. Искусственные индуктивные условия «короткого светового дня» во время вегетативных стадий развития позволили выявить не только то, что время цветения можно менять так, чтобы менять при этом один или более связанных с урожайностью признаков или фенотипов (например, приводя к увеличению числа бобов или семян на узел растения), но также то, что эффект применения этих условий был дозозависимым, когда число цветков, семян и/или бобов на растение (и/или на узел растения) зависело от (i) длительности применения условий короткого дня (т. е. дозы сигнала индукции цветения) и (ii) длины фотопериодов после условий короткого дня в условиях длинного дня (т. е. дозы или длины индуцирующего вегетативный рост сигнала после сигнала индукции короткого дня). Растения сои, помещенные в условия меньшей или менее длительной ранней индукции короткого дня (рИКД) (перед возвращением в условия роста с длинным световым днем), имели больше цветков, бобов и семян на растение с более нормальными высотой и степенью зрелости растения, тогда как растения сои, помещенные в условия большей или более длительной рИКД, давали меньшие, раньше гибнущие растения с меньшим числом бобов и семян на растение (хотя, возможно, с большим числом бобов и/или семян на узел).
[34] Фенотип индукции короткого дня в сое использовали для определения генов, имеющих измененную экспрессию в этих растениях, посредством профилирования транскрипции. Эти исследования позволили определить несколько генов с измененной экспрессией в этих обработанных растениях сои, включая эндогенный ген FT, Gm.FT2a, имеющий повышенную экспрессию в ответ на условия индукции короткого дня. Поэтому предположили, что можно использовать трансгенную экспрессию FT вместо индукции короткого дня для повышения урожая семян, изменения генеративных признаков или фенотипов в растениях, или и того и другого. Эктопическую экспрессию трансгена Gm.FT2a или другой последовательности FT, или их функционального фрагмента, гомолога или ортолога в цветущем или семяносном растении можно использовать для повышения урожая семян и/или изменения одного или более генеративных фенотипов или признаков, что может означать увеличение числа бобов/семян на растение (и/или числа бобов/семян на узел или главный стебель растения). Как дополнительно объясняется ниже и в зависимости от конкретного вида растения, эти связанные с урожайностью или генеративные фенотипы или признаки также можно применять в отношении других ботанических структур, аналогичных бобам бобовых растений, таких как семенные коробочки, стручки, фрукты, орехи, клубни и т. д. Таким образом, растение с эктопической экспрессией последовательности FT может иметь увеличенное число семенных коробочек, стручков, фруктов, орехов, клубней и т. д. на узел (-лы), главный стебель и/или ветку (-и) растения, и/или увеличенное число семенных коробочек, стручков, фруктов, орехов, клубней и т. д. на растение.
[35] Гены Flowering Locus T (FT) играют ключевую роль в большем росте растений, а их функция состоит в интеграции путей цветения. Было показано, что в разных видах белки FT функционируют как мобильный сигнал или флориген, передаваемый от листьев к верхушкам побегов, где он инициирует генеративное развитие. Смотрите, например, Jaeger, K.E. et al., ʺInterlocking feedback loops govern the dynamic behavior of the floral transition in Arabidopsis,ʺ The Plant Cell, 25:820-833 (2013); Corbesier, L et al., ʺFT protein movement contributes to long distance signaling in floral induction of Arabidopsis,ʺ Science 316: 1030-1033 (2007); Jaeger, KE et al., ʺFT protein acts as a long range signal in Arabidopsis,ʺ Curr Biol 17: 1050-1054 (2007); и Amasino, R.M. et al., ʺThe Timing of Flowering,ʺ Plant Physiology, 154(2):516-520 (2010), полное содержание которых включено в данный документ посредством ссылки. В Arabidopsis белки FT связываются с белками 14-3-3 и Flowering Locus D (FD) в меристеме с образованием комплекса цветения, инициирующего активацию ключевых генов идентичности цветковой меристемы APETATAL1 (AP1) и SOC1 в верхушке побега. Смотрите, например, Taoka, K. et al., ʺ14-3-3 protein act as intracellular receptors for rice Hd3a florigen.ʺ Nature 476:332-335 (2011). Ген TERMINAL FLOWER 1 (TFL1) является ключевым репрессором мишеней FT, который поддерживает центр апикальной меристемы побега (АМП) в вегетативном состоянии. TFL1 действует путем репрессии генов LEAFY (LFY) и AP1. Следовательно, относительные концентрации FT и TFL1 в целевых тканях действуют конкурентным образом, контролируя время генеративного перехода меристем из вегетативного состояния, что может приводить к терминации дальнейшего вегетативного роста. Смотрите, например, Abe, M et al., Science 309:1052-1055 (2005); и McGarry, RC et al., Plant Science 188/189: 71-81 (2012).
[36] Гены FT были идентифицированы во многих разных видах, и сообщалось, что эктопическая экспрессия FT индуцирует раннее цветение. Смотрите, например, Kong, F. et al., ʺTwo Coordinately Regulated Homologs of Flowering Locus T Are Involved in the Control of Photoperiodic Flowering in Soybean,ʺ Plant Physiology 154: 1220-1231 (2010); Turck, F. et al., ʺRegulation and identity of florigen: Flowering Locus T moves center stage,ʺ Ann Rev Plant Biol 59: 573-594 (2008); Blackman, BK et al., ʺThe role of recently derived FT paralogs in sunflower domestication,ʺ Curr Biol 20: 629-635 (2010); Lifschitz, E. et al., ʺThe tomato FT orthologs triggers systemic signals that regulate growth and flowering and substitute for diverse environmental stimuli,ʺ PNAS 103: 6398-6403 (2006); Trankner, C. et al., ʺOver-expression of an FT-homologous gene of apple induces early flowering in annual and perennial plants,ʺ Planta 232: 1309-1324 (2010); и Xiang, L. et al., ʺFunctional analysis of Flowering Locus T orthologs from spring orchid (Cymbidium goeringii Rchb. f.) that regulates the vegetative to reproductive transition,ʺ Plant Cell & Biochem 58: 98-105 (2012), полное содержание которых включено в данный документ посредством ссылки. Однако в предыдущих исследования с экспрессией трансгенов FT использовались конститутивные или тканеспецифические промоторы, которые давали либо очень выраженные фенотипы, неклеточные автономные (системные) фенотипы, либо автономные специфические в отношении листьев фенотипы с более ранним цветением растений или всходом по сравнению с контролем и терминацией на более ранних стадиях развития. Учитывая эти факты, эктопическую экспрессию в целом не рассматривали как жизнеспособный подход к повышению урожайности в растениях за счет индукции появления цветков или изменения времени цветения.
[37] Не ограничиваясь какой-либо теорией, считается, что ранний флоригенный сигнал (например, короткий день для сои и других растений КД) может инициировать ранний переход от вегетативного к генеративному состоянию у растений, но также может приводить к терминации части первичной меристемы. При этом возвращение этих растений в неиндуктивные условия роста (например, длинный день для растений КД) после исходного КД-сигнала может сохранить оставшиеся резервы меристемы растения, что сделает возможным продолжение вегетативного роста растения. Таким образом, во время продленной генеративной фазы может развиваться большее число продуктивных цветков, бобов и/или семян на узел (и/или на растение). При индукции раннего цветения также можно создать большее перекрытие между генеративным развитием и вегетативным ростом растения, что может дополнительно стимулировать большую длительность генеративного периода и/или периода цветения или совпадать с ними. В контексте данного документа выражение «длительность генеративного периода» относится ко времени от инициации цветения до конца развития семени/боба и/или наполнения, тогда как «длительность цветения» или «длительность периода цветения» относится ко времени от появления первого открытого цветка до увядания последнего открытого цветка. Посредством возвращения к неиндуктивным условиям роста после индукции раннего цветения более обширные ресурсы будут доступны и направлены на увеличение числа раньше синхронизированных и продуктивных (т. е. не пустых) цветков, бобов и/или семян на растение, в отличие от нормального цветкового развития в растениях короткого дня, в которых позже может происходить уменьшение растительных ресурсов вследствие терминации меристематического роста и созревания растения.
[38] Однако, как указано выше, сигнал индукции цветения (например, ранние условия короткого дня) также может приводить к ранней терминации растения помимо раннего цветения. Следовательно, было сделано предположение, что могут понадобиться оптимальные доза и время сигнала индукции цветения для максимизации урожайности за счет соблюдения баланса между (i) ранним переходом от вегетативной к генеративной стадии и/или синхронизацией цветения с ранним сигналом индукции цветения (приводящей к потенциальному приросту урожайности в каждом узле растения) и (ii) ранней терминацией роста (приводящей к меньшим растениям с меньшим числом междоузлий, меньшим ветвлением и меньшим числом узлов и/или цветков на растение). Меньших доз сигнала индукции цветения может быть достаточно, чтобы индуцировать цветение, при этом снижая или минимизируя эффект ранней терминации растения, с получением более крупных растений с увеличенным числом цветков, бобов и/или семян на узел (и/или на растение). С другой стороны, более высокие дозы сигнала индукции цветения могут приводить к ранней терминации растения (помимо раннего цветения) с получением меньших растений с относительно небольшим числом цветков, бобов и/или семян на растение вследствие меньшего размера растения с меньшим числом междоузлий и/или веток на растение, несмотря на возможное наличие большего числа цветков, бобов и/или семян на узел (и/или на растение) по сравнению с растениями дикого типа или контрольными растениями в нормальных условиях роста. Как указано выше, эти эффекты эктопической экспрессии FT также могут включать увеличенное число семенных коробочек, стручков, фруктов, орехов, клубней и т. д. на узел (и/или на растение) в зависимости от конкретного вида растения.
[39] Индукционный фенотип «короткого светового дня», упомянутый выше для сои, использовали для скрининга в отношении генов, имеющих измененную экспрессию в этих растениях, посредством профилирования транскрипции, что привело к определению эндогенного гена FT, Gm.FT2a, имеющего повышенную экспрессию в ответ на условия индукции с коротким днем. Соответственно, было сделано предположение, что экспрессию флоригенного трансгена FT, такого как Gm.FT2a, можно использовать в качестве сигнала индукции цветения, чтобы вызвать раннее цветение и увеличить число цветков, бобов и/или семян на узел (и/или на растение) по сравнению с растением дикого типа или контрольным растением, не содержащим трансген FT. В соответствии с вариантами реализации данного изобретения соответствующий контроль времени, локации и дозы экспрессии флоригенного FT во время вегетативных стадий развития можно использовать, чтобы индуцировать цветение и получить растения, имеющие большее число цветков, бобов и/или семян на узел по сравнению с растением дикого типа или контрольным растением, не содержащим трансген FT. Вместо световых условий рИКД FT можно экспрессировать на низком уровне в вегетативной меристеме, чтобы обеспечить сигнал индукции раннего цветения. Соответственно, промотор из гена Erecta (pErecta или pEr), характеризующийся более низкой меристематической экспрессией во время вегетативных стадий развития, был выбран для начального исследования с трансгеном Gm.FT2a. Однако учитывая, что предыдущие исследования показали, что конститутивная экспрессия FT дает растения, имеющие выраженный фенотип с ранней терминацией, и дополнительно, что сайт действия для периферически вырабатываемого и транслоцированного из листьев FT находится в меристеме, существовала возможность, что прямая меристематическая экспрессия FT может давать даже более сильные и выраженные фенотипы (и/или нежизнеспособные растения) по сравнению с конститутивной экспрессией FT.
[40] Эффект сверхэкспрессии Gm.FT2a с промотором pErecta незамедлительно проявлялся в поколении R0 трансформированных растений сои, которые характеризовались ранним цветением, сниженной урожайностью семян (например, только около 8 семян/растение) и очень ранней терминацией, что позволяет предположить, что баланс между индукцией цветения и репрессией цветения/вегетативным ростом был сильно смещен в сторону цветения и ранней гибели. Однако с этих растений было собрано достаточно семян R1, чтобы можно было проводить дополнительные эксперименты. Было сделано предположение, что выращивание семян сои поколения R1 в условиях фотопериода с длинным днем (репрессивный в отношении цветения) в теплице может замедлить развитие фенотипов, связанных с ранними цветением и гибелью, наблюдаемых в растениях R0. С учетом теоретического ответа на дозу было сделано дополнительное предположение, что сегрегацию гомозиготных, гемизиготных и нулевых в отношении FT2a растений сои можно исследовать вместе в теплице, чтобы оценить ответ на дозу в результате сверхэкспрессии FT. В этих экспериментах (дополнительно описанных ниже) наблюдали, что сегрегированные растения имели разные фенотипы: нулевые растения имели сходство с растениями дикого типа в терминах архитектуры растения и числа бобов на узел (и на растение), тогда как гомозиготные растения рано гибли и имели сильно выраженный карликовый фенотип (хотя, возможно, с увеличенным числом бобов на узел). При этом гемизиготные растения были крупнее и больше походили на нулевые растения или растения дикого типа, но демонстрировали фенотип с усиленным цветением с увеличенным числом бобов на узел (и/или на растение). Эти открытия показывают, что экспрессию трансгена FT на вегетативной стадии и/или в меристеме можно использовать для получения высокоурожайного растения (аналогично применению условий рИКД) и что эффект экспрессии FT может быть дозозависимым, так как растения сои, гемизиготные в отношении трансгена FT2a, под управлением слабого меристематического промотора демонстрировали высокоурожайный фенотип с увеличенным числом бобов на узел без более выраженных фенотипов с ранней гибелью и малой высотой растения, наблюдаемых у гомозиготных в отношении FT2a растений при выращивании в условиях длинного дня (вегетативных).
[41] Соответственно экспрессию трансгена FT на вегетативной стадии при соответствующем уровне дозы можно использовать, чтобы индуцировать раннее цветение и получать растения, имеющие увеличенное число цветков, бобов, семенных коробочек, стручков, фруктов, орехов, клубней и/или семян на узел по сравнению с растением дикого типа или контрольным растением, не содержащим трансген FT. Соответствующий уровень дозы FT можно обеспечить с помощью промотора, выбранного для управления экспрессией трансгена FT. Более слабый или низкий уровень экспрессии трансгена FT в вегетативной меристеме можно использовать, чтобы обеспечить сигнал индукции раннего цветения, при этом сохраняя или продлевая длительность генеративного и/или цветкового развития и не приводя к слишком ранней терминации развития растения. Снова, промотор из гена Erecta (pErecta или pEr), характеризующийся более низкой меристематической экспрессией во время вегетативных стадий развития, был выбран для начального исследования с трансгеном Gm.FT2a в растениях сои. Как дополнительно описано ниже, другие промоторы со сходными профилями и уровнями экспрессии в вегетативной меристеме имели сходные эффекты в растениях сои, такие как раннее цветение и/или увеличенное число бобов на узел. Отдельно или в дополнение к выбору промотора для воздействия на уровень экспрессии трансгена можно использовать разные трансгены FT из сои или других видов, которые могут снижать «дозу» раннего сигнала FT, доставляемую в вегетативную меристему, в зависимости от уровня активности трансгенного белка FT в клетке растения. Действительно, исследовали несколько трансгенов FT из сои и других видов растений, и было показано, что они имеют разные эффекты на цветение и другие генеративные признаки при трансгенной экспрессии в растениях сои.
[42] Не ограничиваясь теорией, было сделано дополнительное предположение, что увеличенное число бобов на узел в растениях с трансгеном FT может быть результатом, по меньшей мере частично, увеличения числа меристем соцветий и флоральных меристем, индуцированных из вегетативных апикальных и аксиллярных меристем побегов в каждом из испытавших воздействие узлов, что может привести к появлению большего числа цветков и/или выпущенных цветочных гроздьев в этих узлах. Такое увеличение числа флоральных меристем, индуцированное в каждом узле растения в ответ на сверхэкспрессию FT, может происходить за счет одного или более механизмов или путей, которые могут не зависеть от времени цветения и/или длительности генеративной стадии. Однако меристематические изменения могут поначалу быть микроскопическими и, следовательно, при наблюдении не вызывать «раннее цветение» на такой стадии при простом визуальном осмотре, хотя генеративные изменения в меристеме могут уже начать происходить. Ранняя вегетативная экспрессия FT может приводить к более раннему по сравнению с обычным формированию и развитию генеративных меристем в одном или более узлах трансгенного растения. Затем эти генеративные меристемы могут обеспечивать или обуславливать образование большего числа цветочных кистей с последующим появлением на них цветков в каждом узле. Не ограничиваясь теорией, было сделано дополнительное предположение, что более поздняя экспрессия FT во время генеративных стадий может подавлять развитие цветков в каждом узле. Таким образом, более поздно развивающиеся цветки в рамках соответствующей кисти могут гибнуть и, таким образом, больше растительных ресурсов может быть направлено на более рано развивающиеся цветки и генеративные структуры в рамках кисти для более эффективного образования полноразмерных бобов. Сигнал индукции раннего цветения также может приводить к тому, что большая доля существующего меристематического потенциала будет становиться генеративной и проходить стадию развития цветков. Соответственно, может происходить повышенная синхронизация цветочного развития с образованием большего числа зрелых бобов на узел растения.
[43] Однако, как указано выше, сигнал индукции цветения также приводит к ранней терминации развития растения помимо раннего цветения. Хотя растения сои, экспрессирующие различные трансгены FT с меристематическим промотором вегетативной стадии, таким как промотор pErecta, имеют увеличенное число бобов на узел на главном стебле растения, многие из этих растений все еще демонстрируют сниженную высоту растения и/или сниженное ветвление, что приводит к меньшему числу узлов на растение, главный стебель и/или ветки. Таким образом, хотя уровень экспрессии FT в растении можно регулировать выбором промотора конкретной вегетативной стадии для подавления выходящих за рамки развития типов и повышения урожайности посредством замедления ранней терминации, трансгенные экспрессирующие FT растения сои могут все еще иметь сниженное число цветущих узлов на растение, что может снижать общую урожайность растения, несмотря на повышенное число узлов на существующий узел на главном стебле.
[44] Следовательно, в данном документе сделано предположение, что несмотря на наблюдаемое увеличение числа бобов на узел в растениях сои с экспрессией FT на вегетативной стадии, может быть необходимо дополнительно ослабить, регулировать или ограничить уровень экспрессии трансгена FT для смягчения этих фенотипов ранней терминации и, таким образом, достижения оптимальной урожайности. Если можно сохранить увеличенное число бобов (или других ботанических структур, таких как семенные коробочки, стручки, фрукты, орехи, клубни и т. д.) на узел растения, увеличивая при этом число бобов на растение, например, посредством избегания или замедления терминации, тогда можно будет дополнительно оптимизировать или улучшить общую урожайность растения.
[45] В соответствии с вариантами реализации данного изобретения в данном документе сделано предположение, что урожайность растения можно увеличить или повысить путем ослабления или модификации уровня и/или времени экспрессии трансгена FT посредством супрессии. Как дополнительно описано ниже, количество или пространственно-временной профиль трансгенного FT можно снизить и/или скорректировать посредством природных и/или искусственно созданных молекул РНК, которые нацелены на трансгенный FT для супрессии. Было сделано предположение, что хотя экспрессия трансгенного FT в аксиллярной и апикальной меристеме может инициировать их перенос во флоральную меристему, продолжение экспрессии FT, например, во время генеративных стадий развития, может привести к ранней терминации меристемы и остановке роста и ветвления всего растения. Хотя можно выбрать и использовать промотор вегетативной стадии для экспрессии трансгена FT для ослабления фенотипа ранней терминации и поддержания или продления вегетативного роста и длительности генеративной стадии растения, дополнительная супрессия трансгена FT может дополнительно смягчить фенотип ранней терминации и улучшить или усилить рост, развитие и длительность генеративной стадии растения. Действительно, авторы данного изобретения наблюдали, что супрессия трансгена FT в сое может приводить к более нормальным высоте и ветвлению растения с большим числом узлов на растение по сравнению только с экспрессией трансгенного FT (т. е. без супрессии). Растения сои с комбинированной экспрессией/супрессией трансгена FT будут сохранять большее число бобов на узел с дополнительным смягчением фенотипа ранней терминации, наблюдаемого только при экспрессии трансгенного FT.
[46] Супрессию трансгена FT можно обеспечивать разными путями. В соответствии с первым подходом трансген FT первой экспрессионной кассеты можно подавлять посредством второй экспрессионной кассеты, кодирующей молекулу РНК, нацеленную на трансген FT для супрессии. Молекула РНК может кодироваться последовательностью ДНК пригодной для транскрипции, функционально связанной с промотором пригодным для экспрессии в растениях, при этом последовательность ДНК пригодная для транскрипции содержит нацеливающую последовательность, которая соответствует по меньшей мере части трансгена FT и/или комплементарной с ней последовательности. В соответствии со вторым подходом трансген FT может кодировать целевой сайт для эндогенной молекулы РНК, при этом целевой сайт является комплементарным с эндогенной молекулой РНК так, что эндогенная молекула РНК нацелена на трансген FT для супрессии. Эндогенная молекула РНК может естественным образом существовать в клетке растения, в которой экспрессируется трансген FT. В соответствии с этим подходом для супрессии не нужна вторая экспрессионная кассета. Также оба эти подхода для супрессии можно использовать вместе. Например, трансген FT может находиться в первой экспрессионной кассете и использоваться в комбинации со второй экспрессионной кассетой, содержащей последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая соответствует по меньшей мере части трансгена FT (и/или комплементарную с ней последовательность) (т. е. первый целевой сайт), так что молекула РНК нацелена на трансген FT для супрессии, и при этом трансген FT дополнительно содержит второй целевой сайт для эндогенной молекулы РНК, которая также нацелена на трансген FT для супрессии. Первый и второй целевые сайты могут быть одинаковыми или разными по последовательности и могут находиться в одной или в разных локациях в транскрипте FT. В контексте данного документа первая полинуклеотидная последовательность или молекула «соответствует» второй полинуклеотидной последовательности или молекуле, если первая последовательность или молекула является сходной, идентичной и/или комплементарной со второй последовательностью или молекулой, например, более чем на 30%, более чем на 40%, более чем на 50%, более чем на 60%, более чем на 70%, более чем на 80%, более чем на 90%, более чем на 95% или 100% идентичной и/или комплементарной.
[47] В соответствии с одним аспектом данного изобретения предложены рекомбинантные молекула ДНК, вектор или конструкция, содержащие по меньшей мере две экспрессионные кассеты, включая первую экспрессионную кассету и вторую экспрессионную кассету, при этом первая экспрессионная кассета содержит полинуклеотидную последовательность, кодирующую белок FT (т. е. трансген FT), функционально связанную с первым промотором пригодным для экспрессии в растениях, а вторая экспрессионная кассета содержит последовательность ДНК пригодную для транскрипции, функционально связанную со вторым промотором пригодным для экспрессии в растениях, причем последовательность ДНК пригодная для транскрипции содержит последовательность, которая соответствует по меньшей мере части трансгена FT. Транскрибируемая последовательность ДНК может кодировать молекулу РНК, содержащую нацеливающую последовательность, которая является комплементарной по меньшей мере части пре-мРНК или зрелой мРНК, кодируемой полинуклеотидной последовательностью, кодирующей белок FT (т. е. трансген FT) первой экспрессионной кассеты, так что функция молекулы РНК состоит в подавлении трансгена FT. «Нацеливающая последовательность» молекулы РНК, кодируемой последовательностью ДНК пригодной для транскрипции, может содержать всю или часть молекулы РНК и кодируется последовательностью последовательности ДНК пригодной для транскрипции, которая соответствует по меньшей мере части трансгена FT и/или комплементарной с ней последовательности. Таким образом, последовательность ДНК пригодная для транскрипции может кодировать молекулу РНК, которая содержит нацеливающую последовательность, которая является комплементарной по меньшей мере части мРНК-транскрипта трансгена FT. В зависимости от конкретного трансгена FT и/или нацеливающей последовательности молекулы РНК, кодируемой последовательностью ДНК пригодной для транскрипции, также может происходить супрессия эндогенного гена FT второй экспрессионной кассетой помимо трансгена FT или же может происходить супрессия эндогенного гена FT второй экспрессионной кассетой вместо трансгена FT. Многие генные и белковые последовательности FT могут быть идентичными или сходными с одним или более нативными или эндогенными генами FT в трансформируемом растении и, таким образом, служить в качестве базиса для конструирования молекул РНК и нацеливающих последовательностей для супрессии этих нативных и эндогенных генов. Когда последовательность ДНК пригодная для транскрипции кодирует молекулу РНК, которая нацелена и подавляет трансген FT, эндогенный ген FT или их оба, общий уровень экспрессии и активности геном и трансгенов FT можно регулировать, ограничивать или снижать в одной или более тканях трансгенного растения. В одном аспекте молекула нуклеиновой кислоты, содержащая нацеливающую последовательность, способна гибридизироваться с комплементарной последовательностью нуклеиновой кислоты (например, целевым сайтом) с образованием двухцепочечной нуклеиновой кислоты (например, дцРНК). В одном аспекте гибридизация нацеливающей последовательности первой молекулы нуклеиновой кислоты (например, супрессорной молекулы РНК) с последовательностью целевого сайта второй молекулы нуклеиновой кислоты (например, мРНК-транскрипта трансгена FT) может приводить к супрессии второй молекулы нуклеиновой кислоты. Например, если полинуклеотидная последовательность трансгена FT является нативной для растения, в котором она экспрессируется (или близкородственной), то молекула РНК может быть дополнительно нацелена на соответствующий нативный ген FT для супрессии, в особенности если молекула РНК нацелена на кодирующую последовательность (экзон) трансгена FT. В таких случаях комбинированная супрессия нативных и трансгенных генов FT посредством молекулы РНК, кодируемой последовательностью ДНК пригодной для транскрипции, может дополнительно снижать дозу белка FT в соответствующих тканях растения. Однако даже при трансгенной экспрессии нативного гена FT не кодирующие белок последовательности, такие как 5' НТО, 3' НТО, лидерные и/или интронные последовательности можно варьировать, не влияя на последовательность кодируемого белка FT. В контексте данного документа «кодирующая полинуклеотидная последовательность» или «полинуклеотидная последовательность» трансгена могут содержать не только кодирующие белок (или экзонные) последовательности, но также другие пригодные для транскрипции последовательности, связанные с кодирующей последовательностью трансгена, которые могут образовывать часть кодируемой последовательность пре-мРНК или зрелой мРНК, такие как 5' НТО, 3' НТО, лидерные и/или интронные последовательности. Таким образом, в контексте данного документа выражения «кодирующая полинуклеотидная последовательность» трансгена FT и «полинуклеотидная последовательность», кодирующая белок FT, можно употреблять взаимозаменяемо.
[48] В соответствии с вариантами реализации данного изобретения первая экспрессионная кассета и вторая экспрессионная кассета могут находиться в одной рекомбинантной молекуле ДНК, векторе или конструкции или же первая экспрессионная кассета и вторая экспрессионная кассета могут находиться в отдельных рекомбинантных молекулах ДНК, векторах или конструкциях. Таким образом, в соответствии с некоторыми вариантами реализации изобретения могут быть предоставлены две рекомбинантные молекулы ДНК, два вектора или две конструкции, содержащие первую рекомбинантную молекулу ДНК, вектор или конструкцию и вторую рекомбинантную молекулу ДНК, вектор или конструкцию, при этом первые рекомбинантные молекула ДНК, вектор или конструкция содержат первую экспрессионную кассету, содержащую полинуклеотидную последовательность, кодирующую белок FT (т. е. трансген FT), функционально связанную с первым промотором пригодным для экспрессии в растениях, а вторые рекомбинантные молекула ДНК, вектор или конструкция содержат вторую экспрессионную кассету, содержащую последовательность ДНК пригодную для транскрипции, функционально связанную со вторым промотором пригодным для экспрессии в растениях, причем последовательность ДНК пригодная для транскрипции соответствует по меньшей мере части трансгена FT и/или комплементарной с ней последовательности. Транскрибируемая последовательность ДНК может кодировать молекулу РНК, содержащую нацеливающую последовательность, которая является комплементарной по меньшей мере части пре-мРНК или зрелой мРНК, кодируемой трансгеном FT первой экспрессионной кассеты, так что функция молекулы РНК состоит в подавлении трансгена FT.
[49] Предложенные в данном документе рекомбинантные молекулу ДНК, вектор или конструкцию, содержащие трансген FT, можно использовать при трансформации растения для создания трансгенного растения, содержащего трансген FT. В соответствии с некоторыми вариантами реализации изобретения трансген FT может находиться в первой экспрессионной кассете и использоваться в комбинации со второй экспрессионной кассетой, содержащей последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая соответствует по меньшей мере части трансгена FT и/или комплементарной с ней последовательности, при этом первую и вторую экспрессионные кассеты трансформируют в растение в виде одного или отдельных событий трансформации. В соответствии с некоторыми вариантами реализации изобретения трансген FT, трансформированный в растение, может содержать целевой сайт для эндогенной молекулы РНК, которая может быть нацелена на трансген FT и инициировать его супрессию.
[50] Кодирующая полинуклеотидная последовательность трансгена FT может включать Gm.FT2a (SEQ ID NO: 1) или любую полинуклеотидную последовательность, кодирующую белок Gm.FT2a (SEQ ID NO: 2). Кодирующая полинуклеотидная последовательность трансгена FT также может соответствовать другим генам FT в сое или других растениях. Например, другие кодирующие полинуклеотидные последовательности из сои, которые можно использовать в качестве трансгена FT в соответствии с представленными вариантами реализации изобретения, включают: Gm.FT5a (SEQ ID NO: 3) или полинуклеотидную последовательность, кодирующую белок Gm.FT5a (SEQ ID NO: 4), или Gm.FT2b (SEQ ID NO: 5) или полинуклеотидную последовательность, кодирующую белок Gm.FT2b (SEQ ID NO: 6). Кроме того, примеры кодирующих полинуклеотидных последовательностей из других видов растений, которые можно использовать, включают: Zm.ZCN8 (SEQ ID NO: 7) из кукурузы или полинуклеотидную последовательность, кодирующую белок Zm.ZCN8 (SEQ ID NO: 8), Nt.FT-подобный или Nt.FT4 (SEQ ID NO: 9) из табака или полинуклеотидную последовательность, кодирующую Nt.FT-подобный белок или белок Nt.FT4 (SEQ ID NO: 10), Le.FT или SFT (SEQ ID NO: 11) из томата или полинуклеотидную последовательность, кодирующую белок Le.FT или SFT (SEQ ID NO: 12), At.FT (SEQ ID NO: 13) из Arabidopsis или полинуклеотидную последовательность, кодирующую белок At.FT (SEQ ID NO: 14), At.TSF (SEQ ID NO: 15) из Arabidopsis или полинуклеотидную последовательность, кодирующую белок At.TSF (SEQ ID NO: 16), Os.HD3a (SEQ ID NO: 17) из риса или полинуклеотидную последовательность, кодирующую белок Os.HD3a (SEQ ID NO: 18), или Pt.FT (SEQ ID NO: 19) из Populus trichocarpa или полинуклеотидную последовательность, кодирующую белок Pt.FT (SEQ ID NO: 20). Дополнительные примеры кодирующих полинуклеотидных последовательностей для трансгенов и белков FT, которые также можно использовать, включают следующие: Gm.FT5b (SEQ ID NO: 21) из сои или любую полинуклеотидную последовательность, кодирующую белок Gm.FT5b (SEQ ID NO: 22); Gh.FT1 (SEQ ID NO: 23) из хлопка или любую полинуклеотидную последовательность, кодирующую белок Gh.FT1 (SEQ ID NO: 24); Bn.FTA2a (SEQ ID NO: 25) из канолы или любую полинуклеотидную последовательность, кодирующую белок Bn.FTA2a (SEQ ID NO: 26); Ta.FT3B1 (SEQ ID NO: 27) из пшеницы или любую полинуклеотидную последовательность, кодирующую белок Ta.FT3B1 (SEQ ID NO: 28); или Ps.FTa1 (SEQ ID NO: 29) из гороха или любую полинуклеотидную последовательность, кодирующую белок Ps.FTa1 (SEQ ID NO: 30). Кодирующие полинуклеотидные последовательности для трансгенов FT, кодирующие дополнительные белки FT из других видов, имеющие известные аминокислотные последовательности, также можно использовать в соответствии с вариантами реализации данного изобретения, которые могут, например, включать следующие: Md.FT1 и Md.FT2 из яблони (Malus domestica); Hv.FT2 и Hv.FT3 из ячменя (Hordeum vulgare); Cs.FTL3 из хризантемы; Ls.FT из латука (Lactuca sativa); Pn.FT1 и Pn.FT2 из пирамидального тополя (Populus nigra); Pa.FT из кленолистного платана (Platanus acerifolia); Dl.FT1 из лонгана (Dimocarpus longan); Ps.FTa1, Ps.FTa2, Ps.FTb1, Ps.FTb2 и Ps.FTc из гороха (Pisum sativum); Ac.FT из ананаса (Ananas comosus); Cm-FTL1 и Cm-FTL2 из тыквы (Cucurbita maxima); Ro.FT из розы; Cg.FT из весенней орхидеи (Cymbidium); Fv.FT1 из земляники (Fragaria vesca); Bv.FT2 из сахарной свеклы (Beta Vulgaris); Ha.FT4 из подсолнечника (Helianthus annuus); и Ta.FT или TaFT1 из пшеницы (Triticum aestivum), и последовательности, которые являются по меньшей мере на 60% идентичными, по меньшей мере на 65% идентичными, по меньшей мере на 70% идентичными, по меньшей мере на 75% идентичными, по меньшей мере на 80% идентичными, по меньшей мере на 85% идентичными или по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичными с одной или более такими известными полинуклеотидными и/или белковыми последовательностями. Смотрите, например, Wickland, DP et al., ʺThe Flowering Locus T/Terminal Flower 1 Gene Family: Functional Evolution and Molecular Mechanismsʺ, Molecular Plant 8: 983-997 (2015), содержание которой включено в данный документ посредством ссылки.
[51] Если не указано иное, описанные в данном документе последовательности нуклеиновых кислот или полинуклеотидные последовательности приведены (слева направо) в направлении от 5' к 3', а аминокислотные или белковые последовательности приведены (слева направо) в направлении от N-конца к C-концу. В соответствии с вариантами реализации данного изобретения также можно использовать дополнительные известные или обнаруженные позже гены и белки FT из этих или других видов. Эти гены FT могут быть известны или восстановлены по их нуклеотидным и/или белковым последовательностям, которые могут быть определены путем визуального осмотра или с помощью компьютерных инструментов поиска и идентификации или компьютерного программного обеспечения (и баз данных) на основе алгоритма сравнения с известными последовательностями, структурными доменами FT и т. д. и в соответствии с любым известным методом выравнивания последовательностей, таким как BLAST, FASTA и т. д.
[52] В соответствии с вариантами реализации данного изобретения трансген FT рекомбинантных молекулы ДНК, вектора или конструкции может содержать полинуклеотидную последовательность, которая при оптимальном выравнивании) является по меньшей мере на 60% идентичной, по меньшей мере на 65% идентичной, по меньшей мере на 70% идентичной, по меньшей мере на 75% идентичной, по меньшей мере на 80% идентичной, по меньшей мере на 85% идентичной или по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичной одной или более кодирующим полинуклеотидным последовательностям FT, перечисленным выше (например, SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27 или 29), или любой другой известной кодирующей последовательности флоригенного FT. Процент идентичности последовательностей среди полинуклеотидных последовательностей вышеперечисленных кодирующих последовательностей генов FT приведен на Фиг. 1A. В каждой ячейке в таблице на Фиг. 1A приведен процент идентичности для гена FT в соответствующем ряду (запрашиваемая последовательность) по сравнению с геном FT в соответствующей колонке (рассматриваемая последовательность), деленный на общую длину запрашиваемой последовательности, а число в скобках представляет общее число идентичных оснований между запрашиваемой и рассматриваемой последовательностями. Как проиллюстрировано на этой фигуре, процент идентичности среди полинуклеотидных последовательностей для этих образцов генов FT находится в диапазоне от около 60% до около 90% идентичности. Таким образом, полинуклеотидную последовательность, которая попадает в один или более из этих диапазонов идентичности последовательностей или имеет более высокую идентичность последовательности, можно использовать в соответствии с вариантами реализации данного изобретения для индукции цветения, повышения урожая и/или изменения одного или более генеративных признаков растения. Сходные кодирующие полинуклеотидные последовательности для FT можно конструировать или выбирать на основании известных белковых последовательностей FT, консервативных аминокислотных остатков и доменов, вырожденности генетического кода и любого известного варианта оптимизации кодонов для конкретного вида растений, подлежащего трансформации.
[53] В соответствии с вариантами реализации данного изобретения трансген FT может содержать полинуклеотидную последовательность, кодирующую аминокислотную или белковую последовательность, которая (при оптимальном выравнивании) является по меньшей мере на 60% идентичной, по меньшей мере на 65% идентичной, по меньшей мере на 70% идентичной, по меньшей мере на 75% идентичной, по меньшей мере на 80% идентичной, по меньшей мере на 85% идентичной или по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичной одной или более кодирующим белковым или аминокислотным последовательностям FT, перечисленным выше (например, SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 или 30), или любой другой известной белковой последовательности флоригенного FT или ее функциональному фрагменту. Такой «функциональный фрагмент» определяется как белок, имеющий полипептидную последовательность, идентичную или очень сходную с полноразмерным белком FT, но в которой отсутствуют один или более аминокислотных остатков, частей, белковых доменов и т. д. полноразмерного белка FT, при условии, что фрагмент остается активным в отношении того, что он приводит к одному или более фенотипическим эффектам или изменениям аналогично полноразмерному белку, при трансгенной экспрессии в растении. Процент идентичности последовательностей среди вышеперечисленных полноразмерных белков FT приведен на Фиг. 1B. Процент рассчитан, как описано выше со ссылкой на Фиг. 1A на основании числа идентичных аминокислотных остатков (в скобках) между запрашиваемой и рассматриваемой белковыми последовательностями FT. Множественное выравнивание этих белков FT также проиллюстрировано на Фиг. 1C. Как видно по этим фигурам, процент идентичности среди белковых последовательностей для этих генов FT находится в диапазоне от около 60% до около 90% идентичности. Таким образом, полинуклеотидную последовательность, кодирующую аминокислотную или белковую последовательность, которая попадает в один или более из этих диапазонов идентичности последовательностей или имеет более высокую идентичность последовательности, можно использовать в соответствии с вариантами реализации данного изобретения для индукции цветения, повышения урожайности и/или изменения одного или более генеративных признаков растения. Эти белковые последовательности FT, кодируемые полинуклеотидной последовательностью согласно данному изобретению, можно конструировать или выбирать на основании известных белковых последовательностей FT и их консервативных аминокислотных остатков и доменов.
[54] Как описано ниже, трансген FT, содержащий одну из вышеприведенных кодирующих последовательностей, может дополнительно содержать один или более экспрессионных и/или регуляторных элементов, таких как энхансер (-ы), промотор (-ы), лидерная (-ые) последовательность (-ти), интрон (-ы) и т. д., и трансген FT может содержать геномную последовательность, кодирующую белок FT или аминокислотную последовательность, или их фрагмент или часть.
[55] В контексте данного документа «идентичность последовательности» или «процент идентичности» относится к степени, в которой две оптимально выровненные последовательности ДНК или белка являются идентичными. В данной области техники известны различные алгоритмы и программы для попарного или множественного выравнивания последовательностей, такие как ClustalW и т. д., которые можно использовать для сравнения идентичности или сходства последовательностей между двумя или более последовательностями, например, между двумя или более генами или белковыми последовательностями FT, или между генной (нуклеотидной) или белковой последовательностью FT и другой нуклеотидной или белковой последовательностью. Например, процент идентичности одной последовательности (запрашиваемой) с другой последовательностью (рассматриваемой) можно рассчитать, как описано выше со ссылкой на Фиг. 1A и 1B (т. е. при оптимальном выравнивании последовательностей разделить число идентичных оснований или остатков на общее число оснований или остатков для запрашиваемой последовательности и умножить на 100%). Хотя в данной области техники известны другие методы выравнивания и сравнения, выравнивание и процент идентичности между двумя последовательностями (включая процент идентичности в вышеописанном диапазоне) могут быть определены с помощью алгоритма ClustalW, смотрите, например, Chenna R. et al., ʺMultiple sequence alignment with the Clustal series of programs,ʺ Nucleic Acids Research 31: 3497-3500 (2003); Thompson JD et al., ʺClustal W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice,ʺ Nucleic Acids Research 22: 4673-4680 (1994); and Larkin MA et al., ʺClustal W and Clustal X version 2.0,ʺ Bioinformatics 23: 2947-48 (2007), полное содержание которых включено в данный документ посредством ссылки. В целях данного изобретения при оптимальном выравнивании двух последовательностей (с допуском гэпов в выравнивании) «процент идентичности» для запрашиваемой последовательности рассчитывают, как описано выше со ссылкой на Фиг. 1A и 1B - т. е. процент идентичности=(число идентичных позиций между запрашиваемой и рассматриваемой последовательностями/общее число позиций в запрашиваемой последовательности) x 100%, где каждая последовательность состоит из ряда позиций (нуклеотидных оснований или аминокислотных остатков). Две оптимально выровненные последовательности также можно описать как имеющие определенный процент идентичности. Необязательно, процент идентичности может быть описан со ссылкой на определенное окно сравнения (например, окно выравнивания) между двумя последовательностями, в случае чего число идентичных позиций в окне сравнения делят на длину в нуклеотидах окна сравнения и умножают на 100%. Окно выравнивания может быть определено как область идентичности, сходства или перекрытия между двумя последовательностями.
[56] Рекомбинантные полинуклеотидная или белковая молекула, или конструкция, или вектор могут быть выделенными. В контексте данного документа термин «выделенный» относится к по меньшей мере частичному отделению молекулы от других молекул, обычно связанных с ней в ее естественном состоянии. В одном варианте реализации изобретения термин «выделенный» относится к молекуле ДНК, которая отделена от нуклеиновых кислот, которые обычно фланкируют молекулу ДНК в ее естественном состоянии. Например, молекула ДНК, кодирующая белок, которая в естественном состоянии присутствует в бактерии, считается выделенной молекулой ДНК, если она не находится в ДНК бактерии, в которой в естественном состоянии можно обнаружить молекулу ДНК, кодирующую белок. Таким образом, молекула ДНК, слитая или функционально связанная с одной или более молекулами ДНК, к которыми бы она не была связана в естественном состоянии, например, в результате применения технологий рекомбинантных ДНК или трансформации растений, считается в данном документе выделенной. Такие молекулы считаются выделенными, даже когда они интегрированы в хромосому клетки-хозяина или находятся в растворе нуклеиновых кислот с другими молекулами ДНК.
[57] Белковая последовательность FT, кодируемая полинуклеотидной последовательностью, или трансген согласно данному изобретению также могут быть сконструированы или выбраны так, чтобы содержать одну или более аминокислотных замен, являющихся химически и/или структурно консервативными (например, замещение одной аминокислоты другой, имеющей сходные химические или физические свойства, такие как гидрофобность, полярность, заряд, стерический эффект, кислая/основная химия, сходные группы боковых цепей, такие как гидроксильные, сульфгидрильные, амино и т. д.), для того, чтобы избежать или минимизировать структурные изменения в белке, которые могут повлиять на его функцию. Например, валин часто является консервативной заменой аланину, а треонин может быть консервативной заменой серину. Дополнительные примеры консервативных аминокислотных замен в белках включают: валин/лейцин, валин/изолейцин, фенилаланин/тирозин, лизин/аргинин, аспарагиновая кислота/глутаминовая кислота и аспарагин/глутамин. Белковая последовательность FT, кодируемая полинуклеотидной последовательностью, или трансген согласно данному изобретению также могут включать белки, которые отличаются одной или более аминокислотами от известной белковой последовательности FT или сходной последовательности в результате наличия делеции (-ий) и/или вставки (-ок), включающих одну или более аминокислот.
[58] Можно идентифицировать различные гены и белки FT от разных видов растений и рассматривать их как гомологи или ортологи FT для применения в данном изобретении, если они имеют сходную последовательность нуклеиновой кислоты и/или белковую последовательность и содержат консервативные аминокислоты и/или структурные домены с по меньшей мере одним известным геном или белком FT. В контексте данного документа подразумевается, что термин «гомолог» в отношении гена или белка FT включает любые гомологи, аналоги, ортологи, паралоги и т. д. гена или белка FT, а термин «гомологичный» в отношении полинуклеотидных или белковых последовательностей означает сходные или идентичные последовательности, включая синтетические, искусственные или сконструированные полинуклеотидные или белковые последовательности. Такой гомолог FT также может быть определен как имеющий такую же или сходную биологическую функцию, что и известные гены FT (например, с аналогичным действием на цветение и/или другие генеративные или связанные с урожайностью признаки или фенотипы при эктопической экспрессии в растении).
[59] Анализ последовательностей и выравнивание белковых последовательностей FT из разных видов растений позволил дополнительно выявить некоторое число консервативных аминокислотных остатков и по меньшей мере один консервативный структурный домен. При применении к различным выровненным белковым последовательностям FT (смотрите, например, Фиг. 1B и 1C) инструмента для определения белковых доменов с использованием базы данных Pfam (например, версии Pfam 26.0, выпущенной в ноябре 2011 г., или более поздних версий), было обнаружено, что эти белки FT содержат по меньшей мере часть предполагаемого фосфатидилэтаноламин-связывающего белкового (PEBP) домена (название домена по Pfam: PBP_N; номер доступа: PF01161). Смотрите, например, Banfield, MJ et al., ʺThe structure of Antirrhinum centroradialis protein (CEN) suggests a role as a kinase inhibitor,ʺ Journal of Mol Biol., 297(5): 1159-1170 (2000), полное содержание которой включено в данный документ посредством ссылки. Было обнаружено, что этот домен PEBP соответствует, например, аминокислотам 28-162 полноразмерного белка Gm.FT2a (смотрите таблицу 5, ниже). Таким образом, белки FT, включенные в варианты реализации данного изобретения, могут включать идентифицированные или охарактеризованные как имеющие или содержащие по меньшей мере домен PEBP (номер доступа: PF01161) в соответствии с анализом Pfam. Соответственно, данное изобретение может дополнительно включать полинуклеотидные последовательности, кодирующие белок FT, содержащий по меньшей мере домен PEBP. Как известно в данной области техники, база данных «Pfam» является крупной коллекцией множественных выравниваний последовательностей и скрытых моделей Маркова, покрывающих многие распространенные белковые семейства, и содержит информацию о различных белковых семействах и их доменных структурах. Посредством определения предполагаемых структурных доменов Pfam для заданной белковой последовательности можно выяснить или определить классификацию и функцию белка. Смотрите, например, Finn, RD et al., ʺThe Pfam protein families database,ʺ Nucleic Acids Research (Database Issue), 42:D222-D230 (2014), полное содержание которой включено в данный документ посредством ссылки.
[60] Варианты реализации данного изобретения могут дополнительно включать полинуклеотидные последовательности, кодирующие индуктивные или флоригенные белки FT. Белок FT, кодируемый полинуклеотидной последовательностью, может быть «индуктивным» или «флоригенным», если белок FT при эктопической экспрессии в растении способен приводить к более раннему цветению и/или повышению плодоносности в контексте числа цветков, бобов, семенных коробочек, стручков, фруктов, орехов, клубней и/или семян на один или более узлов растения. Не ограничиваясь теорией, было сделано дополнительное предположение, что такое повышение плодоносности в контексте числа цветков, бобов, семенных коробочек, стручков, фруктов, орехов, клубней и/или семян на один или более узлов растения может быть результатом увеличения числа меристем в этих узлах, которые переходят от вегетативной к генеративной стадии и дают цветки. Такая повышенная плодоносность в каждом узле вследствие эктопической экспрессии «флоригенного» FT может быть связана с повышением синхронизации выпускания и флорального развития ранних кистей и латеральных меристем в каждом узле. Хотя функция «флоригенного» белка FT может состоять в индукции раннего цветения при эктопической экспрессии в растении, трансгенно экспрессируемый «флоригенный» белок FT может увеличивать число цветков, бобов, семенных коробочек, стручков, фруктов, орехов, клубней и/или семян на узел (узлы) растения за счет одного или более путей или механизмов, независимо или в дополнение к любым флоригенным эффектам, связанным со временем цветения и/или длительностью генеративной стадии.
[61] Флоригенные FT-подобные гены из различных видов растений в общем случае отличаются высокой степенью консервативности. Однако многие белки в семействе PEBP имеют аминокислотные последовательности, которые являются по существу сходными с флоригенными белками FT, но не проявляют себя как флоригены. Например, гены Terminal Flower (TFL) из различных видов растений имеют сходные белковые последовательности с флоригенными генами FT, но в действительности замедляют цветение. В недавней работе были определены конкретные аминокислотные остатки, которые в общем случае не являются общими для флоригенных белков FT и других белков PEBP, таких как TFL, и было показано, что замены во многих из этих позиций преобразуют флоригенные белки FT в белки-репрессоры цветения. Смотрите, например, Ho and Weigel, Plant Cell 26: 552-564 (2014); Danilevskaya et al., Plant Physiology 146(1): 250-264 (2008); Harig et al., Plant Journal 72: 908-921 (2012); Hsu et al., Plant Cell 18: 1846-1861 (2006); Kojima et al., Plant Cell Physiology 43(10): 1096-1105 (2002); Kong et al., Plant Physiology 154: 1220-1231 (2010); Molinero-Rosales et al., Planta 218: 427-434 (2004); Zhai et al., PLoS ONE, 9(2): e89030 (2014), и Wickland DP et al. (2015), выше, полное содержание которых включено в данный документ посредством ссылки. Таким образом, аминокислотные остатки могут служить показателями для дополнительного определения и установления различий флоригенных белков FT согласно данному изобретению.
[62] В соответствии с вариантами реализации данного изобретения «индуктивный» или «флоригенный» белок FT может быть дополнительно определен или охарактеризован как содержащий один или более из следующих аминокислотных остатков (аминокислотные позиции относятся к соответствующим или оптимально выровненным позициям полноразмерного белка FT из Arabidopsis, SEQ ID NO: 14): пролин в аминокислотной позиции 21 (P21); аргинин или лизин в аминокислотной позиции 44 (R44 или K44); глицин в аминокислотной позиции 57 (G57); глутаминовая кислота или аспарагиновая кислота в аминокислотной позиции 59 (E59 или D59); тирозин в аминокислотной позиции 85 (Y85); лейцин в аминокислотной позиции 128 (L128); глицин в аминокислотной позиции 129 (G129); треонин в аминокислотной позиции 132 (T132); аланин в аминокислотной позиции 135 (A135); триптофан в аминокислотной позиции 138 (W138); глутаминовая кислота или аспарагиновая кислота в аминокислотной позиции 146 (E146 или D146); и/или цистеин в аминокислотной позиции 164 (C164). Соответствующие аминокислотные позиции других белков FT можно определить посредством выравнивания с последовательностью FT Arabidopsis (смотрите, например, Фиг. 1C). Специалист в данной области техники сможет определить соответствующие аминокислотные позиции других белков FT на основании выравнивания последовательностей. Несколько из этих ключевых остатков находятся в пределах внешнего петлевого домена FT-подобных белков, определяемого аминокислотами 128-145 полноразмерной последовательности FT Arabidopsis (SEQ ID NO: 14) и соответствующих последовательностей других белков FT (смотрите, например, Фиг. 1C). Таким образом, полинуклеотиды согласно данному изобретению могут кодировать флоригенные белки FT, имеющие один или более из этих консервативных аминокислотных остатков.
[63] Флоригенные белки FT согласно данному изобретению также могут содержать одну или более других аминокислот в одной или более из определенных выше позиций остатков. Например, в случае вышеприведенных аминокислотных позиций последовательности белка FT Arabidopsis (At.FT) (SEQ ID NO: 14), флоригенный белок FT может, в альтернативном варианте, содержать одну или более из следующих аминокислот:: аланин (вместо пролина) в позиции, соответствующей позиции 21 последовательности белка At.FT (P21A), или, возможно, другие небольшие неполярные остатки, такие как глицин или валин, в этой позиции; гистидин (вместо лизина или аргинина) в аминокислотной позиции, соответствующей позиции 44 последовательности белка At.FT, или, возможно, другие полярные аминокислоты в этой позиции; аланин или цистеин (вместо глицина) в аминокислотной позиции, соответствующей позиции 57 последовательности белка At.FT, или, возможно, другие небольшие неполярные остатки, такие как пролин или валин, в этой позиции; аспарагин или серин (вместо глутаминовой кислоты или аспарагиновой кислоты) в аминокислотной позиции, соответствующей позиции 59 последовательности белка At.FT, или, возможно, другие небольшие полярные остатки, такие как глутамин, цистеин или треонин, в этой позиции; разные полярные и неполярные незаряженные остатки (отличные от лейцина) в аминокислотной позиции, соответствующей позиции 85 последовательности белка At.FT; неполярный или гидрофобный незаряженный остаток (отличный от лейцина), такой как изолейцин, валин или метионин, в аминокислотной позиции, соответствующей позиции 128 последовательности белка At.FT; разные меньшие неполярные и незаряженные остатки (отличные от глицина), такие как аланин, валин, лейцин, изолейцин, метионин и т. д., в аминокислотной позиции, соответствующей позиции 129 последовательности белка At.FT, хотя в этой позиции могут допускаться некоторые заряженные и полярные остатки; полярный незаряженный остаток (отличный от треонина) в аминокислотной позиции, соответствующей позиции 132 последовательности белка At.FT; разные аминокислоты, отличные от пролина, такие как треонин, в аминокислотной позиции, соответствующей позиции 135 последовательности белка At.FT; разные другие объемные неполярные или гидрофобные аминокислоты (вместо триптофана), такие как метионин или фенилаланин, в аминокислотной позиции, соответствующей позиции 138 последовательности белка At.FT; разные другие полярные или неположительно заряженные аминокислоты, такие как аспарагин или серин, в аминокислотной позиции, соответствующей позиции 146 последовательности белка At.FT; и/или разные другие полярные или неполярные аминокислоты (вместо цистеина), такие как изолейцин, в аминокислотной позиции, соответствующей позиции 164 последовательности белка At.FT. Специалист в данной области техники сможет определить соответствующие аминокислотные позиции и замены белков FT на основании выравнивания их последовательностей с последовательностью белка FT Arabidopsis. Кроме того, также предусматривается, что в объем флоригенных белков FT могут попадать другие химически консервативные аминокислотные замены, допустимые с точки зрения специалиста в области биохимии белков. Соответственно, полинуклеотиды согласно данному изобретению могут дополнительно кодировать флоригенные белки FT, имеющие одну или более консервативных аминокислотных замен. Действительно, флоригенные белки FT, кодируемые полинуклеотидами согласно данному изобретению, включают нативные последовательности и искусственные последовательности, содержащие одну или более консервативных аминокислотных замен, а также их функциональные фрагменты.
[64] Флоригенные белки FT согласно данному изобретению также могут быть определены как исключающие (т. е. не содержащие) одну или более аминокислотных замен, которые могут быть характерными для TFL или других нефлоригенных или антифлоригенных белков или быть связанными с ними. Например, в случае аминокислотных позиций последовательности белка FT Arabidopsis (SEQ ID NO: 14), во флоригенном белке FT могут быть исключены одна или более из следующих аминокислот (т. е. в соответствующих или оптимально выровненных позициях флоригенного белка FT): фенилаланин или серин в позиции, соответствующей позиции 21 последовательности белка At.FT (например, вместо пролина или аланина); фенилаланин в позиции, соответствующей позиции 44 последовательности белка At.FT (например, вместо аргинина или лизина); гистидин, глутаминовая кислота или аспарагиновая кислота в позиции, соответствующей позиции 57 последовательности белка At.FT (например, вместо глицина); глицин или аланин в позиции, соответствующей позиции 59 последовательности белка At.FT (например, вместо глутаминовой кислоты или аспарагиновой кислоты); гистидин в позиции, соответствующей позиции 85 последовательности белка At.FT (например, вместо тирозина); лизин, аргинин, аланин или метионин в позиции, соответствующей позиции 109 последовательности белка At.FT; лизин или аргинин в позиции, соответствующей позиции 128 последовательности белка At.FT (например, вместо лейцина); глутамин или аспарагин в позиции, соответствующей позиции 129 последовательности белка At.FT (например, вместо глицина); валин или цистеин в позиции, соответствующей позиции 132 последовательности белка At.FT (например, вместо треонина); лизин, аргинин или аланин в позиции, соответствующей позиции 134 последовательности белка At.FT (например, вместо тирозина); пролин в позиции, соответствующей позиции 135 последовательности белка At.FT (например, вместо аланина или треонина); серин, аспарагиновая кислота, глутаминовая кислота, аланин, лизин или аргинин в позиции, соответствующей позиции 138 последовательности белка At.FT (например, вместо триптофана или метионина); лизин или аргинин в позиции, соответствующей позиции 140 последовательности белка At.FT; лизин или аргинин в позиции, соответствующей позиции 146 последовательности белка At.FT (например, вместо кислых или незаряженных полярных остатков); лизин или аргинин в позиции, соответствующей позиции 152 последовательности белка At.FT; и/или аланин в позиции, соответствующей позиции 164 последовательности белка At.FT (например, вместо цистеина или изолейцина). Специалист в данной области техники сможет определить соответствующие аминокислотные позиции и замены других белков FT на основании выравнивания их последовательностей. Соответственно, варианты реализации данного изобретения могут исключать полинуклеотиды, которые кодируют FT-подобные белки, имеющие одну или более вышеуказанных аминокислотных замен, связанных с TFL или другими антифлоригенами. Однако в белке FT могут допускаться одна или несколько таких аминокислотных замен, если он сохраняет при этом флоригенную активность.
[65] Флоригенный белок FT согласно данному изобретению также может быть определен как сходный с известным белком FT в дополнение к тому, что он имеет один или более из вышеуказанных характерных или консервативных аминокислотных остатков. Например, флоригенный белок может быть определен как имеющий по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или ее функциональным фрагментом, в дополнение к одному или более из следующих характерных остатков: тирозин или другой незаряженный полярный или неполярный остаток (например, аланин, триптофан, метионин, лейцин, треонин, цистеин, серин или аспарагин) в аминокислотной позиции, соответствующей позиции 85 последовательности белка At.FT; лейцин или другой неполярный или гидрофобный остаток (например, изолейцин, валин или метионин) в аминокислотной позиции, соответствующей позиции 128 последовательности белка At.FT; и/или триптофан или другой крупный неполярный или гидрофобный остаток (например, метионин или фенилаланин) в аминокислотной позиции, соответствующей позиции 138 последовательности белка At.FT. Такой флоригенный белок FT может быть дополнительно определен как имеющий дополнительные характерные аминокислотные остатки, такие как один или более из следующих: глицин или другой небольшой неполярный и незаряженный остаток (например, аланин, валин, лейцин, изолейцин или метионин) в аминокислотной позиции, соответствующей позиции 129 последовательности белка At.FT; и/или треонин в аминокислотной позиции, соответствующей позиции 132 последовательности белка At.FT.
[66] Флоригенный белок FT согласно данному изобретению также может быть определен как имеющий по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или ее функциональным фрагментом, но не имеющий (т. е. исключающий) один или более нефлоригенных или антифлоригенных остатков, таких как один или более из следующих: гистидин в аминокислотной позиции, соответствующей позиции 85 последовательности белка At.FT; лизин или аргинин в аминокислотной позиции, соответствующей позиции 128 последовательности белка At.FT; и/или серин, аспарагиновая кислота, глутаминовая кислота, лизин или аргинин в аминокислотной позиции, соответствующей позиции 138 последовательности белка At.FT. Такой флоригенный белок FT может быть дополнительно определен как не имеющий (т. е. исключающий) один или более дополнительных остатков, таких как один или более из следующих: глутамин или аспарагин в аминокислотной позиции, соответствующей позиции 129 последовательности белка At.FT; и/или валин или цистеин в аминокислотной позиции, соответствующей позиции 132 последовательности белка At.FT.
[67] В соответствии с вариантами реализации данного изобретения предложены рекомбинантные молекула ДНК, вектор или конструкция, содержащие полинуклеотидную последовательность, кодирующую белок FT, которая функционально связана с одним или более промоторами и/или другими регуляторными элементами, чьей функцией в клетке растения является регуляция или смещение времени и/или локации экспрессии FT, при трансформации в растение. В соответствии с некоторыми вариантами реализации изобретения трансген FT может находиться в первой экспрессионной кассете и использоваться вместе со второй экспрессионной кассетой, содержащей последовательность ДНК пригодную для транскрипции, которая соответствует по меньшей мере части трансгена FT и/или комплементарной с ней последовательности, и кодирует молекулу РНК, которая нацеливает трансген FT для супрессии. В соответствии с некоторыми вариантами реализации изобретения трансген FT может содержать целевой сайт для эндогенной молекулы РНК, которая может быть нацелена на трансген FT и инициировать его супрессию.
[68] Как общепринято считать в данной области техники, термин «промотор» в целом может относиться к последовательности ДНК, которая содержит сайт связывания РНК-полимеразы, сайт инициации транскрипции и/или TATA-бокс и вызывает, инициирует, регулирует, поддерживает и/или стимулирует транскрипцию и экспрессию связанной пригодной для транскрипции полинуклеотидной последовательности и/или гена (или трансгена). Промотор может быть создан синтетически, сконструирован, варьирован и/или получен из известной или природной промоторной последовательности или другой промоторной последовательности (например, предложенной в данном документе). Промотор также может включать химерный промотор, содержащий комбинацию двух или более гетерологичных последовательностей. Таким образом, промотор согласно данному изобретению может включать варианты промоторных последовательностей, которые являются сходными по композиции, но не идентичными с другими промоторными последовательностями, предложенными в данном документе. В контексте данного документа термин «функционально связанный» относится к такой функциональной связи между промотором или другим регуляторным элементом и связанной пригодной для транскрипции полинуклеотидной последовательностью или кодирующей последовательностью гена (или трансгена), что функция промотора и т. д. состоит в инициации, поддержании, изменении, вызывании, регуляции и/или стимуляции транскрипции и экспрессии связанной кодирующей или пригодной для транскрипции полинуклеотидной последовательности, по меньшей мере в конкретной (-ых) ткани (-ях), на конкретной (-ых) стадии (-ях) развития и/или в других определенных условиях. Выражение «промотор пригодный для экспрессии в растениях» относится к промотору, который можно использовать для экспрессии в растении, клетке растения и/или ткани растения связанной кодирующей последовательности, трансгена или пригодной для транскрипции полинуклеотидной последовательности, которая функционально связана с промотором.
[69] Промотор можно классифицировать в соответствии с различными критериями, связанными с профилем экспрессии кодирующей последовательностью или гена (включая трансген), функционально связанной с промотором, например, как конститутивный, связанный с развитием, тканеспецифический, индуцибельный и т. д. Промоторы, которые инициируют транскрипцию во всех или в большинстве тканей растения, называются «конститутивными» промоторами. Промоторы, которые инициируют транскрипцию во время определенных периодов или стадий развития, называются «связанными с развитием» промоторами. Промоторы, чья экспрессия усиливается в определенных тканях растения по сравнению с другими тканями растения, называются «тканеусиленными» или «тканепредпочтительными» промоторами. Таким образом, «тканепредпочтительный» промотор вызывает относитеьно большую или предпочтительную экспрессию в конкретной (-ых) ткани (-ях) растения, но имеет более низкие уровни экспрессии в другой (-их) ткани (-ях) растения. Промоторы, которые обеспечивают экспрессию в конкретной (-ых) ткани (-ях) растения, но при этом в других тканях растения экспрессия незначительна или отсутствует, называются «тканеспецифическими» промоторами. Промотор, который обеспечивает экспрессию в конкретном типе клеток растения, называется «специфическим в отношении типа клеток» промотором. «Индуцибельным» промотором называется промотор, который инициирует транскрипцию в ответ на внешний стимул, такой как холод, засуха, тепло или свет или другие стимулы, такие как повреждение или применение химических веществ. Промотор также можно классифицировать в терминах его происхождения как гетерологичный, гомологичный, химерный, синтетический и т. д. Термин «гетерологичный» в отношении промотора или другой регуляторной последовательности, связанной с полинуклеотидной последовательностью (например, последовательностью ДНК пригодной для транскрипции, кодирующей последовательностью, геном или трансгеном), относится к промотору или регуляторной последовательности, которые не связаны с такой полинуклеотидной последовательностью в природе, например, промотор или регуляторная последовательность имеют происхождение, отличное от связанной с ними полинуклеотидной последовательности, и/или в природе не встречаются в виде растения, подлежащем трансформации промотором или регуляторной последовательностью. В более широком смысле термин «гетерологичный» включает комбинацию двух или более молекул или последовательностей ДНК, если такая комбинация обычно не встречается в природе. В контексте данного документа «обычно не встречается в природе» означает не встречается в природе без вмешательства человека. Например, две или более молекул или последовательностей ДНК будут гетерологичными в отношении друг друга, если они обычно находятся в разных геномах или в разных локусах одного генома, или если они не скомбинированы идентичным образом в природе. В соответствии со многими вариантами реализации изобретения промотор экспрессии в растении функционально связанный с полинуклеотидной последовательностью, кодирующей белок FT, является гетерологичным по отношению к полинуклеотидной последовательности, кодирующей белок FT.
[70] В соответствии с вариантами реализации данного изобретения предложены рекомбинантные молекула ДНК, вектор или конструкция, содержащие флоригенный трансген FT или кодирующую последовательность, функционально связанные с промотором, который является функциональным в растении, которые можно вносить или трансформировать в растение, чтобы изменить связанный с цветением, генеративностью или урожаем признак или фенотип. В вариантах реализации данного изобретения предложена рекомбинантная молекула ДНК, содержащая трансген FT или кодирующую последовательность, функционально связанные с промотором «вегетативной стадии», чтобы при внесении или трансформации в растение вызывать экспрессию трансгена FT на более ранних стадиях развития растения (т. е. во время фазы вегетативного роста растения) для получения повышенного уровня FT в целевых тканях по сравнению с тем, который в ином случае был бы в растении дикого типа на той же стадии развития. Время экспрессии трансгена FT во время вегетативной (-ых) стадии (-ий) развития может быть важным для влияния на один или более связанных с генеративностью, цветением и/или урожайностью признаков иди фенотипов посредством обеспечения временно-индуктивного сигнала для генерации увеличенного количества флоральных меристем и продуктивных цветков в одном или более узлах растения. Экспрессия на вегетативной стадии может быть нужна для инициации раннего цветения и возможности улучшения связанных с генеративностью, цветением и/или урожайностью признаков иди фенотипов, таких как большее число цветков, бобов и т. д. на узел растения. Не ограничиваясь какой-либо теорией, было сделано предположение, что экспрессия трансгена FT в растении на вегетативной стадии может приводить к синхронизации и/или повышению раннего цветения в одном или более узлах с получение большего числа цветков на узел растения. Промоторы, описанные ниже как часть данного изобретения, обеспечивают варианты для регуляции времени экспрессии FT.
[71] В контексте данного документа промотор «вегетативной стадии» включает любой промотор, который инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время одной или более вегетативных стадий развития растения, например, во время одной или более из Ve, Vc, V1, V2, V3, V4 и т. д., и/или любой или всех более поздних вегетативных стадий развития (например, вплоть до стадии Vn). Другими словами термин «вегетативная стадия» относится к вегетативной (-ым) стадии (-ям) развития растения в целом. Такой промотор «вегетативной стадии» может быть дополнительно определен как инициирующий, вызывающий, регулирующий и т. д. транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции в одной или более вегетативных тканях растения, таких как одна или более вегетативных меристематических тканей. Такой промотор «вегетативной стадии» может быть дополнительно определен как «предпочтительный в отношении вегетативной стадии» промотор, который инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции по меньшей мере предпочтительно или главным образом, если не исключительно, во время одной или более вегетативных стадий развития растения (в противоположность генеративным стадиям). При этом каждый из промотора «вегетативной стадии» и «предпочтительного в отношении вегетативной стадии» промотора также может обеспечивать, допускать, вызывать, регулировать и т. д. транскрипцию или экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время генеративной (-ых) фазы (фаз) или стадии (-ий) развития в одной или более клетках или тканях растения, например, в одной или более цветочных или генеративных тканях. В действительности промотор «вегетативной стадии» может даже инициировать, вызывать, регулировать и т. д. транскрипцию или экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции в одной или более генеративных или цветочных тканях в более высоком уровне или в большей степени, чем в вегетативной (-ых) ткани (-ях), при условии, что промотор «вегетативной стадии» также инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время одной или более вегетативных стадий развития растения.
[72] Признаки и характеристики, связанные с вегетативными стадиями развития для заданного вида растения, известны в данной области техники. В случае двудольных растений вегетативные морфологические признаки и характеристики растения во время вегетативных стадий развития могут включать определенную форму семядоли, наличие вегетативных меристем (апикальной, латеральной/аксиллярной и корневой), расположение листьев, форму листьев, форму края листьев, жилкование листьев, черешки, прилистники, раструбы, подсемядольное колено и корни. В соответствии с вариантами реализации данного изобретения промотор «вегетативной стадии» также может быть дополнительно определен по конкретной вегетативной стадии, во время которой он впервые вызывает, инициирует и т. д. наблюдаемую или выраженную транскрипцию или экспрессию связанного с ним гена (или трансгена). Например, промотор вегетативной стадии может представлять собой промотор стадии Vc, промотор стадии V1, промотор стадии V2, промотор стадии V3 и т. д. Следовательно, промотор «стадии Vc» определяется как промотор вегетативной стадии, который впервые инициирует или вызывает транскрипцию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время стадии Vc развития растения, промотор «стадии V1» определяется как промотор вегетативной стадии, который впервые инициирует или вызывает транскрипцию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время стадии V1 развития растения, промотор «стадии V2» определяется как промотор вегетативной стадии, который впервые инициирует или вызывает транскрипцию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время стадии V2 развития растения и т. д., хотя экспрессия связанного гена, трансгена или последовательности ДНК пригодной для транскрипции может происходить непрерывно или с перерывами в одной или более тканях во время более поздних вегетативных (и/или генеративных) стадий развития. Специалист в данной области техники сможет определить время экспрессии заданного гена, трансгена или последовательности ДНК пригодной для транскрипции во время развития растения, используя различные методы и техники молекулярного анализа, известные в данной области техники.
[73] В соответствии с вариантами реализации данного изобретения промотор «вегетативной стадии» может включать конститутивный, тканепредпочтительный или тканеспецифический промотор. Например, промотор вегетативной стадии может регулировать экспрессию связанного с ним гена/трансгена FT или последовательности ДНК пригодной для транскрипции в одной или более тканях растения, например, в одном или более из корней, стеблей, листьев, меристем и т. д. во время вегетативной (-ых) стадии (-ий) развития растения. При этом такой промотор вегетативной стадии может предпочтительно регулировать экспрессию связанного с ним трансгена FT или кодирующей последовательности, или последовательности ДНК пригодной для транскрипции в одной или более меристем растения. В соответствии со многими вариантами реализации изобретения промотор «вегетативной стадии» может быть «меристемо-специфическим» или «меристемо-предпочтительным» промотором, который вызывает экспрессию трансгена FT или кодирующей последовательности, или последовательности ДНК пригодной для транскрипции в меристематической ткани. Известно, что белки FT функционируют в меристеме растения, помогая инициировать переход от вегетативного к генеративному росту после транслокации белка FT из листьев. В противоположность этому, в вариантах реализации данного изобретения предложена экспрессия трансгена FT непосредственно в меристеме растения для индукции цветения и придания растению измененного связанного с генеративностью и/или урожайностью признака или фенотипа. Таким образом, в соответствии с вариантами реализации данного изобретения предложены рекомбинантные молекула ДНК, конструкция или вектор, содержащие трансген FT или кодирующую последовательность, функционально связанные с «меристемо-специфическим» или «меристемо-предпочтительным» промотором, который регулирует экспрессию трансгена FT по меньшей мере предпочтительно в одной или более меристематических тканях растения, при трансформации в растение. В контексте данного документа «меристемо-предпочтительный промотор» относится к промоторам, которые предпочтительно вызывают экспрессию связанного гена, трансгена или последовательности ДНК пригодной для транскрипции по меньшей мере в одной меристематической ткани растения по сравнению с другими тканями растения, например, в одной или более апикальных и/или аксиллярных меристемах, тогда как «меристемо-специфический промотор» относится к промоторам, которые вызывают экспрессию связанного гена, трансгена или последовательности ДНК пригодной для транскрипции исключительно (или почти исключительно) по меньшей мере в одной меристематической ткани растения.
[74] В соответствии с вариантами реализации данного изобретения предложена рекомбинантная молекула ДНК, содержащая кодирующую последовательность FT, функционально связанную с промотором вегетативной стадии, который также может быть меристемо-предпочтительным и/или меристемо-специфическим промотором. Например, промотор может включать промотор pAt.Erecta из Arabidopsis (SEQ ID NO: 31) или его функциональные фрагмент или часть. Два примера усеченной части промотора pAt.Erecta в соответствии с вариантами реализации данного приведены как SEQ ID NO: 32 и SEQ ID NO: 48. Смотрите, например, Yokoyama, R. et al., ʺThe Arabidopsis ERECTA gene is expressed in the shoot apical meristem and organ primordia,ʺ The Plant Journal 15(3): 301-310 (1998). pAt.Erecta является примером промотора вегетативной стадии, который также является меристемо-предпочтительным. Другие меристемо-предпочтительные или меристемо-специфические промоторы вегетативной стадии были идентифицированы на основании их характерного профиля экспрессии (смотрите, например, примеры 4 и 7 ниже), и их также можно использовать для управления экспрессией FT в соответствии с вариантами реализации данного изобретения. Например, были идентифицированы промоторы из следующих генов рецептор-подобной киназы (RLK), которые можно использовать как меристемо-предпочтительные промоторы вегетативной стадии: Glyma10g38730 (SEQ ID NO: 33), Glyma09g27950 (SEQ ID NO: 34), Glyma06g05900 (SEQ ID NO: 35) и Glyma17g34380 (SEQ ID NO: 36) и любые их функциональные части. Меристемо-предпочтительные промоторы вегетативной стадии в соответствии с вариантами реализации данного изобретения также могут включать промоторы генов рецептор-подобной киназы (RLK) из картофеля: PGSC0003DMP400032802 (SEQ ID NO: 37) и PGSC0003DMP400054040 (SEQ ID NO: 38) и любые их функциональные части. С учетом приведенной в данном документе характеристики промотора pAt.Erecta, управляющего экспрессией FT, и аналогичных профилей экспрессии, определенных для других генов RLK, Erecta или Erecta-подобных (Erl), меристемо-предпочтительные или меристемо-специфические промоторы вегетативной стадии согласно данному изобретению могут дополнительно включать любые известные или идентифицированные позже промоторные последовательности генов RLK, Erecta и Erecta-подобных, из других видов двудольных, имеющих профиль экспрессии на вегетативной стадии в меристеме растений.
[75] Дополнительные примеры меристемо-предпочтительных или меристемо-специфических промоторов могут включать промоторы из следующих генов Arabidopsis: Pinhead (At.PNH) (SEQ ID NO: 39), Angustifolia 3 или At.AN3 (SEQ ID NO: 40), At.MYB17 (At.LMI2 или Late Meristem Identity 2; At3g61250) (SEQ ID NO: 41), Kinesin-подобный ген (At5g55520) (SEQ ID NO: 42), AP2/B3-подобные гены, включая At.REM17 (SEQ ID NO: 43) или At.REM19, и Erecta-подобные гены 1 и 2, At.Erl1 (SEQ ID NO: 44) и At.Erl2 (SEQ ID NO: 45) и любые их функциональные части. Другим примером является промотор At.AP1 (pAt.AP1 или pAP1) из Arabidopsis (SEQ ID NO: 49) или его функциональная часть. Однако промотор pAt.AP1 может считаться промотором более поздней вегетативной и генеративной стадии. Учитывая поздний профиль экспрессии на вегетативной и генеративной стадии, промотор pAt.AP1 и родственные промоторы можно применять для управления экспрессией трансгена FT и/или супрессионного элемента трансгена FT. Дополнительные примеры, идентифицированные из сходных генов и/или генов, имеющих сходный профиль экспрессии с промотором pAt.AP1 в нативных видах растений, могут включать промотор из одного из следующих генов: AT1G26310.1 (SEQ ID NO: 50), AT3G30260.1 (SEQ ID NO: 51) или AT5G60910.1 (SEQ ID NO: 52) из Arabidopsis; Glyma01g08150 (SEQ ID NO: 53), Glyma02g13420 (SEQ ID NO: 54), Glyma08g36380 (SEQ ID NO: 55) или Glyma16g13070 (SEQ ID NO: 56) из сои; Solyc02g065730 (SEQ ID NO: 57), Solyc02g089210 (SEQ ID NO: 58), Solyc03g114830 (SEQ ID NO: 59) или Solyc06g069430 (SEQ ID NO: 60) из томата; или GRMZM2G148693 (SEQ ID NO: 61), GRMZM2G553379 (SEQ ID NO: 62), GRMZM2G072582 (SEQ ID NO: 63), или GRMZM2G147716 (SEQ ID NO: 64) из кукурузы, или любую их функциональную часть.
[76] Промотор вегетативной стадии, который также может быть меристемо-предпочтительным и/или меристемо-специфическим промотором, может включать как ранние, так и поздние промоторы вегетативной стадии в зависимости от профиля их экспрессии во время вегетативных стадий развития. Промотор «ранней вегетативной стадии» впервые инициирует или вызывает наблюдаемую или выраженную транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции во время одной или более ранних вегетативных стадий (т. е. стадий Ve-V5), тогда как промотор «поздней вегетативной стадии» впервые инициирует или вызывает наблюдаемую или выраженную транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции во время одной или более поздних вегетативных стадий (т. е. стадии V6 и позже). Промотор ранней или поздней вегетативной стадии также может быть предпочтительным в отношении ранней или поздней вегетативной стадии промотором. «Предпочтительный в отношении ранней вегетативной стадии» промотор инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции преимущественно или в большей степени во время одной или более ранних вегетативных стадий (т. е. стадий Ve-V5) по сравнению с более поздними вегетативными стадиями. Аналогично, «предпочтительный в отношении поздней вегетативной стадии» промотор инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции преимущественно или в большей степени во время одной или более поздних вегетативных стадий (т. е. стадии V6 и позже) по сравнению с более ранними вегетативными стадиями. Соответственно, промотор ранней вегетативной стадии также может быть предпочтительным в отношении поздней вегетативной стадии промотором, если промотор впервые инициирует или вызывает наблюдаемую или выраженную транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции во время более ранних вегетативных стадий, но также инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции преимущественно или в большей степени во время более поздних вегетативных стадий. Перечисленные выше примеры промоторов вегетативной стадии могут включать промоторы ранней и поздней вегетативной стадии, которые также могут быть предпочтительными в отношении ранней вегетативной стадии или предпочтительными в отношении поздней вегетативной стадии.
[77] Полинуклеотидная последовательность промотора вегетативной стадии (или его функциональных фрагмента или части) также может иметь нестрогую идентичность последовательности относительно любого из вышеприведенных промоторов вегетативной стадии и при этом сохранять сходный или идентичный профиль экспрессии связанных последовательности ДНК пригодной для транскрипции, гена или трансгена, функциональной связанных с промотором. Например, промотор вегетативной стадии может содержать полинуклеотидную последовательность, которая является по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичной полинуклеотидной последовательности, выбранной из вышеприведенных SEQ ID NO: 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, или ее функциональной части. «Функциональная часть» известной или предложенной промоторной последовательности определяется как одна или более непрерывных или прерывистых частей известной или предложенной промоторной последовательности, которые могут функционально регулировать, вызывать, стимулировать и т. д. экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции идентичным или сходным образом с известной или предложенной промоторной последовательностью. С учетом данного изобретения специалист в данной области техники сможет определить, приводит ли промотор, содержащий одну или более частей известной или предложенной промоторной последовательности, и/или имеющий более короткую последовательность или последовательность с менее строгой идентичностью последовательности относительно известной или предложенной промоторной последовательности, к сходному профилю экспрессии и/или сходным фенотипам или эффектам, когда связанный с ним репортерный ген или трансген FT экспрессируется в растении, по сравнению с известной или предложенной промоторной последовательностью.
[78] В соответствии с некоторыми вариантами реализации изобретения промотор «генеративной стадии» (определенный ниже) может быть функционально связан и использован для экспрессии трансгена FT или кодирующей последовательности, при условии, что промотор генеративной стадии обеспечивает (т. е. инициирует, вызывает, регулирует и т. д.) по меньшей мере некоторый уровень экспрессии трансгена FT во время вегетативной (-ых) стадии (-ий) развития растения для обеспечения сигнала индукции раннего цветения. Примеры промоторов генеративной стадии приведены ниже. Отнесение заданного промотора к категории промотора ранней или поздней вегетативной стадии и/или промотора генеративной стадии зависит от конкретного вида растения, в котором используется промотор. Промотор, имеющий определенный профиль экспрессии в одном виде растения, например, в своем нативном виде растения, может иметь отличный, измененный или смещенный профиль экспрессии при экспрессии в другом виде растения (например, гетерологично в другом виде растения), хотя предполагается, что профиль экспрессии с заданным промотором часто будет сходным (если не идентичным или почти идентичным) для разных видов растений. Например, промотор генеративной стадии в одном виде растения может функционировать как промотор ранней вегетативной стадии при применении для экспрессии трансгена или последовательности ДНК пригодной для транскрипции в другом виде растения. Таким образом, промотор генеративной стадии можно использовать в некоторых случаях гетерологично для экспрессии трансгена FT и индукции раннего цветения. Например, промотор pAt.AP1 (SEQ ID NO: 49) имеет более предпочтительный в отношении генеративной стадии профиль экспрессии в его нативном растительном виде Arabidopsis, но может регулировать ранний профиль экспрессии на вегетативной стадии в меристеме при гетерологичном применении в растения сои помимо регуляции экспрессии на генеративной стадии.
[79] Как указано выше, рекомбинантные молекула ДНК, конструкция или вектор согласно данному изобретению могут содержать экспрессионную кассету, содержащую полинуклеотидную последовательность, кодирующую белок FT (т. е. трансген FT), которая функционально связана с промотором вегетативной стадии, который также может быть меристемо-предпочтительным и/или меристемо-специфическим промотором. Кодирующая полинуклеотидная последовательность трансгена FT или экспрессионная кассета также может быть функционально связана с одним или более дополнительными регуляторными элементами, такими как энхансеры, лидерные последовательности, сайты инициации транскрипции (СИТ), линкеры, 5' и 3' нетранслируемые области, интроны, сигналы полиаденилирования, области или последовательности терминации и т. д., которые подходят или необходимы для регуляции или обеспечения экспрессии трансгена FT или кассеты для эффективной выработки белка FT в клетке растения. Такие дополнительные регуляторные элементы могут быть необязательными и использоваться для повышения или оптимизации экспрессии трансгена. В целях данного изобретения «энхансер» можно отличить от «промотора» по тому, что в энхансере обычно отсутствует сайт инициации транскрипции, TATA-бокс или эквивалентная последовательность, и поэтому его одного недостаточно для управления транскрипцией. В контексте данного документа «лидерная последовательность» может быть в общем случае определена как последовательность ДНК нетранслируемой 5´ области (5´ НТО) гена (или трансгена) между сайтом инициации транскрипции (СИТ) и стартовым сайтом кодирующей белок последовательности.
[80] В контексте данного документа в отношении полинуклеотида «конструкция» представляет собой сегмент или последовательность полинуклеотида, содержащие один или более элементов последовательности, таких как кодирующая последовательность или последовательность ДНК пригодная для транскрипции, и один или более экспрессионных или регуляторных элементов, таких как промотор, энхансер и т. д. «Экспрессионная кассета» представляет собой тип конструкции, содержащей кодирующую последовательность или последовательность ДНК пригодную для транскрипции, которая может экспрессировать кодирующую последовательность или последовательность ДНК пригодную для транскрипции в подходящем хозяине, таком как растительная или бактериальная клетка, и один или более промоторов и/или регуляторных элементов, функционально связанных с кодирующей последовательностью или последовательностью ДНК пригодной для транскрипции. «Вектор» представляет собой полинуклеотид или молекулу ДНК, которые могут содержать одну или более конструкций и/или экспрессионных кассет и которые подходят для стабильности, хранения или других применений или целей, таких как доставка, трансформация и/или поддержание в растении или клетке-хозяине. «Вектор» может включать плазмиду или кольцевую молекулу ДНК, линейную молекулу ДНК, трансформационный вектор, подходящий для трансформации растений, и т. д. Молекула ДНК или вектор могут содержать одну или более конструкций, экспрессионных кассет, селективных маркеров, элементов репликации и/или поддержки и т. д.
[81] В соответствии с вариантами реализации данного изобретения термин «рекомбинантный» в отношении молекулы полинуклеотида (ДНК или РНК), белка, конструкции, вектора и т. д. относится к полинуклеотидной или белковой молекуле или последовательности, которая обычно не встречается в природе и/или находится в условиях, в которых она обычно не встречается в природе, включая молекулу полинуклеотида (ДНК или РНК), белок, конструкцию и т. д., содержащие комбинацию двух или более полинуклеотидных или белковых последовательностей, которые в природе не являлись бы непрерывными или не находились бы вблизи друг друга без вмешательства человека, и/или молекулу ДНК, конструкцию и т. д., содержащие по меньшей мере две последовательности ДНК, гетерологичные по отношению друг к другу. Рекомбинантная молекула ДНК, конструкция и т. д. может содержать последовательности ДНК, которые отделены от других полинуклеотидных последовательностей, которые находятся вблизи таких последовательностей ДНК в природе, и/или последовательность ДНК, которая является смежной (или непрерывной) с другими полинуклеотидными последовательностями, которые в естественных условиях не находятся вблизи друг друга. Рекомбинантная молекула ДНК, конструкция и т. д. также может относиться к молекуле или последовательности ДНК, которая была генетически спроектирована и сконструирована за пределами клетки. Например, рекомбинантная молекула ДНК может включать подходящую плазмиду, вектор и т. д. и может включать линейную или кольцевую молекулу ДНК. Такие плазмиды, векторы и т. д. могут содержать различные вспомогательные элементы, включая прокариотическую точку начала репликации и селективный маркер, а также экспрессирующий FT трансген или экспрессионную кассету, возможно, в дополнение к гену растительного селективного маркера и т. д.
[82] В соответствии с вариантами реализации данного изобретения предложена вторая экспрессионная кассета, содержащая пригодную для транскрипции полинуклеотидную или ДНК-последовательность, функционально связанную с промотором пригодным для экспрессии в растениях, при этом последовательность ДНК пригодная для транскрипции содержит последовательность, которая соответствует по меньшей мере части трансгена FT и/или комплементарной с ней последовательности и нацелена на трансген FT для супрессии. Транскрибируемая последовательность ДНК может кодировать молекулу РНК, содержащую нацеливающую последовательность, которая является комплементарной по меньшей мере части пре-мРНК или зрелой мРНК, кодируемой полинуклеотидной последовательностью, кодирующей белок FT (т. е. трансген FT), так что молекула РНК подавляет трансген FT. Соответственно, предложены рекомбинантные молекула ДНК, конструкция или вектор для трансформации в растение, содержащие вторую экспрессионную кассету. Такие рекомбинантные молекула ДНК, конструкция или вектор могут дополнительно содержать первую экспрессионную кассету, содержащую кодирующую полинуклеотидную последовательность, кодирующую белок FT (т. е. трансген FT), функционально связанную с первым промотором пригодным для экспрессии в растениях, и при этом вторая экспрессионная кассета содержит последовательность ДНК пригодную для транскрипции, функционально связанную со вторым промотором пригодным для экспрессии в растениях. В альтернативном варианте, могут быть предоставлены две рекомбинантные молекулы ДНК, конструкции или два вектора для трансформации растения, содержащие первую рекомбинантную молекулу ДНК, конструкцию или вектор и вторую рекомбинантную молекулу ДНК, конструкцию или вектор, при этом первая рекомбинантная молекула ДНК, конструкция или вектор содержит первую экспрессионную кассету, содержащую трансген FT, а вторая рекомбинантная молекула ДНК, конструкция или вектор содержит вторую экспрессионную кассету, содержащую последовательность ДНК пригодную для транскрипции, которая содержит последовательность, которая соответствует по меньшей мере части трансгена FT и/или комплементарной с ней последовательности. В соответствии с некоторыми вариантами реализации изобретения промотор пригодный для экспрессии в растениях функционально связан с последовательностью ДНК пригодной для транскрипции, которая кодирует молекулу РНК для супрессии гена FT, или же трансген является гетерологичным по отношению к последовательности ДНК пригодной для транскрипции.
[83] Для супрессии трансгена FT в соответствии с вариантами реализации данного изобретения можно использовать любой известный в данной области техники способ, включая экспрессию антисмысловых РНК, двухцепочечных РНК (дцРНК) или последовательностей РНК с инвертированными повторами, или посредством совместной супрессии или РНК-интерференции (РНКи) посредством экспрессии малых интерферирующих РНК (миРНК), коротких шпилечных РНК (кшРНК), транс-действующих миРНК (тд-миРНК) или микро-РНК (микроРНК). Смотрите, например, публикации патентных заявок США № 2009/0070898, 2011/0296555 и 2011/0035839, содержание которых включено в данный документ посредством ссылки. Соответственно, молекула РНК, кодируемая последовательностью ДНК пригодной для транскрипции, может представлять собой антисмысловую РНК, двухцепочечную РНК (дцРНК) или РНК с инвертированными повторами, малую интерферирующую РНК (миРНК), короткую шпилечную РНК (кшРНК), транс-действующую миРНК (тд-миРНК) или микро-РНК (микроРНК), включая РНК-предшественники, такие как миРНК- или микроРНК-предшественники, которые могут процессироваться или расщепляться до зрелой молекулы РНК, такой как зрелая миРНК или микроРНК. В контексте данного документа термин «супрессия» относится к снижению, уменьшению или элиминации уровня экспрессии мРНК и/или белка, кодируемого целевым геном и/или трансгеном в растении, клетке растения или ткани растения, которое может быть ограничено конкретной тканью и/или стадией развития растения в зависимости от промотора, используемого для экспрессии молекулы РНК.
[84] В соответствии с вариантами реализации данного изобретения предложены рекомбинантные молекула ДНК, конструкция или вектор, содержащие последовательность ДНК пригодную для транскрипции и/или элементы супрессии, кодирующие молекулу РНК или последовательность, нацеленные на трансген FT для супрессии, при этом последовательность ДНК пригодная для транскрипции функционально связана с промотором пригодным для экспрессии в растениях. Так как молекула РНК предназначена для супрессии, молекула РНК, кодируемая последовательностью ДНК пригодной для транскрипции, может являться некодирующей молекулой РНК. В целях данного изобретения «некодирующая молекула РНК» представляет собой молекулу РНК, которая не кодирует белок. В соответствии с некоторыми вариантами реализации изобретения рекомбинантные молекула ДНК, конструкция или вектор могут содержать первую экспрессионную кассету, содержащую трансген FT, и вторую экспрессионную кассету, содержащую последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии. В альтернативном варианте первая экспрессионная кассета, содержащая трансген FT, и вторая экспрессионная кассета, содержащая последовательность ДНК пригодную для транскрипции для супрессии трансгена FT, могут находиться в двух разных рекомбинантных молекулах ДНК, конструкциях или векторах.
[85] Транскрибируемая последовательность ДНК может содержать элемент супрессии, который имеет длину по меньшей мере 15 нуклеотидов, например, длину от около 15 нуклеотидов до около 27 нуклеотидов, или длину 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27 нуклеотидов, при этом элемент супрессии соответствует по меньшей мере части целевого трансгена FT, подлежащего супрессии, и/или комплементарной с ним последовательности ДНК. Во многих вариантах реализации изобретения последовательность ДНК пригодная для транскрипции или элемент супрессии могут иметь длину по меньшей мере 17, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22 или по меньшей мере 23 нуклеотидов (или более) (например, длину по меньшей мере 25, по меньшей мере 30, по меньшей мере 50, по меньшей мере 100, по меньшей мере 200, по меньшей мере 300, по меньшей мере 500, по меньшей мере 1000, по меньшей мере 1500, по меньшей мере 2000, по меньшей мере 3000, по меньшей мере 4000 или по меньшей мере 5000 нуклеотидов). В зависимости от длины и последовательности последовательности ДНК пригодной для транскрипции или элемента супрессии могут допускаться одно или более несовпадений в последовательности или некомплементарных оснований без потери функции супрессии. В действительности даже короткие элементы супрессии РНКи с длиной в диапазоне от около 15 нуклеотидов до около 27 нуклеотидов могут иметь одно или более несовпадений или некомплементарных оснований, но при этом эффективно подавлять целевой трансген FT. Соответственно, смысловой или антисмысловой элемент супрессии может содержать последовательность, которая является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной или комплементарной соответствующей последовательности по меньшей мере сегмента или части целевого трансгена FT или ее комплементарной последовательности, соответственно.
[86] Транскрибируемая последовательность ДНК согласно данному изобретению для нацеленной супрессии трансгена FT может содержать один или более из следующих элементов супрессии и/или нацеливающих последовательностей: (a) последовательность ДНК, которая содержит по меньшей мере одну антисмысловую последовательность ДНК, которая является антисмысловой или комплементарной по меньшей мере одному сегменту или одной части целевого трансгена FT; (b) последовательность ДНК, которая содержит множество копий по меньшей мере одной антисмысловой последовательности ДНК, которая является антисмысловой или комплементарной по меньшей мере одному сегменту или одной части целевого трансгена FT; (c) последовательность ДНК, которая содержит по меньшей мере одну смысловую последовательность ДНК, которая содержит по меньшей мере один сегмент или одну часть целевого трансгена FT; (d) последовательность ДНК, которая содержит множество копий по меньшей мере одной смысловой последовательности ДНК, каждая из которых содержит по меньшей мере один сегмент или одну часть целевого трансгена FT; (e) последовательность ДНК, которая содержит сегмент или часть целевого трансгена FT с инвертированными повторами и/или транскрибируется в РНК для супрессии целевого трансгена FT путем образования двухцепочечной РНК, при этом транскрибируемая РНК содержит по меньшей мере одну антисмысловую последовательность ДНК, которая является антисмысловой или комплементарной по меньшей мере одному сегменту или одной части целевого трансгена FT, и по меньшей мере одну смысловую последовательность ДНК, которая содержит по меньшей мере один сегмент или одну часть целевого трансгена FT; (f) последовательность ДНК, которая транскрибируется в РНК для супрессии целевого трансгена FT путем образования одной двухцепочечной РНК и содержит множество антисмысловых последовательностей ДНК, каждая из которых является антисмысловой или комплементарной по меньшей мере одному сегменту или одной части целевого трансгена FT, и множество смысловых последовательностей ДНК, каждая из которых содержит по меньшей мере один сегмент или одну часть целевого трансгена FT; (g) последовательность ДНК, которая транскрибируется в РНК для супрессии целевого трансгена FT путем образования множества двухцепочечных РНК и содержит множество антисмысловых последовательностей ДНК, каждая из которых является антисмысловой или комплементарной по меньшей мере одному сегменту или одной части целевого трансгена FT, и множество смысловых последовательностей ДНК, каждая из которых содержит по меньшей мере один сегмент или одну часть целевого трансгена FT, при этом множество антисмысловых сегментов ДНК и множество смысловых сегментов ДНК упорядочены в серии из инвертированны повторов; (h) последовательность ДНК, которая содержит нуклеотиды, полученные из микроРНК, предпочтительно растительной микроРНК; (i) последовательность ДНК, которая содержит нуклеотиды из миРНК; (j) последовательность ДНК, которая транскрибируется в РНК-аптамер, способный связываться с лигандом; и (k) последовательность ДНК, которая транскрибируется в РНК-аптамер, способный связываться с лигандом, и ДНК, которая транскрибируется в регуляторную РНК, способную регулировать экспрессию целевого трансгена FT, при этом регуляция целевого трансгена FT зависит от конформации регуляторной РНК, а на конформацию регуляторной РНК имеет аллостерический эффект состояние связывания РНК-аптамера лигандом. Транскрибируемая последовательность ДНК может содержать один или более вышеуказанных элементов супрессии и/или одну или более нацеливающих последовательностей, которые могут соответствовать одной или более последовательностям трансгена FT и/или его комплементарной последовательности.
[87] Множественные смысловые и/или антисмысловые последовательности супрессии последовательности ДНК пригодной для транскрипции для одной или более целевых последовательностей трансгена FT могут быть упорядочены периодически в тандеме или упорядочены в тандемные сегменты или повторы, такие как тандемные инвертированные повторы, которые также могут прерываться одной или более спейсерными последовательностями. Кроме того, смысловая или антисмысловая последовательность последовательности ДНК пригодной для транскрипции или элемента супрессии может идеально не совпадать или не быть комплементарной с целевой последовательностью трансгена FT, в зависимости от последовательности и длины последовательности ДНК пригодной для транскрипции или элемента супрессии. В действительности даже короткие элементы супрессии РНКи с длиной в диапазоне от около 15 нуклеотидов до около 27 нуклеотидов могут иметь одно или более несовпадений или некомплементарных оснований в зависимости от длины элемента супрессии или нацеливающей последовательности, например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 (или более) несовпадений, но при этом эффективно подавлять целевой трансген FT. Соответственно, смысловой или антисмысловой элемент супрессии может содержать последовательность, которая является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной или комплементарной соответствующей последовательности по меньшей мере сегмента или части целевого трансгена FT или ее комплементарной последовательности, соответственно.
[88] В случае антисмысловой супрессии последовательность ДНК пригодная для транскрипции может содержать последовательность, которая является антисмысловой или комплементарной по меньшей мере части или сегменту целевого трансгена FT. Транскрибируемая последовательность ДНК и/или элемент супрессии могут содержать множество антисмысловых последовательностей, которые являются комплементарными одной или более частям или одному или более сегментам целевого трансгена FT, или множество копий антисмысловой последовательности, комплементарной целевому трансгену FT. Антисмысловая последовательность может быть по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной последовательности ДНК, комплементарной по меньшей мере сегменту или части мРНК целевого трансгена FT. Другими словами, антисмысловая последовательность может быть по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% комплементарной целевому трансгену FT.
[89] В контексте данного документа термины «процент комплементарности» или «доля комплементарности» в отношении двух нуклеотидных последовательностей сходны по концепции с процентом идентичности, но относятся к процентной доле нуклеотидов последовательности, которые демонстрируют оптимальное спаривание оснований или гибридизируются с нуклеотидами референсной последовательности, когда два последовательности упорядочены линейно и демонстрируют оптимальное спаривание оснований без вторичных свернутых структур, таких как петли, стебли или шпильки, но с допущением несовпадений и гэпов в спаривании оснований между двумя последовательностями. Такой процент комплементарности может наблюдаться между двумя цепями ДНК, двумя цепями РНК или цепью ДНК и цепью РНК. «Процент комплементарности» можно рассчитать путем (i) оптимального спаривания оснований или гибридизации двух нуклеотидных последовательностей в линейном и полностью развернутом упорядочении (т. е. без сворачивания или вторичных структур) в окне сравнения (например, окне выравнивания), (ii) определения числа позиций, в которых наблюдается спаривание оснований между двумя последовательностями в окне сравнения для получения числа комплементарных позиций, (iii) деления числа комплементарных позиций на общее число позиций в окне сравнения и (iv) умножения этого результата на 100% для получения процента комплементарности двух последовательностей. В этих целях окно выравнивания определяется как область комплементарности между двумя последовательностями. Оптимальное спаривание оснований между двумя последовательностями можно определить на основании известного спаривания нуклеотидных оснований, таких как G-C, A-T и A-U, посредством водородного связывания. Если «процент комплементарности» рассчитывают относительно референсной или запрашиваемой последовательности без уточнения конкретного окна сравнения, то процент идентичности определяют, деля число комплементарных позиций между двумя линейными последовательностями на общую длину референсной последовательности. В целях данного изобретения, когда две последовательности (запрашиваемая и рассматриваемая) имеют оптимальное спаривание оснований (с допуском гэпов и несовпадений или неспаренных нуклеотидов), «процент комплементарности» для запрашиваемой последовательности (когда окно сравнения не определено) равен числу спаренных позиций между двумя последовательностями, деленному на общее число позиций в запрашиваемой последовательности по всей ее длине, что затем умножается на 100%.
[90] Для супрессии трансгена FT с помощью инвертированного повтора или транскрибированной дцРНК последовательность ДНК пригодная для транскрипции может содержать смысловую последовательность, которая содержат сегмент или часть целевого трансгена FT и антисмысловую последовательность, которая является комплементарной сегменту или части целевого трансгена FT, при этом смысловая и антисмысловая последовательности ДНК расположены в тандеме. Каждая из смысловой и антисмысловой последовательностей, соответственно, может быть менее чем на 100% идентичной или комплементарной сегменту или части целевого трансгена FT, как описано выше. Смысловая и антисмысловая последовательности могут быть разделены спейсерной последовательностью так, чтобы молекула РНК, транскрибированная с последовательности ДНК пригодной для транскрипции, образовывала стебель, петлю или структуру типа «стебель-петля» между смысловой и антисмысловой последовательностями. В ином случае последовательность ДНК пригодная для транскрипции может содержать множество смысловых и антисмысловых последовательностей, которые расположены в тандеме, которые также могут быть разделены одной или более спейсерными последовательностями. Транскрибируемая последовательность ДНК, содержащая множество смысловых и антисмысловых последовательностей, может быть упорядочена в виде групп смысловых последовательностей за которыми следуют группы антисмысловых последовательностей, или в виде групп тандемно расположенных смысловых и антисмысловых последовательностей.
[91] Для супрессии трансгена FT с помощью микро-РНК (микроРНК) последовательность ДНК пригодная для транскрипции может содержать последовательность ДНК, полученную из последовательности микроРНК, нативной для вируса или эукариота, такого как животное или растение, или модифицированную или полученную из такой нативной последовательности микроРНК. Такие нативные или полученные из нативных последовательности микроРНК могут образовывать структуру с гибридизацией «в себе» и служить каркасом для микроРНК-предшественника, и также могут соответствовать стеблевой области нативной последовательности микроРНК-предшественника, такой как в нативной (или полученной из нативной) последовательности при-микроРНК или пре-микроРНК. При этом, кроме этих нативных или полученных из нативных каркасных или препроцессированных последовательностей микроРНК, сконструированные микроРНК согласно данному изобретению дополнительно содержат последовательность, соответствующую сегменту или части целевого трансгена FT. Таким образом, кроме препроцессированных или каркасных последовательностей, элемент супрессии может быть сконструирован, чтобы дополнительно содержать смысловую и/или антисмысловую последовательность, которая соответствует сегменту или части целевого трансгена FT, и/или последовательность, которая является с ним комплементарной, хотя допускается наличие одного или более несовпадений в последовательности.
[92] Сконструированные микроРНК применимы для нацеленной супрессии генов с повышенной специфичностью. Смотрите, например, Parizotto et al., Genes Dev. 18:2237-2242 (2004), и публикации патентных заявок США № 2004/0053411, 2004/0268441, 2005/0144669 и 2005/0037988, содержание которых включено в данный документ посредством ссылки. микроРНК представляют собой некодирующие РНК. При расщеплении молекулы микроРНК-предшественника образуется зрелая микроРНК, которая, как правило, имеет длину от около 19 до около 25 нуклеотидов (обычно длину от около 20 до около 24 нуклеотидов в растениях), например, длину 19, 20, 21, 22, 23, 24 или 25 нуклеотидов, и имеет последовательность, соответствующую гену-мишени супрессии и/или его комплементарной последовательности. Зрелая микроРНК гибридизируется с целевыми транскриптами мРНК и управляет связыванием комплекса белков с целевыми транскриптами, что может ингибировать трансляцию и/или приводить к разрушению транскрипта, осуществляя, таким образом, негативную регуляцию или подавление экспрессии целевого гена. микроРНК-предшественники также применимы в растениях для управления синфазной выработкой миРНК, транс-действующих миРНК (тд-миРНК) в процессе, в котором необходима РНК-зависимая РНК-полимераза для супрессии целевого гена. Смотрите, например, Allen et al., Cell 121:207-221 (2005), Vaucheret Science STKE, 2005:pe43 (2005), и Yoshikawa et al. Genes Dev., 19:2164-2175 (2005), содержание которых включено в данный документ посредством ссылки.
[93] В соответствии с вариантами реализации данного изобретения предложены рекомбинантные молекула ДНК, конструкция или вектор, содержащие последовательность ДНК пригодную для транскрипции, кодирующие молекулу микроРНК или микроРНК-предшественника для нацеленной супрессии трансгена FT. Такая последовательность ДНК пригодная для транскрипции может содержать последовательность длиной по меньшей мере 19 нуклеотидов, которая соответствует трансгену FT и/или последовательности, комплементарной трансгену FT, хотя допускается наличие одного или более несовпадений в последовательности и/или неспаренных нуклеотидов.
[94] Трансген FT также можно супрессировать с помощью одной или более малых интерферирующих РНК (миРНК). Путь миРНК включает несинфазное расщепление более длинной промежуточной двухцепочечной РНК («двойной спирали РНК») на малые интерферирующие РНК (миРНК). Размер или длина миРНК, как правило, находится в диапазоне от около 19 до около 25 нуклеотидов или пар оснований, но обычные классы миРНК включают содержащие 21 пару оснований или 24 пары оснований. Таким образом, последовательность ДНК пригодная для транскрипции согласно данному изобретению может кодировать молекулу РНК длиной по меньшей мере от около 19 до около 25 нуклеотидов, например, диной 19, 20, 21, 22, 23, 24 или 25 нуклеотидов. Для супрессии с помощью миРНК предложены рекомбинантные молекула ДНК, конструкция или вектор, содержащие последовательность ДНК пригодную для транскрипции и/или элемент супрессии, кодирующие молекулу миРНК для нацеленной супрессии трансгена FT.
[95] В соответствии с вариантами реализации данного изобретения предложены рекомбинантные молекула ДНК, вектор или конструкция, содержащие последовательность ДНК пригодную для транскрипции, кодирующую некодирующую молекулу РНК, которая связывается или гибридизируется с последовательностью целевой мРНК в клетке растения, такой как кодирующая (экзон) и/или нетранслируемая (НТО) последовательность целевой мРНК, при этом целевая молекула мРНК кодирует белок FT, а последовательность ДНК пригодная для транскрипции функционально связана с промотором пригодным для экспрессии в растениях. Кроме нацеливания на последовательность зрелой мРНК, некодирующая молекула РНК, кодируемая последовательностью ДНК пригодной для транскрипции, может быть нацелена на интронную последовательность трансгена или транскрипта FT. В соответствии с другими вариантами реализации изобретения предложены рекомбинантные молекула ДНК, вектор или конструкция, содержащие последовательность ДНК пригодную для транскрипции, кодирующую некодирующую молекулу РНК (предшественника), которая расщепляется или процессируется до зрелой некодирующей молекулы РНК, которая связывается или гибридизируется с целевой мРНК в клетке растения, при этом целевая молекула мРНК кодирует белок FT, а последовательность ДНК пригодная для транскрипции функционально связана с промотором пригодным для экспрессии в растениях, который может быть тканеспецифическим, тканепредпочтительным, связанным с развитием и/или промотором другого типа.
[96] В соответствии с вариантами реализации данного изобретения предложены рекомбинантные молекула ДНК, вектор или конструкция, содержащие последовательность ДНК пригодную для транскрипции, кодирующую некодирующую молекулу РНК, при этом некодирующая молекула РНК является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% комплементарной по меньшей мере сегменту или части молекулы мРНК (i), экспрессируемой из трансгена FT и/или (ii) кодирующей белок FT в растении или клетке растения, при этом последовательность ДНК пригодная для транскрипции функционально связана с промотором пригодным для экспрессии в растениях. Некодирующая молекула РНК может быть нацелена на последовательность зрелой мРНК или мРНК-предшественника, 5' или 3' нетранслируемую область (НТО), кодирующую последовательность (экзон) и/или интрон или интронную последовательность трансгена или транскрипта FT. В соответствии с некоторыми вариантами реализации изобретения некодирующая молекула РНК нацелена на трансген FT для супрессии и является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% комплементарной по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26 или по меньшей мере 27 последовательным нуклеотидам полинуклеотидной (кодирующей) последовательности, кодирующей белок FT (например, SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27 или 29), или любой другой известной кодирующей последовательности флоригенного FT. В соответствии с другими вариантами реализации изобретения некодирующая молекула РНК является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% комплементарной по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26 или по меньшей мере 27 последовательным нуклеотидам молекулы мРНК, кодирующей белок FT, который является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичным SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 или 30, или любой другой известной белковой последовательности флоригенного FT или ее функциональному фрагменту. В контексте данного документа термин «последовательный» в отношении полинуклеотидной или белковой последовательности означает отсутствие делеций или гэпов в последовательности. В соответствии с вариантами реализации данного изобретения некодирующая молекула РНК, кодируемая последовательностью ДНК пригодной для транскрипции рекомбинантных молекулы ДНК, вектора или конструкции, предложенных в данном документе, может представлять собой зрелую микроРНК или миРНК, или микроРНК- или миРНК-предшественника, которые могут процессироваться или расщепляться в клетке растения с образованием зрелой микроРНК или миРНК.
[97] В соответствии с некоторыми вариантами реализации изобретения последовательность ДНК пригодная для транскрипции может содержать последовательность, кодирующую нацеливающую последовательность молекулы РНК, которая является комплементарной и/или гибридизируется с мРНК конкретного гена или трансгена Gm.FT2a для нацеливания на ген или трансген Gm.FT2a для супрессии. Транскрибируемая последовательность ДНК может содержать последовательность (например, SEQ ID NO: 65), кодирующую нацеливающую последовательность (например, SEQ ID NO: 66) молекулы РНК, кодируемой последовательностью ДНК пригодной для транскрипции или транскрибируемой с нее. Нацеливающая последовательность молекулы РНК может представлять собой любую последовательность достаточной длины, которая является комплементарной с сегментом или частью мРНК, кодируемой трансгеном FT, а последовательность ДНК пригодная для транскрипции может содержать последовательность, которая кодирует нацеливающую последовательность молекулы РНК или транскрибируется в нее. Например, последовательность ДНК пригодная для транскрипции, кодирующая микроРНК-предшественника, может содержать SEQ ID NO: 67, которая может процессироваться в зрелую микроРНК, содержащую SEQ ID NO: 67, нацеленную на ген или трансген Gm.FT2a для супрессии. мРНК, кодируемая целевым геном или трансгеном FT, может содержать целевой сайт для молекулы РНК, кодируемой последовательностью ДНК пригодной для транскрипции. Такой целевой сайт в мРНК трансгена FT может содержать, например, SEQ ID NO: 68, которая может кодироваться последовательностью (например, SEQ ID NO: 69) гена или трансгена FT. Таким образом, кодирующая полинуклеотидная последовательность трансгена FT может содержать последовательность, кодирующую целевой сайт для молекулы РНК.
[98] Кроме промотора пригодного для экспрессии в растениях, рекомбинантные молекула ДНК, конструкция, вектор или экспрессионная кассета, содержащие последовательность ДНК пригодную для транскрипции, кодирующую некодирующую молекулу РНК для супрессии трансгена FT, также могут быть функционально связаны с одним или более дополнительными регуляторными элементами, такими как энхансеры, сайты инициации транскрипции (СИТ), линкеры, сигналы полиаденилирования, 5' и/или 3' каркасные или остовные последовательности, последовательности или области терминации и т. д., которые подходят, необходимы или предпочтительны для регуляции или обеспечения экспрессии последовательности ДНК пригодной для транскрипции в клетке или ткани растения. Такие дополнительные регуляторные элементы могут быть необязательными и использоваться для повышения или оптимизации экспрессии последовательности ДНК пригодной для транскрипции.
[99] В соответствии с некоторыми вариантами реализации изобретения последовательность ДНК пригодная для транскрипции может содержать последовательность, которая соответствует по меньшей мере части некодирующей последовательности трансгена FT и/или комплементарной с ним последовательности, такую как 5' или 3' нетранслируемая область (НТО) или интронная последовательность трансгена FT, что может обеспечить возможность избирательной супрессии трансгена FT относительно эндогенного гена FT. «Некодирующие последовательности трансгена FT» (не путать с «некодирующей молекулой РНК», кодируемой последовательностью ДНК пригодной для транскрипции, для супрессии гена или трансгена FT) представляют собой последовательности трансгена FT, которые транскрибируются и образуют часть пре-мРНК и/или зрелой мРНК, но не кодируют трансгенный белок FT. Соответственно, последовательность ДНК пригодная для транскрипции может кодировать молекулу РНК, содержащую нацеливающую последовательность, которая соответствует по меньшей мере части некодирующей последовательности трансгена FT и/или комплементарной с ней последовательности. Таким образом, последовательность ДНК пригодная для транскрипции может содержать последовательность, которая соответствует по меньшей мере части пре-мРНК или зрелой мРНК, кодируемой трансгеном FT. Последовательность последовательности ДНК пригодной для транскрипции и кодируемая нацеливающая последовательность молекулы РНК зависят от конкретных некодирующих последовательностей трансгена FT, которые могут быть одинаковыми или разными или уникальными относительно эндогенного (-ых) гена (-ов) FT. В соответствии с некоторыми вариантами реализации изобретения предложены рекомбинантные молекула ДНК, вектор или конструкция, содержащие экспрессионную кассету, которая содержит последовательность ДНК пригодную для транскрипции, имеющую последовательность, которая соответствует по меньшей мере части некодирующей последовательности трансгена FT и/или комплементарной с ней последовательности. Аналогично, как описано выше, могут быть предоставлены две или более экспрессионных кассет, включая первую экспрессионную кассету и вторую экспрессионную кассету, при этом первая экспрессионная кассета содержит полинуклеотидную последовательность, кодирующую белок FT (т. е. трансген FT), функционально связанную с первым промотором пригодным для экспрессии в растениях, а вторая экспрессионная кассета содержит последовательность ДНК пригодную для транскрипции, функционально связанную со вторым промотором пригодным для экспрессии в растениях, причем последовательность ДНК пригодная для транскрипции содержит последовательность, которая соответствует по меньшей мере части некодирующей последовательности трансгена FT и/или комплементарной ей последовательности. Первая и вторая экспрессионные кассеты могут находиться в одной молекуле ДНК, одном векторе или одной конструкции или в отдельных молекулах ДНК, векторах или конструкциях.
[100] Транскрибируемая последовательность ДНК, кодирующая молекулу РНК, которая нацелена на трансген FT для супрессии, может быть функционально связана с промотором пригодным для экспрессии в растениях. Профиль экспрессии молекулы РНК может зависеть от конкретного промотора пригодного для экспрессии в растениях. Как описано выше, экспрессию трансгена FT под управлением промотора вегетативной стадии можно использовать для инициации раннего цветения и повышения числа цветков, бобов и т. д. на узел растения, но также она может приводить к ранней гибели растения. Недавно было сделано предположение, что дополнительную экспрессию молекулы РНК, нацеленной на трансген FT для супрессии, можно использовать для корректировки и/или ослабления профиля и уровня экспрессии трансгена FT для дополнительного смягчения фенотипов ранней терминации. Это может происходить посредством снижения количества транскрипта и белка из трансгена FT (т. е. снижения уровня экспрессии) и/или модификации профиля экспрессии (т. е. корректировки или ограничения профиля трансгенной экспрессии FT). Не ограничиваясь теорией, считается, что снижение экспрессии трансгена FT может быть достаточно для индукции раннего цветения со смягчением фенотипов ранней терминации. Аналогично, ограниченный пространственно-временный профиль экспрессии FT может снижать экспрессию FT в конкретных тканях и/или на конкретных стадиях развития, когда трансгенный FT может вызывать раннюю терминацию. Таким образом, в соответствии с вариантами реализации данного изобретения время и профиль экспрессии трансгена FT и молекулы РНК (нацеленной на трансген FT для супрессии) могут быть одинаковыми, перекрывающимися или разными.
[101] В соответствии со многими вариантами реализации изобретения, приведенными выше, могут быть предоставлены по меньшей мере две экспрессионные кассеты, включая первую экспрессионную кассету и вторую экспрессионную кассету, при этом первая экспрессионная кассета содержит трансген FT, функционально связанный с первым промотором пригодным для экспрессии в растениях, а вторая экспрессионная кассета содержит последовательность ДНК пригодную для транскрипции, функционально связанную со вторым промотором пригодным для экспрессии в растениях, причем последовательность ДНК пригодная для транскрипции кодирует молекулу РНК, нацеленную на трансген FT для супрессии. Две экспрессионные кассеты могут находиться в одной рекомбинантной молекуле ДНК, конструкции или векторе или находиться в отдельных рекомбинантных молекулах ДНК, конструкциях или векторах. Как описано выше, первый промотор пригодный для экспрессии в растениях, функционально связанный с трансгеном FT, может быть промотором вегетативной стадии, который также может быть меристемо-специфическим или меристемо-предпочтительным промотором. Второй промотор пригодный для экспрессии в растениях, функционально связанный с последовательностью ДНК пригодной для транскрипции, может включать различные типы промоторов, включая конститутивные, индуцибельные, связанные с развитием, тканеспецифические, тканепредпочтительные, вегетативной стадии, генеративной стадии и т. д., но время и профиль экспрессии молекулы РНК должны по меньшей мере частично перекрываться со временем и профилем экспрессии трансгена FT. В соответствии с некоторыми вариантами реализации изобретения второй промотор пригодный для экспрессии в растениях может быть конститутивным промотором или промотором вегетативной стадии для снижения уровня экспрессии трансгена FT. Такой конститутивный промотор или промотор вегетативной стадии также может быть тканеспецифическим или тканепредпочтительным промотором и/или может характеризоваться широким перекрытием со временем и профилем экспрессии трансгена FT. В действительности конститутивный или перекрывающийся профиль экспрессии последовательности ДНК пригодной для транскрипции (и супрессорной молекулы РНК) по отношению к трансгену FT может быть эффективным при снижении количества или дозы экспрессии FT, в особенности если супрессия трансгена FT является неидеальной или неполной. В некоторых случаях трансген FT и супрессорная конструкция даже могут быть функционально связаны с одинаковыми или сходными промоторами. Например, первый промотор пригодный для экспрессии в растениях, управляющий экспрессией трансгена FT, может представлять собой промотор ранней или поздней вегетативной стадии и/или генеративной стадии, а второй промотор пригодный для экспрессии в растениях, управляющий экспрессией последовательности ДНК пригодной для транскрипции, кодирующей молекулу РНК для супрессии, может представлять собой промотор ранней или поздней вегетативной стадии и/или генеративной стадии
[102] В данной области техники известно много примеров конститутивных промоторов, таких как промотор вируса мозаики цветной капусты (CaMV) 35S и 19S (смотрите, например, патент США № 5352605), усиленный промотор CaMV 35S, такой как промотор CaMV 35S с областью омега (смотрите, например, Holtorf, S. et al., Plant Molecular Biology, 29: 637-646 (1995) или двойной усиленный промотор CaMV (смотрите, например, патент США № 5322938), промотор вируса мозаики норичника (FMV) 35S (смотрите, например, патент США № 6372211), промотор вируса мозаики мирабилис (MMV) (смотрите, например, патент США № 6420547), промотор колимовируса хлоротичной полосатости арахиса (смотрите, например, патент США № 5850019), нопалиновый или октопиновый промотор, убиквитиновый промотор, такой как полиубиквитиновый промотор сои (смотрите, например, патент США № 7393948), промотор S-аденозилметионинсинтетазы Arabidopsis (смотрите, например, 8809628) и т. д., или любые функциональные части вышеуказанных промоторов, при этом содержание каждой из вышеприведенных ссылок включено в данный документ посредством ссылки. В альтернативном варианте второй промотор пригодный для экспрессии в растениях может представлять собой промотор вегетативной и/или генеративной стадии, примеры которых приведены в данном документе.
[103] В соответствии с другими вариантами реализации изобретения второй промотор пригодный для экспрессии в растениях может иметь более отличающиеся время и/или профиль экспрессии, например, в других тканях растения и/или на других стадиях развития, относительно трансгена FT. Таким образом, эффективный пространственно-временной профиль экспрессии трансгена FT можно модифицировать, изменять и/или корректировать в зависимости от относительных времени и профилей экспрессии трансгена FT и последовательности ДНК пригодной для транскрипции, кодирующей молекулу РНК для супрессии трансгена FT (а также конкретной нацеливающей последовательности молекулы РНК). При этом, в соответствии со многими вариантами реализации изобретения последовательность ДНК пригодная для транскрипции (и молекула РНК) может экспрессироваться на более поздней стадии развития или в более поздней ткани относительно начала экспрессии трансгена FT, так что трансген FT может обеспечивать сигнал индукции раннего цветения перед супрессией более поздней экспрессией супрессорной молекулы РНК, или, иными словами, трансген FT может супрессироваться после сигнала индукции раннего цветения для снижения или смягчения ранней терминации. Например, первый промотор пригодный для экспрессии в растениях, управляющий экспрессией трансгена FT, может представлять собой промотор ранней вегетативной стадии, а второй промотор пригодный для экспрессии в растениях, управляющий экспрессией последовательности ДНК пригодной для транскрипции, кодирующей молекулу РНК для супрессии, может представлять собой промотор поздней вегетативной стадии и/или промотор генеративной стадии, или первый промотор пригодный для экспрессии в растениях может представлять собой промотор поздней вегетативной стадии, а второй промотор пригодный для экспрессии в растениях может представлять собой промотор генеративной стадии. В более широком смысле второй промотор пригодный для экспрессии в растениях может инициировать, вызывать и/или регулировать экспрессию связанного с ним трансгена или последовательности ДНК пригодной для транскрипции на более поздней стадии развития, чем первый промотор пригодный для экспрессии в растениях, так, чтобы супрессорная конструкция в общем случае экспрессировалась после исходного сигнала индукции FT цветения во время более ранней (-их) вегетативной (-ых) стадии (-ий) развития. Таким образом, второй промотор пригодный для экспрессии в растениях может представлять собой промотор более поздней стадии развития, чем первый промотор пригодный для экспрессии в растениях. Например, второй промотор пригодный для экспрессии в растениях может управлять экспрессией на более поздней стадии развития, чем первый промотор пригодный для экспрессии в растениях, но в тех же самых типах тканей или линиях дифференцировки (например, в меристеме), что и первый промотор пригодный для экспрессии в растениях. Такой промотор вегетативной стадии и/или генеративной стадии также может быть тканеспецифическим или тканепредпочтительным промотором, таким как меристемо-специфический или меристемо-предпочтительный меристемы промотор. Примеры промоторов поздней вегетативной стадии приведены выше.
[104] Посредством экспрессии последовательности ДНК пригодной для транскрипции и молекулы РНК для супрессии трансгена FT во время одной или более поздних стадий развития растения относительно трансгена FT, эффективный профиль экспрессии трансгена FT можно модифицировать, изменять и/или корректировать до более ранних стадий развития и/или тканей относительно экспрессии одного трансгена FT. В некоторых случаях экспрессия трансгена FT на вегетативной стадии может задерживаться или продолжаться во время более поздних вегетативных и/или генеративных стадий или в более поздних тканях в растении. Таким образом, экспрессия молекулы РНК, которая нацелена на трансген FT для супрессии, может снижать уровень трансгена FT на этих более поздних стадиях и/или в более поздних тканях для эффективного ограничения уровня экспрессии трансгена FT до более ранних стадий развития и/или тканей. В результате можно поддерживать или сохранять сигнал индукции раннего цветения, тогда как более позднюю экспрессию FT можно ослаблять или уменьшать, чтобы избежать или замедлить раннюю терминацию оставшихся меристематических резервов растения и обеспечить возможность продолжения вегетативного роста и развития растения после цветения.
[105] В контексте данного документа промотор «генеративной стадии» определяется как любой промотор, который инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время одной или более генеративных стадий развития растения, например, во время одной или более из стадий развития R1, R2, R3, R4, R5, R6, R7 и/или R8. Такой промотор «генеративной стадии» может быть дополнительно определен как «предпочтительный в отношении генеративной стадии» промотор, который инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции по меньшей мере предпочтительно или главным образом, если не исключительно, во время одной или более генеративных стадий развития растения (в противоположность вегетативным стадиям). При этом каждый из промотора «генеративной стадии» и «предпочтительного в отношении генеративной стадии» промотора также может инициировать, обеспечивать, допускать, вызывать, регулировать и т. д. транскрипцию или экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время вегетативной (-ых) фазы (фаз) или стадии (-ий) развития в одной или более клетках или тканях растения. Таким образом, промотор генеративной стадии также может быть промотором вегетативной стадии при экспрессии во время обеих фаз развития (т. е. во время как вегетативной, так и генеративной стадий развития). Такой промотор генеративной стадии также может быть тканеспецифическим или тканепредпочтительным промотором, таким как меристемо-специфический или меристемо-предпочтительный промотор. Промотор «генеративной стадии» может быть дополнительно определен как инициирующий, вызывающий, регулирующий и т. д. транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции в одной или более генеративных тканях растения. Такой промотор «генеративной стадии» также может быть определен как «флорально-предпочтительный» промотор, который инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции по меньшей мере предпочтительно или главным образом, если не исключительно, по меньшей мере в одной флоральной или генеративной ткани, такой как флоральная меристема, или «флорально-специфический» промотор, который инициирует, вызывает, регулирует и т. д. транскрипцию или экспрессию связанного с ним гена/трансгена или последовательности ДНК пригодной для транскрипции исключительно (или почти исключительно) по меньшей мере в одной флоральной или генеративной ткани. Признаки и характеристики этих генеративных стадий для заданного вида растения известны в данной области техники.
[106] Примеры промоторов генеративной стадии, которые также могут быть промоторами ранней или поздней вегетативной стадии в зависимости от их профиля экспрессии в заданном виде растения, могут включать следующие промоторы из генов томата: промотор Sl.Nod (pSl.Nod, pLe.Nod или pNod) (SEQ ID NO: 70), промотор Sl.MADS5 (pSl.MADS5, pLe.MADS5 или pMADS5) (SEQ ID NO: 71) или промотор Sl.MADS-RIN (pSl.MADS-RIN, pLe.MADS-RIN или pMADS-RIN) (SEQ ID NO: 72), или их функциональную часть. Дополнительные примеры, идентифицированные как имеющие гомологию и/или сходный профиль экспрессии с промотором pSl.MADS5 и/или pSl.MADS-RIN в нативных видах растений, могут включать промотор из одного из следующих генов: AT1G24260.1 (SEQ ID NO: 73), AT2G45650.1 (SEQ ID NO: 74), AT3G02310.1 (SEQ ID NO: 75), или AT5G15800.1 (SEQ ID NO: 76), или AT2G03710.1 (SEQ ID NO: 77) из Arabidopsis; Glyma05g28140 (SEQ ID NO: 78), Glyma08g11120 (SEQ ID NO: 79), Glyma11g36890 (SEQ ID NO: 80), Glyma08g27670 (SEQ ID NO: 81), Glyma13g06730 (SEQ ID NO: 82), или Glyma19g04320 (SEQ ID NO: 83) из сои; Solyc02g089200 (SEQ ID NO: 84), Solyc03g114840 (SEQ ID NO: 85), Solyc12g038510 (SEQ ID NO: 86), Solyc04g005320 (SEQ ID NO: 87) или Solyc05g056620 (SEQ ID NO: 88) из томата; или GRMZM2G159397 (SEQ ID NO: 89), GRMZM2G003514 (SEQ ID NO: 90), GRMZM2G160565 (SEQ ID NO: 91), GRMZM2G097059 (SEQ ID NO: 92), GRMZM2G099522 (SEQ ID NO: 93) или GRMZM2G071620 (SEQ ID NO: 94) из кукурузы или любую функциональную часть любого из вышеприведенных промоторов.
[107] В соответствии с вариантами реализации данного изобретения промотор «генеративной стадии» также может быть дополнительно определен по конкретной генеративной стадии, во время которой он впервые вызывает, инициирует и т. д. наблюдаемую или выраженную транскрипцию или экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции. Например, промотор генеративной стадии может представлять собой промотор стадии R1, промотор стадии R2, промотор стадии R3 и т. д. Следовательно, промотор «стадии R1» определяется как промотор генеративной стадии, который впервые инициирует или вызывает транскрипцию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время стадии R1 развития растения, промотор «стадии R2» определяется как промотор генеративной стадии, который впервые инициирует или вызывает транскрипцию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции во время стадии R2 развития растения, и т. д., хотя экспрессия связанного гена, трансгена или последовательности ДНК пригодной для транскрипции может происходить непрерывно или с перерывами в одной или более тканях во время более поздних генеративных стадий развития. Переход от вегетативной к генеративной стадии (и начало стадии R1) определяется в соответствии со стандартными в данной области техники конвенциями для заданного культурного растения (т. е. обычно, как в случае сои, это видимое появление первого открытого цветка на растении). Специалист в данной области техники сможет определить время экспрессии заданного гена, трансгена или последовательности ДНК пригодной для транскрипции во время развития растения, используя различные методы и техники молекулярного анализа, известные в данной области техники, если это время экспрессии уже не известно.
[108] В соответствии с вариантами реализации данного изобретения промотор «генеративной стадии» может включать конститутивный, тканепредпочтительный или тканеспецифический промотор. Например, промотор генеративной стадии может регулировать экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции в одной или более тканях растения, например, в одном или более из корней, стеблей, листьев, меристем и т. д. во время генеративной (-ых) стадии (-ий) развития растения. При этом такой промотор генеративной стадии может предпочтительно регулировать экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции в одной или более меристем растения. В соответствии со многими вариантами реализации изобретения промотор «генеративной стадии» может быть «меристемо-специфическим» или «меристемо-предпочтительным» промотором, который вызывает экспрессию связанного с ним гена, трансгена или последовательности ДНК пригодной для транскрипции в меристематической ткани, которая по меньшей мере частично соответствует профилю экспрессии трансгена FT и ослабляет и/или корректирует экспрессию трансгена FT.
[109] Полинуклеотидная последовательность этих промоторов (или их функциональных фрагментов или частей) также может иметь нестрогую идентичность последовательности и при этом сохранять сходный или идентичный профиль экспрессии связанных гена, трансгена или последовательности ДНК пригодной для транскрипции, функциональной связанных с промотором. Например, промотор поздней вегетативной и/или генеративной стадии может содержать полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичной полинуклеотидной последовательности, выбранной из вышеприведенных SEQ ID NO: 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 или 94, или ее функциональной части. «Функциональная часть» известной или предложенной промоторной последовательности определена выше.
[110] В соответствии с вариантами реализации данного изобретения молекула РНК, кодируемая второй экспрессионной кассетой, содержащей последовательность ДНК пригодную для транскрипции, функционально связанную со вторым промотором пригодным для экспрессии в растениях, может вызывать снижение или элиминацию уровня экспрессии мРНК и/или белка, кодируемых трансгеном FT в одной или более тканях растения посредством супрессии трансгена FT. При применении второй экспрессионной кассеты уровень экспрессии транскрипта трансгенного FT и/или белка может быть снижен по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% в одной или более тканях растения, таких как одна или более меристематических тканей, по сравнению с уровнями транскрипта мРНК и/или белка трансгена FT, которые наблюдались бы в тех же самых тканях растения без второй экспрессионной кассеты. Уровни транскрипта мРНК и/или белка трансгена FT могут быть снижены на 1%-100%, 1%-75%, 1%-50%, 1%-25%, 5%-100%, 5%-95%, 5%-90%, 5%-85%, 5%-80%, 5%-75%, 5%-70%, 5%-65%, 5%-60%, 5%-55%, 5%-50%, 5%-45%, 5%-40%, 5%-35%, 5%-30%, 5%-25%, 5%-20%, 5%-15%, 5%-10%, 10%-100%, 10%-90%, 10%-80%, 10%-70%, 10%-60%, 10%-50%, 10%-40%, 10%-30%, 10%-20%, 25%-100%, 25%-75%, 25%-50%, 50%-100%, 50%-75% или 75%-100% в одной или более тканях растения по сравнению с уровнями транскрипта мРНК и/или белка трансгена FT, которые наблюдались бы в тех же самых тканях растения без второй экспрессионной кассеты.
[111] В соответствии с дополнительными вариантами реализации изобретения в ином случае вторая экспрессионная кассета может быть сконструирована так, чтобы кодировать молекулу РНК, которая нацелена на эндогенный ген FT для супрессии. Избирательную супрессию эндогенного гена FT можно обеспечивать путем нацеливания на его кодирующую последовательность, если трансген FT имеет отличную от эндогенного гена кодирующую последовательность (т. е. молекула РНК может содержать нацеливающую последовательность, которая является комплементарной по меньшей мере части кодирующей последовательности эндогенного гена FT). В альтернативном варианте, даже если кодирующие последовательности трансгена FT и эндогенного гена FT являются одинаковыми или сходными, вторая экспрессионная кассета может быть сконструирована так, чтобы кодировать молекулу РНК, которая нацелена на нетранслируемую или некодирующую последовательность мРНК, кодируемой эндогенным геном FT, например, в пределах 5' НТО, 3'НТО, интронных и/или лидерных последовательностей мРНК-транскрипта эндогенного FT, если эти последовательности отличаются или отсутствуют в трансгене FT (т. е. молекула РНК может содержать нацеливающую последовательность, которая является комплементарной по меньшей мере части нетранслируемой или некодирующей последовательности эндогенного гена FT). В соответствии с этими вариантами реализации изобретения последовательность ДНК пригодная для транскрипции второй экспрессионной кассеты может быть сконструирована в соответствии с предложенными в данном документе принципами для нацеливания на конкретную кодирующую или нетранслируемую (некодирующую) последовательность мРНК, кодируемую эндогенным геном FT, для супрессии, вместо последовательности мРНК, кодируемой трансгеном FT.
[112] В соответствии с другим широким аспектом данного изобретения предложены рекомбинантные молекула ДНК, конструкция или вектор, содержащие полинуклеотидную последовательность, кодирующую белок FT (т. е. трансген FT), функционально связанную с промотором пригодным для экспрессии в растениях, при этом полинуклеотидная последовательность дополнительно содержит последовательность, кодирующую целевой сайт или сенсор для эндогенной молекулы РНК, такой как эндогенная микроРНК или миРНК, при этом целевой сайт или сенсор находятся в транскрипте пре-мРНК и/или зрелой мРНК, кодируемом трансгеном FT, например, в пределах 5' НТО, 3'НТО, интронных и/или лидерных последовательностей. В контексте данного документе «сенсор» представляет собой целевой сайт малой некодирующей РНК в мРНК-транскрипте трансгена FT, который является комплементарным эндогенной молекуле РНК, такой как эндогенная микроРНК или миРНК. Эндогенная молекула РНК может встречаться в природе в клетке или ткани растения и функционировать, подавляя один или более целевых генов, имеющих целевой сайт для эндогенной молекулы РНК. В данном документе сделано предположение, что трансген FT может быть дополнительно сконструирован так, чтобы содержать последовательность, кодирующую целевой сайт или сенсор мРНК для эндогенной молекулы РНК, так, чтобы происходила супрессия трансгена FT эндогенной молекулой РНК. Следовательно, супрессию трансгена FT можно использовать для смягчения фенотипов ранней терминации, наблюдаемых при только экспрессии трансгенного FT (т. е. без супрессии), аналогично супрессии посредством второй экспрессионной кассеты, кодирующей супрессионную молекулу РНК. Эндогенная молекула РНК может представлять собой любую известную встречающуюся в природе малую молекулу РНК, такую как микроРНК, миРНК и т. д., чья функция состоит в инициации супрессии одного или более целевых генов в клетке растения. В соответствии со многими вариантами реализации изобретения эндогенная молекула РНК может естественным образом экспрессироваться во время поздних вегетативных и/или генеративных стадий развития (например, в одной или более поздних вегетативных, генеративных и/или флоральных тканях) так, что эндогенная молекула РНК вызывает супрессию трансгена FT после обеспечения исходного сигнала индукции цветения. В соответствии со многими вариантами реализации изобретения промотор пригодный для экспрессии в растениях, целевой сайт трансгена FT или они оба являются гетерологичными по отношению к кодирующей полинуклеотидной последовательности трансгена FT.
[113] В соответствии с некоторыми вариантами реализации изобретения эндогенная молекула РНК может представлять собой одну или более эндогенных молекул микроРНК, например, одну или более из молекул РНК miR156 и/или miR172. Последовательности эндогенных молекул miR156 и miR172 будут зависеть от конкретного вида растения, в котором будет экспрессироваться трансген FT. трансген FT может быть сконструирован так, чтобы кодировать целевой сайт или сенсор мРНК для молекулы miR156 или miR172 в представляющем интерес виде растения, которое может быть выбрано на основании уровня и времени экспрессии одной или более молекул miR156 и miR172. В сое существует три молекулы miR172, которые экспрессируются на более высоких уровнях во время, близкое к переходу от вегетативной к генеративной стадии, miRNA172a (SEQ ID NO: 95), miRNA172c (SEQ ID NO: 96), или miRNA172k (SEQ ID NO: 97), и существует три молекулы miR156, которые присутствуют в избытке при переходе от молодого ко взрослому растению, miR156a (SEQ ID NO: 103), miR156c (SEQ ID NO: 104), или miR156q (SEQ ID NO: 105). Таким образом, полинуклеотидная последовательность, кодирующая белок FT, может дополнительно содержать последовательность, кодирующую один или более целевых сайтов или сенсоров для одной или более таких эндогенных молекул РНК miR156 или miR172. Каждый из целевых сайтов или сенсоров miR156 или miR172 может находиться в транскрипте пре-мРНК и/или зрелой мРНК, кодируемом трансгеном FT, например, в пределах кодирующей, 5' НТО, 3'НТО и/или интронной последовательности РНК, кодируемой полинуклеотидной последовательностью трансгена FT, хотя целевые сайты или сенсоры miR156 или miR172 чаще находятся в некодирующей и/или нетранслируемой последовательности. Примеры последовательностей, кодирующих целевой сайт или сенсор для молекулы miR156 сои, включают SEQ ID NO: 106, 108, 109 и 110, которые являются комплементарными с одной или более молекулами miR156. Например, последовательность, приведенная как SEQ ID NO: 106, кодирует SEQ ID NO: 107 как целевой сайт или сенсор мРНК для miR156. Примеры последовательностей, кодирующих целевой сайт или сенсор для молекулы miR172 сои, включают SEQ ID NO: 98, 100 и 101, которые являются комплементарными с одной или более молекулами miR172. Например, последовательность, приведенная как SEQ ID NO: 98, кодирует SEQ ID NO: 99 как целевой сайт или сенсор мРНК для miR172. При этом последовательность целевого сайта или сенсора трансгена FT можно определить на основании комплементарной последовательности известной молекулы miR156 или miR172. В действительности, в зависимости от последовательности одной или более эндогенных молекул miR156, miR172 и/или других малых молекул РНК, встречающихся в естественном состоянии в заданном виде растения, экспрессионную кассету трансгенного FT, трансформируемую в такой вид растения, можно сконструировать так, чтобы она кодировала целевой сайт или сенсор для такой эндогенной молекулы miR156, miR172 или другой малой молекулы РНК. В соответствии с некоторыми вариантами реализации изобретения первую экспрессионную кассету, содержащую трансген FT, можно сконструировать так, чтобы она имела последовательность, кодирующую целевой сайт или сенсор для эндогенной молекулы miR156, miR172 или другой малой молекулы РНК, даже если в тех же рекомбинантных молекуле ДНК, конструкции или векторе, или в том же трансгенном растении присутствует вторая экспрессионная кассета, которая содержат последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая дополнительно нацелена на тот же трансген FT для супрессии.
[114] В соответствии с вариантами реализации данного изобретения целевой сайт для эндогенной молекулы РНК будет зависеть от растения, в котором будет экспрессироваться трансген FT. Для многих двудольных видов известны последовательности miR156 и miR172 (и их целевые сайты и сенсоры). Целевой сайт или сенсор мРНК трансгенного FT, комплементарный с эндогенной молекулой РНК, может иметь длину 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27 (или более) нуклеотидов. Как правило, целевой сайт или сенсор трансгена FT сконструирован так, чтобы быть на 100% комплементарным эндогенной miR156 или miR172. Однако целевой сайт или сенсор для эндогенной супрессорной молекулы РНК не обязательно должен быть на 100% комплементарным эндогенной miR156 или miR172, чтобы быть эффективным (т. е., чтобы гибридизироваться с miR156 или miR172 и являться мишенью для супрессии). Например, не полностью идеальная комплементарность может обеспечить гибридизацию более чем одной молекулы miR156, miR172 и/или другой эндогенной молекулы РНК с целевым сайтом или сенсором. Для любого заданного вида растения целевой сайт или сенсор, кодируемый кодирующей полинуклеотидной последовательностью трансгена FT, может в некоторой степени варьироваться, но при этом связываться или гибридизироваться с эндогенной молекулой РНК, такой как эндогенная молекула РНК miR156 или miR172, при экспрессии в клетке растения. Соответственно, целевой сайт мРНК-транскрипта, кодируемый трансгеном FT, может содержать одно или более несовпадений, например 1, 2, 3, 4, 5, 6, 7, 8 или более несовпадений, в зависимости от длины выравнивания между эндогенной молекулой РНК (например, miR156, miR172) и мРНК-транскриптом. В действительности, целевой сайт, кодируемый кодирующей полинуклеотидной последовательностью трансгена FT, может быть по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97% по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5%, по меньшей мере на 99,9% или на 100% комплементарным с нацеливающей последовательностью эндогенной молекулы РНК (например, miR156 или miR172), например, как целевой сайт или сенсор для молекулы a miR172 в сое (SEQ ID NO: 98, 100 или 101) целевой сайт или сенсор для молекулы a miR156 в сое (SEQ ID NO: 106, 108, 109 или 110).
[115] В соответствии с другим широким аспектом данного изобретения предложены способы трансформации клетки, ткани или эксплантата растения рекомбинантными молекулой ДНК, конструкцией или вектором, предложенными в данном документе, для получения трансгенного растения. Рекомбинантные молекула ДНК, конструкция или вектор могут содержать трансген FT или экспрессионную кассету. В зависимости от типа супрессии, трансген FT может дополнительно содержать целевой сайт для эндогенной молекулы РНК. Рекомбинантные молекула ДНК, конструкция или вектор могут содержать вторую экспрессионную кассету, содержащую последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии. В альтернативном варианте трансген FT и последовательность ДНК пригодная для транскрипции, кодирующая молекулу РНК, могут находиться в двух отдельных молекулах ДНК, конструкциях или векторах, которые можно трансформировать в растения вместе или отдельно. Рекомбинантные молекулу ДНК, конструкцию или вектор, содержащие трансген FT и последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, можно трансформировать в растение. В соответствии с другими вариантами реализации изобретения первую рекомбинантную молекулу ДНК, конструкцию или вектор, содержащие трансген FT, и вторую рекомбинантную молекулу ДНК, конструкцию или вектор, содержащие последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, можно совместно трансформировать в растение. В соответствии с другими вариантами реализации изобретения растение, трансформированное первой экспрессионной кассетой, содержащей трансген FT, можно трансформировать второй экспрессионной кассетой, содержащей последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, или растение, трансформированное первой экспрессионной кассетой, содержащей последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, можно трансформировать второй экспрессионной кассетой, содержащей трансген FT. В соответствии с дополнительными вариантами реализации изобретения первое трансгенное растение, содержащее первую экспрессионную кассету, содержащую (i) трансген FT или (ii) последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, можно скрещивать со вторым растением, содержащим вторую экспрессионную кассету, содержащую (i) последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, или (ii) трансген FT, так, чтобы можно было получить одно или более дочерних растений, содержащих как первую, так и вторую экспрессионные кассеты (т. е. как трансген FT, так и последовательность ДНК пригодную для транскрипции).
[116] В данной области техники известны многочисленные способы трансформации хромосом в клетках растений рекомбинантными молекулой ДНК, конструкцией или вектором, которые можно применять в соответствии со способами данного изобретения для получения клетки трансгенного растения, части растения и растения. В соответствии с представленными способами можно применять любые подходящие способы или методики для трансформации растительных клеток, известные в данной области техники. эффективные способы трансформации растений включают бактериально-опосредованную трансформацию, такую как Agrobacterium-опосредованная или Rhizhobium-опосредованная трансформация и опосредованная бомбардировкой микрочастицами трансформация. В данной области техники известны различные способы трансформации эксплантатов трансформационным вектором путем бактериально-опосредованной трансформации или бомбардировки микрочастицами и последующего культивирования и т. д. этих эксплантатов для регенерации или выращивания трансгенных растений. Другие способы трансформации растений, такие как микроинъекция, электропорация, вакуумная инфильтрация, применение высокого давления, ультразвука, перемешивание с карбидокремниевыми волокнами, ПЭГ-опосредованная трансформация и т. д., также известны в данной области техники. Трансгенные растения, получаемые с помощью этих способов трансформации, могут быть химерными или нехимерными в отношении события трансформации, в зависимости от используемых способов и эксплантатов. Подходящие способы пластидной трансформации рекомбинантной молекулой ДНК или конструкцией также известны в данной области техники.
[117] Дополнительно предложены способы экспрессии трансгена FT в одной или более клетках или тканях растения под управлением промотора вегетативной стадии, который также может быть меристемо-предпочтительным или меристемо-специфическим промотором. Экспрессию трансгена FT можно модифицировать, ослаблять и/или корректировать за счет наличия целевого сайта или сенсора для эндогенной молекулы РНК в мРНК, кодируемой трансгеном FT, так, чтобы эндогенная молекула РНК была нацелена на трансген FT для супрессии. Кроме трансгена FT, молекула РНК, которая нацелена на трансген FT для супрессии, также может экспрессироваться из последовательности ДНК пригодной для транскрипции, трансформированной в растение. Такие способы можно использовать для изменения времени цветения растения и/или числа продуктивных или успешных цветков, фруктов, бобов и/или семян на узел растения по сравнению с растением дикого типа или контрольным растением, не содержащим трансген FT. В действительности, способы согласно данному изобретению можно применять для изменения связанных с генеративностью или урожайностью фенотипов или признаков трансгенного растения.
[118] Трансформацию целевого растительного материала или эксплантата можно осуществлять на практике в тканевой культуре в питательной среде, например, смеси питательных веществ, которые обеспечивают рост клеток in vitro. Целевые реципиентные клетки или эксплантаты могут включать, но не ограничиваются этим, меристемы, кончики побегов, протопласты, подсемядольные колена, каллюс, незрелые или зрелые эмбрионы, побеги, почки, узловые секции, листья, гаметы, такие как микроспоры, пыльца, спермии, яйцеклетки, и т. д. или любые их подходящие части. Предусматривается, что в качестве мишени для трансформации можно использовать любую трансформируемую клетку или ткань, из которой можно регенерировать или вырастить фертильное растение. Трансформированные эксплантаты, клетки или ткани можно подвергать дополнительным этапам культивирования, таким как индукция каллюса, селекция, регенерация и т. д., как известно в данной области техники. Трансформированные клетки, ткани или эксплантаты, содержащие вставку рекомбинантной ДНК, можно выращивать или регенерировать в трансгенные растения в культуре, наполнителе или почве в соответствии с известными в данной области техники способами. Трансгенные растения можно дополнительно скрещивать между собой или с другими растениями для получения трансгенных семян и потомства. Трансгенное растение также можно получать путем скрещивания первого растения, содержащего рекомбинантную последовательность ДНК или событие трансформации, со вторым растением, в котором отсутствует вставка. Например, рекомбинантную последовательность ДНК можно вносить в первую линию растений, подлежащих трансформации, которые затем можно скрещивать со второй линией растений для интрогрессии рекомбинантной последовательности ДНК во вторую линию растений. Потомство от такого скрещивания можно дополнительно многократно обратно скрещивать с более желательными линиями, например, на протяжении 6-8 поколений обратного скрещивания, для получения потомства с по существу таким же генотипом, что и исходная родительская линия, но с внесенной рекомбинантной последовательностью ДНК.
[119] Рекомбинантную ДНК-конструкцию или экспрессионную кассету согласно данному изобретению можно включать в ДНК-трансформационный вектор для использования при трансформации целевых клетки, ткани или эксплантата растения. Такой трансформационный вектор согласно данному изобретению может в общем случае содержать последовательности или элементы, необходимые или полезные для эффективной трансформации, помимо последовательности ДНК пригодной для транскрипции и/или трансгена FT или экспрессионной кассеты. В случае Agrobacterium-опосредованной трансформации трансформационный вектор может содержать сегмент сконструированной транспортной ДНК (или Т-ДНК) или область, имеющую две граничные последовательности, левую границу (ЛГ) и правую границу (ПГ), фланкирующие по меньшей мере последовательность ДНК пригодную для транскрипции и/или трансген FT, так, что вставка Т-ДНК в геном растения создаст событие трансформации для последовательности ДНК пригодной для транскрипции и/или трансгена FT. Другими словами, последовательность ДНК пригодная для транскрипции и/или трансген FT были бы расположены между левой и правой границами Т-ДНК, возможно, наряду с дополнительными трансгенами или экспрессионными кассетами, такими как трансген растительного селективного маркера и/или другие представляющие агрономический интерес гены, которые могут обеспечивать представляющий агрономический интерес признак или фенотип растению. Кроме кодирующих белок последовательностей, представляющие агрономический интерес гены могут дополнительно содержать полинуклеотидную последовательность, кодирующую супрессорный РНК-элемент. В соответствии с некоторыми вариантами реализации изобретения последовательность ДНК пригодная для транскрипции и/или трансген FT и трансген растительного селективного маркера (или другой представляющий агрономический интерес ген) могут находиться в отдельных сегментах Т-ДНК в одной или разных рекомбинантных молекулах ДНК, например, как для совместной трансформации. Трансформационный вектор или конструкция могут дополнительно содержать прокариотические поддерживающие элементы, которые в случае Agrobacterium-опосредованной трансформации могут находиться в остове вектора за пределами области (-ей) Т-ДНК.
[120] В соответствии с некоторыми вариантами реализации изобретения первая экспрессионная кассета, содержащая трансген FT, и вторая экспрессионная кассета, содержащая последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, могут находиться в одной Т-ДНК трансформационного вектора (т. е. между одними правой и левой границами Т-ДНК); первая экспрессионная кассета, содержащая трансген FT, может находиться в первой Т-ДНК (содержащей первую правую границу и первую левую границу), а вторая экспрессионная кассета, содержащая последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, может находиться во второй Т-ДНК (содержащей вторую правую границу и вторую левую границу), при этом первая и вторая Т-ДНК находятся в одном трансформационном векторе; или первая экспрессионная кассета, содержащая трансген FT, может находиться в первой Т-ДНК первого трансформационного вектора, а вторая экспрессионная кассета, содержащая последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, может находиться во второй Т-ДНК второго трансформационного вектора. Первую и вторую экспрессионные кассеты, находящиеся в одном или двух трансформационных векторах, можно совместно трансформировать в клетку растения, или же первая и вторая экспрессионные кассеты могут находиться в двух отдельных трансформационных векторах, и их трансформируют в клетки растения отдельно. Первую и вторую экспрессионные кассеты можно трансформировать в одну или более клеток растений, уже содержащих событие трансформации в отношении другой экспрессионной кассеты, или же первую и вторую экспрессионные кассеты можно трансформировать в разные клетки растения, которые можно выращивать или регенерировать в первое и второе трансгенное растение. Первое или второе трансгенные растения и/или их потомство можно скрещивать между собой так, чтобы свести вместе первую и вторую экспрессионные кассеты в одном растении.
[121] Трансген растительного селективного маркера в трансформационном векторе или конструкции согласно данному изобретению можно использовать для помощи в отборе трансформированных клеток или тканей вследствие наличия селекционного агента, такого как антибиотик или гербицид, при этом трансген растительного селективного маркера обеспечивает устойчивость или резистентность к селекционному агенту. Таким образом, селекционный агент может поддерживать или способствовать выживаемости, развитию, росту, пролиферации и т. д. трансформированных клеток, экспрессирующих ген растительного селективного маркера, так, чтобы увеличить долю трансформированных клеток в растении R0. Обычно используемые гены растительных селективных маркеров включают, например, те, которые обеспечивают устойчивость или резистентность к антибиотикам, таким как канамицин или паромомицин (nptII), гигромицин B (aph IV), стрептомицин или спектиномицин (aadA) и гентамицин (aac3 и aacC4), или те, которые обеспечивают устойчивость или резистентность к гербицидам, таким как глюфосинат (bar или pat), дикамба (DMO) и глифосат (aroA или EPSPS). Также можно использовать гены растительных селективных маркеров, которые обеспечивают возможность визуального скрининга в отношении трансформантов, например, люциферазы или зеленого флуоресцентного белка (ЗФБ), или ген, экспрессирующий бета-глюкуронидазу, или ген uidA (GUS), для которого известны различные хромогенные субстраты.
[122] В соответствии с вариантами реализации данного изобретения способы трансформации клетки, ткани или эксплантата растения рекомбинантной молекулой ДНК или конструкцией могут дополнительно включать сайт-направленную или нацеленную интеграцию. В соответствии с этими способами часть рекомбинантной донорной матричной молекулы ДНК (т. е. последовательность для вставки) можно вставлять или интегрировать в необходимый сайт или локус в геноме растения. Последовательность для вставки донорной матрицы может содержать трансген или конструкцию, такие как (i) трансген FT или конструкцию, содержащую полинуклеотидную последовательность, кодирующую белок FT, функционально связанную с промотором вегетативной стадии, который также может быть меристемо-предпочтительным или меристемо-специфическим промотором, и/или (ii) последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, и функционально связана с промотором вегетативной стадии и/или промотором генеративной стадии, который также может быть меристемо-предпочтительным или меристемо-специфическим промотором. Донорная матрица также может иметь одно или два плеча гомологии, фланкирующие последовательность вставки, для стимуляции события нацеленной вставки посредством гомологичной рекомбинации и/или гомологичной репарации. Таким образом, рекомбинантная молекула ДНК согласно данному изобретению может дополнительно содержать донорную матрицу для сайт-направленной или нацеленной интеграции трансгена или конструкции, такой как трансген или конструкция FT, в геном растения.
[123] Любой сайт или локус в геноме растения потенциально может быть выбран для сайт-направленной интеграции трансгена или конструкции согласно данному изобретению. В случае сайт-направленной интеграции сначала может создаваться двухцепочечный разрыв или «ник» в выбранном геномном локусе с помощью сайт-специфической нуклеазы, такой как, например, цинк-пальцевая нуклеаза (ZFN), мегануклеаза, нуклеаза, подобная активаторам транскрипции (TALEN), Argonaute (неограничивающие примеры белков Argonaute включают Thermus thermophilus Argonaute (TtAgo), Pyrococcus furiosus Argonaute (PfAgo), Natronobacterium gregoryi Argonaute (NgAgo), РНК-направляемая нуклеаза (неограничивающие примеры РНК-направляемых нуклеаз включают Cas1, Cas1B, Cas2, Cas3, Cas4, Cas5, Cas6, Cas7, Cas8, Cas9 (также известную как Csn1 и Csx12), Cas10, Csy1, Csy2, Csy3, Cse1, Cse2, Csc1, Csc2, Csa5, Csn2, Csm2, Csm3, Csm4, Csm5, Csm6, Cmr1, Cmr3, Cmr4, Cmr5, Cmr6, Csb1, Csb2, Csb3, Csx17, Csx14, Csx10, Csx16, CsaX, Csx3, Csx1, Csx15, Csf1, Csf2, Csf3, Csf4, Cpf1, их гомологи или их модифицированные версии); рекомбиназы (без ограничений, например, тирозиновой рекомбиназы, присоединенной к мотиву распознавания ДНК (например, рекомбиназы Cre, рекомбиназы Flp, рекомбиназы Tnp1), сериновой рекомбиназы, присоединенной к мотиву распознавания ДНК (например, интегразы PhiC31, интегразы R4, интегразы TP-901); транспозазы (без ограничений, например, ДНК-транспозазы, присоединенной к ДНК-связывающему домену); или любой их комбинации. Также предложены направляющие РНК (например, РНК CRISPR (crРНК), транс-активирующие РНК CRISPR (tracrРНК), направляющие РНК (нРНК), одинарные направляющие РНК (онРНК)), применимые в способах с использованием РНК-направляемых нуклеаз. Можно применять любой известный в данной области техники способ для сайт-направленной интеграции. В присутствии донорной матричной молекулы может происходить репарация двухцепочечного разрыва или «ника» посредством гомологичной рекомбинации между плечами гомологии донорной матрицы и геномом растения или посредством негомологичного соединения концов (НГСК), приводя к сайт-направленной интеграции последовательности вставки в геном растения для создания события нацеленной вставки в сайте двухцепочечного разрыва или «ника» или вблизи него. Таким образом, можно обеспечить сайт-специфическую вставку или интеграцию трансгена или конструкции.
[124] В контексте данного документа термин «вставка» в отношении трансформации растения или сайт-направленной интеграции относится к вставке или интеграции экзогенного полинуклеотида или ДНК-конструкции, молекулы или последовательности, такой как последовательность трансформационного вектора или Т-ДНК или последовательность вставки донорной матрицы, в геном растения. В этом контексте термин «экзогенный» относится к полинуклеотиду или ДНК-конструкции, молекуле или последовательности, которые вносят в клетку или ткань растения, используя подходящий способ или метод трансформации растения или редактирования генома, известный в данной области техники.
[125] В соответствии с вариантами реализации данного изобретения растение, которое можно трансформировать рекомбинантной молекулой ДНК или трансформационным вектором, содержащим трансген FT и/или последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, может включать множество цветущих растений или покрытосеменных растений, которые могут быть дополнительно определены как включающий различные виды двусемядольных (двудольных) растений, такие как соя, хлопок, люцерна, канола, сахарная свекла, люцерна и другие бобовые растения. Двудольное растение может быть представителем вида Brassica sp. (например, B. napus, B. rapa, B. juncea), в частности, видов Brassica, используемых в качестве источника растительных масел, люцерной (Medicago sativa), подсолнечником (Helianthus annuus), сафлором (Carthamus tinctorius), масличной пальмой (Elaeis spp.), кунжутом (Sesamum spp.), кокосом (Cocos spp.), соей (Glycine max), табаком (Nicotiana tabacum), картофелем (Solanum tuberosum), арахисом (Arachis hypogaea), хлопком (Gossypium barbadense, Gossypium hirsutum), сладким картофелем (Ipomoea batatus), маниокой (Manihot esculenta), кофе (Coffea spp.), чаем (Camellia spp.), фруктовыми деревьями, такими как яблоня (Malus spp.), Prunus spp., такие как слива, абрикос, персик, вишня и т. д., груша (Pyrus spp.), инжир (Ficus casica), банан (Musa spp.) и т. д., цитрусовыми деревьями (Citrus spp.), кокосом (Theobroma cacao), авокадо (Persea americana), оливой (Olea europaea), миндалем (Prunus amygdalus), грецким орехом (Juglans spp.), земляникой (Fragaria spp.), арбузом (Citrullus lanatus), перцем (Capsicum spp.), сахарной свеклой (Beta vulgaris), виноградом (Vitis, Muscadinia), томатом (Lycopersicon esculentum, Solanum lycopersicum) и огурцом (Cucumis sativis). Бобовые растения включают бобы и горох. Бобы включают, например, гуар, рожковое дерево, пажитник, сою, фасоль обыкновенную, коровий горох, маш, лимскую фасоль, обыкновенный боб, чечевицу и нут. Учитывая, что данное изобретение может относиться к широкому диапазону видов растений, данное изобретение дополнительно относится к другим ботаническим структурам, аналогичным бобам бобовых растений, таким как семенные коробочки, стручки, фрукты, орехи, клубни и т. д.
[126] В соответствии с вариантами реализации данного изобретения и в зависимости от конкретного трансформируемого вида растения, растение с эктопической экспрессией последовательности флоригенного FT, которую можно модифицировать посредством супрессии, как предложено в данном документе, может иметь измененное или большее число семенных коробочек, стручков, фруктов, орехов, клубней и т. д. на узел (-лы), главный стебель и/или ветку (-и) растения, и/или измененное или большее число семенных коробочек, стручков, фруктов, орехов, клубней и т. д. на растение по сравнению с растением дикого типа или контрольным растением, не содержащим трансген FT.
[127] В соответствии с другим широким аспектом данного изобретения предложены трансгенные растения, клетки растений, семена и части растений, содержащие одно или более событий трансформации или одну или более вставок в геноме по меньшей мере одной клетки растения, при этом событие трансформации или вставка содержат (i) рекомбинантную последовательность ДНК, конструкцию или полинуклеотид, содержащие трансген Flowering Locus T (FT), причем трансген FT содержит полинуклеотидную последовательность, кодирующую белок FT, функционально связанную с промотором вегетативной стадии, который также может быть меристемо-предпочтительным или меристемо-специфическим промотором, и/или (ii) последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, функционально связанную с промотором вегетативной стадии и/или промотором генеративной стадии, который также может быть меристемо-предпочтительным или меристемо-специфическим промотором. Как предложено в данном документе можно осуществлять нацеливание на трансген FT для супрессии посредством трансгенно экспрессируемой и/или эндогенной молекулы РНК. Молекула РНК может кодироваться последовательностью ДНК пригодной для транскрипции, которую также трансформируют в растение, часть растения, семя растения или клетку растения. Белок FT, кодируемый полинуклеотидной последовательностью, может соответствовать нативному гену FT в трансгенном растении, трансформированном полинуклеотидной кодирующей последовательностью, или быть гомологичным или сходным с белком FT, нативным для трансгенного растения (т. е. не нативным для трансгенного растения, но сходным с нативным или эндогенным белком FT), или гетерологичным для трансгенного растения. Такое трансгенное растение можно получать любым удобным способом трансформации, за которым могут следовать селекция, культивирование, регенерация, развитие и т. д., в случае желания или необходимости получения трансгенного растения R0, которое затем можно самоопылять или скрещивать с другими растениями для создания семян R1 и последующих поколений и семян посредством дополнительного скрещивания и т. д. Аналогично, варианты реализации данного изобретения дополнительно включают клетку, ткань, эксплантат и т. д. растения, содержащие одну или более трансгенных клеток, имеющих событие трансформации или геномную вставку рекомбинантной ДНК или полинуклеотидной последовательности, содержащей трансген FT и/или последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии.
[128] Трансгенные растения, клетки растений, семена и части растений согласно данному изобретению могут быть гомозиготными или гемизиготными в отношении трансгенного события или вставки трансгена FT и/или последовательности ДНК пригодной для транскрипции в геном по меньшей мере одной клетки растения, или могут содержать любое число копий трансгенных событий или вставок, содержащих трансген FT и/или последовательность ДНК пригодную для транскрипции. Доза или количество экспрессии трансгена FT могут меняться в зависимости от его зиготности и/или числа копий, что может влиять на степень или меру фенотипических изменений в трансгенном растении и т. д. В соответствии с некоторыми вариантами реализации изобретения трансгенное растение, содержащее трансген FT и/или элемент супрессии FT, которые можно модифицировать, ослаблять и/или корректировать, как предложено в данном документе, может дополнительно характеризоваться как имеющее один или более измененных фенотипов или признаков, связанных с цветением или генеративностью, которые могут включать измененные связанные с урожайностью признаки или фенотипы, такие как повышение числа цветков, бобов и т. д. и/или семян на растение (и/или на узел растения) по сравнению с растением дикого типа или контрольным растением, не содержащим трансген FT (и/или не содержащим элемент супрессии FT). Такое трансгенное растение может дополнительно характеризоваться как имеющее измененную структуру, морфологию и/или архитектуру вследствие изменения высоты растения, профиля ветвления, числа цветочных узлов и т. д. по сравнению с растением дикого типа или контрольным растением. В действительности, связанные с урожайностью фенотипы или признаки, изменяемые сверхэкспрессией FT в трансгенном растении, могут включать: время цветения, длительность генеративной стадии, длительность цветения, количество или время опадания цветков, бобов, стручков, семенных коробочек, фруктов, орехов и т. д., число цветков на узел, число кистей на узел, число веток на растение, число узлов на растение, число узлов на главном стебле, число узлов на ветках, число бобов, семенных коробочек, стручков, фруктов, орехов и т. д. на растение, число бобов, семенных коробочек, стручков, фруктов, орехов и т. д. на узел, число бобов, семенных коробочек, стручков, фруктов, орехов и т. д. на главном стебле, число бобов, семян, семенных коробочек, стручков, фруктов, орехов и т. д. на ветках, массу семян (например, массу 1000 семян), число семян на растение, число семян на главном стебле, число семян на узел и/или измененную архитектуру растения, по сравнению с растением дикого типа или контрольным растением, не содержащим трансген FT (и/или не содержащим элемент супрессии FT). В контексте данного документа термин «сверхэкспрессия» в отношении трансгена FT включает эктопическую экспрессию трансгена.
[129] В целях данного изобретения «растение» может включать эксплантат, сеянец, росток или целое растение на любой стадии регенерации или развития. В контексте данного документа термин «трансгенное растение» относится к растению, чей геном был изменен посредством интеграции или вставки рекомбинантной молекулы ДНК, конструкции или последовательности. Трансгенное растение включает растение R0, выращенное или регенерированное их исходной (-ых) трансформированной (-ых) клетки (-ок) растения, а также потомство трансгенных растений в последующих поколениях или продукты скрещивания трансгенного растения R0. В контексте данного документа термин «часть растения» может относиться к любому органу или интактной ткани растения, таким как меристема, орган/структура побега (например, лист, стебель и клубень), корень, цветок или орган/структура цветка (например, прицветник, чашелистик, лепесток, тычинка, плодолистик, пыльник и семяпочка), семя (например, эмбрион, эндосперм и семенная оболочка), фрукт (например, зрелая завязь), пропагула или другие ткани растения (например, сосудистая ткань, покровная ткань и т. п.), или любой их части. Части растения согласно данному изобретению могут быть жизнеспособными, нежизнеспособными, подлежащими регенерации и/или не подлежащими регенерации. «Пропагула» может включать любую часть растения, которая способна вырасти в целое растение. В целях данного изобретения клетка растения, трансформированная трансгеном FT и/или элементом супрессии FT в соответствии с вариантами реализации данного изобретения, может включать любую клетку растения, которая является компетентной для трансформации, как известно в данной области техники, с учетом способа трансформации, такую как клетка меристемы, эмбриональная клетка, клетка каллюса и т. д. В контексте данного документа термин «клетка трансгенного растения» просто относится к любой клетке растения, трансформированной стабильно интегрированной рекомбинантной молекулой ДНК или последовательностью. Клетка трансгенного растения может включать исходную трансформированную клетку растения, клетку трансгенного растения регенерированного или выращенного растения R0, или клетку трансгенного растения из любого дочернего растения трансформированного растения R0, включая клетки семени или эмбриона растения, или культивируемые клетки растения или клетки каллюса и т. д.
[130] В соответствии со многими вариантами реализации изобретения трансгенное растение может содержать полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором вегетативной стадии. В соответствии с некоторыми вариантами реализации изобретения экспрессию флоригенного белка FT в трансгенном растении можно подавлять на вегетативной и/или генеративной стадии и/или в вегетативной и/или генеративной ткани трансгенного растения, например, посредством эндогенной и/или трансгенно или эктопически экспрессируемой молекулы РНК. В соответствии с некоторыми вариантами реализации изобретения экспрессия флоригенного белка FT в трансгенном растении может быть пространственно и/или временно ограничена малой молекулой РНК. В соответствии с некоторыми вариантами реализации изобретения трансгенное растение может содержать последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на флоригенный ген или трансген FT для супрессии.
[131] Варианты реализации данного изобретения могут дополнительно включать способы создания или получения трансгенных растений, имеющих измененные связанные с генеративностью и/или урожайностью признаки или фенотипы, например, путем трансформации, скрещивания и т. д., при этом способ включает внесение рекомбинантной молекулы ДНК, конструкции или последовательности, содержащей трансген FT и/или последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, которая нацелена на трансген FT для супрессии, в клетку растения, и затем регенерацию или выращивание трансгенного растения из трансформированной клетки растения, что можно осуществлять в условиях селекционного давления, благоприятных для трансгенного события. Такие способы могут включать трансформацию клетки растения рекомбинантной молекулой ДНК или последовательностью, содержащей трансген FT и/или последовательность ДНК пригодную для транскрипции, и отбор растения, имеющего один или более измененных фенотипов или признаков, таких как одно или более из следующего: время цветения, длительность генеративной стадии, длительность цветения, количество или время опадания цветков, бобов, семенных коробочек, стручков, фруктов, орехов и т. д., число цветков на узел, число кистей на узел, число веток на растение, число узлов на растение, число узлов на главном стебле, число узлов на ветках, число бобов, семенных коробочек, стручков, фруктов, орехов и т. д. на растение, число бобов, семенных коробочек, стручков, фруктов, орехов и т. д. на узел, число бобов, семенных коробочек, стручков, фруктов, орехов и т. д. на главном стебле, число бобов, семян, семенных коробочек, стручков, фруктов, орехов и т. д. на ветках, массу семян (например, массу 1000 семян), число семян на растение, число семян на главном стебле, число семян на узел и/или измененная архитектура растения, по сравнению с растением дикого типа или контрольным растением, не содержащим трансген FT (и/или не содержащим элемент супрессии FT). Например, варианты реализации данного изобретения могут включать способы получения трансгенного растения, имеющего увеличенное число цветков, бобов и/или семян на растение (и/или увеличенное число цветков, бобов и/или семян на узел растения), при этом способ включает внесение рекомбинантной молекулы ДНК, содержащей трансген FT и/или последовательность ДНК пригодную для транскрипции, в клетку растения, и затем регенерацию или выращивание трансгенного растения из клетки растения. Затем можно проводить отбор трансгенного растения на основании одного или более вышеуказанных связанных с генеративностью и/или урожайностью признаков иди фенотипов. Отбор трансгенного растения, клетки растения или ткани растения также можно проводить на основании присутствия трансгена FT и/или элемента супрессии FT, используя один или более способов или наборов, известных в данной области техники, таких как секвенирование ДНК, гибридизация, связывание антител и/или другие молекулярные технологии.
[132] В соответствии с вариантами реализации данного изобретения трансгенное растение может иметь по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше цветков, бобов, семян, семенных коробочек, стручков, фруктов, орехов или клубней, чем нетрансгенное контрольное растение. В соответствии с некоторыми вариантами реализации изобретения трансгенное растение может в среднем иметь по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше цветков, бобов, семян, семенных коробочек, стручков, фруктов, орехов или клубней на узел, чем нетрансгенное контрольное растение. Трансгенное растение может в среднем иметь по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел. Трансгенное растение может в среднем иметь 2-10, 2-9, 2-8, 2-7, 2-6, 2-5, 2-4, 2-3, 3-10, 3-9, 3-8, 3-7, 3-6, 3-5, 3-4, 4-10, 4-9, 4-8, 4-7, 4-6 или 4-5 бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел. Трансгенное растение может в среднем иметь по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9 или по меньшей мере на 10 больше цветков, бобов, семян, семенных коробочек, стручков, фруктов, орехов или клубней на узел по сравнению с нетрансгенным контрольным растением. Трансгенное растение может представлять собой растение сои, и трансгенное растение может в среднем иметь больше узлов и/или семян на узел, чем нетрансгенное контрольное растение. Трансгенное растение может зацветать по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 20, по меньшей мере на 25, по меньшей мере на 30, по меньшей мере на 35, по меньшей мере на 40 или по меньшей мере на 45 дней раньше, чем нетрансгенное контрольное растение.
[133] В соответствии с вариантами реализации данного изобретения предложено трансгенное растение, содержащее полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором вегетативной стадии, при этом экспрессия полинуклеотидной кодирующей последовательности пространственно и/или временно ослаблена, ограничена, модифицирована и/или скорректирована молекулой РНК, которая может представлять собой малую некодирующую молекулу РНК. Уровень экспрессии или трансляции мРНК и/или белка флоригенного FT в трансгенном растении может быть подавлен или снижен в одной или более меристематических, генеративных и/или флоральных тканях и/или во время одной или более генеративных стадий. В соответствии с некоторыми вариантами реализации изобретения длительность генеративной стадии и/или длительность цветения трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе, может быть по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 20, по меньшей мере на 25, по меньшей мере на 30, по меньшей мере на 35, по меньшей мере на 40 или по меньшей мере на 45 дней дольше, чем длительность генеративной стадии и/или длительность цветения растения дикого типа или контрольного растения, но также может быть не более чем (т. е. не больше чем) на 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 дней дольше, чем длительность генеративной стадии и/или длительность цветения растения дикого типа или контрольного растения. В соответствии с некоторыми вариантами реализации изобретения начало цветения (т. е. появление первого открытого цветка) трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе, может быть или происходить по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 20, по меньшей мере на 25, по меньшей мере на 30, по меньшей мере на 35, по меньшей мере на 40 или по меньшей мере на 45 дней раньше, чем у растения дикого типа или контрольного растения, но также может быть не более чем (т. е. не больше чем) на 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 дней раньше, чем начало цветения растения дикого типа или контрольного растения.
[134] В соответствии с некоторыми вариантами реализации изобретения число цветков, семян, семенных коробочек, стручков, фруктов, орехов, бобов или клубней у трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе, может быть по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше, чем у растения дикого типа или контрольного растения. В соответствии с некоторыми вариантами реализации изобретения число цветков, семян, семенных коробочек, стручков, фруктов, орехов или бобов на главном стебле трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе, может быть по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше, чем у растения дикого типа или контрольного растения. В соответствии с некоторыми вариантами реализации изобретения число цветков, семян, семенных коробочек, стручков, фруктов, орехов или бобов на узел на главном стебле трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе, может быть по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше, чем у растения дикого типа или контрольного растения.
[135] Каждое из этих характерных количеств или числовых значений на растение, главный стебель или ветку, такое как число цветков, семенных коробочек, семян, стручков, фруктов, орехов или бобов на растение, главный стебель или ветку, можно рассчитать как среднее по двум или более растениям или определить для одного растения, а количества или числовые значения цветков, семенных коробочек, семян, стручков, фруктов, орехов или бобов на узел можно рассчитать как среднее для одного или более растений. Таким образом, можно рассчитывать процентное изменение между двумя растениями, между растением и средним по двум или более растениям или между двумя средними значениями (при этом каждое вреднее значение взято по двум или более растениям).
[136] В соответствии с некоторыми вариантами реализации изобретения число цветков, семенных коробочек, семян, стручков, фруктов, орехов, бобов или клубней на узел трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе, в среднем может быть по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше, чем у растения дикого типа или контрольного растения. В соответствии с некоторыми вариантами реализации изобретения трансгенное растение, содержащее трансген FT и/или элемент супрессии FT, предложенное в данном документе, может в среднем иметь по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 цветков, бобов, семенных коробочек, семян, стручков, фруктов, орехов, бобов или клубней на узел. В соответствии с некоторыми вариантами реализации изобретения трансгенное растение, содержащее трансген FT и/или элемент супрессии FT, предложенное в данном документе, может в среднем иметь 2-10, 2-9, 2-8, 2-7, 2-6, 2-5, 2-4, 2-3, 3-10, 3-9, 3-8, 3-7, 3-6, 3-5, 4-10, 4-9, 4-8, 4-7, 4-6 или 4-5, или около 2, около 3, около 4, около 5, около 6, около 7, около 8, около 9 или около 10 цветков, семенных коробочек, стручков, фруктов, орехов, бобов или клубней на узел. В соответствии с некоторыми вариантами реализации изобретения трансгенное растение, содержащее трансген FT и/или элемент супрессии FT, предложенное в данном документе, может в среднем иметь по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9 или по меньшей мере на 10 больше цветков, семенных коробочек, семян, стручков, фруктов, орехов, бобов или клубней на узел по сравнению с нетрансгенным растением дикого типа или контрольным растением.
[137] В соответствии с некоторыми вариантами реализации изобретения среднее число семенных коробочек, стручков, семян, фруктов, орехов, бобов или клубней и/или среднее число цветков, семенных коробочек, стручков, семян, фруктов, орехов, бобов или клубней на узел трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе (или на главном стебле такого трансгенного растения), может быть на 1%-400%, 1%-350%, 1%-300%, 1%-250%, 1%-200%, 1%-150%, 1%-100%, 1%-75%, 1%-50%, 1%-25%, 5%-400%, 5%-350%, 5%-300%, 5%-250%, 5%-200%, 5%-150%, 5%-100%, 5%-95%, 5%-90%, 5%-85%, 5%-80%, 5%-75%, 5%-70%, 5%-65%, 5%-60%, 5%-55%, 5%-50%, 5%-45%, 5%-40%, 5%-35%, 5%-30%, 5%-25%, 5%-20%, 5%-15%, 5%-10%, 10%-400%, 10%-350%, 10%-300%, 10%-250%,10%-200%, 10%-150%, 10%-100%, 10%-90%, 10%-80%, 10%-70%, 10%-60%, 10%-50%, 10%-40%, 10%-30%, 10%-20%, 25%-400%, 25%-350%, 25%-300%, 25%-250%, 25%-200%, 25%-150%, 25%-100%, 25%-75%, 25%-50%, 50%-400%, 50%-350%, 50%-300%, 50%-250%, 50%-200%, 50%-150%, 50%-100%, 50%-75%, 75%-400%, 75%-350%, 75%-300%, 75%-250%, 75%-200%, 75%-150%, 75%-100%, 100%-400%, 100%-350%, 100%-300%, 100%-250%, 100%-200% или 100%-150% больше, чем у растения дикого типа или контрольного растения. В соответствии с некоторыми вариантами реализации изобретения длительность генеративной стадии трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе, может быть на 1%-400%, 1%-350%, 1%-300%, 1%-250%, 1%-200%, 1%-150%, 1%-100%, 1%-75%, 1%-50%, 1%-25%, 5%-400%, 5%-350%, 5%-300%, 5%-250%, 5%-200%, 5%-150%, 5%-100%, 5%-95%, 5%-90%, 5%-85%, 5%-80%, 5%-75%, 5%-70%, 5%-65%, 5%-60%, 5%-55%, 5%-50%, 5%-45%, 5%-40%, 5%-35%, 5%-30%, 5%-25%, 5%-20%, 5%-15%, 5%-10%, 10%-400%, 10%-350%, 10%-300%, 10%-250%, 10%-200%, 10%-150%, 10%-100%, 10%-90%, 10%-80%, 10%-70%, 10%-60%, 10%-50%, 10%-40%, 10%-30%, 10%-20%, 25%-400%, 25%-350%, 25%-300%, 25%-250%, 25%-200%, 25%-150%, 25%-100%, 25%-75%, 25%-50%, 50%-400%, 50%-350%, 50%-300%, 50%-250%, 50%-200%, 50%-150%, 50%-100%, 50%-75%, 75%-400%, 75%-350%, 75%-300%, 75%-250%, 75%-200%, 75%-150%, 75%-100%, 100%-400%, 100%-350%, 100%-300%, 100%-250%, 100%-200% или 100%-150% больше, в терминах числа дней, чем у растения дикого типа или контрольного растения. В соответствии с некоторыми вариантами реализации изобретения начало цветения трансгенного растения, содержащего трансген FT и/или элемент супрессии FT, предложенного в данном документе, может быть на 1%-400%, 1%-350%, 1%-300%, 1%-250%, 1%-200%, 1%-150%, 1%-100%, 1%-75%, 1%-50%, 1%-25%, 5%-400%, 5%-350%, 5%-300%, 5%-250%, 5%-200%, 5%-150%, 5%-100%, 5%-95%, 5%-90%, 5%-85%, 5%-80%, 5%-75%, 5%-70%, 5%-65%, 5%-60%, 5%-55%, 5%-50%, 5%-45%, 5%-40%, 5%-35%, 5%-30%, 5%-25%, 5%-20%, 5%-15%, 5%-10%, 10%-400%, 10%-350%, 10%-300%, 10%-250%, 10%-200%, 10%-150%, 10%-100%, 10%-90%, 10%-80%, 10%-70%, 10%-60%, 10%-50%, 10%-40%, 10%-30%, 10%-20%, 25%-400%, 25%-350%, 25%-300%, 25%-250%, 25%-200%, 25%-150%, 25%-100%, 25%-75%, 25%-50%, 50%-400%, 50%-350%, 50%-300%, 50%-250%, 50%-200%, 50%-150%, 50%-100%, 50%-75%, 75%-400%, 75%-350%, 75%-300%, 75%-250%, 75%-200%, 75%-150%, 75%-100%, 100%-400%, 100%-350%, 100%-300%, 100%-250%, 100%-200% или 100%-150% раньше, в терминах числа дней, чем у растения дикого типа или контрольного растения.
[138] В соответствии с вариантами реализации данного изобретения предложенные в данном документе трансгенные растения могут иметь комбинацию двух или более признаков или фенотипов, описанных в данном документе, например, двух или более признаков из увеличенного числа бобов, семенных коробочек, стручков, семян, фруктов, орехов или клубней на узел, увеличенного числа бобов, семенных коробочек, стручков, семян, фруктов, орехов или клубней на главном стебле, повышенной длительности генеративной стадии, более раннего начала цветения, минимальной высоты растения, такой как по меньшей мере 900 или более миллиметров (т. е. большей или равной 0,9 метра) в случае сои, и/или сниженного ветвления по сравнению с растением дикого типа или контрольным растением. В соответствии с некоторыми вариантами реализации изобретения трансгенные растения могут в среднем иметь увеличенное число бобов, семенных коробочек, стручков, семян, фруктов или орехов на узел или более раннее начало цветения по сравнению с растением дикого типа или контрольным растением. Такие трансгенные растения могут дополнительно иметь увеличенное число бобов, семенных коробочек, стручков, семян, фруктов, орехов или клубней на главном стебле и/или повышенную длительности генеративной стадии по сравнению с растением дикого типа или контрольным растением.
[139] Например, предложенное в данном документе трансгенное растение может иметь по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше цветков, бобов, семян, семенных коробочек, стручков, фруктов, орехов или клубней на узел и начало цветения, которое происходит по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 20, по меньшей мере на 25, по меньшей мере на 30, по меньшей мере на 35, по меньшей мере на 40 или по меньшей мере на 45 дней раньше по сравнению с растением дикого типа или контрольным растением. Предложенное в данном документе трансгенное растение может в среднем иметь по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9 или по меньшей мере на 10 больше цветков, бобов, семян, семенных коробочек, стручков, фруктов, орехов или клубней на узел и начало цветения, которое происходит по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 20, по меньшей мере на 25, по меньшей мере на 30, по меньшей мере на 35, по меньшей мере на 40 или по меньшей мере на 45 дней раньше по сравнению с растением дикого типа или контрольным растением. Такие трансгенные растения могут дополнительно иметь длительность генеративной стадии и/или цветения, которая по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 20, по меньшей мере на 25, по меньшей мере на 30, по меньшей мере на 35, по меньшей мере на 40 или по меньшей мере на 45 дней дольше, чем длительность генеративной стадии и/или цветения растения дикого типа или контрольного растения, и/или увеличенное число цветков, бобов, семян, семенных коробочек, стручков, фруктов или орехов на главном стебле трансгенного растения, которое по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175% или по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше, чем у растения дикого типа или контрольного растения.
[140] В соответствии с вариантами реализации данного изобретения предложенные в данном документе трансгенные растения могут иметь измененную архитектуру растения с минимальной высотой растения и сниженным ветвлением, что может сопровождаться небольшим снижением числа узлов на растение. Трансгенные растения, экспрессирующие только трансген FT, могут иметь выраженный карликовый фенотип вследствие ранней терминации, что подразумевает небольшую высоту растения наряду со снижением ветвления и количества узлов на растение. Посредством экспрессии трансгена FT с сенсором микроРНК или вторым супрессорным элементом, нацеленным на трансген FT, можно ослабить эти выраженные фенотипы ранней терминации для получения более нормальной высоты растения, сохраняя при этом увеличенное число бобов на узел. В соответствии с этими вариантами реализации изобретения трансгенные растения могут иметь (i) минимальную высоту растения, которая снижена не более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35% или 40% по сравнению с растением дикого типа или контрольным растением (т. е. разница в высоте растений между трансгенным растением и растением дикого типа или контрольным растением не превышает одно или более из этих процентных значений), (ii) общее число веток, сниженное по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по сравнению с растением дикого типа или контрольным растением, и/или (iii) минимальное число узлов на растение (и/или на главный стебель), которое снижено не более чем на 5%, 10%, 15%, 20%, 25%, 30%, 35% или 40% по сравнению с растением дикого типа или контрольным растением (т. е. разница в числе узлов на растение (и/или на главный стебель) между трансгенным растением и растением дикого типа или контрольным растением не превышает одно или более из этих процентных значений). В случае сои предложенное в данном документе трансгенное растение может иметь минимальную высоту, которая составляет по меньшей мере 700 миллиметров (по меньшей мере), по меньшей мере 750 по меньшей мере, по меньшей мере 800 по меньшей мере, по меньшей мере 850 по меньшей мере, по меньшей мере 900 по меньшей мере, по меньшей мере 950 по меньшей мере, по меньшей мере 1000 по меньшей мере, по меньшей мере 1050 по меньшей мере, по меньшей мере 1100 по меньшей мере, по меньшей мере 1150 по меньшей мере, по меньшей мере 1200 по меньшей мере, по меньшей мере 1250 по меньшей мере, по меньшей мере 1300 по меньшей мере, по меньшей мере 1350 по меньшей мере или по меньшей мере 1400 по меньшей мере; общее число узлов на растение, которое составляет по меньшей мере 100, по меньшей мере 125, по меньшей мере 150, по меньшей мере 175, по меньшей мере 200, по меньшей мере 225, по меньшей мере 250, по меньшей мере 275, по меньшей мере 300, по меньшей мере 325, по меньшей мере 350, по меньшей мере 375 или по меньшей мере 400 узлов; и/или общее число веток, которое снижено по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% по сравнению с растением дикого типа или контрольным растением. Все вышеприведенные числовые, процентные и разностные значения для растения дополнительно включают значения, рассчитанные из среднего по множеству растений того же типа.
[141] В соответствии с другим широким аспектом данного изобретения предложены способы посадки трансгенных растений согласно данному изобретению при нормальной или высокой плотности в поле. В соответствии с некоторыми вариантами реализации изобретения урожайность культурного растения на акр (или на земельную площадь) можно повысить путем посадки трансгенных растений согласно данному изобретению при более высокой плотности в поле. Как описано в данном документе, трансгенные растения согласно данному изобретению, экспрессирующие флоригенный белок FT во время вегетативной (-ых) стадии (-ий) развития, и/или с супрессией трансгена FT могут демонстрировать увеличенное число бобов и/или семян на узел (в частности, на главном стебле), но также могут иметь измененную архитектуру растения со сниженным ветвлением и меньшим числом узлов на ветку. Поэтому было сделано предположение, что трансгенные растения согласно данному изобретению можно высевать при более высокой плотности для увеличения урожайности на акр в поле. Для пропашных культур более высокую плотность можно обеспечивать посева большего числа семян/растений на ряд и/или путем снижения расстояния между рядами. В соответствии с некоторыми вариантами реализации изобретения трансгенное культурное растение согласно данному изобретению можно высевать при плотности в поле (количество растений на земельную/полевую площадь), которая по меньшей мере на 5%, 10%, 15%, 20%, 25%, 50%, 75%, 100%, 125%, 150%, 175%, 200%, 225% или 250% выше или больше, чем нормальная плотность посева для такого культурного растения в соответствии со стандартной сельскохозяйственной практикой.
[142] В случае сои типовая плотность посева находится в диапазоне от около 100000 до 150000 семян на акр, а типовое расстояние между рядами находится в диапазоне от около 26 до около 40 дюймов, например, расстояние между рядами составляет 30 дюймов или 36 дюймов. В рамках заданного ряда, как правило, могут высевать около 6-8 семян сои на фут. В противоположность этому, посев с высокой плотностью в случае сои может включать диапазон приблизительно от 150000 до 250000 семян на акр, а расстояние между рядами может находиться в диапазоне от около 10 дюймов или менее до около 25 дюймов, например, расстояние между рядами составляет 10 дюймов, 15 дюймов или 20 дюймов. В случае посева при высокой плотности в пределах каждого ряда можно высевать приблизительно 9-12 семян сои на фут, возможно, в комбинации с меньшим расстоянием между рядами. При этом высокая плотность культур может обеспечиваться узким расстоянием между рядами без увеличения плотности посева в пределах каждого ряда.
[143] В случае хлопка типовая плотность посева находится в диапазоне от около 28000 до 45000 семян на акр, а типовое расстояние между рядами находится в диапазоне от около 38 до около 40 дюймов, например, расстояние между рядами составляет 38 дюймов или 40 дюймов. В рамках заданного ряда, как правило, могут высевать около 2-3 семени хлопка на фут. В противоположность этому, посев с высокой плотностью в случае хлопка может включать диапазон приблизительно от 48000 до 60000 семян на акр, а расстояние между рядами может находиться в диапазоне от около 30 дюймов или менее до около 36 дюймов. В случае посева при высокой плотности в пределах каждого ряда можно высевать приблизительно 3-5 семян хлопка на фут, возможно, в комбинации с меньшим расстоянием между рядами. При этом высокая плотность культуры в случае хлопка может обеспечиваться узким расстоянием между рядами без увеличения плотности посева в пределах каждого ряда.
[144] В случае канолы типовая плотность посева находится в диапазоне от около 360000 до 550000 семян на акр, а типовое расстояние между рядами (между культиваторными стойками) находится в диапазоне от около 6 дюймов до около 16 дюймов. В рамках заданного ряда, как правило, могут высевать около 8-12 семени канолы на фут. В противоположность этому, посев с высокой плотностью в случае канолы может включать диапазон приблизительно от 450000 до 680000 семян на акр, а расстояние между рядами может находиться в диапазоне от около 5 дюймов или менее до около 10 дюймов. В случае посева при высокой плотности в пределах каждого ряда можно высевать приблизительно 10-16 семян канолы на фут, возможно, в комбинации с меньшим расстоянием между рядами. При этом высокая плотность культуры в случае канолы может обеспечиваться узким расстоянием между рядами без увеличения плотности посева в пределах каждого ряда.
[145] Ниже приведены неограничивающие типовые варианты реализации данного изобретения:
1. Рекомбинантная ДНК-конструкция, содержащая первую экспрессионную кассету и вторую экспрессионную кассету, причем первая экспрессионная кассета содержит полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с первым промотором пригодным для экспрессии в растениях, а вторая экспрессионная кассета содержит последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам полинуклеотидной последовательности первой экспрессионной кассеты, и при этом последовательность ДНК пригодная для транскрипции функционально связана со вторым промотором пригодным для экспрессии в растениях.
2. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 1, отличающаяся тем, что нацеливающая последовательность молекулы РНК имеет длину от около 15 до около 27 нуклеотидов.
3. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 1 или 2, отличающаяся тем, что нацеливающая последовательность молекулы РНК имеет длину 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27 нуклеотидов.
4. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-3, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или 100% комплементарной по меньшей мере 15 последовательным нуклеотидам полинуклеотидной последовательности первой экспрессионной кассеты.
5. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-4, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам мРНК-транскрипта, кодируемого полинуклеотидной последовательностью первой экспрессионной кассеты.
6. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-5, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам экзонной или кодирующей последовательности мРНК-транскрипта.
7. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-5, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам некодирующей последовательности мРНК-транскрипта.
8. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-7, отличающаяся тем, что молекула РНК, кодируемая последовательностью ДНК пригодной для транскрипции, представляет собой предшественника микроРНК или миРНК.
9. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-8, отличающаяся тем, что последовательность ДНК пригодная для транскрипции содержит последовательность, которая является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% комплементарной SEQ ID NO: 68 или 69.
10. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-9, отличающаяся тем, что последовательность ДНК пригодная для транскрипции содержит последовательность, которая является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичной SEQ ID NO: 65.
11. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-10, отличающаяся тем, что полинуклеотидная последовательность первой экспрессионной кассеты содержит последовательность, которая является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентичной SEQ ID NO: 69.
12. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-11, отличающаяся тем, что флоригенный белок FT содержит аминокислотную последовательность, имеющую по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или ее функциональным фрагментом.
13. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 12, отличающаяся тем, что флоригенный белок FT дополнительно содержит одну или более из следующих аминокислот: тирозин или другой незаряженный полярный или неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 85 в SEQ ID NO: 14; лейцин или другой неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 128 в SEQ ID NO: 14; и триптофан или другой большой неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 138 в SEQ ID NO: 14.
14. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 12, отличающаяся тем, что флоригенный белок FT не содержит одну или более из следующих аминокислот: гистидин в аминокислотной позиции, соответствующей лизину или аргинину в аминокислотной позиции, соответствующей позиции 85 в SEQ ID NO: 14; лизин или аргинин в аминокислотной позиции, соответствующей позиции 128 в SEQ ID NO: 14; и серин, аспарагиновую кислоту, глутаминовую кислоту, лизин или аргинин в аминокислотной позиции, соответствующей позиции 138 в SEQ ID NO: 14.
15. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 12, отличающаяся тем, что флоригенный белок FT содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или их функционального фрагмента.
16. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-15, отличающаяся тем, что полинуклеотидная последовательность имеет по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27 и 29.
17. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-16, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях является промотором вегетативной стадии.
18. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-17, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях является меристемо-предпочтительным или меристемо-специфическим промотором.
19. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-18, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45 или 48, или ее функциональной частью.
20. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 19, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 31, или ее функциональной частью.
21. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 19, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 32 или SEQ ID NO: 48.
22. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 19, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 44, или ее функциональной частью.
23. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-22, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, или ее функциональной частью.
24. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 23, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 49, или ее функциональной частью.
25. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-24, отличающаяся тем, что второй промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, или ее функциональной частью.
26. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-25, отличающаяся тем, что второй промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 49, или ее функциональной частью.
27. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-26, отличающаяся тем, что второй промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 или 94, или ее функциональной частью.
28. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-27, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях является промотором вегетативной стадии, а второй промотор пригодный для экспрессии в растениях является промотором поздней вегетативной стадии и/или промотором генеративной стадии.
29. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 28, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях является промотором ранней вегетативной стадии.
30. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 28, отличающаяся тем, что второй промотор пригодный для экспрессии в растениях является предпочтительным промотором генеративной стадии.
31. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 1-30, отличающаяся тем, что первый промотор пригодный для экспрессии в растениях инициирует выявляемую экспрессию полинуклеотидной последовательности, кодирующей флоригенный белок FT на более ранней стадии развития, чем та, на которой второй промотор пригодный для экспрессии в растениях инициирует выявляемую экспрессию последовательности ДНК пригодной для транскрипции.
32. Молекула ДНК или вектор, содержащие рекомбинантную ДНК-конструкцию по любому из вариантов реализации изобретения 1-31.
33. Плазмидный вектор для Agrobacterium-опосредованной трансформации, содержащий рекомбинантную ДНК-конструкцию по любому из вариантов реализации изобретения 1-31.
34. Донорная матричная молекула для сайт-опосредованной интеграции, содержащая рекомбинантную ДНК-конструкцию по любому из вариантов реализации изобретения 1-31.
35. Трансгенное растение, содержащее вставку рекомбинантной ДНК-конструкции по любому из вариантов реализации изобретения 1-31 в геноме по меньшей мере одной клетки трансгенного растения.
36. Трансгенное растение по варианту реализации изобретения 35, отличающееся тем, что трансгенное растение является гомозиготным в отношении вставки рекомбинантной ДНК-конструкции.
37. Трансгенное растение по варианту реализации изобретения 35, отличающееся тем, что трансгенное растение является гемизиготным в отношении вставки рекомбинантной ДНК-конструкции.
38. Трансгенное растение по любому из вариантов реализации изобретения 35-37, отличающееся тем, что трансгенное растение является растением короткого дня.
39. Трансгенное растение по любому из вариантов реализации изобретения 35-38, отличающееся тем, что трансгенное растение является двудольным растением.
40. Трансгенное растение по любому из вариантов реализации изобретения 35-39, отличающееся тем, что трансгенное растение является бобовым растением.
41. Трансгенное растение по любому из вариантов реализации изобретения 35-40, отличающееся тем, что трансгенное растение является соей.
42. Трансгенное растение по варианту реализации изобретения 41, отличающееся тем, что трансгенное растение сои дает больше стручков на узел, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
43. Трансгенное растение по любому из вариантов реализации изобретения 35-42, отличающееся тем, что трансгенное растение дает больше цветков на узел, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
44. Трансгенное растение или его часть по любому из вариантов реализации изобретения 35-43, отличающееся тем, что трансгенное растение дает больше семян, семенных коробочек, стручков, фруктов, орехов или бобов на узел трансгенного растения, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
45. Трансгенное растение или его часть по любому из вариантов реализации изобретения 35-44, отличающееся тем, что трансгенное растение цветет раньше, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
46. Трансгенное растение или его часть по любому из вариантов реализации изобретения 35-45, отличающееся тем, что трансгенное растение имеет больше цветочных кистей на узел, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
47. Часть трансгенного растения, содержащая вставку рекомбинантной ДНК-конструкции по любому из вариантов реализации изобретения 1-31 в геноме по меньшей мере одной клетки части трансгенного растения.
48. Часть трансгенного растения по любому из вариантов реализации изобретения 44-47, отличающаяся тем, что часть трансгенного растения представляет собой одно из следующего: семя, фрукт, лист, семядолю, гипокотиль, меристему, эмбрион, эндосперм, корень, побег, стебель, боб, цветок, соцветие, цветоножку, стебелек, пестик, дыхальце, цветоложе, лепесток, чашелистик, пыльцу, тычинку, нить, завязь, семяпочку, перикарпий, флоэму или сосудистую ткань.
49. Рекомбинантная ДНК-конструкция, содержащая полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором пригодным для экспрессии в растениях, причем полинуклеотидная последовательность содержит последовательность, которая кодирует целевой сайт в мРНК-транскрипте, кодируемом полинуклеотидной последовательностью, и при этом целевой сайт мРНК-транскрипта является по меньшей мере на 80% комплементарным эндогенной молекуле РНК.
50. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 49, отличающаяся тем, что целевой сайт мРНК-транскрипта имеет длину по меньшей мере 17 нуклеотидов.
51. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 49 или 50, отличающаяся тем, что целевой сайт мРНК-транскрипта имеет длину 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27 нуклеотидов.
52. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-51, отличающаяся тем, что целевой сайт мРНК-транскрипта является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или но 100% комплементарным эндогенной молекуле РНК.
53. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-52, отличающаяся тем, что целевой сайт находится в некодирующей последовательности мРНК-транскрипта.
54. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-53, отличающаяся тем, что целевой сайт мРНК-транскрипта является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% комплементарным SEQ ID NO: 95, 96, 97, 103, 104 или 105.
55. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-54, отличающаяся тем, что целевой сайт мРНК-транскрипта является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% комплементарным SEQ ID NO: 95 или 103.
56. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-55, отличающаяся тем, что полинуклеотидная последовательность, кодирующая флоригенный белок FT, содержит последовательность, которая является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичной SEQ ID NO: 98, 99, 100, 101, 106, 107, 108, 109 или 110.
57. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-54 или 56, отличающаяся тем, что целевой сайт мРНК-транскрипта является по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентичным SEQ ID NO: 99 или 107.
58. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-57, отличающаяся тем, что флоригенный белок FT содержит аминокислотную последовательность, имеющую по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или ее функциональным фрагментом.
59. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-58, отличающаяся тем, что флоригенный белок FT дополнительно содержит одну или более из следующих аминокислот: тирозин или другой незаряженный полярный или неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 85 в SEQ ID NO: 14; лейцин или другой неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 128 в SEQ ID NO: 14; и триптофан или другой большой неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 138 в SEQ ID NO: 14.
60. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-58, отличающаяся тем, что флоригенный белок FT не содержит одну или более из следующих аминокислот: гистидин в аминокислотной позиции, соответствующей лизину или аргинину в аминокислотной позиции, соответствующей позиции 85 в SEQ ID NO: 14; лизин или аргинин в аминокислотной позиции, соответствующей позиции 128 в SEQ ID NO: 14; и серин, аспарагиновую кислоту, глутаминовую кислоту, лизин или аргинин в аминокислотной позиции, соответствующей позиции 138 в SEQ ID NO: 14.
61. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-61, отличающаяся тем, что флоригенный белок FT содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или ее функциональный фрагмент.
62. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-62, отличающаяся тем, что полинуклеотидная последовательность имеет по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27 и 29.
63. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-62, отличающаяся тем, что промотор пригодный для экспрессии в растениях является промотором вегетативной стадии.
64. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-63, отличающаяся тем, что промотор пригодный для экспрессии в растениях является меристемо-предпочтительным или меристемо-специфическим промотором.
65. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-64, отличающаяся тем, что промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45 или 48, или ее функциональной частью.
66. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-65, отличающаяся тем, что промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 31, или ее функциональной частью.
67. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-65, отличающаяся тем, что промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 32 или SEQ ID NO: 48.
68. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-65, отличающаяся тем, что промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 44, или ее функциональной частью.
69. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 49-68, отличающаяся тем, что промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, или ее функциональной частью.
70. Молекула ДНК или вектор, содержащие рекомбинантную ДНК-конструкцию по любому из вариантов реализации изобретения 49-69.
71. Плазмидный вектор для Agrobacterium-опосредованной трансформации, содержащий рекомбинантную ДНК-конструкцию по любому из вариантов реализации изобретения 49-69.
72. Донорная матричная молекула для сайт-опосредованной интеграции, содержащая рекомбинантную ДНК-конструкцию по любому из вариантов реализации изобретения 49-69.
73. Трансгенное растение, содержащее вставку рекомбинантной ДНК-конструкции по любому из вариантов реализации изобретения 49-69 в геноме по меньшей мере одной клетки трансгенного растения.
74. Трансгенное растение по варианту реализации изобретения 73, отличающееся тем, что трансгенное растение является гомозиготным в отношении вставки рекомбинантной ДНК-конструкции.
75. Трансгенное растение по варианту реализации изобретения 73, отличающееся тем, что трансгенное растение является гемизиготным в отношении вставки рекомбинантной ДНК-конструкции.
76. Трансгенное растение по любому из вариантов реализации изобретения 73-75, отличающееся тем, что трансгенное растение является растением короткого дня.
77. Трансгенное растение по любому из вариантов реализации изобретения 73-76, отличающееся тем, что трансгенное растение является двудольным растением.
78. Трансгенное растение по любому из вариантов реализации изобретения 73-77, отличающееся тем, что трансгенное растение является бобовым растением.
79. Трансгенное растение по любому из вариантов реализации изобретения 73-78, отличающееся тем, что трансгенное растение является соей.
80. Трансгенное растение по любому из вариантов реализации изобретения 73-79, отличающееся тем, что трансгенное растение сои дает больше бобов на узел, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
81. Трансгенное растение по любому из вариантов реализации изобретения 73-80, отличающееся тем, что трансгенное растение дает больше цветков на узел, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
82. Трансгенное растение или его часть по любому из вариантов реализации изобретения 73-81, отличающееся тем, что трансгенное растение дает больше семенных коробочек, стручков, фруктов, орехов или бобов на узел трансгенного растения, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
83. Трансгенное растение или его часть по любому из вариантов реализации изобретения 73-82, отличающееся тем, что трансгенное растение цветет раньше, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
84. Трансгенное растение или его часть по любому из вариантов реализации изобретения 73-83, отличающееся тем, что трансгенное растение имеет больше цветочных кистей на узел, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
85. Часть трансгенного растения, содержащая вставку рекомбинантной ДНК-конструкции по любому из вариантов реализации изобретения 49-69 в геноме по меньшей мере одной клетки части трансгенного растения.
86. Часть трансгенного растения по любому из вариантов реализации изобретения 82-85, отличающаяся тем, что часть трансгенного растения представляет собой одно из следующего: семя, фрукт, лист, семядолю, гипокотиль, меристему, эмбрион, эндосперм, корень, побег, стебель, боб, цветок, соцветие, цветоножку, стебелек, пестик, дыхальце, цветоложе, лепесток, чашелистик, пыльцу, тычинку, нить, завязь, семяпочку, перикарпий, флоэму или сосудистую ткань.
87. Рекомбинантная ДНК-конструкция, содержащая последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам полинуклеотидной последовательности, кодирующей флоригенный белок FT, причем последовательность ДНК пригодная для транскрипции функционально связана с промотором пригодным для экспрессии в растениях.
88. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 87, отличающаяся тем, что нацеливающая последовательность молекулы РНК имеет длину от около 15 до около 27 нуклеотидов.
89. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 87 или 88, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% комплементарной по меньшей мере 15 последовательным нуклеотидам полинуклеотидной последовательности, кодирующей флоригенный белок FT.
90. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-89, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам мРНК-транскрипта, кодируемого полинуклеотидной последовательностью, кодирующей флоригенный белок FT.
91. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-90, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам экзонной или кодирующей последовательности мРНК-транскрипта.
92. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-91, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 80% комплементарной по меньшей мере 15 последовательным нуклеотидам некодирующей последовательности мРНК-транскрипта.
93. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-92, отличающаяся тем, что молекула РНК, кодируемая последовательностью ДНК пригодной для транскрипции, представляет собой предшественника микроРНК или миРНК.
94. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-93, отличающаяся тем, что флоригенный белок FT, кодируемый полинуклеотидной последовательностью, содержит аминокислотную последовательность, имеющую по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или ее функциональным фрагментом.
95. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-94, отличающаяся тем, что флоригенный белок FT дополнительно содержит одну или более из следующих аминокислот: тирозин или другой незаряженный полярный или неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 85 в SEQ ID NO: 14; лейцин или другой неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 128 в SEQ ID NO: 14; и триптофан или другой большой неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 138 в SEQ ID NO: 14.
96. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-94, отличающаяся тем, что флоригенный белок FT не содержит одну или более из следующих аминокислот: гистидин в аминокислотной позиции, соответствующей лизину или аргинину в аминокислотной позиции, соответствующей позиции 85 в SEQ ID NO: 14; лизин или аргинин в аминокислотной позиции, соответствующей позиции 128 в SEQ ID NO: 14; и серин, аспарагиновую кислоту, глутаминовую кислоту, лизин или аргинин в аминокислотной позиции, соответствующей позиции 138 в SEQ ID NO: 14.
97. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-96, отличающаяся тем, что флоригенный белок FT содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или ее функциональным фрагментом.
98. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-97, отличающаяся тем, что полинуклеотидная последовательность, кодирующая флоригенный белок FT, имеет по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27 и 29.
99. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-98, отличающаяся тем, что промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, или ее функциональной частью.
100. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-99, отличающаяся тем, что промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с SEQ ID NO: 49, или ее функциональной частью.
101. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-100, отличающаяся тем, что промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая является по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5% или на 100% идентичной с полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 или 94, или ее функциональной частью.
102. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-101, отличающаяся тем, что промотор пригодный для экспрессии в растениях является промотором вегетативной стадии.
103. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-102, отличающаяся тем, что промотор пригодный для экспрессии в растениях является промотором поздней вегетативной стадии и/или промотором генеративной стадии.
104. Рекомбинантная ДНК-конструкция по любому из вариантов реализации изобретения 87-103, отличающаяся тем, что промотор пригодный для экспрессии в растениях является гетерологичным в отношении последовательности ДНК пригодной для транскрипции.
105. Молекула ДНК или вектор, содержащие рекомбинантную ДНК-конструкцию по любому из вариантов реализации изобретения 87-104.
106. Трансгенное растение, содержащее вставку рекомбинантной ДНК-конструкции по любому из вариантов реализации изобретения 87-104 в геноме по меньшей мере одной клетки трансгенного растения.
107. Трансгенное растение по варианту реализации изобретения 106, отличающееся тем, что трансгенное растение является растением короткого дня.
108. Трансгенное растение по варианту реализации изобретения 106 или 107, отличающееся тем, что трансгенное растение является двудольным растением.
109. Трансгенное растение по любому из вариантов реализации изобретения 106-108, отличающееся тем, что трансгенное растение является бобовым растением.
110. Трансгенное растение по любому из вариантов реализации изобретения 106-109, отличающееся тем, что трансгенное растение является соей.
111. Часть трансгенного растения, содержащая вставку рекомбинантной ДНК-конструкции по любому из вариантов реализации изобретения 87-103 в геноме по меньшей мере одной клетки части трансгенного растения.
112. Часть трансгенного растения по варианту реализации изобретения 111, отличающаяся тем, что часть трансгенного растения представляет собой одно из следующего: семя, фрукт, лист, семядолю, гипокотиль, меристему, эмбрион, эндосперм, корень, побег, стебель, боб, цветок, соцветие, цветоножку, стебелек, пестик, дыхальце, цветоложе, лепесток, чашелистик, пыльцу, тычинку, нить, завязь, семяпочку, перикарпий, флоэму или сосудистую ткань.
113. Способ получения трансгенного растения, включающий
(a) трансформацию по меньшей мере одной клетки эксплантата рекомбинантной ДНК-конструкцией по любому из вариантов реализации изобретения 1-31, 49-69 или 87-104; и
(b) регенерацию или выращивание трансгенного растения из трансформированного эксплантата.
114. Способ по варианту реализации изобретения 113, дополнительно включающий:
(c) отбор трансгенного растения, имеющего один или более из следующих признаков или фенотипов: более раннее цветение, более длительный генеративный период или период цветения, увеличенное число цветков на узел, увеличенное число цветочных кистей на узел, увеличенное число бобов, семенных коробочек, стручков, фруктов или орехов на узел и увеличенное число семян на узел, по сравнению с контрольным растением, не содержащим рекомбинантную ДНК-конструкцию.
115. Способ по варианту реализации изобретения 113 или 114, отличающийся тем, что этап трансформации (a) проводят посредством Agrobacterium-опосредованной трансформации или бомбардировки микрочастицами эксплантата.
116. Способ по любому из вариантов реализации изобретения 113-115, отличающийся тем, что этап трансформации (a) включает сайт-направленную интеграцию рекомбинантной ДНК-конструкции.
117. Способ посадки трансгенного культурного растения, включающий:
посадку трансгенного культурного растения с повышенной плотностью в поле, при этом трансгенное культурное растение содержит вставку рекомбинантной ДНК-конструкции по любому из вариантов реализации изобретения 1-31, 49-69 или 87-104.
118. Способ по варианту реализации изобретения 117, отличающийся тем, что трансгенное культурное растение представляет собой сою, и при этом на акр высаживают от около 150000 до 250000 семян трансгенного соевого растения.
119. Способ по варианту реализации изобретения 117, отличающийся тем, что трансгенное культурное растение представляет собой хлопок, и при этом на акр высаживают от около 48000 до 60000 семян трансгенного хлопкового растения.
120. Способ по варианту реализации изобретения 117, отличающийся тем, что трансгенное культурное растение представляет собой канолу, и при этом на акр высаживают от около 450000 до 680000 семян трансгенного растения канолы.
121. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84 или 106-110, отличающееся тем, что трансгенное растение имеет по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше семян, бобов, семенных коробочек, стручков, фруктов, орехов или клубней, чем нетрансгенное контрольное растение.
122. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84 или 106-110, отличающееся тем, что трансгенное растение имеет в среднем по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150%, по меньшей мере на 175%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350% или по меньшей мере на 400% больше семян, бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел, чем нетрансгенное контрольное растение.
123. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84 или 106-110, отличающееся тем, что трансгенное растение имеет в среднем по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел.
124. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84 или 106-110, отличающееся тем, что трансгенное растение имеет в среднем 2-10, 2-9, 2-8, 2-7, 2-6, 2-5, 2-4, 3-10, 3-9, 3-8, 3-7, 3-6, 3-5, 4-10, 4-9, 4-8, 4-7, 4-6 или 4-5 бобов, семенных коробочек, стручков, фруктов, орехов или клубней на узел.
125. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84 или 106-110, отличающееся тем, что трансгенное растение имеет в среднем по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9 или по меньшей мере на 10 больше семенных коробочек, стручков, фруктов, орехов или бобов на узел по сравнению с нетрансгенным контрольным растением.
126. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84 или 106-110, отличающееся тем, что трансгенное растение цветет по меньшей мере на 1, по меньшей мере на 2, по меньшей мере на 3, по меньшей мере на 4, по меньшей мере на 5, по меньшей мере на 6, по меньшей мере на 7, по меньшей мере на 8, по меньшей мере на 9, по меньшей мере на 10, по меньшей мере на 11, по меньшей мере на 12, по меньшей мере на 13, по меньшей мере на 14, по меньшей мере на 15, по меньшей мере на 20, по меньшей мере на 25, по меньшей мере на 30, по меньшей мере на 35, по меньшей мере на 40 или по меньшей мере на 45 дней раньше, чем нетрансгенное контрольное растение.
127. Трансгенное растение по любому из вариантов реализации изобретения 121, 122, 123, 124, 125 или 126, отличающееся тем, что трансгенное растение представляет собой соевое растение и трансгенное растение имеет в среднем больше бобов на узел, чем нетрансгенное контрольное растение.
128. Трансгенное растение, содержащее полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором вегетативной стадии, при этом экспрессия флоригенного белка FT подавляется в поздней вегетативной и/или генеративной ткани.
129. Трансгенное растение по варианту реализации изобретения 128, отличающееся тем, что экспрессия флоригенного белка FT подавляется малой молекулой РНК.
130. Рекомбинантная ДНК-конструкция, содержащая полинуклеотидную последовательность, кодирующую флоригенный белок FT и функционально связанную с промотором вегетативной стадии, и по меньшей мере одну последовательность ДНК пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая является комплементарной по меньшей мере части полинуклеотидной последовательности.
131. Трансгенное растение, содержащее вставку рекомбинантной ДНК-конструкции по варианту реализации изобретения 130 в геноме по меньшей мере одной клетки трансгенного растения.
132. Трансгенное растение, содержащее рекомбинантную полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором вегетативной стадии, при этом экспрессия полинуклеотидной последовательности пространственно и временно ограничена малой молекулой РНК.
133. Рекомбинантная ДНК-конструкция, содержащая экспрессионную кассету, причем экспрессионная кассета содержит полинуклеотидную последовательность, кодирующую флоригенный белок FT, функционально связанную с промотором пригодным для экспрессии в растениях, при этом промотор пригодный для экспрессии в растениях содержит полинуклеотидную последовательность, которая по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100% идентична полинуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 или 64, или ее функциональной части.
134. Рекомбинантная ДНК-конструкция по варианту реализации изобретения 130 или 133, отличающаяся тем, что флоригенный белок FT содержит аминокислотную последовательность, имеющую по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или ее функциональным фрагментом.
135. Молекула ДНК или вектор, содержащие рекомбинантную ДНК-конструкцию по варианту реализации изобретения 130 или 133.
136. Плазмидный вектор для Agrobacterium-опосредованной трансформации, содержащий рекомбинантную ДНК-конструкцию ппо варианту реализации изобретения 130 или 133.
137. Донорная матричная молекула для сайт-опосредованной интеграции, содержащая рекомбинантную ДНК-конструкцию по варианту реализации изобретения 130 или 133.
138. Трансгенное растение, содержащее вставку рекомбинантной ДНК-конструкции по варианту реализации изобретения 130 или 133 в геноме по меньшей мере одной клетки трансгенного растения.
139. Трансгенное растение по любому из вариантов реализации изобретения 131, 132 или 138, отличающееся тем, что трансгенное растение является гомозиготным в отношении вставки рекомбинантной ДНК-конструкции.
140. Трансгенное растение по любому из вариантов реализации изобретения 131, 132, 138 или 139, отличающееся тем, что трансгенное растение является гемизиготным в отношении вставки рекомбинантной ДНК-конструкции.
141. Трансгенное растение по любому из вариантов реализации изобретения 131, 132 или 138-140, отличающееся тем, что трансгенное растение является растением короткого дня.
142. Трансгенное растение по любому из вариантов реализации изобретения 131, 132 или 138-141, отличающееся тем, что трансгенное растение является двудольным растением.
143. Трансгенное растение по любому из вариантов реализации изобретения 131, 132 или 138-142, отличающееся тем, что трансгенное растение является бобовым растением.
144. Трансгенное растение по любому из вариантов реализации изобретения 131, 132 или 138-143, отличающееся тем, что трансгенное растение является соей.
145. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84, 106-110, 131, 132 или 138-144, отличающееся тем, что трансгенное растение дает больше семян, семенных коробочек, стручков, фруктов, орехов или бобов на узел трансгенного растения, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
146. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84, 106-110, 131, 132 или 138-145, отличающееся тем, что трансгенное растение цветет раньше, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
147. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84, 106-110, 131, 132 или 138-146, отличающееся тем, что трансгенное растение представляет собой соевое растение, которое имеет высоту, составляющую по меньшей мере около 700 миллиметров, на стадии R8.
148. Трансгенное растение по любому из вариантов реализации изобретения 35-46, 73-84, 106-110, 131, 132 или 138-147, отличающееся тем, что трансгенное растение представляет собой соевое растение, которое имеет по меньшей мере 100 узлов на растение на стадии R8.
149. Часть трансгенного растения, содержащая вставку рекомбинантной ДНК-конструкции по варианту реализации изобретения 130 или 133 в геноме по меньшей мере одной клетки части трансгенного растения.
ПРИМЕРЫ
Пример 1. Условия индукции с коротким днем для сои и идентификация генов Flowering Locus T (FT) с помощью профилирования транскрипции.
[146] Этот пример ранее был описан в одновременно находящейся на рассмотрении заявке на патент США № 15/131987 и международной заявке № PCT/US2016/028130, которые в полном объеме включены в данный документ посредством ссылки. Способы фотопериодической световой обработки (т. е. индукции цветения растений в условиях короткого дня) описаны в патенте США № 8935880 и публикации патентной заявки США № 2014/0259905, которые в полном объеме включены в данный документ посредством ссылки. Как дополнительно описано в них, ранняя индукция в условиях короткого дня позволяла получать растения сои, имеющие измененные генеративные признаки, включая увеличенное число бобов/семян на растение. Эксперименты с профилированием транскрипции проводили, используя экспрессионные микроматрицы для определения наличия повышающей регуляции для конкретного транскрипта в этих светоиндуцированных растениях, чтобы идентифицировать гены, которые могут отвечать за опосредование фенотипов короткодневной индукции. В этих экспериментах проводили анализ транскриптов для тканей листьев и цветочных верхушек сои, собранных с растений через 1, 3 и 5 дней после их помещения в индуктивные условия короткого светового дня (короткий день), в сравнении с тканями растений, которые не помещали в индуктивные условия (длинный день)
[147] Как проиллюстрировано на Фиг. 2, повышенное накопление транскриптов наблюдали для конкретного гена Flowering Locus T, Gm.FT2a (SEQ ID NO: 1), в листьях, собранных через 3 и 5 дней после применения условий ранней индукции короткого дня (рИКД), в сравнении с образцами, полученными из (i) тканей цветочных верхушек тех же самых растений, подвергнутых короткодневной индукции, (ii) тканей листьев и цветочных верхушек растений сои, которые вместо этого помещали в условия длинного дня. Эти данные поддерживают вывод, что экспрессия Gm.FT2a индуцируется в тканях листьев растений, подвергнутых условиям рИКД, что не наблюдалось в растениях, которые выращивали в условиях длинного дня. Также экспрессию Gm.FT2a не наблюдали в цветочных верхушках обработанных рИКД растений, что согласуется с моделью экспрессии белка FT, которая индуцируется в периферических листовых тканях в ответ на индуктивные фотопериодические условия, а затем перемещается в участок своего действия в меристемах для индукции цветения. Однако дополнительные эксперименты с применением более чувствительного анализа секвенирования РНК для транскриптов показали наличие некоторой индукции Gm.FT2a в верхушках побегов и аксиллярных почках в ответ на условия рИКД (данные не показаны).
Пример 2. Изучение характеристик профилей экспрессии промотора pAt.Erecta в сое.
[148] Для достижения необходимых признаков или фенотипов посредством трансгенных подходов может требоваться регуляция временных и пространственных профилей эктопической экспрессии гена FT. Физиологические эксперименты с соей для определения экспрессии Gm.FT2a в вегетативных тканях после условий короткодневной индукции (смотрите Фиг. 2) показали, что достижение положительных в отношении урожайности признаков может основываться на более ранней экспрессии FT во время вегетативной стадии. С другой стороны, несмотря на то, что транскрипты FT не выявляются в вегетативных верхушках, было показано, что белок FT преодолевает большое расстояние от листьев до апикальной ткани, где он инициирует переход от вегетативной стадии к генеративной. Смотрите, например, Lifschitz, E. et al., (2006), выше; и Corbeiser, L. et al., ʺFT Protein Movement Contributes to Long-Distance Signaling in Floral Induction of Arabidopsisʺ, Science 316: 1030-1033 (2007). Таким образом, в свете наших собственных наблюдений, мы предложили использовать промотор вегетативной стадии, который является активным в меристеме, для регуляции эктопической экспрессии FT в растении. Посредством экспрессии морфогенетического сигнала FT непосредственно в меристеме на необходимой стадии развития можно обойти или избежать многие эндогенные пути и регуляторные отклики (например, регуляцию трансдукции FT в листьях и транслокацию сигнала FT на большое расстояние). Предыдущие эксперименты с короткодневными индукционными условиями (описанными выше в примере 1) выявили повышенную регуляцию гена Gm.Erecta в меристемах растений сои. Было показано, что промотор pErecta (SEQ ID NO: 31) из Arabidopsis имеет слабую экспрессию в меристеме растений во время вегетативных стадий развития. Соответственно, промотор pAt.Erecta был выбран для первых экспериментов по экспрессии FT.
[149] Дополнительные эксперименты проводили, чтобы дополнительно изучить профили экспрессии pAt.Erecta, слитого с геном репортера GUS в вегетативных и флоральных меристематических тканях. Анализ профилей экспрессии GUS во время развития саженцев сои показал, что промотор pAt.Erecta демонстрирует временный и пространственный профиль экспрессии, предпочтительно в меристематических тканях во время вегетативной стадии развития. Фиг. 3A-3O и 4A-4O и Фиг. 5A-5F и 6A-6F включают два набора изображений, чтобы проиллюстрировать профиль окрашивания GUS. На Фиг. 3A-3O и 5A-5F представлены черно-белые изображения окрашенных тканей, а на Фиг. 4A-4O и 6A-6F, соответственно, представлены черно-белые изображения, соответствующие Фиг. 3A-3O и 5A-5F, соответственно, но с цветовой фильтрацией для демонстрации профиля и интенсивности синего окрашивания GUS. Таким образом, профиль экспрессии окрашивания GUS можно оценить по этим черно-белым изображениям путем сравнения соответствующих изображений на Фиг. 3A-3O и 4A-4O или Фиг. 5A-5F и 6A-6F. Как проиллюстрировано на Фиг. 3A-3O и 4A-4O, окрашивание GUS было выявлено в незрелых однолистных пластинках и черешках сои (Фиг. 4A и 4B) через три дня после посева/прорастания. Экспрессия pAt.Erecta::GUS также хорошо выявлялась в участках трехлистного примордия, апикальной меристемы побегов (АМП) и аксиллярной меристемы на этой ранней вегетативной стадии (Фиг. 4C). Активность GUS не выявлялась в полностью развернутых однолистных и трехлистных листьях через десять дней после прорастания или посева (Фиг. 4D и 4E). Однако активность GUS выявлялась в проксимальной части незрелой, неразвернутой, но полностью развитой трехлистной пластины и с адаксиальной стороны черешка (Фиг. 4F). Подробное наблюдение развивающейся апикальной ткани показало, что сильная экспрессия сохранялась в развивающемся незрелом листовом примордии, аксиллярных меристемах и апикальных меристемах побегов (Фиг. 4G-I).
[150] На ранней генеративной стадии активность промотора pAt.Erecta не выявлялась в зрелых листовых пластинах и была снижена в развивающемся листовом примордии. Сигнал GUS не выявлялся на промежуточной вегетативной стадии в верхушках в апикальной меристеме побегов (АМП) или в аксиллярной меристеме (АМ) после того, как в этих тканях начали формироваться соцветия (Фиг. 4J-4L). На всех поздних стадиях в верхушках или в пазухах цветочного примордия нельзя было выявить какую-либо дополнительную меристематическую активность. Однако экспрессия GUS продолжалась с адаксиальной стороны черешков и в проксимальной части незрелой листовой пластины (Фиг. 4M и 4N), но не в полностью развернутых листовых пластинах (Фиг. 4O). Профили экспрессии GUS с промотором pAt.Erecta также анализировали на более поздних стадиях развития R1 (35-40 дней после прорастания). Аналогично с более ранними стадиями развития, в зрелых листьях или стеблях экспрессия не выявлялась. Однако сильная промоторная активность была выявлена в стеблях соцветий (Фиг. 5A и 6A; смотрите стрелку) и цветоножках (Фиг. 5B и 6B; смотрите стрелку). В обеих тканях экспрессия выявлялась в сосудистых и паренхиматозных клетках (Фиг. 5C и 6C). На этой стадии экспрессия также выявлялась в тычиночных нитях (Фиг. 5D и 6D; смотрите стрелки) и в неопыленных семяпочках (Фиг. 5E, 5F, 6E и 6F; смотрите стрелки на 6F).
[151] Ранее промотор pAt.Erecta был изучен в Arabidopsis. Интересно, что профили экспрессии pAt.Erecta в Arabidopsis были сравнимы с профилями, наблюдаемыми в сое во время вегетативной стадии, но не во время поздних генеративных стадий. В противоположность этому, профиль экспрессии pAt.Erecta в сое снижен в ранних генеративных тканях, но снова повышается в некоторых более поздних генеративных органах и тканях, включая стебли соцветий и цветоножки. Смотрите, например, Chen, M-K et al., FEBS Letters 588: 3912-17 (2014); Yokoyama, R et al.; Shpak, ED et al., Science 309: 290-293 (2005); и Yokoyama, R et al., Plant J 15(3): 301-310 (1998), полное содержание которых включено в данный документ посредством ссылки. Таким образом, промотор pAt.Erecta обеспечивает новый профиль экспрессии в сое.
Пример 3. Экспрессия гена Flowering Locus T, Gm.FT2a, под управлением pAt. Промотор Erecta меняет время цветения и число бобов на узел в сое.
[152] Трансгенные растения сои получали путем трансформации эксплантатов сои рекомбинантной молекулой ДНК (т. е. трансформационным вектором на основе Т-ДНК), содержащей промотор pAt.Erecta, функционально связанный с геном Gm.FT2a, посредством Agrobacterium-опосредованной трансформации для создания четырех событий pAt.Erecta::Gm.FT2a, которые оставляли для дополнительного исследования. Эффект сверхэкспрессии FT2a незамедлительно проявлялся в растениях R0, которые характеризовались очень ранним цветением и терминацией со сниженным урожаем семян (например, только около 8 семян/растение). Эти трансгенные растения Gm.FT2a также имели небольшую высоту и очень мало ветвей, если вообще имели. Сегрегирующие R1растения и их потомство впоследствии выращивали в теплице в условиях длинного дня для начального изучения и получения характеристик. При выращивании этих растений в условиях длинного дня выраженные карликовые фенотипы, наблюдаемые для Gm.FT2a-трансгенных растений R0, были улучшены. В этих экспериментах как гомозиготные, так и гемизиготные растения, выращиваемые в теплице в условиях 16-часового светового дня (т. е. 16/8-часовые фотопериоды день/ночь), цвели намного раньше, чем нулевые сегреганты дикого типа. Gm.FT2a-трансгенные растения цвели через около 19-22 дня после посадки или посева. (смотрите, например, Фиг. 9A-9C). В этих условиях роста трансгенные растения сои, экспрессирующие Gm.FT2a, дополнительно имели увеличенное число бобов на узел на главном стебле по сравнению с контролем дикого типа (смотрите, например, Фиг. 10 и 11, дополнительно обсуждаемые ниже).
[153] Растения, содержащие одно из трансгенных событий pAt.Erecta::Gm.FT2a (событие 1), выращиваемые в регулируемых внешних условиях, дополнительно анализировали с помощью сканирующей электронной микроскопии (СЭМ). Анализ апикальной меристемы побегов (АМП) этих трансгенных растений (собранных через 7 дней после посадки) выявил ранний переход АМП в меристему соцветий (МС) и флоральную меристему (ФМ) (Фиг. 7). В противоположность этому, АМП растений сои дикого типа не дифференцировалась в МС на этой стадии роста. Аналогично, визуализация аксиллярной меристемы трансформантов FT2a (собранных через 9 дней после посадки) показала развитие дормантных меристем соцветий (дМС) (или латеральных примордиальных кистей) в МС и ФМ (Фиг. 8), приводя к более рано развивающимся цветочным веткам (кистям) в узлах этих трансгенных растений. Изучение дополнительных фенотипических характеристик выявило раннее цветение на стадии V1 в экспрессирующих Gm.FT2a растениях сои, которое происходило задолго до перехода к цветению в нулевых сегрегирующих растениях (Фиг. 9A-9C). Эти данные в комбинации с вышеописанным профилем экспрессии pAt.Erecta::GUS показывают, что раннее цветение и, в частности, формирование соцветий и флоральной меристемы, было индуцировано эктопической экспрессией Gm.FT2a во время вегетативной стадии в листовом примордии и апикальной меристеме побегов и аксиллярной меристеме всходов. Считается, что образование большего количества меристем соцветий и флоральных меристем дополнительно вызывает более раннее появление и рост вторичных и третичных кистей, приводя к большему числу продуктивных цветков и бобов, формируемых в узле.
[154] Gm.FT2a-трансгенные растения сои не только демонстрировали более раннее цветение и давали больше бобов на узел на главном стебле (по сравнению с сегрегирующими нулевыми растениями), но также оказалось, что эффекты эктопической экспрессии Gm.FT2a в трансгенных растениях являются дозозависимыми. Хотя как гомозиготные, так и гемизиготные растения имели меньшую высоту и меньшее ветвление, растения, гомозиготные в отношении трансгена Gm.FT2a, испытали более сильное влияние, чем гемизиготные растения, возможно потому, что гомозиготные растения содержат две копии трансгена (т. е. большую дозу) в отличие от только одной копии (т. е. меньшей дозы) в гемизиготных растениях. В условиях роста длинного дня гомозиготные растения погибали раньше и имели меньшую общую высоту с меньшим количеством узлов и веток на главном стебле по сравнению с растениями, гемизиготными в отношении трансгена (Фиг. 10). В отличие от гомозиготных растений, которые демонстрировали большое число субоптимальных карликовых фенотипов, включая очень малое (в случае наличия) число веток на главном стебле, гемизиготные растения имели промежуточный фенотип в терминах вегетативного роста, высоты растения и числа узлов, присутствующих на главном стебле, по сравнению с растениями дикого типа и гомозиготными растениями. В условиях 16-часового длинного дня гемизиготные растения имели более нормальную высоту растений с некоторой степенью ветвления и большую длительность цветения по сравнению с гомозиготными растениями (Фиг. 10). Гемизиготные растения также цвели в течение 40-64 дней после инициации R1, тогда как гомозиготные растения цвели только в течение 16-24 дней вследствие ранней терминации.
[155] Дополнительные эксперименты проводили с растениями, трансформированными конструкцией Gm.FT2a (3 события) в условиях длинного дня (16 часов) и контролируемых внешних условиях, чтобы дополнительно изучить характеристики доза-ответ для гемизиготных и гомозиготных растений. Разница в числе узлов и бобов на главном стебле и ветках, а также среднее число бобов на узел и средняя высота на растение приведены в таблице 1 для трех гомозиготных событий (гомо-событие 2, гомо-событие 3, гомо-событие 4) и трех гемизиготных событий (геми-событие 2, геми-событие 3, геми-событие 4). Эти события отличаются от вышеописанного события 1.
Таблица 1. Данные по уровню событий для гомозиготных и гемизиготных Gm.FT2a-трансгенных растений.
на растение
на растение
на растение
[156] Как показано в таблице 2, гемизиготные растения имели соответственно большее число узлов на главном стебле (ГС) и ветках (ВТ) и большую высоту растений, чем гомозиготные растения. Таим образом, гемизиготные растения в целом подверглись меньшему влиянию, чем гомозиготные растения, и больше напоминают растения дикого типа. Гемизиготные растения также имели большее число бобов на узел и большее число бобов на главном стебле и ветках по сравнению с гомозиготными растениями. Следовательно, гемизиготные растения в целом имели более близкую к нормальному растению архитектуру с большим числом бобов на узел (и на растение), предположительно, вследствие меньшей дозы трансгена Gm.FT2a. Относительный уровень дозы Gm.FT2a на основании зиготности трансгена был дополнительно подтвержден дополнительными экспериментами, показывающими, что уровни транскрипта Gm.FT2a были выше в тканях из гомозиготных растений, чем в тканях из гемизиготных растений (данные не показаны).
[157] Ранняя индукция цветения в этих Gm.FT2a-трансгенных растениях была связана с большим числом бобов (и семян) на узел на главном стебле как в гемизиготных, так и в гомозиготных растениях. Гомозиготные и гемизиготные растения, содержащие трансген Gm.FT2a, имели большее число бобов/семян на узел на главном стебле растения по сравнению с сегрегантами дикого типа (Фиг. 11). Также было обнаружено, что распределение бобов на главном стебле является разным для Gm.FT2a-трансгенных растений и нулевых растений дикого типа. Было обнаружено, что как гомозиготные, так и гемизиготные растения, выращиваемые в условиях длинного дня, имеют больше бобов по меньшей мере в нижних узлах главного стебля и больше бобов на узел в среднем по сравнению с нулевыми растениями дикого типа (данные не показаны). Растения, гемизиготные в отношении трансгена Gm.FT2a, содержали наибольшее число бобов на узел по всей длине главного стебля. Однако эти эффекты зависели от конкретных условий роста, включая длину дня и т. д. В целом, эксперименты, проводимые с соей в условиях более длинного дня демонстрировали тенденцию к большей разнице между трансгенными и нулевыми растениями.
[158] Дозозависимые эффекты трансгенной экспрессии Gm.FT2a также наблюдали в полевых экспериментах. В полевых экспериментах растения сои, гемизиготные в отношении двух событий Gm.FT2a (события 1 и 2, выше), демонстрировали в среднем около 2,68 бобов на узел на главном стебле, а растения, гомозиготные в отношении этих событий, имели в среднем около 1,40 бобов на узел, тогда как нулевые сегрегирующие растения имели около 1,63 бобов на узел. Однако в ранних полевых испытаниях было обнаружено, что растения, гемизиготные в отношении трансгенного Gm.FT2a (событие 2), имели в среднем около 3,21 бобов на узел по сравнению с около 3,05 бобов на узел в среднем в гомозиготных растениях и около 2,19 бобов на узел в нулевых сегрегирующих растениях. В другом мелкоделяночном эксперименте, проводимом в другой полевой локации, было обнаружено, что растения, гемизиготные в отношении трансгена Gm.FT2a (событие 1) имеют в среднем около 2,17 бобов на узел по сравнению с около 2,05 бобов на узел в среднем в растениях, гомозиготных в отношении трансгена Gm.FT2a (событие 2), и около 1,30 бобов на узел в нулевых сегрегирующих растениях. Таким образом, число бобов на узел в растениях, содержащих трансген Gm.FT2a, может зависеть от множества факторов, включая дозу трансгена FT, внешние и полевые условия и, возможно, разницу в сельскохозяйственной практике. Однако, подобно Gm.FT2a-трансгенным растениям, выращиваемым в теплице, гомозиготные и гемизиготные Gm.FT2a-трансгенные растения, выращиваемые в полевых условиях, часто имели меньше узлов на главном стебле, меньшую общую высоту и/или сниженное ветвление в трансгенных растениях. В действительности, растения дикого типа, как правило, характеризуются большим ветвлением и большим общим числом узлов на растение, чем гемизиготные и гомозиготные Gm.FT2a-растения.
[159] Дополнительные физиологические данные получали от гомозиготных Gm.FT2a-трансгенных растений и контрольных растений дикого типа (ДТ), выращиваемых в теплице в условиях 14-часового длинного дня (смотрите таблицу 2). Эти данные представляют усредненные измерения, сделанные для шести Gm.FT2a-трансгенных растений для каждого события или для восьми растений дикого типа.
[160] Для получения фенотипических характеристик этих растений были собраны следующие матрицы: Дни до цветения на R1 (DOFR1); дни до R7 (DOR7); длительность генеративной стадии в дни от R1 до R7 (PDR1R7); число веток на растение (BRPP); общее число фертильных узлов на ветках (FNBR); общее число фертильных узлов на растение (FNLP); общее число фертильных узлов на главном стебле (FNST); число узлов на ветках (NDBR); число узлов на главном стебле (NDMS); число узлов/растение (NDPL); процент фертильных узлов на ветках (PFNB); процент общего числа фертильных узлов (PFNN); процент фертильных узлов на главном стебле (PFNS); число бобов на растение (PDPP); число бобов на главном стебле (PODMS); число бобов на ветках (PODBR); среднее число бобов/узел; число семян на растение на R8 (SDPPR8); и масса 1000 семян (SW1000). Каждое из этих измерений проводили во время сбора, если не указано иное время.
Таблица 2. Фенотипические данные уровня конструкции для трансгенных гомозиготных в отношении Gm.FT2a растений и растений ДТ.
[161] В соответствии с вышеописанными наблюдениями, гомозиготные Gm.FT2a-трансгенные растения испытывали более раннюю индукцию цветения, чем растения ДТ (DOFR1 около 21 дня после посадки вместо около 33-34 дней для растений дикого типа). Эти измерения дополнительно показали, что число веток (и другие измерения, связанные с ветвлением, такие как число узлов или бобов на ветках) было сильно снижено. Так как трансгенные растения имели меньшую высоту и очень слабое ветвление, общее число узлов или бобов на растение также было сильно снижено. Однако число бобов на узел на главном стебле было повышено в трансгенных растениях (например, в среднем около 3,8 бобов/узел) по сравнению с нулевыми растениями дикого типа (например, около 2,4 бобов/узел).
[162] Не ограничиваясь какой-либо теорией, считается, что причиной большего числа бобов на узел, наблюдаемого для трансгенных растений сои, экспрессирующих FT2a в меристеме во время вегетативных стадий развития, по меньшей мере частично может быть синхронизация раннего цветения с ранним появлением вторичных и/или третичных кистей и/или лучшее использование ресурсов с получением большего количества дающих бобы цветков на узел. Ранняя экспрессия FT в меристеме (смотрите, например, Фиг. 3 и 4) может вызывать раннее появление дормантных меристем соцветий с получением большего числа кистей на узел растения так, что большее число кистей дает зрелые цветки и полностью развитые бобы в каждом узле. Однако последующая экспрессия FT в генеративной ткани (смотрите, например, Фиг. 5 или 6) может прекращать флоральное развитие развивающихся позже цветков в каждом узле, приводя к более эффективному размещению ресурсов в более рано развивающихся кистях, цветках и бобах. В растениях сои дикого типа намного меньший процент вторичных и третичных кистей давали цветки и полностью развитые бобы по сравнению с первичными кистями, а более поздно развивающиеся цветки первичной кисти, как правило, не дают зрелых цветков и/или полноразмерных бобов перед опаданием. Таким образом, было сделано предположение, что большее число бобов на узел может формироваться в растениях, экспрессирующих белки FT в вегетативной меристеме за счет синхронизации раннего развития цветков с ранним появлением боковых кистей в одном или более узлах растения. С по меньшей мере промотором pAt.Erecta, управляющим экспрессией FT, позже развивающиеся цветки (которые в ином случае могли бы не дать полностью развитые или полноразмерные бобы) также могут терминироваться экспрессией FT на более поздней генеративной стадии для направления ресурсов в более рано развивающиеся цветки.
Пример 4. Экспрессия гена Flowering Locus T, Gm.FT2a, под управлением альтернативных промоторов вегетативной стадии в сое.
[163] На основании фенотипов, наблюдаемых в предыдущем примере 3, для управления экспрессией трансгена Gm.FT2a были предложены два промотора, которые считаются предпочтительными в отношении листьев промоторами вегетативной стадии: pAt.BLS (SEQ ID NO: 46) и pAt.ALMT6 (SEQ ID NO: 47). В контексте данного документа «предпочтительный в отношении листьев» относится к промотору, который предпочтительно инициирует транскрипцию связанного с ним гена в тканях листьев по сравнению с другими тканями растения. Так как считается, что FT функционирует как мобильный флориген, ранняя экспрессия FT во время вегетативных стадий в периферических тканях, таких как листья, с предпочтительным в отношении листьев или специфическим в отношении листьев промотором может приводить к фенотипам, сходным с меристемо-предпочтительной экспрессией pAt.Erecta::Gm.FT2a. Дополнительно было сделано предположение, что экспрессия FT с вегетативным листовым промотором также может ослаблять сигнал индукции цветения и, следовательно, смягчить фенотипы ранней терминации, наблюдаемые при гомозиготной экспрессии FT в меристеме, и увеличить высоту и ветвление растения.
[164] В этих экспериментах конструировали трансформационные векторы для pAt.ALMT6::Gm.FT2a и pAt.BLS::Gm.FT2a и использовали для трансформации линии сои посредством Agrobacterium-опосредованной трансформации. Было показано, что экспрессия с промотором pAt.BLS начинается в листовом примордии номер 5 (p5) и экспрессируется в первичных жилках листьев только до перехода к цветению, а промотор pAt.ALMT6 также является вегетативным листовым промотором с экспрессией на более поздних стадиях развития по сравнению с pAt.BLS. Смотрите, например, Efroni et al., ʺA Protracted and Dynamic Maturation Schedule Underlies Arabidopsis Leaf Development,ʺ The Plant Cell 20(9): 2293-2306 (2008); и Shani et al., ʺStage-Specific Regulation of Solanum lycopersicum Leaf Maturation by Class 1 KNOTTED1-LIKE HOMEOBOX Proteins,ʺ The Plant Cell 21(10): 3078-3092 (2009). Получали трансгенные растения сои для каждой из этих векторных конструкций и изучали в отношении фенотипов в камерах для выращивания в 14-часовых фотопериодических условиях в сравнении с растениями дикого типа. Для каждой из промоторных конструкций pAt.BLS исследовали шесть трансгенных событий (5 растений на событие), а для промотора pAt.ALMT6 исследовали семь трансгенных событий (5 растений на событие). Для каждой из этих конструкций контрольные данные получали от пяти растений дикого типа.
[165] Для получения фенотипических характеристик этих трансгенных растений были собраны следующие матрицы (таблицы 3 и 4). Отдельные измерения аналогичны определенным выше, а получение фенотипических характеристик проводили для растений, гомозиготных в отношении трансгена.
Таблица 3. Фенотипические данные уровня конструкции для растений pAt.ALMT6::Gm.FT2a и растений ДТ.
Таблица 4. Фенотипические данные уровня конструкции для растений pAt.BLS::Gm.FT2a и растений ДТ.
[166] Трансгенные растения, экспрессирующие Gm.FT2a под управлением альтернативных промоторов pAt.ALMT6 и pAt.BLS были фенотипически более сходными с растениями дикого типа (ДТ), чем трансгенные растения pAT.Erecta::Gm.FT2a. Растения, трансформированные конструкциями pAt.ALMT6::Gm.FT2a и pAt.BLS::Gm.FT2a, имели время цветения и признаки вегетативного роста, сходные с контрольными растениями дикого типа, возможно, с немного увеличенным числом узлов на ветках по сравнению с растениями дикого типа (таблицы 3 и 4). Эти данные можно интерпретировать, как показывающие, что время и локация экспрессии трансгенного FT важны для получения связанных с генеративностью и урожайностью признаков или фенотипов, которые отличаются от растений дикого типа. Просто экспрессии трансгена FT во время более ранних вегетативных стадий развития (например, в тканях листьев) может быть недостаточно для изменения связанных с генеративностью и урожайностью фенотипов растения (например, числа бобов на узел). Таким образом, в соответствии с вариантами реализации данного изобретения, промотор, функционально связанный с флоригенным трансгеном FT, может предпочтительно быть меристемо-специфическим или меристемо-предпочтительным промотором помимо управления экспрессией во время вегетативных стадий развития растения. Однако, когда профили экспрессии для двух вышеуказанных предпочтительных в отношении листьев промоторов исследовали в растениях сои, в развивающихся листьях не наблюдали окрашивание GUS с промотором pAt.BLS, а промотор pAt.ALMT6 не обеспечивал выявляемую экспрессию GUS в листьях до поздних вегетативных стадий с намного более высокой экспрессией во время ранних генеративных стадий. Таким образом, остается возможность того, что экспрессии трансгенов FT в периферических тканях (листьях) во время ранних вегетативных стадий с применением разных тканеспецифических промоторов может быть достаточно, в некоторых случаях, для индукции раннего цветения и/или других связанных с генеративностью и урожайностью признаков или фенотипов, которые также могут зависеть от конкретного исследуемого вида растения.
Пример 5. Идентификация белковых доменов гомологов FT с помощью анализа Pfam.
[167] Ортологи Gm.FT2a идентифицировали с помощью анализа последовательностей и обзора литературы, а несколько примеров этих гомологов FT перечислены в таблице 5 наряду с Gm.FT2a. Они включают другие гены FT сои, а также несколько геном FT из других видов растений. Аминокислотные последовательности этих белков FT анализировали, чтобы идентифицировать любые белковые домены Pfam, используя программное обеспечение HMMER и базы данных Pfam (версия 27.0). Было обнаружено, что эти белковые последовательности FT (SEQ ID NO: 2, 4, 6, 8, 10 и 12) имеют одинаковый домен Pfam, определенный как белок фосфатидилэтаноламин-связывающего домена (PEBP), имеющий название Pfam-домена «PBP_N» и номер доступа Pfam PF01161. Расположение доменов PBP_N в каждой из этих последовательностей белка FT также приведено в таблице 5. Расположение домена PBP_N в других белках FT можно определить посредством выравнивания последовательностей. Следовательно, подразумевается, что любую последовательность ДНК, кодирующую по меньшей мере белок FT, содержащий домен PBP_N, можно использовать в рекомбинантной молекуле ДНК согласно данному изобретению, при условии, что соответствующий белок FT имеет флоригенную активность при эктопической экспрессии в меристеме растения.
Таблица 5. Расположение домена PBP_N (Pfam) в последовательностях белков FT.
SEQ ID NO.
Пример 6. Экспрессия гомологов FT под управлением промотора pAt.Erecta в сое.
[168] Конструировали дополнительные трансформационные векторы, содержащие другие гомологи FT (таблица 6) под управлением промотора pAt.Erecta, и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в отношении их фенотипов в теплице с 14-14,5-часовым естественным фотопериодом светового дня. Для каждой конструкции исследовали шесть событий (6 растений на событие). Также исследовали шесть растений и усредняли для контрольных растений дикого типа (ДТ). Разные группы экспериментов (A-E) проводили, как показано в таблице 6, с отдельными контролями дикого типа.
Таблица 6. Перечень конструкций для некоторых Gm.FT2a и их гомологов с их белковыми последовательностями.
[169] Следующие матрицы были собраны для получения фенотипических характеристик растений, трансформированных каждой из конструкций, перечисленных в таблице 6, для экспрессии гомологов FT с промотором pAt.Erecta в дополнение к данным, полученным для конструкции Gm.FT2a, как описано выше. Отдельные измерения аналогичны определенным выше, а получение фенотипических трансформантов характеристик проводили для растений, гомозиготных в отношении трансгена.
[170] Фенотипические данные были получены для растений, экспрессирующих трансгены Zm.ZCN8 и Nt.FT-подобный под управлением промотора pAt.Erecta (смотрите таблицы 7 и 8). Характерные значения для каждого события в таблицах 7 и 8 усреднены по всем исследуемым растениям, содержащим событие. Также приведена колонка с усреднением значений события для каждого признака.
Таблица 7. Фенотипические данные уровня конструкции и события для растений Zm.ZCN8 и растений ДТ.
(граммы)
Таблица 8. Фенотипические данные уровня конструкции и события для растений Nt.FT-подобный и растений ДТ.
[171] Трансгенные растения сои, экспрессирующие белки Zm.ZCN8 и Nt.FT-подобный, цвели раньше, чем контрольные растения дикого типа и имели увеличенное число бобов на узел (аналогично растениям, экспрессирующим трансген Gm.FT2a). В действительности, растения сои, экспрессирующие Zm.ZCN8 и Nt.FT-подобный, имели несколько фенотипов, сходных с Gm.FT2a-трансгенными растениями, включая меньшее число дней до цветения (DOFR1), меньшее число веток (BRPP), меньше узлов на растение (NDPL), меньше узлов на ветках (NDBR), меньшее число бобов на растение (PDPP) и меньше бобов на ветках (PODBR), наряду с увеличением числа бобов на узел и снижением числа семян на растение (таблицы 7 и 8) по сравнению с контролями дикого типа. Однако несколько негативных фенотипов, наблюдаемых в гомозиготных в отношении Gm.FT2a растениях, были менее выражены в экспрессирующих Zm.ZCN8 и Nt.FT-подобный трансгенных растениях. В целом, растения, экспрессирующие трансген Zm.ZCN8, имели меньшую высоту и меньшее ветвление, но больше бобов на узел на главном стебле. Аналогично, растения, экспрессирующие трансген Nt.FT-подобный, имели меньшую высоту, меньшее ветвление, увеличенное число бобов на узел на главном стебле по сравнению с контрольными растениями дикого типа.
[172] Два трансгенных события Zm.ZCN8 и четыре события Nt.FT-подобный из вышеперечисленных также исследовали в полевых испытаниях в двух разных локациях. Фенотипические данные были получены для растений, экспрессирующих трансгены Zm.ZCN8 и Nt.FT-подобный под управлением промотора pAt.Erecta (таблицы 9 и 10). В случае полевых измерений признаки были аналогичными с перечисленными выше для таблиц с данными по теплицам, за исключением того, что DOR8 и PDR1R8 представляют количество дней до R8 и длительность генеративной стадии между R1 и R8. Кроме того, все остальные признаки определяли при сборе (т. е. на стадии R8) вместо стадии R7. События 1 и 2 в таблице 9 соответствуют событиям 2 и 3 с таблице 7, а события 1-4 в таблице 10 соответствуют событиям 1-4 в таблице 8, соответственно. За исключение количества дней до цветения на R1 (DOFR1) и длительности генеративной стадии в днях от R1 до R8 (PDR1R8), все фенотипические измерения получены на основании данных, собранных в двух локациях. Аналогично наблюдениям в теплице, трансгенные растения сои, экспрессирующие белки Zm.ZCN8 и Nt.FT-подобный, также цвели раньше, чем контрольные растения дикого типа в поле. Zm.ZCN8-трансгенные растения имели увеличенное число бобов на узел, тогда как растения Nt.FT-подобный не демонстрировали четкого увеличения числа бобов на узел в полевых испытаниях.
Таблица 9. Фенотипические данные с полевых испытаний для растений Zm.ZCN8 и растений ДТ.
(* - данные по одной локации)
Таблица 10. Фенотипические данные с полевых испытаний для растений Nt.FT-подобный и растений ДТ.
(* - данные по одной локации)
[173] Дополнительные фенотипические данные были получены для растений, экспрессирующих трансген Gm.FT2b под управлением промотора pAt.Erecta (таблица 11).
Таблица 11. Фенотипические данные уровня конструкции и события для растений Gm.FT2b и растений ДТ.
(граммы)
[174] Трансгенные растения сои, экспрессирующие трансген Gm.FT2b, цвели раньше и имели меньшее ветвление, чем контрольные растения дикого типа. Gm.FT2b-экспрессирующие растения сои характеризовались сниженным количеством дней до цветения (DOFR1), сниженным числом веток (BRPP), меньшим числом узлов на растение (NDPL), меньшим числом узлов на ветках (NDBR), сниженным числом бобов на растение (PDPP) и меньшим числом бобов на ветках (PODBR) (таблица 9). Однако Gm.FT2b-трансгенные растения не демонстрировали увеличение числа бобов на узел. В целом, растения, экспрессирующие трансген Gm.FT2b, имели меньшую высоту и меньшее ветвление по сравнению с контрольными растениями дикого типа. Трансгенные растения сои, экспрессирующие четыре разные события трансгена Gm.FT2b, также исследовали в полевых экспериментах. Фенотипические данные были получены для растений, экспрессирующих трансген Gm.FT2b под управлением промотора pAt.Erecta (таблица 12). События 1-4 в таблице 11 соответствуют событиям 3, 2, 1 и 4 в таблице 12, соответственно. Аналогично наблюдениям в теплице, Gm.FT2b-экспрессирующие растения сои демонстрировали сниженное количество дней до цветения (DOFR1) в поле. Другие фенотипические измерения также демонстрировали аналогичные с наблюдаемыми в теплице признаки по сравнению с контрольными растениями дикого типа.
Таблица 12. Фенотипические данные с полевых испытаний для растений Gm.FT2b и растений ДТ.
[175] Дополнительные фенотипические данные были получены для растений, экспрессирующих трансген Le.SFT под управлением промотора pAt.Erecta (таблица 13).
Таблица 13. Фенотипические данные уровня конструкции и события для растений Le.SFT и растений ДТ.
узел
(граммы)
[176] В целом, растения сои, экспрессирующие трансген Le.SFT, имели меньшую высоту с меньшим ветвлением и в среднем увеличенное число бобов на узел по сравнению с контрольными растениями дикого типа (таблица 13). Однако эти эффекты варьировались и зависели от события. Например, события 1, 3 и 4 демонстрировали раннее цветение (DOFR1), тогда как другие события были нейтральными или фактически имели задержку цветения. Кроме того, некоторые из трансгенных событий Le.SFT демонстрировали увеличение числа бобов на узел в среднем в разной степени, тогда как пара событий были нейтральными в смысле числа бобов на узел. Интересно, что два события (события 5 и 6) имели в среднем наибольшее число бобов на узел, несмотря на задержку цветения.
[177] Дополнительные фенотипические данные были получены для растений, экспрессирующих трансген Gm.FT5a под управлением промотора pAt.Erecta (таблица 14).
Таблица 14. Фенотипические данные уровня конструкции и события для растений Gm.FT5a и растений ДТ.
(граммы)
[178] Трансгенные растения сои, экспрессирующие трансген Gm.FT5a, цвели значительно раньше, чем контрольные растения дикого типа и имели увеличенное число бобов на узел (аналогично растениям, экспрессирующим трансген Gm.FT2a). В действительности, растения сои, экспрессирующие Gm.FT5a, имели несколько фенотипов (сходных с Gm.FT2a-трансгенными растениями), включая меньшее число дней до цветения (DOFR1), меньшее число веток (BRPP), меньше узлов на растение (NDPL), меньше узлов на ветках (NDBR), меньшее число бобов на растение (PDPP) и меньше бобов на ветках (PODBR), наряду с увеличением числа бобов на узел и снижением числа семян на растение (таблица 14). В целом, растения, экспрессирующие трансген Gm.FT5a, имели меньшую высоту и меньшее ветвление, но больше бобов на узел (в частности, на главном стебле) по сравнению с контрольными растениями дикого типа.
[179] Не ограничиваясь какой-либо теорией, эти данные поддерживают модель действия сверхэкспрессии FT дозозависимым образом со степенью или мерой связанных фенотипов (например, раннее цветение, увеличение числа бобов на узел и изменение архитектуры растения) в зависимости от (i) уровня и времени экспрессии FT, (ii) тканевой специфичности экспрессии FT и (iii) относительной активности и целевой специфичности конкретного экспрессируемого белка FT. Например, экспрессия ортологов белка FT из других видов растений в сое может указывать более слабый эффект по сравнению со сверхэкспрессией эндогенного белка FT (Gm.FT2a) в сое, что может быть связано с тем, что ненативные гомологи белка FT имеют более низкую активность в сое. Однако экспрессия некоторых нативных белков FT может не приводить к существенным фенотипическим эффектам, если они имеют отличную специализированную роль в своем нативном состоянии или контексте. Разные белки FT также могут действовать на разные тканевые мишени и рецепторы и, следовательно, иметь разные эффекты на различные связанные с архитектурой растений и цветением признаки и фенотипы.
[180] Вне зависимости от уровня активности конкретного гомолога FT изменение связанных с генеративностью и архитектурой растения фенотипов коррелирует со временем и локацией экспрессии FT. Экспрессия трансгенов FT на вегетативной стадии может быть необходима для индукции раннего цветения и/или увеличения числа флоральных меристем, цветков, бобов и т. д. на узел растения. В действительности, показано, что экспрессия FT в меристематических тканях во время вегетативных стадий развития с соответствующей дозой трансгена FT вызывает генеративные изменения в растениях, которые приводят к увеличению числа цветков, бобов и/или семян на узел. В противоположность этому, экспрессия трансгена Gm.FT2a под управлением предпочтительных в отношении листьев промоторов приводила к очень небольшим, в случае их наличия, фенотипическим изменения, по сравнению с растениями дикого типа. Эти данные показывают, что как время, так и тканевая специфичность (или тканевая предпочтительность) экспрессии FT являются важными факторами, которые влияют на генеративные и/или связанные с урожайностью фенотипические изменения в трансгенных растениях.
[181] Представленные данные позволяют предположить, что разные белки FT могут иметь разные уровни активности и/или разную тканевую специфичность, несмотря на экспрессию с одним и тем же промотором pErecta. Хотя несколько конструкций, экспрессирующих Gm.FT2a, Zm.ZCN8, Nt.FT-подобный и Gm.FT5a, вызывали ранние цветение и терминацию кроме увеличения числа бобов на узел, другие конструкции, экспрессирующие Gm.FT2b и Le.SFT, оказывали другие коррелятивные эффекты на цветение. Экспрессия Gm.FT2b не вызывала ранние цветение и терминацию растений, но и не отличалась существенным увеличением числа бобов на узел. С другой стороны, экспрессия Le.SFT демонстрировала увеличение числа бобов на узел и раннюю терминацию, несмотря на задержку цветения. Интересно, что увеличение числа бобов на узел в FT-трансгенных растениях не коррелирует с продлением генеративной стадии (PDR1R7) и не всегда сопутствовало раннему цветению (DOFR1), как отмечено выше. Эти данные позволяют предположить, что генеративные изменения в ответ на экспрессию белков FT в меристеме на вегетативной стадии могут происходить посредством одного или более независимых механизмов или путей. Увеличение числа бобов на узел в FT-трансгенных растениях может зависеть от числа меристем соцветий и флоральных меристем, индуцированных из вегетативных меристеме в каждом узле, что может происходить независимо от времени цветения и/или длительности генеративной стадии. Однако, как отмечено выше, длительность генеративной стадии не обязательно может коррелировать с длительностью цветения.
Пример 7. Идентификация дополнительных меристематических промоторов вегетативной стадии.
[182] После наблюдения фенотипических эффектов с экспрессией Gm.FT2a под управлением меристемо-предпочтительного промотора вегетативной стадии pAt.Erecta, предполагается, что можно использовать другие меристемо-предпочтительные (меристемо-специфические) промоторы вегетативной стадии для управления экспрессией белков FT для инициации связанных с генеративностью или урожайностью признаков или фенотипов в растениях, таких как увеличенное числом бобов на узел (и/или на растение или главный стебель). Используя изученный профиль экспрессии промотора pAt.Erecta (смотрите пример 2), были идентифицированы другие меристемо-предпочтительные (меристемо-специфические) промоторы вегетативной стадии из сои, картофеля и Arabidopsis. Использовали два биоинформационных подхода для идентификации кандидатных генов из других видов двудольных, включая, например, Arabidopsis, сою, Medicago, картофель и томат, имеющие сходные профили экспрессии с pAt.Erecta: BAR Espressolog и Expression Angler. Смотрите, например, BAR expressolog identification: expression profile similarity ranking of homologous genes in plant species,ʺ Plant J 71(6): 1038-50 (2012); и Toufighi, K et al., ʺThe Botany Array Resource: e-Northerns, Expression Angling, and promoter analyses,ʺ Plant J 43(1): 153-163 (2005). Следовательно, промоторные последовательности из этих генов были предложены для применения при экспрессии трансгенов FT в соответствии с вариантами реализации данного изобретения.
[183] Примеры промоторов генов, идентифицированных в этом анализе, включают следующие: четыре гена рецептор-подобной киназы (RLK) из сои, включая Glyma10g38730 (SEQ ID NO: 33), Glyma09g27950 (SEQ ID NO: 34), Glyma06g05900 (SEQ ID NO: 35) и Glyma17g34380 (SEQ ID NO: 36). Дополнительные примеры включают промоторы гена рецептор-подобной киназы (RLK) из картофеля, PGSC0003DMP400032802 (SEQ ID NO: 37) и PGSC0003DMP400054040 (SEQ ID NO: 38). Возможно, что эти гены RLK могут быть структурно и/или функционально родственными с генами Erecta и Erecta-подобный из Arabidopsis и других видов, так как они тоже являются генами RLK. Другие меристемо-предпочтительные промоторы вегетативной стадии из генов Arabidopsis включают следующие: At.MYB17 (At.LMI2; At3g61250) (SEQ ID NO: 41), Kinesin-подобный ген (At5g55520) (SEQ ID NO: 42), AP2/B3-подобные гены, включая At.REM17 (SEQ ID NO: 43) или At.REM19 и гены Erecta-подобный 1 и 2, At.Erl1 (SEQ ID NO: 44) и At.Erl2 (SEQ ID NO: 45). Каждый из этих промоторов и сходных функциональных последовательностей может быть функционально связан с геном FT для инициации эктопической экспрессии генов FT в одно или более меристемах растений по меньшей мере во время вегетативной (-ых) стадии (-ий) развития.
[184] В отношении гена At.MYB17 (At.LMI2) смотрите Pastore, JL et al., ʺLATE MERISTEM IDENTITY 2 acts together with LEAFY to activate APETALA1,ʺ Development 138: 3189-3198 (2011), полное содержание которой включено в данный документ посредством ссылки. В отношении гена Kinesin-like смотрите Fleury, D et al., ʺThe Arabidopsis thaliana Homolog of Yeast BRE1 Has a Function in Cell Cycle Regulation during Early Leaf and Root Growth,ʺ Plant Cell, 19(2): 417-432 (2007), полное содержание которой включено в данный документ посредством ссылки. В отношении генов REM17 и REM19 Arabidopsis смотрите Mantegazza, O et al., ʺAnalysis of the Arabidopsis REM gene family predicts functions during flower development,ʺ Ann Bot 114(7): 1507-1515 (2014), полное содержание которой включено в данный документ посредством ссылки. Дополнительно в отношении гена At.Erl2 смотрите ʺSpecial Issue: Receptor-like Kinases,ʺ JIPB 55(12): 1181-1286 (2013), и, в частности, Shpak, E., ʺDiverse Roles of ERECTA Family Genes in Plant Development,ʺ JIPB 55(12): 1251-1263 (2013), полное содержание которых включено в данный документ посредством ссылки.
Пример 8. Экспрессия гена Flowering Locus T, Gm.FT2a, под управлением промотора pAt.Erl1 изменяет время цветения и число бобов на узел в сое.
[185] Конструировали трансформационный вектор, содержащий Gm.FT2a под управлением меристемо-предпочтительного промотора вегетативной стадии pAt.Erl1 (SEQ ID NO: 44) и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в отношении их фенотипов в теплице с 14-14,5-часовым естественным фотопериодом светового дня. Для каждой конструкции pAt.Erl1::Gm.FT2a исследовали шесть событий (6 растений на событие) в теплице. Также исследовали шесть растений и усредняли для контрольных растений дикого типа (ДТ). Также исследовали четыре события в поле с 12 параллельными участками поля на событие и сравнивали с контролями ДТ на том же поле. Для получения фенотипических характеристик этих растений были собраны следующие матрицы и выражены в виде среднего для каждого события (а также растений дикого типа) при выращивании в теплице (смотрите таблицу 15) и в поле (смотрите таблицу 16). Также приведена колонка с усреднением по всем событиям на признак.
Таблица 15. Фенотипические данные для растений pAt.Erl1:Gm.FT2a и растений ДТ, выращиваемых в теплице.
узел
(граммы)
Таблица 16. Фенотипические данные для растений pAt.Erl1:Gm.FT2a и растений ДТ, выращиваемых в поле.
(унции)
[186] Трансгенные растения сои, экспрессирующие конструкцию pAt.Erl1::Gm.FT2a, цвели раньше, чем контрольные растения дикого типа и имели увеличенное число бобов на узел (аналогично растениям, экспрессирующим трансген Gm.FT2a под управлением промотора pAt.Erecta). В действительности, растения сои, экспрессирующие pAt.Erl1::Gm.FT2a, имели несколько фенотипов, сходных с pAt.Erecta::Gm.FT2a-трансгенными растениями, включая меньшее число дней до цветения (DOFR1), меньшее число дней до R7 (DOR7), меньшее число веток на растение (BRPP), меньше узлов на растение (NDPL), меньшее число бобов на растение (PDPP), наряду с увеличением числа бобов на узел (таблица 15) по сравнению с контрольными растениями дикого типа. Однако несколько фенотипов, наблюдаемых в растениях pAt.Erecta::Gm.FT2a, таких как число бобов на главном стебле (PODMS), число бобов на ветках (PODBR) и масса 1000 семян (SW1000), были менее выражены в экспрессирующих pAt.Erl1::Gm.FT2a трансгенных растениях. Ранние результаты на второй год полевых исследований также продемонстрировали раннее цветение, что указывает на сходные генеративные признаки. Как следствие, измерения для этих признаков могут быть сокращены по-другому, например, PDPP или PODPP для числа бобов на растение, PDMS или PODMS для числа бобов на главном стебле, PDBR или PODBR для числа бобов на ветках, TPBR для общего числа бобов на ветках и т. д.
[187] Профиль экспрессии для промотора Erecta-подобный 1 Arabidopsis (pAt.Erl1) в сое, измеряемый по окрашиванию GUS, является более ограниченным, чем профиль экспрессии pAt.Erecta в сое, описанный выше. pAt.Erl1 управляет экспрессией GUS в вегетативных аксиллярных меристемах и в ранних флоральных меристемах, полученных из аксиллярной ткани. Однако окрашивание GUS не наблюдается в апикальной меристеме побегов на любой стадии, на которой ее можно отличить от других меристематических тканей развивающегося растения. Экспрессия репортера GUS под управлением промотора pAt.Erl1 не наблюдается в ткани листьев, стебле или корнях на любой стадии (данные не показаны). Учитывая, что экспрессия FT под управлением промотора pAt.Erecta или pAt.Erl1 индуцировала раннее цветение и увеличение числа бобов на узел, вегетативной экспрессии трансгена FT в меристеме растения или вблизи нее в целом может быть достаточно для индукции этих связанных с генеративностью и урожайностью фенотипов или признаков.
Пример 9. Экспрессия микроРНК, нацеленной на Gm.FT2a для супрессии
[188] Было сделано предположение, что снижение уровня экспрессии трансгена Gm.FT2a вод управлением промотора вегетативной стадии в генеративных или флоральных тканях посредством супрессии РНК может продлить генеративную стадию в растениях сои. Чтобы исследовать, влияет ли супрессия эндогенного Gm.FT2a на генеративные или морфологические фенотипы растений сои, конструировали трансформационный вектор, содержащий последовательность ДНК пригодную для транскрипции, кодирующую молекулу микроРНК (микроРНК-FT2a; SEQ ID NO: 67), которая нацелена на экспрессию эндогенного Gm.FT2a под управлением промотора поздней вегетативной и/или генеративной стадии, промотора pAt.AP1 (SEQ ID NO: 49) или промотора pSl.MADS-RIN (SEQ ID NO: 72), и использовали для трансформации растений сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в теплице в условиях 14-14,5-часового фотопериода светового дня. Исследовали по шесть растений на событие и сравнивали в среднем с контрольными растениями дикого типа (ДТ). Усредненные фенотипические данные, полученные по растениям pAP1::miRNA-FT и растениям дикого типа в теплице, приведены в таблице 17. В таблице 18 приведены фенотипические наблюдения для растений pMADS-RIN::miRNA-FT и растений дикого типа в теплице и выражены в виде среднего для каждого события и в виде среднего по событиям и растениям дикого типа.
Таблица 17. Фенотипические данные для растений pAP1::miRNA-FT2a и растений ДТ, выращиваемых в теплице.
[189] В тепличных условиях время и начало цветения в растениях, экспрессирующих конструкцию pAP1::miRNA-FT2a, было приблизительно таким же, что и в контрольных растениях ДТ. Трансгенные растения, экспрессирующие конструкцию pAP1::miRNA-FT2a или pMADS-RIN::miRNA-FT2a, также выращивали в полевых условиях. Исследовали шесть растений, содержащих четыре разных событий конструкции pAP1::miRNA-FT2a и сравнивали в среднем с контрольными растениями дикого типа (ДТ). В случае полевых экспериментов измерения проводили при сборе (стадия R8), если не указано иное. SDARR8 представляет количество семян на площадь (т. е. на квадратный фут) на стадии R8. Усредненные фенотипические данные, полученные для выращенных в поле растений, приведены в таблице 18 для конструкции pAP1::miRNA-FT2a и в таблице 20 для конструкции pMADS-RIN::miRNA-FT2a.
Таблица 18. Фенотипические данные для выращенных в поле растений pAP1::miRNA-FT2a и растений ДТ.
(унции)
[190] В полевых условиях растения сои, трансформированные конструкцией pAP1::miRNA-FT2a снова имели в среднем приблизительно такие же признаки цветения и генеративные признаки, что и контрольные растения ДТ, хотя pAP1::miRNA-FT2a-трансгенные растения могли иметь немного меньше бобов (PDPPR8, PDMSR8, TPBR8, бобов/узел) по сравнению с контрольными растениями ДТ на стадии R8.
Пример 10. Модификация экспрессии Gm.FT2a искусственной микроРНК, управляемой промотором pAP1, изменяет генеративные фенотипы в тепличных условиях.
[191] Чтобы показать, что супрессия Gm.FT2a в поздних вегетативных и/или генеративных тканях после исходной эктопической экспрессии трансгенного Gm.FT2a может продлевать генеративную стадию в растениях сои и/или противодействовать ранней терминации, конструировали трансформационный вектор, содержащий Gm.FT2a под управлением меристемо-предпочтительного промотора вегетативной стадии pAt.Erecta (SEQ ID NO: 31) с областью терминатора Apx или Lhcb2 (T-Apx и T-Lhcb2), и пригодную для транскрипции молекулу ДНК, кодирующую искусственную микроРНК (SEQ ID NO: 67), нацеленную на Gm.FT2a для супрессии и под управлением промотора pAt.AP1 (SEQ ID NO: 49) с областью терминатора GAPDH (каждая конструкция обозначена pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a) и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в теплице с 14-14,5-часовым фотопериодом светового дня. Для каждой конструкции pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a исследовали шесть событий (6 растений на событие) и усредняли данные. Усредненные данные для каждой конструкции также усредняли по событиям. Также исследовали шесть контрольных растений дикого типа (ДТ) и усредняли как контроль. В таблицах 19 и 20 приведены фенотипические данные, полученные для шести событий, а также средние значения для растений pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a и ДТ с двумя разными областями терминатора (T-Apx и T-Lhcb2).
Таблица 19. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Apx | pAP1::miRNA-FT2a::T-GAPDH и растений ДТ в тепличных условиях.
узел
(граммы)
Таблица 20. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Lhcb2 | pAP1::miRNA-FT2a::T-GAPDH и растений ДТ в тепличных условиях.
(граммы)
[192] В этом эксперименте в теплице трансгенные растения сои, содержащие конструкции pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a, характеризовались более ранним началом цветения (DOFR1) и увеличенным числом бобов на узел (и на главный стебель) по сравнению с контрольными растениями ДТ (бобов/узел, PODMS). Трансгенные растения с комбинированной конструкцией pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a имели большую высоту растений и повышенное ветвление, а также увеличенное число узлов на растение (и на главный стебель) и увеличенное число бобов на растение (и на главный стебель) по сравнению с растениями сои только с трансгеном pAt.Erecta::Gm.FT2a без супрессорной кассеты микроРНК (смотрите, например, таблицу 2). На Фиг. 12 приведены полные изображения растений, гомозиготных в отношении pAt.Erecta::Gm.FT2a или pAt.Erecta::Gm.FT2a/pAP1::miRNA-FT2a, демонстрирующие, что дополнительная супрессия трансгена Gm.FT2a является эффективной для смягчения фенотипов ранней терминации, наблюдаемых с одним трансгеном pAt.Erecta::Gm.FT2a, включая небольшую высоту растений и сниженное ветвление.
[193] Эти данные показывают, что супрессия Gm.FT2a в поздних вегетативных и/или генеративнивных тканях после более ранней эктопической дозы трансгена Gm.FT2a является эффективной для инициации раннего цветения и сохранения увеличенного числа бобов на узел, смягчая при этом фенотипы ранней терминации, наблюдаемые в растениях, содержащих один трансген Gm.FT2a. Интересно, что увеличенное число бобов на узел в этих растениях наблюдали без очевидного увеличения длительности генеративной стадии.
Пример 11. Модификация экспрессии Gm.FT2a искусственной микроРНК, управляемой промотором pAP1, изменяет генеративные фенотипы в полевых условиях.
[194] Три из четырех трансформационных событий (в зависимости от года) конструкции pAt.Erecta::Gm.FT2a::T-Apx | pAP1::miRNA-FT2a::T-GAPDH, описанных в примере 10, выращивали и исследовали в полевых условиях в течение двух последовательных лет. Для каждого из событий и контроля ДТ получали и усредняли фенотипические данные (события пронумерованы для соответствия). В таблицах 21 и 22 приведены усредненные фенотипические данные, полученные для этих растений, а также в виде среднего по трем событиям.
[195] Четыре трансформационных события конструкции pAt.Erecta::Gm.FT2a::T-Lhbc2 | pAP1::miRNA-FT::T-GAPDH, описанные в примере 10, выращивали и исследовали в полевых условиях в течение двух последовательных лет. Для каждого события и контроля ДТ получали и усредняли фенотипические данные по некоторому количеству растений. В таблицах 23 и 24 приведены усредненные фенотипические данные, полученные для этих растений, а также в виде среднего по четырем событиям.
Таблица 21. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Apx | pAP1::miRNA-FT::T-GAPDH и растений ДТ, выращенных в поле (год 1).
(унции)
Таблица 22. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Apx | pAP1::miRNA-FT::T-GAPDH и растений ДТ, выращенных в поле (год 2).
(унции)
Таблица 23. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T- Lhbc2 | pAP1::miRNA-FT::T-GAPDH и растений ДТ, выращенных в поле (год 1).
узел
(унции)
Таблица 24. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T- Lhbc2 | pAP1::miRNA-FT::T-GAPDH и растений ДТ, выращенных в поле (год 2).
(унции)
[196] Растения сои, содержащие любую из конструкций pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a (с любым терминатором) цвели раньше (DOFR1) и имели немного продленную генеративную стадию (в днях) между стадиями R1 и R8 (PDR1R8) и увеличенное число бобов на узел (и на растение) на стадии R8 (PDPPR8, бобов/узел) при выращивании в полевых условиях по сравнению с контрольными растениями ДТ. Однако, растения сои, содержащие конструкцию pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a::T-GAPDH, также характеризовались сниженным ветвлением (BRPPR8) по сравнению с контрольными растениями ДТ. Ранние результаты на третий год полевых исследований растений с конструкцией pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a::T-GAPDH также продемонстрировали раннее цветение, что указывает на сходные генеративные признаки.
[197] Эти полевые результаты показывают, что обе конструкции pAt.Erecta::Gm.FT2a | pAP1::miRNA-FT2a::T-GAPDH с разными терминаторами способны повышать признаки урожайности и смягчать фенотипы ранней терминации в полевых условиях (смотрите, например, пример 3, выше), что согласуется с тепличными данными, приведенными в примере 10, выше. Эти данные дополнительно поддерживают модель, что супрессия трансгена Gm.FT2a помогает уменьшить или смягчить фенотипы ранней терминации и архитектуры растений, включая уменьшение высоты растений, ветвления и числа узлов на растение (или на главный стебель), по сравнению с экспрессией одного трансгена Gm.FT2a.
Пример 12. Модификация экспрессии Gm.FT2a искусственной микроРНК, управляемой промотором pSl.MADS5, изменяет генеративные фенотипы в тепличных условиях.
[198] Кроме промотора pAP1, использовали другие промоторы генеративной стадии для экспрессии молекулы микроРНК, нацеленной на трансген Gm.FT2a для супрессии. В одной группе экспериментов конструировали трансформационный вектор, содержащий Gm.FT2a под управлением промотора pAt.Erecta и последовательность ДНК пригодную для транскрипции, кодирующую искусственную микроРНК, которая нацелена на Gm. FT2a для супрессии и под управлением промотора Solanum lycopersicum MADS5 (pSl.MADS5; SEQ ID NO: 71) и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в отношении их фенотипов в теплице с 14-14,5-часовым фотопериодом светового дня. Для конструкции pAt.Erecta::Gm.FT2a::T-Lhcb2 | pSl.MADS5::miRNA-FT2a::T-GAPDH исследовали шесть событий (6 растений на событие). Также исследовали шесть растений и усредняли для контрольных растений дикого типа (ДТ).
[199] В таблице 25 приведены усредненные фенотипические данные для каждого события и растения ДТ и усредненное значение по каждому признаку по всем исследуемым событиям. («--» означает, что данные не получены)
Таблица 25. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Lhcb2 | pSl.MADS5::miRNA-FT::T-GAPDH и растений ДТ в тепличных условиях.
(граммы)
[200] Аналогично с предыдущими примерами, ограничение эктопической экспрессии Gm.FT2a с помощью искусственной микроРНК, экспрессируемой в генеративных тканях, приводило к получению растений сои, которые цвели раньше (DOFR1), чем контрольные растения ДТ. Однако трансгенные растения сои, содержащие конструкцию pAt.Erecta::Gm.FT2a::T-Lhcb2 | pSl.MADS5::miRNA-FT2a::T-GAPDH, имели меньше бобов на растение (PDPP), меньше узлов на растение (NDPL), сниженное число веток (BRPP), меньше семян на растение на стадии R8 (SDPP8) и меньшую длительность генеративной стадии между стадиями R1 и R7 (PDR1R7) по сравнению с контрольными растениями ДТ, хотя эти трансгенные растения имели большее число бобов на узел (и на главный стебель) по сравнению с контрольными растениями ДТ (бобов/узел, PODMS) и фенотипы с улучшенной архитектурой растений по сравнению с экспрессией одного pAt.Erecta::Gm.FT2a (смотрите, например, таблицу 2).
[201] Эти данные дополнительно поддерживают модель, что супрессия трансгена Gm.FT2a помогает уменьшить или смягчить фенотипы ранней терминации с одним трансгеном Gm.FT2a, но экспрессия микроРНК-FT2a с промотором pMADS5 может не быть настолько эффективной, как в случае промотора pAP1, в отношении смягчения фенотипов ранней терминации.
Пример 13. Модификация экспрессии Gm.FT2a искусственной микроРНК, управляемой промотором pSl.MADS5, изменяет генеративные фенотипы в поле.
[202] Трансгенные растения, содержащие три или четыре трансформационных события конструкции pAt.Erecta::Gm.FT2a | pSl.MADS5::miRNA-FT2a, описанные в примере 12, выращивали и исследовали в полевых условиях в течение двух последовательных лет. В случае каждого события и контроля ДТ получали данные для шести растений (события пронумерованы для соответствия). В таблицах 26 и 27 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем событиям.
Таблица 26. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Lhcb2 | pSl.MADS5::miRNA-FT2a::T-GAPDH и растений ДТ, выращенных в поле (год 1).
(унции)
Таблица 27. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Lhcb2 | pSlLe.MADS5::miRNA-FT2a::T-GAPDH и растений ДТ, выращенных в поле (год 2).
(унции)
[203] Растения сои, содержащие конструкцию pAt.Erecta::Gm.FT2a | pSl.MADS5::miRNA-FT2a, цвели раньше (DOFR1) и имели немного продленную генеративную стадию (в днях) между стадиями R1 и R8 (PDR1R8) и увеличенное число бобов на узел на стадии R8 (бобов/узел) в полевых условиях по сравнению с контрольными растениями ДТ. Однако, растения сои, содержащие конструкцию pAt.Erecta::Gm.FT2a | pSl.MADS5::miRNA-FT2a, также характеризовались сниженным ветвлением (BRPPR8) по сравнению с контрольными растениями ДТ.
Пример 14. Модификация экспрессии Gm.FT2a искусственной микроРНК, управляемой промотором pSl.NOD, изменяет генеративные фенотипы в тепличных условиях.
[204] Третий промотор (pSl.NOD), регулирующий экспрессию микроРНК-FT2a, также исследовали в тепличных условиях. Конструировали трансформационный вектор, содержащий Gm.FT2a под управлением промотора pAt.Erecta (SEQ ID NO: 31) и последовательность ДНК пригодную для транскрипции, кодирующую микроРНК-FT2a (SEQ ID NO: 67) под управлением промотора Solanum lycopersicum NOD (pSl.NOD; SEQ ID NO: 70) и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, содержащие шесть событий этой конструкции pAt.Erecta::Gm.FT2a | pSl.NOD::miRNA-FT2a (шесть растений на событие), выращивали в теплице с 14-14,5-часовым фотопериодом светового дня. Данные получали для шести растений для каждого события и контроля дикого типа (ДТ). В таблице 28 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем событиям.
Таблица 28. Фенотипические данные для выращенных в теплице растений pAt.Erecta::Gm.FT2a | pSl.NOD::miRNA-FT2a и растений ДТ.
(граммы)
[205] Растения сои, содержащие конструкцию pAt.Erecta::Gm.FT2a | pSl.NOD::miRNA-FT2a, цвели раньше (DOFR1), чем контрольные растения ДТ и имели более короткую генеративную стадию (PDR1R7), меньше веток на растение (BRPP), меньше узлов на растение (NDPL) и меньше бобов на растение (PDPP) в теплице по сравнению с контрольными растениями ДТ. Однако эти трансгенные растения имели большее число бобов на узел (и на главный стебель) по сравнению с растениями ДТ (бобов/узел, PODMS) и фенотипы с улучшенной архитектурой растений по сравнению с экспрессией одного pAt.Erecta::Gm.FT2a (смотрите, например, таблицу 2).
[206] Эти данные дополнительно поддерживают модель, что супрессия трансгена Gm.FT2a помогает уменьшить или смягчить фенотипы ранней терминации, но экспрессия микроРНК-FT2a под управлением промотора pSl.NOD может не быть настолько де эффективной, как в случае промотора pAP1, в смысле смягчения фенотипов ранней терминации, хотя эти трансгенные растения имели большее число бобов на узел (и на главный стебель), чем контрольные растения ДТ (бобов/узел, PODMS).
Пример 15. Модификация эктопической экспрессии Gm.FT2a с помощью целевого сайта для гетерологичной miR172 изменяет генеративные фенотипы в тепличных условиях.
[207] В качестве альтернативного подхода для супрессии Gm.FT2a создавали конструкции, содержащие трансген Gm.FT2a и сконструированную мишень или сайт связывания (или сенсор) микроРНК, который распознается эндогенной микроРНК в сое, которые служили для ослабления и/или корректировки эктопической экспрессии трансгена Gm.FT2a. Конструировали трансформационные векторы, содержащие трансген Gm.FT2a под управлением промотора pAt.Erecta (SEQ ID NO: 31) с областью терминатора Apx или Lhcb2 (T-Apx и T-Lhcb2), и дополнительно содержащие последовательность (SEQ ID NO: 98), кодирующую целевой сайт микроРНК miR172 (SEQ ID NO: 99) в мРНК трансгенного Gm.FT2a и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в отношении их фенотипов в теплице с 14-14,5-часовым фотопериодом светового дня. Для каждой из двух конструкций pAt.Erecta::Gm.FT2a с сайтом связывания miR172 исследовали шесть событий (6 растений на событие). Также исследовали шесть растений и усредняли для контрольных растений дикого типа (ДТ). В таблицах 29 и 30 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ для каждой из двух конструкций и усредненное значение по каждому признаку по всем исследуемым событиям.
Таблица 29. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Apx/целевой сайт miR172 и растений ДТ.
узел
(граммы)
Таблица 30. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Lhcb2/целевой сайт miR172 и растений ДТ.
(граммы)
[208] Растения сои, содержащие любую из двух конструкций pAt.Erecta::Gm.FT2a/целевой сайт miR172, цвели раньше (DOFR1), но характеризовались сниженным ветвлением (BRPP) и меньшим числом бобов и узлов на растение (PDPP, NDPL) по сравнению с контрольными растениями ДТ. Однако эти трансгенные растения имели большее число бобов на узел (и на главный стебель) по сравнению с контрольными растениями ДТ (бобов/узел, PODMS) и фенотипы с улучшенной архитектурой растений по сравнению с экспрессией одного pAt.Erecta::Gm.FT2a (смотрите таблицу 2).
[209] Эти данные поддерживают гипотезу, что супрессия трансгена Gm.FT2a с помощью целевого сайта для эндогенной miR172 является эффективной для уменьшения или смягчения фенотипов ранней терминации, наблюдаемых при экспрессии трансгена Gm.FT2a, но супрессия трансгена Gm.FT2a с помощью целевого сайта для сконструированной miR172 может не быть настолько же эффективной (по меньшей мере в некоторых случаях), что и экспрессия искусственной микроРНК для супрессии Gm.FT2a с использованием промотора поздней вегетативной и/или генеративной стадии, такого как промотор pAP1, для смягчения фенотипов ранней терминации, хотя Gm.FT2a-трансгенные растения, содержащие целевой сайт miR172, имели большее число бобов на узел (и на главный стебель), чем контрольные растения ДТ (бобов/узел, PODMS) с фенотипами с улучшенной архитектурой растений по сравнению с экспрессией одного Gm.FT2a. На Фиг. 13 приведены полные изображения растений, гомозиготных в отношении pAt.Erecta::Gm.FT2a или pAt.Erecta::Gm.FT2a/целевой сайт miR172, демонстрирующие, что дополнительная супрессия с помощью целевого сайта miR172 является эффективной для смягчения фенотипов ранней терминации, наблюдаемых с одним трансгеном pAt.Erecta::Gm.FT2a, включая небольшую высоту растений и сниженное ветвление.
Пример 16. Модификация эктопической экспрессии Gm.FT2a с помощью целевого сайта для miR172 изменяет генеративные фенотипы в полевых условиях.
[210] Трансгенные растения, содержащие четыре трансформационных события конструкции pAt.Erecta::Gm.FT2a::T-Apx/целевой сайт miR172, описанные в примере 15, выращивали и исследовали в полевых условиях. События 1-4 в таблице 29 соответствуют событиям 1-4 в таблице 31, соответственно. Данные получали для шести растений для каждого события и контроля ДТ. В таблице 31 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем событиям.
Таблица 31. Фенотипические данные для выращенных в поле растений pAt.Erecta::Gm.FT2a::T-Apx/целевой сайт miR172 и растений ДТ.
[211] Аналогично тепличным данным, растения сои с конструкцией pAt.Erecta::Gm.FT2a::T-Apx/целевой сайт miR172 цвели раньше (DOFR1) и имели большее число бобов на узел (и на главный стебель) на стадии R8 (PDPPR8, бобов/узел) в полевых условиях по сравнению с контрольными растениями ДТ. Однако эти растения сои с конструкцией pAt.Erecta::Gm.FT2a::T-Apx/целевой сайт miR172 также имели сниженное ветвление (BRPPR8) и сниженное число бобов и узлов на растение (PDPPR8, NDPLR8) по сравнению с контрольными растениями ДТ.
Пример 17. Модификация эктопической экспрессии Gm.FT2a с помощью усеченного промотора pAt.Erecta и целевого сайта для гетерологичной miR172 изменяет генеративные фенотипы в тепличных условиях.
[212] Усеченный промотор pAt.Erecta использовали для управления ослабленным уровнем экспрессии трансгена Gm.FT2a и сопрягали с целевым сайтом для микроРНК miR172, чтобы возможно дополнительно ослабить и/или скорректировать эктопическую экспрессию трансгена Gm.FT2a. Конструировали трансформационные векторы, содержащие трансген Gm.FT2a под управлением усеченного промотора pAt.Erecta (SEQ ID NO: 32) с областью терминатора Lhcb2 (T-Lhcb2), и дополнительно содержащие последовательность (SEQ ID NO: 98), кодирующую целевой сайт miR172 (SEQ ID NO: 99), и использовали для трансформации растений сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в отношении их фенотипов в теплице с 14-14,5-часовым фотопериодом светового дня. Для конструкции pAt.Erecta_truncated::Gm.FT2a с целевым сайтом miR172 исследовали шесть событий (6 растений на событие). Также исследовали шесть растений и усредняли для контрольных растений дикого типа (ДТ). В таблице 32 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем исследуемым событиям.
Таблица 32. Фенотипические данные для растений pErecta_truncated::Gm.FT2a::T-Lhbc2/целевой сайт miR172 и растений ДТ.
(граммы)
[213] Растения сои, содержащие конструкцию pAt.Erecta_truncated::Gm.FT2a/целевой сайт miR172, цвели раньше (DOFR1), но характеризовались немного сниженным ветвлением (BRPP) и меньшим числом узлов на растение (NDPL) по сравнению с контрольными растениями ДТ. Однако эти трансгенные растения имели большее число бобов на узел (и на главный стебель) по сравнению с контрольными растениями ДТ (бобов/узел, PODMS) и фенотипы с улучшенной архитектурой растений по сравнению с экспрессией одного pAt.Erecta::Gm.FT2a (смотрите, например, таблицу 2).
[214] Эти данные поддерживают гипотезу, что супрессия трансгена Gm.FT2a с помощью целевого сайта для эндогенной miR172 является эффективной для уменьшения или смягчения ранней терминации, наблюдаемой при экспрессии трансгена Gm.FT2a, и/или что экспрессия трансгена Gm.FT2a с усеченным промотором pAt.Erecta может дополнительно смягчать фенотипы ранней терминации для экспрессии одного Gm.FT2a.
Пример 18. Модификация эктопической экспрессии Gm.FT2a с помощью усеченного промотора pAt.Erecta и целевого сайта miR172 изменяет генеративные фенотипы в поле.
[215] Трансгенные растения в отношении трех событий конструкции pAt.Erecta_truncated::Gm.FT2a::T-Lhbc2/целевой сайт miR172, описанные в примере 18, выращивали и исследовали в полевых условиях. События 1, 2 и 5 в таблице 32 соответствуют событиям 1-3 в таблице 33, соответственно. Данные получали для шести растений для каждого события и контроля ДТ. В таблице 33 приведены усредненные фенотипические данные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем событиям.
Таблица 33. Фенотипические данные для растений pErecta_truncated::Gm.FT2a::T-Lhbc2/целевой сайт miR172 и растений ДТ в поле.
(унции)
[216] Аналогично тепличным данным, растения сои с конструкцией pAt.Erecta_truncated::Gm.FT2a/целевой сайт miR172 цвели раньше (DOFR1) и имели большее число бобов на узел (и на главный стебель) на стадии R8 (PDMSR8, бобов/узел) в полевых условиях по сравнению с контрольными растениями ДТ. Однако эти растения сои с конструкцией pAt.Erecta_truncated::Gm.FT2a/целевой сайт miR172 также имели сниженное ветвление (BRPPR8) и сниженное число бобов и узлов на растение (NDPLR8) по сравнению с контрольными растениями ДТ.
Пример 19. Модификация эктопической экспрессии Gm.FT2a и нативной экспрессии Gm.FT2a, Gm.FT5a и Gm.FT5b в сое с помощью искусственной микроРНК изменяет генеративные фенотипы.
[217] Конструировали трансформационный вектор и использовали для трансформации растений сои посредством Agrobacterium-опосредованной трансформации, при этом вектор содержал трансген Gm.FT2a, как описано выше, под управлением меристемо-предпочтительного промотора вегетативной стадии pAt.Erecta (SEQ ID NO: 31) с областью терминатора Lhcb2 (T-Lhcb2), и последовательность ДНК пригодную для транскрипции, кодирующую искусственную микроРНК (SEQ ID NO: 102), которая нацелена не только на Gm.FT2a (эктопический и эндогенный), но также на эндогенные гены Gm.FT5a и Gm.FT5b для супрессии, при этом последовательность ДНК пригодная для транскрипции, кодирующая микроРНК, находится под управлением промотора pAt.AP1 (SEQ ID NO: 49) с областью терминатора GAPDH. Трансгенные растения, созданные с помощью этих событий, изучали в теплице в условиях 14-14,5-часового фотопериода светового дня. Данные получали для шести растений для каждого события и контроля ДТ. В таблице 34 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем событиям.
Таблица 34. Фенотипические данные для растений pAt.Erecta::Gm.FT2a::T-Lhbc2 | pAP1::miRNA-FT2a/FT5a/FT5b::T-GAPDH и растений ДТ, выращенных в теплице.
(граммы)
[218] В таблице 34 приведены измерения некоторых дополнительных признаков, включая PDNDBRR8 (число бобов на узел на ветках) и PDNDMSR8 (число бобов на узел на главном стебле) на стадии R8, PHTR8 (высота растения на стадии R8 в миллиметрах), SDPDR8 (число семян на боб на R8) и SNUM (число семян на растение). Растения сои, экспрессирующие кассету pAt.Erecta::Gm.FT2a с комбинированной супрессией Gm.FT2a, Gm.FT5a и Gm.FT5b, цвели раньше (DOFR1) и имели существенно увеличенное число бобов на узел (и увеличенное число бобов на главном стебле), но сниженное ветвление по сравнению с контрольными растениями ДТ.
Пример 20. Экспрессия эктопического Gm.FT2a под управлением промотора pAP1 изменяет время цветения и число бобов на узел в сое.
[219] Конструировали трансформационный вектор, содержащий Gm.FT2a под управлением промотора pAt.AP1 с областью терминатора Lhcb2, и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в теплице с 14-14,5-часовым фотопериодом светового дня. Данные получали для шести растений для каждого события и контроля ДТ. В таблице 35 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем событиям.
Таблица 35. Фенотипические данные для растений pAt.AP1::Gm.FT2a::T-Lhbc2 и растений ДТ, выращиваемых в теплице.
(граммы)
[220] Растения сои, экспрессирующие кассету pAt.AP1::Gm.FT2a::T-Lhbc2, цвели раньше (DOFR1) и имели существенно увеличенное число бобов на узел (и увеличенное число бобов на главном стебле), но сниженное ветвление по сравнению с контрольными растениями ДТ. Ранние полевые исследования с этой конструкцией также продемонстрировали раннее цветение, показывая, таким образом, что в растениях, выращиваемых в полевых условиях, будут наблюдаться сходные генеративные признаки.
Пример 21. Экспрессия эктопического Gm.FT2a под управлением промотора pSl.Nod в сое.
[221] Конструировали трансформационный вектор, содержащий Gm.FT2a под управлением промотора pSl.Nod с областью терминатора Lhcb2, и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в теплице с 14-14,5-часовым фотопериодом светового дня. Данные получали для шести растений для каждого события и контроля ДТ. В таблице 36 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем событиям.
Таблица 36. Фенотипические данные для растений pSl.Nod::Gm.FT2a::T-Lhbc2 и растений ДТ в теплице.
[222] В этих экспериментах не наблюдали существенных изменений между растениями pSl.Nod::Gm.FT2a::T-Lhbc2 и растениями ДТ. Ранние полевые результаты с этой конструкцией дополнительно показывают отсутствие изменений в начале цветения.
Пример 22. Модификация Gm.FT2a под управлением промотора pAt.Erl1 с помощью искусственной микроРНК, управляемой промотором pSl.MADS-RIN, в сое.
[223] Чтобы проверить гипотезу, что супрессия Gm.FT2a в поздних вегетативных и/или генеративных тканях после исходной эктопической экспрессии трансгенного Gm.FT2a может продлевать генеративную стадию в растениях сои, конструировали трансформационный вектор, содержащий Gm.FT2a под управлением меристемо-предпочтительного промотора вегетативной стадии pAt.Erl1 (SEQ ID NO: 44) с областью терминатора GAPDH (T-GAPDH), и последовательность ДНК пригодную для транскрипции, кодирующую искусственную микроРНК (SEQ ID NO: 67), нацеленную на Gm.FT2a для супрессии и под управлением промотора pSl.MADS-RIN (SEQ ID NO: 72) с областью терминатора T-Apx и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, изучали в теплице с 14-14,5-часовым фотопериодом светового дня. Данные получали для шести растений для каждого события и контроля ДТ. В таблице 37 приведены усредненные фенотипические данные, полученные для каждого события и контроля ДТ и усредненное значение по каждому признаку по всем событиям.
Таблица 37. Фенотипические данные для растений pAt.Erl1::Gm.FT2a::T-GAPDH | pSl.MADS-RIN::miRNA-FT2a:: T-Apx и растений ДТ, выращиваемых в теплице.
[224] Растения сои, экспрессирующие кассеты pAt.Erl1::Gm.FT2a::T-GAPDH | pSl.MADS-RIN::miRNA-FT2a, цвели немного раньше (DOFR1) и имели немного увеличенное число бобов на узел (и немного увеличенное число бобов на главном стебле) и умеренное снижение ветвления по сравнению с контрольными растениями ДТ. Ранние полевые результаты с этой конструкцией также продемонстрировали умеренно-раннее цветение, показывая, что в растениях, выращиваемых в полевых условиях, будут наблюдаться сходные умеренные изменения в генеративных признаках.
Пример 23. Модификация эктопической экспрессии Gm.FT2a с помощью промотора pAt.Erl1 и сенсора miR156 изменяет время цветения.
[225] Конструировали трансформационный вектор, содержащий Gm.FT2a под управлением меристемо-предпочтительного промотора вегетативной стадии pAt.Erl1 (SEQ ID NO: 44) с целевым сайтом miR156 (SEQ ID NO: 106) и областью терминатора GAPDH (T-GAPDH) и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, исследовали в поле. Данные получали для шести растений для каждого события и контроля ДТ. Ранние полевые результаты с этой конструкцией продемонстрировали раннее цветение, показывая, что в растениях, выращиваемых в теплице или в поле, вероятно будут наблюдаться умеренные изменения в генеративных признаках, включая увеличенное число бобов на узел.
Пример 24. Модификация эктопической экспрессии Gm.FT2a с помощью усеченного промотора pAt.Erecta изменяет время цветения.
[226] Конструировали трансформационный вектор, содержащий Gm.FT2a под управлением более короткого усеченного промотора pAt.Erecta (SEQ ID NO: 48) с областью терминатора Lhcb2 (T-Lhcb2) и использовали для трансформации сои посредством Agrobacterium-опосредованной трансформации. Трансгенные растения, созданные с помощью этих событий, исследовали в поле. Данные получали для шести растений для каждого события и контроля ДТ. Ранние полевые результаты с этой конструкцией продемонстрировали немного более раннее начало цветения, показывая, что в растениях, выращиваемых в теплице или в поле, вероятно будут наблюдаться небольшие или умеренные изменения в генеративных признаках, включая немного увеличенное число бобов на узел. Таким образом, наиболее ослабленные генеративные фенотипы и смягченные эффекты ранней терминации могут обеспечиваться этим более минимальным усеченным промотором pAt.Erecta (по сравнению с примерами 3 и 17).
[227] После подробного описания данного изобретения станет очевидной возможность модификаций, вариаций и эквивалентных вариантов реализации без отступления от сути и объема данного изобретения, описанного в данном документе и прилагаемой формуле изобретения. Кроме того, следует понимать, что все примеры в данном описании приведены в качестве неограничивающих примеров.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MONSANTO TECHNOLOGY LLC
BROWER-TOLAND, Brent
DAI, Shunhong
GABBERT, Karen
GOLDSHMIDT, Alexander
HOWELL, Miya
MCDILL, Brad
OVADYA, Dan
SAVIDGE, Beth
SHARMA, Vijay
<120> КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИЗМЕНЕНИЯ ЦВЕТЕНИЯ
И АРХИТЕКТУРЫ РАСТЕНИЙ ДЛЯ УЛУЧШЕНИЯ ПОТЕНЦИАЛА УРОЖАЙНОСТИ
<130> P34461WO00
<150> US 62/410355
<151> 2016-10-19
<150> US 62/411408
<151> 2016-10-21
<160> 110
<170> PatentIn версия 3.5
<210> 1
<211> 531
<212> ДНК
<213> Glycine max
<400> 1
atgcctagtg gaagtaggga tcctctcgtt gttgggggag taattgggga tgtattggat 60
ccttttgaat attctattcc tatgagggtt acctacaata acagagatgt cagcaatgga 120
tgtgaattca aaccctcaca agttgtcaac caaccaaggg taaatatcgg tggtgatgac 180
ctcaggaact tctatacttt gattgcggtt gatcccgatg cacctagccc aagtgacccc 240
aatttgagag aatacctcca ttggttggtg actgatatcc cagcaacaac aggggctagt 300
ttcggccatg aggttgtaac atatgaaagt ccaagaccaa tgatggggat tcatcgtttg 360
gtgtttgtgt tatttcgtca actgggtagg gagaccgtgt atgcaccagg atggcgccag 420
aatttcaaca ctaaagaatt tgctgaactt tacaaccttg gattgccagt tgctgctgtc 480
tatttcaaca ttcagaggga atctggttct ggtggaagga ggttatacta a 531
<210> 2
<211> 176
<212> Белок
<213> Glycine max
<400> 2
Met Pro Ser Gly Ser Arg Asp Pro Leu Val Val Gly Gly Val Ile Gly
1 5 10 15
Asp Val Leu Asp Pro Phe Glu Tyr Ser Ile Pro Met Arg Val Thr Tyr
20 25 30
Asn Asn Arg Asp Val Ser Asn Gly Cys Glu Phe Lys Pro Ser Gln Val
35 40 45
Val Asn Gln Pro Arg Val Asn Ile Gly Gly Asp Asp Leu Arg Asn Phe
50 55 60
Tyr Thr Leu Ile Ala Val Asp Pro Asp Ala Pro Ser Pro Ser Asp Pro
65 70 75 80
Asn Leu Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr
85 90 95
Thr Gly Ala Ser Phe Gly His Glu Val Val Thr Tyr Glu Ser Pro Arg
100 105 110
Pro Met Met Gly Ile His Arg Leu Val Phe Val Leu Phe Arg Gln Leu
115 120 125
Gly Arg Glu Thr Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe Asn Thr
130 135 140
Lys Glu Phe Ala Glu Leu Tyr Asn Leu Gly Leu Pro Val Ala Ala Val
145 150 155 160
Tyr Phe Asn Ile Gln Arg Glu Ser Gly Ser Gly Gly Arg Arg Leu Tyr
165 170 175
<210> 3
<211> 519
<212> ДНК
<213> Glycine max
<400> 3
atggcacggg agaaccctct tgttattggt ggtgtgattg gggatgttct caaccctttt 60
acaagctccg tttctttgac tgtttcaatc aataataggg cgattagcaa tggcttggaa 120
ctcaggccct ctcaagttgt taatcgccct agggttactg ttggtggtga agacctaagg 180
accttctaca ctctggttat ggtggatgca gatgcaccta gccctagcaa ccctgtcttg 240
agggaatacc ttcactggat ggtgacagat attccagcta ccacaaatgc aagctttggg 300
agagaggttg tgttttatga gagcccgaac ccttcagtag ggattcatcg aatcgtgttc 360
gtattgttcc agcaattggg cagagacact gtcatcaccc cagaatggcg ccataatttc 420
aattccagaa actttgctga aattaataac cttgcacctg ttgcagcagc ttatgccaac 480
tgccaaagag agcgtggttg cggtggaagg agatattaa 519
<210> 4
<211> 172
<212> Белок
<213> Glycine max
<400> 4
Met Ala Arg Glu Asn Pro Leu Val Ile Gly Gly Val Ile Gly Asp Val
1 5 10 15
Leu Asn Pro Phe Thr Ser Ser Val Ser Leu Thr Val Ser Ile Asn Asn
20 25 30
Arg Ala Ile Ser Asn Gly Leu Glu Leu Arg Pro Ser Gln Val Val Asn
35 40 45
Arg Pro Arg Val Thr Val Gly Gly Glu Asp Leu Arg Thr Phe Tyr Thr
50 55 60
Leu Val Met Val Asp Ala Asp Ala Pro Ser Pro Ser Asn Pro Val Leu
65 70 75 80
Arg Glu Tyr Leu His Trp Met Val Thr Asp Ile Pro Ala Thr Thr Asn
85 90 95
Ala Ser Phe Gly Arg Glu Val Val Phe Tyr Glu Ser Pro Asn Pro Ser
100 105 110
Val Gly Ile His Arg Ile Val Phe Val Leu Phe Gln Gln Leu Gly Arg
115 120 125
Asp Thr Val Ile Thr Pro Glu Trp Arg His Asn Phe Asn Ser Arg Asn
130 135 140
Phe Ala Glu Ile Asn Asn Leu Ala Pro Val Ala Ala Ala Tyr Ala Asn
145 150 155 160
Cys Gln Arg Glu Arg Gly Cys Gly Gly Arg Arg Tyr
165 170
<210> 5
<211> 531
<212> ДНК
<213> Glycine max
<400> 5
atgcctcgtg gaagtaggga ccctctagtt gttgggcgtg tgattgggga tgtattggac 60
ccttttgaat gttctattcc tatgagggtc acctacaata acaaagatgt cagcaatgga 120
tgtgaattca aaccctcaca agttgtcaac caaccaagaa taaatatcgg tggtgatgat 180
ttcaggaact tctacacttt gatcgcggtt gatcctgatg cacctagccc aagtgatccc 240
aatttcagag aatacctcca ttggttagta actgacattc cagcaacaac ggggcctact 300
ttcggtcatg aggttgtaac atatgaaaat ccacgaccca tgatggggat ccatcgtata 360
gtctttgtgt tatttcgtca acagggtaga gagacagtgt atgcaccagg atggcgccaa 420
aatttcatta ctagagaatt tgctgaactt tacaatcttg gattgccagt tgctgctgtc 480
tattttaaca tccagagaga atctggttgt ggtggaagaa ggctatgtta a 531
<210> 6
<211> 176
<212> Белок
<213> Glycine max
<400> 6
Met Pro Arg Gly Ser Arg Asp Pro Leu Val Val Gly Arg Val Ile Gly
1 5 10 15
Asp Val Leu Asp Pro Phe Glu Cys Ser Ile Pro Met Arg Val Thr Tyr
20 25 30
Asn Asn Lys Asp Val Ser Asn Gly Cys Glu Phe Lys Pro Ser Gln Val
35 40 45
Val Asn Gln Pro Arg Ile Asn Ile Gly Gly Asp Asp Phe Arg Asn Phe
50 55 60
Tyr Thr Leu Ile Ala Val Asp Pro Asp Ala Pro Ser Pro Ser Asp Pro
65 70 75 80
Asn Phe Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr
85 90 95
Thr Gly Pro Thr Phe Gly His Glu Val Val Thr Tyr Glu Asn Pro Arg
100 105 110
Pro Met Met Gly Ile His Arg Ile Val Phe Val Leu Phe Arg Gln Gln
115 120 125
Gly Arg Glu Thr Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe Ile Thr
130 135 140
Arg Glu Phe Ala Glu Leu Tyr Asn Leu Gly Leu Pro Val Ala Ala Val
145 150 155 160
Tyr Phe Asn Ile Gln Arg Glu Ser Gly Cys Gly Gly Arg Arg Leu Cys
165 170 175
<210> 7
<211> 528
<212> ДНК
<213> Zea mays
<400> 7
atgtcagcaa ccgatcattt ggttatggct cgtgtcatac aggatgtatt ggatcccttt 60
acaccaacca ttccactaag aataacgtac aacaataggc tacttctgcc aagtgctgag 120
ctaaagccat ccgcggttgt aagtaaacca cgagtcgata tcggtggcag tgacatgagg 180
gctttctaca ccctggtact gattgacccg gatgccccaa gtccaagcca tccatcacta 240
agggagtact tgcactggat ggtgacagat attccagaaa caactagtgt caactttggc 300
caagagctaa tattttatga gaggccggac ccaagatctg gcatccacag gctggtattt 360
gtgctgttcc gtcaacttgg cagggggaca gtttttgcac cagaaatgcg ccacaacttc 420
aactgcagaa gctttgcacg gcaatatcac ctcagcattg ccaccgctac acatttcaac 480
tgtcaaaggg aaggtggatc cggcggaaga aggtttaggg aagagtag 528
<210> 8
<211> 175
<212> Белок
<213> Zea mays
<400> 8
Met Ser Ala Thr Asp His Leu Val Met Ala Arg Val Ile Gln Asp Val
1 5 10 15
Leu Asp Pro Phe Thr Pro Thr Ile Pro Leu Arg Ile Thr Tyr Asn Asn
20 25 30
Arg Leu Leu Leu Pro Ser Ala Glu Leu Lys Pro Ser Ala Val Val Ser
35 40 45
Lys Pro Arg Val Asp Ile Gly Gly Ser Asp Met Arg Ala Phe Tyr Thr
50 55 60
Leu Val Leu Ile Asp Pro Asp Ala Pro Ser Pro Ser His Pro Ser Leu
65 70 75 80
Arg Glu Tyr Leu His Trp Met Val Thr Asp Ile Pro Glu Thr Thr Ser
85 90 95
Val Asn Phe Gly Gln Glu Leu Ile Phe Tyr Glu Arg Pro Asp Pro Arg
100 105 110
Ser Gly Ile His Arg Leu Val Phe Val Leu Phe Arg Gln Leu Gly Arg
115 120 125
Gly Thr Val Phe Ala Pro Glu Met Arg His Asn Phe Asn Cys Arg Ser
130 135 140
Phe Ala Arg Gln Tyr His Leu Ser Ile Ala Thr Ala Thr His Phe Asn
145 150 155 160
Cys Gln Arg Glu Gly Gly Ser Gly Gly Arg Arg Phe Arg Glu Glu
165 170 175
<210> 9
<211> 525
<212> ДНК
<213> Nicotiana tabacum
<400> 9
atgccaagaa tagatccttt gatagttggt cgtgtggtag gagatgtttt agatccattc 60
acaaggtctg ttgatcttag agtggtttac aataataggg aagtcaacaa tgcatgtggc 120
ttgaaacctt ctcaaattgt tacgcaacct agggttcaaa ttggagggga tgatcttcgc 180
aacttttaca ctctggttat ggtggatcct gatgctccaa gcccaagcaa ccctaacctg 240
agggagtatc tacactggct ggtcacagat atcccagcaa ctacagatac aagctttgga 300
aatgaagtta tatgctacga gaatccacaa ccatcattgg gaattcatcg ctttgttttc 360
gtgttgtttc gacaattggg tcgcgaaact gtgtatgcac caggttggcg tcagaatttc 420
agcacaagag actttgcaga agtttacaat cttggtttgc ccgtttctgc tgtttacttc 480
aattgccata gggagagtgg tactggtggc cgccgcgcat attaa 525
<210> 10
<211> 174
<212> Белок
<213> Nicotiana tabacum
<400> 10
Met Pro Arg Ile Asp Pro Leu Ile Val Gly Arg Val Val Gly Asp Val
1 5 10 15
Leu Asp Pro Phe Thr Arg Ser Val Asp Leu Arg Val Val Tyr Asn Asn
20 25 30
Arg Glu Val Asn Asn Ala Cys Gly Leu Lys Pro Ser Gln Ile Val Thr
35 40 45
Gln Pro Arg Val Gln Ile Gly Gly Asp Asp Leu Arg Asn Phe Tyr Thr
50 55 60
Leu Val Met Val Asp Pro Asp Ala Pro Ser Pro Ser Asn Pro Asn Leu
65 70 75 80
Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr Thr Asp
85 90 95
Thr Ser Phe Gly Asn Glu Val Ile Cys Tyr Glu Asn Pro Gln Pro Ser
100 105 110
Leu Gly Ile His Arg Phe Val Phe Val Leu Phe Arg Gln Leu Gly Arg
115 120 125
Glu Thr Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe Ser Thr Arg Asp
130 135 140
Phe Ala Glu Val Tyr Asn Leu Gly Leu Pro Val Ser Ala Val Tyr Phe
145 150 155 160
Asn Cys His Arg Glu Ser Gly Thr Gly Gly Arg Arg Ala Tyr
165 170
<210> 11
<211> 534
<212> ДНК
<213> Solanum lycopersicum
<400> 11
atgcctagag aacgtgatcc tcttgttgtt ggtcgtgtgg taggggatgt attggaccct 60
ttcacaagaa ctattggcct aagagttata tatagagata gagaagttaa taatggatgc 120
gagcttaggc cttcccaagt tattaaccag ccaagggttg aagttggagg agatgaccta 180
cgtacctttt tcactttggt tatggtggac cctgatgctc caagtccgag tgatccaaat 240
ctgagagaat accttcactg gttggtcacc gatattccag ctaccacagg ttcaagtttt 300
gggcaagaaa tagtgagcta tgaaagtcca agaccatcaa tgggaataca tcgatttgta 360
tttgtattat tcagacaatt aggtcggcaa acagtgtatg ctccaggatg gcgtcagaat 420
ttcaacacaa gagattttgc agaactttat aatcttggtt tacctgttgc tgctgtctat 480
tttaattgtc aaagagagag tggcagtggt ggacgtagaa gatctgctga ttga 534
<210> 12
<211> 177
<212> Белок
<213> Solanum lycopersicum
<400> 12
Met Pro Arg Glu Arg Asp Pro Leu Val Val Gly Arg Val Val Gly Asp
1 5 10 15
Val Leu Asp Pro Phe Thr Arg Thr Ile Gly Leu Arg Val Ile Tyr Arg
20 25 30
Asp Arg Glu Val Asn Asn Gly Cys Glu Leu Arg Pro Ser Gln Val Ile
35 40 45
Asn Gln Pro Arg Val Glu Val Gly Gly Asp Asp Leu Arg Thr Phe Phe
50 55 60
Thr Leu Val Met Val Asp Pro Asp Ala Pro Ser Pro Ser Asp Pro Asn
65 70 75 80
Leu Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr Thr
85 90 95
Gly Ser Ser Phe Gly Gln Glu Ile Val Ser Tyr Glu Ser Pro Arg Pro
100 105 110
Ser Met Gly Ile His Arg Phe Val Phe Val Leu Phe Arg Gln Leu Gly
115 120 125
Arg Gln Thr Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe Asn Thr Arg
130 135 140
Asp Phe Ala Glu Leu Tyr Asn Leu Gly Leu Pro Val Ala Ala Val Tyr
145 150 155 160
Phe Asn Cys Gln Arg Glu Ser Gly Ser Gly Gly Arg Arg Arg Ser Ala
165 170 175
Asp
<210> 13
<211> 528
<212> ДНК
<213> Arabidopsis thaliana
<400> 13
atgtctataa atataagaga ccctcttata gtaagcagag ttgttggaga cgttcttgat 60
ccgtttaata gatcaatcac tctaaaggtt acttatggcc aaagagaggt gactaatggc 120
ttggatctaa ggccttctca ggttcaaaac aagccaagag ttgagattgg tggagaagac 180
ctcaggaact tctatacttt ggttatggtg gatccagatg ttccaagtcc tagcaaccct 240
cacctccgag aatatctcca ttggttggtg actgatatcc ctgctacaac tggaacaacc 300
tttggcaatg agattgtgtg ttacgaaaat ccaagtccca ctgcaggaat tcatcgtgtc 360
gtgtttatat tgtttcgaca gcttggcagg caaacagtgt atgcaccagg gtggcgccag 420
aacttcaaca ctcgcgagtt tgctgagatc tacaatctcg gccttcccgt ggccgcagtt 480
ttctacaatt gtcagaggga gagtggctgc ggaggaagaa gactttag 528
<210> 14
<211> 175
<212> Белок
<213> Arabidopsis thaliana
<400> 14
Met Ser Ile Asn Ile Arg Asp Pro Leu Ile Val Ser Arg Val Val Gly
1 5 10 15
Asp Val Leu Asp Pro Phe Asn Arg Ser Ile Thr Leu Lys Val Thr Tyr
20 25 30
Gly Gln Arg Glu Val Thr Asn Gly Leu Asp Leu Arg Pro Ser Gln Val
35 40 45
Gln Asn Lys Pro Arg Val Glu Ile Gly Gly Glu Asp Leu Arg Asn Phe
50 55 60
Tyr Thr Leu Val Met Val Asp Pro Asp Val Pro Ser Pro Ser Asn Pro
65 70 75 80
His Leu Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr
85 90 95
Thr Gly Thr Thr Phe Gly Asn Glu Ile Val Cys Tyr Glu Asn Pro Ser
100 105 110
Pro Thr Ala Gly Ile His Arg Val Val Phe Ile Leu Phe Arg Gln Leu
115 120 125
Gly Arg Gln Thr Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe Asn Thr
130 135 140
Arg Glu Phe Ala Glu Ile Tyr Asn Leu Gly Leu Pro Val Ala Ala Val
145 150 155 160
Phe Tyr Asn Cys Gln Arg Glu Ser Gly Cys Gly Gly Arg Arg Leu
165 170 175
<210> 15
<211> 528
<212> ДНК
<213> Arabidopsis thaliana
<400> 15
atgtctttaa gtcgtagaga tcctcttgtg gtcggcagtg ttgttggaga tgttcttgat 60
cctttcacga ggttggtctc tcttaaggtc acttatggcc atagagaggt tactaatggc 120
ttggatctaa ggccttctca agttctgaac aaaccaatag tggagattgg aggagacgac 180
ttcagaaatt tctacacctt ggttatggtg gatccagatg tgccgagtcc aagcaaccct 240
caccaacgag aatatctcca ctggttggtg actgatatac ctgccaccac tggaaatgcc 300
tttggcaatg aggtggtgtg ctacgagagt ccacgtcccc cctcgggaat tcatcgtatt 360
gtgttggtat tgttccggca actcggaaga caaacggttt atgcaccggg gtggcgccaa 420
cagttcaaca ctcgtgagtt tgctgagatc tacaatcttg gtcttcctgt ggctgcctct 480
tacttcaact gccagaggga gaatggctgt gggggaagaa gaacgtag 528
<210> 16
<211> 175
<212> Белок
<213> Arabidopsis thaliana
<400> 16
Met Ser Leu Ser Arg Arg Asp Pro Leu Val Val Gly Ser Val Val Gly
1 5 10 15
Asp Val Leu Asp Pro Phe Thr Arg Leu Val Ser Leu Lys Val Thr Tyr
20 25 30
Gly His Arg Glu Val Thr Asn Gly Leu Asp Leu Arg Pro Ser Gln Val
35 40 45
Leu Asn Lys Pro Ile Val Glu Ile Gly Gly Asp Asp Phe Arg Asn Phe
50 55 60
Tyr Thr Leu Val Met Val Asp Pro Asp Val Pro Ser Pro Ser Asn Pro
65 70 75 80
His Gln Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr
85 90 95
Thr Gly Asn Ala Phe Gly Asn Glu Val Val Cys Tyr Glu Ser Pro Arg
100 105 110
Pro Pro Ser Gly Ile His Arg Ile Val Leu Val Leu Phe Arg Gln Leu
115 120 125
Gly Arg Gln Thr Val Tyr Ala Pro Gly Trp Arg Gln Gln Phe Asn Thr
130 135 140
Arg Glu Phe Ala Glu Ile Tyr Asn Leu Gly Leu Pro Val Ala Ala Ser
145 150 155 160
Tyr Phe Asn Cys Gln Arg Glu Asn Gly Cys Gly Gly Arg Arg Thr
165 170 175
<210> 17
<211> 540
<212> ДНК
<213> Oryza sativa
<400> 17
atggccggaa gtggcaggga cagggaccct cttgtggttg gtagggttgt gggtgatgtg 60
ctggacgcgt tcgtccggag caccaacctc aaggtcacct atggctccaa gaccgtgtcc 120
aatggctgcg agctcaagcc gtccatggtc acccaccagc ctagggtcga ggtcggcggc 180
aatgacatga ggacattcta cacccttgtg atggtagacc cagatgcacc aagcccaagt 240
gaccctaacc ttagggagta tctacattgg ttggtcactg atattcctgg tactactgca 300
gcgtcatttg ggcaagaggt gatgtgctac gagagcccaa ggccaaccat ggggatccac 360
cggctggtgt tcgtgctgtt ccagcagctg gggcgtcaga cagtgtacgc gcccgggtgg 420
cgtcagaact tcaacaccaa ggacttcgcc gagctctaca acctcggctc gccggtcgcc 480
gccgtctact tcaactgcca gcgcgaggca ggctccggcg gcaggagggt ctacccctag 540
<210> 18
<211> 179
<212> Белок
<213> Oryza sativa
<400> 18
Met Ala Gly Ser Gly Arg Asp Arg Asp Pro Leu Val Val Gly Arg Val
1 5 10 15
Val Gly Asp Val Leu Asp Ala Phe Val Arg Ser Thr Asn Leu Lys Val
20 25 30
Thr Tyr Gly Ser Lys Thr Val Ser Asn Gly Cys Glu Leu Lys Pro Ser
35 40 45
Met Val Thr His Gln Pro Arg Val Glu Val Gly Gly Asn Asp Met Arg
50 55 60
Thr Phe Tyr Thr Leu Val Met Val Asp Pro Asp Ala Pro Ser Pro Ser
65 70 75 80
Asp Pro Asn Leu Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro
85 90 95
Gly Thr Thr Ala Ala Ser Phe Gly Gln Glu Val Met Cys Tyr Glu Ser
100 105 110
Pro Arg Pro Thr Met Gly Ile His Arg Leu Val Phe Val Leu Phe Gln
115 120 125
Gln Leu Gly Arg Gln Thr Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe
130 135 140
Asn Thr Lys Asp Phe Ala Glu Leu Tyr Asn Leu Gly Ser Pro Val Ala
145 150 155 160
Ala Val Tyr Phe Asn Cys Gln Arg Glu Ala Gly Ser Gly Gly Arg Arg
165 170 175
Val Tyr Pro
<210> 19
<211> 525
<212> ДНК
<213> Populus trichocarpa
<400> 19
atgtcaaggg acagagatcc tctgagcgtt ggccgtgtta taggggacgt gctggacccc 60
ttcacaaagt ctatctccct cagggtcact tacagctcca gagaggtcaa caatggttgc 120
gagctcaagc cctctcaggt tgccaaccag cctagggttg atattggcgg ggaagatcta 180
aggaccttct acactctggt tatggtggac cctgatgcac ccagcccaag tgaccccagc 240
ctaagagaat atttgcattg gttggtgact gatattccag caacaactgg ggcaagcttt 300
ggccatgaaa ctgtgtgcta tgagagcccg aggccgacaa tgggaattca tcggtttgtt 360
ttcgtcttgt ttcggcaact gggcaggcaa actgtgtatg cccctgggtg gcgccagaac 420
ttcaacacca gagactttgc tgaggtctac aatcttggat cgccagtggc tgctgtttat 480
ttcaactgcc agagggagag tggctctggt ggtaggaggc gataa 525
<210> 20
<211> 174
<212> Белок
<213> Populus trichocarpa
<400> 20
Met Ser Arg Asp Arg Asp Pro Leu Ser Val Gly Arg Val Ile Gly Asp
1 5 10 15
Val Leu Asp Pro Phe Thr Lys Ser Ile Ser Leu Arg Val Thr Tyr Ser
20 25 30
Ser Arg Glu Val Asn Asn Gly Cys Glu Leu Lys Pro Ser Gln Val Ala
35 40 45
Asn Gln Pro Arg Val Asp Ile Gly Gly Glu Asp Leu Arg Thr Phe Tyr
50 55 60
Thr Leu Val Met Val Asp Pro Asp Ala Pro Ser Pro Ser Asp Pro Ser
65 70 75 80
Leu Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr Thr
85 90 95
Gly Ala Ser Phe Gly His Glu Thr Val Cys Tyr Glu Ser Pro Arg Pro
100 105 110
Thr Met Gly Ile His Arg Phe Val Phe Val Leu Phe Arg Gln Leu Gly
115 120 125
Arg Gln Thr Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe Asn Thr Arg
130 135 140
Asp Phe Ala Glu Val Tyr Asn Leu Gly Ser Pro Val Ala Ala Val Tyr
145 150 155 160
Phe Asn Cys Gln Arg Glu Ser Gly Ser Gly Gly Arg Arg Arg
165 170
<210> 21
<211> 519
<212> ДНК
<213> Glycine max
<400> 21
atggcacggg agaaccctct tgttattggg ggtgtgattg gggatgttct caatcctttt 60
acaatctccg tttcttttac tatttcaatc aataataggg cgattagcaa tggcttggaa 120
ctgaggccct ctcaagttgt taatcgccct agagtcactg ttggtggtga agacctaagg 180
accttctaca cactggttat ggtggatgca gatgcaccta gccctagcaa ccctgtcttg 240
agggaatacc ttcactggat ggtgacagat attccagcta ccacaaatgc aagctttggg 300
agagaggttg tgttttatga gagcccgaac ccttcagcag ggattcatcg acttgtgttc 360
atattattcc agcaactggg cagagacact gtcatcaccc cagaatggcg ccataatttc 420
aattccagaa actttgctga aattaataac cttgcacctg ttgcagcagc ttatgccaac 480
tgccaaagag agcgtggttg cggtggaagg agatattaa 519
<210> 22
<211> 172
<212> Белок
<213> Glycine max
<400> 22
Met Ala Arg Glu Asn Pro Leu Val Ile Gly Gly Val Ile Gly Asp Val
1 5 10 15
Leu Asn Pro Phe Thr Ile Ser Val Ser Phe Thr Ile Ser Ile Asn Asn
20 25 30
Arg Ala Ile Ser Asn Gly Leu Glu Leu Arg Pro Ser Gln Val Val Asn
35 40 45
Arg Pro Arg Val Thr Val Gly Gly Glu Asp Leu Arg Thr Phe Tyr Thr
50 55 60
Leu Val Met Val Asp Ala Asp Ala Pro Ser Pro Ser Asn Pro Val Leu
65 70 75 80
Arg Glu Tyr Leu His Trp Met Val Thr Asp Ile Pro Ala Thr Thr Asn
85 90 95
Ala Ser Phe Gly Arg Glu Val Val Phe Tyr Glu Ser Pro Asn Pro Ser
100 105 110
Ala Gly Ile His Arg Leu Val Phe Ile Leu Phe Gln Gln Leu Gly Arg
115 120 125
Asp Thr Val Ile Thr Pro Glu Trp Arg His Asn Phe Asn Ser Arg Asn
130 135 140
Phe Ala Glu Ile Asn Asn Leu Ala Pro Val Ala Ala Ala Tyr Ala Asn
145 150 155 160
Cys Gln Arg Glu Arg Gly Cys Gly Gly Arg Arg Tyr
165 170
<210> 23
<211> 525
<212> ДНК
<213> Gossypium hirsutum
<400> 23
atgcctagag acagagatcc tttggttgtt ggtagggtta taggagatgt gttggaccct 60
tttacaaggt ctatttcact tagggtcact tatgctacta gggatgttag caatggtgtt 120
gagcttaagc catctcaagt tgttaaccaa ccaagggttg atattggtgg ggatgatctg 180
aggaccttct acaccttggt tatggtggat cctgatgctc caagtccaag tgacccaaac 240
ctcagggaat acttgcactg gttggttact gatattccag ccacaactgg tgcaagcttt 300
ggtcaagagg tggtctgcta tgagagccca cgaccaacgg tcggtatcca tcgttttgtg 360
ttcgtgctgt tccggcaact tggaaggcaa acggtgtacg ctccagggtg gcgccaaaac 420
ttcaacacta gggactttgc tgagctttac aacctcgggt tgccggtggc tgctgtttac 480
tttaactgcc agagggagag tggatccggt ggccgtagga catga 525
<210> 24
<211> 174
<212> Белок
<213> Gossypium hirsutum
<400> 24
Met Pro Arg Asp Arg Asp Pro Leu Val Val Gly Arg Val Ile Gly Asp
1 5 10 15
Val Leu Asp Pro Phe Thr Arg Ser Ile Ser Leu Arg Val Thr Tyr Ala
20 25 30
Thr Arg Asp Val Ser Asn Gly Val Glu Leu Lys Pro Ser Gln Val Val
35 40 45
Asn Gln Pro Arg Val Asp Ile Gly Gly Asp Asp Leu Arg Thr Phe Tyr
50 55 60
Thr Leu Val Met Val Asp Pro Asp Ala Pro Ser Pro Ser Asp Pro Asn
65 70 75 80
Leu Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr Thr
85 90 95
Gly Ala Ser Phe Gly Gln Glu Val Val Cys Tyr Glu Ser Pro Arg Pro
100 105 110
Thr Val Gly Ile His Arg Phe Val Phe Val Leu Phe Arg Gln Leu Gly
115 120 125
Arg Gln Thr Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe Asn Thr Arg
130 135 140
Asp Phe Ala Glu Leu Tyr Asn Leu Gly Leu Pro Val Ala Ala Val Tyr
145 150 155 160
Phe Asn Cys Gln Arg Glu Ser Gly Ser Gly Gly Arg Arg Thr
165 170
<210> 25
<211> 528
<212> ДНК
<213> Brassica napus
<400> 25
atgtctttaa gtaatagaga tcctcttgtg gtagggagag ttgtaggaga cgttcttgaa 60
tgtttcacaa gatcaatcga tctaagggtt acttatggcc aaagagaggt gacaaatggg 120
ttggatctaa ggccttctca agttctcaac aagccaagag ttgagattgg tggagaagac 180
ctaaggaact tctatacttt ggttatggtg gatccagatg ttccaagtcc tagcaatcct 240
cacctccgag aatatcttca ctggttggtg actgatatcc cagcgacaac tggaacaaac 300
tttggcaatg agattgtgtc ttacgagagt ccaaggccca actcgggtat tcatcgtatc 360
gtgctcgtat tgttccgaca gctcggtagg caaacagtgt atgaaccagg atggcgccaa 420
caattcaaca ctcgtgagtt tgcttcccta tacaatctcg gccttcccgt ggctgcggtt 480
ttctacaatt gtcagaggga gagtggctgc ggaggacgaa gaagttag 528
<210> 26
<211> 175
<212> Белок
<213> Brassica napus
<400> 26
Met Ser Leu Ser Asn Arg Asp Pro Leu Val Val Gly Arg Val Val Gly
1 5 10 15
Asp Val Leu Glu Cys Phe Thr Arg Ser Ile Asp Leu Arg Val Thr Tyr
20 25 30
Gly Gln Arg Glu Val Thr Asn Gly Leu Asp Leu Arg Pro Ser Gln Val
35 40 45
Leu Asn Lys Pro Arg Val Glu Ile Gly Gly Glu Asp Leu Arg Asn Phe
50 55 60
Tyr Thr Leu Val Met Val Asp Pro Asp Val Pro Ser Pro Ser Asn Pro
65 70 75 80
His Leu Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr
85 90 95
Thr Gly Thr Asn Phe Gly Asn Glu Ile Val Ser Tyr Glu Ser Pro Arg
100 105 110
Pro Asn Ser Gly Ile His Arg Ile Val Leu Val Leu Phe Arg Gln Leu
115 120 125
Gly Arg Gln Thr Val Tyr Glu Pro Gly Trp Arg Gln Gln Phe Asn Thr
130 135 140
Arg Glu Phe Ala Ser Leu Tyr Asn Leu Gly Leu Pro Val Ala Ala Val
145 150 155 160
Phe Tyr Asn Cys Gln Arg Glu Ser Gly Cys Gly Gly Arg Arg Ser
165 170 175
<210> 27
<211> 543
<212> ДНК
<213> Triticum aestivum
<400> 27
atgtcggcag cggatccatt ggttgtggct catgttttac aagatgtgct tgatccattt 60
acatcaactg ttccgctcag gatagcctac aacaataggc tagttctggc aggtgctgag 120
ctaagaccat ctgcaattgt aagcaagcca cgagttgata tcggtggcag tgacatgaga 180
gtcctctata ccctgatatt ggtggatcca gacgccccaa gcccaagtca cccatcacta 240
agggagtact tgcactggat ggtgtccgac atccctggaa caactagtgg cagcttcggc 300
caagagcttg tagtttatga aagaccagaa cccagatctg gtattcaccg gatggtattt 360
gtgctgttcc agcaactagg caggggaaca gtttttgcac cagatgtgcg acacaatttc 420
agctgcagaa actttgcacg gcagtaccac ctcaacattg tggctgcctc atatttcaac 480
tgtcaaaggg aaggtggatc tggcggaaga aggtttaggc cagaaagttc tcaaggggag 540
tag 543
<210> 28
<211> 180
<212> Белок
<213> Triticum aestivum
<400> 28
Met Ser Ala Ala Asp Pro Leu Val Val Ala His Val Leu Gln Asp Val
1 5 10 15
Leu Asp Pro Phe Thr Ser Thr Val Pro Leu Arg Ile Ala Tyr Asn Asn
20 25 30
Arg Leu Val Leu Ala Gly Ala Glu Leu Arg Pro Ser Ala Ile Val Ser
35 40 45
Lys Pro Arg Val Asp Ile Gly Gly Ser Asp Met Arg Val Leu Tyr Thr
50 55 60
Leu Ile Leu Val Asp Pro Asp Ala Pro Ser Pro Ser His Pro Ser Leu
65 70 75 80
Arg Glu Tyr Leu His Trp Met Val Ser Asp Ile Pro Gly Thr Thr Ser
85 90 95
Gly Ser Phe Gly Gln Glu Leu Val Val Tyr Glu Arg Pro Glu Pro Arg
100 105 110
Ser Gly Ile His Arg Met Val Phe Val Leu Phe Gln Gln Leu Gly Arg
115 120 125
Gly Thr Val Phe Ala Pro Asp Val Arg His Asn Phe Ser Cys Arg Asn
130 135 140
Phe Ala Arg Gln Tyr His Leu Asn Ile Val Ala Ala Ser Tyr Phe Asn
145 150 155 160
Cys Gln Arg Glu Gly Gly Ser Gly Gly Arg Arg Phe Arg Pro Glu Ser
165 170 175
Ser Gln Gly Glu
180
<210> 29
<211> 531
<212> ДНК
<213> Pisum sativum
<400> 29
atggcaggta gtagcaggaa tcctctcgct gttggtcgtg taattggtga tgtgatagac 60
ccctttgaaa attcggttcc tctccgagtc acctatggta gtagagatgt gaataatggt 120
tgtgagctta aaccctctca cgttggaaat caacccagag tgaatgttgg tggaaacgat 180
ctcaggaaca tttatactct agttcttgtg gacccagatt cacctagccc aagcaaccct 240
acttttaggg agtaccttca ttggttggtg actgatattc cagctactac tgaggtcagt 300
ttcggtaacg aaattgtgag ctatgaaagg ccacgaccca cctcagggat ccatcgtttc 360
gtgtttatac tattccgtca gcagtgtaga caaagggttt acgctccagg atggcgacag 420
aatttcaata caagagaatt tgctgaactt tacaatcttg gatcaccagt tgctgctgtt 480
ttcttcaact gtcaaaggga gagtggctct ggtggaagaa catttagata a 531
<210> 30
<211> 176
<212> Белок
<213> Pisum sativum
<400> 30
Met Ala Gly Ser Ser Arg Asn Pro Leu Ala Val Gly Arg Val Ile Gly
1 5 10 15
Asp Val Ile Asp Pro Phe Glu Asn Ser Val Pro Leu Arg Val Thr Tyr
20 25 30
Gly Ser Arg Asp Val Asn Asn Gly Cys Glu Leu Lys Pro Ser His Val
35 40 45
Gly Asn Gln Pro Arg Val Asn Val Gly Gly Asn Asp Leu Arg Asn Ile
50 55 60
Tyr Thr Leu Val Leu Val Asp Pro Asp Ser Pro Ser Pro Ser Asn Pro
65 70 75 80
Thr Phe Arg Glu Tyr Leu His Trp Leu Val Thr Asp Ile Pro Ala Thr
85 90 95
Thr Glu Val Ser Phe Gly Asn Glu Ile Val Ser Tyr Glu Arg Pro Arg
100 105 110
Pro Thr Ser Gly Ile His Arg Phe Val Phe Ile Leu Phe Arg Gln Gln
115 120 125
Cys Arg Gln Arg Val Tyr Ala Pro Gly Trp Arg Gln Asn Phe Asn Thr
130 135 140
Arg Glu Phe Ala Glu Leu Tyr Asn Leu Gly Ser Pro Val Ala Ala Val
145 150 155 160
Phe Phe Asn Cys Gln Arg Glu Ser Gly Ser Gly Gly Arg Thr Phe Arg
165 170 175
<210> 31
<211> 901
<212> ДНК
<213> Arabidopsis thaliana
<400> 31
aaaccgaccg gagccaacca aaccggttaa catcctaaaa ccaatcatat tttattaagt 60
tttgtgttga tgctaaacca aaaatcattg gcatgcatat ttctaaattt agtaataaac 120
aaaaacactt agaaatcaca cgttcactat actaaaaaac gttgacaaaa acacaacaac 180
tatactaata attaaagaag agaaaactga accaaacttt ttgtaaactc ctgaatttaa 240
attagtaatt gaagtaagaa gatgaagaag aacatgttaa gcaaacaaaa aaattacact 300
aaaatcatat aaaaatacat aattacaaaa gtacccataa gatggattta ttgatatggg 360
tcatctgtga aacaagccac agagagacaa agactcgtaa gtattgggca acgaaagcga 420
cctcctttat tcaccactgc cattaacatg ttcttcttct ccttcttctt ctacatttta 480
tgaccgtttt acccttcaag agagagaaac aaaatcactc cctctcactc actctatctc 540
tctcttctgc aaagcttcag aactctggca gagagataaa agatgatggg gtttttaact 600
ttatcctccc caaataattc ttcttccctt catctctctc tcttacacaa caggtcccta 660
catttgtaca atctcctctc tttaaagact ctctctcttt ctctctccat ctctatctta 720
ctctgtattt ctgtcgtctg agcactcaat gaaaccactg taaatttccg ccagaatttg 780
atgtgatgga acgataaaaa tcattttttc tcggttaaag taaaaaaaca aaaacaaatt 840
tctgtagaaa tcataataaa agaaagaaaa aaaatctaat gtcggtacat aatacggttc 900
t 901
<210> 32
<211> 507
<212> ДНК
<213> Arabidopsis thaliana
<400> 32
aaaccgaccg gagccaacca aaccggttaa catcctaaaa ccaatcatat tttattaagt 60
tttgtgttga tgctaaacca aaaatcattg gcatgcatat ttctaaattt agtaataaac 120
aaaaacactt agaaatcaca cgttcactat actaaaaaac gttgacaaaa acacaacaac 180
tatactaata attaaagaag agaaaactga accaaacttt ttgtaaactc ctgaatttaa 240
attagtaatt gcacaacagg tccctacatt tgtacaatct cctctcttta aagactctct 300
ctctttctct ctccatctct atcttactct gtatttctgt cgtctgagca ctcaatgaaa 360
ccactgtaaa tttccgccag aatttgatgt gatggaacga taaaaatcat tttttctcgg 420
ttaaagtaaa aaaacaaaaa caaatttctg tagaaatcat aataaaagaa agaaaaaaaa 480
tctaatgtcg gtacataata cggttct 507
<210> 33
<211> 2000
<212> ДНК
<213> Glycine max
<400> 33
catgagcaag taagtaaaca ttttatctct gttacactcc aaacacatac actaacttaa 60
gcagagtcct ttttcggcta ttcactccat caccaaagaa tgagctcatc cataaaaaca 120
tatacatgtc aacatgtcga aagatgtaga acctggtaac aataataaag aatgataatt 180
tttttatttt taaaacgaag cactaaaata gatttaatta tatttatcat ataaaattac 240
caattaatca tatatctagt gaaatgatca cttcaagtat aaaaaaagat tttatacttt 300
tcgtctttct gtatttagaa atattagcaa agtcttggat aaaaaagtgg tcgtagcctg 360
tccctgtagt ttccttgtta gtcttgatga acaagaagtt ctcagttctc cccaccctat 420
tctgattcgg tttacatgga agtagtaagt aaccatacac cattatagaa ataatacgat 480
aaccacacgc catgtcttac ctcatgcgtt tactgaagtt gttttcttct tttatttttc 540
tttgatggag ttatggtatt aatattcaat attagattgg aacttgcaga tcaacttcaa 600
gaggcactct ttgataagga taccccaggc attgcttttt gacataacgc caaaaccctc 660
ctaaaaaacc cttcattttc tatctcttag ttccatttta tgcaatgaaa taaaacttct 720
caaatagtgt caaagcccga aaattgccta ccatatattt atcacgattc atgaagggta 780
tcttaattcc tttttttttt ttttcctgaa atgttttttt tgaaggaatt ttcttgaaat 840
gttttaatgc cttttttttt actcaagaaa tgtcttaatg cttgtttact tacataaagt 900
aatatcgttt gtcttttttt acgcaatatt atattctagt actctgtctc tccaatctta 960
ttatttttaa aatttttctt ccttcctatc ctattatgca caaaaaggtg taattttaac 1020
atttttctac tagtaaaaaa cctacaaact ttttctattg ttaaaattaa atataaaagt 1080
aattattttt attttatata aaaatacaaa gattttatgg aaaaatatgt aagatataaa 1140
aatatgatta attattttac tttcatctta acttagcaaa tactttctga tcagtgcctt 1200
atctcgcaca atccacaaac attatctcgc acaagccaca aacacgcgct tcatgatcca 1260
aaattgtacg agcgacgctg tccatgtctc ctagaacgcg cgtagtaaga aataagtgtc 1320
cctttgattt catgttgcat agttaatttt tagtttaaga ttaattttag atagttttcc 1380
atatttttaa ttttatatta aagataaagt caaaattaat gtttagaatt aattgagttt 1440
aagtcatttt aggtaccttt tggataaaga aatttaaatt aaattttaat tcaaaattaa 1500
tataaaccaa aattattaaa acataaatca tattacttta aaattaattt ttcgaaaaag 1560
cacattcaaa gctccactaa aaattgtctt tgattaatag ccgtggatga gatttgattt 1620
attagtgaga aaagacaaag aggtttaagc gcacgcgaag agaggcgcgt aagtaaatag 1680
gagaaacttt agctgtcaaa tatgctggga aacggcgagt acgaatgacg gcggctacca 1740
cccttatatt acagtgacag tctcactctc acctatctag cctaacgtcg cttcaccgcc 1800
gtttcccatt cttattctct ctcttcataa cactcttcct atttacagtt cacgccaaat 1860
gcctgcactc tttctctact attaccaagc attggccaca ccaacaccaa cgaataacct 1920
ttgttattgt aactaataac cactgcattt ttcccatact cgttgatctc ttccactaag 1980
tgctgtggtt ggtgaccgca 2000
<210> 34
<211> 2479
<212> ДНК
<213> Glycine max
<400> 34
ttggattgtg tagaagaaaa aaattgaaaa aaaatatgac atccatgtta atttttgaaa 60
ttttcttata ataattttcc gtcttcaacc aaaccagact cctattaagt atagtaaata 120
ctattatatt tttgtggact tcttaataaa tagtagtaat attttgaaaa gcttttttat 180
ttttacgaaa gtcataataa attataaaca aacttataaa aaatattaaa tcttatagta 240
ctacttttat ataataataa taataataat aataataata ataataataa taaaacgtgt 300
tcaaaattat taatattcct cttgaagttc cgtttcatat tctgtaaaaa aaagttgcgt 360
ttgatattaa aatataacag tactaaaaaa acaacataaa aaagaaaatc atgtttgatg 420
aaagaaaata caaatatatt ttcataaaga gaacttcaca attactcgca atgctgtgtg 480
aaatagggat ataaccttta tccaagacac gttcccatca ttgaagtata attaaatctt 540
ttacggttaa ttataatgaa atcattttgg atttgctttt gcctattatc acttttcaca 600
cgatgatact taattattca tagacctttt tgtcgagtaa gaggggaaat gctaaacttt 660
tctgcttaga ttttttggca tagttaatgg attttagcct ttttctttct tattaatttt 720
tttctttcat aagcatagtc ccggtaaaat tctcactttc agttgatact ttacctcctc 780
cgaaaagttt cccatattag agactcaatg gcgtataaaa tcatcttaaa catttactta 840
taatgaatgg aaataaaatc taaaaagtta gctactaatt ctttcacggc cattacgaag 900
actttgctta aaaatggaaa aaaagcaaaa tataaaagag tgtacattgt ctatttttat 960
aattgacttg gctctgtatg tattatgtaa ttaattttta atcttatatt ttgattattt 1020
atagagatat aaaatgaatt tgatagttaa agaaagaaaa gaagagatga aaaattgtgt 1080
gttcgatcct ctaataaaac taacatttta ataaattaat atttatcatt tttttaatta 1140
tttgagtttt ggaagtgtaa tgagtcgagt aattttattt gatggttgtt tggttcactt 1200
atctatgttg atcaagtaat cgatcaattt atctccatga ataatgatga tttttaagaa 1260
tatttaacat ttgaccatca attccttaaa tcatgtaatt atttttgtca accatgcaac 1320
ctctataaat ataggtccta catatgtttg acattcatca tagtgtgtaa tgtatttttt 1380
ttattaaaaa aaacagagat gatgaactcg tgataaagaa tcacctaaca cattactgat 1440
actctctata aatatcacat gacaacctta aacaaatacg cacaattcat atatcaatat 1500
ccattacttt gtcatattct aatttgagtg taaaagtctt tattattaca gtcttttaag 1560
ttggtttaga gcaatttgag ttaatatctt tatacaaaaa taacttaatt ttttaatatt 1620
atttttaaga catatttctc ataaaaaatc acataattta gtttataatt tttaatttaa 1680
tattatcttc atttttattt ataaaattta attacctaat tcatcaatat taaaaaaata 1740
aattaattta attaatatca ataaatttat cctaaactta taaacattat cattaatgct 1800
cttctctctt aaatgtttat ggatataact tcttttattt aattaaaatg tttattttaa 1860
attaaattaa tgtaagaaat aatacaaatt gaatattgta taaaggaaca aacataattt 1920
tgttttgtat tagaccataa gtaatactcc atattagatt atatatataa cttttatttt 1980
aaaattatag agtatacttt ttttagagga aattatagag caaactacat tcatatgatt 2040
tctcttttat aaatattgaa aacaaaatag ggatatgcaa cagcaaacga gggaggtttg 2100
aggagagagg gagagagaga gaatgtaggc gcgtgtggca cagttatgag ttaagactta 2160
ggagaagtac acattggcat aggcattgtt attggattat gtgtagagtc cgatagacta 2220
gaatgacggc tactagttac tactctctct cttcataaac acaccattta tgtttttccc 2280
ttcccttcac gccaaacgcc tgcactctac actctactct ctcgtgctct gtgactactg 2340
tcactctctc ataaaccaaa catgccctta atccattttc catagtagtt agtgttgtta 2400
ctcatctctt ccatcttcaa tctctcttct ttccttattg ttgctcacca aggtggggtt 2460
ttttgtacgt gtggtggca 2479
<210> 35
<211> 2000
<212> ДНК
<213> Glycine max
<400> 35
cattaaataa ttctaaaaaa gatataaatt tttgtataca aatctatatt taagaaactt 60
ttaatctaga tgtcgatttt aaaaaatatt atttaattaa aaaatattag atggtgtaat 120
aattaatcaa aattatatca agataatctg attcctttct atacacacat aatattattt 180
catccttagt ccctaatatt ttcaattctc attttgttac cagacttgta ccgaacaaaa 240
acaaaatatc taatcatagt tttcattcaa caaaaatgat ttttaactca atttgaaaca 300
cttttcattc atttttaaaa ctaagaaaaa atttgtgatt tatttttata attttgaaaa 360
acattctacc atcattatta ttgtttctac taccatcatt attaatgtta ctactatcac 420
cttcctagtt ataaccgtaa gcattatata tttttattat tattgttatt atgttatttt 480
gttaatatat ttatttttgt tctaaaaaat tattattttt tcatatcttt cactattttt 540
gttattattt tagcaagttt gattattttt tattttaaat atttttatgt gtcacttttt 600
atatcacatt atttaacagt gtgaatcgat aaaaaatata ataattatct ttaatttgta 660
agaatttttt caaaattaaa actgatttta gttcttgaaa aatgtaaaac taaaaatgaa 720
aaccacctaa cggggcctta gtaattagga catggtctcc ctggttaccc acgggatttt 780
ttcacatcaa agaagacctg gtattttcat tttcatgaga tttttgcata tcgaacaagg 840
cattaagaca ggggttgtca ttgtcgtgat agtataattt acatggtcga agtgatagaa 900
actttaacca tcatttacct tgtaccttac tataacacaa aatactacga tttccaaaca 960
ctagatcgcg cgcttatgtt ttcagacaca ttattcttct tcattcataa ataaatttgc 1020
agctagtata tgataattgt accaatttat gtaagttttt tacaaaggac attcttatct 1080
caataaaaaa ctaaatgttt aaaatattct ctagcacatt ttttaaatac attttgtcta 1140
attaattaaa attaaaagag gatataaaaa atatgctgct aacatcttga acatttccgc 1200
aatcaataat ttctcaatct atctgaatat ttttgcaact gtatacaaaa atctcagaac 1260
agaaaattat tgattaaact ggaagaattt aataacattt gattcacgtt tgtttagtga 1320
ttaaaaaatc ataacattac actatctaac aaatgcagca tccataacta ccaaacatta 1380
aacaagagaa acagacaaag tccaataatc acagagacac gcagtgacaa agaaaagaaa 1440
gagggaacgg taaagagaaa ggtgtctctg tcatctcaaa tagattgcca taactccctc 1500
cttctctctc acaagctctt gcagagtgaa agcgaccact ttccgatctc aattaaaagt 1560
atggcataat ttgcaatggc ggaactgaac gaataataat aagagatacc atagttaaga 1620
gagagaaaca caaacatgga aaaagctggg cctcactccc tgggtacaca tagatagaga 1680
ctatggtgca gtgttgcagg ttgtagcaga agctctgcca aatagtgtta actttattcg 1740
agaaaattat tattattatt attattatta ttattctctc tctctagtct attatcagtg 1800
gtaattcagt aatgttgttg cattatagag agagcgtggt ctatgtgcca gggtgatgtg 1860
atgtcatttc actaccttca aagccagaaa aatgcaacag aaaaagcttt catcccatca 1920
catcatttga accatgaatc atgaactagt tttctaaact aaaactataa caacaccttc 1980
ggttgttgtt gttgttggct 2000
<210> 36
<211> 2000
<212> ДНК
<213> Glycine max
<400> 36
aacatttaag atcttaaaga tgccaagagc ttcatatgaa aatgtacaaa agagatttta 60
aaggcaatat caatgctgtg acgccatatt aaaataaaag ggatggtttc tcctgtatat 120
tgagcaattt gtattactta tatacacaaa atctaaattg attcttaaca aatatgtaaa 180
gaaattaata atatgatcaa gttacctgaa gaagctaaaa taaaatagaa aattaagtaa 240
aagaaatgag gagtagaata taagataaca tcaaaaaatt atttcagcat attttaagaa 300
catcaaattt acctttcatc aaaattaatc ttaaaagact aaaacattta attaagttta 360
taaatactca cacaaaatat taatttattt tgtaattatt attttttata tttttattta 420
ctattgcctc aaaatttgca ctaaacaaga gaccctagag atttcgttag aacaataata 480
gacacggtat taaataatta aattaatacg aggatgcata actaccaaac aaatgcgata 540
aataaatgag acgacgagag agcacaacgc gggaatgaga taattaagaa aaaaaatcta 600
ataaattagg aaaaaaaaga cataatatca taagcttgaa tccaatgtac aaagagaggt 660
tggcaataaa gagaaagaga aaagacgtcc ctgtcacctc aaatggattg cattactcat 720
tgaaaaggac attattactt ccgacttttt atattaactt actaattata aaatatataa 780
aaaaatactt caaagatgca tatattttat tttattacat aattacataa cagaataata 840
taaaataatg taactacaca ttaaaacatt aaaatagtga ttggagtagt ggtataagag 900
gacgttgaat tcacgcggaa gagaaggata tatttcatgt ttaatttgtt gtcatgccta 960
gttcaatgta atctaataag taaaaataaa atacaaacaa aataaagatt ttggtttctt 1020
aacaaaagta cttttacttt aaatatatat ttttatctgg tttttaaaca tgcacatatt 1080
taacataaaa gttcatatta aactttttcc tacatacttg gatcaaatag tcacgtattg 1140
caggtaaaaa ataatagtgt agcttataga aatcgtagaa ataagtctat aaaccagaag 1200
aaaaaaaaca ttaaaataat agtatagaaa tctatatcag tgtccccagt tcttacattc 1260
atgacccatt tccccataaa ctctttgcag ataatgcaat ggcaaaacca cacagaaagt 1320
gacccctggg aatcaaaagt taaaaccaat ggcacagcat agcacagtgt acagtgttta 1380
tttactatat agcaaaacac tcactggcat aacactttag ggagagagag agtgaaaaca 1440
agtgtaaaaa gagagaaagt taggaggggg atagagagtg tgtgtgtgtg cagagtttgc 1500
aggcttgtag cagaaatggt ggcagatggt tttaacttta tgtgtgaaat aattttcttc 1560
tatctctttt ctctttagtg ttttctctct ctctctctct cttctttttc ttcctgcatc 1620
ttcttgtgtt tagggagtgt gatgttttgt ggcagaagaa cgatgtgatt ggacacagcc 1680
aaagctgtgg acttgttctg ttactacttt gtaattgtaa tcacataaaa ggctagaggg 1740
tatgaagagt gcacagaaaa atactagtac tagtttcaaa caaaactcac cttactacta 1800
cccttccatc tcaagccata gttgagttga gtggtgcaca gtgtcactat acataccact 1860
aacacccttt tttggttctt gttctgtggc tccttgtgct ttgagcaaga gctttttgag 1920
aaagagcttg gtggtggtgg ttgttgttga gtggtttcat ggttaggctg ttgttaagtt 1980
gaagttcatc agttgcagct 2000
<210> 37
<211> 1399
<212> ДНК
<213> Solanum tuberosum
<400> 37
aacgaaaaat ttagaaacta ttagtgatcc aaatgttcgt gattacctgc aacgagaaca 60
acaacgaata cttgaaaaaa gaaatcgaca atcacaacca caaccataat cgcaacaatt 120
ctcagaatca tatcctaatt ttttttcgaa tagtgctaaa tttgaaaacg acctaccgaa 180
tttctaaatt attgttgtga tcaattaatt attatgttat gtattgtatt ttatcttgta 240
tttaaattat tatgttatgt attgtattgt tatcttgtat ttaaattatc atatcatgta 300
ttgtattttt aaattaattt tttttgcata ttctttataa tgaaaattaa taataaaaca 360
attttattat tcacgaaaat tagaaaaaaa gttaaaatac tattaatttg aaattaaaat 420
agtatatatt aaataatatt tttaaaaata ttatattata tttaaaaaga attatgaata 480
ttagatattt aattaatgga attatatgta aaataatatg ttaattagaa agtaatagaa 540
aaataataaa ataatgaaaa agtagaaata gagagtgtga atagtagaat ttggagaact 600
attcaactct ctaaatttga agaatatagg gtgatttgga ggtgggttgg agtgtccatt 660
ctctatttta ctctcaaaat atagagaatg gagagaaaaa tagaggtgga ttggagatgg 720
tcttagtgac atttttgatt ccgccaatgc tcagttggcg tagtcgctgt caaacttgag 780
aaaggattac ccctttaggc ttgcacagac agtgacttat gatgaaatga agccagagaa 840
ggcactctgt tataacactt aaatgaaaat acatgtgtat ggactagcaa taaaaggggc 900
actagtaatt ttagtaattg aaaagcaagt gtatagagag agataatgag agagaaagag 960
taagtacact actactgcta ctatcccata tagctgtaat gttgcaggtc tgatttttgc 1020
agttgcagac ccccttcttg gcacaagctc ttttaacttt tatcttctca aataattctc 1080
tctctctctc tctctctttt ttctcttttt acattgtgag gaaactgaat acccattgta 1140
tgtattagtg tgaggcctat ctgccacaag gatgtgatgg aacactatgc ttcctctgct 1200
aaaaccccac aaccccaaaa ctctttttca cttcacattt aatcacaatt cctcagtgaa 1260
attattctgt tgctctctct aatttcaatt tcaatgtcgg taagtccaag aactggtttt 1320
tcaattcaaa ggagctgagt tagtgcaaac acttgaggtt ttgagttttg acagagactt 1380
gagtctcaga gaaactacc 1399
<210> 38
<211> 2000
<212> ДНК
<213> Solanum tuberosum
<400> 38
accttatata agttacaatt tagttatgta tataagttaa aattaaatta aaagacattt 60
cgaaataata tgattatacc atttcgaaat taattagaga gagaaataag atctcgcaaa 120
attaagtgtc ttcttgaaat taagaaccat ttttaggaga taattatgta ttttttcatt 180
tttaatttga cacgtatgca tatccactat tttgttttat tccaaagtga cccctacttc 240
ttttggtaat ttctttgagt attttaaact ctagtccccc tttctcaagc aaaaaggctc 300
actcgcgcac gcgcgaagag acattgtgac gcgctggatg gaaaatccag aagcgtaact 360
gtcaaaaaat agaacaactt tgggaaacgg ggtgacggcc gctgccacca cttttttcat 420
ttccaaacac tcattaacta acgtcgtttc accgccgttt actgcttaat gagtatgaat 480
tacactctaa tagtctattt ttacttattt ttaatgtgtt tatcaaatta tatttttaaa 540
tataatactt taaaaatatt atcatcaata ataagagtaa attaaaaaat aaatgacaaa 600
ttgtttctta aattgttaaa ttaaacaatt aaaactgaat atttacaaaa tacctcttaa 660
cttgctaaat taaacaattg aaactatatt tatattaata aattgaactg acaaaaataa 720
ataaaggaac tatatatttt ctcaattata tctttttact aaaatattat ttttctaata 780
ctagttaaac ttttaaaaaa catctaataa agaaaaagaa tttgttcaat tatactttag 840
aagcttttat tattattatt attattagta gtagtagtag tagtaataaa ttagattaaa 900
ttaaagagag aagtattcaa aactcccaaa actattgtat tagttttatt tcagaactat 960
tgacaatctt aatttttttt tttttaattt gactaggtga acttaaatat acttcatttt 1020
ttgcaaaaca agtgaagtac actcttaaat tttcatcaag tttagaaatg ttttcaacaa 1080
tttactagac tctttattaa gaacttcatg ttctttcaag agtttatgag cacttgctat 1140
gtcatgttac agatcaagaa tatctacaga gtgtatctaa atttagtact agtaaagtag 1200
aaaatgtatt acttatctct caaacaatag gtattcatta tactattttg agatgtccaa 1260
caattttttt tcactttatg aaatcaatga ataatttaac acttagttcc taattcccag 1320
taagcattaa ttatagttat ttacttatta tatttttcaa cacattatat tgaaaaagtg 1380
atatagtaaa tctatctttt tattttatta tttcttaaaa tttgtacaaa cttaataata 1440
gacaaatatt gttgaatagg aataataatt tacattaaat ccaatatatt tttcaatagt 1500
tgtcactaaa tgaaaatact tcatctgttt caatttatgt gatagttttc atttttcaaa 1560
agtcagacaa ttatatattt ataaattaag taaaaaatat tataagtcac actaattaac 1620
aattcgaaat attcggtacg gaggaactaa cacttatgtt tttagaccat attagtcttt 1680
tctctctatt tattatataa tattgagagg agagtgcaac caccatggca actttctctg 1740
tcttcataaa acgcagctga cattaaaaac acagacacac acttcgcatt tcatatccct 1800
ctcactacac gccaaatgcc tgctcttcct atttctcttc ttcttctttt tcttcttctc 1860
tctcattcac ataacacaca ttcttgtact aactctgcat cataaactct accccacttt 1920
cttcttcttc tccggtcata ttgctctgaa actccactta ttgctctctc ccggcattta 1980
tttttagttt ctcagaaata 2000
<210> 39
<211> 471
<212> ДНК
<213> Arabidopsis thaliana
<400> 39
taataagaga cgaaaaaaaa ataactaact gatcattacc atccataaat aaatagttgc 60
tgccataaac caaacacatt gtgcttatca aaaagaagaa atttgtactt aatgaaacat 120
tcattattag caaagtgtaa aaccaaagaa aaacaaactt tatttctcat tttattagta 180
aaagtgaaga agagtaaaga aaaagagaga ctgagatgag gctgagagcc tgagtctgcg 240
ggtggagaga gagagaaaga aagcctcttt acacgtgatt tttaaaagag accaaaaccc 300
caaaagcaaa cctcttttgc atgcgtcctt aaaagacata aatttctctc aaaattttct 360
acatcacaaa atcaatcttt ttctcttctt cttcgtcttc atcatcatca tcatcatctt 420
cctctttctc ttcctactga gatattttct ccacattgag aggaaagcta t 471
<210> 40
<211> 1231
<212> ДНК
<213> Arabidopsis thaliana
<400> 40
aggataaatt tcatctatta agatatcagt caattataat gtgttacgtg attcgataaa 60
aaaaaaagac caaaaaaaaa aagaagataa ctattggtaa gcgtaagaaa tgtgtttaca 120
ttttggcatt ttgccaaaac acataaagat ggttagtgat gagacgagac gagtcatgcg 180
ctacttttaa aacaaaatga aaaacatcat taagctaaca aaccaaacac acttgttttg 240
ataacatgtt ctagggaact agttatgcca aatctaatcc gcataagaag actaagtcac 300
aacataattc agtaatttgg ttgagattaa atcctataaa tatgatttta aggtataaga 360
gagaagagac tcttttgatc aacacaatca aacatctaca aagaaaatta tctcacatag 420
ctacttctta atctaatttt ttcattaatc cattttattt taaatgtgaa gaatcgcatc 480
tagatgtgac ctctcatgat aaaaaattaa accattgtaa aaaaaatgtt gtgtaaaact 540
aaatataata aattattaaa aaaatacaaa ttcaatccac taggttaaaa actcctatgt 600
agaacatttt tttatattaa aatgtaaata catgaatctt atttttcgaa aaactaaaga 660
catctttttt ttatatatta attaccaaaa caaaataaga cgacaaaaat attctttgat 720
atagtaaaag aaaactagaa aactagaaaa caataaatta ccaaaacaat ctagaaaaca 780
ataaatccta ctttgcatta ctttattata aaatcccgaa atgaatctat aaatgtagaa 840
aatattatac aaaagttgta agagatttta atatacataa ttacatatat atacaagtaa 900
atacaccgta tatacatacg aaggagtaaa cagtattatt tggtatatag ttacgtctct 960
atatacgaag ggttcaaact tcaaagtaat aatttaatca acaatgtgta catattgata 1020
agtagtagta tatatgtaaa ggtctcacgt ctctataata aagtatgact cgtcacgtga 1080
cctcctcttc ttcgcagaga cagagatagg atgagacaga aagaaaccaa caaaaccaaa 1140
ccccaaaacc caagaaaaag agaaaaacac tctcttctct tctctctctc tctttctatt 1200
taagagactt cactgtctct ctcagtcttt t 1231
<210> 41
<211> 1548
<212> ДНК
<213> Arabidopsis thaliana
<400> 41
ttcacgtgtt tatttattta tttgggttat taaacataaa tcatgtaaat ctgaatcctg 60
tggagatctc tccctagttg atgaatagat atgatgaatt taattctttc atgaaataaa 120
aatatatgaa acatatgtag cagaaaaaga agcatatcta tgaaacaaca aacattcaaa 180
aaaaaaagga aaacggaaaa ttattaatat gaaaactacg gctttgactt gtagctgact 240
acatttacga catatatata taaatggacc ccactgagtg tctgcaaggt ctttacacaa 300
cagtatcttc ttctgtttct ttgactcttt gtgatcccta agcctaccca taatacgtgt 360
ctacatttta ttggattgtt tcgtgactct gtaatctttt ttataagaaa acaagtaata 420
gtgaaattga agtaaatagc tcagcacaga aacttcgaca aaaataactc acagattaga 480
aaagaaaata tatgcataaa tagccatggt tcatttatga acaatttatt cgttttttta 540
gtttataatt tcattaaaac atgtttgtca catcacattt catgtccttc ggctcctact 600
acaacaacaa gtcactgtca tctccattac ttccacttct gctcctttct ttattaactt 660
gttcaaaaac aattctaaga taaataacaa taaatgttgg tctctcttta ttatttcccg 720
gctaaagaag gaggatgtct cgtattatcc gccatcaatg ctcttttgtt tcctgtttct 780
tgcaatttga atccctgaga atcctagccc acttatttac tactttgcct tagctgtttt 840
cgacatcaaa attttggtca tatgactcat atcaatcttc aaatttgata aaatatgttc 900
ccaattcaca aaaacaaaaa agttttcgaa agctcaaaaa cctttaccat ttcaatagta 960
gataggattc ttttagattt gcatttcacg aaaagagaag aaaaaaaatc gaaaaatatt 1020
tgcaatcatg attttttgtt tctgaaggag acctgtagtt gctgtcatga acattaaata 1080
caaatctaat aaatgttgta cgaattttgc gtgtaataaa tggtcagggc cggctcgaag 1140
ctcgctgatc gtcctttttt cgtgtctcta tagcaacaca caatcgtatt tatttcaaac 1200
tttttttact ttgtttccca tccatcaaat ataagtataa aaatgtaaag aatcatcata 1260
tatagatcgt aaattcattg cttcctttgg ctttttattt catctagacg acgttaaaac 1320
cagaccagac caaatacatt tatcattttt cccttttttc taaaattctc tctttgattc 1380
ctatcttctt ctctttattt tcactttgtg ctttctctgt ctctcctatt atgagtctaa 1440
aagtctacta gctgttcaat agttttgtct ttctgtgttt cttcttcttc aaaaccgaaa 1500
gaaattcaaa aagagtcttt cgctgcttgt tagtggggtg aggaacaa 1548
<210> 42
<211> 440
<212> ДНК
<213> Arabidopsis thaliana
<400> 42
aaacccgaac ccgaaccaaa cccgaaccaa aatcttaaat tacccgaatg ggtcttaaat 60
ttctaaatcc gaaaaacccg aacccaaaat acccaacccg aatctgaccc gaatatccga 120
acgcctaatt tttctatgtt aatgaaatca attatatgac atgtttataa agagaaataa 180
attacggtga gaattaagcc catttacgtt acggaaataa aacacccatt taaaaaagcc 240
caacacgtga agcccatttc cgagtgcgtc ccacatttac tccaacggtc gaatcgactc 300
aaacattcaa aatacaaaaa cgctatcttt atcgtcttcc tctgtctctc tctcacaaca 360
cataacgttc aaatcctctc tctctctatc tcgtctctta tctctagatc taaaaatctc 420
ttctttcctc aatctctgtt 440
<210> 43
<211> 317
<212> ДНК
<213> Arabidopsis thaliana
<400> 43
acagacattt acttatacgg ttattgaggt tgaactggac cggagtagca ataaattatc 60
ggttcagttt gggagatcaa accgtttaaa agaaaataat ttgaaatggc cacgcagaat 120
acgagggtct gaggattgta cctcctttct ctgcaaaaac ttaaacgttg atttgactca 180
agcgtcaagg taaggtactc tctcttcata caacatttta gctttacttt ttctctttac 240
tcttctctct ctctttctct ttctctttct ctttcactcg ttctctctca ctcactctct 300
tcacacacag atccaag 317
<210> 44
<211> 3912
<212> ДНК
<213> Arabidopsis thaliana
<400> 44
acaccaataa aaatacacag caataaaatc gctacgtata tatatatata atatgtatta 60
tctattacaa gatagtaata gagtatagca agttgtatca tctaacaaac tatgcgaata 120
aaatttgaac attgtgacat gtagatgtag tgtaatttag ctaagtgctt atcatcagta 180
acatagaccg acttaacttt ttacgaaaaa aaaaaagtaa catagaccga aaaaatgcat 240
atcgtaaatt taatggaaaa cacaatttac gataagtaaa aaacaaaaag aaattacgat 300
aagtcgagaa aaatgcaaca aattgagata aagtattgat aaaaccatga aagtgtcggc 360
gtatgtaaat gcggtgatta atgtgatcat tagagcgtgt gtgttaaacg cggcggtttt 420
agtggagatt gatcagctga taacactctt accgggacga atctaattcc atattcatgg 480
cttgttaaaa cctaagacat acgcaatctc taatttgcta gtatagttag ttctatatta 540
tttttcgact aataatgtaa acatatgatt attaagtcgc aaaaagagtg cttaacaacc 600
aaaaagtgga ttaattaact tggtgggaaa agttacaaaa cctttaatga ttactctttg 660
taccaagaat agtggcgaag cactataaga gcagagaaaa gaagctcaat aatgtactaa 720
aagttgtaga tttttacagc ttaaatacac caaaattaat agaaaagttg gtaatttttt 780
aattcatggc tactgattta gattttagaa aacaatagta gtatcattgt cacatcttaa 840
acacacaata ggtatgtttt aaatcaaagg ccgtagttaa tttgtcaaaa atgtatgcat 900
ttggtatttg gatgtctccg aaaggatgga tatatggact tgttagataa tttcatacct 960
cagtatcaat agtcatggag cccaaattgc tcaaaaacat atttttaatt ccaagacttt 1020
gatgaagacg taataatgag tccaatgggc catcagatac aatgttcgga atttaacggg 1080
tttgttagtt ataagtattg ggcttgacct atctggttca atgatatgta ggaacaaccc 1140
aatttgcaaa gctttattaa aagactcttt agttgtcgtc aaggtttaac ttgtagtagt 1200
tggtaagaaa ttctacgtga aataggcaac attacaaaaa caaaaatcaa ttcgaaatca 1260
tacaaaacga aaccaagtag taaccaacta cactattatg acattaatga ttagacattc 1320
ccaaatcata caagttcctg tcatgaagga aacaatggtc cgtatttgca aacgattaca 1380
aaaattcaaa ccaaaaatga aaaaacgagt taaattattt ggtttataaa aatagtaatg 1440
tcaacagaag actagattgg gaaacctgaa gcgaacagag cttttaaaaa cgagtttgaa 1500
cggctgggat catttggtac aatacccacc gtaagtttgt ttaccctagg gatgcaagcc 1560
aaaggcccaa atcagttact acttactgct acaaccatcg tctcagcttt ttgtctcagc 1620
tttttactaa tgaagcatac aatttcttgg gcatgtcaca tctcgacacg tgtccactat 1680
tctcttctct tattggctac tcgttcgtag gcttctgtta atagatgatc tctctataac 1740
tctaacagtc ttttctttct ctttatttcg ttttggtatt ttaagtttca aattgaaaat 1800
aataggagga aaagtctagt tttaaatatt gtttttttac aagtgaacgt gaaccaattt 1860
acctcttttt ttttatatat cctatcggct aatctggtta gtatcggtag aaatgcaccg 1920
aggtgctaca gagattaatg ctagggatag tcagaccgct tgtatttctg actatcaagt 1980
aaatctacgc ccaactcaca tatttcccaa acaaatgtga tttttttttt tttttttttt 2040
tttttttttt ttttgtaaca aatgtgattt tgttttcaag gaaaatagaa cttacgtttg 2100
ggaatttcac ccttcactaa agcttccttc tgccattaga ccacaaaggc ttgggcaatt 2160
taccattttt gtaaaagtag aaaacaaaat gcctaaaatg ttcatacttc attacatcaa 2220
caaggttatg cccacgatat agaggcatgt aacatttata tatatagtgg aagaagccta 2280
cgagctttat taataagtat aaactctgat tattaggtaa ataaattact taaaacgatt 2340
actcaactga caaaaccgta gttgaataat aaggttacta tgaataccga ttgaatattg 2400
caaagccgga attgaaaaat atataacaga tcaaatgttc aagtgtggtc ataattctca 2460
cataggtcat atagctgaac ccatgcatct atttactagt ctatagaaag tactagagac 2520
gcatacagct gaacctactc tattctttta ttaattttgg ttctcgtgga tacaaaattc 2580
ctccaacatt tattagaacg aataaaacca atatgatgat gattagttat tggtaaacat 2640
ataaacgttg agtaaacttc aaaatagatt gaagtactat taagacttgc attttttccc 2700
cttgggttat attcttgaat cgtttcgaag tattttaact ttcaagaata gaaggttcct 2760
caactataaa caattacatt aatcaaaacc atttctatgt aaacaacata atttttgtat 2820
attttagtct tccccaaaag tttgaccgat agggcggttt agaccgtata gtacgactgt 2880
acaacaaaaa ggactctgga gacctaaaga tccaaaacta tgcaaaataa agatacggtc 2940
ggaccaattt aatctaacaa aaccaaatcc ttatactaaa ctatttaccg atacatttcc 3000
atataacaca gtacacacaa ttaaatcaaa cattattgga agaacaagat agaatattgg 3060
cttaatctcg aacgattaga gttatcctag agcctcggag cttttgtcac atataatata 3120
aactatggta tatataaaca tgactctcat ttgtatttat cgcaaggtac aattccacca 3180
atttttttcg tcccactcat acagctttaa ttgtgaaatc aatccataaa aaaccaacat 3240
gtgacatggt ctctataact ataactataa gatagtaaaa aattcacatc aacataaaag 3300
aaaaccaatc atattggcta aaaaaaacta acggtcgaaa aacgtataac cacaaaacca 3360
aaccggtcca accggtgtcc ccaatcacta tcaaagcatt aactaacttt cacaaggaaa 3420
agcatagttc agtttctcta catcgcttcc catcctctta accctgttta ctcgaatcat 3480
ccaccgttgg atcaaacacg cgctacaaat ctagcgcgtg accgaggttt ttacacagtg 3540
gaatattacc atgcattgga aagcggcgtc tacaacaaac ggcgggtcat gtcaccgtca 3600
aaatcaacct ttcttaattc ctaacgccgt tacttatctc cgtttactaa aaatgttaat 3660
gcgtgtgaga gtgaagatca tatactaatt agaagtggct aatgttttaa cgtgacatta 3720
ttatcatagt taatggttcg atcagagttt taagtagtaa atgatataag tgtgtgtata 3780
taattgcata catatatact ctcacactct gacagatttg tcgtggtctt agtattctct 3840
ttcatggcta gttatatagg gctctagtac attatctctc tctccccatt tctctgtctc 3900
tctcttcttt aa 3912
<210> 45
<211> 2000
<212> ДНК
<213> Arabidopsis thaliana
<400> 45
atctttatgg tcaccgagtc tactgatata attttactgt cgcagtttgt ttccactact 60
taagtttcta taatttcaca gtttgaaaga aaaattactg gttattcagc taaattacaa 120
agattagttt aattagttta gccagtataa tgttttagta aagtattaaa cggcattttt 180
cgttgggaga attatgttat ggtataatct actaatacat acttttacac atatatcaaa 240
aagtttgacc atagtaggta gtacaacata gaagaatcaa gatcggaacc agcaaggaag 300
aagatacggt cggtccatat taagctaaga ggaccaacgt aactcgatat atatttttct 360
gttctctacg ttaccaccat ataaatttta atattgaaaa aatcatcttt tggcattgtg 420
tttgatgtcg gattcggaat atggaaagag gagagatatg agattttggc acaaaggaag 480
ctgccaaagc attagggcaa ccgagtagta acgagatcaa acatcgtttc aatcggacgg 540
tcggggtttg accaatattt ctcggatatc ttttggaccc tacgttctga cttgaacttg 600
atcagtcact tcagtacctt agttttcatt ttcaatgtga tcatgagttt ttttttacat 660
gttagcttca aaacaaatac taatattcat taactatgga tcggcatagt tttcatgtaa 720
tcagctgagc gtttatcata ttgattgaag ctaacatgta aaattctcat gatcacattg 780
acttttgcct acaaatttta aaagagtata caaataattg cttaatgaag atagcttcca 840
tagagaaaga gtaacagctt tatacggagg catagcttta gacacgatct ctgctcttgt 900
gttttttgtt taacactgaa tccacagtga aattactgct catttttttt cattttttat 960
tacatttttt tttttacttt tttatttatt acaatctaca gttctaccaa cttattcaac 1020
ctagtggtac catatcgacc ccaaaattaa tcaatctaat tacaaggtag aaatagaaag 1080
attttatcaa aggagacaac tctgatcgat aatatgttgc aataaaacca tgaaaaactg 1140
taaaaaatat tgaaagctga agaaaaattt tcaaatcgat aaaaggatag tactaaacca 1200
atccggtttg tggcatcttt ttcacccaat cactatcaaa gcattaacta aaaatcacaa 1260
ggaagagcat aatttgattc tctacatcgc agtccacgat aggatttctc tatccaccgt 1320
tggatcaaat ttaataatga tgcacgcgcg cgtcaacggg attttaccca gcaaaggaat 1380
gtcttttcac cggactctta aaagacgttc ttcttttttc acctttgcat tggaaaacgg 1440
cgtttcttct tagaaccgtc gccgtcaaat catacggcct aataaatctc cgtttaacgc 1500
cgttacttta ccgttaagta ctaaaaaaac aaaaaaaaat catttcgatc actgtctcat 1560
taagatgatc ggagatgttt tagcagggtt taacaagtga tgatagtaat gtatgtatat 1620
atgttactga cattattttg tcgttgtcta ataggagggt actaaagttt ctctctctca 1680
tggcgtcgga gctcagcctc tagtaatgta gactgtcctc tctttctctc tctcttcttt 1740
aaacatctct gctctgtttt ccttccagtt cacgctaatc tcctgtgtcg gtcccctctc 1800
tcttttcctt tggtctctcc caacaatggc agaacgactt tgtacccttc ttttgctctt 1860
tgtttgaatt tcgtttcttg ctacaaagct tcaaaggatc tgacttttcc ctaaacagaa 1920
aaagaggtct ttaaccaaaa aaggttgtta cttgttttct gggtttcgtg gtgttactct 1980
tgaggaagaa gaagaagaag 2000
<210> 46
<211> 1470
<212> ДНК
<213> Arabidopsis thaliana
<400> 46
ctacctaata taactagcta gggatttcta ctcttgtttt cataatcgat ctacggacat 60
ttctcggaac gtggtcaaga ttcatgagtc ttctgttttt tatgtctctg ttcaatttgg 120
tttagagatt agtatgctta tttgtttatt tcatatatgg ttatgagagg agaggctaat 180
ggcatatact ctgatgtttg tgatggctgc taatatcgtt gaggagttat tcacgttgtt 240
tcatgcgcaa aaatcaacag aaaaaattct gattatgagc caactctgtg aacccttata 300
gtgcgcccag aggtttgcga ggcaaaatcc cgatgaacca gaaggaattt tagatctcta 360
tcaacaataa ctatgatgga gctcgtttaa attcatcaca gcgacaacat cattaggctg 420
cccaacgtct atgtctcctg gaggtgatgg tacttgatct ctcaaccaat tttcttgaaa 480
atatcatgcc ttgtgagcgc tttcatattg cgcctaaaat acccaatacg caatgaacct 540
acttccaaag gcatagaaaa aaaactgata atgataatga gatttgtcac tatacttatc 600
ctatccctac ataggagccg tttgattgtt tagtccatgt tttcattttg tttagtctaa 660
tgctatataa cttttcttta tcagtctatt gttatatgac ttatatatat ctcaagagat 720
aaggccaata aatcttcttc ttaattatat ctgaagactc aaaacatatt ttgagtttaa 780
taaaataaat aacgtccaaa tgctacatac aaacggacca aattcatgga ggtataaatt 840
taaattattt tttgttccaa agtgtatgca gtgatttatt gatgaatgcg atagagcggc 900
gaaagagaat aatcgtcacc tagaagacaa attgatcggc cgtacatata tacataaata 960
caaacctgcc acttcacatg tcacccacct ttaagcaccc ccttcacata catactttct 1020
ataacaaaaa tatcagcttc tagttcatat ttatgttaca ataactcgag tgaatcatac 1080
taaaaaaatg taatgctttc tctaaatagg agataaaatg caccctccga cctaactaaa 1140
gattccttat tttagctatt taagacatat tgcacatgta tagagataca taaacacata 1200
tgcaatatgc acatcttcta tacattgaaa aaagctgatc ttgcaaatat ttgtcttaca 1260
caacacaagc gaccaaagcg atgcgtttcc caatgataag gttacgacat acttacacga 1320
ctctctctat tgtctcgtct ctttctttcc tcatccctct cctttgtctc ctttcactct 1380
atttttcact tttcagaata cttttacgta aaaatcatgg acatgtcatt gtctccaccc 1440
tactatactc tttttttgtt ctttttgttt 1470
<210> 47
<211> 1793
<212> ДНК
<213> Arabidopsis thaliana
<400> 47
ttggttgtct ggcatcatca ttttgtaccg tttctcccaa agtaagaaac ggtacaatct 60
tctcttatat agatttcata ccccaaaacc ctaaattcat tagggttttc aaaaaaaaaa 120
atcacgttta cctctaaacc aatcttctct tatatagata aatcataacg tttgtttgat 180
ttttcagttt tctacttaac caatattaaa ctaaagtcga attgagatga gtggtagcaa 240
accacagttt aattaagaag ttaattatag gccacatgat tgagcaagcc tttttgtttt 300
gtaacacatc ttatcagctg cttaaaattt tggctgcctc ccattggcca actggtctaa 360
acatcattgc attggcattc tcataatcaa tcaatctaat gagaaacttt gaatatttat 420
gaaaaactga ataacaacat aacataaacg aacaatgtaa aaaagaaaaa cacaaaaaaa 480
aaaacacttt aaaaaacaaa aaccaaaaac tcttaaacta taaactcatg aacacttagt 540
gatgaggtct gaaagggtgt aaccaccacc tgttgtcaat aggtgacaac ttcttcttgg 600
gaacattcgg gaaagtgaag gcttaggtga cggttgtctt aaaagtctct tttagttaat 660
tcatcgtatt ttcgatgggc attacgtttg atgcataaag gcccatatgg gctatacatg 720
tactgcgttt gagtggcttt ctaaggattg atgtattgtc tctatgagag tattcgttta 780
actcatggag atctactctc cacgatattt tctgtaaact tttctttttg ttgattagat 840
aaatagaaaa ttgtgtagag cgaaactttt aatgaattaa aatgcggaag cgattaaagc 900
atgaatagat aaattggaca agagattaaa cgagggatca tctagttttt acactgatca 960
ctagtcatct gcttgcagaa gaagtatatc attaatcaag caaaacgagg gcataaattt 1020
cttacaaata acttttacag taggttaatg attttttaat aacttgtcca tttcacatgc 1080
atgtgtatct ttgtactata catgctaagt gtttcattaa tcaagataaa cgtgtctacg 1140
aataacttaa aacagtacaa cttccctaaa aaattcatta aatgaaaggt ttttatagat 1200
tatacattgc acggtacggt tcggttacca ttcgaagtct aaaaagagaa tgacggttct 1260
gataatgctt ttaatcgctt ttgtattgta aatcattaaa acagtaagcc ggataccgaa 1320
ttactaatca gacccaaaaa agaatctata ggaaaaatat caactgaaga gcgggtaggc 1380
ttgaccttga aaggaagaat ggtgagcgag cggtggatag atatgtaata aattgtaacg 1440
ctttcaaaat gtcaaagtca caagtcacat tactcacgag ccaacactaa ccatgcaact 1500
tttgttttga cattttccta aactttaggt ataaaatacc cgcgtaataa ataacctctt 1560
cataattggg tccacccact cacaggtcca cacataagga accgaaaaag gtaaaattca 1620
aaaacttaca aagtttttta gagatgatgt ggtgaagtat tgcattaatg gaataatggg 1680
aaaagaaagt aattgcaacg tacgtataga ttaatccatt gacacaaatg aaaagtttct 1740
ttctatttaa tgtacacaac aaaggttctc ttcagagtaa tttaggggaa aaa 1793
<210> 48
<211> 257
<212> ДНК
<213> Arabidopsis thaliana
<400> 48
acacaacagg tccctacatt tgtacaatct cctctcttta aagactctct ctctttctct 60
ctccatctct atcttactct gtatttctgt cgtctgagca ctcaatgaaa ccactgtaaa 120
tttccgccag aatttgatgt gatggaacga taaaaatcat tttttctcgg ttaaagtaaa 180
aaaacaaaaa caaatttctg tagaaatcat aataaaagaa agaaaaaaaa tctaatgtcg 240
gtacataata cggttct 257
<210> 49
<211> 1787
<212> ДНК
<213> Arabidopsis thaliana
<400> 49
aagggatatt taatgggaag aaaagaaggg tggagatgta acaaaggcga agataatgga 60
tattcttggg atgttgtctt caaggccacg agcttagatt cttttagttt tgctcaattt 120
gttaagtttc tacttttcct tttgttgctt actacttttg ctcatgatct ccatatacat 180
atcatacata tatatagtat actatcttta gactgatttc tctatacact atcttttaac 240
ttatgtatcg tttcaaaact caggacgtac atgtttaaat ttggttatat aaccacgacc 300
atttcaagta tatatgtcat accataccag atttaatata acttctatga agaaaataca 360
taaagttgga ttaaaatgca agtgacatct ttttagcata ggttcatttg gcatagaaga 420
aatatataac taaaaatgaa ctttaactta aatagatttt actatattac aattttttct 480
ttttacatgg tctaatttat ttttctaaaa ttagtataat tgttgttttg atgaaacaat 540
aataccgtaa gcaatagttg ctaaaagatg tccaaatatt tataaattac aaagtaaatc 600
aaataaggaa gaagacacgt ggaaaacacc aaataagaga agaaatggaa aaaacagaaa 660
gaaatttttt aacaagaaaa atcaattagt cctcaaacct gagatattta aagtaatcaa 720
ctaaaacagg aacacttgac taacaaagaa atttgaaacg tggtccaact ttcacttaat 780
tatattgttt tctctaaggc ttatgcaata tatgccttaa gcaaatgccg aatctgtttt 840
tttttttttt gttattggat attgactgaa aataaggggt tttttcacac ttgaagatct 900
caaaagagaa aactattaca acggaaattc attgtaaaag aagtgattaa gcaaattgag 960
caaaggtttt tatgtggttt atttcattat atgattgaca tcaaattgta tatatatggt 1020
tgttttattt aacaatatat atggatataa cgtacaaact aaatatgttt gattgacgaa 1080
aaaaaatata tgtatgtttg attaacaaca tagcacatat tcaactgatt tttgtcctga 1140
tcatctacaa cttaataaga acacacaaca ttgaacaaat ctttgacaaa atactatttt 1200
tgggtttgaa attttgaata cttacaatta ttcttctcga tcttcctctc tttccttaaa 1260
tcctgcgtac aaatccgtcg acgcaataca ttacacagtt gtcaattggt tctcagctct 1320
accaaaaaca tctattgcca aaagaaaggt ctatttgtac ttcactgtta cagctgagaa 1380
cattaaatat aataagcaaa tttgataaaa caaagggttc tcaccttatt ccaaaagaat 1440
agtgtaaaat agggtaatag agaaatgtta ataaaaggaa attaaaaata gatattttgg 1500
ttggttcaga ttttgtttcg tagatctaca gggaaatctc cgccgtcaat gcaaagcgaa 1560
ggtgacactt ggggaaggac cagtggtccg tacaatgtta cttacccatt tctcttcacg 1620
agacgtcgat aatcaaattg tttattttca tatttttaag tccgcagttt tattaaaaaa 1680
tcatggaccc gacattagta cgagatatac caatgagaag tcgacacgca aatcctaaag 1740
aaaccactgt ggtttttgca aacaagagaa accagcttta gcttttc 1787
<210> 50
<211> 1731
<212> ДНК
<213> Arabidopsis thaliana
<400> 50
atttctctta aaataactaa attatatgaa gaaaaaacaa gagagataac gacgatcttg 60
atctaattag gaaagttttc taatgatggt aatgtgaaag agtgcttctt tcactcttta 120
tttaaagaag agatattttg gaaatagcgg tttgaaagaa agctataact tggtattggg 180
gaaggaaata aaccagagtt ggtttctagg atgtgttgtc gacttctcat tggtctgatt 240
agacttccat tgcctaatgt cgagtctatg ttttctcgta tataattttc aataagtgga 300
acattgataa aaaaaataac aataattgat tatcgacgtc tagtgacgtg aaaatgggtt 360
agctagacaa gtgaaatatg cacagaccac agacttcaga gcttccccaa gtgtcgcatt 420
cgatttgcat tgacggcgga tatttcttaa ataattttct ttcattttct aactatatta 480
ttggttgttg atatatattt tttgtaaata aaaatgtaat aatgtaacca agtagttata 540
gaggttttaa ttgctcggcg gtaagaacag tgaagtacat atagatgttt cttggtagag 600
ttgaacttca attgacaact gtgtattttg ttgagtcaat agatttcacg ttggatataa 660
agatacagca gaagaaaatt aattttgaag tttgggttaa ttaaggaaat atccaaaata 720
caaattacca taagtttttt ttgtactact aagcaaatta tatactcaac ttttcttttt 780
gctaaaattt gtctttgatg gaattctagg gaataaatta agagaactac gtattataga 840
ttaatacacc atgatcactt taagcagacc aaatgataat aacttattga acacgattta 900
ttcatgtagt acgtacatag atccaaagat cggaataaga tacgagagaa aatggttacc 960
ccatttattt atgtggagat aagaagcaag caactaaagc aattaaaagt accaaagaag 1020
aacatttaga gcaaactaaa agaatctaaa gctcgtgccc ttggcgacac tatccgctga 1080
tctccattat caacactttt cgtacatatg cagtacttcc tcctttgtcc attattaaaa 1140
tttagcatat atgtttgaat cgttgccgct ttcaattttt tttttttttg agtatattgt 1200
tttgagtgtt gtatatccgt caacatatta cacatctata tttttcaact ttttggatga 1260
atttactaag ttggcataaa ttatcaaaaa acaaattggt aaatgatctg ttattaaatt 1320
gtgattaaaa taacattttg accaaaacaa acctcgcatc acacataatt atgatatttt 1380
attatatggt gcatgcaata tctgttaact aagatgctat ttgaatgtta atttcaatgt 1440
gtcatccaat ccaatcgagt ttttttttct ttttaaaaaa acaacaaaat tcatggtcac 1500
tataaatact cttttattct taagaatttt tttctcctgt attttccaaa aataatagtc 1560
catttttacc ttatttatct cccgaagaaa ttggatcgat caatgaagga aagaaatcaa 1620
atggtcttat gatcaaagca acattgagaa attcaatcta caaaaagcag acacatctcg 1680
acgtaagaaa gaagaaatta tcatagtgat caaaagtacg taaaatcgga a 1731
<210> 51
<211> 2001
<212> ДНК
<213> Arabidopsis thaliana
<400> 51
atagaaaaaa gtggttatcc aagctacaca aactttttag acttatttct ctcattcttc 60
tagagatttt taatgaaatt tgtatatact tgaaatgcat ataaaataaa taagaaaaca 120
atatctactt aatgtcctgt tcaagaatta ttaagaaatt tcactacgtt gttaagtcca 180
ttttactcca ccttctccac tggagttaga ctctactaag tcgcgttatc ctgcagagta 240
aagattgact atgcattgga ccttgtcgat gtgaaaatgt taaaaagata attattatga 300
aatctctact ataacatatt tggtttcctc aattttaaaa tacctatttt tttctcagtt 360
taccattaac caatctattc cgtgatattt aatgtttaaa cccttcttca attctattta 420
acctacattc taaacaaggt gtcctcattt tcaaaatcct aaactcatct tcatctatat 480
ttctattttc tgccaaaatc ataccacaaa aaacatatac gaaaaatgac cacggaaatt 540
gtcttttatt gtttatttcc aaagtcaacc aagttgactg ttctttatat aatgattttt 600
ttttaaaaaa ttatatattg agctaagaaa atattaagtg taattttcaa aaagagaaaa 660
tatatttatt ataaaaatct atagtggtgg atcaaaattc tggtttaaat tattgtatca 720
attttgaggt tcaaatttta ggatggaaga gaaacgtaga atgcacttaa agttctgtcg 780
atttttgtta gtacataatc cctcatataa ccatacatat acttattgca ataaccatac 840
gttaagaata gggaccaact tcatcggtgc ttctgttaga catttcaaga atgatatatc 900
acattcatgt atctccgtat atgtattaag accaatgact aaactcagcc attgtagata 960
tagttcaggt aaaactgtca attgtggatc agtatgttga aaattgttaa ctatggttcg 1020
cttgtaacag aatataaata taataataat atataatact aatagtaata tatataataa 1080
taataaaaag caagcactaa ttattttata gaaacacttt aaaaagtatt aaaatctcat 1140
ttaaaacaac tctccaagtt ggtagtccat tgatctacaa gacagctcca cctgaaccac 1200
atccacaatg taaaatttaa ccgtacacat aaaccatgat cataagatgc aacatggtaa 1260
aatctctggt gaagttttcg taatcgatga tgaatatata tatatatata tatatatata 1320
tatatatata tatatatata tatatatata tatatataca atatattttt attttcaatc 1380
tatttagtaa gtacatattt gttatgaaag tacaaaaata acattgtaat aggtcaagct 1440
ctttgtggtg gtttacattg taataggtca agctctttat tattatttta ctatatgtat 1500
cttcttatcc attcttatat tttatatcat atatggtcaa aagaaccaat cgtatcacag 1560
cagcatttgt taatagaact ttgatcttgg taattacagg ttctatattg aaatcgcagg 1620
agccaaacca gcaacttggg ttaattatta acttcattca ccaataataa taattgatcg 1680
tcaagactat ttcggacaca aagacataaa tacttgtttt ctgctctccc tttccctaaa 1740
tgtatcattt gatactttct ctttttccct ccatatgcct tttgtgtgta taaatatatg 1800
tatatgaata agttcacaaa aatagaaaat taaatcaaat cttcgcgtaa tttctcatca 1860
aactccactt ttcttctttt taagagaatc tagggtttct tctactactt cttctttctt 1920
ctttaggtgg tcaaatttcc aagttcttct tttagctctc tcttttgttt ccaagaaacc 1980
tgagaagaat ttttgtagat a 2001
<210> 52
<211> 1814
<212> ДНК
<213> Arabidopsis thaliana
<400> 52
tctacagtga cgtaagtgat gtggtataaa tacggtatgt gacgtgaata catagacgat 60
gatatttgtg gaaaaaaaag aaagaaaaaa aaaacacaaa agctacatac gagtggaaga 120
agagaccaga gtggagataa agttttaagg gctgtttggg aaataaacca tttgatgtgt 180
tgtcgagtcc tcattggcta ctttttactg tgcttgtaac tcgttcgtta gttttgtgcc 240
tccctttagc ttacattgtt tccgtaccgt acggactttt gttattgttt ttaaggttaa 300
gaaatcagac caaagaactc aatagatatt aaaggagaat aatctttaac tccttaatac 360
tttctacagt aacactataa cgactatata tagggtttaa atattctttc aaaatgcaaa 420
ttgtattttg gttttttaat ttttcttttt gcatggagac aagttttttt ctggttaaat 480
gcacggagaa attttaattt tatttaaggt gactttctgt ttttccttta aacagggaga 540
aacattgtgc ttacaatttc aaagatatat atattagata aaattaaata tagtgtgttt 600
taataagtac acgaaagaat ttgacccaat tgtaataaaa ccttaggaaa aatagtaatt 660
ttataattgc aaacacaaaa ataacacgga acattttaca atattttatc ctgctaaatt 720
ggaaggaaaa aaactaaaat gatgtccttt tcttcaattt caagttaagt atcgatcttc 780
tctttgctct ggaaattgat gaacctacaa agtggaagct aggctgaaat ttagctgctg 840
aaccaacaaa actcttaaca tcaaatgaag catgttctat agatcgtggc gttgatcttt 900
ttggaccaac caatatgcaa aatgcatata ttgttgtaaa aaaaatgcct atattccata 960
acttattcac ttgatatact ataatttttc ttttgaccgg gaaaaagtgg cctatttatg 1020
ggaagagaat ctcaaacgta tgatactctc aatgtaggaa aagtctctag actaccattt 1080
tcttttactc ctttagaccc attggatttg ggtagatgga tttattaaat acaatgtaag 1140
gagtttttaa atgaaatata aagatacttt aatgattaac tggtaactgg taaattggta 1200
atgtactact attgtagtca atgtaagaaa atagttacga aaataaaacc ttttctgtca 1260
attaataact cactactata atttttgtag gattaacaca tcacactaag ctattttatg 1320
actaaataag taaatataat ttcttccgaa ggttcaactt tttgagtggt tattgaatag 1380
ggaacgtgtt ccgataagaa gttaacaaaa caacattcat gtcggtccca tgactattat 1440
atgtctgact ctgtgtgata tcgatatata cataacatat attggtctga aaagtggaaa 1500
atctatttta agatttggta actgatcaat gaattgataa ctgatagtct gataccaaac 1560
ataaactagt tttgtacact aacaaaataa gaatgaaata tcaaattttg taagaattgg 1620
taactgatat aatgaatcat cgtaactgat tattttcttt taccttccga cgtaaatttg 1680
tttatgttgc tcttaattat gttcgtacct taattgatca taaacacata aattttagtg 1740
attccttatg tcgagttgtc aatggtttgg aagattggta gctcctgaca tttcatcgga 1800
atttcttctc tcca 1814
<210> 53
<211> 2001
<212> ДНК
<213> Glycine max
<400> 53
tttcgtgtgt gtgaacaaaa taaatgatct gcacatgtat catggttata gtaacaagtc 60
ccagctccca agggtagtag ctgcttaaag acacacggaa accctcgagg ataatggtgg 120
agagagagtg ttgaaatttc aaccatctca cttttttctt ctaccttatt ctttagccga 180
aaattaagtt ctaactttaa aatacagatt tgcttcagaa gttgattttt taggtttttt 240
tttttctgga agaccaatat taatttgtga tagttagtta aaaaaattat attatgtttt 300
gtgatagtta gttgaaaaaa ttatattgtg ttttgctact aatttacttt caaaatataa 360
atatccaaat atatatataa atcttatcac ttgaaaatag atggtgggta tatggactca 420
aatctatgga tcggtctgtt taacccacga attttgcaga taacaagcct ttttttaaaa 480
gaaaattcgc ataactatat ccaagttttt cttagttcgg tccattaagc tagcacatct 540
agtagtcttt atccatggac atattattaa tttgttatgt taaaattttg atttttaatc 600
tagtggtata ttttagtatg atagatttta acttaaaaaa tgaagtcaat tttttattac 660
taattttata catttttcac ttttaaaaaa tatttatttc ataagaaata tttttaaatt 720
actatttggg tccatggatc aatttattta tctgagtttt tatgggctag atacaaatct 780
tggaaaaaag ccaatttatt tcatggattg gcttatttga tccgtctaaa atgcaagctt 840
cacaagacaa accttaaaca taccatacca tccttttatc tatctctact tcaaaatcaa 900
tttttgcaac attcactcaa tggtgcactt aattaacaaa ccctcatcca tatacacata 960
tttagagatc aacaatatga ttatctatca aaaatacaca aaatcagtgt gtgtttgggt 1020
aggcgttgac aaaaattagt tttgaatgaa attgatttta taattttttt tttgttaaaa 1080
ttgattttga agtaatatta tttatgtttg gatgttttat taaaaaatta agttatgaat 1140
aaaatgaagt acataatttt ggaccaaaaa ttattcaaaa ttatttcaac ccaaaattaa 1200
ttctgtatcc aaagtcaatt ttaaattttt ctttgatgtg aaactaaaca tgtaaaaatg 1260
tatttaaatt aaaattaatt ttagacttat aattaattct ctgtggtcaa tccaaataca 1320
cactcacact tagaatgtat gaaatttcaa tttttaactt tctcatctat gagctgttcc 1380
tattcctcct tcccctccta tgccctcact agggagccag ccagccatat tccaaaagcc 1440
cttattatca cacatgggtc cctccatagt caaaataaaa ataatatcat gatcactgtt 1500
tggccataaa gagctatacg acacacatgg acacagtagt acactgccca accaatcaca 1560
cgtcgacagc acaccgttcc caaactactt cacctttccc aaaccagaaa ccaaaaccac 1620
ttgtcatcaa acccctgccc agatagtttt tctccatttc aatattttac ttcacctttt 1680
gaggctttgt gggtactaca aaacataaca caattgaact cactgtgctt tcccatgaca 1740
cacatctata cttgtccaga agaagaaaga tccatgaact aacattccca cacgctcgct 1800
tcaccatatt tgccaccctt ttaaccctca cttcttgggt ttattttgct cctttttttt 1860
ttccttgttt ggggtttgca tttttcctgg ttgaaaaagg gaagaacttg aactaattgg 1920
ttaagttacc tatctatcta tctatctagg gtataatatt ttatatcagt tattaaagga 1980
aagaaagaaa gaaacgaaga t 2001
<210> 54
<211> 2001
<212> ДНК
<213> Glycine max
<400> 54
tcactagggt agtagttgct taaagacaca cggaaacatt taaggataat tgtggagaga 60
gagtgttgaa atttcaatca tctctctctc taccacggta tacttcaata aaaaaaatta 120
aggactaatt ttaaaataca gagatttatt ctagaggttg attcttttag tgtgtttgat 180
tttatgttaa tacctcaaac atacatttag aatcccacaa aattagtttg gtatcatgtt 240
tggattttca aaagttaatt ttgtaacgta cgtttgggat aaacctaggt ttgggtttgg 300
atcagaccaa caaatttgta gcttttaaag tgaaattact ttttatttgt atatttagga 360
tagaaacatg catgaagtaa aaatactttt gattagtata tatccaaaca aatatcaaca 420
cttttgaaca aaaagggtaa tcatgttcta ttaatatttt ttttttttgt gataaagaag 480
tagctgaagc ttcttatttg acaattaaat aattcttctc ctatcggatt ggtccatttt 540
taaagtaaaa tgatacctca aattgtgact atatacacaa gccgtgaatc aaatcttaga 600
ccttggttaa aagactcaag tgctaagtca tttgtaccaa taacttttgg tataagtaaa 660
ctcatttttt acaacatact tttgattcaa acttatgttc gcaaacttta tacaaatatg 720
cacttagtgt gtttggatat ttcctagaat gaattttgag tgccaaatca aggtggaaat 780
attgcaaagg ttaaagtaaa tatttgttac tttgaccttt tcaagttacc atgttattga 840
taaagagtat ttatcgattt ttattaatga ttaatctttg tcaaaaaatt tagttagtta 900
gttttagcgg gattttttcc tcctaattat atttttttca tccacaatac ttgaatttga 960
caccttcatt aaaaggatta agtctgtatt actcagattg ttactttgcc tgctttaagt 1020
tgattttgat aagattgaaa gctaatccaa atatatattt tcacattaaa aattttattg 1080
catttaaaat taattggctt aaaaataaat tttgaattat atatatatat tgaatttgtt 1140
ataactttta gcaagaaaaa atatttaaac acagaccaca ttatctcaaa ataaatttta 1200
attaaaatta ttttattcaa aaatcaattt ttatcaatat tcacccaaac acacaaactt 1260
aatttaaaaa aaaatcctca tttatattag agatccacaa tatagttatc tatatatcaa 1320
ccatacacaa aatcataacg taagaaattt caattttcaa ccatctcatg tgatctatgc 1380
atgctattat tcctcctacc cctcctattc cctcactagg gagccagcca tattccaaaa 1440
gctcttaaca cacatgggtc cctccatagt cataataaaa ataatatcat catcactgtg 1500
tggccataaa gagctacaag acacacatgg acacagtagt acactgccca accaatcaca 1560
cgtcgacagc acaacgatcc caaactactt cacctttccc aaaccagaaa ccaaaaccac 1620
ttgtcaccaa accccagtcc cagatagttt tctcaccatt tccgtatttt acttcacctt 1680
tagtgggtag tggttacatg atatcagcac actttcactc actgtgcttt cccgtgacac 1740
gcatctatac ttgtccagaa gaagtaagat ccatgaacta acattcccac acgctcgctt 1800
caccatattt gccacccttt taacctcact tcttagggtt attttgctcc cttttccttg 1860
tttgggaatt gggtttggtt tggtttttct tggttgtaaa aggtaaagaa gaactaattg 1920
gttaagttac tatatatcta gctagggtat ataatattat ataattattg ttattaaagg 1980
aaacaaagaa agaactaaga t 2001
<210> 55
<211> 2001
<212> ДНК
<213> Glycine max
<400> 55
acaaaagatc acaaaattga acaataatga caatacctcg cattgaagta gttcaataca 60
tattctgagt atgactcgcg agtacatgta tctcatgttt cagtttttaa ccacagctgg 120
atgccatgga cacttttaat tctattcttt taaatgagat acctggccta tcaattttaa 180
gggtaaatta aaactcagaa atcaacatac taaaaaattg catgcatgtc cgcaaaagaa 240
aatgtttaag gcagtatata ttcactagtg cacaaagttt tgaccttaaa tattgaaata 300
gtgaccatac gagtgtaatg tttcagatat atataatgct aattatggac taattaatta 360
aaatagagga ttgctttcaa taggaaaata gtagtgtaat ggaaaccgga aagtgaacta 420
gaaagaaatg ttaaaaatgg tctagggaaa aagttaagga gaaaatggat tatacataat 480
gtcaaaaatt ttataccgct gattataatt tatatattat gtaggaaaaa tttattaaat 540
tttaaaataa ttaaaattat aatttatgat tgaatgatat tataaaacaa ttttacacaa 600
tcaatttata aatattaaac ttaaaagata aacctaaaaa atactatttt tctttatcat 660
aatattagta taaaataatt ctactaaaaa aaataattaa tatttataaa aatacatata 720
aaataaatat tttttttata acataattta ttttatatat aaaaattaat caaatatttt 780
aactttggat tacttaatta aaaaatgatt cctaaaaaag accatttgaa tattatttgg 840
tggacgaagg gatggaccag agttcaatac tcgtgggttt tggcggcgtc aatgagagga 900
tgcacgtaat gttcgggtcc gtacggcatt gccactgttt aaaccatcgg acacttgaaa 960
gctcaaagca gtgactgtga tgagcagctc gcaatagaga atccaaaatt cccaaaagca 1020
aaaacaaaac ccaaaaagca aaagagatat cattgtgtgg ctgttagata ccacagacag 1080
caacatggta actgaccacc caatccgggc tcgacagcgc aacgttagca aaaccgccct 1140
ggttttttcc caaaccagaa accactttat cgccaaaccc caatgtgatt agagtgttgc 1200
taggtgcacc tactgttatt gctggtgcac ccaaccttct ttgataatga taaaattatc 1260
cgtcttcttt ttccctttac ggatcaagtt gatccgcaag ttgattttta agacttacag 1320
atcaagttaa tcggtaagtc ttttatggat caacttgatc cgtaagtctt aaaaattaat 1380
ttaccaatca acttgatccg taagaagctt gcagatcaag ttgatccata aaagacttaa 1440
aaatcaattt gcggatcaac ttgatccgta agaagcttac gaatcaagtt gatccgtaaa 1500
agacttacgg atcaacttga tccgtaagtc ttaacaatct acttgcggat caacttgatc 1560
cgtaagaaac ttgcagatca tctatatcaa ctgtagatca actaaaacat atgcggatcg 1620
actcattaca tatgtggacc aacctgaatg agctaggtgc acaaaaatat ttttaaaaat 1680
acatagggat atttttgtct tttcatgtta agtgttaggt gcccaacaac aataatgctg 1740
ggtgcactta gtaacaccca tgtgattagg gatatataac aacatagcat actcacacta 1800
ctactcactg cggttttttt ctcctccaga agaagaaaga tccttaaatc aacattctct 1860
ctccctccct tggttataat agcaagcttt tcaagcatat ttccggggtt tgttcccttt 1920
tccttgttta gggttttctt tggaaaaaaa aggtaattag gtataataat ataattaaag 1980
caaaaaaaaa aaaaataaca t 2001
<210> 56
<211> 1162
<212> ДНК
<213> Glycine max
<400> 56
agcgcaccgg gaaccaaaac gcgtgtacgc gtaccacgta tcccaattcc ataagaaatt 60
ctaaaaaccc acacgaacca ttttgggcag gaacaaaatc ccccagacga cgacacctca 120
gaaagttagg ggcattttgg tactttctgc atgtgttaga gccttgtttg tataaaggat 180
atagatattt gtctaaggtg tatattgtaa acaaaatatg actttcctat tcttacatgg 240
tcttttgtct tataaaagat gatagtgacc gagttgataa ttgttcacaa taataatatg 300
tgtaaagtga tagtcagtta acaagtgtcg actacccgtc gattccgtac aagatagtaa 360
tcatacgagt gtaaagtttc ctatagagag agagacatga atactaaggg ggattattta 420
attaaaatag aggattgttt taaataggta aataataata ataataataa taataataat 480
aataataata ataataataa taataagcaa aggagaaaga gatgttaaaa atggtggaag 540
gaaaaagata accctaaaaa ggaacatttg aatatttggt ggacgaaggg atggaccaga 600
gttcaatact cgtgggtcgt ggcgccgtca acgtaaggat gcacgtaatg ttctggttca 660
tatacgacat tgacactgtt taaaccatca gacacttgaa agcaaagcag tgagtgtgac 720
tgtgagagag cagcaataga gaatccaaaa tcccgaaaat caaaaacaaa acccaaaaag 780
caaaagagat atgattgtgt ggctgttagt taccacgaca acaacatggt aactgacaag 840
ccaatcaggg atcgacagcg caacgttaag aaaactaccc cggtttttcg taaaccagaa 900
accacttgtc gccaaacccc aatgtgatta gtgatatata ataacatagc atactcacac 960
taccactcac tgcggttttt ctcctccaga agaagaaaga tccgtaaatt aacattctct 1020
ccctcccttc gctataatag caagcttttc aagcatattt ctggggtttg gtcccttttc 1080
cttgtttggg gttttcttgg gaaaaaagaa gtaattaggt ataataatag tataactaaa 1140
gcaaaaaaaa agacagtaat at 1162
<210> 57
<211> 2001
<212> ДНК
<213> Solanum lycopersicum
<400> 57
atctttcaaa gagacggatt tagagcgagt tctaatctaa taaaaaatta ttcaataaca 60
ccatacttga aattaataac gtttacaatt actttttttt gaaacgtagg ggcatgtgaa 120
attaaaatta aagcgtaaat gaaaattcac aatgtctaaa ttcggaacta acagatgcta 180
tgcaggagag caacaaaaga agaaacccta attgctaaat ggaaaaaagt gcaaggaaaa 240
atcaagtttc tatatgtgtc ttttaagtca attattcatg gtgtcaactg tcaatatata 300
cggggataat gcacaaatac ctctcaactt atgcccgaaa tctcaaagac acacttatac 360
tatactaagg tcctattatt atttttgtta ataatttttt atcccttttc tgcttacgtg 420
gcactaaatt gtgggaccaa cgttgattgg cttttttttc caagctagtg tcacgtaggc 480
cgaaaagggg cagaaaatta ttaataaaaa taagtttagg ggtaatagga ctttagtata 540
atataaatat gtctctggga tttcgggcat aagttgaggg atacttgtgc actatatgcg 600
gtatttttat ttaggggtgg tttggtttga agaaagttat gatgctatga ttagttattt 660
tttagtgaat gtttgatttg ttgcattaaa aataatatgt atggcataat ttttaagaat 720
aatttatttc ttcgattttc ttcgtaaatg tgaaagtgat aatataaaaa tagcttaaga 780
ggaaaatttt gtttaactat ttttccagtt atctcatcat taattcatta ttactcgact 840
caagacaata ataactcaaa attatagggt cctttggtgc gagggatcaa aaataacgat 900
aatgtgataa aaaaaaaaat cttgtttagt tgtcatgttt agaataactt atccaccatt 960
tacattatag tgatgagata tgttattcgt aaataactac cttcaaaata acctatcctg 1020
taataactta ttcccaacga tagtaataaa aatttatgtt acgattattt ttctttatcc 1080
atcactggac taaacgtgtt ggaagaactt taatttagag ttggtgggct aactgtcgtt 1140
attgggaaac ctgtatgcat attgaaaaag taaaaaaaag acaaagagtg ttgtttgtag 1200
gtacaattgg tgtcgaatag taattggaga gtactgctgt gaagtgactc tagttgttta 1260
actgtttctt cactatgaac cacacgatga caaacgtagt acaatcgaag ccaaaaatag 1320
attcaaggtt attacaaaac ttaaataaca aaaccacaaa cactgcaatt atactaccta 1380
gtatattagt actagcagtg agactgtttc gtttttgatc aaaaatttcg cgctcgagtt 1440
taatataggt tgtatcaatg gtgaagctat ctcacccttg atcagaaatt tcgagttttg 1500
aatataaaaa aaaattatat taagagcacc actcagaatg aattttgcag tgtacgattc 1560
aaatttaatt gggggctcta atacgaaatt ccgcattggg tggaaaagga aaaagaaaaa 1620
gctatgatca atctactctc cactgttgca gtttaccctg ctatgttgta ctaaattgta 1680
ttcttgcatg aatctcaaag gataatattt gattttcttt taattataag tatttaaaat 1740
tatatccaaa aaaaaatata gcttatttgt gattccgaga tctgtgagta gaaaatccta 1800
aaaactattt cgagccaatt tttgagaact atgaaaatat ttaaagtaaa aaattatacc 1860
atttgatgaa tataactaaa atagatattt aaaagattaa ttatcaacgt ttaattcaaa 1920
aattgatgac caagcactag attggtcata tagttttgag attataactt cttaattatt 1980
gggtattgtt aaactttcaa c 2001
<210> 58
<211> 2001
<212> ДНК
<213> Solanum lycopersicum
<400> 58
cccacccttt ggttcttcga accccctacc cgcacccctt tcttcttctt tttcttcggt 60
gatctcgtcc cccgtccccc cccctcaccc ccgcctcctt ctttcttctt tttcggaaca 120
ccctcaccta tttcttcatt tcaaattatt cttacttatt cttaaaagtg atgaataaga 180
aaaaaatgaa aaacccaaca acttgttaca tatcgaaggg tttgttgatt atgatgaact 240
tgaaacattt tttaataaaa aaatttgtaa tttcttcatc tcaaattagt tttttaattt 300
atattattta tttattttga taatgtgttt taaaaattga tgtttctagt tttgaatacg 360
ttagagtttg attttatttt tataatcttg gattaattca taattttctt ttctgttttt 420
atctttctaa aaacgtataa ataaaaataa ataaaaaaga attaaaaaaa gtcaaaattt 480
ttaattttca atgtggcact gacgtgacac taatgtgaca ataaaatgac gcgtgtgtaa 540
tacacttgct actgtgagac tggtattgta gtattagggt tgaaaaaaat cactttaaag 600
atgttaaggg ataatttaaa cgctagtgta gtttaagtgc taaagtaagt tttgcagcca 660
agttcgagag aacttttatg tattttctct ttaaatatat actcttctca ctgacgatta 720
tcgatgtaat gatctgactg ttctttaatt ttcttcaaag ttttatttgg attagtgatt 780
aaatggctaa gacttaattg tcaaagtaac tccctaacca tgatatttct tttattttct 840
ttttaaaatt gatctcttta ttggcttatt tctcctattt tatttcacct ctttcttccc 900
tatttcctct aagacgcaat aaaaagagtg ctttgaaaga aataaaagaa attgtatgct 960
taaaaaagta ttaggaagag aactattccc aatatttatg gacaagatag tatattgcta 1020
agatggcgga atttcaataa tttttaatga aatatataat gtatttatga actaaattag 1080
aattgaagat ttatttttat acaattaaat tttaattatt aatttaattt atatcatgta 1140
tcactagttc aagtaaaaat ttagagaaaa tggaaagaaa ataaacgaag aagagccaaa 1200
tctaattagg catatgctac aatggaaccg cattaacaaa caaaaatatt taaaactact 1260
cctaaaataa aggaggaaaa catatattat aaatcacaaa aaatattagt atcacaaaaa 1320
tgaacctgag ggacatatta tgaaactttt atataaagta ataataatca aattttagaa 1380
tttaaattag ccaagtgaaa tatatacctt taattataat tttattttta ttaaaaaaac 1440
gatgtcatat atgaaatgta gagagtacta catagtgcag aagtactgaa tgtcctagga 1500
ccttagcata taaggagtat atactaaaaa taagaatgac gtaaaacacc atcaatgcaa 1560
ctattatacg aataaaaact caataagtat ggcccaacca ttacctgcca acccgttgaa 1620
atctcgatta atttaaattt acgtacaaaa taaataaaaa tttcaaacta aaactatcta 1680
atcacatttt gtctggtggt atgtagcata attttgtggc tcttaaccac cagatactag 1740
cagtgtgtac gttttatcca atcacaaatc gacaacgcaa caccccttaa tgcttaaacc 1800
actcttgtat caggttatta ttattccctt tcactcaatc aatcaaaaat caacaaataa 1860
aacctccccc cccaaccctc aatcatgctt cttcttccat atagtctctc aattagtcca 1920
aacaaacctc tctatctatg ctaggtagct tatatgattt aatagttcga ttaatttaaa 1980
tacgcattaa agatagagga t 2001
<210> 59
<211> 1812
<212> ДНК
<213> Solanum lycopersicum
<400> 59
tttcgtcaaa agtgttgtca aatttctatt ggttcacaat actcttcaac tcatttaact 60
tttactcacc gtttcaaaaa caattaactc tagtctgact tgattgacta gacacggagt 120
ttaagagtat aaagaagatt tttaaatata taattgtaaa ctaaaacata tttagaaaaa 180
ttgagatagt aataattaac aaaaacggac tcactctctc ccttttctca ttattactcg 240
gccgcaaact cttaaaaata cacgccttaa ttaatactct tgcctaatag agtattcatt 300
tagcacattt ttaagaaaat tgtaaattac taaggatatg attttttata taatggacaa 360
ttgttattaa aaagacgaag atatttttta aaacttttat tcgaaacaaa tatgagaaaa 420
ttggaaaaaa aattcagaaa atgttttttt cataccaaac acactcctaa gtttaagtag 480
ggaaaatcgt ctgatatacc tctcaacttt gtcatttagg gttgatatac cccttgttat 540
gaaagtggct catatatacc cctacttgta aacaaatggc tcacatatac cctttttctc 600
taacggaaat gaaaacaaaa taattttagt ctaaattttt attatttttt tctaaaaaat 660
ataatcccat atgaataaat ttaatcctcg tcaaacatat ttttttttac tttattttgt 720
ttcaataact aatttataat tattattttg atgataaaat ttatttatgt ttcactaata 780
ttcttgtaaa acttattgta gatgatcaaa ttttttcttc gaatccgaaa ttaaattaca 840
atacacatac agaaaaatag tttaattttt tattctttaa actaagaaat gaaagaaaaa 900
aacaaaataa gataagaaat tcaaataatt ataataaaag aagtcaaaaa ataatttatg 960
tatgaaaaaa aattaaaata taccttgaac tttgatagaa gaatcatatt tacccctaaa 1020
taattttttt ttaaaaatta gaagtaataa atataaattt aaaattaatt ttttaaaatt 1080
tgttaaatga agggtatatg cgagccattt tgtaacggca ggggtatatg ttagccgttt 1140
gtataacggt aagggcatag atgagccact tttataacga ggggtatata agctccaaat 1200
gacaaagttg agaggtatat caaacccttc tcctatttaa gtatttagca tatcatttaa 1260
tagaataaat taaataaata ctttatatga gaaaattgaa aaaaaaaatt caaaaaatgt 1320
tttccttcat actaaacaca cttctaatct aagtatttag catatcattt aatagaataa 1380
attaaataaa tactttagat gaatattaat tggtatcttg atttagatag ataattggga 1440
cgggacctca tgttcaaatt ttaagagaga taaaaatatt aaatgattct tttcattgtt 1500
ttagtgttgt tgaatagaat tatttaatac attttattaa aggatgatga taattatttt 1560
atcaaaatta atctaactgt acgaaagatc atcaaaatat taattagtat catccaaaaa 1620
acaatttctt aaaaatcagg caacaagata tggaaataag atcttttgtt ttttcttata 1680
tttgaataaa agaaaaagac tacgtattta atatctcata tgtaatatat aatgaataat 1740
cttttttttt taataaaagt atcataaaat tatagagcac tagaaaaatc atttcttttt 1800
gactaatatg gc 1812
<210> 60
<211> 1880
<212> ДНК
<213> Solanum lycopersicum
<400> 60
atctgaaata acttttgttg ggcaaaatat cccagatgtg gaagagagag aatatagtgg 60
tttttaaaaa accagagtgg tttcgtcaaa tgtgttgtcg atttttcatt ggacagagaa 120
gatggattat ttgttatgtg tctcaataaa acccacaagt ttttttttgt acagtagaca 180
atagccgtgc gcatcttgta gccaggtgat gcgaaacaat ggaataacgc ccaccatctt 240
tttgaaattt cggtgaaaat agtagcttcg tcacgaatta atatttgata aatattatta 300
tacattcata atcactgctt cttttaaata aaatattttt ttcgttttat atcaattgat 360
tttttttata tgtttattga aaaaaaatta taagtaagaa gatgatattg ctaattccac 420
acatattact tttagtatga tgataaacta atataaaact gagggagtag attatttgtt 480
ataataagat agagatactg ttaaaaaata tgatatagta aatgaagttg gtataataaa 540
aaatattaaa aggaaatgct tcactaatga ggccttatat agcacgattt ttttttatga 600
tagattatat atattatagt tagggaatta catggctttg agacatattg gcctctacat 660
agtttcgaag cctattggct tccacgtatt ttttatatat tagttattac ggctacctta 720
tcaaaacatg ctaatttaat acaaattatt cttaaaacga gcctagtaga tataactctc 780
tgttggtcat cttttacaag cgccatagta tgctcggagg ggtagatagt atagtaattt 840
gggaggacga tgttagcgtg gtacctagtc ttgacaaaaa ctctgcttca tggtatatat 900
aacttaagac tgatgttttt atataattgg tatagtttaa tttatgattc cattacgttt 960
aattgtgtga ttgtatattt aaaacttaaa tttctataac agtttataaa attttgtatt 1020
gctattaaat atatttttta aaataaaaca aaagaaatta ataaggaagt atgtcttttt 1080
tattcggaca tgatgattca taaactggga taaagattta taatagattg tagggtaaat 1140
cttatattta ggtatttcat tttcttataa tttttatcag ctgtatataa gtttcaatgg 1200
tttaatttat tgtagtaata ggttattgtt ggtgcttctg ttgaataaat aacaaaatca 1260
agcattatgg gtatatagtt gtttataatt tctttgatac gatggtacaa aattatctta 1320
tgacttgagg ggggtgtttg gtaggcaata tttcggagga atatttcaaa attaaatttt 1380
aaataaattt atagttactc tcttcttaat tatttgttga tattttaatt taaaattgtc 1440
tcaattattt ataaaaattt taaattctta attaatttaa ttcataatta ataaagataa 1500
aataataaat tactatatca actatcattt tttaataata tattatttaa aaattgaata 1560
aatatttaaa aataaaaaaa tttatattta attgataata tatcaatcaa acgcaatata 1620
aatttaattc gcaaaaatca aagcgtaaag ttaaccaatt cattggctgg gtggatagca 1680
gtcgtttgta tggacaagaa ttaatgtacg gctaatacta ttggttaatt tattgagcaa 1740
attgtgtggt ccaactggat attcactctc ttatcccttt cgttttcctc ttttagtatt 1800
ttatttttca ccccatagta attgttattt tttaaatgtg cattggataa atttatatat 1860
atatatatat gtaataatta 1880
<210> 61
<211> 2001
<212> ДНК
<213> Zea mays
<400> 61
cccgccgagc aagtcaatcg ccccatcatg cggacttgct cggcaaatgg gctagagaga 60
ggtttatggg cctcgccttg ggtaccctgt tcccggtacc cgacaatgac cttcctcgga 120
tgctgatagg tcaattaaag aaacaacaat ggatatatat ggataggtat agaggtgtaa 180
ggctatctct agaacgttgc ctattcttat acccatattc aaactttatt gataaaatgt 240
tggacaggtc tggtgccctt ggaacaagtg ttgtttccat tctccagagt ggactacttc 300
ttgcgctgat ttgtttggtg agttaccgaa ggagatttag gggaagaaaa acagggcact 360
tataagtgat atattgttta tctcagatgt attgatcact tctctggtat tggtgcaatg 420
tattggggta ccgatcactg agtaatcacg caatgtattg gggtactaaa tcctctctgg 480
tatcgattat tcatgcaatg tattgacgat tttaataagt gaatcgccaa tgtatatgat 540
atttccactg gcggtgtact taatacagcc gccagtgtat atacatcatt tccactgacg 600
gttcagttaa gtgaaccgca agtgtatatg acatttccac tggcggtgta ctttatagaa 660
ccgccagtgt atatacatcc tttacactga cggttcagtt aagtgaacca ccagtgtata 720
tgatatttcc actggcggtg tacttaatac agctgccagt gtatatacat cctttatact 780
gacggttcag ttaagtgaac cgacagtgta tatgatattt ccactgccgg tgtacttaat 840
acagctgcca gtgtatatac atcctttata ctgacggttc agttaagtga accgccagta 900
tatattatat ttccactggc ggtttactta ataaaaccgc aagtgtaaat acatcattta 960
cactgacagt tttgttaagt gaaccaccag cgtatatata tttacactgc cggttcgtta 1020
agacgggccc gtctgttttt ttcactggcg tgctgtaact gaaaccgcca ttataaattt 1080
ctacgtgccg ccaccttaga gctcttttct actagtgtta acttcttttc ttgtagacca 1140
tttggaaaac aggaaacaac gcggtactgt attcaacaac agatggttgt ccacacctat 1200
gacaatcatg gcgtcaatgc agtagtaagt ttgtcgtttt tgtgtgtgtg tgtttattag 1260
ccgtttcttt gttttttttc ttctgttgag ctccaacttt atgaaacgtc gtaagctggt 1320
aattatgaaa tgtaaggatt tggagagaga aaaaaaacgg gagggaaaac catgcatgct 1380
gctgacgcga cggccggacg cagacgcaac aatgcccccg gtgcggcgtt gtcgagcagc 1440
cactgcacca ccccacgcat cacctgcagt aatctagcga cgggtttttc ttatttattt 1500
atttatttat ttatttttct tctctccctc cctccctcag atttgttttc gttttcatta 1560
atcgttatta ccagcaatta attaacttta tctattgatt taccaaaccg caataaagaa 1620
tatatatatt cttttattaa ggtccagtaa taagcagcac agaagcgcag gtgcagcagc 1680
agcagcgtca gcgcccgagg cgcgcacgag agaaacagag gctgacgagg tggggcccgt 1740
gcgggccttg accaatcgga gttcgacaac agcctggcca cccacaaaca cacactcctt 1800
cgcctcgcgc cggccgtcgt cgcctccctc caccgaacga tccctcctcc tcctcctcct 1860
cctcctcctc gcatcccacc ccaccccacc ttctccttaa agctacctgc ctacccggcg 1920
gttgccgccg ccgcaatcga tcgaccggaa gagaaagagc agctagctag ctagcagatc 1980
ggagcacggc aacaaggcga t 2001
<210> 62
<211> 1610
<212> ДНК
<213> Zea mays
<400> 62
tagtgttatc catggccaca ttattttgtt tgtttgagtt agtttcatta ttcaagcaac 60
agtccattga tgcaataatt gacatataac agttgtacac attatcttgc taaaaccgga 120
actattgttt ccagtatcaa aaaaatataa cctgataatg aattttccat tggattttat 180
gcaatatcca gattctcaag atctcttggg aaccaaacgc cgccaaaaat cggttccaca 240
aacgaattcg ataaagcaag tgacaacaac gatttcagtg agattttttt taaaatacac 300
tactctactc caggaatgac taggacaaca tagatagata gtgaagggaa aaatagtggc 360
tgcccttgcc aacatctttt ggttatgata gcaagtgtaa taaggtgatg tagatggact 420
acatgagacg ccacgtcaga tttaaaaatg tggaacaaag agaagtggag aaaaaaattg 480
ggttgctcgc tagtagccaa ctgagagtgg gttggacacg gactccaaag actccctgtt 540
agagagagag aggggttgac caaatattaa atatacaacc ggtatcctcg aagagttatt 600
atacaaatga ttgtctatac gtgacatgac aacatcacaa accaactata gactacatat 660
tactctatct atactaaaat ataattcatt ttaacgctaa ttacatattt attaattaac 720
ttatgaatgt attttgtatg tatatctaca ttcattatct tctattcgaa tgtagataga 780
aaaagagcaa tagaactata ttttgggaca gaagaagtat taattagaga gtatttggtt 840
tctaaagact tagtccctca attttattct tattcagtcc ctaaattgac aaatacaaaa 900
actgaaatta agttttagat tttatatttg acaattttat actataataa aatagagaga 960
ttaaaaatta atacctagaa atcaaatata ctcttaaact tcacttcgtg ccagaggcta 1020
gctgcgacta gctgcgagat tggaatggat ccggtttcga ccgtacgagg aaggacgctg 1080
gcccaggcag tggggccttg tgatgggaga tgcggtgggg cccgacgggt ccggccgcgg 1140
ggcatcggct aatgggagtt cgacaacggc agcctcggaa cccatcccgg tttcgcgata 1200
ccccctcact gctccagtgc tccctcctcc cctcccctcc gatcaagtcg gggcaacgcg 1260
catcactcgc tttaaatccg cacctcccgg ccggtcccct tatcacctca ccttctcctt 1320
tgagtcctct ctctccgccg ccgcagctag ctgtgacgtt atgctctcgc cggcgccata 1380
gcgccagcgc ctaccgtcta caactatcca gccttaggct tacctatccc gtcaatcaag 1440
cctctcgtaa ggaacaagga aggtagctag ctagttctat agctgctgtc gtcgtcgtca 1500
tcggcggcgg cggcgcctgt tcttagagga taaggttgtc ctagcggaga gggagctagc 1560
caggatttcg gttgagatca agagggggag caggcggcgg cggcggcgat 1610
<210> 63
<211> 2001
<212> ДНК
<213> Zea mays
<400> 63
cccccctcta ggcgactatc aaggatccct atccaaacgg ccctaagtgc gagacgggta 60
tggactagag gtcggtgccg aggaggtagc agggaggtgc gagattctgt tacagagatc 120
gcggggtgct cgggccacac aacggcagcg cgaggcgttt ggcatggtcc gccaaactcg 180
cgaagacgac gaccgggagg cgtggggccc actgcgcagc gtgatagttt ggtcgcgcag 240
cgggtgcggt gagcggctga cgagagggtc ccgcccgcca gcgagccggg gtgtgcgatg 300
ggccagcgag cgcgagaacg tagttgggcc gcgcgaagcg aggagttggc tcgaaattgg 360
gccgaataga gtggaattgg cccatgaagc ctttttattc ttttcttttt atattttctg 420
ttttctgttt tcttttcttt ttattttttt caattcccaa tttgaacttc aaaatatgag 480
tatgaaacta gtacccaatt tgaagttcaa gtatgacttt gaatttgtac tcaaattaga 540
tttttaatca taccagtatg gttaagtttg tgtatttata aactttgttt tatattttat 600
tttatccctt tctttctttt tttcctcaaa tactcttctc attatcattt ttatttaatt 660
catattatta ttgattttaa tgcacaaaca aaaaatccaa tatgatgcaa tggtttattt 720
gtgtcttatt aaggatctac ttttttttac atgagtggtc acatgtaatg ataactagag 780
gtacacatac atatataaag gaaacaattt ctccttttat tcttccttac aaagtgggta 840
ttacaatcct ttcatttgca ctttcttcga tgcattgatt gttgattatc ccatgtttct 900
atacctctta gaggttggac attgctcctt tatataaaaa cacacctaga acgagtgacc 960
ttagagttgt tctccatctt tggatgctga ataagttgca tgttagaagc tcattagccg 1020
atgaagtgta aacatctcta gtgtgaatac tttatggtgg aaagtgtttc tgttgctttg 1080
ttgattgtca cagtttgtgt cccatgtaat tctaactcta gccatggact tttttcttcg 1140
gtctattagc ttgagtgcta tgttaggttg ctaccaagac aaaatacact cacttgtgag 1200
tgttgaagtt ggattttgtt cctttagggc tagcttgaaa cttaaatccc ctccagagtt 1260
tttggggatt gagtgaaaaa tgagctattt tcctactcaa tcttcgagaa ttatagaggg 1320
aatttaagtt tttaaactag ccattgtcta aaaaatgtca tcttcttccc cgtgtctaac 1380
tcggccatgt cgctcgtgct aggggaggtt cgactgttgt aacacccaaa atttctattt 1440
tgagaatcaa ttaaatttct ttaaaaatat ttgaattaat tcttttatgt gtattatact 1500
gctaaaaata tcttcttctt ctcggccgta caagtaggtc gctttccaat atatattctc 1560
gttttacaat attttcaacg cattttttcc ttttattaag gtccaagtaa taagtagtag 1620
taccggtggg gaaagagaaa gagagagaag cgcggccgca gcgagcagcg tcgtcagcgg 1680
ttggggcgcg gacgagagtg agaggctgac gaggtgggcc cgtgcgagcc ttgaccaatc 1740
ggagttcgac agcagcctgc ccccaaaccc acgcacgctc atcacacaga cacacacact 1800
ctctgtgtct ctcgcgtcgc gcccggccgt cgcctcccct ccctccctgc accgaccgat 1860
ccctcccctg aacccctcct cacatcctac cacctcttta aagctaccca gctacctgcc 1920
tgcctcgcct caacctcgcc ggcggccgca gccgcataga ccggaagaga aaggaagcag 1980
agatcggagg caggcgaaga t 2001
<210> 64
<211> 1589
<212> ДНК
<213> Zea mays
<400> 64
ggtttcgctc gtcccgctgt cgtgttttga ttggacgcgg gggttttgga gcggcgtgga 60
ggcagctaga ccgtcggatc atgacgggga tcgttattgc gggccagaag gatgggccta 120
gcgaggccgg cgttcgagtg atgcgctcgt cagggcgcgc ggggcaggga ttggtcgagc 180
ctggcgtggg ccggaagggt gcggttcagt ggtgagatat ggttttttcc attttgcttg 240
ttccagttcc agtccagcct tccagggtcg gtcgggcaca agggagcgag atggcaagtc 300
aaacgtcgcg tttgctgcag ggcgtctggc tgatgggtcc acacgggtgt aggaccggat 360
gtctgtgagg ctattatcaa taaaagtttt atgggagttt catgcacatt taatggtatg 420
tcacgtcagc attttggacg ttatgccata tcatttaaaa tgaatgggtt tcagagataa 480
aattagtttg atgtggatga aatcatgtca acccgttttc aaagtcttgg aaactatgtg 540
aaatgtccat tgatagtggt ttgtttaatc ttaccatatt ttactaacat ctattggtta 600
tttagttgca tcatttaatt agtatattaa tctatgaaaa tgaaagtttg cattgagaag 660
tattatttca tttttagttt cataacactt ttgatgatgt ggcattgttg gaaagagcga 720
tatgaaatcc ctattgtgaa cagcctgagt gtcctcccct gtttcttttt ccctcggaga 780
aactgtgatt gagggttttg aataacaagg aattttagcc cactcaatac cgtttaattc 840
tctttgtcca aacaaatcat tattgtagat tattcattat tattaggaaa gattcaggtt 900
accctccata cctattaggc tttatttgga tactttgtat agtgttttat atattataat 960
ttgtggcttc tgtacagtgt tatatcatca ctagatgtgt ggtttctgta ttgtcaccaa 1020
ataacatggg ggtcatgtgt ggtttttgta gaataatttt atagtacgat gttgtcatga 1080
ctctacaagg gaactttaca tgaattaaac ctgcacaaaa tttacaagct tttgagcctc 1140
tgtcatgaat gtacaatgtt atagaaatac aagaagtgta gccttgcata tttgtataaa 1200
ttgtttgggg gaaagaatct atgcttcaaa aaatgtggcc ttgtagcttg cacaaagtac 1260
atgttgtaca atgctacaga agaaacatgt cttgccgctc agccaaaagg accgaccgtg 1320
agaatcagag cactgcccct gagtctaagt aaacagaaaa agaggacaaa atgagttatt 1380
acaatacaga gaggcaaaga ttcttggaac tatagaccac aaactttagg gtcgtcaacc 1440
ccaccaccca cccgtgcccc tcgcacgcgg gcccgcctcc ttgcgcacta ccaccggacc 1500
atggtccctt ttaaatactt caccgccacc cactccccct ttttgcgatg acctcattgt 1560
catctttccg gtaaactagg cacctcttt 1589
<210> 65
<211> 21
<212> ДНК
<213> Glycine max
<400> 65
tgtaggtaac cctcatagga c 21
<210> 66
<211> 21
<212> РНК
<213> Glycine max
<400> 66
uguagguaac ccucauagga c 21
<210> 67
<211> 328
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 67
ggcagagccg tgcccgtctc atcccctgcc cgtgcaagca gctaggtagg acgatttgag 60
cgtggtgtta ggccgaaccg ctgaaggaag attgctccac tgttgactgc attgtaggta 120
accctcatag gacaaatgta ttgcttatat tcagcaatat aatgttcgtc ctatgatttt 180
tacctacaat atagtcgata gtggaagaac ggtaacatat gtggtttgca gcaggtgagc 240
aggatgggtg tggatgattg aatatctctg ttcagtgttt tcatcatctg actgaacact 300
gaatcagctt gctgacgtta gaggttag 328
<210> 68
<211> 21
<212> РНК
<213> Glycine max
<400> 68
guccuaugag gguuaccuac a 21
<210> 69
<211> 21
<212> ДНК
<213> Glycine max
<400> 69
gtcctatgag ggttacctac a 21
<210> 70
<211> 3058
<212> ДНК
<213> Solanum lycopersicum
<400> 70
aatcataaac acaaatataa gaaaaaattt tgtgatagat taataattaa cgtaaaactc 60
atcaatttac aaaaatctct tagaataatc agtgaacgat tcatataatc gaccctaact 120
gctcctaatt ggtgtgttat cattgttata agctaaaagt agttatgatg aactatacat 180
tatgtggtaa acaaattact tcaaaccata atatattgtg gggcttgatg ggattttgtc 240
aatttcatca aagaattttg ttttgggcca ctttgacatt atgcatccaa aaaggtccaa 300
tagataacta gcccacttaa taagttcatt tactcctctt gctgattttg gactaaacag 360
aagagccaga aatcacagac ttatccattt tgtggtccag actgtgtcac cacctttgag 420
aaaaggtaac aacgacgaca tattcagtga agttgcacga gtagagtttt aaaaggagag 480
cgtgtacatt gtcttacgaa aaaaatttgt gttacatagc gcgtcatttg aatgagacct 540
aatgaggtac aaattcaaaa taatcagact ctaatataga aaacatgata aatacttgat 600
ttatcccata ctatgtgata cattttaata tatagtttat tttaaaagat atgatacata 660
tatcacataa actgaaacgt cggaatgaat aaaaaatgtt gttattacta ggtttcttgt 720
gactaataat ctaaagctcc tttgaagaag taattcctag aaattaggtt tacctaccac 780
tacttttttc tttttttttg acacaagtga aggtataagt tgaaacaatg accaattact 840
catgggaagt tgtttattag cccacaggtc tcattggcca cttatatttt agcatagtta 900
cttcgagaga tcaatcaaaa aacttacaaa aatatttatt cagtagagtc gatagtaaat 960
atttatcatt caccatcgta tgatatacat ttgatatata ttttaggtgt tgattttctc 1020
atacatacaa gttgtataat ataacataca cttcagatac atatagtttg aagtcaaaat 1080
ttatatgcaa aatatgaggt atgttaacac gtgatctctc cataaagcta aataatttat 1140
gtatatattt tttaaatata catataatat tatattctaa tttgttttgc ccttttttag 1200
tggtacaatt atatttttaa aattttaaat tcgtctctag ctaacttgca catatagttt 1260
gaagtcacat acacttggta ctctcttcac ctacattcaa cttctgcttt gaaaacatac 1320
atacatagac ataatatatt cgtataattt taataaaaaa atatcgtata cacgcaaata 1380
tattatttta tttttaaaga aaatgaaaat ccaaaatatg acaatcccaa gtttgtggcc 1440
aggtgttaaa cacttgtgga ctaaacatat atatttattt tttcaattta tccatagggc 1500
acacacttag aaaaaatggg catttcccca tagttttggc ctaaagttcc taaaaaccac 1560
tggcttcttc tgcattctcc aaaactgtgg aaccaaaaga cttataagta ctgtttcttg 1620
gtttaattat ttttacgtat tttattttta aagaatataa tatttaaatt ttaatatttt 1680
attaaaatta tgtatcgtct tttaaatcat ataattatat tgaaagttga aattaaaaaa 1740
cttactaaat ataaataaaa atgcttaaat taaaacagaa ggagtaatat ctaaaatgag 1800
ttatatatat atatataaaa gctttattta atacgaatat tttattcata tagtgtgagc 1860
tcataaaatt tattcataat ttgagaatag ttaatgactt atttttcgat ataatattgt 1920
tattctcttc tcaaaagatt tactagtaat gcgaggactg ttaatgacgt attctttaag 1980
ctcgaatgat ttagatttaa cctttatata aatatttaat gacttttatg aaatatatca 2040
agatattcga aatggtaagt atcaaatata tattttgttg cataaagttt ttttctaaac 2100
taaagtgcag agaactttat acactatagg agtaatattt actacttata taagtagtac 2160
aatattgagt aatatttact gtttattaat tattatatta tattaatata ctccctatcc 2220
aagaataact cgactttacc aataaaaagt cactgtaatt tctctttgct cctgagttaa 2280
atatttttat tcggttattc tcgtagccga ttaaagttat atagatatta agaaaatata 2340
tttaggcttt ttatattata tttaaaagtt aattatgttt attttagtta tttatcaaat 2400
attatcttat accctgcgta taaactaaag taaatatcac attaaattta cgtatagtaa 2460
aagtaatgtg attattaatt atataaattt tattaaatat gtgaataatt tagctcctga 2520
tctactatca aacgaattat tatagtatta gtgacggagc catcatattt ttaagggttt 2580
attcgaacct tcttcagcga aaaattatac tatttctata tgattaaaat aactttttag 2640
atatatacaa taaatgtcaa accccattca atcattttaa gtatttattt cttcaaatta 2700
tcgaactctt ttatcgaaaa ttttgaatcg accgctatat actaatattt tatttaaaac 2760
cacagattta tcattcatga accgacaaat gtatttaaat ttactgacca tataacagaa 2820
cctgataaca cataaactac ttattattat tattattatt attgttatta taatcatagt 2880
accaaaaaaa atataaaaat aatattactc acgtactgag aattaaataa taaataaata 2940
aataaagtga taaacaaaaa caagtgactg gaacattgga aattatccaa aaccatcaaa 3000
acaaaatatc tataaataga tagaaattca ttcttatttc ttacttcact tacaaaaa 3058
<210> 71
<211> 2245
<212> ДНК
<213> Solanum lycopersicum
<400> 71
tcttgtcaat atgatctcaa ataacaaata attctatgac aatatgtatt aaccatttta 60
aaacatcgat cttatgttct ttcaattata attaatttac taaatattaa ttatatttta 120
caacatcgta taatatatat gtgatacaca tgtcaaagca cgtgcggtga agctaaatat 180
ttaaataact ttaaagtaac tttcaattaa tattagtttg aattaaaaaa aataatgaat 240
tagtcatgag atttgcgtac tcttactttt gaagagtgtg ttatcactct tataataggt 300
aaaagggaaa agggtctgat atacccctca actttgtcat ttggagctga tatacccctc 360
gttataaaag tggctcatat atgcccttac cgctatataa acggctcaca tatacccctg 420
ccgttacaaa atggctcaca tatacccttc atttaacgga agttaaaaca ttagttttaa 480
atttatattt attacttcta attttttaaa aaaaattatt taggggtata tatgattctt 540
ctatcaaagt tcaaggttta ttgtaatttt tttcatacat aaattatttt ttgacttctt 600
ttattatagt tatttgaatt tcttattctt attttgtttt ttttctttca ttccttagtt 660
taaagaataa aaaattaaac tatttttttg tgtgtattgt aatttaattt cgtattcgaa 720
gaaaaaattt ggtcatctat aataagtttt acaagaatat tagtgaaaca taaataaatt 780
tgattatcaa aataataatt ataaattaat cattgaaaca aaaaaagtca aaaaaatatg 840
tttgacgagg attaaattac tcatatggga ttatattttt tagaaaaatt attatttttc 900
atttccgtta gaggaaaatg gtatatgtga gtcatttgtt tacaagtagg ggtatatatg 960
agtcactttc ataacaaggg gtatatcagc tctaaatgac aaagttgagg ggtatatcag 1020
acccttttcc ctatgtaaaa tctaaaatta agtttgaact cacataaaat tatataggcc 1080
gtaacctact taacccattg tcatcactaa ttatatagag atcttgattt gatatattaa 1140
aagtaaatgc atcacatatt ttttttaaaa attatttatt tgtaaaaata aggtcgacaa 1200
atactgtgaa atcaatgtga aaaaggtttt gatcgttgag tgtatcttta actatggtga 1260
tgcacaacgt aacgaaatca ttttcattac caatattatg aatttttaca ttatatataa 1320
aataagatat ataactaata tccatatatt atattacata tataaattaa aaatatataa 1380
cgaacaaaaa tactacaaaa ttaatggaat acactctatg aatccagcat acacaaatag 1440
agcctctacg taagccagtt gttatctaat ctgtttagtc actatgacat cagataagat 1500
atctgtttag ggtacccgtt tacacatcag cttttaaggt ttcctactta ccaaacactt 1560
ctccttcacc aaattgtttc tccaatctca ttcaaacaaa cacacaacta ggtggttcga 1620
acaaactcaa taattttttt ttaaaaaaaa tttatattta tactaaaaat taaataaata 1680
tacatgtaca tttgtttctt aactcataac aaaattaatt aacgactcag tgggatcgtg 1740
aaaatgtttt ttacggctaa agttatgaat ttaaaccata gtatccacaa aaagttaagt 1800
ttccattttt tttcccaaag aaaatttaaa ataacaaact cttaatttca aaatatggtg 1860
cacaaaatat aaggggaaag ggttaaattg agataatccg gtgtcatttt aaagcgaaca 1920
aaattgattt tttctaaaac taaaaatcaa gaaacaaaat agaaacatat caaataagac 1980
aacaaaagtg tgtaacgtga caatgtgata taatacgaaa taccctagga ataattgaac 2040
acataaaatt cactataaaa ggacaatgtc ataattaatt tttgtaaata aaatattcac 2100
cactttacat gatacgtaat tggtatttgg tacaaaattt gagtaatagt aagataaatg 2160
tagtagtagt gtggtactta ctatggttat gtctatatat acatattgca tatgtatata 2220
taaaaagatt gaaacaaaga aaaaa 2245
<210> 72
<211> 2234
<212> ДНК
<213> Solanum lycopersicum
<400> 72
tatgatcttt ttcaatgaag tgattcagtt caatggaact caaattttat atgtggtagg 60
aattttatat caagtcacta atttattttg ataaccatcg agttagtagt taaaattatg 120
atattgatat gttttaagat agaattgaat acataaaagg tagatctggt acataaacta 180
ttgtgcttat gtagaatttg gggaagaaac gtcaaggaat ataatgtaaa gtatagtaga 240
caatttattt tatcgtatac atattaataa ttattttcac gattcgaata tatataaccg 300
atagatcaca caataataaa tattagtgtt gctcatcgaa aactccgatg cactaatgtt 360
tgccactaat tcttaagata gataacaaac acatctaaac attattaatt aagtgtatat 420
atacaacata ttttaaactt attctataac tggatttcaa tttaaaaaaa ataatgatgt 480
gtcatgtccc aaagttagtt gcactctaaa aaaagttaaa aggtttttaa ccaaaaataa 540
cttcttgact ataacaaatt agagttggaa ttaataatca aaacatataa aaattgatat 600
ttttaaacaa gttttacacc ataatgtagc aatccatcct gttagtgata ttgtctgctt 660
taaatctagg aatgtacgtc tttaaaatgc gtcattagtg ggtaagacat gcttacttaa 720
aacacgtcat taatgaataa gatttgttta cttatatact caacatctct catatatttt 780
actgatgtga aattagttat cttaaaccgg aatgtcagta cacttcattt gtatcttttt 840
ttatatgagc cattatcatt tacatgtaaa agtgcacctt aaagctggtt aagcttataa 900
actataaatt gttcattttt tctcgtttaa taatcaatat ctacttaaca aggcctgttt 960
aatagatgat aatagtttaa gtagaaaaat gaaattgtaa cttttttacg acttttaaca 1020
tttcaactat cagttagtaa tatgctcatc cattacatat tttaaagaga acaaagaacc 1080
attaaaaggt taaaaactta ttataaagtt aaatattttt tcagtatata tgaaaggacc 1140
ttacaagtta caactaaatc ttttgaaaga aaagtatcgg tcactactaa gttttccaag 1200
aaaaacaaca acaaaggaac aatctttttc taccacaagg ggatgtgact attgatagaa 1260
tccattcatt ttaatgggag ggcaattttt ttttaagcgg attcaaaata taaaaaagta 1320
aatatacgga caaaaaaaaa taagaaaatt tatcaacgta tacataagaa aagttgcata 1380
cttccaaata gacatgatac ataaacatga tctttaactt gacgtcagtt ggcaactata 1440
tgtgcacaag taggcactta aacttgtata agattgaaca attgacacat tcatcctaca 1500
ggcaccctac atgaaaattt tgtgtcctgc gtggcgtcct acgtgtatca tgtcatgcat 1560
gacatgtgtg gctacttgtt caattttata caagagtaag tgcctacttg tgcgcatcca 1620
aagttgaggg tcatagttac cgactgacgt caagttaaga gtcatgttta tgtattatgc 1680
cctccaggta acatagattt gaagaagcat ggaatgcatg tagatcttac ttctcgtgaa 1740
aatggttttc aaatacgaat agattagtct cggctcaagt aaaacatttt aaaagtaagt 1800
acttaagaca aaataataca ataataaaaa agttatgata atattaaata ataaaaacta 1860
tagcaaaata taatatatta tcgaagcaaa cataaatgtc taattcaagc ctcgataaat 1920
gaaaaaaata atctaatttg aacaccgcaa ctttctttta aatgggccct ccacgacact 1980
tcatgatata tagtaaaaca aaaaagtctt tattctcttt tcttcttgac tagggaacca 2040
ttagatttta aagacattaa atctattacc cttaccctaa gaataagaag atgtaaagta 2100
gaagagaaaa caaccaaaac catatatata catatatata attacattat attgtcttat 2160
aacatatagt cttttaagga aaaacaaatt tagaaaaaaa taatattatt ttacattttt 2220
tttcttcata caat 2234
<210> 73
<211> 1302
<212> ДНК
<213> Arabidopsis thaliana
<400> 73
actatatacc ctccaattat tgtgtaccaa agaccctcat aggatttatt caaatattgc 60
aaaattgaaa gaaaaaatgt taattaccct atccatgctt agatattttc aaacctaaaa 120
atttggtgca tttttgtgtt tatacataat tagtaaagga gagaaattag agttccactc 180
tcaccaacac tttattctag ctagtggttt aatttttcaa tttcagtcca tatttagttt 240
agagaaaaat gtgattctgc caagaaagtt tgatgctttt ttacttagtt catcgaatta 300
tagagattaa taattgaaaa tcctacaaaa aaccctaaca tttaaaacca tttttattta 360
atacgttgag agagacagag atattaaaat cgtatgattc gtaagagtgt gatgttgaaa 420
atgagagatt aataatggaa ggtggagatg gcgcgtgtgc gatgagtgat tgcaacccta 480
aacagaaaat agtagggcaa tgaatgagtt tggacacgtg tcgacatctc gatggtaggg 540
tctgataaat ccacctgatt tttttatata aaaaattttg attttataaa tttttctttt 600
ttacttataa aatcgagttc agggaatcat gtgacctaac cttaactagg tgaagcctcg 660
tacgattttc ccaacttacg gaactaccct tgtgattggt taaaaatgta aagtaaaaca 720
ctactcgttt gtgatgtttt catgatatct aaaactctta ctgctagttt tgataaatct 780
tactgctaga tttgcttttc cttttccaat ctatagtact gctaagatta tttttgttag 840
tgaaattaac agaaatgtct tttgtattag tctactttat aaaccaccat tttgatgtgg 900
ccaaaaaaaa aaccatgttg ataaattcag tttggtaaga gagtctgatg agacacaaaa 960
aaaattatgg gaaagaaaga aaacataaat ggataaaata aacagagatt tgaatataag 1020
atatagttta ttttggttat cttagggttc gtccgatgtt agagatcatg tctgaccgaa 1080
agtcttagtg ctttttggtt gcagacgtaa ttgctttatt ctgaccggta agtaggtgat 1140
ggacacaaag gtatgattca attagaaaaa ctaaacatag cattattatt ctgtttggtt 1200
atatttaaac ccattagctt cttttctctt ttgatttgca cattgaatcg cttattaatc 1260
tcacttggtc atggtctcat agaagcattt taagcaaatt tg 1302
<210> 74
<211> 2001
<212> ДНК
<213> Arabidopsis thaliana
<400> 74
aataaaaaac tactagatta cagctcttga ttggttgata acttgatatc atatatcgtg 60
tttgtagttg aagatgtaaa gatttatcat cttgtatttg aattttgcac aatatataat 120
gtgatgattc tatgtttgtt tgtaaactta tgtgcaaatg ggcgataact aaacgttcgt 180
aaaatagtta catgtactaa ttaatcgaag cacataaata ttatatatat atatatgtat 240
atatatgaaa cgattcattg attttaagta tttaatttat tttttaagat tttagttgtc 300
ttaacctcgt acgaagaaga aggatatata ctatttaact cgtggagatg atgaggttcg 360
gatatttttc cttaagacca caagacactg acacgccgac tgatcgataa aaaaagttaa 420
ggcctacaat acaaaagagt agcagattcc cttacacgtg tttcatttat gatctgttaa 480
ttaactccat tgagcttcaa tatctcatta gccgaaaatt aacttgacgt tttccattga 540
actgtcgaaa aaatttgtag aaaaagtgaa atgtccccta tttaacttcc aagtttaaaa 600
cctaaaatta attagttacc gttttgatga ataacgttga aagaatcgtc aacatatcaa 660
atgatgcaga tacaacaagg gacaaaaaca tcaaaaaatt gattaaaaat aatcattcag 720
atattagcaa ttaaactgta agtaaatgat tgcatatata tatatgaatg aatacatata 780
tatgtatcaa actgtaagta aataatacat acatatatat atatatatat aggaaaatat 840
ctcatttttc aatcattttc agaggtaaac atttttaaag acaattttac ctaacccaac 900
atcttactat atttaaccag ctctgcgaga gcttcaaaac aatgatgaat tttctgcccc 960
ttttcattga ccaaataaaa gttcacaaat ttgtaaaacc aatcagcatt aatttcgcac 1020
gtagtttact tcgtccgatt ttagatcaag tagacatttt aaccaaacat attgaatcac 1080
ggttcaatca agatacatgg ttgcgagtat aatatatcaa tccttcaccg cattagaaaa 1140
ccaaattttc tatttaattt agcgtgttct tttaatgaac gcagcgtcag cgacaacaaa 1200
gaagaaaaac agatctgcgg cgagaaaaaa tacattgatt agagaagaac tgccgcaaaa 1260
gatgtacgat gatgaagatt gacgtgacgc tgcttaattt cagcgattca tttgatgcaa 1320
ttgcaattca tcggctatca tcggcgactc atccgaaatt gttattttca agctttaatg 1380
tcgttttact tacctactac ttctcatgac acgtcgtttc agtccgctat tgccgctggc 1440
gcagcatcaa ataaaagaac acgctaggat agcttgaaaa gggtacaata actagttata 1500
gaagaacatg agccataaca tttggaaaca aaatgagtta gtttgaattt gaaacatcgc 1560
gctctatgta aaaaaagcaa aaaagaaaag aaaagagtcc taataattaa aaagagaaaa 1620
taaaaggaat tttcaatggt ccgactgtta caagtagatt tccattttta ggaatctagc 1680
tataacgatg aagacagagt tatcattttg ttccatcaaa tatatgacga tatttatatt 1740
taatttcttc aacaacaaat atctcatttg ttggtgccac tttcacatac ttaggacgac 1800
taataattaa ttaaaaagga tttatgtaat aacgcaccat attaacctgt aacaagaaga 1860
attgaaagta atacaagttt atatatatag caacacattt atcgtgtacg atactttatt 1920
ccttttatct attcttgaaa aaaagttacc aattcttgag aagaagaaga aatcagaatc 1980
aagagaagga gagagaaaga t 2001
<210> 75
<211> 1597
<212> ДНК
<213> Arabidopsis thaliana
<400> 75
tacaatatct ctctctctac ttctttactc tttctctctc ttccatcttt tacacagaaa 60
gtaaaaaaca ttctcacacc ttctctccca agtgcgtgcc acgcagacac cattatttgc 120
catgagtagt tagttgctag ttgctactaa ttaagaaaaa tgaattaagt ttttaaaaca 180
aacgttgtct agttatataa tccatgtcca tatacatcta gatatatgac ttagatacca 240
atgtttcgac tcttttaggt ctacacgtac gttgcccaaa cttcatattt gagacatctt 300
tatttatttg tcaacagaaa tattgaaaca tgcatggatc ttgatattct aaaggtgcct 360
gaattaaaat agaacgataa cgttttaaaa cctaattccc aatttgtagt ttatatattt 420
cttgtttgat ccatattatt acaagcctat atatagtgta tataaaactc aattaagctt 480
caaaaagtca gaaaactcat caatagctca agttccacta attaatgccc gaatttaaag 540
ttcatctcta tagtttaaaa tttgttcgta gctagatttt gcatcttgga gtggttagtt 600
atgtttatta gacacttgga atgcttttga atgtacaatg tccggaaaaa aaaactaata 660
ctgaaaaggg gatttgtcca agtggtggta gataggagga ggcgcgtgag attggggaaa 720
cattggtttc ttctgcaatg aatgaaacga aagcagctat catcattttc tttttcttac 780
ttcacaagcc gcagaaaagc ctctcctacc ttaaaatgga catgtacgtg tcgcttttct 840
attgcttcct atctattcga caacattgaa gttttgttct attactttcg tattcaattt 900
ttaatttttg tttgagaata ccaattttgt tttggatcta aactcgttct aatgtaaaaa 960
ataataatca gccgcagtat atcaatatgt tacattgtat ctggacgtgg gatatctgac 1020
catgtctcca tgaatccatg atgattgaca gatttatagg gataagtatc ctggtttagg 1080
taatccataa gtatttatga atattatgaa aataaatttt gatcagaaag attaattagt 1140
taagactatg atgtagggta ttttaaaata ttgctaaaaa ttttgcgcgc tttcagtatg 1200
tatatttatt ttactagttt tcggttgata tatgatttct tgaagtaatt aaggttatta 1260
gctaaatgga agagaacgtg aggaatataa cacatatgtg atcacatacg aatatatgta 1320
ggtttaactt aattggttcg ttgattattc tttataaaag tgaaagtaga tttaaatttg 1380
ttttccaatc ttctatgttt ggccattgtt tgcaagagtt ttgggaatta aagtcttttt 1440
aggtgagacc aagaagggta aaatatgagt ttttgggtct agaatttata agttaaatag 1500
tttattctca tttctaatta ttgttgacca aaaaaaaaaa aaactgtttg gttttgaggt 1560
ttaattactt attgtatatg tacactctca atcataa 1597
<210> 76
<211> 1552
<212> ДНК
<213> Arabidopsis thaliana
<400> 76
tttactttca ttcccacgct ctctttaagc acgtgtgata cagtcaccaa ataattggct 60
cttgtgatac aattaccaat taaacttgta tatatatgtt tatatgttat ttaaaggata 120
aatttttatt tcgtattact tactttagag ttttcattat agggttatta tttaatttga 180
acatctatgt gtttctcctc aggtagaatt catgtttgtg tatatatggg tgtctactat 240
ttatggaata tttatacaaa acatctaaac atatcattgc ttgaaaattc tatgtttata 300
tcataatagc aaattgttta tgtttagtta tatataacac aacaatagta ctctaagaaa 360
aacagcatca tgcacgtttg atggttgact agtaactaga cacacgaggc acaaaggtta 420
tcagttgatt aacatgtgta tgtatatacg gtctttcact tatcacatta caaacttgaa 480
agtaaaattt gtttagcgat attaagaaag tttatatata gagacctcgt actagctgga 540
aatgtatatc taaaatgaaa gtacactccc tcttacatac agtttaatat attttcaaca 600
taaaacatat gtacatagta ctagcttatt ttttaaccaa aacttttggg tttgatagtt 660
taacaactcg gtcaagaatc tcatattttc ttacttcaaa taattgccaa tatattctag 720
ttctttttgt ttttaaatta tacctggtaa ttttctaacg agagtctcat aattgcaagt 780
tgtagtagtc ttgcagctgg atatgaagcg cgtgaattaa aactaaataa tacttacaat 840
aaatgaaagc aacgtatcat atcattttct agttgttttc agaagccgca gaaaagcatc 900
ttctacctta aaatgggttt ccatgtgtcg atgccttatt ggatcatact ttcttacttt 960
ttaattcagt ttaaaataaa ttgaaaaatg agataaacat ttaagtggtt caattatcat 1020
aaaaaacact aaaactgata aaatagccac ataatatagg tcatatcaaa taaatgagaa 1080
ataatatttg tatgcctaaa tcaagttatc catgtttgaa ggtgtttgca gtgaggtata 1140
tatgtttttg tctaataaag attacagtta tgattatgta acataaatta gataatattt 1200
acagctcgcg atacactaca attgaaacgt ggttaattag tgaaactgaa atttgaagaa 1260
gaggatgaaa tatgaatgat attcgttaaa atgatctctt agattgtata gtcattgtcc 1320
cccattgcca aaagatcaac cacttacata aagtaaaacg catctttagt taaaagctaa 1380
ccaaaagagt ggaacatatt tatttttgga ttgcatttgc gaatttcatc aatatatggt 1440
tttgttcaat tgggaaattt aaataactcc actaaaatgt acaaagtaat tttttttcga 1500
caaagaatct atgaagctaa aaaatctacc cataagtcac ttttagcaga aa 1552
<210> 77
<211> 2001
<212> ДНК
<213> Arabidopsis thaliana
<400> 77
catcaatcta tatgttgcat gttgtaaggt cacaacttgg aaccataaaa gaatggtgga 60
ggatagcaag tgcgtagaag ataaggatca ttttacatga taatctggat aagacatgcg 120
catatacatc aagtttccat caacaagatt tatagtaccc aaaagaaaga aagaaaaaaa 180
ctaatattcc atcgatctat agaagttgaa caaaataact aaggtaccaa gtgaaatatg 240
agtcagcaag caaagttaaa aaaaaagttg tgtgagacat atcacatgag taaattaaca 300
acaaccatca tcatcatgat gtagatagta taagatgcca tgagaagaag tgaggaaaaa 360
caaattaacc tgacaagaag catcctaaaa aattaacctg tcaaacaatt accaaccttt 420
aaagtgaaaa aaaaagttga aaacactaag gctttgagag cttaaatgtt cataaacaat 480
tttccttttt cttgccaaga tcaatctgca atttttgtgt caagcatgta cgagttattg 540
ttataaataa atctagagtc gttatgtgag ttctactgta ttttatgaaa atcgattaac 600
tagtaaaata catcagtctt cttaagaaga gaacctaaac acgaaaccct ctaataaatg 660
ctagattgca tattcttaca catctatatt agtgtcaaaa acatgattgg actgatttta 720
tagtattgaa caagaacgtg actaaatttt cagaaattgg aaagaaaaca aaaacatgat 780
atatttcaat atctaaattt caccatatat atataaaaag acatagtgca tgtgagacgt 840
aaaaaccttt gtaaataaat tttctcttta aatagtaaat agtaccatat cagattaacc 900
atttcagagt gacataattt gtttgtaacc gtatagatcc gttttatgca ttaaaacgat 960
cgtgaagtag ctgtcatacg aaagaacttg tcggcaagag aagcaaagca taagcagaaa 1020
aaaacatatc ttttagaagc ctatcatttt cttactttta ttcacaaaca cacacaatat 1080
acattataag tgttatctac ataatctaaa cgtgtcaata cctgaaaaaa caacaaaact 1140
ttatttgcac ttctttcatt tcatgaacaa tacataacca gatattagat aggacttgga 1200
cttgtgaata tgctctattt aaggcatctt tataggttat atttagaatc tttttcttat 1260
ttcttttttg agcatattat taaactatgg actagatctg atgaaagaaa gcaatctatt 1320
tatatattat ggtgtaaata ttatctttaa aaaatccaat ggaggagagt gaaagagaaa 1380
agttgaagca ttttgtttgg actatagaga gagagaaaaa aagatcttaa ctctccttag 1440
aaaagtacta ggaatcaatt tttattttct gcaaaaacaa aagtgtaaaa gaaaattaat 1500
aataatatat attccctgat gaagtaagac taaaataatg taactacaca aaaatacttt 1560
ttagaattta taatatttta tattaatttt taaaaaagga aagttgataa gattggatat 1620
aagtttggaa gcatttattt ggccaagaat ggcttagcat ctctgcaaaa ccaacacaaa 1680
gctatattct cttaaaaatc agttcaacaa aagaagaacc tgaacacagt tggcccacca 1740
ccaccactac cacaatctcc tcctccacca ccaccaccta gtcaccggaa accaattcat 1800
gccctagatt aagaaccaga atccttttga gacaagatct atatatacac tctacacatt 1860
tacttataca ctttatctag atatagatgt gtgtgtgtat aaaggttctt tttcattact 1920
tgttggttta gtgataaaaa ggaggagagt tttcagttgg gttttggttt cttggtgaga 1980
gaagagagaa aaagagagga t 2001
<210> 78
<211> 1558
<212> ДНК
<213> Glycine max
<400> 78
acacgtaaag tggacctaag gatatactta taataaattt ttataattta tatttttttc 60
catcacatca ctacttatat ctattttttt tctttttatt ctaatctttc tcgtaattaa 120
aatgtaaaat ttaatgtatg agtaacattg tatattaaat tttaaaagta aattaaaatt 180
atttttatca gcaaaataaa ttttattaaa cttgggtaaa ggggtgccac aacttatgcc 240
catagtatca tgtcattacc ttcagtccta gtaccagatt ttcatatatt ctctaaacat 300
attttcattg tggattcaat catggatcaa ccgttagttg atgttttcgt acttttcgtg 360
ggagacattc ttcgtatcat aaaacaattt cctttattat cttcttaaac tctgttcttt 420
ttttttaaaa aaaaaaatct gttaaataac tatttttagg agatgaatag taattgaatt 480
acatataatt ataagaaaat gattttacaa ataattacct tgagaacaat gattaagaaa 540
tcgataaata aaaaattagg taagatgcag tagaaacatt aattaaatgt caatatatat 600
atatactaat ttcttaacaa ttgatcaatc tcaataatac tgtcaaatgt gcatatcaat 660
tggcattaga tggttttagt ttagatagtg atattgagtt ttttttttta tgcaagtgat 720
attgagtctg tacatatggc ctctaaaaat aacactcaat gattaacaaa attgtatttt 780
actggtgaaa tggaagtatt attattaaat ataatttcag ggtattaaat taagaaaatt 840
gttgaattaa gtgactccgt tttatgtcat aaagcactaa taatacatac attaattttt 900
aatgaataaa ttttacgtct ctagtttaat attaattatg tactaatagt gttaggattg 960
ctatcaagga gagtctaaat atatcattta aggaaataaa agtacaaagt ttttctggta 1020
aaagatagca tttattatgt caaaaattaa tgaaactcgt ctaattaatg cataatttgt 1080
taagtgattt aaaatcttta atatggtgta tttaatattt attaactact atccttaatt 1140
agcaggacac tacttaacaa gaccgtaata gttcaaaatt acgtcataga aagtttaaag 1200
aataatggga gaaatcataa attatgttag gattgatgaa aatatgattg attagaacga 1260
agcgaaataa aatttcaagt taatcatcat ttggattttt ttaaaatgca atagaatgat 1320
aaataatgaa atgaatttca tctcatttca tccaacccta ctcataaaat tatagtatat 1380
attacttttt acttgtattc aatcgcaatt ctattctttt taaattaaaa actcagacat 1440
aattatcatt tctacgttgc attttttaca aacacgtcta cctacttaat tactcttgca 1500
gctagcttgt tacttttaac ttataagagt atcaacggaa catgattgct taaatgga 1558
<210> 79
<211> 1545
<212> ДНК
<213> Glycine max
<400> 79
acacgtaaag tggacctaat tttaattaag actaaggata tacttataat aattttttta 60
taatttatat ttgttttcta tcacatcact ggctttatct atttattttt cttttttatt 120
ctcatcttta tctaaattaa aatgtaaaat tttatgtatg agtaccatta tcaaattttg 180
aaagcaaact aaaattattt ttttatcggc aaaataaaat tattttttta tcggcaaaat 240
aaaatttatt aaacttgggt ataggggtat cgcaacctat acacatagta taatgtcagt 300
gccttcagtc ctactaccaa attttattct attctataaa catattttca ttgtcgattc 360
aatctcttta attttatcaa attttcaatt gagttttatc ttcctctcat ccacattttt 420
ttgctggggt taaagagact aaattaatgt tattaatttg aagtataaaa attaactaat 480
tcgttaaatt aattcataag aggaaagtgg gattgcattg gagggtagca agaaagccat 540
tgaaagaaaa cgcagcagcg atcatttgta taaagtataa actacttcct acgtactata 600
tgtatgaagt gccattctaa catttttttt tcttctaaat tttatattgt gttatagtat 660
gaaaataaaa attactcact agatttggcc tagtgatggg atttgaatag tttgtacaag 720
atgaaggttt aaactttgtt gttgacatta tacatagaaa aatacaagaa aaaaattatt 780
atcatcttaa actctgttct ttaaaaaaaa aacagtagtg ttaaataact gtttttaaga 840
gatgaatagt aattacaaat aattataaga aaattatttt actaatcatt actttgagaa 900
caatgattaa gaaatcaata aataaaaaat ataaagaaat aactatttaa cttgcgtttc 960
aatttttttt aagattacaa tattatagtc cgtgaataca cattttcctt ttgtgaataa 1020
aggaagtaaa cattggtagg gaaccaagaa gtctaaagca gtttgcttgt ttgccttaaa 1080
tttttcttta gctcgaaggc atgtgaaatg aatatttcat tgtgagtaat tatgagattt 1140
tcttccaatt aaggcaccaa agatgtaaaa aaatgaaata gtttattttt gtttaatcag 1200
tattagagtt gcttttaatt tgatttttcc tgactgaatg ctaacaactt ttgctaataa 1260
tagttttcat atgaattggc gttgaaagtt aaatcttcag atttaattca cgcattatta 1320
ttattattat tataagaatt ggattagata aaagaatggt taaatttatt attattttgt 1380
taggcttata cctttacata taatattatt attaatttgc agtaggaaac aatattctat 1440
aataagaatg attattaaaa tatgaaataa gaacttttca aaatctgaaa ttatgcagcc 1500
acgctgggcg agtagtatct cgctgagcaa gcagtgcgca ttaca 1545
<210> 80
<211> 2001
<212> ДНК
<213> Glycine max
<400> 80
ttaaatttaa attgacgtgc tgaactgaca tttcgatttc aaattgacca caagaaaaag 60
agaacgcgta aacattattc atttatttta tttgttcttt atttatttct tctaaagtac 120
ttagactaac taataacgag ttaaatattc ctaaaaaaaa ctaacgagtt aaatagctat 180
atggttgaag tgatgttaag attttagttg tgggatgatt tgttcttgaa taaaaaatac 240
ttaatgttca ttaagtatct tccataaaaa tatctttttc tcctcttgat ttagttattt 300
attaatatta ttgtgtaagt gtttataagt ttgtgattta tcgtaacttt agaatgaatc 360
aaagttctat gatcctaaaa atgtttacac ctagacctag ttgttaaaaa ataaactttc 420
attaagattc cttgtttact tttaaaaatc gacttttaaa ttttttacac atatttttat 480
gtcatttatt ttaatatcat gtaatacaca ttattaatcc caaattatac tctgtaatta 540
attgtaaaaa atatacaata ttatacatct acaattttgt tcgtagggta ttatatgttt 600
atttataaga atttaagttt tatataatat aaaaatgaca aaattacatt ttttttgtct 660
cccagcttat ttccattttt tctaattttt gtctctcggt aatttaattc agtcctctta 720
ttttataaaa tcctataatg ttagttccca agccacaata cgttgatcgt tcatgtgtca 780
tatctttatt ggatgatgac cgacacatat tatgttttta ttggtcaata aaaataacaa 840
tgtatttcat cttttatgca gttgacattc aatcacaaca taacatatga cagaatcatc 900
atctaataag aatgtgacat ctaacagtca acatcatttg ttaacggtca atatctaaat 960
gtgacattag aagactaata ttgcacgatt ttacaagata ggaggattaa attcgtgaat 1020
taaattaatg ggggaccaaa tttataattt tccctataaa aatatttata atatcaatca 1080
atttttaaaa aatgtttcaa atatatctcc taaattactt attattataa aaattaaaat 1140
tctcaccata taataatcta taactacatg agaatataaa attttatatt aaatccaaaa 1200
atatcggaaa gaataggggt agttgggtaa atgcatcatg taacatacga gctacctacg 1260
actatgaggg ttcacctcgt ttaaggttag ttcctgaatc cgaaacagtg agctgaaaat 1320
caagcccgct ccccacttca cctttcgaca cgtggcactg ttgtgacata ttctctccaa 1380
tcatcgttag tcatcaggga ccctatttag ggcttctccc atttttcttg gaaatttcca 1440
ttaccaaccc ctccctcctc aatctcctta tgttccttaa tttggtcctt ctttctccac 1500
cgtctgattc ttcctacttt tcaatcaacc gcgttcccac cacagtagta tccacattac 1560
cctgaatttt aatttgagca gtgtttactt ggcccggtaa tcaaagcaca ggacacaggt 1620
gatttatgaa gcaaattaag ctaagagaaa aagacagcta gagagagaga aagagatatt 1680
tgattttgga gttagcatcc attaccattc ccatttgacc tgataaggat gcttttaatt 1740
tgctgggatt cttaataaca aggtagaata caattaataa tactcgtaca tacctcttag 1800
tatcacactt tagactttac accatataaa atacatacat gttacagtat atgttatata 1860
caaggcctac atatatatta tagagattat atatatatat atatatatat atatattcta 1920
aattttgtga gtggatatta ttactttgag cgtgagaagg ggaagagtag agagagagag 1980
agagagatgg gaaggggaag a 2001
<210> 81
<211> 2001
<212> ДНК
<213> Glycine max
<400> 81
gagataaatg tggttttgta cctagtcaac ttccgcgtat gatatgagac acgattacat 60
taagcgtgac atgtacgtat tggaaatgta tgtgtccaag aaaataagga aatataacct 120
caaaaatttg taagagaatg gatttcccat atttgttcaa aagctaagct tacagctttg 180
ccgtgctatt ctgctattgc acagctatgt atatctatat ccaaatgcga tatatagcaa 240
aatgaaataa aatttagcaa gattaactta agtataataa catgtttttt tacttttata 300
taattagaaa ttattttgta cattgattaa taattactta taagtacaga taaaatatac 360
aaaaatatag atttgaaaag tattttaagt aagtactagt ttatttaata aaaatatgtg 420
agaagatcca taattacatg agaagagtat ttttcactct caagaaaatg aagagacgga 480
cttattaaat agataaataa tttttaatat atctatgttg aatgaacgaa tttagaaaca 540
cttcttgaat ttattttttt ttaaaaaaga tgcgaatttt ccaaattatt tttccctatt 600
agaagctatt ttctaaacaa tcttttttac aaacaatttt ttctaataat ctcttgtagt 660
taagaaaata gttccacatc ctagcgtagg gaaaaggtag ctaagtaggt aggtgctaga 720
aattgtaacc ttcaagatca catcttattt ttcattgtac tgatgagtga tgacaacgtg 780
agtttcaatt ccaaagataa caactaatat tagggatgtt gacaattata tataaatata 840
tatagattca attcatatct acgaaaatta cttatgatat atagcaaggt aattattatt 900
attaataata tcaagagtat gaagccggat aaatatgctt tttttaaaac cggaggatac 960
tatagtaacc ttcatatata gatctacccc attgccaccc taattaataa tgtgctggaa 1020
aatatcttac tagtcacttt caaatttcaa ccaaaaatgt aaatatacat tatttctcct 1080
attgattgtt ttcacatcaa gtactaccag ctttccattt aattaccact tactggcaat 1140
gaaaaaaatc tcatctgtta cttttccaat aattctgcta ttttaacaag tgaagaacaa 1200
tgcttcaagg tgtggcttca ctaatgaagt tatttatact atagtgaata taagccagtg 1260
ataaagtgac acgtgtggaa tccattttaa ggtatgtgac gacgttatga tactcttgct 1320
gtgcctctct gtagacagta gaaaatgaca cagattttca ctgcaaacag aaaattatag 1380
gtaacggaga gataggttga aaaaacaagg tcacaagaat aaaaaagttt aacgtaggaa 1440
aaataatatc atttttgtaa gtaatagtat ctatctatat gacagctgtc actacgcgcc 1500
agttttctcc cactggagca acgagtgttg agtgtctcac acgcgcctat gttgcgtgtg 1560
ggggaggtga ttgtcttcca aaaatacgtt aacatggaaa atcatgggaa agagaaagtt 1620
acatgaaact agaaagaact ccaaccctaa gctgcactcc atttttttct ggtggagatg 1680
gaaaatcctg aggataaaaa ggaaacttag aaaagagagt acatatacaa tacaagacaa 1740
cttcacacac acaacacttt cctctctctc tctctctctc tctagggttc cgagtttgaa 1800
gttgaaagtg ttgaactatc tctagctagc ttttcacaaa tttggttgca cttgcaactg 1860
aggcaggaaa gaggggcacg agaggaggaa gaggaaagag aagaaaaacc aagaaaagtg 1920
gagaaaggga taggtgttgt acagaaatag aaattaaaat tgagtgaaaa ttaaagagaa 1980
gaaggagtga tagggagata t 2001
<210> 82
<211> 1643
<212> ДНК
<213> Glycine max
<400> 82
taaaaatata tataacatgg ttttaaataa taaaacatta aaataaaata ataacgtatc 60
aaataaaatc ataaaaatat actaataaat aagtcaactt aatattattt attatatatt 120
taaatatata tatatatata tatatatata tatatatata atttttttat ttaaaataaa 180
aataaaaccg taaacaattt aaattaaaaa aacacaggtt aacaaaacaa aaacaagttt 240
tccaaatgaa aaaaagcaaa aaaatatttt acgactttaa agtcataaaa taaatttttt 300
ttttaatgaa atcgtaaata attttataac tttgatttaa agtaaaaaaa aattacgact 360
ttaaaatctt aaaaaaaata aaatttaaac tgaagttgta aataatttta cgacttcaat 420
taaaaaaaaa taaaaagtca tatcagatgt tacgactttt gagttagaag tcataacatc 480
tgttataact tatcccattt tggataattt ttcaaaatat acaccttatt ggaaaattgg 540
gtaaaatttt acccctaatt gataaaaaag tcaacgatat aatttcccat ttagattcca 600
accattaaca gatttttaat tgatgaatag tataaatttt tatagttgct ccttataaat 660
taataacttg aaaaaataat gatatttaat ggaatctgat taaaattttg aaaaacaaaa 720
tataagaact ctgtcaacag cttttaaatt agagatttat cttaaaactc aataaaatta 780
taatatatgg atcgatctaa attagtaaat tctgaatagt actaatgtaa ccttaatact 840
attattatcc atgcctatct gaaagactaa attcccgttt tgcatgctag aaaatgaaag 900
ccagtgataa agtgacacgt gggggtccag tttaaggtat ctgacgacgt tcttgcagtg 960
ctctactaac gtgaacacag tggaaaaaaa tgacagaatt ttcttaatat catccacagt 1020
taaagacagc tgtctccacg cgcccgtgta ttagaggcgt cccacaagcc aataggttat 1080
aatgagcgtg tttcatacgc gctataagtg agaacgggaa aatatttttt gccaaaaata 1140
ccttaaccca gtaaagcatg ataaaaagaa acttgtatga aacaggaaac tcggaccaac 1200
cctagcaaga tgcactccat ttaatggtgg agattggaac aaagagaaaa atagaaaaag 1260
aaaaaaagtg aacatctgag gataaaaaag ccaagtttga tagacacaac tgtgttgttg 1320
ttgttgttga tgatgtttgc tttgttctct ttctctctcc tcaaattttt tcctctctct 1380
ctagggttcc aagagtgtct tgaactactc cagaaccctc tcttgttttt cacaaatttg 1440
ggtttagtag agtactgacc cagaaaagaa ggttcaacag gtacctaaga gaggggatag 1500
aaagaaaaaa atagaaactg tacgtataaa agaagaaaga aacaaagata taaggaaaaa 1560
gggaaaatat tttgaataag gaagatataa ggcaatatat aaaaatatta gtatttgata 1620
ataattaggt gtagaaatat tat 1643
<210> 83
<211> 2001
<212> ДНК
<213> Glycine max
<400> 83
agctgtttca cacaaactat taattactgg ccaggttaat tactcaagaa gtagtaatac 60
tatcagtatt gatattaggt tatattttcc tattacaagt ttatattgtc ctgtacaact 120
ttgtagtttt actaagtttc taaactaagt aaataattac aatataaaaa aatctttaca 180
ttactccgtc tatcctataa caattattgt cttagaccat tttttataca aataaaaaaa 240
ataaaaaagt ttaattactt atttacttct tatacttttt aaatttatct tttttagttt 300
ctataattag taagtatatt ttttaatcca caaaatatat attttaattt ctaaaatgtt 360
cctgcagtta actttttttt aactaacaaa gttaaaaaaa ttaacgagat aaataccttt 420
taggaattaa aatataaatt tgaaggatta aaaaatttat ttattaaatt ttagagacta 480
aaaaattcat ttattaatta taagaactaa aaggaataag tttaaaaatt ataagaatta 540
aatgggtaat taaaccaaaa aataataaat agataaaata aaataatatt tttataaaat 600
taatattata taattattaa tttattttta gattttgtag ttgatcgtta atatagccaa 660
cgttcctgct gcaagaagct accccggata ttccgtcccc atctaccaaa acaatcggaa 720
atgtttcaga ttttatagtt gatctcttaa tatataagag atataggtgg aaaattcatt 780
aatgttatat taaaaactaa aattacaatt atattaggat aaaaatattt tcttataacg 840
gatgaagtat tgattaatta gaaatttttt atgtatgatg attttgttaa tttttatgat 900
aattatttta aaatcattta taacagattt ttaattaatc cgtagtataa attttttatg 960
ctatttgtgt atcgaaatta aactatgtta aattactcct tataatttaa taacttgata 1020
gaaaaataat gatatttaat gaacagggat ctgattaatt ttttttaaaa aaatataaga 1080
actctgtcaa ctgcttttaa attagatatt tatcttaaaa ctcaataaaa ttatatgtaa 1140
tggatagatc taaattctaa atattaatgt aaccttaata ctattattat ccatgcctat 1200
ctgaaagact aaatttccgt tttgcatgct agaaaatgga agccagtgat aatctgacac 1260
gtggggtcca gtttaaggta tctgacgacg ttcttgcagt gctctactta cgtgaacaca 1320
gtaaaaaaaa tgacagattt tttcttaaaa gcatccacag ttaaagacag ctgtctccac 1380
gcgcccgtgt aaaacacgcg accccgcatc aaagagggtt acactccgag tgtgtttctc 1440
acgctctata agtgcgattg ggtaaatatt tgtttgccaa aaatacctta accgagtaaa 1500
gcatgataaa aaaaaacttg tatgaaacag gaaactcaga ccaaccctag taagatgcac 1560
aacattttat ggtggagatt ggaacaaaga gataaaaaga aagagaaaaa aagtgaacat 1620
ctgaggataa aaaagccaag ttagataaca ggagagatga acacaactgt gttgtagttg 1680
ttgttgttga tgtttgcttt gttctctttc tctctctctc tagggtttca agagtgtttt 1740
gaactactcc agaaccctct cttgtttttc acaaatttgg gttcagtaga gtactgaccc 1800
agaaaagaag attcaacagg tacctaagag aaggaaagag ggggatagaa agaaagaaaa 1860
agaaatagaa actgcacgta taaaagaaga aagaaagaat caaagaaaat aggaaaaaag 1920
ggcaaatatt ttgtttgaat aagatataag gcaatagtaa tattagtatt gttgataata 1980
attaggtaga aaaaatatta t 2001
<210> 84
<211> 2001
<212> ДНК
<213> Solanum lycopersicum
<400> 84
aataagatga aagttatttt tacgctaaat aagatgaaag aatcttattt ttatgttaaa 60
taagatgaat attttatttt aaagctaaat aagatgaaag tttaagttaa atgagatgaa 120
catttaaatt ttaatatata cgacataatc atggcaatac acacaaaaaa aatatttaag 180
ctaaataaga ggtaattttt atttgtaaga atgaataact aaatcttgta caaaaaaaaa 240
aaactaaata aggtgagggt atttttgtaa acaaccaaca acttattctc aaaaaaaata 300
aataataaat attaatttaa atatgacaaa ccaaacaaac aactaatccc tatacaacat 360
attccagcat aactagtatt caaatcaaac aacccctcta tgaaatccat aagacaagaa 420
ataaaacaaa attgcaaaac aatcaataga ttaaggtcta ataagacata agtagataag 480
tgaatcgttg aagaagacat tgaattttga tatagtacaa ctccatacct ttttatggtt 540
attcatgtta atcttagggt attcgatata actttacaag taaaatctgt aaaagatata 600
cattattctt atctttattt agaaagatta tttttgattg actctcaaat caaaaatagt 660
gtaatcgagt atgatttttc aaaaaaacaa aaaaacatca atataacaat atgagcgaaa 720
taaactaagt aataggcatt gtaaaaaagg aagaaaaaga tgcttatgac ttatctccgt 780
tactgaattg gttttcctct tctccctaat aagcaaagag ccaaagacta atattgaaat 840
gagttatttc ctcatatgat attcgacatt aatcctttca tcatcaatta gttttttcga 900
atgaagttag actcaaaatc ccttgtgaaa ctttcaaaaa attaggttta tgagttgagt 960
tggtttcaga atgctaaaaa taaaatgcat aatacatata ttgtatccta aatttggctt 1020
caaattttaa ctttgacctc taactttcat aatgcacaaa caaacacttt gactatctaa 1080
ctttcaaata aataaacaca tgagtcttac atgacaaaaa tatacatacg acaccacgta 1140
ggacgaaaaa tgacatgtaa gacatgtgtg tctatttgtt caattttata caagtttaac 1200
tgtttaagtg tctacttgtg cacacccaaa gtggaagggc ataaatgtta tttgaagtca 1260
agttaaagcc atacaaaata aaaattgaat tatgtcttat ttaagatgga taagtagttt 1320
agctaaataa atttttgtta gtaagttttc catttctata aatttacagt gaagaagtga 1380
gttatttgct tacgcatgat atgtacgtaa tatccactaa tacaccgacg cgtgtccagc 1440
caatttagta cacgcctttg ttctttcact gatggaccgc acaaatgaga agcaaaagct 1500
ccaacaaact aaccaagcgc gtgtatccca gacaacgaat agttgttgtg cgtgtactcc 1560
acgcgcatca acagaagcgt aagactagtc cctataatgc attggctaaa tacatgaaac 1620
ttgaaaaagt agtggaaata agaaccaacc ctaaagctct aaggtatcta aatttggagt 1680
acctaagcaa atcctaaagt taaaacaatg aatccctaaa gaagatagga agaaatgcca 1740
tagataaaaa caacccatgt tcactttttc tctctctaaa cattgaaatt caaccaaaac 1800
aaaaaacaaa agttgataag aatcctttct ttctttcttt gtgtgtgtgt gtgtctagct 1860
agggtttgca tttctttcac aattttggtt gtttcagtag gagagaaaag aggatctaag 1920
agttagccaa gagaagaaat tagtgagaaa ataaagtaga aaaagatcat cagaggaagg 1980
agggatgggt agaggaagag t 2001
<210> 85
<211> 1817
<212> ДНК
<213> Solanum lycopersicum
<400> 85
ttacaccccc actaaaaaac ccaaaagtta aaacaaagag catctaacta ttaatatcac 60
gttagaaacg tgcgatcatg tcatttaaaa gtttatatcg atagagatag tacatttttg 120
ttatttaatt atagggggaa aaaaacaaat atatctttga attatcatta ataatatgca 180
gatatcttcc gtcatacttt tgggacgata ttggtgtccc caccgtccaa aaactagagc 240
atatatatcc tttactctaa taagactgaa cagagacacg tgacacaatc atattcattg 300
atcatatatt caatatgaaa atgacaagtc ggtggataag attatgacaa ttgtatgtct 360
gttagtttaa agggtatata tgttctattt ctgggtggca gggcaccaat atgtcaaaag 420
tatgacgaaa agtatttgct tacgacaaaa acgatacttg ggggttatat ttgtcttttt 480
tcccttaatg gtatcctcaa caattgtcaa gctaataaag cgctacttct aattattcaa 540
atgatcgagt tattttatgt atgttaatat tgcaagcgac ttaatatctc caaacattgt 600
tcgaactcag cacgtacaat tatcaaacca aagagcaaag taggtctcga caaaacgaag 660
agtatcataa tacctcgttc gttattcttt cctaaaatat aatttttatg ttgaaagtaa 720
aaaaaattag cataaaaatt aatctattac gactgacgcg ttgttcaaag tcgagagaat 780
aatttaaagt ggtaggaaat caaaattgat ttgggtattt atttaactca tattataata 840
ggcttttttt gttttaataa ttcactagga atatattctc tttttcaaga taaattaggt 900
tttgcaatgc tattatatat aaatagaaac attactagca aattttttga gtgttagaag 960
tagtagaaaa ttatttattt aagtaaatgt atagaatttt gaatgatgga gaaatgttga 1020
aagattatta aactgtgaaa taaaaggatt gtgttggctt attggacggt ttttaattaa 1080
tgaaggaata ttggacggtt gctgattgat gaagacagaa aataatttga acgaaaatga 1140
tgaatattgt gaaaatatct aattatgtca ttttaaggga aaaattaatt tcacttcaaa 1200
tataattaga gtattattag aattttcttt ttctttctaa ataacacaac aatttccttt 1260
tgtcaaatca accaagttat tagcatccta tggatcacac ctaacaaatg tacataactt 1320
cttctattct gatttttatg tctcattttt ctttttagtt attaaaaaaa atatattcag 1380
ttttatttta tttttaaaat tctcatttca cactttgtaa ttattaatta tttattttaa 1440
ttcattatca aattatatcc tataaagtag aactagtgta aaaacaaatt atctttattt 1500
ttaatcgagt caactcgtcc ttcataccca aaatgtatcc cacactcact ctattaacat 1560
acagtgagta gtacatgata agtttgttaa ataaatttta taccatcagt acatgcaatt 1620
ttatgtcaat aaattacaaa tatagatatt tgtgtagtgc acccttcttt tatagtaata 1680
gatttttaga gttagctagt aagtgtataa tatcccttga tttaataaca attattcact 1740
atattatatt gagatgttta tcaatatttt tttactttat aaaattaata aataatttta 1800
tattaagttt ttaattt 1817
<210> 86
<211> 2001
<212> ДНК
<213> Solanum lycopersicum
<400> 86
ttcaagaatt tatgttctta catatttatc tatctatcta tctatctatc tatctatcta 60
tctatctatc tatatatata tatatatata tatatgaagt ctcccactta tcggtaagtg 120
taatttcttt tatttttttt aatctattaa caaattttta aatttttccc tgagccataa 180
caattgtata atttaaatat gttctttttc ttacgaaatg tcataacaat tattctcttc 240
tttattttta ttttaatatt gattaaagaa ataataattt attattttct caataattca 300
tttattagaa attcgtgagt tatgtgataa tgatgaataa tgaaatttat gtcaaaatat 360
tattaatatt ttgtataatt attttttcta taatttttag tgtatgaata ttaaaatatt 420
aataaaggat tatttgcaag ttaataagaa aaagacagct cgtaagggaa gcatcgacac 480
gttggtaatt aaacactggc gattgtacta ttacgttgat gttcgtgtcc aaaaggtaat 540
acgatgtatc aatgtgaaac attaatttac ccaaaaccac aaaaaggacc tacacttatt 600
acatataggg taactccatg tacacctata tatatacata taataataaa ataaataata 660
tacattcata aataattgca tatatatgta gagacacact ttttaaggtg tataaaaata 720
taacttttta gagttcagtt ctcaggtgaa atttattagt atctgctcta tcattattaa 780
taggtctatg tttgagaact atcaccaagt tgattgggct attttagaag ggtagaggtt 840
tgacacaaaa gttaatttag ataatatttc taattgatga atataagaaa tatgttttta 900
ttaatcgtac agatacttat agttttactt aattttgcta ttagattgat ttgtacaatt 960
cgtcttataa gtataaaatt taaaatttgt ataattttat ttttgattat ataaatcaag 1020
aattttatgt atgtttgtcc taactatttg tatataattt ataaaaaaat tgataataaa 1080
ttgtcttgtt tgtatactga gaaacgaaat atacaaacaa atttctgaaa aaattctgac 1140
cgtataaata cagaatttat atatatttaa cgtatttata tattcgcaag tgaaacttat 1200
aagcagacat aaatatgcat accaacataa atatacaaac ctcaatctta atagcaaata 1260
aatataaata taaaacacaa ttatcgaaac tataagtcta aaatcttaat atatctattt 1320
tatttgctat tagtaagatc atgaggggga ggcagatgtg agttatgagg attcactagc 1380
tttgactaaa ttgttaaata gttaataagt atacgtaaca aatttgtgta cttagtaggc 1440
gtttaattat agaacatttt tttaagaaaa taaaaatttc tttatttaag tttttcaaaa 1500
aaaaaatcat ctcttaaaat ttgtaaaaga attcatattt gacgtgaaaa gattattacg 1560
tcatatcagg gaattaaaga ataaccagtt taaattatat tattgtttat ttattgacta 1620
gcggatattt atttaattat attctcagta ttattttata tgacatcatt tttttagttg 1680
atctcaaaaa aatgttacct tacttcacac aaatattcaa gatttatatt aaactacaag 1740
tttccaaaaa ataaaaataa ttcttaaaaa taaaaaatgt gtcacataaa atgaaacata 1800
tatatttaaa catttatatg tgacttatca atttgagttg ggttatatga aagtgacaaa 1860
cgattagata gggcataaca gtgcttctct ctctttccat taaatttggt agtccacata 1920
cagagagagt agaaaaagtg tgttaaccta gagtggaata atagtgtttt tcttgttaga 1980
gacaagaaaa gagagaaaaa t 2001
<210> 87
<211> 1882
<212> ДНК
<213> Solanum lycopersicum
<400> 87
gttatggttt tggttctttt ttctgtcctt ttgttcttag ggtaataaat aaatagcttt 60
gttgggccat ggggtttcct aatattacaa cattgtatct atttttctta tatctgacgt 120
ataaggtata ataatttcag gataaatttt atcgtgtgtt tagttgaaag cttaggtagt 180
tattcttaga ttatttctcc taccccattt atattttaat aacggaatat gttatctcat 240
atgtatagca aataaaataa taacttattt tgaagtaatt aattaattct gaaataattt 300
attcacgatc aaatgatcct tattaatatt actttagacc cttttaaata ttgcattttt 360
ggtaattctg caaactgctt ttgttatttc ttctgcctgt gtcccttgtc tctctataat 420
taatatataa gtaaaatgtg ttttgatgtt tagggccaaa aaaagaagac aagtcaatac 480
tattaaccat tattattttt ggtttctcac caactaacct tttaatatca agtttttgcc 540
cctattttgg ggtggtattt aatttgtatc aaattacaaa ataaataaaa ggagacataa 600
gtttagaatt ttttttaggt ataagttgtg tagtacctaa tttggaagac ataagttaaa 660
agaattttga agttagattg atttggaatc aaaattaaaa ttttatttaa ataggtaatt 720
agattataaa aaataatatt tttattggaa aacaacataa tttgttgaaa actattaaat 780
attatgaaaa ttttaattat atatttttat acaatttttt aaatgagtaa atcacgattc 840
gtaaataaag tatcagaaac gtttgtaatt acattttatt aaaaagtttc caattctcat 900
tattttataa actactaaaa ataaaagttt ttcccacatt tccattttaa tggaaattgt 960
aagacataat attaaaggtt gtaggtattt gtatccctta ctgggattgg ggagtgtttg 1020
aaaagacctt tatatggaga tacattatta gccccttata ttggaaatat catatctata 1080
aaattcaaaa gttaattcat gacgaaaaaa aatatctaaa ttatattaaa gagatcacat 1140
attttttcta gctatgactg gacatatagt gcgtggataa ttttagtatg aagatctaac 1200
atcaaaaagc aagaatggga tgaatcgtgt attaatatca tgtaaggagc gaactcataa 1260
gaaaaaaatt gttcagatca tattaaaata tataccaatt cttaaaccat cgagacggag 1320
acttttcaca aattacatac atactagaca ttataaatat ctttttacat catcaatata 1380
tagtataggt aagtatatct tactacacta tcaatttaaa ttcatcaata attactgaac 1440
aaataattcg atcgtgaata tcttttacac tgtcaacaca tataattgca agtcgaaaag 1500
tatttagcaa tcaagggttt tacaagaatt tttggtgcta ataaaatgta taacaacctt 1560
aaatgttgtt tgtttttcct taaacaagac atagcacact cccccttgat gtatcttttt 1620
gggacatacc acatgtttct gttacataag ttggatattt tgatattaga tacctaagaa 1680
tgtgtcatca tgttactcca tacatatcaa acaatatttc acttcaattt gaaatattta 1740
aaatcaagat ttgtaatcac ataaactaaa atacgttaac gtaattaatc aatcttgatt 1800
caacacaaat attaatgaga gaaaatattg attcaaaaga taaaagcaca tagtgtatgg 1860
gaattgatat tcaaatacct aa 1882
<210> 88
<211> 1574
<212> ДНК
<213> Solanum lycopersicum
<400> 88
aatgaaaaag aaaaaataaa gcaatagatc ccatcttatt taaaaaggga aatagtacaa 60
cccacttttt ttttttgtat ttatattttt gattttgttt ctctctattt cattcgtttt 120
aatttatgtg gggttagtgc gatgtattta tttcaaaaat aataatgtgg gtgaaatagt 180
gatctttcta ttaaattaga tattttatgt atacattttt tgtcgaatta atataatatt 240
ttctcattaa acttacatgt tccaaaagga tcgaatgatg tacttggttg aattgcgaag 300
taattttttt tagagaaaca acgatcaatt ctcacttaat ttttttttta tattcacgtt 360
ctaaaaatcc taaatctaag aaaaaaatgg gagtaatttg gaacttaaat ctaagacaag 420
tcttaattat gtcttgttta gctaattaaa ctatcaaaat aaaaatattt tttatttaaa 480
atagtatcca aaaaagaatt acttttggag agtcaatttt tgaatacctt gttaatttga 540
taaatatttg tatttatatt ataacaataa tttatacttg aacaaagttt tgaaaatact 600
ttccattttg ccctactata cgtactactc aaaatattaa aacccatttt tttcttaaaa 660
gtttggccaa aacacttcaa tttcctttaa aagttggcca tactaactac atttaatttg 720
tacaaatcaa aattatttta taactcatat cattggcgga acttgacgtg agttgtctaa 780
aataaacaaa gtttaataaa agtgtataaa ttaaaattac tgttaacttt agaaaaatac 840
caatgagttt gacctttttt acaagttgaa caatacaaac tttaatcaat attattaaaa 900
tatattttca ttttattgat ataagaaatt actacaattt ataatacttt tcctataatt 960
tcaaattttt aaattttctg aaatattaaa ccaatctaat ctaattcaat ttaatcaaat 1020
taattcatat aaagcaaaat taaataggaa aatattccat atcaaagtga gtagtttctc 1080
tattctattt ttatatttca aataggaaaa attcactttt ctataattaa gaataattca 1140
attttaattc tttccctttt aactcttatg aaataattta taatcacaca actattcaag 1200
tattatttta caccataaat ttcaaatctt ttcatttttt cttcttaaat attatactaa 1260
atcaaataat atcatataaa ataaaacata aaaaaatata tattttgaga aattaaaaag 1320
aaaataatgt caataatttg tttctttttt tttctcttaa atagagtaca tgaataggat 1380
agaataggtg tggaaaaagg tgtaaataat aaataaacaa tttaacaagt actatgaaaa 1440
atggtattat aattatttaa aatgaaaacc agatggtatt taagaatgtg ttgtcgagtt 1500
ttgattggtt gaaaggacaa catagtatgg tactcatttt tgtatggtgg atatataatg 1560
tctatcacag attt 1574
<210> 89
<211> 2001
<212> ДНК
<213> Zea mays
<400> 89
agtctcttgt tgggctggac gcctccatca aggcgcgagg tcaagggcac agttaaccgt 60
tgtgctaact ggtggagatc aattccaaca cactggacta gtgctgggac taacttaaaa 120
ataggagcct aaagcacggt ccaacaagaa ataaaatagg tcgggctacc acgactcgaa 180
ggtgggtcta gacctgacct caagttacgg cctgttgggc ccagcacggc ccacacatat 240
gggtcggttt gggcctacac ggccccaatg aagcctatat tatttaattt ctttagtttc 300
gtaaatttat aaactttata ttgttgtgat atttggactt tatgcggtca aatgatgcta 360
gcattgttta atattgtggt tgcaatattt ggattttacg aggtttgaat atataggacg 420
agcttggacc ggcacgattc aacaaaagca cggcttgctt tagagtagaa ctgaccattg 480
tttctacttt tcaggcccta aaagtttttt tttatcttct tagcccgatc ccagcactag 540
actggactgg actgagacct tgtactttga agtaagatgc atgagttcgt tatgcggatt 600
cgcaaggcgc gcgtacagta cagctcggca cccaacagct agtagtacgc acgttccgtt 660
aatccgctgg atggatggat cgatcggaga cggacagggg cggacgcgcg gcaaacgtac 720
ggtgcagtta ttgtcgtccg ccggatcgat caatcgaccg gcgcggcgga cggatcgaac 780
agtgcccgaa catgcacgtc cgtcccctac gcctgcggcg tgcagcatgc gcgcggatcg 840
tagtccccgg tcgatcggat gcgcgggccg gaccccggcg ctgccgaccg ggaggcggga 900
gacttggttc gtttcgcacc tgctgccttg tctcgcgctc gcgcggcgcg tcaggggtgg 960
ttggtcgcgt acttgcgttg gctgctgcct gggtggctct ccgcctctcc tggccacggc 1020
gagactgatg cgcgcgctgg cccagctttg gtcgctgttg cgagctggtc tggacagcga 1080
cccggcccgg ccggccggcc ggccgccgag accgaaagga agcaacgtac aaccagcagg 1140
aagcaagggg tgagagagag cgagagagga ggggcgtgca gccgtccggt ccagcaggcg 1200
acggaatgga ggacacgccg ggcaggtcgc tgtgcgcctg tgcctgcgtg cgcgatcgcg 1260
agtggccagt caccagcagg ccggccatta aaggagagca cgtgacggcg cgccagtcgc 1320
ttccttcgct tcgcttgctc gggcgccggc ggggaccacc agggtaaaag ccgagcgcgc 1380
aggacgcgac ggcgacggcg acggcgacgg acgggacggg tcccatgagc ccatcaccac 1440
gagcggcgtg gacgtggagg tggatggaat gaccgatcga ccgatcgatc gcgagtgatg 1500
actgatgagt gtggcgtgac tccgatccct gatccctccc catccctagc tttccggcaa 1560
cgcgctaccg ggccgggggc ctagggtttc cccccctacg gatgctttgc cggaaacggc 1620
aacctgacgc cgaggcgcgc gcaccacccc tgcgcccacc ggctccttcc ctgcgccgcg 1680
ctgatgataa ctcagtccct gcacaggccc cggccccggc cccagcccca ccaccgctac 1740
tccactaggc cctggttgct agccagctcg cttgcttgct tcgattccta tcctagcccc 1800
cgtgccatcg ctttcctctc gttatttagc cctccgttcc cgaccctcat cctccgctcc 1860
agacttccag catctccgct ccggctgcgc tctgccttgc tttcctgcta cctgctctag 1920
cgcgagcgag agaggtacgg cggccgatct ggcggcgcag gcggagggct cggccggggc 1980
cggcaagtcg gcgccgaaca t 2001
<210> 90
<211> 1032
<212> ДНК
<213> Zea mays
<400> 90
acatgaggag tgggttgatt ccactaaaat tgatggaatg aacttattat gcatcaactc 60
ataaagcata gagtgattcc acaaaccaaa cacaccatta gtttattgac caacctcagt 120
tctttgatat ataaaagttg tttgatccgt gtgcaacaaa tagtttttca ggaatttggg 180
acgtacccca tctcttaaat gtctagactg attggacata ttaatctaat tttagtagct 240
aagtattagc tctcaaacac ctcctgggaa tgctgcccta aaaatggaat atcggtacgt 300
cggatcggag aaaggttggg gtatcgtggt ccaaagcatg cgaaagcaac ggcgcagggc 360
tggaaacctg agaccaggtg aggtgcacga cgacatgcat atggtttggg ttaggcctag 420
gagctggttc tctctccatg catggtcagc tcgccgcttt tgccgccttc gtgtatggct 480
tgccccatgc catgcatcgc gccgtgtaca cttgtggcgt aggggcgggg ccgccgcatc 540
ggagcgcccc cgtttcggca cggtcctccc agttttaggg taaacccagc tagggtagtg 600
ggggtaactg gccagcgcca ctccaaatct accctccttc aatttaaagc tgagaaatac 660
tgtagtatat actagagtag agcgagagaa gggagatgtg gatagatggg tggatgggga 720
cgcgtgaaaa agatgcgaga gagaagagac gaccggacag gcagccacac acagtaacag 780
tagtgaaccc tgcccctttt cccggtctct ccactgatat tccgctcctg tccctgtcct 840
ccccggacgg agctaataga gccggctctg ctcatcatta tatcgtcgcg cacaaatgcg 900
aagcctagca gcacttgtgt ccggcggcct tgtgttcgtg ggggatgtgt ggcatattag 960
ctagctgata agcggccggc cgaagagcaa gcgcagtgag aagaagaagc tcggatcgga 1020
ggaggtcggc at 1032
<210> 91
<211> 2000
<212> ДНК
<213> Zea mays
<400> 91
tgtctcgatc tctcctctcc tctcctctcc tcccgttggt gtgactgtag tagatccttt 60
gcccgtgtca gaacaagctg ctcctcggac cgggtaatgt taaacatcgg aggagccttt 120
gcctaggatc cgtaacgggg aggaaagaga aaaaaaacta aggatgatta tggataccgt 180
gtaataactg ctaactacag ttagcccatc tcagcggact ctctgcccta tattgtatgt 240
cactttctat tataaactac actatacaac ctatgatgta aaataatgtt ttgcacgttc 300
atatataaat cagtcgaaga aagggtgcct cactacaggg aatggtttct attggacacc 360
ttagcattca atcagtcatg tccccccccc ccccaaaaaa aaaatgcacc catccagtcg 420
atttttgtca tatttgaatt cggtggtgct ccatgcacgc gtacctgctt tgaccaattt 480
atacgatcaa tatataactt acgttcttac ggttcttaga ctttatgaga ctttgcaagt 540
atgtttggat acaaatcaca ctaatgtgca tctttgtaaa ctaaattctt ttgattaaat 600
ttgtaatttt aaggtttaac ctgtttttgt tgtgtagacg acgttaggca ccgatcgtcg 660
cttcgctata tatctttgtt gtagacgacg ttagactcct agattaaata agcgaaaacc 720
gatcgtcgct tcgctatctt tgtttatttg tttgtggctg ctctacgctg aagagcccac 780
aggccacagc cccacacgac acgttaggca cccccaccca ccatccgcgc ataatataag 840
ctactgcaaa atatatgccg gcggagcccg agcgagcttt gtacttgctc cgccgtggcc 900
tggctccagg atgctttgga tttcgtgcgg cgccgtacgt ccaggcaaac agacaagtgg 960
agctgcatgt cctaaaagcc cggcaatcaa acacgctcta gcagcagcat ggatcacaga 1020
tatcagtcat ggggtggcgc tggcgcgggt gggtggccag gtggaggtgg gtgcatgtcg 1080
tcgtcgtcgt cccatacaga aattggctca cgtatgtata cgctgcgtac aggcagtagt 1140
acacaattac tagcaccaat gcaatccaac ggatggatct tcgcacaccc gccacccggt 1200
taaattaagc tactcctacc tctcccagtc tcccttggcc tgcctctata tttttgggca 1260
gcctccacca gccgggcgga tggggttgga tcgtcgtatc tgaggcggcg tggtcgtcca 1320
aggcgaaagc aacggcgcag ggctgggacc ctagtaggtg catgaggtcg tgcatggcgc 1380
gcgagatgca tggtttgggt taggcctagg aggttctctc tccatggcat gggtagctcg 1440
cgccgcttgg ctgccgttct cgtgtatgcg catgcaccag gcatttgcac cgcgccgtgt 1500
atatttctgg cgtgggggcc ggcgccgcat tggagctgca gccccgtttc ggcacggaca 1560
cgggacacct cccgttaggg taagcccggg gcagtgggta actgcccagc gccactactc 1620
cgaatttacc ctccttttat ttttaaagct tgggagaggg gagaatggat ggatggatgg 1680
atgtagacgc gtgaaaaaga tgcgcgagac cggcagcgtg tgctacaggg gcagccaggc 1740
acacacacac acagtgaccc tgcccctttt cccggccgtc tcgctctcca ccgatattcc 1800
gctcctcctg tccagtcctc ctcccccgag ccggctcatt atatcgtccg tcgcgcagca 1860
caacgcaagt ttgctagcgg ccggatcagc agccacaaaa cgaggagagc aaccacgctg 1920
cacacagaga cgcccgtgtg tgagatatag agcaagctcg atcgaaggaa ggagggaagc 1980
tagagatcgt acgtcgccat 2000
<210> 92
<211> 2001
<212> ДНК
<213> Zea mays
<400> 92
gtcgaaacgc cgacaatttg ttacacggtt accactgcac agcgagtacg acaacaagcc 60
taagatagtc cacttcttcg cattcctata cttctcactg tgatctacgg cactacgaca 120
ctatttcgag gcaaaaacag agggaagatg cctaaccaaa attctaatga agaattacac 180
cgtgaatgat ggcggcggtg gacgacggtg gcaatggcaa aaccctaacc ctgcatcatt 240
ttcccttcac ctttctattt tttccacgtg catagcatgg cagtccctcg acaatagaaa 300
cacatgtaag gtttcagtgg atatatccca atcgttgtac ttaagcagca ttcataaggt 360
gatttagttt ttttccctaa atcttgcaac gtgcataact tcgcgattga aactttaatt 420
aatacatgta atcagtcgaa tggaatgcac tggtttttag gcatgtatat gacctcaaat 480
catccacgca aggaatggat aaaatgacaa atcttcattg tcttcttaaa ttcaggcgat 540
cttcgtaaaa acagttgatt catataaaaa tagaaaatat atttggagaa attttctgca 600
tgtccttgta attttgctta gtaccatatt tatcatcgta aatgttataa tcccttctat 660
ataccactct gatacaattt cgtacctttt taattatgcc aacgcaagtg ggcgagtgat 720
atagtaggga ctagaatatc tgtgatgata aataatgtac tagacaaaat tacagtagca 780
tacatgaaat tgtcccttat atttgccatg cattttttgc tattacatct tagcataata 840
atcttggaag cacatcgcat gagttatcga ttcaagttag atatatagat gcatagtaga 900
caacatttag ttacgcaacg gcatctggtt ccaagaggag ctttgcaaga gatcaattga 960
atttagggcc tggaatcgtt accaaatcag tgatgattgc cggttgggtt cacatgagca 1020
gataaaaaaa tggagatgat catcgtcctt tcagaatcgc taacagatat ggaagtgatg 1080
aagtccagga ctccacatga tcttactaca cacatgccag aagtctggaa caagaacatg 1140
ccggatccct aagcagaaaa cggatcgtat agcggtctcc tttctggaaa aagcgacgca 1200
aaacggatcg atgacctctc tcaccatgtc aacccgtgct gaggagctcc gtcctgtctg 1260
cacgcactat ggcaatggcg accggcctct tccgagctgc gaatcataac ggcatgtctg 1320
caagctcgat cgctgcaagc atgccttccc gttggaagga tcgagctgct cgatggagga 1380
aagaggaaag cagcgcgccg cgcatggcta tagcagttgg caggtgaggg cctctagcgg 1440
caacgggggc ctttgcccaa aatcacggca agccgaggtt ccacctggaa aaatccactc 1500
cgttgctctc tcccttttct ctctctctag catcgacctg tcgaatcctc actggtctat 1560
tcagttcggc aacgaggaga gagatagaca gagagacgga cgggaggctg acacatggcc 1620
ggatattggg gtgcggaatt gaatttggtt aatgcaaaag gtggcgtgtg aggacggacc 1680
gacggaggca atcacgagac gggaggggtt ggccttttgc ctctagggtt ccgggtcgcc 1740
caccacctta ccggaaatgg caatgcggga cgcgccccaa tcactcacca caccacccct 1800
ttcttctcgc ccttttaacc caatcgtctc tccaccaccc aactcctcct gcctgtgctc 1860
tcctcctttt tctccactcc gcttttgctt ggttccatcg ggccggagag gagaagctag 1920
ctaactagca gcagctctgt tggtgtgtgt gtgtgtggag ggtagctgca gctggggcta 1980
gctggaaagg tcgggagcca t 2001
<210> 93
<211> 668
<212> ДНК
<213> Zea mays
<400> 93
atcgaagata gggttgctcg aaacaaaaaa aaaatctgca gccgcagact gtatgcccta 60
cgctattttg ccgtaggaga gttggaacct ttgatgtagc gtttgtacta ctcggggtac 120
gctatccact atttggttga ggtatggtgg gaaagaaatg ataaaatata tggttgttgg 180
tgtagagttg atatatgaaa taaatatgac tgcagatgat tattgtgata tatggtaaat 240
acttttgatg ataaaaataa aatatttttt tagagtagta cggatagcct tatcgaccta 300
tgtacctggc agcgctgtga tccatcagct agcgaccaat cactcgccca ccacggcatc 360
gccaggagct gttgcttttt gcgagctgca tggtgggggc ctccatcgaa ggcgagggga 420
cggggcagag cgccctgatc gacgcgtgat aaccgattga tgtgccccca gttcgcccgt 480
accagcgcgc gccccctcgg cctcgtcctg cgtccgcctg cgtgctggtg cggcgcgctc 540
gcgctggcgg acgtccagac cgcaataatc tcgcggcctc gcgcgaggag gaccgaggac 600
aggaggtgcg atgcgatgca ataaaggttg ccgtacgcga gtgagtcgga cagagagaga 660
gagagaga 668
<210> 94
<211> 718
<212> ДНК
<213> Zea mays
<400> 94
ttatttggtg cttcaccgcc ggagccaggc tagctataca ctttgtagtt gtttgtaggg 60
gtatatagga gcagtatcta cagtagcagc actcttcacc ggtccagcta gtaaatgcgg 120
tatctgtcgt ctgtcgagct aacctatcat atcagcgcca tgcgccccgg ccggtcgtaa 180
cctagctagg agtagctagc taggactagc tagctaggag cctaagcgcc cagcccagtg 240
ggtggtagcc taccaagggt gaggaagagg agctgagcta ggaccgcgag gcgagcgaga 300
tccaatctgc accccacgaa cgaaaagatt cttccccgcc ggcgtcgctc tctcatccgt 360
cgacgtctcg ctccttcctt cctctctctc tctctctctc tctctctctc tctctctctc 420
tttctctctc tcagccagca gcaagcatat agcccagcac caccacatgc ccaagggccc 480
tccctctccc tcgtcgtcgg gccaattgag tgtgagagct cgaaaaaacc caggggatcg 540
gccggaccag cagcgagcga gcgcgagctc tgcgtgcgtg tgtgtgtctg cgcgctagat 600
tagatcacct ccatcgtcaa taattgcagg cagatccata tagtctgctg gtggcgagac 660
aaagcaacgg atcgtcgtcg atccggagag cggaaagcgc gcagatcgcg gcggccat 718
<210> 95
<211> 21
<212> РНК
<213> Glycine max
<400> 95
agaaucuuga ugaugcugca u 21
<210> 96
<211> 21
<212> РНК
<213> Glycine max
<400> 96
ggaaucuuga ugaugcugca g 21
<210> 97
<211> 21
<212> РНК
<213> Glycine max
<400> 97
ugaaucuuga ugaugcugca u 21
<210> 98
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 98
atgcagcatc atcaagattc t 21
<210> 99
<211> 21
<212> РНК
<213> Glycine max
<400> 99
augcagcauc aucaagauuc u 21
<210> 100
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 100
ctgcagcatc atcaagattc c 21
<210> 101
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 101
atgcagcatc atcaagattc a 21
<210> 102
<211> 328
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 102
ggcagagccg tgcccgtctc atcccctgcc cgtgcaagca gctaggtagg acgatttgag 60
cgtggtgtta ggccgaaccg ctgaaggaag attgctccac tgttgactgc atttgggcta 120
ggtgcatcgg gataaatgta ttgcttatat tcagcaatat aatgttcatc ccgatatgcc 180
tagcccaaat atagtcgata gtggaagaac ggtaacatat gtggtttgca gcaggtgagc 240
aggatgggtg tggatgattg aatatctctg ttcagtgttt tcatcatctg actgaacact 300
gaatcagctt gctgacgtta gaggttag 328
<210> 103
<211> 21
<212> РНК
<213> Glycine max
<400> 103
ugacagaaga gagugagcac a 21
<210> 104
<211> 21
<212> РНК
<213> Glycine max
<400> 104
uugacagaag auagagagca c 21
<210> 105
<211> 21
<212> РНК
<213> Glycine max
<400> 105
ugacagaaga gagugagcac u 21
<210> 106
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 106
gtgctcactc tcttctgtca a 21
<210> 107
<211> 21
<212> РНК
<213> Glycine max
<400> 107
gugcucacuc ucuucuguca a 21
<210> 108
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 108
tgtgctcact ctcttctgtc a 21
<210> 109
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 109
gtgctctctc tcttctgtca a 21
<210> 110
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственная последовательность
<400> 110
agtgctcact ctcttctgtc a 21
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УВЕЛИЧЕНИЯ УРОЖАЙНОСТИ НИЗКОРОСЛЫХ РАСТЕНИЙ ПУТЕМ МАНИПУЛЯЦИИ МЕТАБОЛИЗМА ГИББЕРЕЛЛИНА | 2017 |
|
RU2788379C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ УВЕЛИЧЕНИЯ УРОЖАЙНОСТИ НИЗКОРОСЛЫХ РАСТЕНИЙ ПУТЕМ МАНИПУЛЯЦИИ МЕТАБОЛИЗМА ГИББЕРЕЛЛИНА | 2017 |
|
RU2837282C2 |
| МОДУЛИРОВАНИЕ СОДЕРЖАНИЯ АМИНОКИСЛОТ В РАСТЕНИИ | 2019 |
|
RU2799785C2 |
| РАСТЕНИЯ С СОКРАЩЕННЫМ ПЕРИОДОМ ВРЕМЕНИ ДО НАСТУПЛЕНИЯ ЦВЕТЕНИЯ | 2017 |
|
RU2792235C2 |
| РАСТЕНИЯ СО СНИЖЕННЫМ СОДЕРЖАНИЕМ АСПАРАГИНА | 2016 |
|
RU2742725C2 |
| МОДУЛИРОВАНИЕ СОДЕРЖАНИЯ РЕДУЦИРУЮЩИХ САХАРОВ В РАСТЕНИИ | 2019 |
|
RU2801948C2 |
| ИНСЕКТИЦИДНЫЕ БЕЛКИ | 2017 |
|
RU2765722C2 |
| ПОСЛЕДОВАТЕЛЬНОСТИ СИНТЕТИЧЕСКИХ НУКЛЕОТИДОВ, КОДИРУЮЩИХ ИНСЕКТИЦИДНЫЙ КРИСТАЛЛИЧЕСКИЙ БЕЛОК, И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2820699C2 |
| СНИЖЕНИЕ ПРЕВРАЩЕНИЯ НИКОТИНА В НОРНИКОТИН В РАСТЕНИЯХ | 2015 |
|
RU2733837C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЙ РЕЦЕПТОР, И РОДСТВЕННЫЕ КОМПОЗИЦИИ | 2019 |
|
RU2835579C2 |
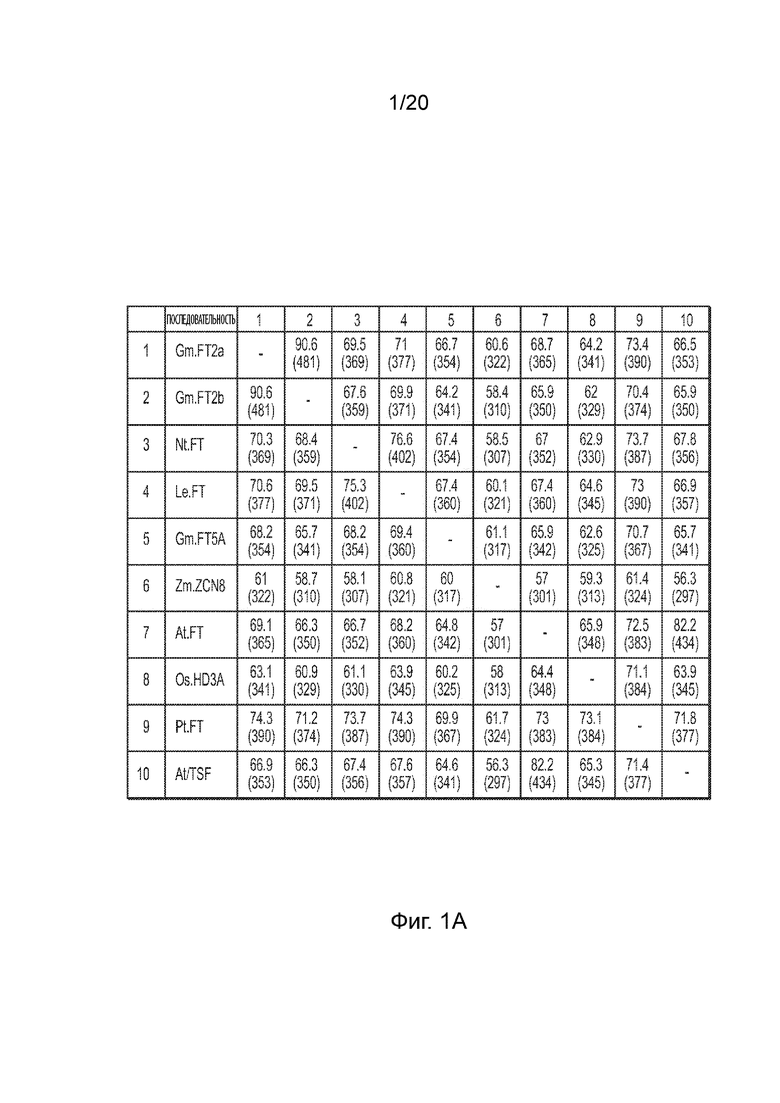
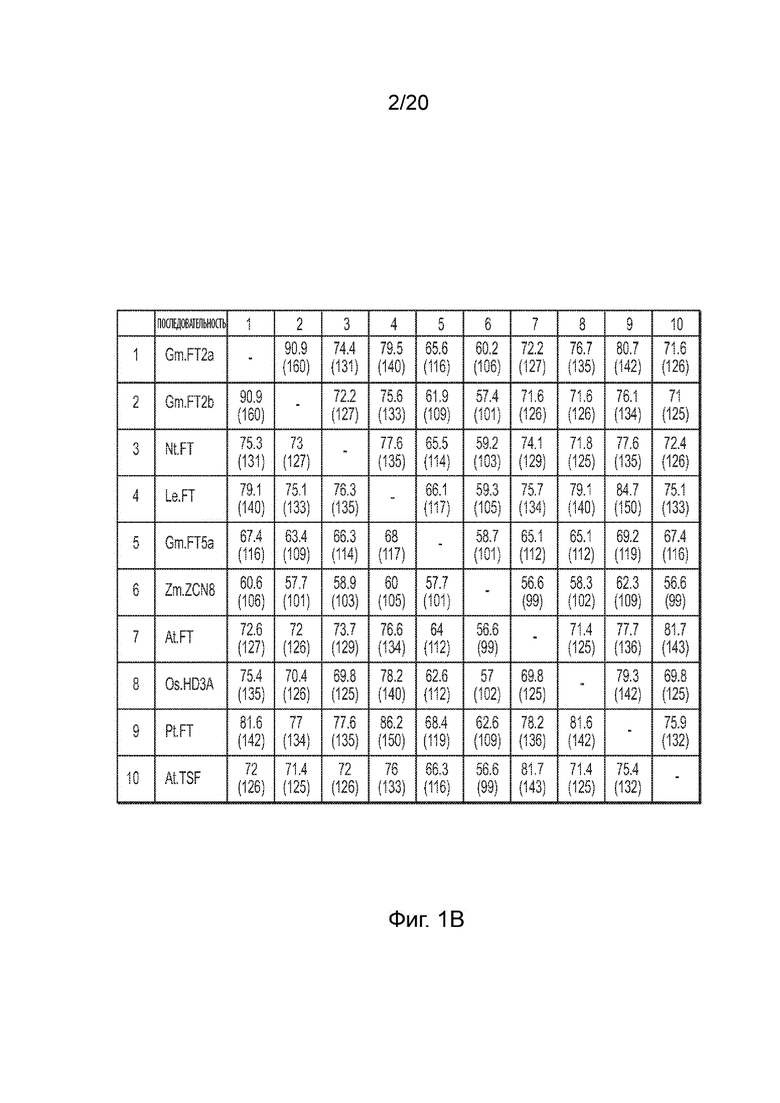


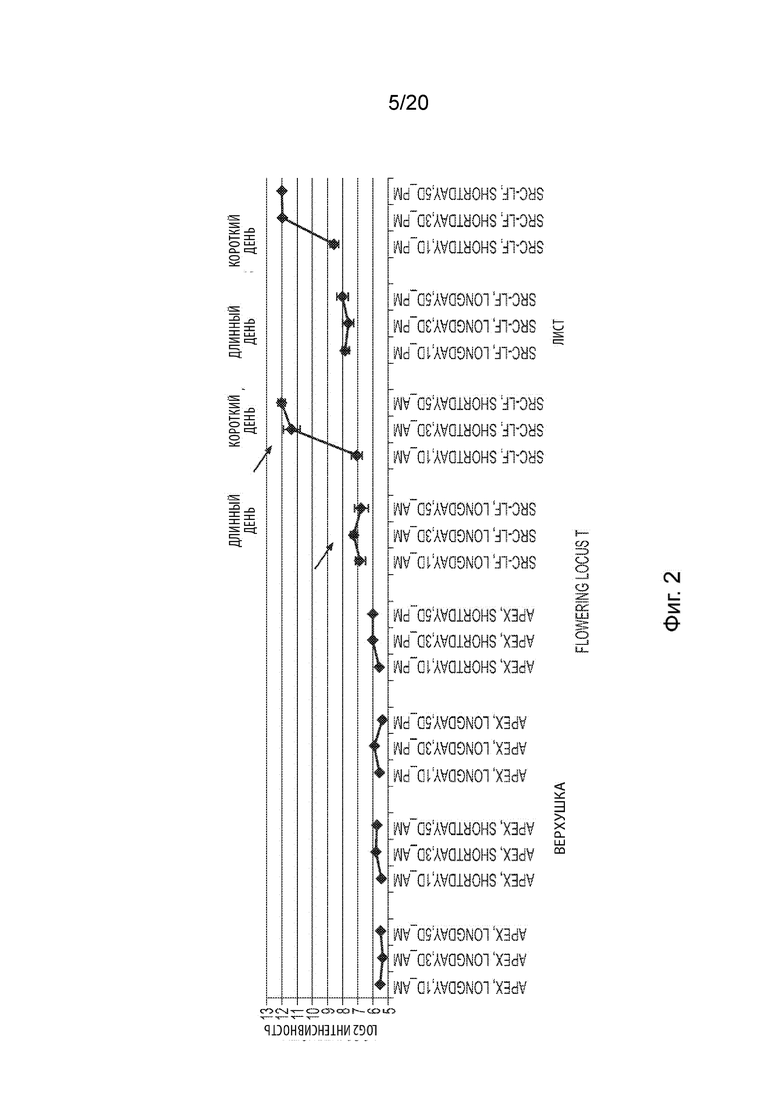
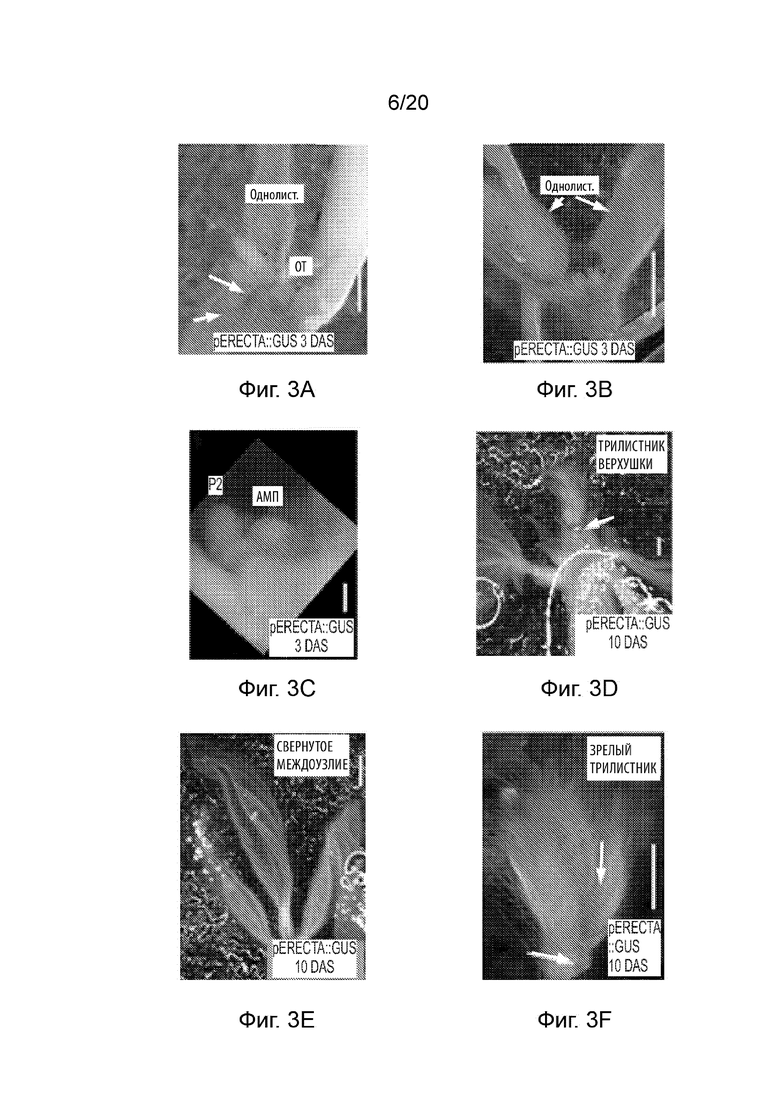
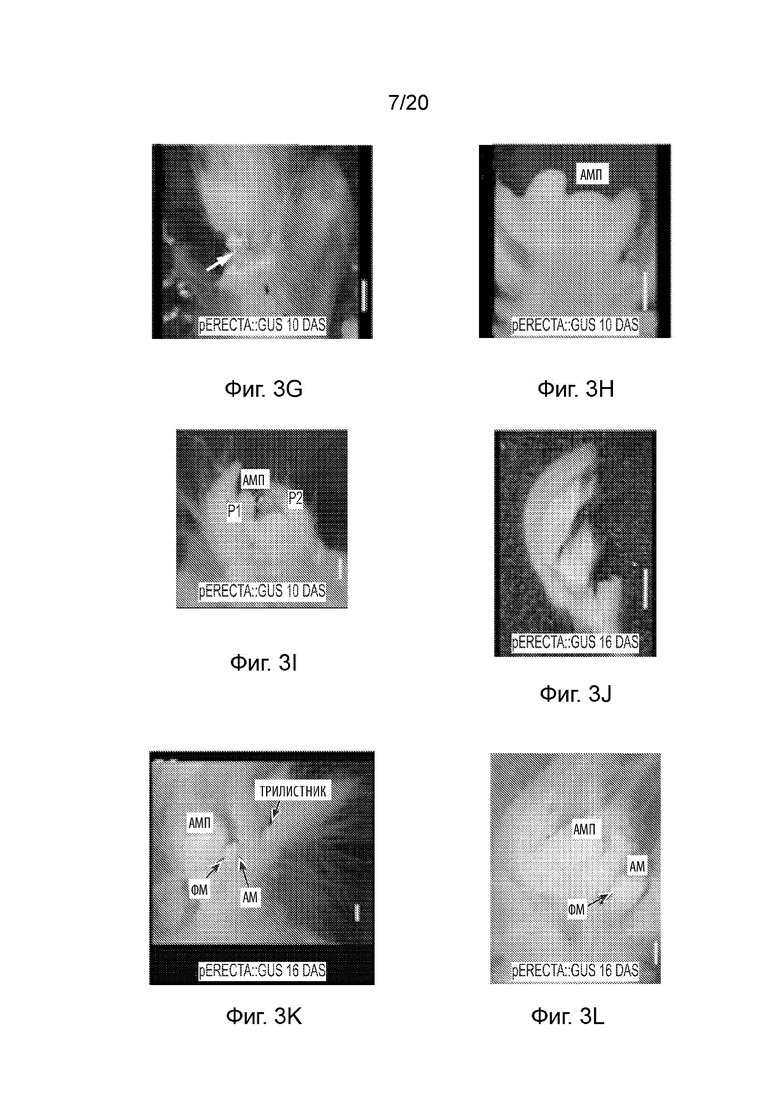
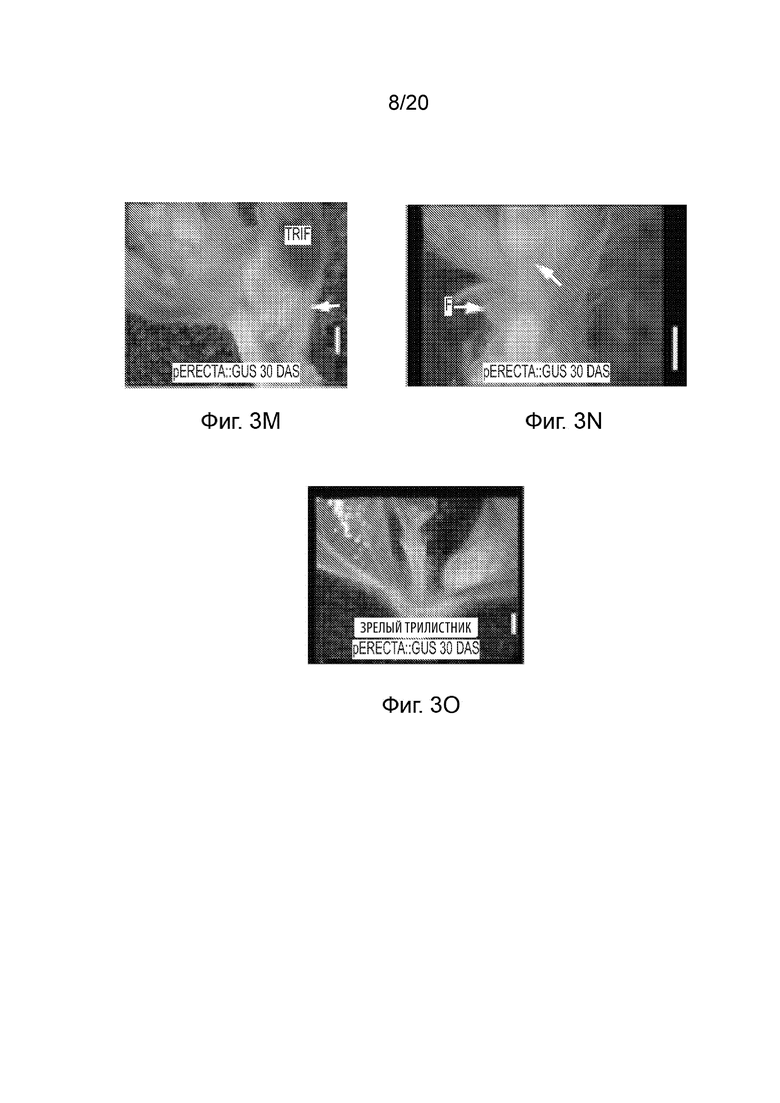
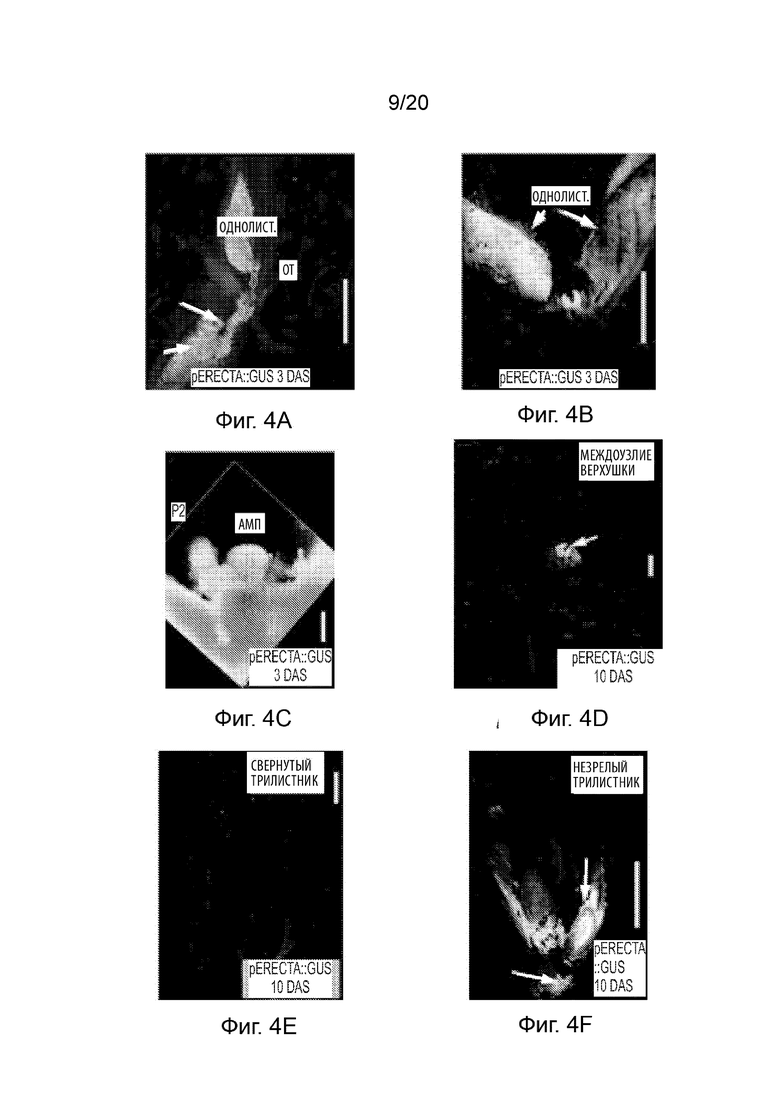
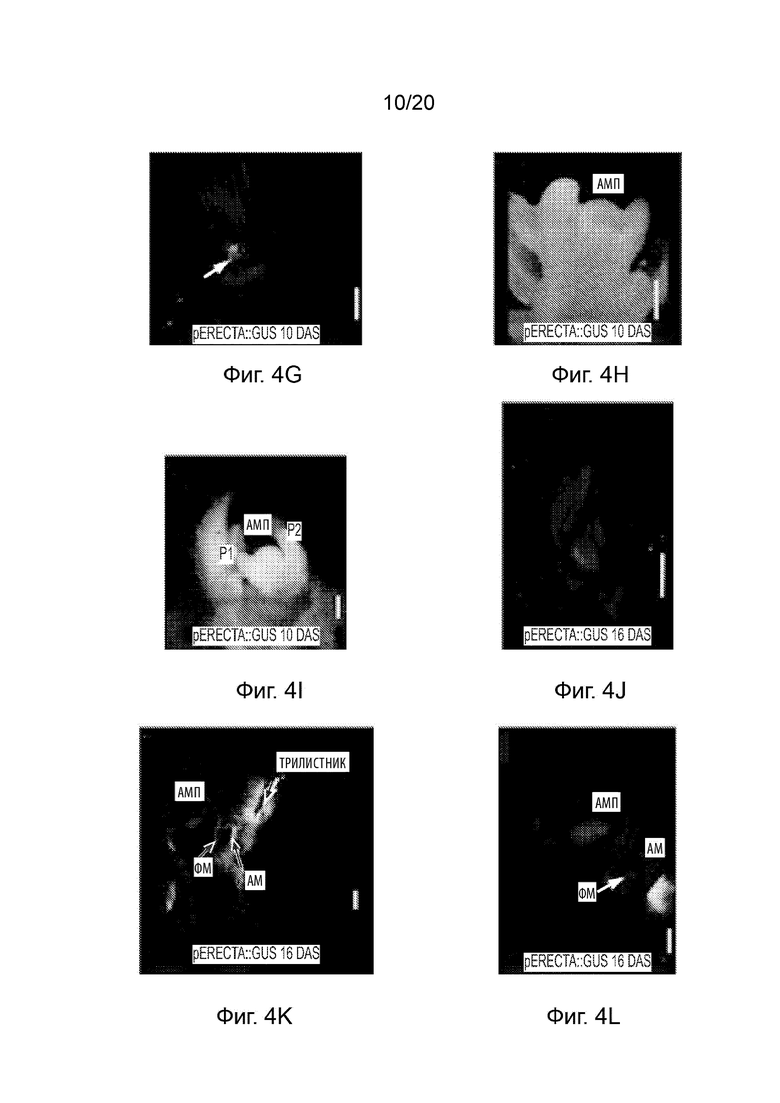

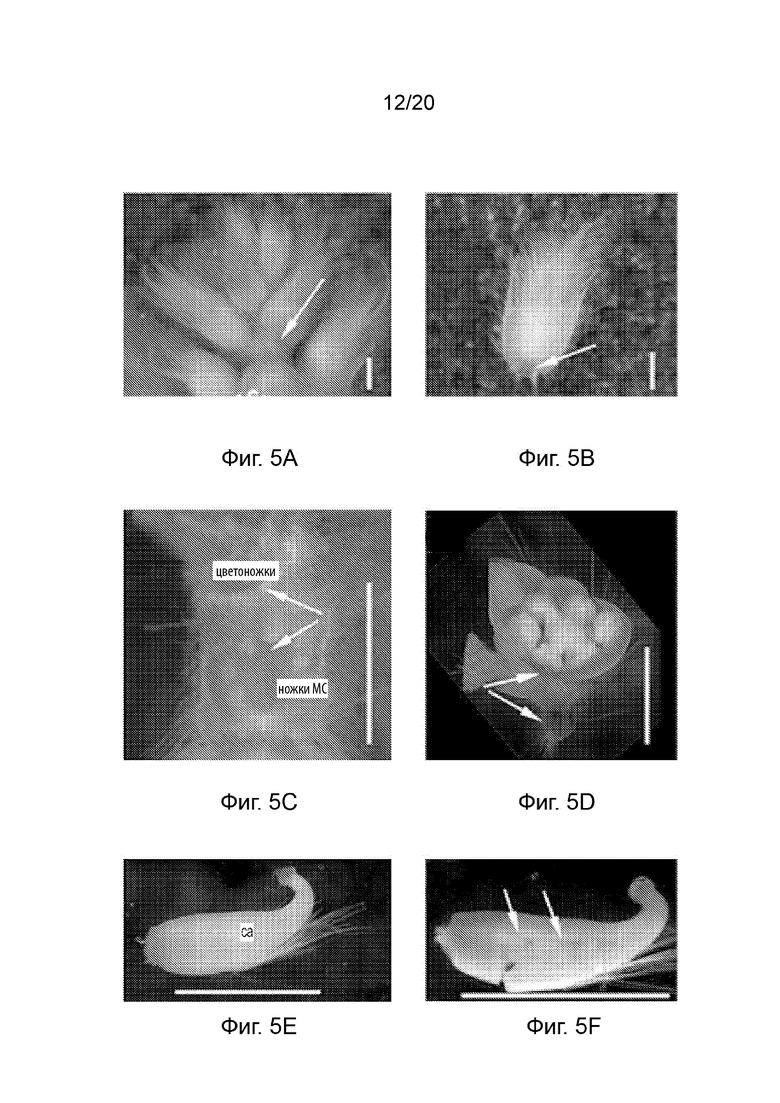
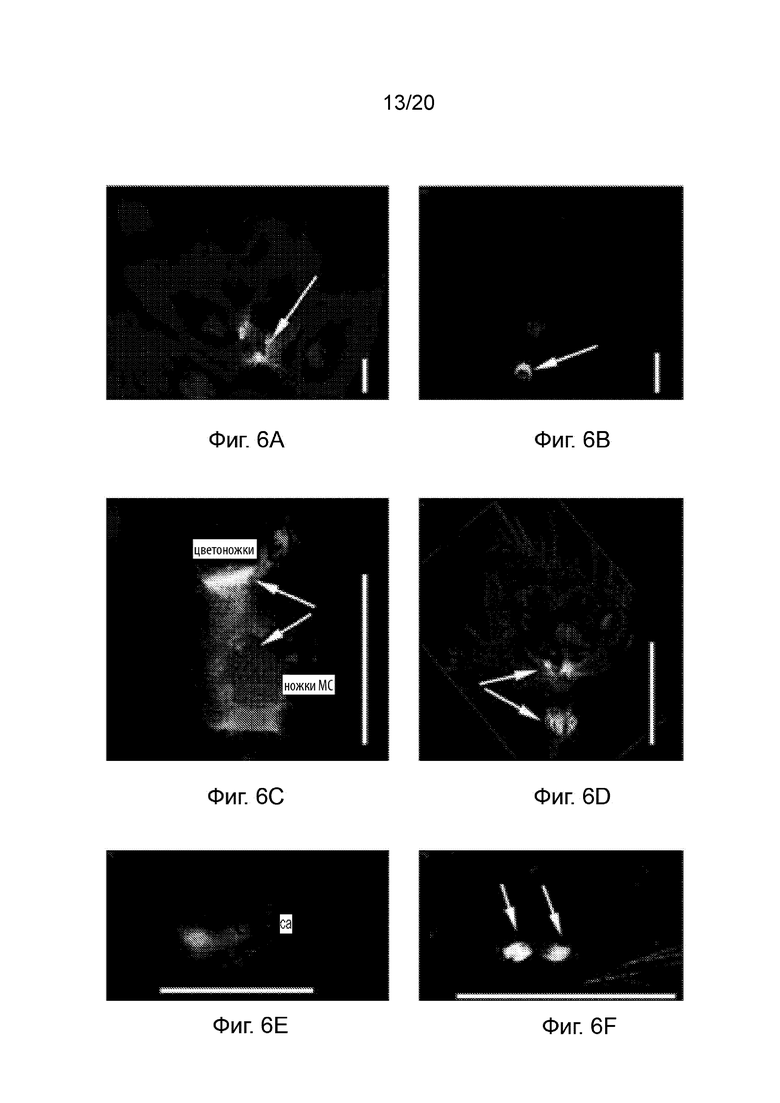
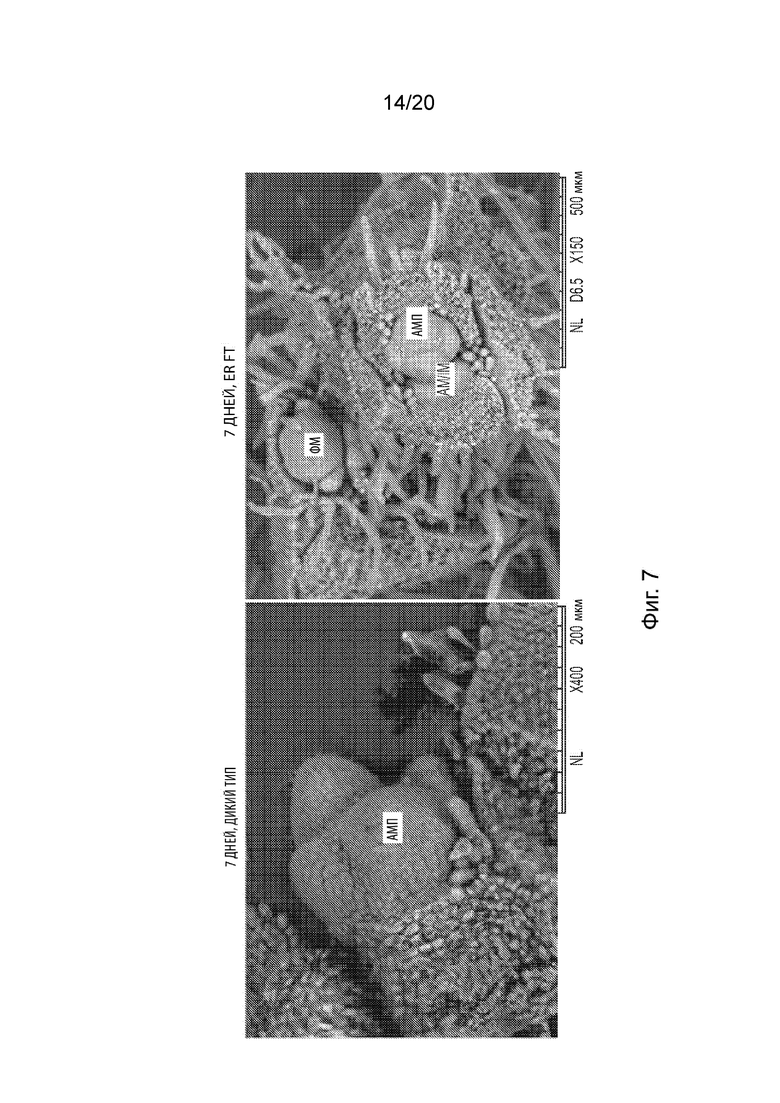
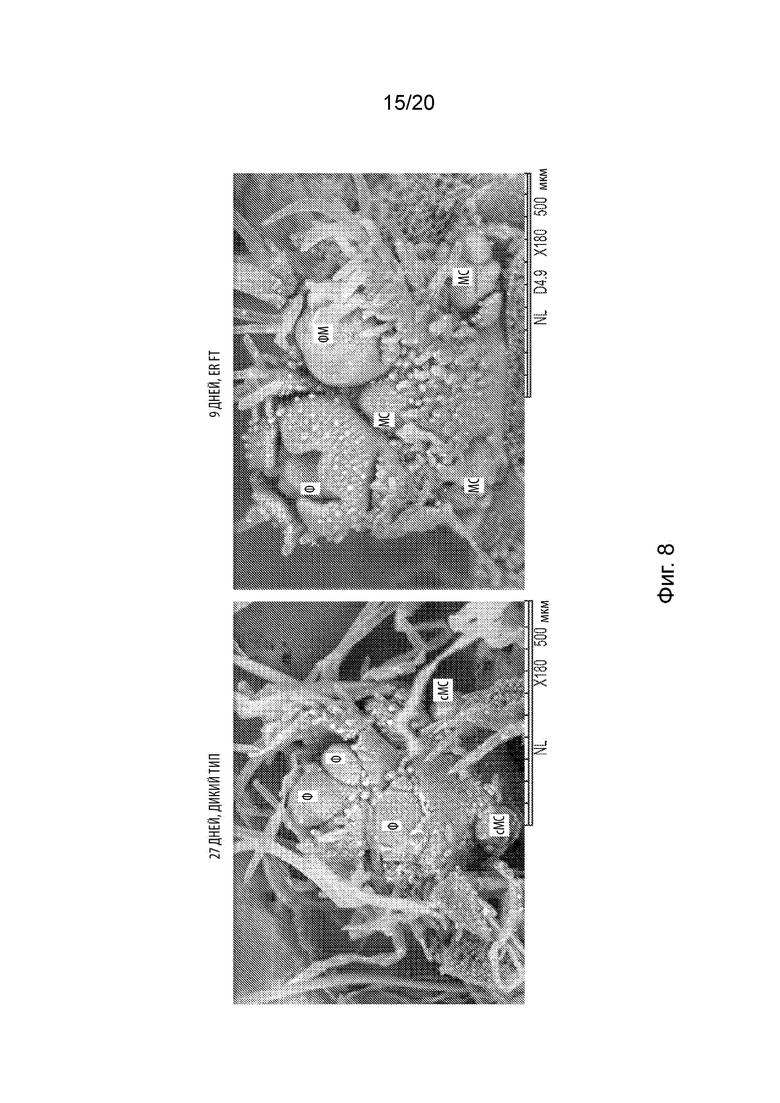
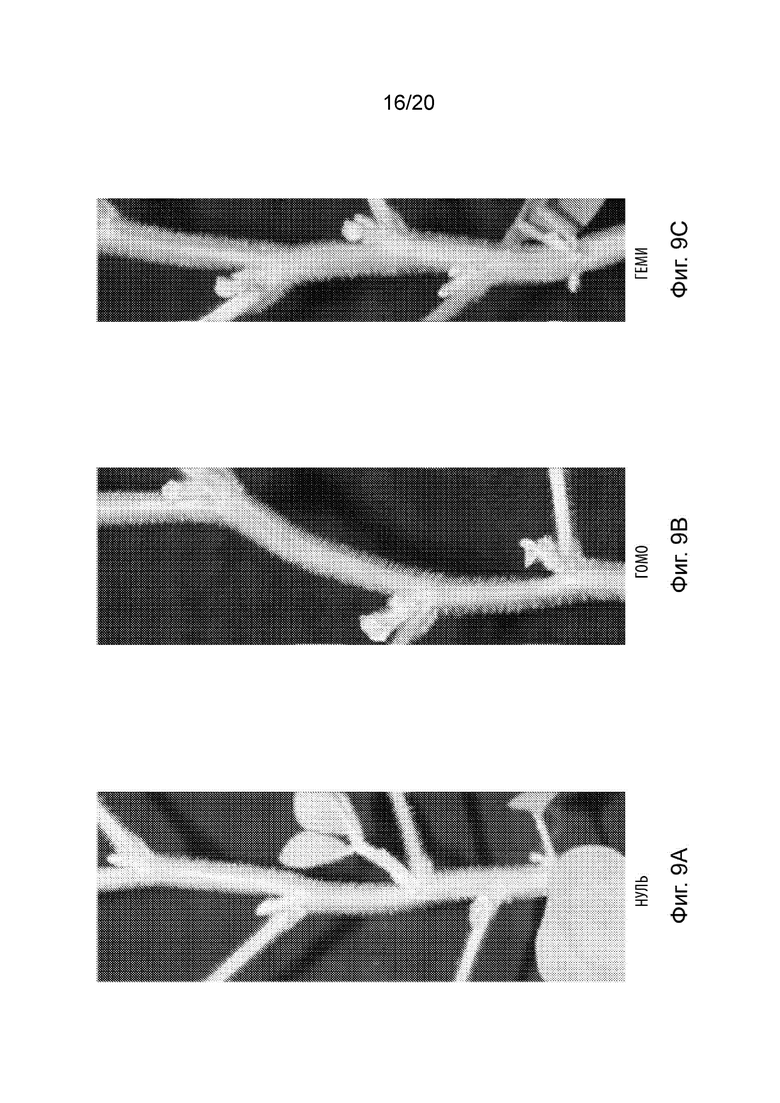




Изобретение относится к области биохимии, в частности к рекомбинантной ДНК-конструкции для модуляции флорального развития в растении. Также раскрыты трансгенное растение и часть указанного трансгенного растения, содержащие указанную ДНК-конструкцию. Изобретение позволяет эффективно ускорять развитие трансгенного растения. 3 н. и 26 з.п. ф-лы, 13 ил., 37 табл., 22 пр.
1. Рекомбинантная ДНК-конструкция для модуляции флорального развития в растении, содержащая первую экспрессионную кассету и вторую экспрессионную кассету, причем первая экспрессионная кассета содержит полинуклеотидную последовательность, кодирующую флоригенный белок FT, содержащий аминокислотную последовательность, имеющую по меньшей мере 90% идентичность последовательности с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28 и 30, или их функциональный фрагмент, функционально связанную с первым промотором, пригодным для экспрессии в растениях, а вторая экспрессионная кассета содержит последовательность ДНК, пригодную для транскрипции, кодирующую молекулу РНК, содержащую нацеливающую последовательность, которая является по меньшей мере на 80% комплементарной по меньшей мере 19 последовательным нуклеотидам полинуклеотидной последовательности первой экспрессионной кассеты, и при этом указанная последовательность ДНК, пригодная для транскрипции, функционально связана со вторым промотором, пригодным для экспрессии в растениях.
2. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что нацеливающая последовательность молекулы РНК является по меньшей мере на 85% комплементарной по меньшей мере 19 последовательным нуклеотидам полинуклеотидной последовательности первой экспрессионной кассеты или мРНК, кодируемой полинуклеотидной последовательностью первой экспрессионной кассеты.
3. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что нацеливающая последовательность молекулы РНК по меньшей мере на 90% комплементарна по меньшей мере 19 последовательным нуклеотидам полинуклеотидной последовательности первой экспрессионной кассеты или мРНК, кодируемой полинуклеотидной последовательностью первой экспрессионной кассеты.
4. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что нацеливающая последовательность молекулы РНК по меньшей мере на 80% комплементарна по меньшей мере 21 последовательному нуклеотиду полинуклеотидной последовательности первой экспрессионной кассеты или мРНК, кодируемой полинуклеотидной последовательностью первой экспрессионной кассеты.
5. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что указанная последовательность ДНК, пригодная для транскрипции, содержит последовательность, которая является по меньшей мере на 80% комплементарной SEQ ID NO: 65, 68 или 69.
6. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что флоригенный белок FT дополнительно содержит одну или более из следующих аминокислот: тирозин или другой незаряженный полярный или неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 85 в SEQ ID NO: 14; лейцин или другой неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 128 в SEQ ID NO: 14; и триптофан или другой большой неполярный остаток в аминокислотной позиции флоригенного белка FT, соответствующей аминокислотной позиции 138 в SEQ ID NO: 14.
7. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что флоригенный белок FT не содержит одну или более из следующих аминокислот: гистидин в аминокислотной позиции, соответствующей лизину или аргинину в аминокислотной позиции, соответствующей позиции 85 в SEQ ID NO: 14; лизин или аргинин в аминокислотной позиции, соответствующей позиции 128 в SEQ ID NO: 14; и серин, аспарагиновую кислоту, глутаминовую кислоту, лизин или аргинин в аминокислотной позиции, соответствующей позиции 138 в SEQ ID NO: 14.
8. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что указанная полинуклеотидная последовательность является по меньшей мере на 60% идентичной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27 и 29.
9. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что указанный первый промотор, пригодный для экспрессии в растениях, содержит полинуклеотидную последовательность, которая является по меньшей мере на 70% идентичной полинуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63 и 64, или ее функциональной части.
10. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что второй промотор, пригодный для экспрессии в растениях, содержит полинуклеотидную последовательность, которая является по меньшей мере на 70% идентичной полинуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, или ее функциональной части.
11. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что второй промотор, пригодный для экспрессии в растениях, содержит полинуклеотидную последовательность, которая является по меньшей мере на 70% идентичной полинуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 и 94, или ее функциональной части.
12. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что первый промотор, пригодный для экспрессии в растениях, является промотором вегетативной стадии, а второй промотор, пригодный для экспрессии в растениях, является промотором поздней вегетативной стадии и/или промотором генеративной стадии.
13. Рекомбинантная ДНК-конструкция по п. 12, отличающаяся тем, что первый промотор, пригодный для экспрессии в растениях, является промотором ранней вегетативной стадии.
14. Рекомбинантная ДНК-конструкция по п. 12, отличающаяся тем, что второй промотор, пригодный для экспрессии в растениях, является предпочтительным промотором генеративной стадии.
15. Рекомбинантная ДНК-конструкция по п. 1, отличающаяся тем, что первый промотор, пригодный для экспрессии в растениях, инициирует выявляемую экспрессию полинуклеотидной последовательности, кодирующей флоригенный белок FT, на более ранней стадии развития, чем та, на которой второй промотор, пригодный для экспрессии в растениях, инициирует выявляемую экспрессию указанной транскрибируемой последовательности ДНК.
16. Трансгенное растение для самомодуляции флорального развития, содержащее вставку рекомбинантной ДНК-конструкции по п. 1 в геноме по меньшей мере одной клетки трансгенного растения.
17. Трансгенное растение по п. 16, отличающееся тем, что указанное трансгенное растение является соей.
18. Трансгенное растение по п. 17, отличающееся тем, что указанное трансгенное растение сои дает больше стручков на узел, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
19. Трансгенное растение по п. 16, отличающееся тем, что указанное трансгенное растение дает больше цветков на узел, чем контрольное растение, не содержащее указанную рекомбинантную ДНК-конструкцию.
20. Трансгенное растение по п. 16, отличающееся тем, что указанное трансгенное растение дает больше семян, семенных коробочек, стручков, фруктов, орехов или бобов на узел трансгенного растения, чем контрольное растение, не содержащее указанную рекомбинантную ДНК-конструкцию.
21. Трансгенное растение по п. 16, отличающееся тем, что указанное трансгенное растение цветет раньше, чем контрольное растение, не содержащее указанную рекомбинантную ДНК-конструкцию.
22. Трансгенное растение по п. 16, отличающееся тем, что указанное трансгенное растение имеет больше цветочных кистей на узел, чем контрольное растение, не содержащее указанную рекомбинантную ДНК-конструкцию.
23. Часть трансгенного растения, содержащая вставку конструкции рекомбинантной ДНК по п. 1 для самомодуляции флорального развития в геноме по меньшей мере одной клетки части трансгенного растения.
24. Часть трансгенного растения по п. 23, отличающаяся тем, что часть трансгенного растения представляет собой часть трансгенного растения сои.
25. Часть трансгенного растения по п. 24, отличающаяся тем, что часть трансгенного растения представляет собой часть растения сои, которое дает больше стручков на узел, чем контрольное растение, не содержащее рекомбинантную ДНК-конструкцию.
26. Часть трансгенного растения по п. 23, отличающаяся тем, что часть трансгенного растения представляет собой часть растения, которое дает больше цветков на узел, чем контрольное растение, не содержащее указанную рекомбинантную ДНК-конструкцию.
27. Часть трансгенного растения по п. 23, отличающаяся тем, что часть трансгенного растения представляет собой часть растения, которое дает больше семян, семенных коробочек, стручков, фруктов, орехов или бобов на узел трансгенного растения, чем контрольное растение, не содержащее указанную рекомбинантную ДНК-конструкцию.
28. Часть трансгенного растения по п. 23, отличающаяся тем, что часть трансгенного растения представляет собой часть растения, которое цветет раньше, чем контрольное растение, не содержащее указанную рекомбинантную ДНК-конструкцию.
29. Часть трансгенного растения по п. 23, отличающаяся тем, что часть трансгенного растения представляет собой часть растения, которое имеет больше цветочных кистей на узел, чем контрольное растение, не содержащее указанную рекомбинантную ДНК-конструкцию.
| Приспособление для очистки, охлаждения, смешивания, поглощения или т.п. воздуха, газов и паров жидкостями | 1926 |
|
SU23910A1 |
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2007 |
|
RU2456278C2 |
| KR 101315345 B1, 08.10.2013 | |||
| US 20140020128 A1, 16.01.2014. | |||
Авторы
Даты
2022-07-06—Публикация
2017-10-18—Подача