Изобретение относится к медицине и ветеринарии, в частности к лекарственным препаратам, применяемым для предотвращения, замедления прогрессирования и/или лечения состояний, опосредованных ферментом дипептидилпептидазой-4, т.е. заболеваний, расстройств или состояний, которые можно лечить или предупреждать путем ингибирования этого фермента.
Дипептидилпептидаза-4 (согласно номенклатуре ферментов IUBMB EC.3.4.14.5, далее - ДПП-4) представляет собой мембраносвязанную сериновую пептидазу, которая локализуется в ряде тканей (кишечник, печень, легкие, почки), а также на Т-лимфоцитах крови, где фермент известен как CD-26. В литературе этот фермент имеет больше количество названий, включая DPP4, DP4, DAP-IV, FAPS, белок 2, образующий комплекс с аденозиндезаминазой, белок, связывающий аденозиндезаминазу (ADAbp), дипептидиламинопептидаза IV; Xaa-Pro-дипептидиламинопептидаза; Gly-Pro-нафтиламидаза; постпролиндипептидил-аминопептидаза IV; лимфоцитарный антиген CD26; гликопротеин GP110; глицилпролинамино-пептидаза; глицилпролинаминопептидаза; Х-пролил-дипептидиламино-пептидаза; pepX; лейкоцитарный антиген CD26; глицилпролил-дипептидиламино-пептидаза; дипептидилпептидгидролаза; глицилпролиламино-пептидаза; дипептидиламинопептидаза IV; аминоацилпролилдипептидиламино-пептидаза; инициирующая Т-клетки молекула Tp103; X-PDAP.
ДПП-4 является неклассической сериновой аминодипептидазой, которая отщепляет дипептиды Xaa-Pro с аминоконца (N-конца) полипептидов и белков. Также известно, что зависимое от ДПП-4 медленное высвобождение дипептидов типа X-Gly или X-Ser происходит в случае некоторых встречающихся в природе пептидов.
Ингибиторы ДПП-4 могут применяться в качестве лекарственных средств для предотвращения, замедления прогрессирования и/или лечения состояний, опосредованных ДПП-4.
В результате исследований выявлен ряд соединений, ингибирующих ДПП-4, которые начали применяться в медицинской практике.
Так, например, известно применение ингибитора дипептидилпептидазы 4 (ДПП-IV) для лечения предотвращения или снижения риска смертности в результате сердечно-сосудистых заболеваний, включающее их введение страдающему субъекту. Также ингибитор вводится для предотвращения или снижения риска несмертельного инфаркта миокарда и/или несмертельного инсульта и/или сахарного диабета. В качестве такого ингибитора используется саксаглиптин, вилдаглиптин, ситаглиптин (EA 201101231 А1, 30.09.2010).
Известно, что использование ингибиторов ДПП-4 способствует восстановлению нарушенной глюкозозависимой секреции инсулина и коррекции повышенного уровня глюкагона - ключевых расстройств, которые характерны для сахарного диабета.
В последние годы особое внимание во всем мире уделяется изучению роли гормонов желудочно-кишечного тракта в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека. Главным образом, вышеперечисленные эффекты обусловлены действием глюкагонподобного пептида-1 (ГПП-1) (Green B.D., Flatt P.R. Incretin hormone mimetics and analogues in diabetes therapeutics // Best Practice & Research Clinical Endocrinology & Metabolism. - 2007. - T. 21. - №. 4. - C. 497-516). Недостатком ГПП-1 является его короткий период жизни (4-5 минут) из-за быстрой инактивации ферментом ДПП-4 (Hansen L., Deacon C.F., Ørskov С. et al. Glucagon-Like Peptide-1-(7-36) Amide Is Transformed to Glucagon-Like Peptide-1-(9-36) Amide by Dipeptidyl Peptidase IV in the Capillaries Supplying the L Cells of the Porcine Intestine 1 // Endocrinology. - 1999. - T. 140. - №. 11. - C. 5356-5363.). Поэтому в клинической практике невозможно использовать ГПП-1 в качестве лекарственного препарата.
Ингибиторы ДПП-4 предотвращают быструю инактивацию эндогенного ГПП-1, тем самым усиливают и пролонгируют его действие. Известные ингибиторы ДПП-4 - глиптины (ситаглиптин (Янувия®), вилдаглиптин (Галвус®), саксаглиптин (Онглиза®) и линаглиптин (Тражента®)), представляют собой малые молекулы, ингибирующие каталитический сайт ДПП-4.
Глиптины, ингибируя ДПП-4, повышают, в частности, концентрацию 2-х известных гормонов семейства инкретинов: ГПП-1 и глюкозозависимого инсулинотропного полипептида. Использование ингибиторов ДПП-4 способствует восстановлению нарушенной глюкозозависимой секреции инсулина и коррекции повышенного уровня глюкагона - ключевых расстройств, которые характерны для сахарного диабета.
Глиптины приводят более чем к 90% ингибированию фермента (Fukuda-Tsuru S. et al. 2012) и, как следствие, значительно снижают образование метаболита ГПП-1 (9-36)амида, за счет которого потенцируется действие основного гормона ГПП-1 (7-36)амида.
Перспективным с точки зрения соотношения безопасности применения и эффективности являются пептидные ингибиторы ДПП-4. Так, для трипептидов, содержащих Trp-Arg-Xaa, IC50 в отношении ингибирования ДПП-4 составляет менее 500 µМ (Lan, Ito, Ito, & Kawarasaki. (2014). Trp-Arg-Xaa tripeptides act as uncompetitive-type inhibitors of human dipeptidyl peptidase IV. Peptides, 54, 166-170). Пептиды, содержащие Trp-Arg-Xaa, проявляют конкурентный тип ингибирования ДПП-4. У конкурентных ингибиторов, чей эффект связан с взаимодействием с субстратом, происходит специфическое ингибирование ДПП-4, что позволяет снизить потенциальные токсические эффекты (Eckhardt, Langkopf, Mark et al. (2007). 8-(3-(R)-Aminopiperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methyl-quinazolin-2-ylmethyl)-3, 7-dihydropurine-2, 6-dione (BI 1356), a highly potent, selective, long-acting, and orally bioavailable dpp-4 inhibitor for the treatment of type 2 diabetes. Journal of medicinal chemistry, 50(26), 6450-6453).
Таким образом, существует высокая потребность в новых ингибиторах ДПП-4.
Задача настоящего изобретения заключается в разработке средства с ингибирующим ДПП-4 действием и создание на его основе средства для предотвращения, замедления прогрессирования и/или лечения состояний, в патогенез которых вовлечен фермент ДПП-4.
Технический результат, обеспечиваемый изобретением, заключается в расширении спектра биологически активных веществ, применяемых для предотвращения, замедления прогрессирования и/или лечения состояний, опосредованных ферментом дипептидилпептидазой-4, т.е. заболеваний, расстройств или состояний, которые можно лечить или предупреждать путем ингибирования этого фермента.
Для решения поставленной задачи предлагается средство для предотвращения, замедления прогрессирования и/или лечения состояний, в патогенез которых вовлечен фермент ДПП-4, содержащее действующее вещество и фармацевтически приемлемый носитель или носители, которое в качестве действующего начала включает миристоил-трипептид или его гидраты, сольваты или соли следующей структуры:
Myr-Trp-Arg-Glu-OH
Для структурных аналогов заявляемого соединения было показано наличие специфической ингибирующей активности в отношении ДПП-4 (Lan et al. 2014). Образование конъюгатов пептидов с жирными кислотами улучшает фармакокинетический профиль и может приводить к улучшению биодоступности при пероральном приеме (Novakovic, Anderson, Grasso. (2014). Myristic acid conjugation of [D-Leu-4]-OB3, a biologically active leptin-related synthetic peptide amide, significantly improves its pharmacokinetic profile and efficacy. Peptides. 62. 176-182). Природные объекты, такие как лосось, мясо крупного рогатого скота и пр., могут также служить источником выделения пептидов, оказывающих ингибирующее действие на ДПП-4 (Li-Chan, Hunag, Jao, Ho, & Hsu. (2012). Peptides derived from Atlantic salmon skin gelatin as dipeptidyl-peptidase IV inhibitors. Journal of Agricultural and Food Chemistry, 60, 973-978; WO 2006068480 A3, Priority date 23.12.2004). Ранее было показано, что комплекс биологически активных веществ, выделенный из гонад морских ежей Strongylocentrotus droebachiensis, содержащий в том числе пептиды, аминокислоты и жирные кислоты, обладает антидиабетическим действием (Пат RU №2520695, С1, приоритет 04.02.2013). Дальнейшее разделение и очистка позволила установить, что липофильный пептид гонад морских ежей S.droebachiensis обладает ингибирующей активностью в отношении ДПП-4. Однако при хранении наблюдалась его деструкция. Для обеспечения стабильности была предпринята попытка синтезировать аналог природного пептида.
Данное средство, обладающее ингибирующим ДПП-4 действием, содержит Myr-Trp-Arg-Glu-OH и фармацевтически приемлемые вспомогательные вещества. Предпочтительно оно предназначено для нормализации уровня инкретинов в крови и/или нормализации функции эндотелиальных клеток.
Предлагаемое средство выполняют в виде различных лекарственных форм, предпочтительно твердых лекарственных форм - таблеток, таблеток с замедленным/пролонгированным высвобождением, капсул, гранул, порошков. В качестве вспомогательных веществ могут быть использованы вещества, обычно применяемые в фармацевтической промышленности для производства твердых лекарственных форм, например крахмал, сахара, целлюлоза и ее производные, желатин, поливинилпирролидон, полиэтиленоксид, фосфат кальция, лубрикант, смачивающий агент, как натрийлаурилсульфат, сложные эфиры полиоксиэтиленсорбитана и жирных кислот (твины), сложные эфиры сорбитана и жирных кислот (спаны), предпочтительно крахмал, в том числе модифицированный, лактоза, микрокристаллическая целлюлоза, натрийкроскарбоксиметилцеллюлоза, поливинилпирролидон, вспомогательные вещества - ингибиторы высвобождения, лубрикант. Примерами последнего являются стеариновая кислота и/или ее соли - стеарат кальция, стеарат магния, стеарат цинка, тальк, коллоидная двуокись кремния, полиэтиленгликоль, гидрогенизованное растительное масло, жидкий парафин. Новая композиция может также содержать ароматизаторы, красители и/или вкусовые добавки.
Предпочтительно препарат изготавливают в форме таблетки, которая может иметь оболочку. Наличие последней улучшает внешний вид, органолептические свойства лекарственной формы, защищает ее от механических повреждений.
Предпочтительное количество действующего начала (Myr-Trp-Arg-Glu-ОН) в единичной дозе составляет: от 1 мг до 50 мг, более предпочтительно 5 мг. В рамках настоящего изобретения термин Myr-Trp-Arg-Glu-OH подразумевает также гидраты, сольваты и соли Myr-Trp-Arg-Glu-OH, например гидрохлорид.
Получение заявляемой лекарственной формы может быть осуществлено в соответствии с известными способами изготовления твердых лекарственных форм. Все способы включают стадию объединения активного ингредиента с носителем, который состоит из одного или более вспомогательных ингредиентов. В общем случае заявляемую фармацевтическую композицию получают путем унифицированного и однородного объединения Myr-Trp-Arg-Glu-OH с жидким или тонкоизмельченным твердым носителем, или с тем и другим, и затем, в случае необходимости, придают продукту требуемую форму, например, методом влажной грануляции с последующим добавлением к сухим гранулам лубриканта, формованием окончательной смеси ингредиентов с образованием лекарственной формы заданной конфигурации и размера, и, при необходимости, нанесением оболочки, или методом прямого прессования с последующим нанесением оболочки.
В основе изобретения лежит неожиданно обнаруженное авторами свойство ранее не описанного соединения Myr-Trp-Arg-Glu-OH в отношении ключевого фермента метаболизма ДПП-4. В результате проведенных исследований Myr-Trp-Arg-Glu-OH был выявлен как средство для ингибирования фермента ДПП-4.
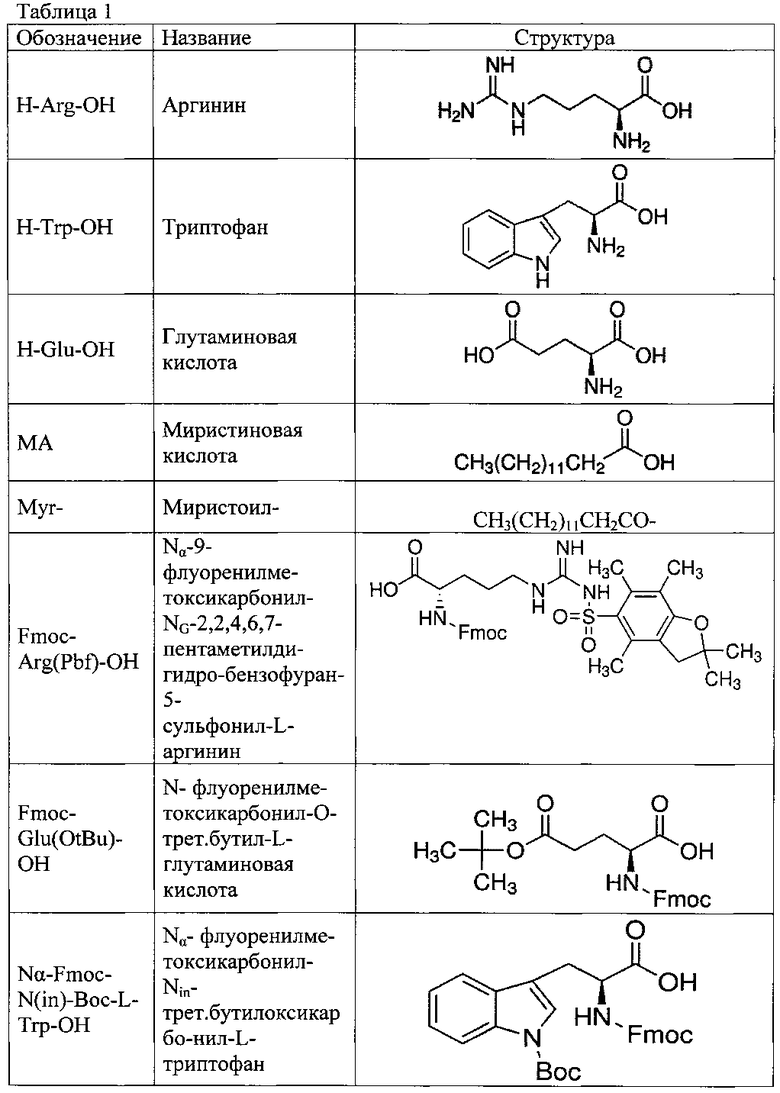
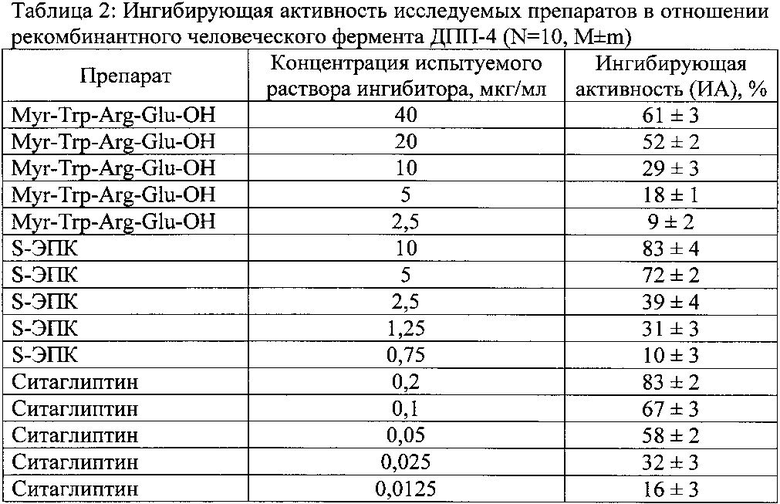
В качестве иллюстративных материалов к описанию приложены результаты масс спектрометрического анализа и хроматографическая чистота (Рисунки 1 и 2).
На рисунке 1 показан масс спектрометрический анализ, подтверждающий структуру миристоил-трипептида (Myr-Trp-Arg-Glu-OH).
На рисунке 2 - ВЭЖХ-хроматограмма заявляемого миристоил-трипептида. Условия анализа: хроматограф Shimadzu (Япония) с колонкой Luna С18 (2) 4,6×150 мм (размер частиц сорбента 5 мкм) и предколонкой (3 мм), заполненной тем же сорбентом (Phenomenex, США) в градиентном режиме элюирования смесью 0,03% раствора трифторуксусной кислоты (фаза А) и ацетонитрила (фаза Б), скорость подачи элюента 1,0 мл/мин, объем проб 20 мкл, длины волн детектирования 210 нм).
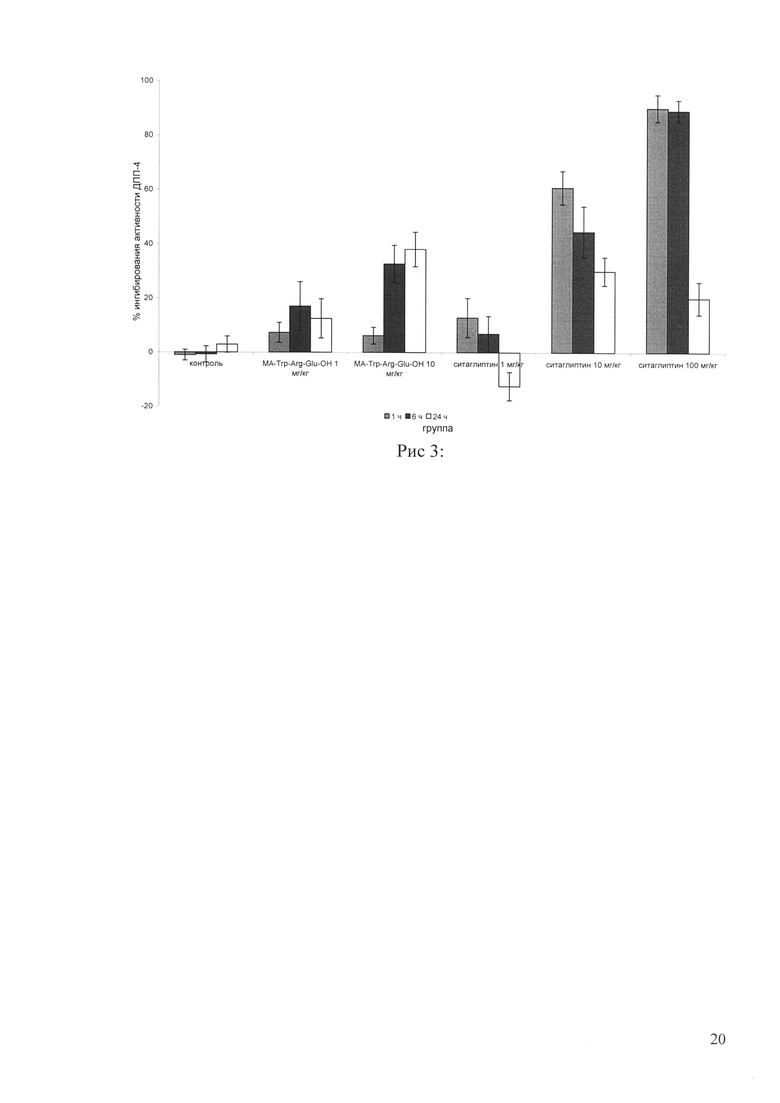
На рисунке 3 - ингибирующая активность исследуемых препаратов.
Фармакологические свойства и способ получения заявляемого в настоящем изобретении миристоил-трипептида (Myr-Trp-Arg-Glu-OH) в литературе не описаны.
Синтез заявляемого миристоил-трипептида осуществляли по нижеследующей методике. Список использованных сокращений представлен в таблице 1.
В реакторе для твердофазного синтеза суспендировали 6.0 г 2-хлортритильной смолы (емкость 1.5 ммоль/г) в 45 мл DCM, выдерживали в течение 5 мин, смолу отфильтровывали, промывали 2×30 мл DCM. К смоле добавляли раствор 4.25 г (10.0 ммоль) Fmoc-Glu(OtBu)-OH и 6 мл (36 ммоль) DIPEA в 30 мл DCM, перемешивали в течение 60 мин при комнатной температуре. Смолу отфильтровывали, промывали 2×30 мл DCM, обрабатывали 2×30 мл смеси DCM/метанол/DIPEA (17:2:1) в течение 10 мин, промывали 2×30 мл DCM и 3×30 мл DMF. В реактор загружали 30 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×30 мл DMF.
В реактор загружали охлажденный (4°C) раствор 12.98 г (20.0 ммоль) Fmoc-Arg(Pbf)-OH, 2.98 г (22.0 ммоль) HOBt и 3.42 мл (22.0 ммоль) DIC в 30 мл DMF, перемешивали в течение 2 час при комнатной температуре. Смолу отфильтровывали, промывали 6×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×30 мл DMF.
В реактор загружали охлажденный (4°C) раствор 10.53 г (20.0 ммоль) Nα-Fmoc-N(in)-Boc-L-Trp-OH, 2.98 г (22.0 ммоль) HOBt и 3.42 мл (22.0 ммоль) DIC в 30 мл DMF, перемешивали в течение 2 час при комнатной температуре. Смолу отфильтровывали, промывали 6×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×30 мл DMF.
В реактор загружали охлажденный (4°C) раствор 4.57 г (20.0 ммоль) миристиновой кислоты (MA), 2.98 г (22.0 ммоль) HOBt и 3.42 мл (22.0 ммоль) DIC в 30 мл DMF, перемешивали в течение 2 час при комнатной температуре. Смолу отфильтровывали, промывали 6×30 мл DMF, 4×30 мл DCM, сушили, добавляли 30 мл смеси TFA/TIS/EDT/H2O (37:1:1:1), выдерживали в течение 4 час при комнатной температуре, отфильтровывали, промывали 3×20 мл трифторуксусной кислотой, объединенные фильтраты упаривали до объема ~20 мл, к остатку добавляли 60 мл сухого эфира. Выпавший осадок отфильтровывали, промывали на фильтре эфиром, сушили. Полученный продукт растворяли в 50 мл воды, раствор замораживали и лиофилизовали. Лиофилизат растворяли в 30 мл воды и наносили на колонку с ионообменной смолой Amberlite IRA-400 (Cl- форма). Колонку промывали водой, фракции, содержащие продукт, объединяли, упаривали до объема ~40 мл и наносили на обращеннофазную колонку Waters X-Bridge С18, 10 мкм, 127 Å, 50×250 мм. Элюирование проводили при скорости потока элюента 50 мл/мин. Фаза А: 0,1% HCl/H2O, B: /ацетонитрил. Градиент: 0% (В)-70% (В) за 70 минут. Фракции, содержащие основной продукт, объединяли, упаривали до объема ~50 мл, замораживали и лиофилизовали. Получено 5.2 г (74%) продукта с чистотой (ВЭЖХ) 95.3%. Масс спектр: вычислено М+ 700.88, получено М+ 700.44. Аминокислотный анализ: аргинин 1.00 (1), глутаминовая кислота 0.95 (1), триптофан 1.00 (1).
Нижеследующие примеры фармакологических исследований подтверждают возможность применения заявленного Myr-Trp-Arg-Glu-OH в качестве средства с ингибирующим ДПП-4 действием.
Пример 1. Определение активности ДПП-4 in vitro с использованием рекомбинантного человеческого фермента и фермента, содержащегося в плазме крови крыс
Определение активности фермента ДПП-4 проводили с использованием в качестве хромогенного субстрата глицил-L-пролин-п-нитроанилида, из которого под действием ДПП-4 образуются дипептид глицил-L-пролин (Гли-Про) и п-нитроанилин. В присутствии ингибиторов ДПП-4 концентрация продуктов реакции снижается. Для определения использовали раствор субстрата с концентрацией 1 ммоль/л (глицил-L-пролин-п-нитроанилида), в 0,1 М Трис-буферном растворе pH=8.0 (рабочий буфер).
Аналитическую часть исследования проводили в 96-луночных планшетах. В ряды лунок вносили 20 мкл плазмы крови крыс или раствора фермента (0,025 МЕ/мл) и 40 мкл рабочего буферного раствора. Затем во все лунки добавляли 40 мкл раствора субстрата для начала реакции, после чего планшет инкубировали 30 мин при 37°C. В течение этого времени измеряли на планшетном спектрофотометре xMark™ Microplate Spectrophotometer (Bio-Rad, USA) оптическую плотность реакционной смеси при 405 нм каждые 5 минут.
После инкубации строили зависимость изменения оптической плотности при 405 нм от времени ферментной реакции D=f (t, мин) для каждого образца. Определяли линейную область изменения оптической плотности и строили линейное уравнение y=а×x+b с коэффициентом регрессии не менее 0,99. Для дальнейших расчетов использовали значение тангенса угла наклона линейной зависимости (tgα, равное значению коэффициента «а»).
Рассчитывали % ингибирующей активности по формуле:
ИА (%)=(tgαконтроль-tgαпроба)∗100/tgαконтроль,
где tgαконтроль - тангенс угла наклона линейной зависимости, полученной для положительного контроля (100% активности фермента); tgαпроба - тангенс угла наклона линейной зависимости, полученной для испытуемых проб (пробы с испытуемыми препаратами и специфическим ингибитором).
По результатам анализа серии растворов исследуемых препаратов с различными концентрациями, для которых значения ИА (%) находятся в диапазоне от 10 до 90% строили зависимость ИА от концентрации препарата (мг/мл). По уравнению регрессии полученной зависимости определяли IC50 - концентрацию исследуемого вещества (мг/мл), вызывающую 50% ингибирование активности ДПП-4.
Для определения использовали плазму крови, полученную от аутбредных крыс-самцов возраста 10-12 недель с массой тела 200-250 г. Кровь забирали постмортально. Эвтаназия осуществлялась с помощью CO2-камеры. Животные находились там до полной потери сознания, затем животное извлекалось, вскрывалась грудная полость, и осуществлялось полное стерильное обескровливание шприцем из полостей сердца.
Кровь забирали в пробирки, в качестве антикоагулянта использовали гепарин. Отобранные пробы крови центрифугировали при 1800 g в течение 20 мин для получения плазмы при температуре +4°C. Замороженную плазму хранили до анализа при -20°C.
Перед началом количественного определения активности ДПП-4 образцы размораживали. В качестве препаратов сравнения использовали ситаглиптин и специфический ингибитор ДПП-4 - S-ЭПК. Ингибирующая активность в зависимости от дозы исследуемых препаратов представлена в таблице 2.
Ингибирующая активность исследуемой субстанции в отношении ДПП-4 плазмы крови человека и лабораторных животных представлена в таблице 3.
Для определения типа ингибирования и расчета константы Михаэлиса Кm применяли графический способ, используя двойные обратные координаты Лайнуивера-Бэрка, т.е. строили зависимости 1/v от 1/[S]. По характеру зависимостей делали вывод о типе ингибирования.
Установили, что Myr-Trp-Arg-Glu-OH проявляет свойства конкурентного ингибитора ДПП-4, при этом расчетное значение Кm на фоне использования Myr-Trp-Arg-Glu-OH составило 0,842, против 0,486 в контрольном эксперименте.
Пример 2. Определение ингибирующей активности Myr-Trp-Arg-Glu-OH in vivo
Исследование ингибирующей активности проводили при внутрижелудочном введении аутбредным крысам-самцам. Было сформировано 7 групп животных по 10 штук в каждой. Myr-Trp-Arg-Glu-OH вводили в трех дозах: 0,1 мг/кг, 1,0 мг/кг и 10 мг/кг. Препарат сравнения ситаглиптин вводили в дозе 100 мг/кг (Fukuda-Tsuru, Anabuki, Abe et al. (2012). A novel, potent, and long-lasting dipeptidyl peptidase-4 inhibitor, teneligliptin, improves postprandial hyperglycemia and dyslipidemia after single and repeated administrations. European journal of pharmacology, 696(1), 194-202) и дополнительно в дозах 1 мг/кг и 10 мг/кг. Активность ДПП-4 оценивали до введения, через 1, 6 и 24 часа после введения объектов. Кровь для анализа отбирали из хвостовой вены в объеме 0,5 мл в гепаринизированные пробирки. Затем центрифугировали в течение 15 минут (1800 g, 4°C). Полученную плазму крови до анализа хранили при температуре -20°C. Аналитическую часть исследования и расчет ингибирующей активности проводили аналогично примеру 1. Результаты определения представлены на рисунке 3.
Введение ситаглиптина в дозе 100 мг/кг приводило к 90% ингибированию через 1 час и 6 часов и уменьшалось до 20% через 24 часа после введения, что согласуются с литературными данными. Однократное введение Myr-Trp-Arg-Glu-OH в дозе 0,1 мг/кг не оказало влияния на активность фермента ДПП-4. Введение Myr-Trp-Arg-Glu-OH в дозе 1 мг/кг оказало ингибирующее действий (17%) через 6 ч. При введении Myr-Trp-Arg-Glu-OH в дозе 10 мг/кг активность фермента была снижена в среднем на 34% и была выраженной в течение суток наблюдения.
Пример 3 Получение таблеток, покрытых оболочкой
Просеянные порошки Myr-Trp-Arg-Glu-OH в количестве 20 г, 162 г микрокристаллической целлюлозы и 6 г кросповидона перемешивают до однородности и увлажняют 40% раствором поливинилпирролидона низкомолекулярного, массу гранулируют, гранулят сушат при 45-55°C до остаточной влаги 2,0-3,0%. Сухое вещество вновь гранулируют, к грануляту добавляют 2 г стеарата магния и таблетируют на таблеточном прессе, получая таблетки-ядра, которые содержат 10 мг Myr-Trp-Arg-Glu-OH.
Состав для желудочно-растворимого покрытия готовят следующим образом. 6,5 г гидроксипропилметилцеллюлозы при перемешивании всыпают в 69,5 г воды и оставляют для набухания при перемешивании. Отдельно готовят раствор полиэтиленгликоля из 3 г, 1 г полисорбата и 12,5 г воды, добавляют в него 4,5 г талька и 3 г титана двуокиси, перемешивают, полученную суспензию добавляют в раствор гидроксипропилметилцеллюлозы. Смесь перемешивают до однородности и используют для нанесения покрытия на таблетки-ядра до получения равномерного покрытия со средним увеличением веса таблетки приблизительно на 2,5-3%.
Пример 4 Мягкие капсулы с кишечнорастворимой оболочкой.
Myr-Trp-Arg-Glu-OH в количестве 333 г растворяют при перемешивании в 1667 г среднецепочечных триглицеридов. Отдельно готовят раствор полисахарида агар-агара и получают мягкие капсулы по 0,3 г с кишечнорастворимым покрытием в соответствии с заявкой 2014142863 (от 23.10.2014).
Таким образом, снижение активности ДПП-4 приводит к стабилизации поступившего извне инкретина, т.е применением Myr-Trp-Arg-Glu-OH можно контролировать расщепление инкретина в крови, чем достигается нормализация уровня инкретинов. Из этого следует возможность применения Myr-Trp-Arg-Glu-OH для предотвращения, замедления прогрессирования и/или лечения состояний/заболеваний, опосредованных ферментом дипептидилпептидазой IV, предпочтительно для нормализации уровня инкретинов в крови и/или нормализации функции эндотелиальных клеток.


| название | год | авторы | номер документа |
|---|---|---|---|
| ГИПОГЛИКЕМИЧЕСКОЕ СРЕДСТВО ПЕПТИДНОЙ СТРУКТУРЫ, ИНГИБИРУЮЩЕЕ ДИПЕПТИДИЛПЕПТИДАЗУ-4 | 2015 |
|
RU2600810C1 |
| ПЕПТИД ДЛЯ ЛЕЧЕНИЯ САХАРНОГО ДИАБЕТА 2-ГО ТИПА И ЕГО ОСЛОЖНЕНИЙ | 2014 |
|
RU2573933C1 |
| ПРОИЗВОДНЫЕ ГЕМИНА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2002 |
|
RU2238950C2 |
| ИНГИБИРУЮЩЕЕ ДИПЕПТИДИЛПЕПТИДАЗУ IV СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2485952C2 |
| Ингибиторы фактора VIIa | 1999 |
|
RU2223967C2 |
| ИНГИБИТОР ДИПЕПТИДИЛПЕПТИДАЗЫ-4 ДЛЯ ЛЕЧЕНИЯ САХАРНОГО ДИАБЕТА 2-ГО ТИПА | 2015 |
|
RU2628573C2 |
| АНАЛЬГЕТИЧЕСКОЕ СРЕДСТВО ПЕПТИДНОЙ СТРУКТУРЫ НА ОСНОВЕ УНДЕКАПЕПТИДА, СОДЕРЖАЩЕГО D-ОКТААРГИНИНОВЫЙ ВЕКТОР | 2013 |
|
RU2541127C1 |
| ПРОИЗВОДНЫЕ ГЕМИНА, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМКОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2009 |
|
RU2415868C1 |
| НОВЫЕ ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОНИЖЕНИЯ КРОВЯНОГО ДАВЛЕНИЯ | 2002 |
|
RU2305553C2 |
| ГЕМИНПЕПТИДЫ, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМКОМПОЗИЦИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ АГЕНТОВ | 2004 |
|
RU2280649C1 |
Изобретение относится к медицине и касается средства для предотвращения, замедления прогрессирования и/или лечения состояний, в патогенез которых вовлечен фермент ДПП-4, содержащего действующее вещество и фармацевтически приемлемый носитель или носители. В качестве действующего начала средство включает миристоил-трипептид Myr-Trp-Arg-Glu-OH или его гидраты, сольваты или соли. Изобретение обеспечивает расширение спектра биологически активных веществ, применяемых для предотвращения, замедления прогрессирования и/или лечения заболеваний, расстройств или состояний, которые можно лечить или предупреждать путем ингибирования фермента дипептидилпептидазы-4. 4 з.п. ф-лы, 4 пр., 3 ил., 3 табл.
1. Средство для предотвращения, замедления прогрессирования и/или лечения состояний, в патогенез которых вовлечен фермент ДПП-4, содержащее действующее вещество и фармацевтически приемлемый носитель или носители, которое в качестве действующего начала включает миристоил-трипептид или его гидраты, сольваты или соли следующей структуры:
Myr-Trp-Arg-Glu-OH
2. Средство по п. 1, отличающееся тем, что представляет собой одну из следующих лекарственных форм, пригодных для перорального или парентерального применения: сублингвальные таблетки, таблетки и капсулы, раствор для инъекций, назальный спрей, назальные капли, суббукальный пластырь, ректальные суппозитории.
3. Средство по п. 1 или 2, отличающееся тем, что количество действующего начала (Myr-Trp-Arg-Glu-OH) в единичной дозе средства составляет: от 1 мг до 50 мг, более предпочтительно 5 мг.
4. Средство по п. 1 или 2, отличающееся тем, что действующее вещество находится в виде его соли - гидрохлорида.
5. Средство по п. 1 или 2, отличающееся тем, что оно дополнительно содержит фармацевтически приемлемые вспомогательные вещества.
| LAN VT., et al., Trp-Arg-Xaa tripeptides act as uncompetitive-type inhibitors of human dipeptidyl peptidase IV.Peptides | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| SCHON E., et al., Dipeptidyl peptidase IV in the immune system | |||
| Effects of specific enzyme inhibitors on activity of dipeptidyl peptidase IV and | |||
Авторы
Даты
2016-07-10—Публикация
2015-08-20—Подача