Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и наборам для прогнозирования риска дыхательной недостаточности, почечной недостаточности или тромбопении у пациента, страдающего сепсисом.
Предшествующий уровень техники
Сепсис является клиническим синдромом, осложняющим тяжелую инфекцию и характеризующимся системным воспалением и широко распространенным повреждением тканей, и, таким образом, является основной причиной поступления и смертности в некардиологических отделениях интенсивной терапии (ОИТ). Обычными возбудителями являются грамотрицательные организмы, стафилококки и менингококки. Различают три стадии воспалительного ответа с прогрессивно повышающимся риском недостаточности органов-мишеней и гибели: сепсис, тяжелый сепсис и септический шок. Тяжелый сепсис является сепсисом, сопровождающимся признаками недостаточности по меньшей мере одного органа. Сердечно-сосудистая недостаточность обычно проявляется снижением давления, дыхательная недостаточность - гипоксемией, почечная недостаточность - олигурией, а гематологическая недостаточность - коагулопатией.
Соответственно, необходимы способы прогнозирования риска дыхательной недостаточности, почечной недостаточности или тромбопении у пациента, страдающего сепсисом.
Результаты недавних исследований позволили предположить, что у пациентов, страдающих сепсисом, уровень эндокана в крови связан с тяжестью и исходом заболевания у пациентов и может представлять новый маркер дисфункции эндотелиальных клеток (Scherpereel A., Depontieu F., Grigoriu В., Cavestri В., Tsicopoulos A., Gentina Т., Jourdain M., Pugin J., Tonnel A.B., Lassalle P. Endocan, a new endothelial marker in human sepsis. Crit, Care Med. 2006 Feb; 34(2): 532-7 («Эндокан, новый эндотелиальный маркер сепсиса у человека»)). Однако роль эндокана в прогнозировании риска дыхательной недостаточности, почечной недостаточности и тромбопении у пациента, страдающего сепсисом, еще не исследована.
Изложение сущности изобретения
Настоящее изобретение относится к способу прогнозирования риска органной недостаточности, выбранной из группы, состоящей из дыхательной недостаточности, почечной недостаточности и тромбопении, у пациента, страдающего сепсисом, включающему этап, состоящий из измерения концентрации эндокана в образце крови, полученном у указанного пациента, страдающего сепсисом.
Подробное описание изобретения
Авторы изобретения показали, что уровень эндокана в крови представляет инструмент для прогнозирования дыхательной недостаточности, и/или почечной недостаточности, и/или тромбопении у пациентов, страдающих сепсисом.
Соответственно, настоящее изобретение относится к способу прогнозирования риска развития органной недостаточности, выбранной из группы, состоящей из дыхательной недостаточности, почечной недостаточности и тромбопении, у пациента, страдающего сепсисом, включающему этап, состоящий из измерения концентрации эндокана в образце крови, полученном у указанного пациента, страдающего сепсисом.
Как применяется здесь, термин «пациент, страдающий сепсисом», означает пациента, страдающего тяжелым сепсисом или септическим шоком.
Как применяется здесь, термин «дыхательная недостаточность» имеет значение, общепринятое в данной области техники, и определяется как неспособность дыхательной системы выполнять свою роль, то есть поддерживать нормальный гемостаз (трансформацию венозной крови, богатой CO2, в артериальную кровь, богатую O2). Дыхательная недостаточность развивается, когда скорость газообмена между атмосферой и кровью не соответствует метаболическим потребностям организма.
Как применяется здесь, термин «почечная недостаточность» имеет значение, общепринятое в данной области техники, и описывает медицинское состояние, когда почки не могут адекватно фильтровать токсины и отходы жизнедеятельности из крови.
Как применяется здесь, термин «тромбопения» имеет значение, общепринятое в данной области техники, и описывает аномальное снижение числа тромбоцитов в крови.
Как применяется здесь, термин «эндокан» или «ESM-1» имеет значение, общепринятое в данной области техники, и относится к эндотелиоцит-специфичной молекуле-1, которая является 50-кДа дерматан-сульфатным протеогликаном, экспрессируемым эндотелиальными клетками в легких и почках (Lassalle P., Molet S., Janin A., et al: ESM-1 is a novel human endothelial cell-specific molecule expressed in lung and regulated by cytokines. J. Biol. Chem. 1996; 271: 20458-20464 («ESM-1 является новой эндотелиоцит-специфичной молекулой человека, экспрессируемой в легких и регулируемой цитокинами»)), и которую можно обнаружить в крови человека (Bechard D., Meignin V., Scherpereel A., et al: Characterization of the secreted form of endothelial-cell-specific molecule 1 by specific monoclonal antibodies. J. Vase. Res. 2000; 37:417-425 («Характеристика избранной формы эндотелиоцит-специфичной молекулы-1 с помощью специфических моноклональных антител»); Bechard D., Gentina Т., Delehedde M., et al: Endocan is a novel chondroitin sulfate/dermatan sulfate proteoglycan that promotes hepatocyte growth factor/scatter factor mitogenic activity. J Biol Chem 2001; 276:48341-48349 («Эндокан является новым хондроитин-сульфатным/дерматан-сульфатным протеогликаном, стимулирующим митогенную активность фактора роста гепатоцитов/рассеивающего фактора»).
Как применяется здесь, термин «образец крови» относится к образцу цельной крови, сыворотки или плазмы. Обычно образец крови готовят при поступлении пациента в отделение интенсивной терапии (ОИТ) с тяжелым сепсисом и септическим шоком.
Как только образец крови приготовлен, можно измерить концентрацию ESM-1 любым способом, известным в данной области техники. Например, концентрацию ESM-1 можно измерить с помощью стандартных электрофоретических и иммунодиагностических методик, включая такие иммунологические методы, как конкурентный анализ, прямой анализ или сэндвич-анализ. Такие методы включают вестерн-блоттинг, тесты агглютинации; меченые или опосредованные ферментами иммуноанализы, такие как ИФА; анализы в системах биотина/стрептавидина; радиоиммуноанализы; иммуноэлектрофорез, иммунопреципитацию, высокоэффективную жидкостную хроматографию (ВЭЖХ), эксклюзионную хроматографию, твердофазовую аффинную хроматографию и т.д., но не ограничиваются ими.
В частном варианте осуществления такие способы включают обеспечение контакта образца крови с партнером связывания, способным к избирательному взаимодействию с ESM-1, присутствующим в образце крови.
Партнер связывания может в целом быть антителом, которое может быть поликлональным или моноклональным, предпочтительно моноклональным. Поликлональные антитела к ESM-1 можно получить с помощью известных способов, посредством введения подходящего антигена или эпитопа животному, выбранному, например, из свиней, коров, лошадей, кроликов, коз, овец и мышей, среди прочего. Различные адъюванты, известные в данной области техники, можно применять для усиления выработки антител. Хотя антитела, пригодные в осуществлении изобретения, могут быть поликлональными, предпочтительными являются моноклональные антитела. Моноклональные антитела к ESM-1 можно приготовить и выделить с применением любой методики, обеспечивающей получение молекул антител с помощью постоянных клеточных линий в культуре. Методики получения и выделения включают гибридомную технологию, исходно описанную Kohler and Milstein (1975); методику B-клеточной гибридомы человека (Cote et al., 1983); и методику ЭБВ-гибридомы (Cole et al. 1985), но не ограничиваются ими. Альтернативно, методики, описанные для получения одноцепочечных антител (см., например, патент США № 4,946,778), можно приспособить для получения анти-ESM-1 одноцепочечных антител. Антитела, пригодные для осуществления настоящего изобретения, также включают анти-ESM-1 фрагменты, включая F(ab′)2 фрагменты, которые можно получить при расщеплении пепсином интактной молекулы антитела, и Fab фрагменты, которые можно получить путем восстановления дисульфидных мостиков F(ab′)2 фрагментов, но не ограничиваются ими. Альтернативно, можно получить Fab и/или scFv библиотеки экспрессии для обеспечения быстрой идентификации фрагментов, обладающих необходимой специфичностью к ESM-1. Например, можно применить фаговый дисплей антител. В таком методе одноцепочечные Fv (scFv) или Fab фрагменты экспрессируют на поверхности подходящего бактериофага, например, M13. Вкратце, извлекают клетки селезенки подходящего организма-носителя, например мыши, иммунизированного белком. Получают кодирующие области VL и VH цепей из клеток, продуцирующих необходимые антитела к белку. Эти кодирующие области затем сливают с концевыми участками фаговой последовательности. Как только фаг вставляют в подходящий носитель, например бактерию, фаг воспроизводит фрагмент антитела. Фаговые дисплеи антител можно также обеспечить путем комбинации способов, известных в данной области техники. Фрагменты антител, воспроизводимые фагом, затем можно использовать как часть иммуноанализа.
Анти-ESM-1 моноклональные антитела коммерчески поставляются Lunginnov (Лилль, Франция). Например, антитело к эндокану человека/ESM-1 антитело MEP08 выявляет N-концевой участок эндокана человека (Bechard et al. (2000) J. Vase. Res. 37:417-425; Grigoriu et al. (2006) Clin. Cancer Res. 12:4575-4582; Maurage et al. (2009) Exp. Neurol. 68:836-844; Leroy et al. (2010) Histopathology 56:180-187; Sarrazin et al. (2010) J. Cane. Sci. Ther. 2:47-52). Антитело к эндокану человека / ESM-1 антитело, клон MEP19 выявляет C-концевой участок эндокана человека (Bechard et al. (2000) J. Vase. Res. 37:417-425; Grigoriu et al. (2006) Clin. Cancer Res. 12:4575-4582; Maurage et al. (2009) Exp. Neurol. 68:836-844; Leroy et al. (2010) Histopathology 56:180-187; Sarrazin et al. (2010a) J. Cane. Sci. Ther. 2:47-52; и Sarrazin et al. (2010b) Glycobiology 20:1380-1388).
В другом варианте осуществления партнер связывания может быть аптамером. Аптамеры являются классом молекул, представляющим альтернативу антителам с точки зрения распознавания молекул. Аптамеры являются олигонуклеотидными или олигопептидными последовательностями, способными распознавать фактически любой класс целевых молекул с высокой аффинностью и специфичностью. Такие лиганды могут быть выделены посредством систематической эволюции лигандов путем экспоненциального обогащения (SELEX) библиотеки случайной последовательности, как описано Tuerk C. and Gold L., 1990. Библиотеку случайной последовательности получают путем комбинаторного химического синтеза ДНК. В этой библиотеке каждый член является линейным олигомером уникальной последовательности, в итоге химически модифицированным. Возможные модификации, применение и преимущества данного класса молекул описаны в Jayasena S.D., 1999. Пептидные аптамеры состоят из конформационно ограниченных вариабельных участков антител, выявляемых белком молекулярной платформы, таким как тиоредоксин A из E. coli, выбранных из комбинаторных библиотек двухгибридными способами (Colas et al., 1996).
Партнеры связывания из настоящего изобретения, такие как антитела или аптамеры, могут быть мечеными выявляемой молекулой или веществом, таким как флуоресцентная молекула, радиоактивная молекула, или любыми другими метками, известными в данной области техники. Метки, известные в данной области техники, в целом обеспечивают сигнал (напрямую или опосредованно).
Как применяется здесь, термин «меченый», по отношению к антителу, охватывает прямое мечение антитела или аптамера путем связывания (т.е. физического соединения) обнаруживаемой субстанции, такой как радиоактивный агент или флюорофор (например, флюоресцеин изотиоцианат (ФИТЦ) или фикоэритрин (ФЭ) или индоцианин (Су5)), с антителом или аптамером, а также непрямое мечение зонда или антитела посредством реакции с обнаруживаемым веществом. Антитело или аптамер можно метить радиоактивной молекулой с помощью любого способа, известного в данной области техники. Например, радиоактивные молекулы включают радиоактивные атомы для сцинтиграфических исследований, такие как I123, I124, In111, Re186, Re188, но не ограничиваются ими.
Вышеупомянутые способы анализа в целом включают связывание партнера связывания (т.е. антитела или аптамера) на твердой подложке. Твердые подложки, которые можно применять для осуществления настоящего изобретения, включают такие субстраты, как нитроцеллюлоза (например, в форме мембраны или лунки планшета для микротитрования); поливинилхлорид (например, листы или лунки планшета для микротитрования); полистирольный латекс (например, бусы или планшеты для микротитрования); поливинилфторид; диазотированная бумага; нейлоновые мембраны; активированные бусы, магнитно-чувствительные бусы, и тому подобное.
В частности, можно применять метод ИФА, в котором ячейки планшета для микротитрования покрывают набором антител к ESM-1. Образец крови, содержащий или способный содержать ESM-1, затем добавляют к покрытым ячейкам. После периода инкубации, достаточного для формирования комплексов антиген-антитело, планшет(ы) можно отмыть для удаления несвязавшихся компонентов и добавить вторичную связываемую молекулу с выявляемой меткой. Проводят реакцию вторичной связываемой молекулы с любым маркерным белком связанного образца, планшет отмывают и выявляют присутствие вторичной связанной молекулы с применением способов, хорошо известных в данной области техники.
Обычно применяют ИФА набор, поставляемый Lunginnov (Лилль, Франция); EndoMark H1® (ИФА набор для выявления эндокана человека). Другие ИФА методы описаны в: Bechard et al. (2000) J. Vase. Res. 37:417-425; Grigoriu et al. (2006) din. Cancer Res. 12:4575-4582; Leroy et al. (2010) Histopathology 56:180-187; Sarrazin et al. (2006) BBA Reviews 1765:25-37; Sarrazin et al. (2010a) J. Cane. Sci. Ther. 2:47-52; Scherpereel et al. (2003) Cancer Res. 63:6084-6089; Scherpereel et al. (2006) Crit. Care Med. 34(2):532-537.
Измерение концентрации ESM-1 (с помощью методов на основе иммуноанализа, или без них) может также включать разделение белков; центрифугирование на основе молекулярной массы белков; электрофорез на основе массы и заряда; ВЭЖХ на основе гидрофобности; эксклюзионную хроматографию на основе размера; и твердофазовое аффинное разделение на основе аффинности белков к конкретной используемой твердой фазе. После разделения ESM-1 можно идентифицировать на основе известного «профиля разделения», например времени удерживания, для белка и измерить с помощью стандартных методик. Альтернативно, разделенные белки можно обнаружить и определить, например, с помощью масс-спектрометра.
Способ в соответствии с настоящим изобретением особо пригоден для прогнозирования органной недостаточности, в частности дыхательной недостаточности, в течение 48-72 часов после поступления в ОИТ пациентов с тяжелым сепсисом и септическим шоком.
Способ в соответствии с настоящим изобретением может дополнительно включать этап сравнения концентрации ESM-1 с предварительно определенным пороговым значением. Данное сравнение указывает на то, подвержен ли пациент риску дыхательной недостаточности, почечной недостаточности или тромбопении. Например, предварительно определенное пороговое значение представляет концентрацию, измеренную в среднем у здоровых пациентов, а именно у пациентов, у которых не развивается органная недостаточность. Обычно концентрация ниже предварительно определенного порогового значения, выявленного у здоровых пациентов, прогнозирует органную недостаточность, в частности дыхательную недостаточность, в течение 48-72 часов после поступления в ОИТ пациентов с тяжелым сепсисом и септическим шоком.
Таким образом, способ из настоящего изобретения можно применять для классификации пациентов, страдающих сепсисом, и затем можно применять для выбора точного лечения в отделении интенсивной терапии. Например, пациенты, подверженные высокому риску развития дыхательной недостаточности, почечной недостаточности или тромбопении, могут получать более интенсивное лечение и наблюдение, по сравнению с пациентами, менее подверженными этому риску. Таким образом, такой способ может помогать врачу в выборе терапевтического лечения, которое может, соответственно, состоять в применении правильных лекарств пациентам. Таким образом, можно приспособить затраты на лечение к пациентам, поступившим в отделение интенсивной терапии, и соответственно, способ из настоящего изобретения может представлять полезный инструмент для управления такими отделениями. Наконец, способ из настоящего изобретения можно применять для контроля терапевтического исхода пациентов, страдающих сепсисом.
Другая задача настоящего изобретения относится к применению ESM-1 в качестве маркера дыхательной недостаточности, почечной недостаточности или тромбопении у пациента, страдающего сепсисом.
Другая задача настоящего изобретения относится к набору для прогнозирования риска развития органной недостаточности, выбранной из группы, состоящей из дыхательной недостаточности, почечной недостаточности или тромбопении, включающему средства измерения концентрации ESM-1. Набор может включать антитело или набор антител, как описано выше. В частном варианте осуществления антитела из набора антител являются мечеными, как описано выше. Набор может также содержать другие упакованные подходящим образом реагенты и материалы, необходимые для конкретного протокола определения, включая твердофазные матрицы, если они применяются, и стандарты. Набор может также содержать средства для определения других маркеров органной недостаточности, такие как C-реактивный белок (СРБ) или прокальцитонин (ПКТ), ИЛ-6, ФНОα.
Изобретение далее иллюстрировано следующими чертежами и примерами. Однако эти примеры и фигуры не должны интерпретироваться как ограничивающие каким-либо образом объем настоящего изобретения.
Чертежи
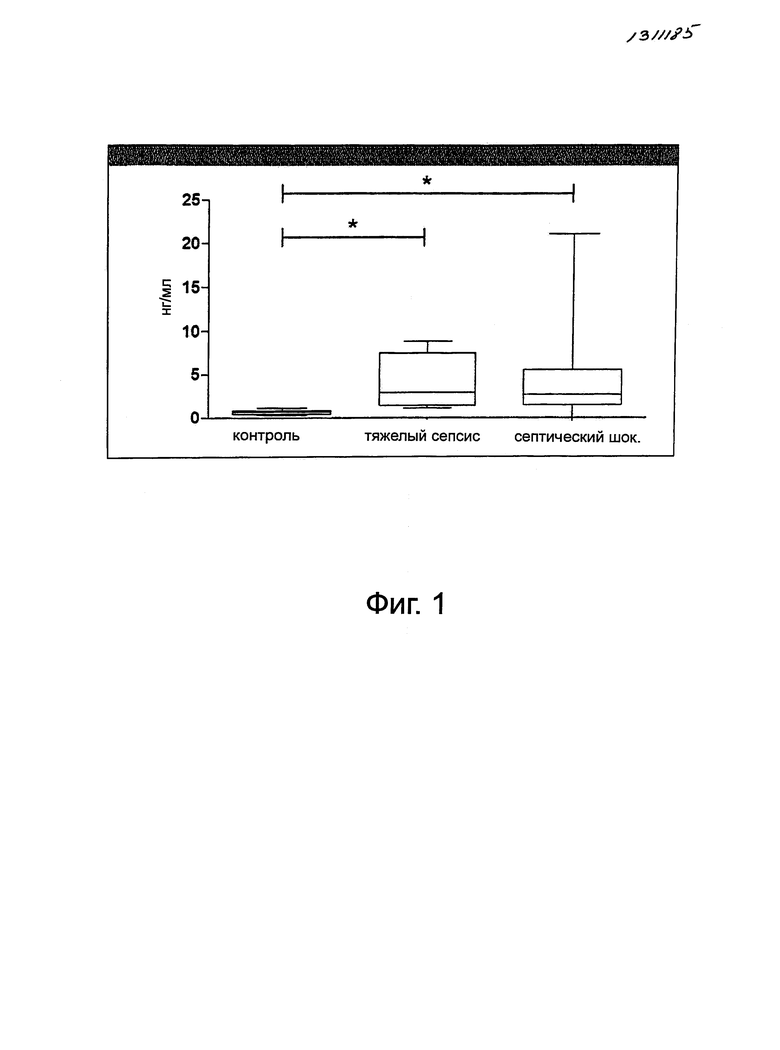
Фигура 1. Повышение уровней эндокана в плазме пациентов при тяжелом сепсисе (Sepsis Sévère) и септическом шоке (Choc Septique), по сравнению со здоровыми добровольцами (Témoin) (*:p<0,05).
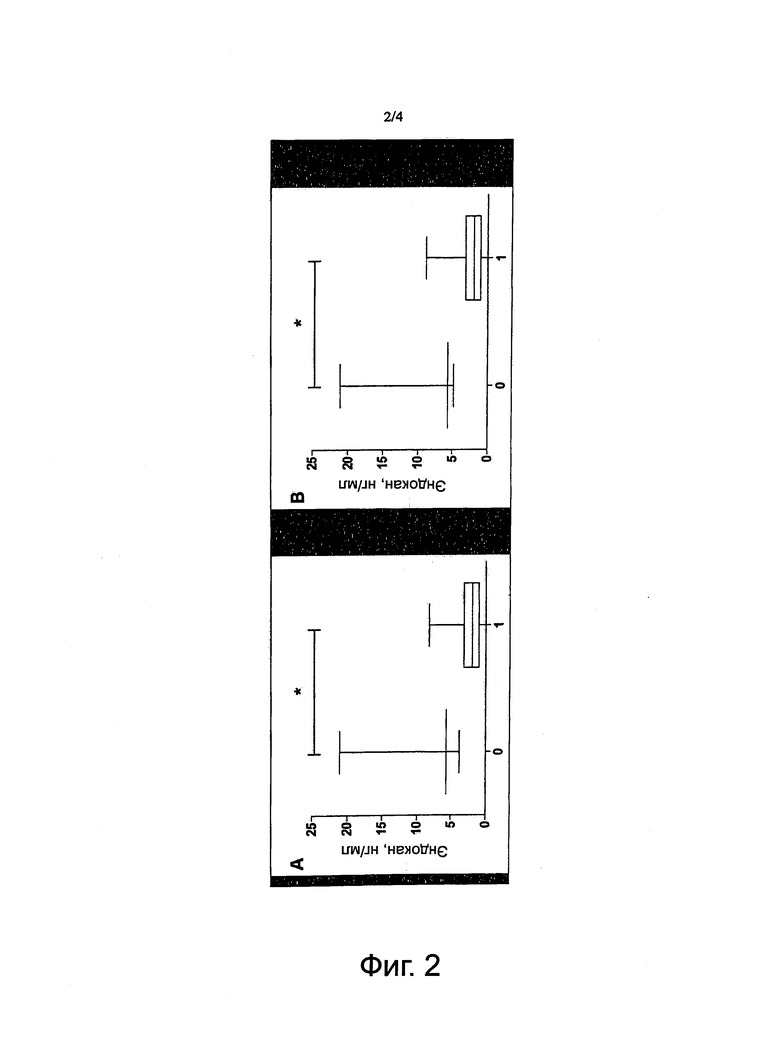
Фигура 2. Эндокан и дыхательная недостаточность. А: уровни эндокана у пациентов без дыхательной недостаточности (0), с ОПЛ/ОРДС (1) в 48 часов (*:p<0,05). В: уровни эндокана у пациентов без дыхательной недостаточности (0), с ОПЛ/ОРДС (1) спустя 72 часа(*:p<0,05).
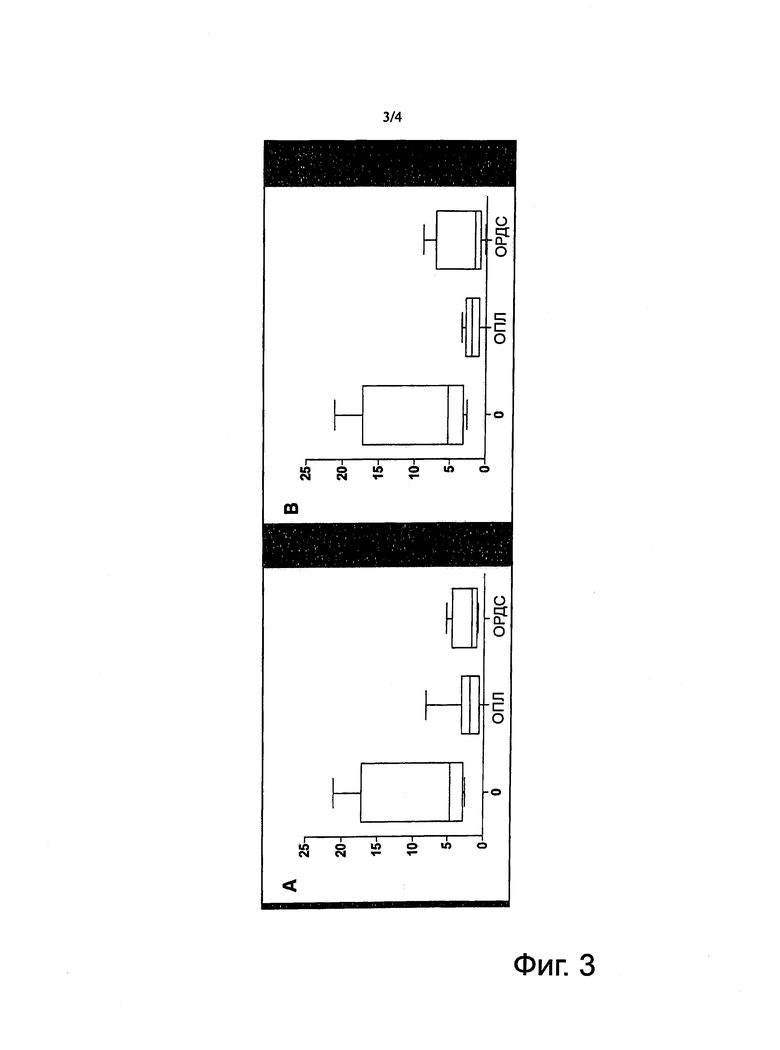
Фигура 3. Эндокан и тяжесть дыхательных нарушений. A: уровни эндокана у пациентов без дыхательной недостаточности (0), с ОПЛ, с ОРДС в 48 часов. В: уровни эндокана у пациентов без дыхательной недостаточности (0), с ОПЛ, с ОРДС спустя 72 часа.
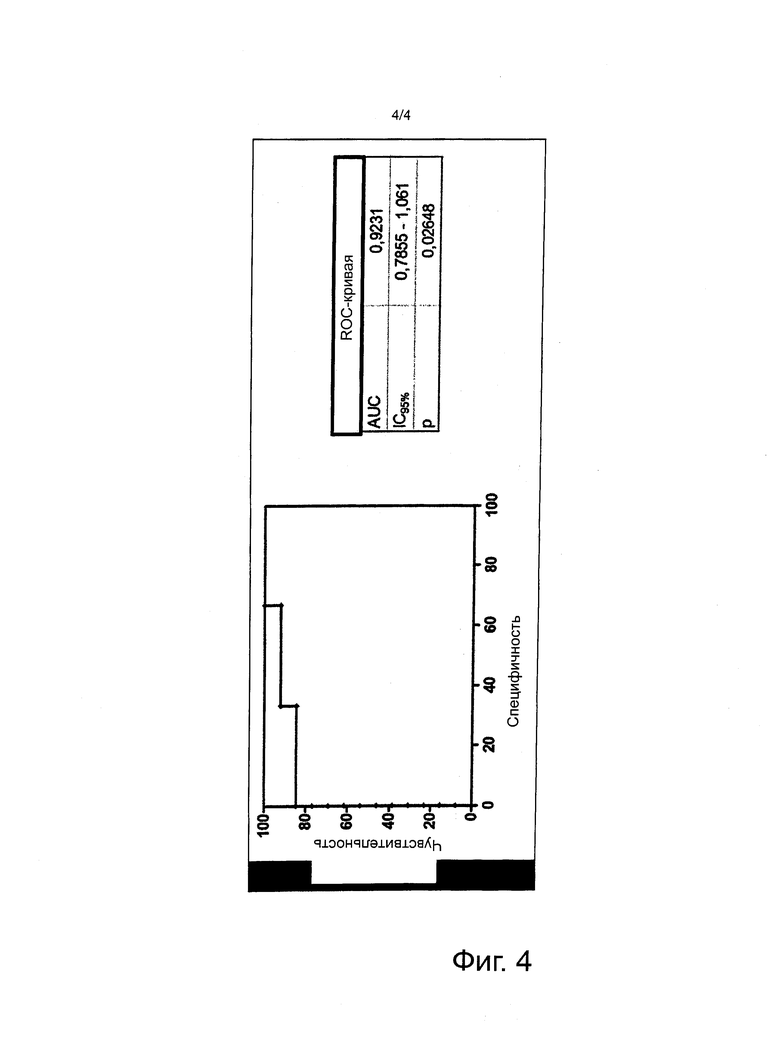
Фигура 4. ROC-кривая (график зависимости чувствительности от частоты ложноположительных заключений) уровней эндокана в плазме при наличии дыхательной недостаточности спустя 48 часов. AUC: Площадь под кривой зависимости концентрации от времени. Таблица под графиком указывает на расчетную чувствительность и специфичность в зависимости от значения уровней эндокана в плазме. Серой линией показан предел эндокана (3,55 нг/мл) для наилучшего значения чувствительности/специфичности (84,62%, 100%, соответственно).
Пример 1
Высокий уровень эндокана в крови указывает на пациентов, страдающих сепсисом с дыхательной недостаточностью (определяемой по PaO2/FiO2<200), и/или с почечной недостаточностью (определяемой по уровню креатинина >20 мг/мл), и или тромбопенией (Таблица 1).
Пример 2: Низкие уровни эндокана прогнозируют дыхательную недостаточность спустя 48-72 часа после поступления в ОИТ пациентов с тяжелым сепсисом и септическим шоком
Введение
Острое поражение легких (ОПЛ) и острый респираторный дистресс-синдром (ОРДС) являются распространенными клиническими нарушениями, характеризующимися повреждением альвеолярного эпителия и эндотелия, ведущим к развитию острой дыхательной недостаточности. Её определяют по легочному газообмену. Термин ОПЛ относится к пациентам с отношением PaO2/FiO2<300 MMHg, в то время как отношение <200 MMHg определяет ОРДС. Как ОПЛ, так и ОРДС могут развиваться как при прямом повреждении легких, таком как пневмония, аспирация, контузия легких или ингаляция токсических веществ, так и при непрямом экстрапульмонарном повреждении, таком как сепсис, которое является наиболее преобладающим состоянием и причиной смерти при ОРДС, но также при множественных трансфузиях продуктов крови, остром панкреатите, неторакальной травме с шоком, диссеминированной внутрисосудистой коагуляции (ДВК). Частота ОПЛ или ОРДС составляет 7,1% от всего числа пациентов, поступивших в отделение интенсивной терапии (ОИТ). Уровень смертности, связанной с ОРДС и ОПЛ, составляет 30-40%. Для большинства пациентов с ОРДС, клинический исход определяется в первые 7-10 суток после постановки диагноза, поскольку в этот период половина пациентов либо умирает, либо снимается с механической вентиляции. Выжившие после ОРДС восстанавливают легочную функцию в течение 6-12 месяцев, но часто сохраняются остаточные нарушения, включая умеренную рестрикцию/обструкцию, нарушение газообмена при физической нагрузке или снижение диффузионной способности.
Прогностические показатели повышения смертности включают повышение возраста, наличие нелегочной дисфункции органов, цирроз печени, активное онкологическое заболевание и септический шок; в то время как исходная степень нарушения газообмена является плохим прогностическим признаком клинического исхода. Простой точный маркер на основе крови, способный оценить исходную тяжесть ОПЛ/ОРЛС и точно следовать развитию воспаления, будет очень полезным для прогнозирования врачами исхода и для более правильного выбора терапевтических мероприятий.
ОПЛ/ОРДС можно разделить на экссудативную, пролиферативную и фиброзную фазу со значительными совпадениями. Экссудативная фаза развивается в острую раннюю фазу (1-7 суток после повреждения) и характеризуется диффузным альвеолярным повреждением (ДАП) с некрозом альвеолярных клеток I типа, интерстициальным и альвеолярным отеком с большим количеством белка, геморрагией и диффузными нейтрофильными альвеолярными инфильтратами. Пролиферативная фаза начинается типично спустя 1-2 недели после исходного повреждения и характеризуется пролиферацией и гиперплазией альвеолярных клеток II типа, и пролиферацией фибробластов в интерстиции, и позднее в альвеолярной полости. Только у некоторых пациентов наступает фибротическая фаза, обычно начинающаяся спустя 10-14 суток после исходного повреждения. Она характеризуется накоплением лимфоцитов и макрофагов, а также фиброзом и извилистыми сосудами, суженными из-за миоинтимального утолщения и фиброза стенки сосудов.
Нейтрофилы считаются основными игроками воспалительных процессов, связанных с ОПЛ/ОРДС. Они накапливаются в легочной ткани и в жидкости, промывающей бронхоальвеолярную полость, у пациентов с ОРДС. Нейтрофилы защищают от вторгающихся микроорганизмов, но также вызывают повреждение клеток путем продукции и секреции провоспалительных медиаторов, свободных радикалов, активных форм кислорода, и протеаз. Эти наблюдения поддерживают представление о том, что нейтрофил-зависимое воспаление является не только результатом, но и причиной ОПЛ. Однако специфические регуляторные механизмы, контролирующие накопление ПМН в легких во время ОПЛ/ОРДС, полностью не установлены.
Основной поражаемой целью в случае непрямого повреждения, такого как наблюдается при сепсисе, является легочный эпителий. Наше представление о механизмах, управляющих патофизиологическим ответом эндотелиальных клеток при ОРДС, остается неполным. Повреждение эндотелия повышает проницаемость сосудов и, таким образом, стимулирует формирование отека легких. Однако эндотелиальные клетки могут также активироваться независимо от повреждения клеток, включая (i) индукцию локальной коагуляции, приводящую к избыточному отложению фибрина, (ii) избыточную экспрессию молекул адгезии, таких как ICAM-1, поддержку привлечения и миграции лейкоцитов в интерстиции и альвеолярные пространства. Это может быть связано с повышением растворимого ICAM-1 при тяжелом сепсисе, однако, ICAM-1 также экспрессируется на фибробластах и лейкоцитах, снижая селективность экспрессии sICAM-1 к легочному эндотелию. Кроме того, капиллярный легочный эндотелий характеризуется отсутствием экспрессии двух основных молекул адгезии E-селектина и VCAM-1, даже при активации капиллярного эндотелия в легких при ОРДС.
С другой стороны, имеются развивающиеся и согласующиеся данные о том, что эндокан можно считать биомаркером активированных эндотелиальных клеток легочных сосудов. Эндокан (или ESM-1) был идентифицирован как протеогликан, специфичный для эндотелиальных клеток, состоящий из белкового ядра из 20 кДа с уникальной гликозаминогликановой цепью из хондроитинсульфата/дерматансульфата, O-связанной с серином 137. Эндокан экспрессируется главным образом в легких и в меньшей степени в капиллярах почек. Селективность легочных капилляров управляется короткой промоторной последовательностью. Цитокины, такие как ФНО или ИЛ-1, или бактериальный ЛПС, запускают синтез и секрецию эндокана эндотелиальными клетками. Эндокан связывается со своим рецептором лейкоцитарным интегрином LFA-1 и ингибирует взаимодействие LFA-1/ICAM-1, что позволяет сделать предположение о роли эндокана в контроле лейкоцитарного диапедеза. Ранние исследования продемонстрировали, что уровни эндокана в крови повышаются у пациентов с тяжелым сепсисом, что является плохим диагностическим признаком, так же как и уровни прокальцитонина, который в настоящее время является наилучшим прогностическим маркером сепсиса.
Для объяснения того, как развиваются ОПЛ/ОРДС при сепсисе, мы предположили, что вскоре после заражения легких бактериями активированные макрофаги высвобождают ИЛ-8 для привлечения нейтрофилов, и ФНОα, который в свою очередь активирует эндотелиальные клетки легких, экспрессирующие ICAM-1 и эндокан для контроля диапедеза лейкоцитов. Но если сепсис является достаточно тяжелым для индукции внутрисосудистой активации нейтрофилов, происходит протеолиз эндокана, индуцированный протеазами нейтрофилов, приводящими к обострению диапедеза нейтрофилов и к индукции органной недостаточности. Если наша гипотеза верна, мы сможем найти связь между кинетикой эндокана и частотой дыхательной недостаточности при тяжелом сепсисе.
Пациенты и методы
В настоящем исследовании были привлечены двадцать один пациент и девять здоровых добровольцев. Все пациенты поступили в отделение интенсивной терапии госпиталя Лилльского университета. Критерием включения было наличие у пациентов тяжелого сепсиса или септического шока, в соответствии с классификацией ACC/SCCM. Критериями исключения был возраст <18 лет и беременность. Критериями исключения были септический шок несептического происхождения и иммуносупрессивная терапия за 1 месяц до поступления в ОИТ.
Признаки дисфункции органов определяли при включении и спустя 24, 48 и 72 часа: показатели по шкале комы Глазго ≤14, PaO2≤9,75 кПа, насыщение кислородом ≤92%, ОПЛ (PaO2/FiO2≤300), ОРДС (PaO2/FiO2≤200), систолическое кровяное давление ≤90 MMHg, падение систолического кровяного давления ≥40 мм Hg от базовой линии, pH≤7,3, лактат ≥2,5 ммоль/л, креатинин ≥177 мкмоль/л, удвоение креатинина у пациентов с известным заболеванием почек, олигурия <30 мл/час в течение >3 часов или ≤0,7 л/24 часа, протромбиновое время <0,6 с (эталон 0,70-1,30 с), тромбоциты ≤100×109/л, билирубин ≥43 мкмоль/л, и паралитическая кишечная непроходимость. Септический шок определяли как гипотензию, присутствующую несмотря на адекватную инфузионную реанимацию в течение по меньшей мере 1 часа.
Образцы крови отбирали в 5 мл пробирки с цитратом у включенных в исследование пациентов при поступлении в ОИТ. Затем образцы центрифугировали при 3000 g в течение 15 мин при 4°C, отбирали аликвоты по 500 мкл плазмы на пробирку, а затем замораживали при -80°C в течение 1,5 часов. Уровни эндокана определяли с помощью ИФА (Lunginnov, Франция).
Данные были представлены в виде медианы и интерквартильной широты или в виде среднего значения ± среднеквадратическое отклонение. Анализ данных включал сравнение путем дисперсионного анализа уровней эндокана в плазме при включении и присутствии или отсутствии недостаточности каждого органа в каждый момент времени исследования. При значимости группы сравнивали 2 на 2 с применением апостериорных анализов с коррекцией Бонферрони. Прогностическое значение эндокана оценивали по ROC кривой. Все статистические расчеты проводили с применением статистического программного обеспечения SPSS.
Результаты
Уровни эндокана в плазме повышались при тяжелом сепсисе (3,96±3,35 нг/мл) и септическом шоке (4,33±5,01 нг/мл) по сравнению со здоровыми людьми (0,67±0,25 нг/мл) (p<0,05) (фигура 1).
Пациенты с дыхательной недостаточностью спустя 48 часов и 72 часа показали существенно сниженные уровни эндокана в плазме, чем у пациентов без дыхательной недостаточности в те же самые моменты времени (p<0,05, фигура 2).
Уровни эндокана в плазме не различались при ОПЛ и ОРДС. Они были низкими в обеих группах (фигура 3).
ROC эндокана и дыхательной недостаточности спустя 48 часов показала AUC = 0,923 (p<0,05). Значения эндокана <3,55 при поступлении прогнозировали дыхательную недостаточность спустя 48 часов с чувствительностью 84,62% и специфичностью 100% (фигура 4).
Ссылки
В данной заявке различные ссылки описывают уровень области техники, к которой относится настоящее изобретение. Таким образом, раскрытия этих ссылок включены в настоящее описание.
Изобретение относится к области медицины, а именно к способу прогноза риска дыхательной недостаточности у септического пациента. Сущность способа состоит в том, что проводят стадию измерения концентрации эндокана в образце крови, полученной от упомянутого септического пациента, и стадию сравнения концентрации эндокана с заданными пороговыми значениями, представляющими концентрации, измеренные в среднем у пациентов, у которых не развилась дыхательная недостаточность. При концентрации более низкой, чем предварительно определенное значение, прогнозируют дыхательную недостаточность через 48-72 часа после поступления больных с сепсисом в ОИТ. Использование заявленного способа позволяет повысить эффективность прогноза риска развития дыхательной недостаточности у септического пациента. 4 ил., 1 табл., 2 пр.
Способ прогноза риска дыхательной недостаточности у септического пациента, включающий стадию, состоящую из измерения концентрации эндокана в образце крови, полученной от упомянутого септического пациента, и стадию сравнения концентрации эндокана с заданными пороговыми значениями, представляющими концентрации, измеренные в среднем у пациентов, у которых не развилась дыхательная недостаточность, при концентрации более низкой, чем предварительно определенное значение, прогнозируют дыхательную недостаточность через 48-72 часа после поступления больных с сепсисом в ОИТ.
Авторы
Даты
2016-07-10—Публикация
2012-01-20—Подача