Настоящее изобретение относится к соединениям формулы
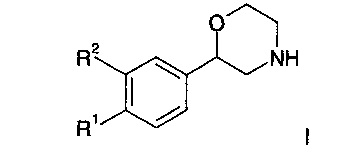
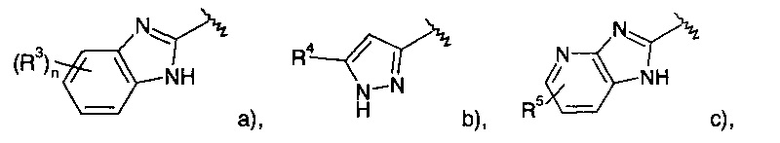
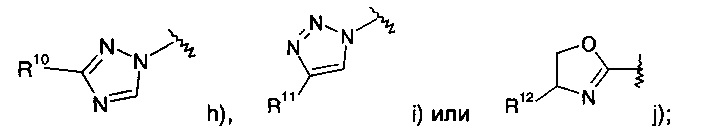
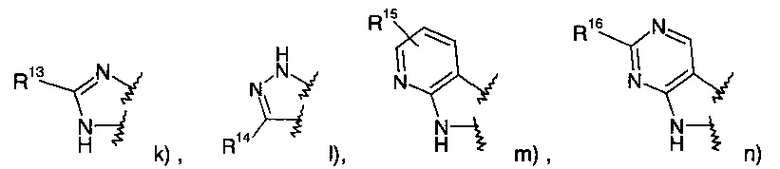
где R1 представляет собой одно- или двухчленную гетероарильную группу, выбранную из группы, состоящей из

R2 предста56вляет собой водород или галоген; или
R1 и R2 могут образовывать вместе с атомами углерода, к которым они присоединены, следующие кольца
или 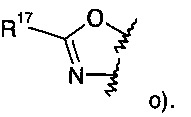
R3 представляет собой водород, галоген или низший алкил; n представляет собой 1 или 2;
R4 представляет собой фенил, замещенный одним или двумя заместителями, выбранными из галогена или циано, или представляет собой пиридинил, возможно замещенный галогеном, или представляет собой тетрагидропиран, или представляет собой -NH-С(O)-фенил, возможно замещенный галогеном;
R5 представляет собой водород или галоген;
R6-R13 представляют собой фенил, возможно замещенный галогеном:
R14 представляет собой -NH-С(O)-фенил, замещенный галогеном;
R15 представляет собой водород, низший алкил, замещенный галогеном или представляет собой галоген;
R16 представляет собой водород или низший алкокси;
R17 представляет собой пиридинил, возможно замещенный низшим алкокси или низший алкил, замещенный галогеном;
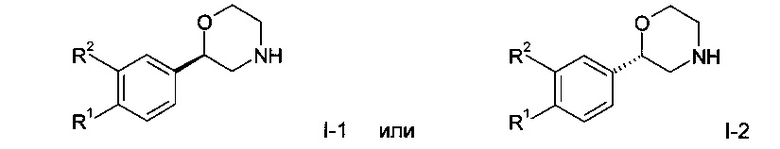
к их фармацевтически приемлемым кислотно-аддитивным солям, ко всем рацемическим смесям, ко всем их соответствующим энантиомерам и/или оптическим изомерам и ко всем таутомерным формам соединений формулы I.
Было обнаружено, что соединения формулы I обладают хорошей аффинностью к рецепторам следовых аминов, особенно к TAAR1.
Соединения могут быть полезны для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (СДВГ), расстройств, вызванных стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, и метаболических расстройств, таких как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых расстройств.
Некоторые из физиологических эффектов (т.е. эффекты на сердечно-сосудистую систему, гипотония, индукция седативного эффекта), которые были обнаружены для соединений, которые могут связываться с адренорецепторами (WO 02/076950, WO 97/12874 или ЕР 0717037) можно рассматривать как нежелательные побочные эффекты в случае лекарственных средств, направленных на лечении заболеваний центральной нервной системы, как описано выше. Поэтому является желательным получить лекарственные средства, обладающие селективностью в отношении рецептора TAAR1 по сравнению с адренергическими рецепторами. Объекты настоящего изобретения проявляют селективность в отношении рецептора TAAR1 по отношению к адренергическим рецепторам, в частности хорошей селективностью по сравнению с альфа1 и альфа2 адренергическими рецепторами человека и крысы.
Классические биогенные амины (серотонин, норэпинефрин, эпинефрин, допамин, гистамин) как нейромедиаторы играют важную роль в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их деградация и обратный захват после высвобождения строго регулируются. Известно, что дисбаланс уровней биогенных аминов является ответственным за изменение функции мозга при многих патологических состояниях [2-5]. Соединения, образующие второй класс эндогенных аминов, так называемые следовые амины (trace amines, ТА), очень схожи с классическими биогенными аминами по своей структуре, метаболизму и субклеточной локализации. ТА включают п-тирамин, β-фенилэтиламин, триптамин и октопамин, и их уровень в нервной системе млекопитающих существенно ниже уровня классических биогенных аминов [6].
Нарушение их регуляции связано с различными психическими заболеваниями, такими как шизофрения и депрессия [7], и другими состояниями, такими как синдром дефицита внимания и гиперактивности, головная боль типа мигрени, болезнь Паркинсона, злоупотребление веществами, вызывающими зависимость, и расстройства приема пищи [8, 9].
В течение долгого времени существование ТА-специфических рецепторов являлось всего лишь гипотезой, основанной на присутствии в ЦНС (центральной нервной системе) человека и других млекопитающих анатомически дискретных сайтов связывания, обладающих высокой аффинностью к ТА [10, 11]. Соответственно считалось, что фармакологическое действие ТА опосредовано тем же известным механизмом, что и действие классических биогенных аминов, то есть либо сигналом, вызывающим их высвобождение, либо ингибированием их обратного захвата, либо “перекрестным связыванием” с их рецепторной системой [9, 12, 13]. В последнее время данная точка зрения претерпела значительные изменения в связи с идентификацией нескольких членов нового семейства GPCR (G-белок-связанных рецепторов), рецепторов следовых аминов (TAAR) [7, 14]. Обнаружено 9 TAAR-генов в геноме человека (включая 3 псевдогена) и 16 генов в геноме мыши (включая 1 псевдоген). TAAR-гены не содержат интронов (за одним исключением, TAAR2 содержит 1 интрон) и расположены рядом на одном хромосомном сегменте. Филогенетическое родство генов этих рецепторов, согласующееся с высокой степенью схожести, получаемой при сравнении с GPCR-фармакофором, и фармакологические данные дают возможность предположить, что эти рецепторы образуют три различных подсемейства [7, 14]. TAAR1 относится к первому подклассу, состоящему из четырех генов (TAAR1-4), которые представлены в геномах человека и грызунов высококонсервативными последовательностями. ТА активируют TAAR1 через Gα. Показано, что нарушение регуляции ТА связано с этиологией различных заболеваний, таких как депрессия, психоз, синдром дефицита внимания и гиперактивности, злоупотребление веществами, вызывающими зависимость, болезнь Паркинсона, головная боль типа мигрени, расстройства приема пищи, метаболические расстройства, и поэтому использование TAAR-лигандов в лечении данных заболеваний может являться весьма перспективным.
Поэтому получение новых знаний о рецепторах следовых аминов весьма актуально.
Использованные ссылки:
1. Deutch, A.Y. and Roth, R.H. (1999) Neurotransmitters. In Fundamental Neuroscience (2nd edn) (Zigmond, M.J., Bloom, F.E., Landis, S.C., Roberts, J.L, and Squire, L.R., eds.), pp. 193-234, Academic Press.
2. Wong, M.L. and Licinio, J. (2001) Research and treatment approaches to depression. Nat. Rev. Neurosci. 2, 343-351.
3. Carlsson, A. et al. (2001) Interactions between monoamines, glutamate, and GABA in schizophrenia: new evidence. Annu. Rev. Pharmacol. Toxicol. 41, 237-260.
4. Tuite, P. and Riss, J. (2003) Recent developments in the pharmacological treatment of Parkinsonʹs disease. Expert Opin. Investig. Drugs 12, 1335-1352.
5. Castellanos, F.X. and Tannock, R. (2002) Neuroscience of attention-deficit/hyperactivity disorder: the search for endophenotypes. Nat. Rev. Neurosci. 3, 617-628.
6. Usdin, Earl; Sandler, Merton; Editors. Psychopharmacology Series, Vol. 1: Trace Amines and the Brain. [Proceedings of a Study Group at the 14th Annual Meeting of the American College of Neuropsychoparmacology, San Juan, Puerto Rico] (1976).
7. Lindemann, L. and Hoener, M. (2005) A renaissance in trace amines inspired by a novel GPCR family. Trends in Pharmacol. Sci. 26, 274-281.
8. Branchek, T.A. and Blackburn, T.P. (2003) Trace amine receptors as targets for novel therapeutics: legend, myth and fact. Curr. Opin. Pharmacol. 3, 90-97.
9. Premont, R.T. et al. (2001) Following the trace of elusive amines. Proc. Natl. Acad. Sci. USA 98, 9474-9475.
10. Mousseau, D.D. and Butterworth, R.F. (1995) A high-affinity [3H] tryptamine binding site in human brain. Prog. Brain Res. 106, 285-291.
11. McCormack, J.K. et al. (1986) Autoradiographic localization of tryptamine binding sites in the rat and dog central nervous system. J. Neurosci. 6, 94-101.
12. Dyck, L.E. (1989) Release of some endogenous trace amines from rat striatal slices в присутствии and absence of a monoamine oxidase inhibitor. Life Sci. 44, 1149-1156.
13. Parker, E.M. and Cubeddu, L.X. (1988) Comparative effects of amphetamine, phenylethylamine and related drugs on dopamine efflux, dopamine uptake and mazindol binding. J. Pharmacol. Exp. Ther. 245, 199-210.
14. Lindemann, L. et al. (2005) Trace amine associated receptors form structurally and functionally distinct subfamilies of novel G protein-coupled receptors. Genomics 85, 372-385.
Предметом настоящего изобретения являются новые соединения формулы I и их фармацевтически приемлемые соли их применение для изготовления лекарственных средств для лечения заболеваний, связанных с биологической функцией рецепторов следовых аминов, их получение и лекарственные средства на основе соединений по изобретению при лечении или профилактике таких заболеваний, как депрессия, тревожные расстройства, биполярное расстройство, синдром дефицита внимания и гиперактивности, расстройства, вызванные стрессом, психотические расстройства, такие как шизофрения, неврологические заболевания, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, гипертензия, злоупотребление веществами, вызывающими зависимость, и метаболические расстройства, такие как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства потребления и ассимиляции энергии, расстройства и нарушения температурного гомеостаза, нарушения сна и циркадного ритма и сердечно-сосудистые расстройства.
Предпочтительными показаниями к применению соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, тревога и синдром дефицита внимания и гиперактивности (СДВГ) и сахарный диабет.
Как использовано в данном описании, термин “низший алкил” означает группу с насыщенной прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и т.д. Предпочтительными алкильными группами являются группы, содержащие 1-4 атома углерода.
Как использовано в данном описании, термин “низший алкокси” означает группу, где алкильный остаток, как определено выше, присоединен через атом кислорода.
Термин “галоген” означает хлор, иод, фтор и бром.
Как использовано в данном описании, термин “низший алкил, замещенный галогеном” означает группу с насыщенной прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, как определено выше для термина «низший алкил», где по меньшей мере один атом водорода заменен на галоген. Предпочтительным атомом галогена является фтор. Примерами таких групп являются CF3, CHF2, CH2F, CH2CF3 или CH2CHF2.
Термин “фармацевтически приемлемые кислотно-аддитивные соли” включает в себя соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метан-сульфоновая кислота, п-толуолсульфоновая кислота и т.д.
Рацемическая смесь или рацемат являются такие, которые имеет равные количества левых и правых энантиомеров хиральной молекулы.
Энантиомером является один из двух стереоизомеров, которые являются зеркальным отображением друг друга.
Таутомерами являются изомеры органических соединений, которые легко переходят друг в друга в результате химической реакции. Эту реакция обычно приводит к формальной миграции атома водорода или протона, в сопровождении с переключением одинарной связи и смежной двойной связи. Вследствие быстрого взаимопревращения, таутомеры, как правило, считаются одним и тем же химическим соединением.
Воплощениями настоящего изобретения являются следующие структуры:
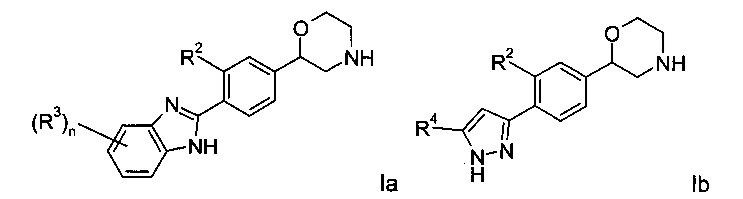
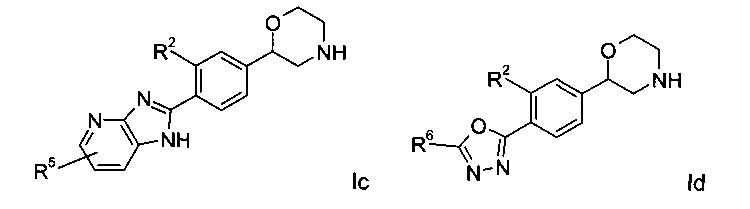
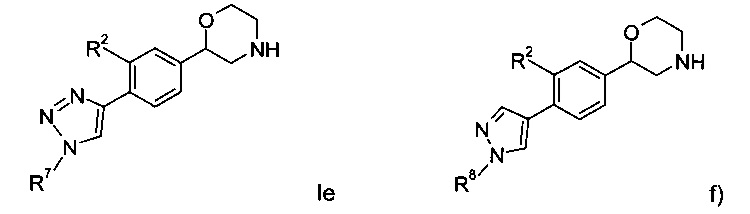

где R2 представляет собой водород или галоген; или
R3 представляет собой водород, галоген или низший алкил; n представляет собой 1 или 2;
R4 представляет собой фенил, замещенный одним или двумя заместителями, выбранными из галогена или циано, или представляет собой пиридинил, возможно замещенный галогеном, или представляет собой тетрагидропиран, или представляет собой -NH-С(O)-фенил, возможно замещенный галогеном;
R5 представляет собой водород или галоген;
R6-R13 представляют собой фенил, возможно замещенный галогеном;
R14 представляет собой -NH-С(O)-фенил, замещенный галогеном;
R15 представляет собой водород, низший алкил, замещенный галогеном или галоген; и
R16 представляет собой водород или низший алкокси;
R17 представляет собой пиридинил, возможно замещенный низшим алкокси или низший алкил, замещенный галогеном;
или их фармацевтически приемлемые кислотно-аддитивные соли все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
Соединениями формулы Ia являются:
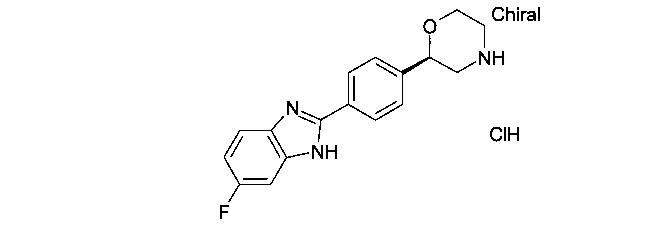
2-(4-(1Н-бензо[d]имидазол-2-ил)фенил)морфолин
2-(4-(6-хлор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(S)-2-(4-(6-фтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(S)-2-(4-(4,6-дифтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(R)-2-(4-(фтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин или
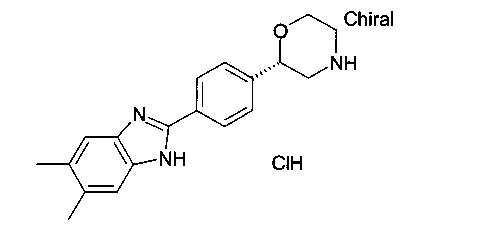
(S)-2-(4-(5,6-диметил-1Н-диметил[d]имидазол-2-ил)фенил)морфолин.
Соединениями формулы Ib являются:
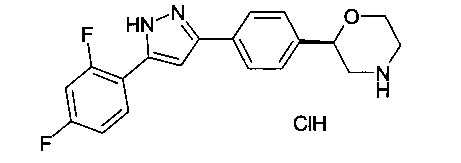
2-(4-(5-(4-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(4-(5-(6-хлорпиридин-3-ил)-1Н-пиразол-3-ил)фенил)морфолин
4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(R)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
3-[5-(4-морфолин-2-ил-фенил)-2Н-пиразол-3-ил]-бензонитрил
(S)-2-(4-(5-(2,4-дифторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-2-(4-(5-(2,4-дифторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-2-(4-(5-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-4-фтор-N-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензамид
(R)-2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-3-фтор-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-2-{4-[5-(6-хлор-пиридин-3-ил)-1Н-пиразол-3-ил]-фенил}-морфолин
(R)-2-{4-[5-(6-хлор-пиридин-3-ил)-1Н-пиразол-3-ил]-фенил}-морфолин
(S)-2-(3-фтор-4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-2-(3-фтор-4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин или
(S)-2-(4-(5-(2-хлорпиридин-4-ил)-1Н-пиразол-3-ил)фенил)морфолин.
Соединение формулы Ic представляет собой:
(S)-2-(4-(6-бромо-1Н-имидазо[4,5-b]пиридин-2-ил)фенил)морфолин.
Соединениями формулы Id являются:
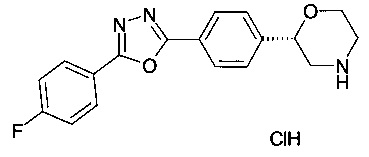
(S)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолин или
(R)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолин.
Соединениями формулы Ie являются:
(S)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолин или
(R)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолин.
Соединениями формулы If являются:
(S)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолин или
(R)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолин.
Соединениями формулы Ig являются:
(S)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолин или
(R)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолин.
Соединениями формулы Ih являются:
(S)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолин или
(R)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолин.
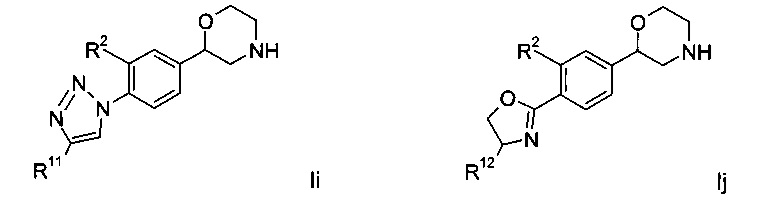
Соединениями формулы Ii являются:
(S)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолин или
(R)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолин.
Соединение формулы Ij представляет собой:
(S)-2-{4-[(R)-4-(4-фтор-фенил)-4,5-дигидро-оксазол-2-ил]-фенил}-морфолин.
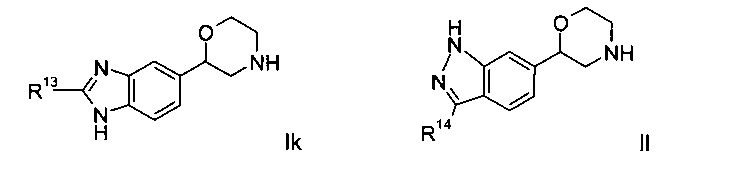
Соединениями формулы Ik являются:
(S)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолин или
(R)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолин.
Соединение формулы II представляет собой:
4-фтор-N-(6-(морфолин-2-ил)-1Н-индазол-3-ил)бензамид.
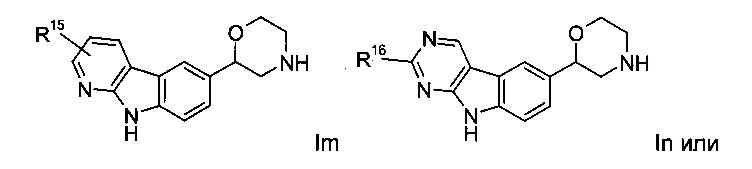
Соединениями формулы Im являются:
(S)-2-(9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(3-хлор-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(R)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(2-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин или
(R)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин.
Соединение формулы In представляет собой:
(S)-2-(2-изопропокси-9Н-пиримидо[4,5-b]индол-6-ил)морфолин.
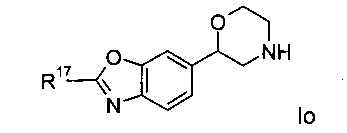
Соединениями формулы Io являются:
(R)-2-(6-этоксипиридин-3-ил)-6-(морфолин-2-ил)диметил[d]оксазол
(R)-6-(морфолин-2-ил)-2-(6-(трифторметил)пиридин-3-ил)диметил[d]оксазол
(R)-6-(морфолин-2-ил)-2-(2-(трифторметил)пиридин-4-ил)диметил[d]оксазол или
(S)-6-(морфолин-2-ил)-2-(2-(трифторметил)пиридин-4-ил)диметил[d]оксазол.
Соединения формулы I по изобретению и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области техники, например, с помощью способов, описанных ниже, которые включают депротекцию соединения формулы
с помощью HCl в диоксане в течение 2 часов при 60°C, или с помощью CF3COOH в дихлорметане при комнатной температуре до соединения формулы
где PG представляет собой кислотно-лабильную аминозащитную группу, такую как трет-бутоксикарбонильная группа, a R1 и R2 являются такими, как описано выше и, если необходимо, конвертирование полученного соединения в фармацевтически приемлемые кислотно-аддитивные соли.
Получение соединений формулы I по настоящему изобретению может быть проведена в последовательными или конвергентными путями синтеза. Синтезы соединений по изобретению показаны на следующих схемах 1-16 и в описании 55 конкретных примеров. Навыки, необходимые для проведения реакции и очистки полученных продуктов известны специалистам в данной области техники. Заместители и индексы, используемые в следующем описании процессов имеют значения, указанные здесь ранее, если не указано иное.
Более подробно, соединения формулы I могут быть получены с помощью способов, приведенных ниже, с помощью способов, приведенных в примерах, или аналогичными способами. Подходящие условия реакции для отдельных реакционных стадий известны специалисту в данной области техники. Последовательность реакций не ограничивается показанной на схемах 1-16, однако, в зависимости от исходных материалов и их соответствующей реакционной способности, последовательность стадий реакции может быть свободно изменена. Исходные материалы являются либо коммерчески доступными, либо могут быть получены способами, аналогичными способам, приведенным ниже, способами, описанными в ссылках, приведенных в описании или в примерах, или способами, известными в данной области техники.

Стадия А: N-защищенной производное морфолина 3 может быть формилировано посредством использования оргнометаллического реагента, такого как н-бутиллитий или втор-бутиллитий или трет-бутиллитий, в комбинации с диметилформамидом в подходящем растворителе, таком как ТГФ при температурах от -78°C до -10°C в течение 1-18 часов.
Предпочтительными условиями являются использование н-бутиллития и диметилформамида в ТГФ при -78°C в течение 2 часов. Предпочтительной защитной группой PG является трет-бутоксикарбонильная группа.
Стадия В: Циклизация альдегида 4а с 1,2-диаминоариловыми соединениями 5 может быть выполнена посредством взаимодействия этих соединений в присутствии окислительного реагента, такого как метабисульфит натрия в подходящем растворителе, таком как диметилацетамид при температурах от 0°C до 100°C в течение 1-24 часов.
Предпочтительными условиями являются применение метабисульфита натрия в диметилацетамиде при 90°C в течение 18 часов.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, НОАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
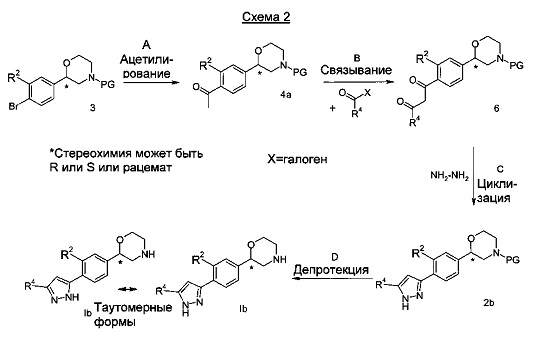
Стадия А: N-защищенное производное морфолина 3 может быть ацетилировано посредством использования оргнометаллического реагента, такого как н-бутиллитий или втор-бутиллитий или трет-бутиллитий в комбинации с N-метокси-N-метилацетамидом или диметилацетамидом в подходящем растворителе, таком как ТГФ при температурах от -78°C до 0°C в течение 1-18 часов.
Предпочтительными условиями являются использование н-бутиллития и N-метокси-N-метилацетамида в ТГФ при -78°C в течение 1 ч. Предпочтительной защитной группой PG является трет-бутоксикарбонильная группа.
Стадия В: Ацетильное соединение 4а может быть депротонировано с использованием основания, такого как литий-бис-(триметилсилил)амид или диизопропиламид лития в подходящем растворителе, таком как ТГФ и затем дополнительно взаимодействовать с хлорангидридом или эфиром VIII при температурах от -78°C до 0°C в течение 1-18 часов.
Предпочтительными условиями являются использование бис-(триметилсилил)амида лития и хлорангидрида в ТГФ при -78°C в течение 1 часов.
Стадия С: Дикарбонильное соединение 6 может взаимодействовать с гидразином или его гидратом в подходящем растворителе, таком как этанол, метанол, н-пропанол или изопропанол при от 0 до 80°С в течение 1-18 часов.
Предпочтительными условиями являются взаимодействие с гидратгидразином в этаноле при кипении с обратным холодильником в течение 3-4 часов.
Стадия D: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOAc или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
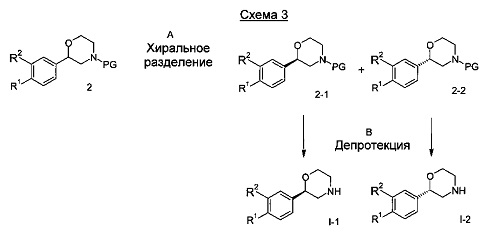
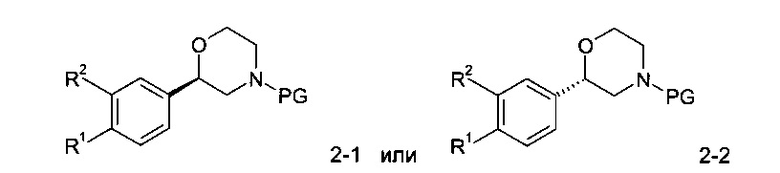
Стадия А: Защищенные морфолина 2 могут быть разделены на из энантиомерные формы посредством хирального разделения. Предпочтительной защитной группой является трет-бутоксикарбонильная группа, предпочтительным хиральным разделением является хиральная хроматография с использованием хиральной неподвижной фазы, такой как Chiralpak AD, и подходящего растворителя, такого как смесь изопропанола и гептана.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
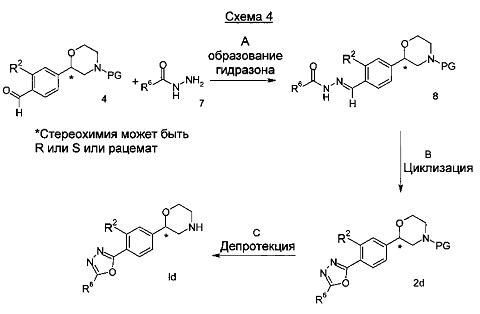
Стадия А: Взаимодействие альдегида 4 с гидразидом 7 может быть выполнена посредством перемешивания обоих компонентов в подходящем растворителе, таком как этанол, метанол, ТГФ или дихлорметан с или без осушителя, такого как молекулярные сита или сульфат магния при температурах от 0°C до 60°C.
Предпочтительными условиями являются перемешивание в этаноле при комнатной температуре без осушителя в течение 2 часов.
Стадия В: Окислительная циклизация может быть достигнута посредством обработки 8 окисляющим реагентом, таким как [бис(трифторацетокси)йод]бензол в подходящем растворителе, таком как хлороформ, дихлорметан, 1,2-диметоксиэтан, ТГФ или диэтиловый эфир при температурах от -78°C до кипения с обратным холодильником в течение 1-24 часов.
Предпочтительными условиями являются обработка [бис(трифторацетокси)йод]бензолом в течение 20 минут при комнатной температуре.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0°C до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
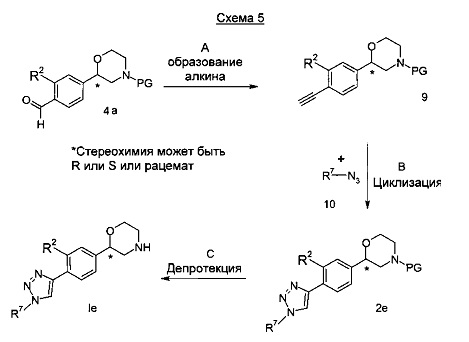
Стадия А: Образование алкилена может быть выполнено посредством взаимодействия альдегида 4а с подходящим реагентом, таким как диметил 1-диазо-2-оксопропилфосфонат и основанием, таким как карбонат калия или карбонат натрия в растворителе, таком как метанол, этанол или изопропанол при температурах -20°C - 60°C в течение 15 мин - 18 часов. Альтернативно, может быть использовано взаимодействие альдегида 4а с тетрабромметаном и трифенилфосфином, с последующей обработкой сильным основанием, таким как бутиллитий.
Предпочтительными условиями являются применение диметил 1-диазо-2-оксопропилфосфоната и карбоната калия в метаноле при комнатной температуре в течение 2 часов.
Стадия В: Образование триазола может быть достигнуто посредством взаимодействия алкина 9 с азидом 10 в подходящем растворителе, таком как бензол, толуол, дихлорметан, тетрагидрофуран, пиридин, N,N-диизопропиламин или триэтиламин с или без катализатора, такого как соли меди при от -20°C до 60°C в течение от 15 минут до 18 часов.
Предпочтительными условиями являются применение йодида меди (I) в N,N-диизопропиламине в качестве растворителя при комнатной температуре в течение 3 часов.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или Н3РО4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.

Стадия А: Связывание бромпроизводного 3 с подходящей бороновой кислотой или эфиром бороновой кислоты 11 может быть выполнено посредством использования палладиевого катализатора, такого как ацетат палладия (II) или хлорид палладия (II) или тетракис(трифенилфосфин)палладий(0) в комбинации с лигандом, таким как трифенилфосфин, трициклогексилфосфин или аналогичным, и основанием, таким как фосфат калия, карбонат калия, карбонат цезия, триэтиламин или диизопропилэтиламин, в подходящем растворителе, таком как диоксан, диметилацетамид, диметилформамид, тетрагидрофуран, диметоксиэтан, диглим, этанол, метанол или вода при от 20°C до 180°C в течение от 5 минут до 18 часов в присутствии или без микроволнового излучения.
Предпочтительными условиями являются применение тетракис(трифенилфосфин)палладия (0) фосфата калия в диметилацетамиде при 150°C под микроволновым излучением в течение 10 минут.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
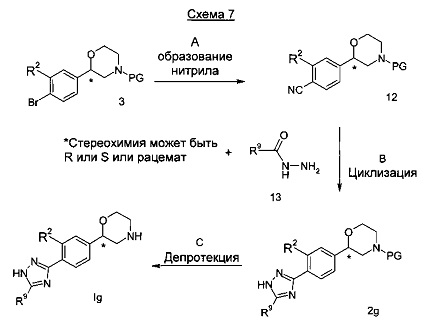
Стадия А: Образование нитрила может быть выполнено посредством взаимодействия бромида 3 с подходящим реагентом, таким как цианид цинка и катализатора, такого как тетракис(трифенилфосфин)палладий(0), в растворителе, таком как диметилформамид, при температурах от 20°C - 120°C в течение 1 ч - 24 часов.
Предпочтительными условиями являются применение цианида цинка и тетракис(трифенилфосфин)палладия (0) в диметилформамиде при 85°С в течение ночи.
Стадия В: Образование триазола может быть достигнуто посредством взаимодействия нитрила 12 с гидразидом 13 в подходящем растворителе, таком как этанол, метанол, пропанол или бутан-1-ол, с подходящим основанием, таким как карбонат калия, карбонат натрия при от 20°C до 160°C в течение от 1 ч до 24 часов.
Предпочтительными условиями являются применение карбоната калия в бутан-1-оле в качестве растворителя при 150°C в течение 3 часов.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при 5 комнатной температуре в течение ночи.
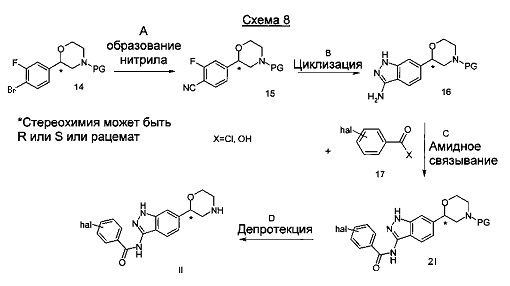
Стадия А: Образование нитрила может быть выполнено посредством взаимодействия дигалогенового соединения 14 с подходящим реагентом, таким как цианид цинка, и катализатором, таким как тетракис(трифенилфосфин)палладий(0), в растворителе, таком как диметилформамид, при температурах от 20°C - 120°C в течение 1 ч - 24 часов.
Предпочтительными условиями являются применение цианид цинка и тетракис(трифенилфосфин)палладия (0) в диметилформамиде при 85°C в течение ночи.
Стадия В: Образование аминоиндазола 16 может быть достигнуто посредством взаимодействия нитрила 15 с гидразином, гидратгидразинием или солью гидразиния, такой как хлорид гидразиния или сульфат гидразиния, в подходящем растворителе, таком как этанол, метанол, пропанол или бутан-1-ол, с или без подходящего основания, такого как карбонат калия, карбонат натрия, при от 20°С до 140°С в течение от 1 ч до 24 часов.
Предпочтительными условиями являются применение гидратгидразиния в этаноле в качестве растворителя при кипении с обратным холодильником в течение 18 часов.
Стадия С: Амидное связывание может быть достигнуто посредством взаимодействия аминоиндазола 16 с подходящим ацилирующим реагентом 17, таким как хлорангидрид, и основанием, таким как диизопропилэтиламин, триэтиламин или пиридин, в растворителе, таком как дихлорметан, дихлорэтан, тетрагидрофуран, бензол, толуол, пиридин, при температурах от -20°C до 100°C в течение от 1 ч до 24 часов.
Альтернативно, в качестве ацилирующего реагента 17 может быть использована кислота (Х=ОН) в присутствии амидсвязывающего реагента, такого как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), дициклогексилкарбодиимид (DCC), O-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониягексафторфосфат (HBTU), O-(Бензотриазол-1-ил)- N,N,Nʹ,Nʹ-тетраметилурониятетрафторборат (TBTU) или аналогичный, и основания, такого как триэтиламин, диизопропилэтиламин или пиридин, в растворителе, таком как метиленхлорид, 1,2-дихлорэтан, тетрагидрофуран или этилацетат.
Предпочтительными условиями являются применение хлорангидрида в пиридине при комнатной температуре в течение 18 часов.
Стадия D: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
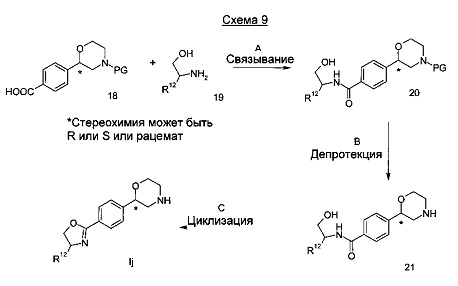
Стадия А: Амидное связывание может быть достигнуто посредством взаимодействия кислоты 18 с аминоспиртом 19 в присутствии в присутствии подходящего амидсвязывающего реагента, такого как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), дициклогексилкарбодиимид (DCC), О-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониягексафторфосфат (HBTU), О-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониятетрафторборат (TBTU) или аналогичного, и основанием, таким как триэтиламин, диизопропилэтиламин, пиридин или диметиламинопиридин в растворителе, таком как дихлорметан, 1,2-дихлорэтан, тетрагидрофуран или этилацетат при от -20°C до 80°C в течение от 1 ч до 24 часов.
Предпочтительными условиями являются применение 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) в дихлорметане при комнатной температуре в течение 18 часов.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Стадия С: Циклизация может быть достигнута посредством обработки промежуточного соединения 21 активирующим реагентом, таким как трифторид диэтиламиносеры (DAST) в дихлорметане при от -20°C до 40°C в течение от 1 ч до 24 часов.
Предпочтительными условиями являются применение трифторида диэтиламиносеры (DAST) в дихлорметане в течение 5 часов при комнатной температуре.
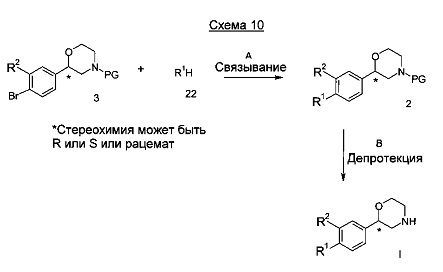
Стадия А: Связывание бромопроизводного 3 с подходящим гетероциклом 22 может быть выполнено посредством использования медного катализатора, такого как йодид меди (I) или бромид меди (I), в комбинации с лигандом, таким как 8-гидроксихинолин или аналогичным, и основанием, таким как карбонат натрия, карбонат калия, карбонат цезия, в подходящем растворителе, таком как диоксан, диметилформамид, диметилацетамид, тетрагидрофуран, диметоксиэтан, диглим, этанол, метанол или вода или их смеси при от 20°C до 180°C в течение 15 мин до 48 часов в присутствии или без микроволнового излучения.
Предпочтительными условиями являются применение йодида меди (I), 8-гидроксихинолина и карбоната цезия в смеси диметилформамида и воды при 150°С в течение 48 часов.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HОАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
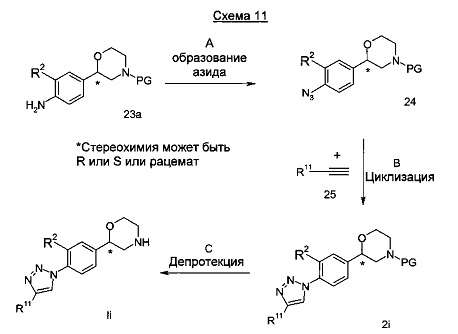
Стадия А: Образование азида может быть выполнено посредством взаимодействия анилина 23а с подходящим реагентом, таким как нитрит натрия, и водным раствором кислоты, такой как соляная кислота или серная кислота, с последующим азидом натрия в воде при температуре от 0°C до комнатной температуры в течение от 5 минут до 2 часов.
Предпочтительными условиями являются применение нитрита натрия, соляной кислоты, азида натрия и воды при 0°C в течение 20 мин.
Стадия В: Образование триазола может быть достигнуто посредством взаимодействия азида 24 с алкином 25 в подходящем растворителе, таком как бензол, толуол, дихлорметан, тетрагидрофуран, пиридин, N,N-диизопропиламин или триэтиламин, с или без катализатора, такого как соли меди при от -20°C до 60°C в течение от 15 минут до 18 часов.
Предпочтительными условиями являются применение йодида меди (I) в N,N-диизопропиламине в качестве растворителя при комнатной температуре в течение 2 часов.
Стадия С: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
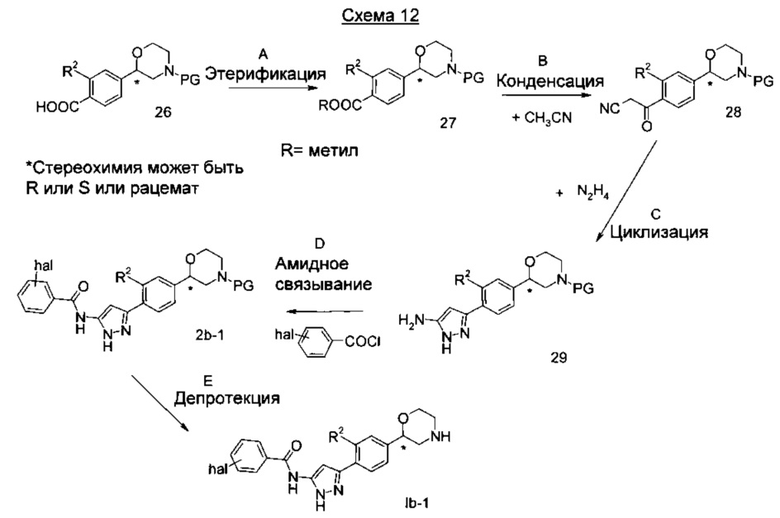
Стадия А: Этерификация может быть выполнена различными способами, такими как взаимодействие с алкилгалидом в присутствии подходящего основания, такого как карбонат калия, карбонат натрия или карбонат цезия в растворителе, таком как диметилформамид, диметилацетамид или тетрагидрофуран, при температурах от 0°C до 160°C в течение от 20 минут до 24 часов. Другим способом является реакция кислоты с алкилдиазосоединением, таким как диазометан, при комнатной температуре в течение нескольких часов.
Предпочтительная R группа представляет собой метил, предпочтительными условиями являются применение метилйодида, карбоната калия в диметилформамиде при комнатной температуре в течение ночи.
Стадия В: Взаимодействие эфира 27 с ацетонитрилом может быть достигнуто посредством обработки основанием, таким как н-бутиллитий, втор-бутиллитий или аналогичным, в растворителе, таком как тетрагидрофуран, диоксан или эфир при от -78°C до 20°C в течение 15 минут до 18 часов.
Предпочтительными условиями являются применение н-бутиллития в тетрагидрофуране при -78°C в течение 3 часов.
Стадия С: Цианоацетильное соединение 28 может взаимодействовать с гидразином или его гидратом в подходящем растворителе, таком как этанол, метанол, н-пропанол или изопропанол при от 0 до 80°C в течение 1-18 часов.
Предпочтительными условиями являются взаимодействие с гидратгидразином в этаноле при 60°C в течение 6 часов.
Стадия D: Амидное связывание может быть достигнуто посредством взаимодействия аминопиразола 29 с подходящим ацилирующим реагентом 4-гал-фенил-CO-Cl, и основанием, таким как диизопропилэтиламин, триэтиламин, пиридин или 4-диметиламинопиридин в растворителе, таком как дихлорметан, дихлорэтан, тетрагидрофуран, бензол, толуол, пиридин или их смеси при температурах от -20°C до 100°C в течение 1 ч до 24 ч.
Альтернативно, в качестве ацилирущего реагента 4-гал-фенил-СО-Cl может быть использована кислота в присутствии амидсвязывающего реагента, Ю такого как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), дициклогексилкарбодиимид (DCC), O-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониягексафторфосфат (HBTU), O-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониятетрафторборат (TBTU) или аналогичного, и основанием, таким как триэтиламин, диизопропилэтиламин или пиридин, в растворителе, таком как метиленхлорид, 1,2-дихлорэтан, тетрагидрофуран или этилацетат.
Предпочтительными условиями являются применение хлорангидрида, пиридина и каталитического количества 4-диметиламинопиридина в смеси тетрагидрофурана и дихлорметана при комнатной температуре в течение 18 часов.
Стадия Е: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
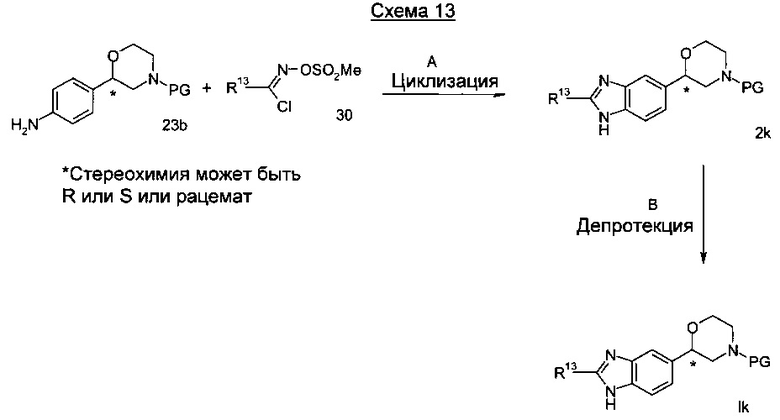
Стадия А: Циклизация может быть достигнута посредством взаимодействия анилина 23b с метилсульфонилокси-имидоил хлоридом 30 и подходящим основанием, таким как N,N,Nʹ,Nʹ-тетраметилэтилендиамин, триэтиламин или диметилэтиламин в растворителе, таком как тетрагидрофуран, толуол, диметилформамид, хлороформ или ацетонитрил, в соответствии со способом, описанным для аналогичных соединений у Yamamoto et al. (J. Org. Chem 2009, 74, 1394) при температуре от 20°C до 60°C в течение от 1 до 24 часов.
Предпочтительными условиями являются применение N,N,Nʹ,Nʹ-тетраметилэтилендиамина в тетрагидрофуране при 60°C в течение 18 часов.
Стадия В: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
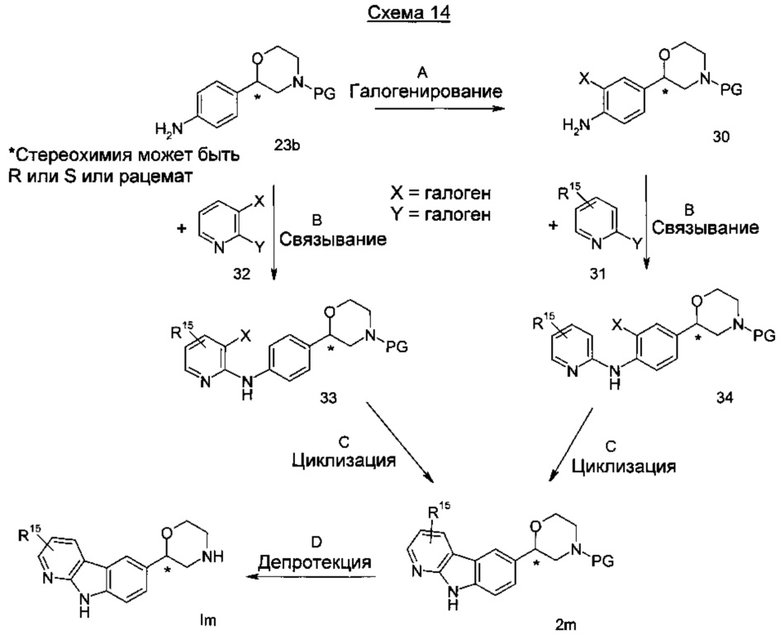
Стадия А: Галогенирование анилина 23b может быть выполнено посредством взаимодействия с подходящим гелогенирующим реагентом, таким как N-хлорсукцинимид или N-бромсукцинимид в тетрахлорметане, хлороформе или диметилформамиде при температуре от 0°C до 75°C в течение от 15 минут до 6 часов.
Предпочтительными условиями являются применение N-хлорсукцинимида в диметилформамиде при 60°C в течение 1 ч.
Стадия В: Связывание анилина 23b или анилина 30 с пиридиновыми соединениями 32 или 31 может быть достигнуто посредством использования палладиевого катализатора, такого как трис(дибензилиденацетон)дипалладий) или тетракис(трифенилфосфин)палладий(0), в комбинации с подходящим лигандом, таким как ксантфос, трифенилфосфин, трициклогексилфосфин или аналогичный, и основанием, таким как фосфат калия, карбонат калия, карбонат цезия в подходящем растворителе, таком как диоксан, диметилацетамид, диметилформамид, тетрагидрофуран, диметоксиэтан или диглим при от 50°C до 140°C в течение от 1 ч до 18 часов в присутствии или без микроволнового излучения.
Предпочтительными условиями являются применение трис(дибензилиденацетон)дипалладия) и карбоната цезия в диоксане при 100°C в течение 2 часов.
Стадия С: Циклизация может быть достигнута посредством использования палладиевого катализатора, такого как ацетат палладия (II) или хлорид палладия (II) с подходящим лигандом, таким как трифенилфосфин, трициклогексилфосфин или аналогичным, и 1,8-диазабицикло[5.4.0]ундец-7-еном в подходящем растворителе, таком как о-ксилен или смеси о-ксилена с диметилацетамидом при от 140°C до 170°C в течение от 1 ч до 18 часов в присутствии или без микроволнового излучения.
Предпочтительными условиями являются применение ацетата палладия (II), трициклогексилфосфина и 1,8-диазабицикло[5.4.0]ундец-7-ена в смеси о-ксилена и диметилацетамида при 155°C в течение 16 часов.
Стадия D: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
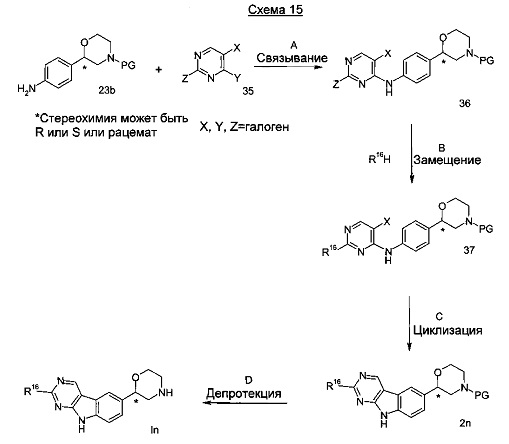
Стадия А: Связывание анилина 23b с пиримидиновым соединением 35 может быть достигнуто посредством использования палладиевого катализатора, такого как трис(дибензилиденацетон)дипалладий) или тетракис(трифенилфосфин)палладий(0) в комбинации с подходящим лигандом, таким как ксантфос, трифенилфосфин, трициклогексилфосфин или аналогичным, и основанием, таким как фосфат калия, карбонат калия, карбонат цезия, в подходящем растворителе, таком как диоксан, диметилацетамид, диметилформамид, тетрагидрофуран, диметоксиэтан или диглим при от 50°C до 140°C в течение от 1 ч до 18 часов в присутствии или без микроволнового излучения.
Предпочтительными условиями являются применение трис(дибензилиденацетон)дипалладия) и карбоната цезия в диоксане при 100°C в течение 2 часов.
Стадия В: Замещение галогена Z посредством алкоксигруппы R16 может быть достигнуто нагреванием соединения 36 с соответствующим спиртом R16H и основанием, таким как трет-бутоксид калия или гидрид натрия или аналогичным при от 20°C до 140°C в течение от 1 ч до 18 часов.
Предпочтительными условиями являются применение спирта вместе трет-бутоксидом калия при 90°C в течение ночи.
Стадия С: Циклизация может быть достигнута посредством использования палладиевого катализатора, такого как ацетат палладия (II) или хлорид палладия (II) с подходящим лигандом, таким как трифенилфосфин, трициклогексилфосфин или аналогичным, и 1,8-диазабицикло[5.4.0]ундец-7-ена в подходящем растворителе, таком как о-ксилен или смеси о-ксилена с диметилацетамидом при от 140°C до 170°C в течение от 1 ч до 18 часов в присутствии или без микроволнового излучения.
Предпочтительными условиями являются применение ацетата палладия (II), трициклогексилфосфина и 1,8-диазабицикло[5.4.0]ундец-7-ена в смеси о-ксилена и диметилацетамида при 155°C в течение 16 часов.
Стадия D: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3, ТГФ, МеОН, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
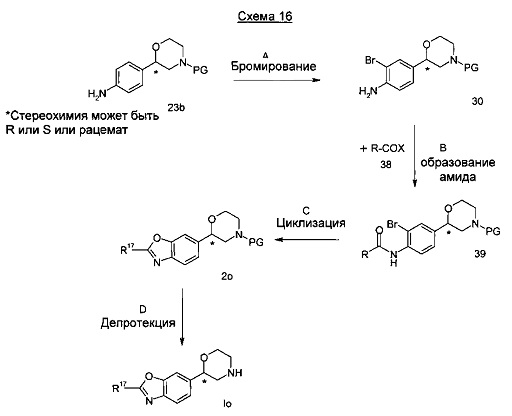
Стадия А: Бромирование анилина 30 может быть выполнено взаимодействием с подходящим бромирующим реагентом, таким как N-бромсукцинимид в тетрахлорметане, хлороформе или диметилформамиде при температуре от 0°C до 75°C в течение от 15 минут до 6 часов.
Предпочтительными условиями являются применение N-бромсукцинимида в диметилформамиде при комнатной температуре в течение 1 ч.
Стадия В: Амидное связывание может быть достигнуто посредством взаимодействия броманилина 30 с подходящим ацилирующим реагентом 38, таким как хлорангидрид, и основанием, таким как диизопропилэтиламин, триэтиламин или пиридин в растворителе, таком как дихлорметан, дихлорэтан, тетрагидрофуран, бензол, толуол, пиридин, при температурах от -20°C до 100°C в течение от 1 ч до 24 часов. Хлорангидрид может быть образован из кислоты разными способами, известными в уровне техники, такими как обработка кислоты тионилхлоридом, фосфороксихлоридом, фосфорпентахлоридом или 1-хлор-N,N2-триметилпропениламином с или без роганического растворителя.
Альтернативно, в качестве ацилирующего реагента может быть использована кислота в присутствии амидсвязывающего реагента, такого как 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), дициклогексилкарбодиимид (DCC), O-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониягексафторфосфат (HBTU), O-(Бензотриазол-1-ил)-N,N,Nʹ,Nʹ-тетраметилурониятетрафторборат (TBTU) или аналогичного, и основания, такого как триэтиламин, диизопропилэтиламин или пиридин, в растворителе, таком как метиленхлорид, 1,2-дихлорэтан, тетрагидрофуран или этилацетат.
Предпочтительными условиями являются применение свежеприготовленного из кислоты и N,N2-триметилпропениламина хлорангидрида, и его взаимодействие с броманилином 30 в дихлорметане в присутствии диизопропилэтиламина.
Стадия С: Циклизация может быть достигнута посредством использования медного катализатора, такого как йодид меди (I)или трифлат меди (I), с подходящим лигандом, таким как 1,10-фенантролин и основанием, таким как карбонат цезия, карбонат натрия или карбонат калия, в подходящем растворителе, таком как 1,2-диметоксиэтан, 1,4-диоксан или диметилацетамид при от 80°C до 150°C в течение от 1 до 18 часов.
Предпочтительными условиями являются применение йодида меди (I), 1,10-фенантролина и карбоната цезия в 1,2-диметоксиэтане при 125°C в течение 18 часов.
Стадия D: Отщепление аминозащитной группы может быть достигнуто различными способами, известными в уровне техники. Трет-бутоксикарбонильная группа может быть отщеплена с использованием минеральной кислоты, такой как HCl, H2SO4 или H3PO4 или органической кислоты, такой как CF3COOH, CHCl2COOH, HOАс или п-толуолсульфоновой кислоты в растворителе, таком как CH2Cl2, CHCl3l ТГФ, МеOH, EtOH или H2O при от 0 до 60°C.
Предпочтительными условиями являются применение HCl в диоксане в течение 2 часов при 60°C или применение CF3COOH в дихлорметане при комнатной температуре в течение ночи.
Выделение и очистка соединений
Выделение и очистка соединений и промежуточных соединений, описанных здесь, может быть осуществлена, если необходимо, с помощью любым подходящим способом разделения или очистки, таких как, например, фильтрации, экстракции, кристаллизации, колоночной хроматографии, тонкослойной хроматографии, хроматография в толстом слое, препаративная жидкостная хроматография низкого или высокого давления или комбинации этих способов. Конкретные иллюстрации подходящих методик разделения и выделения могут быть даны со ссылкой на способы и примеры, изложенные ниже. Тем не менее, другие эквивалентные процедуры разделения или выделения, конечно, также могут быть использованы. Рацемические смеси хиральных соединений формулы I могут быть разделены с помощью хиральной ВЭЖХ. Рацемические смеси хиральных промежуточных соединений синтеза также могут быть разделены с помощью хиральной ВЭЖХ.
Соли соединений Формулы I
Соединения формулы I являются основными и могут быть превращены в соответствующие кислотно-аддитивные соли. Превращение осуществляют путем обработки по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органической кислоты, такой как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Как правило, свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в аналогичном растворителе. Температуру поддерживают в пределах от 0°C до 50°C. Полученная соль выпадает в осадок самопроизвольно или может быть выделена из раствора с помощью менее полярного растворител.
Пример 1
2-(4-(1Н-бензо[d]имидазол-2-ил)фенил)морфолина гидрохлорид
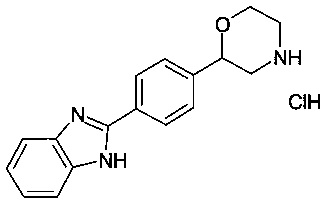
а) трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилат
трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилат (684 мг, 2 ммоль, CAS 1131220-82-0) в ТГФ (6 мл) охладили до -78°C, обработали н-бутиллитием по каплям (1.88 мл, 3 ммоль, 1.6 М раствор в гексане) и перемешивали 30 мин при -78°C. Диметилформамид (1 мл, 2 ммоль) добавили по каплям и смесь перемешивали в течение 2 ч при -78°C, и затем дали нагреться до -10°C. Реакционную смесь погасили посредством добавления насыщенного раствора хлорида аммония (4 мл) и воды (4 мл) и получившуюся смесь разделили между водой и этил ацетатом.
Органический слой промыли солевым раствором, высушили над MgSO4 и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии (20 г силикагель, гептан/этилацетат 4:1) с получением 320 мг серо-белого осадка. MS (ISP):292.3([М+Н]+).
b) трет-бутил 2-(4-(1Н-диметил[d]имидазол-2-ил)фенил)морфолин-4-карбоксилат
трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилат (300 мг, 1.03 ммоль) растворили в диметилацетамиде (4.5 мл). Добавили 1,2-Диаминобензол (134 мг, 1.24 ммоль) и метабисульфит натрия (294 мг, 1.54 ммоль) и реакционную смесь перемешивали при 90°C в течение ночи. После охлаждения, реакционную смесь влили в воду и экстрагировали этилацетатом. Органический слой высушили над MgSO4 и эвапорировали. Неочищенное вещество очистили с помощью флеш-хроматографии (20 г силикагель, 40-70% этилацетат в гептане) с получением белого осадка (333 мг, 85%). MS (ISP): 280.3 (100%, [М-ВОС+Н]+), 380.2 (20%, [М+Н]+).
с) 2-(4-(1Н-бензо[d]имидазол-2-ил)фенил)морфолина гидрохлорид
трет-бутил 2-(4-(1Н-диметил[d]имидазол-2-ил)фенил)морфолин-4-карбоксилат (330 мг, 0.87 ммоль) растворили в диоксане (12 мл) и добавили раствор HCl в диоксане (4М, 3.25 мл, 13 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Осадок отфильтровали, промыли эфиром и высушили под вакуумом при 60°C с получением 2-(4-(1Н-диметил[d]имидазол-2-ил)фенил)морфолина гидрохлорида (232 мг, 85%) в виде серо-белого осадка. MS (ISP): 280.1 ([М+Н]+).
Пример 2
2-(4-(6-хлор-1Н-диметил[d]имидазол-2-ил)фенил)морфолина гидрохлорид
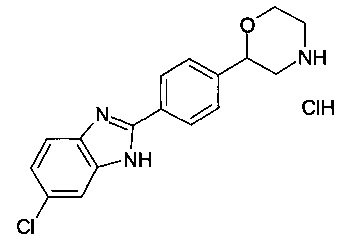
Соединение, указанное в заголовке получили по аналогии с примером 1, используя 4-хлор-1,2-диаминобензол вместо 1,2-диаминобензола на стадии b). Серо-белый осадок. MS (ISP): 313.9 ([{35Cl}M+H]+), 315.2 ([{37Cl}M+H]+).
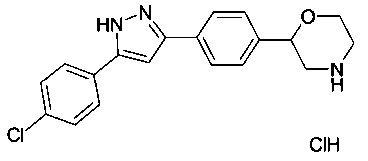
Пример 3
2-(4-(5-(4-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
а) трет-бутил 2-(4-ацетилфенил)морфолин-4-карбоксилат
Трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилат (750 мг, 2.19 ммоль, CAS 1131220-82-0) в ТГФ (6 мл) охладили до -78°C, обработали н-бутиллитием по каплям (2.05 мл, 3.29 ммоль, 1.6 М раствор в гексане) и перемешивали 1 ч при -78°C. N-метокси-N-метилацетамид (226 мг, 2.19 ммоль) добавили и смесь перемешивали в течение 1 ч при -78°C, и затем дали нагреться до -5°C. Реакционную смесь погасили посредством добавления насыщенного раствора хлорида аммония (4 мл) и воды (4 мл) и получившуюся смесь разделили между водой и этилацетатом.
Органический слой промыли солевым раствором, высушили над MgSO4 и сконцентрировали под вакуумом. Остаток очистили с помощью флеш-хроматографии (20 г силикагель, гептан/этилацетат 4:1) с получением 430 мг белого осадка. MS (ISP): 323.3 ([M+NH4]+).
b) трет-бутил 2-(4-(3-(4-хлорфенил)-3-оксопропаноил)фенил)морфолин-4-карбоксилат
трет-бутил 2-(4-ацетилфенил)морфолин-4-карбоксилат (210 мг, 0.69 ммоль) растворили в ТГФ (3.5 мл). Добавили по каплям литий-бис-(триметилсилил)-амидный раствор (2.05 мл, 2.05 ммоль, 1.0 М раствор в ТГФ) и желтую реакционную смесь перемешивали при -78°C в течение 1 часа. Добавили 4-хлорбензоилхлорид (120 мг, 0.69 ммоль) и реакционную смесь перемешивали в течение 90 мин и погасили посредством добавления 1М водной соляной кислоты. Добавили этилацетат и органический слой высушили над MgSO4 и эвапорировали. Неочищенное вещество очистили с помощью флеш-хроматографии (10 г силикагель, 10-50% этилацетат в гептане) с получением серо-белого осадка (215 мг, 70%). MS (ISP): 388.2 ([{35Cl}M-tBu+H]+), 390.3 ([{37Cl}М-tBu+Н]+).
c) трет-бутил 2-(4-(5-(4-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат
Раствор трет-бутил 2-(4-(3-(4-хлорфенил)-3-оксопропаноил)фенил)морфолин-4-карбоксилата (210 мг, 0.473 ммоль) и гидратгидразина (35.5 мг, 0.70 ммоль) в этаноле (3.5 мл) нагрели до кипения с обратным холодильником с перемешиванием в течение ночи. Чистый желтый раствор эвапорировали при пониженном давлении, добавили воду и этилацетат.Органический слой разделили, водный слой экстрагировали снова этилацетатом. Объединенные органические слои высушили над MgSO4 и эвапорировали. Неочищенное вещество очистили с помощью флеш-хроматографии (10 г силикагель, 10-50% этилацетат в гептане) с получением белого осадка (208 мг, 89%). MS (ISP neg): 438.3 ([{35Cl}M-H]+), 440.4 ([{37Cl}M-H]+).
d) 2-(4-(5-(4-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
трет-бутил 2-(4-(5-(4-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат (180 мг, 0.41 ммоль) растворили в диоксане (5.5 мл) и добавили раствор HCl в диоксане (4М, 1.53 мл, 6.15 ммоль). Реакционную смесь перемешивали в течение 2 ч при 60°C и в течение ночи при комнатной температуре. Осадок отфильтровали, промыли эфиром и высушили под вакуумом с получением 2-(4-(5-(4-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорида (131 мг, 85%) в виде белого осадка. MS (ISP): 340.1 ([{35Cl}M+H]+), 342.1 ([{37Cl}M+H]+).
Пример 4
2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
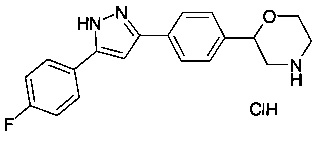
Соединение, указанное в заголовке получили по аналогии с примером 3, используя 4-фторбензоилхлорид вместо 4-хлорбензоилхлорида на стадии b). Белый осадок. MS (ISP): 324.3 ([М+Н]+).
Пример 5
2-(4-(5-(6-хлорпиридин-3-ил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
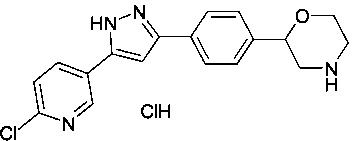
Соединение, указанное в заголовке получили по аналогии с примером 3, используя 6-хлорникотиноилхлорид вместо 4-хлорбензоилхлорида на стадии b). Белый осадок. MS (ISP): 341.1 ([М+Н]+).
Пример 6
4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрила гидрохлорид
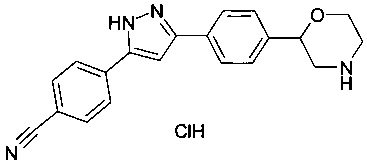
Соединение, указанное в заголовке получили по аналогии с примером 3, используя 4-цианобензиолхлорид вместо 4-хлорбензоилхлорида на стадии b). Белый осадок. MS (ISP): 331.1 ([М+Н]+).
Пример 7
(S)-2-(4-(6-бромо-1Н-имидазо[4,5-b]пиридин-2-ил)фенил)морфолина гидрохлорид
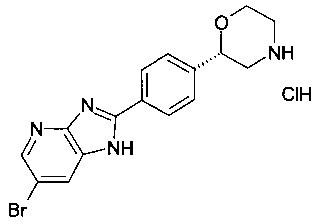
Соединение, указанное в заголовке получили по аналогии с примером 1 с использованием (S)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата и 3-бромпиридин-1,2-диамина вместо 1,2-диаминобензола на стадии b). Серо-белый осадок. MS (ISP): 359.1 ([{79Br}М+Н]+), 361.1 ([{81Br}М+Н]+).
Пример 8
(R)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
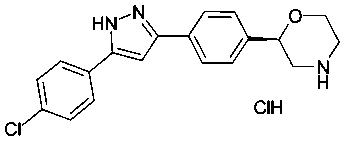
а) трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат
трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат получили по аналогии с примером 3, используя 3-хлорбензоилхлорид вместо 4-хлорбензоилхлорида на стадии b). Белый осадок. MS (ISP neg): 438.3 ([{35Cl}M-H]+), 440.4 ([{37Cl}M-H]+).
b) (R)-трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат
(R)-трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат получили с помощью хроматографического разделения энантиомеров. Посредством разделения 159 мг трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилата на колонке Chiralpak AD (элюент гептан/этанол) получили 52 мг (R)-трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилата и 52 мг (S)-энантиомера. Белый осадок. MS (ISP): 440.2 ([{35Cl}M+H]+), 442.2 ([{37Cl}M+H]+).
с) (R)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (R)-трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-(3-(4-хлорфенил)-3-оксопропаноил)фенил)морфолин-4-карбоксилата на стадии d). Белый осадок. MS (ISP): 340.1 ([{35Cl}M+H]+), 342.1 ([{37Cl}M+H]+).
Пример 9
(S)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид

a) трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат
трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат получили по аналогии с примером 3, используя 3-хлорбензоилхлорид вместо 4-хлорбензоилхлорида на стадии b). Белый осадок. MS (ISP neg): 438.3 ([{35Cl}M-H]+), 440.4 ([{37Cl}M-H]+).
b) (S)-трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат получили с помощью хроматографического разделения энантиомеров. С помощью разделения 159 мг трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилата на колонке Chiralpak AD (элюент гептан/этанол) получили 52 мг (S)-трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилата и 52 мг (R)-энантиомера. Белый осадок. MS (ISP): 440.2 ([{35Cl}M+H]+), 442.2 ([{37Cl}M+H]+).
c) (S)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (S)-трет-бутил 2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-(3-(4-хлорфенил)-3-оксопропаноил)фенил)морфолин-4-карбоксилата на стадии d). Белый осадок. MS (ISP): 340.1 ([{35Cl}M+H]+), 342.1 ([{37Cl}M+H]+).
Пример 10
(S)-2-(4-(6-фтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолина гидрохлорид
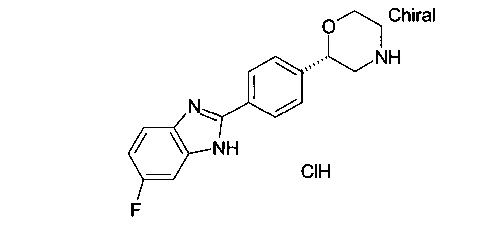
Соединение, указанное в заголовке получили по аналогии с примером 1 с использованием (S)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата и 1,2-диамино-4-фтор-диаминобензола вместо 1,2-диаминобензола на стадии b). Светло-коричневый осадок. MS (ISP): 298.2 ([М+Н]+).
Пример 11
(S)-2-(4-(4,6-дифтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолина гидрохлорид
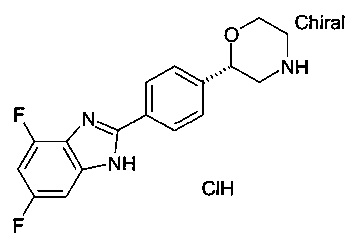
Соединение, указанное в заголовке получили по аналогии с примером 1 с использованием (S)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата и 1,2-диамино-3,5-дифтор-диаминобензола вместо 1,2-диаминобензола на стадии b). Светло-желтый осадок. MS (ISP): 316.1 ([М+Н]+).
Пример 12
3-[5-(4-морфолин-2-ил-фенил)-2Н-пиразол-3-ил]-бензонитрила гидрохлорид
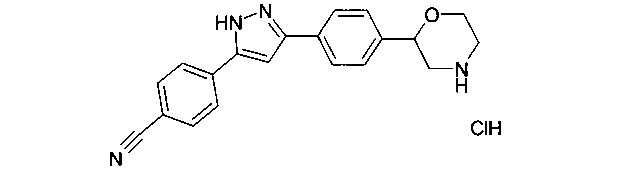
Соединение, указанное в заголовке получили по аналогии с примером 3, используя 3-цианобензиолхлорид вместо 4-хлорбензоилхлорида на стадии b). Серо-белый осадок. MS (ISP): 331.1 ([М+Н]+).
Пример 13
(S)-2-(4-(5-(2,4-дифторфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
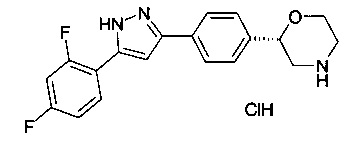
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 2,4-дифторбензоилхлорида вместо 4-хлорбензоилхлорида на стадии b). Светло-желтый осадок. MS (ISP): 342.1 ([М+Н]+).
Пример 14
(R)-2-(4-(5-(2,4-дифторфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (R)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 2,4-дифторбензоилхлорида вместо 4-хлорбензоилхлорида на стадии b). Светло-желтый осадок. MS (ISP): 342.1 ([М+Н]+).
Пример 15
(R)-2-(4-(6-фтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолина гидрохлорид
Соединение, указанное в заголовке получили по аналогии с примером 1 с использованием (R)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата и 1,2-диамино-4-фтор-диаминобензола вместо 1,2-диаминобензола на стадии b). Светло-красный осадок. MS (ISP): 298.2 ([М+Н]+).
Пример 16
(S)-2-(4-(5,6-диметил-1Н-диметил[d]имидазол-2-ил)фенил)морфолина гидрохлорид
Соединение, указанное в заголовке получили по аналогии с примером 1 с использованием (S)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилат и 1,2-диамино-4,5-диметил-диаминобензола вместо 1,2-диаминобензола на стадии b). Серо-белый осадок. MS (ISP): 308.3 ([М+Н]+).
Пример 17
(S)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолина гидрохлорид
а) (S)-трет-бутил 2-(4-((2-(4-фторбензоил)гидразоно)метил)фенил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилат (120 мг, 0.41 ммоль) и 4-фторбензогидразид (64 мг, 0.41 ммоль) растворили в этаноле (2 мл) и перемешивали в течение 2 ч при комнатной температуре. Растворитель эвапорировали и добавили эфир/этанол (3:1) для выпадения продукта в осадок. Кристаллы отфильтровали с получением белого осадка (101 мг, 58%). MS (ISP): 327.1 ([M-tBu+H]+).
b) (S)-трет-бутил 2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолин-4-карбоксилат
[бис(трифторацетокси)йод]бензол (90.5 мг, 0.211 ммоль) растворили в хлороформе (5 мл), затем добавили (S)-трет-бутил 2-(4-((2-(4-фторбензоил)гидразоно)метил)фенил)морфолин-4-карбоксилат (75 мг, 0.175 ммоль) и смесь перемешивали при комнатной температуре в течение 20 мин. Растворитель эвапорировали и остаток очистили с помощью флеш-хроматографии (10 г силикагель, 10-20% этилацетат в гептане) с получением белого осадка (49 мг, 66%). MS (ISP): 370.1 ([M-tBu+H]+), 426.1 ([М+Н]+).
c) (S)-2-(4-(5-(4-Фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолина гидрохлорид
(S)-трет-бутил 2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолин-4-карбоксилат (45 мг, 0.105 ммоль) растворили в диоксане (1 мл) и добавили раствор HCl в диоксане (4М, 0.317 мл, 1.27 ммоль). Реакционную смесь перемешивали в течение 2 ч при 60°C. После охлаждения добавили эфир (2 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолина гидрохлорида (32 мг, 84%) в виде белого осадка. MS (ISP): 326.1 ([М+Н]+).
Пример 18
(S)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолина гидрохлорид
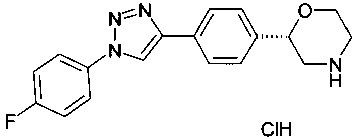
a) (S)-трет-бутил 2-(4-этинилФенил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилат (120 мг, 0.41 ммоль) растворили в метаноле (5 мл), затем добавили карбонат калия (114 мг, 0.824 ммоль), с последующим диметил 1-диазо-2-оксопропилфосфонатом (99 мг, 0.515 ммоль). Смесь перемешивали в течение 2 ч при комнатной температуре. Добавили этилацетат (50 мл) раствор бикарбоната натрия (50 мл), водную фазу снова экстрагировали этил ацетатом. Объединенные органические слои высушили (MgSO4) и эвапорировали. Остаток очистили с помощью флеш-хроматографии (10 г силикагель, 10-20% этилацетат в гептане) с получением бесцветного масла (103 мг, 87%).
b) (S)-трет-бутил 2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолин-4-карбоксилат
1-азидо-4-фторбензол (24 мг, 0.174 ммоль) растворили в N,N-диизопропилэтиламине (0.75 мл), затем добавили (S)-трет-бутил 2-(4-этинилфенил)морфолин-4-карбоксилат (50 мг, 0.175 ммоль) с последующим йодидом меди (I) (33 мг, 0.174 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч. Зеленую смесь сконцентрировали на роторном испарителе, добавили силикагель (0.5 г) и после непродолжительного растирания смесь поместили на колонку силикагеля для очистки. Флеш-хроматография (5 г силикагель, 30% этилацетат в гептане) дала белый осадок (21 мг, 28%). MS (ISP): 369.1 ([M-tBu+H]+), 425.2 ([М+Н]+).
c) (S)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолина гидрохлорид
(S)-трет-бутил 2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолин-4-карбоксилат (20 мг, 0.047 ммоль) растворили в диоксане (1 мл) и добавили раствор HCl в диоксане (4М, 0.14 мл, 0.56 ммоль). Реакционную смесь перемешивали в течение 2 ч при 60°C. После охлаждения добавили эфир (2 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолина гидрохлорида (13 мг, 76%) в виде белого осадка. MS (ISP): 325.2 ([М+Н]+).
Пример 19
(S)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолина гидрохлорид
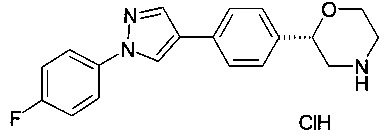
(a) (S)-трет-бутил 2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолин-4-карбоксилат
Смесь (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата (100 мг, 0.29 ммоль), 1-(4-фторфенил)-1Н-пиразол-4-илбороновой кислоты (60 мг, 0.29 ммоль), трехосновного фосфата калия (124 мг, 0.585 ммоль) и тетракис(трифенилфосфин)палладия (0) (13.5 мг, 0.0117 ммоль) в диметилацетамиде (2 мл) поместили в пробирку для микроволновой печи, закрыли и нагревали при 150°C в течение 10 мин с использованием микроволнового синтезатора (Personal Chemistry Emrys Optimizer). После охлаждения добавили воду (10 мл), и реакционную смесь экстрагировали этилацетатом. Водную фазу снова экстрагировали этилацетатом дважды. Объединенные органические слои высушили (MgSO4) и эвапорировали. Остаток очистили с помощью флеш-хроматографии (12 г силикагель, 10-50% этилацетат в гептане) с получением светло-коричневого осадка (45 мг, 36%). MS (ISP): 424.1 ([М+Н]+).
b) (S)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолина гидрохлорид
(S)-трет-бутил 2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолин-4-карбоксилат (45 мг, 0.106 ммоль) растворили в диоксане (0.2 мл) и добавили раствор HCl в диоксане (4М, 0.4 мл, 1.59 ммоль). Реакционную смесь перемешивали при 60°C в течение ночи. После охлаждения добавили эфир (2 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолина гидрохлорида (38 мг, 99%) в виде белого осадка. MS (ISP): 324.2 ([М+Н]+).
Пример 20
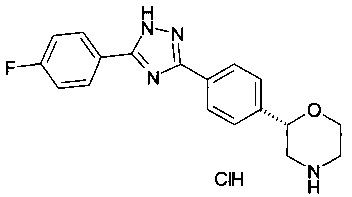
(S)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолина гидрохлорид
а) (S)-трет-бутил 2-(4-цианофенил)морфолин-4-карбоксилат
Смесь (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата (400 мг, 1.17 ммоль), тетракис(трифенилфосфин)палладия (0) (405 мг, 0.35 ммоль) и цианида цинка (206 мг, 1.75 ммоль) в диметилформамиде (6 мл) дегазировали аргоном и нагревали в закрытой пробирке при 85°C на шейкере Büchi в течение ночи. После охлаждения добавили воду (30 мл), и реакционную смесь экстрагировали этилацетатом (50 мл). Водную фазу снова экстрагировали этилацетатом (50 мл). Объединенные органические слои снова экстрагировали концентрированным раствором хлорида натрия, высушили (MgSO4) и эвапорировали. Остаток очистили с помощью флеш-хроматографии (20 г силикагель, 10% этилацетат в гептане) с получением белого осадка (233 мг, 69%). MS (ISP): 289.1 ([М+Н]+), 306.2 ([M+NH4]+).
b) (S)-трет-бутил 2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)Фенил)морфолин-4-карбоксилат
4-фторбензогидразид (50 мг, 0.324) и (S)-трет-бутил 2-(4-цианофенил)морфолин-4-карбоксилат (112 мг, 0.389 ммоль) и карбонат калия (22.5 мг, 0.162 ммоль) растворили в бутан-1-оле (1 мл) и перемешивали в закрытой пробирке в течение 3 ч при 150°C. Пробирку открыли и нагревание продолжили в течение дополнительных 15 минут для эвапорации большинства растворителя.
Желтый остаток разделили между водой и этилацетатом. Объединенные органические слои высушили (MgSO4) и эвапорировали. Флеш-хроматография (10 г силикагель, 10% to 30% этилацетат в гептане) дала белый осадок (30 мг, 22%). MS (ISP):369.2 ([M-tBu+H]+), 425.2 ([М+Н]+).
c) (S)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолина гидрохлорид
(S)-трет-бутил 2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолин-4-карбоксилат (28 мг, 0.066 ммоль) растворили в диоксане (0.5 мл) и добавили раствор HCl в диоксане (4М, 0.2 мл, 0.79 ммоль). Реакционную смесь перемешивали при 60°C в течение 2 ч. После охлаждения добавили эфир (2 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолина гидрохлорида (26 мг, 99%) в виде белого осадка. MS (ISP): 325.2 ([М+Н]+).
Пример 21
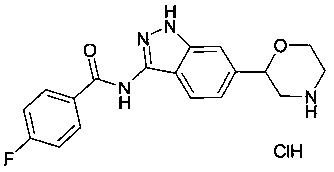
4-фтор-N-(6-(морфолин-2-ил)-1Н-индазол-3-ил)бензамида гидрохлорид
а) 2-(4-бромо-3-фтор-фенил)-оксиран
2-бромо-1-(4-бромо-3-фторфенил)-этанон [CAS 1003879-02-4] (32.3 г, 109 ммоль) растворили в этаноле (250 мл). Реакционную смесь охладили до 5°C с получением желтой суспензии. Добавили борогидрид натрия (4.13 г, 109 ммоль) в течение 5 мин. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавили метоксид натрия (2.95 г, 54.6 ммоль). Реакционную смесь перемешивали при 50°C в течение 6 ч. Реакционную смесь влили в трет-бутил метиловый эфир и экстрагировали солевым раствором. Органический слой высушили над MgSO4 и сконцентрировали под вакуумом с получением желтого масла (25.1 г, 94%). GC-EI-MS: 216 ([М⋅+]).
b) 1-(4-бромо-3-Фтор-фенил)-2-(2-гидрокси-этиламино)-этанол
2-(4-бромо-3-фтор-фенил)-оксиран (25.1 г, 109 ммоль) объединили с тетрагидрофураном (70 мл) с получением желтого раствора. Добавили этаноламин (66.4 г, 65.1 мл, 1.09 моль). Получившийся оранжевый раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь влили в солевой раствор и дважды экстрагировали этилацетатом. Органические слои высушили над MgSO4 и сконцентрировали под вакуумом с получением желтого масла (27.9 г, 92%), MS (ISP): 277.9 ([{79Br}M+H]+), 279.9 ([{81Br}M+H]+).
с) [2-(4-бромо-3-фтор-фенил)-2-гидрокси-этил]-(2-гидрокси-этил)-карбаминовой кислоты трет-бутиловый эфир
1-(4-бромо-3-фтор-фенил)-2-(2-гидрокси-этиламино)-этанол (27.9 г, 100 ммоль) растворили в тетрагидрофуране (200 мл) и охладили до 0°C. Ди-трет-бутилдикарбонат (24.1 г, 110 ммоль) добавили и ледяную ванну убрали. Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Реакционную смесь влили в воду и экстрагировали дихлорметаном. Реакционную смесь влили в EtOAc и экстрагировали разбавленным NaOH и солевым раствором. Органический слой высушили над MgSO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 0%-10% метанол в дихлорметане) с получением 25.3 г (66.5%) [2-(4-бромо-3-фтор-фенил)-2-гидрокси-этил]-(2-гидрокси-этил)-карбаминовой кислоты трет-бутилового эфира в виде желтого масла, MS (ISP): 322.0 ([{79Br}M-tBu+H]+), 324.3 ([{81Br}M-tBu+H]+), 378.1 ([{79Br}M+H]+), 380.1 ([{81Br}M+H]+).
d) 2-(4-бромо-3-фтор-фенил)-морфолин-4-карбоновой кислоты трет-бутиловый эфир
[2-(4-бромо-3-фтор-фенил)-2-гидрокси-этил]-(2-гидрокси-этил)-карбаминовой кислоты трет-бутиловый эфир (25.3 г, 66.9 ммоль) и триэтиламин (10.2 г, 14.0 мл, 100 ммоль) объединили с тетрагидрофураном (270 мл) с получением светло-желтого раствора. Реакционную смесь охладили до 0-5°C и метансульфонилхлорид (8.43 г, 5.73 мл, 73.6 ммоль) добавили по каплям. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч с получением белой суспензии. Реакционную смесь отфильтровали и промыли тетрагидрофураном (20 мл). Калия 2-метил-2-бутоксид (1.7 М в толуоле, 59 мл, 100 ммоль) добавили по каплям к фильтрату при 0-5°C. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь влили в этилацетат и экстрагировали разбавленным водным раствором соляной кислоты (pH 5), водой и солевым раствором. Органический слой высушили над MgSO4 и сконцентрировали под вакуумом с получением желтого масла, которое затем очистили с помощью флеш-хроматографии (силикагель, гептан/этилацетат 4:1): желтый осадок (19.5 г, 81%), MS (ISP): 259.9 ([{79Br}М-ВОС+Н]+), 261.9 ([{81Br}М-ВОС+Н]+).
e) трет-бутил 2-(4-циано-3-фторфенил)морфолин-4-карбоксилат
В 20 мл пробирку для микроволновой печи добавили 2-(4-бромо-3-фтор-фенил)-морфолин-4-карбоновой кислоты трет-бутиловый эфир (1.5 г, 4.16 ммоль) N-метил-пирролидин (10 мл) и цианид меди (I) (559 мг, 6.25 ммоль). Пробирку закрыли и нагревали в микроволновом синтезаторе (Personal Chemistry Emrys Optimizer) при 180°C в течение 30 мин. Реакционную смесь влили в трет-бутилметиловый эфир (150 мл) и экстрагировали солевым раствором (3×50 мл). Органические слои высушили над MgSO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 50 г, 0%-70% этилацетат в гептане) с получением желтого осадка (101 мг, 8%), MS (ISP): 307.2 ([М+Н]+).
f) трет-бутил 2-(3-амино-1Н-индазол-6-ил)морфолин-4-карбоксилат
Гидразинмоногидрат (47.6 мг, 0.046 мл, 0.95 ммоль) и трет-бутил 2-(4-циано-3-фторфенил) морфолин-4-карбоксилат (97 мг, 0.32 ммоль) растворили в этаноле (1 мл) и реакционную смесь кипятили с обратным холодильником в течение ночи. После охлаждения, растворитель эвапорировали и продукт экстрагировали водой (3 мл) и этилацетатом (5 мл). Органический слой высушили над MgSO4 и сконцентрировали под вакуумом с получением желтого масла, которое дополнительно очистили с помощью флеш-хроматографии (силикагель, этилацетат). Продукт выделили в виде желтого масла (49 мг, 49%), MS (ISP): 219.2 (100%, [М-ВОС+Н]+), 263.2 (80%, [M-tBu+H]+), 319.2 (30%, [М+Н]+).
g) трет-бутил 2-(3-(4-фторбензамидо)-1Н-индазол-6-ил)морфолин-4-карбоксилат
Трет-бутил 2-(3-амино-1Н-индазол-6-ил)морфолин-4-карбоксилат (43 мг, 0.135 ммоль) растворили в пиридине (0.2 мл) и раствор охладили до -5°C. 4-фторбензоилхлорид (21.4 мг, 0.135 ммоль) медленно добавили. Через 5 мин, охлаждающую ванну убрали и перемешивание продолжили в течение ночи. Реакционную смесь разбавили этилацетатом (2 мл) и промыли 1М раствором лимонной кислоты (2 мл). Органический слой высушили над MgSO4 и сконцентрировали под вакуумом с получением коричневого масла, которое дополнительно очистили с помощью колоночной флеш-хроматографии (силикагель, 50%-100% этилацетат в гептане). Продукт выделили в виде желтого осадка (40 мг, 67%), MS (ISP): 441.3 (100%, ([M-tBu+H]+), 385.2 (38%, [М+Н]+).
h) 4-фтор-N-(6-(морсфолин-2-ил)-1Н-индазол-3-ил)бензамида гидрохлорид
Трет-бутил 2-(3-(4-фторбензамидо)-1Н-индазол-6-ил)морфолин-4-карбоксилат (40 мг, 0.09 ммоль) растворили в диоксане (0.2 мл) и добавили раствор HCl в диоксане (4М, 0.34 мл, 1.36 ммоль). Реакционную смесь перемешивали в течение 2 ч при 60°C. После охлаждения добавили эфир (2 мл), смесь перемешивали в течение 30 мин и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением 4-фтор-N-(6-(морфолин-2-ил)-1Н-индазол-3-ил)бензамида гидрохлорида (22 мг, 66%) в виде серо-белого осадка. MS (ISP): 341.2 ([М+Н]+).
Пример 22
(S)-2-{4-[(R)-4-(4-фтор-фенил)-4,5-дигидро-оксазол-2-ил]-фенил}-морфолин
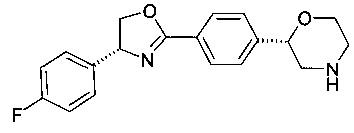
a) (трет-бутил 2-(4-((R)-1-(4-фторфенил)-2- гидроксиэтилкарбамоил)фенил)морфолин-4-карбоксилат
Смесь (R)-2-амино-2-(4-фторфенил)этанола (68.6 мг, 0.44 ммоль), (S)-4-(4-(трет-бутоксикарбонил)морфолин-2-ил)бензойной кислоты [CAS 1131220-40-0], (136 мг, 0.44 ммоль), 1-этил-3-(3-диметиламинопропил)карбодиимида (170 мг, 0.88 ммоль), 4-диметиламинопиридина (54.0 мг, 0.44 ммоль) и триэтиламина (179 мг, 0.25 мл, 1.77 ммоль) в дихлорметане (9 мл) перемешивали при комнатной температуре в течение ночи. Реакцию погасили с помощью добавления 1М раствора лимонной кислоты (5 мл). Органический слой разделили, промыли насыщенным раствором бикарбоната натрия (5 мл), высушили над MgSO4 и эвапорировали. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, градиент гептан/этилацетат), с получением белой пены (100 мг, 51%), MS (ISP): 445.4 (100%, [M-tBu+H]+), 389.3 (29%, [М+Н]+).
b) N-((R)-1-(4-фторфенил)-2-гидроксиэтил)-4-((S)-морфолин-2-ил)бензамид
(S)-трет-бутил 2-(4-((R)-1-(4-фторфенил)-2-гидроксиэтилкарбамоил)фенил)морфолин-4-карбоксилат (44 мг, 0.099 ммоль) растворили в дихлорметане (0.3 мл) и добавили трифторуксусную кислоту (447 мг, 0.3 мл, 3.92 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 60 мин. Растворитель и избыток трифторуксусной кислоты эвапорировали. Остаток растворили в дихлорметане (3 мл) и экстрагировали насыщенным раствором бикарбоната натрия (2 мл). Органический слой высушили над MgSO4 и эвапорировали. Неочищенный продукт сразу использовали на следующей стадии.
MS (ISP): 345.1([М+Н]+).
c) (S)-2-{4-[(R)-4-(4-фтор-фенил)-4,5-дигидро-оксазол-2-ил}-фенил)-морфолин
N-((R)-1-(4-фторфенил)-2-гидроксиэтил)-4-((S)-морфолин-2-ил)бензамид (14.4 мг, 0.042 ммоль) растворили в дихлорметане (0.4 мл) и добавили диэтиламиносеры трифторид (DAST) (6.74 мг, 0.042 ммоль). Реакционную смесь оставили перемешиваться при комнатной температуре в течение 5 часов. Реакционную смесь влили через колотый лед, смешанный с 25% раствором гидроксида аммония (10 мл) и раствор экстрагировали дважды дихлорметаном (2×10 мл). Объединенный органический слой высушили над MgSO4 и эвапорировали с получением вязкого осадка. Добавление гептан/этилацетата 4:1 и нескольких капель дихлорметана дало белый осадок, который выделили фильтрацией и высушили под вакуумом с получением продукта, в виде белого осадка (5.1 мг, 37%): MS (ISP): 327.2 ([М+Н]+).
Пример 23
(R)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолина гидрохлорид
Соединение, указанное в заголовке получили по аналогии с примером 20 с использованием (R)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а). Белый осадок. MS (ISP): 325.2 ([М+Н]+).
Пример 24
(S)-2-(4-(5-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
Соединение, указанное в заголовке получили по аналогии с примером 3, используя тетрагидро-2Н-пиран-4-карбонилхлорида вместо 4-хлорбензоилхлорида на стадии b). Белый осадок. MS (ISP): 314.2 ([М+Н]+).
Пример 25
(S)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолина гидрохлорид
a) (S)-трет-бутил 2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолин-4-карбоксилат
3-(4-фторфенил)-1Н-1,2,4-триазол (CAS [95728-10-2], 200 мг, 0.9 ммоль) растворили в смеси диметилформамида и воды (5.5 мл; v/v=10:1) и последовательно добавили (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилат (368 мг, 1.08 ммоль), карбонат цезия (1.46 г, 4.48 ммоль), йодид меди (I) (5.1 мг, 0.027 ммоль) и 8-гидроксихинолин (4 мг, 0.027 ммоль). Пробирку закрыли и реакционную смесь оставили перемешиваться при 150°C в течение 48 ч. Согласно ТСХ, реакция завершилась. После охлаждения, добавили воду и этилацетат. Органический слой высушили над MgSO4 и эвапорировали. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, градиент гептан/этилацетат), серо-белый осадок (205 мг, 54%), MS (ISP): 425.2 ([М+Н]+).
b) (S)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолина гидрохлорид
(S)-трет-бутил 2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолин-4-карбоксилат (201 мг, 0.47 ммоль) растворили в диоксане (0.5 мл) и добавили раствор HCl в диоксане (4М, 1.75 мл, 7.1 ммоль). Реакционную смесь перемешивали в течение 3 ч при 60°C. После охлаждения добавили эфир (2 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолина гидрохлорида в виде белого осадка (170 мг, 99%). MS (ISP): 325.2 ([М+Н]+).
Пример 26
(R)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолина гидрохлорид
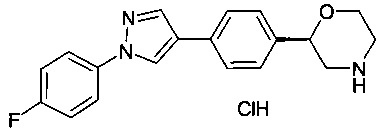
Соединение, указанное в заголовке, получили по аналогии с примером 19 с использованием (R)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а). Белый осадок. MS (ISP): 324.3 ([М+Н]+).
Пример 27
(S)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолина гидрохлорид
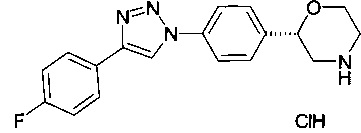
а) (S)-трет-бутил 2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилат (150 мг, 0.54 моль) растворили в 3 М уксусной кислоте, затем охладили до 0°C. Добавили нитрит натрия (93 мг, 1.35 ммоль) и желтый раствор перемешивали при 0°C в течение 5 мин. Затем к смеси добавили азид натрия (70 мг, 1.08 ммоль) и перемешивание продолжили в течение 15 мин. Этилацетат добавили для растворения преципитата и перемешивание продолжили в течение 15 мин. Органический слой разделили и водный слой снова экстрагировали этилацетатом. Объединенные органические слои последовательно экстрагировали 0.1 М раствором лимонной кислоты и 1М раствором бикарбоната натрия. После высушивания над MgSO4 органический слой эвапорировали с получением неочищенного (S)-трет-бутил 2-(4-азидофенил)морфолин-4-карбоксилата в виде желтого масла (161 мг), которое использовали для следующей реакции циклообразования.
(S)-трет-бутил 2-(4-азидофенил)морфолин-4-карбоксилат (76 мг, 0.25 mol) растворили в диизопропилэтиламине (800 мг, 6.24 ммоль). Добавили 1-этинил-4-фторбензол (30 мг, 0.25 ммоль), с последующим йодидом меди (I) (48 мг, 0.25 ммоль). Смесь перемешивали в течение 2 ч при комнатной температуре. Зеленую смесь сконцентрировали на роторном испарителе, добавили силикагель (0.5 г) и после непродолжительного растирания смесь поместили на колонку силикагеля для очистки. Флеш-хроматография (5 г силикагель, 10-30% этилацетат в гептане) дала белый осадок (17 мг, 16%), MS (ISP): 425.2 ([М+Н]+).
b) (S)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)Фенил)морфолина гидрохлорид
(S)-трет-бутил 2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолин-4-карбоксилат (14 мг, 0.033 ммоль) растворили в диоксане (0.5 мл) и добавили раствор HCl в диоксане (4М, 0.2 мл, 0.8 ммоль). Реакционную смесь перемешивали в течение 5 ч при 60°C. После охлаждения добавили эфир (2 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолина гидрохлорида (10 мг, 84%) в виде белого осадка. MS (ISP): 325.2 ([М+Н]+).
Пример 28
(S)-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрила гидрохлорид
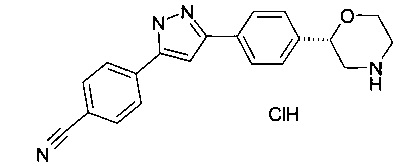
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 4-цианобензиолхлорида вместо 4-хлорбензоилхлорида на стадии b). Серо-белый осадок. MS (ISP): 331.2 ([М+Н]+).
Пример 29
(S)-2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
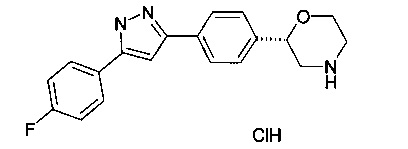
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата гидрохлорид вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 4-фторбензоилхлорида вместо 4-хлорбензоилхлорида на стадии b). Серо-белый осадок. MS (ISP): 324.3 ([М+Н]+).
Пример 30
(S)-4-фтор-N-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензамида гидрохлорид
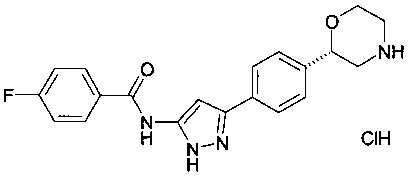
a) (S)-трет-бутил 2-(4-(метоксикарбонил)фенил)морфолин-4-карбоксилат
(S)-4-(4-(трет-бутоксикарбонил)морфолин-2-ил)бензойную кислоту [CAS 1131220-40-0], (500 мг, 1.63 ммоль) растворили в диметилформамиде (8.6 мл). Добавили карбонат калия (675 мг, 4.88 ммоль) и йодометан (346 мг, 0.152 мл, 2.44 ммоль). Реакционную смесь встряхивали при комнатной температуре в течение ночи. Раствор разбавили водой (25 мл) и экстрагировали этилацетатом (2×40 мл). Объединенный органический слой высушили над MgSO4 и эвапорировали с получением светло-желтого масла. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 25% этилацетат в гептане). Выделили белый осадок (427 мг, 82%), MS (ISP): 266.1 (100%, [М-tBu+H]+), 222.1 (40%, [М-ВОС+Н]+), 322.2 (7% [М+Н]+).
b) (S)-трет-бутил 2-(4-(2-цианоацетил)фенил)морфолин-4-карбоксилат
Н-бутиллитий 1.6 М в гексане (1.63 мл, 2.61 ммоль) разбавили тетрагидрофураном (2 мл) и охладили до -78°C. Ацетонитрил (107 мг, 0.137 мл, 2.61 ммоль) добавили по каплям и перемешивание продолжили в течение 1 часа. (S)-трет-бутил 2-(4-(метоксикарбонил)фенил)морфолин-4-карбоксилат (420 мг, 1.31 ммоль), растворенный в тетрагидрофуране, медленно добавили к белой суспензии в течение 10 мин. Через 3 часа, реакцию погасили посредством добавления насыщенного раствора хлорида аммония (5 мл) и экстрагировали диэтиловым эфиром (10 мл). Органический слой высушили над MgSO4 и эвапорировали.
Неочищенный материал очистили с помощью флеш-хроматографии (силикагель, градиент гептан/этилацетат) с получением продукта в виде светло-желтого осадка (360 мг, 83%), 1Н NMR (300 MHz, CDCl3) δ ppm: 1.49 (s, 9Н), 2.69-2.83 (m, 1H), 2.98-3.13 (m, 1H), 3.69 (td, J=9 Hz, J=0.5 Hz, 1H), 3.88-4.20 (m, 3H), 4.07 (s, 2H), 4.5 (dd, J=9 Hz, J=0.5 Hz), 7.54 (d, J=6.4 Hz), 7.92 (d, J=6.4 Hz).
c) (S)-трет-бутил 2-(4-(5-амино-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-(2-цианоацетил)фенил)морфолин-4-карбоксилат (340 мг, 1.03 ммоль) растворили в этаноле (0.9 мл) и добавили гидразинмоногидрат (124 мг, 0.120 мл, 2.47 ммоль). Реакционную смесь нагревали в течение 6 часов при 60°C и перемешивали при комнатной температуре в течение ночи. Эвапорация растворителя дала пены, которая кристаллизовалась при добавлении смеси гептан/этилацетат: желтый осадок, (320 мг, 90%).
MS (ISP): 289.1 (100%, [M-tBu+H]+), 345.1 (26% [М+Н]+), 245.2 (9%, [М-ВОС+Н]+).
d) (S)-трет-бутил 2-(4-(5-(4-фторбензамидо)-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-(5-амино-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат (100 мг, 0.29 ммоль) растворили в смеси тетрагидрофуран/дихлорметан 2:3 (1.5 мл) затем добавили пиридин (46 мг, 0.047 мл, 0.58 ммоль) и 4-диметиламинопиридин (1.7 мг, 0.014 ммоль)при 0°C. Через 5 мин добавили 4-фторбензоилхлорид (55.2 мг, 0.348 ммоль) и реакционную смесь перемешивали при 0°C в течение 1 ч. Охлаждающую ванну убрали и реакционную смесь оставили перемешиваться при комнатной температуре в течение ночи. Реакцию погасили добавлением 1М лимонной кислоты (3 мл) и экстрагировали этилацетатом (5 мл). Органический слой высушили над MgSO4 и эвапорировали. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, гептан/этилацетат 1:1). Выделили серо-белый осадок (100 мг, 74%), MS (ISP): 411.2 (100%, [M-tBu+H]+), 467.2 (66%, [М+Н]+).
e) (S)-4-фтор-N-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензамида гидрохлорид
(S)-трет-бутил 2-(4-(5-амино-1Н-пиразол-3-ил)фенил)морфолин-4-карбоксилат (95 мг, 0.2 ммоль) растворили в диоксане (0.8 мл) и добавили раствор HCl в диоксане (4М, 0.76 мл, 3.0 ммоль). Реакционную смесь перемешивали в течение 2 ч при 60°C. После охлаждения добавили эфир (2 мл), смесь перемешивали в течение 30 мин и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-4-фтор-N-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензамида гидрохлорида (59 мг, 72%) в виде серо-белого осадка. MS (ISP): 367.2 ([М+Н]+).
Пример 31
(R)-2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
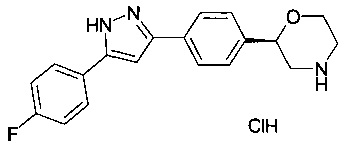
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (R)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 4-фторбензоилхлорида вместо 4-хлорбензоилхлорида на стадии b). Серо-белый осадок. MS (ISP): 324.2 ([М+Н]+).
Пример 32
(R)-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрила гидрохлорид
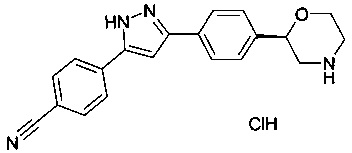
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (R)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 4-цианобензиолхлорида вместо 4-хлорбензоилхлорида на стадии b). Серо-белый осадок. MS (ISP): 331.2 ([М+Н]+).
Пример 33
(S)-3-фтор-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрила гидрохлорид
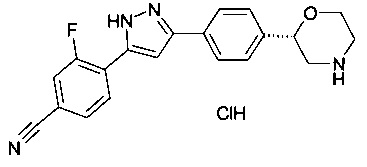
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 4-циано-2-фторбензоилхлорида вместо 4-хлорбензоилхлорида на стадии b). Светло-желтый осадок. MS (ISP): 349.1 ([М+Н]+).
Пример 34
(R)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолина гидрохлорид
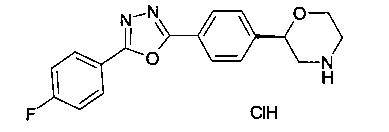
Соединение, указанное в заголовке получили по аналогии с примером 17 с использованием (R)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата на стадии а). Белый осадок. MS (ISP): 326.2 ([М+Н]+).
Пример 35
(R)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолина гидрохлорид
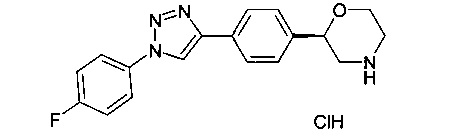
Соединение, указанное в заголовке получили по аналогии с примером 18 с использованием (R)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-формилфенил)морфолин-4-карбоксилата на стадии а). Серо-белый осадок. MS (ISP): 325.2 ([М+Н]+).
Пример 36
(R)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолина гидрохлорид
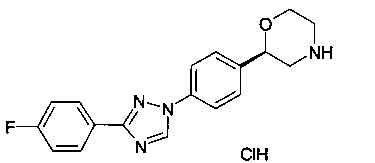
Соединение, указанное в заголовке получили по аналогии с примером 25 с использованием (R)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а). Белый осадок. MS (ISP): 325.2 ([М+Н]+).
Пример 37
(S)-2-{4-[5-(6-хлор-пиридин-3-ил)-1Н-пиразол-3-ил]-фенил}-морфолин гидрохлорид
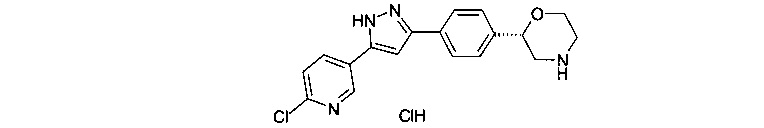
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 6-хлорникотиноилхлорида вместо 4-хлорбензоилхлорида на стадии b). Светло-желтый осадок. 341.2 ([{35Cl}M+H]+), 343.3 ([{37Cl}M+H]+).
Пример 38
(R)-2-{4-[5-(6-хлор-пиридин-3-ил)-1Н-пиразол-3-ил]-фенил}-морфолина гидрохлорид
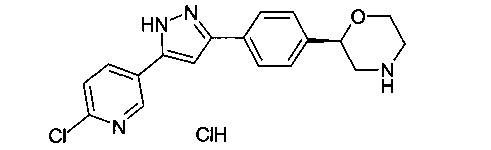
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (R)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 6-хлорникотиноилхлорида вместо 4-хлорбензоилхлорида на стадии b). Светло-желтый осадок. 341.2 ([{35Cl}M+H]+), 343.2 ([{37Cl}M+H]+).
Пример 39
(R)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолина гидрохлорид
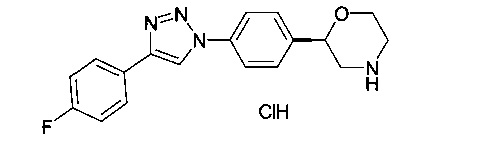
Соединение, указанное в заголовке получили по аналогии с примером 27 с использованием (R)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата на стадии а). Белый осадок. MS (ISP): 325.2 ([М+Н]+).
Пример 40
(S)-2-(3-фтор-4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
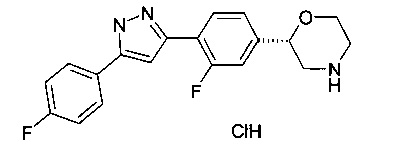
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (S)-трет-бутил 2-(4-бромо-3-фторфенил)морфолин-4-карбоксилата (синтез рацемата описан в Примере 21 с последующим препаративным хиральным разделением на колонке Chiralpak AD с использованием 4% изопропанол/гептан) вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 4-фторбензоилхлорида вместо 4-хлорбензоилхлорида на стадии b). Серо-белый осадок. MS (ISP): 342.1 ([М+Н]+).
Пример 41
(R)-2-(3-фтор-4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
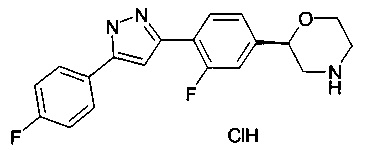
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (R)-трет-бутил 2-(4-бромо-3-фторфенил)морфолин-4-карбоксилата (синтез рацемата описан в Примере 21 с последующим препаративным хиральным разделением на колонке Chiralpak AD с использованием 4% изопропанол/гептан) вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 4-фторбензоилхлорида вместо 4-хлорбензоилхлорида на стадии b). Серо-белый осадок. MS (ISP): 342.1 ([М+Н]+).
Пример 42
(S)-2-(4-(5-(2-хлорпиридин-4-ил)-1Н-пиразол-3-ил)фенил)морфолина гидрохлорид
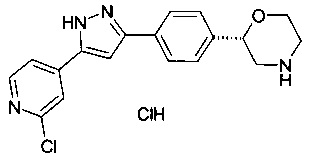
Соединение, указанное в заголовке получили по аналогии с примером 3 с использованием (S)-трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата вместо трет-бутил 2-(4-бромфенил)морфолин-4-карбоксилата на стадии а) и 2-хлоризоникотиноилхлорида вместо 4-хлорбензоилхлорида на стадии b). Светло-коричневый осадок, MS (ISP): 341.2 ([{35Cl}M+H]+), 343.1 ([{37Cl}M+H]+).
Пример 43
(S)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолина гидрохлорид
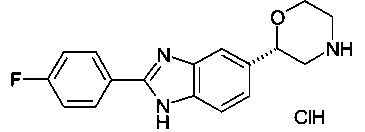
а) 4-фтор-N-(метилсульфонилокси)бензимидоилхлорид
4-Фторбензальдегида оксим (1.5 г, 10.8 ммоль) растворили в смеси диметилформамида (1 мл), тетрагидрофурана (10 мл) и хлороформа (10 мл). N-хлор-сукцинимид (1.51 г, 11.3 ммоль) медленно добавили, поддерживая температуру при 40°C. Смесь перемешивали в течение 1 ч, затем погасили водой (10 мл). Водный слой отбросили и органический слой промыли водой (10 мл). Органический слой высушили (MgSO4) и эвапорировали. Остаток растворили в этилацетате (50 мл) и раствор охладили до 0°C. Добавили триэтиламин (2.4 г, 23.7 ммоль) и смесь перемешивали при 0°C в течение 10 минут с получением белой суспензии. Метансульфонилхлорид (1.36 г, 11.9 ммоль) медленно добавили при 0°C, и смесь перемешивали при комнатной температуре в течение 1 ч. Кристаллы отфильтровали, фильтрат промыли дважды водой (10 мл), высушили над MgSO4 и сконцентрировали при пониженном давлении.
Флеш-хроматография остатка (50 г силикагель, 10-30% этилацетат в гептане) дала белый осадок (1.28 г, 47%); 1Н NMR (300 MHz, CDCl3) δ ppm: 3.27 (s, 3Н), 7.16 (t, J=9 Hz, 2H), 7.96 (dd, J=6 Hz, J=9 Hz, 2H).
b) (S)-трет-бутил 2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолин-4-карбоксилат
Раствор (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата (140 мг, 0.5 моль), 4-фтор-N-(метилсульфонилокси)бензимидоилхлорида (152 мг, 0.6 ммоль) и N,N,Nʹ,Nʹ-тетраметилэтилендиамина (123 мг, 1.06 ммоль) в тетрагидрофуране (0.8 мл) встряхивали в закрытой пробирке при 60°C в течение ночи. Добавили воду, и смесь дважды экстрагировали этилацетатом. Объединенные органические слои высушили (MgSO4) и эвапорировали. Флеш-хроматография (10 г силикагель, 10-30% этилацетат в гептане) дала белый осадок (92 мг, 46%), MS (ISP): 398.2 ([М+Н]+).
c) (S)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолина гидрохлорид
(S)-трет-бутил 2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолин-4-карбоксилат (88 мг, 0.22 ммоль) растворили в диоксане (1 мл) и добавили раствор HCl в диоксане (4М, 0.66 мл, 2.66 ммоль). Реакционную смесь перемешивали в течение 3 ч при 60°C. После охлаждения добавили эфир (2 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолина гидрохлорида (56 мг, 76%) в виде серо-белого осадка. MS (ISP): 298.2 ([М+Н]+).
Пример 44
(R)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолина гидрохлорид
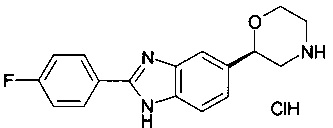
Соединение, указанное в заголовке получили по аналогии с примером 43 с 25 использованием (R)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата на стадии b). Серо-белый осадок. MS (ISP): 298.2 ([М+Н]+).
Пример 45
(S)-2-(9Н-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорид
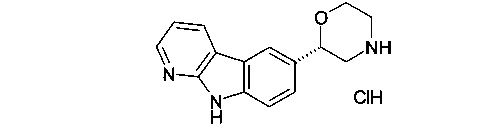
а) (S)-трет-бутил 2-(4-(3-хлорпиридин-2-иламино)фенил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилат (120 мг, 0.43 моль), 2,3-дихлорпиридин (64 мг, 0.43 ммоль) и карбонат цезия (211 мг, 0.647 ммоль) объединили с диоксаном (2 мл) с получением суспензии. Смесь дегазировали аргоном в течение 5 мин. Добавили ксантфос (15 мг, 0.026 ммоль) и трис(дибензилиденацетон)дипалладия хлороформный комплекс (13 мг, 0.013 ммоль). Реакционную смесь закрыли и перемешивали при 100°C в течение 2 ч. Неочищенную реакционную смесь отфильтровали через фильтр-шприц, сконцентрировали под вакуумом и очистили с помощью флеш-хроматографии (20 г силикагель, 5-20% этилацетат в гептане) с получением светло-желтой пены (88 мг, 53%); MS (ISP): 390.2 ([{35Cl}M+H]+), 392.2 ([{37Cl}M+H]+).
b) (S)-трет-бутил 2-(9Н-пиридо[2,3-b]индол-6-ил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-(3-хлорпиридин-2-иламино)фенил)морфолин-4-карбоксилат (47 мг, 0.12 ммоль), ацетат палладия (II) (2.7 мг, 0.012 ммоль), трициклогексилфосфин тетрафторборат (9 мг, 0.024 ммоль) и DBU (37 мг, 0.24 ммоль) растворили в смеси о-ксилена (0.7 мл) и диметилацетамида (0.7 мл). Смесь дегазировали аргоном в течение 5 мин и нагревали при 155°C в течение 16 ч в закрытой пробирке. После охлаждения, реакционную смесь влили в воду и экстрагировали этилацетатом. Органический слой высушили над MgSO4 и эвапорировали. Флеш-хроматография (2 г силикагель, 10-30% этилацетат в гептане) дала белый осадок (22 мг, 52%), MS (ISP): 354.3 ([М+Н]+).
с) (S)-2-(9Н-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорид
(S)-трет-бутил 2-(9Н-пиридо[2,3-b]индол-6-ил)морфолин-4-карбоксилат (22 мг, 0.062 ммоль) растворили в диоксане (0.5 мл) и добавили раствор HCl в диоксане (4М, 0.19 мл, 0.75 ммоль). Реакционную смесь перемешивали в течение 2 ч при 60°C. После охлаждения добавили эфир (2 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(9H-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорида (17 мг, 94%) в виде светло-желтого осадка. MS (ISP): 254.2 ([М+Н]+).
Пример 46
(S)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорид
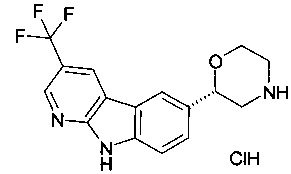
Соединение, указанное в заголовке, получили по аналогии с примером 45 с использованием 2,3-дихлоро-5-(трифторметил)пиридина вместо 2,3-дихлорпиридина на стадии а). Серо-белый осадок. MS (ISP): 322.2 ([М+Н]+).
Пример 47
(S)-2-(3-хлор-9Н-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорид
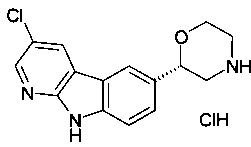
Соединение, указанное в заголовке получили по аналогии с примером 45 с использованием 2,3,5-трихлоро-пиридина вместо 2,3-дихлорпиридина на стадии а). Светло-желтый осадок. MS (ISP): 288.0 ([М+Н]+).
Пример 48
(R)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорид
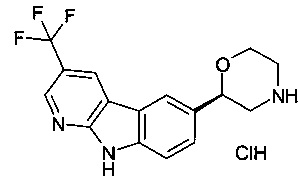
Соединение, указанное в заголовке получили по аналогии с примером 45 с использованием 2,3-дихлоро-5-(трифторметил)пиридина вместо 2,3-дихлорпиридина и (R)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата на стадии а). Светло-желтый осадок. MS (ISP): 322.2 ([М+Н]+).
Пример 49
(S)-2-(2-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорид

а) (S)-трет-бутил 2-(4-амино-3-хлорфенил)морфолин-4-карбоксилат
В 150 мл круглодонной колбе (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилат (5 г, 18 ммоль) растворили в диметилформамиде (30 мл). Добавили N-хлорсукцинимид (2.4 г, 18 ммоль) и смесь перемешивали при 60°C в течение 1 ч. Реакционную смесь влили в этилацетат и экстрагировали насыщенным раствором хлорида натрия. Органические слои высушили над MgSO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 100 г, 30% этилацетат в гептане) с получением светло-желтого осадка (4.0 г, 71%) MS (ISP): 313.1 ([{35Cl}M+H]+), 315.1 ([{37Cl}M+H]+).
b) (S)-2-(2-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорид
Соединение, указанное в заголовке, получили по аналогии с примером 45 с использованием 2-хлор-6-(трифторметил)пиридина вместо 2,3-дихлорпиридина и (S)-трет-бутил 2-(4-амино-3-хлорфенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата на стадии а). Серо-белый осадок. MS (ISP): 322.2 ([М+Н]+).
Пример 50
(R)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолина гидрохлорид
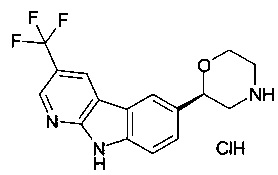
Соединение, указанное в заголовке получили по аналогии с примером 49 с использованием (R)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата вместо (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата на стадии а). Светло-желтый осадок. MS (ISP): 322.2 ([М+Н]+).
Пример 51
(S)-2-(2-изопропокси-9Н-пиримидо[4,5-b]индол-6-ил)морфолина гидрохлорид

а) (S)-трет-бутил 2-(4-(2,5-дихлоропиримидин-4-иламино)фенил)морфолин-4-карбоксилат
Смесь (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата (100 мг, 0.36 ммоль), 2,4,5-трихлоропиримидина (66 мг, 0.36 ммоль) и диизопропилэтиламина (70 мг, 0.54 ммоль) растворили в 2-пропаноле (1.5 мл) и встряхивали при 80°C в течение ночи. Большую часть растворителя эвапорировали. Добавили раствор хлорида аммония и смесь экстрагировали этилацетатом дважды. Объединенные органические слои высушили (MgSO4) и эвапорировали.
Остаток очистили посредством колоночной хроматографии (силикагель, 10-30% этилацетат в гептане, 20 г ISCO колонка) с получением белого осадка (342 мг, 75%) MS (ISP): 425.1 ([{35Cl}M+H]+), 427.2 ([{37Cl}M+H]+).
b) (S)-трет-бутил 2-(4-(5-хлор-2-изопропоксипиримидин-4-иламино)фенил)морфолин-4-карбоксилат
К перемешанному раствору трет-бутоксида калия (116 мг, 1.03 ммоль) в пропан-2-оле (2 мл) добавили (S)-трет-бутил 2-(4-(2,5-дихлоропиримидин-4-иламино)фенил)морфолин-4-карбоксилат (110 мг, 0.26 ммоль) и смесь встряхивали при 90°C в течение ночи. После охлаждения, реакционную смесь влили в воду и экстрагировали этилацетатом. Органический слой высушили над MgSO4 и эвапорировали. Остаток очистили посредством колоночной хроматографии (силикагель, 5-15% этилацетат в гептане, 10 г ISCO колонка). Белая пена (58 мг, 50%). MS (ISP): 449.3 ([{35Cl}M+H]+), 451.1 ([{37Cl}M+H]+).
с) (S)-трет-бутил 2-(2-изопропокси-9Н-пиримидо[4,5-b]индол-6-ил)морфолин-4-карбоксилат
(S)-трет-бутил 2-(4-(5-хлор-2-изопропоксипиримидин-4-иламино)фенил)морфолин-4-карбоксилат (55 мг, 0.12 ммоль), ацетат палладия (II) (2.8 мг, 0.012 ммоль), трициклогексилфосфинтетрафторборат (9 мг, 0.024 ммоль) и DBU (1,8-диазабицикло[5.4.0]ундец-7-ен; 37 мг, 0.245 ммоль)растворили в смеси о-ксилена (0.5 мл) и N,N-диметилацетамида (0.5 мл). Смесь дегазировали Ar в течение 5 мин, пробирку закрыли и нагревали при 155°C в течение 16 ч. Реакционную смесь влили в воду и экстрагировали этилацетатом. Органический слой высушили над MgSO4 и эвапорировали. Остаток очистили посредством колоночной хроматографии (SiO2, 5-20% EtOAc в гептане, 2 г ISCO колонка). Белый осадок (11 мг, 22%). MS (ISP): 413.3 ([М+Н]+).
d) (S)-2-(2-изопропокси-9Н-пиримидо[4,5-b]индол-6-ил)морфолина гидрохлорид
(S)-трет-бутил 2-(2-изопропокси-9Н-пиримидо[4,5-b]индол-6-ил)морфолин-4-карбоксилат (11 мг, 0.027 ммоль) растворили в диоксане (0.5 мл) и добавили раствор HCl в диоксане (4М, 0.08 мл, 0.32 ммоль). Реакционную смесь перемешивали в течение 1 ч при 60°C. После охлаждения добавили эфир (1 мл) и осадок отфильтровали. Его промыли эфиром и высушили под вакуумом с получением (S)-2-(2-изопропокси-9Н-пиримидо[4,5-b]индол-6-ил)морфолина гидрохлорида (6 мг, 64%) в виде серо-белого осадка. MS (ISP): 313.3 ([М+Н]+).
Пример 52
(R)-2-(6-этоксипиридин-3-ил)-6-(морфолин-2-ил)диметил[d]оксазола гидрохлорид
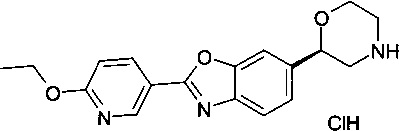
a) (R)-трет-бутил 2-(4-амино-3-бромфенил)морфолин-4-карбоксилат
В 100 мл круглодонной колбе, (R)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилат (4.3 г, 15.4 ммоль) растворили в диметилформамиде (30 мл). N-Бромсукцинимид (2.75 г, 15.4 ммоль) добавили и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь влили в этилацетат и экстрагировали насыщенным раствором хлорида натрия. Органические слои высушили над MgSO4 и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 100 г, градиент 0-50% этилацетат в гептане) с получением белого осадка (5.2 г, 94%), MS (ISP): 301.3 ([{79Br}M-tBu+H]+), 303.4 ([{81Br}M-tBu+H]+).
b) (R)-трет-бутил 2-(3-бромо-4-(6-этоксиникотинамидо)фенил)морфолин-4-карбоксилат
Под аргоном 6-этоксиникотиновую кислоту (94 мг, 0.56 ммоль) суспендировали в дихлорметане (6.5 мл) и 1-хлор-N,N2-триметилпропениламин (93.5 мг, 0.7 ммоль) добавили по каплям и смесь перемешивали в течение 30 минут при комнатной температуре. Во второй колбе (R)-трет-бутил 2-(4-амино-3-бромфенил)морфолин-4-карбоксилат (200 мг, 0.56 ммоль) растворили в дихлорметане (5 мл) и добавили этилдиизопропиламин (181 мг, 1.4 ммоль). К этому раствору по каплям добавили раствор хлорангидрида, образовавшийся в первой колбе, и смесь перемешивали при комнатной температуре в течение 30 минут. Добавили воду и смесь экстрагировали дихлорметаном. Органическая фаза была высушена над сульфатом магния, отфильтровали и сконцентрировали под вакуумом. Неочищенное вещество очистили с помощью флеш-хроматографии (силикагель, 10 г, 10%-50% EtOAc в гептане) с получением серо-белого осадка (260 мг, 92%), MS (ISP): 506.5 ([{79Br}M+H]+), 508.5 ([{81Br}M+H]+).
c) (R)-трет-бутил 2-(2-(6-этоксипиридин-3-ил)диметил[d]оксазол-6-ил)морфолин-4-карбоксилат
(R)-трет-бутил 2-(3-бромо-4-(6-этоксиникотинамидо)фенил)морфолин-4-карбоксилат (100 мг, 0.2 ммоль), карбонат цезия (130 мг, 0.4 ммоль), 1,10-фенантролин (3.6 мг, 0.02 ммоль), йодид меди (I) (1.9 мг, 0.01 ммоль) смешали вместе в 1,2-диметоксиэтане (2 мл). Суспензию дегазировали аргоном и нагревали в течение ночи в атмосфере аргона при 125°C. Смесь охладили и влили в этилацетат и отфильтровали. Фильтрат адсорбировали на силикагеле и отделили с помощью хроматографии (градиент 10%-50% EtAc в гептане) с получением серо-белого осадка (34 мг, 40%). MS (ISP): 426.6 ([M+H]+).
d) (R)-2-(6-этоксипиридин-3-ил)-6-(морфолин-2-ил)диметил[d]оксазола гидрохлорид
(R)-трет-бутил 2-(2-(6-этоксипиридин-3-ил)диметил[d]оксазол-6-ил)морфолин-4-карбоксилат (31 мг, 0.073 ммоль) растворили в диоксане (0.3 мл). Затем добавили раствор HCl в диоксане (4М, 0.27 мл, 1.09 ммоль) и реакционную смесь перемешивали при 60°C в течение 2 часов. После охлаждения, осадок отфильтровали и промыли диэтиловым эфиром и высушили под вакуумом с получением (R)-2-(6-этоксипиридин-3-ил)-6-(морфолин-2-ил)диметил[d]оксазола гидрохлорида (15 мг, 58%) в виде светло-желтого осадка. MS (ISP): 326.6 ([М+Н]+).
Пример 53
(R)-6-(морфолин-2-ил)-2-(6-(трифторметил)пиридин-3-ил)диметил[d]оксазола гидрохлорид
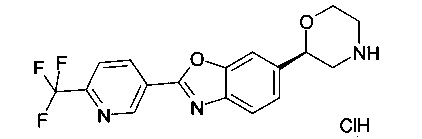
Соединение, указанное в заголовке получили по аналогии с примером 52 с использованием 6-(трифторметил)никотиновой кислоты вместо 6-этоксиникотиновой кислоты на стадии b). Белый осадок. MS (ISP): 350.6 ([М+Н]+).
Пример 54
(R)-6-(морфолин-2-ил)-2-(2-(трифторметил)пиридин-4-ил)диметил[d]оксазола гидрохлорид
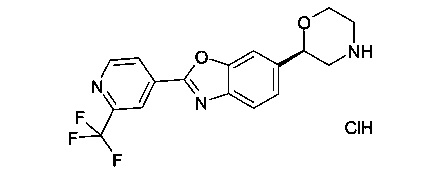
Соединение, указанное в заголовке, получили по аналогии с примером 52 с использованием 2-(трифторметил)-изоникотиновой кислоты вместо 6-этоксиникотиновой кислоты на стадии b). Светло-коричневая пена. MS (ISP): 350.6 ([М+Н]+).
Пример 55
(S)-6-(морфолин-2-ил)-2-(2-(трифторметил)пиридин-4-ил)диметил[d]оксазола гидрохлорид
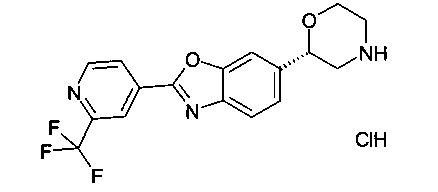
Соединение, указанное в заголовке, получили по аналогии с примером 52 с использованием (S)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата вместо (R)-трет-бутил 2-(4-аминофенил)морфолин-4-карбоксилата на стадии а) и 2-(трифторметил)-изоникотиновой кислоты вместо 6-этоксиникотиновой кислоты на стадии b). Светло-коричневая пена. MS (ISP): 350.6 ([М+Н]+).
Соединения формулы I и их фармацевтически применяемые аддитивные соли проявляют различные фармакологические свойства. В частности, было обнаружено, что соединения по настоящему изобретению обладают хорошим сродством к рецепторам следовых аминов (TAARs), особенно TAAR1.
Указанные соединения изучали в соответствии с методиками, данными ниже.
Материалы и способы
Создание экспресионных плазмид TAAR и стабильно трасфицированные клеточные линии
Для создания экспресионных плазмид из геномной ДНК были амплифицированы кодирующие последовательности TAAR 1 человека, крысы и мыши по существу, как описано у Lindemann et al. [14]. Использовали ПЦР систему Expand High Fidelity PCR System (Roche Diagnostics) с 1.5 мМ Mg2+, и очищенные ПЦР продукты клонировали в pCR2.1-TOPO клонирующий вектор (Invitrogen) в соответствии с инструкцией производителя. ПЦР продукты субклонировали в pIRESneo2 вектор (BD Clontech, Palo Alto, California), и экспрессионные векторы проверяли на последовательности перед тем как ввести в клеточные линии.
Клетки HEK293 (АТСС # CRL-1573) культивировали по существу, как описано у Lindemann et al. (2005). Для создания стабильно трансфицированных клеточных линий клетки HEK293 трансфицировали экспресионными плазмидами pIRESneo2, содержащими кодирующие TAAR последовательности (описанные выше), совместно с липофектамином 2000 (Invitrogen) в соответствии с инструкцией производителя, и через 24 часа после трансфекции в культивируемую среду добавили 1 мг/мл G418 (Sigma, Buchs, Switzerland). После 10-дневного периода культивирования клоны изолировали, вырастили и протестировали на чувствительность к следовым аминам (все соединения покупались в компании Sigma) с помощью cAMP Biotrak Enzyme immunoassay (EIA) System (Amersham) следуя протоколу для EIA без ацетилирования, предоставленному производителем. Моноклональные клеточные линии, которые показывали стабильные значения ЕС50 в течение 15 пассажей культивирования использовались для всех последующих исследований.
Анализ связывания радиолиганда на TAAR1 крысы
Подготовка мембран и связывание радиолиганда.
HEK-293 клетки, стабильно экспрессирующие TAAR1 крысы хранили при 37°C и 5% CO2 в среде DMEM с высоким содержанием глюкозы, содержащей фетальную телячью сыворотку (10%, инактивированную нагреванием в течение 30 мин при 56°C), пенициллин/стрептомицин (1%) и 375 мкг/мл генетицин (Gibco). Клетки высвободили из культуральной колбы с использованием трипсин/ЭДТА, собрали, дважды промыли ледяным фосфатно-солевым буфером (PBS) (без Са2+ и Mg2+), осадили при 1ʹ000 rpm в течение 5 мин при 4°C, заморозили и хранили при -80°C. Замороженный осадок суспендировали в 20 мл HEPES-NaOH (20 мМ, pH 7.4), содержащем 10 мМ ЭДТА и гомогенизировали на Polytron (РТ 6000, Kinematica) при 14ʹ000 rpm в течение 20 сек. Гомогенат центрифугировали при 48ʹ000×g в течение 30 мин при 4°C. Затем супернатант удалили и отбросили и осадок ресуспендировали в 20 мл HEPES-NaOH (20 мМ, pH 7.4), содержащем 0.1 мМ ЭДТА с использованием Polytron (20 сек при 14ʹ000 rpm). Эту процедуру повторили и конечный осадок ресуспендировали в HEPES-NaOH, содержащем 0.1 мМ ЭДТА, и гомогенизировали с использованием Polytron. Обычно, аликвоты по 2 мл мембранных частей хранили при -80°C. Для каждой новой порции мембран определяли константу диссоциации (Kd) с помощью кривой насыщения. Использовали TAAR1 радиолиганд 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламин (описанный в WO 2008/098857) в концентрации, эквивалентной рассчитанному значению Kd, которое обычно составляло около 2.3 нМ, что в результате приводило к связыванию приблизительно 0.2% радиолиганда и специфичности связывания, отражающего приблизительно 85% общего связывания. Неспецифическое связывание определялось как количество 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина, связанного в присутствии 10 мкМ немеченого лиганда. Все соединения тестировались в широком диапазоне концентраций (10 пМ до 10 мкМ) в повторах. Тестовые соединения (20 мкл/лунку) поместили в 96 глубоколуночный планшет (TreffLab), и добавили 180 мкл HEPES-NaOH (20 мМ, pH 7.4),содержащего MgCl2 (10 мМ) и CaCl2 (2 мМ) (буфер связывания), 300 мкл радиолиганда 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина в концентрации 3.3×Kd в нМ и 500 мкл мембран (ресуспендированных при 50 мкг белка на мл). 96 глубоколуночные планшеты инкубировали в течение 1 часа при 4°C. Инкубирование завершили быстрой фильтрацией через планшет Unifilter-96 (Packard Instrument Company) и стеклянные фильтры GF/C (Perkin Elmer), предварительно замоченные в течение 1 часа в полиэтиленамине (0.3%), и промыли 3 раза 1 мл холодного буфера для связывания. После добавления 45 мкл Microscint 40 (PerkinElmer), планшеты Unifilter-96 закрыли и через 1 час считывали радиоактивность с помощью TopCount Microplate сцинтиляционного счетчика (Packard Instrument Company).
Анализ связывания радиолиганда на TAAR1 мыши
Подготовка мембран и связывание радиолиганда.
НЕК-293 клетки, стабильно экспрессирующие TAAR1 мыши хранили при 37°C и 5% CO2 в среде DMEM с высоким содержанием глюкозы, содержащей фетальную телячью сыворотку (10%, инактивированную нагреванием в течение 30 мин при 56°C), пенициллин/стрептомицин (1%) и 375 мкг/мл генетицин (Gibco). Клетки высвободили из культуральной колбы с использованием трипсин/ЭДТА, собрали, дважды промыли ледяным фосфатно-солевым буфером (PBS) (без Са2+ и Mg2+), осадили при 1ʹ000 rpm в течение 5 мин при 4°С, заморозили и хранили при -80°C. Замороженный осадок суспендировали в 20 мл HEPES-NaOH (20 мМ, pH 7.4), содержащем 10 мМ ЭДТА и гомогенизировали на Polytron (РТ 6000, Kinematica) при 14ʹ000 rpm в течение 20 сек. Гомогенат центрифугировали при 48ʹ000×g в течение 30 мин при 4°C. Затем супернатант удалили и отбросили и осадок ресуспендировали в 20 мл HEPES-NaOH (20 мМ, pH 7.4), содержащем 0.1 мМ ЭДТА с использованием Polytron (20 сек при 14ʹ000 rpm). Эту процедуру повторили и конечный осадок ресуспендировали в HEPES-NaOH, содержащем 0.1 мМ ЭДТА, и гомогенизировали с использованием Polytron. Обычно, аликвоты по 2 мл мембранных частей хранили при -80°C. Для каждой новой порции мембран определяли константу диссоциации (Kd) с помощью кривой насыщения. Использовали TAAR1 радиолиганд 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламин (описанный в WO 2008/098857) в концентрации, эквивалентной рассчитанному значению Kd, которое обычно составляло около 0.7 нМ, что в результате приводило к связыванию приблизительно 0.5% радиолиганда и специфичности связывания, отражающего приблизительно 70% общего связывания. Неспецифическое связывание определялось как количество 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина, связанного в присутствии 10 мкМ немеченого лиганда. Все соединения тестировались в широком диапазоне концентраций (10 пМ до 10 мкМ) в повторах. Тестовые соединения (20 мкл/лунку) поместили в 96 глубоколуночный планшет (TreffLab), и добавили 180 мкл HEPES-NaOH (20 мМ, pH 7.4),содержащего MgCl2 (10 мМ) и CaCl2 (2 мМ) (буфер связывания), 300 мкл радиолиганда 3[Н]-(S)-4-[(этил-фенил-амино)-метил]-4,5-дигидро-оксазол-2-иламина в концентрации 3.3×Kd в нМ и 500 мкл мембран (ресуспендированных при 60 мкг белка на мл). 96 глубоколуночные планшеты инкубировали в течение 1 часа при 4°C. Инкубирование завершили быстрой фильтрацией через планшет Unifilter-96 (Packard Instrument Company) и стеклянные фильтры GF/C (Perkin Elmer), предварительно замоченные в течение 1 часа в полиэтиленамине (0.3%), и промыли 3 раза 1 мл холодного буфера для связывания. После добавления 45 мкл Microscint 40 (PerkinElmer), планшеты Unifilter-96 закрыли и через 1 час считывали радиоактивность с помощью TopCount Microplate сцинтиляционного счетчика (Packard Instrument Company).
Соединения показали следующие значения Ki (мкм) для мышей или крыс на TAAR1 (в мкМ), данные в таблице ниже.
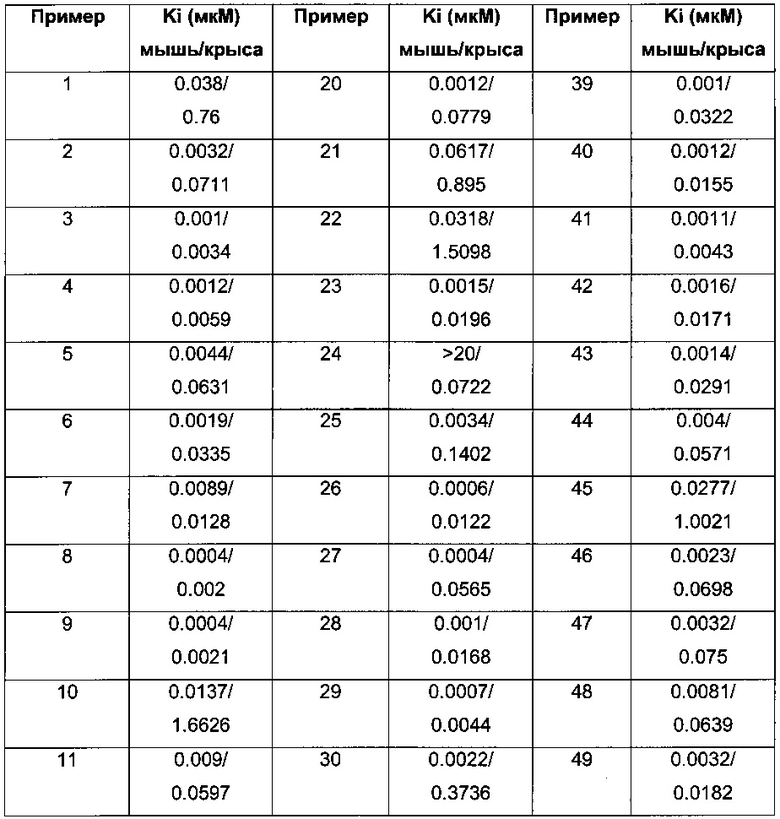
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве лекарственных средств, например в форме фармацевтических препаратов. Фармацевтические препараты могут вводиться перорально, например, в форме таблеток, покрытых оболочкой таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако, введение также может быть эффективным ректально, например, в форме суппозиториев, парентерально, например, в форме растворов для инъекций.
Соединения формулы I могут быть переработаны вместе с фармацевтически инертными, неорганическими или органическими носителями для производства фармацевтических препаратов. Лактоза, кукурузный крахмал или их производные, тальк, стеариновые кислоты или их соли и аналогичные соединения могут быть использованы, например, в качестве носителей для таблеток, покрытых оболочкой таблеток, драже и твердых желатиновых капсул. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воска, жиры, полутвердые и жидкие полиолы и аналогичные вещества. В зависимости от природы активного вещества, однако, обычно не требуются какие-либо носители в случае мягких желатиновых капсул. Подходящими носителями для производства растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и аналогичные вещества. Подходящими носителями для суппозиториев являются, например, натуральные или гидрогенизированные масла, воска, жиры, полутвердые или жидкие полиолы и аналогичные вещества.
Фармацевтические препараты, кроме того, могут содержать консерванты, растворители, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Также они могут содержать терапевтически ценные вещества.
Лекарственные средства, содержащие соединения формулы I или их фармацевтически приемлемые соли и терапевтически инертные носители являются объектом настоящего изобретения, также как и способы для их получения, которые включают приведение одного или более соединений формулы I и/или их фармацевтически приемлемых кислотно-аддитивных солей и, в случае необходимости, одного или более терапевтически ценного вещества в галенову лекарственную форму вместе с одним или более терапевтически инертным носителем.
Наиболее предпочтительными показаниями в соответствии с настоящим изобретением являются те, которые включают заболевания центральной нервной системы, например лечение или профилактика депрессии, психоза, болезни Паркинсона, тревожности, дефицита внимания и гиперактивности (СДВГ) и сахарного диабета.
Дозировка может варьироваться в широких пределах и, конечно, должна будет подбираться в зависимости от индивидуальных требований в каждом конкретном случае. В случае перорального введения дозировка для взрослых может изменяться в пределах от приблизительно 0,01 мг до приблизительно 1000 мг соединения формулы I в день или соответствующего количества его фармацевтически приемлемой соли. Дневная доза может вводиться в виде одиночной дозы, либо в виде нескольких приемов и, вдобавок, верхний предел может превышаться, когда это необходимо.

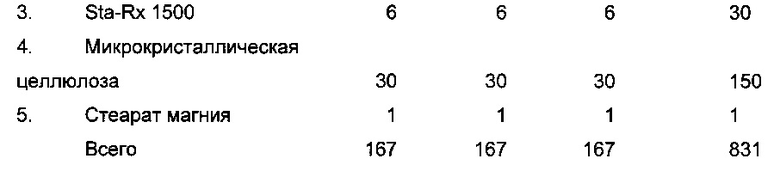
Способ изготовления
1. Смешать ингредиенты 1, 2, 3 и 4 и гранулировать с очищенной водой.
2. Высушить гранулят при 50°C.
3. Пропустить гранулы через подходящее измельчительное оборудование.
4. Добавить ингредиент 5 и смешивать 3 минуты; спрессовать на подходящем прессе.
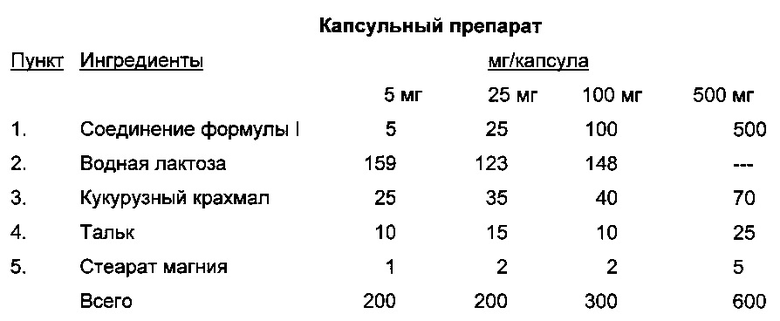
Способ изготовления
1. Смешивать ингредиенты 1, 2 и 3 в подходящем миксере в течение 30 минут.
2. Добавить ингредиенты 4 и 5 и смешивать в течение 3 минут.
3. Заполнить подходящие капсулы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТРИАЗОЛКАРБОКСАМИДА | 2013 |
|
RU2637938C2 |
| ЗАМЕЩЕННЫЕ БЕНЗАМИДНЫЕ ПРОИЗВОДНЫЕ | 2010 |
|
RU2595902C2 |
| ПИПЕРИДИНИЛПИРАЗОЛОПИРИМИДИНОНЫ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2713937C2 |
| 2-ОКСА-5-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2015 |
|
RU2697651C2 |
| ФЕНОКСИМЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2746481C1 |
| НОВЫЕ ПИРАЗОЛПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2769448C2 |
| ПРОИЗВОДНЫЕ МОРФОЛИН-ПИРИДИНА | 2015 |
|
RU2690154C2 |
| ПИПЕРАЗИНО[1,2-А]ИНДОЛ-1-ОНЫ И [1,4]ДИАЗЕПИНО[1,2-А]ИНДОЛ-1-ОН | 2014 |
|
RU2628126C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНОВ | 2011 |
|
RU2554353C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛО[3,4-с]ПИРИДИНА | 2015 |
|
RU2709810C2 |
Настоящее изобретение относится к соединениям формулы
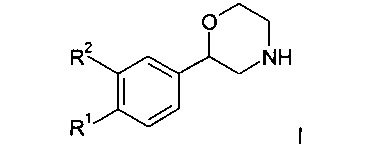 ,
,
а также к фармацевтическим композициям на их основе. Технический результат: получены новые соединения, обладающие аффинностью к рецепторам к TAAR1, которые могут применяться для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (СДВГ), расстройств, вызванных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, метаболических расстройств, нарушения питания, диабета, диабетических осложнений, ожирения, дислипидемии, расстройств потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых расстройств. 4 н. и 19 з.п. ф-лы, 16 схем, 1 табл., 55 пр.
1. Соединение формулы
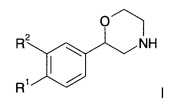 ,
,
где R1 представляет собой одно- или двухчленную гетероарильную группу, выбранную из группы, состоящей из

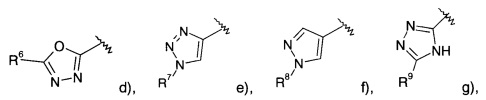
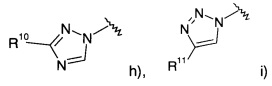 или
или 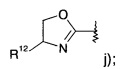
R2 представляет собой водород или галоген; или
R1 и R2 могут образовывать вместе с атомами углерода, к которым они присоединены, следующие кольца
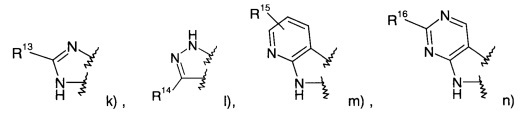 или
или 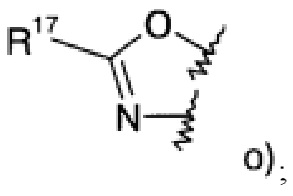
R3 представляет собой водород, галоген или низший алкил; n представляет собой 1 или 2;
R4 представляет собой фенил, замещенный одним или двумя заместителями, выбранными из галогена или циано, или представляет собой пиридинил, возможно замещенный галогеном, или представляет собой тетрагидропиран, или представляет собой -NH-С(O)-фенил, возможно замещенный галогеном;
R5 представляет собой водород или галоген;
R6-R13 представляют собой фенил, возможно замещенный галогеном:
R14 представляет собой -NH-С(O)-фенил, замещенный галогеном;
R15 представляет собой водород, низший алкил, замещенный галогеном, или представляет собой галоген;
R16 представляет собой водород или низший алкокси;
R17 представляет собой пиридинил, возможно замещенный низшим алкокси, или низший алкил, замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
2. Соединение формулы Ia, охватываемое формулой I по п. 1,
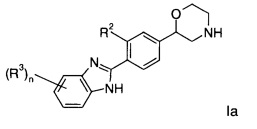 ,
,
где R2 представляет собой водород;
R3 представляет собой водород, галоген или низший алкил и
n представляет собой 1 или 2,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
3. Соединение формулы Ib, охватываемое формулой I по п. 1,
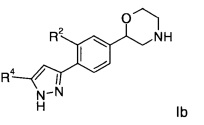 ,
,
где R2 представляет собой водород или галоген и
R4 представляет собой фенил, замещенный одним или двумя заместителями, выбранными из галогена или циано, или представляет собой пиридинил, возможно замещенный галогеном, или представляет собой тетрагидропиран, или представляет собой -NH-С(O)-фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
4. Соединение формулы Ic, охватываемое формулой I по п. 1,
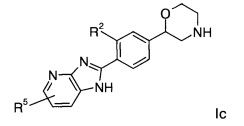 ,
,
где R2 представляет собой водород и
R5 представляет собой водород или галоген,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
5. Соединение формулы Id, охватываемое формулой I по п. 1,
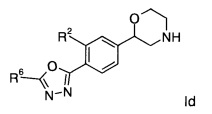 ,
,
где R2 представляет собой водород и
R6 представляет собой фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
6. Соединение формулы Ie, охватываемое формулой I по п. 1,
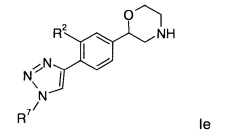 ,
,
где R2 представляет собой водород или
R7 представляет собой фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
7. Соединение формулы If, охватываемое формулой I по п. 1,
 ,
,
R2 представляет собой водород и
R8 представляет собой фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
8. Соединение формулы Ig, охватываемое формулой I по п. 1,
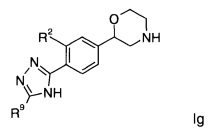 ,
,
где R2 представляет собой водород и
R9 представляет собой фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
9. Соединение формулы Ih, охватываемое формулой I по п. 1,
 ,
,
где R2 представляет собой водород или
R10 представляет собой фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
10. Соединение формулы Ii, охватываемое формулой I по п. 1,
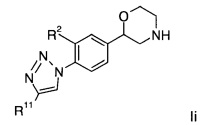 ,
,
где R2 представляет собой водород и
R11 представляет собой фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
11. Соединение формулы Ij, охватываемое формулой I по п. 1,
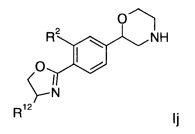 ,
,
где R2 представляет собой водород и
R12 представляет собой фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
12. Соединение формулы Ik, охватываемое формулой I по п. 1,
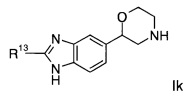 ,
,
где R13 представляет собой фенил, возможно замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
13. Соединение формулы Il, охватываемое формулой I по п. 1,
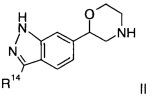 ,
,
где R14 представляет собой -NH-С(O)-фенил, замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
14. Соединение формулы Im, охватываемое формулой I по п. 1,
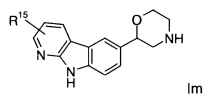 ,
,
где R15 представляет собой водород, низший алкил, замещенный галогеном или галоген,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
15. Соединение формулы In, охватываемое формулой I по п. 1,
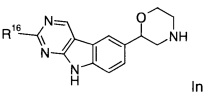 ,
,
где R16 представляет собой водород или низший алкокси,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
16. Соединение формулы Io, охватываемое формулой I по п. 1,
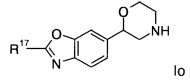
R17 представляет собой пиридинил, возможно замещенный низшим алкокси, или низший алкил, замещенный галогеном,
или его фармацевтически приемлемые кислотно-аддитивные соли, все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры и все таутомерные формы соединений формулы I.
17. Соединение формулы I по п. 1, которое представляет собой
2-(4-(1Н-бензо[d]имидазол-2-ил)фенил)морфолин
2-(4-(6-хлор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(S)-2-(4-(6-фтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(S)-2-(4-(4,6-дифтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(R)-2-(4-(6-фтор-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
(S)-2-(4-(5,6-диметил-1Н-диметил[d]имидазол-2-ил)фенил)морфолин
2-(4-(5-(4-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
2-(4-(5-(6-хлорпиридин-3-ил)-1Н-пиразол-3-ил)фенил)морфолин
4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(R)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-2-(4-(5-(3-хлорфенил)-1Н-пиразол-3-ил)фенил)морфолин
3-[5-(4-морфолин-2-ил-фенил)-2Н-пиразол-3-ил]-бензонитрил
(S)-2-(4-(5-(2,4-дифторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-2-(4-(5-(2,4-дифторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-2-(4-(5-(тетрагидро-2Н-пиран-4-ил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-4-фтор-N-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензамид
(R)-2-(4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-3-фтор-4-(3-(4-(морфолин-2-ил)фенил)-1Н-пиразол-5-ил)бензонитрил
(S)-2-{4-[5-(6-хлор-пиридин-3-ил)-1Н-пиразол-3-ил]-фенил}-морфолин
(R)-2-{4-[5-(6-хлор-пиридин-3-ил)-1Н-пиразол-3-ил]-фенил}-морфолин
(S)-2-(3-фтор-4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(R)-2-(3-фтор-4-(5-(4-фторфенил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-2-(4-(5-(2-хлорпиридин-4-ил)-1Н-пиразол-3-ил)фенил)морфолин
(S)-2-(4-(6-бромо-1Н-имидазо[4,5-b]пиридин-2-ил)фенил)морфолин
(S)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолин
(R)-2-(4-(5-(4-фторфенил)-1,3,4-оксадиазол-2-ил)фенил)морфолин
(S)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолин
(R)-2-(4-(1-(4-фторфенил)-1Н-1,2,3-триазол-4-ил)фенил)морфолин
(S)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолин
(R)-2-(4-(1-(4-фторфенил)-1Н-пиразол-4-ил)фенил)морфолин
(S)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолин
(R)-2-(4-(5-(4-фторфенил)-1Н-1,2,4-триазол-3-ил)фенил)морфолин
(S)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолин
(R)-2-(4-(3-(4-фторфенил)-1Н-1,2,4-триазол-1-ил)фенил)морфолин
(S)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолин
(R)-2-(4-(4-(4-фторфенил)-1Н-1,2,3-триазол-1-ил)фенил)морфолин
(S)-2-{4-[R-4-(4-фтор-фенил)-4,5-дигидро-оксазол-2-ил]-фенил}-морфолин
(S)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолин
(R)-2-(2-(4-фторфенил)-1Н-диметил[d]имидазол-5-ил)морфолин
4-фтор-N-(6-(морфолин-2-ил)-1Н-индазол-3-ил)бензамид.
(S)-2-(9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(3-хлор-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(R)-2-(3-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(2-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(R)-2-(2-(трифторметил)-9Н-пиридо[2,3-b]индол-6-ил)морфолин
(S)-2-(2-изопропокси-9Н-пиримидо[4,5-b]индол-6-ил)морфолин
(R)-2-(6-этоксипиридин-3-ил)-6-(морфолин-2-ил)диметил[d]оксазол
(R)-6-(морфолин-2-ил)-2-(6-(трифторметил)пиридин-3-ил)диметил[d]оксазол
(R)-6-(морфолин-2-ил)-2-(2-(трифторметил)пиридин-4-ил)диметил[d]оксазол или
(S)-6-(морфолин-2-ил)-2-(2-(трифторметил)пиридин-4-ил)диметил[d]оксазол.
18. Способ получения соединения формулы I по любому из пп. 1-17, при котором осуществляют депротекцию соединения формулы
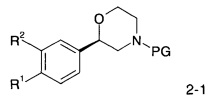 или
или 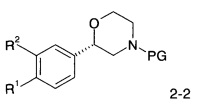
с помощью HCl в диоксане в течение 2 часов при 60°С или с помощью CF3COOH в дихлорметане при комнатной температуре до соединения формулы
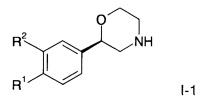 или
или  ,
,
где PG представляет собой кислотно-лабильную аминозащитную группу, выбранную из трет-бутоксикарбонила, a R1 и R2 являются такими, как определено в п. 1, и
при необходимости конвертирование полученных соединений в фармацевтически приемлемую кислоту.
19. Фармацевтическая композиция, обладающая селективностью к рецепторам следовых аминов (TAAR1), содержащая соединение по любому из пп. 1-17 в эффективном количестве и фармацевтически приемлемый носитель и/или адъювант.
20. Фармацевтическая композиция по п. 19, содержащая соединение по любому из пп. 1-17 и фармацевтически приемлемый носитель и/или адъювант, для применения при лечении депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (СДВГ), расстройств, вызванных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, метаболических расстройств, нарушения питания, диабета, диабетических осложнений, ожирения, дислипидемии, расстройств потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых расстройств.
21. Соединения по любому из пп. 1-17 для применения в качестве терапевтически активных веществ, обладающих селективностью к рецепторам TAAR1.
22. Соединения по любому из пп. 1-17 для применения в качестве терапевтически активных веществ для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (СДВГ), расстройств, вызванных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, метаболических расстройств, нарушения питания, диабета, диабетических осложнений, ожирения, дислипидемии, расстройств потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых расстройств.
23. Применение соединения по любому из пп. 1-17 для изготовления лекарственного средства для терапевтического и/или профилактического лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания и гиперактивности (СДВГ), расстройств, вызванных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертензии, злоупотребления веществами, вызывающими зависимость, метаболических расстройств, нарушения питания, диабета, диабетических осложнений, ожирения, дислипидемии, расстройств потребления и ассимиляции энергии, расстройств и нарушений температурного гомеостаза, нарушений сна и циркадного ритма и сердечно-сосудистых расстройств.
| WO2009019149 A1, 12.02.2009 | |||
| ПОРШНЕВОЙ НАСОС ОДНОСТОРОННЕГО ДЕЙСТВИЯ | 1994 |
|
RU2076950C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2188194C2 |
| ПРОИЗВОДНОЕ ЦИННАМИДА ТИПА МОРФОЛИНА | 2006 |
|
RU2381225C1 |
Авторы
Даты
2017-05-31—Публикация
2013-01-08—Подача