Область изобретения
Настоящее изобретение относится к производным 7-(гетероарил-амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-уксусной кислоты формулы (I) и их применению в качестве модуляторов рецептора простагландина D2, в особенности в качестве модуляторов рецептора простагландина D2 ("DP рецептора"), в лечении различных простагландин-опосредованных болезней и расстройств, к фармацевтическим композициям, содержащим эти соединения и к способам их получения. В частности, такие производные могут применяться отдельно или в составе фармацевтических композиций для лечения как хронических, так и острых аллергических/иммунных болезней/расстройств, таких как астма, аллергическая астма, эозинофильная астма, тяжелая астма, ринит, аллергический ринит, гигантская крапивница, аллергия на яд насекомых, медикаментозные аллергии, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, бронхиальная астма, пищевая аллергия, системные тучноклеточные расстройства, анафилактический шок, крапивница, экзема, язвенный колит, хроническая обструктивная болезнь легких (ХОБЛ), воспалительная болезнь кишечника и ревматоидный артрит; эозинофил-связанных болезней, включающих васкулиты малых сосудов, такие как синдром Чарга-Стросса, гранулематоз Вегенера, микроскопическая ангиопатия (и орган-специфическое подмножество последней), гиперэозинофильные синдромы, такие как эозинофильная пневмония, эозинофильный эзофагит, рефлюксный эзофагит, эозинофильный эндокардит (эндокардит Леффлера), синдром эозинофилии-миалгии, эозинофильный фасцит, эозинофильный пустулезный фолликулит (эозинофильный пустулез Офуджи), эозинофильные язвы, ангиолимфоидная гиперплазия с эозинофилией (ALHE), эозинофильная флегмона (синдром Велла), хроническая эозинофильная лейкемия и DRESS синдром (лекарственная кожная реакция, сопровождающаяся эозинофилией и системными проявлениями); и базофил-связанных болезней, включающих базофильный лейкоз и базофильный лейкоцитоз.
Предпосылки создания изобретения
В ответ на контакт с аллергеном в аллергических условиях, тучные клетки активируются и выделяют медиаторы, такие как гистамин, тромбоксан А2 (ТхА2), цистеиновые лейкотриены (CysLT) и простагландин D2 (PGD2). Эти медиаторы взаимодействуют с их соответствующими рецепторами и вызывают физиологические эффекты, такие как повышенная проницаемость сосудов, отек, зуд, заложенность носа и легочная гиперемия, бронхоконстрикция и секреция слизи. Например, повышенная проницаемость сосудов дает чрезмерную инфильтрацию эозинофильных и базофильных лейкоцитов в ткани и, таким образом, усиливает аллергическую реакцию.
Современные лечения аллергических болезней включают агенты, которые могут блокировать или другим способом прерывать такие взаимодействия, например, антигистамины (антагонисты гистаминового H1 рецептора), антагонисты лейкотриеного рецептора, агонисты бета-адренергического рецептора, и кортикостероиды. В основном, лечения анти-гистаминами и антагонистами лейкотриенов имеют ограниченную эффективность, и длительное применение кортикостероидов часто связано с нежелательными побочными эффектами.
PGD2 представляет собой агонист, который, как известно, действует на два G-белок-сопряженных рецептора, PGD2 рецептор DP1 и недавно идентифицированный CRTH2 (молекула, гомологичная хемотактическому рецептору, экспрессируемая на Th2 клетках) рецептор (который называют также "DP2 рецептор").
Считается, что повышенные PGD2 уровни вызывают воспаление, наблюдаемое при аллергических болезнях, таких как аллергический ринит, аллергическая астма, аллергический конъюнктивит, атопический дерматит и подобные. Поэтому, блокирование взаимодействия PGD2 с его рецепторами считается полезной терапевтической стратегией для лечения таких болезней.
GB 2388540 раскрывает применение раматробана ((3R)-3-(4-фторбензол-сульфонамидо)-1,2,3,4-тетрагидрокарбазол-9-пропионовая кислота), антагониста ТхА2 рецептора (который называют также "TP рецептор") с дополнительной антагонистической активностью к CRTH2, для профилактики и лечения аллергических болезней, таких как астма, аллергический ринит или аллергический конъюнктивит. В Т. Ishizuka et al., Cardiovascular Drug Rev. 2004, 22(2), 71-90 описано влияние раматробана на воспаление на поздней стадии. Кроме того, была описана пероральная биодоступность раматробана и его способность ингибировать in vitro миграцию эозинофилов, вызванную простагландином D2 (Journal of Pharmacology and Experimental Therapeutics, 305(1), p.347-352 (2003)).
WO 2003/097598 и WO 2003/097042 раскрывают аналоги раматробана с CRTH2 антагонистической активностью. Ulven et al, J. Med. Chem. 2005, 48(4), 897-900 раскрывают дополнительные аналоги раматробана.
WO 2008/017989 раскрывает производные (3-амино-1,2,3,4-тетрагидро-9Н-карбазол-9-ил)-уксусной кислоты с CRTH2 антагонистической активностью. WO 2011/117798 раскрывает производные 3-(гетероарил-амино)-1,2,3,4-тетрагидро-9Н-карбазола.
WO 2007/019675, WO 2010/031182 и WO 2010/031183 раскрывают различные производные 6,7,8,9-тетрагидро-пиридо[1,2-а]индол-уксусной кислоты с CRTH2 антагонистической активностью.
WO 10/031184 раскрывает производные азаиндола с CRTH2 антагонистической активностью.
Описание изобретения
1) Настоящее изобретение относится к производным 7-(гетероарил-амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-уксусной кислоты формулы (I),
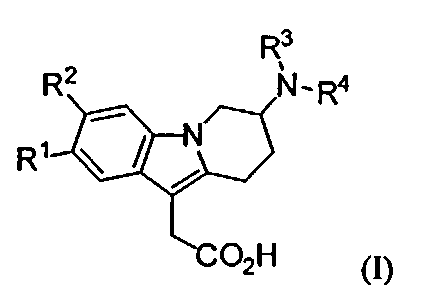
в которой
R1 и R2 представляют собой независимо друг от друга водород, (С1-С4)алкил, (С1-С4)алкокси, галоген, трифторметокси или трифторметил;
R3 представляет собой водород, (С1-С4)алкил, (С1-С2)алкокси-(С2-С3)алкил, (C1-С4)фторалкил или (С3-С6)циклоалкил-(С1-С2)алкил; и
R4 представляет собой гетероарильную группу, которая является незамещенной или моно-, ди- или три-замещенной, где заместители независимо выбирают из группы, которая включает галоген, (С1-С4)алкил, (С3-С6)циклоалкил, (С1-С4)алкокси, (C1-С4)фторалкил и фенил (предпочтительно галоген, (С1-С4)алкил и (С1-С4)фторалкил); и к солям (в частности фармацевтически приемлемым солям) таких соединений.
Соединения формулы (I) в соответствии с вариантом осуществления 1) могут содержать один или больше стереогенных или асимметричных центров, например, один или больше асимметричных атомов углерода. Заместители около двойной связи могут быть в (Z)- или (E)-конфигурации, пока не указано иначе. Таким образом, соединения формулы (I) могут быть в виде смеси стереоизомеров или предпочтительно в виде чистых стереоизомеров. Смеси стереоизомеров могут быть разделены по способу, известному специалисту, квалифицированному в данной области техники.
Следующие разделы представляют определения различных химических остатков для соединений в соответствии с изобретением и предназначены для того, чтобы использовать их единообразно по всему описанию и Формуле изобретения, пока другое четко выраженное определение не обеспечит более широкое или более узкое определение.
Термин "алкил", используемый отдельно или в комбинации, относится к линейной или разветвленной алкильной группе, содержащей от одного до четырех атомов углерода. Термин "(Cx-Cy)алкил" (каждый из х и у является целым числом), относится к алкильной группе, как определено выше, содержащей от x до y атомов углерода. Например, (С1-С4)алкильная группа содержит от одного до четырех атомов углерода. Типичные примеры алкильных групп включают метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил и трет-бутил.
Если "R1" представляет собой "(С1-C4)алкил", термин означает (С1-С4)алкильные группы, как определено выше. Примеры указанных групп включают метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил и трет-бутил. Предпочтительным является метил.
Если "R2" представляет собой "(С1-С4)алкил", термин означает (С1-С4)алкильные группы, как определено выше. Примеры указанных групп включают метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бугил и трет-бутил. Предпочтительным является метил.
Если "R3" представляет собой "(С1-С4)алкил", термин означает (C1-С4)алкильные группы, как определено выше. Примеры указанных групп включают метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил и трет-бутил. Предпочтительными являются метил, этил, н-пропил, изо-пропил и изо-бутил; более предпочтительными являются метил, этил и н-пропил; наиболее предпочтительным является метил.
Если "R4" представляет собой "гетероарил, который замещен (С1-С4)алкилом", термин "(С1-С4)алкил" означает (С1-С4)алкильные группы, как определено выше. Примеры указанных групп включают метил, этил, п-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил и трет-бутил. Предпочтительным является метил.
Термин "алкокси", используемый отдельно или в комбинации, относится к группе алкил-О-, где алкильная группа является такой, как определена выше. Термин "(Cx-Cy)алкокси" (каждый из x и y представляет собой целое число) относится к алкокси группе, как определено выше, которая содержит от x до y атомов углерода. Например, (С1-С4)алкокси группа содержит от одного до четырех атомов углерода. Типичные примеры алкокси групп включают метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор-бутокси и трет-бутокси.
Если "R1" представляет собой "(С1-С4)алкокси" группу, термин означает (C1-С4)алкокси группы, как определено выше. Примеры указанных групп включают метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор-бутокси и трет-бутокси. Предпочтительной является метокси группа.
Если "R2" представляет собой "(С1-С4)алкокси" группу, термин означает (C1-С4)алкокси группы, как определено выше. Примеры указанных групп включают метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор-бутокси и трет-бутокси. Предпочтительной является метокси группа.
Если "R4" представляет собой "гетероарил, который замещен (С1-С4)алкокси группой", термин "(С1-С4)алкокси" означает (С1-С4)алкокси группы, как определено выше. Примеры указанных групп включают метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор-бутокси и трет-бутокси. Предпочтительной является метокси группа.
Термин "(С1-С2)алкокси-(С2-С3)алкил" относится к (С2-С3)алкильной группе, как определено выше, в которой один атом водорода заменен (С1-С2)алкокси группой, как определено выше. Примеры (С1-С2)алкокси-(С2-С3)алкильных групп включают метокси-этил (особенно 2-метокси-этил), метокси-пропил (особенно 2-метокси-пропил и 3-метокси-пропил), этокси-этил (особенно 2-этокси-этил) и этокси-пропил (особенно 2-этокси-пропил и 3-этокси-пропил). Предпочтительным является 2-метокси-этил.
Термин "(С3-С6)циклоалкил", используемый отдельно или в комбинации, означает циклоалкильную группу, состоящую из 3-6 атомов углерода. Примеры (С3-С6)циклоалкильных групп включают циклопропил, циклобутил, циклопентил и циклогексил. Предпочтительным является циклопропил.
Термин "(С3-С6)циклоалкил-(С1-С2)-алкил" относится к (С1-С2)алкильной группе, как определено выше, в которой один атом водорода заменен (С3-С6)циклоалкильной группой, как определено выше. Примерами (С3-С6)циклоалкил-(С1-С2)алкильных групп являются циклопропил-метил, циклобутил-метил, циклопентил-метил, циклогексил-метил, циклопропил-этил (особенно 1-циклопропил-этил и 2-циклопропил-этил), циклобутил-этил (особенно 1-циклобутил-этил и 2-циклобутил-этил), циклопентил-этил (особенно 1-циклопентил-этил и 2-циклопентил-этил) и циклогексил-этил (особенно 1-циклогексил-этил и 2-циклогексил-этил). Предпочтительным является циклопропил-метил.
Термин "(Cx-Cy)фторалкил" (каждый из x и y представляет собой целое число) относится к алкильной группе, как определено выше, которая содержит от x до y атомов углерода, в которой один или больше (и возможно все) атомов водорода заменены атомом фтор. Например, (С1-С4)фторалкильная группа содержит от одной до четырех атомов углерода, где от одного до девяти атомов водорода заменены атомом фтора.
Если "R3" представляет собой "(С1-С4)фторалкил" термин означает (С1-С4)фторалкильную группу, как определено выше. Примеры указанных групп включают дифторметил, трифторметил, 2,2-дифторэтил и 2,2,2-трифторэтил. Предпочтительные примеры включают 2,2-дифторэтил и 2,2,2-трифторэтил. Наиболее предпочтительным является 2,2-дифторэтил.
Если "R4" представляет собой "гетероарил, который замещен (C1-С4)фторалкилом", термин "(С1-С4)фторалкил" означает (С1-С4)фторалкильную группу, как определено выше. Примеры указанных групп включают дифторметил, трифторметил, 2,2-дифторэтил и 2,2,2-трифторэтил. Предпочтительные примеры включают дифторметил и трифторметил. Наиболее предпочтительным является трифторметил.
Термин галоген означает фтор, хлор, бром или йод.
Если "R1" представляет собой "галоген", термин означает предпочтительно фтор и хлор и наиболее предпочтительно фтор.
Если "R2" представляет собой "галоген", термин означает предпочтительно фтор и хлор и наиболее предпочтительно фтор.
Если "R4" представляет собой "гетероарил, который замещен галогеном", термин "галоген" означает предпочтительно фтор, хлор и бром, более предпочтительно фтор и хлор и наиболее предпочтительно хлор.
Термин "гетероарил", используемый отдельно или в комбинации, означает 5- - 10-членное моноциклическое или бициклическое ароматическое кольцо, которое содержит 1, 2 или 3 гетероатома, которые независимо выбирают из кислорода, азота и серы. Предпочтительно термин "гетероарил" означает 5- - 10-членное моноциклическое или бициклическое ароматическое кольцо, которое содержит один атом азота и необязательно один дополнительный гетероатом, который независимо выбирают из кислорода, азота и серы. Наиболее предпочтительными являются 6-членные моноциклические ароматические кольцевые системы, которые содержат один или два атома азота. Примеры таких гетероарильньгх групп включают фуранил, оксазолил, изоксазолил, оксадиазолил, тиенил, тиазолил, изотиазолил, тиадиазолил, пиролил, имидазолил, пиразолил, триазолил, пиридил, пиримидил, пиридазинил, пиразинил, индолил, изоиндолил, бензофуранил, изобензофуранил, бензотиофенил, индазолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензоизотиазолил, бензотриазолил, бензо[2,1,3]оксадиазолил, бензо[2,1,3]тиадиазолил, бензо[1,2,3]тиадиазолил, хинолинил, изохинолинил, циннолинил, хиназолинил, хиноксалинил и фталазинил. Предпочтительные примеры таких гетероарильных групп включают пиридил (особенно пиридин-2-ил), пиримидил (особенно пиримидин-2-ил), бензоксазолил (особенно бензоксазол-2-ил), бензотиазолил (особенно бензотиазол-2-ил) и хиназолинил (особенно хиназолин-2-ил и хиназолин-4-ил). Дополнительные предпочтительные примеры включают изоксазолил (особенно изоксазол-3-ил), тиазолил (особенно тиазол-2-ил), тиадиазолил (особенно тиадиазол-2-ил), пиразолил (особенно пиразол-3-ил) и хиноксалинил (особенно хиноксалин-2-ил). Более предпочтительным является пиримидил (особенно пиримидин-2-ил), бензоксазолил (особенно бензоксазол-2-ил) и бензотиазолил (особенно бензотиазол-2-ил). Наиболее предпочтительным является пиримидил (особенно пиримидин-2-ил). Гетероарильная группа может быть незамещенной или моно-, ди- или три-замещенной (предпочтительно незамещенной или моно-замещенной и наиболее предпочтительно моно-замещенной), где заместители независимо выбирают из группы, которая включает галоген, (С1-С4)алкил, (С3-С6)циклоалкил, (С1-С4)алкокси, (С1-С4)фторалкил и фенил. Примеры таких незамещенных, моно-, ди- или три-замещенных гетероарильных групп включают 5-фтор-пиримидин-2-ил, 5-хлор-пиримидин-2-ил, 5-трифторметил-пиримидин-2-ил, 5-фтор-бензоксазол-2-ил, 6-фтор-бензоксазол-2-ил, 5-фтор-бензотиазол-2-ил, и 6-фтор-бензотиазол-2-ил. Дополнительные примеры включают 5-метил-пиримидин-2-ил, хиназолин-2-ил, 6-фтор-хиназолин-2-ил, 7-фтор-хиназолин-2-ил, 2-метил-хиназолин-4-ил и 6-фтор-хиноксалин-2-ил. Предпочтительные примеры включают 5-фтор-пиримидин-2-ил, 5-хлор-пиримидин-2-ил, 5-метил-пиримидин-2-ил, 5-фтор-бензоксазол-2-ил, 6-фтор-бензоксазол-2-ил, хиназолин-2-ил, 7-фтор-хиназолин-2-ил и 6-фтор-хиноксалин-2-ил. Более предпочтительные примеры включают 5-фтор-пиримидин-2-ил, 5-хлор-пиримидин-2-ил, 5-фтор-бензоксазол-2-ил, и 6-фтор-бензоксазол-2-ил. Наиболее предпочтительными являются 5-фтор-пиримидин-2-ил и 5-хлор-пиримидин-2-ил.
2) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с вариантом осуществления 1), в которых
R1 представляет собой водород, (С1-С4)алкил, (С1-С4)алкокси, галоген или трифторметокси;
R2 представляет собой водород, галоген или трифторметил;
R3 представляет собой водород, (С1-С4)алкил, (С1-С2)алкокси-(С2-С3)алкил, (C1-С4)фторалкил или (С3-С6)циклоалкил-(С1-С2)алкил; и
R4 представляет собой гетероарильную группу, которая является незамещенной или моно- или ди-замещенной, где заместители независимо выбирают из группы, которая включает галоген, (С1-С4)алкил, (С3-С6)циклоалкил, (С1-С4)алкокси, (С1-С4)фторалкил и фенил (предпочтительно из галоген, (С1-С4)алкил и (С1-С4)фторалкил); и к солям (в частности фармацевтически приемлемым солям) таких соединений.
3) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с вариантом осуществления 1), в которых
R1 представляет собой водород, (С1-С4)алкил, (С1-С4)алкокси, галоген или трифторметокси;
R2 представляет собой водород, галоген или трифторметил;
R3 представляет собой водород или (С1-С4)алкил; и
R4 представляет собой гетероарильную группу, которая является незамещенной или моно- или ди-замещенной (особенно моно-замещенной), где заместители независимо выбирают из группы, которая включает галоген, (С1-С4)алкил и (C1-С4)фторалкил (предпочтительно галоген и (С1-С4)фторалкил); и к солям (в частности фармацевтически приемлемым солям) таких соединений.
4) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с вариантом осуществления 1), в которых
R1 представляет собой водород, метил, метокси, фтор, хлор или трифторметокси (особенно водород);
R2 представляет собой водород, фтор, хлор или трифторметил (особенно фтор, хлор или трифторметил);
R3 представляет собой водород или метил; и
R4 представляет собой гетероарильную группу, которая является незамещенной или моно-замещенной фтором, хлором или трифторметилом (особенно фтором или хлором);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
5) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с вариантом осуществления 1), в которых
R1 представляет собой водород;
R2 представляет собой водород, фтор, хлор или трифторметил (особенно фтор или хлор);
R3 представляет собой метил; и
R4 представляет собой гетероарильную группу, которая является моно-замещенной фтором или хлором, где гетероарильную группу выбирают из пиримидин-2-ила, бензоксазол-2-ила и бензотиазол-2-ила;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
6) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-4), в которых
R1 представляет собой водород, (С1-С4)алкил или галоген (особенно водород, метил, фтор или хлор);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
7) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-4), в которых
R1 представляет собой водород или галоген (особенно водород, фтор или хлор); и к солям (в частности фармацевтически приемлемым солям) таких соединений.
8) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-5), в которых
R1 представляет собой водород; и к солям (в частности фармацевтически приемлемым солям) таких соединений.
9) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-3) или 6)-8), в которых
R2 представляет собой водород, галоген или трифторметил;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
10) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-4) или 6)-8), в которых
R2 представляет собой водород, фтор, хлор или трифторметил;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
11) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-8), в которых
R2 представляет собой фтор или хлор;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
12) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1), 2) или 6)-11), в которых
R3 представляет собой водород, (С1-С4)алкил, (С1-С2)алкокси-(С2-С3)алкил или (С3-С6)циклоалкил-(С1-С2)алкил;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
13) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1), 2) или 6)-11), в которых
R3 представляет собой водород, метил, этил, н-пропил, 2-метокси-этил, 2,2-дифторэтил или циклопропил-метил;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
14) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-4) или 6)-11), в которых
R3 представляет собой водород или метил;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
15) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-11), в которых
R3 представляет собой (С1-С4)алкил (особенно метил);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
16) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-4) или 6)-11), в которых
R3 представляет собой водород;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
17) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1), 2) или 6)-16), в которых
R4 представляет собой гетероарильную группу, которая является незамещенной или моно- или ди-замещенной (особенно моно-замещенной), где заместители независимо выбирают из группы, которая включает галоген, (С1-С4)алкил, (С3-С6)циклоалкил, (С1-С4)алкокси и (С1-С4)фторалкил;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
18) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1), 2) или 6)-16), в которых
R4 представляет собой гетероарильную группу, которая является незамещенной или моно-замещенной (особенно моно-замещенной) галогеном, (С3-С6)циклоалкилом или (С1-С4)фторалкилом (особенно фтором, хлором, циклопропилом или трифторметилом);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
19) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-3) или 6)-16), в которых
R4 представляет собой гетероарильную группу, которая является моно-замещенной галогеном или (С1-С4)фторалкилом (особенно фтор, хлор или трифторметил);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
20) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-16), в которых
R4 представляет собой гетероарильную группу, которая является моно-замещенной фтором или хлором;
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
21) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 17)-20), в которых
гетероарильную группу выбирают из пиримидила (особенно пиримидин-2-ила), бензоксазолила (особенно бензоксазол-2-ила) и бензотиазолила (особенно бензотиазол-2-ила);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
22) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 17)-20), в которых
гетероарильная группа представляет собой пиримидил (особенно пиримидин-2-ил);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
23) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 17)-20), в которых
гетероарильная группа представляет собой бензоксазолил (особенно бензоксазол-2-ил);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
24) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 17)-20), в которых
гетероарильная группа представляет собой бензотиазолил (особенно бензотиазол-2-ил);
и к солям (в частности фармацевтически приемлемым солям) таких соединений.
25) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-24), в которых абсолютная конфигурация стереогенного центра является такой, как показана в формуле Ist1

и к солям (в частности фармацевтически приемлемым солям) таких соединений.
26) Дополнительный вариант воплощения настоящего изобретения относится к соединениям в соответствии с любым из вариантов воплощения 1)-24), в которых абсолютная конфигурация стереогенного центра является такой, как показана в формуле Ist2

и к солям (в частности фармацевтически приемлемым солям) таких соединений.
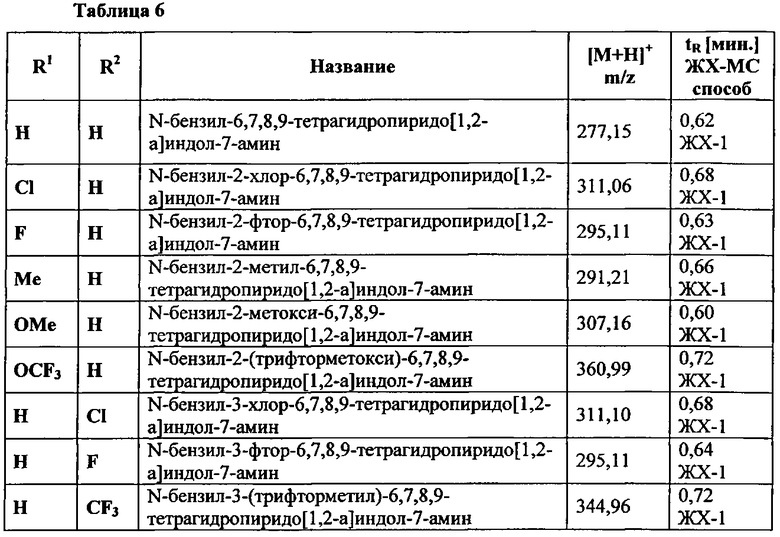
27) Предпочтительные соединения формулы (I), как определено в варианте воплощения 1), выбирают из группы, которая включает такие как:
2-(7-((5-хлорпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-(метил(5-(трифторметил)пиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[е]тиазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(2-фтор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота,
2-(2-фтор-7-((5-фторбензо[(1]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-2-метокси-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-2-метокси-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-2-метил-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-2-метил-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(2-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(2-хлор-7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-хлорпиримидин-2-ил)(метил)амино)-3-фтор-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-(метил(5-(трифторметил)пиримидин-2-ил)амино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторбензо[d]тиазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((6-фторбензо[с1]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-хлорпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-хлорпириммидин-2-ил)(метил)амино)-3-(трифторметил)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-хлорпиримидин-2-ил)(метил)амино)-2-(трифторметокси)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-3-(трифторметил)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-2-(трифторметокси)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-3-(трифторметил)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-2-(трифторметокси)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-3-(трифторметил)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-2-(трифторметокси)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторбензо[(1]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
(S)-2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
(R)-2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторбензо[d]оксазол-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота; и
2-(3-хлор-7-((5-хлорпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
или соли (в частности фармацевтически приемлемые соли) таких соединений;
необходимо понимать, что для любых представленных выше соединений стереогенный центр, который специфически не обозначен, может быть в абсолютной (R)- или абсолютной (S)-конфигурации.
28) Дополнительные предпочтительные соединения формулы (I), как определено в варианте воплощения 1), выбирают из группы, которая включает такие как:
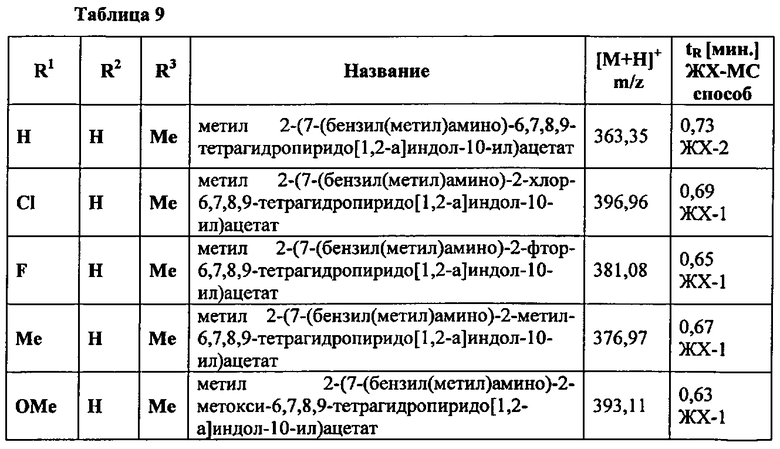
2-(3-хлор-7-(метил(5-метилпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(метил(хиназолин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((6-фторхиназолин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((7-фторхиназолин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(метил(2-метилхиназолин-4-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((6-фторхиноксалин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((2,2-дифторэтил)(5-фторбензо[d]оксазол-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(этил(5-фторпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторбензо[d]оксазол-2-ил)(изопропил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторпиримидин-2-ил)(2-метоксиэтил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторбензо[d]оксазол-2-ил)(изобутил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторпиримидин-2-ил)(пропил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(этил(5-фторбензо[d]оксазол-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота; и
2-(3-хлор-7-((циклопропилметил)(5-фторпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
или соли (в частности фармацевтически приемлемые соли) таких соединений;
необходимо понимать, что для любых представленных выше соединений стереогенный центр, который специфически не обозначен, может быть в абсолютной (R)- или абсолютной (S)-конфигурации.
Пока однозначно не указано иначе, общие термины и названия, используемые выше в данном описании, и ниже предпочтительно принимают в контексте данного описания следующие значения:
Когда используется множественная форма для соединений, солей, фармацевтических композиций, болезней и подобного, предполагается, что она также означает одно соединение, соль или подобное.
Термин "фармацевтически приемлемые соли" относится к нетоксичным солям присоединения неорганических или органических кислот и/или оснований. Может быть сделана ссылка на "Salt selection for basic drags" (Выбор солей для основных лекарственных препаратов), Int. J. Pharm. (1986), 33, 201-217.
Соединения формулы (I) в соответствии с любым из вариантов воплощения 1)-28), или их фармацевтически приемлемые соли, могут использоваться для получения лекарственного средства, и подходят для профилактики и/или лечения болезней, которые выбирают из группы, состоящей из хронических и острых аллергических/иммунных болезней/расстройств, включающих такие как астма, аллергическая астма, эозинофильная астма, тяжелая астма, ринит, аллергический ринит, гигантская крапивница, аллергия на яд насекомых, медикаментозные аллергии, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, бронхиальная астма, пищевая аллергия, системные тучноклеточные расстройства, анафилактический шок, крапивница, экзема, язвенный колит, хроническая обструктивная болезнь легких (ХОБЛ), воспалительная болезнь кишечника и ревматоидный артрит; эозинофил-связанных болезней, включающих васкулиты малых сосудов, такие как синдром Чарга-Стросса, гранулематоз Вегенера, микроскопическая ангиопатия (и орган-специфическое подмножество последней), гиперэозинофильные синдромы, такие как эозинофильная пневмония, эозинофильный эзофагит, рефлюксный эзофагит, эозинофильный эндокардит (эндокардит Леффлера), синдром эозинофилии-миалгии, эозинофильный фасцит, эозинофильный пустулезный фолликулит (эозинофильный пустулез Офуджи), эозинофильные язвы, ангиолимфоидная гиперплазия с эозинофилией (ALHE), эозинофильная флегмона (синдром Велла), хроническая эозинофильная лейкемия и DRESS синдром (лекарственная кожная реакция, сопровождающаяся эозинофилией и системными проявлениями); и базофил-связанных болезней, включающих базофильный лейкоз и базофильный лейкоцитоз.
В предпочтительном варианте воплощения, соединения формулы (I) в соответствии с любым из вариантов воплощения 1)-28), или их фармацевтически приемлемые соли, могут использоваться для получения лекарственного средства, и подходят для профилактики и/или лечения болезней, которые выбирают из группы, включающей такие как астма, аллергическая астма, эозинофильная астма, тяжелая астма, аллергический ринит, гигантская крапивница, аллергия на яд насекомых, медикаментозные аллергии, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, пищевая аллергия, системные тучноклеточные расстройства, анафилактический шок, крапивница и экзема.
В другом предпочтительном варианте воплощения, соединения формулы (I) в соответствии с любым из вариантов воплощения 1)-28), или их фармацевтически приемлемые соли, могут использоваться для получения лекарственного средства, и подходят для профилактики и/или лечения болезней, которые выбирают из группы, состоящей из эозинофил-связанных болезней, включающих васкулиты малых сосудов, такие как синдром Чарга-Стросса, гранулематоз Вегенера, микроскопическая ангиопатия (и орган-специфическое подмножество последней), гиперэозинофильные синдромы, такие как эозинофильная пневмония, эозинофильный эзофагит, рефлюксный эзофагит, эозинофильный эндокардит (эндокардит Леффлера), синдром эозинофилии-миалгии, эозинофильный фасцит, эозинофильный пустулезный фолликулит (эозинофильный пустулез Офуджи), эозинофильные язвы, ангиолимфоидная гиперплазия с эозинофилией (ALHE), эозинофильная флегмона (синдром Велла), хроническая эозинофильная лейкемия и DRESS синдром (лекарственная кожная реакция, сопровождающаяся эозинофилией и системными проявлениями).
В еще одном другом предпочтительном варианте воплощения, соединения формулы (I) в соответствии с любым из вариантов воплощения 1)-28), или их фармацевтически приемлемые соли, могут использоваться для получения лекарственного средства, и подходят для профилактики и/или лечения болезней, которые выбирают из группы, состоящей из базофил-связанных болезней, включающих базофильный лейкоз и базофильный лейкоцитоз.
Настоящее изобретение также относится к применению соединений формулы (I) в соответствии с любым из вариантов воплощения 1)-28) для получения фармацевтических композиций для лечения и/или профилактики указанных выше болезней.
Настоящее изобретение также относится к фармацевтически приемлемым солям и к фармацевтическим композициям и составам соединений формулы (I) в соответствии с любым из вариантов воплощения 1)-28).
Фармацевтическая композиция в соответствии с настоящим изобретением содержит по крайней мере одно соединение формулы (I) в соответствии с любым из вариантов воплощения 1)-28) (или его фармацевтически приемлемую соль) в качестве активного агента и необязательно носители и/или разбавители и/или вспомогательные вещества.
Соединения формулы (I) в соответствии с любым из вариантов воплощения 1)-28) и их фармацевтически приемлемые соли могут использоваться в качестве лекарственных средств, например, в форме фармацевтических композиций для энтерального (такого как в особенности перорального) или парентерального (включая местное применение или ингаляцию) введения.
На производство фармацевтических композиций может влиять способ, который будет известен любому специалисту, квалифицированному в данной области техники (см., например, Remington, The Science and Practice of Pharmacy, 21st Edition (2005), Part 5, "Pharmaceutical Manufacturing" [опубликовано Lippincott Williams & Wilkins]) путем приведения описанных соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически ценными веществами, в галеновую лекарственную форму вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими материалами-носителями и, при желании, обычно применяемыми фармацевтическими вспомогательными веществами.
Настоящее изобретение также относится к способу профилактики или лечения болезни или расстройства, упомянутого в данном описании, который включает введение субъекту фармацевтически активного количества соединения формулы (I) в соответствии с любым из вариантов воплощения 1)-28), или его фармацевтически приемлемой соли.
Настоящее изобретение также включает изотопно меченные, в особенности 2Н (дейтерий) меченные соединения формулы (I), причем соединения являются идентичными соединениям формулы (I), за исключением того, что один или больше атомов заменены на атом, имеющий тот же атомный номер, но атомную массу отличающуюся от атомной массы, которая обычно встречается в природе. Изотопно меченные, в особенности 2Н (дейтерий) меченные соединения формулы (I) и их соли входят в объем настоящего изобретения. Замещение водорода более тяжелым изотопом 2Н (дейтерий) может привести к большей метаболической стабильности, что в результате приводит, например, к увеличенному in vivo периоду полувыведения или сниженным размерам доз, или может привести к сниженному ингибированию цитохром Р450 ферментов, что в результате приводит, например, к улучшенному профилю безопасности. В одном из вариантов воплощения изобретения, соединения формулы (I) не являются изотопно меченными, или они являются меченными только одним или большим количеством атомов дейтерия. В подварианте воплощения, соединения формулы (I) вообще не являются изотопно меченными. Изотопно меченные соединения формулы (I) могут быть получены по аналогии со способами, описанными ниже, но используя подходящий изотопный вариант подходящих реагентов или исходных материалов.
Любая ссылка на соединение формулы (I), (IST1) или (IST2) в данном тексте должна пониматься также как ссылка на соли (и в особенности фармацевтически приемлемые соли) таких соединений, где приемлемо и целесообразно. Преимущества, показанные для соединений формулы (I) конечно применяются при внесении необходимых изменений к соединениям формулы (IST1) и соединениям формулы (IST2), а также солям и фармацевтически приемлемым солям соединений формулы (I), формулы (IST1) или формулы (IST2). То же самое относится к этим соединениям в качестве лекарственных средств, к фармацевтическим композициям, содержащим эти соединения, в качестве активных компонентов или к применениям этих соединений для производства лекарственного средства для лечения болезней в соответствии с настоящим изобретением.
Если это не касается температуры, термин "приблизительно" (или альтернативно "около"), помещенный перед числовым значением "X", относится в текущей заявке к интервалу, составляющему от X минус 10% от X до X плюс 10% от X, и предпочтительно к интервалу, составляющему от X минус 5% от X до X плюс 5% от X. В частном случае температур, термин "приблизительно" (или альтернативно "около"), помещенный перед температурой "Y", относится в текущей заявке к интервалу, составляющему от температуры Y минус 10°C до Y плюс 10°C, и предпочтительно к интервалу, составляющему от Y минус 5°C до Y плюс 5°C. Кроме того, термин "комнатная температура" (кт), как используется в данном описании, относится к температуре приблизительно 25°C.
Когда же выражение "от … до" используют для описания числового ряда, следует понимать, что концевые точки указанного ряда однозначно включаются в этот интервал. Например: если температурный интервал, как описано, составляет от 40°C до 80°C, это означает, что концевые точки 40°C и 80°C включаются в интервал или если переменная определяется как целое число от 1 до 4, это означает, что переменные являются целым числом 1, 2, 3 или 4.
Как указано раньше, соединения формулы (I) модулируют PGD2 активацию CRTH2 рецептора. Биологический эффект таких соединений может быть протестирован во многих in vitro, ex vivo и in vivo исследованиях. Способность соединений формулы (I) связывать CRTH2 рецептор может быть измерена с помощью методов, подобных тем, которые описаны в литературе (Arimura A. et al., J. Pharmacol. Exp. Ther. 2001, 298(2), 411-419; и Sawyer N. et al, Br. J. Pharmacol, 2002, 137, 1163-1172, соответственно) и с помощью анализов, описанных ниже в экспериментальной части.
Другой аспект данного изобретения представляет собой способ получения соединений формулы (I). Соединения в соответствии с формулой (I) настоящего изобретения могут быть получены в соответствии с последовательностью реакций, показанной в схемах ниже, где R1, R2, R3 и R4 принимают значения, указанные для формулы (I). Другим используемым аббревиатурам дано определение в экспериментальной части. В некоторых случаях характерные группы R1, R2, R3 и R4 могут быть несовместимы с блоком реакций, проиллюстрированным в схемах ниже, и поэтому будут требовать применения защитных групп (PG). Например, может быть необходимо защитить реакционно способные функциональные группы, такие как гидрокси, амино, имино, тио или карбокси группы, где желательно в конечном продукте избежать их нежелательного участия в этих реакциях. Применение защитных групп хорошо известно в данной области техники. Поэтому предполагается, что такие защитные группы, если необходимо, находятся на своем месте.
В общем, все химические превращения могут быть осуществлены в соответствии с хорошо известными стандартными методологиями, как описано в литературе или как описано в процедурах ниже. Полученные соединения также могут быть превращены в их фармацевтически приемлемые соли по способу, известному perse.
Соединения формулы (I) могут быть получены из соответствующих производных (Е)-этил 3-(1-(2-(трет-бутокси)-2-оксоэтил)-1Н-индол-2-ил)акрилата (4). Соединения (4) получают путем реакции соответствующих производных (Е)-этил 3-(1Н-индол-2-ил)акрилата (3) с трет-бутил-бромацетатом в присутствии основания, такого как CS2CO3 в соответствующем растворителе, таком как ДМФА. Производные (Е)-этил3-(1Н-индол-2-ил)акрилата (3) могут быть получены или с помощью реакции Виттига из коммерчески доступных или хорошо известных производных 1Н-индол-2-карбальдегида (1) путем реакции с карбэтоксиметилен трифенилфосфораном в апротонном растворителе, таком как ДХМ, или с помощью реакции Хека из коммерчески доступных или хорошо известных производных индола (2) путем реакции с этил-акрилатом в присутствии катализатора, такого как Pd(OAc)2, и окислителя, такого как трет-бутил-пербензоат, в смеси АсОН и диоксана (Gaunt M.J. et al, Angewandte Chemie, 2005, 44, 3125-3129).
Гидрогенирование полученных производных (Е)-этил3-(1-(2-(трет-бутокси)-2-оксоэтил)-1Н-индол-2-ил)акрилата (4) над катализатором, таким как Pd-C 10% или PtO2, в апротонном растворителе, таком как ЕА, которое сопровождается реакцией с KOtBu в апротонном растворителе, таком как ТГФ, приводит к получению соответствующих производных трет-бутил 7-оксо-6,7,8,9-тетрагидропиридо[1,2-а]индол-6-карбоксилата (5). Декарбоксилирование путем реакции с силикагелем в апротонном растворителе, таком как толуол, и последующие восстановительные аминирования, во-первых, с бензиламином в присутствии восстанавливающего агента, такого как NaBH(ОАс)3, в апротонном растворителе, таком как ДХМ, и, во-вторых, с соответствующим альдегидом (в качестве предшественника радикала R3) в присутствии восстанавливающего агента, такого как NaBH4, в протонном растворителе, таком как MeOH, приводит к получению соответствующих производных N-бензил-6,7,8,9-тетрагидропиридо[1,2-а]индол-7-амина (6). Ацилирование Фриделя-Крафта с оксалил-хлоридом в апротонном растворителе, таком как ДХМ, которое сопровождается эстерификацией с помощью MeOH и последующим восстановлением с триэтилсиланом в присутствии ТФУК, приводит к получению соответствующих производных метил 2-(7-(бензиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (7). Дебензилирование путем гидрогенирования над катализатором, таким как Pd-C 10%, в протонном растворителе, таком как EtOH, или путем реакции с 1-хлорэтил-хлорформиатом и MeOH в апротонном растворителе, таком как ДХМ, приводит к получению соответствующих производных N-замещенного метил 2-(7-амино-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (8). Реакция с соответствующим гетероарил-галогенидом, таким как R4-Cl, в присутствии основания, такого как K2CO3, в апротонном растворителе, таком как ДМА, которая сопровождается омылением с помощью основания, такого как NaOH, привела к получению соединений формулы (I) (Способ А).

Соединения формулы (I), в которых R3 представляет собой водород, могут быть получены из соответствующих производных трет-бутил 7-оксо-6,7,8,9-тетрагидропиридо[1,2-а]индол-6-карбоксилата (5). Декарбоксилирование путем реакции с силикагелем в апротонном растворителе, таком как толуол, приводит к получению соответствующих производных 8,9-дигидропиридо[1,2-а]индол-7(6Н)-она (9). Восстановительное аминирование с ацетатом аммония в присутствии восстанавливающего агента, такого как NaBH3CN, в смеси АсОН и EtOH и последующая установка Вое защиты приводит к получению соответствующих производных трет-бутил (6,7,8,9-тетрагидропиридо[1,2-а]индол-7-ил)карбамата (10). Ацилирование Фриделя-Крафта путем реакции с оксалил-хлоридом в апротонном растворителе, таком как ДХМ, которое сопровождается эстерификацией с помощью MeOH и последующим восстановлением с триэтилсиланом в присутствии ТФУК, приводит к получению соответствующего метил 2-(7-амино-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (11). Реакция с соответствующим гетероарил-галогенидом, таким как R4-Cl, в присутствии основания, такого как K2CO3, в апротонном растворителе, таком как ДМА, и которая сопровождается омылением с помощью основания, такого как NaOH, привела к получению соединений формулы (I).
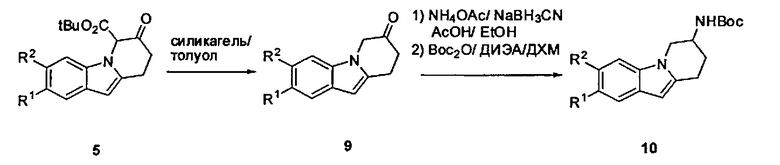
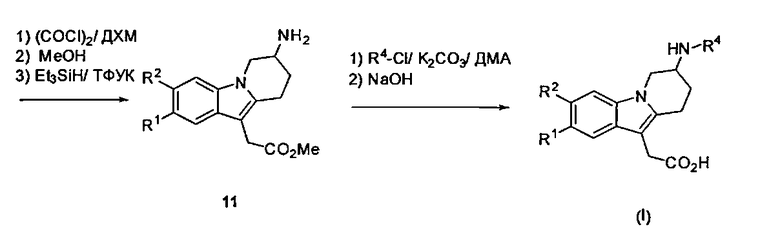
Схема 2: Общий путь синтеза для получения соединений формулы (I) (R3 представляет собой Н)
Производные 1Н-индол-2-карбальдегида (1) могут быть получены путем восстановления коммерчески доступных или хорошо известных производных этил 1Н-индол-2-карбоксилата (12) с восстанавливающим агентом, таким как АГЛ, в апротонном растворителе, таком как ТГФ, что приводит к получению соответствующей производной (1Н-индол-2-ил)метанола (13). Окисление окисляющим агентом, таким как активный диоксид марганца в апротонном растворителе, таком как ДХМ, приводит к получению желательных производных 1Н-индол-2-карбальдегида (1).

Схема 3: Общий путь синтеза для получения производных 1Н-индол-2-карбальдегида (1)
Соединения формулы (I) также могут быть получены из соответствующих производных 8,9-дигидропиридо[1,2-а]индол-7(6Н)-она (9). Восстановительное аминирование с ацетатом аммония в присутствии восстанавливающего агента, такого как NaBH3CN, в смеси АсОН и EtOH приводит к получению соответствующих производных 6,7,8,9-тетрагидропиридо[1,2-а]индол-7-амина (14). Реакция с соответствующим гетероарил-галогенидом, таким как R4-Cl, в присутствии основания, такого как K2CO3 в апротонном растворителе, таком как ДМА, и последующее алкилирование с соответствующим R3-X (с X=I, Br, OTf) в присутствии сильного основания, такого как NaH, в апротонном растворителе, таком как ДМА, приводит к получению желательной производной 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индола (15). Ацилирование Фриделя-Крафта путем реакции с оксалил-хлоридом в апротонном растворителе, таком как ДХМ, которая сопровождается эстерификацией с MeOH, восстановлением с триэтилсиланом в присутствии ТФУК и наконец омылением с основанием, таким как NaOH, обеспечивает получение соединений формулы (I) (Способ В).


Схема 4: Общий путь синтеза для получения соединений формулы (I) (Способ В)
Когда соединения формулы (I) или промежуточные соединения структур 6-8, 10 или 15 получают в форме смесей энантиомеров, энантиомеры могут быть разделены используя способы, известные специалисту, квалифицированному в данной области: например, путем образования и разделения диастереомерных солей или с помощью ВЭЖХ на хиральной неподвижной фазе, такой как колонка Regis Whelk-O1(R,R) (10 мкм), колонка Daicel ChiralCel OD-H (5-10 мкм), или колонка Daicel ChiralPak IA (10 мкм) или AD-H (5 мкм). Типичными условиями хиральной ВЭЖХ являются изокритическая смесь элюента A (EtOH, в присутствии или отсутствии амина, такого как ТЭА и/или диэтиламин) и элюента В (гексан), при скорости потока от 0,8 до 150 мл/мин.
Экспериментальная часть:
Аббревиатуры (как использовано в данном описании):
Химия
Общие положения
Все растворители и реагенты являются такими, как они были получены из коммерческих источников, пока не указано другое.
Температуры представлены в градусах Цельсия (°C). Пока не указано другое, реакции проводят при комнатной температуре (кт).
В смесях, соотношения частей растворителя или элюента или смесей реагентов в жидкой форме представлены как соотношения объемов (об./об.), пока не указано другое.
Условия аналитической ВЭЖХ являются такими, как использованы в Примерах ниже:
ВЭЖХ/МС анализы проводят на системе Agilent 1100, оснащенной бинарным насосом Dionex Р580, матричным фотодиодным детектором Dionex PDA-100 и масс-спектрометром Finnigan AQA (ЖХ-1 и ЖХ-2).
Время удерживания ЖХ получают, используя следующие условия элюирования:
- ЖХ-1: Аналитическая ВЭЖХ на колонке Waters Atlantis Т3 (4,6×30 мм, 5 мкм); линейный градиент вода / 0,04% ТФУК (А) и MeCN (В) от 5% до 95% В в течение 1,5 минуты; скорость потока 4,5 мл/мин., детектирование при 210 нм.
- ЖХ-2: Аналитическая ВЭЖХ на колонке Zorbax® SB-AQ (4,6×50 мм, 3,5 мкм, Agilent); линейный градиент вода/ 0,04% ТФУК (А) и MeCN (В) от 5% до 95% B в течение 1,5 минуты; скорость потока 4,5 мл/мин., детектирование при 210 нм.
Препаративные ВЭЖХ/МС очистки проводят на Gilson 333/334 бинарной градиентной насосной системе высокого давления с автосамплером Gilson 215 и коллектором фракций, детектором Dionex UVD340U DAD, детектором Polymerlabs PL-ELS 1000 ELS и детектором Finnigan AQA MS или детектором Thermo MSQ Plus MS, используя колонку Waters Atlantis T3 (10 мкм, 30×75 мм), с линейным градиентом MeCN (А) и вода/ 0,5% муравьиная кислота (В) в течение 5 мин.; скорость потока 75 мл/мин.
Аналитическую ВЭЖХ на хиральной неподвижной фазе проводят на колонке Daicel ChiralPak AD-H (4,6×250 мм, 5 мкм). Типичными условиями хиральной ВЭЖХ являются изократическая смесь: 50% гептан+0,05% ДЭА и 50% EtOH+0,05% ДЭА, при скорости потока 0,8 мл/мин., детектирование при 210 нм (хиральная ВЭЖХ-1) или изократическая смесь: 50% гептан и 50% EtOH+0,1% ТФУК, при скорости потока 0,8 мл/мин., детектирование при 210 нм (хиральная ВЭЖХ-2).
Препаративную ВЭЖХ на хиральной неподвижной фазе проводят на колонке Daicel ChiralPak AD-H (20×250 мм, 5 мкм). Типичными условиями хиральной ВЭЖХ является изократическая смесь: 50% EtOH и 50% гексан, при скорости потока 16 мл/мин., детектирование при 210 нм (хиральная ВЭЖХ-3).
А. Синтез производных 7-(гетероарил-амино)-6,7,8,9-тетрагидропиридо[1,2-а] индол-уксусной кислоты (Способ А)
А.1. Синтез производных этил 3-(1Н-индол-2-ил)акрилата
Общая процедура А (с помощью реакции Виттига):
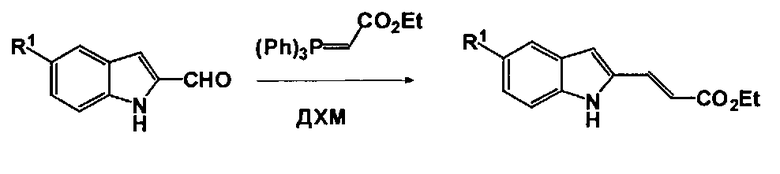
К раствору соответствующей производной 1Н-индол-2-карбальдегида (12 ммоль) в ДХМ (135 мл) добавляют карбэтоксиметилен-трифенилфосфоран (12 ммоль). Реакционную смесь перемешивают при кт в течение 16 ч., концентрируют в вакууме и остаток очищают путем ФХ (ЕА/н-гептан: от 0/10 до 3/7) с получением заглавного соединения в виде твердого вещества.
Следующие производные (Е)-этил3-(1Н-индол-2-ил)акрилата синтезируют в соответствии с описанной выше общей процедурой
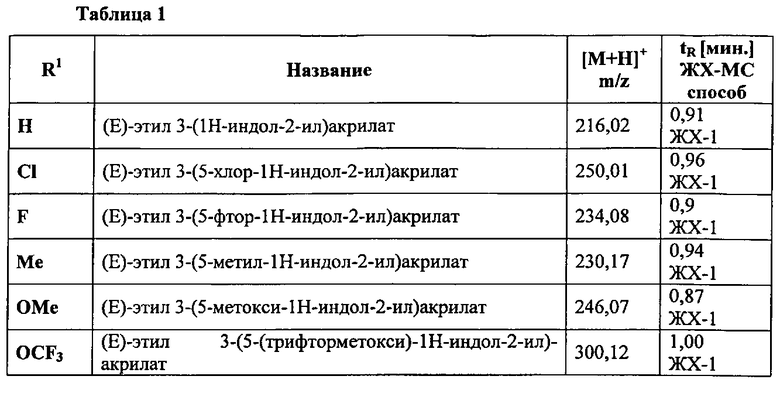
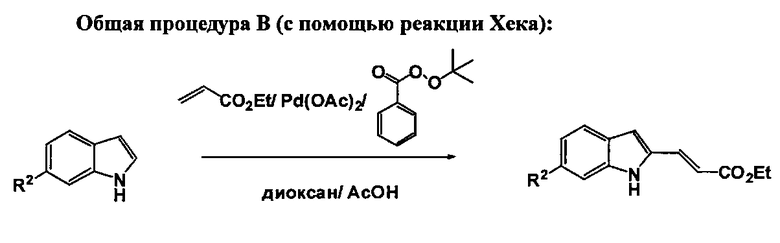
К смеси соответствующей производной индола (14 ммоль), этил-акрилата (28 ммоль), трет-бутил-пербензоата (12,6 ммоль) в смеси диоксана (27 мл) и АсОН (9 мл) добавляют Pd(OAc)2. Реакционную смесь перемешивают при 70°C в течение 18 часов. После охлаждения до кт, реакционную смесь нейтрализуют насыщ. NaHCO3 раствором, разбавляют с помощью ЭА и фильтруют через целит. Органический экстракт промывают снова насыщ. NaHCO3 раствором, солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (ЕА/н-гептан: от 0/10 до 3/7) с получением заглавного соединения в виде твердого вещества.
Следующие производные (Е)-этил 3-(1Н-индол-2-ил)акрилата синтезируют в соответствии с описанной выше общей процедурой.

А.2 Синтез производных (Е)-этил 3-(1-(2-(трет-бутокси)-2-оксоэтил)-1Н-индол-2-ил)акрилата

Общая процедура:
К раствору соответствующей производной (Е)-этил3-(1Н-индол-2-ил)акрилата (26 ммоль) в сухом ДМФА (85 мл) добавляют трет-бутил-бромацетат (43 ммоль) и CS2CO3 (56 ммоль). Реакционную смесь перемешивают при 60°C в течение 20 ч. После охлаждения до кт, реакционную смесь разбавляют ацетоном (85 мл) и фильтруют. Фильтрат концентрируют в вакууме и остаток очищают путем ФХ (ЕА/н-гептан: от 0/10 до 2/8), что приводит к получению заглавного соединения в виде масла.
Следующие производные (Е)-этил 3-(1-(2-(трет-бутокси)-2-оксоэтил)-1Н-индол-2-ил)акрилата синтезируют в соответствии с описанной выше общей процедурой.


А.3 Синтез производных трет-бутил 7-оксо-6,7,8,9-тетрагидропиридо[1,2-а]индол-6-карбоксилата
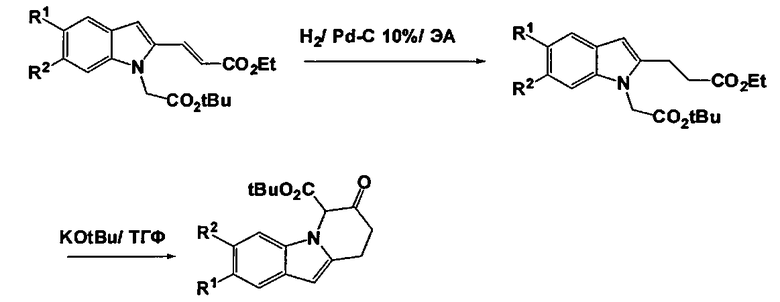
Общая процедура:
Суспензию соответствующей производной (Е)-этил 3-(1-(2-(трет-бутокси)-2-оксоэтил)-1Н-индол-2-ил)акрилата (8,5 ммоль), Pd-C 10% (300 мг) в ЭА (28 мл) перемешивают в атмосфере водорода в течение 2 ч. при кт. Реакционную смесь затем фильтруют через целит, что приводит к получению сырого дисложного эфира, который используют на следующей стадии без дополнительного очищения. К холодному (-10°C) раствору сырого дисложного эфира (8,5 ммоль) в сухом ТГФ (22,5 мл) добавляют капельным способом раствор трет-бутоксида калия (8,5 ммоль) в сухом ТГФ (112,5 мл). Реакционную смесь оставляют перешиваться при кт в течение 10 мин., гасят с помощью HCl 1N (12 мл) и экстрагируют с помощью н-гексана. Объединенные органические экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (ЕА/н-гептан: от 0/10 до 1/9), что приводит к получению заглавного соединения в виде масла.
Следующие производные трет-бутил 7-оксо-6,7,8,9-тетрагидропиридо[1,2-а]индол-6-карбоксилата синтезируют в соответствии с описанной выше общей процедурой, за исключением трет-бутил 3-хлор-7-оксо-6,7,8,9-тетрагидропиридо[1,2-а]индол-6-карбоксилата, где Pd-C 10% заменяют на PtO2 гидрат.

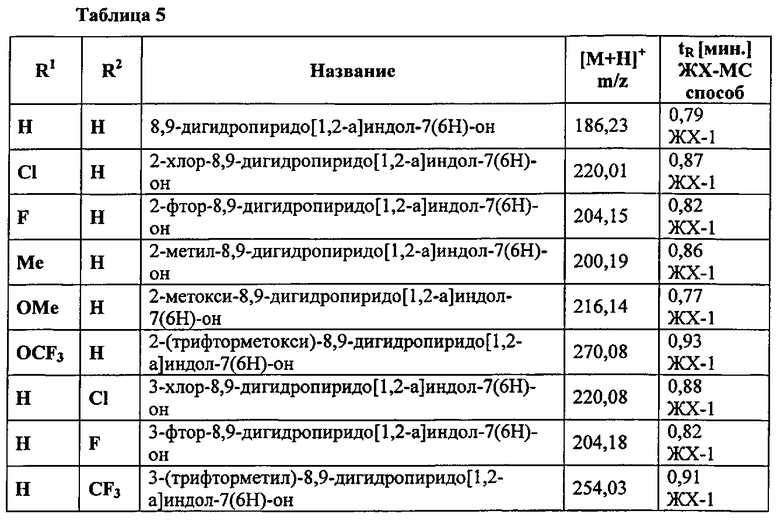
А.4 Синтез производных 8,9-дигидропиридо[1,2-а]индол-7(6Н)-она

Общая процедура:
Смесь соответствующей производной трет-бутил 7-оксо-6,7,8,9-тетрагидропиридо[1,2-а]индол-6-карбоксилата (5.3 ммоль) и силикагеля (7 г) в толуоле (70 мл) перемешивают при орошении в течение 6 ч. и оставляют перешиваться при кт в течение ночи. Реакционную смесь затем фильтруют, твердое вещество промывают с помощью ЭА и фильтрат концентрируют в вакууме, что приводит к получению заглавного соединения, которое используют на следующей стадии без дополнительного очищения.
Следующие производные 8,9-дигидропиридо[1,2-а]индол-7(6Н)-она синтезируют в соответствии с описанной выше общей процедурой.
А.5 Синтез производных М-бензил-6,7,8,9-тетрагидропиридо[1,2-а]индол-7-амина
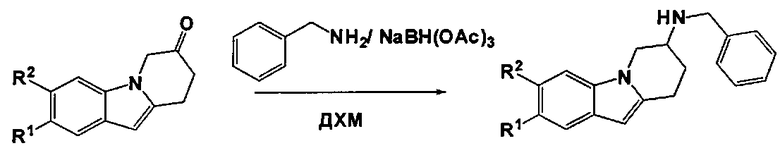
Общая процедура:
К раствору соответствующей производной 8,9-дигидропиридо[1,2-а]индол-7(6Н)-она (2,7 ммоль) в сухом ДХМ (20 мл) добавляют последовательно бензиламин (3 ммоль) и NaBH(OAc)3 (2,7 ммоль). Полученную реакционную смесь перемешивают при кт в течение 1 ч. и затем гасят с помощью насыщ. NaHCO3 раствора. Водную фазу экстрагируют с помощью ДХМ, объединенные органические экстракты промывают водой, солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (ЕА/н-гептан: от 0/10 до 3/7), что приводит к получению заглавного соединения в виде масла.
Следующие производные N-бензил-6,7,8,9-тетрагидропиридо[1,2-а]индол-7-амина синтезируют в соответствии с описанной выше общей процедурой.
А.6 Синтез производных N-бензил-N-алкил-6,7,8,9-тетрагидропиридо[1,2-а]индол-7-амина
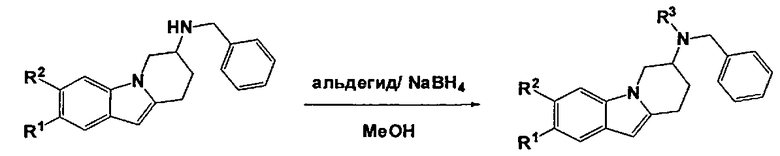
Общая процедура:
К холодному (0°C) раствору соответствующей производной N-бензил-6,7,8,9-тетрагидропиридо[1,2-а]индол-7-амина (2 ммоль) и формальдегида (36,5% в воде, 10 ммоль) в сухом MeOH (20 мл) добавляют порциями в течение 20 мин. NaBH4 (6 ммоль). Полученную реакционную смесь оставляют нагреваться до кт и перемешивают в течение ночи. Реакционную смесь затем выливают в воду и экстрагируют с помощью ЭА. Объединенные органические экстракты промывают солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме, что приводит к получению заглавного соединения в виде масла, которое используют на следующей стадии без дополнительного очищения.
Следующие производные N-бензил-N-алкил-6,7,8,9-тетрагидропиридо[1,2-а]индол-7-амина синтезируют в соответствии с описанной выше общей процедурой.

А.7 Синтез производных метил 2-(7-(бензил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)-2-оксоацетата

Общая процедура:
К холодному (0°C) раствору соответствующей производной N-бензил-N-алкил-6,7,8,9-тетрагидропиридо[1,2-а]индол-7-амина (2 ммоль) в сухом ДХМ (40 мл) добавляют оксалил-хлорид (4 ммоль). После перемешивания при 0°C в течение 1 ч., добавляют MeOH (3 мл) и реакционную смесь перемешивают при 0°C в течение 1 ч., гасят с помощью насыщ. NaHCO3 раствора. Водную фазу экстрагируют с помощью ДХМ, объединенные экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме, что приводит к получению заглавного соединения в виде масла, которое используют на следующей стадии без дополнительного очищения.
Следующие производные метил 2-(7-(бензил(алкил)амино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)-2-оксоацетата синтезируют в соответствии с описанной выше общей процедурой.

А.8 Синтез производных метил 2-(7-(бензил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата

Общая процедура:
К раствору соответствующего метил 2-(7-(бензил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)-2-оксоацетата (1 ммоль) в ТФУК (11 мл) добавляют триэтилсилан (2 ммоль). Реакционную смесь перемешивают при кт в течение 2 ч. и концентрируют в вакууме. Полученный остаток растворяют в ЭА, промывают насыщ. NaHCO3 раствором, водой, солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (ЕА/н-гептан: от 0/10 до 3/7) с получением заглавного соединения в виде твердого вещества.
Следующие производные метил 2-(7-(бензил(алкил)амино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)ацетата синтезируют в соответствии с описанной выше общей процедурой.

А.9 Синтез производных метил 2-(7-(алкиламино)-6,7,8,9-тетрагид ропиридо[1,2-а]индол-10-ил)ацетата
Общая процедура А (путем гидрогенирования над Pd-C 10%):

Смесь соответствующей производной метил 2-(7-(бензил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (1 ммоль) и Pd-C 10% (60 мг) в MeOH (30 мл) перемешивают в атмосфере водорода в течение 12 ч. Реакционную смесь фильтруют через целит, и фильтрат концентрируют в вакууме, что приводит к получению заглавного соединения в виде масла, которое используют на следующей стадии без дополнительного очищения.
Следующие производные метил 2-(7-(алкиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата синтезируют в соответствии с описанной выше общей процедурой.


Общая процедура В (с помощью реакции с 1-хлорэтил-хлорформиатом):

К раствору соответствующей производной метил 2-(7-(бензил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (1 ммоль) в сухом ДХМ (15 мл) в запечатываемой пробирке, добавляют 1-хлорэтил-хлорформиат (2 ммоль). Реакционную смесь перемешивают при 80°C в течение 12 ч. После охлаждения до кт, реакционную смесь концентрируют в вакууме. К остатку добавляют MeOH (15 мл), реакционную смесь перемешивают при орошении в течение 1 ч. и концентрируют в вакууме. Остаток растворяют в ЭА и промывают с помощью насыщ. NaHCO3 раствора. Водную фазу экстрагируют с помощью ЕА, объединенные экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (ДХМ/ MeOH: от 10/0 до 9/1), что приводит к получению заглавного соединения в виде масла.
Следующие производные метил 2-(7-(алкиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата синтезируют в соответствии с описанной выше общей процедурой.

А.10 Синтез производных 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-уксусной кислоты
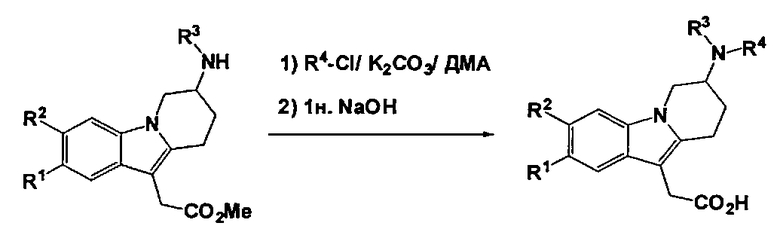
Общая процедура:
Смесь соответствующей производной метил 2-(7-(алкиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (1 ммоль), подходящего R4-Cl (1 ммоль) и K2CO3 (1,5 ммоль) в ДМА (20 мл) перемешивают при 130°C в течение 12 ч. После охлаждения до кт, 1 н. NaOH (20 мл) добавляют к реакционной смеси. Реакционную смесь перемешивают при кт в течение 2 ч. и затем 37% HCl добавляют до рН 1-2. Продукты непосредственно очищают с помощью преп. ВЭЖХ, что обеспечивает получение конечного соединения.
Получение примеров
Следующие производные 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-уксусной кислоты синтезируют в соответствии с описанной выше общей процедурой.

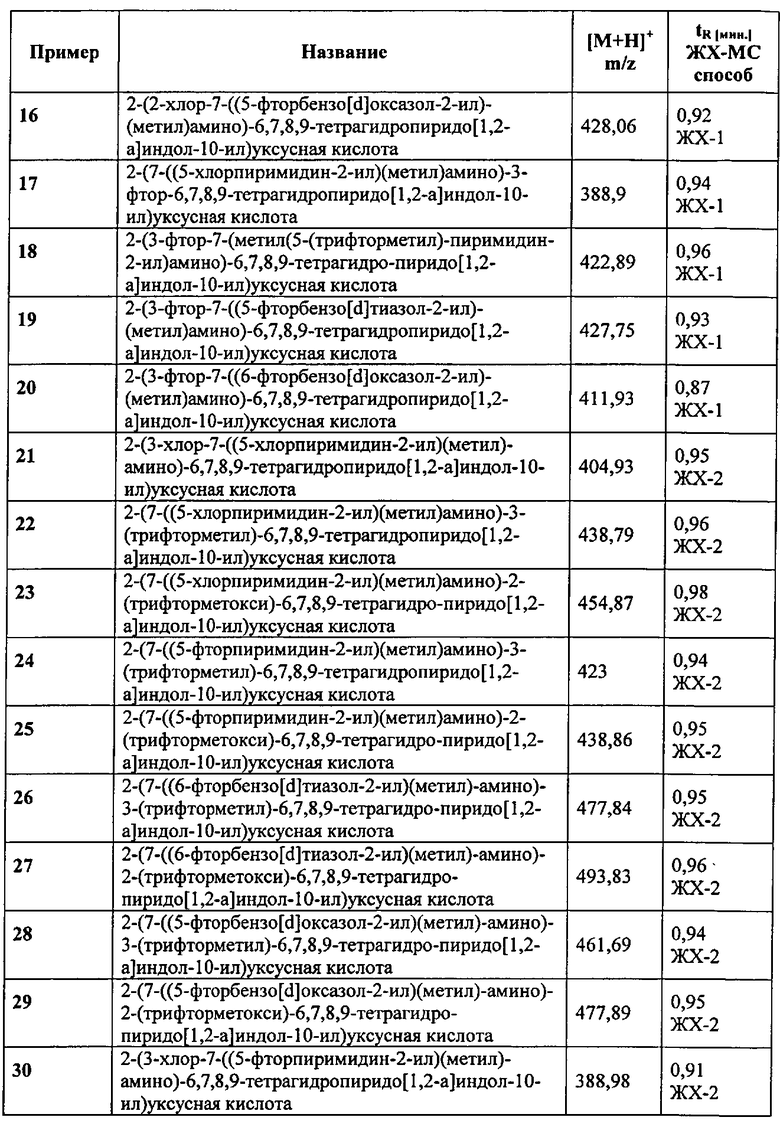

В.1 Синтез (S)-2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусной кислоты и (R)-2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусной кислоты
В.1.1 Синтез (S)-метил 2-(3-хлор-7-(метиламино)-6,7,8,9-тетрагидро-пиридо[1,2-а]индол-10-ил)ацетата и (R)-метил 2-(3-хлор-7-(метиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата

К раствору метил 2-(7-(бензил(метил)амино)-3-хлор-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (365 мг, 0,92 ммоль) в сухом ДХМ (13,4 мл) в запечатываемой пробирке, добавляют 1-хлорэтил-хлорформиат (0,2 мл, 1,84 ммоль). Реакционную смесь перемешивают при 80°C в течение 12 ч. После охлаждения до кт, реакционную смесь концентрируют в вакууме. К остатку добавляют MeOH (13,4 мл), реакционную смесь перемешивают при орошении в течение 1 ч. и концентрируют в вакууме. Остаток растворяют в ЭА и промывают насыщ. NaHCO3 раствором. Водную фазу экстрагируют с помощью ЭА, объединенные экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (ДХМ/ MeOH: от 10/0 до 9/1), что приводит к получению рацемата в виде масла.
ЖХ-МС (ЖХ-1):tR:0,59 мин./[М+Н]+:306,96.
Два энантиомера полученного продукта разделяют с помощью препаративной хиральной ВЭЖХ (хиральная ВЭЖХ-3):
(S)-метил2-(3-хлор-7-(метиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетат (60 мг, 21%): ВЭЖХ (хиральная ВЭЖХ-1): tR: 8,45 мин.;
(R)-метил2-(3-хлор-7-(метиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетат (60 мг, 21%): ВЭЖХ (хиральная ВЭЖХ-1): tR: 10,23 мин.
В.1.2 Синтез (S)-2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусной кислоты (пример 32)

Смесь (S)-метил 2-(3-хлор-7-(метиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (60 мг, 0.19 ммоль), 2-хлор-5-фторпиримидина (0,0175 мл, 0,19 ммоль) и K2CO3 (65,5 мг, 0,47 ммоль) в ДМА (2 мл) перемешивают при 130°C в течение 2 дней. После охлаждения до кт, к реакционной смеси добавляют 1 н. NaOH (2,5 мл). Реакционную смесь перемешивают при кт в течение 2 ч. и затем добавляют 37% HCl до pH 1-2. Продукт непосредственно очищают с помощью преп. ВЭЖХ, что обеспечивает получение заглавного соединения в виде масла.
ЖХ-МС (ЖХ-2): tR: 0,91 мин./[М+Н]+:389,18.
ВЭЖХ (хиральная ВЭЖХ-2):tR:8,6 мин.
В.1.3 Синтез (R)-2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусной кислоты (пример 33)

Смесь (R)-метил2-(3-хлор-7-(метиламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (60 мг, 0,19 ммоль), 2-хлор-5-фторпиримидина (0,0175 мл, 0,19 ммоль) и K2CO3 (65,5 мг, 0,47 ммоль) в ДМА (2 мл) перемешивают при 130°C в течение 2 дней. После охлаждения до кт, к реакционной смеси добавляют 1 н. NaOH (2,5 мл). Реакционную смесь перемешивают при кт в течение 2 ч. и затем добавляют 37% HCl до pH 1-2. Продукт непосредственно очищают с помощью преп. ВЭЖХ, что обеспечивает получение заглавного соединения в виде масла.
ЖХ-МС (ЖХ-2):tR:0,91 мин./[М+Н]+: 389,16.
ВЭЖХ (хиральная ВЭЖХ-2):tR:11,25 мин.
С.1 Синтез производных 2-(7-(гетероариламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусной кислоты (R3 представляет собой Н)
С.1.1 Синтез производных трет-бутил (6,7,8,9-тетрагидропиридо[1,2-а]индол-7-ил)карбамата

Общая процедура:
К раствору соответствующей производной 8,9-дигидропиридо[1,2-а]индол-7(6Н)-она (0,23 ммоль) в EtOH (5 мл) добавляют порциями последовательно ацетат аммония (4,6 ммоль, 20 эквив.) и NaBH3CN (0,11 ммоль, 0,5 эквив.). Затем добавляют АсОН (0,3 мл) и реакционную смесь перемешивают при кт в течение 1 ч. 30 мин. Реакционную смесь далее гасят водой, подщелачивают до pH 9 с помощью 1 н. NaOH и фильтруют. Фильтрат экстрагируют дважды с помощью ДХМ, объединенные экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме, что приводит к получению амина, который используют на следующей стадии без дополнительного очищения.
К раствору этого сырого амина (0,23 ммоль) в сухом ДХМ (2 мл), добавляют последовательно Boc2O (0,23 ммоль) и ДИПЭА (0,46 ммоль). Реакционную смесь перемешивают при кт в течение 3 ч., разбавляют с помощью ДХМ и промывают насыщ. NaHCO3 раствором. Водную фазу экстрагируют дважды с помощью ДХМ, объединенные экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (ЕА/н-гептан: от 0/10 до 2/8), что приводит к получению заглавного соединения в виде масла.
Следующие производные трет-бутил (6,7,8,9-тетрагидропиридо[1,2-а]индол-7-ил)карбамата синтезируют в соответствии с описанной выше общей процедурой.

С.1.2 Синтез производных метил 2-(7-амино-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата

Общая процедура:
К холодному (0°C) раствору соответствующей производной трет-бутил (6,7,8,9-тетрагидропиридо[1,2-а]индол-7-ил)карбамата (1,4 ммоль) в сухом ДХМ (28,5 мл) добавляют оксалил-хлорид (2,8 ммоль). После перемешивания при 0°C в течение 1 ч., добавляют MeOH (2,3 мл) и реакционную смесь перемешивают при 0°C в течение 1 ч., гасят с помощью насыщ. NaHCO3 раствора. Водную фазу экстрагируют с помощью ДХМ, объединенные экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме, что приводит к получению кето-сложного эфира в виде масла, которое используют на следующей стадии без дополнительного очищения.
К сырому кето-сложному эфиру (1,28 ммоль) в ТФУК (12.3 мл) добавляют триэтилсилан (2,56 ммоль). Реакционную смесь перемешивают при кт в течение 2 ч. и концентрируют в вакууме. Полученный остаток растворяют в ЭА, промывают насыщ. NaHCO3 раствором, водой, солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (ЕА/н-гептан: от 0/10 до 3/7) с получением заглавного соединения в виде твердого вещества.
Следующие производные метил 2-(7-амино-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата синтезируют в соответствии с описанной выше общей процедурой.

С.1.3 Синтез производных 2-(7-(гетероариламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусной кислоты

Общая процедура:
Смесь соответствующей производной метил 2-(7-амино-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)ацетата (1 ммоль), подходящего R4-Cl (1 ммоль) и K2CO3 (1,5 ммоль) в ДМА (20 мл) перемешивают при 130°C в течение 12 ч. После охлаждения до кт, к реакционной смеси добавляют 1 н. NaOH (20 мл). Реакционную смесь перемешивают при кт в течение 2 ч. и затем добавляют 37% HCl до pH 1-2. Продукты непосредственно очищают с помощью преп. ВЭЖХ, что обеспечивает получение конечного продукта.
Получение примеров
Следующие производные 2-(7-(гетероариламино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусной кислоты синтезируют в соответствии с описанной выше общей процедурой.

D.1 Синтез производных 7-(гетероарил-амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-уксусной кислоты (Способ В)
D.1.1 Синтез производных 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индола
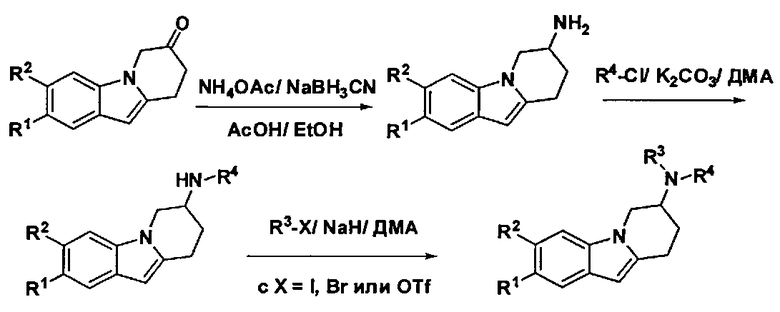
Общая процедура:
К раствору соответствующей производной 8,9-дигидропиридо[1,2-а]индол-7(6Н)-она (9,1 ммоль) в EtOH (208 мл) добавляют порциями последовательно ацетат аммония (182 ммоль, 20 эквив.) и NaBH3CN (4,55 ммоль, 0,5 эквив.). Затем добавляют АсОН (12 мл) и реакционную смесь перемешивают при кт в течение 1 ч. 30 мин. Реакционную смесь далее гасят водой, подщелачивают до pH 9 с помощью 1 н. NaOH и фильтруют. Фильтрат экстрагируют дважды с помощью ДХМ, объединенные экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме, что приводит к получению амина, который используют на следующей стадии без дополнительного очищения.
К раствору сырого амина (0,77 ммоль) в ДМА (2 мл) добавляют последовательно подходящий R4-Cl (0,77 ммоль, 1 эквив.) и K2CO3 (1,15 ммоль, 1,5 эквив.). Реакционную смесь перемешивают при 100°C в течение 3 ч. После охлаждения до кт, смесь разбавляют с помощью ЭА, промывают насыщ. NaHCO3 раствором, водой, солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают с помощью ФХ (от н-гептана до смеси н-гептан/ЭА: 8/2), что приводит к получению желаемых производных 7-(гетероарил-амино)-6,7,8,9-тетрагидропиридо[1,2-а] индола в виде твердого вещества.
К раствору соответствующей производной 7-(гетероарил-амино)-6,7,8,9-тетрагидропиридо[1,2-а]индола (0,045 ммоль) в ДМА (1 мл), добавляют NaH (50% в минеральном масле) (0,09 ммоль, 2 эквив.). Реакционную смесь перемешивают при кт в течение 5 мин., затем добавляют подходящий R3-X (с X=I, Br или OTf) (0,45 ммоль, 10 эквив.) и реакционную смесь перемешивают при 50°C в течение 16 ч. Добавляют еще NaH (4 эквив.) и R3-X (10 эквив.) и перемешивание при 50°C продолжают в течение 1 дня. Продукт непосредственно очищают с помощью преп. ВЭЖХ, что обеспечивает получение заглавного соединения в виде масла.
Следующие производные 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индола синтезируют в соответствии с описанной выше общей процедурой.


D.1.2 Синтез производных 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-уксусной кислоты

Общая процедура:
К холодному (0°C) раствору соответствующей производной 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индола (0,05 ммоль) в ДХМ (1 мл), добавляют оксалил-хлорид (0.1 ммоль, 2 эквив.). После перемешивания при 0°C в течение 1 ч., добавляют MeOH (0,08 мл) и реакционную смесь перемешивают при 0°C в течение 1 ч., гасят с помощью насыщ. NaHCO3 раствора. Водную фазу экстрагируют с помощью ДХМ, объединенные экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме, что приводит к получению кето-сложного эфира в виде масла, которое используют на следующей стадии без дополнительного очищения.
К сырому кето-сложному эфиру (0,01 ммоль) в ТФУК (0,1 мл) добавляют триэтилсилан (0,025 ммоль, 2,5 эквив.). Реакционную смесь перемешивают при кт в течение 16 ч. и концентрируют в вакууме. Полученный остаток растворяют в ЭА, промывают насыщ. NaHCO3 раствором, водой, солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме, что обеспечивает получение производной ацетата метил 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индола в виде масла, которое используют на следующей стадии без дополнительного очищения.
К раствору сырой производной ацетата метил 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индола (0,01 ммоль) в смеси MeCN (0,5 мл)/ДМФА (0,1 мл) добавляют 1 н. NaOH (1 мл). Реакционную смесь перемешивают при кт в течение 3 ч., подкисляют с помощью 37% HCl (0,02 мл) и очищают путем преп. ВЭЖХ, что обеспечивает получение конечного соединения в виде твердого вещества.
Следующие производные 7-(гетероарил(алкил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-уксусной кислоты синтезируют в соответствии с описанной выше общей процедурой.


Биологические исследования:
Получение мембран с hCRTH2 рецептором и исследование методом меченных атомов с использованием радиоактивного лиганда:
Сначала рекомбинантные HEK293-hCRTH2 клетки отделяют от культуральных планшетов в 5 мл буфера А/планшет (Буфер А: 5 мМ Tris, 1 мМ MgCl2-6H2O pH=7,4), используя резиновый скребок. Затем клетки переносят в пробирки для центрифугирования и центрифугируют в течение 5 минут при 400 g. Сгусток клеток снова суспендируют в том же буфере и пробирки замораживают при -80°C. Клетки размораживают оттаиванием и фрагменты мембран образуют путем гомогенизации, используя гомогенизатор Polytron (30 секунд). Фрагменты мембран затем центрифугируют при 3000 g в течение 20 минут и снова суспендируют в буфере С (Буфер С: 75 мМ Tris, 25 мМ MgCb, 250 мМ сахарозы pH 7,4). Аликвоты фрагментов мембран хранят при -20°C.
Исследования связывания проводят в конечном объеме 250 мкл. Сначала в каждую лунку вносят по 25 мкл исследуемого соединения, предварительно разведенного в связующем буфере (связующий буфер: 50 мМ Tris-основания, 100 мМ NaCl, 1 мМ EDTA, 0,1% БСА (без протеазы), 0,01% NaN3, 10 мМ MnCl2 pH 7,0). После добавления 75 мкл связующего буфера, к каждой лунке добавляют по 50 мкл радиолиганда 3H-PGD2 (при 2,5 нМ (220.000 dpm/лунку) от ANAWA ART0662). Исследование связывания начинают путем добавления 100 мкл CRTH2 фрагментов мембран, достигая конечной концентрации 20 мкг/лунку. Для неспецифического связывания, PGD2 добавляют к реакционной смеси до 10 мМ конечной концентрации. Эту смесь для исследования инкубируют в течение 90 минут при комнатной температуре и затем фильтруют через GF/C фильтрационный 96-луночный планшет, который предварительно пропитывают в течение 3 часов в 0,5% полиэтиленимине (ПЭИ). Лунки фильтра промывают три раза очень холодным связующим буфером. Затем в каждую лунку добавляют 40 мкл Microscint-40 (Packard) и оставшуюся радиоактивность количественно определяют на Topcount (Packard).
Антагонистическая активность представленных для примера соединений показана в Таблице 16.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 3-(ГЕТЕРОАРИЛАМИНО)-1,2,3,4-ТЕТРАГИДРО-9Н-КАРБАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРОВ ПРОСТАГЛАНДИНА D2 | 2011 |
|
RU2562255C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2667498C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-{2-[4-(6-ФТОРБЕНЗО[D]ИЗОКСАЗОЛ-3-ИЛ)ПИПЕРИДИН-1-ИЛ]ЭТИЛ}-2-МЕТИЛ-6,7,8,9-ТЕТРАГИДРО-4Н-ПИРИДО[1,2-А]ПИРИМИДИН-4-ОНА, ПРОМЕЖУТОЧНЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНОГО ПРОИЗВОДНОГО | 2003 |
|
RU2272037C9 |
| ЗАМЕЩЕННЫЕ ПИРРОЛЫ | 1994 |
|
RU2141960C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ПИРРОЛОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2014332C1 |
| ЗАМЕЩЕННЫЕ ИЗОХИНОЛИНОВЫЕ И ИЗОХИНОЛИНОНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ | 2007 |
|
RU2455302C2 |
| ПРОИЗВОДНЫЕ ИНДОЛЬНОГО РЯДА В КАЧЕСТВЕ ИНГИБИТОРОВ p38 КИНАЗЫ | 2000 |
|
RU2278115C2 |
| АЦИЛИРОВАННЫЕ 6, 7, 8, 9-ТЕТРАГИДРО-5H-БЕНЗОЦИКЛОГЕПТЕНИЛАМИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ | 2002 |
|
RU2301797C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2678305C1 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРРОЛИЗИНА И ПИРИДОИНДОЛИЗИНА | 2003 |
|
RU2342386C2 |
Изобретение относится к производным 7-(гетероарил-амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-уксусной кислоты формулы (I) или фармацевтически приемлемой соли такого соединения, где R1 и R2 представляют собой независимо друг от друга водород, (C1-C4)алкил, (C1-C4)алкоксигруппу, галоген, трифторметоксигруппу или трифторметил; R3 представляет собой водород, (C1-C4)алкил, (C1-C2)алкокси-(C2-C3)алкил, (C1-C4)фторалкил или (C3-C6)циклоалкил-(C1-C2)алкил; и R4 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, (C3-C6)циклоалкил, (C1-C4)алкоксигруппу, (C1-C4)фторалкил и фенил; где термин "гетероарил" означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее один атом азота и необязательно один дополнительный гетероатом, выбранный из кислорода, азота и серы. Также изобретение относится к фармацевтической композиции на основе соединения формулы (I) и применению соединения формулы (I). Технический результат: получены новые гетероциклические соединения, обладающие антагонистической активностью в отношении CRTH2 рецептора. 3 н. и 14 з.п. ф-лы, 19 табл., 51 пр.
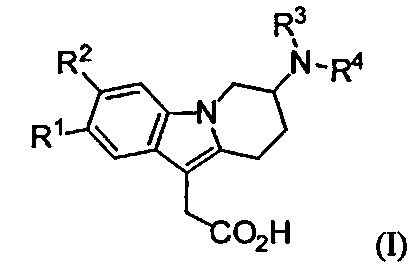
1. Соединение формулы (I):
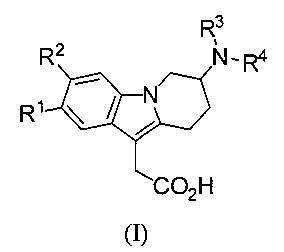
в которой
R1 и R2 представляют собой независимо друг от друга водород, (C1-C4)алкил, (C1-C4)алкоксигруппу, галоген, трифторметоксигруппу или трифторметил;
R3 представляет собой водород, (C1-C4)алкил, (C1-C2)алкокси-(C2-C3)алкил, (C1-C4)фторалкил или (C3-C6)циклоалкил-(C1-C2)алкил; и
R4 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной, где заместители независимо выбраны из группы, включающей галоген, (C1-C4)алкил, (C3-C6)циклоалкил, (C1-C4)алкоксигруппу, (C1-C4)фторалкил и фенил;
где термин "гетероарил" означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее один атом азота и необязательно один дополнительный гетероатом, выбранный из кислорода, азота и серы;
или фармацевтически приемлемая соль такого соединения.
2. Соединение по п.1, в котором
R1 представляет собой водород, (C1-C4)алкил, (C1-C4)алкоксигруппу, галоген или трифторметоксигруппу;
R2 представляет собой водород, галоген или трифторметил;
R3 представляет собой водород или (C1-C4)алкил; и
R4 представляет собой гетероарильную группу, которая является незамещенной или монозамещенной, где заместители независимо выбраны из группы, включающей галоген и (C1-C4)фторалкил;
где термин "гетероарил" означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее один атом азота и необязательно один дополнительный гетероатом, выбранный из кислорода, азота и серы;
или фармацевтически приемлемая соль такого соединения.
3. Соединение по п.1, в котором
R1 представляет собой водород;
R2 представляет собой водород, фтор, хлор или трифторметил;
R3 представляет собой метил; и
R4 представляет собой гетероарильную группу, которая является монозамещенной фтором или хлором, где гетероарильная группа выбрана из пиримидин-2-ила, бензоксазол-2-ила и бензотиазол-2-ила;
или фармацевтически приемлемая соль такого соединения.
4. Соединение по п.2, в котором R1 представляет собой водород; или фармацевтически приемлемая соль такого соединения.
5. Соединение по п.1, в котором R2 представляет собой водород, галоген или трифторметил; или фармацевтически приемлемая соль такого соединения.
6. Соединение по любому из пп.1, 2 или 4, в котором R2 представляет собой фтор или хлор; или фармацевтически приемлемая соль такого соединения.
7. Соединение по любому из пп.1, 2, 4 или 5, в котором R3 представляет собой водород или метил; или фармацевтически приемлемая соль такого соединения.
8. Соединение по п.6, в котором R3 представляет собой водород или метил; или фармацевтически приемлемая соль такого соединения.
9. Соединение по любому из пп.1, 2, 4 или 5, в котором R4 представляет собой гетероарильную группу, которая является монозамещенной галогеном или (C1-C4)фторалкилом;
где термин "гетероарил" означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее один атом азота и необязательно один дополнительный гетероатом, выбранный из кислорода, азота и серы;
или фармацевтически приемлемая соль такого соединения.
10. Соединение по п.8, в котором R4 представляет собой гетероарильную группу, которая является монозамещенной галогеном или (C1-C4)фторалкилом;
где термин "гетероарил" означает 5-10-членное моноциклическое или бициклическое ароматическое кольцо, содержащее один атом азота и необязательно один дополнительный гетероатом, выбранный из кислорода, азота и серы;
или фармацевтически приемлемая соль такого соединения.
11. Соединение по п.9, в котором гетероарильная группа выбрана из пиримидила, бензоксазолила и бензотиазолила; или фармацевтически приемлемая соль такого соединения.
12. Соединение по п.10, в котором гетероарильная группа выбрана из пиримидила, бензоксазолила и бензотиазолила; или фармацевтически приемлемая соль такого соединения.
13. Соединение по п. 1, которое выбирают из группы, состоящей из следующих соединений:
2-(7-((5-хлорпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-(метил(5-(трифторметил)пиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]тиазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(2-фтор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота,
2-(2-фтор-7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-2-метокси-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-2-метокси-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-2-метил-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-2-метил-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(2-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(2-хлор-7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-хлорпиримидин-2-ил)(метил)амино)-3-фтор-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-(метил(5-(трифторметил)пиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторбензо[d]тиазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((6-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-хлорпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-хлорпиримидин-2-ил)(метил)амино)-3-(трифторметил)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-хлорпиримидин-2-ил)(метил)амино)-2-(трифторметокси)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-3-(трифторметил)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторпиримидин-2-ил)(метил)амино)-2-(трифторметокси)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-3-(трифторметил)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((6-фторбензо[d]тиазол-2-ил)(метил)амино)-2-(трифторметокси)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-3-(трифторметил)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-2-(трифторметокси)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторбензо[d]оксазол-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
(S)-2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
(R)-2-(3-хлор-7-((5-фторпиримидин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-фтор-7-((5-фторбензо[d]оксазол-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-хлорпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(метил(5-метилпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(метил(хиназолин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((6-фторхиназолин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((7-фторхиназолин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(метил(2-метилхиназолин-4-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((6-фторхиноксалин-2-ил)(метил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((2,2-дифторэтил)(5-фторбензо[d]оксазол-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(этил(5-фторпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторбензо[d]оксазол-2-ил)(изопропил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторпиримидин-2-ил)(2-метоксиэтил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторбензо[d]оксазол-2-ил)(изобутил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-((5-фторпиримидин-2-ил)(пропил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота;
2-(3-хлор-7-(этил(5-фторбензо[d]оксазол-2-ил)амино)-6,7,8,9-тетрагидропиридо-[1,2-а]индол-10-ил)уксусная кислота; и
2-(3-хлор-7-((циклопропилметил)(5-фторпиримидин-2-ил)амино)-6,7,8,9-тетрагидропиридо[1,2-а]индол-10-ил)уксусная кислота;
или фармацевтически приемлемая соль такого соединения.
14. Фармацевтическая композиция, включающая соединение по любому из пп.1-13 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, где соединение обладает антагонистической активностью в отношении CRTH2 рецептора.
15. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль для применения в качестве лекарственного средства, где соединение обладает антагонистической активностью в отношении CRTH2 рецептора.
16. Применение соединения по любому из пп.1-13 или его фармацевтически приемлемой соли для приготовления лекарственного средства для профилактики и/или лечения болезни, выбранной из группы, состоящей из хронических и острых аллергических болезней/расстройств, включающих астму, аллергическую астму, эозинофильную астму, тяжелую астму, ринит, аллергический ринит, гигантскую крапивницу, аллергию на яд насекомых, медикаментозные аллергии, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, бронхиальную астму, пищевую аллергию, анафилактический шок, крапивницу, экзему, хроническую обструктивную болезнь легких (ХОБЛ), васкулиты малых сосудов, такие как синдром Чарга-Стросса, эозинофильный эзофагит и эозинофильную флегмону (синдром Велла).
17. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль для профилактики и/или лечения болезни, выбранной из группы, состоящей из хронических и острых аллергических болезней/расстройств, включающих астму, аллергическую астму, эозинофильную астму, тяжелую астму, ринит, аллергический ринит, гигантскую крапивницу, аллергию на яд насекомых, медикаментозные аллергии, аллергический синусит, аллергический нефрит, аллергический конъюнктивит, атопический дерматит, бронхиальную астму, пищевую аллергию, анафилактический шок, крапивницу, экзему, хроническую обструктивную болезнь легких (ХОБЛ), васкулиты малых сосудов, такие как синдром Чарга-Стросса, эозинофильный эзофагит и эозинофильную флегмону (синдром Велла).
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Рельсовый контакт | 1926 |
|
SU7246A1 |
| АППАРАТ ПРИ ПАРОВОМ КОТЛЕ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПОЛУЧЕНИЯ ПАРОГАЗА | 1912 |
|
SU3129A1 |
Авторы
Даты
2016-09-10—Публикация
2012-04-13—Подача