Изобретение относится к нанобиотехнологии и может быть использовано при изготовлении структурированных скаффолдов, состоящих из высокоориентированных нановолокон из биосовместимых полимеров, пригодных для изготовления нервных кондуитов используемых в нейрохирургии и для получения органоидов мозга in vitro в качестве полезных моделей для исследования развития и прогнозирования патологий.
Трехмерные культуры тканей мозга, выращенные in vitro и называемые органоидами, представляют интерес не только для нейробиологии в области исследования процессов развития мозга и нейродегенеративных заболеваний, но и для медицины как модель для скрининга потенциальных лекарственных препаратов и основа для дальнейшей разработки тканеинженерных конструкций в нейрохирургии. [1-4].
В настоящее время для получения органоидов головного мозга предлагается использовать стволовые (незрелые) клетки [5, 6]. Однако для получения определенного фенотипа эти клетки необходимо дифференцировать. Еще одним способом является инкапсуляция одиночных клеток, полученных при диссоциации нейросфер (индуцированных из нервных стволовых клеток розеточного типа) в препарате экстрацеллюлярного матрикса Matrigel [7]. Для получения однородных по размеру и форме органоидов используют полые волокна из альгината натрия с диаметром 600-1000 мкм, внутри которых развиваются трехмерные органоиды мозга из человеческих индуцированных стволовых клеток [8].
Аналогом заявляемого изобретения является существующая технология получения агрегатов мультипотентных клеток на волоконных подложках с использованием незрелых стволовых клеток [9]. В данном изобретении (в сравнении с предлагаемым способом) есть ряд недостатков:
1. Общие для использования плюрипотентных и мультипотентных стволовых клеток (ПСК и МСК) материально-технических ограничения такие как: длительное время получения, отсутствие стандартизованных протоколов, необходимость использования дорогостоящих культуральных сред, факторов роста, специализированного оборудования, сложные и трудоемкие производственные процессы [10]. Кроме того, из-за низкого потенциала пролиферации и дифференцировки из-за неполного репрограммирования использование мультипотентных клеток зачастую приводит к получению клеток дифференцированных по разным направлениям: например, нейрональные или нейрогенные, миогенные, теногенные, хондрогенные или остеогенные. Этот недостаток отмечен и сами авторами изобретения [9].
2. Предлагаемое использование непористой микрофиламентной структуры с диаметром филаментов от 1 до 60 мкм не соответствует размерам структур внеклеточного матрикса головного мозга, которые по последним, данные имеют размеры 80-220 нм [11].
В силу вышеперечисленных недостатков ПСК интерес вызывает использование зрелых (соматических) клеток, поскольку они имеют нормальную клеточную морфологию и характерную для исходной ткани функциональную активность. Первичная культура нейронов крыс - распространенный объект в области исследования нейронной дифференцировки, образования синапсов и нейронной коммуникации. В настоящее время разработано крайне мало способов для получения органоидов мозга (нейросфер) из культуры зрелых нейронов, в то время как этот подход, не требующий большого количества реактивов и длительного времени культивирования мог бы стать перспективным при создании клеточных 3D моделей мозга. Наиболее близкий аналог предлагаемого способа получения нейросфер предложен в работе [12, 13] основан на спонтанном образовании нейросфер при высокой плотности клеток через 6-7 дней культивирования без какой-либо смены среды или добавления ростовых добавок. Существенным недостатком данного подхода является генерация свободно плавающих нейросфер. В то же время данный протокол позволяет поддерживать культуру до 30 дней. В ряде работ [14, 15] для получения адгезивных нейросфер было предложено использование использование препарата экстрацеллюлярного матрикса Matrigel(c). Однако авторы не рекомендуют культивировать полученные нейросферы дольше 9-10 дней из-за гибели клеток внутри сфероида. Кроме того, Matrigel не содержит характерных для головного мозга биохимических стимулов и не имитирует нанотопологические свойства внеклеточного матрикса.
Хотя первичная культура нейронов имеет большее сходство с системой in vivo, однако отсутствие внутренней пространственной целостности и архитектоники ткани мозга имеет существенный недостаток. Внеклеточный матрикс (ВКМ) мозга представляет собой нановолоконную структуру, которая участвует во всех сигнальных событиях, происходящих между клетками мозга и, как показано, играет важную роль в патогенезе различных нейродегенеративных заболеваний [16].
Таким образом, для получения органо-подобных культур с архитектурой, близкой с ткани мозга, in vivo необходимо реализовать не только взаимодействие клеток с характерной морфологией и активностью, но и их взаимодействие с искусственными структурами, имитирующими компоненты ВКМ. Таким образом, для создания технологии получения искусственных органоидов требуется решить технические проблемы, связанные с получением подложек из ориентированных нановолокон, а также с разработкой эффективного способа получения нейросфер из клеток мозга.
Для получения волокнистых материалов, используемых в качестве подложек, ускоряющих и направляющих рост клеток, а также для доставки лекарств, иммобилизации ферментов, обработки ран широко применяется метод электроспиннинга (электропрядения) [17]. Однако, получение волоконных наноразмерных структур с элементами близкими по размеру компонентам ВКМ мозга (80-220 нм) связано с технологическими трудностями, обусловленными малым диаметром волокон.
Особый интерес представляют материалы из ориентированных волокон с диаметром менее одного микрона, позволяющими осуществлять ускоренный и направляемых рост нервных клеток [18-20]. Известны многочисленные конструкции установок, используемые для получения ориентированных волокон, основанные на электронапылении раствора полимера на вращающийся заземленный металлический ротор. [21]. При этом на поверхности ротора формируется наномат из ориентированных волокон полимера. Недостатком данного способа является возможное загрязнение волокон материалом подложки, их деформация и слипание на поверхности, а также трудность получения свободных волокон в растворе или воздухе, что затрудняет возможность модификации поверхности получаемых волокон химическими методами и ограничивает использование таких волокон в дизайне 3D клеточных скаффолдов. Существуют варианты получения ориентированных волокон без использования подложки - электронапыление на параллельные неподвижные электроды. Эта технология позволяет получать наноматы с высокой степенью ориентации, а также перпендикулярно ориентированные волокна [22]. Недостатком данного метода является малая площадь получаемого образца и возможность получения ориентированных волокон только в тонком слое [23]. Еще один способ получения ориентированных свободных нановолокон - электронапыление полимера на изолированный вращающийся ротор с высокой скоростью вращения (~5000 об/мин) [24]. Электронейтрализация образующихся волокон в данном случае происходит за счет осаждения на них противоионов, образующихся при одновременном электрораспылении нейтрального растворителя (этанол) из капилляра с противоположным зарядом, расположенного с другой стороны ротора. Недостатком данной технологии является сложность конструкции высокоскоростного ротора и низкая эффективность процесса получения высокоориентированных образцов из-за нестабильности одновременного поддержания электрораспыления с двух близко расположенных капилляров с противоположным зарядом.
Перспективным способом получения ориентированных волокон является осаждение нитей полимера, образующихся при электрораспылении, на вращающемся проволочном коллекторе, состоящем из параллельно закрепленных заземленных электродов, закрепленных в торцах барабана параллельно оси вращения [25]. Преимуществами данного способа является простота конструкции установки для изготовления волокон, возможность получения свободных высокоориентированных наноматов, удобных для снятия и дальнейшей модификации, и возможность получения больших партий образцов, однородных по плотности и диаметру образующих их нановолокон. Недостатком этой технологии является ограниченная толщина получаемого наномата: при электронапылении в течение 40 минут и более накопление на наномате электрического заряда приводит к снижению степени ориентации получаемых волокон. Предлагаемый заявителями способ является усовершенствованием данного способа получения высокоориентированных волокнистых наноматов.
Для решения технической проблемы накопления заряда на осаждаемых волокнах было предложено ввести в процесс получения наноматов на вращающемся заземленном проволочном коллекторе дополнительную стадию электронейтрализации. При длительном электрораспылении на образованных между проволоками коллектора волокнах, накапливается электрический заряд, одноименный полярности распыляемого раствора полимера. Этот заряд отталкивает следующие осаждаемые заряженные волокна, что приводит к снижению эффективности электропрядения и к нарушению ориентации получаемого наномата. Таким образом, время изготовления наномата из ориентированных волокон, и, как следствие, его плотность ограничены из-за накопления на нем заряда. Для нейтрализации остаточного электрического заряда процесс электрораспыления периодически приостанавливается, и наномат без снятия вместе с коллектором обрабатывается воздушными аэроионами, противоположного знака. Аэроионы генерируются с помощью коронного разряда с острия металлического электрода, соединенного с источником высокого напряжения с полярностью, противоположной приложенной к капилляру с полимером.
Технический результат данного изобретения заключается в одновременном получении партии из нескольких десятков подложек для последующего культивирования нейронов гиппокампа однородных по плотности и структуре, и состоящих из ориентированных нановолокон, не ограниченной временем накопления электрического заряда на волокне при электропрядении.
Заявляемый способ получения органоидов мозга (нейросфер) на наноструктурированных скаффолдах из высокоориентированных свободно позиционируемых нановолокон был детально описан в работе, опубликованной авторами заявляемого патента 4 августа 2021 года [26]:
Для получения ориентированных нановолокон был распылен раствор нейлона 4,6 с концентрацией 10% масс. на вращающийся проволочный заземленный коллектор с диаметром 108 мм и расстоянием между соседними проволоками 13 мм. Диаметр проволоки 1,4 мм, скорость вращения коллектора 80 об/мин. Металлический капилляр для распыления был изготовлен из иглы для шприца диаметром 0,4 мм и закреплен на расстоянии 10 см от коллектора. Капилляр присоединялся к источнику высокого напряжения положительной полярности. Раствор нейлона подавался с помощью шприцевого насоса со скоростью 0,5 мкл/мин. Ток при электрораспылении поддерживался в диапазоне 250-350 нА. Каждые 10 минут электрораспыление останавливалось, и образующийся наномат обрабатывали отрицательными аэроионами в течение 5 минут. За время нейтрализации электрическое поле, измеряемое с помощью портативного измерителя электрического поля вблизи волокон на коллекторе, уменьшалось с 27 В/м до 5 В/м. Скаффолды для выращивания клеток нервной ткани получали партиями по 30 образцов при снятии получаемых нановолокон с одного коллектора. Готовые нановолокна переносили на стерильные стеклянные подложки размером 11×13×1.5 мм и фиксировали по краям раствором полистирола в толуоле. Ориентация и диаметр волокон, а также плотность получаемого наномата определяли с помощью методов атомно-силовой и трансмиссионной электронной микроскопии. Полученный за 60 мин наномат имел плотность около 120 волокон на 100 мкм сечение (перпендикулярное оси ориентации волокон), средний диаметр волокон составлял ~110 нм. Изображение волокон и скаффолдов приведено в дополнительных материалах (фиг. 1 А-В - получение наноструктурированных скаффолдов. А - Ориентированные нановолокна из нейлона на проволочном коллекторе. Б - Скаффолды из ориентированных нейлоновых волокон на стеклянной подложке. AS - субмикронные волокна, AU - нановолокна. В - изображение волокон на поверхности скаффолда, полученное с помощью атомно-силового микроскопа.)
Для получения нейросфер на скаффолдах из ориентированных ультратонких нановолокон были использованы нейроны гиппокампа полученные из головного мозга новорожденных (1-3 дня) крыс Sprague-Dawley в соответствии с протоколом, описанным в [27]. Нейроны гиппокампа культивировали при 37°С и 5% содержании CO2 в среде Neurobasal-A, содержащей 2% раствор В27. Нейроны гиппокампа культивировались в различной концентрации - 5×104, 7,5×104 и 1,2×105 на скаффолд. В качестве контроля клетки высевали на стекло покрытое поли-D-лизином.
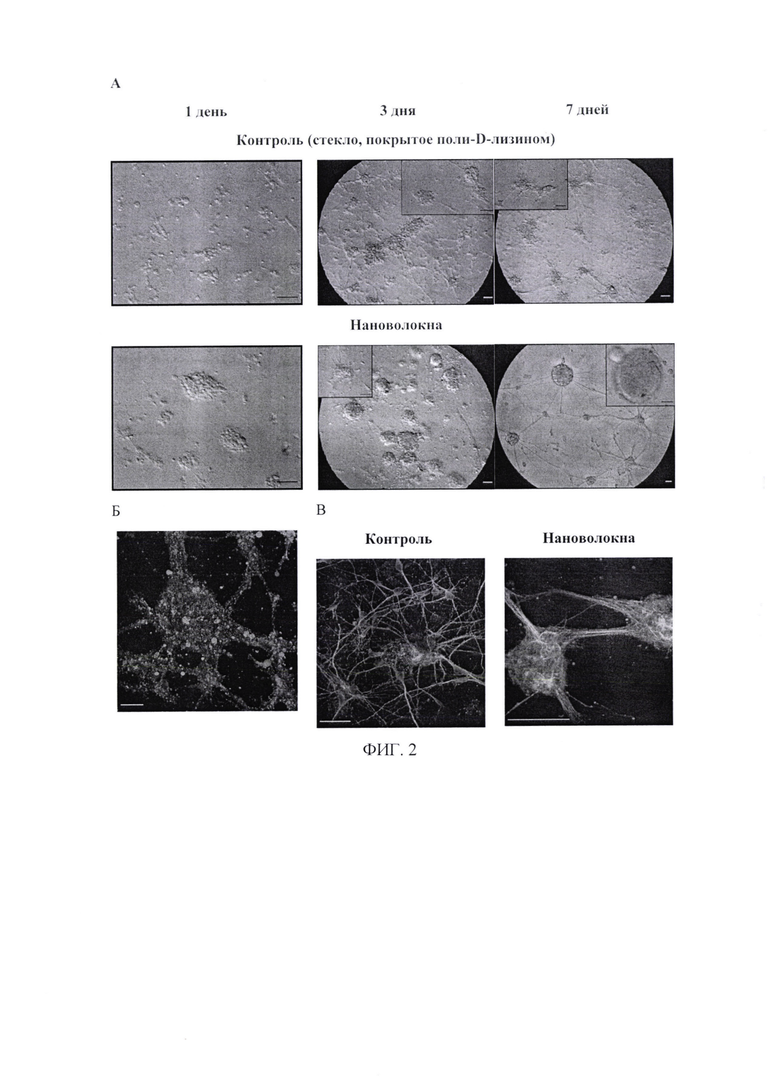
В первые сутки клетки на стекле, покрытом поли-D-лизином, почти не образовывали сфер даже при плотности 1,2×105 клеток на образец; в основном наблюдались их скопления и одиночные сферы небольшого размера. К третьему дню культивирования формировались небольшие агрегаты, похожие на розетки, окруженные популяцией отдельных клеток. В то же время на ультратонких нановолокнах формирование нейросфер начиналось с первого дня культивирования. Ко второму дню на внешней поверхности нейросфер отмечались проекции нейронов и образование мостов между отдельными нейросферами. Максимальное количество крупных нейросфер было получено к седьмому дню культивирования на ультратонких волокнах (фиг. 2А - Фазово-контрастные изображения нейросфер, сформированных на стекле, покрытом поли-D-лизином (контроль) и на нановолокнах на 1, 3 и 7 день культивирования. Шкала - 50 мкм). Морфологический анализ (количество и площадь) микрофотографий нейросфер проводили с использованием программного обеспечения ImageJ. Количество нейросфер составляло 35±15 на один скаффолд, а их площадь варьировала от 1416 до 6252 мкм2. Анализ соотношения живых/мертвых клеток показал, что нейроны в нейросферах, сформированных на нановолокнах, остаются жизнеспособными; количество мертвых клеток не превышало 5% (фиг. 2Б - Жизнеспособность нейронов с составе нейросферы культивированной на нановолокнах в течение 7 дней (кальцеин-положительные клетки (зеленый) - живые; окрашенные припидий йодидом - мертвые клетки (красный). Шкала - 50 мкм). Иммунофлуоресцентные изображения нейросфер, полученных на стекле и на нановолокнах на 7 день культивирования, показаны на фиг. 2В. Клетки окрашивали антителами против глиального фибриллярного кислого белка (GFAP, красный), нейронального β3-тубулина для визуализации аксонов (зеленый), ассоциированного с микротрубочками белка 2 (МАР2, голубой) для окрашивания дендритов и для окрашивания ядра использовали Hoechst (синий). Шкала - 100 мкм).
Использование заявленного подхода позволяет получать органоиды мозга, пригодные для применения в нейробиологии в области исследования процессов развития мозга и нейродегенеративных заболеваний, а также модель для доклинического исследования (скрининга) таргетных лекарственных препаратов.
Источники информации
1. Qian, X., Song. Н., and Ming, G.L. Brain organoids: advances, applications and challenges. Development. 2019, 146(8), dev166074. doi: 10.1242/dev.166074;
2. Ju Hong, Y., and Tae Do, J. Neural lineage differentiation from pluripotent stem cells to mimic human brain tissues. Front. Bioeng. Biotechnol. 2019, 7:400. doi: 10.3389/fbioe.2019.00400/;
3. Shou, Y., Liang, F., Xu, S., and Li, X. The application of brain organoids: from neuronal development to neurological diseases. Front. Cell. Dev. Biol. 2020, 8, 579659. doi:10.3389/fcell.2020.579659,
4. 

 Method for establishing autism-like model with hiPSCs (hiPSCs) source. Chinese. 2020. Patent CN 111254107
Method for establishing autism-like model with hiPSCs (hiPSCs) source. Chinese. 2020. Patent CN 111254107
5. Zimmermann W.H., Zafeiriou M. Methods of producing bioengineered neuronal organoids (benos) and uses thereof. US. 2020. Patent US 2020208105 A1
6. Anand R., Mckay S. A neural organoid composition and methods of use. US. 2019. Patent US 2019017018 A1
7. Fan J., Wang A., Zou T. Method for preparing 3d brain organ. EU. 2021. Patent EP 3766965 A1
8. 
 Method for realizing brain development of hiPSCs source by taking hollow fibers as carrier. Chinese. 2021. Patent CN 107937344 B
Method for realizing brain development of hiPSCs source by taking hollow fibers as carrier. Chinese. 2021. Patent CN 107937344 B
9. The designation of the inventor has not yet been filed. Method for tissue culture development on scaffold and differentiated tissue culture. EU. 2017. Patent EP 3190176 A1
10. Nikolakopoulou P., Rauti R., Voulgaris D., Shlomy I., Maoz B.M., Herland A. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 2020, V. 143(11), 3181-3213. doi.org/10.1093/brain/awaa268
11. Hrabetova, S., Cognet, L., Rusakov, D.A., and  U.V. Unveiling the extracellular space of the brain: from super-resolved microstructure to in vivo function. J. Neurosci. 2018, 38(44), 9355-9363. doi: 10.1523/jneurosci.1664-18.2018
U.V. Unveiling the extracellular space of the brain: from super-resolved microstructure to in vivo function. J. Neurosci. 2018, 38(44), 9355-9363. doi: 10.1523/jneurosci.1664-18.2018
12. Khan J, Das G, Gupta V, Mohapatra S, Ghosh S, Ghosh S. Neurosphere Development from Hippocampal and Cortical Embryonic Mixed Primary Neuron Culture: A Potential Platform for Screening Neurochemical Modulator. ACS Chem. Neurosci. 2018, 9(11), 2870-2878. doi: 10.1021 /acschemneuro.8b00414.
13. Das, G., Gupta, V., Khan, J., Mukherjee, D., Ghosh, S. Generation of Neurospheres from Mixed Primary Hippocampal and Cortical Neurons Isolated from E14-E16 Sprague Dawley Rat Embryo. J. Vis. Exp. 2019, (150), e59800, doi:10.3791/59800.
14. Rybachuk, O., Kopach, O., Pivneva, Т., & Kyryk, V. Isolation of Neural Stem Cells from the embryonic mouse hippocampus for in vitro growth or engraftment into a host tissue. Bio-protocol. 2019, 9(4), e3165. https://doi.org/10.21769/BioProtoc.3165
15. 

 Method for preparing brain organoid. 2021. Patent KR 102228400 B1
Method for preparing brain organoid. 2021. Patent KR 102228400 B1
16. Cembran, A., Bruggeman, K.F., Williams, R.J., Parish, C.L. & Nisbet, D.R. Biomimetic Materials and Their Utility in Modeling the 3-Dimensional Neural Environment. ISCIENCE. 2020, 23(1), 16-. doi:10.1016/j.isci.2019.100788
17. Haider, A., Haider, S., & Kang, I.-K. A comprehensive review summarizing the effect of electrospinning parameters and potential applications of nanofibers in biomedical and biotechnology. 2018, https://doi.org/10.1016/J.ARABJC.2015.11.015
18. Ghasemi-Mobarakeh, L.; Prabhakaran, M.P.; Morshed, M.; Nasr-Esfahani, M.H.; Ramakrishna, S. Electrospun poly(epsilon-caprolactone)/gelatin nanofibrous scaffolds for nerve tissue engineering. Biomaterials. 2008, 29, 4532-4539. https://doi.org/10.1016/j.biomaterials.2008.08.007.;
19.  X.; Yang, F.; Huang, Y.; Yu, Y. Role of integrin in influencing differentiation of PC12 cell grown on PLLA-aligned nanofiber: a mRNA-microRNA-protein integrative study. Regen. Biomater. 2017, 4, 89-96. https://doi.org/10.1093/rb/rbw040.;
X.; Yang, F.; Huang, Y.; Yu, Y. Role of integrin in influencing differentiation of PC12 cell grown on PLLA-aligned nanofiber: a mRNA-microRNA-protein integrative study. Regen. Biomater. 2017, 4, 89-96. https://doi.org/10.1093/rb/rbw040.;
20. Lim, S.H.; Liu, X.Y.; Song, H.; Yarema, K.J.; Mao, H.Q. The effect of nanofiber-guided cell alignment on the preferential differentiation of neural stem cells. Biomaterials 2010, 31, 9031-9039. https://doi.org/10.1016/j.biomaterials.2010.08.021.
21. Omer, S.;  L.;
L.;  R.; Sebe, I. Scale-up of Electrospinning: Market Overview of Products and Devices for Pharmaceutical and Biomedical Purposes. Pharmaceutics. 2021, 13, 286. https://doi.org/10.3390/pharmaceutics13020286
R.; Sebe, I. Scale-up of Electrospinning: Market Overview of Products and Devices for Pharmaceutical and Biomedical Purposes. Pharmaceutics. 2021, 13, 286. https://doi.org/10.3390/pharmaceutics13020286
22.  J., Kador K.E., Lynch A.P., Ahearne M. Characterization of extracellular matrix modified poly(ε-caprolactone) electrospun scaffolds with differing fiber orientations for corneal stroma regeneration. Materials Science and Engineering: C. 2020, 108, 110415. https://doi.org/10.1016/j.msec.2019.110415.
J., Kador K.E., Lynch A.P., Ahearne M. Characterization of extracellular matrix modified poly(ε-caprolactone) electrospun scaffolds with differing fiber orientations for corneal stroma regeneration. Materials Science and Engineering: C. 2020, 108, 110415. https://doi.org/10.1016/j.msec.2019.110415.
23. Прокопчук H.P., Шашок Ж.С., Прищепенко Д.В., Меламед В.Д. (2015) Электроформование нановолокон из раствора хитозана. Полимерные материалы и технологии, Т. 1(2), 36-56
24. Antonova, O.Y.; Kochetkova, O.Y.; Shlyapnikov, Y.M. ECM-Mimetic Nylon Nanofiber Scaffolds for Neurite Growth Guidance. Nanomaterials. 2021, 11, 516. https://doi.org/10.3390/nano11020516
25. Katta P., Alessandro M., Ramsier R.D., and Chase Continuous G.G. Electrospinning of Aligned Polymer Nanofibers onto a Wire Drum Collector. Nano Letters. 2004, 4(11), 2215-2218. doi: 10.1021/n10486158
26. Antonova O.Y., Kochetkova O.Y., Kanev I.L., Shlyapnikova E.A., and Shlyapnikov Y.M. Rapid Generation of Neurospheres from Hippocampal Neurons Using Extracellular-Matrix-Mimetic Scaffolds. ACS Chemical Neuroscience. 2021, 12(15), 2838-2850. doi: 10.1021/acschemneuro.1c00201
27. Salazar, I.L., Mele, M., Caldeira, M., Costa, R.O., Correia, В., Frisari, S., and Duarte, С.B. Preparation of primary cultures of embryonic rat hippocampal and cerebrocortical neurons. Bio-Protocol. 2017, 7, e2551.
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ МОЗГОВЫХ ОРГАНОИДОВ | 2022 |
|
RU2784072C1 |
| СПОСОБ СТИМУЛЯЦИИ ПРОДУКЦИИ НЕЙРОТРОФНЫХ РОСТОВЫХ ФАКТОРОВ КЛЕТКАМИ НЕЙРОГЛИИ IN VITRO | 2024 |
|
RU2839377C1 |
| Способ стимуляции продукции нейротрофных ростовых факторов клетками нейроглии in vitro | 2022 |
|
RU2793910C1 |
| Применение клеток штамма Lactobacillus fermentum U-21 для предотвращения патологических изменений в тканях, вызванных оксидативным стрессом | 2019 |
|
RU2757118C2 |
| Способ лечения повторяющихся неудач имплантации эмбриона при вспомогательных репродуктивных технологиях | 2024 |
|
RU2838873C1 |
| Таргетная неинвазивная трансплантация в мозг функционально активных митохондрий для лечения нейродегенеративных заболеваний | 2019 |
|
RU2744453C2 |
| Способ нивелирования невротических состояний посттравматического стрессового расстройства и комплексного посттравматического стрессового расстройства | 2024 |
|
RU2841469C1 |
| Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией из децеллюляризированных тканей зуба человека | 2019 |
|
RU2716594C1 |
| Нейроимплантат для восстановления спинного мозга | 2024 |
|
RU2829632C1 |
| СПОСОБ ВЫБОРА МИТОХОНДРИЙ ДЛЯ ЭКСПЕРИМЕНТАЛЬНОЙ ТЕРАПИИ МЕЛАНОМЫ В16-F10 | 2022 |
|
RU2794762C1 |

Изобретение относится к биотехнологии, а именно к способу получения органоидов мозга на скаффолдах из высокоориентированных нановолокон из биосовместимых полимеров. Способ предусматривает использование нановолокон для изготовления нервных кондуитов. Изобретение эффективно для использования в нейрохирургии и для получения органоидов мозга in vitro в качестве полезных моделей для исследования развития и прогнозирования патологий. 1 пр.
Способ получения органоидов мозга культивированием нейронов гиппокампа с использованием нейробазальных сред на наноструктурированных скаффолдах из высокоориентированных свободно позиционируемых нановолокон, получаемых путем осаждения нитей полимера на вращающийся проволочный коллектор, состоящий из параллельно закрепленных заземленных электродов, закрепленных в торцах барабана параллельно оси вращения, отличающийся тем, что введена дополнительная стадия нейтрализации электрического заряда путем остановки электрораспыления и обработки аэроионами противоположного заряда, причем аэроионы генерируются с помощью коронного разряда с острия металлического электрода, соединенного с источником высокого напряжения с полярностью, противоположной приложенной к капилляру с полимером, где в качестве полимера применяется нейлон.
| US20130288366 A1, 17.02.2021 | |||
| US20190169576 A1, 06.06.2019 | |||
| Antonova O | |||
| et al., Rapid generation of neurospheres from hippocampal neurons using extracellular-matrix-mimetic scaffolds, ACS Chem | |||
| Neurosci., 14.07.2021, 12, 15 | |||
| LI S | |||
| et al | |||
| Improved neuron culture using scaffolds made of three-dimensional PDMS micro-lattices,Biomedical Materials, |
Авторы
Даты
2023-06-08—Публикация
2021-12-22—Подача