Область техники, к которой относится изобретение
Настоящее изобретение относится к панелям дискретных объемов микроокружений клеточных культур, обладающих различными свойствами, т.е. различными механическими и/или биохимическими свойствами (т.е. клеточной адгезией, сигнализацией, способностью к разложению), влияющими на фенотип и судьбу клетки, т.е. пролиферацию/самообновление, образование колоний, дифференциацию и/или миграцию, к способам изготовления таких панелей, набору компонентов для изготовления таких панелей и к комбинаторному способу тестирования влияния композиций гидрогеля на характер клеточного роста, в особенности, трудно поддающихся культивированию типов клеток, таких как стволовые клетки.
Уровень техники
Двумерные системы клеточных культур, так же как и трехмерные системы клеточных культур природного происхождения, известны уже много лет в качестве моделей для выяснения сложного поведения клеток, в особенности, в области исследования рака или стволовых клеток.
Двумерные системы клеточных культур имеют один недостаток, они не обеспечивают модели экспрессии генов и клеточные фенотипы, которые близко напоминали бы обнаруживаемые in vivo. Кроме того, от них нельзя ожидать точного воспроизведения некоторых ключевых физиологических особенностей in vivo микроокружения клеточных культур, в особенности, пространственных ограничений, протеолитического ремоделирования, опосредуемой жесткостью механотрансдукции и соответствующего режима презентации лигандов.
3D-системы клеточных культур природного происхождения имеют недостаточно определенные композиции и демонстрируют вариации от партии к партии, что делает невозможным изменение их свойства систематическим путем и независимый контроль их основных параметры их матрикса.
Соответственно, целью настоящего изобретения заключается в устранении недостатков предшествующего уровня техники, в особенности, в обеспечении средств и способов, которые позволяют осуществлять быструю идентификацию микроокружений клеточных культур, контролирующих желаемые модели поведения клеток.
раскрытие изобретения
В первом аспекте изобретение относится к панели дискретных объемов микроокружений клеточной культуры (предпочтительно, к каждому), которые обладают различными свойствами, влияющими на поведение инкапсулированных клеток.
В настоящем документе, термин «инкапсулированные в микроокружение клеточной культуры» или аналогичные выражения означают, что клетка(клетки) внедрена/внедрены в матрикс таким образом, что они полностью окружены указанным матриксом, тем самым имитируя природные условия роста клеток.
В настоящем документе, термин «микроокружение» или «объем микроокружения», соответственно, означает такой объем, который подходит для высокопроизводительных тестирующих устройств, в особенности, для многолуночных планшетов. Типичные объемы, анализируемые в многолуночных планшетах, находятся в диапазоне, от приблизительно 100 нл до приблизительно 500 мкл, предпочтительно, от приблизительно 200 нл до приблизительно 20 мкл.
Термин «дискретные объемы» относится к пространственно отделенным бляшкам или областям внутри панели. Отделенные бляшки или области могут находиться в контакте друг с другом или могут быть отделены друг от друга, например, пластиковым барьером. В каждом или на каждом из этих дискретных объемов, клетки желательного клеточного типа могут быть помещены таким образом, чтобы они были отделены друг от друга. Они не вступают в контакт друг с другом в начале эксперимента и остаются таковыми в течение долгого времени, таким образом, они растут независимо от соседнего объема и только под влиянием их микроокружения клеточных культур.
В частности, может быть применена панель трехмерных гидрогелей, имеющих дискретные объемы и обладающих различными свойствами, влияющими на клеточную пролиферацию/самообновление, образование колоний, дифференциацию и/или миграцию. Применяемые гидрогели представляют собой гидрогели, полученные поперечной сшивкой молекул-предшественников гидрогеля, предпочтительно, гидрофильных полимеров, таких как полимеры на основе поли(этиленгликоля)(PEG), наиболее предпочтительно, полимеры на основе PEG с разветвлённой структурой, сшитые с помощью совместимых с клетками реакций образования поперечных связей.
В настоящем документе, термин «способный к образованию поперечных связей с помощью совместимых(совместимых) с клетками реакции(реакций)» (или аналогичная терминология), включает реакции как на основе (i) образования ковалентной связи, которые выбирают из группы, состоящей из a) энзиматические реакции, предпочтительно, зависящие от активированного фактора XIIIa трансглутаминазы; и b) неэнзиматические и/или некаталитические реакции, предпочтительно, реакция присоединения по Михаэлю; и/или ii) образования нековалентной связи (например, на основе гидрофобных взаимодействий, H-связей, Ван-дер-Ваальсовых или электростатических взаимодействий; в особенности, индуцируемых под действием температурных изменений или изменений в ионной силе буфера).
В предпочтительных воплощениях, выбирают такие молекулы-предшественники на основе PEG, которые могут быть сшиты с применением или активируемого тромбином фактора XIIIa в физиологических условиях по механизму образования поперечных сшивок, который подробно описан в работе Ehrbar et al., 2007, или посредством мягкой химической реакции по механизму образования поперечных сшивок, как описано в работе Lutolf et al., 2003.
Сшивку молекул-предшественников гидрогеля выполняют в присутствии таких типов клеток, которые будут изучать в дискретных объемах панели, таким образом, что клетки инкапсулируются гидрогелевым мариксом, т.е. располагаются в отдельном микроокружении клеточных культур.
Различные механические и биохимические факторы из микроокружения клеточных культур влияют на поведение клеток в терминах пролиферации/самообновления, дифференциации, миграции и/или образования колоний в 3D. В панели по изобретению, эти факторы могут отличаться от объема к объему и, таким образом, позволяют реализовать влияние индивидуальных факторов или комбинаций факторов на тот тип клеток, которые должны быть исследованы одновременно во множестве, предпочтительно, сотни или тысячи уникальных микроокружений клеточных культур. Таким образом, влияние индивидуальных факторов на судьбу клетки в микроокружениях клеточных культур может быть систематически вскрыто, и, в особенности, могут быть быстро определены гидрогелевые микроокружения клеточных культур, контролирующие поведение трудно поддающихся культивированию типов клеток, таких как стволовые клетки.
Механические свойства трехмерного гидрогелевого матрикса по изобретению могут быть изменены путем варьирования содержания полимера микроокружений клеточных культур, а также молекулярной массы и/или функциональности (числа участков, доступных для сшивания) полимерных предшественников геля. Таким образом, например жёсткость матрикса, выраженная в модулях Юнга (E), может меняться от 300 до 5400 Па.
Кроме того, физико-химические свойства матрикса с течением времени могут быть изменены путем наделения гелевого матрикса способностью к деградации, которую обеспечивают включением в матрикс пептидов, обладающих различной чувствительностью (т.е. kcat/Km) к секретируемым клетками протеазам, таким как матриксные металлопротеиназы (MMPs) или плазмин. Чувствительность к протеазам и получаемые изменения в физико-химических свойствах матрикса, если протеазы секретируются клетками, обеспечивают эффективную клеточную пролиферацию и миграцию в трехмерном матриксе. Чтобы соответствовать требованиям, предъявляемым к механическим свойствам гидрогелевых матриксов, которые имеют различную чувствительность к протеолитической деградации, содержание предшественника в матриксе может быть точно подобрано путем варьирования содержания полимера-предшественника матрикса, молекулярной массы и/или функциональности (числа участков, доступных для сшивания) полимерных предшественников геля. В гидрогелевом матриксе на основе PEG, чувствительность к протеазам может быть изменена, например, путем включения различных пептидных последовательностей с различной чувствительностью к секретируемым клетками протеазам в молекулы-предшественники матрикса, как описано более подробно ниже.
Биохимические свойства микроокружения клеточной культуры можно модулировать добавлением одной или нескольких биологически активных молекул к матриксу. В настоящем документе, эти биологически активные молекулы могут быть выбраны, например, из следующей группы
- факторы внеклеточного матрикса (ECM);
- факторы межклеточных взаимодействий; и/или
- факторы клеточной сигнализации.
Применяемые факторы внеклеточного матрикса i) могут представлять собой, например, белки ECM, такие как ламинины, коллагены, эластины, фибронектин или эластин, протеогликаны, такие как гепаринсульфаты или хондроитинсульфаты, полисахариды, не представляющие собой протеогликаны, такие как гиалуроновые кислоты, или матрицеллюлярные белки, такие как белки семейства CN, фибулины, остеопонтин, периостин, члены семейства SPARC, тенасцины или тромбоспондины. Эти факторы ECM могут быть применены либо в полноразмерном варианте или в виде функциональные строительных блоков меньшего размера, таких как пептиды и олигосахариды.
Применяемые белки межклеточных взаимодействий ii), главным образом, трансмембранные белки, могут представлять собой белки, вовлеченные в межклеточную адгезию, такие как кадгерины, селектины, или молекулы клеточной адгезии (CAM), принадлежащие к суперсемейству Ig (ICAM и VCAM), или компоненты трансмембранной системы клеточных сигналов, такие как Notch-лиганды Delta-like и Jagged.
Применяемые факторы клеточной сигнализации iii) могут представлять собой факторы роста или морфогены развития, такие как принадлежащие к следующим семействам: адреномедуллин (AM), ангиопоэтин (Ang), аутокринный фактор миграции, костные морфогенетические белки (BMPs), нейротрофический фактор из тканей мозга (BDNF), эпидермальный фактор роста (EGF), эритропоэтин (EPO), фактор роста фибробластов (FGF), нейротрофический фактор глиальной клеточной линии (GDNF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцит-макрофаг-колониестимулирующий фактор (GM-CSF), фактор-9 роста и дифференцировки (GDF9), фактор роста гепатоцитов (HGF), фактор роста из гепатомы (HDGF), инсулиноподобный фактор роста (IGF), фактор ингибирования лейкоза (LIF), стимулирующий миграцию фактор, миостатин (GDF-8), фактор роста нервов (NGF) и другие нейротрофины, тромбоцитарный фактор роста (PDGF), тромбопоэтин (TPO), трансформирующий фактор роста альфа (TGF-α), трансформирующий фактор роста бета (TGF-β), фактор некроза опухолей-альфа (TNF-α), фактор роста эндотелия сосудов (VEGF), сигнальный путь Wnt, плацентарный фактор роста (PlGF) или представители большого класса цитокинов или хемокинов.
Факторы внеклеточного матрикса i) и межклеточных взаимодействий ii) могут быть сайт-специфически присоединены к гидрогелевому матриксу или перед сшивкой, или в процессе сшивки. Функционализация геля с биологически активными молекулами может быть достигнута путем прямого образования ковалентной связи между свободными функциональными группами на биомолекуле (например, амино- или тиоловыми группами), или на пептидном субстрате для сшивающего фермента (например, трансглутаминазы) и на сетке геля, или посредством аффинного связывания между доменом на рекомбинантном/меченом белке и вспомогательном белке, прикрепленном к гелю. Меченые белки включают белки с Fc-метками, биотиновыми метками или His-метками, так чтобы существовала возможность присоединения к белку А (или к белку G, белку A /G), стрептавидину (или нейтравидину) или к NTA.
Биомолекулы могут потребовать различные стратегии присоединения к сетям гидрогеля. Более крупные полученные из ECM или имитирующие ECM белки и пептиды предпочтительно прикрепляют к гидрогелю с помощью неспецифического присоединения с применением линейных, гетеробифункциональных линкеров. Одна функциональная группа данного линкера вступает в реакцию с функциональными группами, прикрепленными к концам полимерных цепей, предпочтительно, с тиольными группами. Другая функциональная группа линкера способна к неспецифическому связыванию с представляющей интерес биомолекулой через ее аминогруппы. Последнюю функциональную группу выбирают из группы, состоящей из сукцинимидилового активного сложного эфира, такого как N-гидроксисукцинимид (NHS), сукцинимидил-альфа-метилбутаноат, сукцинимидил-пропионат; альдегида; тиоловой группы; тиол-селективной группы, такой как акрилат, малеимид или винилсульфон; пиридилтиоэфира и пиридилдисульфида. Предпочтительно, к биомолекулам прикрепляют NHS-PEG-малеимидные линкеры.
Факторы клеточной сигнализации iii) также могут быть добавлены к сшитому гидрогелевому матриксу, инкапсулирующему клетки, в растворимой форме в пространственно разделенные области и, таким образом, они будут иметь возможность свободно диффундировать в матрикс и достигать клетки. Альтернативно, они могут быть прикреплены к матриксу таким же способом, как описан выше, для факторов внеклеточного матрикса i) и межклеточных взаимодействий ii).
Другой аспект настоящего изобретения относится к способу изготовления панели, описанной в настоящем документе. В частности, этот способ включает следующие стадии
- обеспечение одной или нескольких молекул-предшественников гидрогеля;
- комбинирование и распределение различных комбинаций молекул-предшественников гидрогеля в соответствии со стадией a) на или в дискретные объемы подложки, предпочтительно, многолуночного планшета;
- добавление к указанным дискретным объемам одной или нескольких биологически активных молекул и присоединение указанных молекул или, по меньшей мере, к одной присутствующей молекуле-предшественнику гидрогеля, или к гидрогелю, образованному на стадии e), или обеспечение для них свободной диффузии;
- добавление клеток на/в указанные дискретные объемы подложки; и
- сшивание указанных молекул-предшественников гидрогеля с образованием гидрогелевого матрикса.
На стадии a) вышеописанного способа применяемые молекулы-предшественники гидрогеля, предпочтительно, представляют собой химически или энзиматически реакционноспособные полимерные предшественники на основе PEG, к которым могут быть прикреплены биомолекулы и которые могут быть сшиты с помощью механизмов, не ставящих под угрозу жизнеспособность клеток. Если предшественники на основе PEG включают (глутамин- и лизин-несущие) пептидные субстраты для трансглутаминазы, такие, например, как фактор XIIIa, то сшивание может быть осуществлено с помощью данного фермента. Наиболее предпочтительно, чтобы молекулы-предшественники также включали различные чувствительные к протеолизу пептидные последовательности для того чтобы сделать возможной опосредуемую клетками деградацию гидрогеля, т.е. локализованные изменения в структурных и механических свойствах матрикса с течением времени.
Стадию b) вышеописанного способа предпочтительно осуществляют с помощью автоматизированного способа изготовления гелей и миниатюризированных образцов для достижения требуемого уровня разнообразия в формировании содержащих клетки 3D-матриксов, имеющих большое количество различных микроокружений клеточных культур, а также для достижения требуемых повторов. С этой целью, предпочтительно применяют коммерчески доступного робота для дозирования жидкостей для точного синтеза столь малых объемов как от 100 до 500 нанолитров каждой из уникальных смесей молекул-предшественников в соответствии со стадией a), предпочтительно в трех повторностях, полностью автоматизированным способом, на подложке, такой как предметное стекло или, предпочтительно, в многолуночном планшете, таком как, стандартный 1536-луночный планшет. Последний формат предпочтителен, поскольку он предоставляет идеальное отношение поверхности к объему для выбранных капель гидрогеля и представляет собой стандартный формат, который может быть адаптирован к различным экспериментальным устройствам. Сразу после формирования 3D гидрогелевого матрикса, система может функционировать как мультимодальная платформа для анализа, в которой множество показаний могут быть получены параллельно.
На стадии c) вышеописанного способа, биологически активные молекулы выбирают, как описано выше в настоящем документе.
На стадии e) сшивка молекул-предшественников гидрогеля для формирования трехмерной гидрогелевого матрикса может быть достигнута путем применения, по меньшей мере, одного перекрестно-сшивающего агента. Если применяют молекулы-предшественники на основе PEG, то выбранный перекрестно-сшивающий агент представляет собой активируемый тромбином фактор XIIIa или химически реакционноспособный несущий бифункциональный олигопептид ММР-чувствительный субстрат (как описано в работе Lutolf et al., 2003). Однако, также возможно, что сшивание может происходить немедленно после комбинации двух различных молекул-предшественников, которые легко вступают в реакцию друг с другом (так как, например, с помощью высокоселективной так называемой клик-химии или с помощью другой химической, неэнзиматической реакции, такой как, например, реакция присоединения по Михаэлю).
Панель распределенных предшественников гидрогеля можно хранить и применять (т.е. приводить в контакт с клетками для экспериментов по скринингу) в более поздний момент времени. Хранение предпочтительно осуществляют в многолуночном планшете (например, в 96-, 384- или 1536-луночном планшете) и его можно осуществлять, или сохраняя предшественников в растворе (еще без перекрестно-сшивающего агента), или иначе в виде лиофилизированных предшественников, т.е. в виде порошка. Порошок не вступает в реакцию и остается непрореагировавшим, это означает, что практически ни один из структурных компонентов (например, PEG) предшественника не прореагировал с перекрестно-сшивающим агентом. После добавления, например, буфера, лиофилизированные предшественники солюбилизируют, и после чего они могут реагировать друг с другом.
Еще один аспект настоящего изобретения относится к комбинаторному способу тестирования влияния композиций гидрогеля на характер клеточного роста. В частности, этот комбинаторный способ включает следующие стадии
- обеспечение одной или нескольких молекул-предшественников гидрогеля;
- комбинирование и распределение различных комбинаций молекул-предшественников гидрогеля в соответствии со стадией a) на/в дискретных объемах подложки, предпочтительно, многолуночного планшета;
- последующее добавление к указанным дискретным объемам указанной подложки одной или нескольких биологически активных молекул и либо присоединение указанных молекул, по меньшей мере, к одной из присутствующих молекул-предшественников гидрогеля, или к гидрогелю, образованному на стадии e) или обеспечение для них свободной диффузии;
- добавление клеток (желательного клеточного типа) на/в указанные дискретные объемы подложки;
- сшивание указанных молекул-предшественников гидрогеля с образованием гидрогелевого матрикса;
- обеспечение роста указанных клеток (и изменения их поведения) в указанных дискретных объемах указанного гидрогелевого матрикса;
- мониторинг указанных клеток на протяжении стадии f) с течением времени;
- определение поведения для различных микроокружений клеточных культур, в котором поведение предпочтительно выбирают из группы, состоящей из степени пролиферации, образования колоний, дифференциации, миграции или их комбинаций, предпочтительно, для полной панели различных микроокружений клеточных культур;
- при необходимости, определение синергетических и/или антагонистических эффектов друг на друга биологически активных молекул и/или механических свойств и/или чувствительности к энзиматической деградации дискретных микроокружений клеточных культур, предпочтительно, под действием протеиназ;
- при необходимости, идентификация специфической композиции гидрогеля, или диапазона композиций гидрогеля, которая определяет поведение конкретных клеток;
- при необходимости, выделение клеток, по меньшей мере, из одного гидрогелевого микроокружения клеточных культур для дальнейшего анализа, предпочтительно, фенотипического анализа, или для непрерывного культивирования клеток или пассирования.
Различные молекулы-предшественники гидрогеля, применяемые на стадии a), предпочтительно выбирают, как описано в другом месте настоящего описания.
Стадию b) вышеописанного комбинаторного способа предпочтительно осуществляют с помощью автоматизированного способа, как описано в другом месте настоящего описания.
На стадии c) вышеописанного комбинаторного способа, указанные биологически активные молекулы могут быть выбраны, как описано в другом месте настоящего описания.
На стадии e), сшивка молекул-предшественников гидрогеля, обеспеченная на стадии a), может быть достигнута, как описано в другом месте настоящего описания.
На стадии f) комбинаторного способа клеткам дают возможность пролиферировать/самообновляться, формировать колонии, дифференцировать или мигрировать в дискретные объемы гидрогелевого матрикса, предпочтительно в течение от нескольких дней вплоть до нескольких недель.
Контролирование поведения клеток на стадии g) комбинаторного способа может происходить в фиксированные моменты времени, например, после определенного количества дней, и многократно. Контролирование осуществляют, например, путем автоматизированных способов визуализации, с помощью или обычной или конфокальной микроскопии, и может включать покадровую обработку изображений.
Определение пролиферации/самообновления, образования колоний, дифференциации и/или миграционного поведения для различных микроокружений клеточных культур на стадии h) комбинаторного способа может быть выполнено, например, с помощью микроскопии с широким полем, или с помощью клеток, экспрессирующих флуоресцентные маркеры, такие как зеленый флуоресцентный белок (GFP), или клеток, иммуннокрашенных с помощью флуоресцентных антител, и путем количественной оценки интенсивности флуоресценции при их росте и изменении их поведения, например, при самообновлении или дифференциации, или с помощью количественного анализа развития единичной клетки в многоклеточных колониях в 3D с помощью микроскопии. Таким образом, может быть получено, например, считывание показаний числа и кинетики клеток, растущих в каждом дискретном микроокружение клеточных культур, уровень экспрессии репортерного гена, или трехмерная морфология растущих клеток и клеточных колоний. Другие морфометрические измерения, такие как, например, эксцентриситет клеток или колоний, монолитность, степень полярности, могут быть оценены и количественно определены. Вариабельность данных измерений также может быть количественно определена для оценки меры гетерогенности.
Количественное определение поведения клеток для полной панели многообразных микроокружений клеточных культур на стадии i) комбинаторного способа может дать одну или несколько композиций гидрогеля, которые в дальнейшем могут быть применены и масшабированы до 3D клеточных культур в желаемых приложениях.
На стадии j), при необходимости, специфические микроокружения клеточных культур могут быть переварены для сбора клеток. Сбор клеток полезен для получения непрерывной клеточной культуры/пассирования, а также для последующих фенотипических анализов, таких как проточная цитометрия, анализ экспрессии генов, для анализов in vivo и т.п.
Еще в одном аспекте изобретение относится к набору компонентов для изготовления и, необязательно, с помощью 3D гидрогелевых микропанелей, которые описаны выше и которые подходят для применения в комбинаторном способе, описанном выше. Такой набор включает в виде отдельных компонентов
- одну или несколько молекул-предшественников гидрогеля, предпочтительно, одну или несколько молекул PEG с разветвлённой структурой (как описано в другом месте настоящего описания);
- одну или несколько биологически активных молекул (как описано в другом месте настоящего описания);
- при необходимости, по меньшей мере, один перекрестно-сшивающий агент для молекул-предшественников a) (как описано в другом месте настоящего описания); и
- инструкции по применению указанных компонентов, предпочтительно, в соответствии со способами, описанными выше в настоящем документе.
Инструкции по применению d) компонентов от a) до c) в составе набора компонентов упаковывают вместе с указанными компонентами и обеспечивают инструкции в соответствии со способом изготовления трехмерного матрикса, а также с комбинаторным способом исследования влияния гидрогелевого микроокружения клеточных культур на пролиферацию и/или дифференциацию клеток, как описано выше.
Автором настоящего изобретения пришлось столкнуться с различными проблемами при разработке изобретения, особенно в плане предсказания наиболее перспективных возможностей для их преодоления надлежащим образом:
1. Требования, предъявляемые к характеристике и получению жидких предшественников гидрогеля
1.1 Для обеспечения высокопроизводительных процедур, предшественники гидрогеля должны быть совместимы с автоматической робототехникой для дозирования жидкостей. Для воспроизводимого распределения они не должны быть ни слишком вязкими, ни слишком липкими. Было установлено, что жидкости, варьирующие по вязкости от вязкости воды до вязкости 10%-ного (по масс.) водного раствора PEG с молекулярной массой между 10 и 40 кДа, могут быть применены для надежного распределения. Большинство предшественников гидрогелевых сетей природного происхождения, основанные на белках или сахарах (например, Matrigel™, коллаген, фибрин, ламинин, гиалуроновая кислота и т.п., т.е. существующий уровень техники и наиболее часто применяемые гели для 3D-клеточных культур), не могут быть надежно распределены, поскольку они не отвечают данному требованию. Данные наиболее часто применяемые композиции геля не могут быть применены для доведения изобретения до степени практического осуществления.
Вышеупомянутый диапазон вязкости, например, может быть достигнут с помощью такого остова гидрогеля, который основан не на белках или сахарах, а скорее на гидрофильных полимерах, наиболее предпочтительно, на разветвленных молекулах поли(этиленгликоля), имеющих от 3 до 8 «ножек» («ножка») с молекулярной массой между 2000 и 5000 кДа, которые образуются в диапазоне концентрации предшественников между 1 и 10% (масс./объем).
1.2 Предшественники гидрогеля должны быть стабильными и не превращаться спонтанно в гель при комнатной температуре или не реагировать спонтанно под воздействием света. Большинство предшественников гидрогелевых сетей природного происхождения (например, Matrigel™, коллаген, фибрин) превращаться спонтанно в гель при комнатной температуре или даже при температурах ниже комнатной. Кроме того, многие из предшественников синтетических гидрогелей (например, фотополимеризуемые PEG-гели) светочувствительны и, таким образом, спонтанно образуют гель. Данные наиболее часто применяемые композиции геля не идеальны доведения изобретения до степени практического осуществления.
Для предупреждения спонтанного образования геля, могут быть применены такие реакции образования поперечных связей, которые основаны на энзиматических реакциях, предпочтительно, реакции, основанные на применении трансглутаминаз, в этом случае активный фермент может быть добавлен или на самой последней стадии получения микропанели (т.е. после проведения комбинаторного смешивания), или в раствор, лишенный кальция, который необходим для активности сшивающего фермента, или охлаждением планшета ниже приблизительно 10° по Цельсию для драматического снижения энзиматической реакции сшивания.
1.3 Должно существовать контролируемое запускающее событие для инициации гелеобразования жидких предшественников. Более конкретно, смешивание компонентов до добавления данного инициациирующего гелеобразование компонента не должно приводить к реакции. Это не относится к гидрогелевым сетям природного происхождения, поэтому и данные композиции не идеалены для доведения изобретения до степени практического осуществления.
Вышеупомянутое запускающее событие, например, может представлять собой добавление фермента, индуцирующего сшивание, предпочтительно, фермента, представляющего собой члена семейства трансглутаминаз, добавление кальция к раствору, лишенному кальция, и поэтому фермент был в нем неактивен, или нагреванием планшета до комнатной температуры от приблизительно 10° по Цельсию для инициирования энзиматической реакции сшивания.
1.4 Должен существовать определенный период между активацией жидкого предшественника, когда с материалом в жидкой форме, до его затвердевания в форме гидрогеля, можно было бы легко и контролируемо манипулировать. Более конкретно, материал должен быть обработан в жидкой форме при комнатной температуре и не должен превращаться в гель в течение минимального периода времени, равного от 2-х до 4-х минут, что представляет собой типичное время необходимое для распределения на конечном планшете. В наиболее часто применяемых композициях геля для 3D-клеточных культур, кинетика полимеризации не поддается контролю, и такого установленного периода времени не существует. Данные композиции, следовательно, не идеалены для доведения изобретения до степени практического осуществления. В контексте настоящего изобретения, данную проблему предпочтительно преодолевают путем инициации гелеобразования с помощью сшивающего фермента, который дополнительно представляет собой чувствительный к температуре фермент (т.е. может быть деактивирован снижением температуры), обеспечением мощного средства для настройки продолжительности временного периода до того, как вязкость станет слишком высокой для успешного распределения.
Наиболее подходящие ферменты для применения в контексте настоящего изобретения представляют собой членов семейства трансглутаминаз, наиболее предпочтительно, активируемый тромбином фактор XIIIa.
2. Требования, предъявляемые к свойствам твердого гидрогеля
2.1 Конечный материал геля должен быть ненабухающим и несжимаемым. Набухание или сжатие определяют в настоящем документе как увеличение или снижение в объеме между объемом раствора предшественников (который распределен в планшете) и объемом гидрогеля после достижения равновесия со средой, в которую его поместили. Более конкретно, отношение набухания, определяемое в настоящем документе как конечный объем геля в равновесии с водой, деленный на объем геля сразу после синтеза (т.е. соответствующий объему раствора предшественников), должно быть между 80 и 130%. В особенности, набухание гидрогеля в воде обычно измеряют следующим образом: Гели синтезируют (обычно 25 мкл в объеме), взвешивают в воздухе и в этаноле до и после набухание в течение 48 часов в 1 мл деионизированной воды и после сублимационной сушки, с помощью набора для определения плотности. Объемы гелей после сшивки (Vg,c) и после набухания (Vg,s) определяют на основании закона плавучести Архимеда. Отношение между Vg,s/Vg,c определяют как отношение набухания. Невыполнение этого требования может привести к неоднородности свойств материала, деформации материала и к возможному отделению геля от подложки, каждое из этих событий наносит ущерб доведению изобретения до степени практического осуществления. Насколько известно авторам настоящего изобретения, большинство, если не все системы синтетических гидрогелей в значительной степени набухают после сшивания и, следовательно, не могут быть в идеале применены для доведения изобретения до степени практического осуществления. Авторы настоящего изобретения спроектировали конфигурации полимерных предшественников (т.е. функциональности и молекулярные массы) для того, чтобы идентифицировать гели, которые не набухают и не сжимаются. Более конкретно, гидрогели формируют из разветвленных гидрофильных полимеров, наиболее предпочтительно, макромеров поли(этиленгликоля), имеющих 8 «ножек» (т.е. 8 функциональных групп), с молекулярной массой по 5000 кДа каждый и несущих пептидные субстраты для сшивающих ферментов трансглутаминаз, при формировании при концентрации предшественников в диапазоне между 1 и 10% (масс./объем), были идентифицированы авторами настоящего изобретения (из большой библиотеки других конфигураций макромеров и реакций образования поперечных связей) для выполнения этого критерия ненабухания и безсжатия.
2.2 Конечный материал геля должен иметь такие биофизические свойства (т.е. жёсткость), которые можно контролировать независимо от их биохимических свойств (т.е. способности к деградации и к передаче сигналов). Более конкретно, изменение свойства геля путем изменения содержания полимером не должно влиять на способность к деградации. Наиболее часто применяемые гели для 3D-клеточных культур (например, Matrigel™, коллаген, фибрин, ламинин) не позволяют изменять биофизические свойства гелей независимо от их биохимических свойств и, следовательно, не могут быть в идеале применены для доведения изобретения до степени практического осуществления. Авторы настоящего изобретения решили эту проблему путем конструирования систем гидрогеля, в которых изменения в жёсткости линейно зависят от изменений в содержании полимера. При изменении в способности к деградации гелей посредством включения различных субстратов протеаз в остов геля, данная линейность позволяет найти точное соответствие между биофизическими свойствами гелей, имеющих различную способность к деградации.
2.3 Конечный материал геля должен разрушаться путем строго локализованного разрыва остова геля (т.е. когда отверстия создаются внутри гелей), а не путем глобальной, неспецифической деградации (т.е. когда весь образец геля растворяется). Многие широко применяемые синтетические материалы гидрогеля, такие как материалы, включающие гидролитически нестабильные сложноэфирные связи (например, PEG-гели, сформированные с помощью акрилатных групп), разрушаются нелокализованными механизмами. Кроме того, многие широко применяемые гели для 3D-клеточных культур (например, Matrigel™ или фибрин) растворяются полностью и неспецифически (Matrigel™ особенно склонен к неконтролируемой деградации) и, следовательно, не могут быть в идеале применены для доведения изобретения до степени практического осуществления.
В контексте настоящего изобретения, строго локализованное разрушение остова геля достигают путем помещения субстратов протеаз, прикрепленными к концам разветвленных гидрофильных полимеров, в остове сети гидрогеля, так что секретируемые клетками протеазы, прикрепленные к клеточной мембране (например, мембраносвязанные протеазы), расщепляют гидрогели только в непосредственной близости от клеточной поверхности, не выходя за ее пределы. Предпочтительно, такие гели оказываются разлагаемыми матриксными металлопротеиназами (MMP) посредством включения пептидов с различной чувствительностью (т.е. kcat/Km) к секретируемым клетками ММР.
2.4 Конечный материал геля должен позволять биохимическим факторам (например, белкам или пептидам) прикрепляться к нему без снижения их биологической активности после присоединения. Кроме того, прикрепление биохимических факторов не должно влиять на биофизические свойства геля. Многие широко применяемые синтетические материалы гидрогеля сформированы с помощью химии образования поперечных связей, которые или несовместимы с функциональным включением биохимических факторов, или изменяют их биофизические характеристики вследствие включения; данные системы, следовательно, не могут быть в идеале применены для доведения изобретения до степени практического осуществления. Кроме того, наиболее часто применяемые гели для 3D-клеточных культур (например, Matrigel™, коллаген, фибрин, ламинин) не позволяют включать биохимические факторы специфически и, следовательно, не могут быть в идеале применены для доведения изобретения до степени практического осуществления. Авторы настоящего изобретения разработали системы синтетического гидрогеля, которые позволяют присоединять до 1 мг/мл белка или 1 мМ пептида без изменения жёсткости конечного геля более чем на 20%.
Этого достигают предпочтительно путем сайт-специфического прикрепления биохимических факторов к гидрогелевому матриксу или перед, или в ходе сшивки. Функционализация геля биологически активными молекулами может быть достигнута путем прямого образования ковалентной связи между свободными функциональными группами на биомолекуле (например, амино- или тиоловые группы) или на пептидном субстрате для сшивающего фермента (например, для трансглутаминазы) и на сетке геля, или, предпочтительно, в случае чувствительных белков клеточной сигнализации, посредством аффинного связывания между доменом на рекомбинантном/меченом белке и на вспомогательном белке, прикрепленном к гелю. Меченые белки включают белки, имеющие Fc-метки, биотиновые метки или His-метки, такие как метки, обеспечивающие связывание с белком А (или белком G, белком A/G), со стрептавидином (или нейтравидином) или NTA. Для биомолекул могут потребоваться различные стратегии для присоединения к гидрогелевым сетям. Более крупные происходящие из ECM или ECM-имитирующие белки и пептиды предпочтительно прикреплены к гидрогелю посредством неспецифического присоединения с помощью линейных, гетеробифункциональных линкеров. Одна функциональная группа данного линкера вступает в реакцию с функциональными группами, прикрепленными к концам полимерных цепей, предпочтительно, с тиольными группами. Другая функциональная группа линкера способна неспецифически связываться с представляющей интерес биомолекулой через ее аминогруппы. Последнюю функциональную группу выбирают из группы, состоящей из сукцинимидиловых активных сложных эфиров, таких как N-гидроксисукцинимид (NHS), сукцинимидил-альфа-метилбутаноат, сукцинимидил-пропионат; альдегида; тиоловой группы; тиол-селективной группы, такой как акрилат, малеимид или винилсульфон; пиридилтиоэфира и пиридилдисульфида. Предпочтительно, к биомолекулам прикреплены NHS-PEG-малеимидные линкеры.
2.5 Конечный материал геля должен быть присоединен к подложке микропанели, которая обычно представляет собой пластик или стекло. Более конкретно, данная подложка представляет собой обработанные или необработанные предметные стекла для микроскопа, стандартные обработанные или необработанные гамма-облучением пластиковые лабораторные принадлежности для клеточных культур, обработанные или необработанные многолуночные планшеты, обработанные или необработанные высокой плотности (384, 1536-луночные) планшеты для клеточных культур. Невыполнение этого требования может привести к отделению геля и потере исследуемого образца. Многие широко применяемые синтетические материалы гидрогеля не прикрепляются к таким поверхностям и, таким образом, не могут быть применены для доведения изобретения до степени практического осуществления.
Было установлено, что материалы гидрогеля, которые не набухают или не сжимаются, обладают предпочтительным присоединением к подложкам, как описаны выше. Более конкретно, для выполнения этих критериев, отсутствие набухания и сжатия, авторами настоящего изобретения были идентифицированы (из большой библиотеки макромеров других конфигураций и реакций образования поперечных связей) гидрогели, сформированные из разветвленных гидрофильных полимеров, наиболее предпочтительно, из макромеров поли(этиленгликоля), имеющих 8 «ножек» (т.е. 8 функциональных групп), с молекулярной массой 5000 кДа каждый, и несущие пептидные субстраты для сшивающих ферментов трансглутаминаз, при формировании в диапазоне концентрации предшественников между 1 и 10% (масс./объем),
3. Требования, предъявляемые к роботизированному распределению в нано/микролитровом масштабе
3.1 Роботизированное устройство по распределению жидкостей должно быть способно точно смешивать большие объемы жидкостей, а также дозировать капли жидкостей в нанолитровом диапазоне в пространственно адресуемый формат. Большинство коммерчески доступных устройств по распределению жидкостей не позволяют дозировать с точностью нанолитрового диапазона. Кроме того, устройство по распределению жидкостей должно сохранять точность распределения для жидкостей, значительно различающихся по вязкости. Более конкретно, точные объемы должны сохраняться для жидкостей, варьирующих по вязкости от воды до вязкости 10%-ного PEG. Коммерчески доступного робота для дозирования жидкостей предпочтительно применяют для точного дозирования объемов, не превышающих 50 нанолитров (макс. +/- 1% ошибка в точности).
3.2 Должны быть разработаны стратегии, позволяющие избегать испарения геля в объеме, лежащем в микро- и, в особенности, в нанолитровом диапазоне, требующие очень кропотливой работы по оптимизации и разработке протокола. Более конкретно, следует избегать испарения в промежуток времени между распределением и добавлением среды на желатинизированные образцы. Более конкретно, испарение маленьких объемов предшественника/геля (приблизительно 100 нл – 1 мкл) следует избегать в течение примерно 20-ти минут. Более конкретно, смешивание и распределение следует проводить при контролируемой температуре и влажности, конкретно, например, при 25°C и 30% относительной влажности, из которой температуру точки росы, равную, например, 6°C, рассчитывают и устанавливают для блока охлаждения. Более конкретно, температуру подложки (обычно многолуночного планшета) следует контролировать с помощью блока охлаждения. Более конкретно, температуру окружающей среды и относительную влажность окружающей среды применяют для расчета точки росы, и блок охлаждения устанавливают на температуру точки росы. Более конкретно, планшет следует поддерживать при температуре точки росы во время проведения многочисленных стадий дозирования. Более конкретно, после того, как выполняют все стадии дозирования геля, планшет должен быть помещен в перевернутом виде в инкубатор (37°C, 5% CO2) на 20 минут для завершения гелеобразования, предотвращая при этом испарение. Более конкретно, после завершения гелеобразования, планшет должен быть быстро (приблизительно, 1 мин) заполнен небольшим количеством основной среды (обычно 1 мкл в случае 1536-луночного планшета). Кроме того, в ходе проведения анализа, среда должна быстро обмениваться. Более конкретно, среда может быть удалена из планшета центрифугированием (приблизительно 200-300 g).
3.3 Смешивание жидких предшественников геля следует проводить в точно определенной, иерархически упорядоченной последовательности, требующей некоторой кропотливой работы по оптимизации и разработке протокола. Это требует тщательного планирования и работы по оптимизации. Более конкретно, исходные растворы полимерных предшественников, различающихся по чувствительности к протеазам, должны сначала быть разбавлены до различных концентраций. Затем биохимические факторы, такие как белки и пептиды, должны быть добавлены к раствору, с последующим добавлением клеток и индукторов сшивки, которые предпочтительно представляют собой сшивающий фермент. Несоблюдение этой последовательности может привести к потере независимости между различными физическими и химическими свойствами и к неудаче в доведении изобретения до степени практического осуществления. Несоблюдение последовательности также может привести к неверным концентрациям белков, неверной плотности клеток или преждевременному гелеобразованию.
3.4 Должны быть обеспечены плотность клеток и гомогенное 3D-распределение внутри геля, требующие некоторой кропотливой работы по оптимизации и разработки протокола. Более конкретно, времена распределения и задержки в связи с добавлением сшивающего агента должны быть оптимизированы. Кроме того, объем геля должен быть оптимизирован для конкретных форматов подложки для обеспечения оптимальной жизнеспособности клеток (лимитированной диффузией) и предупреждения испарения при сохранении миниатюризированного минимального объема. Более конкретно, объем геля обычно равен 1 мкл для лунки 1536-луночного планшета, в результате чего высота геля будет равна приблизительно 500 мкм.
Осуществление изобретения
Ниже будет представлен более подробно ряд воплощений настоящего изобретения.
Создание панелей сигнальных 3D-микроокружений клеточных культур из набора компонентов, представляющих собой молекулярные строительные блоки
Для осуществления трехмерного скрининга клеточных микроокружений в соответствии с настоящим изобретением оказалось полезным сконструировать систему биоматериалов, составленную из библиотеки молекулярных строительных блоков, которые могут быть независимо смешаны и затем сшиты в присутствии клеток для потенциального образования огромного разнообразия трехмерных микроокружений клеток с определенными и независимо контролируемыми свойствами. Было обнаружено, что изобретение предпочтительно может быть осуществлено на основе синтетических гидрогелей в качестве имитаторов трехмерного биологического микроокружения клеток с очень хорошо определенными биохимическими и механическими свойствами (Lutolf and Hubbell, 2005). Предпочтительно, применяют фермент коагуляции, активированную трансглутаминазу, фактор XIIIa (FXIIIa), для сшивания преполимеров с разветвлённой структурой на основе поли(этиленгликоля) (PEG) в 3D-гидрогелевые сети в физиологических условиях (см. фиг. 1a) (Ehrbar et al., 2007). Действительно, было обнаружено, что одиночные мышиные ESC, инкапсулированные внутри таких гидрогелей на основе PEG, демонстрируют очень хорошую жизнеспособность (89,1±7,3%), которая существенно не отличается (p=0,44) от стандартных условий культивирования на покрытом желатином пластике (92,5±3,6%); результаты подробно не показано. Инкапсулированные в гель одиночные ESC физически отделены друг от друга с начала эксперимента и остаются в таком же состоянии с течением времени, таким образом, разрастаясь в виде клональныхй образований. Для обеспечения эффективного роста в трех измерениях, гели можно сделать восприимчивыми к протеолитическому ремоделированию под действием клеточного секрета, конструируя гели, несущие сайты субстратов протеаз для деградации (Lutolf et al., 2003; Patterson and Hubbell, 2010) (см. фиг. 1a). Кроме того, биологически активные молекулы, такие как олигопептиды или белки, могут быть сайт-специфически прикреплены к матриксу в ходе сшивки (фиг. 1a). Данный молекулярный «набор инструментов» для изготовления различных гидрогелевых матриксов позволяет эффективно исследовать очень большой комбинаторный пул различных клеточных 3D-микроокружений.
В качестве проверки и подтверждения принципа действия системы, получали пять ключевых типов сигналов трехмерных in vivo микроокружений, в которых каждая из данных характеристика могла быть независимо изменена (см. фиг. 1b): механические свойства подложки (сокращенно как «MP»), чувствительность к протеолитической деградации («DG»), белки внеклеточного матрикса («EC»), белки межклеточного взаимодействия («CC») и растворимые факторы («SF»). Путем варьирования содержания полимера, жёсткости (представленные модулями Юнга, E) гелей были заданы приблизительно от 300 до 5400 Па (Ehrbar et al., 2011) (фиг. 1b), что находится в соответствующем физиологическом диапазоне для мягких тканей (Engler et al., 2006). Гели были обеспечены различно разлагаемыми матриксными металлопротеиназами (MMP) посредством включения пептидов с различной чувствительностью (т.е. kcat/Km) к секретируемым клетками ММР (Lutolf et al., 2003). Важно отметить, что содержание предшественников контролировали для того, чтобы полностью соответствовать механическим свойствам гелей, сшитых с помощью различных пептидов-субстратов ММР. Таким образом, ключевые механические и биохимические свойства данной системы синтетического геля контролируют независимо. Для систематического модулирования свойств клеточной сигнализации матриксов, выбрали набор ECM и белков рекомбинантных факторов роста, о которых известно, что они вовлечены в регулирование плюрипотентности ESC, и энзиматически присоединили к гелям в контексте настоящего изобретения (см. фиг. 1b). Взаимодействие ESC с ламинином, фибронектином и коллагеном IV раньше связывали с потерей плюрипотентности в 2D (Prudhomme et al., 2004). Однако лигирование их интегриновых гомодимеров пептидыми аналогами в трехмерной системе культивирования указывает на то, что они, напротив, могут способствовать поддержанию самообновления (Lee et al., 2010). Кроме того, растет объем работ, указывающих на роль трансмембранных белков, вовлеченных в межклеточную передачу сигналов в качестве медиаторов самообновления: E-Cadherin, EpCam и Jagged были выбраны в настоящем документе в качестве репрезентативных примеров (Andrews et al., 2008; Gires et al., 2009; Soncin et al., 2009). Наконец, растворимые регуляторные факторы ESC: фактор, ингибирующий лейкемию (LIF), морфогенетический белок кости 4 (BMP4) и фактор роста фибробластов 4 (FGF4) (Prudhomme et al., 2004; Qi et al., 2004; Ying et al., 2003) были применены для свободной от сыворотки композиции среды, так что они могли достигать инкапсулированных клеток, пользуясь диффузионными свойствами сетки геля. В настоящем воплощении, были заданы четыре уровня модуляция для каждой из пяти категорий, что привело к общему пространству параметров равному 1024 уникальных условий (см. фиг. 1c). Кроме того, плотность клеток, все больше признаваемая в качестве важного модулятора судьбы ESC под действием аутокринных эффектов, может быть назначена в данной экспериментальной системе, а также ретроспективно визуализирована, как показано ниже.
Такой уровень сложности в формировании трехмерных содержащих клетки матриксов, а также необходимость повторов, предпочтительно доводят до практического осуществления посредством миниатюризации объемов образца и адаптацией автоматизированного способы изготовления геля (см. фиг. 1c) и анализа судьбы клетки (см. фиг. 1d). Более конкретно, применяют коммерчески доступного робота для дозирования жидкостей для точного синтеза одного мкл каждого из уникальных условий в трех повторностях, полностью автоматизированным способом, на предметные стекла (не показано) или в стандартные 1536-луночные планшеты (не показано). Последний формат выбрали, поскольку он давал идеальное отношение поверхности к объему для выбранных гидрогелевых капель и представлял собой стандартный формат, который может быть адаптирован к различным экспериментальным устройствам. Как только трехмерная панель гелей была создана, система могла функционировать в качестве мультимодальной платформы для анализа, для которой множество показаний может быть получено одновременно.
Судьба ESC в высокой степени зависит от композиции 3D-микроокружения клеточных культур
Для того чтобы получить количественную информацию по самообновлению и дифференциации ESC в ответ на вышесказанную панель трехмерных микроокружений клеточных культур, применяют клеточную линию с репортером Oct4-GFP, в сочетании с автоматизированной визуализацией и анализом изображений (см. фиг. 1d). Транскрипционный фактор Oct4 широко рассматриваться в качестве маркера плюрипотентности ESC (Niwa et al., 2000). Изображения клеток, встроенных в трехмерные матриксы, получают на следующий день после посева, для определения фактического исходного числа клеток для каждой лунки. В наиболее пермиссивных условиях, данные клетки формируют сферические колонии в течение трех дней, и сохраняют способность к размножению до фиксации после пяти дней инкубации (см. фиг. 1d, левая панель). Конфокальная микроскопия подтвердила, что колонии, растущие в данные условия, находились в истинном трехмерные пространства, толщиной приблизительно 500 мкм (см. фиг. 1d, средняя панель). Автоматизированную визуализацию полной 3D-архитектуры гидрогеля совмещали с эффективной системой анализа изображений для получения ряда морфологических показаний. В качестве меры пролиферации принимали площадь колоний, а в качестве меры плюрипотентности ESC интенсивность GFP (см. фиг. 1d, правая панель).
Для каждой из уникальных комбинаций эффекторы матрикса (т.е. MP, DG, EC, CC и SF), площадь колонии и интенсивность GFP рассчитывали как среднее из трех повторов. Каждое усредненное значение было представлено в виде квадрата, и ему был придан цвет (красный, представляющий относительно высокие значения, и синий, представляющий относительной низкие значения) и все значения/квадраты были организованы условием на входе, таким образом, создавая изображение двумерной цветовой карты (см. фиг. 2a). В общем, было установлено, что модуляция растворимых факторов представляет собой сильным предиктор интенсивности цветовой карты, с условием LIF, приводящим как к сильной пролиферации, так и к самообновлению, с противоположным эффектом для FGF4 и BMP4, и промежуточный режим выявили для условий без растворимых факторов. В первую десятку условий для самообновления и пролиферации попали все условия в рамках условия LIF, и большинство имели тенденцию находиться в условиях с плохими механическими свойствами и в отсутствии белков межклеточного взаимодействия. Действительно, если все микроокружения клеточных культур откладывали на графике как площади колонии против интенсивности GFP (см. фиг. 2b), то появлялись три популяции, которые были идентифицированы как микроокружения клеточных культур, содержащие LIF, без факторов («None») и BMP4/FGF4, с очень небольшим перекрытием между ними. Зависимость от LIF оказалась сильным биологическим подтверждением платформы, поскольку известно, что LIF представляет собой критический сигнал для сохранения плюрипотентности и самообновления ESC посредством фосфорилирования транскрипционного фактора передатчика сигнала и активатора транскрипции (STAT) 3 (Niwa et al., 1998). Кроме того, отношения отчетливой зоны против GFP возникли из такого представления, предполагая, что корреляция между самообновлением и пролиферацией связана с конкретным режимом для растворимых факторов; для FGF/BMP, независимо от характеристики роста, самообновление было утрачено, тогда как с пролиферацией LIF сильно коррелировало, до самообновления. В микроокружениях клеточных культур, лишенных каких-либо эндогенных растворимых факторов, наблюдали самообновление колоний. Это резко контрастирует со свободными от LIF двумерными культурами, где происходит быстрая потеря плюрипотентности ESC, и что указывает на возможную роль других факторов, вовлеченных в сохранении ESC в трех измерениях. Интересно отметить, что большинство характеристик самообновления и пролиферации (т.е. большая GFP, большая площадь) матрикса во всех субпопуляциях обнаруживают в условиях низкой жёсткости матрикса (см. фиг. 2c и 2d).
Системные анализы выявили относительный и комбинаторный эффекты детерминантов судьбы ESC в трех измерениях
Для количественной оценки на систематической основе измерения самообновления и пролиферации как функции передачи сигналов микроокружения клеточных культур, применяли обобщенные линейные модели (GLM), которые охватывали все пять детерминант микроокружения клеточных культур и их взаимодействия (см. фиг. 3). Данный подход позволил объяснить более чем 70% вариабельности в системе. Благодаря разъединению тонких эффектов от более доминирующих, может быть количественно определена относительная важность различных факторов (см. фиг. 3a), установлена глобальная иерархия компонентов, влияющих на судьбу ESC в трех измерениях. Растворимые факторы составили более чем 60% дисперсии модели. Физические свойства, включая способность матрикса к биологическому разложению и жёсткость, составили приблизительно половину оставшейся дисперсии модели, и связаны с эффектами белков и исходной плотностью клеток, на каждый приходится не более 15%.
Роль индивидуальных факторов также исследовали в рамках этих категорий (см. фиг. 3b). BMP4 и FGF4, когда представлены в виде одиночных факторов в свободной от сыворотки среде, как в контексте настоящего изобретения, нарушенное самообновление и отсутствие другого фактора микроокружения могут преодолевать данный эффект до любой значительной степени. Подверженные деградации матриксы способствуют самообновлению, но не обязательно пролиферации. Таким образом, физические параметры матрикса могут не только диктовать рост колоний, но также координировать стволовость. Эти процессы не всегда действуют одновременно и могут быть опосредованы взаимодействующими факторами. Действительно, белки ECM имеют тенденцию вызывать увеличение размера колоний, но снижать экспрессию Oct4, что согласуется с предыдущими результатами, полученными при двумерном анализе, где было показано, что ламинин и фибронектин усиливают дифференциацию ESC (Prudhomme et al., 2004). Удивительно, но белки межклеточного взаимодействия, такие как EpCam, в настоящей системе имеет тенденцию вызывать уменьшение, как пролиферации, так и самообновления, хотя раньше в двумерных исследованиях все три выбранных белка были вовлечены в поддержание самообновления ESC (Andrews et al., 2008; Gires et al., 2009; Soncin et al., 2009). Это говорит о том, что определенные пути могут быть активированы различно или подавляться другими факторами в трехмерном окружении.
Синергетические или антагонистические эффекты между статистически значимыми факторами представлены картой сети взаимодействий (см. фиг. 3c) и в виде кластеризованных двумерными цветовых карт, демонстрирующих значительные парные взаимодействия (фиг. 3d-g). В то время как некоторые взаимодействия, такие как включающие растворимые факторы, были вовлечены как в самообновление, так и в пролиферацию, другие были специфичными в отношении самообновления (см. фиг. 3c). Например, присутствие EpCam со всеми белками ECM снижало рост колоний (фиг. 3e), тогда как присутствие коллагена в гелях с низкой плотностью клеток увеличивало рост колоний (фиг. 3f). Таким образом, ECM белки, с их ролью в активации комплексов клеточной адгезии посредством включения интегрина (Lee et al., 2010), были вовлечены в модулирование чисто физическими компонентами матрикса. В целом, схема взаимодействия сосредоточена вокруг растворимых факторов, подчеркивая их ключевую роль в регулировании судьбы ESC, даже в трехмерном окружении.
Дополнительные анализы раскрывают эффекты жёсткости на судьбу ESC
Для более детального исследования ключевых аспектов регуляции ESC в 3D, идентифицированных с помощью этого крупномасштабного скрининга, платформа была выполнена совместимой с взаимодополняющими последующими анализами клеток, включающими проточную цитометрию и количественный RT-PCR (см. фиг. 4). Новое считывание показаний были реализованы в более целенаправленных экспериментах (см. фиг. 4a) и в режиме замедленной съемки (см. фиг. 4b), для того, чтобы также пролить свет на динамику 3D-поведения ESC. Например, действенность LIF одновременно изучали, проводя исследование зависимости от дозы, и эффект механических свойств оценивали путем расширения диапазона жёсткости и ретроспективными измерениями жёсткости каждого геля (не показано), и был исследован более широкий диапазон заранее заданных плотностей клеток (см. фиг. 4a).
Пролиферация сохранялась во всех условиях в течение первых двух дней, за которыми проявлялась сильная зависимость от всех трех параметров (см. фиг. 4c). В особенности, LIF сохранял свою пролиферативную роль в 3D, даже в концентрации на три порядка меньше, чем в 2D-стандарте. Было подтверждено, что пролиферация имеет непосредственное отношение к снижению жесткости матрикса, в то же время было установлено, что промежуточная жёсткость представляет собой оптимальную жесткость для самообновления и колониеобразующей эффективности (см. фиг. 4d). Этот вывод находится в соответствии с данными, предполагающими, что в 3D давление твердой фазы может контролировать клеточный рост, как на макроскопическом, так и на клеточном уровне в многоклеточных агрегатах, таких как опухолевые сфероиды (Helmlinger et al., 1997). Недавние исследования показали, что эластичность in vitro подложки может направлять судьбу стволовых клеток (Engler et al., 2006; Gilbert et al., 2010). Настоящие результаты, полученные в контексте изобретения, позволяют предположить, что механические свойства могли бы играть аналогичную и фундаментальную роль в регулировании поддержания ESC в 3D, где оптимальные свойства в их диапазоне, измеряемые в начале бластоцисты, могли бы быть наиболее подходящими (Khalilian et al., 2010; Murayama et al., 2006).
Для того чтобы подтвердить результаты, полученные на уровне колоний, проточной цитометрией одиночной клетки и данными по экспрессии генов, гидрогелевые матриксы в каждой лунке расщепляли раствором протеаз при сохранении целостности клеток. Общее количество клеток, определенное проточной цитометрией, наиболее близко коррелировало с мерой общей площади колонии, определенной с помощью визуализации (не показано). Чтобы лучше определить роль плотности клеток, общую площадь колонии нормализовали на исходную плотность клеток: хотя более высокие исходные плотности клеток приводили к более крупным колониям, это не отражалось на фактическом числе клеток, подсчитанном с помощью проточной цитометрии (см. фиг. 4e), следовательно, можно предположить, что клетки в составе более крупных колоний могли умереть. Как и в случае данных, полученных на основе изображений, каждое условие могло быть визуализировано индивидуально; представление двумерной цветовой карты (см. фиг. 4f) указывает на четкую тенденцию к градуированному двунаправленному влиянию LIF и MP, наблюдение было подкреплено глобальным анализом, показывающим почти равноценную роль данных двух факторов во влиянии на пролиферацию и сниженную роль плотности клеток.
Дополнительное преимущество диссоциации клетки от гелей заключается в возможности легко применять иммуноцитохимический анализ. Например, окрашивание на SSEA1, поверхностный маркер, широко применяемый в качестве комплементарного маркера плюрипотентности на транскрипционные факторы, такие как Oct4, показывает широкий диапазон экспрессии SSEA1, даже в случаях высокого Oct4 (см. фиг. 4g). Экспрессия SSEA1, как правило, достигает более высокого уровня, в более мягких матриксах, и субпопуляции с высоким SSEA1/низким Oct4 появились в случаях высокого LIF и высокого MP, следовательно, можно предположить, что в результате изменений в механических свойствах и концентрации LIF, некоторые клетки прошли ранние стадии коммитирования, которые проявились тонкими изменениями во внутриклеточных и внеклеточных маркерах плюрипотентности.
Чтобы продемонстрировать, что клетки, отобранные из гелей, могут быть применены практически для любого дополнительного последующего анализа, проводили количественный RT-PCR на отобранных образцах. Такие анализы показали, что экспрессия некоторых генов, ассоциированных с плюрипотентностью, была значительно подавлена Rex1), тогда как экспрессия других генов (Nanog) оставалась практически неизменной в ответ на изменения в физико-химическом окружении, в то время как изменения в 3D жёсткости матрикса приводило к значительной положительной регуляции Map2, гена, ассоциированного с ранней нейроэктодермальной дифференциацией (см. фиг. 4h). В своей совокупности, возможность получать данные мультимодальные показания, включая покадровую обработку изображений, проточную цитометрию и PCR, открывает широкие перспективы для наблюдения за клеточными системами в 3D микроокружениях клеточных культур в составе микропанелей в соответствии с изобретением.
Систематический факторный анализ микроокружения клеточных культур выявил комплекс факторов, маркирующих подпись нейроэпителиальной дифференциации
Для демонстрации другого воплощения изобретения, применяют аналогичную методику, как была описана выше, для исследования факторов, модулирующих раннее развитие нервной системы, в особенности, нейроэпителиальную дифференциацию ESC.
Важно отметить, что за пределами количественного определения показаний пролиферации и дифференциации, последнюю оценивали по интенсивность GFP, отражающую экспрессию Sox1, условия, которое, как считают, могло бы воссоздать морфологические особенности нейроэпителиальных кист, определяемых как ткани, включающие изогнутые эпителиальные клеточные слои, охватывающие просвет (Gin, 2010), в том числе их сферические и нео-поляризационные особенности.
Для того чтобы поддерживать широкомасштабное пространство параметров (5 категорий x 4 фактора на категорию), но оптимизировать количество необходимых экспериментальных условий, полный факторный дизайн эксперимента был изменен так, чтобы сосредоточиться на двух раундах изменений в 4-х категориях. На первой панели, MP, DG, EC и SF оценивали в полном факторном дизайне (без CC-белков), и на второй, MP, DG, EC, CC оценивали аналогичным образом, с растворимым фактором FGF4 во всех условия.
Количественное определение результатов проводили с помощью ранее описанной, основанной на GLM, стратегии моделирования. Растворимые факторы, преобладавшие под действием LIF, вносили более чем 74% вариабельности, наблюдаемой для площади колонии, только с незначительным вкладом механических свойств и чувствительностью к ММР (5%) и пренебрежимо малым влиянием других факторов (данные не показаны). В отличие от этого, вариабельность в интенсивности GFP была связана с гораздо более широким набором факторов: в то время как растворимые факторы по-прежнему предоставляли наибольшую долю (32%), на белки межклеточного взаимодействия приходилось 16% дисперсии и на физические свойства (механические свойства и ММР-чувствительностью) приходилось по 9% на каждого (см. фиг. 5a).
Вклад индивидуальных факторов в интенсивность Sox1-GFP дополнительно проанализировали для определения того, какие факторы будет играть роль в качестве положительного или отрицательного регулятора дифференциации. FGF4 представляет собой растворимый фактор, который имел самый сильный положительный эффект на GFP, тогда как оба LIF и BMP4 представляли собой сильные отрицательные регуляторы нейроэпителиального пути (см. фиг. 5b). Отсутствие какого-либо растворимого фактора приводило только к небольшому отрицательному эффекту на экспрессию Sox1-GFP, указывая на то, что исходное условие производит в основном нейтральный эффект на судьбу клетки в тестируемых условиях. Что касается механических свойств, то промежуточный мягкий диапазон в эластичности стимулирует самую высокую экспрессию Sox1-GFP. Действительно, слабый отрицательный эффект на дифференциацию появляется в мягких матриксах и более выраженный отрицательный эффект в более жестких условиях (см. фиг. 5b).
Неподверженный деградации матрикс в значительно большей степени позволяет образование GFP+ колоний по сравнению с ММР-чувствительными матриксами (см. фиг. 5b). Следует отметить, что не было замечено никаких изменений в объемных механических свойствах матрикса с течением времени в любом из синтетических матриксов в течение 5 дней, следовательно, можно предположить, что обнаруженный эффект не зависит от объемных изменений в механических свойствах и поэтому был испытан в локальном клеточном масштабе и в масштабе колонии (данные не показаны).
Эффекты белков ECM на экспрессию Sox1-GFP в данной синтетической системе были незначительны, когда присутствовали индивидуально, в отличие от ожидаемых изменений в профиле дифференциации, ожидаемом на основании ECM-обогащенных природных матриксах, таких как Matrigel. Наконец, было обнаружено, что белки межклеточного взаимодействия представляют собой сильные отрицательные регуляторы дифференциации. В особенности Jagged, лиганд, активизирующий сигнальный путь Notch, рассматривается как самый сильный отрицательный регулятор экспрессии GFP (см. фиг. 5b), следовательно, можно предположить, что добавление настоящего фактора не обязательно подействует как по команде на желаемую судьбу клетки, направляя недифференцированную клетку к этой линии, а в действительности может способствовать противоположному поведению.
Было показано, что взаимодействия между факторами вносит 8% от общего дисперсии модели GFP, и на основе математической модели всех возможных взаимодействий категорий, было установлено, что статистически значимымы 5-парные взаимодействия (см. фиг. 5c). Растворимые факторы (SF) взаимодействовали с тремя другими категориями, обеими биофизическими (MP и DG), а также с биохимической (EC) категорией (см. фиг. 5f, g, h). Данные эффектов взаимодействия SF похоже представляют собой систематические данные по всем трем категориям: FGF4, например, имеет аддитивный эффект на все другие факторы, что может быть интерпретировано просто как нелинейный эффект, который не учитывают в качестве основного эффекта в линейной модели, но чья нелинейность может быть поймана при таком анализе взаимодействий. Аналогичным образом, недеградируемое условие также демонстрирует такой нелинейный эффект, но условие Ecad оказывает положительное влияние в условии высокой подверженности деградации (см. фиг. 5d). Аналогичным образом, ECad имеет более выраженный положительный эффект в одном из более жестких условий (см. фиг. 5e).
Скринированные условия обеспечивают основу для теоретических представлений о нейроэпителиальной морфологии и полярности
Высокопроизводительные скрининги, такие как представленные в настоящем документе, могут служить в качестве инструментов при создании гипотез для более адресных исследований. Например, было показано, что предполагаемый нелинейный эффект FGF4, идентифицированный с помощью анализа факторного взаимодействия, был опосредован плотностью клеток: при относительно высокой плотности клеток (3 миллиона клеток/мл) добавление FGF4 к среде давало незначительный эффект, в то время как при снижении плотности клеток (1 миллион клеток/мл), отсутствие FGF4 приводило к потере пролиферации и снижению интенсивности GFP (см. фиг. 6a), что подчеркивает роль этого фактора роста в качестве аутокринного регулятора нейронной дифференциации.
Из анализа набора изображений от такого скрининга также выводят дополнительные показатели за пределами средней площади колонии, как меру пролиферации, и экспрессию Sox1-GFP, как меру дифференциации, с морфологическими показателями, в особенности, имеющими актуальное значение, чтобы связать наблюдаемые фенотипы с вводимыми микроокружениями клеточных культур. Применяя подход с выделением кластеров для объединения многомерных выходов в кластеры связанной морфологии, пролиферации и дифференциации (не показано), может быть сконструирована фенотипическая подпись, которая обеспечивает более полное представление о поведении клетки. Таким образом, стало возможным определить, что характеристики гладких, круглых колоний получают почти исключительно в неподверженных деградации условиях, в то время как колонии, сохраняющие высокую экспрессию GFP, но с более эксцентричными и звездообразными формами, присутствовали в матриксах, подверженных деградации (см. фиг. 6b). В дополнительных экспериментах (не показано) с помощью ингибиторов ММР широкого спектра действия, было установлено, что данное явление действительно опосредуется протеазами. Таким образом, путем расширения представляющех интерес показателей для включения морфологических признаков, стало возможным идентифицировать конкретные условия микроокружения, включая различные морфологии, которые могут быть связаны со специфическими морфогенетическими путями.
Один из признаков формирования нейронной кисты – это развитие люмена. Конфокальные 3D реконструкции ясно показали, что колонии действительно были хорошо распределены по всей толщине геля, и не демонстрировали особого планарного смещения (см. фиг. 6b). Колонии, расшие в близком соседстве в 3D конфигурации в неподверженных деградации гелях не сливались, но сохраняли между собой тонкую гидрогелевую границу (см. фиг. 6b), следовательно, можно предположить, что рост в таких матриксах достигался под действием внешней силы в отношении матрикса, а не каким-либо ремоделированием. Наиболее существенно, что степень апикально-базальной полярности (см. фиг. 6c) и начала возможной инволюции наблюдали в выбранных условиях, которые характеризуются неподверженным деградации матриксом и FGF4. Дополнительные эксперименты выявили, что в то время как в условиях, где присутствовали одиночные факторы ECM, регистрировали только нечастое появление полярности кист, если в матрикс были включены все три компонента ECM (ламинин, коллаген IV и фибронектин), была установлена надежная и частая полярность (см. фиг. 6d).
При таком высокопроизводительном подходе, ответ ESC в панелях 3D микроокружений клеточных культур дал новые идеи в понимании регуляции нейроэпителиальной дифференциации. Как и в исследовании самообновления ESC, растворимые факторы играли ведущую роль, в особенности, для определения пролиферации, и имели четкий эффект как в содействие, так и в противодействии дифференциации. Эффекты матрикса, в особенности, чувствительность матрикса к ММР, играет одинаково важную роль в определении судьбы клеток. Действительно, сферические нейроэпителиальные колонии наблюдали только в неподверженных деградации матриксах, тогда как в подверженных деградации матриксах, степень дифференциации и морфология колоний были значительно изменены. Кроме того, белки, вовлеченные в межклеточные взаимодействия, нарушали нейроэпителиальную дифференциацию, тогда как белки ECM играли значительную роль в создании апикально-базальной полярности только будучи представленными комбинаторной образом. Поэтому высокопроизводительная платформа, такая как платформа, разработанная в настоящем документе, рассматривается не только как инструмент для понимания влияния микроокружений клеточных культур на пути развития, но также как мощный способ генерации гипотез, которые могут привести к выяснению более сложных механизмов.
Платформа с применением панелей применима к многопараметровым анализам и к различным типам клеток
Дополнительные воплощения изобретения включают возможность исследования миграции и проведения морфологических анализов. Кроме того, такие анализы могут быть выполнены, начиная с одиночной клетки (как показано раньше) или от клеточных агрегатов, сформированных in vitro (например, эмбриоидные тельца) или изолированных непосредственно из живой ткани. В качестве примера, мезенхимальные стволовые клетки агрегировали до размеров в 300 клеток, их включали в комбинаторные микроокружения клеточных культур, и их миграцию оценивали через 16 часов (в присутствии PDGF в качестве растворимого фактора в среде). Как прикрепленные к матриксу имитирующие ECM пептиды (мотив фибронектина, полученный из RGD), так и чувствительность к матриксным ММР модулировали миграционный ответ клеток, направленный наружу от кластера (см. фиг. 7a). Разнообразные кластеры эпителиальных клеток, включая, например клетки поджелудочной железы, эндометриальные, кишечные клетки или клетки молочной железы, могут быть включены в платформу скрининга, и оцененные по маркерам стволовых клеток, полярности или другим морфологическим признакам (см. фиг. 7b).
Подробное описание экспериментов
Синтез предшественников гидрогеля
PEG-винилсульфон (PEG-VS) получали и характеризовали как описано в другом месте (Lutolf and Hubbell, 2003). На второй стадии, PEG-VS функционализировали фактором XIIIa-пептидные субстраты посредством реакции присоединения по Михаэлю. Применяли глутамин-содержащий пептид (NQEQVSPL-ERCG-NH2) и различные типы лизин-содержащих пептидов с различной чувствительной к ММР последовательностью: AcFKGG-GPQGIWGQ-ERCG-NH2 (пептид W), AcFKGG-GDQGIAGF-ERCG- NH2 (пептид A), AcFKGG-PQGIAGQ-ERCG-NH2 (пептид G), AcFKGG-VPMSMRGG-ERCG-NH2 (пептид V). В результате получали один предшественник глутамин-PEG (Q-PEG) и четыре различных предшественника лизин-PEG: W-PEG, A-PEG, V-PEG, G-PEG. Функционализацию и характеристику данных предшественников проводили, как описано в другом месте (Ehrbar et al., 2007). Коротко, пептиды добавляли к PEG-VS в 1,2-кратном молярном избытке по отношению к VS-группам в 0,3 M триэтаноламине (pH 8,0) при 37°C в течение 2-х часов, с последующим диализом (Snake Skin, MWCO 10k, PIERCE) против сверхчистой воды в течение 4-х дней при 4°C. После диализа обессоленные продукты (Q-PEG, W-PEG, A-PEG, V-PEG, G-PEG) лиофилизировали и получали белый порошок.
Получение гидрогеля
Фактор XIII (Fibrogammin P, CSL Behring) восстанавливали водой из лиофилизированного порошка до концентрации 200 Ед./мл. 1 мл фактора XIIIa активировали 100 мкл тромбина (20 Ед./мл, Sigma-Aldrich, Швейцария) в течение 30 мин при 37°C. Аликвоты активированного фактора XIIIa хранили при -80°C для дальнейшего применения. Растворы предшественников для получения гидрогелей с конечным содержанием по сухой массе, варьирующим от 1,5 до 4%, получали с помощью стехиометрически сбалансированных ([Lys]/[Gln] = 1) растворов Q-PEG и каждого из четырех лизин-PEG в Tris-буфере (TBS, 50 мМ, pH 7,6), содержавшем 50 мМ хлорид кальция. Реакцию сшивания полимеров инициировали 10 Ед./мл активированного тромбином фактора XIIIa и энергичным смешиванием. Для получения дискообразных матриксов, жидкие реакционные смеси (50 мкл) зажимали между стерильными гидрофобными стеклянными предметными стеклами для микроскопии (полученными в результате обработки с помощью SigmaCote, Sigma), разделенными спейсерами (толщиной приблизительно 1 мм) и закрепляли зажимами. Матриксы затем инкубировали в течение 30 мин при 37°C.
Характеристика ММР-опосредуемой деградации
Три 50 мкл гелевых диска с 3,5% масс./объем PEG изготавливали для каждой из 4-х пептидных последовательностей и оставляли набухать в течение 12-ти часов в 50 мМ Tris, 100 мМ NaCl, 10 мМ CaCl2 буфере при рН 7,5. Затем их взвешивали и помещали в раствор 40 мМ ММР-1, растворенной в том же буфере. Массу геля регистрировали с 2-часовыми интервалами в течение первых 12-ти часов, затем при t = 18, 24, 48 и 72 часам. Определяли время до полной деградация или непосредственно, или с помощью линейной регрессии (для G-пептида), и инвертировали для получения показателя способности к биологическому разложению.
Характеристика механических свойств
Гелевые диски (n=3 для каждой чувствительности к ММР) оставляли набухать в буфере в течение 12-ти часов и затем выполняли реологические измерения небольших пульсирующих сдвигов при деформации. Набухшие гидрогелевые диски толщиной от 1 до 1,4 мм зажимали между двумя пластинами реометра Bohlin CV 120 (Bohlin Instruments), со сжатием вплоть до диапазона между от 85% до 75% от их исходной толщины, чтобы избежать смещения. Затем осуществляли измерения в режиме постоянного напряжения (5%). Напряжение сдвига регистрировали в диапазоне частот от 0,1 до 1 Гц и получали средние динамические модули упругости G’ в этом диапазоне частот. Динамический модуль упругости (G’) откладывали как функцию от %PEG (масс./объем) в гидрогеле для каждой из 4-х ММР-чувствительностей. По экспериментальным точкам для G’ против %PEG проводили линейную интерполяцию. %PEG, соответствующий 0, 600, 1200 и 1800 Па, определяли для каждой способности к биологическому разложению.
Модификация матриксов белками межклеточных взаимодействий
Для связывания белков межклеточного взаимодействия с сетью гидрогеля применяют стратегию конъюгирования Fc-tag/белка A. Для придания белку A чувствительности к катализируемому фактором XIIIa сшиванию, Q-содержащий пептид присоединяли к белку A с помощью NHS-PEG-малеимида, гетеробифункционального PEG-линкера. Модификации белка A достигали в двустадийной реакции: функционализации с малеимидной группой в результате реакции NHS-PEG-малеимида в 10-кратном молярном избытке, с последующим прикрепление Q-пептида через боковую цепь его цистеина. Затем, с помощью SDS-PAGE качественно оценивали A-функционализацию Q-белка. Если имела место опосредуемая фактором XIIIa реакция сшивания, то для детекции выбирали лизин-содержащий зонд, Lys-Tamra, субстрат для фактора XIIIa, способный вступать в реакцию с флуоресцентным счетчиком. При смешивании белка A и Lys-Tamra в присутствии фактора XIIIa, флуоресцентный сигнал, соответствующий белку A, обнаруживали на SDS-PAGE и при сканировании флуоресценции в геле, что означало успешную био-конъюгацию. Для достижения ковалентного присоединения белков межклеточного взаимодействия к гидрогелям на основе фактора XIIIa, Fc-меченые E-кадгерин, EpCAM и Jagged (R&D Systems) предварительно смешивали с Q-белком A в 1,66 молярном избытке в течение 30 мин при комнатной температуре. Учитывая тот факт, что белок A имеет пять сайтов связывания для Fc, мы получали 3-кратный молекулярный избыток каждого из сайтов связывания Fc по отношению к Fc-белку, что должно обеспечить оптимальную иммобилизацию морфогенов. Полученный раствор полностью функциональных белковых конструктов разделяли на аликвоты и хранили при –20ºC до дальнейшего применения.
Определение чувствительности белков ECM к опосредуемому фактором XIIIa сшиванию
Основываясь на гипотезе, что крупноразмерные белки ECM могут представлять собой природные субстраты для фактора XIIIa и будут прикрепляться к сети гидрогеля без дальнейшей конъюгации, применяли в растворе следующие представляющей интерес белки ECM: ламинин, коллаген I (BD Biosciences), фибронектин (R&D Systems). Проводили анализ связывания флуоресценции, в котором белки смешивали с каждым из флуоресцентных фактор XIIIa-субстратов (Q-пептид-Alexa647 или Lys-Tamra) в присутствии фактора XIIIa. Реакции качественно анализировали при помощи SDS-PAGE и сканирования флуоресценции в геле и показали, что белки действительно чувствительны к основанному на факторе XIIIa сшиванию. Все ECM белки разделяли на аликвоты при 4°C и хранили при -20°C.
Клеточные культуры
Во всех экспериментах по самообновлению ESC мышиные эмбриональные стволовые клетки Oct4-GFP (mESC) (линия R1, предоставленная Zandstra lab) культивировали обычным способом на покрытых желатином чашках в среде, содержавшей 15% сыворотки (Hyclone) и 106 Ед./мл LIF (Millipore). За двенадцать часов до эксперимента, среду заменяли свободной от сыворотки нокаутной средой (KO).
Во всех экспериментах по нейроэпителиальной дифференциации мышиный эмбриональные стволовые клетки Sox1-GFP (клеточная линия 46C, предоставленная Tanaka lab) культивировали обычным способом в среде, содержавшей 15% сыворотки (Hyclone) и 106 Ед./мл LIF (Millipore). Перед экспериментом, клетки трипсинизировали и ресуспендировали в нейтральной среде для дифференциации, лишенной каких-либо индукционных сигналов. Композиция N2/B27 была такой, как описано в другом месте (Ying, 2003).
Во всех экспериментах по миграции мезенхимальных стволовых клеток, первичные мультипотентные мезенхимальные стволовые клетки из человеческой плаценты (клетки, предоставленные Ehrbar lab, применяли на пассаже 8), культивировали обычным способом в среде, содержавшей 15% сыворотки (Invitrogen). Планшеты Aggrewell (STEMCELL Technologies SARL) применяли для получения клеточных агрегатов по 250 клеток каждый, которые затем собирали и применяли в экспериментах по инкапсулированию в гель. Для стимуляции миграция в исследовании, к базальной среде добавляли 50 нг/мл PDGF (Peprotech).
Эксперименты с клетками эпителия молочной железы осуществляли с помощью клеточной линии MCF10A, которую культивировали обычным способом в среде роста и дифференцировали, как описано в другом месте (Debnath, 2003). Агрегаты первичных эпителиальных клеток изолировали и дифференцировали с помощью стандартных методик и реагентов, как описано в другом месте (Jin, 2013; Schatz, 2000; Li, 2012; поджелудочной железы, эндометриальные, кишечные, соответственно).
Исследование жизнеспособности
Исследование жизнеспособности осуществляли для сравнения поведения клеток в условиях 2D и 3D. Клетки mESC дикого типа трипсинизировали и высевали на покрытые желатином чашки для ведения культуры (2D) или инкапсулировали в 600 Pa неподверженный деградации (A) гидрогелевый диск (3D) в концентрации 1 M клеток/мл. Инкубацию при 37°C, 5% CO2 осуществляли в течение 4-х часов в +LIF свободных от сыворотки условиях, с последующим окрашиванием для анализа жизнеспособности клеток с помощью анализа на жизнеспособность клеток LIVE/DEAD Cell Viability Assay, следуя инструкции производителя. Проводили обычную (2D) или конфокальную (3D) визуализацию флуоресценции, с последующим подсчетом вручную доли живых (зеленые) против мертвых (красные) клеток в трех независимых образцах.
Роботизированное смешивание и распределение
Для достижения комбинаторной комплексности данного подхода применяли автоматического робота для дозирования жидкостей Hamilton Microlab StarPlus с насадкой Nanopipettor. Все автоматизированные стадии были запрограммированы с помощью компьюторного обеспечения MicroLab Vector Software, версия 4.1.1 (HAMILTON Bonaduz AG, Швейцария). Исходные растворы заранее смешанных стехиометрически сбалансированных растворов PEG, соответствующие четырем пептидам, получали смешиванием предшественника глутамин-PEG (Q-PEG) с четырьмя различными предшественниками лизин-PEG: W-PEG, A-PEG, V-PEG, G-PEG. Каждый из данных четырех исходных растворов разводили до реологически-определенных четырех соответствующих концентраций, необходимых для достижения подобранной целевой жёсткости. Разведение и все последующие стадии способа были выполнены с помощью робота, при этом параметры работы с жидкостями были оптимизированы для каждого класса материалов и проверены измерением массы на весах (данные не показаны). Важно отметить, что 30% от общего конечного объема оставляли пустым (запасной объем) для учета последующего добавления белков, клеток и фактора XIIIa (10% от общего объема для каждого компонента). Данные 16 комбинаций разделяли на аликвоты в 256 лунок 384-луночного планшета. EC и CC белки оттаивали на льду, разводили до концентрации 500 нМ, и помещали в лунки охлажденного 384-луночного планшета. Четыре EC-белка (включая пустой контроль) распределяли в 256 лунок, заполненных предшественниками геля, затем черырьмя белками CC, ортогональном образом, так что получить в конце данной стадии 256 уникальных комбинаций MP, DG, EC и CC (4x4x4x4). 96-луночный планшет готовили со средами, содержавшими три растворимых фактора и пустой контроль: FGF4, BMP4 в концентрации 10 нг/мл (R&D Systems) и LIF в концентрации 106 Ед./мл (Millipore). Клетки трипсинизировали и ресуспендировали в свободной от сыворотки среде в концентрации 1 x 106 клеток/мл и хранили на льду. Одновременно, замороженные аликвоты фактора XIIIa оттаивали и также хранили на льду. Затем последовательно, клетки распределяли в восемь лунок смешанных предшественников геля, за этим сразу же следовало распределение и роботизированное замешивание фактора XIIIa. Немедленно за добавлением фактора XIIIa, но до начала гелеобразования (приблизительно 2-3 мин), применяли 8-канальный Nanopipettor для отбора по 12,5 мкл из каждой лунки и дозирования по 1 мкл в 12 лунок 1536-луночного планшета. Эту процедуру повторяли в общей сложности восемь раз для 1536-луночного планшета (12 x 8 каналов x 8 раз x 12 капель/(канал.время) = 768 капель) для заполнения половины 1536-луночного планшета. На протяжении всей процедуры 1536-луночный планшет охлаждали до 4°C для предотвращения испарения. Закончив раунд распределения геля, 4 различные среды из 96-луночного планшета распределяли в 1536-луночный экспериментальный планшет. Стадии дозирования среды также осуществляли последовательно, и они были синхронизированы таким образом, что сшивание всех гелей происходило в течение приблизительно 30-ти минут. В целом процедура от трипсинизации до завершения дозирования среды занимала два часа, и ее проводили четыре раза для всего эксперимента (4 x 4 полпланшета по 1536 лунки = 3072 лунки).
Для экспериментов по нейроэпителиальной дифференциации, на первой панели, модуляцию растворимых факторов проводили со всеми другими комбинациями, за исключением белков межклеточного взаимодействия. На второй панели, все белки межклеточного взаимодействия протестировали против всех других условий, отличных от растворимых факторов, которые были ограничены условием с FGF4. Данный режим растворимых факторов выбирали, поскольку известно, что он наиболее благоприятен для нейроэпителиальной дифференциации2, в особенности, в ситуации с низкой плотностью клеток, где механизмы аутокринной обратной связи ослаблены. В данном исследовании, чтобы идентифицировать роль внешних факторов независимо от аутокринных механизмов, мы ввели относительно разреженную исходную плотность клеток, равную 200 клеток/мкл, с ежедневной сменой среды.
Измерение механических свойств in situ
В экспериментах, сфокусированных на механических свойствах, была разработана методика измерения жёсткости по вдавливанию в каждой из 384 лунок (не показано). Прибор для испытаний на сжатие (TA.XTPlus Texture Analyze, Stable Micro Systems Ltd) был оснащен выполненным на заказ 1,5 мм в диаметре вдавливающим наконечником. Силу регистрировали между 0 и 70% напряжения. Модуль Юнга рассчитывали по наклону кривой между 20 и 30% напряжения (Elow), с помощью уравнения: E = 2ad / F(1-v2), где a представляет собой радиус цилиндра наконечника индентора (0,75 мм), d представляет собой глубина углубления в мм, F представляет собой зарегистрированную силу в N, и ν предсаляет собой отношение Пуассона, принимаемое равным 0,5.
Диссоциация геля, проточная цитометрия и анализ экспрессии генов
Гели в 384-луночном планшете отмывали в PBS в течение 30-ти минут, затем инкубировали при 37°C с раствором для диссоциации клеток TrypLE Express (Invitrogen) в течение трех циклов по 30 минут. После каждого цикла, клетки собирали, переносили в 96-луночный планшет с круглым дном и хранили при 4°C. В конце способа лунки промывали содержавшей сыворотку средой. В тех случаях, когда осуществляли окрашивание антителами, применяли SSEA-1-AlexaFluor647 (EBiosciences) в соответствии с инструкцией производителя. Клетки анализировали с помощью проточного цитометра Accuri C6 (BD Biosciences). Для PCR, диссоциацию клеток осуществляли с TrypleE Express как описано выше, RNA выделяли с помощью реагента для выделения Tripure (Roche) в соответствии с инструкцией производителя, cDNA синтезировали с помощью набора для синетза cDNA iScript Select (BioRad) и RT-PCR осуществляли, применяя iQ SYBR Green Supermix (BioRad) с помощью прибора Applied Biosystems 7500.
Визуализация
Все визуализации осуществляли с помощью автоматизированной системы визуализации BD Pathway 435 (BD Biosciences). Визуализацию проводили на планшетах с живыми клетками при D1 в канале GFP. Планшеты фиксировали 4% параформальдегидом и окрашивали DAPI при D5, с последующей визуализацией в каналах GFP и DAPI. Применяли такой 4x объектив (Olympus UPlan FLN N.A. 0,13), чтобы вся лунка целиком попадала в единое поле зрения. Даже при таком низком разрешении, можно различить одиночные клетки при D1. На каждом ху позиции, т.е. для каждой лунки, получали шесть изображения через z-стек высотой 800 мкм. Для каждой лунки, данные шесть изображений в каждом канале были сложены в единое дополнительное изображение. 3D информационное содержание всего эксперимента получали в течение менее чем через четыре часа.
Анализ изображений
Все изображения из экспериментов по самообновлению ESC обрабатывали с помощью алгоритмов, разработанных в CellProfiler v.9777 (Broad Institute). Для анализа D1: Вводили сложенные стеки изображений для каждой лунки в канал GFP. Изображениям задавали пороговые значения и сегментировали. Число клеток на лунку представляло собой считывание только показаний, представляющих интерес в настоящем документе. Все сегментации были подтверждены путем визуального осмотра. Для анализа D5: Сложенные стеки изображений для каждой лунки вводили в канал GFP и DAPI. Изображениям DAPI задавали пороговые значения и сегментировали. Идентифицированные области колоний в DAPI применяли как рамки для изображений GFP. Для каждой колонии регистрировали площадь (в пикселях), среднюю (по пикселям колоний) интенсивность DAPI и среднюю интенсивность GFP.
Все изображения из экспериментов по нейроэпителиальной дифференциации обрабатывали с помощью алгоритмов, разработанных в CellProfiler v. 11710 (Broad Institute). Коротко, сложенные стеки изображений для каждой лунки вводили в канал GFP и DAPI. Изображениям DAPI задавали пороговые значения и сегментировали с помощью алгоритма сегментации Otsu Adaptive. Колонии идентифицировали в случае, если они занимали площадь более 8 пикселей (т.е. колонии меньшего размера выбрасывали из дальнейшего анализа). Идентифицированные области колоний в DAPI применяли как рамки для изображений GFP. Для каждой колонии, из этого способа сегментации получали параметры формы, а параметры интенсивность колоний DAPI и GFP для данных колоний получали их исходных, необработанных изображений. Все сегментации были подтверждены путем визуального осмотра.
Обработка данных
Для обработки и визуального изучения данных применяли Matlab R2010b (Mathworks) и Matlab R2010b. Число колонии в D1 и D5, а также число колоний, среднюю площадь колоний (в пикселях) и среднюю интенсивность GFP и DAPI (в условных единицах флуоресценции), все в D5, рассчитывали путем усреднения данных по одиночной колонии для каждой лунки (3072 экспериментальных точек) и для каждого уникального условия (1024 экспериментальных точек). Интенсивность GFP была нормирована на интенсивность DAPI, и площадь была преобразована из пикселей в мм2. Затем данные были сосредоточены вокруг среднего и перестроены на входные условия с получением двумерных цветовых карт, представленных на фигуре 2.
Статистический анализ
Данные из индивидуальных условий вводили в R V2.11. Для площади колонии и нормализованной интенсивности GFP, были определены модели GLM (генерализованные линейные модели), которые принимали во внимание все возможные условия взаимодействия. Процедуру стадии AIC проводили для получения оптимальных моделей, основанных на критерии Акаике. Процедуру GLM в программе SAS v9.0 (SAS Institute) применяли для проверки значимости варьирования площади колонии. Различия в средних LS ± стандартные погрешности с контролем были протестированы на достоверность. Такую же процедуру применяли для объяснения вариабельности в интенсивности GFP. Примененные модели рассматривают эффекты MP, DG, CC, EC и SF, а также взаимодействия, определяемые как значимые. Для всех параметрических испытаний, нормальность остатков и однородность дисперсии рассмотривалт по графикам QQ и Тьюки-Анскомб, соответственно. Для улучшения нормальности остатков применяли Log преобразования. Карту сетевого взаимодействия, где размер узла было линейно пропорционален произведению нормированной площади и нормированной интенсивности GFP, строили в Cytoscape (USCD), и матрицы взаимодействия и кластеризацию выполняли в MeV v.4.4 (TM4 Microarray Suite).
ССЫЛКИ
Andrews, P.W., Fox, V., Gokhale, P.J., Walsh, J.R., Matin, M., and Jones, M. (2008). Cell-cell signaling through NOTCH regulates human embryonic stem cell proliferation. Stem Cells 26, 715-723.
Debnath, J., Muthuswamy, S. K. & Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods 30, 256-268, (2003).
Ehrbar, M., Rizzi, S.C., Schoenmakers, R.G., Miguel, B.S., Hubbell, J.A., Weber, F.E., and Lutolf, M.P. (2007). Biomolecular hydrogels formed and degraded via site-specific enzymatic reactions. Biomacromolecules 8, 3000-3007.
Ehrbar, M., Sala, A., Lienemann, P., Ranga, A., Mosiewicz, K., Bittermann, A., Rizzi, S.C., Weber, F.E., and Lutolf, M.P. (2011). Elucidating the role of matrix stiffness in 3D cell migration and remodeling. Biophys J 100, 284-293.
Engler, A.J., Sen, S., Sweeney, H.L., and Discher, D.E. (2006). Matrix elasticity directs stem cell lineage specification. Cell 126, 677-689.
Flaim, C.J., Chien, S., and Bhatia, S.N. (2005). An extracellular matrix microarray for probing cellular differentiation. Nat Methods 2, 119-125.
Gilbert, P.M., Havenstrite, K.L., Magnusson, K.E., Sacco, A., Leonardi, N.A., Kraft, P., Nguyen, N.K., Thrun, S., Lutolf, M.P., and Blau, H.M. (2010). Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science 329, 1078-1081.
Gin, E., Tanaka, E. M. & Brusch, L. A model for cyst lumen expansion and size regulation via fluid secretion. J Theor Biol 264, 1077-1088, (2010).
Gires, O., Gonzalez, B., Denzel, S., Mack, B., and Conrad, M. (2009). EpCAM Is Involved in Maintenance of the Murine Embryonic Stem Cell Phenotype. Stem Cells 27, 1782-1791.
Gobaa, S., Hoehnel, S., Roccio, M., Negro, A., Kobel, S., and Lutolf, M.P. (2011). Artificial niche microarrays for probing single stem cell fate in high throughput. Nat Methods 8, 949-955.
Griffith, L.G., and Swartz, M.A. (2006). Capturing complex 3D tissue physiology in vitro. Nat Rev Mol Cell Biol 7, 211-224.
Helmlinger, G., Netti, P.A., Lichtenbeld, H.C., Melder, R.J., and Jain, R.K. (1997). Solid stress inhibits the growth of multicellular tumor spheroids. Nat Biotechnol 15, 778-783.
Jin, L. et al. Colony-forming cells in the adult mouse pancreas are expandable in Matrigel and form endocrine/acinar colonies in laminin hydrogel. Proc Natl Acad Sci U S A 110, 3907-3912, (2013).
Khalilian, M., Navidbakhsh, M., Valojerdi, M.R., Chizari, M., and Yazdi, P.E. (2010). Estimating Young's modulus of zona pellucida by micropipette aspiration in combination with theoretical models of ovum. J R Soc Interface 7, 687-694.
Khan, F., Tare, R.S., Kanczler, J.M., Oreffo, R.O.C., and Bradley, M. (2010). Strategies for cell manipulation and skeletal tissue engineering using high-throughput polymer blend formulation and microarray techniques. Biomaterials 31, 2216-2228.
Kraehenbuehl, T.P., Langer, R., and Ferreira, L.S. (2011). Three-dimensional biomaterials for the study of human pluripotent stem cells. Nature Methods 8, 731-736.
LaBarge, M.A., Nelson, C.M., Villadsen, R., Fridriksdottir, A., Ruth, J.R., Stampfer, M.R., Petersen, O.W., and Bissell, M.J. (2009). Human mammary progenitor cell fate decisions are products of interactions with combinatorial microenvironments. Integr Biol (Camb) 1, 70-79.
Lee, S.T., Yun, J.I., Jo, Y.S., Mochizuki, M., van der Vlies, A.J., Kontos, S., Ihm, J.E., Lim, J.M., and Hubbell, J.A. (2010). Engineering integrin signaling for promoting embryonic stem cell self-renewal in a precisely defined niche. Biomaterials 31, 1219-1226.
Li, V. S. & Clevers, H. In vitro expansion and transplantation of intestinal crypt stem cells. Gastroenterology 143, 30-34, (2012).
Lutolf, M.P., and Hubbell, J.A. (2003). Synthesis and physicochemical characterization of end-linked poly(ethylene glycol)-co-peptide hydrogels formed by Michael-type addition. Biomacromolecules 4, 713-722.
Lutolf, M.P., and Hubbell, J.A. (2005). Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat Biotechnol 23, 47-55.
Lutolf, M.P., Lauer-Fields, J.L., Schmoekel, H.G., Metters, A.T., Weber, F.E., Fields, G.B., and Hubbell, J.A. (2003). Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: engineering cell-invasion characteristics. Proc Natl Acad Sci U S A 100, 5413-5418.
Mei, Y., Saha, K., Bogatyrev, S.R., Yang, J., Hook, A.L., Kalcioglu, Z.I., Cho, S.W., Mitalipova, M., Pyzocha, N., Rojas, F., et al. (2010). Combinatorial development of biomaterials for clonal growth of human pluripotent stem cells. Nat Mater 9, 768-778.
Murayama, Y., Mizuno, J., Kamakura, H., Fueta, Y., Nakamura, H., Akaishi, K., Anzai, K., Watanabe, A., Inui, H., and Omata, S. (2006). Mouse zona pellucida dynamically changes its elasticity during oocyte maturation, fertilization and early embryo development. Hum Cell 19, 119-125.
Niwa, H., Burdon, T., Chambers, I., and Smith, A. (1998). Self-renewal of pluripotent embryonic stem cells is mediated via activation of STAT3. Gene Dev 12, 2048-2060.
Niwa, H., Miyazaki, J., and Smith, A.G. (2000). Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat Genet 24, 372-376.
Patterson, J., and Hubbell, J.A. (2010). Enhanced proteolytic degradation of molecularly engineered PEG hydrogels in response to MMP-1 and MMP-2. Biomaterials 31, 7836-7845.
Prudhomme, W., Daley, G.Q., Zandstra, P., and Lauffenburger, D.A. (2004). Multivariate proteomic analysis of murine embryonic stem cell self-renewal versus differentiation signaling. Proc Natl Acad Sci U S A 101, 2900-2905.
Qi, X., Li, T.G., Hao, J., Hu, J., Wang, J., Simmons, H., Miura, S., Mishina, Y., and Zhao, G.Q. (2004). BMP4 supports self-renewal of embryonic stem cells by inhibiting mitogen-activated protein kinase pathways. Proc Natl Acad Sci U S A 101, 6027-6032.
Schatz, F., Soderland, C., Hendricks-Munoz, K. D., Gerrets, R. P. & Lockwood, C. J. Human endometrial endothelial cells: isolation, characterization, and inflammatory-mediated expression of tissue factor and type 1 plasminogen activator inhibitor. Biol Reprod 62,(2000).
Schmeichel, K.L., and Bissell, M.J. (2003). Modeling tissue-specific signaling and organ function in three dimensions. J Cell Sci 116, 2377-2388.
Soen, Y., Mori, A., Palmer, T.D., and Brown, P.O. (2006). Exploring the regulation of human neural precursor cell differentiation using arrays of signaling microenvironments. Mol Syst Biol 2.
Soncin, F., Mohamet, L., Eckardt, D., Ritson, S., Eastham, A.M., Bobola, N., Russell, A., Davies, S., Kemler, R., Merry, C.L., et al. (2009). Abrogation of E-cadherin-mediated cell-cell contact in mouse embryonic stem cells results in reversible LIF-independent self-renewal. Stem Cells 27, 2069-2080.
Yamada, K.M., and Cukierman, E. (2007). Modeling tissue morphogenesis and cancer in 3D. Cell 130, 601-610.
ing, Q.L., Nichols, J., Chambers, I., and Smith, A. (2003). BMP induction of Id proteins suppresses differentiation and sustains embryonic stem cell self-renewal in collaboration with STAT3. Cell 115, 281-292.
Ying, Q. L., Stavridis, M., Griffiths, D., Li, M. & Smith, A. Conversion of embryonic stem cells into neuroectodermal precursors in adherent monoculture. Nat Biotechnol 21, 183-186,(2003).
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Панель, имеющая дискретные объемы микроокружений клеточной культуры, обладающие различными свойствами, влияющими на поведение инкапсулированных клеток, в особенности, на пролиферацию, образование колоний, дифференциацию, миграцию или их комбинации.
6. Панель по п. 1, в которой дискретные объемы микроокружений клеточной культуры включают гидрогели.
7. Панель по любому из п.п. 1 или 2, в которой по меньшей мере, два из дискретных объемов микроокружения клеточной культуры различно подвержены деградации под действием протеиназ, предпочтительно, матриксных металлопротеиназ.
8. Панель по любому из п.п. 1-3, в которой, по меньшей мере, два из дискретных объемов микроокружения клеточной культуры
i) включают различные факторы внеклеточного матрикса; предпочтительно выбираемые из группы, состоящей из пептидов, белков, полисахаридов и их комбинаций; наиболее предпочтительно те, которые выбирают из группы, состоящей из ламининов, коллагенов, эластинов, фибронектина, эластина, протеогликанов, полисахаридов, не представляющих собой протеогликаны, матрицеллюлярных белков, матрицеллюлярных белков типа SPARC (кислый и богатый цистеинами секретируемый белок), тенасцинов, тромбоспондинов и их комбинаций; и/или
ii) включают различные факторы межклеточного взаимодействия; предпочтительно выбираемые из группы, состоящей из пептидов, белков, полисахаридов и их комбинаций; наиболее предпочтительно, из кадгеринов, селектинов, молекул клеточной адгезии (CAM), в особенности, ICAM и VCAM, компонентов системы трансмембранной клеточной сигнализации или их комбинаций; и/или
iii) включают различных факторы клеточной сигнализации; предпочтительно выбираемые из следующей группы: факторы роста или морфогены развития; наиболее предпочтительно, выбираемые из следующей группы: адреномедуллин (AM), ангиопоэтин (Ang), аутокринный фактор миграции, костные морфогенетические белки (BMP), нейротрофический фактор из тканей мозга (BDNF), эпидермальный фактор роста (EGF), эритропоэтин (EPO), фактор роста фибробластов (FGF), нейротрофический фактор глиальной клеточной линии (GDNF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцит-макрофаг колониестимулирующий фактор (GM-CSF), фактор роста и дифференцировки-9 (GDF9), фактор роста гепатоцитов (HGF), фактор роста из гепатомы (HDGF), инсулиноподобный фактор роста (IGF), фактор ингибирования лейкоза (LIF), стимулирующий миграцию фактор, миостатин (GDF-8), нейротрофины, в особенности фактор роста нервов (NGF), тромбоцитарный фактор роста (PDGF), тромбопоэтин (TPO), трансформирующий фактор роста альфа (TGF-α), трансформирующий фактор роста бета (TGF-β), фактор некроза опухолей-альфа (TNF-α), фактор роста эндотелия сосудов (VEGF), плацентарный фактор роста (PlGF), цитокины, хемокины и их комбинации; и/или
iv) имеют различную жёсткость.
9. Панель по любому из п.п. 1-4, в которой микроокружения клеточных культур строятся из молекул-предшественников, способных к образованию поперечных связей в совместимой с клетками реакции(совместимых с клетками реакциях), на основании
- образования ковалентной связи, которую выбирают из группы, состоящей из
- энзиматических реакций, предпочтительно зависящих от активированного фактора трансглутаминазы XIIIa; и
- неэнзиматических и/или некаталитических реакций, предпочтительно, реакции присоединения по Михаэлю; и/или
- образования нековалентной связи.
10. Панель по любому из п.п. 1-5, в которой микроокружения клеточных культур строятся из линейных или разветвленных гидрофобных полимеров, наиболее предпочтительно, разветвленных молекул поли(этиленгликоля).
11. Способ изготовления панели по п.п. 1-6, включающий следующие стадии
- обеспечение одной или нескольких молекул-предшественников гидрогеля;
- комбинирование и распределение различных комбинаций молекул-предшественников гидрогеля в соответствии со стадией a) на дискретных объемах подложки, предпочтительно, на многолуночном планшете;
- добавление к указанным дискретным объемам указанной подложки одной или нескольких биологически активных молекул и присоединение указанных молекул или, по меньшей мере, к одной присутствующей молекуле-предшественнику гидрогеля, или к гидрогелю, образованному на стадии e), или обеспечение для них свободной диффузии;
- добавление клеток на/в указанные дискретные объемы подложки; и
- сшивание указанных молекул-предшественников гидрогеля с образованием гидрогелевого матрикса.
17. Способ по п. 8, в котором на стадии c) добавляют одну или несколько биологически активных молекул, которые выбирают из следующей группы: факторы внеклеточного матрикса, факторы межклеточного взаимодействия и факторы системы клеточных сигналов.
18. Комбинаторный способ тестирования влияния композиций гидрогеля на характер клеточного роста, включающий:
- обеспечение одной или нескольких молекул-предшественников гидрогеля;
- комбинирование и распределение различных комбинаций молекул-предшественников гидрогеля в соответствии со стадией a) на/в дискретные объемы подложки, предпочтительно, многолуночного планшета;
- последующее добавление к указанным дискретным объемам указанной подложки одной или нескольких биологически активных молекул, и присоединение указанных молекул или, по меньшей мере, к одной из присутствующих молекул-предшественников гидрогеля, или к гидрогелю, образованному на стадии e), или обеспечение для них свободной диффузии;
- добавление клеток на/в указанные дискретные объемы подложки;
- сшивание указанных молекул-предшественников гидрогеля с образованием гидрогелевого матрикса;
- обеспечение роста указанных клеток в указанных дискретных объемах указанного гидрогелевого матрикса;
- мониторинг указанных клеток на протяжении стадии f) с течением времени;
- определение поведения для различных микроокружений клеточных культур, в котором поведение предпочтительно выбирают из группы, состоящей из степени пролиферации, образования колоний, дифференциации, миграции или их комбинаций;
- при необходимости, определение синергетических и/или антагонистических эффектов друг на друга биологически активных молекул и/или механических свойств и/или чувствительности к энзиматической деградация дискретного микроокружения клеточных культур, предпочтительно, под действием протеиназ;
- при необходимости, идентификация специфической композиции гидрогеля или диапазона композиций гидрогеля, определяющих поведение конкретных клеток;
- при необходимости, выделение клеток, по меньшей мере, из одного гидрогелевого микроокружения клеточных культур для дальнейшего анализа, предпочтительно, фенотипического анализа, или для непрерывного культивирования клеток или пассирования.
30. Комбинаторный способ по п. 9, в котором одну или несколько биологически активных молекул стадии c) выбирают из следующей группы: факторы внеклеточного матрикса, факторы межклеточного взаимодействия и факторы системы клеточных сигналов.
31. Набор компонентов для изготовления панели, имеющей дискретные объемы гидрогеля, по любому из п.п. 1-6, включающий в качестве компонентов
- одну или несколько молекул-предшественников гидрогеля;
- одну или несколько биологически активных молекул;
- необязательно, по меньшей мере, один сшивающий агент для молекул-предшественников a); и
- инструкции по применению указанных компонентов, предпочтительно в соответствии со способом по любому из п.п. 7-10.
36. Набор по п. 11, в котором
- молекулу(молекулы) компонента b) выбирают из следующей группы: факторы внеклеточного матрикса, факторы межклеточного взаимодействия и/или факторы системы клеточных сигналов; и/или
- фактор XIIIa включают в качестве компонента c).
39. Набор по любому из п.п. 11 или 12, в котором молекулы-предшественники гидрогеля компонента a) включают или состоят из молекул поли(этиленгликоля) с разветвлённой структурой.
40. Набор по любому из п.п. 11-13, в котором, по меньшей мере, две молекулы-предшественники гидрогеля обеспечивают в качестве компонента a), которые способны к образованию поперечных связей под действием фермента, предпочтительно, включенного в качестве компонента c); предпочтительно, одна, по меньшей мере, из двух молекул-предшественников гидрогеля фунционализована глутамин-несущим пептидным субстратом, а другая лизин-несущим пептидным субстратом для сшивающего фермента, и трансглутаминазу фактор XIIIa включают в качестве компонента c).
41. Набор по любому из п.п. 11-14, в котором, по меньшей мере, молекулы-предшественники гидрогеля компонента a) обеспечивают заранее поставленными в лунки многолуночного планшета в существенно непрореагировавшей форме, предпочтительно, в сухой форме.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ТРАНСПЛАНТАЦИИ КЛЕТОК ИЗ ПЛОТНЫХ ТКАНЕЙ | 2011 |
|
RU2574364C2 |
| СПОСОБ ПРИВИВКИ КЛЕТОК ПЕЧЕНИ СУБЪЕКТУ С ЗАБОЛЕВАНИЕМ ИЛИ ДИСФУНКЦИЕЙ ПЕЧЕНИ | 2011 |
|
RU2736955C2 |
| КОМПОЗИЦИИ ТРАНСПЛАНТАТА ДЛЯ ПЕРЕСАДКИ КЛЕТОК | 2018 |
|
RU2828021C2 |
| 3D IN VITRO ДВУХФАЗНЫЙ КОСТНО-ХРЯЩЕВОЙ КОНСТРУКТ | 2013 |
|
RU2615439C2 |
| ИСКУССТВЕННЫЕ ТКАНИ ПЕЧЕНИ, МАТРИКСЫ ИСКУССТВЕННЫХ ТКАНЕЙ И СПОСОБЫ ИХ ИЗГОТОВЛЕНИЯ | 2014 |
|
RU2625016C2 |
| Способ индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированного матрикса зуба и периодонтальной связки человека | 2022 |
|
RU2813729C1 |
| МАТЕРИАЛ ДЛЯ КУЛЬТУР КЛЕТОК, ПОЛУЧЕННЫЙ ИЗ РАСТЕНИЙ | 2011 |
|
RU2597978C2 |
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ЭПИТЕЛИАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ОРГАНОИДОВ, СОДЕРЖАЩИХ УКАЗАННЫЕ СТВОЛОВЫЕ КЛЕТКИ | 2010 |
|
RU2555545C2 |
| УСТРОЙСТВО И СПОСОБЫ ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2017 |
|
RU2741806C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГОМОГЕННОЙ ПОПУЛЯЦИИ СТВОЛОВЫХ КЛЕТОК И ЕЕ ПРИМЕНЕНИЕ | 2007 |
|
RU2433172C2 |
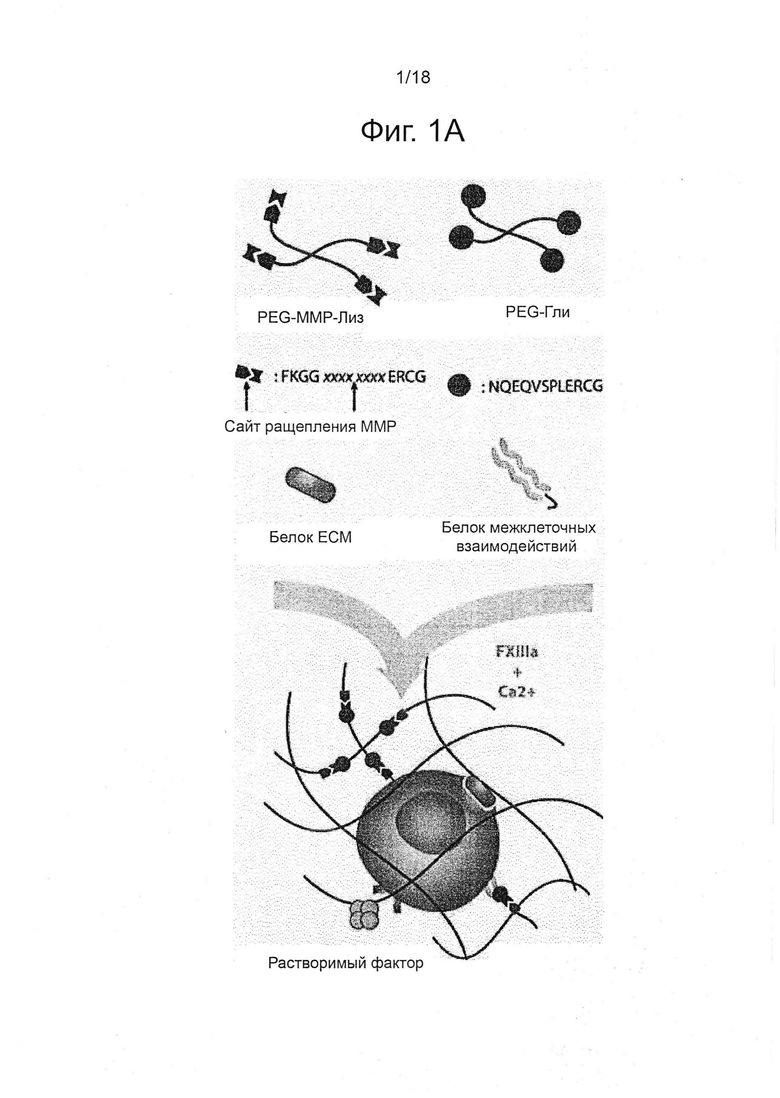
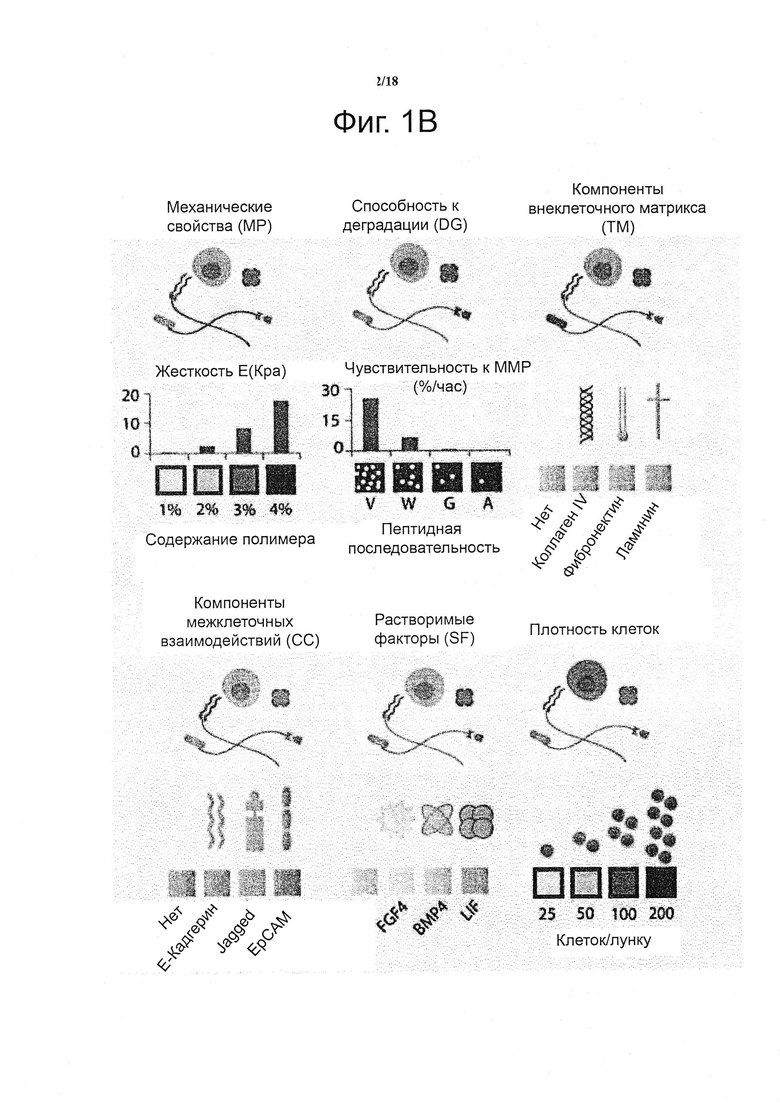
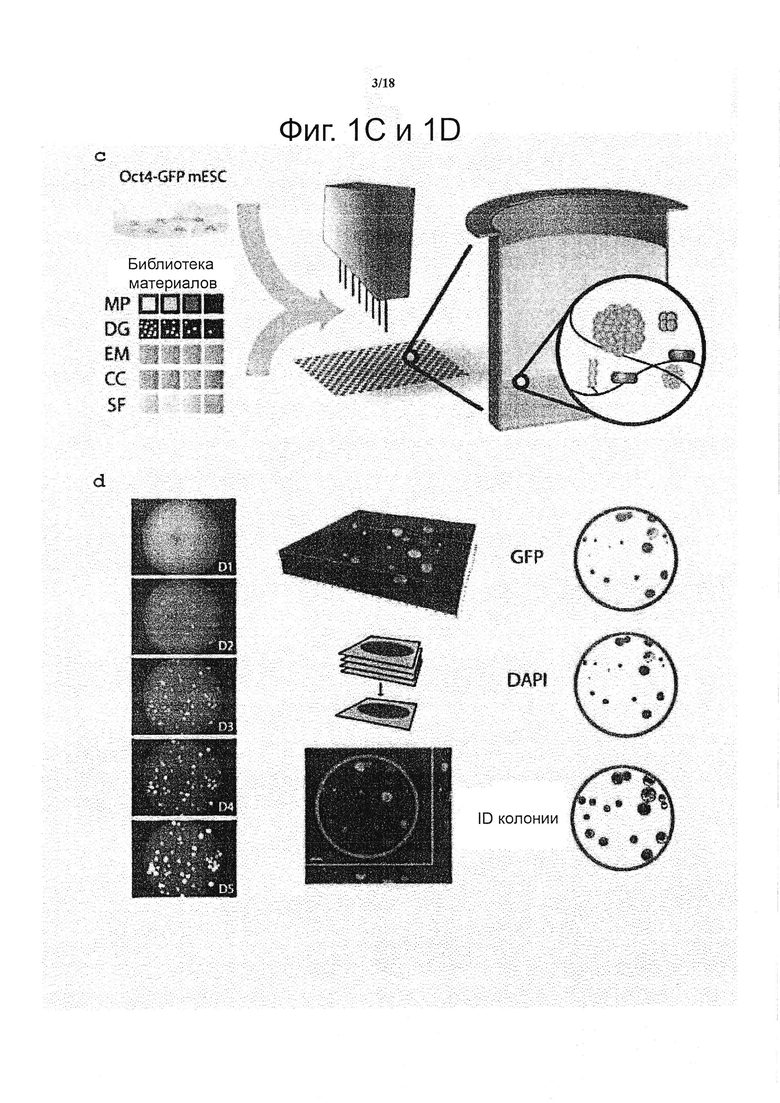
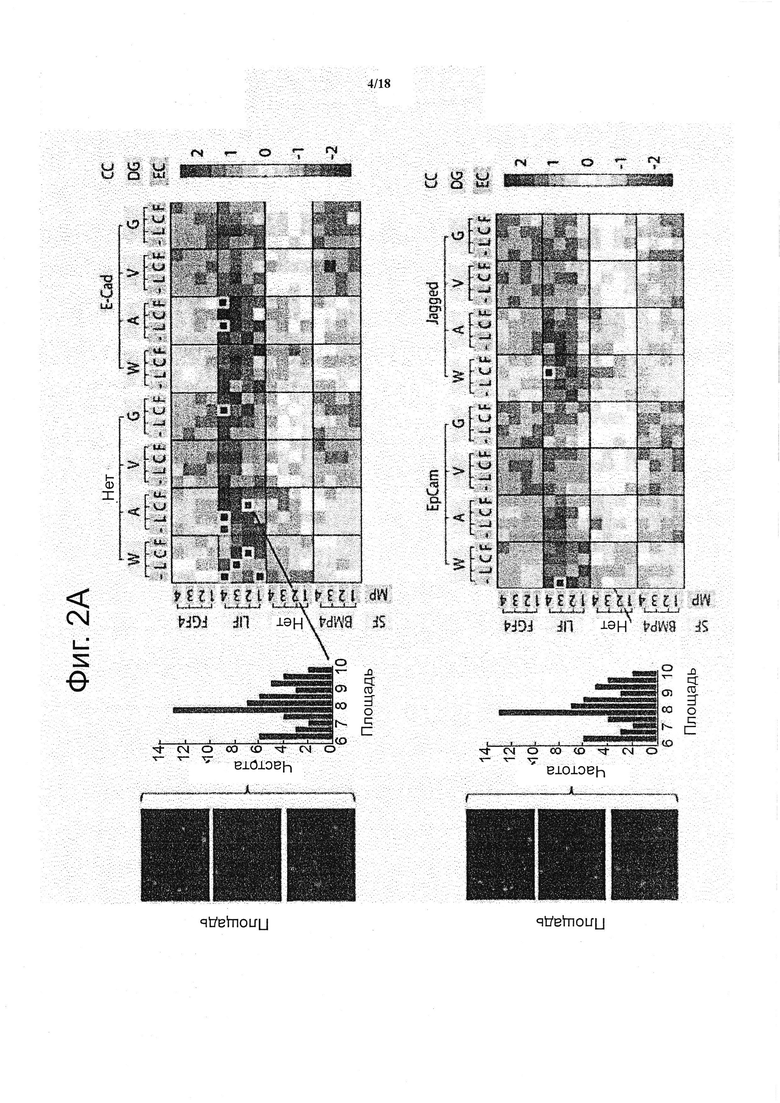
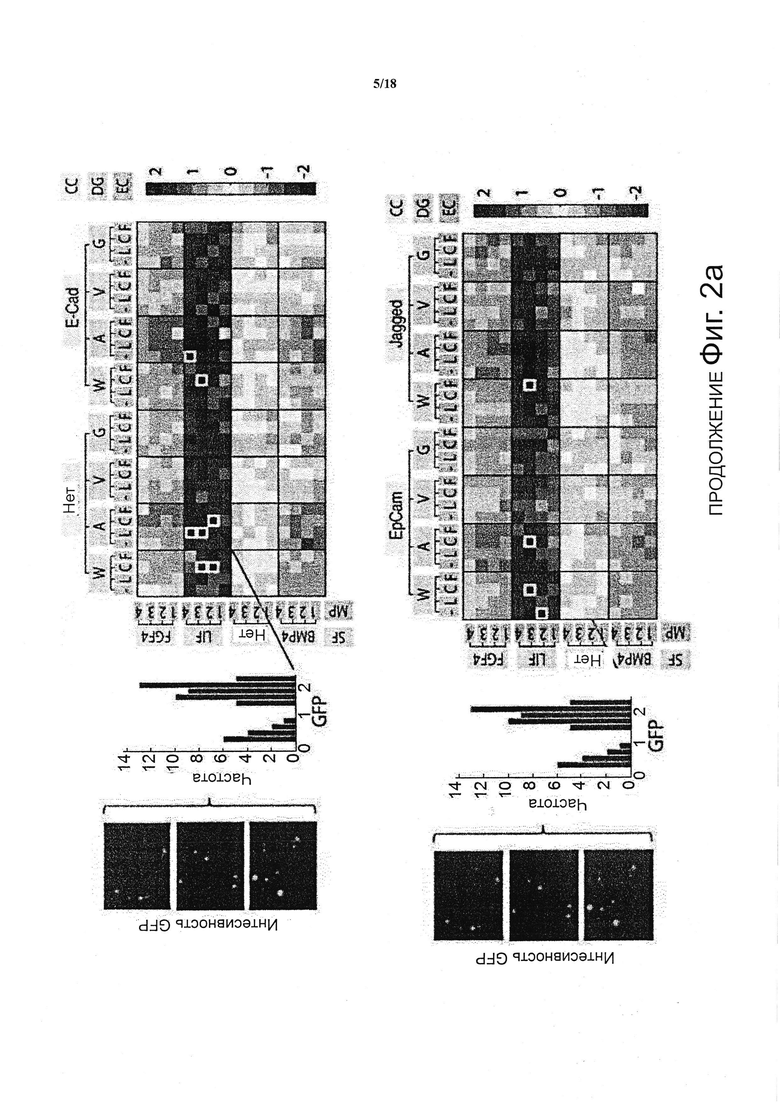
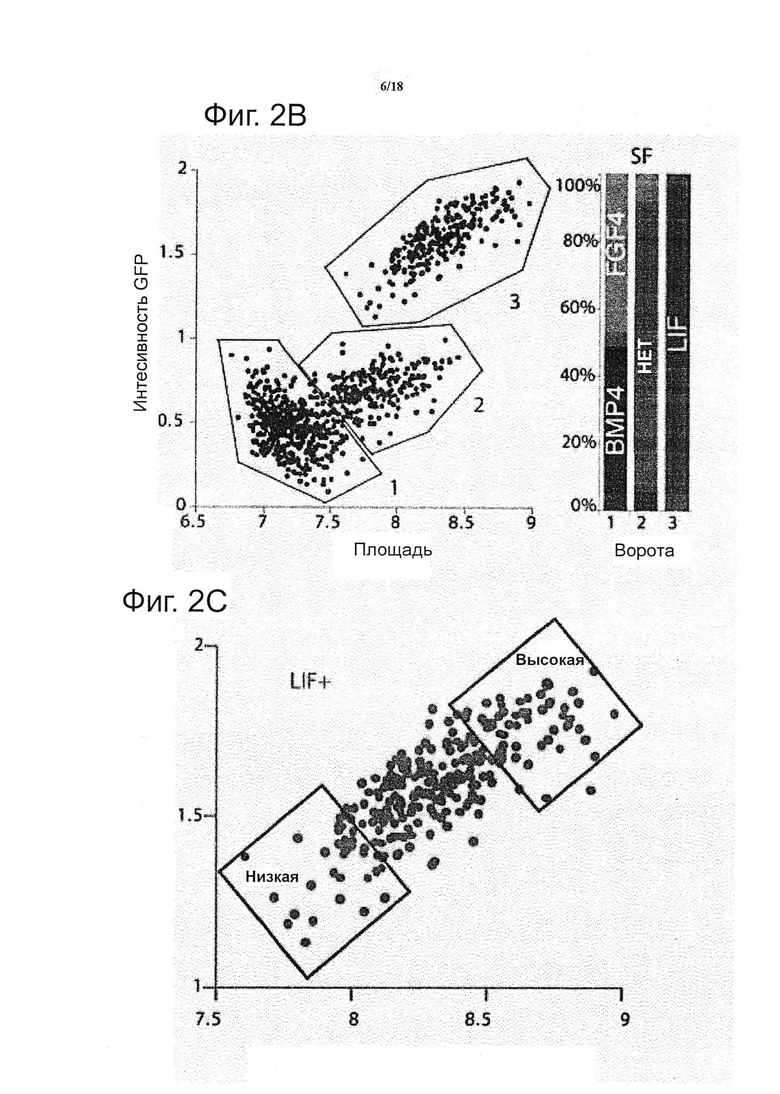
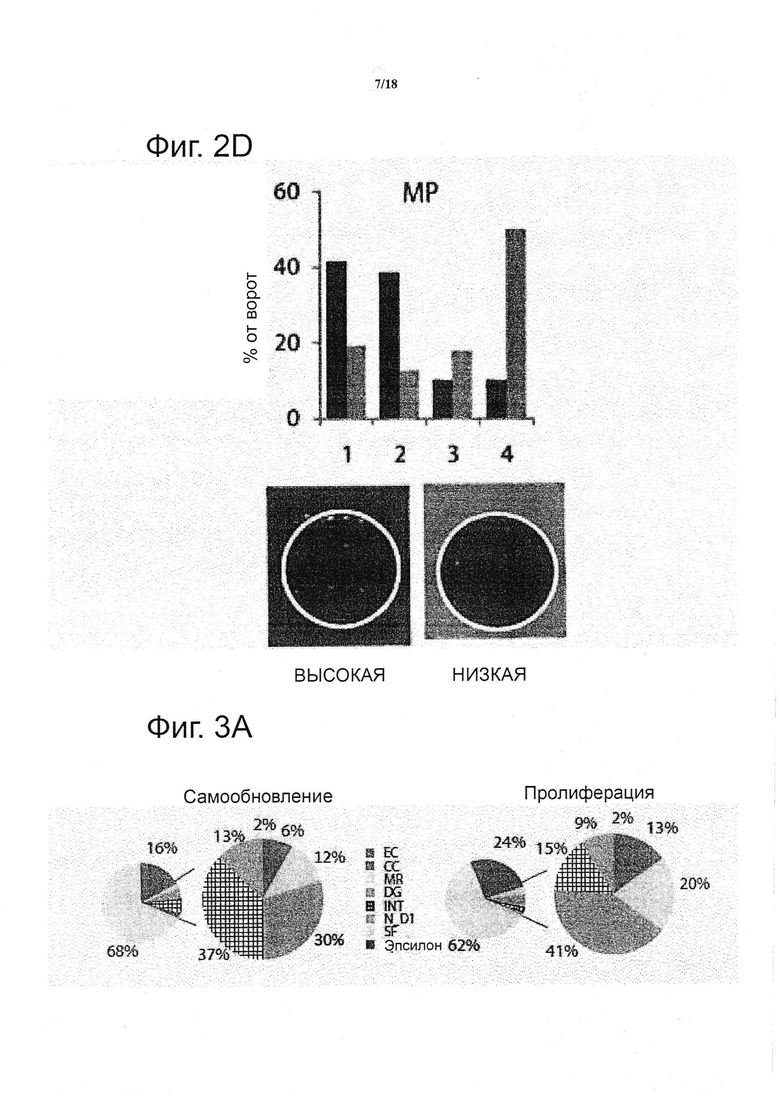

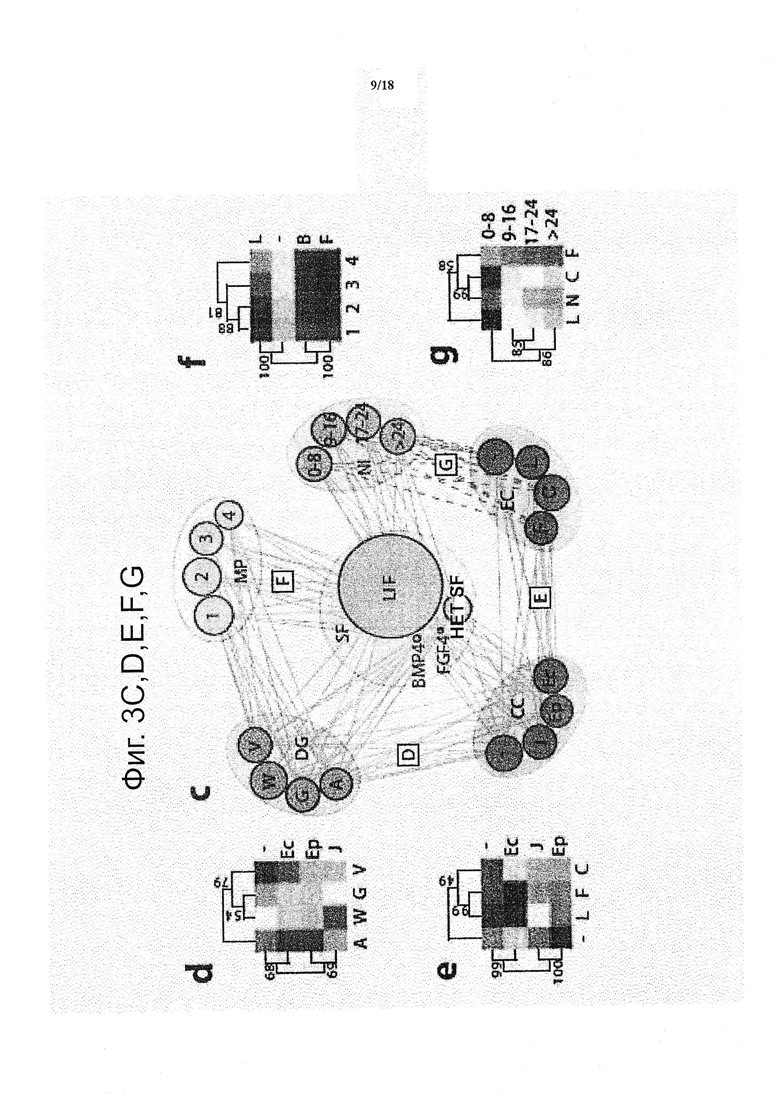
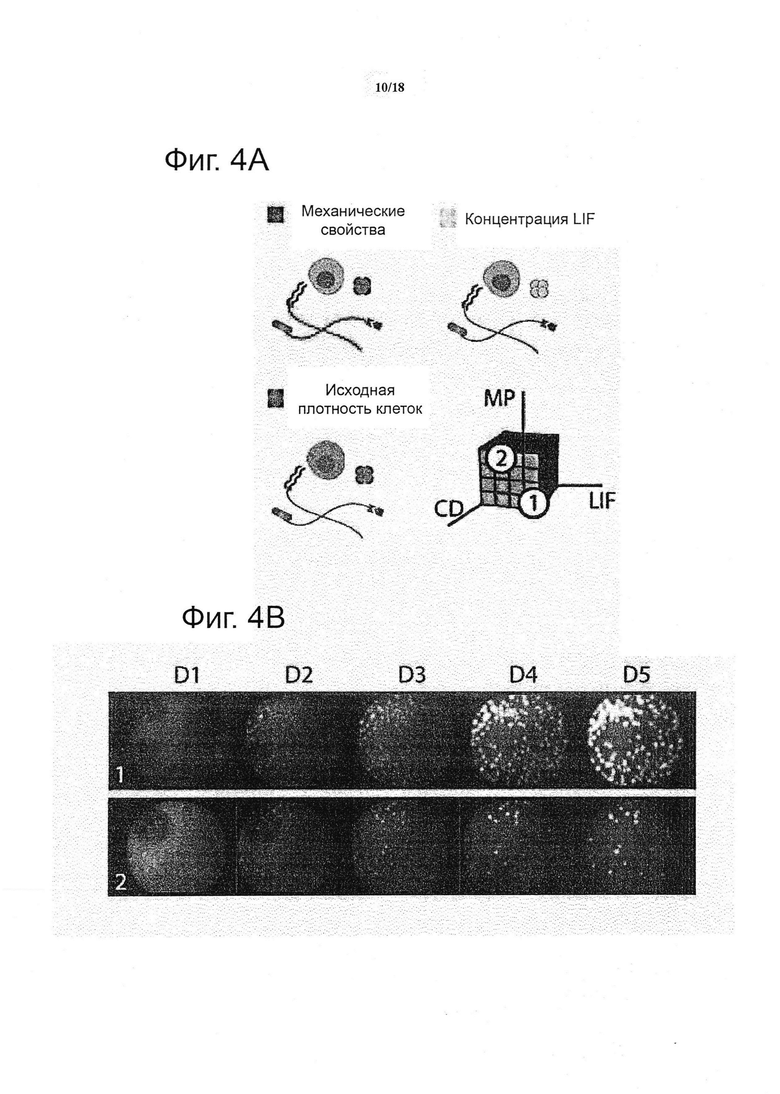
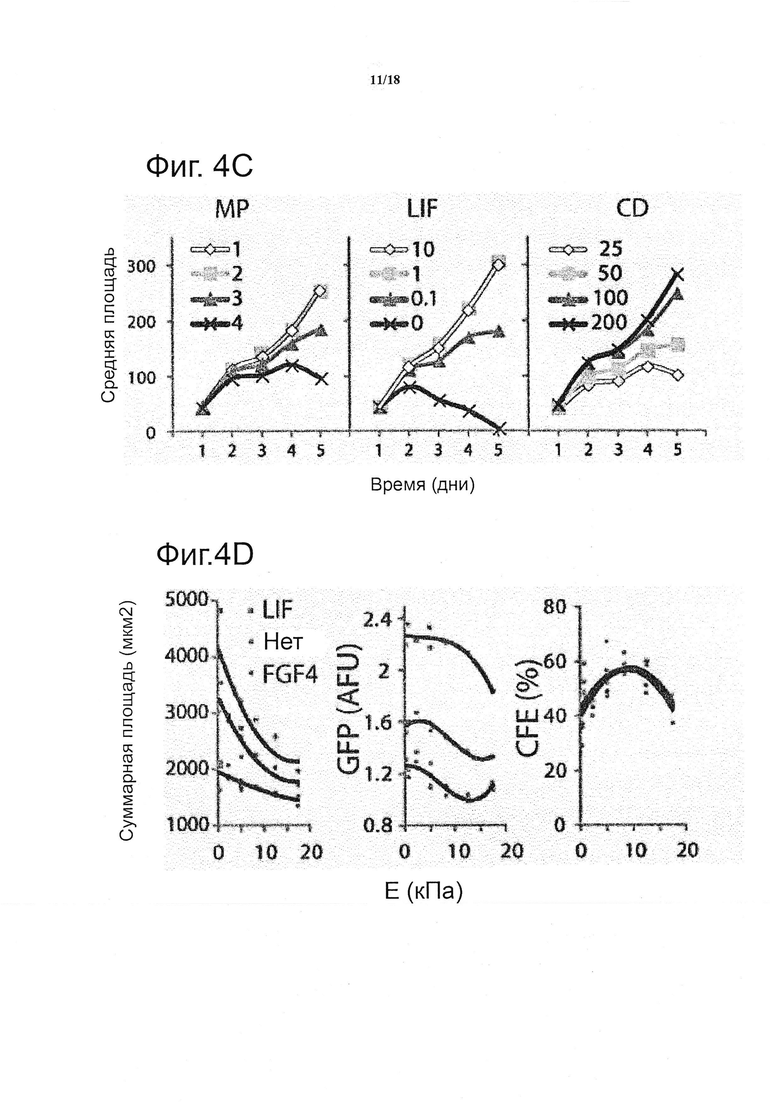
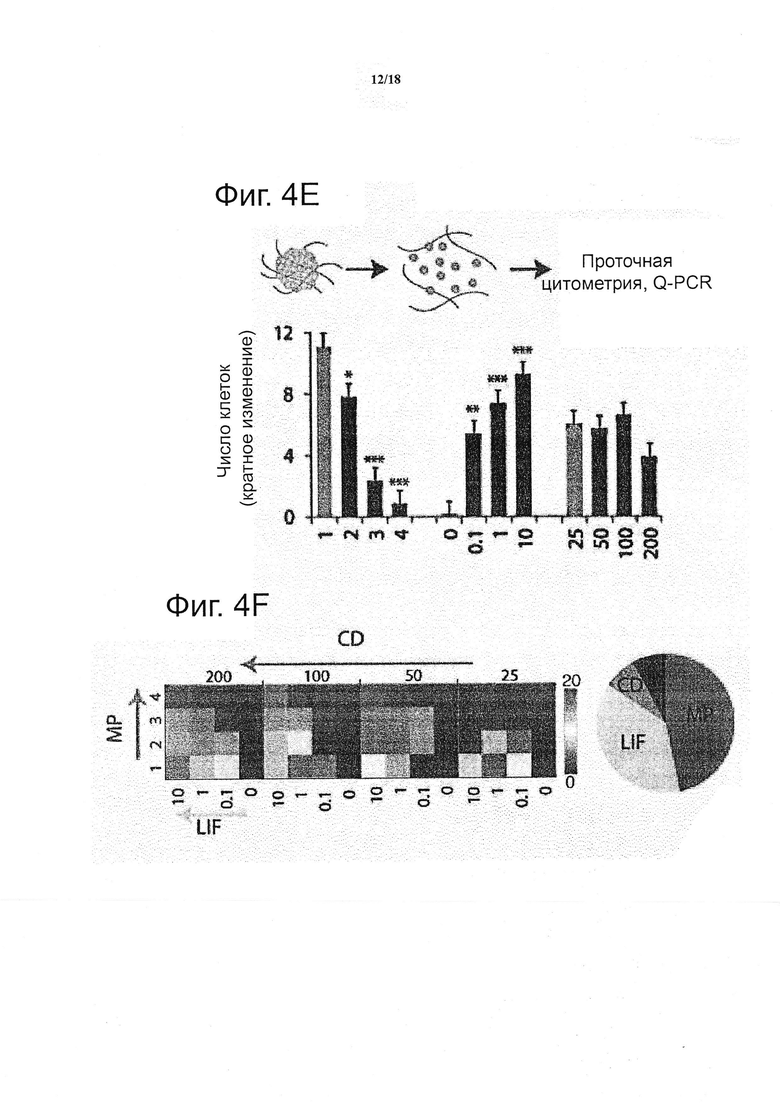
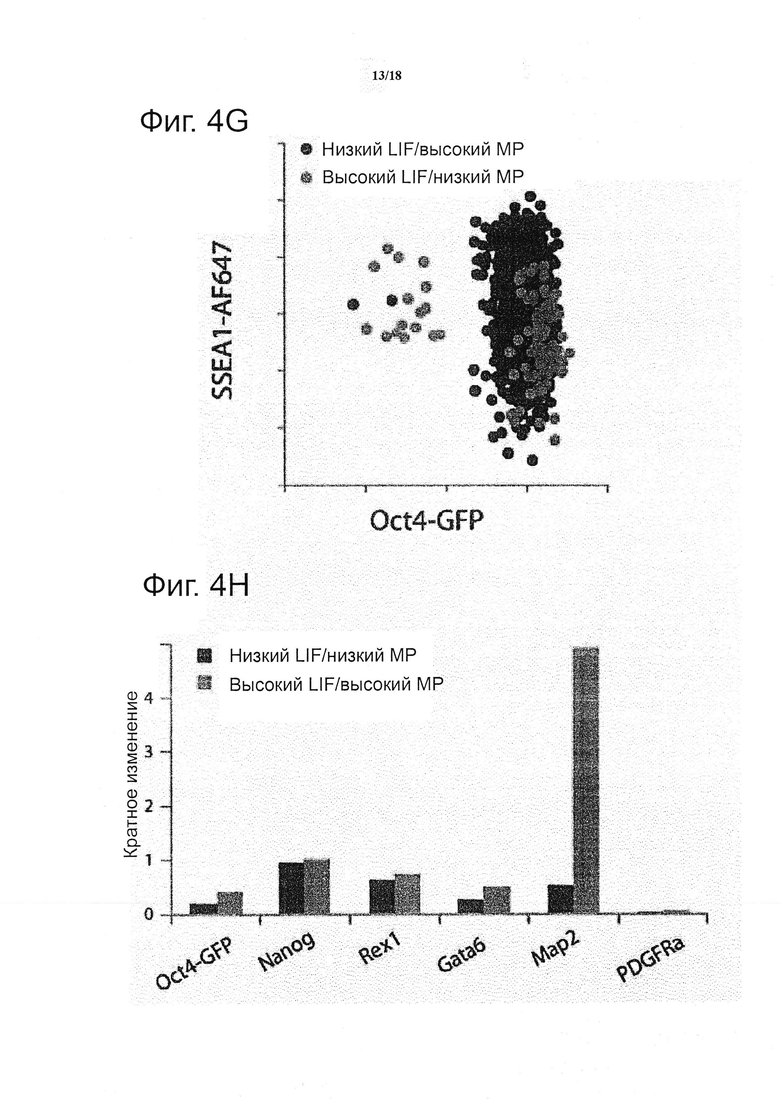
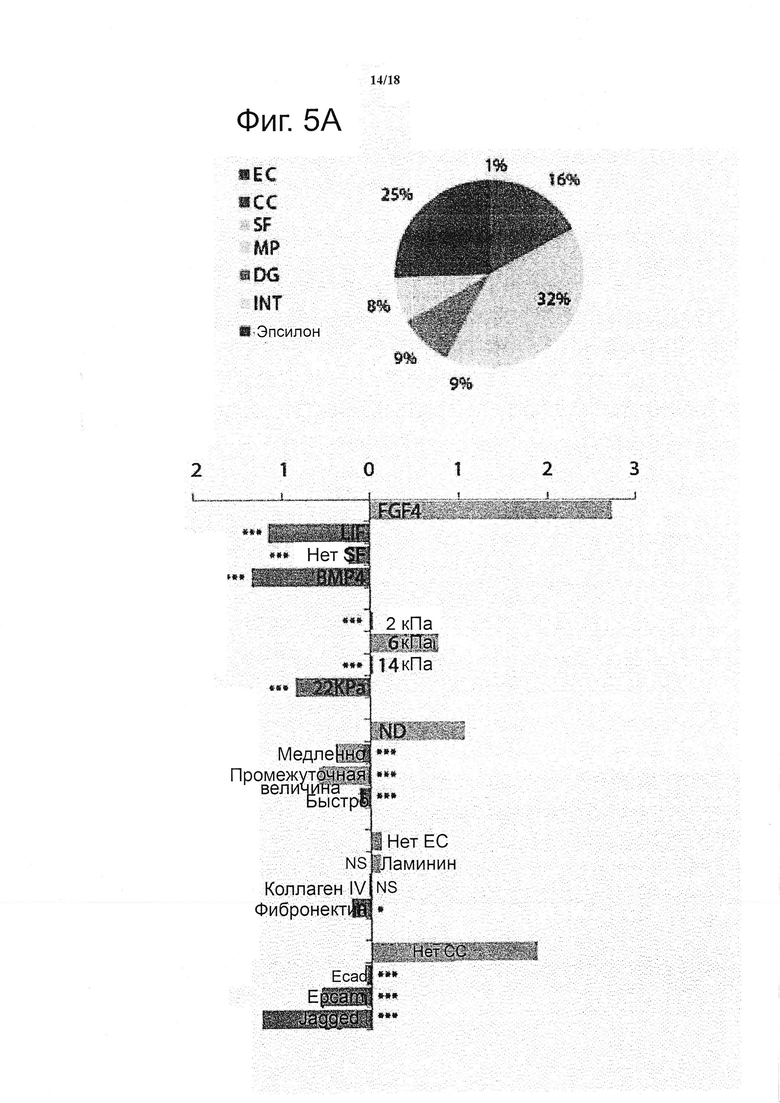
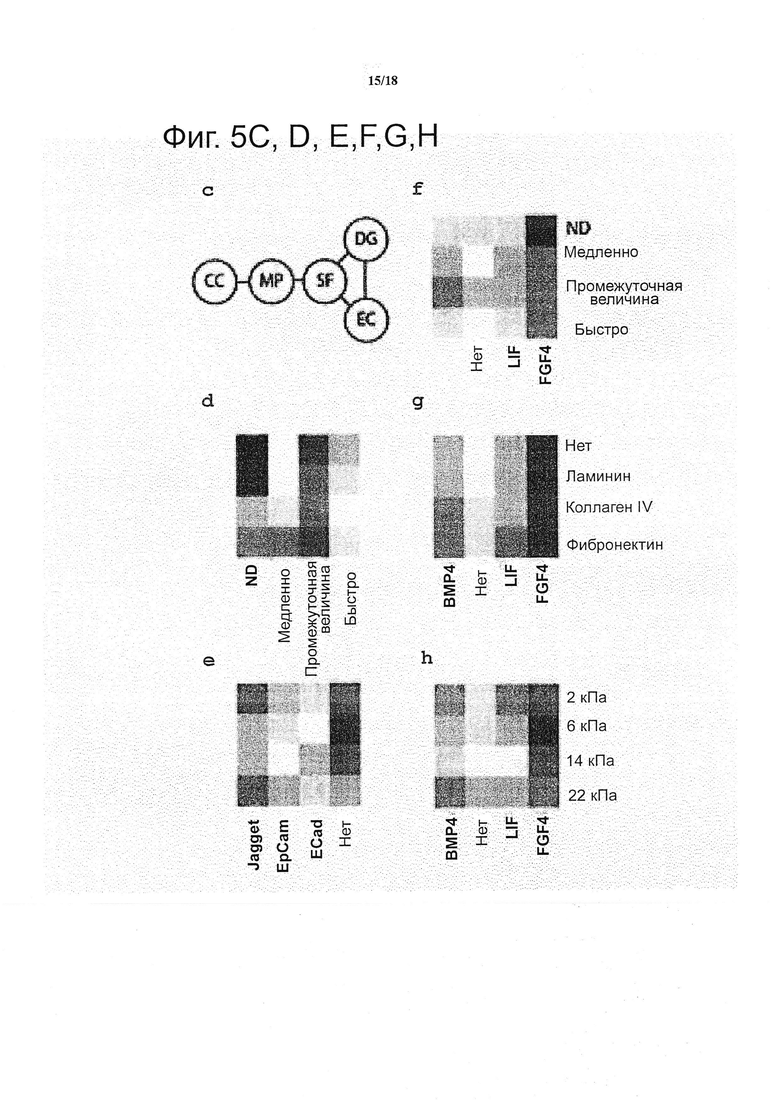
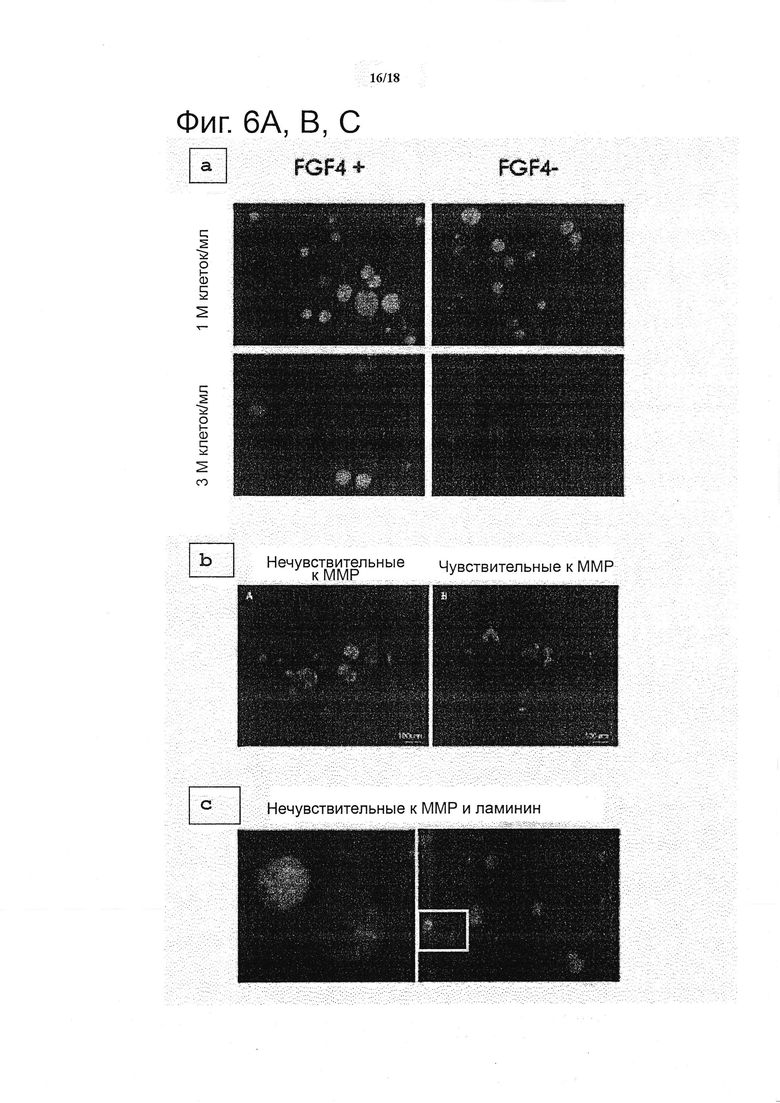
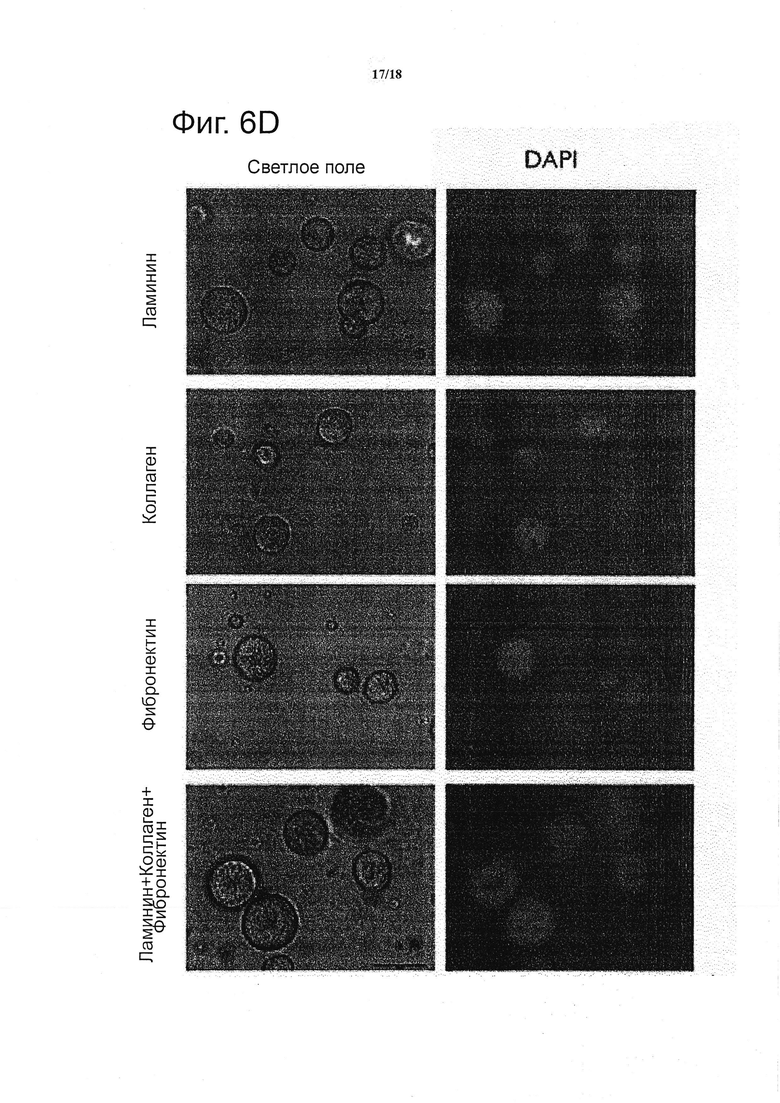
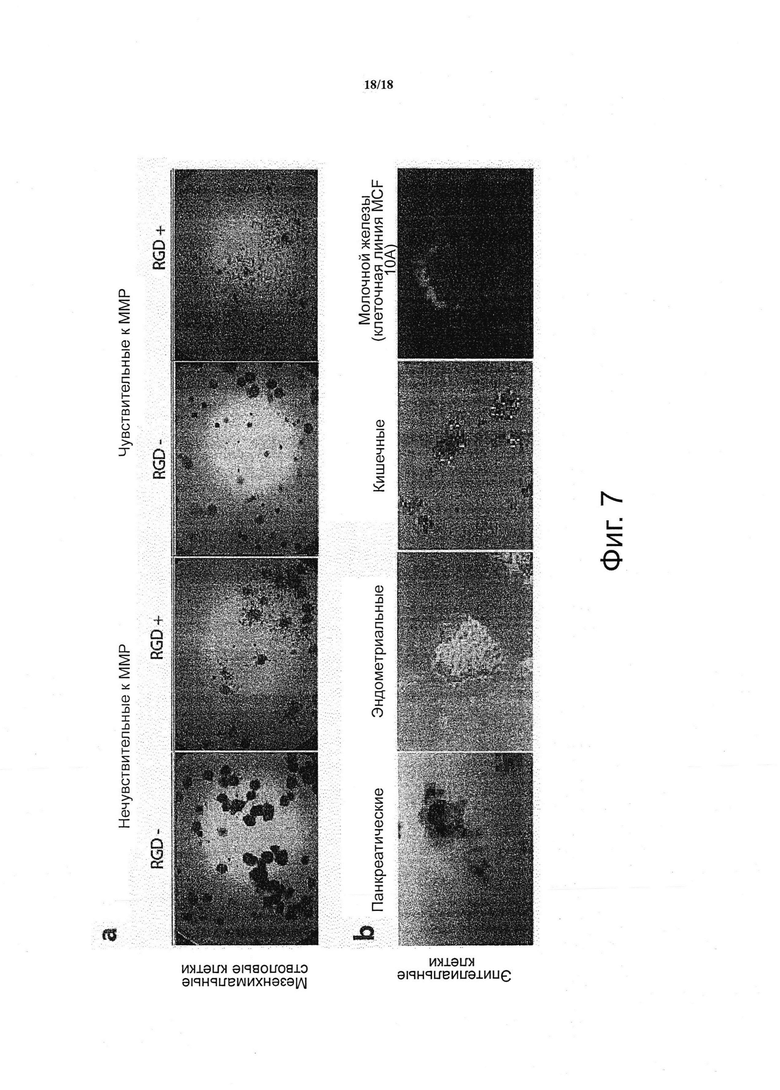
Группа изобретений относится к панелям дискретных объемов микроокружений клеточных культур, обладающих различными свойствами, к способу и набору для изготовления таких панелей и к комбинаторному способу тестирования влияния композиций гидрогеля на характер клеточного роста. Способ изготовления панели включает обеспечение более чем одной молекулы-предшественника гидрогеля различного типа, не являющейся предшественниками гидрогелевых сетей, основанных на белках или сахарах, и представляющей собой разветвленные гидрофильные молекулы поли(этиленгликоля) с молекулярной массой от 10 до 40 кДа, имеющие от 3 до 8 ответвлений, в диапазоне концентраций между 1 и 10% (масс./об.), и необязательно по меньшей мере одного перекрестно сшивающего агента. Комбинируют и распределяют молекулы-предшественники гидрогеля и необязательно по меньшей мере один перекрестно сшивающий агент на дискретных объемах подложки на многолуночном планшете в автоматическом режиме. Добавляют одну или несколько биологически активных молекул. Присоединяют указанные молекулы по меньшей мере к одной присутствующей молекуле-предшественнику гидрогеля или к образованному гидрогелю или обеспечивают их свободную диффузию. Добавляют клетки на/в указанные дискретные объемы многолуночного планшета. Сшивают молекулы-предшественники гидрогеля путем реакции, катализируемой энзиматически, или реакцией присоединения по Михаэлю, с образованием гидрогелевого матрикса. Изобретения позволяют получать панель дискретных объемов микроокружений клеточных культур в автоматическом режиме с контролируемой полимеризацией и осуществлять быструю идентификацию микроокружений клеточных культур, контролирующих желаемые модели поведения клеток. 4 н. и 5 з.п. ф-лы, 7 ил.
1. Способ изготовления панели, которая имеет дискретные объемы микроокружений клеточной культуры, обладающие различными свойствами, влияющими на поведение инкапсулированных клеток, включающий следующие стадии:
а) обеспечение более чем одной молекулы-предшественника гидрогеля различного типа, причем молекулы-предшественники не являются предшественниками гидрогелевых сетей естественного происхождения, основанных на белках или сахарах и представляют собой разветвленные гидрофильные молекулы поли(этиленгликоля) с молекулярной массой от 10 до 40 кДа, имеющие от 3 до 8 ответвлений, в диапазоне концентраций между 1 и 10% (масс./об.), и необязательно,по меньшей мере одного перекрестно сшивающего агента, для строительства микроокружения клеточных культур;
b) комбинирование и распределение различных комбинаций молекул-предшественников гидрогеля и необязательно по меньшей мере одного перекрестно сшивающего агента в соответствии со стадией a) на дискретных объемах подложки на многолуночном планшете в автоматическом режиме;
c) добавление к указанным дискретным объемам многолуночного планшета одной или нескольких биологически активных молекул и присоединение указанных молекул или по меньшей мере к одной присутствующей молекуле-предшественнику гидрогеля, или к гидрогелю, образованному на стадии e), или обеспечение для них свободной диффузии;
d) добавление клеток на/в указанные дискретные объемы многолуночного планшета; и
e) сшивание указанных молекул-предшественников гидрогеля путем реакции, катализируемой энзиматически или от реакции присоединения по Михаэлю, с образованием гидрогелевого матрикса.
2. Способ по п. 1, в котором на стадии c) добавляют одну или несколько биологически активных молекул, которые выбирают из следующей группы: факторы внеклеточного матрикса, факторы межклеточного взаимодействия и факторы системы клеточных сигналов.
3. Комбинаторный способ тестирования влияния композиций гидрогеля на характер клеточного роста, включающий:
a) обеспечение более чем одной молекулы-предшественника гидрогеля различного типа, причем молекулы-предшественники не являются предшественниками гидрогелевых сетей естественного происхождения, основанных на белках или сахарах, и представляют собой разветвленные гидрофильные молекулы поли(этиленгликоля) с молекулярной массой от 10 до 40 кДа, имеющие от 3 до 8 ответвлений, в диапазоне концентраций между 1 и 10% (масс./об.), и необязательно по меньшей мере одного перекрестно сшивающего агента, для строительства микроокружения клеточных культур;
b) комбинирование и распределение различных комбинаций молекул-предшественников гидрогеля и необязательно по меньшей мере одного перекрестно сшивающего агента в соответствии со стадией a) на/в дискретные объемы многолуночного планшета в автоматическом режиме;
c) последующее добавление к указанным дискретным объемам указанного многолуночного планшета одной или нескольких биологически активных молекул и присоединение указанных молекул или по меньшей мере к одной из присутствующих молекул-предшественников гидрогеля, или к гидрогелю, образованному на стадии e), или обеспечение для них свободной диффузии;
d) добавление клеток на/в указанные дискретные объемы многолуночного планшета;
e) сшивание указанных молекул-предшественников гидрогеля путем реакции, катализируемой энзиматически или от реакции присоединения по Михаэлю, с образованием гидрогелевого матрикса;
f) обеспечение роста указанных клеток в указанных дискретных объемах указанного гидрогелевого матрикса;
g) мониторинг указанных клеток на протяжении стадии f) с течением времени;
h) определение поведения для различных микроокружений клеточных культур.
4. Комбинаторный способ по п. 3, в котором одну или несколько биологически активных молекул стадии c) выбирают из следующей группы: факторы внеклеточного матрикса, факторы межклеточного взаимодействия и факторы системы клеточных сигналов.
5. Набор компонентов для изготовления панели, имеющей дискретные объемы гидрогеля, обладающие различными свойствами, влияющими на поведение инкапсулированных клеток, способом по любому из пп. 1-4, включающий в качестве компонентов:
a) более чем одну молекулу-предшественника гидрогеля различного типа, где молекула-предшественник представляет собой разветвленную гидрофильную молекулу поли(этиленгликоля) с молекулярной массой от 10 до 40 кДа, имеющую от 3 до 8 ответвлений, в диапазоне концентраций между 1 и 10% (масс./об.);
b) одну или несколько биологически активных молекул;
c) необязательно по меньшей мере один перекрестно сшивающий агент для молекул-предшественников a); и
d) инструкции по применению указанных компонентов в способе по любому из пп. 1-4.
6. Набор по п. 5, в котором
- молекулу (молекулы) компонента b) выбирают из следующей группы: факторы внеклеточного матрикса, факторы межклеточного взаимодействия и/или факторы системы клеточных сигналов; и/или
- фактор XIIIa включают в качестве компонента c).
7. Набор по любому из пп. 5 или 6, в котором по меньшей мере две молекулы-предшественники гидрогеля обеспечивают в качестве компонента a), которые способны к образованию поперечных связей под действием фермента.
8. Набор по любому из пп. 5 или 6, в котором по меньшей мере молекулы-предшественники гидрогеля компонента a) обеспечивают заранее поставленными в лунки многолуночного планшета в существенно непрореагировавшей форме.
9. Панель для тестирования влияния композиций гидрогеля на характер клеточного роста, имеющая дискретные объемы микроокружений клеточной культуры, обладающие различными свойствами, влияющими на поведение инкапсулированных клеток, получаемая способом по любому из пп. 1 или 2, которая создается и хранится в многолуночном планшете из 96, 256, 384 или 1536 лунок.
| YANG P | |||
| J | |||
| ET AL | |||
| "Modulation of Mesenchymal Stem Cell Shape in Enzyme-Sensitive Hydrogels Is Decoupled from Upregulation of Fibroblast Markers Under Cyclic Tension", Tissue Engineering Part A, 1 November 2012, v.18, no | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| RAZA A | |||
| ET AL | |||
| "The influence of matrix properties on growth and morphogenesis of human pancreatic ductal | |||
Авторы
Даты
2020-04-08—Публикация
2014-05-08—Подача