Область техники
Настоящее изобретение относится к антителу, которое связывается с человеческим ILT7.
Уровень техники изобретения
Интерферон α (далее упоминаемый как ИФНα, интерферон - как ИФН) и интерферон β (ИФНβ) известны как ИФН 1 типа, которые обладают противовирусной активностью или противоопухолевой активностью. С другой стороны, также выявлено, что ИФНα связан с аутоиммунным заболеванием. Например, имеются сообщения о патологической продукции ИФНα у больных с указанными ниже аутоиммунными заболеваниями. Также предполагается, что нейтрализация ИФНα может уменьшить симптомы аутоиммунных заболеваний.
Системная красная волчанка (Shiozawa et al., Arthr. & Rheum. 20 35, 412, 1992).
Хронический ревматизм (Hopkins et al., Clin. Exp. Immunol. 73, 88, 1988).
Имеются сообщения о случаях, при которых введение рекомбинантного гена ИФНα2 или ИФН вызывало манифестацию или ухудшение симптомов аутоиммунных заболеваний (Wada et al., Am. J. Gastroenterol. 90, 136, 1995; Perez et al., Am. J. Hematol. 49, 365, 1995; Wilson LE et al., Semin. Arthritis. Rheum. 32, 163-173, 2002).
Также дополнительно выявлено, что ИФНα индуцирует дифференцировку дендритных клеток. Дендритная клетка является также антигенпрезентирующей клеткой. Поэтому считается, что индукция дифференцировки дендритных клеток является важной составляющей механизма аутоиммунных заболеваний. Предполагается, что существует глубокая связь между индукцией дифференцировки дендритных клеток под действием ИФНα и началом системной красной волчанки (Blanco et al., Science, 16:294, 1540-1543, 2001). Таким образом, указывается, что ИФНα тесно связан с противоопухолевой активностью, а также с аутоиммунными заболеваниями. Кроме того, ИФНα глубоко вовлечен в начало псориаза (Nestle FO et al., J. Exp. Med. 202, 135-143, 2005)
Интерферон-продуцирующие клетки (ИПК) определяют как клетки, которые продуцируют большое количество ИФН 1 типа, связанного с вирусной инфекцией. Небольшое количество ИПК находятся в крови. Считается, что лимфоциты периферической крови составляют 1% или менее ИПК. Вместе с тем, ИПК обладает очень высокой способностью к продукции ИФН. Способность ИПК продуцировать ИФН достигает, например, 3000 пг/мл/104 клеток. Таким образом, можно сказать, что в крови большая часть ИФНα или ИФНβ, вырабатываемых при вирусной инфекции, являются результатом активности ИПК, несмотря на небольшое число этих клеток.
С другой стороны, ИПК представляют собой недифференцированные лимфатические дендритные клетки, которые считаются клетками-предшественниками дендритных клеток. ИПК могут называться плазмоцитоидными дендритными клетками. ИПК дифференцируются в дендритные клетки путем вирусной стимуляции, и посредством T-клеток они индуцируют продукцию ИФНγ или интерлейкина ИЛ-10. Дифференцировка ИПК в дендритные клетки происходит также посредством стимуляции ИЛ-3. Дифференцированные путем стимуляции ИЛ-3 дендритные клетки посредством T-клеток индуцируют продукцию цитокина Th2 (ИЛ-4, ИЛ-5 и ИЛ-10). Таким образом, ИПК имеют свойства, которые позволяют им дифференцироваться в разные дендритные клетки посредством разной стимуляции.
Соответственно, существует два вида ИПК: ИФН продуцирующие клетки и клетки-предшественники дендритных клеток. Обе вида клеток играют важную роль в иммунной системе. Другими словами, ИПК являются одними из важных клеток поддержки различных аспектов иммунной системы.
Непатентный документ 1: Shiozawa et al., Arthr. & Rheum. 35, 412, 1992.
Непатентный документ 2: Hopkins et a1., Clin. Exp. Immunol. 73, 88, 1988.
Непатентный документ 3: Wada et al., Am. J. Gastroenterol. 90, 136, 1995.
Непатентный документ 4: Parez et al., Am. J. Hematol. 49, 365, 1995.
Непатентный документ 5: Bianco et al., Science, 16:294, 1540-1543, 2001.
Непатентный документ 6: Ju et al., Gene. 2004 Apr 28; 331: 159-64.
Непатентный документ 7: Colonna M et al., Seminars in Immunology 12: 121-127, 2000.
Непатентный документ 8: Nakajima H. et al., J. Immunology 162: 5-8, 1999.
Непатентный документ 9: Wilson LE et al, Semin Arthritis. Rheum. 32, 163-173, 2002.
Непатентный документ 10: Nestle FO et al., J. Exp. Med. 202, 135-143, 2005.
Патентный документ 1: WO 03/12061 (опубликованная патентная заявка США № 2003-148316)
Раскрытие изобретения
[Проблемы, решаемые настоящим изобретением]
Задача согласно изобретению состоит в обеспечении связывания антитела с иммуноглобулиноподобным транскриптом 7 (ILT7) и в обнаружении, идентификации или выделении ИПК. Другая задача согласно изобретению представляет собой регуляцию активности ИПК.
[Средства решения проблем]
Для регуляции активности гуморального фактора, такого как ИФН, эффективно введение антител, которые распознают указанный фактор. Например, осуществлялись попытки лечения аутоиммунных заболеваний антителами против интерлейкина (ИЛ)-1 или ИЛ-4 (Guler et al., Arthritis Rheum., 44. S307, 2001). Кроме того, предполагается, что нейтрализация антител может служить средством терапии аутоиммунных заболеваний, подобно интерферону (Stewart, TA. Cytokine Growth Factor Rev, 14; 139-154, 2003). Можно прогнозировать, что подход, аналогичный описанному выше, будет эффективен для ИФН, продуцируемых ИПК. Вместе с тем, такой подход основан на эффекте ингибирования гуморального фактора после продукции указанного фактора. Если продукцию желательного гуморального фактора можно регулировать прямым образом, можно достичь более значительных терапевтических эффектов.
Имеются сообщения об антителах, распознающих человеческие ИПК. Например, моноклональное анти-BDCA-2-антитело представляет собой человеческое ИПК-специфичное моноклональное антитело (Dzionek A. et al. J. Immunol. 165: 6037-6046, 2000). Выявлено, что моноклональное анти-BDCA-2-антитело эффективно ингибирует продукцию ИФН человеческими ИПК (J. Exp. Med. 194: 1823-1834, 2001). Дополнительно, имеются данные, что моноклональные антитела, которые распознают интерферон-продуцирующие клетки у мышей, ингибируют продукцию интерферона (Blood 2004 Jun. 1; 103/11: 4201-4206. Epub 2003 Dec). Указывается, что уменьшение количества дендритных клеток у мышей происходило благодаря моноклональным антителам против плазмоцитоидных дендритных клеток (J. Immunol. 2003, 171: 6466-6477).
Сходным образом, будут полезны антитела, распознающие человеческие ИПК и способные регулировать активность. Например, авторы согласно изобретению ранее показали, что антитело, которое распознает Ly49Q, специфически связывается с мышиными ИПК. Вместе с тем, антитело против Ly49Q не влияет на активность мышиных ИПК (Blood, 1 April 2005, Vol. 105, No.7, и pp. 2787-2792; WO 2004/13325). С другой стороны, известно, что ILT7 представляет собой молекулу, специфическая экспрессия которой отмечена в плазмоцитоидных дендритных клетках (Ju XS et al., и Gene. 2004 Apr 28; 331:159-64; WO 03/12061). Вместе с тем, не было получено антител против ILT7. Таким образом, эффекты антител на ИПК ·остаются неизвестными.
ILT7 является мембранным белком, содержащим иммуноглобулиноподобный мотив. В публикациях о нем указано, что он представляет собой одну из молекул, экспрессируемую в клетках миелоидной системы или лимфатической системы (Colonna M et al., Seminars in Immunology 12:121-127, 2000). Многочисленные молекулы, имеющие аналогичные ILT7 структуры, упоминаются как семейство ILT. Также семейство ILT имеет структурное подобие с рецепторами ингибиторов клеток-киллеров (KIR). Наряду с другими молекулами семейства ILT, ILT7 имеет четыре иммуноглобулиноподобных домена C-типа. Считается, что ILT7 посылает сигналы активации в клетку, как в случае с ILT1, ILT1-подобным белком, ILT8 и LIR6a. Имеются доказательства, что молекула, принадлежащая семейству ILT, экспрессируется в клетках гемоцитарной системы (Young et al., Immunogenetics 53: 270-278, 2001; “The KIR Gene Cluster”. Carrington, Mary and Norman, Paul. Bethesda (MD): National Library of Medicine (US), NCBI; 2003).
Дополнительно, путем субтрактивной гибридизации выявлена высокая экспрессия ILT7 в плазмоцитоидных дендритных клетках (ПДК), и низкая экспрессия ILT7 выявлена в дендритных клетках моноцитарного происхождения (ДКМП). Экспрессия ILT2 и ILT3 наблюдалась не только в ПДК, но также и в дендритных клетках (ДК), полученных из положительных клеток ДКМП или CD34. Вместе с тем, поскольку мРНК в ILT7 специфически экспрессируется в ПДК, было выявлено, что мРНК может служить маркером ПДК. Дополнительно было обнаружено, что в этом случае экспрессия ILT7 снижается путем стимуляции CpG (Ju XS et al. Gene. 2004 Apr 28; 331: 159-64; WO 03/12061).
Авторы согласно изобретению подтвердили, что изучение человеческой ИПК содействовало специфической экспрессии ILT7 в ИПК. Кроме того, авторы согласно изобретению делали попытку получить антитела к ILT7 и объяснить эффекты. Например, молекулы, составляющие семейства ILT, такие как ILT2 и ILT3, обладают высокой консервативностью, особенно в аминокислотных последовательностях внеклеточных доменов (фиг. 9). Эти семейства ILT в разных клетках крови проявляют, соответственно, характерные профили экспрессии. В этой связи очень важной задачей является получение антитела, которое способно иммунологически различать другие молекулы семейства ILT и ILT7. Вместе с тем, в силу препятствий, описанных ниже, с использованием в качестве иммуногена ILT7, фактически трудно получить антитело, которое специфически связывается с человеческими ИПК.
Обычно белок, полученный технологией рекомбинантных генов, используют в качестве иммуногена для получения антитела, которое распознает следовые количества белков, происходящих из живых организмов. Авторы согласно изобретению сделали попытку экспрессировать человеческий ILT7 на основе информации о последовательности оснований кДНК человеческого ILT7, который уже был обнаружен, и аминокислотной последовательности, кодируемой последовательностью оснований (номер доступа в GenBank Accession № NM_012276). Вместе с тем, в нормальных условиях авторы согласно изобретению не могли получить рекомбинантный человеческий ILT7.
Часто для получения белкового антитела осуществлялись попытки использования части аминокислотной последовательности природного белка в качестве иммуногена. Вместе с тем, существует небольшое число аминокислотных последовательностей в белках, специфичных для человеческого ILT7, поскольку в семействе ILT чрезвычайно высока гомология аминокислотных последовательностей. Кроме того, существует необходимость выбора области, составляющей участок, который распознается антителами в качестве эпитопа на поверхности клеток с целью предоставления антителам возможности распознавать молекулы на поверхности клеток. Поэтому считалось, что невозможно создать антитело, которое является специфичным для ILT7, путем использования фрагмента аминокислотной последовательности в качестве иммуногена.
Авторы согласно изобретению показали, что в указанных условиях можно получить антитело, которое связывается с ИПК путем использования специального иммуногена. Дополнительно, авторы согласно изобретению выявили, что полученное таким образом антитело специфически распознает человеческие ИПК и обладает дополнительным эффектом регуляции активности, и таким образом успешно осуществили настоящее изобретение. Таким образом, настоящее изобретение относится к нижеуказанному анти-ILT7-антителу, способу его получения и к его использованию.
[Эффекты, связанные с настоящим изобретением]
Настоящее изобретение обеспечивает иммуноген, полезный для получения антитела, которое распознает человеческий ILT7, и способ получения античеловеческого антитела ILT7 с использованием иммуногена. ILT7 представляет собой мембранный белок, принадлежащий семейству ILT. В частности, аминокислотная последовательность внеклеточного домена в семействах ILT является высоко консервативной. Поэтому получение антитела, которое распознает представителей семейства ILT, посредством общепринятых способов иммунизации, представляет собой чрезвычайно трудную задачу. Авторы согласно изобретению показали, что антитело, распознающее человеческий ILT7, можно легко получить при использовании клеток животных, в которых ILT7 коэкспрессируется с белком клеточной мембраны. Анти-ILT7-антитело, которое можно получать согласно настоящему изобретению, обладает высокой специфичностью, и отличает клетки, экспрессирующие другие семейства ILT, от клеток, которые экспрессируют человеческие ИПК.
В предпочтительном варианте осуществления античеловеческое антитело ILT7, обеспечиваемое согласно настоящему изобретению, связывается с человеческими ИПК. Дополнительно, антитело согласно изобретению специфически распознает человеческие ИПК. Таким образом, оно является полезным для обнаружения и выделения ИПК. ИПК представляет собой клетку, которая вырабатывает большую часть интерферона 1 типа. Поэтому ее обнаружение и выделение является важным для диагностики и изучения заболеваний, таких как аутоиммунные заболевания, в которые вовлечены ИПК. В особенности, согласно результатам авторов согласно изобретению, в присутствии ИФНα экспрессия ILT7 в ИПК не снижается. У больных с аутоиммунными заболеваниями часто повышена экспрессия ИФНα. Это означает, что анти-ILT7-антитело согласно изобретению можно использовать для обнаружения и выделения ИПК, например, у больных с аутоиммунными заболеваниями, у которых повышена экспрессия ИФНα.
В предпочтительном варианте осуществления анти-ILT7-антитело согласно изобретению действует в качестве регулятора активности человеческих ИПК. Таким образом, анти-ILT7-антитело согласно изобретению можно использовать для ингибирования активности ИПК. Как описано ранее, экспрессия ILT7 в ИПК не снижается в присутствии ИФНα. Поэтому можно ожидать терапевтический эффект у больных с аутоиммунными заболеваниями, при которых повышена экспрессия ИФНα, при ингибировании активности ИПК антителом согласно изобретению.
Ограниченное число ИПК продуцируют большое количество ИФН. Антитела, также как и молекулы ИФН, необходимы для нейтрализации ИФН. Вместе с тем, согласно настоящему изобретению, активация продуцирующих клеток ингибируется прямым образом. В результате можно ожидать мощного ингибирующего действия на ИФН, даже в случае использования меньшего количества антител, по сравнению с нейтрализацией анти-ИФН-антителом. Кроме того, в случае продолжительной продукции ИФН, прогнозируется, что нейтрализация антителами ИФН представляет собой транзиторное ингибирование. В настоящем изобретении при ингибировании активности ИПК можно ожидать, что ингибирующее действие на продукцию ИФН будет происходить на протяжении длительного периода времени.
Краткое описание фигур
Фигура 1a представляет собой фотографию, на которой способом RT-ПЦР (полимеразной цепной реакцией в реальном времени) изучали экспрессию мРНК гена ILT7. На ней отражен результат анализа экспрессии мРНК гена ILT7 в человеческих иммуноцитах.
Фигура 1b представляет собой диаграмму, на которой показано сравнение экспрессии мРНК гена ILT7 в разных тканях и клетках человека, изученной с применением методики количественной ПЦР. На горизонтальной оси показаны исследованные ткани и клетки, а на вертикальной оси показан уровень экспрессии ILT7, который стандартизирован в соответствии с уровнем экспрессии гена GAPDH.
Фигура 2 представляет собой диаграмму, показывающую структуры белка ILT7, где на фиг. 2 (a) приведена аминокислотная последовательность белка ILT7, и дополнительно на фигуре показана рассчитанная секреция сигнальной последовательности и трансмембранный домен, и на фиг. 2 (b) показана схематическая диаграмма белков ILT7, которые кодируются сконструированными векторами экспрессии.
Фигура 3 представляет собой диаграмму, показывающую результат введения в клетки вектора экспрессии ILT7 и вектора экспрессии FcRγ, и результат исследования экспрессии молекул ILT7 на поверхности клеток посредством проточной цитометрии FCM. На горизонтальной оси отложена интенсивность флуоресценции, обнаруживаемая в анти-FLAG-антителе, а именно, интенсивность экспрессии на клеточной поверхности молекул ILT7, к которым присоединена метка FLAG, и на вертикальной оси отложено число клеток.
На фигуре 4 показаны фотографии, на которых в клетки были введены вектор экспрессии ILT7 и вектор экспрессии FcRγ, и ассоциацию молекул анализировали путем иммунопреципитации и Вестерн-блоттинга. Слева схематически отображены результаты блотинга молекулы ILT7 с антиFLAG-антителом после иммунопреципитации молекулы FcRγ анти-myc-антителом (фигура сверху), и блоттинг молекулы FcRγ с анти-myc-антителом (фигура снизу). Аналогично, справа схематически изображены результаты блоттинга молекулы ILT7 с антителом антиFLAG после иммунопреципитации молекулы FcRγ с антителом антиFLAG (выше) и блоттинга молекулы FcRγ с анти-myc-антителом (ниже).
Фигура 5 представляет собой фотографию, полученную при изучении гликозилирования молекулы ILT7 посредством введения в клетку вектора экспрессии ILT7 и вектора экспрессии FcRγ и обработки N-гликозидазой. Слева на фотографии показаны размеры ILT7 без обработки ILT7 N-гликозидазой, а справа показаны размеры ILT7 при обработке N-гликозидазой.
Фигура 6a представляет собой диаграмму результатов изучения реактивности полученного моноклонального анти-ILT7-антитела путем анализа FCM. (a) показан результат анализа связывания анти-ILT7-антитела с фракцией BDCA-2-положительных ИПК посредством использования лимфоцитов периферической крови человека и двойного окрашивания анти-ILT7-антител и анти-BDCA-2-антител. Вертикальная ось показывает реактивность к BDCA-2-антителу, а горизонтальная ось показывает реактивность к каждому из полученных анти-ILT7-антител.
Фигура 6b представляет собой диаграмму результатов исследования путем анализа FCM реактивности полученных моноклональных анти-ILT7-антител. (b) показан результат связывания анти-ILT7-антитела с молекулой ILT7, полученный с использованием клеток 293T, в которые были встроены векторы экспрессии ILT7 и FcRγ. Вертикальная ось соответствует реактивности анти-FLAG-антитела, а именно, интенсивности экспрессии молекул ILT7, к которым присоединили метку FLAG, а горизонтальная ось соответствует реактивности соответствующих анти-ILT7-антител.
На фигуре 7 представлены диаграммы результатов исследования путем анализа FCM реактивности двух клонов из полученных моноклональных анти-ILT7-антител лимфоцитов периферической крови человека. Три диаграммы слева соответствуют результатам №11, а на трех диаграммах справа показаны результаты №17. На диаграммах слева каждая ось, отмеченная ILT7, отражает реактивность ILT7 №11. Аналогично на диаграммах справа каждая ось, отмеченная ILT7, отражает реактивность ILT7 №17.
На фигуре 8 показан результат сравнения и изучения активности связывания полученных моноклональных анти-ILT7-антител ILT7 №11 и ILT7 №17 с человеческими лимфоцитам с активностью связывания анти-BDCA-2-антитела. Вертикальная ось означает реактивность анти-CD123-антитела, а горизонтальная ось означает реактивность каждого антитела. Таким образом, каждое антитело связывается с участком CD123-положительной клетки. На этой диаграмме показаны результаты анализа реактивности при стимуляции лимфоцитов двумя видами CpGs и ИФНα.
Фигура 9a представляет собой диаграмму, показывающую аминокислотные последовательности молекул семейства с высокой гомологией с молекулами ILT7. Каждая аминокислотная последовательность внеклеточного домена показана главным образом в виде выравнивания; фиг. 9b является продолжением фиг. 9a; и фиг. 9c является продолжением фиг. 9b.
На фигуре 10 показаны результаты изучения реактивности полученных моноклональных анти-ILT7-антител ILT7 №11 и ILT7 №17 в отношении молекул ILT1, ILT2 и ILT3, при использовании клеток, в которые были встроены их векторы экспрессии. На верхней диаграмме показаны результаты, подтвердившие реактивность в отношении клеток, в которых молекулы ILT7 с меткой FLAG коэкспрессировались с FcRy. На нижней диаграмме показаны результаты изучения реактивности в отношении клеток, в которые вставляли ILT1, ILT2, ILT3 и FcRy (левая диаграмма: ILT7 №11, правая диаграмма: ILT7 №17). На горизонтальной оси показана реактивность каждого анти-ILT7-антитела.
Фигура 11 представляет собой диаграмму, показывающую действие полученных моноклональных анти-ILT7-антител ILT7 №11 и ILT7№17 на интерферонопродуцирующую способность человеческих лимфоцитов. Горизонтальная ось диаграммы соответствует концентрации ИФНα в супернатанте культуры при стимуляции лимфоцитов человека вирусом гриппа, а на вертикальной оси показаны обработанные антитела. Термин "отсутствие инфекции" означает результаты, полученные на клетках, которые не стимулировали вирусом гриппа.
Фигура 12 представляет собой диаграмму, показывающую CDC активность (комплементзависимую цитотоксичность) полученных моноклональных анти-ILT7-антител ILT7 №37, ILT7 №28 и ILT7 №33. Даже при использовании моноклональных анти-ILT7-антител, полученных из какой-либо гибридомы, 80% или больше CDC активности проявлялось при концентрации антитела 0,1 мкг/мл или выше. В случае других антител, отличных от моноклонального анти-ILT7-антитела, CDC активности в отношении клеток-мишеней не наблюдалось.
Фигура 13 представляет собой диаграмму, показывающую интернализацию полученных моноклональных анти-ILT7-антител ILT7 №17, ILT7 №26, ILT7 №37, ILT7 №28 и ILT7 №33 с клетками-мишенями.
Интенсивность флуоресценции аллофикоцианина (APC) является индикатором количества иммунных комплексов ILT7-анти-ILT7-антитело, которые присутствуют на клеточной поверхности перед инкубацией, - и она обнаруживается независимо от того, присутствует ли иммунный комплекс ILT7-анти-ILT7-антитело - на клетке-мишени или включается в клетку после инкубации. С другой стороны, интенсивность флуоресценции флуоресцеина изоцианата (FITC) - является индикатором количества иммунных комплексов ILT7-анти-ILT7-антитело, которые остаются на поверхности клеток после инкубации. Таким образом, интенсивность флуоресценции FITC уменьшается при интернализации.
Лучший способ осуществления изобретения
Имеются сообщения, что человеческий ILT7 (иммуноглобулиноподобный транскрипт 7) является молекулой, которая специфически экспрессируется в плазмоцитоидных дендритных клетках (Gene. 2004 Apr 28; 331:1 59-64; WO 03/12061). С другой стороны, также известно, что человеческие ILT7 можно использовать как прогностический индикатор для прогноза лимфомы (WO 2005/24043). Вместе с тем, не существует принятого способа получения антитела, способного распознавать человеческий ILT7
Человеческий ILT7 состоит из 499 аминокислотных остатков, как показано в SEQ ID NO:2, и представляет собой трансмембранный белок 1 типа, содержащий в структуре четыре иммуноглобулиноподобных домена и одну трансмембранную область (445-466; от 429 до 450 в SEQ ID NO:2). Из 444 аминокислотных остатков, включающих в себя N-конец, 16 аминокислотных остатков (от -15 до -1 в SEQ ID NO:2) являются сигнальными последовательностями, и от 17 до 444 аминокислотных остатка (от 1 до 428 в SEQ ID NO:2) составляют внеклеточный домен. С другой стороны, C-концевая область представляет собой внутриклеточный домен. Большинство участков человеческого ILT7 являются внеклеточными доменами, и 33 аминокислотных остатка составляют внутриклеточный домен (от 467 до 499; от 451 до 483, в SEQ ID NO:2). Не предполагается, что во внутриклеточном домене присутствует мотив, вовлеченный в передачу сигнала. Непроцессированная аминокислотная последовательность человеческого ILT7 показана в SEQ ID NO:2 и последовательность оснований кДНК, кодирующая аминокислотную последовательность, показана в SEQ ID NO:1. В этом случае кодирующие области зрелого пептида (72)…(1520), показанные в SEQ ID NO:1, не содержат кодоны терминации и инициирования. Таким образом, кодирующие белок последовательности, которые содержат кодоны терминации и инициирования, указаны в SEQ ID NO:1 от 24 до 1523.
Считается, что лигандный сигнал передается в клетки путем ассоциации человеческого ILT7 с сигнал-трансдуцирующей молекулой. Например, в клетках присутствует большинство γ-цепей Fc-рецептора. Дополнительно, внутриклеточный домен содержит мотив активации на основе тирозина иммунорецептора (ITAM), который вовлечен в передачу сигнала. ITAM представляет собой участок аминокислотной последовательности, которая обычно обнаруживается в адапторных молекулах, связанных с иммунорецепторами, такими как Fc-рецепторы. В ITAM содержится, например, мотив YxxL (SEQ ID NO:76), который является мишенью фосфорилирования тирозина, и передача сигнала осуществляется фосфорилированием. Известные примеры сигнал-трансдуцирующей молекулы, которая содержит ITAM во внутриклеточном домене, включают в себя CD3ξ и DAP12, в дополнение к γ-цепи рецептора Fc. Среди этих сигнал-трансдуцирующих молекул молекула, связанная с человеческим ILT7, предположительно является γ-цепью Fc рецептора. В настоящее время не выявлен лиганд, который связывается с человеческим ILT7.
Авторы согласно изобретению в генном анализе подтвердили, что ILT7 специфически экспрессируется в человеческих ИПК. Авторы согласно изобретению считают, что при изучении ИПК может быть полезным возможность получения антитела, способного иммунологически отличать человеческие ILT7 от других молекул. Вместе с тем, в семействе ILT существует множество молекул с подобными структурами, включающими в себя ILT7. Молекулы, такие как ILT1, ILT2, ILT3, ILT4, ILTS, ILT6 или LIR-8, содержат высокогомологичные аминокислотные последовательности, особенно в их внеклеточных доменах. Поэтому авторы согласно изобретению считают, что имеются трудности в получении антитела, способного различать эти молекулы при использовании в качестве иммуногена пептидный домен, содержащий часть аминокислотной последовательности, которая составляет внеклеточный домен. Затем авторы согласно изобретению пробовали получить антитело против человеческого ILT7, используя в качестве иммуногенов клетки, экспрессирующие человеческий ILT7.
Вместе с тем, использование общепринятых векторов экспрессии не приводило к экспрессии кДНК человеческого ILT7 в животных клетках. Имелись сообщения, что молекула ILT1, имеющая структуру, очень сходную со структурой ILT7, связывается с γ-цепью Fc-рецептора. Таким образом, когда в качестве клеток-хозяев использовали клетки, в которых экспрессировалась γ-цепь Fc-рецептора, такие как клетки RBL (базофильной лейкемии крыс) и клетки P81S (мастоцитомы мышей), наблюдалась экспрессия ILT1 на поверхности клетки. Вместе с тем, если экспрессию ILT7 вызывали на клетках 293, в которых γ-цепь Fc-рецептора изначально на экспрессировалась, экспрессия на клеточной поверхности не наблюдалась. С другой стороны, показано, что экспрессию ILT1 на клеточной поверхности можно достоверно выявлять, когда ILT1 коэкспрессируется с γ-цепью Fc-рецептора (Nakajima H. et al., J. Immunology 162:5-8. 1999). Вместе с тем, не существует какой-либо информации об иммуногене для получения антитела ILT7.
Например, по сообщениям, клетки RBL, в которые введен ген ILT1, используются как иммуногены для получения антитела ILT1. Авторы согласно изобретению пробовали получить антитела ILT7, используя комбинацию клеток RBL с геном ILT7 тем же образом, как описано выше. Вместе с тем, даже если в клетках RBL (Р815) вызывалась экспрессия ILT7, экспрессии ILT7 на поверхности клеток не наблюдалась, и таким образом, его нельзя использовать в качестве иммуногена.
Авторы согласно изобретению провели исследование, предназначенное для получения антитела, способного распознавать человеческий ILT7. В результате авторы согласно изобретению выявили, что желательное антитело можно получить путем использования в качестве иммуногена специфически трансформированной клетки, и осуществили настоящее изобретение. Таким образом, настоящее изобретение относится к моноклональному антителу, которое связывается с внеклеточным доменом человеческого ILT7, и относится к фрагменту, содержащему его антигенсвязывающую область.
В настоящем изобретении человеческий ILT7 можно определять как молекулу природного происхождения, которая экспрессируется в человеческих ИПК, или как молекулу, которая является иммунологическим эквивалентом ILT7, который экспрессируется в человеческих ИПК. В настоящем изобретении связывание антител с человеческим ILT7 можно подтверждать, например, следующим образом.
- Доказательство, основанное на реактивности к клеткам человека:
Согласно результатам авторов согласно изобретению, в человеческих ИПК наблюдалась специфическая экспрессия человеческого ILT7. Вначале человеческий ILT7 выделяли как ген, экспрессия которого обнаружена в плазмоцитоидных дендритных клетках (Blood. 2002 100; 3295-3303, Gene. 2004 Apr 28; 331:159-64). Кроме того, известно также, что его можно использовать как маркер плазмоцитоидных дендритных клеток (WO 03/12061). Предполагается, что плазмоцитоидные дендритные клетки и ИПК представляют собой почти идентичные популяции клеток, или имеют общие большие участки. Поэтому не существует каких-либо противоречий между указанными публикациями и результатами, полученными авторами согласно изобретению.
Во-первых, при рассмотрении в настоящем изобретении указанного профиля экспрессии человеческого ILT7, считается, что одним из важных свойств антитела, которое связывается с человеческим ILT, является активность связывания ИПК или плазмоцитоидных дендритных клеток по меньшей мере с определенной субпопуляцией. Маркеры клеточной поверхности, специфичные для соответствующих клеточных популяций, можно использовать, чтобы определить, является ли конкретная клетка клеткой ИПК или плазмоцитоидной дендритной клеткой. Например, связывание с желательными клетками можно подтверждать двойным окрашиванием с антителом, которое связывается с маркерами клеточной поверхности и с антителом, связывающую активность которого необходимо проверить. Таким образом, ИПК в настоящем изобретении содержат, например, клетки, которые экспрессируют BDCA2.
- Доказательство, основанное на реактивности к трансформированным клеткам, экспрессирующим человеческий ген ILT7:
Авторы согласно изобретению обнаружили восстановление иммунологических свойств ILT7, экспрессируемого в человеческих ИПК, если экспрессию человеческого гена ILT7 проводили в конкретных условиях. Поэтому, реактивность к человеческому ILT7 также можно подтверждать на основании реактивности антител к клеткам, в которые искусственно введен ген, кодирующий ILT7. Таким образом, настоящее изобретение относится к моноклональному антителу, которое содержит в качестве внеклеточного домена аминокислотную последовательность, составляющую внеклеточный домен, и связывается с молекулой, которая коэкспрессируется с сигнал-трансдуцирующей молекулой или относится к фрагменту, содержащему его антигенсвязывающую область. В настоящем изобретении указано, что внеклеточный домен составлен из аминокислотной последовательности, которая соответствует положениям от 17-ого до 444-ого в N-концевой аминокислотной последовательности, показанной в SEQ ID NO:2 (положения от 1 до 428 в SEQ ID NO:2).
Например, иммунологические свойства ILT7, экспрессируемого в человеческих ИПК, сохраняются в клетках, совместно трансфицируемых вектором экспрессии, который содержит ДНК, кодирующую человеческий ILT7, и вектор экспрессии, который содержит ДНК, кодирующую сигнал-трансдуцирующую молекулу. Таким образом, трансформированная клетка, которая коэкспрессирует человеческий ILT7 и сигнал-трансдуцирующую молекулу, является предпочтительной для подтверждения связывающей аффинности антител к внеклеточному домену человеческого ILT7 согласно изобретению. В настоящем изобретении в качестве контроля желательно использовать нетрансформированную клетку, если реактивность антител подтверждается с использованием трансформированной клетки. Кроме того, важно также подтверждение отсутствия связывания антител при использовании в качестве контроля той же клетки-хозяина, которая экспрессирует только сигнал-трансдуцирующую молекулу.
В настоящем изобретении молекулу, которая индуцирует экспрессию человеческого ILT7 на клеточной поверхности, можно использовать как сигнал-трансдуцирующую молекулу для коэкспрессии. В настоящем изобретении сигнал-трансдуцирующую молекулу можно также определить как молекулу, способную придавать иммунологическое свойство человеческого ILT7 природного происхождения по меньшей мере внеклеточному домену молекулы ILT7 в клетке, которая экспрессирует ILT7. Используемый в настоящем изобретении термин "иммунологические свойства" человеческого ILT7 природного происхождения означает распознавание антителом, которое связывается с человеческими ИПК.
В частности, предпочтительно использование в качестве сигнал-трансдуцирующей молекулы γ-цепи Fc-рецептора или DAP12. В настоящем изобретении γ-цепь Fc-рецептора особенно предпочтительна в качестве сигнал-трансдуцирующей молекулы. Указанная γ-цепь Fc-рецептора представляет собой молекулу, состоящую из аминокислотных последовательностей, показанных в SEQ ID NO:16. Сигнал-трансдуцирующая молекула может представлять собой фрагмент, поскольку человеческий ILT7, предназначенный для коэкспрессии, локализуется на клеточной поверхности. Так как человеческий ILT7 для коэкспрессии локализуется на клеточной поверхности, в аминокислотных последовательностях, показанных в SEQ ID NO:16, допускаются мутации или добавления аминокислотной последовательности. Таким образом, настоящее изобретение обеспечивает способы получения клеток, которые продуцируют моноклональное антитело, связывающееся с внеклеточным доменом человеческого ILT7, которые содержат следующие этапы:
(1) введение иммунным животным клетки, которая экспрессирует экзогеннЫЙ белок, содержащий внеклеточный домен человеческого ILT7, и молекулы, содержащей аминокислотные последовательности, описанные в SEQ ID NO:16; и
(2) выбор антитело-продуцирующей клетки, которая продуцирует антитело, связывающееся с человеческим ILT7, из антитело-продуцирующей клетки иммунных животных.
Соответственно, в качестве антитела, связывающегося с человеческим ILT7, в настоящем изобретении предпочтительно использовать антитело, у которого не наблюдается перекрестной реакции с клеточными популяциями, для которых известна экспрессия семейств ILT, отличных от ILT7. В частности, в качестве антитела, связывающегося с человеческим ILT7, в настоящем изобретении предпочтительно использовать антитело, у которого нельзя выявить связывание с клеточными популяциями с известным отсутствием экспрессии семейств ILT, кроме ILT7, в тех же условиях, как и условия, в которых достоверно подтверждается связывание с ИПК. Как ранее описано, например, ILT2 и ILT3 экспрессируются не только в плазмоцитоидных дендритных клетках ПДК, но также и в дендритных клетках (ДК), происходящих из ДКМП или CD34 положительных клеток (Gene. 2004 Ap 28: 331: 159-64). С другой стороны, экспрессию ILT7 невозможно обнаружить благодаря дифференцировке ИПК в дендритные клетки. Таким образом, антитело не может обнаружить связывание с ДК, происходящими из положительных ДКМП или CD34 клеток в условиях, при которых можно подтвердить связывание с ИПК, в которых содержатся антитела, связывающиеся с человеческим ILT7 согласно изобретению.
Далее сообщается о следующих характеристиках экспрессии в отношении других молекул семейства ILT ("The KIR Gene Cluster" Carrington, Mary and Norman, Paul. Bethesda (MD): National Library of Medicine (US), NCBI; 2003, Gene. 2004 Apr 28; 331: 159-64). Таким образом, антитело, которое связывается с человеческими ИПК или ПДК, и для которого невозможно подтвердить связывание со следующими клетками, включено в антитело, обладающее специфичностью к ILT7:
ILT1: клетки миелоидного происхождения (моноциты, ДК, происходящие из моноцитов, макрофаги);
ILT2: ПДК, B-клетки, CD34 положительные клетки, ДК, происходящие из CD34 положительных клеток, и ДК, происходящие из моноцитов;
ILT5: моноциты, ДК, происходящие из положительных клеток CD34, и ДК, происходящие из моноцитов; и
ILT8: клетки, происходящие из моноцитов.
Таким образом, моноклональное антитело, которое связывается с внеклеточным доменом человеческого ILT7, в настоящем изобретении предпочтительно содержит моноклональное антитело, обладающее следующими иммунологическими свойствами:
a) моноклональное антитело связывается с человеческими ИПК; и
b) связывание моноклонального антитела с одной или больше клетками, выбираемыми из группы, состоящей из моноцитов, макрофагов, B-клеток, CD34-положительных клеток и дендритных клетки, происходящих из указанных клеток, невозможно подтвердить в условиях для связывания с человеческими ИПК.
В качестве моноклонального антитела согласно изобретению, предпочтительно использовать антитело, в котором связывание с моноцитами, макрофагами, B-клетками, CD34-положительными клетками и дендритными клетками, происходящими из указанных клеток, невозможно подтвердить в условиях связывания, в особенности с человеческими ИПК.
Альтернативно, моноклональное антитело, которое связывается с внеклеточным доменом человеческого ILT7, в настоящем изобретении предпочтительно содержит моноклональное антитело, обладающее следующими иммунологическими свойствами:
c) указанное моноклональное антитело связывается с трансформированной клеткой, которая совместно трансфицирована вектором экспрессии, экспрессивно несущим ДНК, кодирующую человеческий ILT7, и вектором экспрессии, экспрессивно несущим ДНК, кодирующую сигнал-трансдуцирующую молекулу;
d) невозможность подтверждения связывания с клеткой - хозяином перед трансформацией в условиях для связывания с совместно трансфицированными клетками, как описано в пункте c); или
указанное моноклональное антитело согласно изобретению содержит моноклональное антитело, обладающее следующими иммунологическими свойствами:
e) связывание с клеткой-хозяином, которая экспрессирует только сигнал-трансдуцирующей молекулу, невозможно подтвердить в условиях связывания с совместно трансфицированными клетками, как описано в пункте c).
В настоящем изобретении факт несовпадения анти-ILT7 моноклонального антитела с другими молекулами ILT семейства можно подтвердить, используя клетки, в которых была вызвана экспрессия каждой молекулы из ILT семейства. Таким образом, для вызванной экспрессии кДНК, кодирующую каждую из аминокислотных последовательностей ILT семейства, внедряют в соответствующую клетку-хозяин. Моноклональное анти-ILT7-антитело, перекрестную реакцию которого нужно подтвердить, создают для контакта с полученной трансформированной клеткой. Затем появляется возможность подтвердить, что, если не наблюдается связывание антитела с клеткой, которая экспрессирует молекулы семейства ILT, отличные от ILT7, антитело будет способно к иммунологическому различению ILT7 и других молекул семейства ILT. Например, в примерах, описанных ниже, подтверждается факт несовпадения с ILT1, ILT2 и ILT3 моноклональных анти-ILT7-антител, полученных согласно настоящему изобретению. Таким образом, предпочтительным примером моноклонального антитела в настоящем изобретении является моноклональное антитело, связывающееся с ILT7, в котором при аналогичных условиях невозможно обнаружить связывание с ILT1, ILT2 и ILT3.
В частности, ILT2 и ILT3 являются генами, экспрессия которых в ИПК была подтверждена (Ju et al. Gene 331, 159-164, 2004). Вместе с тем, эти молекулы могут проявлять характер экспрессии, уникальный для каждого типа клетки, в зависимости от соответствующих уровней дифференцировки в ИПК или условий, таких как стимуляция вирусами или другими цитокинами. Использование антитела, которое способно иммунологически отличать эти молекулы семейства ILT от ILT7, позволяет специфически обнаруживать изменения в экспрессии ILT7.
Связывание моноклонального антитела, связывающую активность которого необходимо подтвердить, с разными типами клеток, можно подтверждать на основании, например, принципа проточной цитометрии. Для подтверждения реактивность антител на основании принципа проточной цитометрии имеет преимущество мечение антитела молекулой или атомной группой, которая заранее продуцирует обнаружимый сигнал. Обычно применяют флуоресцентные или люминесцентные метки. Можно использовать флуоресцентный активный сортировщик клеток (FACS) для анализа связывания флуоресцентно меченых антител с клетками на основе принципа проточной цитометрии. Использование FACS позволяет эффективно подтверждать связывание многих антител ко многим клеткам.
В частности, например, антитело А, которое ранее считали способным идентифицировать ИПК, и антитело B, чьи свойства связывания с ИПК необходимо проанализировать, реагируют с клеточными популяциями, содержащими одновременно ИПК. Антитело A и антитело B являются мечеными флуоресцентным сигналом, который заранее взаимно распознается этими антителами. В случае, если оба сигнала обнаруживаются в одинаковых клеточных популяциях, можно подтвердить связывание этих антител с этими клеточными популяциями. Другими словами, выявлено, что оба антитела A и B обладают одинаковыми связывающими свойствами. В случае, если они связываются с разными клеточными популяциями, очевидно, что эти два антитела обладают разными связывающими свойствами.
Предпочтительный пример моноклонального антитела согласно изобретению может содержать моноклональное антитело, которое продуцирует гибридома ILT7 №11 или ILT7 №17. Гибридома ILT7 №11 и гибридома ILT7 №17 были депонированы 21 октября 2005 года Национальным институтом передовой промышленной науки и технологии, в Международном патентном депозитарии микроорганизмов (National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary) под номерами доступа FERM BP-10704 и FERM BP-10705, 21 октября 2005 г.
Информация по указанному депозитарию:
(a) Название и адрес учреждения депозитария
Название: Национальный институт передовой промышленной науки и технологии, Международный патентный депозитарий микроорганизмов:
Адрес: AIST Tsukuba Central 6, 1-1-1, Higashi, Tsukuba-shi, Ibaraki, Japan (zip code 305-8566)
(b) Дата депонирования: 21 октября 2005 года
(c) Номер доступа: FERM BP-10704 (гибридома ILT7 №11)
(c) Номер доступа: FERM BP-10705 (гибридома ILT7 №17)
Моноклональное антитело согласно изобретению может представлять собой фрагмент, содержащий его антигенсвязывающую область. Например, в качестве антитела согласно изобретению можно использовать фрагмент антитела, содержащий область связывания антигена, который получен путем ферментативного расщепления IgG. Конкретно, фрагменты антител, такие как Fab и F(ab')2 можно получать расщеплением папаином или пепсином. Известно, что эти фрагменты антител можно использовать как молекулы антител, обладающие аффиностью к антителам. С другой стороны, также можно использовать антитела, сконструированные технологией рекомбинантных генов, при условии сохранения удовлетворительной активности связывания с антигеном. Примеры антител, сконструированных технологией рекомбинантных генов, содержат химерные антитела, CDR-трансплантированные антитела (антитела с трансплантированными участками, определяющими комплементарность), одноцепочечные Fvs, димеры, линейные антитела и полиспецифичные антитела, образованные из фрагментов антител. Общеизвестно, что указанные антитела можно получать при использовании моноклональных антител или антитело-продуцирующих клеток, которые вырабатывают антитела.
Моноклональное антитело согласно изобретению может быть получено при использовании в качестве иммуногена специфичной трансформированной клетки. Таким образом, настоящее изобретение относится к способу получения клеток, продуцирующих моноклональное антитело, которое связывается с внеклеточным доменом человеческого ILT7, который содержит следующие этапы:
(1) введение иммунным животным клетки, которая экспрессирует экзогенный белок, содержащий внеклеточный домен человеческого ILT7, и молекулы, содержащей аминокислотные последовательности, описанные в SEQ ID NO:16; и
(2) выбор антитело-продуцирующей клетки, которая продуцирует антитело, связывающееся с человеческим ILT7, из антитело-продуцирующей клетки иммунных животных.
Полученные таким образом антитело-продуцирующие клетки или бессмертные антитело-продуцирующие клетки культивируют, и затем желательные моноклональные антитела можно извлекать из культуры. В отношении способа получения бессмертных антитело-продуцирующих клеток известны различные способы.
В способе получения моноклонального антитела согласно изобретению применяемые примеры молекулы, которая ассоциируется с человеческим ILT7 для продукции трансформированной клетки, используемой в качестве иммуногена, содержат белки клеточной мембраны. Среди них сигнал-трансдуцирующая молекула, которая находится в клеточных мембранах, является предпочтительной для использования в качестве белка клеточной мембраны согласно изобретению. Термин «сигнал-трансдуцирующая молекула» означает молекулу, которая ассоциирована с белками и клетками, имеющими рецепторные структуры во внеклеточном домене, и передает стимуляцию лигандного связывания на рецепторы в клетки. Примеры сигнал-трансдуцирующих молекул включают в себя γ-цепь Fc-рецептора, DAP12 или им подобные. Например, для использования в качестве белка клеточной мембраны согласно изобретению предпочтительной является γ-цепь Fc-рецептора. Аминокислотные последовательности человеческого DAP12 и γ-цепи Fc-рецептора, а также последовательность оснований кДНК, которая кодирует указанные последовательности, являются общеизвестными. Последовательность оснований человеческой γ-цепи Fc-рецептора и аминокислотная последовательность, кодируемая последовательностью оснований, показана в SEQ ID NO:15 и 16, соответственно.
В настоящем изобретении трансформированную клетку, которую будут использовать в качестве иммуногена, можно получать, например, путем изготовления клетки, экспрессивно несущей следующее из a) и b):
(а) экзогенный полинуклеотид, кодирующий аминокислотную последовательность, содержащую внеклеточный домен человеческого ILT7; и
(b) экзогенный полинуклеотид, кодирующий γ-цепь Fc-рецептора.
В настоящем изобретении экзогенный полинуклеотид означает полинуклеотид, который искусственно внедрен в клетку-хозяина. Если в качестве клеток используют человеческие клетки, в клетки человека вводят человеческие гены. В такой комбинации искусственно внедренный полинуклеотид означает экзогенный полинуклеотид. Поэтому эктопическая экспрессия человеческого ILT7 или γ-цепи Fc-рецептора человека состоит в экспрессии экзогенного полинуклеотида.
Используемый в настоящем изобретении термин «внеклеточный домен человеческого ILT7» означает аминокислотную последовательность от 17-ого до 444-ого положения аминокислотной последовательности, описанной в SEQ ID NO:2, которая соответствует внеклеточному домену аминокислотной последовательности (от 1 до 428 положения в SEQ ID NO:2). В качестве аминокислотной последовательности согласно изобретению, содержащей внеклеточный домен человеческого ILT7, предпочтительно использовать аминокислотную последовательность, которая содержит каждую область, например, начиная с N-конца, в следующем порядке:
[сигнальная последовательность + внеклеточный домен + трансмембранный домен + внутриклеточная область]
Альтернативно, аминокислотная последовательность, которая не имеет части внутриклеточной области, как описано ниже, включена в состав аминокислотной последовательности, содержащей внеклеточный домен человеческого ILT7 согласно изобретению. [сигнальная последовательность + внеклеточный домен + трансмембранный домен + часть внутриклеточной области].
Кроме того, в состав аминокислотной последовательности, содержащей внеклеточный домен человеческого ILT7 согласно изобретению включена структура, которая, как упомянуто ниже, не имеет внутриклеточной области. [сигнальная последовательность + внеклеточный домен + трансмембранный домен].
В указанной структуре области, отличные от внеклеточной области, могут представлять собой аминокислотные последовательности, которые выбирают из аминокислотной последовательности, показанной в SEQ ID NO:2, или могут быть объединены с другими аминокислотными последовательностями, имеющими гомологию областей. Например, аминокислотная последовательность, составляющая сигнальную последовательность, трансмембранный домен и внутриклеточную область, может представлять собой аминокислотную последовательность молекул семейства ILT, отличных от ILT7. Или она может объединяться с аминокислотной последовательностью семейства ILT других видов, кроме человека. Дополнительно, аминокислотная последовательность, которая составляет другие области, кроме внеклеточной области, может содержать мутацию на уровне, при котором может поддерживаться функция каждой области. Альтернативно, между каждой областью могут вставляться другие области. Например, метка эпитопа, такая как FLAG, также может быть вставлена между сигнальной последовательностью и внеклеточным доменом. В частности, сигнальную последовательность удаляют процессированием во время ее переноса на поверхность клеточной мембраны, после трансляции в белок. Поэтому, в качестве сигнальной последовательности можно использовать случайную аминокислотную последовательность, которая индуцирует перенос белка после трансляции на клеточную мембрану. Более конкретно, как аминокислотную последовательность, содержащую внеклеточный домен человеческого ILT7, предпочтительно использовать аминокислотную последовательность (SEQ ID NO:2) человеческого ILT7.
Поэтому в настоящем изобретении случайная последовательность оснований, которая кодирует аминокислотную последовательность, составляющую вышеупомянутую структуры [сигнальную последовательность + внеклеточный домен + трансмембранный домен + внутриклеточная область], может использоваться как полинуклеотид, который составляет экзогенный полинуклеотид, описанный в (a). Например, аминокислотная последовательность SEQ ID NO 2: кодируется последовательностью оснований, описанной в SEQ ID NO:1.
В настоящем изобретении вектор экспрессии, экспрессивно несущий вышеупомянутые полинуклеотиды (a) и (b), можно внедрять в соответствующую клетку-хозяин, чтобы получить трансформированную клетку, которая будет использоваться в качестве иммуногена. Один вектор или разные векторы могут нести полинуклеотиды (a) и (b). Если каждый полинуклеотид несут разные векторы, клетки-хозяева совместно трансфицируются с двумя видами векторов.
Предпочтительные примеры клеток-хозяев согласно изобретению содержат клетки млекопитающих. Конкретные примеры клеток-хозяев содержат клетки, полученные от людей, обезьян, мышей или крыс. Особенно предпочтительными в качестве клеток-хозяев являются клетки человеческого происхождения. Например, предпочтительно в качестве клеток-хозяев согласно изобретению использовать клетки 293T человеческого происхождения. Клетки 293T можно получать как ATCC CRL-11268. Кроме того, также можно в качестве клеток-хозяев использовать клетки, полученные от иммунных животных. Если в качестве иммуногенов используют клетки, полученные от иммунных животных, клетки-хозяева дают небольшой иммунологический ответ. По этой причине можно эффективно получать антитело против внеклеточного домена экзогенно экспрессируемого ILT7. Таким образом, например, когда в качестве иммунных животные используются мыши, клетки, полученные из мышей, также можно использовать как клетки-хозяева.
Вышеупомянутые полинуклеотиды можно трансформировать в клетки путем переноса их на векторе, способном индуцировать экспрессию в клетках-хозяевах. Можно использоваться коммерчески доступные векторы, способные индуцировать экспрессию в клетках млекопитающих. В настоящем изобретении можно использовать такие векторы экспрессии, как вектор pCMV-Script (R), вектор PSG5 (производимый компанией Stratagene), pкДНК3.1 (производимый компанией Invitrogen).
Полученные таким путем трансформированные клетки вводят иммунным животным в случае необходимости вместе с дополнительными компонентами, такими как адъюванты. Примеры применяемых адъювантов содержат полный адъювант Фрейнда и тому подобное. В случае использования мышей как иммунных животных, трансформированные клетки можно вводить в диапазоне от 104 до 106 клеток, более конкретно, от 104 до 106 клеток. Обычно, иммуноген в виде многократной дозы вводят с равными интервалами, до повышения титра антител. Например, при краткосрочной иммунизации, трансформированные клетки вводят с интервалами от 2 до 4 дней, более конкретно с интервалами 3 дня. После двукратного или трехкратного введения можно извлекать антитело-продуцирующие клетки. Альтернативно, эти клетки вводят один раз в неделю, и антитело-продуцирующие клетки также можно извлекать через пять или шесть введений.
В настоящем изобретении извлеченные антитело-продуцирующие клетки клонируют для получения моноклональных антител. Предпочтительно, что антитело-продуцирующие клетки для клонирования делают бессмертными. Например, можно использовать способ слияния клеток, такой как способ гибридомы или трансформирование вирусом Эпштейна-Барра (EBV), в качестве способа получения бессмертных антитело-продуцирующих клеток.
В отношении антитело-продуцирующих клеток, одна клетка продуцирует один вид антитела. Поэтому, посев клеточных популяций, происходящих из одной клетки (то есть клонирование) дает возможность получать моноклональные антитела. Способ гибридомы охватывает процесс, в котором антитело-продуцирующие клетки сливают с подходящей бессмертной клеточной линией, и затем подвергают клонированию. Бессмертные антитело-продуцирующие клетки можно клонировать такой методикой, как способ предельных разведений. Известно, что существует множество клеточных линий, полезных для способа гибридомы. Эти клеточные линии являются превосходными по эффективности получения бессмертных лимфоцитарных клеток и имеют различные генетические маркеры, необходимые для выбора успешно слитых клеток. Дополнительно, если предполагается получение антитело-продуцирующих клеток, также можно использовать клеточную линию, неспособную продуцировать антитела.
Например, широко используются клеточные линии миеломы мыши P3x63Ag8.653 (ATCC CRL-1580) и P3x63Ag8U.1 (ATCCCRL-1597) как полезные для способа клеточного слияния у мышей или крыс. Вообще, гибридому создают слиянием однородных клеток, тогда как моноклональное антитело также можно получать из гетерогибридомы от разных видов среди близкородственных видов.
Общеизвестны конкретные протоколы слияния клеток. То есть, для осуществления слияния клеток антитело-продуцирующие клетки иммунных животных смешивают с подходящими партнерами слияния. Примеры используемых антитело-продуцирующих клеток включают в себя клетки селезенки, лимфоциты, забранные из лимфатического узла и B-клетки периферической крови. Можно использовать различные клеточные линии, описанные выше, в качестве клеток слияния. Для слияния клеток можно применять полиэтиленгликолевый способ и способ электрического слияния.
Затем, на основе селективных маркеров слитых клеток осуществляют отбор успешно слитых клеток. Например, если для слияния клеток выбирают HAT-сенситивную клеточную линию, проводят отбор успешно слитых клеток, выбирая клетки, растущие в среде HAT (гипоксантин, аминоптерин, тимидин). Дополнительно, антитела, продуцируемые выбранными клетками, обладают подтвержденной желательной реактивностью.
Проводили скрининг каждой гибридомы на основе реактивности антител. Таким образом, гибридому, продуцирующую антитела, которые связываются с человеческим ILT7, выбирают описанным ранее способом. Предпочтительно, при субклонировании выбранной гибридомы, и затем при окончательном подтверждении получения желательного антитела, подтвержденное антитело выбирают как гибридому, продуцирующую моноклональное антитело согласно изобретению.
В частности, можно выбирать желательную гибридому на основе реактивности к человеческим клеткам или реактивности к трансформированной клетке, которая экспрессирует ген человеческого ILT7. Антитела, которые связывают с клетками, могут быть обнаружены на основе принципа иммунологического исследования. Например, для обнаружения желательного антитела можно применять твердофазный иммуноферментный анализ ELISA, в котором клетки используются в качестве антигенов. Более конкретно, создают культуру супернатанта из гибридомы для контакта с матрицей, на которой человеческая ИПК или трансформированная клетка используется как иммуноген. Если супернатантная культура содержит желательное антитело, антитело захватывается клеткой, иммобилизированной на матрице. Затем твердую фазу отделяют от супернатантной культуры, которую при необходимости промывают. После того можно проводить обнаружение антитела, захваченного в твердой фазе. Для обнаружения антител можно использовать антитело, которое распознает антитело. Например, мышиное антитело может быть обнаружено антителом к антимышиному иммуноглобулину. Обнаружение облегчается, если антитело, которое распознает антитело, имеет метку. Примеры применяемых меток включают в себя ферменты, флуоресцентные краски, люминесцентные краски и тому подобное.
С другой стороны, в качестве матрицы для иммобилизации клеток можно использовать частицы и внутреннюю стенку микротитровальной чашки. Клетки могут быть иммобилизованы на частицах, сделанных из пластмассы или на поверхности контейнера путем физической адсорбции. Примеры матриц, применяемых для иммобилизации клеток, включают в себя гранулы из полистирола и реакционные пробирки.
При выборе гибридом можно прогнозировать получение антитела не против ILT7, а против клетки-хозяина трансформированной клетки, используемой в качестве иммуногена. Например, как показано в примерах, если в качестве иммуногена используется человеческая клетка, и мышь используется как иммунное животное, человеческая клетка распознает чужеродную субстанцию. Таким образом, прогнозируют продукцию антитела, которое связывается с чужеродной субстанцией. В настоящем изобретении предполагается получение антитела, способного распознавать человеческий ILT7. Таким образом, нет необходимости получать антитело, которое распознает другие антигены человеческой клетки, кроме человеческого ILT7. При скрининге для удаления гибридом, которые продуцируют такое антитело, можно абсорбировать нежелательные антитела перед подтверждением реактивности антитела.
Нежелательные антитела можно абсорбировать антигеном, с которым у антитела предполагается наличие связывания. В частности, например, антитело против других антигенов человеческой клетки, кроме человеческого ILT7, может быть абсорбировано клеткой, которая не способна обнаруживать экспрессию человеческого ILT7. В настоящем изобретении предпочтительно использовать клетку-хозяин, применяемую для иммуногена в качестве антигена для абсорбции нежелательных антител. Альтернативно, в качестве антигена для абсорбции антител можно использовать клетку-хозяин, не экспрессирующую внеклеточный домен человеческого ILT7, но экспрессирующую молекулу, которая ассоциируется с ILT7.
В отношении моноклонального антитела, для которого подтверждена активность связывания к антигену, при необходимости подтверждают его фактический эффект на активность ИПК. Действие на ИПК можно подтверждать, например способами, описанными ниже.
В отношении моноклонального антитела согласно изобретению проводят культивирование гибридомы, продуцирующей моноклональное антитело, и из получаемой культуры извлекают моноклональное антитело согласно изобретению. Гибридому можно культивировать in vitro или in vivo. Если гибридому культивируют in vitro, культивирование можно проводить с использованием общепринятой культуральной среды, такой как RPMI1640. Иммуноглобулин, секретируемый гибридомой, накапливается в супернатантной культуре. Таким образом, можно получать моноклональное антитело согласно изобретению посредством сбора супернатантной культуры и ее очистки в случае необходимости. Очистка иммуноглобулина облегчается, если в культуральную среду не добавляют сыворотку. Вместе с тем, для ускорения пролиферации гибридомы и содействия продукции антител можно добавлять к культуральной среде также 10% эмбриональную бычью сыворотку.
Также можно проводить культивирование гибридомы in vivo. В частности, можно осуществлять внутрибрюшинное культивирование гибридомы путем инокуляции гибридомы в брюшную полость голых мышей. Накопление моноклональных антител происходит в асцитической жидкости. Таким образом, при получении и очистке асцитической жидкости согласно требованиям, можно получать требуемое моноклональное антитело. Полученные моноклональные антитела можно подходящим образом модифицировать или обрабатывать согласно предполагаемому использованию.
Моноклональное антитело согласно изобретению можно экспрессировать путем получения кДНК, которая кодирует антигенсвязывающую область антитела из гибридомы, и путем внедрения ее соответствующий вектор экспрессии. Общеизвестна технология получения кДНК, которая кодирует вариабельную область антитела, и затем ее экспрессия в подходящую клетку-хозяин. Дополнительно, также известен способ создания химерного антитела путем сшивания вариабельной области, содержащей антигенсвязывающую область, в постоянную область.
Предпочтительные примеры моноклонального антитела согласно изобретению содержат моноклональные антитела, продуцируемые гибридомой №11 (инвентарный номер: FERM BP-107 04), гибридомой №17 (инвентарный номер; FERM BP-10705) или гибридомой №37. Ниже описаны аминокислотные последовательности, которые составляют вариабельные области этих моноклональных антител, а также кодирующие их последовательности оснований кДНК. Поэтому в настоящем изобретении являются предпочтительными, например, химерные антитела, получаемые конъюгацией этих вариабельных областей к константным областям других иммуноглобулинов. В аминокислотных последовательностях, описанных в перечне последовательностей, зрелый белок составляет аминокислотная последовательность от 1 до С-конца. Таким образом, идущие подряд последовательности аминокислот от 1 до С-конца для каждой аминокислотной последовательности представляют собой зрелую последовательность каждой аминокислотной последовательности. С другой стороны, аминокислотная последовательность, представленная по порядковым номерам от N-конца до -1, является сигнальной последовательностью.
Например, можно создать мышиное (вариабельная область) - человеческое (константная область) химерное антитело путем сшивания генов этих вариабельных областей в константную область тяжелой цепи человеческого IgG1 и ген, кодирующий константную область легкой цепи человеческого Ig каппа, соответственно. Ниже описаны аминокислотные последовательности такого химерного антитела и кодирующие их последовательности оснований, соответственно. Химерные антитела, определяемые этими последовательностями, показывают конструкцию предпочтительного варианта осуществления моноклонального анти-ILT7-антитела согласно изобретению. В следующих аминокислотных последовательностях химерных антител последовательность аминокислот от N-конца до -1 соответствует сигнальной последовательности, и последовательность аминокислот от 1 до C-конца соответствует зрелому белку. Таким образом, предпочтительным в настоящем изобретении является химерное антитело, состоящее из тяжелых и легких цепей, которые составлены из последовательности аминокислот от 1 до С-конца для каждой аминокислотной последовательности.
Дополнительно, антигенсвязывающую активность моноклонального антитела также можно переносить на другие иммуноглобулины. Вариабельная область иммуноглобулина состоит из области, определяющей комплементарность (CDR) и каркасной области. Антигенсвязывающее свойство каждого иммуноглобулина определяется CDR-областью, и каркасная область сохраняет структуру области связывания антигена. Аминокислотные последовательности CDR имеют высокое разнообразие, тогда как аминокислотные последовательность каркасного участка высоко консервативны. Известно, что аминокислотная последовательность, составляющая CDR, включена в каркасную область других молекул иммуноглобулина, что позволяет переносить антигенсвязывающую активность. Был создан способ, в котором антигенсвязывающие свойства разных иммуноглобулинов пересаживают на человеческий иммуноглобулин путем использования этой методики. Используемый в настоящем изобретении термин «область связывания антигена» может содержать CDR, которую пересаживают на каркасную область. Таким образом, термин «фрагмент, содержащий антигенсвязывающую область конкретного моноклонального антитела» содержит фрагмент человеческого иммуноглобулина, содержащего вариабельную область, на которую пересаживают CDR моноклонального антитела. Например, каждая из аминокислотных последовательностей вышеупомянутых вариабельных областей содержит следующие аминокислотные последовательности (SEQ ID NO) в качестве CDR.
(58)
(59)
(60)
(61)
(62)
(63)
(64)
(65)
(66)
(67)
(68)
(69)
(70)
(71)
(72)
(73)
(74)
(75)
На основе информации о последовательности оснований, которая кодирует вышеупомянутые аминокислотные последовательности, и информации о последовательности оснований, которая кодирует каркасную (FR) область человеческого иммуноглобулина, путем конъюгации обеих последовательностей оснований можно разработать праймер и можно амплифицировать кДНК, имеющую последовательности оснований. Операцию повторяют для каждой каркасной и вариабельной области, в которой можно сконструировать мышиные CDR1, CDR2, и CDR3, связанные человеческой FR. Дополнительно, если при необходимости конъюгируют последовательность оснований, которая кодирует константную область человеческого иммуноглобулина, можно получать гуманизированное антитело с константной областью.
В качестве химерного антитела, содержащего вышеупомянутые вариабельные области, или гуманизированного антитела, в которое пересаживают CDR, составляющую вариабельную область, антитело с константной областью, полученной из IgG или IgM, представляет собой предпочтительное антитело согласно изобретению. Авторы согласно изобретению подтвердили, что моноклональное антитело против ILT7 проявляет CDC активность на клетки, экспрессирующие ILT7. Таким образом, антитело, имеющее константную область, происходящую из IgG или IgM, проявляет цитотоксичность против ILT7-экспрессирующих клеток в силу CDC-эффекта. Такие антитела являются полезными для ингибирования ряда клеток, экспрессирующих ILT7, таких как ИПК.
Химерное антитело, способное распознавать ILT7 или гуманизированное антитело, обеспечиваемое согласно настоящему изобретению, можно получать путем генно-инженерного способа с использованием полинуклеотидов, кодирующих указанные антитела. Например, полинуклеотид, который является последовательностью оснований, описанной ниже последовательностями SEQ ID NO, и кодирует аминокислотную последовательность, составляющую зрелый белок для каждой аминокислотной последовательности, можно использовать в качестве полинуклеотида, кодирующего вариабельные области №11 или №17. Последовательность аминокислот, расположенных подряд от 1 до С-конца для каждой аминокислотной последовательности соответствует зрелому белку. Если каждый зрелый белок экспрессируется как отдельный белок, предпочтительно располагать сигнал к секреции в N-конец каждой аминокислотной последовательности. Например, в аминокислотных последовательностях, показанных в этих SEQ ID NO, последовательность аминокислот от N-конца до -1 можно использовать как сигнальную последовательность, если такие белки экспрессируются в животных клетках. Альтернативно, эти вариабельные области могут секретироваться как зрелые белки при использовании случайной сигнальной последовательности, которая позволяет секрецию иммуноглобулина.
№11 SEQ ID NO:50 (последовательность оснований), SEQ ID NO:52 (последовательность оснований),
№17 SEQ ID NO:54 (последовательность оснований), SEQ ID NO:56 (последовательность оснований)
Тем же образом, как описано выше в отношении полинуклеотида, кодирующего гуманизированное антитело, можно создавать полинуклеотид, который экспрессирует гуманизированное антитело, используя последовательность оснований, которая кодирует белок, имеющий сигнальную последовательность, добавляемую к N-концу. Если отдельные векторы несут тяжелые и легкие цепи, оба вектора совместно трансфицируются в одну клетку-хозяина. Для конструирования молекулы иммуноглобулина с обеими цепями используют тяжелые и легкие цепи, экспрессируемые от каждого вектора. Как полинуклеотид, кодирующий тяжелую цепь, так и полинуклеотид, кодирующий легкую цепь, также могут переноситься одним вектором. Клетка-хозяин, в которую ко-трансфицирован вектор, несущий оба полинуклеотида, экспрессирует тяжелые и легкие цепи и продуцирует иммуноглобулин, имеющий обе цепи.
Эти полинуклеотиды могут экспрессироваться как антитела, используя систему вектор-хозяин, способную к экспрессии гена антитела. Кроме того, если они экспрессируются в виде единственной молекулы белка путем соединения вариабельной области тяжелой цепи с вариабельной областью легкой цепи, сигнальную последовательность можно располагать на N-конце молекулы белка. Известный пример такой молекулы антитела включает в себя scFv молекулу, в которой вариабельная область тяжелой цепи и вариабельная область легкой цепи связаны линкером.
Каждое из моноклональных антител, полученных таким образом, составляет моноклональное антитело согласно изобретению. Другими словами, моноклональное антитело, которое состоит из иммуноглобулина, содержащего область связывания антигена, и кодируется полинуклеотидом, происходящим из кДНК, кодирующей область связывания антигена вышеупомянутых моноклональных антител, составляет моноклональное антитело согласно изобретению.
Как описано ранее, клетки RBL, в которых вызвана экспрессия гена ILT1, можно использовать в качестве иммуногена для получения антител ILT1. Вместе с тем, невозможно подтвердить экспрессию ILT7 на поверхности клеток RBL (PSiS), и таким образом, его нельзя использовать в качестве иммуногена. Авторы согласно изобретению выявили, что экспрессия человеческого ILT7 на клеточной поверхности может индуцироваться коэкспрессией человеческого ILT7 и других белков клеточной мембраны, которые ассоциируются с человеческим ILT7. Затем авторы согласно изобретению выявили, что в качестве иммуногена можно получать антитело, которое связывается с человеческими ИПК, при использовании трансформированной клетки, экспрессия которой индуцирована таким образом, и пришли к осуществлению согласно изобретению.
Таким образом, настоящее изобретение обеспечивает иммуноген для получения антитела, которое связывается с внеклеточным доменом человеческого ILT7, и содержит животные клетки, в которых сохраняется (a) полинуклеотид, который кодирует аминокислотную последовательность, содержащую внеклеточный домен человеческого ILT7; и (b) полинуклеотид, который кодирует γ-цепь Fc-рецептора, чтобы экзогенно экспрессироваться, или фракции их клеточной мембраны.
Прошло более шести лет или больше после выявления структуры человеческого ILT7 в 1998 году. Вместе с тем, до настоящего времени еще не получено антитело, способное к специфичному распознаванию ILT7. В настоящем изобретении впервые обеспечивается антитело, способное распознавать человеческий ILT7 при использовании иммуногена. Таким образом, настоящее изобретение обеспечивает антитело, способное распознавать человеческий ILT7, которое можно получить следующими этапами:
(1) введение иммунным животным клетки, которая экзогенно экспрессирует белок, содержащий внеклеточный домен человеческого ILT7, и молекулы, содержащей аминокислотные последовательности, описанные в SEQ ID NO:16; и
(2) выбор антитело-продуцирующей клетки, которая продуцирует антитело, связывающееся с человеческим ILT7, из антитело-продуцирующей клетки иммунных животных.
(3) культивирование антитело-продуцирующих клеток, выбранных в этапе (2), и
извлечение из культуры антитела, способного распознавать человеческий ILT7.
Выявлено, что человеческий ILT7 специфически экспрессируется в человеческой ИПК. В серийном анализе генетической экспрессии SAGE, проведенном авторами согласно изобретению, также подтверждена специфическая экспрессия человеческого ILT7 в человеческой ИПК. Вместе с тем, по прошлым сообщениям, уровни экспрессии ILT7 в обоих случаях анализировали на основе мРНК. Поскольку не было обеспечено антитело, способное к обнаружению человеческого ILT7, общепринятый анализ состояния экспрессии белка не проводили. Анализ человеческого белка ILT7 осуществляли при условии, что антитело связывается с внеклеточным доменом человеческого ILT7 согласно изобретению.
Авторы согласно изобретению фактически подтвердили, что моноклональное антитело, которое связывается с внеклеточным доменом человеческого ILT7 согласно настоящему изобретению, специфически обнаруживает человеческие ИПК. Таким образом, настоящее изобретение относится к способу обнаружения интерферонпродуцирующих клеток, который содержит следующие этапы: контакт тестируемой клетки с моноклональным антителом, которое связывается с внеклеточным доменом человеческого ILT7 или фрагмента, содержащего антигенсвязывающую область; и обнаружение моноклонального антитела, которое связывается с клетками или фрагментом, содержащим его антигенсвязывающую область.
Обнаружение человеческих ILT7 согласно настоящему изобретению позволяет определять, является ли конкретная клетка интерферонпродуцирующей клеткой. Таким образом, настоящее изобретение обеспечивает способ идентификации ИПК, используя человеческий ILT7 в качестве индикатора. Альтернативно, человеческие ИПК можно выделять путем сепарации клеток, в которых обнаружен человеческий ILT7 согласно настоящему изобретению. Таким образом, настоящее изобретение обеспечивает способ выделения ИПК, используя в качестве индикатора человеческий ILT7.
На основе анализа человеческого антитела ILT7 было подтверждено снижение уровня экспрессии ILT7 в ИПК, дифференцировка которых была индуцирована CpG и тому подобным. Таким образом, используя в качестве индикатора ILT7, можно специфически обнаруживать ИПК перед индукцированием их дифференцировки. Другими словами, моноклональное антитело согласно изобретению является полезным, в особенности для обнаружения ИПК перед их дифференцировкой в дендритные клетки. Используемое в настоящем изобретении понятие "ИПК перед их дифференцировкой" может обозначать клеточные популяции, которые сохраняют способность продуцировать интерферон.
Моноклональное антитело согласно изобретению, которое связывается с внеклеточной областью человеческого ILT7 или фрагмента, содержащего его антигенсвязывающую область, заранее можно подвергать мечению. Например, антитела можно легко обнаруживать путем мечения их люминесцентными красками или флуоресцентными красками. Более конкретно, создают меченое флуоресцентной краской антитело для контакта с клеточной популяцией, которая может содержать ИПК и затем с клетками, связывание антитела настоящего связанного изобретения с которыми можно обнаруживать, использую флуоресцентную краску как индикатор. Дополнительно, можно выделять ИПК посредством сепарации клеток, в которых обнаружена флуоресцентная краска. Ряд этапов можно легко осуществлять на основе принципа FACS.
Альтернативно, антитело согласно изобретению может заранее связываться с твердофазной матрицей, такой как магнитные частицы. Антитело, связанное с твердофазной матрицей, распознает человеческий ILT7, и затем происходит захват ИПК в твердофазной матрице. В результате можно обнаруживать или выделять ИПК.
Антитело, необходимое для способа обнаружения ИПК согласно настоящему изобретению, может обеспечиваться в виде реагентов для обнаружения ИПК. То есть, настоящее изобретение обеспечивает реагент для обнаружения интерферонпродуцирующих клеток, который содержит моноклональное антитело, связывающееся с внеклеточным доменом человеческого ILT7, или фрагмент, содержащий его антигенсвязывающую область. Реагент для обнаружения ИПК согласно изобретению в дополнение к антителам можно использовать в комбинации с положительным контролем или с отрицательным контролем. Например, в качестве положительного контроля можно использовать трансформированные клетки, которые экспрессируют внеклеточный домен человеческого ILT7, и используются для иммуногена, а также ИПК, полученные от человека. Обычно из периферической крови можно получить только небольшое количество человеческих ИПК. Поэтому в качестве положительного контроля в реагенте согласно изобретению особенно предпочтительно использовать трансформированную клетку. С другой стороны, в качестве отрицательного контроля может использоваться случайная клетка, которая не экспрессирует человеческий ILT7.
Таким образом, настоящее изобретение обеспечивает комплект для обнаружения человеческих ИПК, который содержит:
(a) моноклональное антитело, которое связывается с внеклеточным доменом человеческого ILT7, или фрагмент, содержащий его антигенсвязывающую область; и
(b) клетку, которая экспрессирует экзогенный белок, содержащий внеклеточный домен человеческого ILT7, и экзогенную молекулу, ассоциированную с человеческим ILT7.
Авторы согласно изобретению провели анализ действия антитела, которое связывается с внеклеточным доменом человеческого ILT7 на ИПК. В результате было подтверждено, что антитело, связывающееся с внеклеточным доменом человеческого ILT7, ингибирует активность ИПК. Таким образом, настоящее изобретение относится к способу ингибирования активности интерферонпродуцирующих клеток, который содержит этап контакта с интерферонпродуцирующей клеткой любого из следующих компонентов:
(a) моноклонального антитела, которое связывается с человеческим ILT7 и ингибирует активность интерферонпродуцирующих клеток, или фрагмента, содержащего его антигенсвязывающую область; и
(b) иммуноглобулина, на который пересаживают область, определяющую комплементарность, моноклонального антитела, описанного в пункте (a), или фрагмент, содержащий его антигенсвязывающую область.
Альтернативно, настоящее изобретение относится к способу ингибирования активности интерферонпродуцирующих клеток живых организмов, который содержит этап введения живому организму любого из следующих компонентов:
(a) моноклонального антитела, которое связывается с человеческим ILT7 и ингибирует активность интерферонпродуцирующих клеток, или фрагмента, содержащего его антигенсвязывающую область; и
(b) фрагмента, содержащего иммуноглобулин, на который пересаживают область, определяющую комплементарность, моноклонального антитела, описанного в пункте (a), или фрагмента, содержащего его антигенсвязывающую область; и
(c) полинуклеотида, который кодирует компоненты, описанные в пунктах (a) или (b).
Используемый в настоящем изобретении термин «интерферонпродукцирующие клетки (ИПК)» означает клетки, которые обладают способностью вырабатывать ИФН и экспрессировать ILT7 на клеточной поверхности. Далее, если не указано иначе, термин «ИПК» охватывает не только клетки, которые являются клетками-предшественниками дендритных клеток, но также и клетки, способные продуцировать ИФН и экспрессировать ILT7 на клеточной поверхности. Способы идентификации таких ИПК общеизвестны. Выделять ИПК из других клеток крови можно с использованием в качестве индикаторов некоторых маркеров клеточной поверхности. В частности, свойства маркеров клеточной поверхности человеческих ИПК описаны ниже (Shortman, K. and Liu, YJ. Nature Reviews 2: 151-161, 2002). В последние годы был опубликован ряд предположений, что BDCA-2 положительную клетку определяют как ИПК (Dzionek, A. et al. J. Immunol. 165; 6037-6046, 2000).
[Характеристика антигенов клеточной поверхности человеческих ИПК]
CD4-положительный, CD123-положительный,
Происходящие из линий (CD3, CD14, CD16, CD19, CD20, CD56) отрицательные и CD11-отрицательные.
Таким образом, можно также сказать, что ИПК являются клетками, обладающими свойствами экспрессии указанных известных маркеров и обладающими способностью продуцировать ИФН. Дополнительно, клетки живых организмов, способные продуцировать ИФН, входят в ИПК, даже если указанные клетки представляют собой клеточную популяцию с характеристиками, отличающимися от параметров экспрессии характеристики экспрессии этих маркеров. Дополнительно, примеры свойств, которые обычно проявляют человеческие ИПК, представлены следующим образом: [Морфологические свойства клеток]
- Сходны с плазматическими клетками
- Круглые клетки с гладкой клеточной поверхностью
- Имеют относительно большое ядро
[Функциональные свойства клеток]
- При вирусной инфекции за короткий промежуток времени продуцируют большое количество интерферонов 1 типа.
- Дифференцируются в дендритные клетки после вирусной инфекции.
Используемое в настоящем изобретении понятие «ингибирование активности ИПК» означает ингибирование по меньшей мере одной из функций ИПК. Примеры функции ИПК включают в себя продукцию ИФН и выживаемость клетки. Выживаемость клетки также можно переводить на число клеток. Поэтому в случае ингибирования этих двух функций или какой-либо из функций, указывается, что ингибирована активность ИПК. Выявлено что ИФН 1 типа, продуцируемый ИПК, приводит к возникновению различных заболеваний. В этой связи ингибирование ряда ИПК и продукции ИФН является полезным в лечении этих заболеваний.
Например, подчеркивается взаимоотношение между патологическим состоянием при аутоиммунных заболеваниях и ИФНα. Большая часть ИФНα продуцируется ИПК. Таким образом, путем ингибирования продукции ИФНα можно облегчать патологические состояния, вызванные ИФНα. Используемое в настоящем изобретении понятие "ингибирование продукции ИФН посредством ИПК" означает ингибирование продукции по меньшей мере одного из ИФН, продуцируемых ИПК. Предпочтительными ИФН согласно изобретению являются ИФН 1 типа. Важное значение среди них имеет ИФНα.
Таким образом, настоящее изобретение относится к ингибитору продукции ИФН, который содержит в качестве активного компонента антитело, связывающееся с внеклеточным доменом ILT7. Альтернативно, настоящее изобретение обеспечивает способ ингибирования продукции ИФН, содержащий этап введения антитела, которое связывается с внеклеточным доменом ILT7. Дополнительно, настоящее изобретение относится к использованию антитела, которое связывается с внеклеточным доменом ILT7, для производства лекарственной композиции, ингибирующей продукцию ИФН.
Клетки, в которых большое количество ИФН продуцируется небольшим количеством клеток, включены в число ИПК. Например, клетки-предшественники дендритных клеток, стимулированные вирусами и тому подобным, продуцируют наибольшую часть ИФН, вырабатываемых живым организмом. Ингибирование ряда ИПК, что вызывает продукцию значительного количества ИФН, приводит к супрессии продукции ИФН. Таким образом, патологические состояния, вызванные ИФНα, можно уменьшить путем ингибирования ряда ИПК. Было подтверждено, что предпочтительным вариантом осуществления согласно изобретению является моноклональное анти-ILT7-антитело, связанное с клетками, экспрессирующими ILT7, и затем приобретающее цитотоксическое действие от комплементзависимой цитотоксичности (CDC). Эффект CDC представляет собой один из важных механизмов лекарственного препарата антитела. Моноклональное анти-ILT7-антитело согласно изобретению также обладает мощной цитотоксичностью против клеток, экспрессирующих ILT7, таких как ИПК, в силу его CDC-эффекта. Таким образом, в предпочтительном варианте осуществления в отношении моноклонального анти-ILT7-антитела, можно ожидать действия ингибирования продукции ИФН посредством цитотоксичности против ИПК, в дополнение к механизму ингибирования продукции ИФН.
Антитело, которое распознает внеклеточный домен человеческого ILT7, используемого в настоящем изобретении, можно получать ранее описанным способом. Антитело согласно изобретению может быть представлено любым классом антител. Также не ограничены виды организмов, из которых получают указанное антитело. Дополнительно, в качестве антитела можно использовать фрагмент, содержащий антигенсвязывающую область антитела. Например, в качестве антитела согласно изобретению может использоваться фрагмент антитела, содержащий антигенсвязывающую область, которая получена ферментативным расщеплением IgG. В частности, фрагменты антитела, такие как Fab и F(ab')2, можно получать расщеплением папаином или пепсином. Общеизвестно, что эти фрагменты антитела можно использовать как молекулы антитела, обладающие аффинностью к антителам. Альтернативно, также можно использовать антитела, сконструированные технологией рекомбинантных генов, при условии сохранения удовлетворительной антигенсвязывающей активности.
Примеры антител, сконструированных технологией рекомбинантных генов, включают в себя химерные антитела, CDR-трансплантированные антитела, одноцепочечные Fvs, димеры, линейные антитела и полиспецифические антитела, образованные из фрагментов антитела. Общеизвестно, что эти антитела могут быть обеспечены использованием моноклональных антител.
Антитела согласно изобретению при необходимости можно модифицировать. Согласно настоящему изобретению, антитело, которое распознает внеклеточный домен человеческого ILT7, обладает ингибирующим действием на активность ИПК. Таким образом, предполагается, что само антитело обладает цитотоксичностью против ИПК. Известны подклассы антител, проявляющие мощное эффекторное действие. Альтернативно, ингибирующее действие на активность ИПК можно дополнительно усиливать путем модификации антитела цитотоксическим агентом. Примеры цитостатических агентов приведены ниже.
Токсины: эндотоксин Pseudomonas (FE), дифтерийный токсин, рицин.
Радиоизотопы: Tc99m, Sr89, I131, Y90.
Противораковые агенты: калихеамицин, митомицин, паклитаксел.
Токсины, состоящие из белков, можно конъюгировать с антителами или их фрагментам с бифункциональным реактивом. Альтернативно, ген, кодирующий токсин, связан с геном, кодирующим антитело, и также можно получать слитые белки обоих генов. Также известен способ конъюгирования антител с радиоизотопами. Например, известен способ мечения антител радиоизотопами с использованием хелирующего агента. Кроме того, противораковые агенты можно конъюгировать с антителами, используя сахарные цепи или бифункциональный реактив.
Авторы согласно изобретению подтвердили феномен включения в клетки моноклонального антитела, которое связывается с ILT7, экспрессируемым на клеточной мембране, после связывания (интернализация). Таким образом, цитотоксические вещества можно доставлять в клетки путем контакта антител, конъюгированных с указанными цитотоксическими агентами согласно изобретению, с клетками, экспрессирующими ILT7. То есть, настоящее изобретение обеспечивает активный ингибитор клеток, экспрессирующих ILT7, которые содержат моноклональное анти-ILT7-антитело, к которому конъюгирован цитотоксический агент в качестве активного компонента. Альтернативно, настоящее изобретение относится к использованию моноклонального анти-ILT7-антитела, к которому конъюгирован цитотоксический агент, для получения активного ингибитора клеток, экспрессирующих ILT7. Дополнительно, настоящее изобретение обеспечивает способ ингибирования активности клеток, экспрессирующих ILT7, содержащий этап введения моноклонального анти-ILT7-антитела, к которому конъюгирован цитотоксический агент.
В настоящем изобретении также можно использовать в качестве активного компонента антитело, структура которого искусственно модифицирована. Например, известны различные способы модификации для повышения цитотоксичности и устойчивости антител. В частности, известен иммуноглобулин, в котором модифицированы сахарные цепи тяжелых цепей (Shinkawa, T. et al. J. Biol. Chem. 278:3466-3473. 2003). Антителозависимая клеточноопосредованная цитотоксичность (ADCC) иммуноглобулина усиливалась модификацией сахарных цепей. Альтернативно, также известен иммуноглобулин, в котором модифицирована аминокислотная последовательность Fc области. Таким образом, действие ADCC усиливали путем искусственного повышения связывающей активность иммуноглобулина к Fc-рецептору (Shield, RL. et al. J. Biol. Chem. 276; 6591-6604, 2001).
После связывания IgG с Fc-рецептором он включается в клетки. Затем IgG связывается с Fc-рецептором, который экспрессируется в эндосоме, и снова высвобождается в кровь. Этот феномен был выявлен. После включения в клетку IgG с высокой активностью связывания с Fc-рецептором имеет лучший шанс повторного высвобождения в кровь. В результате время удерживания IgG в крови увеличивается (Hinton, PR. et al. J Biol Chem. 279: 6213-6216. 2004). В дополнение к этому указано, что модификация аминокислотной последовательности Fc-области вызывает изменение активности комплементзависимой цитотоксичности (CDC). Эти модифицированные антитела можно использовать в качестве антитела согласно изобретению.
При контакте антитела, которое связывается с внеклеточным доменом человеческого ILT7, с ИПК, происходит ингибирование активности ИПК. Поэтому указанные антитела можно использовать для ингибирования или способа ингибирования активности ИПК. Таким образом, настоящее изобретение обеспечивает в качестве активного компонента активный ингибитор ИПК, который содержит по меньшей мере один компонент, выбираемый из группы, состоящей из следующих пунктов от (a) до (c). Альтернативно, настоящее изобретение относится к способу ингибирования активности ИПК, содержащему этап введения по меньшей мере одного компонента, выбираемого из группы, состоящей из следующих пунктов от (a) до (c). Дополнительно, настоящее изобретение относится к использованию для получения активного ингибитора ИПК по меньшей мере одного компонента, выбираемого из группы, состоящей из следующих пунктов от (a) к (c):
(a) моноклонального антитела, которое связывается с человеческим ILT7 или фрагментом, содержащим его антигенсвязывающую область;
(b) иммуноглобулина, на который пересаживают область, определяющую комплементарность антитела, описанного в п. (a), или фрагмента, содержащего его антигенсвязывающую область; и
(c) полинуклеотида, который кодирует компоненты, описанные в п.п. (a) или (b).
В настоящем изобретении моноклональное антитело, которое распознает внеклеточный домен человеческого ILT7, может использоваться как моноклональное антитело, которое ингибирует активность ИПК. В настоящем изобретении можно использовать одно или больше моноклональных антител. Например, для использования в настоящем изобретении смешивают одно или больше моноклональных антител, которые распознают внеклеточный домен человеческого ILT7.
Можно подтвердить наличие ингибирующего действия на выработку ИФН у антител ИПК таким образом, как описано ниже. ИПК продуцируют большое количество ИФН в силу вирусной стимуляции. Антитела контактируют с ИПК перед вирусной стимуляцией ИПК, после, или во время как стимуляции. Способность продуцировать ИФН у каждого из получаемых ИПК сравнивают со способностью каждого контроля, с которым не контактируют антитела. Можно оценивать возможность продуцировать ИФН, измеряя содержание ИФНα или ИФНβ в супернатантной культуре ИПК. По результатам сравнения можно подтвердить, что тестируемые антитела эффективно ингибируют способность продуцировать ИФН, если количество ИФН в супернатанте значительно уменьшается при добавлении антител. Известны такие способы измерения ИФН. ИПК вырабатывают большую часть ИФН в живом организме. Таким образом, состояние продуцирования ИФН в живом организме может быть отрегулировано путем ингибирования способности ИПК продуцировать ИФН.
Действие ИПК согласно изобретению сохранение количества ИПК. Поэтому ингибирование действия ИПК в настоящем изобретении содержит ингибирование количества ИПК. При достоверном ингибировании числа ИПК в присутствии антител, можно выявить, что антитела ингибируют активность ИПК. Как в случае с продукцией ИФН, в качестве сравнительного контроля может использоваться инертный иммуноглобулин, полученный от тех же видов животных, что и антитело, активность которого необходимо подтвердить. Можно проводить количественное сравнение ИПК в цитометрах. Число клеток можно подсчитывать с FACS или под микроскопом.
Дополнительно, указано, что ИПК дифференцируются в клетки, которые индуцируют Th2, называемые дендритными клетками 2 (ДК2) в результате вирусной инфекции или подобной стимуляцией. Если можно ингибировать продукцию ИФН вирусной стимуляцией ИПК, их дифференцировка в Th2 также может быть ингибирована. Поэтому предполагается, что моноклональное антитело согласно изобретению, которое ингибирует продукцию ИФН, также может иметь терапевтический эффект при различных аллергических заболеваниях.
При введении антитела, распознающего внеклеточный домен человеческого ILT7, в организм-хозяин, отличающийся от вида организма, из которого происходит антитело, желательно обработать антитело в такую форму, которая с трудом распознается хозяином как чужеродный агент. Например, невозможно легко распознать иммуноглобулин как чужеродный агент при обработке антитела в следующие молекулы. Известна технология обработки молекулы иммуноглобулина, описанная ниже. Фрагмент, содержащий антигенсвязывающую область, которая не имеет константной области (Monoclonal Antibodies: Principles and Practice, third edition, Academic Press Limited. 1995; Antibody Engineering, A Practical Approach, IRL PRESS, 1996)
- Химерное антитело, составленное из антигенсвязывающей области моноклональных антител и константной области иммуноглобулина хозяина ("Gene Expression Experiment Manual", Isao Ishida, Tamie Ando, eds., Kodansha, 1994)
- CDR-замещенное антитело, в которой область, определяющая комплементарность (CDR) иммуноглобулина хозяина заменяют на CDR моноклонального антитела ("Gene Expression Experiment Manual", Isao Ishida, Tamie Ando, eds., Kodansha, 1994)
Альтернативно, человеческое антитело можно получать с использованием животных нечеловеческого происхождения в качестве иммунных животных, в которых включают ген человеческого антитела. Например, трансгенные мыши с генами человеческого антитела имели практическое использование, как иммунные животные, для получения человеческих антител (Ishida et al., Cloning and Stem Cells, 4:85-95, 2002). Использование таких животных позволяет получать человеческое антитело, которое распознает ILT7 с применением иммуногенов, как описано ранее. У людей предпочтительно введение человеческого антитела.
Альтернативно, также можно получать ген вариабельной области человеческого иммуноглобулина способом фагового дисплея (McCafferty J. et al., Nature 348: 552-554, 1990; Kretzschmar T et. al., Curr. Opin. Biotechnol. 2002 Dec; 13(6): 598-602). В способе фагового дисплея ген, кодирующий вариабельную область человеческого иммуноглобулина, вставляется в ген фага. Также можно создавать фаговую библиотеку с использованием разных генов иммуноглобулина в качестве источников. Фаг экспрессирует вариабельную область, как в слитом белке из белка, составленного из фага. Вариабельная область, экспрессируемая фагом на поверхности фага, сохраняет антигенсвязывающую активность. Поэтому выбирают фаги, которые связываются с антигенами или клетками, в которых экспрессируются антигены, что позволяет, таким образом, скрининг в фаговой библиотеке фага, в котором экспрессируется вариабельная область, имеющая желательную связывающую активность. Дополнительно, в фаговых частицах сохраняется выбранный таким образом ген, кодирующий вариабельную область, которая имеет желательную связывающую активность. То есть в способе фагового дисплея, в качестве индикатора может быть получен ген, кодирующий вариабельную область с желательной связывающей активностью, при использовании связывающей активности вариабельной области.
Рассматривая активный ингибитор ИПК или способ ингибирования активности ИПК согласно изобретению, антитело, которое распознает внеклеточный домен человеческого ILT7, или фрагмент антитела, который содержит по меньшей мере антигенсвязывающую область антитела, можно вводить в виде белка или полинуклеотида, кодирующего белок. При введении полинуклеотидов желательно использовать вектор, в котором полинуклеотид, кодирующий желаемый белок, находится под контролем соответствующего промотора, для экспрессии требуемого белка. Также в вектор можно помещать ген-усилитель и терминатор. Известен вектор, который несет ген тяжелых и легких цепей, составляющих иммуноглобулин, и способный к экспрессии молекулы иммуноглобулина.
Вектор, способный экспрессировать иммуноглобулин, можно вводить внедрением его в клетки. При введении живым организмам, вектора с возможностью инфицирования клеток путем введения их в живые организмы, его можно внедрять прямым образом. После выделения лимфоцитов из живого организма вектор внедряют в лимфоциты, которые можно обратно вводить в живой организм (ex vivo).
Рассматривая активный ингибитор ИПК или способ ингибирования активности ИПК согласно настоящему изобретению в отношении количества моноклональных антител, которые будут вводиться живым организмам, иммуноглобулин обычно вводят в диапазоне от 0,5 мг до 100 мг, например, от 1 мг до 50 мг, предпочтительно от 2 мг до 10 мг на 1 кг веса тела. Интервалы введения антитела в живые организмы можно регулировать подходящим образом, чтобы концентрация иммуноглобулина в живых организмах во время лечения поддерживалась на эффективном уровне. В частности, например, антитело можно вводить с интервалами от 1 до 2 недель. Можно выбирать путь введения. Специалисты в данной области техники могут подходящим образом выбирать эффективный путь введения при лечении. Конкретные примеры путей введения включают в себя пероральное или парентеральное введение. Антитела вводят системно или местно, например, путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, подкожной инъекции, или подобными путями. Примеры подходящих рецептур согласно изобретению для парентерального введения включают в себя растворы для инъекций, суппозитории и распыляемые растворы. Если антитело контактирует с клетками, иммуноглобулин добавляют к культуральной среде обычно в диапазоне 1 мкг/мл, предпочтительно 10 мкг/мл, более предпочтительно 50 мкг/мл, дополнительно предпочтительно 0,5 мг/мл.
Рассматривая активный ингибитор ИПК или способ ингибирования активности ИПК согласно настоящему изобретению, моноклональное антитело можно вводить живым организмам дополнительными способами. Обычно моноклональное антитело смешивают с фармацевтически приемлемой основой. При необходимости можно смешивать моноклональное антитело с добавками, такими как загустители, стабилизаторы, консерванты и солюбилизаторы. Примеры такой основы или добавок включают в себя лактозу, лимонную кислоту, стеариновую кислоту, стеарат магния, сахарозу, крахмал, тальк, желатин, агар, растительное масло и этиленгликоль. Термин "фармацевтически приемлемый" означает одобрение регулирующим органом каждого правительства или перечисление в Фармакопее каждой страны, или в другой общепризнанной фармакопее для использования у животных, у млекопитающих, и более конкретно, у людей. Активный ингибитор ИПК согласно изобретению также может обеспечиваться в виде однократных или множественных доз лиофилизированных порошков или таблеток. Дополнительно, лиофилизированные порошки или таблетки можно использовать в комбинации со стерильной водой для инъекций, с физиологическим раствором или буферным раствором для разведения композиций с целью получения желательной концентрации перед введением.
Дополнительно, когда моноклональное антитело вводят как вектор, экспрессирующий иммуноглобулин, тяжелые и легкие цепи котрансфицируют в другую плазмиду, и каждую плазмиду можно вводить в диапазоне от 0,1 до 10 мг, например, от 1 до 5 мг, на 1 кг веса тела. Для введения плазмиды в клетки in vitro содержание используемых векторов будет составлять от 1 до 5 мкг/106 клеток. Далее в настоящем изобретении это будет конкретно описано посредством примеров.
Все предшествующие документы из данной области техники, цитируемые в настоящем изобретении, включены со ссылкой во всей их полноте.
Пример 1
А. Анализ экспрессии ILT7
А-1 Анализ с использованием библиотеки SAGE
Экспрессию генов в человеческих моноцитах, ИПК и ИПК, обработанных вирусом простого герпеса HSV, сравнивали и анализировали способом серийного анализа генетической экспрессии (Торговая марка; SAGE). Способ анализа описан ниже. Из человеческой периферической крови выделяли моноциты, как BDCA-4 положительные клетки, и ИПК выделяли как CD14 положительные клетки, используя клеточный сортер. Дополнительно, ИПК культивировали в течение 12 часов в присутствии вируса простого герпеса (HSV), и затем приготавливали дифференцированные ИПК. РНК получали из соответствующих клеток, с последующим получением библиотеки SAGE, используя комплект I-SAGE (торговая марка) (производства Invitrogen). Данные из полученных последовательностей оснований около 100000 меток анализировали, используя программное обеспечение анализа SAGE (производства Invitrogen). В результате был найден ген, в котором, по подсчетам, соотношение моноцит/ИПК/ИПК+HSV составляло 0/16/0, а именно, ILT7 (GenBank Acc №NM_012276), известный как ген, проявляющий специфичную экспрессию ИПК. ILT7 представляет собой мембранный белок с иммуноглобулиноподобными доменами, кодируемый последовательностью оснований, которая показана в SEQ ID NO:1 (фиг. 2 (a). Сообщается, что мРНК из ILT7 экспрессируется в ИПК (Blood 100, 3295-3303 (2002)).
A-2) RT-ПЦР
Более подробно исследовали экспрессию ILT7 в гемоцитарных клетках. Каждую клетку предварительно выделяли из человеческой периферической крови клеточным сортером. РНК извлекали из каждой из выделенных клеточных популяций, из которых синтезировали кДНК. Количественную ПЦР проводили согласно общепринятому способу, используя в качестве матрицы получаемую кДНК, и анализировали уровень экспрессии мРНК из ILT7.
Применяли следующие условия для последовательностей оснований праймеров и ПЦР:
Прямой праймер: 5' CTC CAA CCC CTA CCT GCT GTC 3' (SEQ ID NO:3)
Обратный праймер: 5' TTC CCA AGG CTC CAC CAC TCT 3' (SEQ ID NO:4)
1 цикл ПЦР (при 94°C в течение 3 минут)
25 циклов ПЦР (при 94°C в течение 30 секунд, при 58°C в течение 30 секунд, и при 72°C в течение 1 минуты)
1 цикл ПЦР (при 72°C в течение 6 минут)
При стимуляции ИПК моноцитами проводили изучение ИПК, HSV и CD19-положительных клеток (то есть, B-клеток), CD3-положительных клеток (то есть, Т-клеток), T-клеток, стимулированных PMA и CD56-положительных клеток (то есть, NK-клеток), и было выявлено, что ILT7 специфически экспрессируется в ИПК (фиг. 1 (a).
A-3) Количественный RT-ПЦР
Дополнительно, исследовали экспрессию в других органах и тканях путем количественной ПЦР, используя ABI PRISM 7000 (производства Applied Biosystem). В качестве панели кДНК использовали BD (Торговая марка), MTC - множественную тканевую кДНК панель (Human I; Cat.No.636742, Human immune; Cat.No.636748, Human blood fractions: Cat. No. 636750; все из перечисленного производства Becton Dickinson), и те же кДНК, полученные из гемоцитарных клеток, как описано в п.2).
Использовали следующие последовательности оснований праймеров:
Прямой праймер для ILT7: 5' CCT CAA TCC AGC ACA AAA GAA GT 3' (SEQ ID NO:5)
Обратный праймер для ILT7: 5' CGG ATG AGA TTC TCC ACT GTG TAA 3' (SEQ ID NO:6)
Прямой праймер для GAPDH: 5' CCA ССС ATG GCA AAT TCC 3' (SEQ ID NO:7)
Обратный праймер для GAPDH: 5' TGG GAT TTC CAT TGA TGA CAA G 3' (SEQ ID NO:8)
ПЦР проводили, используя ABI PRISM 7000 (производства Applied Biosystem) и комплект SYBR green PCR master mix (производства той же компании). Для анализа использовали программное обеспечение системы обнаружения последовательности (производства той же компании).
Применяли следующие условия реакции:
Этап 1: 1 цикл ПЦР (при 50°C в течение 2 минут)
Этап 2: 1 цикл ПЦР (при 95°C в течение 10 минут)
Этап 3: 40 циклов ПЦР (при 95°С в течение 15 секунд, при 60°C в течение 1 минуты)
Сравнение экспрессии гена ILT7 проводили между каждой тканью путем стандартизации по уровню экспрессии гена глицеральдегид-3-фосфатдегидрогеназы (GAPDH) с известной конститутивной экспрессией. В результате было отмечено, что ILT7 не экспрессируется в каких-либо органах, кроме лимфатических тканей, и специфически экспрессируется в ИПК.
B. Получение ILT7 и векторов экспрессии FcRγ
Для экспрессии белков ILT7 последовательно проводили клонирование генов и получение векторов экспрессии.
B-1) Клонирование генов ILT7
Поли(A)+РНК, выделенную из человеческой периферической крови, извлекали из ИПК, из которых синтезировали кДНК, используя праймер oligo dT и комплект для синтеза кДНК Super Script Choice System. Адаптер EcoRI лигировали в синтезируемую кДНК, которую лигировали в вектор pME18S, расщепляемый EcoRI, что приводило к получению библиотеки кДНК человеческой ИПК. Ген ILT7 амплифицировали способом ПЦР, используя полученную библиотеку кДНК в качестве матрицы, а так же используя праймеры со следующими последовательностями оснований. Для реакции ПЦР применяли 1 единицу KOD плюс ДНК полимеразу (производства TOYOBO CO., LTD). Устанавливали условия реакции в 25 циклов ПЦР (при 94°C в течение 15 секунд, при 55°C в течение 30 секунд, и при 68°C в течение 2 минут) после 1 цикла ПЦР при 94°C в течение 2 минут.
Прямой праймер: 5' CAG GGC CAG GAG GAG GAG ATG 3' (SEQ ID NO:9)
Обратный праймер: 5' TCA GCA GAC ACT TCC CCA ACT 3' (SEQ ID NO:10)
Амплифицированный фрагмент ILT7 кДНК в 2 kb выделяли и извлекали электрофорезом, используя 1% агарозный гель, затем его клонировали в плазмидный вектор pCR4 Blunt-TOPO (производства Invitrogen), используя комплект для клонирования Zero Blunt TOPO PCR Cloning kit (производства Invitrogen). Проводили анализ последовательностей оснований полученных генов, и было выявлено, что получен желательный ген ILT7, показанный в SEQ ID NO:1.
B-2) Получение векторов экспрессии ILT7 с меткой FLAG
Была сконструирована соответствующая плазмида, экспрессирующая белок, в котором метки FLAG были слиты с N- и С-концами ILT7. ILT7 сливали с меткой, что позволяло подтвердить экспрессию белка ILT7 путем обнаружения метки. Желательную последовательность амплифицировали способом ПЦР, используя в качестве матрицы ген ILT7, полученный, как описано в п. 1), а также используя праймеры со следующими последовательностями оснований. Для реакции ПЦР применяли 1 единицу KOD плюс ДНК полимеразу (производства TOYOBO CO., LTD). Устанавливали условия реакции в 25 циклов ПЦР (при 94°C в течение 15 секунд, при 55°C в течение 30 секунд, и при 68°C в течение 2 минут) после 1 цикла ПЦР при 94°C в течение 2 минут.
Для N-FLAG ILT7
Прямой праймер (SEQ ID NO:11): 5' CCG ctc gag ATG ACC CTC ATT CTC ACA AGC CTG CTC TTC TTT GGG CTG AGC CTG GGC [GAT TAC AAG GAT GAC GAC GAT AAG] CCC AGG ACC CGG GTG CAG GCA GAA 3'
Обратный праймер (SEQ ID NO:12): 5' C TAG act agt TCA GAT CTG TTC CCA AGG CTC 3'
Для C-FLAG ILT7
Прямой праймер (SEQ ID NO:13): 5' CCG ctc gag ATG ACC CTC ATT CTC ACA AGC 3'
Обратный праймер (SEQ ID NO:14): 5' C TAG act agt TCA [CTT ATC GTC GTC ATC CTT GTA ATC] GAT CTG TTC CCA AGG CTC 3'
В вышеупомянутых последовательностях оснований каждый подчеркнутый участок в скобках показывает последовательность оснований, кодирующую прикрепленную метку FLAG, и каждая строчная буква показывает сайт расщепления для фермента рестрикции XhoI или SpeI. Фрагменты ДНК, амплифицированные посредством ПЦР, были расщеплены XhoI и SpeI, которые после этого выделяли электрофорезом в геле. Извлеченные фрагменты ДНК в 2 kb лигировали в вектор pME18X, расщепленный XhoI и SpeI тем же способом, как описано выше. Затем конструировали два типа плазмид, способных экспрессировать желательный белок слияния, то есть pME18X-N-FLAG ILT7 и pME18 X-C-FLAG ILT7, соответственно.
B-3) Клонирование генов FcRγ
Белок FcRγ считался белком, способным к ассоциации с белком ILT7. Молекула согласно изобретению является геном с последовательностями оснований и аминокислотными последовательностями SEQ ID NO:15 и 16 (GenbankAcc № NM_004106, J. Biol. Chem. 265, 6448-6452 (1990)). Указанная молекула представляет собой молекулу (γ-цепь), которая составляет Fc ξ RI, то есть высоко аффинный рецептор IgE. Также он называется Fc ξ RI γ, но далее в настоящем изобретении он будет упоминаться как FcRγ. В этом отношении настоящая молекула также известна как компонент FcγR или FcαR. Настоящий ген был клонирован способом ПЦР, как показано ниже, для получения векторов экспрессии. Ген FcRγ амплифицировали способом ПЦР, используя в качестве матрицы библиотеку кДНК человеческих ИПК, как описано в п. 1), а также используя праймеры со следующими последовательностями оснований. Для реакции ПЦР применяли 1 единицу KOD плюс ДНК полимеразу (производства TOYOBO CO., LTD). Устанавливали условия реакции в 25 циклов ПЦР (при 94°C в течение 15 секунд, при 55°C в течение 30 секунд, и при 68°C в течение 2 минут) после 1 цикла ПЦР при 94°C в течение 2 минут.
Прямой праймер: 5' CCC AAG ATG ATT CCA GCA GTG 3' (SEQ ID NO:17)
Обратный праймер: 5' GGA AGA ACC AGA AGC CAA AGA 3' (SEQ ID NO:18)
Амплифицированный фрагмент FcRγ кДНК в 0,3 kb выделяли и извлекали электрофорезом, используя 2% агарозный гель, затем его клонировали в плазмидный вектор pCR4 Blunt-TOPO (производства Invitrogen), используя комплект для клонирования Zero Blunt TOPO PCR Cloning kit (производства Invitrogen). Проводили анализ последовательностей оснований полученных генов, и было подтверждено, что клонирован желательный ген FcRγ, показанный в SEQ ID NO:15.
B-4) Получение Myc-меченых векторов экспрессии FcRγ
Плазмиду, экспрессирующую белок, в котором Myc-метку присоединяли к С-концу, конструировали таким образом, чтобы было можно подтвердить экспрессию белка FcRγ. Желательную последовательность амплифицировали способом ПЦР, используя в качестве матрицы ген FcRγ, полученный согласно описанию в п.3), а также используя праймеры со следующими последовательностями оснований. Для реакции ПЦР применяли 1 единицу KOD плюс ДНК полимеразу (производства TOYOBO CO., LTD). Устанавливали условия реакции в 25 циклов ПЦР (при 94°C в течение 15 секунд, при 55°C в течение 30 секунд, и при 68°C в течение 2 минут) после 1 цикла ПЦР при 94°C в течение 2 минут.
Прямой праймер (SEQ ID NO:19): 5' CCG ctc gag ATG ATT CCA GCA GTG GTC TTG 3'
Обратный праймер (SEQ ID NO:20): 5' CTA Gac tag tCT A[CA GAT CCT CTT CAG AGA TGA GTT TCT GCT C]CT GTG GTG GTT TCT CAT G 3'
В вышеупомянутых праймерных последовательностях подчеркнутый участок в скобках показывает последовательность оснований, кодирующую прикрепленную метку Myc, и каждая строчная буква показывают сайт расщепления для фермента рестрикции XhoI или SpeI. Фрагменты ДНК, амплифицированные посредством ПЦР, были расщеплены XhoI и SpeI, которые после этого выделяли электрофорезом в геле. Извлеченные фрагменты ДНК в 0,3 kb лигировали в вектор pME18X, расщепленный XhoI и SpeI тем же способом, как описано выше. Затем конструировали плазмиду, способную экспрессировать желательный белок слияния, то есть pME18X-Myc-FcRγ .
C. Экспрессия ILT7 в животных клетках
Изучали экспрессию ILT7 в животных клетках, используя векторы экспрессии, полученные, как описано выше.
C-1) Экспрессия в клетках 293T
ДНК, состоящие из следующих пяти комбинаций, были введены в 293T клетки (7×105 клеток), используя комплект для трансфекции Effectene (производства Qiagen). Через два дня после введения проводили анализ проточной цитометрии (анализ FCM).
(1) pME18X-N-FLAG ILT7 2 мкг
(2) pME18X-C-FLAG ILT7 2 мкг
(3) pME18X-N-FLAG ILT7 1 мкг + pME18X-Myc-FcRγ 1 мкг
(4) pME18X-C-FLAG ILT7 1 мкг + pME18X-Myc-FcRγ 1 мкг
(5) pME18X-Myc-FcRγ 2 мкг
Анализ способом FCM осуществляли тем же образом, как описано в п. A-4 следующего примера 2. Для реакции использовали Cy3 конъюгированное анти-FLAG-антитело (производства Sigma), и для анализа использовали FACScan (производства Becton Dickinson). В результате было выявлено, что только небольшое число ILT7 экспрессировались на клеточной поверхности, при реакции единственным, тогда как ILT7 экспрессировался внеклеточно и мощно при совместном воздействии с FcRγ (фиг. 3). Известно, что мышиный FcRγ имеет высокую гомологию с человеческим FcRγ. Вместе с тем, если в качестве хозяев использовали клетки р815 (мышиной мастоцитомы), которые экспрессируют мышиный FcRγ, экспрессия ILT7 не наблюдалась.
C-2) Анализ иммунопреципитации и способ вестерн-блоттинга.
Коэкспрессию ILT7 с FcRγ на клеточной поверхности подтверждали следующим образом. После иммунопреципитации для каждой клетки 293T проводили анализ разных антител, которые коэкспрессировались с обоими генами в соответствующих комбинациях, описанных в п. от (1) до (5). В клетки 293T (7×105 клеток) вводили ДНК, из которой через два дня после введения клетки 293T извлекали тем же образом, как описано в п. (1). Клеточные фракции растворяли в лизирующем буфере (0,5% тритон, 150 мМ NaCl) и оставляли на льду на 20 минут. Затем несколько раз проводили повторную аспирацию с использованием иглы (27 G), с последующим центрифугированием при 15 K об/мин в течение 20 минут. К 200 мкг лизата получаемых продуктов добавляли анти-myc-антитело (2 мкг, производства Santa cruz biotechnology) или антиFLAG-антитело (2 мкг, производства Sigma), и дополнительно перемешивали вращением при 4°C в течение 4 часов. Затем добавляли белок A/G A/G Sepharose 4 Fast Flow mix (производства Amersham Bioscience) и перемешивали вращением при 4°C в течение 1 часа. После этого полученные преципитацией фракции промывали 3 раза лизирующим буфером следующей композиции.
Лизирующий буфер:
0,5% тритон X-100,
50 мМ HEPE8 (уровень pH 7,6),
150 мМ NaCl,
1 мМ ЭДТА,
10% глицерин,
1 мМ дитиотреитола (ДТТ),
2 мМ фенилметилсульфонил фторида (ПМСФ),
1 мкг/мл апротинина,
1 мкг/мл лейпептина,
1 мкг/мл пепстатина A,
0,1 мкг/мл химистатина,
1 мМ Na3VO4,
0,1 мМ β-глицерофосфата.
Буфер для образца электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) добавляли к промытым преципитатам, которые кипятили в течение 5 минут и центрифугировали, с последующим проведением электрофореза с 10% гелем додецилсульфата (SDS). После электрофореза образцы переносили из гелей на поливинилиденфторидную мембрану PVDF (мембрана Immobilon-p-transfer: производства Millipore) согласно общепринятой методике. Блоттинг проводили с антиFLAG-антителом и анти-myc-антителом. Подтверждали, что в клетках 293T присутствовал ILT7, ассоциированный с FcRγ, поскольку их присутствие выявлено в каждом иммунопреципитате (фиг. 4).
C-3) Анализ сахарной цепи
Поскольку в анализе вестерн-блоттинг наблюдали несколько полос ILT7, изучена возможность гликозилирования ILT7. Проводили иммунопреципитацию антиFLAG-антителом 200 мкг лизата клеток 293T, которые экспрессировали N-FLAG ILT7 и Myc-FcRγ, тем же образом, как описано в п. 1) и 2). Затем суспендировали преципитированные фракции в 60 мкл буфера N-гликозидазы с нижеуказанной композицией, и аликвотные количества 30 мкл каждого полученного раствора помещали в пробирки.
Буфер N-гликозидазы:
10 мМ ЭДТА,
0,2% SDS,
0,5% тритон X-100,
1% 2-меркаптоэтанола в ФБР (фосфатно-буферном растворе).
После этого в одну пробирку добавляли 3 единицы 3 мкл N-гликозидазы (№1365177, производства Roche) для реакции при 37°С в течение 15 часов. Дополнительно к этому добавляли 7 мкл буфера для образца, который нагревали при 100°С в течение 5 минут, с последующим проведением электрофореза с 10% SDS. После электрофореза гель переносили на мембрану PVDF, на которую добавляли 1 мкл поликлонального анти-ILT7-антитела, как описано в п. 4), и оставляли для реакции при в 4°C в течение ночи. Получаемый продукт промывали с буфером TBS-T и проводили реакцию с меченым перексидазой хрена (HRP) антикроличьим антителом (производства Jackson) в 100000-кратном разведении при комнатной температуре. Затем проводили окрашивание с системой обнаружения вестерн-блоттинга ECL (производства Amersham bioscience). В результате кажущуюся молекулярную массу уменьшали путем обработки N-гликозидазой. Таким образом, предполагалось, что сахарные цепи добавляли к ILT7 (фиг. 5).
С-4) Получение поликлонального анти-ILT7-антитела
Используемое поликлональное анти-ILT7-антитело, согласно описанию в п. 3), получали следующим образом. Осуществляли химический синтез пептида из 23 аминокислот, соответствующих C-концу ILT7 (CSQEANSRKDNAPFRVVEPWEQI; SEQ ID NO:21), и присоединяли его к белку гемоцианина лимфы улитки (KLH), который являлся носителем, и использовали получаемый продукт в качестве иммуногена. Кроликов внутрикожно иммунизировали иммуногеном, смешанным с полным адъювантом Фрейнда. После проведения у всех кроликов шести иммунизаций (один раз в неделю) подтверждали повышенный титр антитела в сыворотке, и затем проводили отбор цельной крови. После этого некоторое количество сыворотки подвергали аффинной очистке, используя пептидную колонку тех же последовательностей. Получаемый продукт был идентифицирован как поликлональное анти-ILT7-антитело.
Пример 2
А. Получение моноклонального анти-ILT7-антитела
А-1) Получение иммуногена
Клетки для использования в качестве иммуногенов приготовляли путем внедрения генов в клетки 293T, как описано ниже. Добавляли 46,4 мкг трансгена (23,2 мкг pME18 X-C-FLAG ILT7 и 23,2 мкг pME18X-Myc-FcRγ) на дно 100 мм чашки, покрытой коллагеном (IWAKI), сверху наносили 3мл среды opti-MEM (GIBCO) и перемешивали. После этого, помимо раствора трансгена, 58 мкл липофектамина (Торговая марка) -2000 (Invitrogen) разводили 3 мл opti-MEM, которой давали отстояться при комнатной температуре в течение 5 минут, и приготовляли раствор липофектамина. Затем раствор липофектамина аккуратно добавляли в чашку, содержащую трансгенный раствор, и перемешивали. После отстаивания при комнатной температуре в течение 20 минут в чашку аккуратно добавляли 10 мл 293T-клеток, разведенных до концентрации 1×105 клеток/мл, используя культуральную среду DMEM (SIGMA), содержащую 10% ЭБС (эмбриональной бычьей сыворотки). Получаемую среду подвергали статическому культивированию в инкубаторе при 37°C в атмосфере CO2 в течение 48 часов, из которой клетки извлекали путем раскапывания пипеткой. Полученные клетки использовали в качестве трансфектантов для иммуногенов.
A-2) Получение гибридом
За один день до иммунизации клеток вводили 50 мкл эмульсии, полученной путем смешивания 200 мкл ФБР с 200 мкл полного адъюванта Фрейнда (FREUND) (RM606-1, производства Mitsubishi Kagaku Iatron, Inc), в подошвы обеих лап четырех самок мышей Balb/c (в возрасте четырех недель) для иммунизации. На следующий день проводили иммунизацию 50 мкл 2×107 клеток, суспендированных в 400 мкл ФБР. Вторую и третью иммунизации осуществляли каждые четыре дня. Через три дня после третьей иммунизации выполняли слияние клеток следующим образом. Клетки забирали из лимфатических узлов конечностей иммунизированных мышей. Клетки мышиной миеломы P3-X63-Ag8-U1, культивированные в культуральной среде RPMI1640 (SIGMA), содержащей 10% ЭБС, смешивали с клетками, полученными из лимфатических узлов и миеломы таким образом, чтобы отношение клеток мышиной миеломы к клеткам, полученным из лимфатических узлов и миеломы, составляло от 2:1 до 10:1, и из этой смеси центрифугированием извлекали клетки. Полиэтиленгликоль PEG4000 (MERCK) разведенный в равных частях культуральной средой RPMI1640, добавляли к полученным клеточным фракциям, которые подвергали слиянию клеток. После промывания клеток получаемый продукт суспендировали в 160 мл 15% среды ЭБС-HAT, содержащей комплемент, и затем высевали в шестнадцать 96-луночных планшет в количестве 200 мкл на лунку. Через три дней проводили замену культуральной среды. Через одну-две недели наблюдений за образованием колоний проводили первичный скрининг.
A-3) Скрининг гибридомы клеточным анализом ELISA.
Гибридому, продуцирующую антитело-мишень, подвергали скринингу следующим клеточным анализом ELISA. Клетки, полученные согласно описанию в п. 1), использованные в количестве 1×107 клеток на 96-луночных планшет, суспендировали в 0,5% бычьего сывороточного альбумина БСА/2 мМ ЭДТА/ФБР, и затем аликвотные количества 100 мкл/на лунку добавляли в планшет для клеточного анализа ELISA (NUNC 249570 96V NW PS). Центрифугирование осуществляли со скоростью 2000 оборотов в минуту при 4°C, и затем удаляли супернатант. Собранную супернатантную культуру добавляли в количестве 50 мкл/на лунку, и проводили реакцию при комнатной температуре в течение 30 минут. Дважды проводили операцию промывания, в которую входило добавление 0,5% БСА/2 мМ и ЭДТА/ФБР в каждую лунку, центрифугирование со скоростью 2000 оборотов в минуту при 4°C в течение 2 минут, и затем удаление супернатанта. После промывания в каждую лунку добавляли разведенное в 10000 раз меченое пероксидазой антимышиное козье антитело IgG (IM0819; Beckman coulter) в количестве 50 мкл/на лунку, которое реагировало в течение 30 минут. Операцию промывания с использованием 0,5% БСА/2 мМ-ЭДТА/ФБР проводили дважды, с последующим добавлением раствора для окрашивания. Приготовленный раствор антитела заменяли на ФБР (-) посредством диализной мембраны (10000 отверстий, производства PIERCE), для получения очищенных анти-ILT7 химерных антител.
A-4) Оценка реактивности антитела анализом проточной цитометрии (FCM).
Супернатант культуры гибридомы подвергали анализу проточной цитометрии (FCM). Клетки, полученные согласно описанию в п. 1), суспендировали в 0,5% БСА/2 мМ ЭДТА/ФБР, после чего переносили в центрифужную пробирку в концентрации 1×105 на один образец, с последующим добавлением 40 мкл каждой культуры и проведением реакции при комнатной температуре в течение 30 минут. Операция промывания, проводимая дважды, включала в себя добавление 1 мл 0,5% БСА/2 мМ ЭДТА/ФБР на каждую пробирку, центрифугирование при 1200 оборотах в минуту при 4°С в течение 3 минут и удаление супернатанта. 40 мкл разведенного в 100 раз FITC-меченого антимышиного козьего антитела IgG (IM0819; Beckman coulter), добавляли после промывания в каждую лунку, и проводили реакцию при комнатной температуре в течение 30 минут. Операцию промывания с использованием 0,5% БСА/2 мМ-ЭДТА/ФБР проводили дважды, с последующим анализом проточной цитометрии FC500 (Beckman coulter). Выбирали гибридому, которая продуцировала антитело, реагирующее не только на клетку-хозяин, а специфически реагирующее на клетку, в которую вставляли ген. Выбираемую гибридому клонировали способом предельных разведений, и были получены гибридомы №11 и №17, которые продуцируют моноклональные антитела.
B. Оценка реактивности анти-ILT7-антитела
Подобно методике, описанной в п. C-1) примера 1, ILT7, в котором метку FLAG присоединяли к N-концу, коэкспрессировали с молекулой FcRγ в клетки 293T. Затем анализом FCM подтверждали реактивность антитела, полученного в примере 2, используя FACScan (Becton Dickinson). В результате получали подтверждение, что все антитела, продуцируемые гибридомами №11 и №17, полученными согласно описанию в п. A), реагируют на клетки, в которые был введен ген ILT7 и которые экспрессировал ILT7 (фиг. 6 (b)). Дополнительно, из периферической крови человека выделяли лимфоциты, используя оборудование Ficoll, и затем проводили двойное окрашивание с полученным анти-ILT7-антителом и FE-меченым анти-BDCA-2-антителом (Miltenyi). После этого изучали реактивность к лимфоцитам. В результате выявлено связывание моноклонального антитела, продуцируемого гибридомами №11 и №17, с BDCA-2-положительной клеткой. Таким образом, подтверждено, что оба моноклональных антитела распознавали молекулы ILT7, экспрессируемые человеческими ИПК (фиг. 6 (a). Эти моноклональные антитела обозначены, как анти-ILT7-антитело №11 и анти-ILT7-антитело №17, соответственно. Осуществляли более подробный анализ.
Проводили анализ множественного окрашивания лимфоцитов периферической крови человека, используя полученное анти-ILT7-антитело, анти-дифференцировочное-1-антитело (анти-CD3, CD14, CD16, CD19, антитела CD56; Becton Dickinson), анти-CD123-антитело (Becton Dickinson) и анти-BDCA-2-антитело (Miltenyi). В отношении ILT7-антитело-положительных фракций, линиеспецифический маркер был отрицательным, CD123 был положительным и BDCA-2 был положительным. Результаты подтвердили, что ИПК окрашивались только ILT7№11 и ILT7№17 (фиг. 7).
Дополнительно, анализ FCM проводили изучения экспрессии разных молекул, при которой лимфоциты периферической крови человека стимулировали CpG или ИФНα в течение 24 часов. CpGODN2216 использовали как CpGA, который индуцирует продукцию ИФН из ИПК, и CpGODN2006 использовался в качестве CpGB, который способствует созреванию дендритных клеток (Moseman et al. J. Immunology. 173, 4433-4442, 2004). Устанавливали окно для отрицательной фракции линиеспецифического маркера. После анализа реактивности анти-BDCA-2-антитела и анти-ILT7-антитела к CD123-положительной клеточной популяции, большая часть ILT7-положительных фракций исчезала даже после стимуляции CpG в течение 24 часов. С другой стороны, некоторые клетки BDCA-2 оказывались положительными после стимуляции CpG в течение 24 часов (фиг. 8). Предполагается, что дифференцировка ИПК в разные клетки происходит немедленно после стимуляции CpG. Было показано, что анти-ILT7-антитело согласно изобретению является полезным в качестве первичного специфического антитела к ИПК. Дополнительно, было подтверждено, что ИПК в лимфоцитах периферической крови не дифференцируются в присутствии ИФНα, в этом случае при высоком коэффициенте выживаемости у ИПК сохранялась экспрессию ILT7, дополнительно ILT7 стабильно присутствовало в ИПК при аутоиммунных заболеваниях с вероятным высоким уровнем ИФН в сыворотке.
C. Оценка специфичности анти-ILT7-антитела.
ILT7 принадлежит к семейству ILT/LIR, и существует множество молекул с высокой гомологией, в особенности с высокой гомологией во внеклеточной области (фиг. 9). Сообщается об экспрессии в ИПК мРНК молекул, в особенности таких как ILT2 и ILT3 (Ju et al. Gene 331, 159-164, 2004). Поэтому реактивность этих молекул подтверждали с использованием трансгенных клеток.
C-1) Клонирование молекулы ILTl и получение векторов экспрессии.
Синтезировали кДНК от РНК, полученной из миндалины человека, используя олигопраймер dT и комплект системы отбора SuperScript для синтеза кДНК. Затем, адаптер NotI лигировали в вектор pME18S, расщепляемый NotI, что приводило к получению библиотеки кДНК человеческой миндалины.
Ген ILT1 с меткой FLAG на С-конце амплифицировали способом ПЦР, используя полученную библиотеку кДНК в качестве матрицы, а так же используя праймеры со следующими последовательностями оснований. Для реакции ПЦР применяли 1 единицу KOD плюс ДНК полимеразу (производства TOYOBO CO., LTD). Устанавливали условия реакции в 25 циклов ПЦР (при 94°C в течение 15 секунд, при 55°C в течение 30 секунд, и при 68°C в течение 2 минут) после 1 цикла ПЦР при 94°C в течение 2 минут.
Прямой праймер (SEQ ID NO:22): 5' CCG ctc gag ATG ACC ССС ATC CTC ACG GTC C 3'
Обратный праймер (SEQ ID NO:23): 5' CTA Gac tag tTC A[CT TAT CGT CGT CAT CCT TGT AAT C]CC TCC CGG CTG CAT CTT G 3'
В вышеупомянутых праймерных последовательностях каждый подчеркнутый участок в скобках показывает последовательность оснований, кодирующую прикрепленную метку FLAG, и каждая строчная буква показывает сайт расщепления для фермента рестрикции XhoI или SpeI. Фрагменты ДНК, амплифицированные посредством ПЦР, были расщеплены XhoI и SpeI, которые после этого выделяли электрофорезом в геле. Извлеченные фрагменты ДНК в 2 kb лигировали в вектор pME18X, расщепленный XhoI и SpeI тем же способом, как описано выше. Затем конструировали плазмиду, способную экспрессировать желательный белок слияния, то есть pME18X-N-FLAG ILT1. Последовательность оснований и аминокислотная последовательность показана в SEQ ID NO:24 и 25.
C-2) Получение экспрессирующих клеток и оценка реактивности антитела
Для ILT2 (SEQ ID NO:26) и ILT3 (SEQ ID NO:28) использовали векторы экспрессии, в которых соответствующие гены были клонированы в сайты XbaI или XhoI из pcDNA4.1 (производства Invitrogen). ДНК следующих комбинаций вводили в клетки 293T (7×105 клеток) тем же образом, как описано в п. C-1). Через два дня после введения проводили анализ FCM, и затем анализировали анти-ILT7-антитело.
(1) pME18X-N-FLAG ILT7 1 мкг + pME18X-Myc-FcRγ 1 мкг
(2) pME18X-C-FLAG ILT1 0,5 мкг + pME18X-Myc-FcRγ 0,5 мкг + pcDNA4.1-ILT2 0,5 мкг + pcDNA4.1-ILT3 0,5 мкг
В результате выявлено отсутствие реакции на клетки любых антитела, в которых наблюдалась экспрессия ILT1. Поэтому предполагается, что эти анти-ILT7-антитела специфически распознают молекулы ILT7 на ИПК (фиг. 10).
Пример 3
Действие анти-ILT7-антитела на способность продуцировать человеческий ИФН.
Лимфоциты периферической крови человека высевали на 96-луночную планшету в количестве 2×105 клеток/на лунку, и проводили их реакцию с 5 мкг/мл разных антител при 37°C. После культивирования в течение 1 часа в лунки добавляли вирус гриппа PR8. Через 24 часа культивирования измеряли ИФНα в супернатантной культуре комплектом для анализа ELISA (Bender Med System). Как результат, отмечали ингибирование продукции ИФН добавлением анти-ILT7-антитела (фиг. 11). В частности, было выявлено, что на продукцию ИФН из ИПК влияет анти-ILT7-антитело согласно изобретению.
Пример 4
CDC-активность анти-ILT7-антител
A. Получение моноклональных анти-ILT7-антител
Клон, продуцирующий моноклональное антитело, получали тем же образом, как описано в п. от А-1) до A-4) примера 2. Реактивность оценивали тем же способом, как описано в п. B примера 2, и специфичность оценивали согласно описанию в п. C примера 2. В результате были получены гибридомы №37, №28 и №33, которые продуцируют моноклональные анти-ILT7-антитела с хорошей реактивностью и специфичностью. CDC-активность измеряли, как описано ниже, с использованием моноклонального анти-ILT7-антитела, которое продуцировали три вида этих гибридом.
B. Определение CDC-активности
B-1) За один день до получения клеточной линии-мишени (клеточная линия ILT7-CHO), нижеуказанную ДНК вводили в клетки CHO-k1, которые высевали в количестве 6×105 клеток на чашку (6 см в диаметре), с использованием реагента трансфекции Effectene (производства QLAGEN) и затем выбирали устойчивые штаммы, используя 800 мкг/мл зеоцина (производства Invitrogen).
Введенная ДНК: pкДНК3.1-C-FLAG ILT7 1 мкг + pME18X-Myc FcRγ 2 мкг.
После этого получали клеточную линию с высокой экспрессией ILT7, используя клеточный сортер (BD FACSAria, производства Becton Dickinson). Анализом FCM подтверждали, что выбранная клеточная линия проявляет высокую экспрессию ILT7. Анализ FCM осуществляли согласно способу, описанному в п. A-4) примера 2, за исключением того, что для FCM использовали BD FACSCaliber (производства BD).
Для первичного антитела и вторичного антитела использовали, соответственно, следующие антитела.
Первичное антитело: 5 мкг/мл мышиного анти-ILT7-антитело (№37),
вторичное антитело: R-фикоэритрин (R-PE) - конъюгированное козье антимышиное специфичное многоклональное антитело против иммуноглобулина (BD)
B-2) Реакция клеток-мишеней на анти-ILT7-антитела
Извлекали полученные клетки-мишени, как описано в п. B-1) (клетка ILT7-CHO), используя 5 мМ раствора ЭДТА/ФБР, которые затем суспендировали в среде CDC с нижеуказанной композицией, чтобы концентрация составляла 4×105 клеток/мл. Суспензию в аликвотных количествах 50 мкл/на лунку высевали в каждую лунку 96-луночного планшета.
Среда CDC:
RPMI1640
0,1% БСА
100 ед./мл пенициллина
100 мкг/мл стрептомицина
10 мМ Hepes (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота), уровень pH 7,6)
2 мМ L-глутамина
В каждую лунку добавляли 50 мкл раствора анти-ILT7-антитела, приготовленного в среде CDC, и смешивали таким образом, чтобы конечная концентрация антител составляла 0,1 мкг/мл, 0,5 мкг/мл, 1 мкг/мл и 5 мкг/мл. Дополнительно в лунки добавляли 50 мкл среды CDC, содержащей комплемент с нижеуказанной композицией, и перемешивали таким образом, чтобы конечная концентрация комплемента составляла 6%, с последующим культивированием при 37°C в течение 2 часов.
Среда CDC, содержащая комплемент:
1 мл комплемента новорожденного кролика (№ в каталоге: CL3441, производства CEDARLANE)
Среда CDC (см. выше)
Затем суспензию центрифугировали (условия центрифугирования: 250 об/мин в течение 4 минут), и супернатант извлекали, обращая внимание на поддержание стерильности для клеток. Количество лактатдегидрогеназы (ЛДГ) в супернатанте измеряли общепринятым способом, определяемым по "количеству ЛДГ, проникающей из клетки-мишени посредством активности комплемента" (тестовый образец).
Также для определения активности CDC были подготовлены следующие параметры:
- Спонтанное высвобождение ЛДГ из клетки-мишени: проводили культивирование и приготовление только клеток-мишеней в том же объеме, как объем образца.
- Максимальное высвобождение ЛДГ из клетки-мишени: проводили культивирование и приготовление только клеток-мишеней в объеме, равном объему образца, и затем за 60 минут до извлечения супернатанта к ним добавляли раствор тритон X-100, входящий в состав комплекта, чтобы конечная концентрация составляла 0,8%.
- Контроль коррекции объема: приготовляли количество тритон X-100, равное количеству, добавленному для приготовления максимального высвобождения ЛДГ из клетки-мишени, добавляли к культуральной среде того же объема, как объем образца.
- Уровень культуральной среды: приготовляли объем культуральный среды, равный объему образца и раствора, к которому добавляли комплемент, содержащий среду CDC, и добавляли к культуральной среде, чтобы она имела тот же объем, как образец.
Объем культуральной среды, равный объему образца, вычитали из спектральной поглощательной способности максимального показателя мишени и спонтанного показателя мишени. Раствор, к которому добавляли комплемент, содержащий среду CDC, добавляли в культуральную среду, чтобы он имел объем, равный объему образца, вычитали из спектральной поглощательной способности тестового образца и корректировали. Активность CDC вычисляли нижеуказанным уравнением. Результаты показаны в таблице 1 и на фигуре 12. Даже в случае использования моноклональных анти-ILT7-антител, полученных из какой-либо гибридомы, 80% или больше активности CDC проявлялось при концентрация антитела 0,5 мкг/мл или больше.
Активность CDC (%) = (Тестовый образец - спонтанный показатель мишени)/(максимальный показатель мишени - объем контроля - спонтанный показатель мишени)×100
Сравнительный пример 1
Аналогичное исследование проводили тем же образом, как описано в п. В и п. C примера 4, кроме использования мышиного IgG2a вместо анти-ILT7-антитела. Результаты показаны в примере 4, а также в таблице 5 и фигуре. Активность CDC к клеткам-мишеням не наблюдалась у других антител, кроме анти-ILT7 моноклонального антитела.
Пример 5
Интернализация анти-ILT7-антитела к клеткам-мишеням
A. Моноклональное анти-ILT7-антитело
Использовали следующие моноклональные анти-ILT7-антитела.
Моноклональные анти-ILT7-антитела: №17, №26, №37, №28 и №33
B. Наблюдение интернализации
В-1) Получение клеточной линии-мишени (клеточная линия ILT7-CHO)
Клеточная линия-мишень (клеточная линия ILT7-CHO) была получена тем же способом, как описано в п. B-1 примера 4.
В-2) Реакция клеток-мишеней на анти-ILT7-антитело
Извлеченные клетки ILT7-CHO суспендировали в ледяном буфере (T (-) + 10% ФБР), имеющем нижеуказанную композицию, в концентрации 1×106 клеток/мл, используя 5 мМ раствора ЭДТА/ФБР.
Среда T (-):
RPMI1640
100 единиц/мл пенициллина
100 мкг/мл стрептомицина
10 мМ Hepes (уровень pH 7,6)
2 мМ L-глутамина
1 мМ пирувата натрия
50 мкМ 2-меркаптоэтанола
10% нагретая инактивированная эмбриональная бычья сыворотка
Согласно описанию выше, 1 мл суспензии помещали в центрифужные пробирки объемом 15 мл, и проводили центрифугирование (условия центрифугирования: 1200 об/мин, при 4°C, в течение 5 минут), и затем удаляли супернатант. К дебрису добавляли 200 мкл суспензии моноклонального анти-ILT7-антитела (10 мкг/мл), перемешивали и культивировали при 4°C в течение 30 минут, с последующим двукратным промыванием ледяной T (-) средой (количество используемой среды: 10 мл на промывание, условия центрифугирования: 1200 оборотов в минуту, при 4°C, в течение 5 минут).
B-3) Модификация иммунного комплекса ILT7-анти-ILT7-антитело, присутствующего на поверхности клеток-мишеней
Затем осуществляли модификацию иммунного комплекса ILT7-анти-ILT7-антитело, находящегося на клеточной поверхности, вторичным антителом, имевшим флуоресцентную метку для обнаружения. Конкретный способ описан ниже. APC-меченое (аллофикоцианином) козье анти-мышиное поликлональное антитело против IgG (№ в каталоге: 550826BD, производства Bioscience|), содержащее ледяную T (-) среду, добавляли к дебрису, полученному согласно описанию в п. B-2), которое культивировали с затемнением при 4°C в течение 20 минут с последующим двукратным промыванием ледяной T (-) средой (количество используемой среды: 10 мл на промывание, условия центрифугирования: 1200 оборотов в минуту, при 4°C, в течение 5 минут). Затем к этому добавляли ледяную T (-) среду и использовали в виде суспензии в концентрации 1×106 клеток/мл.
B-4) Индукция интернализации путем инкубации при 37°С
Суспензию, полученную, как описано в п. B-3, в равных частях разделяли на две пробирки (обозначенные пробирками (a) и (b)). Пробирки (a) и (b) культивировали при 37° и 4°C, соответственно, с затемнением в течение 60 минут. Для прекращения интернализации добавляли 1% ЭБС/ФБР (ледяную) после инкубации. Полученный раствор центрифугировали (условия центрифугирования: 1200 оборотов в минуту, при 4°C, в течение 5 минут), и затем удаляли супернатант с последующим двукратным промыванием 1% ЭБС/ФБР (ледяным) (количество раствора: 10 мл на 1 промывание, условия центрифугирования: 1200 оборотов в минуту, при 4°C, в течение 5 минут).
B-5) Модификация иммунного комплекса ILT7-анти-ILT7-антитела, остающегося на поверхности клеток-мишеней после инкубации
Иммунный комплекс ILT7-анти-ILT7-антитело, который оставался на поверхности клетки после инкубации, модифицировали третичным антителом для обнаружения флуоресценции. Конкретный способ описан ниже. 20 мкл суспензии, содержащей третичные антитела (FITC-меченое ослиное антикозье антитело против IgG (№ в каталоге: sc-2024, производства Santa cruz biotechnology), добавляли к дебрису, полученному, как описано в п. B-4), затем перемешивали и отстаивали при 4°C в течение 15 минут в условиях затемнения. Полученный раствор промывали (количество раствора: 10 мл на промывание, условия центрифугирования: 1200 оборотах в минуту, при 4°C, в течение 5 минут).
B-6) Анализ анти-ILT7-антитела, присутствующего в клетках-мишенях
Впоследствии к дебрису, полученному согласно описанию в п. B-5, добавляли 150 мкл 1% ЭБС/ФБР,), который суспендировали и собирали в микротитровальную пробирку объемом 1,2 мл, с последующим проведением анализа FCM. В этом анализе отдельно оценивали среднюю интенсивность флуоресценции (MPI) каждой клетки в случае FITC и АРС. Дополнительно, вычисляли отношение интенсивность флуоресценции (%) следующим уравнением:
Коэффициент интенсивности флуоресценции (%) = (средняя интенсивность флуоресценции клеток, инкубированных при 37°C в течение 60 минут)/(средняя интенсивность флуоресценции клеток, инкубированных при 4°C в течение 60 минут)×100
Интенсивность флуоресценции FITC является индикатором количества иммунного комплекса ILT7-анти-ILT7-антитело, который остается на поверхности клетки после инкубации. Средняя интенсивность флуоресценции FITC клеток, культивированных при 37°C в течение 60 минут, снижалась примерно на 50% по сравнению с клетками, культивированными при 4°C.
С другой стороны, интенсивность флуоресценции APC представляет собой индикатор количества иммунного комплекса ILT7-анти-ILT7-антитело, присутствующего на клеточной поверхности перед инкубацией. Иммунный комплекс антитела ILT7-анти-ILT7 выявляется независимо от того, присутствует ли он на поверхности клетки, или включается в клетку после инкубации. В примере 5 интенсивность APC флуоресценции после инкубации при температуре 37°C была эквивалентна интенсивности APC флуоресценции в случае инкубации при 4°C. Это указывает на то, что иммунный комплекс ILT7-анти-ILT7-антитело может иметь любую локализацию в клетках-мишенях, даже в случае инкубации при произвольной температуре. Как упомянуто выше, было выявлено, что моноклональное анти-ILT7-антитело вызывало интернализацию ILT7 посредством инкубации при 37°C.
Сравнительный пример 2
Аналогичную операцию выполняли тем же образом, как описано в примере 5, за исключением того, что вместо анти-ILT7-антитела использовали мышиный IgG2a. Результаты показаны в примере 5, а также в таблице 2, таблице 3 и фигуре 13. В случае, если использовали мышиный IgG2a, не наблюдались какие-либо изменения в интенсивности флуоресценции FITC и APC, таким образом, было выявлено, что мышиный IgG2a не вызывал интернализацию ILT7.
Пример 6
Изучение структуры античеловеческого мышиного моноклонального антитела ILT7
(Последовательности вариабельных областей)
A. Клонирование кДНК, кодирующей вариабельную область мышиного анти-ILT7-антитела
А-1) Изучение гибридом, которые продуцируют мышиные анти-ILT7-антитела
Следующие гибридомы использовали в качестве гибридом, продуцирующих мышиные анти-ILT7-антитела.
- Гибридома №11 (инвентарный номер: FERM BP-l0704)
- Гибридома №17 (инвентарный номер: FERM BP-10705)
A-2) Выделение непроцессированных РНК
Непроцессированные РНК выделяли из гибридом, описанных в п. A-1), используя коммерчески доступный комплект "RNeasy Mini Kit" (№ в каталоге: 74106, производства Qiagen) согласно инструкции, прилагаемой в комплекте. В обоих случаях, из 1×107 гибридом было получено около 200 мкг непроцессированных РНК.
A-3) Амплификация и фрагментация кДНК, кодирующей вариабельную область тяжелой цепи мыши
Проводили амплификацию кДНК, кодирующую вариабельную область тяжелой цепи мыши посредством способа 5' RACE, используя 5 мкг непроцессированных РНК, выделенных, как описано в п. A-2. Для амплификации использовали коммерчески доступный комплект "5' RACE System for Rapid Amplification of cDNA ENDs, Version 2.0 Kit" (№ в каталоге: 18374-058, производства Invitrogen). Далее приводится конкретное описание. Вначале синтезировали с обратной транскриптазой первую цепь кДНК из непроцессированных РНК, полученных, как описано в п. A-2). Последовательности оснований антисмысловых праймеров (GSP1), используемых при этом, показаны в таблице 4.
(24-мерный)
(20-мерный)
(24-мерный)
(20-мерный)
Затем непроцессированные РНК расщепляли РНКазой и первая цепь кДНК оставалась единственной цепью, и очищалась способом низкоплавкой агарозы (1,5%). Дополнительно, dC (то есть, нуклеотидный гомополимер) присоединяли к 3'-концу первой цепи кДНК, используя концевую дезоксинуклеотидилтрансферазу (TdT). Амплификацию кДНК проводили ПЦР-способом, используя якорные праймеры (SEQ ID NO:34), обладающие комплементарностью нуклеотидного полимера к dC (якорная последовательность) на 3'-конце, в таблице 4 показаны антисмысловые праймеры (GSP2). Дополнительно, полученные ПЦР продукты использовали в качестве матрицы. Амплификацию кДНК проводили способом вложенной ПЦР (Nested PCR), используя праймер AUAP (SEQ ID NO:35) и антисмысловые праймеры (GSP2), показанные в таблице 4. Дополнительно, продукты ПЦР очищали методикой низкоплавкой агарозы (1,5%).
Якорный праймер для 5' RACE (SEQ ID NO:34)
5'-GGC CAC GCG TCG ACT AGT ACG GGI IGG GII GGG IIG-3' (36-мерный)
праймер ADAP для 5' RACE (SEQ ID NO:35)
5'-GGC CAC GCG TCG ACT AGT AC-3' (20-мерный)
A-4) Амплификация и фрагментация кДНК, кодирующей вариабельную область легкой цепи мыши
Проводили амплификацию кДНК, кодирующую вариабельную область легкой цепи мыши из непроцессированных РНК, выделенных, как описано в п. A-2, тем же способом, как описано в п. A-3). Последовательности оснований праймеров, используемых при этом, показаны в таблице 5. Полученные продукты ПЦР очищали методикой низкоплавкой агарозы (1,5%).
Праймеры, используемые для амплификации гена, кодирующего вариабельную область легкой цепи мыши
#17
(24-мерный)
(21-мерный)
A-5) Подтверждение последовательности оснований кДНК и определение области CDR
Проводили клонирование вариабельной области тяжелой цепи, полученной согласно описанию в п. A-3), и кДНК фрагмента вариабельной области легкой цепи, полученной, как описано в п. A-4), в вектор pCR4 Blunt-TOPO, используя коммерчески доступный комплект "Zero Blunt TOPO PCR Cloning Kit" (№ в каталоге: 1325137, производства Invitrogen) согласно инструкции, прилагаемой в комплекте, который затем вводили в компетентные клетки Escherichia coli, чтобы получить трансформант Escherichia coli. Из трансформанта получали вышеупомянутую плазмиду, после чего подтверждали последовательность оснований кДНК в плазмиде, используя автоматический секвенатор ДНК "PCR-based ABI PRISM 3100 Genetic Analyzer" (производства Applied Biosystems). Правильные последовательности выделяли путем исключения транскриптов, полученных из неактивной РНК благодаря сдвигу рамки, и бессмысленным мутациям рядом с областью, определяющей комплементарность (далее называемой "CDR-областью"). Затем проводили сравнение гомологии последовательности оснований кДНК, составляющих плазмиду, с базой данных Kabat, и определяли последовательности CDR-области и вариабельной области в соответствующих вариабельных областях. Для гибридомы №37, полученной в примере 4, также определяли последовательности CDR-области и вариабельной области в вариабельных областях аналогичной методикой, как описано в п. от A-1) до A-5) из примера 6 с использованием гибридомы №17. Далее в следующих SEQ ID NO показаны последовательности оснований кДНК вариабельных областей тяжелой цепи и вариабельных областей легкой цепи анти-ILT7 моноклональных антител, продуцируемых каждой гибридомой, и аминокислотные последовательности, кодируемые указанными последовательностями.
[Подтверждение изотипа константной области]
В отношении супернатантной культуры гибридомы, подтверждали изотип константной области полученного моноклонального антитела, используя коммерчески доступный комплект для изотипирования мышиного моноклонального антитела (№ в каталоге: MMT1, производство Serotec Product). Константной областью тяжелой цепи античеловеческого мышиного антитела ILT7 №11 являлся Igγ3, и константной областью легкой цепи являлся Igκ. Дополнительно, каждая из константных областей тяжелой цепи античеловеческого мышиного антитела ILT7 №17 и античеловеческого мышиного антитела ILT7 №37 представляла собой IgY2a, и каждой константной областью легкой цепи являлся Igκ.
Пример 7
Получение химерных антител
A. Клонирование кДНК, кодирующей константную область человеческого IgG
Константная область тяжелой цепи человеческого IgG1 и константная область легкой цепи человеческого Ig-каппа были выбраны из библиотеки кДНК человеческих ИПК. Затем осуществляли клонирование выбранных областей в вектор pCR4 Blunt-TOPO, используя коммерчески доступный комплект "Zero Blunt TOPO PCR Cloning Kit" (№ в каталоге: 1325137, производства Invitrogen) согласно инструкции, прилагаемой в комплекте, который затем вводили в компетентные клетки Escherichia coli, чтобы получить трансформант Escherichia coli. Из трансформанта получали вышеупомянутую плазмиду, после чего подтверждали последовательность оснований кДНК в плазмиде использованием автоматического секвенатора ДНК "PCR-based ABI PRISM 3100 Genetic Analyzer" (производства Applied Biosystems).
B. Лигирование вариабельной области с константной областью и клонирование
Использовали полученную согласно описанию в п. A) кДНК, кодирующую константную область тяжелой цепи, и кДНК, кодирующую вариабельную область тяжелой цепи, полученную, как описано в п. A-5) из примера 6, соответственно. В обеих ДНК присутствовала область с наложением последовательностей оснований ДНК. Затем получали двунитевую ДНК способом распространения наложения последовательностей, используя область. Конкретно методика изложена ниже.
C-1) Приготовление кДНК, кодирующей тяжелую цепь химерного антитела ILT7
"Плазмиду с кДНК, кодирующей вариабельные области тяжелой цепи №11 и №17", которая была получена согласно описанию в п. A-5), расщепляли ферментами рестрикции NotI и XbaI, и затем очищали способом агарозного геля (1, 5%). Каждый из получаемых продуктов растворяли в буфере TE с нижеуказанной композицией, до концентрации 100 пмоль/мкл, чтобы приготовить раствор кДНК, кодирующей фрагмент вариабельной области тяжелой цепи.
Буфер TE:
10 мм Трис-HCl
1 мМ ЭДТА
Уровень pH от 7,5 до 8,0
Дополнительно, "плазмиду с кДНК, кодирующей константную область тяжелой цепи", полученную согласно описанию в п. B, обрабатывали тем же способом, как описано выше, для приготовления раствора 100 пмоль/мкл. Затем оба раствора смешивали, и после этого обе области наложения подвергали гибридизации посредством отстаивания их вначале при 70°C в течение 10 минут, и затем отстаиванием при 37°C в течение 5 минут. После этого кДНК амплифицировали способом ПЦР, полученную кДНК расщепляли ферментами рестрикции NotI и XbaI и очищали способом агарозного низкоплавкого геля (1,5%).
C-2) Приготовление кДНК, кодирующей легкую цепь химерного антитела ILT7
Использовали, соответственно, кДНК, кодирующую константную область легкой цепи, полученную согласно описанию в п. A), и кДНК кодирующую вариабельную область легкой цепи, полученную, как описано в п. A-5) из примера 6. Способом, аналогичным описанному в п. C-1), получали кДНК, кодирующую легкую цепь химерного антитела ILT7, используя эти кДНК.
C-3) Клонирование
Полученную, как описано в п. C-1), кДНК, клонировали в плазмидный вектор pcDNA3.1-зеоцин (производства Invitrogen) используя NotI и XbaI как сайты клонирования, чтобы получить вектор экспрессии тяжелой цепи химерного антитела ILT7. Дополнительно, кДНК, полученную, как описано в п.C-2), клонировали в плазмидный вектор pcDNA3.1-гигромицин (производства Invitrogen), используя NotI и XbaI в качестве сайтов клонирования, для получения вектора экспрессии легкой цепи химерного антитела ILT7. Наименование каждого вектора показано в таблице 6.
Наименование плазмидных векторов
D. Экспрессия химерного антитела ILT7
D-1) Транзиторная трансформация
Вектор экспрессии тяжелой цепи химерного антитела ILT7 в количестве 1 мкг и 1 мкг вектора экспрессии легкой цепи химерного антитела ILT7, которые были получены согласно описанию в п. C-3), были ко-трансфицированы в клетки 293T, используя комплект трансфекции Effectene (№ в каталоге: 301427, производства Qiagen). После этого полученные продукты культивировали при 37°C с использованием культуральной среды DMEM с 2% ФБР с низким содержанием IgG, со следующей композицией.
Культуральная среда DMEM с 2% ФБР с низким содержанием IgG:
Культуральная среда DMEM (№ в каталоге: D5796, производства Sigma)
2% ФБР с низким содержанием IgG (№ в каталоге: SH30151.03, производства HyClone)
2 мМ L-глутамина
100 ед./мл пенициллина
100 мкг/мл стрептомицина
Уровень pH 7,2 до pH 7,4
После введения векторов полученную среду культивировали в течение 96 часов, и собирали супернатантную культуру. Затем удаляли фрагменты клеток путем центрифугирования для получения неочищенного раствора антитела.
D-2) Гомеостатическая трансформация
Вектор экспрессии тяжелой цепи химерного антитела ILT7 в количестве 1 мкг и 1 мкг вектора экспрессии легкой цепи химерного антитела ILT7, которые были получены согласно описанию в п. C-3), были ко-трансфицированы в клетки YB2/0 (клетки, полученные из миеломы крысы, ATCC№CRL-1622) используя комплект для трансфекции Effectene (№ в каталоге: 301427, производства Qiagen). Среди используемых плазмидных векторов вектор экспрессии тяжелой цепи является маркером устойчивости к зеоцину, и вектор экспрессии легкой цепи является маркером устойчивости к гигромицину. Поэтому, клетки, в которые были введены оба вектора, можно выращивать в культуральной среде, к которой добавлены одновременно зеоцин и гигромицин. Таким образом, клетки культивировали в культуральной среде RPMI, к которой были добавлены зеоцин и гигромицин, и производили отбор устойчивых штаммов.
Культуральная среда RPMI с добавлением зеоцина и гигромицина:
Культуральная среда RPMI1640 (№ в каталоге: R8758, производства Sigma)
10% ФБР
0,01 м HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота)
1 мМ пирувата натрия
2 мМ L-глутамина
100 ед./мл пенициллина
100 мкл/мл стрептомицина
55 мкМ 2-меркаптоэтанола
0,5 мг/мл зеоцина
0,5 мг/мл гигромицина
Уровень pH от 7,2 до pH 7,4
Через три дня определяли количество полученного антитела в супернатантной культуре способом ELISA. Была выбрана клеточная линия, продуцирующая химерное антитело ILT7, с высоким уровнем экспрессии и достаточным увеличением количества клеток. Кроме того, осуществляли единственное клонирование выбранных клеточных линий методикой клеточного сортера, чтобы получить следующие клеточные линии:
клеточная линия №11, продуцирующая химерное антитело ILTT7: №11 - 5 клеточных линий и №11 - 16 клеточных линий
клеточная линия №17, продуцирующая химерное антитело ILT7: №17 - 24 клеточных линий
Вышеупомянутые клеточные линии (№11 - 5 клеточных линий, №11 - 16 клеточных линий и №17 - 24 клеточных линий) соответственно, культивировали в среде RPMI с добавлением 5% ФБР, со следующей композицией. Устанавливали температуру инкубации и время инкубации, соответственно, 37°C и 96 часов,.
Культуральная среда RPMI с добавлением 5% ФБР:
Культуральная среда RPMI1640 (№ в каталоге: R8758S, производства Sigma)
5% ФБР
0,01 моль HEPES
1 мМ пирувата натрия
2 мМ L-глутамина
100 ед./мл пенициллина
100 мкг/мл стрептомицина
100 мкл/мл стрептомицина
55 мкМ 2-меркаптоэтанола
Уровень pH от 7,2 до pH 7,4
Супернатантную культуру собирали и затем центрифугированием удаляли клеточные фрагменты, чтобы получить неочищенный раствор антитела.
E. Очистка антител
Каждый из неочищенных растворов антитела, полученных как описано в п. D-1 и D-2, очищали на колонке, использую афинность белков (Protein А Sepharose FF, № в каталоге 17-1279-01, производства Amershram Pharmacia). Условия очистки были следующими. Аффинную очистку проводили с использованием буфера ФБР (-), с указанной ниже композицией, в качестве адсорбционного буфера и 0,1 моля буфера цитрата натрия (уровень pH 3) в качестве буфера элюции, согласно прилагаемой инструкции. К элюированным фракциям добавляли 1 моль Трис-HCl (уровень pH 8,0) для регулирования уровня pH примерно до 7,2. Показатели измеренной оптической плотности OD составляли от 450 до 620 нм и затем выбирали лунки, показывающие положительную реакцию. В отношении концентрации очищенных антител определяли спектральную поглощательную способность в 280 нм и вычисляли на основе 1,38 OD/мг/мл. Отношения между полученными химерными антителами ILT7, гибридомами, из которых был получен ген вариабельной области и клетками-хозяева, суммарно отражены в таблице 7.
ФБР (-) буфер:
0,2 г/л монокалия дигидрофосфат
0,2 г/л хлорида калия
8 г/л хлорида натрия
1, 15 г/л безводный моногидрофосфат динатрия
Полученные химерные антитела
Ниже показаны последовательности оснований кДНК и аминокислотные последовательности тяжелых и легких цепей полученных химерных антител, соответственно. В каждой аминокислотной последовательности последовательность аминокислот от N-конца до -1 является сигнальной последовательностью, и последовательность аминокислот от 1 до C-конца является зрелым белком. Таким образом, тяжелые и легкие цепей, составляющие указанные химерные антитела, состоят из последовательности аминокислот от 1 до С-конца указанных ниже аминокислотных последовательностей.
Промышленная применимость
Настоящее изобретение обеспечивает иммуноген, полезный для производства антитела, специфически распознающего человеческий ILT7 и способ получения анти-ILT7-антитело с использованием иммуногена. Антитело, специфически распознающее человеческий ILT7 согласно изобретению, специфически распознает ILT7 в присутствии семейства ILT. Поэтому антитело согласно изобретению можно использовать для обнаружения и выделения человеческого ILT7. Например, используя антитело согласно изобретению, также можно анализировать локализацию ILT7. Предполагается, что ILT7 представляет собой молекулу, близко связанную с дифференцировкой и функцией ИПК или дендритных клеток. Поэтому антитело, которое распознает ILT7 с высокой специфичностью, является полезным для анализа функции ИПК или дендритных клеток. Известны раковые клетки, подобные ИПК (имеющие свойства, при которых экспрессируется BDCA-2) (Chaper L et al. Eur. J. Immunol. 34; 418-426, 2004, Maeda T et al., Int. J. Hematol. 81; 148-154, 2005). Подтверждение экспрессии ILT7 в этих клетках может позволить диагностировать рак и использовать их в качестве терапевтического агента.
В случае аутоиммунных заболеваний, указано, например, на глубокую связь между ИФНα, который продуцируют ИПК, и развитием кожного заболевания псориаза (Nestle FO et al., J. Exp. Med. 202, 135-143, 2005). Таким образом, тяжесть псориаза можно оценивать идентификацией ИПК в ткани кожи больных псориазом, то есть в образцах биопсии, используя анти-ILT7-антитело.
Известно, что развитие СПИДа у ВИЧ-инфицированных больных коррелирует с количеством ИПК. В частности, у больных, не проявляющих симптоматики, выявляют большое количество ИПК, и в начале заболевания наблюдается снижение количества ИПК (Soumells V. et al., Blood 98; 906-912, 2001). Таким образом, это эффективно для прогноза вирусной инфекции, такой как ВИЧ.
Например, ILT7 представляет собой молекулу, которая специфически экспрессируется в человеческой ИПК. Поэтому, анти-ILT7-антитело согласно изобретению можно использовать для обнаружения, идентификации или выделения ИПК. ИПК представляют собой клетки, которые производят большую часть интерферона 1 типа. Поэтому их обнаружение, идентификация или выделение являются важной задачей для диагностики и изучения заболеваний, в которые вовлечен интерферон 1 типа. Примерами таких заболеваний, при которых интерферон вовлекается в формирование патологического состояния, могут быть различные аутоиммунные заболевания и инфекции.
Дополнительно, анти-ILT7-антитело согласно изобретению обладает ингибирующим действием на активность ИПК. Таким образом, можно ингибировать активность ИПК путем использования анти-ILT7-антител согласно изобретению. Кроме того, путем ингибирования активности ИПК можно лечить заболевания, в которые вовлечен интерферон 1 типа. В частности, анти-ILT7-антитело согласно изобретению полезно для различных аутоиммунных заболеваний и инфекций, при которых интерферон вовлечен в формирование патологического состояния. В частности, анти-ILT7-антитело способно эффективно уничтожать ИПК, так как обладает высокой специфичностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ ILT17 | 2006 |
|
RU2456298C2 |
| МОЛЕКУЛА АДГЕЗИИ Т-КЛЕТОК И АНТИТЕЛО, НАПРАВЛЕННОЕ ПРОТИВ МОЛЕКУЛЫ | 2006 |
|
RU2396275C2 |
| МОНОКЛОНАЛЬНОЕ АНТИ-CD20-АНТИТЕЛО | 2006 |
|
RU2415871C2 |
| ЧЕЛОВЕЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ AILIM, КОСТИМУЛИРУЮЩЕЙ МОЛЕКУЛЫ ПЕРЕДАЧИ СИГНАЛА, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2001 |
|
RU2262511C2 |
| МЕТОД ДЕТЕКЦИИ РАКА | 2013 |
|
RU2646464C2 |
| АНТИТЕЛА ПРОТИВ CCR2 | 2009 |
|
RU2547595C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ РАКА | 2009 |
|
RU2533460C2 |
| МЕТОД ДЕТЕКЦИИ РАКА | 2013 |
|
RU2646466C2 |
| ЛЕЧЕНИЕ РАКА ПРИ ПОМОЩИ НАПРАВЛЕННЫХ НА МИШЕНЬ АНТИТЕЛ IN VIVO | 2011 |
|
RU2642305C2 |
| АНТИ-СD3-АНТИТЕЛО И МОЛЕКУЛА, СОДЕРЖАЩАЯ ЭТО АНТИТЕЛО | 2017 |
|
RU2790326C2 |























































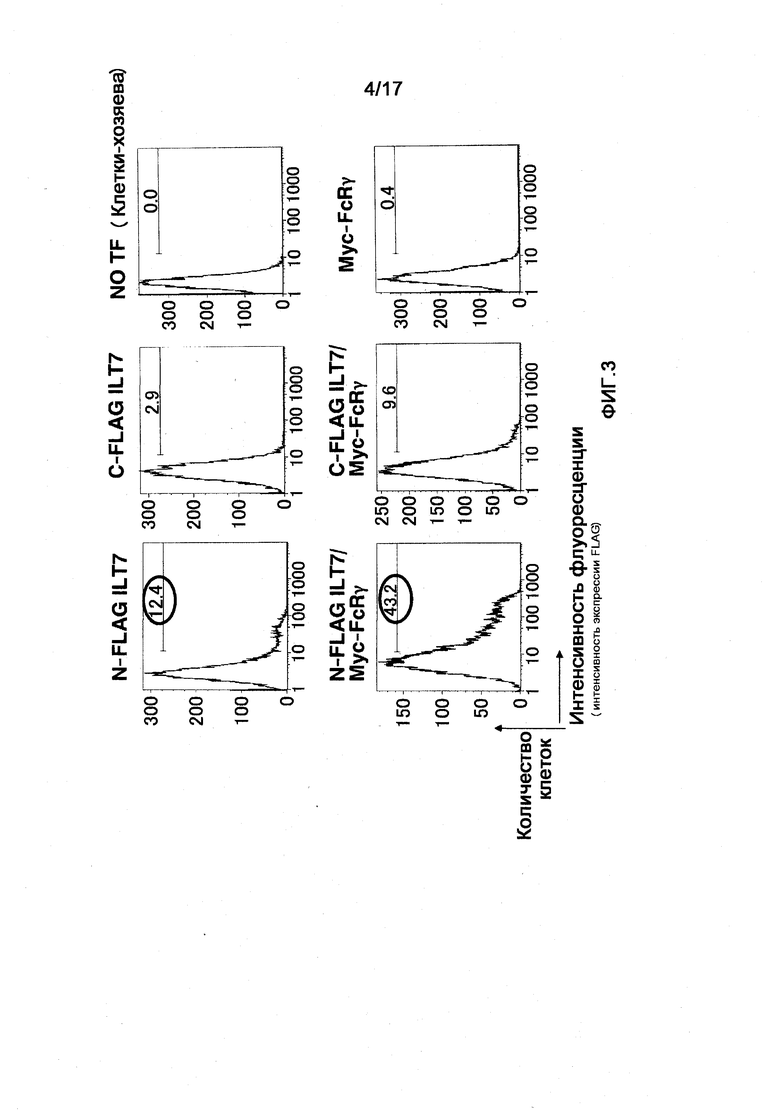
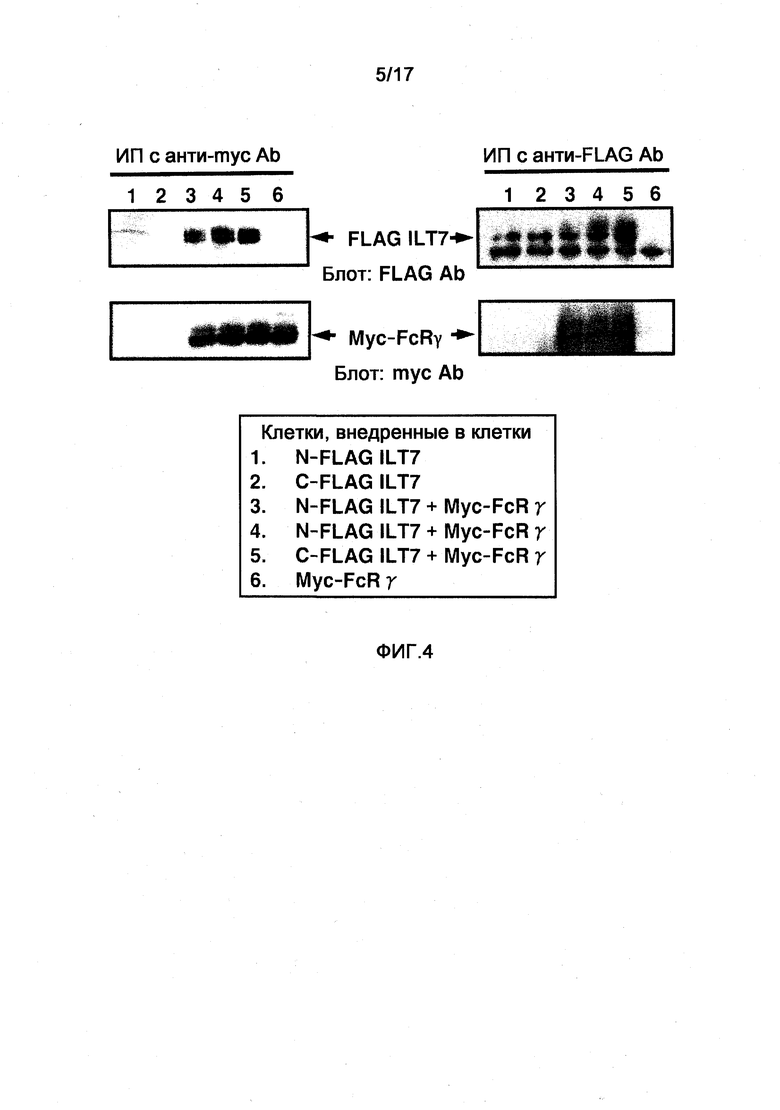
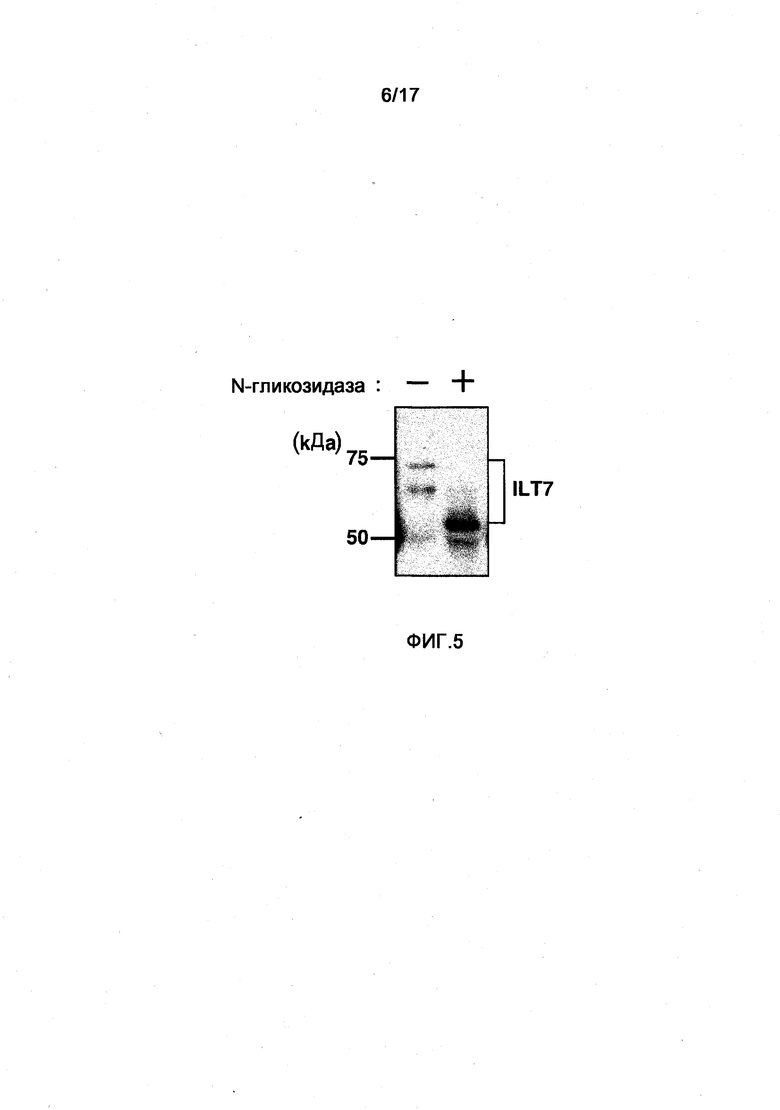
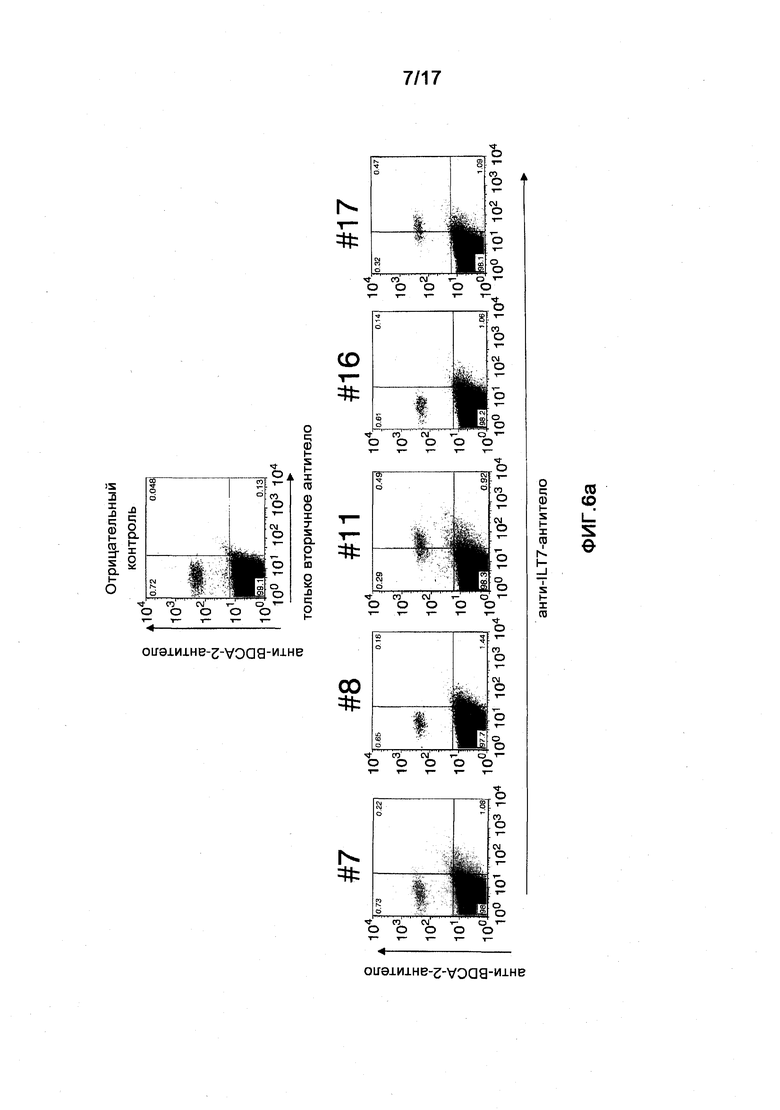
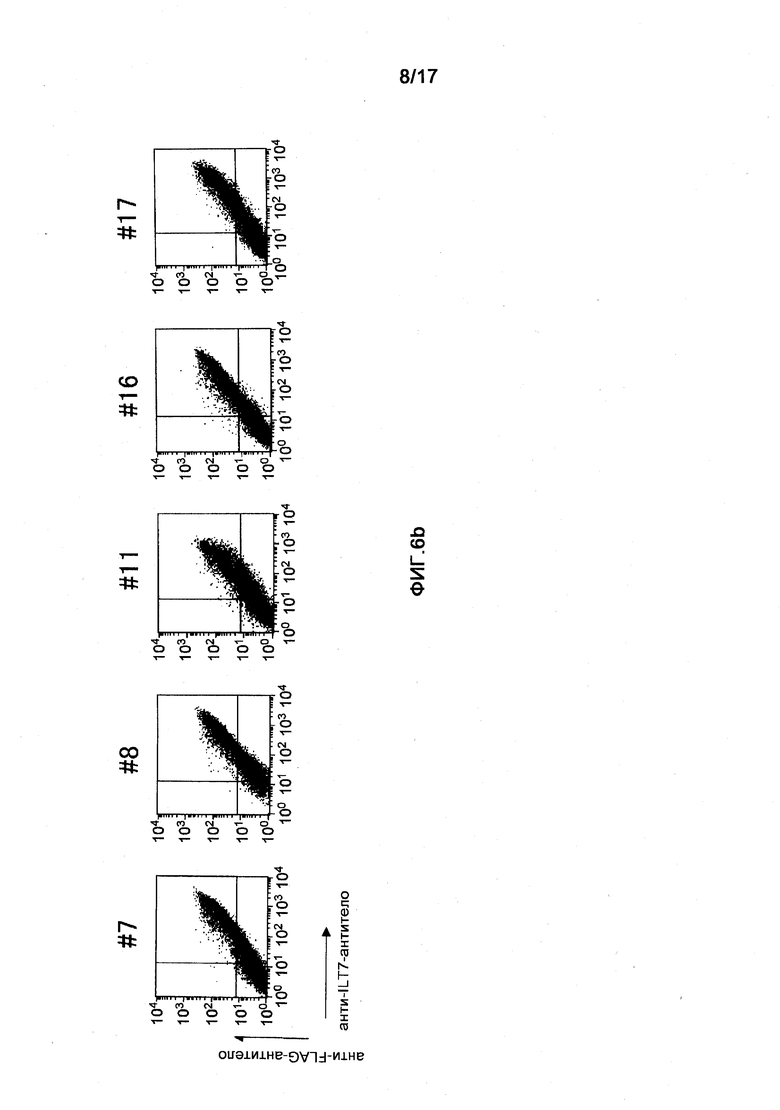
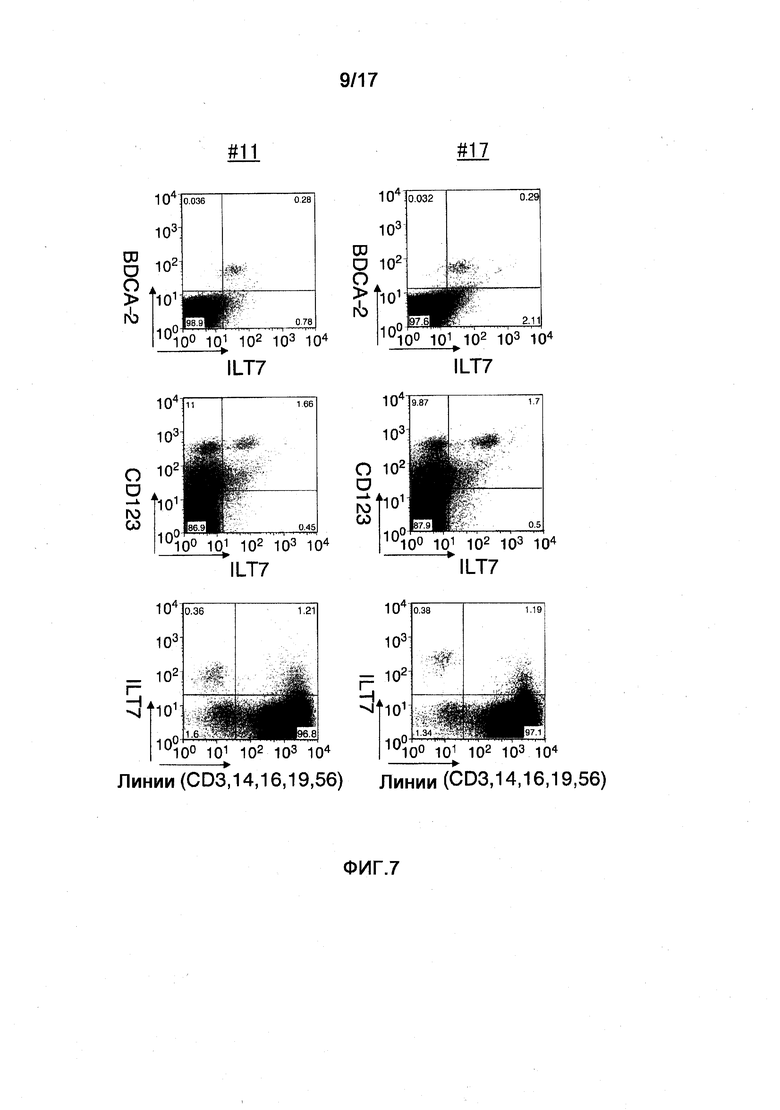
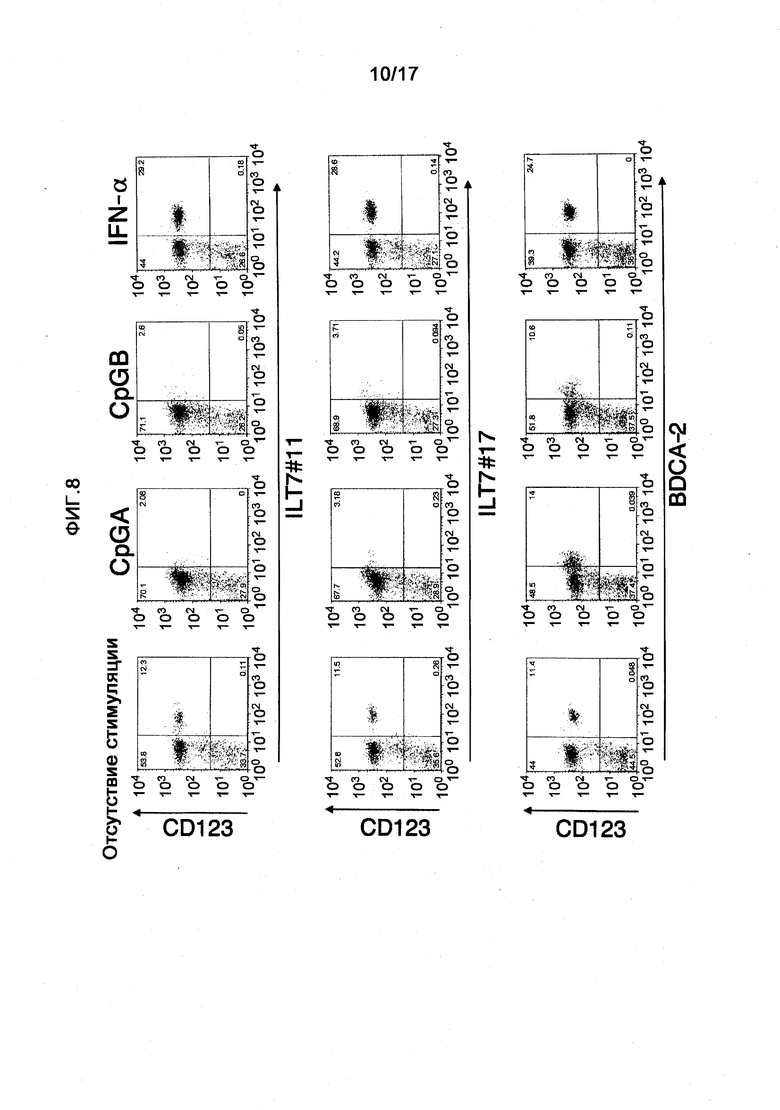



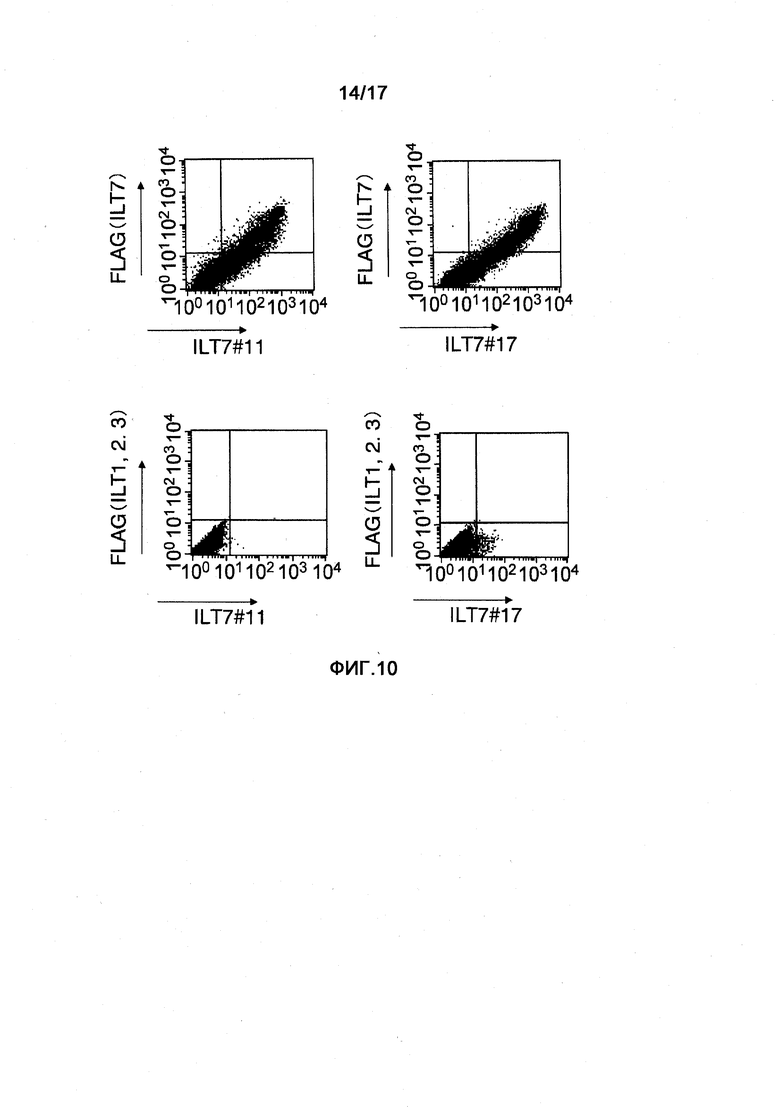
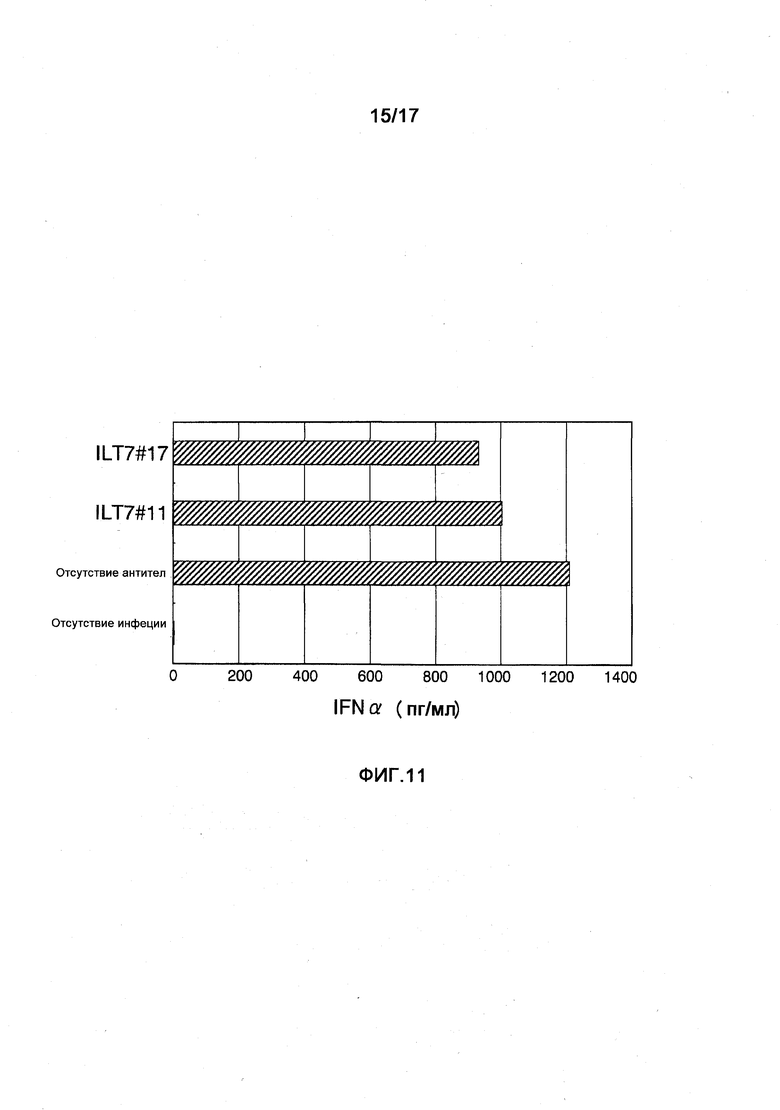
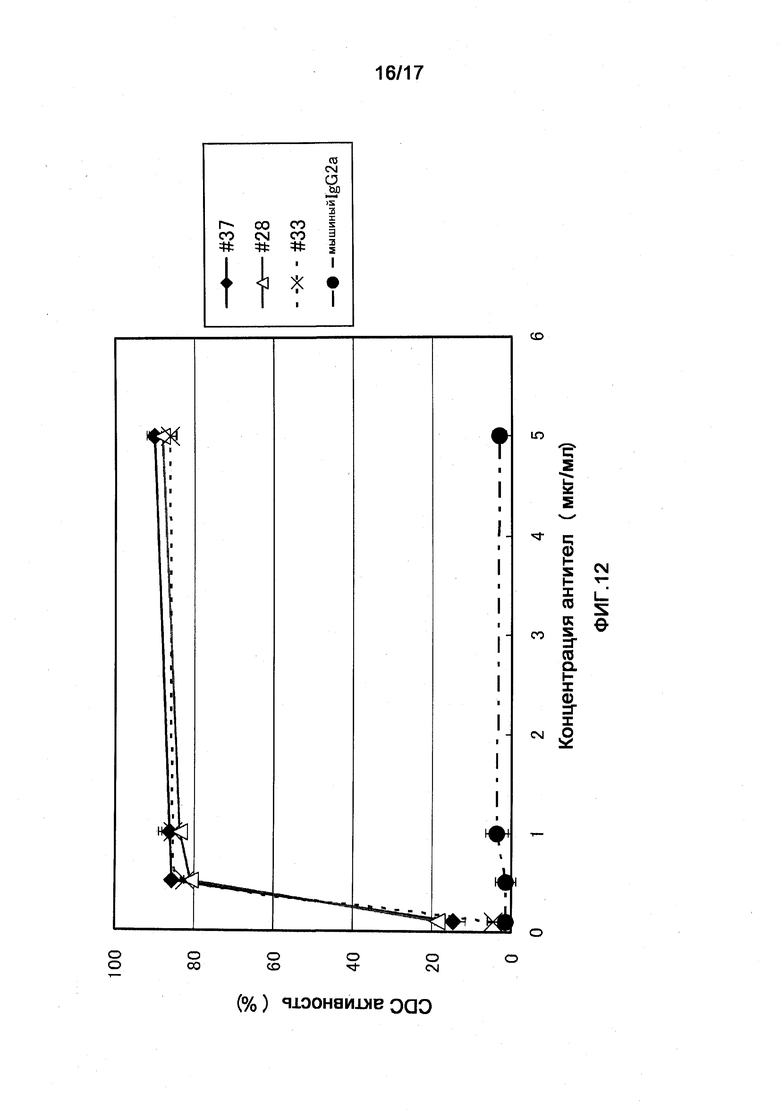
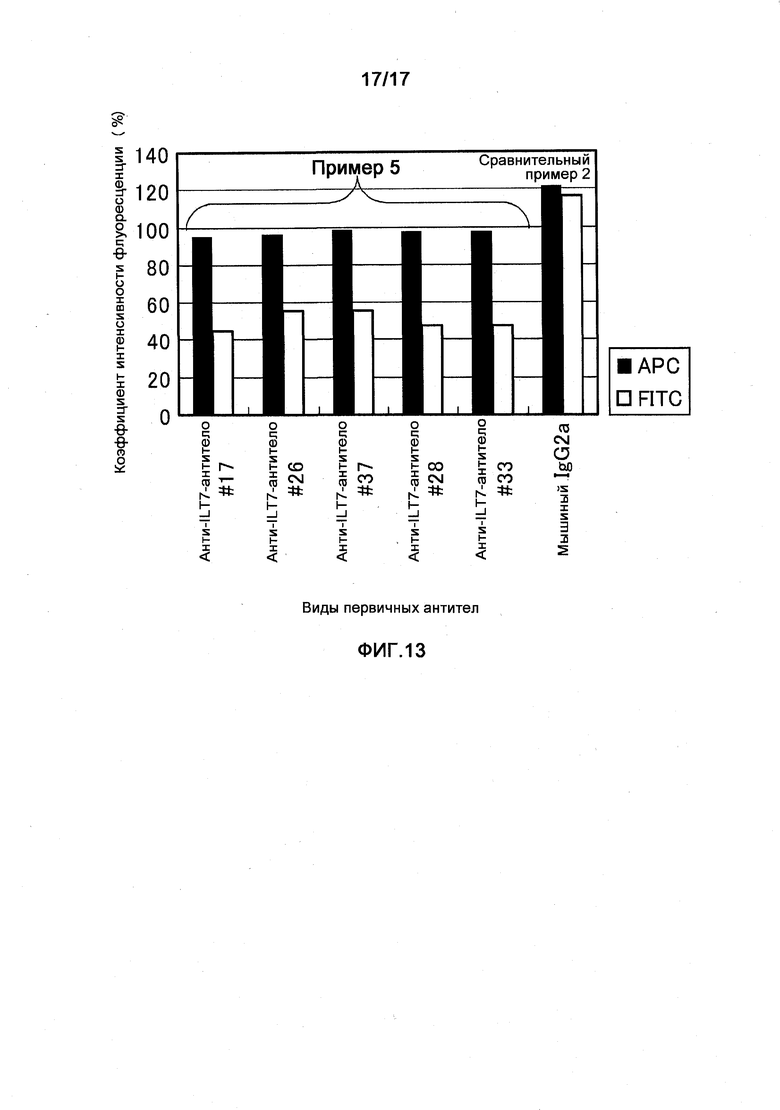
Изобретение относится к биохимии. Описано моноклональное антитело, которое связывается с ILT7 человека, не связывается ни с каким из ILT1, ILT2 и ILT3 человека, подавляет продуцирование ILT7-экспрессирующими клетками интерферона α (IFNα), или фрагмент, содержащий его антигенсвязывающую область. Анти-ILT7-антитело, связывающееся с ИПК и ингибирующее их действие. С помощью анти-ILT7-антитела согласно изобретению можно ингибировать активность ИПК и можно лечить или предотвращать связанное с интерфероном заболевание. Экспрессия ILT7 сохраняется в ИПК даже в присутствии ИФНα. Таким образом, действие анти-ILT7-антитела как ингибитора активности ИПК можно ожидать даже у больного аутоиммунным заболеванием с повышенной продукцией ИФНα. 5 з.п. ф-лы, 13 ил., 7 табл., 7 пр.
1. Моноклональное антитело, которое связывается с ILT7 человека, не связывается ни с каким из ILT1, ILT2 и ILT3 человека, подавляет продуцирование ILT7-экспрессирующими клетками интерферона α (IFNα), или фрагмент, содержащий его антигенсвязывающую область, где моноклональное антитело содержит аминокислотные последовательности, указанные в следующих подпунктах i)-iii) в качестве CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи и вариабельной области легкой цепи:
i) CDR1 вариабельной области тяжелой цепи: SDYAWN (SEQ ID NO: 58);
CDR2 вариабельной области тяжелой цепи: YISYSGSTSYNPSLKSR (SEQ ID NO: 59); и
CDR3 вариабельной области тяжелой цепи: SPPYYAMDY (SEQ ID NO: 60);
CDR1 вариабельной области легкой цепи: KASQDVGTAVA (SEQ ID NO: 61);
CDR2 вариабельной области легкой цепи: WASTRHT (SEQ ID NO: 62); и CDR3 вариабельной области легкой цепи: QQYSSYPLT (SEQ ID NO: 63);
ii) CDR1 вариабельной области тяжелой цепи: SYWIH (SEQ ID NO: 64);
CDR2 вариабельной области тяжелой цепи: RIYPGTGSTYYNEKFKG (SEQ ID NO: 65);
и CDR3 вариабельной области тяжелой цепи: YPTYDWYFDV (SEQ ID NO: 66);
CDR1 вариабельной области легкой цепи: RASQSISNYLH (SEQ ID NO: 67);
CDR2 вариабельной области легкой цепи: YASQSIS (SEQ ID NO: 68);
CDR3 вариабельной области легкой цепи: QQSNSWPLT (SEQ ID NO: 69); или
iii) CDR1 вариабельной области тяжелой цепи: SDYAWN (SEQ ID NO: 70);
CDR2 вариабельной области тяжелой цепи: YISYSGSTSYNPSLKSR (SEQ ID NO: 71);
CDR3 вариабельной области тяжелой цепи: ALPLPWFAY (SEQ ID NO: 72);
CDR1 вариабельной области легкой цепи: KASQDVGTAVA (SEQ ID NO: 73);
CDR2 вариабельной области легкой цепи: WASTRHT (SEQ ID NO: 74); и
CDR3 вариабельной области легкой цепи: QQYSSYPYT (SEQ ID NO: 75).
2. Моноклональное антитело по п. 1, где ILT7 экспрессирующая клетка представляет собой интерферонпродуцирующую клетку (IPC).
3. Моноклональное антитело по п. 1 или 2, где клетка является CD123-положительная или BDCA-2-положительная.
4. Моноклональное антитело по п. 1 или 2, где клетка является CD3-отрицательной, CD14-отрицательной, CD16-отрицательной, CD19-отрицательной, CD20-отрицательной и CD56-отрицательной.
5. Моноклональное антитело по п. 1, где моноклональное антитело продуцируется гибридомой ILT7#11, депонированной под номером доступа FERM BP-10704, или гибридомой ILT7#17, депонированной под номером доступа FERM ВР-10705.
6. Моноклональное антитело по п. 1, где фрагмент, содержащий антигенсвязывающую область моноклонального антитела, представляет собой Fab, F(ab′)2, одноцепочечную Fv или димер.
| WO 2003034275 A2, 24.04.2003 | |||
| Raymond G | |||
| Goodwin et al, Cloning of the human and murine interleukin-7 receptors: Demonstration of a soluble form and homology to a new receptor superfamily, Volume 60, Issue 6, 23 March 1990, Pages 941-951; | |||
| Cunningham BC et al, Dimerization of the extracellular domain of the human growth hormone receptor by a single |
Авторы
Даты
2016-10-10—Публикация
2012-03-28—Подача