Изобретение относится к области органической химии - получению производных 3-фурилпропан-1-она, представляющих интерес в синтезе веществ фармацевтического назначения.
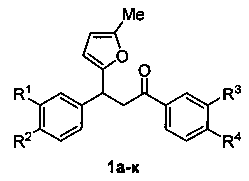
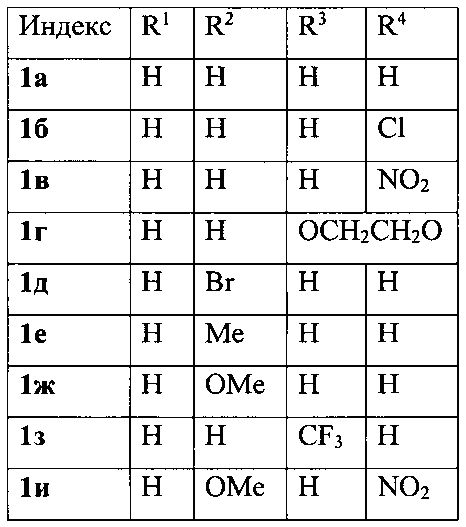
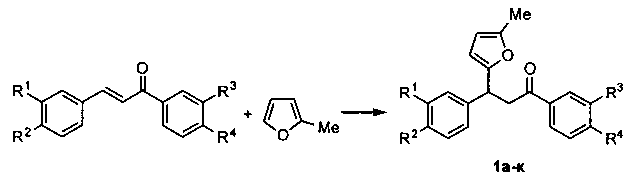
Изобретение относится к разработке способа получения производных 3-фурилпропан-1-она общей формулы 1а-к, которые могут быть использованы в качестве исходных веществ для синтеза 4-арил-4-оксобутановых кислот - ингибиторов кинуренин-3-гидролазы, обладающих нейропротекторным действием [Giordani, A.; Pevarello, P.; Cini, М.; Bormetti, R.; Greco, F.; Toma, S.; Speciale, C; Varasi. M. Bioorg. Med. Chem. Lett, 1998, 8, 2907].
Существующие методы синтеза производных 3-фурилпропан-1-онов основаны на реакции сопряженного присоединения фуранов к α,β-непредельным карбонильным соединениям. Однако реализация такого подхода, как правило, требует использования катализаторов на основе солей металлов платиновой группы [J.J. Hirner, D.J. Faizi, S.A. Blum, J. Am. Chem. Soc, 2014,136, 4740-4745; X. Zhang, X.Q. Yu, X.J. Feng, M. Bao, Synlett, 2012, 23, 1605-1608] или особых условий проведения (высокое давление, низкая температура) [Jenner, G.; Gacem, В. J. Phys. Org. Chem. 2003,16,265; Hanessian, S.; Stoffman, E.J.L.; Mi, X.L.; Renton, P. Org. Lett., 2011, 13, 840]. С другой стороны, известны методы, основанные на использовании доступных кислот Бренстеда [Dyker, G.; Muth, Е.; Hashmi, A.S.K.; Ding, L. Adv. Synth. Catal. 2003, 345, 1247] или Льюиса [Hashmi, A.S.K.; Schwarz, L.; Choi, J.-H.; Frost, Т.M. Angew. Chem. Int. Ed., 2000, 39, 2285; D.A. Evans, K.R. Fandrick, H.J. Song, K.A. Scheidt, R. Xu, J. Am. Chem. Soc, 2007, 129, 10029-10041]. Однако использование последних ограничено присутствием чувствительных к условиям реакций функциональных групп в исходных субстратах.
К недостаткам описанных методов следует отнести ограниченную область применения, использование дорогостоящих катализаторов на основе драгоценных или редкоземельных металлов, а также применение специфических условий реакций. Таким образом, разработка простого и эффективного метода синтеза производных 3-фурилпропан-1-онов с использованием доступного катализатора в мягких реакционных условиях с возможностью введения разнообразных функциональных групп в структуру конечного продукта является актуальной задачей.
Задача изобретения - разработка нового эффективного метода получения разнообразных производных 3-фурилпропан-1-она в мягких условиях, позволяющего расширить номенклатуру потенциально биологически активных веществ, и представляющих собой удобные исходные соединения для синтеза замещенных 4-арил-4-оксобутановых кислот.
Техническим результатом является разработка нового метода получения широкого ряда 3-фурилпропан-1-онов, основанного на реакции сопряженного присоединения 2-метилфурана к α,β-непредельным карбонильным соединениям.
В основе заявляемого метода лежит описанный ранее метод синтеза производных 3-фурилпропанона взаимодействием 2-метилфурана с α,β-непредельными карбонильными соединениями в присутствии каталитических количеств трифлата меди(II) [Bulbule, V.J.; Deshpande, V.Н.; Bedekar, А.V. J. Chem. Research (S), 2000, 220]. К недостаткам данного метода следует отнести ограниченную область применения реакции, умеренные выходы продуктов реакции и необходимость в использовании легкогидролизующегося и дорогостоящего трифлата меди(II).
Технический результат достигается в результате взаимодействия α,β-ненасыщенных кетонов с 2-метилфураном в 1,2-дихлорэтане при комнатной температуре в присутствии доступного бромида меди(II) в течение 4 часов.
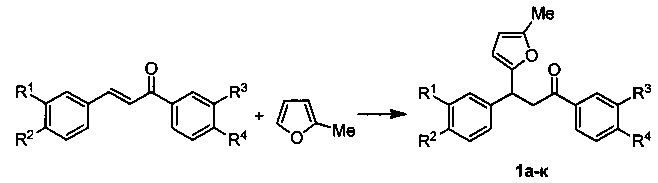
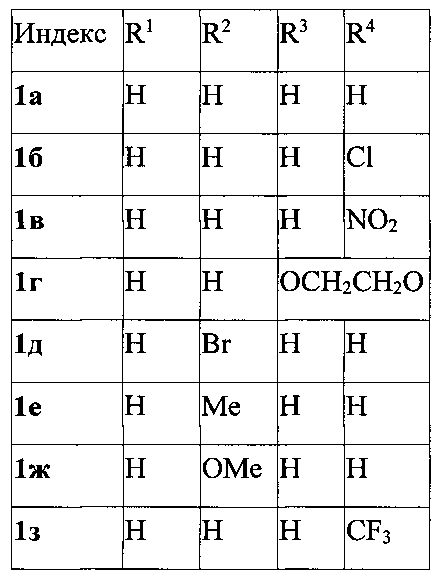
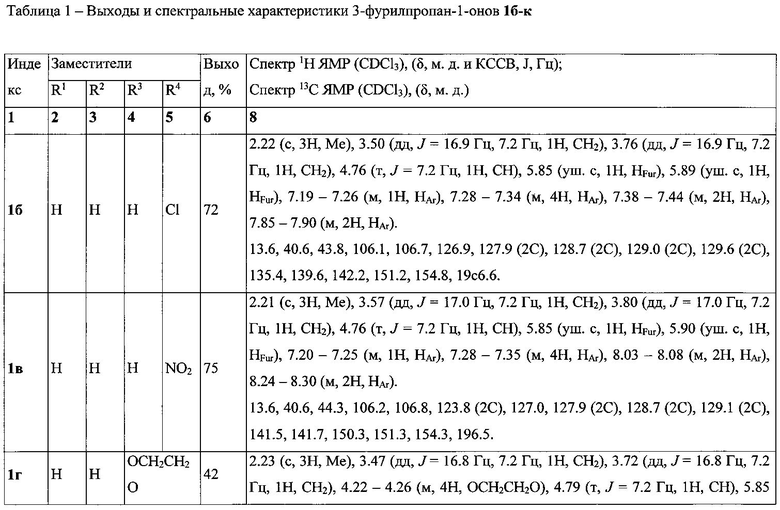
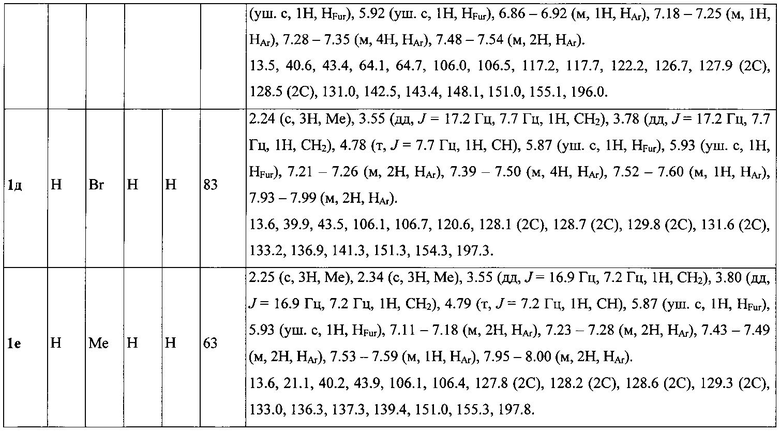
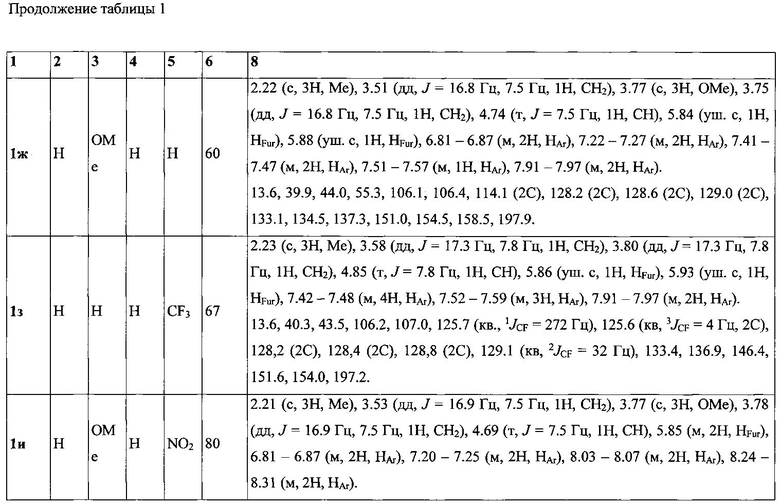
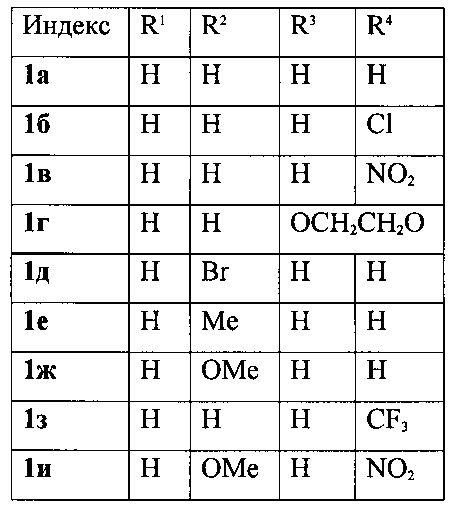
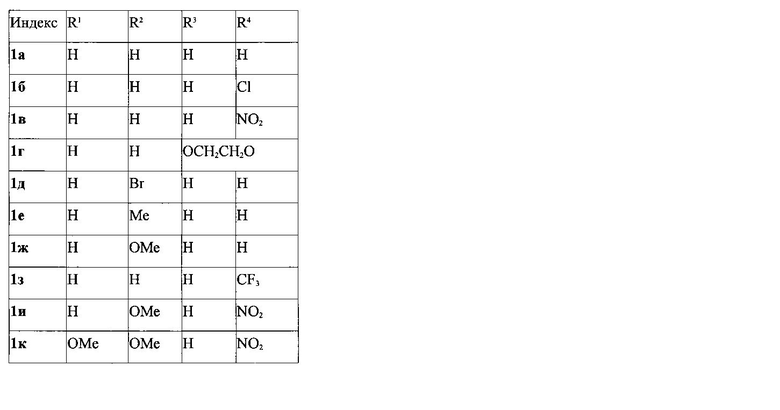
Выходы продуктов реакции и спектральные характеристики полученных 3-фурилпропан-1-онов 1а-к приведены в таблице 1.
Полученный технический результат открывает путь к широкому ряду производных 3-фурилпропан-1-она 1, позволяя вводить в структуру конечных продуктов разнообразные заместители.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.

Примеры осуществления заявляемого способа получения 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-она 1а.
Пример 1.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.058 г бромида меди(II) (0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 73% (0.552 г).
Rf=0.40 (этилацетат/петролейный эфир 1:4)
Спектр 1Н ЯМР (CDCl3), (δ, м.д. и КССВ, J, Гц): 2.23 (с, 3Н, Me), 3.54 (дд, J=16.9 Гц, 7.2 Гц, 1Н, СН2), 3.80 (дд, J=16.9 Гц, 7.2 Гц, 1Н, СН2), 4.80 (т, J=7.2 Гц, 1H, СН), 5.85 (уш. с, 1H, HFur), 5.91 (уш. с, 1Н, HFur), 7.20-7.26 (м, 1Н, HAr), 7.28-7.36 (м, 4Н, HAr), 7.42-7.47 (м, 2Н, HAr), 7.53-7.57 (м, 1H, HAr), 7.92-7.98 (м, 2Н, HAr).
Спектр 13С ЯМР (CDCl3), (δ, м.д.): 13.6, 40.6, 43.9, 106.1, 106.6, 126.8, 128.0 (2С), 128.2 (2С), 128.6 (2С), 128.7 (2С), 133.1, 137.3, 142.4, 151.2, 155.0, 197.8.
Пример 2.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.065 г CuSO4·5H2O (0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 0%.
Пример 3.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.047 г Cu(ОАс)2 (0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 0%.
Пример 4.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.035 г CuCl2 (0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 48% (0.362 г).
Пример 5.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.049 мл HBr (43% w/w, 0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 52% (0.393 г).
Пример 6.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.021 мл HCl (38% w/w, 0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 18% (0.136 г).
Пример 7.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.015 мл ледяной уксусной кислоты (0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 5% (0.038 г).
Пример 8.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.058 г бромида меди(II) (0.26 ммоль) и 8.5 мл 1,4-диоксана перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 0%.
Пример 9.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.058 г бромида меди(II) (0.26 ммоль) и 8.5 мл диметилформамида перемешивают на магнитной мешалке при комнатной температуре в течение 4 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 0%.
Пример 10.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.058 г бромида меди(II) (0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 3 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 50% (0.378 г).
Пример 11.
Смесь 0.540 г бензилиденацетофенона (2.6 ммоль), 0.585 мл 2-метилфурана (6.5 ммоль), 0.058 г бромида меди(II) (0.26 ммоль) и 8.5 мл 1,2-дихлорэтана перемешивают на магнитной мешалке при комнатной температуре в течение 12 часов. Реакционную массу фильтруют через тонкий слой силикагеля (марки Macherey-Nagel, фракция 40-63 мкм), промывают CH2Cl2 (10 мл) и удаляют растворитель при пониженном давлении. Целевой 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-он выделяют методом колоночной хроматографии на силикагеле (марки Macherey-Nagel, фракция 40-63 мкм), элюент - CH2Cl2/петролейный эфир (1:9). Выход 72% (0.554 г).
В таблице 2 приведены данные о влиянии условий проведения реакции на выход 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-она 1а (примеры 1-11).

Как видно из таблицы 2, результат, а именно, получение 3-(5-метил-фур-2-ил)-1,3-дифенилпропан-1-она 1а, с максимально высоким выходом может быть достигнут при перемешивании смеси исходных соединений при комнатной температуре в 1,2-дихлорэтане в присутствии 10 мол.% бромида меди(II) в течение 4 часов. Использование таких катализаторов, как CuSO4, Cu(OAc)2, CuCl2, HBr, HCl или АсОН в 1,2-дихлорэтане при комнатной температуре, а также замена растворителя на ДМФА или 1,4-диоксан не позволяет выделить целевой продукт с более высоким выходом.
Таким образом, методом 1 получен ряд производных 3-(5-метилфур-2-ил)-1,3-дифенилпропан-1-она 1а-к с выходами 42-83%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5, 6-ДИГИДРО-4Н-ФУРО[2', 3':3, 4]ЦИКЛОГЕПТА[1, 2-B]БЕНЗОФУРАНА | 2015 |
|
RU2602822C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 7-АЛКИЛ-2,3-ДИГИДРО-1Н-ПИРРОЛО[1,2-d][1,4]ДИАЗЕПИН-4(5Н)-ОНА | 2017 |
|
RU2659390C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АЦИЛВИНИЛ)ИНДОЛОВ | 2012 |
|
RU2495027C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-(БЕНЗИЛ)ФУРАНА | 2014 |
|
RU2570420C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4-ДИЗАМЕЩЕННЫХ ФУРАНОВ | 2023 |
|
RU2810211C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-(3,5-ДИФЕНИЛФУРАН-2-ИЛ)БУТАН-2-ОНА | 2016 |
|
RU2634000C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-{1-[(4-МЕТИЛФЕНИЛ)СУЛЬФОНИЛ]-1Н-ИНДОЛ-2-ИЛ}БУТ-3-ЕН-2-ОНА | 2012 |
|
RU2488581C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-(2-ФУРИЛ)ФТАЛИДА | 2015 |
|
RU2583058C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-(2-АЦИЛВИНИЛ)ИНДОЛОВ | 2014 |
|
RU2570421C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАГИДРОФУРО[3,2-c]ПИРИДИНОВ | 2023 |
|
RU2810212C1 |
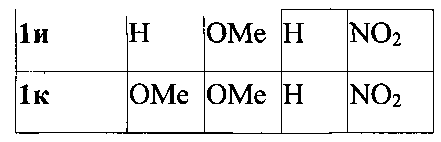
Изобретение относится к области органической химии - получению производных 3-фурилпропан-1-онов формулы 1а-к, где R1-R4имеют следующие значения:
которое заключается во взаимодействии 2-метилфурана с доступными α,β-непредельными карбонильными соединениями в присутствии бромида меди(II) в 1,2-дихлорэтане при комнатной температуре в течение 4 часов. Эти соединения представляют интерес в синтезе веществ фармацевтического назначения. 2 табл., 11пр.
Способ получения производных 3-фурилпропан-1-онов общей формулы 1,
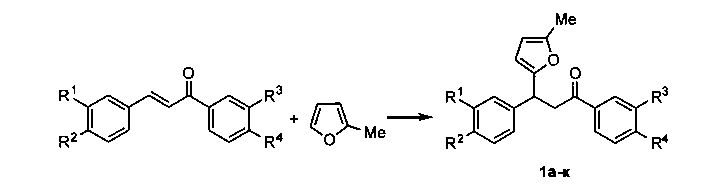
характеризующийся тем, что смесь доступных α,β-непредельных карбонильных соединений, 2-метилфурана, бромида меди(II) перемешивают в 1,2-дихлорэтане при комнатной температуре в течение 4 часов.
| Vivek J | |||
| Bulbule et al, "Cu(OTf)2 catalysed reactions of furan and thiophene wiht a,b-unsaturated ketones, J.Chem.Research (S), 2000,p.220-221 | |||
| СПОСОБ ПОЛУЧЕНИЯ 5-АРИЛ-2,3-ДИГИДРО-2,3-ФУРАНДИОНОВ | 1990 |
|
SU1727378A1 |
Авторы
Даты
2016-11-20—Публикация
2015-11-02—Подача