Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса спиро{пирано[2,3-d]пиримидин-5,3′-пирролов} и к способу их получения, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии.
Известны структурные аналоги заявленных соединений - 7-амино-5-арил-2,4-диоксо-1,3,4,5-тетрагидро-2H-пирано[2,3-d]пиримидин-6-карбонитрилы, являющиеся продуктами взаимодействия ароматических альдегидов с малононитрилом и барбитуровой кислотой в среде этанол-вода в присутствии L-пролина, образующиеся по следующей схеме (М. Bararjanian, S. Balalaie, В. Movassagh and A.M. Amani. One-pot synthesis of pyrano[2,3-d]pyrimidinone derivatives catalyzed by L-proline in aqueous media // J. Iran. Chem. Soc., 2014, 6, 436-442):
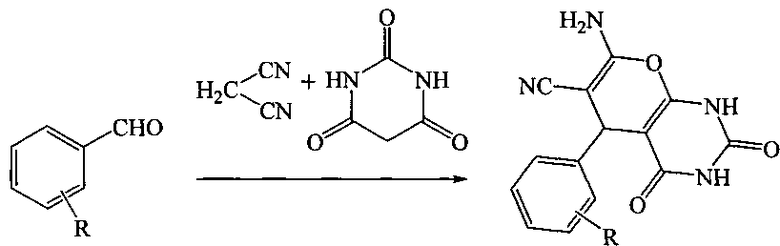
R=4-Br; 3-Cl; 4-CN; 2,3-Cl2; 2,4-Cl2; 3-NO2; 3-OH; 4-NO2; 4-CF3
К недостаткам данного способа относится невозможность получения 7-амино-2,2′,4-триоксо-5′-фенил-1,1′,2,2′,3,4-гексагидроспиро{пирано[2,3-d]пиримидин-5,3′-пиррол}-6-карбонитрилов.
Задачей изобретения является разработка простого способа синтеза неописанных в литературе 7-амино-2,2′,4-триоксо-5′-фенил-1,1′,2,2′,3,4-гексагидроспиро{пирано[2,3-d]пиримидин-5,3′-пиррол}-6-карбонитрилов и расширения арсенала средств воздействия на живой организм.
Поставленная задача осуществляется путем взаимодействия 5-фенил-1H-пиррол-2,3-дионов (Ia-д) с малононитрилом и барбитуровой кислотой в соотношении 1:1:1 в среде растворителя в присутствии триэтиламина с последующим выделением целевых продуктов, по следующей схеме:
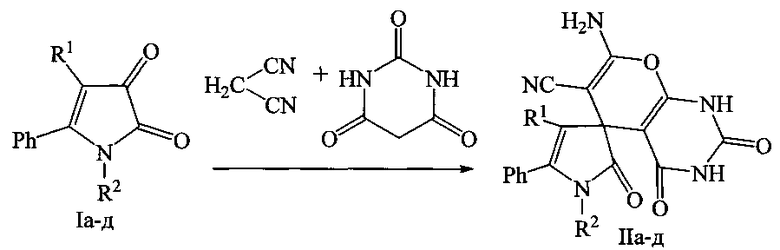
I, II: R1=COOEt, R2=CH2Ph (а), С6Н11-с (б), Н (в), R1=Ph, R2=CH2Ph (г), Н (д).
Процесс ведут при температуре 80-110°С в присутствии триэтиламина в качестве катализатора, а в качестве растворителя используют абсолютный 1,4-диоксан либо другие инертные апротонные растворители.
Из патентной и технической литературы не были выявлены способы получения 7-амино-2,2′,4-триоксо-5′-фенил-1,1′,2,2′,3,4-гексагидроспиро-{пирано[2,3-d]пиримидин-5,3′-пиррол}-6-карбонитрилов, имеющие сходные признаки с заявляемым способом, а именно не использовались исходные продукты, катализаторы, растворители, в которых проходит реакция, и интервал температур, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. 7-Амино-1′-бензил-2,2′,4-триоксо-5′-фенил-4′-этоксикарбонил-1,1′,2,2′,3,4-гексагидроспиро{пирано[2,3-d]пиримидин-5,3′-пиррол}-6-карбонитрил (IIа).
К раствору 1.0 ммоль 1-бензил-5-фенил-4-этоксикарбонил-1H-пиррол-2,3-диона (Iа) в 5 мл абсолютного 1,4-диоксана добавляли 1.0 ммоль малононитрила и 0.3 ммоль триэтиламина, кипятили 2 мин, добавляли 1.0 ммоль барбитуровой кислоты, кипятили 45 мин, охлаждали, образовавшийся осадок отфильтровывали и перекристаллизовывали из смеси ацетон-дихлорметан 1:1. Выход 61%, т. пл. 248-250°С. Соединение (IIа) C27H21N5O6.
Найдено, %: С 63.58; Н 4.22; N 13.53.
Вычислено, %: С 63.40; Н 4.14; N 13.69.
Соединение (IIа) - бесцветное кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, трудно растворимое в менее полярных органических растворителях, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В спектре ЯМР 1Н соединения (IIа), записанном в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец, присутствуют два синглета протонов групп NH при 11.32 и 12.37 м.д., уширенный синглет протонов группы NH2 при 7.49 м.д., триплет и мультиплет протонов этильной группы этоксикарбонильного заместителя при 0.81 м.д. и при 3.79 м.д. соответственно, а также два дублета протонов метиленовой группы бензильного заместителя при 4.45 и 4.53 м.д.
В спектре ЯМР 13С соединения (IIа), записанном в растворе в ДМСО-d6, присутствуют следующие сигналы (м.д.): 13.4, 44.0, 47.6, 55.5, 58.8, 86.1, 110.7, 117.1, 126.5, 126.9, 127.8, 128.0, 128.3, 129.4, 129.6, 136.5, 149.2, 153.6, 155.2, 159.3, 161.4, 161.7, 178.1.
Пример 2. 7-Амино-2,2′,4-триоксо-4′,5′-дифенил-1,1′,2,2′,3,4-гексагидроспиро{пирано[2,3-d]пиримидин-5,3′-пиррол}-6-карбонитрил (IIд).
К раствору 1.0 ммоль 4,5-дифенил-1H-пиррол-2,3-диона (Iд) в 5 мл абсолютного 1,4-диоксана добавляли 1.0 ммоль малононитрила и 0.3 ммоль триэтиламина, кипятили 3 мин, добавляли 1.0 ммоль барбитуровой кислоты, кипятили 50 мин, охлаждали, образовавшийся осадок отфильтровывали и перекристаллизовывали из ДМСО. Выход 56%, т. пл. 250-252°C. Соединение (IIд) C23H15N5O4.
Найдено, %: С 65.09; Н 3.46; N 16.30.
Вычислено, %: С 64.94; Н 3.55; N 16.46.
Соединение (IIд) - бесцветное кристаллическое вещество, легкорастворимое в ДМСО и ДМФА, нерастворимое в менее полярных органических растворителях и воде. Устойчиво при хранении в обычных условиях.
В ИК-спектре соединения (IIд), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний групп NH2 и NH при 3360, 3296 и 3160 см-1, цианогруппы при 2210 см-1, карбонильных групп в виде широкой полосы при 1689 см-1.
В спектре ЯМР 1Н соединения (IIд), записанном в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец и группы NH2 в области 6.97-7.30 м.д., присутствуют три синглета протонов групп NH при 10.17, 11.15 и 12.07 м.д.
Пример 3. Фармакологическое исследование соединений (IIа, б) на наличие противомикробной активности.
Исследование противомикробной активности заявляемых соединений проводили на грамположительных микроорганизмах Staphylococcus aureus (штамм 906).
Противомикробное действие выявляли методом двукратных серийных разведений в соответствии с методикой изучения противомикробного действия препаратов (Першин Г.Н. Методы экспериментальной химиотерапии. - М.: Медицина, 1971, с. 109). Готовили исходные разведения микроорганизмов в физиологическом растворе из суточной агаровой культуры по оптическому стандарту мутности на 10 ME. Для определения противомикробного действия микробную взвесь (микробная нагрузка равна 2.5·105 микробных тел в 1 мл питательной среды) вносили в приготовленные разведения препарата в питательной среде. Факт ингибирования микробных клеток в разведениях препаратов отмечали после 20-ти часового термостатирования при 37°С. Окончательные результаты фиксировали через 7 суток после высева на скошенный агар РПА.
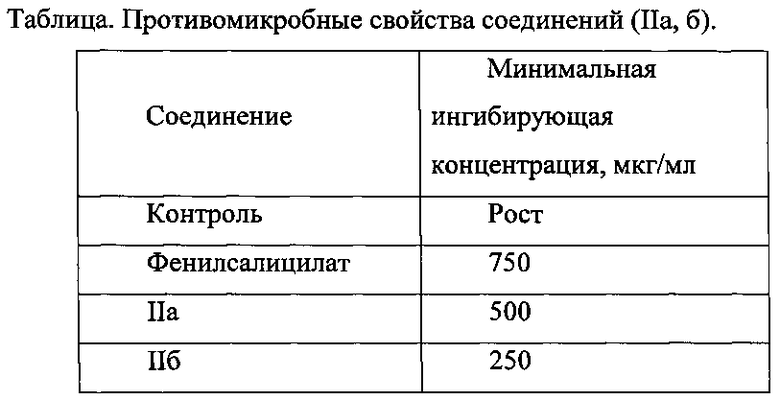
Противомикробную активность оценивали по минимально действующей концентрации. Максимально испытанная концентрация соединения соответствовала 1000 мкг/мл. Эталоном сравнения служил известный в медицинской практике фенилсалицилат.
Проведенные исследования показали (см. таблицу), что соединения (IIа, б) проявляют выраженное ингибирующее действие относительно штаммов золотистого стафилококка в интервале концентраций 250-500 мкг/мл, что активнее в 2-3 раза эталона - фенилсалицилата.
Предлагаемый способ прост в осуществлении, одностадиен и позволяет получить неописанные в литературе 7-амино-2,2′,4-триоксо-5′-фенил-1,1′,2,2′,3,4-гексагидроспиро{пирано[2,3-d]пиримидин-5,3′-пиррол}-6-карбонитрилы (IIа-д) с хорошими выходами, которые могут найти применение в качестве исходных продуктов для синтеза гетероциклических систем и в фармакологии в качестве потенциальных лекарственных средств.
Изобретение относится к способу получения новых соединений класса спиро{пирано[2,3-d]пиримидин-5,3′-пирролов}, а именно 7-амино-2,2′,4-триоксо-5′-фенил-1,1′,2,2′,3,4-гексагидроспиро{пирано[2,3-d]пиримидин-5,3′-пиррол}-6-карбонитрилов общей формулы I, где R1=COOEt, Ph; R2=CH2Ph, C6H11-c, Н, путем взаимодействия 5-фенил-1H-пиррол-2,3-дионов с малононитрилом и барбитуровой кислотой в присутствии триэтиламина в среде инертного апротонного растворителя. Технический результат - получение новых соединений, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии как обладающие противомикробной активностью. 2 з.п. ф-лы, 1 табл., 3 пр.
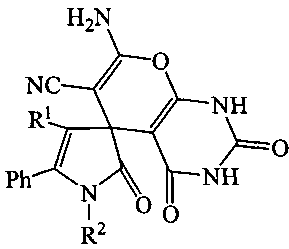
1. Способ получения 7-амино-2,2′,4-триоксо-5′-фенил-1,1′,2,2′,3,4-гексагидроспиро{пирано[2,3-d]пиримидин-5,3′-пиррол}-6-карбонитрилов в общей формулы
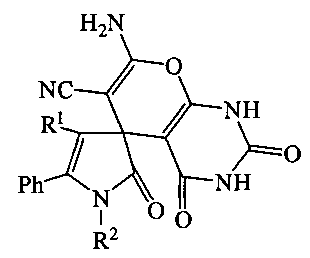
где R1 = COOEt, Ph; R2 = CH2Ph, C6H11-c, H, отличающийся тем, что 5-фенил-1H-пиррол-2,3-дионы подвергают взаимодействию с малононитрилом и барбитуровой кислотой в соотношении 1:1:1 в присутствии триэтиламина в среде инертного апротонного растворителя с последующим выделением целевых продуктов.
2. Способ по п. 1, отличающийся тем, что процесс ведут при температуре 80-110°С.
3. Способ по п. 1 или 2, отличающийся тем, что в качестве растворителя используют абсолютный 1,4-диоксан.
| M.Bararjanian et al, "One-Pot Synthesis of Pyrano[2,3-d]pyrimidinone Derivatives by L-Proline in Aqueous Media",J.Iran Chem.Soc, 2009, p.436-442 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СПИРОСОЕДИНЕНИЯ | 2010 |
|
RU2506266C2 |
Авторы
Даты
2016-12-20—Публикация
2015-11-17—Подача