Изобретение относится к медицине, в частности к медицинской микробиологии, и может быть использовано для прогнозирования благоприятного (выздоровление) или неблагоприятного исхода (рецидивирование, хронизация) артритов, связанных с инфекцией (инфекционных, реактивных артритов).
Артриты, связанные с инфекцией - реактивные и инфекционные артриты являются одной из актуальных проблем современной ревматологии, в том числе педиатрической. По данным экспертов ВОЗ, начиная с 2000 года, отмечается неуклонный рост этих заболеваний, лидирующих по частоте и социальной значимости, как в России, так и в других странах. Наиболее распространен среди ревматических заболеваний реактивный артрит, который встречается у 86,9 на 100000 детского населения и относится к группе серо-негативных спондилоартритов [Детская ревматология. Атлас / Под редакцией А.А. Баранова, Е.И. Алексеевой. - М.: Союз педиатров России, 2009. - 248 с.].
На IV Международном рабочем совещании по реактивным артритам (г. Берлин, 1999 г.) было достигнуто соглашение по определению реактивных артритов (РеА) как заболеваний суставов (негнойного характера), развивающихся вскоре (обычно не позднее, чем через 4 недели) после острой кишечной или урогенитальной инфекции, а также после носоглоточной инфекции. Этиологическими факторами постэнтероколитического РеА считают иерсинии, сальмонеллы, шигеллы, геликобактер, клостридии; урогенного - хламидии, уреаплазмы, микоплазмы.
Высока распространенность и так называемых инфекционных артритов, развивающихся непосредственно на фоне клинической картины инфекционного заболевания (постстрептококковый, поствирусный, артрит Лайма) [Насонов Е.Л. Реактивные артриты / Е.Л. Насонов // Клинические рекомендации. Ревматология // Под ред. Е.Л. Насонова. - М.: ГЭОТАР-Медиа, 2008. - С. 86-91].
По данным Гапоновой Т.В. у 73,3% больных реактивным артритом диагностируется хламидийная или кишечная инфекция [Гапонова Т.В. Клинико-иммунологические взаимосвязи при реактивных артритах различной этиологии: дис. … канд. мед. наук. - Санкт-Петербург, 2009, 116 с.].
Артриты, связанные с инфекцией, развиваются преимущественно после перенесенной носоглоточной инфекции (в 89,5% случаев) и характеризуются относительно благоприятным течением заболевания [Балабанова P.M., Белова Б.С. XXI век: инфекция и ревматические заболевания. Научно-практическая ревматология, 2006, №3, с. 4-6].
Особое место в этиопатогенезе реактивных и инфекционных артритов, по мнению ряда исследователей, занимает кишечный микробном [Scher JU, Abramson SB. The microbiome and rheumatoid arthritis. Nat Rev Rheumatol. 2011; 7 (10): 569-78].
Данные об участии кишечной микробиоты в патогенезе артритов у детей представлены в работе Stoll M.L. [Stoll M.L. et al. Arthritis Rheumatol. 2014; 66 (Supl 11); 5228-5229].
Кроме прямых доказательств патогенетической значимости микробиома при патологии суставов имеются косвенные - иммунологические, свидетельствующие о повышении уровня антиклебсиеллезных IgG у пациентов с анкилозирующими спондилоартритами [Schwimmbeck PL, Yu DT, Oldstone MB. Autoantibodies to HLA B27 in the sera of HLA B27 patients with ankylosing spondylitis and Reiter’s syndrome. Molecular mimicry with Klebsiella pneumoniae as potential mechanism of autoimmune disease. J Exp Med. 1987; 166 (1): 173-81].
Гиперколонизация клебсиелл у больных анкилозирующим спондилитом, которая нередко встречается и у здоровых лиц, важна, как оказалось, с позиции молекулярной мимикрии между клебсиеллой и HLA В-27 [Khan MA, Mathieu A, Sorrentino R, Akkoc N. The pathogenetic role of HLA-B27 and its subtypes. Autoimmun Rev. 2007; 6 (3): 183-9].
Доказана роль микроорганизмов, составляющих микробиом: Klebsiella pneumonia, Bacteroides vulgates и сульфатирующих бактерий, в частности Disulfovibrio disulfuricans, в патогенезе реактивного артрита [Yeoh N., Burton J.P., Suppiah P., Reid G., Stebbings S. The role of the Microbiome in Rheumatic Diseases. Curr. Rheumatol. Rep. (2013); 15: 314].
В то же время, принимая во внимание данные многочисленных исследований, неправильно считать, что один какой-либо вид микроорганизмов приводит к развитию реактивного артрита, большое значение имеет гиперколонизация бактерий (состояние дисбиоза) в микробиоме, которая может быть фактором инициации и поддержания воспалительного процесса. Дисбиозы кишечника способствуют увеличению проницаемости кишечной стенки для микроорганизмов, составляющих кишечный микробиоценоз, и их молекулярных компонентов, стимулируют механизм транслокации компонентов кишечной микробиоты и иммунных клеток в суставы, приводя к развитию и усилению воспалительного процесса при реактивных и инфекционных артритах [Scher JU, Abramson SB. The microbiome and rheumatoid arthritis. Nat Rev Rheumatol. 2011; 7 (10): 569-78].
На важную роль кишечного микробиома в развитии воспалительных ревматических заболеваний указывают исследования Yeoh N., Burton J.P., Suppiah P., Reid G., Stebbings S., из которых следует, что состояние эубиоза кишечника поддерживает полноценное морфофункциональное состояние суставов. Напротив, состояние кишечного дисбиоза является центральным патогенетическим звеном, ведущим к формированию артрита [Yeoh N., Burton J.P., Suppiah P., Reid G., Stebbings S. The role of the Microbiome in Rheu-matic Diseases. Curr. Rheumatol. Rep. (2013); 15: 314].
Таким образом, на сегодняшний день, доказана роль микробного фактора и прежде всего кишечного микробиома в развитии реактивных и инфекционных артритов.
Главной целью клиницистов при лечении реактивных и инфекционных артритов является ликвидация причинного фактора - инфекционного агента, а также излечение или достижение стойкой клинико-лабораторной ремиссии суставного синдрома. Всем пациентам с РеА и инфекционным артритом проводится антибактериальная терапия с учетом возраста, индивидуальной переносимости, соответствующего триггерного агента, тяжести и характера течения суставного синдрома. Лечение артритов, наряду с антибиотиками, включает назначение нестероидных противовоспалительных препаратов, локальную терапию - местное применение нестероидных противовоспалительных препаратов в виде мазей, кремов, гелей, при торпидном течении РеА или хронизации процесса - прием сульфасалазина [Детская ревматология. Атлас / Под редакцией А.А. Баранова, Е.И. Алексеевой. - М.: Союз педиатров России, 2009. - 248 с., [Насонов Е.Л. Реактивные артриты / Е.Л. Насонов // Клинические рекомендации. Ревматология // Под ред. Е.Л. Насонова. - М.: ГЭО-ТАР-Медиа, 2008. - с. 86-91].
У большинства больных (80-90%) РеА заканчивается полным выздоровлением. Однако у части пациентов эпизоды РеА рецидивируют и в дальнейшем появляются признаки спондилоартрита, особенно у HLA-B27 позитивных больных [Насонов Е.Л. Реактивные артриты / Е.Л. Насонов // Клинические рекомендации. Ревматология // Под ред. Е.Л. Насонова. - М.: ГЭО-ТАР-Медиа, 2008. - с. 86-91].
Отмечается значительная склонность к развитию рецидивов у больных с синдромом Рейтера, как из-за возможности реинфицирования, так и персистирования хламидийной инфекции. Исход острого артрита в хронический наблюдается у 20-50% больных. В 15% случаев развивается тяжелое нарушение функции суставов [Жолобова Е.С., Чистякова Е.Г., Дагбаева Д.В. Реактивные артриты у детей - диагностика и лечение /Е.С. Жолобова, Е.Г. Чистякова, Д.В. Дагбаева http//www.lvrach.ru/2007/02/4534797. Лечащий врач#02/07].
Ведущие ревматологи связывают прогноз течения реактивного артрита, инфекционных артритов, в первую очередь, с эффективностью проводимой антибактериальной терапии [Детская ревматология. Атлас / Под редакцией А.А. Баранова, Е.И. Алексеевой. - М.: Союз педиатров России, 2009. - 248 с. [Насонов Е.Л. Реактивные артриты / Е.Л. Насонов // Клинические рекомендации. Ревматология // Под ред. Е.Л. Насонова. - М: ГЭОТАР-Медиа, 2008. - с. 86-91].
Известны способы прогнозирования исхода реактивных и инфекционных артритов, основанные на использовании анализа клинических данных: анамнеза заболевания, динамики клинических симптомов артрита, лабораторных, ультразвуковых, рентгенологических изменений.
Так, разработанный Гапоновой Т.В. способ прогнозирования исхода реактивного артрита включает 5 факторов: длительность заболевания до начала базисной терапии >12 месяцев, уровень СОЭ >15 мм/ч, суставной индекс >4 баллов, уровень боли по визуально-аналоговой шкале (ВАШ) >30 мм и состояние больного по ВАШ >36 мм, оцениваемых через 1 месяц лечения. У больных с наличием одного или двух факторов риск неблагоприятного исхода реактивного артрита увеличивается в 1,8 раза, 3-5 факторов - в 2,6 раза [Гапонова Т.В. Клинико-иммунологические взаимосвязи при реактивных артритах различной этиологии: дис. … канд. мед. наук. - Санкт-Петербург, 2009, 116 с.].
Как показывает клиническая практика, далеко не всегда отмечается параллелизм между динамикой клинических симптомов на фоне лечения и исходом артрита. Между тем, важная роль в определении исхода реактивных и инфекционных артритов принадлежит качественной и количественной характеристике микроорганизмов, выполняющих роль триггерной инфекции.
Известно, что важным свойством, обеспечивающим способность патогенных и условно-патогенных микроорганизмов к выживанию и персистенции, является репродуктивная функция, включающая рост и размножение микроорганизмов. Именно эти показатели являются главными критериями эффективности антибактериальной терапии, направленной против роста и размножения микробной клетки [Бухарин О.В., Перунова Н.Б. Микросимбиоценоз. Екатеринбург: УрО РАН, 2014; 260 с.].
Известны в настоящее время клинико-иммунологические и иммуногенетические методы прогнозирования исхода реактивных и инфекционных артритов. В частности, исследования Исакановой А.О. показали целесообразность определения в качестве прогностических критериев РеА иммуногенетического профиля с уточнением HLA-фенотипа [Исаканова А.О. Иммуногенетическая характеристика реактивного артрита в зависимости от клинической картины и этиологических вариантов его развития. Автореф. дисс. … канд. мед. наук. Челябинск, 2000, 24 с.].
Известен способ прогнозирования исхода реактивного артрита, в основе которого лежат полученные Чаплыгиной Л.Н. данные о том, что при острых формах РеА имеет место достоверное увеличение лактоферрина крови и нейтрофилов; при рецидивирующих - увеличение уровня ФНО-α, снижение ИФ-Y, показателей фагоцитарной активности. Выявлены прямая зависимость ФНО-α и обратная зависимость ИФ-Y с вариантом течения и длительностью РеА, что позволяет использовать ФНО-α и ИФ-Y для прогнозирования исхода реактивных артритов [Чаплыгина Л.Н. Клинико-диагностическое значение лактоферрина и молекул цитокинов у больных реактивными артритами. Автореф. дисс. … канд. мед. наук., Ярославль, 2007, 24 с.].
Однако исследования иммуногенетического статуса трудоемкие, требуют наличия иммуногенетической лаборатории, дорогостоящего оборудования и обученного персонала, что не всегда выполнимо в условиях лечебных учреждений первичного звена здравоохранения.
Заявляемое изобретение направлено на достижение технического результата, заключающегося в создании достоверного, простого в осуществлении и экономически выгодного способа прогнозирования благоприятного (выздоровление) или неблагоприятного (рецидивирование, хронизация) исхода реактивных и инфекционных артритов.
Для достижения указанного технического результата в заявляемом способе прогнозирования исхода реактивных и инфекционных артритов после завершения курса антибактериальной терапии у пациента производят забор кала для бактериологического исследования на микрофлору, проводят высев фекалий в разведении 10-5 на чашку Петри с 1,5% ГРМ-агаром и антибактериальным препаратом, применяемым при лечении данного больного, в минимальной подавляющей концентрации в диапазоне устойчивости, чашку инкубируют, затем проводят подсчет выросших на чашке колоний микроорганизмов и при содержании колоний в количестве меньше 5000 КОЕ/г прогнозируют благоприятный исход артрита, а при содержании колоний микроорганизмов в количестве, равном или большем 5000 КОЕ/г, прогнозируют неблагоприятный исход артрита.
Отличительными признаками предложенного способа являются забор и высев фекалий в разведении 10-5 на чашку Петри с 1,5% ГРМ-агаром и антибактериальным препаратом, применяемым при лечении данного больного, в минимальной подавляющей концентрации в диапазоне устойчивости, инкубирование, подсчет выросших на чашке колоний микроорганизмов и связь количества выросших колоний с возможностью прогнозирования исхода реактивных и инфекционных артритов. Так при содержании колоний микроорганизмов в количестве меньше 5000 КОЕ/г прогнозируют благоприятный исход артрита, а при содержании колоний микроорганизмов в количестве, равном или большем 5000 КОЕ/г, прогнозируют неблагоприятный исход артрита.
Достигаемый при осуществлении изобретения технический результат состоит в возможности прогнозирования благоприятного (выздоровление) или неблагоприятного (рецидивирование, хронизация) исхода реактивных и инфекционных артритов, позволяет планировать и реализовывать целенаправленные превентивные лечебные мероприятия, сокращающие сроки пребывания больного в стационаре. При этом за счет того, что способ не предполагает выделение чистой культуры возбудителя и его идентификации, сокращается время для его осуществления (не более 24-х часов). Заявляемый способ является недорогим и простым в осуществлении, так как не требует для осуществления специального дорогостоящего оборудования и мероприятий по специальной подготовке персонала бактериологических лабораторий.
Авторами экспериментально установлена новая совокупность статистически значимых биопараметров для дифференциации больных с благоприятным (выздоровление) и неблагоприятным (рецидивирование, хронизация) исходом реактивных и инфекционных артритов.
Авторами были проведены клинико-микробиологические исследования, направленные на выявление вышеуказанной новой совокупности статистически значимых биопараметров, позволяющих прогнозировать исход (выздоровление или рецидивирующее, хроническое течение) артритов, связанных с инфекцией (инфекционных и реактивных артритов).
Трехлетний клинико-микробиологический мониторинг 34 детей от 2 до 16 лет с реактивным и инфекционным артритом позволил сформировать две репрезентативные группы пациентов в зависимости от исхода заболевания: в первую группу вошли 21 человек с благоприятным исходом (выздоровление); вторую группу составили 13 больных с неблагоприятным исходом (рецидивирование, хронизация).
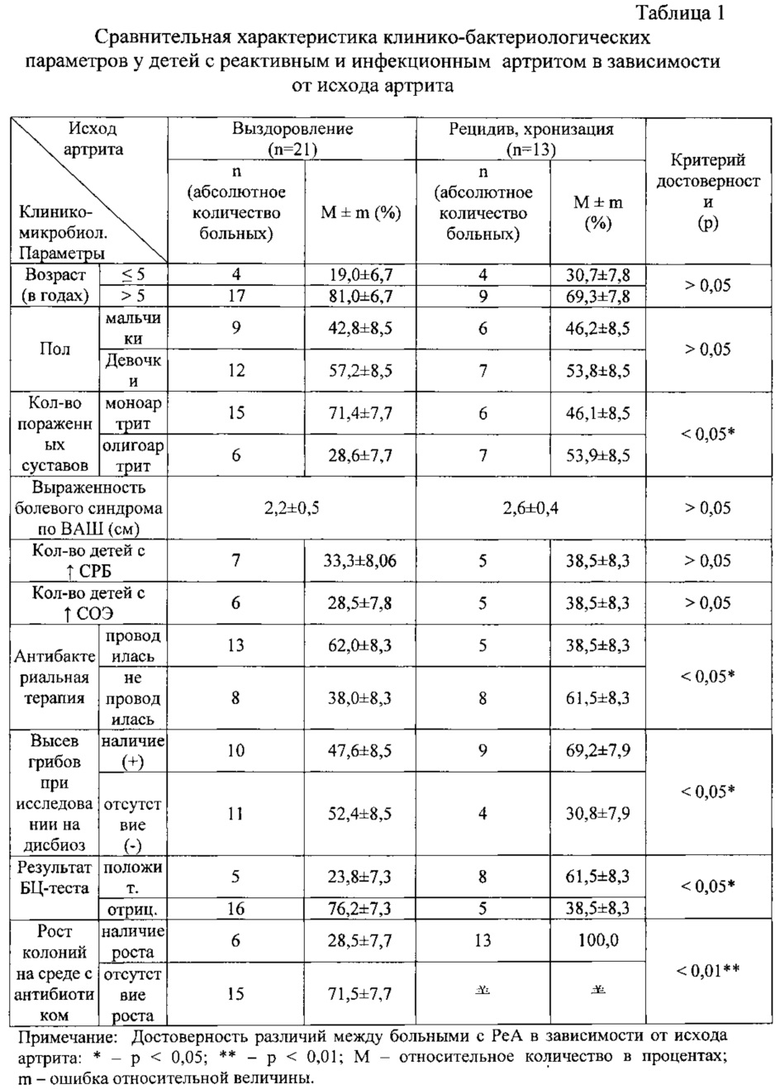
Результаты исследований приведены в таблице 1.
Как видно из таблицы 1, такие важные клинические параметры, как пол ребенка, возраст детей, выраженность болевого синдрома по визуально-аналоговой шкале (ВАШ), а также показатели, свидетельствующие об активности воспалительного процесса: повышение уровня С-реактивного белка (СРБ) и скорости оседания эритроцитов (СОЭ) достоверно не отличаются (р>0,05) у больных с благоприятным и неблагоприятным исходом артрита.
К достоверно значимым признакам (критерий достоверности р<0,05) отнесены следующие признаки:
- факт проведенной антибактериальной терапии (частота встречаемости проведенной антимикробной терапии в анамнезе выше у детей с благоприятным исходом артрита в сравнении с пациентами с неблагоприятным исходом артрита);
- выделение дрожжеподобных грибов при исследовании на дисбиоз кишечника в количестве более 10 КОЕ/г чаще отмечается у детей с неблагоприятным исходом;
- положительный результат бактериоциногенного теста, свидетельствующего о наличии кишечного дисбиоза и воспалительных изменениях в желудочно-кишечном тракте, чаще выявлялся у детей с неблагоприятным исходом.
Наиболее достоверным критерием, определяющим исход артрита, представляется рост колоний микроорганизмов на среде с антибактериальным препаратом, использованным в лечении конкретного больного РеА или инфекционным артритом, так как наличие роста колоний микроорганизмов на среде с антибактериальным препаратом наблюдалось у подавляющего большинства детей с неблагоприятным исходом (хронизацией, рецидивированием) артрита (13 пациентов из 13, т.е. 100%); в то время как у детей с благоприятным исходом (выздоровлением) наличие роста колоний имело место лишь у 6 детей из 21 (28,5±7,7%; р<0,01).
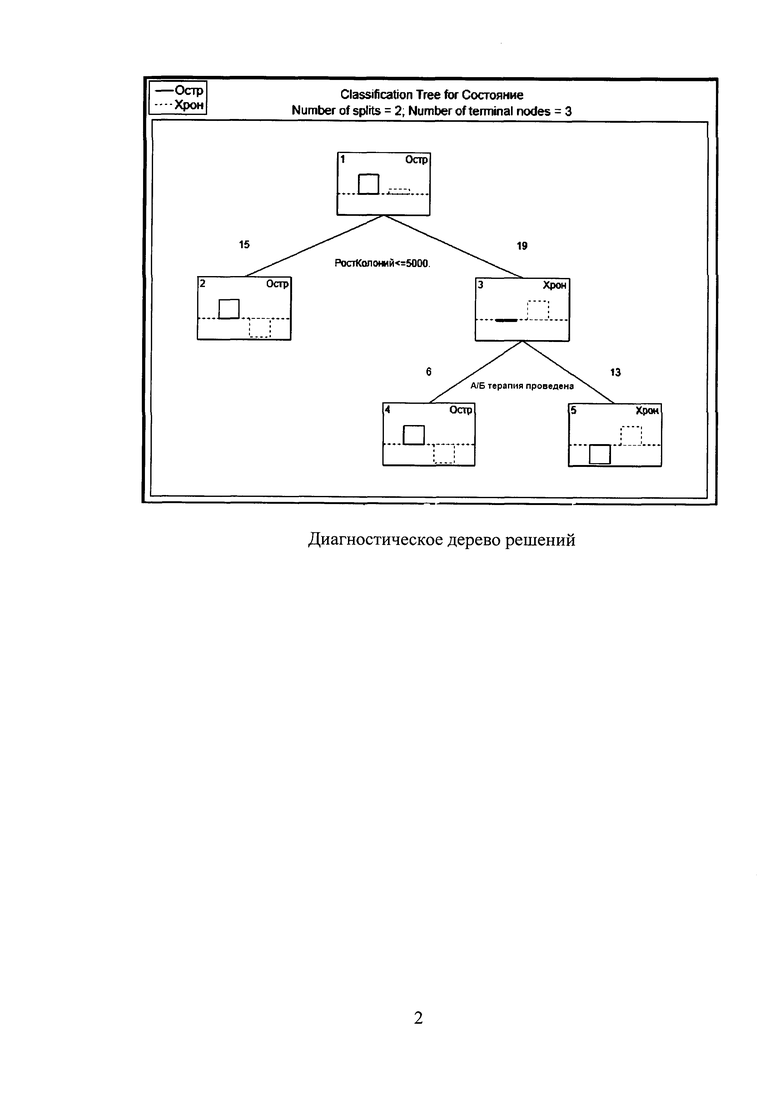
Полученные результаты были статистически обработаны с помощью программного обеспечения STATISTICA 10 (модуль Classification Tree).
На фигуре показано диагностическое дерево решений, демонстрирующее зависимость исхода артрита от факта наличия проведенной антибактериальной терапии, а также от количества колоний микроорганизмов, выросших на среде с антибактериальным препаратом, который был использован в лечении каждого конкретного больного.
Суммарные результаты по определению исхода артрита приведены в табл. 2.
Приведенные в таблице 2 результаты свидетельствуют о том, что при благоприятном исходе артрита у 100% больных (21 ребенок с выздоровлением) отмечается рост колоний микроорганизмов при посеве фекалий на 1,5% ГРМ-агар с антибактериальным препаратом в количестве менее 5000 КОЕ/г. Напротив, у всех 13 больных с неблагоприятным исходом артрита (хронизацией, рецидивированием) количество выросших колоний микроорганизмов равно или более 5000 КОЕ/г.

Таким образом, при содержании колоний микроорганизмов в количестве меньше 5000 КОЕ/г прогнозируют благоприятный исход артрита (выздоровление), а при содержании колоний микроорганизмов в количестве, равном или большем 5000 КОЕ/г, прогнозируют неблагоприятный исход артрита (рецидивирование, хронизацию).
Способ осуществляется следующим образом.
1. После завершения курса антибактериальной терапии у пациента производят забор кала для бактериологического исследования на микрофлору.
2. Проводят высев фекалий в разведении 10-5 на чашку Петри с 1,5% ГРМ-агаром и антибактериальным препаратом, применяемым при лечении данного больного, в минимальной подавляющей концентрации (МПК) в диапазоне устойчивости.
Величину МПК антибиотиков (в мкг/мл) в диапазоне устойчивости в отношении патогенных и условно-патогенных бактерий определяют в соответствии с критериями, официально принятыми в РФ, приведенными в Методических Указаниях 4.2. 1890. 04 [Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам: Методические указания. - М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004].
Таким образом, если больному проводили лечение ампициллином, то, в соответствии с вышеупомянутыми указаниями, используют МПК ампициллина в диапазоне устойчивости, которая составляет 32 мкг/мл.
Для приготовления разведения ампициллина в указанной коцентрации во флакон с сухим веществом антибактериального препарата вводят 10 мл 0,9% физиологического раствора хлорида натрия, берут микропипеткой 64 мкл полученного раствора и смешивают со 100 мл готового расплавленного до 37°C 1,5% ГРМ-агара, тщательно перемешивают полученную среду и разливают на чашки Петри. Перед заполнением расплавленной средой чашки Петри устанавливают на строго горизонтальную поверхность. Глубина агарового слоя в чашке должна быть 3-4 мм. После заполнения чашки оставляют при комнатной температуре для застывания и подсушивания на 10-15 минут. Хранить чашки можно закрытыми в полиэтиленовых пакетах при 4-8°C в течение 7-10 суток. При использовании чашек после хранения в холодильнике их также необходимо подсушить в течение 10-20 мин при 37°C с приоткрытой крышкой.
Готовят разведение фекалий 10-5 в 0,9% физиологическом растворе хлорида натрия. Для этого помещают 1 г фекалий в пробирку №1 и добавляют 9,0 мл 0,9% физиологического раствора хлорида натрия. Берут 0,1 мл суспензии из пробирки №1 и вносят в пробирку №2, смешивали с 9,9 мл 0,9% физиологического раствора хлорида натрия.
Далее проводят посев разведения фекалий 10-5 на чашки Петри с антибактериальным препаратом. Для этого берут по 0,1 мл полученного разведения и помещают на поверхность подготовленных ранее чашек Петри с питательной средой и антибактериальным препаратом. Инокулят растирают шпателем равномерно по всей поверхности чашки.
3. Чашки инкубируют в термостате в течение 24-х часов при температуре 37°C.
4. Проводят подсчет выросших на чашке колоний микроорганизмов.
5. При содержании колоний микроорганизмов в количестве меньше 5000 КОЕ/г прогнозируют благоприятный исход артрита (выздоровление), а при содержании колоний микроорганизмов в количестве, равном или большем 5000 КОЕ/г, прогнозируют неблагоприятный исход (рецидивирование, хронизацию).
Примеры конкретного выполнения способа.
Пример 1. Пациент К., 12 лет, поступил в кардиоревматологическое отделение с жалобами на боли, увеличение размеров, деформацию правого коленного сустава. После проведенного обследования выставлен диагноз: постэнтероколитический реактивный артрит правого коленного сустава. С целью проведения противовоспалительной антимикробной терапии назначен в/мышечно ампициллин в суточной дозе 100 мг/кг веса. По завершении курса лечения отмечалась положительная динамика заболевания, выражающаяся нормализацией формы и размеров пораженного сустава с восстановлением его функций, значительным снижением симптомов интоксикации, снижением показателей СОЭ и С-реактивного белка.
Для прогнозирования исхода артрита проведен посев фекалий в разведении 10-5 на чашку Петри с 1,5% ГРМ-агаром и ампициллином в концентрации 32 мкг/мл, что представляет минимальную подавляющую концентрацию в диапазоне устойчивости в соответствии с критериями, приведенными в Методических Указаниях 4.2. 1890. 04 [Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам: Методические указания. - М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004].
После 24-х часов инкубации в термостате проведен подсчет выросших на чашке колоний микроорганизмов. Количество выросших колоний микроорганизмов составило 400000 КОЕ/г.
На основании полученных результатов (количество выросших колоний микроорганизмов более 5000 КОЕ/г) и согласно заявляемому способу был сделан прогноз о неблагоприятном исходе заболевания, т.е. о риске развития рецидива и хронизации.
Дальнейшее течение артрита подтвердило правильность прогностического заключения, сделанного с использованием заявляемого способа.
Наблюдение в катамнезе показало, что через 4 месяца после первой госпитализации больной поступил повторно по поводу рецидива артрита правого коленного сустава после перенесенной носоглоточной инфекции.
Данные проведенного дополнительного исследования (рентгенологическое и УЗИ-исследование, томография сустава), невысокая гуморальная активность (показатели СОЭ и С-реактивного белка) свидетельствовали о реактивном характере артрита с рецидивирующим течением.
Пример 2. Больная А., 7 лет, поступила в отделение кардиоревматологии по поводу артрита левого коленного сустава и обоих голеностопных суставов, развившегося через 3-3,5 недели после перенесенной инфекции мочевыводящих путей. Назначено противовоспалительное антимикробное лечение, включающее инъекции цефтазидима внутримышечно в дозе 50 мг/кг веса в сутки. По окончании курса лечения отмечалась положительная динамика в виде отсутствия суставного синдрома, симптомов интоксикации и гуморальной активности (нормальные показатели СОЭ и С-реактивного белка).
Для определения прогноза исхода артрита произведен посев фекалий в концентрации 10-5 на чашку Петри с 1,5% ГРМ-агаром, содержащим цефтазидим в минимальной подавляющей концентрации в диапазоне устойчивости - 32 мкг/мл в соответствии с критериями, приведенными в Методических Указаниях 4.2. 1890. 04 [Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам: Методические указания. - М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004].
После инкубации в термостате в течение 24-х часов на чашке роста колоний микроорганизмов не выявлено, что свидетельствует о благоприятном исходе артрита (выздоровлении) у больной. Наблюдение данной пациентки в катамнезе на протяжении 2-х лет не выявило рецидива артрита.
Пример 3. Больной Н., 8 лет, поступил в отделение кардиоревматологии с диагнозом: артрит левого коленного сустава на фоне носоглоточной инфекции (инфекционный артрит).
Назначена антимикробная терапия, включающая азтреонам внутримышечно в дозе 50 мг/кг веса в сутки. Для прогнозирования исхода артрита по окончании курса лечения проведен посев фекалий в разведении 10-5 на чашку Петри с 1,5% агаром, содержащим азтреонам в минимальной подавляющей концентрации в диапазоне устойчивости - 32 мкг/мл в соответствии с критериями, приведенными в Методических Указаниях 4.2. 1890. 04 [Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам: Методические указания. - М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004].
После 24-х часов инкубации в термостате на чашке выявлен рост колоний микроорганизмов в количестве 3000 КОЕ/г, что свидетельствует о благоприятном исходе артрита (выздоровлении). Наблюдение в катамнезе в течение двух лет подтвердило отсутствие рецидивирования и симптомов хронизации артрита у данного пациента.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ХРОНИЧЕСКОГО ТЕЧЕНИЯ УРОГЕНИТАЛЬНОЙ ГОНОКОККОВОЙ ИНФЕКЦИИ | 2006 |
|
RU2332671C2 |
| Способ прогнозирования исхода оперативного лечения хронического остеомиелита | 1985 |
|
SU1372216A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ИЕРСИНИОЗОВ У ДЕТЕЙ | 2010 |
|
RU2422828C1 |
| СПОСОБ РАННЕГО ПРОГНОЗИРОВАНИЯ ХРОНИЧЕСКОГО ТЕЧЕНИЯ ЗАБОЛЕВАНИЯ У ДЕТЕЙ, ПЕРЕНЕСШИХ ОСТРЫЙ ПИЕЛОНЕФРИТ | 2001 |
|
RU2194281C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ СУСТАВНОЙ ФОРМЫ РЕВМАТОИДНОГО АРТРИТА | 2007 |
|
RU2343487C1 |
| СПОСОБ ОЦЕНКИ ВОЗМОЖНОСТИ ДОСТИЖЕНИЯ МИНИМАЛЬНОЙ АКТИВНОСТИ БОЛЕЗНИ У БОЛЬНЫХ ПСОРИАТИЧЕСКИМ АРТРИТОМ | 2024 |
|
RU2829416C1 |
| СПОСОБ ДИАГНОСТИКИ РАЗЛИЧНЫХ ФОРМ ХРОНИЧЕСКОГО ТОНЗИЛЛИТА | 2009 |
|
RU2429477C2 |
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ ЗДОРОВЬЯ ЧЕЛОВЕКА ПРИ ПРОГНОЗИРОВАНИИ ТЕЧЕНИЯ ИНФЕКЦИОННОГО ЗАБОЛЕВАНИЯ | 2014 |
|
RU2595863C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАНИЙ К НАЧАЛУ ПРИЕМА ГЕННО-ИНЖЕНЕРНЫХ БИОЛОГИЧЕСКИХ ПРЕПАРАТОВ ПРИ НЕЭФФЕКТИВНОСТИ БАЗИСНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ ПРЕПАРАТОВ ПРИ РАННИХ ФОРМАХ ПСОРИАТИЧЕСКОГО АРТРИТА | 2020 |
|
RU2731807C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ СУСТAВОВ | 2019 |
|
RU2707278C1 |
Изобретение относится к биотехнологии и может быть использовано для прогнозирования благоприятного или неблагоприятного исхода инфекционных и реактивных артритов. Способ предусматривает забор кала у пациента для бактериологического исследования на микрофлору после завершения курса антибактериальной терапии. Проводят высев фекалий в разведении 10-5 на чашку Петри с 1,5% ГРМ-агаром и антибактериальным препаратом, применяемым при лечении данного больного, в минимальной подавляющей концентрации в диапазоне устойчивости, с последующим инкубированием и подсчетом выросших на чашке колоний микроорганизмов. При этом при содержании колоний в количестве меньше 5000 КОЕ/г прогнозируют благоприятный исход артрита. При содержании колоний микроорганизмов в количестве, равном или большем 5000 КОЕ/г, прогнозируют неблагоприятный исход артрита. Изобретение позволяет упростить способ прогнозирования благоприятного или неблагоприятного исхода реактивных и инфекционных артритов. 1 ил., 2 табл., 3 пр.
Способ прогнозирования исхода реактивных и инфекционных артритов, характеризующийся тем, что после завершения курса антибактериальной терапии у пациента производят забор кала для бактериологического исследования на микрофлору, проводят высев фекалий в разведении 10-5 на чашку Петри с 1,5% ГРМ-агаром и антибактериальным препаратом, применяемым при лечении данного больного, в минимальной подавляющей концентрации в диапазоне устойчивости, чашку инкубируют, затем проводят подсчет выросших на чашке колоний микроорганизмов и при содержании колоний микроорганизмов в количестве меньше 5000 КОЕ/г прогнозируют благоприятный исход артрита, а при содержании колоний микроорганизмов в количестве, равном или большем 5000 КОЕ/г, прогнозируют неблагоприятный исход.
| ЧАПЛЫГИНА Л.Н., Клинико- диагностическое значение лактоферрина и молекул цитокинов у больных реактивными артритами, Автореф | |||
| дис | |||
| на соискание ученой степени кандидата медицинских наук, Ярославль, 2007, стр | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ИСАКАНОВА А.О | |||
| Иммуногенетическая характеристика реактивного артрита в зависимости от клинической картины и этиологических вариантов его развития, Автореф | |||
| дис | |||
| на соискание ученой степени кандидата медицинских наук, Челябинск, 2000, с | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| LUIS VITETTA, SAMANTHA COULSON, et.al., The gastrointestinal microbiome and musculoskeletal diseases: A beneficial role for probiotics and prebiotics, Pathogens, 2013, N 2, p | |||
| РАСПРЕДЕЛИТЕЛЬНЫЙ МЕХАНИЗМ ДЛЯ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО ГОРЕНИЯ | 1922 |
|
SU606A1 |
| JEHAN ALAM, YONG CHUL KIM et.al., Potential role of bacterial infection in autoimmune diseases: A new aspect of molecular minicry, Immune Networc, 2014, v.14, N.14, р.7-13 | |||
| ЧАПЛЫГИНА Л.Н., Лактоферрин как критерий активности у больных реактивными артритами, Фундаментальные исследования.,2004, N 4, стр.90-91. | |||
Авторы
Даты
2017-01-10—Публикация
2016-05-04—Подача