Изобретение относится к использованию химических соединений в области медицины в качестве эффективного лекарственного средства при изготовлении фармакологических препаратов для предупреждения и лечения заболеваний, при которых в клетках наблюдаются нарушения системы микротрубочек. Прежде всего, в эту группу заболеваний можно отнести заболевания с гиперпролиферативным проявлением (раковые заболевания, кандидозы, кистозные заболевания; хроническое воспаление, ревматоидный артрит) и такие широко распространенные и в настоящее время неизлечимые нейродегенеративные расстройства, как болезнь Альцгеймера (БА), болезнь Паркинсона (БП), боковой амиотрофический склероз (БАС), фронто-темпоральная дегенерация (ФТД), хорея Гентингтона, ряд неврологических расстройств и возможно ряд сердечнососудистых патологий, а также атеросклероз и рестенозис.
Микротрубочки являются неотъемлемой частью цитоскелета клетки и выполняют целый ряд функций - как связанных с обеспечением процессов деления клеток, так и с поддержанием формы клетки, ее полярности, обеспечения внутриклеточного транспорта как биомолекул, так и мембранных структур, органелл, модуляции взаимодействия факторов роста с клеточными рецепторами, внутриклеточной передачей сигнала. С множественностью функций связано и то, что нарушение образования микротрубочек, изменение их количества, нарушения структуры, регуляции и функций в клетках является характерным для различающихся клиническими проявлениями патологий.
До сих пор лечение этих заболеваний представляет собой проблему, требующую решений, а в случае значительного числа патологий, в частности, для заболеваний с нейродегенеративным компонентом, лечение является преимущественно симптоматическим, и до настоящего времени не разработаны эффективные средства, непосредственно воздействующие на патогенетический процесс, лежащий в основе заболевания. (Field J. et al. Microtubule-targeting agents are clinically successful due to both mitotic and interphase impairment of microtubule function, 2014, Bioorganic & Medicinal Chemistry, Volume 22, Issue 18, Pages 5050-5059; Ballatore C, Brunden KR, Huryn DM, Trojanowski JQ, Lee VM, Smith AB 3rd. Microtubule stabilizing agents as potential treatment for Alzheimer's disease and related neurodegenerative tauopathies. J Med Chem. 2012 Nov 8; 55(21):8979-96.)
Микротрубочки являются динамическими структурами и находятся в равновесии со своими растворимыми белковыми субъединицами, α- и β-тубулин гетеродимерами, процесс сборки микротрубочек происходит в результате полимеризации тубулина и регулируется множеством факторов, наряду с этим постоянно идет процесс деполимеризации тубулина или разборка микротрубочек. Равновесие процессов полимеризации-деполимеризации определяет состояние системы микротрубочек в клетке. Именно с динамическим состоянием сборки-разборки микротрубочек (полимеризации-деполимеризации тубулина) связана возможность реализации многих функций микротрубочек. Так преобладание полимеризации тубулина приводит к стабилизации микротрубочек и может, независимо от структуры вновь образующихся микротрубочек, препятствовать работе митотического веретена и, соответственно, делению клеток. Таким образом, стабилизация микротрубочек рассматривается как эффективный путь предотвращения гиперпролиферации клеток, благодаря нарушению образования митотического веретена и аресту клеточного деления в метафазе (Loong НН, Yeo W. Microtabule-targeting agents in oncology and therapeutic potential in hepatocellular carcinoma. OncoTargets and therapy. 2014; 7:575-585. doi:10.2147/OTT.S46019.).
В то же время, для обеспечения сохранности функциональной активности стабилизированных микротрубочек в интерфазных (неделящихся) клетках - функций по поддержанию формы клетки, ее полярности и внутриклеточного транспорта - важным является сохранность нормальной структуры микротрубочек, что является необходимым при лечении неврологических, в частности, нейродегенеративных заболеваний, и ряда других, не связанных с гиперпролиферацией клеток, патологий. (Hur Е-М, Lee BD. Microtubule-Targeting Agents Enter the Central Nervous System (CNS): Double-edged Swords for Treating CNS Injury and Disease. International Neurourology Journal. 2014; 18(4):171-178. doi:10.5213/inj.2014.18.4.171; Sengottuvel V, Fischer D. Facilitating axon regeneration in the injured CNS by microtubules stabilization. Commun Integr Biol. 2011 Jul; 4(4):391-3.). Микротрубочки нормальной структуры представляют собой ровные длинные тяжи, лежащие иногда пучками или попарно, в условиях как in vivo, так и в in vitro экспериментах структуру микротрубочек можно контролировать электронной микроскопией.
Известен ряд природных соединений, обладающих свойством стабилизации микротрубочек, (Rohena СС, Mooberry SL. Recent progress with microtubule stabilizers: new compounds, binding modes and cellular activities. Nat Prod Rep. 2014 (3):335-55.) Эти соединения влияют на сборку/разборку микротрубочек и их функции, связываясь и стабилизируя микротрубочки, благодаря стимуляции полимеризации тубулина.
Однако эти соединения являются природными, и их выделение и модификация представляется экономически менее выгодной, чем синтез новых химических соединений.
Известен стабилизатор микротрубочек Паклитаксель, который был впервые предложен для лечения онкологических заболеваний и который обладает свойством стимулировать полимеризацию тубулина, и стабилизировать таким образом микротрубочки клетки (Mekhail ТМ, Markman М. Paclitaxel in cancer therapy. Expert Opin Pharmacother. 2002 Jun; 3(6):755-66. Review. PubMed PMID: 12036415) и который был также предложен для лечения нейродегенеративных заболеваний, в частности, болезни Альцгеймера (Brunden KR, Trojanowski JQ, Smith AB 3rd, Lee VM, Ballatore C. Microtubule-stabilizing agents as potential therapeutics for neurodegenerative disease. Bioorg Med Chem. 2014 Sep 15; 22(18):5040-9. doi: 10.1016/j.bmc.2013.12.046. Epub 2013 Dec 30. Review. PubMed PMID: 24433963; PubMed Central PMCID: PMC4076391.) как препарат стабилизирующий микротрубочки, в результате чего компенсируется дефицит быстрого аксонального транспорта в системе.
Однако это соединение является веществом природного происхождения и его получение и химическая модификация представляется экономически менее выгодным, чем синтез низкомолекулярных соединений, способных стабилизировать микротрубочки.
Известны соединения, близкие по структуре описываемым в данном патенте, включающие адамантановые фрагменты, предлагаемых авторами как "таксол-подобные" структуры (Olga N. Zefirova, Evgeniya V. Nurieva, Heiko Lemcke, Andrei A. Ivanov, Dmitrii V. Shishov, Dieter G. Weiss, Sergei A. Kuznetsov, Nikolay S. Zefirov, Design, synthesis, and bioactivity of putative tubulin ligands with adamantane core, Bioorganic & Medicinal Chemistry Letters, Volume 18, Issue 18, 15 September 2008, Pages 5091-5094, ISSN 0960-894X)
Эти соединения вызывают увеличение полимеризации тубулина, но без сборки микротрубочек нормальной структуры, а с образованием аморфного осадка.
Однако при этом не происходит образования и стабилизации микротрубочек.
Известны соединения, включающие комплексы адамантановых фрагментов с колхицином (Zefirova ON, Nurieva EV, Shishov DV, Baskin II, Fuchs F, Lemcke H,  , Weiss DG, Zefirov NS, Kuznetsov SA. Synthesis and SAR requirements of adamantane-colchicine conjugates with both microtubule depolymerizing and tubulin clustering activities. Bioorg Med Chem. 2011 Sep 15; 19(18):5529-38. doi: 10.1016/j.bmc.2011.07.040. Epub 2011 Jul 28. PubMed PMID: 21873068.).
, Weiss DG, Zefirov NS, Kuznetsov SA. Synthesis and SAR requirements of adamantane-colchicine conjugates with both microtubule depolymerizing and tubulin clustering activities. Bioorg Med Chem. 2011 Sep 15; 19(18):5529-38. doi: 10.1016/j.bmc.2011.07.040. Epub 2011 Jul 28. PubMed PMID: 21873068.).
Эти соединения вызывают ингибирование полимеризации тубулина и соответственно, подавление образования микротрубочек, т.е. проявляют эффект, противоположный стабилизации микротрубочек.
Известны соединения, включающие индол-содержащие фрагменты, влияющие на процесс полимеризации тубулина (Patil SA, Patil R, Miller DD. Indole molecules as inhibitors of tubulin polymerization: potential new anticancer agents. Future Med Chem. 2012 Oct; 4(16):2085-115. doi: 10.4155/fmc.12.141. Review. PubMed PMID: 23157240).
Однако эти соединения рассматриваются как ингибиторы полимеризации тубулина, снижающие образование микротрубочек, а не стабилизирующие их.
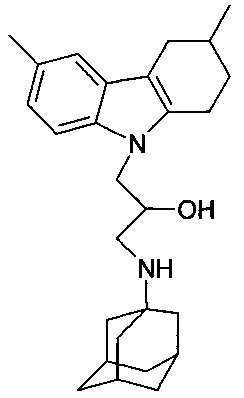
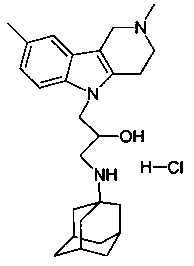
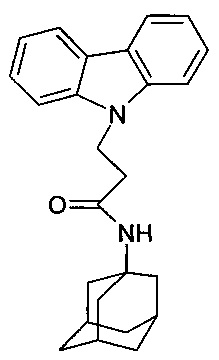
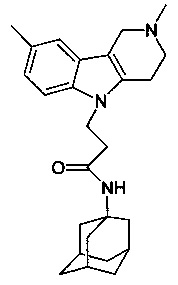
Известно соединение 1-(адамантан-1-иламино)-3-карбазол-9-ил-пропан-2-ол; относящееся г группе адамантсодержащих индолов (см. ACS on STN.RN 439142-30-0, Entered STN: 17 Jul 2002, Chemical Supplier: Ambinter), но соли и биологическая активность этого соединения не раскрыты.
Предлагаемое изобретение решает задачу получения синтетических стабилизаторов микротрубочек с расширенным спектром применения.
Технический эффект при этом заключается в стимуляции полимеризации тубулина, приводящей к стабилизации микротрубочек нормальной структуры.
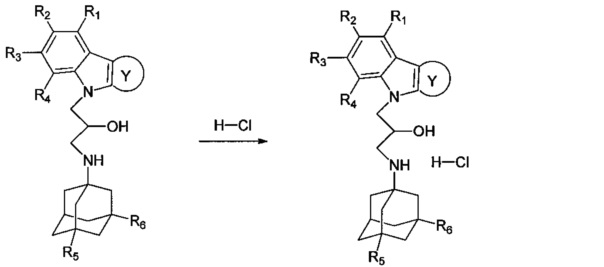
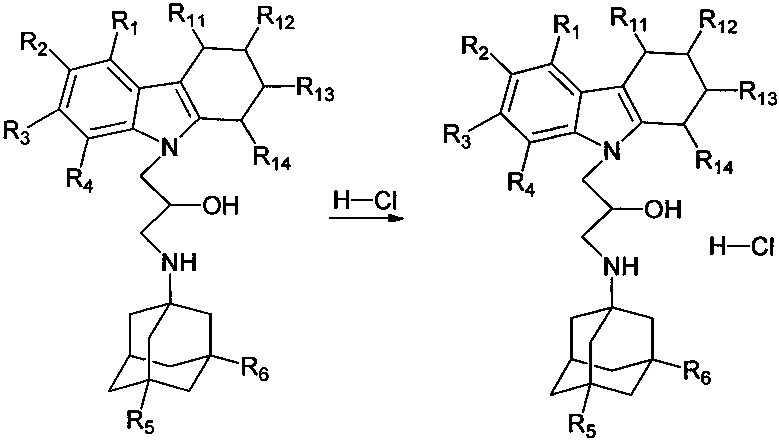
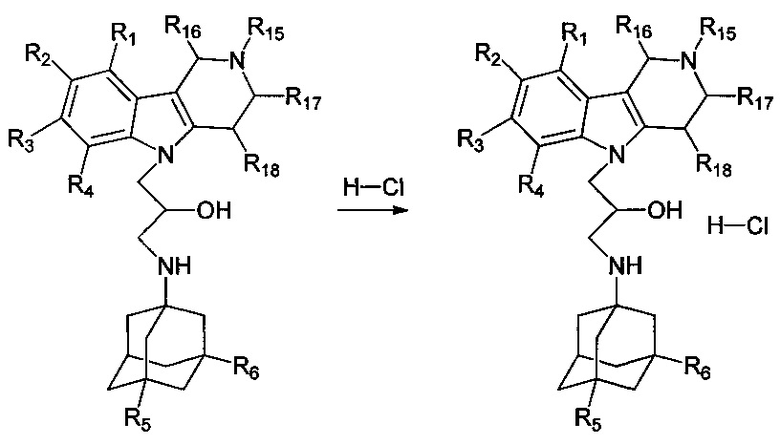
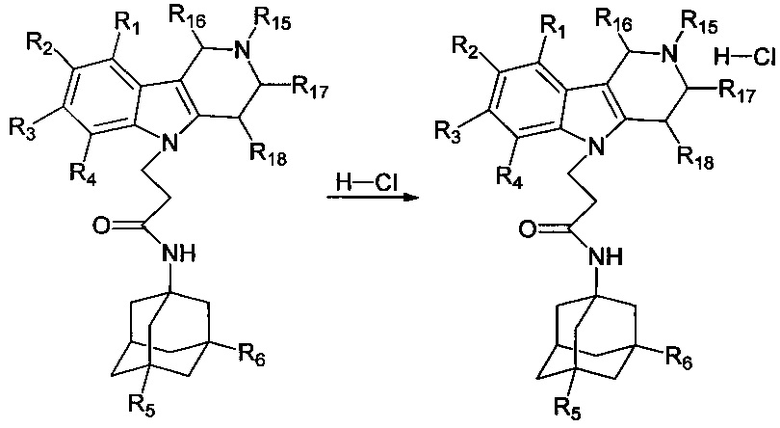
Настоящее изобретение относится к новым соединениям адамантансодержащим индолам и их гидрохлоридам, общей формулы 1,
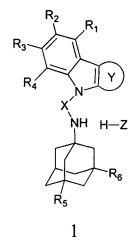
в которой
R1, R2, R3, R4: могут быть одинаковыми или различными и независимо представляют Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси;
R5, R6, могут быть одинаковыми или различными и независимо представляют Н, (C1-C6) алкил, ONO2;
X представляет СН2СН(ОН)СН2 или СН2СН2С(O);
Z=нет, О;
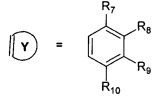 или
или 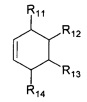 или
или 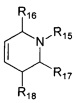
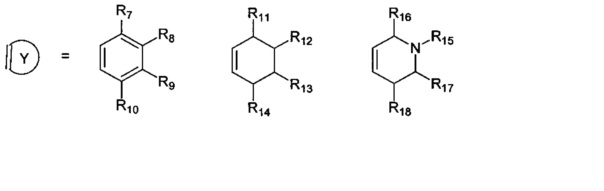
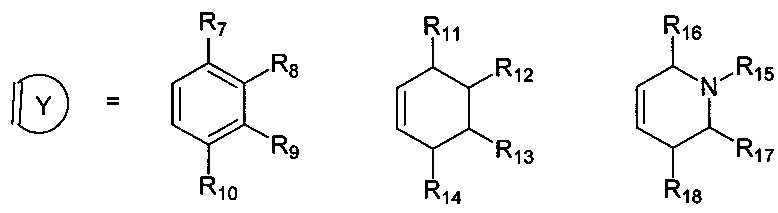
R7, R8, R9, R10 могут быть одинаковыми или различными и независимо представляют Н, F, О, Br, (C1-C6) алкил, (C1-C6) алкокси;
R11, R12, R13, R14, R15, R16, R17, R18 могут быть одинаковыми или различными и независимо представляют Н, (C1-C6) алкил.
При этом при условии, что если R1, R2, R3, R4, R5, R6 каждый независимо представляет Н,
X представляет -СН2СН(ОН)СН2-,
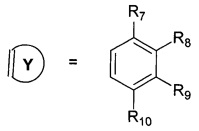
где R7, R8, R9, R10 каждый независимо представляют Н, то Z представляет собой Cl; Среди соединений формулы 1, составляющих один из объектов настоящего изобретения, предпочтительными являются следующие 2 группы соединений, которые могут быть представлены формулами 1.1 и 1.2, приведенными ниже.
В частности, первой группой предпочтительных соединений формулы 1 являются адамантансодержащие индолы и их гидрохлориды общей формулы 1.1
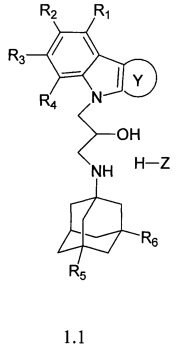
в которой R1, R2, R3, R4, R5, R6, Z, Y, имеют значения, определенные выше для формулы I
В рамках адамантансодержащих индолов и их гидрохлоридов группы 1.1 наиболее предпочтительными являются адамантансодержащие карбазолы и гидрохлориды общей формулы 1.1.1

в которой R1, R2, R3, R4, R5, R, Z, R7, R8, R9, R10 имеют значения, определенные выше для формулы 1.
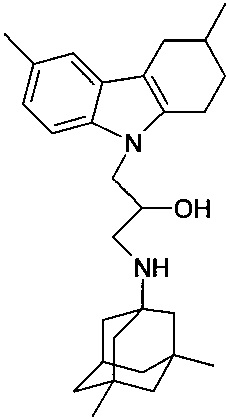
В рамках подгруппы 1.1.1 наиболее предпочтительными являются 1-(адамантан-1-иламино)-3-(3,6-дибром-карбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(3,6-дихлор-карбазол-9-ил)-пропан-2-ол;
3-(3,5-диметиладамантан-1-иламино)-1-карбазол-9-ил)-пропан-2-ол;
1-(3,6-дибромкарбазол-9-ил)-3-(3,5-диметиладамантан-1-иламино)-пропан-2-ол;
3-(3,5-диметиладамантан-1-иламино)-1-(3,6-дихлоркарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-карбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(3,6-дибром-карбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(3,6-дихлор-карбазол-9-ил)-пропан-2-ол гидрохлорид;
3-(3,5-диметиладамантан-1 -иламино)-1 -карбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(3,6-дибромкарбазол-9-ил)-3-(3,5-диметиладамантан-1-иламино)-пропан-2-ол гидрохлорид;
3-(3,5-диметиладамантан-1-иламино)-1-(3,6-дихлоркарбазол-9-ил)-пропан-2-ол гидрохлорид
Второй подгруппой наиболее предпочтительных адамантансодержащих индолов и их гидрохлоридов группы 1.1 являются адамантансодержащие тетрагидрокарбазолы и их гидрохлориды общей формулы 1.1.2
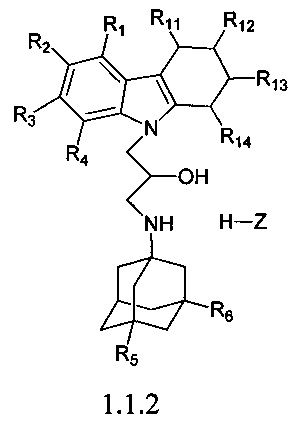
в которой R1, R2, R3, R4, R5, R6 Z, R11, R12, R13, R14, имеют значения, определенные выше для формулы 1
Предпочтительными соединениями этой подгруппы являются:
1-(адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(3,5-диметил-адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(3,6-диметил-адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(3,6-диметил-адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(3,5-диметил-адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(3,6-диметил-адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида;
1-(3,6-диметил-адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
Третьей подгруппой наиболее предпочтительных адамантансодержащих индолов и их гидрохлоридов группы 1.1 являются адамантансодержащие гамма-карболины и их гидрохлориды общей формулы 1.1.3.
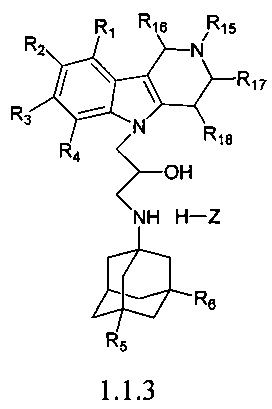
в которой R1, R2, R3, R4, R5, R6, Z, R15, R16, R17, R18, имеют значения, определенные выше для формулы 1.
Предпочтительными соединениями этой подгруппы являются:
1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропан-2-ол;
1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропан-2-ол гидрохлорид.
Второй группой предпочтительных соединений формулы 1 являются адамантансодержащие индолы и их гидрохлориды общей формулы 1.2
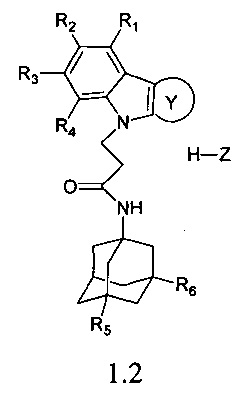
в которой R1, R2, R3, R4, R5, R6, Z, Y, имеют значения, определенные выше для формулы 1.
Среди соединений формулы 1.2, предпочтительными являются следующие 3 подгруппы соединений, которые могут быть представлены формулами 1.2.1, 1.2.2 и 1.2.3, приведенными ниже.
Первую подгруппу предпочтительных адамантансодержащих индолов группы 1.2 составляют адамантансодержащие карбазолы общей формулы 1.2.1.
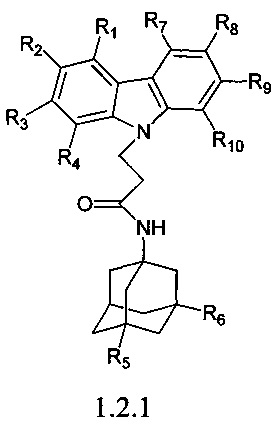
в которой R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, имеют значения, определенные выше для формулы 1.
Предпочтительными соединениями этой подгруппы являются:
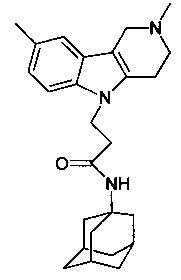
N-(адамантан-1-ил)-3-карбазол-9-ил)-пропионамид;
N-(3,5-диметил-адамантан-1-ил-3-карбазол-9-ил)-пропионамид.
Вторую подгруппу предпочтительных адамантансодержащих индолов группы 1.2 составляют адамантансодержащие тетрагидрокарбазолы общей формулы 1.2.2
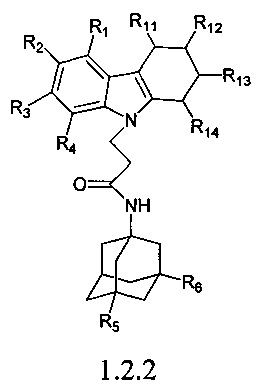
в которой R1, R2, R3, R4, R5, R6,, R11, R12, R13, R14, имеют значения, определенные выше для формулы 1.
Предпочтительным соединением этой подгруппы является:
N-(адамантан-1-ил)-3-(3,4-дигидро-1H-карбазол-9-ил)-пропионамид
Третью подгруппу предпочтительных адамантансодержащих индолов группы 1.2 составляют адамантансодержащие гамма-карболины и их гидрохлориды общей формулы 1.2.3.
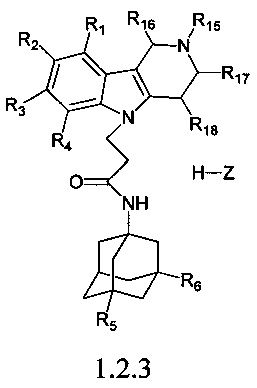
в которой R1, R2, R3, R4, R5, R6, R15, R16, R17, R18 имеют значения, определенные выше для формулы 1.
Предпочтительными соединениями этой подгруппы являются:
1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропионамид;
1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропионамид гидрохлорид.
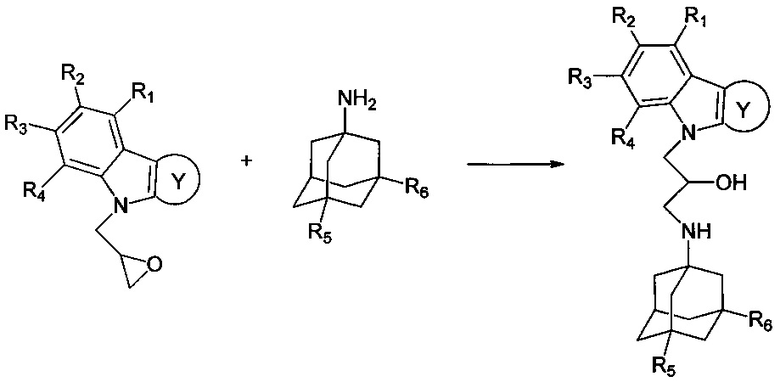
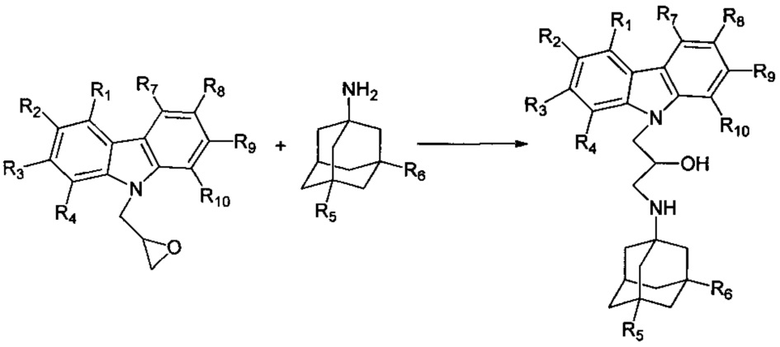
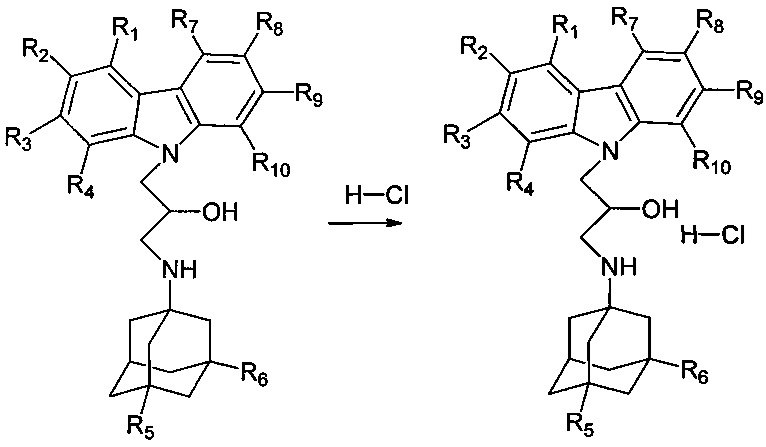
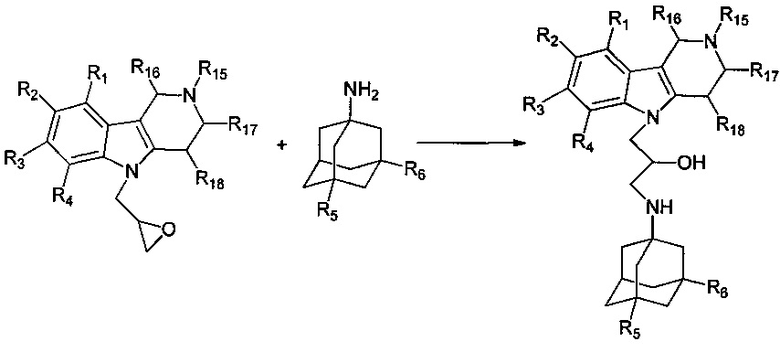
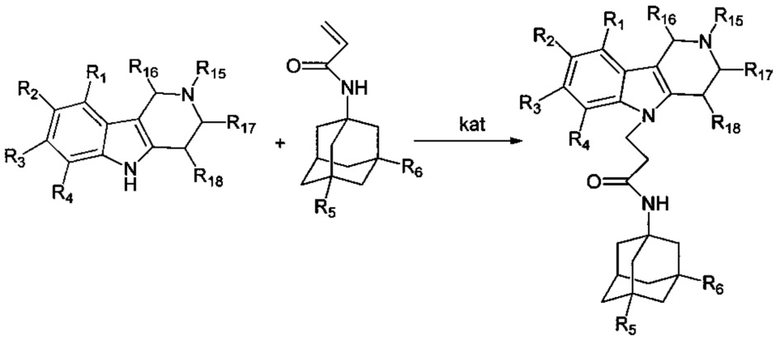
Другими аспектами изобретения являются способы получения различных подгрупп адамантансодержащих индолов и их гидрохлоридов общей формулы 1.
Способ получения адамантансодержащих индолов формулы 1.1 заключается в том, что эквимольную смесь карбазолов общей формулы 2,
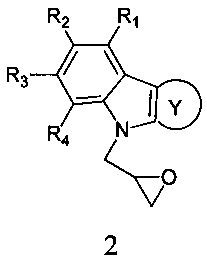
в которой R1, R2, R3, R4, R5, R6, Y, имеют значения, определенные выше для формулы 1,
и аминоадамантанов общей формулы 3,

в которых R5, R6 имеют значения, определенные выше для формулы 1, нагревают в растворителе, выбранном из ряда этанол, пропанол, изо-пропанол, при температуре 70-90°C в течение 2-6 часов.
Способ получения гидрохлоридов адамантансодержащих индолов формулы 1.1 заключается в растворении адамантансодержащих индолов формулы 1.1 в 10%-ом растворе HCl в изопропаноле.
Способ получения адамантансодержащих индолов, общей формулы 1.2 заключается в том, что эквимольную смесь карбазолов общей формулы 4,
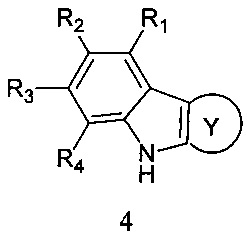
в которой R1, R2, R3, R4, R5, R6, Y, имеют значения, определенные выше для формулы 1
и адамантилакриламидов, общей формулы 5,
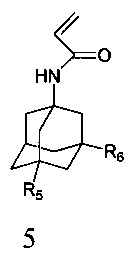
в которых R5, R6 имеют значения, определенные выше для формулы 1; нагревают в диметилсульфоксиде или диметилформамиде в присутствии катализатора, выбранного из ряда: метилат натрия, третбутилат калия, гидроокись калия или фторид цезия, при температуре 100-140°C в течение 2-12 часов.
Способ получения гидрохлоридов адамантансодержащих гамма-карболинов формулы 1.2.3 заключается в растворении адамантансодержащих гамма-карболинов формул 1.2.3 в 10%-ом растворе HCl в изопропаноле.
Еще одним аспектом изобретения является обнаруженное нами применение соединений общей формулы 1 стабилизировать микротрубочки.
Также еще одним аспектом изобретения является применение соединения общей формулы 1 лечить и предупреждать заболевания, связанные с нарушениями системы микротрубочек.
Также еще одним аспектом изобретения является фармакологическое средство в качестве стабилизатора микротрубочек при лечении и предупреждении заболеваний, связанных с нарушениями системы микротрубочек, содержащее в качестве активного начала эффективное количество соединения формулы 1 и фармацевтически приемлемый носитель.
На фиг. 1 приведены данные по влиянию различных концентраций соединения 18 (1 - 25 мкМ, 2 - 50 мкМ, 3 - 100 мкМ) на полимеризацию тубулина:
А - измеряемую как увеличение во времени оптической плотности суспензии тубулин-микротрубочки при 355 нм,
Б - концентрационная зависимость скорости линейной фазы полимеризации тубулина в присутствии соединения 18.
На фиг. 2 приведены электронномикроскопические микрофотографии препаратов полимеризованного тубулина (образованных микротрубочек). А - контрольная проба, увеличение × 4000. (Б-Д) - полимеры тубулина (микротрубочки), образованные в присутствии соединения 18: Б - 25 мкМ,
увеличение х4000; C - 100 мкМ, увеличение х4000; Д - 100 мкМ, увеличение х12500.
На фиг. 3 приведены данные по влиянию гидрохлорида и основания (соединения 26 и 18, соответственно, в концентрации 0,1 мМ) на полимеризацию тубулина, измеряемую как увеличение во времени оптической плотности суспензии тубулин-микротрубочки при 355 нм. Каждая кривая представляет собой среднее трех измерений.
На фиг. 4 приведены данные по влиянию различных концентраций соединения 7 (1 - 25 мкМ, 2 - 50 мкМ, 3 - 100 мкМ) на полимеризацию тубулина: А - измеряемую как увеличение во времени оптической плотности суспензии тубулин-микротрубочки при 355 нм, Б - концентрационная зависимость скорости линейной фазы полимеризации тубулина в присутствии соединения 7.
На фиг. 5 приведены электронномикроскопические микрофотографии препаратов полимеризованного тубулина (микротрубочек), образованных в присутствии 50 мкМ соединения 7: А - увеличение х4000; Б - увеличение х10000.
На фиг. 6 приведены данные по влиянию 100 мкМ соединений 2, 8, 17, 20, 22 на полимеризацию тубулина, представленные как максимальная скорость увеличения светопоглощения суспензии микротрубочек, нормализованная к контрольной пробе.
На фиг 7 приведены данные по влиянию 100 мкМ соединений 3, 4, 5, 6, 9, 10, 11, 12 на полимеризацию тубулина, представленные как зависимость от времени увеличения светопоглощения суспензии микротрубочек. Каждая кривая представляет собой среднее трех измерений.
Приведенные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
Структуры полученных соединений подтверждались данными химического, спектрального анализа и других физико-химических характеристик. Спектры ПМР сняты на приборе Brucker CXP-200 (200 МГц). Мультиплетности наблюдаемых сигналов указываются в сокращенном виде: (с) - синглет, (д) - дублет, (т) - триплет, (к) - квадруплет и (м) - мультиплет.
Синтетическая часть
Производные адамантансодержащих замещенных индолов общей формулы 1, обладающих заявленными свойствами, можно получить путем коньюгации индольной и аминоадамантановой составляющих, соответствующих заявляемому составу и объединенных через заявляемый молекулярный спейсер X. Синтетические способы для получения соединений формулы 1 представляют две общие группы, иллюстрированные следующими примерами.
Синтез соединений формулы 1.1 адамантансодержащих индолов (крабазолов, тетрагидрокарбазолов, гамма-карболинов) и их гидрохлоридов (общая методика)
Процесс проводят нагреванием эквимольной смеси соответствующих замещенных индолов и аминоадамантанов (схема 1) в растворителе (этанол, пропанол, изо-пропанол) при температуре 70-90°C в течение 2-6 часов.
Схема 1. получения соединений общей формулы 1.1
Где R1, R2, R3, R4 = H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси,
R5, R6 = (C1-C6) алкил, ONO2
R7, R8, R9, R10 = H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси
R11, R12, R13, R14, R15, R16, R17, R18 = H, (C1-C6) алкил.
Для получения гидрохлоридов адамантансодержащих индолов соответствующие адамантансодержащие индолы, полученные по схеме 1, растворяют в 10%-ом растворе HCl в изопропаноле (схема 2).
Схема 2. получения гидрохлоридов соединений общей формулы 1.1
Где R1, R2, R3, R4 = H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси,
R5, R6 = (C1-C6) алкил, ONO2
R7, R8, R9, R10 = H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси
R11, R12, R13, R14, R15, R16, R17, R18 = H, (C1-C6) алкил
Схема 1.1 получения адамантансодержащих карбазолов общей формулы 1.1.1
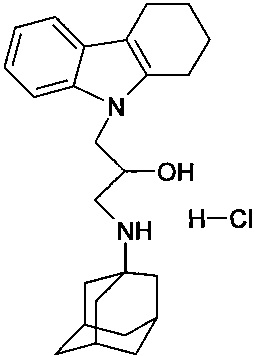
Пример 1: Способ получения 1-(адамантан-1-иламино)-3-карбазол-9-ил-пропан-2-ола (соединение 1)
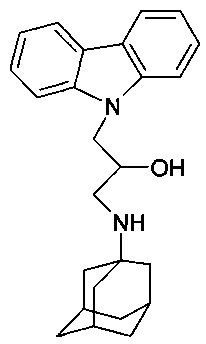
В качестве исходных веществ берут 1 ммоль 9-оксиранилметил-9H-карбазола и 1 ммоль аминоадамантана. В качестве растворителя берут 20 мл этанола. Реакционную массу нагревают при температуре 70°C в течение 6 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 78%. Т. пл. 163-164°C. Спектр ЯМР 1H (CDCl3) δ, м.д 1.40-1.73 (м, 12 H, CH2); 1.94-2.10 (м, 3 H, CH); 2.57 (дд, 1 H, CH2NH, J=12.0, 8.5); 2.80 (дд, 1 H, CH2NH, J=12.0, 3.7); 4.01-4.17 (м, 1 H, CHOH); 4.23-4.47 (м, 2 H, CH2N); 7.16-7.32 (м, 2 H, CHAr); 7.38-7.56 (м, 4 H, CHAr); 8.09 (д, 2 H, CHAr, J=7.8)
Пример 2: Способ получения 1-(адамантан-1-иламино)-3-(3,6-дибром-карбазол-9-ил)-пропан-2-ола (соединение 2)
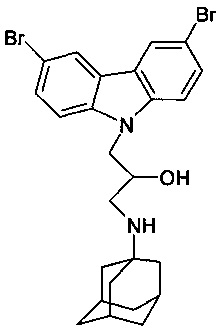
В качестве исходных веществ берут 1 ммоль 9-оксиранилметил-9H-3,6-дибромкарбазола и 1 ммоль аминоадамантана. В качестве растворителя берут 20 мл изо-пропанола. Реакционную массу нагревают при температуре 85°C в течение 2 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 77%. Т. пл. 188-189°C. Спектр ЯМР 1H (CDCl3) δ, м.д.): 1.32-1.71 (м, 12 H, CH2); 1.88-2.08 (м, 3 H, CH); 2.49 (дд, 1 H, CH2NH, J=11.7, 8.5); 2.76 (дд, 1 H, CH2NH, J=11.7, 3.7); 3.88-4.04 (м, 1 H, CHOH); 4.16-4.30 (м, 2 H, CH2N); 7.33 (д, 2 H, CHAr, J=8.8); 7.53 (дд, 2 H, CHAr, J=8.8, 1.7); 8.09 (д, 2 H, CHAr, J=1.7)
Пример 3: Способ получения 1-(адамантан-1-иламино)-3-(3,6-дихлор-карбазол-9-ил)-пропан-2-ола (соединение 3)
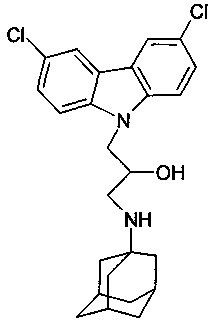
В качестве исходных веществ берут 1 ммоль 9-оксиранилметил-9H-3,6-дихлоркарбазола и 1 ммоль аминоадамантана. В качестве растворителя берут и 20 мл пропанола. Реакционную массу нагревают при температуре 90°C в течение 3 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 72%. Т. пл. 173-174°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.31-1.67 (м, 12 H, CH2); 1.88-2.04 (м, 3 H, CH); 2.48 (дд, 1 H, CH2NH, J=11.7, 8.8); 2.72 (дд, 1 H, CH2NH, J=11.7, 3.7); 3.86-4.02 (м, 1 H, CHOH); 4.16-4.30 (м, 2 H, CH2N); 7.31-7.45 (м, 4 H, CHAr); 7.93 (д, 2 H, CHAr, J=1.7)
Пример 4: Способ получения 3-(3,5-диметиладамантан-1-иламино)-1-карбазол-9-ил-пропан-2-ола (соединение 4)
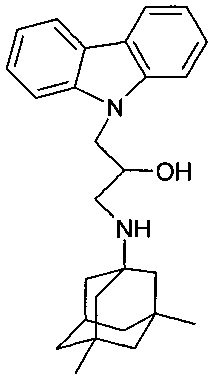
В качестве исходных веществ берут 1 ммоль 9-оксиранилметил-9H-карбазола и 1 ммоль 3,5-диметиладамантан-1-амина. В качестве растворителя берут 20 мл этанола. Реакционную массу нагревают при температуре 80°C в течение 4 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 71%. Т. пл. 81-83°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.77 (с, 6 H, CH3); 0.96-1.30 (м, 12 H, CH2); 2.02 (септет, 1 H, CH, J=2.7); 2.53 (дд, 1 H, CH2NH, J=11.7, 8.5); 2.74 (дд, 1 H, CH2NH, J=11.7, 3.4); 3.95-4.11 (м, 1 H, CHOH); 4.17-4.41 (м, 2 H, CH2N); 7.14-7.30 (м, 2 H, CHAr); 7.38-7.50 (м, 4 H, CHAr); 8.07 (д, 2 H, CHAr, J=7.8)
Пример 5: Способ получения 1-(3,6-дибромкарбазол-9-ил)-3-(3,5-диметиладамантан-1-иламино)-пропан-2-ола (соединение 5)
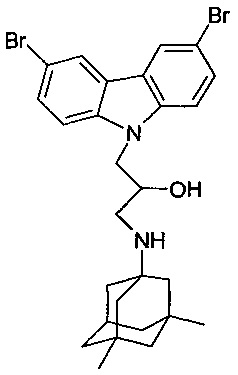
В качестве исходных веществ берут 1 ммоль 9-оксиранилметил-9H-3,6-дибромкарбазола и 1 ммоль 3,5-диметиладамантан-1-амина. В качестве растворителя берут 20 мл изо-пропанола. Реакционную массу нагревают при температуре 85°C в течение 6 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 70%. Т. пл. 63-64°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.80 (с, 6 H, CH3); 1.00-1.37 (м, 12 H, CH2); 2.05 (септет, 1 H, CH, J=2.7); 2.49 (дд, 1 H, CH2NH, J=12.0, 8.8); 2.78 (дд, 1 H, CH2NH, J=12.0, 3.7); 3.89-4.04 (м, 1 H, CHOH); 4.15-4.40 (м, 2 H, CH2N); 7.33 (д, 2 H, CHAr, J=8.8); 7.53 (дд, 2 H, CHAr, J=8.8, 2.0); 8.10 (д, 2 H, CHAr, J=2.0)
Пример 6: Способ получения 3-(3,5-диметиладамантан-1-иламино)-1-(3,6-дихлоркарбазол-9-ил)-пропан-2-ола (соединение 6)
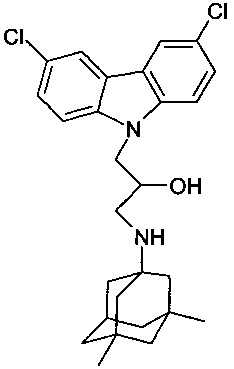
В качестве исходных веществ берут 1 ммоль 9-оксиранилметил-9H-3,6-дихлоркарбазола и 1 ммоль 3,5-диметиладамантан-1-амина. В качестве растворителя берут 20 мл изо-пропанола. Реакционную массу нагревают при температуре 83°C в течение 3 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 75%. Т. пл. 60-61°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.80 (с, 6 H, CH3); 1.01-1.37 (м, 12 H, CH2); 2.06 (септет, 1 H, CH, J=2.7); 2.50 (дд, 1 H, CH2NH, J=12.0, 9.0); 2.79 (дд, 1 H, CH2NH, J=12.0, 3.7); 3.90-4.05 (м, 1 H, CHOH); 4.16-4.30 (м, 2 H, CH2N); 7.34-7.45 (м, 4 H, CHAr); 7.93-7.99 (м, 2 H, CHAr)
Схема 2.1 получения адамантансодержащих гидрохлоридов карбазолов общей формулы 1.1.1
Пример 7: Способ получения 1-(адамантан-1-иламино)-3-карбазол-9-ил-пропан-2-ол гидрохлорида. (соединение 7)
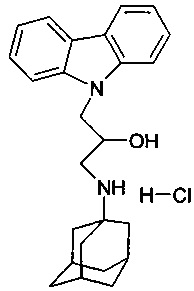
В качестве исходного вещества берут 1 ммоль 1-(адамантан-1-иламино)-3-карбазол-9-ил-пропан-2-ола, полученного в соответствии с примером 1 растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 94%. Т. пл. 167-168°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.44-1.70 (м, 6 H, CH2); 1.71-2.00 (м, 6 H, CH2); 2.00-2.19 (м, 3 H, CH); 2.93-3.29 (м, 2 H, CH2); 4.19-4.40 (м, 1 H, CHOH); 4.40-4.56 (м, 2 H, CH2N); 5.83 (уш. с, 1 H, OH); 7.19 (т, 2 H, CHAr, J=7.3); 7.44 (т, 2 H, CHAr, J=8.0); 7.70 (д, 2 H, CHAr, J=8.0); 8.12 (д, 2 H, CHAr, J=7.3); 8.49 (т, 1 H, NH, J=8.0); 8.77 (т, 1 H, NH, J=8.0)
Пример 8: Способ получения 1-(адамантан-1-иламино)-3-(3,6-дибром-карбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 8)
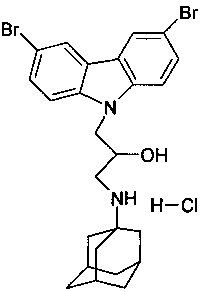
В качестве исходного вещества берут 1 ммоль 1-(адамантан-1-иламино)-3-(3,6-дибром-карбазол-9-ил)-пропан-2-ола, полученного в соответствии с примером 2, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 95%. Т. пл. 178-179°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.48-1.74 (м, 6 H, CH2); 1.75-2.01 (м, 6 H, CH2); 2.03-2.23 (м, 3 H, CH); 2.89-3.10 (м, 1 H, CH2); 3.12-3.30 (м, 1 H, CH2); 4.18-4.38 (м, 1 H, CHOH); 4.40-4.56 (м, 2 H, CH2N); 5.82 (д, 1 H, OH, J=4.4); 7.59 (дд, 2 H, CHAr, J=8.8, 2.0); 7.73 (д, 2 H, CHAr, J=8.8); 8.47 (д, 2 H, CHAr, J=2.0); 8.61 (уш.с, 1 H, NH); 8.95 (уш.с, 1 H, NH).
Пример 9: Способ получения 1-(адамантан-1-иламино)-3-(3,6-дихлор-карбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 9)
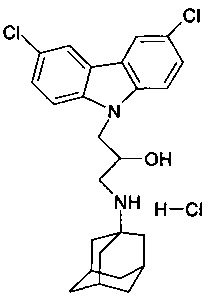
В качестве исходного вещества берут 1 ммоль 1-(адамантан-1-иламино)-3-(3,6-дихлор-карбазол-9-ил)-пропан-2-ола, полученного в соответствии с примером 3, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 93%. Т. пл. 184-186°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.67 (м, 6 H, CH2); 1.68-1.93 (м, 6 H, CH2); 1.97-2.14 (м, 3 H, CH); 2.79-3.00 (м, 1 H, CH2); 3.02-3.20 (м, 1 H, CH2); 4.08-4.26 (м, 1 H, CHOH); 4.27-4.56 (м, 2 H, CH2N); 5.73 (уш.с, 1 H, OH); 7.42 (дд, 2 H, CHAr, J=8.8, 2.0); 7.70 (д, 2 H, CHAr, J=8.8); 8.25 (д, 2 H, CHAr, J=2.0); 8.28.
Пример 10: Способ получения 3-(3,5-диметиладамантан-1-иламино)-1-карбазол-9-ил-пропан-2-ол гидрохлорида (соединение 10).
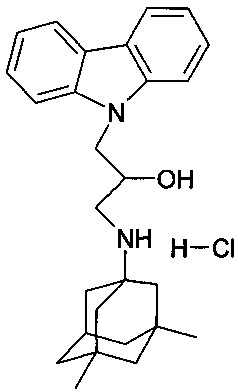
В качестве исходного вещества берут 1 ммоль 3-(3,5-диметиладамантан-1-иламино)-1-карбазол-9-ил-пропан-2-ола, полученного в соответствии с примером 4, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 96%. Т. пл. 227-229°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.84 (с, 6 H, CH3); 0.98-1.20 (м, 2 H, CH2); 1.20-1.34 (м, 4 H, CH2); 1.36-1.62 (м, 4 H, CH2); 1.63-1.80 (м, 2 H, CH2); 2.15 (уш.с, 1 H, CH); 2.92-3.28 (м, 2 H, CH2); 4.20-4.40 (м, 1 H, CHOH); 4.40-4.58 (м, 2 H, CH2N); 5.84 (д, 1 H, OH, J=4.9); 7.19 (т, 2 H, CHAr, J=7.3); 7.44 (т, 2 H, CHAr, J=7.1); 7.71 (д, 2 H, CHAr, J=7.3); 8.14 (д, 2 H, CHAr, J=7.1); 8.68 (т, 1 H, NH, J=8.0); 8.98 (уш.с, 1 H, NH)
Пример 11: Способ получения 1-(3,6-дибромкарбазол-9-ил)-3-(3,5-диметиладамантан-1-иламино)-пропан-2-ол гидрохлорида (соединение 11)
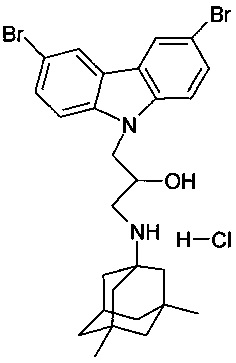
В качестве исходного вещества берут 1 ммоль 1-(3,6-дибромкарбазол-9-ил)-3-(3,5-диметиладамантан-1-иламино)-пропан-2-ола, полученного в соответствии с примером 5, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 94%. Т. пл. 263-264°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.87 (с, 6 H, CH3); 1.02-1.23 (м, 2 H, CH2); 1.24-1.36 (м, 4 H, CH2); 1.41-1.64 (м, 4 H, CH2); 1.65-1.80 (м, 2 H, CH2); 2.19 (уш.с, 1 H, CH); 2.90-3.09 (м, 1 H, CH2); 3.14-3.30 (м, 1 H, CH2); 4.18-4.34 (м, 1 H, CHOH); 4.34-4.58 (м, 2 H, CH2N); 5.77 (д, 1 H, OH, J=5.2); 7.62 (дд, 2 H, CHAr, J=8.8, 2.0); 7.73 (д, 2 H, CHAr, J=8.8); 8.48 (д, 2 H, CHAr, J=2.0); 8.69 (т, 1 H, NH, J=8.0); 8.91 (т, 1 H, NH, J=8.0)
Пример 12: Способ получения 3-(3,5-диметиладамантан-1-иламино)-1-(3,6-дихлоркарбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 12).
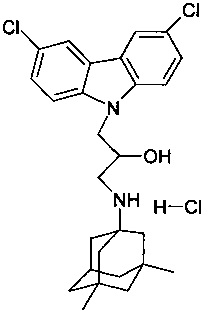
В качестве исходного вещества берут 1 ммоль 3-(3,5-диметиладамантан-1-иламино)-1-(3,6-дихлоркарбазол-9-ил)-пропан-2-ола, полученного в соответствии с примером 6, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 95%. Т. пл. 282-284°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.87 (с, 6 H, CH3); 1.04-1.24 (м, 2 H, CH2); 1.26-1.40 (м, 4 H, CH2); 1.42-1.64 (м, 4 H, CH2); 1.65-1.84 (м, 2 H, CH2); 2.18 (уш.с, 1 H, CH); 2.90-3.10 (м, 1 H, CH2); 3.15-3.32 (м, 1 H, CH2); 4.18-4.34 (м, 1 H, CHOH); 4.34-4.58 (м, 2 H, CH2N); 5.78 (д, 1 H, OH, J=4.6); 7.51 (дд, 2 H, CHAr,, J=8.8, 2.0); 7.77 (д, 2 H, CHAr, J=8.8); 8.34 (д, 2 H, CHAr, J=2.0); 8.64 (уш.с, 1 H, NH); 8.95 (уш.с, 1 H, NH).
Схема 1.2 получения соединений общей формулы 1.1.2.
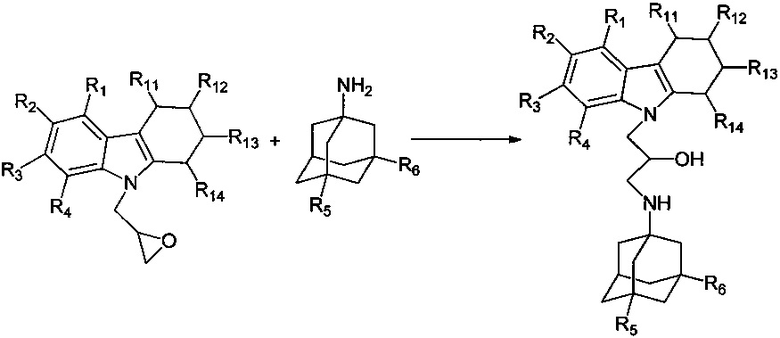
Пример 13: Способ получения 1-(Адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола (соединение 13).
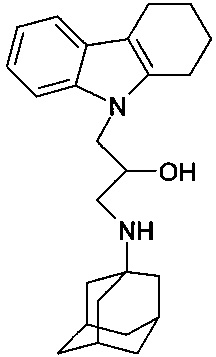
В качестве исходных веществ берут 1 ммоль 9-оксиранилметил-2,3,4,9-тетрагидро-1H-карбазола и 1 ммоль аминоадамантана. В качестве растворителя берут 20 мл этанола. Реакционную массу нагревают при температуре 70°C в течение 5 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 72%. Т. пл. 74-75°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.44-1.70 (м, 13 H, CH2); 1.78-2.09 (м, 7 H, CH2); 2.23-2.40 (м, 2 H, CH2); 2.60-2.79 (м, 5 H, CH2); 3.86-4.12 (м, 3 H, CH+CH2N); 7.07 (м, 2 H, CHAr); 7.28 (д, 1 H, J=6.8, CHAr); 7.44 (д, 1 H, J=6.8, CHAr).
Пример 14: Способ получения 1.-(3,5-диметил-адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола (соединение 14).
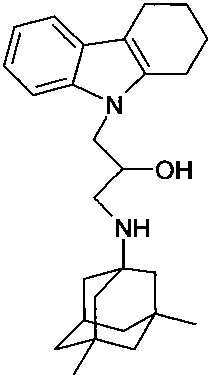
В качестве исходных веществ берут 1 ммоль 9-оксиранилметил-2,3,4,9-тетрагидро-1H-карбазола и 1 ммоль 3,5-диметиладамантан-1-амина. В качестве растворителя берут 20 мл пропанола. Реакционную массу нагревают при температуре 90°C в течение 4 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 75%. Т. пл. 68-70°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.79 (с, 6 H, CH3); 1.01-1.40 (м, 12 H, CH2); 1.75-1.97 (м, 4 H, CH2); 2.80 (м, 1 H, CH2); 2.46-2.87 (м, 5 H, CH2); 3.45 (м, 1 H, CH2); 3.76 (м, 1 H, CH2); 4.2-4.34 (м, 3 H, CH+CH2N); 7.08 (м, 2 H, CHAr); 7.28 (м, 1 H, CHAr); 7.45 (д, 1H, J=6.8, CHAr).
Пример 15: Способ получения 1-(адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола (соединение 15).
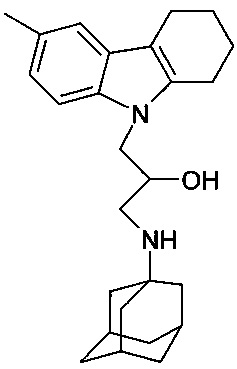
В качестве исходных веществ берут 1 ммоль 6-метил-9-оксиранилметил-2,3,4,9-тетрагидро-1H-карбазола и 1 ммоль аминоадамантана. В качестве растворителя берут 20 мл этанола. Реакционную массу нагревают при температуре 70°C в течение 6 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 74%. Т. пл. 70-71°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.44-1.70 (м, 12 H, CH2); 1.76-2.07 (м, 7 H, CH2); 2.23-2.40 (м, 2 H, CH2); 2.42 (с, 3 H, CH3CAr); 2.45-2.60 (м, 1 H, CH2); 2.60-2.79 (м, 5 H, CH2); 3.86-4.12 (м, 3 H, CH+CH2N); 6.92 (д, 1 H, J=8.3, CHAr); 7.16 (д, 1 H, J=8.3, CHAr); 7.20 (с, 1 H, CHAr).
Пример 16: Способ получения 1-(3,6-диметил-адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола (соединение 16).
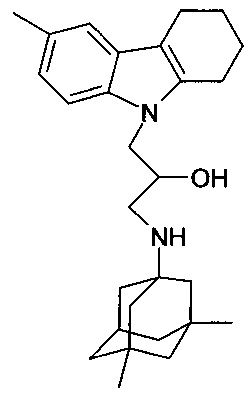
В качестве исходных веществ берут 1 ммоль 6-метил-9-оксиранилметил-2,3,4,9-тетрагидро-1H-карбазола и 1 ммоль 3,5-диметиладамантан-1-амина. В качестве растворителя берут 20 мл пропанола. Реакционную массу нагревают при температуре 85°C в течение 5 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 77%. Т. пл. 66-67°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.84 (с, 6 H, CH3); 1.02-1.23 (м, 2 H, CH2); 1.29 (с, 4 H, CH2); 1.40-1.95 (м, 9 H, CH2); 2.18 (м, 1 H, CH2); 2.47 (с, 3 H, CH3CAr); 2.54-3.18 (м, 4 H, CH2); 3.45 (м, 2 H, CH2); 3.92-4.24 (м, 4 H, CH+CH2N+OH); 5.75 (д, 1 H, J=4.2, OH); 6.98 (д, 1 H, J=8.1, CHAr); 7.20 (д, 1 H, J=8.1, CHAr); 7.28 (с, 1 H, CHAr).
Пример 17: Способ получения 1-(адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола (соединение 17).
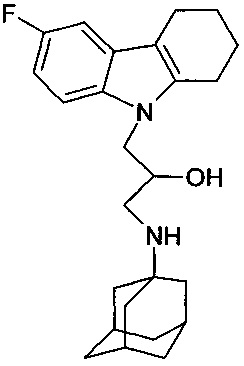
В качестве исходных веществ берут 1 ммоль 6-фтор-9-оксиранилметил-2,3,4,9-тетрагидро-1H-карбазола и 1 ммоль аминоадамантана. В качестве растворителя берут 20 мл изопропанола. Реакционную массу нагревают при температуре 82°C в течение 2 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 69%. Т. пл. 76-77°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.45-1.70 (м, 12 H, CH2); 1.72-2.10 (м, 8 H, CH2); 2.23-2.40 (м, 2 H, CH2); 2.60-2.90 (м, 5 H, CH2); 4.00 (д, 2 H, J=4.9, CH2); 4.32 (м, 1 H, CH); 6.81 (тд, 1 H, JHH=JHF=9.0, JHH=2.4, CHAr); 7.02 (м, 1 H, CHAr); 7.20 (дд, 1 H, JHH=9.0, JHF=4.6, CHAr).
Пример 18: Способ получения 1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола (соединение 18).
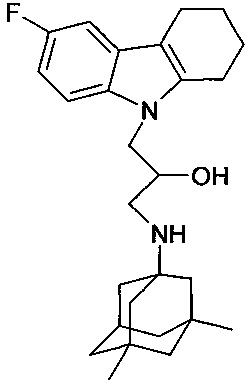
В качестве исходных веществ берут 1 ммоль 6-фтор-9-оксиранилметил-2,3,4,9-тетрагидро-1H-карбазола и 1 ммоль 3,5-диметиладамантан-1-амина. В качестве растворителя берут 20 мл этанола. Реакционную массу нагревают при температуре 70°C в течение 4 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 70%. Т. пл. 121-122°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.81 (с, 6 H, CH3); 0.97-1.40 (м, 12 H, CH2); 1.75-1.97 (м, 4 H, CH2); 2.10 (м, 1 H, CH2); 2.42-2.82 (м, 6 H, CH2); 3.45 (м, 2 H, CH2); 3.86-4.04 (м, 3 H, CH+CH2N); 6.83 (тд, 1 H, JHH=JHF=9.0, JHH=2.4, CHAr); 7.06 (м, 1 H, CHAr); 7.18 (дд, 1 H, JHH=9.0, JHF=4.4, CHAr).
Пример 19: Способ получения 1-(адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола (соединение 19).
В качестве исходных веществ берут 1 ммоль 3,6-диметил-9-оксиранилметил-2,3,4,9-тетрагидро-1H-карбазола и 1 ммоль аминоадамантана. В качестве растворителя берут 20 мл изопропанола. Реакционную массу нагревают при температуре 85°C в течение 3 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 71%. Т. пл. 56-58°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.86 (с, 6 H, CH3); 1.00-1.34 (м, 10 H, CH3+CH2); 1.40-2.06 (м, 9 H, CH2); 2.40 (с, 3 H, CH3CAr); 2.52-2.90 (м, 6 H, CH2); 3.88-4.26 (м, 3 H, CH+CH2N); 5.75 (ш. с, 1 H, OH); 6.84 (д, 1 H, J=8.3, CHAr); 7.16 (с, 1 H, CHAr); 7.32 (д, 1 H, J=8.3, CHAr); 8.54 (ш. с, 1 H, NH+); 8.82 (ш. с, 1 H, NH+).
Пример 20: Способ получения 1-(3,6-диметил-адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола (соединение 20).
В качестве исходных веществ берут 1 ммоль 3,6-диметил-9-оксиранилметил-2,3,4,9-тетрагидро-1H-карбазола и 1 ммоль 3,5-диметиладамантан-1-амина. В качестве растворителя берут 20 мл пропанола. Реакционную массу нагревают при температуре 90°C в течение 5 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 76%. Т. пл. 61-63°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.80 (с, 6 H, CH3); 1.01-1.29 (м, 10 H, CH3+CH2); 1.40-2.06 (м, 9 H, CH2); 2.42 (с, 3 H, CH3CAr); 2.52-2.90 (м, 6 H, CH2); 3.82-4.10 (м, 3 H, CH+CH2N); 6.91 (д, 1 H, J=8.3, CHAr); 7.14 (д, 1 H, J=8.3, CHAr); 7.19 (с, 1 H, CHAr).
Схема 2.2 получения гидрохлоридов соединений общей формулы 1.1.2.
Пример 21: Способ получения 1-(адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола гидрохлорида (соединение 21).
В качестве исходного вещества берут 1 ммоль 1-(адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола, полученного в примере 13, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 95%. Т. пл. 122-124°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.45-1.98 (м, 13 H, CH2); 2.00-2.10 (м, 6 H, CH2); 2.60-3.02 (м, 4 H, CH2); 3.60 (м, 3 H, CH2); 4.12 (м, 2 H, CH2); 6.96 (м, 2 H, CHAr); 7.34 (д, 1 H, J=7.8, CHAr); 7.44 (д, 1 H, J=7.6, CHAr); 8.58 (ш. с, 1 H, NH+); 8.86 (ш. с, 1 H, NH+).
Пример 22: Способ получения 1-(3,5-диметил-адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 22).
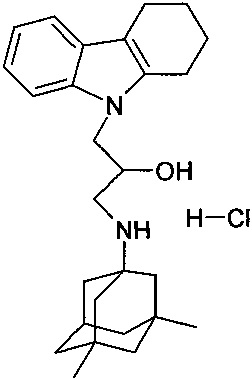
В качестве исходного вещества берут 1 ммоль 1-(3,5-диметил-адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола, полученного в примере 14, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 94%. Т. пл. 114-116°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.85 (с, 6 H, CH3); 1.01-1.23 (м, 2 H, CH2); 1.29 (с, 4 H, CH2); 1.40-1.95 (м, 9 H, CH2); 2.18 (м, 1 H, CH2); 2.54-3.18 (м, 6 H, CH2); 3.92-4.28 (м, 3 H, CH+CH2N); 5.75 (д, 1 H, JHH=4.2, OH); 6.96 (м, 2 H, CHAr); 5.75 (ш. с, 1 H, OH); 6.87 (д, 1 H, J=8.3, CHAr); 7.13 (с, 1 H, CHAr); 7.32 (д, 1 Н, J=8.3, CHAr); 8.55 (ш. с, 1 H, NH+); 8.81 (ш. с, 1 H, NH+).
Пример 23: Способ получения 1-(адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 23).
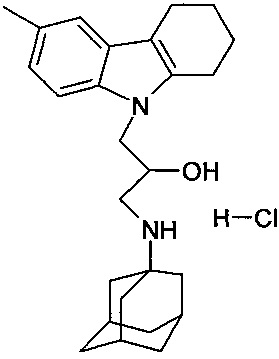
В качестве исходного вещества берут 1 ммоль получения 1-(адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола, полученного в примере 15, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 96%. Т. пл. 114-115°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.40-1.97 (м, 13 H, CH2); 2.10 (м, 4 H, CH2); 2.36 (с, 3 H, CH3CAr); 2.53-2.80 (м, 4 H, CH2); 2.82-2.99 (м, 5 H, CH2); 3.86-4.12 (м, 3 H, CH+CH2N); 6.86 (д, 1 H, J=8.3, CHAr); 7.12 (с, 1 H, CHAr); 7.32 (д, 1 H, J=8.3, CHAr); 8.54 (ш. с, 1 H, NH+); 8.81 (ш. с, 1 H, NH+)
Пример 24: Способ получения 1-(3,6-диметил-адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 24).
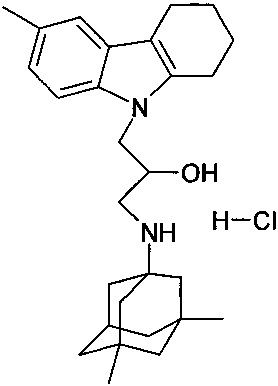
В качестве исходного вещества берут 1 ммоль 1-(3,6-диметил-адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола, полученного в примере 16, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 95%. Т. пл. 103-105°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.85 (с, 6 H, CH3); 0.97-1.23 (м, 2 H, CH2); 1.29 (с, 4 H, CH2); 1.40-1.95 (м, 9 H, CH2); 2.18 (м, 1 H, CH2); 2.36 (с, 3 H, CH3CAr); 2.54-3.18 (м, 6 H, CH2); 3.90-4.24 (м, 3 H, CH+CH2N); 5.74 (ш. с, 1 H, OH); 6.86 (д, 1 H, J=8.5, CHAr); 7.12 (с, 1 H, CHAr); 7.32 (д, 1 H, J=8.5, CHAr); 8.54 (ш. с, 1 H, NH+); 8.80 (ш. с, 1 H, NH+).
Пример 25: Способ получения 1-(адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 25).
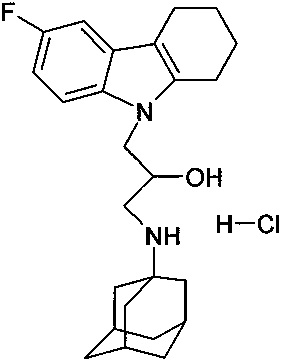
В качестве исходного вещества берут 1 ммоль 1-(3,6-диметил-адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола, полученного в примере 17, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 93%. Т. пл. 134-136°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.40-1.97 (м, 13 H, CH2); 2.10 (м, 4 H, CH2); 2.52-2.82 (м, 4 H, CH2); 2.83-2.98 (м, 5 H, CH2); 3.86-4.12 (м, 3 H, CH+CH2N); 6.87 (т, 1 H, JHH=JHF=9.0, CHAr); 7.07 (д, 1 H, JHH=9.0, CHAr); 7.20 (дд, 1 H, JHH=9.0, JHF=4.6, CHAr); 8.64 (ш. с, 1 H, NH+); 9.00 (ш. с, 1 H, NH+).
Пример 26: Способ получения 1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 26).
В качестве исходного вещества берут 1 ммоль 1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола, полученного в примере 18, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 96%. Т. пл. 240-242°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.86 (с, 6 H, CH3); 0.97-1.23 (м, 2 H, CH2); 1.29 (с, 4 H, CH2); 1.40-1.95 (м, 9 H, CH2); 2.18 (м, 1 H, CH2); 2.54-3.18 (м, 6 H, CH2); 3.92-4.28 (м, 3 H, CH+CH2N); 5.75 (д, 1 H, JHH=4.2, OH); 6.87 (тд, 1 H, JHH=JHF=9.5, JHH=2.4, CHAr); 7.06 (дд, 1 H, JHH=2.4, JHF=9.5, CHAr); 7.45 (дд, 1 H, JHH=9.5, JHF=4.4, CHAr); 8.62 (т, 1 H, JHH=9.0, NH+); 8.94 (т, 1 H, JHH=9.0, NH+)
Пример 27: Способ получения 1-(адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 27)
В качестве исходного вещества берут 1 ммоль 1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола, полученного в примере 19, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 93%. Т. пл. 165-167°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.09 (д, 3 H, CH3CH, J=5.4); 1.42-1.76 (м, 13 H, CH3CH+CH2); 1.80-2.02 (м, 5 H, CH2); 2.04-2.40 (м, 2 H, CH2); 2.38 (с, 3 H, CH3CAr); 2.46-2.60 (м, 2 H, CH2); 2.60-2.98 (м, 4 H, CH2 3.92-4.28 (м, 3 H, CH+CH2N); 5.77 (ш. с, 1 H, OH); 6.86 (д, 1 H, J=8.3, CHAr); 7.12 (с, 1 H, CHAr); 7.31 (д, 1 H, J=8.3, CHAr); 8.55 (ш. с, 1 H, NH+); 8.85 (ш. с, 1 H, NH+).
Пример 28: Способ получения 1-(3,6-диметил-адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида (соединение 28)
В качестве исходного вещества берут 1 ммоль 1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ола, полученного в примере 20, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 97%. Т. пл. 142-144°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.86 (с, 6 H, CH3); 1.00-1.34 (м, 10 H, CH3+CH2); 1.40-2.06 (м, 9 H, CH2); 2.40 (с, 3 H, CH3CAr); 2.52-2.90 (м, 6 H, CH2); 3.88-4.26 (м, 3 H, CH+CH2N); 5.75 (ш. с, 1 H, OH); 6.84 (д, 1 H, J=8.3, CHAr); 7.16 (с, 1 H, CHAr); 7.32 (д, 1 H, J=8.3, CHAr); 8.54 (ш. с, 1 H, NH+); 8.82 (ш. с, 1 H, NH+).
Схема 1.3 получения соединений общей формулы 1.1.3.
Пример 29: Способ получения 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропан-2-ол (соединение 29).

В качестве исходных веществ берут 1 ммоль 3,6-диметил-9-оксиранилметил-2,3,4,9-тетрагидро-1H-пиридо[4,3-b]индола и 1 ммоль аминоадамантана. В качестве растворителя берут 20 мл изопропанола. Реакционную массу нагревают при температуре 85°C в течение 6 часов, охлаждают, выпавший осадок отфильтровывают. Полученный продукт представляет собой бесцветное твердое вещество, выход: 71%. Т. пл. 112-114°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.86 (с, 3 H, CH3); 1.00-1.34 (м, 10 H, CH3+CH2); 1.40-2.06 (м, 8 H, CH2); 2.40 (с, 3 H, CH3CAr); 2.52-2.90 (м, 6 H, CH2); 3.42 (с, 3 H, CH3); 3.88-4.26 (м, 3 H, CH+CH2N); 5.75 (ш. с, 1 H, OH); 6.84 (д, 1 H, J=8.3, CHAr); 7.16 (с, 1 H, CHAr); 7.32 (д, 1 H, J=8.3, CHAr).
Схема 2.3 получения гидрохлоридов соединений общей формулы 1.1.3.
Пример 30: Способ получения 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропан-2-ол гидрохлорида (соединение 30).
В качестве исходного вещества берут 1 ммоль 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропан-2-ола, полученного в примере 29, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 94%. Т. пл. 225-227°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.76 (м, 12 H, CH2); 1.80-2.02 (м, 5 H, CH2); 2.04-2.40 (м, 2 H, CH2); 2.38 (с, 3 H, CH3CAr); 2.46-2.60 (м, 2 H, CH2); 2.60-2.98 (м, 4 H, CH2); 3.43 (с, 3 H, CH3); 3.92-4.28 (м, 3 H, CH+CH2N); 5.77 (ш. с, 1 H, OH); 6.86 (д, 1 H, J=8.3, CHAr); 7.12 (с, 1 H, CHAr); 7.31 (д, 1 H, J=8.3, CHAr); 8.85 (ш. с, 1 H, NH+).
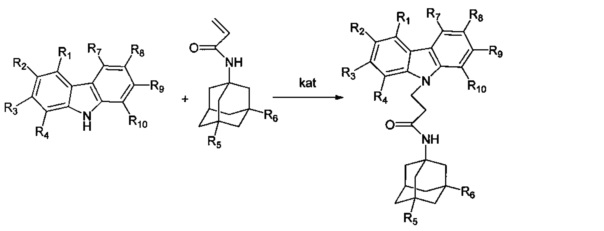
Схема 3. получения адамантансодержащих индолов (карбазолов, тетрагидрокарбазолов, гамма-карболинов) формулы 1.2.

где: R1, R2, R3, R4 = H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси,
R5, R6 = (C1-C6) алкил, ONO2;

Где R7, R8, R9, R10 = H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси;
R11, R12, R13, R14, R15, R16, R17, R18 = H, (C1-C6) алкил;
kat = MeONa, трет.-BuOK, КОН, CsF.
Общая методика: процесс проводят нагреванием эквимольной смеси карбазолов или тетрагидрокарбазолов и адмантанилакриламидов (схема 3) в диметилсульфоксиде (ДМСО) или диметилформамиде (ДМФА) в присутствии катализатора, выбранного из ряда: метилат натрия (MeONa), третбутилат калия (трет.-BuOK), гидроокись калия (КОН) и фторид цезия (CsF)) при температуре 120-160°C в течение 2-12 часов.
Схема 3.1 получения адамантансодержащих индолов формулы 1.2.1.
Пример 31: Способ получения N-адамантан-1-ил-3-карбазол-9-ил-пропионамида (соединение 31).
В качестве исходных веществ берут 1 ммоль карбазола, 1 ммоля адмантанилакриламида, в качестве катализатора берут 300 мг MeONa в 1,5 мл ДМФА. Нагревали при перемешивании при 140-150°C в течение 2 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагируют хлористым метиленом. Хлористый метилен упаривали и остаток хроматографировали на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 154-156°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.75 (м, 12 H, CH2); 1.80-2.04 (м, 3 H, CH2); 2.62 (т, 2 H, CH2, J=6.6); 4.66 (т, 2 H, CH2, J=6.6); 5.00 (уш.с, 1 H, NH); 7.14-7.30 (м, 2 H, CHAr); 7.35-7.54 (м, 4 H, CHAr); 8.06 (д, 2 H, CHAr, J=7.6)
Пример 32: Способ получения N-адамантан-1-ил-3-карбазол-9-ил-пропионамида (соединение 31)
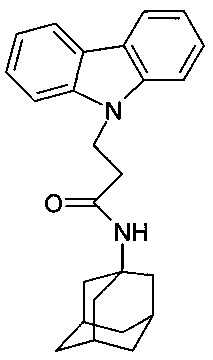
Отличается от примера 31 тем, что в качестве катализатора берут 200 мг CsF. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 154-156°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.75 (м, 12 H, CH2); 1.80-2.04 (м, 3 H, CH2); 2.62 (т, 2 H, CH2, J=6.6); 4.66 (т, 2 H, CH2, J=6.6); 5.00 (уш.с, 1 H, NH); 7.14-7.30 (м, 2 H, CHAr); 7.35-7.54 (м, 4 H, CHAr); 8.06 (д, 2 H, CHAr, J=7.6).
Пример 33: Способ получения N-адамантан-1-ил-3-карбазол-9-ил-пропионамида (соединение 31).
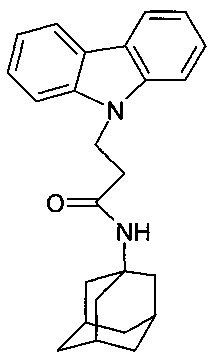
Отличается от примера 31 тем, что в качестве катализатора берут 300 мг трет.-BuOK. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 154-156°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.75 (м, 12 H, CH2); 1.80-2.04 (м, 3 H, CH2); 2.62 (т, 2 H, CH2, J=6.6); 4.66 (т, 2 H, CH2, J=6.6); 5.00 (уш.с, 1 H, NH); 7.14-7.30 (м, 2 H, CHAr); 7.35-7.54 (м, 4 H, CHAr); 8.06 (д, 2 H, CHAr, J=7.6)
Пример 34: Способ получения N-адамантан-1-ил-3-карбазол-9-ил-пропионамида (соединение 31).
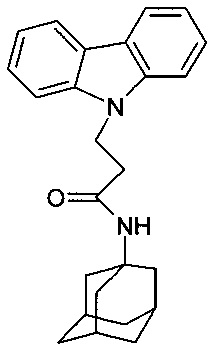
Отличается от примера 31 тем, что в качестве катализатора берут 100 мг КОН. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 154-156°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.75 (м, 12 H, CH2); 1.80-2.04 (м, 3 H, CH2); 2.62 (т, 2 H, CH2, J=6.6); 4.66 (т, 2 H, CH2, J=6.6); 5.00 (уш.с, 1 H, NH); 7.14-7.30 (м, 2 H, CHAr); 7.35-7.54 (м, 4 H, CHAr); 8.06 (д, 2 H, CHAr, J=7.6).
Таким образом, примеры 31-34 подтверждают, что использование различных катализаторов из заявляемого ряда, не влияет на получаемый продукт.
Пример 35. Способ получения N-(3,5-диметил-адамантан-1-ил-3-карбазол-9-ил-пропионамида (соединение 32).
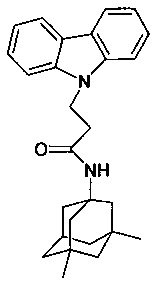
В качестве исходных веществ берут 1 ммоль карбазола, 1 ммоля 3,5-диметиладмантанилакриламида, в качестве катализатора берут 300 мг MeONa в 1,5 мл ДМФА. Нагревают при перемешивании при 140-150°C в течение 6 ч. ДМФА удалили в вакууме 3 мм рт.ст., из остатка продукт экстрагируют хлористым метиленом. Хлористый метилен упаривают и остаток хроматографируют на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 105-107°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.26 (с, 6H, CH3); 1.40-1.71 (м, 12 H, CH2); 1.82-2.11 (м, 3 H, CH2); 2.61 (т, 2 H, CH2, J=6.6); 4.60 (т, 2 H, CH2, J=6.6); 5.09 (уш.с, 1 H, NH); 7.12-7.32 (м, 2 H, CHAr); 7.38-7.50 (м, 4 H, CHAr); 8.08 (д, 2 H, CHAr, J=7.6).
Пример 36: Способ получения N-(3,5-диметил-адамантан-1-ил-3-карбазол-9-ил-пропионамида (соединение 32).
Отличается от примера 35 тем, что в качестве катализатора берут 200 мг CsF. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 105-107°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.26 (с, 6H, CH3); 1.40-1.71 (м, 12 H,CH2); 1.82-2.11 (м, 3 H, CH2); 2.61 (т, 2 H, CH2, J=6.6); 4.60 (т, 2 H, CH2, J=6.6); 5.09 (уш.с, 1 H, NH); 7.12-7.32 (м, 2 H, CHAr); 7.38-7.50 (м, 4 H, CHAr); 8.08 (д, 2 H, CHAr, J=7.6).
Пример 37. Способ получения N-(3,5-диметил-адамантан-1-ил-3-карбазол-9-ил-пропионамида (соединение 32).
Отличается от примера 35 тем, что в качестве катализатора берут 300 мг трет.-BuOK. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 105-107°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.26 (с, 6H, CH3); 1.40-1.71 (м, 12 H, CH2); 1.82-2.11 (м, 3 H, CH2); 2.61 (т, 2 H, CH2, J=6.6); 4.60 (т, 2 H, CH2, J=6.6); 5.09 (уш.с, 1 H, NH); 7.12-7.32 (м, 2 H, CHAr); 7.38-7.50 (м, 4 H, CHAr); 8.08 (д, 2 H, CHAr, J=7.6)
Пример 38: Способ получения N-(3,5-диметил-адамантан-1-ил-3-карбазол-9-ил-пропионамида (соединение 32).

Отличается от примера 35 тем, что в качестве катализатора берут 100 мг KOH. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 105-107°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.26 (с, 6H, CH3); 1.40-1.71 (м, 12 H, CH2); 1.82-2.11 (м, 3 H, CH2); 2.61 (т, 2 H, CH2, J=6.6); 4.60 (т, 2 H, CH2, J=6.6); 5.09 (уш.с, 1 H, NH); 7.12-7.32 (м, 2 H, CHAr); 7.38-7.50 (м, 4 H, CHAr); 8.08 (д, 2 H, CHAr, J=7.6).
Таким образом, примеры 35-38 подтверждают, что использование различных катализаторов из заявляемого ряда не влияет на получаемый продукт.
Схема 3.2 получения адамантансодержащих индолов общей формулы 1.2.2.
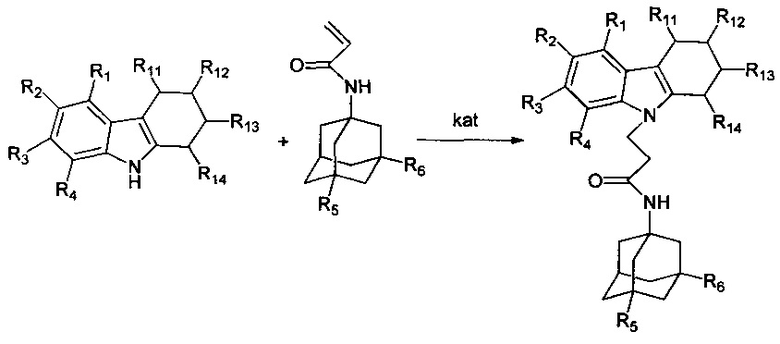
Пример 39: Способ получения N-адамантан-1-ил-3-(3,4-дигидро-1H-карбазол-9-ил-пропионамида (соединение 33)
В качестве исходных веществ берут 1 ммоль тетрагидрокарбазола, 1 ммоль адмантанилакриламида, в качестве катализатора берут 300 мг MeONa в 1,5 мл ДМФА. Нагревают при перемешивании при 140-150°C в течение 12 ч. ДМФА удаляют в вакууме 3 мм рт.ст., из остатка продукт экстрагируют хлористым метиленом. Хлористый метилен упаривают и остаток хроматографируют на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой бесцветное твердое вещество, выход: 81%. Т. пл. 97-99°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.69 (м, 15 H, CH2); 1.81-2.09 (м, 4 H, CH2); 2.20-2.32 (м, 2 H, CH2); 2.42-2.51 (м, 2 H, CH2); 2.69 (т 2 H, J=6.2, CH2,); 4.67 (т 2 H, 7=6.2, CH2,); 5.05 (с, 1 H, NH); 7.15 (м, 2 H, CHAr); 7.36 (д, 1 H, J=6.6, CHAr); 7.57 (д, 1 H, J=6.6, CHAr)
Пример 40: Способ получения N-адамантан-1-ил-3-(3,4-дигидро-1H-карбазол-9-ил)-пропионамида (соединение 33)
Отличается от примера 39 тем, что в качестве катализатора берут 200 мг CsF. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 97-99°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.69 (м, 15 H, CH2); 1.81-2.09 (м, 4 H, CH2); 2.20-2.32 (м, 2 H, CH2); 2.42-2.51 (м, 2 H, CH2); 2.69 (т 2 H, J=6.2, CH2,); 4.67 (т 2 H, J=6.2, CH2,); 5.05 (с, 1 H, NH); 7.15 (м, 2 H, CHAr); 7.36 (д, 1 H, J=6.6, CHAr); 7.57 (д, 1 H, J=6.6, CHAr)
Пример 41: Способ получения N-адамантан-1-ил-3-(3,4-дигидро-1H-карбазол-9-ил)-пропионамида (соединение 33).
Отличается от примера 39 тем, что в качестве катализатора берут 300 мг трет.-BuOK. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 97-99°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.69 (м, 15 H, CH2); 1.81-2.09 (м, 4 H, CH2); 2.20-2.32 (м, 2 H, CH2); 2.42-2.51 (м, 2 H, CH2); 2.69 (т 2 H, J=6.2, CH2,); 4.67 (т 2 H, J=6.2, CH2,); 5.05 (с, 1 H, NH); 7.15 (м, 2 H, CHAr); 7.36 (д, 1 H, J=6.6, CHAr); 7.57 (д, 1 H, J=6.6, CHAr)
Пример 42: Способ получения N-адамантан-1-ил-3-(3,4-дигидро-1H-карбазол-9-ил)-пропионамида (соединение 33)
Отличается от примера 39 тем, что в качестве катализатора берут 100 мг KOH. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 97-99°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.69 (м, 15 H, CH2); 1.81-2.09 (м, 4 H, CH2); 2.20-2.32 (м, 2 H, CH2); 2.42-2.51 (м, 2 H, CH2); 2.69 (т 2 H, J=6.2, CH2,); 4.67 (т 2 H, J=6.2, CH2,); 5.05 (с, 1 H, NH); 7.15 (м, 2 H, CHAr); 7.36 (д, 1 H, J=6.6, CHAr); 7.57 (д, 1 H, J=6.6, CHAr)
Таким образом, примеры 39-42 подтверждают, что использование различных катализаторов из заявляемого ряда, не влияет на получаемый продукт.
Схема 3.3 получения соединений общей формулы 1.2.3.
Пример 43: Способ получения 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропионамида (соединение 34).

В качестве исходных веществ берут 1 ммоль гамма-карболина, 1 ммоль адмантанилакриламида, в качестве катализатора берут 300 мг MeONa в 1,5 мл ДМФА. Нагревают при перемешивании при 140-150°C в течение 10 ч. ДМФА удаляют в вакууме 3 мм рт.ст., из остатка продукт экстрагируют хлористым метиленом. Хлористый метилен упаривают и остаток хроматографируют на силикагеле (60 меш), элюент метанол/хлороформ = 1/5. Полученный продукт представляет собой бесцветное твердое вещество, выход 79%. Т. пл. 115-117°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.69 (м, 13 H, CH2); 1.79-2.07 (м, 4 H, CH2); 2.01 (с, 3 H, CH3); 2.18-2.31 (м, 2 H, CH2); 2.44-2.52 (м, 2 H, CH2); 2.75 (т 2 H, J=6.2, CH2,); 3.18 (с, 3 H, CH3); 4.72 (т 2 H, J=6.2, CH2,); 5.15 (с, 1 H, NH); 7.21 (с, 1 H, CHAr); 7.42 (д, 1 H, J=6.6, CHAr); 7.61 (д, 1 H, J=6.6, CHAr)
Пример 44: Способ получения 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-дмантанилакриламида (соединение 34)
Отличается от примера 43 тем, что в качестве катализатора берут 200 мг CsF. Полученный продукт представляет собой бесцветное твердое вещество, выход 79%. Т. пл. 115-117°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.69 (м, 13 H, CH2); 1.79-2.07 (м, 4 H, CH2); 2.01 (с, 3 H, CH3); 2.18-2.31 (м, 2 H, CH2); 2.44-2.52 (м, 2 H, CH2); 2.75 (т 2 H, J=6.2, CH2,); 3.18 (с, 3 H, CH3); 4.72 (т 2 H, J=6.2, CH2,); 5.15 (с, 1 H, NH); 7.21 (с, 1 H, CHAr); 7.42 (д, 1 H, J=6.6, CHAr); 7.61 (д, 1 H, J=6.6, CHAr)
Пример 45: Способ получения 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропионамида (соединение 34)
Отличается от примера 43 тем, что в качестве катализатора берут 100 мг трет.-BuOK. Полученный продукт представляет собой бесцветное твердое вещество, выход 79%. Т. пл. 115-117°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.69 (м, 13 H, CH2); 1.79-2.07 (м, 4 H, CH2); 2.01 (с, 3 H, CH3); 2.18-2.31 (м, 2 H, CH2); 2.44-2.52 (м, 2 H, CH2); 2.75 (т 2 H, J=6.2, CH2,); 3.18 (с, 3 H, CH3); 4.72 (т 2 H, J=6.2, CH2,); 5.15 (с, 1 H, NH); 7.21 (с, 1 H, CHAr); 7.42 (д, 1 H, J=6.6, CHAr); 7.61 (д, 1 H, J=6.6, CHAr)
Пример 46: Способ получения 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропионамида (соединение 34)
Отличается от примера 43 тем, что в качестве катализатора берут 100 мг KOH. Полученный продукт представляет собой бесцветное твердое вещество, выход: 84%. Т. пл. 115-117°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.69 (м, 13 H, CH2); 1.79-2.07 (м, 4 H, CH2); 2.01 (с, 3 H, CH3); 2.18-2.31 (м, 2 H, CH2); 2.44-2.52 (м, 2 H, CH2); 2.75 (т 2 H, J=6.2, CH2,); 3.18 (с, 3 H, CH3); 4.72 (т 2 H, J=6.2, CH2,); 5.15 (с, 1 H, NH); 7.21 (с, 1 H, CHAr); 7.42 (д, 1 H, J=6.6, CHAr); 7.61 (д, 1 H, 7=6.6, CHAr).
Таким образом, примеры 43-46 подтверждают, что использование различных катализаторов из заявляемого ряда, не влияет на получаемый продукт.
Схема 4 получения гидрохлоридов адамантансодержащих гамма-карболинов формулы 1.2.3.
Из всей группы соединений 1.2 гидрохлориды можно получать только у подгруппы 1.2.3. Для получения гидрохлоридов адамантансодержащих индолов формулы 1.2.3 соответствующие адамантансодержащие индолы полученные по схеме 3.3 растворяют в 10%-ом растворе HCl в изопропаноле (схема 4).
где: R1, R2, R3, R4 = H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси;
R5, R6 = (C1-C6) алкил, ONO2;
Где R7, R8, R9, R10 = H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси;
R11, R12, R13, R14, R15, R16, R17, R18 = H, (C1-C6) алкил
Пример 47: Способ получения гидрохлорида 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропионамида (соединение 35).
В качестве исходного вещества берут 1 ммоль 1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1H-пиридо[4,5-b]индол-5-ил)-пропионамида, полученного в примере 43, растворяют в 2 мл 10%-ного раствора HCl в изопропаноле при температуре 50°C. Охлаждают до 0°C, выпавший осадок отфильтровывают. Полученный продукт представляет собой белое твердое вещество, выход: 95%. Т. пл. 233-235°C. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.42-1.76 (м, 12 H, CH2); 1.80-2.02 (м, 5 H, CH2); 2.04-2.40 (м, 2 H, CH2); 2.38 (с, 3 H, CH3CAr); 2.46-2.60 (м, 2 H, CH2); 2.60-2.98 (м, 4 H, CH2); 3.43 (с, 3 H, CH3); 3.92-4.28 (м, 3 H, CH+CH2N); 5.77 (ш. с, 1 H, OH); 6.86 (д, 1 H, J=8.3, CHAr); 7.12 (с, 1 H, CHAr); 7.31 (д, 1 H, J=8.3, CHAr); 8.85 (ш. с, 1 H, NH+).
Исследования токсичности заявляемой группы соединений, проведенный согласно руководящему документу ОЭСР Test №420 «Acute Oral Toxicity - Fixed Dose Procedure», показал, что средняя летальная доза LD50 (мыши, орально) превышает 300 мг/кг, что позволяет отнести данные соединения к малотоксичным. При этом они не оказывают заметного нейротоксического действия в интервале активных исследуемых доз, что делает их ценными для применения в медицине, при лечении и профилактике заболеваний.
Биологическая активность полученных соединений
Возможность осуществления изобретения с реализацией заявляемого назначения подтверждается следующими примерами 48-53.
Способность исследуемых соединений, общей формулы 1 влиять на образование микротрубочек была исследована in vitro методом оптической регистрации процесса полимеризации тубулина с образованием микротрубочек. Метод основан на модифицированном для планшетного ридера методе Шелански и Ли (Shelanski, М.L., Gaskin, F. and Cantor, С.R. (1973). Microtubule assembly in the absence of added nucleotides. Proc. Natl. Acad. Sci. U.S.A. 70, 765-768. Lee, J.C. and Timasheff, S.N. (1977). In vitro reconstitution of calf brain microtubules: effects of solution variable. Biochemistry, 16, 1754-1762.), которые показали, что увеличение оптической плотности суспензии тубулина и микротрубочек пропорционально содержанию полимеров микротрубочек.
Структуру образовавшихся полимеров тубулина определяли с помощью электронномикроскопического контроля структуры микротрубочек методом негативного контрастирования.
Пример 48. Определение влияния соединения 18 на полимеризацию тубулина
Исследования проводились на коммерческом препарате тубулина из свиного мозга 97% очистки в присутствии гуанозинтрифосфата (ГТФ) при постоянной температуре (37°C) в планшетном формате. Полимеризация тубулина с образованием микротрубочек регистрировалась по изменению оптической плотности суспензии.
Исследуемые вещества разводят в ДМСО, прогретом до температуры 37°C до концентрации, в 50 раз превышающих конечные концентрации скрининга. В ячейки предварительно прогретого планшета добавляют по 2 мкл веществ.
Раствор тубулина разводят до концентрации белка 0.4 мг/мл в буфере (50 мМ Tris-HCl, pH=6,9, 0,2 мМ GTP, 12 мМ MgCl2) с температурой 4°C. Максимально быстро разливают многоканальной пипеткой по 100 мкл в пробы с веществами и в контрольные пробы, содержащие только ДМСО. Немедленно помещают планшет в ридер и начинают запись кинетической кривой. Добавление раствора тубулина к буферу содержащему ГТФ стимулирует начало полимеризации тубулина, (т.е. образования микротрубочек) с достаточно выраженной лаг-фазой (отсутствие роста оптической плотности), участком линейного нарастания оптической плотности и участком неизменной увеличенной оптической плотности, характеризующей установление равновесия между микротрубочками (полимерами тубулина) и неполимеризованным тубулином.
На фиг. 1 показано влияние различных концентраций соединения 18 (1 - 25 мкМ, 2 - 50 мкМ, 3 - 100 мкМ) на полимеризацию тубулина:
Как следует из фиг. 1, наличие в пробе соединения 18 значительно укорачивает лаг-фазу увеличивает скорость увеличения оптической плотности в пробе, что свидетельствует о стимулирующем влиянии соединения 18 на процесс полимеризации тубулина. Также и уровень максимальной оптической плотности в присутствии соединения 18 значительно превышает уровень оптической плотности в контрольных пробах, где присутствует только эквивалентный объем растворителя, что свидетельствует о более высокой концентрации микротрубочек (полимеров тубулина) в пробах в соединением 18. Таким образом, полученные данные позволяют утверждать, что соединение 18 обладает способностью стабилизировать микротрубочки, увеличивая соотношение микротрубочки/неполимеризованный тубулин.
Пример 49. Исследование структуры микротрубочек, образованных при полимеризации тубулина в присутствии соединения 18.
Для проверки неожиданно выявленных нами свойств соединения 18-стимулировать сборку микротрубочек как результата полимеризации тубулина определяют структуру образовавшихся полимеров тубулина с помощью электронномикроскопического контроля структуры микротрубочек методом негативного контрастирования. После проведения полимеризации тубулина 10 мкл суспензии микротрубочек фиксируют в течение 30 секунд в 10 мкл 0,5% глутаральдегида. Затем фиксированные микротрубочки наносят на гексагональную медную сетку для электронной микроскопии, покрытую формваровой пленкой. Через 10-15 секунд каплю суспензии с формваровой пленки осторожно убирают фильтровальной бумагой и на пленку наносят каплю насыщенного раствора уранилацетата. Через 30 секунд ее убирают так же фильтровальной бумагой. Сеточку с образцом высушивают, затем на сеточку напыляют углерод и далее она используется для электронно-микроскопического контроля. На Фиг. 2 приведены электронномикроскопические микрофотографии препаратов полимеризованного тубулина (образованных микротрубочек).
Как следует из фиг. 2, в присутствии соединения 18 образуются ровные длинные микротрубочки стандартной структуры, не отличающиеся от контрольных проб. В контрольном образце (фиг. 2, А) мы наблюдаем микротрубочки в виде длинных, до нескольких микрон, тяжей с ровными и четкими краями и состоящими из двух попарно связанных микротрубочек, что является характерными признаком нормальных микротрубочек, в образцах полимеризованного тубулина в присутствии соединения 18 в концентрациях выше 25 мкМ (фиг. 2, Б-Д) картина абсолютно аналогичная: те же ровные длинные тяжи из попарно лежащих микротрубочек с четкими стенками (видно при большем увеличении на микрофотографии 2Д), лишенными какой бы то ни было деформации, но количество этих микротрубочек увеличивается в образце пропорционально росту концентрации 18.
Таким образом, полученные в примере 48 при полимеризации тубулина соединением 18 микротрубочки имеют нормальную структуру.
Пример 50. Сравнение влияния соединения 18 и его гидрохлорида - соединения 26 на полимеризацию тубулина.
Все как в примере 48, только в качестве соединения, вызывающего полимеризацию тубулина, берут соединение 26, являющееся гидрохлоридом соединения 18.
На фиг. 3 приведены данные по влиянию гидрохлорида и основания (соединения 26 и 18, соответственно, в концентрации 0,1 мМ) на полимеризацию тубулина, измеряемую как увеличение во времени оптической плотности суспензии тубулин-микротрубочки при 355 нм. Каждая кривая представляет собой среднее трех измерений.
Как следует из фиг. 3, стимуляция полимеризации тубулина с образованием микротрубочек в присутствии гидрохлорида (соединение 26) превышает наблюдаемую в присутствии основания (соединение 18) - происходит укорочение лаг-фазы и увеличение скорости увеличения оптической плотности в пробе, что свидетельствует об ускорении образования полимеров тубулина. Также и уровень максимальной оптической плотности в присутствии соединений 18 и 26 значительно превышает уровень оптической плотности в контрольных пробах, где присутствует только эквивалентный объем растворителя. Эти данные свидетельствуют о стимулирующем влиянии соединений 18 и 26 на процесс полимеризации тубулина и, следовательно, на процесс стабилизации микротрубочек, а также более высокой эффективности гидрохлоридной формы соединения.
Пример 51. Определение влияния соединения 7 на полимеризацию тубулина.
Все как в примере 48, только в качестве соединения, вызывающего полимеризацию тубулина берут соединение 7. Как следует из фиг. 4 наличие в пробе соединения 7 значительно укорачивает лаг-фазу и увеличивает скорость увеличения оптической плотности в пробе, что свидетельствует об ускорении образования полимеров тубулина, т.е. микротрубочек. Также и уровень максимально достигаемой оптической плотности в присутствии соединения 7 значительно превышает уровень максимально достигаемой оптической плотности в контрольных пробах, где присутствует только эквивалентный объем растворителя. Таким образом, полученные данные позволяют утверждать, что соединение 7 обладает способностью стабилизировать микротрубочки, увеличивая соотношение микротрубочки/неполимеризованный тубулин.
Пример 52. Исследование структуры микротрубочек, образованных при полимеризации тубулина в присутствии соединения 7.
Структуру образовавшихся полимеров тубулина определяют с помощью электронномикроскопического контроля структуры микротрубочек методом негативного контрастирования как в примере 49. На фиг. 5 приведены электронномикроскопические микрофотографии препаратов полимеризованного тубулина (микротрубочек), образованных в присутствии 50 мкМ соединения 7: А - увеличение x4000; Б - увеличение x10000.
Как следует из фиг. 5, как и в примере 49, в присутствии соединения 7 образуются длинные микротрубочки стандартной структуры, не отличающиеся от контрольных проб. В контрольном образце (фиг. 2, А) мы наблюдаем микротрубочки в виде длинных, до нескольких микрон, тяжей с ровными и четкими краями и состоящими из двух попарно связанных микротрубочек, что является характерными признаком нормальных микротрубочек, в образцах полимеризованного тубулина в присутствии соединения 7 в концентрации 50 мкМ (фиг. 5, А) картина абсолютно аналогичная: те же ровные длинные тяжи из попарно лежащих микротрубочек с четкими стенками (видно при большем увеличении на микрофотографии 5Б), лишенными какой бы то ни было деформации.
Таким образом, полученные в примере 51 при полимеризации тубулина соединением 7 микротрубочки имеют нормальную структуру.
Пример 53. Определение влияния соединений 2, 8, 17, 20, 22 на полимеризацию тубулина.
Все как в примере 48, только в качестве соединений, вызывающих полимеризацию тубулина берут соединения 2, 8, 17, 20, 22 в концентрации 100 мкМ. Сборку микротрубочек регистрируют по изменению оптической плотности суспензии. Добавление ГТФ к раствору тубулина стимулирует начало полимеризации тубулина, т.е. сборки (образования) микротрубочек с достаточно выраженной лаг-фазой (отсутствие роста оптической плотности), участком линейного нарастания оптической плотности и участком неизменной увеличенной оптической плотности, характеризующей установление равновесия между микротрубочками (полимерами тубулина) и неполимеризованным тубулином. На фиг. 6 приведены данные по влиянию 100 мкМ соединений 2, 8, 17, 20, 22 на полимеризацию тубулина, представленные как максимальная скорость увеличения светопоглощения суспензии микротрубочек, нормализованная к контрольной пробе.
Как следует из фиг. 6, наличие в пробе вышеперечисленных соединений в концентрации 100 мкМ увеличивает скорость роста оптической плотности в пробе, что свидетельствует об ускорении образования полимеров тубулина, т.е. микротрубочек.. Данные свидетельствуют о наиболее значительном эффекте соединения 8 на процесс полимеризации тубулина, т.е. на процесс сборки микротрубочек, - скорость увеличения светопоглощения суспензии тубулин-микротрубочки более чем в 3 раза превышает аналогичный показатель для контрольной пробы. Таким образом, полученные данные позволяют утверждать, что все соединения 2, 8, 17, 20, 22 обладает способностью стабилизировать микротрубочки, увеличивая соотношение микротрубочки/неполимеризованный тубулин.
Пример 54. Определение влияния соединений 3, 4, 5, 6, 9, 10, 11, 12 на полимеризацию тубулина.
Все как в примере 48, только в качестве соединений, вызывающих полимеризацию тубулина берут соединения 3, 4, 5, 6, 9, 10, 11, 12 в концентрации 100 мкМ. Сборку микротрубочек регистрируют по изменению оптической плотности суспензии. Добавление ГТФ к раствору тубулина стимулирует начало полимеризации тубулина, т.е. сборки (образования) микротрубочек с достаточно выраженной лаг-фазой (отсутствие роста оптической плотности), участком линейного нарастания оптической плотности и участком неизменной увеличенной оптической плотности, характеризующей установление равновесия между микротрубочками (полимерами тубулина) и неполимеризованным тубулином. На фиг 7 приведены данные по влиянию 100 мкМ соединений 3, 4, 5, 6, 9, 10, 11, 12 на полимеризацию тубулина, представленную как зависимость от времени увеличения светопоглощения суспензии микротрубочек. Каждая кривая представляет собой среднее трех измерений.
Как следует из фиг. 7, наличие в пробе каждого из вышеперечисленных соединений в концентрации 100 мкМ укорачивает лаг-фазу и увеличивает скорость увеличения оптической плотности в пробе, что свидетельствует об ускорении образования полимеров тубулина, т.е. микротрубочек. Также и уровень максимально достигаемой оптической плотности в присутствии исследуемых соединений значительно превышает уровень максимально достигаемой оптической плотности в контрольной пробе, где присутствует только эквивалентный объем растворителя. Полученные данные свидетельствуют о стимулирующем влиянии соединений на процесс полимеризации тубулина, и, таким образом, позволяют утверждать, что все соединения 3, 4, 5, 6, 9, 10, 11, 12 обладает способностью стабилизировать микротрубочки, увеличивая соотношение микротрубочки/неполимеризованный тубулин.
Как видно из приведенных примеров, соединения общей формулы I обладают свойством стабилизации микротрубочек, причем полученные микротрубочки обладают нормальной структурой.
Следующий аспект изобретения составляет предназначение соединений формулы 1 для лечения и предупреждения заболеваний, связанных с нарушениями системы микротрубочек, в частности, нейродегенеративных расстройств и заболеваний с гиперпролиферативным проявлением. Назначаемая для приема доза активного компонента (соединения формулы I или его фармацевтически приемлемых солей) варьирует в зависимости от многих факторов, таких как возраст, пол, вес пациента, симптомы и тяжесть заболевания, конкретно назначаемое соединение, способ приема, форма препарата, в виде которой назначается активное соединение.
Обычно, общая назначаемая доза составляет от 1 до 200 мг в день. Общая доза может быть разделена на несколько доз, например, для приема от 1 до 4 раз в день. При оральном назначении интервал общих доз активного вещества составляет от 10 до 200 мг в день, предпочтительно, от 15 до 150 мг. При парентеральном приеме интервал назначаемых доз составляет от 5 до 100 мг в день, предпочтительно, от 5 до 50 мг, а при внутривенных инъекциях от 1 до 50 мг в день, предпочтительно, от 1 до 25 мг. Точная доза может быть выбрана лечащим врачом.
Как это обычно принято в медицине, соединения формулы 1 согласно настоящему изобретению рекомендуется применять в виде фармакологических средств, составляющих соответственно следующий аспект изобретения.
Фармакологическое средство в качестве стабилизаторов микротрубочек при лечении и предупреждении заболеваний, связанных с нарушениями системы микротрубочек содержит в качестве активного начала эффективное количество соединения формулы 1, составляющее обычно от 1 до 20 вес. %, или от 1 мг до 20 мг в дозируемой форме, в сочетании с одной или более фармацевтически приемлемыми вспомогательными добавками, такими как разбавители, связующие, разрыхляющие агенты, адсорбенты, ароматизирующие вещества, вкусовые агенты. В соответствии с известными методами фармацевтические композиции могут быть представлены различными жидкими или твердыми формами. Примеры твердых лекарственных форм включают, например, таблетки, пилюли, желатиновые капсулы и др.
Композиции, как правило, получают с помощью стандартных процедур, предусматривающих смешение активного начала с жидким или тонко измельченным твердым носителем.
Как видно из приведенных примеров, применением соединений формулы 1 предлагаемое изобретение решает задачу получения синтетических стабилизаторов микротрубочек с расширенным спектром применения за счет стимуляции полимеризации тубулина, приводящей к стабилизации микротрубочек нормальной структуры.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ АДАМАНТАНСОДЕРЖАЩИХ ИНДОЛОВ И ИХ ГИДРОХЛОРИДОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ NMDA-РЕЦЕПТОРОВ | 2016 |
|
RU2621348C1 |
| ПРИМЕНЕНИЕ АДАМАНТАНСОДЕРЖАЩИХ ИНДОЛОВ И ИХ ГИДРОХЛОРИДОВ В КАЧЕСТВЕ ЦИТОПРОТЕКТОРОВ И ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С УВЕЛИЧЕНИЕМ ЦИТОЗОЛЬНОЙ КОНЦЕНТРАЦИИ КАЛЬЦИЯ, И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2015 |
|
RU2608737C1 |
| ПРОИЗВОДНЫЕ ФЕНОТИАЗИНСОДЕРЖАЩИХ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛОВ В КАЧЕСТВЕ СРЕДСТВА ДЛЯ СНИЖЕНИЯ НЕКОНТРОЛИРУЕМОЙ АГРЕГАЦИИ БЕЛКОВ В НЕРВНОЙ СИСТЕМЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ СНИЖЕНИЯ НЕКОНТРОЛИРУЕМОЙ АГРЕГАЦИИ БЕЛКОВ В НЕРВНОЙ СИСТЕМЕ | 2013 |
|
RU2529899C1 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛСОДЕРЖАЩИХ ФЕНОТИАЗИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ 5-HT, СПОСОБЫ ПОЛУЧЕНИЯ ИХ ХЛОРГИДРАТОВ И ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2013 |
|
RU2530881C1 |
| СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЯ, В КОТОРОМ ПОКАЗАН 5НТ-ПОДОБНЫЙ АГОНИСТ, ПРОИЗВОДНОЕ ТЕТРАГИДРОКАРБАЗОЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АКТИВНОСТЬ АГОНИСТА 5НТ-ПОДОБНЫХ РЕЦЕПТОРОВ | 1992 |
|
RU2137474C1 |
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3-АМИНОЗАМЕЩЕННЫЕ 6-(3,5-ДИМЕТИЛПИРАЗОЛ-1-ИЛ)-1,2,4,5-ТЕТРАЗИНЫ | 2012 |
|
RU2519218C2 |
| СПОСОБ МОДУЛЯЦИИ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2525115C2 |
| АМИНОТЕТРАЛИНОВЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2010 |
|
RU2546649C2 |
| ПРОИЗВОДНЫЕ 3-КАРБОКСИПРОПИЛ-АМИНОТЕТРАЛИНА И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ MU-ОПИОИДНОГО РЕЦЕПТОРА | 2008 |
|
RU2482107C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
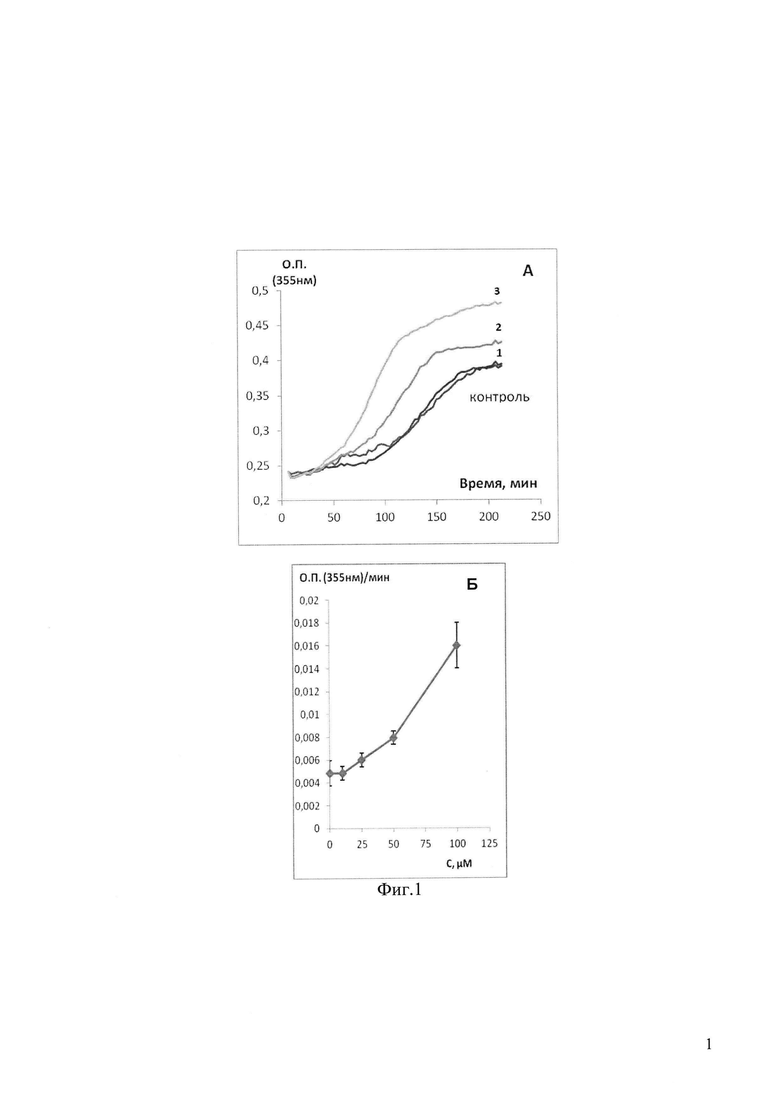
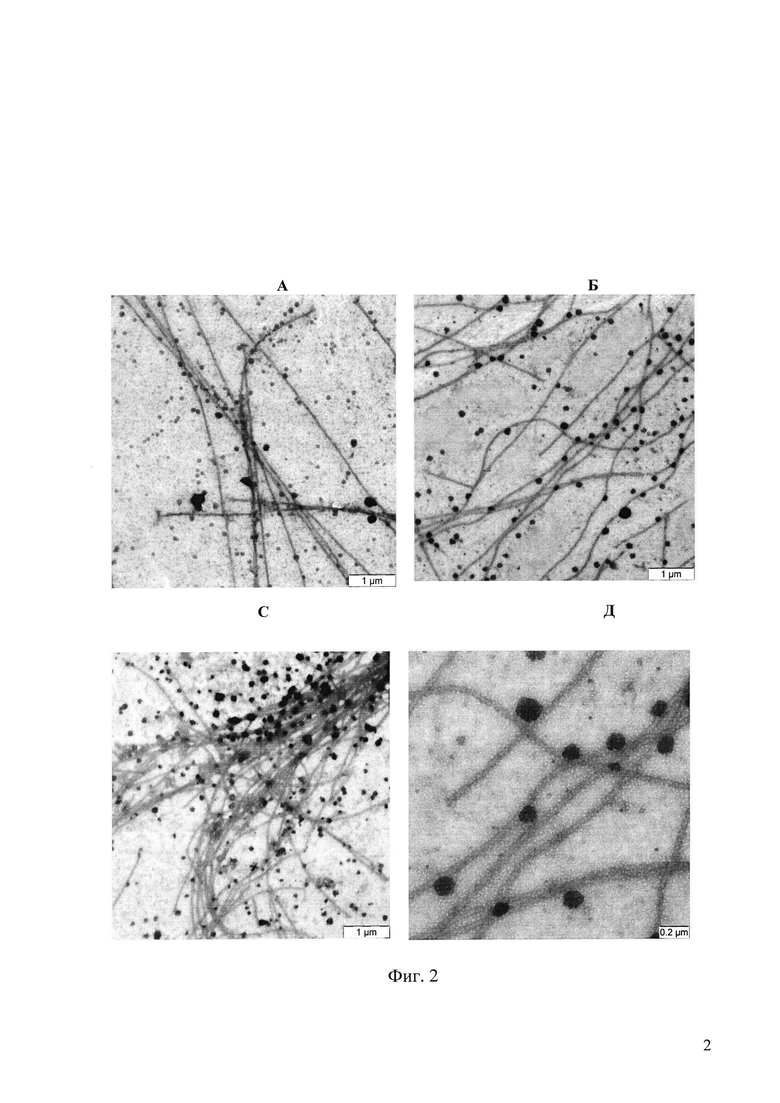
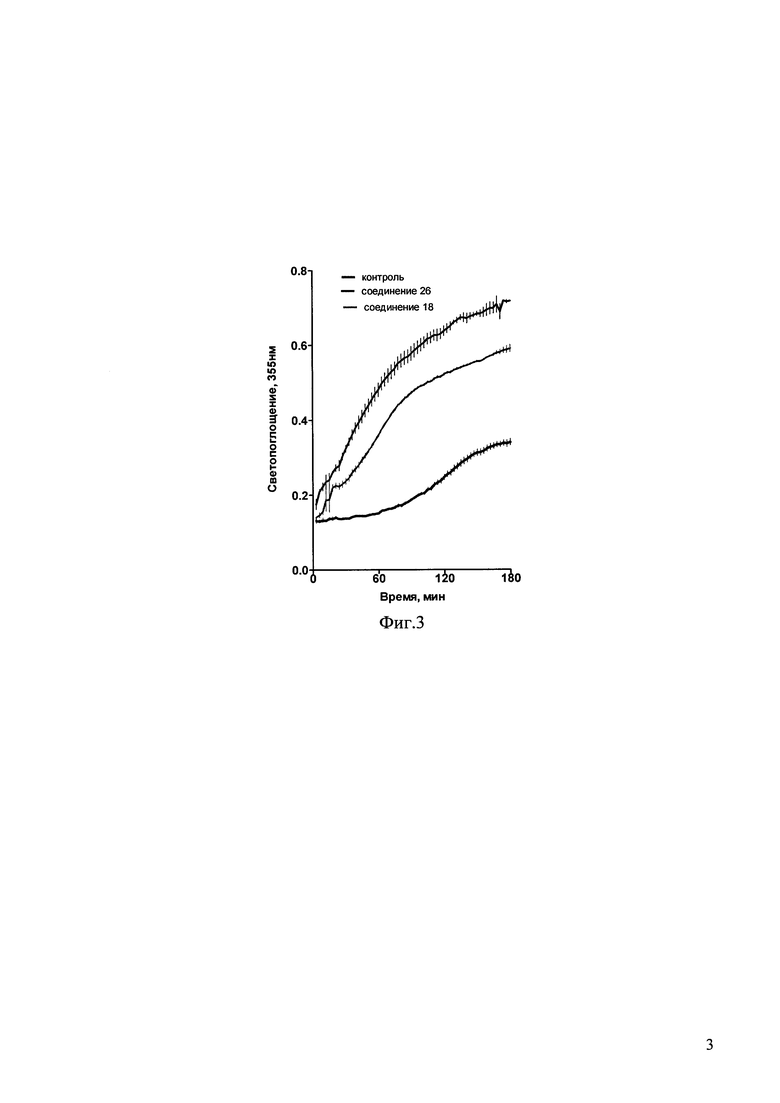
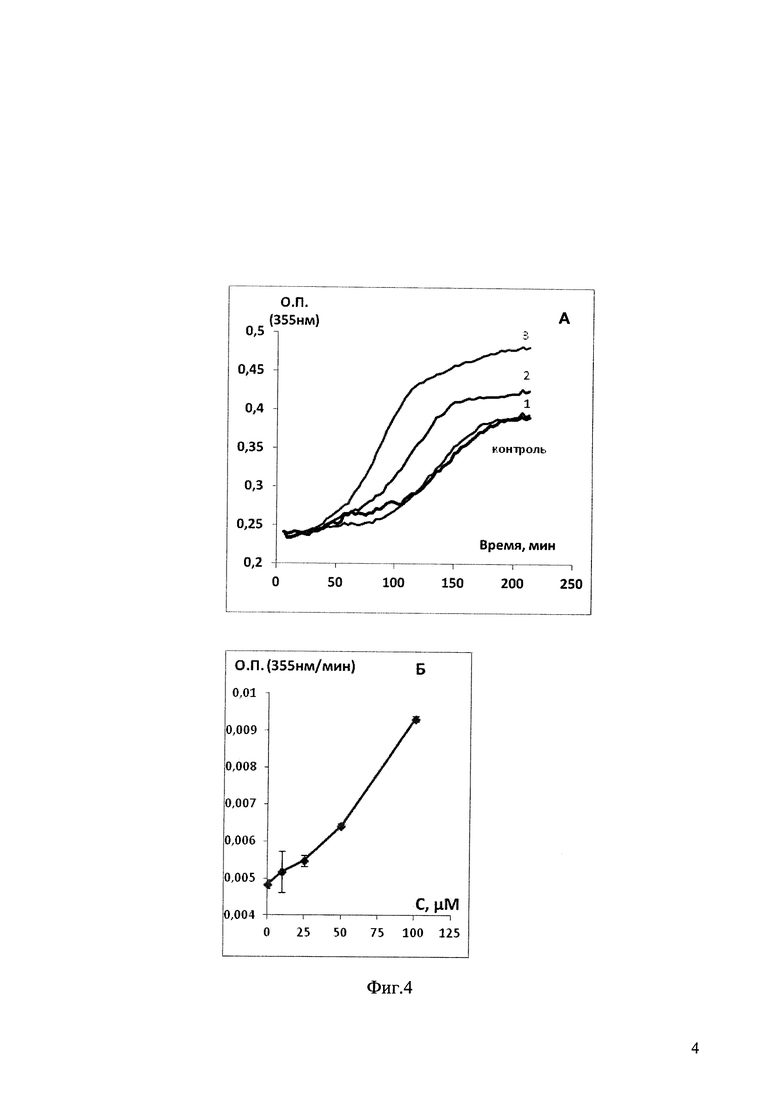
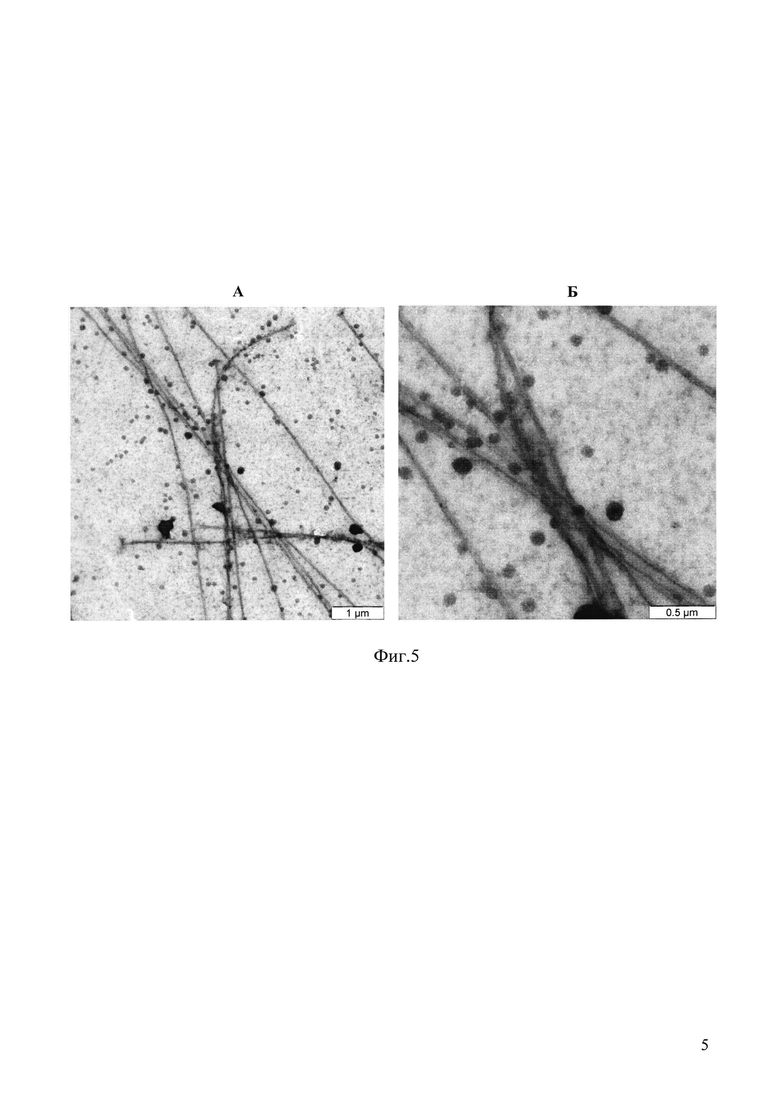
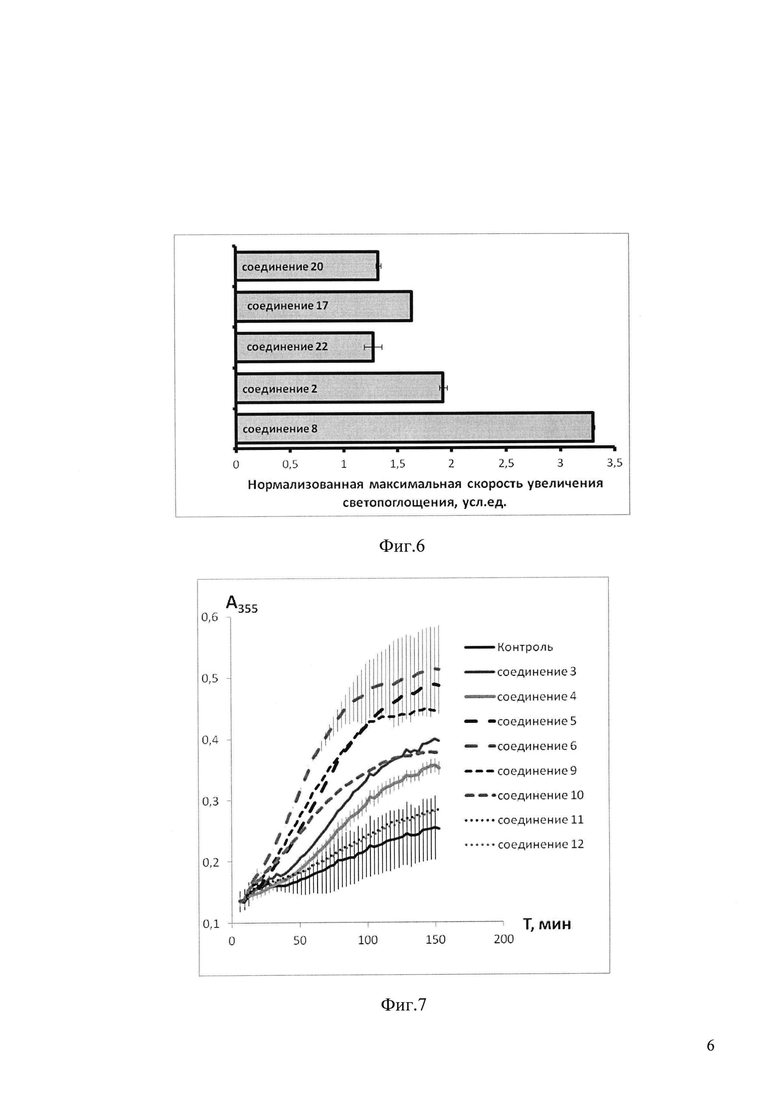
Изобретение относится к новым адамантансодержащим индолам и их гидрохлоридам общей формулы 1, в которой R1, R2, R3, R4 могут быть одинаковыми или различными и независимо представляют H, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси; R5, R6 могут быть одинаковыми или различными и независимо представляют H, (C1-C6) алкил, ONO2; X представляет CH2CH(OH)CH2 или CH2CH2C(O); Z = нет, Cl; R7, R8, R9, R10 могут быть одинаковыми или различными и независимо представляют Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси; R11, R12, R13, R14, R15, R16, R17, R18 могут быть одинаковыми или различными и независимо представляют H, (C1-C6) алкил. Соединения обладают свойством стабилизации микротрубочек и могут использоваться для лечения или предупреждения заболеваний, связанных с нарушением системы микротрубочек, например, таких как гиперпролиферативные проявления и нейродегенеративные расстройства. 8 н. и 14 з.п. ф-лы, 7 ил., 54 пр.
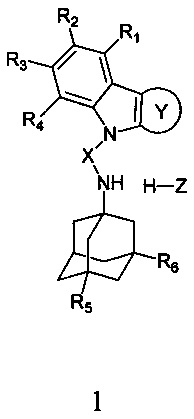 ,
, 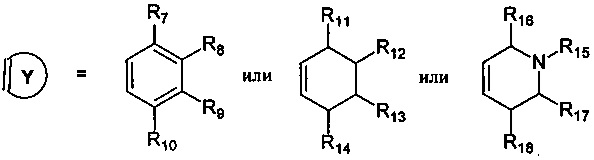
1. Адамантансодержащие индолы и их гидрохлориды общей формулы 1,
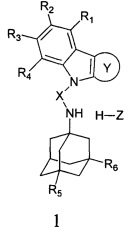
в которой Rl, R2, R3, R4 могут быть одинаковыми или различными и независимо представляют Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси;
R5, R6 могут быть одинаковыми или различными и независимо представляют Н, (C1-C6) алкил, ONO2;
X представляет СН2СН(ОН)СН2 или СН2СН2С(O);
Z=нет, Cl;
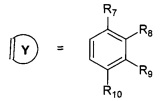 или
или 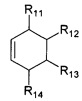 или
или 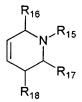
где R7, R8, R9, R10 могут быть одинаковыми или различными и независимо представляют Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси;
R11, R12, R13, R14, R15, R16, R17, R18 могут быть одинаковыми или различными и независимо представляют Н, (C1-C6) алкил,
при условии, что если R1, R2, R3, R4, R5, R6 каждый независимо представляет Н,
X представляет -СН2СН(ОН)СН2-,
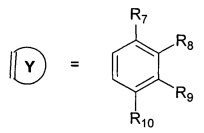
где R7, R8, R9, R10 каждый независимо представляет Н, то Z представляет собой Cl.
2. Соединения по п. 1, представляющие адамантансодержащие индолы и их гидрохлориды общей формулы 1.1

в которой R1, R2, R3, R4, R5, R6, Z, Y имеют значения, определенные выше для формулы 1.
3. Соединения по п. 2, представляющие адамантансодержащие карбазолы и гидрохлориды общей формулы 1.1.1
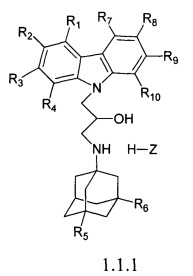
в которой R1, R2, R3, R4, R5, R6, Z, R7, R8, R9, R10 имеют значения, определенные выше для формулы 1.
4. Соединения по п. 3, представляющие:
1-(адамантан-1-иламино)-3-(3,6-дибром-карбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(3,6-дихлор-карбазол-9-ил)-пропан-2-ол;
3-(3,5-диметиладамантан-1-иламино)-1-карбазол-9-ил-пропан-2-ол;
1-(3,6-дибромкарбазол-9-ил)-3-(3,5-диметиладамантан-1-иламино)-пропан-2-ол;
3-(3,5-диметил адамантан-1-иламино)-1-(3,6-дихлоркарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-карбазол-9-ил-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(3,6-дибром-карбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(3,6-дихлор-карбазол-9-ил)-пропан-2-ол гидрохлорид;
3-(3,5-диметиладамантан-1-иламино)-1-карбазол-9-ил-пропан-2-ол гидрохлорид;
1-(3,6-дибромкарбазол-9-ил)-3-(3,5-диметиладамантан-1-иламино)-пропан-2-ол гидрохлорид;
3-(3,5-диметиладамантан-1-иламино)-1-(3,6-дихлоркарбазол-9-ил)-пропан-2-ол гидрохлорид.
5. Соединения по п. 2, представляющие адамантансодержащие тетрагидрокарбазолы и их гидрохлориды общей формулы 1.1.2

в которой R1, R2, R3, R4, R5, R6, Z, R11, R12, R13, R14 имеют значения, определенные выше для формулы 1.
6. Соединения по п. 5, представляющие:
1 -(адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(3,5-диметил-адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(3,6-диметил-адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(3,6-диметил-адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол;
1-(адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(3,5-диметил-адамантан-1-иламино)-3-(1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(3,6-диметил-адамантан-1-иламино)-3-(6-метил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(3,6-диметил-адамантан-1-иламино)-3-(6-фтор-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид;
1-(адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорида;
1-(3,6-диметил-адамантан-1-иламино)-3-(3,6-диметил-1,2,3,4-тетрагидрокарбазол-9-ил)-пропан-2-ол гидрохлорид.
7. Соединения по п. 2, представляющие адамантансодержащие гамма-карболины и их гидрохлориды общей формулы 1.1.3.
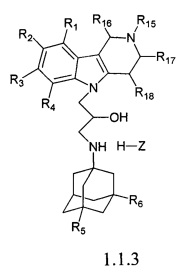
в которой R1, R2, R3, R4, R5, R6, Z, R15, R16, R17, R18 имеют значения, определенные выше для формулы 1.
8. Соединения по п. 7, представляющие:
1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1Н-пиридо[4,5-b]индол-5-ил)-пропан-2-ол;
1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1Н-пиридо[4,5-b]индол-5-ил)-пропан-2-ол гидрохлорид.
9. Соединения по п. 1, представляющие адамантансодержащие индолы и их гидрохлориды формулы 1.2

в которой R1, R2, R3, R4, R5, R6, Z, Y имеют значения, определенные выше для формулы 1.
10. Соединения по п. 9, представляющие адамантансодержащие карбазолы общей формулы 1.2.1
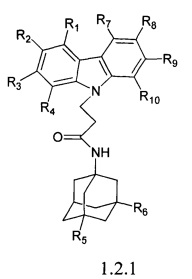
в которой R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 имеют значения, определенные выше для формулы 1.
11. Соединения по п. 10, представляющие N-адамантан-1-ил-3-карбазол-9-ил-пропионамид; N-(3,5-диметил-адамантан-1-ил-3-карбазол-9-ил-пропионамид.
12. Соединения по п. 9, представляющие адамантансодержащие тетрагидрокарбазолы общей формулы 1.2.2
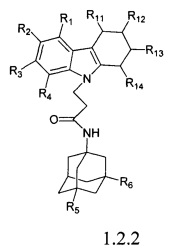
в которой R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 имеют значения, определенные выше для формулы 1.
13. Соединения по п. 12, представляющие
N-адамантан-1-ил-3-(3,4-дигидро-1H-карбазол-9-ил-пропионамид.
14. Соединения по п. 9, представляющие адамантансодержащие гамма-карболины и их гидрохлориды общей формулы 1.2.3
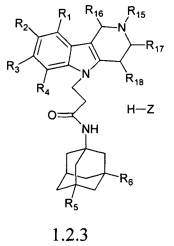
в которой R1, R2, R3, R4, R5, R6, R15, R16, R17, R18 имеют значения, определенные выше для формулы 1.
15. Соединения по п. 14, представляющие:
1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1Н-пиридо[4,5-b]индол-5-ил)-пропионамид;
1-(адамантан-1-ил)-3-(2,8-диметил-3,4-дигидро-1Н-пиридо[4,5-b]индол-5-ил)-пропионамид гидрохлорид.
16. Способ получения адамантансодержащих индолов формулы 1.1 по п. 2, заключающийся в том, что эквимольную смесь карбазолов общей формулы 2,
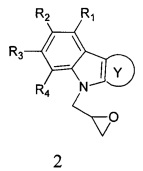
в которой R1, R2, R3, R4, R5, R6, Y имеют значения, определенные выше для формулы 1, и аминоадамантанов общей формулы 3,
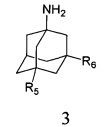
в которой R5, R6 имеют значения, определенные выше для формулы 1, нагревают в растворителе, выбранном из ряда этанол, пропанол, изопропанол, при температуре 70-90°C в течение 2-6 часов.
17. Способ получения гидрохлоридов адамантансодержащих индолов формулы 1.1 по п. 2, заключающийся в растворении адамантансодержащих индолов формулы 1.1 в 10%-ном растворе HCl в изопропаноле.
18. Способ получения адамантансодержащих индолов формулы 1.2 по п. 9, заключающийся в том, что эквимольную смесь карбазолов общей формулы 4
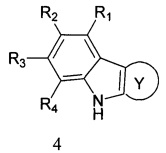
в которой R1, R2, R3, R4, R5, R6, Y имеют значения, определенные выше для формулы 1, и адамантилакриламидов общей формулы 5,

в которой R5, R6 имеют значения, определенные выше для формулы 1, нагревают в диметилсульфоксиде или диметилформамиде в присутствии катализатора, выбранного из ряда: метилат натрия, третбутилат калия, гидроокись калия или фторид цезия, при температуре 100-140°C в течение 2-12 часов.
19. Способ получения гидрохлоридов адамантансодержащих гамма-карболинов формулы 1.2.3 по п. 14, заключающийся в растворении адамантансодержащих гамма-карболинов формулы 1.2.3 в 10%-ном растворе HCl в изопропаноле.
20. Применение соединения общей формулы 1 по любому из пп. 1-15 для стабилизации микротрубочек.
21. Применение соединения общей формулы 1 по любому из пп. 1-15 для лечения и предупреждения заболеваний, связанных с нарушениями системы микротрубочек.
22. Фармакологическое средство в качестве стабилизаторов микротрубочек при лечении и предупреждении заболеваний, связанных с нарушениями системы микротрубочек, содержащее активное начало и фармацевтически приемлемый носитель, отличающееся тем, что в качестве активного начала содержит эффективное количество соединения формулы 1,
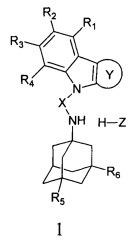
в которой R1, R2, R3, R4 могут быть одинаковыми или различными и независимо представляют Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси;
R5, R6 могут быть одинаковыми или различными и независимо представляют Н, (C1-C6) алкил, ONO2;
X представляет СН2СН(ОН)СН2 или СН2СН2С(O);
Z=нет, Cl;
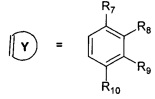 или
или  или
или 
где R7; R8, R9, R10 могут быть одинаковыми или различными и независимо представляют Н, F, Cl, Br, (C1-C6) алкил, (C1-C6) алкокси;
R11, R12, R13, R14, R15, R16, R17, R18 могут быть одинаковыми или различными и независимо представляют Н, (C1-C6) алкил.
| Database CA (online), ACS on STN, RN 439142-30-0, Entered STN: | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| ПРОИЗВОДНЫЕ АДАМАНТАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ВОЗДЕЙСТВИЯ НА ИММУНОСУПРЕССИЮ | 1998 |
|
RU2197477C2 |
| Olga N | |||
| Zefirova et al., "Design, synthesis, and bioactivity of putative | |||
| tubulin ligands with adamantane core"; Bioorganic & Medicinal | |||
| Chemistry Letters, 2008, Volume 18, Issue 18, Pages 5091-5094. | |||
Авторы
Даты
2017-01-23—Публикация
2015-10-27—Подача