Изобретение относится к области ветеринарной медицины, а более конкретно - к паразитологии (=гельминтологии) к «Способу сбора максимального количества зрелых (=оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (=Trichocephalus) suis», предназначенное для использования при паразитологических лабораторных или/и полевых исследованиях сборов оплодотворенных яиц от живых, половозрелых самок Trichuris (=Trichocephalus) suis, от спонтанно зараженных возбудителем трихоцефалеза диких или/и домашних свиней, который необходим при решении фундаментальных и прикладных научных задач в области эпизоотологии, биологии, систематики, терапии и профилактики трихоцефалеза домашних или/и диких (в зоопарковых, цирковых, охотничьих хозяйствах) свиней.
Известно, что паразитарный зооноз Trichuris (=Trichocephalus) suis (Schrank, 1788) является возбудителем болезни диких и домашних свиней [7], лошадей (факультативно) [5] и в личиночной стадии может паразитировать у кроликов [6] и человека.
Известно, что экономический ущерб от трихоцефалеза свиней выражается: в отставании роста и развитии молодняка свиней; живой вес зараженных трихоцефалезом поросят составляет лишь 50-60% веса здоровых; сильно инвазированные поросята в месячном возрасте остаются такими же, как и при рождении [1].
Известно, что для получения сборов яиц гельминтов исследователи применяли следующие способы: методы копроовоскопии (флотации, комбинированные) от спонтанно зараженных возбудителем трихоцефалеза диких (зоопарковых, цирковых) или/и домашних животных [Котельников Г.А. - 1, Пасечник В.Е., и др. - 4].
Эти способы имеют некоторые недостатки:
а) они требуют больших затрат времени и труда, так как для сборов больших количеств яиц трихурисов (=трихоцефалов) необходимо соответственно и большое количество фекалий от зараженных возбудителем трихоцефалеза домашних или диких свиней;
б) загрязнение сборов яиц гельминтов остатками частиц непереваренных кормов и жиров от свиней, что затрудняет исследования в условиях лаборатории;
в) неизвестен вид возбудителя инвазии, так как кроме Trichuris suis может быть и другой возбудитель болезни Dioctophyme renale (Goeze, 1782), который имеет очень схожие морфологически яйца с яйцами трихурисов, кроме того может быть и микст инвазия этими двумя возбудителями болезни: Trichuris suis + D. renale, что также может зачеркнуть чистоту опытов;
г) количество яиц собранных этими известными методами при спонтанном трихоцефалезе (=трихурозе) бывает незначительным, особенно при слабой степени инвазии.
Известен способ сбора яиц путем разрушения половых органов самок гельминтов [В.Е. Пасечник, 1984, 2000 - 2, 3]. Этот способ имеет следующие недостатки:
1) сбор яиц сильно загрязнен остатками разрушенных тканей женских половых органов самок паразита, что в процессе эксперимента вызывает развитие секундарной бактериальной микрофлоры и гниение;
2) сбор яиц загрязнен большим количеством неоплодотворенных яиц;
3) при этом в способе сбора яиц получение до 100% оплодотворенных яиц невозможно, так как основная масса зрелых яиц находится в дистальной части вагины и в вульве (во влагалище) и только частично в матке.
4) довольно часто необходимы сборы до 100% зрелых яиц для экспериментального заражения лабораторных животных с тысячами инвазионных яиц в 1 г назначаемой дозы на одно экспериментальное животное.
Следовательно, исследователям по этим причинам получить с помощью этих известных способов сборов яиц: флотации, комбинированным, путем разрушения половых органов самок от трихоцефалов вида: Trichuris suis в максимально возможно большом количестве до 100% зрелые яйца, для проведения экспериментов в полевых или/и в лабораторных условиях, практически невозможно, так как отнимает много сил и рабочего времени.
Поэтому нами был впервые изобретен новый «Способ сбора максимального количества зрелых (=оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (=Trichocephalus) suis», который с учетом недостатков, отмеченных выше, в известных способах сборов яиц паразитов более эффективный, чем известные науке способы.
С учетом изложенного выше, мы воспользовались как одним из средств для реализации нашей цели, приведенной ниже, известным физиологическим солевым раствором Rhode-Saito [Rhode Н., Saito Y. - 15], которым пользовались и цитировали в своих работах ученые различных стран мира: Saito Yutaka (один из авторов раствора - Rhode-Saito: на стр: 378: "… von isotonischen gepufferten 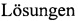 nach Rhode-Saito …"): - 16; Da Costa, S.F. Gomes - 11 (Abstract: "… in a Rhode-Saito solusion"); Da Costa, S.F. Gomes - 12 (Abstract: "… solution in Rhode-Saito …"); Ettisch G. - 13 (Experimental Part: … containing Rhode-Saito … (abbreviated Rh-S)); Rebello, Silvio; Da Costa - 14 (Abstract: "… in Rhode-Saito’s liquid …").
nach Rhode-Saito …"): - 16; Da Costa, S.F. Gomes - 11 (Abstract: "… in a Rhode-Saito solusion"); Da Costa, S.F. Gomes - 12 (Abstract: "… solution in Rhode-Saito …"); Ettisch G. - 13 (Experimental Part: … containing Rhode-Saito … (abbreviated Rh-S)); Rebello, Silvio; Da Costa - 14 (Abstract: "… in Rhode-Saito’s liquid …").
Предварительно, прежде чем приступить к разработке впервые изобретенного нами «Способа …», был приготовлен известный (11, 12, 13, 14, 16) физиологический солевой раствор Rhode-Saito [15], в соответствии с методикой, изложенной (=описанной) в статье авторов этого раствора (Rhode Н., Saito Y. - 15), которая состоит в следующем (см. страница 504 [Rhode H.-Saito Y. - 15]):
в начале был приготовлен солевой раствор А на 1 л, который состоит из:
NaCl - 168,0 г; KCl - 4,2 г; CaCl2 - 4,2 г; MgCl2 - 2,1 г;
в последующем был приготовлен солевой раствор В на 1 л, который состоит из: 10 см3 нормального раствора Na2CO3;
и в дальнейшем был приготовлен раствор С на 1 л, который состоит из: 8,52 см3 нормального раствора Н3РО4.
В последующем для получения собственно физиологического солевого раствора Rhode-Saito [15] мы соединили 3 приготовленных вышеуказанных солевых раствора, руководствуясь Таблицей, представленной на странице 505 [15], в которой указано соотношение солевых растворов: С = 500 см3 + В = 500 см3, которые при температуре 37°С будут соответствовать PH.=7,52 и к 1000 см3 смесей солевых растворов В и С добавили 50 см3 солевого раствора А.
При разработке нашего изобретения исходили из того, что паразит локализуется в толстом отделе кишечника хозяина (в нашем случае свиней) и следовательно предложенный авторами физиологический солевой раствор Rhode-Saito (который по своему химическому составу приближается к составу пищеварительного тракта млекопитающих) [15] подходил для реализации нашей цели, так как используя его в нашем изобретении «Способе …», создавали наиболее оптимальные условия для паразита, которые способствовали живым, половозрелым самкам возбудителя паразитарного зооноза Trichuris suis откладывать максимальное количество зрелых (=оплодотворенных) яиц.
Целью изобретения является использование впервые разработанного нами «Способа сбора максимального количества зрелых (=оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (=Trichocephalus) suis», для получения естественным способом (приближенного к условиям жизнедеятельности Т. suis в организме свиней) максимального количества до 100% зрелых (=оплодотворенных) яиц от живых, активных, половозрелых самок Т. suis, предназначенного для проведения экспериментов в лабораторных и/или полевых условиях при изучении фундаментальных и/или прикладных вопросов гельминтологии.
Поставленная цель достигается тем, что при проведении сбора яиц от возбудителя паразитарного зооноза Т. suis применяют разработанный нами впервые «Способ сбора максимального количества зрелых (=оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (=Trichocephalus) suis», заключающийся в отборе индивидуально только что извлеченных из слепой и толстой кишок методом гельминтологических вскрытий [по К.И. Скрябину - 6] от спонтанно зараженных возбудителем трихоцефалеза диких или/и домашних свиней, только живых, половозрелых и активных самок Т. suis, в каждую отдельную пробирку с физиологическим солевым раствором Rhode-Saito [15, 16], и экспонирования их при t=38°C-40°C в течение 5 часов в условиях термостата, отличающийся от известных способов сбора яиц: флотации, комбинированного, разрушения половых органов самок гельминтов, тем, что:
половые органы самок Т. suis не разрушаются для получения зрелых яиц (в отличие от известного способа сбора путем разрушения гонад самок гельминтов),
происходит естественная откладка оплодотворенных яиц в пробирки с физиологическим солевым раствором Rhode-Saito, при t=38° - 40°С в течение 5 часов в условиях термостата живыми, половозрелыми самками Trichuris (=Trichocephalus) suis (в отличие от известного способа сбора яиц, когда разрушают гонады самок паразита, а следовательно его убивают);
не происходит загрязнения сборов яиц большим количеством неоплодотворенных яиц Trichuris (=Trichocephalus) suis (в отличие от известного способа сбора яиц путем разрушения гонад самок гельминтов);
без загрязнения сбора яиц Trichuris (=Trichocephalus) suis частицами непереваренного корма и особенно жиров от свиней (в отличие от известных способов сбора яиц гельминтов: флотации, комбинированного);
нет необходимости исследовать большое количество фекалий от спонтанно зараженных трихоцефалами диких или/и домашних свиней, чтобы получить максимальное количество зрелых (2000 и более) яиц Trichuris suis (в отличие от известных способов сбора яиц: флотации, комбинированного);
достаточно иметь в эксперименте от 200 живых, половозрелых самок, чтобы получить максимальное количество до 100% зрелых яиц Т. suis (в отличие от известных способов сбора яиц: флотации, комбинированного, когда исследователь ограничен в количестве спонтанно зараженных трихоцефалами диких или/и домашних свиней);
нет необходимости в центрифуге (в отличие от известного комбинированного способа);
нет необходимости в приготовлении различных солевых растворов, которые часто отсутствуют в широкой продаже или имеют ограничения (аммиачная селитра и др.), так как могут быть использованы в целях проведения террористических актов (в отличие от известных способов сбора яиц: флотации, комбинированном);
без загрязнения сбора частицами разрушенных копулятивных органов самок и без микрофлоры, что предотвращает гниение яиц (в отличие от известного способа: разрушения половых органов самок гельминтов);
известен вид возбудителя инвазии Т. suis (в отличие от известных способов: флотации, комбинированном, когда вид неизвестен);
исследователь получает чистый сбор, состоящий из до 100% (и при необходимости до нескольких тысяч) зрелых (=оплодотворенных) яиц от живых, половозрелых самок Trichuris (=Trichocephalus) suis.
Сопоставительный анализ заявляемого технического решения с прототипом: известными способами: флотации, комбинированным; способа сбора яиц, когда разрушают половые органы самок гельминтов, показывает, что заявляемый способ отличается от известных тем, что проводят индивидуальный отбор только что извлеченных из слепой и толстой кишок методом гельминтологических вскрытий [по К.И. Скрябину, - 6] от спонтанно зараженных возбудителем трихоцефалеза диких или/и домашних свиней, живых, половозрелых и активных самок Trichuris suis в каждую отдельную пробирку с физиологическим солевым раствором Rhode-Saito и экспонированием их при t=38°C - 40°С в течение 5 часов в условиях термостата.
В результате экспериментаторы получают чистые сборы максимального количества зрелых яиц выделившихся естественным путем из половых органов самок, так как еще живые, половозрелые и активные самки Trichuris (=Trichocephalus) suis, откладывают произвольно в пробирки с физиологическим солевым раствором Rhode-Saito, до 100% зрелые (=оплодотворенные) яйца (при необходимости до нескольких тысяч).
Эти отличия позволяют сделать вывод о соответствии заявляемого технического решения критерию «новизна». Признаки, отличающие заявляемое техническое решение от прототипа (способов сборов яиц: флотации, комбинированного; разрушения женских половых органов самок гельминтов), не выявлены в других технических решениях, и поэтому они обеспечивают заявляемому техническому решению соответствие критерию «существенные отличия».
Примеры конкретного выполнения предлагаемого способа.
Пример 1. От 9 свиней (в возрасте 2-6 месяцев), спонтанно зараженных трихоцефалезом, провели сбор яиц известными методами копроовоскопии (контроль): флотации, комбинированным и одновременно от 200 живых, половозрелых самок Trichuris (= Trichocephalus) suis, предлагаемым «Способом сбора максимального количества зрелых (= оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (= Trichocephalus) suis» (опыт) в течение 5 часов рабочего времени.
При проведении сборов яиц известными методами копроовоскопии (флотации по Фюллеборну, комбинированным по Дарлингу - Котельников Г.А. - 1), были получены следующие результаты:
поверхностный слой взвеси был загрязнен частицами непереваренного корма и жиров, что значительно затрудняло исследования и количество яиц в сборах;
количество экскрементов от зараженных свиней, иногда было очень мало для постановки проб известными методами: флотации, комбинированным, для сбора яиц Trichuris (= Trichocephalus) suis в течение рабочего времени;
количество яиц Trichuris (= Trichocephalus) suis в 1 г проб экскрементов от свиней довольно часто было незначительным; количество яиц в сборе составило 990, что несомненно мало для проведения заражения животных в условиях лаборатории.
Одновременно провели опыт по сбору яиц от 200 живых, половозрелых самок Trichuris (= Trichocephalus) suis, полученных от исследованных на вскрытии (из толстого кишечника и слепой кишки) свиней по предлагаемому «Способу сбора максимального количества зрелых (= оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (= Trichocephalus) suis».
Каждую из 200 живых, половозрелых самок Trichuris (= Trichocephalus) suis помещали в отдельную пробирку с раствором Rhode-Saito (который по своему химическому составу приближается к составу пищеварительного тракта млекопитающих) и экспонировали их при t=38°-40°С в течение 5 часов в термостате, то есть в условиях, приближенных к жизнедеятельности самок возбудителя паразитарного зооноза Trichuris (= Trichocephalus) suis в организме свиней.
По истечении 5 часов пробирки извлекали из термостата и сравнивали результаты опыта и контроля.
В результате выяснилось, что при сборе яиц по предлагаемому нами «Способу сбора максимального количества зрелых (= оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (= Trichocephalus) suis» (опыт), данный способ отличается от известных способов (флотации, комбинированного) сбора яиц Trichuris (= Trichocephalus) suis (контроль) тем, что:
нет необходимости в приготовлении и использовании различных химических солей и в приготовлении из них растворов, для сбора оплодотворенных яиц Trichuris (= Trichocephalus) suis (в отличие от известных способов сбора яиц гельминтов: флотации, комбинированного);
нет необходимости в центрифуге (в отличие от известного способа сбора яиц гельминтов: комбинированного);
нет частиц непереваренного корма и жиров от свиней (в отличии от известных способов сбора яиц гельминтов: флотации, комбинированных);
нет необходимости в большом количестве спонтанно зараженных возбудителем трихоцефалеза домашних или диких свиней, так как можно собрать на вскрытии нескольких больных свиней от 200 и более живых, половозрелых самок Trichuris (= Trichocephalus) suis и следовательно получить по предлагаемому «Способу сбора максимального количества зрелых (= оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (= Trichocephalus) suis», свыше 2000 оплодотворенных яиц (в отличие от известных способов сбора яиц гельминтов: флотации, комбинированного, когда исследователь ограничен в количестве спонтанно зараженных трихоцефалами животных: в нашем примере 9 свиней и 200 живых, половозрелых самок Trichuris suis);
исключается необходимость исследовать большое количество фекалий от спонтанно зараженных трихоцефалезом диких или/и домашних свиней с целью получения максимального количества яиц Trichuris (= Trichocephalus) suis (в отличие от известных способов сбора яиц гельминтов: флотации, комбинированных);
в нашем опыте в сборе яиц по предлагаемому способу «Способ сбора максимального количества зрелых (= оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (= Trichocephalus) suis», было 3650 оплодотворенных яиц, а в контроле по известным методам копроовоскопии (флотации, комбинированным) 990 яиц, что несомненно мало для проведения заражения экспериментальных животных.
Следовательно данный пример убедительно показывает преимущество предлагаемого «Способа сбора максимального количества зрелых (= оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (= Trichocephalus) suis».
Пример 2. При исследовании на мясокомбинатах, убойных пунктах в России (Московской области), Республике Молдова - толстого кишечника и слепой кишки от спонтанно зараженных трихоцефалами домашних свиней, 2-х кабанов (= вепрей) в Республике Молдова, были собраны живые, половозрелые 500 самок Trichuris (= Trichocephalus) suis.
Собранные только живые, половозрелые самки трихоцефалов вида: Trichuris (= Trichocephalus) suis, были использованы для получения сборов яиц по двум способам:
1-й (опыт) по заявляемому способу, т.е. индивидуального (в отдельную пробирку) сбора яиц только от каждой живой, половозрелой самки Trichuris (= Trichocephalus) suis (активные и еще живые, половозрелые 250 самок трихурисов (= трихоцефалов) естественно, произвольно откладывают яйца в пробирки с раствором Rhode-Saito (который по своему химическому составу приближается к составу пищеварительного тракта млекопитающих) в период экспозиции пробирок с самками Trichuris (= Trichocephalus) suis при t=38°С-40°С в течение 5 часов в термостате, т.е. в условиях приближенных к жизнедеятельности самок возбудителя паразитарного зооноза Trichuris (= Trichocephalus) suis в организме свиней;
и 2-м (контроль) известным способом сбора яиц: разрушения вульвы, вагины, матки 250 самок Trichuris (= Trichocephalus) suis.
В последующем отбирали подряд по 2500 яиц Trichuris (= Trichocephalus) suis, культивировали в термостате при t=28-30°С и просматривали под микроскопом, чтобы сравнить наш способ сбора яиц (1-й - опыт) и известный способ сбора яиц, когда экспериментаторы разрушают половые органы самок трихоцефалов: матки, вагины, вульвы (2-й - контроль).
В результате выяснилось, что в сборах 2500 яиц Trichuris (= Trichocephalus) suis по известному способу (2-й - контроль):
сбор состоял из большого количества более 1700 (до 68%) неоплодотворенных яиц; в сборе было очень много частиц разрушенных тканей половых органов самок Trichuris (= Trichocephalus) suis;
в процессе проведения эксперимента приходилось тратить большое количество времени на выборку незрелых (= неоплодотворенных) от зрелых (= оплодотворенных) яиц, которое в очень сильной степени тормозило исследования;
развилось 32% (800) яиц, а остальные начали загнивать, а при предлагаемом нами способе (1-й опыт) сбора:
2500 яйца Trichuris (= Trichocephalus) suis до 100% случаев были зрелыми и развивались без наличия секундарной микрофлоры;
в сборе из 2500 яиц не было частиц разрушенных тканей половых органов самок Trichuris (= Trichocephalus) suis.
Таким образом, результаты культивирования яиц, собранные по разработанному нами «Способу сбора яиц (1-й - опыт)», подтвердили данные (до 68%) неоплодотворенных яиц; в сборе было очень много частиц разрушенных тканей половых органов самок Trichuris (=Trichocephalus) suis;
в процессе проведения эксперимента приходилось тратить большое количество времени на выборку незрелых (=неоплодотворенных) от зрелых (=оплодотворенных) яиц, которое в очень сильной степени тормозило исследования; развилось 32% (800) яиц, а остальные начали загнивать.
А при предлагаемом нами способе (1-й опыт) сбора: 2500 яйца Т. suis до 100% случаев были зрелыми и развивались без наличия секундарной микрофлоры; в сборе из 2500 яиц не было частиц разрушенных тканей половых органов самок Т. suis.
Таким образом, результаты культивирования яиц, собранные по разработанному нами «Способу (1-й - опыт)», подтвердили данные, полученные при использовании предлагаемого «Способа сбора максимального количества зрелых (=оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (=Trichocephalus) suis» от диких или/и домашних свиней, которые были выявлены нами впервые.
Использование предлагаемого «Способа сбора максимального количества зрелых (=оплодотворенных) яиц (in vitro) от половозрелых самок возбудителя паразитарного зооноза Trichuris (=Trichocephalus) suis» от диких или/и домашних свиней, обеспечивает по сравнению с известными способами: [3, 4] флотации, комбинированного; способа сбора яиц путем разрушения половых органов самок гельминтов (вульвы, вагины, матки), следующие преимущества:
сокращает время и снижает трудоемкость исследований за счет исключения:
необходимости иметь в эксперименте большое количество зараженных трихоцефалами диких или/и домашних свиней, так как достаточно иметь в опыте от 200 живых, половозрелых самок Trichuris (=Trichocephalus) suis (в отличие от способов сбора яиц: флотации, комбинированного, при которых исследовать большое количество больных трихоцефалезом свиней бывает проблематично, особенно в зоопарках, цирках и племенных фермах, где количество дрессированных, диких или домашних (=племенных) свиней может исчисляться единичными особями);
необходимости проведения исследований большого количества фекалий от спонтанно больных трихоцефалезом свиней, с целью сбора максимального количества (2000 и более) оплодотворенных яиц Т. suis (в отличие от известных способов сбора яиц: флотации, комбинированного);
необходимости проведения вскрытия половых органов самок Trichuris (=Trichocephalus) suis (в отличие от известного способа сбора яиц: разрушения половых органов самок гельминтов);
исключает загрязненность полученного сбора яиц обрывками частиц тканей половых органов от самок: Trichuris. (=Trichocephalus)suis (в отличие от известного способа разрушения половых органов самок гельминтов);
исключает загрязненность сборов яиц частицами непереваренного корма и особенно жиров от свиней (в отличие от известных способов сбора яиц гельминтов: флотации, комбинированных);
исключает загнивание и развитие секундарной бактериальной инфекции в культуре яиц, полученной предлагаемым нами способом (в отличие от известного способа сбора яиц: при разрушении половых органов самки);
нет необходимости в центрифуге (в отличие известного комбинированного способа);
нет необходимости в приготовлении различных солевых растворов, которые часто отсутствуют в широкой продаже или имеют ограничения (аммиачная селитра и др.), так как могут быть использованы в целях проведения террористических актов (в отличие от известных способов сбора яиц: флотации, комбинированном, при которых часто рекомендуется использовать аммиачную селитру, или токсичные для человека реактивы);
известен вид возбудителя инвазии Trichuris (=Trichocephalus) suis (в отличие от известных способов сбора яиц: флотации, комбинированном, когда вид возбудителя инвазии неизвестен, так как домашние или дикие свиньи могу быть заражены Trichuris suis или Dioctophyme renale (Goeze, 1782), или 2-мя видами гельминтов: Trichuris suis + Dioctophyme renale);
заявленный способ сбора максимального количества зрелых (=оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (=Trichocephalus) suis легко осуществим в лабораторных условиях;
предлагаемый способ обеспечивает получение до 100% зрелых (=оплодотворенных) яиц трихоцефалов (при необходимости до нескольких тысяч) от только живых, активных самок Trichuris (=Trichocephalus) suis, отобранных при гельминтологических вскрытиях из толстых и слепых кишок зараженных спонтанно возбудителем трихоцефалеза диких или/и домашних свиней и помещенных в отдельные пробирки с физиологическим солевым раствором Rhode-Saito, при t=38°C-40°C, с экспонированием их в течение 5 часов в условиях термостата (в отличие от известных способов: флотации, комбинированных, при которых количество яиц в сборах бывает иногда незначительным, особенно при слабой интенсивности инвазии).
Заявленный способ предназначен для исследований в условиях лаборатории или/и полевых экспериментов, при решении фундаментальных и прикладных задач в области эпизоотологии, систематики, биологии, терапии и профилактики трихоцефалеза диких (в зоопарковых, цирковых, охотничьих хозяйствах) или/и домашних свиней.
Источники информации
1. Котельников Г.А. Гельминтологические исследования животных и окружающей среды. //Справочник. - М.- Колос - 1983 - 208 с.
2. Мозговой А.А. Экспериментальное изучение клиники трихоцефалеза свиней. //Ветеринария. - 1952 - №10. - С. 24-27.
3. Пасечник В.Е. Перекрестное заражение трихоцефалами приотарных собак и овец в Молдавии. // Бюллетень Всесоюзного института гельминтологии имени К.И. Скрябина (ВИГИС). М. - 1984. - Вып. - 37. - С. 57.
4. Пасечник В.Е. Дисс. … кандидата ветеринарных наук. - М. - ВИГИС. - 2000. - С. 124-125.
5. Пасечник В.Е., Успенский А.В., Микулец Ю.И., Жданова В.Ю. //Методические рекомендации по диагностике, профилактике и мерам борьбы с гельминтозами цирковых животных. - М. - Изд. Россельхозакадемии (=РАСХН). - 2008. - 50 с.
6. Пасечник В.Е. Значимость изучения трихоцефалеза домашних и диких животных отряда Парнокопытных.//Сб. Материалов докладов научной конференции «Теория и практика борьбы с паразитарными болезнями». - М. - 2014. - Вып. 15. С. 216-218.
7. Полищук М.Г., Звержановский М.И. Лошадь - новый хозяин нематоды Trichocephalus suis. //Труды Кубанского сельскохозяйственного института. Краснодар. - 1980. - Выпуск 184 (212). - С. 71.
8. Скрябин К.И. Метод полных гельминтологических вскрытий позвоночных, включая человека. //Изд. 1-го Московского государственного университета - М. - 1928. - 36 с.
9. Скрябин К.И., Петров A.M. Основы ветеринарной нематодологии. // Изд. «Колос». - М. - 1964. - С. 470-474.
10. Тукалевский И.М. Развитие власоглава в организме хозяина. //Труды Полтавского сельскохозяйственного ин-та. - 1949. - В. IV. - С. 111-118.
11. Da Costa, S.F. Gomes. Comte rendu des seanses de la Sotiete de biologic - 1930. - V. - 103. - №5. - PP. 339-342.
12. Da Costa, S.F. Gomes. J. Comte rendu des seanses de la Sotiete de biologie. Paris. - May 1.- 1930 - Vol. 103. - №14. - PP. 1257-1259.
13. Ettisch G. //The Journal of General Phisiology. Sept. 20, 1950 - 34 (1). - PP. 43-57.
14. Rebello, Silvio; Da Costa, S.F.Gomes; Rico, J.Toscano. //Comte rendu des seanses de la Societe de biologie. - 1928. - Vol.- 98. - №6. - PP. 475-477.
15. Rhode H, Saito Y.  die Herstelling einer physiologichen
die Herstelling einer physiologichen 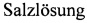 von verschiedener CH
von verschiedener CH  Warm- und
Warm- und 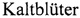 . Mit 1 Kurve. //Zeitschrift
. Mit 1 Kurve. //Zeitschrift  die gesamte Experimentelle Medicine. Berlin, 1923. - Vol. 38. - Issue 1. S. 503-505.
die gesamte Experimentelle Medicine. Berlin, 1923. - Vol. 38. - Issue 1. S. 503-505.
16. Saito Yutaka. Die Resorption 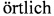
 Mittel von der Schleimhaut der Harnblase. //Archiv fur experimentelle Pathologie und Pharmakologie. September 1924. Volume 102. Issue 5. - S. 367-381.
Mittel von der Schleimhaut der Harnblase. //Archiv fur experimentelle Pathologie und Pharmakologie. September 1924. Volume 102. Issue 5. - S. 367-381.
Изобретение относится к области паразитологии, в частности к способу сбора максимального количества зрелых (оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (Trichocephalus) suis. Способ заключается в отборе индивидуально и только живых, активных, половозрелых самок Trichuris suis из толстой, слепой кишок спонтанно зараженных возбудителем трихоцефалеза при исследовании гельминтологическими методами на вскрытии диких кабанов или/и домашних свиней в отдельные пробирки с раствором Rhode-Saito. Раствор по своему химическому составу приближен к составу пищеварительного тракта млекопитающих. Экспозиция пробирок с живыми, активными, половозрелыми самками Trichuris suis в условиях, приближенных к жизнедеятельности паразита в организме свиней, осуществляется при t=38°C-40°C в течение 5 часов в термостате. Заявленный способ предназначен для исследований в условиях лаборатории или/и полевых экспериментов, при решении фундаментальных и прикладных научных задач в области эпизоотологии, биологии, систематики, терапии и профилактики трихоцефалеза домашних или/и диких свиней. 2 пр.
Способ сбора максимального количества зрелых (=оплодотворенных) яиц (in vitro) от самок возбудителя паразитарного зооноза Trichuris (=Trichocephalus) suis, заключающийся в отборе индивидуально и только живых, активных, половозрелых самок Trichuris suis из толстой, слепой кишок спонтанно зараженных возбудителем трихоцефалеза, при исследовании гельминтологическими методами на вскрытии диких кабанов или/и домашних свиней, в отдельные пробирки с раствором Rhode-Saito, который по своему химическому составу приближается к составу пищеварительного тракта млекопитающих, и экспозицией пробирок с живыми, активными, половозрелыми самками Trichuris suis в условиях, приближенных к жизнедеятельности паразита в организме свиней: при t=38°C-40°C в течение 5 часов в термостате.
| Паразитология и инвазионные болезни сельскохозяйственных животных | |||
| Третье, испр | |||
| и дополн | |||
| изд | |||
| Под ред | |||
| проф | |||
| В.С | |||
| Ершова | |||
| М., "Колос", 1964, с 44-58 | |||
| СПОСОБ КУЛЬТИВИРОВАНИЯ ЯИЦ ТРЕМАТОД | 2001 |
|
RU2193310C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ЭМБРИОНИРОВАННЫХ ЯИЦ TRICHURIS | 2009 |
|
RU2540145C2 |
| ПАСЕЧНИК В.Е | |||
| Эколого-эпизоотологические основы профилактики трихоцефалеза овец в Республике Молдова | |||
| Автореф | |||
| диссерт | |||
| на соискание уч | |||
| степени кандидата ветеринарных наук | |||
| Москва, 2000г. | |||
Авторы
Даты
2017-01-30—Публикация
2015-06-08—Подача