Изобретение относится к аналитической химии, а именно к способам определения продуктов химического гидролиза дезоксирибонуклеиновой кислоты (ДНК).
В последние годы интенсивно развивается направление выявления маркеров, так или иначе связанных с ДНК опухолевых клеток. К этим маркерам относятся опухоле-специфичные мутации, метилированные фрагменты ДНК и аддукты ДНК. Аддукты ДНК аддукты могут быть потенциальными маркерами риска возникновения рака легкого, так как их содержание в тканях является результирующей взаимодействия канцерогенных факторов и реакцией организма с учетом индивидуальных особенностей систем метаболизма и репарации. Наличие патогенетически значимых для опухоли изменений ДНК в циркулирующих ДНК крови идентифицируют и количественно определяют методами масс-спектрометрии (TOF/TOF, TOF/MS, реже MS/MS). Для масс-спектрометрического анализа аддукты ДНК необходимо высвободить в виде отдельных модифицированных азотистых оснований и/или нуклеозидов. Для этого ДНК подвергается термическому, химическому или энзиматическому гидролизу. В то время как многие аддукты ДНК, включая 7-алкил-гуанин‚ 3-алкил-аденин и 8-нитро-гуанин, термически неустойчивы и могут быть селективно высвобождены из структуры ДНК путем нагрева [1, 2], другие повреждения ДНК стабильны и требуют расщепления. Этот шаг может быть выполнен либо путем ферментативного, либо путем химического гидролиза. При химическом гидролизе ДНК расщепляется путем разрыва обеих эфирных связей и фосфатных N-гликозидных между дезоксирибозой и пуриновым (пиримидиновым) основанием. В ходе такого гидролиза в смеси наблюдается большой набор соединений различных классов, но сходных по физико-химическим свойствам, что затрудняет их хроматографическое разделение. При этом очевидно, что без хроматографического разделения смеси невозможно корректно идентифицировать продукты гидролиза, в том числе и аддукты ДНК методами масс-спектрометрии.
Известны различные способы разделения продуктов химического гидролиза ДНК методом высокоэффективной жидкостной хроматографии (ВЭЖХ) – обращенно-фазовая хроматография и хроматография гидрофильного взаимодействия. Каждый из методов имеет ряд недостатков. Обращенно-фазовая хроматография не способна качественно разделить полярные компоненты, что вынуждает использовать более длинные колонки для увеличения времени удерживания, что приводит к удорожанию анализа, а также уменьшению стабильности масс-спектрометрической системы при дальнейшей идентификации аддуктов ДНК. Хроматография гидрофильного взаимодействия позволяет эффективно разделить все продукты гидролиза ДНК, но при этом требует длительной пробоподготовки, в ходе которой есть вероятность потери аддуктов ДНК и других продуктов гидролиза.
Известен способ хроматографического разделения продуктов гидролиза ДНК продуктов с помощью хроматографии гидрофильного взаимодействия (HILIC) - варианта нормальнофазной хроматографии на специальных колонках [3]. В качестве неподвижной фазы используется амидная колонка TSKgel Amide-80 2,0×150 мм с размером зерна 3 мкм. В качестве элюентов используется ацетонитрил и 10 миллимоль ацетата аммония в воде. Общее время анализа составляет 100 минут. Для проведения хроматографического разделения образец должен представлять собой смесь продуктов гидролиза в ацетонитриле или метаноле, для чего образец содержащий продукты гидролиза ДНК, упаривают под током азота и затем сухой остаток растворяют в ацетонитриле. Существенными недостатками данного метода являются трудоемкость пробоподготовки, а так же длительное время разделения продуктов гидролиза - 100 минут, что увеличивает стоимость одного анализа в несколько раз. Кроме того, для идентификации продуктов гидролиза необходимо растворение стандартных образцов веществ в ацетонитриле или метаноле, что не представляется возможным для некоторых соединений.
Известен другой способ разделения продуктов гидролиза ДНК с помощью обращенно-фазной хроматографии на колонках С18 [4]. Данный способ находит более широкое применение, так как анализируемая проба и стандарты веществ находятся в водном растворе. В качестве колонки для разделения используется Restec Ultra C18 4,6×250 мм с размером зерна 5 мкм. В качестве элюентов используются ацетонитрил и 85 миллимолярного ацетата аммония в воде. Недостатком данного способа недостаточное удерживание на колонке полярных компонентов, поэтому для улучшения разделения полярных компонентов в данном способе предлагается использовать более длинные колонки, но при этом увеличивается время анализа и расход элюентов, что также увеличивает стоимость разделения.
Технической задачей настоящего изобретения является разработка способа хроматографического разделения и определения продуктов химического гидролиза ДНК с целью идентификации аддуктов ДНК.
Поставленная задача решается тем, что способ определения продуктов химического гидролиза дезоксирибонуклеиновой кислоты (ДНК), включает хроматографическое определение продуктов гидролиза, но в отличие от прототипа, анализ проводят на хроматографической колонке с фазой представляющей собой диоксид кремния, модифицированный пентафторфенилом 4.6×150 мм с размером зерна 5 мкм, при 28 °С, причем адсорбировавшиеся на продукты гидролиза ДНК элюируют смесью воды с добавлением муравьиной кислоты и ацетонитрила в градиентном режиме: на первом этапе градиент ацетонитрила изменяется линейно от 0 до 25 % за 6 минут, затем в течение 4 минут выдерживается режим с 25 % ацетонитрилом, на заключительном этапе происходит уравновешивание фазы в течение 4 минут 100 % водой с 0,1 % муравьиной кислотой со скорость элюирования 0,6 мл/мин.
При скорости потока 0,6 мл/мин, используют спектрофотометрический детектор с длиной волны 260 нм с последующим определением времени удержания и площадей хроматографических пиков продуктов химического гидролиза ДНК.
Для анализа используют колонки с сорбентом Luna PFP(2), обеспечивающим выдающуюся селективность для сильнополярных соединений, сложных природных продуктов, изомеров и других близко родственных соединений. Это достигается за счёт использования пентафлуорофенила на пропильном линкере, который обеспечивает множество механизмов удерживания в отличие от традиционных носителей с обратной фазой (С18, С8), в которых селективность обеспечивается только одним механизмом взаимодействия.
Механизмы взаимодействия, обеспечивающие селективность
колонкам Luna PFP(2):
• Водородные граничные взаимодействия;
• Диполь-дипольные взаимодействия;
• Ароматические и π-π взаимодействия;
• Гидрофобные взаимодействия.
Основными преимуществами Luna PFP(2) является превосходная селективность, достигаемая за счёт 4 механизмов взаимодействия и ортогональную селективность даже при использовании традиционных обращённо-фазовых систем с подвижной фазой.
Применение муравьиной кислоты позволяет использовать данный способ разделения продуктов гидролиза ДНК для масс-спектрометрического детектирования продуктов гидролиза ДНК, в отличие от фосфатных буферов. Также применение муравьиной кислоты позволяет повысить эффективность ионизации продуктов гидролиза в положительном режиме при масс-спектрометрическом детектировании.
Использование градиентного режима позволяет последовательно десорбировать компоненты смеси с неподвижной фазы, а также применение ацетонитрила до 25 % в качестве элюента позволяет существенно сократить стоимость анализа.
Использование заявляемых условий позволяет добиться приемлемого разделения продуктов химического гидролиза ДНК с целью идентификации аддуктов ДНК.
В дальнейшем способ поясняется примерами.
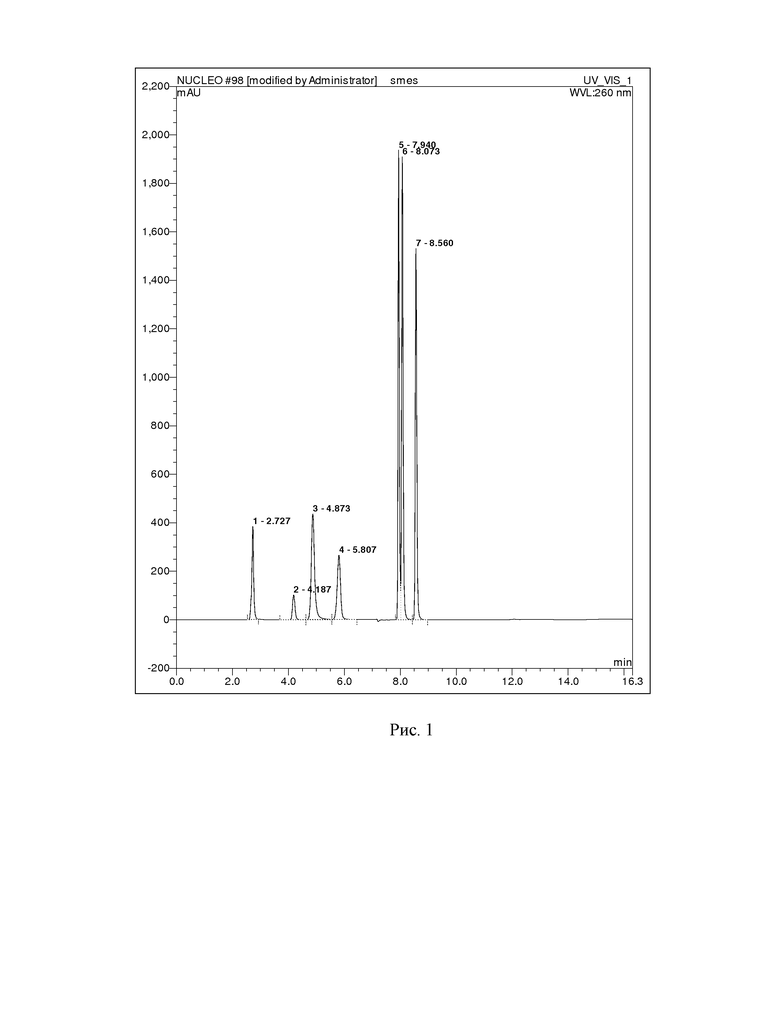
ПРИМЕР 1. Путем растворения готовят водный раствор стандартных веществ: аденин, гуанин, цитизин, цитидин, тимин, тимидин, 2-дезоксигуанозин. Далее из анализируемой смеси отбирают пробу объёмом 1 мкл и вводят в жидкостной хроматограф. Для разделения смеси используют колонку Phenomenex Luna PFP(2) 4.6×150 мм с размером зерна 5 мкм, где разделение проводят в градиентном режиме: на первом этапе градиент ацетонитрила изменяется линейно от 0 до 25 % за 6 минут, затем в течение 4 минут выдерживается режим с 25 % ацетонитрилом, на заключительном этапе происходит уравновешивание фазы в течение 4 минут 100 % водой с 0,1 % муравьиной кислотой. Скорость элюирования 0,6 мл/мин. Детекция продуктов гидролиза осуществляется спектрофотометрическим детектором при длине волны 260 нм. В результате анализа определяют времена удерживания продуктов гидролиза для идентификации: аденин (время удержания = 2,727 мин), гуанин (время удержания = 4,187 мин), цитизин (время удержания = 4,873 мин), цитидин (время удержания = 5,807 мин), тимин (время удержания = 7,940 мин), тимидин (время удержания = 8,073 мин), 2-дезоксигуанозин (время удержания = 8,560 мин).
На рисунке 1 представлена хроматограмма стандартных веществ, характерных для химического гидролиза ДНК.
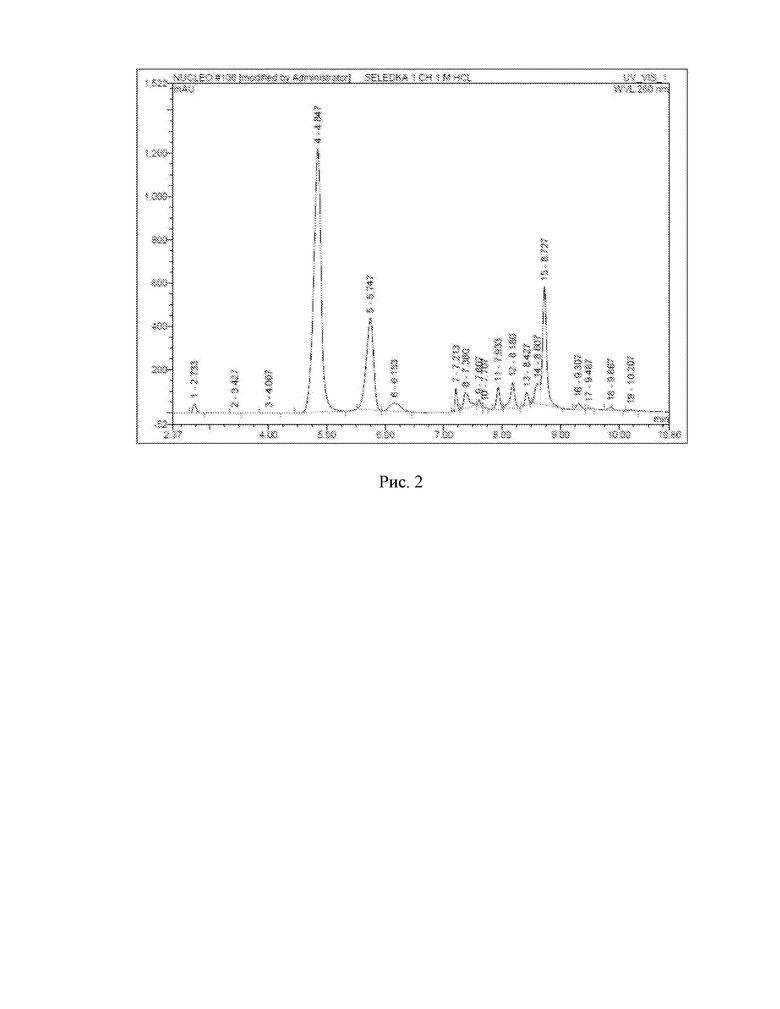
ПРИМЕР 2. ДНК выделенную колоночным методом подвергают химическому гидролизу 0,1 М соляной кислотой при 70 °С в течение 4 часов. После охлаждают до комнатной температуры и нейтрализуют эквимолярным количеством гидроксида натрия. Далее из анализируемой смеси отбирают пробу объёмом 1 мкл и вводят в жидкостной хроматограф. Для разделения смеси используют колонку Phenomenex Luna PFP(2) 4.6×150 мм с размером зерна 5 мкм, где разделение проводят в градиентном режиме: на первом этапе градиент ацетонитрила изменяется линейно от 0 до 25 % за 6 минут, затем в течение 4 минут выдерживается режим с 25 % ацетонитрилом, на заключительном этапе происходит уравновешивание фазы в течение 4 минут 100 % водой с 0,1 % муравьиной кислотой. Скорость элюирования 0,6 мл/мин. Детекция продуктов гидролиза осуществляется спектрофотометрическим детектором при длине волны 260 нм. В результате анализа определяют времена удерживания продуктов гидролиза для идентификации: аденин (время удержания = 2,727 мин), гуанин (время удержания = 4,007 мин), цитизин (время удержания = 4,847 мин), цитидин (время удержания = 5,747 мин), тимин (время удержания = 7,933 мин), тимидин (время удержания = 8,180 мин), 2-дезоксигуанозин (время удержания = 8,607 мин).
На рисунке 2 представлена хроматограмма продуктов химического гидролиза ДНК.
Источники информации
1. Googin M., Loeber R., Prk S., Walker V., Wickliffe J., and Tretyakova N. HPLC-ESI+-MS/MS analysis of N7-gunine-N7-guanine DNA cross-links in tissues of mice exposed to 1,3-butadiene. 2007 // Chemical Research in Toxicology. 20, 5: 839-847.
2. Singer B., and Grunberger D. Molecular Biology of Mutagens and Carcinogens. 1983. Plenum Press, New York and London.
3. Chen P., Li W., Li Q., Wang Y., Li Z., Ni Y., Koike K.
4. Kelly M.C., White B., Smyth M.R. Separation of oxidatively damaged DNA nucleobases and nucleosides on packed and monolith C18 columns by HPLC-UV-EC // Journal of Chromatography B. 863 (2008) 181-186.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения производных катехоламинов в моче | 2018 |
|
RU2688184C1 |
| СПОСОБ ХРОМАТОГРАФИЧЕСКОГО РАЗДЕЛЕНИЯ КОМБИНИРОВАННОЙ ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ, СОДЕРЖАЩЕЙ АМЛОДИПИН И ВАЛСАРТАН | 2015 |
|
RU2603941C1 |
| СПОСОБ ПОЛУКОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ТРИТЕРПЕНОВЫХ КИСЛОТ В ЭКСТРАКТАХ ДРЕВЕСНОЙ ЗЕЛЕНИ ПИХТЫ СИБИРСКОЙ МЕТОДОМ ЖИДКОСТНОЙ ХРОМАТО-МАСС-СПЕКТРОМЕТРИИ | 2023 |
|
RU2810636C1 |
| Способ определения мельдония в моче человека | 2017 |
|
RU2639475C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЙЕССОТОКСИНОВ В МОЛЛЮСКАХ | 2018 |
|
RU2716233C1 |
| СПОСОБ ВЫСОКОЭФФЕКТИВНОГО ЖИДКОСТНО-ХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ АЛКИЛФОСФОНОВЫХ И/ИЛИ О-АЛКИЛАЛКИЛФОСФОНОВЫХ КИСЛОТ В ВОДНОМ РАСТВОРЕ | 2017 |
|
RU2653582C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КАРМУАЗИНА В СОКАХ | 2015 |
|
RU2596796C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ДИМЕТИЛТЕРЕФТАЛАТА В МОЧЕ МЕТОДОМ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ | 2010 |
|
RU2425380C1 |
| Способ определения производных стероидных гормонов в моче | 2021 |
|
RU2764363C1 |
| Способ количественного определения леводопы в плазме крови | 2017 |
|
RU2665164C1 |
Изобретение относится к аналитической химии, а именно к способам определения продуктов химического гидролиза дезоксирибонуклеиновой кислоты (ДНК). Способ определения продуктов химического гидролиза дезоксирибонуклеиновой кислоты (ДНК) включает хроматографическое определение продуктов гидролиза. При этом анализ проводят на хроматографической колонке с фазой, представляющей собой диоксид кремния, модифицированный пентафторфенилом 4.6×150 мм с размером зерна 5 мкм, при 28 °С. Причем адсорбировавшиеся на продукты гидролиза ДНК элюируют смесью воды с добавлением муравьиной кислоты и ацетонитрила в градиентном режиме: на первом этапе градиент ацетонитрила изменяется линейно от 0 до 25 % за 6 минут, затем в течение 4 минут выдерживается режим с 25 % ацетонитрилом, на заключительном этапе происходит уравновешивание фазы в течение 4 минут 100 % водой с 0,1 % муравьиной кислотой со скоростью элюирования 0,6 мл/мин. Техническим результатом является обеспечение возможности приемлемого разделения продуктов химического гидролиза ДНК с целью идентификации аддуктов ДНК. 1 з.п. ф-лы, 2 ил.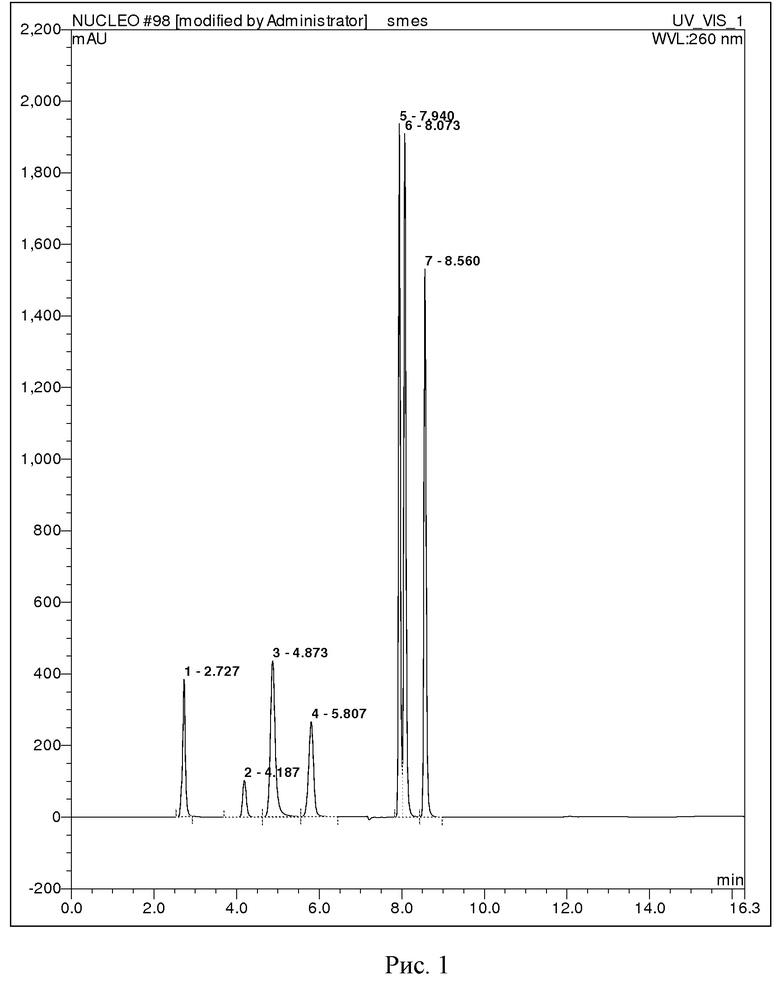
1. Способ определения продуктов химического гидролиза дезоксирибонуклеиновой кислоты (ДНК), включающий хроматографическое определение продуктов гидролиза, отличающийся тем, что анализ проводят на хроматографической колонке с фазой, представляющей собой диоксид кремния, модифицированный пентафторфенилом 4.6×150 мм с размером зерна 5 мкм, при 28 °С, причем адсорбировавшиеся на продукты гидролиза ДНК элюируют смесью воды с добавлением муравьиной кислоты и ацетонитрила в градиентном режиме: на первом этапе градиент ацетонитрила изменяется линейно от 0 до 25 % за 6 минут, затем в течение 4 минут выдерживается режим с 25 % ацетонитрилом, на заключительном этапе происходит уравновешивание фазы в течение 4 минут 100 % водой с 0,1 % муравьиной кислотой со скорость элюирования 0,6 мл/мин.
2. Способ по п. 1, отличающийся тем, что при скорости потока 0,6 мл/мин используют спектрофотометрический детектор с длиной волны 260 нм с последующим определением времени удержания и площадей хроматографических пиков продуктов химического гидролиза ДНК.
| Kelly M.C | |||
| et al, Separation of oxidatively damaged DNA nucleobases and nucleosides on packed and monolith C18 columns by HPLC-UV-EC, Journal of Chromatography B | |||
| Водяные лыжи | 1919 |
|
SU181A1 |
| et al, HPLC-ESI+-MS/MS analysis of N7-gunine-N7-guanine DNA cross-links in tissues of mice exposed to 1,3-butadiene, Chemical Research in Toxicology, 839-847, 20(5), 2007;CN 104977280 A 14.10.2015. | |||
Авторы
Даты
2017-02-01—Публикация
2015-10-27—Подача