ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6, способному связываться с CCL18 и/или CCL20, а также к способу количественной оценки концентрации растворимого полипептида рецептора CCR6 в жидком образце от пациента. Настоящее изобретение также относится к способу детектирования и/или прогнозирования интерстициального заболевания легких или рака у пациента путем определения уровня растворимого полипептида рецептора CCR6 в образце от упомянутого пациента и, кроме того, обеспечивает фармацевтическую композицию, содержащую соединение, способное ингибировать активность и/или экспрессию CCL18 или CCL20 для лечения упомянутых заболеваний. Настоящее изобретение также относится к изолированному полипептиду, способному связываться с рецептором хемокина CCR6 и ингибировать его активность, и способу определения дополнительных ингибиторов активности рецептора CCR6. Кроме того, настоящее изобретение относится к способу детектирования интерстициального заболевания легких или рака у пациента путем определения уровня экспрессии гена CCR6 в образце от упомянутого пацента и дополнительно обеспечивает фармацевтические композиции, содержащие ингибиторы активности и/или экспрессии рецептора CCR6 для лечения упомянутых заболеваний.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Интерстициальные заболевания легких представляют собой гетерогенную группу заболеваний, сопровождающихся воспалением и фиброзом различной степени при поражении паренхимы легких. В последнее время подгруппа идиопатических интерстициальных пневмоний была классифицирована по семи различным синдромам. Наиболее частыми из этих состояний являются идиопатический легочный фиброз (IPF), неспецифическая интерстициальная пневмония (NSIP) и криптогенная организующаяся пневмония (СОР). Этиология упомянутых заболеваний остается неясной и молекулярные механизмы, побуждающие их патогенез, мало изучены. Тем не менее, окончательный путь пролиферации фибробластов и высвобождение внеклеточной матрицы представляет собой общий путь фиброзирующих заболеваний легких известной и неизвестной этиологии, в том числе коллаген-сосудистых и системных воспалительных заболеваний с пульмональными проявлениями, ведущих к фиброзу (например, ревматоидный артрит, системная склеродермия, склеродермия, аллергический пневмонит, некоторые формы альвеолита, обусловленного действием лекарственного средства).
Характерным типом хронической фиброзирующей интерстициальной пневмонии неизвестной причины является идиопатический легочный фиброз (IPF). Исследования легочной ткани от пациентов, страдающих IPF, демонстрируют характерный набор гистологических/патологических признаков, известных как обычная интерстициальная пневмония (UIP). NSIP напротив относится к случаям интерстициальной пневмонии, при которой может идентифицироваться четкая структура более однородного воспаления и фиброз, отличный от UIP.
IPF чаще встречается у мужчин, чем у женщин, и обычно возникает у пациентов в возрасте 50 лет и старше.
Широко распространенным способом диагностики и мониторинга интерстициальных болезней легких, как, например IPF, является цитологическое исследование бронхоальвеолярного лаважа (BAL). Бронхоальвеолярный лаваж от пациентов, больных IPF, характеризуется весьма высоким общим количеством клеток и макрофагов, повышенным процентным содержанием лимфоцитов, нейтрофилов и эозинофилов по сравнению с бронхоальвеолярным лаважем у здоровых контрольных пациентов.
Дополнительными общими симптомами IPF являются одышка, особенно во время или после физической активности, и сухой кашель. Упомянутые симптомы часто не появляются до тех пор, пока болезнь не запущена, а необратимые поражения легких уже произошли.
Прогноз IPF довольно плохой при среднем времени выживания 3 года с момента установления диагноза.
В настоящее время эффективных методов и средств лечения легочного фиброза нет. Часто лечение ограничивается лечением воспалительной реакции, которая происходит в легких. Стандартная терапия включает противовоспалительные и цитостатические препараты, такие как стероиды и циклофосфамиды или азатиоприн, однако эти методы лечения малоэффективны, например, при NSIP (у которого, кроме того, прогноз лучше, чем у IPF) или десквамативной интерстициальной пневмонии (DIP). IPF, однако, не поддается воздействию большинства из этих терапевтических средств. Экспериментальные терапевтические исследования с использованием IFNγ, Bosentan® (антагонист эндотелина), Aviptadil® (вазоактивный интестинальный пептид, VIP) или ингибитора тирозинкиназы Imatinib® также не выявили сильного положительного действия этих препаратов.
Поэтому важной задачей остается разработка новых методов лечения различных видов фиброза легких, особенно IPF. Существует потребность в новых клеточных мишенях, а также терапевтических молекулах, которые могут эффективно воздействовать на эти мишени.
Хемокины представляют собой семейство хемоаттрактантных, провоспалительных цитокинов, необходимых для гомеостаза и активации иммунной системы. Они направляют миграцию иммунных клеток в участки воспаления и инфекции. Хемокины связываются со специфическими рецепторами клеточной поверхности, принадлежащими к семейству семитрансмембранному домену, G-белок сопряженным рецепторам.
CCL18, также известный как легочный и регулируемый активацией хемокин (PARC), альтернативный макрофагальный СС хемокин 1, ассоциированный с активацией (АМАС-1), макрофагальный воспалительный белок -4 (MIP-4) и полученный из дендритных клеток хемокин 1 (DCCK1), является хемокином, который в основном экспрессируется широким спектром моноцитов/макрофагов и дендритных клеток. Он конститутивно экспрессируется на высоких уровнях в легких человека. CCL18 привлекает Т-клетки, незрелые дендритные клетки и стимулирует синтез коллагена фибробластами. Кроме того, есть признаки, что CCL18 также может вызывать хемотаксис В-клеток.
Уровни CCL18 повышаются при различных болезненных состояниях, как например, воспалительные заболевания кожи, легких и суставов. Кроме того, было установлено, что CCL18 высвобождается на высоких уровнях альвеолярными макрофагами от пациентов, страдающих легочным фиброзом, и уровни этого хемокина в сыворотке крови являются прогностическим маркером при фиброзных заболеваниях.
Более того, можно продемонстрировать, что CCL18 индуцирует дифференцирование фибробластов в мио-фибробласты и индуцирует экспрессию коллагена и α-гладкомышечного-актина. Благодаря своим известным коллаген-индуцирующим свойствам, высокие уровни CCL18 могли бы напрямую связываться с повышенным матричным отложением при легочном фиброзе.
Однако, точному анализу сигнальных событий и возможных терапевтических вмешательств в сигнализацию CCL18 препятствует тот факт, что его рецептор не известен.
В последнее время в клинической медицине в качестве новой формы терапии были внедрены растворимые рецепторы. Большинство растворимых рецепторов конкурируют с их мембраносвязанными аналогами за их лиганды и таким образом действуют как конкурентные антагонисты. Растворимые рецепторы имеют то преимущество, что они высоко специфичны, связываются со своими мишенями с высоким сродством, и, менее вероятно, индуцируют иммунный ответ, который может ослаблять их действия. Кроме того, они имеют потенциал действия на расстоянии, таким образом, что их можно вводить далеко от места действия. С учетом этих преимуществ растворимые рецепторы обладают значительным потенциалом для терапевтического использования.
Рак представляет собой класс заболеваний, когда группа клеток демонстрирует неконтролируемый рост, инвазию, а иногда и метастаз. Эти три злокачественных свойства карцином отличают их от доброкачественных опухолей, которые являются самоограничивающимися и не внедряются или не метастазируют.
Рак - одна из основных проблем со здоровьем, является причиной около 13% всех смертей в мире. По данным Американского общества борьбы с раковыми заболеваниями 7,6 млн. человек умерли от рака в мире в 2007 году. Смертность от рака будет продолжать расти, и по оценкам, составит 12 миллионов случаев смерти в 2030 г..
Разработка новых методов лечения в борьбе с раком, следовательно, остается важной задачей.
Рак легких является главной причиной смертности, связанной с раковыми заболеваниями, и одним из наиболее важных злокачественных новообразований из-за его высокой распространенности и возрастающей частоты заболеваний. Почти 80% всех случаев рака легких гистологические, определяемые как немелкоклеточный рак легких (NSCLC). Несмотря на преимущества новых технологий и разработке новых лекарственных препаратов, способствующих более ранней диагностике и более эффективному лечению, NSCLC остается опасным для жизни заболеванием. Общее время выживания, составляющее 5 лет для больных с NSCLC, все еще остается низким и даже на ранних стадиях болезни частота рецидивов достаточно высокая. Неблагоприятный прогноз связан с весьма агрессивным поведением опухоли, что демонстрируется быстрым ростом опухоли и ранними метастазами. Несмотря на то, что точный механизм канцерогенеза и метастазирования при NSCLC до сих пор неизвестен, микроокружение опухоли, видимо, играет ключевую роль в развитии злокачественных заболеваний и диссеминации опухолевых клеток.
NSCLC обозначает термин, описывающий несколько форм опухолей. 25-40% NSCLC - это аденокарцинома. Опухоли этого типа развиваются из продуцирующих слизь клеток и расположены в основном на периферии легких. Опухоль второго по частоте гистологического типа представляет собой плоскоклеточную карциному, которая развивается из плоских клеток, покрывающих поверхность альвеол и бронхиол.
Микросреда солидных опухолей представляет собой сложную смесь клеточных и неклеточных факторов. Особенно способствуют росту опухолевых клеток и их распространению иммунные клетки, расположенные в окружении опухоли, и хемокины-помехи. Ассоциированные с опухолью макрофаги (ТАМ) представляют собой одну из наиболее важных подгрупп иммунных клеток в микросреде опухоли и составляют до 50% от массы опухоли. Некоторые исследования демонстрируют существенную взаимосвязь между числом ассоциированных с опухолью макрофагов и плохим прогнозом при злокачественных заболеваниях.
ЦЕЛЬ И КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Одной из целей настоящего изобретения является создание изолированного растворимого полипептида рецептора CCR6, способного связываться с CCL18 и/или CCL20.
Еще одной целью изобретения является разработка способа количественной оценки концентрации растворимого полипептида рецептора CCR6 в жидком образце от пациента (объекта), а также диагностического метода in vitro, который можно использовать для детектирования и/или прогнозирования интерстициального заболевания легких или рака у объекта.
Следующей целью настоящего изобретения является создание ингибитора активности рецептора CCR6. Еще одной целью изобретения является разработка способа идентификации ингибиторов активности рецептора CCR6.
Другой целью настоящего изобретения является создание фармацевтических композиций, содержащих соединения, пригодные для лечения интерстициального заболевания легких и/или рака, когда упомянутые интерстициальные заболевания легких представляют собой, предпочтительно, идиопатический легочный фиброз (IPF), а упомянутый рак предпочтительно аденокарциному, наиболее предпочтительно аденокарциному легких.
Эти и другие цели, как видно из последующего описания и формулы изобретения, достигаются за счет предмета изобретения в независимых пунктах формулы изобретения. Некоторые из предпочтительных примеров осуществления изобретения определены зависимыми пунктами формулы.
В первом аспекте настоящее изобретение предусматривает изолированный растворимый полипептид рецептора CCR6, содержащий или состоящий из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 1, и
(b) фрагмента аминокислотной последовательности в соответствии с (а);
в котором упомянутый растворимый изолированный полипептид рецептора CCR6 способен связываться с CCL18 и/или CCL20.
В другом аспекте настоящее изобретение относится к способу количественной оценки концентрации растворимого полипептида рецептора CCR6 в жидком образце от пациента, в котором способ включает следующие стадии:
(а) иммобилизация захватывающей молекулы, специфичной к растворимому рецептору CCR6 на твердой подложке;
(b) добавление жидкого образца от пациента
(c) факультативное добавление лиганда растворимого рецептора CCR6, в котором упомянутый лиганд представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.:18., SEQ ID NO.: 19, SEQ ID NO.: 20 или SEQ ID NO.: 21;
(d) добавление детектирующего агента, специфичного к лиганду в соответствии с (с), в котором упомянутый детектирующий агент содержит обнаруживаемую метку;
(e) количественная оценка сигнала от детектирующего агента в соответствии с (d).
Еще в одном аспекте настоящее изобретение относится к способу детектирования и/или прогнозирования интерстициального заболевания легких или рака у пациента, в котором способ включает стадию определения уровня растворимого полипептида рецептора CCR6 в образце от упомянутого пациента.
Еще в одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение, способное ингибировать активность и/или экспрессию CCL18 или CCL20.
В другом аспекте настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением для применения в терапии.
Еще в одном аспекте настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением или фармацевтической композиции в соответствии с изобретением для использования для лечения или предупреждения интерстициального заболевания легких и/или рака.
Еще в одном аспекте настоящее изобретение относится к детектирующему агенту, специфичному к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением для использования при детектировании интерстициального заболевания легких или рака в образце от пациента.
Еще в одном аспекте настоящее изобретение предусматривает изолированный полипептид, содержащий или состоящий из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 9, 22 или 23, и
(b) фрагмента аминокислотной последовательности, в соответствии с (а);
в котором упомянутый изолированный полипептид способен связываться с рецептором CCR6 и ингибировать активность рецептора CCR6.
В другом аспекте настоящее изобретение относится к изолированному полину клеотиду, кодирующему полипептид в соответствии с изобретением.
Еще в одном аспекте настоящее изобретение относится к способу идентификации соединения, способного ингибировать активность рецептора CCR 6, в котором способ включает следующие стадии:
(a) контактирование рецептора CCR 6 с тестируемым соединением;
(b) добавление агониста рецептора CCR6, в котором упомянутый агонист представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 5 или SEQ ID NO.: 18;
(c) определение активности упомянутого рецептора CCR6; и
(d) выбор упомянутого тестируемого соединения в качестве соединения, способного ингибировать активность рецептора CCR6, если активность рецептора CCR6, определенная в (с), ниже, чем активность рецептора CCR6, определенная в контрольной группе.
В следующем аспекте настоящее изобретение относится к способу детектирования интерстициального заболевания легких или рака у объекта, включающий стадию определения уровня экспрессии гена CCR6 в образце от упомянутого объекта.
В другом аспекте настоящее изобретение предусматривает фармацевтическую композицию, содержащую соединение, способное ингибировать активность и/или экспрессию рецептора CCR6.
Еще в одном аспекте настоящее изобретение относится к фармацевтической композиции в соответствии с изобретением для использования для лечения или предупреждения интерстициального заболевания легких и/или рака.
В следующем аспекте настоящее изобретение также относится к использованию соединения, способного ингибировать активность и/или экспрессию рецептора CCR6, или фармацевтической композиции в соответствии с изобретением для изготовления лекарственного препарата для лечения или предупреждения интерстициального заболевания легких и/или рака.
ОПИСАНИЕ ЧЕРТЕЖЕЙ:
Фигура 1. Экспрессия CCR6 мРНК разными фибробластными линиями у пациентов, больных плоскоклеточным раком (n=3), NSIP (n=2) и UIP (n=3). Экспрессия CCR6 была нормализована с помощью гена «домашнего хозяйства» глицерин альдегид-3-фосфат-дегидрогеназа (GAPdH).
Фигура 2. Анализ экспрессии CCR6 разными фибробластными линиями у пациентов, больных UIP (верхняя панель, левая и средняя), NSIP (верхняя правая панель) и плоскоклеточным раком (SQ СА, нижняя панель).
Фигура 3. CCR6 не экспрессируется в контрольном легком (А), однако, в фиброзных легких экспрессию CCR6 можно обнаружить на апикальной поверхности альвеолярных эпителиальных клеток (В и С, острие стрелки) и на фибробластах (С, стрелки) (увеличение: А: × 100, В: × 200, С: × 400).
Фигура 4. Нестимулированное (unst.) высвобождение FGF2 повышено в фибробластах из фиброзных легких (серый, n=6 (UIP n=3, саркоидоз n=1, NSIP n=1, неопределенная n=1)) по сравнению с фибробластами из нефиброзных легких (светло-серый, "Contr.", n=6). CCL18 индуцирует значительную повышающую регуляцию [апрегуляцию] высвобождения FGF2 в фибробластах из фиброзных легких, и лишь незначительную в фибробластах из нефиброзных легких. Блокада CCR6 блокирующим антителом ингибирует CCL18-индуцированную повышающую регуляцию высвобождения FGF2. Опять же, этот эффект наблюдается только в фибробластах из фиброзных легких.
Фигура 5. Экспрессия ССЫ8-индуцированного коллагена I мРНК в трех из четырех (верхняя панель) и экспрессия альфа-гладкомышечного актина (αSMA) мРНК во всех исследованных фибробластных клеточных линий легких человека (нижняя панель) (на ординате указаны названия линий). Экспрессия коллагена I мРНК и экспрессия альфа-гладкомышечного актина (αSMA) мРНК блокируется анти-CCR6 (rE = относительная Экспрессия).
Фигура 6. Трансформированная линия крысиных альвеолярных эпителиальных клеток RLE-6TN подвергается эпителиально-мезенхимальному переходу (ЕМТ) после стимуляции с помощью TGFβ или CCL18. Стрелки указывают на фибробласт-подобные клетки. Период культивирования = 6 дней.
Фигура 7. Вестерн-блот анализ экспрессии виментина и αSMA, культивированных в течение 6 дней, либо в нестимулированном виде, либо в присутствии TGFβ, TGFβ+TNFα, CCL18 или CCL18+TNFα.
Фигура 8. Иммуно-реактивность для αSMA оценивали по 11 иммуно-флуоресценции на 6-ой день. RLE-6TN клетки оставались нестимулированными (А) или стимулированными с помощью (В) TGFβ+TNFα, (С) CCL18 (D) или CCL18+TNFα. Ядра окрашиваются с помощью DAPI. αSMA видна только на панели В, демонстрируя типичную форму фибробластов (острие стрелки). В отличие от этого, на панели С и D видны только ядра.
Фигура 9. Иммуно-реактивность CD90 оценивали по иммуно-флуоресценции на 6-ой день. RLE-6TN клетки оставались нестимулированными (А) или стимулированными с помощью TGFβ+TNFα (В), CCL18 (С). Ядра окрашиваются с помощью ToPro3. Нестимулированные клетки не экспрессируют CD90 и видны только ядра. В отличие от этого, как TGFβ+TNFα, так и CCL18-стимулированные клетки экспрессируют CD90, о чем свидетельствует демонстрация формы клеток.
Фигура 10. CCL18-индуцированная экспрессия αSMA обнаружена в CCR6-трансфицированных RLE-6TN, но не ложно-трансфицированных клетках. В отличие от этого, TGFβ индуцируют экспрессию αSMA в обеих клеточных линиях.
Фигура 11. Первичную AECII человека стимулировали в течение 12 дней с использованием TGFβ+TNFα или CCL18 в отсутствии или присутствии TNFα. Весь клеточный лизат был выделен с помощью 10% SDS-PAGE и проанализирован с помощью вестерн-блоттинга. Нестимулированные клетки лишь в незначительной степени экспрессировали α-гладкомышечный актин (αSMA) и не экспрессировали виментин. Стимуляция с помощью TGFβ+TNFα и CCL18 отдельно или в комбинации с TNFα обеспечивала регуляцию с сильным повышением обеих молекул. Интересен тот факт, что цитокератин регулируется с понижением = подавляется с помощью TGFβ+TNFα, но сохраняется при использовании CCL18 отдельно или в комбинации с TNFα.
Фигура 12. Экспрессия CCR6 мононуклеарными клетками периферической крови через 7 дней культивирования в присутствии или отсутствии фитогемагглютинина (РНА; 5 мк/мл). Клеточные препараты разделили на группы препаратов с «высокой» или «низкой» экспрессией CCR6 на основании их первоначальной экспрессии CCR6. После культивирования нестимулированные препараты не изменили модель экспрессии CCR6. В отличие от этого, стимуляция фитогемагглютинином снизила экспрессию CCR6 в группе с высокой экспрессией и повысила экспрессию в группе с низкой экспрессией.
Фигура 13. Понижающая регуляция [даунрегуляция] рецептора CCR6 через 20 минут инкубации с помощью CCL18 (10 нг/мл). Инкубация с помощью CCL18 приводит к заметной понижающей регуляции поверхностной экспрессии CCR6. Этот эффект обусловлен интернализацией рецептора после лиганд-рецепторного взаимодействия.
Фигура 14. FACS [сортировка флуоресцентно-активированных клеток] анализ CCL18-индуцированной понижающей регуляции экспрессии CCR6 на лимфоцитах человека и его ингибирование ингибитором PS-AU-1015 (полипептид согласно SEQ ID NO.: 9). Субпопуляция свежевыделенных человеческих лимфоцитов экспрессирует рецептор CCR6 хемокина, видимый как более низкий пик с правой стороны основного пика (поз. контроль). При инкубации с помощью CCL18 (10 нг/мл) в течение 20 минут пик заметно снижается (только CCL18). После инкубации клеток с помощью CCL18 (10 нг/мл) в присутствии ингибитора PS-AU-1015 (SEQ ID NO: 9; 100 нг/мл), такая понижающая регуляция не происходит (CCL18+ ингибитор). Использование только ингибитора неэффективно.
Фигура 15. Окрашивание CCR6 в легочных секциях из контрольного легкого (А) и два легких с аденокарциномой (В, С). Окрашивание в контрольном легком не наблюдается, тогда как опухолевые клетки положительны по отношению к CCR6 (красного цвета, стрелки).
Фигура 16. Экспрессия CCR6 на поверхности клеток легкого с аденокарциномой (верхняя панель) и клеток мезотелиомы плевры (нижняя панель). Левый пик обозначает изотипный контроль, правый пик обозначает экспрессию CCR6. Две из трех клеточных линий аденокарциномы и все клеточные линии плевральной мезотелиомы демонстрируют маркированную экспрессию CCR6.
Фигура 17. Перечень праймеров, используемых для PCR [полимеразная цепная реакция].
Фигура 18. Вестерн-блот анализ сывороток от здоровых добровольцев, выступающих в качестве контрольной группы (n=3, полосы 1-3) и пациентов с фиброзом (UIP) (n=3; полосы 4-6) (А). Молекулярные размеры приведены на границе графика. (С = контроль; М = маркер белка). Денситометрический анализ вестерн-блотов (В).
Фигура 19. Анализ контрольных сывороток от здоровых добровольцев (n=9) и пациентов с фиброзом (UIP, n=19).
Фигура 20 Блокировка детектирования растворимого CCR6 (sCCR6) с помощью ELISA [твердофазный иммуноферментный анализ] с использованием CCR6 лигандов CCL18 и CCL20 (100 нг/мл каждый) в течение 1 часа. Низкая и средняя концентрации полностью блокируются, тогда как высокая концентрация уменьшается на одну треть. Сыворотка 1, 2 и 3 - это сыворотка от здоровых добровольцев.
Фигура 21. Процентное содержание лимфоцитов в бронхоальвеолярном лаваже от sCCR6-положительных и sCCR6-отрицательных контрольных объектов и (UIP) пациентов. Процентное содержание лимфоцитов значительно увеличено в сыворотке крови sCCR6-положительных пациентов. Этот эффект менее выражен в контрольной группе (незначительный).
Фигура 22. Процентное содержание CD3+ и HLA-DR+ лимфоцитов, NK-клеток и CDLA+ дендритных клеток в бронхоальвеолярном лаваже от sCCR6-положительных и sCCR6-отрицательных (UIP) пациентов.
Фигура 23. Все группы пациентов показали значительно повышенный уровень CCL18 в сыворотке крови по сравнению с контрольными.
Фигура 24. Средние уровни CCL18 всех Т стадий были значительно выше по сравнению с контрольной группой (p<0,0002). Кроме того, наблюдалась существенная разница между группами пациентов с самыми низкими против двух самых высоких Т-стадий.
Фигура 25. Определение точек отсечения с использованием кривой соотношений правильного и ложного обнаружения сигналов = кривой приемника/оператора (ROC, слева) и графиков против критериального значения (справа). ROC анализ выявил точку отсечения 83 нг/мл для различия между контрольной группой и пациентами с опухолью. Критериальный график показал точку отсечения 160 нг/мл для критерия смерти за период наблюдения.
Фигура 26. Каплана-Мейера-анализ выживаемости пациентов с NSCLC относительно уровня CCL18 в сыворотке крови.
Фигура 27. Каплана-Мейера-анализ выживаемости пациентов с аденокарциномой относительно уровня CCL18 в сыворотке крови.
Фигура 28. В подгруппе пациентов с аденокарциномой средние N-стадии в группе с высокими уровнями CCL18 в сыворотке крови значительно выше по сравнению с подгруппой с нормальными уровнями CCL18 в сыворотке крови.
Фигура 29. CCL18 индуцирует повышающую регуляцию экспрессии FSP1 в аденокарциномных клетках (А549). TGFβ использовали в объеме 2 нг/мл. Экспрессию определяли с помощью qPCR через 72 часа культивирования. (С = нестимулированные клетки).
Фигура 30. CCL 18 индуцирует экспрессию Snail в аденокарциномных клетках (А549). TGFβ использовали в объеме 2 нг/мл. Экспрессию определяли с помощью вестерн-блоттинга через 72 часа культивирования. (С = нестимулированные клетки).
Фигура 31. CCL18 индуцирует понижающую регуляцию экспрессии Е-кадгерина в аденокарциномных клетках (А549). TGFβ использовали в объеме 2нг/мл. Экспрессию определяли с помощью qPCR через 72 часа культивирования. (С = нестимулированные клетки).
Фигура 32. Процентное содержание CCR6-положительных фибробластов в пределах фибробластных линий, полученных из легких пациентов с различными опухолями.
Фигура 33 Перечень последовательностей SEQ ID NO: 1-9 и SEQ ID NO: 18-27.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При изучении нижеприведенного подробного описания настоящего изобретения следует понимать, что данное изобретение не ограничивается конкретной методологией, протоколами и реагентами, описанными в настоящем документе, поскольку они могут варьироваться. Также следует понимать, что терминология, используемая в настоящем документе, принята только в целях описания конкретных примеров осуществления изобретения и не предназначена для ограничения объема настоящего изобретения, который ограничивается только прилагаемой формулой изобретения. Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют общепринятый смысл, понятный обычному специалисту в данной области.
Несмотря на то, что в тексте данного описания приводятся несколько документов, которые включены со ссылкой во всей их полноте, ничто в данном документе не должно быть истолковано как признание, что изобретение не дает право датировать задним числом раскрытие сущности изобретения на основании предшествующего изобретения.
Вводятся следующие определения. В контексте данного описания и в предполагаемой формуле изобретения формы единственного числа существительных включают также соответствующие формы множественного числа, если иное четко не оговаривается.
Следует понимать, что термин «содержат», и такие варианты, как «содержит» и «содержащий» не ограничивающие. Для целей настоящего изобретения термин «состоящий из» считается предпочтительным вариантом термина «включающий».
Если в дальнейшем в этом документе обозначено, что группа содержит, как минимум, определенное количество примеров осуществления, это означает, что такое определение охватывает группу, которая предпочтительно состоит только из этих примеров.
Термины «примерно» и «приблизительно» в контексте настоящего изобретения обозначает диапазон точности, который специалистом в данной области техники рассматривается как диапазон, обеспечивающий технический эффект рассматриваемого признака. Этот термин обычно включает в себя отклонения от упомянутого числового значения в пределах ±10%, предпочтительно ±5%.
Процентная идентичность между двумя последовательностями предпочтительно определяется с помощью математического алгоритма Карлина и Альтшуля [Karlin and Altschul (1993) Proc. Natl. Acad. Sci USA 90: 5873-5877]. Такой алгоритм например, включен в программы BLASTn и BLASTp, Altschul et al. (1990) J. Mol. Biol. 20 215: 403-410, доступные на сайте NCBI (http://www.ncbi.nlm.nih.gov/blast/Blast.cgi).
Процентная идентичность предпочтительно определяется стандартными параметрами программ BLASTn и BLASTp.
Исследования полинуклеотида с помощью BLAST предпочтительно проводить, используя программу BLASTn.
Относительно общих параметров, в окне «Max Target Sequences» задать 100, отметить окно «Short queries», в окне «Expect threshold» задать 10, а в окне «Word Size» задать 28. Относительно параметров подсчета «Match/mismatch Scores» задать 1, -2, а в окне «Gap Costs» - Расходы пробела задать линейные значения. Относительно параметров фильтров и маскирования окно «Low complexity regions» не отмечать, окно «Species-specific repeats» не отмечать, окно «Mask for lookup table only» отметить, окно «Mask lower case letters» не отмечать.
Исследования белка с помощью BLAST предпочтительно проводить, используя программу BLASTp.
Относительно общих параметров в окне «Max Target Sequences» задать 100, отметить окно «Short queries», в окне «Expect threshold» задать 10, а в окне «Word Size» задать 3. Относительно параметров подсчета в окне «Matrix»-Матрица задать BLOSUM62, в окне «Gap Costs» задать Existence: 11 Extension: 1, в окне «Compositional adjustments» задать «Conditional compositional score matrix adjustment». Относительно параметров фильтров и маскирования окно «Low complexity regions» не отмечать, окно «Mask for lookup table only» отметить, а окно «Mask lower case letters» не отмечать.
Процент идентичности определяется по всей длине соответствующей эталонной последовательности, т.е. по всей длине последовательности согласно SEQ ID номеру или SEQ ID номерам, указанным в соответствующем контексте. Например, аминокислотная последовательность, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 1, имеет, как минимум, 80% идентичность по отношению к SEQ ID NO.: 1 по всей длине SEQ ID NO.: 1. В другом варианте последовательность, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 8, имеет, как минимум, 80% идентичность по отношению к SEQ ID NO.: 8 по всей длине SEQ ID NO.: 8.
Термин «объект», используемый в настоящем документе, относится к человеку или животному, предпочтительно млекопитающему, как например, не принадлежащие к человеческому роду приматы, мыши, крысы, кролики, морские свинки, собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи, козы и тому подобное. Предпочтительно «объект» в контексте настоящего изобретения - это человек.
Термины «рецептор CCR6 хемокина или «рецептор CCR6», «лиганд 18 хемокина» или «CCL 18» и «лиганд 20 хемокина» или «CCL20», упомянутые в контексте настоящего изобретения, хорошо известны в данной области. Таким образом, средний специалист может легко получить полинуклеотидные и аминокислотные последовательности рецептора CCR6, CCL18 и CCL20 и их ортологичные и сплайс-изоформы из любой подходящей общей базы данных, как например, база данных NCBI (http://www.ncbi.nlm.nih.gov/pubmed/). Термины «рецептор CCR6» и «CCR6» используются в настоящем документе равноправно.
«Рецептор CCR6», «CCL18» и «CCL20», как упоминаются в контексте настоящего изобретения, представляют собой предпочтительно рецептор CCR6 млекопитающих, CCL18 и CCL20, наиболее предпочтительно рецептор CCR6 человека и CCL18 человека или CCL20 человека. Рецептор CCR6 человека можно, например, найти в базе данных NCBI под номером NM 004367.5 (вариант транскрипта 1; SEQ ID NO.: 3) или NM 031409.3 (вариант транскрипта 2, SEQ ID NO.: 4). CCL18 человека можно, например, найти в базе данных NCBI под номером NM 002988.2 (SEQ ID NO.: 5). CCL20 человека можно, например, найти в базе данных NCBI под номером NM 004591,2 (вариант транскрипта 1; SEQ ID NO.: 6) или NM 001130046.1 (вариант транскрипта 2, SEQ ID NO.: 7).
CCR6 иногда также называют CD 196. CCL 18 иногда также называют легочным и активационно-регулируемым хемокином (PARC), альтернативным макрофагальным, ассоциированным с активацией СС хемокином 1 (АМАС-1), макрофагальным воспалительным белком-4 (MIP-4) или полученным из дендритных клеток хемокином 1 (DCCK1).
Термины IPF (идиопатический легочный фиброз) и UIP (обычная интерстициальная пневмония) используются в данном тексте как синонимы.
Авторы настоящего изобретения, как ни удивительно, обнаружили, что CCL18 представляет собой лиганд/агонист рецептора CCR6, член семи-трансмембранного G-белок-сопряженного семейства рецепторов хемокинов. Авторами также было установлено, что растворимый полипептид рецептора CCR6 можно найти в сыворотке крови у здоровых добровольцев, но их можно обнаружить только в незначительном количестве или вовсе не обнаружить в сыворотке крови людей, больных IPF. Авторами также установлено, что изолированный растворимый полипептид рецептора CCR6 может использоваться в терапии, в частности для лечения интерстициального заболевания легких или рака. Авторами также установлено, что ингибиторы активности рецептора CCR6 можно использовать для лечения интерстициального заболевания легких или рака.
Таким образом, в одном аспекте настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6, содержащего или состоящего из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет, как минимум, 80% идентичность относительно к последовательности согласно SEQ ID NO.: 1 и
(b) фрагмента аминокислотной последовательности в соответствии с (а);
в котором упомянутый растворимый изолированный полипептид рецептора CCR6 способен связываться с CCL18 и/или CCL20.
В предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением дополнительно содержит аминокислотную последовательность, которая имеет, как минимум, 80, 85, 90, 95 или 98% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту. В особенно предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением дополнительно содержит аминокислотную последовательность, которая имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту. В другом, особенно предпочтительном, варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением дополнительно содержит аминокислотную последовательность согласно SEQ ID NO.: 2 или ее фрагменту. В другом предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 или ее фрагменту, и аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту. Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 90% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 или ее фрагменту, и аминокислотную последовательность, которая имеет, как минимум, 90% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту. Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 или ее фрагменту, и аминокислотной последовательности, которая имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту.
Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением содержит или состоит из аминокислотной последовательности согласно SEQ ID NO.: 1 или ее фрагменту и аминокислотной последовательности согласно SEQ ID NO.: 2 или ее фрагменту.
Предпочтительно, CCL 18 и/или CCL20 представляет собой CCL 18 человека и/или CCL20 человека. Наиболее предпочтительно упомянутый CCL18 представляет собой полипептид согласно SEQ ID NO.: 18, а упомянутый CCL20 представляет собой полипептид согласно SEQ ID NO.: 19.
Термин «изолированный» в контексте настоящего изобретения означает, что полипептид или полинуклеотид извлечен из его естественной среды и/или представлены в виде, в котором они не встречаются в природе. «Изолированный» полипептид или «изолированный» полинуклеотид может быть также полипептидом или полинуклеотидом, который был создан in vitro.
Термин «изолированный растворимый полипептид рецептора CCR6» в соответствии с использованием в настоящем документе предназначен для отличия изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением от полипептидов мембраносвязанного рецептора, как например, мембраносвязанного рецептора CCR6. Например, в контексте настоящего изобретения любой природный растворимый полипептид рецептора CCR6, который в эндогенных условиях растворяется в биологической жидкости объекта (например, сыворотке, плазме, бронхоальвеолярном лаваже, плевральной жидкости, мокроте, слюне или моче) и не встроен в клеточную мембрану или не прикреплен к клеточной мембране, считается «растворимым».
Так, в одном варианте изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением может быть природным растворимым полипептидом рецептора CCR6, который был выделен из образца от объекта.
В другом варианте изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением может представлять собой также рекомбинантный полипептид, который был получен in vitro, и который, по существу, растворим в водных растворах, как например, физиологические водные растворы, предпочтительно в сыворотке крови, плазме, бронхоальвеолярном лаваже, плевральном выпоте, мокроте, слюне или моче. Наиболее предпочтительно в сыворотке крови.
В предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением, как минимум, на 50%, предпочтительно, как минимум, на 60%, более предпочтительно, как минимум, на 70%, более предпочтительно, как минимум, на 75%, более предпочтительно, как минимум, на 80%, более предпочтительно, как минимум, на 85% или наиболее предпочтительно, как минимум, на 90% растворим в водном растворе, предпочтительно в сыворотке крови, плазме, бронхоальвеолярном лаваже, плевральном выпоте, мокроте, слюне или моче. В особенно предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением, как минимум, на 75% растворим в водном растворе, предпочтительно в сыворотке крови, плазме, бронхоальвеолярном лаваже, плевральной жидкости, мокроте, слюне или моче. Для определения растворимости в процентном соотношении изолированного растворимого CCR6 полипептида в соответствии с изобретением специалист может, например, центрифугировать образец, содержащий полипептид, а затем измерить количество полипептида в супернатанте и общее количество полипептида в образце. Процентную растворимость можно рассчитать как процент от количества полипептида в супернатанте к общему количеству полипептида в образце до центрифугирования.
В предпочтительном варианте осуществления изобретения растворимость изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением в вышеупомянутых водных растворах не требует добавления детергентов. В другом предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением не содержит трансмембранный домен.
В одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 85%, более предпочтительно, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 1.
В особенно предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет 90%, 95% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 1.
В другом особенно предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) представляет собой последовательность согласно SEQ ID NO.: 1. Если изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением состоит из аминокислотной последовательности согласно SEQ ID NO.: 1, изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением предпочтительно имеет длину 48 аминокислот.
В другом предпочтительном варианте осуществления изобретения в аминокислотной последовательности в соответствии с (а) изменяются не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных последовательностей согласно SEQ ID NO:1 (то есть удаленные, вставленные, измененные и/или замененные другими аминокислотами).
Замещение в аминокислотной последовательности в соответствии с изобретением может быть консервативным или неконсервативным замещением, предпочтительно консервативным замещением. В некоторых вариантах осуществления изобретения замещение также включает замену природной аминокислоты неприродной аминокислотой. Консервативное замещение содержит замещение аминокислоты другой аминокислотой, имеющий химическое свойство, подобное замещаемой аминокислоте.
Предпочтительно, консервативное замещение представляет собой замещение, выбранное из группы, состоящей из:
(i) замещение основной аминокислоты другой, несходной основной аминокислотой;
(ii) замещение кислой аминокислоты другой, несходной кислой аминокислотой;
(iii) замещение ароматической аминокислоты другой, несходной ароматической аминокислотой;
(iv) замещение неполярной алифатической аминокислоты другой, несходной неполярной алифатической аминокислотой; и
(v) замещение полярной, незаряженной аминокислоты другой, несходной полярной, незаряженной аминокислотой.
Основная аминокислота предпочтительно выбирается из группы, состоящей из аргинина, гистидина и лизина. Кислая аминокислота предпочтительно представляет собой аспартат и глутамат.
Ароматическая аминокислота предпочтительно выбирается из группы, состоящей из фенилаланина, тирозина и триптофана. Неполярная алифатическая аминокислота предпочтительно выбирается из группы, состоящей из глицина, аланина, валина, лейцина, метионина и изолейцина. Полярная, незаряженная аминокислота предпочтительно выбирается из группы, состоящей из серина, треонина, цистеина, пролина, аспарагина и глутамина. В отличие от консервативного замещения аминокислоты неконсервативное замещение аминокислоты заключается в замене аминокислоты любой аминокислотой, которая не подпадает под изложенные выше консервативные замещения от (i) до (v).
Аминокислоты изолированного растворимого полипептида CCR6 в соответствии с изобретением также могут модифицированными, например химически модифицированными. Например, боковая цепь или свободный амино- или карбокси- конец аминокислоты белка могут быть модифицированы, например, с помощью гликозилирования, амидирования, фосфорилирования, убиквитинирования и т.д. В целях повышения внутриклеточной устойчивости и/или снижения иммунной реакции объекта на изолированный растворимый полипептид CCR6 в соответствии с изобретением изолированный растворимый полипептид CCR6 в соответствии с изобретением может быть, например, модифицирован путем ацетилирования, пегилирования, амидирования или D-аминокислотной инкорпорации.
В предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) содержит, как минимум, 8, как минимум, 9, как минимум, 10, как минимум, 11, как минимум, 12, как минимум, 13, как минимум, 14, как минимум, 15, как минимум, 16, как минимум, 17, как минимум, 18, как минимум, 19, как минимум, 20, как минимум, 25, как минимум, 30, как минимум, 35, как минимум, 40 или, как минимум, 45 последовательных аминокислот последовательности согласно SEQ ID NO.: 1. В особенно предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) содержит, как минимум, 8, как минимум, 15, как минимум, 20, как минимум, 30 или, как минимум, 40 аминокислот последовательности согласно SEQ ID NO.: 1.
В другом предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 80%, предпочтительно, как минимум, 85%, более предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, более предпочтительно, как минимум, 92%, более предпочтительно, как минимум, 93%, более предпочтительно, как минимум, 94%, более предпочтительно, как минимум, 95%, более предпочтительно, как минимум, 96%, более предпочтительно, как минимум, 97%, более предпочтительно, как минимум, 98%, более предпочтительно, как минимум, 99% и наиболее предпочтительно 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 и включает, как минимум, 8, более предпочтительно, как минимум, 12, более предпочтительно, как минимум, 15, более предпочтительно, как минимум, 20, более предпочтительно, как минимум, 25, более предпочтительно, как минимум, 30, более предпочтительно, как минимум, 35, более предпочтительно, как минимум, 40 и наиболее предпочтительно, как минимум, 45 последовательных аминокислот последовательности согласно SEQ ID N0.: 1.
Еще в одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95% или, как минимум, 98% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 и содержит, как минимум, 20, как минимум, 25, как минимум, 30 или, как минимум, 40 последовательных аминокислот последовательности согласно SEQ ID NO.: 1. В наиболее предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 и содержит, как минимум, 20 последовательных аминокислот последовательности согласно SEQ ID NO.: 1 или имеет, как минимум, 98% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 и содержит, как минимум, 25 последовательных аминокислот последовательности согласно SEQ ID NO.: 1.
В предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину менее 3000 аминокислот, предпочтительно менее 2000 аминокислот, более предпочтительно менее 1000 аминокислот, более предпочтительно менее 500 аминокислот, более предпочтительно менее 300 аминокислот, более предпочтительно менее 200 аминокислот, более предпочтительно менее 100 аминокислот или наиболее предпочтительно менее 80 аминокислот.
Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину от, как минимум, 8 до, как минимум, 3000 аминокислот, предпочтительно от, как минимум, 8 до, как минимум, 2000 аминокислот, более предпочтительно от, как минимум, 8 до, как минимум, 1000 аминокислот, более предпочтительно от, как минимум, 8 до 500 аминокислот, более предпочтительно от, как минимум, 8 до 300 аминокислот, более предпочтительно от, как минимум, 8 до 200 аминокислот, и еще более предпочтительно от, как минимум, 8 до 100 аминокислот или от, как минимум, 8 до 80 аминокислот.
В другом предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину от, как минимум, 20 до, как минимум, 3000 аминокислот, предпочтительно от, как минимум, 20 до, как минимум, 2000 аминокислот, более предпочтительно от, как минимум, 20 до, как минимум, 1000 аминокислот, более предпочтительно от, как минимум, 20 до 500 аминокислот, более предпочтительно от, как минимум, 20 до 300 аминокислот, более предпочтительно от, как минимум, 20 до 200 аминокислот, и еще более предпочтительно от, как минимум, 20 до 100 аминокислот или от, как минимум, 20 до 80 аминокислот.В другом предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину от, как минимум, 30 до, как минимум, 3000 аминокислот, предпочтительно от, как минимум, 30 до, как минимум, 2000 аминокислот, более предпочтительно от, как минимум, 30 до, как минимум, 1000 аминокислот, более предпочтительно от, как минимум, 30 до 500 аминокислот, более предпочтительно от, как минимум, 30 до 300 аминокислот, более предпочтительно от, как минимум, 30 до 200 аминокислот, и еще более предпочтительно от, как минимум, 30 до 100 аминокислот или от, как минимум, 30 до 80 аминокислот.
Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину от, как минимум, 40 до, как минимум, 3000 аминокислот, предпочтительно от, как минимум, 40 до, как минимум, 2000 аминокислот, более предпочтительно от, как минимум, 40 до, как минимум, 1000 аминокислот, более предпочтительно от, как минимум, 40 до 500 аминокислот, более предпочтительно от, как минимум, 40 до 300 аминокислот, более предпочтительно от, как минимум, 40 до 200 аминокислот, и еще более предпочтительно от, как минимум, 40 до 100 аминокислот или от, как минимум, 40 до 80 аминокислот. Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину от, как минимум, 50 до, как минимум, 3000 аминокислот, предпочтительно от, как минимум, 50 до, как минимум, 2000 аминокислот, более предпочтительно от, как минимум, 50 до, как минимум, 1000 аминокислот, более предпочтительно от, как минимум, 50 до 500 аминокислот, более предпочтительно от, как минимум, 50 до 300 аминокислот, более предпочтительно от, как минимум, 50 до 200 аминокислот, и еще более предпочтительно от, как минимум, 50 до 100 аминокислот или от, как минимум, 50 до 80 аминокислот. В особенно предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину от, как минимум, 20 до, как минимум, 500 аминокислот.
В другом предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину, как минимум, 8, более предпочтительно, как минимум, 10, более предпочтительно, как минимум, 20, более предпочтительно, как минимум, 30, более предпочтительно, как минимум, 40, более предпочтительно, как минимум, 45 и еще более предпочтительно, как минимум, 48 аминокислот. В особенно предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину, как минимум, 30, как минимум, 40 или, как минимум, 48 аминокислот. В особенно предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением имеет длину 48 аминокислот.
Фрагмент, как правило, представляет собой часть аминокислотной последовательности, к которой он относится.
В предпочтительном варианте осуществления изобретения фрагмент в соответствии с (b) имеет длину, как минимум, 8, как минимум, 9, как минимум, 10, как минимум, 11, как минимум, 12, как минимум, 13, как минимум, 14, как минимум, 15, как минимум, 16, как минимум, 17, как минимум, 18, как минимум, 19, как минимум, 20, как минимум, 21, как минимум, 22, как минимум, 23, как минимум, 24, как минимум, 25, как минимум, 26, как минимум, 27 или, как минимум, 28 аминокислот.В предпочтительном варианте осуществления изобретения фрагмент в соответствии с (b) имеет длину, как минимум, 10, как минимум, 15 или, как минимум, 20 аминокислот.В особенно предпочтительном варианте осуществления изобретения фрагмент в соответствии с (b) имеет длину, как минимум, 15 аминокислот, более предпочтительно, как минимум, 20, более предпочтительно, как минимум, 30 или наиболее предпочтительно, как минимум, 40 аминокислот. В другом особенно предпочтительном варианте осуществления изобретения фрагмент в соответствии с (b) имеет длину, как минимум, 40 аминокислот.
Способность изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением связываться с CCL18 и/или CCL20 можно определить любым подходящим способом, известным специалисту. Например, специалист может определить способность растворимого полипептида рецептора CCR6 в соответствии с изобретением связываться с CCL18 и/или CCL20 с помощью дрожжевого двухгибридного анализа или с помощью биохимического анализа, например, анализа выпадения, анализа коиммунопреципитации, твердофазного иммуноферментного анализа (ELISA), количественного анализа радиолигандного связывания, анализа плазменного резонанса или любым другим способом, известным специалистам. При использовании анализа выпадения или анализа плазменного резонанса полезно слить, как минимум, один из белков с аффинной меткой, например HIS-меткой, GST-меткой или другой меткой, хорошо известной в данной области биохимии.
В предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением обладает способностью ингибировать активность CCL18 и/или CCL20.
Термин «ингибирование активности CCL18 и/или CCL20», используемый в настоящем изобретении, означает, что активность CCL18 и/или CCL20 понижающе регулируется или аннулируется изолированным растворимым полипептидом рецептора CCR6 в соответствии с изобретением или любым другим соединением, способным ингибировать деятельность CCL18 и/или CCL20, описание которого приведено в настоящем документе (например, антитела, специфичные к CCL18 и/или CCL20).
Например, в одном примере осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением или любое другое соединение, способное ингибировать активность CCL18 и/или CCL20, описанное в настоящем документе, при связывании с CCL18 и/или CCL20 может ингибировать взаимодействие CCL18 и/или CCL20 с мембраносвязанным рецептором CCR6, так что CCL18 или CCL20 не может активировать упомянутый рецептор. Таким образом, ингибирование активности CCL18 и/или CCL20 может быть, например, обусловлено ингибированием взаимодействия CCL18 и/или CCL20 с мембраносвязанным рецептором CCR6. В другом варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением или любое другое соединение, способное ингибировать активность CCL18 и/или CCL20, описанное в настоящем документе, при связывании с CCL 18 и/или CCL20 может ингибировать хемотаксическую активность CCL18 и/или CCL20. Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением или любое другое соединение, способное ингибировать активность CCL18 и/или CCL20, описанное в настоящем документе, при связывании с CCL18 и/или CCL20 может ингибировать взаимодействие CCL18 и/или CCL20 с мембраносвязанным рецептором CCR6 и хемотаксическую активность CCL18 и/или CCL20. Изолированной растворимый полипептид рецептора CCR6 в соответствии с изобретением или любое другое соединение, способное ингибировать активность CCL18 25 и/или CCL20, описанное в настоящем документе, может, например, ингибировать активность CCL18 и/или CCL20 путем секвестирования упомянутых белков и тем самым снизить их биологическую доступность.
Способность изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность CCL18 и/или CCL20 лигандов рецептора CCR6 можно, например, определить измерением активности мембраносвязанного рецептора CCR6.
В одном варианте специалист может, например, определить способность изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность CCL18 и/или CCL20 путем инкубации клеток, экспрессирующих мембраносвязанный рецептор CCR6 в присутствии CCL18 или CCL20, и в присутствии или отсутствии изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или любого другого тестируемого соединения и последующего лизиса клеток и анализа фосфорилирования ERK, нисходящей молекулы сигнализации CCR6, методом Вестерн-блотинга. В этом примере низкий уровень фосфорилирования ERK в присутствии изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или любого другого тестируемого соединения по сравнению с уровнем фосфорилирования ERK в отсутствии изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или любого другого тестируемого соединения показывает, что изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением или другое тестируемое соединение способны ингибировать активность мембраносвязанного рецептора CCR6 с помощью CCL18 и/или CCL20. Один из способов определения фосфорилирования ERK с помощью Вестерн-блотинг анализа, например, описан в работе Lin et al. J Proteome Res. 2010 Jan; 9(1):283-97. В аналогичном примере фосфорилирование других нисходящих эффекторов рецептора CCR6, например, Akt, SAPK/JNK киназы, фосфатидилинозитол-3-киназа или фосфолипаза С, можно проанализировать, чтобы определить способность изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность CCL18 и/или CCL20.
Способность изолированного растворимого полипептида CCR6 в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность CCL18 и/или CCL20 можно, например, также определить путем измерения хемотаксической активности CCL18 и/или CCL20.
Хемотаксическую активность CCL18 и/или CCL20 можно, например, определить путем проведения хемотаксического анализа в присутствии или отсутствии изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или любого другого тестируемого соединения. Специалист может, например, выполнить хемотаксический анализ в камере. Пример такого анализа, например, описан в работе Christopherson et al. J Pharmacol Exp Ther. 2002 Jul; 302(1):290-5. Снижение хемотаксической активности CCL18 и/или CCL20 в присутствии изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или другого тестируемого соединения показывает, что изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением или другое тестируемое соединение способны ингибировать хемотаксическую активность CCL18 и/или CCL20.
Кроме того, способность изолированного растворимого полипептида CCR6 в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность CCL18 можно, например, также определить путем измерения CCL18-стимулированного высвобождения FGF2 или CCL18-опосредованной индукции коллагена и/или α-SMA в присутствии упомянутого изолированного растворимого полипептида CCR6 или другого соединения. В этом примере ингибирование CCL18-индуцированной повышающей регуляции FGF2 и/или ингибирование CCL18-опосредованной индукции коллагена и/или α-SMA экспрессии в присутствии изолированного растворимого полипептида CCR6 или другого тестируемого соединения в сравнении с контрольным образцом, к которому изолированный растворимый полипептид CCR6 или другое соединение не добавили, указывает, что изолированный растворимый полипептид CCR6 или другое соединение способны ингибировать активность CCL18. Помимо этого, чтобы определить способность изолированного растворимого полипептида CCR6 в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность CCL18, специалист может определить, происходит ли понижающая регуляция или аннулирование индукции эпителиально-мезенхимального перехода (ЕМТ) с помощью CCL18.
Альтернативно или дополнительно могут использоваться любые другие способы, которые подходят для определения активности CCL18 и/или CCL20 и которые существуют в данной области и известны среднему специалисту.
Изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением или любое другое соединение, которое способно ингибировать активность CCL18 и/или CCL20, может ингибировать активность CCL18 и/или CCL20, как минимум, на 10%, как минимум, на 20%, как минимум, на 30%, как минимум, на 40%, как минимум, на 50%, как минимум, на 60%, как минимум, на 70%, более предпочтительно, как минимум, на 80%, как минимум, на 90%, как минимум, на 91%, как минимум, на 92%, как минимум, на 93%, как минимум, на 94%, как минимум, на 95%, как минимум, на 96%, как минимум, на 97%, как минимум, на 98% или, как минимум, на 99% по сравнению с контролем. В предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением или любое другое соединение, которое способно ингибировать активность CCL18 и/или CCL20, ингибирует активность CCL18 и/или CCL20, как минимум, на 50%, как минимум, на 60% или, как минимум, на 70%. В другом предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением или любое другое соединение, описанное в настоящем документе, которое способно ингибировать активность CCL18 и/или CCL20, может ингибировать активность CCL18 и/или CCL20 на 100%.
В другом предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением не содержит трансмембранный домен.
Термин «трансмембранный домен» используется в настоящем документе в его обычном и хорошо известном значении в данной области. Трансмембранный домен, например, может быть частью белка, в котором содержится высокий процент неполярных, гидрофобных аминокислотных остатков, как например, валин, лейцин, изолейцин, тирозин, фенилаланин и триптофан, и который обеспечивает разделение белка на липидную бислойную мембрану. Термин «высокий процент неполярных, гидрофобных аминокислотных остатков» означает, что, как минимум, 50%, предпочтительно, как минимум, 60%, более предпочтительно, как минимум, 70%, более предпочтительно, как минимум, 80%, более предпочтительно, как минимум, 5 90%, наиболее предпочтительно, как минимум, 95% или более аминокислот трансмембранного домена являются неполярными, гидрофобными аминокислотными остатками.
В другом аспекте настоящее изобретение относится к изолированному полинуклеотиду, кодирующему растворимый изолированный полипептид рецептора CCR6 в соответствии с изобретением.
В предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину менее 9000 нуклеотидов, менее 8000 нуклеотидов, менее 7000 нуклеотидов, менее 6000 нуклеотидов, менее 5000 нуклеотидов, менее 4000 нуклеотидов, менее 3000 нуклеотидов, менее 2000 нуклеотидов, менее 1000 нуклеотидов, менее 500 нуклеотидов или менее 300 нуклеотидов.
Еще в одном предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину от, как минимум, 24 до 9000 нуклеотидов, предпочтительно от, как минимум, 24 до 8000 нуклеотидов, более предпочтительно от, как минимум, 24 до 7000 нуклеотидов, более предпочтительно от, как минимум, 24 до 6000 нуклеотидов, более предпочтительно от, как минимум, 24 до 5000 нуклеотидов, более предпочтительно от, как минимум, 24 до 4000 нуклеотидов, более предпочтительно от, как минимум, 24 до 3000 нуклеотидов, более предпочтительно от, как минимум, 24 до 2000 нуклеотидов, более предпочтительно от, как минимум, 24 до 1000 нуклеотидов или еще более предпочтительно от, как минимум, 24 до 500 нуклеотидов или еще более предпочтительно от, как минимум, 24 до 300 нуклеотидов. В другом предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину от, как минимум, 60 до 9000 нуклеотидов, предпочтительно от, как минимум, 60 до 8000 нуклеотидов, более предпочтительно от, как минимум, 60 до 7000 нуклеотидов, более предпочтительно от, как минимум, 60 до 6000 нуклеотидов, более предпочтительно от, как минимум, 60 до 5000 нуклеотидов, более предпочтительно от, как минимум, 60 до 4000 нуклеотидов, более предпочтительно от, как минимум, 60 до 3000 нуклеотидов, более предпочтительно от, как минимум, 60 и 2000 нуклеотидов, более предпочтительно от, как минимум, 60 до 1000 нуклеотидов или еще более предпочтительно от, как минимум, 60 до 500 нуклеотидов или еще более предпочтительно от, как минимум, 60 до 300 нуклеотидов. Еще в одном предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину от, как минимум, 90 до 9000 нуклеотидов, предпочтительно от, как минимум, 90 до 8000 нуклеотидов, более предпочтительно от, как минимум, 90 до 7000 нуклеотидов, более предпочтительно от, как минимум, 90 до 6000 нуклеотидов, более предпочтительно от, как минимум, 90 до 5000 нуклеотидов, более предпочтительно от, как минимум, 90 до 4000 нуклеотидов, более предпочтительно от, как минимум, 90 до 3000 нуклеотидов, более предпочтительно от, как минимум, 90 до 2000 нуклеотидов, более предпочтительно от, как минимум, 90 до 1000 нуклеотидов или еще более предпочтительно от, как минимум, 90 до 500 нуклеотидов или еще более предпочтительно от, как минимум, 90 до 300 нуклеотидов. Еще в одном предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину от, как минимум, 120 до 9000 нуклеотидов, предпочтительно от, как минимум, 120 до 8000 нуклеотидов, более предпочтительно от, как минимум, 120 до 7000 нуклеотидов, более предпочтительно от, как минимум, 120 до 6000 нуклеотидов, более предпочтительно от, как минимум, 120 до 5000 нуклеотидов, более предпочтительно от, как минимум, 120 до 4000 нуклеотидов, более предпочтительно от, как минимум, 120 до 3000 нуклеотидов, более предпочтительно от, как минимум, 120 до 2000 нуклеотидов, более предпочтительно от, как минимум, 120 до 1000 нуклеотидов или еще более предпочтительно от, как минимум, 120 до 500 нуклеотидов или еще более предпочтительно от, как минимум, 120 до 300 нуклеотидов. Еще в одном предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину от, как минимум, 140 до 9000 нуклеотидов, предпочтительно от, как минимум, 140 до 8000 нуклеотидов, более предпочтительно от, как минимум, 140 до 7000 нуклеотидов, более предпочтительно от, как минимум, 140 до 6000 нуклеотидов, более предпочтительно от, как минимум, 140 до 5000 нуклеотидов, более предпочтительно от, как минимум, 140 до 4000 нуклеотидов, более предпочтительно от, как минимум, 140 до 3000 нуклеотидов, более предпочтительно от, как минимум, 140 до 2000 нуклеотидов, более предпочтительно от, как минимум, 140 до 1000 нуклеотидов или еще более предпочтительно от, как минимум, 140 до 500 нуклеотидов или еще более предпочтительно от, как минимум, 140 до 300 нуклеотидов.
В другом предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, 24 нуклеотида, как минимум, 50 нуклеотидов, как минимум, 60 нуклеотидов, как минимум, 70 нуклеотидов, как минимум, 80 нуклеотидов, как минимум, 90 нуклеотидов, как минимум, 100 нуклеотидов, как минимум, 200 нуклеотидов, как минимум, 500 нуклеотидов, как минимум, 800 нуклеотидов, как минимум, 1000 нуклеотидов, как минимум, 1500 нуклеотидов, как минимум, 2000 нуклеотидов, как минимум, 2500 нуклеотидов, как минимум, 3000 нуклеотидов или, как минимум, 3500 нуклеотидов. В особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, 24, как минимум, 50 нуклеотидов, как минимум, 60 нуклеотидов, как минимум, 70 нуклеотидов, как минимум, 80 нуклеотидов, как минимум, 90 нуклеотидов, как минимум, 100 нуклеотидов, как минимум, 200 нуклеотидов. В особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, 140 нуклеотидов.
В другом особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину 144 нуклеотида.
Специалисту будет понятно, что вследствие вырожденности генетического кода данный полипептид в соответствии с изобретением может кодироваться различными нуклеотидными последовательностями.
В предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 8.
Еще в одном предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 85%, предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 8. В особенно предпочтительном варианте осуществления изобретения полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 85%, предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 95% или еще более предпочтительно, как минимум, 98% идентичность по отношению к последовательности согласно SEQ ID NO.: 8.
В особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 8. В другом особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением содержит или состоит из последовательности согласно SEQ ID NO.: 8.
Изолированный полинуклеотид в соответствии с изобретением может представлять собой одно- или двуцепочечную молекулу РНК или ДНК.
В некоторых вариантах осуществления изобретения изолированный полинуклеотид в соответствии с изобретением может быть вставлен в вектор экспрессии. Вектор экспрессии может представлять собой, например, прокариотический или эукариотический вектор экспрессии, как например, плазмида, минихромосома, космида, бактериальный фаг, ретровирусный вектор или любой иной вектор, известный специалистам. Специалист знает, как выбирать соответствующий вектор в зависимости от конкретных потребностей.
Таким образом, настоящее изобретение также относится к вектору экспрессии, содержащему полинуклеотид в соответствии с изобретением.
Еще в одном аспекте настоящее изобретение относится к способу количественной оценки концентрации растворимого полипептида рецептора CCR6 в жидком образце от объекта, в котором способ включает следующие стадии:
(a) иммобилизация захватывающей молекулы, специфичной к упомянутому растворимому полипептиду рецептора CCR6 на твердой подложке;
(b) добавление жидкого образца от объекта;
(c) факультативное добавление лиганда упомянутого растворимого полипептида рецептора CCR6, в котором упомянутый лиганд представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 18., SEQ ID NO.: 19, SEQ ID NO.: 20 или SEQ ID NO.: 21;
(d) добавление детектирующего агента, специфичного к лиганду в соответствии с (с), в котором упомянутый детектирующий агент содержит метку;
(e) количественная оценка сигнала от детектирующего агента в соответствии с (d).
В предпочтительном варианте осуществления вышеупомянутого способа стадии (а), (b), (с), (d), (е) осуществляются в этом порядке. Способ предпочтительно выполняется in vitro.
Термин «растворимый полипептид рецептора CCR6», используемый в настоящем документе, подразумевает полипептид рецептора CCR6, который не встроен в клеточную мембрану или не прикреплен к клеточной мембране. «Растворимый полипептид рецептора CCR6», таким образом, следует отличать от «мембраносвязанного рецептора CCR6». Например, в контексте настоящего изобретения любой природный растворимый полипептид рецептора CCR6, который в эндогенных условиях растворяется в биологической жидкости объекта (например, сыворотке, плазме, бронхоальвеолярном лаваже, плевральной жидкости, мокроте, слюне или моче) и не встроен в клеточную мембрану или не прикреплен к клеточной мембране, считается «растворимым».
Таким образом, в одном примере «растворимый полипептид рецептора CCR6» в рамках вышеупомянутого способа в соответствии с изобретением может быть природным растворимым полипептидом рецептора CCR6. В одном предпочтительном варианте осуществления изобретения упомянутый природный растворимый полипептид рецептора CCR6 может быть обнаружен с помощью анти-ССРб антитела, направленного к N-концевому внеклеточному домену CCR6.
В другом предпочтительном варианте осуществления изобретения природный растворимый полипептид рецептора CCR6 содержит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO: 1; и
(b) фрагмента аминокислотной последовательности в соответствии с (а);.
в котором упомянутый изолированный растворимый полипептид рецептора CCR6 способен связываться с CCL18 и/или CCL20.
В одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 85%, более предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 95% или еще более предпочтительно, как минимум, 98% идентичность по отношению к последовательности согласно SEQ ID NO.: 1. В особенно предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO.: 1. В наиболее предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 1.
В другом особенно предпочтительном варианте осуществления изобретения природный растворимый полипептид рецептора CCR6 содержит или состоит из аминокислотной последовательности согласно SEQ ID NO.: 1.
В другом варианте «растворимый полипептид рецептора CCR6» в рамках вышеупомянутого способа в соответствии с изобретением может быть также рекомбинантным «растворимым полипептидом рецептора CCR6», который был создан in vitro и который растворим в водных растворах, как например, физиологические водные растворы, предпочтительно в сыворотке крови, плазме, бронхоальвеолярном лаваже, плевральном выпоте, мокроте, слюне или моче. В одном предпочтительном варианте осуществления изобретения растворимый полипептид рецептора CCR6 представляет собой изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением.
Предпочтительно «растворимый полипептид рецептора CCR6» в рамках вышеупомянутого способа в соответствии с изобретением, как минимум, на 50%, более предпочтительно, как минимум, на 60%, более предпочтительно, как минимум, на 70%, более предпочтительно, как минимум, на 75%, более предпочтительно, как минимум, на 80%, более предпочтительно, как минимум, на 85% или наиболее предпочтительно, как минимум, на 90% растворим в водном растворе, предпочтительно в сыворотке крови, плазме, бронхоальвеолярном лаваже, плевральном выпоте, мокроте, слюне или моче. В особенно предпочтительном варианте осуществления изобретения «растворимый полипептид рецептора CCR6» в рамках вышеупомянутого способа в соответствии с изобретением, как минимум, на 75% растворим в водном растворе, предпочтительно в сыворотке крови, плазме, бронхоальвеолярном лаваже, плевральном выпоте, мокроте, слюне или моче. Для определения растворимости в процентном соотношении «растворимого полипептида рецептора CCR6» специалист может, например, центрифугировать образец, содержащий растворимый полипептид рецептора CCR6, а затем измерить количество упомянутого полипептида в супернатанте и общее количество полипептида в образце. Процентную растворимость можно рассчитать как процент от количества полипептида рецептора CCR6 в супернатанте к общему количеству полипептида рецептора CCR6 в образце до центрифугирования.
В одном предпочтительном варианте осуществления вышеупомянутого способа в соответствии с изобретением жидкий образец от объекта выбирается из группы, состоящей из сыворотки, плазмы, бронхоальвеолярного лаважа, плеврального выпота, мокроты, слюны и мочи. В особенно предпочтительном варианте осуществления изобретения жидкий образец от объекта представляет собой сыворотку крови. Предпочтительно, образец выделен из тела объекта, от которого он получен.
В предпочтительном варианте осуществления изобретения упомянутая захватывающая молекула в соответствии с (а) и/или упомянутый детектирующий агент в соответствии с (d) представляет собой антитело или аптамер.
«Аптамер» может представлять собой ДНК, РНК или пептидный аптамер. Полинуклеотидный аптамер предпочтительно имеет длину примерно от 10 до примерно 300 нуклеотидов. Предпочтительно аптамер имеет длину примерно от 30 до примерно 100 нуклеотидов. Наиболее предпочтительно аптамер имеет длину примерно от 10 до 60 нуклеотидов. Аптамеры могут быть получены любым способом, известным в данной области, включая, например, синтетический, рекомбинантный способы и способ очистки.
Предпочтительно, антитело представляет собой моноклональное или поликлональное антитело. В некоторых вариантах осуществления изобретения антитело может быть также выбрано из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2.
Захватывающая молекула или детектирующий агент специфичны к данному соединению, например, растворимому полипептиду рецептора CCR6 или лиганду растворимого полипептида рецептора CCR6, если они связываются с упомянутым соединением с более высоким сродством, чем с любым другим соединением в образце (то есть, нецелевым). Предпочтительно, захватывающая молекула или детектирующий агент специфичны к данному соединению, если они связываются только с упомянутым соединением и совсем не связываются с нецелевым соединением. Детектирующий агент в соответствии с (d) содержит метку. Использовать можно любую пригодную метку, которая может прикрепляться к детектирующему агенту. Предпочтительно, метка детектируемая или катализирует ферментативную реакцию, продукт которой является детектируемым.
В одном предпочтительном варианте осуществления изобретения метка ковалентно или нековалентно прикреплена к детектирующему агенту. Примеры меток, которые могут прикрепляться к детектирующему агенту, содержат, например, флуоресцентные красители, как например, цианиновые красители, например,. Цианин 3, Цианин 5 или Цианин 7, Alexa Fluor красители, например, Alexa 594, Alexa 488 или Alexa 532, красители семейства флуоресцеина, R-фикоэритрин, Texas Red, родамин и флуоресцеинизотиоцианат (FITC). Детектирующие агенты также могут быть маркированы ферментами, как например, пероксидаза хрена, щелочная фосфатаза или бета-лактамаза, радиоизотопами, как например, 3H, 14С, 32Р, 33Р, 35S или 125I, металлом, как например, золото, или биотином. В особенно предпочтительном варианте осуществления изобретения метка представляет собой флуоресцентную метку. В другом варианте осуществления изобретения меткой также может быть вторичный детектирующий агент, содержащий метку в соответствии с вышеприведенным описанием. Предпочтительно вторичный детектирующий агент способен специфически связываться с описанным выше детектирующим агентом. В особенно предпочтительном варианте осуществления изобретения вторичный детектирующий агент является антителом.
В одном предпочтительном варианте осуществления изобретения детектирующий агент в соответствии с (d) специфичен к полипептиду, содержащему или состоящему из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 18., SEQ ID NO.: 19., SEQ ID NO.: 20 или SEQ ID NO.: 21. Еще в одном предпочтительном варианте осуществления изобретения детектирующий агент в соответствии с (d) специфичен к полипептиду, содержащему или состоящему из аминокислотной последовательностью, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 18. В другом предпочтительном варианте осуществления изобретения детектирующий агент в соответствии с (d) специфичен к полипептиду, содержащему или состоящему из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 19. Еще в одном предпочтительном варианте осуществления изобретения детектирующий агент в соответствии с (d) специфичен к полипептиду, содержащему или состоящему из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 20. Еще в одном предпочтительном варианте осуществления изобретения детектирующий агент в соответствии с (d) специфичен к полипептиду, содержащему или состоящему из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 21.
В наиболее предпочтительном варианте осуществления изобретения детектирующий агент в соответствии с (d) специфичен к полипептиду, содержащему или состоящему из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 18.
Предпочтительно упомянутый твердый носитель в соответствии с (а) представляет собой пластмассовую или стеклянную поверхность. Для обеспечения иммобилизации захватывающей молекулы на твердом носителе твердый носитель может быть в некоторых вариантах осуществления изобретения предварительно покрыт реагентом, выбранным из группы, состоящей из карбодииминов, имидо- или сукцинимидилэфиров, этансульфокислоты, глутаральдегида и полилизина.
В одном предпочтительном варианте осуществления изобретения упомянутый выше способ в соответствии с изобретением выполняется в титрационном микропланшете.
В другом предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%), как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 18, SEQ ID NO.: 19., SEQ ID NO.: 20 или SEQ ID NO.: 21. Еще в одном предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 18. В другом предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 19. Еще в одном предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%), как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 20. Еще в одном предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 21.
В особенно предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет 95%, как минимум, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 18, SEQ ID NO.: 19 или SEQ ID NO.: 20 или SEQ ID NO.: 21. В другом особенно предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет 95%, как минимум, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 18. В другом особенно предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет 95%, как минимум, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 19. Еще в одном особенно предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет 95%, как минимум, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 20. Еще в одном особенно предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет 95%, как минимум, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 21.
Еще в одном особенно предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO.: 18., SEQ ID NO.: 19, SEQ ID NO.: 20 или SEQ ID NO.: 21.
Еще в одном особенно предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO.: 18. В наиболее предпочтительном варианте осуществления изобретения лиганд в соответствии с (с) представляет собой полипептид, включающий или состоящий из аминокислотной последовательности согласно SEQ ID NO.: 18.
Вышеупомянутый способ в соответствии с изобретением может использоваться для количественной оценки общего количества растворимого полипептида рецептора CCR6 в жидком образце от объекта или количества растворимого полипептида рецептора CCR6, связанного с CCL18, CCL20 и/или бета дефенсином в жидком образце от объекта.
Если необходимо количественно оценить общее количество растворимого полипептида рецептора CCR6 в жидком образце, предпочтительно добавлять лиганд на стадии (с) для насыщения полипептида рецептора CCR6, присутствующего в образце с лигандом. Если необходимо количественно оценить растворимый полипептид рецептора CCR6, связанный с CCL18, CCL20 и/или бета дефенсином в жидком образце от объекта, предпочтительно не добавлять лиганд на стадии (с). Детектирующий агент в соответствии с (d) затем определит только лиганд-связанные растворимые полипептиды рецептора CCR6 в жидком образце.
Выбор соответствующего способа количественной оценки сигнала от детектирующего агента на стадии (е) будет зависеть от характера метки детектирующего агента. Соответствующие способы количественной оценки сигнала от меченного детектирующего агента хорошо известны в данной области.
Например, если меткой является фермент (как например, щелочная фосфатаза), можно добавить бесцветный субстрат (как например, ρ - нитрофенил фосфат), который преобразуется ферментом в окрашенный продукт. После добавления упомянутого субстрата количество окрашенного продукта, полученного с помощью фермента, можно, например, измерить спектрофотометрически.
В другом варианте, если меткой является флуоресцентный краситель, флуоресцентный сигнал можно, например, определить количественно с помощью лазерного сканера.
В другом аспекте настоящее изобретение также относится к способу детектирования и/или прогнозирования интерстициального заболевания легких или рака у объекта, в котором способ включает стадию определения уровня растворимого полипептида рецептора CCR6 в образце от упомянутого объекта.
Такой способ предпочтительно выполняется in vitro.
«Растворимый полипептид рецептора CCR6» в рамках вышеупомянутого способа в соответствии с изобретением предпочтительно является природным растворимым полипептидом рецептора CCR6.
В одном предпочтительном варианте осуществления изобретения растворимый полипептид рецептора CCR6 содержит или состоит из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 и
(b) фрагмента аминокислотной последовательности в соответствии с (а);
в котором упомянутый растворимый изолированный полипептид рецептора CCR6 способен связываться с CCL18 и/или CCL20.
В одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 85%, более предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 95% или еще более предпочтительно, как минимум, 98% идентичность по отношению к последовательности согласно SEQ ID NO.: 1. В особенно предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO:. 1. В наиболее предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 1.
В другом особенно предпочтительном варианте осуществления изобретения, растворимый полипептид рецептора CCR6 содержит или состоит из аминокислотной последовательности согласно SEQ ID NO.: 1.
Еще в одном предпочтительном варианте осуществления изобретения растворимый полипептид рецептора CCR6 представляет собой безлигандный растворимый полипептид рецептора CCR6. В этом контексте термин «безлигандный» означает, что растворимый полипептид рецептора CCR6 не связан с лигандом, как например, CCL18 или CCL20.
В одном варианте осуществления изобретения уровень растворимого полипептида рецептора CCR6 может определяться путем контактирования образца от объекта с детектирующим агентом, специфичным к CCR6, предпочтительно с детектирующим агентом, специфичным к растворимому полипептиду рецептора CCR6. Детектирующий агент специфичен к CCR6 или растворимому полипептиду рецептора CCR6, если он связывается с CCR6 или растворимым полипептидом рецептора CCR6 с высоким сродством, чем с любым другим соединением в образце (то есть, нецелевым). Предпочтительно, детектирующий агент специфичен к CCR6 или растворимому полипептиду рецептор CCR6, если он связывается только с CCR6 или растворимым полипептидом рецептора CCR6 и совсем не связывается с нецелевым соединением. В предпочтительном варианте осуществления изобретения детектирующий агент, специфичный к растворимому полипептиду рецептора CCR6, связывается с внеклеточным доменом CCR6. В особенно предпочтительном варианте осуществления изобретения детектирующий агент, специфичный к растворимому полипептиду рецептора CCR6, связывается с последовательностью согласно SEQ ID NO.: 1.
Предпочтительным детектирующим агентом для определения растворимого полипептида рецептора CCR6 является антитело или аптамер. Предпочтительно, антитело представляет собой моноклональное или поликлональное антитело. В некоторых вариантах осуществления изобретения антитело может быть также выбрано из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2. В одном предпочтительном варианте осуществления изобретения могут использоваться коммерчески доступные антитела, специфичные к CCR6 или растворимому полипептиду рецептора CCR6.
Антитела, описанные в настоящем документе, можно получить любым подходящим способом, известным специалистам в данной области. Поликлональные антитела можно, например, получить путем иммунизации животных антигеном выбора, в то время как моноклональные антитела определенной специфичности можно, например, получить с помощью гибридомной технологии, разработанной Колером и Мильштейном (Kohler and Milstein, 1976, Eur. J. Immunol., 6:511-519).
В предпочтительном варианте осуществления изобретения детектирующий агент в соответствии с вышеприведенным описанием может содержать детектируемую метку. Использовать можно любую пригодную метку, которая может прикрепляться к детектирующему агенту. В одном предпочтительном варианте осуществления изобретения детектируемая метка ковалентно или нековалентно прикреплена к детектирующему агенту. Примеры меток, которые могут прикрепляться к детектирующему агенту, включают, например, флуоресцентные красители, как например, цианиновые красители, например. Цианин 3, Цианин 5 или Цианин 7, Alexa Fluor красители, например, Alexa 594, Alexa 488 или Alexa 532, красители семейства флуоресцеина, R-фикоэритрин, Texas Red, родамин и флуоресцеинизотиоцианат (FITC). Детектирующие агенты также могут быть маркированы ферментами, как например, пероксидаза хрена, щелочная фосфатаза или бета-лактамаза, радиоизотопами, как например, 3H, 14C, 32Р, 33P, 35S или 125I, металлом, как например, золото, или биотином. В другом предпочтительном варианте осуществления изобретения детектируемый агент может быть также определен вторичным детектирующим агентом, содержащим метку в соответствии с вышеприведенным описанием.
Предпочтительно вторичный детектирующий агент способен специфически связываться с описанным выше детектирующим агентом. В особенно предпочтительном варианте осуществления изобретения вторичный детектирующий агент представляет собой антитело.
Уровень растворимого полипептида рецептора CCR6 в образце от объекта может определяться любым способом, известным в данной области. В некоторых вариантах осуществления изобретения уровень растворимого полипептида рецептора CCR6 в образце от объекта, может, например, определяться с помощью иммуноанализа, как например, ELISA, Вестерн-блот, иммунопреципитация или радиоиммуноанализ. Уровень растворимого полипептида рецептора CCR6 в образце от объекта может также определяться с помощью описанного выше способа количественного анализа растворимого полипептида рецептора CCR6 в жидком образце от объекта.
Термины «детектирование интерстициальной болезни легких» или «детектирование рака» в соответствии с использованием в настоящем документе означают, что у объекта или в образце от объекта можно идентифицировать наличие интерстициального заболевания легких или ракового заболевания или нарушения. Предпочтительно, заранее не известно, болен ли упомянутый объект интерстициальным заболеванием легких или раком соответственно. В одном предпочтительном варианте осуществления изобретения есть подозрение, что объект имеет интерстициальное заболевание легких или рак.
Для детектирования интерстициального заболевания легких или рака у объекта уровень растворимого полипептида рецептора CCR6 в образце от объекта может в некоторых вариантах осуществления изобретения определяться наряду с измерением или определением количества других соединений или факторов, указывающих на интерстициальное заболевание легких или рак соответственно. Например, известные маркеры интерстициального заболевания легких, как например, сывороточные маркеры сурфактантный белок (SP) А и D или известные маркеры рака можно обнаружить в одном и том же образце или в другом образце от объекта. Специалистам известны другие соответствующие маркеры.
В предпочтительном варианте осуществления изобретения описанный выше способ дополнительно включает стадию сравнения уровня растворимого полипептида рецептора CCR6, определенного в образце от объекта, с уровнем растворимого полипептида рецептора CCR6 в контрольном образце, в котором более низкий уровень растворимого полипептида рецептора CCR6, определенный в образце от объекта, по сравнению с контрольным образцом указывает на наличие интерстициального заболевания легких или рака у объекта.
В другом предпочтительном варианте осуществления изобретения описанный выше способ дополнительно включает стадию сравнения уровня безлигандного растворимого полипептида рецептора CCR6, определенного в образце от объекта, с уровнем безлигандного растворимого полипептида рецептора CCR6 в контрольном образце, когда более низкий уровень безлигандного растворимого полипептида рецептор CCR6, определенный в образце от объекта, по сравнению с контрольным, указывает на наличие интерстициального заболевания легких или рака у объекта. В этом контексте термин «безлигандный» означает, что растворимый полипептид рецептора CCR6 не связан с лигандом, как например, CCL18 или CCL20.
Чтобы определить общее количество растворимого полипептида рецептора CCR6 или количества лиганд-связанного/безлигандного растворимого полипептида рецептора CCR6 в образце от объекта, специалист может, например, применить описанный выше способ квантификации количества растворимого полипептида рецептора CCR6 в жидком образце от объекта.
В одном предпочтительном варианте осуществления изобретения контрольный образец представляет собой образец от здорового объекта. В предпочтительном варианте осуществления изобретения более низкий уровень растворимого полипептида рецептора CCR6, определенный в образце от объекта, по сравнению с контрольным образцом указывает на наличие интерстициального заболевания легких или рака у объекта. Предпочтительно, уровень растворимого полипептида рецептора CCR6, определенный в образце от объекта, как минимум, в 2 раза, предпочтительно, как минимум, в 3 раза, как минимум, в 4 раза, как минимум, в 5 раз, как минимум, в 10 раз, как минимум, в 20 раз, как минимум, в 30 раз, как минимум, в 40 раз, как минимум, в 50 раз, как минимум, в 60 раз, как минимум, в 70 раз, как минимум, в 80 раз, как минимум, в 90 раз, как минимум, в 100 раз, как минимум, в 500 раз, как минимум, в 1000 раз или, как минимум, в 10000 раза ниже, чем в контрольном образце. Наиболее предпочтительно, уровень растворимого рецептора CCR6, определенный в образце от объекта, как минимум, в 2 раза, как минимум, в 3 раза, как минимум, в 10 раз, как минимум, в 50 раз, как минимум, в 100 раз или, как минимум, в 1000 раз ниже, чем в контрольном образце. В одном предпочтительном варианте осуществления изобретения растворимый полипептид рецептора CCR6 является безлигандным растворимым полипептидом рецептора.
В другом предпочтительном варианте осуществления изобретения контрольным образцом также может быть образец, полученный от объекта, который болен интерстициальным заболеванием легких или раком (контрольный объект), т.е. объекта, у которого независимо диагностировано интерстициальное заболевание легких или рак, причем рак - это предпочтительно аденокарцинома, наиболее предпочтительно аденокарцинома легких. В таких случаях более низкий уровень растворимого рецептора полипептида CCR6, определенный в образце от объекта, в сравнении с контрольным образцом указывает на дальнейшее прогрессирование интерстициального заболевания легких или рака у объекта, от которого был получен образец, по сравнению с контрольным. В одном предпочтительном варианте осуществления изобретения растворимый полипептид рецептора CCR6 представляет собой безлигандный растворимый полипептид рецептора CCR6.
В контексте настоящего изобретения контрольный образец предпочтительно выделяется из тела объекта, от которого он получен.
Термин «прогнозирование интерстициального заболевания легких или рака» в соответствии с использованием в настоящем документе относится к прогнозированию течения или исхода диагностированного или детектированного интерстициального заболевания легких или рака, например, в течение определенного периода времени, например, во время лечения или после лечения. Этот термин может также относиться к определению шансов на выживание или выздоровление после интерстициального заболевания легких или рака, а также к прогнозированию ожидаемого времени выживания объекта.
Например, уровень растворимого полипептида рецептора CCR6 может определяться в образце от объекта в данный момент времени и сравниваться с соответствующим уровнем растворимого полипептида рецептора CCR6, определенным в образце от одного и того же объекта в более поздний момент времени, когда увеличение или снижение уровня растворимого полипептид рецептора CCR6 указывает на улучшение или ухудшение состояния болезни. Такой подход можно, например, использовать при лечении пациентов, страдающих от интерстициального заболевания легких или рака.
Так, в одном предпочтительном варианте осуществления изобретения вышеупомянутый способ в соответствии с изобретением можно также использовать для контроля эффективности лечения интерстициального заболевания легких или рака in vitro. Эффективность лечения интерстициального заболевания легких или рака можно, например, контролировать, определяя уровень растворимого полипептида CCR6 в разных образцах от объекта, которые были предоставлены в течение определенного периода времени, когда объект, от которого были получены образцы, лечили от интерстициального заболевания легких или рака. Увеличение или снижение уровня растворимого полипептида CCR6 в образцах, взятых от объекта за определенный период времени, может затем показать эффективность лечения. В одном предпочтительном варианте осуществления изобретения растворимый полипептид рецептора CCR6 представляет собой безлигандный растворимый полипептид рецептора CCR6.
В одном предпочтительном варианте осуществления изобретения уровень растворимого полипептида рецептора CCR6 в контрольном образце может быть определен параллельно с уровнем растворимого полипептида рецептора CCR6 в образце от объекта.
В другом предпочтительном варианте осуществления изобретения контрольный образец может быть заданным значением. Такое значение может, например, базироваться на результатах предыдущих экспериментов, определяющих уровень растворимого полипептида рецептора CCR6 в одном или нескольких образцах от здорового объекта или от объекта, о котором известно, что он болен интерстициальным заболеванием легких или раком. В некоторых вариантах осуществления изобретения заданное значение может быть получено из базы данных.
В одном предпочтительном варианте осуществления изобретения уровень растворимого полипептида рецептора CCR6 может сравниваться с двумя или более контрольными образцами, например, с 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более чем 100 контрольными образцами.
Предпочтительно образец от объекта, используемый в способах в соответствии с изобретением, выделяется из тела объекта. Образец предпочтительно представлен в жидком виде. В предпочтительном варианте осуществления изобретения жидкий образец выбирается из группы, состоящей из крови, сыворотки, плазмы, бронхоальвеолярного лаважа, плевральной жидкости, мокроты, слюны или мочи. В особенно предпочтительном варианте осуществления изобретения образец представляет собой сыворотку крови. Предпочтительно, образец бесклеточный и безмембранный. Для удаления клеток и клеточных мембран из образца перед определением уровня растворимого полипептида рецептора CCR6 специалист может, например, центрифугировать образец.
Еще в одном аспекте настоящее изобретение также относится к диагностическому набору для детектирования интерстициального заболевания легких или рака, включающий детектирующий агент, специфичный к CCR6 или растворимому полипептиду рецептора CCR6.
В предпочтительном варианте осуществления изобретения детектирующий агент, специфичный к растворимому полипептиду рецептора CCR6, специфически связывается с внеклеточным доменом CCR6. В особенно предпочтительном варианте осуществления изобретения детектирующий агент, специфичный к растворимому полипептиду рецептора CCR6, специфически связывается с последовательностью согласно SEQ ID NO.: 1.
В предпочтительном варианте осуществления изобретения упомянутый детектирующий агент представляет собой антитело или аптамер.
Предпочтительно, антитело представляет собой моноклональное или поликлональное антитело. В некоторых вариантах осуществления изобретения детектирующий агент может быть также выбран из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2. В одном предпочтительном варианте осуществления изобретения могут использоваться коммерчески доступные антитела, специфичные к CCR6 или растворимому полипептиду рецептора CCR6.
«Аптамером», специфичным к CCR6 или растворимому полипептиду рецептора CCR6, может быть, например, ДНК, РНК или пептидный аптамер.
Полинуклеотидный аптамер предпочтительно имеет длину примерно от 10 до 300 нуклеотидов. Предпочтительно аптамер имеет длину примерно от 30 до 100 нуклеотидов. Наиболее предпочтительно аптамер имеет длину примерно от 10 до 60 нуклеотидов.
Аптамеры можно получить любым известным способом, включая синтетический, рекомбинантный способы и способ очистки, их можно использовать отдельно или в комбинации с другими аптамерами, специфичными к CCR6 или растворимому полипептиду рецептора CCR6.
В одном предпочтительном варианте осуществления изобретения растворимый полипептид рецептора CCR6 в рамках описанного выше способа в соответствии с изобретением является безлигандным растворимым полипептидом рецептора CCR6.
В предпочтительном варианте осуществления вышеописанного способа интерстициальное заболевание легких выбирается из группы, состоящей из диффузного паренхиматозного заболевания легких известной причины (предпочтительно коллагеновое сосудистое заболевание или болезни, вызываемые загрязнением окружающей среды, или связанное с действием лекарственного средства диффузное паренхиматозное заболевание легких), гранулематозного диффузного паренхиматозного заболевания легких (предпочтительно саркоидоз) и других форм диффузного паренхиматозного заболевания легких (предпочтительно лимфангио лейомиоматоз (LAM), легочный лангергансоклеточный гистиоцитоз /гистиоцитоз Х (НХ) или эозинофильная пневмония).
В другом предпочтительном варианте осуществления вышеописанного способа интерстициальное заболевание легких является идиопатической интерстициальной пневмонией.
В особенно предпочтительном варианте осуществления вышеописанного способа интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, ассоциированного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии. Наиболее предпочтительно, интерстициальное заболевание легких является идиопатическим легочным фиброзом.
В другом предпочтительном варианте осуществления вышеописанного способа вид рака выбирается из группы, состоящей из рака легкого, рака молочной железы, рака поджелудочной железы, рака предстательной железы, нейробластомы, меланомы, рака мозга, рака почки, рака мочевого пузыря, рака яичника, рака крови и рака толстой кишки.
В особенно предпочтительном варианте осуществления вышеописанного способа вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы. Наиболее предпочтительно, рак представляет собой аденокарциному, предпочтительно аденокарциному легких.
Настоящее изобретение в другом аспекте также относится к фармацевтической композиции, содержащей соединение, способное ингибировать активность и/или экспрессию CCL18 или CCL20.
Фармацевтическая композиция в соответствии с изобретением может вводиться перорально, например, в виде пилюль, таблеток, лакированных таблеток, таблеток с сахарным покрытием, гранул, твердых и мягких желатиновых капсул, водных, спиртовых или масляных растворов, сиропов, эмульсий или суспензий, или ректально, например, в виде суппозиториев. Введение может также осуществляться парентерально, например, подкожно, внутримышечно или внутривенно в виде раствора для инъекций или инфузий. Другими подходящими формами введения является, например, чрескожное или местное введение, например, в виде мазей, настоек, спреев или трансдермальных терапевтических систем, или ингаляционное введение в форме назальных спреев или аэрозольных смесей.
В предпочтительном варианте осуществления изобретения фармацевтическая композиция в соответствии с изобретением вводится парентерально, например, в виде растворов для инъекций или инфузий, перорально, например, в форме таблетки, пилюли, пастилки или капсулы, или путем ингаляции.
Для изготовления пилюль, таблеток, таблеток с сахарным покрытием и твердых желатиновых капсул могут использоваться, например, лактоза, крахмал, например, кукурузный крахмал, или производные крахмала, тальк, стеариновая кислота или ее соли и т.д. Носителями для мягких желатиновых капсул и суппозиториев являются, например, жиры, воски, полутвердые и жидкие полиолы, природные или отвержденные жиры и т.д. Подходящими носителями для приготовления растворов, например, растворов для инъекций, или эмульсий или сиропов являются, например, вода, физиологический раствор хлористого натрия, спирты, такие как этанол, глицерин, полиолы, сахароза, инвертированный сахар, глюкоза, маннит, растительные масла и т.д.
В некоторых вариантах осуществления изобретения фармацевтические композиции также содержат добавки, как например, наполнители, разрыхлители, связующие вещества, смазывающие вещества, увлажняющие агенты, стабилизаторы, эмульгаторы, дисперсанты, консерванты, подсластители, красители, вкусовые вещества, ароматизаторы, загустители, разбавители, буферные вещества, растворители, солюбилизаторы, агенты для достижения депо-эффекта, соли для изменения осмотического давления, покровные вещества или антиоксиданты.
Примеры подходящих наполнителей для многообразных различных форм фармацевтических композиций, описанных здесь, можно, например, найти в "Handbook of Pharmaceutical Excipients", 2nd Edition, (1994), Edited by A Wade and PJ Weller.
В предпочтительном варианте осуществления изобретения соединение, способное ингибировать активность и/или экспрессию CCL18 или CCL20, выбирается из группы, состоящей из изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением, малой молекулы, способной связываться с CCL18 или CCL20, аптамера, специфичного к CCL18 или CCL20, антитела, специфичного к CCL18 или CCL20, антисмысловой молекулы, пригодной для снижения или ингибирования экспрессии CCL18 или CCL20, и молекулы сиРНК, пригодной для снижения или ингибирования экспрессии CCL18 или CCL20.
Термин «малая молекула», используемый в настоящем описании, относится к небольшим органическим соединениям с низкомолекулярным весом.
Малая молекула может быть синтетическим соединением, не встречающимся в природе, или природным соединением, выделенным из природных источников или встречающимся в природных источниках, как, например, клетки, растения, грибы, животные и тому подобное. Малая молекула в контексте настоящего изобретения предпочтительно имеет молекулярный вес менее 5000 Дальтон, более предпочтительно менее 4000 Дальтон, более предпочтительно менее 3000 Дальтон, более предпочтительно менее 2000 дальтон или еще более предпочтительно менее 1000 дальтон. В особенно предпочтительном варианте осуществления изобретения малая молекула в контексте настоящего изобретения имеет молекулярный вес менее 800 дальтон.
В другом предпочтительном варианте осуществления изобретения малая молекула в контексте настоящего изобретения имеет молекулярный вес от 50 до 3000 Дальтон, предпочтительно от 100 до 2000 Дальтон, более предпочтительно от 100 до 1500 Дальтон и еще более предпочтительно от 100 до 1000 Дальтон. Наиболее предпочтительно малая молекула в контексте настоящего изобретения имеет молекулярный вес от 100 до 800 Дальтон.
Малые молекулы, способные связываться с CCL18 или CCL20 можно, например, идентифицировать путем скрининга небольших библиотек соединений.
«Аптамер» может быть ДНК, РНК или пептидным аптамером, специфичным к CCL18 или к CCL20.
Полинуклеотидный аптамер предпочтительно имеет длину от примерно 10 до примерно 300 нуклеотидов. Предпочтительно аптамер имеет длину от примерно 30 до примерно 100 нуклеотидов. Наиболее предпочтительно аптамер имеет длину от примерно 10 до 60 нуклеотидов.
Аптамеры можно получить любым известным способом, включая синтетический, рекомбинантный способы и способ очистки, их можно использовать отдельно или в комбинации с другими аптамерами, специфичными к CCL18 или CCL20.
Антитело, специфичное к CCL18 или для CCL20, может быть моноклональным или поликлональным антителом. В некоторых вариантах осуществления изобретения антитело может быть также выбрано из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2, при условии, что упомянутые варианты или фрагменты антитела специфичны к CCL18 или к CCL20.
Термин «антисмысловая молекула, пригодная для снижения или ингибирования экспрессии CCL18 или CCL20» относится к полинуклеотиду, комплиментарному CCL18 мРНК или CCL20 мРНК соответственно. Предпочтительно, упомянутая антисмысловая молекула пригодна для использования в антисмысловом подходе для ингибирования трансляции CCL18 мРНК или CCL20 мРНК в клетке. Упомянутая антисмысловая молекула может быть молекулой ДНК или РНК и может быть одноцепочечной или двухцепочечной. В предпочтительном варианте осуществления изобретения антисмысловая молекула представляет собой одноцепочечную молекулу ДНК или двухцепочечную или одноцепочечную молекулу РНК.
Антисмысловая молекула предпочтительно имеет длину от примерно 10 до примерно 500 нуклеотидов, от примерно 11 до примерно 200 нуклеотидов, от примерно 12 до примерно 100 нуклеотидов, от примерно 13 до примерно 75 нуклеотидов, или от примерно 14 до примерно 50 нуклеотидов, от примерно 15 до примерно 40 нуклеотидов, от примерно 16 до примерно 30 нуклеотидов, или от примерно 17 до примерно 25 нуклеотидов.
Молекула сиРНК, пригодная для снижения или ингибирования экспрессии CCL18 или CCL20, может быть одноцепочечной или двухцепочечной молекулой сиРНК, которая способна к гибридизации с CCL18 мРНК или CCL20 мРНК, тем самым индуцируя РНК-интерференцию или любой иной внутриклеточный антисмысловой механизм, который приводит к снижению или ингибированию экспрессии белка CCL18 или белка CCL20.
Упомянутая молекула сиРНК может быть любой последовательностью, которая дает возможность молекуле сиРНК индуцировать РНК-интерференцию, приводящую к снижению или ингибированию экспрессии белка CCL18 или белка CCL20.
Предпочтительно, молекула сиРНК имеет длину от 10 до 100, от 12 до 80, от 14 до 60, от 16 до 50, от 17 до 40, более предпочтительно от 18 до 30 нуклеотидов и наиболее предпочтительно от 18 до 26 нуклеотидов.
Соединение, способное снизить или ингибировать экспрессию CCL 18 или CCL20 или пригодное для снижения или ингибирования экспрессии CCL 18 или CCL20, может снизить или ингибировать экспрессию CCL18 или CCL20, как минимум, на 10%, как минимум, на 20%, как минимум, на 30%, как минимум, на 40%, как минимум, на 50%, как минимум, на 60%, как минимум, на 70%, более предпочтительно, как минимум, на 80%, как минимум, на 90%, как минимум, на 91%, как минимум, на 92%, как минимум, на 93%, как минимум, на 94%, как минимум, на 95%, как минимум, на 96%, как минимум, на 97%, как минимум, на 98% или, как минимум, на 99% по сравнению с контрольным образцом. В некоторых предпочтительных вариантах осуществления изобретения соединение, способное снизить или ингибировать экспрессию CCL18 или CCL20 или пригодное для снижения или ингибирования экспрессии CCL18 или CCL20, может снизить или ингибировать экспрессию CCL 18 или CCL20 на 100%.
В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция в соответствии с изобретением содержит дополнительное активное соединение, пригодное для лечения или предупреждения интерстициального заболевания легких и/или рака.
Примерами дополнительного активного соединения, пригодного для лечения интерстициального заболевания легких являются, например, противовоспалительные препараты, как например, преднизон или другие кортикостероиды, азатиоприн, метотрексат, микофенолат или циклофосфамид, антиоксиданты, как например, ацетилцистеин антифибротические агенты, как например, босентан или пирфенидон, миноциклин, силденафил, талидомид, анти-TNF антитела, как например, инфликсимаб; этанерцепт, интерферон гамма, анти-IL-13 антитела, ингибиторы эндотелина, зилеутон, антикоагулянты, макролиды, фосфодиэстеразы (PDE) 4 ингибиторы, как например, рофлумиласт, авиптадил, альфа-меланоцит-стимулирующий гормон (альфа-МСГ), ингибиторы тирозинкиназы, как например, иматиниб, дазатиниб и нилотиниб.
Дополнительным активным соединением, пригодным для лечения рака, предпочтительно является химиотерапевтический агент. Химиотерапевтические агенты, пригодные для лечения рака, хорошо известны специалистам. Примерами химиотерапевтических агентов являются, например, темозоломид, адриамицин, доксорубицин, эпирубицин, 5-фторурацил, цитозинарабинозид («Ага-С»), циклофосфамид, тиотепа, бусульфан, цитоксин, таксоиды, например, паклитаксел, токсотер, метотрексат, цисплатин, мелфалан, винбластин, блеомицин, этопозид, ифосфамид, митомицин С, митоксантрон, винкристин, винорельбин, карбоплатин, тенипозид, дауномицин, карминомицин, аминоптерин, дактиномицин, митомицины, мелфалан и другие соответствующие азотистые иприты и гормональные агенты, действие которых направлено на регулирование или ингибирование действия гормонов на опухоли, такие как тамоксифен и онапристон.
Фармацевтическая композиция в соответствии с изобретением может содержать один или несколько дополнительных активных соединений, пригодных для лечения или предупреждения интерстициального заболевания легких, и/или один или несколько дополнительных активных соединений, пригодных для лечения или предупреждения рака. В предпочтительном варианте осуществления изобретения фармацевтическая композиция в соответствии с изобретением содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 дополнительных активных соединений, пригодных для лечения или предупреждения интерстициального заболевания легких, и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 дополнительных активных соединений, пригодных для лечения рака.
В других предпочтительных вариантах осуществления изобретения один или несколько отдельных композиций, содержащих активные соединения, пригодные для лечения или предупреждения интерстициального заболевания легких, и/или активное соединение, пригодное для лечения или предупреждения рака, можно вводить объекту, предпочтительно человеку, в сочетании с фармацевтической композицией в соответствии с изобретением, содержащей соединение, способное ингибировать активность и/или экспрессию CCL18 или CCL20.
В предпочтительном варианте осуществления изобретения интерстициальное заболевание легких выбирается из группы, состоящей из диффузного паренхиматозного заболевания легких известной причины (предпочтительно коллагеновое сосудистое заболевание или болезни, вызываемые загрязнением окружающей среды, или связанное с действием лекарственного средства диффузное паренхиматозное заболевание легких), гранулематозного диффузного паренхиматозного заболевания легких (предпочтительно саркоидоз) и других форм диффузного паренхиматозного заболевания легких (предпочтительно лимфангио лейомиоматоз (LAM), легочный лангергансоклеточный гистиоцитоз/гистиоцитоз Х (НХ) или эозинофильная пневмония).
В другом предпочтительном варианте осуществления изобретения интерстициальное заболевание легких является идиопатической интерстициальной пневмонией.
В особенно предпочтительном варианте осуществления изобретения интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, ассоциированного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии. Наиболее предпочтительно, интерстициальное заболевание легких является идиопатическим легочным фиброзом.
В другом предпочтительном варианте осуществления изобретения вид рака выбирается из группы, состоящей из рака легкого, рака молочной железы, рака поджелудочной железы, рака предстательной железы, нейробластомы, меланомы, рака мозга, рака почки, рака мочевого пузыря, рака яичника, рака крови и рака толстой кишки.
В особенно предпочтительном варианте осуществления изобретения вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы. Наиболее предпочтительно, рак представляет собой аденокарциному, преимущественно аденокарциному легких.
Авторы настоящего изобретения неожиданно обнаружили, что изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением пригоден для терапевтического использования.
Таким образом, в следующем аспекте настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением для применения в терапии.
Было установлено, что некоторые заболевания характеризуются повышенным уровнем CCL18 или CCL20 в сыворотке крови, и это означает, что уровни CCL18 или CCL20 в сыворотке от пациента, имеющего это заболевание, повышенный по сравнению с уровнем CCL18 или CCL20 в сыворотке крови от здоровых контрольных объектов.
Таким образом, настоящее изобретение также относится к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением или к фармацевтической композиции в соответствии с изобретением для использования для лечения или предупреждения заболевания, характеризующегося повышенным уровнем CCL18 и/или CCL20 в сыворотке крови. Термин «повышенный уровень CCL18 и/или CCL20 в сыворотке» означает, что уровень CCL18 и/или CCL20 в сыворотке крови пациентов, имеющих это заболевание, повышенный по сравнению с уровнем CCL18 и/или CCL20 в сыворотке от здорового контрольного объекта.
В другом аспекте настоящее изобретение также относится к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением или к фармацевтической композиции в соответствии с изобретением для использования для лечения или предупреждения заболевания, выбранного из группы, состоящей из интерстициального заболевания легких, рака, болезни Гоше, талассемии, предпочтительно β-талассемии, ревматоидного артрита, ретроперитонеального фиброза (болезнь Ормонда) и/или хронического воспалительного заболевания кожи, предпочтительно атопического дерматита или буллезного пемфигоида.
В предпочтительном варианте осуществления изобретения интерстициальное заболевание легких выбирается из группы, состоящей из диффузного паренхиматозного заболевания легких известной причины (предпочтительно коллагеновое сосудистое заболевание или болезни, вызываемые загрязнением окружающей среды, или связанное с действием лекарственного средства диффузное паренхиматозное заболевание легких), гранулематозного диффузного паренхиматозного заболевания легких (предпочтительно саркоидоз) и других форм диффузного паренхиматозного заболевания легких (предпочтительно лимфангиолейомиоматоз (LAM), легочный лангергансоклеточный гистиоцитоз/гистиоцитоз Х (НХ) или эозинофильная пневмония).
В другом предпочтительном варианте осуществления изобретения интерстициальное заболевание легких является идиопатической интерстициальной пневмонией.
В особенно предпочтительном варианте осуществления изобретения интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, ассоциированного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии. Наиболее предпочтительно, интерстициальное заболевание легких является идиопатическим легочным фиброзом.
В другом предпочтительном варианте осуществления изобретения вид рака выбирается из группы, состоящей из рака легкого, рака молочной железы, рака поджелудочной железы, рака предстательной железы, нейробластомы, меланомы, рака мозга, рака почки, рака мочевого пузыря, рака яичника, рака крови и рака толстой кишки.
В особенно предпочтительном варианте осуществления изобретения вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы. Наиболее предпочтительно, рак представляет собой аденокарциному, предпочтительно аденокарциному легких.
Еще в одном аспекте настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением или фармацевтической композиции в соответствии с изобретением для использования для лечения или предупреждения интерстициального заболевания легких и/или рака.
В соответствии с использованием в настоящем документе термин «предупреждение» и его грамматические эквиваленты относятся к любому уменьшению предрасположенности к интерстициальному заболеванию легких и/или раку или риска развития у объекта интерстициального заболевания легких и/или рака.
В другом аспекте настоящее изобретение относится к использованию изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением или фармацевтической композиции в соответствии с изобретением для изготовления лекарственного препарата для лечения или предупреждения интерстициального заболевания легких и/или рака.
В другом аспекте настоящее изобретение относится также к детектирующему агенту, специфичному к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением.
В предпочтительном варианте осуществления изобретения детектирующий агент является антителом или аптамером.
«Аптамер» может быть ДНК, РНК или пептидным аптамером. Полинуклеотидный аптамер предпочтительно имеет длину примерно от 10 до 300 нуклеотидов. Предпочтительно аптамер имеет длину примерно от 30 до 100 нуклеотидов. Наиболее предпочтительно аптамер имеет длину примерно от 10 до 60 нуклеотидов. Аптамеры могут быть получены любым способом, известным в данной области, включая, например, синтетический, рекомбинантный способы и способ очистки.
Предпочтительно, антитело представляет собой моноклональное или поликлональное антитело. В некоторых вариантах осуществления изобретения детектирующий агент может быть также выбран из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2. Детектирующий агент предпочтительно содержит детектируемую метку. Пригодные метки описаны выше.
Детектирующий агент специфичен к изолированному растворимому полипептиду рецептора CCR6 в соответствии с настоящим изобретением, если он связывается с растворимым полипептидом рецептора CCR6 в соответствии с настоящим изобретением с более высоким сродством, чем с любым другим соединением в образце (то есть, нецелевым). Предпочтительно, детектирующий агент специфичен к растворимому полипептиду рецептора CCR6 в соответствии с настоящим изобретением, если он связывается только с растворимым полипептидом рецептора CCR6 в соответствии с настоящим изобретением и совсем не связываются с нецелевым соединением.
В предпочтительном варианте осуществления изобретения интерстициальное заболевание легких выбирается из группы, состоящей из диффузного паренхиматозного заболевания легких известной причины (предпочтительно коллагеновое сосудистое заболевание или болезни, вызываемые загрязнением окружающей среды, или связанное с действием лекарственного средства диффузное паренхиматозное заболевание легких), гранулематозного диффузного паренхиматозного заболевания легких (предпочтительно саркоидоз) и других форм диффузного паренхиматозного заболевания легких (предпочтительно лимфангиолейомиоматоз (LAM), легочный лангергансоклеточный гистиоцитоз/ гистиоцитоз Х (НХ) или эозинофильная пневмония).
В другом предпочтительном варианте осуществления изобретения интерстициальное заболевание легких является идиопатической интерстициальной пневмонией.
В особенно предпочтительном варианте осуществления изобретения интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, связанного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии. Наиболее предпочтительно, интерстициальное заболевание легких является идиопатическим легочным фиброзом.
Еще в одном предпочтительном варианте осуществления изобретения вид рака выбирается из группы, состоящей из рака легкого, рака молочной железы, рака поджелудочной железы, рака предстательной железы, нейробластомы, меланомы, рака мозга, рака почки, рака мочевого пузыря, рака яичника, рака крови и рака толстой кишки.
В особенно предпочтительном варианте осуществления изобретения вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы. Наиболее предпочтительно, рак представляет собой аденокарциному, предпочтительно аденокарциному легких.
Еще в одном аспекте настоящее изобретение относится также к детектирующему агенту, специфичному к рецептору CCR6 или к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением для использования при детектировании интерстициального заболевания легких или рака в образце от объекта.
В предпочтительном варианте осуществления изобретения интерстициальная болезнь легких выбирается из группы, состоящей из диффузного паренхиматозного заболевания легких известной причины (предпочтительно коллагеновое сосудистое заболевание или болезни, вызываемые загрязнением окружающей среды, или связанное с действием лекарственного средства диффузное паренхиматозное заболевание легких), гранулематозного диффузного паренхиматозного заболевания легких (предпочтительно саркоидоз) и других форм диффузного паренхиматозного заболевания легких (предпочтительно лимфангиолейомиоматоз (LAM), легочный лангергансоклеточный гистиоцитоз /гистиоцитоз Х (НХ) или эозинофильная пневмония).
В другом предпочтительном варианте осуществления изобретения интерстициальное заболевание легких является идиопатической интерстициальной пневмонией.
В особенно предпочтительном варианте осуществления изобретения интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, связанного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии. Наиболее предпочтительно, интерстициальное заболевание легких является идиопатическим легочным фиброзом.
Еще в одном предпочтительном варианте осуществления изобретения вид рака выбирается из группы, состоящей из рака легкого, рака молочной железы, рака поджелудочной железы, рака предстательной железы, нейробластомы, меланомы, рака мозга, рака почки, рака мочевого пузыря, рака яичника, рака крови и рака толстой кишки.
В особенно предпочтительном варианте осуществления изобретения вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы. Наиболее предпочтительно, рак представляет собой аденокарциному, предпочтительно аденокарциному легких.
В другом предпочтительном варианте осуществления изобретения детектирующий агент является антителом или аптамером.
«Аптамер» может быть ДНК, РНК или пептидным аптамером. Полинуклеотидный аптамер предпочтительно имеет длину примерно от 10 до 300 нуклеотидов. Предпочтительно аптамер имеет длину примерно от 30 до 100 нуклеотидов. Наиболее предпочтительно аптамер имеет длину от примерно 10 до 60 нуклеотидов. Аптамеры могут быть получены любым способом, известным в данной области, включая, например, синтетический, рекомбинантный способы и способ очистки.
Предпочтительно, антитело представляет собой моноклональное или поликлональное антитело. В некоторых вариантах осуществления изобретения детектирующий агент может быть также выбран из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2. Детектирующий агент предпочтительно содержит детектируемую метку. Пригодные метки описаны выше.
Детектирующий агент специфичен к рецептору CCR6 или к изолированному растворимому полипептиду рецептора CCR6 в соответствии с настоящим изобретением, если он связывается с рецептором CCR6 или с изолированным растворимым полипептидом рецептора CCR6 в соответствии с настоящим изобретением с более высоким сродством, чем с любым другим соединением в образце (то есть нецелевым). Предпочтительно, детектирующий агент специфичен к рецептору CCR6 или к изолированному растворимому полипептиду рецептора CCR6 в соответствии с настоящим изобретением, если он связывается только с рецептором CCR6 или с растворимым полипептидом рецептора CCR6 в соответствии с настоящим изобретением и совсем не связываются с нецелевым соединением.
В этом контексте образец от объекта может быть жидким или твердым. В одном предпочтительном варианте осуществления изобретения образец от объекта выбирается из группы, состоящей из сыворотки, плазмы, бронхоальвеолярного лаважа, плеврального выпота, мокроты, слюны и мочи. В особенно предпочтительном варианте осуществления изобретения жидким образцом от объекта является сыворотка крови. В другом предпочтительном варианте осуществления изобретения образец от объекта представляет собой образец ткани, предпочтительно образец ткани легкого. Образцы тканей могут быть, например, свежими или замороженными образцами ткани или фиксированными, заключенными в парафин образцами. В одном предпочтительном варианте осуществления изобретения образец может представлять собой образец биопсии или резекции. Еще в одном предпочтительном варианте осуществления изобретения образец представляет собой образец бронхиальной щеточной биопсии.
В предпочтительном варианте осуществления способа в соответствии с изобретением, изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением, использования в соответствии с изобретением и/или детектирующего агента в соответствии с изобретением интерстициальное заболевание легких выбирается из группы, состоящей из диффузного паренхиматозного заболевания легких известной причины (предпочтительно коллагеновое сосудистое заболевание или болезни, вызываемые загрязнением окружающей среды, или связанное с действием лекарственного средства диффузное паренхиматозное заболевание легких), гранулематозного диффузного паренхиматозного заболевания легких (предпочтительно саркоидоз) и других форм диффузного паренхиматозного заболевания легких (предпочтительно лимфангиолейомиоматоз (LAM), легочный лангергансоклеточный гистиоцитоз/ гистиоцитоз Х (НХ) или эозинофильная пневмония).
В особенно предпочтительном варианте осуществления способа в соответствии с изобретением, изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением, использования в соответствии с изобретением и/или детектирующего агента в соответствии с изобретением интерстициальное заболевание легких является идиопатической интерстициальной пневмонией.
В другом предпочтительном варианте осуществления способа в соответствии с изобретением, изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением, использования в соответствии с изобретением и/или детектирующего агента в соответствии с изобретением интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, связанного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии.
В особенно предпочтительном варианте осуществления способа в соответствии с изобретением, изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением, использования в соответствии с изобретением и/или детектирующего агента в соответствии с изобретением интерстициальное заболевание легких является идиопатическим легочным фиброзом. Общие сведения о классификации интерстициальных болезней легких специалист может, например, найти в Международной междисциплинарной согласованной классификации идиопатической интерстициальной пневмонии Американского торакального общества/Европейского респираторного общества; Am J Respir Crit Care Med. 2002 Jan 15; 165(2):277-304 [American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias, American Thoracic Society; European Respiratory Society, Am J Respir Crit Care Med. 2002 Jan 15; 165(2):277-304].
В некоторых вариантах осуществления изобретения интерстициальное заболевание легких может быть вызвано состоянием, выбранном из группы, состоящей из склеродермии легких, саркоидоза, гиперчувствительного пневмонита, ревматоидного артрита, системной красной волчанки и асбестоза.
В другом варианте осуществления способа в соответствии с изобретением, изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением, использования в соответствии с изобретением и/или детектирующего агента в соответствии с изобретением вид рака выбирается из группы, состоящей из рака легкого, рака молочной железы, рака поджелудочной железы, рака предстательной железы, нейробластомы, меланомы, рака мозга, рака почки, рака мочевого пузыря, рака яичников, рака крови и рака толстой кишки.
Еще в одном предпочтительном варианте осуществления способа в соответствии с изобретением, изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением, использования в соответствии с изобретением и/или детектирующего агента в соответствии с изобретением вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы.
В особенно предпочтительном варианте осуществления способа в соответствии с изобретением, изолированного растворимого полипептида рецептора CCR6 в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением, использования в соответствии с изобретением и/или детектирующего агента в соответствии с изобретением рак представляет собой рак легких, наиболее предпочтительно аденокарциному легких или мезотелиому плевры. В наиболее предпочтительном варианте осуществления изобретения рак представляет собой аденокарциному легких.
Авторы настоящего изобретения, кроме того, неожиданно обнаружили, что ингибиторы активности рецептора CCR6 можно использовать для лечения интерстициального заболевания легких или рака.
Таким образом, еще в одном аспекте настоящее изобретение относится к изолированному полипептиду, содержащему или состоящему из аминокислотной последовательности, выбранной из группы, состоящей из:
(e) аминокислотной последовательности, которая имеет, как минимум, 80%, более предпочтительно, как минимум, 85%, более предпочтительно, как минимум, 90%, еще более предпочтительно, как минимум, 95% и наиболее предпочтительно 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 9, 22 или 23, и
(f) фрагмента аминокислотной последовательности в соответствии с (а);
в котором упомянутый изолированный полипептид способен связываться с рецептором CCR6 и ингибировать активность рецептора CCR6.
Предпочтительно упомянутый рецептор CCR6 является рецептором CCR6 человека. В одном предпочтительном варианте осуществления изобретения упомянутый рецептор CCR6 представляет собой полипептид, кодируемый последовательностью согласно SEQ ID NO.: 3 или SEQ ID NO.: 4. В другом предпочтительном варианте осуществления изобретения упомянутый рецептор CCR6 представляет собой полипептид согласно SEQ ID NO.: 27.
В предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 9, SEQ ID NO.: 22 или SEQ ID NO.: 23. В наиболее предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 9, SEQ ID NO.: 22 или SEQ ID NO.: 23.
В другом предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 9. Еще в одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) является аминокислотной последовательностью согласно SEQ ID NO.: 9.
В другом предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 22. Еще в одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) является аминокислотной последовательностью согласно SEQ ID NO.: 22.
В другом предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 23. Еще в одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) является аминокислотной последовательностью согласно SEQ ID NO.: 23.
В некоторых предпочтительных вариантах осуществления изобретения аминокислотная последовательность в соответствии с (а) может иметь, как минимум, 80%, предпочтительно, как минимум, 85%, более предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, более предпочтительно, как минимум, 92%, более предпочтительно, как минимум, 93%, более предпочтительно, как минимум, 94%, более предпочтительно, как минимум, 95%, более предпочтительно, как минимум, 96%, более предпочтительно, как минимум, 97%, более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 9 и SEQ ID NO.: 22.
В другом предпочтительном варианте осуществления изобретения в аминокислотной последовательности в соответствии с (а) изменено не более 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот последовательности согласно SEQ ID NO: 9, SEQ ID NO.: 22 или SEQ ID NO.: 23 (то есть, удалены, вставлены, модифицированы и/или замещены другими аминокислотами).
Еще в одном предпочтительном варианте осуществления изобретения в аминокислотной последовательности в соответствии с (а) изменено не более 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот последовательности согласно SEQ ID NO: 9 (то есть, удалены, вставлены, модифицированы и/или замещены другими аминокислотами). В другом предпочтительном варианте осуществления изобретения в аминокислотной последовательности, в соответствии с (а) изменено не более 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот последовательности согласно SEQ ID NO: 22, (то есть, удалены, вставлены, модифицированы и/или замещены другими аминокислотами). Еще в одном предпочтительном варианте осуществления изобретения в аминокислотной последовательности, в соответствии с (а) изменено не более 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот последовательности согласно SEQ ID NO: 23 (то есть, удалены, вставлены, модифицированы и/или замещены).
Аминокислоты вышеупомянутого изолированного полипептида в соответствии с изобретением также могут быть модифицированными, например, химически модифицированными. Например, боковая цепь или свободный амино- или карбокси-конец аминокислоты белка могут быть модифицированы, например, гликозилированием, амидированием, фосфорилированием, убиквитинированием и т.д.
В предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) содержит, как минимум, 8 последовательных аминокислот последовательности согласно SEQ ID NO.: 9, 22 или 23. Так, в одном из предпочтительных примеров осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 80%, предпочтительно, как минимум, 85%, более предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, более предпочтительно, как минимум, 92%, более предпочтительно, как минимум, 93%, более предпочтительно, как минимум, 94%, более предпочтительно, как минимум, 95%, более предпочтительно, как минимум, 96%, более предпочтительно, как минимум, 97%, более предпочтительно, как минимум, 98%, еще более предпочтительно, как минимум, 99% или наиболее предпочтительно 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 9, 22 или 23 и содержит, как минимум, 8 последовательных аминокислот последовательности согласно SEQ ID NO.: 9, 22 или 23. В другом предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 80%, предпочтительно, как минимум, 85%, более предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, более предпочтительно, как минимум, 92%, более предпочтительно, как минимум, 93%, более предпочтительно, как минимум, 94%, более предпочтительно, как минимум, 95%, более предпочтительно, как минимум, 96%, более предпочтительно, как минимум, 97%, более предпочтительно, как минимум, 98%, еще более предпочтительно, как минимум, 99% и наиболее предпочтительно 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 9 и содержит, как минимум, 8 или, как минимум, 15 последовательных аминокислот последовательности согласно SEQ ID NO.: 9. Еще в одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 80%, предпочтительно, как минимум, 85%, более предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, более предпочтительно, как минимум, 92%, более предпочтительно, как минимум, 93%, более предпочтительно, как минимум, 94%, более предпочтительно, как минимум, 95%, более предпочтительно, как минимум, 96%, более предпочтительно, как минимум, 97%, более предпочтительно, как минимум, 98%, еще более предпочтительно, как минимум, 99% или наиболее предпочтительно 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 22 и содержит, как минимум, 8 или, как минимум, 15 последовательных аминокислот последовательности согласно SEQ ID NO.: 22. В другом предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 80%, предпочтительно, как минимум, 85%, более предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, более предпочтительно, как минимум, 5 92%, более предпочтительно, как минимум, 93%, более предпочтительно, как минимум, 94%, более предпочтительно, как минимум, 95%, более предпочтительно, как минимум, 96%, более предпочтительно, как минимум, 97%, более предпочтительно, как минимум, 98%, еще более предпочтительно, как минимум, 99% или наиболее предпочтительно 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 23 и содержит, как минимум, 8 или, как минимум, 15 последовательных аминокислот последовательности согласно SEQ ID NO.: 23. В другом предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95%, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO: 9., 22 или 23 и содержит, как минимум, 9, как минимум, 10, как минимум, 11, как минимум, 12, как минимум, 13, как минимум, 14, как минимум, 15, как минимум, 16, как минимум, 17, как минимум, 18, как минимум, 19 или, как минимум, 20 последовательных аминокислот последовательности согласно SEQ ID NO.: 9, 22 или 23. В более предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95%, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 9, 22 или 23 и содержит, как минимум, 8 или, как минимум, 15 последовательных аминокислот последовательности согласно SEQ ID NO.: 9, SEQ ID NO.: 22 или SEQ ID NO.: 23.
Еще в одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95%, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 9 и содержит, как минимум, 9, как минимум, 10, как минимум, 11, как минимум, 12, как минимум, 13, как минимум, 14, как минимум, 15, как минимум, 16, как минимум, 17, как минимум, 18, как минимум, 19 или, как минимум, 20 последовательных аминокислот последовательности согласно SEQ ID NO.: 9.
В другом предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95%, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 22 и содержит, как минимум, 9, как минимум, 10, как минимум, 11, как минимум, 12, как минимум, 13, как минимум, 14, как минимум, 15, как минимум, 16, как минимум, 17, как минимум, 18, как минимум, 19 или, как минимум, 20 последовательных аминокислот последовательности согласно SEQ ID NO.: 22.
Еще в одном предпочтительном варианте осуществления изобретения аминокислотная последовательность в соответствии с (а) имеет, как минимум, 95%, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 23 и содержит, как минимум, 9, как минимум, 10, как минимум, 11, как минимум, 12, как минимум, 13, как минимум, 14, как минимум, 15, как минимум, 16, как минимум, 17, как минимум, 18, по крайней мере, 19 или, как минимум, 20 последовательных аминокислот последовательности согласно SEQ ID NO.: 23.
В предпочтительном варианте осуществления изобретения изолированный полипептид в соответствии с изобретением имеет длину менее 3000 аминокислот, предпочтительно менее 2000 аминокислот, более предпочтительно менее 1000 аминокислот, более предпочтительно менее 500 аминокислот, более предпочтительно менее 300 аминокислот, более предпочтительно менее 200 аминокислот, более предпочтительно менее 100 аминокислот или наиболее предпочтительно менее 50 аминокислот.
Еще в одном предпочтительном варианте осуществления изобретения изолированный полипептид в соответствии с изобретением имеет длину от, как минимум, 8 до, как минимум, 3000 аминокислот, предпочтительно от, как минимум, 8 до, как минимум, 2000 аминокислот, более предпочтительно от, как минимум, 8 до, как минимум, 1000 аминокислот, более предпочтительно от, как минимум, 8 до 500 аминокислот, более предпочтительно от, как минимум, 8 до 300 аминокислот, более предпочтительно от, как минимум, 8 до 200 аминокислот, и еще более предпочтительно от, как минимум, 8 до 100 аминокислот или от, как минимум, 8 до 50 аминокислот.
Наиболее предпочтительно изолированный полипептид в соответствии с изобретением имеет длину, как минимум, 8, минимум 29 аминокислот или минимум 31 аминокислоту.
В другом предпочтительном варианте осуществления изобретения изолированный полипептид в соответствии с (а) имеет длину как минимум, от 29 до 3000 аминокислот, предпочтительно как минимум, от 29 до 2000 аминокислот, более предпочтительно как минимум, от 29 до 1000 аминокислот, как минимум, от 29 до 500 аминокислот, как минимум, от 29 до 300 аминокислот, как минимум, от 29 до 200 аминокислот, как минимум, от 29 до 100 аминокислот или как минимум, от 29 до 50 аминокислот.
Еще в одном предпочтительном варианте осуществления изобретения изолированный полипептид в соответствии с (а) имеет длину как минимум, от 31 до 3000 аминокислот, предпочтительно как минимум, от 31 до 2000 аминокислот, более предпочтительно как минимум, от 31 до 1000 аминокислот, как минимум, от 31 до 500 аминокислот, как минимум от 31 до 300 аминокислот, как минимум, от 31 до 200 аминокислот, как минимум, от 31 до 100 аминокислот или как минимум, от 31 до 50 аминокислот.
Фрагмент, как правило, представляет собой часть аминокислотной последовательности, к которой он относится.
В предпочтительном варианте осуществления изобретения фрагмент в соответствии с (b) имеет длину, как минимум, 8, как минимум, 9, как минимум, 10, как минимум, 11, как минимум, 12, как минимум, 13, как минимум, 14, как минимум, 15, как минимум, 16, как минимум, 17, как минимум, 18, как минимум, 19, как минимум, 20, как минимум, 21, как минимум, 22, как минимум, 23, как минимум, 24, как минимум, 25, как минимум, 26, как минимум, 27 или, как минимум, 28 аминокислот. В предпочтительном варианте осуществления изобретения фрагмент в соответствии с (b) имеет длину, как минимум, 10, как минимум, 15 или, как минимум, или, как минимум, 20 аминокислот.В наиболее предпочтительном варианте осуществления изобретения фрагмент в соответствии с (b) имеет длину 15 аминокислот.
В другом особенно предпочтительном варианте осуществления изобретения изолированный полипептид в соответствии с изобретением содержит или состоит из аминокислотной последовательности согласно SEQ ID NO.: 9, SEQ ID NO.: 22 или SEQ ID NO.: 23, в котором упомянутый полипептид способен связываться с рецептором CCR6 и ингибировать активность рецептора CCR6. Наиболее предпочтительно вышеупомянутый изолированный полипептид в соответствии с изобретением содержит или состоит из аминокислотной последовательности согласно SEQ ID NO.: 9, в которой упомянутый полипептид способен связываться с рецептором CCR6 и ингибировать активность рецептора CCR6.
Способность полипептида в соответствии с изобретением связываться с рецептором CCR6 можно определить любым подходящим способом, известным специалисту. Например, специалист может определить способность полипептида связываться с CCR6 рецептором с помощью дрожжевого двухгибридного анализа или с помощью биохимического анализа, например, анализа выпадения, анализа коиммунопреципитации, твердофазного иммуноферментного анализа (ELISA), количественного анализа радиолигандного связывания, анализа на основе клеточного сортинга с возбуждением флуоресценции (FACS), анализа плазмонного резонанса или любым другим способом, известным специалисту. При использовании анализа выпадения или анализа плазмонного резонанса полезно слить, как минимум, один из белков с аффинной меткой, например HIS-меткой, GST-меткой или другой меткой, хорошо известной в данной области биохимии.
Термин «ингибирование активности рецептора CCR6», используемый в настоящем документе, означает, что активность рецептора CCR6 понижающе регулируется или аннулируется и/или что активация рецептора CCR6 ингибируется.
Например, в одном примере осуществления изобретения изолированный полипептид в соответствии с изобретением или любое другое соединение, способное ингибировать активность и/или экспрессию рецептора CCR6, описанное в настоящем документе, может стерически блокировать рецептор CCR6, так что агонист рецептора CCR6 (например, CCL 18 или CCL20) не может активировать рецептор. Таким образом, ингибирование активности рецептора CCR6 может быть, например, обусловлено ингибированием взаимодействия рецептора CCR6 с одним из его лигандов, т.е. CCL 18 и/или CCL20, полипептидом или любым другим соединением, которое связывается с рецептором CCR6, но не опосредует событие сигнализации само по себе.
В другом варианте осуществления изобретения изолированный полипептид в соответствии с изобретением или любое другое соединение, способное ингибировать активность и/или экспрессию рецептора CCR6, может понижающее регулировать или аннулировать имеющуюся активность рецептора CCR6.
Способность изолированного полипептида в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность рецептора CCR6 можно, например, определить измерением экспрессии на клеточной поверхности CCR6, как представлено в настоящем документе ниже в Примере 6 и на Фигурах 13 и 14, в котором ингибирование интернализации рецептора CCR6 в присутствии агониста рецептора CCR6 (как например, CCL18) и изолированного полипептида или другого тестируемого соединения, по сравнению с контрольным образцом (например, присутствие только агониста рецептора CCR6) указывает на то, что изолированный полипептид или другое соединение способны ингибировать активность рецептора CCR6.
В другом варианте специалист может также определить способность изолированного полипептида в соответствии с изобретением или другого тестируемого соединения ингибировать активность CCR6 путем инкубации экспрессирующих CCR6 клеток в присутствии агониста рецептора CCR6, например, CCL18 или CCL20, и в присутствии или отсутствии изолированного полипептида или другого тестируемого соединения и последующего лизиса клеток и анализа фосфорилирования ERK, нисходящей молекулы сигнализации CCR6, с помощью Вестерн-блоттинг анализа. В этом примере более низкий уровень фосфорилирования ERK в присутствии полипептида или другого тестируемого соединения в сравнении с уровнем фосфорилирования ERK в отсутствии изолированного полипептида или другого соединения показывает, что полипептид или другое соединение способны ингибировать активность рецептора CCR6. Один из способов определения фосфорилирования ERK с помощью Вестерн-блоттинг анализа, например, описан в работе Lin et al. J Proteome Res. 2010 Jan; 9(1):283-97. В аналогичном примере фосфорилирование других нисходящих эффекторов CCR6, например, Akt, SAPK/JNK киназы, фосфатидилинозитол-3-киназа или фосфолипаза С, можно проанализировать с целью определения способности изолированного полипептида в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность рецептора CCR6.
Способность изолированного полипептида в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность рецептора CCR6 можно также, например, определить путем измерения CCL 18-стимулированного высвобождения FGF2 или CCL18-опосредованной индукции коллагена и/или α-SMA в присутствии упомянутого полипептида или другого соединения, как представлено ниже в Примере 4 и на Фиг. 4 и 5. В этом примере ингибирование CCL18-индуцированной повышающей регуляции FGF2 и/или ингибирование CCL18-опосредованной индукции коллагена и/или α-SMA экспрессии в присутствии полипептида или другого тестируемого соединения в сравнении с контрольным образцом, к которому полипептид или другое соединение не добавляли, указывает на то, что изолированный полипептид или другое соединение способны ингибировать активность рецептора CCR6. Помимо этого, чтобы определить способность изолированного полипептида в соответствии с изобретением или любого другого тестируемого соединения ингибировать активность CCR6, специалист может также определить, происходит ли понижающая регуляция или аннулирование индукции эпителиально-мезенхимального перехода (ЕМТ) с помощью CCL18.
Альтернативно или дополнительно могут использоваться любые другие способы, пригодные для определения активности рецептора CCR6, существующие в данной области и известные среднему специалисту.
Изолированный полипептид в соответствии с изобретением или любое другое соединение, которое способно ингибировать активность рецептора CCR6, может ингибировать активность рецептора CCR6, как минимум, на 10%, как минимум, на 20%, как минимум, на 30%, как минимум, на 40%, как минимум, на 50%, как минимум, на 60%, как минимум, на 70%, более предпочтительно, как минимум, на 80%, как минимум, на 90%, как минимум, на 91%, как минимум, на 92%, как минимум, на 93%, как минимум, на 94%, как минимум, на 95%, как минимум, на 96%, как минимум, на 97%, как минимум, на 98% или, как минимум, на 99% по сравнению с контрольным образцом. В некоторых предпочтительных вариантах осуществления изобретения полипептид в соответствии с изобретением или любое другое соединение, описанное в настоящем документе, способное ингибировать активность рецептора CCR6, может ингибировать активность рецептора CCR6 на 100%.
В другом аспекте настоящее изобретение относится к изолированному полинуклеотиду, кодирующему изолированный полипептид в соответствии с изобретением.
В предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину менее 6000 нуклеотидов, менее 5000 нуклеотидов, менее 4000 нуклеотидов, менее 3000 нуклеотидов, менее 2000 нуклеотидов, менее 1000 нуклеотидов или менее 500 нуклеотидов.
Еще в одном предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум от, 24 до 9000 нуклеотидов, предпочтительно, как минимум, от 24 до 8000 нуклеотидов, более предпочтительно, как минимум, от 24 до 7000 нуклеотидов, более предпочтительно, как минимум, от 24 до 6000 нуклеотидов, более предпочтительно, как минимум, от 24 до 5000 нуклеотидов, более предпочтительно, как минимум, от 24 до 4000 нуклеотидов, более предпочтительно, как минимум, от 24 до 3000 нуклеотидов, более предпочтительно, как минимум, от 24 до 2000 нуклеотидов, более предпочтительно, как минимум, от 24 до 1000 нуклеотидов или еще более предпочтительно, как минимум, от 24 до 500 нуклеотидов. В другом предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, 24 нуклеотида, как минимум, 87 нуклеотидов или, как минимум, 93 нуклеотида.
В другом предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину от, как минимум, 87 до 9000 нуклеотидов, предпочтительно, как минимум, от 87 до 8000 нуклеотидов, более предпочтительно, как минимум, от 87 до 7000 нуклеотидов, более предпочтительно, как минимум, от 87 до 6000 нуклеотидов, более предпочтительно, как минимум, от 87 до 5000 нуклеотидов, более предпочтительно, как минимум, от 87 до 4000 нуклеотидов, более предпочтительно, как минимум, от 87 до 3000 нуклеотидов, более предпочтительно, как минимум, от 87 до 2000 нуклеотидов, более предпочтительно, как минимум, от 87 до 1000 нуклеотидов или еще более предпочтительно, как минимум, от 87 до 500 нуклеотидов.
В другом предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, 87 нуклеотидов, как минимум, 100 нуклеотидов, как минимум, 200 нуклеотидов, как минимум, 500 нуклеотидов, как минимум, 800 нуклеотидов, как минимум, 1000 нуклеотидов, как минимум, 1500 нуклеотидов, как минимум, 2000 нуклеотидов, как минимум, 2500 нуклеотидов, как минимум, 3000 нуклеотидов или, как минимум, 3500 нуклеотидов. В особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, 87 нуклеотидов или, как минимум, 100 нуклеотидов.
В другом предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, от 93 до 9000 нуклеотидов, предпочтительно, как минимум, от 93 до 8000 нуклеотидов, более предпочтительно, как минимум, от 93 до 7000 нуклеотидов, более предпочтительно, как минимум, от 93 до 6000 нуклеотидов, более предпочтительно, как минимум, от 93 до 5000 нуклеотидов, более предпочтительно, как минимум, от 93 до 4000 нуклеотидов, более предпочтительно, как минимум, от 93 до 3000 нуклеотидов, более предпочтительно, как минимум, от 93 до 2000 нуклеотидов, более предпочтительно, как минимум, от 93 до 1000 нуклеотидов или еще более предпочтительно, как минимум, от 93 до 500 нуклеотидов.
В другом предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, 24 нуклеотида, как минимум, 50 нуклеотидов, как минимум, 87 нуклеотидов, как минимум, 93 нуклеотида, как минимум, 100 нуклеотидов, как минимум, 200 нуклеотидов, как минимум, 500 нуклеотидов, как минимум, 800 нуклеотидов, как минимум, 1000 нуклеотидов, как минимум, 1500 нуклеотидов, как минимум, 2000 нуклеотидов, как минимум, 2500 нуклеотидов, как минимум, 3000 нуклеотидов или, как минимум, 3500 нуклеотидов. В особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением имеет длину, как минимум, 24 нуклеотида, как минимум, 87 нуклеотидов или, как минимум, 93 нуклеотида.
Специалисту будет понятно, что вследствие вырожденности генетического кода данный полипептид в соответствии с изобретением может кодироваться различными нуклеотидными последовательностями.
В предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 24, SEQ ID NO.: 25 или SEQ ID NO.: 26.
Еще в одном предпочтительном варианте осуществления изобретения полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 85%, предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 24, SEQ ID NO.: 25 или SEQ ID NO.: 26. В особенно предпочтительном варианте осуществления изобретения полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 85%, предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 95% или еще более предпочтительно, как минимум, 98% идентичность по отношению к последовательности согласно SEQ ID NO.: 24, SEQ ID NO.: 25 или SEQ ID NO.: 26.
В другом предпочтительном варианте осуществления изобретения полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 80%, как минимум, 85%, предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичностью последовательности согласно SEQ ID NO.: 24. В другом предпочтительном варианте осуществления изобретения полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 80%, как минимум, 85%, предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 25. Еще в одном предпочтительном варианте осуществления изобретения полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет, как минимум, 80%, как минимум, 85%, предпочтительно, как минимум, 90%, более предпочтительно, как минимум, 91%, еще более предпочтительно, как минимум, 92%, еще более предпочтительно, как минимум, 93%, еще более предпочтительно, как минимум, 94%, еще более предпочтительно, как минимум, 95%, еще более предпочтительно, как минимум, 96%, еще более предпочтительно, как минимум, 97%, еще более предпочтительно, как минимум, 98% или еще более предпочтительно, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 26.
В особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением содержит или состоит из последовательности, которая имеет 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 24, SEQ ID NO.: 25 или SEQ ID NO.: 26. В другом особенно предпочтительном варианте осуществления изобретения изолированный полинуклеотид в соответствии с изобретением содержит или состоит из последовательности согласно SEQ ID NO.: 24, SEQ ID NO.: 25 или SEQ ID NO.: 26.
Изолированный полинуклеотид в соответствии с изобретением может представлять собой одно- или двухцепочечную РНК или ДНК молекулу.
В некоторых вариантах осуществления изобретения изолированный полинуклеотид в соответствии с изобретением может быть вставлен в вектор экспрессии. Вектор экспрессии может быть прокариотическим или эукариотическим вектором экспрессии как например, плазмида, минихромосома, космида, бактериальный фаг, ретровирусный вектор или любой другой вектор, известный специалистам. Специалистам известно, как выбрать соответствующий вектор в зависимости от специфических потребностей.
Настоящее изобретение, таким образом, также относится к вектору экспрессии, содержащему полинуклеотид в соответствии с изобретением.
Еще в одном аспекте настоящее изобретение относится к способу идентификации соединения, способного ингибировать активность рецептора CCR6, в котором способ включает следующие стадии:
(a) контактирование рецептора CCR6 с тестируемым соединением;
(b) добавление агониста рецептора CCR6, в котором упомянутый агонист представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 5 или SEQ ID NO.: 18;
(c) определение активности упомянутого рецептора CCR6; и
(d) выбор упомянутого тестируемого соединения в качестве соединения, способного ингибировать активность рецептора CCR6, если активность рецептора CCR6, определенная в (с), ниже, чем активность рецептора CCR6, определенная в контрольном образце.
В предпочтительном варианте осуществления вышеупомянутого способа стадии (а), (b), (с), (d) осуществляются в этом порядке.
В предпочтительном варианте осуществления изобретения рецептор CCR6 в соответствии с (а) экспрессируется клеткой, предпочтительно на поверхности клетки. В другом предпочтительном варианте осуществления изобретения рецептор CCR6 в соответствии с (а) представляет собой рекомбинантный рецептор CCR6, предпочтительно очищенный рекомбинантный рецептор CCR6. Если рецептор CCR6 в соответствии с (а) экспрессируется клеткой, предпочтительно на поверхности клетки, упомянутая клетка может, например, входить в состав клеточной реакционной системы. В предпочтительном варианте осуществления изобретения упомянутая клетка выбирается из группы, состоящей из фибробласта, альвеолярной эпителиальной клетки, лимфоцита и клетки легкого. Еще в одном предпочтительном варианте осуществления изобретения упомянутая клетка выбирается из группы, состоящей из фибробласта, альвеолярной эпителиальной клетки, лимфоцита и клетки легкого, в котором клетка взята от пациента, больного интерстициальным заболеванием легких или раком. В предпочтительном варианте осуществления изобретения упомянутое интерстициальное заболевание легких является идиопатическим легочным фиброзом, а рак - аденокарциномой, преимущественно аденокарциномой легких.
Если рецептор CCR6 в соответствии с (а) является рекомбинантным рецептором CCR6, предпочтительно очищенным рекомбинантным рецептором CCR6, рецептор CCR6 может входить в состав бесклеточной реакционной системы. Агонист рецептора CCR6 в соответствии с (b) можно затем добавлять к клеточной или бесклеточной реакционной системе.
Термин «реакционная система» в данном контексте относится к экспериментальной установке, в которой клетки, экспрессирующие рецептор CCR6 или рекомбинантный рецептор CCR6, помещаются в пробирку с клеточной культурой, в пробирку с тканевой культурой, в пробирку Эппендорфа, реакционную камеру или другую емкость, содержащую необходимые буферы и/или другие реагенты, пригодные для осуществления вышеупомянутого способа, и в которой данный вариант осуществляется в упомянутой пробирке с клеточной культурой, в пробирке с тканевой культурой, в пробирке Эппендорфа, реакционной камере или в другой емкости. Вышеупомянутый способ может, таким образом, в некоторых вариантах осуществления изобретения дополнительно иметь стадию создания клеточной или бесклеточной реакционной системы, содержащей рецептор CCR 6. Если способ содержит упомянутую стадию, то предпочтительно, чтобы упомянутой стадией была стадия (а), т.е. первая стадия данного способа.
Предпочтительно, рецептор CCR6 является рецептором CCR6 человека. В одном предпочтительном варианте осуществления изобретения упомянутый рецептор CCR6 представляет собой полипептид, кодированный последовательностью согласно SEQ ID NO.: 3 или SEQ ID NO.: 4. В другом предпочтительном варианте осуществления изобретения упомянутый рецептор CCR6 представляет собой полипептид согласно SEQ ID NO.: 27.
В предпочтительном варианте осуществления изобретения упомянутое тестируемое соединение представляет собой антитело, малую молекулу или пептид. Предпочтительно, антитело является моноклональным или поликлональным антителом. В некоторых вариантах осуществления изобретения антитело может быть также выбрано из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2.
В другом предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%), как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 5. В особенно предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 95%, как минимум, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 5.
В другом предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 18. В особенно предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 95%, как минимум, 98% или 100% идентичность по отношению к последовательности согласно SEQ ID NO.: 18.
В другом предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) содержит или состоит из аминокислотной последовательности, которая содержит, как минимум, 8, 9, 10, 11, 12, 13, 14, 15, 16, 20, 30, 50 или 60 заменимых аминокислот последовательности согласно SEQ ID NO:5.
В другом предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) содержит или состоит из аминокислотной последовательности, которая содержит, как минимум, 8, 9, 10, 11, 12, 13, 14, 15, 16, 20, 30, 50 или 60 заменимых аминокислот последовательности согласно SEQ ID NO:18.
В другом предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 5 и которая содержит, как минимум, 30 или, как минимум, 50 заменимых аминокислот последовательности согласно SEQ ID NO:5.
Еще в одном предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 85%, как минимум, 90%, как минимум, 91%, как минимум, 92%, как минимум, 93%, как минимум, 94%, как минимум, 95%, как минимум, 96%, как минимум, 97%, как минимум, 98%, как минимум, 99% идентичность по отношению к последовательности согласно SEQ ID NO.: 18 и которая содержит, как минимум, 30 или, как минимум, 50 заменимых аминокислот последовательности согласно SEQ ID NO:18. В особенно предпочтительном варианте осуществления изобретения полипептид в соответствии с (b) представляет собой полипептид согласно SEQ ID NO:18.
Активность рецептора CCR6 можно, например, определить любым из способов определения активности рецептора CCR6, описанного в настоящем документе выше.
Выбор соответствующего контрольного образца зависит от способа, используемого для определения активности рецептора CCR6. Специалистам известно, как выбирать соответствующий контрольный образец. Некоторые подходящие примеры по определению активности рецептора CCR6 и соответствующие контрольные образцы представлены ниже в разделе, где приведены примеры.
Контрольный образец может, например, быть образцом, в котором активность рецептора CCR6 определена в присутствии агониста рецептора CCR6 и в отсутствии тестируемого соединения.
В предпочтительном варианте осуществления изобретения активность рецептора CCR6, определенная в (с), как минимум, на 5%, как минимум, на 10%, как минимум, на 15%, как минимум, на 20%, как минимум, на 25%, как минимум, на 30%, как минимум, на 35%, как минимум, на 40%, как минимум, на 45%, как минимум, на 50%, как минимум, на 55%, как минимум, на 60%, как минимум, на 65%, как минимум, на 70%, как минимум, на 75%, как минимум, на 80%, как минимум, на 85%, как минимум, на 90%, как минимум, на 95% или, как минимум, на 99% ниже, чем активность рецептора CCR6 в контрольном образце.
В особенно предпочтительном варианте осуществления изобретения активность рецептора CCR6, определенная в (с), как минимум, на 60%, как минимум, на 70%, как минимум, на 80%, как минимум, на 90%, как минимум, на 95% или, как минимум, на 98% ниже, чем активность рецептора CCR6 в контрольном образце.
В другом предпочтительном варианте осуществления изобретения активность рецептора CCR6, определенная (с), на 100% ниже, чем активность рецептора CCR6 в контрольном образце.
Еще в одном предпочтительном варианте осуществления изобретения активность рецептора CCR6, определенная (с), как минимум, в 2 раза, как минимум, в 3 раза, как минимум, в 4 раза, как минимум, в 5 раз, как минимум, в 6 раз, как минимум, в 7 раз, как минимум, в 8 раз, как минимум, в 9 раз, как минимум, в 10 раз, как минимум, в 20 раз, как минимум, в 30 раз, как минимум, в 40 раз, как минимум, в 50 раз, как минимум, 60 раз, как минимум, 70 раз, как минимум, 80 раз, как минимум, 90 раз, как минимум, в 100 раз, как минимум, в 500 раз, как минимум, в 1000 раз или, как минимум, в 10000 раз ниже, чем активность рецептора CCR6 в контрольном образце.
Настоящее изобретение, кроме того, относится к способу детектирования интерстициального заболевания легких или рака у объекта, включающему стадию определения уровня экспрессии гена CCR6 в образце от упомянутого объекта.
Упомянутый способ предпочтительно выполняется in vitro.
Предпочтительно, рецептор CCR6 является рецептором CCR6 человека. В предпочтительном варианте осуществления изобретения упомянутый рецептор CCR6 представляет собой полипептид, кодированный последовательностью согласно SEQ ID NO.: 3 или SEQ ID NO.: 4. В другом предпочтительном варианте осуществления изобретения упомянутый рецептор CCR6 представляет собой полипептид согласно SEQ ID NO.: 27.
В одном варианте осуществления изобретения уровень экспрессии CCR6 может определяться путем контактирования образца от объекта с детектирующим агентом, специфичным к CCR6. Детектирующий агент специфичен к CCR6, если он связывается с CCR6 с более высоким сродством, чем с любым другим соединением в образце (то есть, нецелевым). Предпочтительно, детектирующий агент специфичен к CCR6, если он связывается только с CCR6 и совсем не связывается с нецелевым соединением.
Настоящее изобретение также относится к способу обнаружения или определения степени рака у объекта, включающий стадию определения уровня экспрессии гена CCL18 в образце от упомянутого объекта.
Термин «определение степени рака», используемый в настоящем документе, относится к классификации рака путем определения некоторых характеристик рака, как например, его агрессивность и его прогноз. В одном предпочтительном варианте осуществления изобретения «определение степени рака», предпочтительно аденокарциномы, может выполняться путем сопоставления количества CCL18, определенного в образце от объекта, со степенью рака, предпочтительно степенью аденокарциномы, наиболее предпочтительно степенью аденокарциномы легких.
В одном варианте осуществления изобретения уровень экспрессии CCL18 может определяться путем контактирования образца от объекта с детектирующим агентом, специфичным к CCL18. Детектирующий агент специфичен к CCL18, если он связывается с CCL18 с более высоким сродством, чем с любым другим соединением в образце (то есть, нецелевым). Предпочтительно, детектирующий агент специфичен к CCL18, если он связывается только с CCL18 и совсем не связывается с нецелевым соединением.
«Определение уровня экспрессии гена CCR6» означает, что можно определить уровень или количество CCR6 мРНК и/или белка. В некоторых вариантах осуществления изобретения можно определить экспрессию на клеточной поверхности рецептора CCR6. «Определение уровня экспрессии гена CCL18» означает, что можно определить уровень или количество CCL18 мРНК и/или белка. В предпочтительном варианте осуществления изобретения упомянутый CCL18 представляет собой полипептид согласно SEQ ID NO.: 18.
Экспрессии CCR6 мРНК или экспрессию CCL18 мРНК можно, например, определить с помощью способа гибридизации на месте [in situ], нозерн-блоттинга, с помощью анализов защиты от РНКазы или ПЦР-методом, как например, ПЦР обратной транскрипции или количественной ПЦР в реальном времени. Специалистам известно, как выполняются эти способы.
В некоторых вариантах осуществления изобретения общая РНК может выделяться из образца от объекта перед определением количества мРНК.
Пригодные детектирующие агенты, которые можно использовать для определения уровня экспрессии CCR6 мРНК, представляют собой, например, антисмысловые олигонуклеотидные зонды, специфичные к CCR6 мРНК. Пригодные детектирующие агенты, которые можно использовать для определения уровня экспрессии CCL18 мРНК, представляют собой, например, антисмысловые олигонуклеотидные зонды, специфичные к CCL18 мРНК. Антисмысловые олигонуклеотидные зонды могут быть РНК или ДНК олигонуклеотидные зондами. В предпочтительном варианте осуществления изобретения олигонуклеотидный зонд представляет собой одноцепочечную молекулу РНК.
Олигонуклеотидный зонд специфичен к CCR6 мРНК, если он способен к гибридизации с CCR6 мРНК в очень жестких условиях. Олигонуклеотидный зонд специфичен к CCL18 мРНК, если он способен к гибридизации с CCL18 мРНК в очень жестких условиях.
В соответствии с использованием в настоящем документе, термин «гибридизируются» или «гибридизируется» относится к гибридизации первого полинуклеотида со вторым полинуклеотидом. Чтобы определить, гибридизируются два полинуклеотида друг с другом, специалист предпочтительно выполняет эксперименты по гибридизации in vitro в умеренных или жестких условиях гибридизации. Анализы гибридизации и условия известны специалистам в данной области, их можно найти, например, в работе Current Protocols in Molecular Biology, John Wiley & Sons, N. Y., 6.3.1-6.3.6, 1991. Жесткие условия могут быть, например, условия, в которых гибридизация происходит в 6Х хлорид натрия /цитрат натрия (SSC) при 45°С, с последующим промыванием в 0,2 Х SSC, 0,1% SDS при 65°С.
Предпочтительным детектирующим агентом для определения белка CCR6 или белка CCL18 является антитело или аптамер. Предпочтительно, антитело является моноклональным или поликлональным антителом. В некоторых вариантах осуществления изобретения детектирующий агент может быть также выбран из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2. В одном предпочтительном варианте осуществления изобретения могут использоваться коммерчески доступные антитела, специфичные к CCR6 или CCL18. Один из примеров коммерчески доступных антител - античеловеческий CCR6 mAb - описан ниже в Примере 1.
В предпочтительном варианте осуществления изобретения детектирующий агент в соответствии с вышеприведенным описанием может содержать детектируемую метку. Использовать можно любую пригодную метку, которая может прикрепляться к детектирующему агенту. В одном предпочтительном варианте осуществления изобретения детектируемая метка ковалентно или нековалентно прикреплена к детектирующему агенту. Примеры меток, которые могут прикрепляться к детектирующему агенту, включают, например, флуоресцентные красители, как например, цианиновые красители, например. Цианин 3, Цианин 5 или Цианин 7, Alexa Fluor красители, например, Alexa 594, Alexa 488 или Alexa 532, красители семейства флуоресцеина, R-фикоэритрин, Texas Red, родамин и флуоресцеинизотиоцианат (FITC). Детектирующие агенты также могут быть маркированы ферментами, как например, пероксидаза хрена, щелочная фосфатаза или бета-лактамаза, радиоизотопами, как например, 3H, 14С, 32Р, 33Р, 35S или 125I, металлом, как например, золото, или биотином. В другом предпочтительном варианте осуществления изобретения детектирующий агент может быть также обнаружен вторичном детектирующим агентом, содержащим метку в соответствии с вышеприведенным описанием.
Предпочтительно вторичный детектирующий агент способен специфически связываться с описанным выше детектирующим агентом. В особенно предпочтительном варианте осуществления изобретения вторичным детектирующим агентом является антитело.
В некоторых вариантах осуществления изобретения уровень экспрессии CCR6 или экспрессии CCL18 можно, например, определить способами, предусматривающими гистологические или клеточно-биологические процедуры. В некоторых вариантах осуществления изобретения могут использоваться визуальные методы, как например, световая микроскопия, иммунофлюоресцентная микроскопия или электронная микроскопия, или проточная цитометрия или люминометрия. В предпочтительном варианте осуществления изобретения уровень экспрессии CCR6 или экспрессии CCL18 определяется с помощью иммуногистохимии.
Термины «детектирование интерстициальной болезни легких» или «детектирование рака», используемый в настоящем описании, означает, что у объекта или в образце от объекта можно определить наличие интерстициального заболевания легких или ракового заболевания или нарушения. Предпочтительно, заранее не известно, болен ли объект интерстициальным заболеванием легких или раком соответственно. В одном предпочтительном варианте осуществления изобретения есть подозрение, что объект болен интерстициальным заболеванием легких или раком.
Для детектирования интерстициального заболевания легких или рака у объекта уровень экспрессии гена CCR6 в образце от объекта может определяться в некоторых вариантах осуществления изобретения наряду с измерением или определением количества других соединений или факторов, указывающих на интерстициальное заболевание легких или рак соответственно. Например, известные маркеры интерстициального заболевания легких, как например, сывороточные маркеры сурфактантный белок (SP) А и D или известные маркеры рака можно обнаружить в одном и том же образце или в другом образце от объекта. Специалистам известны другие соответствующие маркеры. В некоторых вариантах осуществления изобретения специалист может дополнительно к определению уровня экспрессии гена CCR6 в образце от объекта также исследовать гистологическую картину образца для дальнейшего исследования, болен ли объект интерстициальным заболеванием легких или раком.
Для детектирования рака у объекта уровень экспрессии гена CCL18 в образце от объекта может определяться в некоторых вариантах осуществления изобретения наряду с измерением или определением количества других соединений или факторов, указывающих на рак. Например, известные маркеры рака можно обнаружить в одном и том же образце или в другом образце от объекта. Специалистам известны другие соответствующие маркеры. В некоторых вариантах осуществления изобретения специалист может дополнительно к определению уровня экспрессии гена CCL18 в образце от объекта также исследовать гистологическую картину образца для дальнейшего исследования, болен ли объект раком.
В предпочтительном варианте осуществления изобретения описанный выше способ дополнительно включает стадию сравнения уровня экспрессии гена CCR6, определенного в образце от объекта, с уровнем экспрессии гена CCR6 в контрольном образце, в котором более высокий уровень экспрессии гена CCR6, определенный в образце от объекта, по сравнению с контрольным образцом указывает на наличие интерстициального заболевания легких или рака у объекта.
В другом предпочтительном варианте осуществления изобретения описанный выше способ дополнительно включает стадию сравнения уровня экспрессии гена CCL18, определенного в образце от объекта, с уровнем экспрессии гена CCL18 в контрольном образце, в котором более высокий уровень экспрессии гена CCL18, определенный в образце от объекта, по сравнению с контрольным образцом указывает на наличие рака у объекта.
В одном предпочтительном варианте осуществления изобретения контрольный образец представляет собой образец от здорового объекта. В предпочтительном варианте осуществления изобретения более высокий уровень экспрессии CCR6, определенный в образце от объекта, по сравнению с контрольным указывает на наличие интерстициального заболевания легких или рака у объекта. В другом предпочтительном варианте осуществления изобретения более высокий уровень экспрессии CCL18, определенный в образце от объекта, по сравнению с контрольным указывает на наличие рака у объекта. Термин «более высокий уровень» означает, что уровень экспрессии CCR6 или экспрессии CCL18, определенный в образце от объекта, как минимум, в 2 раза, предпочтительно, как минимум, в 3 раза, как минимум, в 4 раза, как минимум, в 5 раз, как минимум, в 10 раз, как минимум, в 20 раз, как минимум, в 30 раз, как минимум, в 40 раз, как минимум, в 50 раз, как минимум, в 60 раз, как минимум, в 70 раз, как минимум, в 80 раз, как минимум, в 90 раз, как минимум, в 100 раз, как минимум, в 500 раз, как минимум, в 1000 раз или, как минимум, в 10000 раз выше, чем в контрольном образце. Наиболее предпочтительно, уровень экспрессии CCR6 или экспрессии CCL18, определенный в образце от объекта, как минимум, в 2 раза, как минимум, в 3 раза, как минимум, в 10 раз, как минимум, в 50 раз, как минимум, в 100 раз или, как минимум, в 1000 раз выше, чем в контрольном образце.
В другом предпочтительном варианте осуществления изобретения контрольным образцом также может быть образец, полученный от объекта, который болен интерстициальным заболеванием легких или раком (контрольный объект), т.е. объект, у которого независимо диагностировали интерстициальное заболевание легких или рак, причем рак - это предпочтительно аденокарцинома, наиболее предпочтительно аденокарцинома легких. В таких случаях более высокий уровень экспрессии гена CCR6 или экспрессии гена CCL18, определенный в образце от объекта, по сравнению с контрольным образцом указывает на дальнейшее прогрессирование интерстициального заболевания легких или рака у объекта, от которого был получен образец, по сравнению с контрольным.
В другом предпочтительном варианте осуществления изобретения контрольным образцом также может быть здоровая ткань, извлеченная из пораженного органа объекта, о котором известно или предполагается, что он болен интерстициальным заболеванием легких или раком, причем рак предпочтительно аденокарцинома, наиболее предпочтительно аденокарцинома легких. В таких случаях предпочтительно, чтобы испытуемый образец (т.е. образец от объекта) извлекался из пострадавшей (т.е. больной) части упомянутого органа или части упомянутого органа, который, по предположению, поражен заболеванием, а контрольный образец извлечен из здоровой части того же органа. Термин «пораженный орган» в данном контексте означает орган, который поражен заболеванием, то есть интерстициальным заболеванием легких или раком.
В контексте настоящего изобретения контрольный образец предпочтительно выделен из тела объекта, от которого он получен.
В некоторых предпочтительных вариантах осуществления изобретения вышеупомянутый способ в соответствии с изобретением может также использоваться для контроля эффективности лечения интерстициального заболевания легких или рака in vitro. Эффективность лечения интерстициального заболевания легких или рака можно, например, контролировать, определяя уровень экспрессии CCR6 в разных образцах от объекта, которые были предоставлены в течение определенного периода времени, когда объект, от которого были получены образцы, лечили от интерстициального заболевания легких или рака. Повышение или понижение уровня экспрессии CCR6 в образцах, полученных от объекта за определенный период времени, может затем служить показателем эффективности лечения.
Эффективность лечения рака можно, например, также контролировать, определяя уровень экспрессии CCL18 в разных образцах от объекта, которые были предоставлены в течение определенного периода времени, когда объект, от которого были получены образцы, лечили от рака. Повышение или понижение уровня экспрессии CCL18 в образцах, полученных от объекта за определенный период времени, может затем служить показателем эффективности.
В одном предпочтительном варианте осуществления изобретения уровень экспрессии CCR6 в контрольном образце можно определить параллельно с уровнем экспрессии CCR6 в образце от объекта. Еще в одном предпочтительном варианте осуществления изобретения уровень экспрессии CCL18 в контрольном образце можно определить параллельно с уровнем экспрессии CCL18 в образце от объекта.
В другом предпочтительном варианте осуществления изобретения контрольный образец может быть заданным значением. Такое значение может, например, базироваться на результатах предыдущих экспериментов, определяющих степень уровней экспрессии CCR6 или уровней экспрессии CCL18 в одном или нескольких образцах от здорового объекта или от объекта, о котором известно, что он болен интерстициальным заболеванием легких или раком. В некоторых вариантах осуществления изобретения заданное значение может быть получено из базы данных.
В одном предпочтительном варианте осуществления изобретения уровень экспрессии CCR6 может сравниваться с двумя или более контрольными образцами, например, с 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более чем 100 контрольными образцами. В другом предпочтительном варианте осуществления изобретения уровень экспрессии CCL18 может сравниваться с двумя или более контрольными образцами, например, с 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или более чем 100 контрольными образцами.
Предпочтительно образец от объекта, используемый в способах в соответствии с изобретением, выделяется из тела объекта. Образец предпочтительно представляет собой твердый образец. В предпочтительном варианте осуществления изобретения образец от объекта представляет собой образец ткани, предпочтительно образец ткани легкого. Образцы тканей могут быть, например, свежими или замороженными образцами ткани или фиксированными, заключенными в парафин образцами. В одном предпочтительном варианте осуществления изобретения образец может представлять собой образец биопсии или резекции. В другом предпочтительном варианте осуществления изобретения образец представляет собой фибробластную клеточную линию, образованную из хирургического материала или из материала, полученного из фиброзных легких, как например, описано ниже в Примере 1. В другом предпочтительном варианте осуществления изобретения образец представляет собой образец бронхиальной щеточной биопсии.
В некоторых вариантах осуществления изобретения образец от объекта представляет собой жидкость, предпочтительно жидкость организма.
В предпочтительном варианте осуществления изобретения жидкость организма выбирается из группы, состоящей из крови, плазмы, бронхоальвеолярного лаважа, плевральной жидкости, мокроты, слюны, сыворотки или мочи.
В некоторых вариантах осуществления изобретения жидкий образец может быть обогащен относительно представляющих интерес клеток, например, циркулирующих фиброцитов или Т-клеток, если образец используется для исследования, болен ли объект интерстициальным заболеванием легких, или раковых клеток, если образец используется для исследования, болен ли объект раком.
Обогащение может выполняться любым известным специалисту способом.
Обогащение можно, например, выполнять с использованием твердой подложки, например, колонки, покрытой специфическими антителами, как например, антитела, специфичные к Т-клеткам, если должны обогащаться Т-клетки, или антитела, специфичные к антигену рака легких, если должны обогащаться клетки рака легких. Альтернативно, обогащение можно, например, также выполнять с использованием фильтрационных способов, как например, фильтрация через сетку, или путем иммобилизации специфических аптамеров на микрофлюидном канале и перекачки жидкого образца через это устройство.
Еще в одном аспекте настоящее изобретение также относится к диагностическому набору для детектирования интерстициального заболевания легких или рака, содержащий детектирующий агент, специфичный к полинуклеотиду CCR6 или полипептиду CCR6.
Предпочтительно, полинуклеотид CCR6 представляет собой CCR6 мРНК.
В предпочтительном варианте осуществления изобретения упомянутый детектирующий агент представляет собой антитело, аптамер или олигонуклеотидный зонд.
Описание антител и олигонуклеотидных зондов, пригодных для обнаружения полинуклеотида CCR6, в частности CCR6 мРНК, и полипептида CCR6 приведено выше.
Еще в одном аспекте настоящее изобретение также относится к диагностическому набору для детектирования рака, содержащему детектирующий агент, специфичный к полинуклеотиду CCL18 или полипептиду CCL18.
Предпочтительно, упомянутый полинуклеотид CCL18 представляет собой CCL18 мРНК.
В предпочтительном варианте осуществления изобретения упомянутый детектирующий агент представляет собой антитело, аптамер или олигонуклеотидный зонд.
Описание антител и олигонуклеотидных зондов, пригодных для обнаружения полинуклеотида CCL18, в частности CCL18 мРНК, и полипептида CCL18 приведено выше.
В предпочтительном варианте осуществления изобретения диагностический набор, кроме того, содержит дополнительные компоненты или реагенты, которые пригодны для выполнения способов в соответствии с изобретением, как например, буферы или контрольные образцы. В другом предпочтительном варианте осуществления изобретения компоненты, содержащиеся в диагностическом наборе, находятся в одном или нескольких контейнерах. Диагностический набор в соответствии с настоящим изобретением может также содержать инструкцию по использованию диагностического набора и его компонентов.
Настоящее изобретение в другом аспекте также относится к фармацевтической композиции, содержащей соединение, способное ингибировать активность и/или экспрессию рецептора CCR6.
Фармацевтическая композиция в соответствии с изобретением может вводиться перорально, например, в виде пилюль, таблеток, лакированных таблеток, таблеток с сахарным покрытием, гранул, твердых и мягких желатиновых капсул, водных, спиртовых или масляных растворов, сиропов, эмульсий или суспензий, или ректально, например, в виде суппозиториев. Введение может также осуществляться парентерально, например, подкожно, внутримышечно или внутривенно в виде раствора для инъекций или инфузий. Другими подходящими формами введения являются, например, чрескожное или местное введение, например, в виде мазей, настоек, спреев или трансдермальных терапевтических систем, или ингаляционное введение в форме назальных спреев или аэрозольных смесей.
В предпочтительном варианте осуществления изобретения фармацевтическая композиция в соответствии с изобретением вводится парентерально, например, в виде растворов для инъекций или инфузий, перорально, например, в форме таблетки, пилюли, пастилки или капсулы, или путем ингаляции.
Для изготовления пилюль, таблеток, таблеток с сахарным покрытием и твердых желатиновых капсул могут использоваться, например, лактоза, крахмал, например, кукурузный крахмал или производные крахмала, тальк, стеариновая кислота или ее соли и т.д. Носителями для мягких желатиновых капсул и суппозиториев являются, например, жиры, воски, полутвердые и жидкие полиолы, природные или отвержденные жиры и т.д. Подходящими носителями для приготовления растворов, например, растворов для инъекций, или эмульсий или сиропов являются, например, вода, физиологический раствор хлористого натрия, спирты, такие как этанол, глицерин, полиолы, сахароза, инвертированный сахар, глюкоза, маннит, растительные масла и т.д.
В некоторых вариантах осуществления изобретения фармацевтические композиции также содержат добавки, как например, наполнители, разрыхлители, связующие вещества, смазывающие вещества, увлажняющие агенты, стабилизаторы, эмульгаторы, дисперсанты, консерванты, подсластители, красители, вкусовые вещества, ароматизаторы, загустители, разбавители, буферные вещества, растворители, солюбилизаторы, агенты для достижения депо-эффекта, соли для изменения осмотического давления, покровные вещества или антиоксиданты.
Примеры подходящих наполнителей для многообразных различных форм фармацевтических композиций, описанных здесь, можно, например, найти в "Handbook of Pharmaceutical Excipients", 2nd Edition, (1994), Edited by A Wade and PJ Weller.
В предпочтительном варианте осуществления изобретения соединение, способное ингибировать активность и/или экспрессию рецептора CCR6, выбирается из группы, состоящей из полипептида в соответствии с изобретением, малой молекулы, способной связываться с рецептором CCR6, изолированного полинуклеотида в соответствии с изобретением, аптамера, специфичного к рецептору CCR6, антитела, специфичного к рецептору CCR6, антисмысловой молекулы, пригодной для снижения или ингибирования экспрессии рецептора CCR6, и молекулы сиРНК, пригодной для снижения или ингибирования экспрессии рецептора CCR6.
Малые молекулы, способные связываться с рецептором CCR6, можно, например, идентифицировать путем скрининга небольших библиотек соединений.
Способность малой молекулы связываться с рецептором CCR6 можно, например, определить с помощью описанных выше способов. Аналогичные способы можно, например, применить для определения способности малой молекулы связываться с CCL18 или CCL20.
Термин «аптамер» в соответствии с использованием в настоящем документе относится к ДНК, РНК или пептидному аптамеру, специфичному к CCL18 или к CCL20 соответственно.
Полинуклеотидный аптамер предпочтительно имеет длину, примерно от 10 до 300 нуклеотидов. Предпочтительно аптамер имеет длину, примерно от 30 до 100 нуклеотидов. Наиболее предпочтительно аптамер имеет длину, примерно от 10 до 60 нуклеотидов.
Аптамеры можно получить любым известным способом, включая синтетический, рекомбинантный способы и способ очистки, их можно использовать отдельно или в комбинации с другими аптамеры, специфичными к CCL18 или к CCL20.
Антитело, специфичное к рецептору CCR6, может быть моноклональным или поликлональным антителом. В некоторых вариантах осуществления изобретения антитело может быть также выбрано из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2, при условии, что упомянутые варианты или фрагменты антитела специфичны к рецептору CCR6.
Термин «антисмысловая молекула, пригодная для снижения или ингибирования экспрессии рецептора CCR6» относится к полинуклеотиду, комплиментарному CCR6 мРНК. Предпочтительно, что упомянутая антисмысловая молекула пригодна для использования в антисмысловом подходе для ингибирования трансляции CCR6 мРНК в клетке. Упомянутая антисмысловая молекула может быть молекулой ДНК или РНК и может быть одноцепочечной или двухцепочечной. В предпочтительном варианте осуществления изобретения антисмысловая молекула представляет собой одноцепочечную молекулу ДНК или двухцепочечную или одноцепочечную молекулу РНК.
Антисмысловая молекула предпочтительно имеет длину от примерно 10 до примерно 500 нуклеотидов, примерно от 11 до 200 нуклеотидов, примерно от 12 до примерно 100 нуклеотидов, примерно от 13 до 75 нуклеотидов, или примерно от 14 до 50 нуклеотидов, примерно от 15 до 40 нуклеотидов, примерно от 16 до 30 нуклеотидов, или примерно от 17 до 25 нуклеотидов.
Молекула сиРНК, пригодная для снижения или ингибирования экспрессии рецептора CCR6, может быть одноцепочечной или двухцепочечной молекулой сиРНК, которая способна к гибридизации с CCR6 мРНК, тем самым индуцируя РНК-интерференцию или любой иной внутриклеточный антисмысловой механизм, который приводит к снижению или ингибированию экспрессии белка CCR6.
Молекула сиРНК может быть любой последовательности, которая дает возможность молекуле сиРНК индуцировать РНК-интерференцию, приводящую к снижению или ингибированию экспрессии белка CCR6.
Предпочтительно, молекула сиРНК имеет длину от 10 до 100, от 12 до 80, от 14 до 60, от 16 до 50, от 17 до 40, более предпочтительно от 18 до 30 нуклеотидов и наиболее предпочтительно от 18 до 26 нуклеотидов.
В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция в соответствии с изобретением содержит дополнительное активное соединение, пригодное для лечения или предупреждения интерстициального заболевания легких и/или рака.
Примерами дополнительного активного соединения, пригодного для лечения интерстициального заболевания легких являются, например, противовоспалительные препараты, как например, преднизон или другие кортикостероиды, азатиоприн, метотрексат, микофенолат или циклофосфамид, антиоксиданты, как например, ацетилцистеин антифибротические агенты, как например, босентан или пирфенидон, миноциклин, силденафил, талидомид, анти-TNF антитела, как например, инфликсимаб; этанерцепт, интерферон гамма, анти-IL-13 антитела, ингибиторы эндотелина, зилеутон, антикоагулянты, макролиды, фосфодиэстеразы (PDE) 4 ингибиторы, как например, рофлумиласт, авиптадил, альфа-меланоцит-стимулирующий гормон (альфа-МСГ), ингибиторы тирозинкиназы, как например, иматиниб, дазатиниб и нилотиниб.
Дополнительным активным соединением, пригодным для лечения рака, предпочтительно является химиотерапевтический агент.Химиотерапевтические агенты, пригодные для лечения рака, хорошо известны специалистам. Примерами химиотерапевтических агентов являются, например, темозоломид, адриамицин, доксорубицин, эпирубицин, 5-фторурацил, цитозинарабинозид (Ara-C), циклофосфамид, тиотепа, бусульфан, цитоксин, таксоиды, например, паклитаксел, токсотер, метотрексат, цисплатин, мелфалан, винбластин, блеомицин, этопозид, ифосфамид, митомицин С, митоксантрон, винкристин, винорельбин, карбоплатин, тенипозид, дауномицин, карминомицин, аминоптерин, дактиномицин, митомицины, мелфалан и другие соответствующие азотистые иприты и гормональные агенты, действие которых направлено на регулирование или ингибирование действия гормонов на опухоли, такие как тамоксифен и онапристон.
Фармацевтическая композиция в соответствии с изобретением может содержать один или несколько дополнительных активных соединений, пригодных для лечения или предупреждения интерстициального заболевания легких, и/или один или несколько дополнительных активных соединений, пригодных для лечения или предупреждения рака. В предпочтительном варианте осуществления изобретения фармацевтическая композиция в соответствии с изобретением содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 дополнительных активных соединений, пригодных для лечения или предупреждения интерстициального заболевания легких, и/или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более 10 дополнительных активных соединений, пригодных для лечения рака.
В других предпочтительных вариантах осуществления изобретения один или несколько отдельных композиций, содержащих активное соединение, пригодное для лечения или предупреждения интерстициального заболевания легких, и/или активное соединение, пригодное для лечения или предупреждения рака, можно вводить объекту, предпочтительно человеку, в сочетании с фармацевтической композицией в соответствии с изобретением, содержащей соединение, способное ингибировать активность и/или экспрессию рецептора CCR6.
Еще в одном аспекте настоящее изобретение относится к фармацевтической композиции в соответствии с изобретением для использования для лечения или предупреждения интерстициального заболевания легких и/или рака.
Еще в одном аспекте настоящее изобретение относится к использованию соединения, способного ингибировать активность и/или экспрессию рецептора CCR6, или к фармацевтической композиции в соответствии с изобретением для изготовления лекарственного препарата для лечения или предупреждения интерстициального заболевания легких и/или рака.
В предпочтительном варианте осуществления изобретения соединение, способное ингибировать активность и/или экспрессию рецептора CCR6, выбирается из группы, состоящей из изолированного полипептида в соответствии с изобретением, малой молекулы, способной связываться с рецептором CCR6, изолированного полинуклеотида, кодирующего изолированный полипептид в соответствии с изобретением, аптамера, специфичного к рецептору CCR6, антитела, специфичного к рецептору CCR6, антисмысловой молекулы, пригодной для снижения или ингибирования экспрессии рецептора CCR6, и молекулы сиРНК, пригодной для снижения или ингибирования экспрессии рецептора CCR6. Такие соединения, способные ингибировать активность и/или экспрессию рецептора CCR6, описаны выше. В особенно предпочтительном варианте использования в соответствии с изобретением соединение, способное ингибировать активность и/или экспрессию рецептора CCR6, выбирается из группы, состоящей из изолированного полипептида в соответствии с изобретением и изолированного полинуклеотида, кодирующего изолированный полипептид в соответствии с изобретением.
Настоящее изобретение также относится к использованию соединения, способного ингибировать активность и/или экспрессию CCL18 или CCL20, для изготовления лекарственного препарата для лечения или предупреждения интерстициального заболевания легких и/или рака.
В предпочтительном варианте осуществления вышеупомянутого использования в соответствии с изобретением соединение, способное ингибировать активность и/или экспрессию CCL18 или CCL20, выбирается из группы, состоящей из малой молекулы, способной связываться с CCL18 или CCL20, аптамера, специфичного к CCL18 или CCL20, антитела, специфичного к CCL18 или CCL20, антисмысловой молекулы, пригодной для снижения или ингибирования экспрессии CCL18 или CCL20, и молекулы сиРНК, пригодной для снижения или ингибирования экспрессии CCL18 или CCL20.
Настоящее изобретение также относится к использованию детектирующего агента, выбранного из группы, состоящей из:
(a) детектирующего агента, специфичного к полинуклеотиду, кодирующему рецептор CCR6;
(b) детектирующего агента, специфичного к рецептору CCR6;
(c) детектирующего агента, специфичного к полинуклеотиду, кодирующему CCL18;
(d) детектирующего агента, специфичного к белку CCL18;
(e) детектирующего агента, специфичного к полинуклеотиду, кодирующему CCL20; и
(f) детектирующего агента, специфичного к белку CCL20
для детектирования интерстициального заболевания легких или рака в образце от объекта.
Предпочтительно, упомянутый полинуклеотид в соответствии с (а), (с) и/или (е) представляет собой мРНК. Соответствующие детектирующие агенты для определения CCR6 мРНК, CCL18 мРНК или CCL20 мРНК являются, например, антисмысловыми олигонуклеотидными зондами, специфичными к CCR6 мРНК, CCL18 мРНК или CCL20 мРНК. Предпочтительный детектирующий агент для определения рецептора CCR6, белка CCL18 или белка CCL20 представляет собой антитело или аптамер. Предпочтительно, антитело является моноклональным или поликлональным антителом. В некоторых вариантах осуществления изобретения детектирующий агент может быть также выбран из вариантов или фрагментов антитела, как например, одноцепочечные антитела, диатела, минитела, одноцепочечные фрагменты Fv (sc(Fv)), sc (Fv)2 антитела, фрагменты Fab или фрагменты F(ab')2. Одним примером коммерчески доступного антитела, специфичного к CCR6, является античеловеческий CCR6 mAb, описанный ниже в Примере 1. Детектирующий агент предпочтительно содержит детектируемую метку.
В одном предпочтительном варианте осуществления способа в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением и/или использования в соответствии с изобретением интерстициальное заболевание легких выбирается из группы, состоящей из диффузного паренхиматозного заболевания легких известной причины (предпочтительно коллагеновое сосудистое заболевание или болезни, вызываемые загрязнением окружающей среды, или связанное с действием лекарственного средства диффузное паренхиматозное заболевание легких), гранулематознОго диффузного паренхиматозного заболевания легких (предпочтительно саркоидоз) и других форм диффузного паренхиматозного заболевания легких (предпочтительно лимфангиолейомиоматоз (LAM), легочный лангергансоклеточный гистиоцитоз /гистиоцитоз Х (НХ) или эозинофильная пневмония).
В особенно предпочтительном варианте осуществления способа в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением и/или использования в соответствии с изобретением интерстициальная болезнь легких является идиопатической интерстициальной пневмонией.
В другом предпочтительном варианте осуществления способа в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением и/или использования в соответствии с изобретением интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, связанного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии. В особенно предпочтительном варианте осуществления способа в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением и/или использования в соответствии с изобретением интерстициальное заболевание легких является идиопатическим легочным фиброзом. Общие сведения о классификации интерстициальных болезней легких специалист может, например, найти в Международной междисциплинарной согласованной классификации идиопатической интерстициальной пневмонии Американского торакального общества/Европейского респираторного общества; Am J Respir Crit Care Med. 2002 Jan 15; 165(2):277-304 [American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias, American Thoracic Society; European Respiratory Society, Am J Respir Crit Care Med. 2002 Jan 15; 165(2):277-304].
В некоторых вариантах осуществления изобретения интерстициальное заболевание легких может быть вызвано состоянием, выбранным из группы, состоящей из склеродермии легких, саркоидоза, гиперчувствительного пневмонита, ревматоидного артрита, системной красной волчанки и асбестоза.
В другом варианте осуществления способа в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением и/или использования в соответствии с изобретением вид рака выбирается из группы, состоящей из рака легкого, рака молочной железы, рака поджелудочной железы, рака предстательной железы, нейробластомы, меланомы, рака мозга, рака почки, рака мочевого пузыря, рака яичников, рака крови и рака толстой кишки. Еще в одном предпочтительном варианте осуществления способа в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением и/или использования в соответствии с изобретением вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы.
В особенно предпочтительном варианте осуществления способа в соответствии с изобретением, диагностического набора в соответствии с изобретением, фармацевтической композиции в соответствии с изобретением и/или использования в соответствии с изобретением вид рака представляет собой рак легких, наиболее предпочтительно аденокарциному легких, или мезотелиому плевры. В наиболее предпочтительном варианте осуществления изобретения вид рака представляет собой аденокарциному легких.
Настоящее изобретение также относится к:
(1) Способу идентификации соединения, способного ингибировать активность рецептора CCR6, в котором способ включает следующие стадии:
(a) контактирование рецептора CCR6 с тестируемым соединением;
(b) добавление агониста рецептора CCR6, в котором упомянутый агонист представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 5 или SEQ ID NO.: 18;
(c) определение активности упомянутого рецептора CCR6; и
(d) выбор упомянутого тестируемого соединения в качестве соединения, способного ингибировать активность рецептора CCR6, если активность рецептора CCR6, определенная в (с), ниже, чем активность рецептора CCR6, определенная в контрольном образце.
(2) Способу по пункту (1), в котором упомянутое тестируемое соединение представляет собой антитело, малую молекулу или пептид.
(3) Способу детектирования интерстициального заболевания легких или рака у объекта, включающему стадию определения уровня экспрессии гена CCR6 в образце от упомянутого объекта.
(4) Способу по пункту (3), в котором способ дополнительно включает стадию сравнения уровня экспрессии гена CCR6, определенного в образце от объекта, с уровнем экспрессии гена CCR6 в контрольном образце, в котором более высокий уровень экспрессии гена CCR6, определенный в образце от объекта, в сравнении с контрольным образцом указывает на наличие интерстициального заболевания легких или рака у объекта.
(5) Способу по пункту (3) или (4), в котором интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, связанного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии.
(6) Способу по пункту (3) или (4), в котором вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы.
(7) Способу количественной оценки концентрации растворимого полипептида рецептора CCR6 в жидком образце от объекта, в котором способ включает следующие стадии:
(a) иммобилизация захватывающей молекулы, специфичной к растворимому рецептору CCR6 на твердой подложке;
(b) добавление жидкого образца от объекта;
(c) факультативное добавление лиганда упомянутого растворимого рецептора CCR6, в котором упомянутый лиганд представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 18., SEQ ID NO.: 19., SEQ ID NO.: 20 или SEQ ID NO.: 21;
(d) добавление детектирующего агента, специфичного к лиганду в соответствии с (с), в котором упомянутый детектирующий агент содержит метку;
(e) количественная оценка сигнала от детектирующего агента в соответствии с (d).
(8) Способу по пункту (7), в котором упомянутый растворимый полипептид рецептора CCR6 является изолированным растворимым полипептидом рецептора CCR6 в соответствии с изобретением.
(9) Способу детектирования и/или прогнозирования интерстициального заболевания легких или рака у объекта, в котором способ включает стадию определения уровня растворимого полипептида рецептора CCR6 в образце от упомянутого объекта.
(10) Способу по пункту (9), в котором способ дополнительно включает стадию сравнения уровня растворимого полипептида рецептора CCR6, определенного в образце от объекта, с уровнем растворимого полипептида рецептора CCR6 в контрольном образце, в котором более низкий уровень растворимого полипептида рецептора CCR6, определенный в образце от объекта, по сравнению с контрольным образцом указывает на наличие интерстициального заболевания легких или рака у объекта.
(11) Способу по пункту (9) или (10), в котором интерстициальное заболевание легких выбирается из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, связанного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии.
(12) Способу по пункту (9) или (10), в котором вид рака выбирается из группы, состоящей из аденокарциномы, предпочтительно аденокарциномы легких, плеврамезотелиомы, колоректальной карциномы, карциномы предстательной железы, карциномы молочной железы, карциномы почки, гепатоцеллюлярной карциномы, неходжкинской лимфомы и ходжкинской лимфомы.
Далее настоящее изобретение будет описано со ссылкой на некоторые из конкретных примеров. Но эти примеры не следует рассматривать как ограничительные.
ПРИМЕРЫ
Пример 1 - Материалы и Способы
Библиотека фагового дисплея
Для идентификации CCL18-связывающего мотива использовали созданную библиотеку фагового дисплея (Л.1).
Клетки и клеточные линии
Фибробластные линии были созданы либо из хирургического материала из пневм- эктомий, либо из дольковых эктомий от пациентов с различными опухолями, либо из остаточного материала, полученного из фиброзных легких с помощью видеотораскопии (VATS). У пациентов были либо аденокарцинома легких, немелкоклеточный рак, либо сквамозная карцинома. Фиброз был результатом идиопатического легочного фиброза (UIP), неспецифической интерстициальной пневмонии, саркоидоза, гиперчувствительного пневмонита, пневмокониоза или системной склеродермии. Ткань разрезали на небольшие куски (приблизительно длиной 0,5 см по кромке) и поместили в 6-луночные планшеты, содержащие 1 мл Quantum 333 (РАА, Пашинг, Австрия) с 1% пенициллином/стрептомицином. Растущие фибробласты собрали, когда они достигли примерно 80% конфлуентности трипсинизацией, культивировали в 75-см2 колбах с клеточной культурой (NUNC Thermo Fisher, Роскилле, Дания) в Quantum 333 и впоследствии расщепили (1:3-1:5). Созданные линии были зарегистрированы в исследованиях из каналов 3-8.
Если не указано иное, упомянутые клетки стимулировали с помощью 10 нг/мл человеческого рекомбинантного CCL18, 2,5 нг/мл TGFβ с добавлением или без добавления 1 нг/мл TNFα.
AECII выделили, как описано ранее (Л.2). Итак, макроскопически легочную ткань без опухоли сначала нарезали на срезы = шлифы и срезы промыли три раза при 4°С в забуференном фосфатом физиологическом растворе (PBS), а затем дигерировали в стерильном растворе диспазы (2,5 мг диспазы II (Invitrogen GmbH, Карлсруэ, Германия) и 50 μг/мл ДНКазы I (Roche Diagnostics, Мангейм, Германия)) при 37°С в течение 60 мин. После дигерирования с использованием диспазы срезы тщательно отмерили (отобрали пипеткой) в течение нескольких минут с помощью 10 мл пипетки с широким входом. Неочищенную ткань и клеточные суспензии отфильтровали через нейлоновую сетку с ячейками 50 и 20 цм. Клеточную суспензию затем наслоили на градиентный раствор (PAN Biotech GmbH, Айденбах, Германия) и центрифугировали при 800xg в течение 20 мин.
Клетки из интерфазы промыли и инкубировали в 100-мм чашках Петри (макс. 6×107 клеток/чашка) в среде RPMI [Roswell Park Memorial Institute medium] (Invitrogen, Карлсруе, Германия) с помощью 10% эмбриональной телячьей сыворотки (FCS) (РАА Laboratories GmbH, Кельбе, Германия) и 1% пенициллина/стрептомицина (Biochrom AG, Берлин, Германия) при 37°С во влажной камере (5% CO2, 37°С) в течение 15, 20 и, если возможно, 30 мин для удаления прилипающих=адгезивных клеток (в основном альвеолярных макрофагов, моноцитов и фибробластов) с неприлипающих клеток.
Клетки аденокарциномы легких и клетки мезотелиомы плевры человека были щедрым подарком от проф. НН Fiebig, Oncotest, Фрайбург. Клетки культивировали в среде RPMI 1640, содержащей 10% FCS и 100 ед/мл [U/ml] стрептомицина и пенициллина. Культуры расщепили = разделили в соотношении 1:3, когда они достигли 90% конфлуентности.
Проточная цитометрия
Поверхностную экспрессию CCR6 фибробластных и опухолевых клеточных линий, а также RLE-6TN определили с помощью FITC-меченного анти-человеческого антитела CCR6 (R&D Systems, Миннеаполис, Миннесота) и подсчитали с помощью цитометра FACSCalibur (BD, Гейдельберг, Германия). Трипсинизированные клетки должны инкубироваться 3 ч в среде при 37°С для обеспечения повторной экспрессии молекул на поверхности. Чтобы предотвратить адгезию клеток, эта инкубация проводилась в полипропиленовых пробирках.
CCR6 экспрессию RLE-6TN клеток также проанализировали с использованием поликлонального козьего анти-CCR6 антитела (CKR6/C20, Santa Cruz Biotechnology, Санта-Круз, Калифорния) и FITC-меченного мышиного-анти-козъего антитела (DAKO, Глоструп, Дания).
Поверхностную экспрессию CCR6 опухолевых клеточных линий также оценили с помощью РЕ-меченного анти-человеческого антитела CCR6 (R&D Systems, Миннеаполис, Миннесота) и измерили с помощью FACS Calibur (Beckton Dickinson, Гейдельберг, ФРГ).
Анализ экспрессии CCR6 в карциноме легких человека
Свежевыделенную опухолевую ткань из аденокарциномы легких нарезали на куски длиной не более 1×1×0,5 см по кромке. Ткань стабилизировали с помощью стабилизирующего раствора HOPE (DCS, Гамбург, ФРГ) при температуре 4°С и залили парафином. Срезы ткани были депарафинизированы и окрашены для экспрессии CCR6 с помощью методики с применением пероксидов (Л.5) с использованием коммерчески доступных антител (R&D Systems, Висбаден, ФРГ).
Иммуногистохимия
Иммуногистохимию проводили, как описано (Л.3, Л.4) с использованием анти-человеческого CCR6 mAb (клон 53103, изотип мышиный IgG2b; R&D Systems Europe, Великобритания) и методики с использованием меченного пероксидазой стрептавидина-биотина (DAKO LSAB2 System; DakoCytomation, Германия). Контрастное окрашивание выполнили гемалюмом Майера. Для отрицательного контроля, включенного в каждую серию окрашивания, срезы были окрашены без первичного антитела.
Твердофазный иммуноферментный анализ [ELISA] FGF2
Для оценки высвобождения CCL18-индуцированного FGF2 фибробласты собрали, подсчитали и посеяли 300000 клеток на лунку в 6-луночный планшет с клеточной культурой Quantum 333. Клетки оставили для прикрепления на ночь и среду заменили на 1 мл DMEM [модифицированная по способу Дульбекко среда Игла] плюс 10% FCS. Клетки либо оставляли нестимулированными, либо стимулировали с помощью 10 нг/мл человеческого рекомбинантного CCL18. Чтобы блокировать взаимодействие CCR6/CCL18, блокирующее антитело против CCR6 (R&D Systems, Висбаден, ФРГ) или иррелевантное антитело (мышиный анти-человеческий IgG, R&D Systems) добавили в конечную концентрацию 20 μг/мл в параллельных культурах. Через 24 часа культивирования супернатант собрали и хранили при -80°С до определения FGF2.
Концентрации FGF2 измеряли с помощью комплекта разработки ELISA (R&D) и выполняли в соответствии с инструкцией поставщика.
ПЦР в реальном времени
По истечении указанного периода культивирования всю РНК извлекли с помощью TRIzol реагента в соответствии с протоколом производителя (Invitrogen, Карлсруе, Германия). Общая РНК была реверсивно транскрибирована с помощью StrataScript RT (Stratagene, Санта-Клара, Калифорния) с использованием олиго (dT) 12-18 праймера для получения к ДНК в соответствии с протоколом производителя. Специфические праймеры к CCR6 человека, коллаген типа I, альфа-гладкомышечный актин и GAPDH [глицеральдегид-3-фосфатдегидрогеназа] были разработаны с использованием программного обеспечения Primer3 (Институт медико-биологических исследований Уайтхеда, Кембридж, США; http://frodo.wi.mit.edu/cgi-bin/primer3/primer3_www.cgi), программного обеспечения Amplify 1,2 (Университет Висконсина, США; http://engels.genetics.wisc.edu/amplify) с помощью баз данных LocusLink и GenBank (Национальный центр биотехнологической информации; http://www.ncbi.nlm.nih.gov/LocusLink/index.html). Каталоговые кодовые номера для нуклеотидных последовательностей, использованные для создания соответствующих праймеров и последовательностей праймеров, приведены на Фигуре 17.
Все праймеры были интрон-перекрывающими и синтезированными с помощью MWG-Biotech (MWG-Biotech AG, Германия). ПНР в реальном времени проводили с помощью iQ SYBR Green SuperMix, iCycler термоциклера = амплификатора и программного обеспечения iCycler IQ 3.0 (Bio-Rad Laboratories GmbH, Германия) в соответствии с протоколом производителя. Для контроля специфичности продуктов амплификации был выполнен анализ кривой плавления. Амплификация неспецифических продуктов не наблюдалась ни в одной из реакций. Рассчитывали значение порогового цикла (Ct) и использовали его для расчета относительного уровня специфической мРНК по следующей формуле: «относительная экспрессия =2(CtGAPDH-CtCCL18)×10000» для каждого образца кДНК.
Вестерн-блоттинг
По истечении указанного периода культивирования клетки промыли один раз в PBS и лизировали в ледяном буфере для лизиса. Все клеточные лизаты варили при 93°С в течение 5 мин в равных объемах загрузочного буфера (0,5 М Трис-HCl pH 6,8, 2% SDS, 0, 05% бромфенолсиний, 20% 2-меркаптоэтанол, 10% глицерин).
Все образцы обработали 12% додецилсульфатомом натрия-PAGE, разделили с помощью электрофореза и перенесли на мембрану из поливинилидендифторида (PVDF). После блокирования в течение 2 ч в Трис-буферизированном физиологическом растворе (TBS), содержащем 5% обезжиренное сухое молоко, мембраны инкубировали с первичным антителом (кролик-анти-коллаген I (Rockland, Гилбертвилль, Калифорния); анти αSMA (кроличий-анти- αSMA (Abeam, Кембридж, Массачусетс); анти виментиномом (Санта-Круз); анти CCR6: CKR6/C20, Санта-Круз), разбавленного в соотношении 1:700 раствором TBS при 4°С в течение ночи. Визуализация была выполнена с использованием соответствующих вторичных антител, меченных IRDye 800CW или IRDye 700CW (Li-COR Bioscience, Бад Хомбург, Германия), разбавленных 1:10000-1:20000, в течение 2 ч и сканированных с помощью системы Odyssey (Li-COR Biosience) в соответствии с инструкциями производителей.
Анализ экспрессии CCR6 с помощью PBMNC [мононуклеары периферической крови] в присутствии или отсутствии РНА
Мононуклеары периферической крови человека выделили из крови венопункции с помощью центрифугирования в градиенте плотности, промыли и подсчитали. Клетки откорректировали до 1×106 клеток на мл в полной культуральной среде (RPMI 1640 с 10% эмбриональной телячьей сывороткой и 100 ед. пенициллина/стрептомицина) и культивировали в течение 24 ч либо в отсутствии, либо в присутствии 1 μг/мл фитогемагглютинина (РНА). Процентное содержание CCR6-положительных клеток измерили с помощью FITC-меченных анти-CCR6 антител (R&D Systems, Висбаден, ФРГ) и подсчитали в FACS calibur (Becton Dickinson, Гейдельберг, ФРГ).
Ингибирование понижающей регуляции CCR6
Свежевыделенные мононуклеары инкубировали в течение 20 мин с помощью 10 нг/мл CCL18, 100 нг/мл ингибитора-пептида PS-AU-105 (полипептид согласно SEQ ID NO.: 9), комбинации обоих или оставили необработанными. Инкубация выполнялась в RPMI 1640 с 10% эмбриональной телячьей сывороткой и 100 ед/мл стрептомицина/пенициллина при 37°С. После инкубации клетки центрифугировали и супернатант отбросили. Клетки фиксировали 4% параформальдегидом в течение 5 минут на льду и дважды промыли в PBS, содержащем 1% PCS. После фиксации клетки были окрашены с помощью флуоресцеин-конъюгированных антител против CCR6 (R&D Systems, Висбаден, ФРГ) и проанализировали с помощью проточной цитометрии (FACSCalibur и Quantiquest, оба производства Becton Dickinson, Франклин Лейке, США).
Статистика (Фиг. 1-16)
Все статистические вычисления проводились с использованием непараметрической статистики. Парный анализ увеличения или ингибирования выполнялся с использованием критерия знаковых рангов Уилкоксона; непарные группы были проанализированы с использованием U-критерия Манна-Уитни. Значения р<0,05 считались значимыми. Данные представлены в виде ящичковых диаграмм. В этом случае среднее значение приводится как линия в прямоугольнике, указывающая 25 и 75 процентиль. 5 и 95 процентиль обозначены в виде линий под или над прямоугольником, значения за пределами или выше 5 и 95 процентиля изображены в виде точек.
Пациенты
Сыворотку крови взяли у здоровых добровольцев (n=6), пациентов с заболеваниями NSIP (n=6) и UIP (n=13) венепункцией. Через час свертывания кровь центрифугировали в течение 15 мин и образцы сыворотки поделили на аликвоты и хранили при - 80°С до выполнения ELISA.
Вестерн-блоттинг анализ сыворотки крови (Пример 8)
Сыворотку разбавили 1:10 вестерн-блот буфером и варили при 93°С в течение 5 мин в равных объемах загрузочного буфера (0,5 М Трис-HCl pH 6,8, 2% SDS, 0, 05% бромфенолсиний, 20% 2-меркаптоэтанол, 10% глицерин).
Образцы подвергли электрофорезу с 12% додецилсульфат натрий полиакриламид гелем (SDS-PAGE), разделили с помощью электрофореза и перенесли на мембрану из поливинилидендифторида (PVDF). После блокирования в течение 2 ч в Трис-буферизированном физиологическом растворе (TBS), содержащем 5% обезжиренное сухое молоко, мембраны инкубировали с первичным анти-CCR6 антителом (CKR6/C20, Санта-Круз), разведенным 1:700 раствором TBS, при 4°С в течение ночи. Визуализация была выполнена с использованием вторичного антитела, меченного IRDye 800CW (Li-COR Bioscience, Бад Хомбург, Германия), разбавленного 1:10000-1:20000, в течение 2 ч. Отпечатки затем сканировали и подсчитали с помощью системы и программного обеспечения Odyssey (Li-COR Biosience) в соответствии с инструкциями производителей.
ELISA CCR6
Анализ ELISA выполняли в соответствии с инструкцией поставщика (Uscn Life Science Inc., Ухань, Китай).
Блокирование свободного растворимого CCR6
Сыворотку крови разбавили равным объемом раствора PBS/BSA (1% бычий сывороточный альбумин, Sigma, Диссенхофен, Германия) либо без каких-либо добавок, либо содержащим CCL18 или CCL20 (оба от PeproTech, Гамбург, Германия; 100 нг/мл каждый). Разбавленную сыворотку инкубировали в течение 1 ч при 37°С, а затем измерили с помощью ELISA.
Бронхоальвеолярный лаваж
Культивирование бронхоскопии, бронхоальвеолярного лаважа и клеток бронхоальвеолярного лаважа проводили с применением стандартной технологии, как описано ранее (Л.8, Л.9). В конце периода культивирования супернатанты собрали и хранили при -70°С до выполнения анализа на концентрации CCL18. Жизнеспособность клеток определяли путем исключения Трипана синего и всегда жизнеспособность клеток превышала 95%.
Определение лейкоцитарной формулы клеток бронхоальвеолярного лаважа
Определение лейкоцитарной формулы клеток выполняли путем подсчета, как минимум, 200 клеток на клеточном отпечатке, окрашенном красителем Май-Грюнвальда.
Для иммунопероксидазного окрашивания клетки зафиксировали на покрытых поли-L-лизином предметных стеклах (Bio-Rad, Мюнхен, Германия) и увеличили в объеме = расширили с помощью пероксидазной-антиперксидазной (РАР) технологии с использованием моноклональных антител против CD4, CD8, IL-2R (Ortho Diagnostic Systems; Неккаргемюнд, Германия) и человеческого лейкоцитарного антигена-DR (HLA-DR) (Becton Dickinson, Гейдельберг, Германия). Было насчитано, как минимум, 200 клеток, положительные клетки экспрессируются как процент от всех лимфоцитов.
Статистика (Фигуры 18-22)
Данные приведены в виде средних значений ± стандартное отклонение [SD]. Сравнения номинальных данных выполняются с помощью критерия хи-квадрат.Текущие данные анализируются с помощью непараметрического U-критерия Манна-Уитни. Все статистические вычисления проводились с использованием Stat View.
Материал и методы, относящиеся к Примерам 11-17 и Фигурам 23-32:
Характеристики пациентов с NSCLC [немелкоклеточный рак легких-НМРЛ] и здоровых контрольных пациентов
В это исследование было включено сто семьдесят пациентов, у которых диагносцирован НМРЛ (Стадия I - Стадия IV, 6-е издание UICC [Международный союз против рака]), и контрольная группа из 31 здорового добровольца. Средний возраст пациентов составил 64×10 лет, 125 мужчин и 45 женщин. Аденокарцинома была диагностирована у 70 пациентов, 54 пациентов имели сквамозную карциному, а в 46 случаях осматривающий патолог описал смешанную гистологию. В соответствии с классификацией стадийности Международного Союза Против Рака (6-е Издание), было обнаружено 22 пациента в стадии IA, 19 в стадии IB, 5 в стадии IIB, 29 в IIIA, 25 в IIIB и 69 в стадии IV. В одном случае стадия по UICC не была определена из-за недостаточной записи данных, которые представляли только узловое состояние. Контрольная группа состояла из 10 женщин и 22 мужчин, средний возраст которых был 32±11 лет.
Все процедуры получения информированного согласия, сбора данных и защиты частной жизни были утверждены комитетом по этике Медицинского центра Университета Фрайбурга. Клинические данные были получены из банка данных медицинских карт медицинского центра Университета Фрайбурга. Образцы сыворотки крови от каждого индивидуума были получены на момент постановки диагноза во время их клинической обработки до начала какого-либо терапевтического лечения. До выполнения анализа сыворотки хранились при -80°С. Диагноз НМРЛ был подтвержден гистологическим или цитологическим исследованием. Гистологический тип был определен в соответствии с классификацией Всемирной Организации Здравоохранения. Все опухоли были классифицированы согласно 6-му изданию UICC.
Иммунодетекция CCL18 в сыворотке крови
Венозную кровь брали с помощью обычной процедуры. Образцы крови отдыхали 20 минут перед центрифугированием. После центрифугирования образцы сыворотки заморозили при температуре -80°С и сохранили. CCL18 определили количественно с помощью набора DuoSet ELISA Development System Kit (R&D Systems Europe, Висбаден, Германия). Предел обнаружения для твердофазного иммуноферментного анализа CCL18 составил 7 пг/мл. Все образцы измерили в двух экземплярах. Для дублирующих образцов были приняты среднестатистические погрешности метода 10% а коэффициенты вариации для серии анализов были приняты 20%.
Индукция ЕМТ с помощью CCL18
Клетки клеточной линии аденокарциномы А549 посеяли в 6-луночные планшеты и оставили для адгезии на ночь. После адгезии клетки стимулировали указанным количеством CCL18. В качестве положительного контроля использовали TGFβ. Клетки собрали через 72 часа и проанализированы либо с помощью ПЦР, либо с помощью вестерн-блоттинга.
Выделение фибробластных линий
Фибробластные линии были созданы из хирургического материала из пневм-эктомий или дольковых эктомий от пациентов с различными опухолями. Ткань нарезали на небольшие куски (приблизительно длиной 0,5 см по кромке) и поместили в 6-луночные планшеты, содержащие 1 мл Quantum 333 (РАА, Пашинг, Австрия) с 1% пенициллином/стрептомицином. Растущие фибробласты собрали, когда они достигли примерно 80% конфлуентности трипсинизацией, культивировали в 75-см2 колбах с клеточной культурой (NUNC Thermo Fisher, Роскилле, Дания) в Quantum 333 и впоследствии разделили (1:3-1:5).
Проточная цитометрия
Поверхностную экспрессию CCR6 фибробластных линий определяли с помощью ПТС-меченного анти-человеческого антитела CCR6 (R&D Systems, Миннеаполис, Миннесота) и измерили с помощью цитометрии (FACSCalibur, Becton Dickinson, Франклин Лейке, США).
Статистика
Концентрации приведены как средние значения (диапазон). Статистический анализ проводился с использованием программного обеспечения Stat View 5.0 (SAS Institute, Северная Каролина). Данные представлены как средние значения со стандартным отклонением и показаны в виде ящичковых диаграмм. Сравнения между группами пациентов выполнены с помощью дисперсионного анализа [ANOVA] и теста Бонферрони-Данна для множественных сравнений. Связанные переменные, такие как получение цитокинов идентичных клеточных культур после различных стимуляций сравнили с помощью критерия знаковых рангов Уилкоксона. РПЦ анализ и «диаграммы против нормативного значения» были выполнены с помощью MedCalc (MedCalc Software bvba, Мариакерк, Бельгия).
В одиночных сравнениях значения вероятности считались значимыми, если они были меньше 0,05. В множественных сравнениях уровни по p были скорректированы по числу сравнений (Бонферрони).
Пример 2 - Идентификация CCL18-связанного пептида с помощью фагового дисплея
После 3 циклов связывания фагов библиотеки фагов (как описано в Примере 1) с фиксированным на планшете человеческим CCL18 фаг-инфицированные Е. coli посеяли на агар и 20 колоний собрали, увеличили и выделили ДНК для секвенирования. Некоторые из последовательностей не были информационными или закодированными на гены-мишени, не принадлежащие к человеческому роду, однако, одна последовательность с четкой связью с рецептором 6 СС-хемокина (CCR6) была идентифицирована.
Пример 3 - Анализ экспрессии CCR6 на первичной человеческой фибробластной линии
ПЦР
Исследования экспрессии с использованием праймеров для CCR6 показали высокую вариабельность экспрессии CCR6 мРНК. Самая высокая экспрессия была обнаружена в фибробластной линии, полученной из легких пациентов, больных обычной интерстициальной пневмонией (UIP). Линии, полученные от пациентов, больных неспецифической интерстициальной пневмонией (NSIP) или сквамозной карциномой, экспрессировали только несущественные = минимальные уровни CCR6 мРНК (Фиг. 1).
FACS [сортировка флуоресцентно-активированных клеток]
Проточно-цитометрические анализы созданных фибробластных линий выявили экспрессию детектируемого CCR6 только на фибробластных линиях, полученных от пациентов, больных UIP. Линии, образованные из легких пациентов, больных сквамозной карциномой или NSIP, не экспрессируют детектируемый CCR6 на их поверхности (Фиг. 2). Повышенная экспрессия CCR6 фибробластов из фиброзных легких оставалась повышенной по всем каналам (данные не показаны).
Иммуногистохимия
Иммуногистохимические исследования на срезах ткани, взятой из легких пациентов с IPF/UIP, не выявили экспрессию CCR6 в нормальной легочной ткани (Фиг. 3А). В фиброзных легких экспрессия CCR6 была обнаружена на апикальной поверхности альвеолярных эпителиальных клеток (Фиг. 3В) и на фибробластах (Фиг. 3С).
Пример 4 - Функциональный анализ CCR6
Экспрессия FGF2
Фибробласты, полученные из нефиброзных легких, высвобождали только минимальные уровни FGF2. CCL18 стимулирует высвобождение FGF2 в этих клетках лишь незначительно. В отличие от этого, нестимулированные фибробласты, полученные из фиброзных легких, высвобождают повышенные уровня FGF2 (p<0,005 по сравнению с контрольной группой), которые далее регулируются с повышением [апрегулируются] с помощью CCL18 (p<0,05, Фиг. 4).
Блокада CCR6 блокирующим антителом не оказывает влияния на CCL18-стимулированное высвобождение FGF2 линиями нефиброзных фибробластов. В фибробластах, полученных из фиброзных легких, блокада CCR6 значительно снизила CCL18-индуцированную повышающую регуляцию FGF2 (p<0,05).
Экспрессия коллагена
Как сообщалось, CCL18 индуцирует экспрессию коллагена и aSMA (7, 18). Таким образом, было определено, является ли индукция этих молекул также CCR6-зависимой. Как показано на Фиг. 5 (верхняя панель), CCL18 обеспечивает повышающую регуляцию экспрессии коллагена I в трех из четырех анализируемых клеточных линиях. Эта индукция ингибировалась во всех трех реактивных клеточных линиях CCL18 блокадой CCR6 с помощью блокирующего антитела. Такой же результат был получен для CCL18-индуцированный повышающей регуляции αSMA. Та же клеточная линия, которая не смогла повысить экспрессию коллагена I с помощью стимуляции CCL18, также не действовала в случае с αSMA (Фиг. 5, нижняя панель).
Пример 5 - Индукция эпителиально-мезенхимального-перехода (ЕМТ) в миофибробластаы с помощью CCL18 является CCR6-зависимой
ЕМТ крысиной альвеолярной эпителиальной клеточной линии RLE-6TN
Крысиная альвеолярная эпителиальная клеточная линия RLE-6TN раскрывает типичную кубовидную форму эпителиальных клеток (Фиг. 6 вверху). Культивирование этих клеток в течение шести дней в присутствии CCL18 индуцирует дифференциацию в веретенообразные, фибробластоподобные клетки (Фиг. 6 середина, см. стрелки) в некоторых зонах. Эта дифференциация более выражена в присутствии TGFβ (Фиг. 6 внизу, см. стрелки), поскольку почти все клетки показывают веретенообразный, фибробластоподобный фенотип. Это указывает на то, что CCL18 индуцируют, как минимум, частично ЕМТ в клетках RLE-6TN.
Вестерн-блот анализы RLE-6TN после того, как ЕМТ индуцирован либо с помощью CCL18, либо с помощью TGFβ, выявили экспрессию виментина после культивирования в присутствии CCL18, которая усиливается TNFα (Фиг. 7). В обоих режимах была заметна только слабая экспрессия αSMA. TGFβ индуцировал сильную экспрессию αSMA, но не индуцировал экспрессию виментина.
Флуоресцентная микроскопия показала, что стимуляция с помощью TGFβ действительно индуцирует экспрессию αSMA в клетках RLE-6TN (Фиг. 8В), а CCL18 или CCL18/TNFα нет (Фиг. 8С и D). В отличие от этого, все стимуляции индуцировали экспрессию CD90 (Фиг. 9В и С), хотя экспрессия CD90 была более интенсивной при использовании CCL18. Количественная ПЦР в реальном времени RLE-6TN показала слабую экспрессию крысиного CCR6. Тем не менее, анализ белка CCR6 с помощью вестерн-блоттинга или проточной цитометрии не смогли продемонстрировать экспрессию CCR6 с использованием RLE-6TN (данные не показаны). Поэтому клетки были временно трансфицированы коммерчески доступной плазмидой, содержащей последовательность ДНК, кодирующую CCR6 человека. После трансфекции стимуляция с помощью CCL18 индуцировала αSMA в трансфицированных клетках CCR6, но не ложно-трансфицированных клетках. В отличие от этого, TGFβ индуцировал экспрессию αSMA в клетках обоих типах (Фиг. 10).
ЕМТ первичных альвеолярных эпителиальных клеток человека
Стимуляция изолированных человеческих первичных альвеолярных эпителиальных клеток типа II, стимулированных либо TGFβ+TNFα, либо CCL18 с или без TNFα, также индуцирует ЕМТ, как продемонстрировано индукцией экспрессии виментина и αSMA и пониженной экспрессией цитокератин (Фиг. 11).
Пример 6 - Ингибирование CCL18-индуцированной понижающей регуляции экспрессии CCR6 на PBMNC [мононуклеары периферической крови]
Изолированные мононуклеары периферической крови человека (PBMNC) были сгруппированы в соответствии с основным процентным содержанием в них клеток CCR6+. Культивирование PBMNC без активации не изменяет процентное содержание клеток CCR6+. В отличие от этого активация с помощью РНА увеличивает процентное содержание CCR6+ в препаратах с низкой начальной пропорцией CCR6+ (Фиг. 12, заштрихованные полосы), но уменьшает в препаратах с высокой пропорцией CCR6+ (Фиг. 12, белые полосы).
Инкубация изолированных, CCR6+-обогащенных мононуклеаров периферической крови с помощью CCL18 в течение 20 минут в результате привела к уменьшению процентного содержания клеток CCR6+ (Фиг. 13), возможно, вследствие интернализации рецептора CCR6. Такое CCL18-индуцированное снижение экспрессии CCR6 уменьшается в присутствии пептида PS-AU-105 ингибитора (полипептид согласно SEQ ID NO.: 9). На Фиг. 14 демонстрируется четкая субпопуляция клеток CCR6+ в нестимулированной (пол. контроль) культуре. CCL18 стимуляция уменьшает эту субпопуляцию, как демонстрирует более низкий второй пик (только CCL18). CCL18 стимуляция в присутствии ингибитора-пептида PS-AU-105 (полипептид согласно SEQ ID NO.: 9) не обеспечивает понижающую регуляцию субпопуляции CCR6+. Ингибитор сам по себе не дает эффекта (только ингибитор).
Пример 7 - Анализ экспрессии CCR6 в карциноме легких человека
Иммуногистохимия
Анализ контрольного легкого не выявил окрашивания CCR6 (Фиг. 15А). В отличие от этого опухолевые клетки показали четкую экспрессию CCR6 (Фиг. 15В и С, стрелки). Кроме того, некоторые фибробласты показали также слабую экспрессию CCR6 (Фиг. 15С, острие стрелки).
FACS
FACS анализ выявил четко выраженную экспрессию CCR6 в двух из трех клеточных линиях аденокарциномы (Фиг. 16, верхняя панель) и всех клеточных линиях мезотелиомы плевры (Фиг. 16, нижняя панель). Клеточная линия аденокарциномы легких LxFA 526L показывает несущественную экспрессию CCR6.
Пример 8 - Определение растворимого CCR6 (sCCR6) в сыворотке крови пациентов с легочным фиброзом и в сыворотке крови от здоровых контрольных объектов
Вестерн-блот анализ
Вестерн-блот анализ выявил, что sCCR6 присутствует в сыворотке крови от здоровых добровольцев и пациентов с UIP (Фиг. 18А). Количественный анализ вестерн-блоттинга показал небольшое, но, тем не менее, значимое снижение максимума интенсивности для фиброзных пациентов по сравнению с контрольной группой (Фиг. 18В).
ELISA
Чтобы более точно оценить различия, которые наблюдались при вестерн-блоттинге, измерили концентрацию sCCR6 с помощью коммерчески доступного твердофазного иммуноферментного анализа [ELISA] CCR6. В 15 из 19 образцов от пациентов с фиброзом (NSIP: n=6, UIP: n=13) sCCR6 не смогли обнаружить, но только 2 из 9 образцов сыворотки от здоровых добровольцах оказались отрицательными (p<0,005). Даже в двух образцах, которые оказались положительными при вестерн-блоттинге (полосы 4 и 6 на Фиг. 18А), sCCR6 не был обнаружен с помощью ELISA. В сыворотке крови пациентов с легочным фиброзом концентрации sCCR6 были значительно ниже по сравнению с контрольной группой (18±11 против 216±95 пг/мл; p<0,001; Фиг. 19). Дальнейший анализ основных фиброзных заболеваний не выявил различий между концентрациями sCCR6 в сыворотке крови от пациентов с UIP или NSIP.
Пример 9 - Молекулы sCCR6 в сыворотке крови пациентов с фиброзном являются лиганд-связанными
В твердофазном иммуноферментном анализе sCCR6, описанном в Примере 8, используется моноклональное анти-CCR6 антитело в качестве захватывающего антитела, фиксированного на планшете, и биотин-конъюгированное поликлональное анти-CCR6 антитело в качестве детектирующего антитела. Большинство моноклональных анти-CCR6 антител направлены на N-концевую часть рецептора, имеющего лиганд-связывающий сайт. Чтобы проверить, может ли сайт узнавания антитела молекулы sCCR6 в сыворотке крови от фиброзных пациентов покрываться лигандом вследствие большого количества CCL 18 в такой сыворотке [6, 7], сыворотку от здоровых добровольцев инкубировали с 100 нг/мл CCL18 или CCL20, соответственно, и sCCR6 измерили в блокированной и неблокированной сыворотке с помощью ELISA. Добавление этих лигандов CCR6 ведет к заметному уменьшению сигнала sCCR6 (Фиг. 20). Добавление 100 нг CCL18 или CCL20 почти аннулирует обнаружение CCR6 в сыворотке крови с низкой и средней концентрациями sCCR6. В сыворотке крови с высокой концентрацией sCCR6 наблюдалось только 36% уменьшение в случае с CCL18 и 14% в случае с CCL20.
Таким образом, sCCR6, связанный со своими лигандами CCL18 и CCL20, уже не определяется с помощью ELISA.
Эти результаты показывают, что молекулы sCCR6 в сыворотке крови фиброзных пациентов лиганд-связаны, так что низкие концентрации sCCR6 определяются в сыворотке от упомянутых пациентов методом ELISA (Пример 8). Данные также показывают, что CCL18-блокирующая способность исчерпана у пациентов с отрицательным результатом на безлигандный sCCR6 в сыворотке крови.
Пример 10 - Пациенты с фиброзом, имеющие sCCR6-положительный результат в сыворотке крови, показывают более высокое процентное содержание лимфоцитов в бронхоальвеолярном лаваже (БАЛ), по сравнению с sCCR6-отрицательными пациентами
Сообщалось, что CCL18, который был идентифицирован авторами настоящего изобретения как лиганд рецептора CCR6, индуцирует хемотаксис Т-клетки. Поэтому проверили возможное влияние sCCR6 на популяцию клеток в бронхоальвеолярном лаваже (БАЛ). Действительно, пациенты с фиброзом (NSIP: n=6, UIP:=13) с положительным результатом на безлигандный sCCR6 в сыворотке крови показывают процентное содержание лимфоцитов в БАЛ значительно выше по сравнению с пациентами с отрицательным результатом на безлигандный sCCR6 в сыворотке крови (35,5% против 17,8%, p<0,05). Это различие не наблюдалось в контрольной группе (Фиг. 21).
Эти данные показывают, что sCCR6 снижает биологическую доступность CCL18 в сыворотке крови, тем самым увеличивая градиент концентрации CCL18 между легкими и периферией и ускоряя хемотаксис иммунных клеток в альвеолы легких. Эта функция исчерпана у тех пациентов, у которых оказался отрицательный результат на безлигандный sCCR6, что приводит к накоплению CCL18 и уменьшению функционального градиента концентрации CCL18.
В общем, легочный фиброз у пациентов с повышенным процентным содержанием лимфоцитов менее тяжелый по сравнению с пациентами с низким процентным содержанием лимфоцитов в БАЛ. Анализ лимфоцитных субпопуляций показал небольшое, но значимое увеличение Т-клеток CD3+ у пациентов с положительным результатом на sCCR6 в сыворотке крови (91,0±1,4% против 95,7±1,2%, p<0,05). Напротив, процентное содержание HLA-DR положительных лимфоцитов было ниже у sCCR6-положительных пациентов по сравнению с sCCR6-отрицательными пациентами (32,3±14,4% против 7,0±7,8%, p<0,05). sCCR6-положительные пациенты также показали повышенное процентное содержание NK клеток (CD57+) и CDIa положительных клеток (33,0±9,6% против 14,5±5,6% и 1,0±1,0% против 0,1±0,3%, соответственно, p<0,05 в обоих случаях) (Фиг. 22).
Пример 11 - Уровни CCL18 в сыворотке крови у пациентов с НМРЛ и их корреляция с клинико-патологическими параметрами
Отмечалось значительное различие всех групп пациентов по сравнению с контрольной группой (р<0,0001; Фиг. 23). Уровень CCL18 в сыворотке крови у пациентов с плоскоклеточной карциномой был выше, чем в сыворотке крови от пациентов с аденокарциномой (172±95 нг/мл, 207±139 нг/мл, соответственно, p<0,02). Уровни CCL18 в сыворотке крови увеличивались постепенно и значительно с развитием Т стадии (Фиг. 24). По сравнению с контрольной группой уровень CCL 18 в сыворотке крови был значительно выше у пациентов стадии I (134±74 нг/мл, n=39, p=0,0002) и тем более у пациентов стадии II (176±99 нг/мл, n=61 p<0,0001), III (215±106 нг/мл, n=26 p<0,0001) и IV (219±177 нг/мл, n=28 p<0,0001). Сравнения между пациентами с опухолью показали, что уровни в стадии I были значительно ниже по сравнению со стадией III (215±106 нг/мл, n=26, p<0,005) и стадией IV (219±177 нг/мл, n=28, p=0,002). Уровень CCL18 в стадии III и IV также значительно отличался по сравнению с контрольной группой (p<0,0001).
Пример 12 - Определение точек отсечения уровня CCL18 в сыворотке крови
Анализы соотношений правильного и ложного обнаружения сигналов (ROC) показали точку отсечения 83нг/мл (площадь под кривой (AUC): 0,968; p<0,0001, Фиг. 25 слева) для различия здоровых контрольных объектов и пациентов с НМРЛ. ROC анализы для различия связанной с раком и не связанной с раком смерти не привели к действительному показателю AUC. Для разграничения пациентов с опухолью была построена диаграмма нормативных значений с использованием критерия смерти в пределах периода наблюдения. Этот анализ показал точку одинаковой чувствительности и специфичности (54%), равную 162 нг/мл (Фиг. 25 справа).
Пример 13 - Уровень CCL18 в сыворотке крови и выживание у пациентов с NSCLC
У пациентов с NSCLC и уровнем CCL18 в сыворотке крови выше 160 нг/мл среднее время выживания составило 623 дня, тогда как у пациентов с NSCLC и уровнем в сыворотке между 160 нг/мл и 80 нг/мл среднее время выживания составило 984 дня. У пациентов с уровнем CCL 18 ниже 80 нг/мл среднее время выживания составило 841 день (p<0,004, Фиг. 26).
Пример 14 - Уровень CCL18 в сыворотке крови и выживание в гистологических подгруппах
У пациентов с аденокарциномой легких среднее время выживания 388 дней было установлено в группе с самым высоким уровнем CCL18. В группе с уровнем CCL18 между 160 и 80 нг/мл среднее время выживания составило 788 дней, а в группе с нормальным уровнем CCL18 среднее время выживания составило 1152 дня (p<0,002).
Пример 15 - Уровень CCL18 в сыворотке крови и стадии опухоли в гистологических подгруппах
В отношении подгруппы пациентов с аденокарциномой средние N-стадии в группе с концентрациями CCL18 в сыворотке крови выше 160 нг/мл были значительно выше (1,7±1,1) по сравнению с подгруппой с нормальными уровнями CCL18 в сыворотке крови (0,5±1, p<0,005; Фиг. 28). В отношении пациентов с аденокарциномой также отмечалась тенденция к более высокой частоте метастазов в подгруппе с уровнем CCL18 в сыворотке выше 160 нг (58%), который был ниже в других группах (<160 нг/мл: 42%; нормальный: 25%).
Пример 16 - CCL18 индуцирует ЕМТ в клетках аденокарциномы
Стимуляция клеток аденокарциномы с помощью CCL18 в течение 72 ч индуцирует явную и дозозависимую повышающую регуляцию экспрессии мРНК маркера фибробласта FSP1. CCL18-индуцированная повышающая регуляция была выше, чем TGFβ-индуцированная повышающая регуляция (Фиг. 29). Кроме того, CCL18 также индуцирует дозозависимо экспрессию фибробласт-ассоциированного фактора транскрипции snail [«снейл»]. И в этом случае стимуляция с помощью CCL18 была более эффективной, чем с помощью TGFβ (Фиг. 30). В отличие от названных выше маркеров эпителиальный маркер E-кадгерин был значительно подавлен после 24-часовой стимуляции с помощью CCL18 (Фиг. 31).
Пример 17 - Экспрессия CCR6 в фибробластных линиях от гистологических подгрупп
Фибробласты, выделенные из легких от пациентов, больных аденокарциномой, показывают более высокое процентное содержание CCR6 положительных клеток (30±22%, n=4; Фиг. 32) по сравнению с фибробластными линиями, полученными из сквамозной карциномы легких со смешанной гистологией (2±1%, n=8 и 2±2%, n=6, соответственно).
Результаты, описанные в Примерах 11-17, представляют первое исследование по изучению уровней CCL18 в сыворотке крови у пациентов с раком легких. Было отмечено, что средний уровень CCL18 в сыворотке крови у пациентов с раком легких более чем в четыре раза выше по сравнению с здоровыми контрольными пациентами. Полученные данные демонстрируют, что уровень CCL18 в сыворотке крови повышается в соответствии с Т-стадией. В отличие от этого N- и М-стадия не связаны с уровнем CCL18 в сыворотке крови. Кроме того, уровни CCL18 в сыворотке крови отличались в зависимости от разной гистологии рака легких.
Ассоциированные с опухолью макрофаги (ТАМ) похожи на альтернативно активированные макрофаги, включающие высвобождение CCL18.
Точка отсечения для различия между здоровыми пациентами и пациентами с НМРЛ составляет 83нг/мл и находится в том же диапазоне, что и точка отсечения, определенная авторами, используемая для различия между контрольной группой с фиброзом и здоровыми контрольными пациентами. С помощью ROC анализа нельзя было прогнозировать ассоциированную с раком смерть по уровню CCL18 в сыворотке крови. Таким образом, для определения точки отсечения для разделения пациентов был построен график нормативного значения по выживанию. Этот график нормативного значения CCL18 продемонстрировал концентрацию 160 нг/мл как точку отсечения. Точка отсечения 160 нг/мл строго спрогнозировала среднее время выживания у пациентов с НМРЛ. У пациентов, у которых концентрация CCL18 в сыворотке крови равна 160нг/мл или выше, среднее время выживания на одну треть меньше среднего времени выживания, чем у пациентов с концентрацией CCL18 меньше 160 нг/мл. Этот эффект больше всего отличается в подгруппе пациентов с аденокарциномой. CCL18 представляет собой типичный продукт альтернативно активированных макрофагов и является возможным маркером ассоциированных с опухолью макрофагов [ТАМ]. Поскольку ассоциированные с опухолью макрофаги находятся внутри опухоли, их число должно увеличиваться с массой опухоли. Таким образом, было проанализировано взаимосвязь между уровнем CCL18 в сыворотке крови и Т-стадией в качестве суррогатного маркера размера опухоли. Это относится, в частности, к более низким Т-стадиям и действительно уровень CCL18 в сыворотке крови увеличивается с возрастанием Т-стадий от Т1 до Т3. Основное различие между Т3 и Т4 стадиями заключается в инфильтрации важных медиастинальных структур, но не обязательно отражает увеличение размера. Никакого заметного различия в уровне CCL18 в сыворотке крови пациентов с ТЗ и Т4 стадиями не было обнаружено.
N- и М-стадии представляют собой суррогатные маркеры для гематогенного и лимфогенного метастазирования. Увеличение N-стадий и тенденция к более высокой частоте метастазов у пациентов с высокими уровнями CCL18 в сыворотке крови снова указывает на то, что CCL18 является маркером длительной болезни аденокарциномой.
Параллельно с результатами, полученными с эпителиальными клетками, CCL18 индуцирует эпителиально-мезенхимальный переход [ЕМТ] также и в клетках аденокарциномы. ЕМТ считается важным событием в метастатических процессах. Раковые клетки действительно имеют лишь ограниченный миграционный потенциал. Во время ЕМТ раковые клетки теряют контакт с окружающей тканью и приобретают функции, которые обеспечивают клеткам возможность мигрировать. Повышающая регуляция мезенхимальных маркеров FSP1 и «snail» и понижающая регуляция Е-кадгерина указывают на то, что CCL18 индуцирует ЕМТ в клетках аденокарциномы. Потеря Е-кадгерина адгезионной молекулы тем самым позволяет клетке выйти из опухолевой ткани. FSP1, по предположению, связан с метастазированием и инвазией опухоли. Фактор транскрипции snail регулирует экспрессию коллагена, некоторые матричные металлопротеиназы и α-гладкомышечный актин, который имеет важное значение для подвижности клеток.
Таким образом, CCL18 является биомаркером в стратификации аденокарциномы у пациентов с высоким риском. Данные также показывают, что CCL18 способствует метастазированию опухоли путем индукции ЕМТ.
ЛИТЕРАТУРА
1. Trepel M., Arap W. and Pasqualini, R. 2002. In vivo phage display and vascular heterogeneity: implications for targeted medicine. Curr Opin Chem Biol 6:399-404.
2. Pechkovsky D.V., Zissel G., Ziegenhagen M.W., Einhaus M., Taube C., Rabe K.F., Magnussen H., Papadopoulos Т., Schlaak M. and Muller-Quemheim J. 2000. Effect of proinflammatory cytokines on interleukin-8 mRNA expression and protein production by isolated human alveolar epithelial cells type II in primary culture. Eur Cytokine Netw 11:618-625.
3. Goldmann Т., Wiedom K.H., Kuhl H., Olert J., Branscheid D., Pechkovsky D., Zissel G., Galle J., Muller-Quemheim J. and Vollmer E. 2002. Assessment of transcriptional gene activity in situ by application of HOPE-fixed, paraffin-embedded tissues. Pathol Res Pract 198:91-95.
4. Pechkovsky D.V., Zissel G., Goldmann Т., Einhaus M., Taube C., Magnussen H., Schlaak M. and Muller-Quemheim J. 2002. Pattern of NOS2 and NOS3 mRNA expression in human A549 cells and primary cultured AEC II. Am J Physiol Lung Cell Mol Physiol 282:L684-692.
5. Droemann D., D. Albrecht, J. Gerdes, A.J. Ulmer, D. Branscheid, E. Vollmer, K. Dalhoff, P. Zabel, and T. Goldmann, Human lung cancer cells express functionally active Toll-like receptor 9. Respir Res, 2005. 6(1): p.1.
6. Prasse A., D.V. Pechkovsky, G.B. Toews, M. Schafer, S. Eggeling, C. Ludwig, M. Germann, F. Kollert, G. Zissel, and J. Muller-Quemheim, CCL18 as an indicator of pulmonary fibrotic activity in idiopathic interstitial pneumonias and systemic sclerosis. Arthritis Rheum, 2007. 56(5): p. 1685-93.
7. Prasse A., C. Probst, E. Bargagli, G. Zissel, G.B. Toews, K.R. Flaherty, M. Olschewski, P. Rottoli, and J. Muller-Quemheim, Serum CC-Chemokine Ligand 18 Concentration Predicts Outcome in Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med., 2009. 179(8): p. 717-723.
8. Ziegenhagen MW, Zabel P, Zissel G, Schlaak M, Muller-Quemheim J. Serum level ofinterleukin 8 is elevated in idiopathic pulmonary fibrosis and indicates disease activity. Am J Respir Crit Care Med 1998; 157:762-768.
9. Prasse A, Georges CG, Biller H, Hamm H, Matthys H, Luttmann W, Virchow JC Jr. Thi cytokine pattern in sarcoidosis is expressed by bronchoalveolar CD4+ and CD8+ Т cells. Clin Exp Immunol 2000; 122:241-8.

















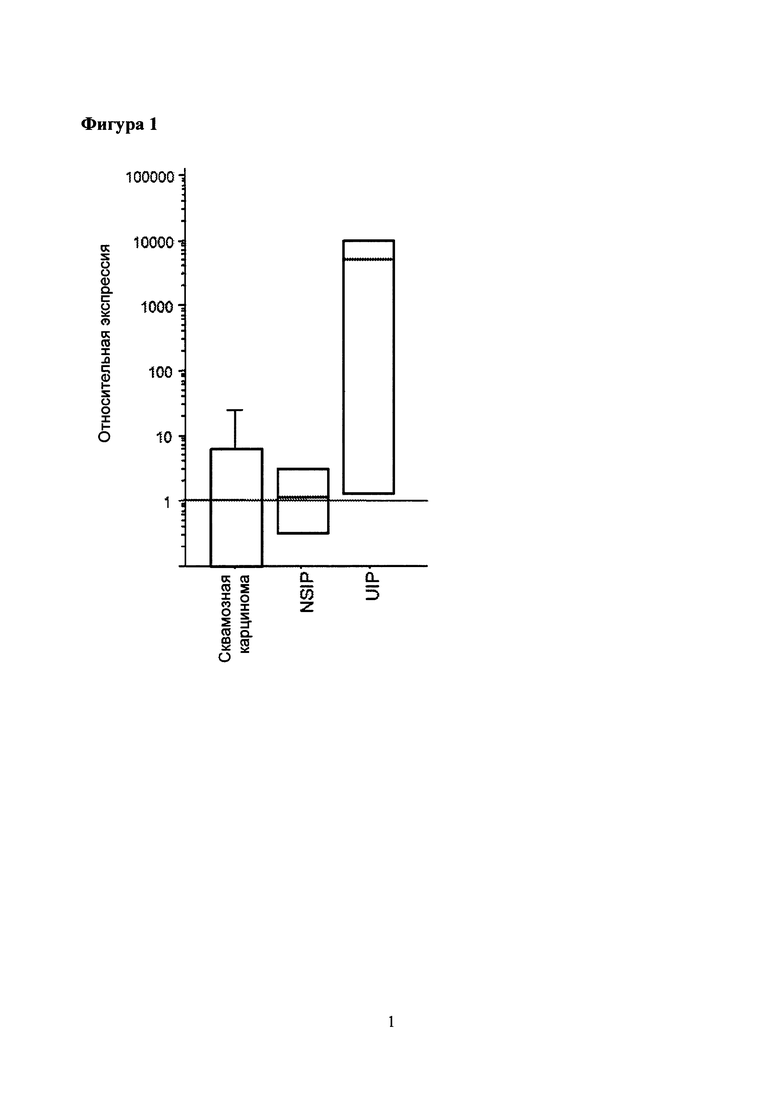
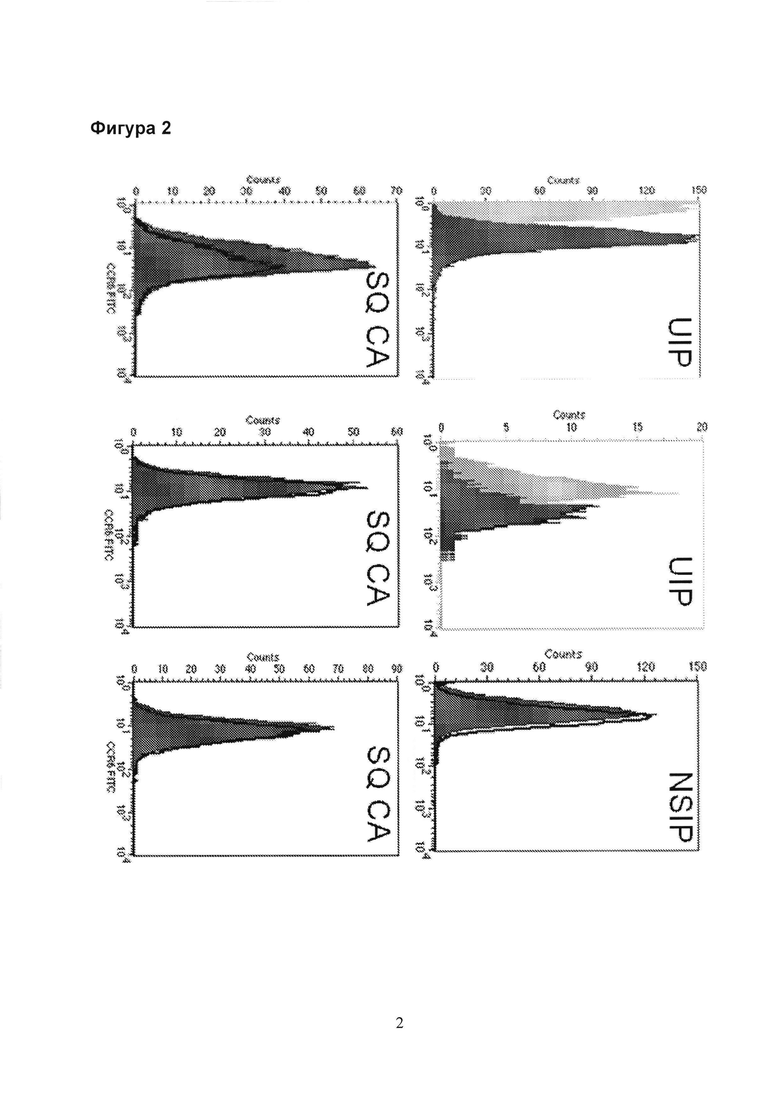
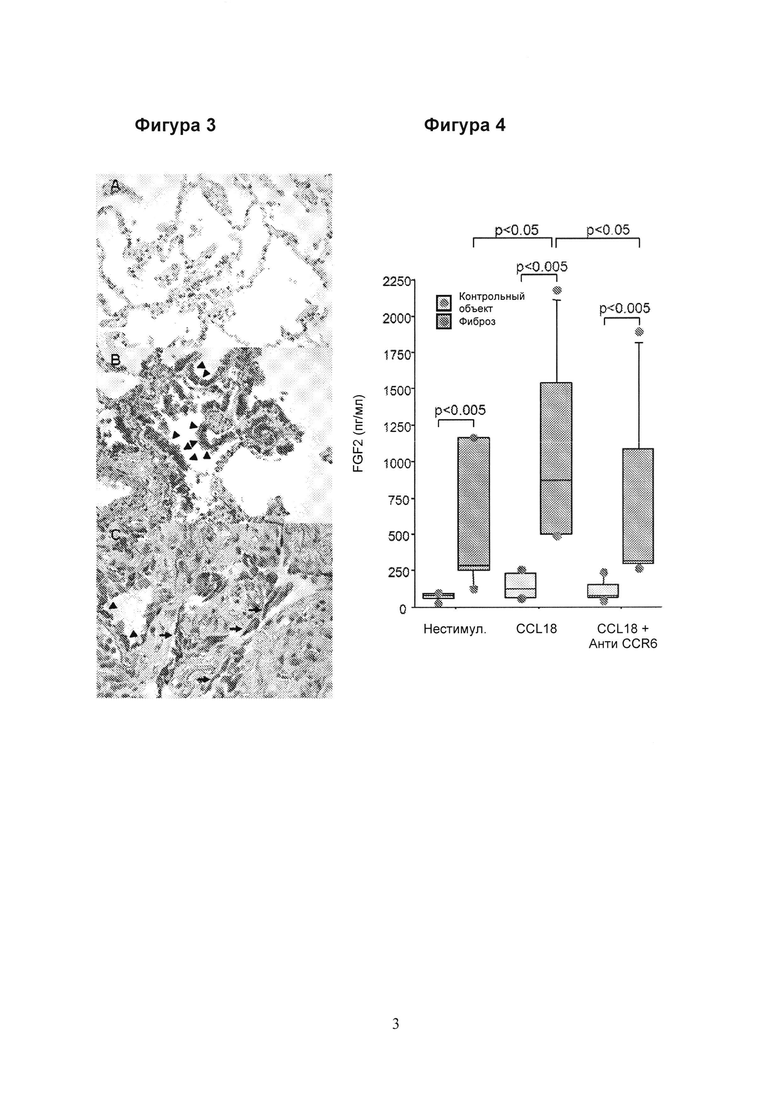
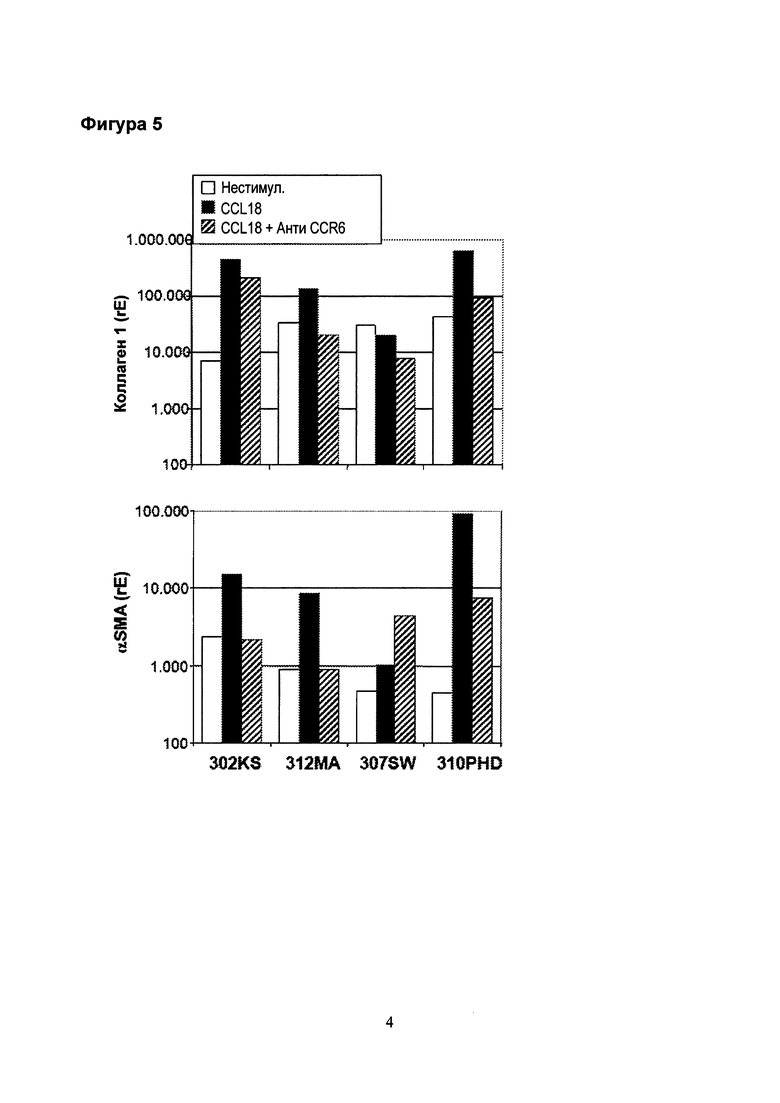
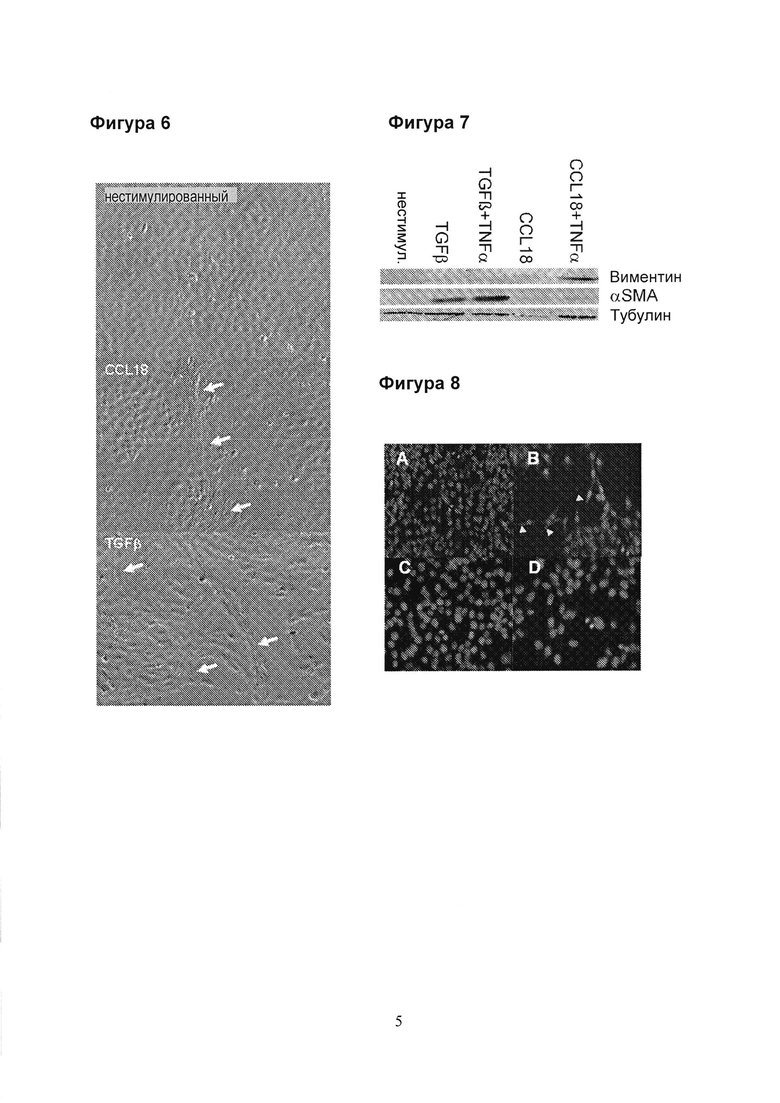
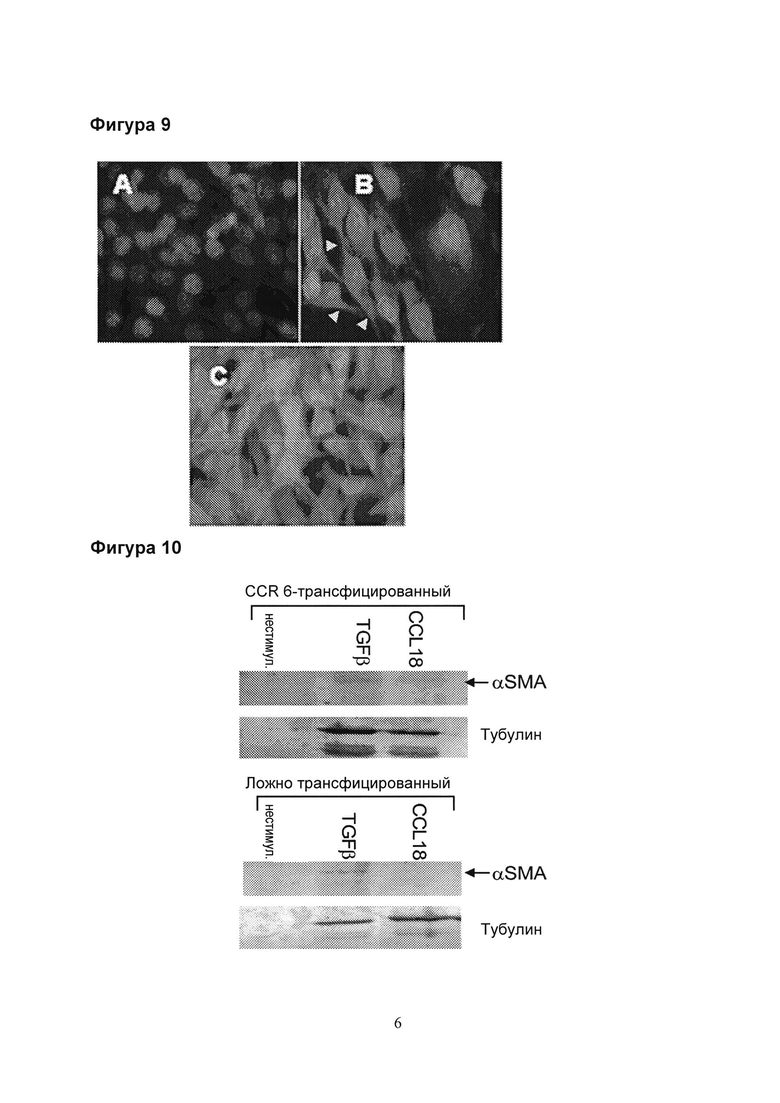
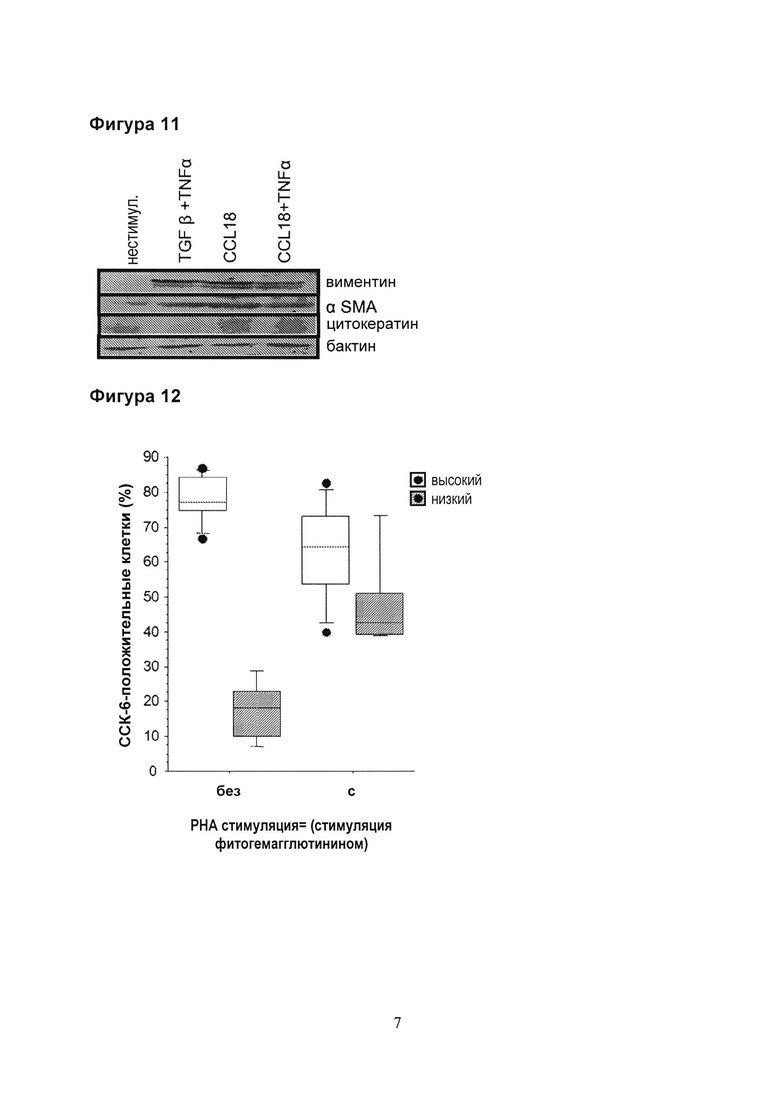
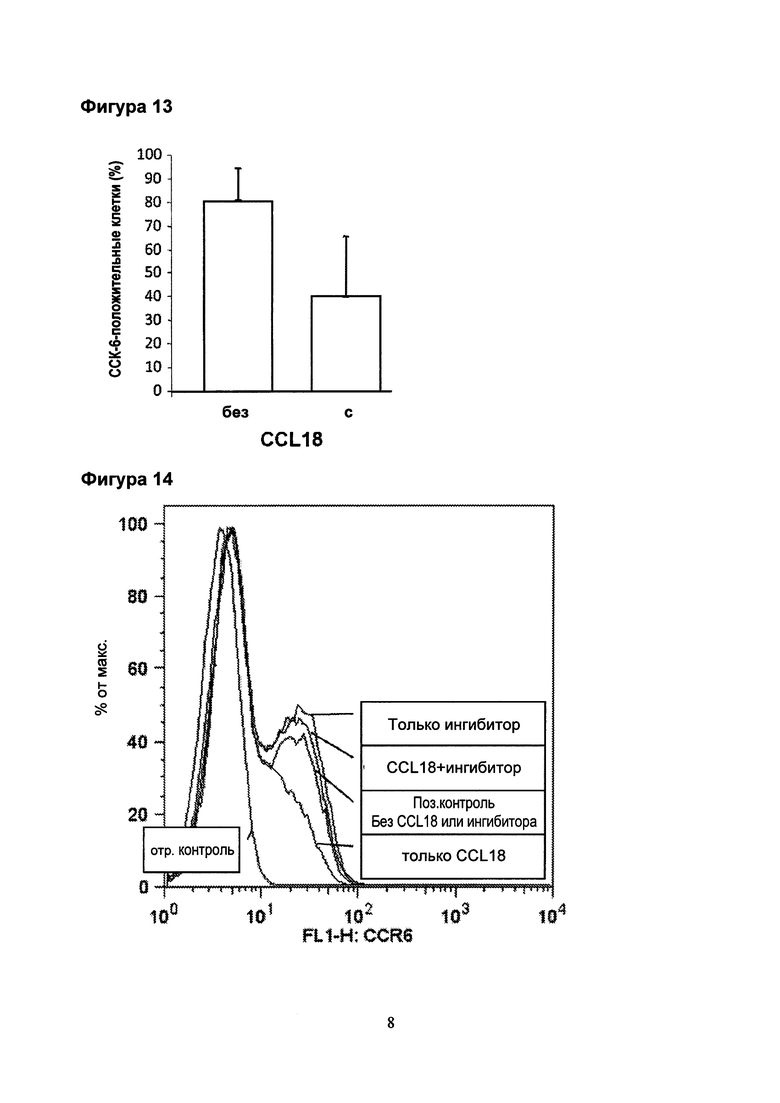
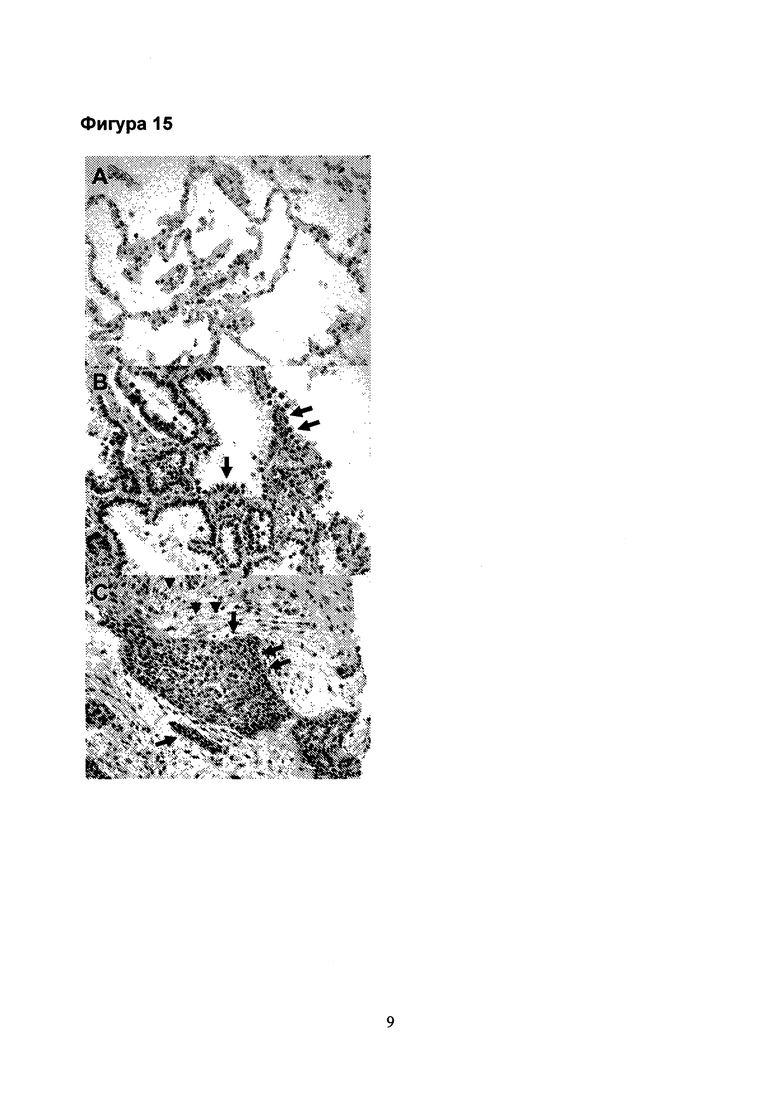
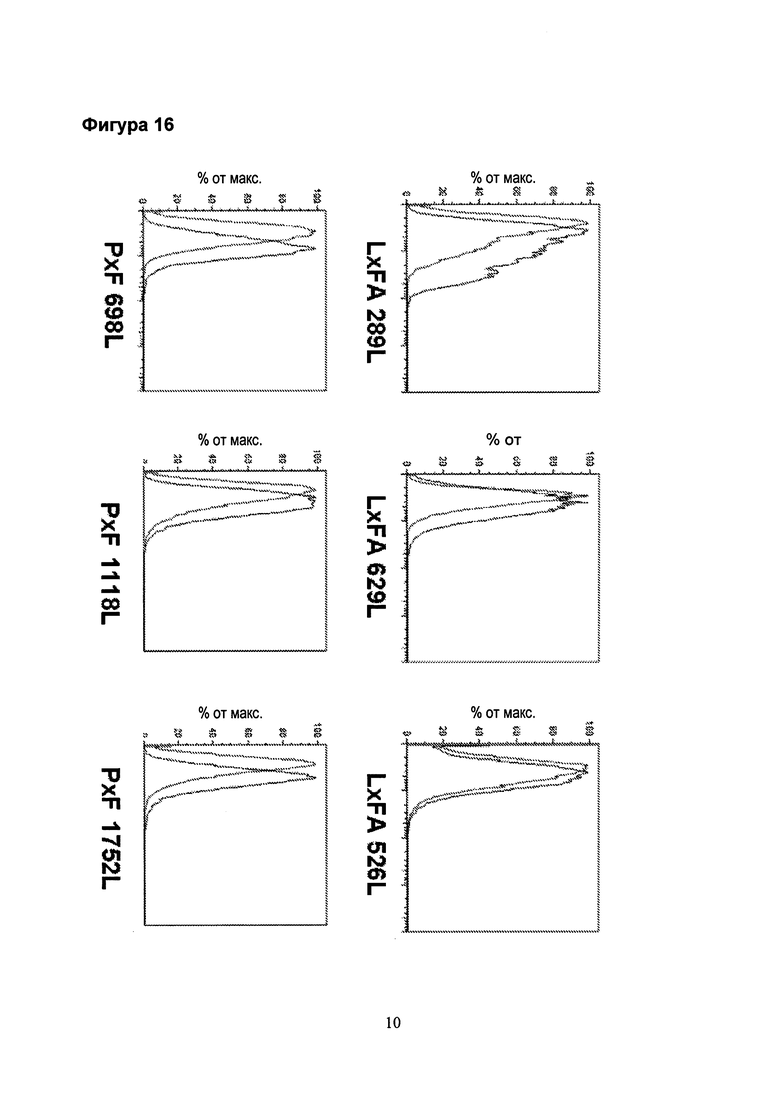
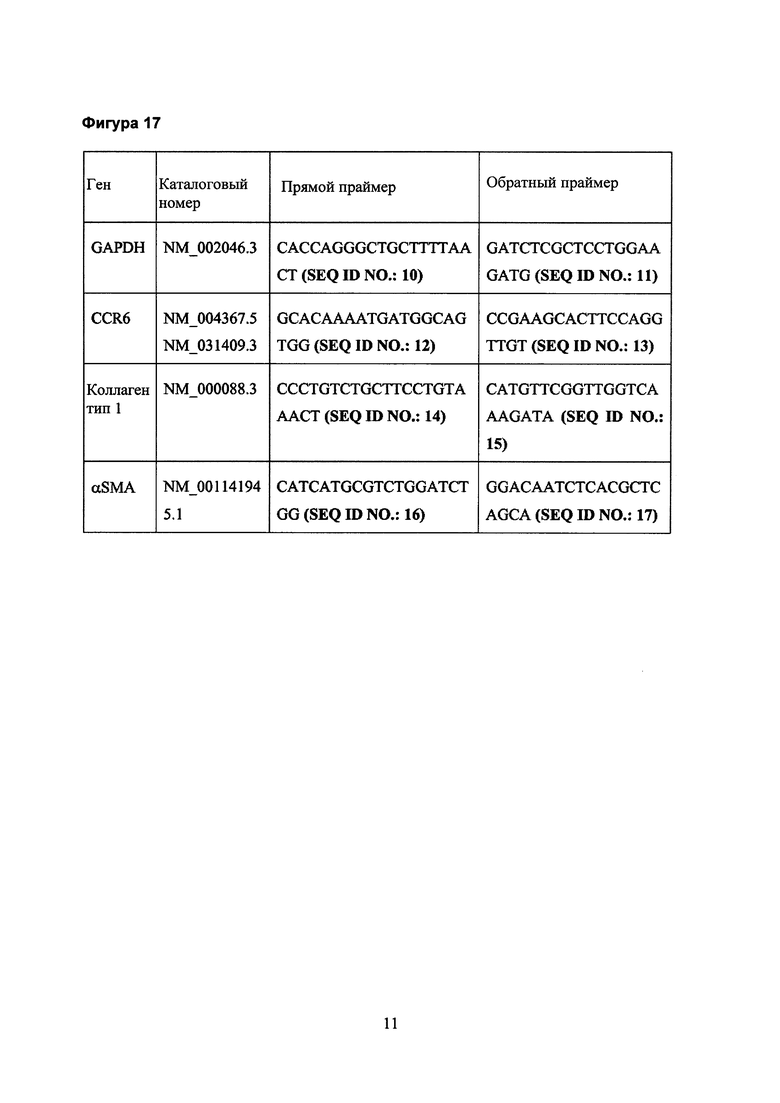
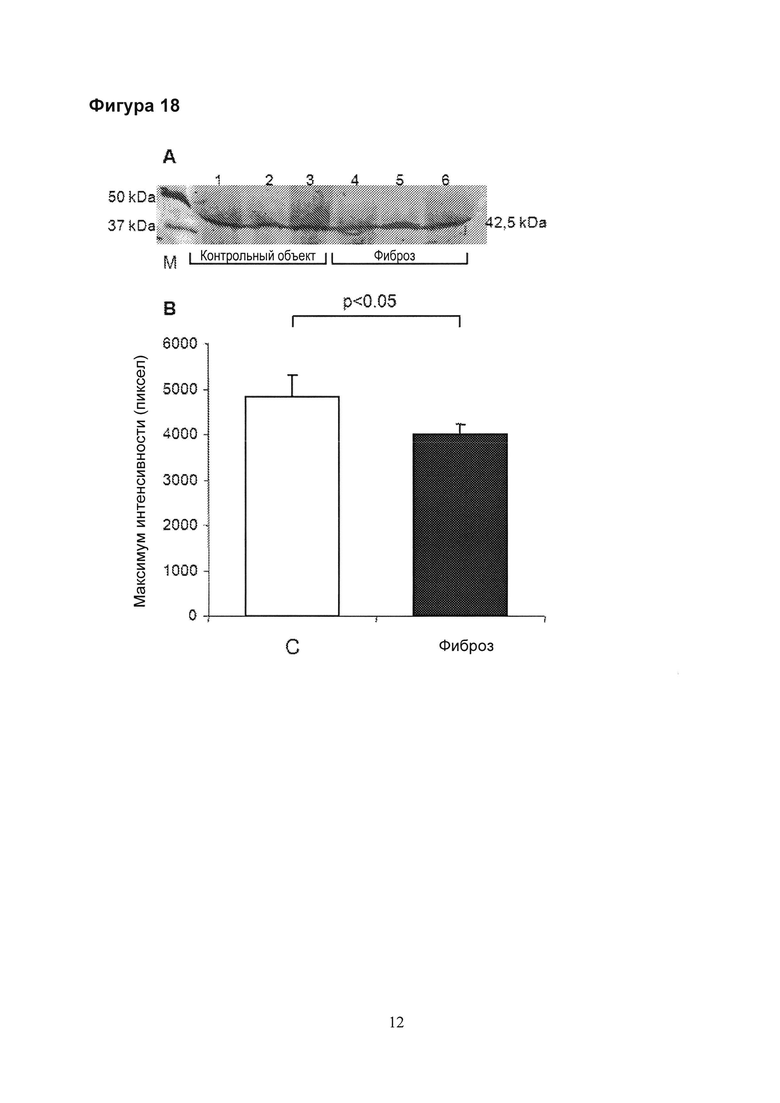
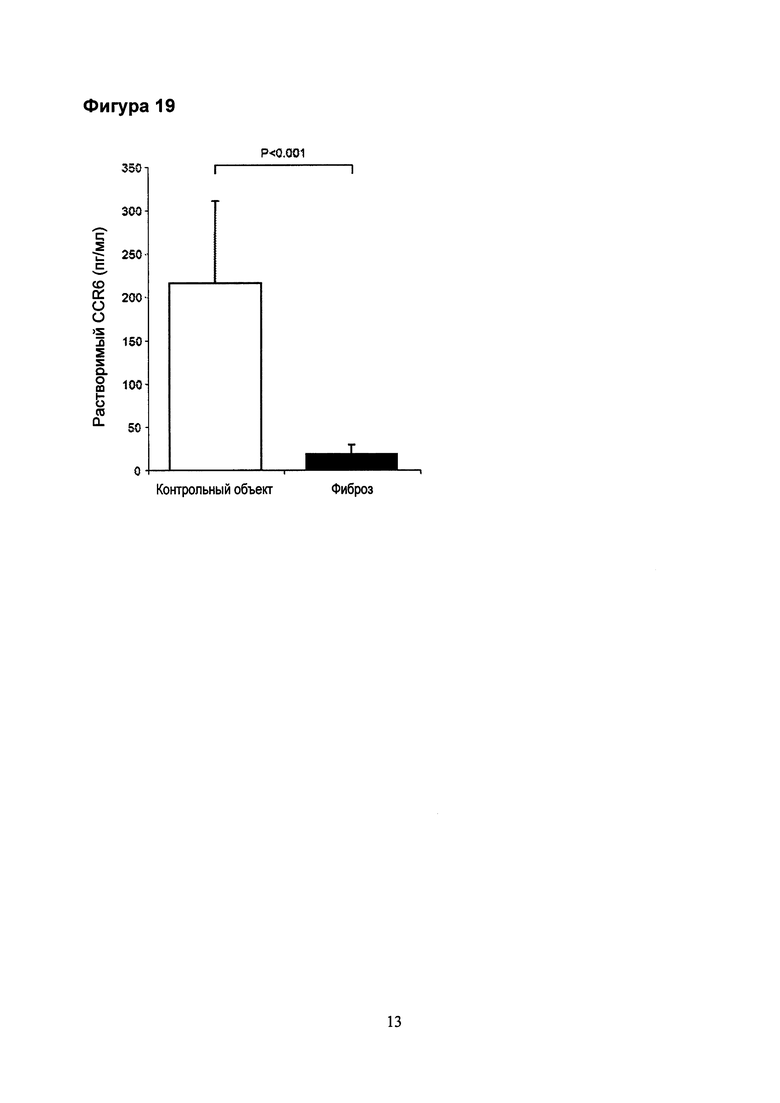
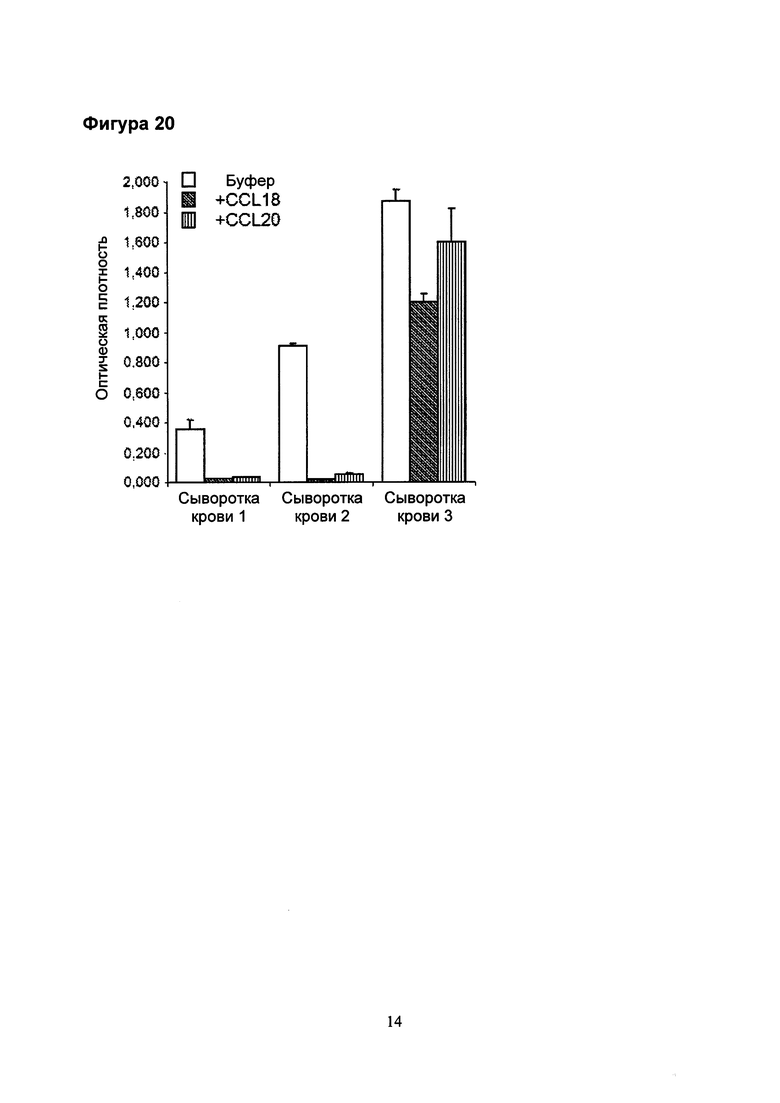
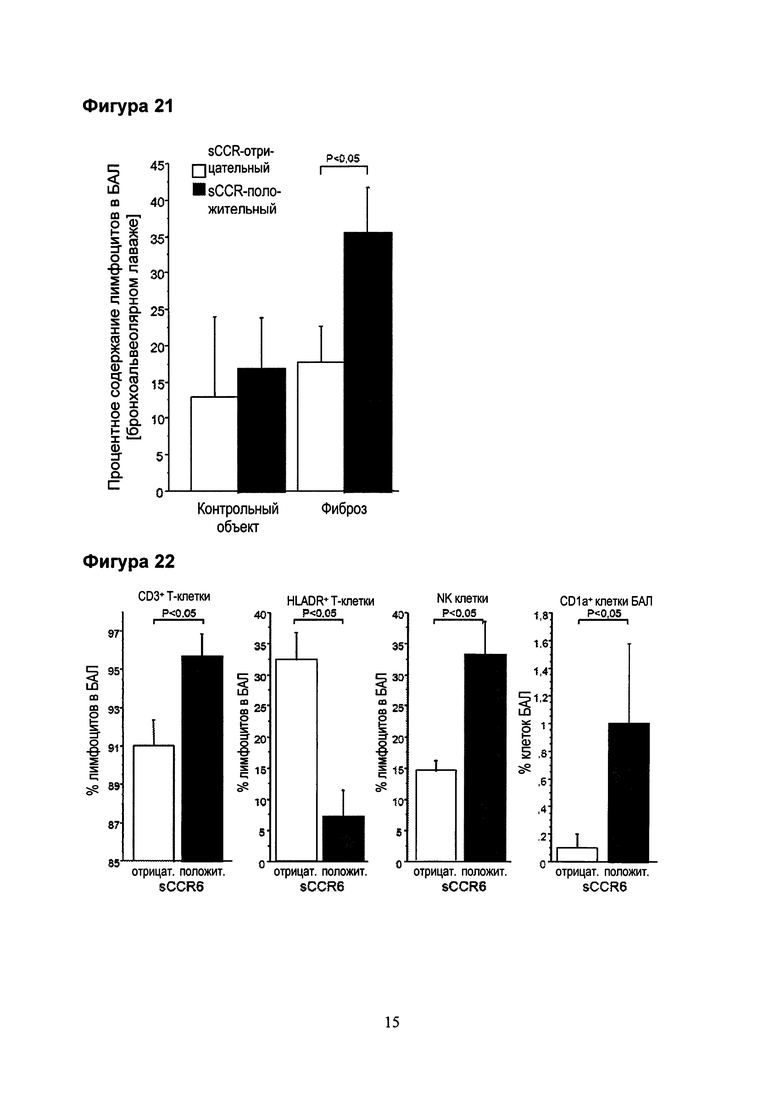
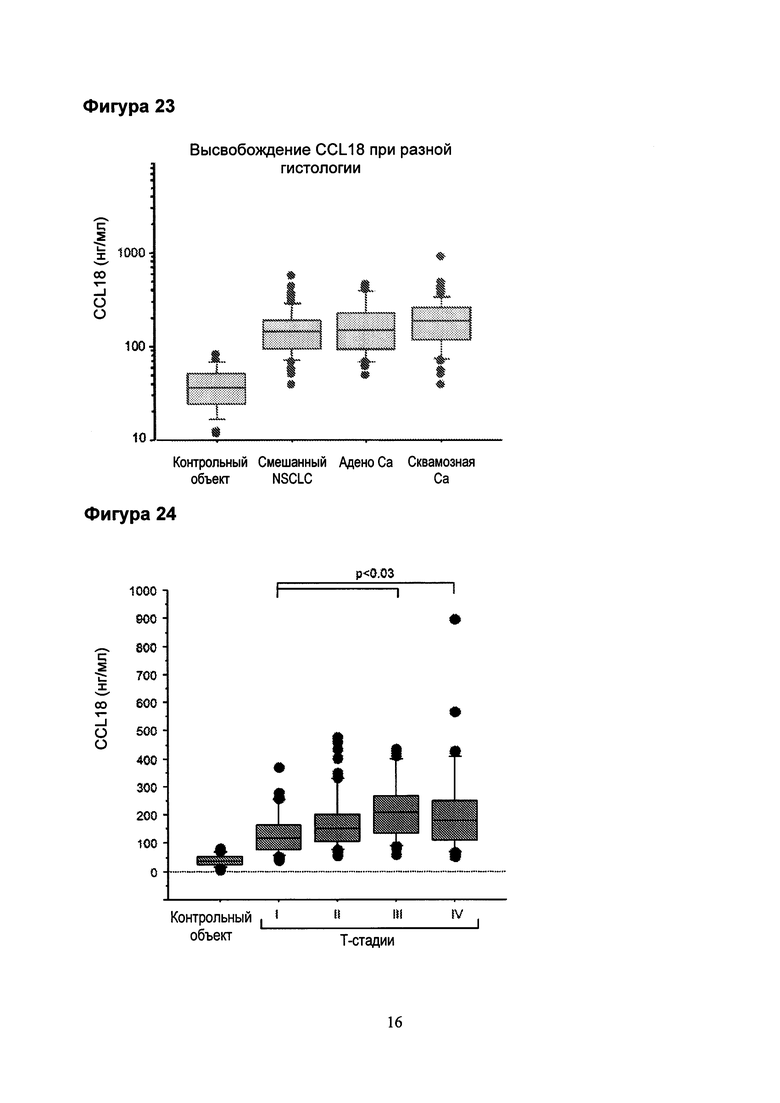
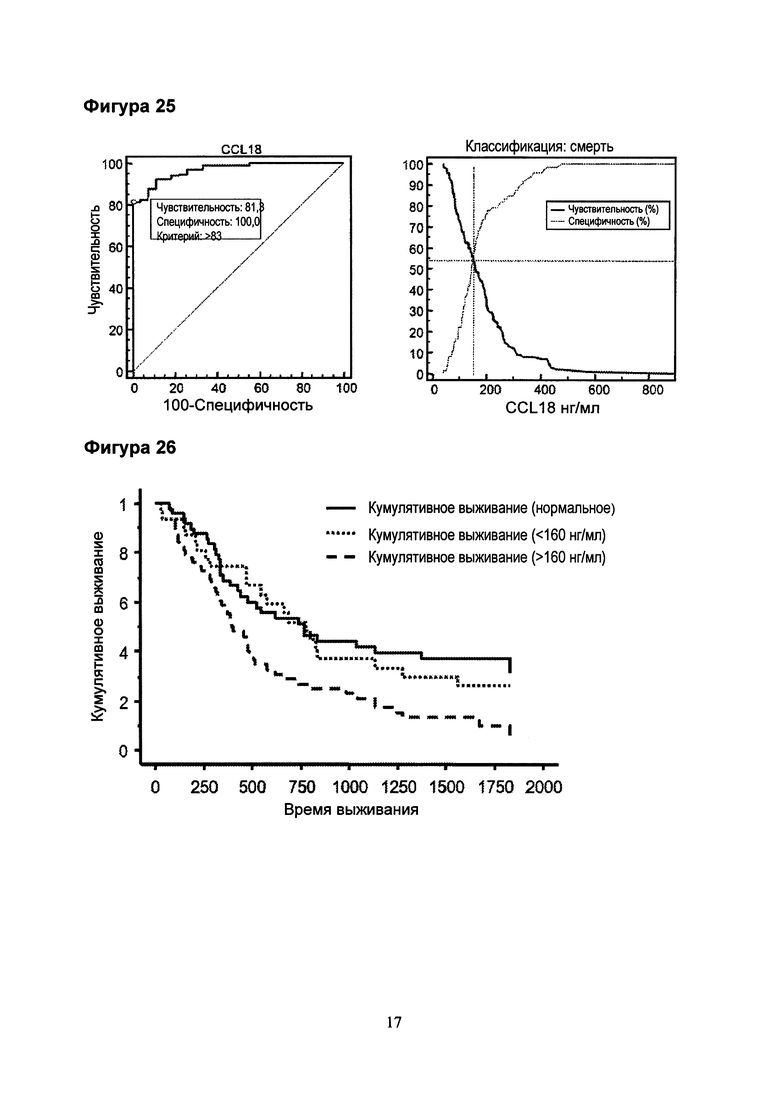
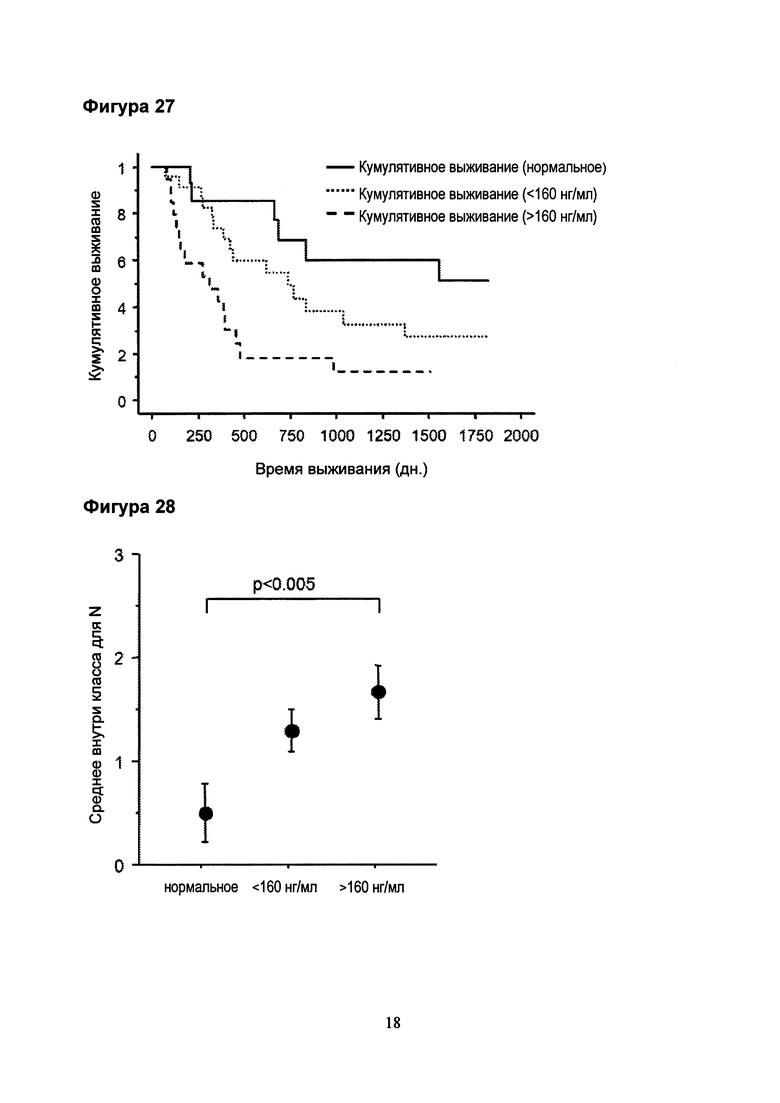
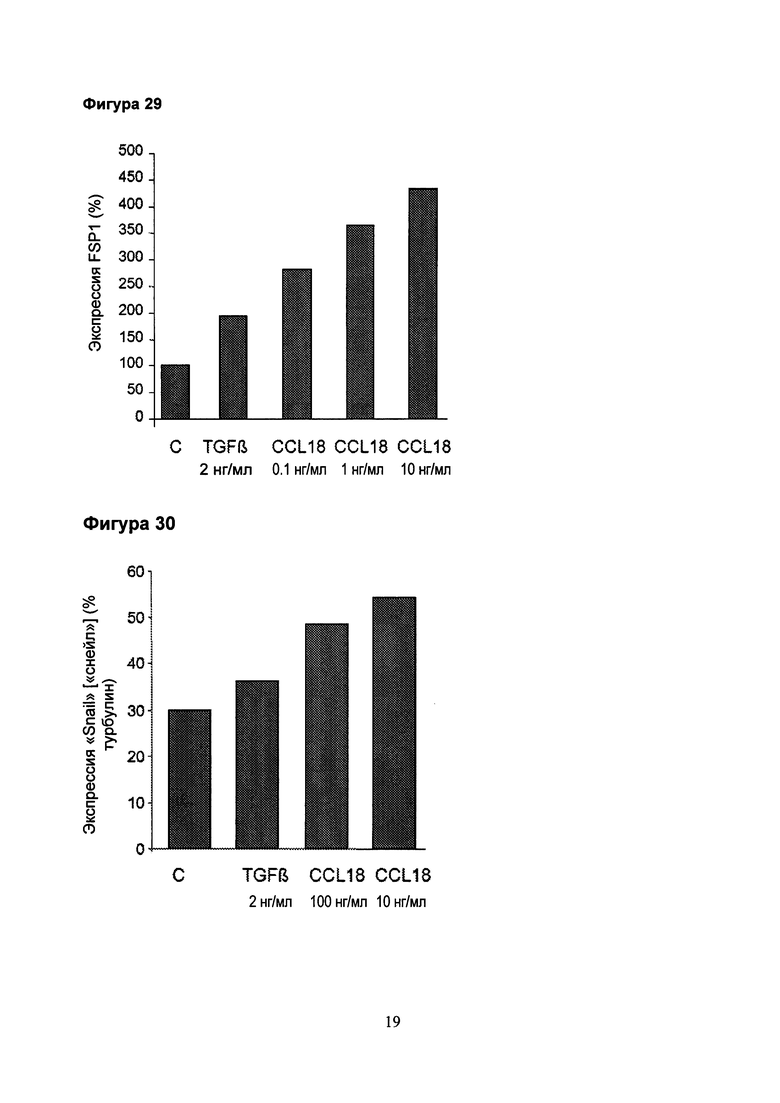
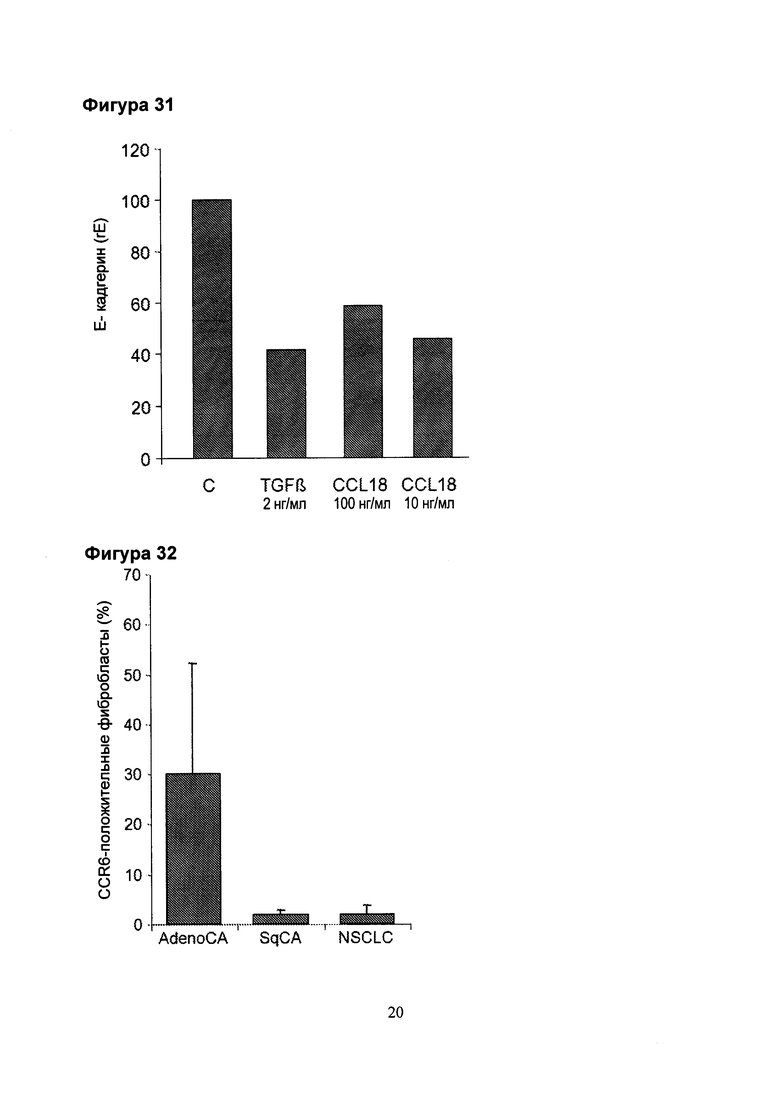


Изобретение относится к области биотехнологии, конкретно к применению в лечении интерстициального заболевания легких и/или рака легких растворимого полипептида рецептора CCR6. Получают полипептид, содержащий CCLVYTSWQI, который состоит из аминокислотной последовательности, которая имеет как минимум 90% идентичность по отношению к последовательности согласно SEQ ID NO: 9. Также получают его фрагмент, содержащий по меньшей мере 12 аминокислот указанной последовательности, включая CCLVYTSWQI. Изобретение позволяет получить полипептид, способный ингибировать индуцированную CCL18 понижающую регуляцию экспрессии CCR6. 1 з.п. ф-лы, 33 ил., 17 пр.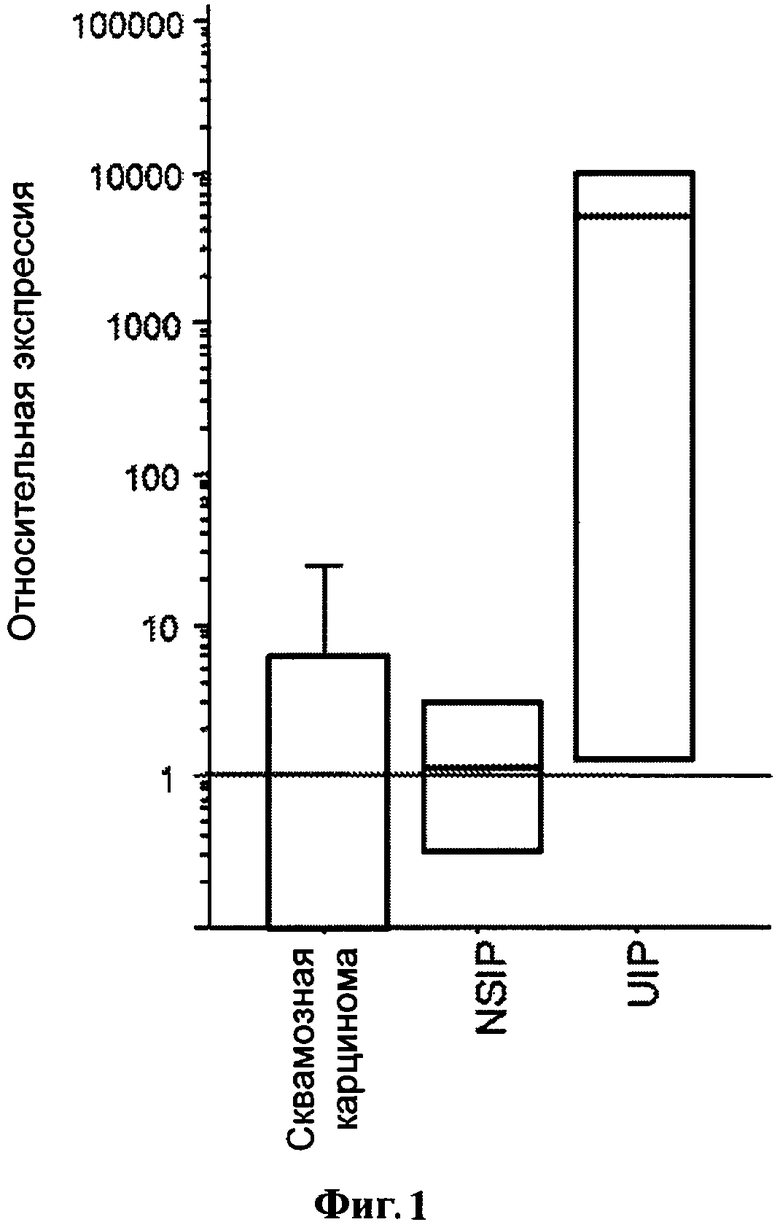
1. Фармацевтическая композиция для применения в лечении интерстициального заболевания легких и/или рака легких, содержащая соединение, способное ингибировать индуцированную CCL18 понижающую регуляцию экспрессии CCR6, в эффективном количестве, где указанное соединение представляет собой изолированный полипептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет как минимум 90% идентичность по отношению к последовательности согласно SEQ ID NO: 9, где аминокислотная последовательность содержит по меньшей мере 10 последовательных аминокислот последовательности согласно SEQ ID NO: 9, а именно CCLVYTSWQI; и
(b) фрагмента аминокислотной последовательности согласно (а), где указанный фрагмент содержит по меньшей мере 12 аминокислот, включая CCLVYTSWQI, где указанный изолированный полипептид способен ингибировать индуцированную CCL18 понижающую регуляцию экспрессии CCR6.
2. Фармацевтическая композиция по п. 1, где интерстициальное заболевание легких выбрано из группы, состоящей из идиопатического легочного фиброза, неспецифической интерстициальной пневмонии, криптогенной организующейся пневмонии, ассоциированного с респираторным бронхиолитом интерстициального заболевания легких, десквамативной интерстициальной пневмонии, острой интерстициальной пневмонии и лимфоцитарной интерстициальной пневмонии.
| US 7166702 B1, 23.01.2007 | |||
| US 2004156822 A1, 12.08.2004 | |||
| WO 2008054764 A2, 08.05.2008 | |||
| WO 2005015206 A2, 17.02.2005; | |||
| КОНСТРУКЦИИ АНТИТЕЛ И ХЕМОКИНОВ И ИХ ПРИМЕНЕНИЕ ПРИ ИММУНОЛОГИЧЕСКИХ НАРУШЕНИЯХ | 2001 |
|
RU2252786C2 |
| ORLANDO M., Modification of proteins and low molecular weight substances with hydroxyethyl starch (HES), Inauguraldissertation, Giesen, 2003, p.166 | |||
| PAKULA AA et al., Genetic analysis of protein stability and function, Anna | |||
| Rev | |||
| Genet., 1989, v.23, p.289-310 | |||
| TOKURIKI N | |||
| ET AL., Stability effects of mutations and protein evolvability, Curr | |||
| Opin | |||
| Struct | |||
| Biol., 2009, v.19, n.5, p.596-604.. | |||
Авторы
Даты
2017-02-02—Публикация
2011-06-24—Подача