ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет и преимущество по международной заявке на патент сер. № PCT/CN2016/073722, поданной 6 февраля 2016 г., которая включена в настоящий документ посредством ссылки полностью и для любых целей.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к мультивалентным и мультиспецифическим связывающим белкам, а также способам получения и применения мультивалентных и мультиспецифических связывающих белков.
ОПИСАНИЕ ПОДАННОГО В ЭЛЕКТРОННОМ ВИДЕ ТЕКСТОВОГО ФАЙЛА
[0003] Содержание текстового файла, поданного в электронном виде вместе с настоящим документом, включено в него полностью посредством ссылки: копия перечня последовательностей в машиночитаемом формате (название файла: EPBI_002_01WO_SeqList_ST25.txt, дата сохранения: 3 февраля 2017 г., размер файла 510 Кб).
УРОВЕНЬ ТЕХНИКИ
[0004] Биспецифические или мультиспецифические антитела были разработаны в рамках исследований, направленных на получение молекул, подходящих для лечения различных воспалительных заболеваний, рака и других расстройств.
[0005] Биспецифические антитела получали с применением квадромной технологии (см. Milstein, С. and A.C. Cuello, Nature, 1983. 305(5934): p. 537-40), основанной на соматическом слиянии клеток двух разных гибридомных линий, экспрессирующих моноклональные антитела мыши с требуемой специфичностью, свойственной биспецифическому антителу. Биспецифические антитела могут также быть получены с применением химической конъюгации двух разных mAb (см. Staerz, U.D., et al., Nature, 1985. 314(6012): p. 628-31). В других способах применялась химическая конъюгация двух разных моноклональных антител или фрагментов антител меньшего размера (см. Brennan, M., et al., Science, 1985. 229(4708): р. 81-3).
[0006] Другой способ представлен сопряжением двух исходных антител с применением гетеробифункционального кросс-линкера. В частности, два разных Fab-фрагмента химически перекрестно связывали через шарнирные остатки цистеина сайт-направленным образом (см. Glennie, M.J., et al., J Immunol, 1987. 139(7): p. 2367-75).
[0007] В недавнем прошлом были разработаны другие форматы рекомбинантных биспецифических антител (см. Kriangkum, J., et al., Biomol Eng, 2001. 18(2): p. 31-40). Для конструирования рекомбинантных биспецифических антител использовали в том числе тандемные одноцепочечные молекулы Fv и диатела, а также различные их производные. Обычно конструирование указанных молекул начинается с двух одноцепочечных Fv-фрагментов (scFv), которые распознают разные антигены (см. Economides, A.N., et al., Nat Med, 2003. 9(1): p. 47-52). Тандемные молекулы scFv (taFv) представляют собой простейший формат, предусматривающий простое соединение двух молекул scFv дополнительным пептидным линкером. Два фрагмента scFv, присутствующие в указанных тандемных молекулах scFv, образуют отдельные объекты с укладкой. Для соединения двух фрагментов scFv могут применяться различные линкеры, имеющие длину до 63 остатков (см. Nakanishi, K., et al. Annu Rev Immunol, 2001. 19: p. 423-74).
[0008] Из недавнего исследования известно об экспрессии тандемного scFv против CD28 и меланома-ассоциированного протеогликана in vivo у трансгенных кроликов и крупного рогатого скота (см. Gracie, J.A., et al., J Clin Invest, 1999. 104(10): p. 1393-401). В указанной конструкции две молекулы scFv были соединены СН1-линкером; в сыворотке обнаруживались концентрации биспецифического антитела до 100 мг/л. К настоящему времени из нескольких исследований известно об экспрессии растворимых тандемных молекул scFv у бактерий (см. Leung, B.P., et al., J Immunol, 2000. 164(12): р. 6495-502; Ito, A., et al., J Immunol, 2003. 170(9): p. 4802-9; Karni, A., et al., J Neuroimmunol, 2002. 125(1-2): p. 134-40) либо с очень коротким Ala3-линкером, либо с длинными богатыми глицином/серином линкерами.
[0009] В недавнем исследовании с применением фагового дисплея репертуар тандемных scFv, содержащих рандомизированные серединные линкеры длиной 3 или 6 остатков, обогащали по молекулам, продуцируемым у бактерий в растворимой и активной форме. Указанный способ обеспечивал выделение предпочтительной тандемной молекулы scFv с линкером длиной 6 остатков аминокислот (см. Arndt, M. and J. Krauss, Methods Mol Biol, 2003. 207: p. 305-21).
[0010] Для экспрессии биспецифических диател (Db) используют формат диател. Диатела получают из фрагментов scFv, уменьшая длину линкера, соединяющего VH и VL домен приблизительно до 5 остатков (см. Peipp, M. and Т. Valerius, Biochem Soc Trans, 2002. 30(4): p. 507-11). Указанное уменьшение размера линкера облегчает димеризацию двух полипептидных цепей за счет перекрестного спаривания доменов VH и VL. Биспецифические диатела получают путем экспрессии двух полипептидных цепей либо со структурой VHA-VLB и VHB-VKA (конфигурация VH-VL), либо со структурой VLA-VHB и VLB-VHA (конфигурация VL-VH) в одной и той же клетке. В недавнем сравнительном исследовании было продемонстрировано, что ориентация вариабельных доменов может влиять на экспрессию и образование активных сайтов связывания (см. Mack, M., G. Riethmuller, and P. Kufer, Proc Natl Acad Sci USA, 1995. 92(15): p. 7021-5).
[0011] Одним из способов обеспечения образования биспецифических диател является получение диател типа «выступ-во-впадине» (см. Holliger, Р., Т. Prospero, and G. Winter, Proc Natl Acad Sci USA, 1993. 90(14): p. 6444-8.18). Указанный способ был продемонстрирован для биспецифического диатела против HER2 и CD3. Большой «выступ» вводили в домен VH путем замены Val37 на Phe, a Leu45 - на Trp, и комплементарную впадину в домене VL получали путем введения мутаций Phe98→Met и Tyr87→Ala в вариабельные домены, направленные либо против HER2, либо против CD3. При применении указанного способа получения доля биспецифических диател может быть увеличена с 72% для исходного диатела до более чем 90% для диатела типа «выступ-во-впадине».
[0012] Одноцепочечные диатела (scDb) представляют собой альтернативную стратегию усовершенствованного получения биспецифических диатело-подобных молекул (см. Holliger, P. and G. Winter, Cancer Immunol Immunother, 1997. 45(3-4): p. 128-30; Wu, A.M., et al., Immunotechnology, 1996. 2(1): p. 21-36). Биспецифические одноцепочечные диатела получают путем соединения двух образующих диатело полипептидных цепей дополнительным серединным линкером длиной приблизительно 15 остатков аминокислот. Следовательно, все молекулы, имеющие молекулярную массу, соответствующую мономерным одноцепочечным диателам (50-60 кДа), являются биспецифическими. В ряде исследований было продемонстрировано, что биспецифические одноцепочечные диатела экспрессируются у бактерий в растворимой и активной форме, при этом большинство очищенных молекул представляют собой мономеры (см. Holliger, P. and G. Winter, Cancer Immunol Immunother, 1997. 45(3-4): p. 128-30; Wu, A.M., et al., Immunotechnology, 1996. 2(1): p. 21-36; Pluckthun, A. and P. Pack, Immunotechnology, 1997. 3(2): p. 83-105; Ridgway, J.B., et al., Protein Eng, 1996. 9(7): p. 617-21).
[0013] Диатело сливали с Fc для получения более Ig-подобных молекул, называемых дидиателом (см. Lu, D., et al., J Biol Chem, 2004. 279(4): p. 2856-65). Кроме того, была описана конструкция мультивалентного антитела, содержащая два повтора Fab в тяжелой цепи IgG и способная к связыванию четырех молекул антигена (см. патент США 8722859 В2, а также Miller, K., et al., J Immunol, 2003. 170(9): р. 4854-61).
[0014] Наиболее новыми примерами являются тетравалентные слитые с IgG одноцепочечные вариабельные фрагменты (scFv) (Dong J, et al., 2011 MAbs 3:273-288; Coloma MJ, Morrison SL 1997 Nat Biotechnol 15:159-163; Lu D, et al., 2002 J Immunol Methods 267:213-226), катумаксомаб, трифункциональное биспецифическое гибридное антитело крысы/мыши к молекуле адгезии эпителиальных клеток/CD3 (Lindhofer H, et al., 1995 J Immunol 155:219-225), биспецифическое scFv-антитело к CD19/CD3 блинатумомаб (Bargou R, et al., 2008 Science 321:974-977), антитела с «Fab двойного действия» (DAF) (Bostrom J, et al., 2009 Science 323:1610-1614), ковалентно связанные фармакофорные пептиды к каталитическим антителам (Doppalapudi VR, et al., 2010 Proc Nati Acad Sci USA 107:22611-22616), использование динамического обмена между полумолекулами IgG4 для получения биспецифических антител (van der Neut Kolfschoten M, et al., 2007 Science 317:1554-1557; Stubenrauch K, et al., 2010 Drug Metab Dispos 38:84-91), или обмен доменов тяжелых цепей и легких цепей в составе антигенсвязывающего фрагмента (Fab) одной половины биспецифического антитела (формат CrossMab) (Schaefer W et al 2011 Proc Natl Acad Sci 108:11187-92).
[0015] В данной области техники существует потребность в одномолекулярных объектах с двойной антигенсвязывающей функцией и в способах получения таких мультивалентных и мультиспецифических связывающих белков. Настоящее изобретение направлено на удовлетворение этой и других потребностей.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0016] Согласно настоящему изобретению предложены мультивалентные и мультиспецифические связывающие белки, а также способы получения и применения таких связывающих белков. Согласно одному варианту реализации настоящего изобретения предложенные мультивалентные и мультиспецифические связывающие белки представляют собой иммуноглобулины с тандемными Fab-фрагментами (FIT-Ig), и способны к связыванию двух или более антигенов, или двух или более эпитопов одного и того же антигена, или двух или более копий одного и того же эпитопа. Мультивалентные и мультиспецифические связывающие белки согласно настоящему изобретению подходят для лечения и/или предотвращения острых и хронических воспалительных заболеваний и расстройств, аутоиммунных заболеваний, рака, повреждений спинного мозга, сепсиса; и других заболеваний, расстройств и состояний. Согласно настоящему изобретению предложены фармацевтические композиции, содержащие мультивалентные и мультиспецифические связывающие белки. Кроме того, согласно настоящему изобретению предложены нуклеиновые кислоты, рекомбинантные экспрессионные векторы и клетки-хозяева для получения таких FIT-Ig. Способы применения FIT-Ig согласно настоящему изобретению для детекции специфических антигенов, in vivo или in vitro, также охвачены настоящим изобретением.
[0017] Согласно настоящему изобретению предложено семейство связывающих белков, которые способны к связыванию двух или более антигенов, например, с высокой аффинностью. Согласно одному аспекту настоящего изобретения предложен способ конструирования биспецифического связывающего белка с применением двух исходных моноклональных антител: mAb А, которое связывается с антигеном А, и mAb В, которое связывается с антигеном В. Связывающие белки, описанные в настоящем документе, согласно одному варианту реализации способны к связыванию антигенов, цитокинов, хемокинов, рецепторов цитокинов, рецепторов хемокинов, родственных цитокинам или хемокинам молекул или белков клеточной поверхности.
[0018] Соответственно, согласно одному аспекту предложены связывающие белки, способные к связыванию двух или более антигенов. Согласно одному варианту реализации настоящего изобретения предложен связывающий белок, содержащий по меньшей мере две полипептидных цепи, отличающийся тем, что указанные полипептидные цепи спариваются с образованием IgG-подобных молекул, способных к связыванию двух или более антигенов. Согласно одному варианту реализации указанный связывающий белок содержит две, три, четыре, пять или более полипептидных цепей. Согласно одному варианту реализации указанный связывающий белок содержит по меньшей мере один VLA, по меньшей мере один VLB, по меньшей мере один VHA, по меньшей мере один VHB, по меньшей мере один CL, и по меньшей мере один СН1, где VL представляет собой вариабельный домен легкой цепи, VH представляет собой вариабельный домен тяжелой цепи, CL представляет собой константный домен легкой цепи, СН1 представляет собой первый константный домен тяжелой цепи, А представляет собой первый антиген, и В представляет собой второй антиген. Согласно дополнительному варианту реализации указанная первая полипептидная цепь содержит VLA, CL, VHB и СН1. Согласно дополнительному варианту реализации указанный связывающий белок дополнительно содержит Fc. Согласно другому варианту реализации указанная Fc-область представляет собой вариант Fc-области. Согласно дополнительному варианту реализации указанный вариант Fc-области проявляет модифицированную эффекторную функцию, такую как АЗКЦ или КЗЦ. Согласно другому варианту реализации указанный вариант Fc-области проявляет модифицированную аффинность или авидность в отношении одного или более FcγR.
[0019] Согласно одному варианту реализации указанный связывающий белок содержит три полипептидных цепи, отличающихся тем, что первая полипептидная цепь содержит VLA, CL, VHB и СН1, вторая полипептидная цепь содержит VHA и СН1, и третья полипептидная цепь содержит VLB и CL. Согласно дополнительному варианту реализации первая полипептидная цепь указанного связывающего белка дополнительно содержит Fc. Согласно другому варианту реализации указанный связывающий белок содержит две полипептидных цепи, отличающихся тем, что первая полипептидная цепь содержит VLA, CL, VHB и СН1, а вторая полипептидная цепь содержит VHA, СН1, VLB и CL. Согласно дополнительному варианту реализации указанная первая полипептидная цепь дополнительно содержит Fc.
[0020] Согласно одному варианту реализации указанный связывающий белок содержит три полипептидных цепи, и соответствующая первой: второй: третьей цепям кДНК при котрансфекции присутствует в молярном соотношении 1:1:1, 1:1.5:1, 1:3:1, 1:1:1.5, 1:1:3, 1:1.5:1.5, 1:3:1.5, 1:1.5:3 или 1:3:3. Согласно другому варианту реализации указанный связывающий белок содержит две полипептидных цепи, и соответствующая первой: второй цепям кДНК при котрансфекции присутствует в молярном соотношении 1:1, 1:1.5 или 1:3, или в любых других соотношениях, за счет оптимизации, чтобы обеспечить максимизацию фракции мономерного FIT-Ig при любой трансфекции.
[0021] Согласно одному варианту реализации связывающий белок согласно настоящему изобретению не содержит пептидного линкера. Согласно одному варианту реализации связывающий белок согласно настоящему изобретению содержит по меньшей мере один аминокислотный или полипептидный линкер. Согласно дополнительному варианту реализации указанный линкер выбран из группы, состоящей из G, GS, SG, GGS, GSG, SGG, GGG, GGGS (SEQ ID NO: 489), SGGG (SEQ ID NO: 490), GGGGS (SEQ ID NO: 491), GGGGSGS (SEQ ID NO: 492), GGGGSGGS (SEQ ID NO: 493), GGGGSGGGGS (SEQ ID NO: 494), GGGGSGGGGSGGGGS (SEQ ID NO: 495), AKTTPKLEEGEFSEAR (SEQ ID NO: 496), AKTTPKLEEGEFSEARV (SEQ ID NO: 497), AKTTPKLGG (SEQ ID NO: 498), SAKTTPKLGG (SEQ ID NO: 499), SAKTTP (SEQ ID NO: 500), RADAAP (SEQ ID NO: 501), RADAAPTVS (SEQ ID NO: 502), RADAAAAGGPGS (SEQ ID NO: 503), RADAAAA(G4S)4 (SEQ ID NO: 504), SAKTTPKLEEGEFSEARV (SEQ ID NO: 505), ADAAP (SEQ ID NO: 506), ADAAPTVSIFPP (SEQ ID NO: 507), TVAAP (SEQ ID NO: 508), TVAAPSVFIFPP (SEQ ID NO: 509), QPKAAP (SEQ ID NO: 510), QPKAAPSVTLFPP (SEQ ID NO: 511), AKTTPP (SEQ ID NO: 512), AKTTPPSVTPLAP (SEQ ID NO: 513), AKTTAPSVYPLAP (SEQ ID NO: 514), ASTKGP (SEQ ID NO: 515), ASTKGPSVFPLAP (SEQ ID NO: 516), GENKVEYAPALMALS (SEQ ID NO: 517), GPAKELTPLKEAKVS (SEQ ID NO: 518), GHEAAAVMQVQYPAS (SEQ ID NO: 519) и AKTTAP (SEQ ID NO: 80). Указанные линкеры могут также представлять собой расщепляемые in vivo пептидные линкеры, чувствительные к протеазам (таким как ММП) линкеры, линкеры на основе дисульфидной связи, которые могут быть расщеплены путем восстановления; и т.п., согласно ранее приведенному описанию («Fusion Protein Technologies for Biopharmaceuticals: Applications and Challenges», ред. Stefan R. Schmidt), или любые расщепляемые линкеры, известные в данной области техники. Такие расщепляемые линкеры могут применяться для высвобождения верхнего Fab in vivo с различными целями, для улучшения проникновения в ткани/клетки и распространения в тканях/клетках, для усиления связывания с мишенями, для снижения потенциальных побочных эффектов, а также для модуляции in vivo функционального и физического времени полужизни 2-х разных областей Fab.
[0022] Согласно одному варианту реализации указанный связывающий белок содержит первый полипептид, содержащий, в направлении от аминоконца к карбоксильному концу, VLA-CL-VHB-CH1-Fc, вторую полипептидную цепь, содержащую, в направлении от аминоконца к карбоксильному концу, VHA-CH1, и третью полипептидную цепь, содержащую, в направлении от аминоконца к карбоксильному концу, VLB-CL; где VL представляет собой вариабельный домен легкой цепи, CL представляет собой константный домен легкой цепи, VH представляет собой вариабельный домен тяжелой цепи, СН1 представляет собой первый константный домен тяжелой цепи, А представляет собой первый эпитоп или антиген, и В представляет собой второй эпитоп или антиген. Согласно одному варианту реализации указанная Fc-область принадлежит IgG1 человека. Согласно другому варианту реализации указанная Fc-область представляет собой вариант Fc-области. Согласно дополнительному варианту реализации последовательность аминокислот Fc-области по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 99% или 100% идентична последовательности SEQ ID NO: 20. Согласно дополнительному варианту реализации CL первой полипептидной цепи слит непосредственно с VHB. Согласно другому варианту реализации CL первой полипептидной цепи соединен с VHB аминокислотным или олигопептидным линкером. Согласно дополнительному варианту реализации указанный линкер представляет собой GSG (SEQ ID NO: 26) или GGGGSGS (SEQ ID NO: 28).
[0023] Согласно другому варианту реализации указанный связывающий белок содержит первый полипептид, содержащий, в направлении от аминоконца к карбоксильному концу, VHB-CH1-CLA-CL-Fc, вторую полипептидную цепь, содержащую, в направлении от аминоконца к карбоксильному концу, VHA-CH1, и третью полипептидную цепь, содержащую, в направлении от аминоконца к карбоксильному концу, VLB-CL; где VL представляет собой вариабельный домен легкой цепи, CL представляет собой константный домен легкой цепи, VH представляет собой вариабельный домен тяжелой цепи, СН1 представляет собой первый константный домен тяжелой цепи, А представляет собой первый эпитоп или антиген, и В представляет собой второй эпитоп или антиген. Согласно одному варианту реализации указанная Fc-область принадлежит IgG1 человека. Согласно другому варианту реализации указанная Fc-область представляет собой вариант Fc-области. Согласно дополнительному варианту реализации последовательность аминокислот Fc-области по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 99% или 100% идентична последовательности SEQ ID NO: 20. Согласно одному варианту реализации СН1 первой полипептидной цепи слит непосредственно с VLA. Согласно другому варианту реализации СН1 первой полипептидной цепи соединен с VLA аминокислотным или олигопептидным линкером. Согласно дополнительному варианту реализации указанный линкер представляет собой GSG (SEQ ID NO: 26) или GGGGSGS (SEQ ID NO: 28).
[0024] Согласно другому варианту реализации указанный связывающий белок содержит первый полипептид, содержащий, в направлении от аминоконца к карбоксильному концу, VLA-CL-VHB-CH1-Fc, и вторую полипептидную цепь, содержащую, в направлении от аминоконца к карбоксильному концу, VHA-CH1-VLB-CL; где VL представляет собой вариабельный домен легкой цепи, CL представляет собой константный домен легкой цепи, VH представляет собой вариабельный домен тяжелой цепи, СН1 представляет собой первый константный домен тяжелой цепи, А представляет собой первый эпитоп или антиген, и В представляет собой второй эпитоп или антиген. Согласно одному варианту реализации Fc-область принадлежит IgG1 человека. Согласно другому варианту реализации Fc-область представляет собой вариант Fc-области. Согласно дополнительному варианту реализации последовательность аминокислот Fc-области по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 99% или 100% идентична последовательности SEQ ID NO: 20. Согласно дополнительному варианту реализации CL первой полипептидной цепи слит непосредственно с VHB. Согласно другому варианту реализации CL первой полипептидной цепи соединен с VHB аминокислотным или олигопептидным линкером. Согласно дополнительному варианту реализации указанный линкер представляет собой GSG (SEQ ID NO: 26) или GGGGSGS (SEQ ID NO: 28).
[0025] Согласно другому варианту реализации связывающий белок содержит первый полипептид, содержащий, в направлении от аминоконца к карбоксильному концу, VHB-CH1-CLA-CL-Fc, и вторую полипептидную цепь, содержащую, в направлении от аминоконца к карбоксильному концу, VLB-CL-VHA-CH1; где VL представляет собой вариабельный домен легкой цепи, CL представляет собой константный домен легкой цепи, VH представляет собой вариабельный домен тяжелой цепи, СН1 представляет собой первый константный домен тяжелой цепи, А представляет собой первый эпитоп или антиген, и В представляет собой второй эпитоп или антиген. Согласно одному варианту реализации Fc-область принадлежит IgG1 человека. Согласно другому варианту реализации Fc-область представляет собой вариант Fc-области. Согласно дополнительному варианту реализации последовательность аминокислот Fc-области по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 99% или 100% идентична последовательности SEQ ID NO: 20. Согласно одному варианту реализации СН1 первой полипептидной цепи слит непосредственно с VLA. Согласно другому варианту реализации СН1 первой полипептидной цепи соединен с VLA аминокислотным или олигопептидным линкером.
Согласно дополнительному варианту реализации указанный линкер представляет собой GSG (SEQ ID NO: 26) или GGGGSGS (SEQ ID NO: 28).
[0026] Связывающие белки согласно настоящему изобретению способны к связыванию пар цитокинов. Например, связывающие белки согласно настоящему изобретению способны к связыванию пар цитокинов, выбранных из группы, состоящей из ИЛ-1α и ИЛ-1β; ИЛ-12 и ИЛ-18, ФНО-α и ИЛ-23, ФНО-α и ИЛ-13; ФНО и ИЛ-18; ФИО и ИЛ-12; ФНО и ИЛ-1-бета; ФНО и MIF (фактора, ингибирующего миграцию макрофагов); ФНО и ИЛ-6, ФНО и рецептора ИЛ-6, ФНО и ИЛ-17; ИЛ-17 и ИЛ-20; ИЛ-17 и ИЛ-23; ФНО и ИЛ-15; ФНО и ФРЭС; рецептора ФРЭС (рФРЭС) и рЭФР; рТРФ и ФРЭС, ИЛ-13 и ИЛ-9; ИЛ-13 и ИЛ-4; ИЛ-13 и ИЛ-5; ИЛ-13 и ИЛ-25; ИЛ-13 и TARC (хемокина, регулируемого тимусом и активацией); ИЛ-13 и MDC (макрофагального хемокина); ИЛ-13 и MIF; ИЛ-13 и ТФР-β; ИЛ-13 и агониста ЛГР; ИЛ-13 и CL25; ИЛ-13 и SPRR2a (малого богатого пролином белка 2а); ИЛ-13 и SPRR2b (малого богатого пролином белка 2b); ИЛ-13 и ADAM8; и ФНО-α и PGE4, ИЛ-13 и PED2, ФНО и PEG2. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию ИЛ-17 и ИЛ-20. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию ИЛ-17 и ИЛ-20; и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела против ИЛ-17 LY и антитела против ИЛ-20 15D2. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию ИЛ-17 и ФНО. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию ИЛ-17 и ФНО; и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела против ИЛ-17 LY и антитела к ФНО голимумаба.
[0027] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают ИЛ-17 и ИЛ-20 и содержат первый полипептид, содержащий последовательность, состоящий или по существу состоящий из последовательности аминокислот, выбранной из группы, состоящей из последовательностей SEQ ID NO: 15, 25 и 27; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 21; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности, соответствующей SEQ ID NO: 23. Согласно другому варианту реализации настоящего изобретения предложенные связывающие белки связывают ИЛ-27 и ИЛ-20, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, выбранной из группы, состоящей из последовательностей SEQ ID NO: 15, 25 и 27, и вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, выбранной из группы, состоящей из последовательностей SEQ ID NO: 29, 30 и 31.
[0028] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают ФНО и ИЛ-17, и содержат первый полипептид, содержащий, состоящий или по существу состоящий из последовательности аминокислот, соответствующей последовательностям SEQ ID NO: 87; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 89; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности, соответствующей SEQ ID NO: 91. Согласно другому варианту реализации указанный связывающий белок способен к связыванию пар мишеней, выбранных из группы, состоящей из CD 137 и CD20, CD 137 и рЭФР, CD137 и Her-2, CD137 и PD-1, CD137 и PDL-1, ФРЭС и PD-L1, Lag-3 и TIM-3, OX40 и PD-1, TIM-3 и PD-1, TIM-3 и PDL-1, рЭФР и DLL-4, CD138 и CD20; CD138 и CD40; CD19 и CD20; CD20 и CD3; CD3 и CD33; CD3 и CD133; CD47 и CD20, CD38 и CD138; CD38 и CD20; CD20 и CD22; CD38 и CD40; CD40 и CD20; CD-8 и ИЛ-6; ХСПГ (хондроитинсульфатпротеогликанов) и RGM A; CTLA-4 и BTNO2; ИФР-1 и ИФР-2; ИФР-1/2 и Erb2B; рИФР-1 и рЭФР; рЭФР и CD13; рИФР-1 и ErbB3; рЭФР-2 и рИФР; рФРЭС-2 и Met; ФРЭС-А и ангиопоэтина-2 (Ang-2); ИЛ-12 и TWEAK; ИЛ-13 и ИЛ-1-бета; рТРФ и ФРЭС, ЕрСАМ и CD3, Her2 и CD3, CD19 и CD3, рЭФР и Her3, CD16a и CD30, CD30 и ПСМА, рЭФР и CD3, СЕА и CD3, TROP-2 и HSG, TROP-2 и CD3, MAG и RGM A; NgR и RGM A; NogoA и RGM A; OMGp и RGM A; PDL-1 и CTLA-4; CTLA-4 и PD-1; PD-1 и TIM-3; RGM А и RGM В; Те38 и ФНО-α; ФНО-α и Blys; ФНО-α и CD-22; ФНО-α и домена CTLA-4; ФНО-α и GP130; ФНО-α и ИЛ-12р40; и ФНО-α и лиганда RANK, фактора IXa и фактора X; рЭФР и PD-L1; рЭФР и cMet; Her3 и рИФР-1; DLL-4 и ФРЭС; PD-1 и PD-L1; и Her3 и PD-1.
[0029] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию CD3 и CD20. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию CD3 и CD20, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела против CD3 ОКТЗ или антитела против CD3, согласно описанию в патенте США 2009/0252683, который включен в настоящий документ полностью посредством ссылки; и антитела против CD20 офатумумаба. Согласно некоторым вариантам реализации указанный полипептид, происходящий из антитела к CD3, находится в верхнем домене, а полипептид, происходящий из антитела к CD20, находится в нижнем домене. В настоящем документе верхний домен представляет собой N-концевой, или «аминопроксимальный» домен, а нижний домен представляет собой С-концевой домен, или домен, расположенный ближе к Fc, если он присутствует. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой CD3, а антиген В представляет собой CD20. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой CD3, а антиген А представляет собой CD20. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к CD3, находится в нижнем домене, а полипептид, происходящий из антитела к CD20, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой CD20, а антиген В представляет собой CD-3. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой CD20, а антиген А представляет собой CD3.
[0030] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, выбранной из группы, состоящей из последовательностей SEQ ID NO: 41 и 48; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 44; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 46. Согласно другому варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD3, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 114; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 115; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 116.
[0031] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа CD20 и того же эпитопа CD3, что и биспецифический связывающий белок FIT018a, при этом биспецифический связывающий белок FIT018a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 316; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 325; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 330.
[0032] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 318, CDR2 VLA из последовательности SEQ ID NO: 319 и CDR3 VLA из последовательности SEQ ID NO: 320.
[0033] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 322, CDR2 VHB из последовательности SEQ ID NO: 323 и CDR3 VHB из последовательности SEQ ID NO: 324.
[0034] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 327, CDR2 VHA из последовательности SEQ ID NO: 328 и CDR3 VHA из последовательности SEQ ID NO: 329.
[0035] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 332, CDR2 VLB из последовательности SEQ ID NO: 333 и CDR3 VLB из последовательности SEQ ID NO: 334.
[0036] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 318, CDR2 VLA из последовательности SEQ ID NO: 319 и CDR3 VLA из последовательности SEQ ID NO: 320; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 322, CDR2 VHB из последовательности SEQ ID NO: 323 и CDR3 VHB из последовательности SEQ ID NO: 324, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 327, CDR2 VHA из последовательности SEQ ID NO: 328 и CDR3 VHA из последовательности SEQ ID NO: 329; a VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 332, CDR2 VLB из последовательности SEQ ID NO: 333 и CDR3 VLB из последовательности SEQ ID NO: 334.
[0037] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 317, и VHB с последовательностью, представленной в SEQ ID NO: 321, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 326, и при этом указанный связывающий белок содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 331.
[0038] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 316; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 325; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 330.
[0039] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD3 и CD20, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[0040] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию CTLA-4 и PD-1. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию CTLA-4 и PD-1, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к CTLA-4 ипилимумаба и антитело к PD-1 ниволумаба.
[0041] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA-4 и PD-1, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 92; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 95; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 97. Согласно одному варианту реализации настоящего изобретения предложен связывающий белок, способный к связыванию одного или более эпитопов на CTLA-4. Согласно одному варианту реализации настоящего изобретения предложен связывающий белок, способный к связыванию одного или более эпитопов на PD-1. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к CTLA-4, находится в верхнем домене, а полипептид, происходящий из антитела к PD-1, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой CTLA-4, а антиген В представляет собой PD-1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой CTLA-4, а антиген А представляет собой PD-1. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к CTLA-4, находится в нижнем домене, а полипептид, происходящий из антитела к PD-1, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой PD-1, а антиген В представляет собой CTLA-4. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой PD-1, а антиген А представляет собой CTLA-4.
[0042] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа CTLA-4 и того же эпитопа PD-1, что и биспецифические связывающие белки NBS3, NBS3R, NBS3-C или NBS3R-С согласно описанию в настоящем документе.
[0043] Биспецифический связывающий белок NBS3 содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 126; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 135; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 140.
[0044] Биспецифический связывающий белок NBS3R содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 145; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 154; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 159.
[0045] Биспецифический связывающий белок NBS3-C содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 164; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 173; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 178.
[0046] Биспецифический связывающий белок NBS3R-C содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 183; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 192; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 197.
[0047] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 128, CDR2 VLA из последовательности SEQ ID NO: 129 и CDR3 VLA из последовательности SEQ ID NO: 130 (например, указанные последовательности на NBS3). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 147, CDR2 VLA из последовательности SEQ ID NO: 148 и CDR3 VLA из последовательности SEQ ID NO: 149 (например, указанные последовательности на NBS3R). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 166, CDR2 VLA из последовательности SEQ ID NO: 167 и CDR3 VLA из последовательности SEQ ID NO: 168 (например, указанные последовательности на NBS3-C). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 185, CDR2 VLA из последовательности SEQ ID NO: 186 и CDR3 VLA из последовательности SEQ ID NO: 187 (например, указанные последовательности на NBS3R-C).
[0048] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 132, CDR2 VHB из последовательности SEQ ID NO: 133 и CDR3 VHB из последовательности SEQ ID NO: 134 (например, указанные последовательности на NBS3). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 151, CDR2 VHB из последовательности SEQ ID NO: 152 и CDR3 VHB из последовательности SEQ ID NO: 153 (например, указанные последовательности на NBS3R). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 166, CDR2 VHB из последовательности SEQ ID NO: 167 и CDR3 VHB из последовательности SEQ ID NO: 168 (например, указанные последовательности на NBS3-C). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержат CDR1 VHB из последовательности SEQ ID NO: 185, CDR2 VHB из последовательности SEQ ID NO: 186 и CDR3 VHB из последовательности SEQ ID NO: 187 (например, указанные последовательности на NBS3R-C).
[0049] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 137, CDR2 VHA из последовательности SEQ ID NO: 138 и CDR3 VHA из последовательности SEQ ID NO: 139 (например, указанные последовательности на NBS3). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 156, CDR2 VHA из последовательности SEQ ID NO: 157 и CDR3 VHA из последовательности SEQ ID NO: 158 (например, указанные последовательности на NBS3R). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 175, CDR2 VHA из последовательности SEQ ID NO: 176 и CDR3 VHA из последовательности SEQ ID NO: 177 (например, указанные последовательности HaNBS-С). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 194, CDR2 VHA из последовательности SEQ ID NO: 195 и CDR3 VHA из последовательности SEQ ID NO: 196 (например, указанные последовательности на NBS3R-C).
[0050] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 142, CDR2 VLB из последовательности SEQ ID NO: 143 и CDR3 VLB из последовательности SEQ ID NO: 144 (например, указанные последовательности на NBS3). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 161, CDR2 VLB из последовательности SEQ ID NO: 162 и CDR3 VLB из последовательности SEQ ID NO: 163 (например, указанные последовательности на NBS3R). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 180, CDR2 VLB из последовательности SEQ ID NO: 181 и CDR3 VLB из последовательности SEQ ID NO: 182 (например, указанные последовательности на NBS3-C). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 199, CDR2 VLB из последовательности SEQ ID NO: 200 и CDR3 VLB из последовательности SEQ ID NO: 201 (например, указанные последовательности на NBS3R-C).
[0051] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 128, CDR2 VLA из последовательности SEQ ID NO: 129 и CDR3 VLA из последовательности SEQ ID NO: 130; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 132, CDR2 VHB из последовательности SEQ ID NO: 133 и CDR3 VHB из последовательности SEQ ID NO: 134; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 137, CDR2 VHA из последовательности SEQ ID NO: 138 и CDR3 VHA из последовательности SEQ ID NO: 139; a VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 142, CDR2 VLB из последовательности SEQ ID NO: 143 и CDR3 VLB из последовательности SEQ ID NO: 144 (например, указанные последовательности на NBS3).
[0052] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 147, CDR2 VLA из последовательности SEQ ID NO: 148 и CDR3 VLA из последовательности SEQ ID NO: 149; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 151, CDR2 VHB из последовательности SEQ ID NO: 152 и CDR3 VHB из последовательности SEQ ID NO: 153; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 156, CDR2 VHA из последовательности SEQ ID NO: 157 и CDR3 VHA из последовательности SEQ ID NO: 158; a VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 161, CDR2 VLB из последовательности SEQ ID NO: 162 и CDR3 VLB из последовательности SEQ ID NO: 163 (например, указанные последовательности на NBS3R).
[0053] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLA на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 166, CDR2 VLA из последовательности SEQ ID NO: 167 и CDR3 VLA из последовательности SEQ ID NO: 168; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 170, CDR2 VHB из последовательности SEQ ID NO: 171 и CDR3 VHB из последовательности SEQ ID NO: 172; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 175, CDR2 VHA из последовательности SEQ ID NO: 176 и CDR3 VHA из последовательности SEQ ID NO: 177; a VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 180, CDR2 VLB из последовательности SEQ ID NO: 181 и CDR3 VLB из последовательности SEQ ID NO: 182 (например, указанные последовательности на NBS3-C).
[0054] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 166, CDR2 VLA из последовательности SEQ ID NO: 167 и CDR3 VLA из последовательности SEQ ID NO: 168; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 170, CDR2 VHB из последовательности SEQ ID NO: 171 и CDR3 VHB из последовательности SEQ ID NO: 172; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 175, CDR2 VHA из последовательности SEQ ID NO: 176 и CDR3 VHA из последовательности SEQ ID NO: 177; a VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 180, CDR2 VLB из последовательности SEQ ID NO: 181 и CDR3 VLB из последовательности SEQ ID NO: 182 (например, указанные последовательности на NBS3R-C).
[0055] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 127, и VHB с последовательностью, представленной в SEQ ID NO: 131, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 136, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 141 (например, указанные последовательности NBS3).
[0056] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 146, и VHB с последовательностью, представленной в SEQ ID NO: 150, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 155, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 160 (например, указанные последовательности NBS3R).
[0057] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 165, и VHB с последовательностью, представленной в SEQ ID NO: 169, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 174, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 179 (например, указанные последовательности на NBS3-C).
[0058] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 184, и VHB с последовательностью, представленной в SEQ ID NO: 188, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 193, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 198 (например, указанные последовательности NBS3R-C).
[0059] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 126; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 135; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 140 (например, указанные последовательности на NBS3).
[0060] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 145; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 154; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 159 (например, указанные последовательности NBS3R).
[0061] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 164; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 173; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 178 (например, указанные последовательности NBS3-C).
[0062] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 183; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 192; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 197 (например, указанные последовательности NBS3R-C).
[0063] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CTLA4 и PD-1, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены.
[0064] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию рЭФР и PD-L1. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию рЭФР и PD-L1, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к рЭФР панитумумаба и антитела к PD-L1 1В12. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к рЭФР, находится в верхнем домене, а полипептид, происходящий из антитела к PD-L1, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой рЭФР, а антиген В представляет собой PD-L1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой рЭФР, а антиген А представляет собой PD-L1. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к рЭФР, находится в нижнем домене, а полипептид, происходящий из антитела к PD-L1, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой PD-L1, а антиген В представляет собой рЭФР. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой PD-L1, а антиген А представляет собой рЭФР.
[0065] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 99; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 100; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 101. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию того же эпитопа рЭФР и того же эпитопа PD-L1, что и биспецифический связывающий белок FIT012a, при этом биспецифический связывающий белок FIT012a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 99; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 100; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 101 (например, указанные последовательности на FIT012a).
[0066] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию того же эпитопа рЭФР и того же эпитопа PD-L1, что и биспецифический связывающий белок FIT012b, при этом биспецифический связывающий белок FIT012b содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 202; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 211; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 216 (например, указанные последовательности на FIT012b).
[0067] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию того же эпитопа рЭФР и того же эпитопа PD-L1, что и биспецифический связывающий белок FIT012d, при этом биспецифический связывающий белок FIT012d содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 221; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 230; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 235 (например, указанные последовательности на FIT012d).
[0068] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 204, CDR2 VLA из последовательности SEQ ID NO: 205 и CDR3 VLA из последовательности SEQ ID NO: 206 (например, указанные последовательности на FIT012b). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 223, CDR2 VLA из последовательности SEQ ID NO: 224 и CDR3 VLA из последовательности SEQ ID NO: 225 (например, указанные последовательности на FIT012d).
[0069] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 208, CDR2 VHB из последовательности SEQ ID NO: 209 и CDR3 VHB из последовательности SEQ ID NO: 210 (например, указанные последовательности на FIT012b). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 227, CDR2 VHB из последовательности SEQ ID NO: 228 и CDR3 VHB из последовательности SEQ ID NO: 229 (например, указанные последовательности на FIT012d).
[0070] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 213, CDR2 VHA из последовательности SEQ ID NO: 214 и CDR3 VHA из последовательности SEQ ID NO: 215 (например, указанные последовательности на FIT012b). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 232, CDR2 VHA из последовательности SEQ ID NO: 233 и CDR3 VHA из последовательности SEQ ID NO: 234 (например, указанные последовательности на FIT012d).
[0071] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 218, CDR2 VLB из последовательности SEQ ID NO: 219 и CDR3 VLB из последовательности SEQ ID NO: 220 (например, указанные последовательности на FIT012b). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 237, CDR2 VLB из последовательности SEQ ID NO: 238 и CDR3 VLB из последовательности SEQ ID NO: 239 (например, указанные последовательности на FIT012d).
[0072] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA содержит CDR1 VLA из последовательности SEQ ID NO: 204, CDR2 VLA из последовательности SEQ ID NO: 205 и CDR3 VLA из последовательности SEQ ID NO: 206, VHB содержит CDR1 VHB из последовательности SEQ ID NO: 208, CDR2 VHB из последовательности SEQ ID NO: 209 и CDR3 VHB из последовательности SEQ ID NO: 210, VHA содержит CDR1 VHA из последовательности SEQ ID NO: 213, CDR2 VHA из последовательности SEQ ID NO: 214 и CDR3 VHA из последовательности SEQ ID NO: 215, a VLB содержит CDR1 VLB из последовательности SEQ ID NO: 218, CDR2 VLB из последовательности SEQ ID NO: 219 и CDR3 VLB из последовательности SEQ ID NO: 220 (например, указанные последовательности на FIT012b).
[0073] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 223, CDR2 VLA из последовательности SEQ ID NO: 224 и CDR3 VLA из последовательности SEQ ID NO: 225; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 227, CDR2 VHB из последовательности SEQ ID NO: 228 и CDR3 VHB из последовательности SEQ ID NO: 229; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 232, CDR2 VHA из последовательности SEQ ID NO: 233 и CDR3 VHA из последовательности SEQ ID NO: 234; a VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 237, CDR2 VLB из последовательности SEQ ID NO: 239 и CDR3 VLB из последовательности SEQ ID NO: 239 (например, указанные последовательности на FIT012d).
[0074] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 203, и VHB с последовательностью, представленной в SEQ ID NO: 207, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 212, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 217 (например, указанные последовательности на FIT012b).
[0075] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 222, и VHB с последовательностью, представленной в SEQ ID NO: 226, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 231, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 236 (например, указанные последовательности на FIT012d).
[0076] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 202; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 211; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 216 (например, указанные последовательности на FIT012b).
[0077] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 221; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 230; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 235 (например, указанные последовательности на FIT012d).
[0078] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают рЭФР и PD-L1, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[0079] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию cMet и рЭФР. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию cMet и рЭФР, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к cMet (h1332 (13.3.2L-A91T,H-42K,S97T)) и антитела к рЭФР панитумумаба. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к cMet, находится в верхнем домене, а полипептид, происходящий из антитела к рЭФР, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-СН1; и третий полипептид VLB-CL, при этом антиген А представляет собой cMet, a антиген В представляет собой рЭФР. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой cMet, а антиген А представляет собой рЭФР. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к cMet, находится в нижнем домене, а полипептид, происходящий из антитела к рЭФ, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой рЭФР, а антиген В представляет собой cMet. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой рЭФР, а антиген А представляет собой cMet.
[0080] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 102; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 103; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 104.
[0081] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа cMet и того же эпитопа рЭФР, что и биспецифический связывающий белок FIT013a, при этом указанный биспецифический связывающий белок FIT013a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 240; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 249; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 254.
[0082] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 242, CDR2 VLA из последовательности SEQ ID NO: 243 и CDR3 VLA из последовательности SEQ ID NO: 244.
[0083] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 246, CDR2 VHB из последовательности SEQ ID NO: 247 и CDR3 VHB из последовательности SEQ ID NO: 248.
[0084] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 251, CDR2 VHA из последовательности SEQ ID NO: 252 и CDR3 VHA из последовательности SEQ ID NO: 253.
[0085] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 256, CDR2 VLB из последовательности SEQ ID NO: 257 и CDR3 VLB из последовательности SEQ ID NO: 258.
[0086] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 242, CDR2 VLA из последовательности SEQ ID NO: 243 и CDR3 VLA из последовательности SEQ ID NO: 244; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 246, CDR2 VHB из последовательности SEQ ID NO: 247 и CDR3 VHB из последовательности SEQ ID NO: 248; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 251, CDR2 VHA из последовательности SEQ ID NO: 252 и CDR3 VHA из последовательности SEQ ID NO: 253; при этом VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 256, CDR2 VLB из последовательности SEQ ID NO: 257 и CDR3 VLB из последовательности SEQ ID NO: 258.
[0087] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 241, и VHB с последовательностью, представленной в SEQ ID NO: 245, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 250, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 255.
[0088] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 240; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 249; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 254.
[0089] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и рЭФР, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[0090] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию фактора IXa и фактора X. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию фактора IXa и фактора X, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела против фактора IXa, и вариабельные легкие и тяжелые цепи, происходящие из антитела против фактора X. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к фактору IXa, находится в верхнем домене, а полипептид, происходящий из антитела к фактору X, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-СН1; и третий полипептид VLB-CL, при этом антиген А представляет собой фактор IXa, а антиген В представляет собой фактор X. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой фактор IXa, а антиген А представляет собой фактор X. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к фактору IXa, находится в нижнем домене, а полипептид, происходящий из антитела к фактору X, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой фактор X, а антиген В представляет собой фактор IXa. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой фактор X, а антиген А представляет собой фактор IXa.
[0091] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 105; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 106; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 107.
[0092] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа фактора IXa и того же эпитопа фактора X, что и биспецифический связывающий белок FIT014a, при этом биспецифический связывающий белок FIT014a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 259; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 268; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 273.
[0093] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 261, CDR2 VLA из последовательности SEQ ID NO: 262 и CDR3 VLA из последовательности SEQ ID NO: 263.
[0094] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 265, CDR2 VHB из последовательности SEQ ID NO: 266 и CDR3 VHB из последовательности SEQ ID NO: 267.
[0095] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 270, CDR2 VHA из последовательности SEQ ID NO: 271 и CDR3 VHA из последовательности SEQ ID NO: 272.
[0096] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 275, CDR2 VLB из последовательности SEQ ID NO: 276 и CDR3 VLB из последовательности SEQ ID NO: 277.
[0097] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 261, CDR2 VLA из последовательности SEQ ID NO: 262 и CDR3 VLA из последовательности SEQ ID NO: 263; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 265, CDR2 VHB из последовательности SEQ ID NO: 266 и CDR3 VHB из последовательности SEQ ID NO: 267; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 270, CDR2 VHA из последовательности SEQ ID NO: 271 и CDR3 VHA из последовательности SEQ ID NO: 272; a VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 275, CDR2 VLB из последовательности SEQ ID NO: 276 и CDR3 VLB из последовательности SEQ ID NO: 277.
[0098] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 260, и VHB с последовательностью, представленной в SEQ ID NO: 264, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 269, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 274.
[0099] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 259; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 268; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 273.
[00100] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают фактор IXa и фактор X, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00101] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию Her3 и рИФР-1. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию Her3 и рИФР-1, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к Her3 патритумаба и антитела к рИФР-1 фигитумумаба. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к Her3, находится в верхнем домене, а полипептид, происходящий из антитела к рИФР-1, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой Her3, а антиген В представляет собой рИФР-1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой Her3, а антиген А представляет собой рИФР-1. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к Her3, находится в нижнем домене, а полипептид, происходящий из антитела к рИФР-1, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой рИФР-1, а антиген В представляет собой Her3. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой рИФР-1, а антиген А представляет собой Her3.
[00102] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 108; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 109; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 110.
[00103] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа Her3 и того же эпитопа рИФР-1, что и биспецифический связывающий белок FIT016a, при этом указанный биспецифический связывающий белок FIT016a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 278; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 287; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 292.
[00104] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 280, CDR2 VLA из последовательности SEQ ID NO: 281 и CDR3 VLA из последовательности SEQ ID NO: 282.
[00105] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 284, CDR2 VHB из последовательности SEQ ID NO: 285 и CDR3 VHB из последовательности SEQ ID NO: 286.
[00106] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 289, CDR2 VHA из последовательности SEQ ID NO: 290 и CDR3 VHA из последовательности SEQ ID NO: 291.
[00107] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 294, CDR2 VLB из последовательности SEQ ID NO: 295 и CDR3 VLB из последовательности SEQ ID NO: 296.
[00108] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 280, CDR2 VLA из последовательности SEQ ID NO: 281 и CDR3 VLA из последовательности SEQ ID NO: 282; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 284, CDR2 VHB из последовательности SEQ ID NO: 285 и CDR3 VHB из последовательности SEQ ID NO: 286; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 289, CDR2 VHA из последовательности SEQ ID NO: 290 и CDR3 VHA из последовательности SEQ ID NO: 291; при этом VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 294, CDR2 VLB из последовательности SEQ ID NO: 295 и CDR3 VLB из последовательности SEQ ID NO: 296.
[00109] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 279, и VHB с последовательностью, представленной в SEQ ID NO: 283, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 288, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 293.
[00110] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 278; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 287; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 292.
[00111] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рИФР-1, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00112] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию дельта-подобного лиганда 4 (DLL-4) и ФРЭС. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию DLL-4 и ФРЭС, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к DLL-4 демцизумаба и антитела к ФРЭС бевацизумаба. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к DLL-4, находится в верхнем домене, а полипептид, происходящий из антитела к ФРЭС, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой DLL-4, а антиген В представляет собой ФРЭС. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-СН1, при этом антиген В представляет собой DLL-4, a антиген А представляет собой ФРЭС. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к DLL-4, находится в нижнем домене, а полипептид, происходящий из антитела к ФРЭС, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой ФРЭС, а антиген В представляет собой DLL-4. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой ФРЭС, а антиген А представляет собой DLL-4.
[00113] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 111; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 112; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 113.
[00114] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа DLL-4 и того же эпитопа ФРЭС, что и биспецифический связывающий белок FIТ017а, при этом биспецифический связывающий белок FIТ017а содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 297; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 306; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 311.
[00115] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 299, CDR2 VLA из последовательности SEQ ID NO: 300 и CDR3 VLA из последовательности SEQ ID NO: 301.
[00116] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 303, CDR2 VHB из последовательности SEQ ID NO: 304 и CDR3 VHB из последовательности SEQ ID NO: 305.
[00117] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 308, CDR2 VHA из последовательности SEQ ID NO: 309 и CDR3 VHA из последовательности SEQ ID NO: 310.
[00118] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 313, CDR2 VLB из последовательности SEQ ID NO: 314 и CDR3 VLB из последовательности SEQ ID NO: 315.
[00119] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 299, CDR2 VLA из последовательности SEQ ID NO: 300 и CDR3 VLA из последовательности SEQ ID NO: 301; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 303, CDR2 VHB из последовательности SEQ ID NO: 304 и CDR3 VHB из последовательности SEQ ID NO: 305; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 308, CDR2 VHA из последовательности SEQ ID NO: 309 и CDR3 VHA из последовательности SEQ ID NO: 310; a VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 313, CDR2 VLB из последовательности SEQ ID NO: 314 и CDR3 VLB из последовательности SEQ ID NO: 315.
[00120] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 298, и VHB с последовательностью, представленной в SEQ ID NO: 302, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 307, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 312.
[00121] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 297; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 306; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 311.
[00122] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают DLL-4 и ФРЭС, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00123] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию Her3 и рЭФР. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию Her3 и рЭФР, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к Her3 патритумаба и антитела к рЭФР панитумумаба. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к Her3, находится в верхнем домене, а полипептид, происходящий из антитела к рЭФР, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой Her3, а антиген В представляет собой рЭФР. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-СН1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой Her3, а антиген А представляет собой рЭФР. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к Her3, находится в нижнем домене, а полипептид, происходящий из антитела к рЭФР, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой рЭФР, а антиген В представляет собой Her3. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой рЭФР, а антиген А представляет собой Her3.
[00124] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 117; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 118; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 119.
[00125] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа Her3 и того же эпитопа рЭФР, что и биспецифический связывающий белок FIT019a, при этом биспецифический связывающий белок FIT019a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 335; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 344; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 349. Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа Her3 и того же эпитопа рЭФР, что и биспецифический связывающий белок FIT019b, при этом биспецифический связывающий белок FIT019b содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 354; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 363; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 368.
[00126] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 337, CDR2 VLA из последовательности SEQ ID NO: 338 и CDR3 VLA из последовательности SEQ ID NO: 339 (например, указанные последовательности на FIT019a). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 356, CDR2 VLA из последовательности SEQ ID NO: 357 и CDR3 VLA из последовательности SEQ ID NO: 358 (например, указанные последовательности на FIT019b).
[00127] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 341, CDR2 VHB из последовательности SEQ ID NO: 342 и CDR3 VHB из последовательности SEQ ID NO: 343 (например, указанные последовательности на FIT019a). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 360, CDR2 VHB из последовательности SEQ ID NO: 361 и CDR3 VHB из последовательности SEQ ID NO: 362 (например, указанные последовательности на FIT019b).
[00128] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 346, CDR2 VHA из последовательности SEQ ID NO: 347 и CDR3 VHA из последовательности SEQ ID NO: 348 (например, указанные последовательности на FIT019a). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 365, CDR2 VHA из последовательности SEQ ID NO: 366 и CDR3 VHA из последовательности SEQ ID NO: 367 (например, указанные последовательности на FIT019b).
[00129] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VHB на третьем полипептиде, где VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 351, CDR2 VLB из последовательности SEQ ID NO: 352 и CDR3 VHB из последовательности SEQ ID NO: 353 (например, указанные последовательности на FIT019a). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VHB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 370, CDR2 VLB из последовательности SEQ ID NO: 371 и CDR3 VLB из последовательности SEQ ID NO: 372 (например, указанные последовательности на FIT019b).
[00130] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 337, CDR2 VLA из последовательности SEQ ID NO: 338 и CDR3 VLA из последовательности SEQ ID NO: 339; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 341, CDR2 VHB из последовательности SEQ ID NO: 342 и CDR3 VHB из последовательности SEQ ID NO: 343; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 346, CDR2 VHA из последовательности SEQ ID NO: 347 и CDR3 VHA из последовательности SEQ ID NO: 348; a VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 351, CDR2 VHB из последовательности SEQ ID NO: 352 и CDR3 VHB из последовательности SEQ ID NO: 353 (например, указанные последовательности на FIT019a).
[00131] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VHB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 356, CDR2 VLA из последовательности SEQ ID NO: 357 и CDR3 VLA из последовательности SEQ ID NO: 358; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 360, CDR2 VHB из последовательности SEQ ID NO: 361 и CDR3 VHB из последовательности SEQ ID NO: 362; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 365, CDR2 VHA из последовательности SEQ ID NO: 366 и CDR3 VHA из последовательности SEQ ID NO: 367; a VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 370, CDR2 VHB из последовательности SEQ ID NO: 371 и CDR3 VHB из последовательности SEQ ID NO: 372 (например, указанные последовательности на FIT019b).
[00132] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержит первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 336, и VHB с последовательностью, представленной в SEQ ID NO: 340, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 345, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 350 (например, указанные последовательности на FIT019a). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержит первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 355, и VHB с последовательностью, представленной в SEQ ID NO: 359, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 364, и содержит третью полипептидную цепь, содержащую VHB с последовательностью, представленной в SEQ ID NO: 369 (например, указанные последовательности на FIT019b).
[00133] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 335; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 344; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 349 (например, указанные последовательности на FIT019a). Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 354; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 363; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 368 (например, указанные последовательности на FIT019b).
[00134] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и рЭФР, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00135] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию PD-1 и PD-L1. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию PD-1 и PD-L1, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к PD-1 ниволумаба и антитела к PD-L1 1В12. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к PD-1, находится в верхнем домене, а полипептид, происходящий из антитела к PD-L1, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой PD-1, а антиген В представляет собой PD-L1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой PD-1, а антиген А представляет собой PD-L1. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к PD-1, находится в нижнем домене, а полипептид, происходящий из антитела к PD-L1, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой PD-L1, а антиген В представляет собой PD-1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой PD-L1, а антиген А представляет собой PD-1.
[00136] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 120; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 121; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 122.
[00137] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа PD-1 и того же эпитопа PD-L1, что и биспецифический связывающий белок FIT020a, при этом биспецифический связывающий белок FIT020a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 120; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 121; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 122.
[00138] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа PD-1 и того же эпитопа PD-L1, что и биспецифический связывающий белок FIT020b, при этом биспецифический связывающий белок FIT020b содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 297; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 306; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 311.
[00139] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 389, CDR2 VLA из последовательности SEQ ID NO: 390 и CDR3 VLA из последовательности SEQ ID NO: 391 (например, указанные последовательности на FIT020a).
[00140] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат CDR1 VLA из последовательности SEQ ID NO: 375, CDR2 VLA из последовательности SEQ ID NO: 376 и CDR3 VLA из последовательности SEQ ID NO: 377 (например, указанные последовательности на FIT020b).
[00141] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 384, CDR2 VHB из последовательности SEQ ID NO: 385 и CDR3 VHB из последовательности SEQ ID NO: 386 (например, указанные последовательности на FIT020a).
[00142] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат CDR1 VHB из последовательности SEQ ID NO: 379, CDR2 VHB из последовательности SEQ ID NO: 380 и CDR3 VHB из последовательности SEQ ID NO: 381 (например, указанные последовательности на FIT020b).
[00143] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 379, CDR2 VHA из последовательности SEQ ID NO: 380 и CDR3 VHA из последовательности SEQ ID NO: 381 (например, указанные последовательности на FIT020a).
[00144] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 384, CDR2 VHA из последовательности SEQ ID NO: 385 и CDR3 VHA из последовательности SEQ ID NO: 386 (например, указанные последовательности на FIT020b).
[00145] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат VLB на третьем полипептиде, где VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 375, CDR2 VLB из последовательности SEQ ID NO: 376 и CDR3 VHB из последовательности SEQ ID NO: 377 (например, указанные последовательности на FIT020a).
[00146] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L 1, и содержат VHB на третьем полипептиде, где VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 389, CDR2 VHB из последовательности SEQ ID NO: 390 и CDR3 VHB из последовательности SEQ ID NO: 391 (например, указанные последовательности на FIT020b).
[00147] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 389, CDR2 VLA из последовательности SEQ ID NO: 390 и CDR3 VLA из последовательности SEQ ID NO: 391; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 384, CDR2 VHB из последовательности SEQ ID NO: 385 и CDR3 VHB из последовательности SEQ ID NO: 386; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 379, CDR2 VHA из последовательности SEQ ID NO: 380 и CDR3 VHA из последовательности SEQ ID NO: 381; a VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 375, CDR2 VHB из последовательности SEQ ID NO: 376 и CDR3 VLB из последовательности SEQ ID NO: 377 (например, указанные последовательности на FIT020a).
[00148] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VHB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 375, CDR2 VLA из последовательности SEQ ID NO: 376 и CDR3 VLA из последовательности SEQ ID NO: 377; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 379, CDR2 VHB из последовательности SEQ ID NO: 380 и CDR3 VHB из последовательности SEQ ID NO: 381; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 384, CDR2 VHA из последовательности SEQ ID NO: 385 и CDR3 VHA из последовательности SEQ ID NO: 386; a VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 389, CDR2 VHB из последовательности SEQ ID NO: 390 и CDR3 VHB из последовательности SEQ ID NO: 391 (например, указанные последовательности на FIT020b).
[00149] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 388, и VHB с последовательностью, представленной в SEQ ID NO: 383, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 378, и содержит третью полипептидную цепь, содержащую VHB с последовательностью, представленной в SEQ ID NO: 374 (например, указанные последовательности на FIT020a).
[00150] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 374, и VHB с последовательностью, представленной в SEQ ID NO: 378, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 383, и содержит третью полипептидную цепь, содержащую VLB с последовательностью, представленной в SEQ ID NO: 388 (например, указанные последовательности на FIT020b).
[00151] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 120; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 121; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 122 (например, указанные последовательности на FIT020a).
[00152] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 373; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 382; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 387 (например, указанные последовательности на FIT020b).
[00153] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают PD-1 и PD-L1, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00154] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию Her3 и PD-1. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию Her3 и PD-1, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к Her3 патритумаба и антитело к рЭФР ниволумаба. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к Her3, находится в верхнем домене, а полипептид, происходящий из антитела к PD-1, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой Her3, а антиген В представляет собой PD-1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой Her3, а антиген А представляет собой PD-1. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к Her3, находится в нижнем домене, а полипептид, происходящий из антитела к PD-1, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VLB-CL, при этом антиген А представляет собой PD-1, а антиген В представляет собой Her3. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой PD-1, а антиген А представляет собой Her3.
[00155] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и содержат первую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 123; вторую полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 124; и третью полипептидную цепь, содержащую последовательность, состоящую или по существу состоящую из последовательности аминокислот, соответствующей SEQ ID NO: 125.
[00156] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа Her3 и того же эпитопа PD-1, что и биспецифический связывающий белок FIT022a, при этом биспецифический связывающий белок FIT022a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 411; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 420; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 425.
[00157] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 413, CDR2 VLA из последовательности SEQ ID NO: 414 и CDR3 VLA из последовательности SEQ ID NO: 415.
[00158] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 417, CDR2 VHB из последовательности SEQ ID NO: 418 и CDR3 VHB из последовательности SEQ ID NO: 419.
[00159] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 422, CDR2 VHA из последовательности SEQ ID NO: 423 и CDR3 VHA из последовательности SEQ ID NO: 424.
[00160] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и содержат VHB на третьем полипептиде, где VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 427, CDR2 VHB из последовательности SEQ ID NO: 428 и CDR3 VLB из последовательности SEQ ID NO: 429.
[00161] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 413, CDR2 VLA из последовательности SEQ ID NO: 414 и CDR3 VLA из последовательности SEQ ID NO: 415; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 417, CDR2 VHB из последовательности SEQ ID NO: 418 и CDR3 VHB из последовательности SEQ ID NO: 419; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 422, CDR2 VHA из последовательности SEQ ID NO: 423 и CDR3 VHA из последовательности SEQ ID NO: 424; a VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 427, CDR2 VHB из последовательности SEQ ID NO: 428 и CDR3 VLB из последовательности SEQ ID NO: 429.
[00162] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 412, и VHB с последовательностью, представленной в SEQ ID NO: 416, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 421, и содержит третью полипептидную цепь, содержащую VHB с последовательностью, представленной в SEQ ID NO: 426.
[00163] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 411; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 420; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 425.
[00164] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают Her3 и PD-1, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00165] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию cMet и PD-L1. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию cMet и PD-L1, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к cMet h1332 и антитела к PD-L1 1В12. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к cMet, находится в верхнем домене, а полипептид, происходящий из антитела к PD-L1, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-СН1; и третий полипептид VHB-CL, при этом антиген А представляет собой cMet, а антиген В представляет собой PD-L1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой cMet, а антиген А представляет собой PD-L1. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к cMet, находится в нижнем домене, а полипептид, происходящий из антитела к PD-L1, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой PD-L1, а антиген В представляет собой cMet. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VLB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой PD-L1, а антиген А представляет собой cMet.
[00166] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа cMet и того же эпитопа PD-L1, что и биспецифический связывающий белок FIT023a, при этом биспецифический связывающий белок FIT023a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 430; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 439; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 444.
[00167] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и PD-L1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 432, CDR2 VLA из последовательности SEQ ID NO: 433 и CDR3 VLA из последовательности SEQ ID NO: 434.
[00168] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и PD-L1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 436, CDR2 VHB из последовательности SEQ ID NO: 437 и CDR3 VHB из последовательности SEQ ID NO: 438.
[00169] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и PD-L1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 441, CDR2 VHA из последовательности SEQ ID NO: 442 и CDR3 VHA из последовательности SEQ ID NO: 443.
[00170] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и PD-L1, и содержат VLB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 446, CDR2 VHB из последовательности SEQ ID NO: 447 и CDR3 VHB из последовательности SEQ ID NO: 448.
[00171] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и PD-L1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 432, CDR2 VLA из последовательности SEQ ID NO: 433 и CDR3 VLA из последовательности SEQ ID NO: 434; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 436, CDR2 VHB из последовательности SEQ ID NO: 437 и CDR3 VHB из последовательности SEQ ID NO: 438; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 441, CDR2 VHA из последовательности SEQ ID NO: 442 и CDR3 VHA из последовательности SEQ ID NO: 443; a VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 446, CDR2 VHB из последовательности SEQ ID NO: 447 и CDR3 VHB из последовательности SEQ ID NO: 448.
[00172] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и PD-L1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 431, и VHB с последовательностью, представленной в SEQ ID NO: 435, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 440, и содержит третью полипептидную цепь, содержащую VHB с последовательностью, представленной в SEQ ID NO: 445.
[00173] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и PD-L1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 430; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 439; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 444.
[00174] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают cMet и PD-L1, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00175] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию В- и Т-лимфоцитарного аттенюатора (BTLA) и PD-1. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию BTLA и PD-1 и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к BTLA 6A5 и антитела к PD-1 ниволумаба. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к BTLA, находится в верхнем домене, а полипептид, происходящий из антитела к PD-1, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой BTLA, а антиген В представляет собой PD-1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой BTLA, а антиген А представляет собой PD-1. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к BTLA, находится в нижнем домене, а полипептид, происходящий из антитела к PD-1, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой PD-1, а антиген В представляет собой BTLA. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой PD-1, а антиген А представляет собой BTLA.
[00176] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа BTLA и того же эпитопа PD-1, что и биспецифический связывающий белок FIT024a, при этом биспецифический связывающий белок FIT024a содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 449; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 458; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 463.
[00177] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа BTLA и того же эпитопа PD-1, что и биспецифический связывающий белок FIT024b, при этом биспецифический связывающий белок FIT024b содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 468; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 477; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 482.
[00178] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 451, CDR2 VLA из последовательности SEQ ID NO: 452 и CDR3 VLA из последовательности SEQ ID NO: 453 (например, указанные последовательности FIT024a).
[00179] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 470, CDR2 VLA из последовательности SEQ ID NO: 471 и CDR3 VLA из последовательности SEQ ID NO: 472 (например, указанные последовательности FIT024b).
[00180] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 455, CDR2 VHB из последовательности SEQ ID NO: 456 и CDR3 VHB из последовательности SEQ ID NO: 457 (например, указанные последовательности FIT024a).
[00181] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 474, CDR2 VHB из последовательности SEQ ID NO: 475 и CDR3 VHB из последовательности SEQ ID NO: 476 (например, указанные последовательности FIT024b).
[00182] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 460, CDR2 VHA из последовательности SEQ ID NO: 461 и CDR3 VHA из последовательности SEQ ID NO: 462 (например, указанные последовательности FIT024a).
[00183] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 479, CDR2 VHA из последовательности SEQ ID NO: 480 и CDR3 VHA из последовательности SEQ ID NO: 481 (например, указанные последовательности FIT024b).
[00184] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VHB на третьем полипептиде, где VLB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 465, CDR2 VHB из последовательности SEQ ID NO: 466 и CDR3 VHB из последовательности SEQ ID NO: 467 (например, указанные последовательности ПТ024а).
[00185] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VHB на третьем полипептиде, где VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 484, CDR2 VHB из последовательности SEQ ID NO: 485 и CDR3 VHB из последовательности SEQ ID NO: 486 (например, указанные последовательности FIT024b).
[00186] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VLB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 451, CDR2 VLA из последовательности SEQ ID NO: 452 и CDR3 VLA из последовательности SEQ ID NO: 453; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 455, CDR2 VHB из последовательности SEQ ID NO: 456 и CDR3 VHB из последовательности SEQ ID NO: 457; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 460, CDR2 VHA из последовательности SEQ ID NO: 461 и CDR3 VHA из последовательности SEQ ID NO: 462; a VHB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 465, CDR2 VHB из последовательности SEQ ID NO: 466 и CDR3 VLB из последовательности SEQ ID NO: 467 (например, указанные последовательности FIT024a).
[00187] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VHB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 470, CDR2 VLA из последовательности SEQ ID NO: 471 и CDR3 VLA из последовательности SEQ ID NO: 472; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 474, CDR2 VHB из последовательности SEQ ID NO: 475 и CDR3 VHB из последовательности SEQ ID NO: 476; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 479, CDR2 VHA из последовательности SEQ ID NO: 480 и CDR3 VHA из последовательности SEQ ID NO: 481; a VHB третьего полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 484, CDR2 VHB из последовательности SEQ ID NO: 485 и CDR3 VHB из последовательности SEQ ID NO: 486 (например, указанные последовательности FIT024b).
[00188] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 450, и VHB с последовательностью, представленной в SEQ ID NO: 454, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 459, и содержит третью полипептидную цепь, содержащую VHB с последовательностью, представленной в SEQ ID NO: 464 (например, указанные последовательности FIT024a).
[00189] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 469, и VHB с последовательностью, представленной в SEQ ID NO: 473, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 478, и содержит третью полипептидную цепь, содержащую VHB с последовательностью, представленной в SEQ ID NO: 483 (например, указанные последовательности FIT024b).
[00190] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 449; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 458; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 463 (указанные последовательности FIT024a).
[00191] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 468; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 477; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 482 (указанные последовательности FIT024b).
[00192] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают BTLA и PD-1, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00193] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию CD20 и CD22. Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию CD20 и CD22, и содержат вариабельные тяжелые и легкие цепи, происходящие из антитела к CD20 офатумумаба и антитела к CD22 эпратузумаба. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к CD20, находится в верхнем домене, а полипептид, происходящий из антитела к CD22, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой CD20, а антиген В представляет собой CD22. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой CD20, а антиген А представляет собой CD22. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к CD20, находится в нижнем домене, а полипептид, происходящий из антитела к CD22, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой CD22, а антиген В представляет собой CD20. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой CD22, а антиген А представляет собой CD20.
[00194] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию того же эпитопа CD20 и того же эпитопа CD22, что и биспецифический связывающий белок FIT021b, при этом биспецифический связывающий белок FIT021b содержит первую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 392; вторую полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 401; и третью полипептидную цепь, содержащую последовательность аминокислот, представленную в SEQ ID NO: 406.
[00195] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD22, и содержат VLA на первом полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 394, CDR2 VLA из последовательности SEQ ID NO: 395 и CDR3 VLA из последовательности SEQ ID NO: 396.
[00196] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD22, и содержат VHB на первом полипептиде, где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 398, CDR2 VHB из последовательности SEQ ID NO: 399 и CDR3 VHB из последовательности SEQ ID NO: 400.
[00197] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD22, и содержат VHA на втором полипептиде, где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 403, CDR2 VHA из последовательности SEQ ID NO: 404 и CDR3 VHA из последовательности SEQ ID NO: 405.
[00198] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD22, и содержат VLB на третьем полипептиде, где VHB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 408, CDR2 VHB из последовательности SEQ ID NO: 409 и CDR3 VHB из последовательности SEQ ID NO: 410.
[00199] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD22, и содержат VLA и VHB на первом полипептиде, VHA на втором полипептиде и VHB на третьем полипептиде, где VLA первого полипептида содержит CDR1 VLA из последовательности SEQ ID NO: 394, CDR2 VLA из последовательности SEQ ID NO: 395 и CDR3 VLA из последовательности SEQ ID NO: 396; где VHB первого полипептида содержит CDR1 VHB из последовательности SEQ ID NO: 398, CDR2 VHB из последовательности SEQ ID NO: 399 и CDR3 VHB из последовательности SEQ ID NO: 400; где VHA второго полипептида содержит CDR1 VHA из последовательности SEQ ID NO: 403, CDR2 VHA из последовательности SEQ ID NO: 404 и CDR3 VHA из последовательности SEQ ID NO: 405; a VHB третьего полипептида содержит CDR1 VLB из последовательности SEQ ID NO: 408, CDR2 VHB из последовательности SEQ ID NO: 409 и CDR3 VHB из последовательности SEQ ID NO: 410.
[00200] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD22, и содержат первую полипептидную цепь, содержащую VLA с последовательностью, представленной в SEQ ID NO: 393, и VHB с последовательностью, представленной в SEQ ID NO: 397, при этом указанный связывающий белок содержит вторую полипептидную цепь, содержащую VHA с последовательностью, представленной в SEQ ID NO: 402, и содержит третью полипептидную цепь, содержащую VHB с последовательностью, представленной в SEQ ID NO: 407.
[00201] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD22, и содержат, состоят или по существу состоят из первой полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 392; второй полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 401; и третьей полипептидной цепи, содержащей последовательность аминокислот, представленную в SEQ ID NO: 406.
[00202] Согласно одному варианту реализации настоящего изобретения предложенные связывающие белки связывают CD20 и CD22, и получены из связывающих белков, описанных в настоящем документе, путем консервативной замены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 или более (включая все промежуточные значения) аминокислот, с сохранением активности, эквивалентной активности соответствующих связывающих белков без указанной замены или замен.
[00203] Согласно одному варианту реализации настоящего изобретения связывающие белки способны к связыванию PD-L1 и TIM3. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к PD-L1, находится в верхнем домене, а полипептид, происходящий из антитела к TIM3, находится в нижнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-СН1; и третий полипептид VHB-CL, при этом антиген А представляет собой PD-L1, а антиген В представляет собой TIM3. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой PD-L1, а антиген А представляет собой TIM3. Согласно некоторым вариантам реализации полипептид, происходящий из антитела к PD-L1, находится в нижнем домене, а полипептид, происходящий из антитела к TIM3, находится в верхнем домене. Например, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VLA-CL-VHB-CH1-Fc; второй полипептид VHA-CH1; и третий полипептид VHB-CL, при этом антиген А представляет собой TIM3, а антиген В представляет собой PD-L1. В другом примере, согласно некоторым вариантам реализации указанные связывающие белки содержат первый полипептид VHB-CH1-VLA-CL-Fc; второй полипептид VHB-CL; и третий полипептид VHA-CH1, при этом антиген В представляет собой TIM3, а антиген А представляет собой PD-L1.
[00204] Согласно одному варианту реализации указанный связывающий белок способен к связыванию одного или более эпитопов на одном или более белках иммунной контрольной точки на Т-клетках, таких как, например, TIM-3, Lag3, индуцируемый Т-клеточный костимулятор (ICOS), BTLA, CD160, 2В4, KIR, CD137, CD27, OX40, CD40L и A2aR. Согласно другому варианту реализации указанный связывающий белок способен к связыванию одного или более эпитопов на одном или более белках поверхности опухолевой клетки, вовлеченных в пути иммунных контрольных точек, таких как, например, PD-L1, PD-L2, галектин-9, HVEM, CD48, В7-1, В7-2, лиганд индуцируемого Т-клеточного костимулятора ICOSL, B7-H3, В7-Н4, CD137L, OX40L, CD70 и CD40.
[00205] Согласно одному аспекту настоящего изобретения предложены фармацевтические композиции, содержащие связывающие белки, описанные в настоящем документе. Согласно одному варианту реализации настоящего изобретения предложены фармацевтические композиции, содержащие связывающий белок по любому из предшествующих пунктов и один или более фармацевтически приемлемый носитель.
[00206] Согласно другому аспекту настоящего изобретения предложены способы лечения или предотвращения воспалительного заболевания, аутоиммунного заболевания, нейродегенеративного заболевания, рака, сепсиса или повреждения спинного мозга у нуждающегося в этом субъекта. Согласно одному варианту реализации указанный способ включает введение субъекту эффективного количества одного или более из связывающих белков согласно настоящему изобретению, или одной или более фармацевтических композиций, содержащих связывающие белки согласно настоящему изобретению и фармацевтически приемлемый носитель. Также согласно настоящему изобретению предложены варианты применения связывающих белков, описанных в настоящем документе, при получении медикамента для лечения или предотвращения воспалительного заболевания, аутоиммунного заболевания, нейродегенеративного заболевания, рака, повреждения спинного мозга или других состояний. Согласно одному варианту реализации указанные воспалительное заболевание, аутоиммунное заболевание, рак, нейродегенеративное заболевание и другие состояния включают, не ограничиваясь перечисленными, астму, ревматоидный артрит, системную красную волчанку, рассеянный склероз, болезнь Альцгеймера, болезнь Паркинсона, инфекционные заболевания и расстройства, такие как псориаз, псориатический артрит, дерматит, системный склероз, воспалительное заболевание кишечника (ВЗК), болезнь Крона, язвенный колит, респираторный дистресс-синдром, менингит, энцефалит, увеит, гломерулонефрит, экзему, астму, атеросклероз, недостаточность адгезии лейкоцитов, синдром Рейно, синдром Шегрена, ювенильный диабет, болезнь Рейтера, болезнь Бехчета, нефрит с иммунными комплексами, IgA-нефропатию, IgM-полинейропатии, иммуноопосредованные тромбоцитопении, такие как острая идиопатическая тромбоцитопеническая пурпура и хроническая идиопатическая тромбоцитопеническая пурпура, гемолитическую анемию, тяжелую миастению, волчаночный нефрит, атопический дерматит, пузырчатку, болезнь Грейвса, тяжелый острый респираторный дистресс-синдром, хореоретинит, тиреоидит Хашимото, гранулематоз Вегенера, синдром Оменна, хроническую почечную недостаточность, острый инфекционный мононуклеоз, ВИЧ, ассоциированные с вирусами герпеса заболевания, диабет 1 типа, болезнь «трансплантат против хозяина» (БТПХ); иммунные расстройства, ассоциированные с отторжением трансплантатов; Т-клеточную лимфому, Т-клеточный острый лимфобластный лейкоз, тестикулярную ангиоцентрическую Т-клеточную лимфому, доброкачественный лимфоцитарный ангиит, первичную микседему, пернициозную анемию, аутоиммунный атрофический гастрит, болезнь Аддисона, инсулинзависимый сахарный диабет, синдром Гудпасчера, симпатическую офтальмию, идиопатическую тромбоцитопению, первичный билиарный цирроз, хронический активный гепатит, язвенный колит, синдром Шегрена, ревматоидный артрит, полимиозит, склеродермию, смешанное заболевание соединительной ткани, обыкновенную пузырчатку, пемфигоид, анкилозирующий спондилит, апластическую анемию, аутоиммунный гепатит, целиакию, дерматомиозит, синдром Гудпасчера, синдром Гийена-Барре, идиопатическую лейкопению, идиопатическую тромбоцитопеническую пурпуру, мужское бесплодие, факогенный увеит, первичную микседему, синдром Рейтера, синдром скованного человека, тиреотоксикоз, язвенный колит, рак молочной железы, рак яичников, рак легкого, рак ободочной и прямой кишки, рак анального канала, рак предстательной железы, рак почки, рак мочевого пузыря, рак головы и шеи, рак поджелудочной железы, рак кожи, рак полости рта, рак пищевода, рак влагалища, рак шейки матки, рак селезенки, рак яичка, рак вилочковой железы, плоскоклеточная карцинома, мелкоклеточный рак легкого, немелкоклеточный рак легкого, бластому, саркому, аденокарциному легкого, плоскоклеточную карциному легкого, карциному брюшины, кожный рак, кожную или интраокулярную меланому, рак прямой кишки, перианальный рак, рак пищевода, рак тонкого кишечника, рак эндокринных желез, рак паращитовидной железы, рак надпочечной железы, саркому мягких тканей, рак уретры, рак мужских/женских половых органов, рак нервов, хронический или острый лейкоз, лимфоцитарную лимфому, гепатому, рак желудка, глиобластому, рак яичников, рак печени, опухоль печени, рак толстой кишки, рак толстого кишечника, рак эндометрия, рак матки, рак слюнной железы, рак почек, рак вульвы, рак щитовидной железы, гестационный диабет, хронические тромбоэмболические заболевания или расстройства, ассоциированные с образованием фибрина, в том числе сосудистые расстройства, такие как тромбоз глубоких вен, артериальный тромбоз, инсульт, метастазирование опухоли, тромболизис, артериосклероз и рестеноз после ангиопластики, септический шок, септицемию, гипотензию, респираторный дистресс-синдром взрослых (ОРДС), диссеминированную внутрисосудистую коагулопатию (ДВК), саркоидоз, артериальный артериосклероз, пептические язвы, ожоги, панкреатит, болезнь поликистозных яичников (СПКЯ), эндометриоз, фиброму матки, доброкачественную гипертрофию предстательной железы, Т-клеточный острый лимфобластный лейкоз (Т-ОЛЛ), церебральную аутосомно-доминантную артериопатию с подкорковыми инфарктами и лейкоэнцефалопатией (ЦАДАСИЛ), тетралогию Фалло (TOF), синдром Алажиля (AS), макулярную дегенерацию и возрастную макулярную дегенерацию, воспалительный фиброз (например, склеродермию, фиброз легких и цирроз), остеоартрит, остеопороз, астму (в том числе аллергическую астму), аллергии, хроническую обструктивную болезнь легких (ХОБЛ), ювенильный диабет I типа с ранним началом, отторжение трансплантата; и СКВ.
[00207] Согласно одному варианту реализации настоящего изобретения предложены способы лечения или предотвращения ревматоидного артрита, псориаза, остеопороза, инсульта, заболевания печени или рака полости рта у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, описанного в настоящем документе, причем указанный связывающий белок способен к связыванию ИЛ-17 и ИЛ-20. Согласно дополнительному варианту реализации указанный связывающий белок FIT-Ig содержит последовательность аминокислот, выбранную из последовательностей SEQ ID NO: 15, 25 и 27; и последовательность аминокислот, соответствующую SEQ ID NO: 21; и последовательность аминокислот, соответствующую SEQ ID NO: 23. Согласно другому варианту реализации указанный связывающий белок FIT-Ig содержит последовательность аминокислот, выбранную из последовательностей SEQ ID NO: 15, 25 и 27; и последовательность аминокислот, выбранную из последовательностей SEQ ID NO: 29, 30 и 31.
[00208] Согласно одному варианту реализации настоящего изобретения предложены способы лечения или предотвращения В-клеточного рака у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, причем указанный связывающий белок FIT-Ig способен к связыванию одного или более В-клеточного антигена. Согласно дополнительному варианту реализации указанный связывающий белок FIT-Ig способен к связыванию CD20. Согласно дополнительному варианту реализации указанный связывающий белок FIT-Ig способен к связыванию CD20 и другого антигена. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию CD3 и CD20. Согласно дополнительному варианту реализации указанный рак представляет собой В-клеточный рак. Согласно еще одному дополнительному варианту реализации указанный В-клеточный рак выбран из группы, состоящей из лимфомы Ходжкина, неходжкинской лимфомы [НХЛ], лимфобластного лейкоза/лимфомы предшественников В-клеток, новообразований зрелых В-клеток, В-клеточного хронического лимфоцитарного лейкоза/мелкоклеточной лимфоцитарной лимфомы, В-клеточного пролимфоцитарного лейкоза, лимфоплазмоцитарной лимфомы, мантийноклеточной лимфомы, фолликулярной лимфомы, кожной лимфомы из клеток центра фолликула, В-клеточной лимфомы маргинальной зоны, лейкоза ворсистых клеток, диффузной крупноклеточной В-клеточной лимфомы, лимфомы Беркитта, плазмоцитомы, плазмоклеточной миеломы, посттрансплантационного лимфопролиферативного расстройства, макроглобулинемии Вальденстрема и анапластической крупноклеточной лимфомы. Согласно одному варианту реализации настоящего изобретения предложены способы лечения или предотвращения В-клеточного рака у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, причем указанный связывающий белок FIT-Ig содержит последовательность аминокислот, соответствующую последовательностям SEQ ID NO: 41 или 48; последовательность аминокислот, соответствующую SEQ ID NO: 44; и последовательность аминокислот, соответствующую SEQ ID NO: 46.
[00209] Согласно одному варианту реализации настоящего изобретения предложены способы лечения или предотвращения аутоиммунного заболевания, воспалительного заболевания или инфекции у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, описанного в настоящем документе, причем указанный связывающий белок способен к связыванию ФНО и ИЛ-17. Согласно дополнительному варианту реализации указанный связывающий белок FIT-Ig содержит последовательности, соответствующие последовательностям SEQ ID NO: 87, 89 и 91. Согласно другому варианту реализации настоящего изобретения предложены способы лечения или предотвращения аутоиммунного или воспалительного заболевания, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, причем указанный связывающий белок способен к связыванию ФНО и ИЛ-17, а аутоиммунное или воспалительное заболевание выбрано из группы, состоящей из болезни Крона, псориаза (в том числе бляшечного псориаза), артрита (в том числе ревматоидного артрита, псориатического артрита, остеоартрита или ювенильного идиопатического артрита), рассеянного склероза, анкилозирующего спондилита, спондилоартропатии, системной красной волчанки, увеита, сепсиса, нейродегенеративных заболеваний, нейрональной регенерации, повреждения спинного мозга, первичного и метастатического рака, респираторного расстройства; астмы; аллергической и неаллергической астмы; астмы, обусловленной инфекцией; астмы, обусловленной инфекцией респираторно-синцитиального вируса (РСВ); хронической обструктивной болезни легких (ХОБЛ); состояния, включающего воспаление дыхательных путей; эозинофилии; фиброза и избыточного слизеобразования; кистозного фиброза; фиброза легких; атопического расстройства; атопического дерматита; крапивницы; экземы; аллергического ринита; аллергического энтерогастрита; воспалительного и/или аутоиммунного состояния кожи; воспалительного и/или аутоиммунного состояния органов ЖКТ; воспалительных заболеваний кишечника (ВЗК); язвенного колита; воспалительного и/или аутоиммунного состояния печени; цирроза печени; фиброза печени; и фиброза печени, вызванного вирусом гепатита В и/или С; склеродермии. Согласно другому варианту реализации настоящего изобретения предложены способы лечения или предотвращения рака у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, описанного в настоящем документе, причем указанный связывающий белок способен к связыванию ФНО и ИЛ-17. Согласно дополнительному варианту реализации указанный рак представляет собой гепатоцеллюлярную карциному; глиобластому; лимфому; или лимфому Ходжкина. Согласно другому варианту реализации настоящего изобретения предложены способы лечения или предотвращения инфекции у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, описанного в настоящем документе, при этом указанная инфекция представляет собой вирусную инфекцию, бактериальную инфекцию, паразитарную инфекцию, инфекцию HTLV-1 (вируса Т-клеточного лейкоза человека 1). Согласно одному варианту реализации настоящего изобретения предложены способы подавления экспрессии защитных иммунных ответов 1 типа, и подавления экспрессии защитного иммунного ответа 1 типа при вакцинации.
[00210] Согласно одному варианту реализации настоящего изобретения предложены способы лечения ревматоидного артрита у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, причем указанный связывающий белок содержит последовательности, соответствующие последовательностям SEQ ID NO: 87, 89 и 91.
[00211] Согласно одному варианту реализации настоящего изобретения предложены способы лечения или предотвращения рака у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, описанного в настоящем документе, причем указанный связывающий белок способен к связыванию CTLA-4 и PD-1. Согласно дополнительному варианту реализации указанный связывающий белок FIT-Ig содержит последовательность аминокислот, содержащую последовательности SEQ ID NO: 92, 95 и 97. Согласно другому варианту реализации настоящего изобретения предложены способы лечения или предотвращения рака у нуждающегося в этом субъекта, отличающиеся тем, что указанный связывающий белок способен к связыванию CTLA-4 и PD-1, и тем, что указанный рак представляет собой рак, как правило, реагирующий на иммунотерапию. Согласно другому варианту реализации указанный рак представляет собой рак, который не был ассоциирован с иммунотерапией. Согласно другому варианту реализации указанный рак представляет собой рак, который представляет собой рефракторное или рецидивирующее злокачественное новообразование. Согласно другому варианту реализации указанный связывающий белок ингибирует рост или выживание опухолевых клеток. Согласно другому варианту реализации указанный рак выбран из группы, состоящей из меланомы (например, метастатической злокачественной меланомы), рака почек (например, светлоклеточной карциномы), рака предстательной железы (например, гормонально-рефрактерной аденокарциномы предстательной железы), аденокарциномы поджелудочной железы, рака молочной железы, рака толстой кишки, рака легкого (например, немелкоклеточного рака легкого), рака пищевода, плоскоклеточной карциномы головы и шеи, рака печени, рака яичников, рака шейки матки, рака щитовидной железы, глиобластомы, глиомы, лейкоза, лимфомы и других злокачественных новообразований.
[00212] Согласно одному варианту реализации настоящего изобретения предложены способы лечения или предотвращения меланомы у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, описанного в настоящем документе, причем указанный связывающий белок способен к связыванию CTLA-4 и PD-1. Согласно дополнительному варианту реализации настоящего изобретения предложены способы лечения или предотвращения меланомы у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, содержащего последовательности аминокислот, соответствующие последовательностям SEQ ID NO: 92, 95 и 97.
[00213] Согласно другому варианту реализации настоящего изобретения предложены способы лечения или предотвращения инфекции или инфекционного заболевания у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту связывающего белка FIT-Ig, описанного в настоящем документе, причем указанный связывающий белок способен к связыванию CTLA-4 и PD-1. Согласно одному варианту реализации указанный связывающий белок FIT-Ig вводят по отдельности, или в комбинации с вакцинами, чтобы стимулировать иммунный ответ на патогены, токсины и аутоантигены. Соответственно, согласно одному варианту реализации настоящего изобретения предложенные связывающие белки могут применяться для стимуляции иммунного ответа на вирусы, инфекционные для человека, такие как, не ограничиваясь перечисленными, вирусы иммунодефицита человека, вирусы гепатита класса А, В и С, вирус Эпштейна-Барр, цитомегаловирус человека, папилломавирусы человека, вирусы герпеса, бактерии, паразитические грибы или другие патогены.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00214] На фиг. 1А показана структура FIT-Ig, состоящих из трех конструкций, таких как FIT1-Ig, FIT2-Ig и FIT3-Ig. На фиг. 1В показаны три конструкции, использованные для получения таких FIT1-Ig.
[00215] На фиг. 2А показана основная структура FIT-Ig, состоящих из двух конструкций. На фиг. 2В показаны две конструкции, использованные для получения таких FIT-Ig.
[00216] На фиг. 3 представлено связывание антигена с двойной специфичностью FIT1-Ig по оценке с применением Biacore. На верхней панели фиг. 3 приведены результаты анализа связывания Biacore, в котором FIT1-Ig сначала насыщали ИЛ-17, а затем ИЛ-20. На нижней панели фиг. 3 приведены результаты анализа Biacore, в котором FIT1-Ig сначала насыщали ИЛ-20, а затем ИЛ-17.
[00217] На фиг. 4. показана растворимость в диапазоне значений рН FIT Ig против ИЛ-17/ИЛ-20 или моноклонального антитела ритуксимаба, по оценке с применением ПЭГ-индуцированного осаждения.
[00218] На фиг. 5 показано связывание с CTLA-4 (фиг. 5А) или PD-1 (фиг. 5 В) FIT10-Ig или исходных антител ипилимумаба и ниволумаба, на основании результатов ИФА ELISA.
[00219] На фиг. 6 представлено исследование множественного связывания FIT10-Ig как с CTLA-4, так и с PD-1. Как связывание CTLA-4 с последующим связыванием PD-1; так и связывание PD-1 с последующим связыванием CTLA-4 обозначено соответствующим образом на фиг. 6.
[00220] На фиг. 7a-7i представлены ЭХ-профили для FIT 12a-Ig (рЭФР/PD-L1; фиг. 7a), FIT13a-Ig (cMet/рЭФР; фиг. 7b), FIT14-Ig (фактор IXa/фактор X; фиг. 7с), FIT16a-Ig (Her3/рИФР-1; фиг. 7d), FIT17a-Ig (DLL-4/ФРЭС; фиг. 7е), FIT18a-Ig (CD20/CD3; фиг. 7f), FIT19a-Ig (Her3/рЭФР; фиг. 7g), FIT20a-Ig (PD-1/PD-L1; фиг. 7h), и FIT22a-Ig (Her3/PD-1; фиг. 7i).
[00221] На фиг. 8 представлено исследование множественного связывания FIT13a-Ig как cMet, так и с рЭФР.
[00222] На фиг. 9А и фиг. 9В показано связывание NBSR или исходного антитела ниволумаба с PD-1 (фиг. 9А) или CTLA-4 (фиг. 9В), на основании результатов ИФА ELISA. В качестве контроля включали IgG1 человека.
[00223] На фиг. 10 представлено исследование множественного связывания NBS3 как с CTLA-4, так и с PD-1. Связывание с CTLA-4 с последующим связыванием PD-1; и связывание PD-1 с последующим связыванием CTLA-4 обозначены соответствующим образом.
[00224] На фиг. 11А представлены профили зависимости средней концентрации в сыворотке от времени для 5 мг/кг NBS3 при внутривенном (в/в) или подкожном (п/к) введении. На фиг. 11В подробно представлены показатели ФК в указанном исследовании.
[00225] На фиг. 12 представлен клеточный анализ блокирования рецепторов NBS3, NBS3-C, NBS3R-C в сравнении с исходным антителом ниволумабом. IgG4 человека включали в качестве контроля.
[00226] На фиг. 13А показана функциональная активность NBS3, NBS3-C, и NBS3R-C в РСЛ-анализах (методом реакции смешанных лимфоцитов), в сравнении с исходным антителом ниволумабом в концентрации 0, 0,01, 0,1, 1 или 10 мкг/мл. Индукцию ИФН-γ измеряли для каждого антитела. IgG человека включали в качестве контроля. На фиг. 13В показана индукция ИЛ-2 указанными антителами.
[00227] На фиг. 14 показана функциональная активность NBS3, NBS3-C и NBS3R-С в анализах с SEB-стимуляцией МКПК в сравнении с исходным антителом ипилимумабом в концентрации 0,016, 0,08, 0,4, 2 или 10 мкг/мл. Продуцирование цитокина ИЛ-2 в супернатанте детектировали с помощью ИФА ELISA.
[00228] На фиг. 15 представлено исследование множественного связывания FIT012b как с рЭФР, так и с PD-L1. Связывание с рЭФР человека с последующим связыванием PD-L1 человека; а также связывание PD-L1 человека с последующим связыванием рЭФР человека обозначены соответствующим образом.
[00229] На фиг. 16А и фиг. 16В представлено исследование множественного связывания FIT012d как с рЭФР человека, так и с PD-L1 человека. Связывание с рЭФР человека с последующим связыванием PD-L1 человека (фиг. 16А); а также связывание PD-L1 человека с последующим связыванием рЭФР человека (фиг. 16В) обозначены соответствующим образом.
[00230] На фиг. 17 представлено исследование множественного связывания FIT013a как с cMet, так и с рЭФР. Связывание cMet с последующим связыванием рЭФР; а также связывание рЭФР с последующим связыванием cMet обозначены соответствующим образом.
[00231] На фиг. 18А-18С представлены анализы FACS, в которых тестировали связывающую активность FIT013a в отношении мембранных c-Met и рЭФР. На фиг. 18А (правая панель) показано двойное связывание с клеткой MKN-45, определенное с применением проточного цитометра BD FACSVerse. На фиг. 18А (левая панель) показано, что в клетках MKN-45 уровень мембранной экспрессии c-Met значительно выше, чем рЭФР, так что сайт связывания c-Met в FIT013a и FIT013a-Fab может быть занят мембранным c-Met, а свободный сайт связывания рЭФР в FIT013a и FIT013a-Fab может быть детектирован с помощью биотинилированного рЭФР. На фиг. 18В (правая панель) показано двойное связывание с клеткой SGC-7901, определенное с применением проточного цитометра BD FACSVerse. На фиг. 18В (левая панель) показано, что в клетках SGC-7901 уровень мембранной экспрессии рЭФР значительно выше, чем c-Met, так что рЭФР сайт связывания в FIT013a и FIT013a-Fab может быть занят мембранным рЭФР, и свободный сайт связывания c-Met в FIT013a и FIT013a-Fab может быть детектирован с помощью биотинилированного c-Met. На фиг. 18С (правая панель) показано двойное связывание с клеткой NCI-H1975, определенное с применением проточного цитометра BD FACSVerse. На фиг. 18С (левая панель) показано, что в клетке NCI-H1975 уровень мембранной экспрессии c-Met равен уровню для рЭФР, так что сайты связывания c-Met и рЭФР в FIT013a и FIT013a-Fab заняты одновременно, и свободный сайт связывания рЭФР или c-Met в FIT013a и FIT013a-Fab не может быть детектирован.
[00232] На фиг. 19 представлена способность FIT013a к ингибированию индуцированного фактором роста гепатоцитов (ФРГ, или HGF) фосфорилирования AKT в клетках NCI-H292. FIT013a, h1332, панитумумаб, комбинацию h1332/панитумумаба, и IgG1 человека добавляли к клеткам и инкубировали в течение 30 минут, после чего добавляли 40 нг/мл ФРГ в аналитический планшет в течение 5 минут. Клетки лизировали и фосфорилирование АКТ детектировали с помощью набора для анализа на фосфорилированную по T202/Y204 ERK.
[00233] На фиг. 20 показан агонистический эффект FIT013a в отсутствие ФРГ по оценке с применением фосфорилирования АКТ. Серийные разведения FIT013a или других антител (h1332, комбинация h1332/панитумумаба, эмибетузумаб, 9.1.2 и IgG1 человека) добавляли к клеткам и инкубировали в течение 30 минут. Клетки лизировали и фосфорилирование AKT детектировали с помощью набора для анализа на фосфорилированную по T202/Y204 ERK.
[00234] На фиг. 21А приведены индивидуальные профили зависимости концентрации в сыворотке от времени для FIT013a (c-met/рЭФР) после введения в/в дозы 5 мг/кг самцам крыс Спрег-Доули (SD) (N=4/точка времени, планшет с c-met). На фиг. 21 В приведены индивидуальные профили зависимости концентрации в сыворотке от времени для FIT013a (c-met/рЭФР) после введения п/к дозы 5 мг/кг самцам крыс Спрег-Доули (N=4/точка времени, планшет с c-met). На фиг. 21С приведены индивидуальные профили зависимости концентрации в сыворотке от времени для FIT013a (c-Met/рЭФР) после введения в/в дозы 5 мг/кг самцам крыс Спрег-Доули (N=4/точка времени, планшет с рЭФР). На фиг. 21D приведены индивидуальные профили зависимости концентрации в сыворотке от времени для FIT013a (c-met/рЭФР) после введения п/к дозы 5 мг/кг самцам крыс Спрег-Доули (N=4/точка времени, планшет для рЭФР).
[00235] На фиг. 22 показано распределение FIT013a, панитумумаба и H1332 в сыворотке и в опухолях мышей nude BALB/c (N=3 животных/группу), которым инокулировали опухолевые клетки NCI-H1975-HGF.
[00236] На фиг. 23 представлена эффективность FIT013a, панитумумаба, Н1332, основы для ингибирования размеров опухолей у мышей nude BALB/c (N=8 животных/группу), которым инокулировали опухолевые клетки NCI-H1975-HGF. Указанные антитела вводили два раза в неделю в/б на протяжении трех недель. Дозировка FIT013a составляла 16 мг/кг, Н1332 или панитумумаба-10 мг/кг.
[00237] На фиг. 24 представлен ферментный анализ на фактор VIIIa-подобную активность с применением набора BIOPHEN FVIII:C (Hyphen-Biomed). Анализировали образцы, содержащие mAb FIX, mAb FX, комбинацию mAb FIX и mAb FX, эмицизумаб, FIT014a и очищенный FVIIIa.
[00238] На фиг. 25 представлено исследование множественного связывания FIT014a как с FIX, так и с FX. Связывание с FIX с последующим связыванием с FX; a также связывание FX с последующим FIX обозначены соответствующим образом.
[00239] На фиг. 26 приведены профили зависимости средней концентрации в сыворотке от времени для 5 мг/кг FIT014a, при внутривенном (в/в) или подкожном (п/к) введении на планшете с hIgG или с фактором X. Концентрации антитела в образцах сыворотки крыс детектировали с применением ИФА ELISA при НПКО 62,5 нг/мл. На планшете с hIgG в качестве белка для покрытия использовали антитело против Fc hIgG, а в качестве антитела для детекции использовали антитело против Fab hIgG. На планшете с фактором Х в качестве белка для покрытия использовали фактор X, а в качестве антитела для детекции использовали антитело против Fc IgG человека.
[00240] На фиг. 27 представлено исследование множественного связывания FIT016a как с Her3, так и с рИФР-1. Связывание с Her3 с последующим связыванием срИФР-1; а также связывание рИФР-1 с последующим связыванием Her3 обозначены соответствующим образом.
[00241] На фиг. 28 представлено исследование множественного связывания FIT017a как с DLL4, так и с ФРЭС. Связывание с DLL4 с последующим связыванием ФРЭС; а также связывание ФРЭС с последующим связыванием DLL4 обозначены соответствующим образом.
[00242] На фиг. 29А и фиг. 29В представлены клеточные FACS-анализы на способность к связыванию FIT018a с CD20 и CD3 на В-клетках человека и Т-клетках человека, со сравнением с родственными исходными антителами (mAb к CD3, офатумумабом; и комбинацией mAb к CD3 и офатумумаба) и IgG1 человека. В анализе, представленном на фиг. 29А, использовали линию В-клеток человека Raji. В анализе, представленном на фиг. 29В, использовали линию Т-клеток человека Jurkat.
[00243] На фиг. 30А представлены клеточные FACS-анализы на способность к связыванию с CD20-клетками яванского макака FIT018a, в сравнении с офатумумабом (CD20) и IgG1 человека против RAC. На фиг. 30В представлены клеточные FACS-анализы на способность к связыванию с Т-клетками яванского макака связывания для FIT018a, в сравнении с офатумумабом (CD20), mAb к CD3.
[00244] На фиг. 31А и фиг. 31В представлена способность FIT018a, офатумумаба, mAb к CD3; и комбинации офатумумаба и mAb к CD3 (1:1) к индукции апоптоза В-клеток человека (Raji) на 2 день (фиг. 31А) и 3 день (фиг. 31В), измеренная в анализах на истощение по В-клеткам.
[00245] На фиг. 32 представлено исследование множественного связывания FIT019a как с Her3, так и с рЭФР. Связывание с Her3 с последующим связыванием рЭФР, а также связывание рЭФР с последующим связыванием Her3 обозначены соответствующим образом.
[00246] На фиг. 33А и фиг. 33В представлено исследование множественного связывания FIT019b как с Her3, так и с рецептором эпидермального фактора роста человека, чрЭФР. Связывание рЭФР с последующим связыванием Her3 (фиг. 33А); а также связывание Her3 с последующим связыванием рЭФР (фиг. 33В) обозначены соответствующим образом.
[00247] На фиг. 34А показана функциональная активность FIT020b в РСЛ-анализах, в сравнении с исходным антителом ниволумабом, 1В12 и комбинацией ниволумаба и 1В12 (1:1) в концентрации 0, 0,01, 0,1, 1, 10 или 100 нМ, по оценке на основании уровня индуцированного ИЛ-2. На фиг. 34В показана индукция ИЛ-2 в концентрации 0, 0,01, 0,03, 0,1, 0,3, 1,3, 10, 30 и 100 нМ указанными антителами.
[00248] На фиг. 35 представлено исследование множественного связывания FIT020b как с PD-L1, так и с PD-1. Связывание с PD-L1 с последующим связыванием PD-1; а также связывание PD-1 с последующим связыванием PD-L1 обозначены соответствующим образом.
[00249]
[00250] На фиг. 36А и фиг. 36В представлены клеточные FACS-анализы связывания FIT021b со сравнением с родственными исходными антителами (офатумумабом, эпратузумабом, и комбинацией офатумумаба и эпратузумаба (1:1)), а также IgG1 человека ввиду его способности связываться с В-клетками человека. В анализе, представленном на фиг. 36А, использовали линию В-клеток человека Raji. В анализе, представленном на фиг. 36В, использовали линию В-клеток человека Daudi.
[00251] На фиг. 37 представлено исследование множественного связывания FIT022a как с Her3, так и с PD-1 человека. Связывание Her3 с последующим связыванием PD-1 человека; а также связывание PD-1 человека с последующим связыванием Her3 обозначены соответствующим образом.
[00252] На фиг. 38А показана функциональная активность FIT022a в РСЛ-анализах, в сравнении с исходным антителом ниволумабом и патритумабом в концентрации 0, 0,01, 0,1, 1 или 10 мкг/мл. Индукцию ИЛ-2 измеряли для каждого антитела. IgG1 человека и IgG4 человека включали в качестве контроля. На фиг. 38 В показана индукция ИФН-γ указанными антителами.
[00253] На фиг. 39А и фиг. 39В представлено исследование множественного связывания FIT023a как с cMet-his, так и с PD-L1-his. Связывание с cMet-his с последующим связыванием PD-L1-his (фиг. 39А); а также связывание PD-L1-his с последующим cMet-his (фиг. 39В) обозначены соответствующим образом.
[00254] На фиг. 40А и фиг. 40В представлено исследование множественного связывания FIT024a как с BTLA-his, так и с PD1-his. Связывание с BTLA-his с последующим связыванием PD1-his (фиг. 40А); а также связывание PD1-his с последующим связыванием BTLA-his (фиг. 40 В) обозначены соответствующим образом.
[00255] На фиг. 41А и фиг. 41В представлено исследование множественного связывания FIT024b как с BTLA-his, так и с PD1-his. Связывание с BT:A-his с последующим связыванием PD1-his (фиг. 41А); а также связывание PD1-his с последующим связыванием BTLA-his (фиг. 41В) обозначены соответствующим образом.
[00256] На фиг. 42А показана функциональная активность FIT024a и FIT024b в РСЛ-анализах, в сравнении с исходным антителом ниволумабом, в концентрации 0,0,01, 0,03, 0,1, 0,3, 1,3, 10, 30 или 100 нМ, по оценке на основании уровня индуцированного ИЛ-2. IgG1 человека включали в качестве контроля. На фиг. 42В показана индукция ИЛ-2 указанными антителами в концентрации 0, 0,01, 0,1, 1, 10 или 100.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00257] Настоящее изобретение относится к мультивалентным и мультиспецифическим связывающим белкам, способам получения указанных связывающих белков и их применения для предотвращения и/или лечения острых и хронических воспалительных заболеваний и расстройств, рака и других заболеваний. Настоящее изобретение относится к мультивалентным и/или мультиспецифическим связывающим белкам, способным к связыванию двух или более антигенов. В частности, настоящее изобретение относится к иммуноглобулинам с тандемными fab-фрагментами (FIT-Ig) и содержащим их фармацевтическим композициям, а также нуклеиновым кислотам, рекомбинантным экспрессионным векторам и клеткам-хозяевам для получения таких FIT-Ig. Способы применения FIT-Ig согласно настоящему изобретению для детекции специфических антигенов, как in vitro, так и in vivo, также охвачены настоящим изобретением.
[00258] Согласно настоящему изобретению предложено новое семейство связывающих белков, способных к связыванию двух или более антигенов, например, с высокой аффинностью. В частности, согласно настоящему изобретению предложен способ конструирования биспецифического связывающего белка с использованием 2 исходных моноклональных антител: mAb А, которое связывается с антигеном а; и mAb В, которое связывается с антигеном b.
[00259] Согласно одному аспекту настоящего изобретения предложен связывающий белок, содержащий вариабельную легкую цепь, специфическую в отношении первого антигена или эпитопа, первый константный домен легкой цепи, вариабельную тяжелую цепь, специфическую в отношении второго антигена или эпитопа, первый домен СН1 тяжелой цепи, вариабельную тяжелую цепь, специфическую в отношении указанного первого антигена или эпитопа, второй домен СН1 тяжелой цепи, вариабельную тяжелую цепь, специфическую в отношении указанного второго антигена или эпитопа, и второй константный домен легкой цепи. Согласно одному варианту реализации указанный связывающий белок дополнительно содержит Fc-область. Указанный связывающий белок может дополнительно содержать один или более аминокислотных или полипептидных линкеров, соединяющих два или более из компонентов связывающего белка. Например, указанный связывающий белок может содержать полипептидный линкер, соединяющий вариабельную область легкой цепи с константной областью легкой цепи.
[00260] Согласно одному варианту реализации настоящего изобретения предложен связывающий белок, содержащий полипептидную цепь, содержащую VLA-CL-(X1)n-VHB-CH1-(X2)n, где VLA представляет собой вариабельный домен легкой цепи mAb A, CL представляет собой константный домен легкой цепи, X1 обозначает аминокислотный или олигопептидный линкер, VHB представляет собой вариабельный домен тяжелой цепи mAb В, СН1 представляет собой первый константный домен тяжелой цепи, Х2 обозначает Fc-область или другой домен димеризации, и n=0 или 1.
[00261] Согласно одному варианту реализации настоящего изобретения предложен связывающий белок, содержащий три разных полипептидных цепи (фиг. 1), отличающийся тем, что первая полипептидная цепь (конструкция №1) содержит VLA-CL-(X1)n-VHB-CH1-(X2)n, где VLA представляет собой вариабельный домен легкой цепи mAb A, CL представляет собой константный домен легкой цепи, X1 обозначает аминокислотный или олигопептидный линкер, VHB представляет собой вариабельный домен тяжелой цепи mAb В, СН1 представляет собой первый константный домен тяжелой цепи, Х2 обозначает Fc-область или другой домен димеризации, и n=0 или 1. Вторая полипептидная цепь (конструкция №2) содержит VHA-CH1, где VHA представляет собой вариабельный домен тяжелой цепи mAb A, a СН1 представляет собой первый константный домен тяжелой цепи. Третья полипептидная цепь (конструкция №3) содержит VHB-CL, где VLB представляет собой вариабельный домен легкой цепи mAb В, а CL представляет собой константный домен легкой цепи.
[00262] Согласно другому варианту реализации настоящего изобретения предложен связывающий белок, содержащий три разных полипептидных цепи, с общим молекулярным дизайном, аналогичным предыдущему варианту реализации, за исключением обратного порядка расположения вариабельных доменов. Согласно указанному варианту реализации первая полипептидная цепь содержит VHB-СН1-(X1)n-VLA-CL-(X2)n, где VLA представляет собой вариабельный домен легкой цепи mAb А, CL представляет собой константный домен легкой цепи, X1 обозначает аминокислотный или олигопептидный линкер, VHB представляет собой вариабельный домен тяжелой цепи mAb В, CH1 представляет собой первый константный домен тяжелой цепи, Х2 обозначает Fc-область или другой домен димеризации, и n=0 или 1. Вторая полипептидная цепь содержит VHA-CH1, где VHA представляет собой вариабельный домен тяжелой цепи mAb А, а СН1 представляет собой первый константный домен тяжелой цепи. Третья полипептидная цепь содержит VLB-CL, где VLB представляет собой вариабельный домен легкой цепи mAb В, a CL представляет собой константный домен легкой цепи.
[00263] Согласно другому варианту реализации настоящего изобретения предложен связывающий белок, содержащий две разных полипептидных цепи (фиг. 2), отличающийся тем, что первая полипептидная цепь (конструкция №1) содержит VLA-CL-(Х1)n-VHB-СН1-(Х2)n, где VLA представляет собой вариабельный домен легкой цепи mAb A, CL представляет собой константный домен легкой цепи, X1 обозначает аминокислотный или олигопептидный линкер, VHB представляет собой вариабельный домен тяжелой цепи mAb В, СН1 представляет собой первый константный домен тяжелой цепи, Х2 обозначает Fc-область или другой домен димеризации, и n=0 или 1. Вторая полипептидная цепь (конструкция №4) содержит VHA-CH1-(X3)n-VLB-CL, где VHA представляет собой вариабельный домен тяжелой цепи mAb А, СН1 представляет собой первый константный домен тяжелой цепи, Х3 обозначает аминокислоту или полипептид, не являющийся константным доменом, n=0 или 1, VLB представляет собой вариабельный домен легкой цепи mAb В, a CL представляет собой константный домен легкой цепи.
[00264] Согласно другому варианту реализации настоящего изобретения предложен связывающий белок, содержащий две полипептидных цепи с общим молекулярным дизайном, аналогичным предыдущему варианту реализации, за исключением обратного порядка расположения вариабельных доменов. Согласно указанному варианту реализации первая полипептидная цепь содержит VHB-CH1-(X1)n-VLA-CL-(X2)n, где VLA представляет собой вариабельный домен легкой цепи mAb А, CL представляет собой константный домен легкой цепи, X1 обозначает аминокислотный или олигопептидный линкер, VHB представляет собой вариабельный домен тяжелой цепи mAb В, СН1 представляет собой первый константный домен тяжелой цепи, Х2 обозначает Fc-область или другой домен димеризации, и n=0 или 1. Вторая полипептидная цепь содержит VLB-CL-(X3)n-VHA-CH1, где VHA представляет собой вариабельный домен тяжелой цепи mAb А, СН1 представляет собой первый константный домен тяжелой цепи, Х3 обозначает аминокислотный или олигопептидный линкер, n=0 или 1, VLB представляет собой вариабельный домен легкой цепи mAb В, и CL представляет собой константный домен легкой цепи.
[00265] Согласно одному варианту реализации домены VH и VL в связывающем белке выбраны из группы, состоящей из вариабельных доменов тяжелых/легких цепей мыши, полностью соответствующих антителам человека вариабельных доменов тяжелых/легких цепей, содержащих привитые CDR вариабельных доменов тяжелых/легких цепей, гуманизированных вариабельных доменов тяжелых/легких цепей, и смесей перечисленного. Согласно предпочтительному варианту реализации VHA/VLA и VHB/VLB способны к связыванию одного и того же антигена. Согласно другому варианту реализации VHA/VLA и VHB/VLB способны к связыванию разных антигенов.
[00266] Согласно одному варианту реализации первая полипептидная цепь содержит VLA-CL-VHB-CH1-Fc, и CL и VHB первой полипептидной цепи прямо слиты друг с другом. Согласно другому варианту реализации указанные CL и VHB соединены аминокислотным или олигопептидным линкером. Согласно другому варианту реализации первая полипептидная цепь содержит VHB-CH1-VLA-CL-Fc, и СН1 и VLA прямо слиты друг с другом. Согласно другому варианту реализации указанные СН1 и VLA соединены аминокислотным или олигопептидным линкером. Согласно дополнительному варианту реализации указанный олигопептидный или полипептидный линкер содержит 1 или более аминокислот любой подходящей последовательности, обеспечивающей гибкость. Предпочтительно, указанный линкер выбран из группы, состоящей из G, GS, SG, GGS, GSG, SGG, GGG, GGGS (SEQ ID NO: 489), SGGG (SEQ ID NO: 490), GGGGS (SEQ ID NO: 491), GGGGSGS (SEQ ID NO: 492), GGGGSGGS (SEQ ID NO: 493), GGGGSGGGGS (SEQ ID NO: 494), GGGGSGGGGSGGGGS (SEQ ID NO: 495), AKTTPKLEEGEFSEAR (SEQ ID NO: 496), AKTTPKLEEGEFSEARV (SEQ ID NO: 497), AKTTPKLGG (SEQ ID NO: 498), SAKTTPKLGG (SEQ ID NO: 499), SAKTTP (SEQ ID NO: 500), RADAAP (SEQ ID NO: 501), RADAAPTVS (SEQ ID NO: 502), RADAAAAGGPGS (SEQ ID NO: 503), RADAAAA(G4S)4 (SEQ ID NO: 504), SAKTTPKLEEGEFSEARV (SEQ ID NO: 505), ADAAP (SEQ ID NO: 506), ADAAPTVSIFPP (SEQ ID NO: 507), TVAAP (SEQ ID NO: 508), TVAAPSVFIFPP (SEQ ID NO: 509), QPKAAP (SEQ ID NO: 510), QPKAAPSVTLFPP (SEQ ID NO: 511), AKTTPP (SEQ ID NO: 512), AKTTPPSVTPLAP (SEQ ID NO: 513), AKTTAPSVYPLAP (SEQ ID NO: 514), ASTKGP (SEQ ID NO: 515), ASTKGPSVFPLAP (SEQ ID NO: 516), GENKVEYAPALMALS (SEQ ID NO: 517), GPAKELTPLKEAKVS (SEQ ID NO: 518), GHEAAAVMQVQYPAS (SEQ ID NO: 519), и AKTTAP (SEQ ID NO: 80). Согласно одному варианту реализации последовательность аминокислот линкера может быть выбрана из группы, состоящей из последовательностей SEQ ID NO. 26, 28 и 49-86. Согласно одному варианту реализации указанный линкер представляет собой GSG (SEQ ID NO: 26) или GGGGSGS (SEQ ID NO: 28). Указанные линкеры могут также представлять собой расщепляемые in vivo пептидные линкеры, чувствительные к протеазам (таким как ММП) линкеры, линкеры на основе дисульфидной связи, которые могут быть расщеплены путем восстановления и т.п., согласно ранее приведенному описанию («Fusion Protein Technologies for Biopharmaceuticals: Applications and Challenges», ред. Stefan R. Schmidt), или любые расщепляемые линкеры известные в данной области техники. Такие расщепляемые линкеры могут применяться для высвобождения верхнего Fab in vivo с различными целями, для улучшения проникновения в ткани/клетки и распространения в тканях/клетках, для усиления связывания с мишенями, для снижения потенциальных побочных эффектов, а также для модуляции in vivo функционального и физического времени полужизни 2-х разных областей Fab. Согласно одному варианту реализации указанный связывающий белок содержит Fc-область. В настоящем документе термин «Fc-область» относится к С-концевой области тяжелой цепи IgG. Примером последовательности аминокислот, содержащей Fc-область IgG1 человека, является последовательность SEQ ID NO: 20. Fc-область IgG содержит два константных домена, СН2 и СН3.
[00267] Согласно одному варианту реализации указанная Fc-область представляет собой вариант Fc-области. Согласно одному варианту реализации указанный вариант Fc-области содержит одну или более модификаций аминокислот, таких как замены, делеции или инсерции, относительно исходной Fc-области. Согласно дополнительному варианту реализации модификации аминокислот Fc-области изменяют активность эффекторной функции по сравнению с активностью исходной Fc-области. Например, согласно одному варианту реализации вариант Fc-области может отличаться измененными (т.е. увеличенными или уменьшенными) антитело-зависимой цитотоксичностью (АЗКЦ), комплемент-опосредованной цитотоксичностью (КЗЦ), фагоцитозом, опсонизацией или связыванием с клетками. Согласно другому варианту реализации модификации аминокислот Fc-области могут изменять (т.е. увеличивать или уменьшать) аффинность варианта Fc-области в отношении FcγR по сравнению с исходной Fc-областью. Например, вариант Fc-области может изменять аффинность в отношении FcγRI, FcγRII, FcγRIII.
[00268] Согласно одному предпочтительному варианту реализации настоящего изобретения предложенные связывающие белки способны к связыванию одной или более мишеней. Согласно одному варианту реализации указанная мишень выбрана из группы, состоящей из цитокинов, белков клеточной поверхности, ферментов и рецепторов. Предпочтительно, указанный связывающий белок способен модулировать биологическую функцию одной или более мишеней. Более предпочтительно, указанный связывающий белок способен нейтрализовать одну или более мишеней.
[00269] Согласно одному варианту реализации настоящего изобретения предложенный связывающий белок способен к связыванию цитокинов, выбранных из группы, состоящей из лимфокинов, монокинов и полипептидных гормонов. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию пар цитокинов, выбранных из группы, состоящей из ИЛ-1α и ИЛ-1β; ИЛ-12 и ИЛ-18, ФНО-α и ИЛ-23, ФНО-α и ИЛ-13; ФНО и ИЛ-18; ФНО и ИЛ-12; ФНО и ИЛ-1-бета; ФНО и MIF; ФНО и ИЛ-6, ФНО и рецептора ИЛ-6, ФНО и ИЛ-17; ИЛ-17 и ИЛ-20; ИЛ-17 и ИЛ-23; ФНО и ИЛ-15; ФНО и ФРЭС; рФРЭС и рЭФР; ИЛ-13 и ИЛ-9; ИЛ-13 и ИЛ-4; ИЛ-13 и ИЛ-5; ИЛ-13 и ИЛ-25; ИЛ-13 и TARC; ИЛ-13 и MDC; ИЛ-13 и MIF; ИЛ-13 и ТФР-β; ИЛ-13 и агониста ЛГР; ИЛ-13 и CL25; ИЛ-13 и SPRR2a; ИЛ-13 и SPRR2b; ИЛ-13 и ADAM8; и ФНО-α и PGE4, ИЛ-13 и PED2, ФНО и PEG2.
[00270] Согласно другому варианту реализации связывающий белок согласно настоящему изобретению способен к связыванию пар мишеней, выбранных из группы, состоящей из CD137 и CD20, CD137 и рЭФР, CD137 и Her-2, CD137 и PD-1, CD137 и PDL-1, ФРЭС и PD-L1, Lag-3 и TIM-3, ОХ40 и PD-1, TIM-3 и PD-1, TIM-3 и PDL-1, рЭФР и DLL-4, ФРЭС и рЭФР, ФРГ и ФРЭС, ФРЭС и ФРЭС (один тот же или другой эпитоп), ФРЭС и Ang2, рЭФР и cMet, ТРФ и ФРЭС, ФРЭС и DLL-4, ОХ40 и PD-L1, ICOS и PD-1, ICOS и PD-L1, Lag-3 и PD-1, Lag-3 и PD-L1, Lag-3 и CTLA-4, ICOS и CTLA-4, CD138 и CD20; CD138 и CD40; CD19 и CD20; CD20 и CD3; CD3 и CD33; CD3 и CD133; CD38 & CD138; CD38 и CD20; CD20 и CD22; CD38 и CD40; CD40 и CD20; CD47 и CD20, CD-8 и ИЛ-6; ХСПГ и RGM A; CTLA-4 и BTNO2; CTLA-4 и PD-1; ИФР-1 и ИФР-2; ИФР-1/2 и Erb2B; рИФР-1 и рЭФР; рЭФР и CD13; рИФР-1 и ErbB3; рЭФР-2 и рИФР; Her2 и Her2 (один и тот же или другой эпитоп); фактор IXa и фактор X, рФРЭС-2 и Met; ФРЭС-А и ангиопоэтина-2 (Ang-2); ИЛ-12 и TWEAK; ИЛ-13 и ИЛ-1-бета; MAG и RGM A; NgR и RGM A; NogoA и RGM A; OMGp и RGM A; PDL-1 и CTLA-4; PD-1 и CTLA-4, PD-1 и TIM-3; RGM А и RGM В; Те38 и ФНО-α; ФНО-α и Blys; ФНО-α и CD-22; ФНО-α и домен CTLA-4; ФНО-α и GP130; ФНО-α и ИЛ-12р40; ФНО-α и лиганда RANK; рЭФР и PD-L1; рЭФР и cMet; Her3 и рИФР-I; DLL-4 и ФРЭС; PD-1 и PD-L1; Her3 и PD-1, Her3 и рЭФР, cMet и PD-L1, и BTLA и PD-1.
[00271] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к CD20, в том числе, но не ограничиваясь перечисленными, офатумумаба, ритуксимаба, йод-131-тозитумомаба, обинутузумаба, ибритутомаба; и антител, описанных в патентах США №9228008, 8206711, №7682612, №8562992, №7799900, №7422739, №7850962, №8097713, №8057793, №8592156, №6652852, №6893625, №6120767, №8084582, №8778339, №9184781, №7381560, №8101179, №9382327, №7151164, №7435803, №8529902, №9416187, №7812116, №8329181, №8034902, №9289479, №9234045, №4987084, №9173961, №9175086, №6410319, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00272] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к CD3, в том числе, но не ограничиваясь перечисленными, муромонаба-CD3, отеликсизумаба, теплизумаба и визилизумаба; и антител, описанных в патентах США №8569450, №7635472,5585097, №6706265, №5834597, №9056906, №9486475, №7728114, №8551478, №9226962, №9192665, №9505849, №8394926, №6306575, №5795727, №8840888, №5627040, №9249217, №8663634, №6491917, №5877299, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00273] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к CTLA-4, в том числе, но не ограничиваясь перечисленными, ипилимумаба и антител, описанных в патентах США №5434131, №5968510, №5844095, №7572772, №6090914, №7311910, №5885796, №5885579, №5770197, №5851795, №5977318, №7161058, №6875904, №7504554, №7034121, №6719972, №7592007, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00274] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к PD-1, в том числе, не ограничиваясь перечисленными, пембролизумаба, ниволумаба, атезолизумаба; и антител, описанных в патентах США №8741295, №7029674, №7722868, №9243052, №8927697, №9181342, №8552154, №9102727, №9220776, №9084776, №8008449, №9387247, №9492540, №8779105, №9358289, №9492539, №9205148, №8900587, №8952136, №8460886, №7414171, №8287856, №8580247, №7488802, №7521051, №8088905, №7709214, №8617546, №9381244, №8993731, №8574872, №7432059, №8216996, №9499603, №9102728, №9212224, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00275] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к PD-L1, в том числе, но не ограничиваясь перечисленными, дурвалумаба, авелумаба; и антител, описанных в патентах США №8741295, №9102725, №8168179, №8952136, №855215, №8617546, №9212224, №8217149, №8383796, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00276] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к рЭФР, в том числе, но не ограничиваясь перечисленными, гефинитиба, эрлотиниба, лапатиниба, цетуксимаба, панитумумаба, вандетаниба, нецитумумаба, осимертиниба; и антител, описанных в патентах США №7723484, №9044460, №9226964, №8658175, №7618631, №8748175, №9499622, №9527913, №9493568, №8580263, №7514240, №9314536, №9051370, №9233171, №9029513, №8592152, №8597652, №9327035, №8628773, №9023356, №9132192, №8637026, №9283276, №9540440, №9545442, №8758756, №9120853, №7981605, №8546107, №7598350, №5212290, №8017321, №7589180, №9260524, №8790649, №9125896, №9238690, №8071093, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00277] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к TIM3 (CD366), в том числе, но не ограничиваясь перечисленными, 4C4G3, 7D3, В8.2С12, F38-2E2; и антител, описанных в патентах США №8841418, №8552156, №9556270, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00278] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к cMet, в том числе, но не ограничиваясь перечисленными, h1332, 71-8000, ab74217; и антител, описанных в патентах США №8673302, №9120852, №7476724, №7892550, №9249221, №9535055, №9487589, №8329173, №9101610, №8101727, №9068011, №9260531, №9296817, №8481689, №8546544, №8563696, №8871909, №8889832, №8871910, №9107907, №8747850, №9469691, №8765128, №8729249, №8741290, №8637027, №8900582, №9192666, №9201074, №9505843, №8821869, №8163280, №7498420, №8562985, №8545839, №9213031, №9213032, №8217148, №8398974, №9394367, №9364556, №8623359, №9011865, №9375425, №9233155, №9169329, №9150655, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00279] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к фактору IXa, в том числе, но не ограничиваясь перечисленными, ab97619, ab128048, ab128038; и антител, описанных в патентах США №7279161, №7033590, №4786726, №6624295, №7049411, №7297336, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00280] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к фактору X, в том числе, но не ограничиваясь перечисленными, РА5-22059, ab97632, В122М.
[00281] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к Her3 (ErbB3), в том числе, но не ограничиваясь перечисленными, дулиготумаба, элгемтумаба, лумретузумаба, патритумаба, серибантумаба; и антител, описанных в патентах США №9346883, №9321839, №8859737, №8362215, №8828388, №9220775, №9217039, №9527913, №9085622, №9192663, №8735551, №9011851, №7846440, №9284380, №8791244, №8691225, №9487588, №8961966, №9034328, №5968511, №9346889, №9217039, №9346890, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00282] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к рИФР-1 (CD221), в том числе, но не ограничиваясь перечисленными, циксутумумаба, далотузумаба, фигитумумаба, ганитумаба, робатумумаба, тепротумумаба; и антител, описанных в патентах США №№7572897, №7579157, №7968093, №7638605, №7329745, №7037498, №7982024, №8642037, №7700742, №9234041, №7815907, №8945871, №8361461, №9056907, №8168410, №7241444, №7914784, №9150644, №7985842, №7538195, №8268617, №8034904, №8344112, №7553485, №8101180, №8105598, №7824681, №8124079, №8420085, №7854930, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00283] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к DLL4, в том числе, но не ограничиваясь перечисленными, демцизумаба, энотикумаба, навициксизумаба; и антител, описанных в патентах США №9469689, №9115195, №8623358, №9132190, №9469688, №9403904, №8663636, №8192738, №750124, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00284] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к ФРЭС, в том числе, но не ограничиваясь перечисленными, бевацизумаба, бролуцизумаба, ранибизумаба; и антител, описанных в патентах США №8921537, 7910098, №7365166, №7060269, №7169901, №6884879, №7297334, №7375193, №9388239, №8834883, №8287873, №7998931, №8007799, №7785803, №9102720, №8486397, №6730489, №6383484, №9441034, №7097986, №9079953, №8945552, №8236312, №7740844, №6403088, №9018357, №8975381, №7691977, №7758859, №8512699, №8492527, №9353177, №8092797, №7811785, №8101177, №8592563, №9090684, №8349322, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00285] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к CD22, в том числе, но не ограничиваясь перечисленными, бектумомаба, эпратузумаба, инотузумаба, моксетумомаба, пинатузумаба; и антител, описанных в патентах США №9181343, №5484892, №9279019, №8591889, №9499632, №8481683, №7355012, №7777019, №8809502, №8389688, №7829086, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00286] Согласно некоторым вариантам реализации указанные связывающие белки содержат вариабельные области или области CDR, происходящие из антител к BTLA (CD272), в том числе, но не ограничиваясь перечисленными, MIH26, ААР44003, МА5-16843, 6А5; и антител, описанных в патентах США №8563694, №9346882, №8580259, №8247537, каждый из которых включен в настоящий документ полностью посредством ссылки.
[00287] Согласно некоторым вариантам реализации указанные связывающие белки содержат антитела согласно описанию в WO 2015103072, который включен в настоящий документ полностью посредством ссылки.
[00288] Согласно одному варианту реализации указанный связывающий белок способен к связыванию ИЛ-17 человека и ИЛ-20 человека. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию ИЛ-17 человека и ИЛ-20 человека, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO. 15 25 и 27; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 21; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 23. Согласно другому варианту реализации указанный связывающий белок способен к связыванию ИЛ-17 человека и ИЛ-20 человека, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO. 15, 25, и 27; и полипептидную цепь №4, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO. 29, 30 и 31.
[00289] Согласно одному варианту реализации указанный связывающий белок способен к связыванию человека CD3 и человека CD20. Согласно дополнительному варианту реализации указанный связывающий белок содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности, выбранной из группы, состоящей из последовательностей SEQ ID NO. 41, 48 и 316; последовательность полипептидной цепи №2, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 44 или SEQ ID NO. 325; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 46 или SEQ ID NO. 330.
[00290] Согласно одному варианту реализации указанный связывающий белок способен к связыванию ИЛ-17 человека и ФНО человека. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию ИЛ-17 человека и ФНО человека, и содержит последовательность полипептидной цепи №1 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 87; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 89; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 91.
[00291] Согласно одному варианту реализации указанный связывающий белок способен к связыванию CTLA-4 человека и PD-1 человека. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию CTLA-4 человека и PD-1 человека, и содержит последовательность полипептидной цепи №1 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 92, SEQ ID NO. 126, SEQ ID NO. 145, SEQ ID NO. 164 или SEQ ID NO. 183; последовательность полипептидной цепи №2, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 95, SEQ ID NO. 135, SEQ ID NO. 154, SEQ ID NO. 173 или SEQ ID NO. 192; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 97, SEQ ID NO. 140, SEQ ID NO. 159, SEQ ID NO. 178 или SEQ ID NO. 197.
[00292] Согласно одному варианту реализации указанный связывающий белок способен к связыванию рЭФР и PD-L1. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию рЭФР и PD-L1, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 99, SEQ ID NO. 202 или SEQ ID NO. 221; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 100, SEQ ID NO. 211 или SEQ ID NO. 230; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 101, SEQ ID NO. 216 или SEQ ID NO. 235.
[00293] Согласно одному варианту реализации указанный связывающий белок способен к связыванию cMet и рЭФР. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию сМЕТ и рЭФР, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 102 или SEQ ID NO. 240; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 103 или SEQ ID NO. 249; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 104 или SEQ ID NO. 254.
[00294] Согласно одному варианту реализации указанный связывающий белок способен к связыванию фактора IXa и фактора X. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию фактора IXa и фактора X, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 105 или SEQ ID NO. 259; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 106 или SEQ ID NO. 268; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 107 или SEQ ID NO. 273.
[00295] Согласно одному варианту реализации указанный связывающий белок способен к связыванию Her3 и рИФР-1. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию Her3 и рИФР-1, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 108, SEQ ID NO. 278; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 109 или SEQ ID NO. 287; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 110 или SEQ ID NO. 292.
[00296] Согласно одному варианту реализации указанный связывающий белок способен к связыванию DLL-4 и ФРЭС. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию DLL-4 и ФРЭС, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 111 или SEQ ID NO. 297; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 112 или SEQ ID NO. 306; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 113 или SEQ ID NO. 311.
[00297] Согласно одному варианту реализации указанный связывающий белок способен к связыванию CD20 и CD3. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию CD20 и CD3, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 114 или SEQ ID NO. 316; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 115 или SEQ ID NO. 325; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 116 или SEQ ID NO. 330.
[00298] Согласно одному варианту реализации указанный связывающий белок способен к связыванию Her3 и рЭФР. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию Her3 и рЭФР, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 117, SEQ ID NO. 335 или SEQ ID NO. 354; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 118, SEQ ID NO. 344 или SEQ ID NO. 363; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 119, SEQ ID NO. 349 или SEQ ID NO. 368.
[00299] Согласно одному варианту реализации указанный связывающий белок способен к связыванию PD-1 и PD-L1. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию PD-1 и PD-L1, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 120 или SEQ ID NO. 373; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 121 или SEQ ID NO. 382; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 122 или SEQ ID NO. 387.
[00300] Согласно одному варианту реализации указанный связывающий белок способен к связыванию Her3 и PD-1. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию Her3 и PD-1, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 123 или SEQ ID NO. 411; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 124 или SEQ ID NO. 420; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 125 или SEQ ID NO. 425.
[00301] Согласно одному варианту реализации указанный связывающий белок способен к связыванию cMet и PD-L1. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию cMet и PD-L1, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 430; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 439; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 444.
[00302] Согласно одному варианту реализации указанный связывающий белок способен к связыванию BTLA и PD-1. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию BTLA и PD-1, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 449 или SEQ ID NO. 468; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 458 или SEQ ID NO. 477; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 463 или SEQ ID NO. 482.
[00303] Согласно одному варианту реализации указанный связывающий белок способен к связыванию CD20 и CD22. Согласно дополнительному варианту реализации указанный связывающий белок способен к связыванию CD20 и CD22, и содержит последовательность полипептидной цепи №1 FIT-Ig, которая приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентична последовательности SEQ ID NO. 392; последовательность полипептидной цепи №2 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 401; и последовательность полипептидной цепи №3 FIT-Ig, приблизительно на 65%, приблизительно на 70%, приблизительно на 75%, приблизительно на 80%, приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% или 100% идентичную последовательности SEQ ID NO. 406.
[00304] Биологически активные варианты или функциональные варианты примеров связывающих белков, описанных в настоящем документе, также входят в объем настоящего изобретения. В настоящем документе выражение «биологически активный вариант» или «функциональный вариант» применительно к белку относится к последовательности аминокислот, где изменены одна или более аминокислот относительно референсной последовательности с сохранением по существу биологической активности указанной референсной последовательности. Указанный вариант может содержать «консервативные» изменения, когда используемая для замены аминокислота обладает аналогичными структурными или химическими свойствами, например, замену лейцина на изолейцин. В таблице ниже приведены примеры консервативных замен аминокислот. Согласно некоторым вариантам реализации указанный вариант содержит одну или более замен аминокислот, отличающихся тем, что одна или более, или все замены представлены заменами на кислотные аминокислоты, такие как аспарагиновая кислота, аспарагин, глутаминовая кислота или глутамин.
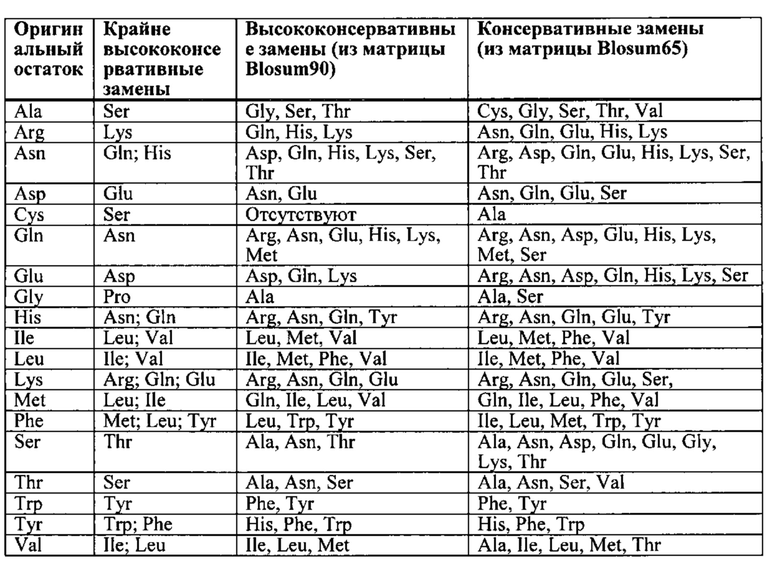
Как вариант, вариант может содержать «неконсервативные» изменения, например, замену глицина на триптофан. Аналогичные незначительные вариации могут также включать делецию или инсерцию аминокислоты, или и то, и другое. Указания для определения остатков аминокислот, которые могут быть заменены, инсертированы или делетированы без элиминации биологической или иммунологической активности можно найти с применением компьютерных программ, хорошо известных в данной области техники, таких как программное обеспечение DNASTAR.
[00305] Связывающие белки, которые способны к связыванию тех же эпитопов на определенной группе мишеней, таких как мишени для примера биспецифического связывающего белка, описанного в настоящем документе, также входят в настоящее изобретение. Указанные эпитопы могут представлять собой линейные эпитопы, конформационные эпитопы или их смесь. Согласно некоторым вариантам реализации те же самые эпитопы могут быть идентифицированы с применением подходящей методики картирования эпитопов, в том числе, но не ограничиваясь перечисленными, рентгеновской ко-кристаллографии, олигопептидного сканирования на чипах, сайт-специфического мутагенеза, картирование с высокопроизводительным мутагенезом, дисплей на поверхности бактериофага и водород-дейтериевого обмена. Дополнительные способы описаны в патентах США №5955264, №65796676, №6984488 и №8802375, каждый из которых полностью и для любых целей включен в настоящий документ посредством ссылки.
[00306] Согласно другому варианту реализации связывающий белок согласно настоящему изобретению способен к связыванию одного или двух цитокинов, связанных с цитокинами белков и рецепторов цитокинов, выбранных из группы, состоящей из ВМР1, ВМР2, ВМР3В (фактор дифференциации роста 10, GDF10), ВМР4, ВМР6, ВМР8, КСФ1 (М-КСФ), КСФ2 (ГМ-КСФ), КСФ-3 (Г-КСФ), эритропоэтин ЕРО, ФРФ-1 (а-ФРФ), ФРФ-2 (b-ФРФ), ФРФ-3 (int-2), ФРФ-4 (HST, ФРФ-5, ФРФ-6 (HST-2), ФРФ-7 (фактор роста кератиноцитов, KGF), ФРФ-9, ФРФ-10, ФРФ-11, ФРФ-12, ФРФ-12В, ФРФ-14, ФРФ-16, ФРФ-17, ФРФ-19, ФРФ-20, ФРФ-21, ФРФ-23, ИФР-1, ИФР-2, ИФН-А1, ИФН-А2, ИФН-А4, ИФН-А5, ИФН-А6, ИФН-А7, ИФН-В1, ИФН-G, ИФН-W1, FIL1, FIL1 (эпсилон), FIL1 (зета), ИЛ-1А, ИЛ-IB, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-11, ИЛ-12А, ИЛ-12В, ИЛ-13, ИЛ-14, ИЛ-15, ИЛ-16, ИЛ-17, ИЛ-17В, ИЛ-18, ИЛ-19, ИЛ-20, ИЛ-22, ИЛ-23, ИЛ-24, ИЛ-25, ИЛ-26, ИЛ-27, ИЛ-28А, ИЛ-28В, ИЛ-29, ИЛ-30, ТРФ-А, FGER1, ФРФ-R2, ФРФ-R3, рЭФР, ROR1, 2В4, KIR, CD137, CD27, OX40, CD40L, A2aR, CD48, B7-1, B7-2, ICOSL, B7-H3, B7-H4, CD137L, OX40L, CD70, CD40, ТРФ-В, ТФР-А, ТФР-В1, ТФР-В2, ТФР-В3, лимфотоксина альфа LTA (ФНО-b), лимфотоксина бета LTB, ФНО (ФНО-a), ФНО-8Б4 (лиганд ОХ40), ФНО-SFS (лиганд CD40), ФНО-SF6 (FasL), ФНО-SF7 (лиганд CD27), ФНО-SF8 (лиганд CD30), ФНО-SF9 (лиганд 4-1ВВ), ФНО-SF10 (TRAIL), ФНО-SF11 (TRANCE), ФНО-SF12 (APO3L), ФНО-SF13 (April), ФНО-SF13B, ФНО-SF14 (HVEM-L), ФНО-SF15S (ингибитор роста эндотелия сосудов VEGI), ФНО-SF18, FIGF (ФРЭС-D), ФРЭС, ФРЭС-В, ФРЭС-С, рецепторов интерлейкинов ИЛ-1R1, ИЛ-1R2, ИЛ-1RL1, ИЛ-1RL2, ИЛ-2RA, ИЛ-2RB, ИЛ-2RG, ИЛ-3RA, ИЛ-4R, ИЛ-5RA, ИЛ-6R, ИЛ-7R, ИЛ-8RA, ИЛ-8RB, ИЛ-9R, ИЛ-10RA, ИЛ-10RB, ИЛ-11RA, ИЛ-12RB1, ИЛ-12RB2, ИЛ-13RA1, ИЛ-13RA2, ИЛ-15RA, ИЛ-17R, ИЛ-18R1, ИЛ-20RA, ИЛ-21R, ИЛ-22R, ИЛ-1HY1, ИЛ-IRAP, ИЛ-1RAPL1, ИЛ-1RAPL2, ИЛ-1RN; ИЛ-6ST, ИЛ-18ВР, ИЛ-18RAP, ИЛ-22RA2, воспалительного фактора аллотрансплантата 1 (AIF1), ФРГ, LEP (лептина), PTN и тромбопоэтина (ТНРО).
[00307] Связывающий белок согласно настоящему изобретению способен к связыванию одного или более хемокинов, рецепторов хемокинов и связанных с хемокинами белков, выбранных из группы, состоящей из CCL1 (I-309), CCL2 (МСР-1/MCAF), CCL3 (MIP-1a), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (МСР-3), CCL8 (mcp-2), CCL11 (эотаксин), CCL13 (МСР-4), CCL15 (MIP-1d), CCL16 (НСС-4), CCL17 (TARC), CCL18 (PARC, легочный регулируемый активацией хемокин)), CCL19 (MIP-3b), CCL20 (MIP-3a), CCL21 (SLC, хемокин вторичной лимфоидной ткани / Exodus-2), CCL22 (MDC / STC-1), CCL23 (MPIF-1), CCL24 (MPIF-2 / эотаксин-2), CCL25 (TECK), CCL26 (эотаксин-3), CCL27 (CTACK / ILC), CCL28, CXCL1 (GRO1), CXCL2 (GRO2), CXCL3 (GRO3), CXCL5 (ENA-78), CXCL6 (GCP-2), CXCL9 (MIG), CXCL10 (IP 10), CXCL11 (I-TAC), CXCL12 (SDF1), CXCL13, CXCL14, CXCL16, PF4 (CXCL4), РРВР (CXCL7), CX3CL1 (SCYD1), SCYE1, XCL1 (лимфотактин), XCL2 (SCM-1b), BLR1 (MDR15), ССВР2 (D6 / JAB61), CCR1 (CKR1 / НМ145), CCR2 (mcp-1RB / RA), CCR3 (CKR3 / CMKBR3), CCR4, CCR5 (CMKBR5 / ChemR13), CCR6 (CMKBR6 / CKR-L3 / STRL22 / DRY6), CCR7 (CKR7 / EBI1), CCR8 (CMKBR8 / TER1 / CKR-L1), CCR9 (GPR-9-6), CCRL1 (VSHK1), CCRL2 (L-CCR), XCR1 (GPR5 / CCXCR1), CMKLR1, хемокиновый орфанный рецептор CMKOR1 (RDC1), CX3CR1 (V28), CXCR4, GPR2 (CCR10), GPR31, GPR81 (FKSG80), CXCR3 (GPR9/CKR-L2), CXCR6 (TYMSTR /STRL33 / Bonzo), HM74, ИЛ-8RA (IL8Ra), ИЛ-8RB (IL8Rb), LTB4R (GPR16), TCP10, представителей суперсемейства хемокиноподобных факторов (CKLFSF) CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, нейротрофического фактора головного мозга (НФГМ), C5R1, КСФ-3, GRCC10 (С10), ЕРО, FY (DARC), GDF5, HIF1A, ИЛ-8, PRL, RGS3, RGS13, SDF2, SLIT2, Toll-подобных рецепторов TLR2 и TLR4, TREM1, TREM2 и VHL.
[00308] Согласно другому варианту реализации связывающий белок согласно настоящему изобретению способен к связыванию белка клеточной поверхности, такого как, например, интегрины. Согласно другому варианту реализации связывающий белок согласно настоящему изобретению способен к связыванию ферментов, выбранных из группы, состоящей из киназ и протеаз. Согласно еще одному варианту реализации связывающий белок согласно настоящему изобретению способен к связыванию рецепторов, выбранных из группы, состоящей из лимфокиновых рецепторов, монокиновых рецепторов и рецепторов полипептидных гормонов.
[00309] Согласно одному варианту реализации указанный связывающий белок является мультивалентным. Согласно другому варианту реализации указанный связывающий белок является мультиспецифическим. Описанные вышеуказанные мультивалентные и/или мультиспецифические связывающие белки обладают желательными свойствами, в частности, с терапевтической точки зрения. Например, указанный мультивалентный и/или мультиспецифический связывающий белок может (1) быть интернализован (и/или катаболизирован) быстрее, чем бивалентное антитело, клеткой, экспрессирующей антиген, с которым связываются указанные антитела; (2) быть агонистическим антителом; и/или (3) индуцировать клеточную смерть и/или апоптоз клетки, экспрессирующей антиген, который указанное мультивалентное антитело способно к связыванию. «Исходное антитело», которое обеспечивает по меньшей мере один вид антиген-связывающей специфичности указанных мультивалентных и/или мультиспецифических связывающих белков, может представлять антитело, которое интернализуется (и/или катаболизируется) клеткой, экспрессирующей антиген, с которым связывается указанное антитело; и/или может представлять собой агонистическое, индуцирующее клеточную смерть и/или индуцирующее апоптоз антитело; а мультивалентный и/или мультиспецифический связывающий белок согласно описанию в настоящем документе может демонстрировать улучшение или улучшения одного или более из указанных свойств. Кроме того, у исходного антитела может отсутствовать любое одно или более из указанных свойств, однако может приобретать их при введении в конструкцию мультивалентного связывающего белка согласно описанию в настоящем документе.
[00310] Согласно другому варианту реализации константа связывания (Kon) связывающего белка согласно настоящему изобретению для одной или более мишеней выбрана из группы, состоящей из: по меньшей мере приблизительно 102 М-1с-1; по меньшей мере приблизительно 103 М-1с-1; по меньшей мере приблизительно 104 М-1с-1; по меньшей мере приблизительно 105 М-1с-1; и по меньшей мере приблизительно 106 М-1с-1 (включая все промежуточные значения), по оценке с применением поверхностного плазмонного резонанса. Предпочтительно, константа связывания (Kon) связывающего белка согласно настоящему изобретению для одной или более мишеней составляет от 102 М-1с-1 до 103 М-1с-1; от 103 М-1с-1 до 104 М-1с-1; от 104 М-1с-1 до 105 М-1с-1; или от 105 М-1с-1 до 106 М-1с-1 (включая все промежуточные значения), по оценке с применением поверхностного плазмонного резонанса.
[00311] Согласно другому варианту реализации константа диссоциации (Koff) связывающего белок для одной или более мишеней выбрана из группы, состоящей из: самое большее приблизительно 10-3с-1; самое большее приблизительно 10-4c-1; самое большее приблизительно 10-5 с-1; и самое большее приблизительно 10-6c-1, по оценке с применением поверхностного плазмонного резонанса (включая все промежуточные значения). Предпочтительно, константа диссоциации (Koff) связывающего белка согласно настоящему изобретению для одной или более мишеней составляет от 10-3с-1 до 10-4c-1; от 10-4с-1 до 10-5c-1; или от 10-5 с-1 до 10-6с-1, по оценке с применением поверхностного плазмонного резонанса (включая все промежуточные значения).
[00312] Согласно другому варианту реализации константа диссоциации (KD) связывающего белка для одной или более мишеней выбрана из группы, состоящей из: самое большее приблизительно 10-7 М; самое большее приблизительно 10-8 М; самое большее приблизительно 10-9 М; самое большее приблизительно 10-10 М; самое большее приблизительно 10-11 М; самое большее приблизительно 10-12 М; и самое большее 10-13 М (включая все промежуточные значения). Предпочтительно, константа диссоциации (KD) связывающего белка согласно настоящему изобретению для ИЛ-12 или ИЛ-23 составляет от 10-7 М до 10-8 М; от 10-8 М до 10-9 М; от 10-9 М до 10-10 М; от 10-10 до 10-11 М; от 10-11 М до 10-12 М; или от 10-12 М до 10-13 М (включая все промежуточные значения).
[00313] Согласно другому варианту реализации % мономеров в связывающем белке согласно настоящему изобретению составляет по меньшей мере приблизительно 75%, приблизительно 76%, приблизительно 77%, приблизительно 78%, приблизительно 79%, приблизительно 80%, приблизительно 80%, приблизительно 82%, приблизительно 83%, приблизительно 84%, приблизительно 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,1%, приблизительно 99,2%, приблизительно 99,3%, приблизительно 99,4%, приблизительно 99,5%, приблизительно 99,6%, приблизительно 99,7%, приблизительно 99,8%, приблизительно 99,9% или более, или 100% (включая все промежуточные значения) при одноэтапном очищении с белком А с применением эксклюзионной хроматографии с ВЭЖХ (ЭХ-ВЭЖХ).
[00314] Согласно другому варианту реализации уровень экспрессии связывающего белка согласно настоящему изобретению составляет по меньшей мере приблизительно 0,01 мг/л, 0,05 мг/л, 0,1 мг/л, приблизительно 0,2 мг/л, приблизительно 0,3 мг/л, приблизительно 0,4 мг/л, приблизительно 0,5 мг/л, приблизительно 0,6 мг/л, приблизительно 0,7 мг/л, приблизительно 0,8 мг/л, приблизительно 0,9 мг/л, приблизительно 1,0 мг/л, приблизительно 2 мг/л, приблизительно 3 мг/л, приблизительно 4 мг/л, приблизительно 5 мг/л, приблизительно 6 мг/л, приблизительно 7 мг/л, приблизительно 8 мг/л, приблизительно 9 мг/л, приблизительно 10 мг/л, приблизительно 11 мг/л, приблизительно 12 мг/л, приблизительно 13 мг/л, приблизительно 14 мг/л, приблизительно 15 мг/л, приблизительно 16 мг/л, приблизительно 17 мг/л, приблизительно 18 мг/л, приблизительно 19 мг/л, приблизительно 20 мг/л, приблизительно 21 мг/л, приблизительно 22 мг/л, приблизительно 23 мг/л, приблизительно 24 мг/л, приблизительно 25 мг/л, приблизительно 26 мг/л, приблизительно 27 мг/л, приблизительно 28 мг/л, приблизительно 29 мг/л, приблизительно 30 мг/л, приблизительно 40 мг/л, приблизительно 50 мг/л, приблизительно 60 мг/л, приблизительно 70 мг/л, приблизительно 80 мг/л, приблизительно 90 мг/л, приблизительно 100 мг/л, приблизительно 200 мг/л, приблизительно 300 мг/л, приблизительно 400 мг/л, приблизительно 500 мг/л, приблизительно 600 мг/л, приблизительно 700 мг/л, приблизительно 800 мг/л, приблизительно 900 мг/л, приблизительно 1000 мг/л (включая все промежуточные значения) или более, в оптимизированных условиях. Согласно некоторым вариантам реализации связывающий белок согласно настоящему изобретению экспрессируется в клетках 293Е или в любых других клетках, подходящих для указанной цели.
[00315] Согласно другому варианту реализации температура перехода Tm1 связывающего белка согласно настоящему изобретению по оценке с применением дифференциальной сканирующей калориметрии (ДСК) составляет по меньшей мере приблизительно 50°С, приблизительно 51°С, приблизительно 52°С, приблизительно 53°С, приблизительно 54°С, приблизительно 55°С, приблизительно 56°С, приблизительно 57°С, приблизительно 58°С, приблизительно 59°С, приблизительно 60°С, приблизительно 61°С, приблизительно 62°С, приблизительно 63°С, приблизительно 64°С, приблизительно 65°С, приблизительно 66°С, приблизительно 67°С, приблизительно 68°С, приблизительно 69°С, приблизительно 70°С, приблизительно 71°С, приблизительно 72°С, приблизительно 73°С, приблизительно 74°С, приблизительно 75°С, приблизительно 76°С, приблизительно 77°С, приблизительно 78°С, приблизительно 79°С, приблизительно 80°С, приблизительно 81°С, приблизительно 82°С, приблизительно 83°С, приблизительно 84°С, приблизительно 85°С, приблизительно 86°С, приблизительно 87°С, приблизительно 88°С, приблизительно 89°С, приблизительно 90°С, приблизительно 95°С, приблизительно 99°С (включая все промежуточные значения) или более.
[00316] Связывающий белок согласно настоящему изобретению демонстрирует высокую стабильность в тесте замораживания-размораживания. Согласно некоторым вариантам реализации при размораживании образца связывающего белка согласно настоящему изобретению и инкубации при 4°С, 25°С и 40°С в течение 1 дня, 3 дней или 7 дней, снижение количества интактного связывающего белка из-за агрегатов составляет менее чем приблизительно 5%, приблизительно 4%, приблизительно 3%, приблизительно 2%, приблизительно 1%, приблизительно 0,5%, приблизительно 0,1%, приблизительно 0,05%, приблизительно 0,01% (включая все промежуточные значения) или менее по оценке с применением ЭХ-ВЭЖХ.
[00317] Согласно другому варианту реализации при внутривенном введении связывающего белка согласно настоящему изобретению наблюдаются один или более следующих показателей ФК (1) кажущийся общий клиренс лекарственного средства из плазмы (CL, мл/сутки/кг), равный приблизительно 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50 (включая все промежуточные значения) или более; (2) кажущийся объем распределения в равновесном состоянии (Vss, мл/кг), равный приблизительно 1, 5, 10, 15, 20, 25, 30, 35,40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95,100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 (включая все промежуточные значения) или более; (3) кажущийся объем в центральном или плазменном компартменте в двухкомпартментной модели (VI, мл/кг), равный приблизительно 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 (включая все промежуточные значения) или более; (4) начальное или диспозиционное время полужизни (альфа-t1/2, дни), равное приблизительно 0,01, 0,05, 0,1, 0,2 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30 (включая все промежуточные значения) или более; (5) терминальное элиминационное время полужизни (бета-t1/2, дни), равное приблизительно 0,01, 0,05, 0,1, 0,2 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30 (включая все промежуточные значения) или более; (6) площадь под кривой зависимости концентрации в плазме от времени (AUC, день × мкг/мл), равная приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000 (включая все промежуточные значения) или более; и (6) среднее время удержания (MRT, дни), равное приблизительно 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30 (включая все промежуточные значения) или более. Согласно некоторым вариантам реализации приведенные выше показатели ассоциированы с дозировкой, составляющей приблизительно 1 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг, 50 мг/кг, 100 мг/кг, 200 мг/кг (включая все промежуточные значения) или более.
[00318] Согласно другому варианту реализации при подкожном введении связывающего белка согласно настоящему изобретению наблюдаются один или более следующих показателей ФК (1) время до достижения максимальной (пиковой) концентрации в плазме после введения лекарственного средства (Tmax, дни), равное приблизительно 0,05, 0,1, 0,2 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20,25,30 (включая все промежуточные значения) или более; (2) максимальная (пиковая) концентрация лекарственного средства в плазме (Cmax, мкг/мл), равная приблизительно 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50,55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 150, 200, 250, 300, 350, 400, 450, 500 (включая все промежуточные значения) или более; (3) элиминационное время полужизни (терминальное t1/2, дни), равное приблизительно 0,01, 0,05, 0,1, 0,2 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30 (включая все промежуточные значения) или более; (4) площадь под кривой зависимости концентрации в плазме от времени от нулевого момента времени до последнего момента с измеряемой концентрацией (AUClast, день × мкг/мл), равная приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000 (включая все промежуточные значения) или более; (5) площадь под кривой зависимости концентрации в плазме от времени от нулевого момента времени до бесконечности (AUCinf, день × мкг/мл), равная приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000 (включая все промежуточные значения) или более; (6) характеризующий образование метаболита из лекарственного средства клиренс (CL/F, мл/сутки/кг), равный приблизительно 0,1, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50 (включая все промежуточные значения) или более; (7) биодоступность (F, %), составляющая приблизительно 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200 (включая все промежуточные значения) или более. Согласно некоторым вариантам реализации приведенные выше показатели ассоциированы с дозировкой, составляющей приблизительно 1 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг, 50 мг/кг, 100 мг/кг, 200 мг/кг (включая все промежуточные значения) или более.
[00319] Согласно другому варианту реализации описанный выше связывающий белок представляет собой конъюгат, дополнительно содержащий агент, выбранный из группы, состоящей из молекулы иммунной адгезии, агента для визуализации, терапевтического агента и цитотоксического агента. Согласно одному варианту реализации указанный агент для визуализации выбран из группы, состоящей из радиоактивной метки, фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки и биотина. Согласно дополнительному варианту реализации указанный агент для визуализации представляет собой радиоактивную метку, выбранную из группы, состоящей из: 3Н, 14С, 35S, 90Y, 99Тс, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm. Согласно одному варианту реализации указанный терапевтический или цитотоксический агент выбран из группы, состоящей из иммуносупрессивного агента, иммуностимулирующего агента, антиметаболита, алкилирующего агента, антибиотика, фактора роста, цитокина, антиангиогенного агента, антимитотического агента, антрациклина, токсина и апоптотического агента. Согласно одному варианту реализации указанный связывающий белок конъюгирован непосредственно с указанным агентом. Согласно другому варианту реализации указанный связывающий белок конъюгирован с указанным агентом посредством линкера. Подходящие линкеры включают, не ограничиваясь перечисленными, аминокислотные и полипептидные линкеры согласно описанию в настоящем документе. Линкеры могут быть расщепляемыми или нерасщепляемыми.
[00320] Согласно другому варианту реализации описанный выше связывающий белок представляет собой кристаллизованный связывающий белок и существует в виде кристалла. Предпочтительно, указанный кристалл представляет собой не содержащий носителя фармацевтический кристалл для контролируемого высвобождения. Более предпочтительно указанный кристаллизованный связывающий белок имеет большую продолжительность полужизни in vivo по сравнению с растворимым эквивалентом указанного связывающего белка. Наиболее предпочтительно, указанный кристаллизованный связывающий белок сохраняет биологическую активность.
[00321] Согласно другому варианту реализации описанный выше связывающий белок гликозилирован. Предпочтительно, гликозилирование представлено паттерном гликозилирования человека.
[00322] Согласно одному аспекту настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей любой из связывающих белков, описанных выше. Согласно дополнительному варианту реализации предложен вектор, содержащий выделенную нуклеиновую кислоту согласно описанию выше, при этом указанный вектор выбран из группы, состоящей из pcDNA; рТТ (Durocher et al., Nucleic Acids Research 2002, Vol 30, No.2); рТТ3 (рТТ с дополнительным сайтом множественного клонирования; pEFBOS (Mizushima, S. and Nagata, S., (1990) Nucleic Acids Research Vol 18, No. 17); pBV; pJV; pcDNA3.1 TOPO, pEF6 TOPO и pBJ. Предложены мультиспецифические связывающие белки и способы их получения. Указанный связывающий белок может быть получен с применением различных методик. В настоящем описании предложены экспрессионные векторы, клетки-хозяева и способы получения указанных связывающих белков.
[00323] Антигенсвязывающие вариабельные домены связывающих белков согласно настоящему изобретению могут быть получены из исходных связывающих белков, в том числе поликлональных антител, моноклональных антител и/или рецепторов, способных к связыванию антигенов, представляющих интерес. Указанные исходные связывающие белки могут встречаться в природе или могут быть получены с применением рекомбинантной технологии. Специалисту в данной области техники хорошо известны многие способы получения антител и/или выделенных рецепторов, в том числе, но не ограничиваясь перечисленными, применение гибридомных методик, метод получения антител из выбранных лимфоцитов (SLAM), применение библиотек фагового, дрожжевого дисплея или дисплея слитых с РНК белков, или другой библиотеки, иммунизация не являющегося человеком животного, у которого содержатся по меньшей мере некоторые иммуноглобулиновые локусы человека, и получение химерных, содержащих привитые CDR и гуманизированных антител. См., например, патентную публикацию США №.20090311253 А1. Вариабельные домены могут также быть получены с применением методик аффинного созревания. Связывающие вариабельные домены связывающих белков могут также быть получены из молекул выделенных рецепторов, полученных посредством процедур экстракции, известных в данной области техники (например, с применением растворителей, детергентов и/или аффинного очищения), или определенных с применением биофизических способов, известных в данной области техники (например, рентгеновской кристаллографии, ЯМР, интерферометрии и/или компьютерного моделирования).
[00324] Предложен вариант реализации, включающий выбор исходных связывающих белков, обладающих по меньшей мере одним или более свойствами, необходимыми для молекулы связывающего белка. Согласно варианту реализации необходимое свойство представляет собой одно или более из свойств, используемых для характеризации показателей антител, такие как, например, антигенная специфичность, аффинность в отношении антигена, активность, биологическая функция, распознавание эпитопов, стабильность, растворимость, эффективность продуцирования, иммуногенность, фармакокинетика, биодоступность, тканевая перекрестная реактивность или связывание ортологичных антигенов. См., например, патентную публикацию США №20090311253.
[00325] Могут также быть разработаны такие мультиспецифические антитела, в которых один или более антигенсвязывающих доменов утратили функциональность. Вариабельные домены могут быть получены с применением методик рекомбинантной ДНК из исходных связывающих белков, полученных любым из способов, описанных в настоящем документе. Согласно варианту реализации вариабельный домен представляет собой вариабельный домен тяжелой или легкой цепи мыши. Согласно другому варианту реализации вариабельный домен представляет собой содержащий привитые CDR или гуманизированный вариабельный домен тяжелой или легкой цепи. Согласно варианту реализации вариабельный домен представляет собой вариабельный домен тяжелой или легкой цепи человека.
[00326] Согласно варианту реализации один или более константных доменов соединены с вариабельными доменами с применением методик рекомбинантной ДНК. Согласно варианту реализации последовательность, содержащая один или более вариабельных доменов тяжелых цепей, соединена с константным доменом тяжелой цепи, а последовательность, содержащая один или более вариабельных доменов легких цепей, соединена с константным доменом легкой цепи. Согласно варианту реализации указанный константные домены представляют собой константные домены тяжелых цепей человека и константные домены легких цепей человека, соответственно. Согласно варианту реализации указанная тяжелая цепь дополнительно соединена с Fc-областью. Указанная Fc-область может представлять собой природную последовательность Fc-области или вариант Fc-области. Согласно другому варианту реализации указанная Fc-область представляет собой Fc-область человека. Согласно другому варианту реализации указанная Fc-область включает Fc-область из IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE или IgD.
[00327] Кроме того, связывающие белки согласно настоящему изобретению могут применяться для тканеспецифической доставки (нацеливания на тканевый маркер и медиатор заболевания для локального улучшения ФК и, соответственно, повышения эффективности и/или снижения токсичности), в том числе для внутриклеточной доставки (нацеливания на интернализуемый рецептор и внутриклеточную молекулу), доставки в головной мозг (нацеливания на трансферриновый рецептор и медиатор заболевания ЦНС для проникновения через гематоэнцефалический барьер). Указанные связывающие белки могут также служить в качестве белка-носителя для доставки антигена в специфическую локацию посредством связывания с не-нейтрализующим эпитопом указанного антигена, а также для увеличения времени полужизни указанного антигена. Кроме того, могут быть разработаны связывающие белки, либо физически соединенные с медицинскими устройствами, имплантируемыми пациентам, либо нацеленные на указанные медицинские устройства (см. Burke et al. (2006) Advanced Drug Deliv. Rev. 58(3): 437-446; Hildebrand et al. (2006) Surface and Coatings Technol. 200(22-23): 6318-6324; Drug/device combinations for local drug therapies and infection prophylaxis, Wu (2006) Biomaterials 27(11):2450-2467; Mediation of the cytokine network in the implantation of orthopedic devices, Marques (2005) Biodegradable Systems in Tissue Engineer. Regen. Med. 377-397). Направление подходящих типов клеток в сайт с медицинским имплантатом может способствовать выздоровлению и восстановлению нормальной функции тканей. Как вариант, предложено также ингибирование медиаторов (в том числе, но не ограничиваясь перечисленными, цитокинов), высвобождаемых при имплантации устройства, слитым белком рецептор/антитело, присоединенным к устройству или нацеленным на устройство.
[00328] Согласно одному аспекту клетку-хозяина трансформируют вектором, описанным выше. Согласно одному варианту реализации указанная клетка-хозяин представляет собой прокариотическую клетку. Согласно дополнительному варианту реализации указанная клетка-хозяин представляет собой Escherichia coli. Согласно другому варианту реализации указанная клетка-хозяин представляет собой эукариотическую клетку. Согласно дополнительному варианту реализации указанная эукариотическая клетка выбрана из группы, состоящей из клетки протиста, клетки животного, клетки растения и клетки гриба. Согласно одному варианту реализации указанная клетка-хозяин представляет собой клетку млекопитающего, в том числе, но не ограничиваясь перечисленными, 293, COS, NS0 и СНО, или клетку гриба, например, Saccharomyces cerevisiae; или клетку насекомого, такую как Sf9.
[00329] Согласно еще одному аспекту настоящего изобретения предложен способ получения связывающего белка согласно описанию выше, включающий культивирование любой из клеток-хозяев, также описанных выше, в культуральной среде в условиях, достаточных для получения указанного связывающего белка. Предпочтительно 50%-75% связывающего белка, полученного указанным способом, представляет собой тетравалентный связывающий белок с двойной специфичностью. Более предпочтительно, 75%-90% связывающего белка, полученного указанным способом, представляет собой тетравалентный связывающий белок с двойной специфичностью. Наиболее предпочтительно, 90%-95% полученного связывающего белка представляет собой тетравалентный связывающий белок с двойной специфичностью.
[00330] Согласно другому варианту реализации предложен связывающий белок, полученный в соответствии со способом, описанным выше.
[00331] Согласно одному варианту реализации предложена композиция для высвобождения связывающего белка, отличающаяся тем, что указанная композиция содержит состав, который, в свою очередь, содержит кристаллизованный связывающий белок согласно описанию выше, и ингредиент; и по меньшей мере один полимерный носитель. Предпочтительно, указанный полимерный носитель представляет собой полимер, выбранный из одного или более полимера из группы, состоящей из: поли(акриловой кислоты), поли(цианоакрилатов), поли(аминокислот), поли(ангидридов), поли(депсипептида), сложных поли(эфиров), поли(молочной кислоты), поли(молочно-ко-гликолевой кислоты), или ПМГК, поли(b-гидроксибутирата), поли(капролактона), поли(диоксанона); поли(этиленгликоля), поли((гидроксипропил)метакриламида, поли[(органо)фосфазена], сложных поли(ортоэфиров), поли(винилового спирта), поли(винилпирролидона), сополимеров малеинового ангидрида/алкилвиниловых эфиров, плюроновых полиатомных спиртов, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированных полисахаридов, их смесей и сополимеров. Предпочтительно, указанный ингредиент выбран из группы, состоящей из альбумина, сахарозы, трегалозы, лактита, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтиленгликоля и полиэтиленгликоля. Согласно другому варианту реализации предложен способ лечения млекопитающего, включающий этап введения указанному млекопитающему эффективного количества композиции, описанной выше.
[00332] Согласно настоящему изобретению также предложена фармацевтическая композиция, содержащая связывающий белок согласно описанию выше и фармацевтически приемлемый носитель. Фармацевтически приемлемые носители включают, не ограничиваясь перечисленными, фосфатный буфер или солевой раствор. Другие обычные парентеральные основы включают растворы фосфата натрия, раствор Рингера с декстрозой, с декстрозой и хлоридом натрия, раствор Рингера с лактатом, или нелетучие масла. Внутривенные основы включают восполнители жидкости и питательных веществ, восполнители электролитов, например, на основе раствора Рингера с декстрозой, и т.п. Могут также присутствовать консерванты и другие добавки, такие как, например, противомикробные средства, антиоксиданты, хелатирующие агенты; а также инертные газы, и т.п. Более конкретно, фармацевтические композиции, подходящие для инъекций, включают стерильные водные растворы (при наличии водорастворимости), или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъецируемых растворов или дисперсий. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и т.п.), и подходящие смеси перечисленного. В некоторых случаях предпочтительно включение изотонических агентов, например, сахаров, полиатомных спиртов, таких как маннит, сорбит или хлорид натрия, в композицию. Продленная абсорбция инъецируемых композиций может быть обеспечена путем включения в указанную композицию агента, который задерживает абсорбцию, например, моностеарата алюминия и желатина.
[00333] Согласно дополнительному варианту реализации указанная фармацевтическая композиция содержит по меньшей мере один дополнительные терапевтический агент для лечения расстройства. Согласно одному варианту реализации указанный дополнительный агент выбран из группы, состоящей из: терапевтических агентов, агентов для визуализации, цитотоксического агента, ингибиторов ангиогенеза (в том числе, но не ограничиваясь перечисленными, антител против ФРЭС или ФРЭС-ловушки); ингибиторов киназ (в том числе, но не ограничиваясь перечисленными, ингибиторов KDR и TIE-2); блокаторов костимулирующих молекул (в том числе, но не ограничиваясь перечисленными, CTLA4-Ig; направленных против В7.1, против В7.2, против PD-1, против CD20); блокаторов молекул адгезии (в том числе, но не ограничиваясь перечисленными, антител против LFA-1, антител против селектинов E/L, низкомолекулярных ингибиторов); антитела против цитокина или его функционального фрагмента (в том числе, но не ограничиваясь перечисленными, антител против ИЛ-18, против ФИО, против ИЛ-6/цитокинового рецептора); метотрексата; циклоспорина; рапамицина; FK506; детектируемой метки или репортера; антагониста ФНО; противоревматического средства; мышечного релаксанта, наркотического средства, нестероидного противовоспалительного лекарственного средства (НПВС), анальгетика, анестетика, седативного средства, местного анестетика, нервно-мышечного блокатора, противомикробного средства, антипсориатического средства, кортикостероида, анаболического стероида, эритропоэтина, иммунизации, иммуноглобулина, иммуносупрессивного средства, гормона роста, лекарственного средства для гормональной заместительной терапии, радиофармацевтического средства, антидепрессанта, антипсихотического средства, стимулирующего средства, медикамента для лечения астмы, бета-агониста, ингаляционного стероида, эпинефрина или его аналога, цитокина и антагониста цитокина.
[00334] Согласно другому аспекту согласно настоящему изобретению предложен способ лечения субъекта-человека, страдающего расстройством, при котором мишени или мишени, которые могут быть связаны связывающим белком согласно описанию выше, оказывают пагубное воздействие, включающий введение указанному субъекту-человеку связывающего белка согласно описанию выше таким образом, чтобы ингибировать активность указанной мишени или мишеней у указанного субъекта-человека и обеспечить лечение или предотвращение указанного расстройства. Согласно одному варианту реализации указанное заболевание или расстройство представляет собой воспалительное состояние, аутоиммунное заболевание или рак. Согласно одному варианту реализации указанное заболевание или расстройство выбрано из группы, включающей артрит, остеоартрит, ювенильный хронический артрит, септический артрит, артрит Лайма, псориатический артрит, реактивный артрит, спондилоартропатию, системную красную волчанку, болезнь Крона, язвенный колит, воспалительное заболевание кишечника, инсулинзависимый сахарный диабет, тироидит, астму, аллергические заболевания, псориаз, дерматит, склеродермию, болезнь «трансплантат против хозяина», отторжение трансплантата органа, острое или хроническое иммунное заболевание, ассоциированное с трансплантацией органа, саркоидоз, атеросклероз, диссеминированная внутрисосудистая коагуляция, болезнь Кавасаки, болезнь Грейвса, нефротический синдром, синдром хронической усталости, гранулематоз Вегенера, пурпуру Шенлейна-Геноха, микроскопический васкулит почек, хронический активный гепатит, увеит, септический шок, синдром токсического шока, септический синдром, кахексию, инфекционные заболевания, паразитарные заболевания, синдром приобретенного иммунодефицита, острый поперечный миелит, хорею Гентингтона, болезнь Паркинсона, болезнь Альцгеймера, инсульт, первичный билиарный цирроз, гемолитическую анемию, злокачественные новообразования, сердечную недостаточность, инфаркт миокарда, болезнь Аддисона, спорадическую полигландулярную недостаточность типа I и полигландулярную недостаточность типа II, синдром Шмидта, (острый) респираторный дистресс-синдром взрослого возраста, алопецию, очаговую алопецию, серонегативную артропатию, артропатию, болезнь Рейтера, псориатическую артропатию, артропатию при язвенном колите, энтеропатический синовит, хламидию, ассоциированную с иерсинией и сальмонеллой артропатию, спондилоартропатию, атероматозное заболевание/артериосклероз, атопическую аллергию, аутоиммунное буллезное заболевание, обыкновенную пузырчатку, листовидную пузырчатку, пемфигоид, линейный IgA-дерматоз, аутоиммунную гемолитическую анемию, гемолитическую анемию с положительным тестом Кумбса, приобретенную пернициозную анемию, ювенильную пернициозную анемию, миалгический энцефалит/доброкачественный миалгический энцефаломиелит («Royal Free Disease»), хронический кандидоз кожи и слизистых оболочек, гигантоклеточный артериит, первичный склерозирующий гепатит, криптогенный аутоиммунный гепатит, синдром приобретенного иммунодефицита, связанные с синдромом приобретенного иммунодефицита заболевания, гепатит В, гепатит С, общий вариабельный иммунодефицит (общую вариабельную гипогаммаглобулинемию), дилатационную кардиомиопатию, женское бесплодие, недостаточность функции яичников, преждевременную недостаточность функции яичников, фиброзирующее заболевание легких, криптогенный фиброзирующий альвеолит, поствоспалительное интерстициальное заболевание легких, интерстициальный пульмонит, ассоциированное с заболеванием соединительной ткани интерстициальное заболевание легких, ассоциированное со смешанным заболеванием соединительной ткани заболевание легких, ассоциированное с системным склерозом интерстициальное заболевание легких, ассоциированное с ревматоидным артритом интерстициальное заболевание легких, ассоциированное с системной красной волчанкой заболевание легких, ассоциированное с дерматомиозитом/полимиозитом заболевание легких, ассоциированное с болезнью Шегрена заболевание легких, ассоциированное с анкилозирующим спондилитом заболевание легких, васкулитное диффузное заболевание легких, ассоциированное с гемосидерозом заболевание легких, индуцированное лекарственными средствами интерстициальное заболевание легких, фиброз, лучевой фиброз, облитерирующий бронхиолит, хроническую эозинофильную пневмонию, лимфоцитарное инфильтративное заболевание легких, постинфекционное интерстициальное заболевание легких, подагрический артрит, аутоиммунный гепатит, аутоиммунный гепатит 1 типа (классический аутоиммунный или волчаночный гепатит), аутоиммунный гепатит 2 типа (гепатит с антителами к микросомам печени и почек), опосредованную аутоиммунитетом гипогликемию, инсулинорезистентность В-типа с черным акантозом, гипопаратиреоз, острое иммунное заболевание, ассоциированное с трансплантацией органа, хроническое иммунное заболевание, ассоциированное с трансплантацией органа, остеоартроз, первичный склерозирующий холангит, псориаз типа 1, псориаз типа 2, идиопатическую лейкопению, аутоиммунную нейтропению, неуточненное заболевание почек, гломерулонефрит, микроскопический васкулит почек, болезнь Лайма, дискоидную красную волчанку, идиопатическое или неуточненное мужское бесплодие, аутоиммунитет к сперме, рассеянный склероз (все подтипы), симпатическую офтальмию, легочную гипертензию на фоне болезни соединительной ткани, синдром Гудпасчера, легочное проявление узелкового полиартериита, острую ревматическую лихорадку, ревматоидный спондилит, болезнь Стилла, системный склероз, синдром Шегрена, болезнь/артериит Такаясу, аутоиммунную тромбоцитопению, идиопатическую тромбоцитопению, аутоиммунное заболевание щитовидной железы, гипертиреоз, аутоиммунный гипотиреоз (болезнь Хашимото), атрофический аутоиммунный гипотиреоз, первичную микседему, факогенный увеит, первичный васкулит, витилиго, острое заболевание печени, хронические заболевания печени, алкогольный цирроз, индуцированное алкоголем повреждение печени, холестаз, идиосинкразическое заболевание печени, индуцированный лекарственным средством гепатит, неалкогольный стеатогепатит, аллергию и астму, инфекцию стрептококков группы В (GBS), психические расстройства (например, депрессию и шизофрению), опосредованные реакциями Th2 и Th1 типа заболевания, острую и хроническую боль (разные формы боли); и рак, такой как рак легкого, молочной железы, желудка, мочевого пузыря, ободочной кишки, поджелудочной железы, яичников, предстательной железы, рак прямой кишки и гематопоэтические злокачественные новообразования (лейкоз и лимфому), абеталипопротеинемию, акроцианоз, острые и хронические паразитарные или инфекционные процессы, острый лейкоз, острый лимфобластный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), острую или хроническую бактериальную инфекцию, острый панкреатит, острую почечную недостаточность, аденокарциномы, воздушное эктопическое сокращение, комплекс СПИД-деменция, индуцированный алкоголем гепатит, аллергический конъюнктивит, аллергический контактный дерматит, аллергический ринит, отторжение аллотрансплантата, дефицит альфа-1-антитрипсина, амиотрофический боковой склероз, анемию, стенокардию, дегенерацию клеток переднего рога, терапию антителами против CD3, антифосфолипидный синдром, антирецепторные реакции гиперчувствительности, аневризмы аорты и периферических сосудов, расслоение аорты, артериальную гипертензию, артериосклероз, артериовенозную фистулу, атаксию, предсердную фибрилляцию (продолжительную или пароксизмальную), предсердное трепетание, атриовентрикулярную блокаду, В-клеточную лимфому, отторжение трансплантата кости, отторжение трансплантата костного мозга (ТКМ), блокаду ножки пучка, лимфому Беркитта, ожоги, аритмию сердца, синдром оглушенного миокарда, опухоли сердца, кардиомиопатию, воспалительный ответ на сердечно-легочное шунтирование, отторжение трансплантата хряща, дегенерацию коры мозжечка, расстройства мозжечка, хаотическую или мультифокальную предсердную тахикардию, ассоциированные с химиотерапией расстройства, хронический миелоцитарный лейкоз (ХМЛ), хронический алкоголизм, хронические воспалительные патологии, хронический лимфоцитарный лейкоз (ХЛЛ), хроническую обструктивную болезнь легких (ХОБЛ), хроническую салицилатную интоксикацию, карциному ободочной и прямой кишки, застойную сердечную недостаточность, конъюнктивит, контактный дерматит, легочное сердце, коронарную недостаточность, болезнь Крейцфельда-Якоба, сепсис с отсутствием роста в культуре, кистозный фиброз, ассоциированные с терапией цитокинами расстройства, деменцию боксеров, демиелинизирующие заболевания, геморрагическую лихорадку денге, дерматит, дерматологические состояния, диабет, сахарный диабет, диабетическую атеросклеротическую болезнь, диффузную болезнь телец Леви, дилатационную застойную кардиомиопатию, расстройств базальных ганглиев, синдром Дауна в среднем возрасте, лекарственные двигательные расстройства, индуцированные лекарственными средствами, блокирующими допаминовые рецепторы ЦНС, чувствительность к лекарственным средствам, экзему, энцефаломиелит, эндокардит, эндокринопатию, эпиглоттит, инфекцию вирусом Эпштейна-Барр, эритромелалгию, экстрапирамидальные и мозжечковые расстройства, семейный гемофагоцитарный лимфогистиоцитоз, отторжение трансплантата вилочковой железы плода, атаксию Фридрейха, функциональные расстройства периферических артерий, микотический сепсис, газовую гангрену, язву желудка, гломерулярный нефрит, отторжение трансплантата любого органа или ткани, грамотрицательный сепсис, грамположительный сепсис, гранулемы, вызванные внутриклеточными организмами, лейкоз ворсистых клеток, болезнь Галлервордена-Шпатца, тиреоидит Хашимото, сенную лихорадку, отторжение трансплантата сердца, гемохроматоз, гемодиализ, гемолитический уремический синдром/тромболитическую тромбоцитопеническую пурпуру, геморрагию, гепатит (А), аритмии пучка Гиса, ВИЧ-инфекцию/ВИЧ-нейропатию, болезнь Ходжкина, гиперкинетические двигательные расстройства, реакции гиперчувствительности, гиперчувствительный пульмонит, гипертензию, гипокинетические двигательные расстройства, оценку гипоталамо-гипофизарно-надпочечниковой оси, идиопатическую болезнь Аддисона, идиопатический фиброз легких, опосредованную антителами цитотоксичность, астению, спинальную мышечную атрофию детского возраста, воспаление аорты, грипп А, воздействие ионизирующего излучения, иридоциклит/увеит/оптический неврит, ишемическое и реперфузионное повреждение, ишемический инсульт, ювенильный ревматоидный артрит, ювенильную спинальную мышечную атрофию, саркому Капоши, отторжение трансплантата почки, легионеллез, лейшманиоз, проказу, поражения кортикоспинальной системы, жировой отек, отторжение трансплантата печени, лимфедему, малярию, злокачественную лимфому, злокачественный гистиоцитоз, злокачественную меланому, менингит, менингококкемию, метаболическая/ идиопатическая мигренозная головная боль, митохондриальное мультисистемное расстройство, смешанное заболевание соединительной ткани, моноклональную гаммопатию, множественную миелому, мультисистемную дегенерацию (синдромы Менцеля,  , Шая-Дрейджера и Мачадо-Джозефа), тяжелую миастению, инфекцию микробактерией группы MAI, инфекцию Mycobacterium tuberculosis, миелодиспластический синдром, инфаркт миокарда, ишемические расстройства миокарда, носоглоточную карциному, неонатальное хроническое заболевание легких, нефрит, нефроз, нейродегенеративные заболевания, нейрогенные мышечные атрофии, нейтропеническую лихорадку, неходжкинскую лимфому, окклюзию брюшной аорты и ее ветвей, окклюзионные расстройства артерий, терапию Okt3, орхит/эпидидимит, орхит/процедуры обратной вазэктомии, органомегалию, остеопороз, отторжение трансплантата поджелудочной железы, карциному поджелудочной железы, паранеопластический синдром/гиперкальциемию злокачественного новообразования, отторжение трансплантата паращитовидной железы, воспалительное заболевание органов таза, круглогодичный ринит, болезнь перикарда, периферическую атеросклеротическую болезнь, расстройства периферических сосудов, перитонит, пернициозную анемию, пневмоцистную пневмонию, пневмонию, POEMS-синдром (синдром полинейропатии, органомегалии, эндокринопатии, наличия М-протеина и поражений кожи), постперфузионный синдром, PPS-синдром («postpump syndrome»), кардиотомный синдром после инфаркта миокарда, преэклампсию, прогрессирующий надъядерный паралич, первичную легочную гипертензию, лучевую терапию, феномен и болезнь Рейно, болезнь Рейно, болезнь Рефсума, регулярную тахикардию с узким желудочковым комплексом, реноваскулярную гипертензию, реперфузионное повреждение, рестриктивную кардиомиопатию, саркомы, склеродермию, сенильную хорею, сенильную деменцию с тельцами Леви, серонегативные артропатии, шок, серповидноклеточную анемию, отторжение аллотрансплантата кожи, синдром поражения кожи, отторжение трансплантата тонкой кишки, солидные опухоли, специфические аритмии, спинальную атаксию, спиноцеребеллярную дегенерацию, стрептококковый миозит, структурные повреждения мозжечка, подострый склерозирующий панэнцефалит, синкопе, сифилис сердечно-сосудистой системы, системную анафилаксию, синдром системной воспалительной реакции, ювенильный ревматоидный артрит с системным началом, Т-клеточный ОЛЛ или ОЛЛ FAB-типа, телеангиэктазию, облитерирующий тромбоангиит, тромбоцитопению, токсичность, трансплантаты, травму/геморрагию, реакции гиперчувствительности III типа, гиперчувствительность IV типа, нестабильную стенокардию, уремию, уросепсис, крапивницу, заболевания клапанов сердца, варикоз вен, васкулит, заболевания вен, тромбоз вен, фибрилляцию желудочков, вирусные и грибные инфекции, вирусный энцефалит/асептический менингит, ассоциированный с вирусом гемофагоцитарный синдром, синдром Вернике-Корсакова, болезнь Вильсона, отторжение ксенотрансплантата любого органа или ткани.
, Шая-Дрейджера и Мачадо-Джозефа), тяжелую миастению, инфекцию микробактерией группы MAI, инфекцию Mycobacterium tuberculosis, миелодиспластический синдром, инфаркт миокарда, ишемические расстройства миокарда, носоглоточную карциному, неонатальное хроническое заболевание легких, нефрит, нефроз, нейродегенеративные заболевания, нейрогенные мышечные атрофии, нейтропеническую лихорадку, неходжкинскую лимфому, окклюзию брюшной аорты и ее ветвей, окклюзионные расстройства артерий, терапию Okt3, орхит/эпидидимит, орхит/процедуры обратной вазэктомии, органомегалию, остеопороз, отторжение трансплантата поджелудочной железы, карциному поджелудочной железы, паранеопластический синдром/гиперкальциемию злокачественного новообразования, отторжение трансплантата паращитовидной железы, воспалительное заболевание органов таза, круглогодичный ринит, болезнь перикарда, периферическую атеросклеротическую болезнь, расстройства периферических сосудов, перитонит, пернициозную анемию, пневмоцистную пневмонию, пневмонию, POEMS-синдром (синдром полинейропатии, органомегалии, эндокринопатии, наличия М-протеина и поражений кожи), постперфузионный синдром, PPS-синдром («postpump syndrome»), кардиотомный синдром после инфаркта миокарда, преэклампсию, прогрессирующий надъядерный паралич, первичную легочную гипертензию, лучевую терапию, феномен и болезнь Рейно, болезнь Рейно, болезнь Рефсума, регулярную тахикардию с узким желудочковым комплексом, реноваскулярную гипертензию, реперфузионное повреждение, рестриктивную кардиомиопатию, саркомы, склеродермию, сенильную хорею, сенильную деменцию с тельцами Леви, серонегативные артропатии, шок, серповидноклеточную анемию, отторжение аллотрансплантата кожи, синдром поражения кожи, отторжение трансплантата тонкой кишки, солидные опухоли, специфические аритмии, спинальную атаксию, спиноцеребеллярную дегенерацию, стрептококковый миозит, структурные повреждения мозжечка, подострый склерозирующий панэнцефалит, синкопе, сифилис сердечно-сосудистой системы, системную анафилаксию, синдром системной воспалительной реакции, ювенильный ревматоидный артрит с системным началом, Т-клеточный ОЛЛ или ОЛЛ FAB-типа, телеангиэктазию, облитерирующий тромбоангиит, тромбоцитопению, токсичность, трансплантаты, травму/геморрагию, реакции гиперчувствительности III типа, гиперчувствительность IV типа, нестабильную стенокардию, уремию, уросепсис, крапивницу, заболевания клапанов сердца, варикоз вен, васкулит, заболевания вен, тромбоз вен, фибрилляцию желудочков, вирусные и грибные инфекции, вирусный энцефалит/асептический менингит, ассоциированный с вирусом гемофагоцитарный синдром, синдром Вернике-Корсакова, болезнь Вильсона, отторжение ксенотрансплантата любого органа или ткани.
[00335] Согласно другому аспекту настоящего изобретения предложен способ лечения пациента, страдающего расстройством, включающий этап введения любого из связывающих белков, описанных выше, до введения, одновременно с введением или после введения второго агента согласно обсуждению выше. Согласно предпочтительному варианту реализации указанный второй агент выбран из группы, состоящей из будесонида, эпидермального фактора роста, кортикостероидов, циклоспорина, сульфасалазина, аминосалицилатов, 6-меркаптопурина, азатиоприна, метронидазола, ингибиторов липоксигеназы, месаламина, олсалазина, балсалазида, антиоксидантов, ингибиторов тромбоксана, антагонистов рецептора ИЛ-1, моноклональных антител против ИЛ-1β, моноклональных антител против ИЛ-6, факторов роста, ингибиторов эластазы, пиридинил-имидазольных соединений, антител или агонистов ФНО, LT, ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-12, ИЛ-13, ИЛ-15, ИЛ-16, ИЛ-18, ИЛ-23, ЕМАР-II, ГМ-КСФ, ФРФ- и ТРФ, антител к CD2, CD3, CD4, CD8, CD-19, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лигандов, метотрексата, циклоспорина, FK506, рапамицина, микофенолата мофетила, лефлуномида, НПВС, ибупрофена, кортикостероидов, преднизолона, ингибиторов фосфодиэстеразы, агонистов аденозиновых рецепторов, антитромботических агентов, ингибиторов комплемента, адренергических агентов, IRAK, NIK, IKK, р38, ингибиторов МАР-киназ, ингибиторов ИЛ-1β-преобразующего фермента, ингибиторов ФНО-α-преобразующего фермента, ингибиторов Т-клеточной сигнализации, ингибиторов металлопротеиназы, сульфасалазина, азатиоприна, 6-меркаптопуринов, ингибиторов ангиотензин-преобразующего фермента, растворимых рецепторов цитокинов, растворимого рецептора ФНО р55, растворимого рецептора ФНО р75, растворимых рецепторов интерлейкинов (sIL) sIL-1RI, sIL-1RII, sIL-6R, противовоспалительных цитокинов, ИЛ-4, ИЛ-10, ИЛ-11, ИЛ-13 и ТФР-β.
[00336] Согласно одному варианту реализации описанные выше фармацевтические композиции вводят субъекту по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, интракапсулярного, внутрихрящевого, внутриполостного, интраклинального, внутримозжечкового, интрацеребровентрикулярного, внутриободочного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, интраплеврального, интрапростатического, внутрилегочного, интраректального, внутрипочечного, интраретинального, интраспинального, интрасиновиального, интраторакального, внутриматочного, интравезикального, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и чрескожного.
[00337] Согласно одному аспекту настоящего изобретения предложено по меньшей мере одно антиидиотипическое антитело по меньшей мере к одному связывающему белку согласно настоящему изобретению. Антиидиотипическое антитело включает любой белок или пептид, содержащий молекулу, которая содержит по меньшей мере часть молекулы иммуноглобулина, например, не ограничиваясь перечисленным, по меньшей мере одну определяющую комплементарность область (CDR) тяжелой или легкой цепи, или ее лигандсвязывающую часть; вариабельную область тяжелой или легкой цепи, константную область тяжелой цепи или легкой цепи, каркасную область; или любую их часть, которая может быть включена в связывающий белок согласно настоящему изобретению.
[00338] Согласно другому варианту реализации связывающие белки согласно настоящему изобретению способны к связыванию одной или более мишеней, выбранных из группы, состоящей из ABCF1; активинового рецептора I типа (ACVR1); активинового рецептора типа IB (ACVR1); активинового рецептора ACVR2; активинового рецептора ACVR2B; активинового рецептора ACVRL1; аденозинового А2А-рецептора (ADORA2A); аггрекана; AGR2; индуцированной активацией цитидиндезаминазы (AICDA); воспалительного фактора аллотрансплантата 1 (AIF1); индуцируемого андрогенами белка 1 (AIG1); AKAP1; AKAP2; АМН; AMHR2; ANGPT1; ANGPT2; ANGPTL3; ANGPTL4; ANPEP; АПК; АРОС1; AR; AZGP1 (цинк-а-гликопротеина); В7.1; В7.2; BAD; BAFF; BAG1; ВАП; BCL2; BCL6; нейротрофического фактора головного мозга (НФГМ); В-клеточного линкерного белка BLNK; BLR1 (MDR15); BlyS; ВМР1; ВМР2; ВМР3В (GDF10); ВМР4; ВМР6; ВМР8; BMPR1A; BMPR1B; BMPR2; BPAG1 (плектина); BRCA1; C19orf10 (интерлейкина IL27w); С3; С4А; С5; C5R1; CANT1; CASP1; CASP4; CAV1; ССВР2 (D6 / JAB61); CCL1 (I-309); CCL11 (эотаксина); CCL13 (МСР-4); CCL15 (MIP-1d); CCL16 (НСС-4); CCL17 (TARC); CCL18 (PARC); CCL19 (MIP-3b); CCL2 (МСР-1); моноцитарного хемотаксического и активирующего фактора (MCAF); CCL20 (MIP-3a); CCL21 (MIP-2); переносчика растворенных веществ (SLC); Exodus-2; CCL22 (MDC / STC-1); CCL23 (MPIF-1); CCL24 (MPIF-2 / эотаксина-2); CCL25 (TECK); CCL26 (эотаксина-3); CCL27 (СТАСK / ILC); CCL28; CCL3 (MIP-1a); CCL4 (МIP-1b); CCL5 (RANTES); CCL7 (MCP-3); CCL8 (mcp-2); циклинов CCNA1; CCNA2; CCND1; CCNE1; CCNE2; CCR1 (CKR1 / HM145); CCR2 (mcp-1RB / RA); CCR3 (CKR3 / CMKBR3); CCR4; CCR5 (CMKBR5 / ChemR13); CCR6 (CMKBR6 / CKR-L3 / STRL22 / DRY6); CCR7 (CKR7 / EBI1); CCR8 (CMKBR8 / TER1 / CKR-L1); CCR9 (GPR-9-6); CCRL1 (VSHK1); CCRL2 (L-CCR); CD164; CD19; CD1С; CD20; CD200; CD-22; CD24; CD28; CD3; CD37; CD38; CD3E; CD3G; CD3Z; CD4; CD40; CD40L; CD44; CD45RB; CD47, CD48, CD52; CD69; CD70, CD72; CD74; CD79A; CD79B; CD8; CD80; CD81; CD83; CD86; CD137, CD138, B7-1, B7-2, ICOSL, B7-H3, B7-H4, CD137L, OX40L, CDH1 (Е-кадгерина); CDH10; CDH12; CDH13; CDH18; CDH19; CDH20; CDH5; CDH7; CDH8; CDH9; CDK2; CDK3; CDK4; CDK5; CDK6; CDK7; CDK9; ингибиторов циклин-зависимой киназы CDKN1A (p21Wap1/Cip1); CDKN1B (p27Kip1); CDKN1C; CDKN2A (p16INK4a); CDKN2B; CDKN2C; CDKN3; CEBPB; CER1; CHGA; CHGB; хитиназы; углеводной сульфотрансферазы 10 (CHST10); представителей суперсемейства хемокиноподобных факторов (CKLFSF) CKLFSF2; CKLFSF3; CKLFSF4; CKLFSF5; CKLFSF6; CKLFSF7; CKLFSF8; CLDN3; CLDN7 (клаудина-7); CLN3; CLU (кластерина); cMet; хемокиноподобного рецептора 1 (CMKLR1); хемокинового орфанного рецептора CMKOR1 (RDC1); CNR1; COL18A1; COL1A1; COL4A3; COL6A1; CR2; CRP; КСФ1 (М-КСФ); КСФ2 (ГМ-КСФ); КСФ3 (ГКСФ); CTLA-4; CTNNB1 (β-катенина); CTSB (катепсина В); CX3CL1 (SCYD1); CX3CR1 (V28); CXCL1 (GRO1); CXCL10 (индуцируемый интерфероном белок IP-10); CXCL11 (I-TAC / индуцируемого интерфероном белка IP-9); CXCL12 (SDF1); CXCL13; CXCL14; CXCL16; CXCL2 (GRO2); CXCL3 (GRO3); CXCL5 (ENA-78 / LIX); CXCL6 (GCP-2); CXCL9 (MIG); CXCR3 (GPR9/CKR-L2); CXCR4; CXCR6 (TYMSTR /STRL33 / Bonzo); CYB5; CYC1; CYSLTR1; DAB2IP; DES; DKFZp451J0118; DLL-4; DNCL1; дипептидилпептидазы DPP4; E2F1; ECGF1; EDG1; EFNA1; EFNA3; EFNB2; ЭФР; рЭФР; ELAC2; ENG; ENO1; ENO2; ENO3; EPHB4; EPO; ERBB2 (Her-2); EREG; ERK8; ESR1; ESR2; F3 (TF); FADD; FasL; FASN; FCER1A; FCER2; FCGR3A; ФРФ-; ФРФ-1 (a-ФРФ); ФРФ-10; ФРФ-11; ФРФ-12; ФРФ-12В; ФРФ-13; ФРФ-14; ФРФ-16; ФРФ-17; ФРФ-18; ФРФ-19; ФРФ-2 (b-ФРФ); ФРФ-20; ФРФ-21; ФРФ-22; ФРФ-23; ФРФ-3 (int-2); ФРФ-4 (HST; ФРФ-5; ФРФ-6 (HST-2); ФРФ-7 (фактора роста кератиноцитов, KGF); ФРФ-8; ФРФ-9; ФРФ-R3; FIGF (ФРЭС-D); FIL1 (эпсилон); FIL1 (зета); FLJ12584; FLJ25530; FLRT1 (фибронектина); FLT1; FOS; FOSL1 (FRA-1); FY (DARC); π-субъединицы рецептора ГАМК (A) GABRP (GABAa); GAGEB1; GAGEC1; GALNAC4S-6ST; GATA3; GDF5; GFI1; GGT1; ГМ-КСФ; GNAS1; GNRH1; GPR2 (CCR10); GPR31; GPR44; GPR81 (FKSG80); GRCC10 (C10); GRP; GSN (гельзолина); GSTP1; HAVCR2; гистондезацетилазы HDAC4; гистондезацетилазы HDAC5; гистондеацетилазы HDAC7A; гистондезацетилазы HDAC9; ФРГ; HIF1A; HIP1; гистамин и рецепторы гистамина; Неr3; лейкоцитарного антигена человека HLA-A; лейкоцитарного антигена человека HLA-DRA; НМ74; гемоксигеназы НМОХ1; HUMCYT2A; ICEBERG; ICOSL; ID2; ИФН-а; ИФН-А1; ИФН-А2; ИФН-А4; ИФН-А5; ИФН-А6; ИФН-А7; ИФН-В1; ИФН-гамма; ИФН-W1; иммуноглобулиневязывающего белка IGBP1; ИФР-1; рИФР-1; ИФР-2; связывающих инсулиноподобный фактор роста белков IGFBP2, IGFBP3, IGFBP6; ИЛ-1; ИЛ-10; ИЛ-10RA; ИЛ-10RB; ИЛ-11; ИЛ-11RA; ИЛ-12; ИЛ-12А; ИЛ-12В; ИЛ-12RB1; ИЛ-12RB2; ИЛ-13; ИЛ-13RA1; ИЛ-13RA2; ИЛ-14; ИЛ-15; ИЛ-15RA; ИЛ-16; ИЛ-17; ИЛ-17В; ИЛ-17С; ИЛ-17R; ИЛ-18; ИЛ-18ВР; ИЛ-18R1; ИЛ-18RAP; ИЛ-19; ИЛ-1А; ИЛ-1В; ИЛ-1F10; ИЛ-1F5; ИЛ-1F6; ИЛ-1F7; ИЛ-1F8; ИЛ-1F9; ИЛ-1HY1; ИЛ-1R1; ИЛ-1R2; ИЛ-1RAP; ИЛ-1RAPL1; ИЛ-1RAPL2; ИЛ-1RL1; ИЛ-1RL2, ИЛ-1RN; ИЛ-2; ИЛ-20; ИЛ-20RA; ИЛ-21R; ИЛ-22; ИЛ-22R; ИЛ-22RA2; ИЛ-23; ИЛ-24; ИЛ-25; ИЛ-26; ИЛ-27; ИЛ-28А; ИЛ-28В; ИЛ-29; ИЛ-2RА; ИЛ-2RВ; ИЛ-2RG; ИЛ-3; ИЛ-30; ИЛ-3RA; ИЛ-4; ИЛ-4R; ИЛ-5; ИЛ-5RA; ИЛ-6; ИЛ-6R; ИЛ-6SТ (гликопротеина 130); ИЛ-7; ИЛ-7R; ИЛ-8; ИЛ-8RA; ИЛ-8RB; ИЛ-8RB; ИЛ-9; ИЛ-9R; ИЛ-K; ингибина альфа (INHA); ингибина бета A (INHBA); инсулиноподобных факторов 3 (INSL3) и 4 (INSL4); IRAK1; IRAK2; интегрина альфа-1 ITGA1; интегрина альфа-2 ITGA2; интегрина альфа-3 ITGA3; ITGA6 (интегрина α-6); интегрина альфа (ITGAV); интегрина бета-3 (ITGB3); ITGB4 (интегрина β-4); JAG1; JAK1; JAK3; JUN; K6HF; KАI1; KDR; KITLG; KLF5 (связывающего белка GC-бокса); KLF6; KLK10; KLK12; KLK13; KLK14; KLK15; KLK3; KLK4; KLK5; KLK6; KLK9; KRT1; KRT19 (кератина 19); KRT2A; KRTHB6 (специфического кератина волос II типа); LAMA5; LEP (лептина); Lingo-p75; Lingo-Troy; ЛПС; LTA (ФНО-b); LTB; LTB4R (GPR16); LTB4R2; LTBR; MACMARCKS; MAG или Omgp; МАР2K7 (c-Jun); MDK; MIB1; мидкина; MIF; MIP-2; MKI67 (Ki-67); ММП2; ММП9; MS4A1; MSMB; МТ3 (металлотионектина-III); MTSS1; MUC1 (муцин); MYC; MYD88; NCK2; нейрокана; NFKB1; NFKB2; ФРН-В (ФРН); рФРН; NgR-Lingo; NgR-Nogo66 (Nogo); NgR-p75; NgR-Troy; NME1 (NM23A); NOX5; NPPB; NR0B1; NR0B2; NR1D1; NR1D2; NR1H2; NR1H3; NR1H4; NR1I2; NR1I3; NR2C1; NR2C2; NR2E1; NR2E3; NR2F1; NR2F2; NR2F6; NR3C1; NR3C2; NR4A1; NR4A2; NR4A3; NR5A1; NR5A2; NR6A1; NRP1; NRP2; экто-5'-нуклеотидазы (NT5E); NTN4; ODZ1; OPRD1; PCSK9; P2RX7; PAP; PART1; PATE; PAWR; PCA3; ядерного антигена пролиферирующих клеток (PCNA); PD-1; PD-L1; альфа-4/бета-7, ОХ40, GITR, TIM-3, Lag-3, В7-Н3, В7-Н4, миостатина (GDF8), CGRP, Lingo-1, фактора IХа, фактора X, ICOS, GARP, BTLA, CD160, ROR1, 2В4, KIR, CD27, ОХ40, CD40L, A2aR, ТРФ-А; субъединицы В фактора роста тромбоцитов (PDGFB); РЕСАМ1; PF4 (CXCL4); PGF; рецептора прогестерона (ПГР); фосфакана; PIAS2; PIK3CG; урокиназного активатора плазминогена УАП (uPA); PLG; PLXDC1; РРВР (CXCL7); PPID; PR1; PRKCQ; PRKD1; PRL; PROC; PROK2; PSAP; АСКП; рецептора фактора активации тромбоцитов PTAFR; гомолога фосфатазы и тензина (PTEN); PTGS2 (СОХ-2); PTN; RAC2 (p21Rac2); RARB; RGS1; RGS13; RGS3; RNF110 (ZNF144); ROBO2; S100A2; SCGB1D2 (липофилина В); SCGB2A1 (маммаглобина 2); SCGB2A2 (маммаглобина 1); SCYE1 (активирующего эндотелиальные клетки и моноциты цитокина); SDF2; SERPINA1; SERPINA3; SERPINB5 (маспин); SERPINE1 (PAI-1); SERPINF1; SHBG; SLA2; SLC2A2; SLC33A1; SLC43A1; SLIT2; SPP1; SPRR1B (Sprl); ST6GAL1; STAB1; STAT6; STEAP; STEAP2; TB4R2; ТВХ21; TCP10; фактора роста тератокарциномы-1 (TDGF1); ТЕК; ТФР-А; ТФР-В1; ТФР-В1I1; ТФР-В2; ТФР-В3; ТФР-ВI; ТФР-BR1; TФP-BR2; ТФР-BP3; TH1L; THBS1 (тромбоспондина-1); THBS2; THBS4; тромбопоэтина (ТНРО); TIE (Tie-1); TIMP3; тканевого фактора; Toll-подобных рецепторов TLR10; TLR2; TLR3; TLR4; TLR5; TLR6; TLR7; TLR8; TLR9; ФНО; ФНО-а; ФНО-АIР2 (В94); ФНО-АIР3; рецепторов суперсемейства рецепторов фактора некроза опухолей ФНО-RSF11А; ФНО-RSF1A; ФНО-RSF1B; ФHO-RSF21; ФНО-RSF5; ФНО-RSF6 (Fas); ФНО-RSF7; ФНО-RSF8; ФНО-RSF9; ФНО-SF10 (TRAIL); ФНО-SF11 (TRANCE); ФНО-SF12 (APO3L); ФНО-SF13 (April); ФНО-SF13В; ФНО-SF14 (HVEM-L); ФНО-SF15 (VEGI); ФНО-SF18; ФНО-SF4 (лиганда ОХ40); ФНО-SF5 (лиганда CD40); ФHO-SF6 (FasL); ФНО-SF7 (лиганда CD27); ФНО-SF8 (лиганда CD30); ФНО-SF9 (лиганда 4-1ВВ); TOLLIP; Toll-подобных рецепторов; ТОР2А (топоизомеразы Iia); ТР53; тропомиозина ТРМ1; тропомиозина ТРМ2; TRADD; TRAF1; TRAF2; TRAF3; TRAF4; TRAF5; TRAF6; TREM1; TREM2; TRPC6; тимического стромального лимфопоэтина TSLP; TWEAK; ФРЭС; ФРЭС-В; ФРЭС-С; версикана; VHL С5; VLA-4; XCL1 (лимфотактина); XCL2 (SCM-1b); XCR1 (GPR5 / CCXCR1); YY1; и ZFPM2.
[00339] Учитывая, что связывающие белки согласно настоящему изобретению способны связываться с двумя или более антигенами, они могут применяться для детекции антигенов (например, в биологическом образце, таком как образец сыворотки или плазмы), с использованием стандартного иммунологического анализа, такого как иммуносорбентный ферментный анализ (ELISA), радиоиммунологический анализ (RIA) или иммуногистохимическое исследование тканей. FIT-Ig прямо или непрямо метили детектируемым веществом для облегчения детекции связанного или несвязанного антитела. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов с простетическими группами включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеин-изотиоцианат, родамин, дихлортриазиниламин флуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного материала включает люминол; примеры подходящего радиоактивного материала включают 3Н, 14С, 35S, 90Y, 99Тс, 111In, 125I, 131I, 177Lu, 166Ho или 153Sm.
[00340] Согласно одному варианту реализации настоящего изобретения связывающие белки способны нейтрализовать активность антигенов как in vitro, так и in vivo. Соответственно, такие FIT-Ig могут применяться для ингибирования активности антигена, например, в культуре клеток, содержащей указанные антигены, у субъектов-людей или у других субъектов-млекопитающих, у которых присутствуют антигены, с которыми связывающий белок согласно настоящему изобретению вступает в перекрестные реакции. Согласно другому варианту реализации настоящего изобретения предложен способ уменьшения активности антигена у субъекта, страдающего от заболевания или расстройства, при котором активность антигена оказывает пагубное воздействие. Связывающий белок согласно настоящему изобретению может быть введен субъекту-человеку в терапевтических целях.
[00341] Предполагается, что в настоящем документе термин «расстройство, при котором активность антигена оказывает пагубное воздействие» включает заболевания и другие расстройства, при которых, как было показано или как предполагается, присутствие указанного антигена у субъекта, страдающего от указанного расстройства, либо отвечает за патофизиологию расстройства, либо представляет собой фактор, который вносит вклад в усугубление расстройства. Соответственно, расстройство, при котором активность антигена оказывает пагубное воздействие представляет собой расстройство, при котором, как ожидается, снижение активности антигена будет облегчать симптомы и/или прогрессирование расстройства. На такие расстройства может указывать, например, увеличение концентрации антигена в биологической жидкости у субъекта, страдающего от указанного расстройства (например, увеличение концентрации антигена в сыворотке, плазме, синовиальной жидкости и т.п., у указанного субъекта). Неограничивающие примеры расстройств, для лечения которых могут применяться связывающие белки согласно настоящему изобретению, включают расстройства, описанные ниже, а также в разделе, относящемся к фармацевтическим композициям с антителами согласно настоящему изобретению.
[00342] FIT-Ig согласно настоящему изобретению могут связывать один антиген или несколько антигенов. Такие антигены включают, не ограничиваясь перечисленными, мишени, указанные в перечисленных ниже базах данных, который баз данных включены в настоящий документ посредством ссылки. Указанные базы данных мишеней включают, не ограничиваясь перечисленными, следующие:
• Терапевтические мишени (http://xin.cz3.nus.edu.sg/group/cjttd/ttd.asp);
• Цитокины и рецепторы цитокинов (http://www.cytokinewebfacts.com/, http://www.copewithcytokines.de/cope.cgi, и
• http://cmbi.bjmu.edu.cn/cmbidata/cgf/CGF_Database/cytokine.medic.kumamoto-u.ac.jp/CFC/indexR.html);
• Хемокины (http://cytokine.medic.kumamoto-u.ac.jp/CFC/CK/Chemokine.html);
• Рецепторы хемокинов и сопряженные с G-белками рецепторы (GPCR) (http://csp.medic.kumamoto-u.ac.jp/CSP/Receptor.html, http://www.gpcr.org/7tm/);
• Обонятельные рецепторы (http://senselab.med.yale.edu/senselab/ORDB/default.asp);
• Рецепторы (http://www.iuphar-db.org/iuphar-rd/list/index.htm);
• Раковые мишени (http://cged.hgc.jp/cgi-bin/input.cgi);
• Секретируемые белки в качестве потенциальных мишеней антител (http://spd.cbi.pku.edu.cn/);
• Протеинкиназы (http://spd.cbi.pku.edu.cn/), и
• CD-маркеры человека
(http://content.labvelocity.com/tools/6/1226/CD_table_final_locked.pdf) и (Zola Н, 2005 CD molecules 2005: human cell differentiation molecules Blood, 106:3123-6).
[00343] FIT-Ig подходят для применения в качестве терапевтических агентов для одновременной блокировки двух разных мишеней с усилением эффективности/безопасности и/или увеличением охвата пациентов. Такие мишени могут включать растворимые мишени (например, ИЛ-13 и ФНО) и мишени-рецепторы клеточной поверхности (например, рФРЭС и рЭФР). Они могут также применяться для индукции перенаправленной цитотоксичности между опухолевыми клетками и Т-клетками (Неr2 и CD3) при терапии рака, или между аутореактивными клетками и эффекторными клетками при аутоиммунном заболевании/трансплантации, или между любой целевой клеткой и эффекторной клеткой для элиминации вызывающих заболевание клеток при том или ином заболевании.
[00344] Кроме того, FIT-Ig может применяться для запуска кластеризации и активации рецепторов, если он разработан для нацеливания на два разных эпитопа на одном рецепторе. Это может обеспечивать преимущество при получении агонистических и антагонистических терапевтических средств, направленных против GPCR. В указанном случае FIT-Ig может применяться для нацеливания на два разных эпитопа на одной клетке для кластеризации/сигнализации (две молекулы клеточной поверхности) или сигнализации (на одной молекуле). Аналогично, молекула FIT-Ig может быть разработана таким образом, чтобы запускать лигирование CTLA-4, и отрицательный сигнал за счет нацеливания на два разных эпитопа (или 2 копии одного эпитопа) внеклеточного домена CTLA-4, что приводит к понижающей регуляции иммунного ответа. CTLA-4 представляет собой клинически валидированную мишень для терапевтического лечения ряда иммунологических расстройств. Взаимодействия CTLA-4/B7 отрицательно регулируют активацию Т-клеток путем аттенюации прогрессирования клеточного цикла, продуцирования ИЛ-2 и пролиферации Т-клеток после активации, и вовлечение CTLA-4 (CD 152) может понижающе регулировать активацию Т-клеток и способствовать индукции иммунной толерантности. Однако стратегия аттенюации активации Т-клеток путем вовлечения CTLA-4 агонистическим антителом была неуспешной, поскольку для активации CTLA-4 необходимо лигирование. При молекулярном взаимодействии CTLA-4/B7 образуется решетка по типу «перекошенной молнии», как демонстрирует анализ кристаллической структуры (Stamper 2001 Nature410:608). Однако ни один из доступных в настоящее время связывающих CTLA-4 реагентов, в том числе моноклональных антител против CTLA-4, не обладает лигирующими свойствами. Был предпринят ряд попыток решения указанной проблемы. В одном случае было получено мембраносвязанное одноцепочечное антитело, значимо ингибирующее аллогенное отторжение у мышей (Hwang 2002 JI 169:633). В другом случае было получено искусственное связанное с поверхностью АПК одноцепочечное антитело к CTLA-4, демонстрировавшее аттенюацию Т-клеточных ответов (Griffin 2000 JI 164:4433). В обоих случаях лигирование CTLA-4 достигалось за счет близкорасположенных мембраносвязанных антител в искусственных системах. Хотя в указанных экспериментах получено подтверждение концепции понижающей регуляции иммунитета за счет запуска отрицательной CTLA-4-сигнализации, реагенты, использование которых описано в приведенных источниках, не подходят для терапевтического применения. Для указанной цели лигирование CTLA-4 может быть достигнуто с применением молекулы FIT-Ig, нацеленной на два разных эпитопа (или 2 копии одного и того же эпитопа) внеклеточного домена CTLA-4. Обоснование заключается в том, что расстояние, разделяющее два сайта связывания IgG - приблизительно 150-170  - слишком велико для активного лигирования CTLA-4 (30-50
- слишком велико для активного лигирования CTLA-4 (30-50  между 2 гомодимерами CTLA-4). Однако расстояние между двумя сайтами связывания на FIT-Ig (на одном плече) значительно меньше, также в диапазоне от 30-50
между 2 гомодимерами CTLA-4). Однако расстояние между двумя сайтами связывания на FIT-Ig (на одном плече) значительно меньше, также в диапазоне от 30-50  , что обеспечивает надлежащее лигирование CTLA-4.
, что обеспечивает надлежащее лигирование CTLA-4.
[00345] Аналогичным образом, FIT-Ig может быть нацелен на два разных представителя рецепторных комплексов клеточной поверхности (например, ИЛ-12R альфа и бета). Кроме того, FIT-Ig может быть нацелен на CR1 и растворимый белок/патоген для запуска быстрого выведения целевого растворимого белка/патогена.
[00346] Кроме того, FIT-Ig согласно настоящему изобретению могут применяться для тканеспецифической доставки (нацеливание на тканевый маркер и медиатор заболевания для улучшения локальной ФК и, соответственно, повышения эффективности и/или снижения токсичности), в том числе внутриклеточной доставки (нацеливание на интернализуемый рецептор и внутриклеточную молекулу), доставки в головной мозг (нацеливание на трансферриновый рецептор и медиатор заболевания ЦНС для проникновения через гематоэнцефалический барьер). FIT-Ig могут также служить в качестве белка-носителя для доставки антигена в специфическую локацию за счет связывания с не-нейтрализующим эпитопом указанного антигена, а также для увеличения времени полужизни указанного антигена. Кроме того, FIT-Ig может быть разработан таким образом, чтобы физически соединяться с медицинскими устройствами, имплантируемыми пациентам, или быть нацелены на указанные медицинские устройства. (Burke, Sandra Е.; Kuntz, Richard Е.; Schwartz, Lewis В. Zotarolimus (ABT-578) eluting стенты. Advanced Drug Delivery Reviews (2006), 58(3), 437-446.; Surface coatings for biological activation and functionalization of medical devices. Hildebrand, H.F.; Blanchemain, N.; Mayer, G.; Chai, F.; Lefebvre, M.; Boschin, F. Surface and Coatings Technology (2006), 200(22-23), 6318-6324.; Drug/ device combinations for local drug therapies and infection prophylaxis. Wu, Peng; Grainger, David W. Biomaterials (2006), 27(11), 2450-2467.; Mediation of the cytokine network in the implantation of orthopedic devices. Marques, A.P.; Hunt, J.A.; Reis, Rui L. Biodegradable Systems in Tissue Engineering and Regenerative Medicine (2005), 377-397; Page: 52
[00347] Mediation of the cytokine network in the implantation of orthopedic devices. Marques, A.P.; Hunt, J.A.; Reis, Rui L. Biodegradable Systems in Tissue Engineering and Regenerative Medicine (2005), 377-397.) Вкратце, направление клеток подходящих типов в сайт медицинского имплантата может способствовать исцелению и восстановлению нормальной функции ткани. Как вариант, также предложено ингибирование медиаторов (в том числе, но не ограничиваясь указанными, цитокинов), высвобождаемых при имплантации устройства, с применением FIT-Ig, сопряженным или нацеленным на устройство. Например, на протяжении многих лет в интервенционной кардиологии применялись стенты для раскрытия блокированных артерий и улучшения тока крови, поступающей в сердечную мышцу. Однако известно, что использование традиционных стентов из чистого металла вызывает рестеноз (повторное сужение артерий в области вмешательства) у некоторых пациентов и может приводить к образованию кровяных тромбов. Недавно был описан стент, покрытый антителами против CD34, использование которого уменьшает рестеноз и предотвращает образование кровяных тромбов за счета захвата эндотелиальных клеток-предшественников (ЭКП), циркулирующих в крови. Эндотелиальные клетки представляют собой клетки, выстилающие кровеносные сосуды, обеспечивая плавное движение крови. ЭКП прикрепляются к твердой поверхности стента, образуя гладкий слой, который не только способствует исцелению, но и предотвращает рестеноз и образование кровяных тромбов - осложнений, ранее ассоциированных с применением стентов (Aoji et al., 2005 J Am Coll Cardiol. 45(10): 1574-9). Помимо улучшения исхода у пациентов, которым требуется установка стентов, возможно также применение у пациентов, которым требуется кардиоваскулярное шунтирование. Например, простетический сосуд (искусственная артерия), покрытый антителами против ЭКП, устранит необходимость использования артерий, взятых из ног или рук пациентов, в качестве трансплантатов для шунтирования. Это позволит снизить продолжительность хирургических операций и анестезии, что, в свою очередь, будет снижать смертность при коронарной хирургии. Разрабатывают FIT-Ig таким образом, чтобы он связывался с маркером клеточной поверхности (таким как CD34), а также белком (или эпитопом любого типа, в том числе, но не ограничиваясь перечисленными, липидами и полисахаридами), который был нанесен на имплантированное устройство для облегчения рекрутинга клеток. Такие подходы могут также применяться в общем случае с другими медицинскими имплантатами. Как вариант, FIT-Ig могут быть нанесены на медицинские устройства, и после имплантации и высвобождения всех FIT из устройства (или в любом другом случае, когда может требоваться дополнительный свежий, в том числе при старении и денатурации уже загруженного FIT-Ig) указанное устройство может быть перезагружено путем системного введения пациенту свежего FIT-Ig, при этом указанный FIT-Ig разработан таким образом, чтобы связываться с представляющей интерес мишенью (цитокином, маркером клеточной поверхности (таким как CD34) и т.п.) за счет одной группы сайтов связывания; и с мишенью, нанесенной на устройство (в том числе белком, эпитопом любого типа, в том числе, но не ограничиваясь перечисленными, липидами, полисахаридами и полимерами) за счет другой группы сайтов связывания. Указанная технология обеспечивает преимущество, расширяя применимость имплантатов с покрытием.
[00348] Молекулы FIT-Ig согласно настоящему изобретению также подходят для применения в качестве терапевтических молекул для лечения различных заболеваний. Такие молекулы FIT-Ig могут связывать одну или более мишеней, вовлеченных в специфическое заболевание. Примеры таких мишеней при различных заболеваниях представлены ниже.
[00349] Многие белки, как было обнаружено, вовлечены в общий аутоиммунный и воспалительный ответ, в том числе С5, CCL1 (I-309), CCL11 (эотаксин), CCL13 (mср-4), CCL15 (MIP-1d), CCL16 (НСС-4), CCL17 (TARC), CCL18 (PARC), CCL19, CCL2 (mср-1), CCL20 (MIP-3a), CCL21 (MIP-2), CCL23 (MPIF-1), CCL24 (MPIF-2 / эотаксин-2), CCL25 (ТЕСK), CCL26, CCL3 (MIP-1a), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (mcp-3), CCL8 (mcp-2), CXCL1, CXCL10 (индуцируемый интерфероном белок IP-10), CXCL11 (I-TAC / индуцируемый интерфероном белок IP-9), CXCL12 (SDF1), CXCL13, CXCL14, CXCL2, CXCL3, CXCL5 (ENA-78 / LIX), CXCL6 (GCP-2), CXCL9, ИЛ-13, ИЛ-8, CCL13 (mcp-4), CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CX3CR1, ИЛ-8RA, XCR1 (CCXCR1), ИФН-А2, ИЛ-10, ИЛ-13, ИЛ-17С, ИЛ-1А, ИЛ-1В, ИЛ-1F10, ИЛ-1F5, ИЛ-1F6, ИЛ-1F7, ИЛ-1F8, ИЛ-1F9, ИЛ-22, ИЛ-5, ИЛ-8, ИЛ-9, LTA, LTB, MIF, SCYE1 (активирующий эндотелиальные клетки и моноциты цитокин), SPP1, ФНО, ФНО-SF5, ИФН-А2, ИЛ-10RA, ИЛ-10RB, ИЛ-13, ИЛ-13RA1, ИЛ-5RA, ИЛ-9, ИЛ-9R, ABCF1, BCL6, С3, С4А, СЕВРВ, CRP, ICEBERG, ИЛ-1R1, ИЛ-1RN, ИЛ-8RB, LTB4R, TOLLIP, FADD, IRAK1, IRAK2, MYD88, NCK2, ФНО-АIР3, TRADD, TRAF1, TRAF2, TRAF3, TRAF4, TRAF5, TRAF6, активиновый рецептор I типа (ACVR1), активиновый рецептор типа IB (ACVR1), активиновый рецептор ACVR2, активиновый рецептор ACVR2B, активиновый рецептор ACVRL1, CD28, CD3E, CD3G, CD3Z, CD69, CD80, CD86, CNR1, CTLA-4, CYSLTR1, FCER1A, FCER2, FCGR3A, GPR44, HAVCR2, OPRD1, P2RX7, Toll-подобных рецепторов TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, BLR1, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL11, CCL13, CCL15, CCL16, CCL17, CCL18, CCL19, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CX3CL1, CX3CR1, CXCL1, CXCL2, CXCL3, CXCL5, CXCL6, CXCL10, CXCL11, CXCL12, CXCL13, CXCR4, GPR2, SCYE1, SDF2, XCL1, XCL2, XCR1, АМН, AMHR2, BMPR1A, BMPR1B, BMPR2, C19orf10 (интерлейкин IL27w), CER1, КСФ1, КСФ2, КСФ-3, DKFZp451J0118, ФРФ-2, GFI1, ИФН-А1, ИФН-В1, ИФН-G, ИФР-1, ИЛ-1А, ИЛ-1B, ИЛ-1R1, ИЛ-1R2, ИЛ-2, ИЛ-2RА, ИЛ-2RB, ИЛ-2RG, ИЛ-3, ИЛ-4, ИЛ-4R, ИЛ-5, ИЛ-5RA, ИЛ-6, ИЛ-6R, ИЛ-6ST, ИЛ-7, ИЛ-8, ИЛ-8RA, ИЛ-8RB, ИЛ-9, ИЛ-9R, ИЛ-10, ИЛ-10RA, ИЛ-10RB, ИЛ-11, ИЛ-11RA, ИЛ-12А, ИЛ-12В, ИЛ-12RB1, ИЛ-12RB2, ИЛ-13, ИЛ-13RA1, ИЛ-13RA2, ИЛ-15, ИЛ-15RA, ИЛ-16, ИЛ-17, ИЛ-17R, ИЛ-18, ИЛ-18R1, ИЛ-19, ИЛ-20, KITLG, LEP, LTA, LTB, LTB4R, LTB4R2, LTBR, MIF, NPPB, ТРФ-В, ТВХ21, фактор роста тератокарциномы-1 (TDGF1), ТФР-А, ТФР-В1, ТФР-В1I1, ТФР-В2, ТФР-В3, ТФР-В1, ТФР-BR1, TФP-BR2, ТФР-BR3, TH1L, ФНО, рецепторы суперсемейства рецепторов фактора некроза опухолей ФНО-RSF1A, ФНО-RSF1B, ФНО-RSF7, ФНО-RSF8, ФНО-RSF9, ФНО-RSF11A, ФНО-RSF21, ФНО-SF4, ФНО-SF5, ФНО-SF6, ФНО-SF11, ФРЭС, ZFPM2 и RNF110 (ZNF144). Также предусмотрены FIT-Ig, способные к связыванию одной или более из мишеней, перечисленных выше.
[00350] Аллергическая астма характеризуется наличием эозинофилии, метаплазии бокаловидных клеток, изменениями эпителиальных клеток, гиперреактивностью дыхательных путей (ГДП) и экспрессией цитокинов Th2 и Тh1, а также повышенными уровнями IgE в сыворотке. В настоящее время общепризнано, что воспаление дыхательных путей представляет собой ключевой фактор, лежащий в основе патогенеза астмы, вовлекающего комплексное взаимодействие воспалительных клеток, таких как Т-клетки, В-клетки, эозинофилы, тучные клетки и макрофаги, и секретируемых ими медиаторов, в том числе цитокинов и хемокинов. Наибольшее значение при противовоспалительном лечении астмы в настоящий момент имеют кортикостероиды, однако механизм их действия является неспецифическим, и имеются вопросы, связанные с безопасностью их применения, в частности, в популяции пациентов молодого возраста. Соответственно, требуется разработка более специфических целевых видов терапии. Появляется все больше доказательств того, что ИЛ-13 у мышей имитирует многие признаки астмы, в том числе ГДП, гиперсекрецию слизи и фиброз дыхательных путей, независимо от эозинофильного воспаления (Finotto et al., International Immunology (2005), 17(8), 993-1007; Padilla et al., Journal of Immunology (2005), 174(12), 8097-8105).
[00351] Было обнаружено, что ИЛ-13 играет решающую роль в инициации патологических ответов, ассоциированных с астмой. Разработка терапии моноклональными антителами против ИЛ-13 для уменьшения эффектов ИЛ-13 в легком представляет собой впечатляющий новый подход, который может обеспечить многообещающий новый способ лечения астмы. Тем не менее, в патогенез астмы вовлечены и другие медиаторы дифференциальных иммунологических путей, и блокирование указанных медиаторов, помимо блокирования ИЛ-13, может обеспечивать дополнительный благоприятный терапевтический эффект. Такие пары мишеней включают, не ограничиваясь перечисленными, ИЛ-13 и провоспалительный цитокин, такой как фактор некроза опухоли-α (ФНО-α). ФНО-α может усиливать воспалительный ответ при астме, и может быть связан с тяжестью заболевания (McDonnell, et al., Progress in Respiratory Research (2001), 31 (New Drugs for Asthma, Allergy and COPD), 247-250.). Это предполагает, что блокирование как ИЛ-13, так и ФНО-α может обеспечивать благоприятные эффекты, в частности, при тяжелом заболевании дыхательных путей. Согласно предпочтительному варианту реализации FIT-Ig согласно настоящему изобретению связывает мишени ИЛ-13 и ФНО-α и применяется для лечения астмы.
[00352] Модели на животных, такие как модель индуцированной OVA астмы на мышах, с помощью которых может быть проведена оценка как воспаления, так и ГДП, известны в данной области техники и могут применяться для определения возможности лечения астмы различными молекулами FIT-Ig. Модели для исследования астмы на животных описаны в источниках: Coffman, et al., Journal of Experimental Medicine (2005), 201(12), 1875-1879; Lloyd, et al., Advances in Immunology (2001), 77, 263-295; Boyce et al., Journal of Experimental Medicine (2005), 201(12), 1869-1873; и Snibson, et al., Journal of the British Society for Allergy and Clinical Immunology (2005), 35(2), 146-52. Помимо рутинных оценок безопасности для указанных пар мишеней, при выборе наилучших пар мишеней могут требоваться и быть целесообразными специфические тесты на степень иммуносупрессии (см. Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization (1992), 77 99-102; Hart et al., Journal of Allergy and Clinical Immunology (2001), 108(2), 250-257).
[00353] На основе приведенных выше принципов с применением той же модели для оценки эффективности и безопасности могут быть определены другие пары мишеней, с которыми могут связываться молекулы FIT-Ig, и подходящие для лечения астмы. Предпочтительно, такие мишени включают, не ограничиваясь перечисленными, ИЛ-13 и ИЛ-1-бета, поскольку ИЛ-1-бета также вовлечен в воспалительные ответ при астме; ИЛ-13, цитокины и хемокины, которые вовлечены в воспаление, такие как ИЛ-13 и ИЛ-9; ИЛ-13 и ИЛ-4; ИЛ-13 и ИЛ-5; ИЛ-13 и ИЛ-25; ИЛ-13 и TARC; ИЛ-13 и MDC; ИЛ-13 и MIF; ИЛ-13 и ТФР-β; ИЛ-13 и агонист ЛГР; ИЛ-13 и CL25; ИЛ-13 и SPRR2a; ИЛ-13 и SPRR2b; и ИЛ-13 и ADAM8. Настоящим изобретением также предусмотрены FIT-Ig, способные к связыванию одной или более вовлеченных в астму мишеней, выбранных из группы, состоящей из КСФ1 (МКСФ), КСФ2 (ГМ-КСФ), КСФ-3 (ГКСФ), ФРФ-2, ИФН-А1, ИФН-В1, ИФН-G, гистамина и рецепторов гистамина, ИЛ-1А, ИЛ-1В, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-11, ИЛ-12А, ИЛ-12 В, ИЛ-13, ИЛ-14, ИЛ-15, ИЛ-16, ИЛ-17, ИЛ-18, ИЛ-19, KITLG, ТРФ-В, ИЛ-2RА, ИЛ-4R, ИЛ-5RA, ИЛ-8RА, ИЛ-8RВ, ИЛ-12RВ1, ИЛ-12RB2, ИЛ-13RА1, ИЛ-13RА2, ИЛ-18R1, тимического стромального лимфопоэтина TSLP, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL17, CCL18, CCL19, CCL20, CCL22, CCL24, CX3CL1, CXCL1, CXCL2, CXCL3, XCL1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CX3CR1, GPR2, XCR1, FOS, GATA3, JAK1, JAK3, STAT6, ТВХ21, ТФР-В1, ФНО-SF6, YY1, CYSLTR1, FCER1A, FCER2, LTB4R, TB4R2, LTBR и хитиназы.
[00354] Ревматоидный артрит (РА), системное заболевание, характеризуется хронической воспалительной реакцией в синовиальной оболочке суставов и ассоциирован с дегенерацией хряща и эрозией околосуставной кости. Множество провоспалительных цитокинов, в том числе ФНО, хемокины и факторы роста, экспрессируются в пораженных заболеванием суставах. Было показано, что системное введение антитела против ФНО или слитого белка растворимого рецептора фактора некроза опухоли (ррФНО) в моделях РА на мышах оказывает противовоспалительное действие и защитное действие на суставы. Клинические исследования, в которых активность ФНО у пациентов с РА блокировали путем внутривенного введения инфликсимаба (Harriman G, Harper LK, Schaible TF. 1999 Summary of clinical trials in rheumatoid arthritis using infliximab, an anti-TNFalpha treatment. Ann Rheum Dis 58 Suppl 1:I61-4.), химерного моноклонального антитела (mAB) против ФНО, подтвердили, что ФНО регулирует продуцирование ИЛ-6, ИЛ-8, МСР-1 и ФРЭС, рекрутинг иммунных и воспалительных клеток в суставы, ангиогенез и снижение уровней матриксных металлопротеиназ 1 и 3 в крови. Улучшение понимания пути воспаления при ревматоидном артрите привело к идентификации других терапевтических мишеней, вовлеченных в ревматоидный артрит. Многообещающие варианты лечения, например, антагонисты интерлейкина-6 (MRA), CTLA4Ig (абатасепт, Genovese Мс et al., 2005 Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition. N Engl J Med. 353:1114-23.), а также направленная против В-клеток терапия (ритуксимаб, Okamoto Н, Kamatani N. 2004 Rituximab for rheumatoid arthritis. N Engl J Med. 351:1909) уже тестировались в рандомизированных контролируемых испытаниях в последние годы. Были идентифицированы и другие цитокины, обеспечивающие, как было показано, преимущества в моделях на животных, в том числе интерлейкин-15, интерлейкин-17 и интерлейкин-18, и в настоящее время идут клинические испытания указанных агентов. Терапия антителами с комбинированной двойной специфичностью против ФНО и другого медиатора потенциально способна значительно усиливать клиническую эффективность и/или охват пациентов. Например, блокирование и ФНО, и ФРЭС может потенциально устранять воспаление и ангиогенез, оба из которых вовлечены в патофизиологию РА. Также предусмотрено блокирование специфическими Ig FIT-Ig других пар мишеней, вовлеченных в РА, в том числе, но не ограничиваясь перечисленными, ФНО и ИЛ-18; ФНО и ИЛ-12; ФНО и ИЛ-23; ФНО и ИЛ-1-бета; ФНО и MIF; ФНО и ИЛ-17; и ФНО и ИЛ-15. Помимо рутинных оценок безопасности для указанных пар мишеней, при выборе наилучших пар мишеней могут требоваться и быть целесообразными специфические тесты на степень иммуносупрессии (см. Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization (1992), 77 99-102; Hart et al., Journal of Allergy and Clinical Immunology (2001), 108(2), 250-257). Оценка того, подходит ли молекула Ig FIT-Ig для лечения ревматоидного артрита, может быть проведена в доклинических моделях РА на животных, например, в модели индуцированного коллагеном артрита на мышах. Другие подходящие модели также хорошо известны в данной области техники (см. Brand DD., Comp Med. (2005) 55(2): 114-22).
[00355] Отличительной иммунопатогенной чертой системной красной волчанки (СКВ) является активация поликлональных В-клеток, которая приводит к гиперглобулинемии, продуцированию аутоантител и образованию иммунных комплексов. Фундаментальная аномалия заключается, по-видимому, в неспособности Т-клеток подавлять недопустимые клоны В-клеток из-за генерализованной дисрегуляции Т-клеток. Кроме того, взаимодействию В- и Т-клеток содействует ряд цитокинов, таких как ИЛ-10, а также костимулирующих молекул, таких как CD40 и CD40L, В7 и CD28 и CTLA-4, которые инициируют второй сигнал. Указанные взаимодействия наряду с нарушением фагоцитарного клиренса иммунных комплексов и апоптотического материала, продлевают иммунный ответ, приводя к повреждению тканей. Перечисленные ниже мишени могут быть вовлечены в СКВ и потенциально могут быть использованы для способа терапевтического вмешательства, задействующего FIT-Ig: терапии, нацеленной на В-клетки - CD-20, CD-22, CD-19, CD28, CD4, CD80, лейкоцитарный антиген человека HLA-DRA, ИЛ-10, ИЛ-2, ИЛ-4, рецепторы суперсемейства рецепторов фактора некроза опухолей ФHO-RSF5, ФHO-RSF6, ФНО-SF5, ФHO-SF6, BLR1, гистондезацетилазы HDAC4, HDAC5, HDAC7A, HDAC9, ICOSL, иммуноглобулинсвязывающий белок IGBP1, MS4A1, RGS1, SLA2, CD81, ИФН-В1, ИЛ-10, рецепторы суперсемейства рецепторов фактора некроза опухолей ФНО-RSF5, ФНО-RSF7, ФНО-SF5, индуцированная активацией цитидиндезаминаза (AICDA), В-клеточный линкерный белок BLNK, GALNAC4S-6ST, гистондезацетилазы HDAC4, HDAC5, HDAC7A, HDAC9, ИЛ-10, ИЛ-11, ИЛ-4, INHA, ингибин бета A (INHBA), KLF6, рецептор суперсемейства рецепторов фактора некроза опухолей ФНО-RSF7, CD28, CD38, CD69, CD80, CD83, CD86, дипептидилпептидаза DPP4, FCER2, ИЛ-2RA, рецепторы суперсемейства рецепторов фактора некроза опухолей ФНО-RSF8, ФНО-SF7, CD24, CD37, CD40, CD72, CD74, CD79A, CD79B, CR2, ИЛ-1R2, интегрин альфа-2 ITGA2, интегрин альфа-3 ITGA3, MS4A1, ST6GAL1, CD1С, углеводная сульфотрансфераза 10 (CHST10), лейкоцитарные антигены человека HLA-A и HLA-DRA, и экто-5'-нуклеотидаза (NT5E); костимулирующих сигналов - CTLA-4 или В7.1/В7.2; ингибирования выживания В-клеток - BlyS, BAFF; инактивации комплемента - С5; модуляции цитокинов: ключевой принцип заключается в том, что суммарный биологический ответ в любой ткани представляет собой результат уравновешивания локальных уровней провоспалительных или противовоспалительных цитокинов (см. Sfikakis РР et al., 2005 Curr Opin Rheumatol 17:550-7). СКВ считают управляемым Th-2 заболеванием, характеризующимся документированным повышением уровней ИЛ-4, ИЛ-6, ИЛ-10 в сыворотке. Также предусмотрены Ig FIT-Ig, способные к связыванию одной или более мишеней, выбранных из группы, состоящей из ИЛ-4, ИЛ-6, ИЛ-10, ИФН-α и ФНО-α. Комбинация мишеней, описанных выше, будет усиливать терапевтическую эффективность при СКВ, что может быть протестировано в нескольких доклинических моделях волчанки (см. Peng SL (2004) Methods Mol Med.; 102:227-72).
[00356] Рассеянный склероз (PC) представляет собой комплексное заболевание человека аутоиммунного типа с преимущественно неизвестной этиологией. Основная патология при рассеянном склерозе представлена повсеместным иммунологическим разрушением основного белка миелина (ОБМ) в нервной системе. PC представляет собой заболевание с комплексными патологиями, включающее инфильтрацию CD4+ и CD8+ Т-клетками и ответ в центральной нервной системе. Была описана экспрессия в ЦНС при PC как цитокинов, так и реакционноспособных соединений азота и костимуляторных молекул. Большое значение имеют иммунологические механизмы, которые вносят вклад в развитие аутоиммунитета. В частности, важными для идентификации терапевтических мишеней областями являются экспрессия антигенов, взаимодействие цитокинов и лейкоцитов, и регуляторные Т-клетки, которые помогают обеспечивать баланс/модулировать другие Т-клетки, такие как клетки Тh1 и Th2.
[00357] ИЛ-12 представляет собой провоспалительный цитокин, продуцируемый АПК и способствующий дифференцировке эффекторных клеток Тh1. ИЛ-12 продуцируется в развивающихся очагах заболевания у пациентов с PC, а также у пораженных экспериментальным аутоиммунным энцефаломиелитом (ЭАЭ) животных. Ранее было показано, что вмешательство в пути ИЛ-12 эффективно предотвращает ЭАЭ у грызунов, и что нейтрализация ИЛ-12р40 in vivo с применением mAb против ИЛ-12 оказывает благоприятные эффекты в модели индуцированного миелином ЭАЭ у обыкновенных игрунок.
[00358] TWEAK является представителем семейства ФИО, конститутивно экспрессируемым в центральной нервной системе (ЦНС), обладающим провоспалительными, пролиферативными или апоптотическими эффектами в зависимости от типов клеток. Его рецептор, Fn14, экспрессируется в ЦНС эндотелиальными клетками, реактивными астроцитами и нейронами. Экспрессия мРНК TWEAK и Fn14 увеличивалась в спинном мозге при экспериментальном аутоиммунном энцефаломиелите (ЭАЭ). Лечение антителом против TWEAK при индуцированном миелин-олигодендроглиоцитарным гликопротеином (MOG) ЭАЭ у мышей C57BL/6 приводило к снижению тяжести заболевания и инфильтрации лейкоцитами при лечении мышей после фазы примирования.
[00359] Согласно одному аспекту настоящее изобретение относится к молекулам Ig FIT-Ig, способным к связыванию одной или более, предпочтительно двух мишеней, выбранных из группы, состоящей из ИЛ-12, TWEAK, ИЛ-23, CXCL13, CD40, CD40L, ИЛ-18, ФРЭС, VLA-4, ФНО, CD45RB, CD200, ИФН-гамма, ГМ-КСФ, ФРФ-, С5, CD52, и CCR2. Предпочтительный вариант реализации включает FIT-Ig против ИЛ-12/TWEAK с двойной специфичностью в качестве терапевтического агента, благоприятного для лечения PC. В данной области техники известны несколько моделей на животных для оценки полезности молекул FIT-Ig для лечения PC (см. Steinman L, et al., (2005) Trends Immunol. 26(11):565-71; Lublin FD., et al., (1985) Springer Semin Immunopathol. 8(3):197-208; Genain CP, et al., (1997) J Mol Med. 75(3):187-97; Tuohy VK, et al., (1999) J Exp Med. 189(7): 1033-42; Owens T, et al., (1995) Neurol Clin. 13(l):51-73; и 't Hart BA, et al., (2005) J Immunol 175(7):4761-8. Помимо рутинных оценок безопасности для указанных пар мишеней, при выборе наилучших пар мишеней могут требоваться и быть целесообразными специфические тесты на степень иммуносупрессии (см. Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization (1992), 77 99-102; Jones R. 2000 Rovelizumab (ICOS Corp). IDrugs. 3(4):442-6).
[00360] Патофизиологию сепсиса инициируют компоненты внешней мембраны как грамотрицательных организмов (липополисахарид [ЛПС], липид А, эндотоксин), так и грамположительных организмов (липотейхоевая кислота, пептидогликан). Указанные компоненты внешней мембраны способны связываться с рецептором CD14 на поверхности моноцитов. С помощью недавно описанных Toll-подобных рецепторов сигнал затем передается в клетку, что приводит к последующему продуцированию провоспалительных цитокинов, фактора некроза опухоли альфа (ФНО-альфа) и интерлейкина-1 (ИЛ-I). Генерализованные воспалительный и иммунный ответ представляют собой важнейшие характеристики септического шока и играют центральную роль в патогенезе повреждения тканей, мультиорганной недостаточности и смерти, индуцируемых сепсисом. Цитокины, в частности, фактор некроза опухоли (ФНО) и интерлейкин (ИЛ)-1, как было показано, являются критически важными медиаторами септического шока. Указанные цитокины оказывают прямой токсический эффект на ткани; они также активируют фосфолипазу А2. Указанные и другие эффекты приводят к увеличению концентраций фактора активации тромбоцитов, стимуляции активности синтазы оксида азота, стимуляции инфильтрации тканей нейтрофилами и стимуляции активности нейтрофилов.
[00361] Лечение сепсиса и септического шока остается серьезной клинической проблемой; в недавних проспективных исследований модификаторов биологического отклика (а именно, направленных против ФНО, против MIF), целью которых был воспалительный ответ, продемонстрирована лишь умеренная клиническая польза. В последнее время возник интерес к видам терапии, направленным на обращение сопутствующих периодов подавления иммунитета. Исследования на экспериментальных животных и пациентах в критическом состоянии продемонстрировали, что усиление апоптоза в лимфоидных органах и некоторых паренхиматозных тканях вносит вклад в указанное подавление иммунитета, анергию и дисфункцию систем органов. При септическом синдроме апоптоз лимфоцитов может быть запущен в результате отсутствия ИЛ-2 или высвобождения глюкокортикоидов, гранзимов или так называемых «цитокинов смерти»: фактора некроза опухоли альфа или лиганда Fas. Апоптоз продолжается в результате аутоактивации цитозольных и/или митохондриальных каспаз, на которую могут влиять проапоптотические и антиапоптотические представители семейства Всl-2. У экспериментальных животных лечение ингибиторами апоптоза может не только предотвращать апоптоз лимфоидных клеток; оно может также улучшать исход. Хотя перспектива клинических испытаний антиапоптотических агентов пока остается отдаленной, в основном ввиду технических трудностей, ассоциированных с их введением и нацеливанием на ткани, ингибирование апоптоза лимфоцитов представляет собой привлекательную терапевтическую мишень у пациентов с сепсисом. Сходным образом, нацеливание агента с двойной специфичностью как на воспалительный медиатор, так и на медиатор апоптоза может обеспечивать дополнительное преимущество. Согласно одному аспекту настоящее изобретение относится к Ig FIT-Ig, способным к связыванию одной или более мишеней, вовлеченных в сепсис, предпочтительно, двух мишеней, выбранных из группы, состоящей из ФНО, ИЛ-1, MIF, ИЛ-6, ИЛ-8, ИЛ-18, ИЛ-12, ИЛ-23, FasL, ЛПС, Toll-подобных рецепторов, Toll-подобного рецептора TLR-4, тканевого фактора, МIР-2, аденозинового А2А-рецептора (ADORA2A), CASP1, CASP4, ИЛ-10, ИЛ-1В, NFKB1, PROC, рецептора суперсемейства рецепторов фактора некроза опухолей ФНО-RSF1A, КСФ-3, ИЛ-10, ИЛ-1В, ИЛ-6, аденозинового А2А-рецептора (ADORA2A), CCR3, ИЛ-10, ИЛ-1 В, ИЛ-1RN, MIF, NFKB1, рецептора фактора активации тромбоцитов (PTAFR), Toll-подобных рецепторов TLR2 и TLR4, GPR44, гемоксигеназы НМОХ1, мидкина, IRAK1, NFKB2, SERPINA1, SERPINE1 и TREM1. Оценка эффективности таких FIT-Ig при сепсисе может осуществляться в доклинических моделях на животных, известных в данной области техники (см. Buras JA, et al., (2005) Nat Rev Drug Discov. 4(10):854-65 и Calandra T, et al., (2000) Nat Med. 6(2): 164-70).
[00362] Хронические нейродегенеративные заболевания обычно представляют собой возрастные заболевания, характеризующиеся прогрессирующей утратой нейрональных функций (смерть нейронов, демиелинизация), утратой подвижности и памяти. Новые данные о механизмах, лежащих в основе хронических нейродегенеративных заболеваний (например, болезни Альцгеймера), указывают на комплексную этиологию; обнаружены различные факторы, которые вносят вклад в их развитие и прогрессирование, например, возраст, гликемический статус, продуцирование и мультимеризация амилоида, накопление конечных продуктов усиленного гликозилирования (AGE), которые связываются с соответствующим рецептором RAGE (рецептор AGE), повышенным окислительным стрессом в головном мозге, снижение мозгового кровообращения, нейровоспаление, включающее высвобождение воспалительных цитокинов и хемокинов, нейрональная дисфункция и активация микроглии. Соответственно, при указанных хронических нейродегенеративных заболеваниях происходит комплексное взаимодействие нескольких типов клеток и медиаторов. Стратегии лечения таких заболеваний ограничены и в основном представлены либо блокированием воспалительных процессов неспецифическими противовоспалительными агентами (например, кортикостероидами, ингибиторами СОХ), либо агентами для предотвращения утраты нейронов и/или синаптических функций. Указанные виды лечения неспособны остановить прогрессирование заболевания. Последние исследования предполагают, что более целевая терапия, например, антителами к растворимому А-β-пептиду (в том числе к олигомерным формам А-β) может не только содействовать остановке прогрессирования заболевания, но и способствовать сохранению памяти. Указанные предварительные наблюдения предполагают, что специфическая терапия, нацеленная более чем на один медиатор заболевания (например, на А-β и провоспалительный цитокин, такой как ФНО) может обеспечивать даже большую терапевтическую эффективность при хронических нейродегенеративных заболеваниях, чем наблюдаемая при нацеливании на один механизм заболевания (например, на растворимый А-β по отдельности) (см. С.Е. Shepherd, et al, Neurobiol Aging. 2005 Oct 24; Nelson RB., Curr Pharm Des. 2005; 11:3335; William L. Klein.; Neurochem Int. 2002; 41:345; Michelle С Janelsins, et al., J Neuroinflammation. 2005; 2:23; Soloman В., Curr Alzheimer Res. 2004; 1:149; Igor Klyubin, et al., Nat Med. 2005; 11:556-61; Arancio O, et al., EMBO Journal (2004) 1-10; Bornemann KD, et al., Am J Pathol. 2001; 158:63; Deane R, et al., Nat Med. 2003; 9:907-13; и Eliezer Masliah, et al., Neuron. 2005; 46:857).
[00363] Молекулы FIT-Ig согласно настоящему изобретению могут связывать одну или более мишеней, вовлеченных в хронические нейродегенеративные заболевания, такие как болезнь Альцгеймера. Такие мишени включают, не ограничиваясь перечисленными, любой медиатор, растворимый или расположенный на поверхности клеток, вовлеченный в патогенез БА, например, AGE (S100A, амфотерин), провоспалительные цитокины (например, ИЛ-1), хемокины (например, МСР 1), молекулы, которые ингибируют регенерацию нервов (например, Nogo, RGM А), молекулы, усиливающие рост нейритов (нейротрофины). Эффективность молекул FIT-Ig может быть валидирована в доклинических моделях на животных, например, на трансгенных мышах, у которых происходит сверхэкспрессия предшественника амилоидного белка или RAGE и развиваются симптомы, подобные симптомам при болезни Альцгеймера. Кроме того, могут быть сконструированы молекулы FIT-Ig и их эффективность может быть протестирована в моделях на животных; может быть выбран наилучший терапевтический FIT-Ig для тестирования на пациентах-людях. Возможно также применение молекул FIT-Ig для лечения других нейродегенеративных заболеваний, таких как болезнь Паркинсона. В патологию при болезни Паркинсона вовлечен альфа-синуклеин. FIT-Ig, способные к нацеливанию на альфа-синуклеин и воспалительные медиаторы, такие как ФНО, ИЛ-1, МСР-1, могут оказаться эффективными для терапии болезни Паркинсона, и такие FIT-Ig предусмотрены настоящим изобретением.
[00364] Несмотря на возрастающее понимание механизмов патологии, повреждение спинного мозга (ПСМ) остается разрушительным состоянием и представляет собой медицинское показание, характеризующееся высокой медицинской потребностью. Чаще всего повреждение спинного мозга представлено контузионным или компрессионным повреждением; первичное повреждение обычно сопровождается механизмами вторичного повреждения (воспалительные медиаторы, например, цитокины и хемокины), отягощающими исходное повреждение и приводящими к значимому, иногда более чем 10-кратному, увеличению очага поражения. Указанные первичные и вторичные механизмы при ПСМ очень сходны с механизмами повреждения головного мозга, вызванного другими причинами, например, инсультом. Удовлетворительного лечения не существует, и болюсные инъекции высоких доз метилпреднизолона (MP) представляют собой единственный используемый вид терапии в пределах короткого 8-часового временного интервала после повреждения. Указанное лечение, однако, предназначено исключительно для предотвращения вторичного повреждения без обеспечения сколько-либо значимого функционального восстановления. Оно является объектом резкой критики ввиду отсутствия однозначной эффективности и наличия тяжелых нежелательных явлений, таких как иммуносупрессия, сопровождаемая инфекциями и серьезными гистопатологическими изменениями в мышцах. Других одобренных лекарственных средств, биологических средств или малых молекул, стимулирующих эндогенный регенеративный потенциал, не существует, однако в последние годы была показана эффективность перспективных принципов лечения и кандидатных лекарственных средств в моделях ПСМ на животных. Отсутствие функционального восстановления при ПСМ у человека в значительной степени вызвано факторами, ингибирующими рост нейритов, в сайтах поражения, в рубцовой ткани, в миелине, а также на ассоциированных с повреждением клетках. Такие факторы представлены миелин-ассоциированными белками NogoA, OMgp и MAG, RGM А, ассоциированные с рубцами ХСПГ (хондроитинсульфат-протеогликаны) и ингибиторные факторы реакционноспособных астроцитов (некоторые семафорины и эфрины). Однако в сайте поражения обнаруживаются не только ингибирующие рост молекулы, но и стимулирующие рост нейритов факторы, такие как нейротрофины, ламинин, L1 и другие. Наличие указанного ансамбля ингибирующих рост нейритов и стимулирующих рост молекул может объяснять, почему блокирование отдельных факторов, таких как NogoA или RGM А, приводило к значимому функциональному восстановлению в моделях ПСМ на грызунах, поскольку снижение ингибирующего влияния может сдвигать равновесие от ингибирования роста в сторону стимуляции роста. Однако восстановление, наблюдаемое при блокировании одной ингибирующей разрастание нейритов молекулы, было неполным. Для достижения более быстрого и выраженного восстановления может быть желательно либо блокировать две ингибирующие разрастание нейритов молекулы, например, Nogo и RGM А, или блокировать ингибирующую разрастание нейритов молекулу и усилить функции стимулирующей разрастание нейритов молекулы, например, Nogo и нейротрофинов, или блокировать ингибирующую разрастание нейритов молекулу, например, Nogo, и провоспалительную молекулу, например, ФНО (см. McGee AW, et al., Trends Neurosci. 2003; 26:193; Marco Domeniconi, et al., J Neurol Sci. 2005; 233:43; Milan Makwanal, et al., FEBS J. 2005; 272:2628; Barry J. Dickson, Science. 2002; 298:1959; Felicia Yu Hsuan Teng, et al., J Neurosci Res. 2005; 79:273; Таrа Karnezis, et al., Nature Neuroscience 2004; 7, 736; Gang Xu, et al., J. Neurochem. 2004; 91; 1018).
[00365] Предусмотрены также другие FIT-Ig, способные связывать пары мишеней, такие как NgR и RGM A; NogoA и RGM A; MAG и RGM A; OMGp и RGM A; RGM А и RGM В; ХСПГ и RGM А; аггрекан, мидкин, нейрокан, версикан, фосфакан, Те38 и ФНО-а; специфические антитела к Аβ-глобуломеру в комбинации с антителами, стимулирующими спраутинг дендритов и аксонов. Патология дендритов представляет собой очень ранний признак БА; известно, что NOGO А ограничивает рост дендритов. Антитела такого типа могут быть скомбинированы с любыми антителами к кандидатным белкам ПСМ (миелиновые белки). Другие мишени FIT-Ig могут включать любую комбинацию NgR-p75, NgR-Troy, NgR-Nogo66 (Nogo), NgR-Lingo, Lingo-Troy, Lingo-p75, MAG или Omgp. Кроме того, мишени могут также включать любой медиатор, растворимый или расположенный на поверхности клеток, вовлеченный в ингибирование нейритов, например, Nogo, Ompg, MAG, RGM А, семафорины, эфрины, растворимый A-b, провоспалительные цитокины (например, ИЛ-1), хемокины (например, MIP 1а), молекулы, которые ингибируют регенерацию нервов. Эффективность молекул, направленных против Nogo/против RGM А, или аналогичного FIT-Ig может быть валидирована в доклинических моделях повреждения спинного мозга на животных. Кроме того, указанные молекулы FIT-Ig могут быть сконструированы и их эффективность может быть протестирована в моделях на животных; наилучший терапевтический FIT-Ig может быть выбран для тестирования на пациентах-людях. Кроме того, могут быть сконструированы молекулы FIT-Ig, нацеленные на два отдельных сайта связывания лиганда на одном рецепторе, например, рецепторе Nogo, который связывает три лиганда Nogo, Ompg и MAG, и RAGE, который связывает А-b и S100 А. Кроме того, ингибиторы разрастания нейритов, например, Nogo и рецептор Nogo, также играют роль в предотвращении регенерации нервов при иммунологических заболеваниях, таких как рассеянный склероз. Ингибирование взаимодействия Nogo с рецептором Nogo, как было показано, улучшает восстановление в моделях рассеянного склероза на животных. Соответственно, молекулы FIT-Ig, который могут блокировать функцию одного иммунного медиатора, например, цитокина, такого как ИЛ-12, и молекулы ингибитора разрастания нейритов, например, Nogo или RGM, могут обеспечивать более быстрое действие и большую эффективность, чем молекула, блокирующая отдельно либо иммунный медиатор, либо ингибитор разрастания нейритов.
[00366] Терапия моноклональными антителами возникла как важный метод терапии рака (von Mehren М, et al., 2003 Monoclonal antibody therapy for cancer. Annu Rev Med.; 54:343-69). Антитела могут проявлять противоопухолевый эффекты за счет индукции апоптоза, перенаправленной цитотоксичности, вмешательства во взаимодействия лигандов с рецепторами, или предотвращения экспрессии белков, критически важных для неопластического фенотипа. Кроме того, антитела могут быть нацелены на компоненты микроокружения опухоли, обеспечивая нарушение жизненно важных структур, например, образования ассоциированной с опухолью сосудистой сети. Антитела могут также быть нацелены на рецепторы, лиганды которых представляют собой факторы роста, например, на рецептор эпидермального фактора роста. Указанное антитело, соответственно, ингибирует связывание естественных лигандов, которые стимулируют рост клеток, с целевыми опухолевыми клетками. Как вариант, антитела могут индуцировать антиидиотипическую сеть, комплемент-опосредованную цитотоксичность или антителозависимую клеточную цитотоксичность (АЗКЦ). Применение антитела с двойной специфичностью, нацеленного на два отдельных опухолевых медиаторов, предположительно будет обеспечивать дополнительное преимущество по сравнению с моноспецифической терапией. Также предусмотрены Ig FIT-Ig, способные к связыванию следующих пар мишеней для лечения онкологического заболевания: ИФР-1 и ИФР-2; ИФР-1/2 и Еrb2В; рФРЭС и рЭФР; CD20 и CD3, CD138 и CD20, CD38 и CD20, CD38 и CD138, CD40 и CD20, CD138 и CD40, CD38 и CD40. Другие комбинации мишеней включают один или более представителей семейства ЭФР/еrb-2/еrb-3. Другие вовлеченные в онкологические заболевания мишени (одна или более), которые могут быть связаны Ig FIT-Ig, включают, однако не ограничиваясь перечисленными, выбранные из группы, состоящей из: CD52, CD20, CD19, CD3, CD4, CD8, ВМР6, ИЛ-12А, ИЛ-1А, ИЛ-1B, ИЛ-2, ИЛ-24, INHA, ФНО, ФНО-SF10, ВМР6, ЭФР, ФРФ-1, ФРФ-10, ФРФ-11, ФРФ-12, ФРФ-13, ФРФ-14, ФРФ-16, ФРФ-17, ФРФ-18, ФРФ-19, ФРФ-2, ФРФ-20, ФРФ-21, ФРФ-22, ФРФ-23, ФРФ-3, ФРФ-4, ФРФ-5, ФРФ-6, ФРФ-7, ФРФ-8, ФРФ-9, GRP, ИФР-1, ИФР-2, ИЛ-12А, ИЛ-1А, ИЛ-1В, ИЛ-2, INHA, ТФР-А, ТФР-В1, ТФР-В2, ТФР-В3, ФРЭС, CDK2, ЭФР, ФРФ-10, ФРФ-18, ФРФ-2, ФРФ-4, ФРФ-7, ИФР-1, рИФР-1, ИЛ-2, ФРЭС, BCL2, CD164, ингибиторов циклин-зависимой киназы CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2B, CDKN2C, CDKN3, GNRH1, связывающего инсулиноподобный фактор роста белка IGFBP6, ИЛ-1А, ИЛ-1B, ODZ1, PAWR, PLG, ТФР-В1I1, AR, BRCA1, CDK3, CDK4, CDK5, CDK6, CDK7, CDK9, E2F1, рЭФР, ENO1, ERBB2, ESR1, ESR2, связывающего инсулиноподобный фактор роста белка IGFBP3, связывающего инсулиноподобный фактор роста белка IGFBP6, ИЛ-2, инсулиноподобного фактора 4 (INSL4), MYC, NOX5, NR6A1, PAP, ядерного антигена пролиферирующих клеток (PCNA), PRKCQ, PRKD1, PRL, ТР53, ФРФ-22, ФРФ-23, ФРФ-9, связывающего инсулиноподобный фактор роста белка IGFBP3, ИЛ-2, INHA, KLK6, ТР53, CHGB, GNRH1, ИФР-1, ИФР-2, INНА, инсулиноподобного фактора 3 (INSL3), инсулиноподобного фактора 4 (INSL4), PRL, KLK6, SHBG, NR1D1, NR1H3, NR1I3, NR2F6, NR4A3, ESR1, ESR2, NR0B1, NR0B2, NR1D2, NR1H2, NR1H4, NR1I2, NR2C1, NR2C2, NR2E1, NR2E3, NR2F1, NR2F2, NR3C1, NR3C2, NR4A1, NR4A2, NR5A1, NR5A2, NR6A1, ПГР, RARB, ФРФ-1, ФРФ-2, ФРФ-6, KLK3, KRT1, АРОС1, BRCA1, CHGA, CHGB, CLU, COL1A1, COL6A1, ЭФР, ERBB2, ERK8, ФРФ-1, ФРФ-10, ФРФ-11, ФРФ-13, ФРФ-14, ФРФ-16, ФРФ-17, ФРФ-18, ФРФ-2, ФРФ-20, ФРФ-21, ФРФ-22, ФРФ-23, ФРФ-3, ФРФ-4, ФРФ-5, ФРФ-6, ФРФ-7, ФРФ-8, ФРФ-9, GNRH1, ИФР-1, ИФР-2, связывающего инсулиноподобный фактор роста белка IGFBP3, связывающего инсулиноподобный фактор роста белка IGFBP6, ИЛ-12А, ИЛ-1А, ИЛ-1В, ИЛ-2, ИЛ-24, INHA, инсулиноподобных факторов 3 (INSL3) и 4 (INSL4), KLK10, KLK12, KLK13, KLK14, KLK15, KLK3, KLK4, KLK5, KLK6, KLK9, ММП2, ММП9, MSMB, NTN4, ODZ1, РАР, УАП, PRL, PSAP, SERPINA3, SHBG, ТФР-А, TIMP3, CD44, CDH1, CDH10, CDH19, CDH20, CDH7, CDH9, CDH1, CDH10, CDH13, CDH18, CDH19, CDH20, CDH7, CDH8, CDH9, ROBO2, CD44, ИЛ-K, интегрина альфа-1 ITGA1, АПК, CD164, COL6A1, MTSS1, РАР, ТФР-В1I1, AGR2, индуцируемого андрогенами белка 1 (AIG1), АKАР1, АKАР2, CANT1, CAV1, CDH12, CLDN3, CLN3, CYB5, CYC1, DAB2IP, DES, DNCL1, ELAC2, ENO2, ENO3, FASN, FLJ12584, FLJ25530, GAGEB1, GAGEC1, GGT1, GSTP1, HIP1, HUMCYT2A, ИЛ-29, K6HF, KАI1, KRT2A, MIB1, PART1, PATE, РСА3, PIAS2, PIK3CG, PPID, PR1, АСКП, SLC2A2, SLC33A1, SLC43A1, STEAP, STEAP2, тропомиозина ТРМ1, тропомиозина ТРМ2, TRPC6, ANGPT1, ANGPT2, ANPEP, ECGF1, EREG, ФРФ-1, ФРФ-2, FIGF, FLT1, JAG1, KDR, LAMA5, NRP1, NRP2, PGF, PLXDC1, STAB1, ФРЭС, ФРЭС-С, ANGPTL3, ВАI1, COL4A3, ИЛ-8, LAMA5, NRP1, NRP2, STAB1, ANGPTL4, РЕСАМ1, PF4, PROK2, SERPINF1, ФНО-АIР2, CCL11, CCL2, CXCL1, CXCL10, CXCL3, CXCL5, CXCL6, CXCL9, ИФН-А1, ИФН-В1, ИФН-G, ИЛ-1В, ИЛ-6, MDK, EDG1, EFNA1, EFNA3, EFNB2, ЭФР, ЕРНВ4, ФРФ-R3, ФРГ, ИФР-1, интегрина бета ITGB3, ТРФ-А, ТЕK, ТФР-А, ТФР-В1, ТФР-В2, ТФР-BR1, CCL2, CDH5, COL18A1, EDG1, ENG, интегрина альфа (ITGAV), интегрина бета-3 (ITGB3), THBS1, THBS2, BAD, BAG1, BCL2, циклинов CCNA1, CCNA2, CCND1, CCNE1, CCNE2, CDH1 (Е-кадгерина), ингибиторов циклин-зависимой киназы CDKN1B (p27Kip1), CDKN2A (p16INK4a), COL6A1, CTNNB1 β-катенина), CTSB (катепсина В), ERBB2 (Her-2), ESR1, ESR2, F3 (TF), FOSL1 (FRA-1), GATA3, GSN (гельзолина), связывающего инсулиноподобный фактор роста белка IGFBP2, ИЛ-2RА, ИЛ-6, ИЛ-6R, ИЛ-6SТ (гликопротеина 130), ITGA6 (интегрина α-6), JUN, KLK5, KRT19, МАР2K7 (c-Jun), MKI67 (Ki-67), ФРН-В (ФРН), рФРН, NME1 (NM23A), ПГР, УАП (uРА), гомолога фосфатазы и тензина (PTEN), CTLA-4, ОХ40, GITR, TIM-3, Lag-3, В7-Н3, В7-Н4, GDF8, CGRP, Lingo-1, ICOS, GARP, BTLA, CD160, ROR1, SERPINB5 (маспина), SERPINE1 (PAI-1), ТФР-А, THBS1 (тромбоспондина-1), TIE (Tie-1), рецептора суперсемейства рецепторов фактора некроза опухолей ФНО-RSF6 (Fas), ФНО-SF6 (FasL), ТОР2А (топоизомеразы Iia), ТР53, AZGP1 (цинк-а-гликопротеина), BPAG1 (плектина), ингибитора циклин-зависимой киназы CDKN1A (p21Wap1/Cip1), CLDN7 (клаудина-7), CLU (кластерина), ERBB2 (Неr-2), ФРФ-1, FLRT1 (фибронектина), π-субъединицы рецептора ГАМК (A) GABRP (GABAa), GNAS1, ID2, ITGA6 (интегрина α-6), ITGB4 (интегрина β-4), KLF5 (связывающего белка GC-бокса), KRT19 (кератина 19), KRTHB6 (специфического кератина волос II типа), MACMARCKS, МТ3 (металлотионектина-III), MUC1 (муцина), простагландин-эндопероксид-синтазы PTGS2 (СОХ-2), RAC2 (p21Rac2), S100A2, SCGB1D2 (липофилина В), SCGB2A1 (маммаглобина 2), SCGB2A2 (маммаглобина 1), SPRR1B (Spr1), THBS1, THBS2, THBS4 и ФНО-АIР2 (В94).
[00367] Согласно варианту реализации заболевания, лечение или диагностика которых могут быть проведены с применением композиций и способов, предложенных согласно настоящему изобретению, включают, не ограничиваясь перечисленными, первичный и метастатический рак, в том числе карциномы молочной железы, ободочной кишки, прямой кишки, легкого, ротоглотки, гортаноглотки, пищевода, желудка, поджелудочной железы, печени, желчного пузыря и желчевыводящих путей, тонкого кишечника, мочевыводящих путей (в том числе почек, мочевого пузыря и уротелия), женских половых путей (в том числе шейки матки, матки и яичников, а также хориокарциному и гестационную трофобластическую болезнь), мужских половых путей (в том числе опухоли предстательной железы, семенных пузырьков, яичек и зародышевых клеток), эндокринных желез (в том числе щитовидной, надпочечниковой и питуитарной желез) и кожи, а также гемангиомы, меланомы, саркомы (в том числе возникающие из костной ткани и мягких тканей, а также саркому Капоши), опухоли головного мозга, нервов, глаз и мозговых оболочек (в том числе астроцитомы, глиомы, глиобластомы, ретинобластомы, нейромы, нейробластомы, шванномы и менингиомы), солидные опухоли, возникающие из гематопоэтических злокачественных новообразований, таких как лейкозы, и лимфомы (как ходжкинские, так и неходжкинские лимфомы).
[00368] Согласно варианту реализации антитела согласно настоящему изобретению или их антигенсвязывающие части применяют для лечения рака или предотвращения метастазирования из опухолей, описанных в настоящем документе, либо отдельно, либо в комбинации с радиационной терапией и/или другими химиотерапевтическими агентами.
[00369] В соответствии с другим вариантом реализации настоящего изобретения иммунная эффекторная клетка человека принадлежит к лимфоидной линии клеток человека. Согласно указанному варианту реализации эффекторная клетка может предпочтительно представлять собой Т-клетку человека, В-клетку человека или естественную киллерную (NK) клетку человека. Предпочтительно, такие клетки оказывают либо цитотоксический, либо апоптотический эффект на целевую клетку. В частности, предпочтительно, указанная лимфоидная клетка человека представляет собой цитотоксическую Т-клетку, которая после активации оказывает цитотоксический эффект на целевую клетку. Соответственно, в соответствии с указанным вариантом реализации мобилизованная активность эффекторной клетки человека представлена цитотоксической активностью указанной клетки.
[00370] В соответствии с предпочтительным вариантом реализации активация цитотоксических Т-клеток может происходить путем связывания антигена CD3 в качестве эффекторного антигена на поверхности цитотоксических Т-клеток биспецифическим антителом из указанного варианта реализации настоящего изобретения. Антиген CD3 человека присутствует и на хелперных Т-клетках, и на цитотоксических Т-клетках. CD3 человека представлен антигеном, который экспрессируется на Т-клетках как часть мультимолекулярного Т-клеточного комплекса и содержит три разных цепи: СD3-эпсилон, СD3-дельта и СD3-гамма.
[00371] Активация цитотоксического потенциала Т-клеток представляет собой комплексное явление, мобилизующее взаимосвязанные действия нескольких белков. Белок Т-клеточного рецептора («TCR») представляет собой мембраносвязанный содержащий дисульфидные связи гетеродимер, состоящий из двух разных гликопротеиновых субъединиц. TCR распознает и связывает чужеродный пептидный антиген, который, в свою очередь, был связан представителем очень разнообразных белков класса главного комплекса гистосовместимости («МНС») и презентирован, в связанном с МНС виде, на поверхности антигенпрезентирующих клеток («АПК»).
[00372] Хотя вариабельный TCR связывает чужеродный антиген согласно описанию выше, сигнал для Т-клетки о том, что произошло указанное связывание, зависит от присутствия других, инвариантных, сигнальных белков, ассоциированных с TCR. Указанные сигнальные белки в связанной форме в совокупности называются CD3-комплексом, а в настоящем документе в совокупности называются CD3-антигеном.
[00373] Активация Т-клеточной цитотоксичности, таким образом, обычно зависит прежде всего от связывания TCR с белком МНС, связанным, в свою очередь, с чужеродным антигеном, расположенным на отдельной клетке. Активация CD3-зависимого сигнального каскада, отвечающего за клональную экспансию Т-клеток и, в конечном итоге, Т-клеточной цитотоксичности могут произойти только после того, как произошло указанное начальное связывание TCR-MHC.
[00374] Однако связывание СD3-антигена человека первой или второй частью биспецифического антитела согласно настоящему изобретению активирует Т-клетки, обеспечивая цитотоксический эффект на другие клетки в отсутствие независимого связывания TCR-MHC. Это означает, что цитотоксичность Т-клеток может быть активирована клонально-независимым образом, т.е. независимо от специфического клона TCR, который несет указанная Т-клетка. Это позволяет активировать Т-клеточный компартмент полностью, вместо активации только специфических Т-клеток с определенной клональной идентичностью.
[00375] Соответственно, в свете вышеизложенного, согласно специфическому предпочтительному варианте реализации настоящего изобретения предложено биспецифическое антитело, эффекторный антиген которого представлен CD3-антигеном человека. Биспецифическое антитело в соответствии с указанным вариантом реализации настоящего изобретения может содержать в общей сложности два или три вариабельных домена антитела.
[00376] В соответствии с дополнительными вариантами реализации настоящего изобретения другие ассоциированные с лимфоидными клетками эффекторные антигены, связываемые биспецифическим антителом согласно настоящему изобретению, могут быть представлены антигеном CD16 человека, антигеном NKG2D человека, антигеном NKp46 человека, антигеном CD2 человека, антигеном CD28 человека или антигеном CD25 человека.
[00377] В соответствии с другим вариантом реализации настоящего изобретения эффекторная клетка человека принадлежит к миелоидной линии человека. Предпочтительно, указанная эффекторная клетка может представлять собой моноцит человека, нейтрофильный гранулоцит человека или дендритную клетку человека. Предпочтительно, такие клетки оказывают либо цитотоксический, либо апоптотический эффект на целевую клетку. Предпочтительные антигены согласно указанному варианту реализации, которые могут быть связаны биспецифическим антителом согласно настоящему изобретению, могут представлять собой антиген CD64 человека или антиген CD89 человека.
[00378] В соответствии с другим вариантом реализации настоящего изобретения целевой антиген представляет собой антиген, который экспрессируется исключительно на целевой клетке или эффекторной клетке при заболевании, но при этом либо не экспрессируется, либо экспрессируется на незначительном уровне, либо недоступен при здоровом состоянии. Примеры таких целевых антигенов, которые могут быть специфически связаны биспецифическим антителом согласно настоящему изобретению, могут предпочтительно быть выбраны из ЕрСАМ, CCR5, CD19, HER-2 neu, HER-3, HER-4, рЭФР, ПСМА, СЕА, MUC-1 (муцин), MUC2, MUC3, MUC4, MUC5AC, MUC5B, MUC7, βhCG, Lewis-Y, CD20, CD33, CD30, ганглиозида GD3, 9-O-Ацетил-CD3, GM2, Globo Н, фукозил-GM1, поли-СА, GD2, карбоангидразы IX (MN/CAIX), CD44v6, Sonic Hedgehog (Shh), Wue-1, плазмаклеточного антигена, (мембраносвязанного) IgE, хондроитинсульфат-протеогликана меланомы (MCSP), CCR8, предшественника ФНО-альфа, STEAP, мезотелина, антигена А33, антигена стволовых клеток предстательной железы (АСКП), Ly-6; десмоглеина 4, неоэпитопа Е-кадгерина, фетального рецептора ацетилхолина, CD25, маркера СА19-9, маркера СА-125 и рецептора II типа мюллеровой ингибирующей субстанции (MIS), sTn (сиалированного антигена Tn; TAG-72), FAP (антигена активации фибробластов), эндосиалина, рЭФР-vIII, LG, SAS и CD63.
[00379] В соответствии со специфическим вариантом реализации целевой антиген, который специфически связывает биспецифическое антитело, может представлять собой связанный с раком антиген, например, антиген, связанный со злокачественным состоянием. Такой антиген либо экспрессируется, либо доступен на злокачественной клетке, однако либо не присутствует, либо не присутствует на значимом уровне, либо недоступен на незлокачественной клетке. Соответственно, биспецифическое антитело согласно настоящему изобретению в соответствии с указанным вариантом реализации представляет собой биспецифическое антитело, стимулирующее активность иммунной эффекторной клетки человека против злокачественной целевой клетки, несущей целевой антиген, или обеспечивающее доступность указанного целевого антигена.
[00380] Генная терапия: Согласно конкретному варианту реализации предложено введение последовательностей нуклеиновых кислот, кодирующих связывающий белок согласно настоящему изобретению, или другой профилактический или терапевтический агент согласно настоящему изобретению, для лечения, предотвращения, управления или облегчения расстройства, или одного или более его симптомов, путем генной терапии. Генная терапия относится к терапии, осуществляемой путем введения субъекту экспрессированной или экспрессируемой нуклеиновой кислоты. Согласно указанному варианту реализации нуклеиновые кислоты продуцируют кодируемое ими антитело, или профилактический или терапевтический агент согласно настоящему изобретению, опосредующее(ий) профилактический или терапевтический эффект.
[00381] Любые доступные в данной области техники способы генной терапии могут применяться в способах согласно настоящему изобретению. Общую информацию о способах генной терапии можно найти в источниках: Goldspiel et al. (1993) Clin. Pharmacy 12:488-505; Wu and Wu (1991) Biotherapy 3:87-95; Tolstoshev (1993) Ann Rev. Pharmacol. Toxicol. 32:573-596; Mulligan (1993) Science 260:926-932; Morgan and Anderson (1993) Ann Rev. Biochem. 62:191-217; и May (1993) TIBTECH 11(5):155-215. Подходящие для применения способы рекомбинантной ДНК-технологии, общеизвестные в данной области техники, описаны в источниках: Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); и Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990). Подробное описание различных способов генной терапии приведено в патентной публикации США № US 20050042664.
[00382] Диагностика: Согласно описанному в настоящем документе изобретению также предложены варианты диагностического применения, в том числе, но не ограничиваясь перечисленными, диагностические способы анализа, диагностические наборы, содержащие один или более связывающих белков, и адаптированные способы и наборы для применения в автоматизированных и/или полуавтоматизированных системах. Предложенные способы, наборы, и адаптированные способы и наборы могут применяться для детекции, мониторинга и/или лечения заболевания или расстройства у индивидуума. Подробнее такое применение описано ниже.
[00383] А. Способ анализа: Согласно настоящему изобретению также предложен способ определения присутствия, количества или концентрации аналита или его фрагмента в тестируемом образце с применением по меньшей мере одного связывающего белка согласно описанию в настоящем документе. Любой подходящий анализ, известный в данной области техники, подходит для применения в указанном способе. Примеры включают, не ограничиваясь перечисленными, иммунологические анализы и/или способы, задействующие масс-спектрометрию. Иммунологические анализы, предложенные согласно настоящему изобретению, могут включать, в том числе, иммунологические сендвич-анализы, радиоиммунологический анализ (РИА), ферментный иммунологический анализ (ИФА), твердофазный иммуноферментный анализ (ELISA), иммунологические анализы на основе конкурентного ингибирования, флуоресцентный поляризационный иммунологический анализ (ФПИА), метод иммуноанализа с ферментативным усилением (EMIT), резонансный перенос энергии биолюминесценции (BRET) и гомогенный хемилюминесцентный анализ. Иммунологический анализ с хемилюминесцентными микрочастицами, в частности, с использованием автоматизированного анализатора ARCHITECT® (Abbott Laboratories, Абботт Парк, Иллинойс), представляет собой пример иммунологического анализа. Настоящим изобретением предусмотрены способы, задействующие масс-спектрометрию, включая, не ограничиваясь перечисленными, MALDI (матричная лазерная десорбция/ионизация) или SELDI (усиленная поверхностью лазерная десорбция/ионизация).
[00384] Для практической реализации настоящего изобретения предусмотрены способы взятия, манипуляций, обработки и анализа тестируемых биологических образцов с применением иммунологических анализов и масс-спектрометрии, хорошо известные специалисту в данной области техники (US 2009-0311253 A1).
[00385] В. Набор: Также предложен набор для анализа тестируемого образца на присутствие, количество или концентрацию аналита или его фрагмента в тестируемом образце. Указанный набор содержит по меньшей мере один компонент для анализа тестируемого образца на аналит или его фрагмент, и инструкции для анализа тестируемого образца на аналит или его фрагмент. Указанный по меньшей мере один компонент для анализа тестируемого образца на аналит или его фрагмент может включать композицию, содержащую связывающий белок, согласно описанию в настоящем документе, и/или связывающий белок против аналита (или фрагмент, вариант, или фрагмент варианта такого белка), который необязательно иммобилизован на твердой фазе. Необязательно, указанный набор может содержать калибратор или контроль, который может содержать выделенный или очищенный аналит. Указанный набор может содержать по меньшей мере один компонент для анализа тестируемого образца на аналит посредством иммунологического анализа и/или масс-спектрометрии. Компоненты набора, в том числе аналит, связывающий белок и/или связывающий белок против аналита, или их фрагменты, необязательно могут быть помечены любой известной в данной области техники детектируемой меткой. Материалы и способы для создания предусмотренного продукта при практической реализации настоящего изобретения известны специалисту в данной области техники (US 2009-0311253 A1).
[00386] С. Адаптация набора и способа: Набор (или его компоненты), а также способ определения присутствия, количества или концентрации аналита в тестируемом образце посредством анализа, такого как иммунологический анализ согласно описанию в настоящем документе, могут быть адаптированы для применения в различных автоматизированных и полуавтоматизированных системах (в том числе отличающихся тем, что твердая фаза содержит микрочастицу) согласно описанию, например, в патентах США №5089424 и №5006309, и коммерчески доступных, например, от Abbott Laboratories (Абботт Парк, Иллинойс) под названием ARCHITECT®. Другие доступные платформы от Abbott Laboratories включают, не ограничиваясь перечисленными, AxSYM®, IMx® (см., например, патент США №5294404, PRISM®, ИФА (гранулы) и Quantum™ II, а также другие платформы. Кроме того, анализы, наборы и компоненты набор могут применяться в других форматах, например, в электрохимических или других переносных или портативных аналитических системах. Настоящее изобретение, например, применимо к коммерческой портативной электрохимической системе для иммунологического анализа от Abbott (i-STAT®, Abbott Laboratories), позволяющей проводить иммунологические сендвич-анализы. Иммуносенсоры, способы их получения и использования в одноразовых тестовых устройствах описаны, например, в патентах США №5063081, №7419821 и №7682833; и публикациях США №20040018577, №20060160164 и US №20090311253. Специалистам в данной области техники будет хорошо понятно, что другие подходящие модификации и адаптации способов, описанных в настоящем документе, являются очевидными и могут быть осуществлены с применением подходящих эквивалентов без отступления от объема вариантов реализации, описанных в настоящем документе. Определенные варианты реализации, подробно описанные выше, станут понятнее после изучения приведенных ниже примеров, которые включены исключительно для иллюстрации и не предназначены для ограничения.
[00387] Хотя настоящее изобретение было достаточно подробно описано с привлечением иллюстраций и примеров для ясности понимания, специалисту в данной области техники, в свете изложенных принципов настоящего изобретения, будет хорошо понятно, что могут быть внесены определенные изменения и модификации без отступления от существа или объема прилагаемой формулы изобретения. Приведенные ниже примеры служат исключительно для иллюстрации, а не для ограничения. Специалисты в данной области техники смогут легко определить различные второстепенные показатели, которые могут быть изменены или модифицированы, с получением по существу аналогичных результатов.
ПРИМЕРЫ
Пример 1. Конструирование, экспрессия, очищение и анализ иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против ИЛ17/ИЛ-20
[00388] Чтобы продемонстрировать технологию FIT-Ig авторы настоящего изобретения получили группу молекул FIT-Ig против ИЛ-17/ИЛ-20: FIT1-Ig, FIT2-Ig и FIT3-Ig, все из которых содержат 3 разных полипептида, как показано на фиг. 1, где антиген А представляет собой ИЛ-17, а антиген В представляет собой ИЛ-20. ДНК-конструкция, использованная для получения FIT-Ig, способного к связыванию ИЛ-17 и ИЛ-20, изображена на фиг. 1В. Вкратце, исходные mAb включали два высокоаффинных антитела, против ИЛ-17 (клон LY) (патент США №7838638) и против ИЛ-20 человека (чИЛ-20, клон 15D2) (опубликованная заявка на патент США № US 2014/0194599). Для получения конструкции FIT-Ig №1 VL-CL LY прямо (FIT1-Ig) или посредством линкера из 3 аминокислот (FIT2-Ig) или 7 аминокислот (FIT3-Ig) сливали с N-концом тяжелой цепи 15D2 (как показано в таблице 1). Конструкция №2 представлена VH-CH1 LY, а 3-я конструкция представлена VL-CL 15D2. Указанными 3 конструкциями для каждого FIT-Ig котрансфицировали клетки клетки 293, что приводило к экспрессии и секреции белка FIT-Ig.
[00389] Авторы настоящего изобретения также получили группу молекул FIT-Ig против ИЛ-17/ИЛ-20: FIT4-Ig, FIT5-Ig и FIT6-Ig, каждая из которых содержит 2 разных полипептида, как показано на фиг. 2. ДНК-конструкции, использованные для получения FIT-Ig, способного к связыванию ИЛ-17 и ИЛ-20, изображены на фиг. 2В, где антиген А представляет собой ИЛ-17, а антиген В представляет собой ИЛ-20. Вкратце, исходные mAb включали два высокоаффинных антитела против ИЛ-17 (клон LY) и против чИЛ-20 (клон 15D2). Для получения конструкции FIT-Ig №1 VL-CL LY прямо (FIT4-Ig) или посредством линкера из 3 аминокислот (FIT5-Ig) или 7 аминокислот (FIT6-Ig) сливали с N-концом тяжелой цепи 15D2 (как показано в таблице 1). Для получения конструкции FIT-Ig №4 VH-CH1 LY прямо (FIT4-Ig) или посредством линкера из 3 аминокислот (FIT5-Ig) или 7 аминокислот (FIT6-Ig) сливали с N-концом легкой цепи 15D2. Указанными 2 ДНК-конструкциями (конструкция №1 и №4) для каждого FIT-Ig котрансфицировали клетки 293, что приводило к экспрессии и секреции белка FIT-Ig. Процедуры ПЦР-клонирования подробно описаны ниже.
Пример 1.1: Молекулярное клонирование молекул FIT-Ig против ИЛ-17/ИЛ-20:
[00390] Для клонирования конструкции №1 легкую цепь LY амплифицировали посредством ПЦР с применением прямых праймеров, которые отжигали на сигнальной последовательности легкой цепи, и обратных праймеров, которые отжигали на С-конце легкой цепи. Тяжелую цепь 15D2 амплифицировали посредством ПЦР с применением прямых праймеров, которые отжигали на N-конце VH 15D2, и обратных праймеров, которые отжигали на С-конце СН. Указанные 2 ПЦР-фрагмента очищали на геле и объединяли с применением ПЦР с перекрывающимися праймерами, используя пару праймеров для сигнального пептида и СН. Объединенный ПЦР-продукт клонировали в экспрессионный вектор 293, который уже содержал последовательность Fc человека.

[00391] Для клонирования конструкции №2 VH-CH1 LY амплифицировали посредством ПЦР с применением прямых праймеров, которые отжигали на сигнальном пептиде тяжелой цепи, и обратного праймера, который отжигали на С-конце СН1. ПЦР-продукт очищали на геле перед клонированием в экспрессионный вектор 293.
[00392] Для клонирования конструкции №3 легкую цепь 15D2 амплифицировали посредством ПЦР с применением прямого праймера, который отжигали на N-конце сигнального пептида легкой цепи, и обратного праймера, который отжигали на конце CL. ПЦР-продукт очищали на геле перед клонированием в экспрессионный вектор 293.
[00393] Для клонирования конструкции №4 VH-CH1 LY амплифицировали посредством ПЦР с применением прямого праймера, который отжигали на N-конце сигнального пептида тяжелой цепи, и обратного праймера, который отжигали на конце CH1. VL 15D2 амплифицировали с применением праймеров, которые отжигали на конце VL 15D2. Оба ПЦР-продукта очищали на геле и объединяли с применением ПЦР с перекрывающимися праймерами. Объединенный ПЦР-продукт очищали на геле и клонировали в экспрессионный вектор 293. В таблице 2 представлены последовательности ПЦР-праймеров, использованных для описанного выше молекулярного клонирования.


[00394] Итоговые последовательности FIT1-Ig, FIT2-Ig, FIT3-Ig, FIT4-Ig, FIT5-Ig и FIT6-Ig против чИЛ-17/чИЛ-20 перечислены в таблице 3.










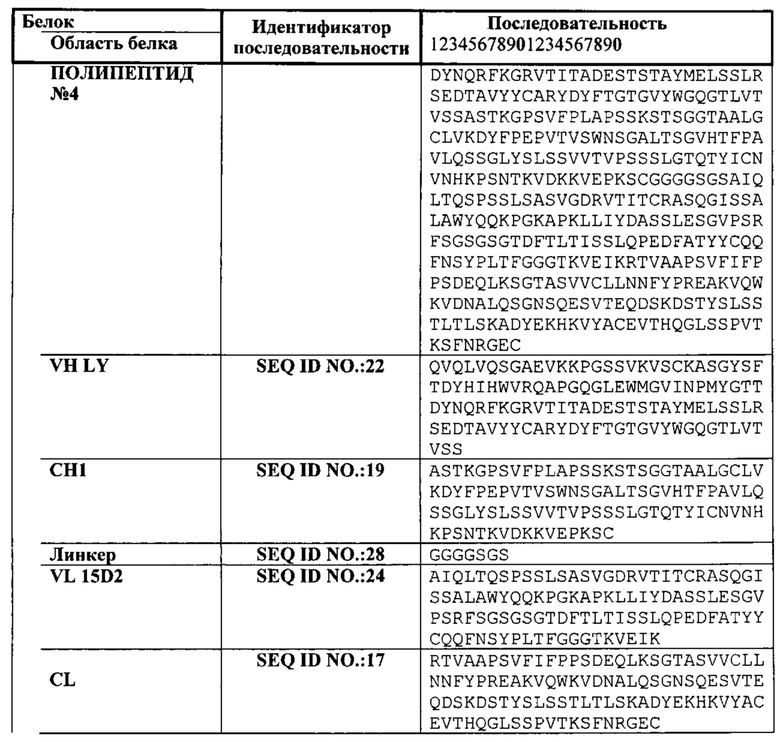
Пример 1.2: Экспрессия, очищение и анализ белков FIT-Ig против ИЛ-17/ИЛ-20:
[00395] Все ДНК-конструкции каждого FIT-Ig субклонировали в векторы на основе pBOS и секвенировали для обеспечения точности. Конструкции №1, №2 и №3 каждого FIT-Ig (1, 2 и 3) или конструкции №1 и №4 каждого FIT-Ig (4, 5 и 6) транзиентно коэкспрессировали с применением полиэтиленимина (ПЭИ) в клетках 293Е. Вкратце, ДНК в экспрессионной среде FreeStyle™ 293 смешивали с ПЭИ до конечной концентрации, соответствующей отношению ДНК к ПЭИ 1:2, инкубировали в течение 15 минут (не более чем 20 минут) при комнатной температуре, и затем добавляли к клеткам 293Е (1,0-1,2×106/мл, жизнеспособность клеток >95%) до достижения отношения 60 мкг ДНК/120 мл культуры. Через 6-24 часа в качалочной культуре к трансфицированным клеткам добавляли пептон до конечной концентрации 5%, при перемешивании на 125 об/мин/мин, при 37°С, 8% CO2. На 6-7 день собирали супернатант путем центрифугирования и фильтрации, и очищали белок FIT-Ig хроматографией с белком A (Pierce, Рокфорд, Иллинойс) в соответствии с инструкциями производителя. Белки анализировали с применением ДСН-ПААГ и определяли их концентрации по А280 и с помощью ВСА-анализа (Pierce, Рокфорд, Иллинойс).
[00396] Для экспрессии FIT1-Ig, FIT2-Ig и FIT3-Ig использовали разные молярные отношения ДНК и 3 конструкций, в том числе: конструкция №1:№2:№3=1:1:1, конструкция №1:№2:№3=1:1.5:1.5; и конструкция №1:№2:№3=1:3:3 (таблица 4). Белки FIT-Ig очищали хроматографией с белком А. Выход очищения (7-16 мг/л) согласовался с результатами количественного определения hIgG в экспрессионной среде для каждого белка. Состав и чистоту очищенных FIT-Ig анализировали с применением ДСН-ПААГ как в восстанавливающих, так и в невосстанавливающих условиях. В невосстанавливающих условиях FIT-Ig мигрировал в виде одной полосы с массой приблизительно 250 кДА. В восстанавливающих условиях каждый из белков FIT-Ig давал по две полосы, одну с более высокой молекулярной массой, соответствующую конструкции №1 с массой приблизительно 75 кДА, и одну с более низкой молекулярной массой, соответствующей конструкциям №2 и №3, перекрывающихся в области приблизительно 25 кДА. ДСН-ПААГ показал, что каждый FIT-Ig экспрессируется в виде одной разновидности продукта, и 3 полипептидные цепи эффективно спариваются с образованием IgG-подобной молекулы. Размеры цепей, а также полноразмерного белка молекул FIT-Ig согласуются с молекулярной массой, рассчитанной на основе последовательностей аминокислот.
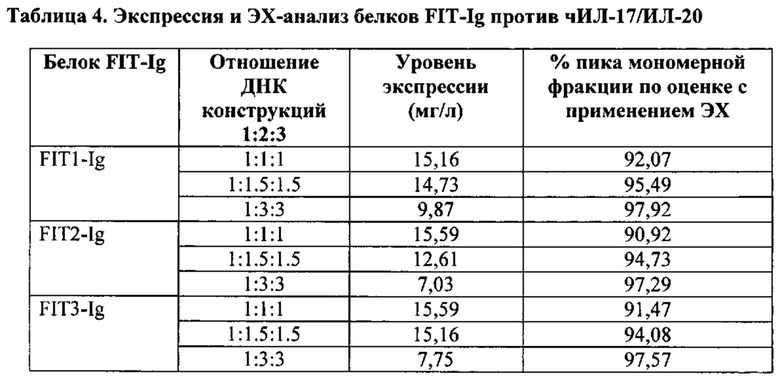
[00397] Для дополнительного исследования физических свойств FIT-Ig в растворе использовали эксклюзионную хроматографию (ЭХ) для анализа каждого белка. Для ЭХ-анализа FIT-Ig очищенный FIT-Ig в ФСБ вводили в колонку TSKgel SuperSW3000 размером 300×4,6 мм (TOSOH). Для проведения ЭХ использовали инструмент для ВЭЖХ модели U3000 (DIONEX). Все белки определяли с использованием УФ-детекции на 280 нм и 214 нм. Элюция была изократической, при скорости потока 0,25 мл/мин. Для всех 3 белков FIT-Ig наблюдался один главный пик, что демонстрирует физическую гомогенность формы мономерных белков (таблица 4). При отношении конструкций №1:№2:№3, составляющем 1:3:3, наблюдался лучший профиль мономерности по оценке с применением ЭХ для всех 3 белков FIT-Ig (таблица 4).
[00398] Из таблицы 4 также видно, что уровни экспрессии всех белков FIT-Ig сопоставимы с уровнями для обычных mAb, что свидетельствует, что FIT-Ig может быть эффективно экспрессирован в клетках млекопитающих. Для экспрессии FIT4-Ig, FIT5-Ig и FIT6-Ig отношение ДНК конструкций №1:№4 составляло 1:1; уровни экспрессии находились в диапазоне 1-10 мг/л, а % пика мономерной фракции по оценке с применением ЭХ находился в диапазоне 58-76%. При использовании указанной конкретной комбинации mAb (LY и 15D2) для 3-полипептидных FIT-Ig конструкций (FIT1-Ig, FIT2-Ig и FIT3-Ig) наблюдался лучший профиль экспрессии по сравнению с 2-полипептидными конструкциями FIT-Ig (FIT4-Ig, FIT5-Ig и FIT6-Ig); соответственно, функциональные свойства FIT1-Ig, FIT2-Ig и FIT3-Ig анализировали дополнительно.
Пример 1.3. Определение аффинности связывания антигена FIT-Ig против ИЛ-17/ИЛ-20
[00399] Кинетику связывания FIT-Ig с рчИЛ-17 и рчИЛ-20 определяли с применением поверхностного плазмонного резонанса (таблица 5) на инструменте Biacore X100 (Biacore АВ, Уппсала, Швеция) с использованием HBS-EP (10 мМ HEPES, рН 7,4, 150 мМ NaCl, 3 мМ ЭДТК и 0,005% сурфактанта Р20) при 25°С. Вкратце, поликлональное антитело козы против IgG человека, специфическое в отношении Fcγ-фрагмента (Pierce Biotechnology Inc, Рокфорд, Иллинойс) прямо иммобилизовали на биосенсорном чипе СМ5 категории «для исследований» с применением стандартного набора для сочетания аминов в соответствии с инструкциями изготовителя. Очищенные образцы FIT-Ig разводили в забуференном HEPES солевом растворе для захвата на реакционных поверхностях, покрытых специфическим в отношении Fc антителом козы против IgG человека, и вводили на реакционные матрицы при скорости потока 5 мкл/мин. Константы скорости связывания и скорости диссоциации, kon (M-1с-1) и koff (с-1) определяли при постоянной скорости потока 30 мкл/мин. Константы скорости получали, проводя измерения кинетики связывания при десяти разных концентрациях антигена в диапазоне от 1,25 до 1000 нМ. Затем рассчитывали равновесную константу диссоциации (М) для реакции между FIT-Ig и целевыми белками на основе кинетических констант скорости по следующей формуле: KD=koff/kon. Аликвоты образцов антигена также одновременно вводили на холостую референсную и реакционную поверхности СМ для регистрации и вычитания какого-либо обусловленного неспецифическим связыванием фона, обеспечивая элиминацию большей части изменений показателя преломления и шума при введении. Поверхности регенерировали посредством последующего двукратного введения 25 мл 10 мМ глицина (рН 1,5) при скорости потока 10 мкл/мин. Поверхности с иммобилизованным антителом против Fc полностью регенерировали и полностью сохраняли захватывающую способность на протяжении 12 циклов.

[00400] Анализ Biacore показал, что общие показатели связывания трех FIT-Ig с чИЛ-17 и чИЛ-20 были аналогичными, при этом показатели аффинности FIT-Ig были очень сходны с показателями исходных mAb LY и 15D2, и не наблюдалось снижения аффинности связывания для какого-либо из антигенсвязывающих доменов (таблица 5).
[00401] Кроме того, также анализировали методом Biacore тетравалентное связывание антигена FIT-Ig с двойной специфичностью. FIT1-Ig сначала захватывали антителом козы против Fc человека на сенсорном чипе Biacore, вводили первый антиген и наблюдали сигнал связывания. После насыщения FIT1-Ig первым антигеном вводили второй антиген и наблюдали второй сигнал. Для FIT2-Ig указанный анализ осуществляли, либо вводя сначала ИЛ-17, а затем ИЛ-20, либо вводя сначала ИЛ-20, а затем ИЛ-17 (фиг. 3). При любой последовательности детектировали двойную связывающую активность, и насыщение связывания обоих антигенов происходило при 25-30 RU. Аналогичные результаты получали для FIT2-Ig и FIT3-Ig. Соответственно, каждый FIT-Ig был способен связывать оба антигена одновременно, как тетравалентная молекула с двойной специфичностью.
[00402] Профиль экспрессии и двойные связывающие свойства FIT-Ig ясно продемонстрировали, что в молекуле FIT-Ig оба VL-CL корректно спаривались с соответствующими им VH-CH1 с образованием 2 функциональных связывающих доменов, и экспрессировались в виде одного мономерного тетравалентного биспецифического полноразмерного белка FIT-Ig. Это отличает FIT-Ig от молекул антител мультивалентного типа (Miller и Presta, патент США 8722859), которые демонстрируют тетравалентную, но при этом моноспецифическую связывающую активность в отношении одного целевого антигена.
Пример 1.4 Определение биологической активности FIT-Ig против ИЛ-17/ИЛ-20
[00403] Биологическую активность FIT-Ig в отношении нейтрализации функции ИЛ-17 измеряли с применением биологического анализа на GROα. Вкратце, клетки Hs27 высевали с плотностью 10000 клеток/50 мкл/лунку в 96-луночные планшеты. FIT-Ig или контрольное антитело против ИЛ-17 (25 мкл) добавляли в лунки в двух повторностях, со стартовой концентрацией 2,5 нМ и последующим серийным разведением 1:2 до концентрации 5 пМ. Затем в каждую лунку добавляли ИЛ-17А (25 мкл). Конечная концентрация ИЛ-17А составляла 0,3 нМ. Клетки инкубировали при 37°С в течение 17 часов, после чего собирали клеточный культуральный супернатант. Концентрации GRO-α в клеточных культуральных супернатантах измеряли с помощью набора для определения CACL1/GRO-альфа человека Quantikine в соответствии с протоколом производителя (R&D Systems).
[00404] Биологическую активность FIT-Ig, нейтрализующую функцию ИЛ-20, измеряли с применением анализа пролиферации клеток ИЛ-20R+ BAF3. Вкратце, 25 мкл рекомбинантного ИЛ-20 человека в концентрации 0,8 нМ добавляли в каждую лунку 96-луночных планшетов (конечная концентрация ИЛ-20 составляла 0,2 нМ). Антитело или FIT-Ig против ИЛ20, или другое контрольное антитело разводили до концентрации 400 нМ (рабочая концентрация составляла 100 нМ) с последующим 5-кратным серийным разведением и добавляли в 96-луночные аналитические планшеты (по 25 мкл на лунку). Затем в каждую лунку добавляли клетки BaF3, стабильно трансфицированные рецептором ИЛ-20, в концентрации 10000 клеток/лунку в объеме 50 мкл RPMI 1640 плюс 10% ФБС, гигромицин В в концентрации 800 мкг/мл, G418 в концентрации 800 мкг/мл. После 48-часовой инкубации в каждую лунку добавляли по 100 мкл люминесцентного буфера CellTiter-Glo. Содержимое перемешивали в течение 2 минут на орбитальном шейкере для индукции лизиса клеток, и инкубировали планшеты при комнатной температуре в течение 10 минут для стабилизации люминесцентного сигнала. Люминесценцию регистрировали на SpectraMax М5.
[00405] Как показано в таблице 5, все FIT-Ig были способны нейтрализовать и чИЛ-20, и чИЛ-17, с показателями аффинности, аналогичными показателям исходных антител. Судя по результатам функционального анализа с применением как метода Biacore, так и клеточного анализа нейтрализации, все 3 FIT-Ig, по-видимому, полностью сохраняют активность исходных mAb. Между тремя FIT-Ig отсутствовали значимые функциональные различия, что свидетельствует о необязательности наличия линкера, и о том, что конструкция FIT-Ig обеспечивает достаточную гибкость и пространственный размер, чтобы обеспечивать двойное связывание в отсутствие пептидного спейсера между 2 связывающими областями Fab. Этим они отличаются от молекул типа DVD-Ig, где линкер между 2 вариабельными доменами на каждой из 2 полипептидных цепей необходим для сохранения активности нижнего (2-го) вариабельного домена.
Пример 1.5 Исследование стабильности FIT-Ig против ИЛ-17/ИЛ-20
[00406] Образцы белка FIT1-Ig в цитратном буфере (рН=6,0) инкубировали по отдельности при постоянной температуре 4°С, 25°С и 40°С в течение 1 дня, 3 дней или 7 дней; Аналогичным образом, образцы белка FIT1-Ig замораживали/размораживали один, два или три раза. Фракции интактного полного мономерного белка во всех образцах детектировали с помощью ЭХ-ВЭЖХ, при этом 10 мкг каждого образца белка вводили в систему для ВЭЖХ UltiMate 3000, оснащенную колонкой Superdex200 5/150 GL, при скорости потока 0,3 мл/мин в течение 15 минут, и данные регистрировали и анализировали с применением программного обеспечения Chromeleon, поставляемого производителем. Из таблицы 6 видно, что FIT1-Ig и FIT3-Ig продолжали находиться в виде полностью интактных мономерных молекул в указанных условиях термической стимуляции.

Пример 1.6 Исследование растворимости FIT-Ig против ИЛ-17/ИЛ-20
[00407] Растворимость FIT1-Ig анализировали путем измерения признаков осаждения в присутствии возрастающих концентраций ПЭГ6000 (ПЭГ6000 приобретали у Shanghai Lingfeng Chemical Reagent Co., Ltd). Вкратце, вычисляли растворимость белка в присутствии ПЭГ6000 как функцию концентрации ПЭГ6000 (0, 5%, 10%, 15%, 20%, 25% и 30%). Исследования растворимости проводили при температуре 25°С в растворе с рН 6,0. Вкратце, белок осаждали путем смешивания подходящих количеств забуференных стоковых растворов белка, ПЭГ и буфера для получения требуемой концентрации компонентов. Итоговый объем доводили до 200 мкл и устанавливали концентрацию белка 1,0 мг/мл. Итоговые растворы тщательно перемешивали и уравновешивали в течение 16 часов. После уравновешивания растворы центрифугировали при 13000 об/мин в течение 10 мин для отделения белкового осадка. Растворимость белка измеряли при 280 нм с применением Spectra Max Plus384 (Molecular Device); рассчитывали по показателям поглощения супернатанта, и вычисляли концентрацию на основании стандартной кривой концентрации белка (фиг. 4А). Авторы настоящего изобретения также проанализировали коммерческое антитело ритуксан с применением того же экспериментального способа в условиях 3 разных значений рН (фиг. 4В). По-видимому, растворимость белка зависит от значений рН; и прогнозируемая растворимость FIT-Ig будет находиться в диапазоне, характерном для моноклональных антител.
Пример 1.7 Фармакокинетическое исследование FIT-Ig против ИЛ-17/ИЛ-20
[00408] Оценивали фармакокинетические свойства FIT1-Ig на самцах крыс Спрег-Доули (SD). Самцам крыс Спрег-Доули вводили белки FIT-Ig в виде одной внутривенной дозы 5 мг/кг через канюлю в яремной вене или подкожно в области спины. Образцы сыворотки собирали в разные моменты времени на протяжении периода 28 дней; серийное взятие крови осуществляли через 0, 5, 15 и 30 минут; 1, 2, 4, 8 и 24 часа; и 2, 4, 7, 10, 14, 21 и 28 дней через хвостовую вену, и анализировали, захватывая в ИФА ELISA на ИЛ-17 человека и/или ИЛ-20 человека. Вкратце, планшеты для ИФА ELISA покрывали антителом козы против биотина (5 мкг/мл, 4°С, в течение ночи), блокировали Superblock (Pierce) и инкубировали с биотинилированным ИЛ-17 человека (ИФА ELISA для захвата ИЛ-17) или ИЛ-20 (ИФА ELISA для захвата ИЛ-20) в концентрации 50 нг/мл в 10% Superblock TTBS при комнатной температуре в течение 2 часов. Получали серийные разведения образцов сыворотки (0,5% сыворотки, 10% Superblock в TTBS) и инкубировали в планшете в течение 30 минут при комнатной температуре. Детекцию проводили HRP-меченым антителом козы против антител человека, и определяли концентрации с помощью стандартных кривых, используя метод четырехпараметрической логистической аппроксимации. У нескольких животных, в частности, в группе подкожного введения, наблюдалось неожиданное резкое снижение концентраций FIT-Ig после 10 дня, вероятно, обусловленное развивающимся ответом против антител человека. Указанных животных исключали из итоговых расчетов. Значения фармакокинетических показателей определяли, используя некомпартментную модель, с помощью программного обеспечения WinNonlin (Pharsight Corporation, Маунтин Вью, Калифорния).
[00409] В исследовании ФК у крыс концентрации FIT1-Ig в сыворотке были очень сходными при определении с использованием двух разных способов ИФА ELISA, свидетельствуя, что молекула была интактной и способной к связыванию обоих антигенов in vivo. При в/в дозировании FIT1-Ig демонстрировал двухфазный фармакокинетический профиль, состоящий из фазы распределения с последующей фазой элиминации, аналогичный профилю ФК стандартных молекул IgG. Фармакокинетические показатели, рассчитанные на основании результатов двух разных аналитических способов, были очень сходными; они представлены в таблице 7. Выведение FIT-Ig было медленным (~12 мл/сутки/кг), при малых объемах распределения (Vss~130 мл/кг), что приводило к продолжительному времени полужизни (T1/2>10 дней). После подкожного введения FIT-Ig всасывался медленно, с достижением максимальных концентраций в сыворотке, составляющих приблизительно 26,9 мкг/мл, через 4 дня после дозирования. Период полувыведения в конечной фазе составлял приблизительно 11 дней, а биодоступность при подкожном введении приближалась к 100%. Как демонстрируют указанные результаты, свойства FIT1-Ig очень сходны со свойствами стандартной молекулы IgG in vivo, указывая на потенциал для терапевтического применения при сопоставимых режимах дозирования.
[00410] Исследование фармакокинетики FIT-Ig продемонстрировало неожиданный прорыв в области разработки мультиспецифических Ig-подобных биологических средств. Систему исследования фармакокинетики на крысах часто используют в фармацевтический промышленности для доклинической оценки терапевтических mAb, и она хорошо подходит для прогнозирования фармакокинетического профиля mAb у человека. Продолжительное время полужизни и медленное выведение FIT-Ig обеспечивает терапевтическую полезность при хронических показаниях с менее частым дозированием, аналогично терапевтическому mAb. Кроме того, FIT-Ig, размер которого на 100 кДа больше размера IgG, по-видимому, эффективно проникал в ткани за счет IgG-подобного показателя объема распределения, судя по результатам исследования ФК.

Пример 1.8 Исследование с разработкой стабильных клеток линии СНО с FIT-Ig
[00411] Наблюдалась эффективная экспрессия FIT-Ig в транзиентно трансфицированных клетках 293Е. Для дополнительного определения технической осуществимости получения FIT-Ig осуществляли стабильную трансфекцию клеток как линии CHO-DG44, так и линии CHO-S, с последующей клональной селекцией; также проводили анализ продуктивности. Вкратце, клетки СНО трансфицировали с помощью электропорации 8×106 клеток в 400 мкл раствора для трансфекции с добавлением 20 мкг ДНК (для клеток СНО DG44) или 25 мкг ДНК (для клеток CHO-S), субклонированных в вектор Freedom рСНО (Life Technologies). Стабильную линию клеток выбирали с применением рутинных процедур. Вкратце, для выбора CHO-DG44 после трансфекции выбирали стабильный пул (-HT/2P/400G, где Р = мкг/мл пуромицина, G = мкг/мл G418), и анализировали продуцирование белка с применением ИФА ELISA на IgG. Выбирали лучшие пулы и переходили к проведению нескольких раундов амплификации при возрастающей концентрации МТХ (50, 100, 200 и 500 нМ), с последующим анализом продуцирования белка с применением ИФА ELISA на IgG. Затем выбирали лучшие пулы для субклонирования. Для выбора клеток CHO-S первую фазу выбора проводили в среде, содержащей 10P/400G/100M (М = нМ МТХ), с последующим анализом продуцирования белка. Затем выбирали лучшие пулы и переходили ко 2 фазе выбора либо в 30P/400G/500M, либо в 50P/400G/1000M, с последующим измерением продуцирования белка с применением ИФА ELISA. Затем выбирали лучшие пулы для субклонирования. Для анализа белковой продуктивности пулы полностью восстановленных клеток (жизнеспособность >90%) высевали с плотностью 5×105 жизнеспособных клеток/мл (СНО DG44) или 3×105 жизнеспособных клеток/мл (СНО-S) с применением 30 мл свежей среды (среда CD FortiCHO™ с добавлением 6 мМ L-глутамина) в качалочные колбы объемом 125 мл. Клетки инкубировали на качающейся платформе при 37°С, относительной влажности 80%, 8% CO2 и 130 об/мин. Образцы культур отбирали ежедневно или через регулярные интервалы (например, на 0, 3, 5, 7, 10, 12 и 14 день) для определения плотности, жизнеспособности и продуктивности клеток, до снижения жизнеспособности культуры ниже 50% или до 14 дня культивирования. После взятия образцов культуру, по мере необходимости, подпитывали глюкозой.
[00412] В целом процесс получения стабильно продуцирующей FIT1-Ig линии клеток СНО отличается характеристиками, аналогичными характеристикам при разработке получения моноклонального антитела в клетках СНО. Например, при анализе пулов DG44 в условиях 2P/400G плотность жизнеспособных клеток (VCD) продолжала увеличиваться до 10-12 дня, достигая приблизительно 1,3Е7, при этом жизнеспособность клеток оставалась на уровне выше 80% до 13-14 дня, а продуктивность достигала почти 40 мг/мл на 14 день. При амплификации в условиях 5P/400G/50M продуктивность достигала более 50 мг/мл на 14 день. При выборе клеток CHO-S титр превышал 200 мг/мл в 1 фазе выбора и 370 мг/мл во 2 фазе выбора. Указанные уровни продуктивности аналогичны ранее наблюдавшимся при разработке обычных mAb человека в нашей лаборатории, что свидетельствует о mAb-подобной технической осуществимости получения FIT-Ig для коммерческого применения.
Пример 2: Конструирование, экспрессия и очищение иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против CD3/CD20
[00413] Чтобы продемонстрировать, способен ли FIT-Ig связываться с антигенами клеточной поверхности, авторы настоящего изобретения получили молекулу FIT-Ig против CD3/CD20 FIT7-Ig, а также FIT8-Ig, представляющий собой 3-полипептидную конструкцию, как показано на фиг. 1. Конструкция, использованная для получения FIT-Ig, способного к связыванию CD3 и CD20 клеточной поверхности, изображена на фиг. 1B. Вкратце, исходные mAb включают два высокоаффинных антитела, против CD3 (OKT3) и против CD20 (офатумумаб). Для получения конструкции №1 FIT7-Ig VL-CL OKT3 сливали прямо (FIT7-Ig) или посредством линкера из 7 аминокислот (FIT8-Ig) с N-концом тяжелой цепи офатумумаба (как показано в таблице 8). Конструкция №2 представлена VH-CH1 OKT3, а 3-я конструкция представлена VL-CL офатумумаба. Указанными 3 конструкциями FIT-Ig котрансфицировали клетки 293, что приводило к экспрессии и секреции белков FIT-Ig. Процедуры ПЦР-клонирования подробно описаны ниже:
Пример 2.1 Молекулярное клонирование FIT-Ig против CD3/CD20:
[00414] Способ молекулярного клонирования аналогичен способу для FIT-Ig против чИЛ-17/чИЛ-20.

[00415] В таблице 9 приведены последовательности ПЦР-праймеров, использованных для молекулярного конструирования, описанного выше.
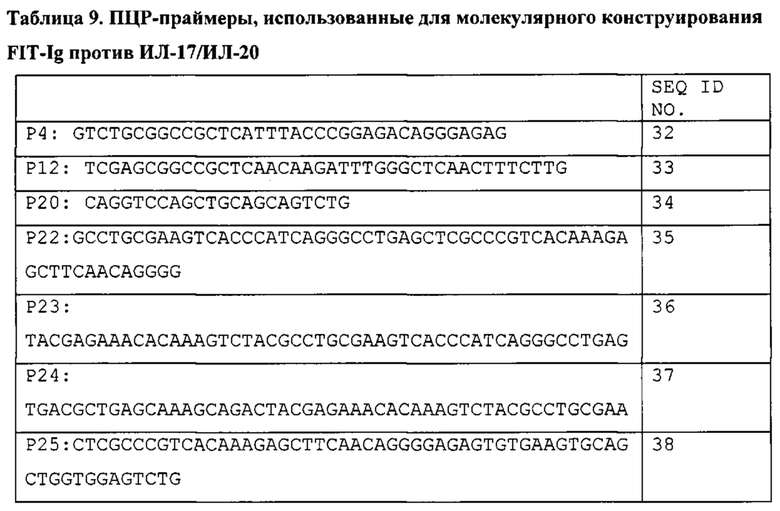
[00416] Итоговые последовательности FIT-Ig против CD3/CD20 приведены в таблице 10.
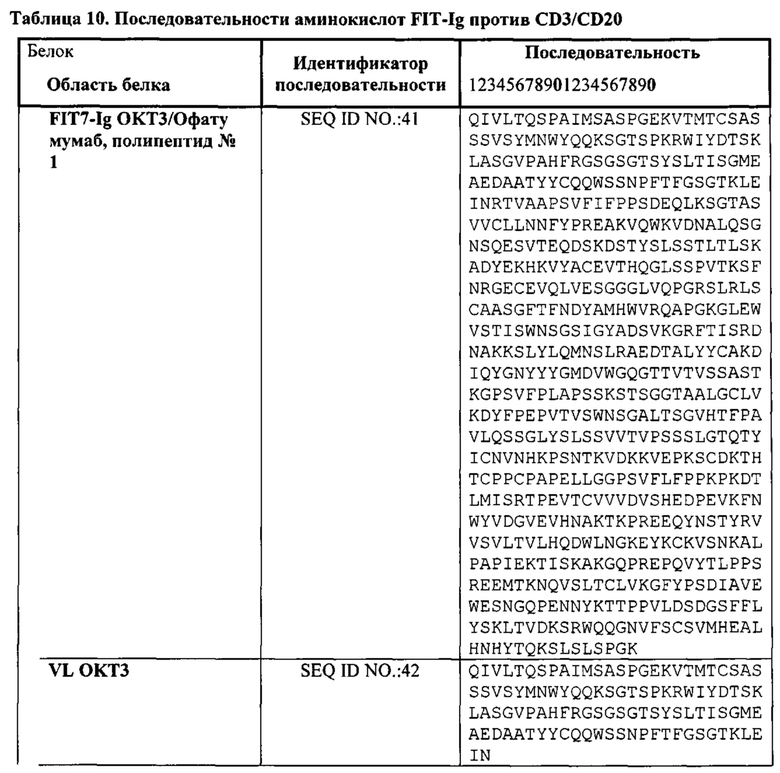



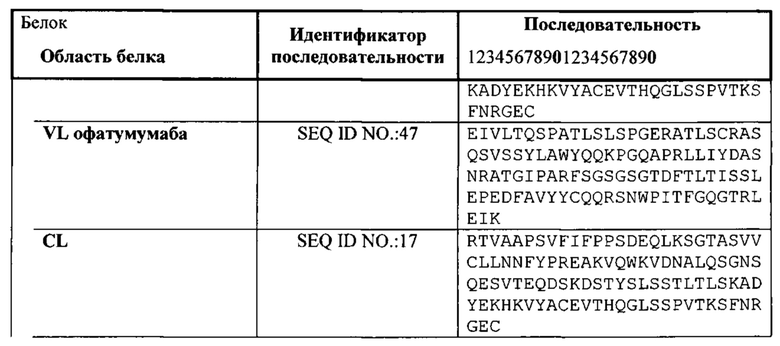
Пример 2.2 Экспрессия и очищение FIT-Ig против CD3/CD20:
[00417] Все ДНК-конструкции каждого FIT-Ig субклонировали в векторы на основе pBOS и секвенировали для обеспечения точности. Конструкции №1, №2, и №3 каждого FIT-Ig транзиентно коэкспрессировали с применением полиэтиленимина (ПЭИ) в клетках 293Е. Вкратце, ДНК в экспрессионной среде FreeStyle™ 293 смешивали с ПЭИ до конечной концентрации, соответствующей отношению ДНК к ПЭИ 1:2, инкубировали в течение 15 минут (не более чем 20 минут) при комнатной температуре, и затем добавляли к клеткам 293Е (1,0-1,2×106/мл, жизнеспособность клеток >95%) до достижения отношения 60 мкг ДНК/120 мл культуры. Через 6-24 часов в качалочной культуре к трансфицированным клеткам добавляли пептон до конечной концентрации 5%, при перемешивании на 125 об/мин/мин., 37°С, 8% СО2. На 6-7-й день супернатант собирали путем центрифугирования и фильтрации, и белок FIT-Ig очищали хроматографией с белком A (Pierce, Рокфорд, Иллинойс) в соответствии с инструкциями изготовителя. Белки анализировали с применением ДСН-ПААГ, и определяли их концентрацию по А280 и с помощью ВСА-анализа (Pierce, Рокфорд, Иллинойс) (таблица 11).

Пример 2.3 Связывающая активность молекул FIT-Ig против CD3/CD20:
[00418] Связывание FIT-Ig против CD3/CD20 с обеими мишенями анализировали с применением FACS, используя клетки Jurkat, которые экспрессируют CD3 на поверхности клеток, а также клетки Raji, которые экспрессируют CD20 на поверхности клеток. Вкратце, 5×105 клеток промывали в ледяном ФСБ и блокировали 2% ФБС на льду в течение 1 часа. Клетки инкубировали с антителом, FIT-Ig (100 нМ) или изотипическим контролем, на льду в течение 1 часа и 3-кратно промывали ФСБ. Добавляли вторичное антитело (меченое Alexa Fluor 488 антитело козы против IgG человека, Invitrogen) и инкубировали с клетками на льду в течение 1 часа в темноте с последующим трехкратным промыванием ФСБ. Образцы анализировали на FACSCalibur. Связывание на поверхности клеток показывает, что как FIT7-Ig, так и FIT8-Ig были способны связываться с обоими антигенами клеточной поверхности, CD3 и CD20, зависимым от концентрации образом. FIT-Ig показал сниженную интенсивность связывания с CD3 на клетках Jurkat, однако усиленную интенсивность связывания с CD20 на клетках Raji по сравнению со связывающей активностью исходных mAb. Во всех исследованиях связывания FIT7-Ig и FIT8-Ig показали аналогичную связывающую активность в отношении обоих антигенов, что свидетельствует об отсутствии значимого влияния линкера на связывающую способность FIT8-Ig (таблица 12).
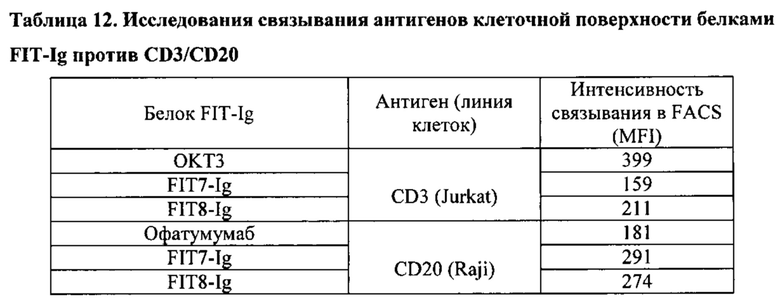
Пример 3: Конструирование, экспрессия и очищение иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против ФНО/ИЛ-17
[00419] Также получали другой FIT-Ig, который может связываться с ИЛ-17 человека и ФНО-α человека (FIT9-Ig), используя клон LY mAb против ИЛ-17, а также mAb против ФИО голимумаб, в 3-полипептидной конструкции, показанной на фиг. 1. Для получения конструкции FIT9-Ig №1 VL-CL голимумаба прямо сливали с N-концом тяжелой цепи LY (как показано в таблице 13). Конструкция №2 представлена VH-CH1 голимумаба, а 3-я конструкция представлена VL-CL LY. Указанными 3 конструкциями FIT9-Ig котрансфицировали клетки 293, что приводило к экспрессии и секреции белков FIT-Ig. Итоговые последовательности FIT-Ig против ФНО/ИЛ-17 приведены в таблице 14.
Пример 3.1 Молекулярное клонирование FIT-Ig против ФНО/ИЛ-17:
[00420] Способ молекулярного клонирования аналогичен способу для FIT-Ig против чИЛ-17/чИЛ-20.



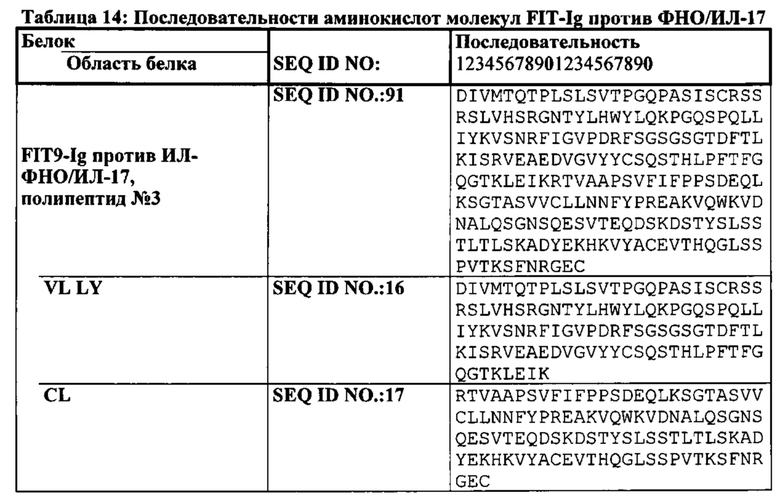
Пример 3.2 Экспрессия, очищение и анализ белков FIT-Ig против ФНО/ИЛ-17:
[00421] Все ДНК-конструкции каждого FIT-Ig субклонировали в векторы на основе pBOS и секвенировали для обеспечения точности. Конструкция №1, №2 и №3 FIT9-Ig транзиентно коэкспрессировали с применением полиэтиленимина (ПЭИ) в клетках 293Е согласно приведенному ранее описанию, и очищали белки FIT9-Ig хроматографией с белком А. Уровень экспрессии составлял 10-23 мг/л. Проводили функциональный анализ очищенного белка с применением клеточного анализа на ИЛ-17 (продуцирование GROα клетками Hs27) и ФНО (продуцирование ИЛ-8 клетками L929). Мощность нейтрализации ФНО человека для FIT9-Ig составляла 11,6 пМ (относительно 15,9 пМ для голимумаба в том же эксперименте), нейтрализации ИЛ-17 человека - 122 пМ (относительно 51,5 пМ для LY в том же эксперименте). В целом, FIT9-Ig сохранял биологическую активность исходных mAb.
Пример 4: Конструирование, экспрессия и очищение иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против CTLA-4/PD-1
[00422] Другой FIT-Ig, который может связываться с CTLA-4 человека и PD-1 человека (FIT10-Ig) получали, используя mAb против CTLA-4 ипилимумаб, а также mAb против PD-1 ниволумаб в 3-полипептидной конструкции, показанной на фиг. 1. Для получения конструкции FIT10-Ig №1 VL-CL ипилимумаба прямо сливали с N-концом тяжелой цепи ниволумаба (как показано в таблице 15). Конструкция №2 представлена VH-CH1 ипилимумаба, а 3-я конструкция представлена VL-CL ниволумаба. Указанными 3 конструкциями FIT10-Ig котрансфицировали клетки 293, что приводило к экспрессии и секреции белков FIT10-Ig.
Пример 4.1 Молекулярное клонирование FIT-Ig против CTLA-4/PD-1:
[00423] Способ молекулярного клонирования аналогичен способу для FIT-Ig против ИЛ-17/ИЛ-20 человека. Итоговые последовательности FIT-Ig против CTLA-4/PD-1 приведены в таблице 16.



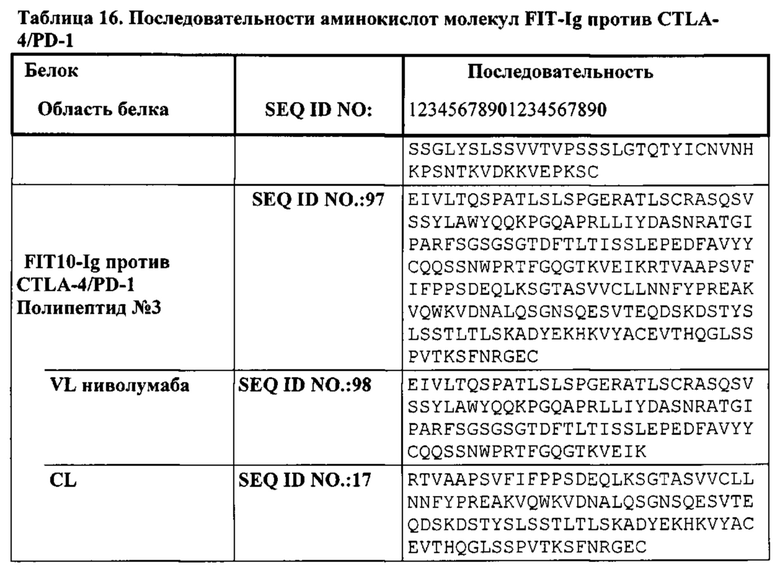
Пример 4.2 Экспрессия, очищение и функциональный анализ белков FIT-Ig против CTLA-4/PD-1:
[00424] Все ДНК-конструкции каждого FIT-Ig субклонировали в векторы на основе pBOS и секвенировали для обеспечения точности. Конструкции FIT10-Ig №1, №2 и №3 транзиентно коэкспрессировали с применением полиэтиленимина (ПЭИ) в клетках 293Е согласно приведенному ранее описанию; белки FIT9-Ig очищали хроматографией с белком А с получением 98% мономерного полного белка. Уровни экспрессии достигали 43 мг/л. Проводили анализ связывания очищенного белка с применением ИФА ELISA с рекомбинантными CTLA-4-Ig и PD-1. Вкратце, для связывания с CTLA-4 на 96-луночных планшетах иммобилизовали CTLA-4-Ig человека (R&D Systems), после чего проводили рутинные процедуры промывания и блокирования. Затем в планшет добавляли FIT-10-Ig или ипилимумаб в различных концентрациях, с последующими инкубацией и несколькими этапами промывания, и детектировали конъюгированным с HRP антителом против Fab человека. Для связывания с PD-1 на 96-луночных планшетах иммобилизовали PD-1 человека (с гистидиновой меткой) (R&D Systems), после чего проводили рутинные процедуры промывания и блокирования. Затем в планшет добавляли FIT-10-Ig или ниволумаб в различных концентрациях, с последующими инкубацией и несколькими этапами промывания, и детектировали конъюгированным с HRP антителом против Fc человека (фиг. 5). По-видимому, FIT10-Ig был способен связывать как CTLA-4 (А), так и PD-1 (В) с активностью, аналогичной исходным mAb ипилимумабу и ниволумабу, соответственно.
[00425] Кроме того, проводили исследование связывания с несколькими антигенами с применением OctetRed для определения того, был ли FIT10-Ig способен связывать рекомбинантный CTLA-4 и PD-1 одновременно. Вкратце, FIT10-Ig иммобилизовали на сенсоре AR2G в концентрации 10 мкг/мл, с последующим связыванием CTLA-4-Ig, а затем PD-1 (или сначала PD-1, а затем CTLA-4-Ig) в аналитическом буфере (ФСБ рН 7,4, 0,1% БСА, 0,02% Tween), в концентрации 80 нМ. В конце эксперимента поверхность пятикратно регенерировали 10 мМ глицином при рН 1,5 (фиг. 6). Указанный эксперимент показывает, что FIT10-Ig способен связывать PD-1 после того, как он уже связался с CTLA-4, и наоборот, свидетельствуя, что FIT10-Ig способен связывать и CTLA-4-Ig, и PD-1 одновременно.
Пример 5: Конструирование, экспрессия и очищение дополнительного иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig)
[00426] FIT-Ig, специфичные в отношении рЭФР и PD-L1; cMet и рЭФР; фактора IXa и фактора X; Her3 и рИФР-1; DLL-4 и ФРЭС; CD20 и CD3; Her3 и рЭФР; PD-1 и PD-L1; Her3 и PD-1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 17. В таблице 18 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для каждого из FIT-Ig.
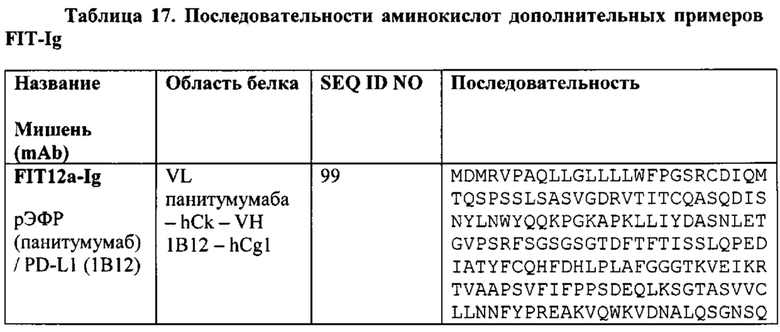









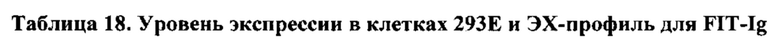

[00427] ЭХ-профили для каждого из FIT-Ig из таблиц 17 и 18 также представлены на фиг. 7a-7i.
[00428] Данные функционального связывания для FIT13a-Ig приведены ниже в таблице 19. Кроме того, проводили исследование связывания с несколькими антигенами для определения того, был ли FIT13a-Ig способен связывать cMet и рЭФР. Результаты указанного исследования представлены на фиг. 8, и демонстрируют, что FIT13a-Ig был способен связывать как cMet, так и рЭФР одновременно.

[00429] Данные функционального связывания для связывающей активности FIT14-Ig в отношении фактора IXa приведены ниже в таблице 20.

[00430] Результаты указанного исследования демонстрируют, что могут быть сконструированы, экспрессированы и очищены дополнительные FIT-Ig, которые демонстрируют функциональное связывание с целевыми белками.
Пример 6; Конструирование, экспрессия и очищение нового иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против CTLA-4/PD-1
[00431] Новые FIT-Ig, специфичные в отношении CTLA4 и PD1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 21. В таблице 21 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для каждого из FIT-Ig.


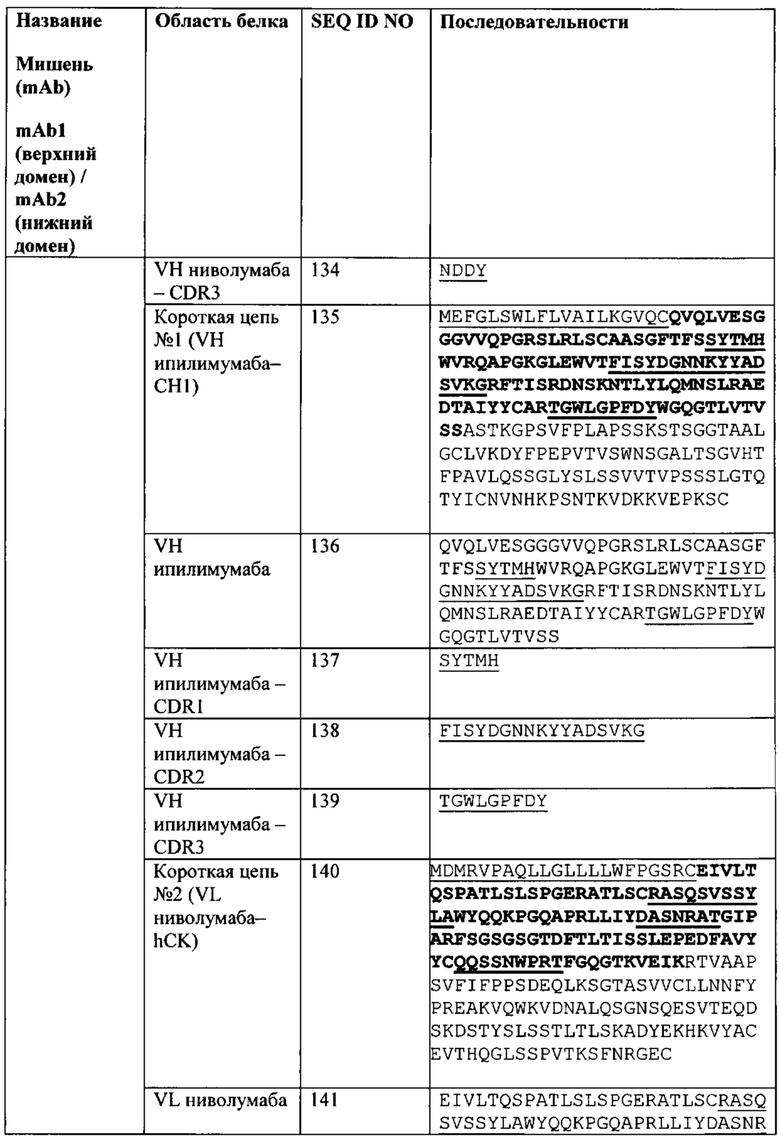
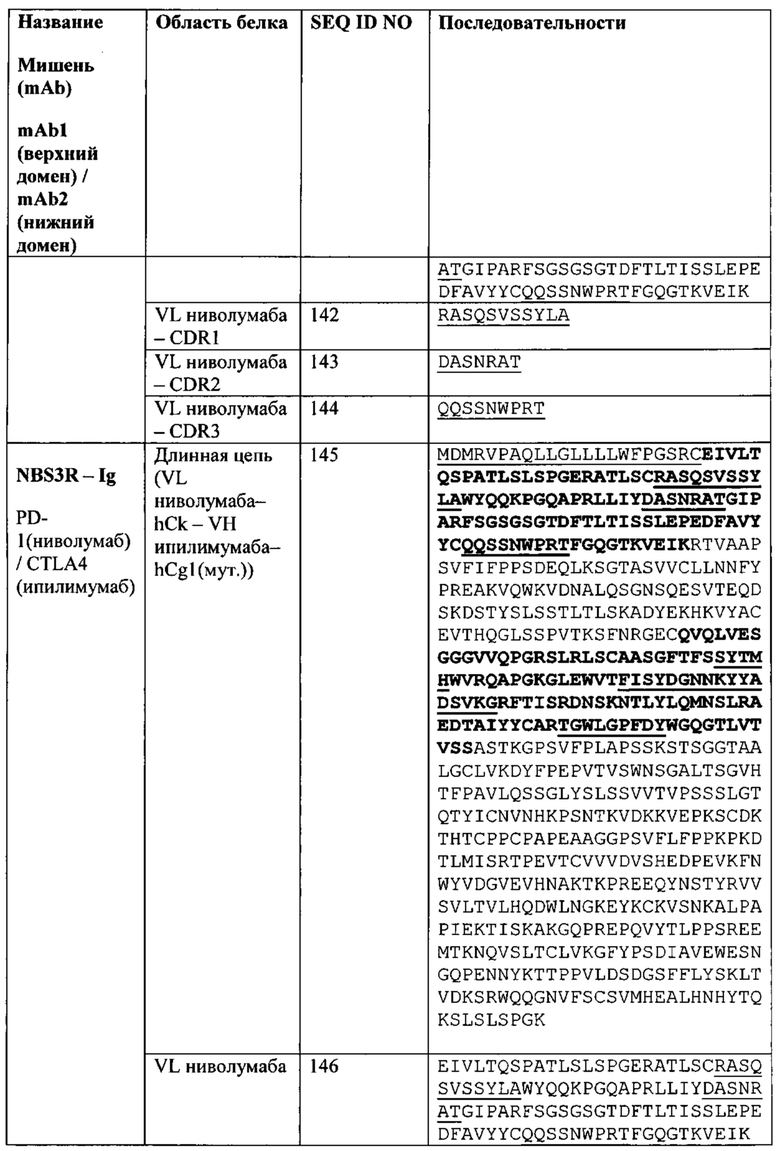

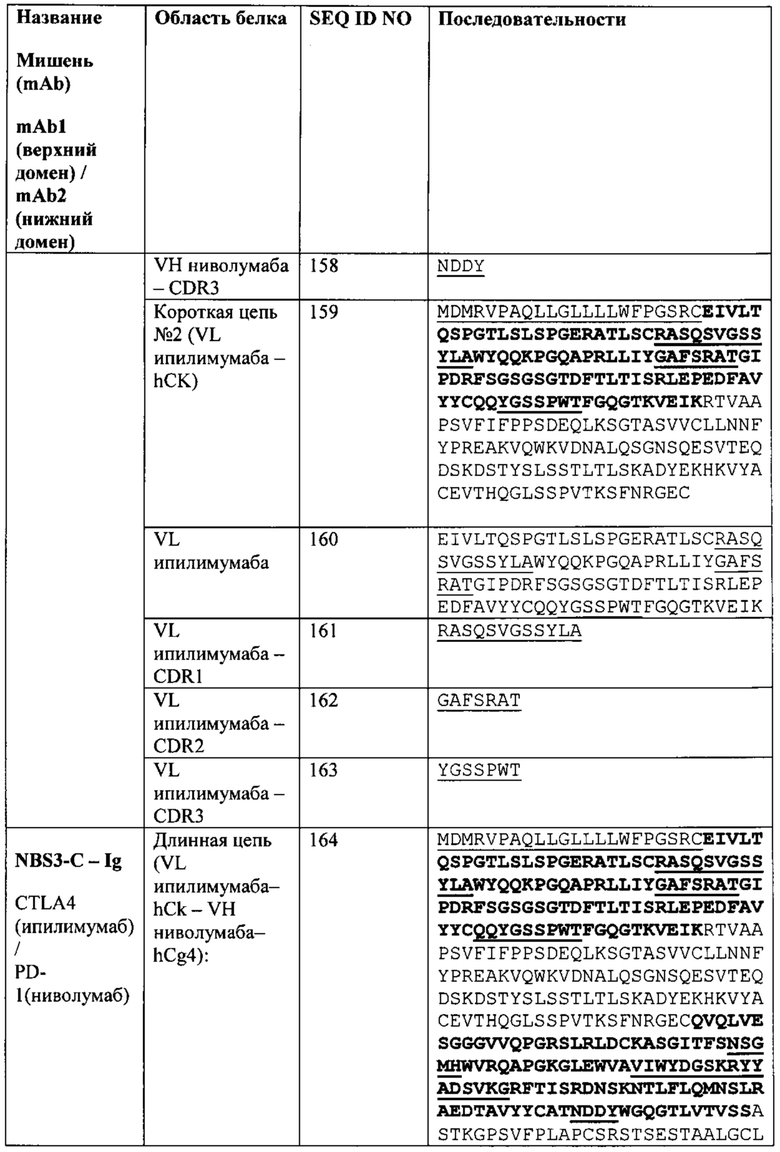



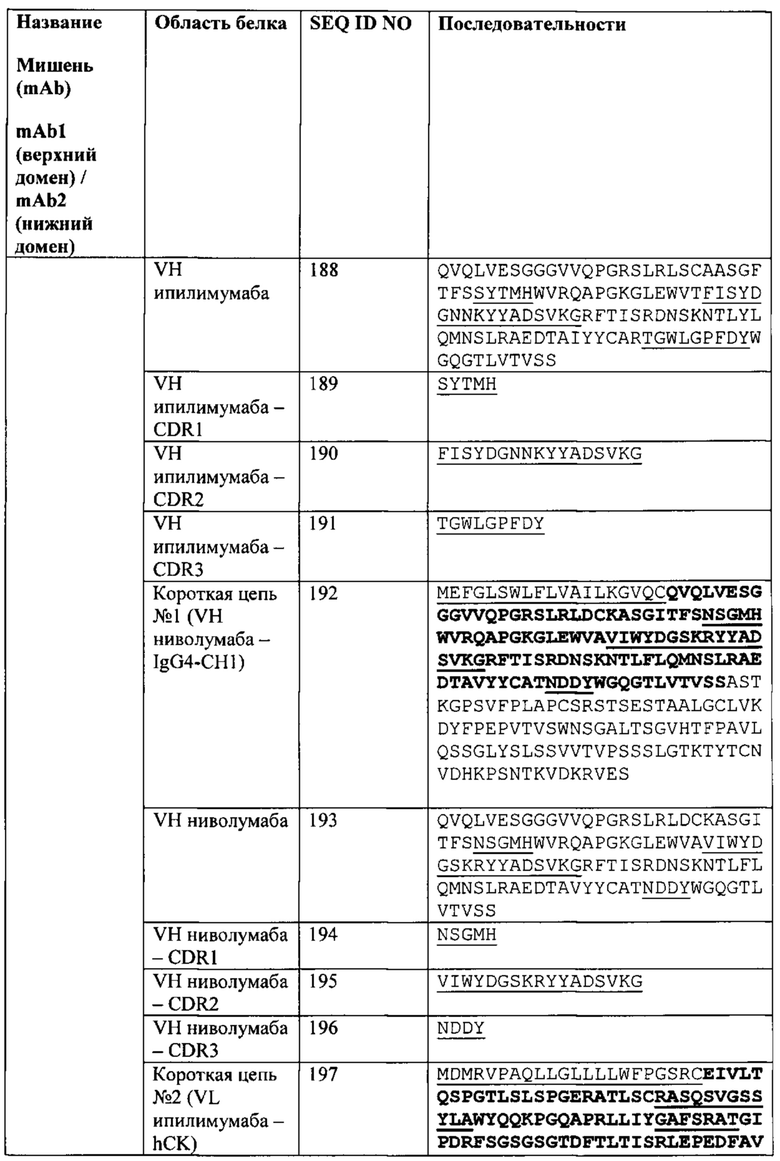
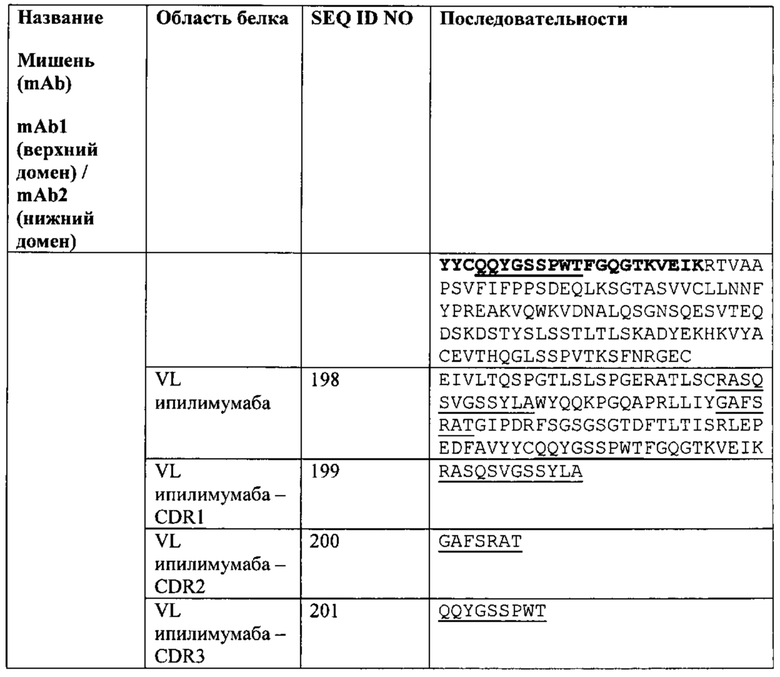
[00432] Указанные длинная цепь и короткая цепь содержат лидерную последовательность, которая может быть представлена либо последовательностью MDMRVPAQLLGLLLLWFPGSRC (SEQ ID NO: 487), либо последовательностью MEFGLSWLFLVAILKGVQC (SEQ ID NO: 488).

[00433] Уровень экспрессии оценивали при получении в небольшом масштабе без какой-либо оптимизации, за исключением NBS3. Все ЭХ-образцы подвергают одноэтапному очищению с белком A. FIT-Ig в формате как IgG1, так и IgG4 может быть получен в виде гомогенного белка из клеток 293.
Функциональные исследования
[00434] Данные функционального связывания для указанных антител представлены ниже в таблице 23. Эти данные предполагают, что изменение константных последовательностей IgG не влияет на аффинность, однако она может быть увеличена путем размещения определенного Fab в верхнем домене.

[00435] Исследование связывания методом ИФА ELISA: Тестировали связывание NBS3R в ИФА ELISA. Вкратце, для связывания с CTLA-4 белок CTLA-4-Ig человека (R&D Systems) иммобилизовали на 96-луночных планшетах, после чего проводили рутинные процедуры промывания и блокирования. Затем FIT-Ig или родственные моноклональные антитела в различных концентрациях добавляли в планшет, с последующими инкубацией и несколькими этапами промывания, и детектировали HRP-конъюгированным антителом против Fab человека. Для связывания с PD-1 PD-1 человека (с гистидиновой меткой) (R&D Systems) иммобилизовали на 96-луночных планшетах, после чего проводили рутинные процедуры промывания и блокирования. Затем NBS3R или ниволумаб в различных концентрациях добавляли в планшет, с последующими инкубацией и несколькими этапами промывания, и детектировали HRP-конъюгированным антителом против Fc человека. По-видимому, NBS3R был способен связывать как CTLA-4 (А), так и PD-1 (В), соответственно. Результат приведен на фиг. 9А и фиг. 9В.
[00436] Исследование множественного связывания: Также проводили исследование множественного связывания NBS3. Результат приведен на фиг. 10.
[00437] Исследование термостабильности: Также проводили тест на термостабильность указанных антител, результат которого представлен в таблице 24. Температуру плавления измеряли с применением ДСК.
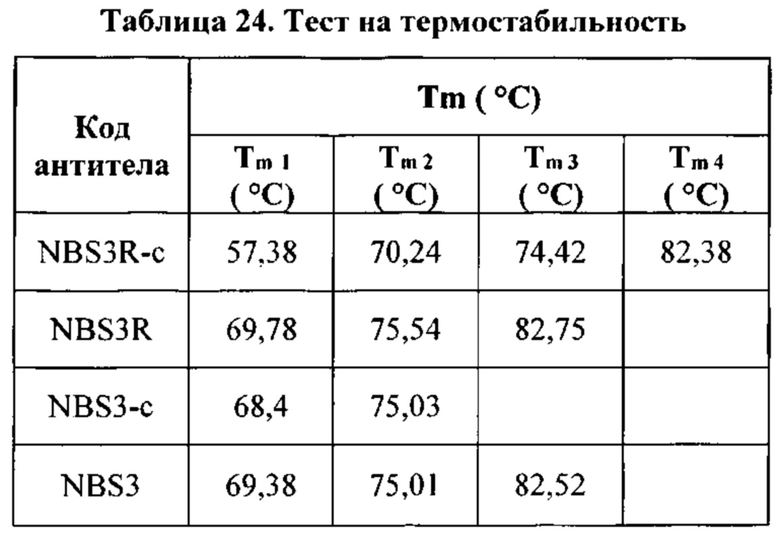
[00438] Исследование стабильности при хранении: Стабильность NBS3 при хранении оценивали с применением метода ЭХ-ВЭЖХ; результат представлен в таблице 25. Образцы подвергали циклам замораживания/размораживания один, два или три раза; исходя из профиля ЭХ-ВЭЖХ, агрегации или разложения не наблюдалось. Образцы обрабатывали при 4°С, 25°С или 40°С в течение 1 дня, 3 дней или 7 дней; исходя из профиля ЭХ-ВЭЖХ, агрегации или разложения не наблюдалось.
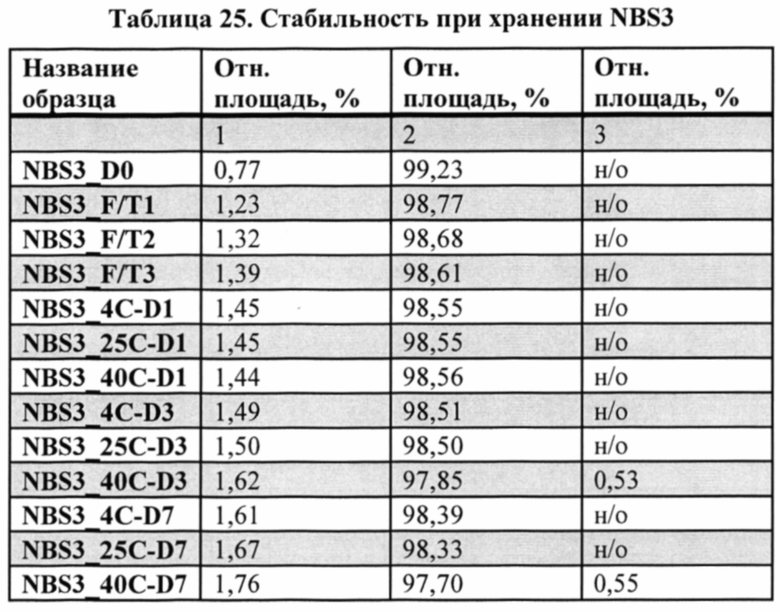
[00439] Дополнительно проводили тестирование NBS3 в исследовании ФК у крыс; результат представлен на фиг. 11А и фиг. 11В. Цель указанного исследования заключалась в оценке фармакокинетики NBS3 после одного внутривенного (в/в) или подкожного (п/к) введения у крыс Спрег-Доули. В/в дозу вводили посредством инъекции в дорсальную вену стопы, а п/к дозу вводили посредством подкожной инъекции. В назначенные моменты времени животных удерживали руками и собирали в пробирки приблизительно по 240 мкл крови/точку времени путем пункции хвостовой вены или пункции сердца. Образцы крови помещали в условия комнатной температуры на 0,5 ч. Затем образцы крови центрифугировали (10000 g, 5 мин при 4°С) для получения образцов сыворотки. Образцы сыворотки немедленно помещали на хранение при -80°С до анализа. Образцы анализировали в ИФА ELISA совместно с раствором для дозирования. Измеренную дозовую концентрацию использовали для расчета показателей ФК.
[00440] NBS3, NBS3-C и NBS3R-C тестировали в анализе блокирования клеточных рецепторов. Вкратце, PD1-Fc иммобилизовали на 96-луночных планшетах, после чего проводили рутинные процедуры промывания и блокирования. Затем разведенный FIT-Ig и биотинилированный PD-L1-Fc добавляли в каждую лунку, с последующими инкубацией и несколькими этапами промывания, и детектировали стрептавидином-HRP. Результат приведен на фиг. 12.
[00441] Функциональную активность NBS3, NBS3-C и NBS3R-C дополнительно тестировали в РСЛ-анализах (реакции смешанных лимфоцитов) и в анализе с SEB-стимуляцией МКПК.
[00442] В РСЛ-анализах проводили реакцию смешанных лимфоцитов с применением происходящих из моноцитов дендритных клеток от одного донора и аллогенных CD4 Т-клеток от другого донора. Брали образцы цельной крови у здоровых доноров и выделяли МКПК из цельной крови путем центрифугирования в градиенте Фиколл-Пак. В 1 день выделяли МКПК от одного донора и разводили не содержащей сыворотки средой RPMI 1640 до 1×106/мл. Разведенные МКПК высевали в 6-луночный планшет для тканевых культур по 3 мл/лунку и инкубировали в течение 3 часов. Удаляли супернатант и отмывали неприкрепленные клетки. Прикрепленные моноциты поляризовали в дендритные клетки, используя 250 Ед/мл ИЛ-4 и 500 Ед/мл ГМ-КСФ в среде RPMI1640 с 10% ФБС. Среду заменяли на свежую среду с ИЛ-4 и ГМ-КСФ на 4 день. На 7 день собирали незрелые ДК и обрабатывали 1 мкг/мл ЛПС в среде RPMI1640 с 10% ФБС в течение дополнительных 24 часов для созревания. На 8 день выделяли CD4 Т-клетки из МКПК другого донора с использованием негативного отбора и доводили до конечной концентрации 2×106 клеток/мл. Зрелые ДК обрабатывали митомицином С при 37°С в течение 1,5 часов. Затем ДК промывали ФСБ и доводили до конечной концентрации 1×106 клеток/мл. В 96-луночный планшет добавляли по 100 мкл/лунку CD4 Т-клеток (клетки-респондеры) и предварительно обрабатывали тестируемым антителом в разбавленной концентрации в течение 30 минут. Затем добавляли по 100 мкл/лунку зрелых ДК (клетки-стимуляторы). Итоговый объем в каждой лунке составляет 200 мкл. РСЛ инкубировали при 37 градусах в течение 72 часов для теста с ИЛ-2 и 120 часов для теста с ИФН-гамма, соответственно, с применением ИФА ELISA. Результат приведен на фиг. 13А и фиг. 13В.
[00443] В анализах с SEB-стимуляцией МКПК клетки МКПК выделяли из крови здоровых доноров центрифугированием в градиенте Фиколл-Пак. Выделенные МКПК высевали в 96-луночный планшет для тканевых культур с плотностью 1×105 клеток/лунку. Затем указанные МКПК предварительно обрабатывали разведенными тестируемыми антителами в течение 30 минут. В клеточную культуральную среду добавляли энтеротоксин стафилококка В (SEB) до конечной концентрации 100 нг/мл. Итоговый аналитический составлял 200 мкл/лунку. Клетки культивировали в течение 96 часов и собирали культуральный супернатант. Продуцирование цитокина ИЛ-2 в супернатанте детектировали с помощью ИФА ELISA. Результат приведен на фиг. 14.
Пример 7; Конструирование, экспрессия и очищение дополнительного иммуноглобулина против рЭФР/PD-L1 с тандемными Fab-фрагментами (FIT-Ig)
[00444] Новые FIT-Ig, специфичные в отношении рЭФР и PD-L1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 26. В таблице 27 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для каждого из FIT-Ig.
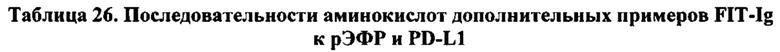



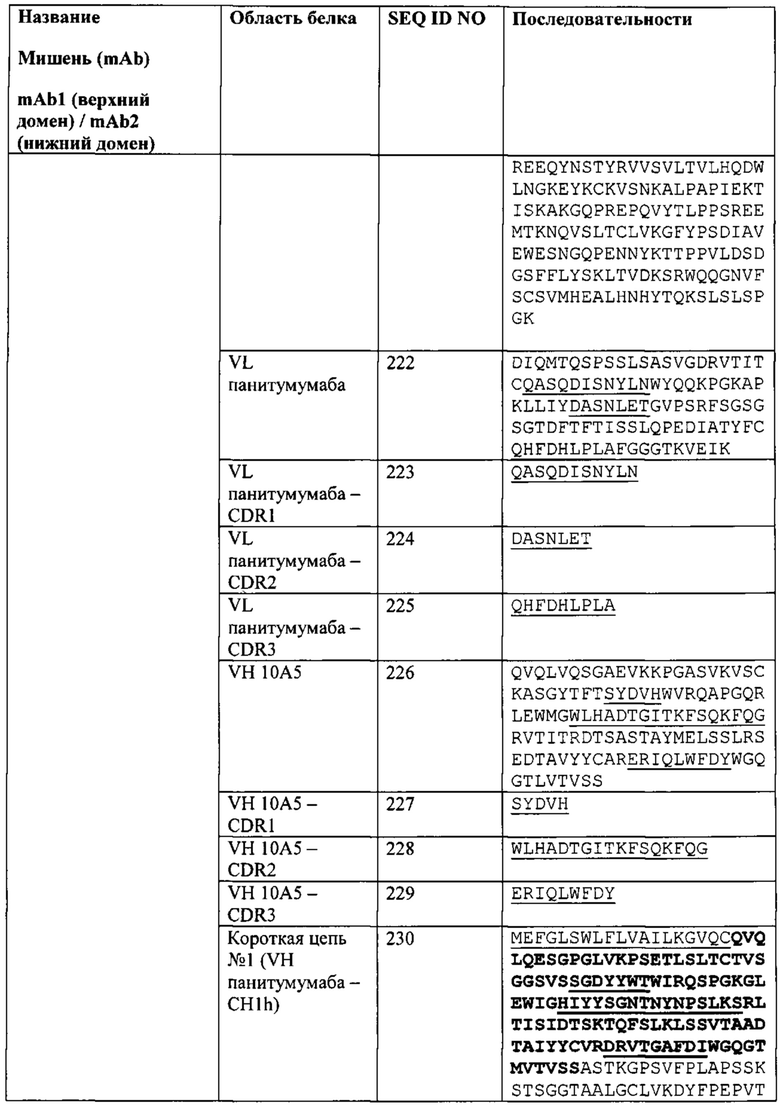

[00445] ЭХ-профиль и данные экспрессии указывают на наблюдаемую более высокую чистоту FIT012d относительно FIT012b в результате замены последовательностей антитела к PD-L1.
[00446] Данные функционального связывания для указанных двух антител представлены ниже в таблице 28 и таблице 29. Эти данные предполагают, что изменение константных последовательностей IgG не влияет на аффинность, однако она может быть увеличена путем размещения определенного Fab в верхнем домене.
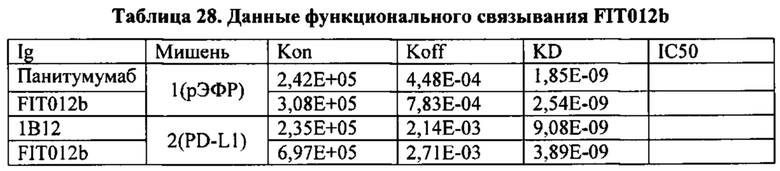

[00447] Также проводили исследование множественного связывания FIT012b и FIT012d. Результат приведен на фиг. 15 (FIT012b) и фиг. 16А-В (FIT012d).
Пример 8: Конструирование, экспрессия и очищение иммуноглобулина против cMet/рЭФР с тандемными Fab-фрагментами (FIT-Ig)
[00448] Новые FIT-Ig, специфичные в отношении cMet и рЭФР, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 30. В таблице 31 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для каждого из FIT-Ig.
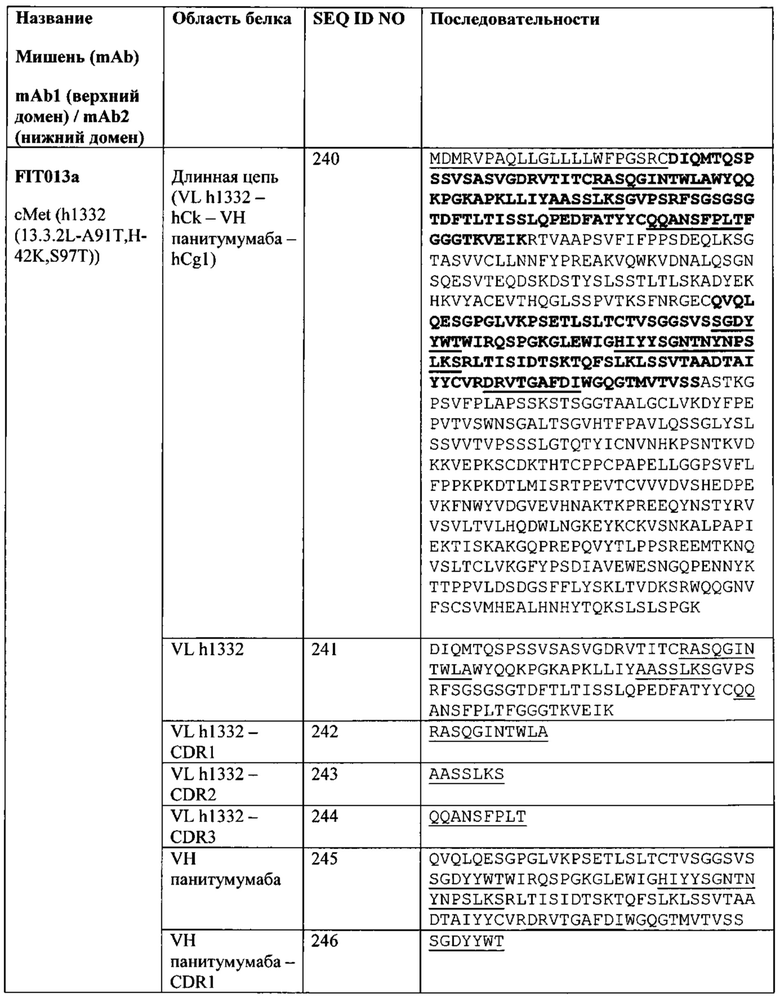



Данные о стабильности
[00449] Стабильность FIT013a при хранении оценивали методом ЭХ-ВЭЖХ; результат представлен в таблице 32. Образцы подвергали циклам замораживания/размораживания один, два или три раза; исходя из профиля ЭХ-ВЭЖХ, агрегации или разложения не наблюдалось. Образцы обрабатывали при 4°С, 25°С или 40°С в течение 1 дня, 3 дней или 7 дней; исходя из профиля ЭХ-ВЭЖХ, агрегации или разложения не наблюдалось.
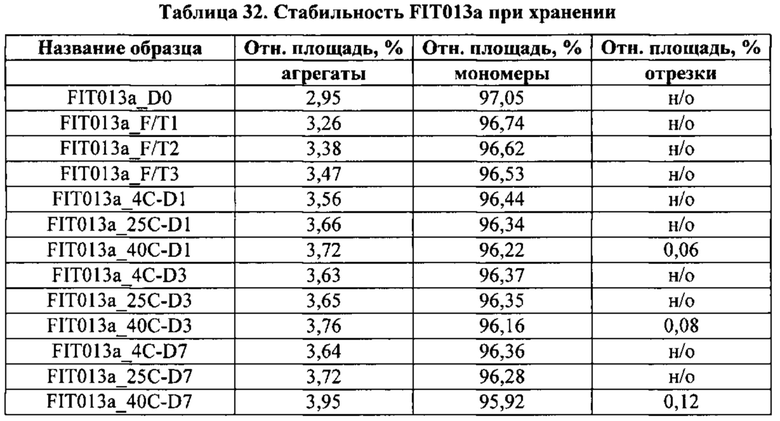
[00450] Функциональное исследование: Данные связывания белков для FIT013a представлены ниже в таблице 33 и таблице 34.
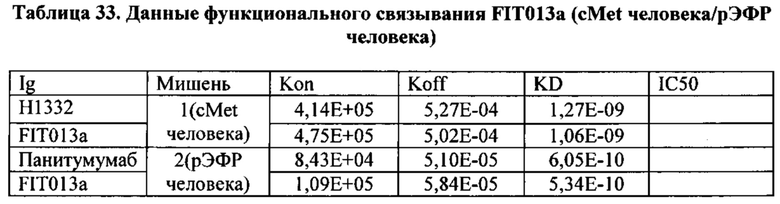
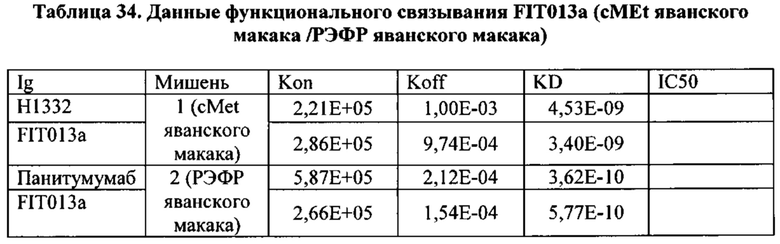
[00451] Также проводили исследование множественного связывания FIT013a. Результат представлен на фиг. 17.
[00452] Кроме того, определяли связывающую активность FIT013a в линиях раковых клеток с помощью проточной цитометрии на BD FACSVerse. Клетки, выращенные в культуре, отсоединяли от флакона, используя среду без трипсина, и собирали. Собранные клетки промывали в буфере ФСБ, содержащем 2% ФБС. Затем клетки разделяли на аликвоты и инкубировали с серийными разведениями (1:5) FIT013a на льду в течение 1 часа. Стартовая рабочая концентрация FTI013a составляла 20 мкг/мл. Клетки промывали, ресуспендировали и инкубировали с разведенным 1:100 меченным Alexa Fluor® 488 антителом мыши против IgG1 человека (Invitrogen, Кат. № А-10631) на льду, защищая от света, в течение 1 часа. Клетки промывали и детектировали сигнал на проточном цитометре BD FACSVerse в соответствии с протоколами производителя.
[00453] Указанные эксперименты продемонстрировали, что FIT013a может связываться с многими линиями раковых клеток, такими как NCI-H1993, НСС827, MKN-45, SGC-7901, ЕВС-1, А549, KP4, NCI-H292, NCI-H1975 и т.п. Геометрическое среднее значение интенсивности флуоресценции (MFI) и ЕС50 для каждой линии клеток приведены в таблице 35.
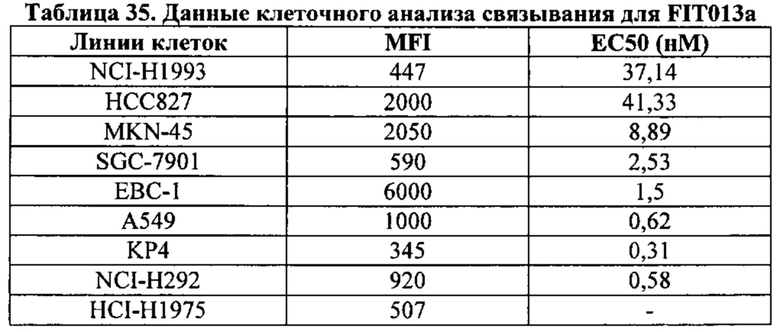
[00454] Кроме того, проводили FACS-анализы для измерения двойного связывания FIT013a с мембранными c-Met и рЭФР, чтобы показать его множественную связывающую активность.
[00455] В указанном анализе использовали несколько линий клеток. MKN-45 (клетки аденокарциномы желудка человека) экспрессировали c-Met на высоком уровне и рЭФР на низком уровне. SGC-7901 (рак желудка человека) экспрессировали высокий уровни рЭФР на высоком уровне и c-Met на низком уровне. NCI-H1975 (немелкоклеточный рак легкого человека) экспрессировали c-Met и рЭФР на одинаковых уровнях.
[00456] Клетки, выращенные в культуре, отсоединяли от флакона, используя среду без трипсина, и собирали. Собранные клетки промывали в буфере ФСБ, содержащем 2% ФБС. Клетки разделяли на аликвоты и инкубировали с серийными разведениями FIT013a или FIT013a-Fab на льду в течение 1 часа. Затем клетки промывали и инкубировали с 1 мкг/мл биотинилированного с-МЕТ человека или биотинилированного рЭФР человека на льду в течение 1 часа. Клетки ресуспендировали и инкубировали с 4 мкг/мл меченного Alexa Fluor® 488 стрептавидина (Invitrogen, кат. № S32354) на льду, защищая от света, в течение 1 часа. Клетки промывали и детектировали сигнал на проточном цитометре BD FACSVerse в соответствии с протоколами производителя.
[00457] В тех случаях, когда уровень мембранной экспрессии c-Met в клетках значительно выше, чем уровень экспрессии рЭФР (например, на клетках MKN-45), сайт связывания c-Met FIT013a и FIT013a-Fab может быть занят мембранным c-Met, свободный сайт связывания рЭФР FIT013a и FIT013a-Fab может быть детектирован с помощью биотинилированного рЭФР. В тех случаях, когда уровень мембранной экспрессии рЭФР в клетках значительно выше, чем уровень экспрессии c-Met (например, на SGC-7901), сайт связывания рЭФР FIT013a и FIT013a-Fab может быть занят мембранным рЭФР, свободный сайт связывания c-Met FIT013a и FIT013a-Fab может быть детектирован с помощью биотинилированного c-Met. В тех случаях, когда уровень мембранной экспрессии c-Met в клетке равен уровню рЭФР (например, на клетке NCI-H1975), сайты связывания c-Met и рЭФР FIT013a и FIT013a-Fab заняты одновременно, и свободный сайт связывания рЭФР или c-Met FIT013a и FIT013a-Fab не может быть детектирован. Как продемонстрировано на фиг. 18А-18С, FIT013a и FIT013a-Fab могут одновременно связываться с двумя рецепторами c-Met и рЭФР на поверхности клеток.
[00458] Анализ сигнализации: Далее, FIT013a использовали для ингибирования индуцированного ФРГ фосфорилирования АKТ в клетках. Клетки NCI-H292 высевали с плотностью 2×105 на лунку в 96-луночный планшет и оставляли на ночь в бессывороточной среде. В планшет добавляли серийные разведения FIT013a или других родственных антител и инкубировали в течение 30 минут, после чего в аналитический планшет в течение 5 минут 40 нг/мл добавляли ФРГ. Клетки лизировали и фосфорилирование АKТ детектировали с применением набора для анализа на фосфорилированную по T202/Y204 ERK (Cisbio, кат. №: 64AKSPEG). Указанный эксперимент демонстрирует, что активность FIT013a, нейтрализующая индуцированное ФРГ фосфорилирование АKТ в клетках NCI-H292, превосходит активность комбинации mAb. FIT013a ингибировал фосфорилирование АKТ на 80%, тогда как комбинация антител к рЭФР и c-Met ингибировала фосфорилирование АKТ на 60%, см. фиг. 19.
[00459] Анализ агонистов: Агонистический эффект антител к c-Met, рЭФР в FIT013a тестировали, используя фосфорилирование АKТ. Клетки NCI-H441 высевали с плотностью 2×105 на лунку в 96-луночный планшет и оставляли на ночь в бессывороточной среде. Серийные разведения FIT013a или других родственных антител добавляли в планшет и инкубировали в течение 30 минут. Клетки лизировали и детектировали фосфорилирование АKТ с применением набора для анализа на фосфорилированную по T202/Y204 ERK (Cisbio, кат. №: 64AKSPEG). Как показано на фиг. 20, в указанном эксперименте наблюдается слабый агонистический эффект FIT013a в отсутствие ФРГ.
[00460] Исследование истощения рецепторов: тестировали FIT013a, чтобы выяснить, способен ли они истощать и c-Met, и рЭФР на мембране клеток. Антитело к c-Met, антитело к рЭФР и FIT013a инкубировали с клетками Н441 на протяжении более 16 ч при 37°С, а затем оставшиеся на поверхности клеток рЭФР и c-Met детектировали с помощью FACS. Указанный результат подтверждает, что FIT013a способен истощать с-Met и рЭФР клеточной мембраны примерно на 70%, что превышает результат для антитела к c-Met или антитела к рЭФР, см. таблицу 36.
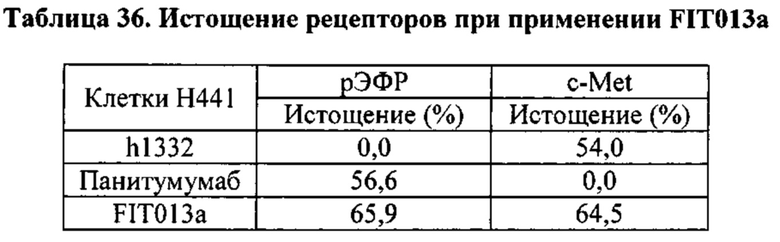
[00461] Исследование ФК у крыс: Цель указанного исследования заключалась в оценке фармакокинетики FIT013a (c-met/рЭФР) после одного внутривенного (в/в) или подкожного (п/к) введения у крыс Спрег-Доули. Для в/в и п/к дозирования тестируемый FIT013a (c-met/рЭФР) растворяли (в 10 мМ цитрате натрия, 50 мМ NaCl, рН 6,0) до концентрации 2,3 мг/мл (лот: 160408001). В указанном исследовании использовали в общей сложности 8 самцов крыс Спрег-Доули с массой тела приблизительно 195-208 г, приобретенных у SLAC Laboratory Animal Co. LTD., квалификационный номер: SCXK (SH) 2008001659659. Дизайн дозирования и взятия образцов представлен в таблице 37.


[00462] В/в дозу вводили посредством инъекции в дорсальную вену стопы, а п/к дозу вводили посредством подкожной инъекции. В назначенные моменты времени животных удерживали руками и собирали в пробирки приблизительно по 240 мкл крови/точку времени путем пункции хвостовой вены или пункции сердца. Образцы крови помещали в условия комнатной температуры на 0,5 ч. Затем образцы крови центрифугировали (10000g, 5 мин при 4°С) для получения образцов сыворотки. Образцы сыворотки немедленно помещали на хранение при -80°С до анализа. Образцы детектировали с применением ИФА ELISA, используя белок c-Met и рЭФР, соответственно. Данные о зависимости концентрации от времени для FIT013a (с-met/рЭФР) в сыворотке крыс в в/в и п/к исследованиях приведены в таблицах 38-41 и проиллюстрированы фиг. 21A-21D.

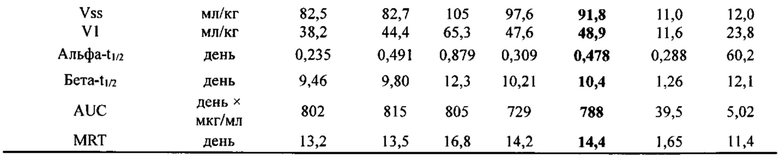
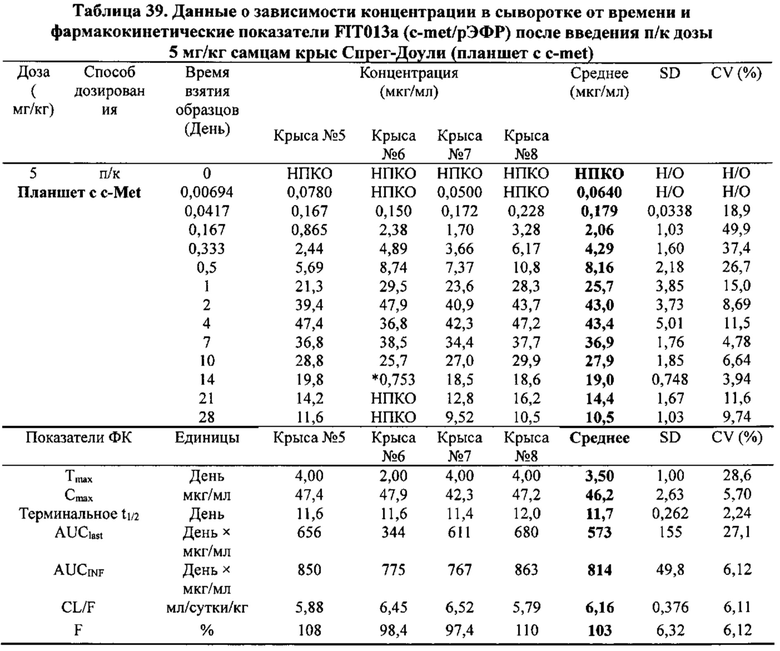
*: Концентрация в сыворотке в указанный момент времени была исключена из расчетов среднего значения и показателей ФК ввиду возможного присутствия антитела против лекарственного средства.

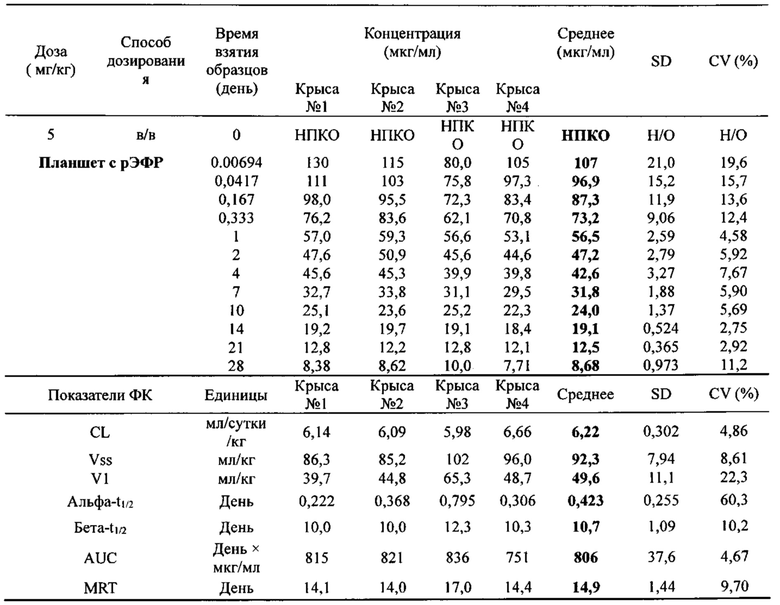
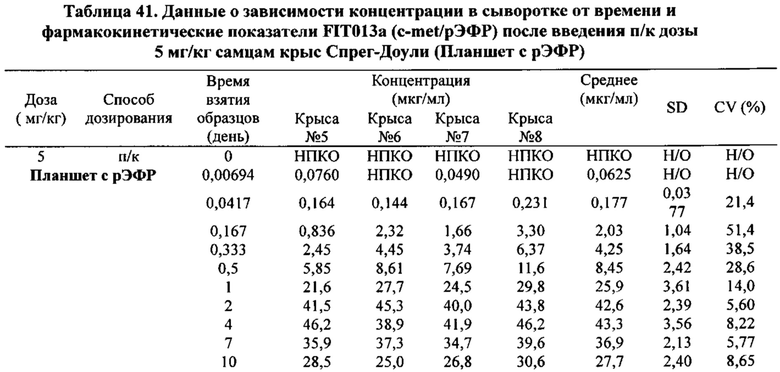

*: Концентрация в сыворотке в указанный момент времени была исключена из расчетов среднего значения и показателей ФК ввиду возможного присутствия антитела против лекарственного средства.
Исследование распределения в модели ксенотрансплантата опухоли NCI-H1975-HGF.
[00463] В указанном исследовании измеряли концентрация FIT013a в сыворотке и в опухолях через 24 часа после в/б введения одной дозы несущим опухоли NCI-H1975-HGF мышам nude BALB/c.
[00464] Клетки NCI-H1975-HGF подкожно инокулировали мышам nude BALB/c. Когда средний объем опухолей достигал 200-250 мм3, мышей случайным образом распределяли в четыре группы: FIT013a, Н1332, группу панитумумаба и группу основы. Группа FIT013a получала одну в/б дозу 16 мг/кг; группа Н1332 или панитумумаба получала одну в/б дозу 10 мг/кг. Группа основы получала дозу рецептурного буфера: 10 мМ цитрат натрия, 50 мМ NaCl, рН 6,0. Через 24 часа после дозирования собирали опухоли и сыворотку. Опухоли гомогенизировали и собирали супернатант для последующего ИФА ELISA. Проводили количественное определение FIT013a, панитумумаба и H1332 как в сыворотке, так и в опухолях с применением общего метода ИФА ELISA для hIgG.
[00465] Указанный эксперимент демонстрирует, что в сыворотке и опухолях наблюдалось распределение FIT013a, сопоставимое с распределением моноклональных антител, см. фиг. 22.
Исследование эффективности в модели ксенотрансплантата NCI-H1975-HGF
[00466] В указанном исследовании измеряли эффективность FIT013a в модели ксенотрансплантата NCI-H1975-HGF.
[00467] Клетки NCI-H1975-HGF подкожно инокулировали мышам nude BALB/c. Когда средний объем опухолей достигал 100-130 мм3, а максимальный объем опухоли составлял менее 140 мм3, мышей случайным образом распределяли в четыре группы, FIT013a, H1332, группу панитумумаба и группу основы. Указанные антитела вводили два раза в неделю в/б на протяжении трех недель. Дозировка FIT013a составляла 16 мг/кг, H1332 или панитумумаба - 10 мг/кг. Группа основы получала дозу рецептурного буфера: 10 мМ цитрат натрия, 50 мМ NaCl, рН 6,0. Объем опухолей и массу тела мышей измеряли дважды в неделю. Процент ингибирования роста опухоли (% TGI) определяли как разницу между средним объемом опухолей (MTV) в получавшей лечение контролем группе и MTV в получавшей лечение тестируемым антителом группе.
[00468] Эксперимент демонстрирует большую наблюдаемую эффективность FIT013a по сравнению с моноклональным антителом к рЭФР или c-Met, см. фиг. 23.
Пример 9: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против Фактора IXa/Фактора X
[00469] FIT-Ig, специфичные в отношении фактора IXa и фактора X, конструировали согласно приведенным выше примерам. Указанные примеры FIT-Ig и соответствующие им последовательности приведены ниже в таблице 42. В таблице 43 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для каждого из FIT-Ig.
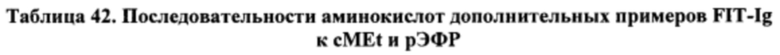
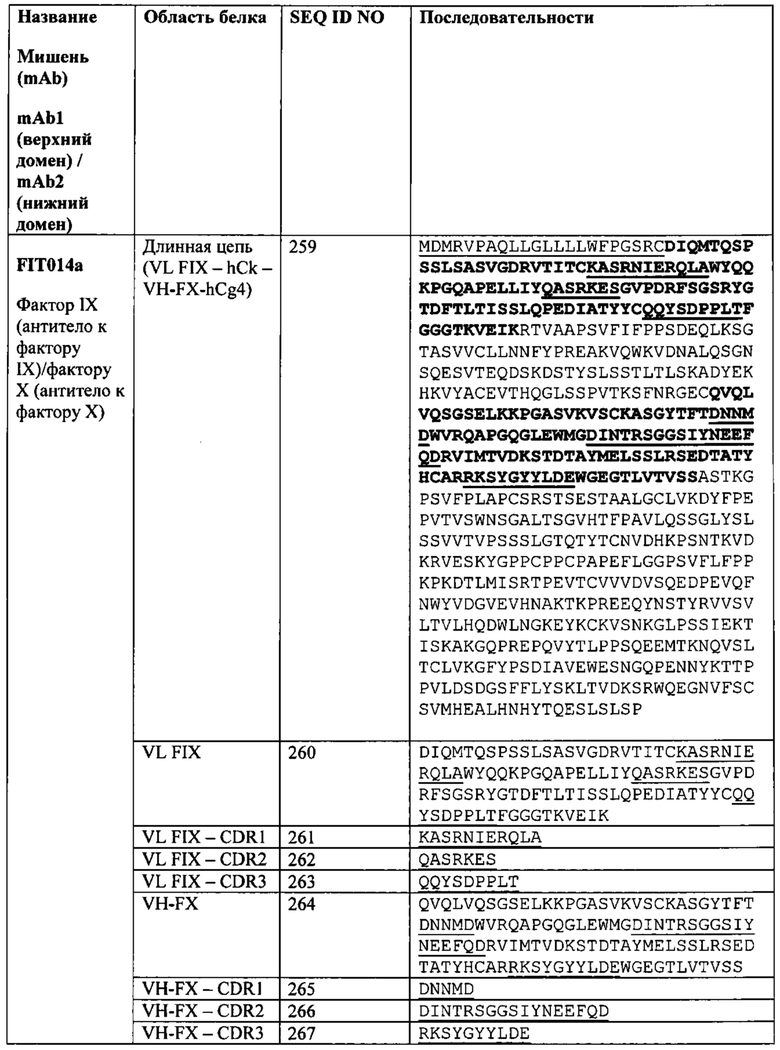

Функциональное исследование
[00470] Измерение аффинности с применением поверхностного плазмонного резонанса: Кинетику FIT-Ig связывания с фактором IX человека и фактором X человека (Enzyme Research Laboratory) определяли с применением поверхностного плазмонного резонанса на инструменте Biacore X100 (Biacore АВ, Уппсала, Швеция), используя HBS-ЕР (10 мМ HEPES, рН 7,4, 150 мМ NaCl, 3 мМ ЭДТК и 0,005% сурфактанта Р20) при 25°С. Вкратце, специфическое в отношении Fc-фрагмента поликлональное антитело козы против IgG человека (Pierce Biotechnology Inc, Рокфорд, Иллинойс) прямо иммобилизовали на биосенсорном чипе СМ5 категории «для исследований» с применением стандартного набора для сочетания аминов в соответствии с инструкциями изготовителя. Очищенные образцы FIT-Ig разводили в забуференном HEPES солевом растворе для захвата на поверхностях, покрытых специфическим в отношении Fc-фрагмента антителом козы против IgG человека, и вводили на реакционные матрицы при скорости потока 5 мкл/мин. Константы скорости связывания и скорости диссоциации, kon (M-1c-1) и koff (c-1), определяли при постоянной скорости потока 30 мкл/мин. Константы скорости получали, проводя измерения кинетики связывания при концентрациях антигена 500 нМ. Затем на основании кинетических констант скорости рассчитывали равновесную константу диссоциации (М) FIT-Ig и целевых белков по следующей формуле: KD=koff/kon. Аликвоты образцов антигена также одновременно вводили на холостую референсную и реакционную поверхности СМ для регистрации и вычитания какого-либо обусловленного неспецифическим связыванием фона, обеспечивая элиминацию большей части изменений показателя преломления и шума при введении. Поверхности регенерировали посредством последующего двукратного введения 25 мл 10 мМ глицина (рН 1,5) при скорости потока 10 мкл/мин. Поверхности с иммобилизованным антителом против Fc полностью регенерировали и полностью сохраняли захватывающую способность на протяжении 12 циклов. Данные связывания белков для FIT014a представлены ниже в таблице 44.

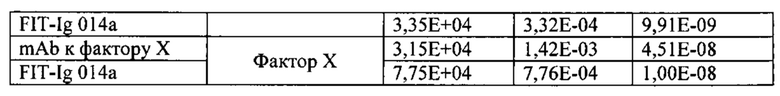
[00471] Анализ на фактор VIIIa-подобную активность: FVIIIa-подобную активность FIT-Ig оценивали с применением ферментного анализа в соответствии с инструкциями изготовителя набора BIOPHEN FVIII:C (Hyphen-Biomed, 221402-RUO). Указанный результат подтверждает, что FIT014a обладает FVIIIa-подобной активностью, сопоставимой с активностью эмицизумаба и очищенного FVIIIa, тогда как моноклональные антитела к фактору IX и фактору X, а также их комбинация, не обладали активностью, см. фиг. 24.
[00472] Исследование связывания с несколькими антигенами; указанное исследование проводили с применением OctetRed для определения того, способен ли FIT014a связывать фактор IX человека и фактор X человека одновременно. Вкратце, FIT014a иммобилизовали на сенсоре AR2G в концентрации 10 мкг/мл, с последующим связыванием фактора IX человека и затем фактора X человека (Enzyme Research Laboratory) в аналитическом буфере (ФСБ рН 7,4, 0,1% БСА, 0,02% Tween) с концентрацией 500 нМ. В конце эксперимента поверхность пятикратно регенерировали 10 мМ глицином при рН 1,5. Указанный эксперимент демонстрирует, что FIT014a способен связывать фактор X человека после того, как он уже связался с фактором IX человека, свидетельствуя, что FIT014a может связывать и фактор IX, человека и фактор X человека одновременно, см. фиг. 25.
[00473] Исследование стабильности: Образцы белка FIT014a в цитратном буфере (рН=6,0) инкубировали индивидуально при постоянной температуре 4°С, 25°С и 40°С в течение 1 дня, 3 дней или 7 дней. Аналогичным образом, образцы белка FIT014a замораживали/размораживали один, два или три раза. Фракции интактного полного мономерного белка во всех образцах детектировали с помощью ЭХ-ВЭЖХ, при этом 10 мкг каждого образца белка вводили в систему для ВЭЖХ UltiMate 3000, оснащенную колонкой Superdex200 5/150 GL при скорости потока 0,3 мл/мин в течение 15 минут, и данные регистрировали и анализировали с применением программного обеспечения Chromeleon, поставляемого производителем. Из таблицы 45 видно, что FIT014a продолжал находиться в виде полностью интактной мономерной молекулы в указанных условиях термической стимуляции.
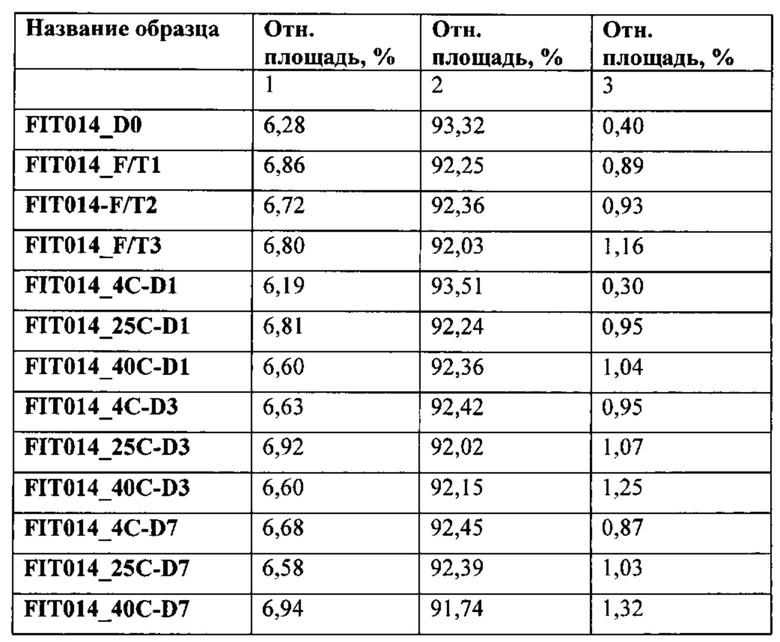
[00474] Исследование ФК у крыс: Проводили исследование ФК FIT014a на крысах; результат представлен на фиг. 26 и в таблице 46. Концентрации антитела в образцах сыворотки крыс детектировали с применением ИФА ELISA при НПКО 62,5 нг/мл. На планшете с hIgG белок для покрытия представляет собой антитело против Fc hIgG, и антитело для детекции представляет собой Fab против hIgG. На планшете с фактором X белок для покрытия представляет собой фактор X человека, тогда как антитело для детекции представляет собой антитело против Fc IgG человека.


Пример 10: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против HER3/рИФР-1
[00475] FIT-Ig, специфичные в отношении HER3 и рИФР-1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 47. В таблице 48 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig.




Функциональные исследования
[00476] Исследование функционального связывания: Данные функционального связывания для FIT016a представлены ниже в таблице 49.

[00477] Исследование связывания с несколькими антигенами: указанное исследование проводили с применением OctetRed для определения того, способен ли FIT016a связывать Her3 и рИФР-1 одновременно. Указанный эксперимент показывает, что FIT016a способен связывать Her3 после того, как он уже связался с рИФР-1, свидетельствуя, что FIT016a способен связывать и Her3, и рИФР-1 одновременно, см. фиг. 27.
Пример 11: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против DLL4/ФРЭС
[00478] FIT-Ig, специфичные в отношении DLL4 и рИФР-1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 50. В таблице 51 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig.

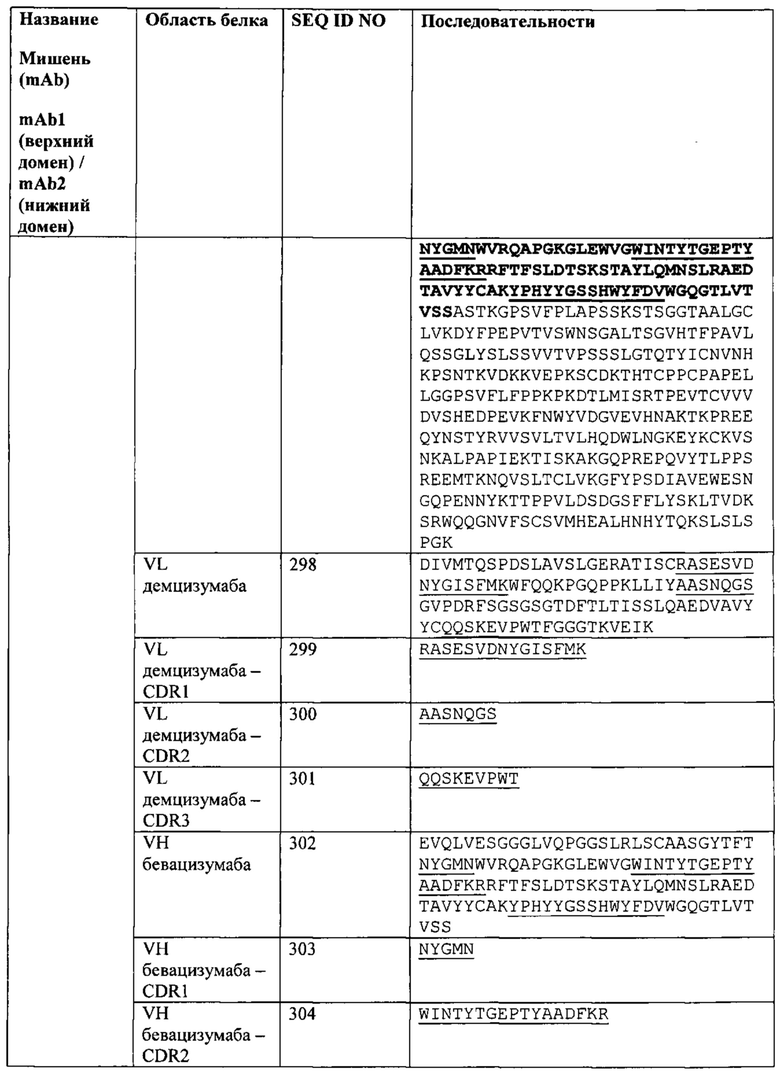

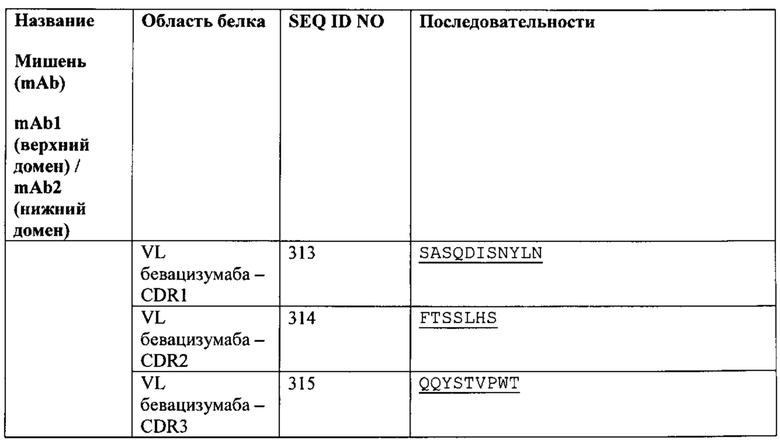

Функциональные исследования
[00479] Исследование функционального связывания: Данные функционального связывания для FIT017a представлены ниже в таблице 52.

[00480] Исследование связывания с несколькими антигенами: указанное исследование проводили с применением OctetRed для определения того, способен ли FIT017a связывать одновременно DLL4 и ФРЭС. Указанный эксперимент показывает, что FIT017a способен связывать DLL4 после того, как он уже связался с ФРЭС, свидетельствуя, что FIT017a способен связывать и DLL4, и ФРЭС одновременно, см. фиг. 28.
Пример 12: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против CD20/CD3
[00481] FIT-Ig, специфичные в отношении CD20 и CD3, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 53. В таблице 54 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig.

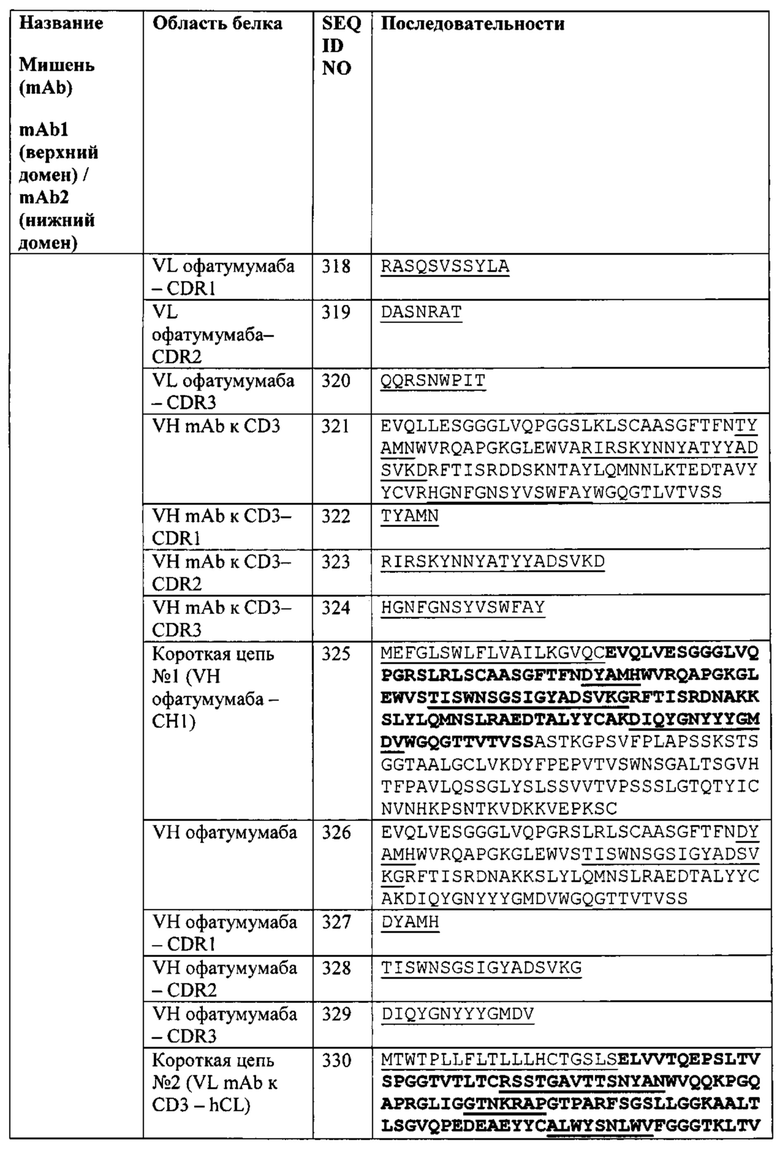


Функциональные исследования
[00482] Исследование функционального связывания: Данные функционального связывания для FIT018a представлены ниже в таблице 55.
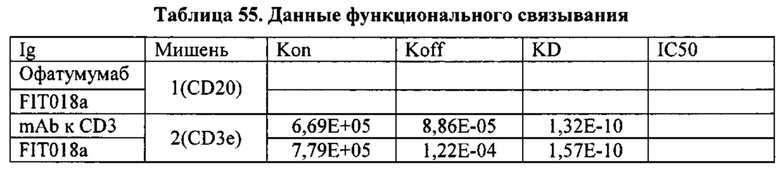
[00483] Исследование связывания на основе клеток: Связывающую активность FIT018a в отношении В-клеток и Т-клеток человека или яванского макака определяли с помощью проточной цитометрии на BD FACSVerse. Клетки Raji использовали для детекции связывания с В-клетками человека. Клетки Jurkat использовали для детекции связывания с Т-клетками человека. Первичные Т-клетки яванского макака применяли для детекции связывания с Т-клетками яванского макака. Клетки HEK 293, транзиентно трансфицированные CD20 яванского макака, использовали для детекции связывания с В-клетками яванского макака. Клетки промывали в буфере ФСБ, содержащем 2% ФБС. Затем клетки разделяли на аликвоты и инкубировали с серийными разведениями (1:5) FIT018a на льду в течение 1 часа. Стартовая рабочая концентрация FIT018a составляла 20 мкг/мл. Клетки промывали, ресуспендировали и инкубировали с разведенным 1:100 меченым Alexa Fluor® 488 антителом мыши против IgG1 человека (Invitrogen, Кат. №А-10631) на льду, защищая от света, в течение 1 часа. Клетки промывали и детектировали сигнал на проточном цитометре BD FACSVerse в соответствии с протоколами производителя. Указанные эксперименты продемонстрировали, что FIT018a может связываться с В-клетками и Т-клетками человека (Raji представляет собой линию В-клеток человека, a Jurkat - линию Т-клеток человека), см. фиг. 29А и фиг. 29В. FIT018a также может связываться с CD20 и CD3 яванского макака, см. фиг. 30А и фиг. 30В.
[00484] Анализ истощения по В-клеткам: Активность FIT018a in vitro измеряли с применением анализа истощения по В-клеткам. МКПК человека выделяли с применением среды Фиколл-Пак (Ficoll Paque Plus, GE HEALTHCARE, кат. №: GE17144002) в соответствии с инструкцией производителя. Целевые клетки Raji собирали и высевали в аналитический планшет с плотностью 5×104 на лунку. Готовили серийные разведения антител и добавляли в аналитический планшет. В аналитический планшет добавляли 2,5×105 на лунку МКПК и инкубировали на протяжении двух дней или 3 дней. После инкубации В-клетки детектировали с помощью антитела против CD19 с применением аппарата для FACS. Указанные эксперименты продемонстрировали, что FIT018a может индуцировать апоптоз В-клеток, см. фиг. 31А и фиг. 31В.
Пример 13: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против HER3/рЭФР
[00485] FIT-Ig, специфичные в отношении HER3 и рЭФР, конструировали согласно приведенным выше примерам. Указанные примеры FIT-Ig и соответствующие последовательности приведены ниже в таблице 56. В таблице 57 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig.
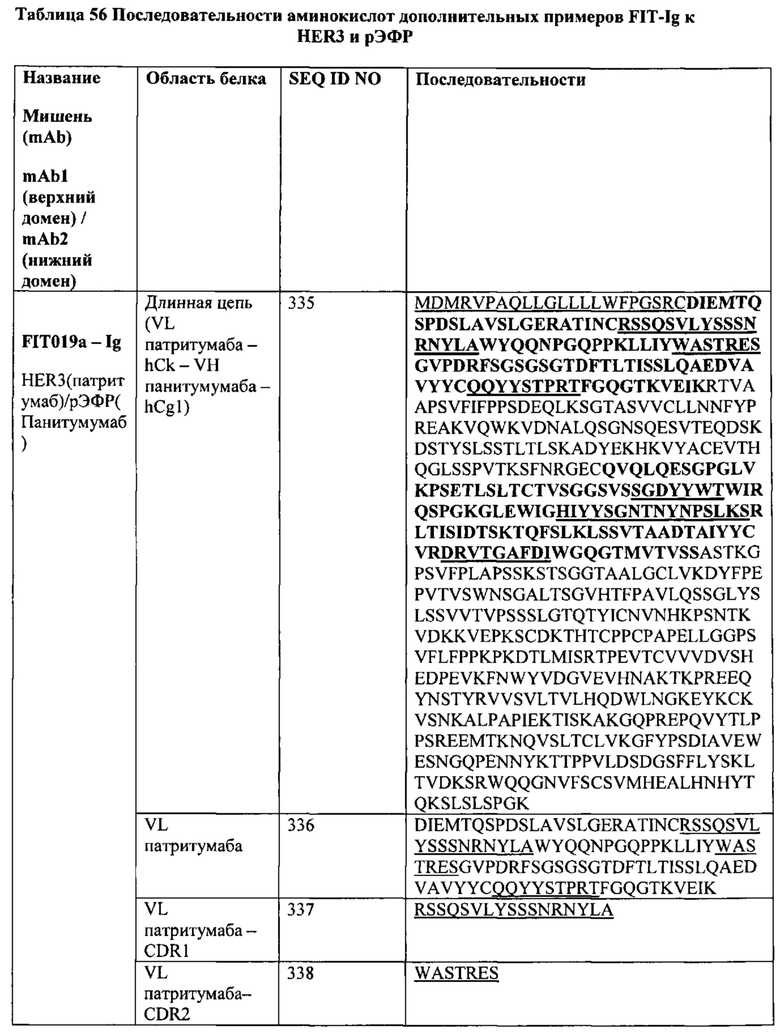
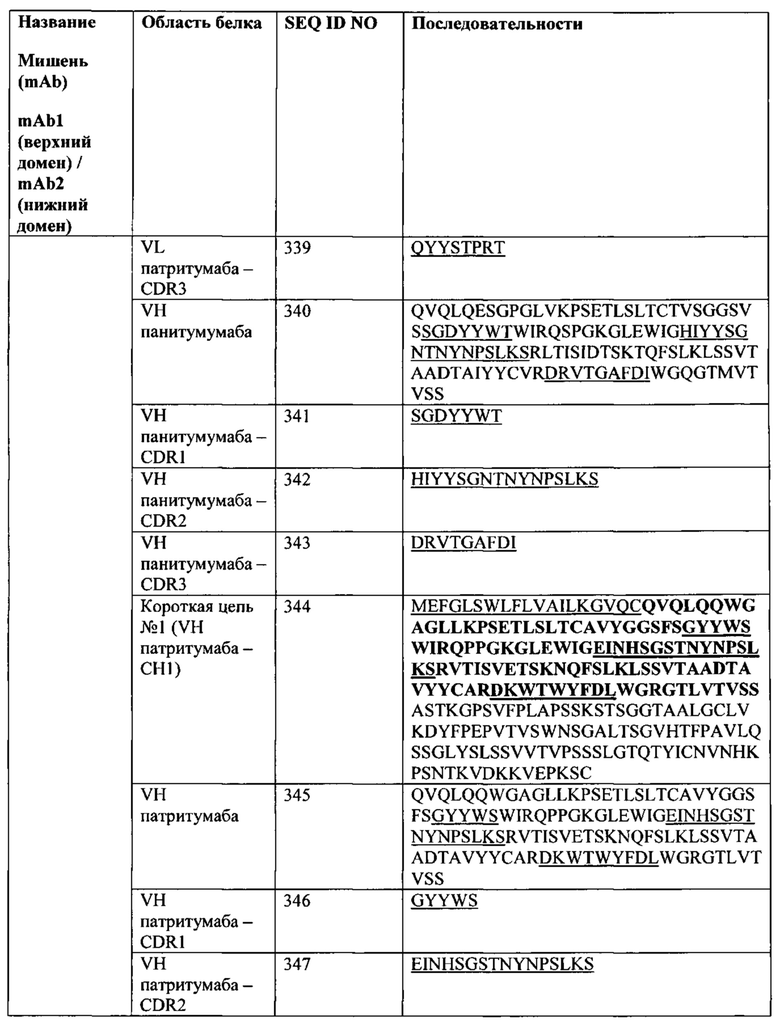
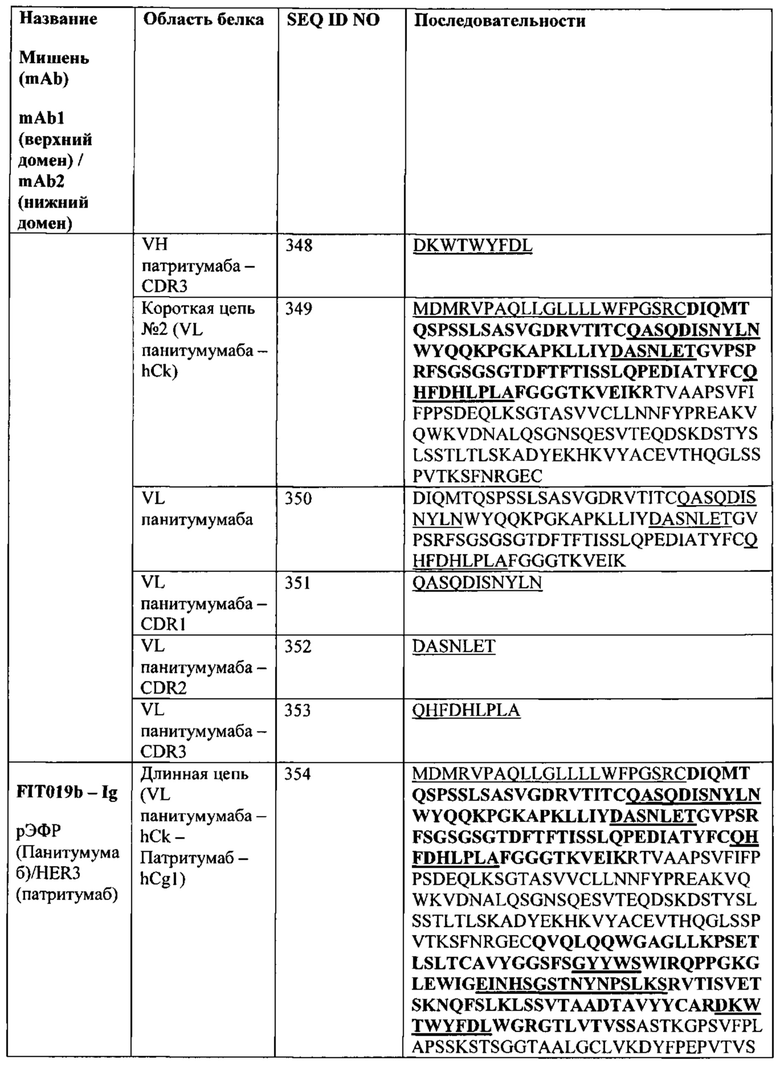
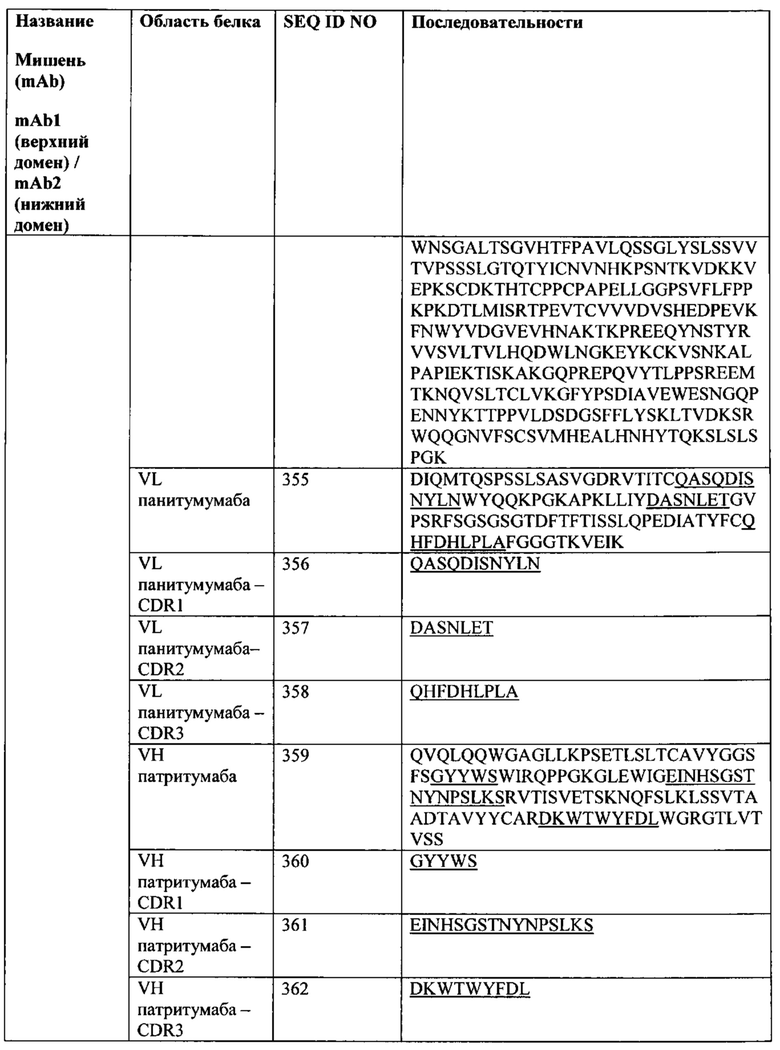
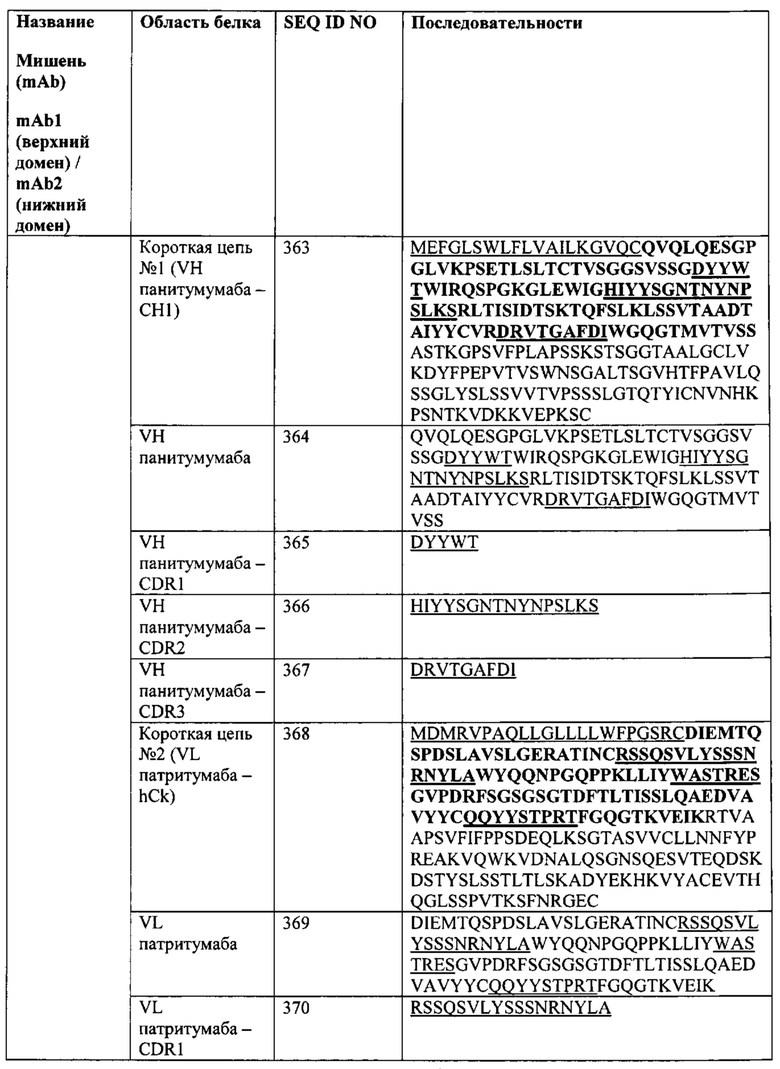


Функциональные исследования
[00486] Исследование функционального связывания: Данные функционального связывания для FIT019a и FIT019b представлены ниже в таблице 58 и таблице 59, соответственно.

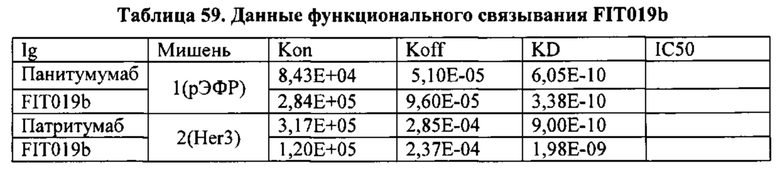
[00487] Исследование множественного связывания: Проводили исследование множественного связывания FIT019a и FIT019b. Результат приведен на фиг. 32 (FIT019a) и фиг. 33А-В (FIT019b), соответственно. Указанный результат подтверждает, что и FIT019a, и FIT019b могут связываться с HER3 и рЭФР одновременно.
Пример 14: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против PD-L1/PD-1
[00488] FIT-Ig, специфичные в отношении PD-L1 и PD-1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 60. В таблице 61 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig.


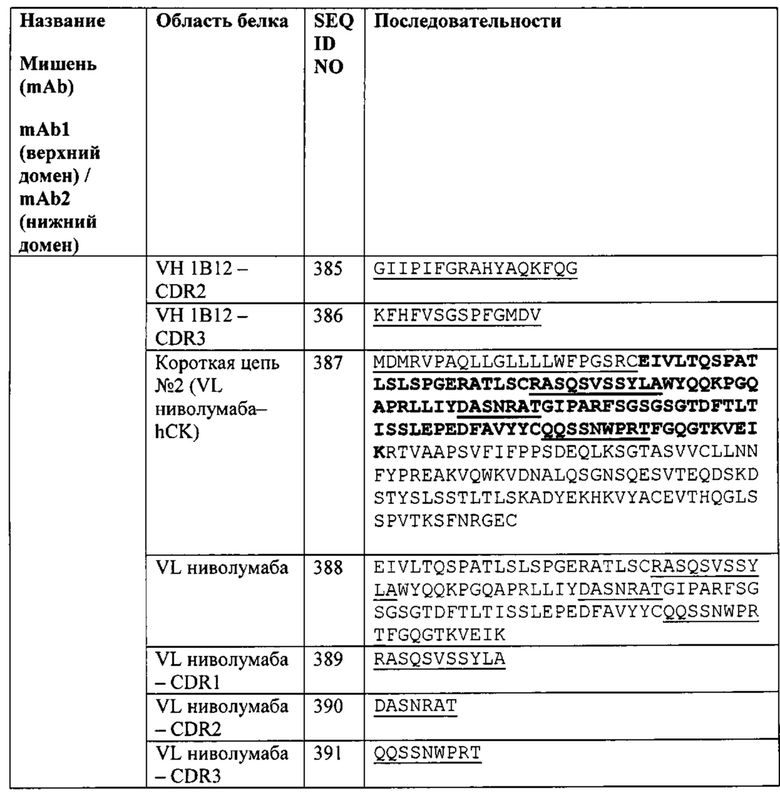

Функциональные исследования
[00489] Измерение аффинности с применением поверхностного плазмонного резонанса: Кинетику FIT-Ig связывания с rhPD-L1 и rhPD-1 определяли с применением поверхностного плазмонного резонанса на инструменте Biacore X100 (Biacore АВ, Уппсала, Швеция) в HBS-EP (10 мМ HEPES, рН 7,4,150 мМ NaCl, 3 мМ ЭДТК и 0,005% сурфактанта P20) при 25°С. Вкратце, по 40 резонансных единиц (RU) rhPD-L1 и rhPD-1 прямо иммобилизовали на биосенсорном чипе СМ5 категории «для исследований» с применением стандартного набора для аминного сочетания в соответствии с инструкциями изготовителя. Константы скорости получали, проводя измерения кинетики связывания при семи разных концентрациях антигена в диапазоне от 1 до 40 нМ. Затем на основании кинетических констант скорости рассчитывали равновесную константу диссоциации (М) для реакции между FIT-Ig и целевыми белками по следующей формуле: KD=koff/kon. Аликвоты образцов FIT-Ig/антитело также одновременно вводили на холостую референсную и реакционную поверхности СМ для регистрации и вычитания какого-либо обусловленного неспецифическим связыванием фона, обеспечивая элиминацию большей части изменений показателя преломления и шума при введении. Поверхности регенерировали посредством последующего двукратного введения 25 мл 10 мМ глицина (рН 1,5) при скорости потока 10 мкл/мин. Данные функционального связывания для FIT020b представлены ниже в таблице 62.
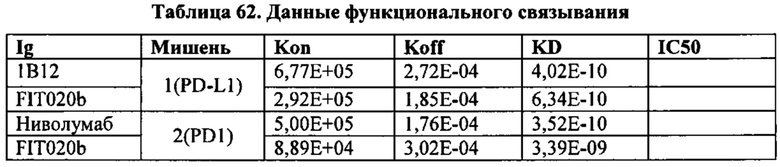
[00490] Тестирование функциональной активности с применением РСЛ-анализа: Реакцию смешанных лимфоцитов проводили с применением происходящих из моноцитов дендритных клеток от одного донора и аллогенных CD4 Т-клеток от другого донора. Брали образцы цельной крови у здоровых доноров и выделяли МКПК из цельной крови путем центрифугирования в градиенте Фиколл-Пак. В 1 день выделяли МКПК от одного донора и разводили не содержащей сыворотки средой RPMI 1640 до 1×106/мл. Разведенные МКПК высевали в 6-луночный планшет для тканевых культур по 3 мл/лунку и инкубировали в течение 3 часов. Удаляли супернатант и отмывали неприкрепленные клетки. Прикрепленные моноциты поляризовали в дендритные клетки, используя 250 Ед/мл ИЛ-4 и 500 Ед/мл ГМ-КСФ в среде RPMI1640 с 10% ФБС. Среду заменяли на свежую среду с ИЛ-4 и ГМ-КСФ на 4 день. На 7 день собирали незрелые ДК и обрабатывали 1 мкг/мл ЛПС в среде RPMI 1640 с 10% ФБС в течение дополнительных 24 часов для созревания. На 8 день выделяли CD4 Т-клетки из МКПК другого донора с использованием негативного отбора и доводили до конечной концентрации 2×106 клеток/мл. Зрелые ДК обрабатывали митомицином С при 37°С в течение 1,5 часов. Затем ДК промывали ФСБ и доводили до конечной концентрации 1×106 клеток/мл. В 96-луночный планшет добавляли по 100 мкл/лунку CD4 Т-клеток (клетки-респондеры) и предварительно обрабатывали тестируемым антителом в разбавленной концентрации в течение 30 минут. Затем добавляли по 100 мкл/лунку зрелых ДК (клетки-стимуляторы). Итоговый объем в каждой лунке составляет 200 мкл. РСЛ инкубировали при 37 градусах в течение 72 часов для теста с ИЛ-2. Результат приведен на фиг. 34А и фиг. 34В.
[00491] Исследование множественного связывания: Проводили исследование множественного связывания FIT020b. Результат приведен на фиг. 35. Указанный результат подтверждает, что FIT020b может связываться с PD-L1 и PD-1 одновременно.
Пример 15: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против CD20/CD-22
[00492] FIT-Ig, специфичные в отношении CD20 и CD22, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 63. В таблице 64 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig.
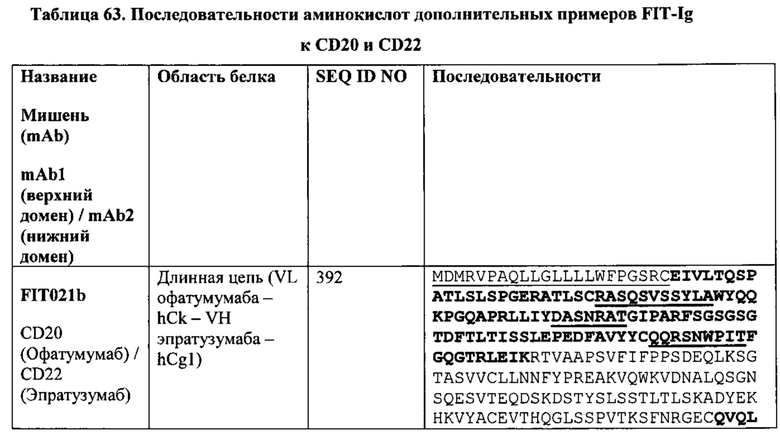
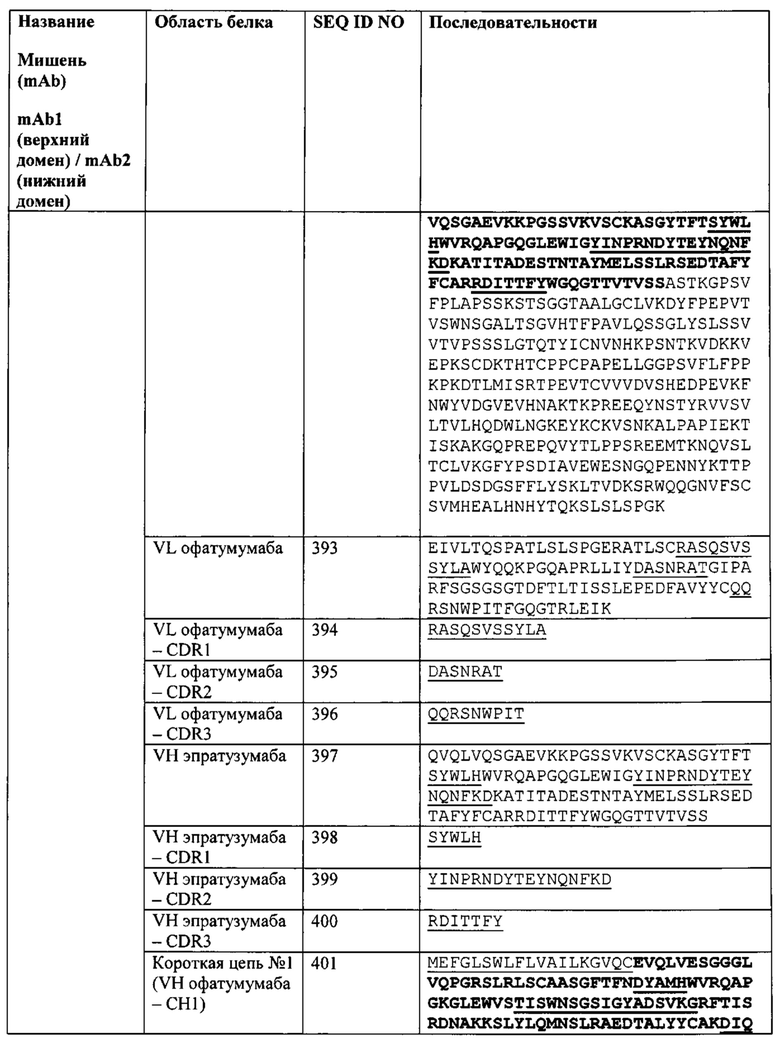



Функциональные исследования
[00493] Исследование связывания на основе клеток: Связывающую активность FIT021b в отношении клеток линий В-клеточной лимфомы Raji или Daudi определяли с помощью проточной цитометрии на BD FACSVerse. Клетки промывали в буфере ФСБ, содержащем 2% ФБС. Затем клетки разделяли на аликвоты и инкубировали с серийными разведениями (1:5) FIT021b на льду в течение 1 часа. Стартовая рабочая концентрация FIT021b составляла 20 мкг/мл. Клетки промывали, ресуспендировали и инкубировали с разведенным 1:100 меченым Alexa Fluor® 488 антителом мыши против IgG1 человека (Invitrogen, Кат. №А-10631) на льду, защищая от света, в течение 1 часа. Клетки промывали и детектировали сигнал на проточном цитометре BD FACSVerse в соответствии с протоколами производителя. Указанные эксперименты продемонстрировали, что FIT021b может связываться с клетками линий В-клеточной лимфомы Raji или Daudi, см. фиг. 36А и фиг. 36В.
Пример 16: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против HER3/PD-1
[00494] FIT-Ig, специфичные в отношении HER3 и PD1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 65. В таблице 66 представлен уровень экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig.

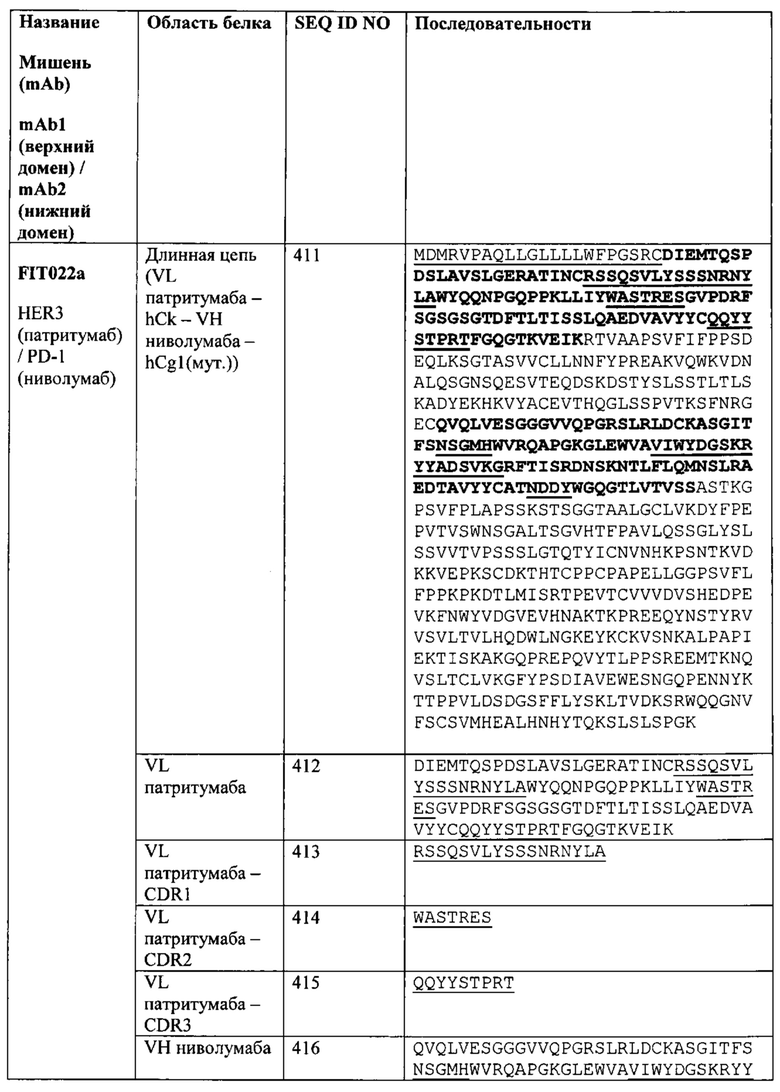
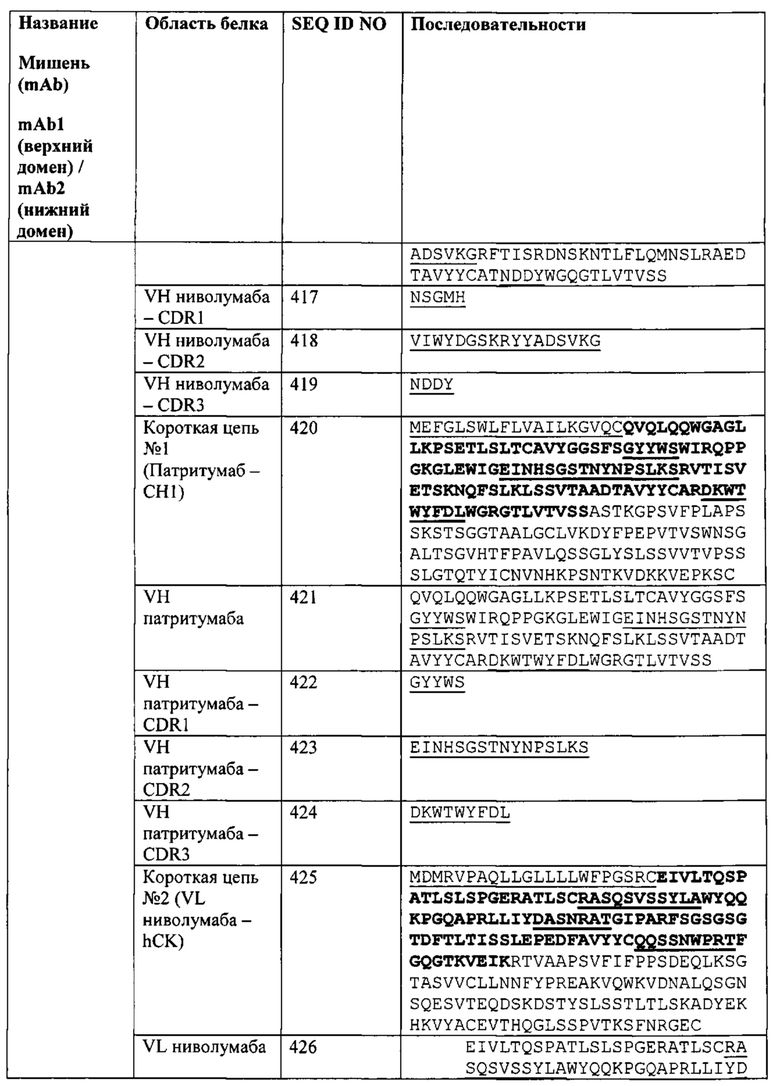


Функциональные исследования
[00495] Измерение аффинности с применением поверхностного плазмонного резонанса: Кинетику связывания FIT022a-Ig с Her3-his и hPD-1-Fc определяли с применением поверхностного плазмонного резонанса. Результат представлен в таблице 67.

[00496] Исследование множественного связывания: Проводили исследование множественного связывания FIT022a. Результат приведен на фиг. 37. Указанный результат подтверждает, что FIT022a может связываться с PD-L1 и PD-1 одновременно.
[00497] Функциональный РСЛ-анализ: Реакцию смешанных лимфоцитов проводили с применением происходящих из моноцитов дендритных клеток от одного донора и аллогенных CD4 Т-клеток от другого донора. Брали образцы цельной крови у здоровых доноров и выделяли МКПК из цельной крови путем центрифугирования в градиенте Фиколл-Пак. В 1 день выделяли МКПК от одного донора и разводили не содержащей сыворотки средой RPMI 1640 до 1×106/мл. Разведенные МКПК высевали в 6-луночный планшет для тканевых культур по 3 мл/лунку и инкубировали в течение 3 часов. Удаляли супернатант и отмывали неприкрепленные клетки. Прикрепленные моноциты поляризовали в дендритные клетки, используя 250 Ед/мл ИЛ-4 и 500 Ед/мл ГМ-КСФ в среде RPMI1640 с 10% ФБС. Среду заменяли на свежую среду с ИЛ-4 и ГМ-КСФ на 4 день. На 7 день собирали незрелые ДК и обрабатывали 1 мкг/мл ЛПС в среде RPMI 1640 с 10% ФБС в течение дополнительных 24 часов для созревания. На 8 день выделяли CD4 Т-клетки из МКПК другого донора с использованием негативного отбора и доводили до конечной концентрации 2×10е6 клеток/мл. Зрелые ДК обрабатывали митомицином С при 37° в течение 1,5 часов. Затем ДК промывали ФСБ и доводили до конечной концентрации 1×106 клеток/мл. В 96-луночный планшет добавляли CD4 Т-клетки (клетки-респондеры) по 100 мкл/лунку и предварительно обрабатывали тестируемым антителом в разбавленной концентрации в течение 30 минут. Затем добавляли зрелые ДК (клетки-стимуляторы), по 100 мкл/лунку. Итоговый объем в каждой лунке составляет 200 мкл. РСЛ инкубировали при 37 градусах в течение 72 часов для теста с ИЛ-2 и 120 часов для теста с ИФН-гамма, соответственно, с применением ИФА ELISA. Результат приведен на фиг. 38А и фиг. 38В.
Пример 17: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против cMet/PD-L1
[00498] FIT-Ig, специфичные в отношении cMet и PD-L1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 68. В таблице 69 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig.


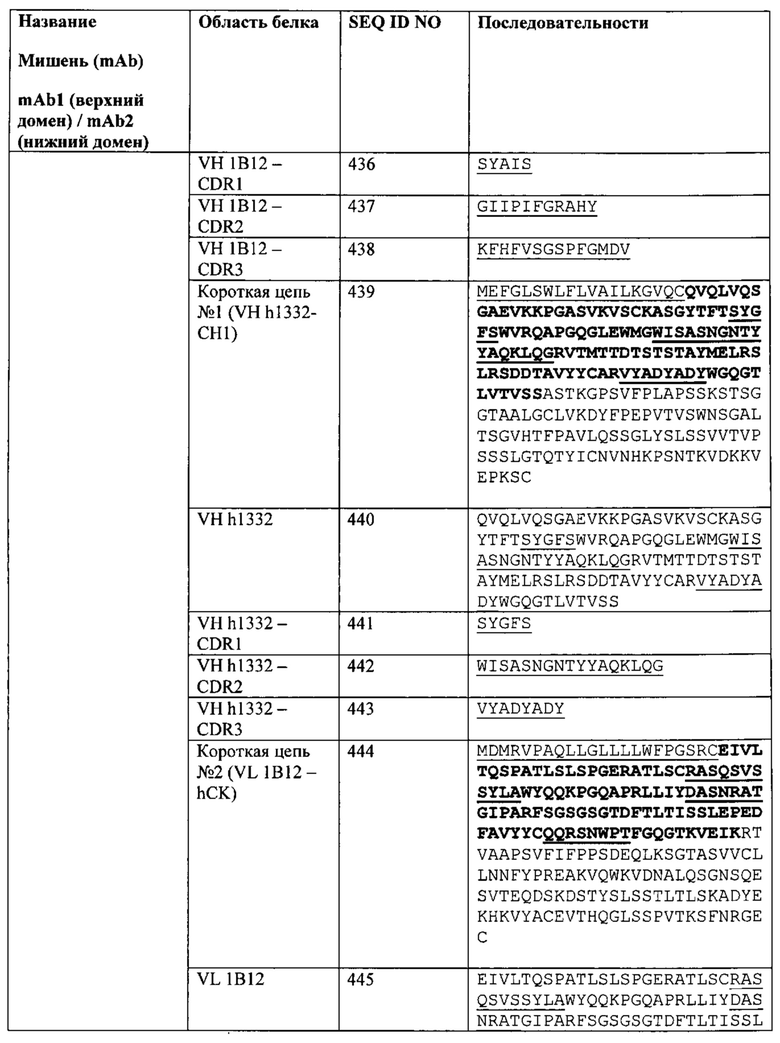


Функциональные исследования
[00499] Измерение аффинности с применением поверхностного плазмонного резонанса: Кинетику связывания FIT023a-Ig с cMet и PD-L1 определяли с применением поверхностного плазмонного резонанса. Результат представлен в таблице 70.
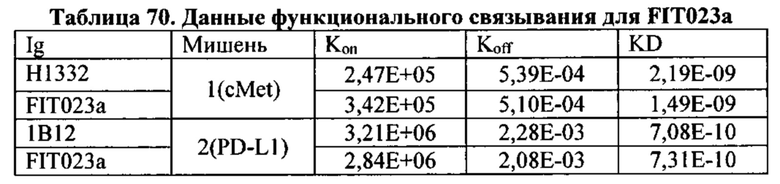
[00500] Исследование множественного связывания: Проводили исследование множественного связывания FIT023a. Результат приведен на фиг. 39А и фиг. 39В. Указанный результат подтверждает, что FIT023a может связываться с cMet и PD-L1 одновременно.
Пример 18: Исследование иммуноглобулина с тандемными Fab-фрагментами (FIT-Ig) против BTLA/PD-1
[00501] FIT-Ig, специфичные в отношении BTLA и PD-L1, конструировали согласно приведенным выше примерам. Примеры указанных FIT-Ig и соответствующие им последовательности приведены ниже в таблице 71. В таблице 72 приведены уровни экспрессии в клетках 293Е и ЭХ-профиль для FIT-Ig. И FIT024a, и FIT024b отличались хорошей чистотой после одноэтапного очищения с белком А.

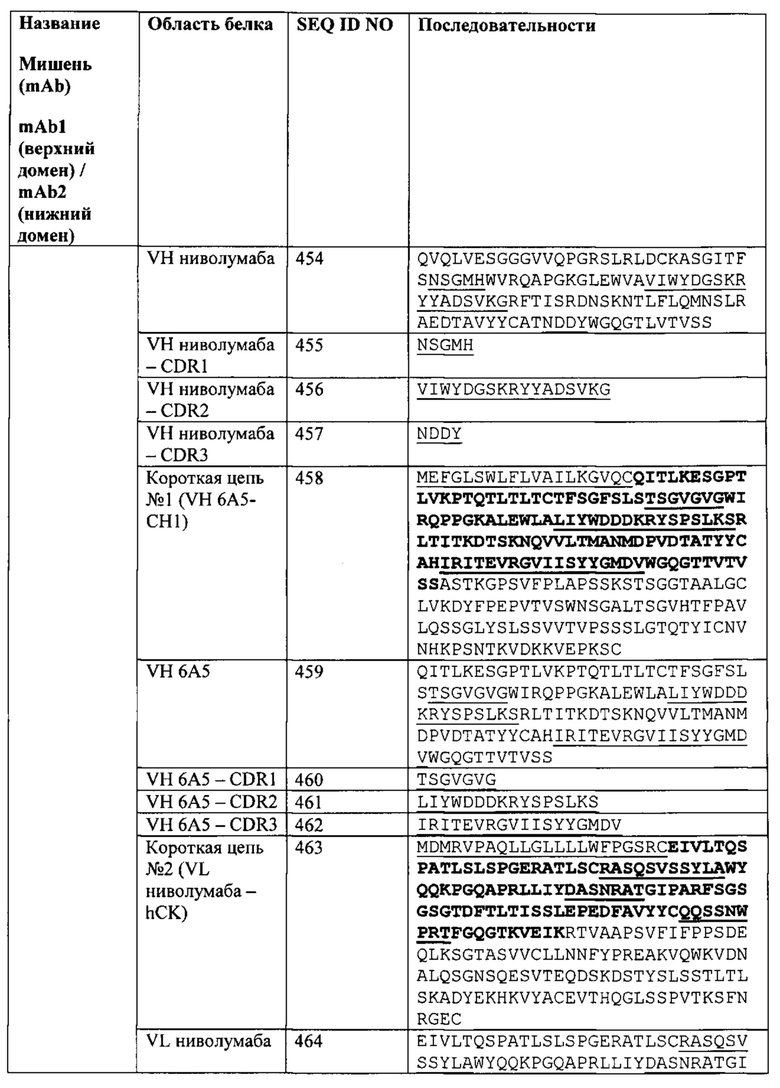

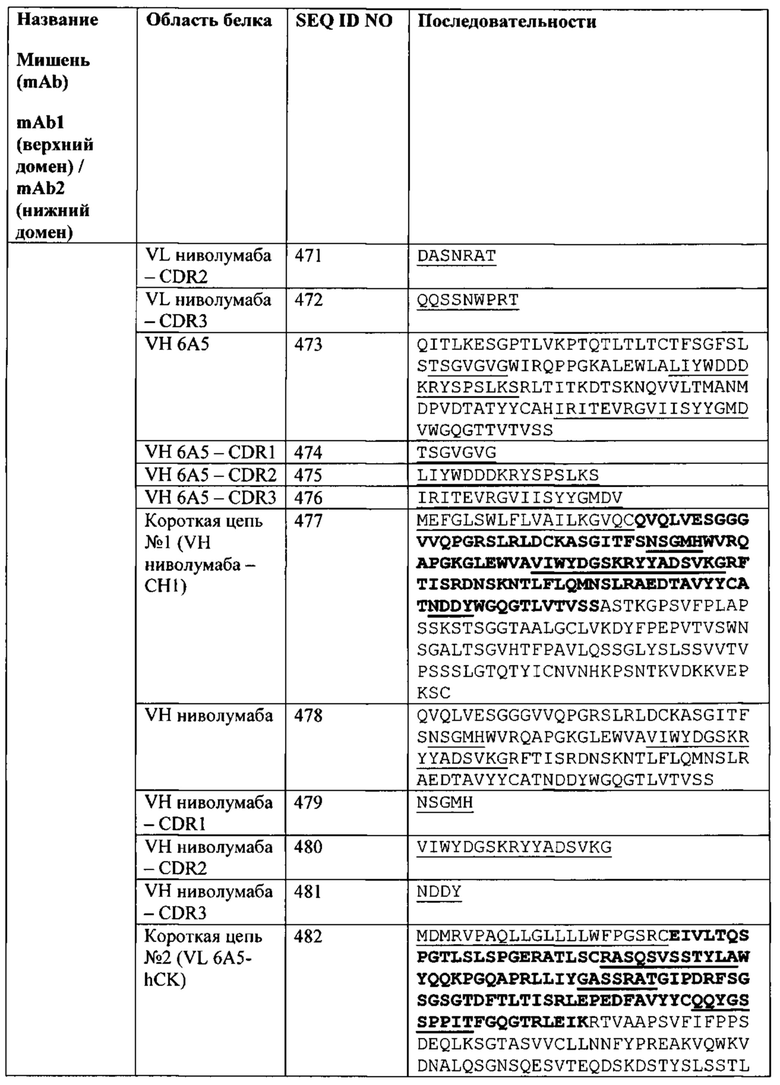

Функциональные исследования
[00502] Измерение аффинности с применением поверхностного плазмонного резонанса: Кинетику связывания FIT024a-Ig и FIT024b-Ig с BTLA4 и PD-1 определяли с применением поверхностного плазмонного резонанса. Результат представлен в таблице 73.
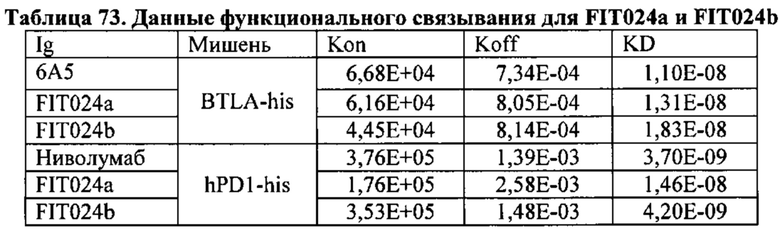
[00503] Исследование множественного связывания: Проводили исследование множественного связывания FIT024a и FIT024b. Результат приведен на фиг. 40А-В и на фиг. 41A-B. Указанный результат подтверждает, что и FIT024a, и FIT024b могут связываться с BTLA4 и PD-1 одновременно.
[00504] Функциональный РСЛ-анализ: Реакцию смешанных лимфоцитов проводили с применением происходящих из моноцитов дендритных клеток от одного донора и аллогенных CD4 Т-клеток от другого донора. Брали образцы цельной крови у здоровых доноров и выделяли МКПК из цельной крови путем центрифугирования в градиенте Фиколл-Пак. В 1 день выделяли МКПК от одного донора и разводили не содержащей сыворотки средой RPMI 1640 до 1×106/мл. Разведенные МКПК высевали в 6-луночный планшет для тканевых культур по 3 мл/лунку и инкубировали в течение 3 часов. Удаляли супернатант и отмывали неприкрепленные клетки. Прикрепленные моноциты поляризовали в дендритные клетки, используя 250 Ед/мл ИЛ-4 и 500 Ед/мл ГМ-КСФ в среде RPMI1640 с 10% ФБС. Среду заменяли на свежую среду с ИЛ-4 и ГМ-КСФ на 4 день. На 7 день собирали незрелые ДК и обрабатывали 1 мкг/мл ЛПС в среде RPMI 1640 с 10% ФБС в течение дополнительных 24 часов для созревания. На 8 день выделяли CD4 Т-клетки из МКПК другого донора с использованием негативного отбора и доводили до конечной концентрации 2×10е6 клеток/мл. Зрелые ДК обрабатывали митомицином С при 37C° в течение 1,5 часов. Затем ДК промывали ФСБ и доводили до конечной концентрации 1×106 клеток/мл. В 96-луночный планшет добавляли по 100 мкл/лунку CD4 Т-клеток (клетки-респондеры) и предварительно обрабатывали тестируемым антителом в разбавленной концентрации в течение 30 минут. Затем добавляли по 100 мкл/лунку зрелых ДК (клетки-стимуляторы). Итоговый объем в каждой лунке составляет 200 мкл. РСЛ инкубировали при 37 градусах в течение 72 часов для теста с ИЛ-2. Результат приведен на фиг. 42А и фиг. 42В. И FIT024a, и FIT024b отличались более высокой активностью в отношении усиления активации Т-клеток в исследовании с РСЛ по сравнению с ниволумабом.
[00505] Все публикации, патентные заявки и выданные патенты, упоминаемые в настоящем описании, включены в настоящий документ посредством ссылки, так же, как если бы в частном индивидуальном порядке было указано, что каждая индивидуальная публикация, патентная заявка или каждый индивидуальный выданный патент полностью включены посредством ссылки.
[00506] Если не указано иное, все технические и научные термины в настоящем документе имеют значения, соответствующие общеизвестным специалистам в области техники, к которой относится настоящее изобретение. Хотя при практической реализации или тестировании настоящего изобретения могут применяться любые способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, здесь описаны предпочтительные способы и материалы.
[00507] Публикации, которые обсуждаются в настоящем документе, упомянуты исключительно ввиду раскрытия до даты подачи настоящей заявки. Ничто в настоящем документе не должно толковаться как допущение того, что настоящему изобретению не может быть присвоен приоритет относительно такой публикации в силу более ранней даты изобретения.
[00508] Хотя настоящее изобретение было описано применительно к специфическим вариантам его реализации, следует понимать, что возможны дополнительные модификации, и что настоящим документом предусмотрено включение любых вариантов, любого применения или адаптации настоящего изобретения, в целом соответствующих принципам настоящего изобретения, в том числе отступлений от настоящего документа, относящихся к известным или обычным практическим методам в области техники, к которой относится настоящее изобретение, и применимых к существенным признакам, описанным выше в настоящем документе и входящим в объем прилагаемой формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Epimab BioTherapeutics, Inc. / Эпимаб БиоТерапьютикс, Инк.
<120> ИММУНОГЛОБУЛИН С ТАНДЕМНЫМИ FAB-ФРАГМЕНТАМИ И ВАРИАНТЫ ЕГО
ПРИМЕНЕНИЯ
<130> EPM-102.1P RU
<140>
<141>
<150> PCT/US2017/016691
<151> 2017-02-06
<150> PCT/CN2016/073722
<151> 2016-02-06
<160> 519
<170> PatentIn, версия 3.5
<210> 1
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 1
caggtgcagc tggtgcagag cggcgccgaa g 31
<210> 2
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 2
gctggacctg agagcctgaa ccgccaccac cacactctcc cctgttgaag c 51
<210> 3
<211> 52
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 3
ggtggtggcg gttcaggctc tcaggtccag cttgtgcaat ctggcgccga gg 52
<210> 4
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 4
gtctgcggcc gctcatttac ccggagacag ggagag 36
<210> 5
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 5
taagcgtacg gtggctgcac catctgtctt c 31
<210> 6
<211> 59
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 6
cggcgccaga ttgcacaagc tggacctggc ctgaaccaca ctctcccctg ttgaagctc 59
<210> 7
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 7
gctggacctg agagcctgaa ccgccaccac cacactctcc cctgttgaag c 51
<210> 8
<211> 52
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 8
ggtggtggcg gttcaggctc tcaggtccag cttgtgcaat ctggcgccga gg 52
<210> 9
<211> 59
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 9
tacctcggcg ccagattgca caagctggac ctgacactct cccctgttga agctctttg 59
<210> 10
<211> 56
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 10
catgacacct taacagaggc cccaggtcgt tttacctcgg cgccagattg cacaag 56
<210> 11
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 11
caataagctt tacatgacac cttaacagag gccccag 37
<210> 12
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 12
tcgagcggcc gctcaacaag atttgggctc aactttcttg 40
<210> 13
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 13
gctgctgctg tggttccccg gctcgcgatg cgctatacag ttgacacagt c 51
<210> 14
<211> 53
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 14
gaagatgaag acagatggtg cagccaccgt acgcttgatc tctacctttg ttc 53
<210> 15
<211> 676
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полипептид FIT1-Ig против ИЛ-17/ИЛ-20
<400> 15
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1. 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Val His Ser
20 25 30
Arg Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ile Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Leu Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu Val
210 215 220
Gln Ser Gly Ala Glu Val Lys Arg Pro Gly Ala Ser Val Lys Val Ser
225 230 235 240
Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asp Ile Ile His Trp Val
245 250 255
Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met Gly Trp Ile Asn Ala
260 265 270
Gly Tyr Gly Asn Thr Gln Tyr Ser Gln Asn Phe Gln Asp Arg Val Ser
275 280 285
Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr Met Glu Leu Ile Ser
290 295 300
Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Glu Pro Leu
305 310 315 320
Trp Phe Gly Glu Ser Ser Pro His Asp Tyr Tyr Gly Met Asp Val Trp
325 330 335
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
340 345 350
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
355 360 365
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
370 375 380
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
385 390 395 400
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
405 410 415
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
420 425 430
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
435 440 445
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
450 455 460
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
465 470 475 480
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
485 490 495
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
500 505 510
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
515 520 525
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
530 535 540
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
545 550 555 560
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
565 570 575
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
580 585 590
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
595 600 605
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
610 615 620
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
625 630 635 640
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
645 650 655
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
660 665 670
Ser Pro Gly Lys
675
<210> 16
<211> 112
<212> БЕЛОК
<213> Homo sapiens
<400> 16
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1. 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Val His Ser
20 25 30
Arg Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ile Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Leu Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 17
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 17
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1. 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 18
<211> 127
<212> БЕЛОК
<213> Mus sp.
<400> 18
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asp
20 25 30
Ile Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Ala Gly Tyr Gly Asn Thr Gln Tyr Ser Gln Asn Phe
50 55 60
Gln Asp Arg Val Ser Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ile Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Pro Leu Trp Phe Gly Glu Ser Ser Pro His Asp Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 19
<211> 103
<212> БЕЛОК
<213> Homo sapiens
<400> 19
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1. 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys
100
<210> 20
<211> 227
<212> БЕЛОК
<213> Homo sapiens
<400> 20
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1. 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 21
<211> 222
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полипептид FIT1-Ig против ИЛ-17/ИЛ-20
<400> 21
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Met Tyr Gly Thr Thr Asp Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Phe Thr Gly Thr Gly Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
<210> 22
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<400> 22
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Met Tyr Gly Thr Thr Asp Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Phe Thr Gly Thr Gly Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 23
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полипептид FIT1-Ig против ИЛ-17/ИЛ-20
<400> 23
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 24
<211> 107
<212> БЕЛОК
<213> Mus sp.
<400> 24
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 25
<211> 679
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полипептид FIT2-Ig против ИЛ-17/ИЛ-20
<400> 25
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1. 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Val His Ser
20 25 30
Arg Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ile Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Leu Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gly Ser Gly Gln Val
210 215 220
Gln Leu Val Gln Ser Gly Ala Glu Val Lys Arg Pro Gly Ala Ser Val
225 230 235 240
Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asp Ile Ile
245 250 255
His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met Gly Trp
260 265 270
Ile Asn Ala Gly Tyr Gly Asn Thr Gln Tyr Ser Gln Asn Phe Gln Asp
275 280 285
Arg Val Ser Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr Met Glu
290 295 300
Leu Ile Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
305 310 315 320
Glu Pro Leu Trp Phe Gly Glu Ser Ser Pro His Asp Tyr Tyr Gly Met
325 330 335
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr
340 345 350
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
355 360 365
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
370 375 380
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
385 390 395 400
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
405 410 415
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
420 425 430
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
435 440 445
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
450 455 460
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
465 470 475 480
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
485 490 495
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
500 505 510
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
515 520 525
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
530 535 540
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
545 550 555 560
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
565 570 575
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
580 585 590
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
595 600 605
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
610 615 620
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
625 630 635 640
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
645 650 655
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
660 665 670
Leu Ser Leu Ser Pro Gly Lys
675
<210> 26
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 26
Gly Ser Gly
1
<210> 27
<211> 683
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полипептид FIT3-Ig против ИЛ-17/ИЛ-20
<400> 27
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1. 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Val His Ser
20 25 30
Arg Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ile Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Leu Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gly Gly Gly Gly Ser
210 215 220
Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Arg Pro
225 230 235 240
Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr
245 250 255
Asn Asp Ile Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu
260 265 270
Trp Met Gly Trp Ile Asn Ala Gly Tyr Gly Asn Thr Gln Tyr Ser Gln
275 280 285
Asn Phe Gln Asp Arg Val Ser Ile Thr Arg Asp Thr Ser Ala Ser Thr
290 295 300
Ala Tyr Met Glu Leu Ile Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr
305 310 315 320
Tyr Cys Ala Arg Glu Pro Leu Trp Phe Gly Glu Ser Ser Pro His Asp
325 330 335
Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser
340 345 350
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
355 360 365
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
370 375 380
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
385 390 395 400
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
405 410 415
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
420 425 430
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
435 440 445
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
450 455 460
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
465 470 475 480
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
485 490 495
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
500 505 510
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
515 520 525
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
530 535 540
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
545 550 555 560
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
565 570 575
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
580 585 590
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
595 600 605
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
610 615 620
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
625 630 635 640
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
645 650 655
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
660 665 670
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680
<210> 28
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 28
Gly Gly Gly Gly Ser Gly Ser
1. 5
<210> 29
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT4-Ig против ИЛ-17/ИЛ-20
<400> 29
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Met Tyr Gly Thr Thr Asp Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Phe Thr Gly Thr Gly Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Ala Ile
210 215 220
Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg
225 230 235 240
Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ala Leu Ala
245 250 255
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Asp
260 265 270
Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly
275 280 285
Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp
290 295 300
Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Ser Tyr Pro Leu Thr Phe
305 310 315 320
Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser
325 330 335
Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
340 345 350
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
355 360 365
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser
370 375 380
Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr
385 390 395 400
Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys
405 410 415
Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn
420 425 430
Arg Gly Glu Cys
435
<210> 30
<211> 439
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT5-Ig против ИЛ-17/ИЛ-20
<400> 30
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Met Tyr Gly Thr Thr Asp Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Phe Thr Gly Thr Gly Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Gly Ser
210 215 220
Gly Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val
225 230 235 240
Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser
245 250 255
Ala Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
260 265 270
Ile Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser
275 280 285
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
290 295 300
Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Ser Tyr Pro
305 310 315 320
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
325 330 335
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
340 345 350
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
355 360 365
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
370 375 380
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
385 390 395 400
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
405 410 415
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
420 425 430
Ser Phe Asn Arg Gly Glu Cys
435
<210> 31
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT6-Ig против ИЛ-17/ИЛ-20
<400> 31
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Met Tyr Gly Thr Thr Asp Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Phe Thr Gly Thr Gly Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Gly Gly
210 215 220
Gly Gly Ser Gly Ser Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu
225 230 235 240
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
245 250 255
Gly Ile Ser Ser Ala Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
260 265 270
Pro Lys Leu Leu Ile Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro
275 280 285
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
290 295 300
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe
305 310 315 320
Asn Ser Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
325 330 335
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
340 345 350
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
355 360 365
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
370 375 380
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
385 390 395 400
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
405 410 415
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
420 425 430
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
435 440
<210> 32
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 32
gtctgcggcc gctcatttac ccggagacag ggagag 36
<210> 33
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 33
tcgagcggcc gctcaacaag atttgggctc aactttcttg 40
<210> 34
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 34
caggtccagc tgcagcagtc tg 22
<210> 35
<211> 59
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 35
gcctgcgaag tcacccatca gggcctgagc tcgcccgtca caaagagctt caacagggg 59
<210> 36
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 36
tacgagaaac acaaagtcta cgcctgcgaa gtcacccatc agggcctgag 50
<210> 37
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 37
tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 50
<210> 38
<211> 59
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 38
ctcgcccgtc acaaagagct tcaacagggg agagtgtgaa gtgcagctgg tggagtctg 59
<210> 39
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 39
gctgctgctg tggttccccg gctcgcgatg cgaaattgtg ttgacacagt c 51
<210> 40
<211> 52
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотидный праймер
<400> 40
aagatgaaga cagatggtgc agccaccgta cgtttaatct ccagtcgtgt cc 52
<210> 41
<211> 665
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT7-Ig: OKT3/Офатумумаб
<400> 41
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1. 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala His Phe Arg Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Gly Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Asn Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
210 215 220
Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
225 230 235 240
Thr Phe Asn Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys
245 250 255
Gly Leu Glu Trp Val Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly
260 265 270
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
275 280 285
Lys Lys Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
290 295 300
Ala Leu Tyr Tyr Cys Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr
305 310 315 320
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
325 330 335
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
340 345 350
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
355 360 365
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
370 375 380
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
385 390 395 400
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
405 410 415
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
420 425 430
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
435 440 445
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
450 455 460
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
465 470 475 480
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
485 490 495
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
500 505 510
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
515 520 525
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
530 535 540
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
545 550 555 560
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
565 570 575
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
580 585 590
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
595 600 605
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
610 615 620
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
625 630 635 640
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
645 650 655
Lys Ser Leu Ser Leu Ser Pro Gly Lys
660 665
<210> 42
<211> 106
<212> БЕЛОК
<213> Mus sp.
<400> 42
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1. 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala His Phe Arg Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Gly Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Asn
100 105
<210> 43
<211> 122
<212> БЕЛОК
<213> Homo sapiens
<400> 43
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 44
<211> 222
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT7-Ig: OKT3/Офатумумаб
<400> 44
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Thr Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
<210> 45
<211> 119
<212> БЕЛОК
<213> Mus sp.
<400> 45
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Thr Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 46
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT7-Ig: OKT3/Офатумумаб
<400> 46
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 47
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 47
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 48
<211> 672
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT8-Ig: OKT3/Офатумумаб
<400> 48
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1. 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala His Phe Arg Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Gly Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Asn Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys Gly Gly Gly Gly Ser Gly Ser Glu Val Gln Leu
210 215 220
Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg Ser Leu Arg Leu
225 230 235 240
Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asp Tyr Ala Met His Trp
245 250 255
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Thr Ile Ser
260 265 270
Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val Lys Gly Arg Phe
275 280 285
Thr Ile Ser Arg Asp Asn Ala Lys Lys Ser Leu Tyr Leu Gln Met Asn
290 295 300
Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys Ala Lys Asp Ile
305 310 315 320
Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr
325 330 335
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
340 345 350
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
355 360 365
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
370 375 380
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
385 390 395 400
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
405 410 415
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
420 425 430
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
435 440 445
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
450 455 460
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
465 470 475 480
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
485 490 495
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
500 505 510
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
515 520 525
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
530 535 540
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
545 550 555 560
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
565 570 575
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
580 585 590
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
595 600 605
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
610 615 620
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
625 630 635 640
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
645 650 655
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
660 665 670
<210> 49
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 49
Gly Gly Ser
1
<210> 50
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 50
Ser Gly Gly
1
<210> 51
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 51
Gly Gly Gly
1
<210> 52
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 52
Gly Gly Gly Ser
1
<210> 53
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 53
Ser Gly Gly Gly
1
<210> 54
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 54
Gly Gly Gly Gly Ser
1. 5
<210> 55
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 55
Gly Gly Gly Gly Ser Gly Gly Ser
1. 5
<210> 56
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 56
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1. 5 10
<210> 57
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 57
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1. 5 10 15
<210> 58
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 58
Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg
1. 5 10 15
<210> 59
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 59
Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg
1. 5 10 15
Val
<210> 60
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 60
Ala Lys Thr Thr Pro Lys Leu Gly Gly
1. 5
<210> 61
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 61
Ser Ala Lys Thr Thr Pro Lys Leu Gly Gly
1. 5 10
<210> 62
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 62
Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val
1. 5 10 15
<210> 63
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 63
Ser Ala Lys Thr Thr Pro
1. 5
<210> 64
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 64
Ser Ala Lys Thr Thr Pro Lys Leu Gly Gly
1. 5 10
<210> 65
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 65
Arg Ala Asp Ala Ala Pro
1. 5
<210> 66
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 66
Arg Ala Asp Ala Ala Pro Thr Val Ser
1. 5
<210> 67
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 67
Arg Ala Asp Ala Ala Ala Ala Gly Gly Pro Gly Ser
1. 5 10
<210> 68
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 68
Arg Ala Asp Ala Ala Ala Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly
1. 5 10 15
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 69
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 69
Ser Ala Lys Thr Thr Pro
1. 5
<210> 70
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 70
Ser Ala Lys Thr Thr Pro Lys Leu Gly Gly
1. 5 10
<210> 71
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 71
Ser Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala
1. 5 10 15
Arg Val
<210> 72
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 72
Ala Asp Ala Ala Pro
1. 5
<210> 73
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 73
Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
1. 5 10
<210> 74
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 74
Thr Val Ala Ala Pro
1. 5
<210> 75
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 75
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
1. 5 10
<210> 76
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 76
Gln Pro Lys Ala Ala Pro
1. 5
<210> 77
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 77
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro
1. 5 10
<210> 78
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 78
Ala Lys Thr Thr Pro Pro
1. 5
<210> 79
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 79
Ala Lys Thr Thr Pro Pro Ser Val Thr Pro Leu Ala Pro
1. 5 10
<210> 80
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 80
Ala Lys Thr Thr Ala Pro
1. 5
<210> 81
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 81
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro
1. 5 10
<210> 82
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 82
Ala Ser Thr Lys Gly Pro
1. 5
<210> 83
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 83
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
1. 5 10
<210> 84
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 84
Gly Glu Asn Lys Val Glu Tyr Ala Pro Ala Leu Met Ala Leu Ser
1. 5 10 15
<210> 85
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 85
Gly Pro Ala Lys Glu Leu Thr Pro Leu Lys Glu Ala Lys Val Ser
1. 5 10 15
<210> 86
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> последовательность пептидного линкера
<400> 86
Gly His Glu Ala Ala Ala Val Met Gln Val Gln Tyr Pro Ala Ser
1. 5 10 15
<210> 87
<211> 664
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT9-Ig: ФНО/ИЛ-17
<400> 87
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu Val Gln Ser Gly Ala
210 215 220
Glu Val Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser
225 230 235 240
Gly Tyr Ser Phe Thr Asp Tyr His Ile His Trp Val Arg Gln Ala Pro
245 250 255
Gly Gln Gly Leu Glu Trp Met Gly Val Ile Asn Pro Met Tyr Gly Thr
260 265 270
Thr Asp Tyr Asn Gln Arg Phe Lys Gly Arg Val Thr Ile Thr Ala Asp
275 280 285
Glu Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu
290 295 300
Asp Thr Ala Val Tyr Tyr Cys Ala Arg Tyr Asp Tyr Phe Thr Gly Thr
305 310 315 320
Gly Val Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
325 330 335
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
340 345 350
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
355 360 365
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
370 375 380
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
385 390 395 400
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
405 410 415
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
420 425 430
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
435 440 445
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
450 455 460
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
465 470 475 480
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
485 490 495
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
500 505 510
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
515 520 525
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
530 535 540
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
545 550 555 560
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
565 570 575
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
580 585 590
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
595 600 605
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
610 615 620
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
625 630 635 640
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
645 650 655
Ser Leu Ser Leu Ser Pro Gly Lys
660
<210> 88
<211> 108
<212> БЕЛОК
<213> Homo sapiens
<400> 88
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 89
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT9-Ig: ФНО/ИЛ-17
<400> 89
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Asn Gly Leu Glu Trp Val
35 40 45
Ala Phe Met Ser Tyr Asp Gly Ser Asn Lys Lys Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Ile Ala Ala Gly Gly Asn Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
130 135 140
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
195 200 205
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
210 215 220
Glu Pro Lys Ser Cys
225
<210> 90
<211> 126
<212> БЕЛОК
<213> Homo sapiens
<400> 90
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Asn Gly Leu Glu Trp Val
35 40 45
Ala Phe Met Ser Tyr Asp Gly Ser Asn Lys Lys Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Ile Ala Ala Gly Gly Asn Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 91
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT9-Ig: ФНО/ИЛ-17
<400> 91
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1. 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Val His Ser
20 25 30
Arg Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ile Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Leu Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 92
<211> 658
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT10-Ig: CTLA-4/PD-1
<400> 92
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu Val Glu Ser Gly Gly
210 215 220
Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Asp Cys Lys Ala Ser
225 230 235 240
Gly Ile Thr Phe Ser Asn Ser Gly Met His Trp Val Arg Gln Ala Pro
245 250 255
Gly Lys Gly Leu Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Lys
260 265 270
Arg Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
275 280 285
Asn Ser Lys Asn Thr Leu Phe Leu Gln Met Asn Ser Leu Arg Ala Glu
290 295 300
Asp Thr Ala Val Tyr Tyr Cys Ala Thr Asn Asp Asp Tyr Trp Gly Gln
305 310 315 320
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
325 330 335
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
340 345 350
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
355 360 365
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
370 375 380
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
385 390 395 400
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
405 410 415
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
420 425 430
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
435 440 445
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
450 455 460
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
465 470 475 480
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
485 490 495
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
500 505 510
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
515 520 525
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
530 535 540
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
545 550 555 560
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
565 570 575
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
580 585 590
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
595 600 605
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
610 615 620
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
625 630 635 640
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
645 650 655
Gly Lys
<210> 93
<211> 108
<212> БЕЛОК
<213> Homo sapiens
<400> 93
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 94
<211> 113
<212> БЕЛОК
<213> Homo sapiens
<400> 94
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 95
<211> 221
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT10-Ig: CTLA-4/PD-1
<400> 95
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
<210> 96
<211> 118
<212> БЕЛОК
<213> Homo sapiens
<400> 96
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 97
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> полипептид FIT10-Ig: CTLA-4/PD-1
<400> 97
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 98
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 98
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 99
<211> 689
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT12a: рЭФР/PD-L1 (VL панитумумаба-hCk-VH
1B12-hCg1)
<400> 99
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln His
100 105 110
Phe Asp His Leu Pro Leu Ala Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser Ser Val Lys Val
245 250 255
Ser Cys Lys Thr Ser Gly Asp Thr Phe Ser Ser Tyr Ala Ile Ser Trp
260 265 270
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Gly Ile Ile
275 280 285
Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe Gln Gly Arg Val
290 295 300
Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser
305 310 315 320
Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys Ala Arg Lys Phe
325 330 335
His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val Trp Gly Gln Gly
340 345 350
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 100
<211> 241
<212> БЕЛОК
<213> Homo Sapiens
<400> 100
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val
35 40 45
Ser Ser Gly Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr
65 70 75 80
Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys
85 90 95
Thr Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp
115 120 125
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
225 230 235 240
Cys
<210> 101
<211> 235
<212> БЕЛОК
<213> Homo Sapiens
<400> 101
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Arg Ser Asn Trp Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
115 120 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
130 135 140
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
145 150 155 160
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
165 170 175
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
195 200 205
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
210 215 220
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 102
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT13a: cMET/рЭФР, полипептид 1 (VL h1332-hCk-VH
панитумумаба-hCg1)
<400> 102
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Val Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Gly Ile Asn Thr Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Lys Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Ala Asn Ser Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu
245 250 255
Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly Asp Tyr Tyr Trp
260 265 270
Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Ile Gly His
275 280 285
Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg
290 295 300
Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe Ser Leu Lys Leu
305 310 315 320
Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr Cys Val Arg Asp
325 330 335
Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 103
<211> 239
<212> БЕЛОК
<213> Homo Sapiens
<400> 103
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Gly Phe Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Trp Ile Ser Ala Ser Asn Gly Asn Thr Tyr Tyr Ala
65 70 75 80
Gln Lys Leu Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Val Tyr Ala Asp Tyr Ala Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 104
<211> 236
<212> БЕЛОК
<213> Homo Sapiens
<400> 104
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln His
100 105 110
Phe Asp His Leu Pro Leu Ala Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 105
<211> 680
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT14: фактор IX/фактор X, полипептид 1 (VL FIX-hCk-VH
FX-hCg4)
<400> 105
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser
35 40 45
Arg Asn Ile Glu Arg Gln Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Glu Leu Leu Ile Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val
65 70 75 80
Pro Asp Arg Phe Ser Gly Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Tyr Ser Asp Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala Ser Val Lys Val
245 250 255
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn Asn Met Asp Trp
260 265 270
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Asp Ile Asn
275 280 285
Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe Gln Asp Arg Val
290 295 300
Ile Met Thr Val Asp Lys Ser Thr Asp Thr Ala Tyr Met Glu Leu Ser
305 310 315 320
Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr His Cys Ala Arg Arg Lys
325 330 335
Ser Tyr Gly Tyr Tyr Leu Asp Glu Trp Gly Glu Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
450 455 460
Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
465 470 475 480
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
485 490 495
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
500 505 510
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
515 520 525
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
530 535 540
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
545 550 555 560
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
565 570 575
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
580 585 590
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
595 600 605
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
610 615 620
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
625 630 635 640
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
645 650 655
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
660 665 670
Gln Glu Ser Leu Ser Leu Ser Pro
675 680
<210> 106
<211> 245
<212> БЕЛОК
<213> Homo Sapiens
<400> 106
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Tyr Tyr Asp Ile Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg
65 70 75 80
Arg Glu Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys
245
<210> 107
<211> 236
<212> БЕЛОК
<213> Homo Sapiens
<400> 107
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser
35 40 45
Arg Asn Ile Glu Arg Gln Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Glu Leu Leu Ile Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val
65 70 75 80
Pro Asp Arg Phe Ser Gly Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Tyr Ser Asp Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 108
<211> 697
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT16a: Her3/рИФР-1, полипептид 1 (VL патритумаба-hCk-VH
фигитумумаба-hCg1)
<400> 108
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Glu Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser
35 40 45
Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr
50 55 60
Gln Gln Asn Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser
65 70 75 80
Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
100 105 110
Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln
115 120 125
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
130 135 140
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
145 150 155 160
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
165 170 175
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
180 185 190
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
195 200 205
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
210 215 220
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
225 230 235 240
Glu Cys Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro
245 250 255
Gly Gly Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser
260 265 270
Ser Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
275 280 285
Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Thr Thr Phe Tyr Ala Asp
290 295 300
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Thr Thr
305 310 315 320
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
325 330 335
Tyr Cys Ala Lys Asp Leu Gly Trp Ser Asp Ser Tyr Tyr Tyr Tyr Tyr
340 345 350
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
355 360 365
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
370 375 380
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
385 390 395 400
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
405 410 415
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
420 425 430
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
435 440 445
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
450 455 460
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
465 470 475 480
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
485 490 495
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
500 505 510
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
515 520 525
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
530 535 540
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
545 550 555 560
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
565 570 575
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
580 585 590
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
595 600 605
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
610 615 620
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
625 630 635 640
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
645 650 655
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
660 665 670
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
675 680 685
Lys Ser Leu Ser Leu Ser Pro Gly Lys
690 695
<210> 109
<211> 239
<212> БЕЛОК
<213> Homo Sapiens
<400> 109
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe
35 40 45
Ser Gly Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln
85 90 95
Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 110
<211> 236
<212> БЕЛОК
<213> Homo Sapiens
<400> 110
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Phe Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Gly Ile Arg Asn Asp Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Arg Leu Ile Tyr Ala Ala Ser Arg Leu His Arg Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln
100 105 110
His Asn Ser Tyr Pro Cys Ser Phe Gly Gln Gly Thr Lys Leu Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 111
<211> 693
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT17a: DLL4/ ФРЭС, полипептид 1 (VL демцизумаба-hCk-VH
бевацизумаба-hCg1)
<400> 111
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Val Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Ser Cys Arg Ala Ser
35 40 45
Glu Ser Val Asp Asn Tyr Gly Ile Ser Phe Met Lys Trp Phe Gln Gln
50 55 60
Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln
65 70 75 80
Gly Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr
100 105 110
Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp Thr Phe Gly Gly Gly Thr
115 120 125
Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
245 250 255
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
260 265 270
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
275 280 285
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
290 295 300
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
305 310 315 320
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
325 330 335
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
340 345 350
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
355 360 365
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
370 375 380
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
385 390 395 400
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
405 410 415
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
420 425 430
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
435 440 445
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
450 455 460
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
465 470 475 480
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
485 490 495
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
500 505 510
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
515 520 525
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
530 535 540
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
545 550 555 560
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
565 570 575
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
580 585 590
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
595 600 605
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
610 615 620
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
625 630 635 640
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
645 650 655
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
660 665 670
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
675 680 685
Leu Ser Pro Gly Lys
690
<210> 112
<211> 241
<212> БЕЛОК
<213> Homo Sapiens
<400> 112
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe
35 40 45
Thr Ala Tyr Tyr Ile His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Tyr Ile Ser Ser Tyr Asn Gly Ala Thr Asn Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Arg Val Thr Phe Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Asp Tyr Asp Tyr Asp Val Gly Met Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
225 230 235 240
Cys
<210> 113
<211> 236
<212> БЕЛОК
<213> Homo Sapiens
<400> 113
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Val Leu Ile Tyr Phe Thr Ser Ser Leu His Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Tyr Ser Thr Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 114
<211> 691
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT18a: CD20/CD3, полипептид 1 (VL офатумумаба-hCk-VH
mAb к CD3-hCg1(мут.))
<400> 114
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Arg Ser Asn Trp Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Glu Val Gln Leu
225 230 235 240
Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Lys Leu
245 250 255
Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr Ala Met Asn Trp
260 265 270
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Arg
275 280 285
Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp
290 295 300
Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Ala Tyr Leu Gln
305 310 315 320
Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg
325 330 335
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly
340 345 350
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
355 360 365
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
370 375 380
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
385 390 395 400
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
405 410 415
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
420 425 430
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
435 440 445
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
450 455 460
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
465 470 475 480
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
485 490 495
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
500 505 510
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
515 520 525
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
530 535 540
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
545 550 555 560
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
565 570 575
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
580 585 590
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
595 600 605
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
610 615 620
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
625 630 635 640
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
645 650 655
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
660 665 670
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
675 680 685
Pro Gly Lys
690
<210> 115
<211> 244
<212> БЕЛОК
<213> Homo Sapiens
<400> 115
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Asn Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys
85 90 95
Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu
100 105 110
Tyr Tyr Cys Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met
115 120 125
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
225 230 235 240
Pro Lys Ser Cys
<210> 116
<211> 235
<212> БЕЛОК
<213> Homo Sapiens
<400> 116
Met Thr Trp Thr Pro Leu Leu Phe Leu Thr Leu Leu Leu His Cys Thr
1. 5 10 15
Gly Ser Leu Ser Glu Leu Val Val Thr Gln Glu Pro Ser Leu Thr Val
20 25 30
Ser Pro Gly Gly Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala
35 40 45
Val Thr Thr Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Gly Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr
85 90 95
Leu Ser Gly Val Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu
100 105 110
Trp Tyr Ser Asn Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val
115 120 125
Leu Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser
130 135 140
Ser Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser
145 150 155 160
Asp Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser
165 170 175
Pro Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn
180 185 190
Asn Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp
195 200 205
Lys Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr
210 215 220
Val Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
225 230 235
<210> 117
<211> 691
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT19a: Her3/рЭФР, полипептид 1 (VL патритумаба-hCk-VH
панитумумаба-hCg1)
<400> 117
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Glu Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser
35 40 45
Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr
50 55 60
Gln Gln Asn Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser
65 70 75 80
Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
100 105 110
Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln
115 120 125
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
130 135 140
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
145 150 155 160
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
165 170 175
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
180 185 190
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
195 200 205
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
210 215 220
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
225 230 235 240
Glu Cys Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro
245 250 255
Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser
260 265 270
Ser Gly Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly
275 280 285
Leu Glu Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn
290 295 300
Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr
305 310 315 320
Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile
325 330 335
Tyr Tyr Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly
340 345 350
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
355 360 365
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
370 375 380
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
385 390 395 400
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
405 410 415
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
420 425 430
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
435 440 445
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
450 455 460
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
465 470 475 480
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
485 490 495
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
500 505 510
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
515 520 525
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
530 535 540
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
545 550 555 560
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
565 570 575
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
580 585 590
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
595 600 605
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
610 615 620
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
625 630 635 640
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
645 650 655
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
660 665 670
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
675 680 685
Pro Gly Lys
690
<210> 118
<211> 239
<212> БЕЛОК
<213> Homo Sapiens
<400> 118
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe
35 40 45
Ser Gly Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln
85 90 95
Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 119
<211> 236
<212> БЕЛОК
<213> Homo Sapiens
<400> 119
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln His
100 105 110
Phe Asp His Leu Pro Leu Ala Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 120
<211> 689
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT20a: PD-1/PD-L1, полипептид 1 (VL ниволумаба-hCk-VH
1B12-hCg1(мут.))
<400> 120
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser Ser Val Lys Val
245 250 255
Ser Cys Lys Thr Ser Gly Asp Thr Phe Ser Ser Tyr Ala Ile Ser Trp
260 265 270
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Gly Ile Ile
275 280 285
Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe Gln Gly Arg Val
290 295 300
Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser
305 310 315 320
Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys Ala Arg Lys Phe
325 330 335
His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val Trp Gly Gln Gly
340 345 350
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 121
<211> 235
<212> БЕЛОК
<213> Homo Sapiens
<400> 121
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe
35 40 45
Ser Asn Ser Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Phe Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val
115 120 125
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
130 135 140
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
145 150 155 160
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
165 170 175
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
180 185 190
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
195 200 205
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
210 215 220
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 122
<211> 235
<212> БЕЛОК
<213> Homo Sapiens
<400> 122
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Arg Ser Asn Trp Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
115 120 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
130 135 140
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
145 150 155 160
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
165 170 175
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
195 200 205
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
210 215 220
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 123
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FIT22a: Her3/PD-1, полипептид 1 (VL патритумаба-hCk-VH
ниволумаба-hCg1(мут.))
<400> 123
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Glu Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser
35 40 45
Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr
50 55 60
Gln Gln Asn Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser
65 70 75 80
Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
100 105 110
Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln
115 120 125
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
130 135 140
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
145 150 155 160
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
165 170 175
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
180 185 190
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
195 200 205
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
210 215 220
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
225 230 235 240
Glu Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro
245 250 255
Gly Arg Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser
260 265 270
Asn Ser Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
275 280 285
Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp
290 295 300
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
305 310 315 320
Leu Phe Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
325 330 335
Tyr Cys Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 124
<211> 239
<212> БЕЛОК
<213> Homo Sapiens
<400> 124
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe
35 40 45
Ser Gly Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln
85 90 95
Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 125
<211> 236
<212> БЕЛОК
<213> Homo Sapiens
<400> 125
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 126
<211> 680
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL ипилимумаба-hCk-VH ниволумаба-hCg1(мут.))
<400> 126
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Gly Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Gly Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly
65 70 75 80
Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
85 90 95
Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
100 105 110
Gln Tyr Gly Ser Ser Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln
225 230 235 240
Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg
245 250 255
Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser Gly Met His
260 265 270
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Val Ile
275 280 285
Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys Gly Arg
290 295 300
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe Leu Gln Met
305 310 315 320
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Thr Asn
325 330 335
Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
340 345 350
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
355 360 365
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
370 375 380
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
385 390 395 400
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
405 410 415
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
420 425 430
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
435 440 445
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
450 455 460
Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
465 470 475 480
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
485 490 495
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
500 505 510
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
515 520 525
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
530 535 540
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
545 550 555 560
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
565 570 575
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
580 585 590
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
595 600 605
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
610 615 620
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
625 630 635 640
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
645 650 655
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
660 665 670
Ser Leu Ser Leu Ser Pro Gly Lys
675 680
<210> 127
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба
<400> 127
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 128
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR1
<400> 128
Arg Ala Ser Gln Ser Val Gly Ser Ser Tyr Leu Ala
1. 5 10
<210> 129
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR2
<400> 129
Gly Ala Phe Ser Arg Ala Thr
1. 5
<210> 130
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR3
<400> 130
Gln Gln Tyr Gly Ser Ser Pro Trp Thr
1. 5
<210> 131
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба
<400> 131
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 132
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR1
<400> 132
Asn Ser Gly Met His
1. 5
<210> 133
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR2
<400> 133
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 134
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR3
<400> 134
Asn Asp Asp Tyr
1
<210> 135
<211> 240
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH ипилимумаба-CH1)
<400> 135
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Ser Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile
100 105 110
Tyr Tyr Cys Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
<210> 136
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба
<400> 136
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 137
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR1
<400> 137
Ser Tyr Thr Met His
1. 5
<210> 138
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR2
<400> 138
Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 139
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR3
<400> 139
Thr Gly Trp Leu Gly Pro Phe Asp Tyr
1. 5
<210> 140
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL ниволумаба-hCK)
<400> 140
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 141
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба
<400> 141
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 142
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR1
<400> 142
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 143
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR2
<400> 143
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 144
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR3
<400> 144
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1. 5
<210> 145
<211> 684
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL ниволумаба-hCk-VH
ипилимумаба-hCg1(мут.))
<400> 145
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu
245 250 255
Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Thr Met His Trp
260 265 270
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Thr Phe Ile Ser
275 280 285
Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
290 295 300
Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
305 310 315 320
Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala Arg Thr Gly
325 330 335
Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
340 345 350
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
355 360 365
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
370 375 380
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
385 390 395 400
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
405 410 415
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
420 425 430
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
435 440 445
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
450 455 460
Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe
465 470 475 480
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
485 490 495
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
500 505 510
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
515 520 525
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
530 535 540
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
545 550 555 560
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
565 570 575
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
580 585 590
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
595 600 605
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
610 615 620
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
625 630 635 640
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
645 650 655
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
660 665 670
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680
<210> 146
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба
<400> 146
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 147
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR1
<400> 147
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 148
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR2
<400> 148
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 149
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR3
<400> 149
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1. 5
<210> 150
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба
<400> 150
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 151
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR1
<400> 151
Ser Tyr Thr Met His
1. 5
<210> 152
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR2
<400> 152
Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 153
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR3
<400> 153
Thr Gly Trp Leu Gly Pro Phe Asp Tyr
1. 5
<210> 154
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH ниволумаба-CH1)
<400> 154
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe
35 40 45
Ser Asn Ser Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Phe Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val
115 120 125
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
130 135 140
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
145 150 155 160
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
165 170 175
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
180 185 190
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
195 200 205
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
210 215 220
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 155
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба
<400> 155
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 156
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR1
<400> 156
Gly Met His
1
<210> 157
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR2
<400> 157
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 158
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR3
<400> 158
Asn Asp Asp Tyr
1
<210> 159
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL ипилимумаба-hCK)
<400> 159
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Gly Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Gly Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly
65 70 75 80
Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
85 90 95
Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
100 105 110
Gln Tyr Gly Ser Ser Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 160
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба
<400> 160
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 161
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR1
<400> 161
Arg Ala Ser Gln Ser Val Gly Ser Ser Tyr Leu Ala
1. 5 10
<210> 162
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR2
<400> 162
Gly Ala Phe Ser Arg Ala Thr
1. 5
<210> 163
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR3
<400> 163
Tyr Gly Ser Ser Pro Trp Thr
1. 5
<210> 164
<211> 677
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL ипилимумаба-hCk-VH
ниволумаба-hCg4)
<400> 164
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Gly Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Gly Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly
65 70 75 80
Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
85 90 95
Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
100 105 110
Gln Tyr Gly Ser Ser Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln
225 230 235 240
Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg
245 250 255
Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser Gly Met His
260 265 270
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Val Ile
275 280 285
Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys Gly Arg
290 295 300
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe Leu Gln Met
305 310 315 320
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Thr Asn
325 330 335
Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
340 345 350
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr
355 360 365
Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
370 375 380
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
385 390 395 400
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
405 410 415
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr
420 425 430
Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val
435 440 445
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
450 455 460
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
465 470 475 480
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
485 490 495
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
500 505 510
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
515 520 525
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
530 535 540
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
545 550 555 560
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
565 570 575
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
580 585 590
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
595 600 605
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
610 615 620
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
625 630 635 640
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
645 650 655
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
660 665 670
Leu Ser Leu Gly Lys
675
<210> 165
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба
<400> 165
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 166
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR1
<400> 166
Arg Ala Ser Gln Ser Val Gly Ser Ser Tyr Leu Ala
1. 5 10
<210> 167
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR2
<400> 167
Gly Ala Phe Ser Arg Ala Thr
1. 5
<210> 168
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR3
<400> 168
Gln Gln Tyr Gly Ser Ser
1. 5
<210> 169
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба
<400> 169
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 170
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR1
<400> 170
Asn Ser Gly Met His
1. 5
<210> 171
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR2
<400> 171
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 172
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR3
<400> 172
Asn Asp Asp Tyr
1
<210> 173
<211> 240
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH ипилимумаба-CH1)
<400> 173
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Ser Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile
100 105 110
Tyr Tyr Cys Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
<210> 174
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба
<400> 174
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 175
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR1
<400> 175
Ser Tyr Thr Met His
1. 5
<210> 176
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR2
<400> 176
Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 177
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR3
<400> 177
Thr Gly Trp Leu Gly Pro Phe Asp Tyr
1. 5
<210> 178
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL ниволумаба-hCK)
<400> 178
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 179
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба
<400> 179
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 180
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR1
<400> 180
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 181
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR2
<400> 181
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 182
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR3
<400> 182
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1. 5
<210> 183
<211> 684
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL ниволумаба-hCk-VH
ипилимумаба-hCg1(мут.))
<400> 183
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu
245 250 255
Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Thr Met His Trp
260 265 270
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Thr Phe Ile Ser
275 280 285
Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe
290 295 300
Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn
305 310 315 320
Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Ala Arg Thr Gly
325 330 335
Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
340 345 350
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
355 360 365
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
370 375 380
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
385 390 395 400
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
405 410 415
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
420 425 430
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
435 440 445
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
450 455 460
Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe
465 470 475 480
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
485 490 495
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
500 505 510
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
515 520 525
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
530 535 540
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
545 550 555 560
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
565 570 575
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
580 585 590
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
595 600 605
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
610 615 620
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
625 630 635 640
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
645 650 655
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
660 665 670
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680
<210> 184
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба
<400> 184
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 185
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR1
<400> 185
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 186
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR2
<400> 186
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 187
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR3
<400> 187
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1. 5
<210> 188
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба
<400> 188
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 189
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR1
<400> 189
Ser Tyr Thr Met His
1. 5
<210> 190
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR2
<400> 190
Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 191
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ипилимумаба - CDR3
<400> 191
Thr Gly Trp Leu Gly Pro Phe Asp Tyr
1. 5
<210> 192
<211> 232
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH ниволумаба-IgG4-CH1)
<400> 192
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe
35 40 45
Ser Asn Ser Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Phe Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val
115 120 125
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
130 135 140
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
145 150 155 160
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
165 170 175
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
180 185 190
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
195 200 205
Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
210 215 220
Lys Val Asp Lys Arg Val Glu Ser
225 230
<210> 193
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба
<400> 193
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 194
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR1
<400> 194
Asn Ser Gly Met His
1. 5
<210> 195
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR2
<400> 195
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 196
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR3
<400> 196
Asn Asp Asp Tyr
1
<210> 197
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL ипилимумаба-hCK)
<400> 197
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Gly Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Gly Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly
65 70 75 80
Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
85 90 95
Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
100 105 110
Gln Tyr Gly Ser Ser Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 198
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба
<400> 198
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 199
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR1
<400> 199
Arg Ala Ser Gln Ser Val Gly Ser Ser Tyr Leu Ala
1. 5 10
<210> 200
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR2
<400> 200
Gly Ala Phe Ser Arg Ala Thr
1. 5
<210> 201
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ипилимумаба - CDR3
<400> 201
Gln Gln Tyr Gly Ser Ser Pro Trp Thr
1. 5
<210> 202
<211> 689
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL панитумумаба-hCk-VH
1B12-hCg1)
<400> 202
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln His
100 105 110
Phe Asp His Leu Pro Leu Ala Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser Ser Val Lys Val
245 250 255
Ser Cys Lys Thr Ser Gly Asp Thr Phe Ser Ser Tyr Ala Ile Ser Trp
260 265 270
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Gly Ile Ile
275 280 285
Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe Gln Gly Arg Val
290 295 300
Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser
305 310 315 320
Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys Ala Arg Lys Phe
325 330 335
His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val Trp Gly Gln Gly
340 345 350
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 203
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба
<400> 203
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln His Phe Asp His Leu Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 204
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR1
<400> 204
Gln Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1. 5 10
<210> 205
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR2
<400> 205
Asp Ala Ser Asn Leu Glu Thr
1. 5
<210> 206
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR3
<400> 206
Gln His Phe Asp His Leu Pro Leu Ala
1. 5
<210> 207
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12
<400> 207
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Thr Ser Gly Asp Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Lys Phe His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 208
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR1
<400> 208
Ser Tyr Ala Ile Ser
1. 5
<210> 209
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR2
<400> 209
Gly Ile Ile Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe Gln
1. 5 10 15
Gly
<210> 210
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR3
<400> 210
Lys Phe His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val
1. 5 10
<210> 211
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH панитумумаба-CH1h)
<400> 211
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val
35 40 45
Ser Ser Gly Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr
65 70 75 80
Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys
85 90 95
Thr Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp
115 120 125
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
225 230 235 240
Cys
<210> 212
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба
<400> 212
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 213
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR1
<400> 213
Ser Gly Asp Tyr Tyr Trp Thr
1. 5
<210> 214
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR2
<400> 214
His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 215
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR3
<400> 215
Asp Arg Val Thr Gly Ala Phe Asp Ile
1. 5
<210> 216
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL 1B12-hCk)
<400> 216
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Arg Ser Asn Trp Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
115 120 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
130 135 140
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
145 150 155 160
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
165 170 175
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
195 200 205
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
210 215 220
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 217
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12
<400> 217
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 218
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR1
<400> 218
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 219
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR2
<400> 219
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 220
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR3
<400> 220
Gln Gln Arg Ser Asn Trp Pro Thr
1. 5
<210> 221
<211> 684
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL панитумумаба-hCk-VH
10A5-hCg1)
<400> 221
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln His
100 105 110
Phe Asp His Leu Pro Leu Ala Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val
245 250 255
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asp Val His Trp
260 265 270
Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met Gly Trp Leu His
275 280 285
Ala Asp Thr Gly Ile Thr Lys Phe Ser Gln Lys Phe Gln Gly Arg Val
290 295 300
Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr Met Glu Leu Ser
305 310 315 320
Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Glu Arg
325 330 335
Ile Gln Leu Trp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
340 345 350
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
355 360 365
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
370 375 380
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
385 390 395 400
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
405 410 415
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
420 425 430
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
435 440 445
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
450 455 460
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
465 470 475 480
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
485 490 495
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
500 505 510
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
515 520 525
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
530 535 540
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
545 550 555 560
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
565 570 575
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
580 585 590
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
595 600 605
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
610 615 620
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
625 630 635 640
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
645 650 655
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
660 665 670
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680
<210> 222
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба
<400> 222
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln His Phe Asp His Leu Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 223
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR1
<400> 223
Gln Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1. 5 10
<210> 224
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR2
<400> 224
Asp Ala Ser Asn Leu Glu Thr
1. 5
<210> 225
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR3
<400> 225
Gln His Phe Asp His Leu Pro Leu Ala
1. 5
<210> 226
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 10A5
<400> 226
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asp Val His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Leu His Ala Asp Thr Gly Ile Thr Lys Phe Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Ile Gln Leu Trp Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 227
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 10A5 - CDR1
<400> 227
Ser Tyr Asp Val His
1. 5
<210> 228
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 10A5 - CDR2
<400> 228
Trp Leu His Ala Asp Thr Gly Ile Thr Lys Phe Ser Gln Lys Phe Gln
1. 5 10 15
Gly
<210> 229
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 10A5 - CDR3
<400> 229
Glu Arg Ile Gln Leu Trp Phe Asp Tyr
1. 5
<210> 230
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH панитумумаба-CH1h)
<400> 230
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val
35 40 45
Ser Ser Gly Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr
65 70 75 80
Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys
85 90 95
Thr Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp
115 120 125
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
225 230 235 240
Cys
<210> 231
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба
<400> 231
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 232
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR1
<400> 232
Ser Gly Asp Tyr Tyr Trp Thr
1. 5
<210> 233
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR2
<400> 233
His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 234
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR3
<400> 234
Asp Arg Val Thr Gly Ala Phe Asp Ile
1. 5
<210> 235
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL 10A5-hCk)
<400> 235
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Gly Ile Ser Ser Trp Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys
50 55 60
Ala Pro Lys Ser Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Tyr Asn Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 236
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 10A5
<400> 236
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 237
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 10A5 - CDR1
<400> 237
Arg Ala Ser Gln Gly Ile Ser Ser Trp Leu Ala
1. 5 10
<210> 238
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 10A5 - CDR2
<400> 238
Ala Ala Ser Ser Leu Gln Ser
1. 5
<210> 239
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 10A5 - CDR3
<400> 239
Gln Gln Tyr Asn Ser Tyr Pro Tyr Thr
1. 5
<210> 240
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL h1332-hCk-VH
панитумумаба-hCg1)
<400> 240
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Val Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Gly Ile Asn Thr Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Lys Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Ala Asn Ser Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu
245 250 255
Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly Asp Tyr Tyr Trp
260 265 270
Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Ile Gly His
275 280 285
Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg
290 295 300
Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe Ser Leu Lys Leu
305 310 315 320
Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr Cys Val Arg Asp
325 330 335
Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 241
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL h1332
<400> 241
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asn Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 242
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL h1332 - CDR1
<400> 242
Arg Ala Ser Gln Gly Ile Asn Thr Trp Leu Ala
1. 5 10
<210> 243
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL h1332 - CDR2
<400> 243
Ala Ala Ser Ser Leu Lys Ser
1. 5
<210> 244
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL h1332 - CDR3
<400> 244
Gln Gln Ala Asn Ser Phe Pro Leu Thr
1. 5
<210> 245
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба
<400> 245
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 246
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR1
<400> 246
Ser Gly Asp Tyr Tyr Trp Thr
1. 5
<210> 247
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR2
<400> 247
His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 248
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR3
<400> 248
Asp Arg Val Thr Gly Ala Phe Asp Ile
1. 5
<210> 249
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH h1332-CH1)
<400> 249
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Gly Phe Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Trp Ile Ser Ala Ser Asn Gly Asn Thr Tyr Tyr Ala
65 70 75 80
Gln Lys Leu Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Val Tyr Ala Asp Tyr Ala Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 250
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH h1332
<400> 250
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Gly Phe Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Ser Asn Gly Asn Thr Tyr Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Tyr Ala Asp Tyr Ala Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 251
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH h1332 - CDR1
<400> 251
Ser Tyr Gly Phe Ser
1. 5
<210> 252
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH h1332 - CDR2
<400> 252
Trp Ile Ser Ala Ser Asn Gly Asn Thr Tyr Tyr Ala Gln Lys Leu Gln
1. 5 10 15
Gly
<210> 253
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH h1332 - CDR3
<400> 253
Val Tyr Ala Asp Tyr Ala Asp Tyr
1. 5
<210> 254
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL панитумумаба-hCk)
<400> 254
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln His
100 105 110
Phe Asp His Leu Pro Leu Ala Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 255
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба
<400> 255
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln His Phe Asp His Leu Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 256
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR1
<400> 256
Gln Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1. 5 10
<210> 257
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR2
<400> 257
Asp Ala Ser Asn Leu Glu Thr
1. 5
<210> 258
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR3
<400> 258
Gln His Phe Asp His Leu Pro Leu Ala
1. 5
<210> 259
<211> 680
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL FIX-hCk-VH FX-hCg4)
<400> 259
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser
35 40 45
Arg Asn Ile Glu Arg Gln Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Glu Leu Leu Ile Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val
65 70 75 80
Pro Asp Arg Phe Ser Gly Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Tyr Ser Asp Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala Ser Val Lys Val
245 250 255
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn Asn Met Asp Trp
260 265 270
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Asp Ile Asn
275 280 285
Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe Gln Asp Arg Val
290 295 300
Ile Met Thr Val Asp Lys Ser Thr Asp Thr Ala Tyr Met Glu Leu Ser
305 310 315 320
Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr His Cys Ala Arg Arg Lys
325 330 335
Ser Tyr Gly Tyr Tyr Leu Asp Glu Trp Gly Glu Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys
450 455 460
Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
465 470 475 480
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
485 490 495
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
500 505 510
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
515 520 525
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
530 535 540
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
545 550 555 560
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
565 570 575
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
580 585 590
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
595 600 605
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
610 615 620
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
625 630 635 640
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
645 650 655
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
660 665 670
Gln Glu Ser Leu Ser Leu Ser Pro
675 680
<210> 260
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL FIX
<400> 260
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Arg Asn Ile Glu Arg Gln
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Asp Pro Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 261
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL FIX - CDR1
<400> 261
Lys Ala Ser Arg Asn Ile Glu Arg Gln Leu Ala
1. 5 10
<210> 262
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL FIX - CDR2
<400> 262
Gln Ala Ser Arg Lys Glu Ser
1. 5
<210> 263
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL FIX - CDR3
<400> 263
Gln Gln Tyr Ser Asp Pro Pro Leu Thr
1. 5
<210> 264
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH FX
<400> 264
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asn
20 25 30
Asn Met Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Asn Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe
50 55 60
Gln Asp Arg Val Ile Met Thr Val Asp Lys Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr His Cys
85 90 95
Ala Arg Arg Lys Ser Tyr Gly Tyr Tyr Leu Asp Glu Trp Gly Glu Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 265
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH FX - CDR1
<400> 265
Asp Asn Asn Met Asp
1. 5
<210> 266
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH FX - CDR2
<400> 266
Asp Ile Asn Thr Arg Ser Gly Gly Ser Ile Tyr Asn Glu Glu Phe Gln
1. 5 10 15
Asp
<210> 267
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH FX - CDR3
<400> 267
Arg Lys Ser Tyr Gly Tyr Tyr Leu Asp Glu
1. 5 10
<210> 268
<211> 245
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH F-IX-CH1h)
<400> 268
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Tyr Tyr Asp Ile Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg
65 70 75 80
Arg Glu Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys
245
<210> 269
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH F-IX
<400> 269
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Tyr Tyr
20 25 30
Asp Ile Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg Arg Glu Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 270
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH F-IX - CDR1
<400> 270
Ser Tyr Tyr Asp Ile Gln
1. 5
<210> 271
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH F-IX - CDR2
<400> 271
Ser Ile Ser Pro Ser Gly Gln Ser Thr Tyr Tyr Arg Arg Glu Val Lys
1. 5 10 15
Gly
<210> 272
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH F-IX - CDR3
<400> 272
Arg Thr Gly Arg Glu Tyr Gly Gly Gly Trp Tyr Phe Asp Tyr
1. 5 10
<210> 273
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL F-X-hCk)
<400> 273
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser
35 40 45
Arg Asn Ile Glu Arg Gln Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Glu Leu Leu Ile Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val
65 70 75 80
Pro Asp Arg Phe Ser Gly Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Tyr Ser Asp Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 274
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL F-X
<400> 274
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Arg Asn Ile Glu Arg Gln
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Glu Leu Leu Ile
35 40 45
Tyr Gln Ala Ser Arg Lys Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Arg Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Asp Pro Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 275
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL F-X - CDR1
<400> 275
Lys Ala Ser Arg Asn Ile Glu Arg Gln Leu Ala
1. 5 10
<210> 276
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL F-X - CDR2
<400> 276
Gln Ala Ser Arg Lys Glu Ser
1. 5
<210> 277
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL F-X - CDR3
<400> 277
Gln Gln Tyr Ser Asp Pro Pro Leu Thr
1. 5
<210> 278
<211> 697
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL патритумаба-hCk-VH
фигитумумаба-hCg1)
<400> 278
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Glu Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser
35 40 45
Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr
50 55 60
Gln Gln Asn Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser
65 70 75 80
Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
100 105 110
Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln
115 120 125
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
130 135 140
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
145 150 155 160
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
165 170 175
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
180 185 190
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
195 200 205
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
210 215 220
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
225 230 235 240
Glu Cys Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro
245 250 255
Gly Gly Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser
260 265 270
Ser Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
275 280 285
Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Thr Thr Phe Tyr Ala Asp
290 295 300
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Thr Thr
305 310 315 320
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
325 330 335
Tyr Cys Ala Lys Asp Leu Gly Trp Ser Asp Ser Tyr Tyr Tyr Tyr Tyr
340 345 350
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
355 360 365
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
370 375 380
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
385 390 395 400
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
405 410 415
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
420 425 430
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
435 440 445
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
450 455 460
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
465 470 475 480
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
485 490 495
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
500 505 510
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
515 520 525
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
530 535 540
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
545 550 555 560
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
565 570 575
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
580 585 590
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
595 600 605
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
610 615 620
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
625 630 635 640
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
645 650 655
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
660 665 670
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
675 680 685
Lys Ser Leu Ser Leu Ser Pro Gly Lys
690 695
<210> 279
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба
<400> 279
Asp Ile Glu Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr Gln Gln Asn Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 280
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR1
<400> 280
Arg Ser Ser Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu
1. 5 10 15
Ala
<210> 281
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR2
<400> 281
Trp Ala Ser Thr Arg Glu Ser
1. 5
<210> 282
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR3
<400> 282
Gln Gln Tyr Tyr Ser Thr Pro Arg Thr
1. 5
<210> 283
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH фигитумумаба
<400> 283
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Thr Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Leu Gly Trp Ser Asp Ser Tyr Tyr Tyr Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 284
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH фигитумумаба - CDR1
<400> 284
Ser Tyr Ala Met Asn
1. 5
<210> 285
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH фигитумумаба - CDR2
<400> 285
Ala Ile Ser Gly Ser Gly Gly Thr Thr Phe Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 286
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH фигитумумаба - CDR3
<400> 286
Asp Leu Gly Trp Ser Asp Ser Tyr Tyr Tyr Tyr Tyr Gly Met Asp Val
1. 5 10 15
<210> 287
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH патритумаба -CH1)
<400> 287
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe
35 40 45
Ser Gly Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln
85 90 95
Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 288
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба
<400> 288
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 289
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR1
<400> 289
Gly Tyr Tyr Trp Ser
1. 5
<210> 290
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR2
<400> 290
Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 291
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR3
<400> 291
Asp Lys Trp Thr Trp Tyr Phe Asp Leu
1. 5
<210> 292
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL фигитумумаба-hCk)
<400> 292
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Phe Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Gly Ile Arg Asn Asp Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Arg Leu Ile Tyr Ala Ala Ser Arg Leu His Arg Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln
100 105 110
His Asn Ser Tyr Pro Cys Ser Phe Gly Gln Gly Thr Lys Leu Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 293
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL фигитумумаба
<400> 293
Asp Ile Gln Met Thr Gln Phe Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Arg Leu His Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Cys
85 90 95
Ser Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 294
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL фигитумумаба - CDR1
<400> 294
Arg Ala Ser Gln Gly Ile Arg Asn Asp Leu Gly
1. 5 10
<210> 295
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL фигитумумаба - CDR2
<400> 295
Ala Ala Ser Arg Leu His Arg
1. 5
<210> 296
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL фигитумумаба - CDR3
<400> 296
Leu Gln His Asn Ser Tyr Pro Cys Ser
1. 5
<210> 297
<211> 693
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL демцизумаба-hCk-VH
бевацизумаба-hCg1)
<400> 297
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Val Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Ser Cys Arg Ala Ser
35 40 45
Glu Ser Val Asp Asn Tyr Gly Ile Ser Phe Met Lys Trp Phe Gln Gln
50 55 60
Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln
65 70 75 80
Gly Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr
100 105 110
Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp Thr Phe Gly Gly Gly Thr
115 120 125
Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
245 250 255
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
260 265 270
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
275 280 285
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
290 295 300
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
305 310 315 320
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
325 330 335
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
340 345 350
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
355 360 365
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
370 375 380
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
385 390 395 400
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
405 410 415
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
420 425 430
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
435 440 445
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
450 455 460
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
465 470 475 480
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
485 490 495
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
500 505 510
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
515 520 525
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
530 535 540
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
545 550 555 560
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
565 570 575
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
580 585 590
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
595 600 605
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
610 615 620
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
625 630 635 640
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
645 650 655
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
660 665 670
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
675 680 685
Leu Ser Pro Gly Lys
690
<210> 298
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL демцизумаба
<400> 298
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Ser Phe Met Lys Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 299
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL демцизумаба - CDR1
<400> 299
Arg Ala Ser Glu Ser Val Asp Asn Tyr Gly Ile Ser Phe Met Lys
1. 5 10 15
<210> 300
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL демцизумаба - CDR2
<400> 300
Ala Ala Ser Asn Gln Gly Ser
1. 5
<210> 301
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL демцизумаба - CDR3
<400> 301
Gln Gln Ser Lys Glu Val Pro Trp Thr
1. 5
<210> 302
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH бевацизумаба
<400> 302
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 303
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH бевацизумаба - CDR1
<400> 303
Asn Tyr Gly Met Asn
1. 5
<210> 304
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH бевацизумаба - CDR2
<400> 304
Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe Lys
1. 5 10 15
Arg
<210> 305
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH бевацизумаба - CDR3
<400> 305
Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
1. 5 10
<210> 306
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH демцизумаба -CH1h)
<400> 306
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe
35 40 45
Thr Ala Tyr Tyr Ile His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Tyr Ile Ser Ser Tyr Asn Gly Ala Thr Asn Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Arg Val Thr Phe Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Asp Tyr Asp Tyr Asp Val Gly Met Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
225 230 235 240
Cys
<210> 307
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH демцизумаба
<400> 307
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ala Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Ser Ser Tyr Asn Gly Ala Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Phe Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Asp Tyr Asp Val Gly Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 308
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH демцизумаба - CDR1
<400> 308
Ala Tyr Tyr Ile His
1. 5
<210> 309
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH демцизумаба - CDR2
<400> 309
Tyr Ile Ser Ser Tyr Asn Gly Ala Thr Asn Tyr Asn Gln Lys Phe Lys
1. 5 10 15
Gly
<210> 310
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH демцизумаба - CDR3
<400> 310
Asp Tyr Asp Tyr Asp Val Gly Met Asp Tyr
1. 5 10
<210> 311
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL бевацизумаба-hCk)
<400> 311
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Val Leu Ile Tyr Phe Thr Ser Ser Leu His Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Tyr Ser Thr Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 312
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL бевацизумаба
<400> 312
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 313
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL бевацизумаба - CDR1
<400> 313
Ser Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1. 5 10
<210> 314
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL бевацизумаба - CDR2
<400> 314
Phe Thr Ser Ser Leu His Ser
1. 5
<210> 315
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL бевацизумаба - CDR3
<400> 315
Gln Gln Tyr Ser Thr Val Pro Trp Thr
1. 5
<210> 316
<211> 691
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL офатумумаба-hCk-VH mAb к
CD3-hCg1(мут.))
<400> 316
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Arg Ser Asn Trp Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Glu Val Gln Leu
225 230 235 240
Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Lys Leu
245 250 255
Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr Ala Met Asn Trp
260 265 270
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Arg
275 280 285
Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp
290 295 300
Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Ala Tyr Leu Gln
305 310 315 320
Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg
325 330 335
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly
340 345 350
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
355 360 365
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
370 375 380
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
385 390 395 400
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
405 410 415
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
420 425 430
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
435 440 445
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
450 455 460
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
465 470 475 480
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
485 490 495
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
500 505 510
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
515 520 525
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
530 535 540
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
545 550 555 560
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
565 570 575
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
580 585 590
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
595 600 605
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
610 615 620
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
625 630 635 640
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
645 650 655
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
660 665 670
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
675 680 685
Pro Gly Lys
690
<210> 317
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL офатумумаба
<400> 317
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 318
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL офатумумаба - CDR1
<400> 318
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 319
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL офатумумаба - CDR2
<400> 319
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 320
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL офатумумаба - CDR3
<400> 320
Gln Gln Arg Ser Asn Trp Pro Ile Thr
1. 5
<210> 321
<211> 125
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH mAb к CD3
<400> 321
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Ala Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 322
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH mAb к CD3 -CDR1
<400> 322
Thr Tyr Ala Met Asn
1. 5
<210> 323
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH mAb к CD3 - CDR2
<400> 323
Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser
1. 5 10 15
Val Lys Asp
<210> 324
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH mAb к CD3 - CDR3
<400> 324
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1. 5 10
<210> 325
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH офатумумаба-CH1)
<400> 325
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Asn Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys
85 90 95
Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu
100 105 110
Tyr Tyr Cys Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met
115 120 125
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
225 230 235 240
Pro Lys Ser Cys
<210> 326
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH офатумумаба
<400> 326
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 327
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH офатумумаба - CDR1
<400> 327
Asp Tyr Ala Met His
1. 5
<210> 328
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH офатумумаба - CDR2
<400> 328
Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 329
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH офатумумаба - CDR3
<400> 329
Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val
1. 5 10
<210> 330
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL mAb к CD3-hCL)
<400> 330
Met Thr Trp Thr Pro Leu Leu Phe Leu Thr Leu Leu Leu His Cys Thr
1. 5 10 15
Gly Ser Leu Ser Glu Leu Val Val Thr Gln Glu Pro Ser Leu Thr Val
20 25 30
Ser Pro Gly Gly Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala
35 40 45
Val Thr Thr Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Gly Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr
85 90 95
Leu Ser Gly Val Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu
100 105 110
Trp Tyr Ser Asn Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val
115 120 125
Leu Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser
130 135 140
Ser Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser
145 150 155 160
Asp Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser
165 170 175
Pro Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn
180 185 190
Asn Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp
195 200 205
Lys Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr
210 215 220
Val Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
225 230 235
<210> 331
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL mAb к CD3
<400> 331
Glu Leu Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1. 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 332
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL mAb к CD3 - CDR1
<400> 332
Arg Ser Ser Thr Gly Ala Val Thr Thr Ser Asn Tyr Ala Asn
1. 5 10
<210> 333
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL mAb к CD3 - CDR2
<400> 333
Gly Thr Asn Lys Arg Ala Pro
1. 5
<210> 334
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL mAb к CD3 - CDR3
<400> 334
Ala Leu Trp Tyr Ser Asn Leu Trp Val
1. 5
<210> 335
<211> 691
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL патритумаба-hCk-VH
панитумумаба-hCg1)
<400> 335
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Glu Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser
35 40 45
Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr
50 55 60
Gln Gln Asn Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser
65 70 75 80
Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
100 105 110
Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln
115 120 125
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
130 135 140
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
145 150 155 160
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
165 170 175
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
180 185 190
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
195 200 205
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
210 215 220
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
225 230 235 240
Glu Cys Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro
245 250 255
Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser
260 265 270
Ser Gly Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly
275 280 285
Leu Glu Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn
290 295 300
Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr
305 310 315 320
Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile
325 330 335
Tyr Tyr Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly
340 345 350
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
355 360 365
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
370 375 380
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
385 390 395 400
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
405 410 415
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
420 425 430
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
435 440 445
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
450 455 460
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
465 470 475 480
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
485 490 495
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
500 505 510
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
515 520 525
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
530 535 540
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
545 550 555 560
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
565 570 575
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
580 585 590
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
595 600 605
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
610 615 620
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
625 630 635 640
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
645 650 655
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
660 665 670
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
675 680 685
Pro Gly Lys
690
<210> 336
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба
<400> 336
Asp Ile Glu Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr Gln Gln Asn Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 337
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR1
<400> 337
Arg Ser Ser Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu
1. 5 10 15
Ala
<210> 338
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR2
<400> 338
Trp Ala Ser Thr Arg Glu Ser
1. 5
<210> 339
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR3
<400> 339
Gln Tyr Tyr Ser Thr Pro Arg Thr
1. 5
<210> 340
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба
<400> 340
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 341
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR1
<400> 341
Ser Gly Asp Tyr Tyr Trp Thr
1. 5
<210> 342
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR2
<400> 342
His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 343
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR3
<400> 343
Asp Arg Val Thr Gly Ala Phe Asp Ile
1. 5
<210> 344
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH патритумаба -CH1)
<400> 344
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe
35 40 45
Ser Gly Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln
85 90 95
Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 345
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба
<400> 345
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 346
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR1
<400> 346
Gly Tyr Tyr Trp Ser
1. 5
<210> 347
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR2
<400> 347
Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 348
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR3
<400> 348
Asp Lys Trp Thr Trp Tyr Phe Asp Leu
1. 5
<210> 349
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL панитумумаба-hCk)
<400> 349
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val
65 70 75 80
Pro Ser Pro Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe
85 90 95
Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln
100 105 110
His Phe Asp His Leu Pro Leu Ala Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
130 135 140
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
145 150 155 160
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
165 170 175
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
180 185 190
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
195 200 205
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
210 215 220
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 350
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба
<400> 350
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln His Phe Asp His Leu Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 351
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR1
<400> 351
Gln Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1. 5 10
<210> 352
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR2
<400> 352
Asp Ala Ser Asn Leu Glu Thr
1. 5
<210> 353
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR3
<400> 353
Gln His Phe Asp His Leu Pro Leu Ala
1. 5
<210> 354
<211> 683
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL панитумумаба-hCk-
патритумаб-hCg1)
<400> 354
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser
35 40 45
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Phe Cys Gln His
100 105 110
Phe Asp His Leu Pro Leu Ala Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu Thr Leu Ser Leu
245 250 255
Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr Tyr Trp Ser Trp
260 265 270
Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Glu Ile Asn
275 280 285
His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr
290 295 300
Ile Ser Val Glu Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser
305 310 315 320
Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asp Lys Trp
325 330 335
Thr Trp Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser
340 345 350
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
355 360 365
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
370 375 380
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
385 390 395 400
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
405 410 415
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
420 425 430
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
435 440 445
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
450 455 460
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
465 470 475 480
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
485 490 495
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
500 505 510
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
515 520 525
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
530 535 540
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
545 550 555 560
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
565 570 575
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
580 585 590
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
595 600 605
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
610 615 620
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
625 630 635 640
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
645 650 655
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
660 665 670
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680
<210> 355
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба
<400> 355
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln His Phe Asp His Leu Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 356
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR1
<400> 356
Gln Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1. 5 10
<210> 357
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR2
<400> 357
Asp Ala Ser Asn Leu Glu Thr
1. 5
<210> 358
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL панитумумаба - CDR3
<400> 358
Gln His Phe Asp His Leu Pro Leu Ala
1. 5
<210> 359
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба
<400> 359
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 360
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR1
<400> 360
Gly Tyr Tyr Trp Ser
1. 5
<210> 361
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR2
<400> 361
Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 362
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR3
<400> 362
Asp Lys Trp Thr Trp Tyr Phe Asp Leu
1. 5
<210> 363
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH панитумумаба -CH1)
<400> 363
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val
35 40 45
Ser Ser Gly Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr
65 70 75 80
Asn Pro Ser Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys
85 90 95
Thr Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala
100 105 110
Ile Tyr Tyr Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp
115 120 125
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
210 215 220
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
225 230 235 240
Cys
<210> 364
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба
<400> 364
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 365
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR1
<400> 365
Asp Tyr Tyr Trp Thr
1. 5
<210> 366
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR2
<400> 366
His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 367
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH панитумумаба - CDR3
<400> 367
Asp Arg Val Thr Gly Ala Phe Asp Ile
1. 5
<210> 368
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL патритумаба-hCk)
<400> 368
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Glu Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser
35 40 45
Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr
50 55 60
Gln Gln Asn Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser
65 70 75 80
Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
100 105 110
Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln
115 120 125
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
130 135 140
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
145 150 155 160
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
165 170 175
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
180 185 190
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
195 200 205
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
210 215 220
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
225 230 235 240
Glu Cys
<210> 369
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба
<400> 369
Asp Ile Glu Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr Gln Gln Asn Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 370
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR1
<400> 370
Arg Ser Ser Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu
1. 5 10 15
Ala
<210> 371
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR2
<400> 371
Trp Ala Ser Thr Arg Glu Ser
1. 5
<210> 372
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR3
<400> 372
Gln Gln Tyr Tyr Ser Thr Pro Arg Thr
1. 5
<210> 373
<211> 678
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL 1B12-hCk-VH
ниволумаба-hCg1(мут.))
<400> 373
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Arg Ser Asn Trp Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
115 120 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
130 135 140
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
145 150 155 160
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
165 170 175
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
195 200 205
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
210 215 220
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu Val
225 230 235 240
Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Asp
245 250 255
Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser Gly Met His Trp Val
260 265 270
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Val Ile Trp Tyr
275 280 285
Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
290 295 300
Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe Leu Gln Met Asn Ser
305 310 315 320
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Thr Asn Asp Asp
325 330 335
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
340 345 350
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
355 360 365
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
370 375 380
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
385 390 395 400
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
405 410 415
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
420 425 430
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
435 440 445
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
450 455 460
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
465 470 475 480
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
485 490 495
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
500 505 510
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
515 520 525
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
530 535 540
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
545 550 555 560
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
565 570 575
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
580 585 590
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
595 600 605
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
610 615 620
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
625 630 635 640
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
645 650 655
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
660 665 670
Ser Leu Ser Pro Gly Lys
675
<210> 374
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL I1B12
<400> 374
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 375
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR1
<400> 375
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 376
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR2
<400> 376
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 377
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR3
<400> 377
Gln Gln Arg Ser Asn Trp Pro Thr
1. 5
<210> 378
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба
<400> 378
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 379
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR1
<400> 379
Asn Ser Gly Met His
1. 5
<210> 380
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR2
<400> 380
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 381
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR3
<400> 381
Asn Asp Asp Tyr
1
<210> 382
<211> 245
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH 1B12-CH1)
<400> 382
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ser Ser Val Lys Val Ser Cys Lys Thr Ser Gly Asp Thr Phe
35 40 45
Ser Ser Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Gly Ile Ile Pro Ile Phe Gly Arg Ala His Tyr Ala
65 70 75 80
Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Phe Cys Ala Arg Lys Phe His Phe Val Ser Gly Ser Pro Phe Gly
115 120 125
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys
245
<210> 383
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12
<400> 383
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Thr Ser Gly Asp Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Lys Phe His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 384
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR1
<400> 384
Ser Tyr Ala Ile Ser
1. 5
<210> 385
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR2
<400> 385
Gly Ile Ile Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe Gln
1. 5 10 15
Gly
<210> 386
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR3
<400> 386
Lys Phe His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val
1. 5 10
<210> 387
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL ниволумаба-hCK)
<400> 387
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 388
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба
<400> 388
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 389
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR1
<400> 389
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 390
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR2
<400> 390
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 391
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR3
<400> 391
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1. 5
<210> 392
<211> 682
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL офатумумаба-hCk-VH
эпратузумаба-hCg1)
<400> 392
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Arg Ser Asn Trp Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser Ser Val Lys Val
245 250 255
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp Leu His Trp
260 265 270
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile Gly Tyr Ile Asn
275 280 285
Pro Arg Asn Asp Tyr Thr Glu Tyr Asn Gln Asn Phe Lys Asp Lys Ala
290 295 300
Thr Ile Thr Ala Asp Glu Ser Thr Asn Thr Ala Tyr Met Glu Leu Ser
305 310 315 320
Ser Leu Arg Ser Glu Asp Thr Ala Phe Tyr Phe Cys Ala Arg Arg Asp
325 330 335
Ile Thr Thr Phe Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
340 345 350
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
355 360 365
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
370 375 380
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
385 390 395 400
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
405 410 415
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
420 425 430
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
435 440 445
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
450 455 460
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
465 470 475 480
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
485 490 495
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
500 505 510
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
515 520 525
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
530 535 540
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
545 550 555 560
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
565 570 575
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
580 585 590
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
595 600 605
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
610 615 620
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
625 630 635 640
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
645 650 655
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
660 665 670
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680
<210> 393
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL офатумумаба
<400> 393
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 394
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL офатумумаба - CDR1
<400> 394
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 395
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL офатумумаба - CDR2
<400> 395
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 396
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL офатумумаба - CDR3
<400> 396
Gln Gln Arg Ser Asn Trp Pro Ile Thr
1. 5
<210> 397
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH эпратузумаба
<400> 397
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Arg Asn Asp Tyr Thr Glu Tyr Asn Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Ile Thr Ala Asp Glu Ser Thr Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Phe Tyr Phe Cys
85 90 95
Ala Arg Arg Asp Ile Thr Thr Phe Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 398
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH эпратузумаба - CDR1
<400> 398
Ser Tyr Trp Leu His
1. 5
<210> 399
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH эпратузумаба - CDR2
<400> 399
Tyr Ile Asn Pro Arg Asn Asp Tyr Thr Glu Tyr Asn Gln Asn Phe Lys
1. 5 10 15
Asp
<210> 400
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH эпратузумаба - CDR3
<400> 400
Arg Asp Ile Thr Thr Phe Tyr
1. 5
<210> 401
<211> 244
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH офатумумаба-CH1)
<400> 401
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Asn Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys
85 90 95
Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu
100 105 110
Tyr Tyr Cys Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met
115 120 125
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
225 230 235 240
Pro Lys Ser Cys
<210> 402
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH офатумумаба
<400> 402
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 403
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH офатумумаба - CDR1
<400> 403
Asp Tyr Ala Met His
1. 5
<210> 404
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH офатумумаба - CDR2
<400> 404
Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 405
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH офатумумаба - CDR3
<400> 405
Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val
1. 5 10
<210> 406
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL эпратузумаба-hCk)
<400> 406
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser
20 25 30
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Met Ser Cys Lys Ser Ser
35 40 45
Gln Ser Val Leu Tyr Ser Ala Asn His Lys Asn Tyr Leu Ala Trp Tyr
50 55 60
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser
65 70 75 80
Thr Arg Glu Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala
100 105 110
Thr Tyr Tyr Cys His Gln Tyr Leu Ser Ser Trp Thr Phe Gly Gly Gly
115 120 125
Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile
130 135 140
Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val
145 150 155 160
Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys
165 170 175
Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu
180 185 190
Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu
195 200 205
Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr
210 215 220
His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu
225 230 235 240
Cys
<210> 407
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL эпратузумаба
<400> 407
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ala Asn His Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys His Gln
85 90 95
Tyr Leu Ser Ser Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 408
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL эпратузумаба - CDR1
<400> 408
Lys Ser Ser Gln Ser Val Leu Tyr Ser Ala Asn His Lys Asn Tyr Leu
1. 5 10 15
Ala
<210> 409
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL эпратузумаба - CDR2
<400> 409
Trp Ala Ser Thr Arg Glu Ser
1. 5
<210> 410
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL эпратузумаба - CDR3
<400> 410
His Gln Tyr Leu Ser Ser Trp Thr
1. 5
<210> 411
<211> 685
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL патритумаба-hCk-VH
ниволумаба-hCg1(мут.))
<400> 411
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Glu Met Thr Gln Ser Pro Asp Ser
20 25 30
Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser
35 40 45
Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr
50 55 60
Gln Gln Asn Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser
65 70 75 80
Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
100 105 110
Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln
115 120 125
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
130 135 140
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
145 150 155 160
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
165 170 175
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
180 185 190
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
195 200 205
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
210 215 220
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
225 230 235 240
Glu Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro
245 250 255
Gly Arg Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser
260 265 270
Asn Ser Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
275 280 285
Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp
290 295 300
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
305 310 315 320
Leu Phe Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
325 330 335
Tyr Cys Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
340 345 350
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
355 360 365
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
370 375 380
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
385 390 395 400
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
405 410 415
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
420 425 430
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
435 440 445
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
450 455 460
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
465 470 475 480
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
485 490 495
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
500 505 510
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
515 520 525
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
530 535 540
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
545 550 555 560
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
565 570 575
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
580 585 590
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
595 600 605
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
610 615 620
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
625 630 635 640
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
645 650 655
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
660 665 670
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680 685
<210> 412
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба
<400> 412
Asp Ile Glu Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Ser Asn Arg Asn Tyr Leu Ala Trp Tyr Gln Gln Asn Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 413
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR1
<400> 413
Arg Ser Ser Gln Ser Val Leu Tyr Ser Ser Ser Asn Arg Asn Tyr Leu
1. 5 10 15
Ala
<210> 414
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR2
<400> 414
Trp Ala Ser Thr Arg Glu Ser
1. 5
<210> 415
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL патритумаба - CDR3
<400> 415
Gln Gln Tyr Tyr Ser Thr Pro Arg Thr
1. 5
<210> 416
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба
<400> 416
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 417
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR1
<400> 417
Asn Ser Gly Met His
1. 5
<210> 418
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR2
<400> 418
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 419
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR3
<400> 419
Asn Asp Asp Tyr
1
<210> 420
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (Патритумаб -CH1)
<400> 420
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys
20 25 30
Pro Ser Glu Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe
35 40 45
Ser Gly Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro
65 70 75 80
Ser Leu Lys Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln
85 90 95
Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 421
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба
<400> 421
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Glu Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Lys Trp Thr Trp Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 422
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR1
<400> 422
Gly Tyr Tyr Trp Ser
1. 5
<210> 423
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR2
<400> 423
Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1. 5 10 15
<210> 424
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH патритумаба - CDR3
<400> 424
Asp Lys Trp Thr Trp Tyr Phe Asp Leu
1. 5
<210> 425
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VH ниволумаба-hCK)
<400> 425
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 426
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба
<400> 426
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 427
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR1
<400> 427
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 428
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR2
<400> 428
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 429
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR3
<400> 429
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1. 5
<210> 430
<211> 689
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL h1332-hCk-VH 1B12-hCg1)
<400> 430
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
20 25 30
Val Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
35 40 45
Gln Gly Ile Asn Thr Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Lys Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Ala Asn Ser Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val Gln Leu
225 230 235 240
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser Ser Val Lys Val
245 250 255
Ser Cys Lys Thr Ser Gly Asp Thr Phe Ser Ser Tyr Ala Ile Ser Trp
260 265 270
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Gly Ile Ile
275 280 285
Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe Gln Gly Arg Val
290 295 300
Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser
305 310 315 320
Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys Ala Arg Lys Phe
325 330 335
His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val Trp Gly Gln Gly
340 345 350
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
355 360 365
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
370 375 380
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
385 390 395 400
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
405 410 415
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
420 425 430
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
435 440 445
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
450 455 460
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
465 470 475 480
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
485 490 495
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
500 505 510
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
515 520 525
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
530 535 540
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
545 550 555 560
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
565 570 575
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
580 585 590
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
595 600 605
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
610 615 620
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
625 630 635 640
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
645 650 655
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
660 665 670
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
675 680 685
Lys
<210> 431
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL h1332
<400> 431
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asn Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Lys Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 432
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL h1332 - CDR1
<400> 432
Arg Ala Ser Gln Gly Ile Asn Thr Trp Leu Ala
1. 5 10
<210> 433
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL h1332 - CDR2
<400> 433
Ala Ala Ser Ser Leu Lys Ser
1. 5
<210> 434
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL h1332 - CDR3
<400> 434
Gln Gln Ala Asn Ser Phe Pro Leu Thr
1. 5
<210> 435
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12
<400> 435
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Thr Ser Gly Asp Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Arg Ala His Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Lys Phe His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 436
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR1
<400> 436
Ser Tyr Ala Ile Ser
1. 5
<210> 437
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR2
<400> 437
Gly Ile Ile Pro Ile Phe Gly Arg Ala His Tyr
1. 5 10
<210> 438
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 1B12 - CDR3
<400> 438
Lys Phe His Phe Val Ser Gly Ser Pro Phe Gly Met Asp Val
1. 5 10
<210> 439
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH h1332-CH1)
<400> 439
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Gly Phe Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Trp Ile Ser Ala Ser Asn Gly Asn Thr Tyr Tyr Ala
65 70 75 80
Gln Lys Leu Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Val Tyr Ala Asp Tyr Ala Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
130 135 140
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
145 150 155 160
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
165 170 175
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
180 185 190
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
195 200 205
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
210 215 220
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 440
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH h1332
<400> 440
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Gly Phe Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Ser Asn Gly Asn Thr Tyr Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Tyr Ala Asp Tyr Ala Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 441
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH h1332 - CDR1
<400> 441
Ser Tyr Gly Phe Ser
1. 5
<210> 442
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH h1332 - CDR2
<400> 442
Trp Ile Ser Ala Ser Asn Gly Asn Thr Tyr Tyr Ala Gln Lys Leu Gln
1. 5 10 15
Gly
<210> 443
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH h1332 - CDR3
<400> 443
Val Tyr Ala Asp Tyr Ala Asp Tyr
1. 5
<210> 444
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL 1B12-hCK)
<400> 444
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Arg Ser Asn Trp Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
115 120 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
130 135 140
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
145 150 155 160
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
165 170 175
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
195 200 205
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
210 215 220
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 445
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12
<400> 445
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 446
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR1
<400> 446
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 447
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR2
<400> 447
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 448
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 1B12 - CDR3
<400> 448
Gln Gln Arg Ser Asn Trp Pro Thr
1. 5
<210> 449
<211> 681
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL 6A5-hCk-VH
ниволумаба-hCg1(мут.))
<400> 449
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Gly Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Thr Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly
65 70 75 80
Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
85 90 95
Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
100 105 110
Gln Tyr Gly Ser Ser Pro Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Val
225 230 235 240
Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu
245 250 255
Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser Gly Met
260 265 270
His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Val
275 280 285
Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys Gly
290 295 300
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe Leu Gln
305 310 315 320
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Thr
325 330 335
Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
340 345 350
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
355 360 365
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
370 375 380
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
385 390 395 400
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
405 410 415
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
420 425 430
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
435 440 445
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
450 455 460
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
465 470 475 480
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
485 490 495
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
500 505 510
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
515 520 525
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
530 535 540
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
545 550 555 560
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
565 570 575
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
580 585 590
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
595 600 605
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
610 615 620
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
625 630 635 640
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
645 650 655
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
660 665 670
Lys Ser Leu Ser Leu Ser Pro Gly Lys
675 680
<210> 450
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 6A5
<400> 450
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Thr
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 451
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 6A5 - CDR1
<400> 451
Arg Ala Ser Gln Ser Val Ser Ser Thr Tyr Leu Ala
1. 5 10
<210> 452
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 6A5 - CDR2
<400> 452
Gly Ala Ser Ser Arg Ala Thr
1. 5
<210> 453
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 6A5 - CDR3
<400> 453
Gln Gln Tyr Gly Ser Ser Pro Pro Ile Thr
1. 5 10
<210> 454
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба
<400> 454
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 455
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR1
<400> 455
Asn Ser Gly Met His
1. 5
<210> 456
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR2
<400> 456
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 457
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR3
<400> 457
Asn Asp Asp Tyr
1
<210> 458
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH 6A5-CH1)
<400> 458
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys
20 25 30
Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu
35 40 45
Ser Thr Ser Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys
50 55 60
Ala Leu Glu Trp Leu Ala Leu Ile Tyr Trp Asp Asp Asp Lys Arg Tyr
65 70 75 80
Ser Pro Ser Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys
85 90 95
Asn Gln Val Val Leu Thr Met Ala Asn Met Asp Pro Val Asp Thr Ala
100 105 110
Thr Tyr Tyr Cys Ala His Ile Arg Ile Thr Glu Val Arg Gly Val Ile
115 120 125
Ile Ser Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr
130 135 140
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
145 150 155 160
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
165 170 175
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
180 185 190
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
195 200 205
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
210 215 220
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
225 230 235 240
Val Asp Lys Lys Val Glu Pro Lys Ser Cys
245 250
<210> 459
<211> 128
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 6A5
<400> 459
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1. 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Ala Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Ile Arg Ile Thr Glu Val Arg Gly Val Ile Ile Ser Tyr
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 460
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 6A5 - CDR1
<400> 460
Thr Ser Gly Val Gly Val Gly
1. 5
<210> 461
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 6A5 - CDR2
<400> 461
Leu Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Ser Pro Ser Leu Lys Ser
1. 5 10 15
<210> 462
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 6A5 - CDR3
<400> 462
Ile Arg Ile Thr Glu Val Arg Gly Val Ile Ile Ser Tyr Tyr Gly Met
1. 5 10 15
Asp Val
<210> 463
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL ниволумаба-hCK)
<400> 463
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 464
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба
<400> 464
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 465
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR1
<400> 465
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 466
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR2
<400> 466
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 467
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR3
<400> 467
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1. 5
<210> 468
<211> 694
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Длинная цепь (VL ниволумаба-hCk-VH
6A5-hCg1(мут.))
<400> 468
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Ala Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
100 105 110
Ser Ser Asn Trp Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
115 120 125
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gln Ile Thr Leu
225 230 235 240
Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln Thr Leu Thr Leu
245 250 255
Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser Gly Val Gly Val
260 265 270
Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu Ala Leu
275 280 285
Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Ser Pro Ser Leu Lys Ser Arg
290 295 300
Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val Val Leu Thr Met
305 310 315 320
Ala Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala His Ile
325 330 335
Arg Ile Thr Glu Val Arg Gly Val Ile Ile Ser Tyr Tyr Gly Met Asp
340 345 350
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys
355 360 365
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
370 375 380
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
385 390 395 400
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
405 410 415
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
420 425 430
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
435 440 445
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
450 455 460
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
465 470 475 480
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
485 490 495
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
500 505 510
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
515 520 525
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
530 535 540
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
545 550 555 560
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
565 570 575
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
580 585 590
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
595 600 605
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
610 615 620
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
625 630 635 640
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
645 650 655
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
660 665 670
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
675 680 685
Ser Leu Ser Pro Gly Lys
690
<210> 469
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба
<400> 469
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 470
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR1
<400> 470
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1. 5 10
<210> 471
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR2
<400> 471
Asp Ala Ser Asn Arg Ala Thr
1. 5
<210> 472
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL ниволумаба - CDR3
<400> 472
Gln Gln Ser Ser Asn Trp Pro Arg Thr
1. 5
<210> 473
<211> 128
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 6A5
<400> 473
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1. 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Ala Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Ile Arg Ile Thr Glu Val Arg Gly Val Ile Ile Ser Tyr
100 105 110
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 474
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 6A5 - CDR1
<400> 474
Thr Ser Gly Val Gly Val Gly
1. 5
<210> 475
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 6A5 - CDR2
<400> 475
Leu Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Ser Pro Ser Leu Lys Ser
1. 5 10 15
<210> 476
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH 6A5 - CDR3
<400> 476
Ile Arg Ile Thr Glu Val Arg Gly Val Ile Ile Ser Tyr Tyr Gly Met
1. 5 10 15
Asp Val
<210> 477
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 1 (VH ниволумаба-CH1)
<400> 477
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe
35 40 45
Ser Asn Ser Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Phe Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val
115 120 125
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
130 135 140
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
145 150 155 160
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
165 170 175
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
180 185 190
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
195 200 205
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
210 215 220
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235
<210> 478
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба
<400> 478
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 479
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR1
<400> 479
Asn Ser Gly Met His
1. 5
<210> 480
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR2
<400> 480
Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val Lys
1. 5 10 15
Gly
<210> 481
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VH ниволумаба - CDR3
<400> 481
Asn Asp Asp Tyr
1
<210> 482
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Короткая цепь 2 (VL 6A5-hCK)
<400> 482
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys Glu Ile Val Leu Thr Gln Ser Pro Gly Thr
20 25 30
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
35 40 45
Gln Ser Val Ser Ser Thr Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly
65 70 75 80
Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
85 90 95
Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
100 105 110
Gln Tyr Gly Ser Ser Pro Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 483
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 6A5
<400> 483
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Thr
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Pro Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 484
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 6A5 - CDR1
<400> 484
Arg Ala Ser Gln Ser Val Ser Ser Thr Tyr Leu Ala
1. 5 10
<210> 485
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 6A5 - CDR2
<400> 485
Gly Ala Ser Ser Arg Ala Thr
1. 5
<210> 486
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> VL 6A5 - CDR3
<400> 486
Gln Gln Tyr Gly Ser Ser Pro Pro Ile Thr
1. 5 10
<210> 487
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> лидерная последовательность
<400> 487
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1. 5 10 15
Phe Pro Gly Ser Arg Cys
20
<210> 488
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> лидерная последовательность
<400> 488
Met Glu Phe Gly Leu Ser Trp Leu Phe Leu Val Ala Ile Leu Lys Gly
1. 5 10 15
Val Gln Cys
<210> 489
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерная последовательность
<400> 489
Gly Gly Gly Ser
1
<210> 490
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 490
Ser Gly Gly Gly
1
<210> 491
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 491
Gly Gly Gly Gly Ser
1. 5
<210> 492
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 492
Gly Gly Gly Gly Ser Gly Ser
1. 5
<210> 493
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 493
Gly Gly Gly Gly Ser Gly Gly Ser
1. 5
<210> 494
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 494
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1. 5 10
<210> 495
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 495
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1. 5 10 15
<210> 496
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 496
Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg
1. 5 10 15
<210> 497
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 497
Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg
1. 5 10 15
Val
<210> 498
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 498
Ala Lys Thr Thr Pro Lys Leu Gly Gly
1. 5
<210> 499
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 499
Ser Ala Lys Thr Thr Pro Lys Leu Gly Gly
1. 5 10
<210> 500
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 500
Ser Ala Lys Thr Thr Pro
1. 5
<210> 501
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 501
Arg Ala Asp Ala Ala Pro
1. 5
<210> 502
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 502
Arg Ala Asp Ala Ala Pro Thr Val Ser
1. 5
<210> 503
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 503
Arg Ala Asp Ala Ala Ala Ala Gly Gly Pro Gly Ser
1. 5 10
<210> 504
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 504
Arg Ala Asp Ala Ala Ala Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly
1. 5 10 15
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 505
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 505
Ser Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala
1. 5 10 15
Arg Val
<210> 506
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 506
Ala Asp Ala Ala Pro
1. 5
<210> 507
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 507
Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
1. 5 10
<210> 508
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 508
Thr Val Ala Ala Pro
1. 5
<210> 509
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 509
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
1. 5 10
<210> 510
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 510
Gln Pro Lys Ala Ala Pro
1. 5
<210> 511
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 511
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro
1. 5 10
<210> 512
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 512
Ala Lys Thr Thr Pro Pro
1. 5
<210> 513
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 513
Ala Lys Thr Thr Pro Pro Ser Val Thr Pro Leu Ala Pro
1. 5 10
<210> 514
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 514
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro
1. 5 10
<210> 515
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 515
Ala Ser Thr Lys Gly Pro
1. 5
<210> 516
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 516
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
1. 5 10
<210> 517
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 517
Gly Glu Asn Lys Val Glu Tyr Ala Pro Ala Leu Met Ala Leu Ser
1. 5 10 15
<210> 518
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 518
Gly Pro Ala Lys Glu Leu Thr Pro Leu Lys Glu Ala Lys Val Ser
1. 5 10 15
<210> 519
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкерная последовательность
<400> 519
Gly His Glu Ala Ala Ala Val Met Gln Val Gln Tyr Pro Ala Ser
1. 5 10 15
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЧЕТЫРЕХВАЛЕНТНЫЕ СИММЕТРИЧНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2019 |
|
RU2807346C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ НА ОСНОВЕ ПСЕВДО-FAB | 2019 |
|
RU2820254C2 |
| РЕКОМБИНАНТНАЯ CORYNEBACTERIUM GLUTAMICUM ДЛЯ ЭФФЕКТИВНОГО СИНТЕЗА ВЫСОКООЧИЩЕННОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ И ЕЕ ОЛИГОСАХАРИДОВ | 2019 |
|
RU2823305C1 |
| ВЫСОКОАФФИННЫЕ АНТИ-PD-1 И АНТИ-LAG-3 АНТИТЕЛА И ПОЛУЧЕННЫЕ ИЗ НИХ БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2782381C2 |
| АНТАГОНИСТЫ NGF ДЛЯ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2829812C2 |
| ИММУНОГЛОБУЛИН С ТАНДЕМНЫМ РАСПОЛОЖЕНИЕМ FAB-ФРАГМЕНТОВ И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2769133C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| ВАРИАНТЫ IgG-FC ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2814952C2 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
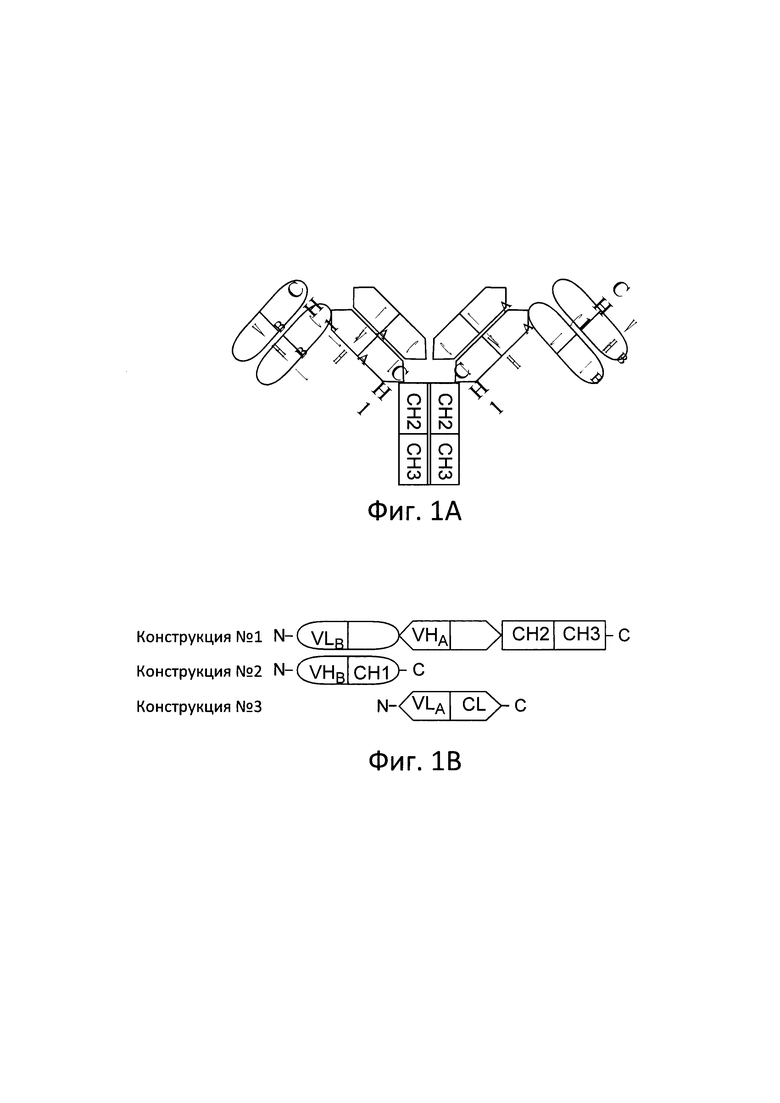


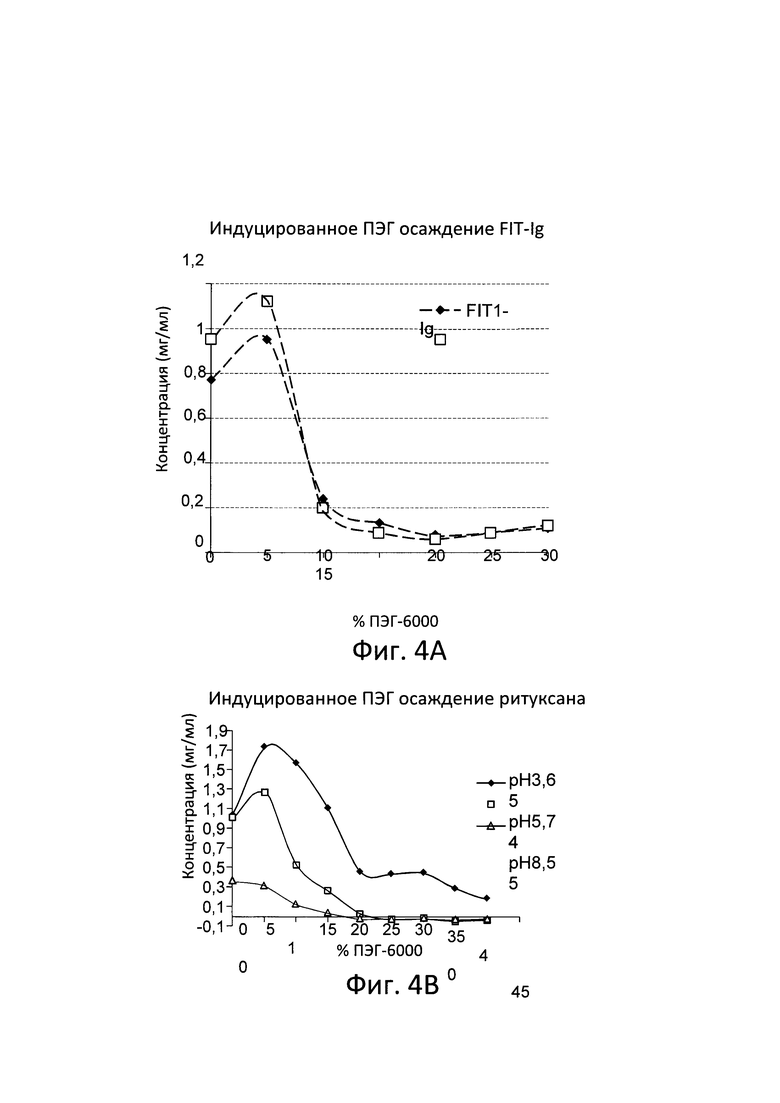

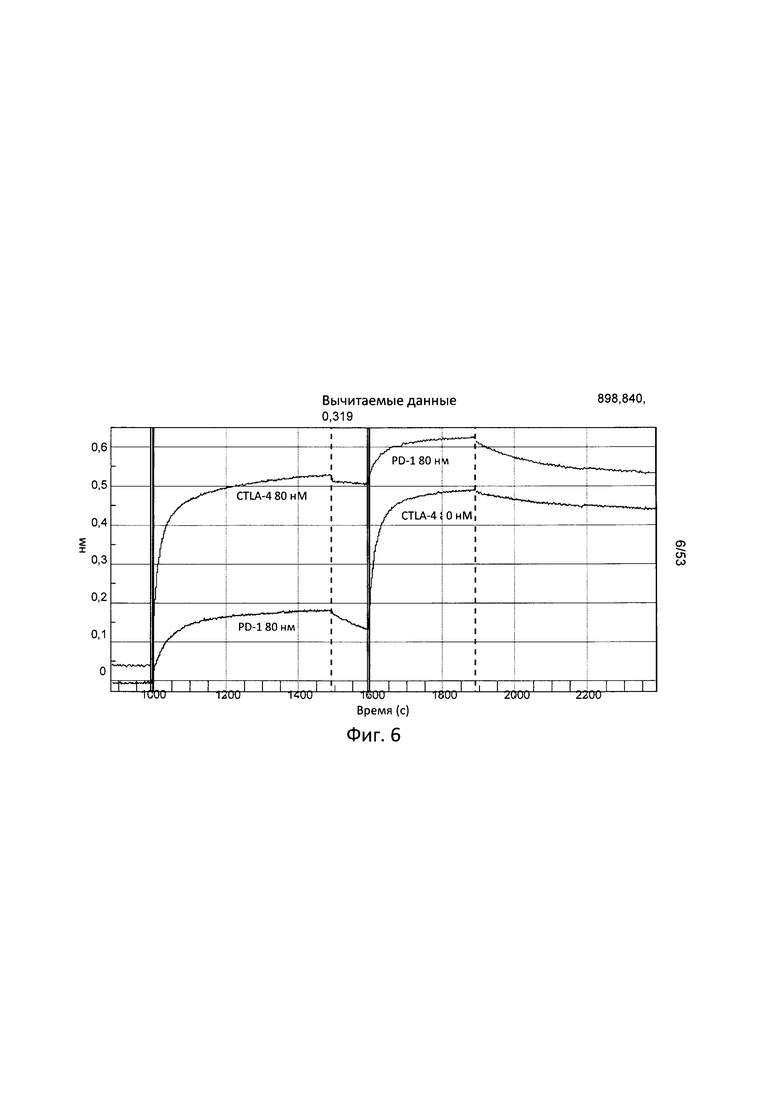




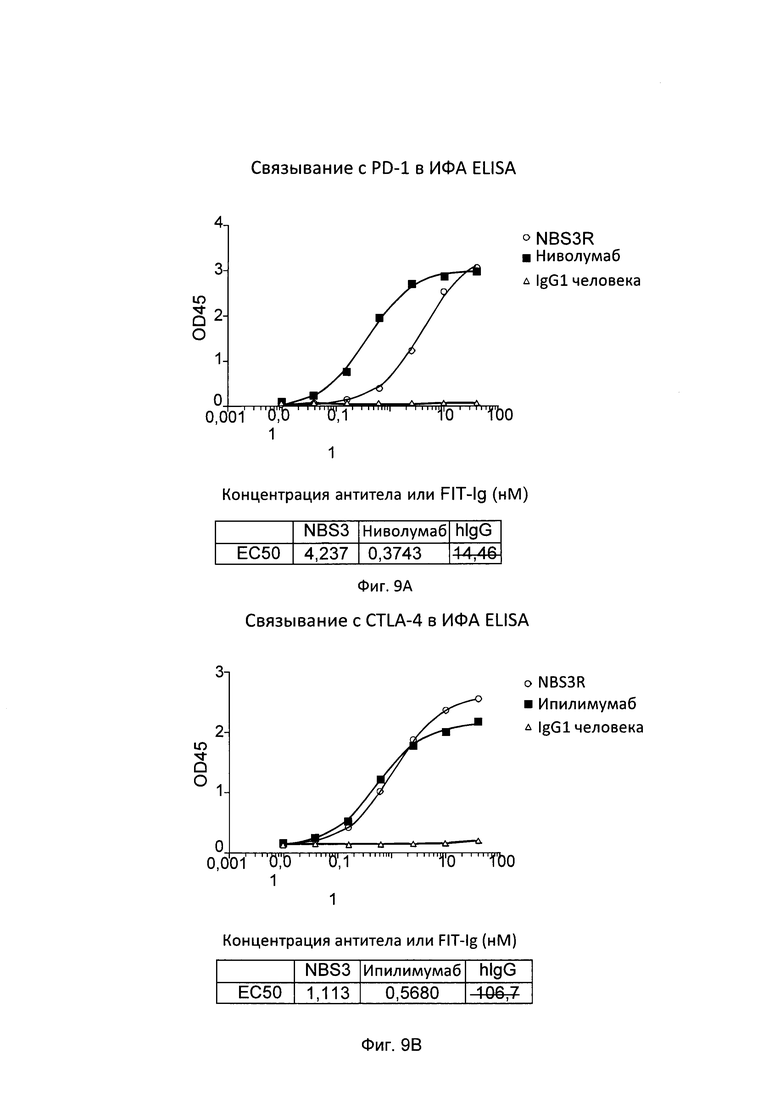

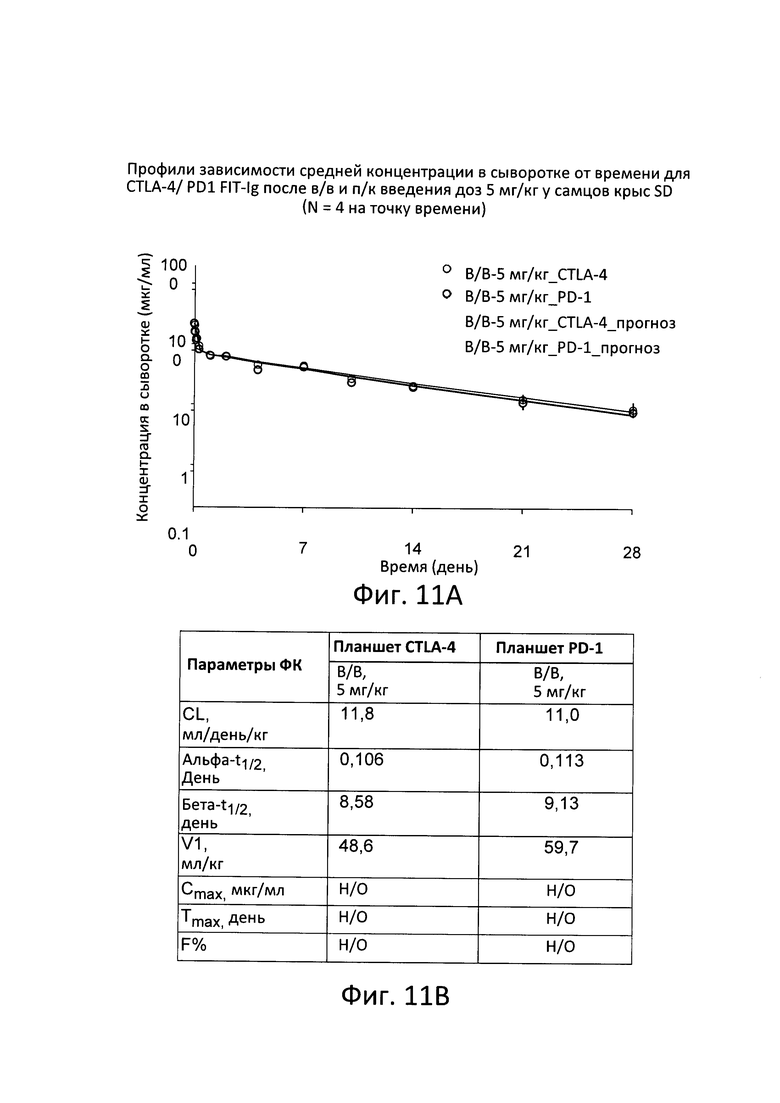
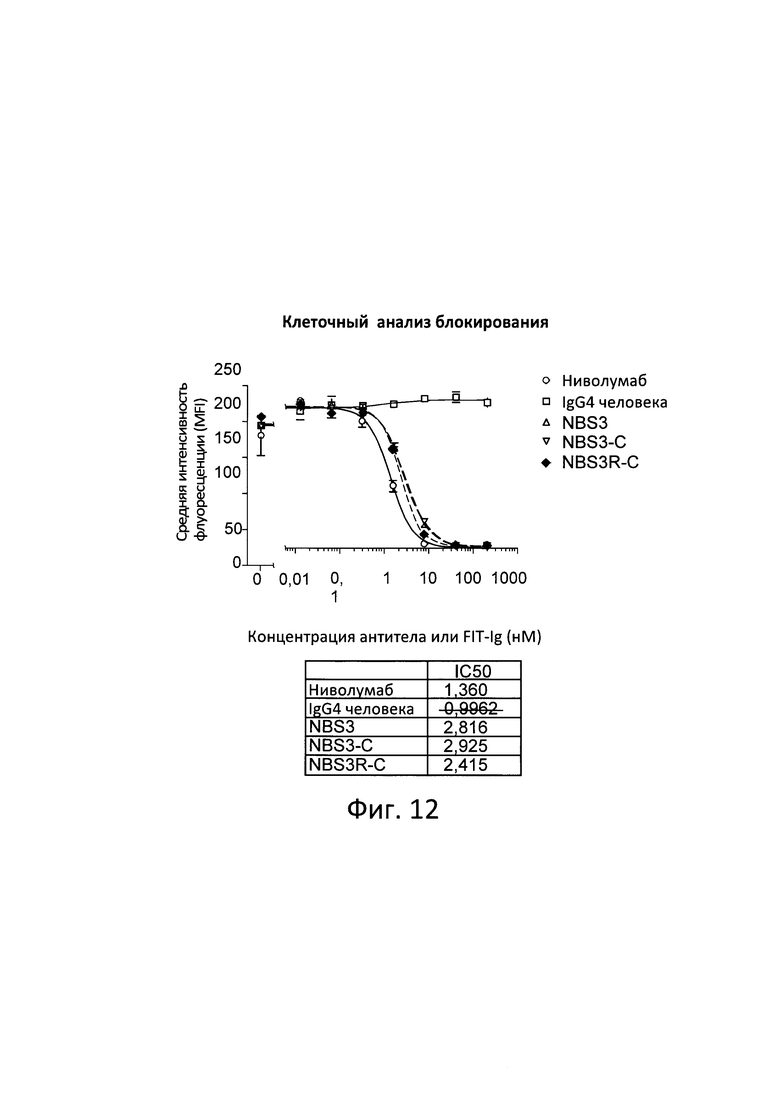
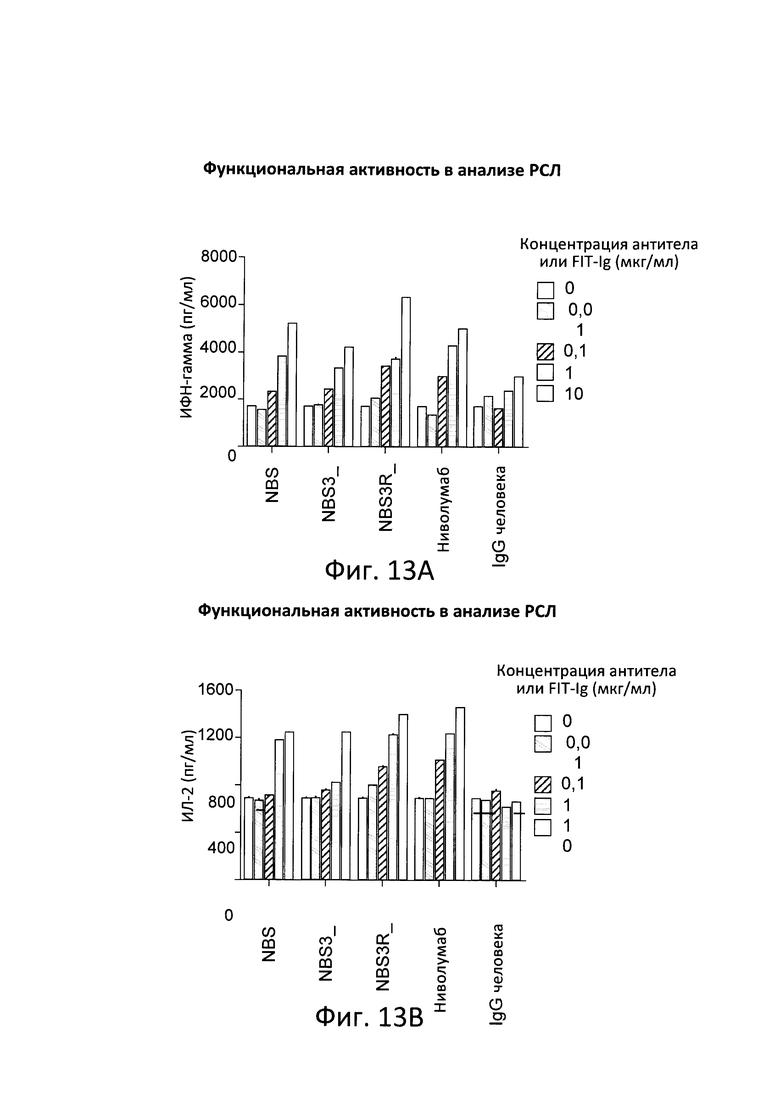
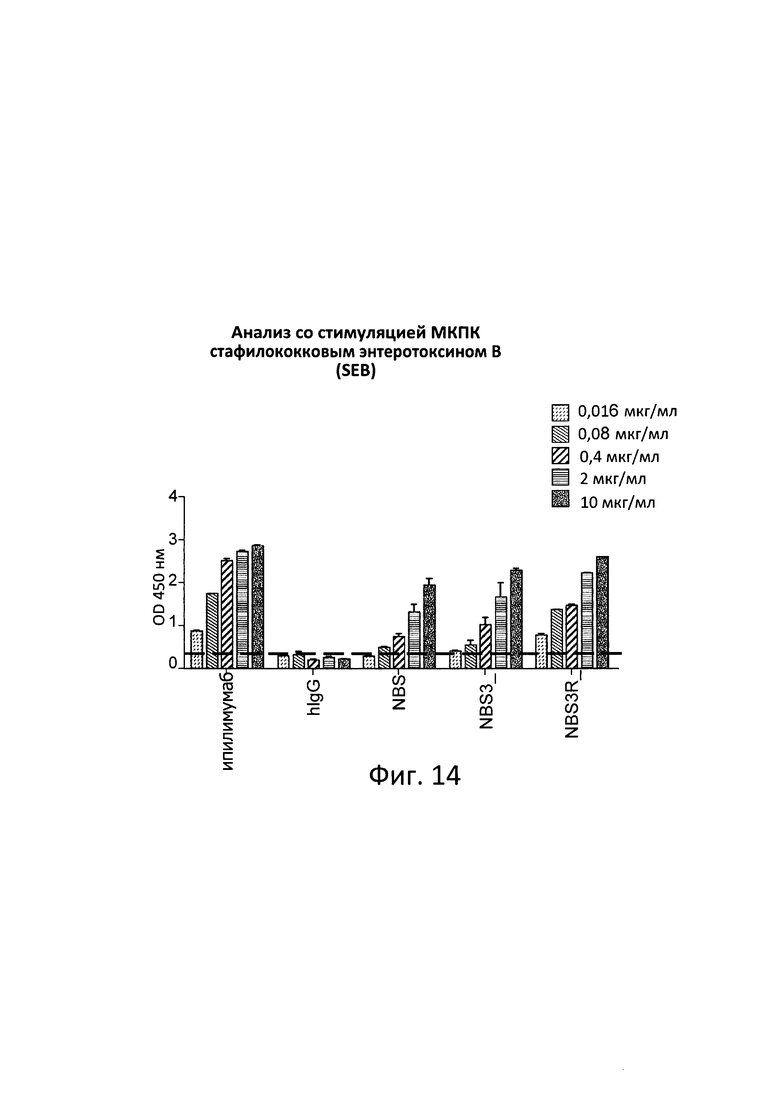
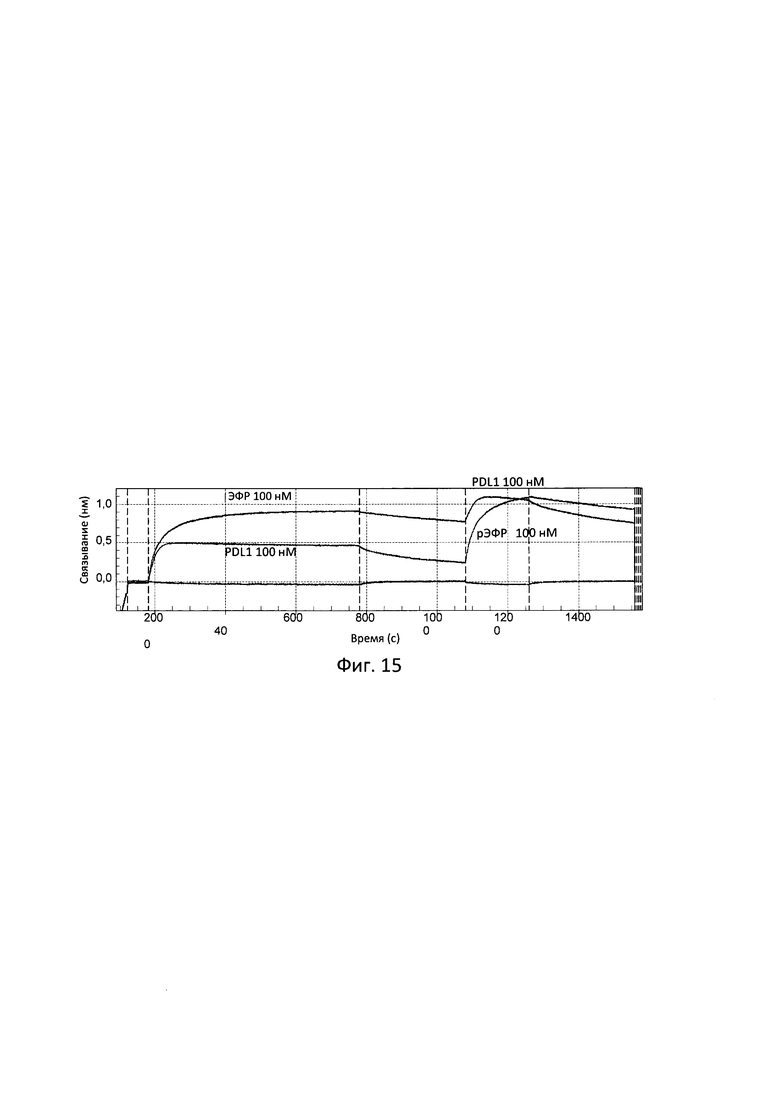

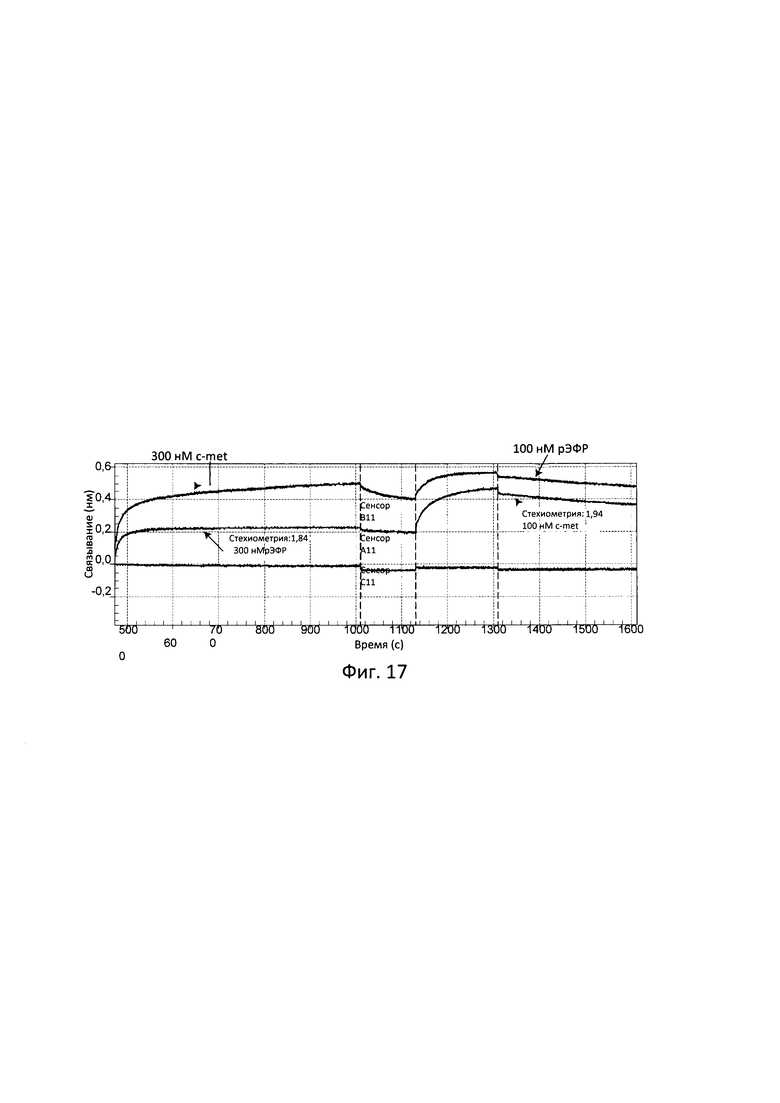
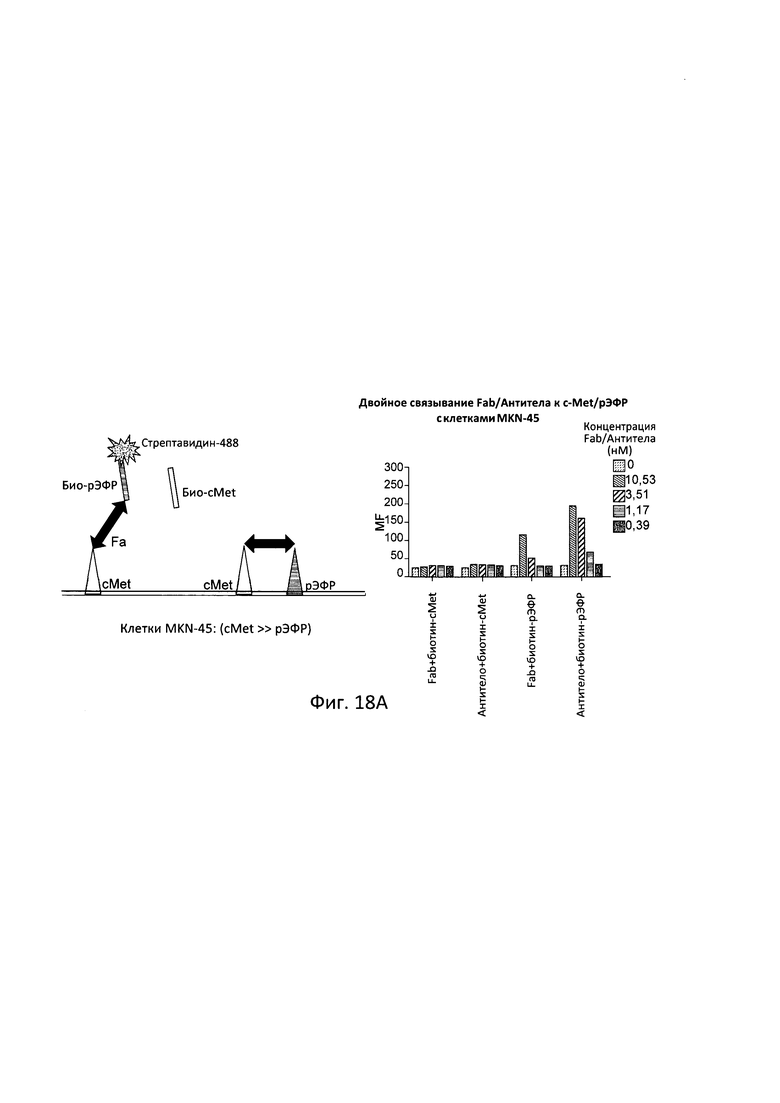
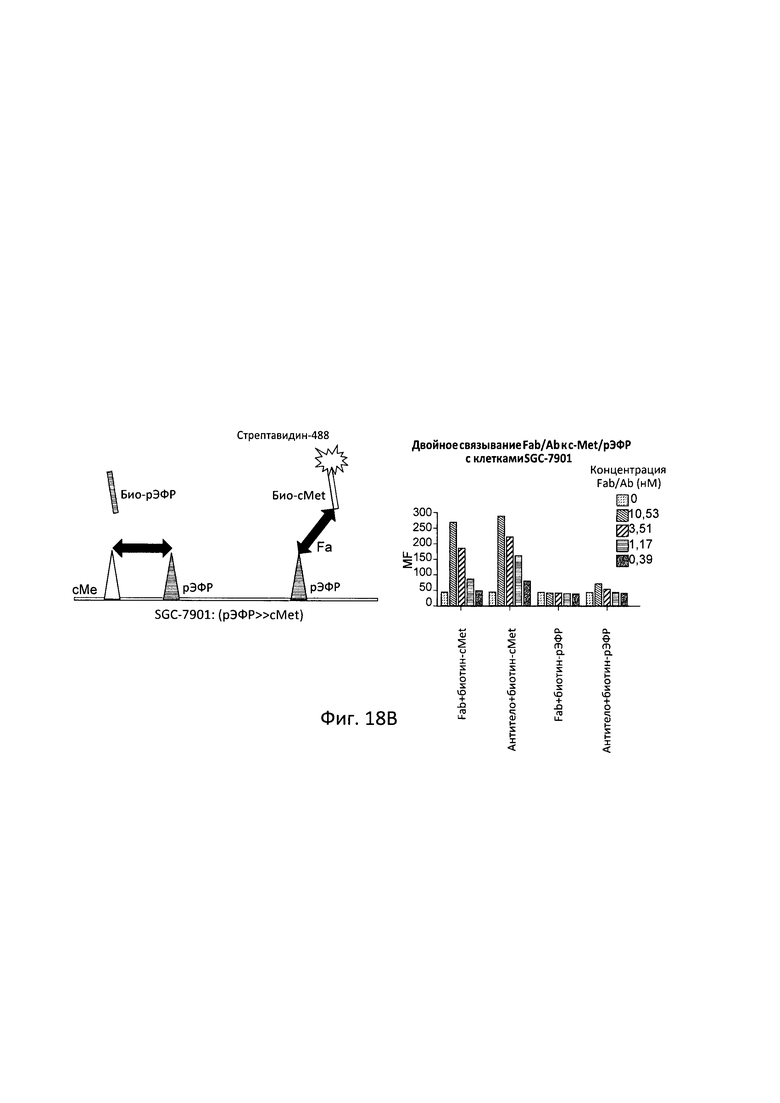
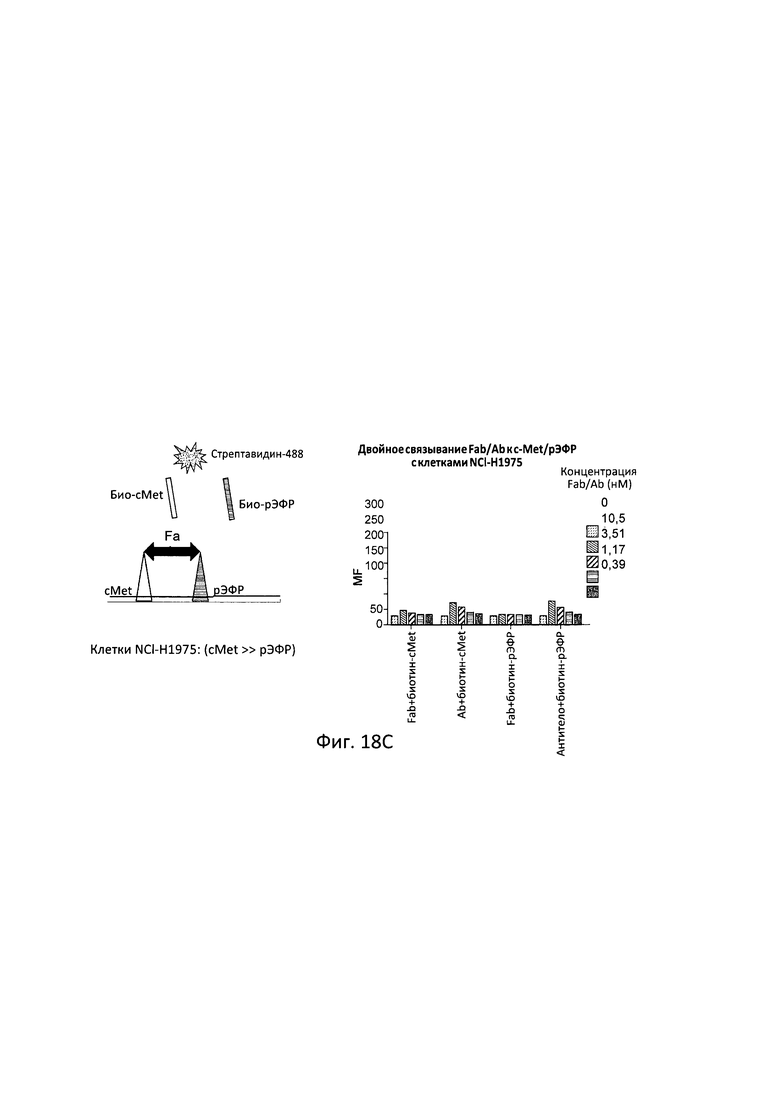
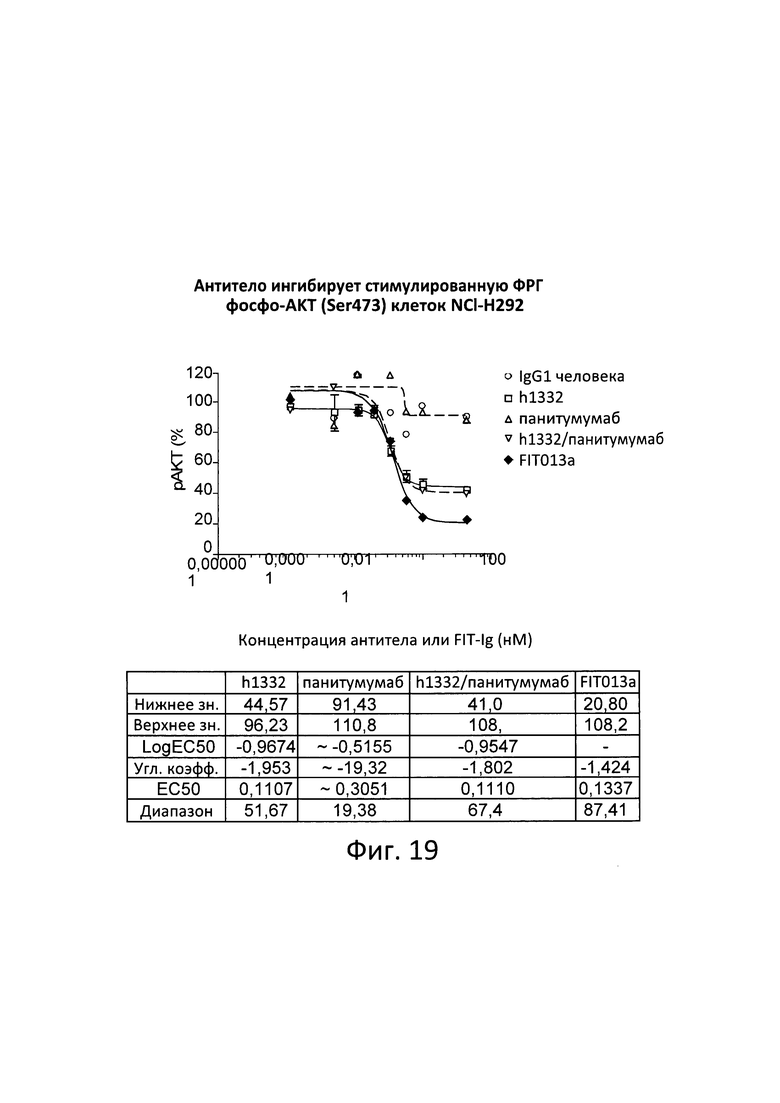
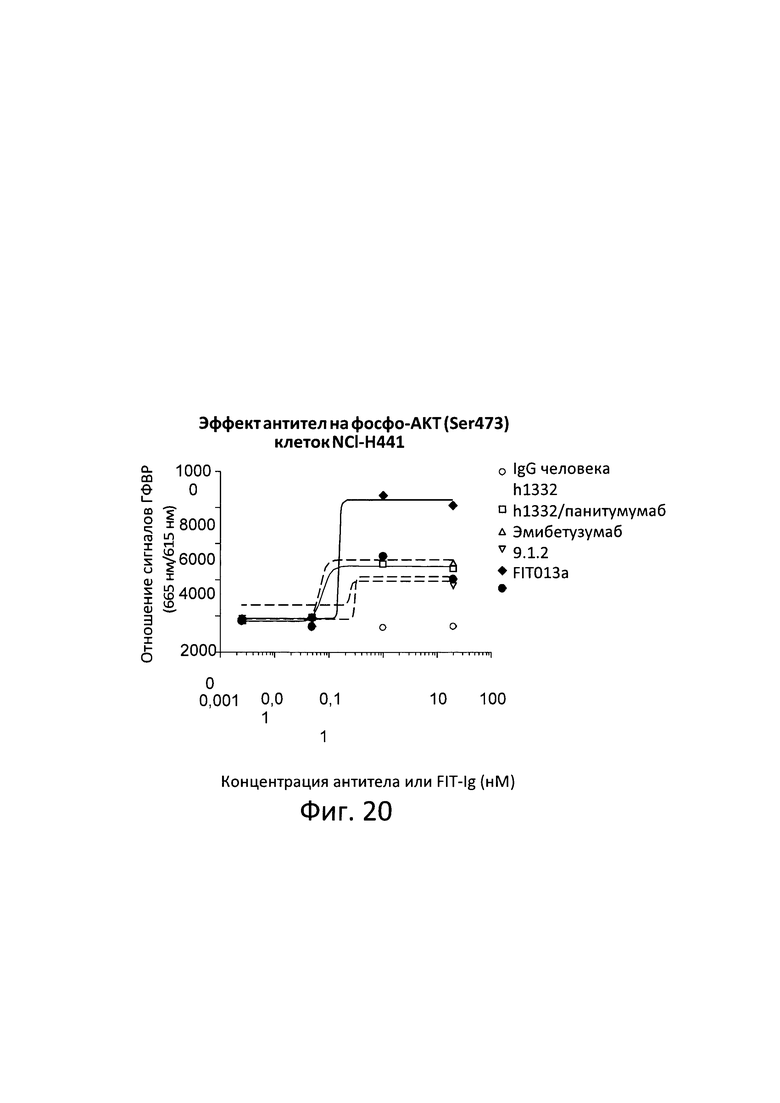
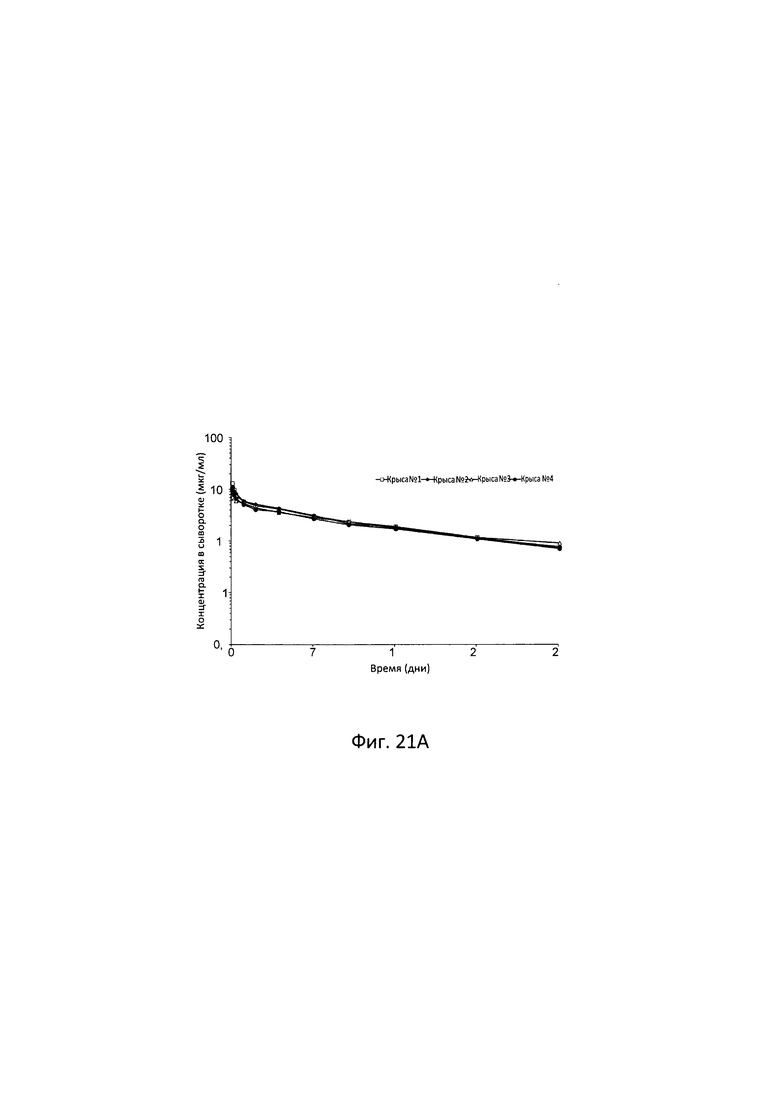
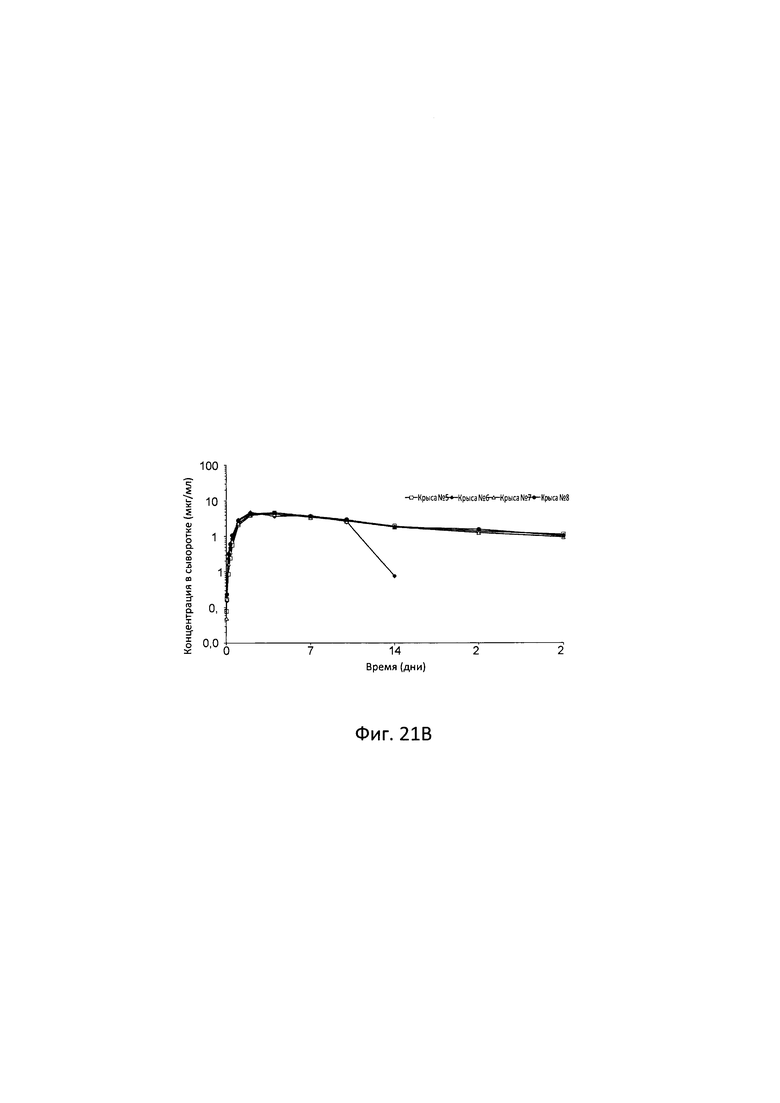

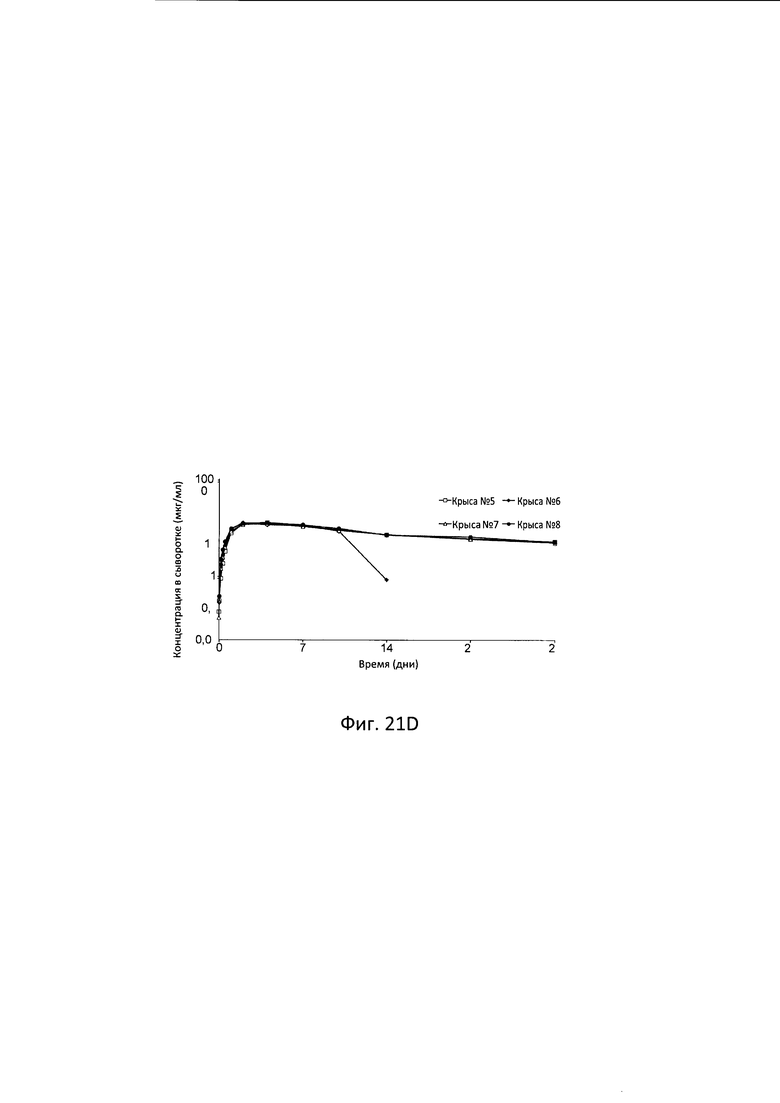



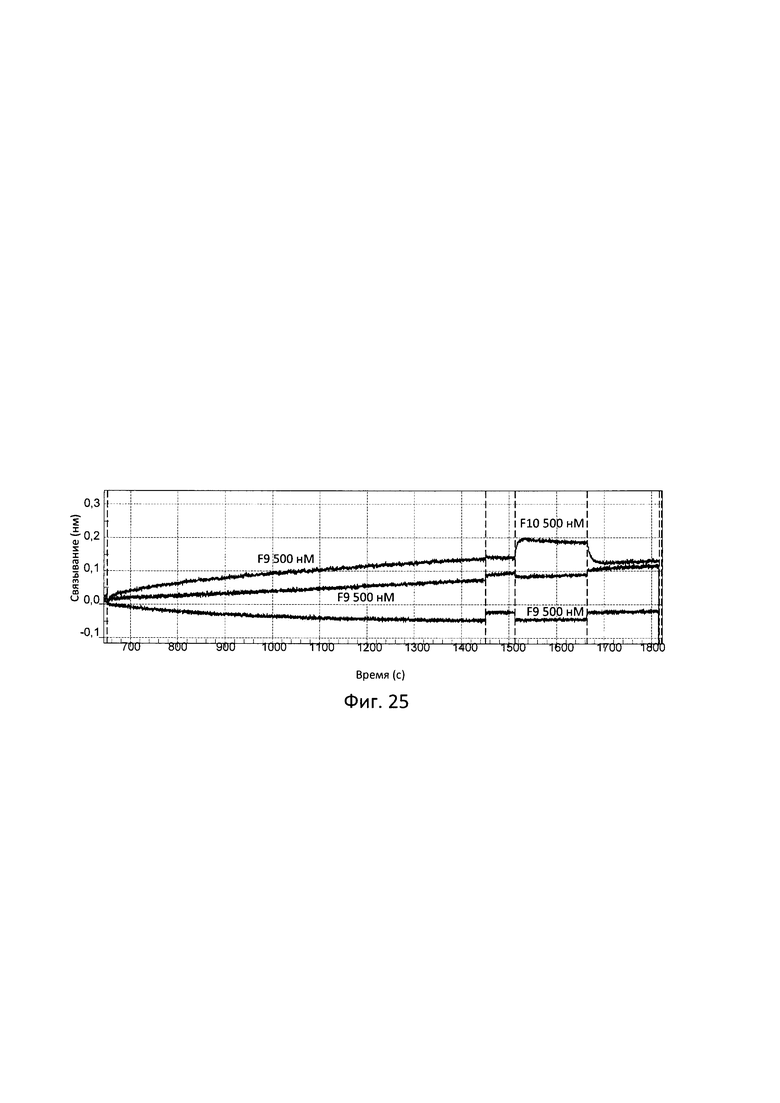

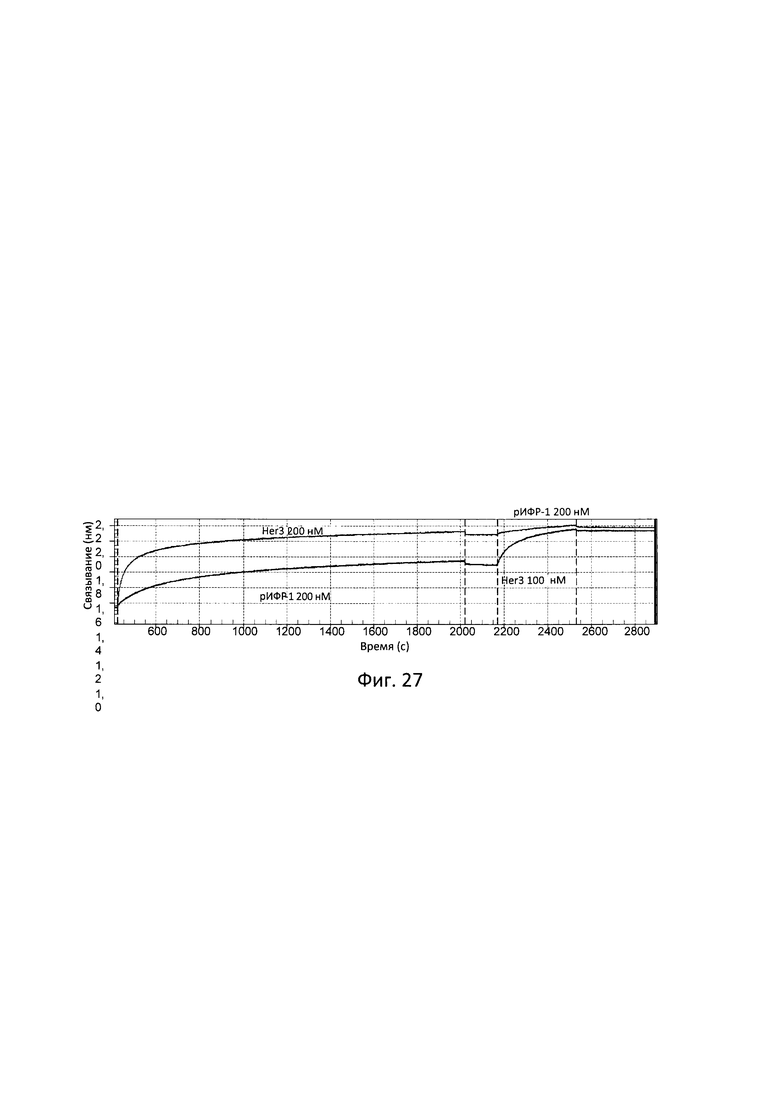
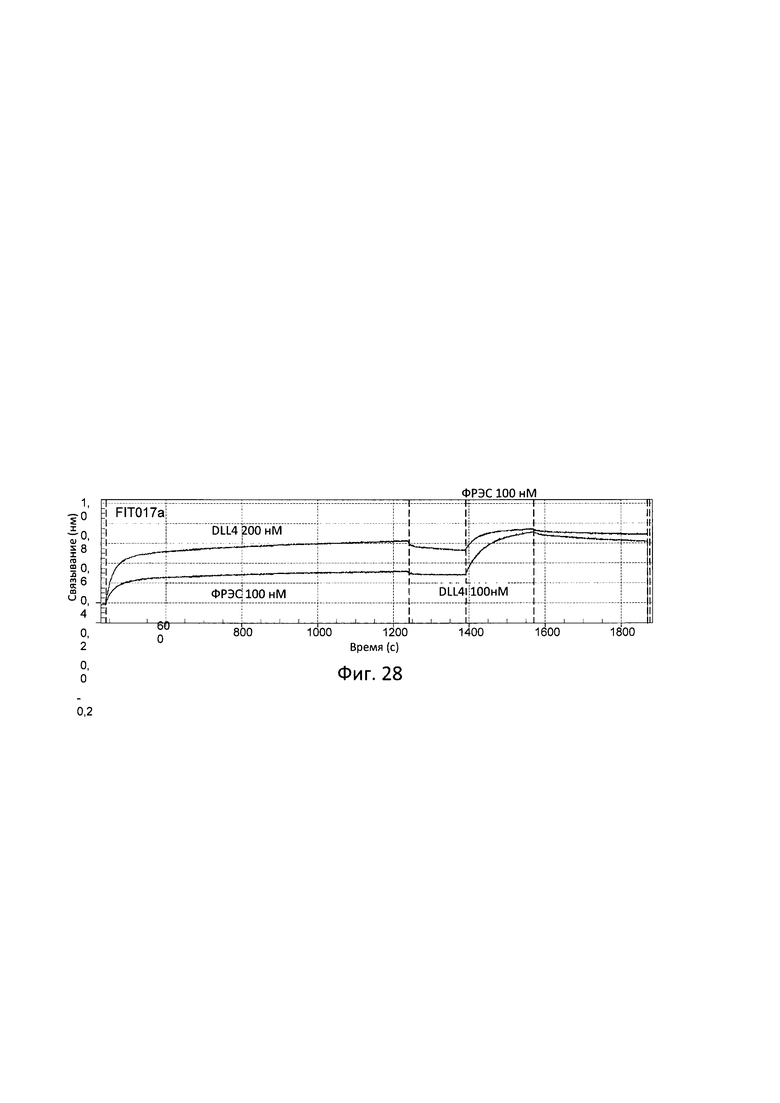
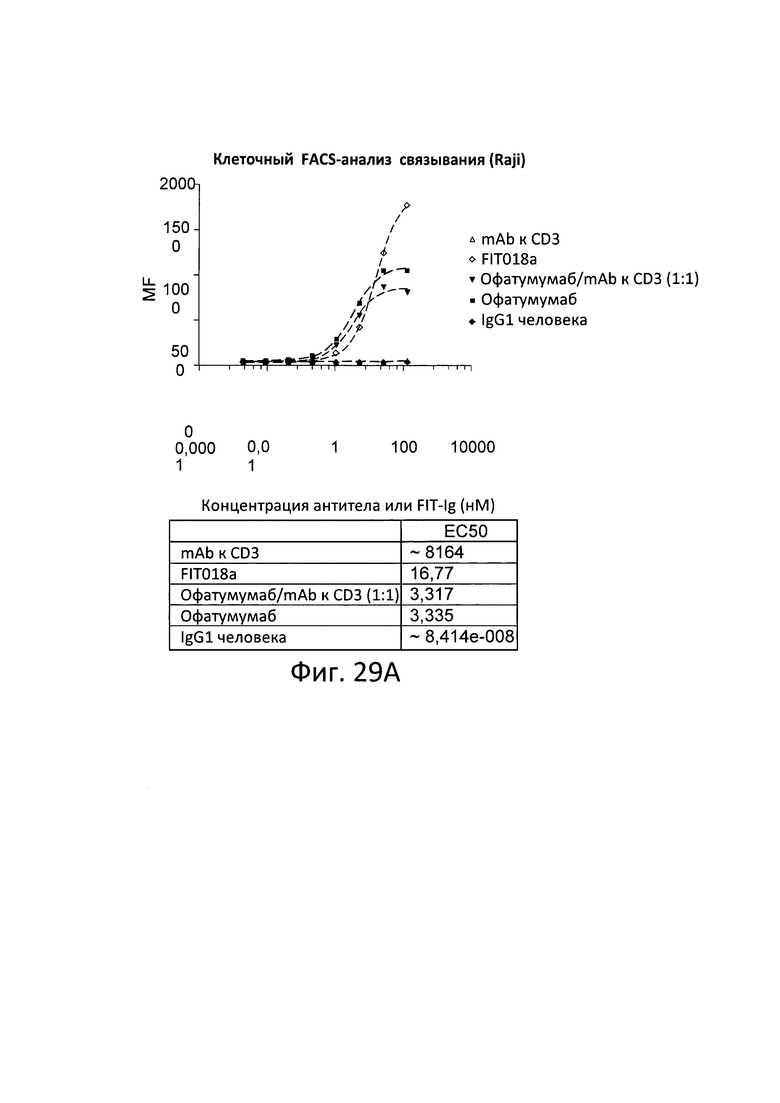
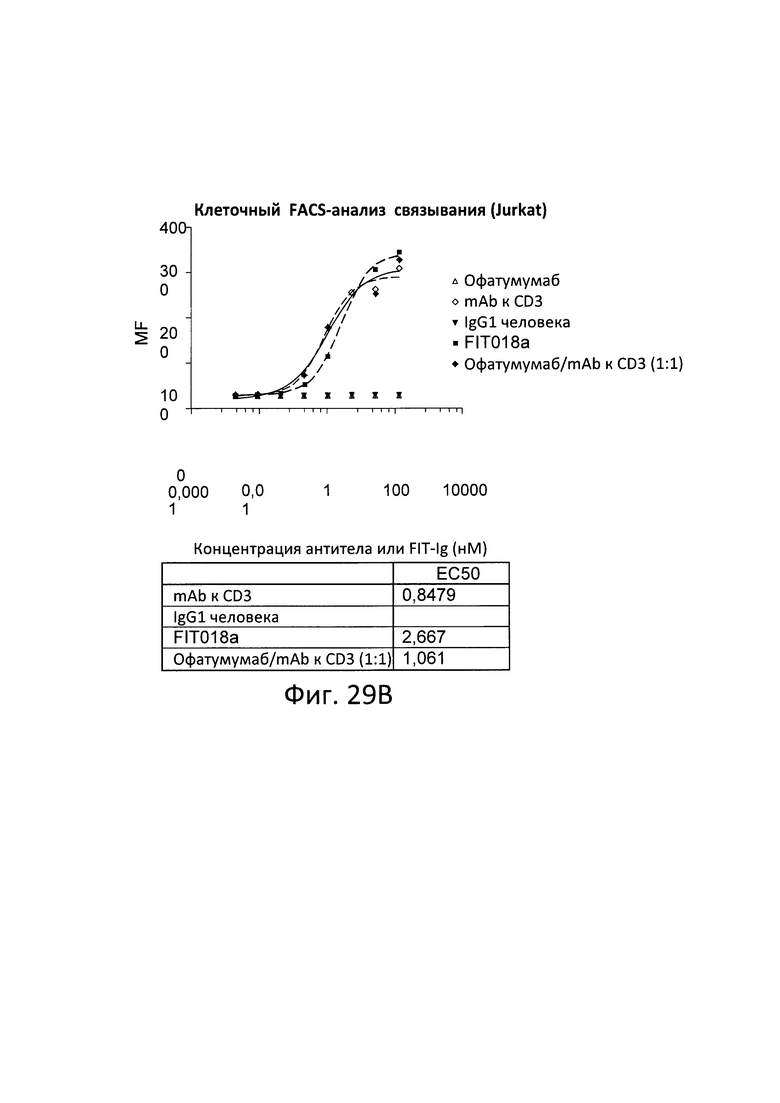
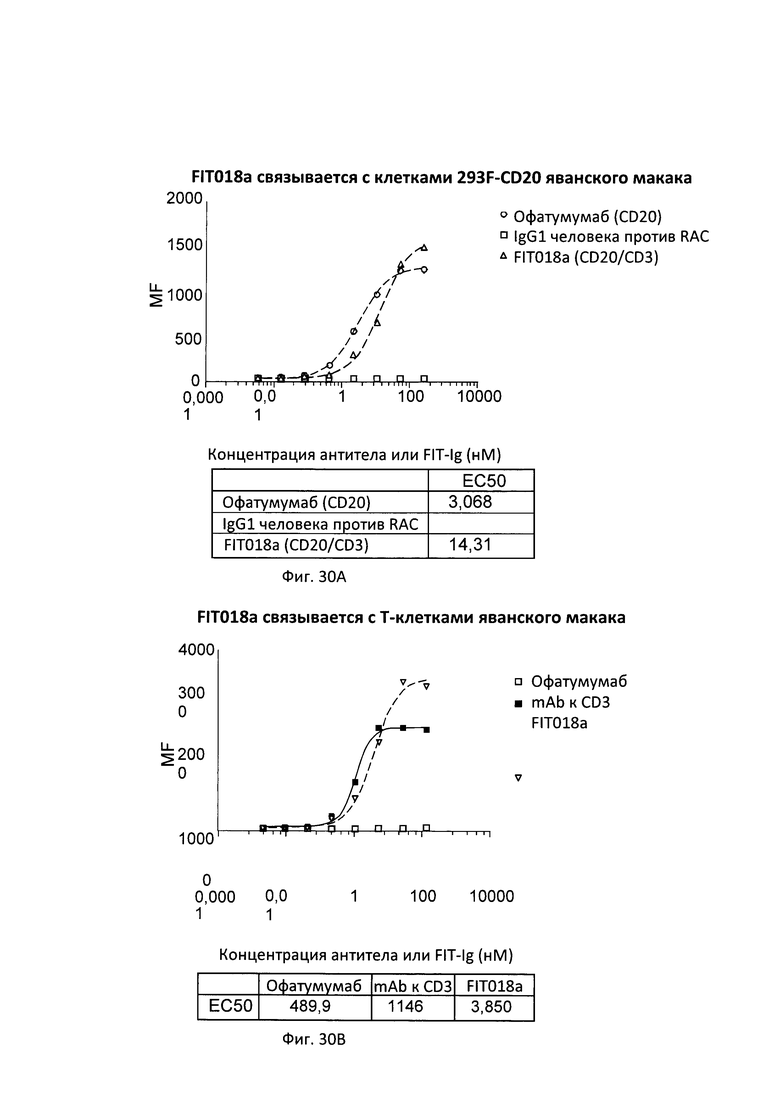
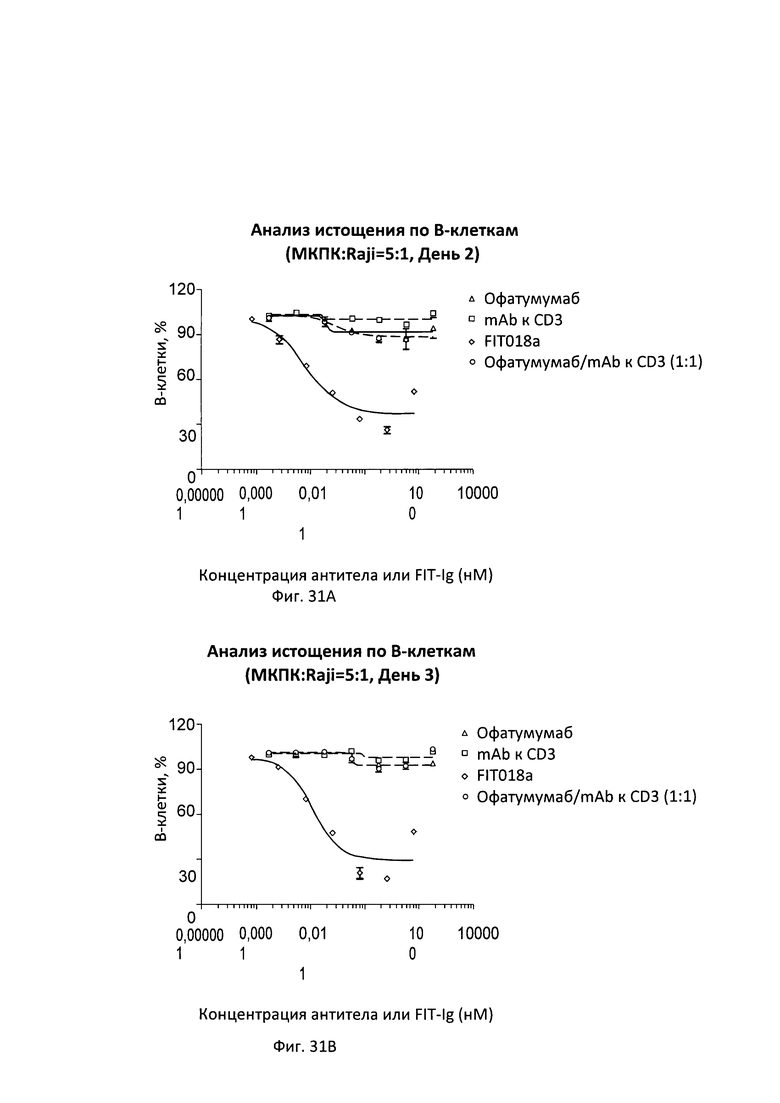

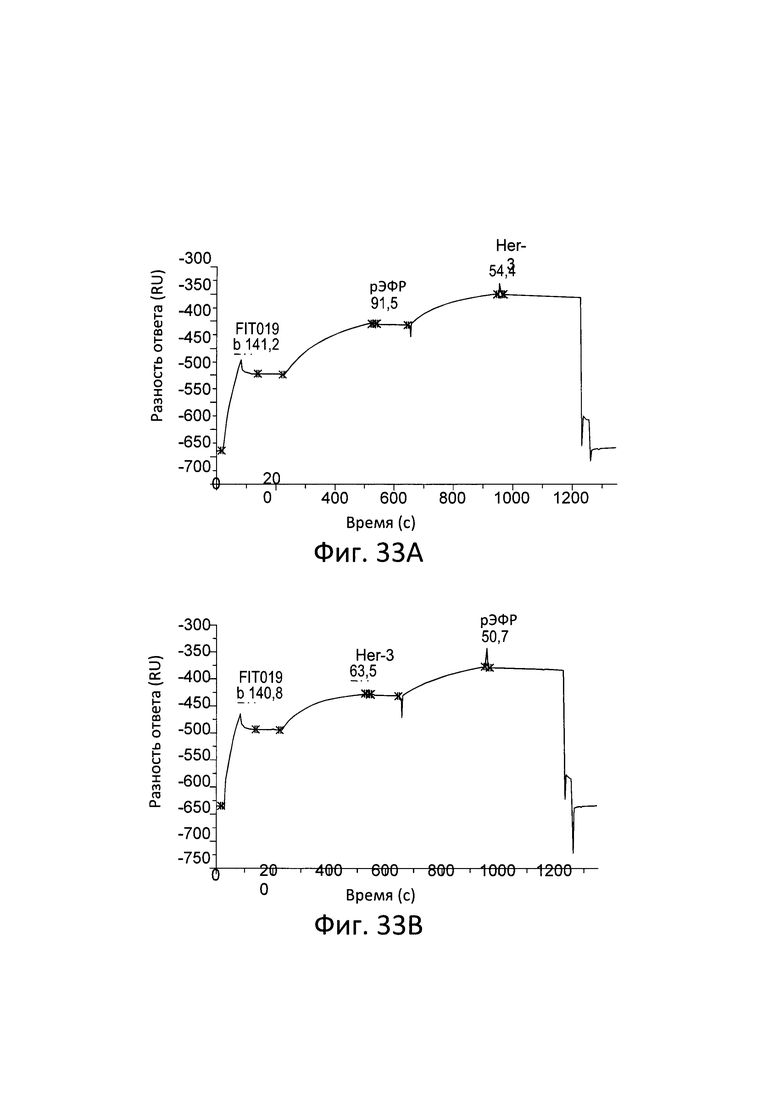





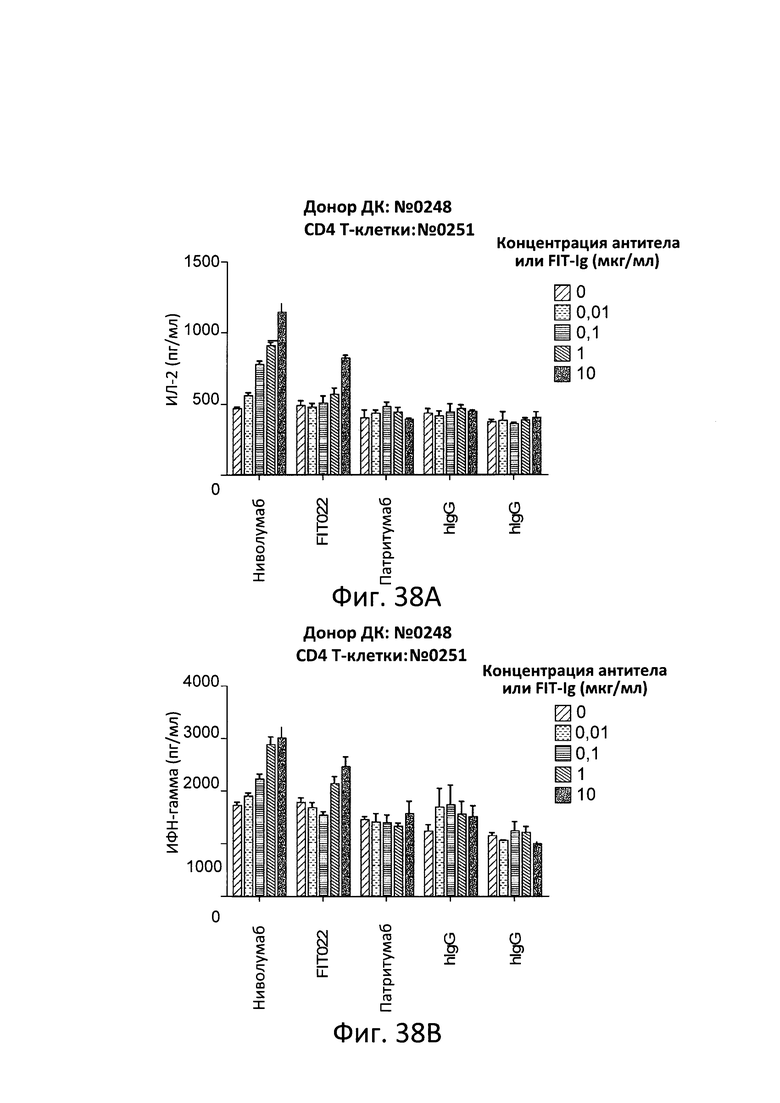
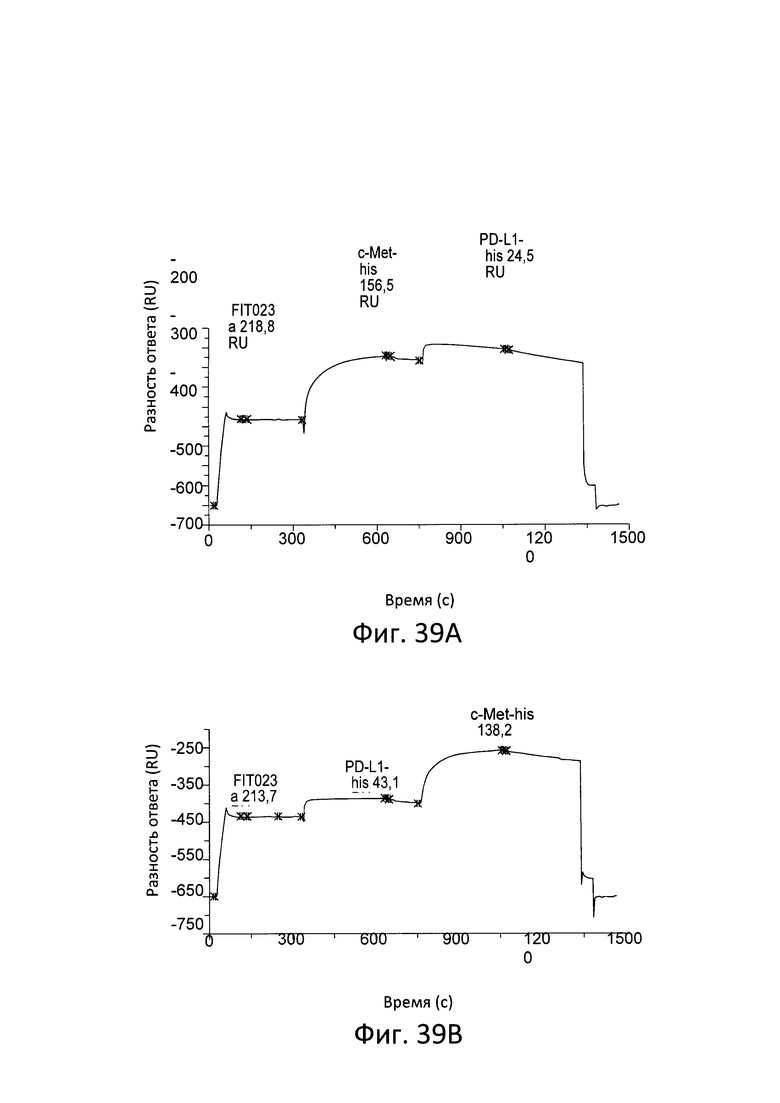
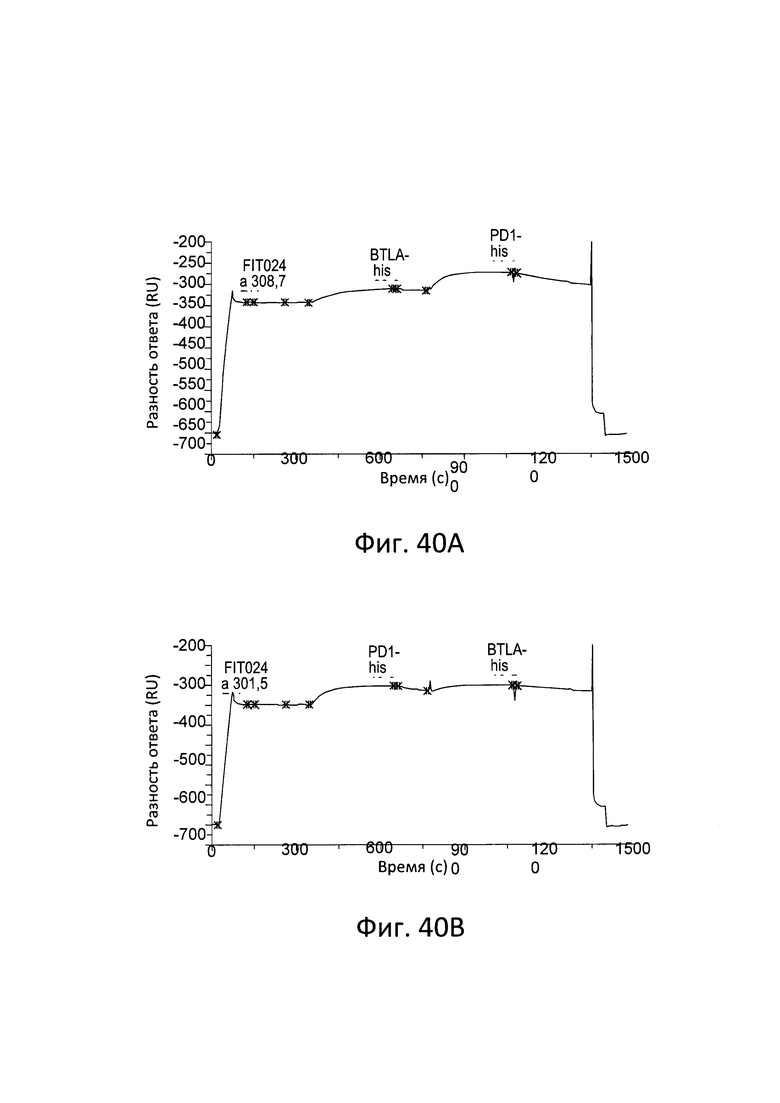


Заявленное изобретение относится к биспецифическим связывающим белкам, связывающим два антигена и содержащим три полипептидных цепи. Также изобретение относится к фармацевтической композиции для лечения или предотвращения рака, ассоциированного с cMet и/или EGFR, и способу лечения или предотвращения рака с использованием вышеуказанной композиции. 4 н. и 2 з.п. ф-лы, 18 пр., 42 ил., 73 табл.
1. Биспецифический связывающий белок, связывающий антиген А и антиген В, содержащий три полипептидных цепи,
при этом первая полипептидная цепь содержит в направлении от амино конца к карбоксильному концу или (1) VLA-CL-VHB-CH1-Fc; или (2) VHB-CH1-VLA-CL-Fc, где VLA представляет собой вариабельный домен легкой цепи антитела первого исходного антитела, которое связывает антиген A, CL представляет собой константный домен легкой цепи антитела, VHB представляет собой вариабельный домен тяжелой цепи антитела из второго исходного антитела, которое связывает антиген В, и СН1 представляет собой первый константный домен тяжелой цепи антитела, и где между вариабельными доменами и константными доменами нет вставленных линкеров;
указанная вторая полипептидная цепь содержит, в направлении от амино конца к карбоксильному концу, VHA-CH1, где VHA представляет собой вариабельный домен тяжелой цепи первого исходного антитела, которое связывает антиген А, и СН1 представляет собой первый константный домен тяжелой цепи антитела, где между VHA и СН1 нет вставленного линкера; и
указанная третья полипептидная цепь содержит, в направлении от амино конца к карбоксильному концу, VLB-CL, где VLB представляет собой вариабельный домен легкой цепи второго исходного антитела, которое связывает антиген В, и CL представляет собой константный домен легкой цепи антитела, где между VLB и CL нет вставленного линкера;
где две из указанных первых полипептидных цепей, две из указанных вторых полипептидных цепей и две из указанных третьих полипептидных цепей способны ассоциироваться с образованием биспецифического, тетравалентного связывающего белка, содержащего шесть полипептидных цепей, имеющих четыре функциональных связывающих Fab звена;
причем указанный биспецифический связывающий белок связывает антигены А и В, где А представляет собой cMet и В представляет собой EGFR, и содержит вариабельные домены VLA, VHa, VLb, и VHb, содержащие последовательности аминокислот для каждой из трех последовательностей CDR (CDR-1, CDR-2, CDR-3), где:

2. Биспецифический связывающий белок по п. 1, отличающийся тем, что указанный биспецифический связывающий белок связывает антигены А и В и содержит домены VLA, VHA, VLB и VHB, содержащие последовательность аминокислот для VLA, VHA, VLB и V/Нв, где:

3. Биспецифический связывающий белок по п. 2, отличающийся тем, что указанный связывающий белок связывает антигены А и В и содержит первую, вторую и третью полипептидную цепи, имеющие последовательности аминокислот, представленные ниже:

4. Связывающий белок с одной или более консервативными заменами аминокислот в связывающем белке по любому из пп. 1-3, обладающий активностью, эквивалентной соответствующему связывающему белку по пп. 1-3 без консервативных замен аминокислот.
5. Фармацевтическая композиция для лечения или предотвращения рака, ассоциированного с cMet и/или EGFR, содержащая связывающий белок по любому из пп. 1-3 и фармацевтически приемлемый носитель.
6. Способ лечения или предотвращения рака, ассоциированного с cMet и/или EGFR, у нуждающегося в этом субъекта, включающий введение указанному субъекту эффективного количества фармацевтической композиции по п. 5.
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| CASTOLDI R et al | |||
| "A novel bispecific EGFR/Met antibody blocks tumor-promoting phenotypic effects induced by resistance to EGFR inhibition and has potent antitumor activity", 2013, Oncogene, Vol | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Приспособление для обмолачивания льна | 1925 |
|
SU5593A1 |
| БРЕДЕР ВВ и др | |||
| "Панитумумаб (вектибикс) в терапии химиорезистентного метастатического рака толстой | |||
Авторы
Даты
2022-03-17—Публикация
2017-02-06—Подача