Настоящее изобретение относится к антигенсвязывающим белкам, содержащим новый CD3-связывающий сайт. В частности, настоящее изобретение относится к мультиспецифичным антигенсвязывающим белкам. Указанный новый CD3-связывающий сайт содержит гуманизированные домены VH и VL.
Антиген CD3 ассоциирован с комплексом рецептора Т-лимфоцитов на Т-лимфоцитах. Мультиспецифичные антигенсвязывающие белки, обладающие специфичностью к CD3 и антигену клетки-мишени, могут запускать цитотоксическую активность Т-лимфоцитов в отношении клеток-мишеней. То есть, посредством мультиспецифичного связывания антигенсвязывающего белка с CD3 и с клеткой-мишенью, например, клеткой опухоли, может вызываться лизис клетки. Антигенсвязывающие белки с CD3-связывающим сайтом и их получение известны в технике (и описаны, например, у Kipriyanov et al., 1999, Journal of Molecular Biology 293:41-56, Le Gall et al., 2004, Protein Engineering, Design & Selection, 17/4:357-366).
Кроме антител, получаемых из квадрогибридомы, был разработан широкий спектр форм фрагментов мультиспецифичных рекомбинантных антител. Одна конкретная форма фрагментов поливалентных, и необязательно мультиспецифичных антител называется «тандемными диателами» (TandAb®), поскольку их конструкция основана на межмолекулярном спаривании вариабельных доменов VH и VL двух разных полипептидов, как описано для диател (Holliger et al., 1993, Proc. Natl. Acad. Sci. USA, 90:6444-6448). Описанные антитела биспецифичны и обладают специфичностью к антигену опухоли и CD3. В отличие от двухвалентных тандемов scFv-scFv (scFv)2 тандемные диатела четырехвалентны, поскольку они содержат четыре антигенсвязывающих сайта. Тандемные диатела не содержат константных доменов иммуноглобулинов. Сообщалось, что тандемные диатела обладают такими преимуществами, как высокое сродство, более высокая авидность, более низкая скорость выведения, и проявляют благоприятный уровень эффективности in vitro и in vivo (Kipriyanov et al. J. Mol. Biol. (1999) 293, 41- 56 и Kipriyanov Meth. Mol. Biol. (2009) 562, 177-193).
Такие биспецифичные диатела могут образовывать связь между клеткой опухоли (например, клеткой хронического лимфолейкоза В-лимфоцитов) и CD3-T-лимфоцитом иммунной системы человека, способствуя уничтожению клетки опухоли. Прочное связывание клетки опухоли с Т-лимфоцитом вызывает разрушение клетки опухоли. Хотя было показано, что такие тандемные диатела эффективны при применении в лечебных целях, например, для терапевтических концепций при лечении опухолей, остается потребность в улучшенных антигенсвязывающих молекулах.
Чтобы облегчить токсикологическую оценку рекрутиующих Т-лимфоциты фрагментов мультиспецифичных антител у нечеловекообразных приматов (НЧП) в ходе доклинической разработки, желательно получить перекрестно-реагирующий CD3-связывающий домен.
Для гуманизации был выбран IgG мыши клон SP34 (EMBO J. 1985. 4(2):337-344; J. Immunol. 1986, 137(4):1097-100; J. Exp. Med. 1991, 174:319-326; J. Immunol. 1991, 147(9):3047-52), который связывается с CD3ε человека и яванской макаки.
Хотя гуманизация посредством введения CDR (гипервариабельного участка) VH из иммуноглобулина мыши в наиболее гомологичный каркасный участок VH человека (VH3_72 человека) приводил к сохранению функции молекулы, введение CDR VL из иммуноглобулина мыши в каркасную область VL человека с наивысшей гомологией (vλ7_7a человека) неожиданно приводило либо к плохой экспрессии тандемных диател, либо к образованию тандемных диател, не способных распознавать CD3.
Следовательно, цель настоящего изобретения состоит в получении CD3-связывающих доменов с функциональным спариванием VL/VH, хорошей стабильностью, хорошим уровнем экспрессии и другими биофизическими свойствами.
Данная проблема была разрешена посредством заявленного предмета изобретения.
Было показано, что функционального спаривания VL/VH можно достичь при применении другого каркасного участка VL из иммуноглобулина человека. Неожиданно замена каркасного участка VL из λ-цепи иммуноглобулина мыши на каркасный участок VL κ-цепи иммуноглобулина человека (Vκ1_39 человека) приводило к связыванию белка с более высоким сродством связывания CD3, способностью к экспрессии и цитотоксической активностью в отношении лизиса клеток-мишеней, индуцируемого биспецифичными тандемными диателами. Но такие молекулы обладали более слабой стабильностью и другими биофизическими свойствами. На следующем этапе было показано, что аминокислоты в положениях VH111 и VL49 (которые напрямую контактируют друг с другом согласно модели) критичны для свойств связывания и стабильности данного CD3-связывающего сайта, например, в молекуле биспецифичного антитела, в частности мультимерных антигенсвязывающих белках, таких как, например, диатела или тандемные диатела. Мутации в VH111 с введением Y или Н, а также добавление мутации в VL49, при которой G заменена на А, неожиданно приводят к образованию связывающих доменов с улучшенными свойствами стабильности, и при этом сохраняются исходное сродство связывания и/или цитотоксичность. Для данных белков может наблюдаться улучшенная 7-дневная стабильность при 40°С, в частности, когда они экспрессируются в форме димерных тандемных диател. Кроме того, указанные клоны демонстрируют повышенное содержание правильно димеризованных тандемных диател, а также улучшенное восстановление.
Таким образом, согласно одному аспекту настоящего изобретения предложен антигенсвязывающий белок, содержащий по меньшей мере один CD3-связывающий сайт, причем указанный CD3-связывающий сайт содержит:
(a) вариабельный домен тяжелой цепи (VH), выбранный из VH, представленных в SEQ ID NO:6, 7, 8 или 9, и вариабельный домен легкой цепи (VL), выбранный из VL, представленных в SEQ ID NO: 1, 2, 3 или 4 или
(b) вариабельный домен тяжелой цепи (VH) с последовательностью, идентичной по меньшей мере на 95% VH, представленной в SEQ ID №:8, причем аминокислотным остатком в положении 111 является Y или Н, и вариабельный домен легкой цепи (VL), с последовательностью, идентичной по меньшей мере на 95%, VL, представленной в SEQ ID №:3, причем аминокислотным остатком в положении 49 является G или А; или
(c) вариабельный домен тяжелой цепи (VH), включающий от 1 до 5 консервативных аминокислотных замен по сравнению с VH, представленной в SEQ ID №:8, причем аминокислотным остатком в положении 111 является Y или Н, и вариабельный домен легкой цепи (VL), включающий от 1 до 5 консервативных аминокислотных замен по сравнению с VL, представленной в SEQ ID №:3, причем аминокислотным остатком в положении 49 является G или А.
Согласно определенным вариантам реализации указанный антигенсвязывающий белок, содержащий по меньшей мере один CD3-связывающий сайт согласно определению, данному выше, не является биспецифичным связывающим белком, который специфически связывается с CD33 человека и CD3 человека, причем CD3-связывающий сайт содержит по меньшей мере один вариабельный домен тяжелой цепи антитела и по меньшей мере один вариабельный домен легкой цепи, образующие антигенсвязывающий сайт для CD3 человека, и указанный анти-CD3 вариабельный домен легкой цепи выбран из группы, состоящей из SEQ ID №:1-3, а указанный анти-CD3 вариабельный домен тяжелой цепи выбран из группы, состоящей из SEQ ID №:6-8. Согласно конкретным вариантам реализации указанный антигенсвязывающий белок не является биспецифичным тандемным диателом, которое связывается с CD33 и CD3, причем указанный нти-CD3 вариабельный домен легкой цепи выбран из группы, состоящей из SEQ ID №:1-3, а указанный анти-CD3 вариабельный домен тяжелой цепи выбран из группы, состоящей из SEQ ID №:6-8. Такие биспецифичные CD33- и CD3-связывающие белки раскрываются в PCT/US 2015/038666, поданной 30 июня 2015 г., и Заявке на патент США №14/642,497, поданной 9 марта 2015 г., в которых испрашивается приоритет Заявки на патент США №62/019795, поданной 1 июля 2014 г., Заявки на патент США №62/111470, поданной 3 февраля 2015 г. Согласно дополнительным вариантам реализации настоящего изобретения антигенсвязывающий белок, содержащий по меньшей мере один CD3-связывающий сайт согласно определению, данному выше, не является биспецифичным связывающим белком, который специфически связывается с CD33 человека и CD3 человека.
Термин «антигенсвязывающий белок» относится к производному иммуноглобулина с антигенсвязывающими свойствами, т.е. полипептидам-иммуноглобулинам или их фрагментам, которые содержат антигенсвязывающий сайт. Указанный связывающий белок содержит вариабельные домены антитела или его фрагмента. Каждый антигенсвязывающий сайт образован вариабельным доменом тяжелой цепи (VH) антитела, т.е., иммуноглобулина, и вариабельным доменом легкой цепи антитела (VL), связывающимися с одним и тем же эпитопом, тогда как вариабельный домен тяжелой цепи (VH) содержит три гипервариабельных участка (CDR) тяжелой цепи: CDR1, CDR2 и CDR3. В отдельных случаях связывающий белок согласно некоторым вариантам реализации настоящего изобретения не содержит константных доменов иммуноглобулина. В отдельных случаях вариабельные домены тяжелой и легкой цепи, образующие антигенсвязывающий сайт, ковалентно связаны друг с другом, например, посредством пептидного линкера, или в других случаях вариабельные домены тяжелой и легкой цепи нековалентно связаны друг с другом, образуя антигенсвязывающий сайт. Термин «антигенсвязывающий белок» относится также к моноклональным антителам классов IgA, IgD, IgE, IgG или IgM и фрагментам антител или производным антител, включая, например, фрагменты Fab, Fab', F(ab')2, Fv, одноцепочечное Fv, тандемное одноцепочечное Fv ((scFv)2), диатело, флекситело (WO 03/025018) и тандемное диатело (TandAb®)(Kipriyanov et al., 1999, J. Mol. Biol, 293:41-56; Cochlovius et al, 2000, Cancer Res., 60:4336-4341; Reusch et al., 2004, Int. J. Cancer, 112:509-518, Kipriyanov, 2009, Methods Mol Biol, 562:177-93; McAleese and Eser, 2012, Future Oncol. 8:687-95). «TandAb» является торговой маркой компании «Affimed Therapeutics», применяемым для обозначения тандемного диатела. В контексте настоящего изобретения «TandAb» и тандемное диатело применяются как синонимы.
Согласно определенным вариантам реализации CD3-связывающий сайт содержит VH, причем каркасный участок VH получен из каркасного участка VH3_72 иммуноглобулина человека, а каркасный участок VL получен из Vκ1_39 иммуноглобулина человека. Согласно конкретному варианту реализации указанный CD3-связывающий сайт содержит VH, выбранный из VH, представленных в SEQ ID №:8 или 9, a VL выбран из VL, представленных в SEQ ID №:3 или 4. В некоторых случаях указанный CD3-связывающий сайт содержит (i) VH, представленную в SEQ ID №:8, и VL, представленную в SEQ ID №:3, или (ii) VH, представленную в SEQ ID №:9, и VL, представленную в SEQ ID №:4. Согласно альтернативным вариантам реализации указанные домены тяжелой и легкой цепи включают гомологи или варианты последовательностей, описанных в настоящей заявке и специфически связывающихся с CD3. Согласно некоторым вариантам реализации последовательность VL или VH для CD3 сходна, но не идентичная по аминокислотной последовательности последовательностям SEQ ID №:3 или 8, в которых (i) аминокислотный остаток в положении VH111 является F, Y или Н, или (ii) аминокислотный остаток в положении VH111 является F, Y или Н, а аминокислотный остаток в положении VL49 является G или А. Согласно определенным вариантам реализации вариант последовательности VH или VL обладает идентичностью 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91%, 90%, 89%, 88%, 87%, 86%, 85%, 84%, 83%, 82%, 81% или 80% с последовательностью, представленной в SEQ ID №:3 или 8, и специфически связывается с CD3, причем (i) аминокислотный остаток в положении VH111 является F, Y или Н, или (ii) аминокислотный остаток в положении VH111 является F, Y или Н, а аминокислотный остаток в положении VL49 является G или А.
Согласно дополнительным вариантам реализации вариант VH и/или VL включает 1, 2, 3, 4, 5, 6, 7 или 8 консервативных аминокислотных замен. Консервативные замены включают среди алифатических аминокислот взаимную замену аланина, валина, лейцина и изолейцина; взаимную замену гидроксильных остатков серина и треонина, замену в пределах кислых остатков аспартата и глутамата, замены между амидными остатками аспарагином и глутамином, замену в пределах основных остатков лизина и аргинина, и замену среди ароматических остатков фенилалаинина и тирозина. В некоторых случаях вариант VH и/или VL включает 1, 2, 3, 4, 5, 6, 7 или 8 таких консервативных замен при условии, что (i) аминокислотный остаток в положении VH111 является F, Y или Н, или (ii) аминокислотный остаток в положении VH111 является F, Y или Н, а аминокислотный остаток в положении VL49 является G или А. В некоторых случаях такие замены сделаны не в CDR.
Согласно еще некоторым вариантам реализации вариант VH и/или VL включает замены, которые усиливают свойства CDR, например, повышают стабильность, уровень экспрессии, восстановление, сродство связывания с CD3 и/или цитотоксическую активность. Кроме того, согласно определенным вариантам реализации указанный антигенсвязывающий белок является поливалентным, т.е. содержит два, три или более связывающих сайта для CD3.
В некоторых случаях антигенсвязывающий белок согласно настоящему изобретению является многофункциональным. В настоящей заявке термин «многофункциональный» применяется, чтобы указать, что связывающий белок согласно настоящему изобретению, проявляет две, три или более разных биологических функции, причем одной функцией является связывание с CD3. Например, разные биологические функции включают разные специфичности к разным антигенам. В некоторых случаях многофункциональный антигенсвязывающий белок является мультиспецифичным, т.е. обладает специфичностью связывания в отношении CD3 и еще одного, двух или трех антигенов. Такие мультиспецифичные антигенсвязывающие белки включают, например, мультиспецифичные F(ab')2, фрагменты Fv, одноцепочечный Fv, тандемный одноцепочечный Fv ((scFv)2), диатело, флекситело (WO 03/025018) и тандемное диатело.
Согласно определенным вариантам реализации указанный антигенсвязывающий белок содержит по меньшей мере один CD3-связывающий сайт и по меньшей мере один дополнительный антигенсвязывающий сайт, специфичный к веществу бактерий, вирусному белку, аутоиммунному маркеру или антигену, присутствующему на конкретной клетке, такому как поверхностный белок клетки, экспрессируемый на поверхности В-лимфоцита, Т-лимфоцита, естественного киллера (NK), миелоидной клетки, фагоцита или клетки опухоли. Такие антигенсвязывающие молекулы способны связывать две клетки и могут применяться для направления Т-клеток на специфическую мишень.
Примерами таких мишеней могут быть клетки опухоли или возбудители инфекций, такие как вирусные или бактериальные патогены, например, вирус денге, вирус простого герпеса, вирус гриппа, ВИЧ (вирус иммунодефицита человека) или клетки, несущие на своей поверхности аутоиммунные мишени, такие как ИЛ-2, аутоиммунный маркер или аутоиммунный антиген.
Согласно определенным вариантам реализации по меньшей мере еще один антигенсвязывающий сайт специфичен в отношении антигена клетки опухоли. Антигенами для клеток опухолей могут быть антигены опухолей и поверхностные антигены клеток соответствующей опухоли, например, специфические маркеры опухоли. Такой мультиспецифичный антигенсвязывающий белок связывается и с клеткой опухоли, и с CD3 на поверхности Т-лимфоцитов, тем самым запуская цитотоксический ответ, индуцируемый Т-лимфоцитом. В настоящей заявке термин «антиген опухоли» включает опухолеассоциированный антиген (ОАА) и опухольспецифичный антиген (ОСА). В настоящей заявке термин «опухолеассоциированный антиген (ОАА)» относится к белку, который присутствует на клетках опухоли, и на здоровых клетках в эмбриональный период жизни (только фетальные антигены), и после рождения в избранных органах, но в гораздо более низкой концентрации, чем на клетках опухоли. ОАА могут также присутствовать в строме вблизи клетки опухоли, но экспрессируются в меньших количествах в строме в других частях организма. В отличие от ОАА термин «опухольспецифичный антиген (ОСА)» относится к белку, экспрессируемому клетками опухоли. Термин «поверхностный антиген» относится к любому антигену или его фрагменту, способному распознаваться антителом на поверхности клетки.
Примеры антигенов клеток опухолей включают без ограничений CD19, CD20, CD30, белок-предшественник рецептора ламинина, EGFR (рецептор эпидермального фактора роста) 1, EGFR2, EGFR3, EGFRvIII, Ер-САМ, PLAP, антиген Томсона-Фридерайха (ТФ), MUC-1 (муцин), IGFR, CD5, ИЛ4-R альфа, ИЛ13-R, FcεRI и IgE, которые описаны в технике.
Согласно другим вариантам реализации указанный антиген-связывающий белок может содержать по меньшей мере один CD3-связывающий сайт и по меньшей мере один дополнительный антиген-связывающий сайт, специфичный к молекуле, выбранной из группы, состоящей из лекарственного препарата, токсина, радионуклеотида, фермента, альбумина, например, сывороточного альбумина и липопротеина, существующих в природе лигандов, таких как цитокины или хемокины. Если молекулой-мишенью является альбумин, альбумин или сывороточный альбумин могут быть выбраны из группы источников, состоящей из организма человека, коровы, кролика, собаки и мыши.
Согласно определенным вариантам реализации указанный антигенсвязывающий белок является мультиспецифичным и обладает первой специфичностью к CD3 и второй специфичностью к CD19, CD30, EGFRvIII или HSA. Согласно конкретному варианту реализации мультиспецифичный белок с первой специфичностью к CD3 не обладает второй специфичностью к CD33.
Согласно еще одному аспекту антиген-связывающий белок согласно настоящему изобретению является мультимером, т.е. содержит два, три или более полипептидов, образующих по меньшей мере один антиген-связывающий сайт для CD3. В настоящей заявке термин «мультимер» относится к комплексу из двух или более полипептидов. Согласно определенным вариантам реализации полипептиды мультимера нековалентно связаны друг с другом, в частности при условии, что между указанными полипептидами нет ковалентной связи. Согласно определенным вариантам реализации указанный мультимер является гомомерным, т.е. состоит из идентичных полипептидов. Термин «полипептид» относится к полимеру из аминокислотных остатков, соединенных амидными связями. Согласно определенным вариантам реализации полипептид является одноцепочечным гибридным белком, который не разветвлен. В указанном полипептиде вариабельные домены антитела связаны друг с другом. Согласно другим вариантам реализации указанный полипептид может содержать остатки заменимых аминокислот наряду с N-концевыми и/или С-концевыми остатками вариабельных доменов. Например, согласно некоторым вариантам реализации такие остатки заменимых аминокислот могут содержать последовательность Tag на С-конце, которая, как предполагается, полезна для очистки и определения указанного полипептида. Согласно определенным вариантам реализации указанный мультимер является димерным, т.е. содержит два полипептида. Примеры мультимера, включенного в настоящее изобретение, включают диатело, тандемное диатело и флекситело.
Согласно определенным вариантам реализации указанным мультимером является антиген-связывающий белок в форме тандемного диатела. Такие тандемные диатела конструируют путем соединения четырех вариабельных связывающих домена антитела, например, два VH и два VL, в единую генную конструкцию, которая способна к нековалентной димеризации. В таких тандемных диателах длина линкера такова, что не допускает внутримолекулярного спаривания вариабельных доменов, так что молекула не может скручиваться внутри себя, образуя одноцепочечное диатело, но скорее способствует спариванию с комплементарными доменами другой цепи. Также домены расположены так, что соответствующие домены спариваются во время такой димеризации. После экспрессии с генетического конструкта две полипептидных цепи скручиваются «голова к хвосту», образуя функциональный нековалентный димер приблизительно 105 кДа (Kipriyanov Meth. Mol. Biol. (2009) 562, 177-193, McAleese and Eser, 2012, Future Oncol. 8:687-95). Несмотря на отсутствие внутримолекулярных ковалентных связей образовавшийся димер очень стабилен, остается интактным и не переходит обратно в мономерную форму.
Тандемные диатела обладают целым рядом свойств, которые обеспечивают преимущества перед традиционными моноклональными антителами и другими менее крупными молекулами Fv. Тандемные диатела содержат только вариабельные домены антител и, следовательно, лишены любых побочных эффектов, которые могут быть ассоциированы с компонентом Fc. Поскольку тандемные диатела поливалентны и позволяют двухвалентное связывание с CD3, авидность такая же, что и у IgG. Размер тандемного диатела согласно определенным вариантам реализации составляет приблизительно 105 кДа, и это меньше, чем размер IgG, что может улучшать проникновение в опухоль. Однако размер значительно превышает порог выведения почками для клиренса первого порядка, что дает фармакокинетическое преимущество по сравнению с менее крупными формами антител на основе антитело-связывающих сайтов или каркасных участков не-антител. Тандемные диатела хорошо экспрессируются в клетках-хозяевах, например, клетках млекопитающих - СНО (яичника китайского хомячка). Предполагается, что для тандемных диател существуют надежные предшествующие и последующие технологические процессы (например, Meth. Mol. Biol. (2009) 562, 177-193).
В некоторых случаях мультиспецифичный антиген-связывающий белок, например, тандемное диатело, описываемое в настоящей заявке, разработано так, чтобы было возможно специфическое нацеливание на клетки опухоли путем рекрутинга цитотоксичеких Т-лимфоцитов. Это повышает АЗКЦ (антителозависимую клеточную цитотоксичность) по сравнению с традиционными антителами. Антитела не способны напрямую рекрутировать цитотоксические Т-лимфоциты. В отличие от этого, мультиспецифичный антигенсвязывающий белок, например, тандемное антитело, привлекая молекулы CD3, экспрессирующиеся специфически на данных клетках, может перекрестно связывать цитотоксический Т-лимфоцит и клетки опухоли с высокой специфичностью, что значительно увеличивает цитотоксический потенциал указанных молекул.
Согласно одному аспекту указанный мультимер является биспецифичным тандемным диателом, причем каждый полипептид такого биспецифичного тандемного диатела содержит четыре вариабельных домена, VL и VH CD3, обладающие второй специфичностью, отличной от CD3. Согласно определенным вариантам реализации четыре вариабельных домена соединены пептидными линкерами L1, L2 и L3 и в некоторых случаях расположены в направлении с N-конца к С-концу следующим образом:
(i) VL (CD3)-L1-VH (второй антигенсвязывающий сайт)-L2-VL(второй антигенсвязывающий сайт)-L3-VH(CD3); или
(ii) VH (CD3)-L1-VL(второй антигенсвязывающий сайт)-L2-VH(второй антигенсвязывающий сайт)-L3-VL(CD3); или
(iii) VL(второй антигенсвязывающий сайт)-L1-VH(CD3)-L2-VL(CD3)-L3-VH(второй антигенсвязывающий сайт); или
(iv) VH(второй антигенсвязывающий сайт)-L1-VL(CD3)-L2-VH(CD3)-L3-VL(второй антигенсвязывающий сайт).
Согласно определенным вариантам реализации «другой антигенсвязывающий сайт» специфичен в отношении антигена опухоли, например, CD19, CD30 или EGFRvIII. Согласно конкретному варианту реализации указанный антиген опухоли не является CD33.
Длина линкеров влияет на гибкость тандемного диатела. Следовательно, согласно некоторым вариантам реализации длина пептидных линкеров L1, L2 и L3 такова, что домены одного полипептида могут образовывать внутримолекулярные связи с доменами другого полипептида, образуя димерное антигенсвязывающее тандемное диатело. Согласно определенным вариантам реализации такие линкеры являются «короткими», т.е. состоят из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 аминокислотных остатков. Так, в некоторых случаях указанные линкеры состоят из приблизительно 12 или менее аминокислотных остатков. В случае 0 аминокислотных остатков линкер является пептидной связью. Такие короткие линкеры благоприятствуют внутримолекулярной димеризации двух полипептидов и образованию корректных антигенсвязывающих сайтов между вариабельными доменами легкой цепи антитела и вариабельными доменами тяжелой цепи антитела разных полипептидов. Укорочение линкера до приблизительно 12 или менее аминокислотных остатков в целом препятствует образованию внутримолекулярного взаимодействия между соседними доменами одного полипептида. Согласно некоторым вариантам реализации указанные линкеры состоят из приблизительно 3 - приблизительно 12, в частности приблизительно 3 - приблизительно 10, например, 4, 5, 6, 7, 8 или 9 остатков заменимых аминокислот.
Что касается аминокислотного состава линкеров, пептиды выбирают так, чтобы они не препятствовали димеризации двух полипептидов. Например, линкеры, содержащие глицин или серии, обычно обеспечивают устойчивость к протеазам. Аминокислотная последовательность линкеров может быть оптимизирована, например, методами фагового дисплея для улучшения связывания антигена и производственного выхода антигенсвязывающего димерного полипептида. Примеры пептидных линкеров, подходящих для тандемного диатела согласно настоящему изобретению включают GGSGGS (SEQ ID №:16), GGSG (SEQ ID №:17) или GGSGG (SEQ ID №:18).
Согласно некоторым вариантам реализации мультимерный антиген-связывающий белок, описываемый в настоящей заявке, получают путем экспрессии полинуклеотидов, кодирующих полипептид тандемного диатела, который соединяется с другим идентичным полипептидом, образуя антиген-связывающее тандемное диатело. Следовательно, другим аспектом является полинуклеотид, например, ДНК или РНК, кодирующий полипептид мультимерного антигенсвязывающего белка, описываемого в настоящей заявке, например, тандемного диатела.
Указанный полинуклеотид конструируют известными способами, такими как сочетание генов, кодирующих вариабельные домены антитела, либо разделенные пептидными линкерами, либо согласно другим вариантам реализации напрямую связанные пептидной связью, в один генетический конструкт, функционально связанный с соответствующим промотором, и необязательно соответствующим терминатором транскрипции, и экспрессия его в бактерии или другой подходящей системе экспрессии, такой как, например, клетки СНО. В зависимости от применяемой системы векторов и хозяина можно применять любое число подходящих элементов транскрипции и трансляции. Промотор выбирают так, чтобы он запускал экспрессию указанного полинуклеотида в соответствующей клетке-хозяине.
Согласно некоторым вариантам реализации указанный полинуклеотид вводят в вектор, предпочтительно вектор экспрессии, который представляет собой еще один вариант реализации настоящего изобретения. Такой рекомбинантный вектор можно сконструировать известными способами.
Для заключения в клетку и экспрессии полинуклеотида, кодирующего полипептид, например, желаемое тандемное диатело, можно применять широкий спектр векторов экспрессии/ систем хозяев. Примеры векторов экспрессии для экспрессии в клетках E.coli включают pSKK (Le Gall et al., J Immunol Methods. (2004) 285(1): 111-27) или pcDNA5 («Invitrogen») для экспрессии в клетках млекопитающих.
Таким образом, антиген-связывающее тандемное диатело, как описано в настоящей заявке, согласно некоторым вариантам реализации получают путем введения вектора, кодирующего полипептид, как описан выше, в клетку-хозяин и культивирования указанной клетки-хозяина при условиях, при которых цепи полипептидов экспрессируются, могут быть выделены и, необязательно, дополнительно очищены. Для выделения и очистки полипептидов необходимы Taq, которые являются преимуществом при введении in vivo.
Согласно другим аспектам в настоящей заявке предложены фармацевтические композиции, содержащие антиген-связывающий белок согласно настоящему изобретению, например, тандемное диатело, вектор, содержащий полинуклеотид, кодирующий полипептид указанного антиген-связывающего белка, или клетку-хозяин, трансформированную указанным вектором, и по меньшей мере один фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый носитель» включает без ограничений любой носитель, который не препятствует эффективности биологической активности ингредиентов и который не токсичен для пациента, которому его вводят. Примеры подходящих фармацевтических носителей хорошо известны в технике и включают фосфатно-солевые буферы, воду, эмульсии, такие как масляные/водные эмульсии, разные типы смачивающих агентов, стерильные растворы и др. Такие носители могут быть составлены традиционными способами и могут вводиться субъекту в соответствующей дозе. Предпочтительно композиции стерильные. Также указанные композиции могут содержать вспомогательные вещества, такие как консерванты, эмульгаторы и диспергирующие агенты. Действие микроорганизмов можно предупредить путем включения разных антибактериальных и противогрибковых агентов. Введение соответствующих композиций можно проводить разными путями, например, внутривенно, внутрибрюшинно, подкожно, внутримышечно, местно или внутрикожно. Конечно, путь введения зависит от типа терапии и типа соединения, содержащегося в фармацевтической композиции. Режим дозирования должен определять лечащий врач, и на него влияют другие клинические факторы. Как хорошо известно в медицине, дозировки для любого пациента зависят от многих факторов, включая размеры пациента, площадь поверхности кожи, его возраст, пол, конкретное соединение, которое следует вводить, время и путь введения, тип терапии, общее состояние здоровья и другие препараты, которые вводятся совместно.
Также согласно настоящему изобретению предложено медицинское применение или способ, при которых антигенсвязывающий белок, описываемый в настоящей заявке, вводится в эффективной дозе субъекту, например, пациенту для иммуносупрессорной терапии, например, при трансплантации, лечении аутоиммунного заболевания, воспалительного заболевания, инфекционного заболевания, аллергии или рака (например, неходжкинской лимфомы; хронического лимфолейкоза; лимфомы Ходжкина; солидных опухолей, например, образующихся при раке молочной железы, раке яичника, раке толстой и ободочной кишки, раке почки или раке желчных протоков; минимальной остаточной болезни; метастатических опухолях, например метастазирующем раке легких, костей, печени или головного мозга). Указанный антигенсвязывающий белок можно применять в условиях профилактики или лечения, один или в сочетании с современными средствами лечения.
Типы рака, которые можно лечить при помощи мультиспецифического антиген-связывающего белка согласно настоящему изобретению включают без ограничений первичный и метастатический рак коры надпочечников, рак анального отверстия, апластическую анемию, рак желчных протоков, рак мочевого пузыря, рак костей, метастазы в кости, опухоли ЦНС (центральной нервной системы) периферический рак ЦНС, рак молочной железы, болезнь Катлемена, рак шеи, детскую неходжкинскую лимфому, рак толстой, ободочной и прямой кишки, рак эндометрия, рак пищевода, опухоли из семейства опухолей Юинга (например, саркому Юинга), рак глаз, рак желчного пузыря, карциноиды желудочно-кишечного тракта, стромальные опухоли желудочно-кишечного тракта, гестационную трофобластическую болезнь, волосатоклеточный лейкоз, болезнь Ходжкина, саркому Капоши, рак почек, рак гортани и гиполарингеальный рак, острый лимфолейкоз, острый миелоидный лейкоз, детский лейкоз, хронический лимфолейкоз, хронический миелоидный лейкоз, рак печени, рак легких, карциноиды легких, неходжкинскую лимфому, рак молочной железы у мужчин, злокачественную мезотелиому, множественную миелому, миелодистрофический синдром, миелопролиферативные расстройства, рак носовой полости и околоносовых пазух, рак носоглотки, нейробластому, рак ротовой полости и ротоглотки, остеосаркому, рак яичника, рак поджелудочной железы, рак полового члена, опухоль гипофиза, рак предстательной железы, ретинобластому, рабдомиосаркому, рак слюнных желез, саркому (рак мягких тканей у взрослых), меланому, немеланомный рак кожи, рак желудка, рак яичек, рак тимуса, рак щитовидной железы, рак матки (например, саркома матки), рак влагалища, рак вульвы и макроглобулинемию Вальденстрема.
Термин «эффективная доза» относится к количествам активного ингредиента, которых достаточно, чтобы повлиять на течение и тяжесть заболевания, привести к уменьшению или ремиссии такой патологии. «Эффективную дозу», полезную при лечении и/или профилактике таких заболеваний или расстройств, можно определить при помощи способов, известных опытному специалисту (например, Fingl et al., The Pharmacological Basis of Therapeutics, Goddman and Gilman, eds. Macmillan Publishing Co., New York, pp. 1-46 (1975)).
Согласно другому аспекту настоящего изобретения антигенсвязывающий белок, описываемый в настоящей заявке, применяют при производстве иммуносупрессорного препарата или препарата для лечения аутоиммунного заболевания, воспалительного заболевания, инфекционного заболевания, аллергии или рака (например, неходжкинской лимфомы; хронического лимфолейкоза; лимфомы Ходжкина; солидных опухолей, например, образующихся при раке молочной железы, раке яичника, раке толстой и ободочной кишки, раке почки или раке желчных протоков; минимальной остаточной болезни; метастатических опухолях, например метастазирующем раке легких, костей, печени или головного мозга). Где особо показано, что мультиспецифичные связывающие белки обладают особой ценностью при лечении конкретного заболевания, указанные антигенсвязывающие белки можно также применять при производстве препарата для лечения такого конкретного заболевания.
Способы получения фармацевтических композиций, т.е., лекарственных препаратов, и клиническое применение антигенсвязывающих белков при профилактике и/или лечении таких заболеваний, как, например, рак, известны специалистам в данной области техники.
Согласно конкретному аспекту настоящего изобретения антигенсвязывающий белок является мультиспецифичным и применяется для лечения рака, поскольку такой мультиспецифичный антигенсвязывающий белок можно применять для перенаправления цитотоксических эффекторных клеток на клетки опухоли. Такая терапевтическая концепция хорошо известна в технике. Например, клинические исследования показали регресс опухоли у пациентов, получавших анти-CD3 × антиопухолевое биспецифичное антитело (например, Canevari, S. et al., J. Natl. Cancer Inst., 87:1463-1469,1996), или пациентов, получавших anra-CD16 × антиопухолевое биспецифичное антитело (e.g. Hartmann et al.; Clin Cancer Res. 2001; 7(7):1873-81). Также было получено подтверждение концепции для разных рекомбинантных биспецифичных антител, содержащих только вариабельные домены (Fv) (Cochlovius et al.; Cancer Research, 2000, 60:4336-4341) или недавно в клинических исследованиях с мономерными молекулами одно цепочечных Fv антител в форме BiTE® (два одноцепочечных антитела с разными специфичностями, соединенные вместе; «Amgen», Германия, Bargou R. et al., Science, 2008, 321(5891):974-977; Baeuerle PA and Reinhardt C., Cancer Res. 2009, 69(12):4941-4944). Димерные антигенсвязывающие белки, описываемые в настоящей заявке, можно применять в качестве лекарственных препаратов и при реализации способов лечения аналогичным путем, что и биспецифичные антитела, известные в технике, поскольку они способны перенаправлять терапевтические, например, цитотоксические механизмы при помощи таких же сочетанных специфичностей антител. Также известны иммуносупрессорные антитела, моноспецифичные в отношении CD3, такие как Муромонаб-CD3, применяемые для лечения отторжения трансплантата, острого отторжения трансплантата почек (аллотрансплантата), трансплантатов печени и сердца. Таким образом, антигенсвязывающие белки, специфичные в отношении альбумина и CD3, можно применять при реализации тех же способов лечения, что и известные моноспецифичные анти-CD3 антитела.
Указанный антигенсвязывающий белок и его композиции могут быть в виде оральной, внутривенной, внутрибрюшинной или другой фармацевтически приемлемой лекарственной формы. Согласно некоторым вариантам реализации композицию вводят перорально, и лекарственной формой является таблетка, капсула, капсуловидная таблетка или другая форма для перорального введения. Согласно некоторым вариантам реализации композиция предназначена для парентерального введения, например, внутривенного, внутрибрюшинного, внутримышечного или подкожного, и вводится в форме раствора, содержащего указанную антигенсвязывающую молекулу.
Специалисты в данной области техники могут легко и без особого труда сконструировать и получить антигенсвязывающие белки, описываемые в настоящей заявке, при помощи установленных технологий и стандартных способов, известных в технике, см., например, Sambrook, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory (1989) N.Y.; The Protein Protocols Handbook, edited by John M. Walker, Humana Press Inc. (2002); или Antibody engineering: methods and protocols / edited by Benny K.C. Lo; Benny K.C. II Series: Methods in molecular biology (Totowa, N.J.)).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1: Связывание и цитотоксическая активность тандемных диател, содержащих разные анти-CD3 домены. (А) Клетки Раджи CD19+ человека, клетки Юркат CD3+ человека и клетки CD3+ HSC-F яванской макаки окрашивались на льду 10 мкг/мл тандемного диатела TandAb В, содержащего CD3-связывающий домен var_w (SEQ ID №:1 и 6) в сочетании с CD19-связывающим доменом. Связанное поверхностью клеток тандемное диатело определяли при помощи анти-His mAb (моноклонального антитела), а затем FITC-конъюгированного антимышиного IgG козы. Средние интенсивности флуоресценции, определенные посредством проточной цитометрии, моделировали как сигмоидальную кривую зависимости ответа от дозы нелинейной регрессией для расчета KD. (В) Значения ЕС50 определяли в пробе на цитотоксичность с кальцеин-меченными клетками-мишенями EGFRvIII+ F98 и МКПК (мононуклеарными клетками периферической крови) в качестве эффекторных клеток в соотношении эффектор: мишень 50:1 с временем инкубации 4 ч. ЕС50 рассчитывали при помощи нелинейной регрессии данных, моделируемых сигмоидальной кривой.
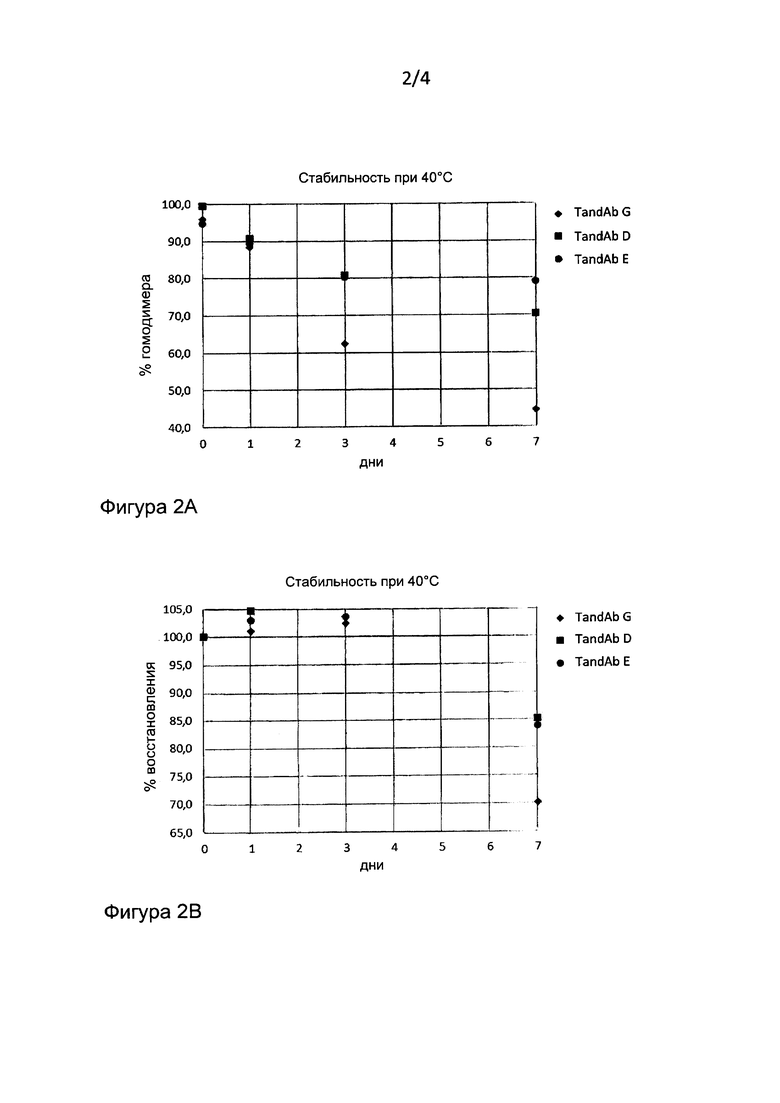
Фиг. 2: Биофизическая стабильность, оцениваемая посредством эксклюзионной ВЭЖХ (высокоэффективной жидкостной хроматографии). TandAb G (SEQ ID №:14), TandAb D (SEQ ID №: 11) и TandAb E (SEQ ID №:12) инкубировали при 40°C в течение семи (7) дней. (А) Содержание гомодимерного тандемного диатела, (В) % восстановления.
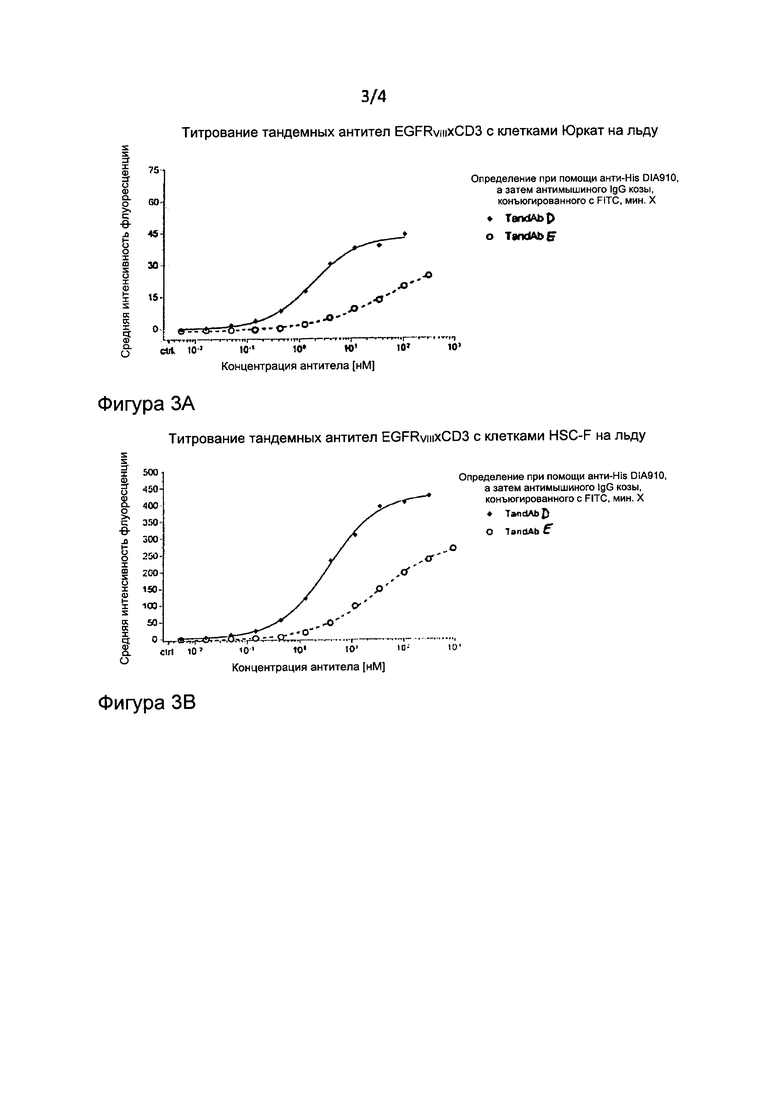
Фиг. 3: Сродство связывания и перекрестная реактивность тандемных диател EGFRvIII/CD3 с гуманизированными анти-CD3 доменами. Клетки Юркат CD3+ человека (А) и клетки CD3+ HSC-F яванской макаки (В) окрашивались возрастающими концентрациями TandAb D (SEQ ID №:11) (KD на Юркат=1,822 нМ, KD на HSC-F=3,4 нМ) и TandAb Е (SEQ ID №:12) (KD на Юркат=27,74 нМ, KD на HSC-F=24,3 нМ). Связанное поверхностью клеток тандемное диатело определяли при помощи анти-His mAb, а затем FITC-конъюгированного антимышиного IgG козы. Для расчета KD средние интенсивности флуоресценции, определенные посредством проточной цитометрии, моделировали как сигмоидальную кривую зависимости ответа от дозы нелинейной регрессией.
Фиг. 4: Цитотоксическая активность тандемных диател EGFRvIII/CD3 с гуманизированными анти-CD3 доменами. Значения EC50 определяли в 4-часовой пробе на цитотоксичность с кальцеин-меченными клетками-мишенями EGFRvIII+ F98 и МКПК в качестве эффекторных клеток в соотношении эффектор: мишень 50:1. Значения ЕС50 рассчитывали при помощи нелинейной регрессии данных, моделируемых сигмоидальной кривой.
Ниже описан пример генерирования конкретного VL и VH, содержащего сайт связывания CD3 антигенсвязывающего белка согласно настоящему изобретению:
На первом этапе CDR VH SP34 мыши (BD Bioscience; J. Immunol. Methods., 1994, 178:195) встраивали в наиболее гомологичный каркасный участок антитела человека (VH3_72 человека) IgG1, и получали химерный связывающий домен, состоящий из вновь гуманизированного VH и исходной λ-цепи VL из антитела мыши. Данные о связывании показывают, что химерная молекула сохраняла функцию. Таким образом, гуманизированная цепь VH не изменялась во время последующих этапов гуманизации для цепи VL.
Для гуманизации последовательности VL SP34 мыши CDR из антитела мыши встраивали в каркасный участок VL антитела человека с максимальной гомологией исходному каркасному участку в антителе мыши (Vλ7_7a человека). Конструкции, содержащие данную близкородственную λ-цепь, генерировали путем введения обратных мутаций и оценивали в форме тандемного диатела в сочетании с CD19-связывающим доменом. Обратные мутации выбирали на основании сравнения моделей исходного SP34 мыши и гуманизированных вариантов, содержащих каркасный участок Vλ7_7a; они были выбраны для уменьшения стерических конфликтов и сохранения конформации донорского CDR из антитела мыши при встраивании в акцепторный каркасный участок из антитела человека. Однако все из указанных λ цепь-содержащих тандемных диател либо плохо экспрессировались, либо не могли распознавать антиген.
Следовательно, был выбран альтернативный способ гуманизации цепи VL. При второй стратегии анализировали данные о тяжелых и легких цепях в том, что касалось оптимального спаривания тяжелых и легких цепей. Была совершена попытка встраивания CDR из антитела мыши в фиксированный каркасный участок антитела человека (Vκ1_39 человека). Таким образом, λ-цепь была заменена на κ-цепь. Было показано, что каркасный участок Vκ1_39 для легкой цепи может быть совместим с каркасным участком VH3_72, который был применен для гуманизации тяжелой цепи (описано выше). Впоследствии было проверено, приводит ли применение каркасного участка Vκ1_39 в сочетании с каркасным участком VH3_72 к образованию Fv с улучшенным спариванием VL/VH, и может ли оно приводить к выходу гуманизированного домена с хорошей стабильностью, экспрессией и другими биофизическими свойствами.
Было сгенерировано несколько тандемных диател, содержащих либо небольшой набор индивидуальных мутаций, либо их сочетание. Обратные мутации выбирали с целью уменьшения стерических конфликтов и сохранения конфигураций CDR донорского антитела мыши, когда его встраивают в акцепторный каркасный участок антитела человека. Самое удивительное, κ-цепь-содержащие антиген-связывающие белки демонстрировали более хорошие свойства с приемлемым уровнем экспрессии и связыванием с CD3-человека и яванской макаки. На основании их биофизических и функциональных свойств, а также соответствующего выхода экспрессии Vκ-связывающие домены var_w были определены как наиболее многообещающие кандидаты, и, следовательно, были выбраны для дальнейшей разработки. Исходную стабильность var_w можно было значительно улучшить посредством мутаций в VL: D72→Т72, К73→D73 и А74→F74, которые приводили к получению кандидата var_x.
В ходе успешных этапов гуманизации CD3-связывающего домена var_w и var_x сочетали с дополнительными антигенсвязывающими сайтами, отличными от анти-CD19, а именно анти-EGFRvIII, анти-ЕрСАМ и анти-CD30, чтобы оценить доступность указанных двух вариантов для спаривания с разными сайтами для антигенов опухолей. Сочетание var_w и var_x с указанными сайтами связывания с мишенью опухоли привело к получению хорошо экспрессируемых и стабильных тандемных диател, которые проявляли и связывание с мишенью, и Т-лимфоцит-опосредуемую цитотоксичность. На Фигуре 1А проиллюстрирована активность связывания TandAb В - антитела, содержащего CD3-связывающие домены var_w в сочетании с CD19-связывающим доменом, которая была измерена посредством проточной цитометрии. Показано сродство связывания (KD) TandAb В в отношении линии CD19-экспрессирующих клеток Раджи человека, линии CD3+-T-лимфоцитов человека (Юркат) и линией CD3-экспрессирующих клеток яванской макаки (HSC-F). Наблюдаемая перекрестная реактивность не демонстрировала значимых различий в связывании (Kd) с CD3 яванской макаки и человека. На Фигуре 1В представлена цитотоксическая проба, в которой тандемные диатела содержат CD3-связывающие домены var_w или var_x в сочетании с EGFRvIII-связывающим доменом. Линия EGFRvIII-экспрессирующих клеток F98 эффективно лизировалась в 4-часовой цитотоксической пробе (мечение кальцеином) при применении в качестве эффекторов МКПК человека. Опосредованный тандемным диателом лизис клеток-мишеней под действием var_w-содержащего TandAb G (SEQ ID №:14) был сопоставим с лизисом под действием контрольного TandAb F (SEQ ID №:13), содержащего исходный CD3-Связывающий домен мыши SP34.
Анализ последовательности и моделирование клонов var_w и var_x указали на важнейшую роль аминокислот в положениях VH111 и VL49 (которые прямо контактируют друг с другом согласно модели) для свойств связывания и стабильности указанных вариантов в тандемных диателах. В указанных положениях вводили несколько различных мутаций, и оценивали их индивидуально или в тандемных диателах, в сочетании с EGFRvIII-доменом. В положении VH111 мутации были с W на Т, Q, N, S, F, Y, R или Н; в положении VL49 мутации были с G на А, V, S, Т или N. Все полученные тандемные диатела оценивали на предмет свойств связывания, цитотоксичности и стабильности.
Мутация в положении VH111 с W на Y и в положении VL49 с G на А приводила к получению CD3-связывающего домена var_y, тогда как одиночная мутация в положении VH111 с W на H приводила к образованию домена var_z; указанные связывающие домены приводили к получению тандемных диател TandAb D (var_y) (SEQ ID №:11) и TandAb Е (var_z) (SEQ ID №:12), которые проявляли повышенную стабильность по сравнению с исходным var_w. VH111 занимает особое положение с CDRH3, которое, согласно правилу Шираи (Kuroda et al, 2008, Proteins, 73:608), определяет, будет ли конформация, принятая CDRH3 вытянутой или изогнутой. Это следует из экспериментов, которые показали, что для W в данном положении допустимы замены, на остаток, который должен содержать большие ароматические кольца, такие как F, Y или Н; в ином случае ожидается утрата связывания. Кроме того, смоделированный прямой контакт VL49 с остовом вблизи с VH111 также накладывает значительные ограничения на природу допустимых остатков. Применение эксклюзионной хроматографии (ЭХ) для отслеживания содержания гомодимерного тандемного диатела показало повышение 7-дневной стабильности при 40°С для указанных белков. Оба клона демонстрировали повышенное содержание желаемого гомодимера тандемного диатела по сравнению с TandAb G (SEQ ID №:14), содержащим исходный var_w, а также повышенное восстановление. Ни фигурах 2А и 2В проиллюстрирована стабильность TandAb D (SEQ ID №:11), TandAb Е (SEQ ID №: 12) и TandAb G (SEQ ID №: 14) в течение 7 дней при 40°С.
Неожиданно функциональный анализ также продемонстрировал, что активность связывания и цитотоксичность указанных тандемных диател сохраняется. На Фигурах 3А и 3В показано связывание титрованных тандемных диател TandAb D, содержащих var_y, и TandAb Е (SEQ ID №:12), содержащих var_z, с линией CD3+-клеток человека (Юркат) и линией CD3-экспрессирующих клеток яванской макаки (HSC-F), которое определяли посредством проточной цитометрии. Значения KD рассчитывали при помощи нелинейной регрессии, и они в обобщенном виде показаны в таблицах ниже. Для CD3 человека и яванской макаки наблюдалось сопоставимое сродство связывания, что указывает на перекрестную реактивность CD3-связывающего домена. TandAb D (SEQ ID №:11) демонстрировало сродство связывания к CD3 человека более чем в 10 раз больше (KD=1,8 нМ), чем TandAb Е (KD=27,7 нМ) (SEQ ID №:12).
TandAb D (SEQ ID №:11), содержащее var_y, и его предшественник TandAb G (SEQ ID №:14), содержащий var_w, сравнивали напрямую в 4-часовой пробе на цитотоксичность с высвобождением кальцеина с применением линии EGFRvIII-экспрессирующих клеток F98 в качестве клеток-мишеней и МКПК человека в качестве эффекторных клеток. Лизис клеток-мишеней, индуцированный обоими антителами, наблюдался с зависимостью от концентрации, и проявлял сопоставимую активность (TandAb G EC50=129 пМ, TandAb D ЕС50=122 пМ). Кривая титрования показана на Фигуре 4.
В заключении следует отметить, что начиная с клона мыши SP34 цепи VH и VL подвергались пошаговой гуманизации путем встраивания CDR. Стабильность гуманизированных молекул была еще увеличена в тандемных диателах посредством точечных мутаций в остатках каркасного участка, и выбор таких замен позволили сохранить активность связывания и цитотоксичность. Два оптимизированных CD3-связывающих домена var_y и var_z демонстрировали очень хорошую перекрестную реактивность с CD3 яванской макаки. Сродство к мишени оптимизированных доменов отличалось приблизительно в 10 раз, что позволило сгенерировать тандемные диатела с разным сродством при рекрутинге Т-лимфоцитов. Выровненные аминокислотные последовательности VH и VL CD3-связывающих доменов (var_y и var_z), два промежуточных варианта (var_w и var_x) и исходный клон мыши (SP34) показаны в Таблице 1.


--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Affimed Therapeutics
<120> CD3-связывающий домен
<130> A 3268
<150> PCT/EP2014/002177
<151> 2014-08-07
<160> 18
<170> BiSSAP 1.0
<210> 1
<211> 110
<212> PRT
<213> искусственная последовательность
<220>
<221> ИСТОЧНИК
<222> 1..110
<223> /mol_type="белок"
/note="VL var_w"
/organism="искусственная последовательность"
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr
20 25 30
Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Lys Ala Pro Lys
35 40 45
Gly Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ser Arg
50 55 60
Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Thr Leu Thr Ile Ser Ser
65 70 75 80
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Leu Trp Tyr Ser
85 90 95
Asn Leu Trp Val Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 2
<211> 110
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..110
<223> /mol_type="белок"
/note="VL var_x"
/organism="искусственная последовательность"
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr
20 25 30
Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Lys Ala Pro Lys
35 40 45
Gly Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg
50 55 60
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
65 70 75 80
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Leu Trp Tyr Ser
85 90 95
Asn Leu Trp Val Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 3
<211> 110
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..110
<223> /mol_type="белок"
/note="VL var_y"
/organism="искусственная последовательность"
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr
20 25 30
Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Lys Ala Pro Lys
35 40 45
Ala Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ser Arg
50 55 60
Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Thr Leu Thr Ile Ser Ser
65 70 75 80
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Leu Trp Tyr Ser
85 90 95
Asn Leu Trp Val Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 4
<211> 110
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..110
<223> /mol_type="белок"
/note="VL var_z"
/organism="искусственная последовательность"
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr
20 25 30
Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Lys Ala Pro Lys
35 40 45
Gly Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ser Arg
50 55 60
Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Thr Leu Thr Ile Ser Ser
65 70 75 80
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Leu Trp Tyr Ser
85 90 95
Asn Leu Trp Val Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 5
<211> 109
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..109
<223> /mol_type="белок"
/note="VL SP34 мыши"
/organism="искусственная последовательность"
<400> 5
Gln Ala Val Val Thr Gln Glu Ser Ala Leu Thr Thr Ser Pro Gly Glu
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Asp His Leu Phe Thr Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Thr Glu Asp Glu Ala Ile Tyr Phe Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 6
<211> 125
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..125
<223> /mol_type="белок"
/note="VH var_w"
/organism="искусственная последовательность"
<400> 6
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 7
<211> 125
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..125
<223> /mol_type="белок"
/note="VH var_x"
/organism="искусственная последовательность"
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 8
<211> 125
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..125
<223> /mol_type="белок"
/note="VH var_y"
/organism="искусственная последовательность"
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Tyr Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 9
<211> 125
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..125
<223> /mol_type="белок"
/note="VH var_z"
/organism="искусственная последовательность"
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser His Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 10
<211> 125
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..125
<223> /mol_type="белок"
/note="VH SP34 мыши"
/organism="искусственная последовательность"
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Lys Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 11
<211> 494
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..494
<223> /mol_type="белок"
/note="TandAb D"
/organism="искусственная последовательность"
<400> 11
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr
20 25 30
Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Lys Ala Pro Lys
35 40 45
Ala Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ser Arg
50 55 60
Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Thr Leu Thr Ile Ser Ser
65 70 75 80
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Leu Trp Tyr Ser
85 90 95
Asn Leu Trp Val Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly
100 105 110
Ser Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
115 120 125
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
130 135 140
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
145 150 155 160
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
165 170 175
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
180 185 190
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
195 200 205
Met Tyr Tyr Cys Ala Arg Leu Gly Ser Ser Trp Thr Asn Asp Ala Phe
210 215 220
Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Ser
225 230 235 240
Gly Gly Ser Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser
245 250 255
Pro Gly Gln Thr Ala Arg Ile Thr Cys Ser Gly Asp Ala Leu Pro Lys
260 265 270
Gln Tyr Ala Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu
275 280 285
Val Ile Tyr Lys Asp Ser Glu Arg Pro Ser Gly Ile Pro Glu Arg Phe
290 295 300
Ser Gly Ser Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val
305 310 315 320
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Ala Asp Ser Ser
325 330 335
Gly Thr Pro Leu Ile Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu
340 345 350
Gly Gly Ser Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly
355 360 365
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
370 375 380
Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly
385 390 395 400
Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr
405 410 415
Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg
420 425 430
Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr
435 440 445
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg His Gly Asn Phe Gly Asn
450 455 460
Ser Tyr Val Ser Tyr Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
465 470 475 480
Val Ser Ser Ala Ala Ala Gly Ser His His His His His His
485 490
<210> 12
<211> 494
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..494
<223> /mol_type="белок"
/note="TandAb E"
/organism="искусственная последовательность"
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr
20 25 30
Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Lys Ala Pro Lys
35 40 45
Gly Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ser Arg
50 55 60
Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Thr Leu Thr Ile Ser Ser
65 70 75 80
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Leu Trp Tyr Ser
85 90 95
Asn Leu Trp Val Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly
100 105 110
Ser Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
115 120 125
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
130 135 140
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
145 150 155 160
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
165 170 175
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
180 185 190
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
195 200 205
Met Tyr Tyr Cys Ala Arg Leu Gly Ser Ser Trp Thr Asn Asp Ala Phe
210 215 220
Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Ser
225 230 235 240
Gly Gly Ser Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser
245 250 255
Pro Gly Gln Thr Ala Arg Ile Thr Cys Ser Gly Asp Ala Leu Pro Lys
260 265 270
Gln Tyr Ala Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu
275 280 285
Val Ile Tyr Lys Asp Ser Glu Arg Pro Ser Gly Ile Pro Glu Arg Phe
290 295 300
Ser Gly Ser Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val
305 310 315 320
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Ala Asp Ser Ser
325 330 335
Gly Thr Pro Leu Ile Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu
340 345 350
Gly Gly Ser Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly
355 360 365
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
370 375 380
Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly
385 390 395 400
Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr
405 410 415
Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg
420 425 430
Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr
435 440 445
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg His Gly Asn Phe Gly Asn
450 455 460
Ser Tyr Val Ser His Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
465 470 475 480
Val Ser Ser Ala Ala Ala Gly Ser His His His His His His
485 490
<210> 13
<211> 493
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..493
<223> /mol_type="белок"
/note="TandAb F"
/organism="искусственная последовательность"
<400> 13
Gln Ala Val Val Thr Gln Glu Ser Ala Leu Thr Thr Ser Pro Gly Glu
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Asp His Leu Phe Thr Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Thr Glu Asp Glu Ala Ile Tyr Phe Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Ser
100 105 110
Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
115 120 125
Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe
130 135 140
Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu
145 150 155 160
Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser
165 170 175
Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser
180 185 190
Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met
195 200 205
Tyr Tyr Cys Ala Arg Leu Gly Ser Ser Trp Thr Asn Asp Ala Phe Asp
210 215 220
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Ser Gly
225 230 235 240
Gly Ser Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro
245 250 255
Gly Gln Thr Ala Arg Ile Thr Cys Ser Gly Asp Ala Leu Pro Lys Gln
260 265 270
Tyr Ala Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val
275 280 285
Ile Tyr Lys Asp Ser Glu Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser
290 295 300
Gly Ser Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val Gln
305 310 315 320
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Ala Asp Ser Ser Gly
325 330 335
Thr Pro Leu Ile Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu Gly
340 345 350
Gly Ser Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
355 360 365
Val Gln Pro Lys Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe
370 375 380
Thr Phe Asn Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys
385 390 395 400
Gly Leu Glu Trp Val Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala
405 410 415
Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp
420 425 430
Asp Ser Gln Ser Ile Leu Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu
435 440 445
Asp Thr Ala Met Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser
450 455 460
Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
465 470 475 480
Ser Ser Ala Ala Ala Gly Ser His His His His His His
485 490
<210> 14
<211> 494
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..494
<223> /mol_type="белок"
/note="TandAb G"
/organism="искусственная последовательность"
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr
20 25 30
Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Lys Ala Pro Lys
35 40 45
Gly Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ser Arg
50 55 60
Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Thr Leu Thr Ile Ser Ser
65 70 75 80
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Leu Trp Tyr Ser
85 90 95
Asn Leu Trp Val Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly
100 105 110
Ser Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
115 120 125
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
130 135 140
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
145 150 155 160
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
165 170 175
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
180 185 190
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
195 200 205
Met Tyr Tyr Cys Ala Arg Leu Gly Ser Ser Trp Thr Asn Asp Ala Phe
210 215 220
Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Ser
225 230 235 240
Gly Gly Ser Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser
245 250 255
Pro Gly Gln Thr Ala Arg Ile Thr Cys Ser Gly Asp Ala Leu Pro Lys
260 265 270
Gln Tyr Ala Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu
275 280 285
Val Ile Tyr Lys Asp Ser Glu Arg Pro Ser Gly Ile Pro Glu Arg Phe
290 295 300
Ser Gly Ser Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val
305 310 315 320
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Ala Asp Ser Ser
325 330 335
Gly Thr Pro Leu Ile Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu
340 345 350
Gly Gly Ser Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly
355 360 365
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
370 375 380
Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly
385 390 395 400
Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr
405 410 415
Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg
420 425 430
Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr
435 440 445
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg His Gly Asn Phe Gly Asn
450 455 460
Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
465 470 475 480
Val Ser Ser Ala Ala Ala Gly Ser His His His His His His
485 490
<210> 15
<211> 494
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..494
<223> /mol_type="белок"
/note="TandAb H"
/organism="искусственная последовательность"
<400> 15
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr
20 25 30
Ser Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Lys Ala Pro Lys
35 40 45
Gly Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Val Pro Ala Arg
50 55 60
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
65 70 75 80
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Leu Trp Tyr Ser
85 90 95
Asn Leu Trp Val Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly
100 105 110
Ser Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
115 120 125
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
130 135 140
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
145 150 155 160
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
165 170 175
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
180 185 190
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
195 200 205
Met Tyr Tyr Cys Ala Arg Leu Gly Ser Ser Trp Thr Asn Asp Ala Phe
210 215 220
Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Ser
225 230 235 240
Gly Gly Ser Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser
245 250 255
Pro Gly Gln Thr Ala Arg Ile Thr Cys Ser Gly Asp Ala Leu Pro Lys
260 265 270
Gln Tyr Ala Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu
275 280 285
Val Ile Tyr Lys Asp Ser Glu Arg Pro Ser Gly Ile Pro Glu Arg Phe
290 295 300
Ser Gly Ser Ser Ser Gly Thr Thr Val Thr Leu Thr Ile Ser Gly Val
305 310 315 320
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Ala Asp Ser Ser
325 330 335
Gly Thr Pro Leu Ile Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu
340 345 350
Gly Gly Ser Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly
355 360 365
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
370 375 380
Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly
385 390 395 400
Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr
405 410 415
Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg
420 425 430
Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr
435 440 445
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg His Gly Asn Phe Gly Asn
450 455 460
Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
465 470 475 480
Val Ser Ser Ala Ala Ala Gly Ser His His His His His His
485 490
<210> 16
<211> 6
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..6
<223> /mol_type="белок"
/note="пептидный линкер"
/organism="искусственная последовательность"
<400> 16
Gly Gly Ser Gly Gly Ser
1 5
<210> 17
<211> 4
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..4
<223> /mol_type="белок"
/note="пептидный линкер"
/organism="искусственная последовательность"
<400> 17
Gly Gly Ser Gly
1
<210> 18
<211> 5
<212> PRT
<213> искусственная последовательность
<220>
<221> SOURCE
<222> 1..5
<223> /mol_type="белок"
/note="пептидный линкер"
/organism="искусственная последовательность"
<400> 18
Gly Gly Ser Gly Gly
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МУЛЬТИВАЛЕНТНЫЕ FV-АНТИТЕЛА | 2016 |
|
RU2785766C2 |
| БИСПЕЦИФИЧЕСКИЙ АНТИГЕНСВЯЗЫВАЮЩИЙ БЕЛОК EGFR/CD16 | 2019 |
|
RU2792240C2 |
| ВАРИАНТНЫЕ СВЯЗЫВАЮЩИЕ CD3 ДОМЕНЫ И ИХ ПРИМЕНЕНИЕ В КОМБИНИРОВАННОЙ ТЕРАПИИ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2810222C2 |
| КОМБИНАЦИЯ АНТИТЕЛ CD30XCD16 ДЛЯ ТЕРАПИИ С АНТАГОНИСТОМ PD-1 | 2016 |
|
RU2761352C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2810924C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2832669C2 |
| АНТИ-ROR1/АНТИ-CD3 БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2020 |
|
RU2831608C2 |
| ТРИФУНКЦИОНАЛЬНАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2015 |
|
RU2753882C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ ADAM9, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2783619C2 |
| CD3-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2020 |
|
RU2826453C2 |


Изобретение относится к области биохимии, в частности к антигенсвязывающему белку для связывания с CD3. Также раскрыты полинуклеотид, кодирующий указанный белок, фармацевтическая композиция, содержащая указанное антитело. Раскрыты способ получения указанного антитела и применение указанного полинуклеотида или вектора. Изобретение позволяет эффективно лечить заболевания, ассоциированные с CD3. 5 н. и 6 з.п. ф-лы, 1 пр., 1 табл., 4 ил.
1. Антигенсвязывающий белок для связывания с CD3, содержащий CD3-связывающий сайт, содержащий вариабельные домены антитела и, необязательно, содержащий дополнительный антигенсвязывающий сайт, причем указанный CD3-связывающий сайт содержит:
(a) вариабельный домен тяжелой цепи (VH), представленный в SEQ ID №:6, и вариабельный домен легкой цепи (VL), представленный в SEQ ID №:1; или
(b) вариабельный домен тяжелой цепи (VH), представленный в SEQ ID №:7, и вариабельный домен легкой цепи (VL), представленный в SEQ ID №:2; или
(c) вариабельный домен тяжелой цепи (VH), представленный в SEQ ID №:8, и вариабельный домен легкой цепи (VL), представленный в SEQ ID №:3; или
(d) вариабельный домен тяжелой цепи (VH), представленный в SEQ ID №:9, и вариабельный домен легкой цепи (VL), представленный в SEQ ID №:4; и
антигенсвязывающий белок по (a), (b), (c) или (d) не является биспецифичным связывающим белком, который специфично связывается с CD33 человека и CD3 человека, причем указанный CD3-связывающий сайт содержит анти-CD3 вариабельный домен легкой цепи, выбранный из группы, состоящей из SEQ ID №:1-3, и анти-CD3 вариабельный домен тяжелой цепи, выбранный из группы, состоящей из SEQ ID №:6-8.
2. Антигенсвязывающий белок по п. 1, отличающийся тем, что указанный дополнительный антигенсвязывающий сайт является специфичным для клетки опухоли.
3. Антигенсвязывающий белок по п. 2, отличающийся тем, что указанный дополнительный антигенсвязывающий сайт не специфичен для CD33.
4. Антигенсвязывающий белок по п. 1, отличающийся тем, что указанный антигенсвязывающий белок содержит первый полипептид и второй полипептид, и каждый полипептид содержит по меньшей мере четыре вариабельных домена цепей, связанных друг с другом, причем указанный антигенсвязывающий белок содержит CD3-связывающий сайт по п. 1 и дополнительный антигенсвязывающий сайт, специфичный для второго антигена.
5. Антигенсвязывающий белок по п. 4, отличающийся тем, что каждый полипептид содержит по меньшей мере четыре вариабельных домена, соединенные друг с другом пептидными линкерами L1, L2 и L3 в следующем порядке:
(i) VL (CD3)-L1-VH (2-й антиген)-L2-VL(2-й антиген)-L3-VH(CD3);
(ii) VH (CD3)-L1-VL(2-й антиген)-L2-VH(2-й антиген)-L3-VL(CD3);
(iii) VL(2-й антиген)-L1-VH(CD3)-L2-VL(CD3)-L3-VH(2-й антиген); или
(iv) VH(2-й антиген)-L1-VL(CD3)-L2-VH(CD3)-L3-VL(2-й антиген).
6. Антигенсвязывающий белок по п. 5, отличающийся тем, что линкеры L1, L2 и L3 состоят приблизительно из 12 или менее аминокислотных остатков.
7. Полинуклеотид, кодирующий антигенсвязывающий белок по любому из пп. 1-6.
8. Фармацевтическая композиция для иммунотерапевтического применения, содержащая (i) эффективную дозу антигенсвязывающего белка по любому из пп. 1-6, или вектор, содержащий полинуклеотид по п. 7 и (ii) фармацевтически приемлемый носитель.
9. Способ получения антигенсвязывающего белка по любому из пп. 1-6, включающий
(i) введение в клетку-хозяина полинуклеотида по п. 7,
(ii) культивирование клетки-хозяина при условиях, при которых указанный антигенсвязывающий белок экспрессируется, и
(iii) очистку экспрессированного антигенсвязывающего белка.
10. Применение полинуклеотида по п. 7 или вектора, содержащего полинуклеотид по п. 7, для приготовления фармацевтической композиции для иммунотерапии.
11. Антигенсвязывающий белок по любому из пп. 1-6 для применения в качестве лекарственного средства для лечения, выбранного из группы, состоящей из иммуносупрессивного лечения, лечения аутоиммунного заболевания, воспалительного заболевания, инфекционного заболевания, аллергии и рака.
| Счетчик | 2017 |
|
RU2698431C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОБЕЗЖЕЛЕЗНЕННОГО МАЛОФОСФОРИСТОГО МАРГАНЦЕВОГО ШЛАКА | 2005 |
|
RU2295577C2 |
| US 20100015087 A1, 21.01.2010 | |||
| ИММУНОСУПРЕССОРНЫЕ ПОЛИПЕПТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ | 2008 |
|
RU2506275C2 |
Авторы
Даты
2021-02-09—Публикация
2015-08-05—Подача