Предлагаемое изобретение относится к области органической химии, в частности, к новому способу получения n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоатов общей формулы (1):

Замещенные фураны могут найти применение в тонком органическом синтезе в качестве исходных синтонов для создания биологически активных соединений медицинского и сельскохозяйственного назначения. Фурановый фрагмент молекулы содержится во многих фармацевтических препаратах, проявляющих антибактериальные, противовирусные, противоопухолевые, обезболивающие, противосудорожные свойства ([1] J.A. Marshall, X.J. Wang. J. Org. Chem., 1992, 57, 3387. [2] J.A. Marshall and E.M. Wallace. J. Org. Chem., 1995, 60, 796. [3] J. Mendez-Andino and L.A. Paquette. Org. Lett, 2000, 2, 4095. [4] X.L. Hou, Z. Yang, H.N.C. Wong. in Progress in Heterocyclic Chemistry. 2003, Vol. 15, 167-205).
Известен способ ([5] A.V. Kel’in and V. Gevorgyan. Efficient synthesis of 2-mono- and 2,5-disubstituted furans via the CuI-catalyzed cycloisomerization of alkynyl ketones. J. Org., Chem., 2002, 67, 95-98) получения 2,5-диалкилзамещенных фуранов общей формулы (2) реакцией циклоизомеризации алкинилкетонов в присутствии катализатора CuI с выходами 63-94% по схеме:
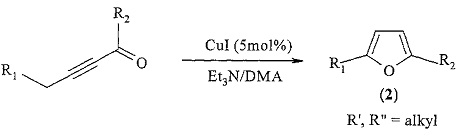
Известным способом не могут быть получены метил n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоаты общей формулы (1).
Известен способ ([6] A. Aponick, C.-Y. Li, J. Malinge, E.F. Marques. An extremely facile synthesis of furans, pyrroles, and thiophenes by the dehydrative cyclization of propargyl alcohols. Org. Lett., 2009, 11, 4624-4627) получения 2,3,5-триалкилзамещенных фуранов общей формулы (3), реакцией циклизации пропаргиловых спиртов в среде тетрагидрофурана в присутствии каталитических количеств AuCl с выходами 82-95% по схеме:
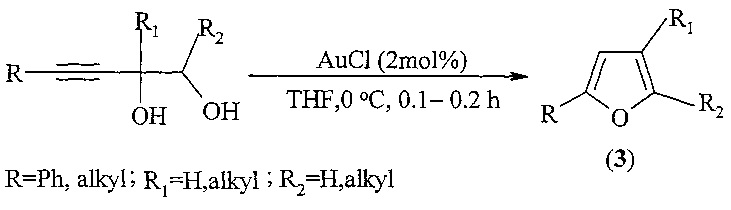
Известным способом не могут быть получены метил n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоаты общей формулы (1).
Известен способ ([7] D. Suzuki, Y. Nobe, R. Tanaka, Y. Takayama, F. Sato, H. Urabe. Facile preparation of various heteroaromatic compounds via azatitanacyclopentadiene intermediates. J. Am. Chem. Soc, 2005, 127, 7474-7479) получения тетразамещенных алкилфуранов общей формулы (4) взаимодействием дец-3-ина с метилцианатом и Ti(OPri)4, приводящего к образованию интермедиатного азатитанациклопентадиена, последующее взаимодействие которого с нонаналем позволяет получать тетразамещенный фуран (4) по схеме:
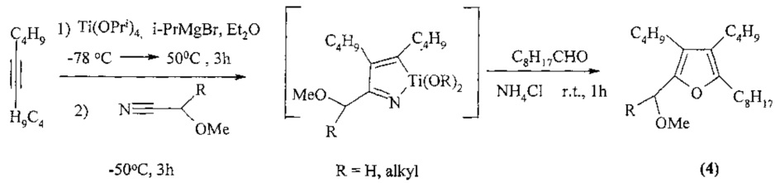
Известным способом не могут быть получены n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоаты общей формулы (1).
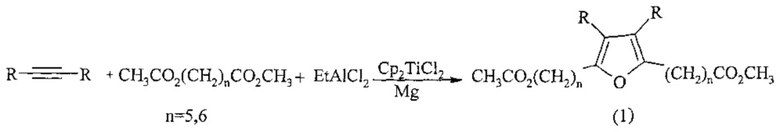
Известен способ ([8] M.G. Shaibakova, L.O. Khafizova, N.M. Chobanov, R.R. Gubaidullin, N.R. Popod’ko, U.M. Dzhemilev. The efficient one-pot synthesis of tetraalkyl substituted furans from symmetrical acetylenes, EtAlCl2, and carboxylic esters catalyzed. Tet. Let., 2014, 55, 1326-1328) получения тетраалкилзамещенных фуранов общей формулы (5) путем взаимодействия диалкилзамещенных ацетиленов с двукратным избытком эфиров алкилкарбоновых кислот в присутствии магния, EtAlCl2 и катализатора Cp2TiCl2,

Известным способом не могут быть получены метил n-[3,4-диалкил-(n-метокси-n-оксоалкил)-2-фурил]алканоаты общей формулы (1).
Предлагается новый способ получения n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоатов.
Сущность способа заключается во взаимодействии диалкилзамещенных ацетиленов общей формулы RC≡CR, где R=С2Н5, С3Н7, С4Н9, с двукратным избытком метиловых эфиров α,ω-дикарбоновых кислот общей формулы CH3CO2(СН2)nCO2CH3, где n=5,6, в присутствии магния (Mg порошок), EtAlCl2 (этилалюминийдихлорида) и катализатора Cp2TiCl2, взятых в мольном соотношении RC≡CR:CH3CO2(СН2)nCO2CH3:EtAlCl2:Mg:Cp2TiCl2=10:20:(50-70):40:(1,8-2,2), предпочтительно 10:20:60:40:2 ммоль. Реакцию проводят в тетрагидрофуране, в атмосфере аргона при температуре 60°C и атмосферном давлении. Время реакции 4-8 ч. Выход целевого продукта 54-76%. Реакция протекает по схеме:
Целевой продукт (1) образуется только лишь с участием дизамещенных ацетиленов RC≡CR, этилалюминийдихлорида (EtAlCl2), метиловых эфиров α,ω-дикарбоновых кислот CH3CO2(СН2)nCO2CH3 и магния (акцептор ионов хлора). В присутствии других соединений алюминия (например, Et2AlCl, Et3Al, Bui3Al, i-Bu2AlH), других эфиров (например, простые эфиры, эфиры монокарбоновых кислот), других непредельных соединений (например, терминальные ацетилены, дизамещенные олефины) или других металлов (например, Al, Cu, Fe) целевые продукты (1) не образуются.
Изменение соотношения исходных реагентов в сторону увеличения их содержания по отношению к диалкилзамещенному ацетилену не приводит к существенному повышению выхода целевого продукта (1). Снижение количества EtAlCl2, CH3CO2(СН2)nCO2CH3 или Mg по отношению к диалкилзамещенному ацетилену уменьшает выход метил n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоатов (1).
Проведение указанной реакции в присутствии катализатора Cp2TiCl2 больше 2.2 ммолей приводит к образованию побочных продуктов (гексазамещенных бензолов) и существенному уменьшению выхода целевого продукта (1). Использование катализатора Cp2TiCl2 менее 1.8 ммолей снижает выход метил n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоатов (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 60°C. При более высокой температуре (например, 80°C) увеличиваются энергозатраты на проведение процесса, а при меньшей температуре (например, 40°C) снижается скорость реакции.
Существенные отличия предлагаемого способа:
Предлагаемый способ позволяет получать метил n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоаты (1). Для этого в качестве исходных соединений используют симметричные диалкилацетилены, этилалюминийдихлорид, метиловые эфиры α,ω-дикарбоновых кислот CH3CO2(СН2)nCO2CH3, магний (Mg порошок) и катализатор Cp2TiCl2. Cp2TiCl2 взятые в мольном соотношении 10:20:60:40:2.
В известном способе в качестве исходных реагентов используются симметричные диалкилацетилены (RC≡CR), этилалюминийдихлорид (EtAlCl2), эфиры монокарбоновых кислот R'CP2Rʺ, магний (Mg порошок) и катализатор Cp2TiCl2, взятые в мольном соотношении 10:40:20:40:1. Известным способом не могут быть получены n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоаты (1).
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор, установленный на магнитной мешалке, при охлаждении до 0°C, в атмосфере аргона помещают 20 мл тетрагидрофурана, 7,6 мл (60 ммолей) EtAlCl2, 0,97 г (40 ммоль) магния, 0,5 г (20% ммоль) катализатора Cp2TiCl2. Перемешивают при 0°C в течение 1 ч, после чего добавляют 1,1 г (10 ммоль) окт-4-ина и 4,04 г (20 ммоль) диметилового эфира пробковой кислоты CH3CO2(СН2)6CO2CH3. Реакционную массу нагревают с обратным холодильником до 60°C в течение 6 часов. Получают метил 7-[5-(7-метокси-7-оксогептил)-3,4-дипропил-2-фурил]гептаноат формулы (1а) с выходом 73%.
Спектральные характеристики метил 7-[5-(7-метокси-7-оксогептил)-3,4-дипропил-2-фурил]гептаноата (1а).
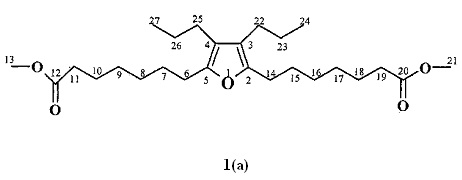
ИК-спектр, ν, см-1: 3449, 2932,2859, 1740, 1588, 1462, 1436, 1251, 1198, 1117.
Спектр ЯМР 1Н, CDCl3, δ, м.д.: 0.92 т (6Н, 2СН3, J=7.2 Гц), 1.33 м (8Н, 4СН2) 1.44 секстет (4Н, 2СН2, J=7.6 Гц), 1.59 м (4Н, 2СН2), 1.63 м (4Н, 2СН2), 2.22 т (4Н, 2СН2, J=7.6 Гц), 2.30 м (4Н, 2СН2), 2.47 т (4Н, 4СН2, J=7.6 Гц), 3.66 с (6Н, СН3). Спектр ЯМР 13С, δ, м.д.: 14.19 (С24,27)24.17 (С23,26), 24.87 (С10,18), 25.87 (С22,25), 26.19 (С6,14), 28.67 (С7,15), 28.92 (С8,16), 28.96 (С9,17), 34.05 (С11,19), 51.41 (С13,21), 118.78 (С3,4), 148.62 (С2,5), 174.26 (С12,20). Масс-спектр: m/z 436 [М]+. Найдено, (%): С 71.52; Н 10.16, C26H44O5. Вычислено, (%): С 71.56; Н 10.09.
Спектральные характеристики метил 7-[5-(7-метокси-7-оксогептил)-3,4-дибутил-2-фурил]гептаноата (1b).
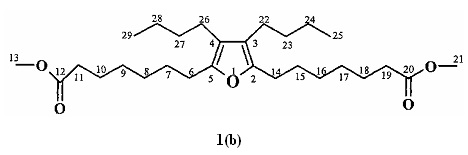
ИК-спектр, ν, см-1: 3412, 2930, 2858, 1740, 1638, 1588, 1461, 1437, 1259, 1199, 1093.
Спектр ЯМР 1Н, CDCl3, δ, м.д.: 0.93 т.(6Н, 2СН3, J=7.0 Гц), 1.34 м (16Н, 8СН2), 1.58 м (4Н, 2СН2), 1.63 м (4Н, 2СН2), 2.22 т (4Н, 2СН2, J=6.0 Гц), 2.32 м (4Н, 2СН2), 2.48 т (4Н, 2СН2, J=6.0 Гц), 3.68 с (6Н, 2СН3). Спектр ЯМР 13С, δ, м.д.: 13.98 (С25,29), 22.76 (С24,28), 23.45 (С22,26), 24.89 (С10,18), 26.49 (С6,14), 28.69 (С7,15), 28.93 (С9,17), 28.97 (С8,16), 33.31 (С23,27), 34.06 (С11,19), 51.43 (С13,21), 119.50 (С3,4), 148.48 (С2,5), 174.19 (С12,20). Масс-спектр: m/z 464 [М]+. Найдено, (%): С 72.37; Н 10.41, C28H48O5. Вычислено, (%): С 71.41; Н 10.34.
Спектральные характеристики метил 7-[5-(7-метокси-7-оксогептил)-3,4-диэтил-2-фурил]гептаноата (1с).

ИК-спектр, ν, см-1: 3449, 2931, 2857, 1740, 1589, 1462, 1436, 1252, 91198, 1111.
Спектр ЯМР 1Н, CDCl3, δ, м.д.: 1.06 т (6Н, 2СН3, J=6 Гц), 1.32 м (8Н, 4СН2), 1.56 м (4Н, 2СН2), 1.61 м (4Н, 2СН2), 2.28 м (8Н, 4СН2), 2.47 т (4Н, 2СН2, J=6 Гц), 3.65 с (6Н, 2СН3). Спектр ЯМР 13С, δ, м.д.: 15.80 (С23,25), 16.80 (С22,24), 24.73 (С10,18), 26.08 (С14,6), 28.76 (С15,7), 28.93 (С9,17), 29.11 (С10,16), 34.02 (С11,19), 51.38 (С13,21), 120.33 (С3,4), 148.20 (С2,5), 174.22 (С12,20). Масс-спектр: m/z 408 [М]+. Найдено, (%): С 70.55; Н 9.87, C24H40O5. Вычислено, (%): С 70.59; Н 9.80.
Спектральные характеристики метил 6-[5-(6-метокси-6-оксогексинил)-3,4-дипропил-2-фурил]гексаноата (1d).
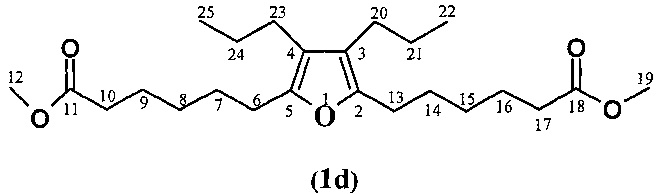
ИК-спектр, ν, см-1: 2954, 2930, 2868, 1740, 1457, 1437, 1375, 1254, 1198, 1171, 1112. Спектр ЯМР 1Н, CDCl3, δ, м.д.: 0.93 т (6Н, СН3, J=8 Гц), 1.36 м (4Н, 2СН2), 1.45 секстет (4Н, 2СН2, J=7.6 Гц), 1.59 м (4Н, 2СН2), 1.64 м (4Н, 2СН2), 2.23 т (4Н, 2СН2, J=8 Гц), 2.32 т (4Н, 2СН2, J=8 Гц), 2.50 т (4Н, СН2, J=8.0 Гц.). 3.68 с (6Н, 2СН3). Спектр ЯМР 13С, δ, м.д.: 14.20 (С22,25), 24.17 (С21,24), 24.76 (С9,16), 25.85 (С20,23), 26.10 (С6,13), 28.47 (С8,15), 28.49 (С7,14), 34.05 (С10,17), 51.44 (С12,19), 118.78 (С3,4), 148.45 (С2,5), 174.24 (С11,18). Масс-спектр: m/z 408 [М]+. Найдено, (%): С 70.55; Н 9.87, С24Н40О5. Вычислено, (%): С 70.59; Н 9.80.
Другие примеры, подтверждающие способ, приведены в табл. 1.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРААЛКИЗАМЕЩЕННЫХ ФУРАНОВ | 2012 |
|
RU2536407C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-2-ЦИКЛООКТЕН-1-ОНОВ | 2016 |
|
RU2664661C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-2-ЦИКЛОГЕПТЕН-1-ОНОВ И 2,3-ДИАЛКИЛ-2-ЦИКЛОГЕПТЕН-1,4-ДИОНОВ | 2015 |
|
RU2624904C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-АЛКИЛ-N,N-ДИ(АЛКАДИИНИЛ)АМИНОВ | 2015 |
|
RU2626008C2 |
| АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА НА ОСНОВЕ ЧЕТВЕРТИЧНЫХ АММОНИЕВЫХ СОЛЕЙ | 2014 |
|
RU2561281C1 |
| СПОСОБ ПОЛУЧЕНИЯ (2R,4R)-2-АЛКИЛ-3-(2-МЕРКАПТОБЕНЗОИЛ)-1,3-ТИАЗОЛИДИН-4-КАРБОНОВЫХ КИСЛОТ | 2012 |
|
RU2526619C2 |
| N, N', N'-ТРИЗАМЕЩЕННЫЕ ИЗОСЕЛЕНОМОЧЕВИНЫ | 2010 |
|
RU2434852C1 |
| Димерные соли пиридиния, содержащие фурановый фрагмент, обладающие биоцидным действием, способ получения, применение | 2024 |
|
RU2834421C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3,4-ДИАЛКИЛ-2,5-БИС(ТРИМЕТИЛСИЛИЛ)-МАГНЕЗАЦИКЛОПЕНТА-2,4-ДИЕНОВ | 2005 |
|
RU2290405C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛМАГНЕЗАЦИКЛОГЕПТ-2-ЕНОВ И 4,5-ДИАЛКИЛМАГНЕЗАЦИКЛОГЕПТ-4-ЕНОВ | 2010 |
|
RU2547265C2 |
Изобретение относится к способу получения метил n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоатов общей формулы (1), где, R=С2Н5, С3Н7, С4Н9; R'=(СН2)nCOOCH3, n=5, 6, взаимодействием диалкилацетиленов общей формулы R-C≡C-R, где R=С2Н5, С3Н7, С4Н9, с эфирами карбоновых кислот в присутствии магния (Mg, порошок) и катализатора Cp2TiCl2 с метиловые эфиры α,ω-дикарбоновых кислот CH3CO2(СН2)nCO2CH3, где n=5, 6, при мольном соотношении RC≡CR : CH3CO2(СН2)nCO2CH3 : EtAlCl2 : Mg : Cp2TiCl2 = 10:20:(50-70):40:(1.8-2.2), в тетрагидрофуране в атмосфере аргона при 60°С и атмосферном давлении в течение 4-8 ч. Выход метил n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоатов (1) составляет 54-76%. Эти соединения представляют интерес в качестве исходных синтонов для создания биологически активных соединений медицинского и сельскохозяйственного назначения, проявляющих антибактериальные, противовирусные, противовоспалительные, противогрибковые, противоопухолевые, обезболивающие, противосудорожные свойства. 1 табл., 1 пр.

Способ получения метил n-[3,4-диалкил-5-(n-метокси-n-оксоалкил)-2-фурил]алканоатов общей формулы (1):
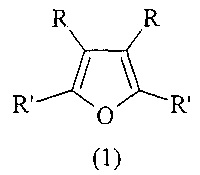
где R=С2Н5, С3Н7, С4Н9; R'=(СН2)nCOOCH3
n=5, 6
взаимодействием диалкилацетиленов общей формулы R-C≡C-R, где R=С2Н5, С3Н7, С4Н9, с эфирами карбоновых кислот в присутствии магния (Mg, порошок) и катализатора Cp2TiCl2, отличающийся тем, что в качестве эфиров карбоновых кислот используются метиловые эфиры α,ω-дикарбоновых кислот CH3CO2(СН2)nCO2CH3, где n=5, 6, реакцию проводят при мольном соотношении RC≡CR : CH3CO2(СН2)nCO2CH3 : EtAlCl2 : Mg : Cp2TiCl2 = 10:20:(50-70):40:(1.8-2.2), в тетрагидрофуране в атмосфере аргона при 60°С и атмосферном давлении в течение 4-8 ч.
| Mariya G.Shaibakova et al, "The efficient one-pot synthesis of tetraalkyl substituted furans from symmentrical acetilenes, EtAlCL2, and carboxylic esters catalyzed by Cp2TiCL2", Tetrahedron letters, 2014, v.55,p.1326-1328 | |||
| Daisuki et al, "Facile Preparation of Various Heteroamatic Compaunds via Azatitanacyclopentadiene Intermediates",JACS,2005, v.127,p.7474-7479 | |||
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛДИГИДРОФУРАН-2(3Н)-ОНОВ | 2013 |
|
RU2537349C2 |
Авторы
Даты
2017-03-24—Публикация
2015-07-06—Подача