Изобретение относится к области органического синтеза, конкретно к способу получения 3-алкилдигидрофуран-2(3H)-онов общей формулы (I):
 (I),
(I),
где R=н-С4Н9, н-С5Н12, н-С6Н13.
Предлагаемые соединения представляют интерес в качестве прекурсоров и строительных блоков в синтезе огромного числа природных соединений, обладающих различного рода биологической активностью ([1], S.C. Sinha, E. Keinan. Total synthesis of naturally occurring acetogenins: solamin and reticulatacin // J. Am. Chem. Soc. 1993, 115, 11, 4891-4892). Интерес к данному классу органических соединений обусловлен возможностью синтеза на их основе ингибиторов ВИЧ-1 протеазы ([2], A.K. Grosh, S.P. McKee, W.J. Thompson. An efficient synthesis of hydroxyethylene dipeptide isosteres: the core unit of potent HIV-1 protease inhibitors // J. Org. Chem. 1991, 56, 23, 6500-6503). Кроме того, они известны как носители приятных запахов и поэтому представляют интерес для пищевой и косметической промышленности ([3], U. Ravid, R.M. Silverstein, L.R. Smiht. Synthesis of the enantiomers of 4-substituted γ-lactones with known absolute configuration // Tetrahedron, 1978, 34, 1499-1452).
Известен способ ([4], М. Casey, A.C. Manage, P.J. Murphy. A novel stereoselective route to γ-butyrolactones // Tetrahedron Lett., 1992, 33, 7, 965-968) получения 4,5-дизамещенных дигидрофуран-2(3H)-онов общей формулы (2) присоединением сульфоксидов к α,β-ненасыщенным эфирам карбоновых кислот в присутствии литийизопропиламида (LDA) (ТГФ, -78°C) с последующей перегруппировкой образующегося аддукта с помощью N-галогенсукцинимида (NXS) или PhI(OCOCF3)2 в хлористом метилене при комнатной температуре по схеме:

Известным способом не могут быть получены 3-алкилдигидрофуран-2(3H)-оны (1).
Известен способ ([5], A.M. Meyers, Y. Yamamoto, E.D. Mihelich, R.A. Bell. Asymmetric synthesis of 2-disubstituted butyrolactones and valerolactones // J. Org. Chem. 1980, 45, 14, 2792-2796) получения 3-алкилдигидрофуран-2(3H)-онов общей формулы (4) кислотным гидролизом α-замещенных оксазолинов (3) по схеме:

Известен способ ([6], M. Maslak, R. Matovic, R.N. Saicic. Reaction of silyl ketene acetales with epoxides: a new method for the synthesis of the γ-butanolides // Tetrahedron, 2004, 60, 8957-8966) получения 3-бутилдигидрофуран-2(3H)-она (1a) взаимодействием силилкетенацеталя с эпоксидом и TiCl4 с последующим добавлением каталитических количеств пара-TsOH:

Недостатком данного способа является необходимость проведения реакции при низкой температуре (-60°C), а также выделение промежуточного продукта перед добавлением пара-толуолсульфокислоты (пара-TsOH).
Предлагается новый способ получения 3-алкилдигидрофуран-2(3H)-онов общей формулы (1).
Сущность способа заключается во взаимодействии N,N-диметилалк-2-ин-1-аминов общей формулы (CH3)2NCH2≡C-R, где R=C4H9, С5Н11, С6Н13 с триэтилалюминием (AlEt3) в гексане в инертной атмосфере в присутствии катализатора цирконацендихлорида (Cp2ZrCl2), взятых в мольном соотношении (CH3)2NCH2≡C-R:AlEt3:Cp2ZrCl2=10:20:2, при нагревании до ~ 40°C в течение 4 ч, с последующим охлаждением реакционной массы до -10°C, добавлением эфирата трехфтористого бора (BF3·Et2O) в двукратном по отношению к AlEt3 количестве и перемешиванием при комнатной температуре (~ 20°C) в течение 45 мин. К охлажденной до 0°C реакционной массе добавляют 20%-ный раствор NaOH и затем медленно по каплям 30%-ный раствор Н2О2. Реакционную массу перемешивают в течение 24 ч. Выход целевого продукта (1) составляет 60-62%. Реакция протекает по схеме:
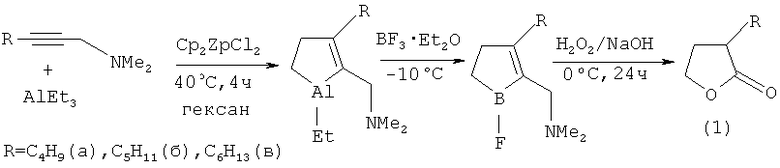
3-Алкилдигидрофуран-2(3H)-оны (1) образуются только лишь с участием N,N-диметилалк-2-ин-1-аминов, триэтилалюминия, катализатора цирконацендихлорида, эфирата трехфтористого бора, перекиси водорода и водного раствора щелочи. В присутствии других фторсодержащих производных бора (например, EtBF2, PhBF3K), других алюминийорганических соединений (например, Et2AlCl, EtAlCl2), других непредельных соединений (например, диалкилзамещенные ацетилены, α-олефины) или другого катализатора (например, Cp2TiCl2, Pd(acac)2, NiCl2, Ni(acac)2, CoCl2) целевые продукты (1) не образуются.
Существенные отличия предлагаемого способа:
В известном способе в качестве исходных реагентов используются силилкетен-ацеталь, эпоксид, TiCl4 и катализатор пара-TsOH. Синтез осуществляется в две стадии с выделением промежуточного продукта. Первая стадия проводится при низкой температуре (-60°C).
В предлагаемом способе используются в качестве исходных соединений N,N-диметилалк-2-ин-1-амины, триэтилалюминий, катализатор цирконацендихлорид, эфират трехфтористого бора и перекись водорода.
Преимущества предлагаемого метода:
1. Предлагаемый способ является однореакторным.
2. Реакция не требует сильного охлаждения.
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор, установленный на магнитной мешалке, в атмосфере инертного газа последовательно помещают 50 мл гексана, 1.39 г (10 ммоль) N,N-диметилгекс-2-ин-1-амина, 0.58 г (2.0 ммоль) Cp2ZrCl2, 3.2 мл (20 ммоль) 86%-ного Et3Al и перемешивают 4 ч при нагревании до 40°C. Затем реакционную массу охлаждают до -10°C, добавляют 5.1 мл (40 ммоль) BF3·Et2O и перемешивают при комнатной температуре 45 мин. Затем реакционную массу охлаждают до 0°C и добавляют 6.4 мл 20%-ного водного раствора NaOH и далее медленно по каплям прибавляют 2.0 мл 30%-ного водного раствора Н2О2. Реакционную смесь перемешивают на магнитной мешалке при комнатной температуре в течение 24 ч. После отделения органического слоя водный слой экстрагировали диэтиловым эфиром (2×30 мл). Эфирные экстракты объединяли с органическим слоем, сушили CaCl2 и концентрировали в вакууме. Индивидуальные продукты выделяли колоночной хроматографией на силикагеле (элюент - гексан/этил ацетат (50:1)). Получают 3-бутилдигидрофуран-2(3H)-он (1а) с выходом 62%.

3-н-Бутилдигидрофуран-2(3H)-он (1a): Выход 62%. Rf 0.52 (этилацетат-гексан, 1:5). Спектр ЯМР 1Н (δ, м.д., CDCl3): 0.93 (т, 3Н, СН3, 3J=7.0 Гц), 1.20-1.51 (м, 4Н, СН2), 1.87-2.00 (м, 2Н, СН2), 2.36-2.44 (м, 2Н, СН2), 2.49-2.64 (м, 1Н, СН), 4.20 (м, 1Н, СН2-О), 4.35 (м, 1Н, СН2-О). Спектр ЯМР 13С (δ, м.д., CDCl3): 13.87, 22.44, 28.63, 29.48, 30.03, 39.23, 66.44, 179.62.
ПРИМЕР 2. В стеклянный реактор, установленный на магнитной мешалке, в атмосфере инертного газа последовательно помещают 50 мл гексана, 1.53 г (10 ммоль) N,N-диметилгепт-2-ин-1-амина, 0.58 г (2.0 ммоль) Cp2ZrCl2, 3.2 мл (20 ммоль) 86%-ного Et3Al и перемешивают 4 ч при нагревании до 40°C. Затем реакционную массу охлаждают до -10°C, добавляют 5.1 мл (40 ммоль) BF3·Et2O и перемешивают при комнатной температуре 45 мин. Затем реакционную массу охлаждают до 0°C и добавляют 6.4 мл 20%-ного водного раствора NaOH и далее медленно по каплям прибавляют 2.0 мл 30%-ного водного раствора H2O2. Реакционную смесь перемешивают на магнитной мешалке при комнатной температуре в течение 24 ч. После отделения органического слоя водный слой экстрагировали диэтиловым эфиром (2×30 мл). Эфирные экстракты объединяли с органическим слоем, сушили CaCl2 и концентрировали в вакууме. Индивидуальные продукты выделяли колоночной хроматографией на силикагеле (элюент - гексан/этилацетат (50:1)). Получают 3-амилдигидрофуран-2(3H)-он (1б) с выходом 62%.

3-н-Амилдигидрофуран-2(3H)-он (1б): Выход 62%. Rf 0.53 (этилацетат-гексан, 1:5). Спектр ЯМР 1Н (δ, м.д., CDCl3): 0.89 (т, 3Н, СН3, J=6.8 Гц), 1.25-1.48 (м, 6Н, СН2), 1.87-2.00 (м, 2Н, СН2), 2.35-2.43 (м, 2Н, СН2), 2.47-2.55 (м, 1Н, СН), 4.18 (м, 1Н, CH2-O), 4.33 м (1Н, СН2-О). Спектр ЯМР 13С (δ, м.д., CDCl3): 13.95, 22.42, 26.97, 28.61, 30.26, 31.50, 39.23, 66.49, 179.63.
ПРИМЕР 3. В стеклянный реактор, установленный на магнитной мешалке, в атмосфере инертного газа последовательно помещают 50 мл гексана, 1.67 г (10 ммоль) N,N-диметилокт-2-ин-1-амина, 0.58 г (2.0 ммоль) Cp2ZrCl2, 3.2 мл (20 ммоль) Et3Al и перемешивают 4 ч при нагревании до 40°C. Затем реакционную массу охлаждают до -10°C, добавляют 5.1 мл (40 ммоль) BF3·Et2O и перемешивают при комнатной температуре 45 мин. Затем реакционную массу охлаждают до 0°C и добавляют 6.4 мл 20%-ного водного раствора NaOH и далее медленно по каплям прибавляют 2.0 мл 30%-ного водного раствора H2O2. Реакционную смесь перемешивают на магнитной мешалке при комнатной температуре в течение 24 ч. После отделения органического слоя водный слой экстрагировали диэтиловым эфиром (2×30 мл). Эфирные экстракты объединяли с органическим слоем, сушили CaCl2 и концентрировали в вакууме. Индивидуальные продукты выделяли колоночной хроматографией на силикагеле (элюент - гексан/этилацетат (50:1)). Получают 3-гексилдигидрофуран-2(3H)-он (1в) с выходом 60%.
3-н-Гексилдигидрофуран-2(3H)-он (1в): Выход 60%. Rf 0.53 (этилацетат-гексан, 1:5). Спектр ЯМР 13H смотреть в диссере (δ, м.д., CDCl3): 0.85 (т, 3Н, СН3,J=6.8 Гц), 1.21-1.43 (м, 8Н, СН2), 1.77-1.90 2.05 (м, 2Н, СН2), 2.31-2.38 2.48(м, 2Н, СН2), 2.40-2.51 (м, 1Н, СН), 4.24 (м, 1Н, СН2-O), 4.32 4.41 м (1Н, СН2-O). Спектр ЯМР 13С (δ, м.д., CDCl3). 14.05, 22.90, 25.41, 26.70, 28.60, 30.90, 31.55, 39.90, 66.25, 179.80.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПИРИДИНАТОВ 1-ФТОР(ХЛОР)-3-АЛКИЛ(АРИЛ)БОРОЛАНОВ | 2013 |
|
RU2532925C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-БРОМ-3-АЛКИЛБОРОЛАНОВ | 2012 |
|
RU2507208C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ФТОР-3-АЛКИЛБОРОЦИКЛОПЕНТАНОВ | 2010 |
|
RU2440356C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОР-2,3-ДИАЛКИЛБОРАЦИКЛОПЕНТ-2-ЕНОВ | 2012 |
|
RU2507207C2 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 1,1,3-ТРИАЛКИЛ-1,5-ПЕНТАДИОЛОВ И 1,1,4-ТРИАЛКИЛ-1,5-ПЕНТАНДИОЛОВ | 2002 |
|
RU2235711C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛК-4Z-ЕНОВ | 2001 |
|
RU2203876C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИАЛКИЛ-2-(Н-ПРОПИЛ)-ПРОП-2Z-ЕН-1-ОЛОВ | 2001 |
|
RU2200146C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ЭТИЛ-2-АЗА-3-МЕТИЛ-4-АЛКИЛИДЕНАЛЮМАЦИКЛОГЕПТ-2-ЕНОВ | 2001 |
|
RU2203899C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 1-ЭТИЛАЛЮМАЦИКЛОПЕНТАНОВ | 2001 |
|
RU2191192C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛК-4Z-ЕН-1-ОЛОВ | 2001 |
|
RU2200147C1 |
Изобретение относится к способу получения 3-алкилдигидрофуран-2(3H)-онов формулы I, где R=н-С4Н9,н-С5Н12,н-С6Н13 , который осуществляется взаимодействием N,N-диметилалк-2-ин-1-аминов с триэтилалюминием в присутствии катализатора цирконацендихлорида (Cp2ZrCl2) в инертной атмосфере при температуре ~40°C в течение 4 ч с последующим охлаждением реакционной массы до -10°C, добавлением эфирата трехфтористого бора в двукратном по отношению к AlEt3 количестве, перемешиванием при температуре ~20°C в течение 45 мин, последующим добавлением к охлажденной до 0°C реакционной массе 20%-ного водного раствора NaOH и 30%-ного раствора H2O2 с перемешиванием при комнатной температуре в течение 24 ч. Выход целевых продуктов (1) составляет 60-62%. Данный способ позволяет упростить процесс за счет исключения необходимости проведения процесса при очень низких температурах (-60°С). Полученные соединения представляют интерес в качестве прекурсоров и строительных блоков в синтезе природных соединений, обладающих различного рода биологической активностью, а также известны как носители приятных запахов и поэтому представляют интерес для пищевой и косметической промышленности. 3 пр.
 (I)
(I)
Способ получения 3-алкилдигидрофуран-2(3H)-онов общей формулы (I):
 (I),
(I),
где R=н-С4Н9, н-C5H12, н-С6Н13, характеризующийся тем, что N,N-диметилалк-2-ин-1-амины (N,N-диметилгекс-2-ин-1-амин, N,N-диметилгепт-2-ин-1-амин, N,N-диметилокт-2-ин-1-амин) взаимодействуют с триэтилалюминием (Et3Al) в гексане в присутствии катализатора Cp2ZrCl2 в инертной атмосфере в мольном соотношении N,N-диметилалк-2-ин-1-амин : AlEt3 : Cp2ZrCl2=10:20:2 при температуре ~40°C в течение 4 ч, затем реакционную массу охлаждают до -10°C, добавляют двукратное по отношению к AlEt3 количество эфирата трехфтристого бора и перемешивают при температуре (~20°С) в течение 45 мин, после этого реакционную массу охлаждают до 0°C, добавляют 20%-ный водный раствор NaOH, медленно вводят 30%-ный водный раствор H2O2, перемешивают в течение 24 ч при комнатной температуре.
| Veselin Maslak et al,Tetrahedron,2004,v.60,p.8957-8966 | |||
| US 0006673946 B2 06.01.2004 | |||
| 0 |
|
SU192825A1 | |
| СПОСОБ ПОЛУЧЕНИЯ γ-БУТИРОЛАКТОНА | 1996 |
|
RU2138491C1 |
Авторы
Даты
2015-01-10—Публикация
2013-03-29—Подача