ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет на основании предварительной заявки на выдачу патента США с порядковым номером 60/811850, поданной 1 июня 2006 г., которая включена в данное описание в виде ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым моноклональным антителам, которые распознают содержащий углеводы эпитоп на CD43 и эмбриональном опухолевом антигене (CEA), экспрессируемых на негематопоэтических опухолевых или злокачественных клетках. Такие антитела обладают свойством индуцировать клеточную гибель (например, апоптоз) таких негематопоэтических опухолевых или злокачественных клеток в отсутствие цитотоксичного конъюгирования и иммунной эффекторной функции. Такие моноклональные антитела применимы в качестве диагностических и терапевтических средств.
УРОВЕНЬ ТЕХНИКИ
CD43 (также называемый сиалофорином или лейкосиалином), в большой степени сиалилированная молекула, экспрессируется на высоком уровне на большинстве лейкоцитов человека, включая все T-клетки, и тромбоцитах, с молекулярной массой в диапазоне от 115000 до 135000. Экспрессия CD43 нарушена в T-клетках мужчин с синдромом Вискотта-Олдрича, связанным с X-хромосомой рецессивным иммунодефицитный расстройством (Remold-O’Donnell et al. (1987) Blood 70(1): 104-9; Remold-O’Donnel et al. (1984) J. Exp. Med. 159: 1705-23).
Функциональные исследования показали, что анти-CD43 моноклональное антитело стимулирует пролиферацию T-лимфоцитов периферической крови (Mentzer et al. (1987) J. Exp. Med. 1; 165 (5): 1383-92; Park et al. (1991) Nature, 350:706-9) и активацию моноцитов (Nong et al. (1989) J. Exp. Med. 1: 170(1): 259-67). Моноклональное анти-CD43-антитело L11 блокирует связывание T-клеток с лимфатическим узлом и HEV в пееровых бляшках. Антитело L11 ингибирует экстравазацию T-клеток из крови в организованные вторичные лимфоидные ткани (McEvoy et al. (1997) J. Exp. Med. 185: 1493-8). Моноклональное антитело, распознающее молекулу CD43, индуцирует апоптоз гематопоэтических клеток-предшественников (HPC) костного мозга, негативных по маркеру линии, которые экспрессируют CD34 с высокой плотностью (Bazil et al. (1996) Blood, 87(4): 1272-81), и T-лимфобластоидных клеток человека (Brown et al. (1996) J. Biol. Chem. 271: 27686-95). Кроме того, недавние исследования показали, что CD43 функционирует как лиганд для E-селектина на T-клетках человека (Matsumoto et al. (2005) J. Immunol. 175: 8042-50; Fuhlbrigge et al. (2006) Blood, 107: 1421-6).
Интересно, что ученые также обнаружили, что некоторые негематопоэтические опухолевые клетки, в частности аденокарциномы прямой и ободочной кишки, действительно экспрессируют молекулы CD43 на клеточной поверхности. Santamaria et al. (1996) Cancer Research, 56: 3526-9: Baeckstrom et al. (1995) J. Biol. Chem. 270: 13688-92; Baeckstrom et al. (1997) J. Biol. Chem. 272: 11503-9; Sikut et al. (1997) Biochem. Biophy. Res. Commun. 238: 612-6. Было показано, что гликаны на CD43, экспрессированном на клетках линии карциномы ободочной кишки (COLO 205), отличаются от гликанов на CD43 лейкоцитов (Baeckstrom et al. (1997) J. Biol. Chem. 272: 11503-9). Хотя предполагалось, что сверхэкспрессия CD43 вызывает активацию белка-супрессора опухолей p53 (Kadaja et al. (2004) Oncogene 23: 2523-30) и супрессирует подгруппу генов мишеней NF-kappaB, отчасти благодаря ингибированию транскрипционной активности p65 (Laos et al. (2006) Int. J. Oncol. 28: 695-704), прямое доказательство, показывающее роль CD43 в качестве причины образования опухоли ободочной кишки, все еще отсутствует. Применение обычного анти-CD43-антитела в качестве терапевтического средства в случае негематопоэтических опухолевых клеток невозможно на практике, вследствие его сильного связывания как с опухолевыми клетками, так и с иммунными T-клетками. Остается необходимость в создании антител, которые специфично связываются с CD43, экспрессируемым на негематопоэтических опухолевых или злокачественных клетках, но не связывается с CD43, экспрессируемым на лейкоцитах или других клетках гематопоэтического происхождения. Такие антитела могут быть применимы в качестве терапевтических средств для лечения негематопоэтической злокачественной опухоли, экспрессирующей CD43.
CEA в норме экспрессируется в различных железистых эпителиальных тканях (например, в желудочно-кишечном тракте, респираторном и мочеполовых путях), где он, по-видимому, локализован на апикальной поверхности клеток (Hammarstrom, S. (1999) Semin. Cancer Biol. 9, 67-81). В опухолях, происходящих из таких тканей, наблюдается возрастающий уровень распространения экспрессии CEA от апикального мембранного домена до всей клеточной поверхности, наряду с секрецией белка в кровь (Hammarstrom, S. (1999) Semin. Cancer Biol. 9, 67-81). Чрезмерная экспрессия CEA наблюдается во многих типах злокачественных опухолей, включая рак прямой и ободочной кишки, рак поджелудочной железы, рак легкого, рак желудка, гепатоклеточную карциному, рак молочной железы и рак щитовидной железы. Поэтому CEA использовали в качестве маркера опухолей, и иммунологические анализы с целью измерения повышенного количества CEA в крови пациентов, имеющих злокачественную опухоль, долгое время использовали в клинике для прогнозирования и терапии злокачественных опухолей (Gold P, et al. (1965) J. Expl. Med. 122: 467-81; Chevinsky, A. H. (1991) Semin. Surg. Oncol. 7, 162-166; Shively, J. E. et al., (1985) Crit. Rev. Oncol. Hematol. 2, 355-399).
Еще более важно, что CEA стал потенциально применимым ассоциированным с опухолями антигеном для целенаправленной терапии (Kuroki M, et al. (2002) Anticancer Res 22: 4255-64). разработано две основных методики с использованием CEA в качестве мишени при иммунотерапии злокачественной опухоли. Один способ представляет собой специфичное целенаправленное введение генов-самоубийц (ген синтазы оксида азота (iNOS)) (Kuroki M. et al., (2000) Anticancer Res. 20(6A): 4067-71) или изотопов (Wilkinson R. W. et al., (2001) PNAS USA 98, 10256-60, Goldenberg, D. M. (1991) Am. J. Gastroenterol., 86: 1392-1403, Olafsen T. et al., Protein Engineering, Design and Selection, 17, 21-27, 2004) в CEA-экспрессирующие опухолевые клетки с помощью анти-CEA-антител. Такой способ также был распространен на применение антитела или фрагмента антитела, конъюгированного с терапевтическими средствами, такими как лекарственные средства, токсины, радионуклеотиды, иммуномодуляторы или цитокины. Другой способ заключается в использовании иммунологических цитолитических активностей, в частности посредством зависимой от антител клеточной цитотоксичности (ADCC) или зависимой от комплемента цитотоксичности (CDC), для элиминации опухолевых клеток, экспрессирующих CEA (Imakiire T. et al., (2004) Int. J. Cancer: 108, 564-570). Такие способы часто вызывают высвобождение цитокинов, приводящее к системным побочным эффектам.
Все сообщения, публикации и заявки на выдачу патентов, указанные в данном описании, включены в описание в полном объеме в виде ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение относится к новым антителам, которые специфично связываются с эпитопом на CD43 и CEA, экспрессируемых негематопоэтической злокачественной клеткой, но не связывается специфично с CD43, экспрессируемым лейкоцитом (например, периферическими T-клетками человека) или клеткой Jurkat (лимфобластоидная лейкозная клетка). Эпитоп, с которым связываются антитела, содержит углевод. Такие антитела способны индуцировать гибель клеток в указанных негематопоэтических злокачественных клетках в отсутствие цитотоксичного конъюгирования с антителами и иммунной эффекторной функции.
Изобретение относится к антителу, и такое антитело специфично связывается с эпитопом на CD43 и/или CEA, экспрессируемых негематопоэтической злокачественной клеткой, но не связывается специфично с CD43, экспрессируемым лейкоцитом или клеткой Jurkat, и способно индуцировать апоптоз негематопоэтической злокачественной клетки после связывания с эпитопом, экспрессируемым на клеточной поверхности негематопоэтической злокачественной клетки в отсутствие цитотоксичного конъюгирования и иммунной эффекторной функции, при этом эпитоп содержит углевод, и связывание антитела с эпитопом ингибируется углеводом, содержащим структуру Lea, структуру Lea-лактоза, структуру LNDFH II или структуру LNT. В некоторых вариантах эпитоп, с которым связывается антитело, является чувствительным к фукозе.
Негематопоэтические злокачественные клетки включают, без ограничения, клетки рака прямой и ободочной кишки и рака желудка.
В некоторых вариантах антитело, описанное в данной публикации, является моноклональным антителом. В некоторых вариантах антитело, описанное в данной публикации, является мышиным, человеческим, гуманизированным или химерным антителом.
В некоторых вариантах антитело, описанное в данной публикации, при связывании с эпитопом, экспрессированным на клеточной поверхности негематопоэтической злокачественной клетки, уменьшает количество злокачественных клеток и/или ингибирует рост или пролиферацию злокачественной клетки. Например, уменьшение количества клеток или ингибирование клеточного роста в присутствии антитела составляет по меньшей мере примерно 10%, примерно 20%, примерно 30%, примерно 40%, примерно 50%, примерно 65%, примерно 75% или больше, по сравнению с количеством клеток или клеточным ростом в отсутствие антитела.
В некоторых вариантах антитело, описанное в данной публикации, распознает конформационный эпитоп на внеклеточном домене CD43 и CEA, которые экспрессируются негематопоэтической злокачественной клеткой, при этом конформационный эпитоп содержит структуру, имеющую физические и химические свойства, эквивалентные свойствам структуры, образованной трипептидом N’-Trp-Pro-Ile-C’. В некоторых вариантах антитело, описанное в данной публикации, связывается с полипептидом, содержащим аминокислотную последовательность N’-Trp-Pro-Ile-C’ на N-конце полипептида.
В некоторых вариантах антитело, описанное в данной публикации, конкурирует с антителом, содержащим вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 1, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 2, за связывание с эпитопом, присутствующим на клеточной поверхности негематопоэтической злокачественной клетки.
В некоторых вариантах антитело, описанное в данной публикации, конкурирует с антителом, содержащим вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 4, за связывание с эпитопом, присутствующим на клеточной поверхности негематопоэтической злокачественной клетки.
В некоторых вариантах антитело, описанное в данной публикации, конкурирует с антителом, содержащим вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 6, за связывание с эпитопом, экспрессированным на клеточной поверхности негематопоэтической злокачественной клетки.
В некоторых вариантах антитело содержит вариабельную область тяжелой цепи, содержащую три CDR из аминокислотной последовательности SEQ ID NO: 1, и вариабельную область легкой цепи, содержащую три CDR из аминокислотной последовательности SEQ ID NO: 2. В некоторых вариантах антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 1, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 2.
В некоторых вариантах антитело содержит вариабельную область тяжелой цепи, содержащую три CDR из аминокислотной последовательности SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую три CDR из аминокислотной последовательности SEQ ID NO: 4. В некоторых вариантах антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 4.
В некоторых вариантах антитело содержит вариабельную область тяжелой цепи, содержащую три CDR из аминокислотной последовательности SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую три CDR из аминокислотной последовательности SEQ ID NO: 6. В некоторых вариантах антитело содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 5, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 6.
В некоторых вариантах антитело представляет собой гуманизированное антитело, содержащее вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 7, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 8.
В другом аспекте настоящее изобретение относится к полипептидам, содержащим тяжелую цепь и/или легкую цепь или фрагмент антитела, описанного в данной публикации. Изобретение также относится к полипептидам, полученным из любого из антител, описанных в данной публикации, при этом полипептиды специфично связываются с эпитопом на CD43 и CEA, экспрессируемых негематопоэтической злокачественной клеткой, но не связываются специфично с CD43, экспрессированном лейкоцитом или клеткой Jurkat, и способны индуцировать апоптоз негематопоэтической злокачественной клетки после связывания с CD43, экспрессированном на клеточной поверхности негематопоэтической злокачественной клетки в отсутствие цитотоксичного конъюгирования и иммунной эффекторной функции.
В другом аспекте настоящее изобретение относится к полинуклеотидам, кодирующим любое из антител или полипептидов, описанных в данной публикации. Изобретение также относится к векторам (таким как экспрессирующие векторы), содержащим любой из полинуклеотидов, описанных в данной публикации. Изобретение также относится к клеткам-хозяевам, содержащим любой из полинуклеотидов или векторов, описанных в данной публикации.
В другом аспекте настоящее изобретение относится к композициям, содержащим любое из антител или полипептидов, описанных в данной публикации. В некоторых вариантах антитела или полипептиды связаны с агентом. В некоторых вариантах агент является терапевтическим средством (например, радиоактивными остатками, цитотоксинами и химиотерапевтическими средствами). В некоторых вариантах агент представляет собой метку (например, ферменты, флуоресцирующие молекулы и биотин).
Изобретение также относится к фармацевтической композиции, содержащей эффективное количество любого из антител или полипептидов, описанных в данной публикации, или полинуклеотидов, кодирующих антитела или полипептиды, и фармацевтически приемлемый носитель. В некоторых вариантах антитела или полипептиды связаны с терапевтическим средством. В некоторых вариантах композицию готовят для введения посредством внутрибрюшинной, внутривенной, подкожной и внутримышечной инъекций и других форм введения, таких как оральное, мукозальное, ингаляционное, сублингвальное и т.д.
В некоторых вариантах композиция может содержать более одного антитела согласно изобретению или одно антитело согласно изобретению с одним или несколькими другими противоопухолевыми антителами или другими противоопухолевыми средствами.
В другом аспекте настоящее изобретение относится к способам создания антитела или полипептида, описанного в данной публикации, включающим в себя культивирование клетки-хозяина или ее потомства в условиях, которые обеспечивают возможность продуцирования антитела или полипептида, при этом клетка-хозяин содержит экспрессирующий вектор, который кодирует антитело или полипептид. В некоторых вариантах способ дополнительно включает в себя очистку антитела или полипептида.
В другом аспекте изобретение относится к способам создания любого из антител, описанных в данной публикации, посредством экспрессии одного или нескольких полинуклеотидов, кодирующих антитело (которые могут быть экспрессированы отдельно в виде одной легкой или тяжелой цепи, или обе цепи, и легкая и тяжелая, экспрессируются с одного вектора) в подходящей клетке, обычно с последующим извлечением и/или выделением представляющего интерес антитела или полипептидов.
В другом аспекте настоящее изобретение относится к способам индуцирования апоптоза в негематопоэтической злокачественной клетке, экспрессирующей эпитоп на клеточной поверхности, включающим в себя осуществление контакта злокачественной клетки с антителом или полипептидом, описанным в данной публикации. В некоторых вариантах злокачественная клетка находится в организме индивидуума.
В другом аспекте настоящее изобретение относится к способам лечения негематопоэтической злокачественной опухоли у субъекта, включающим в себя введение субъекту эффективного количества композиции, содержащей антитело или полипептид, описанный в данной публикации, при этом антитело или полипептид связывается со злокачественными клетками в организме субъекта. В некоторых вариантах злокачественная опухоль представляет собой рак прямой и ободочной кишки, поджелудочной железы, желудка или легкого.
В другом аспекте настоящее изобретение относится к способам лечения негематопоэтической злокачественной опухоли у субъекта, включающим в себя введение субъекту определенного количества антитела или полипептида, описанного в данной публикации, и определенного количества другого противоопухолевого средства, при этом антитело или полипептид связывается со злокачественными клетками в организме субъекта и при этом антитело или полипептид и противоопухолевое средство совместно обеспечивают эффективное лечение злокачественной опухоли у субъекта.
В другом аспекте настоящее изобретение относится к наборам для лечения негематопоэтической злокачественной опухоли у субъекта, содержащим антитело или полипептид, описанные в данной публикации. Такие наборы дополнительно могут содержать инструкции по введению антитела или полипептида субъекту для лечения злокачественной опухоли.
В другом аспекте настоящее изобретение относится к способам выявления или диагностики негематопоэтической злокачественной опухоли, выявлению индивидуума, имеющего негематопоэтическую злокачественную опухоль, для лечения или наблюдения за прогрессированием негематопоэтической злокачественной опухоли, включающим в себя осуществление контакта образца с антителом или полипептидом, описанным в данной публикации; и регистрацию наличия или отсутствия или уровня связывания антитела или полипептида с клеткой в образце. Наличие связывания между антителом и клеткой в образце свидетельствует о том, что образец может содержать злокачественную клетку, и/или о том, что субъекта, имеющего злокачественную опухоль, можно лечить антителом, описанным в данной публикации. Способы дополнительно могут включать в себя стадию сравнения уровня связывания с контролем.
В другом аспекте настоящее изобретение относится к наборам для выявления или диагностики негематопоэтической злокачественной опухоли, выявления индивидуума, имеющего негематопоэтическую злокачественную опухоль для лечения или наблюдения за прогрессированием негематопоэтической злокачественной опухоли, содержащим антитело или полипептид, описанный в данной публикации, и реагенты для выявления связывания антитела или полипептида с клеткой в образце.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показаны результаты идентификации белка-мишени 5F1. Белок в элюате с 5F1-иммуноаффинной колонки из лизата COLO 205 (дорожки 1 и 3) или лизата COLO 320 (дорожки 2 и 4) подвергали иммуноблоттингу с использованием коммерческого анти-CD43-антитела AF2038 (дорожки 1 и 2) или антитела 5F1 (дорожки 3 и 4).
На фигуре 2A показаны результаты проточно-цитометрического анализа связывания антитела 5F1 с тремя линиями злокачественных клеток: клеток рака прямой и ободочной кишки (COLO 205 и DLD-1) и клеток рака желудка (NCI-N87).
На фигуре 2B показаны результаты проточно-цитометрического анализа связывания антитела 5F1 с нормальными эндотелиальными клетками (HUVEC), нормальными (эмбриональными) клетками легкого (MRC-5), нормальными эпителиальными клетками молочной железы (MCF-10A), нормальными клетками прямой и ободочной кишки (CCD841-CoN), активированными T-лимфоцитами (активируемыми в течение семи дней) или нормальными мононуклеарными клетками периферической крови (PBMC).
На фигуре 3 показано среднее увеличение количества нуклеосом в цитоплазме клеток COLO 205 после инкубации в присутствии антитела 5F1 или 9E10 (анти-myc-антитело) или в контрольной среде в течение 6, 24, и 48 часов.
На фигуре 4 показаны результаты клеточного роста COLO 205, измеряемого в анализе WST-1 после инкубации с антителом 5F1, 9E10 или азидом in vitro в течение 72 часов.
На фигуре 5 показаны результаты клеточного роста, измеряемого в анализе WST-1. Клетки карциномы прямой и ободочной кишки COLO 205 и линию нормальных клеток прямой и ободочной кишки CCD841-CoN либо не обрабатывали, либо инкубировали с 9E10, 5F1 (называемым «m133-5F1»), либо с 0,5% азидом.
На фигуре 6 показаны результаты окрашивания MTT клеток COLO 205 после инкубации с различными концентрациями 5F1 (0, 2, 4, 8, 16, 32, 64 мкг/мл), 9E10 (64 мкг/мл) или с 0,5% азидом.
На фигуре 7 показано влияние in vivo (на размер опухоли) антитела 5F1 (также называемого «m133-5F1») на опухоли COLO 205 человека у мышей SCID. Антитело 5F1 (500 мкг/инъекцию) или контрольное антитело 9E10 (500 мкг/инъекцию) или PBS (необработанные) инъецировали в 0, 3, 5, 7, 10, 12, 14 и 17 день.
На фигуре 8 показано влияние in vivo (на размер опухоли) антитела 5F1 с химическими лекарственными средствами 5FU/LV на опухоли COLO 205 человека у мышей SCID. 5FU/LV инъецировали внутривенно через день четырьмя дозами по 25 мг/кг через неделю после инокуляции клеток COLO 205. Антитело 5F1 инъецировали внутрибрюшинно в дозе 0, 6,25 мг/кг, 12,5 мг/кг и 25 мг/кг дважды в неделю в течение 3 недель через 7 дней после имплантации опухоли.
На фигуре 9A показаны результаты проточно-цитометрического анализа связывания химерного антитела 5F1 с клеткой COLO 205. На фигуре 9B показано процентное содержание позитивных по аннексину V и PI клеток после инкубации клеток COLO 205 с контрольной средой (необработанные), азидом натрия (0,5%), мышиным антителом 5F1 (m5F1, 2-32 мкг/мл) или химерным антителом 5F1 (c5F1, 2-32 мкг/мл).
На фигуре 10 показано окрашивание клеток COLO 205 и NCI-N87 в отношении апоптозной гибели клеток после инкубации с различными антителами. Клетки COLO 205 и NCI-N87 инкубировали в течение ночи с контролем 9E10 (30 мкг/мл), m5F1 (10 мкг/мл) или m5F1 (30 мкг/мл). Затем клетки красили YO-PRO-I (A) или аннексином-V в сочетании с PI (B). Процент окрашивания для каждого условия показан на гистограмме.
На фигуре 11 показано, что m5F1 связывается с рекомбинантным CEA человека (rhCEA), экспрессированном на клетках COLO 205, но не распознает rhCEA, экспрессированный на клетках COS-7. На фигуре 11A лизаты клеток COLO 205, экспрессирующих flag-меченый CEA человека, иммунопреципитировали анти-Flag-антителом M2, иммунопреципитированные белки подвергали разделению в SDS-ПААГ и затем переносили на бумагу NC. Бумагу NC инкубировали с анти-Flag M2, m5F1, 51-41, 138-10 или CEA/Ab-3, как указано. На фигуре 11B клеточные лизаты клеток COS-7, экспрессирующих flag-меченый CEA человека (+), или клеток COS-7, не экспрессирующих CEA (-), иммунопреципитировали анти-Flag-антителом M2, иммунопреципитированные белки подвергали разделению в SDS-ПААГ и затем переносили на бумагу NC. Бумагу NC инкубировали с анти-Flag M2, m5F1 или CEA/Ab-3, как указано.
На фигуре 12 показано, что m5F1 связывается с рекомбинантным CD43 (rhCD43), экспрессированном на клетках COLO 205, но не распознает rhCD43, экспрессированный на клетках COS-7. На фигуре 12A растворимый CD43, экспрессированный клетками COLO 205, очищенный с использованием шариков с белком A-сефарозой, разгоняли в SDS-ПААГ и переносили на бумагу NC, бумагу NC подвергали Вестерн-блоттингу с антителом m5F1, 51-14 или 138-10. На фигуре 12B клеточные лизаты клеток COS-7, трансфицированных hCD43, hCD43/myc-His, или нетрансфицированных клеток подвергали разделению в SDS-ПААГ и переносили на бумагу NC и бумагу NC подвергали Вестерн-блоттингу с анти-CD43 (MEM59) (левая панель) или m5F1 (правая панель).
На фигуре 13 показано, что антитело m5F1 распознает фукозо-зависимый глико-эпитоп. rhCEA, экспрессированный клетками COLO 205, обрабатывали 0, 0,01, 0,03, 0,1 миллиединиц α-1→(2,3,4)-фукозидазы. После обработки белки подвергали разделению в SDS-ПААГ и затем красили Кумасси синим (правая панель) или подвергали Вестерн-блоттингу с антителом m5F1.
На фигуре 14 показана структура Льюисa-лактозы (Lea-лактозы), Льюисb-лактозы (Leb-лактозы), Льюисx-лактозы (Lex-лактозы), лактозы, Льюисy (Ley), сиалил-Льюисx (сиалил-Lex), Льюисa (Lea), лакто-N-тетраозы (LNT) и лекто-N-дифукогексаозы II (LNDFH II).
На фигуре 15 показаны результаты анализа ингибирования связывания при добавлении олигосахаридов, создающих конкуренцию связыванию m5F1, 138-10, и 51-41 с клетками COLO 205. Олигосахариды (LNDFH II, LNT, sLe(x), Le(y), лактозу, Le(x)-лактозу, Le(b)-лактозу, Le(a)-лактозу или Le(a), каждый в концентрации 1 мМ) добавляли в разные лунки, содержащие 2 x 105 клеток COLO 205, с последующим добавлением антител (138-10, 51-41 или m5F1) или без добавления антител в качестве контроля. Связывание антител с клетками COLO 205 измеряли в анализе с использованием проточной цитометрии. Ингибирование связывания олигосахаридами для каждого антитела показано в процентах ингибирования, определяемого по среднему значению флуоресценции, как показано на фигуре.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
«Антитело» означает молекулу иммуноглобулина, способную специфично связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид, и т.д., посредством, по меньшей мере, одного сайта распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. В используемом в настоящем описании смысле термин охватывает не только интактные поликлональные или моноклональное антитела, но также их фрагменты (такие как Fab, Fab’, F(ab’)2, Fv), одноцепочечные (ScFv), их мутанты, слитые белки, содержащие часть антитела, и любую другую модифицированную форму молекулы иммуноглобулина, которая содержит сайт распознавания антигена. Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или их подклассов), и антитело не обязательно должно относится к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константного домена тяжелых цепей антител иммуноглобулины можно отнести к разным классам. Существуют пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называют альфа, дельта, эпсилон, гамма и мю, соответственно. Субъединичные структуры и трехмерные структуры иммуноглобулинов разных классов хорошо известны.
Предполагается, что антитело согласно настоящему изобретению дополнительно включает биспецифичные, полиспецифичные, одноцепочечные и химерные и гуманизированные молекулы, обладающие аффинностью по отношению к полипептиду, придаваемой, по меньшей мере, одной областью CDR антитела. Антитела согласно настоящему изобретению также включают однодоменные антитела, которые представляют собой либо вариабельный домен тяжелой цепи антитела, либо вариабельный домен легкой цепи антитела. Holt et al., Trends Biotechnol. 21: 484-490, 2003. Способы получения доменных антител, содержащих либо вариабельный домен тяжелой цепи антитела, либо вариабельный домен легкой цепи антитела, содержащих три из шести встречающихся в природе определяющих комплементарность областей антитела, также известны в данной области. См., например, Muyldermans, Rev. MoI. Biotechnol. 74: 277-302, 2001.
В настоящем описании термин «моноклональное антитело» относится к антителу, полученному из по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональное антитела в общем являются высоко специфичными, направленными против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение «моноклональное» указывает характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые согласно настоящему изобретению, могут быть получены способом на основе гибридом, впервые описанным Kohler and Milstein, 1975, Nature 256: 495, или могут быть получены способами на основе рекомбинантной ДНК, такими как способ, описанный в патенте США № 4816567. Моноклональные антитела также могут быть выделены из фаговых библиотек, созданных с использованием способов, описанных, например, McCafferty et al., 1990, Nature 348: 552-554.
В настоящем описании термин «химерное антитело» относится к антителу, имеющему вариабельную область или часть вариабельной области первого вида организмов и константную область второго вида организмов. Интактное химерное антитело содержит две копии химерной легкой цепи и две копии химерной тяжелой цепи. Получение химерных антител известно в данной области (Cabilly et al. (1984), Proc. Natl. Acad. Sci. USA, 81: 3273-3277; Harlow and Lane (1988), Antibodies: a Laboratory Manual, Cold Spring Harbor Laboratory). Обычно в таких химерных антителах вариабельная область и легкой, и тяжелой цепей имитирует вариабельные области антител, полученных из одного вида млекопитающих, тогда как константные части гомологичны последовательностям в антителах, полученных из другого вида. Одно из явных преимуществ таких химерных форм состоит в том, что вариабельные области, например, могут быть легко получены из известных в настоящее время источников с использованием легко доступных гидридом или B-клеток организма-хозяина, не являющегося человеком, в комбинации с константными областями, полученными, например, из препаратов клеток человека. В то время как преимущество вариабельной области заключается в простоте получения и на специфичность не влияет ее источник, константная область, если она является человеческой, менее вероятно вызовет иммунный ответ у человека при инъекции антитела, чем в том случае, когда константная область получена из источника, отличного от человека. Однако определение не ограничено таким конкретным примером.
«Изолированным» антителом является антитело, которое было идентифицировано и отделено и/или извлечено из компонентов его природного окружения.
В настоящем описании термин «по существу очищенный», относится к веществу, которое очищено (т.е. не содержит примесей), по меньшей мере, на 50%, более предпочтительно, очищен, по меньшей мере, на 90%, более предпочтительно очищен, по меньшей мере, на 95%, более предпочтительно очищен, по меньшей мере, на 98%, более предпочтительно очищен, по меньшей мере, на 99%.
В настоящем описании термин «гуманизированные» антитела относится к формам антител животных, отличных от человека (например, мышей), которые представляют собой специфичные химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab’, F(ab’)2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. Главным образом, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками из CDR вида, отличного от человека (донорное антитело), такого как мышь, крыса или кролик, обладающей требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области Fv (FR) иммуноглобулина человека заменяют соответствующими остатками животного, отличного от человека. Кроме того, гуманизированное антитело может содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортируемых последовательностях CDR или каркасных последовательностях, но введены для того, чтобы дополнительно улучшить или оптимизировать эффективность антитела. В общем, гуманизированное антитело будет содержать по существу целиком, по меньшей мере, один и обычно два вариабельных домена, в которых все или в основном все области CDR соответствуют областям CDR иммуноглобулина животного, отличного от человека, и все или по существу все области FR являются областями FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области или домена иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Антитела могут иметь Fc-области, модифицированные как описано в WO 99/58572. Другие формы гуманизированных антител имеют одну или несколько CDR (одну, две, три, четыре, пять, шесть), которые изменены по сравнению с исходным антителом, которые также называют одной или несколькими CDR, «полученными из» одной или нескольких CDR исходного антитела.
В настоящем описании термин «человеческое антитело» означает антитело, которое имеет аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, образуемого в организме человека, и/или которое получено с использованием любого способа получения человеческих антител, который известен в данной области или описан в данной публикации. Такое определение человеческого антитела включает антитела, содержащие по меньшей мере один полипептид тяжелой цепи человека или по меньшей мере один полипептид легкой цепи человека. Одним из таких примеров является антитело, содержащее полипептиды легкой цепи мыши и тяжелой цепи человека. Человеческие антитела могут быть получены с использованием различных способов, известных в данной области. В одном варианте человеческое антитело выбрано из фаговой библиотеки, при этом такая фаговая библиотека экспрессирует человеческие антитела (Vaughan et al., 1996, Nature Biotechnology 14: 309-314; Sheets et al., 1998, PNAS (USA) 95: 6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227: 381; Marks et al., 1991, J. Mol. Biol., 222: 581). Человеческие антитела также могут быть получены введением локусов иммуноглобулинов человека в трансгенных животных, например, мышей, у которых эндогенные гены иммуноглобулинов были частично или полностью инактивированы. Такой способ описан, например, в патентах США № 5545807, 5545806, 5569825, 5625126, 5633425 и 5661016. Альтернативно, человеческое антитело может быть получено посредством иммортализации B-лимфоцитов человека, продуцирующих антитело, направленное против антигена-мишени (такие B-лимфоциты могут быть извлечены из организма человека или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., 1991, J. Immunol., 147 (1): 86-95; и патент США № 5750373.
«Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, либо по отдельности, либо в комбинации. Каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных областей (FR), связаны тремя определяющими комплементарность областями (CDR), также известными как гипервариабельные области. CDR в каждой цепи удерживаются вместе в тесной близости посредством FR и вместе с CDR из другой цепи вносят вклад в образование антигенсвязывающего участка антител. Существует, по меньшей мере, две методики определения CDR: (1) способ, основанный на вариабельности последовательностей разных видов (например, Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) способ, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al. (1997) J. Molec. Biol. 273: 927-948)). В используемом в настоящем описании смысле CDR может относиться к CDR, определяемым любым способом или комбинацией обоих способов.
«Константная область» антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела, либо по отдельности, либо в комбинации. Константная область антитела обычно обеспечивает структурную стабильность и другие биологические функции, такие как ассоциация цепей антитела, секреция, перемещение через плаценту и связывание комплемента, но не участвует в связывании с антигеном. Аминокислотная последовательность и соответствующие последовательности экзонов в генах константной области будут зависеть от вида, из которого она получена; однако изменения в аминокислотной последовательности у данного вида, приводящие к аллотипам, будут относительно ограничены в отношении конкретных константных областей. Вариабельная область каждой цепи связана с константной областью связывающей полипептидной последовательностью. Связывающая последовательность кодируется последовательностью «J» в гене легкой цепи, и комбинацией последовательности «D» и последовательности «J» в гене тяжелой цепи.
В настоящем описании понятие «зависимая от антител опосредованная клетками цитотоксичность» и «ADCC» относятся к опосредованному клетками ответу, при котором неспецифичные цитотоксические клетки, которые экспрессируют рецепторы Fc (FcR) (например, природные клетки-киллеры (NK), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. ADCC-активность представляющей интерес молекулы можно оценить с использованием анализов ADCC in vitro, таких как анализы, описанные в патентах США № 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и NK-клетки. Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в Clynes et al., PNAS (USA) 95: 652-656 (1998).
«Комплемент-зависимая цитотоксичность» и «CDC» относятся к лизису мишени в присутствии комплемента. Путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с молекулой (например, антителом) в комплексе со своим антигеном. Чтобы оценить активацию комплемента, можно осуществить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Термины «полипептид», «олигопептид», «пептид» и «белок» используют в настоящем описании взаимозаменяемо по отношению к полимерам аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может прерываться структурами, отличными от аминокислот. Термины также охватывают полимер аминокислот, который был модифицирован естественным образом или в результате вмешательства; например, в результате образования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой обработки или модификации, такой как конъюгация с метящим компонентом. Также в определение включены, например, полипептиды, содержащие один или несколько аналогов аминокислот (включая, например, неприродные аминокислоты, и т.д.), а также другие модификации, известные в данной области. Следует понимать, что поскольку полипептиды согласно изобретению основаны на антителе, полипептиды могут встречаться в виде отдельных цепей или в виде ассоциированных цепей.
Термины «полинуклеотид» или «нуклеиновая кислота», которые используются в настоящем описании взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть введен в полимер ДНК- или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии модификация в структуру нуклеотида может быть введена до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, посредством конъюгирования с метящим компонентом. Другие типы модификаций включают, например, «кэпы», замены одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы, и т.д.) и заряженными связями (например, фосфоротиоаты, фосфородитиоаты, и т.д.), модификации, содержащие боковые остатки, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, ply-L-лизин, и т.д.), модификации интеркаляторами (например, акридин, псорален и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкиляторы, полинуклеотиды с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть замещена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердыми подложками. 5’- и 3’-концевая группа OH может быть фосфорилирована или замещена аминами или органическими кэпирующими группами из 1-20 атомов углерода. Другие гидроксилы также могут быть дериватизованы стандартными защитными группами. Полинуклеотиды также могут содержать аналогичные формы сахаров рибозы и дезоксирибозы, которые обычно известны в данной области, включая, например, 2’-O-метил-, 2’-O-аллил, 2’-фтор- или 2’-азидорибозу, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и лишенные основания аналоги нуклеозидов, такие как метилрибозид. Одна или несколько фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Такие альтернативные связывающие группы включают, без ограничения, варианты, в которых фосфат заменен P(O)S («тиоатом»), P(S)S («дитиоатом»), (O)NR2 («амидатом»), P(O)R, P(O)OR’, CO или CH2 («формацеталем»), где каждый R или R’ независимо означает H или замещенный или незамещенный алкил (1-20C), необязательно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание применимо ко всем указанным полинуклеотидам, включая РНК и ДНК.
В настоящем описании термин «вектор» означает конструкцию, которая способна доставлять и предпочтительно экспрессировать один или несколько представляющих интерес генов или последовательностей в клетке-хозяине. Примеры векторов включают, без ограничения, вирусные векторы, экспрессирующие векторы на основе «голой» ДНК или РНК, плазмидные, космидные или фаговые векторы, ДНК- или РНК-экспрессирующие векторы, ассоциированные с катионными конденсирующими агентами, ДНК- или РНК-экспрессирующие векторы, инкапсулированные в липосомы, и некоторые эукариотические клетки, такие как клетки-продуценты.
В настоящем описании понятие «последовательность регуляции экспрессии» означает последовательность нуклеиновой кислоты, которая управляет транскрипцией нуклеиновой кислоты. Последовательность регуляции экспрессии может представлять собой промотор, такой как конститутивный или индуцируемый промотор, или энхансер. Последовательность регуляции экспрессии оперативно связана с транскрибируемой последовательностью нуклеиновой кислоты.
В настоящем описании понятие «эффективная доза» или «эффективное количество» лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для получения полезных или требуемых результатов. В случае профилактического применения полезные или требуемые результаты включают такие результаты, как исключение или уменьшение риска, уменьшение тяжести или замедление появления заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, проявляющиеся в ходе развития заболевания. В случае терапевтического применения полезные или требуемые результаты включают клинические результаты, такие как уменьшение одного или нескольких симптомов, возникающих в результате заболевания, улучшение качества жизни пациентов, болеющих таким заболеванием, снижение дозы других лекарственных средств, необходимых для лечения заболевания, усиление действия другого лекарственного средства, например, посредством целенаправленной доставки, замедление прогрессирования заболевания и/или продления жизни. В случае рака или опухоли эффективное количество лекарственного средства может уменьшать количество злокачественных клеток; уменьшать размер опухоли; ингибировать (т.е. в некоторой степени замедлять и предпочтительно останавливать) инфильтрацию злокачественных клеток в периферические органы; ингибировать (т.е. в некоторой степени замедлять и предпочтительно останавливать) метастазирование опухолей; ингибировать в определенной степени рост опухоли; и/или в определенной степени ослаблять один или несколько симптомов, связанных с расстройством. Эффективная доза может быть введена за одно или несколько введений. В целях настоящего изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического лечения либо прямо, либо опосредованно. Как понятно с клинической точки зрения, эффективная доза лекарственного средства, соединения или фармацевтической композиции может быть достигнута или не достигнута вместе с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом «эффективная доза» может рассматриваться в контексте введения одного или нескольких терапевтических средств, и можно считать, что одно средство введено в эффективном количестве, если вместе с одним или несколькими другими средствами может быть достигнут или достигнут требуемый результат.
В настоящем описании понятие «вместе с» относится к введению одного средства лечения в дополнение к другому средству лечения. Как таковой, термин «вместе с» относится к введению одного средства лечения до, во время или после введения субъекту другого средства лечения.
В настоящем описании термин «лечение» означает способ получения полезных или требуемых результатов, и предпочтительно включая клинические результаты. В целях настоящего изобретения полезные или требуемые клинические результаты включают, без ограничения, один или несколько из следующих результатов: уменьшение пролиферации (или уничтожение) злокачественных клеток, уменьшение симптомов, возникающих в результате заболевания, улучшение качества жизни субъектов, страдающих от заболевания, снижение дозы других лекарственных средств, необходимых для лечения заболевания, замедление прогрессирования заболевания и/или продление жизни пациентов.
В настоящем описании понятие «задерживание развития заболевания» означает задержку, торможение, замедление, сдерживание, стабилизацию и/или отсрочивание развития заболевания (такого как злокачественная опухоль). Такая задержка может разной по длительности в зависимости от истории болезни и/или субъекта, подвергаемого лечению. Как понятно специалисту в данной области, достаточная или существенная задержка в действительности может включать в себя предотвращение, в случае которого у субъекта не развивается заболевание. Например, может быть задержана злокачественная опухоль в последней стадии, такая как развитие метастазов.
«Индивидуумом» или «субъектом» является млекопитающее, более предпочтительно человек. Млекопитающие также включают, без ограничения, сельскохозяйственных животных, спортивных животных, домашних животных (таких как кошки, собаки, лошади), приматов, мышей и крыс.
В настоящем описании термин «специфично распознает» или «специфично связывает» относится к измеряемым и воспроизводимым взаимодействиям, таким как привлечение и связывание между мишенью и антителом, что является определяющим признаком присутствия мишени в присутствии гетерогенной популяции молекул, включая биологические молекулы. Например, антитело, которое специфично или предпочтительно связывается с эпитопом, представляет собой антитело, которое связывает такой эпитоп с большей аффинностью, авидностью, более легко и/или более продолжительно, чем оно связывается с другими эпитопами мишени или эпитопами, не имеющими отношение к мишени. Также понятно, что при прочтении приведенного определения, например, что антитело (или компонент или эпитоп), которое специфично или предпочтительно связывается с первой мишенью, может связываться или может не связываться специфично или предпочтительно со второй мишенью. По существу «специфичное связывание» или «предпочтительное связывание» не требует обязательного (хотя может включать) исключительного связывания. Антитело, которое специфично связывается с мишенью, может иметь константу ассоциации, составляющую, по меньшей мере, примерно 103 М-1 или 104 М-1, иногда примерно 105 М-1 или 106 М-1, в других случаях примерно 106 М-1 или 107 M-1, примерно от 108 М-1 до 109 М-1, или примерно от 1010 М-1 до 1011 М-1 или выше. Можно использовать различные формы иммуноанализа для отбора антител, специфично иммунологически взаимодействующих с конкретным белком. Например, обычно используют твердофазные иммуноанализы ELISA для отбора моноклональных антител, иммунологически специфично взаимодействующих с белком. См., например, Harlow and Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbor Publications, New York, где описаны формы и условия иммуноанализов, которые можно использовать для определения специфичной иммунореактивности.
В настоящем описании термины «злокачественная опухоль», «опухоль», «раковый» и «злокачественный» относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом(пролиферацией). Примеры злокачественной опухоли включают, без ограничения, карциному, включая аденокарциному, лимфому, бластому, меланому и саркому. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, рак желудочно-кишечного тракта, ходжкинскую и неходжкинскую лимфому, рак поджелудочной железы, глиобластому, рак шейки матки, глиому, рак яичника, рак печени, такой как карцинома печени и гепатома, рак мочевого пузыря, рак молочной железы, рак ободочной кишки, рак прямой и ободочной кишки (колоректальный рак), карциному эндометрия или матки, карциному слюнных желез, рак почек, такой как почечноклеточная карцинома и опухоли Вильмса, базальноклеточную карциному, меланому, рак простаты, рак щитовидной железы, рак семенников, рак пищевода и различные типы рака головы и шеи.
В используемом в настоящем описании и в прилагаемой формуле изобретения формы единственного числа включают формы множественного числа, если контекст ясно не указывает иное. Например, указание «антитело» является ссылкой на антитела в количестве от одного до множества, например, в молярных количествах, и включает их эквиваленты, известные специалистам в данной области, и т.д.
Понятно, что аспекты и варианты изобретения, описанные в данной публикации, включают случаи «состоящие» и/или «по существу состоящие» из аспектов и вариантов.
Антитела и полипептиды, которые специфично связываются с углеводным эпитопом на CD43 и CEA, экспрессируемых на негематопоэтических злокачественных клетках
Изобретение относится к изолированным антителам и полипептидам, полученным из антител, которые специфично связываются с эпитопом на CD43 и/или CEA, экспрессируемых негематопоэтическими злокачественными клетками, но не связываются специфично с CD43, экспрессируемым лейкоцитом (таким как периферическая T-клетка) или клеткой Jurkat. Антитела и полипептиды согласно изобретению дополнительно могут иметь одно или несколько из следующих свойств: (a) связывание антитела или полипептида с эпитопом уменьшается, если молекулу, содержащую эпитоп, обрабатывают α-1→(2,3,4)-фукозидазой; (b) связывание антитела или полипептида с эпитопом ингибируется углеводом, содержащим структуру Lea, структуру Lea-лактоза, структуру LNDFH II и/или структуру LNT; (c) индуцируют гибель негематопоэтической злокачественной клетки (например, в результате апоптоза) после связывания с эпитопом, экспрессированным на клеточной поверхности злокачественной клетки в отсутствие цитотоксичного конъюгирования и иммунной эффекторной функции; (d) ингибируют клеточный рост или пролиферацию негематопоэтической злокачественной клетки после связывания с эпитопом, экспрессированным на клеточной поверхности злокачественной клетки; и (e) лечат или предотвращают появление у индивидуума негематопоэтической злокачественной опухоли, экспрессирующей эпитоп на клеточной поверхности, такой как рак прямой и ободочной кишки и рак желудка.
В настоящем описании термин «ингибирование» включает частичное и полное ингибирование. Например, связывание антитела или полипептида с эпитопом на CD43 и CEA ингибируется, по меньшей мере, примерно на 20%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50%, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80% или по меньшей мере примерно на 90% углеводом, содержащим структуру Lea, структуру Lea-лактоза, структуру LNDFH II или структуру LNT. Связывание антитела с эпитопом может быть ингибировано посредством прямой конкуренции или другими механизмами.
Примеры негематопоэтических злокачественных клеток, экспрессирующих эпитоп, включают, без ограничения, клетки рака прямой и ободочной кишки (такие как COLO 205 и DLD-1) и клетки рака желудка (такие как NCI-N87).
Антитела и полипептиды согласно настоящему изобретению могут распознавать внеклеточный домен CD43, который присутствует на негематопоэтических злокачественных клетках, но не связываются с внеклеточным доменом CD43 лейкоцитов (например, периферических T-клеток), или внеклеточным доменом CD43, который экспрессируется на клетках Jurkat (лимфобластоидная лейкозная клетка). В некоторых вариантах новые антитела или полипептиды согласно изобретению не связываются специфично с CD43, экспрессируемым клеткой гематопоэтического происхождения.
Антитела согласно изобретению могут включать моноклональные антитела, поликлональные антитела, фрагменты антител (например, Fab, Fab’, F(ab’)2, Fv, Fc, и т.д.), химерные антитела, одноцепочечные антитела (ScFv), их мутанты, слитые белки, содержащие часть антитела, и любую другую модифицированную структуру молекулы иммуноглобулина, которая содержит участок распознавания антигена с требуемой специфичностью. Антитела могут представлять собой антитела мыши, крысы, верблюда, человека или иметь любое другое происхождение (включая гуманизированное антитела).
Аффинность связывания полипептида (включая антитело) с CD43 или CEA может составлять менее чем примерно 500 нМ, примерно 400 нМ, примерно 300 нМ, примерно 200 нМ, примерно 100 нМ, примерно 50 нМ, примерно 10 нМ, примерно 1 нМ, примерно 500 пМ, примерно 100 пМ, или примерно 50 пМ. Как хорошо известно в данной области, аффинность связывания может быть выражена в виде KD или константы диссоциации, и повышенная аффинность связывания соответствует пониженному KD. Один из способов определения аффинности связывания антител с CD43 или CEA заключается в измерении аффинности связывания монофункциональных Fab-фрагментов антитела. Чтобы получить монофункциональные Fab-фрагменты, антитело (например, IgG) можно расщепить папаином или экспрессировать рекомбинантно. Аффинность Fab-фрагмента антитела можно определить, используя поверхностный плазмонный резонанс (система измерения поверхностного плазмонного резонанса (SPR) BIAcore3000TM, BIAcore, INC, Piscaway NJ) и ELISA. Получают кинетические скорости ассоциации (kon) и скорости диссоциации (koff) (обычно измеряемые при 25°C) и вычисляют значения равновесной константы диссоциации (KD) в виде koff/kon.
В некоторых вариантах антитела и полипептиды согласно изобретению уменьшают количество злокачественных клеток и/или ингибируют клеточный рост и пролиферацию опухолевых или злокачественных клеток, которые имеют эпитоп. Предпочтительно имеет место уменьшение количества клеток или ингибирование клеточного роста или пролиферации, по меньшей мере, примерно на 10%, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 65%, примерно на 75% или больше по сравнению с клеткой, не обработанной антителом или полипептидами. Злокачественные клетки включают, без ограничения, рак прямой и ободочной кишки, рак поджелудочной железы, рак легкого, рак желудка.
В некоторых вариантах антитела и полипептиды согласно изобретению способны сами индуцировать гибель клеток, например, посредством апоптоза, после связывания эпитопа, экспрессированного на клеточной поверхности негематопоэтической злокачественной клетки. Термин «индуцировать клеточную гибель» в настоящем описании означает, что антитела или полипептиды согласно настоящему изобретению могут непосредственно взаимодействовать с молекулой, экспрессированной на клеточной поверхности, и только связывание/взаимодействие достаточно для индукции клеточной гибели в клетках без помощи других факторов, таких как цитотоксичное конъюгирование или другие иммунные эффекторные функции, т.е. комплемент-зависимой цитотоксичности (CDC), антитело-зависимой клеточной цитотоксичности (ADCC) или фагоцитоза.
В настоящем описании термин «апоптоз» относится к управляемому генами процессу внутриклеточного разрушения клеток. Апоптоз отличается от некроза; он включает в себя разрушение цитоскелета, сжатие и конденсацию цитоплазмы, экспрессию фосфатидилсерина на наружной поверхности клеточной мембраны и пузыревидные вздутия, приводящие к образованию связанных с клеточной мембраной везикул или апоптозных телец. Процесс также называют «запрограммированной гибелью клеток». Во время апоптоза наблюдаются характерные явления, такие как искривленные клеточные поверхности, конденсация ядерного хроматина, фрагментация хромосомной ДНК и утрата митохондриальной функции. Для выявления апоптоза можно использовать различные известные методики, такие как окрашивание клеток аннексином V, йодидом пропидия, анализ фрагментации ДНК и YO-PRO-1 (Invitrogen).
Способы выявления клеточной гибели (такой как апоптоз) включают, без ограничения, выявление морфологии, фрагментации ДНК, ферментативной активности и распада полипептидов, и т.д. См. Siman et al., патент США № 6048703; Martin and Green (1995), Cell, 82: 349-52; Thomberry and Lazebnik (1998), Science, 281: 1312-6; Zou et al., патент США № 6291643; Scovassi and Poirier (1999), Mol. Cell Biochem., 199: 125-37; Wyllie et al. (1980), Int. Rev. Cytol, 68: 251-306; Belhocine et al. (2004), Technol. Cancer Res. Treat., 3(1): 23-32, указанные публикации включены в данное описание ссылкой.
В некоторых вариантах антитела и полипептиды согласно изобретению распознают конформационный эпитоп, экспрессированный на негематопоэтической злокачественной клетке, и такой эпитоп содержит структуру, имеющую физические и химические свойства, эквивалентные свойствам структуры, образованной трипептидом N’-Trp-Pro-Ile-C’. В настоящем описании понятие «эпитоп, который содержит структуру, имеющую физические и химические свойства, эквивалентные свойствам структуры, образованной пептидом» означает, что обе структуры имеют сходные физические и химические свойства в отношении связывания антитела, так что антитело, которое специфично связывается с одной структурой, может связываться с обеими структурами. В некоторых вариантах антитела и полипептиды связываются с полипептидом, содержащим аминокислотную последовательность N’-Trp-Pro-Ile-C’ на N-конце полипептида.
В некоторых вариантах антитела и полипептиды согласно изобретению конкурирует с антителом 5F1, 138-10 или 51-41 за связывание с эпитопом, экспрессированным на клеточной поверхности злокачественной клетки. В некоторых вариантах антитела или полипептиды согласно изобретению связываются с эпитопом на CD43 или CEA, с которым связывается, по меньшей мере, одно из антител 5F1, 138-10 и 51-41.
Можно использовать основанные на конкуренции анализы для определения того, связывают ли два антитела один и тот же эпитоп, посредством распознавания идентичных или стерически перекрывающихся эпитопов, или одно антитело конкурентно ингибирует связывание другого антитела с антигеном. Такие анализы известны в данной области и подробно описаны в примерах. Обычно антиген или экспрессирующие антиген клетки иммобилизуют на многолуночном планшете и измеряют способность немеченых антител блокировать связывание меченых антител. Обычными метками для таких конкурентных анализов являются радиоактивные метки или ферментные метки.
В некоторых вариантах антителом согласно изобретению является антитело 5F1 или антитело, полученное из 5F1. Вариабельные последовательности тяжелой цепи и легкой цепи 5F1 указаны в SEQ ID NO: 1 и SEQ ID NO: 2, соответственно. Изобретение относится к антителу или полипептиду, содержащему фрагмент или область антитела 5F1. В одном варианте фрагмент представляет собой легкую цепь антитела 5F1. В другом варианте фрагмент представляет собой тяжелую цепь антитела 5F1. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 5F1. В еще одном варианте фрагмент содержит одну, две или три CDR из легкой цепи и/или тяжелой цепи антитела 5F1. В некоторых вариантах антитело представляет собой гуманизированное антитело 5F1, такое как h5F1, содержащее вариабельную область тяжелой цепи, показанную в SEQ ID NO: 7, и вариабельную область легкой цепи, показанную в SEQ ID NO: 8. В некоторых вариантах одна или несколько CDR, полученных из антитела 5F1, по меньшей мере, примерно на 85%, по меньшей мере, примерно на 86%, по меньшей мере, примерно на 87%, по меньшей мере, примерно на 88%, по меньшей мере, примерно на 89%, по меньшей мере, примерно на 90%, по меньшей мере, примерно на 91%, по меньшей мере, примерно на 92%, по меньшей мере, примерно на 93%, по меньшей мере, примерно на 94%, по меньшей мере, примерно на 95%, по меньшей мере, примерно на 96%, по меньшей мере, примерно на 97%, по меньшей мере, примерно на 98% или, по меньшей мере, примерно на 99% идентичны, по меньшей мере одной, по меньшей мере двум, по меньшей мере трем, по меньшей мере четырем, по меньшей мере пяти или по меньшей мере шести CDR 5F1.
В некоторых вариантах антителом согласно изобретению является антитело 138-10 или антитело, полученное из 138-10. Вариабельные последовательности тяжелой цепи и легкой цепи 138-10 указаны в SEQ ID NO: 3 и SEQ ID NO: 4, соответственно. Изобретение относится к антителу или полипептиду, содержащему фрагмент или область антитела 138-10. В одном варианте фрагмент представляет собой легкую цепь антитела 138-10. В другом варианте фрагмент представляет собой тяжелую цепь антитела 138-10. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 138-10. В еще одном варианте фрагмент содержит одну, две или три CDR из легкой цепи и/или тяжелой цепи антитела 138-10. В некоторых вариантах антитело представляет собой гуманизированное антитело 138-10. В некоторых вариантах одна или несколько CDR, полученных из антитела 138-10, по меньшей мере примерно на 85%, по меньшей мере примерно на 86%, по меньшей мере примерно на 87%, по меньшей мере примерно на 88%, по меньшей мере примерно на 89%, по меньшей мере примерно на 90%, по меньшей мере примерно на 91%, по меньшей мере примерно на 92%, по меньшей мере примерно на 93%, по меньшей мере примерно на 94%, по меньшей мере примерно на 95%, по меньшей мере примерно на 96%, по меньшей мере примерно на 97%, по меньшей мере примерно на 98% или по меньшей мере примерно на 99% идентичны по меньшей мере одной, по меньшей мере двум, по меньшей мере трем, по меньшей мере четырем, по меньшей мере пяти или по меньшей мере шести CDR 138-10.
В некоторых вариантах антителом согласно изобретению является антитело 51-41 или антитело, полученное из 51-41. Вариабельные последовательности тяжелой цепи и легкой цепи 51-41 указаны в SEQ ID NO: 5 и SEQ ID NO: 6, соответственно. Изобретение относится к антителу или полипептиду, содержащему фрагмент или область антитела 51-41. В одном варианте фрагмент представляет собой легкую цепь антитела 51-41. В другом варианте фрагмент представляет собой тяжелую цепь антитела 51-41. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 51-41. В еще одном варианте фрагмент содержит одну, две или три CDR из легкой цепи и/или тяжелой цепи антитела 51-41. В некоторых вариантах антитело представляет собой гуманизированное антитело 51-41. В некоторых вариантах одна или несколько CDR, полученных из антитела 51-41, по меньшей мере примерно на 85%, по меньшей мере примерно на 86%, по меньшей мере примерно на 87%, по меньшей мере примерно на 88%, по меньшей мере примерно на 89%, по меньшей мере примерно на 90%, по меньшей мере примерно на 91%, по меньшей мере примерно на 92%, по меньшей мере примерно на 93%, по меньшей мере примерно на 94%, по меньшей мере примерно на 95%, по меньшей мере примерно на 96%, по меньшей мере примерно на 97%, по меньшей мере примерно на 98% или по меньшей мере примерно на 99% идентичны, по меньшей мере одной, по меньшей мере двум, по меньшей мере трем, по меньшей мере четырем, по меньшей мере пяти или по меньшей мере шести CDR 51-41.
В некоторых вариантах CDR представляют собой CDR согласно Kabat. В других вариантах CDR представляют собой CDR согласно Chothia. В других вариантах CDR представляют собой комбинацию CDR согласно Kabat и Chothia (также называемые «комбинированными CDR» или «расширенными CDR»). Другими словами, в случае любого конкретного варианта, содержащего более одной CDR, CDR могут быть любыми, согласно Kabat, Chothia и/или комбинированными.
Способы получения антител и полипептидов, происходящих из антител, известны в данной области и описаны в настоящей публикации. Моноклональные антитела согласно настоящему изобретению могут быть получены с использованием хорошо разработанных способов. Например, моноклональные антитела могут быть получены с использованием методики гибридом, такой как способ, описанный в Kohler and Milstein (1975), Nature, 256: 495. В случае основанного на гибридомах способа мышь, хомячка или другого подходящего животного-хозяина обычно иммунизируют иммунизирующим агентом (например, злокачественной клеткой, экспрессирующей CD43 или CEA, CD43 или CEA (включая внеклеточный домен и его фрагменты, экспрессируемые злокачественной клеткой), которые могут быть очищены с использованием антител, описанных в данной публикации, или полипептидом, содержащим аминокислотную последовательность N’-Trp-Pro-Ile-C’ на N-конце полипептида), чтобы вызвать появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфично связываться с иммунизирующим агентом. Альтернативно лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с иммортализованной линией клеток, используя подходящее для слияния средство, такое как полиэтиленгликоль, с образованием клетки гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, (1986) pp. 59-1031). Иммортализованными линиями клеток обычно являются трансформированные клетки млекопитающих, особенно клетки миеломы грызунов, кролика, быка и человека. Обычно используют линии клеток миеломы крыс или мышей. Клетки гибридомы можно культивировать в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или жизнеспособность неслитых иммортализованных клеток. Например, если в исходных клетках отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), то культуральная среда для гидридом обычно будет содержать гипоксантин, аминоптерин и тимидин («среда HAT»), и такие вещества предотвращают рост HGPRT-дефицитных клеток.
Предпочтительными иммортализованными линиями клеток являются линии клеток, которые эффективно сливаются, поддерживают стабильный высокий уровень экспрессии антитела выбранными продуцирующими антитела клетками и являются чувствительными к такой среде, как среда HAT. Более предпочтительными иммортализованными линиями клеток являются линии миеломы мышей, которые могут быть получены, например, от Salk Institute Cell Distribution Center, San Diego, Calif, и Американской коллекции типов культур (АТСС), Manassas, Va. Описаны линии клеток миеломы человека и гетеромиеломы мышь-человек также для получения моноклональных антител человека (Kozbor, J. Immunol. (1984), 133: 3001; Brodeur et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York, (1987) pp. 51-63).
Культуральную среду, в которой культивируют клетки гибридомы, затем можно оценить в отношении присутствия моноклональных антител. Антитела могут быть подвергнуты скринингу в отношении специфичного связывания с эпитопом на CD-43 или CEA, экспрессируемых негематопоэтической злокачественной опухолью или опухолевыми клетками, и отсутствия специфичного связывания с CD43, экспрессируемым лейкоцитами, клетками Jurkat и/или другими экспрессирующими CD43 клетками гематопоэтического происхождения. Для скрининга могут быть использованы злокачественные клетки или внеклеточный домен (включая его фрагменты), содержащие эпитоп. Например, для скрининга можно использовать CEA-N-A2, экспрессированный клетками COLO 205, описанными в примере 10.
Линия клеток Jurkat является линией лимфобластоидных лейкозных клеток и была создана из периферической крови 14-летнего мальчика Schneider et al. Schneider et al., Int. J. Cancer 19: 621-626, 1977. Различные линии клеток Jurkat являются коммерчески доступными, например, из Американской коллекции типов культур (например, ATCC TIB-152, ATCC TIB-153, ATCC CRL-2678).
Предпочтительно специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют иммунопреципитацией или используя анализ связывания in vitro, такой как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Такие способы и анализы известны в данной области. Аффинность связывания моноклонального антитела можно определить, например, с использованием анализа Скэтчарда согласно Munson and Pollard (1980), Anal. Biochem., 107: 220.
Идентифицированные антитела затем можно тестировать в отношении их способности индуцировать клеточную гибель (например, апоптоз) и/или ингибировать клеточный рост или пролиферацию с использованием способов, известных в данной области и описанных в настоящей публикации.
После идентификации требуемых клеток гибридомы клоны могут быть субклонированы способами лимитирующего разведения и выращены стандартными способами (Goding, выше). Подходящие культуральные среды для такой цели включают, например, модифицированную по Дульбекко среду Игла или среду RPMI-1640. Альтернативно клетки гибридомы могут быть выращены in vivo в виде асцитов у млекопитающего.
Моноклональные антитела могут быть созданы посредством культивирования клеток гибридомы, и антитела, секретируемые клетками гибридомы, затем могут быть выделены или очищены. Антитела могут быть выделены или очищены из культуральной среды или асцитной жидкости обычными способами очистки иммуноглобулинов, такими как, например, хроматография на белок A-сефарозе, гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография.
Антитела согласно изобретению также могут быть получены способами, основанными на рекомбинации ДНК, такими как способы, описанные в патентах США № 4816567 и 6331415, которые включены в данное описание ссылкой, например, ДНК, кодирующая моноклональные антитела согласно изобретению, легко может быть выделена и секвенирована с использованием обычных способов (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). Клетки гибридомы согласно изобретению служат в качестве предпочтительного источника такой ДНК. После выделения ДНК можно поместить в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки обезьян COS, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в других условиях не продуцируют белок иммуноглобулина, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах. ДНК также может быть модифицирована, например, заменой кодирующей последовательностью для константных доменов тяжелой и легкой цепи человека вместо гомологичных мышиных последовательностей (патент США № 4816567) или ковалентным связыванием с последовательностью, кодирующей иммуноглобулин, всей или части последовательности, кодирующей неиммуноглобулиновый полипептид. Таким неиммуноглобулиновым полипептидом можно заменить константные домены антитела согласно изобретению или можно заменить вариабельные домены одного антигенсвязывающего центра антитела согласно изобретению, чтобы создать химерное бивалентное антитело.
В некоторых вариантах антитела согласно настоящему изобретению экспрессируются с двух экспрессирующих векторов. Первый экспрессирующий вектор кодирует тяжелую цепь антитела (например, гуманизированного антитела) и содержит первую часть, кодирующую вариабельный область тяжелой цепи антитела, и вторую часть, кодирующую константную область тяжелой цепи антитела. В некоторых вариантах первая часть кодирует вариабельную область, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 7. Второй экспрессирующий вектор кодирует легкую цепь антитела и содержит первую часть, кодирующую вариабельную область легкой цепи антитела, и вторую часть, кодирующую константную область легкой цепи антитела. В некоторых вариантах первая часть кодирует вариабельную область, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 8.
Альтернативно антитела (например, гуманизированное антитело) согласно настоящему изобретению экспрессируются с одного экспрессирующего вектора. Один экспрессирующий вектор кодирует и тяжелую цепь, и легкую цепь антител согласно настоящему изобретению. В некоторых вариантах экспрессирующий вектор содержит полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 7, и вариабельную область легкой цепи, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 8.
Обычно экспрессирующий вектор имеет последовательности регуляции транскрипции и трансляции, которые получены из вида, совместимого с клеткой-хозяином. Кроме того, вектор обычно несет специфичный ген (гены), который способен (способны) обеспечивать фенотипическую селекцию трансформированных клеток.
Известно широкое множество систем экспрессии рекомбинантный хозяин-вектор для эукариотических клеток, и они могут быть использованы в изобретении. Например, Saccharomyces cerevisiae или обычные пекарские дрожжи являются наиболее часто используемыми среди эукариотических микроорганизмов, хотя доступны некоторые другие штаммы, такие как Pichia pastoris. Линии клеток, полученных из многоклеточных организмов, такие как Sp2/0 или клетки яичника китайского хомячка (CHO), которые доступны из ATCC, также могут быть использованы в качестве хозяев. Обычными векторными плазмидами, подходящими для трансформации эукариотических клеток, являются, например, pSV2neo и pSV2gpt (ATCC), pSVL и pSVK3 (Pharmacia), и pBPV-1/pML2d (International Biotechnology, Inc.).
Эукариотическими клетками-хозяевами, применимыми в настоящем изобретении, предпочтительно являются клетки гибридомы, миеломы, плазмацитомы или лимфомы. Однако другие эукариотические клетки-хозяева могут быть соответствующим образом использованы, при условии, что клетки-хозяева млекопитающих способны распознавать транскрипционные и трансляционные последовательности ДНК для экспрессии белков; процессировать лидерный пептид отщеплением лидерной последовательности и секретировать белки; и обеспечивать посттрансляционные модификации белков, например, гликозилирование.
Соответственно, настоящее изобретение относится к эукариотическим клеткам-хозяевам, которые трансформированы рекомбинантными экспрессирующими векторами, содержащими конструкции ДНК, описанные в данной публикации, и которые способны экспрессировать антитела или полипептиды согласно настоящему изобретению. Следовательно, в некоторых вариантах трансформированные клетки-хозяева согласно изобретению, содержат по меньшей мере одну конструкцию ДНК, содержащую последовательности ДНК легкой и тяжелой цепей, описанные в данной публикации, и транскрипционные и трансляционные регуляторные последовательности, которые расположены относительно последовательностей ДНК, кодирующих легкую и тяжелую цепь так, чтобы управлять экспрессией антител или полипептидов.
Клетки-хозяева, используемые в изобретении, могут быть трансформированы различными путями с использованием стандартных способов трансфекции, хорошо известных в данной области. К стандартным способам трансфекции, которые могут быть использованы, относятся способы электропорации, способы слияния протопластов и преципитации фосфатом кальция. Такие методики в общем описаны в F. Toneguzzo et al. (1986), Mol. Cell Biol, 6: 703-706; G. Chu et al., Nucleic Acid Res. (1987), 15: 1311-1325; D. Rice et al., Proc. Natl. Acad. Sci. USA (1979), 79: 7862-7865; и V. Oi et al., Proc. Natl. Acad. Sci. USA (1983), 80: 825-829.
В случае двух экспрессирующих векторов два таких экспрессирующих вектора могут быть перенесены в клетку-хозяина отдельно друг за другом или вместе (совместный перенос или котрансфекция).
Настоящее изобретение также относится к способу получения антител или полипептидов, который включает в себя культивирование клетки-хозяина, содержащей экспрессирующий вектор(ры), кодирующий антитела или полипептиды, и извлечение антител или полипептидов из культуры способами, хорошо известными специалисту в данной области.
Кроме того, требуемые антитела могут быть получены в организме трансгенного животного. Подходящее трансгенное животное может быть получено стандартными способами, которые включают микроинъекцию в яйцеклетки подходящих экспрессирующих векторов, перенос яйцеклеток псевдобеременным самкам и отбор потомков, экспрессирующих требуемое антитело.
Настоящее изобретение также относится к химерным антителам, которые специфично распознают эпитоп на CD43 и CEA, экспрессируемых злокачественной клеткой. Например, вариабельные и константные области химерного антитела получают от разных видов. В некоторых вариантах вариабельные области и тяжелой цепи, и легкой цепи получают из мышиных антител, описанных в данной публикации. В некоторых вариантах вариабельные области содержат аминокислотные последовательности, показанные в SEQ ID NO: 1 и SEQ ID NO: 2. В некоторых вариантах вариабельные области содержат аминокислотные последовательности, показанные в SEQ ID NO: 3 и SEQ ID NO: 4. В некоторых вариантах вариабельные области содержат аминокислотные последовательности, показанные в SEQ ID NO: 5 и SEQ ID NO: 6. В некоторых вариантах константные области и тяжелой цепи и легкой цепь получены из антител человека.
Химерное антитело согласно настоящему изобретению может быть получено способами, хорошо разработанными в данной области. См., например, патент США № 6808901, патент США № 6652852, патент США № 6329508, патент США № 6120767 и патент США № 5677427, каждый из которых включен в данное описание ссылкой. В общем, химерное антитело может быть получено посредством получения кДНК, кодирующих вариабельные области тяжелой и легкой цепей антител, встраивания кДНК в экспрессирующий вектор, который при введении в эукариотические клетки-хозяева экспрессирует химерное антитело согласно настоящему изобретению. Предпочтительно экспрессирующий вектор несет функционально полную константную последовательность тяжелой или легкой цепи, так чтобы любую вариабельную последовательность тяжелой или легкой цепи можно было легко встроить в экспрессирующий вектор.
Настоящее изобретение относится к гуманизированному антителу, которое специфично распознает эпитоп на CD43 и CEA, экспрессируемых негематопоэтической злокачественной клеткой. Гуманизированное антитело обычно представляет собой антитело человека, в котором остатки из CDR заменены остатками из CDR вида, отличного от человека, такого как мышь, крыса или кролик, обладающими требуемой специфичностью, аффинностью и емкостью. В некоторых случаях каркасные остатки Fv антитела человека заменяют соответствующими остатками, полученными из вида, отличного от человека.
Существуют четыре основные стадии гуманизации моноклонального антитела. А именно: (1) определение нуклеотидной и расчет аминокислотной последовательности вариабельных доменов легкой и тяжелой цепи исходного антитела; (2) проектирование гуманизированного антитела, т.е. решение вопроса о том, какую каркасную область антитела использовать в ходе процесса гуманизации; (3) выполнение методики/способов гуманизации и (4) трансфекция и экспрессия гуманизированного антитела. См., например, патенты США № 4816567, 5807715, 5866692, 6331415, 5530101, 5693761, 5693762, 5585089, 6180370 и 6548640. Например, константная область может быть сконструирована так, чтобы она больше была похожа на константные области человека, чтобы избежать иммунного ответа в случае применения антитела в клинических испытаниях и при лечении человека. См., например, патенты США № 5997867 и 5866692.
Важно, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других предпочтительных биологических свойств. Для достижения указанной цели гуманизированные антитела можно получать способом анализа исходных последовательностей и различных концептуальных гуманизированных продуктов, используя трехмерные модели исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Имеются компьютерные программы, которые иллюстрируют и демонстрируют изображения возможных трехмерных конформационных структур выбранных для исследования иммуноглобулиновых последовательностей. Просмотр таких изображений позволяет проводить анализ вероятной роли остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е анализ остатков, которые влияют на способность выбранного для исследования иммуноглобулина связывать его антиген. Таким образом, остатки FR могут быть выбраны и скомбинированы из консенсусной и импортируемой последовательности так, чтобы получить требуемое свойство антитела, такое как повышенная аффинность по отношению к антигену-мишени. В общем, остатки CDR непосредственно и в наибольшей степени вовлечены в процесс, влияющий на связывание антигена. Гуманизированные антитела также могут содержать модификации в шарнирной области, чтобы улучшить одно или несколько характеристик антитела.
В другом альтернативном варианте антитела могут быть подвергнуты скринингу и получены рекомбинантно с использованием методики фагового дисплея. См., например, патенты США № 5565332, 5580717, 5733743 и 6265150; и Winter et al., Annu. Rev. Immunol. 12: 433-455 (1994). Альтернативно методика фагового дисплея (McCafferty et al., Nature 348: 552-553 (1990)) может быть использована для получения антител человека и фрагментов антител in vitro из репертуаров генов вариабельных (V) доменов иммуноглобулинов неиммунизированных доноров. Согласно указанной методике гены V-доменов антител клонируют в рамке в гене либо основного, либо минорного белка оболочки нитчатого бактериофага, такого как M13 или fd, и представляют в виде функциональных фрагментов антител на поверхности фаговой частицы. Поскольку нитчатая частица содержит однонитевую копию ДНК фагового генома, то селекция, основанная на функциональных свойствах антител, также приводит к селекции гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые свойства B-клетки. Фаговый дисплей может быть осуществлен в разных формах; см. обзор, например, в Johnson, Kevin S. and Chiswell, David J., Current Opinion in Structural Biology 3, 564-571 (1993). Для фагового дисплея можно использовать несколько источников участков V-генов. Clackson et al., Nature 352: 624-628 (1991), выделили ряд разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученных из селезенки иммунизированных мышей. Можно сконструировать репертуар V-генов неиммунозированных людей, и антитела к матрице разнообразных антигенов (включая аутоантигены) могут быть выделены по существу согласно методике, описанной в Mark et al., J. Mol. Biol. 222: 581-597 (1991), или Griffith et al., EMBO J. 12: 725-734 (1993). При естественном иммунном ответе гены антител с высокой скоростью накапливают мутации (соматическое гипермутирование). Некоторые введенные изменения будут придавать более высокую аффинность, и во время последующей антигенной стимуляции предпочтительно реплицируются и дифференцируются B-клетки, представляющие высокоаффинный поверхностный иммуноглобулин. Такой природный процесс можно имитировать, используя способ, известный как «перетасовка цепей». Marks, et al., Bio/Technol. 10: 779-783 (1992)). В указанном способе аффинность «первичных» антител человека, полученных с использованием фагового дисплея, может быть улучшена последовательной заменой генов V-областей тяжелой и легкой цепи репертуарами встречающихся в природе вариантов (репертуаров) генов V-доменов, полученных от неиммунизированных доноров. Такой способ позволяет получать антитела и фрагменты антител с аффиностями в пМ-нМ-диапазоне. Методика получения очень больших репертуаров антител в фагах (также известных как «mother-of-all libraries» (библиотеки, являющиеся источником всех антител)) описана в Waterhouse et al., Nucl. Acids Res. 21: 2265-2266 (1993). Перетасовка генов также может быть использована для получения антител человека из антител грызунов, при этом антитело человека имеет сходные аффинности и специфичности с исходным антителом грызунов. Согласно указанному способу, который также называют «эпитопный импринтинг», ген V-домена тяжелой или легкой цепи антител грызунов, полученный способом, основанным на фаговом дисплее, заменяют репертуаром генов V-доменов человека, создавая химеры грызун-человек. Селекция по отношению к антигену приводит к выделению вариабельных областей человека, способных восстанавливать функциональный антигенсвязывающий участок, т.е. эпитоп обусловливает выбор партнера (осуществляет импринтинг). Когда процесс повторяют, чтобы заменить оставшийся V-домен грызунов, получают антитело человека (см. публикацию PCT № WO 93/06213, опубликованную 1 апреля 1993 г.). В отличие от традиционной гуманизации антител грызунов посредством прививки CDR, такой способ обеспечивает полностью человеческие антитела, которые не имеют каркасных остатков или остатков CDR, происходящих из грызунов. Очевидно, что хотя приведенное выше обсуждение относится к гуманизированным антителам, общие обсуждаемые принципы применимы для подгонки антител для применения, например, на собаках, кошках, приматах, лошадях и коровах.
В некоторых вариантах антитело является полностью человеческим антителом. Антитела животных, отличных от человека, которые специфично связывают антиген, могут быть использованы для получения полностью человеческого антитела, которое связывается с данным антигеном. Например, специалист в данной области может использовать способ перестановки цепей, при котором тяжелую цепь антитела животного, отличного от человека экспрессируют совместно с библиотекой для экспрессии, экспрессирующей разные легкие цепи человека. Полученные гибридные антитела, содержащие одну легкую цепь человека и одну тяжелую цепь животного, отличного от человека, затем подвергают скринингу в отношении связывания антигена. Легкие цепи, которые принимают участие в связывании антигена, затем коэкпрессируют с библиотекой тяжелых цепей антител человека. Полученные человеческие антитела еще раз подвергают скринингу в отношении связывания антигена. Способы, такие как указанный способ, дополнительно описаны в патенте США 5565332. Кроме того, можно использовать антиген для прививки животного, которое является трансгенным по генам иммуноглобулинов человека. См., например, патент США 5661016.
Антитело может представлять собой биспецифичное антитело, моноклональное антитело, которое обладает специфичностями связывания по отношению, по меньшей мере, к двум разным антигенам, и может быть получено с использованием антител, раскрытых в настоящем описании. Способы получения биспецифичных антител известны в данной области (см., например, Suresh et al., 1986, Methods in Enzymology 121: 210). Традиционно рекомбинантное получение биспецифичных антител основано на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулинов, при этом две тяжелые цепи имеют разные специфичности (Millstein and Cuello, 1983, Nature 305, 537-539).
Согласно одному способу получения биспецифичных антител вариабельные домены антител с требуемыми специфичностями связывания (антигенсвязывающие участки антител) сливают с последовательностями константных доменов иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, часть шарнира, области CH2 и CH3. Предпочтительно наличие первой константной области тяжелой цепи (CH1), содержащий участок, необходимый для связывания легкой цепи, присутствующей, по меньшей мере, в одном из слияний. ДНК, кодирующие слияния тяжелых цепей иммуноглобулина и при необходимости легкую цепь иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм-хозян. Это обеспечивает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в тех вариантах, когда неравные соотношения трех полипептидных цепей, используемых при конструировании, обеспечивают оптимальные выходы. Однако можно встроить кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях приводит к высоким выходам, или когда соотношения не имеют особого значения.
В одном способе биспецифичные антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелой цепи-легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Такая асимметричная структура с легкой цепью иммуноглобулина только в одной половине биспецифичной молекулы облегчает отделение требуемого биспецифичного соединения от нежелательных комбинаций цепей иммуноглобулина. Такой способ описан в WO 94/04690, опубликованной 3 марта 1994 г.
Гетероконъюгаты антител, содержащие два ковалентно связанных антитела, также входят в объем изобретения. Такие антитела использовали для того, чтобы направить клетки иммунной системы к нежелательным клеткам (патент США № 4676980), и для лечения ВИЧ-инфекции (публикации PCT WO 91/00360 и WO 92/200373, и EP 03089). Гетероконъюгаты антител могут быть получены с использованием любых способов образования поперечных сшивок. Подходящие поперечно сшивающие агенты и способы хорошо известны в данной области и описаны в патенте США № 4676980.
Также могут быть получены одноцепочечные Fv-фрагменты, такие как фрагменты, описанные в Iliades et al., 1997, FEBS Letters, 409: 437-441. Связывание таких одноцепочечных фрагментов с использованием различных линкеров описано в Kortt et al., 1997, Protein Engineering, 10: 423-433. Различные способы рекомбинантного получения и обработки антител хорошо известны в данной области.
Предполагается, что настоящее изобретение охватывает не только моноклональное антитела, описанные выше, но также любые их фрагменты, содержащие активную связывающую область антител, такие как фрагменты Fab, F(ab’)2, scFv, Fv и тому подобные. Такие фрагменты могут быть получены из моноклональных антител, описанных в данной публикации, с использованием способов, хорошо разработанных в данной области (Rousseaux et al. (1986), in Methods Enzymol., 121: 663-69 Academic Press).
Способы получения фрагмента антитела хорошо известны в данной области. Например, фрагмент антитела может быть получен ферментативным расщеплением антител пепсином с получением фрагмента 100 кДа, названного F(ab’)2. Такой фрагмент можно далее расщепить, используя восстанавливающий тиол агент и необязательно блокирующую группу для сульфгидрильных групп, возникающих в результате расщепления дисульфидных связей, с получением моновалентных Fab’-фрагментов 50 кДа. Альтернативно ферментативное расщепление с использованием папаина сразу дает два моновалентных Fab-фрагмента и Fc-фрагмент. Такие способы описаны, например, в патентах США № 4036945 и 4331647 и указанных в них ссылках, патенты включены в данное описание в виде ссылки. Также см. Nisonoff et al. (1960), Arch Biochem. Biophys. 89: 230; Porter (1959), Biochem. J. 73: 119, Edelman et al., in Methods in Enzymology vol. 1, page 422 (Academic Press 1967).
Альтернативно Fab можно получить встраиванием ДНК, кодирующей Fab антитела, в экспрессирующий вектор для прокариота или экспрессирующий вектор для эукариота, и введением вектора в клетку прокариота или эукариота для экспрессии Fab.
Изобретение охватывает модификации антител или полипептидов, описанных в данной публикации, включая функционально эквивалентные антитела, которые существенно не влияют на их свойства, и варианты, которые имеют повышенную или пониженную активность и/или аффинность. Например, аминокислотная последовательность антитела 5F1 или гуманизированного антитела может быть подвергнута мутагенезу, чтобы получить антитело с требуемой аффинностью связывания с CD43 или CEA, экспрессируемыми злокачественной клеткой. Модификация полипептидов является обычной практикой в данной области и не нуждается в подробном описании в данной публикации. Примеры модифицированных полипептидов включают полипептиды с консервативными заменами аминокислотных остатков, одной или несколькими делециями или добавлениями аминокислот, которые не вносят существенных вредных изменений в функциональную активность, или использованием химических аналогов.
Инсерции в аминокислотной последовательности включают слияния на амино- и/или карбоксильном конце, диапазон длины которых составляет от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых инсерций включают антитело с N-концевым остатком метионила или антитело, слитое с эпитопной меткой. Другие инсерционные варианты молекулы антитела включают слияние N- или C-конца антитела с ферментом или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Варианты с заменами имеют, по меньшей мере, один аминокислотный остаток в молекуле антитела, который удаляют и на его место встраивают другой остаток. Участки, представляющие наибольший интерес для основанного на заменах мутагенеза, включают гипервариабельные области, но также предполагаются изменения FR. Консервативные замены показаны в таблице ниже под заголовком «консервативные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены более существенные изменения, показанные в таблице ниже под заголовком «примеры замен» или дополнительно описанные ниже при описании классов аминокислот, и продукты подвергают скринингу.
Аминокислотные замены
Существенные модификации биологических свойств антитела осуществляют посредством отбора замен, которые в значительной степени отличаются по своему влиянию на сохранение (a) структуры полипептидного остова в области замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в сайте-мишени или (c) объема боковой цепи. Встречающиеся в природе группы делятся на группы на основании общих свойств боковых цепей:
(1) неполярные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) полярные незаряженные: Cys, Ser, Thr, Asn, Gln;
(3) кислые (отрицательно заряженные): Asp, Glu;
(4) основные (положительно заряженные): Lys, Arg;
(5) остатки, которые влияют на ориентацию цепей: Gly, Pro; и
(6) ароматические: Trp, Tyr, Phe, His.
Неконсервативные замены осуществляют заменой представителя одного из указанных классов представителем другого класса.
Любой остаток цистеина, не вовлеченный в поддержание правильной конформации антитела, также может быть заменен, обычно серином, чтобы повысить стабильность молекулы к окислению и предотвратить образование аномальных поперечных сшивок. Наоборот, цистеиновая связь (связи) могут быть добавлены к антителу, чтобы повысить стабильность, особенно когда антитело представляет собой фрагмент антитела, такой как Fv-фрагмент.
Диапазон аминокислотных модификаций может составлять от изменения или модификации одной или нескольких аминокислот до полной реконструкции области, такой как вариабельная область. Изменения в вариабельной области могут изменять аффинность и/или специфичность связывания. В некоторых вариантах в домене CDR осуществляют не более одной-пяти консервативных аминокислотных замен. В других вариантах в домене CDR осуществляют не более одной-трех консервативных аминокислотных замен. В других вариантах домен CDR представляет собой CDRH3 и/или CDRL3.
Модификации также включают гликозилированные и негликозилированные полипептиды, а также полипептиды с другими посттрансляционными модификациями, такими как, например, гликозилирование разными сахарами, ацетилирование и фосфорилирование. Антитела подвергаются гликозилированию в консервативных положениях в константных областях (Jefferis and Lund, 1997, Chem. Immunol. 65: 111-128; Wright and Morrison, 1997, TibTECH 15: 26-32). Олигосахаридные боковые цепи иммуноглобулинов влияют на функцию белка (Boyd et al., 1996, Mol. Immunol. 32: 1311-1318; Wittwe and Howard, 1990, Biochem. 29: 4175-4180) и внутримолекулярное взаимодействие между частями гликопротеида, которое может влиять на конформацию и представляемую трехмерную поверхность гликопротеида (Hefferis and Lund, выше; Wyss and Wagner, 1996, Current Opin. Biotech. 7: 409-416). Олигосахариды также могут служить для того, чтобы нацеливать данный гликопротеид на некоторые молекулы на сновании специфичных структур для распознавания. Также сообщалось, что гликозилирование антител влияет на зависимую от антител клеточную цитотоксичность (ADCC). В частности, сообщалось, что клетки CHO с регулируемой тетрациклином экспрессией β(1,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансферазы, катализирующей образование разветвляющегося GlcNAc, имеют повышенную активность ADCC (Umana et al., 1999, Mature Biotech. 17: 176-180).
Гликозилирование антител обычно является либо N-связанным, либо O-связанным. N-связанное относится к связыванию углеводного остатка с боковой цепью остатка аспарагина. Трипептидные последовательности аспарагин-X-серин, аспарагин-X-треонин и аспарагин-X-цистеин, где X означает любую аминокислоту за исключением пролина, представляют собой распознаваемые последовательности для ферментативного связывания углеводного остатка с боковой цепью аспарагина. Таким образом, присутствие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к связыванию одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы с гидроксиаминокислотой, чаще всего серином или треонином, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно сопровождается изменением аминокислотной последовательности, так что она содержит одну или несколько описанных выше трипептидных последовательностей (в случае сайтов N-связанного гликозилирования). Изменение также можно осуществить добавлением или заменой одного или нескольких остатков серина или треонина к последовательности исходного антитела (в случае сайтов O-связанного гликозилирования).
Картина гликозилирования антител также может быть изменена без изменения лежащей в основе нуклеотидной последовательности. Гликозилирование в значительной степени зависит от клетки-хозяина, используемой для экспрессии антитела. Так как тип клеток, используемых для экспрессии рекомбинантных гликопротеидов, например, антител, в качестве потенциальных терапевтических средств редко представлен нативной клеткой, то можно ожидать изменчивость картины гликозилирования антител (см., например, Hse et al., 1997, J. Biol. Chem. 272: 9062-9070).
Кроме выбора клеток-хозяев, факторы, которые влияют на гликозилирование во время рекомбинантного получения антител, включают режим роста, состав среды, плотность культуры, насыщение кислородом, pH, схемы очистки и тому подобное. Предложены различные способы изменения картины гликозилирования, осуществляемого в конкретном организме-хозяине, включая введение или сверхэкспрессию некоторых ферментов, вовлеченных в продукцию олигосахаридов (патенты США № 5047335, 5510261 и 5278299). Гликозилирование или некоторые типы гликозилирования могут быть ферментативно удалены из гликопротеида, например, с использованием эндогликозидазы H (Endo H), N-гликозидазы F, эндогликозидазы F1, эндогликозидазы F2, эндогликозидазы F3. Кроме того, рекомбинантная клетка-хозяин может быть сконструирована генетически так, чтобы она была дефектной по процессингу некоторых типов полисахаридов. Указанные и подобные способы хорошо известны в данной области.
Другие способы модификации включают применение методики связывания, известной в данной области, включая, без ограничения, ферментативные способы, окислительное замещение и хелатирование. Модификации можно использовать, например, для связывания меток в случае иммуноанализа. Модифицированные полипептиды получают, используя способы, разработанные в данной области, и они могут быть подвергнуты скринингу с использованием стандартных анализов, известных в данной области, некоторых из которых описаны ниже и в примерах.
Антитело или полипептид согласно изобретению можно конъюгировать (например, связывать) с таким агентом, как терапевтическое средством или метка. Примерами терапевтических средств являются радиоактивные остатки, цитотоксины или химиотерапевтические молекулы.
Антитело (или полипептид) согласно настоящему изобретению может быть связан с меткой, такой как флуоресцирующая молекула, радиоактивная молекула, фермент или любые другие метки, известные в данной области. В используемом в настоящем описании смысле термин «метка» относится к любой молекуле, которая может быть зарегистрирована. В некоторых вариантах антитело можно метить введением радиоактивно меченой аминокислоты. В некоторых вариантах с антителом могут быть связаны остатки биотина, которые могут быть выявлены с использованием меченого авидина (например, стрептавидина, содержащего флуоресцирующий маркер или ферментативную активность, которые могут быть выявлены оптическими или колориметрическими способами). В некоторых вариантах метка может быть введена или связана с другим реагентом, который, в свою очередь, связывается с представляющим интерес антителом. Например, метка может быть включена или связана с антителом, которое, в свою очередь, специфично связывается с представляющим интерес антителом. В некоторых вариантах метка или маркер также могут представлять собой терапевтическое средство. В данной области известны и могут быть использованы различные способы мечения полипептидов и гликопротеидов. Некоторые распространенные классы меток включают, без ограничения, ферментативные, флуоресцентные, хемилюминесцентные и радиоактивные метки. Примеры меток для полипептидов включают, без ограничения, следующие метки: радиоизотопы или радионуклиды (например, 3H, 14C, 15N, 35S, 90Y, 99Tc, 111In, 125I, 131I), флуоресцентные метки (например, изотиоцианат флуоресцеина (ФИТЦ), родамин, лантанидные люминофоры, фикоэритрин (PE)), ферментативные метки (например, пероксидаза хрена, β-галактозидаза, люцифераза, щелочная фосфатаза, глюкозооксидаза, глюкоза-6-фосфатдегидрогеназа, алкогольдегидрогеназа, малатдегидрогеназа, пенициллиназа, люцифераза), хемилюминесцентные метки, группы биотинила, предварительно определяемые полипептидные эпитопы, распознаваемые вторичным репортером (например, парные последовательности лейциновой молнии, сайты связывания для вторых антител, домены связывания металлов, эпитопные метки). В некоторых вариантах метки связывают спейсерными плечами разной длины, чтобы уменьшить возможные стерические препятствия.
Изобретение также относится к фармацевтическим композициям, содержащим антитела или полипептиды, описанные в данной публикации, и фармацевтически приемлемый носитель или эксципиенты. Фармацевтически приемлемые эксципиенты известны в данной области и представляют собой относительно инертные вещества, которые облегчают введение фармакологически эффективного вещества. Например, эксципиент может придавать форму или консистенцию или действует в качестве разбавителя. Подходящие эксципиенты включают, без ограничения, стабилизирующие агенты, увлажнители и эмульгаторы, соли для изменения осмотического давления, средства для инкапсулирования, буферы и средства для усиления проникновения через кожу. Эксципиенты, а также препараты для парентеральной и непарентеральной доставки лекарственных средств указаны в Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing (2000).
В некоторых вариантах изобретение относится к композициям (описанным в данной публикации) для применения в любом из способов, описанных в данной публикации, или в контексте применения в качестве лекарственного средства и/или применения для производства лекарственного средства.
Полинуклеотиды, векторы и клетки-хозяева
Изобретение также относится к полинуклеотидам, содержащим нуклеотидную последовательность, кодирующую любое из моноклональных антител и полипептидов, описанных в данной публикации. В некоторых вариантах полипептиды содержат последовательности вариабельных областей легкой цепи и тяжелой цепи.
В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи, указанную в SEQ ID NO: 1, и/или последовательность нуклеиновой кислоты, кодирующую вариабельная область легкой цепи, указанную в SEQ ID NO: 2. В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи, содержащую одну, две или три CDR из последовательности SEQ ID NO: 1, и/или последовательность нуклеиновой кислоты, кодирующую вариабельная область легкой цепи, содержащую одну, две или три CDR из последовательности SEQ ID NO: 2. В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, указанные в SEQ ID NO: 9, и/или последовательность нуклеиновой кислоты, указанную в SEQ ID NO: 10.
В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи, указанную в SEQ ID NO: 3, и/или последовательность нуклеиновой кислоты, кодирующую вариабельную область легкой цепи, указанную в SEQ ID NO: 4. В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи, содержащую одну, две или три CDR из последовательности SEQ ID NO: 3, и/или последовательность нуклеиновой кислоты, кодирующую вариабельную область легкой цепи, содержащую одну, две или три CDR из последовательности SEQ ID NO: 4. В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, указанную в SEQ ID NO: 11, и/или последовательность нуклеиновой кислоты, указанную в SEQ ID NO: 12.
В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи, указанную в SEQ ID NO: 5, и/или последовательность нуклеиновой кислоты, кодирующую вариабельную область легкой цепи, указанную в SEQ ID NO: 6. В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи, содержащую одну, две или три CDR из последовательности SEQ ID NO: 5, и/или последовательность нуклеиновой кислоты, кодирующую вариабельную область легкой цепи, содержащую одну, две или три CDR из последовательности SEQ ID NO: 6. В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, указанную в SEQ ID NO: 13, и/или последовательность нуклеиновой кислоты, указанную в SEQ ID NO: 14.
В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, кодирующую вариабельную область тяжелой цепи, указанную в SEQ ID NO: 7, и/или последовательность нуклеиновой кислоты, кодирующую вариабельную область легкой цепи, указанную в SEQ ID NO: 8. В некоторых вариантах полинуклеотиды содержат последовательность нуклеиновой кислоты, указанную в SEQ ID NO: 15, и/или последовательность нуклеиновой кислоты, указанную в SEQ ID NO: 16.
Специалистам в данной области понятно, что в результате вырожденности генетического кода существует много нуклеотидных последовательностей, которые кодируют полипептид, описанный в данной публикации. Некоторые из таких полинуклеотидов имеют минимальную гомологию с нуклеотидной последовательностью какого-либо нативного гена. Таким образом, полинуклеотиды, которые варьируют вследствие различий в использовании кодонов, специально включены в настоящее изобретение. Кроме того, аллели генов, содержащих полинуклеотидные последовательности, представленные в настоящем описании, входят в объем настоящего изобретения. Аллели представляют собой эндогенные гены, которые изменены в результате одной или нескольких мутаций, таких как делеции, добавления и/или замены нуклеотидов. Получаемые в результате мРНК и белок могут, но не обязательно, иметь измененную структуру или функцию. Аллеи могут быть идентифицированы с использованием стандартных способов (таких как гибридизация, амплификация и/или сравнение последовательностей в базе данных).
Полинуклеотиды согласно настоящему изобретению могут быть получены с использованием химического синтеза, способов рекомбинации или ПЦР. Способы химического синтеза полинуклеотидов хорошо известны в данной области и не требуют подробного описания в данной публикации. Специалист в данной области может использовать последовательности, предлагаемые в настоящем изобретении, и коммерческий синтезатор ДНК для получения требуемой последовательности ДНК.
Для получения полинуклеотидов с использованием способов рекомбинации полинуклеотид, содержащий требуемую последовательность, может быть встроен в подходящий вектор и вектор, в свою очередь, может быть введен в подходящую клетку-хозяина для репликации и амплификации, как обсуждается далее в настоящем описании. Полинуклеотиды могут быть встроены в клетки-хозяева способами, известными в данной области. Клетки трансформируют введением экзогенного полинуклеотида посредством прямого поглощения, эндоцитоза, трансфекции, F-спаривания или электропорации. После введения экзогенный полинуклеотид может сохраняться в клетке в виде не интегрированного вектора (такого как плазмида) или интегрированного в геном клетки-хозяина. Амплифицированный таким образом полинуклеотид может быть выделен из клетки-хозяина способами, хорошо известными в данной области. См., например, Sambrook et al. (1989).
Альтернативно, ПЦР позволяет осуществлять репродукцию последовательностей ДНК. Методика ПЦР хорошо известна в данной области и описана в патентах США № 4683195, 4800159, 4754065 и 4683202, а также в PCR: The Polymerase Chain Reaction, Mullis et al. eds., Birkauswer Press, Boston (1994).
Изобретение также относится к векторам (например, клонирующим векторам, экспрессирующим векторам), содержащим последовательность нуклеиновой кислоты, кодирующую любой из полипептидов (включая антитела), описанных в данной публикации. Подходящие клонирующие векторы могут быть сконструированы согласно стандартным способам или могут быть выбраны из большого количества клонирующих векторов, доступных в данной области. Хотя выбор клонирующего вектора может варьировать в зависимости от клетки-хозяина, которую предполагают использовать, применимые клонирующие векторы, в общем, обладают способностью к саморепликации, могут иметь одну мишень для конкретной эндонуклеазы рестрикции и/или могут нести гены маркера, который можно использовать при селекции клонов, содержащих вектор. Подходящие примеры включают плазмиды и вирусы бактерий, например, pUC18, pUC19, Bluescript (например, pBS SK+) и ее производные, mp18, mp19, pBR322, pMB9, ColE1, pCR1, RP4, фаговые ДНК и челночные векторы, такие как pSA3 и pAT28. Указанные и многие другие клонирующие векторы доступны от коммерческих поставщиков, таких как BioRad, Strategene и Invitrogen.
Экспрессирующие векторы, в общем, представляют собой реплицируемые полинуклеотидные конструкции, которые содержат полинуклеотид согласно изобретению. Экспрессирующий вектор может реплицироваться в клетках-хозяевах либо в виде эписом, либо в виде составной части хромосомной ДНК. Подходящие экспрессирующие векторы включают, без ограничения, плазмиды, вирусные векторы, включая аденовирусы, аденоассоциированные вирусы, ретровирусы, космиды и экспрессирующий вектор (векторы), описанный в публикации PCT WO 87/04462. Компоненты вектора обычно могут включать, без ограничения, один или несколько из следующих компонентов: сигнальную последовательность; начало репликации; один или несколько маркерных генов; подходящие элементы регуляции транскрипции (такие как промоторы, энхансеры и терминатор). Для экспрессии (т.е. трансляции) обычно также требуются один или несколько элементов регуляции трансляции, таких как сайты связывания рибосом, сайты инициации трансляции и стоп-кодоны.
Векторы, содержащие представляющие интерес полинуклеотиды, могут быть введены в клетку-хозяина любым из множества подходящих способов, включая электропорацию, трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана или других веществ; бомбардировку микрочастицами; липофекцию и инфекцию (например, в том случае, когда вектором является инфекционный агент, такой как вирус вакцинии). Выбор способа введения векторов или полинуклеотидов часто будет зависеть от особенностей клетки-хозяина.
Изобретение также относится к клеткам-хозяевам, содержащим любой из полинуклеотидов или векторов, описанных в данной публикации. Любые клетки-хозяева, способные сверхэкспрессировать гетерологичные ДНК, можно использовать в целях выделения генов, кодирующих представляющее интерес антитело, полипептид или белок. Не ограничивающие примеры клеток-хозяев млекопитающих включают, без ограничения, клетки COS, HeLa и CHO. См. также публикацию PCT № WO 87/04462. Подходящие клетки-хозяева, отличные от клеток млекопитающих, включают прокариоты (такие как E. coli или B. subtillis) и дрожжи (такие как S. cerevisae, S. pombe или K. lactis).
Диагностические применения
Настоящее изобретение относится к способу применения антител, полипептидов и полинуклеотидов согласно настоящему изобретению для выявления, диагностики и контролирования заболевания, расстройства или состояния, связанного с экспрессией эпитопов (или повышенной, или уменьшенной по сравнению с нормальным образцом, и/или несоответствующей экспрессией, например, при наличии экспрессии в ткани (тканях) и/или клетке (клетках), в которых в норме экспрессия эпитопа отсутствует).
В некоторых вариантах способ включает в себя регистрацию экспрессии эпитопа в образце, полученном от субъекта, у которого предполагается наличие злокачественной опухоли, такой как рак прямой и ободочной кишки, поджелудочной железы, желудка и легкого. Предпочтительно способ регистрации включает в себя осуществление контакта образца с антителом, полипептидом или полинуклеотидом согласно настоящему изобретению и определения того, отличается ли уровень связывания от уровня связывания в контрольном образце или образце для сравнения. Способ также применим для определения того, являются ли антитела или полипептиды, описанные в данной публикации, подходящим средством лечения для пациента.
В используемом в настоящем описании смысле термин «образец» или «биологический образец» относится к целому организму или подгруппе его тканей, клеток или составляющих частей (например, жидкостям организма, включая, без ограничения, кровь, слизь, лимфу, синовиальную жидкость, спинномозговую жидкость, слюну, амниотическую жидкость, амниотическую пуповинную кровь, мочу, вагинальную жидкость и семенную жидкость). «Образец» или «биологический образец», кроме того, относится к гомогенату, лизату или экстракту, полученному из целого организма или подгруппы его тканей, клеток или составных частей или их фракций или частей, включая без ограничения, например, плазму, сыворотку, спинномозговую жидкость, лимфу, наружные срезы кожи, дыхательных, кишечных и мочеполовых путей, слезы, слюну, молоко, клетки крови, опухоли, органы. Чаще всего образец выделяют из животного, но термин «образец» или «биологический образец» также может относится к клеткам или ткани, анализируемой in vivo, т.е. без извлечения из организма животного. Обычно «образец» или «биологический образец» будет содержать клетки из организма животного, но термин также может относиться к неклеточному биологическому материалу, такому как неклеточные фракции крови, слюны или мочи, которые можно использовать для измерения уровней ассоциированных со злокачественной опухолью полинуклеотидов или полипептидов. «Образец» или «биологический образец», кроме того, относится к такой среде, как питательный бульон или гель, в котором размножали организм, который содержит клеточные компоненты, такие как белки или молекулы нуклеиновых кислот.
В одном варианте клетки или лизат клеток/ткани подвергают контакту с антителом и определяют связывание между антителом и клеткой. Когда в тестируемых клетках показана активность связывания по сравнению с контрольной клеткой такого же типа ткани, это может свидетельствовать о том, что тестируемая клетка является канцерогенной. В некоторых вариантах тестируемые клетки получены из тканей человека.
Можно использовать различные способы, известные в данной области, для выявления специфичного связывания антитело-антиген. Примеры иммуноанализов, которые можно осуществлять согласно изобретению, включают поляризационный флуоресцентный иммуноанализ (FPIA), флуоресцентный иммуноанализ (FIA), ферментативный иммуноанализ (EIA), нефелометрический иммуноанализ ингибирования (NIA), твердофазный иммуноферментный анализ (ELISA) и радиоиммуноанализ (RIA). Индикаторный остаток или метящая группа могут быть связаны с антителами, их выбирают так, чтобы они удовлетворяли требованиям, предъявляемым к разным применениям способа, которые часто определяются наличием оборудования для анализа и совместимыми способами иммуноанализа. Подходящие метки включают, без ограничения, радионуклиды (например, 125I, 131I, 35S, 3H или 32P), ферменты (например, щелочную фосфатазу, пероксидазу хрена, люциферазу или β-галактозидазу), флуоресцирующие остатки или белки (например, флуоресцеин, родамин, фикоэритрин, GFP или BFP) или люминесцентные остатки (например, наночастицы QdotTM, поставляемые Quantum Dot Corporation, Palo Alto, CA). Общие способы, применяемые при осуществлении различных иммуноанализов, указанных выше, известны специалистам в данной области.
В целях диагностики полипептиды, включая антитела, можно метить регистрируемым остатков, включая, без ограничения, радиоизотопы, флуоресцирующие метки и различные ферментно-субстратные метки, известные в данной области. Способы конъюгирования меток с антителом известны в данной области.
В некоторых вариантах не требуется мечение полипептидов, включая антитела, согласно изобретению и их присутствие можно выявлять, используя меченое антитело, которое связывается с антителами согласно изобретению.
Антитела согласно настоящему изобретению можно использовать любым известным способом анализа, таким как анализы конкурентного связывания, прямые и опосредованные анализы типа «сэндвич» и анализы, основанные на иммунопреципитации. Zola, Monoclonal Antibodies: A Manual of Techniques, pp.147-158 (CRC Press, Inc. 1987).
Антитела и полипептиды также могут быть использованы для диагностических анализов in vivo, таких как визуализация in vivo. В общем, антитело или полипептид метят радионуклидом (таким как 111In, 99Tc, 14C, 131I, 125I или 3H), так что представляющие интерес клетки или ткань могут быть локализованы с использованием иммуносцинтиграфии.
Антитело также можно использовать в качестве красящего реагента при патологии, применяя способы, хорошо известные в данной области.
Терапевтические применения
Удивительная и неожиданная особенность антител согласно настоящему изобретению связана с их способностью эффективно индуцировать гибель негематопоэтической злокачественной клетки. Таким образом, настоящее изобретение относится к терапевтическим применениям антител и полипептидов согласно настоящему изобретению для лечения злокачественной опухоли, такой как рак прямой и ободочной кишки, рак легкого, рак поджелудочной железы, рак желудка, рак молочной железы, гепатоклеточная карцинома и рак щитовидной железы. Можно лечить любую злокачественную опухоль, такую как рак ободочной кишки, рак прямой и ободочной кишки, рак легкого, рак молочной железы, опухоль головного мозга, злокачественная меланома, почечноклеточная карцинома, рак мочевого пузыря, лимфомы, T-клеточные лимфомы, множественная миелома, рак желудка, рак поджелудочной железы, рак шейки матки, эндометриальная карцинома, рак яичника, рак пищевода, рак печени, сквамозноклеточная карцинома головы и шеи, рак кожи, карцинома мочевыводящих путей, рак простаты, хориокарцинома, рак глотки, рак гортани, гиперплазия стромы яичника, андробластома, гиперплазия эндометрия, эндометриоз, эмбриома, фибросаркома, саркома Капоши, гемангиома, кавернозная гемангиома, ангиобластома, ретинобластома, астроцитома, нейрофиброма, олигодендроглиома, медуллобластома, ганглионейробластома, глиома, рабдомиосаркома, гамартобластома, остеогенная саркома, лейомиосаркома, саркома щитовидной железы и опухоль Вильмса, при условии, что злокачественная клетка экспрессирует эпитоп, распознаваемый антителами, описанными в данной публикации. Способ дополнительно может включать в себя стадию выявления связывания между антителом или полипептидом, описанным в данной публикации, и опухолевой или злокачественной клеткой индивидуума, подвергаемого лечению.
В общем, эффективное количество композиции, содержащей антитело или полипептид, вводят субъекту, нуждающемуся в лечении, тем самым ингибируя рост злокачественной клетки и/или индуцируя гибель злокачественной клетки. Предпочтительно композицию готовят с фармацевтически приемлемым носителем.
В одном варианте композицию готовят для введения посредством внутрибрюшинных, внутривенных, подкожных и внутримышечных инъекций и других форм введения, таких как оральное, мукозальное, ингаляционное, сублингвальное и т.д.
В другом варианте настоящее изобретение также охватывает введение композиции, содержащей антитела или полипептиды согласно настоящему изобретению, конъюгированные с другими молекулами, такими как регистрируемые метки или терапевтические или цитотоксические средства. Средства могут включать, без ограничения, радиоизотопы, токсины, токсоиды, воспалительные средства, ферменты, антисмысловые молекулы, пептиды, цитокины или химиотерапевтические средства. Способы конъюгирования антител с такими молекулами в общем известны специалистам в данной области. См., например, публикации PCT WO 92/08495, WO 91/14438, WO 89/12624, патент США № 5314995 и EP 396387; описания которых включены в данное описание в виде ссылки в полном объеме.
В одном варианте композиция содержит антитело или полипептид, конъюгированный с цитотоксическим средством. Цитотоксические средства могут включать любые средства, которые являются вредными для клеток. Предпочтительный класс цитотоксических средств, которые могут быть конъюгированы с антителами или фрагментами, могут включать, без ограничения, паклитаксол, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи.
Доза, необходимая для лечения, зависит от выбора пути введения, природы препарата, природы заболевания у субъекта, роста, массы, площади поверхности, возраста и пола субъекта; других вводимых лекарственных средств и мнения лечащего врача. Подходящие дозы находятся в диапазоне 0,01–1000,0 мг/кг.
В общем, можно использовать любую из следующих доз: дозу, составляющую, по меньшей мере, примерно 50 мг/кг массы тела; по меньшей мере, примерно 10 мг/кг массы тела; по меньшей мере, примерно 3 мг/кг массы тела; по меньшей мере, примерно 1 мг/кг массы тела; по меньшей мере, примерно 750 мкг/кг массы тела; по меньшей мере, примерно 500 мкг/кг массы тела; по меньшей мере, примерно 250 мкг/кг массы тела; по меньшей мере, примерно 100 мкг/кг массы тела; по меньшей мере, примерно 50 мкг/кг массы тела; по меньшей мере, примерно 10 мкг/кг массы тела; по меньшей мере, примерно 1 мкг/кг массы тела или меньше. В случае многократных введений в течение нескольких дней или дольше, в зависимости от состояния, лечение длится до тех пор, пока не происходит требуемое подавление симптомов заболевания. Примерная схема дозирования включает в себя введение еженедельно дозы, составляющей примерно 6 мг/кг антитела. Однако могут быть применимы другие схемы дозирования, в зависимости от фармакокинетической картины, которую, по мнению врача, требуется достичь. Эмпирические факторы, такие как время полужизни, как правило, будут вносить вклад в определение дозы. Успехи такой терапии легко можно контролировать обычными способами и анализами.
Для некоторых субъектов может требоваться более чем одна доза. Частота введения может быть определена и скорректирована в ходе терапии. Например, частота введения может быть определена или скорректирована на основании типа и стадии злокачественной опухоли, подвергаемой лечению, от того, вводят ли средство для профилактических или терапевтических целей, предыдущей терапии, истории болезни пациента и реакции на средство и решения лечащего врача. Обычно лечащий врач будет вводить терапевтическое антитело (такое как гуманизированное 5F1), пока не будет достигнута соответствующая доза для того, чтобы достичь требуемого результата. В некоторых случаях подходящими могут быть препараты антител длительного непрерывного высвобождения. Различные препараты и устройства для достижения длительного высвобождения известны в данной области.
В одном варианте дозы антител или полипептидов могут быть определены эмпирически у субъектов, которые получили одно или несколько введений. Субъектам вводят возрастающие дозы антител или полипептидов. Чтобы оценить эффективность антител или полипептидов, можно контролировать маркеры симптомов заболевания, такие как CD43 или CEA. Эффективность in vivo также можно измерить посредством оценки массы или объема опухоли, времени прогрессирования заболевания (TDP) и/или определения степени податливости лечению (RR).
Введение антитела или полипептида способом согласно настоящему изобретению может быть непрерывным или периодическим, в зависимости, например, от физиологического состояния реципиента, от того, какова цель введения – терапевтическая или профилактическая, и других факторов, известных специалистам. Введение антитела или полипептида может быть по существу непрерывным на протяжении предварительно выбранного периода времени или может быть в виде серии разделенных во времени доз.
Другие препараты включают подходящие формы для доставки, известные в данной области, включая, без ограничения, носители, такие как липосомы. См., например, Mahato et al. (1997) Pharm. Res. 14: 853-859. Липосомные препараты включают, без ограничения, цитофектины, многослойные везикулы и однослойные везикулы.
В другом варианте композиция может содержать одно или несколько противоопухолевых средств, одно или несколько антител, описанных в данной публикации или антитело или полипептид, который связывается с другим антигеном. Такая композиция может содержать, по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять разных антител. Антитела и другие противоопухолевые средства могут входить в состав одного препарата (например, в смеси, как их часто называют в данной области), или они входят в разные препараты, но их вводят одновременно или последовательно, и они, в частности, применимы для лечения более широкого диапазона популяции пациентов.
Полинуклеотид, кодирующий любое из антител или полипептидов согласно настоящему изобретению (например, антитело 5F1 или гуманизированную форму), также можно использовать для доставки и экспрессии любого из антител или полипептидов согласно настоящему изобретению в требуемой клетке. Очевидно, что экспрессирующий вектор можно использовать для управления экспрессией антитела или полипептида. Экспрессирующий вектор можно вводить любыми способами, известными в данной области, например, внутрибрюшинно, внутривенно, внутримышечно, подкожно, интратекально, интравентрикулярно, орально, энтерально, парентерально, интраназально, дермально, сублингвально или ингаляционно. Например, введение экспрессирующих векторов включает локальное и системное введение, включая инъекцию, оральное введение, введение с использованием «пушки» для доставки частиц или введение с использованием катетера, и местное введение. Специалисту в данной области известно введение экспрессирующих векторов для получения экспрессии экзогенного белка in vivo. См., например, патенты США № 6436908, 6413942 и 6376471.
Также можно использовать целенаправленную доставку терапевтических композиций, содержащих полинуклеотид, кодирующий любое из антител или полипептидов согласно настоящему изобретению. Способы опосредованной рецепторами доставки ДНК описаны, например, в Findeis et al., Trends Biotechnol. (1993) 11: 202; Chiou et al., Gene Therapeutics: Methods and Applications of Direct Gene Transfer (J. A. Wolff, ed.) (1994); Wu et al., J. Biol. Chem. (1988) 263: 621; Wu et al., J. Biol. Chem. (1994) 269: 542; Zenke et al. (1990), Proc. Natl. Acad. Sci. USA, 87: 3655; Wu et al. (1991), J. Biol. Chem. 266: 338. Терапевтические композиции, содержащие полинуклеотид, вводят в диапазоне от примерно 100 нг до примерно 200 мг ДНК в случае локального введения согласно протоколу генной терапии. В протоколе генной терапии также можно использовать диапазоны концентраций от примерно 500 нг до примерно 50 мг, от примерно 1 мкг до примерно 2 мг, от примерно 5 мкг до примерно 500 мкг и от примерно 20 мкг до примерно 100 мкг ДНК.
Терапевтические полинуклеотиды и полипептиды согласно настоящему изобретению можно доставлять, используя носители для доставки генов. Носитель для доставки генов может быть вирусного или невирусного происхождения (в общем см. Jolly (1994), Cancer Gene Therapy 1: 51; Kimura (1994), Human Gene Therapy 5: 845; Connelly (1985), Human Gene Therapy 1: 185; и Kaplitt (1994), Nature Genetics 6: 148). Экспрессия таких кодирующих последовательностей может быть индуцирована с использованием эндогенных промоторов млекопитающих и гетерологичных промоторов. Экспрессия кодирующей последовательности может быть либо конститутивной, либо регулируемой.
Основанные на вирусах векторы для доставки требуемого полинуклеотида и экспрессии в требуемой клетке хорошо известны в данной области. Примеры основанных на вирусах носителей включают, без ограничения, рекомбинантные ретровирусы, например, описанные в публикациях PCT WO 90/07936, WO 94/03622, WO 93/25698, WO 93/25234, WO 93/11230, WO 93/10218, WO 91/02805; патентах США № 5219740, 4777127, патенте GB № 2200651 и патенте EP № 0345242, основанные на альфавирусах векторы, например, векторы на основе вируса Синдбис, вируса леса Семлики (ATCC VR-67; ATCC VR-1247), вируса реки Росс (ATCC VR-373; ATCC VR-1246) и вирус венесуэльского энцефалита лошадей (ATCC VR-923; ATCC VR-1250; ATCC VR 1249; ATCC VR-532)), и векторы на основе аденоассоциированного вируса (AAV), например, публикации PCT WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 и WO 95/00655. Также можно использовать введение ДНК, связанной с инактивированным аденовирусом, которое описано в Curiel (1992), Hum. Gene Ther. 3: 147.
Также можно использовать невирусные носители для доставки и способы, включая, без ограничения, поликатионную конденсированную ДНК, связанную или не связанную с инактивированным аденовирусом (см., например, Curiel (1992), Hum. Gene Ther. 3: 147); связанную с лигандом ДНК (смотри, например, Wu (1989), J. Biol. Chem. 264: 16985); носители для доставки в эукариотические клетки (см., например, патент США № 5814482, публикации PCT WO 95/07994, WO 96/17072, WO 95/30763 и WO 97/42338) и нейтрализацию заряда нуклеиновой кислоты или слияние с клеточными мембранами.
Также можно использовать «голую» ДНК. Примеры способов введения голой ДНК описаны в публикации PCT WO 90/11092 и патенте США № 5580859. Липосомы, которые могут действовать в качестве носителей для доставки генов, описаны в патенте США № 5422120, публикации PCT WO 95/13796, WO 94/23697, WO 91/14445 и патенте EP № 0524968. Дополнительные способы описаны в Philip (1994), Mol. Cell Biol. 14: 2411 и в Woffendin (1994), Proc. Natl. Acad. Sci. 91: 1581.
Композиция, содержащая антитело согласно настоящему изобретению, может быть введена последовательно или одновременно с одним или несколькими другими терапевтическими средствами, такими как химиотерапевтические средства (такие как 5-FU, 5-FU/MTX, 5-FU/лейковорин, левамизол, иринотекан, оксалиплатин, капецитабин или урацил/тегафур), иммуноадъюванты, ингибирующие рост средства, цитотоксические средства и цитокины, и т.д. Количества антитела и терапевтического средства зависят от того, какой тип лекарственного средства используют, патологического состояния, подвергаемого лечению, и режимов и путей введения, но обычно будут меньше, чем при их применении по отдельности.
После введения композиции, содержащей антитело, описанное в данной публикации, эффективность композиции можно оценить как in vitro, так и in vivo различными способами, хорошо известными специалисту в данной области. Различные модели на животных хорошо известны для тестирования противоопухолевой активности выбранной для исследования композиции. Такие модели включают ксенотрансплантацию опухоли человека бестимусным мышам или мышам scid/scid, или генетические модели опухолей мышей, такие как мыши, нокаутированные по p53. Природа in vivo таких животных моделей делает их, в частности, моделями, позволяющими прогнозировать ответы у больных людей. Такие модели могут быть созданы введением клеток в организм сингенных мышей с использованием стандартных способов, например, подкожной инъекции, инъекции в хвостовую вену, имплантации селезенки, внутрибрюшинной имплантации и имплантации под капсулу почки, и т.д.
Наборы
Изобретение также относится к наборам для применения в предлагаемых способах. Наборы согласно изобретению включают одну или несколько емкостей, содержащих очищенное антитело или полипептид, описанные в данной публикации, и инструкции по применению согласно любому из способов, предлагаемых в изобретении, описанном в данной публикации. В некоторых вариантах такие инструкции содержат описание введения антитела для лечения негематопоэтической злокачественной опухоли, такой как рак прямой и ободочной кишки, согласно любому из способов, описанных в данной публикации. Набор дополнительно может содержать описание выбора индивидуума, подходящего для лечения, на основании идентификации индивидуума, у которого имеется заболевание, и идентификации стадии заболевания или на основании выявления того, экспрессируется ли эпитоп на злокачественных клетках индивидуума.
В некоторых вариантах наборы для выявления злокачественной клетки в образце содержат антитело или полипептид, описанный в данной публикации, и реагенты для выявления связывания антитела или полипептида с клеткой в образце.
Инструкции, относящиеся к применению антител или полипептидов для лечения злокачественной опухоли, обычно содержат информацию относительно дозы, схемы дозирования и пути введения в случае предполагаемого лечения. Емкости могут представлять собой единичные дозы, упаковки, содержащие не разделенную на дозы партию (например, упаковки, содержащие препарат для многократного приема) или субъединичные дозы. Инструкции, прилагаемые к наборам согласно изобретению, обычно представляют собой письменные инструкции на этикетке или на вкладыше в упаковку (например, бумажный лист, входящий в набор), но также приемлемы машинно-считываемые инструкции (например, инструкции на магнитном или оптическом запоминающем диске).
На этикетке или вкладыше в упаковку указано, что композиция применяется для лечения злокачественной опухоли, описанной в данной публикации. Инструкции могут быть предложены для практического осуществления любым из способов, описанных в данной публикации.
Наборы согласно настоящему изобретению находятся в подходящей упаковке. Подходящая упаковка включает, без ограничения, флаконы, бутылки, баночки, эластичные упаковки (например, герметичные пакеты Mylar или полиэтиленовые пакеты) и тому подобные. Также предлагаются упаковки для применения вместе со специальным устройством, таким как ингалятор, устройство для назального введения (например, распылитель) или устройство для инфузии, такое как мининасос. Набор может иметь стерильное отверстие для доступа (например, емкость может представлять собой мешок для внутривенного раствора или флакон, имеющий пробку, которая прокалывается иглой для подкожных инъекций). Емкость также может иметь стерильное отверстие для доступа (например, емкость может представлять собой мешок для внутривенного раствора или флакон, имеющий пробку, которая прокалывается иглой для подкожных инъекций). По меньшей мере, одно активное средство в композиции представляет собой антитело, описанное в данной публикации. Емкость дополнительно может содержать второе фармацевтически активное средство.
Наборы необязательно могут содержать дополнительные активные компоненты, такие как буферы, и интерпретируемую информацию. Обычно набор содержит емкость и этикетку или вкладыш в упаковку, находящиеся на емкости или прилагаемые к емкости.
ПРИМЕРЫ
Следующие примеры предлагаются для иллюстрации, но не для ограничения изобретения.
Пример 1: Создание и характеристика моноклональных антител, которые специфично связываются с CD43, экспрессируемым на злокачественных клетках
Создание моноклональных антител
Линию клеток аденокарциномы прямой и ободочной кишки человека COLO 205 (ATCC CCL-222) приобретали от Food Industry Research and Development Institute (CCRC 60054), Hsin-chu, Taiwan, и выращивали в среде RPMI 1640 (GIBCO BRL) с 10% FBS (Hyclone), 100 единицами/мл пенициллина и 100 мкг/мл стрептомицина (GIBCO BRL) при 37°C в увлаженной атмосфере, содержащей 5% CO2. Самку мыши Balb/c 8-недельного возраста иммунизировали три раза 2×107 клеток COLO 205 в 500 мкл PBS или 10 микрограммами частично очищенного белка в CFA каждые две недели, и, наконец, проводили бустер-иммунизацию, используя 2×106 клеток COLO 205 или 10 микрограмм частично очищенного белка в 200 мкл PBS. Через пять дней после последней бустер-иммунизации клетки селезенки сливали с клетками миеломы X63. Гибридомы подвергали селекции, используя DMEM с добавлением 10% FBS (Hyclone) и HAT (Hybri-Max®, Sigma H0262, в конечной концентрации 100 мкМ гипоксантина, 0,4 мкМ аминоптерина, 16 мкМ тимидина). Были созданы три линии клеток гибридомы m5F1, m51-41, m138-10, которые секретируют моноклональное антитело 5F1, 51-41 и 138-10.
Идентификация и характеристика антигена-мишени для моноклонального антитела 5F1
Мембранные белки из ткани злокачественной опухоли прямой и ободочной кишки или клеток COLO 205 выделяли с использованием буфера для экстракции (50 мМ трис-HCl, pH 7,4, 150 мМ NaCl, 1% Nonidet P-40), содержащего ингибиторы протеаз (Complete tabs; Roche Molecular Biochemicals). Лизаты мембранных белков сначала предварительно осветляли на колонке объемом 1 мл, содержащей IgG неиммунизированной мыши, иммобилизованный на сефарозе с белком G (Amersham Pharmacia Biotech Inc., N.J., U.S.A.), и проходящую через колонку часть непосредственно наносили на колонку объемом 1 мл, содержащую 5F1, связанный с белком G-сефарозой. Колонку промывали и элюировали белок-мишень 5F1. Чистоту выделенного белка визуализировали окрашиванием серебром и также идентифицировали с использованием Вестерн-блоттинга после разделения в 8% SDS-ПААГ. Выделенный белок также использовали для иммунизации мышей с целью получения других 5F1-подобных антител, таких как 138-10 или 51-41.
Для экспериментов по иммунопреципитации мембранные белки инкубировали с 5F1 или анти-CD43-антителом (AF2038, R&D System, Inc.) с последующей инкубацией с белком G-сефарозой (Amersham Pharmacia Biotech Inc., N.J., U.S.A.). Преципитаты подвергали разделению в 8% SDS-ПААГ и подвергали Вестерн-блот-анализу (или иммуноанализу).
Белки смешивали с равным объемом буфера для образцов (50 мМ трис-HCl, pH 6,8, 100 мМ DTT, 2% SDS, 0,1% бромфеноловый синий, 10% глицерин), разделяли в 8% SDS-ПААГ и затем переносили на нитроцеллюлозную мембрану (Hybond-C Super, Amersham). Затем нитроцеллюлозную мембрану блокировали 5% обезжиренным молоком в PBS и инкубировали с 5F1 или анти-CD43-мАт (AF2038). Затем блот обрабатывали конъюгированным с пероксидазой хрена антителом козы против иммуноглобулина мыши (Jackson ImmunoResearch Laboratories, West Grove, Pa.) и проявляли, используя хемилюминесцентные реагенты (ECL, Amersham, UK).
Для проверки того, распознает ли 5F1 антиген CD43, использовали коммерчески доступное анти-CD43-мАт (AF2038, R&D system, Inc.) для подтверждения идентичности аффинно очищенного белка 5F1 из лизатов COLO 205 посредством Вестерн-блот-анализа. Лизаты из линии клеток COLO 320, негативной в отношении связывания 5F1, использовали в качестве контроля. Полученные авторами результаты (фиг. 1) показали, что оба антитела анти-CD43 (AF2038) и 5F1 взаимодействовали с белком, захваченным на 5F1-иммуноаффинной колонке, что ясно свидетельствует о том, что 5F1 действительно распознает CD43.
Моноклональное антитело 5F1 специфично распознает CD43, экспрессированный на клеточной поверхности негематопоэтических злокачественных клеток
2×105 клеток COLO 205 высевали в каждую лунку 96-луночного планшета с v-образным дном и инкубировали с разными концентрациями антитела 5F1 в диапазоне от 0,33 до 1 мкг/мл при 4°C в течение 1 часа. Клетки дважды промывали 200 мкл буфера FACS (1×PBS+1% FBS), красили 100 мкл раствора антитела коза против IgG мыши, связанным с PE (Southern Biotech.), в концентрации 1 мкг/мл (в буфере FACS) и затем инкубировали при 4°C в течение 30 мин. Клетки трижды промывали буфером FACS и анализировали проточной цитометрией (BD LSR, BD Life Sciences).
Результаты связывания антител, полученные проточной цитометрией, показаны в таблице 1 ниже. Моноклональное антитело, такое как 5F1 (изотип: IgG3) или 138-10 (изотип IgM) или 51-41 (изотип IgM) распознает поверхностный CD43, экспрессированный на цитоплазматических мембранах злокачественных клеток прямой и ободочной кишки COLO 205 и злокачественных клеток желудка NCI-N87, но не периферических T-клеток или клеток Jurkat (линия лимфобластоидных лейкозных клеток; ATCC TIB-152). См. таблицу 1 ниже. Данные проточной цитометрии (фиг. 2A и фиг. 2B) также показывают, что 5F1 связывается с другими типами злокачественных клеток, такими как злокачественные клетки прямой и ободочной кишки (DLD-1) и злокачественные клетки желудка (NCI-N87), но не связывается с нормальными эндотелиальными клетками (HUVEC), нормальными клетками легких (MRC-5), нормальными эпителиальными клетками молочной железы (MCF-10A), нормальными клетками прямой и ободочной кишки (CCD841-CoN), активированными T-лимфоцитами (активированными в течение семи дней) или нормальными мононуклеарными клетками периферической крови (PBMC).
В таблице 1 показаны антигенсвязывающие свойства анти-CD43-антител, таких как 5F1, 138-10 или 51-41 по отношению к злокачественным клеткам прямой и ободочной кишки, периферическим T-клеткам человека и клеткам Jurkat (линия лимфобластоидных лейкозных клеток).
Для выявления экспрессии белка-мишени 5F1 в клетках COLO 205 и тканях рака прямой и ободочной кишки человека использовали стандартный иммуногистохимический способ. Коротко, клетки или ткань фиксировали для иммуноокрашивания 1 мкг/мл 5F1, инкубировали с меченым биотином антителом против IgG мыши, затем инкубировали с комплексом авидин-биотин-пероксидаза (Vector Laboratories, Inc. Burlingame, CA, U.S.A.) и красили хромогеном тетрахлоридом 3,3’-диаминобензидина. Иммуногистохимическое исследование показало, что 52,5% тканей пациентов с раком прямой и ободочной кишки (31/59) были положительно окрашены 5F1.
Пример 2. Апоптозная активность антител, которые специфично связываются с CD43, экспрессируемым злокачественными клетками
Выявление апоптоза, индуцируемого 5F1, в клетках COLO 205 посредством анализа ELISA
Чтобы оценить тип гибели клеток, индуцированной 5F1, злокачественные клетки прямой и ободочной кишки выращивали в чашках для культивирования и инкубировали в присутствии или в отсутствие 5F1. Уровень межнуклеосомной (апоптозной) фрагментации ДНК определяли с использованием опосредованного антителом улавливания и регистрации комплексов гистоны-ДНК, ассоциированных с цитоплазматическими мононуклеосомами и олигонуклеосомами, используя набор для выявления гибели клеток ELISAPLUS (Roche, № в каталоге 1774425). Анализ ELISA осуществляли согласно инструкциям производителя. Коротко, 1×104 клеток COLO 205 высевали в каждую лунку 96-луночных планшетов и инкубировали с 5F1 или 9E10 (анти-myc-антитело) в концентрации 10 мкг/мл или с контрольной средой. После 6-, 24- или 48-часовой инкубации при 37°C клетки промывали и инкубировали с 200 мкл лизирующего буфера в течение 30 мин. После осаждения ядер (200×g, 10 мин) 20 мкл супернатанта (цитоплазматическая фракция), содержащего фрагментированную ДНК, переносили в планшеты для микротитрования, покрытые стрептавидином, которые были инкубированы с биотинилированным моноклональным антигистоновым антителом. Количество фрагментированной ДНК нуклеосом, связанной с антигистоновым антителом, оценивали с помощью конъюгированного с пероксидазой моноклонального анти-ДНК-антитела, используя ABTS (6-диаммониевую соль 2,2-азиноди[3-этилбензтиазолинсульфоната]) в качестве субстрата. Наконец, определяли оптическую плотность при 405 нм после инкубации с субстратом пероксидазы в течение 10-20 мин., используя считывающее устройство для микропланшетов (Molecular Devices, SPECTRA max M2). Значения для лунок, содержащих лизирующий буфер и только один субстрат, вычитали в качестве фонового значения. Данные анализировали в виде специфичного обогащения моно- и олигонуклеосомами, высвобождаемыми в цитоплазму, на основании полученных значений, используя следующую формулу:

мЕд = оптическая плотность [10-3]
Данные, показанные на фигуре 3, свидетельствуют, что 5F1 индуцировал обогащение нуклеосомами цитоплазмы клеток COLO 205 после 24-часовой инкубации. Количество регистрируемой фрагментированной ДНК в обработанной 5F1 цитоплазме возрастало более чем в 4 раза по сравнению с контрольной средой. Такое обогащение не наблюдалось в клетках, обработанных либо контрольным антителом 9E10 (анти-myc-антитело), либо только средой, что свидетельствует о том, что само антитело 5F1 вызывает апоптоз в злокачественных клетках.
Выявление апоптоза, индуцированного 5F1, 138-10 и 51-41 в клетках COLO 205, с использованием окрашивания аннексином V и PI
Аннексин V окрашивает фосфолипиды, которые переходят на наружную сторону цитоплазматической мембраны на ранней стадии процесса апоптоза. Таким образом, окрашивание аннексина V, которое анализируют с использованием FACS-анализа, показывает, что клетки подвергаются апоптозу. 1,2×105 клеток COLO 205 высевали в каждую лунку 96-луночного планшета и затем к клеткам добавляли разные концентрации 5F1 (2-16 мкг/мл), разбавленного в среде, или свежую среду (необработанный контроль). Для проверки того, необходим ли поперечно-сшивающий агент (CL) для того, чтобы 5F1 индуцировал апоптоз в опухолевых клетках, 20 мкг/мл антитела кролика против IgG мыши (Jackson ImmunoResearch, № в каталоге 315-005-045) добавляли к набору образцов для сравнения. После 6-часовой инкубации при 37°C клетки красили 0,25 мкл конъюгированного с ФИТЦ аннексина V (Strong Biotech Corporation) в 100 мкл буфера для связывания аннексина V при комнатной температуре в течение 15 мин. Затем клетки красили йодидом пропидия (PI, краситель ДНК) и анализировали проточной цитометрией.
Данные проточной цитометрии показали, что обработка 5F1 в отсутствие поперечно сшивающего агента в течение 6 часов в концентрации 4 мкг/мл или выше вызывала появление значительного количества злокачественных клеток, которые подвергались апоптозу, что свидетельствует о том, что само антитело 5F1 отдельно может эффективно индуцировать апоптоз в клетках COLO 205.
Также тестировали индукцию апоптоза в клетках COLO 205 под влиянием других анти-C43-антител, 138-10 и 51-41. В таблице 2 ниже показано, что 5F1, 138-10 или 51-41 индуцировали апоптоз в злокачественных клетках прямой и ободочной кишки. Клетки COLO 205 инкубировали с 32 микрограммами/мл каждого антитела в течение 6 часов и красили аннексином-V, а затем PI с последующим FACS-анализом.
Индукция апоптоза в клетках COLO 205 антителами 5F1, 138-10 и 51-41
Приведенные выше результаты показывают, что такие обработки антителами, специфичными по отношению к злокачественной опухоли, экспрессирующей CD43, могут индуцировать апоптоз в злокачественной клетке.
Выявление апоптоза, индуцированного m5F1 в клетках NCI-87, с использованием окрашивания YO-PRO-1 или окрашивания аннексином V и PI
4×105 клеток NCI-N87 (линия клеток карциномы желудка человека) или 5×105 клеток COLO 205 высевали в 12-луночный планшет для культивирования (Nunc № в каталоге 150628). После культивирования в течение ночи среду заменяли и добавляли антитела в концентрациях, указанных на фигуре 10, или азид и инкубировали в течение 6 часов. Затем клетки обрабатывали трипсином и собирали для окрашивания YO-PRO-1 (Invitrogen, № в каталоге Y3603) или двойного окрашивания аннексином-V-ФИТЦ и PI (Strong Biotech, наборы для выявления апоптоза, № в каталоге AVK250).
Как показано на фиг. 10A и 10B, антитело m5F1 индуцировало апоптоз в клетках NCI-87 и COLO 205, который измеряли по окрашиванию YO-PRO-1 (A) и двойному окрашиванию аннексином-V-ФИТЦ и PI (B). Полученные данные показывают, что m5F1 также может индуцировать апоптоз в клетках карциномы желудка.
Пример 3. Ингибирование роста злокачественных клеток антителом 5F1
Обработка отдельно 5F1 ингибирует рост злокачественных клеток
Злокачественные клетки прямой и ободочной кишки (COLO 205), и нормальные эндотелиальные клетки (HUVEC) высевали и инкубировали с 5F1 или контрольным антителом 9E10. Также в качестве негативного контроля включали необработанные клетки. Жизнеспособность клеток оценивали, используя анализы MTT и WST-1, чтобы выявить пролиферативную активность, как описано в данной публикации.
Анализ WST-1 основан на расщеплении соли тетразолия WST-1 до формазана митохондриальными дегидрогеназами клетки. Получаемый формазан можно оценить количественно с использованием спектрофотометра, измеряя оптическую плотность при 450 нм. Пролиферация жизнеспособных клеток приводит к увеличению общей активности ферментов; а снижение ферментативной активности свидетельствует об ингибировании клеточного роста. Таким образом, анализ WST-1 использовали для оценки степени жизнеспособности опухолевых клеток после обработки 5F1. Коротко, 4×103 клеток COLO 205 в 100 мкл культуральной среды высевали в 5 повторах для каждой обработки в 96-луночном планшете для культивирования. Затем добавляли 10 мкг/мл 5F1, контрольного антитела 9E10 (анти-myc-антитела) или свежей среды (необработанный контроль). Обработку 0,5% азидом натрия (NaN3) также включали в анализ в качестве контроля цитотоксичности. После трехдневной инкубации при 37°C в каждую лунку добавляли 20 мкл реагента WST-1 (Roche, № в каталоге 1664807) и смесь инкубировали при 37°C в течение 30 мин. Измеряли оптическую плотность при 450 нм, которая отражает выживаемость обработанных клеток. Результаты WST-1-анализа клеток COLO 205 показаны на фигуре 4. Данные свидетельствуют о том, что рост клеток COLO 205 был значимо ингибирован (фиг. 4), тогда как на HUVEC (данные не показаны) обработка 5F1 не оказывала влияния. Выживаемость в процентах снижалась до значения, составляющего менее 50%, в обработанных антителом 5F1 злокачественных клетках прямой и ободочной кишки по сравнению с такими клетками, обработанными антителом 9E10, используемым для контроля изотипа. В группе позитивного контроля, обработанной 0,5% азидом натрия, наблюдали выживаемость, составляющую 19%.
В другом эксперименте клетки (2×103) высевали в каждую лунку 96-луночного планшета для культивирования и инкубировали с 10 микрограммами/мл моноклонального антитела 5F1 или контрольного антитела 9E10 (антитело против c-myc). Необработанные клетки использовали в качестве негативных контролей; и клетки, обработанные 0,5% азидом натрия, использовали в качестве позитивных контролей. После двух- или трехдневного периода инкубации при 37°C в каждую лунку добавляли 10 мкл реагента WST-1 и клетки дополнительно инкубировали в течение 30 мин. Затем осуществляли WST-1-анализ жизнеспособности клеток, как описано выше. Результаты, показанные на фигуре 5, свидетельствуют, что рост клеток карциномы прямой и ободочной кишки, таких как COLO 205, был в значительной степени ингибирован антителом 5F1, но антитело не влияло на линию нормальных клеток прямой и ободочной кишки (такую как CCD841-CoN).
MTT-способ является другим основанным на тетразолии способом измерения жизнеспособности и пролиферации клеток. Желтый тетразолий MTT (бромид 3-(4,5-диметилтиазолил-2)-2,5-дифенилтетразолия) восстанавливается метаболически активными клетками, отчасти благодаря действию дегидрогеназных ферментов, с образованием восстановленных эквивалентов, таких как NADH и NADPH. Образуемый в результате внутриклеточный фиолетовый формазан может быть солюбилизирован и количественно оценен спектрофотометрическими способами. Клетки (5×103) высевали в каждую лунку 96-луночного планшета для культивирования и инкубировали с моноклональным антителом 5F1 (диапазон концентраций 0-64 мкг/мл) или контрольным антителом 9E10 (64 мкг/мл) против c-myc. Необработанные клетки использовали в качестве негативных контролей; и клетки, обработанные 0,5% азидом натрия, использовали в качестве позитивных контролей. После 72-часового периода инкубации при 37°C в каждую лунку добавляли 10 мкл реагента MTT и клетки дополнительно инкубировали в течение 2-4 часов до тех пор, пока фиолетовый преципитат не становился видимым. Добавляли 100 мкл детергента (ДМСО). Регистрировали оптическую плотность образцов при 570 нм. Данные MTT-анализа показали, что 5F1 ингибировал пролиферацию клеток COLO 205 зависимым от дозы образом (от 0 до 64 мкг/мл) и ED50 (эффективная доза для 50% ингибирования) составляла 8 мкг/мл (фиг. 6). Как также показано на фиг. 6, обнаружено заметное ингибирование роста клеток при использовании 64 мкг/мл 5F1, тогда как контрольное антитело 9E10 не оказывало такого влияния в такой же концентрации.
Оценка противоопухолевых эффектов 5F1 in vivo
Противоопухолевые эффекты 5F1 in vivo анализировали в мышиной модели ксенотрансплантации опухоли. 5×106 клеток COLO 205 имплантировали подкожно в заднюю боковую область мышей SCID в 0 день. Через неделю после инокуляции клеток в одном эксперименте мышей обрабатывали 500 микрограммами 5F1 или PBS посредством внутрибрюшинной инъекции. В другом эксперименте четыре группы мышей (6 мышей в каждой группе), несущих развившиеся опухоли, внутривенно обрабатывали через день четырьмя дозами по 25 мг/кг 5-фторурацила плюс лейковорин (5 FU/LV), и различными дозами 5F1 посредством внутрибрюшинной инъекции дважды в неделю или без 5F1.
В одном эксперименте имплантацию опухолей у мышей SCID осуществляли подкожной инъекцией злокачественных клеток прямой и ободочной кишки COLO 205 по 1×107 клеток на мышь в 0 день и затем обрабатывали внутрибрюшинной инъекцией моноклонального антитела 5F1 (по 500 мкг на дозу) или контрольного моноклонального антитела 9E10 (антитело против c-myc) или PBS в 0, 3, 5, 7, 10, 12, 14 и 17 день. В каждой группе в эксперименте использовали по пятнадцать мышей. Размер опухоли измеряли, начиная с 5 дня и до 24 дня, получая произведение ширины, ширины и длины (W×W×L) и выражали в мм3. Как показано на фигуре 7, моноклональное антитело 5F1 эффективно подавляло рост опухоли по сравнению с контрольным антителом 9E10 и PBS (без обработки).
Для выявления комбинированных эффектов 5F1 и химиотерапевтических средств, подобных 5FU/LV, мышам внутривенно через день инъецировали 4 дозы по 25 мг/кг 5FU/LV и внутрибрюшинно инъецировали или не инъецировали различные количества антитела 5F1 дважды в неделю в течение 3 недель через 7 дней после имплантации опухоли. Рост опухоли оценивали на основании измерения дважды в неделю объема опухоли (мм3) штангенциркулем и размер опухоли вычисляли, используя формулу: π/6×больший диаметр×(меньший диаметр)2 (Kievit E., Cancer Research, 60: 6649-55). Как показано на фиг. 8, комбинация обработок антителом 5F1 и 5FU/LV значимо ингибировала рост опухоли прямой и ободочной кишки человека по сравнению с обработками химиотерапевтическим средством отдельно (фигура 8).
Пример 4. Три новых анти-CD43-антитела, 5F1, 138-10 и 51-41, распознают сходный эпитоп, экспрессируемый на злокачественных клетках
Для выяснения связывающих свойств трех новых анти-CD43-антител (5F1, 138-10 и 51-41) использовали FACS-анализ. Клетки COLO 205 (100000) красили 1 микрограммом/мл биотинилированного 5F1 при 4°C в течение 1 часа в присутствии разных количеств небиотинилированного антитела 5Fl, 138-10 и 51-41. После промывок клетки дополнительно красили стрептавидином-ФИТЦ в таких же условиях в течение 30 мин. Клетки промывали и анализировали в FACS. Данные, показанные в таблице 3 ниже, представляют среднюю интенсивность флуоресценции из одного типичного эксперимента. Оба антитела 51-41 и 138-10 способны конкурировать с биотинилированным 5F1 за связывание с клетками COLO 205, что свидетельствует о том, что все три антитела связывают сходные сайты связывания, экспрессированные на поверхности клеток COLO 205.
5F1, 138-10 и 51-41 распознают сходные эпитопы, экспрессированные на клетках COLO 205
Пример 5. Определение эпитопа антитела 5F1
Чтобы дополнительно определить структуру эпитопа, распознаваемого моноклональным антителом 5F1, указанное моноклональное антитело использовали для тестирования его способности к специфичному взаимодействию с разными полипептидными последовательностями. 96-луночные планшеты для микротитрования покрывали антителом 5F1 по 50 мкл на лунку в концентрации 10 мкг/мл в буфере для покрывания, содержащем 0,1М NaHCO3 (pH 8,6), в течение ночи при 4°C. После промывки планшеты блокировали инкубацией с блокирующим буфером, содержащим 0,1М NaHCO3 (pH 8,6), 5 мг/мл БСА, 0,02% NaN3 (150 мкл/лунку), по меньшей мере, в течение одного часа при 4°C. Затем планшеты инкубировали со слитыми белками, содержащими различные фрагменты полипептидов, в разных концентрациях в течение одного часа при комнатной температуре. После промывки TBS, содержащим 0,5% твина, связанные слитые с белком полипептиды элюировали 0,2М буфером глицин-HCl (pH 2,2), содержащим 1 мг/мл БСА, и нейтрализовали 1М трис-HCl (pH 9,1). Затем определяли аминокислотную последовательность элюированных слитых с белком полипептидов. Полипептиды, которые связывает антитело 5F1, содержат трипептидную последовательность Trp-Pro-Ile (WPI) от N-конца к C-концу. Такая трипептидная аминокислотная последовательность не присутствует в аминокислотной последовательности CD43. Pallant et al., Proc. Natl. Acad. Sci. USA 86: 1328-32, 1989; Shelley et al., Proc. Natl. Acad. Sci. USA 86: 2819-23, 1989.
Для дополнительного подтверждения трипептидного эпитопа, который связывается антителом 5F1, осуществляли ELISA типа «сэндвич». 96-луночные планшеты для микротитрования покрывали антителом (5F1 или контрольным антителом 9E10) по 50 мкл на лунку в концентрации 1 мкг/мл в течение ночи при 4°C. Планшеты блокировали инкубацией с 0,25% БСА в PBS (150 мкл/лунку) в течение 1 часа при 37°C. Затем планшеты инкубировали со слитыми белками, содержащими различные фрагменты полипептидов, слитые с белком-носителем, в течение 2 часов при комнатной температуре. После промывки 4 раза PBS, содержащим 0,05% твина 20, планшеты инкубировали со специфичным по отношению к белку-носителю антителом в концентрации 2 мкг/мл в течение 1,5 часов при комнатной температуре. После инкубации планшеты 4 раза промывали PBST. Затем в каждую лунку добавляли 50 мкл разведенного 1:3000 антитела козы, против антитела, специфичного к белку-носителю, конъюгированного с HRP, и планшеты инкубировали в течение 1 часа при 37°C. Ферментативную реакцию осуществляли добавлением субстрата фермента HRP, чтобы определить реакционную способность указанного полипептида по отношению к двум антителам (5Fl и 9E10). В таблице 4 ниже показаны данные анализа ELISA для случая, когда на планшете иммобилизовали 5F1 или 9E10. «+» означает, что указанный полипептид связывается с моноклональным антителом; и «-» означает, что указанный полипептид не связывается с моноклональным антителом. Моноклональное антитело 5F1 распознает трипептидную эпитопную структуру WPI. Так как трипептидная последовательность WPI не присутствует в CD43, то полученные данные свидетельствуют, что 5F1 распознает конформационный эпитоп, который включает в себя структуру, имеющую физические и/или химические параметры, сходные или эквивалентные со структурой, образованной трипептидом WPI.
Структуры эпитопов, распознаваемых 5F1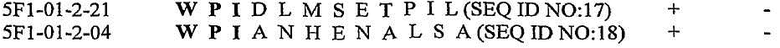


Пример 6. Клонирование вариабельных областей легкой и тяжелой цепей 5F1, 138-10 и 51-41 и гуманизация антител
кДНК вариабельных областей легкой и тяжелой цепей 5F1 амплифицировали в ПЦР и синтезированные кДНК субклонировали в pCRII (Invitrogen) для определения последовательностей. Нуклеотидные последовательности получали и анализировали из нескольких независимых клонов. Отбирали идентичные последовательности кДНК из независимых клонов, представляющих V-области легкой или тяжелой цепи каждого антитела. В таблице 5 ниже показаны транслируемые аминокислотные последовательности и нуклеотидные последовательности, кодирующие V-области легкой и тяжелой цепи 5F1, 138-10, 51-41 и гуманизированного 5F1 (h5F1Vc).
Таблица 5. Аминокислотные последовательности вариабельных областей антител и последовательности нуклеиновой кислоты, кодирующие вариабельные области антител (CDR подчеркнуты)
Аминокислотная последовательность (SEQ ID NO: 1) и нуклеотидная последовательность (SEQ ID NO: 9) тяжелой цепи 5F1


Аминокислотная последовательность (SEQ ID NO: 2) и нуклеотидная последовательность (SEQ ID NO: 10) легкой цепи 5F1

Аминокислотная последовательность (SEQ ID NO: 3) и нуклеотидная последовательность (SEQ ID NO: 11) тяжелой цепи 138-10


Аминокислотная последовательность (SEQ ID NO: 4) и нуклеотидная последовательность (SEQ ID NO: 12) легкой цепи 138-10

Аминокислотная последовательность (SEQ ID NO: 5) и нуклеотидная последовательность (SEQ ID NO: 13) тяжелой цепи 51-41

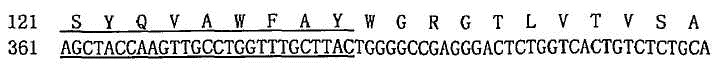
Аминокислотная последовательность (SEQ ID NO: 6) и нуклеотидная последовательность (SEQ ID NO: 14) легкой цепи 51-41

Аминокислотная последовательность (SEQ ID NO: 7) и нуклеотидная последовательность (SEQ ID NO: 15) тяжелой цепи h5F1Vc
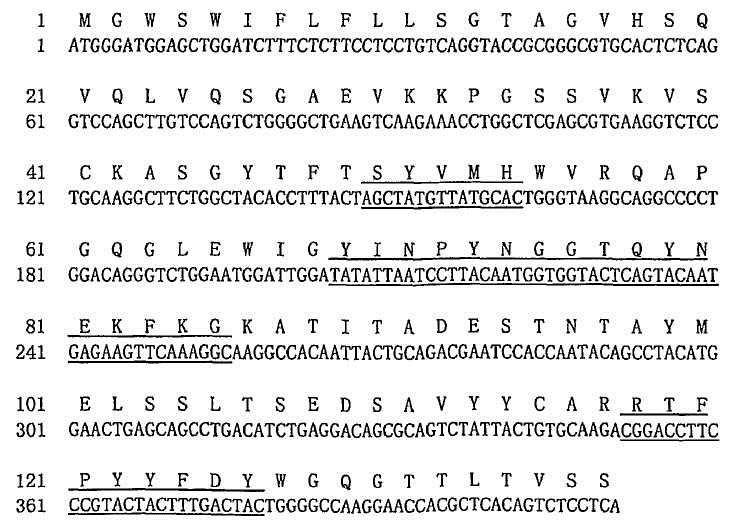
Аминокислотная последовательность (SEQ ID NO: 8) и нуклеотидная последовательность (SEQ ID NO: 16) легкой цепи h5F1Vc

Пример 7. Получение и характеристика химерного антитела 5F1
Конструирование и получение химерного антитела 5F1 [c5F1)
Для конструирования векторов для экспрессии химерного антитела V-область легкой цепи 5F1 субклонировали в плазмиде pVk. pVk содержит промотор CMV и константную область легкой цепи человека. Последовательность и биологическую информацию о константной области легкой цепи человека можно найти в Hieter, P.A., et al. (1980), Cloned human and mouse kappa immunoglobulin constant and J region genes conserve homology in functional segments. Cell, 22 (1 Pt 1): p. 197-207.
V-область тяжелой цепи 5F1 субклонировали в плазмиде pVg1. Плазмида pVg1 имеет промотор CMV и содержит константную область тяжелой цепи IgG1 человека. Последовательность и биологическую информацию о константной области тяжелой цепи IgG1 человека можно найти в Ellison, J. W., B.J. Berson and L.E. Hood (1981), The Nucleotide sequence of a human immunoglobulin C gamma 1 gene., Nucleic acids Res.10: 4071.
Плазмиды, экспрессирующие легкую и тяжелую цепи, затем котрансфицировали в клетки Cos-7. Надосадки, содержащие c5F1, собирали и анализировали в отношении индуцирующей апоптоз функции c5F1.
Функциональное тестирование c5F1
Надосадок, содержащий c5Fl, затем тестировали в отношении его связывания с клетками COLO 205, используя поверхностное окрашивание, и в отношении его функции в анализе апоптоза с использованием аннексина V, как описано выше. Для анализа связывания использовали 0,58 микрограмм/мл c5F1. Для анализа апоптоза использовали 2~32 микрограмма/мл m5F1, c5F1 и 9E10 (контрольное анти-myc-антитело), и инкубация продолжалась 16 часов. Надосадок, содержащий c5F1, связывает клетки COLO 205 и индуцирует апоптоз в клетках COLO 205, так же, как его мышиный аналог, что свидетельствует о том, что клонированные фрагменты кДНК действительно кодируют V-области 5F1 (фиг. 9A и фиг. 9B).
Пример 8. Иммуногистохимическое исследование злокачественной ткани прямой и ободочной кишки с использованием m5F1
Окрашивание ткани антителом m5F1
Экспрессию мишени m5F1 исследовали с использованием иммуногистохимии на залитых в парафин образцах ткани первичной опухоли пациентов с раком прямой и ободочной кишки (n=59). Тканевые матрицы залитых в парафин тканей рака прямой и ободочной кишки получали из SuperBioChips Laboratories (матрицы тканей человека, № в каталоге CD1). Использовали стандартные способы окрашивания для иммуногистохимии согласно инструкции производителя (набор VECTASTAIN Elite ABC, Vector Laboratories). Все срезы нагревали при 58°C в течение 1 часа, парафин удаляли, 5 раз обрабатывая ксилолом, и последовательно регидратировали в растворах этанола с уменьшающимися концентрациями. После блокирования нормальной сывороткой (VECTASTAIN, PK6102) в течение 1 часа срезы инкубировали с m5F1 в концентрации 1 мкг/мл в течение 1 часа при комнатной температуре и затем со вторым биотинилированным антителом против Ig мыши (VECTASTAIN, PK6102). Затем срезы инкубировали с комплексом стрептавидин-биотин (VECTASTAIN, PK6102). Предметные стекла обрабатывали раствором диаминобензидина. Наконец покровные стекла контрастно красили гематоксилином, дегидратировали, просветляли и заключали в 50% глицерин в PBS.
Оценка по относительной шкале
Экспрессию антигена на каждом срезе ткани оценивали два независимых исследователя, и степень окрашивания 5F1 оценивали, используя эмпирическую полуколичественную систему: -, отрицательный результат; +-, слабое окрашивание; +, среднее окрашивание; ++, сильное окрашивание.
Результаты
На всех срезах окрашивание m5F1 преимущественно было мембранным. Всего 31 из 59 образцов опухолей (52,5%) окрашивались позитивно в отношении мишени 5F1, из них 27 (45,8%) имели высокие уровни экспрессии. 19 образцов (32,2%) имели негативное окрашивание в отношении экспрессии мишени m5F1. Суммарные результаты окрашивания всех тестированных образов рака прямой и ободочной кишки показаны в таблице 6 ниже. Полученные данные показывают, что антитело m5F1 можно применять для диагностики рака прямой и ободочной кишки.
Частота экспрессии мишени 5F1 в злокачественных опухолях прямой и ободочной кишки человека
Пример 9. m5F1 связывается с рекомбинантным CEA человека (rhCEA) и CD43 человека (rhCD43), экспрессированными клетками COLO 205, но не распознает rhCEA или rhCD43, экспрессированными клетками COS-7
Получение образца белка
Иммунопреципитация в отношении рекомбинантного Flag-меченого CEA в клетках COLO 205 и COS: кДНК, кодирующую полноразмерный белок CEA (35~702 аминокислот), клонировали в плазмиде pFlag-CMV-1. Сконструированную плазмидную ДНК вводили в клетки COLO 205 (для конструирования стабильной линии клеток) электропорацией или клетки COS (для экспериментов по временной экспрессии) с использованием липофектамина 2000 (Invitrogen, № в каталоге 11668-019). Клетки, экспрессирующие антиген, собирали и лизировали в лизирующем буфере (50 мМ трис-HCl, pH 8,5, 150 мМ NaCl, 1% NP40), содержащем ингибиторы протеаз (Roche, № в каталоге 11836145001). Надосадок клеточных лизатов инкубировали со связанными с анти-Flag (M2, Stratagene, № в каталоге 200472) шариками, содержащими белок G-сефарозу (GE Healthcare, № в каталоге 17-0618-02) в течение 2 часов при 4°C. Белок G-сефарозные шарики затем три раза промывали лизирующим буфером. Белок G-сефарозные шарики, содержащие продукты иммунопреципитации, использовали в качестве образцов для SDS-ПААГ и Вестерн-блота.
Очистка растворимого рекомбинантного белка в случае Cr1-меченого CD43, экспрессированного в клетках COLO 205: кДНК, кодирующую внеклеточный домен белка CD43, клонировали в модифицированной плазмиде pcDNA3, которая содержит N-концевую метку Flag и C-концевые метку Cr1. Сконструированную плазмидную ДНК вводили в клетки COLO 205 электропорацией для получения стабильной линии клеток. Растворимый рекомбинантный hCD4320-253, экспрессированный клетками COLO 205, содержит N-концевую метку 3×Flag и C-концевую метку Cr1. Растворимый белок очищали, используя шарики, содержащие белок A-сефарозу (GE Healthcare, № в каталоге 17-1279-02). После элюирования глициновым буфером и диализа против PBS образцы белка хранили при -20°C для последующего применения.
Лизат целых клеток для получения CD43, временно экспрессированного в клетках COS: Конструкцию, содержащую полноразмерный CD43 человека (в pcDNA3.1myc-His), вводили в клетки COS, используя липофектамин 2000 (Invitrogen, № в каталоге 11668-019). Клетки лизировали буфером RIPA (50 мМ трис-HCl, pH 7,4, 150 мМ NaCl, 1 мМ EDTA, 0,25% SDS, 1% NP-40), содержащим ингибиторы протеаз, и центрифугировали при 21900 g при 4°C в течение 10 минут, чтобы собрать суператант. После количественной оценки Bio-Rad достаточное количество белковых лизатов наносили на SDS-ПААГ для Вестерн-блот-анализа.
Вестерн-блот-анализ
После добавления буфера для образцов образцы белков кипятили при 95°C, наносили на SDS-ПААГ-минигель и затем переносили на NC-бумагу (GE Healthcare, Hybond-ECL, № в каталоге RPN303D). После блокирования мембран 5% обезжиренным молоком в TBS добавляли первые антитела. Связывание первых антител регистрировали с использованием конъюгированного с HRP второго антитела (NEN Life Science, HRP-антитело козы против IgG мыши, № в каталоге NEF822, или Southern Biotech, HRP-антитело козы против Ig мыши, № в катлоге 1010-05) и обрабатывали реагентами для выявления для Вестрен-блоттинга ECL (GE Healthcare, № в каталоге RPN2106).
Результаты
В эксперименте, показанном на фиг. 11A, клеточные лизаты клеток COLO 205, экспрессирующих rhCEA, иммунопреципитировали анти-Flag-антителом и иммунопреципитированные белки разделяли в SDS-ПААГ и переносили на NC-бумагу. NC-бумагу подвергали блоттингу, используя разные антитела: анти-Flag, m5F1, 50-14, 51-41, 138-10, 186-14, 280-6 или анти-CEA-антитело (CEA/Ab-3; название клона COL-1 от NeoMarker, № в каталоге MS-613-P1ABX). Данные, представленные на фиг. 11A, показали, что m5F1, 51-41 и 138-10 распознавали rhCEA, экспрессированный клетками COLO 205.
В эксперименте, показанном на фиг.11B, клеточные лизаты клеток COS-7, экспрессирующих rhCEA, иммунопреципитировали анти-Flag-антителом и иммунопреципитированные белки подвергали разделению в SDS-ПААГ и переносили на NC-бумагу. NC-бумагу подвергали блоттингу, используя разные антитела: анти-Flag, m5F1 или анти-CEA (CEA/Ab-3). Данные, представленные на фиг. 11B, показали, что m5F1 не связывается с rhCEA, экспрессированным клетками COS-7.
В эксперименте, показанном на фиг. 12A, растворимые белки, экспрессированные клетками COLO 205, очищали, используя белок A-сефарозные шарики, и разделяли в SDS-геле и переносили на NC-бумагу. NC-бумагу подвергали блоттингу, используя разные антитела: m5F1, 51-41 или 138-10. Данные, представленные на фиг. 12A, показали, что m5F1, 51-41 и 138-10 распознавали rhCD43, экспрессированный клетками COLO 205.
В эксперименте, показанном на фиг. 12B, растворимые белки, экспрессированные в клетках COLO 205, очищали, используя белок A-сефарозу, и разделяли в SDS-ПААГ и переносили на NC-бумагу. NC-бумагу подвергали блоттингу, используя анти-CD43 (MEM59) (левая панель) или m5F1 (правая панель). Данные, представленные на фиг. 12B, показали, что m5F1 не распознавал rhCD43, экспрессированный клетками COS-7. Полученные данные свидетельствуют, что эпитоп, распознаваемый m5F1, имеет посттрансляционную модификацию, специфичную для некоторых типов клеток.
Пример 10. Эпитоп, распознаваемый m5F1, 51-41 и 138-10, содержит структуру Льюисa (Lea) и зависит от фукозы
Обработка гликозидазой
Рекомбинантный CEA человека (rhCEA) получали в результате экспрессии белка CEA человека в клетках COLO 205. кДНК, кодирующую rhCEA (CEA-N-A2), который представляет собой слияние, содержащее аминокислоты 35-145 (N-домен) и аминокислоты 324-415 (A2-домен) CEA, клонировали в модифицированной плазмиде pcDNA3, которая содержит Flag-метку. Положение аминокислотных остатков CEA основано на положениях аминокислот в пре-белке. Сконструированную плазмидную ДНК вводили в клетки COLO 205 для получения стабильной линии клеток посредством электропорации. Рекомбинантный белок CEA очищали из супернатанта клеточной культуры стабильных линий клеток, экспрессирующих рекомбинантный CEA, используя анти-Flag-антитело.
Для каждой реакции примерно 1,8 мкг рекомбинантного белка (rhCEA) инкубировали с разными количествами (0, 0,01, 0,03 или 0,1 миллиед.) раствора α-1→(2,3,4)-фукозидазы Xanthomonas sp. (Sigma, № в каталоге F1924) при 37°C в течение 20 часов. После обработки образцы белка наносили на SDS-ПААГ для окрашивания Кумасси синим (фиг. 13, левая панель) или для выявления Вестерн-блоттингом (фиг. 13, правая панель) с использованием m5F1.
Как показано на фиг. 13, связывание m5F1 с rhCEA уменьшалось в том случае, когда антиген обрабатывали α-1→(2,3,4)-фукозидазой, что свидетельствует о том, что m5F1 распознает чувствительный к фукозе гликоэпитоп.
Конкурентный анализ олигосахаридов
Чтобы дополнительно тестировать гликоэпитоп, распознаваемый m5F1, проводили конкурентные анализы, используя разные олигосахариды. Олигосахариды приобретали (Льюисa от Sigma, № в каталоге 03499, Льюисb-лактоза от Sigma, № в каталоге L7033, Льюисx-лактоза от Sigma, № в каталоге L7777, Льюисy от Sigma, № в каталоге L7784, силиал-Льюисx от Sigma, № в каталоге S1782, лакто-N-тетраоза от Sigma, № в каталоге L6770, лекто-N-дифукогексаоза II от Sigma, № в каталоге L6645, Льюисa от Calbiochem, № в каталоге 434626, и β-лактоза от Sigma, № в каталоге L3750) и растворяли в PBS. Структуры таких олигосахаридов показаны на фиг. 14. Олигосахариды (в конечной концентрации 1 мМ) добавляли в разные лунки, содержащие 2 x 105 клеток COLO 205, с последующим добавлением указанных антител (m5F1, 51-41 или 138-10; по 0,25 мкг/мл каждого). После инкубации в течение одного часа при 4°C супернатант отбрасывали и добавляли вторые антитела (Southern Biotech, RPE-антитело козы против IgG мыши, № в каталоге 1032-09, или Southern Biotech, RPE-антитело козы против IgM мыши, № в каталоге 1022-09) и регистрировали сигналы связывания с клеткам, используя проточно-цитометрический анализ.
Как показано на фиг. 15, LNDFH II, Lea-лактоза и Lea ингибировали на разных уровнях связывание антител m5F1, 51-41 и 138-10 с клетками COLO 205; и LNT также ингибировал связывание антител 51-41 и 138-10, но значимо не ингибировал связывание m5F1 с клетками COLO 205. Результаты свидетельствует о том, что эпитоп, распознаваемый указанными антителами, может содержать Lea или сходную структуру и является чувствительным к фукозе. Кроме того, антитело m5F1 в большей степени зависит от фукозы, чем антитело 51-41 и 138-10.
Хотя изобретение описано выше подробно в качестве иллюстрации и примера для более ясного понимания, описание и примеры не следует рассматривать как ограничивающие объем изобретения.
Ссылки
Laos, S., Baeckstrom, D, and Hansson, G.C. (2006) Inhibition of NF-kappaB activation and chemokine expression by the leukocyte glycoprotein, CD43, in colon cancer cells. Int. J. Oncol. 28(3): 695-704.
Fuhlbrigge, R.C., King, S.L., Sackstein, R., and Kupper, TS. (2006) CD43 is a ligand for E-selectin on CLA+ human T cells. Blood. 15; 107(4): 1421-6.
Matsumoto, M., Atarashi, К., Umemoto, E., Furukawa, Y., Shigeta, A., Miyasaka, M., and Hirata, T. (2005) CD43 functions as a ligand for E-Selectin on activated T cells. J. Immunol. 15; 175(12): 8042-50.
Pimenidou, A., Madden, L.A., Topping, K.P., Smith, K.A., Monson, J.R., and Greenman, J. (2004) Novel CD43 specific phage antibodies react with early stage colorectal tumours. Oncol. Rep. 11(2): 327-31.
Kadaja, L., Laos, S., and Maimets, T. (2004) Overexpression of leukocyte marker CD43 causes activation of the tumor suppressor proteins p53 and ARF. Oncogene. 19; 23(37): 2523-2530.
Fernandez-Rodriguez, J., Andersson., C.X., Laos, S., Baeckstrom, D., Sikut, A., Sikut, R., and Hansson, G.C. (2002) The leukocyte antigen CD43 is expressed in different cell lines of nonhematopoietic origin. Tumour Biol. 23(4): 193-201.
Cermak, L., Simova, S., Pintzas, A., Horejsi, V., and Andera, L. (2002) Molecular mechanisms involved in CD43-mediated apoptosis of TF-1 cells. Roles of transcription Daxx expression, and adhesion molecules. J Biol Chem. 8;277(10):7955-61.
Carlow, D.A., Corbel, S.Y., and Ziltener, H.J. (2001) Absence of CD43 fails to alter T cell development and responsiveness. J Immunol. 166(1): 256-61.
Nieto, M., Rodriguez-Fernandez, J.L., Navarro, F., Sancho, D., Frade, J.M., Mellado, M., Martinez-A, C, Cabanas, C, and Sanchez-Madrid, F. (1999) Signaling through CD43 induces natural killer cell activation, chemokine release, and PYK-2 activation. Blood. 94(8):2767-77.
Sikut, R., Andersson, C.X., Sikut, A., Fernandez-Rodriguez, J., Karlsson, N.G., and Hansson, G.C. (1999) Detection of CD43 (leukosialin) in colon adenoma and adenocarcinoma by novel monoclonal antibodies against its intracellular domain. Int. J. Cancer. 82(1): 52-8.
Lopez, S., Seveau, S., Lesavre, P., Robinson, M.K., and Halbwachs-Mecarelli, L. (1998) CD43 (sialophorin, leukosialin) shedding is an initial event during neutrophil migration, which could be closely related to the spreading of adherent cells. Cell Adhes. Commun. 5(2): 151-60.
Stockton, B.M., Cheng, G., Manjunath, N., Ardman, В., and von Andrian, U.H. (1998) Negative regulation of T cell homing by CD43. Immunity. 8(3): 373-81.
McEvoy, L.M., Jutila, M.A., Tsao, P.S., Cooke, J.P., and Butcher, E.G. (1997) Anti-CD43 inhibits monocyte-endothelial adhesion in inflammation and atherogenesis. Blood. 90(9): 3587-94.
Baeckstrom, D. (1997) Post-translational fate of a mucin-like leukocyte sialoglycoprotein (CD43) aberrantly expressed in a colon carcinoma cell line. J Biol Chem. 272(17): 11503-9.
McEvoy, L.M., Sun, H., Frelinger, J.G., and Butcher, E.C. (1997) Anti-CD43 inhibition of T cell homing. J Exp Med. 185(8): 1493-8.
Brown, T.J., Shuford, W.W., Wang, W.C., Nadler, S.G., Bailey, T.S., Marquardt, H., and Mittler, R.S. (1996) Characterization of a CD43/leukosialin-mediated pathway for inducing apoptosis in human T-lymphoblastoid cells. J Biol Chem. 271(44): 27686-95.
Santamaria, M., Lopez-Beltran, А., Toro, M., Pena, J., and Molina, I.J. (1996) Specific monoclonal antibodies against leukocyte-restricted cell surface molecule CD43 react with nonhematopoietic tumor cells. Cancer Res. 56(15): 526-9.
Bazil, V., Brandt, J., Chen, S., Roeding, M., Luens, K., Tsukamoto, A., and Hoffman, R. (1996) A monoclonal antibody recognizing CD43 (leukosialin) initiates apoptosis of human hematopoietic progenitor cells but not stem cells. Blood. 87(4): 272-81.
Manjunath, N., Correa, M., Ardman, M., and Ardman, B. (1995) Negative regulation of T-cell adhesion and activation by CD43. Nature. 377(6549): 535-8.
Nong, Y.H., Remold-O’Donnell, E., LeBien, T.W., and Remold, H.G. (1989) A monoclonal antibody to sialophorin (CD43) induces homotypic adhesion and activation of human monocytes. J Exp Med. 170(l): 259-67.
Mentzer, S.J., Remold-O’Donnell, E., Crimmins, M.A., Bierer, B.E., Rosen, F.S., and Burakoff, S.J. (1987) Sialophorin, a surface sialoglycoprotein defective in the Wiskott-Aldrich syndrome, is involved in human T lymphocyte proliferation. J Exp Med. 165(5): 1383-92.
Pallant, A., Eskenazi, A., Mattei, MG., Fournier, R.E.K., Carlsson, S.R., Fukuda, M., and Frelinger, J.G. (1989) Characterization of cDNA encoding human leukosialin and localization of the leukosialin gene to chromosome 16. Proc. Natl. Acad. Sci. USA 86:1328-32.
Shelley, C.S., Remold-O’Donnell, E., Davis III, A.E., Bruns, G.A.P., Rosen, F.S., Carroll, M.C., and Whitehead, A.S. (1989) Molecular characterization of sialophorin (CD43), the lymphocyte surface sialoglycoprotein defective in Wiskott-Aldrich syndrome. Proc. Natl. Acad. Sci. USA 86: 2819-23.
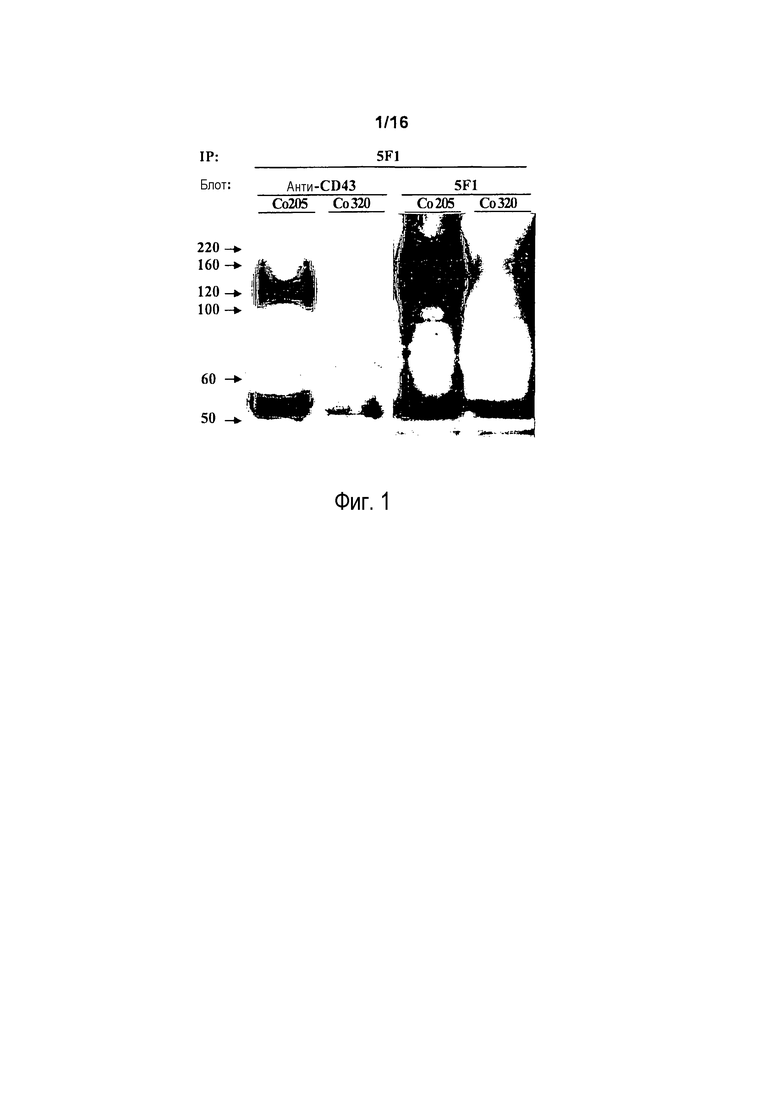
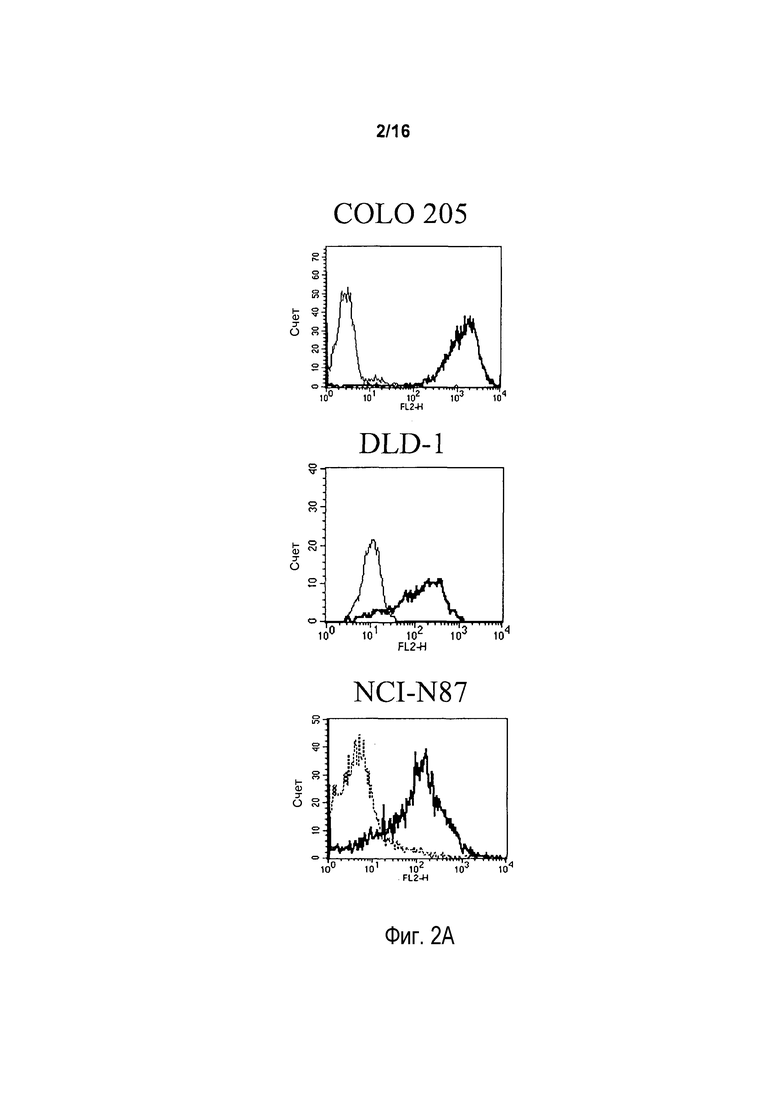
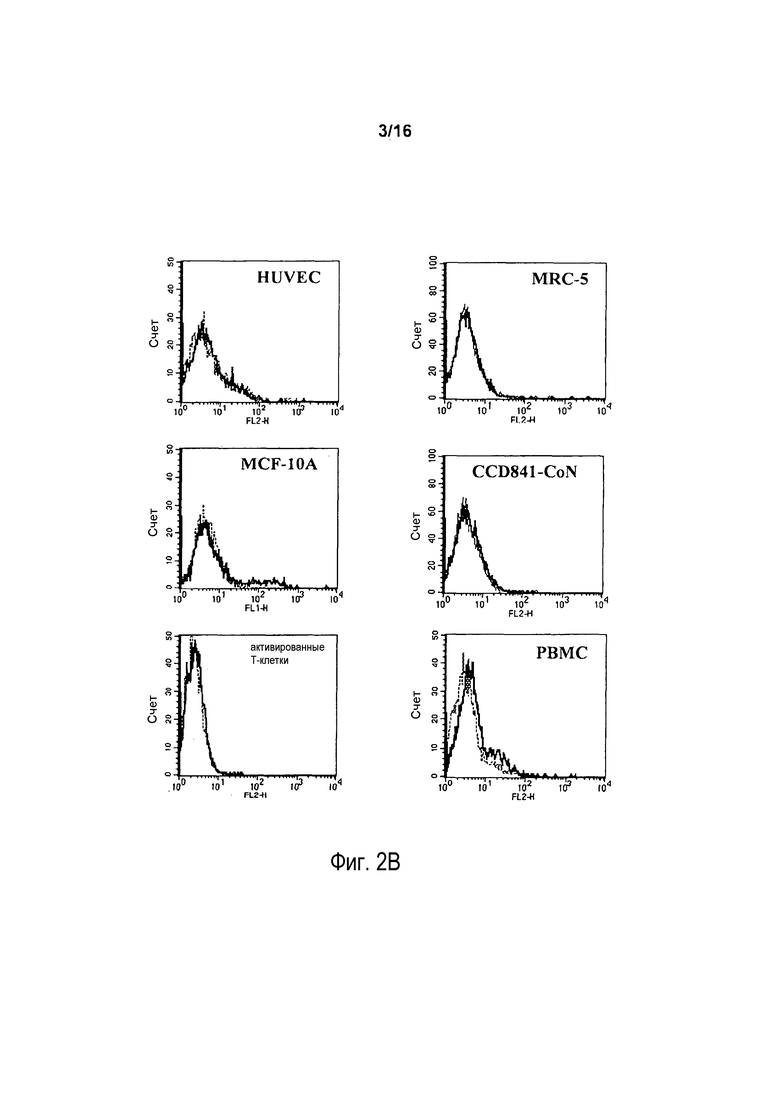
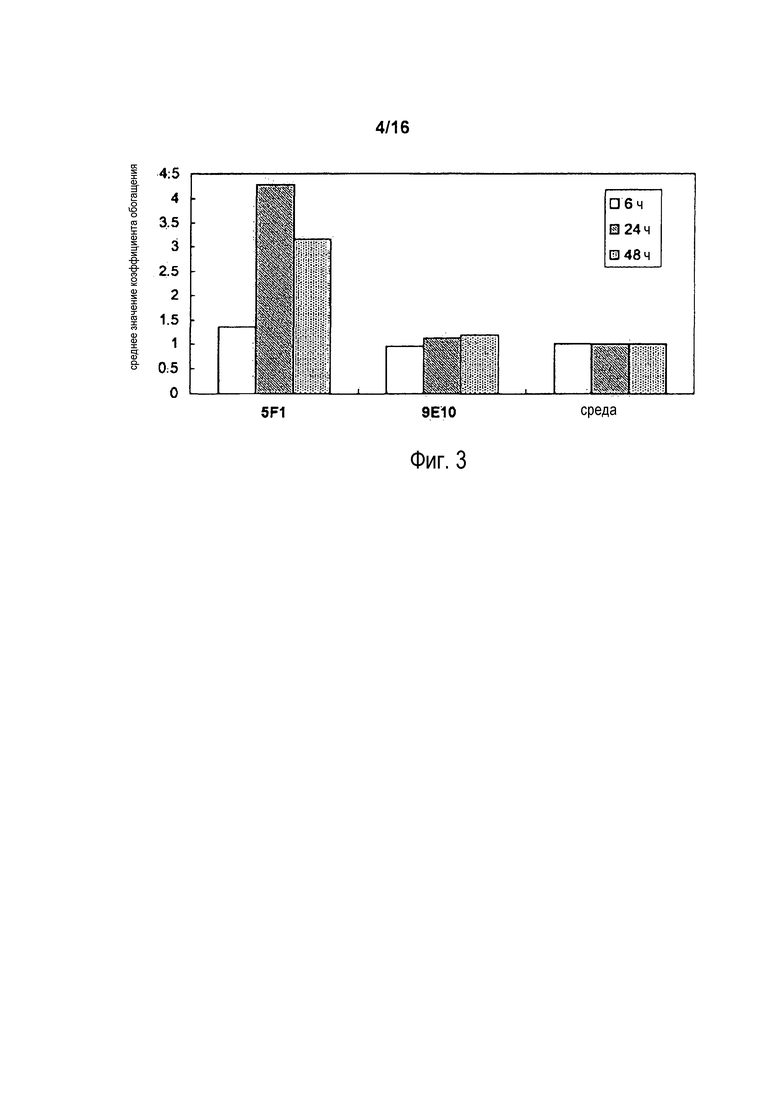
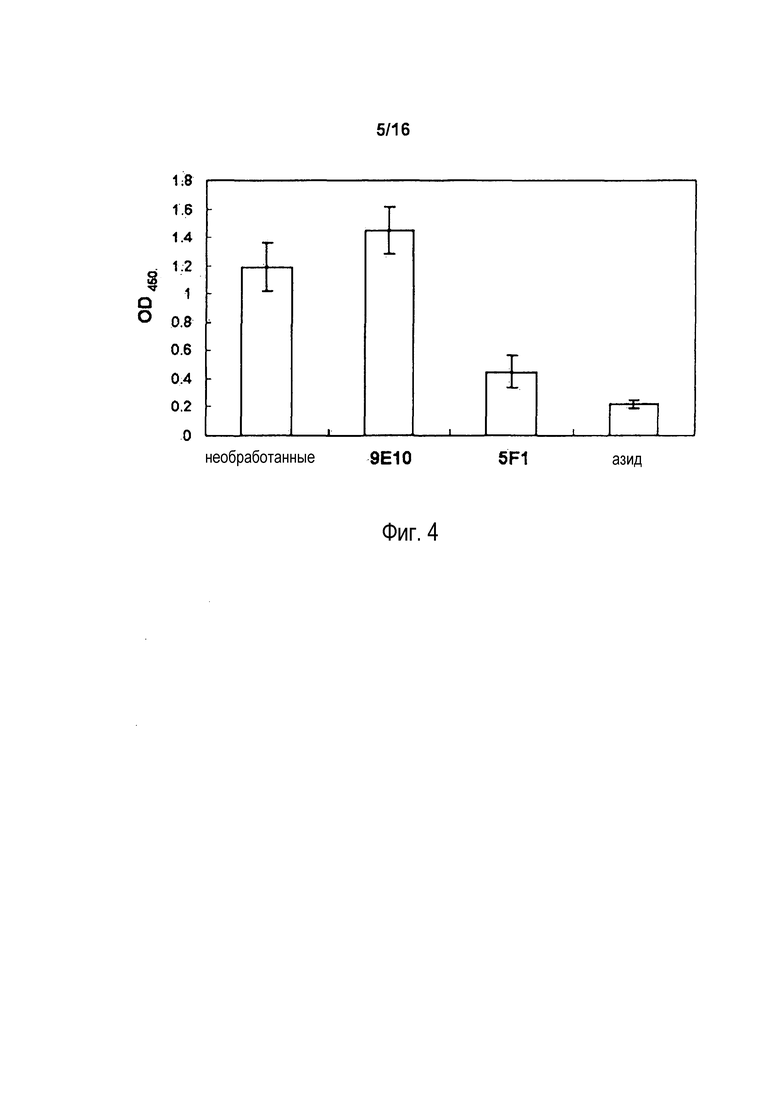
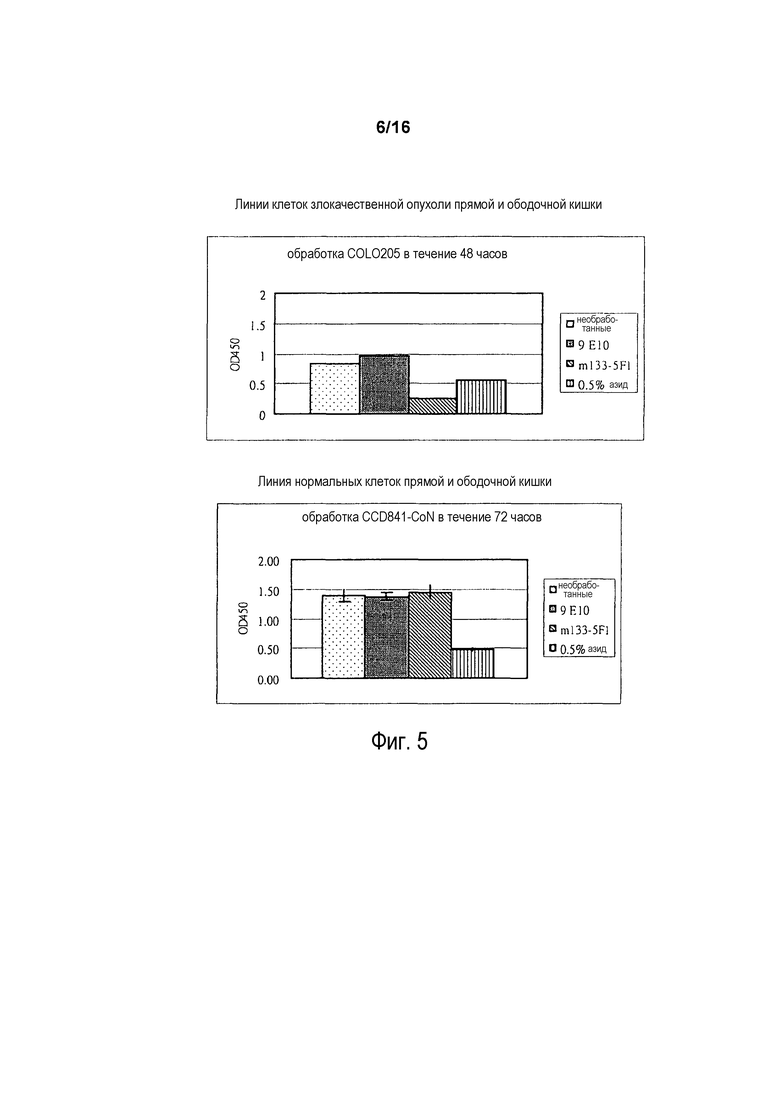
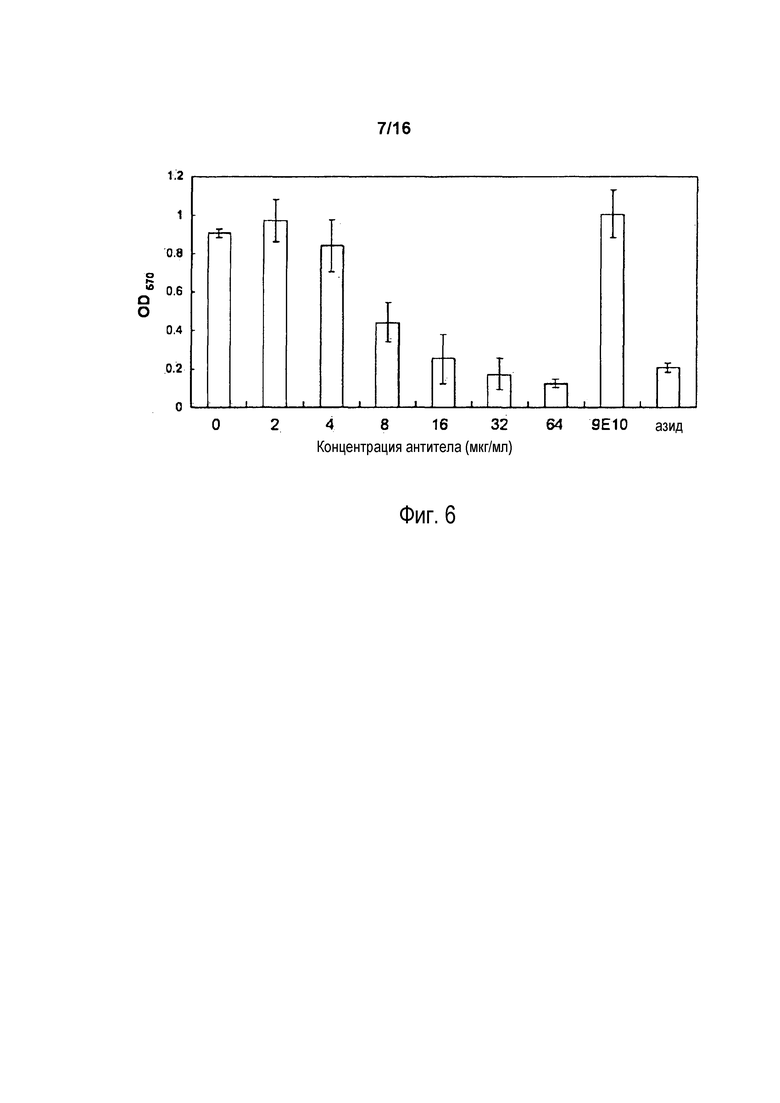
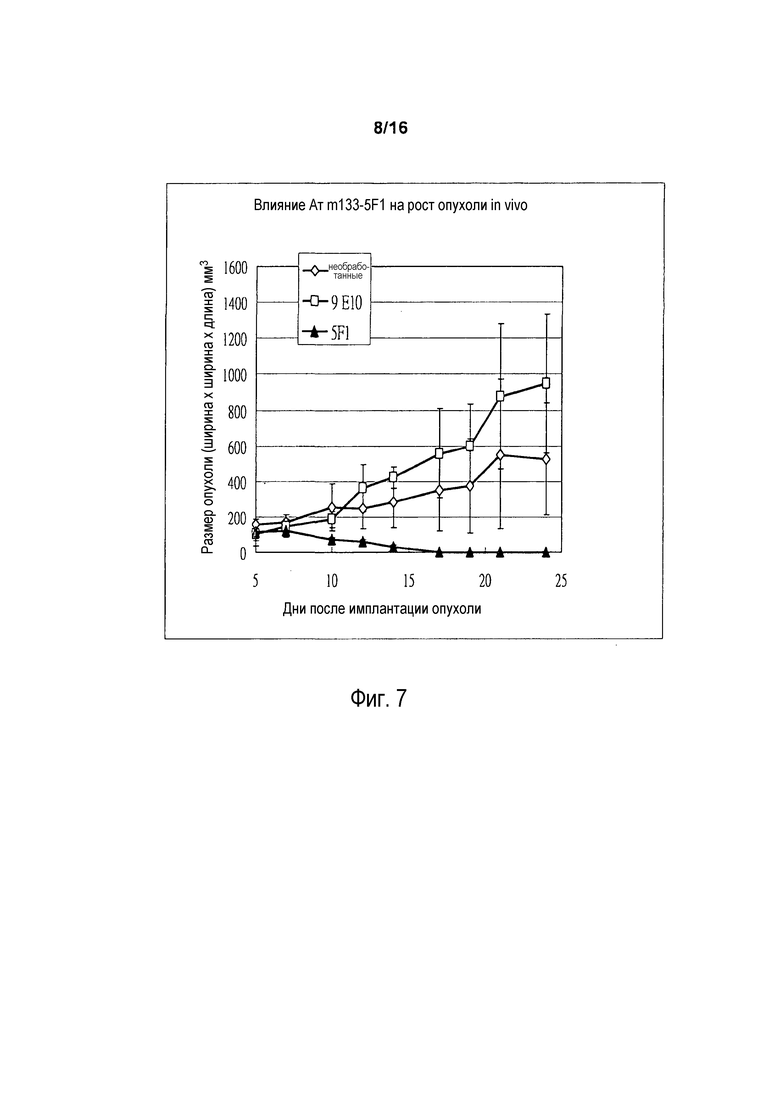
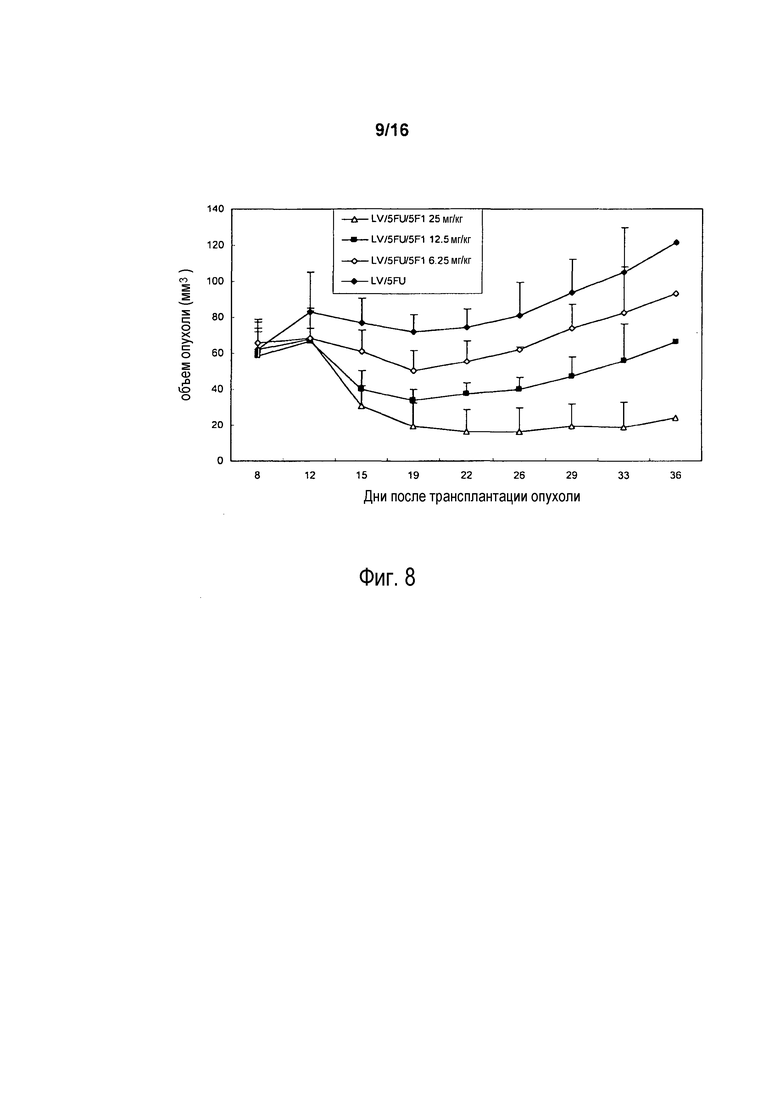
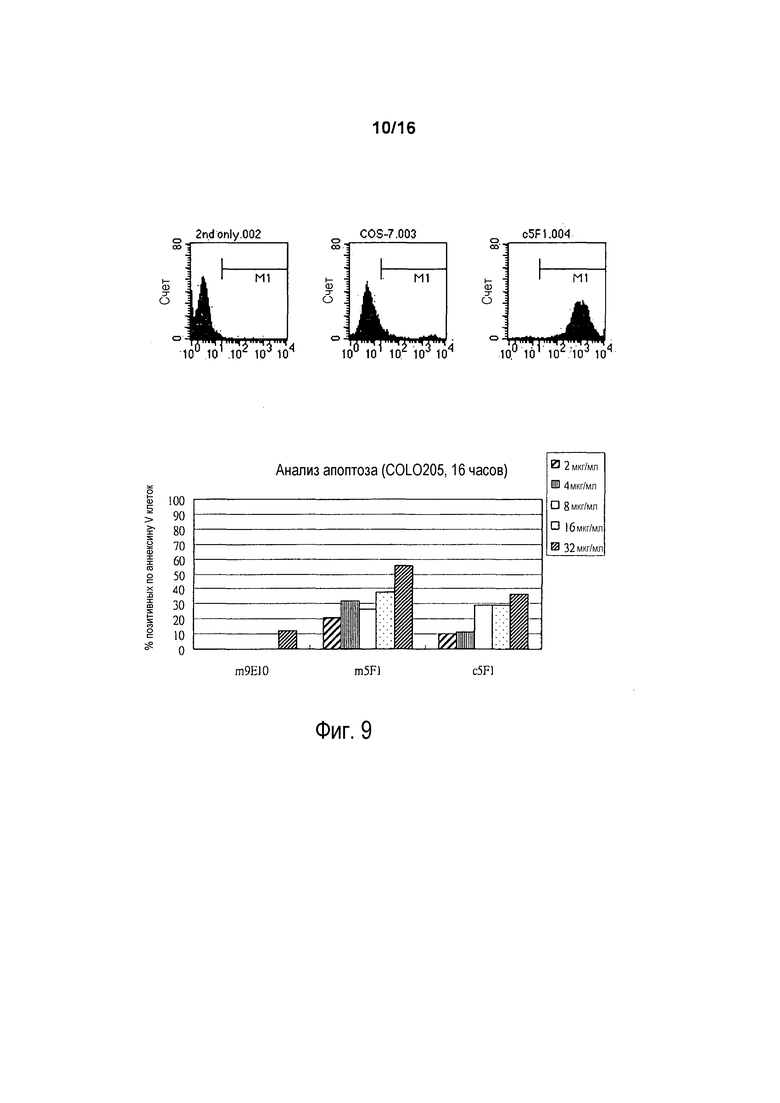
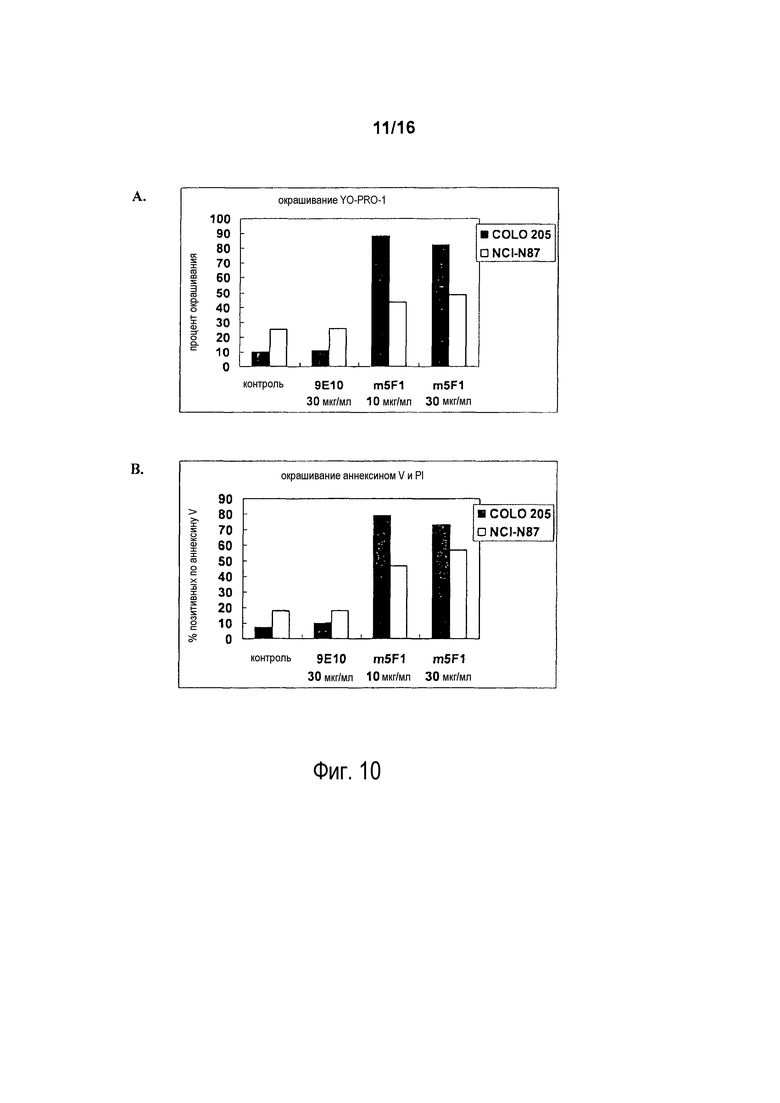
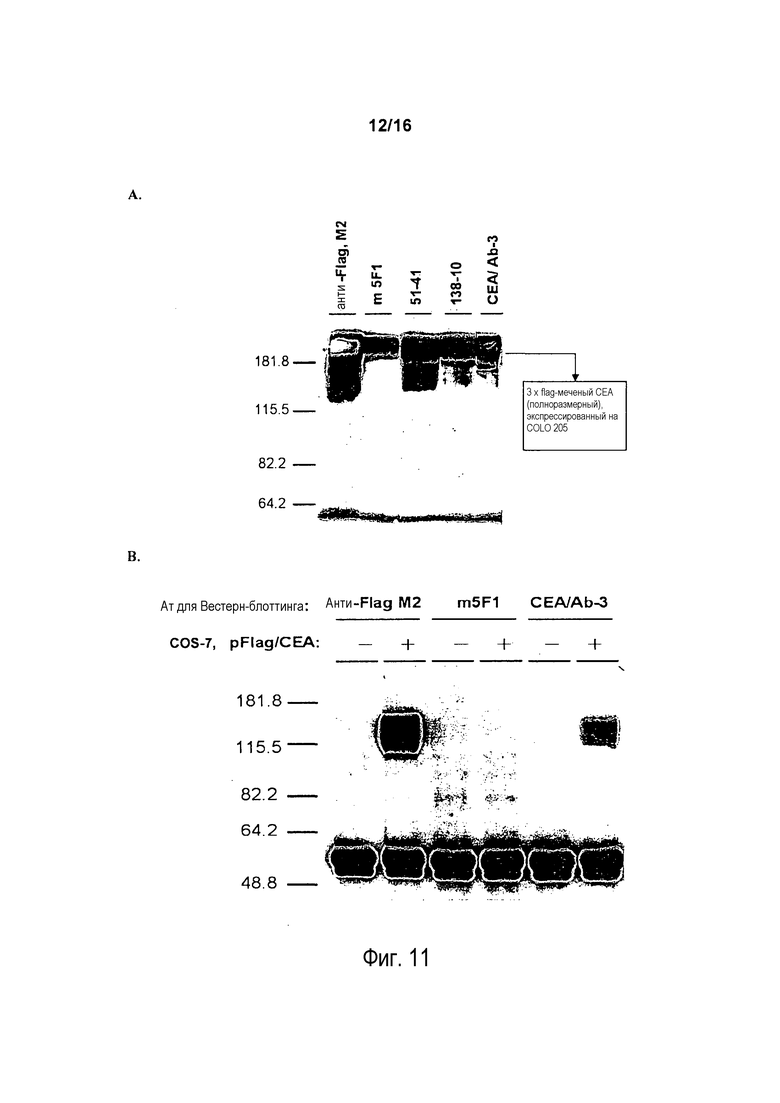
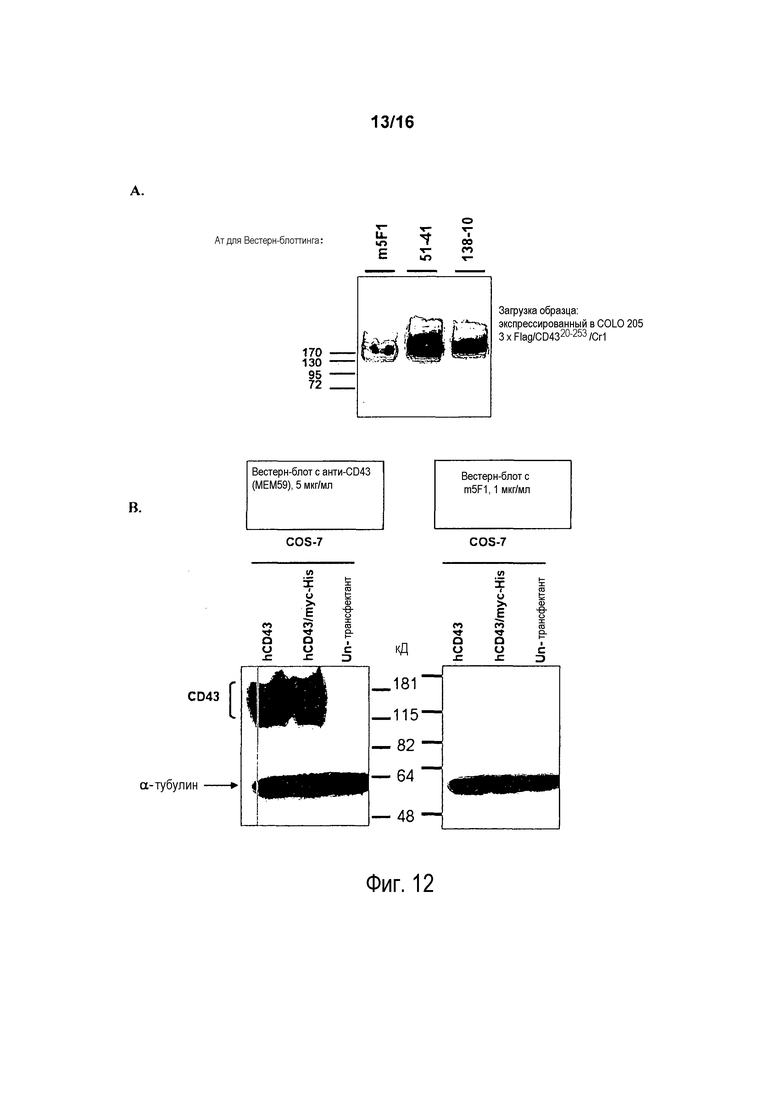
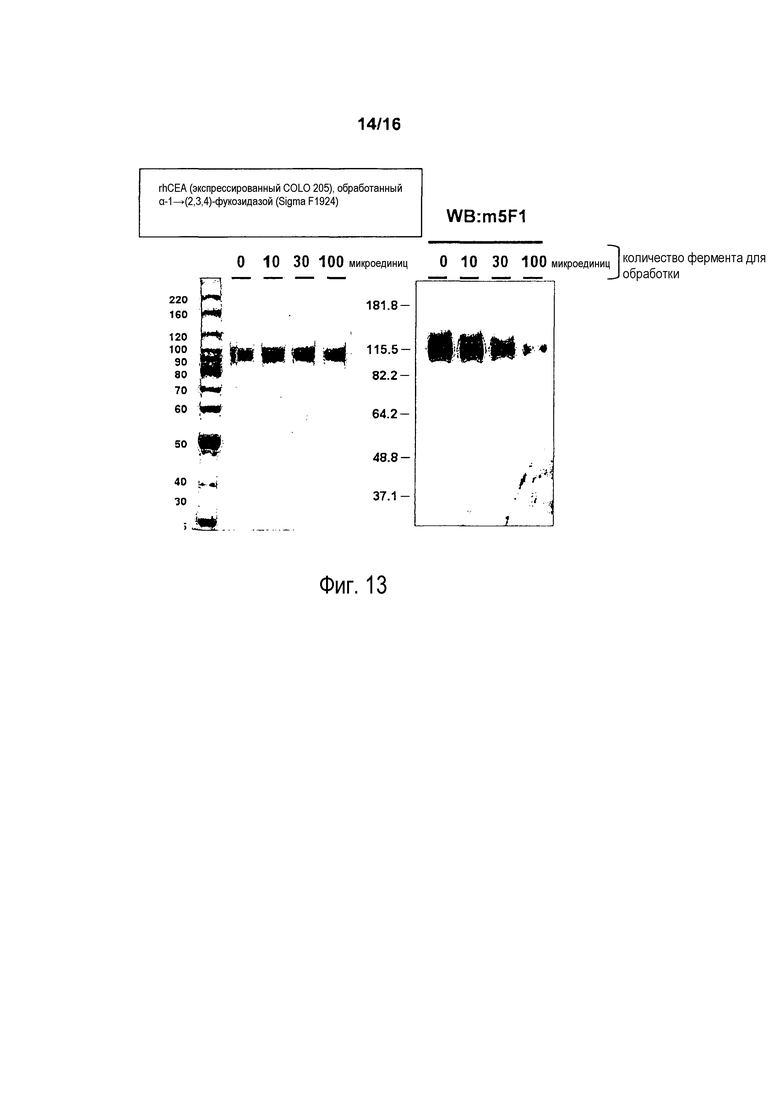
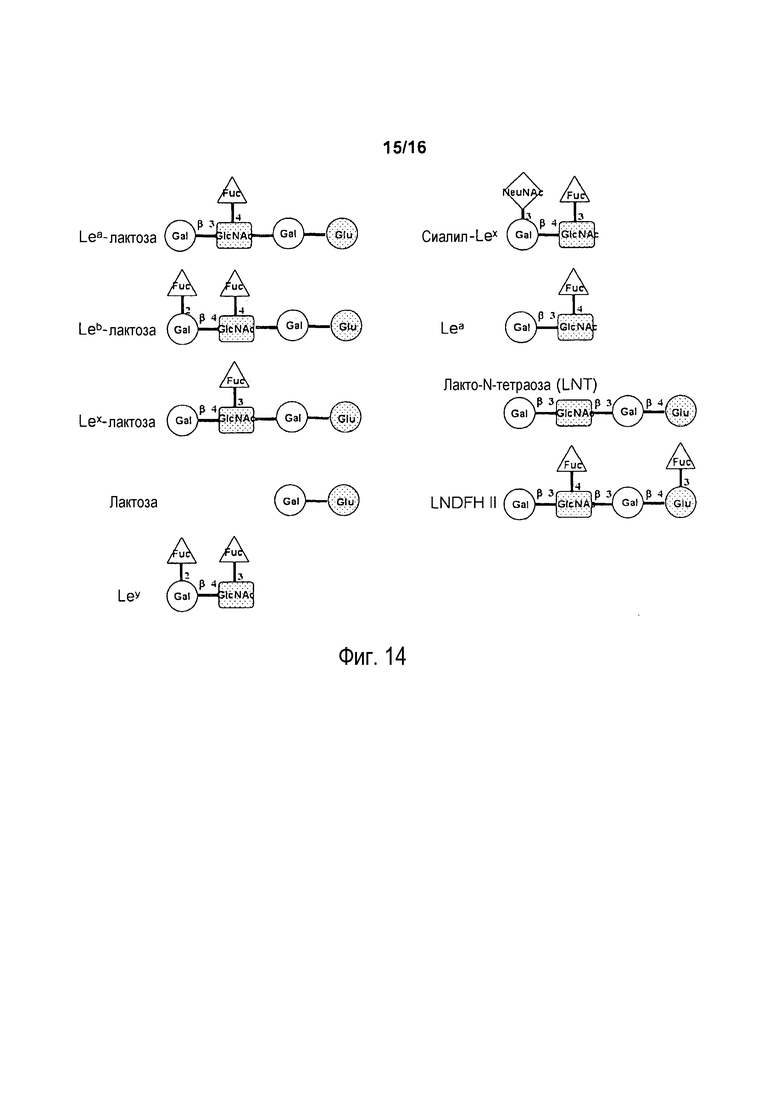
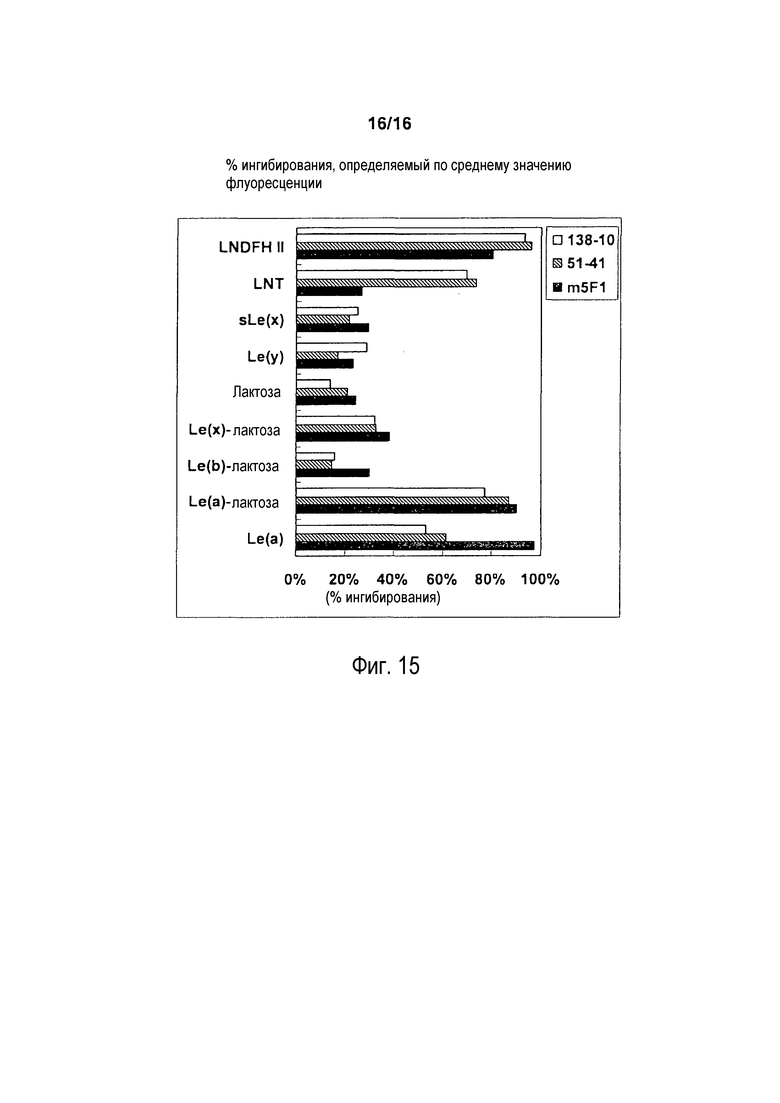
Изобретение относится к биохимии. Описаны антитела, которые специфично связываются с эпитопом на CD43 и CEA, экспрессируемых на негематопоэтических злокачественных клетках, но специфично не связываются с CD43, экспрессируемым лейкоцитом или клеткой Jurkat, и способны индуцировать апоптоз негематопоэтической злокачественной клетки после связывания с эпитопом на клеточной поверхности негематопоэтической злокачественной клетки в отсутствие цитотоксичной конъюгации и иммунной эффекторной функции, при этом эпитоп содержит углеводную структуру и связывание антитела с эпитопом ингибируется углеводом, содержащим структуру Lea, структуру Lea-лактоза, структуру LNDFH II или структуру LNT. Кроме того, настоящее изобретение относится к применению антител, описанных в данной публикации, для достижения диагностических и терапевтических целей. Изобретение увеличивает разнообразие антител, связывающихся с CD43 и CEA. 13 н. и 31 з.п. ф-лы, 15 ил., 6 табл., 10 пр.
1. Моноклональное антитело для диагностики негематопоэтической злокачественной опухоли у индивидуума, где моноклональное антитело специфично связывается с углеводным эпитопом на внеклеточном домене CD43 или СЕА человека, экспрессируемым негематопоэтическими злокачественными клетками человека, где антитело содержит вариабельную область тяжелой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 1 и вариабельную область легкой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 2.
2. Моноклональное антитело по п. 1. где антитело содержит последовательность вариабельной области тяжелой цепи из аминокислотной последовательности SEQ ID NO: 1 и последовательность вариабельной области легкой цепи из аминокислотной последовательности SEQ ID NO: 2.
3. Моноклональное антитело для диагностики негематопоэтической злокачественной опухоли у индивидуума, где моноклональное антитело специфично связывается с углеводным эпитопом на внеклеточном домене CD43 или СЕА человека, экспрессируемым негематопоэтическими злокачественными клетками человека, где моноклональное антитело содержит вариабельную область тяжелой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 3 и вариабельную область легкой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 4.
4. Моноклональное антитело по п. 3, где антитело содержит последовательность вариабельной области тяжелой цепи из аминокислотной последовательности SEQ ID NO: 3 и последовательность вариабельной области легкой цепи из аминокислотной последовательности SEQ ID NO: 4.
5. Моноклональное антитело для диагностики негематопоэтической злокачественной опухоли у индивидуума, где моноклональное антитело специфично связывается с углеводным эпитопом на внеклеточном домене CD43 или СЕА человека, экспрессируемым негематопоэтическими злокачественными клетками человека, где моноклональное антитело содержит вариабельную область тяжелой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 5 и вариабельную область легкой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 6.
6. Моноклональное антитело по п. 5, где антитело содержит последовательность вариабельной области тяжелой цепи из аминокислотной последовательности SEQ ID NO: 5 и последовательность вариабельной области легкой цепи из аминокислотной последовательности SEQ ID NO: 6.
7. Моноклональное антитело для диагностики негематопоэтической злокачественной опухоли у индивидуума, где моноклональное антитело специфично связывается с углеводным эпитопом на внеклеточном домене CD43 или СЕА человека, экспрессируемым негематопоэтическими злокачественными клетками человека, где антитело содержит последовательность вариабельной области тяжелой цепи из аминокислотной последовательности SEQ ID NO: 7 и последовательность вариабельной области легкой цепи из аминокислотной последовательности SEQ ID NO: 8.
8. Моноклональное антитело по любому из пп. 1-7, где негематопоэтической злокачественной клеткой является злокачественная клетка прямой и ободочной кишки человека, злокачественная клетка поджелудочной железы, злокачественная клетка желудка, злокачественная клетка яичника человека, злокачественная клетка пищевода человека или эндометриальная злокачественная клетка человека.
9. Моноклональное антитело по любому из пп. 1-7, где антитело представляет собой гуманизированное антитело.
10. Моноклональное антитело по любому из пп. 1-7, где антитело представляет собой химерное антитело.
11. Моноклональное антитело по любому из пп. 1-7, где антитело представляет собой антитело человека.
12. Моноклональное антитело по любому из пп. 1-7, где антитело связано с меткой.
13. Моноклональное антитело по п. 12, где метка выбрана из группы, состоящей из фермента, флуоресцентной молекулы, хемилюминесцентной молекулы, радиоактивной молекулы и биотина.
14. Моноклональное антитело по п. 13, где метка выбрана из группы, состоящей из 3Н, 14С, 15N, 35S, 90Y, 99Тс, 111In, 125I, 131I), изотиоцианата флуоресцеина (ФИТЦ), родамина, лантанидных люминофоров, фикоэритрина (РЕ), пероксидазы хрена, β-галактозидазы, люциферазы, щелочной фосфатазы, глюкозооксидазы, глюкоза-6-фосфатдегидрогеназы, алкогольдегидрогеназы, малатдегидрогеназы, пенициллиназы и люциферазы.
15. Набор для использования в диагностике негематопоэтической злокачественной опухоли у индивидуума, содержащий моноклональное антитело, которое специфично связывается с углеводным эпитопом на внеклеточном домене CD43 или СЕА человека, экспрессируемым негематопоэтическими злокачественными клетками человека, где моноклональное антитело содержит вариабельную область тяжелой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 1, и вариабельную область легкой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 2; и инструкции по применению.
16. Набор по п. 15, где антитело содержит последовательность вариабельной области тяжелой цепи из аминокислотной последовательности SEQ ID NO: 1 и последовательность вариабельной области легкой цепи из аминокислотной последовательности SEQ ID NO: 2.
17. Набор для использования в диагностике негематопоэтической злокачественной опухоли у индивидуума, содержащий моноклональное антитело, которое специфично связывается с углеводным эпитопом на внеклеточном домене CD43 или СЕА человека, экспрессируемым негематопоэтическими злокачественными клетками человека, где моноклональное антитело содержит вариабельную область тяжелой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 3, и вариабельную область легкой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 4; и инструкции по применению.
18. Набор по п. 16, где антитело содержит последовательность вариабельной области тяжелой цепи из аминокислотной последовательности SEQ ID NO: 3 и последовательность вариабельной области легкой цепи из аминокислотной последовательности SEQ ID NO: 4.
19. Набор для использования в диагностике негематопоэтической злокачественной опухоли у индивидуума, содержащий моноклональное антитело, которое специфично связывается с углеводным эпитопом на внеклеточном домене CD43 или СЕА человека, экспрессируемым негематопоэтическими злокачественными клетками человека, где моноклональное антитело содержит вариабельную область тяжелой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 5, и вариабельную область легкой цепи, которая содержит три CDR из аминокислотной последовательности SEQ ID NO: 6; и инструкции по применению.
20. Набор по п. 19, где антитело содержит последовательность вариабельной области тяжелой цепи из аминокислотной последовательности SEQ ID NO: 5 и последовательность вариабельной области легкой цепи из аминокислотной последовательности SEQ ID NO: 6.
21. Набор для использования в диагностике негематопоэтической злокачественной опухоли у индивидуума, содержащий моноклональное антитело, которое специфично связывается с углеводным эпитопом на внеклеточном домене CD43 или СЕА человека, экспрессируемым негематопоэтическими злокачественными клетками человека, где антитело содержит последовательность вариабельной области тяжелой цепи из аминокислотной последовательности SEQ ID NO: 7 и последовательность вариабельной области легкой цепи из аминокислотной последовательности SEQ ID NO: 8; и инструкции по применению.
22. Набор по любому из пп. 15-21, где негематопоэтической злокачественной клеткой является злокачественная клетка прямой и ободочной кишки человека, злокачественная клетка поджелудочной железы, злокачественная клетка желудка, злокачественная клетка яичника человека, злокачественная клетка пищевода человека или эндометриальная злокачественная клетка человека.
23. Набор по любому из пп. 15-21, где антитело представляет собой гуманизированное антитело.
24. Набор по любому из пп. 15-21, где антитело представляет собой химерное антитело.
25. Набор по любому из пп. 15-21, где антитело представляет собой антитело человека.
26. Набор по любому из пп. 15-21, где антитело связано с меткой.
27. Набор по п. 26, где метка выбрана из группы, состоящей из фермента, флуоресцентной молекулы, хемилюминесцентной молекулы, радиоактивной молекулы и биотина.
28. Набор по п. 27, где метка выбрана из группы, состоящей из 3Н, 14С, 15N, 35S, 90Y, 99Тс, 111In, 125I, 131I), изотиоцианата флуоресцеина (ФИТЦ), родамина, лантанидных люминофоров, фикоэритрина (РЕ), пероксидазы хрена, β-галактозидазы, люциферазы, щелочной фосфатазы, глюкозооксидазы, глюкоза-6-фосфатдегидрогеназы, алкогольдегидрогеназы, малатдегидрогеназы, пенициллиназы и люциферазы.
29. Способ диагностики негематопоэтической злокачественной опухоли у индивидуума, у которого предполагается наличие злокачественной опухоли, включающий осуществление контакта образца из индивидуума с моноклональным антителом, где моноклональное антитело содержит вариабельную область тяжелой цепи, включающую три CDR из аминокислотной последовательности SEQ ID NO: 1, и вариабельную область легкой цепи, включающую три CDR, из аминокислотной последовательности SEQ ID NO: 2, где наличие связывания между антителом и клеткой в образце указывает на то, что образец может содержать раковые клетки.
30. Способ по п. 29, в котором моноклональное антитело содержит вариабельную область тяжелой цепи из аминокислотной последовательности SEQ ID NO: 1 и вариабельную область легкой цепи из аминокислотной последовательности SEQ ID NO: 2.
31. Способ диагностики негематопоэтической злокачественной опухоли у индивидуума, у которого предполагается наличие злокачественной опухоли, включающий осуществление контакта образца из индивидуума с моноклональным антителом, где моноклональное антитело содержит вариабельную область тяжелой цепи, включающую три CDR из аминокислотной последовательности SEQ ID NO: 3, и вариабельную область легкой цепи, включающую три CDR, из аминокислотной последовательности SEQ ID NO: 4, где наличие связывания между антителом и клеткой в образце указывает на то, что образец может содержать раковые клетки.
32. Способ по п. 31, в котором моноклональное антитело содержит вариабельную область тяжелой цепи из аминокислотной последовательности SEQ ID NO: 3 и вариабельную область легкой цепи из аминокислотной последовательности SEQ ID NO: 4.
33. Способ диагностики негематопоэтической злокачественной опухоли у индивидуума, у которого предполагается наличие злокачественной опухоли, включающий осуществление контакта образца из индивидуума с моноклональным антителом, где моноклональное антитело содержит вариабельную область тяжелой цепи, включающую три CDR из аминокислотной последовательности SEQ ID NO: 5, и вариабельную область легкой цепи, включающую три CDR, из аминокислотной последовательности SEQ ID NO: 6, где наличие связывания между антителом и клеткой в образце указывает на то, что образец может содержать раковые клетки.
34. Способ по п. 33, в котором моноклональное антитело содержит вариабельную область тяжелой цепи из аминокислотной последовательности SEQ ID NO: 5 и вариабельную область легкой цепи из аминокислотной последовательности SEQ ID NO: 6.
35. Способ диагностики негематопоэтической злокачественной опухоли у индивидуума, у которого предполагается наличие злокачественной опухоли, включающий осуществление контакта образца из индивидуума с моноклональным антителом, где моноклональное антитело содержит вариабельную область тяжелой цепи из аминокислотной последовательности SEQ ID NO: 7 и вариабельную область легкой цепи из аминокислотной последовательности SEQ ID NO: 8.
36. Способ по любому из пп. 29-35, в котором негематопоэтической злокачественной клеткой является клетка колоректального рака, клетка рака поджелудочной железы человека, клетка рака желудка человека, клетка рака яичников человека, клетка рака пищевода человека или клетка рака эндометрия человека.
37. Способ по любому из пп. 29, 31 или 33, в котором моноклональным антителом является гуманизированное антитело.
38. Способ по любому из пп. 29-35, в котором антителом является химерное антитело.
39. Способ по любому из пп. 29-35, в котором моноклональное антитело является антителом человека.
40. Способ по любому из пп. 29-35, в котором моноклональное антитело связано с меткой.
41. Способ по п. 40, в котором метка выбрана из группы, состоящей из фермента, флуоресцентной молекулы, хемилюминесцентной молекулы, радиоактивной молекулы и биотина.
42. Способ по п. 41, где метка выбрана из группы, состоящей из 3Н, 14С, 15N, 35S, 90Y, 99Тс, 111In, 125I, 131I), изотиоцианата флуоресцеина (ФИТЦ), родамина, лантанидных люминофоров, фикоэритрина (РЕ), пероксидазы хрена, β-галактозидазы, люциферазы, щелочной фосфатазы, глюкозооксидазы, глюкоза-6-фосфатдегидрогеназы, алкогольдегидрогеназы, малатдегидрогеназы, пенициллиназы и люциферазы.
43. Способ по любому из пп. 29-35, 41 или 42, в котором негематопоэтической злокачественной опухолью является колоректальный рак, рак поджелудочной железы, рак желудка, рак яичников, рак пищевода или рак эндометрия.
44. Способ определения, можно ли лечить индивидуума, у которого предполагается наличие злокачественной опухоли, с помощью моноклонального антитела, которое связывается с эпитопом на внеклеточном домене CD43 человека или СЕА человека, экспрессируемых негематопоэтическими злокачественными клетками, но специфично не связываемого с CD43 человека, экспрессируемым на клеточной поверхности периферических Т-клеток человека или клеток Jurkat, где эпитоп содержит углевод, и связывание антитела с эпитопом ингибируется олигосахаридами Leα, Leα-лактозой и лакто-N-дифукогексаозой II (LNDFH II), причем указанный способ включает осуществление контакта образца из индивидуума с моноклональным антителом; где моноклональное антитело содержит вариабельную область тяжелой цепи, включающую три CDR из аминокислотной последовательности SEQ ID NO: 1, и вариабельную область легкой цепи, включающую три CDR, из аминокислотной последовательности SEQ ID NO: 2, вариабельную область тяжелой цепи, включающую три CDR из аминокислотной последовательности SEQ ID NO: 3, и вариабельную область легкой цепи, включающую три CDR, из аминокислотной последовательности SEQ ID NO: 4 или вариабельную область тяжелой цепи, включающую три CDR из аминокислотной последовательности SEQ ID NO: 5, и вариабельную область легкой цепи, включающую три CDR, из аминокислотной последовательности SEQ ID NO: 6;
где наличие связывания между антителом и клеткой в образце указывает на то, что индивидуума со злокачественной опухолью можно лечить антителом.
| WO 2001062286 А1, 30.08.2001 | |||
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, НУКЛЕИНОВАЯ КИСЛОТА И ВЕКТОР, КОДИРУЮЩИЕ АНТИТЕЛО, И ИСПОЛЬЗОВАНИЕ АНТИТЕЛА ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ | 1999 |
|
RU2235131C2 |
Авторы
Даты
2017-04-18—Публикация
2012-05-25—Подача