Данная заявка относится к способу дифференциации плюрипотентных стволовых клеток (PSC) в клетки сосудистого русла (т.е. эндотелиальные клетки (EC) и/или гладкомышечные клетки сосудов (VSMC)). Кроме того, данная заявка относится к способу дифференциации человеческих эмбриональных стволовых клеток (ESC) и индуцированных плюрипотентных стволовых клеток (iPSC) в клетки сосудистого русла на основе связанных стадий индукции химически определенной средой.
Практически все ткани человеческого организма зависят от кровоснабжения. Эндотелиальные клетки образуют выстилки кровеносных сосудов и обеспечивают барьер между кровью и тканями, обладающий селективной проницаемостью. Кроме того, в стенках кровеносных сосудов находятся гладкомышечные клетки сосудов, играющие важную роль в контроле сужения кровеносных сосудов. Повреждение, активация или дисфункция эндотелиальных клеток являются важными характеристиками патофизиологии многих заболеваний.
Следовательно, понимание фундаментальных принципов биологии сосудов имеет крайнюю важность для открытия новых подходов для лечения многих пациентов. Например, пациенты, страдающие от диабета типа 2, имеют значительно большую частоту возникновения заболеваний коронарных артерий (CAD) и периферических сосудистых осложнений, подобных нефропатии и ретинопатии. Таким образом, сосудистые осложнения являются главной причиной значительно повышенных частот смертности и заболеваемости в данной популяции пациентов. Дисфункция эндотелиальных клеток в почке приводит к усиленному росту гладкомышечных клеток сосудов и мезангиальных клеток и к сужению сосудов, приводя к диффузному гломерулосклерозу и затем вызывая тяжелую почечную недостаточность. При диабетической ретинопатии гипергликемия индуцирует гибель гладкомышечных клеток сосудов, приводящую к повреждению и усиленному росту эндотелиальных клеток капилляров сетчатки, что вызывает патофизиологическую пролиферацию сетчатки, которая затем приводит к ухудшению или даже к полной потере зрения. Таким образом, существует потребность в специфичных для пациента моделях клеток сосудистого русла in vitro для исследования сосудистых осложнений и для идентификации подходящих новых мишеней и стратегий для лечения сосудистых осложнений у пациентов с диабетом типа 2.
Эндотелиальные клетки являются критически важными в ангиогенезе и образовании и развитии сосудов, например, в ответ на патологические состояния, такие как хроническая гипоксия или ишемия ткани. Факторы роста, такие как фактор роста эндотелия сосудов (VEGF), могут активировать эндотелиальный каскад сигнализации, приводя к пролиферации клеток и образованию новых трубок. Эндотелиальные клетки-предшественники (EPC) с недавних пор находятся в центре внимания в качестве потенциального терапевтического лечения в регенеративной медицине сосудов: эффективную неоваскуляризацию, индуцированную трансплантацией EPC, для задних конечностей, миокарда и ишемии мозга оценивали во многих доклинических исследованиях, а также в клинических испытаниях для лечения ишемических сердечно-сосудистых заболеваний при хронических и острых заболеваниях коронарных артерий (Yamahara K, Itoh Н., Ther Adv Cardiovasc Dis. 2009 Feb; 3(1): 17-27; Kawamoto A, Asahara Т., Catheter Cardiovasc Interv. 2007 Oct 1; 70(4): 477-84; Marsboom G, Janssens S., Expert Rev Cardiovasc Ther. 2008 Jun; 6(5): 687-701). Одним из главных недостатков потенциального применения автологичных EC/EPC в терапии на основе клеток является их ограниченная способность к размножению и доступность.
Индуцированная лекарственными средствами токсичность часто вызывает повреждение важных органов, таких как печень и легкое. Токсичное лекарственное средство или его метаболит влияет на биологию клеток-мишеней непосредственно, либо провоцирует иммунный ответ в данном органе. При поражении синусоидальных эндотелиальных клеток печени и эндотелиальных клеток легкого токсичностью, индуцированной лекарственным средством, развивается тяжелый отек, который может приводить к печеночной недостаточности или одышке. Разработка специфичных для пациента моделей эндотелиальных клеток in vitro позволила бы оценивать токсичность лекарственного средства in vitro, облегчая разработку лекарственных средств с пониженным риском вызова отека ткани.
Эмбриональные стволовые (ES) клетки и специфичные для пациента индуцированные плюрипотентные стволовые клетки (iPSC) представляют собой потенциальный источник широкомасштабного получения эндотелиальных клеток и эндотелиальных клеток-предшественников для регенеративной сосудистой медицины. При использовании технологии индуцированных плюрипотентных стволовых клеток (iPSC) (Takahashi, K. & Yamanaka, S., "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors", Cell 126, 663-676 (2006)) соматические клетки могут быть перепрограммированы в iPSC путем трансдукции четырех определенных факторов (Sox2, Oct4, Klf4, c-Myc). Технология iPSC обеспечивает генерацию специфичных для пациента iPSC, которые могут дифференцироваться в специфичные для пациента эндотелиальные клетки. Данные специфичные для пациента эндотелиальные клетки являются полезными, например, в моделировании in vitro патофизиологии сосудистых осложнений, ассоциированных с диабетом типа-2, или для оценки токсичности лекарственного средства.
Одним важным предварительным условием для попытки такого моделирования заболевания in vitro является внедрение эффективной, надежной и варьируемой по объему системы дифференциации (Grskovic et al., 2011; Tiscornia et al., 2011; Zhu et al., 2011). Предыдущие попытки дифференцировать человеческие PSC в клетки сосудистого русла не достигли масштабов и эффективности, релевантных для кампаний по изысканию новых лекарственных средств или регенеративных клеточных терапий. Было опубликовано несколько способов дифференциации человеческих плюрипотентных стволовых клеток (эмбриональных стволовых клеток и iPSC) в эндотелиальные клетки. Эндотелиальные клетки, происходящие от плюрипотентных стволовых клеток, определяются минимальным требованием экспрессирования поверхностных маркеров, таких как CD31 и CD144, и способностью формировать трубки на планшетах, покрытых матригелем. James et al. (Nature Biotech 28, 161-167, 2010) дифференцировали эндотелиальные клетки из культур эмбриоидных телец, полученных из эмбриональных стволовых клеток. В данном процессе эмбриоидные тельца последовательно стимулировали разными факторами роста, подобными морфогенетическому белку кости 4, активину А, фактору роста фибробластов 2 и VEGF-A. Авторы использовали маленькую ингибирующую молекулу TGFb (трансформирующий фактор роста-бета) (например, SB431542) для того, чтобы увеличить выход и воспроизводимость дифференциации эндотелиальных клеток. Однако данный способ имеет важные недостатки: во-первых, абсолютный выход эндотелиальных клеток был всего лишь меньше 10% и, во-вторых, общее время, необходимое для дифференциации плюрипотентных стволовых клеток в эндотелиальные клетки, составляло минимум 10 суток. Недавно Tatsumi et al. (Cell Transplantation, 2010) обошли некоторые из этих ограничений с использованием нового подхода для дифференциации эндотелиальных клеток, происходящих от человеческих эмбриональных стволовых клеток. С использованием способа дифференциации, состоящего из поэтапной комбинации 3 суток инкубации в химически определенной бессывороточной среде, дополненной 5 мкМ ингибитором киназы-3b гликогенсинтазы (GSK-3) - ((2'Z,3'E)-6-броминдирубин-3'-оксимом, именуемым «BIO»), и 2 суток инкубации в среде, дополненной фактором роста эндотелия сосудов (VEGF), эндотелиальные клетки индуцируются за 5 суток с примерно 20%-ной эффективностью, определенной по эндотелиальным клеткам, экспрессирующим поверхностный маркер CD144 (кроме того, описываемым как клетки CD144+). Эндотелиальные клетки CD144+ затем сортируют с использованием разделения посредством магнитно-активированной клеточной сортировки (MACS) и размножают для разных пассажей в среде, дополненной VEGF. Затем дифференцированные эндотелиальные клетки тестировали на некоторые отличительные характеристики эндотелиальных клеток: образование капилляроподобных трубок, поглощение ацетилированного липопротеина низкой плотности, меченного 1',1'-диоктадецил-3,3,3',3'-тетраметилиндокарбоцианином (Dil-Ac-LDL) и экспрессия маркеров CD31, CD34, CD144 и VEGFR-2 (рецептор-2 фактора роста эндотелия сосудов). При использовании данного способа общее время, необходимое для дифференциации эндотелиальных клеток, составляло лишь 5 суток, однако абсолютный выход (примерно 20%) эндотелиальных клеток был лишь слегка увеличен. Данный подход имеет дополнительные недостатки: на исходной стадии недифференцированные человеческие эмбриональные стволовые клетки диссоциируют на маленькие комки клеток, и их высаживают на чашки, покрытые коллагеном типа I. При использовании маленьких комков эмбриональных стволовых клеток исходные условия плохо определены, что имеет отрицательное влияние на воспроизводимость.
В заключение, главным недостатком всех известных способов дифференциации является необходимость неопределенных факторов, таких как сыворотка, кондиционированная среда, сокультуры с мышиными стромальными клетками ОР9 или питающими слоями, гетерогенная природа агрегатов клеток или эмбриоидных телец (James et al., 2010, Sumi et al., 2008; Vodyanik et al., 2005; Wang et al., 2007; Levenberg et al., 2002 PNAS; Kane et al., 2010; Tatsumi et al., 2010).
Сохраняется потребность в легко доступном и воспроизводимом способе дифференциации плюрипотентных стволовых клеток в клетки сосудистого русла. Согласно настоящему изобретению предложен улучшенный способ дифференциации плюрипотентных стволовых клеток в эндотелиальные клетки за меньшее время (5 суток) и со значительно повышенным выходом (вплоть до 85%, при определении по клеткам, экспрессирующим маркер CD144), и он может полностью воспроизводиться. Данный новый способ уменьшает необходимость получения эмбриоидных телец или маленьких комков клеток из плюрипотентных стволовых клеток и устраняет главный недостаток в виде низкой воспроизводимости и стандартизации способов, известных в данной области. Кроме того, высокая эффективность (вплоть до 85%-ного выхода эндотелиальных клеток, экспрессирующих маркер CD144) теперь делает возможным применение данных эндотелиальных клеток при изыскании новых лекарственных средств и исследовании их безопасности в больших масштабах, в приложениях регенеративной медицины и в моделировании заболевания in vitro в фармацевтической промышленности. Кроме того, новый способ обеспечивает селективную модуляцию сосудистых клеток-предшественников, что делает возможным сдвиг детерминации линии либо преимущественно в эндотелиальные (~85%), либо в гладкомышечные клетки сосудов (~90%).
Здесь предложен способ дифференциации плюрипотентных стволовых клеток в клетки сосудистого русла, включающий следующие стадии:
а) получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности;
б) инкубирование указанных клеток в примирующей среде, дополненной маленькой молекулой, которая активирует путь бета-катенина (белок бета 1, ассоциированный с кадгерином; название человеческого гена CTNNB1) и/или путь сигнализации с участием рецептора Wnt, и/или путь сигнализации hedgehog (HH);
в) индуцирование дифференциации путем инкубирования указанных примированных клеток в индуцирующей среде.
Предпочтительно среды заменяют между каждой стадией, что означает отбрасывание первой среды, например, путем отсоса перед добавлением к клеткам второй среды.
Фраза «монослой плюрипотентных клеток» в том виде, как она здесь используется, означает то, что берут плюрипотентные стволовые клетки в виде одиночных клеток, которые прикрепляются к адгезивному субстрату в виде пленки толщиной в одну клетку, в отличие от культивирования комков клеток или эмбриоидных телец, при котором к адгезивному субстрату прикрепляется твердая масса клеток во многих слоях, образующих разных трехмерные образования.
Получение монослоя плюрипотентных стволовых клеток на исходной стадии играет решающую роль для воспроизводимости и эффективности способа, и оно не было ранее описано в каких-либо способах дифференциации клеток сосудистого русла. В одном воплощении монослои плюрипотентных стволовых клеток можно получать путем ферментативной диссоциации клеток на одиночные клетки и помещения их на адгезивный субстрат, такой как планшеты, заранее покрытые матригелем (например, BD Matrigel, подходящий для hESC (человеческие эмбриональные стволовые клетки), от BD Bioscience, Geltrex, подходящий для hESC, от Invitrogen, Synthemax от Corning). Примеры ферментов, подходящих для диссоциации на одиночные клетки, включают аккутазу (Invitrogen), трипсин (Invitrogen), TrypLe Express (Invitrogen). В одном воплощении в планшет на адгезивный субстрат высаживают от 20000 до 60000 клеток на см2. Используемая здесь среда представляет собой среду для плюрипотентности, которая облегчает прикрепление и рост плюрипотентных стволовых клеток в виде одиночных клеток в монослое. Термин «среда для плюрипотентности» в том виде, в котором он здесь используется, относится к любой химически определенной среде, полезной для прикрепления плюрипотентных стволовых клеток в виде одиночных клеток в монослое, при сохранении их плюрипотентности, и они хорошо известны в данной области. Термин «среда для плюрипотентности» относится к среде, которая содержит по меньшей мере один из следующих факторов роста: основной фактор роста фибробластов (bFGF, также описываемый как фактор роста фибробластов 2, FGF2) и трансформирующий фактор роста β (TGFβ). В одном воплощении среда для плюрипотентности представляет собой бессывороточную среду, дополненную низкомолекулярным ингибитором Rho-ассоциированного белка, образующего суперспираль, из семейства серин/треониновых киназ (ROCK) протеинкиназ (именуемый здесь ингибитор ROCK киназы).
Таким образом, в одном воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности, где указанная среда для плюрипотентности представляет собой бессывороточную среду, дополненную ингибитором ROCK киназы.
Примерами бессывороточных сред, подходящих для прикрепления, являются mTeSR1 или TeSR2 от Stem Cell Technologies, среда для клеток приматов ES/iPS от ReproCELL и StemPro hESC SFM от Invitrogen, X-VIVO от Lonza. Примерами полезного здесь ингибитора ROCK киназы являются фазудил (1-(5-изохинолинсульфонил)гомопиперазин), тиазовивин (N-бензил-2-(пиримидин-4-иламино)тиазол-4-карбоксамид) и Y27632 ((+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)цикло-гексанкарбоксамида дигидрохлорид, например каталожный номер: 1254 от Tocris bioscience). В одном воплощении среда для плюрипотентности представляет собой бессывороточную среду, дополненную 2-20 мкМ Y27632, предпочтительно 5-10 мкМ Y27632. В другом воплощении среда для плюрипотентности представляет собой бессывороточную среду, дополненную 2-20 мкМ фазудилом. В другом воплощении среда для плюрипотентности представляет собой бессывороточную среду, дополненную 0,2-10 мкМ тиазовивином.
В одном воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности и выращивание указанного монослоя в среде для плюрипотентности в течение одних суток (24 часа). В другом воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности и выращивание указанного монослоя в среде для плюрипотентности в течение 18 часов-30 часов, предпочтительно в течение 23-25 часов.
В другом воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности, где указанная среда для плюрипотентности представляет собой бессывороточную среду, дополненную ингибитором ROCK киназы, и выращивание указанного монослоя в среде для плюрипотентности в течение одних суток (24 часа). В другом воплощении стадия а) описанного выше способа включает получение монослоя плюрипотентных стволовых клеток в среде для плюрипотентности, где указанная среда для плюрипотентности представляет собой бессывороточную среду, дополненную ингибитором ROCK киназы, и выращивание указанного монослоя в среде для плюрипотентности в течение 18 часов - 30 часов, предпочтительно в течение 23-25 часов.
Фраза «подходящая среда для примирования», также описываемая как «примирующая среда», в том виде, как она здесь используется, относится к любой химически определенной среде, полезной для примирования плюрипотентных стволовых клеток до эндотелиальных клеток. Термин «примирующая среда» в том виде, как он здесь используется, относится к среде, которая содержит по меньшей мере один фактор, такой как маленькая молекула, которая активирует путь бета-катенина (белок бета 1, ассоциированный с кадгерином; название человеческого гена CTNNB1) и/или путь сигнализации с участием рецептора Wnt, и/или путь сигнализации hedgehog (HH), что стимулирует индуцирующую активность мезодермы. При инкубации в примирующей среде плюрипотентные стволовые клетки начинают менять морфологию клеток с течением времени, и увеличивается пролиферация клеток. Стадия «примирования» определяется экспрессией конкретных генов и маркеров, участвующих в мезодермальном переходе (например, GATA2, VIMENTIN, SMA, HAND1, FOXa2 (низкая экспрессия), KDR), и понижающей регуляцией генов и маркеров, ассоциированных с плюрипотентностью (например, ОСТ4 (POU5F1), NANOG, SOX2, REX1 (ZFP42), LEFTY1, LEFTY2, TDGF1, DNMT3B, GABRB3, GDF3, TERT).
В одном воплощении указанные маленькие молекулы, активирующие путь бета-катенина (белок бета 1, ассоциированный с кадгерином; название человеческого гена CTNNB1) и/или путь сигнализации с участием рецептора Wnt, и/или путь сигнализации hedgehog (HH), выбраны из группы, состоящей из низкомолекулярных ингибиторов киназы 3 гликогенсинтазы (Gsk3a-b), низкомолекулярных ингибиторов CDC-подобной киназы 1 (Clk-2-4), низкомолекулярных ингибиторов митогенактивируемой протеинкиназы 15 (Mapk15), низкомолекулярных ингибиторов киназы двойной специфичности, регулируемой фосфорилированием тирозина (Y) (Dyrk1a-b 4), низкомолекулярных ингибиторов циклин-зависимой киназы 16 (Pctk-3 4), сглаженных (SMO) активаторов и модуляторов взаимодействия между β-катенином (или γ-катенином) и коактивирующими белками СВР (белок, связывающий CREB) и p300 (белок p300, связывающий E1A).
Предпочтительно указанные ингибиторы киназы 3 гликогенсинтазы (Gsk3a-b) представляют собой ингибиторы GSK3 на основе пирролидинона. Термин «ингибитор GSK3 на основе пирролидинона» в том виде, как он здесь используется, относится к селективным проникающим в клетку конкурирующим с АТФ ингибиторам GSK3α и GSK3β с низкими значениями ИК50 (полумаксимальная ингибирующая концентрация).
В одном воплощении указанный ингибитор GSK3 на основе пирролидинона выбран из группы, включающей 3-(2,4-дихлорфенил)-4-(1-метил-1Н-индол-3-ил)-1Н-пиррол-2,5-дион (SB216763), 3-[(3-хлор-4-гидроксифенил)амино]-4-(2-нитрофенил)-1Н-пиррол-2,5-дион (SB415286), N6-{2-[4-(2,4-дихлорфенил)-имидазол-1-ил-пиримидин-2-иламино]-этил}-3-нитро-пиридин-2,6-диамин 2HCl, 3-имидазо[1,2-a]пиридин-3-ил-4-[2-(морфолин-4-карбонил)-1,2,3,4-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-7-ил]-пиррол-2,5-дион, 9-бром-7,12-дигидро-индоло-[3,2-d][1]бензазепин-6(5Н)-он (кенпауллон), 9-бром-7,12-дигидро-пиридо[3',2':2,3]азепино[4,5-b]индол-6(5Н)-он (CHIR99021) и (3-(3-аминофенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион (CP21R7, также именуемый здесь как «соединение 21»; см., например, L. Gong et al; Bioorganic& Medicinal Chemistry Letters 20 (2010), 1693-1696).
В одном воплощении указанный ингибитор CDC-подобной киназы 1 (Clk1-2-4) выбран из группы, включающей бензотиазол и 3-фтор-N-[1-изопропил-6-(1метил-пиперидин-4-илокси)-1,3-дигидро-бензоимидазол-(2Е)-илиден]-5-(4-метил-1Н-пиразол-3-сульфонил)-бензамид.
В одном воплощении указанный ингибитор митогенактивируемой протеинкиназы 15 (Mapk15) выбран из группы, состоящей из 4-(4-фторфенил)-2-(4-метилсульфинилфенил)-5-(4-пиридил)-1Н-имидазола (SB203580) и 5-изохинолинсульфонамида (Н-89).
В одном воплощении указанный ингибитор киназы двойной специфичности, регулируемой фосфорилированием тирозина (Y) (Dyrk1a-b 4), выбран из группы, включающей 6-[2-амино-4-оксо-4Н-тиазол-(52)-илиденметил]-4-(тетрагидро-пиран-4-илокси)-хинолин-3-карбонитрил.
В одном воплощении указанный сглаженный активатор представляет собой пурморфамин-(2-(1-нафтокси)-6-(4-морфолиноанилино)-9-циклогексилпурин.
Примеры модуляторов взаимодействия между β-катенином (или γ-катенином) и коактивирующими белками CBP (белок, связывающий CREB) и p300 (белок p300, связывающий E1A) представляют собой IQ-1 (2-(4-ацетил-фенилазо)-2-[3,3-диметил-3,4-дигидро-2H-изохинолин-(1E)-илиден]-ацетамид и ICG-001 ((6S,9aS)-6-(4-гидроксибензил)-8-нафталин-1-илметил-4,7-диоксо-гексагидро-пиразино[1,2-а]пиримидин-1-карбоновой кислоты бензиламид (WO 2007056593).
В одном воплощении указанная примирующая среда представляет собой бессывороточную среду, дополненную инсулином, трансферрином и прогестероном. В одном воплощении указанная бессывороточная среда дополнена 10-50 мкг/мл инсулина, 10-100 мкг/мл трансферрина и 10-50 нМ прогестероном, предпочтительно 30-50 мкг/мл инсулина, 20-50 мкг/мл трансферрина и 10-30 нМ прогестероном. Примеры бессывороточных сред, подходящих для примирования, представляют собой среду N2B27 (N2B27 представляет собой смесь 1:1 DMEM (среда Игла, модифицированная по Дульбекко)/F12 (Gibco, Paisley, Великобритания), дополненную N2 и В27 (оба от Gibco)), среду N3 (состоящую из DMEM/F12 (Gibco, Paisley, Великобритания), 25 мкг/мл инсулина, 50 мкг/мл трансферрина, 30 нМ селенита натрия, 20 нМ прогестерона, 100 нМ путресцина (Sigma)) или среду для пролиферации NeuroCult® NS-A (Stemcell Technologies). В одном воплощении указанная примирующая среда представляет собой бессывороточную среду, дополненную инсулином, трансферрином, прогестероном и маленькой молекулой, которая активирует путь бета-катенина (белок бета 1, ассоциированный с кадгерином; название человеческого гена CTNNB1) и/или путь сигнализации с участием рецептора Wnt, и/или путь сигнализации hedgehog (HH). Предпочтительно указанная маленькая молекула выбрана из группы, включающей 3-(2,4-дихлорфенил)-4-(1-метил-1Н-индол-3-ил)-1Н-пиррол-2,5-дион (SB216763), 3-[(3-хлор-4-гидроксифенил)амино]-4-(2-нитрофенил)-1Н-пиррол-2,5-дион (SB415286), N6-{2-[4-(2,4-дихлорфенил)-5-имидазол-1-ил-пиримидин-2-иламино]-этил}-3-нитро-пиридин-2,6-диамин 2HCl, 3-имидазо[1,2-а]пиридин-3-ил-4-[2-(морфолин-4-карбонил)-1,2,3,4-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-7-ил]-пиррол-2,5-дион, 9-бром-7,12-дигидро-индоло[3,2-d][1]бензазепин-6(5Н)-он (кенпауллон), 9-бром-7,12-дигидро-пиридо[3',2':2,3]азепино[4,5-b]индол-6(5Н)-он (CHIR99021), 3-(3-аминофенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион (CP21R7, также именуемый здесь «соединение 21», бензотиазол, 3-фтор-N-[1-изопропил-6-(1-метил-пиперидин-4-илокси)-1,3-дигидро-бензоимидазол-(2Е)-илиден]-5-(4-метил-1Н-пиразол-3-сульфонил)-бензамид, 4-(4-фторфенил)-2-(4-метилсульфинилфенил)-5-(4-пиридил)-1Н-имидазол (SB203580), 5-изохинолинсульфонамид (Н-89), 6-[2-амино-4-оксо-4H-тиазол-(5Z)-илиденметил]-4-(тетрагидро-пиран-4-илокси)-хинолин-3-карбонитрил, 2-(1-нафтокси)-6-(4-морфолиноанилино)-9-циклогексилпурин (пурморфамин), 2-(4-ацетил-фенилазо)-2-[3,3-диметил-3,4-дигидро-2Н-изохинолин-(1Е)-илиден]-ацетамид (IQ-1) и ICG-001 ((6S,9aS)-6-(4-гидроксибензил)-8-нафталин-1-илметил-4,7-диоксо-гексагидро-пиразино[1,2-а]пиримидин-1-карбоновой кислоты бензиламид.
В одном предпочтительном воплощении примирующая среда представляет собой бессывороточную среду, содержащую 10-50 мкг/мл инсулина, 10-100 мкг/мл трансферрина и 10-50 нМ прогестерон, дополненную 0,5-4 мкМ CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион).
В одном воплощении указанная примирующая среда дополнительно содержит рекомбинантный морфогенный белок кости-4 (BMP4).
В одном предпочтительном воплощении примирующая среда представляет собой бессывороточную среду, содержащую 10-50 мкг/мл инсулина, 10-100 мкг/мл трансферрина и 10-50 нМ прогестерон, дополненную 0,5-4 мкМ CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дионом) и 10-50 нг/мл рекомбинантного морфогенного белка кости-4 (BMP4).
В одном воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде в течение по меньшей мере 3 суток (72 часа).
В одном воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде в течение 2-4 суток (от 48 часов до 96 часов).
В другом воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде, где указанная примирующая среда представляет собой бессывороточную среду, дополненную CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дионом). Предпочтительно указанная примирующая среда дополнена 0,5-4 мкМ CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион), наиболее предпочтительно 1-2 мкМ CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион).
В одном воплощении указанная примирующая среда дополнительно содержит рекомбинантный морфогенный белок кости-4 (BMP4).
В другом воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде, где указанная примирующая среда представляет собой бессывороточную среду, дополненную CP21R7 (3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион), и инкубирование указанных клеток в течение трех суток (72 часа).
В одном воплощении указанная примирующая среда дополнительно содержит рекомбинантный морфогенный белок кости-4 (BMP4).
В другом воплощении стадия б) описанного выше способа включает инкубирование указанных клеток в примирующей среде, где указанная примирующая среда представляет собой бессывороточную среду, дополненную CP21R7 (3-(3-аминофенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион), и выращивание указанных клеток в течение 2-4 суток (от 48 часов до 96 часов).
В одном воплощении указанная примирующая среда дополнительно содержит рекомбинантный морфогенный белок кости-4 (BMP4).
Термин «индуцирующая среда» в том виде, как он здесь используется, относится к любой химически определенной среде, полезной для индукции примированных клеток в CD144 позитивные (CD144+) эндотелиальные клетки или гладкомышечные клетки сосудов, позитивные в отношении рецептора бета PDGF (CD140b+), или в общий тип клетки-предшественника на монослое.
Для предпочтительной индукции эндотелиальных клеток указанную индукционную среду дополняют VEGF (фактор роста эндотелия сосудов) или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы. В одном воплощении указанный низкомолекулярный активатор аденилатциклазы приводит к активации пути сигнализации PKA/PKI. В одном воплощении указанные низкомолекулярные активаторы аденилатциклазы выбраны из группы, включающей форсколин ((3R)-(6aальфаH)додекагидро-6бета, 10альфа, 10bальфа-тригидрокси-3бета,4aбета,7,7,10aбета-пентаметил-1-оксо-3-винил-1Н-нафто[2,1-b]пиран-5бета-ил ацетат), 8-бром-цАМФ (8-бромаденозин-3',5'-циклический монофосфат) и адреномедуллин. В одном воплощении указанная индуцирующая среда представляет собой бессывороточную среду, дополненную человеческим сывороточным альбумином, этаноламином, трансферрином, инсулином и гидрокортизоном. Примерами бессывороточных сред, подходящих для индукции, являются StemPro-34 (Invitrogen, основные компоненты: человеческий сывороточный альбумин, липидные агенты, такие как человеческий Ex-Cyte® и этаноламин или их смесь, человеческий цинк инсулин, гидрокортизон, насыщенный железом, переносящий 2-меркаптоэтанол и D,L-токоферола ацетат или их производные, или смеси) и X-VIVO 10 и 15(Lonza).
В одном воплощении указанная индуцирующая среда представляет собой бессывороточную среду, дополненную человеческим сывороточным альбумином, этаноламином, трансферрином, инсулином, гидрокортизоном и 1-10 мкМ форсколином и 5-100 нг/мл VEGF-A. В другом воплощении индуцирующая среда содержит StemPro-34 (от Invitrogen), дополненный 30-70 нг/мл VEGF-A или 30-70 нг/мл плацентарного фактора роста 1 (PLGF-1).
В одном воплощении стадия в) описанного выше способа включает индуцирование дифференциации в эндотелиальные клетки путем инкубирования указанных примированных клеток в индуцирующей среде, дополненной VEGF-A или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы, где указанный низкомолекулярный активатор аденилатциклазы выбран из группы форсколина, 8-бром-цАМФ и адреномедуллина.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в эндотелиальные клетки путем инкубирования указанных примированных клеток в индуцирующей среде, дополненной VEGF-A или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы, в течение одних суток.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в эндотелиальные клетки путем инкубирования указанных примированных клеток в индуцирующей среде, дополненной VEGF-A или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы, в течение 18 часов - 48 часов, предпочтительно в течение 22 часов-36 часов.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в эндотелиальные клетки путем инкубирования указанных примированных клеток в индуцирующей среде, дополненной VEGF-A или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы, в течение одних суток, где указанный низкомолекулярный активатор аденилатциклазы выбран из группы форсколина, 8-бром-цАМФ и адреномедуллина.
С использованием способа, представленного в данном изобретении, теперь возможно дифференцировать эндотелиальные клетки из плюрипотентных стволовых клеток с выходом вплоть до 85% (Фиг. 2). Продукт стадии в) можно легко идентифицировать в культуре клеток как клетки CD144+.
Для преимущественной индукции гладкомышечных клеток сосудов стадия в) описанного выше способа включает инкубацию указанных примированных клеток в индуцирующей среде VSMC в течение 18-48 ч, предпочтительно в течение 22-36 часов. Индуцирующая среда VSMC представляет собой химически определенную среду, дополненную факторами роста и/или маленькими молекулами, усиливающими образование и выживание гладкомышечных клеток сосудов.
В одном воплощении данной стадии индуцирующая среда представляет собой химически определенную среду с заменителем сыворотки (SR среда). SR среда включает основную среду (например, среда RPMI, Invitrogen, кат. №11835-063 или среда DMEM (среда Игла, модифицированная по Дульбекко)), дополненную химически определенным заменителем сыворотки (2-15%), например заменителем сыворотки Knock-out от Invitrogen, кат. №10828028. Она может, кроме того, содержать стабильный глутамин, заменимые аминокислоты и бета-меркаптоэтанол.
В другом воплощении индуцирующая среда дополнена IWR1 (ингибитор ответа Wnt 1) в интервале от 1 до 5 мкМ.
В другом воплощении индуцирующая среда содержит бессывороточную среду, дополненную 2-20 нг/мл активатора пути сигнализации фактора роста тромбоцитов (PDGF) и 2-10 нг/мл активатора пути сигнализации TGF бета. Примеры активаторов сигнализации PDGF включают, например, PDGF-AA, PDGF-ВВ (например, RnD, кат. №220-ВВ) и PDGF-AB. Одним типичным активатором сигнализации TGFбeтa является активинА (например, RnD, кат. №338-АС). Примерами бессывороточных сред, подходящих для индукции, являются среда N2B27 (N2B27 представляет собой смесь 1:1 DMEM/F12 (Gibco, Paisley, Великобритания), дополненную N2 и В27 (оба от Gibco), StemPro-34 (Invitrogen, основные компоненты: человеческий сывороточный альбумин, липидные агенты, такие как человеческий Ex-Cyte®, и этаноламин или их смесь, человеческий цинк инсулин, гидрокортизон, насыщенный железом трансферрин, 2-меркаптоэтанол и D,L-токоферола ацетат или их производные, или смеси) и X-VIVO 10 и 15 (Lonza). В предпочтительном воплощении указанная бессывороточная среда, полезная для преобладающей индукции гладкомышечных клеток сосудов, представляет собой среду N2B27.
В другом воплощении индуцирующая среда содержит бессывороточную среду, дополненную 2-20 нг/мл активатора пути синализации фактора роста тромбоцитов (PDGF) и 2-10 нг/мл активатора пути синализации TGF бета, и, кроме того, содержит человеческий сывороточный альбумин, этаноламин, трансферрин, инсулин и гидрокортизон.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в гладкомышечные клетки сосудов путем инкубирования указанных примированных клеток в индуцирующей среде, как описано выше, в течение одних суток.
В другом воплощении стадия в) описанного выше способа включает индуцирование дифференциации в гладкомышечные клетки сосудов путем инкубирования указанных примированных клеток в индуцирующей среде, как описано выше, в течение 18 часов - 48 часов, предпочтительно в течение 22 часов - 36 часов.
С использованием способа, представленного в данном изобретении, теперь возможна дифференциация гладкомышечных клеток сосудов из плюрипотентных стволовых клеток с выходом 90%. Продукт стадии в) можно легко идентифицировать в культуре клеток как клетки CD140b+.
В другом воплощении указанный способ дополнительно включает стадию
г) инкубирования продукта стадии в) при подходящих условиях для пролиферации эндотелиальных клеток или гладкомышечных клеток сосудов.
Предпочтительно указанные подходящие условия для пролиферации эндотелиальных клеток включают отбор указанных клеток CD144+ и размножение их в химически определенной среде для размножения. Термин «отбор» в том виде, как он здесь используется, относится к ферментативной диссоциации клеток от адгезивного субстрата и последующему ресуспендированию в новой среде. В одном предпочтительном воплощении клетки сортируют после отбора. Сортировка клеток может достигаться способами, известными в данной области, например, посредством магнитно-активированной клеточной сортировки (MACS) (Фиг. 3) или разделения посредством проточной цитометрии - флуоресцентной сортировки клеток (FACS). Термин «среда для размножения» в том виде, как он здесь используется, относится к любой химически определенной среде, полезной для размножения и пассирования эндотелиальных клеток CD144+ на монослое. В одном воплощении указанная среда для размножения представляет собой бессывороточную среду, дополненную VEGF-A. Примерами бессывороточных сред, подходящих для размножения эндотелиальных клеток, являются StemPro-34 (Invitrogen), EGM2 (Lonza) и DMEM/F12 (Invitrogen), дополненные 8 нг/мл FGF-2, 50 нг/мл VEGF и 10 мкМ SB431542 (4-(4-бензо[1,3]диоксол-5-ил-5-пиридин-2-ил-1Н-имидазол-2-ил)-бензамид). Предпочтительно эндотелиальные клетки культивируют в условиях культивирования, связанных с прикреплением к субстрату. В одном воплощении среда для размножения дополнена 5-100 нг/мл VEGF-A. В другом воплощении среда для размножения представляет собой StemPro-34, дополненную 5-100 нг/мл VEGF-A.
Эндотелиальные клетки, полученные описанным здесь способом, можно размножать в течение нескольких пассажей, и их культивирование хорошо охарактеризовано. Можно воспроизводимо замораживать и размораживать аликвоты эндотелиальных клеток, полученных описанным здесь способом.
Предпочтительно указанные условия пролиферации VSMC включают отбор указанных клеток CD140b+ и их размножение в химически определенной среде для размножения. Термин «отбор» в том виде, как он здесь используется, относится к ферментативной диссоциации клеток от адгезивного субстрата и последующему ресуспендированию в новой среде. В одном предпочтительном воплощении клетки сортируют после отбора либо путем позитивной селекции на VSMC CD140b+, либо путем обеднения эндотелиальными клетками CD144+. Сортировка клеток может достигаться способами, известными в данной области, например посредством магнитно-активированной клеточной сортировки (MACS) (Фиг. 3) или разделения посредством проточной цитометрии - флуоресцентной сортировки клеток (FACS). Термин «среда для размножения» в том виде, как он здесь используется, относится к любой химически определенной среде, полезной для размножения и пассирования VSMC CD140b+ на монослое. В одном воплощении указанная среда для размножения идентична описанной индуцирующей среде VSMC. В другом воплощении среда для размножения представляет собой бессывороточную среду, дополненную EGF (эпидермальный фактор роста) (5-20 нг/мл) и FGF2 (фактор роста фибробластов 2) (5-20 нг/мл). Примерами бессывороточных сред, подходящих для размножения VSMC, являются StemPro-34 (Invitrogen), DMEM/F12 (Invitrogen) и DMEM (Invitrogen) или описанная ранее N2B27.
В другом воплощении среда для размножения представляет собой указанную среду SR. Предпочтительно VSMC культивируют в условиях культивирования, связанных с прикреплением к субстрату.
VSMC, полученные описанным здесь способом, можно размножать в течение нескольких пассажей, и их культивирование хорошо охарактеризовано.
В одном воплощении настоящего изобретения предложен способ получения специфичных для пациента или специфичных для здорового индивидуума клеток сосудистого русла. Для этого в описанном здесь способе используют человеческие индуцированные плюрипотентные стволовые клетки (iPSC), полученные от пациента или здорового индивидуума. Указанные специфичные для пациента человеческие iPSC могут быть получены способами, известными в данной области, путем перепрограммирования соматических клеток, полученных от пациентов или здоровых индивидуумов, в плюрипотентные стволовые клетки. Например, от индивидуума, нуждающегося в лечении, или от здорового индивидуума посредством биопсии кожи могут быть получены клетки-фибробласты, кератиноциты или адипоциты и перепрограммированы в индуцированные плюрипотентные стволовые клетки способами, известными в данной области. Другими соматическими клетками, подходящими в качестве источника индуцированных плюрипотентных стволовых клеток, являются клетки-лейкоциты, полученные из образцов крови, эпителиальных клеток или других клеток, полученных из образцов мочи. Специфичные для пациента индуцированные плюрипотентные стволовые клетки затем дифференцируются в специфичные для пациента или специфичные для здорового индивидуума эндотелиальные клетки или гладкомышечные клетки сосудов посредством описанного здесь способа. В другом аспекте изобретения предложена популяция эндотелиальных клеток или гладкомышечных клеток сосудов, полученная любым из вышеописанных способов. Предпочтительно популяция эндотелиальных клеток или гладкомышечных клеток сосудов является специфичной для пациента, т.е. происходящей от iPSC, полученных от больных индивидуумов. В другом воплощении указанная популяция эндотелиальных клеток или гладкомышечных клеток сосудов получена от здорового индивидуума.
Происходящие от пациента эндотелиальные клетки и гладкомышечные клетки сосудов представляют собой релевантную для заболевания модель in vitro для исследования патофизиологии сосудистых осложнений для заболеваний, подобных диабету типа 2 и типа 1, метаболическому синдрому и тяжелому ожирению. В одном воплощении эндотелиальные клетки и/или гладкомышечные клетки сосудов, полученные данным способом, используют для скрининга на соединения, которые обращают, ингибируют или предупреждают сосудистые осложнения, вызванные дисфункцией эндотелиальных клеток, например сосудистые осложнения, вызванные диабетом типа 2 и типа 1, метаболическим синдромом, тяжелым ожирением, гиперхолестеринемией, гипертензией, коронарной болезнью артерий, нефропатией, ретинопатией, почечной недостаточностью, ишемией ткани, хронической гипоксией, атеросклерозом и отеком ткани, вызванным токсичностью, индуцированной лекарственным средством. Предпочтительно указанные эндотелиальные клетки и/или гладкомышечные клетки сосудов, полученные описанным здесь способом по изобретению, происходят от больных субъектов. В другом воплощении эндотелиальные клетки и/или гладкомышечные клетки сосудов, полученные данным способом, используют для скрининга и оценки отека ткани, индуцированного лекарственным средством. Предпочтительно указанные эндотелиальные клетки и/или гладкомышечные клетки сосудов, полученные описанным здесь способом по изобретению, происходят от индивидуумов, пораженных аллергическим отеком ткани, индуцированным лекарственным средством. Дифференциация эндотелиальных клеток и/или гладкомышечных клеток сосудов от больных субъектов представляет уникальную возможность ранней оценки безопасности лекарственного средства в парадигме человеческой системы. В другом воплощении эндотелиальные клетки, полученные данным способом, используют в качестве модели in vitro гематоэнцефалического барьера.
Согласно настоящему изобретению предложен высокоэффективный способ предоставления специфичных для пациента клеток сосудистого русла или совместимых клеток от здоровых индивидуумов с таким же типом HLA (антиген лейкоцитов человека), подходящих для трансплантации, причем и те, и другие получены без участия чужеродного организма. Термин «условия культивирования без участия чужеродного организма» относится к среде и субстрату для прикрепления, которые содержат лишь компоненты человеческого и рекомбинантного происхождения. Таким образом, обходится риск загрязнения ксенопатогенами, и эндотелиальные клетки являются безопасными для применения в регенеративной медицине. Дифференциация специфичных для пациента индуцированных плюрипотентных стволовых клеток (iPSC) в специфичные для пациента эндотелиальные клетки и/или гладкомышечные клетки сосудов с использованием описанного здесь способа представляет собой легко доступную и воспроизводимую технологию для получения аутологических источников эндотелиальных клеток и гладкомышечных клеток сосудов. Применение аутологических и/или совместимых клеток в клеточной терапии дает большое преимущество над применением неаутологических клеток, которые вероятно подвергнуться иммунологическому отторжению. В отличие от этого маловероятно, что аутологические клетки вызовут значительные иммунологические ответы.
В другом предпочтительном аспекте изобретения рассматривается создание биобанка специфичных для пациента эндотелиальных клеток и/или гладкомышечных клеток сосудов. В одном воплощении создается биобанк, содержащий разные популяции эндотелиальных клеток и/или гладкомышечных клеток сосудов, полученных от здоровых индивидуумов и/или пациентов. Термин «биобанк» в том виде, как он здесь используется, означает библиотеку биологических образцов, взятых от разных индивидуумов или видов. Архивная коллекция образцов и ассоциированные данные предназначены для исследовательских целей для того, чтобы заниматься заболеваниями, ассоциированными с сосудистыми осложнениями. В другом воплощении указанный биобанк используют для подходов сосудистой регенеративной медицины.
В другом аспекте согласно изобретению предложена терапевтическая композиция, содержащая эндотелиальные клетки и/или гладкомышечные клетки сосудов, полученные любыми из вышеупомянутых способов или содержащая любые из вышеупомянутых популяций клеток. Предпочтительно терапевтические композиции, кроме того, содержат физиологически совместимый раствор, включающий, например, фосфатно-солевой буферный раствор с 5% человеческого сывороточного альбумина. Указанную терапевтическую композицию можно использовать для лечения, предупреждения или стабилизации заболеваний, ассоциированных с сосудистыми осложнениями, таких как, например, сосудистые осложнения, вызванные диабетом типа 2 и типа 1, метаболическим синдромом, тяжелым ожирением, гиперхолестеринемией, гипертензией, коронарной болезнью артерий, нефропатией, ретинопатией, почечной недостаточностью, ишемией ткани, хронической гипоксией, атеросклерозом и отеком ткани, вызванным токсичностью, индуцированной лекарственным средством, для восстановления функций после инсульта или в качестве носителя для секреции факторов в кровь. Например, клетки-фибробласты, кератиноциты или адипоциты можно получать биопсией кожи от индивидуума, нуждающегося в лечении, или от здорового индивидуума и перепрограммировать в индуцированные плюрипотентные стволовые клетки способами, известными в данной области ("Induction of pluripotent stem cells from adult human fibroblasts by defined factors." Takahashi et al., 2007, Cell 131, 861-72). Другими соматическими клетками, подходящими в качестве источника для индуцированных плюрипотентных стволовых клеток, являются клетки-лейкоциты, полученные из образцов крови, или эпителиальные клетки, или другие клетки, полученные из образцов мочи. Специфичные для пациента индуцированные плюрипотентные стволовые клетки затем дифференцируются в эндотелиальные клетки описанным здесь способом, их отбирают и вводят индивидууму для лечения состояния. Эндотелиальные клетки и/или гладкомышечные клетки сосудов, полученные способом по изобретению, можно использовать для замены или для содействия нормальной функции больной или поврежденной ткани.
Другим воплощением изобретения является применение биобанков эндотелиальных клеток и/или гладкомышечных клеток сосудов для терапии заболеваний, ассоциированных с сосудистыми осложнениями. Биобанки предпочтительно содержат эндотелиальные клетки и/или гладкомышечные клетки сосудов, полученные от пациентов или здоровых индивидуумов с несколькими типами HLA. Трансплантирование клеток, полученных от здорового донора, индивидууму, нуждающемуся в лечении, с совместимым типом HLA устраняет значительную проблему реакций отторжения, обычно ассоциированных с гетерологичными клеточными трансплантатами. Традиционно отторжение предупреждают или уменьшают введением иммунодепрессантов или лекарственных средств против отторжения, таких как циклоспорин. Однако такие лекарственные средства имеют значительные вредные побочные эффекты, например подавление иммунитета, карциногенные свойства, почечную токсичность, а также они являются очень дорогими. Настоящее изобретение устраняет или по меньшей мере значительно уменьшает потребность в лекарственных средствах против отторжения, таких как циклоспорин, имулан, FK-506, глюкокортикоиды, рапамицин и их производные.
В том, что касается терапевтических способов по изобретению, подразумевается, что введение эндотелиальных клеток и/или гладкомышечных клеток сосудов млекопитающему не ограничивается конкретным способом введения, дозировкой или частотой дозирования; в настоящем изобретении рассматриваются все способы введения, включающие внутримышечный, внутривенный, внутрисуставной, в область поражения, подкожный или любой другой путь, достаточный для обеспечения адекватной дозы для предупреждения или лечения заболевания. Эндотелиальные клетки и/или гладкомышечные клетки сосудов можно вводить млекопитающему в одной дозе или в многократных дозах. При введении многократных доз дозы могут быть отделены друг от друга, например, одной неделью, одним месяцем, одним годом или десятью годами. До, во время или после введения клеток также можно вводить один или более чем один фактор роста, гормон, интерлейкин, цитокин, маленькую молекулу или другие клетки для дальнейшего склонения их в сторону дифференциации в конкретный тип клеток.
Термин «осуществление дифференциации», «дифференциация» в том виде, как он здесь используется, относится к одной или более чем одной стадии для превращения менее дифференцированной клетки в соматическую клетку, например, для превращения плюрипотентной стволовой клетки в клетку сосудистого русла. Дифференциация плюрипотентной стволовой клетки в клетку сосудистого русла, т.е. в эндотелиальные клетки и/или гладкомышечные клетки сосудов достигается описанным здесь способом.
Термин «стволовая клетка» в том виде, как он здесь используется, относится к клетке, которая имеет способность к самообновлению. Термин «недифференцированная стволовая клетка» в том виде, как он здесь используется, относится к стволовой клетке, которая имеет способность дифференцироваться в разнообразные типы клеток. Термин «плюрипотентные стволовые клетки» в том виде, как он здесь используется, относится к стволовой клетке, которая может порождать клетки многих типов. Плюрипотентные стволовые клетки (PSC) включают человеческие эмбриональные стволовые клетки (hESC) и человеческие индуцированные плюрипотентные стволовые клетки (hiPSC). Человеческие индуцированные плюрипотентные стволовые клетки могут происходить из перепрограммированных соматических клеток, например, путем трансдукции четырех определенных факторов (Sox2, Oct4, Klf4, с-Myc) посредством известных в данной области способов. Указанные человеческие соматические клетки могут быть получены от здорового индивидуума или от пациента. Данные донорные клетки могут быть легко получены из любого подходящего источника. Предпочтительными здесь являются источники, которые обеспечивают выделение донорных клеток без инвазивных процедур на организме человека, например человеческие клетки кожи, клетки крови или клетки, которые можно получать из образцов мочи. Несмотря на то, что человеческие плюрипотентные стволовые клетки являются предпочтительными, данный способ также применим к плюрипотентным стволовым клеткам, не являющимся человеческими, таким как плюрипотентные стволовые клетки приматов, грызунов (например, крыса, мышь, кролик) и собаки.
«Клетки сосудистого русла» в том виде, как здесь используется данный термин, представляют собой клетки, которые образуют кровеносный сосуд in vivo. Кровеносные сосуды состоят из внутренней выстилки, именуемой слоем интимы, образованной эндотелиальными клетками, и смежного слоя, именуемого средняя оболочка стенки кровеносного сосуда, образованной гладкомышечными клетками. Примерами клеток сосудистого русла являются эндотелиальные клетки (CD144+) и гладкомышечные клетки сосудов (CD140b+).
«Эндотелиальные клетки» в том виде, как здесь используется данный термин, представляют собой клетки, которые экспрессируют специфичный маркер поверхности CD144 (кластер дифференциации 144, также известный как кадгерин 5 типа 2 или кадгерин сосудистого эндотелия (VE), официальное обозначение - CDH5) и обладают характеристиками эндотелиальных клеток, а именно: образованием капилляроподобных трубок и экспрессией одного или более чем одного дополнительного маркера поверхности, выбранного из группы: CD31 (кластер дифференциации 31, официальное обозначение РЕСАМ1), vWF (фактор фон Виллебранда, официальное обозначение VWF), CD34 (кластер дифференциации 34, официальное обозначение CD34), CD105 (кластер дифференциации 105, официальное обозначение ENG), CD146 (кластер дифференциации 146, официальное обозначение МСАМ) и VEGFR-2 (рецептор со вставочным киназным доменом (рецепторная тирозинкиназа типа III), официальное обозначение KDR).
«Гладкомышечные клетки сосудов» в том виде, как здесь используется данный термин, представляют собой клетки, которые экспрессируют специфичный маркер поверхности CD140b (кластер дифференциации 140b, также известный как рецептор бета PDGF (фактор роста тромбоцитов)), и обладают характеристиками гладкомышечных клеток сосудов, а именно сократительной и/или секреторной функциями и экспрессией одного или более чем одного другого белка, выбранного из группы SMA (альфа-актин гладких мышц), SМ22альфа, тяжелая цепь миозина гладких мышц, CRBP1 и Smemb. Фраза «заболевания, ассоциированные с сосудистыми осложнениями» в том виде, как она здесь используется, относится к любому заболеванию, вызванному травмой, активацией или дисфункцией эндотелиальных клеток и/или гладкомышечных клеток сосудов. Примерами заболеваний, ассоциированных с сосудистыми осложнениями, являются диабет типа 2 и типа 1, метаболический синдром, тяжелое ожирение, гиперхолестеринемия, гипертензия, коронарная болезнь артерий, нефропатия, ретинопатия, почечная недостаточность, ишемия ткани, хроническая гипоксия, атеросклероз и отек ткани, вызванный токсичностью, индуцированной лекарственным средством.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
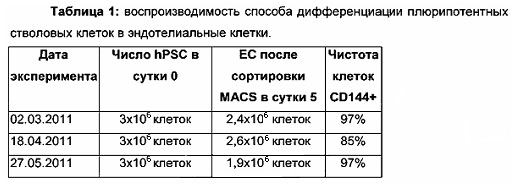
Фиг. 1: схематическое представление способа дифференциации человеческих плюрипотентных стволовых клеток (PSC) в эндотелиальные клетки CD144+. Сутки 0: человеческие PSC ферментативно диссоциировали и высаживали на планшеты, предварительно покрытые матригелем, с использованием концентрации 35000 клеток/см2 в среде для плюрипотентности (mTeSR2 с 10 мкМ Y27631). Сутки 1: замена сред свежей примирующей средой (N2B27 с соединением 21 (CP21R7) 2 мкМ). Сутки 4: замена сред свежей индуцирующей средой (StemPro-34 с 5 мкМ форсколином и 50 нг/мл VEGF-A). Показаны эндотелиальные клетки CD144+ в сутки 5, и их сортируют MACS для дальнейшего размножения.
Фиг. 2: а) Количественная оценка эндотелиальных клеток CD144+, происходящих от стволовых клеток, посредством анализа высокого содержания (HCA) на основе изображений. Человеческие эмбриональные стволовые клетки дифференцировались в условиях монослоя с разными маленькими молекулами. Верхняя и средняя панель: сутки 1, примирующая среда с разными соединениями; сутки 4, индуцирующая среда плюс 50 нг/мл VEGF-A. Один носитель N2B27 (верхняя панель, слева); 150 нг/мл Wnt3a добавлено в примирующую среду (верхняя панель, справа); 6 мкМ SB216763 добавлено в примирующую среду (средняя панель, слева), 2 мкМ CHIR 9902 добавлено в примирующую среду (средняя панель, справа). Нижние панели: сутки 1, примирующая среда с 2 мкМ соединения 21 (CP21R7); сутки 4, индуцирующая среда плюс 50 нг/мл VEGF-A (нижняя панель, слева) и сутки 4, индуцирующая среда плюс 50 нг/мл VEGF-A плюс 5 мкМ форсколин (нижняя панель, справа). DAPI (4',6-диамидин-2-фенилиндол) (ядра клеток), CD144 (окрашивание мембраны), б) График количественной оценки: процент CD144+ позитивных клеток.
Фиг. 3: анализ эндотелиальных клеток CD144+, происходящих из плюрипотентных стволовых клеток, посредством проточной цитометрии. Эндотелиальные клетки, дифференцировавшиеся в условиях монослоя (примирующая среда с 2 мкМ CP21R7, индуцирующая среда с 50 нг/мл VEGF-A и 5 мкМ форсколином), анализировали на экспрессию CD144+ до и после сортировки MACS. До сортировки MACS - 32,5% эндотелиальных клеток CD144+, и после сортировки MACS - 96,5% эндотелиальных клеток CD144+.
Фиг. 4: образование трубки в анализе ангиогенеза. hESC и hiPSC дифференцировались в условиях монослоя (примирующая среда с 2 мкМ CP21R7, индуцирующая среда с 50 нг/мл VEGF-A и 5 мкМ форсколином), и после сортировки MACS их тестировали на образование трубки в анализе ангиогенеза. Покрытие лунки трубчатыми структурами: эндотелиальные клетки, происходящие от hESC - 90%, эндотелиальные клетки, происходящие от hiPSC - 80% (график количественной оценки). Репрезентативные иллюстрации трубчатых структур: эндотелиальные клетки, происходящие от hESC (левая фотография), эндотелиальные клетки, происходящие от hiPSC (правая фотография).
Фиг. 5: характеризация дифференцировавшихся на монослое эндотелиальных клеток, происходящих от hPSC, после сортировки. hESC и hiPSC дифференцировались в условиях монослоя (примирующая среда с 2 мкМ CP21R7, индуцирующая среда с 50 нг/мл VEGF-A и 5 мкМ форсколином), и после сортировки MACS их тестировали на экспрессию маркеров эндотелиальных клеток CD31, vWF, CD144, VEGFR-2 (KDR) посредством иммуноцитохимического анализа и анализа проточной цитометрией. График количественной оценки: эндотелиальные клетки, происходящие из hESC (черные столбики), эндотелиальные клетки, происходящие из hiPSC (черные и белые столбики). Репрезентативные иллюстрации иммуноцитохимии CD31/vWF/DAPI: эндотелиальные клетки, происходящие из hiPSC (левая фотография), эндотелиальные клетки, происходящие из hESC (правая фотография).
Фиг. 6: прямое сравнение BIO относительно CP21R7 для дифференциации hESC в эндотелиальные клетки CD144+. hESC дифференцировались в условиях монослоя в сутки 1 параллельно с использованием разных концентраций (0 мкМ, 0,5 мкМ, 1 мкМ, 2 мкМ) для BIO или для соединения 21 (CP21R7) в качестве добавки в среду носитель N2B27, с последующим переводом в сутки 4 на индуцирующую среду с 50 нг/мл VEGF-A и 5 мкМ форсколина для всех условий. При использовании 0,5 мкМ BIO авторы изобретения смогли достигнуть максимальной экспрессии CD144 (5%), а другие концентрации были токсичными для клеток. CP21R7 демонстрировал ясный ответ на дозу в том, что касается экспрессии CD144 (вплоть до 35%), без какой-либо токсичности при протестированных концентрациях.
Фиг. 7: жизнеспособность криоконсервированных эндотелиальных клеток, происходящих от PSC. 1×106 эндотелиальных клеток, происходящих от hESC, криоконсервировали в сутки 5 после сортировки MACS на экспрессию CD144. 8×105 эндотелиальных клеток, происходящих от hESC (80% от общего числа криоконсервированных клеток), были жизнеспособными после размораживания.
Фиг. 8: воспроизводимость способа дифференциации эндотелиальных клеток. Количественная оценка проточной цитометрией эндотелиальных клеток CD144+, происходящих от стволовых клеток, в сутки 6. Дифференцировались две линии человеческих эмбриональных стволовых клеток (SA001 и SA167 от Cellartis) и две линии индуцированных плюрипотентных стволовых клеток (SBI System bioscience and Life technologies), приводя к средней эффективности от 60 до 80% эндотелиальных клеток CD144+.
Фиг. 9: анализ экспрессии маркеров Oct4 (плюрипотентность), Brachyury/T (панмезодермальный), CD31 и CD144 (эндотелиальные клетки) в динамике при дифференциации. Плюрипотентные стволовые клетки дифференцируются в примирующей среде (сутки 2-4) в мезодермальные клетки-предшественники путем потери экспрессии Oct4 (белые столбики) и приобретения экспрессии Brachyury/T (серые столбики). При замене сред на индуцирующую среду ЕС (в сутки 4) мезодермальные клетки-предшественники дифференцируются далее в эндотелиальные клетки с повышающей регуляцией экспрессии CD31 (темно-серый столбик) и CD144 (черный столбик). Данные сведения были подтверждены полногеномным экспрессионным профилированием (данные не показаны).
Фиг. 10: анализ проточной цитометрией экспрессии маркера, специфичного для эндотелиальных клеток (CD31) и специфичного для гладкомышечных клеток сосудов (CD140b) в сутки 5 способов дифференциации. Здесь описана доля клеток ЕС (черные столбики) и VSMC (серые столбики), дифференцировавшихся сначала с использованием примирующей среды и затем либо с использованием индуцирующей среды для ЕС (StemPro-34 с 200 нг/мл VEGF и 2 мкМ форсколином) или индуцирующей среды для VSMC (RPMI с 10% заменителя сыворотки Knockout). Долю ЕС и VSMC можно модулировать путем тонкой настройки системы дифференциации, что обеспечивает сдвиг детерминации линии либо преимущественно в эндотелиальные (~70%), либо в гладкомышечные клетки сосудов (~90%).
Фиг. 11: схематическое представление способа дифференциации человеческих плюрипотентных стволовых клеток (PSC) в эндотелиальные клетки (А) или гладкомышечные клетки сосудов (Б). С суток 0 до суток 4 протокол для обеих клеток-мишеней является идентичным. Сутки 0: человеческие PSC ферментативно диссоциировали и высаживали на планшеты, предварительно покрытые матригелем, с использованием концентрации 35000 клеток/см2 в среде для плюрипотентности (TeSR2 с 10 мкМ Y27631). Сутки 1: замена сред свежей примирующей средой (N2B27 с 1 мкМ соединением 21 (CP21R7) и 25 нг/мл рекомбинантного морфогенного белка кости-4 (ВМР4)). А) Сутки 4: замена сред свежей индуцирующей средой для ЕС (StemPro-34 с 2 мкМ форсколином и 200 нг/мл VEGF-A) для эндотелиальных клеток. В сутки 6 эндотелиальные клетки (CD144+) очищают посредством препарата MAC. Подвергнутые сортировке эндотелиальные клетки высаживают на планшеты, предварительно покрытые фибронектином, и поддерживают в среде для размножния ЕС (StemPro-34 с 50 нг/мл VEGF). Б) Сутки 4, замена сред свежей индуцирующей средой для VSMC (RPMI с 10% заменителя сыворотки Knockout) для гладкомышечных клеток сосудов (VSMC). В сутки 6 клетки ферментативно диссоциируют и высаживают на планшеты, предварительно покрытые фибронектином, в среду для размножения VSMC (RPMI с 10 нг/мл EGF и 10 нг/мл FGF2).
Фиг. 12: характеризация ЕС, происходящих от SC. Клетки CD144+, очищенные посредством MACS, выращивали до конфлюентности и затем анализировали проточной цитометрией. Клетки, в целом, обладают картиной экспрессии, специфичной для эндотелия: являются позитивными в отношении CD31, CD34, CD105, CD144, CD146, KDR, vWF (фактор фон-Виллебранда) и негативными в отношении маркеров гематопоэтической линии - CD43 и CD45.
Фиг. 13: анализ клеточного взаимодействия клеток сосудистого русла. Первичные человеческие перициты мозга (гладкомышечные клетки сосудов) и эндотелиальные клетки, происходящие от стволовых клеток, сокультивируют в анализах образования трубок. Перициты ассоциировали с трубковидными структурами, которые образовались ЕС, происходящими от SC. 94% от числа посеянных перицитов выравнивалось или оборачивалось вокруг эндотелиальных клеток, происходящие от SC (график количественной оценки).
Фиг. 14: анализ поглощения клетками ацетилированного липопротеина низкой плотности (Ac-LDL). Интернализацию отслеживали посредством применения С, конъюгированного с флуорофором (AlexaFluor594 - Alexa Fluor 594). После инкубации 98% ЕС, происходящих от SC, интернализировали Ac-LDL, конъюгированный с флуорофором, из ростовой среды (график количественной оценки).
Фиг. 15: анализ ответа провоспалительных цитокинов. ЕС, происходящие от SC, демонстрируют повышающую регуляцию экспрессии молекул адгезии, таких как ICAM1 и E-SELECTIN, при введении провоспалительного цитокина. ELISA (твердофазный иммуноферментный анализ) на основе клеток использовали для измерения активации эндотелиальных клеток, происходящих от SC, в ответ на 1 нМ TNFα. И ICAM1, и E-SELECTIN подвергались значительной повышающей регуляции (графики количественной оценки).
Фиг. 16: анализ адгезии лейкоцитов с эндотелием. Активированные эндотелиальные клетки презентируют молекулы адгезии для рекрутинга лейкоцитов. Ответ на 1 нМ TNFα исследовали посредством сокультивирования клеток HL60, окрашенных кальцеином, с ЕС, происходящими от SC. Адгезию клеток HL60 с эндотелиальными клетками количественно оценивали путем измерения интенсивности флуореценции. Рекрутинг лейкоцитов HL60 значительно усиливался при стимуляции ЕС, происходящих от SC, TNFα (график количественной оценки).
Фиг. 17: анализ методом зарастания царапины. В свойствах VSMC, происходящих от SC, в качестве клеток стенки убеждались по миграции/заживлению ран. Со временем VSMC, происходящие от SC, распространялись в край раны в виде одиночных свободных клеток (панель фотографий). Ширину царапины измеряли в четыре разных момента времени (0, 6, 24 и 30 часов), и средние значения использовали для определения закрытия царапины (график количественной оценки).
Фиг. 18: химические структуры ингибиторов GSK3β.
Фиг. 19: отбор соединения. Репортерный анализ TCF/LEF в человеческих репортерных клетках РА-1 (DeAlmeida et al., 2007). После обработки репортерных клеток ингибиторами GSk3 в указанных концентрациях измеряли транскрипционную активность TCF/LEF, опосредованную β-катенином, в виде люциферазной активности. Соединение Cp21R7 индуцировало наивысшую люциферазную активность в концентрации 3 мкМ.
Материалы и методы
Культура клеток:
Среда для плюрипотентности: TeSR2, дополненная Y27632 - ингибитором киназы ROCK (имеется в продаже, например каталожный номер 1254 от Tocris bioscience).
Примирующая среда: N2B27 (N2B27 представляет собой смесь 1:1 DMEM/F12 (Gibco, Paisley, Великобритания), дополненную N2 и В27 (оба от Gibco), дополненную соединением 21 (CP21R7), ингибитором GSK3 на основе пирролидинона.
CP21R7: 3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион (также именуемый здесь «соединение 21»; см., например, L. Gong et al; Bioorganic & Medicinal Chemistry Letters 20 (2010), 1693-1696).
Индуцирующая среда для эндотелиальных клеток: StemPro-34 SFM (Invitrogen), дополненная форсколином и VEGF-A.
Среда для размножения эндотелиальных клеток: StemPro-34 (Invitrogen), дополненная VEGF-A.
Индуцирующая среда для VSMC: среда RPMI 1640 (Invitrogen), дополненная 10% заменителя сыворотки Knockout (Invitrogen).
Среда для размножения VSMC: среда RPMI 1640 (Invitrogen), дополненная 10% заменителя сыворотки Knockout (Invitrogen), EGF и FGF-2.
Человеческие ESC: SA001, партия СА001, были выделены 20 марта 2001 года в Университете Гетеборга и Cellartis АВ Arvid Wallgrens Backe 20, SE-413 46 Гетеборг, Швеция, следуя всем соответствующим законам Швеции, и с одобрения местных комитетов по этике исследований в Университете Гетеборга и Университете Упсалы. Источник эмбрионов: замороженные, остатки от IVF (оплодотворение in vitro). Конфиденциальность донора: для того чтобы защитить частную жизнь и конфиденциальность доноров, все идентификаторы, ассоциированные с донорами эмбрионов, были удалены. Таким образом, информация о донорах не доступна. Примечательно то, что донорство не давало донорам какой-либо финансовой прибыли.
Человеческие iPSC: каталожный номер: SC101A, номер партии 110218-FF от SBI System Biosciences / каталожный номер: А13777 от Life technologies Gibco®, эписомная линия hiPSC.
Получение человеческих клеток сосудистого русла из hESC. Авторы изобретения имеют одобрение для работы с hESC и для получения разных линий клеток (таких как: клетки сосудистого русла, кардиомиоциты, гепатоциты и адипоциты). Ответственный комитет по этике (Ethikkommission beider Basel) и Федеральный офис здравоохранения одобрили исследовательский проект авторов изобретения. (Ref-No: R-FP-S-1-0002-0000).
Протоколы:
Человеческие плюрипотентные стволовые клетки в соответствии с установившейся практикой культивируют на матригеле уровня качества для hESC (BD Bioscience) в среде TeSR2 (Stem cell Technologies). Культуры пассируют каждые 4-6 суток с использованием аккутазы StemPro (Invitrogen). Для повышенной жизнеспособности среду TeSR2 дополняют 10 мкМ ингибитором ROCK за один час до ферментативной диссоциации.
1. Способ дифференциации плюрипотентных стволовых клеток в клетки сосудистого русла
(i) прикрепление и примирование PSC: перед ферментативной диссоциацией колоний hPSC с использованием аккутазы StemPro (Invitrogen) клетки предынкубируют в течение одного часа с 10 мкМ ингибитором ROCK Y27632. 35000 одиночных hPSC на см2 высаживают на культуральные планшеты, покрытые матригелем (BD bioscience) с пониженным содержанием фактора роста, в среду TeSR2, дополненную 10 мкМ ингибитором ROCK. В сутки 1 среду для прикрепления заменяют на среду N2B27 (Gibco), дополненную (а) 2 мкМ соединением 21 (CP21R7) или (б) 1 мкМ соединением 21 (CP21R7) и 25 нг/мл ВМР4 (R&D Systems). Клетки культивируют в течение еще 3 суток без замены сред.
(ii). Индукция ЕС: в сутки 4 примирующую среду заменяют средой StemPro-34 SFM (Invitrogen), дополненной (а) 50 нг/мл VEGF и 5 мкМ форсколином или б) 200 нг/мл VEGF и 2 мкМ форсколином. В сутки 5 индуцирующую среду отбирают, и клетки используют для отделения клеток CD144+ посредством MACS.
2. Очистка посредством MACS
На протяжении всего протокола клетки поддерживали на холоду и использовали предварительно охлажденные растворы. После отбрасывания среды клетки промывали 5 мл PBS (фосфатно-солевой буферный раствор) (не содержащий Са2+ и Mg2+). Затем клетки инкубировали в течение 2-4 минут при 37°C в 3 мл предварительно нагретой аккутазы StemPro (Invitrogen). Клетки ресуспендировали в 3 мл среды StemPro-34 (Invitrogen) путем аккуратного пипетирования их вверх-вниз. Число клеток и жизнеспособность определяли посредством контрастного окрашивания трипановым синим.
Затем клетки центрифугировали при 1000 об./мин в течение 4 мин. Клетки ресуспендировали в буфере MACS (0,5% BSA (бычий сывороточный альбумин) плюс 2 мМ EDTA (этилендиаминтетрауксусная кислота) в PBS), добавляли 20 мкл антитела против α-CD144-PE (BD bioscience) на 1×106 клеток и инкубировали в течение 15 мин при 4°C. После добавления 8 мл среды StemPro-34 клетки центрифугировали при 1000 об./мин в течение 4 мин. Клеточный осадок ресуспендировали в буфере MACS (0,5% BSA плюс 2 мМ EDTA в PBS), добавляли 100 мкл микрошариков, покрытых антителом против РЕ (Miltenyie Biotech), на 1×107 клеток и инкубировали в течение 15 мин при 4°C. Затем добавляли 8 мл среды StemPro-34, и клетки центрифугировали при 1000 об./мин в течение 4 мин. Клетки ресуспендировали в среде StemPro-34 LS (вплоть до 1×107 клеток на мл) и клеточную суспензию фильтровали. Затем суспензию фильтровали с использованием 30 мкм фильтров для предварительного разделения (Miltenyi Biotech). Колонки LS (Miltenyi Biotech) предварительно готовили путем их промывания 3 мл среды StemPro-34. На колонку наносили фильтрованную суспензию клеток (примерно 1×107 клеток на колонку), колонку промывали три раза 3 мл среды StemPro-34. Клетки элюировали с использованием 5 мл среды StemPro-34 плюс 50 нг/мл VEGF (Preprotech). Клетки высевали на чашки для культуры ткани, покрытые человеческим фибронектином (BD Bioscience).
На Фиг. 2 показана количественная оценка CD144- позитивных эндотелиальных клеток, происходящих от стволовых клеток, полученных путем добавления разных маленьких молекул в примирующую среду в сутки 1 и замены ее в сутки 4 на индуцирующую среду плюс 50 нг/мл VEGF-A. С использованием одной примирующей среды N2B27 0,5% области ядра было CD144- позитивной; добавление в примирующую среду 150 нг/мл Wnt3a приводило к 0,8% CD144+ клеток; добавление в примирующую среду 6 мкМ SB216763 приводило к 0,5% CD144+ клеток; добавление в примирующую среду 2 мкМ CHIR 9902 приводило к 14.6% CD144+ клеток; добавление в примирующую среду 2 мкМ соединения 21 (CP21R7) приводило к 40,2% CD144+ клеток и добавление в примирующую среду 2 мкМ соединения 21 (CP21R7) плюс добавление 5 мкМ форсколина в индуцирующую среду в сутки 4 плюс 50 нг/мл VEGF-A (нижняя панель, слева) и в сутки 4 в индуцирующую среду приводило к 54,6% клеток CD144+.
На Фиг. 4 показано, что клетки, дифференцировавшиеся из hESC и hiPSC, способны образовать капилляроподобные трубчатые структуры (происходящие от hESC: 90% / происходящие от hiPSC: 80%).
На Фиг. 5 показано, что клетки, дифференцировавшиеся из hESC и hiPSC, являются позитивными в отношении CD31, vWF, CD144, VEGFR-2 и, таким образом, классифицируются как эндотелиальные клетки.
На Фиг. 6 показано сравнение способа предшествующего уровня техники (Tatsumi et al.) и способа по изобретению. В способе Tatsumi et al. используется ингибитор BIO в разных концентрациях в качестве добавки в N2B27. Несмотря на то, что Tatsumi et al. описывают, что плюрипотентные стволовые клетки дифференцировались в эндотелиальные клетки с примерно 20%-ной эффективностью (определенной по эндотелиальным клеткам, экспрессирующим поверхностный маркер CD144), авторы данного изобретения не смогли воспроизвести такие результаты. Кроме того, наблюдали сильную цитотоксичность ингибитора BIO уже при концентрациях 1 мкМ.
Последовательное дополнение среды на стадии примирования (ii) 25 нг/мл ВМР4 совместно с 1 мкМ CP и среды на стадии индукции (iii) 200 нг/мл VEGF совместно с 2 мкМ форсколином быстро индуцировало экспрессию CD144 во вплоть до 85% клеток на сутки шесть. В разных линиях человеческих ESC и iPSC наблюдали общую надежность и воспроизводимость протокола дифференциации (Фиг. 8).
Получение высокофункциональных эндотелиальных клеток для программ по изысканию новых лекарственных средств и клинических приложений требует большого числа популяций клеток, контролируемых по качеству. Для решения этого вопроса для разделения клеток на фракции CD144+ и CD144- использовали магнитно-активированную клеточную сортировку (MACS). С использованием при разделении настроек, предназначенных для очень сильного выделения положительно меченых клеток, достигали чистоту, превышающую 95% клеток CD144+ (Фиг. 20).
3. Протокол криоконсервации
1×106 клеток суспендируют в 1 мл среды для криоконсервации (90% FBS (фетальная коровья сыворотка) и 10% DMSO (диметилсульфоксид)) и переносят в криососуд. Криососуды помещают в контейнер для замораживания Nalgene Cryo 1°C с достижением скорости охлаждения -1°C/мин в случае хранения при -80°C. Контейнер для замораживания хранят при -80°C в течение 24 часов. Для долговременного хранения клетки затем переносят в жидкий азот.
На Фиг. 7 показано, что 8×105 (80% от общего числа замороженных клеток) криоконсервированных EC, происходящих от PSC, являются жизнеспособными после размораживания. Подавляющее большинство размороженных клеток в течение ночи прикрепляется к чашкам, покрытым фибронектином, и на следующие сутки растет в прикрепленном состоянии. Наблюдается очень мало плавающих (мертвых) клеток. Поддерживалась чистота и идентичность криоконсервированных PSC-EC по показателю экспрессии специфичного эндотелиального маркера (CD31, CD34, CD144, KDR).
4. Эндотелиальная индукция путем фармакологического ингибирования GSK3β
Оценивали потенциальные чаще всего используемые имеющиеся в продаже ингибиторы GSK3β и CP21R7 для активации транскрипции TCF/LEF, опосредованной β-катенином, в человеческих репортерных клетках РА-1 (DeAlmeida et al., 2007). Используемые соединения показаны на Фиг. 18. Анализ дозы-ответа выявил, что все самые мощные ингибиторы GSK3, а именно CP21R7 (CP), 6-броминдирубин-3'-оксим (BIO), СВ36155 и CHIR-99021 (CHIR), демонстрировали крутую кривую активации, свидетельствующую о кооперативном связывании (Фиг. 19). Немодифицированные клетки РА-1 используют для измерения жизнеспособности клеток при помощи уровней АТФ и чувствительных GLI-люциферазных репортерных клеток РА-1 в качестве противоположного скрининга для отслеживания изменений общей транскрипционной активности. В целом, проанализированные ингибиторы Gsk3β показали незначимое увеличение общей транскрипционной активности (данные не показаны). Трехкратное увеличение люциферазной активности, опосредованной GLI, наблюдали при обработке BIO, который был высокотоксичным при концентрации 10 мкМ (данные не показаны). СВ361549 и СВ361556 (MeBIO), а также форсколин (негативный контроль) не индуцировали экспрессию люциферазы. При зависимом от концентрации введении CP была выявлена колоколообразная кривая с наивысшей люциферазной активностью при 3 мкМ. Максимум в 566 раз возросшая люциферазная активность сопровождалась лишь умеренным увеличением пролиферации клеток и небольшими увеличениями общей транскрипционной активности. Зависимое от концентрации введение ранее описанного ингибитора GSK3β SB216763 приводило к пренебрежимо малой экспрессии TCF/LEF люциферазы, опосредованной β-катенином. По результату репортерного анализа с β-катенином использовали три ингибитора GSK3β, а именно BIO, CHIR и CP, из-за их потенциала управлять детерминацией сосудистой линии из человеческих PSC. Кроме перечисленных ингибиторов авторы изобретения включили SB216763 (SB) из-за его структурного сходства с CP (см. Фиг. 18). Плюрипотентные стволовые клетки (i) высаживали в виде одиночных клеток на чашки со средой mTeSRI, дополненной ингибитором Rho-киназы Y-27632 (Watanabe et al., 2007); (ii) инкубировали в примирующей среде (среда N2B27, дополненная ингибитором GSK3β) и (iii) инкубировали в индуцирующей среде (среда StemPro SFM 34, дополненная фактором роста эндотелия сосудов (VEGF; Sumi et al., 2008)), как описано выше в 1 (i) и (ii).
Использовали следующие ингибиторы GSK3:
Ингибитор GSK3 CHIR99021: каталожный номер: 361559 от Merck Millipore
Ингибитор GSK3 SB216763: каталожный номер: 361566 от Merck Millipore
Ингибитор GSK3 BIO: каталожный номер: 3 361550 от Merck Millipore
CP21R7: 3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион (также именуемый здесь как "соединение 21"; см., например, L. Gong et al; Bioorganic& Medicinal Chemistry Letters 20 (2010), 1693-1696).
Пролиферация в клетки сосудистого русла была детектирована в сутки 5. Сосудистая идентичность подтверждается экспрессией кадгерина эндотелия сосудов (VE-кадгерин). Способность индуцировать клетки сосудистого русла была определена по экспрессии VE-кадгерина (CD144) в сутки 5 (Фиг. 19). Анализ проточной цитометрией идентифицировал CP в качестве значительно более мощного ингибитора GSK3β. Зависимая от концентрации обработка приводила к колоколообразной кривой с крутыми склонами, подтверждая предыдущие данные репортерного анализа с TCF/LEF-люциферазой. Примечательно то, что вплоть до 35% клеток экспрессировали CD144 при оптимальной концентрации 1 мкМ, начиная с суток пять. Маленькое соединение BIO, по-видимому, является токсичным при действии на одиночные клетки (данные не показаны). CHIR, который имеет отличную химическую структуру от CP, индуцировал экспрессию CD144 также в виде параболической кривой с достижением оптимума при 6 мкМ концентрации. Согласно репортерному анализу с TCF/LEF-люциферазой после введения SB на платформу для дифференциации не наблюдали экспрессии CD144 (Фиг. 19). Несмотря на то, что SB и CP имеют одинаковый химический остов, отличные группировки могут влиять на химические свойства, например на проницаемость в клетки или растворимость. В клетках, обработанных носителем, не детектировали экспрессию VE-кадгерина (Фиг. 19).
5. Динамика дифференциации
Сигнализация WNT/β-катенина играет фундаментальную роль в индукции образования примитивных жилок (Tam and Loebel, 2007). По этой причине анализировали появление мезодермальных клеток-предшественников во времени. Полногеномный анализ экспрессии генов выявил, что через 24 часа при комбинированной обработке CP и ВМР4 маркеры плюрипотентности, такие как NANOG, UTF1 и SOX2, подвергаются понижающей регуляции (данные не показаны). Повышающая регуляция репрезентативных маркеров: MIXL1, T/BRACHYURY, FGF4 и EOMES указала на то, что решение о линии клеток направляется в мезодерму в пределах тех же самых временных рамок. В ходе дифференциации авторы изобретения не наблюдали повышенную экспрессию генов маркеров, соответствующих нейроэктодерме и эндодерме (данные не показаны). Ген SOX17, маркер начала образования эндодермы, сильно экспрессировался, начиная с суток 5. Эти данные находятся в соответствии с картиной экспрессии SOX17 in vivo в развивающейся и зрелой сосудистой системе (Engert et al., 2009). Не наблюдали детерминации линии в трофэктодерму или висцеральную эндодерму, поскольку релевантные гены, такие как ESX1 и SOX7, не были детектированы (данные не показаны).
Иммуноокрашивания SOX17, ОСТ4, T-BRACHYURY, РЕСАМ-1 и VE-CADHERIN поддерживают транскриптомные данные (количественная оценка показана на Фиг. 9). Экспрессия белка панмезодермального маркера Т-BRACHYURY подтверждает промежуточную PS-подобную клеточную стадию. Обработка CP или ВМР4 индуцировала экспрессию T-BRACHYURY быстро - через одни сутки. Подавляющее большинство клеток достигало пика экспрессии Т-BRACHYURY в сутки три. В сутки четыре экспрессия уменьшалась и исчезала, тем самым имитируя его специфичную картину эмбриональной экспрессии (Tam and Loebel, 2007). Потерю плюрипотентности отслеживали по зависимому от времени снижению экспрессии ОСТ4. Фармакологическое ингибирование GSK3β посредством одного СР21 дифференцировало PSC до картины окрашивания цвета перца с солью клеток SOX17+ в сутки три; тогда как объединенное нанесение CP и ВМР4 предотвращало появление эндодермальных клеток SOX17+ (Фиг. 9). Индукцию эндотелиальной идентичности клеток определяли по соэкспрессии молекулы-1 адгезии тромбоцитов-эндотелиальных клеток (РЕСАМ1) и VE-CADHERIN. Экспрессию эндотелиального маркера детектировали при введении VEGF на сутки 4 (Фиг. 9). Эти сведения были дополнены транскриптомным анализом эндотелиальных маркеров CD34, РЕСАМ1, CDH5 and vWF, которые демонстрировали повышающую регуляцию при действии VEGF более чем в 100 раз в пределах первых 24 часов соответственно (данные не показаны). Система дифференциации авторов настоящего изобретения обеспечивает высокопроизводительное получение эндотелиальных клеток в пределах 5 суток посредством временного появления клеток примитивных жилок.
6. Протокол для дифференциации PSC в VSMC
При использовании протокола дифференциации, описанного выше, после переноса несортированных клеток в среду StemPro, дополненную VEGF, появились две отличные популяции клеток. Типы клеток отличались по морфологии, а также по экспрессии маркеров. Клетки, подобные булыжникам, с плотными контактами клетка-клетка экспрессировали специфичный для эндотелия маркер VE-кадгерин. Уплощенные и веретеновидные клетки давали положительное окрашивание на гладкомышечный актин (αSMA), указавая на идентичность гладкомышечных клеток сосудов (VSMC). В анализе проточной цитометрией клетки разделялись на главную фракцию клеток CD31+/CD140b- и минорную фракцию клеток CD31-/CD140b+ (Фиг. 10).
Замена индуцирующей среды стадии (ii) средой RPMI с 0,5 мкМ IWR (соединение 1, ингибитор ответа Wnt) приводила к обратному распределению клеток CD31+/CD140b- и CD31-/CD140b+.
Адаптированная система дифференциации индуцировала экспрессию PDGFRβ в вплоть до 90% клеток. Иммуноокрашивания SM22a и αSMA подтверждали идентичность клеток CD31-/CD140b+ в качестве VSMC (Фиг. 10).
При использовании этого нового протокола теперь возможно предпочтительно индуцировать либо эндотелиальные клетки, либо гладкомышечные клетки сосудов. Обобщение разных протоколов показано на Фиг. 11.
Дальнейшая характеризация очищенных посредством MACS клеток CD144+ подтвердила эндотелиальный фенотип. Клетки CD144+ имеют однородную булыжникоподобную морфологию и представляют картину экспрессии, специфичной для эндотелия; являются позитивными в отношении CD31, CD34, CD105, CD146, KDR, РЕСАМ1, VE-CADHERIN, vWF (фактор фон-Виллебранда), ZO1 (запирающая зона 1) и негативными в отношении маркеров гематопоэтической линии CD43 и CD45 (Фиг. 12). ЕС, происходящие от стволовых клеток (ЕС, происходящие от SC), все еще имеют пролиферативную способность по меньшей мере вплоть до пассажа 5 и являются позитивными в отношении окрашивания на ID1 и c-Kit, указывая то, что данные клетки находятся в состоянии предшественников (данные не показаны). Очищенные клетки CD144+ культивировали до конфлюентности и затем криоконсервировали. Банки эндотелиальных клеток, происходящих от стволовых клеток, поддаются высокопроизводительным подходам, требующимся для кампаний по изысканию новых лекарственных средств.
7. Функциональная характеризация клеток сосудистого русла, происходящих от стволовых клеток
Поглощение Ac-LDL: клетки инкубировали в среде, содержащей 2,5 мкг/мл ацетилированного липопротеина низкой плотности, конъюгированного с Alexa Fluor 594 (AlexaFluor594-Ac-LDL) от Molecular Probes/Invitrogen в течение 4 ч при 37°C. После инкубации клетки промывали и фиксировали 4% PFA (параформальдегид) в течение 10 мин. Включение AlexaFluor594-Ac-LDL визуализировали с использованием флуоресцентного микроскопа.
Анализ ассоциации перицитов: человеческие перициты сосудов мозга (HBVP) приобретали у ScienCell Research Laboratories. HBVP выращивали в среде для перицитов (ScienCell Research Laboratories). Для образования функциональных трубок и анализов ассоциации SC-EC и HBVP выращивали с использованием набора для ангиогенеза in vitro от AMS biotechnology. Непосредственно перед посевом для функциональных анализов HBVP окрашивались красным цветом и SC-EC окрашивались зеленым цветом с использованием красителей Cell Tracker от Invitrogen согласно инструкциям производителей. Для функциональных анализов равные количества (2×104/см2) клеток обоих типов выращивали в среде для размножения ЕС (StemPro-34 с VEGF).
Протокол ELISA на основе клеток: 20000 эндотелиальных клеток, происходящих от стволовых клеток/лунку, высевали в 96-луночные планшеты и культивировали в течение 2 суток в среде EGM-2 (Lonza) до конфлюентности. Среды заменяли средой EGM-2, дополненной 1 нМ TNFα (R&D Systems). После инкубации в течение 24 часов ЕС, просходящие от SC, кратковременно промывали PBS и фиксировали в PFA. Первичные антитела против человеческого ICAM и против Е-селектина приобретали у R&D Systems. Использовали биотинилированное антитело против мышиного IgG (Amersham) в качестве вторичного антитела и комплекс стрептавидина/пероксидазы (Amersham). Люминесценцию количественно оценивали на микропланшет-ридере.
Анализ адгезии лейкоцитов: 2×104 эндотелиальных клеток, происходящих от стволовых клеток/лунку, высевали на 96-луночные планшеты и культивировали в течение 2 суток в среде EGM-2 (Lonza) до конфлюентности. Среды заменяли средой EGM-2, дополненной 1 нМ TNFα (R&D Systems). ЕС, происходящие от SC, стимулировали TNFα в течение 4 часов. Затем в каждую лунку 96-луночного планшета добавляли 1,5×105 клеток HL60, меченных кальцеином. После инкубации в течение одного часа среду удаляли и Sc-EC промывали PBS. Лизировали планшет 1% раствором детергента NP-40 в течение 15 минут. Супернатанты переносили в Optiplate и флуоресценцию измеряли на микропланшет-ридере.
Лейкоциты HL60 (Collins et al., 1977; Nature, 270, 347) выращивали в среде RPMI-1640 (Invitrogen) с 10% FCS (фетальная коровья сыворотка).
Для того чтобы более глубоко определить эндотелиальный фенотип и ангиогенный потенциал, оценивали способность поглощать Dil-ацетилированный липопротеин низкой плотности (Dil-ac-LDL) и отслеживали динамическую модуляцию барьерной функции. Для образования трубок ЕС, происходящие от SC, высевали на матрицу на основе матригеля.
ЕС, происходящие от SC, быстро формировали сетеподобные структуры с аналогичной структурой, что и контрольные эндотелиальные клетки (данные не показаны).
Обработка ингибиторами ангиогенеза, такими как сульфорафан и моноклональные антитела против VEGF, нарушала образование трубок и уменьшала число узелков, а также длину трубок (данные не показаны). Интересно, что клеточное взаимодействие ЕС, происходящих от SC, со стенкой самоорганизовало их в высокоорганизованные трубковидные структуры.
Человеческие перициты сосудов мозга (HBVP) прежде всего ассоциировали с ЕС, происходящими от SC, способствуя образованию трубчатых структур. Клетки HBVP, по-видимому, формировали оболочку эндотелиальных клеток, происходящих от SC, обворачивая их тело клетки вокруг трубок (Фиг. 13). Одни HBVP не способны формировать трубчатые структуры на матрице матригеля. Для отдачи приказа об образовании трубки клетками стенки сосуда требуется либо присутствие ЕС, происходящих от SC, либо добавление фактора роста тромбоцитов (PDGF) (данные не показаны). Аналогичную самоорганизацию наблюдали, когда в качестве источника клеток стенки использовали VSMC, происходящие от SC (данные не показаны). В свойствах VSMC, происходящих от SC, в качестве клеток стенки также убеждались в анализах миграции/заживления ран, в которых VSMC, происходящие от SC, распространялись в край раны в виде одиночных свободных клеток (Gottlieb and Spector, 1981) (данные не показаны).
Динамическое отслеживание образования монослоя и проницаемости, индуцированной тромбином, с последующим восстановлением барьера измеряли с использованием системы xCeLLigence RT-CA (Atienza et al., 2006; Solly et al., 2004). Данная система обеспечивает мониторинг в реальном времени зависимой от плотности пролиферации и жизнеспособности ЕС, происходящих от SC, без использования метки. Взаимодействие ЕС с микроэлектродами приводит к изменению сопротивления, которое пропорционально числу клеток и морфологии, а также прочности прикрепления клеток (Atienza et al., 2006). Данные авторов изобретения показывают, что после логарифмической фазы роста ЕС, происходящие от SC, достигают плато, до которого они могут дойти за несколько суток без больших колебаний (данные не показаны). После исходного присоединения, распространения и пролиферации ЕС, происходящие от SC, достигали плотного монослоя путем динамического взаимодействия друг с другом через VE-кадгерины и другие белки, опосредущие плотные/адгезионные контакты (данные не показаны). Наблюдаемый быстрый и обратимый эффект на ЕС, происходящие от SC, вазоактивного агента тромбина сопровождается округлением клеток и образованием щелей между эндотелиальными клетками (данные не показаны). Стимуляция эндотелиальных клеток тромбином вызывает временные изменения VE-кадгеринов и ассоциированных катенинов (Marie-Josèphe et al., 1996), приводя к обратимому нарушению свойств проницаемости (данные не показаны). Помимо образования трубковидных структур и плотного монослоя ЕС, происходящие от SC, поглощают из ростовой среды Dil-Ac-LDL (Фиг. 14). В целом, ЕС, происходящие от SC, в проведенных анализах in vitro демонстрируют функциональность, подобную эндотелию.
8. ЕС, происходящие от SC, функционально отвечают на провоспалительные цитокины
В ответ на провоспалительные стимулы ЕС экспрессируют молекулы клеточной адгезии (САМ), включающие внутриклеточную молекулу адгезии-1 (ICAM1) и E-SELECTIN. Активированные ЕС обеспечивают захват лейкоцитов и их связывание с местом воспаления посредством САМ (Rao et al., 2007; Galkina et al., 2007). Воспаление сосудов играет центральную роль в инициации и прогрессировании образования атеросклеротических бляшек (Losis, 2000).
Для определения того, генерирует ли данная система дифференциации настоящие ЕС, авторы данного изобретения подвергали ЕС, происходящие от SC, воздействию провоспалительных цитокинов и анализировали активированную экспрессию эффекторов миграции иммунных клеток. Иммунофлуоресцентный анализ ясно показал повышенную экспрессию ICAM1 при обработке TNF-α (Фиг. 15). Авторы данного изобретения, кроме того, подтвердили присутствие ICAM1 и Е-SELECTIN при стимуляции TNF-α, а также IL-1β (интерлейкин-1бета) посредством проточной цитометрии (Фиг. 16). Экспрессия HLA-ABC служила в качестве контроля для анализа общего и неспецифичного для типа клетки ответа на провоспалительные цитокины. Авторы данного изобретения также провели ELISA на основе клеток для измерения активации ICAM1 и E-SELECTIN в дозозависимом ответе на TNF-α. ЕС, происходящие от SC, имеют уровни экспрессии ICAM1 и Е-SELECTIN, сравнимые с первичными эндотелиальными клетками пупочной вены человека (HUVEC; данные не показаны). Авторы данного изобретения далее использовали ЕС, происходящие от SC, в сокультуре с лейкоцитами HL60 для исследования того, демонстрируют ли молекулы адгезии активированных ЕС, происходящих от SC, биологическую функцию. Оказалось, что адгезия лейкоцитов HL60 значимо возрастала при стимуляции ЕС, происходящих от SC, TNF-α (Фиг. 16). Для анализа того, специфично ли опосредуется адгезия, авторы данного изобретения одновременно обрабатывали ЕС, происходящие от SC, моноклональным антителом против ICAM. В самом деле, ингибирование ICAM1 могло предотвращать адгезию HL60 в зависимости от концентрации (Фиг. 16). Авторы данного изобретения провели статические анализы адгезии с HUVEC для подтверждения адгезии лейкоцитов HL60 в качестве специфического свойства эндотелия, которую можно ингибировать обработкой антителом против ICAM1 (данные не показаны).
Анализ царапин: гладкомышечные клетки сосудов, происходящие от стволовых клеток (VSMC, происходящие от SC), выращивали до конфлюентности. Царапину монослоя VSMC делали с использованием наконечника 200 мкл пипетки. После образования царапины получали изображения той же самой области для определения закрытия царапины.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ РЕЦЕЛЛЮЛЯРИЗАЦИИ ТКАНИ ИЛИ ОРГАНА ДЛЯ УЛУЧШЕНИЯ ПРИЖИВЛЕНИЯ ТРАНСПЛАНТАТА | 2011 |
|
RU2611361C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ИЗ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА И ПОЛУЧАЕМЫЕ СОГЛАСНО ДАННОМУ СПОСОБУ МЕЗЕНХИМАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ | 2020 |
|
RU2823729C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОК ИЗ ЗУБНОЙ ПУЛЬПЫ | 2019 |
|
RU2795621C2 |
| ПЕРЕПРОГРАММИРОВАНИЕ ЭНДОТЕЛИЯ ЧЕЛОВЕКА В ГЕМОПОЭТИЧЕСКИХ ПРЕДШЕСТВЕННИКОВ МНОЖЕСТВЕННЫХ ЛИНИЙ ДИФФЕРЕНЦИРОВКИ С ИСПОЛЬЗОВАНИЕМ ОПРЕДЕЛЕННЫХ ФАКТОРОВ | 2014 |
|
RU2691062C2 |
| МУЛЬТИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ ВНЕПЕЧЕНОЧНЫХ ЖЕЛЧНЫХ ПУТЕЙ И СПОСОБЫ ИХ ВЫДЕЛЕНИЯ | 2010 |
|
RU2580246C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ПРОИСХОДЯЩИХ ИЗ ПУПОВИННОЙ КРОВИ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ ZNF281 | 2010 |
|
RU2511417C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОК, ПРОДУЦИРУЮЩИХ ПАНКРЕАТИЧЕСКИЕ ГОРМОНЫ | 2011 |
|
RU2576000C2 |
| АМНИОТИЧЕСКИЕ АДГЕЗИВНЫЕ КЛЕТКИ | 2009 |
|
RU2562154C2 |
| ДИФФЕРЕНЦИРОВАНИЕ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2011 |
|
RU2627168C2 |
| МУЛЬТИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ ВНЕПЕЧЁНОЧНЫХ ЖЕЛЧНЫХ ПУТЕЙ И СПОСОБЫ ИХ ВЫДЕЛЕНИЯ | 2010 |
|
RU2756584C2 |
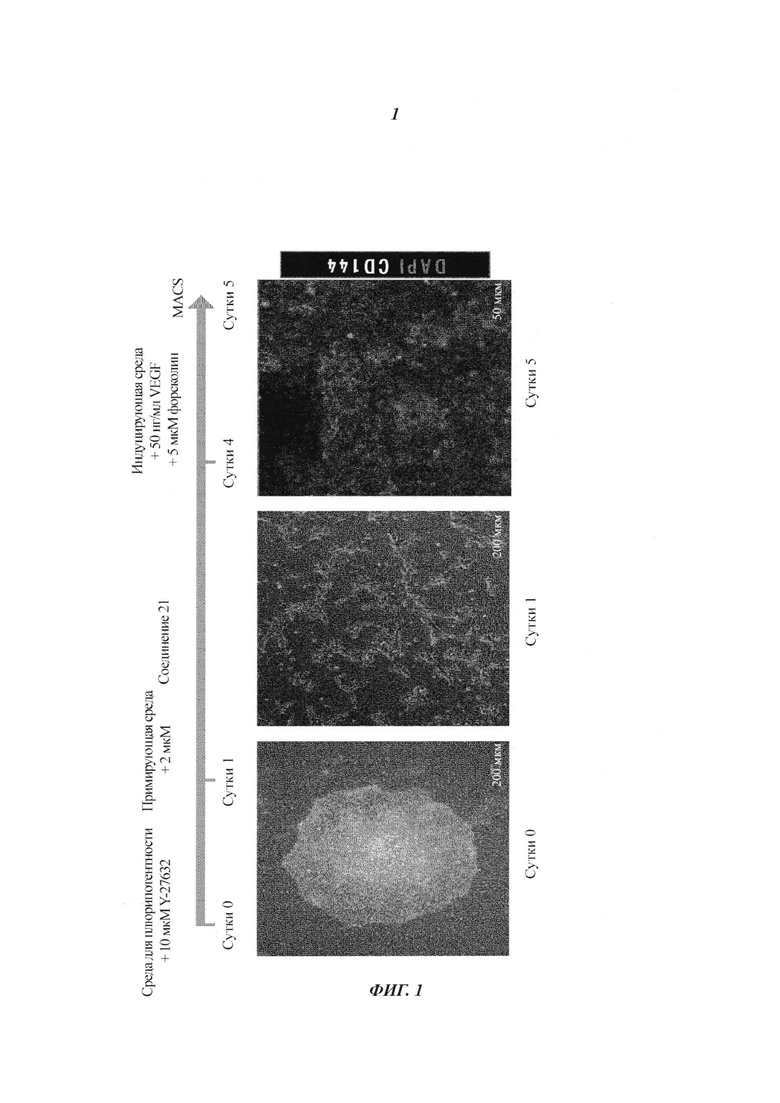
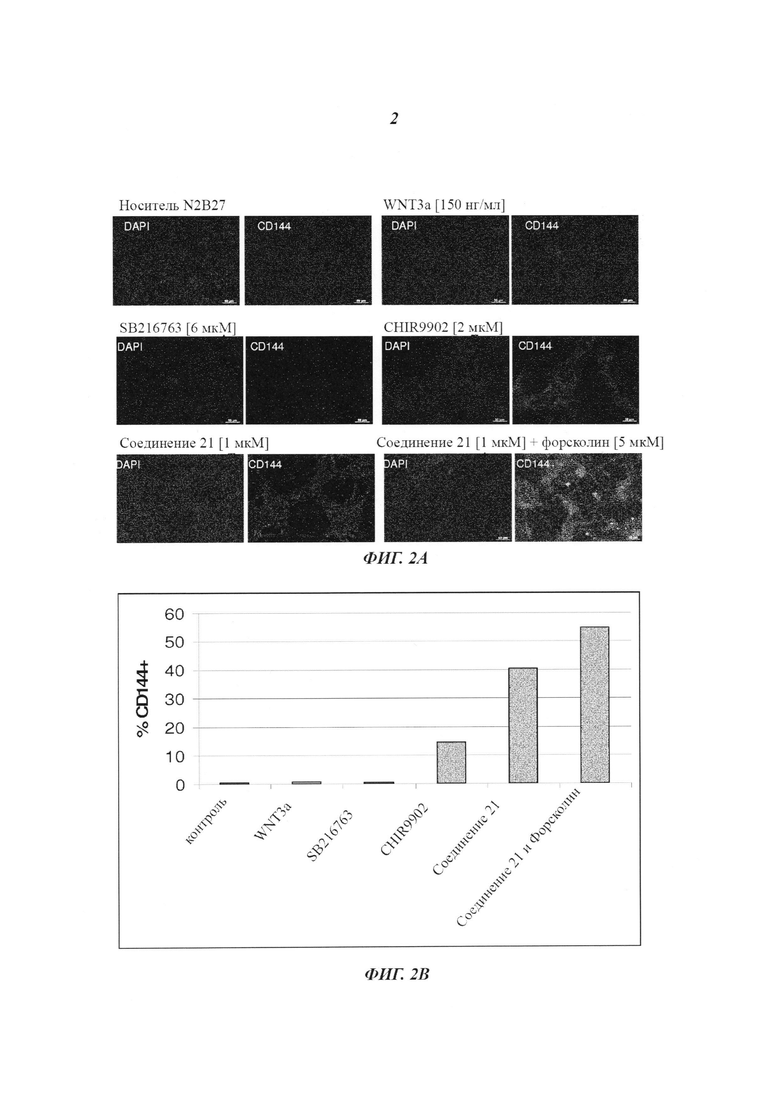
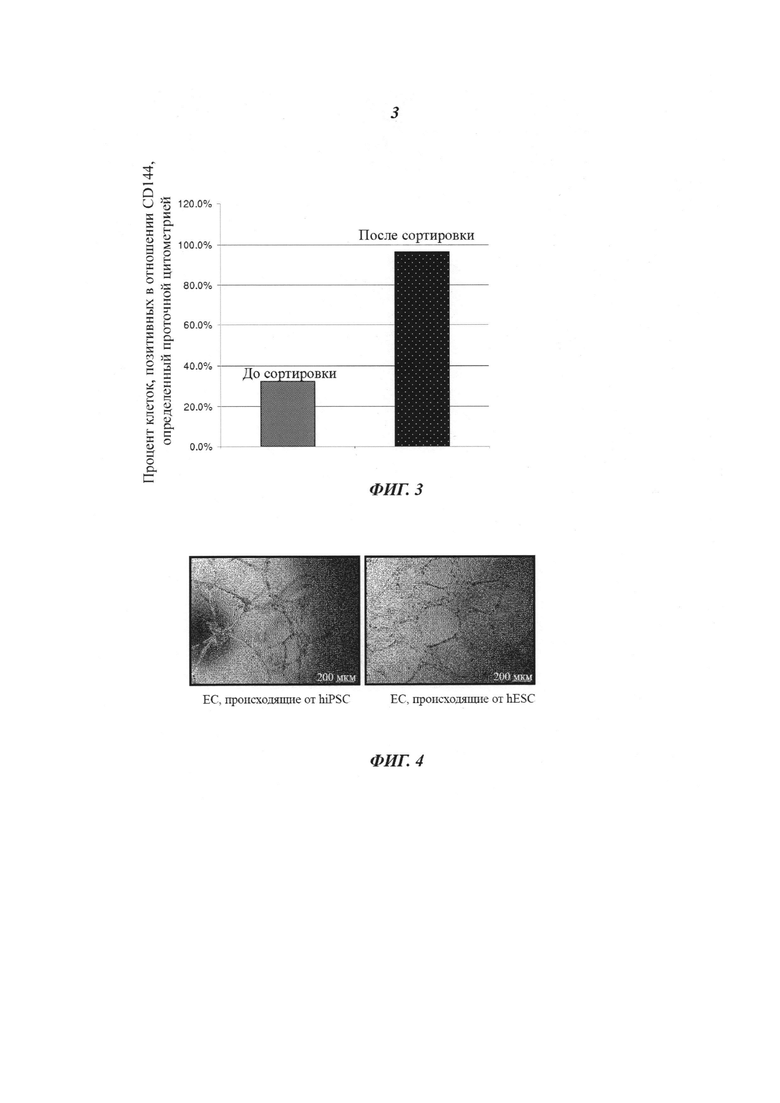
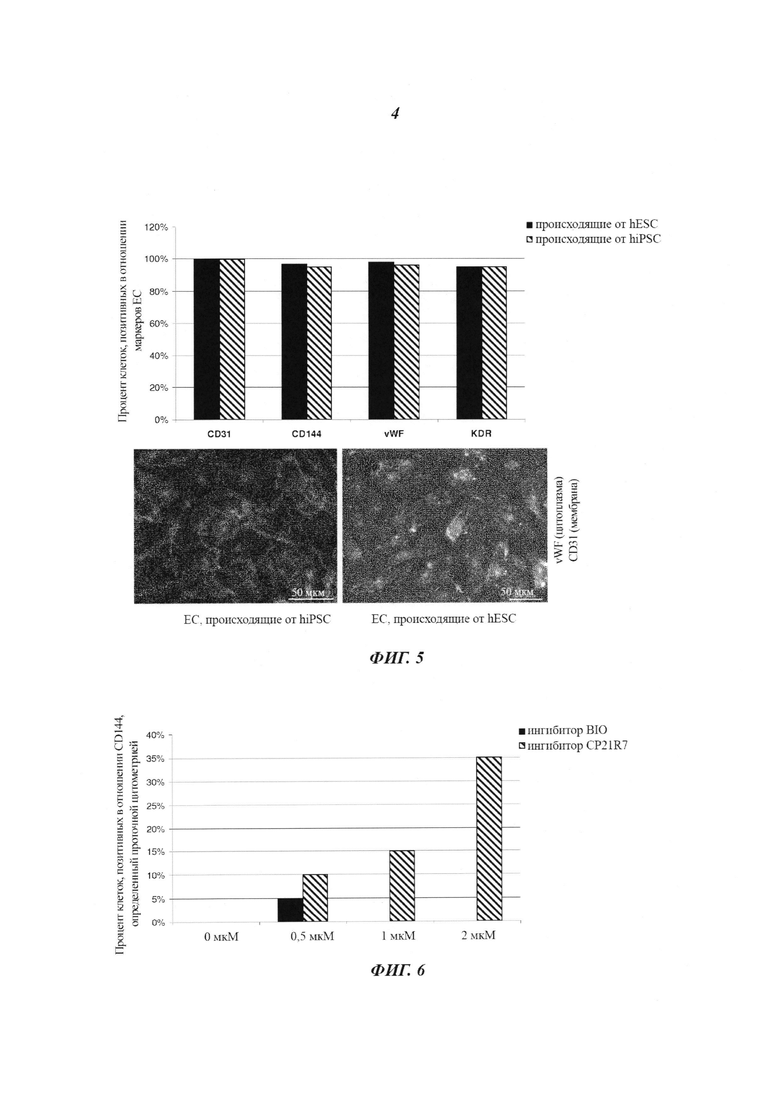
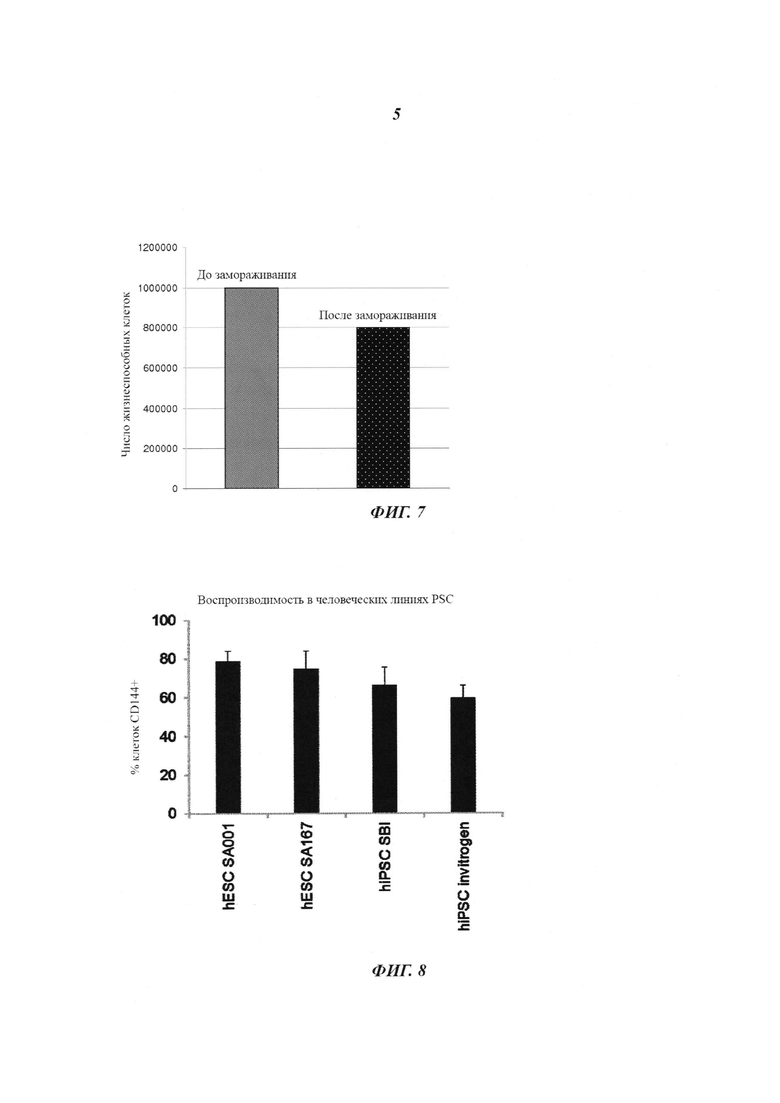
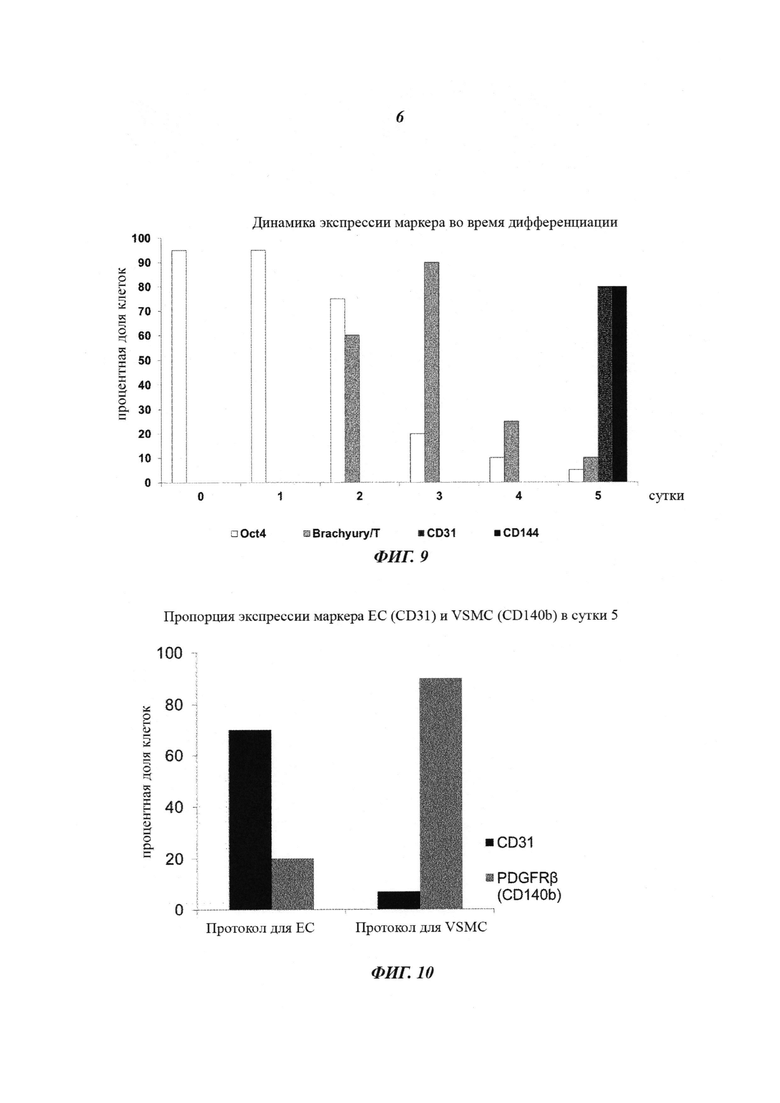
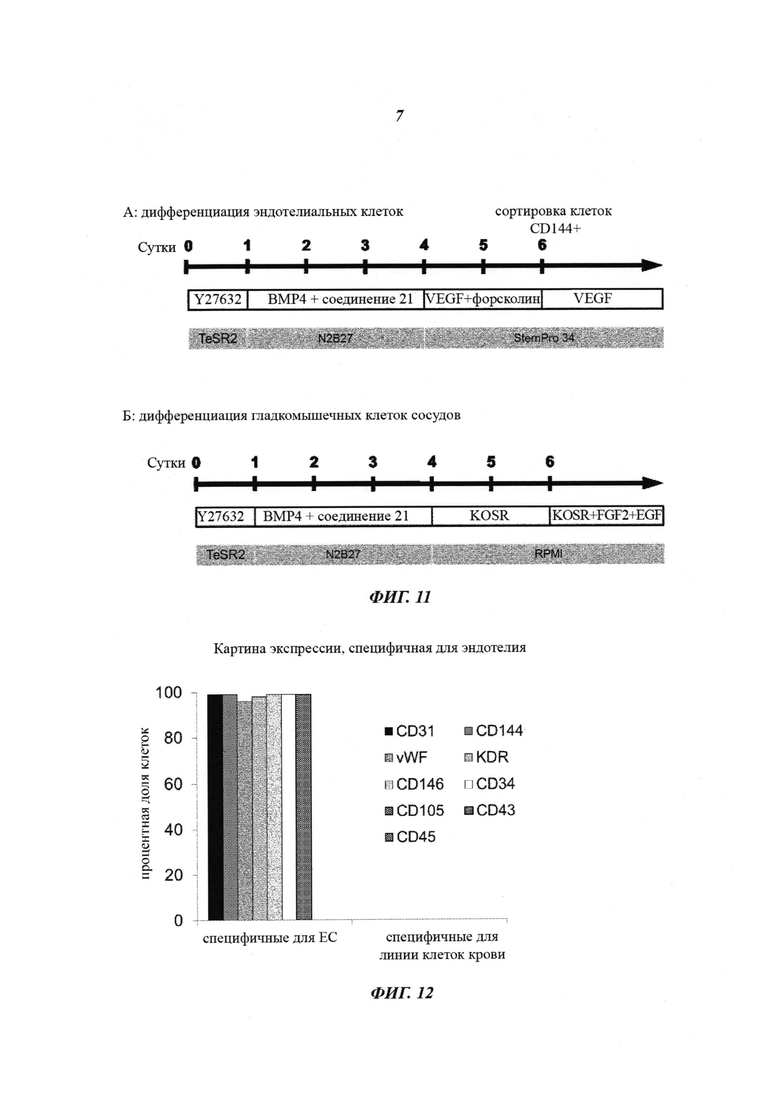
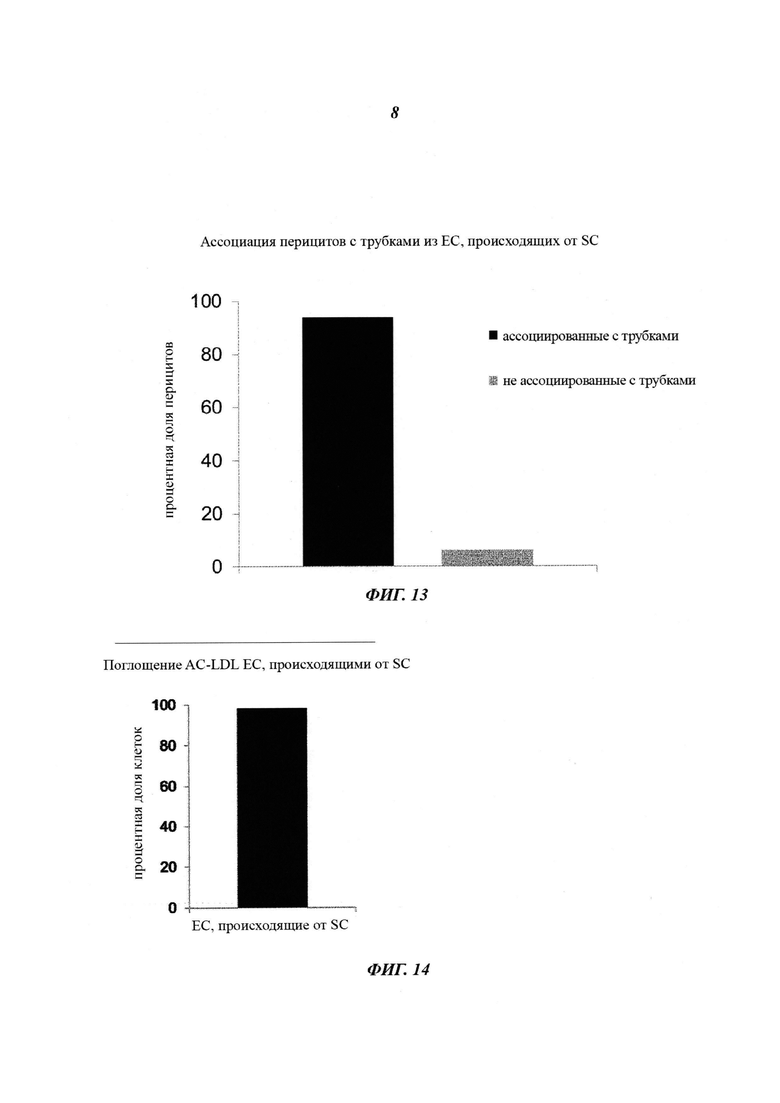
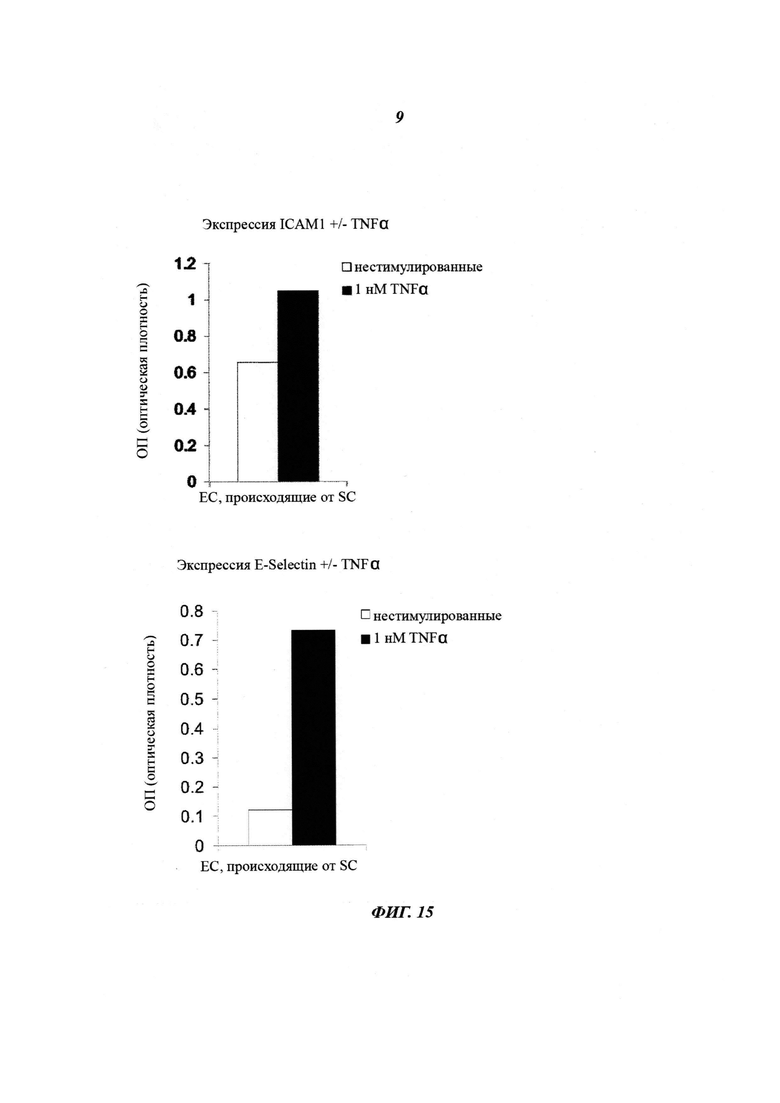
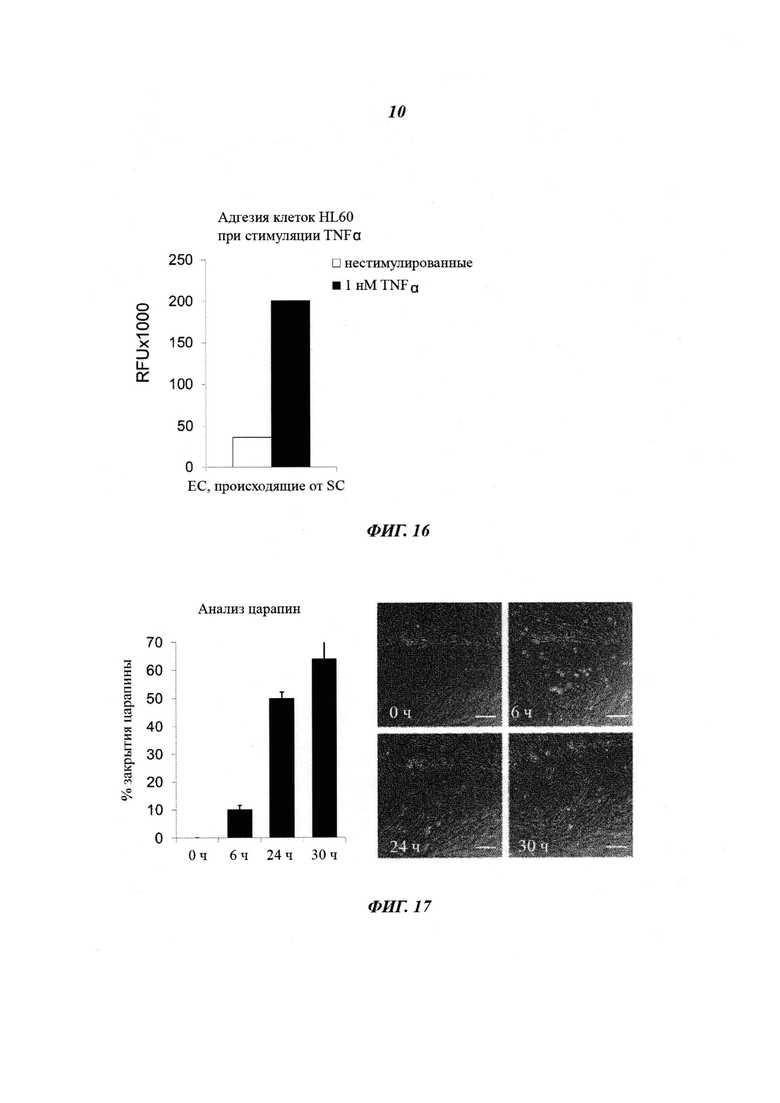
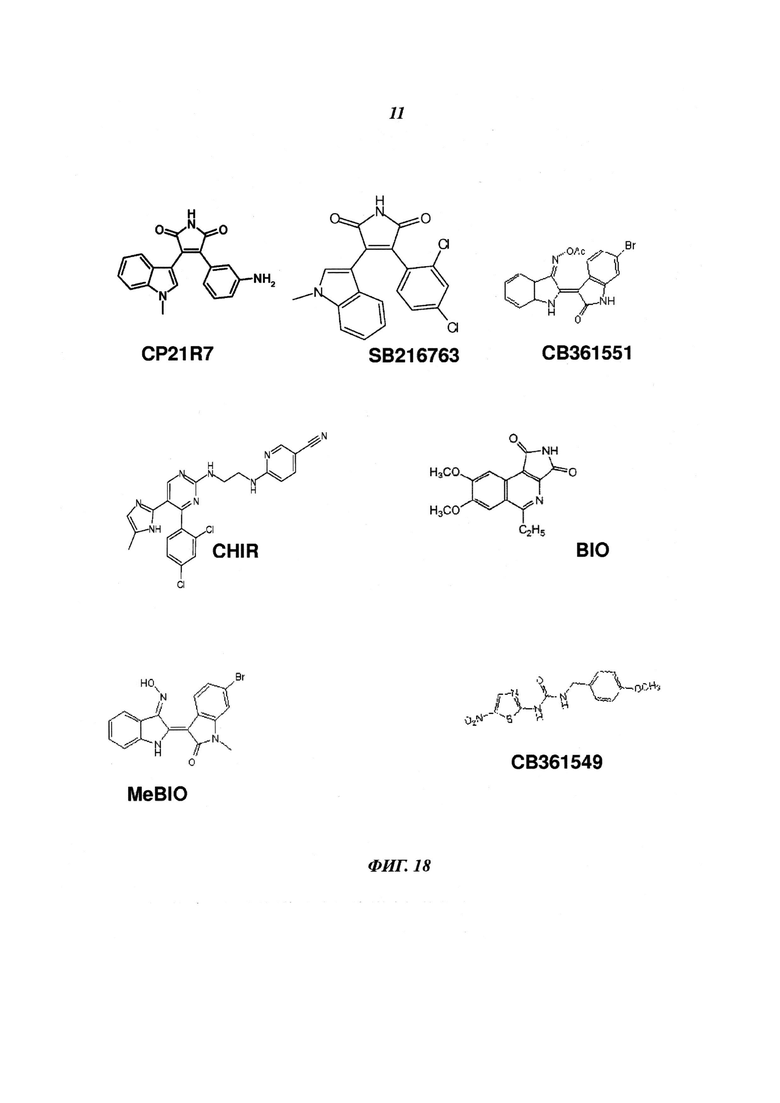
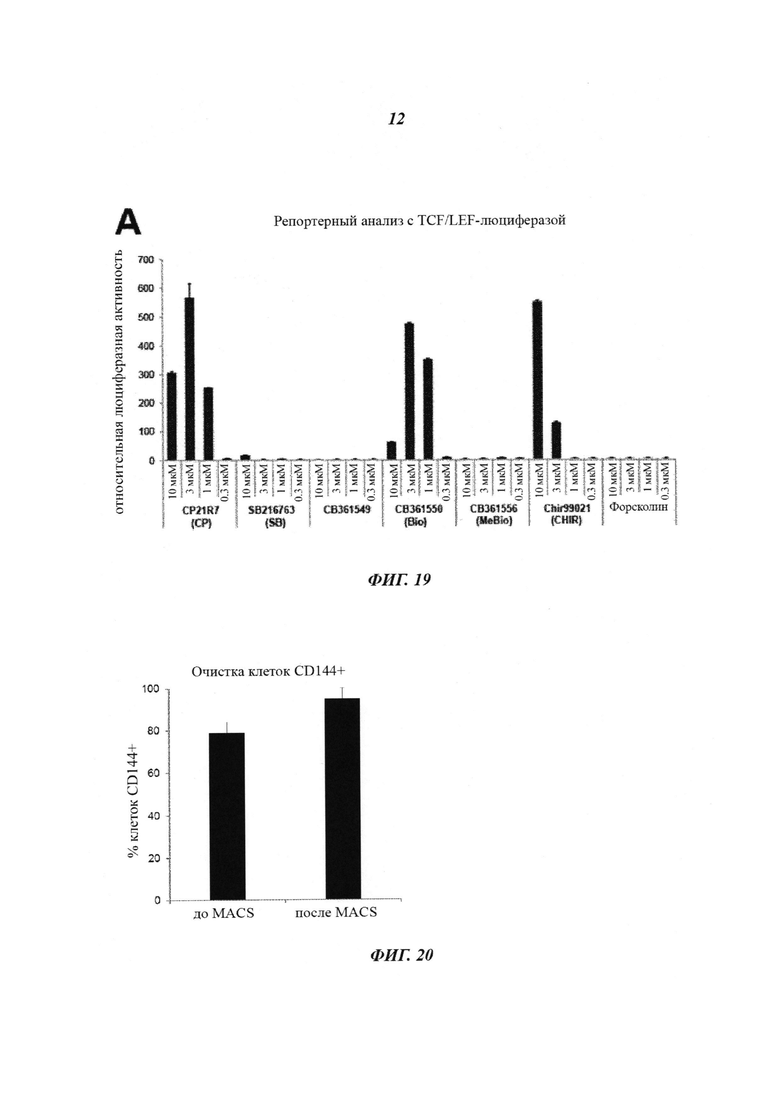
Изобретение относится к биотехнологии. Описан способ дифференциации плюрипотентных стволовых клеток (PSC) в клетки сосудистого русла. Берут плюрипотентные стволовые клетки и получают монослой плюрипотентных стволовых клеток в среде для плюрипотентности. Инкубируют указанные клетки в течение 2-4 суток в примирующей среде с добавлением низкомолекулярного соединения, которое активирует путь бета-катенина, и/или сигнальный путь Wnt, и/или сигнальный путь hedgehog (НН), выбранного из группы низкомолекулярных ингибиторов киназы 3 гликогенсинтазы (Gsk3a-b), низкомолекулярных ингибиторов CDC-подобной киназы 1 (Clk1-2-4), низкомолекулярных ингибиторов митогенактивируемой протеинкиназы 15 (Mapk15), низкомолекулярных ингибиторов киназы двойной специфичности, регулируемой фосфорилированием тирозина (Y) (Dyrk1a-b 4), низкомолекулярных ингибиторов циклин-зависимой киназы 16 (Pctk1-3 4), активаторов и модуляторов Smoothened (SMO) взаимодействия между β-катенином (или γ-катенином) и коактивирующими белками СВР (белок, связывающий CREB) и р300 (белок p300, связывающий Е1А). Индуцируют дифференциацию посредством инкубирования указанных примированных клеток в индуцирующей среде. Изобретение расширяет арсенал способов дифференциации клеток в клетки сосудистого русла. 17 з.п. ф-лы, 20 ил., 1 табл., 8 пр.
1. Способ дифференциации плюрипотентных стволовых клеток в клетки сосудистого русла, влючающий стадии, при которых:
а) берут плюрипотентные стволовые клетки и получают монослой плюрипотентных стволовых клеток в среде для плюрипотентности;
б) инкубируют указанные клетки в течение 2-4 суток в примирующей среде с добавлением низкомолекулярного соединения, которое активирует путь бета-катенина, и/или сигнальный путь Wnt, и/или сигнальный путь hedgehog (НН), выбранного из группы низкомолекулярных ингибиторов киназы 3 гликогенсинтазы (Gsk3a-b), низкомолекулярных ингибиторов CDC-подобной киназы 1 (Clk1-2-4), низкомолекулярных ингибиторов митогенактивируемой протеинкиназы 15 (Mapk15), низкомолекулярных ингибиторов киназы двойной специфичности, регулируемой фосфорилированием тирозина (Y) (Dyrk1a-b 4), низкомолекулярных ингибиторов циклин-зависимой киназы 16 (Pctk1-3 4), активаторов и модуляторов Smoothened (SMO) взаимодействия между β-катенином (или γ-катенином) и коактивирующими белками СВР (белок, связывающий CREB) и р300 (белок p300, связывающий Е1А);
в) индуцируют дифференциацию посредством инкубирования указанных примированных клеток в индуцирующей среде,
где указанная плюрипотентная стволовая клетка представляет собой клетку линии человеческих эмбриональных стволовых клеток SA001 или индуцированную плюрипотентную стволовую клетку.
2. Способ по п. 1 для дифференциации плюрипотентных стволовых клеток в эндотелиальные клетки.
3. Способ по п. 1 для дифференциации плюрипотентных стволовых клеток в гладкомышечные клетки сосудов.
4. Способ по п. 1, где стадия а) дополнительно включает инкубирование указанных клеток в среде для плюрипотентности в течение 18 часов - 30 часов.
5. Способ по п. 1, где стадия в) дополнительно включает инкубирование указанных клеток в индуцирующей среде в течение 18 часов - 48 часов.
6. Способ по п. 1, где указанная среда для плюрипотентности стадии а) представляет собой бессывороточную среду, дополненную ингибитором Rho-ассоциированного белка, образующего суперспираль, из семейства серин/треониновых киназ протеинкиназ (ингибитор ROCK киназы).
7. Способ по п. 6, где указанный ингибитор ROCK киназы выбран из группы, состоящей из следующих: 1-(5-изохинолинсульфонил)гомопиперазин), N-бензил-2-
(пиримидин-4-иламино)тиазол-4-карбоксамид) и (+)-(R)-транс-4-(1-аминоэтил)-N-(4-пиридил)цикло-гексанкарбоксамида дигидрохлорид).
8. Способ по п. 1, где указанная примирующая среда стадии б) представляет собой бессывороточную среду, дополненную инсулином, трансферрином и прогестероном.
9. Способ по п. 1, где указанное низкомолекулярное соединение, которое активирует путь бета-катенина и/или сигнальный путь Wnt, и/или сигнальный путь hedgehog (HH) стадии б) представляет собой 3-(3-амино-фенил)-4-(1-метил-1Н-индол-3-ил)-пиррол-2,5-дион.
10. Способ по п. 1, где указанная примирующая среда стадии б) дополнительно содержит рекомбинантный морфогенный белок кости-4 (ВМР-4).
11. Способ по п. 1, где указанная индуцирующая среда представляет собой бессывороточную среду, дополненную VEGF-A (фактор роста эндотелия сосудов) или плацентарным фактором роста 1 (PLGF-1) и низкомолекулярным активатором аденилатциклазы.
12. Способ по п. 11, где указанные низкомолекулярные активаторы аденилатциклазы выбраны из группы, включающей форсколин ((3R)-(6аальфаН)додекагидро-6бета,10альфа,10bальфа-тригидрокси-3бета,4абета,7,7,10абета-пентаметил-1-оксо-3-винил-1Н-нафто[2,1-b]пиран-5бета-ил ацетат), 8-бром-цАМФ (8-бромаденозин-3',5'-циклический монофосфат) и адреномедуллин.
13. Способ по п. 1, где указанная индуцирующая среда представляет собой среду с заменителем сыворотки или бессывороточную среду, дополненную активаторами сигнального пути TGFбета и сигнального пути PDGF.
14. Способ по п. 1, где указанная индуцированная плюрипотентная стволовая клетка представляет собой человеческую клетку.
15. Способ по п. 1, где указанную индуцированную плюрипотентную стволовую клетку получают от субъекта, страдающего от заболевания, ассоциированного с сосудистыми осложнениями.
16. Способ по п. 1, дополнительно включающий стадию
г) инкубирования продукта стадии в) при условиях, подходящих для пролиферации эндотелиальных клеток или гладкомышечных клеток сосудов.
17. Способ по п. 1, дополнительно включающий создание биобанка эндотелиальных клеток.
18. Способ по п. 1, дополнительно включающий создание биобанка гладкомышечных клеток сосудов.
| WO2010099539 A1, 02.09.2010 | |||
| СПОСОБ КУЛЬТИВИРОВАНИЯ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА EX VIVO | 2006 |
|
RU2323252C1 |
Авторы
Даты
2017-05-11—Публикация
2012-06-04—Подача