ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение относится к антителам человека и антигенсвязывающим фрагментам антител человека, которые специфически связывают ангиопоэтин-подобный белок 3 (hANGPTL3) человека, и к терапевтическим методам применения указанных антител.
УРОВЕНЬТЕХНИКИ
[0002] Ген ангиопоэтин-подобного белка 3 (ANGPTL3) был идентифицирован в базе данных EST по сигнальным последовательностям и амфипатическим спиралям, а затем из библиотеки кДНК эмбриона печени/селезенки человека была выделена полная последовательность кДНК ANGPTL3 (см. Conklin et al., 1999, Genomics62:477-482). Прогнозируемый белок DANGPTL3 из 460 аминокислот содержит на 76% идентичную мышиному ANGPTL3 аминокислотную последовательность и имеет характерную структуру ангиопоэтинов; то есть сигнальный пептид, протяженный спиральный домен, которые прогнозируемо образует димерные или тримерные суперспирали, короткий пептидный линкер и глобулярный фибриноген-гомологичный домен (FD) (см. Conklin et al., 1999, supra). ANGPTL3 содержит 4 консервативных цистеиновых остатка задействованых во внутримолекулярных дисульфидных связях в FD; при этом ANGPTL3 не содержит ни двух дополнительных цистеинов, ни характерного связывающего кальций мотива, присутствующего в FD ангиопоэтинов (ANG; то есть ANG1, ANG2 и ANG4) (см. Conklin et al., 1999, supra), которые являются белковыми факторами роста, способствующими ангиогенезу. Кроме того, в отличие от ANG, ANGPTL3 не связывается с Tie2; тем не менее, возможно, что он также индуцирует ангиогенез, связываясь с интегрином αvβ3 через его С-терминальный FD (см. Camenisch et al., 2002, J Biol Chem 277:17281-17290).
[0003] Полные данные in vivo были получены в рамках модели аутбредных мышей КК, которые отличаются умеренным ожирением с аномально высокими уровнями инсулина, глюкозы и липидов в плазме, подобно сахарному диабету 2 типа у человека (см. Koishi et al., 2002, Nature Genetics 30:151-157). При этом у одной из сублиний мышей, KK/San, были обнаружены аномально низкие уровни липидов в плазме (гиполипидемия), которые наследовались как рецессивные по Менделю. Локус был локализован на хромосоме 4 и в итоге был идентифицирован как ген, кодирующий ANGPTL3, который в экзоне 6 содержал вставку нуклеотидной последовательности из 4 пн (см. Koishi et at., 2002, supra). Напротив, уровни липидов в плазме увеличивались после опосредованного аденовирусом переноса гена ANGPTL3 или после введения рекомбинантного человеческого ANGPTL3 мышам KK/San. Такой эффект не был вызван изменениями в генах, участвующих в синтезе холестерина, клиренсе липопротеинов или окислении NEFA (см. Koishi et al., 2002, supra). Кроме того, анализ in vitro рекомбинантного белка показал, что ANGPTL3 напрямую ингибирует активность липопротеинлипазы (LPL), что свидетельствует о том, что он является модулятором метаболизма липидов, регулирующим уровни триглицеридов липопротеинов очень низкой плотности (ЛОНП) за счет ингибирования активности LPL (см. Shimizugawa et al., 2002, J б/о/ Chem 277(37):33742-33748). Продемонстрировано, что N-терминальный суперспиральный домен, особенно остатки 17-165 N-терминальной области, а не С-терминальный FD ANGPTL3, определяют его активность в отношении увеличения уровней триглицеридов в плазме у мышей (см. Ono et al., 2003, J Biol Chem 278:41804-41809).
[0004] Последовательности нуклеиновых кислот и аминокислотные последовательности для ANGPTL3 человека приведены в последовательностях SEQ ID №:161 и 162, соответственно. Антитела к ANGPTL3 раскрываются, например, в W02008/073300 и патенте США 7,935,796.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] В первом аспекте изобретения предлагаются полностью человеческие моноклональные антитела (mAb) и их антигенсвязывающие фрагменты, которые специфически связываются и нейтрализуют, ингибируют, блокируют, аннулируют, снижают по крайней мере один аспект активности человеческого ANGTPL3, в частности человеческого ANGTPL3 (SEQ ID №:161), или препятствуют ему. Активность ANGPTL3, которую можно нейтрализовать, ингибировать, блокировать, аннулировать, снижать или которой можно препятствовать с помощью антител настоящего изобретения или их фрагментов, включает, среди прочего, ингибирование активности ЛПЛ, индуцирование ангиогенеза и пр. В одном из осуществлений антитело настоящего изобретения или его фрагмент может нейтрализовать, ингибировать, блокировать, аннулировать, снижать активность hANGPTL3 или препятствовать ей, связываясь с эпитопом hANGPTL3, который напрямую задействован в целевой активности hANGPTL3. В другом осуществлении антитело настоящего изобретения или его фрагмент может нейтрализовать, ингибировать, блокировать, аннулировать, снижать активность hANGPTL3 или препятствовать ей, связываясь с эпитопом hANGPTL3, который напрямую не задействован в целевой активности hANGPTL3, но связывание с ним антитела или фрагмента стерически или конформационно ингибирует, блокирует, аннулирует, снижает целевую активность hANGPTL3 или препятствует ей. В еще одном осуществлении антитело настоящего изобретения или его фрагмент связывается с эпитопом hANGPTL3, который напрямую не задействован в целевой активности (например, ингибировании активности ЛПЛ, включая ангиогенез и пр.) hANGPTL3 (то есть неблокирующее антитело), но связывание с ним антитела или фрагмента приводит к повышению клиренса hANGPTL3 из кровообращения по сравнению с клиренсом hANGPTL3 в отсутствие антитела или его фрагмента, а значит, косвенно ингибирует, блокирует, аннулирует, снижает активность hANGPTL3 или препятствует ей. Клиренс hANGPTL3 из кровообращения может заметно повышаться за счет сочетания двух или более различных неблокирующих антител, которые не конкурируют друг с другом в процессе специфического связывания с hANGPTL3.
[0006] Антитела (Abs) могут быть полноразмерными (например, антитело IgG1 или lgG4) или включать только антигенсвязывающую часть (например, фрагмент Fab, F(ab')2 или scFv) и могут быть модифицированы с целью воздействовать на функциональность, например удалять остаточные эффекторные функции (Reddy et al. (2000) J. Immunol. 164:1925-1933).
[0007] В одном осуществлении настоящее изобретение включает антитело или антигенсвязывающий фрагмент антитела, содержащие вариабельную область тяжелой цепи (HCVR), выбираемую из группы, включающей SEQ ID №:2, 18, 34, 50, 66, 82, 98, 114, 130, 146 и 180, или ее существенно аналогичную последовательность с гомологией, имеющей идентичность последовательности не менее 90%, не менее 95%, не менее 98% или не менее 99%. В другом осуществлении антитело или антигенсвязывающий фрагмент антитела содержит HCVR с аминокислотной последовательностью, выбираемой из группы, включающей SEQ ID №:2, 18, 34, 66, 82; 114 и 180. В другом осуществлении антитело или антигенсвязывающий фрагмент антитела содержит HCVR с аминокислотной последовательностью SEQ ID №:66.
[0008] В одном осуществлении антитело или антигенсвязывающий фрагмент антитела включает вариабельную область легкой цепи (LCVR), выбираемую из группы, включающей SEQ ID №:10, 26, 42, 58, 74, 90, 106, 122, 138, 154 и 188, или ее существенно аналогичную последовательность с гомологией, имеющей идентичность последовательности не менее 90%, не менее 95%, не менее 98% или не менее 99%. В другом осуществлении антитело или антигенсвязывающий фрагмент антитела включает LCVR с аминокислотной последовательностью, выбираемой из группы, включающей SEQ ID №:10, 26, 42, 74, 90, 122 и 188. В другом осуществлении антитело или антигенсвязывающий фрагмент антитела содержит LCVR с аминокислотной последовательностью SEQ ID №:74.
[0009] В дальнейших осуществлениях антитело или фрагмент антитела включает пару последовательностей HCVR и LCVR (HCVR/LCVR), выбираемую из группы, включающей SEQ ID №:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154 и 180/188. В одном осуществлении антитело или фрагмент антитела включает пару последовательностей HCVR и LCVR, выбираемую из группы, включающей SEQ ID №:2/10, 18/26, 34/42, 66/74, 82/90, 114/122 и 180/188. Еще в одном осуществлении антитело или фрагмент антитела включает пару последовательностей HCVR и LCVR, включающую SEQ ID №:66/74.
[0010] Во втором аспекте настоящего изобретения приводится антитело или антигенсвязывающий фрагмент антитела, содержащие аминокислотную последовательность определяющей комплементарной области 3 тяжелой цепи (HCDR3), выбираемую из группы, включающей SEQ ID №:8, 24, 40, 56, 72, 88, 104, 120, 136, 152 и 186, или ее существенно аналогичную последовательность с идентичностью последовательности не менее 90%, не менее 95%, не менее 98% или не менее 99%; и аминокислотную последовательность легкой цепи CDR3 (LCDR3), выбираемую из группы, включающей SEQ ID №:16, 32, 48, 64, 80, 96, 112, 128, 144, 160 и 194, или их существенно аналогичные последовательности с идентичностью последовательности не менее 90%, не менее 95%, не менее 98% или не менее 99%. В одном осуществлении антитело или его фрагмент содержит пару аминокислотных последовательностей HCDR3/LCDR3, включающую SEQ ID №:8/16, 24/32, 40/48, 56/64, 72/80, 88/96, 104/112, 120/128, 136/144, 152/160 или 186/194. В еще одном осуществлении антитело или его фрагмент содержит пару аминокислотных последовательностей HCDR3/LCDR3, включающую SEQ ID №:8/16, 24/32, 40/48, 72/80, 88/96, 120/128 или 186/194. Еще в одном осуществлении антитело или фрагмент антитела включает пару аминокислотных последовательностей HCDR3/LCDR3, включающую SEQ ID №:72/80.
[0011] В дальнейшем осуществлении антитело или его фрагмент содержит аминокислотную последовательность тяжелой цепи CDR1 (HCDR1), выбираемую из группы, включающей SEQ ID №:4, 20, 36, 52, 68, 84, 100, 116, 132, 148 и 182, или его существенно аналогичную последовательность, имеющую идентичность последовательности не менее 90%, не менее 95%, не менее 98% или не менее 99%; и аминокислотную последовательность тяжелой цепи CDR2 (HCDR2), выбираемую из группы, включающей SEQ ID №:6, 22, 38, 54, 70, 86, 102, 118, 134, 150 и 184, или его существенно аналогичную последовательность, имеющую идентичность последовательности не менее 90%, не менее 95%, не менее 98% или не менее 99%; и может также содержать аминокислотную последовательность легкой цепи CDR1 (LCDR1), включающей SEQ ID №:12, 28, 44, 60, 76, 92, 108, 124, 140, 156 и 190, или ее существенно аналогичную последовательность, имеющую идентичность последовательности не менее 90%, не менее 95%, не менее 98% или не менее 99%; и/или аминокислотную последовательность легкой цепи CDR2 (LCDR2), выбираемую из группы, включающей SEQ ID №:14, 30, 46, 62, 78, 94, 110, 126, 142, 158 и 192, или ее существенно аналогичную последовательность, имеющую идентичность последовательности не менее 90%, не менее 95%, не менее 98% или не менее 99%.
[0012] В альтернативном варианте настоящее изобретение описывает антитело или антиген-связывающий фрагмент антитела, содержащие сочетание последовательностей тяжелой цепи HCDR1/HCDR2/HCDR3, выбираемое из группы, включающей SEQ ID №:4/6/8, 20/22/24, 36/38/40, 52/54/56, 68/70/72, 84/86/88, 100/102/104, 116/118/120, 132/134/136, 148/150/152 и 182/184/186; и/или сочетание последовательностей легкой цепи LCDR1/LCDR2/LCDR3, выбираемое из группы, включающей SEQ ID №:12/14/16, 28/30/32, 44/46/48, 60/62/64, 76/78/80, 92/94/96, 108/110/112, 124/126/128, 140/142/144, 156/158/160 и 190/192/194. В одном осуществлении аминокислотные последовательности тяжелых и легких цепей CDR составляют сочетание последовательностей CDR, выбираемое из группы, включающей SEQ ID №:4/6/8/12/14/16, 20/22/24/28/30/32, 36/38/40/44/46/48, 52/54/56/60/62/64, 68/70/72/76/78/80, 84/86/88/92/94/96, 100/102/104/108/110/112, 116/118/120/124/126/128, 132/134/136/140/142/144, 148/150/152/156/158/160 и 182/184/186/190/192/194. В одном осуществлении аминокислотные последовательности тяжелых и легких цепей CDR составляют сочетание последовательностей CDR, выбираемое из группы включающей SEQ ID №:4/6/8/12/14/16, 20/22/24/28/30/32, 36/38/40/44/46/48, 68/70/72/76/78/80, 84/86/88/92/94/96, 116/118/120/124/126/128 или 182/184/186/190/192/194. В еще одном осуществлении аминокислотные последовательности тяжелых и легких цепей CDR составляют сочетание последовательностей CDR, включающее SEQ ID №:68/70/72/76/78/80.
[0013] В связанном осуществлении настоящего изобретения приводится антитело или антигенсвязывающий фрагмент антитела, которые специфически связывает hANGPTL3, где антитело или его фрагмент содержит домены тяжелой и легкой цепей CDR, содержащиеся в парах последовательностей HCVR/LCVR, выбираемых из группы, включающей SEQ ID №:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154 and 180/188. Методы и способы идентификации CDR в аминокислотных последовательностях HCVR и LCVR известны специалистам и могут применяться для идентификации CDR в указанных аминокислотных последовательностях HCVR или LCVR, раскрываемых в настоящем документе. Для определения границ CDR могут использоваться общепринятые определения, в том числе, определения по Кабату, определения по Чотиа и определения AbM. В общих чертах, определение по Кабату опирается на вариабельность последовательности, определение по Чотиа основано на локализации структурных петлевых областей, а определение АЬМ представляет собой нечто среднее между подходами Кабата и Чотиа. См., например, Kabat, "Sequences of Proteins of Immunological Interest," National Institutes of Health, Bethesda, Md. (1991); Al-Lazikani et at., J. Mol. Biol. 273:927-948 (1997); и Martin et al., Proc. Nail. Acad. Sci. USA 86:9268-9272 (1989). Для идентификации последовательностей CDR в антителе также доступны открытые базы данных. В одном осуществлении антитело или фрагмент антитела включает последовательности CDR, содержащиеся в паре HCVR и LCVR, включающей SEQ ID №:2/10, 18/26, 34/42, 66/74, 82/90, 114/122 и 180/188. Еще в одном осуществлении антитело или фрагмент антитела включает последовательности CDR, содержащиеся в паре HCVR и LCVR, включающей SEQ ID №:66/74.
[0014] В еще одном связанном осуществлении настоящего изобретения представлено антитело или антигенсвязывающий фрагмент антитела, которые конкурируют за специфическое связывание с hANGPTL3 с антителом или фрагментом антитела, содержащим последовательности тяжелой и легкой цепей CDR, содержащиеся в паре последовательностей HCVR/LCVR, выбираемых из группы, включающей SEQ ID №:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154 и 180/188. В еще одном осуществлении антитело или антигенсвязывающий фрагмент антитела настоящего изобретения конкурирует за специфическое связывание с hANGPTL3 с антителом или его фрагментом, содержащим пару последовательностей HCVR/LCVR, выбираемых из группы, включающей SEQ ID №:66/74. В еще одном осуществлении антитело или антигенсвязывающий фрагмент антитела настоящего изобретения конкурирует за специфическое связывание с hANGPTL3 с антителом или его фрагментом, содержащим сочетание последовательностей тяжелой и легкой цепей CDR, выбираемое из группы, включающей SEQ ID №:4/6/8/12/14/16, 20/22/24/28/30/32, 36/38/40/44/46/48, 52/54/56/60/62/64, 68/70/72/76/78/80, 84/86/88/92/94/96, 100/102/104/108/110/112, 116/118/120/124/126/128, 132/134/136/140/142/144, 148/150/152/156/158/160 and 182/184/186/190/192/194. В одном осуществлении антитело или антигенсвязывающий фрагмент антитела настоящего изобретения конкурирует за специфическое связывание с hANGPTL3 с антителом или его фрагментом, содержащим сочетание последовательностей тяжелой и легкой цепей CDR, выбираемое из группы, включающей SEQ ID №:68/70/72/76/78/80.
[0015] В еще одном связанном осуществлении настоящего изобретения представлено антитело или его антигенсвязывающий фрагмент, связывающиеся с тем же эпитопом на hANGPTL3, который идентифицируется антителом или его фрагментом, содержащим последовательности тяжелой и легкой цепей CDR из пары последовательностей HCVR/LCVR, выбираемых из группы, включающей SEQ ID №:2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154 или 180/188. В одном осуществлении антитело или антигенсвязывающий фрагмент антитела настоящего изобретения связывается с тем же эпитопом на hANGPTL3, который идентифицируется антителом или его фрагментом, содержащим пару последовательностей HCVR/LCVR, выбираемых из группы, включающей SEQ ID №:66/74. В одном осуществлении антитело или фрагмент антитела настоящего изобретения связывается с тем же эпитопом на hANGPTL3, который идентифицируется антителом или его фрагментом, содержащим сочетание последовательностей тяжелой и легкой цепей CDR, выбираемое из группы, включающей 4/6/8/12/14/16, 20/22/24/28/30/32, 36/38/40/44/46/48, 52/54/56/60/62/64, 68/70/72/76/78/80, 84/86/88/92/94/96, 100/102/104/108/110/112,116/118/120/124/126/128, 132/134/136/140/142/144, 148/150/152/156/158/160 и 182/184/186/190/192/194. В одном осуществлении такой эпитоп идентифицируется антителом или его фрагментом, содержащим сочетание последовательностей тяжелой и легкой цепей CDR, выбираемое из группы, включающей SEQ ID №:68/70/72/76/78/80.
[0016] В третьем аспекте настоящего изобретения представлено изолированное антитело анти- hANGPTL-3 или его антигенсвязывающий фрагмент, которые связываются с эпитопом, расположенным в N-терминальной суперспиральной области в остатках 17-209 последовательности SEQ ID №:161, и нейтрализует, ингибирует, аннулирует, сокращает как минимум одну из функций hANGPTL3 или препятствует ей. В еще одном осуществлении настоящего изобретения представлено изолированное антитело или антигенсвязывающий фрагмент антитела, которые специфически связываются с эпитопом, расположенным в N-терминальной суперспиральной области hANGPTL3 (SEQ ID №:161), и нейтрализует, ингибирует, аннулирует, сокращает как минимум одну из функций hANGPTL3 или препятствует ей, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170 (соответствует остаткам с Glu32 по Leu57 hANGPTL3 из SEQ ID №:161). В одном осуществлении антитело или фрагмент антитела настоящего изобретения специфически связывается с эпитопом в остатках 17 -200, 17-100, 17-70, 17-65, 17-60, 17-57 или 17-50 hANGPTL3 (SEQ ID №:161), может быть, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170. В еще одном осуществлении антитело или его фрагмент специфически связывается с эпитопом в остатках 40-200, 40-100, 40-70, 50-200, 50-100, 50-70, 58-200,58-100, 58-70, 58-68 или 61-66 hANGPTL3 (SEQ ID №:161), может быть, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170. В некоторых осуществлениях антитело или его фрагмент связывается с эпитопом, возможно, при участии более чем одного пронумерованного эпитопа или остатка в N-терминальной суперспиральной области hANGPTL3, может быть, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170.
[0017] В четвертом аспекте настоящего изобретения приводятся молекулы нуклеиновой кислоты, кодирующие антитела анти-ANGPTLS или их фрагменты, в частности любые из описанных выше. Настоящее изобретение также охватывает рекомбинантные векторы экспрессии, несущие нуклеиновые кислоты настоящего изобретения, и клетки-хозяева, например бактериальные клетки, такие как E. coli, или клетки млекопитающих, такие как клетки СНО, в которые включаются такие векторы, а также методы приготовления антител путем культивирования клеток-хозяев в условиях, допускающих производство антител и получение произведенных таким образом антител.
[0018] В одном осуществлении настоящего изобретения приводится антитело или его фрагмент, содержащие HCVR, кодируемую последовательностью нуклеиновой кислоты, выбираемой из группы, включающей SEQ ID №:1, 17, 33, 49, 65, 81, 97, 113, 129, 145 и 179, или существенно аналогичную последовательность с гомологией не менее 90%, не менее 95%, не менее 98% или не менее 99%. В еще одном осуществлении антитело или его фрагмент содержит HCVR, кодируемую последовательностью нуклеиновой кислоты, выбираемой из группы, включающей SEQ ID №:1, 17, 33, 65, 81, 113 или 179. Веще одном осуществлении антитело или его фрагмент содержит HCVR, кодируемую последовательностью нуклеиновой кислоты SEQ ID №:65.
[0019] В одном осуществлении антитело или его антигенсвязывающий фрагмент содержит LCVR, кодируемую последовательностью нуклеиновой кислоты, выбираемой из группы, включающей SEQ ID №:9, 25, 41, 57, 73, 89, 105, 121, 137, 153 и 187, или существенно аналогичную последовательность с гомологией не менее 90%, не менее 95%, не менее 98% или не менее 99%. В еще одном осуществлении антитело или его фрагмент содержит LCVR, кодируемую последовательностью нуклеиновой кислоты, выбираемой из группы, включающей SEQ ID №:9, 25, 41, 73, 89, 121 или 187. В еще одном осуществлении антитело или его фрагмент содержит LCVR, кодируемую последовательностью нуклеиновой кислоты SEQ ID №:73.
[0020] В дальнейших осуществлениях антитело или фрагмент антитела включает пару последовательностей HCVR и LCVR (HCVR/LCVR), кодируемую парой последовательностей нуклеиновой кислоты, выбираемой из группы, включающей SEQ ID №:1/9, 17/25, 33/41, 49/57, 65/73, 81/89, 97/105, 113/121, 129/137, 145/153 и 179/187. В одном осуществлении антитело или его фрагмент содержит пару последовательностей HCVR/LCVR, кодируемую парой последовательностей нуклеиновой кислоты SEQ ID №:1/9, 17/25, 33/41, 65/73, 81/89, 113/121 или 179/187. В еще одном осуществлении антитело или его фрагмент содержит пару последовательностей HCVR/LCVR, кодируемую парой последовательностей нуклеиновой кислоты SEQ ID №:65/73.
[0021] В одном осуществлении настоящего изобретения приводится антитело или антигенсвязывающий фрагмент антитела, содержащие домен HCDR3, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №:7, 23, 39, 55, 71, 87, 103, 119, 135, 151 и 185, или существенно аналогичную последовательность с гомологией не менее 90%, не менее 95%, не менее 98% или не менее 99%; и домен LCDR3, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №:15, 31, 47, 63, 79, 95, 111, 127, 143, 159 и 193, или существенно аналогичную последовательность с гомологией не менее 90%, не менее 95%, не менее 98% или не менее 99%. В одном осуществлении антитело или его фрагмент содержит пару последовательностей HCDR3 и LCDR3, кодируемую парой последовательностей нуклеиновой кислоты, выбираемой из группы, включающей SEQ ID №:7/15, 23/31, 39/47, 55/63, 71/79, 87/95, 103/111, 119/127, 135/143, 151/159 и 185/193. В еще одном осуществлении антитело или его фрагмент содержит пару последовательностей HCDR3 и LCDR3, кодируемую парой последовательностей нуклеиновой кислоты SEQ ID №:7/15, 23/31, 39/47, 71/79, 87/95, 119/127 или 185/193. В еще одном осуществлении антитело или его фрагмент содержит пару последовательностей HCDR3 и LCDR3, кодируемую парой последовательностей нуклеиновой кислоты SEQ ID №:71/79.
[0022] В еще одном осуществлении антитело или его фрагмент далее содержит домен HCDR1, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №:3, 19, 35, 51, 67, 83, 99, 115, 131, 147 и 181, или существенно аналогичную последовательность с гомологией не менее 90%, не менее 95%, не менее 98% или не менее 99%; и домен HCDR2, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №:5, 21, 37, 53, 69, 85, 101, 117, 133, 149 и 183, или существенно аналогичную последовательность с гомологией не менее 90%, не менее 95%, не менее 98% или не менее 99%; и может также содержать домен LCDR1, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №:11, 27, 43, 59, 75, 91, 107, 123, 139, 155 и 189, или существенно аналогичную последовательность с гомологией не менее 90%, не менее 95%, не менее 98% или не менее 99%; и/или домен LCDR2, кодируемый нуклеотидной последовательностью, выбираемой из группы, включающей SEQ ID №:13, 29, 45, 61, 77, 93, 109, 125, 141, 157 и 191, или существенно аналогичную последовательность с гомологией не менее 90%, не менее 95%, не менее 98% или не менее 99%.
[0023] В альтернативном варианте настоящее изобретение содержит антитело или антиген-связывающий фрагмент антитела, содержащие сочетание последовательностей тяжелой цепи HCDR1/HCDR2/HCDR3, кодируемое сочетанием нуклеотидной последовательности, выбираемым из группы, включающей SEQ ID №:3/5/7, 19/21/23, 35/37/39, 51/53/55, 67/69/71, 83/85/87, 99/101/103, 115/117/119, 131/133/135, 147/149/151 и 181/183/185; и/или сочетание последовательностей легкой цепи LCDR1/LCDR2/LCDR3, кодируемое сочетанием нуклеотидной последовательности, выбираемым из группы, включающей SEQ ID №:11/13/15, 27/29/31, 43/45/47, 59/61/63, 75/77/79, 91/93/95, 107/109/111, 123/125/127, 139/141/143, 155/157/159 и 189/191/193. Водном осуществлении антитело или его фрагмент содержит последовательности CDR тяжелой и легкой цепей, кодируемые сочетанием нуклеотидной последовательности SEQ ID №:67/69/71/75/77/79.
[0024] В пятом аспекте настоящего изобретения приводится антитело анти-АМОРТ1-3 человека или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи (HCVR), кодируемую сегментами нуклеотидной последовательности, полученными из последовательностей зародышевых линий VH, DH и JH, и вариабельную область легкой цепи (LCVR), кодируемую сегментами нуклеотидной последовательности, полученными из последовательностей зародышевых линий VK и JK, где HCVR и LCVR кодируются сегментами нуклеотидной последовательности, полученными из сочетания зародышевых линий, выбираемого из группы, включающей: (i) VH3-43, DH3-3, JH3, VK1-5 и JK2; (ii) VH3-11, DH1-1, JH4, VK1-39 и JK4; (iii) VH3-30, DH1-7, JH6, VK1-5 и JK1; (iv) VH3-30, DH1-26, JH6, VK1-12 и JK3; (v) VH3-30, DH3-10, JH6, VK1-12 и JK3; и (vi) VH3-23, DH3-10, JH4, VK1-5 и JK1.
[0025] В шестом аспекте настоящего изобретения приводится антитело или его антигенсвязывающий фрагмент, которые специфически связываются с hANGPTL3 при равновесной константой диссоциации (KD), составляющей приблизительно 7 нМ или менее, приблизительно 6 нМ или менее, приблизительно 5 нМ или менее, приблизительно 4 нМ или менее, приблизительно 3 нМ или менее, приблизительно 2 нМ или менее или приблизительно 1 нМ или менее, как показывают результаты измерения методом поверхностного плазменного резонанса (например BIACORE™). В некоторых осуществлениях антитело настоящего изобретения демонстрирует Ко, составляющее приблизительно 800 пМ или менее, приблизительно 700 пМ или менее, приблизительно 600 пМ или менее, приблизительно 500 пМ или менее, приблизительно 400 пМ или менее, приблизительно 300 пМ или менее, приблизительно 200 пМ или менее, приблизительно 100 пМ или менее или приблизительно 50 пМ или менее.
[0026] В седьмом аспекте настоящего изобретения приводится антитело анти-hANGPTL3 или его антигенсвязывающий фрагмент, которые связывают белок hANGPTL3 последовательности SEQ ID №:161, но не вступает в перекрестную реакцию с родственным белком, таким как ангиопоэтин-подобный белок 4 (hANGPTL4; SEQ ID №:164) человека, согласно определению, например, с помощью ELISA, методом поверхностного плазменного резонанса или технологии LUMINEX®XMAP®, как описано в настоящем документе. ANGPTL4 представляет собой еще один секретируемый белок, способный снижать активность LPL и имеющий N-терминальную суперспирально область и С-терминальный фибриногеноподобный домен (Ge et al., 2004, J Biol Chem 279:2038-2045; Yau et al., 2009, J Biol Chem 284:11942-11952). В связанных осуществлениях настоящего изобретения приводится антитело анти-hANGPTL3 или его антигенсвязывающий фрагмент, которые связывают белок hANGPTL-3 и вступает в перекрестную реакцию с белком hANGPTL4, В некоторых осуществлениях аффинность связывания антитела hANGPTL3 или фрагмента антитела белка hANGPTL4 составляет 75% или менее или 50% или менее афинности связывания антитела или фрагмента с белком hANGPTL3.
[0027] В еще одном связанном осуществлении настоящего изобретения представлено антитело анти-hANGPTL3 или его антигенсвязывающий фрагмент, которые не вступает в перекрестную реакцию с ANGPTL3 мыши (mANGPTL3; SEQ ID №:163) или ANGPTL3 крысы (rANGPTL3; SEQ ID №:175), но вступает в перекрестную реакцию с ANGPTL3 яванского макака (Масаса fascicularis) (MfANGPTL3), например с N-терминальными остатками 17-170 SEQ ID №:177 (частичная аминокислотная последовательность MfANGPTL3). В еще одном связанном осуществлении настоящего изобретения представлено антитело анти-hANGPTL3 или его фрагмент, которые вступают в перекрестную реакцию с MfANGPTL3, mANGPTL3 и rANGTPL3.
[0028] Настоящее изобретение включает антитела анти-hANGPTL3 с модифицированной структурой гликозилирования. В некоторых приложениях может оказаться полезным удалить нежелательные сайты гликозилирования, например удалить фукозу для усиления функции антителозависимой клеточно-обусловленной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277:26733). В других приложениях удаление сайта N-гликозилирования может сократить нежелательные иммунные реакции на терапевтические антитела или увеличить аффинность антител. В других приложениях может осуществляться модификация галактозилирования, с тем чтобы изменить комплементзависимую цитотоксичность (CDC).
[0029] В восьмом аспекте настоящего изобретения приводится фармацевтический состав, включающий рекомбинантное антитело человека или его фрагмент, которые специфически связывают hANGPTL3, и фармацевтически приемлемый носитель. В одном осуществлении настоящего изобретения представлен фармацевтический состав, содержащий одно или несколько антител анти-ANGPTL3 или фрагментов антител изобретения, которые не вступают в перекрестную конкуренцию друг с другом, и фармацевтически приемлемый носитель. В одном осуществлении фармацевтический состав настоящего изобретения может содержать два или более неблокирующих антител, которые не вступают в конкуренцию друг с другом за специфическое связывание с hANGPTL3 и проявляют эффективность в удалении hANGPTL3 из обращения. Приемлемые сочетания неблокирующих антител включают, среди прочего, сочетание антител, содержащее пары последовательностей HCVR и LCVR (HCVR/LCVR): (i) SEQ ID №:82/90 и 180/188, соответственно; (ii) SEQ ID №:114/122 и 180/188, соответственно; (iii) SEQ ID №:82/90 и 18/26, соответственно; или (iv) SEQ ID №:114/122 и 18/26, соответственно.
[0030] В связанных осуществлениях настоящего изобретения приводится состав, представляющий собой сочетание антитела или антигенсвязывающего фрагмента антитела настоящего изобретения и второго терапевтического агента. В качестве второго терапевтического агента может выступать один или несколько агентов, таких как (1) ингибиторы редуктазы 3-гидрокси-3-метилглутарил-коэнзима A (HMG-CoA), например церивастатин, аторвастатин, симвастатин, питавастатин, розувастатин, флувастатин, ловастатин, правастатин и им подобные; (2) ингибиторы захвата холестерина и/или реабсорбции желчных кислот; (3) ниацин, который повышает катаболизм липопротеинов; (4) фибраты или амфипатические карбоновые кислоты, которые снижают уровень липопротеина низкой плотности (ЛНП), улучшают уровни липопротеина высокой плотности (ЛВП) и TG, а также сокращают число инфарктов без смертельного исхода; и (5) активаторы фактора транскрипции LXR, который играет роль в удалении холестерина, например 22-гидроксихолестерина, или фиксированные комбинации, например эзетимиб плюс симвастатин; статин с секвестрантом желчных кислот (например, холестирамин, колестипол, колесевелам), фиксированная комбинация ниацин плюс статин (например, ниацин с ловастатином); или с другими агентами, снижающими концентрацию липидов, такими как этиловые эфиры омега-3 жирной кислоты (например, омакор). Кроме того, в качестве второго терапевтического агента может выступать один или несколько других ингибиторов ANGPTL3, а также ингибиторы других молекул, такие K3KANGPTL4, ANGPTL5, ANGPTL6 и пропротеинконвертаза субтилизина/кексина типа 9 (PCSK9), которые участвуют в липидном метаболизме, в частности в гомеостазе холестерина и/или триглицерида. К ингибиторам этих молекул относятся малые молекулы и антитела, которые специфически связывают эти молекулы и блокируют их активность.
[0031] В связанных осуществлениях вторым лекарственным препаратом может быть один или несколько противораковых препаратов, например препараты для химиотерапии, антиангиогенные препараты, препараты ингибиторы роста, цитотоксические препараты, агенты апоптоза и другие препараты, хорошо известные специалистам в области и применяемые для лечения рака или иных пролиферативных заболеваний или нарушений, а также другие лекарственные препараты, например анальгетики, противовоспалительные препараты, в том числе нестероидные противовоспалительные препараты (НСПВП), например ингибиторы Сох-2 и им подобные, с тем чтобы смягчить или устранить симптомы, сопровождающие первопричинный рак/опухоль.
[0032] В девятом аспекте изобретения приводятся способы, позволяющие нейтрализовать, ингибировать, блокировать, аннулировать, снизить активность hANGPTL3 или препятствовать ей с использованием одного или нескольких антител анти-hANGPTL3 или их антигенсвязывающих фрагментов настоящего изобретения. В одном осуществлении изобретения приводится способ лечения, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтического состава, содержащего одно или несколько антител анти-hANGPTL3 настоящего изобретения или их антигенсвязывающих фрагментов и, возможно, одно или несколько дополнительных лекарственных средств, описанных выше. Антитела анти-ANGPTL3 настоящего изобретения или их фрагменты могут выступать в качестве нейтрализующих антител или неблокирующих антител против ANGPTL3 или же их сочетаний.
[0033] В связанных осуществлениях изобретения приводится способ увеличения клиренса hANGPTL3 из кровообращения пациента, нуждающегося в таком лечении, каковой способ включает введение пациенту не менее двух антител анти-hANGPTL3 настоящего изобретения или их фрагментов, которые не конкурируют друг с другом за связывание с hANGPTL3 и, предпочтительно, не блокируют по крайней мере один из аспектов активности hANGPTL3 (то есть неблокирующие антитела). К упомянутому по крайней мере одному аспекту активности hANGPTL3 относится, среди прочего, ингибирование активности LPL, в том числе ангиогенеза, и пр. В одном из осуществлений сочетание не менее чем двух неблокирующих антител анти-hANGPTL3 или их фрагментов повышает клиренс hANGPTL3 из кровообращения не менее примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70% или примерно на 80% по сравнению с клиренсом без введения антител или фрагментов. Уровни hANGPTL3 в кровообращении могут измеряться по результатам анализов in vitro, хорошо известным специалистам в области, а также описанным в настоящем документе. В другом осуществлении сочетание не менее двух неблокирующих антител анти-hANGPTL3 включает пары последовательностей HCVR и LCVR (HCVR/LCVR) из последовательностей (i) SEQ ID №:82/90 и 180/188, соответственно; (ii) SEQ ID №:114/122 и 180/188, соответственно; (iii) SEQ ID №:82/90 и 18/26, соответственно; или (iv) SEQ ID №:114/122 и 18/26, соответственно.
[0034] К заболеваниям или нарушениям, которые поддаются лечению с помощью способов настоящего изобретения, относятся любые заболевания или состояния, при которых отмечается улучшение, смягчение, подавление или предупреждение, или снижение частоты по сравнению с состоянием без лечения антителами анти-hANGPTL3 (например, ANGPTL3-опосредованные заболевания или нарушения) за счет аннулирования, ингибирования, снижения активности ANGPTL3 или иного воздействия на нее. К примерам заболеваний или нарушений, которые поддаются лечению способами настоящего изобретения, среди прочих, относятся заболевания или нарушения, связанные с метаболизмом липидов, например гиперлипидемия, гиперлипопротеинемия и дислипидемия, в том числе атерогенная дислипидемия, диабетическая дислипидемия, гипертриглицеридемия, в том числе острая гипертриглицеридемия с TG>1000 мг/дл, гиперхолестеринемия, хиломикроенмия, смешанная дислипидемия (ожирение, метаболический синдром, диабет и пр.), липодистрофия, липоартрофия и им подобные, которые вызываются, например, пониженной активностью LPL и/или нарушениями LPL, пониженной активностью рецептора ЛНП (LDLR) и/или нарушениями рецептора ЛНП (например гомозиготная наследственная гиперхолестеринемия с LDLR-/-), изменениями АроС2, недостатком АроЕ, повышением АроВ, повышенной продукцией и/или пониженным выведением липопротеинов очень низкой плотности (ЛОНП), лечением определенными препаратами (например дислипидемия, вызванная лечением глюкокортикоидами), любой генетической предрасположенностью, диетой, образом жизни и пр. Способы настоящего изобретения могут также обеспечивать профилактику или лечение заболеваний или нарушений, связанных или вызванных гиперлипидемией, гиперлипопротеинемией и/или дислипидемией, включая, среди прочих, сердечнососудистые заболевания или нарушения, например атеросклероз, аневризма, гипертензия, стенокардия, инсульт, нарушения мозгового кровообращения, застойная сердечная недостаточность, ишемическая болезнь сердца, инфаркт миокарда, заболевания периферических сосудов и им подобные; острый панкреатит, неалкогольный стеатогепатит (NASH); нарушения содержания сахара в крови, например диабет, ожирение и им подобные.
[0035] К другим примерам заболеваний или нарушений, которые поддаются лечению способами настоящего изобретения, относятся рак/опухоли, а также неопухолевые связанные с ангиогенезом заболевания или нарушения, в том числе офтальмологические ангиогенные заболевания, такие как возрастная макулодистрофия, окклюзия центральной вены сетчатки или окклюзия ветки вены сетчатки, диабетическая ретинопатия, ретинопатия недоношенных и им подобные, воспалительные заболевания, например артрит, ревматоидный артрит (RA), псориаз и им подобные.
[0036] Другие осуществления станут очевидными при ознакомлении с приведенным ниже подробным описанием.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0037] На фиг.1 представлено выравнивание последовательностей пептидов 1-3, используемых в эксперименте связывания антитела анти-hANGPTL3 (пример 5) относительно соответствующих участков последовательности hANGPTL3 (то есть по остаткам с 30 до 70 SEQ ID №:161 или GenBank #NP_055310). Пептид 1 (контроль: пептид ANGPTL4; SEQ ID №:168); пептид 2 (пептид ANGPTL3; SEQ ID №:169); и пептид 3 (пептид ANGPTL3; SEQ ID №:170).
[0038] На фиг.2 приведены результаты связывания антитела анти-hANGPTL3 с N-терминальными суперспиральными пептидами hANGPTL3 (пептиды 2 и 3) или hANGPTL4 (пептид 1):  изотипический контроль; и ■: антитело H4H1276S.
изотипический контроль; и ■: антитело H4H1276S.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0039] Прежде чем приступить к подробному описанию настоящего изобретения, необходимо отметить, что настоящее изобретение не ограничивается конкретными способами и изложенными экспериментальными условиями, поскольку такие способы и условия могут меняться. Следует также понимать, что используемая в настоящем документе терминология предназначена исключительно для описания конкретных осуществлений и не носит ограничительного характера, поскольку охват настоящего изобретения ограничивается только прилагаемой формулой изобретения.
[0040] Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое общеизвестно рядовым специалистам в области, к которой относится настоящее изобретение. Хотя на практике или при проверке настоящего изобретения могут использоваться любые способы и материалы, аналогичные или идентичные описанным в настоящем документе, ниже приводится описание предпочтительных способов и материалов.
Определения
[0041] Термин «ангиопоэтин-подобный белок 3 человека», или «hANGPTL3», используемый в настоящем документе, означает hANGPTL3 человека с последовательностью нуклеиновой кислоты, показанной в SEQ ID №:162, и аминокислотную последовательность SEQ ID №:161, или его биологически активный фрагмент.
[0042] Используемый в настоящем документе термин «антитело» предназначен для обозначения молекул иммуноглобулина, составленных из четырех полипептидных цепей, при этом две тяжелые (Н) цепи и две легкие (L) цепи связываются друг с другом дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (HCVR) и константную область тяжелой цепи (СН; содержащую домены CH1, CH2 и CH3). Каждая легкая цепь содержит вариабельную область легкой цепи (LCVR) и константную область легкой цепи CL). Области HCVR и LCVR могут подразделяться на области гипервариабельности, которые называются определяющими комплементарность областями (CDR), перемежаемые областями с более высоким уровнем консервативности, называемыми остовными областями (FR). Каждая область HCVR и LCVR образована тремя CDR и четырьмя FR, расположенными от амино-терминального конца к карбокси-терминальному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4.
[0043] Также возможно замещение одного или нескольких остатков CDR или пропуск одной или нескольких CDR. В научной литературе описаны случаи, когда для связывания можно обойтись без одной или двух CDR. В работе Padlan et al. (1995 FASEB J. 9:133-139) анализировались контактные области между антителами и их антигенами на основании опубликованных кристаллических структур, и сделан вывод о том, что только примерно треть остатков CDR на самом деле вступает в контакт с антигеном. В этой работе также обнаружено множество антител, в которых одна или две CDR не содержат аминокислот, контактирующих с антигеном (см. также Vajdos et al. 2002 J Mol Biol 320:415-428).
[0044] Остатки CDR, не контактирующие с антигеном, можно определить на основании предыдущих исследований (например остатки Н60-Н65 в CDRH2 часто не требуются), по областям CDR Кабата, лежащих вне CDR Чотиа, с помощью молекулярного моделирования и(или) эмпирическим путем. Если CDR или остатки их пропущены, они обычно замещаются аминокислотами, занимающими соответствующее положение в другой последовательности человеческого антитела, или такими консенсусными последовательностями. Положения для замещения CDR и аминокислотами могут также выбираться эмпирически. Эмпирические замещения могут быть консервативными или неконсервативными.
[0045] Используемый в настоящем документе термин «антитело человека» предназначен для обозначения антител с вариабельной и константной областями, полученных из иммуноглобулиновых последовательностей зародышевых линий человека. Описываемые в данном изобретении моноклональные антитела (mAbs) могут включать аминокислотные остатки, не кодируемые иммуноглобулиновыми последовательностями зародышевых линий человека (например, мутации, вызванные случайным или сайт-специфичным мутагенезом in vitro или соматическими мутациями in vivo), например, в областях CDR, особенно в области CDR3. Однако используемый в настоящем документе термин «антитело человека» не подразумевает включения mAbs, в которых на последовательности FR человека привиты CDR последовательности, полученные из зародышевых линий другого вида млекопитающих, например мыши.
[0046] Полностью человеческие антитела анти-hANGPTL3, раскрываемые в настоящем документе, могут включать одно или несколько аминокислотных замещений, вставок и/или делеций в остовной области и/или CDR вариабельных доменов тяжелой и легкой цепи по сравнению с соответствующими эмбриональными линиями. Такие мутации можно легко выявить при сопоставлении аминокислотных последовательностей, раскрываемых в настоящем документе, с эмбриональными последовательностями, которые доступны, например, из открытых баз данных последовательностей антител. Настоящее изобретение включает антитела и их антигенсвязывающие фрагменты, которые получены из любой аминокислотной последовательности, раскрываемой в настоящем документе, где одна или несколько аминокислот в одной или нескольких остовных областях и/или CDR мутируют в соответствующий остаток (остатки) эмбриональной последовательности, из которой получено антитело, или в соответствующий остаток (остатки) другой человеческой эмбриональной последовательности, или с заменой консервативных аминокислот соответствующего эмбрионального остатка (остатков) (такие изменения последовательности в настоящем документе в совокупности называются «эмбриональными мутациями»). Опираясь на раскрываемые в настоящем документе последовательности вариабельных областей тяжелой и легкой цепи, специалист в данной области может без труда получить множество антител и антигенсвязывающих фрагментов, которые содержат одну или несколько отдельных ревертирующих эмбриональных мутаций или их сочетания. В некоторых осуществлениях все остатки остовной области и/или CDR в доменах VH и/или VL ревертивным образом мутированы до остатков, присутствующих в исходной эмбриональной последовательности, на основе которой было получено антитело. В других осуществлениях только определенные остатки подверглись обратной мутации до исходной эмбриональной последовательности, например только мутированные остатки, присутствующие в первых 8 аминокислотах FR1 или последних 8 аминокислотах FR4, или только мутированные остатки, присутствующие в CDR1, CDR2 или CDR3. В других осуществлениях один или несколько остатков остовной области и/или CDR мутировали в соответствующие остатки другой эмбриональной последовательности (то есть эмбриональной последовательности, которая отличалась от эмбриональной последовательности, из которой было изначально получено антитело). Кроме того, антитела настоящего изобретения могут содержать любую комбинацию двух или более эмбриональных мутаций в остовной области и/или CDR, например такие, где определенные индивидуальные остатки мутируют до соответствующих остатков определенной эмбриональной последовательности, тогда как ряд других остатков, которые отличаются от исходной эмбриональной последовательности, сохраняются или мутируют в соответствующие остатки другой эмбриональной последовательности. После получения антител и антигенсвязывающих фрагментов, которые содержат одну или несколько эмбриональных мутаций, их можно легко протестировать на наличие одного или нескольких искомых свойства, например улучшение специфичности связывания, повышение аффинности связывания, повышение или усиление антагонистических или агонистических биологических свойств (в зависимости от обстоятельств), снижение иммуногенности и пр. Антитела и антигенсвязывающие фрагменты, полученные таким общим способом, входят в сферу охвата настоящего изобретения.
[0047] Настоящее изобретение также включает антитела анти-ANGPTL3, содержащие варианты любых аминокислотных последовательностей HCVR, LCVR и/или CDR, раскрываемых в настоящем документе, которые имеют одной или несколько консервативных замещений. Например, настоящее изобретение включает антитела анти-ANGPTL3, имеющие аминокислотные последовательности HCVR, LCVR и/или CDR, например, с 10 или менее, 8 или менее, 6 или менее, 4 или менее, 2 или 1 консервативным аминокислотным замещением относительно любой аминокислотной последовательности HCVR, LCVR и/или CDR, раскрываемой в настоящем документе. В одном осуществлении HCVR содержит аминокислотную последовательность SEQ ID №:487 с 10 или менее консервативными аминокислотными замещениями. В еще одном осуществлении HCVR содержит аминокислотную последовательность SEQ ID №:487 с 8 или менее консервативными аминокислотными замещениями. В еще одном осуществлении HCVR содержит аминокислотную последовательность SEQ ID №:487 с 6 или менее консервативными аминокислотными замещениями. В еще одном осуществлении HCVR содержит аминокислотную последовательность SEQ ID №:487 с 4 или менее консервативными аминокислотными замещениями. В еще одном осуществлении HCVR содержит аминокислотную последовательность SEQ ID №:487 с 2 или 1 консервативным аминокислотным замещением. В одном осуществлении LCVR содержит аминокислотную последовательность SEQ ID №:44 с 10 или менее консервативными аминокислотными замещениями. В еще одном осуществлении LCVR содержит аминокислотную последовательность SEQ ID №:44 с 8 или менее консервативными аминокислотными замещениями. В еще одном осуществлении LCVR содержит аминокислотную последовательность SEQ ID №:44 с 6 или менее консервативными аминокислотными замещениями. В еще одном осуществлении LCVR содержит аминокислотную последовательность SEQ ID №:44 с 4 или менее консервативными аминокислотными замещениями. В еще одном осуществлении LCVR содержит аминокислотную последовательность SEQ ID №:44 с 2 или 1 консервативным аминокислотным замещением.
[0048] Если специально не оговорено иначе, термин «антитело», используемый в настоящем документе, следует относить к молекулам антител, содержащих две тяжелые цепи иммуноглобулина и две легкие цепи иммуноглобулина (то есть « молекулы полных антител»), а также их антигенсвязывающие фрагменты. Термин «антигенсвязывающая часть» антитела, «антигенсвязывающий фрагмент» антитела и им подобные, которые используются в настоящем документе, включает любые природные, получаемые ферментативным путем, синтетические или генетически сконструированные полипептиды или гликопротеины, которые специфически связываются с антигеном с образованием комплекса. Антигенсвязывающие фрагменты антитела могут быть получены, например, из полных молекул антител с использованием любых подходящих стандартных методик, например протеолитического расщепления или рекомбинантных генно-инженерных технологий, включающих манипуляции и экспрессию ДНК, кодирующей вариабельную и (возможно) константную области антитела. Такая ДНК известна и/или легкодоступна, например, из коммерческих источников, библиотек ДНК (в том числе, например, фаг-дисплей библиотек антител), или может быть синтезирована. Секвенирование и манипуляции с ДНК могут проводиться химическими методами или с использованием методик молекулярной биологии, например для организации одной или нескольких вариабельных и/или константных областей в подходящую конфигурацию, или для введения кодонов, образования цистеиновых остатков, модификации, добавления или удаления аминокислот и пр.
[0049] Среди множества примеров антигенсвязывающих фрагментов: (i) фрагменты Fab; (ii) фрагменты F(ab')2; (iii) фрагменты Fd; (iv) фрагменты Fv; (v) одноцепочечные молекулы Fv (scFv); (vi) фрагменты dAb; и (vii) минимальные распознающие компоненты, содержащие аминокислотные остатки, которые воспроизводят гипервариабельную область антитела (например, отдельную определяющую комплементарность область (CDR), например пептид CDR3), или же ограниченный пептид FR3-CDR3-FR4. Другие сконструированные молекулы, например домен-специфические антитела, однодоменные антитела, антитела с удаленным доменом, химерные антитела, антитела с CDR-вставкой, диатела, триатела, тетратела, мини-тела, нанотела (например, моновалентные нанотела, бивалентные нанотела и пр.), малые модульные иммунопрепараты (SMIP) и вариабельные области акулы IgNAR, также входят в сферу охвата используемого в настоящем документе выражения «антигенсвязывающий фрагмент». [0050] Антигенсвязывающий фрагмент антитела будет обычно содержать по крайней мере одну вариабельную область. Вариабельная область может иметь любой размер или аминокислотный состав и обычно будет содержать по крайней мере одну CDR, которая соседствует или находится внутри рамки с одной или несколькими остовными последовательностями. В антигенсвязывающих фрагментах, где домен vh связан с доменом VL, области VH и VL могут быть структурно организованы друг относительно друга любым подходящим образом. Например, вариабельная область может быть димерной и содержать димеры VH-VH, VH-VL или VL-VL. В альтернативном варианте антигенсвязывающий фрагмент антитела может содержать мономерный домен VH или VL.
[0051] В некоторых осуществлениях антигенсвязывающий фрагмент антитела может содержать по крайней мере одну вариабельную область, ковалентным образом связанную с по крайней мере одной константной областью. Среди множества примеров конфигураций вариабельной и констатнтой областей, которые обнаруживаются в антигенсвязывающем фрагменте антитела настоящего изобретения, можно перечислить: (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (х) VL-СН3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3; и (xiv) VL-CL. В любой конфигурации вариабельной и константной областей, в том числе в любом из перечисленных выше примеров конфигураций, вариабельная и константная области могут быть либо непосредственно связаны друг с другом, либо соединяться через полный или частичный шарнир, или линкер. Шарнирная область может содержать не менее 2 (например, 5, 10, 15, 20, 40, 60 или более) аминокислот, что обеспечивает гибкую или полугибкую связь между соседними вариабельными и/или константными областями в одной молекуле полипептида. Более того, антигенсвязывающий фрагмент антитела настоящего изобретения может содержать гомо- или гетеродимер (или иной мультимер) любой из конфигураций вариабельной и константной областей, перечисленных выше, в нековалентной связи друг с другом и/или с одним или несколькими мономерными областями VH или VL (например, посредством дисульфидной связи (связей)).
[0052] Как и в случае молекул полных антител, антигенсвязывающие фрагменты могут быть моноспецифическими или мультиспецифическими (например, биспецифическими). Мультиспецифический антигенсвязывающий фрагмент антитела будет обычно включать не менее двух различных вариабельных доменов, причем каждый из таких вариабельных доменов в состоянии специфически связываться с индивидуальным антигеном или другим эпитопом того же антигена. Любой формат мультиспецифического антитела, включая примеры форматов биспецифических антител, раскрываемые в настоящем изобретении, может быть адаптирован для использования в контексте антигенсвязывающего фрагмента антитела настоящего изобретения с применением стандартных методик, известных специалистам в области.
[0053] В некоторых осуществлениях антитело или фрагменты антитела настоящего изобретения могут быть конъюгированы с терапевтическим агентом («иммуноконъюгат»), например, цитотоксином, химиотерапевтическим препаратом, иммунодепрессантом или радиоактивным изотопом.
[0054] Термин «специфически связываются» или ему подобные означает, что антитело или его антигенсвязывающий фрагмент образует комплекс с антигеном, который сравнительно стабилен в физиологических условиях. Специфическое связывание может характеризоваться равновесной константой диссоциации (KD), равной приблизительно 1×10-6 М или менее (то есть меньшая KD обозначает более прочное связывание). Методы определения специфического связывания молекул известны специалистам в области и включают, например, равновесный диализ, поверхностный плазменный резонанс и пр. Изолированное антитело, которое специфическим образом связывает hANGPTL3, тем не менее может проявлять перекрестную реактивность к другим антигенам, например молекулам ANGPTL3 из других видов, например ANGPTL3 яванского макака, ANGPTL3 мыши, ANGPTL3 крысы и/или hANGPTL4 с аминокислотной последовательностью SEQ ID №:164. Кроме того, мультиспецифические антитела (например, биспецифические), которые связываются с hANGPTL3 и одним или несколькими дополнительными антигенами, тем не менее, рассматриваются как антитела, которые «специфически связывают» hANGPTL3 в соответствии с терминологией настоящего документа.
[0055] Используемый в настоящем документе термин «антитело высокой аффинности» относится к антителам, имеющим аффинность связывания с hANGPTL3, выражаемую через KD, приблизительно 2×10-9 М или менее, приблизительно 1,5×10-9 М или менее, приблизительно 1×10-9 М или менее, приблизительно 0,5×10-9 М или менее, приблизительно 0,25×10-9 М или менее, приблизительно 1×10-10 М или менее, или приблизительно 0,5×10-10 М или менее, как показывают результаты измерения методом поверхностного плазмонного резонанса, например BIACORE™, или результаты измерения аффинности в растворе методом иммуноферментного анализа (ELISA).
[0056] Используемый в настоящем документе термин «KD» предназначен для обозначения равновесной константы диссоциации конкретного взаимодействия антитело-антиген.
[0057] Под используемым в настоящем документе термином «медленно диссоциирующее», под «Koff"» или «kd» подразумевается антитело, комплекс которого с hANGPTL3 диссоциирует с константой скорости 4×10-3 сек-1 или ниже, 3×10-3 сек-1 или ниже, 2×10-3 сек-1 или ниже, 1×10-3 сек-1 или ниже, 1×10-4 сек-1 или ниже, по результатам измерения методом поверхностного плазмонного резонанса, например BIACORE™.
[0058] Под термином «константа внутренней аффинности», или «ka», подразумевается антитело, комплекс которого с hANGPTL3 ассоциирует с константой скорости 1×103 М-1 сек-1 или выше, по результатам измерения методом поверхностного плазменного резонанса, например BIACORE™.
[0059] Используемый в настоящем документе термин «изолированное антитело» предназначен для обозначения антитела, существенно свободного от других mAbs, обладающих иной антигенной специфичностью (например изолированное антитело, которое специфически связывает hANGPTL3, существенно свободно от mAbs, которые специфически связывают антигены, отличные от hANGPTL3). Изолированное антитело, которое специфически связывает hANGPTL3, тем не менее может проявлять перекрестную реактивность к другим антигенам, например молекулам ANGPTL3 из других видов, например яванского макака, мыши, крысы и/или к другим связанным белкам, например ANGPTL4 человека.
[0060] Используемый в настоящем документе термин «нейтрализующее», «блокирующее» или «аннулирующее» антитело (или антитело, которое «нейтрализует», «блокирует» или «аннулирует» функцию ANGPTL3) предназначен для обозначения антитела, связывание которого с ANGPTL3 приводит к непосредственному ингибированию как минимум одной биологической активности ANGPTL3, согласно оценке при помощи стандартных методов анализа in vitro, известных специалистам (см. примеры ниже). Термины «нейтрализовать», «ингибировать», «блокировать» и «аннулировать» могут использоваться равнозначно в настоящем документе. Термин «неблокирующее» антитело относится к антителу, связывание которого с ANGPTL3 напрямую не блокирует целевую активность ANGPTL3, что оценивается по стандартному анализу in vitro, но тем не менее может быть «интерферирующим» антителом, связывание которого с ANGPTL3 приводит к косвенному ингибированию, снижению, смягчению или другому воздействию по крайней мере на один аспект биологической активности ANGPTL3 in vivo, например за счет повышения клиренса ANGPTL3 из кровообращения. Клиренс ANGPTL3 из кровообращения может в особенности усиливаться за счет сочетания не менее, чем двух неблокирующих антител. Нейтрализация, ингибирование, аннулирование, сокращение, подавление или нарушение биологической активности ANGPTL3 может быть оценено путем измерения одного или более показателей биологической активности ANGPTL3 при помощи одного или нескольких стандартных методов анализа in vitro или in vivo, известных специалистам (см. примеры ниже).
[0061] Используемый в настоящем документе термин «поверхностный плазменный резонанс» относится к оптическому явлению, которое позволяет проводить анализ биоспецифических взаимодействий в реальном времени за счет детектирования изменений концентраций белка в биосенсорной матрице, например с помощью системы BIACORE™ (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.).
[0062] Термин «эпитоп» обозначает область антигена, в которой происходит связывание с антителом. Эпитопы могут быть структурными или функциональными. Функциональные эпитопы обычно представляют собой субпопуляцию структурных эпитопов и содержат такие остатки, которые непосредственно способствуют аффинности взаимодействия. Эпитопы также могут быть конформационными, то есть состоящими из разветвленных аминокислот. В ряде осуществлений эпитопы могут включать детерминанты, представляющие собой химически активные поверхностные группировки молекул, такие как аминокислоты, боковые цепи Сахаров, фосфорильные группы или сульфонильные группы, и в ряде осуществлений могут иметь специфические трехмерные структурные характеристики и(или) специфические зарядовые характеристики.
[0063] Термин «существенная идентичность» или «по существу идентичны» в отношении нуклеиновой кислоты или ее фрагмента означает, что при оптимальном сопоставлении с другой нуклеиновой кислотой (или ее комплементарной цепью) с соответствующими добавлениями или делениями наблюдается идентичность нуклеотидной последовательности не менее примерно 90% и более предпочтительно не менее 95%, 96%, 97%, 98% или 99% оснований нуклеотидов, что измеряется с помощью любого известного алгоритма идентичности последовательностей, например FASTA, BLAST или GAP, которые обсуждаются ниже.
[0064] Применяемый в отношении полипептидов термин «существенное сходство» или «по существу подобные» означает, что две пептидные последовательности при их оптимальном сопоставлении, например с помощью программ GAP или BESTFIT с учетом параметров по умолчанию вклада пропусков демонстрируют идентичность последовательностей не менее 90%, и еще более предпочтительно, не менее 95%, 98% или 99%. Предпочтительно положение неидентичных остатков отличается консервативным замещением аминокислот. «Консервативное замещение аминокислот» - это такое замещение, при котором один аминокислотный остаток замещается другим аминокислотным остатком, имеющим боковую цепь (группу R) с аналогичными химическими свойствами (например, заряд или гидрофобность). В общем случае консервативное замещение аминокислот не будет приводить к существенным изменениям функциональных свойств белка. В случае если две или более аминокислотные последовательности отличаются друг от друга консервативными замещениями, процент или степень аналогичности может корректироваться в сторону увеличения, с тем чтобы учесть консервативный характер замещения. Способы такой корректировки хорошо известны специалистам в данной области. См. например, Pearson (1994) Methods Mol. Biol. 24: 307-331. К примерам групп аминокислот, имеющих боковые цепи с аналогичными химическими свойствами, относятся 1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; 2) алифатические гидроксильные боковые цепи: серин и треонин; 3) боковые цепи с амидной группой: аспарагин и глутамин; 4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; 5) боковые цепи со свойствами основания: лизин, аргинин и гистидин; 6) боковые цепи со свойствами кислоты: аспартат и глутамат; и 7) серосодержащие боковые цепи: цистеин и метионин. Предпочтительными группами для консервативного замещения аминокислот являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин. В альтернативном варианте консервативное замещение представляет собой любое изменение, приводящее к положительному значению в логарифмической матрице правдоподобия РАМ250, описанной в работе Gonnet et al. (1992) Science 256: 1443 45. «Умеренно консервативным» замещением называется любое изменение, приводящее к неотрицательному значению в логарифмической матрице правдоподобия РАМ250.
[0065] Подобие последовательностей полипептидов обычно определяют с помощью программного обеспечения для анализа последовательности. Программа для анализа белков сопоставляет подобные последовательности с использованием показателей аналогичности, задаваемых для различных замещений, делеций и других модификаций, в том числе для консервативного замещения аминокислот. Например, программное обеспечение GCG содержит такие программы как GAP и BESTFIT, которые могут использоваться с параметрами по умолчанию для определения гомологии или идентичности последовательности между близкородственными полипептидами, например гомологичными полипептидами различных видов организмов или между исходным белком и его мутантом. См., например, GCG Вер. 6.1. Полипептидные последовательности могут также сопоставляться с помощью FASTA - программы, включенной в GCG Вер. 6.1, - с использованием параметров по умолчанию или рекомендуемых параметров. FASTA (например, FASTA2 и FASTA3) обеспечивает сопоставление и определяет процент идентичности последовательностей в областях с наибольшим перекрыванием между заданной и исследуемой последовательностями (см. выше Pearson (2000)). Другим предпочтительным алгоритмом сопоставления последовательности настоящего изобретения с базой данных, содержащей большое число последовательностей различных организмов, является компьютерная программа BLAST, особенно BLASTP или TBLASTN, которая использует параметры по умолчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215: 403 410 и Altschul et al. (1997) Nucleic Acids Res. 25:3389 402.
[0066] Определение «терапевтически эффективное количество» означает количество, которое оказывает желаемый эффект воздействия, для достижения которого оно вводится. Точное количество будет зависеть от целей лечения, от возраста и размеров объекта, получающего лечение, способа введения и пр., и может быть установлено специалистом в области на основе известных методик (см., например, Lloyd (1999) The Art, Science and Technology of Pharmaceutical Compounding).
Получение антител человека
[0067] Способы формирования человеческих антител у трансгенных мышей хорошо известны специалистам в области. Любые подобные известные способы могут использоваться в контексте настоящего изобретения для приготовления человеческих антител, которые специфически связываются cANGPTL3.
[0068] С помощью технологии VELOCIMMUNE™ или другого известного способа получения моноклональных антител первоначально получали химерные антитела с высокой аффинностью к ANGPTL3, имеющие вариабельную область человека и константную область мыши. Как описано в разделе примеров ниже, антитела характеризуются и выбираются по нужным свойствам, в том числе по аффинности, селективности, эпитопу и т.п.
[0069] В общем случае антитела настоящего изобретения обладают высокой аффинностью, как правило, имея kd от примерно 10-12 М до примерно 10-9 М, если ее измерять по связыванию с антигеном, иммобилизованным на твердой подложке или анализируемым в растворе. Константные области мыши заменяются желаемыми константными областями человека, с тем чтобы получить полные антитела человека, описанные в настоящем изобретении, например исходным IgG1 или IgG4 или модифицированным IgG1 или IgG4. Выбранная константная область может меняться в зависимости от конкретного осуществления, а свойства высокой аффинности антиген-связывания и необходимая специфичность антител определяются вариабельной областью.
Эпитопное картирование и связанные с ним технологии
[0070] Для скрининга антител, которые связываются с конкретным эпитопом, можно проводить стандартный эпитоп перекрестный конкурентный анализ, подобно описанному в Antibodies, Harlow and Lane (Cold Spring Harbor Press, Cold Spring Harb., NY). К другим методам относятся получение мутантов сканированием аланином, пептидный блоттинг (Reineke (2004) Methods Mol Biol 248:443-63), и анализ расщепления пептидов. Кроме того, могут использоваться такие методы, как вырезание эпитопа, экстракция эпитопа и химическая модификация антигенов (Tomer (2000) Protein Science: 487-496).
[0071] Используемый в настоящем документе термин «эпитоп» относится к сайту антигена, на который реагируют В и(или) Т клетки. Эпитопы В-клеток могут быть образованы как непрерывной последовательностью аминокислот, так и разрозненными аминокислотами, оказавшимися рядом в результате фолдинга белка в третичную структуру. Эпитопы, образованные непрерывной последовательностью аминокислот, как правило, сохраняются при воздействии денатурирующих растворителей, тогда как эпитопы, возникшие в результате фолдинга белка в третичную структуру, разрушаются при обработке денатурирующими растворителями. Эпитоп, как правило, формируется не менее чем тремя, а обычно не менее чем пятью или 8-10 аминокислотами во вполне конкретной пространственной конформации.
[0072] Определение профиля с помощью модификации (MAP), также известное как определение профиля антител на основе структуры антигена (ASAP) представляет собой метод классификации большого числа моноклональных антител (mAbs) к одному и тому же антигену в соответствии со сходствами профиля связывания каждого антитела с химически или энзиматически модифицированными антигенными поверхностями (US 2004/0101920). Каждая категория может отражать уникальный эпитоп, который либо четко отличается от эпитопа, представленного в любой другой категории, либо частично перекрывается с ним. Подобная технология позволяет быстро отделять генетически идентичные mAbs, так что их идентификация может быть сконцентрирована на генетически отличающихся mAbs. В случае применения для скрининга гибридомы, MAP может способствовать идентификации редких клонов гибридомы, производящих mAbs с нужными характеристиками. MAP может использоваться для сортировки mAbs анти-ANGPTL3 настоящего изобретения в группы mAbs, связывающих различные эпитопы.
[0073] ANGPTL3 содержит амино-терминальный суперспиральный домен и карбоксил-терминальный фибриногеноподобный домен (FD), причем протеин ANGPTL3 формирует олигомер в отсутствие межмолекулярных дисульфидных связей (Ge et al., 2005, J Lipid Res 46:1484-1490). Известно, что N-терминальный суперспиральный домен играет важную роль в ингибировании активности LPL (Опо et al., 2003, J Biol Chem 278:41804-41809). Таким образом, в некоторых осуществлениях антитело анти-hANGPTL3 или антигенсвязывающий фрагмент антитела связывается с эпитопом, расположенным в N-терминальном суперспиральном домене (остатки 17-209) hANGPTL3 (SEQ ID №:161), и нейтрализует как минимум одну из функций hANGPTL3 (например ингибирование активности LPL). В еще одном осуществлении антитело aHTn-hANGPTL3 или его антигенсвязывающий фрагмент связывается с эпитопом, расположенным в N-терминальном суперспиральном домене hANGPTL3, и нейтрализует как минимум одну из функций hANGPTL3, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170. В одном осуществлении антитело или его фрагмент специфически связывается с эпитопом в остатках 17-200, 17-100, 17-70, 17-65, 17-60, 17-57, 17-55, 17-50, 17-45, 17-40 или 17 - 35 hANGPTL-3 (SEQ ID №:161), может быть, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170. В еще одном осуществлении антитело или его фрагмент специфически связывается с эпитопом в остатках 40-200, 40-100, 40-70, 50-200, 50-100, 50-70, 58-200, 58-100, 58-70, 58-68 или 61-66 (известным как «гепарин-связывающий мотив») DANGPTL3 (SEQ ID №:161), может быть, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170. В некоторых осуществлениях антитело или его фрагмент связывается с эпитопом, возможно, при участии более чем одного пронумерованного эпитопа или остатка в N-терминальной суперспиральной области hANGPTL3, может быть, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170.
[0074] В других осуществлениях антитело hANGPTL3 или его фрагмент связывается с одним или несколькими фрагментами hANGPTL3, например с фрагментом не менее чем 5 остатков, не менее чем 7 остатков, не менее чем 10 остатков, не менее чем 20 остатков, не менее чем 30 остатков, не менее чем 50 остатков, не менее чем 70 остатков, не менее чем 100 остатков, не менее чем 150 остатков или не менее чем 200 остатков hANGPTL3 (SEQ ID №:161), может быть, при условии, что антитело или его фрагмент не связывается с пептидом ANGPTL3 из SEQ ID №:170.
[0075] Настоящее изобретение включает антитела hANGPTL3, которые связываются с тем же эпитопом, что и любые из конкретных примеров антител, описанных в настоящем документе. Аналогичным образом настоящее изобретение также включает антитела анти-hANGPTL3, которые конкурируют за связывание с hANGPTL3 или с фрагментом hANGPTL3 с любыми из конкретных примеров антител, описанных в настоящем документе.
[0076] Легко установить, связывается ли то или иное антитело с тем же эпитопом, что и контрольное антитело анти-hANGPTL3, или конкурирует за связывание с ним, воспользовавшись стандартными методами, известными специалистам в области. Например, чтобы определить, связывается ли испытуемое антитело с тем же эпитопом, что и контрольное антитело анти-hANGPTL3 настоящего изобретения, контрольному антителу позволяют связаться с белком или пептидом hANGPTL3 в условиях насыщения. Затем оценивается способность испытуемого антитела связываться с молекулой hANGPTL3. Если испытуемое антитело в состоянии связываться с hANGPTL3 после связывания в условиях насыщения с контрольным антителом анти-hANGPTL3, можно сделать вывод о том, что испытуемое антитело связывается с эпитопом отличным от контрольного антитела анти-hANGPTL3. С другой стороны, если испытуемое антитело не в состоянии связываться с молекулой hANGPTL3 после связывания в условиях насыщения с контрольным антителом анти-hANGPTL3, тогда испытуемое антитело может связываться с тем же эпитопом, что и эпитоп, связанный с контрольным антителом анти-hANGPTL-3 настоящего изобретения.
[0077] Чтобы определить, конкурирует ли антитело при связывании с контрольным антителом анти-hANGPTL3, представленная выше методология связывания использовалась в двух вариантах: В первом случае контрольному антителу позволяли связываться с молекулой hANGPTL3 в условиях насыщения с последующей оценкой связывания контрольного антитела с молекулой hANGPTL3. Во втором случае испытуемому антителу давали связываться с молекулой hANGPTL3 в условиях насыщения с последующей оценкой связывания контрольного антитела с молекулой ANGPTL3. Если в обоих случаях только первое (насыщающее) антитело в состоянии связываться с молекулой ANGPTL3, то можно заключить, что испытуемое антитело и контрольное антитело конкурируют за связывание с hANGPTL3. Рядовому специалисту в области будет очевидно, что антитело, которое конкурирует за связывание с контрольным антителом, необязательно будет связываться с тем же эпитопом, что и контрольное антитело, но может стерически блокировать связывание контрольного антитела посредством связывания с перекрывающимся или соседствующим эпитопом.
[0078] Два антитела связываются с одним и тем же эпитопом, если каждое конкурентно ингибирует (блокирует) связывание другого антитела с антигеном. То есть 1-, 5-, 10-, 20-или 100-кратный избыток одного антитела ингибирует связывание другого не менее чем на 50%, но предпочтительно, на 75%, 90% или даже 99% по результатам анализа конкурентного связывания (см., например, Junghans et al., Cancer Res, 1990:50:1495-1502). В качестве альтернативы, два антитела имеют один и тот же эпитоп, если по существу все аминокислотные мутации в антигене, которые снижают или блокируют связывание одного антитела, также снижают или блокируют связывание другого. Два антитела имеют перекрывающиеся эпитопы, если некоторые аминокислотные мутации, которые снижают или блокируют связывание одного антитела, также снижают или блокируют связывание другого.
[0079] Дополнительные стандартные эксперименты (например пептидная мутация или анализ связывания) можно провести, чтобы подтвердить, вызвано ли, на самом деле, наблюдаемое отсутствие связывания испытуемого антитела со связыванием того же эпитопа, что и для контрольного антитела, или же стерическое блокирование (или иное явление) определяет отсутствие наблюдаемого связывания. Эксперименты такого рода могут проводиться с использованием ELISA, RIA, поверхностного плазменного резонанса, проточной цитометрии или любого другого количественного или качественного анализа связывания антител, доступного специалистам в области.
Иммуноконъюгаты
[0080] В сферу охвата настоящего изобретения входит моноклональное антитело анти-ANGPTL3 человека, конъюгированное с терапевтическим агентом («иммуноконъюгат»), например цитотоксином, химиотерапевтический препарат, иммунодепрессант или радиоактивный изотоп. К цитотоксическим агентам относятся любые вещества, которые оказывают разрушительное воздействие на клетки. Примеры пригодных для применения цитотоксических агентов и химиотерапевтических средств для образования иммуноконъюгатов известны специалистам в области, см., например, WO 05/103081.
Биспецифичность
[0081] Антитела настоящего изобретения могут быть моноспецифическими, биспецифическими или мультиспецифическими. Мультиспецифические mAbs могут быть специфичны по отношению к различным эпитопам одного целевого полипептида или могут содержать антиген-связывающие домены, специфичные по отношению к нескольким целевым полипептидам. См., например, Tutt et al. (1991) J. Immunol. 147:60-69. mAbs анти-hANGPTLS человека могут быть связаны с другой функциональной молекулой или экспрессироваться одновременно с ней, например с другим пептидом или белком. Например, антитело или его фрагмент могут быть функционально связаны (например, химической связью, генетическим слиянием, нековалентной ассоциацией или иным образом) с одной или несколькими молекулярными структурами, например с другим антителом или фрагментом антитела, с образованием биспецифичного или мультиспецифичного антитела с дополнительной специфичностью связывания.
[0082] Примером формата биспецифического антитела, которое может использоваться в контексте настоящего изобретения, является использование первого домена иммуноглобулина (Ig) CH3 и второго домена Ig CH3, где первый и второй домены Ig CH3 отличаются друг от друга по крайней мере одной аминокислотой и где такое различие на по крайней мере одну аминокислоту уменьшает связывание биспецифического антитела с белком А по сравнению с биспецифическим антителом, в котором такое аминокислотное различие отсутствует. В одном из осуществлений первый домен Ig CH3 связывается с белком А, а второй домен Ig CH3 содержит мутацию, которая уменьшает или блокирует связывание белка А, например модификацию H95R (по номенклатуре экзонов IMGT; H435R по номенклатуре ЕС). Второй CH3 может также содержать модификацию Y96F (по IMGT; Y436F по ЕС). Во втором модуле CH3 могут присутствовать дополнительные модификации: D16E, L18M, N44S, K52N, V57M и V82I (по IMGT; D356E, L358M, N384S, K392N, V397M и V422I по ЕС) в случае антител lgG1; N44S, K52N и V82I (IMGT; N384S, K392N и V422I по ЕС) в случае антител lgG2; и Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (по IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I по ЕС) в случае в случае антител lgG4. Вариации по формату биспецифических антител, описанные выше, относятся к сфере охвата настоящего изобретения.
Биоэквиваленты
[0083] Антитела анти-hANGPTL3 и фрагменты антител настоящего изобретения включают белки, содержащие аминокислотные последовательности, которые отличаются от аминокислотных последовательностей, имеющихся в описанных mAb, но сохраняют способность связывать ANGPTL3 человека. Такие вариантные mAb и фрагменты антител содержат одно или несколько добавлений, делеций или замещений аминокислот, если сопоставить с материнской последовательностью, но проявляют биологическую активность, которая в значительной мере эквивалентна описанной для mAbs. Аналогичным образом, последовательности ДНК, кодирующие антитела анти-hANGPTL3 настоящего изобретения, включают последовательности, которые содержат одно или несколько добавлений, делеций или замещений нуклеотидов, если сопоставить с раскрываемой последовательностью, однако они кодируют антитело анти-hANGPTL3 или фрагмент антитела, которые в значительной мере биоэквивалентны антителу анти-hANGPTL3 или фрагменту антитела настоящего изобретения. Примеры таких вариантных аминокислотных последовательностей и последовательностей ДНК обсуждаются выше.
[0084] Два антигенсвязывающих белка или антитела считаются биоэквивалентными, если, например, они являются фармацевтическими эквивалентами или фармацевтическими альтернативами, для которых скорости и степень абсорбции не проявляют существенных различий при введении в одинаковых молярных дозах в аналогичных экспериментальных условиях, как при разовой дозировке, так и в многократных дозах. Некоторые антитела будут считаться эквивалентными или фармацевтическими альтернативами, если они эквивалентны по степени своей абсорбции, но не по скорости такой абсорбции, но тем не менее могут рассматриваться как биоэквивалентные, поскольку такие различия в скорости абсорбции вносятся намеренно и отражены на маркировке, не являются существенными для достижения эффективных концентраций лекарства в организме при, например, периодическом применении и считаются незначительными с медицинской точки зрения для конкретного исследуемого лекарственного препарата. В одном осуществлении два антигенсвязывающих белка являются биоэквивалентными, если для них отсутствуют значимые клинические различия в плане безопасности, чистоты и активности воздействия.
[0085] В одном осуществлении два антигенсвязывающих белка являются биоэквивалентными, если пациента можно переводить один или несколько раз с контрольного продукта на биологический продукт и обратно без ожидаемого нарастания риска побочных эффектов, в том числе клинических значимых изменений в иммуногенности или снижения эффективности, по сравнению с продолжением терапии без такого перевода.
[0086] В одном из осуществлений два антигенсвязывающих белка являются биоэквивалентными, если они оба действуют по одинаковому механизму или механизмам действия при условии или условиях применения в той мере, в которой такие механизмы известны.
[0087] Биоэквивалентность может быть продемонстрирована и методиками in vivo и in vitro. К методам измерения биоэквивалентности относятся, например, (а) испытания in vivo на человеке или других млекопитающих, при которых концентрация антитела или его метаболитов измеряется в крови, плазме, сыворотке или другой биологической жидкости в зависимости от времени; (b) испытания in vitro, которые коррелированы сданными биодоступности для человека in vivo и с обоснованной степенью достоверности предсказывают их; (с) испытания in vivo на человеке или других млекопитающих, в которых соответствующий острый фармакологический эффект антитела (или его мишени) измеряются в зависимости от времени; и (d) строго контролируемые клинические испытания, в ходе которых устанавливается безопасность, эффективность воздействия, биодоступность или биоэквивалентность антитела.
[0088] Биоэквивалентные варианты антител анти-hANGPTL3 настоящего изобретения могут конструироваться, например, посредством введения различных замещений остатков или последовательностей, или делеций терминальных или внутренних остатков или последовательностей, не нужных для биологической активности. Например, остатки цистеина, не имеющие существенного значения для биологической активности, могут удаляться или замещаться другими аминокислотами, чтобы избежать образования ненужных или неправильных внутримолекулярных дисульфидных мостиков в ходе ренатурации.
Терапевтическое применение и составы препаратов
[0089] В изобретении приводятся терапевтические препараты, включающие антитела анти-hANGPTLS или их антиген-связывающие фрагменты, входящие в сферу охвата настоящего изобретения, и терапевтические методы их применения. Введение терапевтических препаратов в соответствии с настоящим изобретением будет осуществляться в подходящих носителях, наполнителях и прочих веществах, которые включаются в состав препаратов, чтобы обеспечить более эффективный перенос, доставку, переносимость и пр. Множество подходящих составов можно найти в формуляре, известном всем специалистам в области фармацевтической химии: Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA. К таким препаратам относятся, например, порошки, пасты, мази, желе, воски, масла, липиды, липид-содержащие (катионные или анионные) везикулы (например, LIPOFECTIN™), конъюгаты ДНК, безводные абсорбционные пасты, эмульсии масла в воде и воды в масле, эмульсии Carbowax (полиэтиленгликоли различного молекулярного веса), полутвердые гели и полутвердые смеси, содержащие Carbowax. См. также в Powell et al. "Compendium ofexcipients for parenteral formulations" PDA (1998) J Pharm Sci Technol. 52:238-311.
[0090] Доза может меняться в зависимости от возраста и веса пациента, получающего лечение, заболевания, целей лечения, условий, способа введения и пр. При использовании антитела настоящего изобретения для лечения различных болезней и заболеваний, прямо или косвенно связанных cANGPTL3, включая гиперхолестеринемию, расстройства, связанные с липопротеином низкой плотности (ЛНП) и аполипопротеином В, и нарушения липидного метаболизма и т.п., у взрослых пациентов целесообразно вводить внутривенно или подкожно антитело настоящего изобретения в разовой дозе примерно от 0,01 до 20 мг на кг массы тела, более предпочтительно примерно от 0,02 до 7 мг, примерно от 0,03 до 5 мг, или примерно от 0,05 до 3 мг на кг массы тела. В зависимости от тяжести заболевания можно корректировать частоту и продолжительность лечения. В некоторых осуществлениях антитело или антигенсвязывающий фрагмент антитела настоящего изобретения могут вводиться в начальной дозе от не менее 0,1 мг до приблизительно 800 мг, от 1 до приблизительно 500 мг, от 5 до приблизительно 300 мг или от 10 до приблизительно 200 мг, до приблизительно 100 мг или до приблизительно 50 мг.В некоторых осуществлениях после первоначальной дозы может следовать введение еще одной или множества последующих доз антитела или его антигенсвязывающего фрагмента в количествах, которые могут быть совпадать или быть меньше первоначальной дозы, при этом такие последующие дозы разделены по времени на период не менее 1 дня до 3 дней; не менее одной недели, не менее 2 недель; не менее 3 недель; не менее 4 недель; не менее 5 недель; не менее 6 недель; не менее 7 недель; не менее 8 недель; не менее 9 недель; не менее 10 недель; не менее 12 недель; или не менее 14 недель.
[0091] Известны различные системы доставки, и они могут использоваться для введения фармацевтического состава настоящего изобретения, например инкапсуляция в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать мутантные вирусы, опосредованный рецепторами эндоцитоз (см., например, Wu et al. (1987) J. Biol. Chem. 262:4429-4432). К методам введения, среди прочих, относятся чрескожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный и пероральный. Препарат может вводиться любым подходящим способом, например вливанием или болюсной инъекцией, абсорбцией через эпиталиальные или кожно-слизистые оболочки (например, слизистую ротовой полости, слизистую прямой кишки и кишечника и пр.), и может применяться совместно с другими биологически-активными агентами. Введение может быть системным или локальным.
[0092] Фармацевтический состав может также доставляться в везикуле, в частности в липосоме (см. Langer (1990) Science 249:1527-1533; Treat et al. (1989) в Liposomes in the Therapy of Infectious Disease and Cancer, Lopez Berestein and Fidler (eds.), Liss, New York, cc.353-365; Lopez-Berestein, там же, cc.317-327; см. в целом там же).
[0093] В определенных ситуациях фармацевтический состав может доставляться в системе контролируемого высвобождения. В одном из осуществлений может использоваться насос (см. Langer; Sefton (1987) CRC Crit. Ref. Biomed. Eng. 14:201). В другом осуществлении могут использоваться полимерные материалы; см. Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974). В еще одном осуществлении система контролируемого высвобождения может располагаться в непосредственной близости от цели препарата, а потому потребуется лишь малая доля от системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, vol.2, pp.115-138, 1984).
[0094] К инъекционным препаратам могут относиться формы дозировки для внутривенных, подкожных, чрескожных и внутримышечных инъекций, капельных вливаний и пр. Такие инъекционные препараты можно приготовить с помощью известных методов. Например, инъекционные препараты можно приготовить, в частности, посредством растворения, суспендирования или эмульгирования описанного выше антитела или его соли в стерильной водной среде или в масляной среде, которые обычно применяются для инъекций. В качестве водной среды для инъекций предлагаются, например, физиологический раствор, изотонический раствор, содержащий глюкозу, и другие вспомогательные вещества и пр., которые могут использоваться в сочетании с подходящим солюбилизирующим агентом, например спиртом (в частности, этанолом), многоосновным спиртом (например, пропиленгликолем, полиэтиленгликолем), неионогенным поверхностно-активным соединением [например, полисорбатом 80, НСО-50 (аддукт полиоксиэтилена (50 моль) и гидрогенизированного касторового масла] и пр. В качестве масляной среды используются, например, кунжутное масло, соевое масло и пр., которые могут применяться в сочетании с солюбилизирующим агентом, например бензилбензоатом, бензиловым спиртом и пр. Приготовленный таким образом препарат для инъекций предпочтительно фасовать в подходящие ампулы. Фармацевтический состав настоящего изобретения может вводиться подкожно или внутривенно с помощью стандартной иглы и шприца. Кроме того, что касается подкожного введения, в случае применения фармацевтического состава настоящего изобретения можно использовать шприц-ручку. Такой шприц-ручка может быть многоразового или одноразового использования. В многоразовом шприце-ручке обычно используется сменный картридж, который содержит фармацевтический состав. После того как весь фармацевтический состав внутри картриджа был введен, и картридж пуст, отработанный картридж можно легко выбросить и заменить его на новый картридж, в котором содержится фармацевтический состав. После этого шприц-ручка может использоваться повторно. В разовом шприце-ручке сменный картридж не предусмотрен. Напротив, разовый шприц-ручка поставляется уже заполненным фармацевтическим составом, который помещается в резервуаре внутри устройства. После того как в резервуаре не остается фармацевтического состава, все устройство выбрасывают.
[0095] Для подкожного введения фармацевтического состава настоящего изобретения могут применяться самые различные конструкции многоразовых шприцов-ручек и устройств для автоматической инъекции. Примеры включают, без ограничения, AUTOPEN™ (Owen Mumford, Inc., Woodstock, UK), DISETRONIC™ pen (Disetronic Medical Systems, Burghdorf, Switzerland), HUMALOG MIX 75/25™ pen, HUMALOG™ pen, HUMALIN 70/30™ pen (Eli Lilly and Co., Indianapolis, IN), NOVOPEN™ I, II and III (Novo Nordisk, Copenhagen, Denmark), NOVOPEN JUNIOR™ (Novo Nordisk, Copenhagen, Denmark), BD™ pen (Becton Dickinson, Franklin Lakes, NJ), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™, and OPTICLIK™ (sanofi-aventis, Frankfurt, Germany). К примерам разовых шприцов-ручек, которые могут применяться для подкожного введения фармацевтического состава настоящего изобретения, среди прочих, относятся шприц-ручка SOLOSTAR™ (sanoff-aventis), FLEXPEN™ (Novo Nordisk) и KWIKPEN™ (Eli Lilly).
[0096] Фармацевтические составы для перорального или парентерального введения, описанные выше, предпочтительно готовить в лекарственных формах с разовой дозой, подбираемой в соответствии с дозировкой активных ингредиентов. К таким лекарственным формам с разовой дозой относятся, например, таблетки, пилюли, капсулы, инъекции (ампулы), суппозитории и пр. Количество указанного антитела, содержащегося в разовой дозе, обычно составляет от 0,1 до 800 мг на лекарственную форму; особенно в виде инъекции предпочтительно, чтобы количество указанного антитела составляло примерно от 1 до примерно 500 мг, примерно от 5 до примерно 300 мг, примерно от 8 до примерно 200 мг и примерно от 10 до примерно 100 мг в случае других лекарственных форм.
Комбинированная терапия
[0097] В изобретении также приводятся терапевтические способы лечения заболеваний или нарушений, которые прямо или косвенно связаны с hANGPTL3, посредством введения антитела hANGPTL3 настоящего изобретения или его фрагмента в сочетании одним или несколькими терапевтическими агентами. В качестве дополнительного терапевтического агента может выступать один или несколько агентов, которые с положительным эффектом сочетаются с одним или несколькими антителами или фрагментами антитела настоящего изобретения, включая ингибиторы редуктазы HMG-СоА, например церовастатин, аторвастатин, симвастатин, питавастатин, розувастатин, флувастатин, ловастатин, правастатин и им подобные; ниацин; различные фибраты, например фенофибрат, безафибрат, ципрофибрат, клофибрат, гемфиброзил и им подобные; активаторы фактора транскрипции LXR и им подобные. Кроме того, антитело hANGPTL3 или фрагмент антитела настоящего изобретения может вводиться одновременно с другими ингибиторами ANGPTL3, а также ингибиторами других молекул, такими как ANGPTL4, ANGPTL5, ANGPTL6 и пропротеинконвертаза субтилизина/кексина типа 9 (PCSK9), которые участвуют в липидном метаболизме, в частности в гомеостазе холестерина и/или триглицерида. К ингибиторам этих молекул относятся малые молекулы и антитела, которые специфически связывают эти молекулы и блокируют их активность см., например, антитела анти-РС8К9, раскрываемой в патенте U.S. 2010/0166768 А1).
[0098] Кроме того, дополнительными терапевтическими агентами могут быть один или несколько противораковых агентов, например препараты химиотерапии, антиангиогенные препараты, препараты ингибиторы роста, цитотоксические препараты, агенты апоптоза и другие препараты, хорошо известные специалистам в области, применяемые для лечения рака или других пролиферативных заболеваний или нарушений. К примерам противораковых агентов относятся, среди прочих, антимитотический агент, например доцетаксел, паклитаксел и им подобные; соединение для химиотерапии на основе платины, например цисплатин, карбоплатин, ипроплатин, оксалиплатин и им подобные; или иной обычный цитотоксический агент, например 5-фторурацил, капецитабин, иринотекан, лейковорин, гемцитабин и им подобные; антиангиогенные агенты, в том числе антагонисты эндотелиального фактора роста сосудов (VEGF), такие как антитела анти-VEGF, например бевацизумаб (AVASTIN®, Genentech) и блокаторы VEGF на основе рецепторов, например «ловушка VEGF», описанная в патенте США №7,070,959, антагонисты дельта-подобного лиганда 4 (DII4), например антитела анти-DH, описанные в патентной заявке США №2008/0181899, и слитый белок, содержащий внеклеточный домен DII4, например DII4-Fc, описанный в патентной заявке США №2008/0107648; ингибиторы рецепторных тирозинкиназ и/или ангиогенеза, в том числе сорафениб (NEXAVAR® производства Bayer Pharmaceuticals Corp.), сунитиниб (SUTENT® производства Pfizer), пазопаниб (VOTRIENT™ производства GlaxoSmithKline), тоцераниб (PALLADIA™ производства Pfizer), вандетаниб (ZACTIMA™ производства AstraZeneca), цедираниб (RECENTIN® производства AstraZeneca), регорафениб (BAY 73-4506 производства Bayer), акситиниб (AG013736 by Pfizer), лестауртиниб (СЕР-701 by Cephalon), эрлотиниб (TARCEVA® производства Genentech), гефитиниб (IRESSA™ производства AstraZeneca), BIBW 2992 (TOVOK™ производства Boehringer Ingelheim), лапатиниб (TYKERB® производства GlaxoSmithKline), нератиниб (HKI-272 производства Wyeth/Pfizer) и им подобные и фармацевтически приемлемые соли, кислоты или производные любых из перечисленных выше агентов. Кроме того, и другие терапевтические агенты, например анальгетики, противовоспалительные препараты, в том числе нестероидные противовоспалительные препараты (НПВП), такие как ингибиторы Сох-2, и им подобные, могут также вводиться в сочетании с антителом hANGPTL3 настоящего изобретения или его фрагментом, так чтобы смягчить и/или облегчить симптомы, сопровождающие первопричинный рак/опухоль.
[0099] Антитело hANGPTL3 настоящего изобретения или его фрагмент и дополнительный терапевтический агент (агенты) могут вводиться вместе или по отдельности. При использовании раздельных дозировок препаратов антитело настоящего изобретения или его фрагмент и дополнительные агенты могут вводиться одновременно или раздельно с разбивкой по времени, например последовательно, в нужной очередности.
Диагностическое использование антител
[0100] Антитела анти-ANGPTL3 настоящего изобретения могут также использоваться для выявления и/или оценки ANGPTL3 в пробе, например для целей диагностики. Например, анти-ANGPTL3 Ab или его фрагмент могут использоваться для диагностики расстройства или заболевания, характеризующегося аберрантной экспрессией (то есть сверхэкспрессией, недостаточной экспрессией, отсутствием экспрессии и пр.) ANGPTL3. Примеры диагностических анализов на ANGPTL3 могут включать, например, взаимодействие пробы, взятой у пациента, с анти-ANGPTL3 Ab настоящего изобретения, где такое антитело анти-ANGPTL3 мечено детектируемой меткой или репортерной молекулой, или используется для селективного захвата и выделения белка ANGPTL3 из проб пациента. В альтернативном варианте немеченое анти-ANGPTL3 Ab может использоваться в диагностике в сочетании со вспомогательным антителом, которое само по себе несет детектируемую метку. В качестве детектируемой метки или репортерной молекулы может выступать радиоактивный изотоп, например 3H, 14С, 32Р, 35S, 131I или 125I; флуоресцентный или хемилюминесцентный агент, например флуоресцеинизотиоцианат или родамин; или фермент, например щелочная фосфатаза, β-галактозидаза, пероксидаза из хрена или люцифераза. Среди методик анализа, которые могут использоваться для детектирования или измерения ANGPTL3 в образце, можно перечислить твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA), клеточная сортировка с активацией флуоресценции (FACS) и им подобные.
ПРИМЕРЫ
[0101] Приведенные ниже примеры призваны дать рядовым специалистам в области полную информацию и описание того, как следует формулировать и использовать способы и препараты настоящего изобретения, и не призваны ограничивать сферу охвата того, что изобретатели рассматривают как предмет своего изобретения. Предпринимались попытки добиться точности в отношении используемых показателей, но при этом необходимо учитывать ряд экспериментальных ошибок и отклонений. Если не указано иначе, под молекулярным весом понимается усредненный молекулярный вес, температура приводится в градусах Цельсия, а давление находится на уровне атмосферного или близко к этому уровню.
Пример 1. Получение антител человека к ANGPTL3 человека
[0102] Мышей VELOCIMMUNE™ иммунизировали ANGPTL3 человека, и иммунный ответ антител отслеживали с помощью антигенспецифического иммуноанализа с использованием сыворотки, взятой у таких мышей. В-клетки, экспрессирующие анти-hANGPTL-3, взятые из селезенки иммунизированных мышей, которые демонстрировали повышенные титры антител анти-hANGPTL3, сливали с клетками мышиной миеломы с образованием гибридом. Гибридомы проходили скрининг и селекцию для идентификации тех линий клеток, которые экспрессируют hANGPTL-3-специфические антитела, используя анализы, описанные ниже. Анализы позволили идентифицировать несколько клеточных линий, которые продуцируют химерные антитела анти-hANGPTL3, например H1M896N.
[0103] ANGPTL-3-специфичные антитела человека также выделяли напрямую из антиген-иммунизированных В-клеток без слияния с клетками миеломы, как описано в патенте США 2007/0280945 А1. Вариабельные области тяжелой и легкой цепей клонировали, чтобы получить полностью человеческие антитела анти-hANGPT1-3, обозначаемые как Н4Н1248Р, Н4Н1250Р, H4H1263S, H4H1268S, H4H1276S, Н4Н1279Р, Н4Н1282Р, Н4Н1292Р, Н4Н1295Р и Н4Н1296Р. Были установлены стабильные рекомбинантные клеточные линии СНО, экспрессирующие такие антитела.
Пример 2. Анализ использования генов по вариабельным областям
[0104] Для анализа структуры продуцируемых антител клонировали и секвенировали нуклеиновые кислоты, кодирующие вариабельные области антител. На основании последовательности нуклеиновой кислоты и прогнозируемой аминокислотной последовательности антител для каждой вариабельной области тяжелой цепи (HCVR) и вариабельной области легкой цепи (LCVR) определяли степень использования генов. В таблице 1 показано использование генов некоторых антител в соответствии с настоящим изобретением.
[0105] В таблице 2 приведены пары аминокислотных последовательностей тяжелой и легкой цепи вариабельной области выбранных антител анти-hANGPTL3 и их соответствующие идентификаторы антител. Обозначения N, Р и S относятся к антителам, имеющим тяжелую и легкую цепи с идентичными последовательностями CDR, но с вариациями последовательностей в областях, которые выходят за пределы последовательностей CDR (например, в остовных областях). Таким образом, варианты N, Р и S того или иного конкретного антитела отличаются идентичными последовательностями CDR в своих вариабельных областях тяжелой и легкой цепи, но содержат модификации внутри остовных областей.
Пример 3. Кинетические параметры связывания антител анти-hANGPTL3 с ANGPTL3
[0106] Все эксперименты по кинетическому связыванию проводили при 25°С или 37°С с помощью прибора по исследованию молекулярного взаимодействия без использования метки BIACORE™ T200 (GE Healthcare) с использованием сенсорного чипа СМ5. Коротко говоря, поверхность для связывания антигена готовили посредством ковалентного связывания антимышиного lgG-специфического антитела (анти-mFc; GE Healthcare; № по кат. BR-1008-38) или антипентагистидин-специфического антитела (Qiagen; № по кат.34660) с поверхностью сенсорного чипа СМ5 с использованием стандартного метода аминного связывания. Используя HBS-EP (10 мМ HEPES, 150 мМ NaCI, 3 мМ EDTA, 0,05% ПАВ Р20, рН 7,4) или PBSP (10 мМ фосфат натрия, 2,7 мМ KCl, 137 мМ NaCl, 0,025% ПАВ Р20, рН 7,2 или 5,75) в качестве подвижного буфера, фиксировали человеческие и видовые варианты ANGPTL3 с олигогистидиновыми метками на антипентагистидин-связанной поверхности до достижения фактора связывания 4,4- 46,5 RU. Среди фиксируемых рекомбинантных белков: зрелый человеческий ANGPTL3 полной длины (то есть аминокислотные остатки 17-460 последовательности SEQ ID №:161) с С-терминальной декагистидиновой меткой [hANGPTL3(17-460)-His; R&D Systems, штат Миннесота; № по кат. 3829-AN], N-терминальным суперспиральным доменом hANGPTL3 (то есть аминокислотные остатки 17-170 последовательности SEQ ID №:161), содержащие С-терминальную декагистидиновую метку [hANGPTL3 (17-170)-His], N-терминальным суперспиральным доменом ANGPTL3 Масаса fascicularis [то есть аминокислотные остатки 17-170 последовательности SEQ ID №:177 (частичная последовательность Масаса fascicularis ANGPTL3)], содержащие myc-myc-гексагистидиновую метку [MfANGPTL3 (17-170)-mmH; SEQ ID №:167], зрелый человеческий ANGPTL3 полной длины Mus musculus (то есть аминокислотные остатки 17-455 последовательности SEQ ID №:163) с С-терминальной декагистидиновой меткой [mANGPTL3(17-455)-His; R&D Systems, штат Миннесота; № по кат. 136-AN], N-терминальным суперспиральным доменом ANGPTL3 Mus musculus (то есть аминокислотные остатки 17-240 последовательности SEQ ID №:163), содержащий гексагистидиновую метку [mANGPTL3(17-240)-His; SEQ ID №:166], а также N-терминальный суперспиральный домен ANGPTL3 Rattus norvegicus (то есть аминокислотные остатки 17-240 последовательности SEQ ID №:175), содержащий myc-myc-гексагистидиновую метку [KANGPTL3(17-240)-mmH; SEQ ID №:176]. Кроме того, N-терминальный суперспиральный домен hANGPTL3 (то есть аминокислотные остатки 17-169 последовательности SEQ ID №:161), содержащий С-терминальный мышиный слитой Fc [hANGPTL3(17-169)-mFc; SEQ ID №:165] фиксировали на поверхности, связанной с анти-mFc, до достижения фактора связывания 24,8±1.5 RU. Для измерения скоростей связывания и диссоциации при образовании комплекса антитело/антиген использовали одну (таблицы 3 и 7) или несколько (таблицы 4-6) концентраций антитела, наносимые на поверхность фиксированного белка со скоростью 50 мкл/мин в течение 3 минут, и диссоциацию комплекса отслеживали в течение 20 минут. Данные связывания обрабатывали и подгоняли по модели связывания 1:1 с массопереносом с использованием ПО Scrubber версия 2.0а (BioLogic Software). Кинетический период полураспада комплекса (tia) рассчитывали по константе скорости диссоциации, kd.
[0107] В таблице 3 приводятся параметры связывания различных антител анти-ANGPTL3 с hANGPTL3 при 25°С, рН 7,4 в буфере HBS-EP.
[0108] Как показано в таблице 3, антитела анти-hANGPLT3 связывались с полным белком с С-терминальной декагистидиновой меткой [hANGPTL3(17-460)-His] с рассчитанными равновесными константами диссоциации (KD=kd/ka) от 96,8 пМ до 5,62 нМ и с N-терминальным суперспиральным доменом с С-терминальным слитым белком Fc [hANGPTL3(17-169)-mFc] с KoS в интервале от 8,41 пМ до 6,23 нМ.
[0109] В таблицах 4 и 5 представлены данные о межвидовом связывании H4H1276S до ANGPTL3 при 25°С и 37°С, соответственно, при рН 7,4, в буфере HBS-EP. В таблице 6 приводятся параметры связывания H4H1276S с ANGPTL3 человека и яванского макака, при 25°С или 37°С, при рН 5,75 или рН 7,2, в буфере PBSP.
[0110] Как показано в таблицах 4-6, антитело демонстрировало H4H1276S связывание с ANGPTL3 обезьяны, мыши и крысы с аффинностью связывания и кинетическими константами, близкими к связыванию с человеческим ANGPTL3.
[0111] В таблице 7 приводятся параметры связывания некоторых антител анти-АМСРТЬЗ с hANGPTL3 при 37°C, рН 7,4 в буфере HBS-EP. НС: не связано.
[0112] Как показано в таблице 7, антитела анти-hANGPLT3 связывались с полным белком с С-терминальной декагистидиновой меткой [hANGPTL3(17-460)-His] при рН 7,4 и 37°С с расчетными равновесными константами диссоциации (KD=kd/ka) от 158 пМ до 1,02 нМ и с мышиным ANGPTL3 [mANGPTL3(17-455)-His] с KoS в интервале от 167 пМ до 682 пМ, кроме Н4Н1248Р и H4H1263S, которые не проявляли заметного связывания с mANGPTL3. Также приводятся значения кинетических периодов полураспада (t½).
Пример 4. Перекрестный конкурентный анализ антител анти-ANGPTL3 с помощью Biacore
[0113] Эксперименты по перекрестному конкурентному анализу проводили при 25°С на Biacore в основном также, как описано выше в примере 3. Коротко говоря, используя HBS-EP в качестве подвижного буфера, hANGPTL3 полной длины (то есть аминокислотные остатки 17-460 последовательности SEQ ID №:161) с С-терминальной декагистидиновой меткой [hANGPTL3(17-460)-His; R&D Systems, штат Миннесота; №по кат.3829-AN] фиксировали на поверхности с антипентагистидином до фактора связывания 64 RU. Чтобы установить, в состоянии ли два антитела одновременно связываться с фиксированным ANGPTL3, последовательно вносили пары антител в концентрации 167 нМ, каждое со скоростью 4 мкл/мин в течение 15 минут на поверхность, и для каждого связывания измеряли максимальный сигнал фактора связывания (RU). Результаты приводятся в таблице 8, вначале указан фактор связывания для первого антитела (mAb1), затем следует фактор связывания для второго антитела (mAb2) на поверхности ANGPTL3, предварительно насыщенной первым антителом. Значения полужирным шрифтом указывают, что пары антител могут связываться с hANGPTL3 одновременно. Значения курсивом указывают, что пары антител в состоянии связываться с hANGPTL3 одновременно при последовательном добавлении в одном порядке, но не в обратном. Скобки означают самоконкуренцию.
[0114] Как показано в таблице 8, пары антител H1M896N/H4H1279P и H1M896N/H4H1292P были в состоянии одновременно связываться с иммобилизованным ANGPTL3 независимо от порядка добавления антител. Н4Н1250Р связывалось с ANGPTL3, предварительно связанным с Н4Н1279Р; однако если порядок добавления антител менялся на обратный, Н4Н1279Р демонстрировало сигнал связывания, который составлял примерно 24% от ожидаемого максимального фактора после предварительного связывания ANGPTL3 с Н4Н1250Р. Точно также, Н4Н1250Р связывалось с ANGPTL3, предварительно связанным с Н4Н1292Р; однако если порядок добавления антител менялся на обратный, Н4Н1292Р демонстрировало сигнал связывания, который составлял примерно 20% от ожидаемого максимального фактора после предварительного связывания ANGPTL3 с Н4Н1250Р.
Пример 5. Связывание антитела анти-hANGPTL3 с N-терминальными суперспиральными пептидами ANGPTL3
[0115] Для оценки связывания анти-ANGPTL3 антитела H4H1276S с пептидами, полученными из N-терминальной суперспиральной области ANGPTL3 проводили биосенсорный анализ связывания без метки с использованием системы OCTET® RED (ForteBio, Inc.). Для иммобилизации на сенсоре пептиды помечали N-терминальной биотиновой меткой [отделенной гибким линкером из аминокислот «AGSSPGG» (SEQ ID №:171), для пептида 1 и пептида 2; а также аминокислотами «GGGGS» (SEQ ID №:172) для пептида 3], или С-терминальной биотиновой меткой [отделенной гибким линкером из аминокислот «GPSSGAPPPK» (SEQ ID №:173), для пептида 1 и пептида 2; а также аминокислотами «GGGGSK» (SEQ ID №:174) для пептида 3]. Анализировали следующие пептидные последовательности: пептид отрицательного контроля, N-терминальный пептид 1 с биотиновой меткой (SEQ ID №:168; остатки с Arg34 до Leu66 человеческого ANTGPTL4 с SEQ ID №:164], и пептиды, полученные из N-терминального суперспирального домена ANGPTL3, то есть N-терминальный пептид 2 с биотиновой меткой (SEQ ID №:169; остатки с Arg34 до Leu66 hANTGPTL4 с SEQ ID №:161); С-терминальный пептид 2 с биотиновой меткой; N-терминальный пептид 3 с биотиновой меткой (SEQ ID №:170; соответствует остаткам с Glu32 no Leu57 DANTGPTL3 с SEQ ID №:161); и С-терминальный пептид 3 с биотиновой меткой. Пептидные последовательности также приводятся на фиг.1. Покрытые стрептавидином кончики биосенсоров покрывали биотинилированными пептидами, при этом в зависимости от пептида регистрировалось связывание на уровне 1,22-2,26 нМ. Покрытые пептидами кончики биосенсоров затем погружали в лунки, содержащие 1 мкм либо анти-ANGPTL3 антитела H4H1276S, либо соответствующее по изотипу антитело отрицательного контроля, и в течение 2,5 минут отслеживали связывание. Параметры связывания H4H1276S и изотипного контрольного антитела с каждым из пептидов приводятся на фиг.2. Было установлено, что H4H1276S связывается с линейной последовательностью ANGPTL3, определяемой пептидом 2, но не с перекрывающейся, но отличающейся последовательностью, определяемой пептидом 3 (см. также фиг.1). Изотипное контрольное антитело также служило положительным контролем для насыщения биосенсора пептидом 1 (то есть пептидом hANGPTL4), поскольку такое изотипное контрольное антитело специфически распознает hANGPTL4. Как показано на фиг.2, связывание контрольного антитела с пептидом 1 подтвердило, что пептид 1 наряду с другими пептидами присутствовал на поверхности сенсора.
Пример 6. Ингибирование hANGPTL3 антителами анти-hANGPTL3 в биопробах LPL
[0116] Липопротеинлипаза (LPL) играет важную роль в метаболизме липидов в организме человека. LPL катализирует гидролиз триглицеридов и высвобождает жирные кислоты, которые подвергаются метаболизму. ANGPTL3 ингибирует активность LPL, создавая повышенный уровень липидов (см. Oike et al., 2005, Trends in Molecular Medicine 11(10):473-479). N-терминальная суперспиральная область ANGPTL3 ингибирует LPL при экспрессировании без С-терминальной фибриногеновой области, а потому, по-видимому, передает свои ингибирующие функции. Был разработан способ биопроб без применения клеток, чтобы определить способность антител анти-ANGPTL3 ингибировать ANGPTL3-индуцированное снижение активности LPL.
[0117] Ингибирование активности hANGPTL3 антителами анти-ANGPTL3 регистрировали с помощью стационарного флуоресцентного теста липазы CONFLUOLIP™ (Ргодеп, Германия) с использованием трех белков hANGPTL3: зрелый hANGPTL3 полной длины (то есть аминокислотные остатки 17-460 последовательности SEQ ID №:161) с С-терминальной декагистидиновой меткой [hANGPTL3(17-460)-His; R&D Systems, штат Миннесота; № по кат. 3829-AN], N-терминальным суперспиральным доменом (то есть аминокислотные остатки 17-169 последовательности SEQ ID №:161), содержащий С-терминальный мышиный слитой Fc [hANGPTL3(17-169)-mFc; SEQ ID №:165], и N-терминальный суперспиральный домен hANGPTL3 (то есть аминокислотные остатки 17-170 последовательности SEQ ID №:161), содержащий С-терминальную гексагистидиновую метку [hANGPTL3(17-170)-His].
[0118] Коротко говоря, предварительно смешивали бычью LPL (конечная концентрация 2 нМ), АроСIl человека (кофактор LPL, конечная концентрация 0,23 мкМ) и BSA (конечная концентрация 2 мг/мл) в PBS. Рекомбинантные белки hANGPTL3 добавляли к смеси Apo/LPL (конечные концентрации 80-100 нМ). Смеси Apo/LPL/белка ANGPTL3 затем смешивали с последовательно разбавленными антителами анти-hANGPTL3 и инкубировали при комнатной температуре в течение 30 минут. После инкубирования 100 мкл вновь растворенного субстрата липазы 1-тринитрофениламинододеканоил-2-пирендеканоил-3-0-гексадецил-sn-глицерин (LS-A, Progen) добавляли к 25 мкл смеси антитела в 96-луночный аналитический планшет и инкубировали при 37°С в течение двух часов. Затем измеряли интенсивность флуоресценции на 342 нм/400 нм (возбуждение/испускание) с помощью считывателя микропланшет FLEXSTATION® 3 (Molecular Devices, штат Калифорния). Интенсивность флуоресценции прямо пропорциональна активности LPL.
[0119] Антитело H4H1276S проявляло способность подавлять ингибирующую активность hANGPTL3 в отношении LPL. Полный анализ зависимости доза-эффект с использованием белка hANGPTL3 в анализе LPL вначале проводили, чтобы определить ECso ANGPTL3 в каждом эксперименте, а затем определяли ICso для антитела с использованием постоянных концентраций белка ANGPTL3, как показано в таблице 8. Концентрации антитела, необходимые для 50% максимального ингибирования (IC50), оказались равными 9,6 нМ для 80 нМ hANGPTL3(17-460)-His, 2,9 нМ для 100 нМ hANGPTL3(17-170)-His и 21 нМ для 80 нМ hANGPTL3(17-169)-mFc, соответственно. Концентрации антитела при тестировании человеческих белков ANGPTL3 находились в интервале от 0 до 300 нМ.
[0120] Точно так же тестировали H4H1276S в биопробе LPL на его способность ингибировать межвидовые ортологи: N-терминальный домен яванского макака (аминокислотные остатки 17-170 последовательности SEQ ID №:177), экспрессированный с С-терминальной myc-myc-гексагистидиновой меткой [MfANGPTL3(17-170)-mmH; SEQ ID №:167], N-терминальный домен мышиного ортолога с аминокислотными остатками 17-240 из SEQ ID №:163, содержащий С-терминальную гексагистидиновую метку [mANGPTL3(17-240)-His; SEQ ID №:166], зрелый ANGPTL3 полной длины Mus musculus (то есть аминокислотные остатки 17-455 последовательности SEQ ID №:163), содержащий С-терминальную гексагистидиновую метку [mANGPTL3(17-455)-His; R&D Systems, штат Миннесота; № кат. 136-AN]. IC50 оказались равными 10 нМ для 500 нМ постоянной концентрации MfANGPTL3(17-170)-mmH, 14 нМ для 80 нМ постоянной концентрации mANGPTL3(17-455)-His, а также 31 нМ для 500 нМ постоянной концентрации mANGPTL3(17-240)-His. Концентрации антитела при тестировании белков обезьяны и мыши ANGPTL3 находились в интервале от 0 до 600 нМ. Результаты приводятся в табл.9.
[0121] Было также показано, что антитела к N-терминальной области гомологического белка ANGPTL4 блокируют ингибирующую функцию ANGPTL4 в отношении LPL (Lee et al., 2009, J. Biol. Chem. 284:13735-13745). Поэтому для оценки возможной перекрестной реактивности KANGPTL4 ингибирующее анти-ANGPTL3 антитело H4H1276S также тестировали против человеческого ANGPTL4 в анализе LPL липазы, который проводили так же, как описано выше для белков ANGPTL3. Рекомбинантная форма суперспирального домена человеческой ANGPTL4 (остатки 26-148 of SEQ ID №:164), содержащего С-терминальный мышиный слитой lgG2a Fc [hANGPTL3(26-148)-mFc; SEQ ID №:178] демонстрировала ЕС50 в пробе LPL 0,2 нМ (таблица 9). H4H1276S, тестированный в диапазоне концентраций 0-600 нМ, не блокировал такое ингибирование (НС: не связано; в таблице 9).
[0122] Как показано выше, H4H1276S ингибировало активность человеческого ANGPTL3 (полная последовательность и N-терминальный домен), ANGPTL3 обезьяны (N-терминальный домен) и мышиного ANGPTL3 (полная последовательность и N-терминальный домен) в сопоставимой степени в диапазоне ICso примерно 3-31 нМ.
[0123] Субпопуляцию антител также тестировали, чтобы определить, в состоянии ли сочетание двух неблокирующих ANGPTL3 антител, добавляемых одновременно, заблокировать ингибирующую LPL активность ANGPTL3. Пары антител тестировали на ингибирование N-терминальных доменов человеческого и мышиного ANGPTL3, то есть hANGPTL3(17-169)-mFc и mANGPTL3(17-240)-His, соответственно. В этом анализе белки ANGPTL3 демонстрировали значения IC50 при блокировании LPL, равные 47 нМ [для hANGPTL3(17-169)-mFc] и 341 нМ [для mANGPTL3(17-240)-His]. Перечисленные ниже пары при добавлении в конечной концентрации не менее 200 нМ для каждого антитела не блокировали ингибирование LPL как hANGPTL3(17-169)-mFc при 80 нМ, так и mANGPTL3(17-240)-His при 500 нМ: H1M896N+Н4Н1279Р; Н4Н1250Р+Н4Н1279Р; Н4Н1248Р+Н4Н1292Р и H4H1263S+Н4Н1292Р. В том же тесте один только H4H1276S блокировал те же самые постоянные концентрации человеческого и мышиного ANGPTL3 с IC50 на уровне 33 нМ и 64 нМ, соответственно.
Пример 7.1. Воздействие антитела анти-ANGPTL3 in vivo на уровни липидов в сыворотке
[0124] Эффект воздействия анти-hANGPTL3 антитела H4H1726S на уровни липидов в сыворотке изучали на мышах C57BI/6. У мышей брали кровь за 7 дней до эксперимента, и для каждой тестируемой дозы антитела их разделяли на группы по шесть мышей в каждой. Антитела вводили в дозе 5 мг/кг (H4H1726S) и 10 мг/кг [H4H1726S и соответствующий по изотипу контроль hIgG4(S108P) без определенной специфичности] посредством подкожной инъекции на день 0 исследования. У мышей брали кровь через 4 часа после голодания в дни 1, 4, 7 и 12 после инъекции антитела и определяли уровни липидов в сыворотке (триглицериды, общий холестерин, холестерин без ЛВП, ЛНП холестерин и ЛВП холестерин) с помощью системы ADVIA® 1800 Chemistry System (Siemens). Для каждой точки по времени и каждого антитела рассчитывали средние значения. Результаты, представленные в форме (среднее±стандартная ошибка среднего) для концентрации липидов в сыворотке, приводятся в таблицах 10-14.
[0125] Уровни H4H1726S в кровообращении (Ab сыворотки) также определяли с помощью стандартного анализа ELISA. Коротко говоря, планшеты покрывали античеловеческим антителом Fc козы (Sigma-Aldrich) для фиксации Ab сыворотки. Затем к планшетам добавляли сыворотку и фиксированное человеческое антитело регистрировали по хемилюминесценции с помощью конъюгированных с пероксидазой из хрена (HRP) античеловеческих антител IgG козы (Sigma-Aldrich). Результаты, представленные в форме (среднее ± стандартная ошибка среднего), приводятся в таблице 15. Контроль: мыши, получавшие контрольное Ab соответствующего изотипа.
[0126] Разовое введение H4H1276S мышам C57BI/6 в дозе 10 мг/кг привело к ~60% снижению уровня триглицеридов через 7 дней после введения антитела (по сравнению с изотипным контролем). Введение H4H1276S также повлекло за собой значительное снижение общего холестерина, холестерина без ЛВП и ЛВП холестерина, но не оказало никакого воздействия на ЛНП холестерин. Наблюдалось также снижение уровня липидов, но менее выраженное, при уровне дозы 5 мг/кг по сравнению с 10 мг/кг; например уровень триглицеридов в сыворотке снизился на 44% (по сравнению с изотипным контролем) через 7 дней после введения антитела.
Пример 7.2. Воздействие антител анти-ANGPTL3 in vivo на уровни липидов в сыворотке
[0127] Эффект воздействия анти-hANGPTL3 антител H4H1726S компараторного антитела 4.9.1 на уровни липидов в сыворотке изучали на мышах C57BI/6. Антитело 4.9.1 готовили на основе аминокислотных последовательностей SEQ ID №:24 (VH) и SEQ ID No:32 (VL), которые раскрываются в опубликованной патентной заявке США №2008/0177045 и представляют собой изотип мышиного lgG1. У мышей брали кровь за 7 дней до эксперимента и разделяли на группы по шесть мышей в каждой. Антитела H4H1276S, 4.9.1 и соответствующий по изотипу контроль (человеческий IgG4 и мышиный IgG1, соответственно) без определенной специфичности вводили в дозе 10 мг/кг посредством подкожной инъекции на день 0 исследования. У мышей брали кровь через 4 часа после голодания в дни 1, 7, 11 и 20 после инъекции антител и определяли уровни липидов в сыворотке (триглицериды, общий холестерин, холестерин без ЛВП, ЛНП холестерин и ЛВП холестерин) с помощью системы ADVIA® 1800 Chemistry System (Siemens). Для каждой точки по времени и каждого антитела рассчитывали средние значения. Результаты, представленные в форме (среднее ± стандартная ошибка среднего) для концентрации липидов в сыворотке, приводятся в таблицах 16-20.
[0128] Разовая доза 10 мг/кг H4H1276S у мышей C57BI/6 привела к снижению уровней триглицеридов в плазме по сравнению с изотипным контролем в дни 1, 7, 11 и 20 после введения антитела; и такой эффект был более стабильным по сравнению разовым введением дозы такого же уровня с компаратором 4.9.1 (таблица 16). Введение H4H1276S также приводило к снижению общего холестерина (таблица 17) и ЛВП холестерина (таблица 20) у мышей C57BI/6.
Пример 8. Воздействие H4H1276S in vivo на уровни липидов в сыворотке у гиперлипидемических мышей ароЕ-/-
[0129] Эффект воздействия анти-hANGPTL3 антитела H4H1726S на уровни липидов в сыворотке изучали на мышах ароЕ-/-. Для таких мышей характерна гиперлипидемия, причем подавляющая часть их холестерина в кровообращении находится в форме ЛОНП и ЛНП. У мышей брали кровь за 7 дней до эксперимента и разделяли на группы по шесть мышей в каждой. Антитела, H4H1726S и соответствующий по изотипу контроль (hIgG4) без определенной специфичности, вводили в дозе 10 мг/кг посредством подкожной инъекции на день 0 исследования. У мышей брали кровь через 4 часа после голодания в дни 1, 4, 7 и 11 после инъекции антител и определяли уровни липидов в сыворотке (триглицериды, общий холестерин, холестерин без ЛВП, ЛНП холестерин и ЛВП холестерин) с помощью системы ADVIA® 1800 Chemistry System (Siemens). Для каждой точки по времени и каждой получавшей антитело группы рассчитывались средние значения концентрации липидов. Результаты, представленные в форме (среднее ± стандартная ошибка среднего) для концентрации липидов в сыворотке, приводятся в таблицах 21-25.
[0130] Разовое введение H4H1276S мышам ароЕ-/- в дозе 10 мг/кг привело к ~72% (в среднем) снижению уровня триглицеридов в кровообращении (таблица 21) и ~46% (в среднем) ЛНП холестерина (таблица 24) через 7 дней после введения антитела (по сравнению с изотипным контролем АЬ, то есть hlgG4). Введение H4H1276S также приводило к снижению общего холестерина (таблица 22) и холестерина без ЛВП (таблица 23).
[0131] Уровни H4H1726S в кровообращении (Ab сыворотки) также определяли с помощью стандартного анализа ELISA. Коротко говоря, планшеты покрывали античеловеческим антителом Fc козы (Sigma-Aldrich) для фиксации АЬ сыворотки. Затем к планшетам добавляли сыворотку и фиксированные антитела регистрировали по хемилюминесценции с помощью конъюгированных с пероксидазой из хрена (HRP) античеловеческих антител IgG козы (Sigma-Aldrich). Результаты, представленные в форме (среднее ± стандартная ошибка среднего), приводятся в таблице 26 (контроль: мыши, получавшие контрольное Ab соответствующего изотипа, то есть hIgG4).
Пример 9. Воздействие H4H1276S in vivo на уровни липидов в кровообращении у гиперлипидемических мышей Ldlr-/-
[0132] Эффект воздействия aHTM-hANGPTL3 антитела H4H1726S на уровни липидов в сыворотке изучали на мышах Ldlr-/-. Для таких мышей характерна гиперлипидемия, причем подавляющая часть их холестерина в кровообращении находится в форме ЛПН из-за недостатка рецепторов ЛНП, основных рецепторов захвата ЛНП холестерина.
[0133] У мышей брали кровь за 7 дней до эксперимента и разделяли на группы по шесть мышей в каждой. Антитела, H4H1726S и соответствующий по изотипу отрицательный контроль (hIgG4), вводили в дозе 10 мг/кг посредством подкожной инъекции на день О исследования. У мышей брали кровь через 4 часа после голодания в дни 1, 4, 7 и 11 после инъекции антитела и определяли уровни липидов в сыворотке (триглицериды, общий холестерин, холестерин без ЛВП, ЛНП холестерин и ЛВП холестерин) с помощью клинического химического анализатора ADVIA® 1800 Chemistry System (Siemens). Для каждой точки по времени и каждого антитела рассчитывались средние значения. Результаты, представленные в форме (среднее±стандартная ошибка среднего) для концентрации липидов в сыворотке (триглицериды, общий холестерин, холестерин без ЛВП, ЛНП холестерин и ЛВП холестерин), приводятся в таблицах 27-31, соответственно. (Контроль = мыши, получавшие контрольное антитело соответствующего изотипа).
[0134] Как показано в таблицах 27-31, введение H4H1726S мышам Ldlr-/- приводило к существенному снижению триглицеридов в плазме, причем максимальное наблюдаемое снижение достигало 44% (по средним значениям). У животных, получавших H4H1726S, также отмечалось существенное сокращение ЛНП холестерина (до 23%), а также общего холестерина, холестерина без ЛВП и ЛВП холестерина. Снижение ЛНП холестерина у мышей с дефицитом основного рецептора захвата ЛНП холестерина (рецептор ЛНП) указывает на зависимый от рецептора ЛНП механизм снижения ЛНП холестерина при ингибировании ANGPTL3.
[0135] Уровни H4H1726S в кровообращении (Ab сыворотки) также определяли с помощью стандартного анализа ELISA. Коротко говоря, планшеты покрывали античеловеческим антителом Fc козы (Sigma-Aldrich) для фиксации Ab сыворотки. Затем к планшетам добавляли сыворотку и фиксированные антитела регистрировали по хемилюминесценции с помощью конъюгированных с пероксидазой из хрена (HRP) античеловеческих антител IgG козы (Sigma-Aldrich), Результаты, представленные в форме (среднее ± стандартная ошибка среднего), приводятся в таблице 32. (Контроль = мыши, получавшие контрольное антитело соответствующего изотипа).
[0136] Как показано в таблице 32, уровни в сыворотке H4H1726S снизились примерно до 21 мкг/мл на день 11 после введения мышам 10 мг/кг антитела.
[0137] Настоящее изобретение не должно ограничиваться в объеме теми конкретными осуществлениями, которые описаны в настоящем документе. В самом деле, различные модификации изобретения, кроме уже описанных в настоящем документе, будут очевидны для специалистов из приведенного выше описания и приложенных чертежей. Предполагается, что такие модификации попадают в сферу охвата прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВЫСОКОАФФИННЫЕ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К PCSK9 | 2009 |
|
RU2552169C2 |
| ВЫСОКОАФФИННЫЕ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К PCSK9 | 2009 |
|
RU2697773C2 |
| АНТИТЕЛА ПРОТИВ КОМПЛЕКСА ANGPTL3/8 И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2019 |
|
RU2799796C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА С ВЫСОКОЙ АФФИННОСТЬЮ К РЕЦЕПТОРАМ IL-4 ЧЕЛОВЕКА | 2009 |
|
RU2539774C2 |
| АНТИТЕЛА ПРОТИВ КОМПЛЕКСА ANGPTL3/8 И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2019 |
|
RU2791034C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К FEL D1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2658491C2 |
| НОВЫЕ АНТИТЕЛА К BSSL | 2020 |
|
RU2826992C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИТЕЛА К PCSK9 ЧЕЛОВЕКА | 2012 |
|
RU2604139C2 |
| АНТИТЕЛО К ANGPTL3 И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2830101C1 |
| АНТИТЕЛА ЧЕЛОВЕКА К PCSK9 ДЛЯ ПРИМЕНЕНИЯ В СПОСОБАХ ЛЕЧЕНИЯ КОНКРЕТНЫХ ГРУПП ИНДИВИДУУМОВ | 2012 |
|
RU2603481C2 |




























































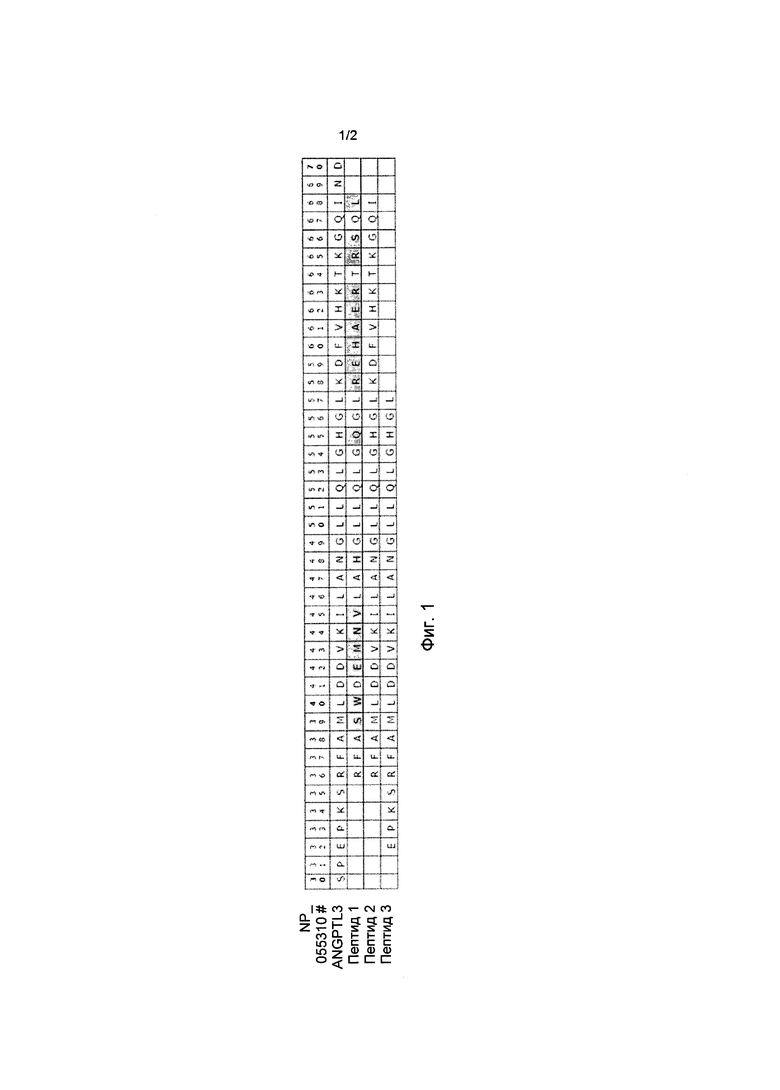
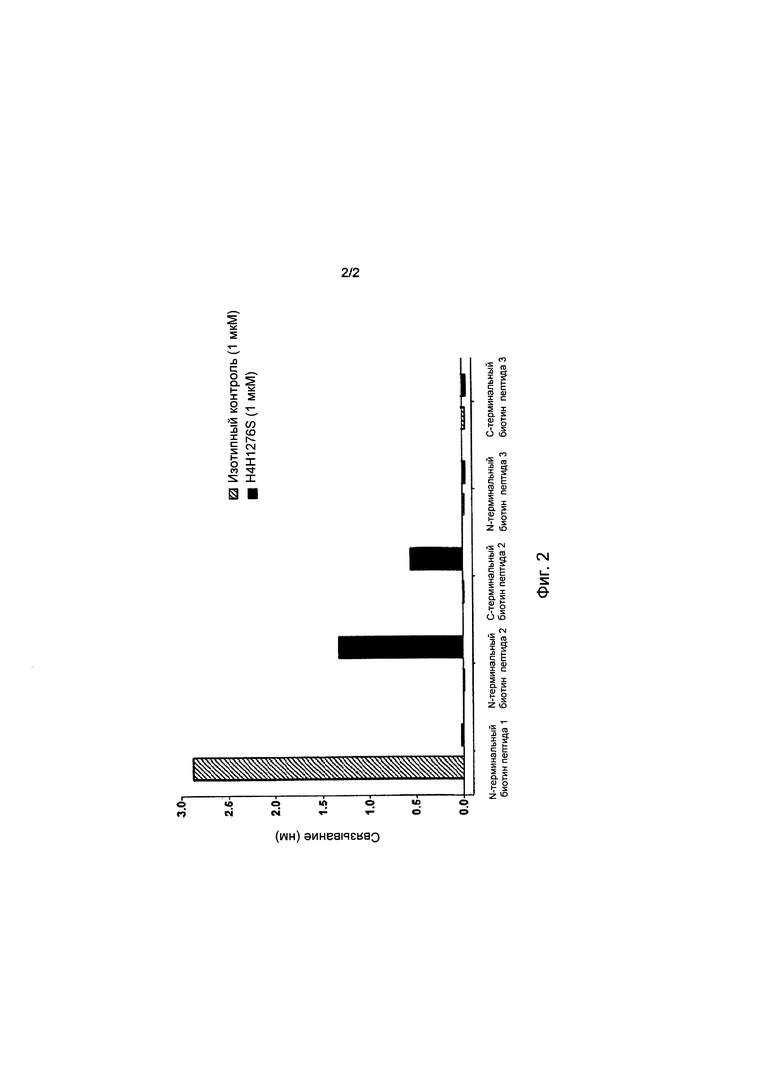
Изобретение относится к биохимии. Представлены полное антитело человека или антигенсвязывающий фрагмент антитела человека, которые специфически связываются с не менее чем одним ангиопоэтин-подобным белком 3 человека (hANGPTL3) и ингибируют или нарушают по крайней мере одну его функцию. Описана нуклеиновая кислота, кодирующая представленное антитело, и вектор экспрессии, содержащий такую кислоту. Представлена клетка-хозяин, содержащая описанный вектор. Описана фармацевтическая композиция, содержащая одно или несколько представленных антител или его фрагментов. Описаны также способы использования представленного антитела. Изобретение может быть использовано при лечении заболеваний или нарушений, связанных с ANGPTL3, таких как гиперлипидемия, гиперлипопротеинемия и дислипидемия, включая гипертриглицеридемию, гиперхолестеринемию, хиломикронемию и пр. Далее, антитела анти-hANGPTL3 могут вводиться пациенту, нуждающемуся в этом, для профилактики или лечения заболеваний или нарушений, для которых аномальный липидный метаболизм является фактором риска. Такие заболевания или нарушения включают сердечно-сосудистые заболевания, такие как атеросклероз и ишемическая болезнь сердца; острый панкреатит; безалкогольный стеатогепатит (NASH); диабет; ожирение и им подобные. 9 н. и 21 з.п. ф-лы, 2 ил., 32 табл., 9 пр.
1. Изолированное антитело человека или его антигенсвязывающий фрагмент, которые специфически связываются с ангиопоэтин-подобным белком 3 человека (hANGPTL3), SEQ ID NO: 161, и нейтрализуют, сокращают как минимум одну из функций hANGPTL3 или препятствуют ей, где антитело или фрагмент содержит последовательности определяющей комплементарность области (CDR) тяжелой цепи HCDR1, HCDR2 и HCDR3 и последовательности CDR легкой цепи LCDR1, LCDR2 и LCDR3, содержащиеся в паре последовательностей (HCVR/LCVR) вариабельной области тяжелой цепи (HCVR) и вариабельной области легкой цепи (LCVR), выбираемой из группы, состоящей из SEQ ID NO: 2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154 и 180/188.
2. Антитело или фрагмент по п. 1, где антитело или его фрагмент связывается с эпитопом, расположенным в N-терминальной суперспиральной области в остатках 17-209 последовательности SEQ ID NO: 161.
3. Антитело или фрагмент по п. 1, где антитело или его фрагмент не связывается с пептидом ANGPTL3 от SEQ ID NO: 170.
4. Антитело или фрагмент по п. 1, где эпитоп расположен в остатках 17-200, 17-100, 17-70, 17-65, 17-60, 17-57, 17-50, 40-200, 40-100, 40-70, 50-200, 50-100, 50-70, 58-200, 58-100, 58-70, 58-68 или 61-66 последовательности SEQ ID NO: 161.
5. Антитело или фрагмент по п. 1, где антитело или фрагмент является химерным или полностью человеческим антителом или фрагментом.
6. Антитело или фрагмент по п. 1, содержащие вариабельную область тяжелой цепи (HCVR), выбираемую из группы, состоящей из SEQ ID NO.: 2, 18, 34, 50, 66, 82, 98, 114, 130, 146 и 180; и/или вариабельную область легкой цепи (LCVR), выбираемую из группы, состоящей из SEQ ID NO: 10, 26, 42, 58, 74, 90, 106, 122, 138, 154 и 188.
7. Антитело или фрагмент по п. 6, где антитело или его фрагмент содержит пару последовательностей HCVR и LCVR (HCVR/LCVR), выбираемую из группы, состоящей из SEQ ID NO: 2/10, 18/26, 34/42, 50/58, 66/74, 82/90, 98/106, 114/122, 130/138, 146/154 и 180/188.
8. Антитело или фрагмент по п. 1, где сочетание последовательности HCDR1/HCDR2/HCDR3 выбирается из группы, состоящей из SEQ ID NO: 4/6/8, 20/22/24, 36/38/40, 52/54/56, 68/70/72, 84/86/88, 100/102/104, 116/118/120, 132/134/136, 148/150/152 и 182/184/186; и/или сочетание последовательности LCDR1/LCDR2/LCDR3 выбирается из группы, состоящей из SEQ ID NO: 12/14/16, 28/30/32, 44/46/48, 60/62/64, 76/78/80, 92/94/96, 108/110/112, 124/126/128, 140/142/144, 156/158/160 и 190/192/194.
9. Антитело или фрагмент по п. 1, где антитело или фрагмент содержит сочетание последовательности HCDR1/HCDR2/HCDR3, выбираемое из группы, состоящей из SEQ ID NO: 4/6/8/12/14/16, 20/22/24/28/30/32, 36/38/40/44/46/48, 52/54/56/60/62/64, 68/70/72/76/78/80, 84/86/88/92/94/96, 100/102/104/108/110/112, 116/118/120/124/126/128, 132/134/136/140/142/144, 148/150/152/156/158/160 и 182/184/186/190/192/194.
10. Антитело или антигенсвязывающий фрагмент по п. 1, где антитело или антигенсвязывающий фрагмент вступает в перекрестную реакцию с ANGPTL3 яванского макака.
11. Антитело или антигенсвязывающий фрагмент по п. 1, где антитело или антигенсвязывающий фрагмент вступает в перекрестную реакцию с ANGPTL3 мыши или крысы.
12. Антитело или антигенсвязывающий фрагмент по п. 1, где антитело или фрагмент вступает в перекрестную реакцию с ANGPTL3 яванского макака, ANGPTL3 мыши и ANGPTL3 крысы.
13. Антитело или фрагмент по любому из пп. 1-12, где фрагмент антитела является одноцепочечным антителом, Fab или F(ab')2.
14. Выделенная молекула нуклеиновой кислоты, кодирующая антитело или его фрагмент по любому из пп. 1-13.
15. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п. 14.
16. Выделенная клетка-хозяин для получения антитела анти-hANGPTL3 или его антигенсвязывающего фрагмента, содержащая вектор экспрессии по п. 15.
17. Способ получения антитела анти-hANGPTL3 или его антигенсвязывающего фрагмента, заключающийся в выращивании клетки-хозяина по п. 16 в условиях, допускающих получение антитела или его фрагмента, и получении антитела или его фрагмента, продуцированного таким образом.
18. Фармацевтическая композиция для профилактики или лечения заболевания или нарушения, которое может быть предотвращено, купировано, облегчено или ингибировано путем сокращения или ингибирования функции ANGPTL3, содержащая эффективное количество одного или нескольких антител или их фрагментов по пп. 1-13 и фармацевтически приемлемый носитель.
19. Фармацевтическая композиция по п.18, где антитело или его фрагмент содержит сочетание последовательности определяющей комплементарность области (CDR) тяжелой цепи и легкой цепи, включающее SEQ ID NO: 68/70/72/76/78/80, или пару HCVR/LCVR вариабельной области тяжелой цепи и вариабельной области легкой цепи, включающую SEQ ID NO: 66/74.
20. Фармацевтическая композиция по п. 18, содержащая сочетание антител или их фрагментов, выбираемых из группы, состоящей из пары последовательностей (HCVR/LCVR) вариабельной области тяжелой цепи (HCVR) и вариабельной области легкой цепи (LCVR):
(i) SEQ ID NO: 82/90 и 180/188;
(ii) SEQ ID NO: 114/122 и 180/188;
(iii) SEQ ID NO: 82/90 и 18/26; и
(iv) SEQ ID NO: 114/122 и 18/26.
21. Фармацевтическая композиция по п. 18, дополнительно состоящая из одного или нескольких дополнительных терапевтических средств, выбираемых из группы, состоящей из ингибитора редуктазы HMG-CoA; ингибитора захвата холестерина или реабсорбции желчных кислот или обоих этих ингибиторов; средства, повышающего катаболизм липопротеинов; средства, сокращающего число инфарктов без смертельного исхода; и активатора фактора транскрипции LXR.
22. Фармацевтическая композиция по п. 18, дополнительно включающая одно или несколько дополнительных терапевтических средств, выбираемых из группы, состоящей из статина, ниацина, фибрата, антитела анти-hANGPTL4 и антитела анти-PCSK9.
23. Способ профилактики или лечения заболевания или нарушения, которое может быть предотвращено, купировано, облегчено или ингибировано путем сокращения или ингибирования функции ANGPTL3, заключающийся во введении пациенту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции по любому из пп. 18-22.
24. Способ профилактики или лечения заболевания или нарушения, которое может быть предотвращено, купировано, облегчено или ингибировано путем сокращения или ингибирования функции ANGPTL3, заключающийся во введении пациенту, нуждающемуся в этом, терапевтически эффективного количества одного или нескольких антител и их фрагментов по любому из пп. 1-13.
25. Способ по п. 24, дополнительно включающий введение пациенту одного или нескольких дополнительных терапевтических средств, выбираемых из группы, состоящей из ингибитора редуктазы HMG-CoA; ингибитора захвата холестерина или реабсорбции желчных кислот или обоих этих ингибиторов; средства, повышающего катаболизм липопротеинов; средства, сокращающего число инфарктов без смертельного исхода; и активатора фактора транскрипции LXR.
26. Способ по п. 24, дополнительно включающий введение пациенту одного или нескольких дополнительных терапевтических средств, выбираемых из группы, состоящей из статина, ниацина, фибрата, антитела анти-hANGPTL4 и антитела анти-PCSK9.
27. Способ по п. 25, согласно которому одно или несколько антител или их фрагментов и один или несколько дополнительных терапевтических средств вводятся одновременно или последовательно.
28. Способ по любому из пп. 23-27, согласно которому указанное заболевание или нарушение выбирается из группы, состоящей из гипертриглицеридемии, гиперхолестеринемии, хиломикронемии, атерогенной дислипидемии, сердечно-сосудистого заболевания или расстройства, острого панкреатита, безалкогольного стеатогепатита (NASH), диабета и ожирения.
29. Применение фармацевтической композиции по любому из пп. 18-22 в лечении заболевания или нарушения, которое может быть предотвращено, купировано, облегчено или ингибировано путем сокращения или ингибирования функции ANGPTL3.
30. Применение по п. 29, где указанное заболевание или нарушение выбирается из группы, состоящей из гипертриглицеридемии, гиперхолестеринемии, хиломикронемии, атерогенной дислипидемии, сердечно-сосудистого заболевания или расстройства, острого панкреатита, неалкогольного стеатогепатита (NASH), диабета и ожирения.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| РЫБАЛЬСКИЙ Н.Г., СЕРОВА М | |||
| А., ИГНАТЬЕВА Г.А., СТАРЧЕУС А.П | |||
| "Моноклональные антитела и гибридомы", Москва: ВАСХНИЛ, 1989, стр.23-44. | |||
Авторы
Даты
2017-05-22—Публикация
2012-06-14—Подача