Изобретение относится к медицине, а именно к нейрохирургии, и может быть использовано при изготовлении силиконового катетера шунтирующей системы (СКШС), используемого для лечения гидроцефалии.
Гидроцефалия - пожизненное заболевание, являющееся одной из наиболее часто встречающихся патологий, наблюдаемых при рождении, и самым распространенным поводом для операций на головном мозге у детей. Данным заболеванием страдают, примерно, один из пятисот детей.
Кроме того, к развитию гидроцефалии могут привести черепно-мозговые травмы и внутричерепные кровоизлияния, которые, по данным Всемирной организации здравоохранения, происходят в среднем каждые пятнадцать секунд.
На сегодняшний день наиболее эффективным способом лечения гидроцефалии является хирургическая процедура (ликворошунтирующая операция), при которой в систему циркуляции спинномозговой жидкости (ликвора) устанавливается шунтирующее устройство (гибкая трубочка-катетер с клапаном) для выведения ликвора из желудочков мозга в брюшную полость (абдоминальный или перитонеальный катетер) или в правое предсердие (кардиальный катетер). При этом шунтирующее устройство должно быть полностью имплантировано под кожу, не вызывая косметических дефектов, не причиняя пациентам дискомфорта и ухудшения качества их жизни.
По этой причине среди шунтирующих систем, широко применяемых в клиниках и больницах, уже давно предпочтение отдается системам, выполненным из силикона [Bayston R. et al. Prevention of hydrocephalus shunt catheter colonisation in vitro by impregnation with antimicrobials // Journal of Neurology, Neurosurgery & Psychiatry. - 1989. - T. 52. - №. 5. - C. 605-609].
Последнее обстоятельство объясняется рядом ценных свойств силикона: нетоксичностью, низким зарядом поверхности, устойчивостью к температурным и химическим воздействиям. Кроме того, силиконы атравматичны и биоинертны в отношении тканей организма.
Между тем, несмотря на ряд очевидных преимуществ, имеющих место при использовании для лечения гидроцефалии шунтирующих систем, выполненных из силикона, существует ряд проблем, среди которых, в первую очередь, необходимо назвать развитие различных воспалительных заболеваний, связанных с возникновением бактериальной инфекции в тканях организма при нахождении в них инородного тела (шунтирующего устройства).
Эти воспалительные процессы, обусловленные чаще всего несколькими патогенными факторами - вирусами, бактериями, грибами, простейшими, в отдельных случаях могут приводить даже к летальному исходу.
К числу эффективных методов, позволяющих добиться снижения бактериемии организма, связанной с шунтированием, относится создание антимикробного покрытия как на внешней, так и на внутренней поверхности используемых катетеров. Исследованиями ряда ученых установлено, что для успешной защиты от инфицирования шунтирующих устройств у детей раннего возраста действие антимикробного препарата должно продолжаться не менее двух месяцев с момента имплантации устройства.
Необходимость столь длительного действия антимикробных препаратов объясняется высокой восприимчивостью (низким иммунитетом) детского организма к различным инфекционным возбудителям, их токсинам, а также чужеродным телам [Aryan Н.Е. et al. Initial experience with antibiotic-impregnated silicone catheters for shunting of cerebrospinal fluid in children // Child's Nervous System. - 2005. - T. 21. - №. 1. - C. 56-61].
Данные обстоятельства выдвигают особые требования к технологии введения бактерицидного препарата в состав материала,из которого изготавливается катетер шунтирующего устройства.
В известных из уровня техники аналогах, в которых описаны способы придания антимикробных свойств СКШС, предлагается в его поверхность различными способами, преимущественно импрегнированием, включать известные антисептики или антибиотики: рифампицин, триметоприм, спирамицин, клиндамицина гидрохлорид, диэтаноламина фузидат, ванкомицин, гентамицин, цефтриаксон, ципрофлаоксоацин и другие препараты или их комбинации, например, рифампицин и клиндамицин, рифампицин и диэтаноламина фузидат, диэтаноламина фузидат и триметоприм [Raffa G. et al. Antibiotic-impregnated catheters reduce ventriculoperitoneal shunt infection rate in high-risk newborns and infants // Child's Nervous System. - 2015. - T. 31. - №. 7. - С. 1129-1138].
Среди названных препаратов предпочтение отдается рифампицину, как препарату, хорошо переносимому детьми в раннем возрасте, в том числе и новорожденными.
Данный препарат универсален, эффективен в отношении широкого круга спектра бактерий и обладает высокой антибактериальной активностью в очень низких дозах.
Кроме того, рядом исследователей отмечено, что рифампицин хорошо совместим с силиконом [Hampl J.A. et al. Rifampin-impregnated silicone catheters: a potential tool for prevention and treatment of CSF shunt infections // Infection. - 2003. - Т. 31. - №. 2. - C. 109-111].
Применительно к системе рифампицин-силикон суть импрегнирования состоит в том, что катетеры в течение определенного времени, как правило нескольких часов, обрабатывают растворами рифампицина в неполярных или малополярных растворителях (например, в хлороформе или метиленхлориде), в которых кремнийорганические резины сильно набухают. После удаления растворителей, осуществляемого в течение нескольких суток (обычно 2-3-х) сушкой изделий при пониженном давлении и повышенной температуре, примерно до 60°С, в катетерах остается рифампицин, который после имплантации последних может высвобождаться в организм, обеспечивая антибактериальное действие.
Из известных публикаций, относящихся к получению антимикробных СКШС, импрегнированных рифампицином, поступление которого в организм происходит в течение временного интервала, необходимого для проявления определенного лечебного эффекта, по нашему мнению, представляют интерес работы, выполненные в России [Ширшов А.В. Супратенториальные гипертензивные внутримозговые кровоизлияния, осложненные острой обструктивной гидроцефалией и прорывом крови в желудочковую систему: дис.- М.: АВ Ширшов, 2006], а также американскими исследователями [Kohnen W. et al. Development of a long-lasting ventricular catheter impregnated with a combination of antibiotics // Biomaterials. - 2003. - T. 24. - №. 26. - C. 4865-4869].
В этих работах было показано, что количество введенного рифампицина до определенного предела зависит от его концентрации в растворах, взятых для обработки катетеров. Приводятся концентрации взятых для набухания растворов, при которых достигается максимальное насыщение катетера антибиотиком.
Для растворов рифампицина в хлороформе эта концентрация составляла 25 г/л, для растворов в метиленхлориде - 29,2 г/л. При этом содержание антибиотика в стенке катетера соответственно достигало соответственно 1,5% и 1,4% от веса катетеров.
По данным, приведенным в работе Ширшова А.В., при таком насыщении катетера рифампицином период проявления антибактериальной активности составляет от 7 до 14 суток.
Между тем, как уже указывалось выше, антимикробное (антибактериальное) действие на поверхности катетера должно продолжаться не менее двух месяцев с момента их имплантации.
Решение данной задачи путем дальнейшего увеличения концентрации рифампицина в растворах [Darouiche R.О., Raad I. Implantable medical device: пат. 5902283 США. - 1999], используемых для импрегнирования, оказалось нецелесообразным, поскольку влияния на продолжительность антибактериального действия при этом не было замечено.
Необходимо также отметить тот факт, что при придании антимикробных свойств катетеру методом импрегнирования после удаления растворителей и восстановления размеров катетера возможны искажения их формы, а также возникновение на поверхности последних шероховатости [Liang X. et al. Effect of cast molded rifampicin/silicone on Staphylococcus epidermidis biofilm formation // Journal of Biomedical Materials Research Part A. - 2006. - T. 76. - №. 3. - C. 580-588], может способствовать удержанию бактериальной колонизации и стать причиной закупорки катетеров.
Во избежание этого опасного явления отдельные катетеры подлежат отбраковке, что в свою очередь вызывает их значительное удорожание. Этому также способствуют и дополнительные расходы, связанные с удалением, улавливанием и последующей утилизацией растворителей, используемых при импрегнировании катетеров. Этому также способствуют и дополнительные расходы, связанные с удалением, улавливанием и последующей утилизацией растворителей, используемых при импрегнировании катетеров.
Задачей, решаемой заявленным изобретением, является создание недорогих антимикробных СКШС с контролируемым выделением активного вещества (рифампицина), позволяющим при сохранении необходимого качества поверхности и соответственно необходимой пропускной способности катетера обеспечить непрерывное поступление активного препарата в ткани организма в течение времени, необходимого для оказания требуемого лечебного эффекта.
Поставленная задача решается путем введения рифампицина в резиновые композиции на основе силоксанового каучука, применяемые для изготовления изделий медицинского назначения.
Пример рецептуры одной из таких композиций представлен ниже.
На вальцах готовят резиновую смесь следующего состава, масс. ч.:
При этом важным остается определение главных факторов, влияющих на процесс высвобождения рифампицина из стенки катетера.
Проведенные исследования показали, что такими факторами являются количество введенного рифампицина в исходную композицию на основе силиконового каучука, а также температурный режим второй стадии вулканизации, которая проводится непосредственно за первой стадией, совмещенной с процессом формования катетера.
Установлено, что при применении смеси, используемой для получения СКШС, наполненной рифампицином в пределах 1-3 масс.ч., с последующим ее формованием, совмещенным с первой стадией вулканизации, осуществляемой при температуре 170-190°С, и второй стадией вулканизации, проводимой непосредственно за формованием в пределах температур 150-190°С, получается катетер, который будучи имплантированным в организм, способен за счет диффузионного фактора высвобождать антибиотик в количествах, необходимых для поддержания антимикробного эффекта не менее двух месяцев с момента имплантации.
Температурный режим формования, совмещенный с первой стадией вулканизации, обоснован, с одной стороны, необходимостью получения катетера с набором требуемых технических свойств, а с другой стороны, требованием предохранить антибиотик (рифампицин) от разложения, имеющего место при более высоких температурах (начиная от 200°С).
В то же время температурный режим второй стадии вулканизации является решающим фактором, определяющим постепенный выход рифампицина из катетеров после их имплантации в течение не менее чем двух месяцев.
Таким образом, изменением характера диффузии введенного в количестве 1-3 масс.ч. рифампицина через стенку катетера в результате изменения температурного режима второй стадии вулканизации, достигнуто увеличение выхода рифампицина до количеств, гарантирующих защиту пациентам от бактериального заражения в сроки от двух и более месяцев.
Последнее обстоятельство, а именно увеличение продолжительности антибактериального действия катетера до двух месяцев и более за счет диффузии рифампицина, введенного в указанном количестве, является основным техническим результатом заявленного изобретения. Достижение технического результата - придания силиконовому катетеру шунтирующей системы, используемой для лечения гидроцефалии, пролонгированных антимикробных свойств обусловлено созданием условий для постепенного, равномерного и, за счет этого, более продолжительного выхода рифампицина, равномерно распределенного по всей толщине стенки катетера, т.е. принципиальным изменением характера диффузии рифампицина и гарантированной его практически постоянной концентрации при выходе, сохраняющейся в течение длительного времени.
Следует указать, что выбранные пределы введения рифампицина диктуются следующими причинами. При содержании рифампицина более 3 масс.ч. возможно выделение его в количествах настолько больших (более 4,5 мг/(с⋅см2), что может оказывать негативное воздействие на детский организм, а также отрицательно влиять на качество поверхности катетера.
Наоборот, при более низком содержании, менее 1 масс.ч, выделение рифампицина может быть недостаточным (менее 1 мг/(с⋅см2)) для организации необходимого уровня лечения.
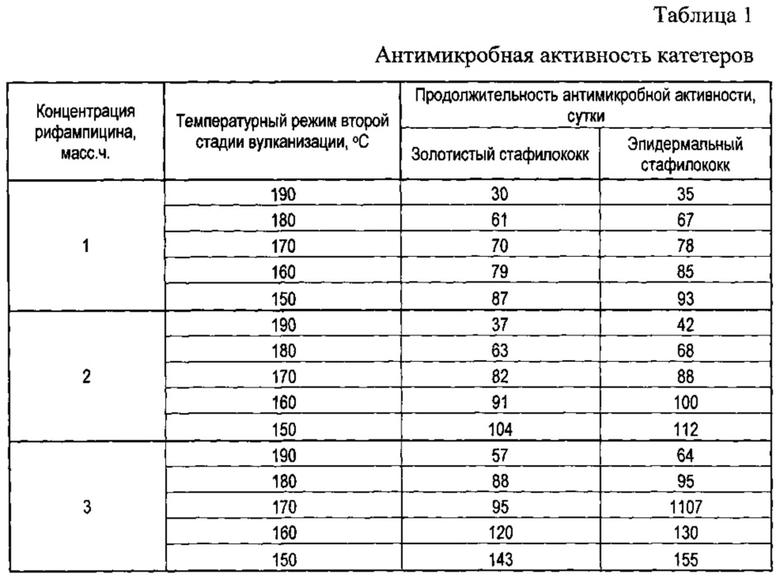
Для иллюстрации предлагаемого изобретения сравнивали антибактериальную активность катетеров с разным содержанием рифампицина и изготовленных при разных температурных режимах второй стадии вулканизации.
Для исследования антибактериальной активности образцов использовали модифицированный метод Kirby-Bauer. В качестве тестовых штаммов были выбраны S. aureus (золотистый стафилококк), S. Eepidermidis (эпидермальный стафилококк).
Оценку антибактериальной активности проводили в чашках Петри на плотной питательной среде Agar Mueller-Hinton (рН 7.4±0.2). Посевная доза бактерий составляла 106 КОЕ/мл (колониеобразующие единицы). На поверхность засеянных чашек помещали по 3-4 образца из каждой испытуемой группы изделия. Все образцы инкубировали при 37°С в течение 24 часов, после чего измеряли диаметры зон задержки роста бактерий вокруг образцов изделия.
Для выявления продолжительности сохранения антибактериальной активности изделия образцы, вокруг которых имелись зоны задержки роста (даже минимальные), ежедневно переносились в свежезасеянные чашки до полного отсутствия зон подавления роста микроорганизмов.
Экспериментальные данные, иллюстрирующие представленную заявку на патентование, приведены в табл. 1.
Как видно из представленных данных, с уменьшением температуры второй стадии вулканизации катетера продолжительность антимикробного действия заметно меняется. Отсюда были выявлены оптимальные температурные параметры второй стадии вулканизации катетера в сочетании с необходимым содержанием рифампицина, обеспечивающие требуемый режим выделения рифампицина на поверхности катетеров. Это температурные пределы от 150-190°С при содержании рифампицина 1-3 масс.ч.
При температуре выше 190°С начинается процесс плавления и последующего разрушения рифампицина, тогда как понижение температуры ниже 150°С не представляется целесообразным, поскольку каталитическая активность платинового катализатора минимальна.
| название | год | авторы | номер документа |
|---|---|---|---|
| Антимикробная композиция на основе силоксанового каучука | 2016 |
|
RU2619836C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ ИЗ СИЛИКОНОВЫХ РЕЗИНОВЫХ КОМПОЗИЦИЙ С АНТИМИКРОБНЫМ ПОКРЫТИЕМ, СПОСОБ ИЗГОТОВЛЕНИЯ СИЛИКОНОВЫХ ПЕССАРИЕВ С АНТИМИКРОБНЫМ ПОКРЫТИЕМ И СИЛИКОНОВЫЙ ПЕССАРИЙ, ИЗГОТОВЛЕННЫЙ ЭТИМ СПОСОБОМ | 2013 |
|
RU2542428C1 |
| ЗАЩИТНОЕ ПОКРЫТИЕ КАТЕТЕРОВ | 2015 |
|
RU2580281C1 |
| Антимикробный тимпанальный шунт | 2016 |
|
RU2632766C1 |
| Способ оценки влияния средств, используемых для профилактики катетер-ассоциированных инфекций, на бактериальную колонизацию поверхности катетеров | 2021 |
|
RU2770112C1 |
| СПОСОБ МЕСТНОЙ АНТИБАКТЕРИАЛЬНОЙ ПРОФИЛАКТИКИ РЕЦИДИВА ПРИ ОДНОЭТАПНОМ РЕВИЗИОННОМ ЭНДОПРОТЕЗИРОВАНИИ У ПАЦИЕНТОВ С ПЕРИПРОТЕЗНОЙ ИНФЕКЦИЕЙ | 2021 |
|
RU2757263C1 |
| СПОСОБ И РЕТРАКТОР ДЛЯ ИНТРАОПЕРАЦИОННОЙ АНТИБАКТЕРИАЛЬНОЙ ПРОФИЛАКТИКИ ПЕРИПРОТЕЗНОЙ ИНФЕКЦИИ ВО ВРЕМЯ ОПЕРАЦИИ ФАЛЛОПРОТЕЗИРОВАНИЯ | 2020 |
|
RU2749763C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИБАКТЕРИАЛЬНОЙ ПОЛИМЕРНОЙ МЕМБРАНЫ | 2011 |
|
RU2489199C1 |
| КОМПОЗИЦИЯ I-II, СОДЕРЖАЩИЕ ЕЕ ИЗДЕЛИЯ И ЕЕ ПРИМЕНЕНИЯ | 2011 |
|
RU2597393C2 |
| СПОСОБ ДРЕНИРОВАНИЯ БОКОВЫХ ЖЕЛУДОЧКОВ У НОВОРОЖДЕННЫХ С ИНТРАВЕНТРИКУЛЯРНЫМИ КРОВОИЗЛИЯНИЯМИ | 2005 |
|
RU2295363C1 |
Изобретение относится к медицине и может быть использовано для изготовления катетера шунтирующей системы для лечения гидроцефалии. Для этого в материал стенки катетера включают рифампицин. Предварительно смешивают силиконовую композицию с рифампицином до содержания рифампицина в смеси от 1 до 3 массовых частей и проводят последующее формование катетера. При этом совмещают формование с первой стадией вулканизации, осуществляемой при температуре 170-190°C. Затем непосредственно за формованием проводят вторую стадию вулканизации, при этом температурные пределы второй стадии вулканизации составляют 150-190°C. Изобретение обеспечивает поддержание антимикробного эффекта не менее двух месяцев после имплантации катетера, используемого для лечения гидроцефалии. 1 табл.
Способ изготовления катетера шунтирующей системы для лечения гидроцефалии, заключающийся во включении рифампицина в материал стенки катетера, сформованного из силиконовой композиции, отличающийся тем, что предварительно смешивают силиконовую композицию с рифампицином до содержания рифампицина в смеси от 1 до 3 массовых частей и проводят последующее формование катетера, совмещая формование с первой стадией вулканизации, осуществляемой при температуре 170-190°C, затем непосредственно за формованием проводят вторую стадию вулканизации, при этом температурные пределы второй стадии вулканизации составляют 150-190°C.
| US 5902283 A, 11.05.1999 | |||
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ГИДРОЦЕФАЛИЕЙ | 2002 |
|
RU2215549C1 |
| ЛЕГЗДАЙН М.А | |||
| и др | |||
| Опыт применения шунтирующих систем, импрегнированных антибиотиками, в лечении различных форм гидроцефалии | |||
| Нейрохирургия и неврология Казахстана, 2009, N 2-3 (15-16), с.81 | |||
| HAMPL J et al | |||
| In vitro and in vivo efficacy of a rifampin-loaded silicone catheter for the prevention of CSF shunt infections | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Найдено из Интернета [он-лайн] на сайте: https://www.ncbi.nlm.nih.gov/pubmed/8748757. | |||
Авторы
Даты
2017-05-23—Публикация
2016-07-26—Подача