Перекрестная ссылка на родственные заявки
Данная заявка заявляет приоритет предварительной заявки US 61/419277, поданной 3 декабря 2010 г. Содержание этой предварительной заявки настоящим включается в данную заявку посредством ссылки во всей своей полноте.
Область техники
Изобретение, раскрытое в данном документе, относится к области способов получения енаминов.
Уровень техники
Енамины представляют собой полезные молекулы. Их используют во множестве реакций, таких как, например, электрофильное замещение и присоединение, окисление и восстановление и циклоприсоединение (J.Kang, Y.R. Cho и J.H. Lee, Bull. Korean Chem Soc. Vol. 13, No.2, 1992).
Раннее способ получения енаминов включал конденсацию альдегидов и кетонов со вторичными аминами (С. Mannich и H. Davidsen, Ber., 69, 2106 (1936)). Mannich и Davidsen обнаружили, что реакцию конденсации альдегида со вторичным амином можно проводить при температурах, близких к 0°С, в присутствии карбоната калия (K2CO3), но, несмотря на это, для проведения реакции конденсации кетона со вторичным амином требуется присутствие оксида кальция (CaO) и высокая температура. Позже Herr и Heyl обнаружили, что проведение такого типа реакций конденсации можно улучшить путем удаления воды (H2O) в ходе азеотропной перегонки с бензолом (M.E. Herr и F.W. Heyl, J. Am. Chem. Soc., 74, 3627 (1952); F.W. Heyl и M.E. Herr, J. Am. Chem. Soc., 75, 1918 (1953); M.E. Herr и F.W. Heyl, J. Am. Chem. Soc., 75, 5927 (1953); F.W. Heyl и M.E.Herr, J. Am. Chem. Soc., 77, 488 (1955)). После данных публикаций было сделано большое количество модификаций способа. Обычно эти модификации основаны на использовании водоотнимающих средств, таких как K2CO3, CaO, п-толуолсульфокислоты (TsOH), эфирата трехфтористого бора (BF3-OEt2), уксусной кислоты (AcOH), сульфата магния (MgSO4), гидрида кальция (CaH2), тетрахлорида титана (TiCl4) и молекулярных сит (см. J. Kang выше). Другие модификации включают химическое превращение воды в какое-либо другое вещество в ходе реакции конденсации (см. J. Kang выше). Подробный обзор большого количества способов получения енаминов представлен в «ЕНАМИНЫ, синтез, структура и реакции». 2-е издание. Под редакцией A. G. Cook, Гл. 2, (1988). Конкретные примеры способов получения енаминов можно найти в следующих источниках:
Патент US 3074940, раскрывающий, что некоторые альдегиды образуют азеотропные смеси с водой, что можно использовать для удаления реакционной воды, образующейся в ходе реакций конденсации некоторых енаминов;
патент US 3530120, раскрывающий реакцию конденсации некоторых енаминов с молекулами арсина в инертной атмосфере;
патент US 5247091, раскрывающий реакции конденсации енаминов в водной среде (S. Kaiser, S.P. Smidt и A. Pfaltz, Angew. Int. Ed. 2006, 45, 5194-5197 и WO 2009/007460 А2, пример 1.а).
Енамины, такие как 1-(3-метилтиобут-1-енил)пирролидин, используют в качестве промежуточных соединений при получении некоторых новых инсектицидов (см., например, U.S. Patent Publications 2005/0228027 и 2007/0203191). Известные в настоящее время способы получения таких тиоенаминов неэффективны в промышленном производстве такого рода енаминов по множеству причин - проблемы предотвращения термического разложения тиоенамина, и несмотря на то, что используемый карбонат калия является эффективным осушителем, проблематично отфильтровать осушитель такого рода в ходе более масштабного производства, чем лабораторный масштаб. Таким образом, в ходе этих типов реакций конденсации требуется удаление воды без использования твердых осушителей или без использования температурных условий, способствующих термическому разложению такого рода енаминов.
Подробное описание изобретения
В общем, способы, раскрытые в данном документе, могут быть проиллюстрированы схемой 1.
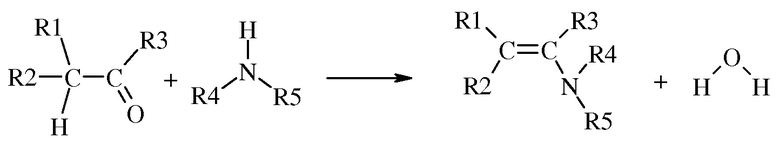
Схема 1
В основном данное изобретение представляет собой способ , включающий:
(А) взаимодействие первой смеси со второй смесью в реакционной зоне,
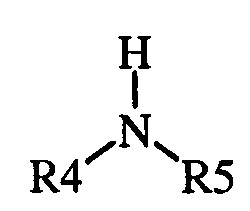
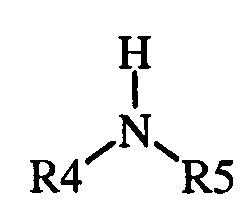
(1) где указанная первая смесь содержит амин следующей формулы
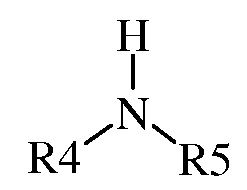
где каждый R 4 и R 5 представляет собой радикал , независимо выбранный из С 1 -С 8 алкила , С 3 -С 8 циклоал кила , С 2 -С 8 алкоксиалкила , С 7 -С 12 арилалкила , С 2 -С 8 алкиламиноалкила, арила и гетероарила , или R 4 и R 5, взятые вместе с N , представляют собой 5- или 6-членное насыщенное или не насыщенное кольцо, и
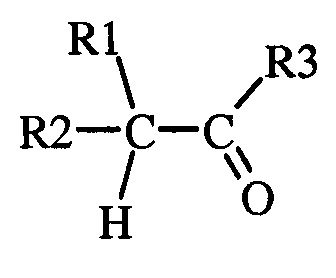
(2) где указанная вторая смесь содержит неполярный растворитель с высокой температурой кипения и карбонил (т.е. альдегид или кетон) следующей формул ы
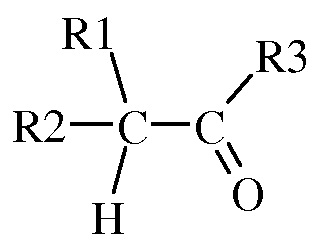
(а) где каждый R 1 и R 2 представляет собой радикал, независимо выбранный из С 1 -С 8 алкила , С 3 -С 8 циклоалкила , С 2 -С 8 алкоксиалкила , С 7 -С 12 арилалкила , С 2 -С 8 алкиламиноалкила, арила и гетероарила , каждый из которых независимо замещен одним или более S - R 6, где каждый R 6 независимо выбран из С 1 -С 8 алкилов, С 3 -С 8 циклоалкилов, С 2 -С 8 алкоксиалкилов, С 7 -С 12 арилалкилов, С 2 -С 8 алкиламиноалкилов, арилов и гетероарилов, и
( b ) где R 3 выбран из H , С 1 -С 8 алкилов, С 3 -С 8 циклоалкилов, С 2 -С 8 алкоксиалкилов, С 7 -С 12 арилалкилов, С 2 -С 8 алкиламиноалкилов, арилов и гетероарилов;
(В) взаимодействие в указанной реакционной зоне указанного амина и указанного карбонила с получени ем енамина и H 2 O , где указанное взаимодействие проводят в условиях дистилляции, включающих :
(1) давление от примерно 100 п аска лей (Па) до примерно 120000 Па и
(2) температуру примерн о ниже, но предпочтительно ниже температуры термического разложения указанного енамина в условиях указанного взаимодействия ; и
(С) удаление паровой фазы из указанной реакционной зоны, где указанная паровая фаза содержит указанный неполярный растворитель с высокой температурой кипения и H 2 O ,
где отношение
(количество первой смеси, добавленной к указанной реакционной зоне) : (количество паровой фазы, удаленной из указанной реакционной зоны)
равно от примерно
(1 часть добавленной первой смеси) : (1 часть удаленной паровой фазы)
до примерно
(1 часть добавленной первой смеси) : (20 частей удаленной паровой фазы).
В основном указанное взаимодействие можно осуществить любым способом, однако более предпочтительно, если указанная первая смесь взаимодействует с указанной второй смесью в указанной реакционной зоне , такой что указанное взаимодействие происходит на или ниже поверхности указанной второй смеси.
В способе можно использовать приблизительно эквимолярные количества указанного амина и указанного карбонила, хотя избытки одного или другого могут быть также использованы. Молярное отношение количеств амина и карбонила может быть равно от примерно 0,9 до примерно 1, 2, однако незначительный молярный избыток амина по сравнению с карбонилом явля ется предпочтительным, например молярно е отношение, составляющее более 1, но мене е примерно 1, 1.
Взаимодействие осуществляют в присутствии неполярного растворителя с высо кой температурой кипения, такого как углеводородные растворители, наиболее предпочтительными являются ароматические уг леводородные растворители, такие как, например, бензол, толуол или ксилол. В настоящее время толуол является предпочтительным растворителем.
В другом варианте осуществлени я данного изобретения указанное взаимодействие проводят в условиях дистилляции, включающих температуру, при которой большая часть, если не весь указанн ый непрореагировавш ий карбонил , находится предпочтительно в указанной второй смеси, а не в указанной паровой фазе. Предпочтительно сохранять карбонил во второй смеси для осуществления его взаимодействия с амином и предотвращения образования азеотропа вода-альдегид. Например, если используют бутиральдегид, желательный интервал температур - от примерно 60 ° С до примерно 80 ° С при давлении 1 атм.
В другом варианте ос уществления данного изобретения указанное взаимодействие осуществляют в условиях дистилляции, включающих давление от примерно 1000 Па до примерно 60000 Па и температуру от примерно 10 ° С до примерно 80 ° С.
В другом варианте осуществления данного изобретения указанное взаимодействие осуществляют в условиях дистилляции, включающих давление от примерно 2500 Па до примерно 30000 Па и температуру от примерно 20 ° С до примерно 70 ° С.
В другом варианте осуществления данного изобретения указанное взаимодействие осуществляют в условиях дистилляции, включающих давление от примерно 5000 Па до примерно 15000 Па и температуру от примерно 25 ° С до примерно 65 ° С. В другом варианте осуществления изобретения предпочтительно поддержание температуры ниже температуры термического разложения 1-(3-метилсульфанил-бут-1-енил)-пирролидина в ходе реакции получения 1-(3-метилсульфанил-бут-1-енил)-пирролидина.
В способах такого рода предпочтительно, чтобы реакцию конденсации проводили в азеотропных условиях с целью удаления желаемого количества воды. Также предпочтительно, чтобы для удаления воды не были использованы осушители.
В другом варианте осуществления данного изобретения R 1 и R 2 независимо представляют собой С 1 -С 8 алкил , С 3 -С 8 циклоалкил , каждый из которых независимо замещен одним или более S - R 6, где каждый R 6 независимо выбран из С 1 -С 8 ал кила .
В другом варианте осуществления данного изобретения R 3 представляет собой H .
В другом варианте осуществления данного изобретения R 4 и R 5 каждый независимо выбран из С 1 -С 8 алкил а и С 3 -С 8 циклоалкила . В другом варианте осуществления изобретения R 4 и R 5, взятые вместе с N , представляют 5- или 6-членное насыщенное или не насыщенное кольцо.
В другом варианте осуществления данного изобретения указанная первая смесь содержит пирролидин, а указанная вторая смесь содержит 3-метилсульфанил-бутиральдегид. В другом варианте осуществления данного изобретения указанный енамин представляет собой 1-(3-метилсульфанил-бут-1-енил)-пирролидин.
В другом варианте осуществления данного изобретения первая смесь и вторая смесь по мере добавления могут взаимодействовать в реакционной зоне.
В другом варианте осуществления данного изобретения отношение
(количество первой смеси, добавленной к указанной реакционной зоне) : (количество паровой фазы, удаленной из указанной реакционной зоны)
равно от примерно
(1 часть добавленной первой смеси) : (2 части удаленной паровой фазы)
до примерно
(1 часть добавленной первой смеси) : (15 частей удаленной паровой фазы).
В другом варианте осуществления данного изобретения отношение
(количество первой смеси, добавленной к указанной реакционной зоне) : (количество паровой фазы, удаленной из указанной реакционной зоны)
равно от примерно
(1 часть добавленной первой смеси) : (3 части удаленной паровой фазы)
до примерно
(1 часть добавленной первой смеси) : (10 частей удаленной паровой фазы).
Примеры
Примеры представлены для иллюстрации целей изобретения, но не в качестве ограничивающих изобретение, раскрытое в данном документе, в данных примерах раскрыты только варианты изобретения.
1. Получение 3-метилтиобутаналя (1) из кротональдегида
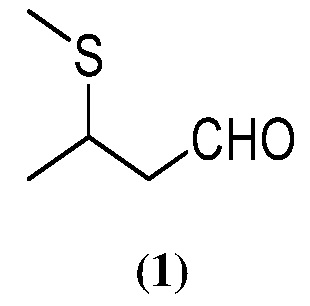
Трехлитровую (л) трехгорлую круглодонную колбу, оснащенную магнитной мешалкой, температурным зондом, капельной воронкой, насадкой для перегонки, наполненной азотом; и очищаемую при помощи отбеливающего газо уловителя , наполнили 100 мл толуола с последующим добавлением 84 г (1, 39 моль) безводной уксусной кислоты с последующим добавлением 61 г (0, 86 моль) кротональдегида. Другие 100 мл толуола используют в качестве раствора для промывки в ходе добавления уксусной кислоты и кротональдегида. Реакционную смесь охлаждают в водяной бане со льдом, а затем через капельную воронку добавляют 500 г (0,906 моль) 12, 7% по массе водного раствора метилмеркаптида натрия в течение 67-минутного (мин) периода. Внутренняя реакционная температура в ходе добавления раст вора меркаптида возрастает с 2 ° С до 13 ° С, а реакционный pH , измеренный с использованием рН индикаторной бумаги, равен приблизительно ~ 7. Водяную баню со льдом убирают и нагревают реакционную смесь до 50 ° С в течение 10 часов (ч). На данном этапе хроматографический газоанализатор (ГХ) показал примерно ~ 0, 8% (относительная площадь) для исходного кротональдегида. Реакци онную смесь затем переносят в 2 -литровую делительную воронку и разбавляют смесь другими 400 мл толуола. Нижний водный слой отфильтровывают и сливают. Оставшийся органический слой промывают 300 мл чистой воды. Нижний водный слой сливают, а оставшийся органический слой переносят обратно в реакционный сосуд. Затем реакционную смесь подвергают азеотропно й отгонке с целью сушки в температурном интервале от 19 ° С до 22 ° С и вакууме при ~ 5300 Па на протяжении примерно 40 мин. Собранный дистиллят содержит в большем количестве толуол и примерн о 0, 2% 3-метилтиобутаналя. После завершения отгонки оставшиеся в сосуде реакционные слои изолируют с целью получения светло-желтого раствора 536 г 3-метилтиобутаналя в толуоле. Газовохром ато графический количественный анализ данной смеси (с использованием дипропилфталата в качестве вн утреннего стандарта) показал 17, 6%-ное содержание по массе 3-метилтиобутаналя (1) в толуоле и 93%-ный выход продукта.
2. Получение 3-метилтиобутаналя (1) из кротональдегида
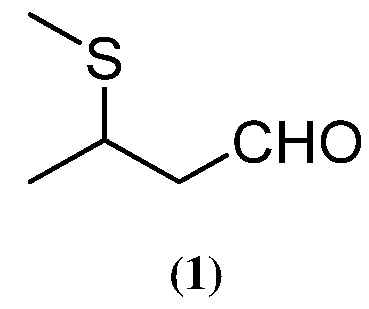
Трехгорлую круглодонную колбу на 500 мл последовательно наполняют 25,00 г (0, 35 моль) 99% кр отональдегида, затем 28,03 г (0, 47 моль) безводной уксусной кислот ы и в конечном счете 57,26 г (0, 62 моль) толуола. Реакционную смесь перемешивают при помощи магнитной мешалки и охлаждают в водяной бане со льдом. Как только внутренняя реакционная температура достигает 2 ° С, через капельную воронку добавляют 143, 79 г (0, 431 моль) 21%-ного по массе водного раствора метил меркаптида натрия в течение 56-минутного периода, а внутренняя реакционная температура в сосуде в ходе добавления возрастает с 2 ° С до 10 ° С. рН, измеренный с использованием индикаторной бумаги, равен приблизительно 7. Водяную баню со льдом убирают и нагревают реакционную смесь до 60 ° С в течение 24 ч, после этого периода реакционной смеси дают возможность о стыть. Фазы реакционной смеси раз деляют. Нижнюю водную фазу ( 147, 95 г ) сливают в поток отходов. Верхнюю органическую фазу ( 97, 6 г ) изолируют. Газово - хроматографический количественный анализ данной смеси (с использованием дипропилфталата в качестве внутреннего ста ндарта) показал 37, 5%-ное содержание по массе 3-метилтиобутаналя (1) в толуоле и 88%-ный выход продукта.
3. Получение 1-(3-метилсульфанилбут-1-енил)пирролидина (2)
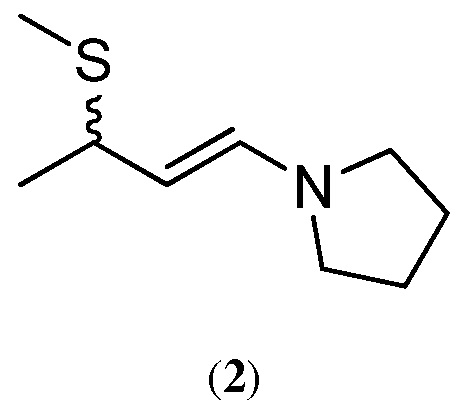
Трехгорлую круглодонную колбу на 500 мл, снабженную насадкой для фракционной перегонки , наполнили 96,55 г (0,31 моль) 37, 5%-ного по массе раствора 3-метилтиобутаналя в толуоле (из Примера 2) с п оследующим добавлением 276 г (3, 0 моль) чистого толуола. Реакционную смесь нагревают до 35 ° С и осуществляют кипячение системы с обратным холодильником при пониженном давлении примерно ~ 9300-10 600 Па. Во время кипячения смесь перемешивают в течение 45 мин, а затем собирают сверху 1 5 , 5 г дистиллята в течение 22 , 0 мин, пока температура сосуда равна примерно 39 ° С. Дополнительны е 16, 5 г дистиллята собирают в течение 12 мин, пока температура сосуда равна примерно 46 ° С. После сбора второй фракции в нижние слои реакционной смеси непрерывно добавляют 21,8 г (0, 31 моль) пирролидина в течение 55 , 0 мин . В ходе добавления пирролидина были соблюдены нижеследующие дистилляционные параметры :
Температура сосуда: 35-47°С.
Температура верхних слоев: 30-47°С.
Давление: примерно 9300-10 600 Па .
В конце добавления пирролидина слои, лежащие ниже линии раздела фаз, промывают примерно 0, 86 г толуола. Дистилляцию продолжают в течение 47 дополнительных минут, убирая сверху легкие слои. Вакуум сбрасывают путем промывки системы азотом, а затем смесь охлаждают до температуры окружающей среды. Собирают в общей сложности 146, 21 г дистиллята. Собирают в общей сложности 186 , 82 г низших дистилляционных слоев и анализируют выход продукта реакции. 1 H NMR спектроскопический анализ смеси продуктов (с использованием бензилацетата в качестве внутреннего стандарта и CDCl 3 в ка честве растворителя) показал 24, 6%-ное содержание по массе 1-(3-метилсульфанилбут-1-енил)пирролидина (2) в толуоле и 87%-ный выход продукта.
4. Получение 1-(3-метилсульфанилбут-1-енил)пирролидина (2)
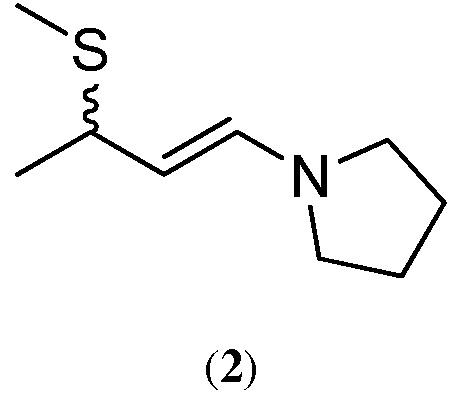
Трехгорлый реактор на 700 мл с рубашкой, снабженный насадкой для фракционной перегонки, наполняют 17 ,00 г (0,326 моль) 22, 7%-ного по массе раствора 3-метилтиобутаналя в толуоле с последующим добавлением дополнительных 284 г (9 , 44 моль) чистого толуола. Реакционную смесь нагревают до 45 ° С и подвергают действию пониженного давления примерно ~ 10600 Па и затем непрерывно добавляют в нижние слои реакционной смеси 24 ,63 г (0, 343 моль) пирролидина в течение 15 мин . В ходе добавления пирролидина были соблюдены нижеследующие дистилляционные параметры :
Температура сосуда : 41-45 ° С .
Температура верхних слоев : 38-40 ° С .
Давление: примерно 10,600 Па .
В конце добавле ния пирролидина слои, лежащие ниже линии раздела фаз, промывают примерно 0, 86 г толуола. Дистилляцию продолжают в течение 28 дополнительных минут, убирая сверху легкие слои. Вакуум сбрасывают путем промывки системы азотом, а затем смесь охлаждают до температуры окружающей среды. Собирают в общей сложности 248, 25 г дистиллята. Собирают в общей сложности 192, 70 г низших дистилляционных слоев и анализируют выход продукта реакции. 1 H NMR спектроскопический анализ смеси продуктов (с использованием бен з и лацетата в качестве внутреннего стандарта и CDCl 3 в качестве растворителя) показал 19 , 3%-ное содержание по массе 1-(3-метилсульфанилбут-1-енил)пирролидина (2) в толуоле и 86%-ный выход продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЕНАМИНОВ | 2011 |
|
RU2586046C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЕНАМИНОВ | 2011 |
|
RU2595036C2 |
| ЦИТОТОКСИЧЕСКИЕ ПЕПТИДЫ И ИХ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2012 |
|
RU2586885C2 |
| АМИНОЗАМЕЩЕННЫЕ ПИРАЗОЛЫ И ПРОМЕЖУТОЧНЫЕ АМИНОЗАМЕЩЕННЫЕ ПИРАЗОЛЫ | 1993 |
|
RU2142455C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ ДЛЯ ХИНОЛОНОВЫХ АНТИБИОТИКОВ | 2003 |
|
RU2289576C2 |
| НОВЫЕ СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2195450C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХИНОЛИНА | 2001 |
|
RU2263110C2 |
| АРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ 6,7-ДИЗАМЕЩЕННЫХ 3-ХИНОЛИНКАРБОКСАМИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ ДЛЯ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВА | 2002 |
|
RU2281940C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТИАЗОЛА, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1997 |
|
RU2191775C2 |
| УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 1-ЗАМЕЩЕННЫХ 2-ТРИФТОРМЕТИЛ-5-АЛКИЛПИРИДИНОВ | 2011 |
|
RU2608317C2 |
Изобретение относится к усовершенствованному способу получения енаминов общей формулы (I), которые могут быть использованы в качестве промежуточных продуктов для получения инсектицидов. Согласно способу получают енамины общей формулы (I)
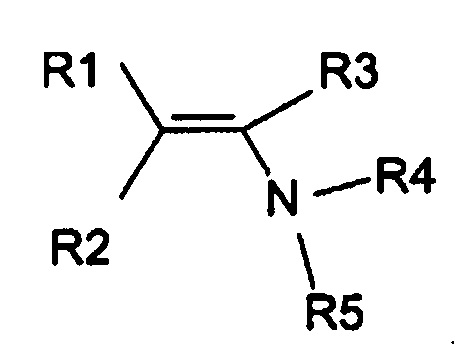
и воду. Способ включает (А) взаимодействие первой смеси со второй смесью в реакционной зоне, (1) где указанная первая смесь содержит амин формулы
 ,
,
где R4 и R5, взятые вместе с N, представляют 5- или 6-членное насыщенное или ненасыщенное кольцо, и (2) где указанная вторая смесь содержит неполярный растворитель с высокой температурой кипения и карбонил, выбранный из альдегида или кетона следующей формулы:
в которой (a) один из R1 и R2 представляет собой радикал, независимо выбранный из C1-C8алкила, и другой представляет собой S-R6, где R6 независимо выбран из C1-C8алкила, и (b) R3 выбран из Н и C1-C8алкила; при этом указанный амин добавляют в нижние слои реакционной смеси, (B) взаимодействие в указанной реакционной зоне указанного амина и указанного карбонила с получением енамина и Н2О в условиях азеотропной дистилляции, включающих (1) давление от примерно 1000 паскалей (Па) до примерно 60000 Па и (2) температуру ниже температуры термического разложения указанного енамина в ходе указанного взаимодействия; и (C) удаление паровой фазы из указанной реакционной зоны, где указанная паровая фаза содержит указанный неполярный растворитель с высокой температурой кипения и Н2О, где массовое соотношение (количество первой смеси, добавленной к указанной реакционной зоне):(количество паровой фазы, удаленной из указанной реакционной зоны) равно от примерно (1 часть добавленной первой смеси):(1 часть удаленной паровой фазы) до примерно (1 часть добавленной первой смеси):(20 частей удаленной паровой фазы). Преимущественно в качестве амина используют пирролидин, в качестве карбонила и неполярного растворителя используют 3-метилсульфанил-бутиральдегид и толуол с получением в качестве целевого продукта 2-(3-метилсульфанилбут-1-енил)пирролидина. Способ позволяет получать продукты с высоким выходом (до 86%), исключить использование осушителей, а также позволяет проводить процесс без использования температурных условий, способствующих термическому разложению получаемых енаминов. 2 н. и 13 з.п. ф-лы, 4 пр.
1. Способ получения енаминов общей формулы (I),
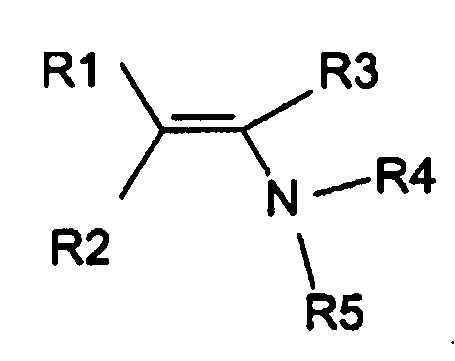
где R1, R3, R4 и R5 определены ниже и
воды,
включающий
(А) взаимодействие первой смеси со второй смесью в реакционной зоне,
(1) где указанная первая смесь содержит амин следующей формулы
 ,
,
где R4 и R5, взятые вместе с N, представляют 5- или 6-членное насыщенное или ненасыщенное кольцо, и
(2) где указанная вторая смесь содержит неполярный растворитель с высокой температурой кипения и карбонил, выбранный из альдегида или кетона следующей формулы
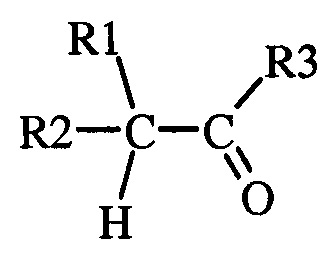 ,
,
в которой (a) один из R1 и R2 представляет собой радикал, независимо выбранный из C1-C8алкила, и другой представляет собой S-R6, где R6 независимо выбран из C1-C8алкила, и
(b) R3 выбран из Н и C1-C8алкила;
причем указанный амин добавляют в нижние слои реакционной смеси,
(B) взаимодействие в указанной реакционной зоне указанного амина и указанного карбонила с получением енамина и Н2О, где указанное взаимодействие осуществляют в условиях азеотропной дистилляции, включающих:
(1) давление от примерно 1000 паскалей (Па) до примерно 60000 Па и
(2) температуру ниже температуры термического разложения указанного енамина в ходе указанного взаимодействия; и
(C) удаление паровой фазы из указанной реакционной зоны, где указанная паровая фаза содержит указанный неполярный растворитель с высокой температурой кипения и Н2О,
где массовое соотношение
(количество первой смеси, добавленной к указанной реакционной зоне):(количество паровой фазы, удаленной из указанной реакционной зоны)
равно от примерно
(1 часть добавленной первой смеси):(1 часть удаленной паровой фазы)
до примерно
(1 часть добавленной первой смеси):(20 частей удаленной паровой фазы).
2. Способ по п. 1, где указанная первая смесь взаимодействует с указанной второй смесью в указанной реакционной зоне таким образом, что указанное взаимодействие происходит на или ниже поверхности указанной второй смеси.
3. Способ по п. 1, где молярное отношение количеств амина и карбонила, использованное при взаимодействии, составляет более 1, но менее примерно 1,1.
4. Способ по п. 1, где указанный неполярный растворитель с высокой температурой кипения представляет собой толуол.
5. Способ по п. 1, где указанное взаимодействие осуществляют в условиях азеотропной дистилляции, включающих давление от примерно 1000 Па до примерно 60000 Па и температуру от примерно 10°С до примерно 80°С.
6. Способ по п. 1, где указанное взаимодействие осуществляют в условиях азеотропной дистилляции, включающих давление от примерно 2500 Па до примерно 30000 Па и температуру от примерно 20°С до примерно 70°С.
7. Способ по п. 1, где указанное взаимодействие осуществляют в условиях азеотропной дистилляции, включающих давление от примерно 5000 Па до примерно 15000 Па и температуру от примерно 25°С до примерно 65°С.
8. Способ по п. 1, где один из R1 и R2 независимо представляет собой C1-C8алкил, а другой представляет собой S-R6, где каждый R6 независимо выбран из C1-C8алкила.
9. Способ по п. 1, где R3 представляет собой Н.
10. Способ по п. 1, где R4 и R5, взятые вместе с N, представляют 5- или 6-членное насыщенное или ненасыщенное кольцо.
11. Способ по п. 1, где указанная первая смесь содержит пирролидин, а указанная вторая смесь содержит 3-метилсульфанил-бутиральдегид.
12. Способ по п. 1, где указанный енамин представляет собой 1-(3-метилсульфанилбут-1-енил)-пирролидин.
13. Способ по п. 1, где соотношение
(количество первой смеси, добавленной к указанной реакционной зоне):(количество паровой фазы, удаленной из указанной реакционной зоны)
равно от примерно
(1 часть добавленной первой смеси):(2 части удаленной паровой фазы)
до примерно
(1 часть добавленной первой смеси):(15 частей удаленной паровой фазы).
14. Способ по п. 1, где соотношение
(количество первой смеси, добавленной к указанной реакционной зоне):(количество паровой фазы, удаленной из указанной реакционной зоны)
равно от примерно
(1 часть добавленной первой смеси):(3 части удаленной паровой фазы)
до примерно
(1 часть добавленной первой смеси):(10 частей удаленной паровой фазы).
15. Способ, включающий:
(A) взаимодействие первой смеси со второй смесью в реакционной зоне,
(1) где указанная первая смесь содержит пирролидин, и
(2) где указанная вторая смесь содержит 3-метилсульфанил-бутиральдегид и толуол;
(B) взаимодействие указанного пирролидина и указанного
3-метилсульфанил-бутиральдегида, где указанный пирролидин добавляют в нижние слои смеси, в указанной реакционной зоне с получением 1-(3-метилсульфанилбут-1-енил)-пирролидина и Н2О, где указанное взаимодействие осуществляют в условиях азеотропной дистилляции, включающих:
(1) давление от примерно 5000 Па до примерно 15000 Па и
(2) температуру от примерно 25°С до примерно 65°С; и
(С) удаление паровой фазы, содержащей толуол и Н2О и, по существу, не содержащей 3-метилсульфанил-бутиральдегид,
где массовое соотношение
(количество добавленной первой смеси):(количество удаленной паровой фазы)
равно от примерно
(1 часть добавленной первой смеси):(3 части удаленной паровой фазы)
до примерно
(1 часть добавленной первой смеси):(10 частей удаленной паровой фазы).
| US 3331875 A, 18.07.1967 | |||
| ROLF CARLSON et al | |||
| Improved Titanium Tetrachlorid Procedure for Enamine Synthesis | |||
| II | |||
| Scope of the Reaction, Acta Chemica Scandinavia B, 1984, 49-53 | |||
| US 3530120 A, 22.09.1970 | |||
| WO 20100004457 A1, 07.01.2010 | |||
| ПРОИЗВОДНЫЕ ХИНОЛИНА В КАЧЕСТВЕ АНТАГОНИСТОВ NPY | 2003 |
|
RU2298002C2 |
Авторы
Даты
2017-05-25—Публикация
2011-11-23—Подача