Настоящая заявка относится к новым замещенным пиперидинилпиразолопиримидинонам, к способам их получения, соединениям для применения по отдельности или в комбинациях в способе лечения и/или профилактики заболеваний, в частности для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них. Настоящее изобретение также относится к лекарственным средствам, содержащим соединения согласно настоящему изобретению для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелых менструальных кровотечений (НМВ), послеродового кровотечения, геморрагического шока, травмы, хирургии, трансплантации, инсульта, заболеваний печени, наследственной ангиодистрофии, кровотечения из носа и синовита и повреждения хряща после гемартроза.
Кровотечение является общим клиническим признаком наследственных и приобретенных гемостатических нарушений, травмы, хирургии, инсульта, тяжелого менструального кровотечения (НМВ) (также называемого меноррагией), послеродового кровотечения и заболеваний печени. Когда ткань повреждена, сосуды могут разрываться, немедленно запуская кровоостанавливающий механизм, что приводит к стабильной фибриновой сети. Фибринолитическая система активируется осаждением фибрина и способствует поддержанию открытого просвета в поврежденных кровеносных сосудах. Баланс между образованием и лизисом фибрина необходим для поддержания и повторного образования гемостатического уплотнения в течение нескольких дней, в течение которых поврежденная стенка сосуда восстанавливается.
Фибринолиз - физиологический механизм, который растворяет сгустки. Фибринолитическая система включает плазминоген, циркулирующий неактивный предшественник плазмина, эффективную сериновую протеазу, участвующую в растворении фибриновых сгустков крови. Тканевый активатор плазминогена (tPA) и активатор плазминогена урокиназного типа (uPA) являются двумя основными активаторами плазминогена, экспрессируемыми во многих типах клеток и тканях (Levi JH, Lancet 2010, 376, 9734, 3-4). Плазминоген связывается с лизиновыми остатками на поверхности фибрина и превращается в плазмин активатором, высвобождаемым из эндотелиальных клеток, tPA, который одновременно связывается с фибрином. В качестве части гемостатического баланса образование и активность плазмина также модулируются множеством ингибиторов, которые включают ингибитор активатора плазминогена (PAI-1), ингибитор фибринолиза, активируемый тромбином (TAFI) и α2-антиплазмин (Cesarman-Maus G, Hajjar KA, Br J Haematol 2005; 129: 307-21).
Активаторы фибринолиза могут терапевтически применяться для растворения кровяных сгустков в тромботических состояниях, таких как инфаркт миокарда или ишемический инсульт, чтобы избежание деградации окружающей ткани (Flemming М, Melzig MF, J Pharm Pharmacol. 2012, 64 (8): 1025-39). С другой стороны, ингибирование фибринолиза может быть и успешно и безопасно использовано в лечении кровотечений. После обширного повреждения тканей, которое происходит в результате травмы или операции, равновесие смещается, и полагают, что фибринолиз является важным фактором кровотечения и коагулопатии. У хирургических больных во многих исследованиях сообщалось об использовании антифибринолитических агентов для уменьшения кровотечения и необходимости аллогенных трансфузий. Наиболее часто используются лизиновые аналоги, ε-аминокапроновая кислота и транексамовая кислота, которые препятствуют связыванию плазминогена с фибрином, что необходимо для активации плазмина (Levi JH, Lancet 2010, 376, 9734, 3-4).
Антифибринолитики - это безопасная и эффективная концепция для снижения кровопотери и повторного кровотечения, без повышенного риска тромботических событий, например: при лечении гемостатических расстройств, таких как гемофилия и болезнь Виллебранда, при тяжелых менструальных кровотечениях (меноррагии) и в разных Хирургические условия.
Антифибринолитики являются безопасной и эффективной проверенной концепцией уменьшения кровопотери и повторного кровотечения без повышенного риска тромботических событий, например, при лечении гемостатических нарушений, таких как гемофилия и болезнь Виллебранда, при тяжелых менструальных кровотечениях (меноррагии) и в разных хирургических условия.
Кровотечение из-за нарушений/дисфункций тромбоцитов, таких как тромбазтемия Гланцмана и тромбоцитопения, а также вызванное антикоагулянтом кровотечение и дефицит PAI-1 могут быть потенциальными областями применения. Пациенты с острым промиелоцитарным лейкозом, у которых часто развиваются сильные кровотечения, также могут пройти антифибринолитическую терапию. Кроме того, было высказано предположение, что блокирование фибринолиза потенциально может быть полезным для блокирования индуцированного плазмином протеолиза, который может иметь биологическое значение во время атеротромбоза и воспалительных состояний, рака и других заболеваний.
Кроме того, было описано, что антиплазмин может быть использован для лечения синовита и повреждения хряща после гемартроза у пациентов с лежащими в основе гемостатическими нарушениями, включая гемофилию и болезнь Виллебранда (L. Nieuwenhuizen L, Roosendaal G, Masterbergen SC, Coeleveld K, Biesma DH, Lafeber FPJG, and Schuthens, REG, J Thrombosis and Haemostasis 2013, 12: 237-245).
Еще одной потенциальной областью применения антифибринолитиков является лечение носового кровотечения, вызванного травмой и другими причинами, также в сочетании с лежащими в основе гемостатическими нарушениями, включая гемофилию и болезнь Виллебранда.
Антифибринолитики также были успешно применены для лечения наследственной болезни Квинке, где может быть продемонстрировано уменьшение числа и тяжести приступов отека у пациентов, получающих лечение транексамовой кислотой (Dunn CJ, Goa KL, Drugs 1999, 57(6): 1005-1032).
Аномальное маточное кровотечение (AUB) может быть диагностировано, когда женщина испытывает изменение в ее менструальной кровопотере (MBL), или степень MBL или модель вагинального кровотечения отличается от таковой, наблюдаемой среди общего женского населения в соответствующей возрастной группе (National Collaborating Centre for Women's and Children's Health (NCCWCH): National Institute for Clinical Excellence (NICE) guidelines. CG44 Heavy Menstrual Bleeding: full guideline. 24 January 2007). Нормальная менструация происходит с циклом 28±7 дней, длительностью 4±2 дня со средним значением MBL 40±20 мл. AUB представляет спектр моделей аномального менструального кровотечения, который включает нерегулярные, тяжелые или длительные менструальные кровотечения или измененный характер кровотечения. AUB может быть связано с овуляторными или ановуляторными циклами. Условиями применения являются дисфункциональное маточное кровотечение (DUB), тяжелое менструальное кровотечение (аномально тяжелое менструальное кровотечение через регулярные промежутки времени, которые также могут увеличиваться), метроррагия (маточное кровотечение с нерегулярными интервалами, особенно между ожидаемыми менструальными периодами) и метроменоррагия (комбинация обоих)
AUB является одним из наиболее частых гинекологических нарушений, наблюдаемых врачами общей практики и гинекологами. Диагноз AUB ставится методом исключения; всегда должна быть исключена органическая причина. Органические причины AUB включают доброкачественную маточную неоплазию, особенно полипы шейки матки и эндометрия и миомы, аденомиоз и злокачественные опухоли шейки матки и эндометрия.
Тяжелое менструальное кровотечение, НМВ (меноррагия), широко описано в медицинской литературе как потеря крови (MBL) 80 мл и более на менструальный период (Hallberg L, Nilsson L. Determination of menstrual blood loss. Scandinav J Clin Lab Invest 1964;16:244-8, Hallberg L, Hogdahl AM, Nilsson L, Rybo G. Menstrual blood loss--a population study. Variation at different ages and attempts to define normality. Acta Obstet Gynecol Scand 1966; 45(3): 320-51, O'Flynn N, Britten N. Menorrhagia in general practice-disease or illness. Soc SCi Med 2000; 50(5): 651-61). В контексте настоящего изобретения тяжелое менструальное кровотечение определяется как менструальная кровопотеря 60 мл или более за цикл, например, от 60 до 80 мл за цикл, в частности более 80 мл за цикл. Согласно NICE, тяжелые менструальные кровотечения должны определяться для клинических целей как чрезмерная менструальная кровопотеря, которая препятствует физическому, эмоциональному, социальному и материальному качеству жизни женщины, и которая может возникнуть сама по себе или в сочетании с другими симптомами. Любые вмешательства должны быть направлены на улучшение качества жизни. Глобальный показатель распространенности тяжелых менструальных кровотечений, основанный на 18 эпидемиологических исследованиях, колеблется от 4% до 52% (Fraser IS, Langham S, Uhl-Hochgraeber K. Health-related quality of life and economic burden of abnormal uterine bleeding. Expert Rev Obstet Gynecol 2009; 4(2): 179-89). Широкое варьирование может объясняться различными методами оценки и выборками населения, используемыми в каждом исследовании. Было установлено, что коэффициент распространенности в исследованиях, которые используют субъективные оценки, стабильно выше, по сравнению с 9-11% в исследованиях, непосредственно измерявших MBL. Однако примерно 30% женщин, страдающих от тяжелых менструальных кровотечений, являются более показательными (Hurskainen R, Grenman S, Komi I, Kujansuu E, Luoto R, Orrainen M, et al. Diagnosis and treatment of menorrhagia. Acta Obstet Gynecol Scand 2007; 86(6): 749-57, El-Hemaidi I, Gharaibeh A, Shehata H. Menorrhagia and bleeding disorders. Curr Opin Obstet Gynecol 2007; 19(6): 513-20). Тяжелые менструальные кровотечения более распространены среди женщин в крайних концах спектра репродуктивного возраста (т.е. девочек-подростков и женщин, приближающихся или переживающих менопаузу) (Shapley М, Jordan K, Croft PR. An epidemiological survey of symptoms of menstrual loss in the community. Br J Gen Pract 2004; 54(502): 359-63).
Лежащие в основе гемостатические нарушения, например, наследственные или приобретенные гемостатические нарушения, такие как гемофилия и болезнь Виллебранда, нарушения/дисфункции тромбоцитов, такие как тромбастения Гланцмана и тромбоцитопения, а также дефицит PAI-1, являются потенциальными причинами тяжелых менструальных кровотечений. Менструация и овуляция являются уникальными кровоостанавливающими задачами, возникающими ежемесячно у женщин репродуктивного возраста. Для контроля чрезмерного кровотечения во время этих событий необходимы интегральные гемостатические системы. В то время как мужчины с умеренными наследственными нарушениями гемостаза часто бессимптомны, женщины страдают значительной болезненностью и нарушением качества жизни, главным образом, при менструальных кровотечениях. Тяжелые менструальные кровотечения часто являются симптомом лежащего в основе гемостатического нарушения и могут быть единственным симптомом кровотечения у женщин. Тяжелое менструальное кровотечение было признано ценным предиктором для диагностики нарушений кровоостанавливания. Проспективное исследование 150 женщин с тяжелыми менструальными кровотечениями выявило частоту недиагностированных гемостатических нарушений 17%, а болезнь Виллебранда была наиболее распространенной с частотой 13%. Впоследствии систематический обзор литературы подтвердил общую распространенность 13% (95% CI 11%, 15,6%) болезни Виллебранда среди 988 женщин в 11 исследованиях. Слабые нарушения функции тромбоцитов также часто встречаются при наследственном гемостатическом нарушении у женщин с тяжелым менструальным кровотечением. Однако нарушения функции тромбоцитов более вероятно остаются невыявленными из-за сложного и специализированного тестирования, требующего свежих образцов. Есть только несколько исследований в литературе, которые оценивают частоту нарушений функции тромбоцитов у женщин с тяжелым менструальным кровотечением. Эти исследования сообщили, что нарушения функции тромбоцитов были более распространены, чем болезнь Виллебранда, и были обнаружены примерно у 50% женщин с тяжелым менструальным кровотечением. Таким образом, связь тяжелых менструальных кровотечений у женщин и наследственных гемостатических нарушений хорошо устанавливается (Kadir RA, Davies J. Hemostatic disorders in women. J Thromb Haemost 2013, 11 (Suppl.1): 170-9).
Транексамовая кислота одобрена для лечения тяжелых менструальных кровотечений и различных хирургических геморрагических состояний. Очень часто требуется несколько доз транексамовой кислоты, и наиболее часто сообщаемыми побочными эффектами, связанными с лекарственными средствами, после перорального приема, являются желудочно-кишечные, такие как тошнота, рвота, диарея и диспепсия (Wellington K, Wagstaff AJ, Drugs 2003, 63 (13): 1417-1433), (Dunn CJ, Goa KL, Drugs 1999, 57(6): 1005-1032). В WO 2006/023000 A1 раскрываются композиции и способы лечения на основе пероральной транексамовой кислоты модифицированного высвобождения.
WO 2010/117323 А1 и WO 2012/047156 А1 относятся к аналогам изоксазол-3(2Н)-она в качестве ингибиторов плазминогена и их применению для лечения связанных с фибринолизом заболеваний, включая наследственные гемостатические нарушения, инсульт, тяжелые менструальные кровотечения и заболевания печени. ЕР 1671962 А1 относится к конденсированным гетероциклическим соединениям, обладающим киназа-ингибирующей активностью (особенно в отношении c-Jun N-терминальной киназы), и ингибирующей активностью в отношении функции АР-1 в качестве фактора транскрипции, полезным в качестве профилактического и/или терапевтического агента для, например, метаболических или воспалительных заболеваний. WO 2009/017954 А1 относится к конденсированным гетероциклическим соединениям, обладающим ингибирующей активностью в отношении Jak2 киназ. WO 2011/140333 А1 относится к идентификации стабилизаторов мультимерных белков, стабилизаторов, включающих разнообразные по структуре соединения. WO 2012/078855 А1 относится, среди прочего, к замещенным пиразолопиримидинам и дигидропиразолопиримидинам и родственным соединениям, а также к способам применения этих соединений для лечения нарушений лизосомального накопления, таких как болезнь Гоше.
WO 2009/023179 А2 относится к азот-содержащим бициклическим химическим соединениям для лечения вирусных инфекций. WO 2009/070567 А1 относится к соединениям пиразоло[1,5-а]пиримидинам, полезным в качестве протеинкиназных ингибиторов, и среди прочего фармацевтическим композициям для лечения заболеваний, таких как, например, рак, воспаление, артрит, вирусные заболевания, нейродегенеративные заболевания, такие как Болезнь Альцгеймера, сердечнососудистые заболевания и грибковые заболевания. WO 2008/011560 А2 относится к бензотиофеновым соединениям и композициям и их применению в качестве лекарственных средств для лечения заболевания и к способам ингибирования активности Rho киназы для лечения таких заболеваний, как офтальмологические заболевания. WO А 2009/008539 А2 относится к конденсированным гетероциклическим производным и способам их применения, в частности, для лечения рака. WO 2004/052315 А2 относится к ингибиторам тирозинкиназы и способам их применения для лечения связанных с тирозинкиназами заболеваний и состояний, таких как ангиогенез, рак, рост опухоли, атеросклероз, возрастная дегенерация макулы, диабетическая ретинопатия и воспалительные заболевания. WO 98/03510 А1 относится к [1,5-а] -пиразоло-1,3,5-триазинам, [1,5-а]-1,2,3-триазоло-1,3,5-триазинам, [1,5-а]-пиразоло-пиримидинам и [1,5-а]-1,2,3-триазоло-пиримидинзазолотриазинам для лечения психических расстройств и неврологических заболеваний.
Задачей настоящего изобретения является обеспечение новых веществ, которые действуют в качестве ингибиторов фибринолиза и, как таковые, пригодны для лечения и/или профилактики заболеваний.
Настоящее изобретение обеспечивает соединения формулы (I-A)
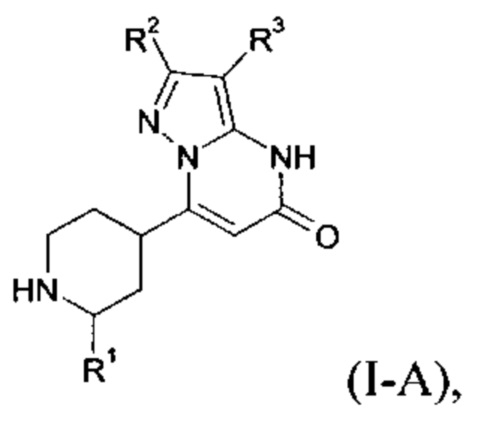
в которой
R1 выбран из водорода и C1-C5 алкила;
R2 выбран из водорода, C1-C4 алкила, С3-С6 циклоалкила, C1-C4 галоалкила, карбоксила, C1-C4 алкилового сложного эфира, C1-C4 алкокси-C1-C4 алкила, фенила,
причем фенил необязательно замещен галогеном,
5-6-членного гетероарила, амино, C1-C4 алкиламида и C1-C4 алкил-сульфонамида;
R3 выбран из водорода, галогена, циано, C1-C4 алкила, C1-C4 алкилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира, -NH-CO-фенила, -CS-NH2,
фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена;
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена и C1-C4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо,
или причем фенил необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкила, C1-C4 галоалкила, С1-С4 галоалкокси, циано, бензилокси, метилсульфонила и фенила,
причем фенил необязательно замещен C1-C4 галоалкилом;
5-6-членного гетероциклила;
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C6 алкила, C1-C6 галоалкила, C1-C4 аминоалкила, C1-C4 алкилового сложного эфира, C1-C4 алкокси, C1-C4 алкокси-C1-C4 алкила, циано, гидроксила, карбоксила, C1-C4 алкил-SO2-C1-C4 алкила и -CO-NH2,
или 5-6-членный гетероарил необязательно замещен одним C3-C6 циклоалкильным заместителем,
причем C3-C6 циклоалкил необязательно замещен фенилом, причем фенил необязательно замещен C1-C4 алкокси или галогеном,
или 5-6-членный гетероарил необязательно замещен одним заместителем, выбранным из
сопряженного или мостикового С5-С12 би- или трициклоалкила;
C3-C6 циклоалкил-C1-C4 алкила;
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена, C1-C4 галоалкила, C1-C4 алкокси, C1-C4 галоалкокси, C1-C4-алкилового сложного эфира, нитро, амино, ди-C1-C4 алкиламина и циано;
фенил-C1-C4 алкила,
причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила, C1-C4 галоалкила, C1-C4 алкокси, C1-C4 галоалкокси;
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкила и гидроксила;
5-6-членного гетероциклоалкила, причем 5-6-членный гетероциклоалкил необязательно замещен C3-C6 циклоалкилом или C1-C4 алкилом;
5-6-членного гетероциклоалкил-С1-С4 алкила,
причем 5-6-членный гетероциклоалкильный фрагмент необязательно замещен C1-C4 алкилом или оксо;
причем C1-C4 алкильный фрагмент необязательно замещен C1-C4 алкилом,
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила и C1-C4 галоалкила;
и
5-6-членного гетероарил-C1-C4 алкила,
причем 5-6-членный гетероарильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С4 алкокси и C1-C4 алкила,
причем C1-C4 алкильный фрагмент необязательно замещен одним или двумя метильными заместителями;
CO-R4, где
R4 выбирается из группы соединений формул
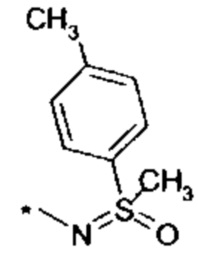 и
и 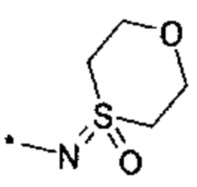 , где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
, где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
и
CO-N(R5R7), где
R5 выбран из водорода, и C1-C4 алкила;
R7 выбран из водорода, C1-C6 алкила, C1-С6 галоалкила, С1-С4-алкокси-C1-C4 алкила, амино-оксо-С1-С4 алкила, нафтила;
C3-C6 циклоалкила, причем C3-C6 циклоалкил необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкила;
C3-C6 циклоалкил-С1-С4 алкила, 5-6-членного гетероциклила, оксазолидинил-С1-С4 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена, и C1-C4-алкокси;
бензил-C3-C6 циклоалкила;
имидазолил-C1-C4 алкила, причем имидазолил-C1-C4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила;
оксазолидинон-С1-С4 алкила;
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и C1-C4 алкокси;
или
- N(R5R7) выбирается из группы 5-7 членных циклических аминов, которые содержат один или два кольцевых атомов азота и ноль или один кольцевой атом кислорода и присоединяются через кольцевой атом азота, причем 5-7 членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из C1-C4 алкокси, оксо, гидроксила, галогена и C1-C4 алкила;
или
R2 и R3 вместе образуют C5-С6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Настоящее изобретение также обеспечивает соединения формулы (I-B)
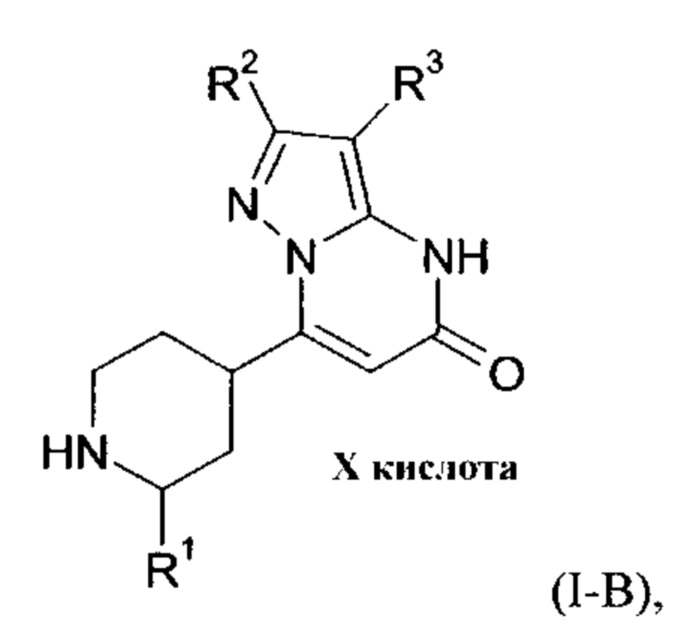
в которой R1, R2, и R3 имеют значения, как определено выше.
Соединения согласно настоящему изобретению представляют собой соединения формул (I-A) или (I-B) и их соли, сольваты и сольваты солей, соединения, охватывающиеся формулами (I-A) или формулами (I-B), упомянутые далее, и их соли, сольваты и сольваты солей, и соединения, охватывающиеся формулами (I-А) или формулами (I-B) и упомянутые далее в качестве примеров варианта выполнения настоящего изобретения и их соли, сольваты и сольваты солей, где соединения, охватывающиеся формулами (I-A) или (I-B) и упомянутые далее уже не являются солями, сольватами и сольватами солей.
В контексте настоящего изобретения термин «х кислота» в любой формуле не указывает на какое-либо определенное стехиометрическое отношение кислоты и соответствующего соединения. Таким образом, в зависимости, например, от щелочности соответствующего соединения, термин «х кислота» означает разные отношения соединения к кислоте, такие как 10:1 - 1:10, 8:1 - 1:8, 7:1 - 1:7, 5:1 - 1:5, 4.5:1 - 1:4.5, 4:1 - 1:4, 3.5:1 - 1:3.5, 3:1 - 1:3, 2.5:1 - 1:2.5, 2:1 - 1:2, 1.5:1 - 1:1.5, и 1:1.
Предпочтительными солями в контексте настоящего изобретения являются физиологически приемлемые соли соединений формулы (I-A) или (I-B) согласно настоящему изобретению. Соли, которые сами по себе не подходят для фармацевтического применения, но могут быть использованы, например, для выделения или очистки соединений формулы (I-A) или (I-B) согласно настоящему изобретению, также включены.
Физиологически приемлемые соли соединений формулы (I-A) или (I-B), согласно настоящему изобретению включают кислотно-аддитивные соли минеральных кислот, карбоновых кислот и сульфоновых кислот, например, соли соляной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, толуолсульфоновой кислоты, бензолсульфоновой кислоты, нафталиндисульфоновой кислоты, муравьиной кислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты, бензойной кислоты, щавелевой кислоты, аскорбиновой кислоты и салициловой кислоты.
Физиологически приемлемые соли соединений формулы (I-A) или (I-B) согласно настоящему изобретению также включают соли обычных оснований, такие как, например и предпочтительно, соли щелочных металлов (например, соли натрия и калия), соли щелочноземельных металлов (например, соли кальция и магния) и соли аммония, полученные из аммиака или органических аминов, имеющих от 1 до 16 атомов углерода, таких как, например и предпочтительно, этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, прокаин, дибензиламин, N-метилморфолин, аргинин, лизин, этилендиамин и N-метилпиперидин.
Согласно варианту выполнения настоящего изобретения, физиологически приемлемые соли соединений формулы (I-A) или (I-B) согласно настоящему изобретению включают соли соляной кислоты, серной кислоты, малеиновой кислоты, уксусной кислоты, трифторуксусной кислоты, фосфорной кислоты, винной кислоты, лимонной кислоты, фумаровой кислоты, щавелевой кислоты, аскорбиновой кислоты, салициловой кислоты и лизина
Согласно варианту выполнения настоящего изобретения, физиологически приемлемые соли соединений формулы (I-A) или (I-B) согласно настоящему изобретению включают соли соляной кислоты, серной кислоты, малеиновой кислоты, уксусной кислоты, трифторуксусной кислоты, винной кислоты, аскорбиновой кислоты и салициловой кислоты.
Согласно варианту выполнения настоящего изобретения, физиологически приемлемые соли соединений формулы (I-A) или (I-B) согласно настоящему изобретению включают соли соляной кислоты и трифторуксусной кислотой.
Согласно варианту выполнения настоящего изобретения, физиологически приемлемыми солями соединений формулы (I-A) или (I-B) согласно настоящему изобретению являются соли соляной кислоты.
Сольваты в контексте настоящего изобретения обозначаются как те формы соединений формулы (I-A) или (I-B) согласно настоящему изобретению, которые образуют комплекс в твердом или жидком состоянии путем координации с молекулами растворителя. Гидраты представляют собой специфическую форму сольватов, в которой координация происходит с водой. Гидраты являются предпочтительными сольватами в контексте настоящего изобретения.
Соединения формулы (IA) или (IB) согласно настоящему изобретению могут существовать в различных стереоизомерных формах в зависимости от их структуры, то есть в форме конфигурационных изомеров или необязательно также в виде конформационных изомеров (энантиомеры и/или диастереомеры, в том числе в случае атропоизомеров). Поэтому настоящее изобретение включает энантиомеры и диастереомеры и их конкретные смеси. Стереоизомерно однородные составляющие могут быть выделены из таких смесей энантиомеров и/или диастереомеров известным образом; для этого предпочтительно используют хроматографические способы, в частности ВЭЖХ хроматографию на ахиральной или хиральной фазе.
В тех случаях, когда соединения формулы (I-А), (I-В) или (IV) в соответствии с настоящим изобретением могут встречаться в таутомерных формах, настоящее изобретение включает все таутомерные формы.
Примерами стереоизомерных форм соединений формулы (I-A) или (I-B) или (IV) согласно настоящему изобретению являются соединения формулы (I-A) или (I-B), как определено выше, и соединения формулы (IV), как определено ниже, где заместитель R1 имеет значение C1-C4 алкил.
Формула (I-A), в которой заместитель R1 имеет значение C1-C4 алкила, включает следующие трансизомеры:
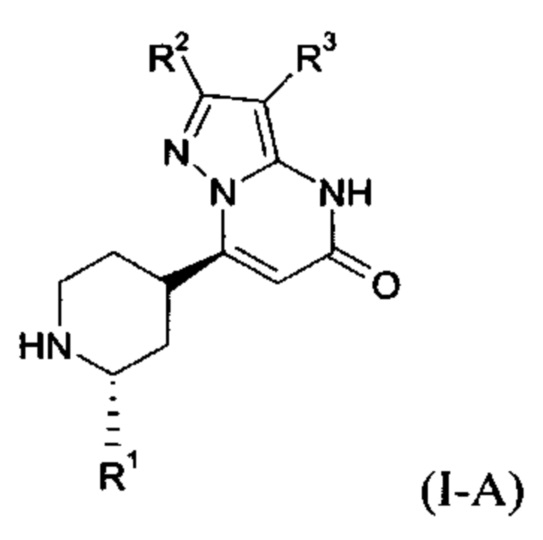
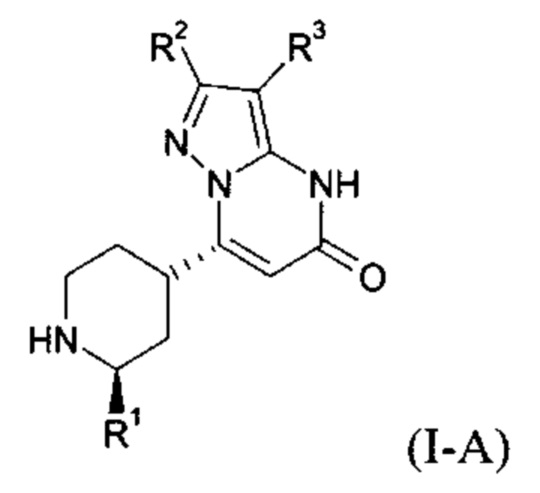
Формула (I-A), в которой заместитель R1 имеет значение C1-C4 алкила, также включает следующие цисизомеры:
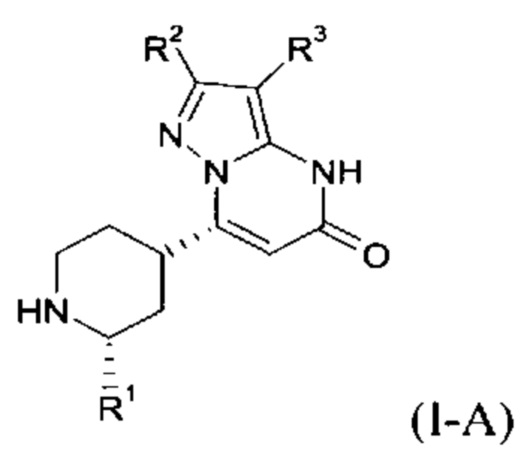
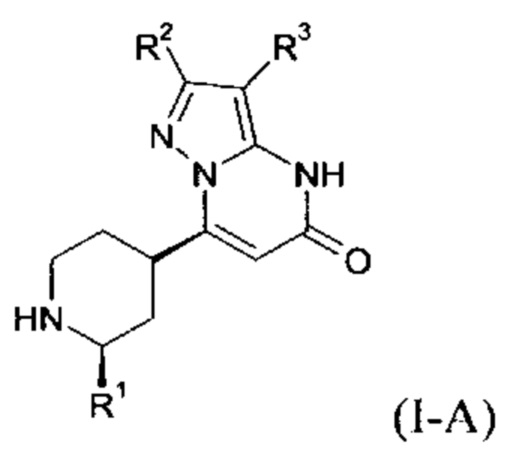
Формула (I-B), в которой заместитель R1 имеет значение C1-C4 алкила, включает следующие трансизомеры:

Формула (I-B), где заместитель R1 имеет значение C1-C4 алкил, также включает следующие цисизомеры:

Формула (IV), в которой заместитель R1 имеет значение C1-C4 алкил, включает следующие трансизомеры:

Формула (IV), в которой заместитель R1 имеет значение C1-C4 алкил, также включает следующие цисизомеры:
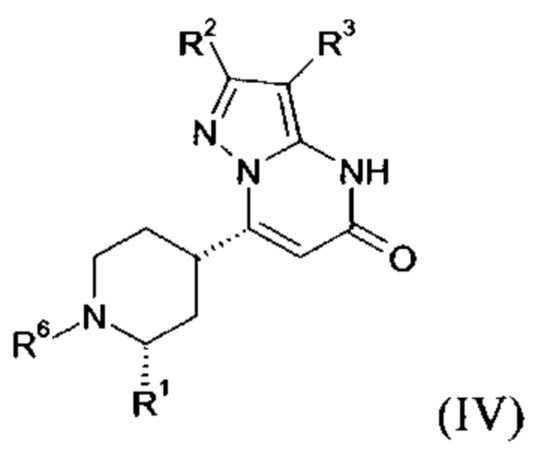
Настоящее изобретение охватывает все возможные стереоизомерные формы, также в случаях, когда никакой стереоизомеризм не указан.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А), (I-B), и (IV), в которых заместитель R1 имеет значение C1-C4 алкила, присутствуют в виде смеси цис- и транс-изомеров.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А), (I-B), и (IV), в которых заместитель R1 имеет значение C1-C4 алкила, присутствуют в виде смеси цис- и транс-изомеров, где более 50%, более 55%, более 60%, более 65%, более 70%, более 75%, более 80%, более 85%, более 90%, более 95%, более 97%, более 98%, или более 99%, соединений формул (I-A), (I-B), и (IV) присутствуют в виде транс-изомера.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А), (I-B), и (IV), где заместитель R1 имеет значение C1-C4 алкила, присутствуют в виде энантиомерно чистых транс-изомеров.
Настоящее изобретение также охватывает все подходящие изотопные варианты соединений формулы (I-A) или (I-B) согласно настоящему изобретению. Изотопный вариант соединения согласно настоящему изобретению понимается в контексте настоящего изобретения как соединение, в котором по меньшей мере один атом в соединение согласно настоящему изобретению заменен на другой атом того же атомного номера, но с другой атомной массой, чем атомная масса, которая обычно или преимущественно встречается в природе. Примерами изотопов, которые могут быть включены в соединение согласно настоящему случаю, являются водород, углерод, азот, кислород, фосфор, сера, фтор, хлор, бром и йод, такие как 2Н (дейтерий), 3Н (тритий), 13С, 14С, 15N, 17O, 18O, 32Р, 33Р, 33S, 34S, 35S, 36S, 18F, 36Cl, 82Br, 123I, 124I, 129I и 131I. Конкретные изотопные варианты соединения согласно настоящему изобретению, особенно те, в которые были включены один или более радиоактивных изотопов, могут быть полезными, например, для изучения механизма действия или распределения активного соединения в организме; из-за сравнительно легко получения и обнаружения, особенно пригодны для этой цели соединения, помеченные изотопами 3Н или 14С. Кроме того, включение изотопов, например, дейтерия, может привести к определенным терапевтическим преимуществам вследствие большей метаболической стабильности соединения, например, продлению периода полураспада в организме или уменьшению требуемой активной дозы; такие модификации соединений формулы (I-A) или (I-B) согласно настоящему изобретению могут поэтому в некоторых случаях также составлять предпочтительный вариант осуществления настоящего изобретения. Изотопные варианты соединений формулы (IA) или (IB) согласно настоящему изобретению могут быть получены способами, известными специалистам, например, описанными ниже способами и способами, описанными в рабочих примерах, с использованием соответствующих изотопных модификаций конкретных реагентов и/или их исходных соединений.
Кроме того, настоящее изобретение также включает пролекарства соединений формулы (I-A) или (I-B) согласно настоящему изобретению. Термин «пролекарства» в контексте настоящего изобретения обозначает соединения, которые сами по себе могут быть биологически активными или неактивными, но превращаются (например, метаболически или гидролитически) в соединения формулы (I-A) или (I-B) согласно настоящему изобретению в ходе их времени пребывания в организме.
В контексте настоящего изобретения заместители имеют следующие значения, если иного не указано:
Алкил в контексте настоящего изобретения представляет собой неразветвленный или разветвленный алкильный радикал, имеющий число атомов углерода, указанное в каждом случае. В качестве примера и в порядке предпочтения можно упомянуть следующее: метил, этил, н-пропил, изопропил, н-бутил, изобутил, 1-метилпропил, трет-бутил, н-пентил, изопентил, 1-этилпропил, 1-метилбутил, 2-метилбутил, 3-метилбутил, н-гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 3-метил-3-этилпропил.
Галоалкил в контексте настоящего изобретения представляет собой алкильный радикал, как определено выше, являющийся моно- или полигалогенированным до максимально возможного числа заместителей. В случае полигалогенирования, атомы галогена могут быть одинаковыми или различными. Согласно настоящему изобретению, галогеном является фтор, хлор, бром или иод, в частности фтор, хлор или бром. В качестве примера и в порядке предпочтения можно упомянуть следующее: фторметил, дифторметил, трифторметил, фторэтил, дифторэтил, трифторэтил, пентафторэтил, хлорметил, дихлорметил, трихлорметил, хлорэтил, дихлорэтил, 3-метил-3-фторэтил-1-фторпропил.
Фторалкил в контексте настоящего изобретения представляет собой алкильный радикал, как определено выше, являющийся моно- или полифторированным до максимально возможного числа заместителей фтор.
Циклоалкил или карбоцикл в контексте настоящего изобретения представляет собой моноциклический насыщенный алкильный радикал, имеющий число кольцевых атомов углерода, установленное в каждом случае. В качестве примера и в порядке предпочтения можно упомянуть следующее: циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Циклоалкилалкил в контексте настоящего изобретения представляет собой моноциклический насыщенный циклоалкильный радикал, как определено выше, присоединенный к алкильной группе, как определено выше. В качестве примера и в порядке предпочтения можно упомянуть следующее: циклопропилметил, циклопропилэтил, циклопропил-пропил, циклопропил-изопропил, циклопропил-бутил, циклопропил-изобутил, циклопропил-1-метилпропил, циклопропил-трет-бутил, циклобутилметил, циклобутилэтил, циклобутил-пропил, циклобутил-изопропил, циклобутил-бутил, циклобутил-изобутил, циклобутил-1-метилпропил, циклобутил-трет-бутил, циклопентилметил, циклопентилэтил, циклопентил-пропил, циклопентил-изопропил циклопентил-бутил, циклопентил-изобутил, циклопентил-1-метилпентил, циклопентил-трет-бутил, циклогексилметил, циклогексилэтил, циклогексил-пропил, циклогексил-изопропил циклогексил-бутил, циклогексил-изобутил, циклогексил-1-метилгексил, и циклогексил-трет-бутил.
Мостиковый би- и трициклоалкил в контексте настоящего изобретения включает С5-С12, или С7-С12, или С8, группы. Бициклические и трициклические группы могут быть сопряженными или мостиковыми. Примеры включают: бицикло-[2,2,1]-гептил, метилбицикло-[2,2,1]-октил, бицикло-[3,3,0]-октил, бицикло-[2,2,2]-октил, бицикло-[3,2,1]-октил, бицикло-[4,3,0]-нонил, и бицикло-[3,3,1]-нонил.
Бициклические азаспиросоединения в контексте настоящего изобретения включают бициклические [2.2], [2.3], [2.4], [2.5], [2.6], [3.3], [3.4], [3.5], [3.6], [4.4], [4.5], [4.6], [5.5], [5.6], и [6.6] азаспиросоединения, причем азаспиросоединения необязательно замещены оксо. Примеры включают азаспиро[2.5]окт-5-ил и азаспиро[3.5]нон-1-ил, причем азаспиросоединения необязательно замещены оксо.
3-6-членный гетероциклоалкил в контексте настоящего изобретения представляет собой моноциклический насыщенный гетероциклоалкильный радикал, который имеет в общем от 3 до 6 кольцевых атомов, который содержит один или два кольцевых гетероатома из группы, состоящей из N, О, S, SO и SO2, и который присоединен через кольцевой атом углерода или, если является подходящим, кольцевой атом азота. В качестве примера можно упомянуть следующее: азетидинил, оксетанил, окситианил, оксоимидазолидинил, оксазолидинил, пирролидинил, пиразолидинил, тетрагидрофуранил, тиоланил, пиперидинил, пиперазинил, тетрагидропиранил, тетрагидротиопиранил, морфолинил, тиоморфолинил, гексагидроазепинил, диазепанил, и гексагидро-1,4-диазепинил. Предпочтительно окситианил, оксоимидазолидинил, оксазолидинил, пиперидинил, пиперазинил, морфолинил и диазепанил.
3-6-членный гетероциклоалкил-алкил в контексте настоящего изобретения представляет собой гетероциклоалкильный радикал, как определено выше, присоединенный к алкильной группе, как определено выше. В качестве примера и в порядке предпочтения можно упомянуть следующее: азетидинилметил, оксетанилметил, окситианилметил, оксоимидазолидинилметил, оксазолидинилметил, пирролидинилметил, пиразолидинилметил, тетрагидрофуранилметил, тиоланилметил, пиперидинилметил, пиперазинилметил, тетрагидропиранилметил, тетрагидротиопиранилметил, морфолинилметил, тиоморфолинилметил, гексагидроазепинилметил, диазепанилметил, гексагидро-1-метил, 4-диазепинил, азетидинилэтил, оксетанилэтил, окситианилэтил, оксоимидазолидинилэтил, оксазолидинилэтил, пирролидинилэтил, пиразолидинилэтил, тетрагидрофуранилэтил, тиоланилэтил, пиперидинилэтил, пиперазинилэтил, тетрагидропиранилэтил, тетрагидротиопиранилэтил, морфолинилэтил, тиоморфолинилэтил, гексагидроазепинилэтил, диазепанилэтил, гексагидро-1-этил, 4-диазепинил. Предпочтительно окситианилметил, оксоимидазолидинилметил, оксазолидинилметил, пиперидинилметил, пиперазинилметил, морфолинилметил, диазепанил, окситианилэтил, оксоимидазолидинилэтил, оксазолидинилэтил, пиперидинилэтил, пиперазинилэтил, морфолинилэтил, диазепанил.
Циклический амин в контексте настоящего изобретения представляет собой 5-7 членный гетероцикл, который содержит один или два кольцевых атомов азота и ноль или один кольцевой атом кислорода, и присоединяется через кольцевой атом азота. В качестве примера можно упомянуть следующее: морфолинил, пиперидинил, пиперазинил, диазепанил, пирролидинил, азиридинил, и азетидинил.
Алкенил в контексте настоящего изобретения представляет собой неразветвленный или разветвленный алкенильный радикал, имеющий от 2 до 6 атомов углерода и одну или две двойные связи. Предпочтительным является неразветвленный или разветвленный алкенильный радикал, имеющий 2-4 атома углерода и одну двойную связь. В качестве примера и в порядке предпочтения можно упомянуть следующее: винил, аллил, изопропенил и н-бут-2-ен-1-ил.
Алкокси в контексте настоящего изобретения представляет собой неразветвленный или разветвленный алкокси радикал, имеющий 1-4 атомов углерода. В качестве примера и в порядке предпочтения можно упомянуть следующее: метокси, этокси, н-пропокси, изопропокси, 1-метилпропокси, н-бутокси, изобутокси и трет-бутокси.
Галоалкокси в контексте настоящего изобретения представляет собой алкокси радикал, как определено выше, являющийся моно- или полигалогенированным до максимально возможного числа заместителей. В случае полигалогенирования, атомы галогена могут быть идентичными или различными. Согласно настоящему изобретению, галогеном является фтор, хлор, бром или иод, в частности фтор, хлор или бром.
Фторалкокси в контексте настоящего изобретения представляет собой алкокси радикал, как определено выше, являющийся моно- или полифторированным до максимально возможного числа заместителей фтор.
Алкоксиалкил в контексте настоящего изобретения представляет собой неразветвленный или разветвленный алкокси радикал, имеющий от 1 до 4 атомов углерода, как определено выше, присоединенный к алкильной группе, как определено выше. В качестве примера и в порядке предпочтения можно упомянуть следующее: метокси-метил, метокси-этил, метокси-пропил, метокси-изопропил, метокси-бутил, метокси-изобутил, метокси-1-метилпропил, метокси-трет-бутил, этокси-метил, этокси-этил, этокси-пропил, этокси-изопропил, этокси-бутил, этокси-изобутил, этокси-1-этилпропил, этокси-трет-бутил, н-пропокси-метил, н-пропокси-этил, н-пропокси-пропил, н-пропокси-изопропил, н-пропокси-бутил, н-пропокси-изобутил, н-пропокси-1-этилпропил, н-пропокси-трет-бутил, изопропокси-метил, изопропокси-этил, изопропокси-пропил, изопропокси-изопропил, изопропокси-бутил, изопропокси-изобутил, изопропокси-1-этилпропил, изопропокси-трет-бутил, 1-метилпропокси-метил, 1-метилпропокси-этил, 1-метилпропокси-пропил, 1-метилпропокси-изопропил, 1-метилпропокси-бутил, 1-метилпропокси-изобутил, 1-метилпропокси-1-этилпропил, 1-метилпропокси-трет-бутил, н-бутокси-метил, н-бутокси-этил, н-бутокси-пропил, н-бутокси-изопропил, н-бутокси-бутил, н-бутокси-изобутил, н-бутокси-1-этилпропил, н-бутокси-трет-бутил, изобутокси-метил, изобутокси-этил, изобутокси-пропил, изобутокси-изопропил, изобутокси-бутил, изобутокси-изобутил, изобутокси-1-этилпропил, изобутокси-трет-бутил, трет-бутокси-метил, трет-бутокси-этил, трет-бутокси-пропил, трет-бутокси-изопропил, трет-бутокси-бутил, трет-бутокси-изобутил, трет-бутокси-1-этилпропил, и трет-бутокси-трет-бутил.
Алкиловый сложный эфир в контексте настоящего изобретения представляет собой неразветвленный или разветвленный алкильный радикал, имеющий от 1 до 4 атомов углерода, как определено выше, который присоединен к карбокси группе.
Алкиламино в контексте настоящего изобретения включает моно- и диалкиламино и представляет собой аминогруппу, в которой один или два атома водорода замещены алкильными радикалами.
5-6-членный гетероарил в контексте настоящего изобретения представляет собой моноциклический ароматический гетероцикл (гетероароматический), который имеет в общем 5 или 6 кольцевых атомов, который содержит до трех идентичных или различных кольцевых гетероатомов из группы, состоящей из N, О и S, и присоединяется через кольцевой атом азота или, если является подходящим, кольцевой атом азота. В качестве примера и в порядке предпочтения можно упомянуть следующее: фуранил, пирролил, тиофенил, пиразолил, имидазолил, тиазолил, включая 1,3-тиазолил, изотиазолил, оксазолил, включая 1,2 оксадиазолил, изоксазолил, изотиазолил, триазолил, включая 1,2,4- и 1,2,3-триазолил, оксадиазолил, включая 1,2,4-оксадиазол-5-ил, 1,2,4-оксадиазол-3-ил, и 1,3,4-оксадиазол-5-ил, тиадиазолил, включая 1,2,3-, 1,2,4-, 1,2,5-, и 1,3,4-, тиадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил и триазинил, включая 1,2,3-, 1,2,4-, и 1,3,5-триазинил.
Галоген в контексте настоящего изобретения включает фтор, хлор, бром и иод. Предпочтительно хлор, бром, или фтор.
Если радикалы в соединениях формулы (I-А) или (I-В) согласно настоящему изобретению являются замещенными, радикалы могут, если иного не указано, быть моно- или полизамещенными. В контексте настоящего изобретения, все радикалы, которые встречаются более одного раза, определяются независимо друг от друга. Предпочтительным является замещение одним, двумя или тремя одинаковыми или разными заместителями
В контексте настоящего изобретения термин «лечение» или «лечить» включает в себя ингибирование, задержку, остановку, улучшение, ослабление, ограничение, снижение, подавление, реверсию или излечение заболевания, состояние, нарушения, травмы и ухудшения здоровья, развитие, течения или прогрессирования таких состояний и/или симптомов таких состояний. Здесь термин «терапия», понимается как синоним термина «лечение».
В контексте настоящего изобретения термины "предотвращение", "профилактика" или "меры предосторожности" используются как синонимы и относятся к предотвращению или уменьшению риска заражения, контракта, страдания от или приобретения заболевания, состояния, нарушения, травмы и ухудшения здоровья, развития или прогрессирования таких состояний и/или симптомов таких состояний.
Лечение или профилактика заболевания, состояния, нарушения, травмы или ухудшения здоровья могут происходить частично или полностью.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-В) определяются следующим образом:
R1 выбран из водорода и C1-C5 алкила;
R2 выбран из водорода, C1-C4 алкила, C3-C6 циклоалкила, C1-C4 галоалкила, карбоксила, C1-C4 алкилового сложного эфира, C1-C4 алкокси-С1-С4 алкила, галогена, метилсульфанила, фенила,
причем фенил необязательно замещен галогеном,
и
5-ти членного гетероарила,
R3 выбран из водорода, галогена, циано, C1-C4 алкила, причем алкил необязательно замещен ди-C1-C4 алкиламино, C1-C4 алкенила, C1-C4 алкилового сложного эфира, причем C1-C4 алкиловый сложный эфир необязательно замещен одним, двумя, тремя, четырьмя или пятью заместителями галоген, С3-С4 циклоалкилового сложного эфира, С3-С4 циклоалкила, карбоксила, карбоксамида, бензилового сложного эфира, -NH-CO-фенила, -CS-NH2,
фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена,
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена и C1-C4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо,
или причем фенил необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкила, C1-C4 галоалкила, C1-C4 галоалкокси, циано, бензилокси, метилсульфонила и фенила,
причем фенил необязательно замещен C1-C4 галоалкилом,
5-6-членного гетероциклил-С1-С4 алкила, причем 5-6-членный гетероциклильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила и оксо;
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C6 алкила, С2-С6 алкенила, C1-С6 галоалкила, C1-C4 аминоалкила, C1-C4 алкилового сложного эфира, C1-C4 алкокси, C1-C4 галоалкокси, C1-C4 алкокси-C1-C4 алкила, циано, гидроксила, карбоксила, C1-C4 алкил-SO2-C1-C4 алкила и -CO-NH2,
или 5-6-членный гетероарил необязательно замещен одним C3-C6 циклоалкильным заместителем,
причем C3-C6 циклоалкил необязательно замещен одним, двумя или тремя заместителями галоген или метил, или фенилом, причем фенил необязательно замещен C1-C4 алкокси или галогеном,
или 5-6-членный гетероарил необязательно замещен одним заместителем, выбранным из
сопряженного или мостикового С5-С12 би- или трициклоалкила,
C3-C6 циклоалкил-С1-С4 алкила, C3-C6 циклоалкил-С1-С4 алкенила,
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена, C1-C4 галоалкила, C1-C4 алкокси, C1-C4 галоалкокси, C1-C4-алкилового сложного эфира, нитро, амино, ди-C1-C4 алкиламина и циано,
фенил-С1-С4 алкила,
причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила, C1-C4 галоалкила, C1-C4 алкокси, C1-C4 галоалкокси и гидроксила,
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкила и гидроксила,
5-6-членного гетероциклоалкила, причем 5-6-членный гетероциклоалкил необязательно замещен С3-C6 циклоалкилом или С1-С4 алкилом,
5-6-членного гетероциклоалкил-С1-С4 алкила,
причем 5-6-членный гетероциклоалкильный фрагмент необязательно замещен C1-C4 алкилом или оксо,
причем C1-C4 алкильный фрагмент необязательно замещен C1-C4 алкилом,
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила и C1-C4 галоалкила,
и
5-6-членного гетероарил-C1-C4 алкила,
причем 5-6-членный гетероарильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкокси и C1-C4 алкила,
причем C1-C4 алкильный фрагмент необязательно замещен одним или двумя метильными заместителями;
-CO-R4, где
R4 выбирается из группы C1-C4 алкила, где C1-C4 алкил необязательно замещен 1 или 2 метилами, и C3-C6 циклоалкила;
-CO-N(R5R7), где
R5 выбран из водорода и C1-C4 алкила;
R7 выбран из водорода, С1-С6 алкила, C1-С6 галоалкила, C1-C4-алкокси-C1-C4 алкила, амино-оксо-C1-C4 алкила, нафтила,
C3-C6 циклоалкила, причем C3-C6 циклоалкил необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкила,
C3-C6 циклоалкил-С1-С4 алкила, 5-6-членного гетероциклила, оксазолидинил-C1-C4 алкила,
бензила, причем фенильный фрагмент бензила необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, причем метильный фрагмент бензила необязательно замещен C1-C4 алкилом;
бензил-C3-C6 циклоалкила,
имидазолил-С1-С4 алкила, причем имидазолил-С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила,
оксазолил-С1-С4 алкила, причем оксазолил-С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила,
оксазолидинон-С1-С4 алкила,
пиридинил-С1-С4 алкила,
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и C1-C4 алкокси;
или
- N(R5R7) выбирается из группы 5-7 членных циклических аминов, которые содержат один или два кольцевых атомов азота, ноль или один кольцевой атом кислорода, ноль или один кольцевой атом серы, и присоединяются через кольцевой атом азота, причем 5-7 членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из C1-C4 алкокси, C1-C4 алкокси C1-C4 алкила, оксо, гидроксила, галогена и C1-C4 алкила; или
- N(R5R7), выбранного из группы двух аннелированных, ароматических, частично насыщенных или насыщенных колец, каждое из которых является 5-7 членным и каждое содержит один или два кольцевых атомов азота и присоединены через кольцевой атом азота;
и
- N(R5R7), выбранного из бициклических азаспиросоединений, причем азаспиросоединения необязательно замещены оксо;
или
R2 и R3 вместе образуют C5-C6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и С1-С5 алкила;
R2 выбран из водорода, С1-С2 алкила, С3-С5 циклоалкила, С1-С2 галоалкила, карбоксила, С1-С2 алкилового сложного эфира, С1-С2 алкокси- С1-С2 алкила, фенила,
причем фенил необязательно замещен заместителем, выбранным из фтора и хлора,
и 5-6-членного гетероарила;
R3 выбран из водорода, брома, хлора, циано, метила, этила, С1-С2 алкилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира, -NH-CO-фенила, -CS-NH2;
фенилсульфонила, причем фенилсульфонил необязательно замещен одним или двумя заместителями, выбранными из хлора и фтора;
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из брома, хлора, фтора, этокси и метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо,
или причем фенил необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила, C1-C2 фторалкила, C1-С2 фторалкокси и циано,
или причем фенил необязательно замещен одним заместителем, выбранным из бензилокси, метилсульфонила и фенила,
причем фенил необязательно замещен С1-С2 галоалкилом;
5-6-членного гетероциклила;
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним или двумя заместителями, выбранными из
C1-С6 алкила, C1-C4 галоалкила, С1-С2 аминоалкила, С1-С2 алкилового сложного эфира, С1-С2 алкокси, С1-С2 алкокси-C1-C4 алкила, циано, гидроксила, карбоксила, С1-С2 алкил-SO2-С1-С2 алкила и -CO-NH2,
или 5-6-членный гетероарил необязательно замещен одним или двумя заместителями, выбранными из C3-C6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен фенилом, причем фенил необязательно замещен С1-С2 алкокси, хлором или фтором,
мостикового би- или трициклоалкила,
C3-C6 циклоалкил-С1-С2 алкила;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена, С1-С2 галоалкила, С1-С2 алкокси, С1-С2 галоалкокси, С1-С2-алкилового сложного эфира, нитро, амино, ди-С1-С2 алкиламино и циано;
фенил-С1-С2 алкила,
причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С2 алкила, С1-С2 фторалкила, С1-С2 алкокси, С1-С2 фторалкокси;
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила и гидроксила;
5-6-членного гетероциклоалкила, причем 5-6-членный гетероциклоалкил необязательно замещен С3-С5 циклоалкилом или С1-С3 алкилом;
5-6-членного гетероциклоалкил-C1-C4 алкила,
причем 5-6-членный гетероциклоалкильный фрагмент необязательно замещен С1-С2 алкилом или оксо;
причем C1-C4 алкильный фрагмент необязательно замещен С1-С4 алкилом,
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, С1-С2 алкила и С1-С2 галоалкила;
и
5-6-членного гетероарил-C1-C4 алкила,
причем 5-6-членный гетероарильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкокси и C1-C2 алкила,
причем С1-С2 алкильный фрагмент необязательно замещен одним или двумя метильными заместителями;
CO-R4, где
R4 выбирается из группы соединений формул
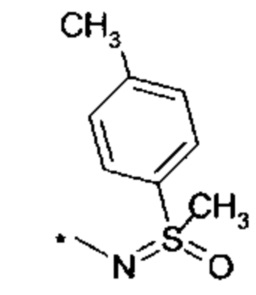 и
и 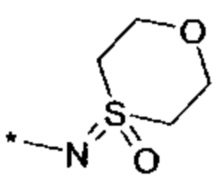 , где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
, где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
и
CO-N(R5R7), где
R5 выбран из водорода и С1-C4 алкила;
R7 выбран из водорода, С1-С6 алкила, С1-С6 галоалкила, С1-С4-алкокси-C1-C4 алкила, амино-оксо-С1-С4 алкила, нафтила;
C3-C6 циклоалкила, причем C3-C6 циклоалкил необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкила;
C3-C6 циклоалкил-C1-C4 алкила, 5-6-членного гетероциклила, оксазолидинил-C1-C4 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и C1-C4-алкокси;
бензил-C3-C6 циклоалкила;
имидазолил-C1-C4 алкила, причем имидазолил-С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила;
оксазолидинон-С1-С4 алкила;
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и С1-C4 алкокси;
или
- N(R5R7) выбирается из группы 5-7 членных циклических аминов, которые содержат один или два кольцевых атомов азота и ноль или один кольцевой атом кислорода и присоединяются через кольцевой атом азота, причем 5-7 членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из C1-C4 алкокси, оксо, гидроксила, галогена и C1-C4 алкила;
или
R2 и R3 вместе образуют C5-С6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и С1-С5 алкил;
R2 выбран из водорода, метила, циклопропила, трифторметила, карбоксила, метилового сложного эфира, метокси-метила, фенила,
причем фенил необязательно замещен фтором,
и тиофенила;
R3 выбран из водорода, брома, хлора, циано, метила, этила, этилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира, -NH-CO-фенила, -CS-NH2,
фенилсульфонила, причем фенилсульфонил необязательно замещен одним или двумя заместителями, выбранными из хлора и фтора;
фенила,
причем фенил необязательно замещен одним или двумя заместителями, выбранными из брома, хлора, фтора и метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо,
или причем фенил необязательно замещен одним или двумя заместителями, выбранными из метила, трифторметила, трифторметокси и циано,
или причем фенил необязательно замещен одним заместителем, выбранным из бензилокси, метилсульфонила и фенила,
причем фенил необязательно замещен трифторметилом;
оксанила;
1,2,4-оксадиазол-5-ила формулы 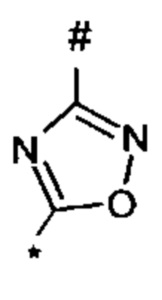 , или 1,3,4-оксадиазол-5-ила формулы
, или 1,3,4-оксадиазол-5-ила формулы 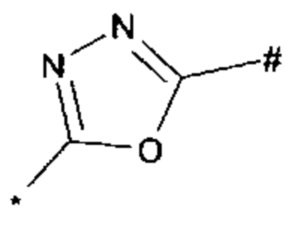 , или 1,2,4-оксадиазол-3-ила
, или 1,2,4-оксадиазол-3-ила 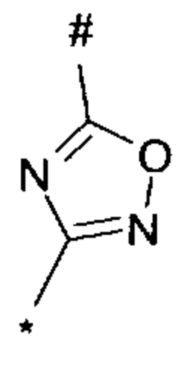 , где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
C1-С6 алкила, C1-C4 галоалкила, аминометила, этилового сложного эфира, метокси-C1-C4 алкила, трет-бутокси-этила, гидроксила, карбоксила, изопропилсульфонилметила, метилсульфонилметила, CO-NH2, C3-C6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен фенилом, причем фенил необязательно замещен хлором или метокси;
бицикло[2.2.2]октила;
циклогексилметила;
фенил-С1-С2 алкила,
причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из хлора, фтора, метила, трифторметила, метокси, изопропил-окси, дифторметокси, трифторметокси;
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из метила, этила и гидроксила;
оксанила;
оксопирролидинилметила,
пиперидинила, причем пиперидинил замещен циклопропилом или изопропилом;
пиперидинилметила, причем пиперидинилметил необязательно замещен метилом;
морфолинилэтила, причем этильный фрагмент необязательно замещен метилом;
тетрагидрофуранила,
1,2,4-триазолилметила, причем метильный фрагмент замещен двумя метильными заместителями;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, трифторметила, метокси, трифторметокси, метилового сложного эфира, нитро, амино, диметиламино и циано;
тиофенила, причем тиофенил необязательно замещен фтором;
фуранила;
имидазолила, причем имидазолил замещен метилом;
тиазолилметила, причем тиазолилметил замещен метилом;
пиридинила, причем пиридинил необязательно замещен одним или двумя заместителями, выбранными из метила, трифторметила, фтора и хлора;
и
пиридинилметила, причем пиридинилметил необязательно замещен метокси;
1,2-оксазолила, причем 1,2-оксазолил замещен фенилом,
пиридинила, причем пиридинил необязательно замещен метокси;
тиофенила, причем тиофенил необязательно замещен заместителем, выбранным из метила и циано;
и
1,3-тиазолила,
причем 1,3-тиазолил замещен одним заместителем, выбранным из C1-C6 алкила, C1-C4 галоалкила, циклопропила и фенила,
причем фенил необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метила и трифторметила,
или причем тиазолил замещен двумя заместителями, выбранными из метила, этила и изопропила, или причем тиазолил необязательно замещен фенилом и метилом;
или
R2 и R3 вместе образуют C5-С6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
1,2,4-оксадиазол-5-ила формулы 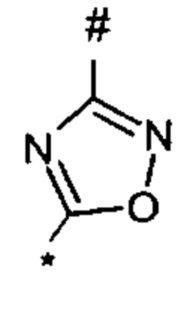 , или 1,3,4-оксадиазол-5-ила формулы
, или 1,3,4-оксадиазол-5-ила формулы 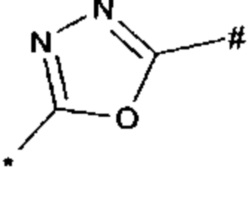 , или 1,2,4-оксадиазол-3-ила формулы
, или 1,2,4-оксадиазол-3-ила формулы 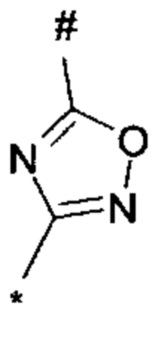 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
С1-С6 алкила, C1-C4 фторалкила, метокси-C1-C4 алкила, трет-бутокси-этила, C3-C6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен фенилом, причем фенил необязательно замещен хлором или метокси;
оксанила;
оксопирролидинилметила,
пиперидинила, причем пиперидинил замещен циклопропилом или изопропилом;
пиперидинилметила, причем пиперидинилметил необязательно замещен метилом;
морфолинилэтила, причем этильный фрагмент необязательно замещен метилом;
тетрагидрофуранила;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, фтора, хлора, трифторметила, метокси, трифторметокси, метилового сложного эфира, нитро, амино, диметиламино, и циано;
и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями фтор и одним метокси заместителем,
или причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора и метокси,
или причем фенильный фрагмент необязательно замещен одним заместителем, выбранным из фтора, хлора, метила, трифторметила, метокси, изопропилокси, трифторметокси и дифторметокси,
причем метильный фрагмент бензила необязательно замещен гидроксилом, этилом или одним или двумя метильными заместителями;
1,2-оксазолила, причем 1,2-оксазолил замещен фенилом,
тиофенила, причем тиофенил необязательно замещен заместителем, выбранным из метила и циано;
и
1,3-тиазолила,
причем 1,3-тиазолил необязательно замещен одним заместителем, выбранным из С1-С5 алкила, C1-C4 галоалкила, циклопропила и фенила,
причем фенил необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метила и трифторметил
или причем 1,3-тиазолил необязательно замещен двумя заместителями, выбранными из метила, этила и изопропила, или причем 1,3-тиазолил необязательно замещен фенилом и метилом;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
1,2,4-оксадиазол-5-ила формулы 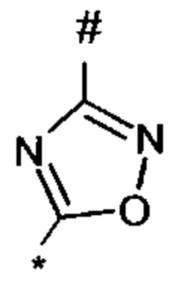 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
C1-C6 алкила, C1-C4 фторалкила, метокси-С1-С4 алкила, трет-бутокси-этила, С3-С6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен фенилом, причем фенил необязательно замещен метокси;
оксанила;
пиперидинила, причем пиперидинил замещен циклопропилом;
пиперидинилметила, причем пиперидинилметил необязательно замещен метилом;
тетрагидрофуранила;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, фтора, хлора, трифторметила, метокси, трифторметокси, метилового сложного эфира, нитро, амино и диметиламино;
и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями фтор и одним заместителем метокси, или
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора и метокси,
или фенильный фрагмент необязательно замещен одним заместителем, выбранным из фтора, хлора, метила, трифторметила, метокси, изопропилокси, трифторметокси и дифторметокси,
причем метильный фрагмент бензила необязательно замещен гидроксилом, этилом, или одним или двумя метильными заместителями;
1,3,4-оксадиазол-5-ила формулы 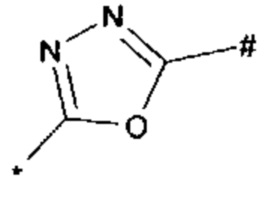 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
C1-C4 алкила, С1-С2 фторалкила, метокси-С1-С4 алкила, трет-бутокси-этила, C3-C6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен фенилом, причем фенил необязательно замещен хлором или метокси;
оксопирролидинилметила,
пиперидинилметила;
морфолинилэтила, причем этильный фрагмент необязательно замещен метилом;
фенила, причем фенил необязательно замещен одним или двумя заместителями, выбранными из
C1-C4 алкила, фтора, хлора, трифторметила, метокси и циано;
и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метокси, трифторметокси и дифторметокси;
1,2,4-оксадиазол-3-ила формулы 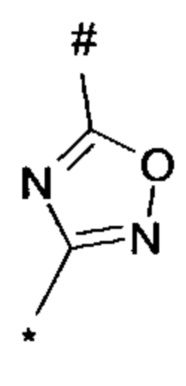 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
C1-C4 алкила,
фенила, причем фенил необязательно замещен одним или двумя заместителями, выбранными из
С1-С2 алкила, фтора, хлора, трифторметила, метокси и трифторметокси;
и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями хлор;
1,2-оксазолила, причем 1,2-оксазолил замещен фенилом,
тиофенила, причем тиофенил необязательно замещен заместителем, выбранным из метила и циано;
1,3-тиазолила,
причем 1,3-тиазолил необязательно замещен одним заместителем, выбранным из C1-C4 алкила, C1-C4 галоалкила, циклопропила и фенила,
причем фенил необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метила и трифторметила,
или причем 1,3-тиазолил необязательно замещен двумя заместителями, выбранными из метила, этила и изопропила, или причем 1,3-тиазолил необязательно замещен фенилом и метилом;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород,
R2 и R3 имеют значения, как определено выше,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород,
R2 представляет собой водород или метил,
R3 определен выше,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород,
R2 представляет собой водород или метил,
R3 выбирается из
1,2,4-оксадиазол-5-ила формулы 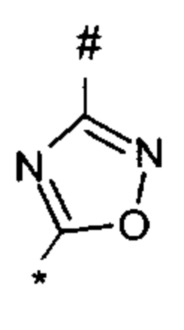 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
С1-С6 алкила, C1-C4 фторалкила, метокси-C1-C4 алкила, трет-бутокси-этила, C3-C6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен фенилом, причем фенил необязательно замещен метокси;
оксанила;
пиперидинила, причем пиперидинил замещен циклопропилом;
пиперидинилметила, причем пиперидинилметил необязательно замещен метилом;
тетрагидрофуранила;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, фтора, хлора, трифторметила, метокси, трифторметокси, метилового сложного эфира, нитро, амино и диметиламино; и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями фтор и одним заместителем метокси, или
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора и метокси,
или фенильный фрагмент необязательно замещен одним заместителем, выбранным из фтора, хлора, метила, трифторметила, метокси, изопропилокси, трифторметокси и дифторметокси,
причем метильный фрагмент бензила необязательно замещен гидроксилом, этилом или одним или двумя метильными заместителями
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород,
R2 представляет собой водород или метил,
R3 выбирается из
1,3,4-оксадиазол-5-ила формулы 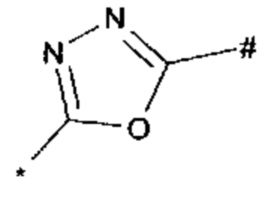 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
C1-C4 алкила, С1-С2 фторалкила, метокси-C1-C4 алкила, трет-бутокси-этила, C3-C6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен фенилом, причем фенил необязательно замещен хлором или метокси;
оксопирролидинилметила,
пиперидинилметила;
морфолинилэтила, причем этильный фрагмент необязательно замещен метилом;
фенила, причем фенил необязательно замещен одним или двумя заместителями, выбранными из
C1-C4 алкила, фтора, хлора, трифторметила, метокси и циано; и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метокси, трифторметокси и дифторметокси.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород,
R2 представляет собой водород или метил,
R3 выбирается из
1,2,4-оксадиазол-3-ила формулы 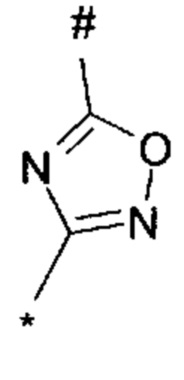 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
C1-C4 алкила,
фенила, причем фенил необязательно замещен одним или двумя заместителями, выбранными из
С1-С2 алкила, фтора, хлора, трифторметила, метокси и трифторметокси; и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями хлор,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород,
R2 представляет собой водород или метил,
R3 выбирается из
1,3-тиазолила,
причем 1,3-тиазолил замещен одним заместителем, выбранным из С1-С5 алкила, C1-C4 галоалкила, циклопропила и фенила,
причем фенил необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метила и трифторметила,
или причем 1,3-тиазолил замещен двумя заместителями, выбранными из метила, этила и изопропила, или причем тиазолил необязательно замещен фенилом и метилом;
и их соли, сольваты и сольваты солей.
Настоящее изобретение обеспечивает соединения общей формулы (I-A)
I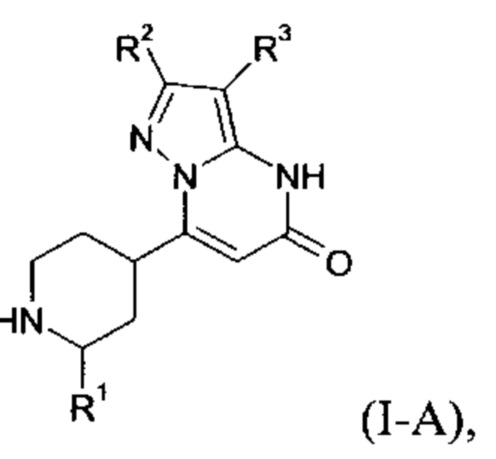
в которой
R1 выбран из водорода и С1-С4 алкила;
R2 выбран из водорода, C1-C4 алкила, C3-C6 циклоалкила, C1-C4 галоалкила, карбоксила, C1-C4 алкилового сложного эфира, C1-C4 алкокси-C1-C4 алкила, фенила, причем фенил необязательно замещен галогеном, 5-6-членного гетероарила, амино, С1-С4 алкиламидо и C1-C4 алкил-сульфонамида;
R3 выбран из водорода, галогена, циано, C1-C4 алкилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира;
фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
галогена, C1-C4 алкила, C1-C4 галоалкила, C1-C4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, C1-C4 галоалкокси, бензилокси, циано, метилсульфонила, и
фенил, причем фенил необязательно замещен C1-C4 галоалкилом;
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, C1-C4 галоалкила, C1-C4 алкокси, C1-C4 алкокси-C1-C4 алкила, циано, C1-C4 алкил-SO2-С1-С4 алкила, CO-NH2, C3-C6 циклоалкила, C3-C6 циклоалкил-С1-С4 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, C1-C4 алкокси и галогена;
5-6-членного гетероциклоалкила, причем 5-6-членный гетероциклоалкил необязательно замещен C3-C6 циклоалкилом;
5-6-членного гетероциклоалкил-С1-С4 алкила, причем 5-6-членный гетероциклоалкил необязательно замещен C1-C4 алкилом;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена, C1-C4 галоалкила, C1-C4 алкокси, С1-С4 галоалкокси, СО-O-С1-С4-алкила, NO2, NH2, ди-C1-C4 алкиламина и циано; и
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила и C1-C4 галоалкила;
CO-R4, где
R4 выбирается из группы соединений формул  и
и  , где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
, где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
и
CO-N(R5R7), где
R5 выбран из водорода, и C1-C4 алкила;
R7 выбран из водорода, С1-С6 алкила, С1-С6 галоалкила, C1-C4-алкокси-C1-C4 алкила, амино-оксо-C1-C4 алкила, нафтила;
C3-C6 циклоалкила, причем C3-C6 циклоалкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила;
C3-C6 циклоалкил-С1-С4 алкила, C3-C6 гетероциклила, оксазолидинил-C1-C4 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и С1-С4-алкокси;
бензил-C3-C6 циклоалкила;
имидазолил-С1-С4 алкила, причем имидазолил-C1-C4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила;
оксазолидинон-C1-C4 алкила;
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и С1-С4 алкокси;
или
- N(R5R7) выбирается из группы 5-7 членных циклических аминов, которые содержат один или два кольцевых атомов азота и ноль или один кольцевой атом кислорода и присоединяются через кольцевой атом азота, причем 5 7 членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из C1-C4 алкокси, оксо, галогена и С1-С4 алкила;
R2 и R3 вместе образуют C5-С6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Настоящее изобретение также обеспечивает соединения формулы (I-B)
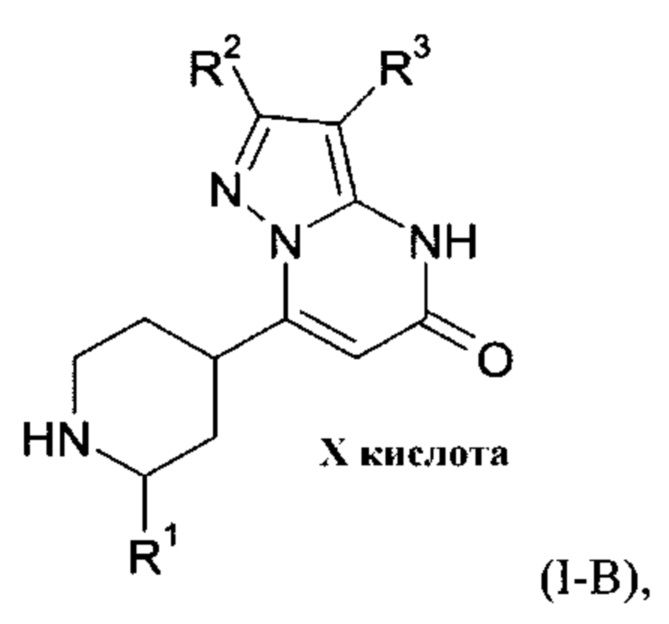
в которой R1, R2, и R3 имеют значения, как определено выше.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и C1 алкила;
R2 выбран из водорода, C1-C4 алкила, C3-C6 циклоалкила, C1-C4 галоалкила, карбоксила, C1-C4 алкилового сложного эфира, C1-C4 алкокси-C1-C4 алкила, фенила, причем фенил необязательно замещен галогеном, 5-6-членного гетероарила;
R3 выбран из водорода, галогена, циано, C1-C4 алкилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира;
фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
галогена, C1-C4 алкила, C1-C4 галоалкила, C1-C4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, C1-C4 галоалкокси, бензилокси, циано, метилсульфонила и
фенила, причем фенил необязательно замещен C1-C4 галоалкилом;
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, C1-C4 галоалкила, C1-C4 алкокси, C1-C4 алкокси-C1-C4 алкила, циано, C1-C4 алкил-SO2-С1-С4 алкила, CO-NH2, C3-C6 циклоалкила, C3-C6 циклоалкил-С1-С4 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, C1-C4 алкокси и галогена;
5-6-членного гетероциклоалкила, причем 5-6-членный гетероциклоалкил необязательно замещен C3-C6 циклоалкилом;
5-6-членного гетероциклоалкил-С1-С4 алкила, причем 5-6-членный гетероциклоалкил необязательно замещен C1-C4 алкилом;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена, C1-C4 галоалкила, C1-C4 алкокси и C1-C4 галоалкокси, СО-O-С1-С4-алкила, NO2, NH2, ди-C1-C4 алкиламина, и циано; и
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила и C1-C4 галоалкила;
или
R2 и R3 вместе образуют C5-C6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и C1 алкила;
R2 представляет собой водород;
R3 выбран из водорода;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
галогена, С1-С4 алкила, C1-C4 галоалкила, C1-C4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, C1-C4 галоалкокси, бензилокси, циано, метилсульфонила и
фенила, причем фенил необязательно замещен С1-С4 галоалкилом;
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, C1-C4 галоалкила, C1-C4 алкокси, С1-С4 алкокси-C1-C4 алкила, циано, C1-C4 алкил-SO2-C1-C4 алкила, CO-NH2, C3-C6 циклоалкила, C3-C6 циклоалкил-С1-С4 алкила;
бензил, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, C1-C4 алкокси и галогена;
5-6-членного гетероциклоалкила, причем 5-6-членный гетероциклоалкил необязательно замещен C3-C6 циклоалкилом;
5-6-членного гетероциклоалкил-С1-С4 алкила, причем 5-6-членный гетероциклоалкил необязательно замещен C1-C4 алкилом;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, C1-C4 галоалкила, C1-C4 алкокси, и C1-C4 галоалкокси, СО-O-С1-С4-алкила, NO2, NH2, ди-C1-C4 алкиламина и циано; и
5-6-членного гетероарила, причем 5-6-членный гетероарил причем необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила и C1-C4 галоалкила;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
галогена, метила, трифторметила, метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, трифторметокси, бензилокси, циано, метилсульфонила и
фенила, необязательно замещен трифторметилом;
оксадиазолила формулы  или
или 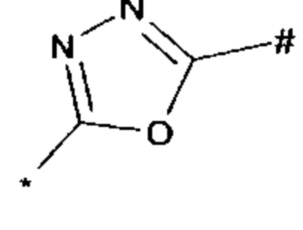 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
C1-C4 алкила, C1-C4 галоалкила, метокси-C1-C4 алкила, С1-С3-алкилсульфонилметила, сульфонил-С1-С3-алкила, CO-NH2, C3-C6 циклоалкила, С3-С6 циклоалкил-C1 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, метокси и галогена;
пиперидинила, причем пиперидинил необязательно замещен циклопропила;
пиперидинилметила, причем пиперидинилметил необязательно замещен метилом;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, трифторметила, метокси, трифторметокси, СО-О-СН3, NO2, NH2, диметиламина и циано;
тиофенила, причем тиофенил необязательно замещен галогеном;
фуранила;
имидазолила, причем имидазолил необязательно замещен метилом;
и
пиридинила, причем пиридинил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, трифторметила и галогена;
пиридинила, причем пиридинил необязательно замещен метокси;
тиофенила, причем тиофенил необязательно замещен заместителем, выбранным из метила и циано;
и
тиазолила, причем тиазолил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила и фенила, причем фенил необязательно замещен заместителем, выбранным из галогена и трифторметила;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 и R2 имеют значения, как определено выше.;
R3 выбирается из
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
галогена, метила, трифторметила, метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, трифторметокси, бензилокси, циано, метилсульфонила и
фенила, необязательно замещен трифторметилом;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
галогена, метила, трифторметила, метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, трифторметокси, бензилокси, циано, метилсульфонила и
фенила, необязательно замещен трифторметилом;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 и R2 имеют значения, как определено выше.;
R3 выбирается из
оксадиазолила формулы 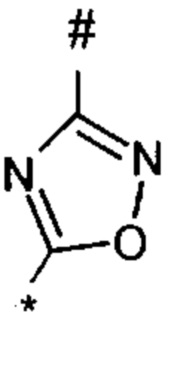 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
C1-C4 алкила, C1-C4 галоалкила, метокси-C1-C4 алкила, C3-C6 циклоалкила, C3-C6 циклоалкил-C1 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, метокси и галогена;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, трифторметила, метокси, трифторметокси, СО-О-СН3, NO2, NH2, диметиламина и циано; и
тиофенила, причем тиофенил необязательно замещен галогеном;
фуранила;
имидазолила, причем имидазолил необязательно замещен метилом;
и
пиридинила, причем пиридинил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, трифторметила и галогена;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
оксадиазолила формулы 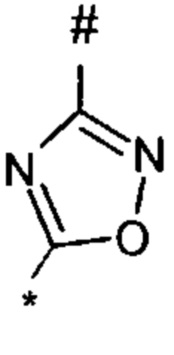 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
C1-C4 алкила, C1-C4 галоалкила, метокси-С1-С4 алкила, C3-C6 циклоалкила, C3-C6 циклоалкил-C1 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, метокси и галогена;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, трифторметила, метокси, трифторметокси, СО-О-СН3, NO2, NH2, диметиламина и циано; и
тиофенила, причем тиофенил необязательно замещен галогеном,
фуранила,
имидазолила, причем имидазолил необязательно замещен метилом,
и
пиридинила, причем пиридинил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, трифторметила и галогена;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 и R2 имеют значения, как определено выше.;
R3 выбирается из
оксадиазолила формулы 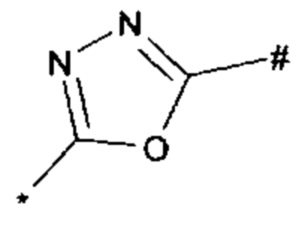 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
C1-C4 алкила, C1-C4 галоалкила, метокси-С1-С4 алкила, C3-C6 циклоалкила, C3-C6 циклоалкил-C1 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, метокси и галогена;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, трифторметила, метокси, трифторметокси; и
тиофенила, причем тиофенил необязательно замещен галогеном;
фуранила;
имидазолила, причем имидазолил необязательно замещен метилом;
и
пиридинила, причем пиридинил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, трифторметила и галогена;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
оксадиазолила формулы 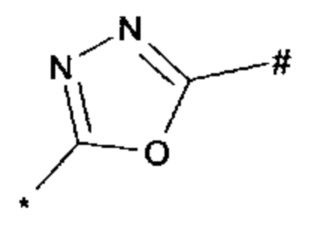 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
C1-C4 алкила, C1-C4 галоалкила, метокси-C1-C4 алкила, C3-C6 циклоалкила, C3-C6 циклоалкил-С1 алкила;
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, метокси и галогена;
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, трифторметила, метокси, трифторметокси; и
тиофенила, причем тиофенил необязательно замещен галогеном;
фуранила;
имидазолила, причем имидазолил необязательно замещен метилом;
и
пиридинила, причем пиридинил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, трифторметила и галогена;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 и R2 имеют значения, как определено выше.;
R3 выбирается из
оксадиазолила формулы 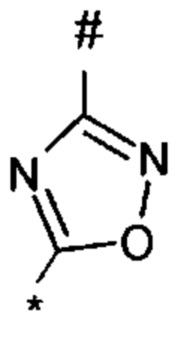 или
или 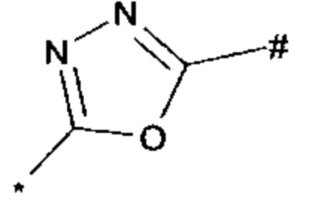 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, трифторметила, метокси, трифторметокси, СО-О-СН3, NO2, NH2, диметиламина и циано; и
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
оксадиазолила формулы  или
или 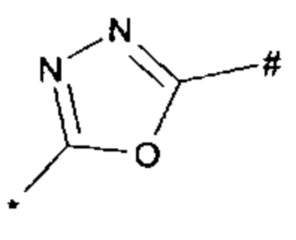 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен заместителем, выбранным из
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, галогена, трифторметила, метокси, трифторметокси, СО-О-СН3, NO2, NH2, диметиламина и циано; и
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 и R2 имеют значения, как определено выше.;
R3 выбирается из
пиридинила, причем пиридинил необязательно замещен метокси,
тиофенила, причем тиофенил необязательно замещен заместителем, выбранным из метила и циано,
тиазолила, причем тиазолил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила и фенила, причем фенил необязательно замещен заместителем, выбранным из галогена и трифторметила,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
пиридинила, причем пиридинил необязательно замещен метокси,
тиофенила, причем тиофенил необязательно замещен заместителем, выбранным из метила и циано,
тиазолила, причем тиазолил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила и фенила, причем фенил необязательно замещен заместителем, выбранным из галогена и трифторметила,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 и R2 имеют значения, как определено выше.;
R3 представляет собой оксадиазолил формулы 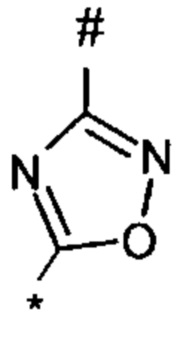 где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен фенильным заместителем, причем фенильный заместитель замещен 4-трифторметилом;
где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен фенильным заместителем, причем фенильный заместитель замещен 4-трифторметилом;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой оксадиазолил формулы 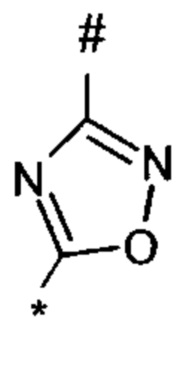 где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен фенильным заместителем, причем фенильный заместитель замещен 4-трифторметилом;
где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен фенильным заместителем, причем фенильный заместитель замещен 4-трифторметилом;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 и R2 имеют значения, как определено выше.;
R3 представляет собой оксадиазолил формулы 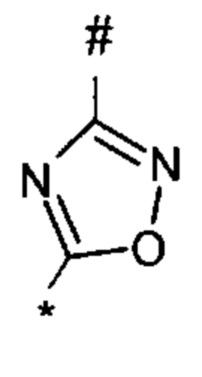 где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен фенильным заместителем, причем фенильный заместитель замещен 3-хлором;
где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен фенильным заместителем, причем фенильный заместитель замещен 3-хлором;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой оксадиазолил формулы 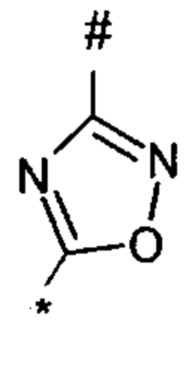 где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен фенильным заместителем, причем фенильный заместитель замещен 3-хлором;
где * означает положение связывания с пиразолпиримидоном, и # означает связь с другим заместителем, причем оксадиазолил замещен фенильным заместителем, причем фенильный заместитель замещен 3-хлором;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
и R2 и R3 каждый имеет значения, как указано выше.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом.
R2 представляет собой водород;
и R1 и R3 каждый имеет значения, как указано выше.
Настоящее изобретение также обеспечивает соединения общей формулы (I-A)
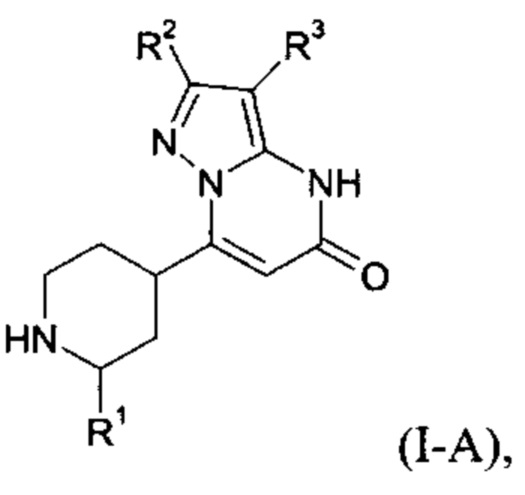
в которой
R1 выбран из водорода и C1-С4 алкила;
R2 выбран из водорода, C1-C4 алкила, C3-C6 циклоалкила, C1-C4 галоалкила, карбоксила, C1-C4 алкилового сложного эфира, C1-C4 алкокси-C1-C4 алкила, фенила, причем фенил необязательно замещен галогеном, 5-6-членного гетероарила, амино, C1-C4 алкиламида и C1-C4 алкил сульфонамида;
R3 выбран из водорода, галогена, циано, C1-C4 алкилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира,
фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила, C1-C4 галоалкила, C1-С4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, C1-C4 галоалкокси, бензилокси, циано и метилсульфонила,
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, C1-C4 алкокси, C1-C4 алкокси C1-C4 алкила, циано, бензила, C3-C6 циклоалкила, фенила, причем фенил необязательно замещен C1-C4 алкилом, галогена, C1-C4 галоалкила, C1-C4 галоалкокси и 5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями галоген,
CO-R4, где
R4 выбирается из группы соединений формул
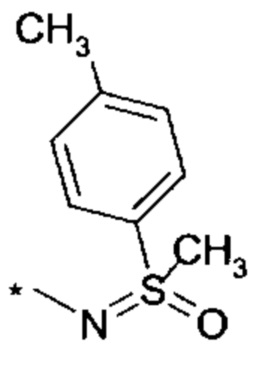 и
и 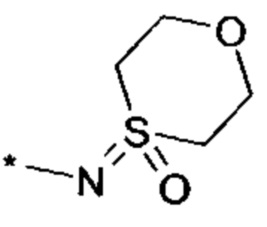 , где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
, где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
и
CO-N(R5R7), где
R5 выбран из водорода и C1-C4 алкила,
R7 выбран из водорода, С1-С6 алкила, C1-С6 галоалкила, C1-C4-алкокси-С1-С4 алкила, амино-оксо-С1-С4 алкила, нафтила,
C3-C6 циклоалкила, причем C3-C6 циклоалкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила,
C3-C6 циклоалкил-С1-С4 алкила, C3-C6 гетероциклила, оксазолидинил-С1-С4 алкила,
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и C1-С4-алкокси,
бензил-C3-C6 циклоалкила,
имидазолил-C1-C4 алкила, причем имидазолил-C1-C4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила,
оксазолидинон-C1-C4 алкила,
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и C1-С4 алкокси;
или
- N(R5R7) выбирается из группы 5-7 членных циклических аминов, которые содержат один или два кольцевых атомов азота и ноль или один кольцевой атом кислорода и присоединяются через кольцевой атом азота, причем 5-7 членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из C1-C4 алкокси, оксо, галогена и C1-C4 алкила;
или
R2 и R3 вместе образуют C5-C6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и C1-C4 алкила;
R2 выбран из водорода, C1-C4 алкила, C3-C6 циклоалкила, C1-C4 галоалкила, карбоксила, C1-C4 алкилового сложного эфира, C1-C4 алкокси-C1-C4 алкила, фенила, причем фенил необязательно замещен галогеном, 5-6-членного гетероарила;
R3 выбран из водорода, галогена, циано, С1-С4 алкилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира, фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена,
С5 арила, причем С5 арил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила, C1-C4 галоалкила, C1-С4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, C1-C4 галоалкокси, бензилокси, циано и метилсульфонила,
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила, C1-C4 алкокси, C1-C4 алкокси С1-С4 алкила, циано, бензила, C3-C6 циклоалкила, фенила, причем фенил необязательно замещен C1-C4 алкилом и 5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями галоген,
CO-R4, где
R4 выбирается из группы соединений формул
 и
и 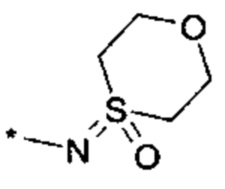 , где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
, где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
и
CO-N(R5R7), где
R5 выбран из водорода, и C1-C4 алкила,
R7 выбран из водорода, C1-C6 алкила, С1-С6 галоалкила, C1-C4-алкокси-С1-С4 алкила, амино-оксо-C1-C4 алкила, нафтила,
C3-C6 циклоалкила, причем C3-C6 циклоалкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, C3-C6 циклоалкил-C1-C4 алкила, C3-C6 гетероциклила, оксазолидинил-C1-C4 алкила,
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, бензил-C3-C6 циклоалкила, имидазолил-С1-С4 алкила, причем имидазолил-C1-C4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, оксазолидинон-С1-С4 алкила,
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена и C1-С4 алкокси;
или
- N(R5R7) выбирается из группы 5-7 членных циклических аминов, которые содержат один или два кольцевых атомов азота и ноль или один кольцевой атом кислорода и присоединяются через кольцевой атом азота, причем 5-7 членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из C1-C4 алкокси, оксо, галогена и C1-C4 алкила;
или
R2 и R3 вместе образуют C5-С6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и C1-C4 алкила;
R2 выбран из водорода, C1-C4 алкила, C3-C6 циклоалкила, C1-C4 галоалкила, карбоксила, C1-C4 алкилового сложного эфира, C1-C4 алкокси-C1-C4 алкила, фенила, причем фенил необязательно замещен галогеном, 5-6-членного гетероарила;
R3 выбран из водорода, галогена, циано, C1-C4 алкилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира, фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, C1-C4 алкила, C1-C4 галоалкила, C1-C4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, C1-C4 галоалкокси, бензилокси, циано и метилсульфонила,
5-6-членного гетероарила,
причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, C1-C4 алкокси, C1-C4 алкокси C1-C4 алкила, циано, бензила, C3-C6 циклоалкила, фенила, причем фенил необязательно замещен C1-C4 алкилом, и 5-6 членного гетероарила, причем 5-6 членный гетероарил необязательно замещен одним, двумя или тремя заместителями галоген,
CO-R4, где
R4 выбирается из группы соединений формул
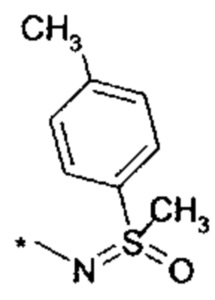 и
и 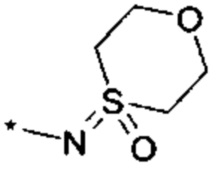 , где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
, где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
и
CO-N(R5R7), где
R5 выбран из водорода и C1-C4 алкила,
R7 выбран из водорода, С1-С6 алкила, С1-С6 галоалкила, C1-C4-алкокси-C1-C4 алкила, амино-оксо-C1-C4 алкила, нафтила,
C3-C6 циклоалкила, причем C3-C6 циклоалкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, С3-С6 циклоалкил-С1-С4 алкила, C3-C6 гетероциклила, оксазолидинил-С1-С4 алкила,
бензила, причем бензил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, бензил-C3-C6 циклоалкила, имидазолил-C1-C4 алкила, причем имидазолил-C1-C4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, оксазолидинон-C1-C4 алкила,
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, галогена, и С1-С4 алкокси;
или
- N(R5R7) выбирается из морфолинила, пиперидинила, пиперазинила, диазепанила и пирролидинила, причем морфолинил, пиперидинил, пиперазинил, диазепанил и пирролидинил необязательно замещены одним, двумя или тремя заместителями, выбранными из C1-C4 алкокси, оксо, галогена и C1-C4 алкила;
или
R2 и R3 вместе образуют C5-C6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и метила;
R2 выбран из водорода, метила, циклопропила, трифторметила, карбоксила, метилового сложного эфира, метокси-метила, фенила, причем фенил необязательно замещен галогеном, и тиенила;
R3 выбран из водорода, галогена, циано, этилового сложного эфира, карбоксила, карбоксамида, бензилового сложного эфира, фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, метила, трифторметила, метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, трифторметокси, бензилокси, циано, и метилсульфонила,
оксадиазолила, причем оксадиазолил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, этила, метоксиизобутила, циклобутила, бензила, тиенила, причем тиенил необязательно замещен галогеном, и фуранила, пиридинила, причем пиридинил необязательно замещен метокси, тиенила, причем тиенил необязательно замещен заместителем, выбранным из метила и циано,
CO-R4, где
R4 выбирается из группы соединений формул 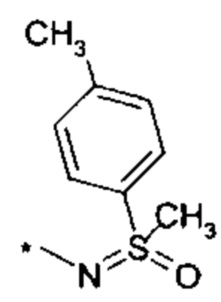 и
и 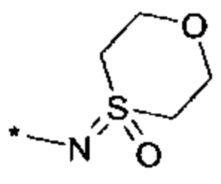 , где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
, где "*" не означает атом водорода или группу СН2, но образует часть связи с атомом, который обозначен в каждом случае, и к которому присоединен R4;
и
CO-N(R5R7), где
R5 выбран из водорода, метила и этила,
R7 выбран из водорода, пропила, изопентила, трифторэтила, метоксипропила, амино-оксо-этила, нафтила, циклобутила, причем циклобутил необязательно замещен метилом, циклопропилметила, циклопентилметила, циклопентилэтила, тетрагидрофуранила, оксазолидинилэтила, бензила, причем бензил необязательно замещен одним, двумя или тремя метильными заместителями, бензил-циклопропила, имидазолилметила, причем имидазолилметил необязательно замещен пропилом, оксазолидинонэтила, фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, этила, галогена, метокси;
или
- N(R5R7) выбирается из морфолинила, пиперидинила, пиперазинила, диазепанила и пирролидинила, причем морфолинил, пиперидинил, пиперазинил, диазепанил и пирролидинил необязательно замещены одним, двумя или тремя заместителями, выбранными из С1-С2 алкокси, оксо, галогена и метила;
или
R2 и R3 вместе образуют циклопентильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом.
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из водорода, галогена, циано, карбоксила, карбоксамида,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, метила, трифторметила, метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо, трифторметокси, бензилокси, циано, и метилсульфонила,
оксадиазолила, причем оксадиазолил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, этила, метоксиизобутила, циклобутила, бензила, тиенила, причем тиенил необязательно замещен галогеном, и фуранила, пиридинила, причем пиридинил необязательно замещен метокси, тиенила, причем тиенил необязательно замещен заместителем, выбранным из метила и циано,
CO-N(R5R7), где
R5 представляет собой водород,
R7 выбран из водорода, пропила, изопентила, трифторэтила, метоксипропила, амино-оксо-этила, нафтила, циклобутила, причем циклобутил необязательно замещен метилом, циклопропилметила, циклопентилметила, циклопентилэтила, тетрагидрофуранила, оксазолидинилэтила, бензила, причем бензил необязательно замещен одним, двумя или тремя метильными заместителями, бензил-циклопропила, имидазолилметила, причем имидазолилметил необязательно замещен пропилом, оксазолидинон-этила, фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, этила, галогена, метокси;
или
- N(R5R7) выбирается из морфолинила, пиперидинила, пиперазинила, диазепанила и пирролидинила, причем морфолинил, пиперидинил, пиперазинил, диазепанил и пирролидинил необязательно замещены одним, двумя или тремя заместителями, выбранными из С1-С2 алкокси, оксо, галогена и метила;
или
R2 и R3 вместе образуют циклопентильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой оксадиазолил, причем оксадиазолил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, этила, метоксиизобутила, циклобутила, бензил, тиенила, причем тиенил необязательно замещен галогеном, и фуранила, пиридинила, причем пиридинил необязательно замещен метокси, тиенила, причем тиенил необязательно замещен заместителем, выбранным из метила и циано.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и C1-C5 алкила;
R2 выбран из водорода, С1-С2 алкила, С3-С4 циклоалкила, С1-C2 галоалкила, карбоксила, С1-С2 алкилового сложного эфира, С1-С2 алкокси- С1-С2 алкила, галогена, метилсульфанила, фенила,
причем фенил необязательно замещен заместителем, выбранным из фтора и хлора,
и 5-6-членного гетероарила;
R3 выбран из водорода, брома, хлора, циано, метила, причем метил необязательно замещен ди-C1-C4 алкиламино, этила, C1-C4 алкенила, C1-C4 алкилового сложного эфира, причем C1-C4 алкиловый сложный эфир необязательно замещен одним, двумя или тремя заместителями фтор, С3-С4 циклоалкилового сложного эфира, С3-С4 циклоалкила, карбоксила, карбоксамида, бензилового сложного эфира, -NH-CO-фенила, -CS-NH2,
фенилсульфонила, причем фенилсульфонил необязательно замещен одним или двумя заместителями, выбранными из хлора и фтора,
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из брома, хлора, фтора, этокси и метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо,
или причем фенил необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила, С1-С2 фторалкила, C1-С2 фторалкокси, и циано,
или причем фенил необязательно замещен одним заместителем, выбранным из бензилокси, метилсульфонила и фенила,
причем фенил необязательно замещен С1-С2 фторалкилом,
5-6-членного гетероциклил-С1-С2 алкила, причем 5-6-членный гетероциклильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила и оксо;
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним или двумя заместителями, выбранными из
С1-С6 алкила, С2-С6 алкенила, C1-C4 галоалкила, С1-С2 аминоалкила, С1-С2 алкилового сложного эфира, С1-С2 алкокси, С1-С2 галоалкокси, С1-С2 алкокси-C1-C4 алкила, циано, гидроксила, карбоксила, С1-С2 алкил-SO2-С1-С2 алкила, и -CO-NH2,
или 5-6-членного гетероарил необязательно замещен одним C3-C6 циклоалкильным заместителем,
причем С3-С6 циклоалкил необязательно замещен одним, двумя или тремя заместителями хлор, фтор или метил, или фенилом, причем фенил необязательно замещен С1-С2 алкокси, хлором или фтором,
мостиково би- или трициклоалкила,
C3-C6 циклоалкил-С1-С2 алкила, C3-C6 циклоалкил-C1-C4 алкенила,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, хлора, фтора, С1-С2 фторалкила, С1-С2 алкокси, С1-С2 фторалкокси, С1-С2-алкилового сложного эфира, нитро, амино, ди-С1-С2 алкиламино и циано,
фенил-С1-С2 алкила,
причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С2 алкила, С1-С2 фторалкила, С1-С2 алкокси, С1-С2 фторалкокси и гидроксила,
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила и гидроксила,
5-6-членного гетероциклоалкила, причем 5-6-членный гетероциклоалкил необязательно замещен С3-С5 циклоалкилом или С1-С3 алкилом,
5-6-членного гетероциклоалкил-С1-С2 алкила,
причем 5-6-членный гетероциклоалкильный фрагмент необязательно замещен С1-С2 алкилом или оксо,
причем С1-С2 алкильный фрагмент необязательно замещен С1-С2 алкилом,
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С3 алкила, и С1-С2 фторалкила,
и
5-6-членного гетероарил-C1-C4 алкила,
причем 5-6-членный гетероарильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкокси и С1-С2 алкила,
причем С1-С2 алкильный фрагмент необязательно замещен одним или двумя метильными заместителями;
CO-R4, где
R4 выбирается из группы C1-C4 алкила, где C1-C4 алкил необязательно замещен 1 или 2 метильными заместителями, и C3-C6 циклоалкила;
и
CO-N(R5R7), где
R5 выбран из водорода, и C1-C4 алкила;
R7 выбран из C1-C4 алкила, C1-C4 галоалкила, С1-С2-алкокси-С1-С4 алкила, амино-оксо-С1-С4 алкила, нафтила,
C3-C6 циклоалкила, причем C3-C6 циклоалкил необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила,
C3-C6 циклоалкил-С1-С2 алкила, 5-6-членного гетероциклила, оксазолидинил-С1-С2 алкила,
бензила, причем фенильный фрагмент бензила необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила, причем метильный фрагмент бензила необязательно замещен С1-С2 алкилом;
бензил-С3-С4 циклоалкила,
имидазолил-С1-С2 алкила, причем имидазолил-С1-С2 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила,
оксазолил-С1-С2 алкила, причем оксазолил-С1-С2 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила,
оксазолидинон-С1-С2 алкила,
пиридинил-С1-С2 алкила,
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила, галогена и С1-С2 алкокси;
или
- N(R5R7) выбирается из группы 5-7 членных циклических аминов, которые содержат один или два кольцевых атомов азота, ноль или один кольцевой атом кислорода, ноль или один кольцевой атом серы, и присоединяются через кольцевой атом азота, причем 5-7 членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из C1-C4 алкокси, С1-С2 алкокси С1-С2 алкила, оксо, гидроксила, галогена и С1-С3 алкила; или
- N(R5R7), выбранного из группы двух аннелированных, ароматических, частично насыщенных или насыщенных колец, каждое из которых является 5-7 членным и каждое содержит один или два кольцевых атомов азота и присоединены через кольцевой атом азота,
или
- N(R5R7) выбирается из азаспиро[2.5]окт-5-ила и окса-азаспиро[3.5]нон-1-ила, причем азаспиросоединения необязательно замещены оксо;
или
R2 и R3 вместе образуют C5-C6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 выбран из водорода и С1-С5 алкила;
R2 выбран из водорода, метила, этила, трифторметила и метилсульфанила;
R3 выбран из C1-C4 алкилового сложного эфира, причем C1-C4 алкиловый сложный эфира необязательно замещен одним, двумя или тремя заместителями фтор, С3-С4 циклоалкилового сложного эфира, С3-С4 циклоалкила,
5-ти членного гетероарила, причем 5-ти членный гетероарил необязательно замещен одним или двумя заместителями, выбранными из
C1-C6 алкила, С2-С6 алкенила, C1-C4 галоалкила, С1-С2 аминоалкила, С1-С2 алкилового сложного эфира, С1-С2 алкокси, С1-С2 галоалкокси, С1-С2 алкокси-С1-С4 алкила, циано, гидроксила, карбоксила, С1-С2 алкил-SO2-С1-С2 алкила и -CO-NH2,
или 5-ти членный гетероарил необязательно замещен одним C3-C6 циклоалкильным заместителем,
причем C3-C6 циклоалкил необязательно замещен одним, двумя или тремя заместителями хлор, фтор или метил, или одним или двумя метильными заместителями, или фенилом, причем фенил необязательно замещен С1-С2 алкокси, хлором или фтором,
мостикового би- или трициклоалкила,
C3-C6 циклоалкил-С1-С2 алкила, C3-C6 циклоалкил-С1-С4 алкенила,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из C1-C4 алкила, хлора, фтора, С1-С2 фторалкила, С1-С2 алкокси, С1-С2 фторалкокси, С1-С2-алкилового сложного эфира, нитро, амино, ди-С1-С2 алкиламино и циано,
фенил-С1-С2 алкила,
причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С2 алкила, С1-С2 фторалкила, С1-С2 алкокси, С1-С2 фторалкокси и гидроксила,
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила и гидроксила,
5-6-членного гетероциклоалкила, причем 5-6-членный гетероциклоалкил необязательно замещен С3-С5 циклоалкилом или С1-С3 алкилом,
5-6-членного гетероциклоалкил-С1-С2 алкила,
причем 5-6-членный гетероциклоалкильный фрагмент необязательно замещен С1-С2 алкилом или оксо,
причем С1-С2 алкильный фрагмент необязательно замещен С1-С2 алкилом,
5-6-членного гетероарила, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С3 алкила и C1-C2 фторалкила,
и
5-6-членного гетероарил-C1-C4 алкила,
причем 5-6-членный гетероарильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкокси и С1-С2 алкила,
причем С1-С2 алкильный фрагмент необязательно замещен одним или двумя метильными заместителями;
или
R2 и R3 вместе образуют C5-С6 циклоалкильное кольцо;
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из
1,2,4-оксадиазол-5-ила формулы 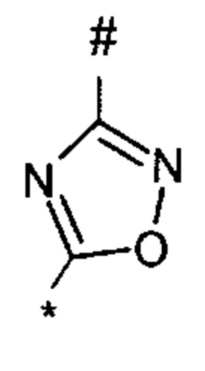 , или 1,3,4-оксадиазол-5-ила формулы
, или 1,3,4-оксадиазол-5-ила формулы 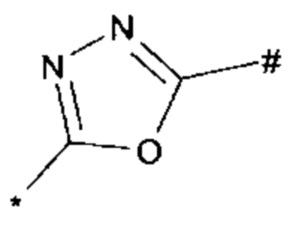 , или 1,2,4-оксадиазол-3-ила формулы
, или 1,2,4-оксадиазол-3-ила формулы 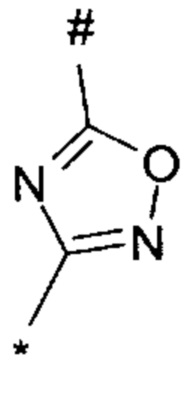 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
С1-С6 алкила, С2-С6 алкенила, C1-C4 фторалкила, С1-С2 фторалкокси, метокси-C1-C4 алкила, трет-бутокси-этила, С1-С2 алкилового сложного эфира, C3-C6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен хлором, фтором, метилом или фенилом, причем фенил необязательно замещен хлором или метокси,
оксанила,
оксопирролидинилметила,
пиперидинила, причем пиперидинил замещен циклопропилом или изопропилом,
пиперидинилметила, причем пиперидинилметил необязательно замещен метилом,
морфолинилэтила, причем этильный фрагмент необязательно замещен метилом,
тетрагидрофуранила,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
C1-C4 алкила, фтора, хлора, трифторметила, метокси, трифторметокси, метилового сложного эфира, нитро, амино, диметиламино и циано,
и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями фтор и одним заместителем метокси, или
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метокси и гидроксила,
или фенильный фрагмент необязательно замещен одним заместителем, выбранным из фтора, хлора, метила, трифторметила, метокси, изопропилокси, трифторметокси и дифторметокси,
причем метильный фрагмент бензила необязательно замещен гидроксилом, этилом, или одним или двумя метильными заместителями,
1,2-оксазолила, причем 1,2-оксазолил замещен фенилом,
тиофенила, причем тиофенил необязательно замещен заместителем, выбранным из метила и циано,
1,3-тиазолила,
причем 1,3-тиазолил необязательно замещен одним заместителем, выбранным из С1-С5 алкила, C1-C4 галоалкила, циклопропила и фенила,
причем фенил необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метила и трифторметил
или причем 1,3-тиазолил необязательно замещен двумя заместителями, выбранными из метильных, этильных и изопропильных заместителей, или причем тиазолил необязательно замещен фенилом и метилом;
пиридинила, причем пиридинил необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метила и трифторметила,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из 1,2,4-оксадиазол-5-ила формулы 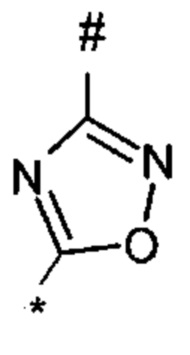 , или 1,3,4-оксадиазол-5-ила формулы
, или 1,3,4-оксадиазол-5-ила формулы 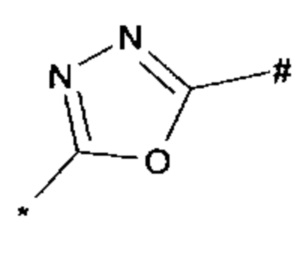 , или 1,2,4-оксадиазол-3-ила формулы
, или 1,2,4-оксадиазол-3-ила формулы 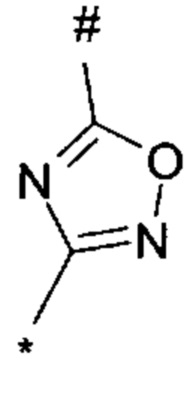 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен одним заместителем, выбранным из
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен одним заместителем, выбранным из
метила, этила, пропила, изопропила, трет-бутила, гексила, трифторметила, трифторэтила, трифторбутила, метоксиметила, метоксипропила, метоксиизобутила, этилового сложного эфира, C3-C6 циклоалкила, бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из метила, метокси, изопропилокси, фтора, хлора, трифторметила, трифторметокси и дифторметокси, или
пиридинила, причем пиридинил необязательно замещен хлором, фтором, метилом или трифторметилом,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой 1,2,4-оксадиазол-5-ил формулы 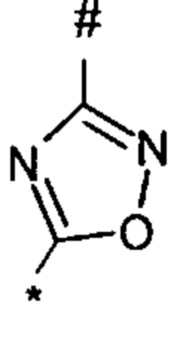 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен трет-бутилом,
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен трет-бутилом,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбирается из 1,2,4-оксадиазол-5-ила формулы 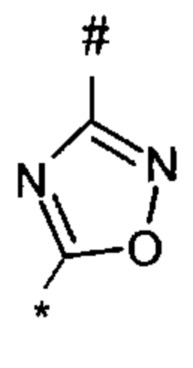 , или 1,3,4-оксадиазол-5-ила формулы
, или 1,3,4-оксадиазол-5-ила формулы 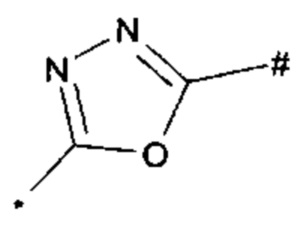 , или 1,2,4-оксадиазол-3-ила формулы
, или 1,2,4-оксадиазол-3-ила формулы 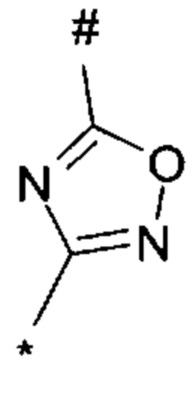 , где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен одним заместителем, выбранным из метила, этила, изопропила, трет-бутила, трифторметила, метоксиэтила, трет-бутоксиэтила, C3-C6 циклоалкила,
, где * означает положение связывания с пиразолпиримидоном, и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен одним заместителем, выбранным из метила, этила, изопропила, трет-бутила, трифторметила, метоксиэтила, трет-бутоксиэтила, C3-C6 циклоалкила,
причем C3-C6 циклоалкил необязательно замещен одним или двумя метильными заместителями,
циклобутила, бензила,
причем фенильный фрагмент бензила необязательно замещен заместителем, выбранным из фтора, хлора и гидроксила,
фенила,
причем фенил необязательно замещен заместителем, выбранным из метила, фтора, хлора, метокси, трифторметила и трифторметокси
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбирается из метилового сложного эфира, этилового сложного эфира, пропилового сложного эфира, изопропилового сложного эфира, причем этиловый сложный эфир и пропиловый сложный эфир необязательно замещены одним, двумя или тремя заместителями фтор, и циклобутилового сложного эфира,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбирается из этилового сложного эфира, пропилового сложного эфира, изопропилового сложного эфира, трет-бутилового сложного эфира, причем этиловый сложный эфир и пропиловый сложный эфир необязательно замещены одним, двумя или тремя заместителями фтор, и циклобутилового сложного эфира,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 представляет собой метил;
R3 представляет собой этиловый сложный эфир,
и их соли, сольваты и сольваты солей.
Согласно варианту выполнения настоящего изобретения, соединения формул (I-А) или (I-B) определяются следующим образом:
R1 представляет собой водород;
R2 выбирается из трифторметила, этила и метилсульфанила,
R3 выбран из С1-С4 алкилового сложного эфира, причем С1-С4 алкиловый сложный эфир необязательно замещен одним, двумя или тремя заместителями фтор, и С3-С4 циклоалкилового сложного эфира,
и их соли, сольваты и сольваты солей.
Определения радикалов, указанных конкретно в соответствующих комбинациях радикалов, заменяются по желанию независимо от конкретных комбинаций, указанных для радикалов, также определениями радикалов других комбинаций.
Согласно варианту выполнения настоящего изобретения, два или более Вариантом выполнения настоящего изобретения, указанных выше, комбинируются.
Настоящее изобретение также обеспечивает способ получения соединений формулы (IV)
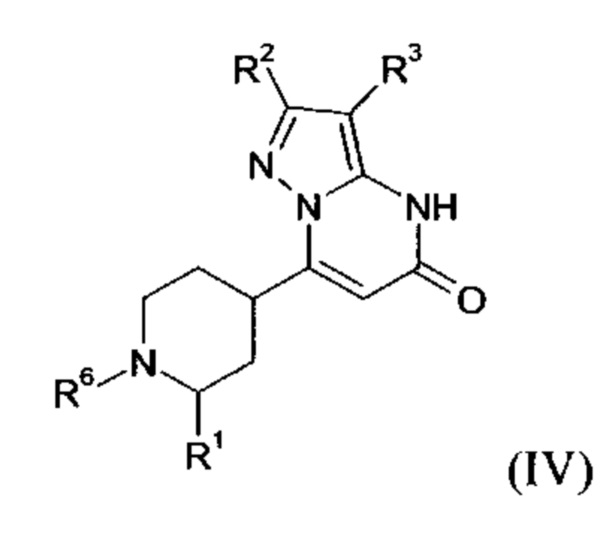
в которой R1, R2, и R3 каждый имеет значения, как указано выше, и R6 представляет собой амино- защитную группу, где
[А] соединение формулы (II-А)
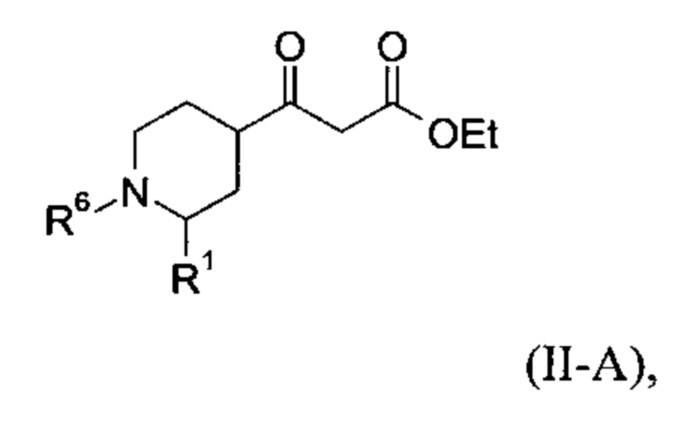
в которой R1 и R6 имеют значения, указанные выше, подвергают реакции с соединением формулы (III)
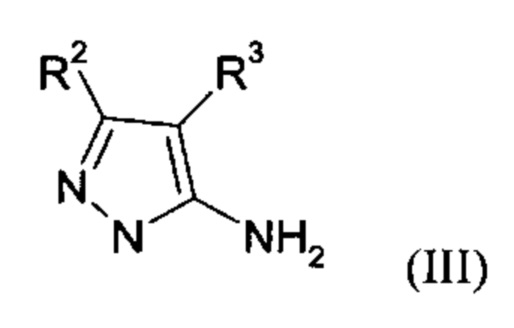
в которой R2 и R3 каждый имеет значения, приведенные выше, в инертном растворителе, необязательно в присутствии основания, с получением соединения формулы (IV)
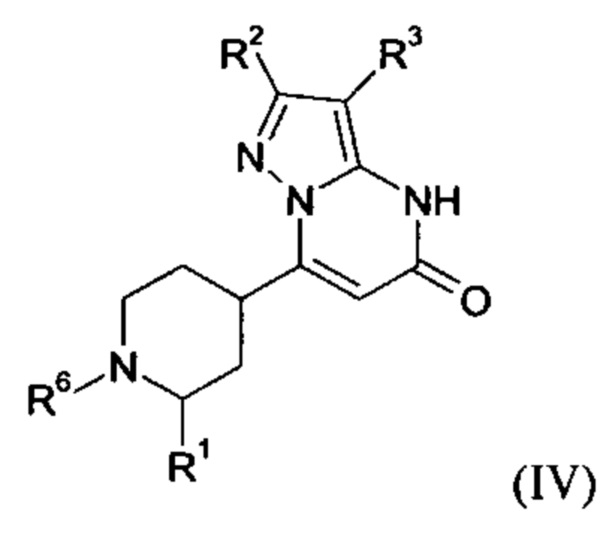
в которой R1, R2, R3, и R6 каждый имеет значения, приведенные выше,
или
[В] соединение формулы (II-В)
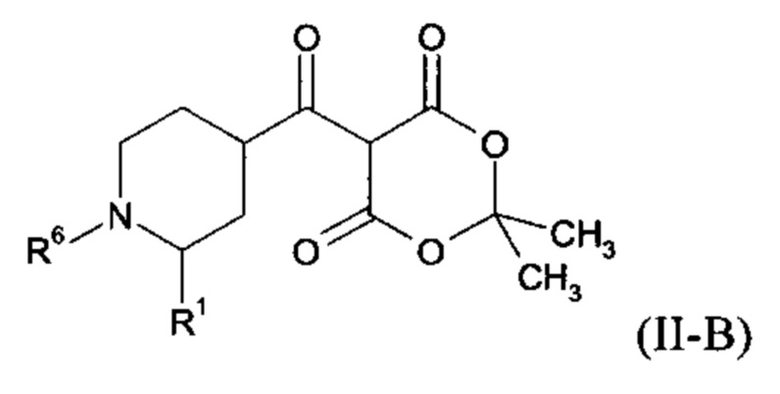
в которой R1 имеет значение, приведенное выше, и R6 представляет собой амино-защитную группу, подвергают реакции с соединением формулы (III)
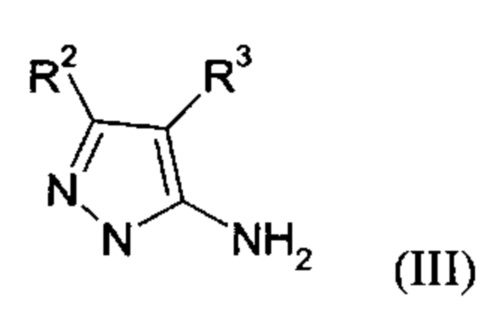
в которой R2 и R3 каждый имеет значения, приведенные выше, в инертном растворителе необязательно в присутствии основания, с получением соединения формулы (IV)
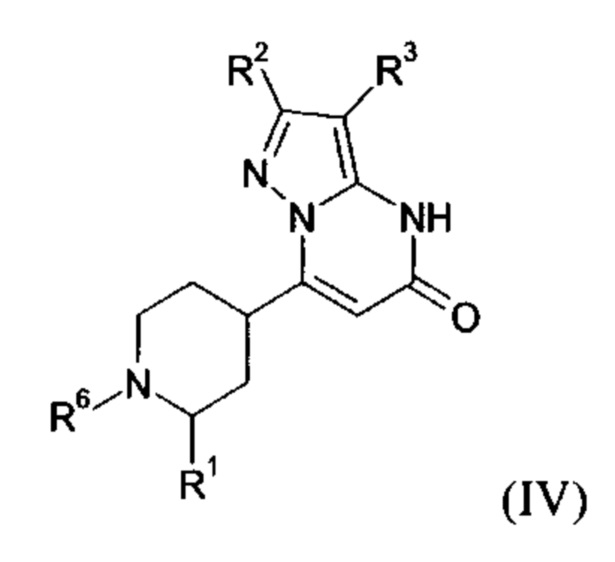
в которой R1, R2, R3, и R6 каждый имеет значения, приведенные выше.
Настоящее изобретение также обеспечивает способ получения соединений формулы (IV)
в которой R1, R2, и R3 каждый имеет значения, как указано выше, и R6 представляет собой амино-защитную группу, где
[В] соединение формулы (II-В)
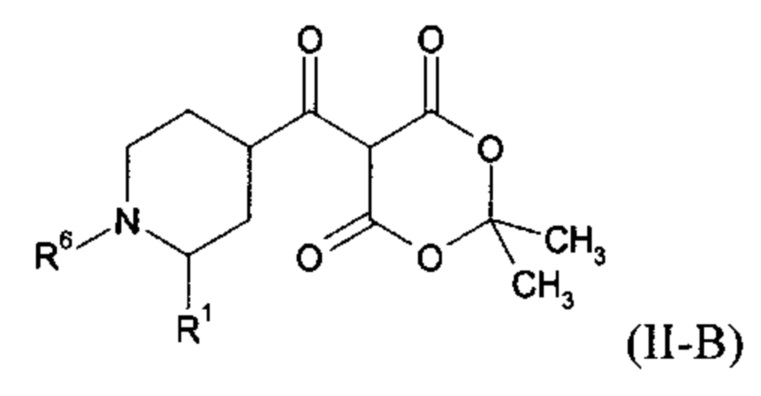
в которой R1 имеет значение, приведенное выше, и R6 представляет собой амино-защитную группу, подвергают реакции с соединением формулы (III)
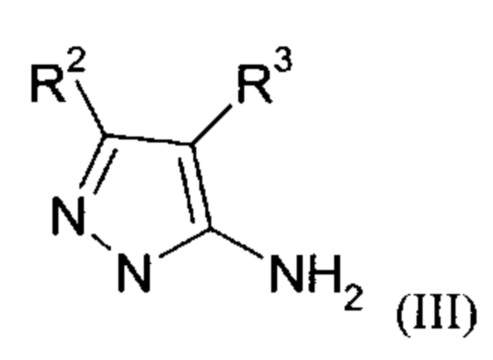
в которой R2 и R3 каждый имеет значения, приведенные выше, в инертном растворителе необязательно в присутствии основания, с получением соединения формулы (IV)
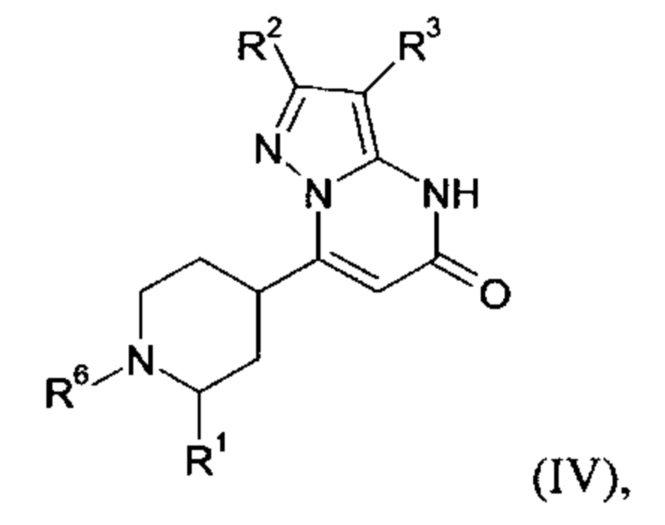
в которой R1, R2, и R3 каждый имеет значения, приведенные выше, и R6 представляет собой амино-защитную группу.
Настоящее изобретение также обеспечивает региоселективный способ получения соединений формулы (IV)
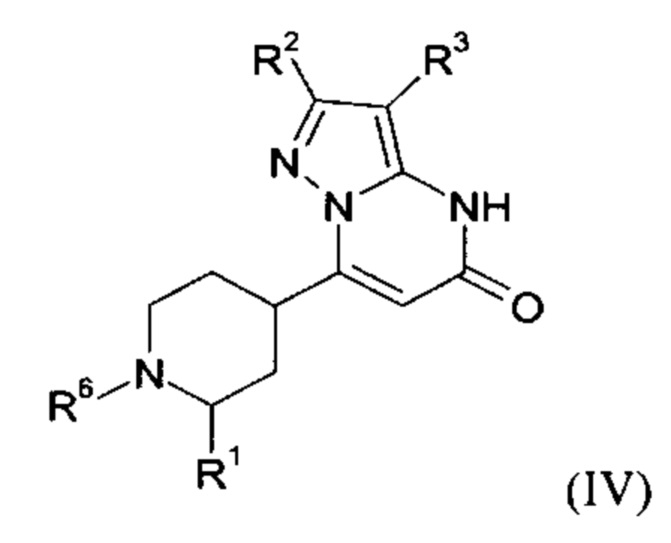
в которой R1, R2, и R3 каждый имеет значения, как указано выше, и R6 представляет собой амино-защитную группу, где
[В] соединение формулы (II-В)
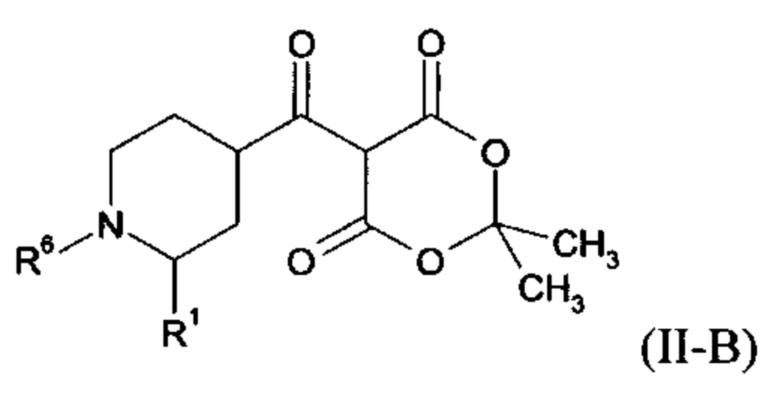
в которой R1 имеет значение, приведенное выше, и R6 представляет собой амино-защитную группу, подвергают реакции с соединением формулы (III)
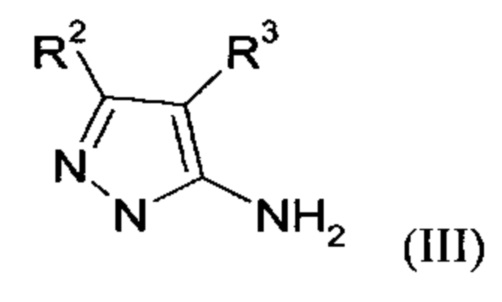
в которой R2 и R3 каждый имеет значения, приведенные выше, в инертном растворителе необязательно в присутствии основания, с получением соединения формулы (IV)

в которой R1, R2, и R3 каждый имеет значения, приведенные выше, и R6 представляет собой амино-защитную группу.
Термин "региоселективный способ" в контексте настоящего изобретения означает способ, который обеспечивает соединение формулы (IV), где менее 20%, менее 15%, менее 10%, менее 5%, менее 3%, менее 2%, менее 1%, менее 0.5%, менее 0.1% или 0% соединения формулы (IV) присутствует в виде региоизомерного соединения формулы IV, показанного далее
Согласно варианту выполнения настоящего изобретения, R6 представляет собой кислотно-расщепляемую амино-защитную группу, такую как трет-бутоксикарбонил (Boc), и соединение формулы (IV)
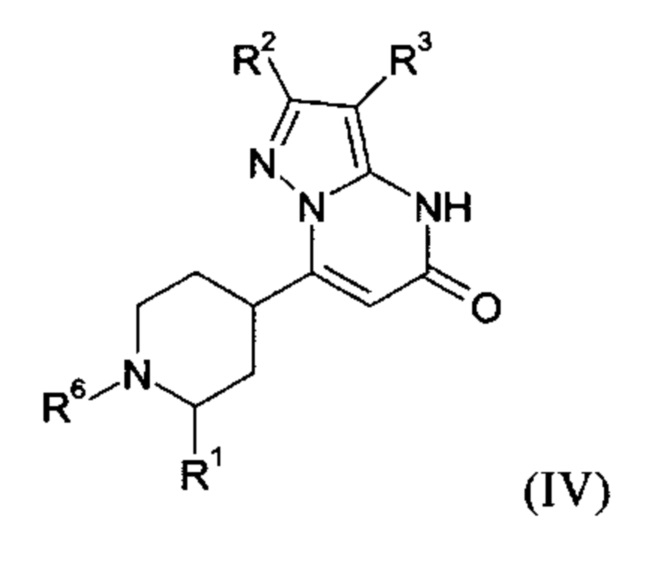
полученное в реакции [А] или [В], подвергают реакции с соединением формулы (I-B) посредством добавления кислоты
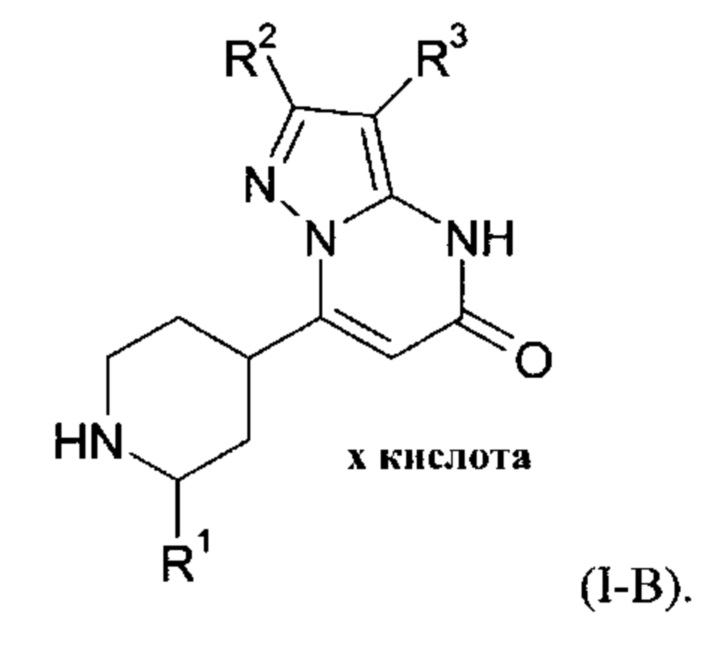
Согласно варианту выполнения настоящего изобретения, соединение формулы (I-А) получают посредством обработки соединения формулы (I-B) основанием.
Согласно варианту выполнения настоящего изобретения, соединение формулы (I-А) получают посредством обработки соединения формулы (I-B) подходящим хроматографическим способом, посредством применения основного элюента.
Согласно варианту выполнения настоящего изобретения, R6 не является расщепляемым кислотой, и соединение формулы (I-A) получают из соединения формулы (IV) путем расщепления амино- защитной группы соединения формулы (IV), например, посредством гидрирования. Примерами этой реакции являются расщепление амино-защитных групп бензилоксикарбонила (Cbz) и необязательно замещенного бензила.
Согласно варианту выполнения настоящего изобретения, соединение формулы (I-В) получают посредством обработки соединения формулы (I-A) кислотой.
Полученные соединения формул (I-A) или (I-B) необязательно превращают с помощью подходящих (i) растворителей и/или (ii) кислот или оснований в их сольваты, соли и/или сольваты солей.
Настоящее изобретение также обеспечивает соединения общей формулы (IV)
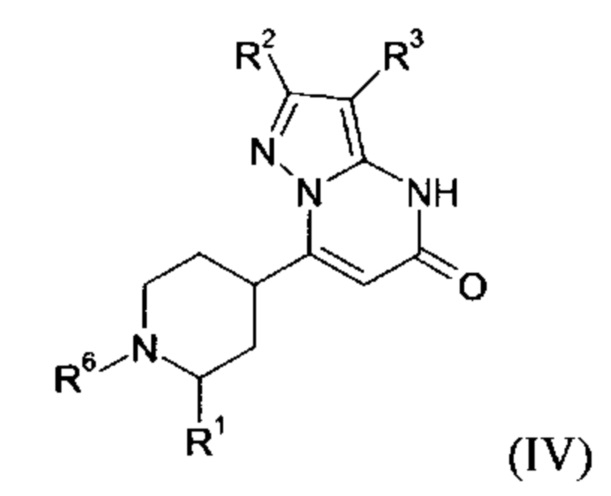
в которой R1, R2, R3, и R6 каждый имеет значения, приведенные выше. Настоящее изобретение также обеспечивает соединение общей формулы (II-В)
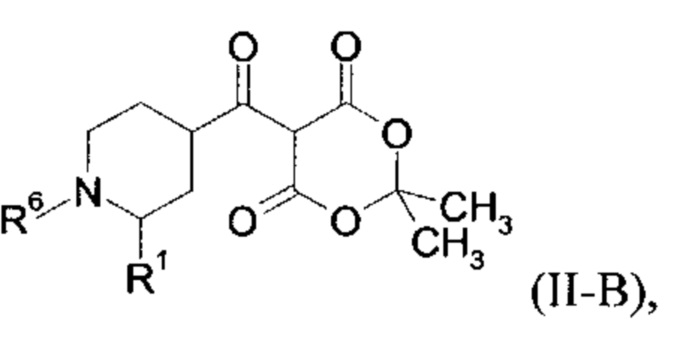
где
R1 выбран из водорода и С1-С4 алкила, и
R6 представляет собой амино-защитную группу.
Настоящее изобретение также обеспечивает соединение общей формулы (II-В)
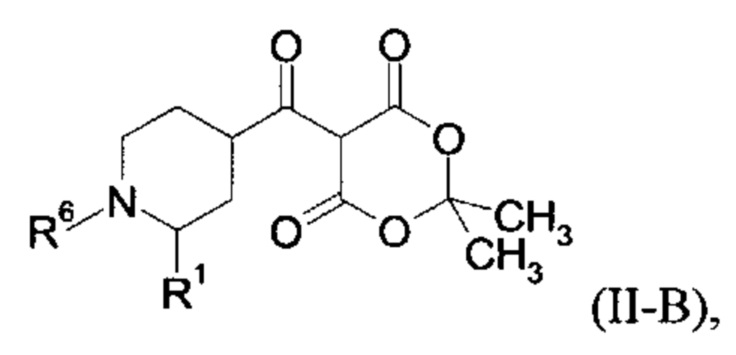
где
R1 выбран из водорода и метила, и
R6 выбирается из трет-бутоксикарбонила (Boc) и бензилоксикарбонила (Cbz).
Настоящее изобретение также обеспечивает соединение общей формулы (II-В)
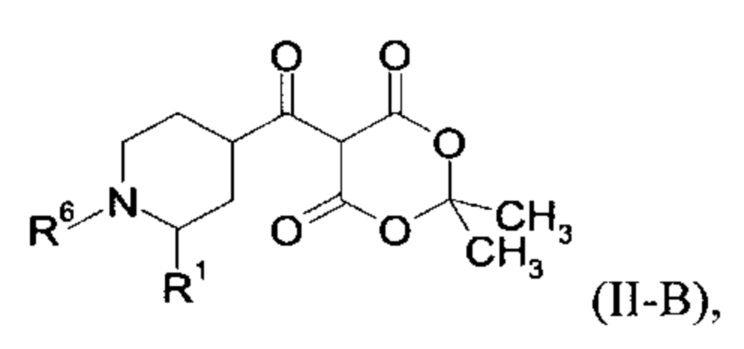
где
R1 выбран из водорода и С1-С4 алкила и
R6 представляет собой трет-бутоксикарбонил (Boc).
Настоящее изобретение также обеспечивает способ получения соединений формулы (VI)

в которой R1, R2, и R6 имеют значения, как определено выше, где соединение формулы (II-В)
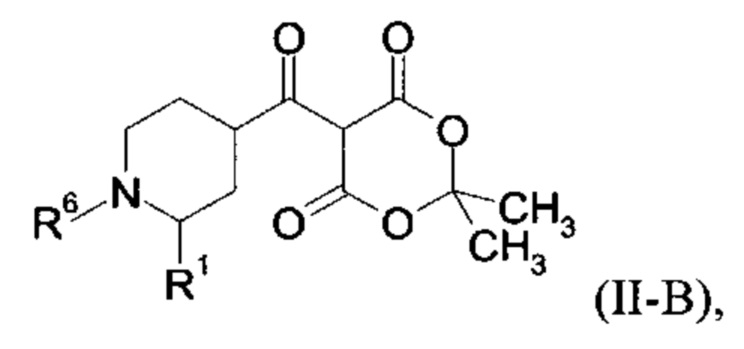
подвергают реакции с соединением формулы (III)

где R3 представляет собой бром, в инертном растворителе необязательно в присутствии основания с получением соединения формулы (VI).
Настоящее изобретение также обеспечивает способ получения соединений формулы (VII)
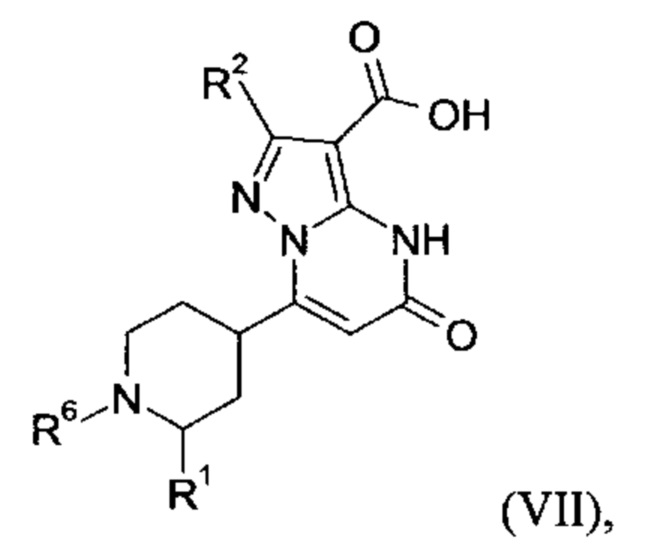
в которой R1, R2 и R6 имеют значения, как определено выше, где соединение формулы (II-В)
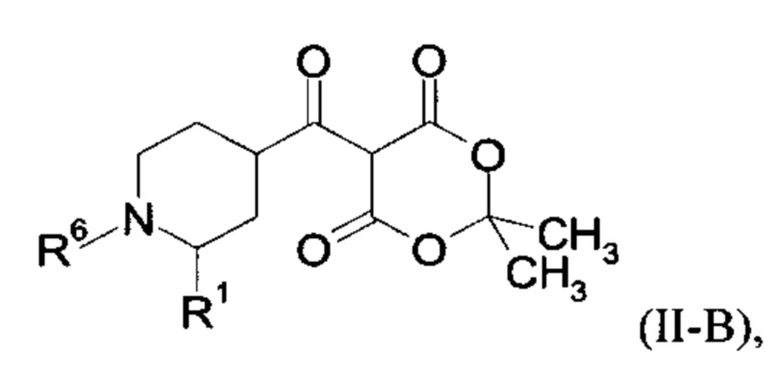
подвергают реакции с соединением формулы (III)
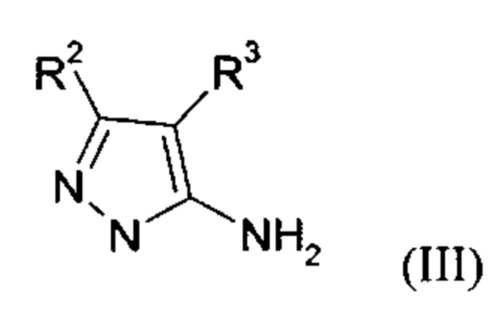
где R3 представляет собой С1-С4 алкиловый сложный эфир, в инертном растворителе необязательно в присутствии основания с получением соединения формулы (VIII)
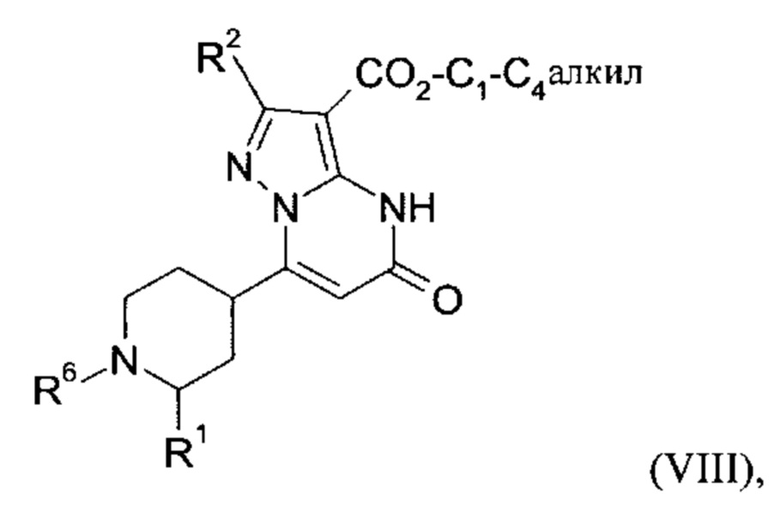
затем соединение формулы (VIII) подвергают реакции в инертном растворителе и в присутствии основания с получением соединения формулы (VII).
Настоящее изобретение также обеспечивает способ получения соединений формулы (IX),
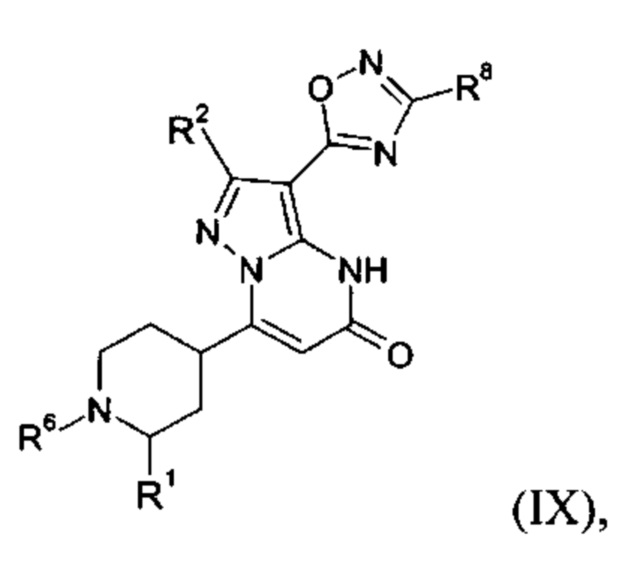
в которой R1, R2 и R6 имеют значения, как определено выше, и R8 определен выше в качестве заместителя 1,2,4-оксадиазол-5-ила, где 1,2,4-оксадиазол-5-ил вместе с R8 образует R3, где
соединение формулы (VII)
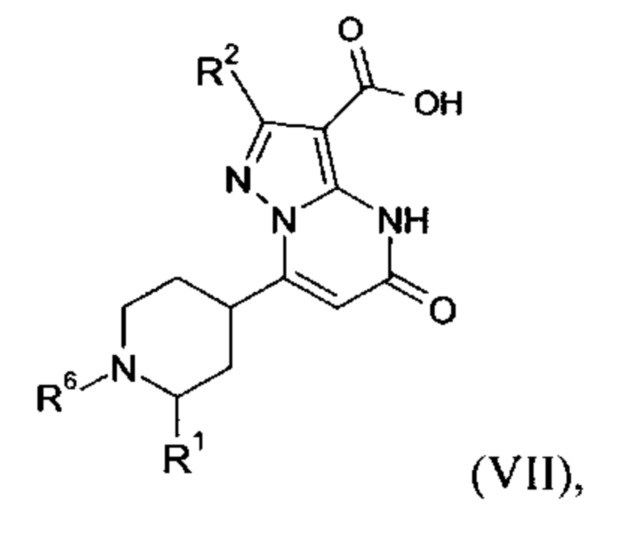
подвергают реакции в инертном растворителе, необязательно в присутствии дегидратирующего реагента, и необязательно в присутствии основания, и в присутствии амидоксима формулы (XXVIII)
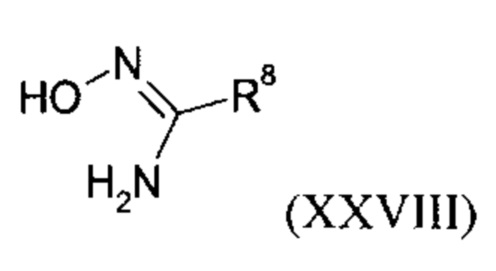
с получением соединения формулы (IX).
Настоящее изобретение также обеспечивает способ получения соединений формулы (X),
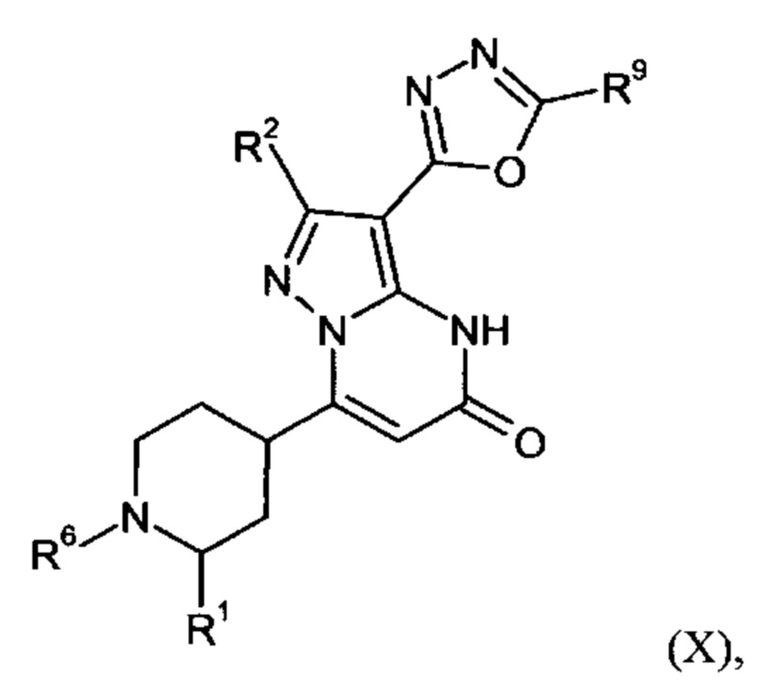
в которой R1, R2 и R6 имеют значения, как определено выше, и R9 определен выше в качестве заместителя 1,3,4-оксадиазол-5-ила, где 1,3,4-оксадиазол-5-ил вместе с R9 образует R3, где
соединение формулы (VII)
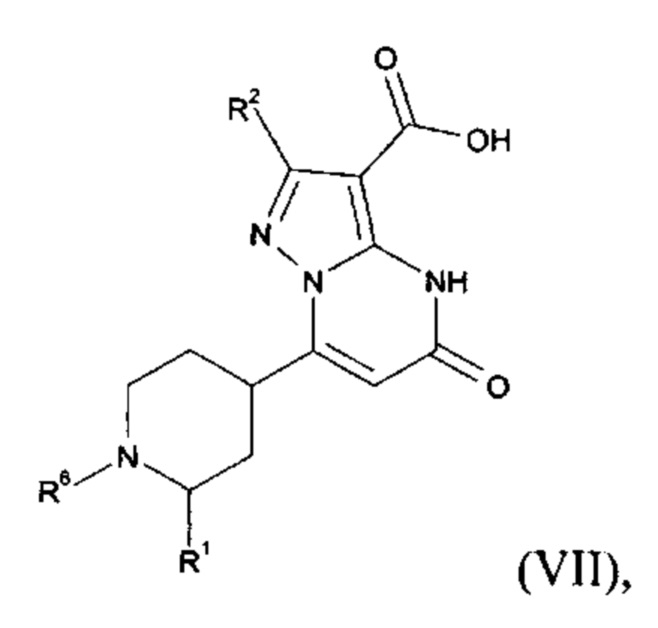
подвергают реакции с H2N-NH-COR9 в инертном растворителе, в присутствии дегидратирующего реагента, и необязательно в присутствии основания, с получением соединения формулы (XI)
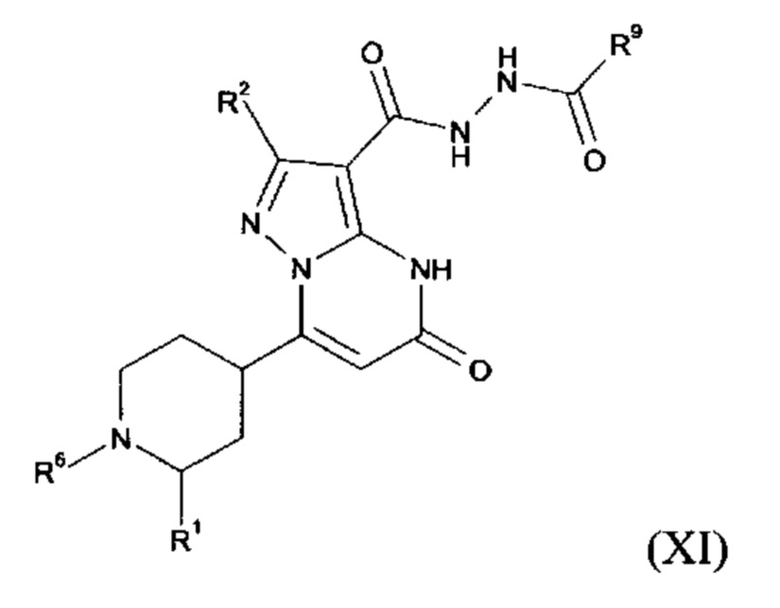
и соединение формулы (XI) затем подвергают реакции с дегидратирующим реагентом, в инертном растворителе, с получением соединения формулы (X).
Настоящее изобретение также обеспечивает способ получения соединений формулы (XII)

в которой R1, R2 и R6 имеют значения, как определено выше, и R10 определен выше в качестве заместителя 1,2,4-оксадиазол-3-ила, где 1,2,4-оксадиазол-3-ил вместе с R10 образует R3, где
соединение формулы
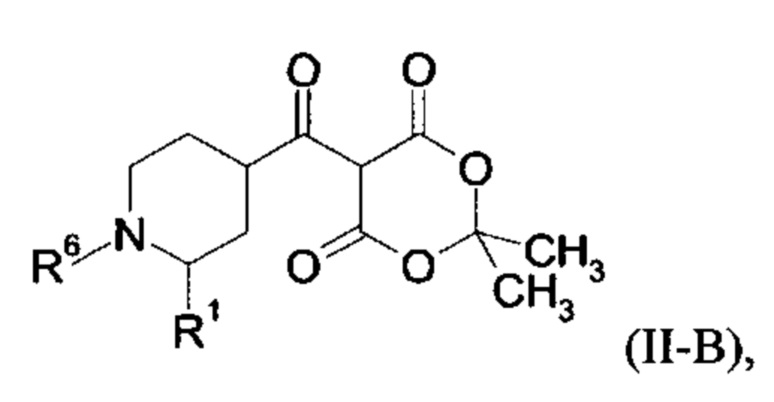
подвергают реакции с соединением формулы (XIII)
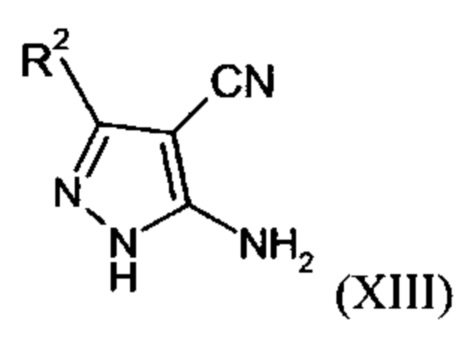
в присутствии инертного растворителя, необязательно в присутствии основания, с получением соединения формулы (XIV)
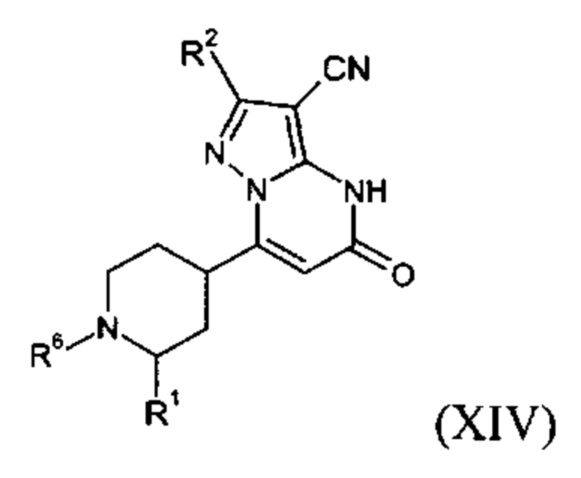
затем соединение формулы (XIV) подвергают реакции с гидроксиламином или его солью, в инертном растворителе, необязательно в присутствии основания с получением соединения формулы (XV)
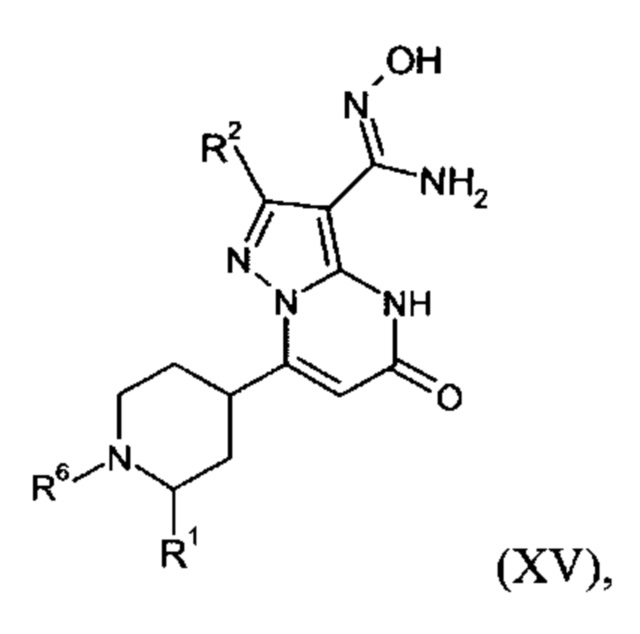
и затем соединение формулы (XV) подвергают реакции с соединением формулы (XVI)
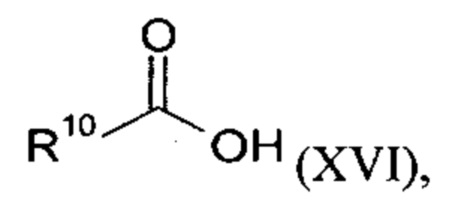
в инертном растворителе, в присутствии амидного связывающего агента и необязательно в присутствии основания с получением соединения формулы (XII).
Настоящее изобретение также обеспечивает способ получения соединений формулы (XVII)
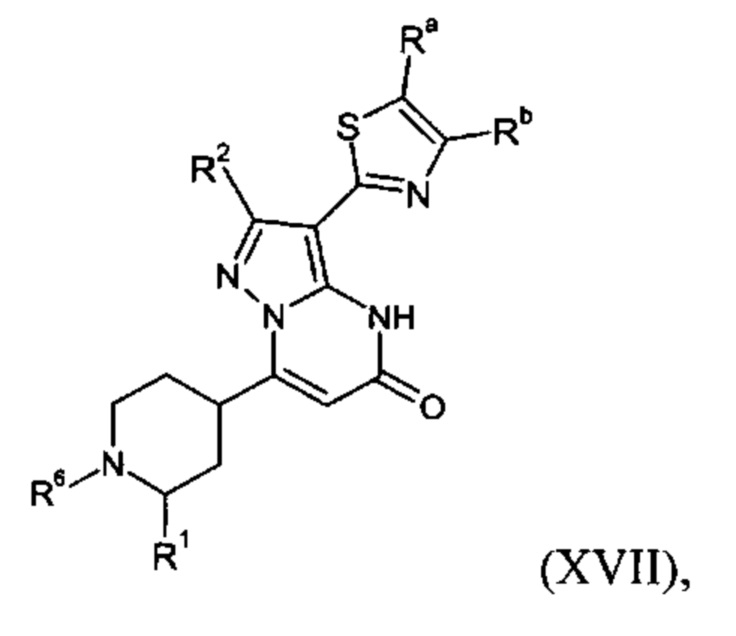
в которой R1, R2 и R6 имеют значения, как определено выше, и Ra/Rb имеют значения, как определено выше, в качестве заместителей 1,3-тиазолила, где 1,3, тиазолил вместе с Ra/Rb образует R3, где соединение формулы (II-В)
подвергают реакции с соединением формулы (XVIII)
в инертном растворителе, необязательно в присутствии основания, с получением соединения формулы (XIX)
и затем соединение формулы (XIX) подвергают реакции с соединением формулы (XX)
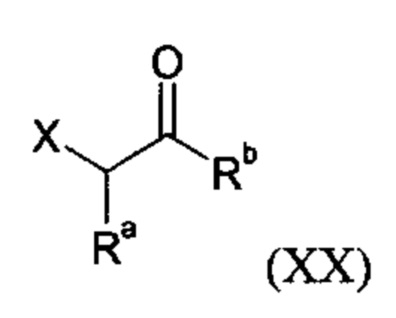
в которой X представляет собой Cl или Br, в инертном растворителе, необязательно в присутствии основания, с получением соединения формулы (XVII).
Настоящее изобретение также обеспечивает способ получения соединений формулы (XXI)
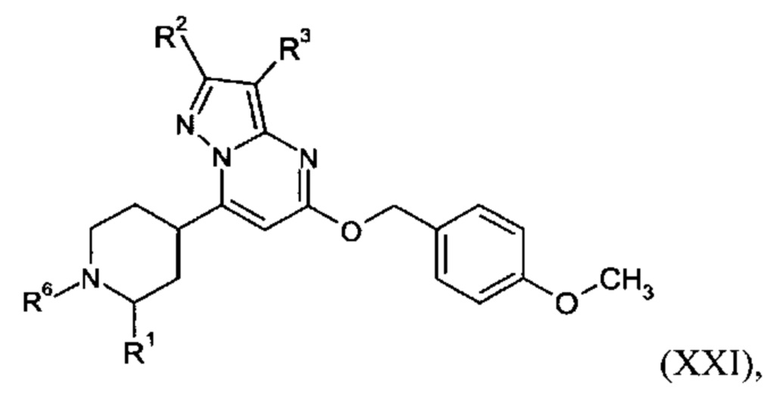
в которой R1, R2, R3, и R6 имеют значения, как определено выше, где соединение формулы (VI)
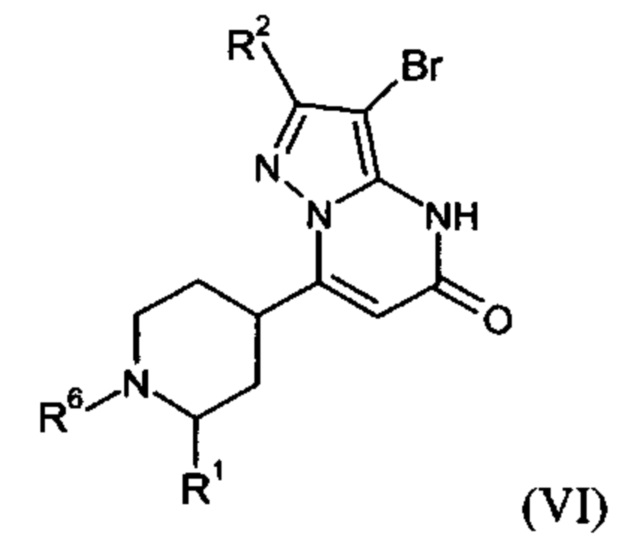
подвергают реакции с 1-(галометил)-4-метоксибензолом в инертном растворителе и необязательно в присутствии основания с получением соединения формулы (XXIII)
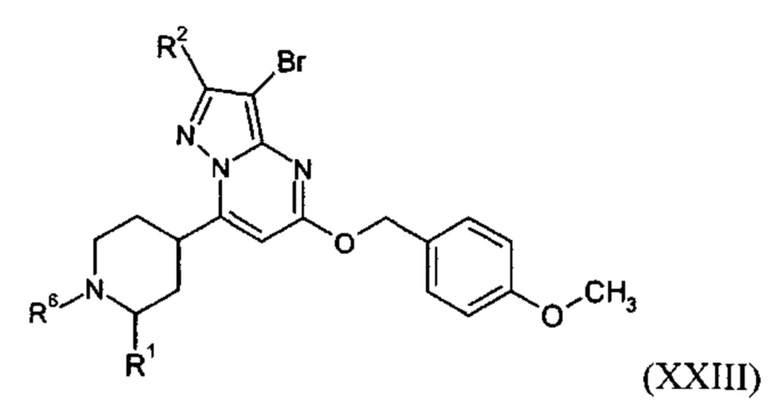
и затем соединение формулы (XXIII) подвергают реакции с соединением формулы (XXIV)
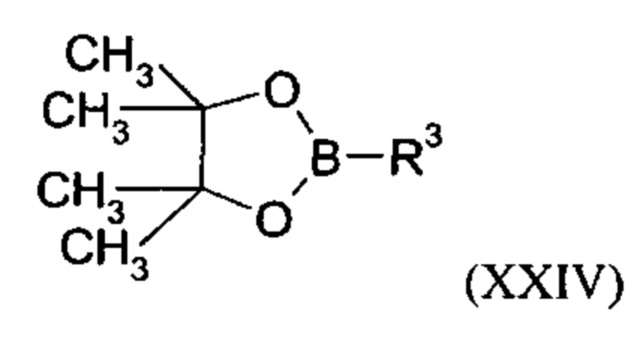
в инертном растворителе и в присутствии палладиевого катализатора, необязательно в присутствии лиганда, и необязательно в присутствии основания с получением соединения формулы (XXI).
Настоящее изобретение также обеспечивает способ получения соединений формулы (XXV)
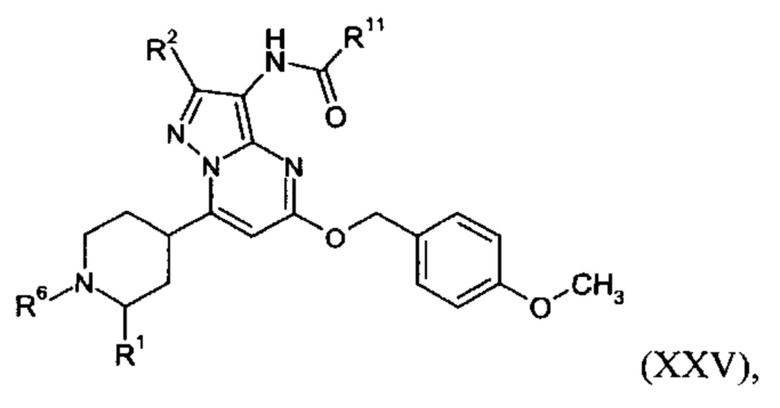
в которой R1, R2, R3, и R6 имеют значения, как определено выше, и R11 выбирается из необязательно замещенного фенила, алкила и циклоалкила, где соединение формулы (XXVI)
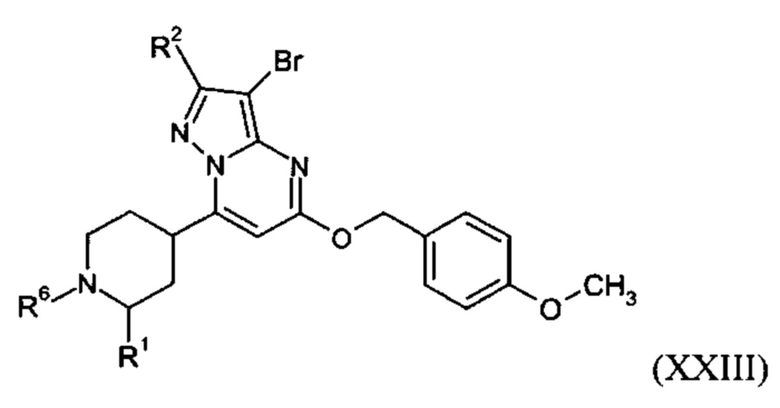
подвергают реакции с соединением формулы (XXVI)
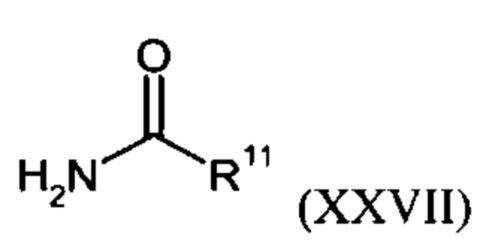
в инертном растворителе в присутствии катализатора, необязательно в присутствии лиганда, и необязательно в присутствии основания с получением соединения формулы (XXV).
Настоящее изобретение также обеспечивает способ получения соединения формулы (XXXIX)
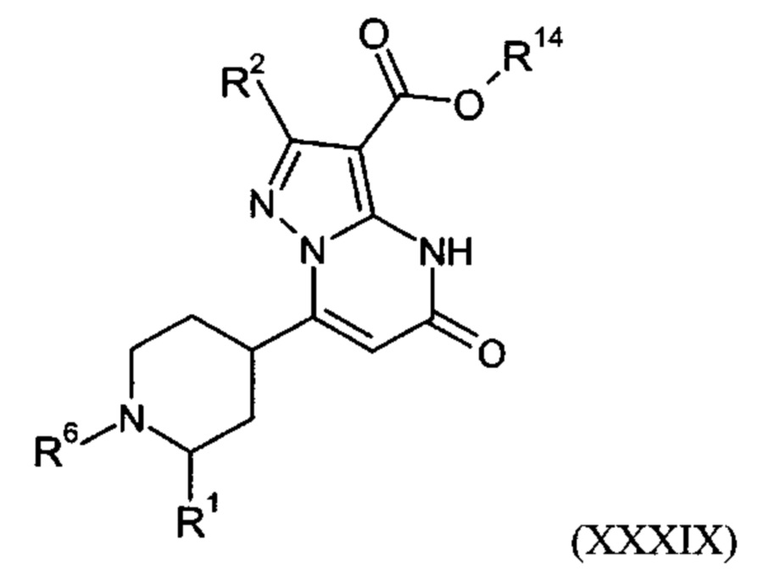
в которой R1, R2, и R6 имеют значения, как определено выше, и R14 выбран из C1-С4 алкила, причем С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями галоген, С3-С4 циклоалкила и бензила, где
[A] соединение формулы (VII)
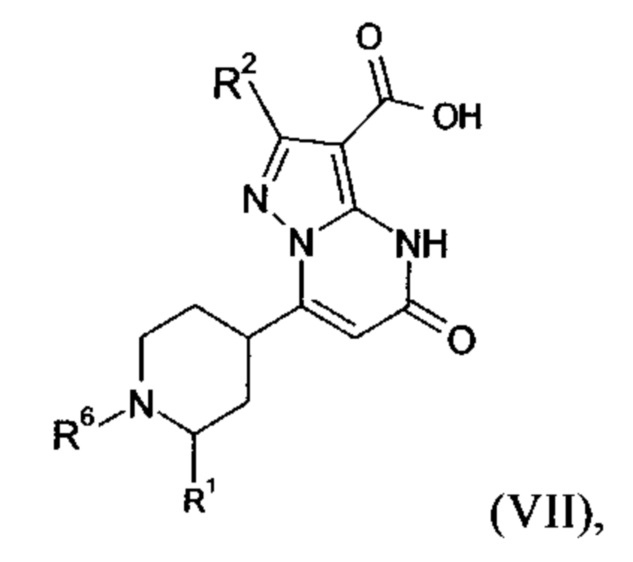
подвергают реакции с R14-2,2,2-тpиxлopэтaнимидaтoм, в присутствии кислоты Льюиса, в инертном растворителе, при температуре от 0°С до температуры флегмы растворителя с получением соединения формулы (XXXIX)
или
[B] соединение формулы (VII) подвергают реакции на первой стадии в инертном растворителе, в присутствии карбодиимидазола в качестве дегидратирующего реагента, и, в случае, когда применяемый дегидратирующий реагент не представляет собой карбодиимидазол, также в присутствии имидазола, необязательно в присутствии основания, при температуре от 0°С до температуры флегмы растворителя с получением соединения формулы (XXXVIII),
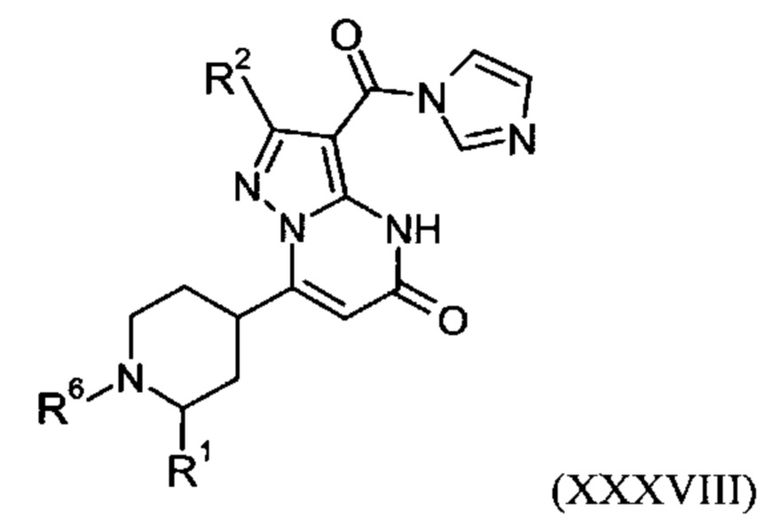
и затем соединение формулы (XXXVIII) подвергают реакции на второй стадии с R14OH, необязательно в инертном растворителе, необязательно в присутствии основания, при температуре от 0°С до температуры флегмы растворителя с получением соединения формулы (XXXIX),
где первая и вторая стадии [В] также могут проводится в виде одной стадии без выделения (XXXVIII).
Настоящее изобретение также обеспечивает соединение общей формулы (VII)
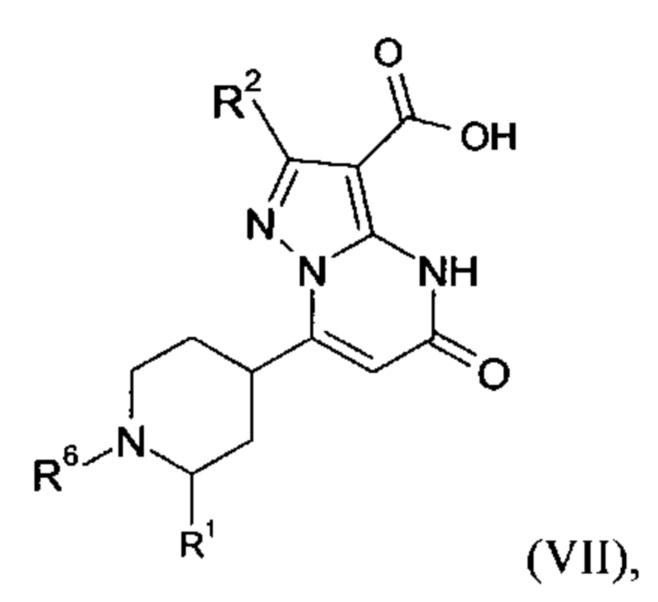
в которой R1, R2, и R6 имеют значения, как определено выше.
Настоящее изобретение также обеспечивает соединение общей формулы (XV)
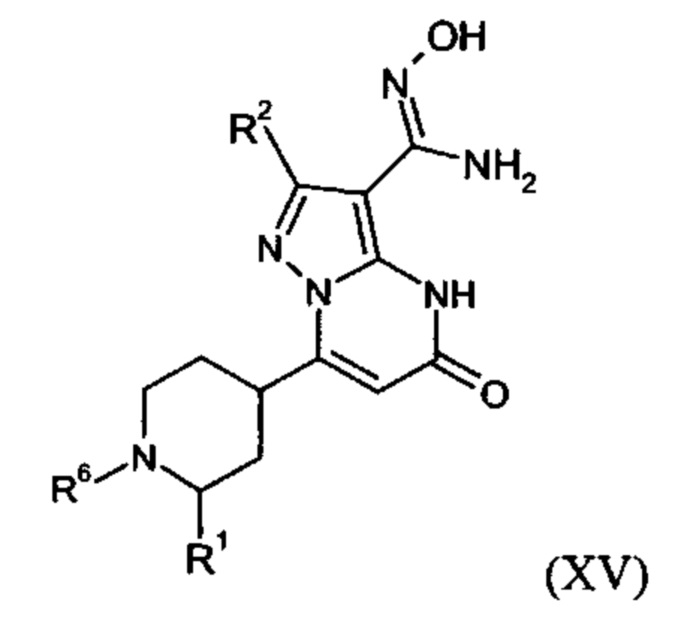
в которой R1, R2, и R6 имеют значения, как определено выше.
Настоящее изобретение также обеспечивает соединение общей формулы (XIX)
в которой R1, R2, и R6 имеют значения, как определено выше.
Настоящее изобретение также обеспечивает соединение общей формулы (VI)
в которой R1, R2, и R6 имеют значения, как определено выше.
Настоящее изобретение также обеспечивает соединение общей формулы (XXIII)
в которой R1, R2, и R6 имеют значения, как определено выше.
Настоящее изобретение также обеспечивает соединение общей формулы (VIII)

в которой R1, R2, и R6 имеют значения, как определено выше.
Настоящее изобретение также обеспечивает соединение общей формулы (XIV)
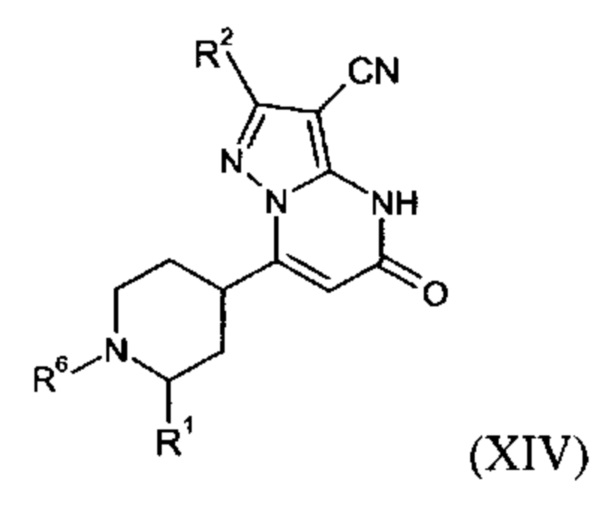
в которой R1, R2, и R6 имеют значения, как определено выше.
Настоящее изобретение также обеспечивает соединение общей формулы (XXXVIII)

в которой R1, R2, и R6 имеют значения, как определено выше.
Другие соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут необязательно также быть получены путем превращения функциональных групп отдельных заместителей, исходя из соединений формулы (I-A) и (I-B), полученных вышеуказанными способами. Эти превращения проводят обычными способами, известными специалисту в данной области техники, и включают, например, такие реакции, как нуклеофильные и электрофильные замещения, окислительные реакции, восстановительные реакции, гидрирование, реакции сочетания, катализируемые переходным металлом, элиминирование, алкилирование, аминирование, эстерификацию, сложноэфирное расщепление, этерификацию, простоэфирное расщепление, образование карбоксамидов, а также введение и удаление временных защитных групп.
Описанные способы получения могут быть проиллюстрированы в качестве примера схемами синтеза, приведенными ниже (схемы 1 и 2).
Схема 1: Синтез пиразолопиримидинонов через пиперидинил-бета-кетоэфир
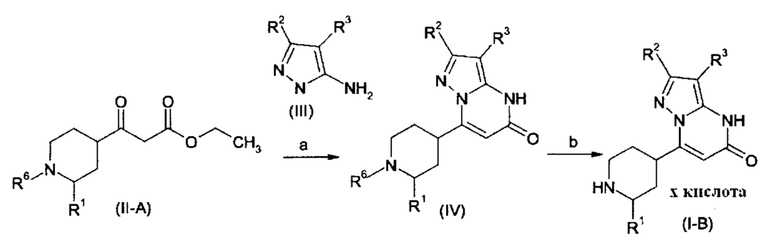
a) Аминопиразол, 1-метокси-2-пропанол, фосфат калия, микроволны, 15 минут, 180°С, b) 4Н НСl в диоксане, комнатная температура или TFA, дихлорметан, комнатная температура
Схема 2: Синтез пиразолопиримидинонов через производную кислоты Мельдрума пиперидинила
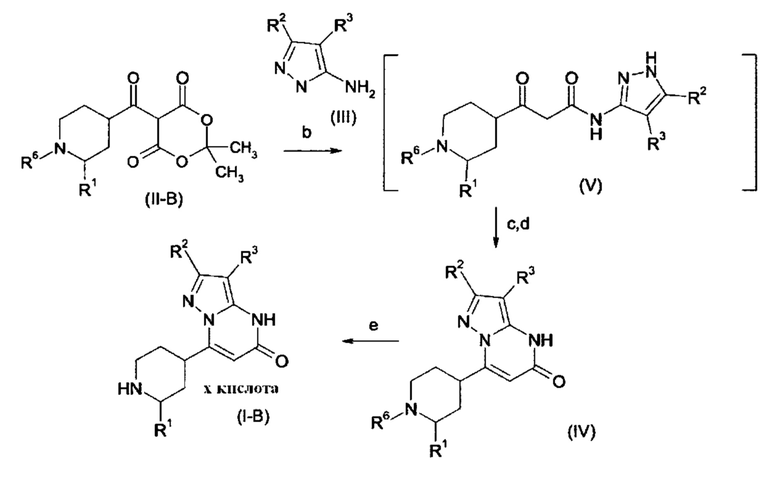
b) ацетонитрил, 60°С; с) выпаривание растворителя, d) 1-метокси-2-пропанол, трифосфат калия, 110°С, е) 4Н НСl в диоксане, комнатная температура или TFA, дихлорметан, комнатная температура.
Подходящими амино-защитными группами (заместитель R6) в формулах (II-А), (II-В) и (IV) являются трет-бутоксикарбонил (Boc), удаляемый сильной концентрированной кислотой, бензилоксикарбонил (Cbz), удаляемый гидрогенолизом, метил или этилкарбамат, удаляемые TMSI в СНСl3 или HBr в АcОН, триметилсилилэтилкарбамат (Теоc), удаляемый фторидом, п-метоксибензилкарбамат (Moz или MeOZ), удаляемый гидрогенолизом, 9-флуоренилметил карбамат (F-moc), удаляемый основанием, и необязательно замещенные бензил или бензиламин, удаляемые гидрогенолизом. Предпочтительным для использования в качестве амино-защитной группы является трет-бутоксикарбонил (Boc).
Согласно варианту выполнения настоящего изобретения, амино-защитная группа R6 выбирается из трет-бутоксикарбонила (Boc) и бензилоксикарбонила (Cbz). Предпочтительным для использования в качестве амино-защитной группы является трет-бутоксикарбонил (Boc).
Реакцию можно также проводить без защиты аминогруппы. В этом случае, R6 представляет собой водород.
Согласно варианту выполнения настоящего изобретения, реакция осуществляется без защиты аминогруппы. В этом варианте выполнения настоящего изобретения, R6 представляет собой водород.
Настоящее изобретение также обеспечивает способ получения соединений формулы (IV)
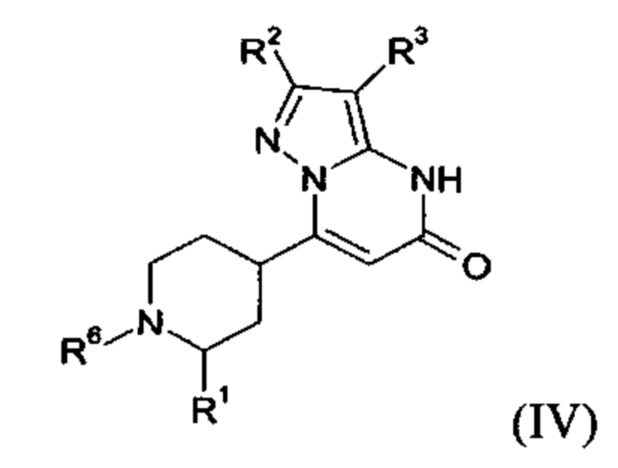
в которой R1, R2, и R3 каждый имеет значения, как указано выше, и R6 представляет собой водород, где
[А] соединение формулы (II-А)
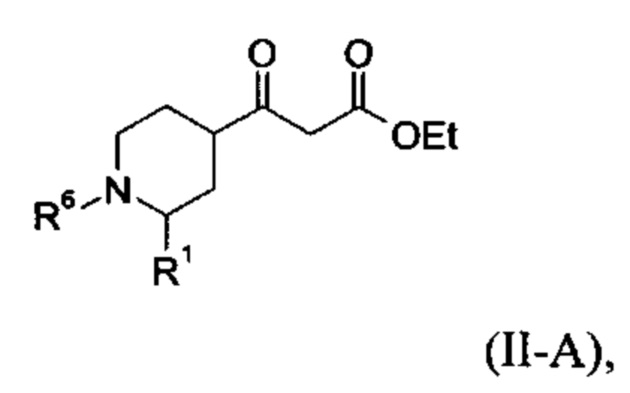
в которой R1 имеет значение, приведенное выше, и R6 представляет собой водород, подвергают реакции с соединением формулы (III)
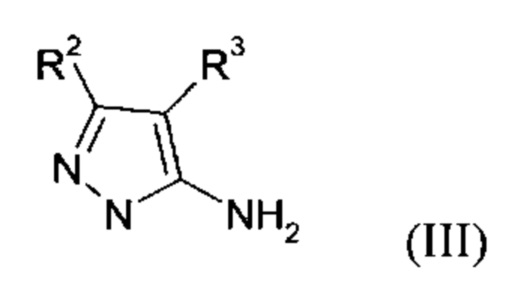
в которой R2 и R3 каждый имеет значения, приведенные выше, в инертном растворителе, необязательно в присутствии основания, с получением соединения формулы (IV)

в которой R1, R2, и R3 каждый имеет значения, приведенные выше, и R6 представляет собой водород,
или
[В] соединение формулы (II-В)
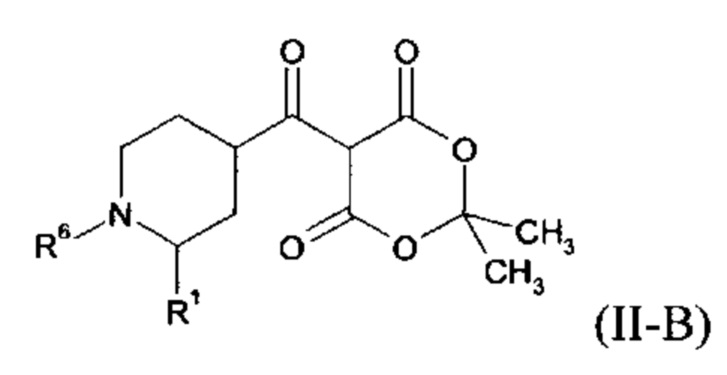
в которой R1 имеет значение, приведенное выше, и R6 представляет собой водород, подвергают реакции с соединением формулы (III)
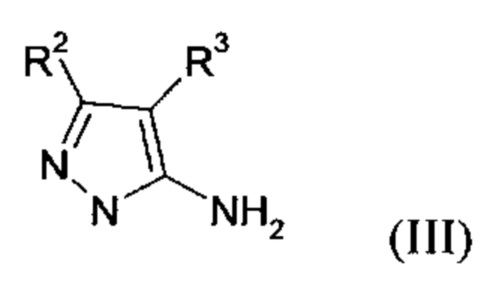
в которой R2 и R3 каждый имеет значения, приведенные выше, в инертном растворителе необязательно в присутствии основания, с получением соединения формулы (IV)
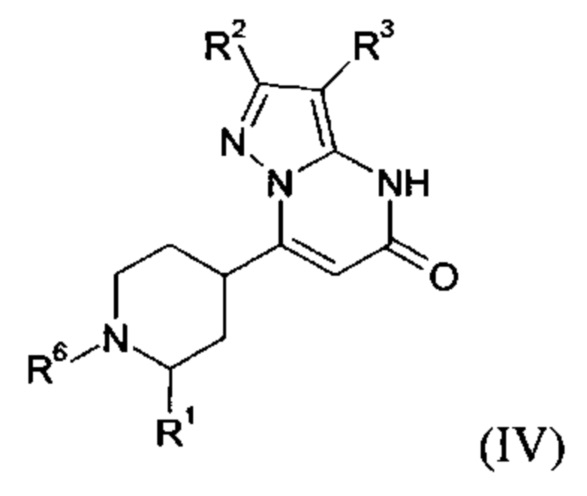
в которой R1, R2, и R3 каждый имеет значения, приведенные выше, и R6 представляет собой водород.
Подходящими растворителями для стадий процесса (II-А)+(III)→(IV) являются инертные растворители, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительными являются полярные растворители с высокими точками кипения, такие как толуол, 1-метокси-2-пропанол, и диоксан, или смеси указанных растворителей.
Процесс конденсации (II-А)+(III)→(IV) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительным является присутствие фосфата калия.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-А) и (III) реагируют в присутствии основания, в частности в присутствии неорганического основания, предпочтительно в присутствии фосфата калия.
Процесс конденсации (II-А)+(III)→(IV) в общем осуществляется в диапазоне температур от 50°С до 250°С, предпочтительно в диапазоне 100°С - 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительным является нагревание реакционной смеси в сосуде, обрабатываемом микроволнами, от 160°С до 200°С.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-А) и (III) реагируют при температуре от 50°С до 250°С, предпочтительно при температуре от 100°С до 200°С.
Процесс конденсации (II-А)+(III)→(IV) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции в каждом случае осуществляются при атмосферном давлении до 15 бар.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-А) и (III) реагируют при давлении между атмосферным давлением и 15 бар.
Как правило, процесс конденсации (II-А)+(III)→(IV) дает смеси региоизомеров. Желаемый региоизомер выделяют подходящим хроматографическим способом, таким как хроматография на силикагеле, высокоэффективная жидкостная хроматография с обращенной фазой или препаративная тонкослойная хроматография. Инертные растворители, используемые в качестве жидкой фазы, включают этилацетат, циклогексан, дихлорметан, метанол, диоксид углерода в сверхкритическом состоянии, воду, ацетонитрил и их смеси. Желаемый региоизомер можно далее выделить кристаллизацией.
Согласно варианту выполнения настоящего изобретения, соединение формулы (IV) выделяют из смеси региоизомеров.
Процесс конденсации (II-В)+(III)→[(V)]→(IV) можно проводить в одну стадию без выделения промежуточного соединения (V), в две отдельные стадии путем изменения условий реакции для образования (V) из (II-В) и (III) и образования (IV) из (V), но без очистки промежуточного соединения (V), или в две отдельные стадии, включающие очистку промежуточного соединения (V). Предпочтительной является методика с двумя отдельными стадиями без очистки промежуточного соединения.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют на первой стадии с соединением формулы (V). Соединение формулы (V) подвергают реакции на второй стадии с соединением формулы (IV) без выделения и очистки промежуточного соединения (V). Согласно другому варианту выполнения настоящего изобретения, растворитель загружают между первой и второй стадией.
Подходящими растворителями для стадий процесса (II-В)+(III)→(V) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение ацетонитрила или толуола в качестве растворителей, или смесей этих растворителей.
Подходящими растворителями для стадий процесса (V)→(IV) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение 1-метокси-2-пропанола или толуола в качестве растворителей, или смесей этих растворителей.
Процесс (II-В)+(III)→(V) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединений формул (II-В) и (III) в отсутствии основания.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют в отсутствии основания.
Процесс конденсации (V)→(IV) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединения формулы (V) с соединением формулы (IV) в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (IV) в присутствии основания, в частности в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, где соединения формул (II-В) и (III) реагируют с соединением формулы (V) и соединение формулы (V) подвергают реакции с соединением формулы (IV) в одну отдельную стадию без выделения промежуточного соединения (V), реакция осуществляется в присутствии основания.
Процесс (II-В)+(III)→(V) в общем осуществляется в диапазоне температур от 0°С до 100°С, температур от 40°С до 80°С.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют при температуре от 0°С до 100°С, предпочтительно от 40°С до 80°С.
Процесс (V)→(IV) в общем осуществляется в диапазоне температур от 0°С до 150°С, температур от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (IV) при температуре от 0°С до 150°С, предпочтительно от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, где R6 представляет собой кислотно-расщепляемую амино-защитную группу, такую как трет-бутоксикарбонил, соединение формулы (IV), полученное в реакции [А] или [В], подвергают реакции с соединением формулы (I-B) посредством добавления кислоты. Эта реакция осуществляется в подходящем растворителе, например, диоксане.
В общем, соли формулы (I-B) могут быть трансформированы в свободные основания формулы (I-A) любым путем, известным специалисту в данной области техники.
Соединение формулы (I-B) могут реагировать с соединением формулы (I-A) путем обработки соединения формулы (I-B) основанием. Предпочтительными основаниями являются аммиак, гидроксид натрия, NaHCO3, и Na2СО3. Это также может быть достигнуто подходящим хроматографическим способом путем применения основного элюента.
Согласно варианту выполнения настоящего изобретения, кислота, применяемая для получения соединения формулы (I-B) из соединения формулы (IV), выбирается из соляной кислоты, трифторуксусной кислоты, уксусной кислоты, серной кислоты, малеиновой кислоты, винной кислоты, аскорбиновой кислоты и салициловой кислоты.
Согласно варианту выполнения настоящего изобретения, где R6 не расщепляется кислотой, соединение формулы (I-A) получают из соединения формулы (IV) путем расщепления амино-защитной группы соединения формулы (IV) в ходе, например, гидрирования. Примерами этой реакции являются расщепление бензилоксикарбонила (Cbz), и необязательно замещенного бензила.
Соединения формул (II-А), (III) и (II-В) являются коммерчески доступными, известными из литературы или могут быть получены аналогично способам, известным из литературы. Синтез соединений формулы (II-В) описан на схеме 3 далее. Схемы 4-6 далее описывают получение определенных соединений формул (I-A) или (I-B).
Схема 3: Синтез производной кислоты Мельдрума метилпиперидинила
а) 2,4-лутидин, KMnO4, вода, 80°С; b) тионилхлорид, метанол, возврат флегмы; с) АcОН, оксид платины (IV), 20 бар, комнатная температура; d) бензилхлорформиат, диизопропилэтиламин, дихлорметан, комнатная температура, затем разделение стереоизомеров посредством хроматографии на хиральной фазе; е) Pd/C, H2, этанол, комнатная температура; f) ди-трет-бутил дикарбонат, тетрагидрофуран, комнатная температура; g) гидроксид лития, тетрагидрофуран/вода, комнатная температура; h) 2,2-диметил-1,3-диоксан-4,6-дион, DMAP, EDCI, дихлорметан, комнатная температура.
Схема 4: Получение 3-(гетеро)арил пиразолопиримидинонов через производную брома
а) ацетонитрил, 60°С; b) 1-метокси-2-пропанол, трифосфат калия, 110°С, с) (2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2'-амино-1,1'-бифенил)]палладий(II) метансульфонат (= Xphos предкатализатор), тетрагидрофуран, 1 М водный раствор трифосфата калия, 40°С; d) 4Н НСl в диоксане, комнатная температура или TFA, дихлорметан, комнатная температура.
Процесс конденсации (II-В)+(III)→[(V)]→(VI) можно проводить в одну стадию без выделения промежуточного соединения (V), в две отдельные стадии путем изменения условий реакции для образования (V) из (II-В) и (III) и образования (VI) из (V), но без очистки промежуточного соединения (V), или в две отдельные стадии, включающие очистку промежуточного соединения (V). Предпочтительной является методика с двумя отдельными стадиями без очистки промежуточного соединения.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют на первой стадии с соединением формулы (V). Соединение формулы (V) подвергают реакции на второй стадии с соединением формулы (VI) без выделения и очистки промежуточного соединения (V). Согласно другому варианту выполнения настоящего изобретения, растворитель загружают между первой и второй стадией.
Подходящими растворителями для стадий процесса (II-В)+(III)→(V) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение ацетонитрила или толуола в качестве растворителей, или смесей этих растворителей.
Подходящими растворителями для стадий процесса (V)→(VI) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение 1-метокси-2-пропанола или толуола или ацетонитрила в качестве растворителей, или смесей этих растворителей.
Процесс (II)+(III)→(V) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединений формул (II-В) и (III) в отсутствии основания.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют в отсутствии основания.
Процесс конденсации (V)→(VI) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединения формулы (V) с соединением формулы (VI) в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (VI) в присутствии основания, в частности в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, где соединения формул (II-В) и (III) реагируют с соединением формулы (V), и соединение формулы (V) подвергают реакции с соединением формулы (VI) в одну отдельную стадию без выделения промежуточного соединения (V), реакция осуществляется в присутствии основания.
Процесс (II-В)+(III)→(V) в общем осуществляется в диапазоне температур от 0°С до 100°С, температур от 40°С до 80°С.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют при температуре от 0°С до 100°С, предпочтительно от 40°С до 80°С.
Процесс (V)→(VI) в общем осуществляется в диапазоне температур от 0°С до 150°С, температур от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (VI) при температуре от 0°С до 150°С, предпочтительно от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, где R6 представляет собой кислотно-расщепляемую амино-защитную группу, такую как трет-бутоксикарбонил, соединение формулы (VI), полученное в реакции [А] или [В], подвергают реакции с соединением формулы (I-B) посредством добавления кислоты. Эта реакция осуществляется в подходящем растворителе, например, диоксане.
В общем, соли формулы (I-B) могут быть трансформированы в свободные основания формулы (I-A) любым путем, известным специалисту в данной области техники.
Соединение формулы (I-B) могут реагировать с соединением формулы (I-A) путем обработки соединения формулы (I-B) основанием. Предпочтительными основаниями являются аммиак, гидроксид натрия, NaHCO3, и Na2CO3. Это также может быть достигнуто подходящим хроматографическим способом путем применения основного элюента.
Согласно варианту выполнения настоящего изобретения, кислота, применяемая для получения соединения формулы (I-B) из соединения формулы (VI), выбирается из соляной кислоты, трифторуксусной кислоты, уксусной кислоты, серной кислоты, малеиновой кислоты, винной кислоты, аскорбиновой кислоты и салициловой кислоты.
Согласно варианту выполнения настоящего изобретения, где R6 не расщепляется кислотой, соединение формулы (I-A) получают из соединения формулы (VI) путем расщепления амино-защитной группы соединения формулы (VI) в ходе, например, гидрирования. Примерами этой реакции являются расщепление бензилоксикарбонила (Cbz), и необязательно замещенного бензила.
Соединения формул (III) и (II-В) являются коммерчески доступными, известными из литературы или могут быть получены аналогично способам, известным из литературы.
Схема 5: Получение 3-амидопиразолопиримидинонов через производную C1-С4 алкилового сложного эфира
а) С1-С4-алкил 5-амино-1Н-пиразол-4-карбоксилат(III), ацетонитрил, 60°С; b) 1-метокси-2-пропанол, трифосфат калия, 110°С, с) LiOH, THF/вода 60°С; d) HNR5R7; HOBt, EDCI. HCl, DMF, RT; e) 4H HCl в диоксане, комнатная температура или TFA, дихлорметан, комнатная температура.
Процесс конденсации (II-В)+(III)→[(V)]→(VIII) можно проводить в одну стадию без выделения промежуточного соединения (V), в две отдельные стадии путем изменения условий реакции для образования (V) из (II-В) и (III) и образования (VIII) из (V), но без очистки промежуточного соединения (V), или в две отдельные стадии, включающие очистку промежуточного соединения (V). Предпочтительной является методика с двумя отдельными стадиями без очистки промежуточного соединения.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют на первой стадии с соединением формулы (V). Соединение формулы (V) подвергают реакции на второй стадии с соединением формулы (VIII) без выделения и очистки промежуточного соединения (V). Согласно другому варианту выполнения настоящего изобретения, растворитель загружают между первой и второй стадией.
Подходящими растворителями для стадий процесса (II-В)+(III)→(V) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение ацетонитрила или толуола в качестве растворителей, или смесей этих растворителей.
Подходящими растворителями для стадий процесса (V)→(VIII) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение 1-метокси-2-пропанола или толуола или ацетонитрила в качестве растворителей, или смесей этих растворителей.
Процесс (II)+(III)→(V) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединений формул (II-В) и (III) в отсутствии основания.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют в отсутствии основания.
Процесс конденсации (V)→(VIII) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединения формулы (V) с соединением формулы (VIII) в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (VIII) в присутствии основания, в частности в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, где соединения формул (II-В) и (III) реагируют с соединением формулы (V), и соединение формулы (V) подвергают реакции с соединением формулы (VIII) в одну отдельную стадию без выделения промежуточного соединения (V), реакция осуществляется в присутствии основания.
Процесс (II-В)+(III)→(V) в общем осуществляется в диапазоне температур от 0°С до 100°С, температур от 40°С до 80°С.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (III) реагируют при температуре от 0°С до 100°С, предпочтительно от 40°С до 80°С.
Процесс (V)→(VIII) в общем осуществляется в диапазоне температур от 0°С до 150°С, температур от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (VIII) при температуре от 0°С до 150°С, предпочтительно от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, где R6 представляет собой кислотно-расщепляемую амино-защитную группу, такую как трет-бутоксикарбонил, соединение формулы (VIII), полученное в реакции [А] или [В], подвергают реакции с соединением формулы (I-B) посредством добавления кислоты. Эта реакция осуществляется в подходящем растворителе, например, диоксане.
В общем, соли формулы (I-B) могут быть трансформированы в свободные основания формулы (I-A) любым путем, известным специалисту в данной области техники.
Соединение формулы (I-B) могут реагировать с соединением формулы (I-A) путем обработки соединения формулы (I-B) основанием. Предпочтительными основаниями являются аммиак, гидроксид натрия, NaHCO3, и Na2СО3. Это также может быть достигнуто подходящим хроматографическим способом путем применения основного элюента.
Согласно варианту выполнения настоящего изобретения, кислота, применяемая для получения соединения формулы (I-B) из соединения формулы (VIII), выбирается из соляной кислоты, трифторуксусной кислоты, уксусной кислоты, серной кислоты, малеиновой кислоты, винной кислоты, аскорбиновой кислоты и салициловой кислоты.
Согласно варианту выполнения настоящего изобретения, где R6 не расщепляется кислотой, соединение формулы (I-A) получают из соединения формулы (VIII) путем расщепления амино-защитной группы соединения формулы (VIII) в ходе, например, гидрирования. Примерами этой реакции являются расщепление бензилоксикарбонила (Cbz), и необязательно замещенного бензила.
Соединения формул (III) и (II-В) являются коммерчески доступными, известными из литературы или могут быть получены аналогично способам, известным из литературы.
Реакция в процессе (VIII)→(VII) в общем осуществляется в растворителях, в присутствии основания, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими растворителями для стадии способа являются, например, вода, или алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как тетрахлорид углерода, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение воды или воды в комбинации с тетрагидрофураном.
Основаниями являются гидроксиды щелочных металлов, такие как гидроксид лития или гидроксид натрия или гидроксид калия или гидроксид цезия. Основания также могут применяться в виде растворов в воде. Предпочтительно применяется гидроксид лития.
Реакция в процессе (VII)→(VII-A) в общем осуществляется в инертном растворителе, необязательно в присутствии дегидратирующего реагента, необязательно в присутствии основания, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1'-карбонилдиимидазол, или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутил хлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), или 1-гидроксибензотриазол (HOBt), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОP), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламино-морфолино-карбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, предпочтительно N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид или N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид в комбинации с 1-гидроксибензотриазолом.
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, предпочтительно диизопропилэтиламин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей, предпочтительно диметилформамид.
Схема 6: Получение 1,2,4-оксадиазол-5-илпиразолопиримидинонов через производную карбоновой кислоты
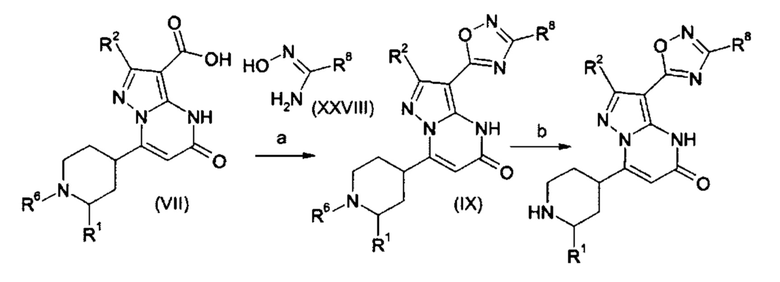
a) i. CDI, диизопропилэтиламин, DMF, 60-90°С ii. амидоксим формулы (XXVIII), 120°С; b) 4Н НСl в диоксане, комнатная температура или TFA, дихлорметан, комнатная температура. R8 определен выше в качестве заместителя 1,2,4-оксадиазол-5-ила, где 1,2,4-оксадиазол-5-ил вместе с R8 образует R3.
Реакция в процессе (VII)→(IX) в общем осуществляется в инертном растворителе, необязательно в присутствии дегидратирующего реагента, необязательно в присутствии основания, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1-карбонилдиимидазол (CDI), или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутил хлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), или 1-гидроксибензотриазол (HOBt), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси) диметиламиноморфолинокарбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, предпочтительно 1,1'-карбонилдиимидазол.
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, предпочтительно диизопропилэтиламин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей, предпочтительно диметилформамид.
Схема 7: Получение 1,3,4-оксадиазол-5-ил-пиразолопиримидинонов через реагент Бургесса
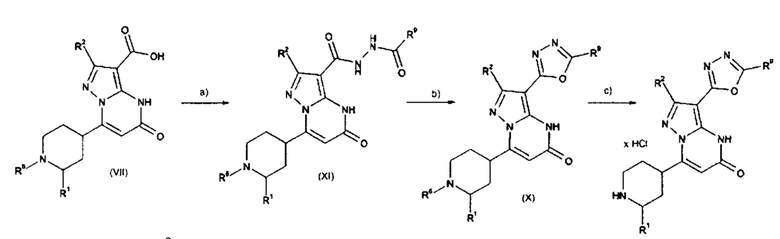
а) гидразид-R9, N,N-Диизопропилэтиламин, N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (HATU), N,N-Диметилформамид, RT; b) метил-N-(триэтиламмониосульфонил)карбамат (Реагент Бургесса), THF, RT; с), 4Н НСl в 1,4-диоксане, 1,4-диоксан, комнатная температура. R9 определен выше в качестве заместителя 1,3,4-оксадиазол-5-ила, где 1,3,4-оксадиазол-5-ил вместе с R9 образует R3.
Реакция в процессе (VII)→(XI) в общем осуществляется в инертном растворителе, необязательно в присутствии основания, необязательно в присутствии дегидратирующего реагента, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид), или карбонильные соединения, такие как 1,1'-карбонилдиимидазол, или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутилхлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N'N'-тетраметилурония гексафторфосфат (HATU), или 1-гидроксибензотриазол (HOBt), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси) диметиламиноморфолинокарбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, предпочтительно O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU).
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, предпочтительно диизопропилэтиламин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей, предпочтительно диметилформамид.
Реакция в процессе (XI)→(X) в общем осуществляется в инертном растворителе, в присутствии дегидратирующего реагента, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, метил N-(триэтиламмониосульфонил)карбамат (Реагент Бургесса), карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1'-карбонилдиимидазол, или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутил хлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси) диметиламиноморфолинокарбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, предпочтительно метил N-(триэтиламмониосульфонил)карбамат.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей, предпочтительно тетрагидрофуран.
Схема 8: Получение 1,2,4-оксадиазол-3-ил-пиразолопиримидинонов через нитрильную производную
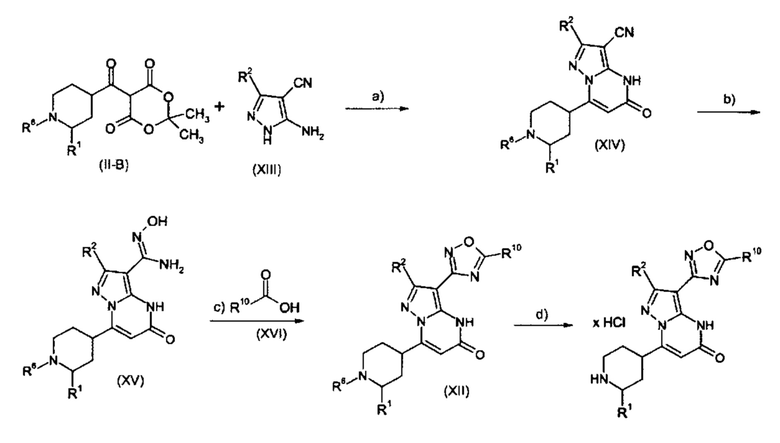
a) i. ацетонитрил, 60°С, ii. 1-метокси-2-пропанол, трифосфат калия, 120°С; b) гидрохлорид гидроксиламина, триэтиламин, этанол, 50°С; с) i. карбоновая кислота (XVI), (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат, этилдиизопропиламин, N,N-диметилформамид, комнатная температура, ii. (XV) 110°С, d) 4Н НСl в 1,4-диоксане, 1,4-диоксан, комнатная температура. R10 определен выше в качестве заместителя 1,2,4-оксадиазол-3-ила, где 1,2,4-оксадиазол-3-ил вместе с R10 образует R3.
Процесс конденсации (II-В)+(XIII)→[(V)]→(XIV) можно проводить в одну стадию без выделения промежуточного соединения (V), в две отдельные стадии путем изменения условий реакции для образования (V) из (II-В) и (XIII), и образования (XIV) из (V), но без очистки промежуточного соединения (V), или в две отдельные стадии, включающие очистку промежуточного соединения (V). Предпочтительной является методика с двумя отдельными стадиями без очистки промежуточного соединения.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (XIII) реагируют на первой стадии с соединением формулы (V). Соединение формулы (V) подвергают реакции на второй стадии с соединением формулы (XIV) без выделения и очистки промежуточного соединения (V). Согласно другому варианту выполнения настоящего изобретения, растворитель загружают между первой и второй стадией.
Подходящими растворителями для стадий процесса (II-В)+(XIII)→(V) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1 -метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметил-сульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение ацетонитрила или толуола в качестве растворителей, или смесей этих растворителей.
Подходящими растворителями для стадий процесса (V)→(XIV) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметил-сульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение 1-метокси-2-пропанола или толуола или ацетонитрила в качестве растворителей, или смесей этих растворителей.
Процесс (II)+(XIII)→(V) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединений формул (II-В) и (XIII) в отсутствии основания.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (XIII) реагируют в отсутствии основания.
Процесс конденсации (V)→(XIV) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединения формулы (V) с соединением формулы (XIV) в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (XIV) в присутствии основания, в частности в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, где соединения формул (II-В) и (XIII) реагируют с соединением формулы (V), и соединение формулы (V) подвергают реакции с соединением формулы (XIV) в одну отдельную стадию без выделения промежуточного соединения (V), реакция осуществляется в присутствии основания.
Процесс (II-В)+(XIII)→(V) в общем осуществляется в диапазоне температур от 0°С до 100°С, температур от 40°С до 80°С.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (XIII) реагируют при температуре от 0°С до 100°С, предпочтительно от 40°С до 80°С.
Процесс (V)→(XIV) в общем осуществляется в диапазоне температур от 0°С до 150°С, температур от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (XIV) при температуре от 0°С до 150°С, предпочтительно от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, где R6 представляет собой кислотно-расщепляемую амино-защитную группу, такую как трет-бутоксикарбонил, соединение формулы (XIV), полученное в реакции [А] или [В], подвергают реакции с соединением формулы (I-B) посредством добавления кислоты. Эта реакция осуществляется в подходящем растворителе, например, диоксане.
В общем, соли формулы (I-B) могут быть трансформированы в свободные основания формулы (I-A) любым путем, известным специалисту в данной области техники.
Соединение формулы (I-B) могут реагировать с соединением формулы (I-A) путем обработки соединения формулы (I-B) основанием. Предпочтительными основаниями являются аммиак, гидроксид натрия, NaHCO3, и Na2СО3. Это также может быть достигнуто подходящим хроматографическим способом путем применения основного элюента.
Согласно варианту выполнения настоящего изобретения, кислота, применяемая для получения соединения формулы (I-B) из соединения формулы (XIV), выбирается из соляной кислоты, трифторуксусной кислоты, уксусной кислоты, серной кислоты, малеиновой кислоты, винной кислоты, аскорбиновой кислоты и салициловой кислоты.
Согласно варианту выполнения настоящего изобретения, где R6 не расщепляется кислотой, соединение формулы (I-A) получают из соединения формулы (XIV) путем расщепления амино-защитной группы соединения формулы (XIV) в ходе, например, гидрирования. Примерами этой реакции являются расщепление бензилоксикарбонила (Cbz), и необязательно замещенного бензила.
Соединения формул (XIII) и (II-В) являются коммерчески доступными, известными из литературы или могут быть получены аналогично способам, известным из литературы.
Реакция в процессе (XIV)→(XV) в общем осуществляется в присутствии гидроксиламина или его соли, в инертных растворителях, необязательно в присутствии основания, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Реакция в процессе (XIV)→(XV) осуществляется в присутствии гидроксиламин или одной из его солей, таких как гидрохлорид гидроксиламина или ацетата гидроксиламина. Предпочтительно применяется гидрохлорид гидроксиламина.
Реакции процесса (XIV)→(XV) может протекать в отсутствии основания, или в присутствии органических оснований, таких как алкоголяты металлов, такие как трет-бутоксид натрия, трет-бутоксид калия, и амиды металлов, или амины, такие как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительным является применение триэтиламина.
Подходящими растворителями для реакций в процессе (XIV)→(XV) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол, 2-метил-2-бутанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение этанола.
Реакции процесса (XIV)→(XV) осуществляются в диапазоне температур от 0°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительным является нагревание реакционной смеси до 50°С.
Реакции процесса (XIV)→(XV) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Реакция в процессе (XV)+(XVI)→(XII) в общем осуществляется в инертном растворителе, необязательно в присутствии дегидратирующего реагента, необязательно в присутствии основания, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1'-Карбонилдиимидазол (CDI), или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, N-изопропоксикарбонил-2-изопропокси-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутил хлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), О-бензотриазоле-N,N,N',N'-тетраметил-урония-гексафтор-фосфат (HBTU), или 1-гидроксибензотриазол (HOBt), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или бензотриазол-1-ил-окси-трис-пирролидино-фосфония гексафторфосфат (коммерчески доступный как РуВОР), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламиноморфолинокарбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, предпочтительно бензотриазол-1-ил-окси-трис-пирролидино-фосфония гексафторфосфат (коммерчески доступный как РуВОР).
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, предпочтительно диизопропилэтиламин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей, предпочтительно диметилформамид.
Реакции процесса (XV)+(XVI)→(XII) осуществляются в диапазоне температур от 0°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительным является нагревание реакционной смеси до 20-110°С.
Реакции процесса (XV)+(XVI)→(XII) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Схема 9: Получение 3-(1,3-тиазол-2-ил)-пиразолопиримидинонов через производную тиоамида
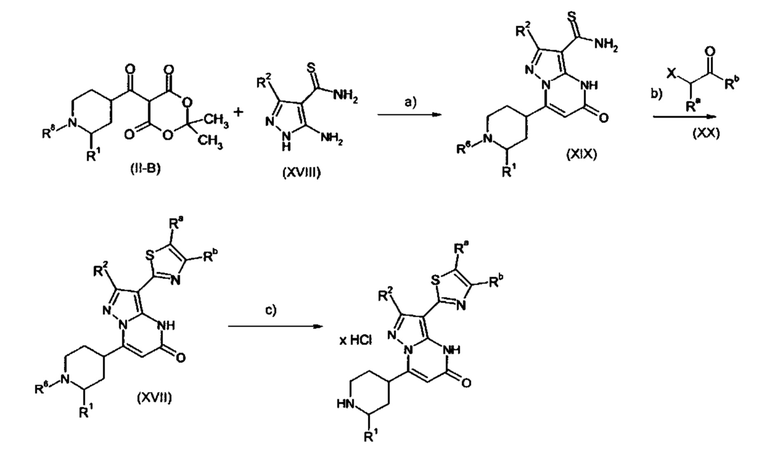
a) i. ацетонитрил, 60°С, ii. 1-метокси-2-пропанол, трифосфат калия, 100°С; b) альфа-гало-кетон (XX), N,N-Диизопропилэтиламин, этанол, 70°С; с) 4Н НСl в 1,4-диоксане, 1,4-диоксан, комнатная температура, всю ночь. X=Cl, Br, Ra/Rb имеют значения, как определено выше, в качестве заместителей 1,3-тиазолила, где 1,3-тиазолил вместе с Ra/Rb образует R3.
Процесс конденсации (II-В)+(XVIII)→[(V)]→(XIX) можно проводить в одну стадию без выделения промежуточного соединения (V), в две отдельные стадии путем изменения условий реакции для образования (V) из (II-В) и (XVIII) и образования (XIX) из (V), но без очистки промежуточного соединения (V), или в две отдельные стадии, включающие очистку промежуточного соединения (V). Предпочтительной является методика с двумя отдельными стадиями без очистки промежуточного соединения.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (XVIII) реагируют на первой стадии с соединением формулы (V). Соединение формулы (V) подвергают реакции на второй стадии с соединением формулы (XIX) без выделения и очистки промежуточного соединения (V). Согласно другому варианту выполнения настоящего изобретения, растворитель загружают между первой и второй стадией.
Подходящими растворителями для стадий процесса (II-В)+(XVIII)→(V) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1 -метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение ацетонитрила или толуола в качестве растворителей, или смесей этих растворителей.
Подходящими растворителями для стадий процесса (V)→(XIX) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение 1-метокси-2-пропанола или толуола или ацетонитрила в качестве растворителей, или смесей этих растворителей.
Процесс (II-В)+(XVIII)→(V) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований.
Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединений формул (II-В) и (XVIII) в отсутствии основания.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (XVIII) реагируют в отсутствии основания.
Процесс конденсации (V)→(XIX) может протекать в отсутствии основания, в присутствии органических оснований, таких как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительной является реакция соединения формулы (V) с соединением формулы (XIX) в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (XIX) в присутствии основания, в частности в присутствии фосфата калия.
Согласно варианту выполнения настоящего изобретения, где соединения формул (II-В) и (XVIII) реагируют с соединением формулы (V) и соединение формулы (V) подвергают реакции с соединением формулы (XIX) в одну отдельную стадию без выделения промежуточного соединения (V), реакция осуществляется в присутствии основания.
Процесс (II-В)+(XVIII)→(V) в общем осуществляется в диапазоне температур от 0°С до 100°С, температур от 40°С до 100°С.
Согласно варианту выполнения настоящего изобретения, соединения формул (II-В) и (XVIII) реагируют при температуре от 0°С до 100°С, предпочтительно от 40°С до 80°С.
Процесс (V)→(XIX) в общем осуществляется в диапазоне температур от 0°С до 150°С, температур от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, соединение формулы (V) подвергают реакции с соединением формулы (XIX) при температуре от 0°С до 150°С, предпочтительно от 60°С до 130°С.
Согласно варианту выполнения настоящего изобретения, где R6 представляет собой кислотно-расщепляемую амино-защитную группу, такую как трет-бутоксикарбонил, соединение формулы (XIX), полученное в реакции [А] или [В], подвергают реакции с соединением формулы (I-B) посредством добавления кислоты. Эта реакция осуществляется в подходящем растворителе, например, диоксане.
В общем, соли формулы (I-B) могут быть трансформированы в свободные основания формулы (I-A) любым путем, известным специалисту в данной области техники.
Соединение формулы (I-B) могут реагировать с соединением формулы (I-A) путем обработки соединения формулы (I-B) основанием. Предпочтительными основаниями являются аммиак, гидроксид натрия, NaHCO3, и Na2СО3. Это также может быть достигнуто подходящим хроматографическим способом путем применения основного элюента.
Согласно варианту выполнения настоящего изобретения, кислота, применяемая для получения соединения формулы (I-B) из соединения формулы (XIX), выбирается из соляной кислоты, трифторуксусной кислоты, уксусной кислоты, серной кислоты, малеиновой кислоты, винной кислоты, аскорбиновой кислоты и салициловой кислоты.
Согласно варианту выполнения настоящего изобретения, где R6 не расщепляется кислотой, соединение формулы (I-A) получают из соединения формулы (XIX) путем расщепления амино-защитной группы соединения формулы (XIX) в ходе, например, гидрирования. Примерами этой реакции являются расщепление бензилоксикарбонила (Cbz), и необязательно замещенного бензила.
Соединения формул (XVIII) и (II-В) являются коммерчески доступными, известными из литературы или могут быть получены аналогично способам, известным из литературы.
Реакция в процессе (XIX)+(XX)→(XVII) в общем осуществляется в инертном растворителе, необязательно в присутствии основания, необязательно в присутствии дегидратирующего реагента, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, метил N-(триэтиламмониосульфонил)карбамат (Реагент Бургесса), карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1'-карбонилдиимидазол, или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутил хлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламиноморфолинокарбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, предпочтительно метил N-(триэтиламмониосульфонил)карбамат.
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или N,N-Диизопропилэтиламин, предпочтительно N,N-Диизопропилэтил амин.
Инертными растворителями являются, например, спирты, такие как алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительно этанол.
Схема 10: реакция сочетания Сузуки с РМВ-защищенной бромпиразолопиримидиноновой производной пиридона
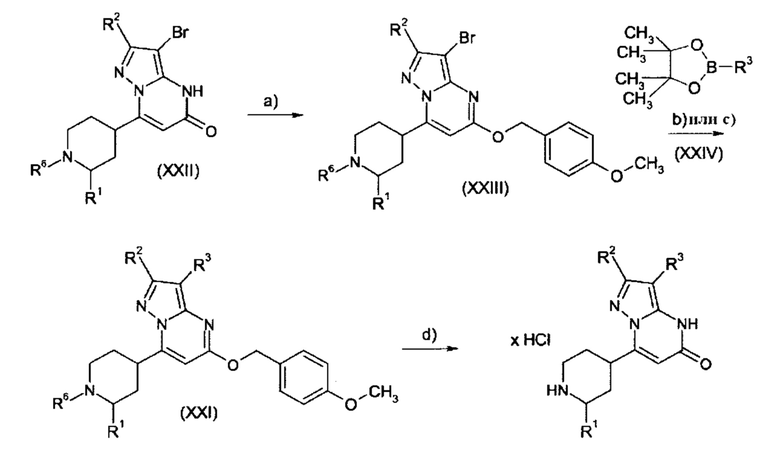
a) 1-(хлорметил)-4-метоксибензол, карбонат калия, N,N-диметилформамид, 45°С;
b) [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), трициклогексилфосфин, трифосфат калия, 1,4-диоксан, микроволны, 140°С с) (2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2'-амино-1,1'-бифенил)]палладий(II), трифосфат калия, 1,4-диоксан, 70°С→110°С; d) 4Н НСl в 1,4-диоксане, 1,4-диоксан, комнатная температура.
Реакция в процессе (XXII)→(XXIII) в общем осуществляется в инертном растворителе, в присутствии основания и 1-(галометил)-4-метоксибензола, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими растворителями для реакций в процессе (XXII)→(XXIII) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол, 2-метил-2-бутанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение N,N-диметилформамид.
Реакции процесса (XXII)→(XXIII) может протекать в отсутствии основания, или в присутствии органических оснований, таких как алкоголяты металлов, такие как трет-бутоксид натрия, трет-бутоксид калия, и амиды металлов, такие как диизопропиламид лития, бис(триметилсилил)амид лития, или амины, такие как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительным является применение карбонат калия.
Реакции процесса (XXII)→(XXIII) осуществляются в диапазоне температур от 0°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительным является нагревание реакционной смеси до 45°С.
Реакции процесса (XXII)→(XXIII) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Реакции процесса (XXII)→(XXIII) может протекать в присутствии 1-(хлорметил)-4-метоксибензола, 1-(бромметил)-4-метоксибензола, 1-(иодметил)-4-метоксибензола, 4-метоксибензилметансульфонат, 4-метоксибензил 4-метилбензолсульфоната. Предпочтительным является применение 1-(хлорметил)-4-метоксибензола.
Реакция в процессе (XXIII)+(XXIV)→(XXI) в общем осуществляется в инертном растворителе, в присутствии катализатора и основания, необязательно в присутствии лиганда, необязательно при обработке микроволнами, предпочтительно в диапазоне температур от комнатной температуры до 150°С при стандартном давлении до 3 бар.
Катализаторами являются, например, палладиевые катализаторы, стандартные для условий реакции Сузуки, предпочтительно катализаторы, такие как дихлорбис(трифенилфосфин)палладий, тетракистрифенилфосфинпалладий(0), палладий(II) ацетат/трисциклогексилфосфин, трис(дибензилиденацетон)дипалладий, бис(дифенилфосфинферроценил)палладий(II) хлорид, 1,3-бис(2,6-диизопропилфенил)имидазол-2-илиден(1,4-нафтохинон)палладий димер, аллил(хлор)(1,3-димезитил-1,3-дигидро-2Н-имидазол-2-илиден)палладий, палладий(II) ацетат/дициклогексил(2',4',6'-триизопропил-бифенил-2-ил)фосфин, [1,1-бис(дифенилфосфино)ферроцен]палладий(II) хлорид монодихлорметан аддукт, [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) или (2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2'-амино-1,1'-бифенил)]палладий(II), предпочтительно [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) или (2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2'-амино-1,1'-бифенил)]палладий(II).
Подходящими лигандами для реакций процесса (XXIII)+(XXIV)→(XXI) являются, как правило, лиганды фосфора, например, трициклогексилфосфин, 2-(Дициклогексилфосфино)3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил (BrettPhos), 2-(ди-трет-бутилфосфино)-2',4',6'- триизопропил-3,6-диметокси-1,1'-бифенил (tBuBrettPhos), 2-дициклогексилфосфино-2',6'-бис(N,N-диметиламино)бифенил (CPhos), 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил (DavePhos), 2-{Бис[3,5-бис(трифторметил)фенил]фосфино}-3,6-диметокси -2',4',6'-триизопропил-1,1'-бифенил (JackiePhos), (2-Бифенил)ди-трет-бутилфосфин (JohnPhos), 2-дициклогексилфосфино-2'-метилбифенил (MePhos), 2-ди(трет-бутил)фосфино-2',4',6'-триизопропил-3-метокси-6-метилбифенил (RockPhos), 2-дициклогексилфосфино-2',6'-диизопропоксибифенил (RuPhos), 2-дициклогексилфосфино-2',6'-диметоксибифенил (SPhos), rac-2-(Ди-трет-бутилфосфино)-1,1'-бинафтил (TrixiePhos), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (XPhos), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (XantPhos), 2-Ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (tBuXPhos), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINАР). Предпочтительным является применение трициклогексилфосфина, или отсутствие лиганда.
Подходящими растворителями для реакций в процессе (XXIII)+(XXIV)→(XXI) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол, 2-метил-2-бутанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метил-пирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение 1,4-диоксана.
Реакции процесса (XXIII)+(XXIV)→(XXI) может протекать в отсутствии основания или в присутствии органических оснований, таких как алкоголяты металлов, такие как трет-бутоксид натрия, трет-бутоксид калия, и амиды металлов, такие как диизопропиламид лития, бис(триметилсилил)амид лития, или амины, такие как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительным является применение трифосфата калия.
Реакции процесса (XXIII)+(XXIV)→(XXI) осуществляются в диапазоне температур от 0°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительным является нагревание реакционной смеси до 70-140°С, необязательно при обработке микроволнами.
Реакции процесса (XXII)→(XXIII) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении до 3 бар.
Схема 11: Реакция сочетания для соединений, в которых R3 представляет собой амид
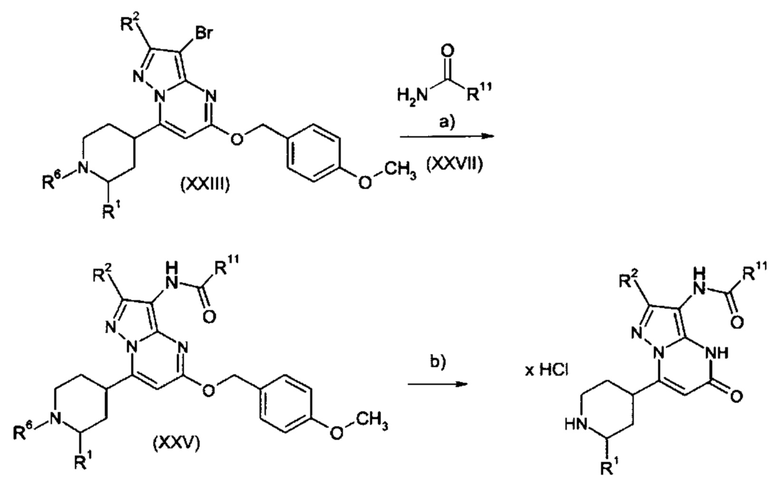
а) [(2-ди-трет-бутилфосфино-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)-2-(2'-амино-1,1'-бифенил)]палладий(II) метансульфонат, 2-(ди-трет-бутилфосфино)-2',4',6'- триизопропил-3,6-диметокси-1,1'-бифенил, трифосфат калия, трет-бутанол, 110°С; b) 4Н НСl в 1,4-диоксане, 1,4-диоксан, комнатная температура. R11 выбирается из необязательно замещенного фенила, алкила и циклоалкила.
Реакция в процессе (XXIII)+(XXVII)→(XXV) в общем осуществляется в инертном растворителе, в присутствии основания и катализатора, необязательно в присутствии лиганда, предпочтительно в диапазоне температур от 20°С до температуры флегмы растворителя при стандартном давлении.
Подходящими растворителями для реакций в процессе (XXIII)+(XXVII)→(XXV) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол, 2-метил-2-бутанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метил-пирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение трет-бутанола.
Реакции процесса (XXIII)+(XXVII)→(XXV) может протекать в отсутствии основания или в присутствии органических оснований, таких как алкоголяты металлов, такие как трет-бутоксид натрия, трет-бутоксид калия, и амиды металлов, такие как диизопропиламид лития, бис(триметилсилил)амид лития, или амины, такие как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительным является применение трифосфата калия.
Реакции процесса (XXIII)+(XXVII)→(XXV) осуществляются в диапазоне температур от 0°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительным является нагревание реакционной смеси до 110°С.
Реакции процесса (XXIII)+(XXVII)→(XXV) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Подходящими катализаторами для реакций в процессе (XXIII)+(XXVII)→(XXV), как правило, является катализатор на основе палладия, например, палладий(II) ацетат, бис(дибензилиденацетон)палладий(0), трис(дибензилиденацетон)дипалладий(0), тетракис(трифенилфосфин)палладий(0), бис(трифенилфосфин)палладий(II) дихлорид, [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), 1,3-бис(2,6-диизопропилфенил)имидазол-2-илиден (1,4-нафтохинон)палладий(0) димер, Метансульфонато[2-(ди-1-адамантилфосфино)-3,6-диметокси-2',4',6'-три-изо-пропил-1,1'-бифенил](2'-амино-1,1'-бифенил-2-ил)палладий(II) (AdBrettPhos Pd G3), метансульфонато{[4-(N,N-диметиламино)фенил]ди-трет-бутилфосфино)(2'-амино-1,1'-бифенил-2-ил)палладий(II) (Amphos Pd G3), [(2-Ди-циклогексилфосфино-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)-2-(2'-амино-1,1'-бифенил)]палладий(II) метансульфонат (BrettPhos Pd G3), [(2-ди-трет-бутилфосфино-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)-2-(2'-амино-1,1'-бифенил)]палладий(II) метансульфонат (tBuBrettPhos Pd G3), Метансульфонато[2-(дициклогексилфосфино)-2'-(N,N-диметиламино)-1,1'-бифенил](2'-амино-1,1'-бифенил-2-ил)палладий(II) (DavePhos Pd G3), Метансульфонато{(R)-(-)-1-[(S)-2-(дициклогексилфосфино)ферроценил]этилди-трет-бутилфосфин}(2'-амино-1,1'-бифенил-2-ил)палладий(II) (JosiPhos Pd G3), метансульфонато(три-трет-бутилфосфино)(2'-метиламино-1,1'-бифенил-2-ил)палладий(II) (P(t-Bu)3 Pd G4), Метансульфонато(трициклогексилфосфин)(2'-амино-1,1'-бифенил-2-ил)палладий(II) (РСу3 Pd G3), Метансульфонато(2-(ди-трет-бутилфосфино)-3-метокси-6-метил-2',4',6'-три-изо-пропил-1,1'-бифенил)(2'-амино-1,1'-бифенил-2-ил)палладий(II) (RockPhos Pd G3), Метансульфонато(2-дициклогексилфосфино-2',6'-ди-изо-пропокси-1,1'-бифенил)(2'-амино-1,1'-бифенил-2-ил)палладий(II) (RuPhos Pd G3), метансульфонато(2-дициклогексилфосфино-2',6'-диметокси-1,1'-бифенил)(2'-амино-1,1'-бифенил-2-ил)палладий(II) (SPhos Pd G3), (2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2'-амино-1,1'-бифенил)]палладий(II) метансульфонат (XPhos Pd G3), метансульфонато(2-ди-трет-бутилфосфино-2',4',6'-три-изо-пропил-1,1'-бифенил)(2'-амино-1,1'-бифенил-2-ил)палладий(II) (tBuXPhos Pd G3), метансульфонато[9,9-диметил-4,5-бис(дифенилфосфино)ксантен][2'-амино-1,1'-бифенил]палладий(II) (XantPhos Pd G3), метансульфонато[2-бис(3,5-ди(трифторметил)фенилфосфино)-3,6-диметокси-2',4',6'-три-изо-пропил-1,1'-бифенил](2'-амино-1,1'-бифенил-2-ил)палладий(II) (JackiePhos Pd G3). Предпочтительным является применение [(2-ди-трет-бутилфосфино-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)-2-(2'-амино-1,1'-бифенил)]палладий(II) метансульфоната.
Подходящими лигандами для реакций процесса (XXIII)+(XXVII)→(XXV) являются, как правило, лиганды фосфора, например, 2-(Ди-1-адамантилфосфино)-3,6-диметокси-2',4',6'-три-изо-пропил-1,1'-бифенил (AdBrettPhos), 2-(Дициклогексилфосфино)3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил (BrettPhos), 2-(Ди-трет-бутилфосфино)-2',4',6'-триизопропил-3,6-диметокси-1,1'-бифенил (tBuBrettPhos), 2-дициклогексилфосфино-2',6'-бис(N,N-диметиламино)бифенил (CPhos), 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил (DavePhos), 2'-(Ди-трет-бутилфосфино)-N,N-диметилбифенил-2-амин (tBuDavePhos), 2'-(Дифенилфосфино)-N,N'-диметил-(1,1'-бифенил)-2-амин (PhDavePhos), 2-{Бис[3,5-бис(трифторметил)фенил]фосфино}-3,6-диметокси -2',4',6'-триизопропил-1,1'-бифенил (JackiePhos), (2-Бифенил)ди-трет-бутилфосфин (JohnPhos), (2-Бифенил)дициклогексилфосфин (CyJohnPhos), 2-дициклогексилфосфино-2'-метилбифенил (MePhos), 2-Ди-трет-бутилфосфино-2'-метилбифенил (tBuMePhos), 2-ди(трет-бутил)фосфино-2',4',6'-триизопропил-3-метокси-6-метилбифенил (RockPhos), 2-дициклогексилфосфино-2',6'-диизопропоксибифенил (RuPhos), 2-дициклогексилфосфино-2',6'-диметоксибифенил (SPhos), rac-2-(Ди-трет-бутилфосфино)-1,1'-бинафтил (TrixiePhos), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (XPhos), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (XantPhos), 2-Ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (tBuXPhos), 2-Ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенил (тетраметил tBuXPhos), 2-Ди-трет-бутилфосфино-4-метокси-3,5,6-триметил-2',4',6'-три-изо-пропилбифенил (Me3(OMe)tBuXPhos), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (ВINАР). Предпочтительным является применение 22-(ди-трет-бутилфосфино)-2',4',6'-триизопропил-3,6-диметокси-1,1'-бифенила.
Схема 12: Получение этилкетон-замещенных пиразолопиримидинонов через амид Вайнреба
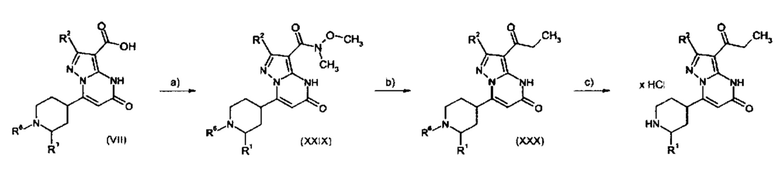
а) 4-диметиламинопиридин, 1-гидроксибензотриазол гидрат, 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид, N-метоксиметанамин гидрохлорид, этилдиизопропиламин, ацетонитрил, комнатная температура; b) бром(этил)магний (1.0 М в тетрагидрофуране), тетрагидрофуран, 0°С - комнатная температура; с) соляная кислота (4Н раствор в 1,4-диоксане), комнатная температура.
Реакционную последовательность можно применять аналогично с бром(метил)магнием с получением производного метилового сложного эфира.
Реакция в процессе (VII)→(XXIX) в общем осуществляется в инертном растворителе, необязательно в присутствии дегидратирующего реагента, необязательно в присутствии катализатора, необязательно в присутствии основания, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1'-карбонилдиимидазол, или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутилхлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), или 1-гидроксибензотриазол (HOBt), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламино-морфолино-карбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, необязательно в присутствии 4-диметиламинопиридина в качестве катализатора. Предпочтительно 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида в комбинации с 1-гидроксибензотриазолом и 4-диметиламинопиридином.
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, предпочтительно диизопропилэтиламин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей, предпочтительно ацетонитрил.
Реакции процесса (VII)→(XXIX) осуществляются в диапазоне температур от 0°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительно комнатная температура.
Реакции процесса (VII)→(XXIX) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Реакция в процессе (XXIX)→(XXX) в общем осуществляется в инертном растворителе, в присутствии органометаллического алкилгалогенидного реагента, предпочтительно в диапазоне температур от -80°С до температуры флегмы растворителя при стандартном давлении.
Реакции процесса (XXIX)→(XXX) в общем осуществляются в присутствии органометаллических алкилгалогенидных реагентов, где металлическим компонентом может быть магний, литий, медь или цинк. Предпочтительно алкилмагния бромид или алкилмагния хлорид.
Реакции процесса (XXIX)→(XXX) в общем осуществляется в инертном органическом растворителе, например, бензоле, толуоле, ксилоле, петролейном простом эфире, гексане, гептане, тетрагидрофуране, диэтиловом простом эфире, изопропиловом простом эфире, ди-н-бутиловом простом эфире, метил-трет-бутиловом простом эфире, диметиловом простом эфире этиленгликоля, 1,4-диоксане или их смесях, предпочтительно тетрагидрофуране.
Реакции процесса (XXIX)→(XXX) осуществляются в диапазоне температур от -80°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительно комнатная температура.
Реакции процесса (XXIX)→(XXX) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Схема 13: Получение метилкетон-замещенных пиразолопиримидинонов
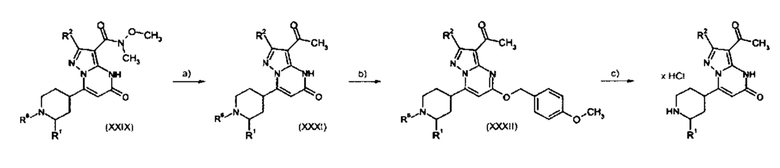
а) бром(метил)магний (3.0 М в простом диэтиловом эфире), тетрагидрофуран, 0°С - комнатная температура; b) карбонат калия, 1-(хлорметил)-4-метоксибензол, N,N-Диметилформамид, комнатная температура; с) соляная кислота (4Н раствор в 1,4-диоксане), комнатная температура.
Реакция в процессе (XXIX)→(XXXI) в общем осуществляется в инертном растворителе, в присутствии органометаллического алкилгалогенидного реагента, предпочтительно в диапазоне температур от -80°С до температуры флегмы растворителя при стандартном давлении.
Реакции процесса (XXIX)→(XXXI) в общем осуществляются в присутствии органометаллических алкилгалогенидных реагентов, где металлическим компонентом может быть магний, литий, медь или цинк. Предпочтительно алкилмагния бромид или алкилмагния хлорид.
Реакции процесса (XXIX)→(XXXI) в общем осуществляется в инертном органическом растворителе, например, бензоле, толуоле, ксилоле, петролейном простом эфире, гексане, гептане, тетрагидрофуране, диэтиловом простом эфире, изопропиловом простом эфире, ди-н-бутиловом простом эфире, метил-трет-бутиловом простом эфире, диметиловом простом эфире этиленгликоля, 1,4-диоксане или их смесях, предпочтительно тетрагидрофуране.
Реакции процесса (XXIX)→(XXXI) осуществляются в диапазоне температур от -80°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительно комнатная температура.
Реакции процесса (XXIX)→(XXXI) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Реакция в процессе (XXXI)→(XXXII) в общем осуществляется в инертном растворителе, в присутствии основания и 1-(галометил)-4-метоксибензола, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими растворителями для реакций в процессе (XXXI)→(XXXII) являются, например, алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол, 2-метил-2-бутанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительным является применение N,N-диметилформамида.
Реакции процесса (XXXI)→(XXXII) может протекать в отсутствии основания или в присутствии органических оснований, таких как алкоголяты металлов, такие как трет-бутоксид натрия, трет-бутоксид калия, и амиды металлов, такие как диизопропиламид лития, бис(триметилсилил)амид лития, или амины, такие как триэтиламин или диизопропилэтиламин, или в присутствии неорганических оснований. Неорганические основания включают фосфаты и карбонаты щелочных металлов или щелочноземельных металлов, таких как фосфат калия, карбонат калия, карбонат цезия, фосфат натрия или карбонат кальция. Предпочтительным является применение карбоната калия.
Реакции процесса (XXXI)→(XXXII) осуществляются в диапазоне температур от 0°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительно комнатная температура.
Реакции процесса (XXXI)→(XXXII) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Реакции процесса (XXXI)→(XXXII) может протекать в присутствии 1-(хлорметил)-4-метоксибензола, 1-(бромметил)-4-метоксибензола, 1-(иодметил)-4-метоксибензола, 4-метоксибензилметансульфонат, 4-метоксибензил 4-метилбензолсульфоната. Предпочтительным является применение 1-(хлорметил)-4-метоксибензола.
Схема 14: Получение алкил кетон-замещенных пиразолопиримидинонов из нитрила
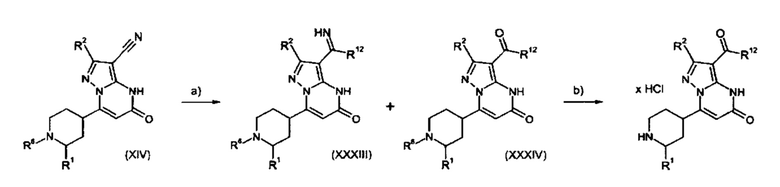
а) R12-бромид или хлорид магния, тетрагидрофуран, комнатная температура-60°С; b) соляная кислота (1Н раствор в воде), ацетонитрил, 40°С. R12 выбран из C1-С5 алкила и С3-С6 циклоалкила.
Реакция в процессе (XIV)→(XXXIII) в общем осуществляется в инертном растворителе, в присутствии металлоорганических алкильного или циклоалкилгалогенидного реагента, предпочтительно в диапазоне температур от -80°С до температуры флегмы растворителя при стандартном давлении.
Реакции процесса (XIV)→(XXXIII) в общем осуществляются в присутствии металлоорганических алкильных или циклоалкилгалогенидных реагентов, где металлическим компонентом может быть магний, лития, медь или цинк. Предпочтительными являются алкил- и циклоалкилмагния бромид, или алкил- и циклоалкилмагния хлорид.
Реакции процесса (XIV)→(XXXIII) в общем осуществляется в инертном органическом растворителе, например, бензоле, толуоле, ксилоле, петролейном простом эфире, гексане, гептане, тетрагидрофуране, диэтиловом простом эфире, изопропиловом простом эфире, ди-н-бутиловом простом эфире, метил-трет-бутиловом простом эфире, диметиловом простом эфире этиленгликоля, 1,4-диоксане или их смесях, предпочтительно тетрагидрофуране.
Реакции процесса (XIV)→(XXXIII) осуществляются в диапазоне температур от -80°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительно 60°С.
Реакции процесса (XIV)→(XXXIII) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Схема 15: Получение пропенил-замещенных пиразолопиримидинонов

а) бром(метил)магний (1.0 М в простом диэтиловом эфире), тетрагидрофуран,0°С - комнатная температура; b) соляная кислота (4Н раствор в 1,4-диоксане), комнатная температура.
Реакция в процессе (XXXI)→(XXXV) в общем осуществляется в инертном растворителе, в присутствии органометаллического алкилгалогенидного реагента, предпочтительно в диапазоне температур от -80°С до температуры флегмы растворителя при стандартном давлении.
Реакции процесса (XXXI)→(XXXV) в общем осуществляются в присутствии органометаллических алкилгалогенидных реагентов, где металлическим компонентом может быть магний, литий, медь или цинк. Предпочтительно применять алкилмагния бромид или алкилмагния хлорид.
Реакции процесса (XXXI)→(XXXV) в общем осуществляется в инертном органическом растворителе, например, бензоле, толуоле, ксилоле, петролейном простом эфире, гексане, гептане, тетрагидрофуране, диэтиловом простом эфире, изопропиловом простом эфире, ди-н-бутиловом простом эфире, метил-трет-бутиловом простом эфире, диметиловом простом эфире этиленгликоля, 1,4-диоксане или их смесях, предпочтительно тетрагидрофуране.
Реакции процесса (XXXI)→(XXXV) осуществляются в диапазоне температур от -80°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительно применяется комнатная температура.
Реакции процесса (XXXI)→(XXXV) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Схема 16: Получение тиазол-замещенных пиразолопиримидинонов
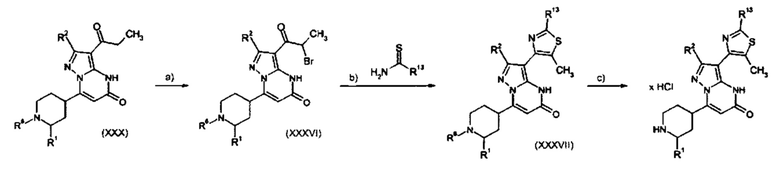
а) пиридиния трибромид, тетрагидрофуран, комнатная температура; b) этилдиизопропиламин, этанол, 70°С; с) соляная кислота (4Н раствор в 1,4-диоксане), комнатная температура. R13 выбирается из фенила, причем фенил необязательно замещен фтором, хлором, трифторметилом, метокси или этокси, феноксиметила, причем феноксиметил необязательно замещен хлором, бензила, причем бензилнеобязательно замещен метокси, пиридинила, причем пиридинил необязательно замещен этилом, пиразинила, пиразолила, причем пиразолил необязательно замещен одним или двумя метилами, имидазолилэтила, оксазола, причем оксазол необязательно замещен метилом, оксадиазола, С3-С6 циклоалкила, оксанила, циано-метила, С1-С4 алкила и трифторметила.
Реакция в процессе (XXX)→(XXXVI) в общем осуществляется в инертном растворителе, необязательно в присутствии основания или кислоты, в присутствии бромирующего агента, предпочтительно в диапазоне температур от -80°С до температуры флегмы растворителя при стандартном давлении.
Бромирующими агентами являются, например, бром (необязательно в присутствии трибромида фосфора, сульфат магния, бромид алюминия или хлорид алюминия), бромтриметилсилан, бромат натрия, 1,4-диазабицикло[2.2.2]октан гидробромид, бромид натрия, бромид меди(II), необязательно в присутствии бромида лития, бромида меди, бромсукцинимид, 1,3-дибром-5,5-диметилгидантоин, гидробромид, необязательно в присутствии пероксида водорода, 1-бутил-3-метилимидазолия трибромид, тетрабутиламмония трибромид, пиридиния трибромид, пиридин гидробромид, триметилфениламмония трибромид, диоксан дибромид, пирролидин-2-он-бром гидробромид (3:1) в присутствии пирролидин-2-она, 1,2-фенилен фосфорбромидит 1,2-фенилен фосфорбромидит, тетрабутиламмония бромид, предпочтительно пиридиния трибромид.
Основаниями являются, например, лития диизопропиламид, дикарбонат натрия, карбонат калия, гидроксид натрия, гидрокарбонат натрия, лития, бис(триметилсилил)амид, пиридин. Предпочтительно основание не применяется.
Кислотами являются, например, серная кислота, уксусная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, бисульфат натрия, соляная кислота. Предпочтительно кислота не применяется.
Растворители являются, например, диметил сульфоксид, ацетонитрил, вода, хлороформ, метанол, этанол, диэтиловый простой эфир, диизопропиловый простой эфир, трет-бутилметиловый простой эфир, этилацетат, тетрахлорид углерода, тетрабромид углерода, дихлорметан, 1,2-дихлорэтан, бензол, толуол, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, ацетон, гексан, циклогексан, или их смеси. Предпочтительно тетрагидрофуран.
Реакции процесса (XXX)→(XXXVI) осуществляются в диапазоне температур от -80°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительно комнатная температура.
Реакции процесса (XXX)→(XXXVI) может осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Реакция в процессе (XXXVI)→(XXXVII) в общем осуществляется в инертном растворителе, необязательно в присутствии основания, необязательно в присутствии дегидратирующего реагента, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, метил N-(триэтиламмониосульфонил)карбамат (Реагент Бургесса), карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1'-карбонилдиимидазол, или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутилхлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или этил циано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси)диметиламиноморфолинокарбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, предпочтительно метил N-(триэтиламмониосульфонил)карбамат.
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или N,N-диизопропилэтиламин, предпочтительно N,N-диизопропилэтиламин.
Инертными растворителями являются, например, спирты, такие как алифатические спирты, такие как, метанол, этанол, изопропанол, 1-метокси-2-пропанол или трет-бутанол, простые эфиры, такие как простой диэтиловый эфир, диоксан, тетрагидрофуран, простой диметиловый эфир гликоля или простой диметиловый эфир диэтиленгликоля, углеводороды, такие как бензол, толуол, ксилол, гексан, циклогексан или фракции минерального масла, галогенированные углеводороды, такие как дихлорметан, трихлорметан, тетрахлорид углерода, 1,2-дихлорэтан, трихлорэтилен или хлорбензол, или другие растворители, такие как ацетон, этилацетат, ацетонитрил, пиридин, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N,N'-диметилпропиленмочивина (DMPU) или N-метилпирролидон (NMP). Также возможно применять смеси указанных растворителей. Предпочтительно этанол.
Реакции процесса (XXXVI)→(XXXVII) осуществляются в диапазоне температур от 0°С до 200°С. Варианты нагрева включают обычное нагревание ниже точки кипения растворителя, при возврате флегмы, или выше точки кипения растворителя в закрытом сосуде, или в закрытом сосуде с помощью микроволнового реактора. Предпочтительно 70°С.
Реакции процесса (XXXVI)→(XXXVII) могут осуществляться при атмосферном, повышенном или пониженном давлении (например, от 0.5 до 25 бар). В общем, реакции осуществляются при атмосферном давлении.
Схема 17: Получение соединения формулы (XXXIX) через производную карбоновой кислоты
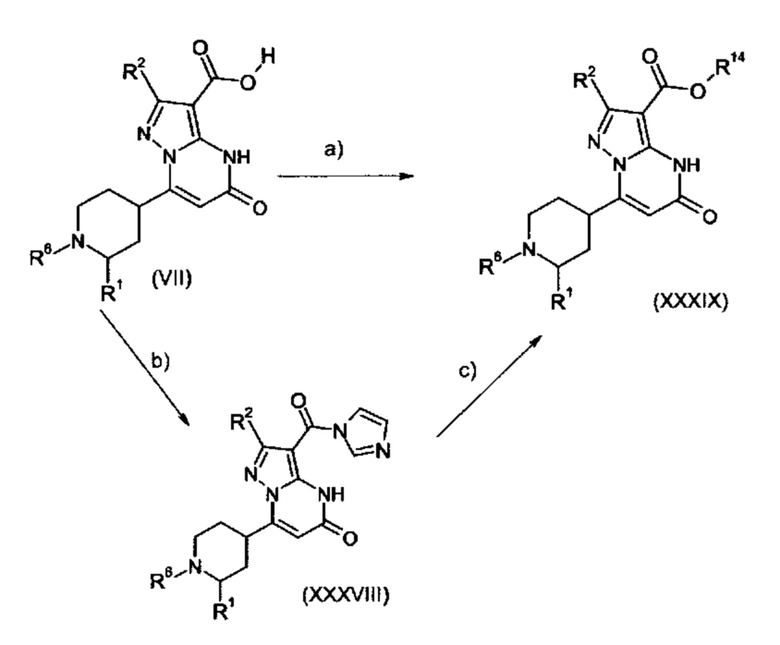
а) R14-2,2,2-трихлорэтанимидат, BF3⋅ОЕt2, THF; b) Карбодиимидазол, THF, возврат флегмы; с) R14OH, NaH, THF, возврат флегмы; или R14OH, THF, возврат флегмы. Стадии b) и С) могут также проводиться в одну стадию без выделения (XXXVIII). R14 выбран из С1-С4 алкила, причем С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями галоген, С3-С4 циклоалкила и бензила.
Реакция в процессе (VII)→(XXXIX) в общем осуществляется в инертном растворителе, необязательно в присутствии кислоты Льюиса, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Кислотами Льюиса являются, например, BF3⋅OEt2, BCl3, SnCl4, TMSTf, AlCl3, предпочтительно BF3⋅OEt2.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей, предпочтительно тетрагидрофуран.
Альтернативно, реакция в процессе (VII)→(XXXIX) может осуществляться посредством спиртов формулы R14OH в качестве реакционноспособных растворителе, вместе с дегидратирующим агентом, необязательно в присутствии основания, необязательно в присутствии инертных растворителей, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном или повышенном давлении. R14 выбран из С1-С4 алкила, причем С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями галоген, С3-С4 циклоалкила и бензила, как определено выше. Подходящими дегидратирующими реагентами согласно настоящему изобретению являются, например, карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1'-карбонилдиимидазол, или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутилхлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), или 1-гидроксибензотриазол (HOBt), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси) диметиламиноморфолинокарбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, реагент Бургесса, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), уксусный ангидрид или карбодиимидазол (CDI), или их смеси, предпочтительно карбодиимидазол (CDI).
Основаниями являются, например, карбонаты щелочных металлов, такие как карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, например, пиридин, триалкиламины, такие как триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, или их комбинации. Предпочтительно 4-диметиламинопиридин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, толуол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей.
Альтернативно, реакция в процессе (VII)→(XXXIX) может осуществляться посредством галогенидов R14, в присутствии основания, в инертном растворителе, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя, при стандартном или повышенном давлении.
R14 галогенидами являются, например, R14Cl, R14Br, и R14I, где R14 выбран из С1-С4 алкила, причем С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями галоген, С3-С4 циклоалкила и бензила, как определено выше.
Основаниями являются, например, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, или карбонат цезия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, например, пиридин, триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, или их комбинации. Предпочтительно применяются карбонат калия или триэтиламин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, толуол, или другие растворители, такие как тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси указанных растворителей.
Альтернативно, реакция в процессе (VII)→(XXXIX) может осуществляться посредством спиртов формулы R14OH, в присутствии алкилазодикарбоксилата и фосфина, в инертных растворителях, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении, где R14 выбран из С1-С4 алкила, причем С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями галоген, С3-С4 циклоалкила и бензила, как определено выше.
Алкилазодикарбоксилатами являются, например, диэтилазодикарбоксилат (DEAD), диизопропил азодикарбоксилат (DIAD), 1,1'-(Азодикарбонил)дипиперидин, 1,1'-азобис(N,N-диметилформамид). Предпочтительно применяется диизопропилазодикарбоксилат (DIAD).
Фосфинами являются, например, трифенилфосфин, 4-(Диметиламино)фенилдифенилфосфин, 4-(Диметиламино)фенилдифенилфосфин, Дициклогексилфенилфосфин, Дифенил-2-пиридилфосфин, 4-Дифенилфосфинометил полистирольная смола, предпочтительно трифенилфосфин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, толуол, или другие растворители, такие как тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси указанных растворителей.
Реакция в процессе (VII)→(XXXVIII) в общем осуществляется с помощью CDI, или с помощью дегидратирующего реагента, отличного от CDI, в комбинации с имидазолом, в инертном растворителе, необязательно в присутствии основания, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Подходящими дегидратирующими реагентами, отличными от CDI, в контексте настоящего изобретения являются, являются, например, карбодиимиды, например, N,N'-диэтил-, N,N'-дипропил-, N,N'-диизопропил- и N,N'-дициклогексилкарбодиимид, N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) (необязательно в присутствии пентафторфенола (PFP)), N-циклогексилкарбодиимид-N'-пропилоксиметил-полистирол (PS-карбодиимид) или карбонильные соединения, такие как 1,1'-карбонилдиимидазол, или 1,2-оксазолиниевые соединения, такие как 2-этил-5-фенил-1,2-оксазолиния 3-сульфат или 2-трет-бутил-5-метил-изоксазолиния перхлорат, или акриламиносоединения, такие как 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, или ангидрид пропанфосфиновой кислоты, или изобутил хлорформиат, или бис-(2-оксо-3-оксазолидинил)фосфорилхлорид или бензотриазолилокситри(диметиламино)фосфония гексафторфосфат, или О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), 2-(2-оксо-1-(2Н)-пиридинил)-1,1,3,3-тетраметилурония тетрафторборат (TPTU), (бензотриазол-1-илокси)бисдиметиламинометилия фторборат (TBTU) или O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU), или 1-гидроксибензотриазол (HOBt), или бензотриазол-1-илокситрис(диметиламино)фосфония гексафторфосфат (ВОР), или этилциано(гидроксиимино)ацетат (Oxyma), или (1-циано-2-этокси-2-оксоэтилиденаминоокси) диметиламиноморфолинокарбения гексафторфосфат (COMU), или N-[(диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метилметанаминия гексафторфосфат, или 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (Т3Р), или их смеси, предпочтительно N-(3-диметиламиноизопропил)-N'-этилкарбодиимид гидрохлорид (EDC) или N,N'-дициклогексилкарбодиимид. Если любой из этих дегидратирующих реагентов, отличных от CDI, применяется в реакции, тогда смесь дегидратирующего реагента с имидазолом является обязательной.
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, предпочтительно диизопропилэтиламин.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, или смеси растворителей, предпочтительно тетрагидрофуран.
Реакция в процессе (XXXVIII)→(XXXIX) в общем осуществляется в инертном растворителе, необязательно в присутствии основания, предпочтительно в диапазоне температур от 0°С до температуры флегмы растворителя при стандартном давлении.
Основаниями являются, например, карбонаты щелочных металлов, например, карбонат натрия или карбонат калия, или гидрокарбонат натрия или гидрокарбонат калия, гидриды щелочных металлов, такие как гидрид натрия, гидрид калия, или органические основания, такие как триалкиламины, например, триэтиламин, N-метилморфолин, N-метилпиперидин, 4-диметиламинопиридин или диизопропилэтиламин, предпочтительно гидрид натрия.
Инертными растворителями являются, например, галогенированные углеводороды, такие как дихлорметан или трихлорметан, углеводороды, такие как бензол, или другие растворители, такие как нитрометан, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, ацетонитрил или пиридин, спирты, такие как соответствующий R14OH, или смеси растворителей, предпочтительно R14OH.
Схема 18: Получение соединения формулы (XXXXI) через сложноэфирную производную
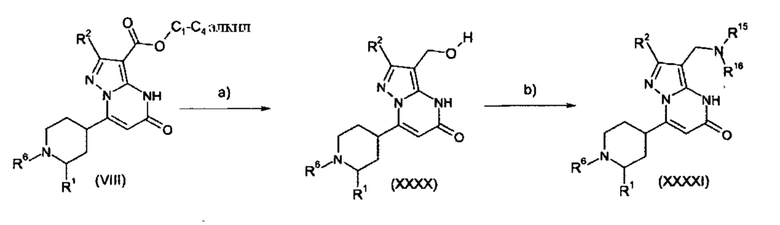
a) LiAlH4, THF; b) трифенилфосфин, NBS, THF, -18°C, затем HNR15R16, возврат флегмы. R15 и R16 выбираются C1-C4 алкила, или N, R15, и R16 вместе образуют 5-6-членный гетероциклил, причем 5-6-членный гетероциклильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила и оксо.
Реакция в процессе (VIII)→(ХХХХ) в общем осуществляется в инертном растворителе, предпочтительно в диапазоне температур от температуры замораживания растворителя до около 40°С при стандартном давлении.
Инертными растворителями являются, например, простоэфирные растворители, выбранные из группы, состоящей из тетрагидрофурана, трет-бутилметилового простого эфира, диэтилового простого эфира, 2-метил-тетрагидрофурана, 1,2-диметоксиэтана, диэтоксиметана, или смеси растворителей, предпочтительно тетрагидрофуран.
Реакция в процессе (ХХХХ)→(XXXXI) в общем осуществляется в инертном растворителе, предпочтительно в диапазоне температур от температуры замораживания растворителя до температуры флегмы растворителя при стандартном давлении.
Инертными растворителями являются, например, простоэфирные растворители, выбранные из группы, состоящей из тетрагидрофурана, диэтилового простого эфира, трет-бутилметилового простого эфира, 2-метил-тетрагидрофурана, 1,2-диметоксиэтана, диэтоксиметана, или смеси растворителей, предпочтительно тетрагидрофуран.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению обладают полезными фармакологическими свойствами и могут быть использованы для профилактики и лечения нарушений у людей и животных.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению открывают дальнейшую альтернативу лечения и, следовательно, обогащения фармацевтической области.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению вызывают ингибирование растворения тромбов (фибринолиз), приводят к увеличению стабильности сгустка (твердость сгустка) и, таким образом, к уменьшению кровотечения, повторного кровотечения и кровопотери. Эти эффекты обусловлены прямым ингибированием плазминогена, основного предшественника плазмина, эффективной сериновой протеазы, участвующей в растворении фибриновых сгустков крови.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению являются подходящими для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них. Соединения формулы (I-A) или (I-B) согласно настоящему изобретению также являются подходящими для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них. Соединения формулы (I-A) или (I-B) согласно настоящему изобретению также являются подходящими для лечения и/или профилактики острого и рецидивного кровотечения у пациентом с лежащими в основе редкими наследственными гемостатическими нарушениями или без них. Соединения формулы (I-A) или (I-В) согласно настоящему изобретению также являются подходящими для лечения и/или профилактики генетических или приобретенных гемостатических нарушений, наследственных или приобретенных гемостатических нарушений, и редких гемостатических нарушений. В рамках настоящего изобретения термин «лежащие в основе наследственные или приобретенные гемостатические нарушения» включает болезнь Виллебранда, нарушение/дисфункцию тромбоцитов, такие как тромбастения Гланцмана и тромбоцитопения, дефицит витамина K, дефицит PAI-1, легкая и умеренная гемофилия, включая гемофилию А (дефицит фактора VIII), гемофилию В (дефицит фактора IX), и гемофилию С (дефицит фактора XI), симптоматические носители гемофилии и других наследственных гемостатических нарушений, аутоиммунные нарушения, которые приводят к образованию антител против фактора свертывания крови, рак крови, заболевания костного мозга, инфекции, почечную недостаточность, заболеваний печени, медикаментозные лечения, медикаментозные лечения, включая гепарин, низкомолекулярный гепарин и производные кумарина, такие как варфарин, случайные травмы и хирургические вмешательства, приводящие к массивной кровопотере и приводящие к критическому снижению уровня факторов свертывания крови, что может привести к дополнительным нехирургическим осложнениям кровотечения (например, коагулопатическое кровотечение), приобретенный синдром Виллебранда (AVWS), характеризующийся структурными или функциональными нарушениями фактора Виллебранда (VWF), которые являются вторичными по отношению к аутоиммунным, лимфопролиферативным или миелопролиферативным, злокачественным, сердечнососудистым или другим нарушениям.
В контексте настоящего изобретения термин слабая гемофилия определяется как уровень активности фактора свертывания крови соответствующего дефицитного фактора от 5% до 50% от нормального уровня, термин умеренная гемофилия определяется как уровень активности фактора свертывания крови соответствующего дефицитного фактора от 1% до 5% от нормального уровня.
В контексте настоящего изобретения, термин лежащие в основе наследственные или приобретенные гемостатические нарушения, определяется как патологические процессы, участвующие в кровообращение.
В контексте настоящего изобретения термины "лежащие в основе наследственные или приобретенные нарушения кровотечения" и "лежащие в основе наследственные или приобретенные гемостатические нарушения" применяются взаимозаменяемо.
В контексте настоящего изобретения, термин лежащий в основе наследственные редкие гемостатические нарушения (RBD) определяется как гемостатические нарушения, вызванные менее распространенными наследственными нарушениями, включая дефицит фибриногена, протромбина, факторов V, комбинаций V+VIII, VII, X, XI и XIII.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут применяться при широком диапазоне геморрагических состояний, таких как кровотечение из верхних отделов желудочно-кишечного тракта, кровоизлияния, вызванные антифибринолитиками, и гинекологические кровотечения, включая тяжелое менструальное кровотечение (меноррагия), плацентарное кровотечение, послеродовое кровотечение и конизация шейки матки.
В контексте настоящего изобретения, тяжелое менструальное кровотечение (меноррагия) определяется как менструальная кровопотеря 60 мл или более за цикл, например от 60 до 80 мл за цикл, в частности более 80 мл за цикл. Также в соответствии с рекомендациями National Institute for Clinical Excellence (NICE) тяжелое менструальное кровотечение определяется для клинических целей как чрезмерная менструальная кровопотеря, которая препятствует физическому, эмоциональному, социальному и материальному качеству жизни женщины, и которая может происходить самостоятельно или в сочетании с другими симптомами.
В контексте настоящего изобретения термины "тяжелое менструальное кровотечение (НМВ)" и "меноррагия" являются взаимозаменяемыми.
В частности, соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут применяться при тяжелом менструальном кровотечении (меноррагия), вызванном лежащими в основе гемостатическими нарушениями, например, наследственными или приобретенными гемостатическими нарушениями, такими как болезнь Виллебранда, нарушения/дисфункция тромбоцитов, такие как тромбастения Гланцмана и тромбоцитопения, дефицит витамина K, дефицит PAI-1, легкая и умеренная гемофилия, включая гемофилию А (дефицит фактора VIII), гемофилию В (дефицит фактора IX), и гемофилию С (дефицит фактора XI), симптоматические носители гемофилии и других наследственных гемостатических нарушений, таких как дефицит фибриногена, протромбина, дефициты факторов V и комбинаций факторов V+VIII, VII, X, XI и XIII, аутоиммунные нарушения, рак крови, заболевания костного мозга, инфекции, почечная недостаточность, заболевания печени, медикаментозные лечения, включая гепарин, низкомолекулярный гепарин и производные кумарина, такие как варфарин, случайные травмы и хирургические вмешательства, приводящие к массивной кровопотере и приводящие к критическому снижению уровня факторов свертывания крови, и приобретенный синдром Виллебранда (AVWS).
Соединения формулы (IA) или (IB) в соответствии с настоящим изобретением могут также применяться для уменьшения предоперационной и послеоперационной кровопотери и повторного кровотечения во время и после различных хирургических вмешательств, включая сердечнососудистое хирургическое вмешательство, включая хирургическое вмешательство посредством аорто-коронарного шунтирования, хирургическое вмешательство в позвоночник, хирургическое вмешательство, связанное с травмой, трансплантацию, включая ортотопическую трансплантацию печени, и гистерэктомию, а также требований к переливанию крови пациентам с лежащими в основе гемостатическими нарушениями или без них. Кроме того, соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут применяться для предотвращения рецидива кровотечения у пациентов после планового незначительного хирургического вмешательства, такого как хирургическое вмешательство в предстательную железу, включая простатэктомию и трансуретральную резекцию предстательной железы, хирургическое вмешательство в мочевыделительную систему, отоларингологическое хирургическое вмешательство (ENT), включая тонзилэктомию, аденоидэктомию, пероральное хирургическое вмешательство и зубное хирургическое вмешательство у пациентов с лежащими в основе гемостатическими нарушениями или без них.
В контексте настоящего изобретения термин «медицинское вмешательство» включает медицинские вмешательства, связанные с кровотечением, такие как хирургическое вмешательство, трансплантация и процедуры. Определение термина «медицинское вмешательство» также включает незначительные медицинские вмешательства, которые могут вызвать кровотечение, такие как удаления зубов, периодонтальная (в десну) хирургическое вмешательство, размещение зубного имплантата, биопсии, например, биопсия зуба, биопсия предстательной железы и биопсия мочевой системы, и удаление мочевых камней.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут также применяться для лечения и/или профилактики острого и рецидивного кровотечения у пациентами с заболеваниями печени, включая пациентов с конечной стадией заболеваний печени у пациентов с лежащими в основе гемостатическими нарушениями или без них.
Соединения формулы (I-A) или (I-B) в соответствии с настоящим изобретением могут также применяться для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с травмой и/или травматической гифемой, геморрагическим инсультом, острым промиелоцитарным лейкозом, и блокировки плазмин-индуцированного протеолиза, который может быть биологическую значимость при атеротромбозе и воспалительных состояниях, раке и других заболеваниях у пациентов с лежащими в основе гемостатическими нарушениями или без них.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут также применяться для лечения и/или профилактики генетических или приобретенных гемостатических нарушений у пациентов, включая болезнь Виллебранда, нарушение/дисфункцию тромбоцитов, как например тромбастения Гланцмана и тромбоцитопения, дефицит витамина К, дефицит PAI-1, легкую и умеренную гемофилию, включая гемофилию А (дефицит фактора VIII), гемофилию В (дефицит фактора IX), и гемофилию С (дефицит фактора XI), симптоматические носители гемофилии и других наследственных гемостатических нарушений, таких как дефицит фибриногена, протромбина, дефициты факторов V и комбинаций факторов V+VIII, VII, X, XI и XIII, аутоиммунные нарушения, рак крови, заболевания костного мозга, инфекции, почечную недостаточность, заболевания печени, медикаментозные лечения, медикаментозные лечения, включая гепарин, низкомолекулярный гепарин и производные кумарина, такие как варфарин, случайные травмы и хирургические вмешательства, приводящие к массивной кровопотере и приводящие к критическому снижению уровня факторов свертывания крови, и приобретенный синдром Виллебранда (AVWS).
Соединения согласно настоящему изобретению могут применяться как отдельно в виде монотерапии, так и в комбинации с другими терапевтическими средствами для устранения гемостатического нарушения. Например, полагают, что совместное введение одного или более соединений согласно настоящему изобретению с полученным из плазмы или рекомбинантным фактором коагуляции, таким как фактор VIIa, фактор VIII, фактор IX или десмопрессин, является полезным для лечения гемофилии.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут также применяться для лечения синовита, где синовит может быть связан с повреждением хряща и связан с гемартрозом у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут также применяться для лечения кровотечения из носа (носовое кровотечение), вызванного травмой или другими причинами у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут также применяться для лечения и/или профилактики генетических или приобретенных гемостатических нарушений у пациентов.
Настоящее изобретение также относится к применению соединений формулы (I-А) или (I-B) согласно настоящему изобретению для лечения и/или профилактики заболеваний, в частности вышеуказанных заболеваний.
Вариантом выполнения настоящего изобретения также является соединение формулы (I-A) или (I-B) согласно настоящему изобретению для применения в способе лечения и/или профилактики заболеваний.
Вариантом выполнения настоящего изобретения также является соединение формулы (I-A) или (I-B) согласно настоящему изобретению для применения в способе лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них.
Вариантом выполнения настоящего изобретения также является соединение формулы (I-A) или (I-B) согласно настоящему изобретению для применения в способе лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями.
Вариантом выполнения настоящего изобретения также является соединение формулы (I-A) или (I-B) согласно настоящему изобретению для применения в способе лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, гинекологическое хирургическое вмешательство, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является соединение формулы (I-A) или (I-B) согласно настоящему изобретению для применения в способе лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, гинекологическое хирургическое вмешательство, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является соединение формулы (I-A) или (I-B) согласно настоящему изобретению для применения в способе лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, гинекологическое хирургическое вмешательство, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является соединение формулы (I-A) или (I-B) согласно настоящему изобретению для применения в способе лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, гинекологическое хирургическое вмешательство, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Настоящее изобретение также относится к применению соединений формулы (I-А) или (I-B) согласно настоящему изобретению для получения лекарственного средства для лечения и/или профилактики заболеваний, в частности вышеуказанных заболеваний.
Настоящее изобретение также относится к применению соединений формулы (I-А) или (I-B) согласно настоящему изобретению для получения лекарственного средства для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, гинекологическое хирургическое вмешательство, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Настоящее изобретение также относится к применению соединений формулы (I-А) или (I-B) согласно настоящему изобретению для получения лекарственного средства для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, гинекологическое хирургическое вмешательство, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B) согласно настоящему изобретению в комбинации с инертным, нетоксичным, фармацевтически приемлемым вспомогательным средством.
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B) согласно настоящему изобретению в комбинации с другим активным соединением, выбранным из группы, включающей фактор VIII, фактор IX, фактор VIIa, активированные концентраты протромбинового комплекса (аРСС) или концентраты протромбинового комплекса (PCCs), ε-аминокапроновую кислоту, этамзилат, парааминобутилбензойную кислоту, транексамовую кислоту, десмопрессин, даназол, комбинированные пероральные контрацептивные средства (СОСР), прогестиновую внутриматочную систему, агонисты глюкокортикоидного рецептора, анальгезирующие средства, и нестероидные противовоспалительные лекарственные средства (NSAID).
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как описано выше, для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них.
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как описано выше, для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них.
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как описано выше, для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями.
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как описано выше, для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными нарушениями кровотечения.
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как определено выше, для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, гинекологическое хирургическое вмешательство, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как определено выше, для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является способ лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них у людей и животных, используя эффективное количество по меньшей мере одного соединения формулы (I-A) или (I-B) согласно настоящему изобретению или лекарственного средства, содержащего соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как определено выше.
Вариантом выполнения настоящего изобретения также является способ лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями у людей и животных, используя эффективное количество по меньшей мере одного соединения формулы (I-A) или (I-B) согласно настоящему изобретению или лекарственного средства, содержащего соединение формулы (I-А) или (I-B) согласно настоящему изобретению, как определено выше.
Вариантом выполнения настоящего изобретения также является способ лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них у людей и животных, используя эффективное количество по меньшей мере одного соединения формулы (I-A) или (I-B) согласно настоящему изобретению или лекарственного средства, содержащего соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как определено выше, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является способ лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них у людей и животных, используя эффективное количество по меньшей мере одного соединения формулы (I-A) или (I-B) согласно настоящему изобретению или лекарственного средства, содержащего соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как определено выше, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является способ лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями у людей и животных, используя эффективное количество по меньшей мере одного соединения формулы (I-A) или (I-B) согласно настоящему изобретению или лекарственного средства, содержащего соединение формулы (I-А) или (I-B) согласно настоящему изобретению, как определено выше, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Вариантом выполнения настоящего изобретения также является способ лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными нарушениями кровотечения у людей и животных, используя эффективное количество по меньшей мере одного соединения формулы (I-A) или (I-B) согласно настоящему изобретению или лекарственного средства, содержащего соединение формулы (I-А) или (I-B) согласно настоящему изобретению, как определено выше, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза.
Эффективность соединений формулы (I-A) и (I-B) согласно настоящему изобретению для лечения и/или профилактики генетических или приобретенных гемостатических нарушений, и острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморранический шок, геморранический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, отоларингологическое хирургическое вмешательство, зубное хирургическое вмешательство, ортопедическое хирургическое вмешательство, хирургическое вмешательство в мочевыделительную систему, хирургическое вмешательство в предстательную железу, сердечнососудистое хирургическое вмешательство, хирургическое вмешательство в позвоночник, трансплантацию печени или легкого, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа, и синовит и повреждение хряща после гемартроза, демонстрируется, например, уменьшением потери крови (количественный выход и лабораторные показатели), сокращением продолжительности кровотечения, повышением твердости сгустка, уменьшением частоты повторных кровотечений, улучшением качества жизни, что может в случае тяжелого менструального кровотечения определяться анкетами влияния усиленной менструации (Menorrhagia Impact Questionnaire), количеством визитов к врачу и/или улучшенным соблюдением режима лечения из-за менее частых дозировок по сравнению с, например, аналогами лизина, включая транексамовую кислоту и ε-аминокапроновую кислоту.
Соединение формулы (I-A) или (I-B) необязательно должно, но необязательно вводиться с одним или более агентами, применяемыми в настоящее время для предотвращения или лечения рассматриваемого нарушения. Эффективное количество таких других агентов зависит от количества соединения согласно настоящему изобретению, типа нарушения или лечения. Они в общем используются при тех же дозах и теми же путями введения, как применялось ранее, или от около 1 до около 99% от ранее применяемых доз. Настоящее изобретение также относится к лекарственным средствам, содержащим по меньшей мере одно из соединений формулы (I-A) или (I-B) согласно настоящему изобретению и одно или более дополнительных активных веществ, в частности для лечения и/или профилактики вышеуказанных заболеваний. В качестве подходящих для комбинации активных веществ можно упомянуть, например, и предпочтительно:
Фактор VIII, фактор IX, фактор VIIa, активированные концентраты протромбинового комплекса (аРСС) или концентраты протромбинового комплекса (РСС), ε-аминокапроновая кислота, этамзилат, парааминобутилбензойная кислота, транексамовая кислота, десмопрессин, даназол, комбинированные пероральные контрацептивные средства (СОСР), прогестиновые внутриматочные системы, агонисты глюкокортикоидного рецептора, анальгезирующие средства, и нестероидные противовоспалительные лекарственные средства (NSAID).
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с фактором коагуляции, в общем известным как фактор VIII, его любыми производными, фрагментами, мутеинами или конъюгатами.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с фактором коагуляции, в общем известным как фактор IX, его любыми производными, фрагментами, мутеинами или конъюгатами.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с фактором коагуляции, в общем известным как фактор VIIa, его любыми производными, фрагментами, мутеинами или конъюгатами.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с активированными концентратами протромбинового комплекса (аРСС) или концентратами протромбинового комплекса (РСС).
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с антифибринолитическими агентами, такими как, например и предпочтительно, ε-аминокапроновая кислота, этамзилат, парааминобутилбензойная кислота и транексамовая кислота.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с десмопрессином.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с даназолом.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с комбинированными пероральными контрацептивными средствами (СОСР), такими как, например и предпочтительно, комбинации эстрогена, например, синтетический эстроген этинилэстрадиол или природные эстрогены эстрадиол и производные эстрадиола, предпочтительно сложный эфир эстрадиола, как например эстрадиолвалериат и эстрадиол гидрат, и гестаген, например, прогестерон, тримегестон, медроксипрогестерон ацетат, мегестрол ацетат, ципротерон ацетат, хлормадинон ацетат, несторон, левоноргестрел, норгестимат, дезогестрел, этоногестрел (3-кетодезогестрел), номегестрол ацетат (NOMAC), норэтистерон ацетат (NETA), дроспиренон, гестоден, диеногест, норэтиндрон ацетат, даназол, норгестрел и танапрогет.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводят в комбинации с внутриматочными средствами, включая внутриутробные пропитанные прогестином устройства, например, внутриматочную систему левоноргестрела LNG-IUS.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с агонистом глюкокортикоидных рецепторов, такими как, например и предпочтительно, кортизол, кортизон, гидрокортизон, преднизон, метил-преднизолон, преднилиден, дефлазакорт, флуокортолон, триамцинолон, дексаметазон или бетаметазон.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с нестероидные противовоспалительные лекарственные средства (NSAID), такими как, например и предпочтительно, ацетилсалициловая кислота, диклофенак, флурбипрофен, ибупрофен, индометацин, мефенамовая кислота, меклофенамовая кислота и напроксен.
В варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся в комбинации с анальгезирующими средствами, такими как например и предпочтительно, ацетаминофен, ацетанилид, аминобензойная кислота, антипирин, салицилат кальция или холина, кодеин, фенацетин, фенилтолоксамин цитрат, салициламид, салицилат натрия и пара-аминобензоат натрия.
Вариантом выполнения настоящего изобретения также является лекарственное средство, содержащее соединение формулы (I-A) или (I-B), как определено выше, в комбинации с другим активным соединением, выбранным из группы, включающей фактор VIII, фактор IX, фактор VIIa, активированные концентраты протромбинового комплекса (аРСС) или концентраты протромбинового комплекса (РСС), ε-аминокапроновую кислоту, этамзилат, парааминобутилбензойную кислоту, транексамовую кислоту, десмопрессин, даназол, гормональные препараты, включая комбинированные пероральные контрацептивные средства (СОСР), прогестиновую внутриматочную систему, агонисты глюкокортикоидного рецептора, анальгезирующие средства, и нестероидные противовоспалительные лекарственные средства (NSAID).
Вариантом выполнения настоящего изобретения также является лекарственное средство, как определено выше, для лечения и/или профилактики генетических или приобретенных гемостатических нарушений, травмы, хирургического вмешательства, инсульта, тяжелого менструального кровотечения (НМВ), включая тяжелое менструальное кровотечение у женщин с лежащими в основе гемостатическими нарушениями, послеродовое кровотечение, заболевания печени, и наследственный ангионевротический отек.
Вариантом выполнения настоящего изобретения также является способ лечения и/или профилактики генетических или приобретенных гемостатических нарушений, травмы, хирургического вмешательства, инсульта, тяжелого менструального кровотечения, включая тяжелое менструальное кровотечение у женщин с лежащими в основе гемостатическими нарушениями, послеродовое кровотечение, заболевания печени, и наследственный ангионевротический отек, у людей и животных, используя эффективное количество по меньшей мере одного соединения формулы (I-A) или (I-B), как определено выше, или лекарственное средство, как определено выше.
Настоящее изобретение также относится к лекарственным средствам, которые содержат по меньшей мере одно соединение формулы (I-A) или (I-B) согласно настоящему изобретению, как правило вместе с одним или более инертными, нетоксичными, фармацевтически приемлемыми вспомогательными средствами, и их применению для вышеуказанных целей.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут быть эффективными после системного и/или местного введения. С этой целью их можно применять подходящим образом, например, пероральным, парентеральным, легочным, назальным, подъязычным, лингвальным, трансбуккальным, ректальным, дермальным, трансдермальным, конъюнктивальным или ушным путем или в виде имплантата или стента.
Для этих путей введения соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут вводиться в подходящих лекарственных формах.
Лекарственные формы, действующие в соответствии с уровнем техники, для быстрого и/или модифицированного высвобождения соединений согласно настоящему изобретению, которые содержат соединения формулы (I-A) или (I-B) согласно настоящему воздействию в кристаллической и/или аморфизованной и/или растворенной форме, таблетки (таблетки без покрытия или с покрытием, например, с энтеросолюбильными покрытиями или покрытиями с замедленным растворением или нерастворимыми покрытиями, которые контролируют высвобождение соединения формула (I-A) или (I-B) согласно настоящему изобретению), таблетки или пленки/капсулы, быстро дезинтегрирующие в полости рта, пленки/лиофилизаты, капсулы (например, твердые или мягкие желатиновые капсулы), пилюли с сахарным покрытием, гранулы, пеллеты, порошки, эмульсии, суспензии, аэрозоли или растворы, являются подходящими для перорального введения.
Парентеральное введение может применяться, не включающее стадию абсорбции (например, внутривенное, внутриартериальное, внутрисердечное, внутриспинальное или внутриполостное), или включающее абсорбцию (например, внутримышечное, подкожное, внутрикожное, чрескожное или внутрибрюшинное). Инъекционные и инфузионные препараты в виде растворов, суспензий, эмульсий, лиофилизатов или стерильных порошков являются подходящими, среди прочего в качестве лекарственных форм для парентерального применения. Внутривенное введение может осуществляться, например, путем болюсного введения или путем непрерывной инфузии.
Ингаляционные лекарственные формы (включая порошковые ингаляторы, небулайзеры), назальные капли, назальные растворы или назальные спреи, таблетки, пленки/капсулы или капсулы для лингвального, сублингвального или буккального применения, суппозитории, препараты для ушей или глаз, вагинальные капсулы, водные суспензии (лосьоны, встряхиваемые смеси), липофильные суспензии, мази, крема, чрескожные терапевтические системы (например, пластыри), молоко, пасты, пены, опудривающие порошки, имплантаты или стенты, например, являются подходящими для других путей введения.
В одном варианте выполнения настоящего изобретения, соединения формулы (I-А) или (I-B) согласно настоящему изобретению могут вводиться в форме назальных капель, назальных растворов или назальных спреев для лечения и/или профилактики острого и рецидивного кровотечения из носа у пациентов, в частности у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями.
В одном варианте выполнения настоящего изобретения, соединения формулы (I-А) или (I-B) в соответствии с настоящим изобретением могут указываться в виде пластырей, пропитанных соединениями формулы (I-A) или (I-B) согласно настоящему воздействию и нанесенных на рану для лечения и/или профилактики острого и рецидивного кровотечения у пациентов, в частности у пациентов с лежащими в их основе наследственными или приобретенными гемостатическими нарушениями. В одном варианте выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) в соответствии с настоящим изобретением вводятся внутримышечно, ректально или трансвагинально для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с травмой и другими формами острого кровотечения, в частности у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями.
В одном варианте выполнения настоящего изобретения, соединения формулы (I-А) или (I-B) согласно настоящему изобретению вводятся в форме средства смыва и средства для глотания или пастилки для лечения и/ ли профилактики острого и рецидивного кровотечения изо рта у пациентов, в частности у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями. Путь введения смывом или глотанием определяется как введение жидкого вещества в слизистую оболочку полости рта путем полоскания полости рта лекарственным средством в течение определенного промежутка времени, после чего его можно проглотить. Действие препарата является одновременно как местным, так и системным.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут также применяться in vitro или ex vivo для ингибирования фибринолиза, например, для анализов in vitro/ex vivo, для ингибирования фибринолиза в крови и продуктах плазмы, для предварительной обработки катетеров и других медицинских устройств и оборудования, для поверхностных покрытий или в биологических образцах.
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут быть преобразованы в вышеупомянутые лекарственные формы. Это может осуществляться известным образом, путем смешивания с инертными, нетоксичными фармацевтически приемлемыми вспомогательными средствами. Эти вспомогательные средства включают среди прочего носители (например, микрокристаллическую целлюлозу, лактозу, маннит), растворители (например, жидкие полиэтиленгликоли), эмульгаторы и диспергирующие средства или смачивающие средства (например, додецилсульфат натрия, полиоксисорбитанолеат), связующие вещества (например, поливинилпирролидон), синтетические и природные полимеры (например, альбумин), стабилизаторы (например, антиоксиданты, такие как аскорбиновая кислота), красители (например, неорганические пигменты, например, оксиды железа) и корректоры вкуса и/или запаха.
Вариантом осуществления настоящего изобретения являются фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (IA) или (IB) согласно настоящему изобретению, предпочтительно вместе с по меньшей мере одним инертным, нонтоксичным, фармацевтически приемлемым вспомогательным средством, и применение этих фармацевтических композиций для вышеуказанных целей.
Для профилактики или лечения заболевания подходящая дозировка соединения согласно настоящему изобретению (при применении отдельно или в сочетании с другими агентами) будет зависеть от типа заболевания, подлежащего лечению, типа соединения, тяжести и течения заболевания, вводится ли соединение для профилактических или терапевтических целей, предыдущей терапии, истории болезни пациента и реакции на соединение, и мнения лечащего врача. Соединение подходящим образом вводится пациенту в одни момент времени или в виде ряда лечений. В зависимости от типа и тяжести заболевания от около 0,1 мкг/кг до около 100 мг/кг соединения является начальной предполагаемой дозой для введения пациенту, посредству, например, одного или более отдельных введений или непрерывной инфузии. Типичная ежедневная доза может составлять от около 0,1 мкг/кг до около 100 мг/кг или более, в зависимости от упомянутых выше факторов. Для повторных введений в течение нескольких дней или более, в зависимости от состояния, лечение поддерживается до желаемого подавления симптомов болезни. Можно вводить изначально более высокую нагрузочную дозу, за которой следуют одна или несколько более низких доз. Однако может быть полезным другой режим дозирования. Прогресс этой терапии легко контролируется с помощью обычных методов и анализов.
В общем, было доказано предпочтительным в случае перорального или парентерального введения вводить количества в диапазоне от 0,1 до 300 или от 0,5 до 50 или от 1 до 50 или от 2 до 10 мг/кг массы тела каждые 24 часа, для достижения эффективных результатов.
Согласно другому варианту выполнения настоящего изобретения было доказано предпочтительным в случае перорального введения таблетки с немедленным высвобождением вводить количества в диапазоне от 5 до 15 или от 7 до 12 или от 9 до 11 или 10 мг/кг массы тела дважды в день (b.i.d.). Было доказано предпочтительным в случае перорального введения таблетки с модифицированным высвобождением вводить количества в два раза ниже, чем в случае перорального введения таблетки немедленного высвобождения.
Тем не менее, может быть необязательным отклоняться от указанных количеств, а именно в зависимости от массы тела, пути введения, индивидуальной реакции на активное вещество, типа препарата и момента времени или интервала времени, когда применение происходит. Таким образом, в некоторых случаях может быть достаточно использовать количества ниже упомянутых, тогда как в других случаях указанный верхний предел должен быть превышен. При применении больших количеств, возможно, целесообразно распределить их на несколько отдельных доз в течение дня.
Согласно другому варианту выполнения настоящего изобретения соединение формулы (I-A) или (I-B) согласно настоящему изобретению вводят перорально один раз или два или три раза в день. Согласно другому варианту выполнения настоящего изобретения соединение формулы (I-A) или (I-B) согласно настоящему изобретению вводят перорально один или два раза в день. Согласно другому варианту выполнения настоящего изобретения соединения формулы (I-А) или (I-B) согласно настоящему изобретению вводят перорально один раз в день. Для перорального введения можно использовать лекарственную форму с быстрым высвобождением или модифицированным высвобождением.
Согласно другому варианту выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся перорально один или два или три раза в день на день 1 или 2 или 3 или 4 или 5 или 6 или 7 или 8 или 9 или 10 месяца. Согласно другому варианту выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся перорально один или два или три раза в день на 2 или 3 или 4 или 5 или 6 или 7 или 8 или 9 или 10 последовательный день месяца. Согласно другому варианту выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся перорально один или два или три раза в день на день 3 или 4 или 5 или 6 или 7 месяца. Согласно другому варианту выполнения настоящего изобретения, соединения формулы (I-A) или (I-B) согласно настоящему изобретению вводятся перорально один или два или три раза в день на 3 или 4 или 5 или 6 или 7 последовательный день месяца.
Следующие конкретные примеры поясняют настоящее изобретение. Настоящее изобретение не ограничено примерами.
Проценты в следующих тестах и примерах приведены в процентах по массе, если не указано иное; частями являются части по массе. Соотношения растворителей, коэффициентов разбавления и концентраций для жидких/жидких растворов относятся в каждом случае к объему.
А. Примеры
Аббревиатуры и акронимы
Препаративная ВЭЖХ
Способ 1A
Колонка: Chromatorex С18 48 мкм 100×30 5 мкм, поток: 50 мл/мин, Элюент: A: ацетонитрил B: вода/0.1% муравьиная кислота, Градиент 20% А→90% А
Способ 2A
Колонка: Xbridge 100×30 5 мкм, поток: 50 мл/мин, Элюент: А: ацетонитрил В: вода/0.2% аммиак, Градиент 10% А→95% А
Способ 3A
Устройство MS: Waters, Устройство ВЭЖХ: Waters (колонка Phenomenex Luna 5μ С18(2) 100А, AXIA Tech. 50×21.2 мм, Элюент A: вода + 0.05% муравьиная кислота, Элюент B: ацетонитрил или метанол (ULC) + 0.05% муравьиная кислота, градиентное элюирование; поток: 40 мл/мин; УФ-обнаружение: DAD; 210-400 нм).
Способ 4A
Устройство MS: Waters, Устройство ВЭЖХ: Waters (колонка Waters X-Bridge С18, 18 мм × 50 мм, 5 мкм, Элюент А: вода + 0.05% триэтиламин, Элюент В: ацетонитрил или метанол (ULC) + 0.05% триэтиламин, градиентное элюирование; поток: 40 мл/мин; УФ-обнаружение: DAD; 210-400 нм).
Способ 5А
Устройство MS: Waters, Устройство ВЭЖХ: Waters (колонка: Phenomenex Synergie polar 4 мкм 80А, AXIA Tech. 50×21.2 мм, Растворитель А: Вода + 0.375% Муравьиная кислота, Растворитель В: Ацетонитрил (ULC) + 0.375% Муравьиная кислота, градиент; Поток: 40 мл/мин; УФ-обнаружение: DAD; 210-400 нм).
LC-MS-Способы
Способ 1В
Устройство: Waters ACQUITY SQD UPLC system; колонка: Waters Acquity UPLC HSS Т3 1.8 μ 50×1 мм; элюент А: 1 л воды + 0.25 мл 99% HCOOH, элюент В: 1 л ацетонитрила + 0.25 мл 99% HCOOH; градиент: 0.0 мин 90% А→1.2 мин 5% А→2.0 мин 5% А; печь: 50°C; поток: 0.40 мл/мин; УФ-обнаружение: 208-400 нм.
Способ 2В
Устройство MS: Waters (Micromass) QM; Устройство ВЭЖХ: Agilent 1100 series; колонка: Agilent ZORBAX Extend-C18 3.0×50 мм 3.5 мкм; Элюент A: 1 л воды + 0.01 моль карбоната аммония, элюент В: 1 л ацетонитрила; градиент: 0.0 мин 98% А→0.2 мин 98% А→3.0 мин 5% А→4.5 мин 5% А; Печь: 40°C; Поток: 1.75 мл/мин; УФ-обнаружение: 210 нм.
Способ 3В
Устройство: Micromass Quattro Premier Waters UPLC Acquity; Колонка: Thermo Hypersil GOLD 1.9 μ 50×1 мм; Элюент A: 1 l Wasser + 0.5 мл 50% муравьиная кислота, Элюент В: 1 л ацетонитрила + 0.5 мл 50% муравьиной кислоты; Градиент: 0.0 мин 97% А→0.5 мин 97% А→3.2 мин 5% А→4.0 мин 5% А Печь: 50°C; Поток: 0.3 мл/мин; УФ-обнаружение: 210 нм.
Способ 4В
Устройство MS: Waters SQD; Устройство ВЭЖХ: Waters UPLC; колонка: Zorbax SB-Aq (Agilent), 50 мм × 2.1 мм, 1.8 мкм; Элюент А: вода + 0.025% муравьиная кислота, Элюент В: ацетонитрил (ULC) + 0.025% муравьиная кислота; градиент: 0.0 мин 98% А - 0.9 мин 25% А - 1.0 мин 5% А - 1.4 мин 5% А - 1.41 мин 98% А - 1.5 мин 98% А; печь: 40°C; поток: 0.600 мл/мин; УФ-обнаружение: DAD; 210 нм.
Способ 5В
Устройство: Waters ACQUITY SQD UPLC system; колонка: Waters Acquity UPLC HSS T3 1.8 μ 30×2 мм; элюент A: 1 л воды + 0.25 мл 99% муравьиная кислота, элюент В: 1 л ацетонитрила + 0.25 мл 99% муравьиная кислота; градиент: 0.0 мин 90% А→1.2 мин 5% А→2.0 мин 5% А печь: 50°C; поток: 0.60 мл/мин; УФ-обнаружение: 208-400 нм.
Способ 6В
Устройство: Waters ACQUITY SQD UPLC system; колонка: Waters Acquity UPLC HSS T3 1.8 μ 50×1 мм; элюент A: 1 л воды + 0.25 мл 99% муравьиная кислота, элюент В: 1 л ацетонитрила + 0.25 мл 99% муравьиная кислота; градиент: 0.0 мин 95% А→6.0 мин 5% А→7.5 мин 5% А печь: 50°C; поток: 0.35 мл/мин; УФ-обнаружение: 210-400 нм.
Способ 7В
Устройство MS: Waters (Micromass) QM; Устройство ВЭЖХ: Agilent 1100 Series; Колонка: Agilent ZORBAX Extend-C18 3.0×50 mm 3.5-Micron; Элюент A: 1 л воды + 0.01 моль карбоната аммония, Элюент В: 1 л ацетонитрила; Градиент: 0.0 мин 98% А→0.2 мин 98% А→3.0 мин 5% А→4.5 мин 5% А; Печь: 40°C; Поток: 1.75 мл/мин; УФ-обнаружение: 210 нм.
Способ 8В
Устройство: Agilent MS Quad 6150; ВЭЖХ: Agilent 1290; Колонка: Waters Acquity UPLC HSS T3 1.8 μ 50×2.1 мм; Элюент A: 1 л воды + 0.25 мл 99% муравьиная кислота, Элюент В: 1 л ацетонитрила + 0.25 мл 99% муравьиная кислота; Градиент: 0.0 мин 90% А→0.3 мин 90% А→1.7 мин 5% А→3.0 мин 5% А Печь: 50°C; Поток: 1,20 мл/мин; УФ-обнаружение: 205-305 нм.
Способ 9В
Устройство MS: ThermoFisherScientific LTQ-Orbitrap-XL; Устройство ВЭЖХ: Agilent 1200SL; Колонка: Agilent, POROSHELL 120, 3×150 мм, SB - С18 2.7 мкм;Элюент А: 1 л воды + 0.1% трифторуксусной кислотой; Элюент В: 1 л ацетонитрила + 0.1% трифторуксусной кислотой; Градиент: 0.0 мин 2% В→0.3 мин 2% В→5.0 мин 95% В→10.0 мин 95% В; Печь: 40°C; Поток: 0.75 мл/мин; УФ-обнаружение: 210 нм.
Способ 10В
Устройство MS: Waters (Micromass) Quattro Micro; Устройство Waters UPLC Acquity; колонка: Waters ВЕН C18 1.7 μ 50×2.1 мм; растворитель A: 1 л воды + 0.01 моль формиата аммония, растворитель В: 1 л ацетонитрила; градиент: 0.0 мин 95% А→0.1 мин 95% А→2.0 мин 15% А→2.5 мин 15% А→2.51 мин 10% А→3.0 мин 10% А; печь: 40°С; потоки: 0.5 мл/мин; УФ-обнаружение: 210 нм.
Способ 11В
Устройство MS: Thermo Scientific FT-MS; Устройство UHPLC+: Thermo Scientific UltiMate 3000; колонка: Waters, HSST3, 2.1×75 мм, C18 1.8 мкм; растворитель A: 1 л воды + 0.01% муравьиная кислота; растворитель В: 1 л ацетонитрила + 0.01% муравьиная кислота; градиент: 0.0 мин 10% В→2.5 мин 95% В→3.5 мин 95% В; печь: 50°С; поток: 0.90 мл/мин; УФ-обнаружение: 210 нм/ Optimum Integration Path 210-300 нм.
Способ 12В
Устройство MS: Waters SQD; Устройство ВЭЖХ: Waters UPLC; колонка: Zorbax SB-Aq (Agilent), 50 мм × 2.1 мм, 1.8 мкм; элюент А: вода + 0.025% муравьиная кислота, элюент В: ацетонитрил (ULC) + 0.025% муравьиная кислота; градиент: 0.0 мин 98% А - 0.9 мин 25% А - 1.0 мин 5% А - 1.4 мин 5% А - 1.41 мин 98% А - 1.5 мин 98% А; печь: 40°С; поток: 0.600 мл/мин; УФ-обнаружение: DAD; 210 нм.
Способ 13В
Тип устройства MS: Agilent Technologies 6130 Quadrupole LC-MS; Тип устройства ВЭЖХ: Agilent Technologies 1260 Infinity; колонка: Waters XSelect (C18, 30×2.1 мм, 3.5 мкм); поток: 1 мл/мин; температура колонки: 35°С; элюент А: 0.1% муравьиная кислота в ацетонитриле; элюент В: 0.1% муравьиная кислота в воде; линейный градиент: t=0 мин 5% A, t=1.6 мин 98% A, t=3 мин 98% А; обнаружение: DAD (220-320 нм); обнаружение: MSD (ESI pos/neg) массовый диапазон: 100-800; обнаружение: ELSD (PL-ELS 2100): газовый поток 1.2 мл/мин, температура газа: 70°С, neb: 50°С.
Способ 14В
Тип устройства MS: Agilent Technologies 6130 Quadrupole LC-MS; Тип устройства ВЭЖХ: Agilent Technologies 1260 Infinity; колонка: Waters XSelect (C18, 50×2.1 мм, 3.5 μ); поток: 0.8 мл/мин; температура колонки: 35°С; элюент А: 0.1% муравьиная кислота в ацетонитриле; элюент В: 0.1% муравьиная кислота в воде; линейный градиент: t=0 мин 5% A, t=3.5 мин 98% A, t=6 мин 98% А; обнаружение: DAD (220-320 нм); обнаружение: MSD (ESI pos/neg) массовый диапазон: 100-800; обнаружение: ELSD (PL-ELS 2100): газовый поток 1.2 мл/мин, температура газа: 70°С, neb: 50°С.
Способ 15В
Тип устройства:  Pump Manager С-615,
Pump Manager С-615,  Pump Module C-601; колонки: GraceResolv™ силикагелевый картридж; 4 г картридж, поток 5 мл/мин; 12 г картридж, поток 16 мл/мин; 40 г картридж, поток 50 мл/мин; 80 г картридж, поток 100 мл/мин; 120 г картридж, поток 160 мл/мин; элюенты: смотрите эксперимент; обнаружение: ТСХ пластины, TLC Silica gel 60 F254 (Merck).
Pump Module C-601; колонки: GraceResolv™ силикагелевый картридж; 4 г картридж, поток 5 мл/мин; 12 г картридж, поток 16 мл/мин; 40 г картридж, поток 50 мл/мин; 80 г картридж, поток 100 мл/мин; 120 г картридж, поток 160 мл/мин; элюенты: смотрите эксперимент; обнаружение: ТСХ пластины, TLC Silica gel 60 F254 (Merck).
Способ 16В
Тип устройства MS: Agilent Technologies LC/MSD SL; Тип устройства ВЭЖХ: Agilent Technologies 1100 Series; колонка: Waters XSelect (C18, 50×2.1 mm, 3.5 μ; поток: 0.8 мл/мин; температура колонки: 25°С; элюент А: 95% ацетонитрил + 5% аммония бикарбонат в воде; элюент В: 10 ммМ аммония бикарбонат в воде pH=9.0; линейный градиент: t=0 мин 5% A, t=3.5 мин 98% A, t=6 мин 98% А; обнаружение: DAD (220-320 нм); обнаружение: MSD (ESI pos/neg) массовый диапазон: 100-800.
Спектроскопия ядерного магнитного резонанса (Примеры 378-395)
Тип 1Н- и 13С-ЯМР устройства: Bruker DMX300 (1H-ЯМР: 300 МГц; 13C-NMR: 75 МГц); внутренний стандарт: тетраметилсилан; химические сдвиги (δ) выражаются в частях на миллион [ppm]; применяются следующие аббревиатуры: s = синглет, d = дублет, t = триплет, q = квартет, m = мультиплет, b = расширенный; постоянные связывания выражаются в Герцах [Гц].
Препаративное разделение диастереомеров
Способ 1С
Фаза: Daicel Chiralpak AZ-H, 5 мкм 250 мм × 30 мм, элюент: изогексан/эталон 1:1; температура: 25°С; поток: 40 мл/мин; УФ-обнаружение: 220 нм.
Способ 2С
Фаза: Daicel Chiralcel OJ-H, 5 мкм 250 мм × 20 мм, элюент: изогексан/изоэтанол 1:1, температура: 30°С; поток: 15 мл/мин; УФ-обнаружение: 220 нм.
Аналитическое разделение энантиомеров
Способ 1D
Фаза: Daicel Chiralpak ШС, 5 мкм 250 мм × 20 мм, элюент: изогексан/изопропанол 7/3; температура: 30°С; поток: 20 мл/мин; УФ-обнаружение: 230 нм.
Аналитическое разделение диастереомеров:
Способ 1Е
Фаза: 250 мм × 4.6 мм Daicel Chiralpak AZ-H 5 мкм, элюент: изогексан/этанол 1/1, температура: 30°С, поток: 1.0 мл/мин; УФ-обнаружение: 220 нм
Способ 2Е
Фаза: 250 мм × 4.6 мм Daicel Chiralcel OJ-H 5 мкм, элюент: изогексан/этанол/ТFА/H2O 60%/40%/0.2%/1%, температура: 30°С, поток: 1.0 мл/мин; УФ-обнаружение: 220 нм
Аналитическое разделение энантиомеров
Способ 1F
Фаза: 250 мм × 4.6 мм Daicel Chiralpak AY-H 5 мкм, элюент: изогексан/этанол 9/1, температура: 45°С, поток: 1.0 мл/мин; УФ-обнаружение: 220 нм
Другие замечания
Микроволновое устройство: Biotage Initiator
Исходные вещества и промежуточные соединения:
Общие методики:
Общая методика 1А: Конденсация аминопиразолов при стандартных условиях.
Смесь трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата (1 экв.) и соответствующего аминопиразола (1 экв.) в ацетонитриле перемешивали при 60°С при ВЭЖХ и/или LC-MS определении полного расходования исходного вещества. После выпаривания растворителя под вакуумом неочищенный продукт растворили в 1-метокси-2-пропаноле, и затем фосфат калия (2 экв.) добавили в смесь. Реакционную смесь перемешивали при 110°С до полного расхода промежуточного соединения. Получение описано конкретно для каждого примера.
Общая методика 2А: реакция перекрестного сочетания Сузуки
Сосуд оборудовали магнитной мешалкой и загрузили XPhos предкатализатор (2-дициклогексилфосфино-2',4',6'-триизопропил-1,1'-бифенил) [2-(2'-амино-1,1'-бифенил]палладия(II)метансульфонат (0.1 экв.), бороную кислоту (1.5 экв.) и трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (1 экв.). Сосуд герметизировали с помощью крышки с резьбой и затем добавили дегазированный тетрагидрофуран и дегазированный 1 М водный раствор K3PO4 (3 экв.) посредством шприца. Затем смесь продули аргоном в течение 2 минут, и затем реакционную смесь перемешивали при 80°С в течение 16 ч. После охлаждения до комнатной температуры органическую фазу отделили от смеси, и водную фазу разбавили водой и экстрагировали этилацетатом. Собранные органические фазы выпарили под вакуумом, и неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А).
Общая методика 3А: Получение Примеров 1-7 в Таблице 1:
36 мг (0.1 ммоль) 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты растворили в 0.3 мл DMF и добавили к 1 экв. соответствующего аминового компонента на 96-луночном планшете, а затем раствор 38.5 мг (0.12 ммоль) 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторбората в 0.3 мл DMF и 25.8 мг (0.2 ммоль) DIPEA. Полученную смесь встряхивали при комнатной температуре всю ночь, и затем выпарили до сухости. Остаток обработали с помощью 0.6 мл TFA и встряхивали при комнатной температуре всю ночь. Смесь выпарили до сухости, и неочищенный продукт обработали с помощью 0.6 мл DMF, отфильтровали, и фильтрат очистили посредством LC-MS Способом 3А или Способом 4А. Фракции, содержащие продукт, выпарили в вакууме на центрифужной сушилке, растворили в 0.6 мл DMSO, затем объединили и выпарили снова с получением конечных продуктов.
Общая методика 4А: Получение Примеров 8-30 в Таблице 2
36 мг (0.1 ммоль) 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты растворили в 0.6 мл 1,2-дихлорэтанв, и 17.8 мг (0.12 ммоль) 1,1'-карбонилдиимидазола добавили. Смесь нагрели до 80°С и перемешивали при этой температуре в течение 2 часов, и затем добавили к 1 экв. соответствующего аминового компонента. Реакционную смесь затем встряхивали при 80°С до 60 часов, и затем выпарили до сухости. Остаток обработали с помощью 0.6 мл DMF, отфильтровали, и фильтрат очистили посредством LC-MS Способом 3А или Способом 4А, чтобы выделить защищенное промежуточное соединение. Фракции, содержащие промежуточное соединение, выпарили в вакууме на центрифужной сушке, растворили в 0.6 мл DMSO, объединили и выпарили снова. Остаток растворили в DCM и обработали 0.4 мл (1.6 ммоль) 4 М раствора хлороводорода в 1,4-диоксане. Смесь встряхивали всю ночь и выпарили до сухости с получением конечных продуктов.
Общая методика 5А: Получение Примеров 31-36 в Таблице 3
36 мг (0.1 ммоль) 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты растворили в 0.6 мл 1-метил-2-пирролидона, и 32.4 мг (0.2 ммоль) 1,1'-карбонилдиимидазола добавили. Смесь нагрели до 60°С и перемешивали при этой температуре в течение 2 часов, и затем добавили 1 экв. соответствующего компонента амидоксима. Реакционную смесь затем встряхивали 110°С до периода, длящегося всю ночь, и затем выпарили до сухости. Остаток обработали с помощью 0.6 мл TFA и встряхивали при комнатной температуре всю ночь. Смесь концентрировали в вакууме, и остаток растворили в 0.6 мл DMF, отфильтровали, и фильтрат очистили посредством LC-MS Способом 3А или Способом 4А. Фракции, содержащие продукт, выпарили в вакууме на центрифужной сушке, растворили в 0.6 мл DMSO, затем объединили и выпарили снова с получением конечных продуктов.
Пример 1А
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат
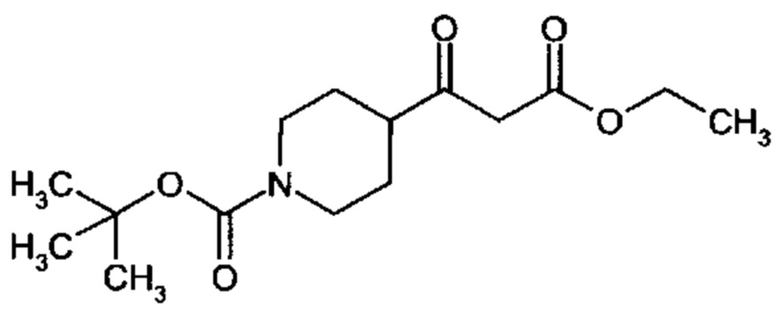
К раствору boc-изонипекотиновой кислоты (150 г, 654 ммоль) в тетрагидрофуране (2100 мл) добавили ди-1Н-имидазол-1-илметанон (159 г, 981 ммоль) и N,N-диметилпиридин-4-амин (40.0 г, 327 ммоль) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 15 ч (Внимание: необходимо контролировать выделение газа). Во второй колбе суспензию 3-этокси-3-оксопропаноата калия (200 г, 1.18 моль) и дихлорида магния (112 г, 1.18 моль) в тетрагидрофуране (2100 мл) нагрели до 50°С в течение 15 ч. Полученную теплую суспензию медленно добавили в первую колбу и интенсивно перемешали. Полученную смесь перемешивали при комнатной температуре в течение 20 ч.
Тетрагидрофуран выпарили в вакууме, воду (1500 мл) и этилацетат (1500 мл) добавили. Смесь охладили до 10°С, и 3N водную HCl добавили до достижения значения pH 1. Органическую фазу отделили, водную фазу экстрагировали этил ацетатом (1500 мл), и объединенные органические фазы промыли с помощью 10% водного NaHCO3 (750 мл) и 10% водного NaCl (750 мл), высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (182 г, 505 ммоль), теоретическая чистота 83%.
LC-MS (Способ 1B): Rt=1.00 мин, MS (ESIPos): m/z=300 [М+Н]+
Пример 2А
Трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат

К раствору 1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты (10 г, 43.6 ммоль) и 2,2-диметил-1,3-диоксан-4,6-диона (6.9 г, 47.98 ммоль) в 100 мл дихлорметана добавили 4-диметиламинопиридин (8.0 г, 65.42 ммоль). После охлаждения смеси до 0°С 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (11.7 г, 61.1 ммоль) добавили по частям, и затем реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь обработали с помощью 50 мл воды, и затем слои разделили. Органический слой экстрагировали с помощью 1М HCl, высушивали над сульфатом магния, отфильтровали и выпарили под вакуумом с получением соединения, указанного в названии (14 г, 86% теоретический выход).
LC-MS (Способ 1B): Rt=1.10 мин, MS (ESIPos): m/z=354 [М-Н]-
Пример 3А
2-Метилизоникотиновая кислота
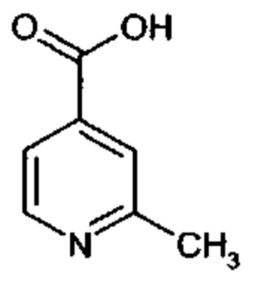
К раствору 2,4-лутидина (280 г, 2.61 моль) в воде (3.0 л) при 80°С добавили перманганат калия (826 г, 5.23 моль) небольшими частями в течение 3 ч. Реакционную смесь перемешивали при 80°С всю ночь. Смесь отфильтровали через силикагель, и затем фильтрат выпарили под вакуумом до достижения объема около 20 мл. Затем раствор обработали с помощью HCl 37% (450 мл) до достижения значения pH 3-4. Раствор хранили 1 ч при 0°С, и затем полученное твердое вещество отфильтровали, промыли водой при 0°С и наконец высушивали под вакуумом всю ночь над пентоксидом фосфора с получения продукта, указанного в названии (130 г, 36% теоретический выход).
LC-MS (Способ 3В): Rt=0.20 мин, MS (ESIPos): m/z=138 [М+Н]+
Пример 4А
Метил 2-метилизоникотинат
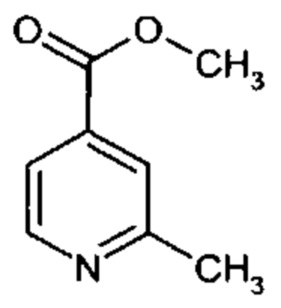
К метанолу (1.54 л) при -10°С добавили медленно тионилхлорид (401 г, 3.37 моль), и раствор перемешивали 10 минут при 0°С. Затем добавили 2-метилизоникотиновую кислоту (154 г, 1.20 моль), и реакционную смесь перемешивали при температуре возврата флегмы всю ночь. Смесь выпарили под вакуумом, затем разбавили в этилацетате и наконец обработали 10% водным раствором гидрокарбоната натрия до достижения значения pH 7. После разделения слоев водную фазу экстрагировали этилацетатом. Все собранные органические фазы высушивали над сульфатом магния, выпарили при высушивании под вакуумом. Неочищенный продукт применяли на следующей стадии без дальнейшей очистки (113.0 г, 48% теоретический выход, 72% чистота).
LC-MS (Способ 1B): Rt=0.43 мин, MS (ESIPos): m/z=152 [М+Н]+
Пример 5А
Метил 2-метилпиперидин-4-карбоксилат
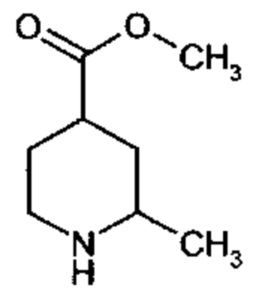
К уксусной кислоте (700 мл) добавили метил 2-метилизоникотинат (79 г, 523 ммоль) и оксид платины (IV) (7.83 г, 34.5 ммоль). Смесь гидрировали в автоклаве при комнатной температуре и 20 бар в течение 2 дней. После этого периода времени оксид платины (IV) (5.00 г, 22.2 ммоль) добавили снова, и смесь гидрировали в течение еще 2 дней при комнатной температуре и 20 бар. После отфильтровывания катализатора фильтрат выпарили под вакуумом с получением соединения, указанного в названии, в количественном выходе.
LC-MS (Способ 2В): Rt=1.15 мин, MS (ESIPos): m/z=158 [М+Н]+
Пример 6А
(-)-Цис-1-бензил 4-метил 2-метилпиперидин-1,4-дикарбоксилат
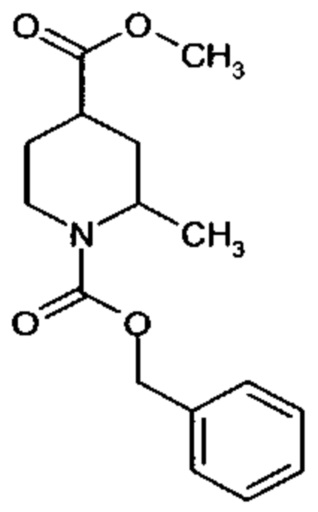
К раствору метил 2-метилпиперидин-4-карбоксилата (138 г, 394 ммоль) в дихлорметане (620 мл) добавили N,N-диизопропилэтиламин (331 г, 2.56 моль). Смесь охладили до 0°С, и затем бензил хлорформиат (80.6 г, 473 ммоль) добавили медленно. Реакционную смесь перемешивали 30 мин при комнатной температуре, и затем добавили воду в смесь. После разделения слоев водную фазу экстрагировали дихлорметаном, и собранные органические слои промыли водой, высушивали над сульфатом магния и выпарили. Неочищенный продукт очистили посредством хроматографии на силикагеле с петролейным эфиром/этилацетатом 8/2, и наконец стереоизомеры разделили посредством хроматографии на хиральной фазе (Способ 1D) с получением соединения, указанного в названии (26.7 г, 23% теоретический выход), в энантиомерно чистой форме.
HPLC (Способ 1F): Rt=14.48 мин
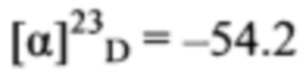 (с 0.9, ацетонитрил)
(с 0.9, ацетонитрил)
Пример 7А
Цис-метил 2-метилпиперидин-4-карбоксилат
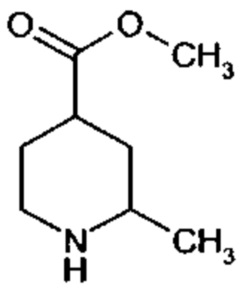
Раствор (-)-цис-1-бензил 4-метил 2-метилпиперидин-1,4-дикарбоксилат (25.00 г, 85.8 ммоль) в этаноле (250 мл) обработали с помощью палладия на угле 10% (1.83 г, 1.72 ммоль) в атмосфере водорода при нормальном давлении и комнатной температуре в течение 16 ч. Смесь отфильтровали через целит, и фильтрат выпарили, и высушивали под вакуумом с получением соединения, указанного в названии (13.95 г, 96% теоретический выход).
LC-MS (Способ 2В): Rt=1.15 мин, MS (ESIPos): m/z=158 [М+Н]+
Пример 8А
Цис-1-трет-бутил 4-метил 2-метилпиперидин-1,4-дикарбоксилат
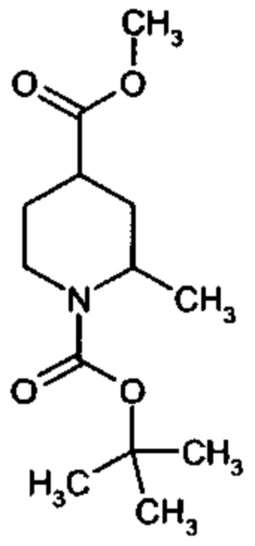
К раствору цис-метил 2-метилпиперидин-4-карбоксилата, полученного в Примере Ошибка! Источник ссылки не найден. (12.95 г, 82.34 ммоль), в тетрагидрофуране (250 мл) в атмосфере аргона добавили ди-трет-бутил дикарбонат (21.58 г, 98.88 ммоль), и реакционную смесь перемешивали при комнатной температуре всю ночь. Смесь выпарили под вакуумом, и неочищенный продукт растворили в этилацетате и обработали 10% водным раствором лимонной кислоты. После разделения слоев органический слой промыли 10% водным раствором лимонной кислоты, насыщенным водным раствором гидрокарбоната натрия и наконец соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили с получением соединения, указанного в названии (27.16 г, 96% теоретический выход, 75% чистота согласно ЯМР). Неочищенный продукт применяли на следующей стадии без дальнейшей очистки.
MS (ESIPos): m/z=258 [M+H]+
Пример 9A
Цис-1-(трет-бутоксикарбонил)-2-метилпиперидин-4-карбоновая кислота
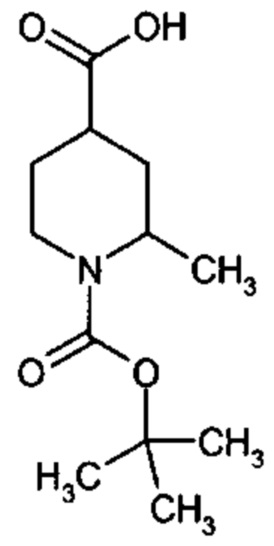
К раствору цис-1-трет-бутил 4-метил 2-метилпиперидин-1,4-дикарбоксилата, полученного в Примере Ошибка! Источник ссылки не найден. (27.16 г, 79.16 ммоль, 75% чистота) в смеси тетрагидрофурана (250 мл) и воды (125 мл) добавили гидроксид лития (10.1 г, 422 ммоль), и смесь перемешивали всю ночь при комнатной температуре. Смесь выпарили под вакуумом и разбавили водой и этилацетатом. После разделения слоев, водную фазу обработали с помощью HCl 37%) до достижения значения pH 4, и затем экстрагировали этилацетатом, высушивали над сульфатом магния, отфильтровали и выпарили под вакуумом с получением соединения, указанного в названии (18.4 г, 95% теоретический выход).
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.27 (bs, 1H), 4.07-3.99 (m, 1H), 3.67-3-61 (m, 1H), 3.06-2.98 (m, 1H), 1.89-1.76 (m, 4H), 1.62-1.53 (m, 1H), 1.39 (s, 9H), 1.04 (d, 3H).
Пример 10A
(-)-Цис-трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]-2-метилпиперидин-1-карбоксилат
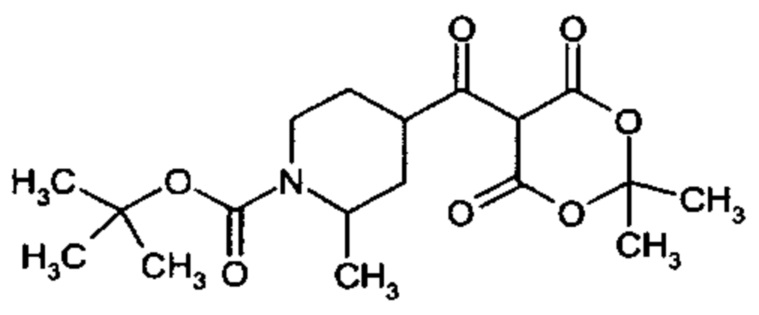
К раствору цис-1-(трет-бутоксикарбонил)-2-метилпиперидин-4-карбоновой кислоты, полученной в Примере Ошибка! Источник ссылки не найден. (17.3 г, 71.0 ммоль), и 2,2-диметил-1,3-диоксан-4,6-диона (11.3 г, 78.0 ммоль) в дихлорметане (190 мл) добавили 4-диметиламинопиридин (13.1 г, 107 ммоль). После охлаждения смеси при 0°С, 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (19.13 г, 100.0 ммоль) добавили по частям, и затем реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь обработали водой, и затем слои разделили. Органический слой промыли 1М HCl, высушивали над сульфатом магния, отфильтровали и выпарили под вакуумом с получением соединения, указанного в названии (20.8 г, 79% теоретический выход).
LC-MS (Способ 1B): Rt=1.16 мин, MS (ESIPos): m/z=370 [М+Н]+
[α]20=-71.36 (с. 0. 625, метанол) WL=589 нм
Пример 11А
Трет-бутил 4-(5-оксо-3-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
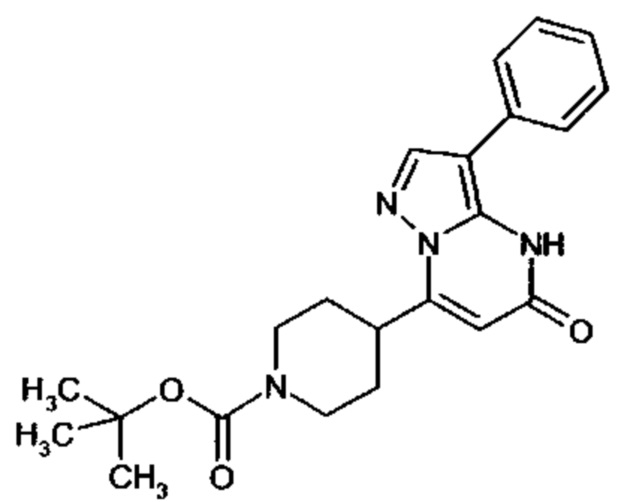
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (450 мг, 81% чистота, 1.22 ммоль), 4-фенил-1Н-пиразол-3-амин (194 мг, 1.22 ммоль, 1 экв.) и фосфат калия (517 мг, 2.43 ммоль, 2 экв.) суспендировали в диоксане (4.3 мл) в сосуде с воздействием микроволн, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 150°С в течение 1 ч. После охлаждения до комнатной температуры, смесь выпарили в вакууме, разбавили водой (20 мл) и экстрагировали этилацетатом (2×20 мл). Объединенные органические слои высушивали сульфатом натрия, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, оставшуюся воду экстрагировали этилацетатом, органический слой высушивали сульфатом натрия, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (13.5 мг, 3% теоретический выход).
LC-MS (Способ 1B): Rt=1.10 мин, MS (ESINeg): m/z=393 [М-Н]-
Пример 12А
Трет-бутил 4-[7-оксо-3-(пиридин-2-ил)-4,7-дигидропиразоло[1,5-а]пиримидин-5-ил]пиперидин-1-карбоксилат
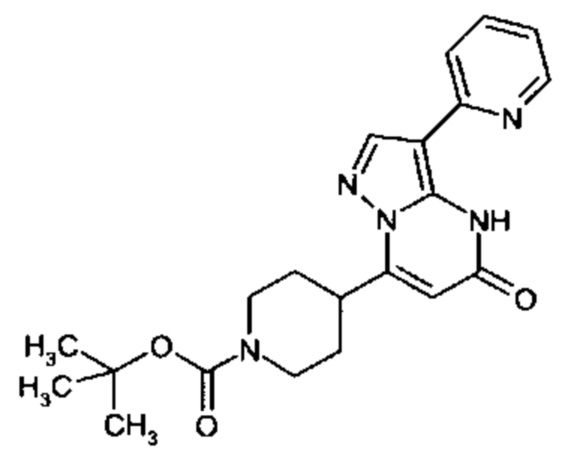
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (2.00 г, 6.68 ммоль, 1.5 экв.), 4-(пиридин-2-ил)-1Н-пиразол-3-амин (713 мг, 4.45 ммоль, 1 экв.) и фосфат калия (1.89 г, 8.91 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (20 мл) в двух сосудах, обрабатываемых микроволнами, объемом 20 мл. Сосуды закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, суспензию разбавили водой (20 мл), нейтрализовали (pH 6) посредством добавления 1Н HCl, и экстрагировали этил ацетатом (2×50 мл). Объединенные органические фазы высушивали над сульфатом магния, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта концентрировали в вакууме с удалением ацетонитрила. Полученную суспензию отфильтровали, остаток промыли водой (2 мл) и высушивали в течение 16 ч при 50°С в вакууме с получением соединения, указанного в названии (240 мг, 14% теоретический выход).
LC-MS (Способ 1B): Rt=1.08 мин, MS (ESIPos): m/z=396 [М+Н]+
Пример 13А
Трет-бутил 4-[2-(метоксиметил)-3-(4-метоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
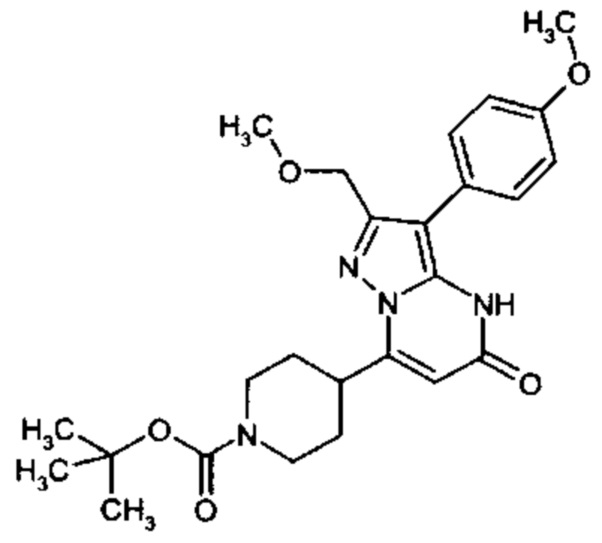
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (350 мг, 1.00 ммоль), 5-(метоксиметил)-4-(4-метоксифенил)-1Н-пиразол-3-амин (351 мг, 1.50 ммоль, 1.5 экв.) и фосфат калия (425 мг, 2.00 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (3 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, суспензию разбавили водой (5 мл), нейтрализовали (pH 6) посредством добавления 1Н HCl, и экстрагировали этилацетатом (2×20 мл). Объединенные органические фазы высушивали над сульфатом магния, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до значения pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, полученную суспензию отфильтровали, остаток промыли водой (2 мл) и высушивали в течение 16 ч при 50°С в вакууме с получением соединения, указанного в названии (86.6 мг, 18% теоретический выход).
LC-MS (Способ 1B): Rt=1.09 мин, MS (ESIPos): m/z=469 [М+Н]+
Пример 14А
Трет-бутил 4-[3-(4-фторфенил)-7-оксо-4,7-дигидропиразоло[1,5-а]пиримидин-5-ил]пиперидин-1-карбоксилат
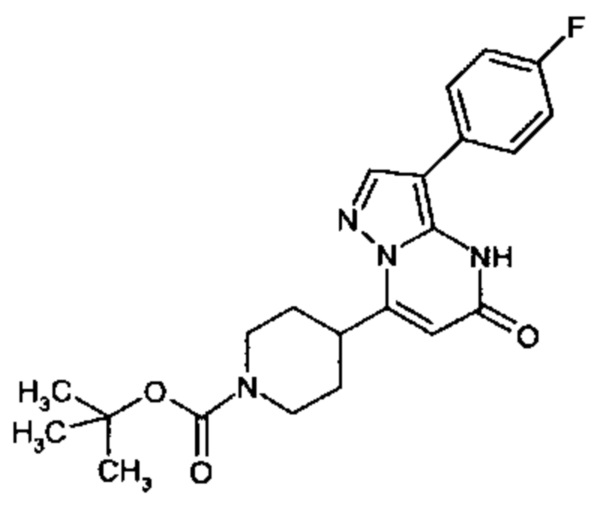
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль, 1.5 экв.), 4-(4-фторфенил)-1Н-пиразол-3-амин (395 мг, 2.27 ммоль, 1 экв.) и фосфат калия (945 мг, 4.45 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, суспензию разбавили с помощью 20 мл дихлорметан/метанол (4:1), отфильтровали через короткий слой силикагеля с помощью 100 мл дихлорметан/метанол (4:1) и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта выпарили в вакууме с удалением ацетонитрила, оставшуюся воду экстрагировали этилацетатом, органический слой высушивали с помощью сульфата магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (64 мг, 90% чистота, 6% теоретический выход).
LC-MS (Способ 1B): Rt=1.11 мин, MS (ESIPos): m/z=413 [М+Н]+
Пример 15А
Трет-бутил 4-[7-оксо-3-(пиридин-3-ил)-4,7-дигидропиразоло[1,5-а]пиримидин-5-ил]пиперидин-1-карбоксилат

Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (561 мг, 1.87 ммоль, 1.5 экв.), 4-(пиридин-3-ил)-1Н-пиразол-3-амин (200 мг, 1.25 ммоль, 1 экв.) и фосфат калия (530 мг, 2.50 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (4 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, суспензию разбавили с помощью 20 мл дихлорметан/метанол (4:1), отфильтровали через короткий слой силикагеля с помощью 100 мл дихлорметан/метанол (4:1) и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта выпарили в вакууме с удалением ацетонитрила и лиофилизовали с получением соединения, указанного в названии (11.3 мг, 2% теоретический выход).
LC-MS (Способ 1B): Rt=0.79 мин, MS (ESIPos): m/z=396 [М+Н]+
Пример 16А
Трет-бутил 4-[3-(2-метоксифенил)-2-метил-7-оксо-4,7-дигидропиразоло[1,5-а]пиримидин-5-ил]пиперидин-1-карбоксилат
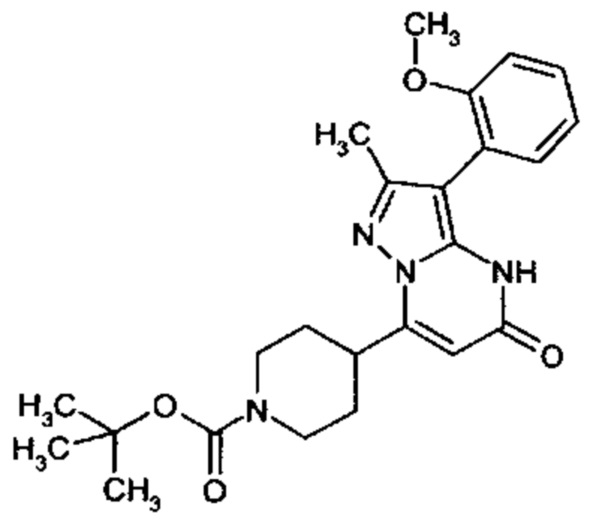
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (221 мг, 0.74 ммоль, 1.5 экв.), 4-(2-метоксифенил)-5-метил-1Н-пиразол-3-амин (100 мг, 0.49 ммоль, 1 экв.) и фосфат калия (209 мг, 0.98 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (2 мл) в сосуде, объемом 5 мл, обрабатываемом микроволнами. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили в вакууме, разбавили водой (5 мл) и экстрагировали этилацетатом (2×10 мл). Объединенные органические слои высушивали сульфатом натрия, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до значения pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, полученную суспензию отфильтровали, остаток промыли водой (0.5 мл) и высушивали в течение 16 ч при 50°С в вакууме с получением соединения, указанного в названии (4.8 мг, 2% теоретический выход).
LC-MS (Способ 1B): Rt=1.12 мин, MS (ESIPos): m/z=439 [М+Н]+
Пример 17А
Трет-бутил 4-{2-метил-5-оксо-3-[3-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (186 мг, 0.62 ммоль, 1.5 экв.), 3-метил-4-[3-(трифторметил)фенил]-1Н-пиразол-5-амин (100 мг, 0.41 ммоль, 1 экв.) и фосфат калия (176 мг, 0.83 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили в вакууме, разбавили водой (5 мл) и экстрагировали этилацетатом (2×10 мл). Объединенные органические слои высушивали сульфатом натрия, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до значения pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, полученную суспензию отфильтровали, остаток промыли водой (0.5 мл) и высушивали в течение 16 ч при 50°С в вакууме с получением соединения, указанного в названии (0.9 мг, 1% теоретический выход).
1Н-ЯМР (400 МГц, метанол-d4): δ=7.7-7.63 (m, 4Н), 5.87 (s, 1Н), 4.26 (d, 2Н), 3.52 (t-подобный, 1H), 3.05-2.89 (m, 2Н), 3.23 (s, 3Н), 2.13 (d, 2Н), 1.64 (dq-подобный, 2Н), 1.48 (s, 9Н), 1 обменный протон не виден.
Пример 18А
Трет-бутил 4-(3-циано-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
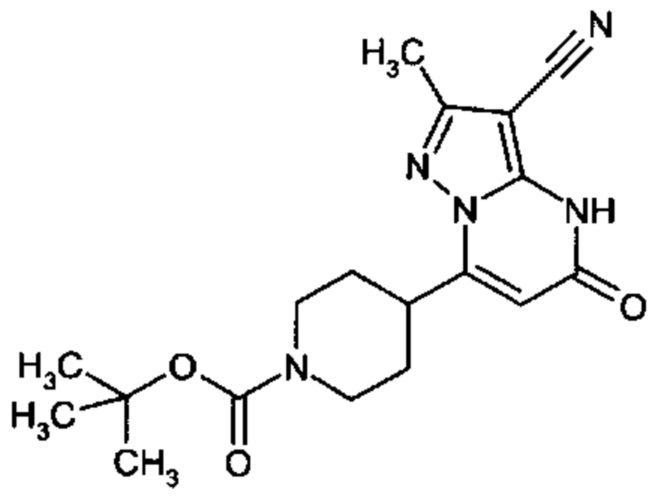
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль, 1.5 экв.), 3-амино-5-метил-1Н-пиразол-4-карбонитрил (272 мг, 2.27 ммоль, 1 экв.) и фосфат калия (945 мг, 4.45 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (6.5 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили в вакууме, разбавили водой (5 мл), довели до значения pH 7 с помощью 1Н HCl и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои высушивали сульфатом натрия, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до значения pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, полученную суспензию отфильтровали, остаток промыли водой (0.5 мл) и высушивали в течение 16 ч при 50°С в вакууме с получением соединения, указанного в названии (62.2 мг, 8% теоретический выход).
LC-MS (Способ 1B): Rt=0.96 мин, MS (ESINeg): m/z=356 [М-Н]-
Пример 19А
Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
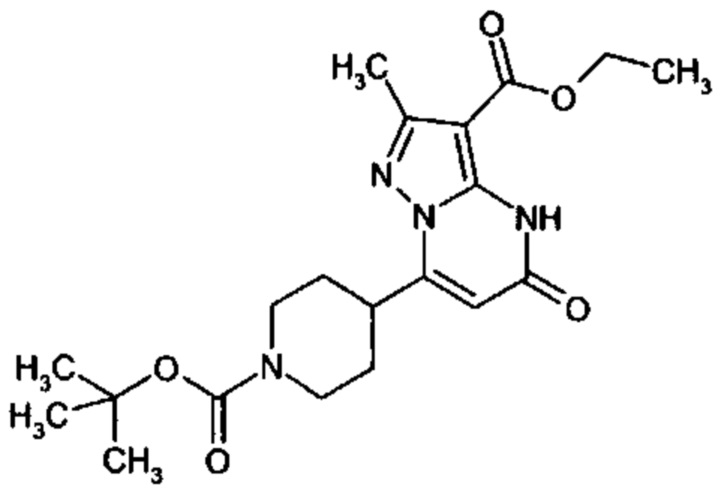
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль, 1.5 экв.), этил 5-амино-3-метил-1Н-пиразол-4-карбоксилат (377 мг, 2.27 ммоль, 1 экв.) и фосфат калия (945 мг, 4.45 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили в вакууме, разбавили водой (5 мл) и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои высушивали сульфатом натрия, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до значения pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, полученный водный раствор экстрагировали этилацетатом (2×20 мл), высушивали над сульфатом натрия, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (31.1 мг, 3% теоретический выход).
LC-MS (Способ 1B): Rt=1.11 мин, MS (ESINeg): m/z=403 [М-Н]-
Пример 20А
Трет-бутил 4-(3-циано-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
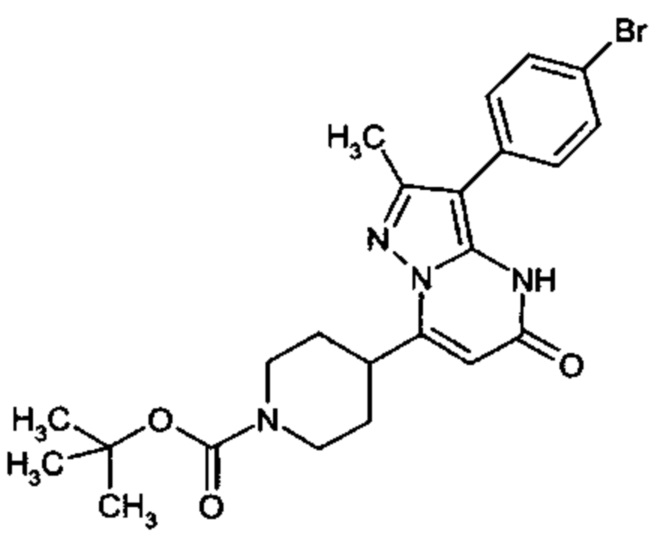
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль, 1.5 экв.), 4-(4-бромфенил)-3-метил-1Н-пиразол-5-амин (585 мг, 2.27 ммоль, 1 экв.) и фосфат калия (945 мг, 4.45 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили в вакууме, разбавили водой (5 мл) и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои высушивали сульфатом натрия, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до значения pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, полученную суспензию отфильтровали, остаток промыли водой (0.5 мл) и высушивали в течение 16 ч при 50°С в вакууме с получением соединения, указанного в названии (180 мг, 16% теоретический выход).
LC-MS (Способ 1B): Rt=1.23 мин, MS (ESIPos): m/z=487 [М+Н]+
Пример 21А
Трет-бутил 4-[2-(метоксиметил)-5-оксо-3-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
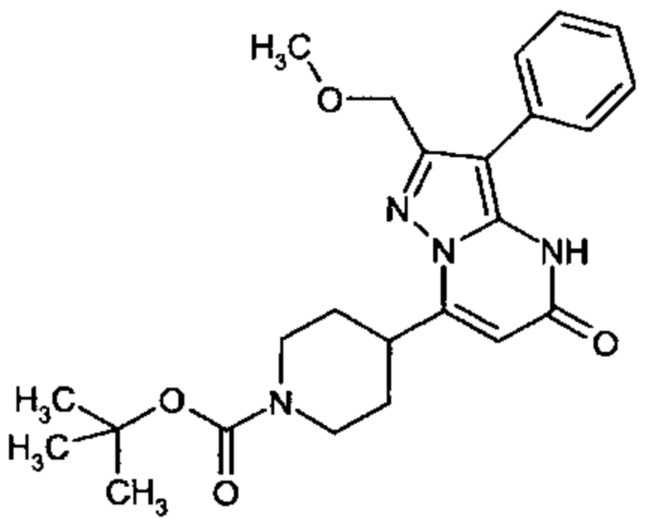
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль, 1.5 экв.), 5-(метоксиметил)-4-фенил-1Н-пиразол-3-амин (476 мг, 2.27 ммоль, 1 экв.) и фосфат калия (945 мг, 4.45 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили в вакууме, разбавили водой (5 мл) и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои высушивали сульфатом натрия, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до значения pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, полученную суспензию отфильтровали, остаток промыли водой (0.5 мл) и высушивали в течение 16 ч при 50°С в вакууме с получением соединения, указанного в названии (303 мг, 30% теоретический выход).
LC-MS (Способ 1B): Rt=1.09 мин, MS (ESIPos): m/z=439 [М+Н]+
Пример 22А
Трет-бутил 4-{3-[3-(бензилокси)фенил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (950 мг, 3.17 ммоль, 1.5 экв.), 4-[3-(бензилокси)фенил]-1Н-пиразол-3-амин (591 мг, 95% чистота, 2.12 ммоль, 1 экв.) и фосфат калия (898 мг, 4.23 ммоль, 2 экв.) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили в вакууме, разбавили водой (5 мл) и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои высушивали сульфатом натрия, отфильтровали и выпарили в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта довели до значения pH 7 путем добавления водного гидроксида аммония. Ацетонитрил выпарили в вакууме, полученную суспензию отфильтровали, остаток промыли водой (0.5 мл) и высушивали в течение 16 ч при 50°С в вакууме с получением соединения, указанного в названии (103 мг, 6% теоретический выход).
LC-MS (Способ 1B): Rt=1.29 мин, MS (ESIPos): m/z=501 [М+Н]+
Пример 23А
Трет-бутил 4-{2-метил-5-оксо-3-[3-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
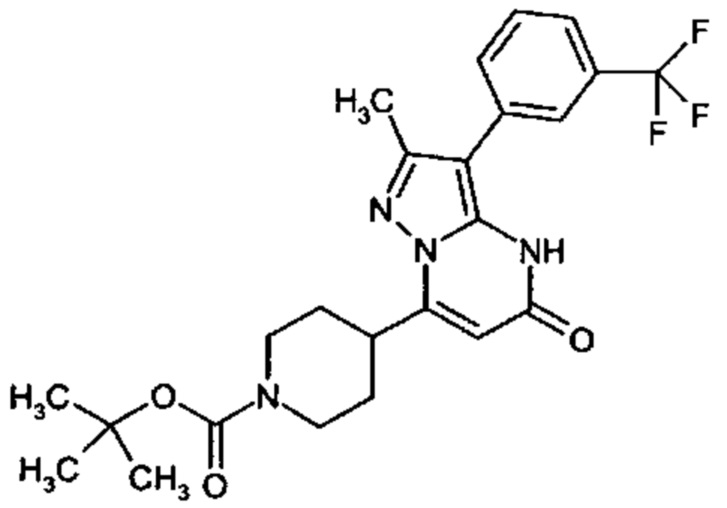
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (2.41 г, 6.68 ммоль), 3-метил-4-[3-(трифторметил)фенил]-1Н-пиразол-5-амин (1.07 г, 4.45 ммоль) и фосфат калия (1.89 г, 8.91 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили, и остаток разбавили в воде и этилацетате. Слои разделили, и водный слой экстрагировали этилацетатом. Собранные органические фазы высушивали над сульфатом магния, отфильтровали и выпарили. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью водного гидроксида аммония. После выпаривания ацетонитрила твердое вещество белого цвета образовалось в водной фазе, которое отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (212 мг, 10% теоретический выход).
LC-MS (Способ 1B): Rt=1.26 мин, MS (ESIPos): m/z=477 [М+Н]+
Пример 24А
Трет-бутил 4-(3-карбамоил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
LC-MS (Способ 1B): Rt=0.77 мин, MS (ESIPos): m/z=362 [М+Н]+
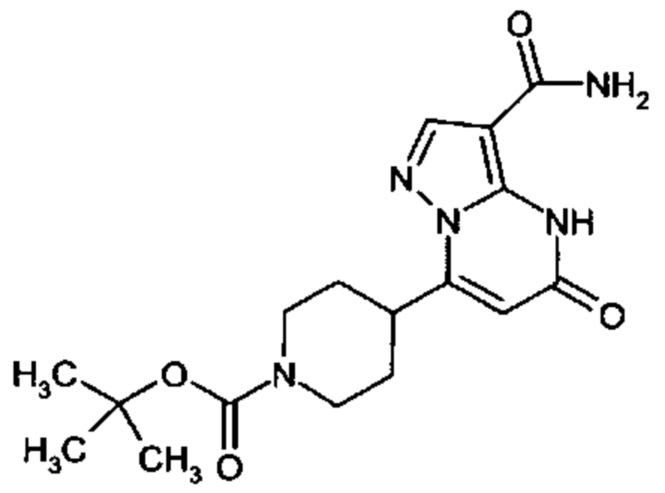
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль), 3-амино-1Н-пиразол-4-карбоксамид (281 мг, 2.23 ммоль) и фосфат калия (945 мг, 4.45 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь разбавили водой, нейтрализовали (pH 5) посредством добавления 1Н HCl, и экстрагировали этилацетатом. Объединенные органические фазы промыли водой и соляным раствором, высушивали над сульфатом магния, отфильтровали и выпарили. В ходе выпаривания выпало в осадок твердое вещество белого цвета, которое отфильтровали. Полученный фильтрат выпарили под вакуумом. Остаток перемешивали в смеси 4 мл ацетонитрила и 1 мл диметилсульфоксида. Полученный осадок отфильтровали, промыли ацетонитрилом и высушивали в течение 2 ч при 50°C с получением соединения, указанного в названии. Фильтрат очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). Объединенные фракции продукта выпарили под вакуумом и лиофилизировали всю ночь с получением соединения, указанного в названии (64 мг, 8% теоретический выход).
LC-MS (Способ 1В): Rt=0.77 мин, MS (ESIPos): m/z=362 [M+H]+
Пример 25А
Трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
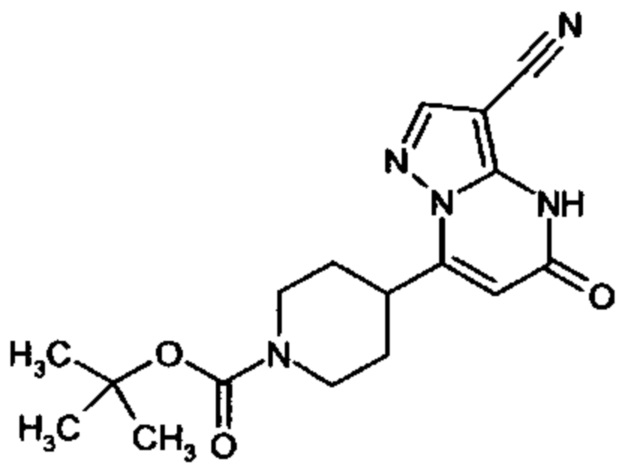
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль), 3-амино-1Н-пиразол-4-карбонитрил (241 мг, 2.23 ммоль) и фосфат калия (945 мг, 4.45 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь разбавили водой, нейтрализовали (pH 6) посредством добавления 1Н HCl и экстрагировали этилацетатом. Объединенные органические фазы промыли водой и соляным раствором, высушивали над сульфатом магния, отфильтровали и выпарили. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое отфильтровали и высушивали всю ночь под вакуумом при 60°C с получением соединения, указанного в названии (110 мг, 14% теоретический выход).
LC-MS (Способ 1B): Rt=0.89 мин, MS (ESINeg): m/z=342 [М-Н]-
Пример 26А
Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
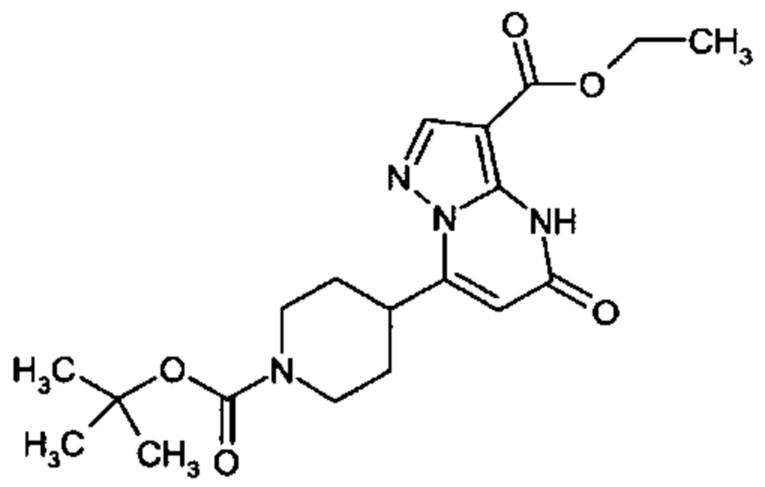
Соединение, указанное в названии, получили согласно общей методике 1А, исходя из 1.31 г (8.44 ммоль) этил 5-амино-1Н-пиразол-4-карбоксилата и 3.0 г (8.44 ммоль) трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата.
Получение: смесь разбавили водой и обработали 1Н HCl до достижения значения pH 5-6. Полученный осадок отфильтровали, промыли водой и высушивали под вакуумом при 60°C с получением соединения, указанного в названии (1.83 г, 54% теоретический выход).
LC-MS (Способ 1B): Rt=1.03 мин, MS (ESIPos): m/z=391 [М+Н]+
Пример 27А
7-[1-(трет-Бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота
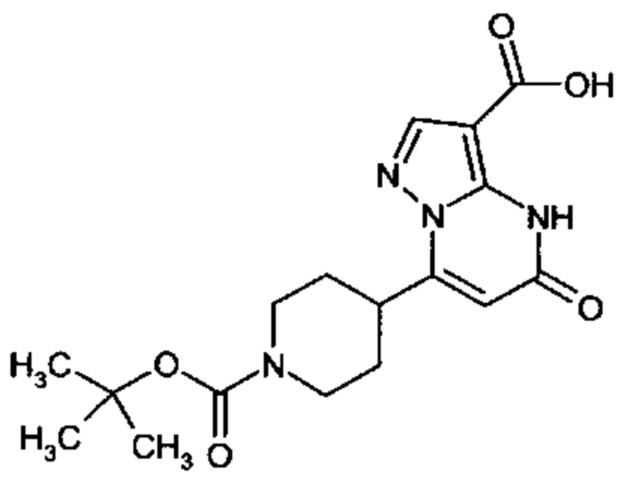
К раствору этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (82 мг, 0.21 ммоль) в смеси 2 мл тетрагидрофурана и 1 мл воды добавили гидроксид лития (50 мг, 2.10 ммоль), и реакционную смесь перемешивали при 60°С в течение 16 ч. После этого 82 мг гидроксида лития добавили в смеси и далее перемешивали при 80°С в течение 10 ч. После охлаждения до комнатной температуры, смесь разбавили водой и нейтрализовали (pH 6) посредством добавления 1Н HCl. Полученное твердое вещество белого цвета отфильтровали и высушивали всю ночь под вакуумом с получением соединения, указанного в названии (60 мг, 78% теоретический выход).
LC-MS (Способ 1B): Rt=0.84 мин, MS (ESINeg): m/z=361 [М-Н]-
Пример 28А
Бензил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
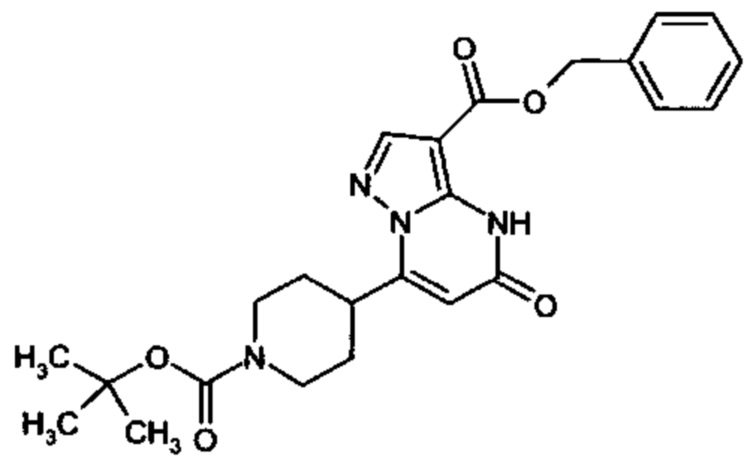
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.0 г, 3.34 ммоль), бензил 5-амино-1Н-пиразол-4-карбоксилат (484 мг, 2.22 ммоль) и фосфат калия (945 мг, 4.45 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь разбавили водой и нейтрализовали (pH 6) посредством добавления 1Н HCl. Полученный осадок отфильтровали, и затем слои отделили от фильтрата, и водный слой экстрагировали этилацетатом. Собранные органические фракции промыли водой, соляным раствором, высушивали над сульфатом магния, отфильтровали и выпарили под вакуумом. Остаток очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали всю ночь под вакуумом при 60°C с получением соединения, указанного в названии (44 мг, 4% теоретический выход).
LC-MS (Способ 1B): Rt=1.16 мин, MS (ESINeg): m/z=451 [М-Н]-
Пример 29 А
Трет-бутил 4-[3-(этилкарбамоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
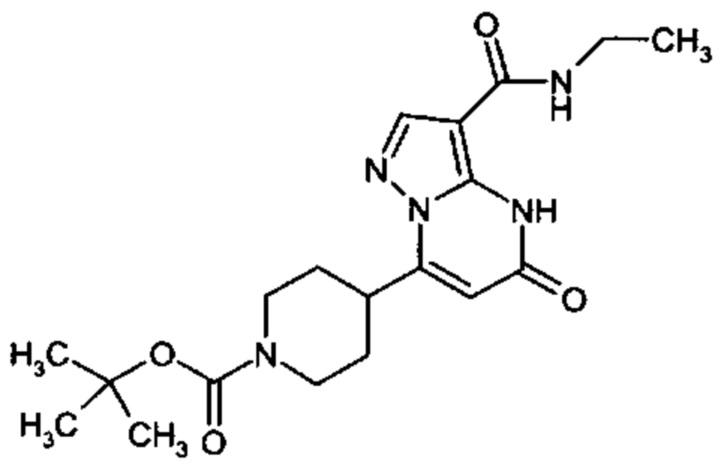
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (50 мг, 0.14 ммоль), 1-(3-Диметиламинопропил)-3-этилкарбодиимид гидрохлорид (34 мг, 0.18 ммоль) и 1-гидрокси-1Н-бензотриазол гидрат (27 мг, 0.18 ммоль) растворили в 1 мл DMF. Смесь перемешивали в течение 10 минут при комнатной температуре, и затем этил амин 2М в ТГФ (7.4 мг, 0.17 ммоль) добавили. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали всю ночь под вакуумом с получением соединения, указанного в названии (11 мг, 54% теоретический выход).
LC-MS (Способ 1B): Rt=0.87 мин, MS (ESIPos): m/z=390 [M+H]+
Пример 30A
Трет-бутил 4-[3-(4-хлорфенил)-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
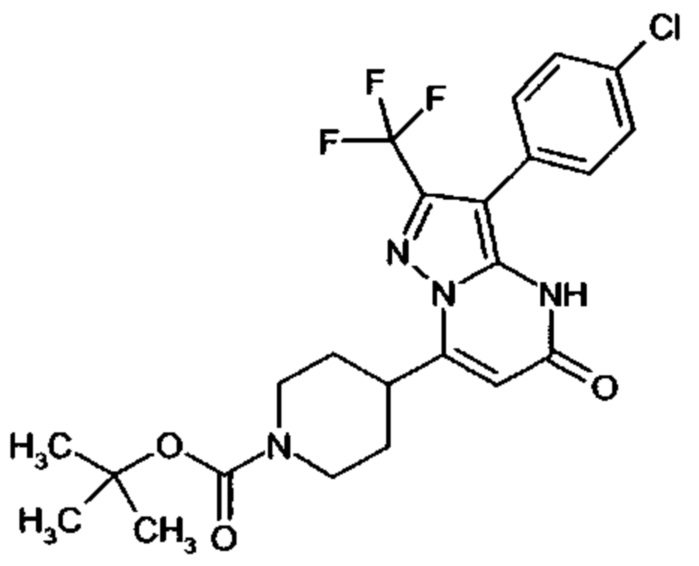
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.03 г, 2.87 ммоль), 4-(4-хлорфенил)-3-(трифторметил)-1Н-пиразол-5-амин (501 мг, 1.95 ммоль) и фосфат калия (813 мг, 3.83 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь выпарили под вакуумом, и остаток разбавили в воде и экстрагировали этилацетатом. Слои разделили, и водный слой экстрагировали этилацетатом. Собранные органические фракции промыли водой и соляным раствором, высушивали над сульфатом магния, отфильтровали и выпарили под вакуумом. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью водного гидроксида аммония, и ацетонитрил выпарили под вакуумом. Полученное твердое вещество в водной фазе отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (92 мг, 7% теоретический выход).
LC-MS (Способ 1B): Rt=1.32 мин, MS (ESINeg): m/z=495 [М-Н]-
Пример 31А
Трет-бутил 4-[3-(изобутилкарбамоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 0.28 ммоль), 1-(3-Диметиламинопропил)-3-этилкарбодиимидгидрохлорид (158 мг, 0.83 ммоль) и 1-гидрокси-1Н-бензотриазол гидрат (126 мг, 0.83 ммоль) растворили в 1 мл DMF. Смесь перемешивали в течение 10 минут при комнатной температуре, и затем изобутиламин (61 мг, 0.83 ммоль) добавили. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали всю ночь под вакуумом с получением соединения, указанного в названии (40 мг, 35% теоретический выход).
LC-MS (Способ 1B): Rt=1.01 мин, MS (ESIPos): m/z=418 [М+Н]+
Пример 32А
Трет-бутил 4-[3-(бензилкарбамоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 0.28 ммоль), 1-(3-Диметиламинопропил)-3-этилкарбодиимидгидрохлорид (158 мг, 0.83 ммоль) и 1-гидрокси-1Н-бензотриазол гидрат (126 мг, 0.83 ммоль) растворили в 1 мл DMF. Смесь перемешивали в течение 10 минут при комнатной температуре, и затем бензиламин (89 мг, 0.83 ммоль) добавили. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали всю ночь под вакуумом с получением соединения, указанного в названии (48 мг, 38% теоретический выход).
LC-MS (Способ 1B): Rt=1.03 мин, MS (ESIPos): m/z=452 [М+Н]+
Пример 33А
Трет-бутил 4-[3-(морфолин-4-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 0.28 ммоль), 1-(3-Диметиламинопропил)-3-этилкарбодиимидгидрохлорид (158 мг, 0.83 ммоль) и 1-гидрокси-1Н-бензотриазол гидрат (126 мг, 0.83 ммоль) растворили в 1 мл DMF. Смесь перемешивали в течение 10 минут при комнатной температуре, и затем морфолин (72 мг, 0.83 ммоль) и N,N-диизопропилэтиламин (72 мг, 0.55 ммоль) добавили. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали всю ночь под вакуумом с получением соединения, указанного в названии (31 мг, 26% теоретический выход).
LC-MS (Способ 1B): Rt=0.87 мин, MS (ESIPos): m/z=432 [М+Н]+
Пример 34А
Трет-бутил 4-[5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.0 г, около 2.77 ммоль), 3-(трифторметил)-1Н-пиразол-5-амин (0.28 г, 1.85 ммоль) и фосфат калия (0.79 г, 3.70 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, растворитель выпарили, и остаток обработали водой и этилацетатом. После разделения слоев водную фазу нейтрализовали путем добавления 4Н HCl и экстрагировали этилацетатом. Собранные органические слои высушивали над сульфатом магния, отфильтровали и выпарили. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью 33% раствора аммиака, и затем ацетонитрил выпарили. Водную фазу экстрагировали этилацетатом, и собранные органические фракции высушивали над сульфатом натрия, отфильтровали и выпарили под вакуумом с получением соединения, указанного в названии (132 мг, 19% теоретический выход).
LC-MS (Способ 1B): Rt=1.06 мин, MS (ESIPos): m/z=387 [М+Н]+
Пример 35А
Трет-бутил 4-[5-оксо-2-(2-тиенил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
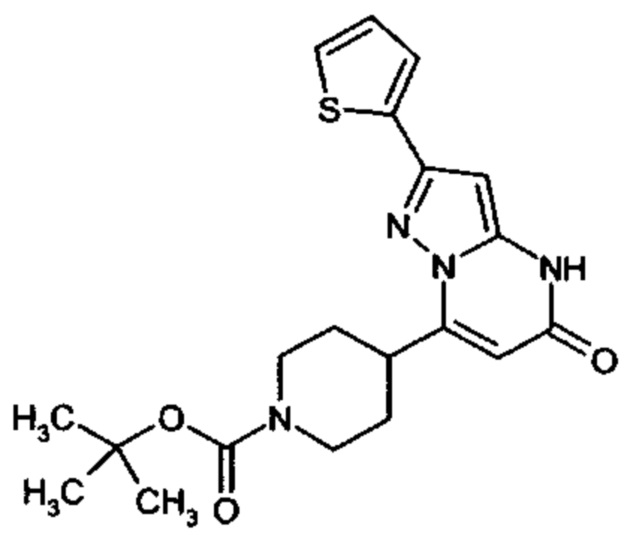
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль), 3-(2-тиенил)-1Н-пиразол-5-амин (0.37 г, 2.23 ммоль) и фосфат калия (945 мг, 4.45 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь разбавили водой и нейтрализовали (pH 6) посредством добавления 1Н HCl. Полученный осадок отфильтровали, и затем слои отделили от фильтрата. Водный слой экстрагировали этилацетатом, и собранные органические слои промыли водой и соляным раствором, высушивали над сульфатом магния, отфильтровали и выпарили под вакуумом. Неочищенный продукт перемешивали в 4 мл смеси ацетонитрил/диметилсульфоксид 3/1. Полученное твердое вещество отфильтровали, промыли ацетонитрилом и высушивали 2 ч под вакуумом при 60°C с получением соединения, указанного в названии (53 мг, 6% теоретический выход).
LC-MS (Способ 1B): Rt=1.08 мин, MS (ESIPos): m/z=401 [М+Н]+
Пример 36А
Трет-бутил 4-(2-циклопропил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
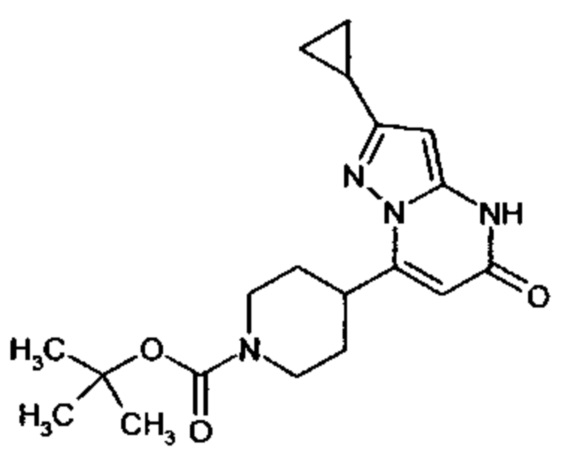
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль), 3-циклопропил-1Н-пиразол-5-амин (0.27 г, 2.23 ммоль) и фосфат калия (945 мг, 4.45 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь разбавили водой и нейтрализовали (pH 6) посредством добавления 1Н HCl. Полученный осадок отфильтровали, и затем фильтрат экстрагировали этилацетатом. Собранные органические слои промыли водой и соляным раствором, высушивали над сульфатом магния, отфильтровали и выпарили под вакуумом. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). Перед полным выпариванием объединенных фракций продукта водную фазу экстрагировали этилацетатом, и собранные органические слои высушивали над сульфатом магния, отфильтровали, выпарили и высушивали под вакуумом с получением соединения, указанного в названии (87 мг, 11% теоретический выход).
LC-MS (Способ 1B): Rt=0.99 мин, MS (ESIPos): m/z=359 [М+Н]+
Пример 37А
Трет-бутил 4-[2-(4-фторфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
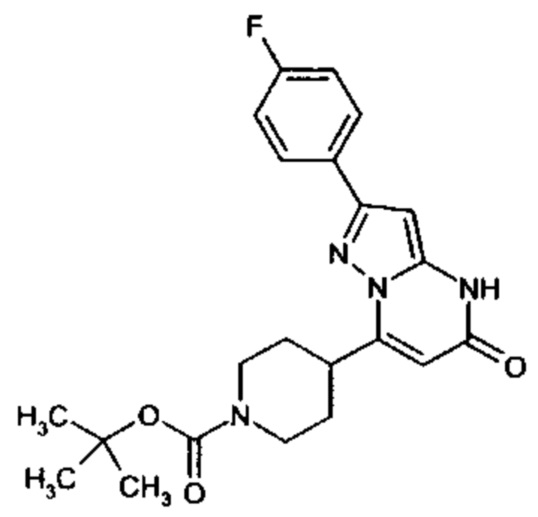
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1.00 г, 3.34 ммоль), 3-(4-фторфенил)-1Н-пиразол-5-амин (0.395 г, 2.23 ммоль) и фосфат калия (945 мг, 4.45 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, смесь разбавили водой, нейтрализовали (pH 6) посредством добавления 1Н HCl, и экстрагировали этилацетатом. Водную фазу выпарили под вакуумом, и неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали 2 ч под вакуумом при 60°C с получением соединения, указанного в названии (119 мг, 13% теоретический выход).
LC-MS (Способ 1B): Rt=1.12 мин, MS (ESIPos): m/z=413 [М+Н]+
Пример 38А
Метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоксилат
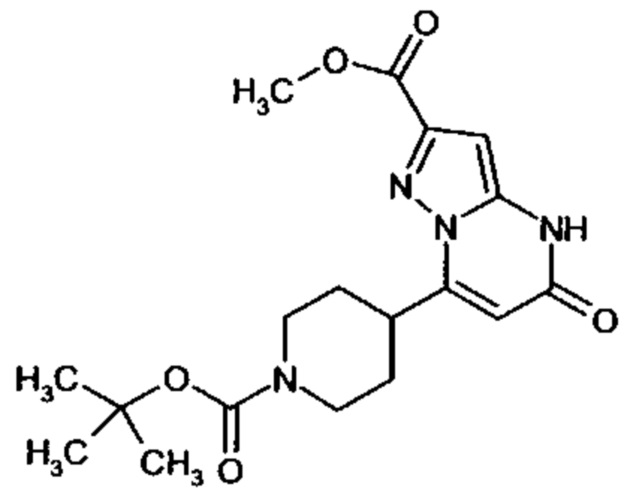
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (0.655 мг, около 1.82 ммоль), метил 5-амино-1Н-пиразол-3-карбоксилат гидрохлорид (0.215 мг, 1.21 ммоль) и фосфат калия (0.514 г, 2.42 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, растворитель выпарили, и остаток обработали водой и этилацетатом. После разделения слоев водную фазу нейтрализовали путем добавления 4Н HCl и экстрагировали этилацетатом. Собранные органические слои высушивали над сульфатом натрия, отфильтровали и выпарили. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью 33% раствора аммиака, и затем ацетонитрил выпарили. Полученное твердое вещество в водной фазе отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (84 мг, 18% теоретический выход).
LC-MS (Способ 1B): Rt=0.89 мин, MS (ESIPos): m/z=377 [М+Н]+
Пример 39А
Трет-бутил 4-(3-бром-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
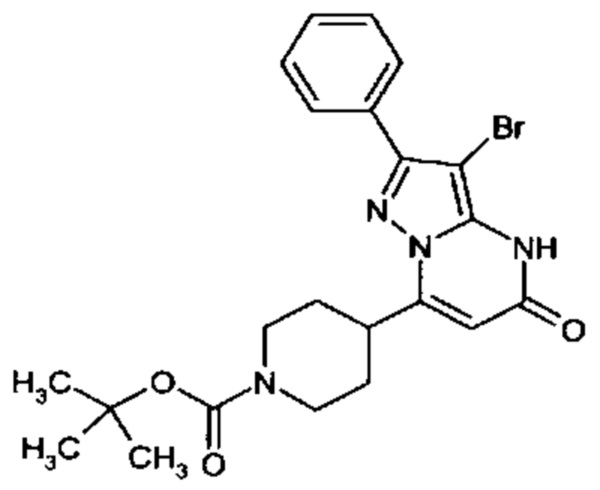
Соединение, указанное в названии, получили согласно общей методике 1А, исходя из 200 мг (0.84 ммоль) 4-бром-3-фенил-1Н-пиразол-5-амина и 300 мг (0.84 ммоль) трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата.
Получение: смесь разбавили водой, нейтрализовали (pH 5-6) путем добавления 1Н HCl и экстрагировали этилацетатом. Собранные органические фракции промыли водой и соляным раствором, высушивали над сульфатом натрия и концентрировали под вакуумом. Остаток перемешивали в 10 мл трет-бутилметилового простого эфира, и полученное твердое вещество отфильтровали, промыли трет-бутилметиловым простым эфиром и высушивали под вакуумом в течение 2 ч при 60°C с получением соединения, указанного в названии (76 мг, 18% теоретический выход).
LC-MS (Способ 1B): Rt=1.22 мин, MS (ESIPos): m/z=473 [М+Н]+
Пример 40А
Трет-бутил 4-(2-оксо-1,7,8,9-тетрагидро-2H-циклопента[3,4]пиразоло[1,5-а]пиримидин-4-ил)пиперидин-1-карбоксилат
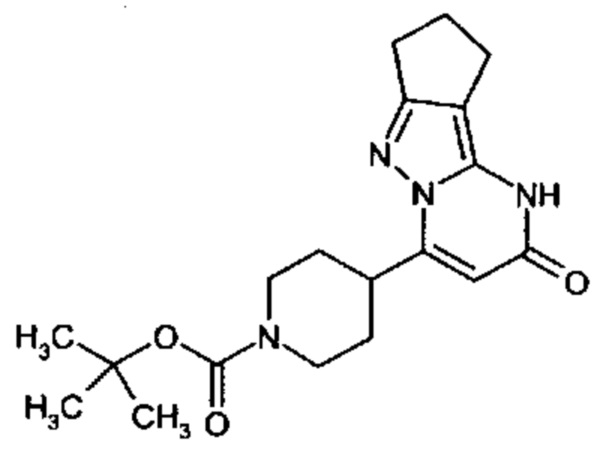
Трет-бутил 4-(3-этокси-3-оксопропаноил)пиперидин-1-карбоксилат (1 г, 2.77 ммоль), 2,4,5,6-тетрагидроциклопента[с]пиразол-3-амин (0.228 мг, 1.85 ммоль) и фосфат калия (0.785 мг, 3.70 ммоль) суспендировали в 1-метокси-2-пропаноле (10 мл) в сосуде, обрабатываемом микроволнами, объемом 20 мл. Сосуд закрыли, и смесь нагрели при обработке микроволнами до 180°С в течение 15 мин. После охлаждения до комнатной температуры, растворитель выпарили, и остаток обработали водой и этилацетатом. После разделения слоев водную фазу нейтрализовали путем добавления 4Н HCl и экстрагировали этилацетатом. Собранные органические слои высушивали над сульфатом магния, отфильтровали и выпарили. Неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью 33% раствора аммиака, и затем ацетонитрил выпарили. Полученное твердое вещество в водной фазе отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (44 мг, 6% теоретический выход).
LC-MS (Способ 2В): Rt=2.19 мин, MS (ESIPos): m/z=359 [М+Н]+
Пример 41А
Трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
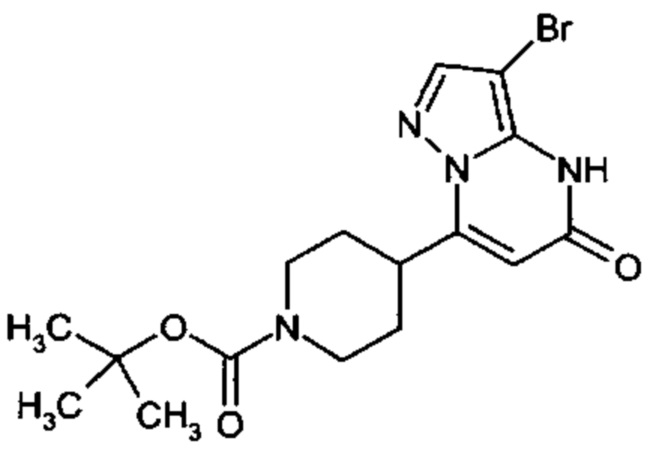
Соединение, указанное в названии, получили согласно общей методике 1А, исходя из 200 мг (1.23 ммоль) 4-бром-1Н-пиразол-5-амина и 439 мг (1.23 ммоль) трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата.
Получение: смесь разбавили водой, нейтрализовали (pH 5-6) путем добавления 1Н HCl и экстрагировали этилацетатом. Собранные органические фракции промыли водой и соляным раствором, высушивали над сульфатом магния и концентрировали под вакуумом. Остаток перемешивали в 10 мл трет-бутилметилового простого эфира, и полученное твердое вещество отфильтровали, промыли трет-бутилметиловым простым эфиром и высушивали под вакуумом в течение 2 ч при 60°C с получением соединения, указанного в названии (134 мг, 26% теоретический выход).
LC-MS (Способ 2В): Rt=0.96 мин, MS (ESIPos): m/z=397 [М+Н]+
Пример 42А
Трет-бутил 4-[3-(3-метил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
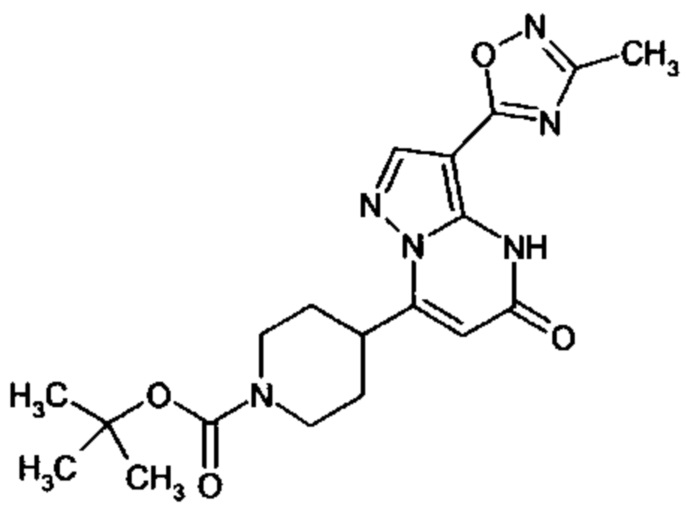
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (50 мг, 0.14 ммоль) в 1 мл диметилформамида добавили 1,1'-карбонилдиимидазол (44 мг, 0.28 ммоль) и N,N-диизопропилэтиламин (36 мг, 0.28 ммоль), и затем реакционную смесь перемешивали 1 ч при 60°С. После этого периода времени N'-гидроксиэтанимидамид (20 мг, 0.28 ммоль) добавили, и смесь перемешивали в течение 4 ч при 120°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). После выпаривания ацетонитрила водную фракцию лиофилизировали всю ночь с получением соединения, указанного в названии (10 мг, 17% теоретический выход).
LC-MS (Способ 1B): Rt=1.01 мин, MS (ESIPos): m/z=401 [М+Н]+
Пример 43А
Трет-бутил 4-[3-(3-изопропил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
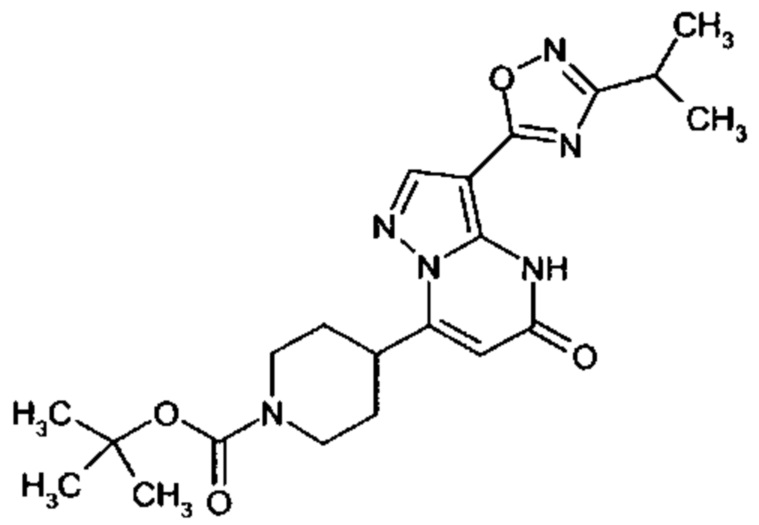
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль) и N,N-диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1 ч при 90°С. После этого периода времени N'-гидрокси-2-метилпропанимидамид (84 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°С. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали в течение 2 ч при 60°С под вакуумом с получением соединения, указанного в названии (101 мг, 57% теоретический выход).
LC-MS (Способ 1B): Rt=1.14 мин, MS (ESIPos): m/z=429 [М+Н]+
Пример 44А
Трет-бутил4-[5-оксо-3-(3-пропил-1,2,4-оксадиазол-5-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
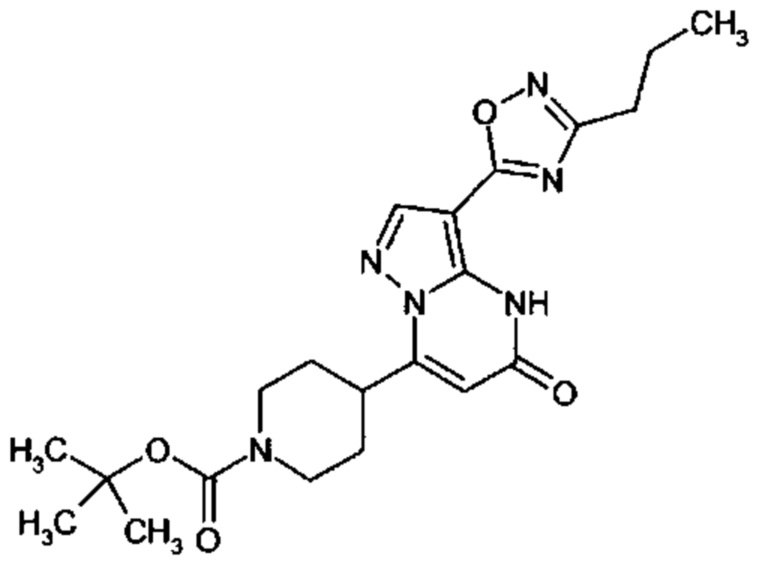
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль) и N,N-диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1 ч при 90°С. После этого периода времени N'-гидроксибутанимидамид (84 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°С. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали в течение 2 ч при 60°С под вакуумом с получением соединения, указанного в названии (71 мг, 40% теоретический выход).
LC-MS (Способ 1B): Rt=1.14 мин, MS (ESIPos): m/z=429 [М+Н]+
Пример 45А
Трет-бутил 4-[5-оксо-3-(3-фенил-1,2,4-оксадиазол-5-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
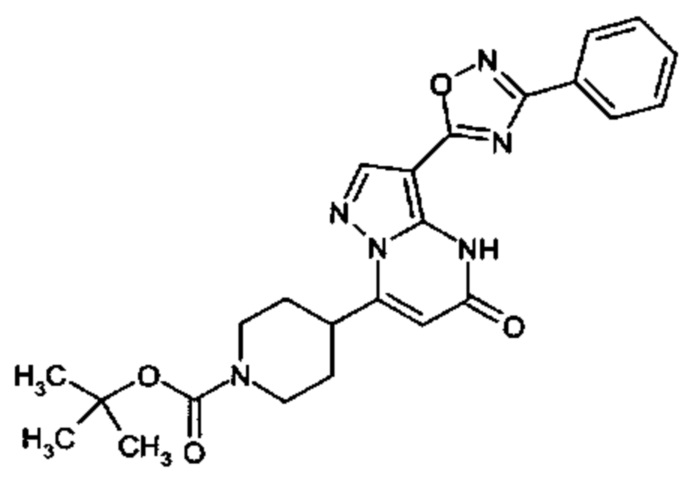
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль) и N,N-диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1 ч при 90°С. После этого периода времени N'-гидроксибензолкарбоксимидамид (112 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°С. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). В ходе выпаривания объединенных фракций продукта выпало в осадок твердое вещество белого цвета, которое собрали путем фильтрации и высушивали в течение 2 ч при 60°С под вакуумом с получением соединения, указанного в названии (115 мг, 60% теоретический выход).
LC-MS (Способ 1B): Rt=1.23 мин, MS (ESIPos): m/z=463 [M+H]+
Пример 46А
Трет-бутил 4-(3-{[метил(4-метилфенил)оксидо-лямбда6-сульфанилиден]карбамоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
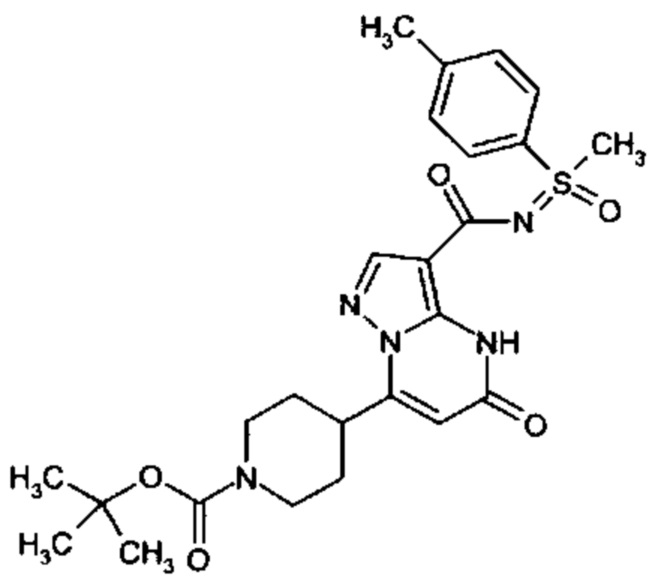
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2 мл дихлорметана добавили 1-хлор-N,N-2-триметилпропениламин (73 мг, 0.55 ммоль), и реакционную смесь перемешивали 2 ч при комнатной температуре. После этого S-метил-S-(4-метилфенил)сульфоксимин (46 мг, 0.28 ммоль) и триэтиламин (55 мг, 0.55 ммоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. После выпаривания растворителя под вакуумом неочищенный продукт разбавили ацетонитрилом и водой, и очистили посредством препаративной ВЭЖХ (Способ 1А). После выпаривания ацетонитрила из объединенных фракций продукта водную фазу экстрагировали этилацетатом. Собранные органические слои высушивали над сульфатом магния, отфильтровали, выпарили и высушивали под вакуумом всю ночь с получением соединения, указанного в названии (16 мг, 12% теоретический выход).
LC-MS (Способ 1B): Rt=1.04 мин, MS (ESIPos): m/z=514 [М+Н]+
Пример 47А
Трет-бутил 4-{3-[(4-оксидо-1,4лямбда4-оксатиан-4-илиден)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
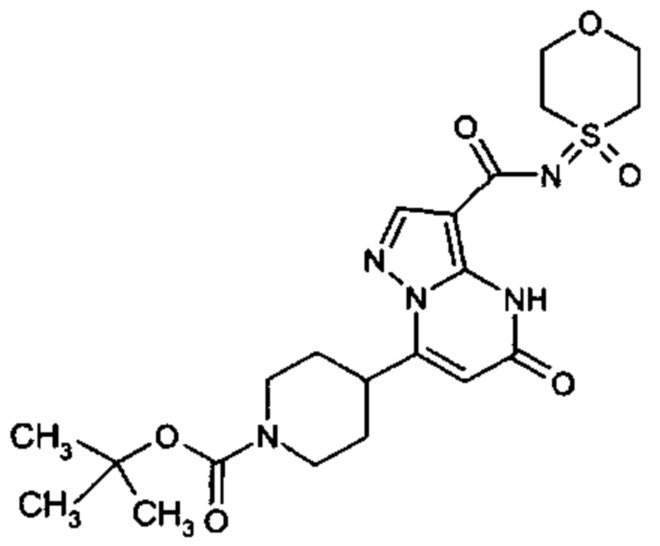
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 4 мл дихлорметана добавили 1-хлор-N,N-2-триметилпропениламин (148 мг, 1.10 ммоль), и реакционную смесь перемешивали 2 ч при комнатной температуре. После этого 1,4-оксатиан-сульфоксимин (74 мг, 0.55 ммоль) и триэтиламин (111 мг, 1.10 ммоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. После выпаривания растворителя под вакуумом неочищенный продукт разбавили ацетонитрилом и водой, и очистили посредством препаративной ВЭЖХ (Способ 1А). После выпаривания ацетонитрила из объединенных фракций продукта водную фазу лиофилизировали всю ночь с получением соединения, указанного в названии (74 мг, 28% теоретический выход).
LC-MS (Способ 1B): Rt=0.89 мин, MS (ESIPos): m/z=480 [М+Н]+
Пример 48А
Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
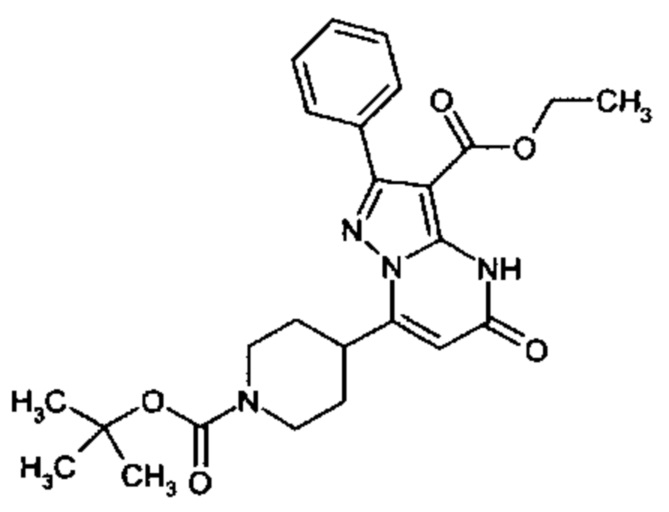
Соединение, указанное в названии, получили согласно общей методике 1А, исходя из этил 5-амино-3-фенил-1Н-пиразол-4-карбоксилата (0.62 г, 2.64 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата (1.00 г, 2.64 ммоль).
Получение: смесь выпарили под вакуумом. Неочищенный продукт разбавили в этилацетате и обработали 1H HCl. После разделения слоев органический слой промыли водой, высушивали под сульфатом натрия, отфильтровали и выпарили под вакуумом. Полученный неочищенный продукт перемешивали в ацетонитриле, отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (0.79 г, 63% теоретический выход).
LC-MS (Способ 1B): Rt=1.26 мин, MS (ESINeg): m/z=465 [М-Н]-
Пример 49А
Трет-бутил 4-{3-[3-(4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль) и N,N-диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1 ч при 90°С. После этого периода времени N'-гидрокси-4-метилбензолкарбоксимидамид (124 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°С. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А). После выпаривания ацетонитрила из объединенных фракций продукта выпало в осадок твердое вещество белого цвета в водной фазе, которое собрали путем фильтрации и высушивали в течение 2 ч при 60°С под вакуумом с получением соединения, указанного в названии (92 мг, 47% теоретический выход).
LC-MS (Способ 1B): Rt=1.28 мин, MS (ESIPos): m/z=477 [М+Н]+
Пример 50А
7-[1-(Трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота
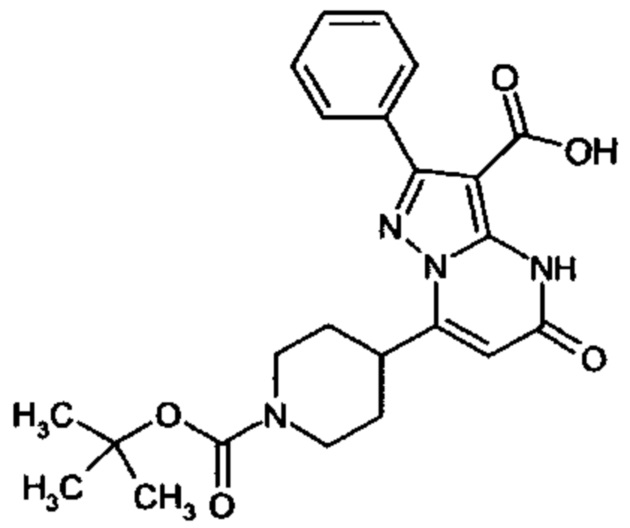
К суспензии соединения Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (617 мг, 1.30 ммоль) в смеси 5.4 мл этанола и 5.4 мл воды добавили моногидрат гидроксида лития (543 мг, 12.96 ммоль), и затем реакционную смесь перемешивали при 60°С в течение 20 ч. После охлаждения до комнатной температуры этанол выпарили под вакуумом, и водную суспензию обработали с помощью 1Н HCl до достижения значения pH=1. Полученное твердое вещество белого цвета отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (0.63 мг, количественный выход).
LC-MS (Способ 1B): Rt=1.03 мин, MS (ESINeg): m/z=437 [М-Н]-
Пример 51А
Трет-бутил-4-(3-хлор-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)-2-метилпиперидин-1-карбоксилат [энантиомерно чистый транс-изомер]
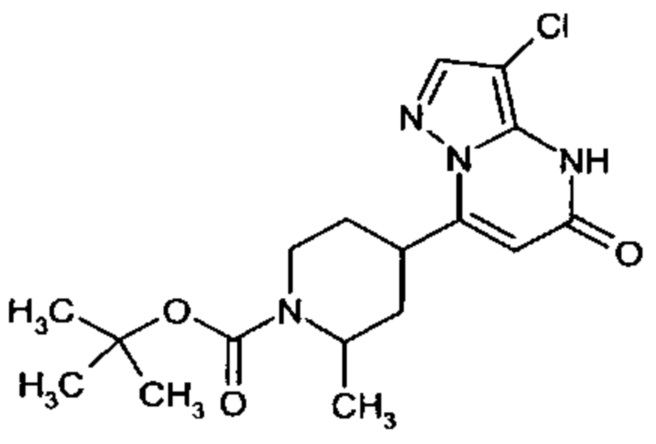
Соединение, указанное в названии, получили согласно общей методике 1А, исходя из 0.50 г (4.25 ммоль) 4-хлор-1Н-пиразол-3-амина и 1.68 г (4.25 ммоль) (-)-цис-трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]-2-метилпиперидин-1-карбоксилата.
Получение: смесь выпарили, и неочищенный продукт обработали с помощью 1Н HCl и этилацетата. После разделения слоев органический слой промыли водой, высушивали над сульфатом натрия и выпарили под вакуумом. Неочищенный продукт перемешивали в ацетонитриле, отфильтровали и высушивали под вакуумом с получением первой фракции, содержащей продукт. Фильтрат выпарили и очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью 33% раствора аммиака, и затем ацетонитрил выпарили. В водной фазе выпало в осадок твердое вещество, которое отфильтровали и высушивали под вакуумом с получением второй фракции, содержащей продукт. После реакции наблюдали эпимеризацию, получая смесь диастереомеров, которые разделили с помощью способа 1С с получением соединения, указанного в названии (385 мг, 24% теоретический выход).
LC-MS (Способ 1B): Rt=1.02 мин, MS (ESIPos): m/z=367 [М+Н]+
HPLC (Способ 1E): Rt=7.75 мин
Пример 52А
Трет-бутил 4-(3-карбамоил-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
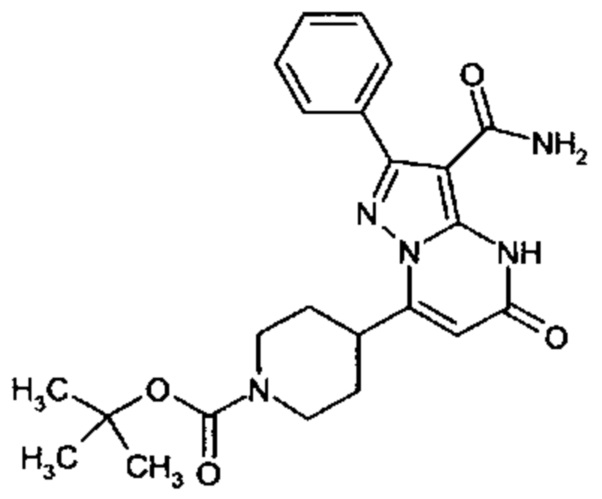
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.21 ммоль) в 2 мл диметилформамида добавили HATU (103 мг, 0.27 ммоль) и DMAP (44 мг, 0.36 ммоль). После этого ацетат аммония (14 мг, 0.18 ммоль) добавили, и затем реакционную смесь перемешивали при комнатной температуре в течение 24 ч, и затем оставили без перемешивания на 5 дней при комнатной температуре в течение 6 дней. Смесь разбавили в DMSO и воде, и очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью 33% раствора аммиака, и затем ацетонитрил выпарили. В водной фазе выпало в осадок твердое вещество белого цвета, которое отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (17 мг, 18% теоретический выход).
LC-MS (Способ 1B): Rt=0.98 мин, MS (ESIPos): m/z=438 [М+Н]+
Пример 53А
7-[1-(Трет-Бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоновая кислота
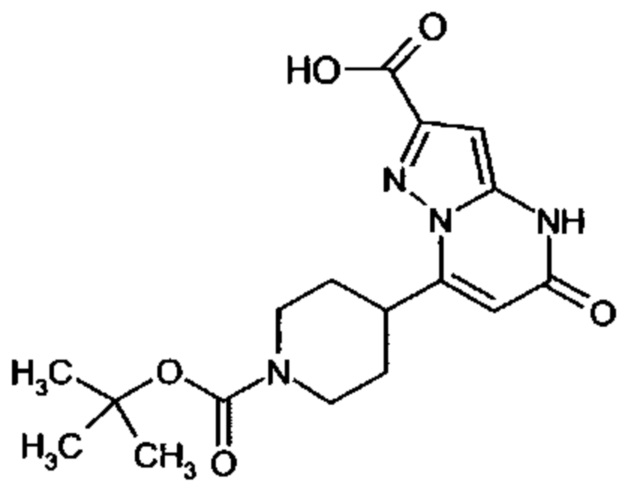
К раствору (1.95 г, около 5.18 ммоль) метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоксилата в метаноле (12 мл) добавили раствор гидроксида лития (1.24 г, 51.80 ммоль) в воде (12 мл). Реакционную смесь перемешивали при 60°С в течение 1 ч. Метанол выпарили под вакуумом, и полученную водную суспензию разбавили водой и экстрагировали этилацетатом. Наконец водную фазу нейтрализовали (pH 5) путем добавления 4М HCl, и полученный осадок отфильтровали, промыли водой и высушивали при 60°С всю ночь с получением соединения, указанного в названии (1.0 г, 52% теоретический выход).
LC-MS (Способ 3В): Rt=1.72 мин, MS (ESINeg): m/z=361 [М-Н]-
Пример 54А
Трет-бутил 4-[3-(бензилкарбамоил)-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
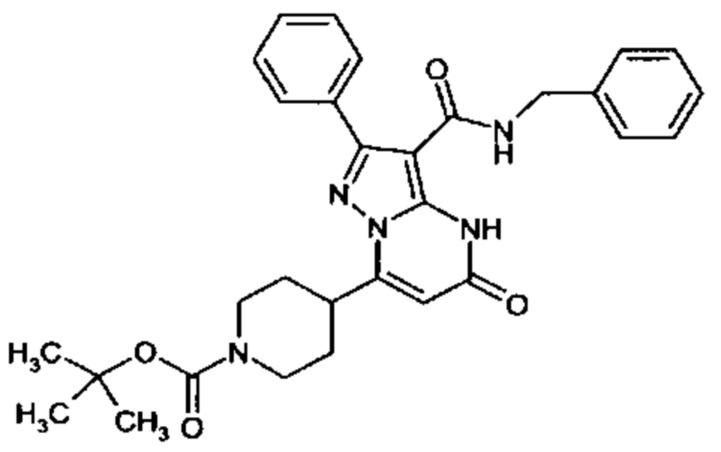
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (50 мг, 0.11 ммоль) в 1 мл диметилформамида добавили HATU (53 мг, 0.13 ммоль) и DMAP (22 мг, 0.18 ммоль). После этого бензиламин (15 мг, 0.14 ммоль) добавили, и затем реакционную смесь перемешивали при комнатной температуре в течение 39 ч. Смесь разбавили в DMSO и воде, и очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью 33% раствора аммиака, и затем ацетонитрил выпарили. Полученную водную фазу экстрагировали этилацетатом, и собранные органические фазы высушивали над сульфатом натрия, отфильтровали и выпарили под вакуумом с получением соединения, указанного в названии (19 мг, 34% теоретический выход).
LC-MS (Способ 1B): Rt=1.21 мин, MS (ESIPos): m/z=528 [М+Н]+
Пример 55А
Трет-бутил 4-[3-(морфолин-4-илкарбонил)-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
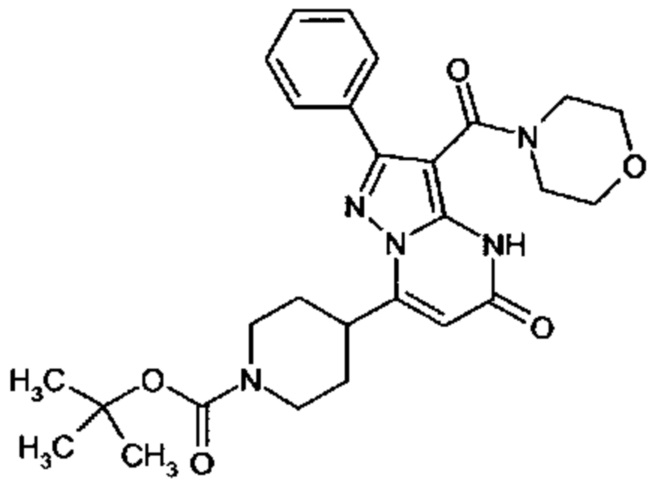
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (50 мг, 0.11 ммоль) в 1 мл диметилформамида добавили HATU (53 мг, 0.13 ммоль) и DMAP (22 мг, 0.18 ммоль). После этого морфолин (8 мг, 0.09 ммоль) добавили, и затем реакционную смесь перемешивали при комнатной температуре в течение 39 ч. Смесь разбавили в DMSO и воде, и очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью 33% раствора аммиака, и затем ацетонитрил выпарили. Полученную водную фазу экстрагировали этилацетатом, и собранные органические фазы высушивали над сульфатом натрия, отфильтровали и выпарили под вакуумом с получением соединения, указанного в названии (12 мг, 22% теоретический выход).
LC-MS (Способ 1B): Rt=1.00 мин, MS (ESIPos): m/z=508 [М+Н]+
Пример 56А
Трет-бутил 4-[3-(изобутилкарбамоил)-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
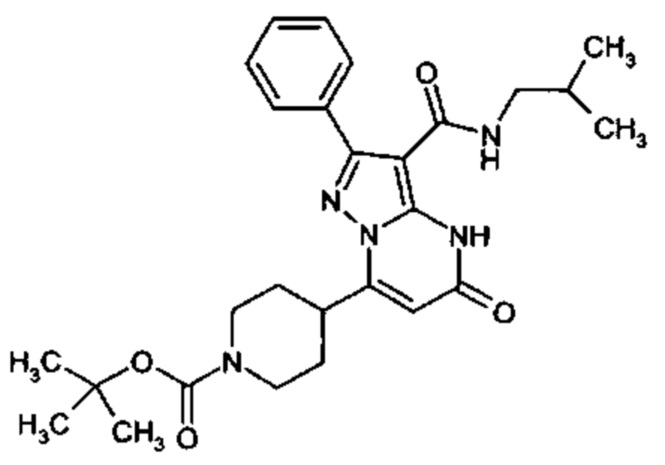
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (50 мг, 0.11 ммоль) в 1 мл диметилформамида добавили HATU (53 мг, 0.13 ммоль) и DMAP (22 мг, 0.18 ммоль). После этого изобутиламин (10 мг, 0.13 ммоль) добавили, и затем реакционную смесь перемешивали при комнатной температуре в течение 39 ч. Смесь разбавили в DMSO и воде, и очистили посредством препаративной ВЭЖХ (Способ 1А). Объединенные фракции продукта нейтрализовали с помощью 33% раствора аммиака, и затем ацетонитрил выпарили. Полученную водную фазу экстрагировали этилацетатом, и собранные органические фазы высушивали над сульфатом натрия, отфильтровали и выпарили под вакуумом с получением соединения (11 г, 21% теоретический выход).
LC-MS (Способ 1B): Rt=1.22 мин, MS (ESIPos): m/z=494 [М+Н]+
Пример 57А
Трет-бутил 4-[3-(4-метилфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
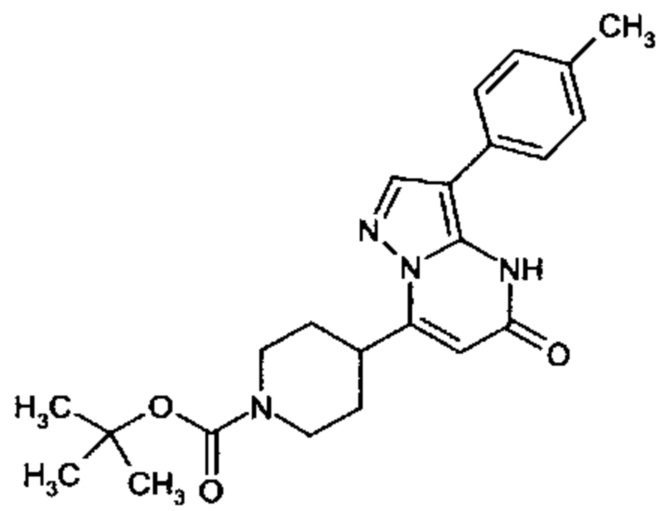
Сосуд, в который загрузили трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (150 мг, 0.38 ммоль), (4-метилфенил)бороновую кислоту (77 мг, 0.57 ммоль), тетракис(трифенилфосфин)палладий(0) (43 мг, 0.04 ммоль), хлорид лития (44 мг, 1.06 ммоль) и карбонат натрия (100 мг, 0.95 ммоль) герметизировали с помощью резьбовой крышки и продули аргоном в течение 10 минут. Затем 3 мл дегазированного раствора толуола, этанола и воды 1/1/1 добавили посредством шприца, и реакционную смесь перемешивали при 100°С в течение 16 ч. После охлаждения до комнатной температуры смесь разбавили водой и экстрагировали этилацетатом. Собранные органические фазы промыли водой, соляным раствором и высушивали над сульфатом магния. После выпаривания растворителя неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 1А). Ацетонитрил выпарили из объединенных фракций продукта, и полученную водную фазу экстрагировали этилацетатом. Собранные органические фазы высушивали над сульфатом магния, отфильтровали, выпарили и высушивали под вакуумом с получением соединения, указанного в названии (7 мг, 4% теоретический выход).
LC-MS (Способ 1В): Rt=2.56 мин, MS (ESIPos): m/z=409 [М+Н]+
Пример 58А
Метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоксилат

Раствор (0.78 г, 5.53 ммоль) метил 5-амино-1Н-пиразол-3-карбоксилата в 20 мл воды обработали с помощью 1Н HCl до достижения значения pH 6, и затем раствор экстрагировали этилацетатом. Объединенные органические фазы высушивали над сульфатом магния, отфильтровали и выпарили под вакуумом. Полученный амин прореагировал с 1.97 г (5.53 ммоль) трет-бутил. 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата согласно общей методике 1А.
Получение: смесь разбавили водой, нейтрализовали (pH 5) посредством добавления 1Н HCl, и экстрагировали этилацетатом. Объединенные органические фазы промыли водой и соляным раствором, высушивали над сульфатом магния, отфильтровали и выпарили. Неочищенный продукт применяли на следующей стадии без дальнейшей очистки (1.95 г, 34% теоретический выход, 37% чистота согласно LC-MS).
LC-MS (Способ 1B): Rt=0.87 мин, MS (ESINeg): m/z=375 [M-H]-
Пример 59A
7-[1-(трет-Бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоновая кислота
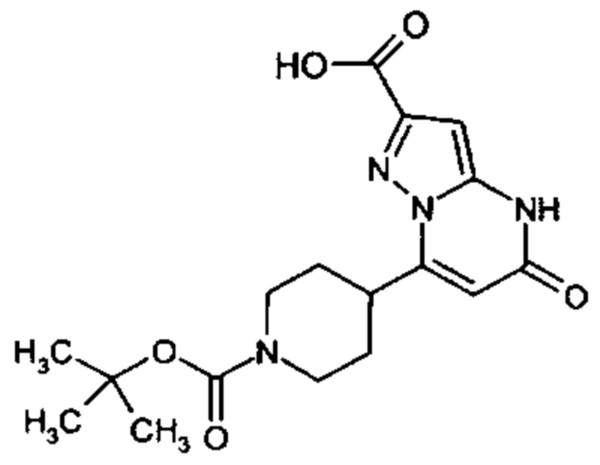
К раствору (1.95 г, около 5.18 ммоль) метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоксилата в метаноле (12 мл) добавили раствор гидроксида лития (1.24 г, 51.80 ммоль) в воде (12 мл). Реакционную смесь перемешивали при 60°С в течение 1 ч. Метанол выпарили под вакуумом, и полученную водную суспензию разбавили водой и экстрагировали этилацетатом. Наконец водную фазу нейтрализовали (pH 5) путем добавления 4М HCl, и полученный осадок отфильтровали, промыли водой и высушивали при 60°С всю ночь с получением соединения, указанного в названии (1.0 г, 52% теоретический выход).
LC-MS (Способ 3В): Rt=1.72 мин, MS (ESINeg): m/z=361 [М-Н]-
Пример 60A
Трет-бутил 4-[3-(4-цианофенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

Согласно общей методике 2А, смесь (4-цианофенил)бороновой кислоты (83 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 46 мг, 30% теоретический выход.
LC-MS (Способ 1B): Rt=1.07 мин, MS (ESINeg): m/z=418 [М-Н]-
Пример 61А
Трет-бутил 4-[3-(3-хлорфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

Согласно общей методике 2А, смесь 3-хлорфенил бороновой кислоты (89 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 39 мг, 25% теоретический выход.
LC-MS (Способ 1B): Rt=1.18 мин, MS (ESINeg): m/z=427 [М-Н]-
Пример 62А
Трет-бутил 4-[3-(2-цианофенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
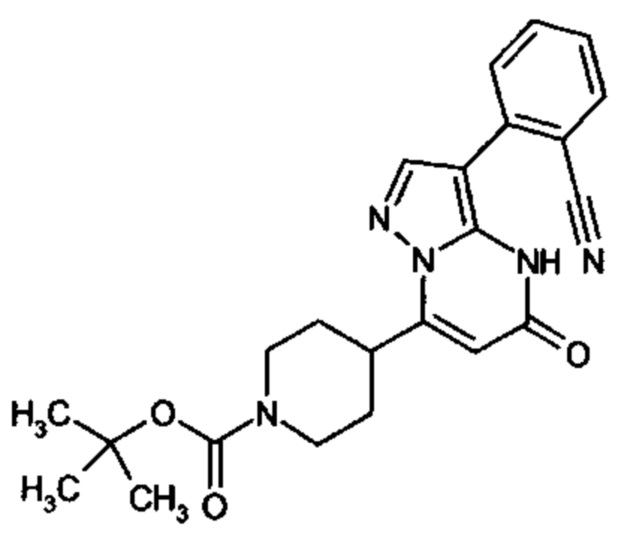
Согласно общей методике 2А, смесь 2-цианофенил бороновой кислоты (83 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 24 мг, 15% теоретический выход.
LC-MS (Способ 1B): Rt=1.03 мин, MS (ESINeg): m/z=418 [М-Н]-
Пример 63А
Трет-бутил 4-[3-(3-цианофенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
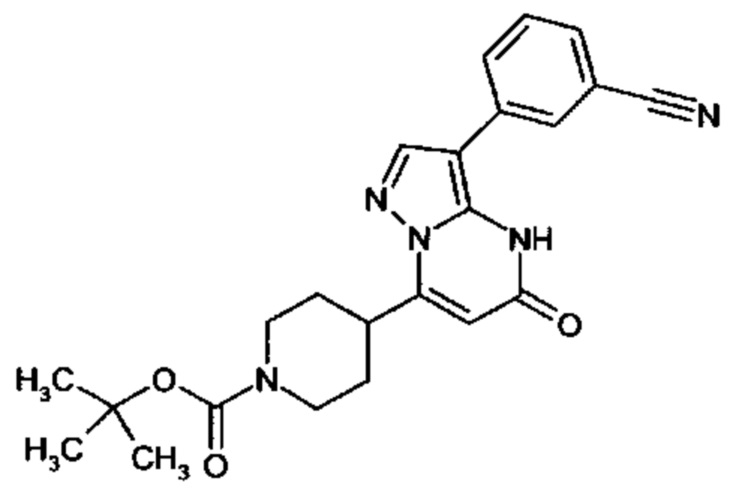
Согласно общей методике 2А, смесь (3-цианофенил)бороновой кислоты (83 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 34 мг, 22% теоретический выход.
LC-MS (Способ 1B): Rt=1.08 мин, MS (ESINeg): m/z=418 [М-Н]-
Пример 64А
Трет-бутил 4-(3-карбамоил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)-2-метилпиперидин-1-карбоксилат [энантиомерно чистый транс-изомер]
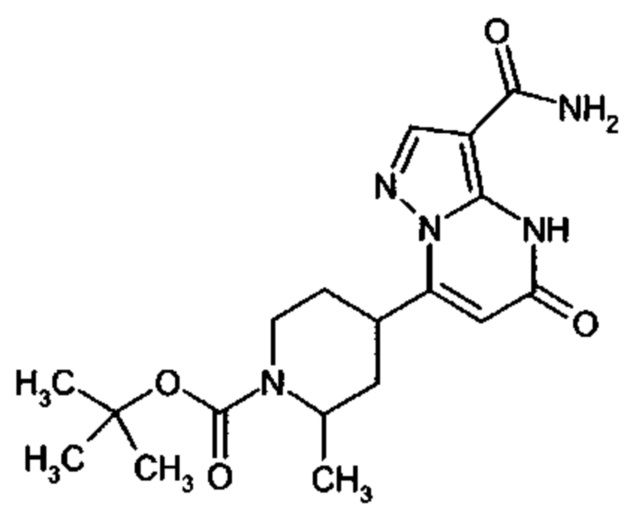
Соединение, указанное в названии, получили согласно общей методике 1А, исходя из 164 мг (1.27 ммоль) 3-амино-1Н-пиразол-4-карбоксамида и 500 мг (1.27 ммоль) {-)-цис-трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]-2-метилпиперидин-1-карбоксилата.
Получение: смесь выпарили, и неочищенный продукт обработали водой, и экстрагировали этилацетатом. После разделения фаз желтое твердое вещество выпало в осадок в водную фазу, которое отфильтровали. Водную фазу нейтрализовали с помощью 1Н HCl до достижения pH 6, и затем экстрагировали этилацетатом. Собранные органические слои высушивали над сульфатом натрия, отфильтровали, выпарили и высушивали под вакуумом. После реакции наблюдали эпимеризацию, получая смесь диастереомеров, которые разделили с помощью способа 1С с получением соединения, указанного в названии (120 мг, 25% теоретический выход).
LC-MS (Способ 1B): Rt=0.82 мин, MS (ESIPos): m/z=376 [М+Н]+
HPLC (Способ 1E): Rt=8.28 мин
Пример 65А
Трет-бутил 4-[3-(3-фторфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

Согласно общей методике 2А, смесь (3-фторфенил) бороновой кислоты (79 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 20 мг, 13% теоретический выход.
LC-MS (Способ 1B): Rt=1.09 мин, MS (ESINeg): m/z=411 [М-Н]-
Пример 66А
Трет-бутил 4-[3-(4-метоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
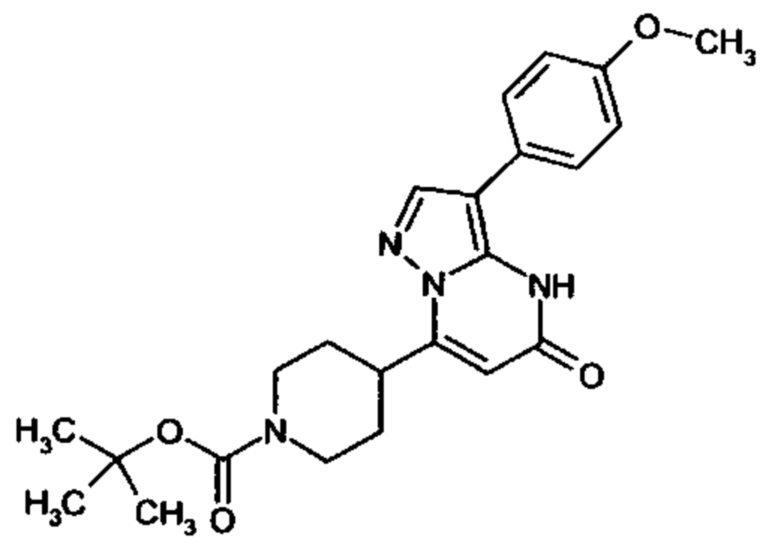
Согласно общей методике 2А, смесь (4-метоксифенил)бороновой кислоты (86 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 18 мг, 9% теоретический выход.
LC-MS (Способ 1B): Rt=1.09 мин, MS (ESINeg): m/z=423 [М-Н]-
Пример 67А
Трет-бутил 4-[3-(3,4-диметоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

Согласно общей методике 2А, смесь (3,4-диметоксифенил)бороновой кислоты (103 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 37.76 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 48 ч. Выход: 30 мг, 18% теоретический выход.
LC-MS (Способ 1B): Rt=1.04 мин, MS (ESINeg): m/z=453 [М-Н]-
Пример 68А
Трет-бутил 4-{3-[4-(метилсульфонил)фенил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
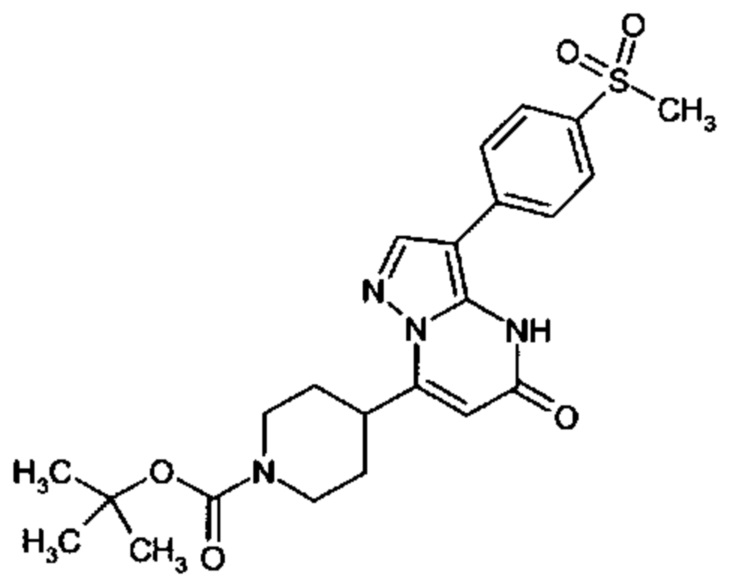
Согласно общей методике 2А, смесь 2[4-(метилсульфонил)фенил]бороновой кислоты (150 мг, 0.38 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 37.76 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 48 ч. Выход: 54 мг, 22% теоретический выход.
LC-MS (Способ 1B): Rt=0.97 мин, MS (ESINeg): m/z=471 [М-Н]-
Пример 69А
Трет-бутил 4-[3-(2-фторфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
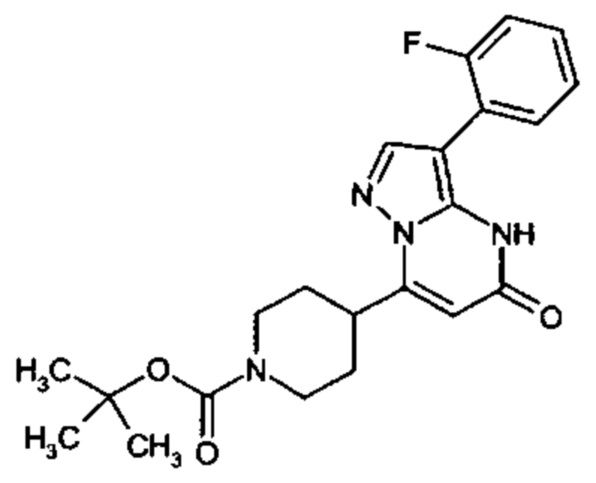
Согласно общей методике 2А, смесь (2-фторфенил) бороновой кислоты (79 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 15 мг, 22% теоретический выход.
LC-MS (Способ 1B): Rt=1.10 мин, MS (ESINeg): m/z=411 [М-Н]-
Пример 70А
Трет-бутил 4-{5-оксо-3-[3-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
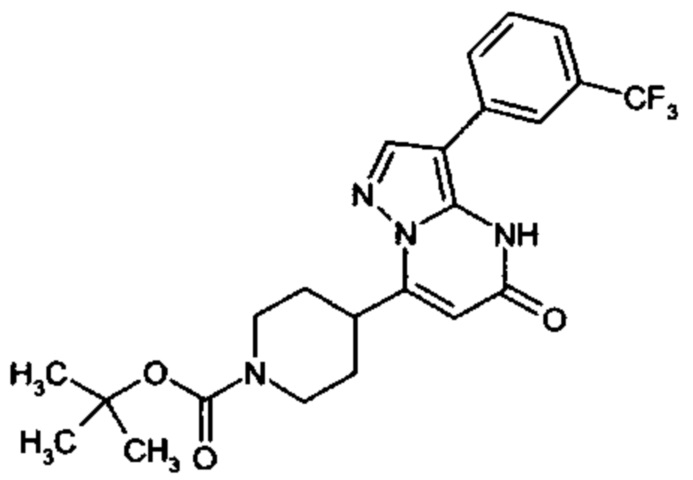
Согласно общей методике 2А, смесь [3-(трифторметил)фенил]бороновой кислоты (107 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 71 мг, 41% теоретический выход.
LC-MS (Способ 1B): Rt=1.19 мин, MS (ESINeg): m/z=461 [М-Н]-
Пример 71А
Трет-бутил 4-{5-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
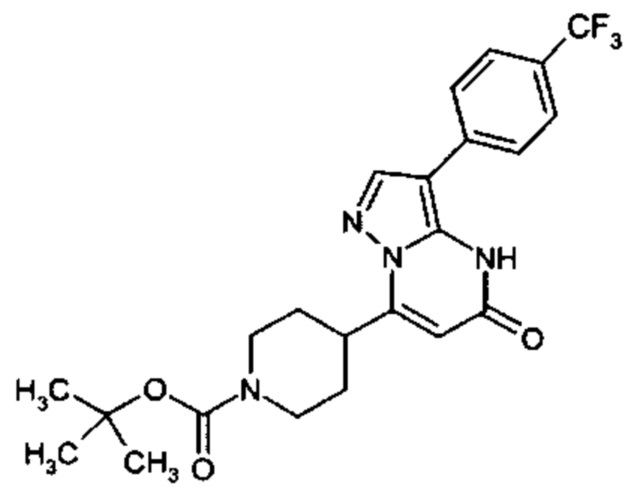
Согласно общей методике 2А, смесь [4-(трифторметил)фенил]бороновой кислоты (107 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 16 ч. Выход: 42 мг, 22% теоретический выход.
LC-MS (Способ 1B): Rt=1.19 мин, MS (ESINeg): m/z=461 [М-Н]-
Пример 72А
Трет-бутил 4-[5-оксо-3-(2-тиенил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
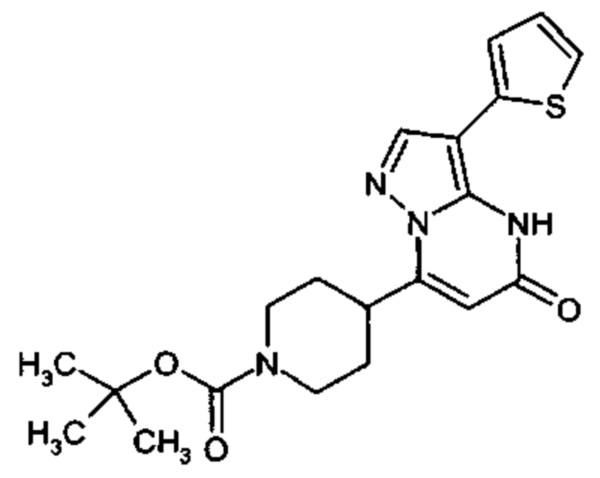
Согласно общей методике 2А, смесь 2-тиенилбороновой кислоты (72 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 24 ч. Выход: 26 мг, 15% теоретический выход.
LC-MS (Способ 1B): Rt=1.06 мин, MS (ESIPos): m/z=401 [М+Н]+
Пример 73А
Трет-бутил 4-[3-(3-метоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
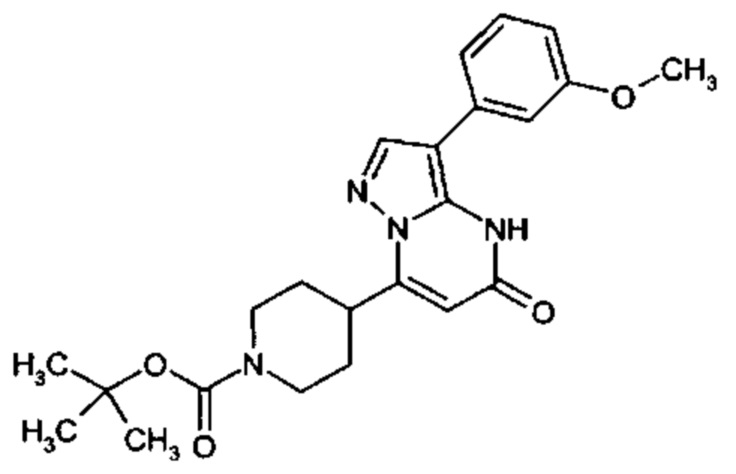
Согласно общей методике 2А, смесь (3-метоксифенил)бороновой кислоты (86 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 24 ч. Выход: 40 мг, 24% теоретический выход.
LC-MS (Способ 1B): Rt=1.08 мин, MS (ESINeg): m/z=424 [М-Н]-
Пример 74А
Трет-бутил 4-[3-(2,3-дигидро-1,4-бензодиоксин-6-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

Согласно общей методике 2А, смесь 2,3-дигидро-1,4-бензодиоксин-6-илбороновой кислоты (101 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 48 ч. Выход: 13 мг, 7% теоретический выход.
LC-MS (Способ 1B): Rt=1.08 мин, MS (ESINeg): m/z=451 [М-Н]-
Пример 75А
Трет-бутил 4-[3-(2,5-диметоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
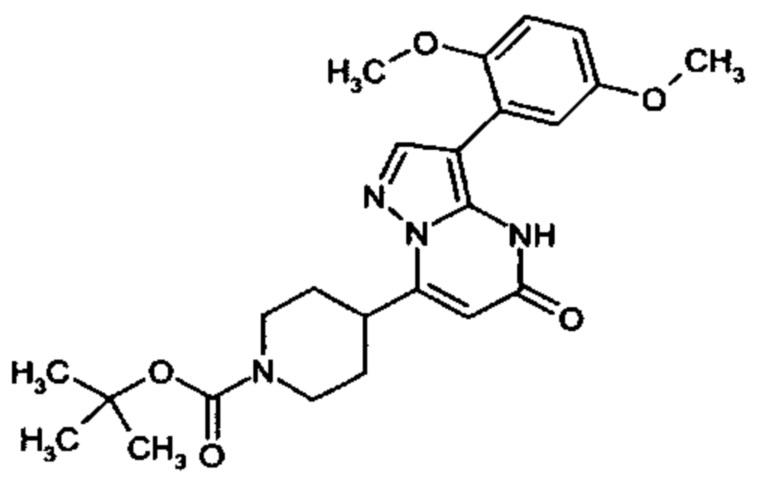
Согласно общей методике 2А, смесь 2 (2,5-диметоксифенил)бороновой кислоты (103 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 48 ч. Выход: 22 мг, 11% теоретический выход.
LC-MS (Способ 1B): Rt=1.12 мин, MS (ESINeg): m/z=453 [М-Н]-
Пример 76А
Трет-бутил 4-{5-оксо-3-[2-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
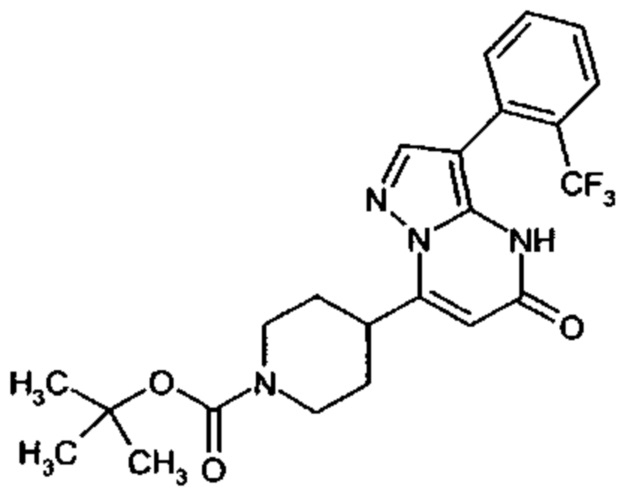
Согласно общей методике 2А, смесь [2-(трифторметил)фенил]бороновой кислоты (107 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3 мл) и дегазированного 1М водного раствора K3PO4 (1.1 мл) перемешивали при 80°С в течение 64 ч. Выход: 16 мг, 24% теоретический выход.
LC-MS (Способ 1B): Rt=1.16 мин, MS (ESINeg): m/z=461 [М-H]-
Пример 77А
Трет-бутил 4-[3-(4-фторфенил)-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
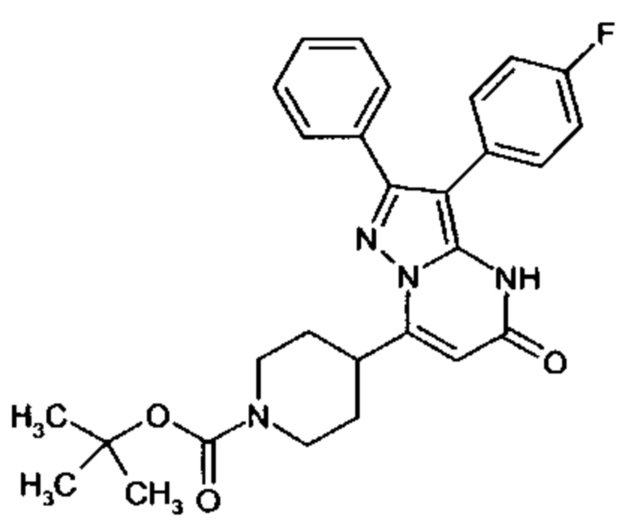
Согласно общей методике 2А, смесь (4-фторфенил)бороновой кислоты (66 мг, 0.48 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (26 мг, 0.03 ммоль), дегазированного ТГФ (2.5 мл) и дегазированного 1М водного раствора K3PO4 (0.95 мл) перемешивали при 80°С в течение 16 ч. Выход: 36 мг, 24% теоретический выход.
LC-MS (Способ 1B): Rt=0.70 мин, MS (ESIPos): m/z=387 [M-H-boc]-
Пример 78A
Трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)-2-метилпиперидин-1-карбоксилат [энантиомерно чистый транс-изомер]
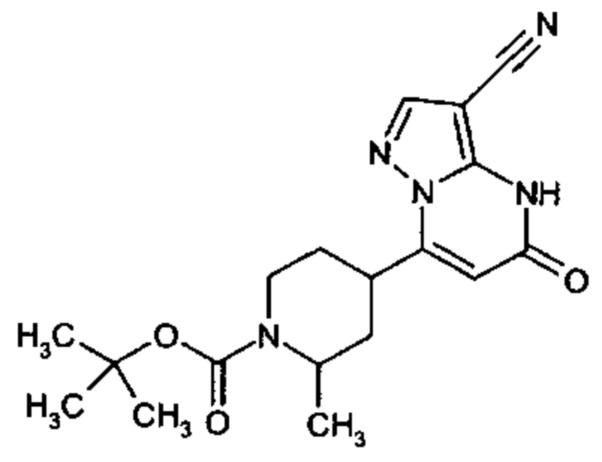
Соединение, указанное в названии, получили согласно общей методике 1А, исходя из 141 мг (1.27 ммоль) 3-амино-1Н-пиразол-4-карбонитрила и 500 мг (1.27 ммоль) (-)-цис-трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]-2-метилпиперидин-1-карбоксилата.
Получение: смесь выпарили, и неочищенный продукт обработали водой, и экстрагировали этилацетатом. Водную фазу нейтрализовали с помощью 1Н HCl до достижения значения pH 5, и затем экстрагировали этилацетатом. Собранные органические слои высушивали над сульфатом натрия, отфильтровали, выпарили и высушивали под вакуумом. После реакции наблюдали эпимеризацию, получая смесь диастереомеров, которые разделили с помощью способа 2С с получением соединения, указанного в названии (207 мг, 46% теоретический выход).
LC-MS (Способ 1B): Rt=0.95 мин, MS (ESINeg): m/z=356 [M-H]-
HPLC (Способ 2E): Rt=8.68 мин
Пример 79A
Трет-бутил 4-[3-(4-метил-2-тиенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
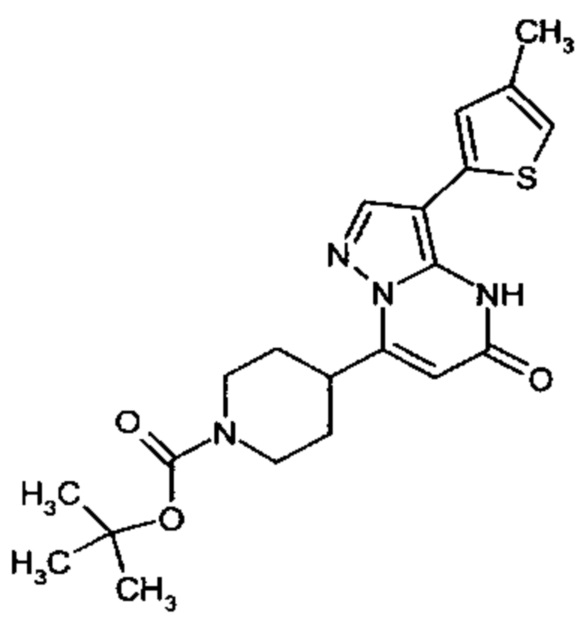
Согласно общей методике 2А, смесь (4-метил-2-тиенил)бороновой кислоты (80 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3.0 мл) и дегазированного 1М водного раствора K3PO4 (1.13 мл) перемешивали при 80°С в течение 3 дней. Выход: 27 мг, 17% теоретический выход.
LC-MS (Способ 1B): Rt=1.14 мин, MS (ESIPos): m/z=415 [М+Н]+
Пример 80А
Трет-бутил 4-[3-(2-метоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
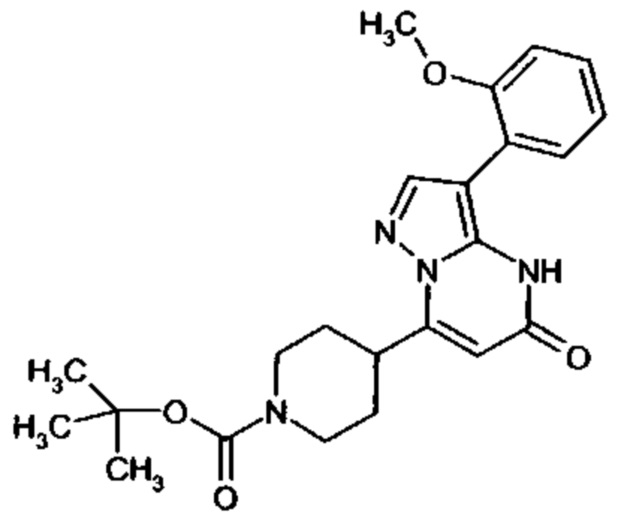
Согласно общей методике 2А, смесь (2-метоксифенил)бороновой кислоты (86 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3.0 мл) и дегазированного 1М водного раствора K3PO4 (1.13 мл) перемешивали при 80°С в течение 3 дней. Выход: 46 мг, 26% теоретический выход.
LC-MS (Способ 1B): Rt=1.09 мин, MS (ESINeg): m/z=424 [М-Н]-
Пример 81А
Трет-бутил 4-[3-(4-циано-2-тиенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
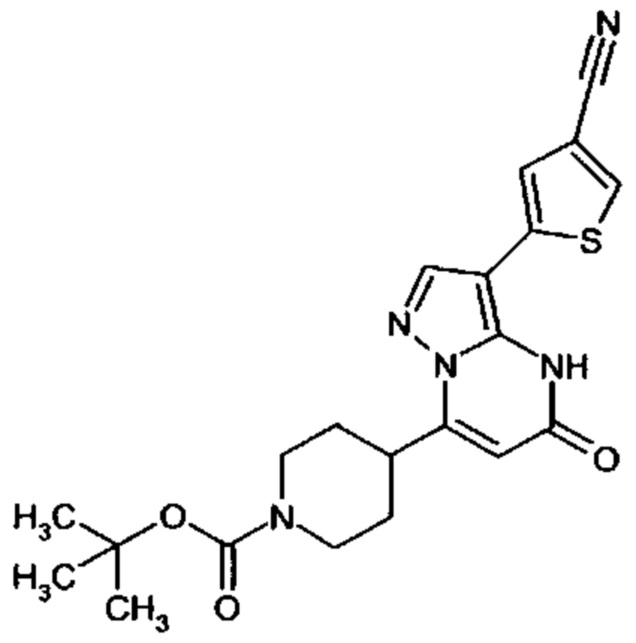
Согласно общей методике 2А, смесь (4-циано-2-тиенил)бороновой кислоты (86 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3.0 мл) и дегазированного 1М водного раствора K3PO4 (1.13 мл) перемешивали при 80°С в течение 24 ч. Выход: 4 мг, 3% теоретический выход.
LC-MS (Способ 1B): Rt=1.05 мин, MS (ESINeg): m/z=424 [М-Н]-
Пример 82А
Трет-бутил 4-[3-(6-метоксипиридин-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
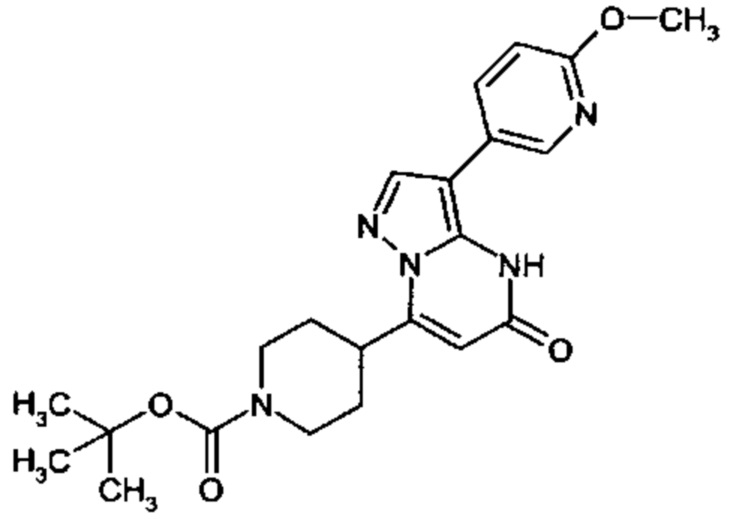
Согласно общей методике 2А, смесь (6-метоксипиридин-3-ил)бороновой кислоты (86 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3.0 мл) и дегазированного 1М водного раствора K3PO4 (1.13 мл) перемешивали при 80°С в течение одного дня. Выход: 43 мг, 27% теоретический выход.
LC-MS (Способ 1B): Rt=0.99 мин, MS (ESIPos): m/z=426 [М+Н]+
Пример 83А
Трет-бутил 4-{5-оксо-3-[3-(трифторметокси)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
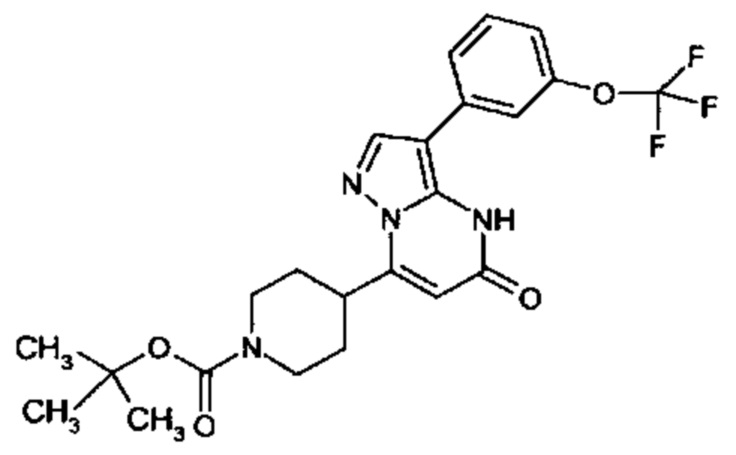
Согласно общей методике 2А, смесь [3-(трифторметокси)фенил]бороновой кислоты (116 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3.0 мл) и дегазированного 1М водного раствора K3PO4 (1.13 мл) перемешивали при 80°С в течение 16 ч. Выход: 48 мг, 26% теоретический выход.
LC-MS (Способ 1B): Rt=1.22 мин, MS (ESIPos): m/z=479 [М+Н]+
Пример 84А
Трет-бутил 4-{5-оксо-3-[2-(трифторметокси)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
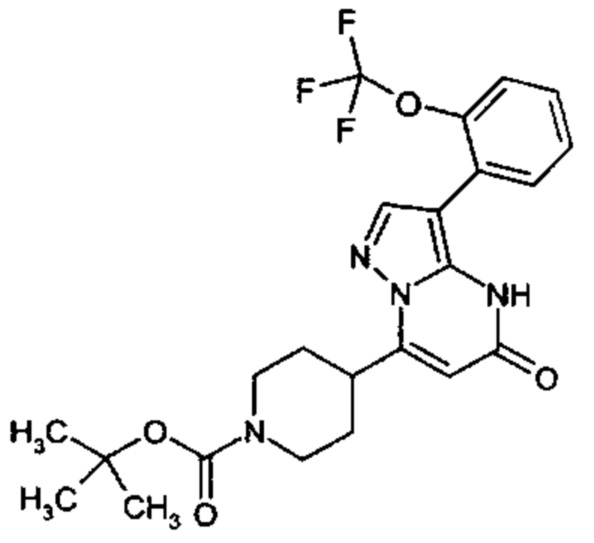
Согласно общей методике 2А, смесь [2-(трифторметокси)фенил]бороновой кислоты (116 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3.0 мл) и дегазированного 1М водного раствора K3PO4 (1.13 мл) перемешивали при 80°С в течение 16 ч. Выход: 49 мг, 27% теоретический выход.
LC-MS (Способ 1B): Rt=1.17 мин, MS (ESINeg): m/z=477 [М-Н]-
Пример 85А
Трет-бутил 4-[3-(3-хлор-4-фторфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
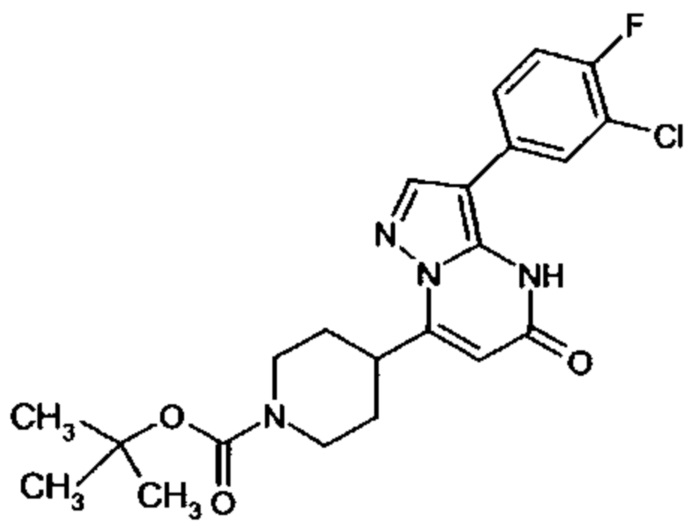
Согласно общей методике 2А, смесь (3-хлор-4-фторфенил)бороновой кислоты (98 мг, 0.57 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (150 мг, 0.38 ммоль), XPhos предкатализатора (32 мг, 0.04 ммоль), дегазированного ТГФ (3.0 мл) и дегазированного 1М водного раствора K3PO4 (1.13 мл) перемешивали всю ночь при 80°С. Выход: 34 мг, 20% теоретический выход.
LC-MS (Способ 1B): Rt=1.17 мин, MS (ESINeg): m/z=445 [М-Н]-
Пример 86А
3-(Диметиламино)-2-(фенилсульфонил)акрилонитрил
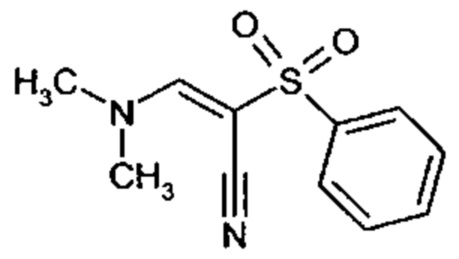
N,N-Диметилформамид диметилацеталь (1.84 г, 15.5 ммоль) в н-гексане (8 мл) добавили к (фенилсульфонил)ацетонитрилу (2.00 г, 11.0 ммоль) при 0°С, и смесь перемешивали при комнатной температуре в течение 16 ч. Полученное твердое вещество отфильтровали, промыли н-пентаном и высушивали с получением соединения, указанного в названии, с чистотой 92% (2.49 г, 87% теоретический выход).
LC-MS (Способ 1B): Rt=0.73 мин, MS (ESIPos): m/z=237 [М+Н]+
Пример 87А
4-(Фенилсульфонил)-1Н-пиразол-3-амин
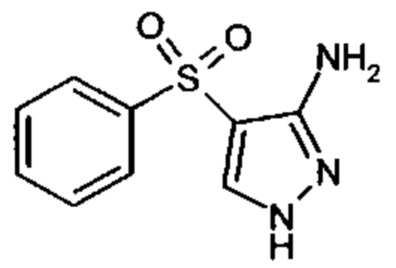
3-(Диметиламино)-2-(фенилсульфонил)акрилонитрил (2.48 г, 10.50 ммоль) растворили в этаноле (20 мл) и обработали гидразингидратом (0.55 г, 11.0 ммоль). После перемешивания при 50°С в течение 8 ч, смесь охладили до комнатной температуры и концентрировали в вакууме. Остаток растворили в смеси воды и этилацетата. Водный слой экстрагировали еще раз этилацетатом. Объединенные органические слои промыли дважды водой, высушивали над сульфатом магния, концентрировали в вакууме и очистили с помощью колоночной хроматографии (этилацетат) с получением соединения, указанного в названии (1.02 г, 43% теоретический выход).
LC-MS (Способ 2 В): Rt=0.56 мин, MS (ESIPos): m/z=224 [М+Н]+
Пример 88А
Трет-бутил 4-[5-оксо-3-(фенилсульфонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
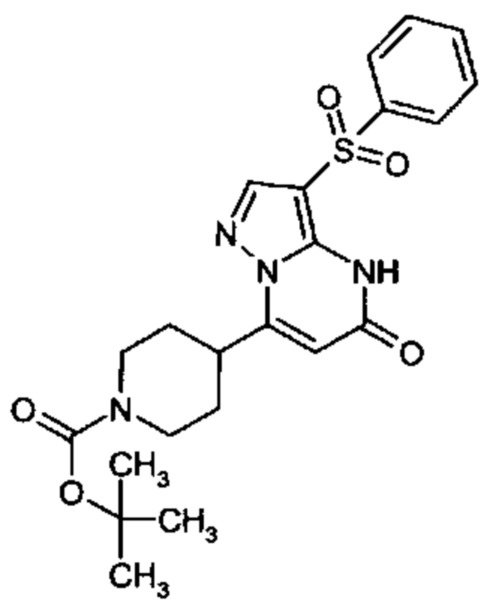
4-(Фенилсульфонил)-1Н-пиразол-3-амин (1.01 г, 4.52 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (1.61 г, 4.52 ммоль) растворили в ацетонитриле (20 мл) и нагревали с возвратом флегмы в течение 4 ч. После охлаждения до комнатной температуры, растворитель удалили в вакууме, и остаток растворили в 1-метокси-2-пропанолее (10 мл). Фосфат калия (1.92 г, 9.04 ммоль) добавили, и смесь перемешивали при 80°С в течение 4 ч и при 100°С в течение 2 ч. В результате концентрирования в вакууме и очистки с помощью препаративной ВЭЖХ (Способ 1А) получили соединение, указанное в названии (0.82 г, 39% теоретический выход).
LC-MS (Способ 1B): Rt=1.04 мин, MS (ESINeg): m/z=457 [М-Н]-
Пример 89А
2-[(2,4-дихлорфенил)сульфонил]-3-(диметиламино)акрилонитрил

N,N-Диметилформамид диметилацеталь (0.67 г, 5.60 ммоль) в н-гексане (5 мл) добавили к [(2,4-дихлорфенил)сульфонил]ацетонитрилу (1.00 г, 4.00 ммоль) при 0°С, и смесь перемешивали при комнатной температуре в течение 16 ч. Полученное твердое вещество отфильтровали, промыли н-пентаном и высушивали с получением соединения, указанного в названии (1.15 г, 94% теоретический выход).
LC-MS (Способ 1B): Rt=0.96 мин, MS (ESIPos): m/z=305 [М+Н]+
Пример 90А
4-[(2,4-Дихлорфенил)сульфонил]-1Н-пиразол-3-амин
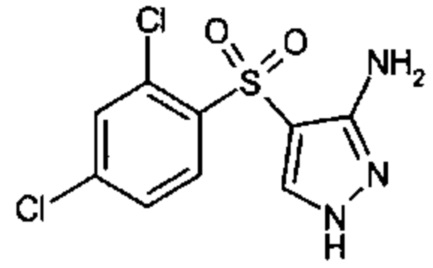
2-[(2,4-Дихлорфенил)сульфонил]-3-(диметиламино)акрилонитрил (1.15 г, 3.77 ммоль) растворили в этаноле (10 мл) и обработали гидразингидратом (0.20 г, 3.96 ммоль). После перемешивания при 50°С в течение 8 ч, смесь охладили до комнатной температуры и концентрировали в вакууме. Остаток растворили в смеси воды и этил ацетата. Водный слой экстрагировали еще раз этилацетатом. Объединенные органические слои промыли дважды водой, высушивали над сульфатом магния, концентрировали в вакууме и очистили с помощью колоночной хроматографии (этилацетат) с получением соединения, указанного в названии (0.93 г, 51% теоретический выход) с чистотой 60%.
LC-MS (Способ 1B): Rt=0.81 мин, MS (ESIPos): m/z=292 [М+Н]+
Пример 91А
Трет-бутил 4-{3-[(2,4-дихлорфенил)сульфонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
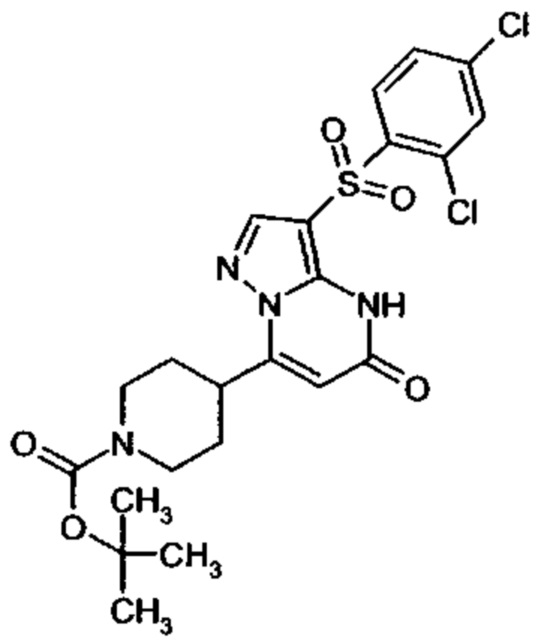
4-[(2,4-Дихлорфенил)сульфонил]-1Н-пиразол-3-амин (60% чистота, 0.93 г, 3.18 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (1.13 г, 3.18 ммоль) растворили в ацетонитриле (15 мл) и нагревали с возвратом флегмы в течение 4 ч. После охлаждения до комнатной температуры, растворитель удалили в вакууме, и остаток растворили в 1-метокси-2-пропанолее (10 мл). Фосфат калия (1.63 г, 7.66 ммоль) добавили, и смесь перемешивали при возврате флегмы в течение 4 ч. В результате концентрирования в вакууме и очистки с помощью препаративной ВЭЖХ (Способ 1А) получили соединение, указанное в названии (0.62 г, 31% теоретический выход).
LC-MS (Способ 1B): Rt=1.20 мин, MS (ESINeg): m/z=525 [М-Н]-
Пример 92А
N'-гидрокси-2,4-диметилбензолкарбоксимидамид
К раствору 2,4-диметилбензонитрила (300 мг, 2.29 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (238 мг, 3.43 ммоль) и триэтиламин (301 мг, 2.97 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°С. После этого периода времени гидроксиламмония хлорид (79 мг, 1.14 ммоль) и триэтиламин (116 мг, 1.14 ммоль) снова добавили, и смесь перемешивали 6 ч при 60°С. Затем смесь перемешивали при обработке микроволнами в течение 1.5 ч при 60°С. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (157 мг, 26% теоретический выход, чистота 60%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=1.57 мин, m/z=165 (М+Н)+
Пример 93А
N'-гидрокси-4-метил-2-(трифторметил)бензолкарбоксимидамид

К раствору 4-метил-2-(трифторметил)бензонитрила (300 мг, 1.62 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (169 мг, 2.43 ммоль) и триэтиламин (213 мг, 2.11 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°С, и затем 3 ч при 90°С. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (250 мг, 46% теоретический выход, чистота 65%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=1.75 мин, m/z=219 (М+Н)+
Пример 94А
2-Хлор-N'-гидрокси-4-метилбензолкарбоксимидамид
К раствору 2-хлор-4-метилбензонитрила (300 мг, 1.98 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (206 мг, 2.97 ммоль) и триэтиламин (260 мг, 2.57 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°С. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (224 мг, 29% теоретический выход, чистота 48%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=1.64 мин, m/z=185 (М+Н)+
Пример 95А
2-Фтор-N'-гидрокси-4-метилбензолкарбоксимидамид
К раствору 2-фтор-4-метилбензонитрила (300 мг, 2.22 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (231 мг, 3.33 ммоль) и триэтиламин (292 мг, 2.89 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°С. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (268 мг, 66% теоретический выход, чистота 92%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=1.52 мин, m/z=169 (М+Н)+
Пример 96А
3-Хлор-2-фтор-N'-гидроксибензолкарбоксимидамид
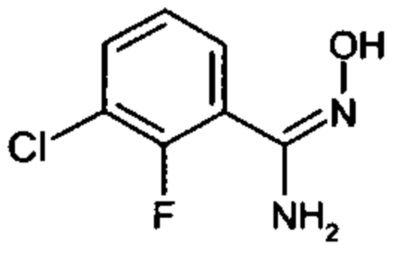
К раствору 3-хлор-2-фторбензонитрила (1 г, 6.43 ммоль) в 32 мл этанола добавили гидроксиламмония хлорид (670 мг, 9.64 ммоль) и триэтиламин (846 мг, 8.36 ммоль), и затем реакционную смесь перемешивали 3.5 ч при 50°С. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (1.29 г, 100% теоретический выход).
LC-MS (способ 2В): Rt=1.65 мин, m/z=189 (М+Н)+
Пример 97А
3-Фтор-N'-гидрокси-4-(трифторметил)бензолкарбоксимидамид

К раствору 3-фтор-4-(трифторметил)бензонитрила (500 мг, 2.64 ммоль) в 13 мл этанола добавили гидроксиламмония хлорид (276 мг, 3.96 ммоль) и триэтиламин (348 мг, 3.44 ммоль), и затем реакционную смесь перемешивали 3.5 ч при 50°С. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (603 мг, 93% теоретический выход, чистота 91%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 1B): Rt=0.72 мин, m/z=223 (М+Н)+
Пример 98А
2-Фтор-N'-гидрокси-4-(трифторметил)бензолкарбоксимидамид
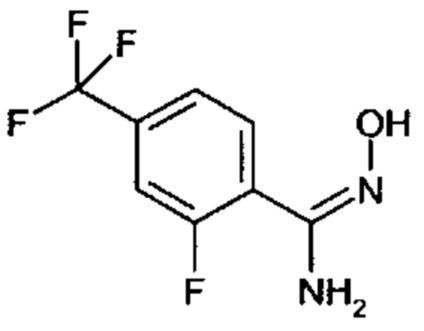
К раствору 2-фтор-4-(трифторметил)бензонитрила (500 мг, 2.64 ммоль) в 13 мл этанола добавили гидроксиламмония хлорид (275 мг, 3.96 ммоль) и триэтиламин (348 мг, 3.44 ммоль), и затем реакционную смесь перемешивали 13 ч при 50°С. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (525 мг, 82% теоретический выход, чистота 91%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 1B): Rt=0.64 мин, m/z=223 (М+Н)+
Пример 99А
2-Хлор-N'-гидрокси-4-(трифторметил)бензолкарбоксимидамид
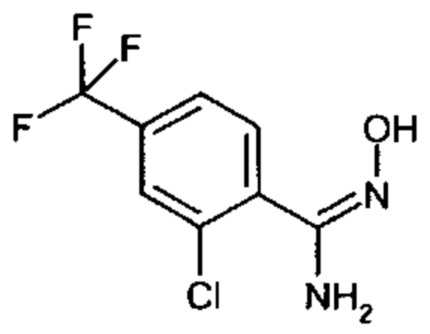
К раствору 2-хлор-4-(трифторметил)бензонитрила (500 мг, 2.43 ммоль) в 12 мл этанола добавили гидроксиламмония хлорид (253 мг, 3.65 ммоль) и триэтиламин (320 мг, 3.16 ммоль), и затем реакционную смесь перемешивали 3.5 ч при 50°С. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (481 мг, 67% теоретический выход, чистота 80%). Соединение применяли без дальнейшей очистки.
LC-MS (Способ 3В): Rt=1.49 мин, m/z=239 (М+Н)+
Пример 100А
5-Хлор-2-фтор-N'-гидроксибензолкарбоксимидамид
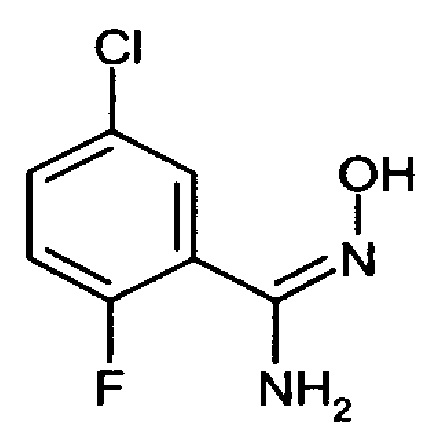
К раствору 5-хлор-2-фторбензонитрила (500 мг, 3.21 ммоль) в 16 мл этанола добавили гидроксиламмония хлорид (335 мг, 4.82 ммоль) и триэтиламин (422 мг, 4.18 ммоль), и затем реакционную смесь перемешивали 6 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (465 мг, 65% теоретический выход, чистота 85%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 3B): Rt=0.68 мин, m/z=189 (М+Н)+
Пример 101А
3-Хлор-5-фтор-N’-гидроксибензолкарбоксимидамид
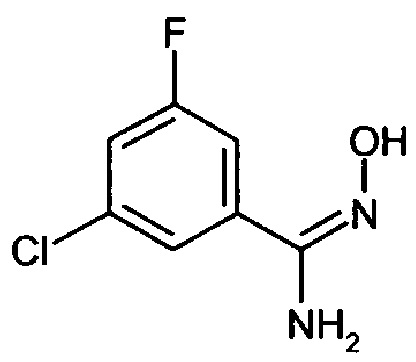
К раствору 3-хлор-5-фторбензонитрила (500 мг, 3.21 ммоль) в 10 мл эталона добавили гидроксиламмония хлорид (335 мг, 4.82 ммоль) и триэтиламин (422 мг, 4.18 ммоль), и затем реакционную смесь перемешивали 6 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (577 мг, 89% теоретический выход, чистота 94%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 3B): Rt=1.08 мин, m/z=189 (М+Н)+
Пример 102А
N’-гидрокси-2-метил-4-(трифторметил)бензолкарбоксимидамид

К раствору 2-метил-4-(трифторметил)бензонитрила (500 мг, 2.70 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (281 мг, 4.05 ммоль) и триэтиламин (355 мг, 3.51 ммоль), и затем реакционную смесь перемешивали 24 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (450 мг, 76% теоретический выход).
LC-MS (способ 2В): Rt=1.69 и 1.91 мин, m/z=219 (М+Н)+
Пример 103А
3-Хлор-N’-гидрокси-2-метилбензолкарбоксимидамид

К раствору 3-хлор-2-метилбензонитрила (500 мг, 3.30 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (343 мг, 4.95 ммоль) и триэтиламин (434 мг, 4.29 ммоль), и затем реакционную смесь перемешивали 12 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (484 мг, 80% теоретический выход).
LC-MS (способ 2В): Rt=1.69 и 1.72 мин, m/z=185 (М+Н)+
Пример 104А
5-Хлор-N’-гидрокси-2-метилбензолкарбоксимидамид
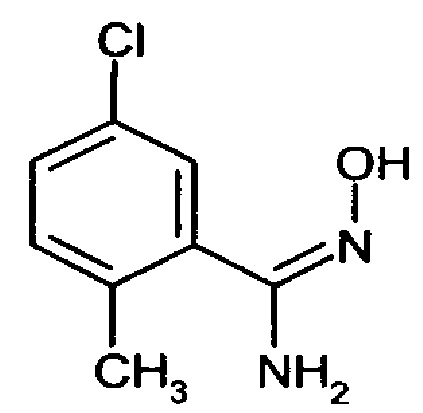
К раствору 5-хлор-2-метилбензонитрила (500 мг, 3.30 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (343 мг, 4.95 ммоль) и триэтиламин (434 мг, 4.29 ммоль), и затем реакционную смесь перемешивали 18 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этил ацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (330 мг, 54% теоретический выход).
LC-MS (способ 7В): Rt=1.69 и 1.72 мин, m/z=185 (М+Н)+
Пример 105А
3-Хлор-N’-гидрокси-4-метоксибензолкарбоксимидамид
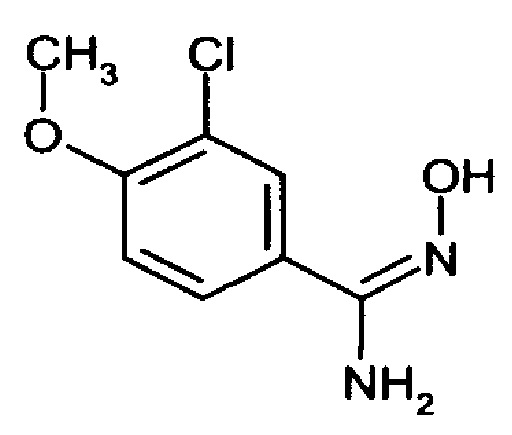
К раствору 3-хлор-4-метоксибензонитрила (500 мг, 3.30 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (311 мг, 4.0 ммоль) и триэтиламин (392 мг, 4.0 ммоль), и затем реакционную смесь перемешивали 16 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и дихлорметане и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (124 мг, 19% теоретический выход).
LC-MS (способ 3B): Rt=0.79 мин, m/z=201 (М+Н)+
Пример 106А
2,3-Дихлор-N’-гидроксибензолкарбоксимидамид
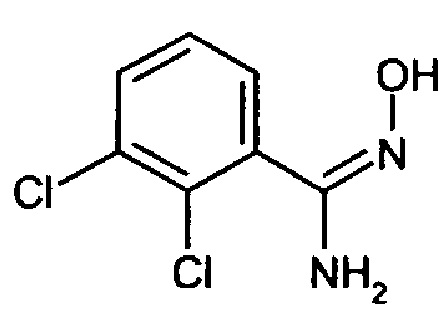
К раствору 2,3-Дихлорбензонитрила (500 мг, 3.30 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (303 мг, 4.0 ммоль) и триэтиламин (382 мг, 4.0 ммоль), и затем реакционную смесь перемешивали 16 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этил ацетате и дихлорметане и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (225 мг, 36% теоретический выход).
LC-MS (способ 2В): Rt=1.66 мин, m/z=205 (М+Н)+
Пример 107А
3-Хлор-4-фтор-N’-гидроксибензолкарбоксимидамид
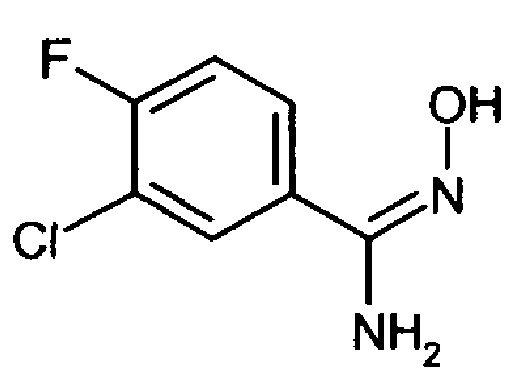
К раствору 3-хлор-4-фторбензонитрила (500 мг, 3.0 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (335 мг, 5.0 ммоль) и триэтиламин (422 мг, 4.0 ммоль), и затем реакционную смесь перемешивали 13 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в дихлорметане и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (451 мг, 74% теоретический выход).
LC-MS (способ 2B): Rt=1.73 мин, m/z=189 (М+Н)+
Пример 108А
5-Хлор-N’-гидрокси-2-(трифторметил)бензолкарбоксимидамид
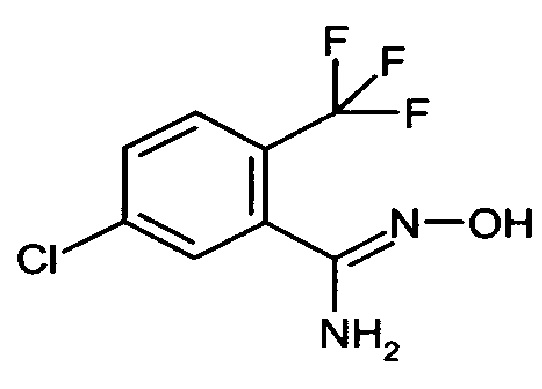
К раствору 5-хлор-2-(трифторметил)бензонитрила (500 мг, 2.0 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (253 мг, 4.0 ммоль) и триэтиламин (320 мг, 3.0 ммоль), и затем реакционную смесь перемешивали 13 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в дихлорметане и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (430 мг, 67% теоретический выход, чистота 90%). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=1.87 мин, m/z=239 (М+Н)+
Пример 109А
N’-гидрокси-6-(трифторметил)пиридин-2-карбоксимидамид
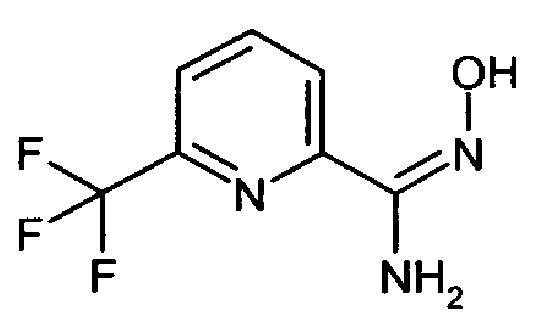
К раствору 6-(трифторметил)пиридин-2-карбонитрила (500 мг, 3.0 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (302 мг, 4.0 ммоль) и триэтиламин (382 мг, 4.0 ммоль), и затем реакционную смесь перемешивали 13 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в дихлорметане и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (261 мг, 44% теоретический выход).
LC-MS (способ 2В): Rt=1.88 мин, m/z=206 (М+Н)+
Пример 110А
N’-гидрокси-4-(трифторметил)пиридин-2-карбоксимидамид
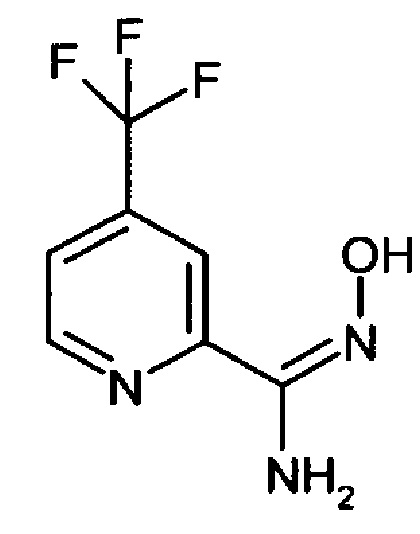
К раствору 4-(трифторметил)пиридин-2-карбонитрила (500 мг, 3.0 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (302 мг, 4.0 ммоль) и триэтиламин (382 мг, 4.0 ммоль), и затем реакционную смесь перемешивали 13 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в дихлорметане и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (432 мг, 65% теоретический выход, 90% чистота). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=1.78 мин, m/z=206 (М+Н)+
Пример 111А
2-Хлор-N’-гидроксипиридин-3-карбоксимидамид
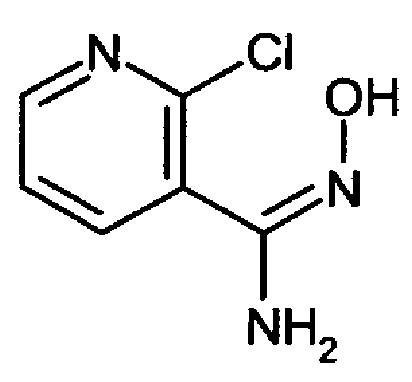
К раствору 2-хлорникотинонитрила (500 мг, 4.0 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (376 мг, 5.0 ммоль) и триэтиламин (474 мг, 5.0 ммоль), и затем реакционную смесь перемешивали 13 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в дихлорметане и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (300 мг, 24% теоретический выход, 50% чистота). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=0.48 мин, m/z=172 (М+Н)+
Пример 112А
3-Хлор-N’-гидрокси-4-(трифторметокси)бензолкарбоксимидамид
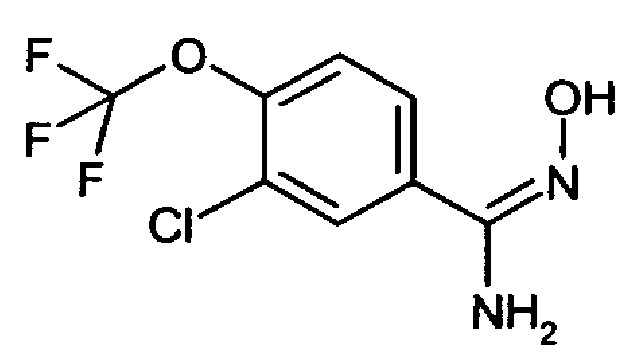
К раствору 3-хлор-4-(трифторметокси)бензонитрила (500 мг, 2.0 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (235 мг, 3.0 ммоль) и триэтиламин (297 мг, 3.0 ммоль), и затем реакционную смесь перемешивали 13 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в дихлорметане и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (243 мг, 33% теоретический выход, 77% чистота). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=2.16 мин, m/z=255 (М+Н)+
Пример 113А
2,6-Дихлор-N’-гидрокси-4-(трифторметил)бензолкарбоксимидамид
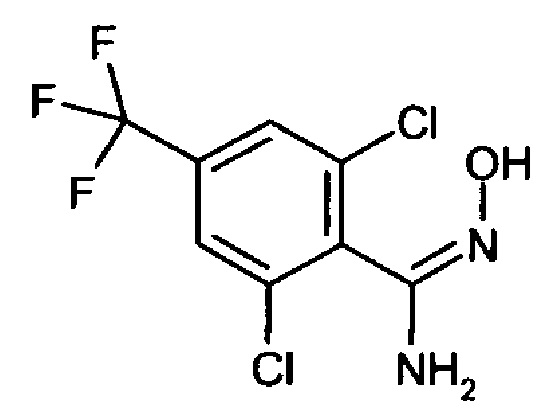
К раствору 2,6-дихлор-4-(трифторметил)бензонитрила (500 мг, 2.08 ммоль) в 12 мл этанола добавили гидроксиламмония хлорид (217 мг, 3.12 ммоль) и триэтиламин (274 мг, 2.71 ммоль), и затем реакционную смесь перемешивали 3.5 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этил ацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (399 мг, 16% теоретический выход, 22% чистота). Соединение применяли без дальнейшей очистки.
LC-MS (способ 1B): Rt=0.72 мин, m/z=273 (М+Н)+
Пример 114А
3,5-Дихлор-N’-гидроксибензолкарбоксимидамид

К раствору 3,5-дихлорбензонитрила (500 мг, 3.00 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (303 мг, 4.00 ммоль) и триэтиламин (382 мг, 4.0 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в дихлорметане и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (108 мг, 10% теоретический выход, 58% чистота). Соединение применяли без дальнейшей очистки.
LC-MS (способ 1B): Rt=1.99 мин, m/z=205 (М+Н)+
Пример 115А
N’-гидрокси-2,4-бис(трифторметил)бензолкарбоксимидамид
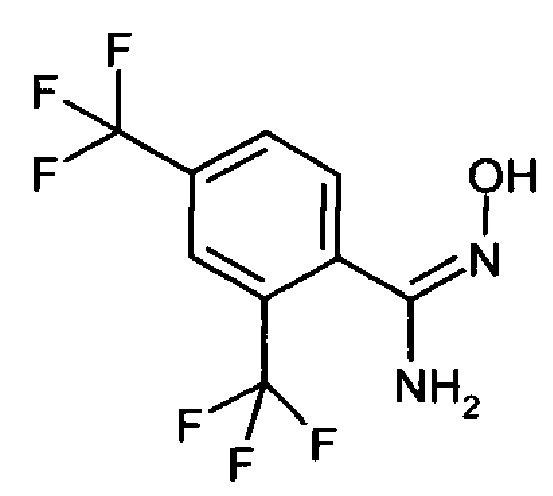
К раствору 2,4-(трифторметил)бензонитрил (500 мг, 2.10 ммоль) в 12 мл этанола добавили гидроксиламмония хлорид (218 мг, 3.14 ммоль) и триэтиламин (275 мг, 2.72 ммоль), и затем реакционную смесь перемешивали 3.5 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (397 мг, 27% теоретический выход, 39% чистота). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=2.04 мин, m/z=273 (М+Н)+
Пример 116А
N’-гидрокси-4-(трифторметил)бензолкарбоксимидамид
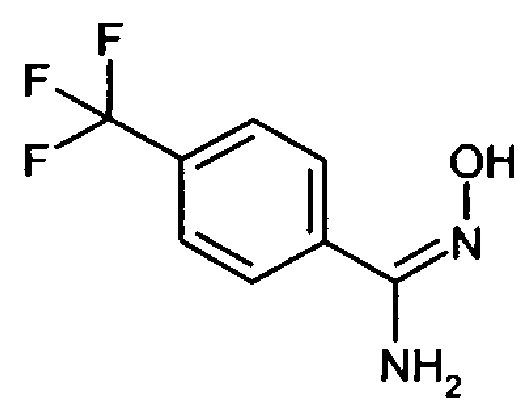
К раствору 4-(трифторметил)бензонитрила (5 г, 29.22 ммоль) в 148 мл этанола добавили гидроксиламмония хлорид (3.05 г, 43.83 ммоль) и триэтиламин (3.84 г, 37.98 ммоль), и затем реакционную смесь перемешивали 5 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этил ацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (5.93 г, 99% теоретический выход).
LC-MS (способ 2В): Rt=1.86 мин, m/z=205 (М+Н)+
Пример 117А
N’-гидрокси-3-метокси-4-метилбензолкарбоксимидамид
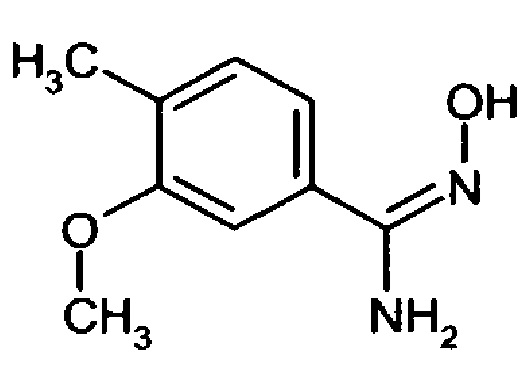
К раствору 3-метокси-4-метилбензонитрила (300 мг, 2.03 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (212 мг, 3.06 ммоль) и триэтиламин (268 мг, 2.65 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (274 мг, 75% теоретический выход).
LC-MS (способ 1B): Rt=0.33 мин, m/z=181 (М+Н)+
Пример 118А
3-Фтор-N’-гидрокси-4-метилбензолкарбоксимидамид
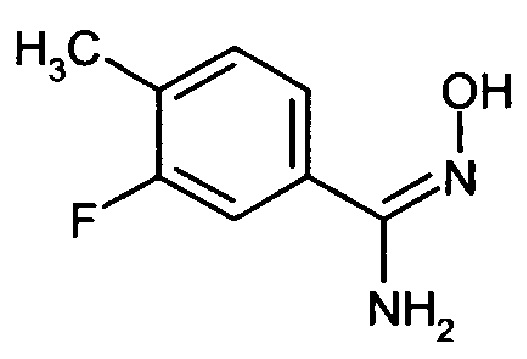
К раствору 3-фтор-4-метилбензонитрила (300 мг, 2.22 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (231 мг, 3.33 ммоль) и триэтиламин (292 мг, 2.89 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (331 мг, 87% теоретический выход).
LC-MS (способ 2В): Rt=1.61 мин, m/z=169 (М+Н)+
Пример 119А
N’-гидрокси-4-метил-3-(трифторметил)бензолкарбоксимидамид
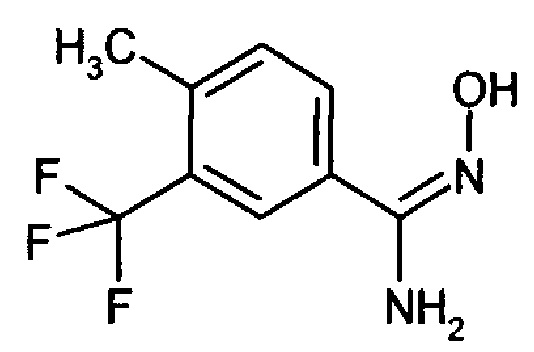
К раствору 4-метил-3-(трифторметил)бензонитрила (300 мг, 1.62 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (168 мг, 2.43 ммоль) и триэтиламин (213 мг, 2.11 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой и соляным раствором. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (352 мг, 100% теоретический выход).
LC-MS (способ 2В): Rt=1.97 мин, m/z=219 (М+Н)+
Пример 120А
3-Хлор-N’-гидрокси-4-метилбензолкарбоксимидамид
К раствору 3-хлор-4-метилбензонитрила (300 мг, 1.98 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (207 мг, 2.97 ммоль) и триэтиламин (260 мг, 2.58 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°C. После этого периода времени гидроксиламмония хлорид (69 мг, 1.0 ммоль) и триэтиламин (100 мг, 1.0 ммоль) снова добавили, и смесь перемешивали в течение 2 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (325 мг, 58% теоретический выход, 65% чистота). Соединение применяли без дальнейшей очистки.
LC-MS (способ 1B): Rt=0.46 мин, m/z=185 (М+Н)+
Пример 121А
N’-гидрокси-3,4-диметилбензолкарбоксимидамид
К раствору 3,4-диметилбензонитрила (300 мг, 2.29 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (238 мг, 3.43 ммоль) и триэтиламин (301 мг, 2.97 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (282 мг, 75% теоретический выход).
LC-MS (способ 1B): Rt=0.33 мин, m/z=165 (М+Н)+
Пример 122А
3-Хлор-N’-гидроксибензолкарбоксимидамид
К раствору 3-хлорбензонитрила (10 г, 72.7 ммоль) в 367 мл этанол добавили гидроксиламмония хлорид (7.58 г, 109.0 ммоль) и триэтиламин (9.56 г, 94.5 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (10.77 г, 81% теоретический выход, 93% чистота). Соединение применяли без дальнейшей очистки.
LC-MS (способ 2В): Rt=1.64 мин, m/z=171 (М+Н)+
Пример 123А
6-хлор-N’-гидроксипиридин-2-карбоксимидамид
К раствору пиридин-2-карбонитрила (500 мг, 4.0 ммоль) в 10 мл этанола добавили гидроксиламмония хлорид (376 мг, 5.0 ммоль) и триэтиламин (474 мг, 5.0 ммоль), и затем реакционную смесь перемешивали всю ночь при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (573 мг, 81% теоретический выход).
LC-MS (Способ 7В): Rt=1.58 мин, m/z=172 (М+Н)+
Пример 124А
N’-гидрокси-2-метил-4-(трифторметил)бензолкарбоксимидамид
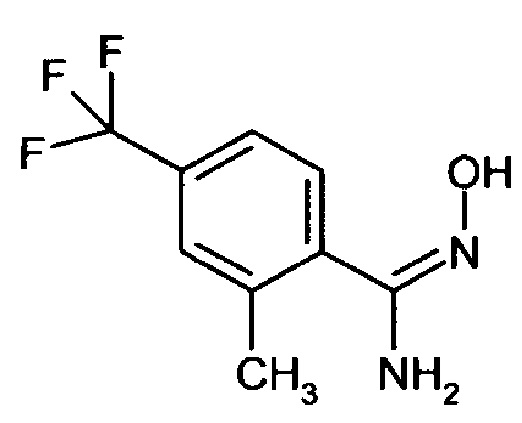
К раствору 2-метил-4-(трифторметил)бензонитрила (500 мг, 2.70 ммоль) в 14 мл этанола добавили гидроксиламмония хлорид (281 мг, 4.05 ммоль) и триэтиламин (355 мг, 3.51 ммоль), и затем реакционную смесь перемешивали 24 ч при 50°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество растворили в этилацетате и экстрагировали водой. Органическую фазу высушивали над сульфатом магния, отфильтровали и выпарили в вакууме с получением соединения, указанного в названии (450 мг, 76% теоретический выход).
LC-MS (способ 2B): Rt=1.91 мин, m/z=219 (М+Н)+
Пример 125А
Трет-бутил 4-(5-оксо-3-{3-[3-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-3-(трифторметил)бензолкарбоксимидамид (112 мг, 0.55 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя из собранных фракций получили твердое вещество белого цвета с получением соединения, указанного в названии (63 мг, 43% теоретический выход).
LC-MS (способ 1B): Rt=1.35 мин, m/z=531 (М+Н)+
Пример 126А
Трет-бутил 4-{3-[3-(3-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
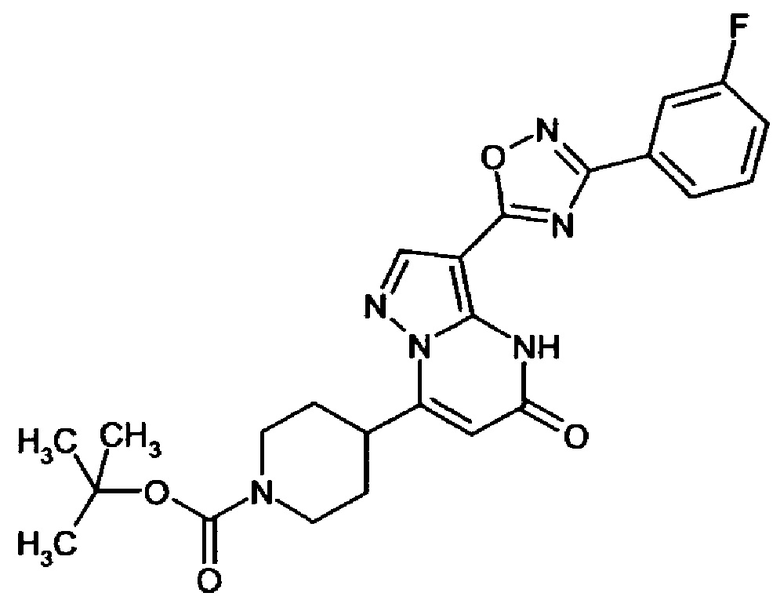
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3-фтор-N’-гидроксибензолкарбоксимидамид (85 мг, 0.55 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя из собранных фракций получили твердое вещество белого цвета с получением соединения, указанного в названии (90 мг, 68% теоретический выход).
LC-MS (способ 1B): Rt=1.27 мин, m/z=479 (М-Н)-
Пример 127А
Трет-бутил 4-(5-оксо-3-{3-[4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
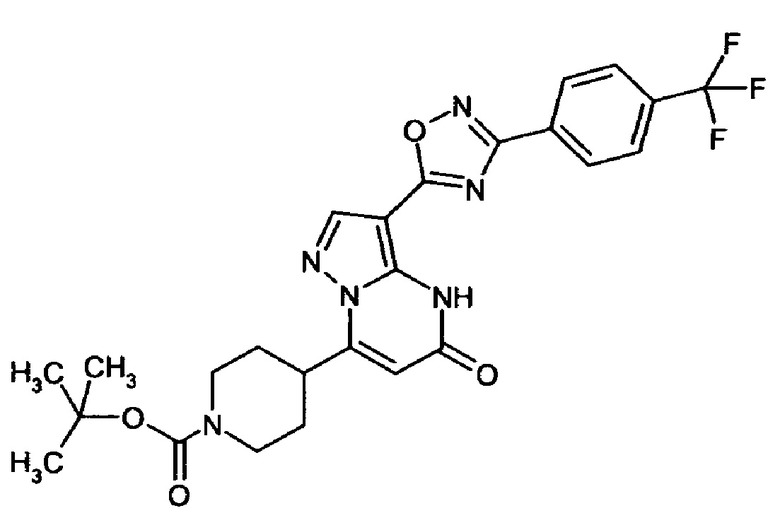
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (5.26 г, 14.52 ммоль) в 105 мл диметилформамида добавили 1,1'-карбонилдиимидазол (4.71 г, 29.05 ммоль), DBU (5.20 г, 34.13 ммоль) и N,N-Диизопропилэтиламин (3.75 г, 29.05 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-4-(трифторметил)бензолкарбоксимидамид (5.93 г, 29.05 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество очистили посредством флеш-хроматографии на силикагеле (растворитель : дихлорметан). После выпаривания фракций, полученное твердое вещество перекристаллизовали из ацетонитрила с получением соединения, указанного в названии (1.52 г, 20% теоретический выход).
LC-MS (способ 1B): Rt=1.39 мин, m/z=531 (М+Н)+
Пример 128А
Трет-бутил 4-{3-[3-(4-бензилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
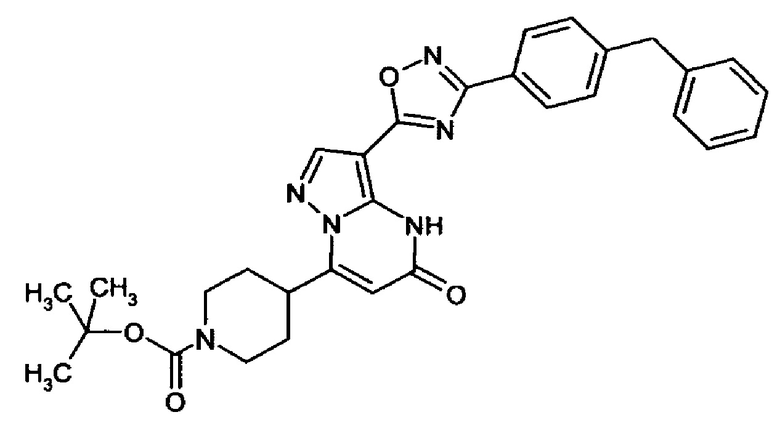
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамидае добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 4-бензил-N’-гидрокси-2-фенилэтанимидамид (124 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя из собранных фракций получили твердое вещество белого цвета с получением соединения, указанного в названии (12 мг, 6% теоретический выход).
LC-MS (способ 1B): Rt=1.11 мин, m/z=477 (М+Н)+
Пример 129А
Трет-бутил 4-(5-оксо-3-{3-[4-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
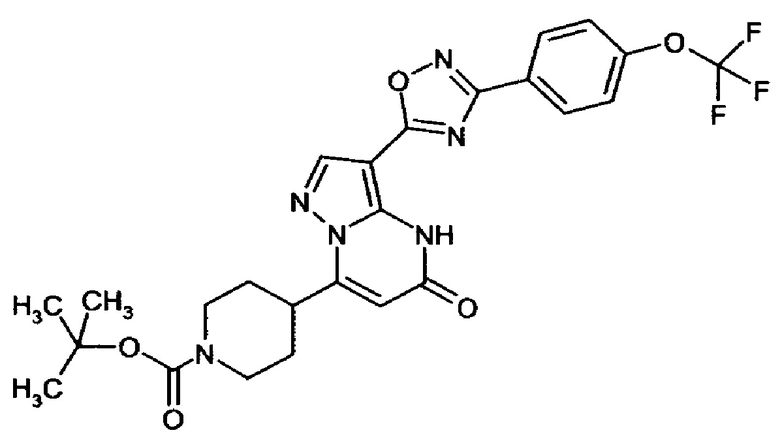
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-4-(трифторметокси)бензолкарбоксимидамид (182 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя из собранных фракций получили твердое вещество белого цвета с получением соединения, указанного в названии (117 мг, 52% теоретический выход).
LC-MS (способ 1B): Rt=1.33 мин, m/z=547 (М+Н)+
Пример 130А
Трет-бутил 4-{3-[3-(3-метокси-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
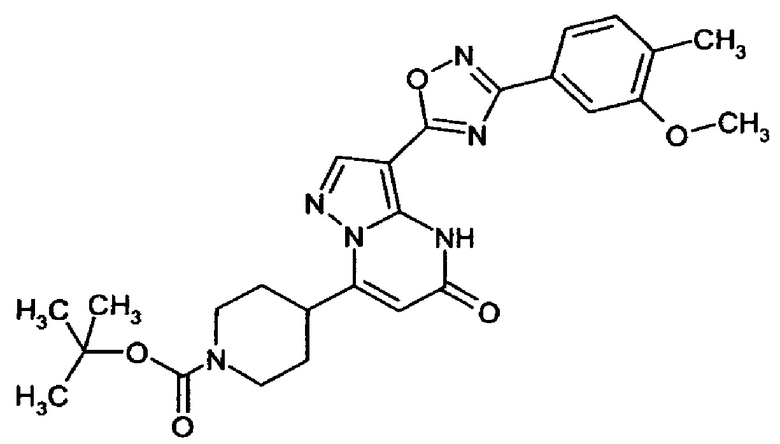
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-3-метокси-4-метилбензолкарбоксимидамид (149 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя из собранных фракций получили твердое вещество белого цвета с получением соединения, указанного в названии (26 мг, 11% теоретический выход, чистота 90%).
LC-MS (способ 1B): Rt=1.29 мин, m/z=507 (М+Н)+
Пример 131А
Трет-бутил 4-{3-[3-(3-фтор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
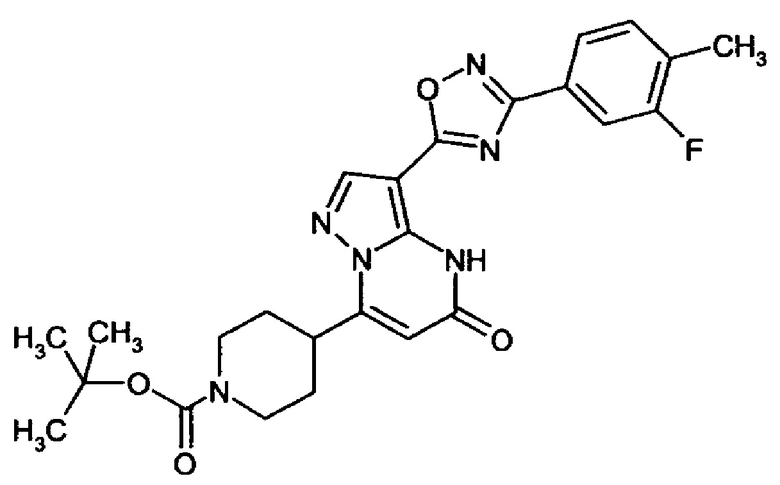
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3-фтор-N’-гидрокси-4-метилбензолкарбоксимидамид (139 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя из собранных фракций получили твердое вещество белого цвета с получением соединения, указанного в названии (87 мг, 42% теоретический выход).
LC-MS (способ 1B): Rt=1.28 мин, m/z=495 (М+Н)+
Пример 132А
Трет-бутил 4-(3-{3-[4-метил-3-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
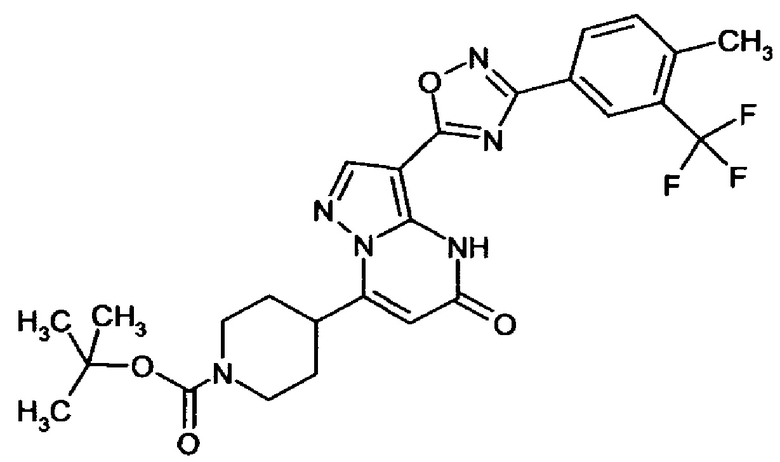
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-4-метил-3-(трифторметил)бензолкарбоксимидамид (180 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя из собранных фракций получили твердое вещество белого цвета с получением соединения, указанного в названии (126 мг, 43% теоретический выход, чистота 76%).
LC-MS (способ 1B): Rt=1.36 мин, m/z=545 (М+Н)+
Пример 133А
Трет-бутил 4-{3-[3-(2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
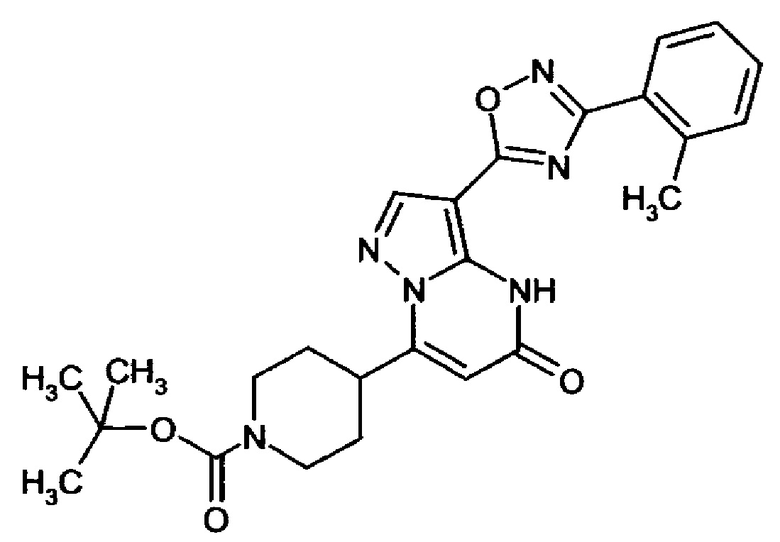
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-2-метилбензолкарбоксимидамид (149 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций твердое вещество белого цвета образовалось в водной фазе, которое отфильтровали и высушивали в вакууме всю ночь с получением соединения, указанного в названии (109 мг, 55% теоретический выход).
LC-MS (способ 1B): Rt=1.30 мин, m/z=477 (М+Н)+
Пример 134А
Трет-бутил 4-{3-[3-(3-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
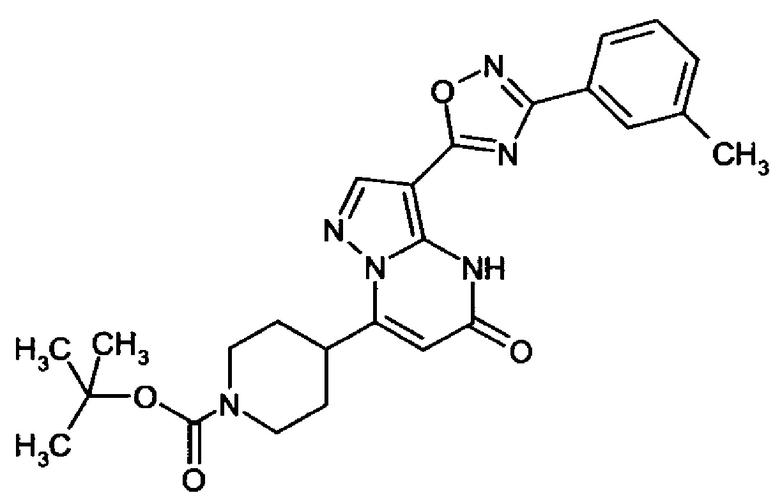
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-3-метилбензолкарбоксимидамид (124 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций твердое вещество белого цвета образовалось в водной фазе, которое отфильтровали и высушивали в вакууме всю ночь с получением соединения, указанного в названии (67 мг, 32% теоретический выход, чистота 94%).
LC-MS (способ 1B): Rt=1.31 мин, m/z=477 (М+Н)+
Пример 135А
Трет-бутил 4-{3-[3-(2-хлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
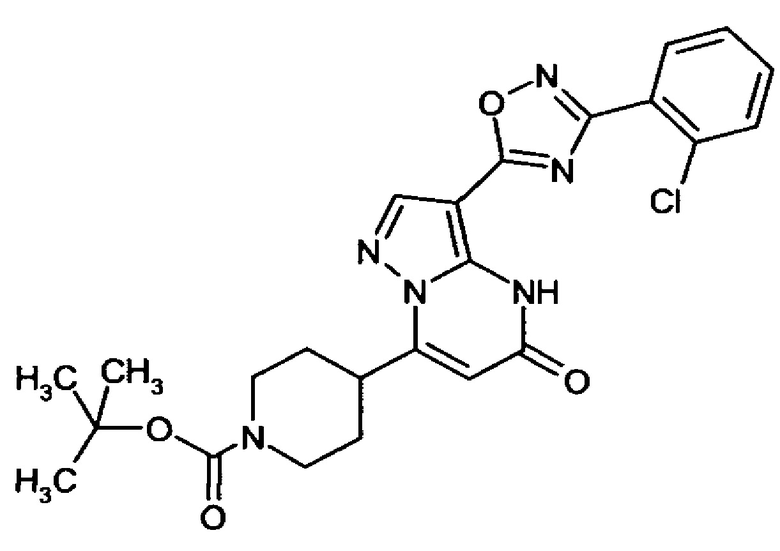
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 2-хлор-N’-гидроксибензолкарбоксимидамид (124 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций, твердое вещество белого цвета образовалось в водной фазе, которое отфильтровали и высушивали в вакууме всю ночь с получением соединения, указанного в названии (107 мг, 52% теоретический выход).
LC-MS (способ 1B): Rt=1.26 мин, m/z=497 (М+Н)+
Пример 136А
Трет-бутил 4-{3-[3-(3-фтор-4-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
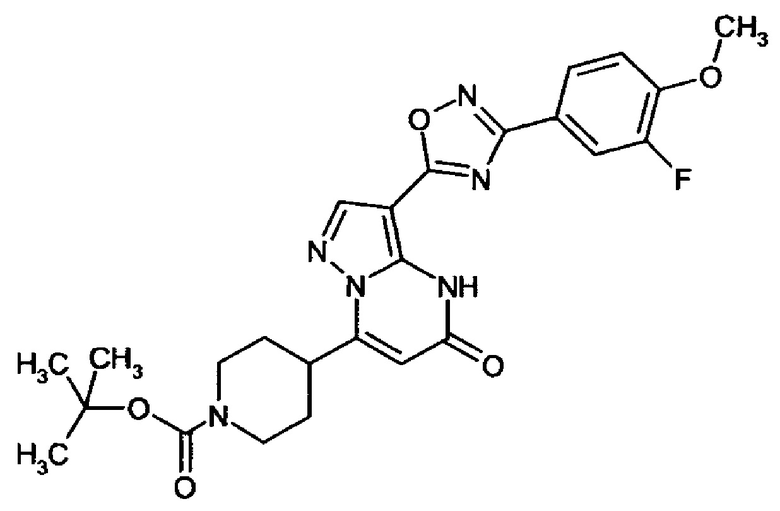
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3-фтор-N’-гидрокси-4-метоксибензолкарбоксимидамид (152 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 6 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций, твердое вещество белого цвета образовалось в водной фазе, которое отфильтровали и высушивали в вакууме всю ночь с получением соединения, указанного в названии (85 мг, 40% теоретический выход).
LC-MS (способ 1B): Rt=1.26 мин, m/z=511 (М+Н)+
Пример 137А
Трет-бутил 4-{3-[3-(3-хлор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
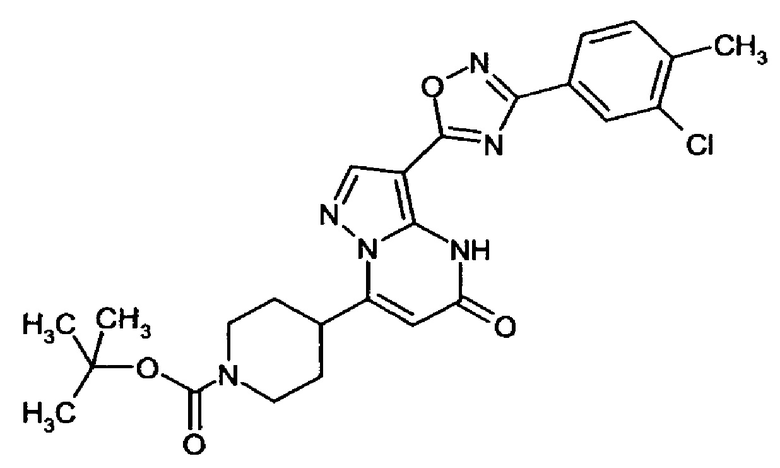
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3-хлор-N’-гидрокси-4-метилбензолкарбоксимидамид (124 мг, 0.83 ммоль, 65% чистота) добавили, и смесь перемешивали в течение 6 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций твердое вещество белого цвета образовалось в водной фазе, которое отфильтровали и высушивали в вакууме всю ночь с получением соединения, указанного в названии (87 мг, 37% теоретический выход, чистота 90%).
LC-MS (способ 1B): Rt=1.34 мин, m/z=511 (М+Н)+
Пример 138А
Трети-бутил 4-(5-оксо-3-{3-[3-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилзтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-3-(трифторметокси)бензолкарбоксимидамид (364 мг, 0.83 ммоль, 50% чистота) добавили, и смесь перемешивали в течение 5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций твердое вещество белого цвета образовалось в водной фазе, которое отфильтровали и высушивали в вакууме всю ночь с получением соединения, указанного в названии (68 мг, 29% теоретический выход).
LC-MS (способ 1B): Rt=4.39 мин, m/z=546 (М-Н)-
Пример 139А
Трет-бутил 4-{3-[3-(3-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
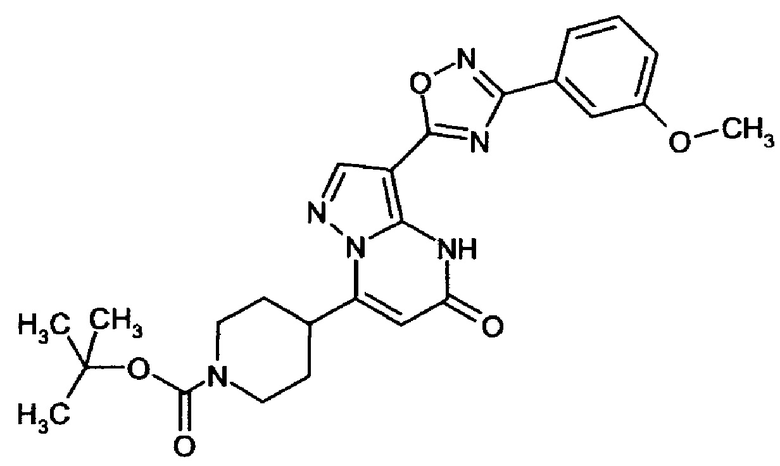
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 2.6 мл 1-метил-2-пирролидона добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль) и N,N-Диизопропилэтиламин (106 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-3-метоксибензолкарбоксимидамид (68 мг, 0.41 ммоль) добавили, и смесь перемешивали в течение 8 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций твердое вещество белого цвета образовалось в водной фазе, которое отфильтровали и высушивали в вакууме всю ночь с получением соединения, указанного в названии (81 мг, 36% теоретический выход, 90% чистота).
LC-MS (способ 1B): Rt=1.17 мин, m/z=493 (М+1)+
Пример 140А
Трет-бутил 4-{3-[3-(4-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
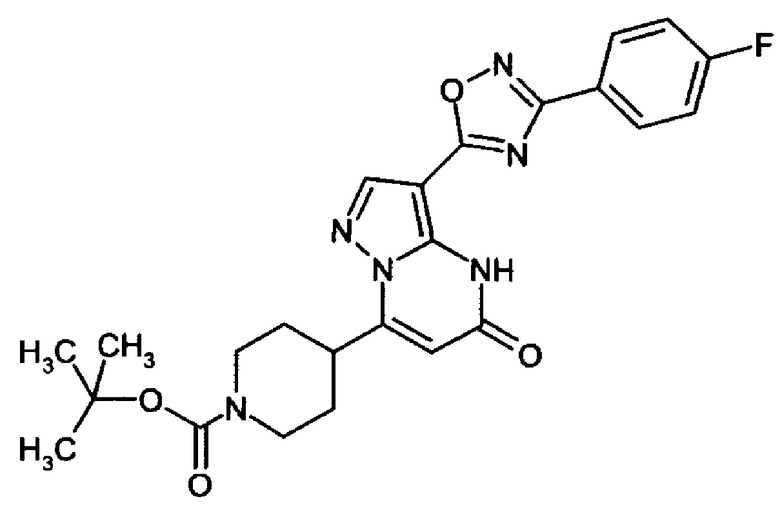
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (107 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 4-фтор-N’-гидроксибензолкарбоксимидамид (127 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций полученное твердое вещество в водной фракции отфильтровали и высушивали всю ночь в вакууме с получением соединения, указанного в названии (33 мг, 16% теоретический выход).
LC-MS (способ 1B): Rt=1.19 мин, m/z=481 (М+Н)+
Пример 141А
Трет-бутил 4-{3-[3-(2,4-диметилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
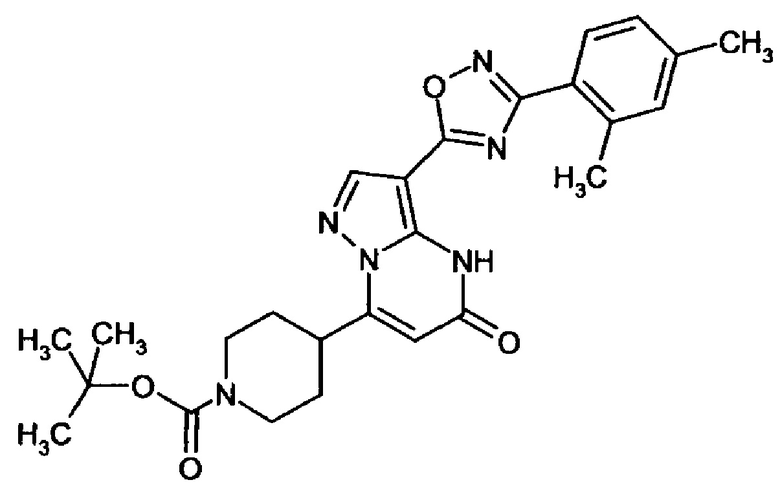
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (107 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-2,4-диметилбензолкарбоксимидамид (136 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 6 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций полученное твердое вещество в водной фракции отфильтровали и высушивали всю ночь в вакууме с получением соединения, указанного в названии (54 мг, 27% теоретический выход).
LC-MS (способ 1B): Rt=1.31 мин, m/z=491 (М+Н)+
Пример 142А
Трет-бутил 4-(3-{3-[4-метил-2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
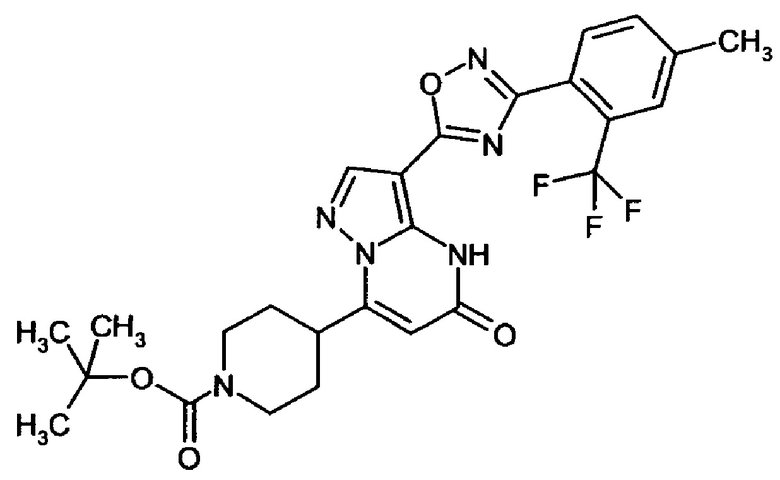
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (144 мг, 0.95 ммоль) и N,N-Диизопропилэтиламин (107 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-4-метил-2-(трифторметил)бензолкарбоксимидамид (277 мг, 0.83 ммоль, 65% чистота) и молекулярные сита добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя из собранных фракций получили твердое вещество белого цвета с получением соединения, указанного в названии (63 мг, 27% теоретический выход).
LC-MS (способ 1B): Rt=1.26 мин, m/z=546 (М+Н)+
Пример 143А
Трет-бутил 4-{3-[3-(3,4-диметилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (144 мг, 0.95 ммоль) и N,N-Диизопропилэтиламин (107 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N’-гидрокси-3,4-диметилбензолкарбоксимидамид (136 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 5.5 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя соединение, указанное в названии, получили (16 мг, 8% теоретический выход).
LC-MS (способ 1B): Rt=1.36 мин, m/z=491 (М+Н)+
Пример 144А
Трет-бутил 4-{3-[3-(2-хлор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (107 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 2-хлор-N’-гидрокси-4-метилбензолкарбоксимидамид (237 мг, 0.58 ммоль, 45% чистота) добавили, и смесь перемешивали в течение 6 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций полученное твердое вещество в водной фракции отфильтровали и высушивали всю ночь в вакууме с получением соединения, указанного в названии (120 мг, 55% теоретический выход).
LC-MS (способ 1B): Rt=1.32 мин, m/z=511 (М+Н)+
Пример 145А
Трет-бутил 4-{3-[3-(2-фтор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
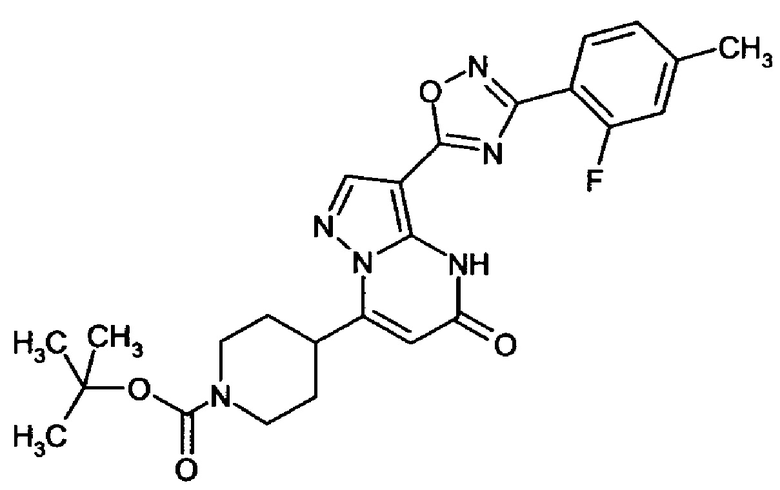
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (107 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 2-фтор-N’-гидрокси-4-метилбензолкарбоксимидамид (151 мг, 0.83 ммоль, 92% чистота) добавили, и смесь перемешивали в течение 3 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания ацетонитрила из собранных фракций полученное твердое вещество в водной фракции отфильтровали и высушивали всю ночь в вакууме с получением соединения, указанного в названии (113 мг, 53% теоретический выход).
LC-MS (способ 1B): Rt=1.27 мин, m/z=495 (М+Н)+
Пример 146А
Трет-бутил 4-{3-[3-(3-хлор-2-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
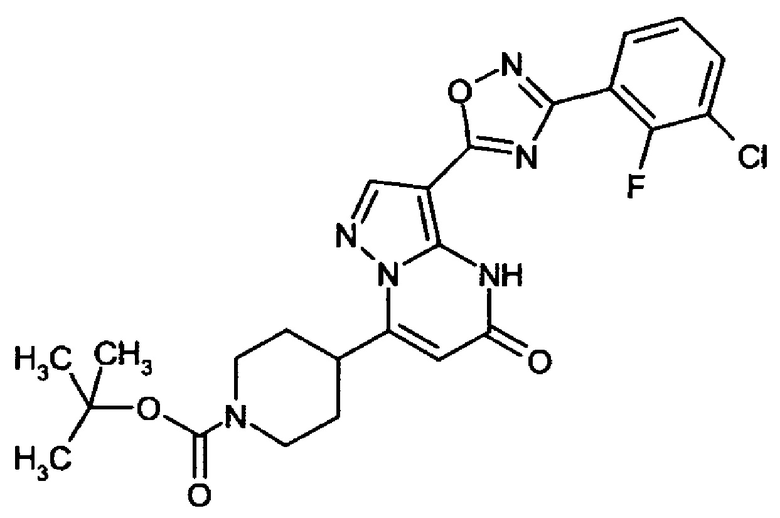
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (1.23 г, 3.40 ммоль) в 34 мл диметилформамида добавили 1,1'-карбонилдиимидазол (1.10 г, 6.81 ммоль), DBU (1.22 мг, 8.00 ммоль) и N,N-Диизопропилэтиламин (880 мг, 6.81 ммоль), и затем реакционную смесь перемешивали 2 ч при 90°C. После этого периода времени 3-хлор-2-фтор-N’-гидроксибензолкарбоксимидамид (1.42 г, 6.81 ммоль, 90% чистота) добавили, и смесь перемешивали в течение 9 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в ацетонитриле и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (88 мг, 5% теоретический выход).
LC-MS (способ 1B): Rt=1.33 мин, m/z=515 (М+Н)+
Пример 147А
Трет-бутил 4-{3-[3-(6-хлорпиридин-2-ил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
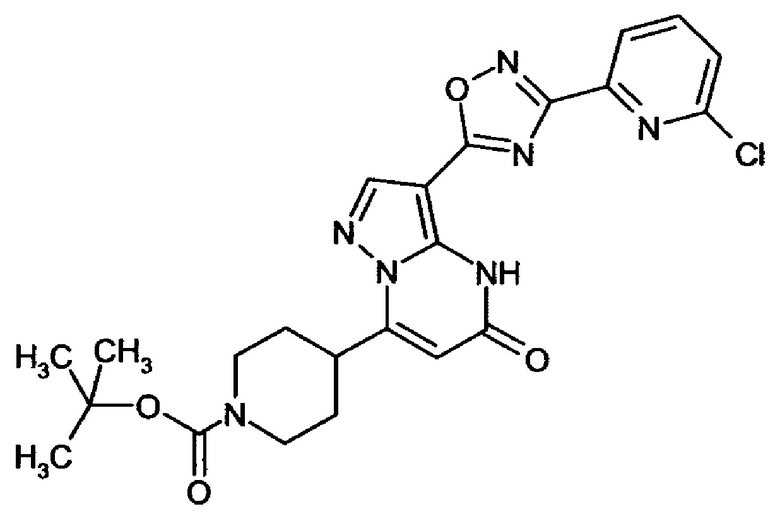
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 4 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (107 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 3 ч при 90°C. После этого периода времени 6-хлор-N’-гидроксипиридин-2-карбоксимидамид (142 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 10 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (31 мг, 14% теоретический выход).
LC-MS (способ 1B): Rt=1.10 мин, m/z=498 (М+Н)+
Пример 148А
Трет-бутил 4-(3-{3-[3-фтор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
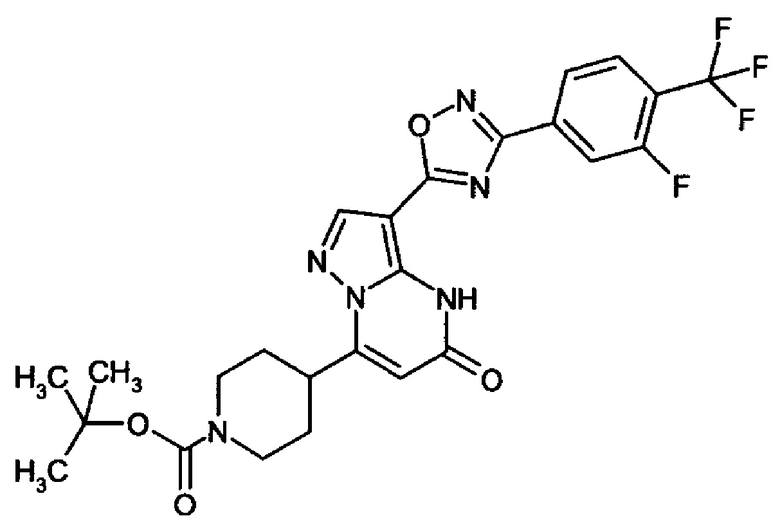
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3-фтор-N’-гидрокси-4-(трифторметил)бензолкарбоксимидамид (134 мг, 0.55 ммоль, 91% чистота) добавили, и смесь перемешивали в течение 20 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 3 мл ацетонитрил и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (26 мг, 9% теоретический выход, 50% чистота).
LC-MS (способ 1B): Rt=1.32 мин, m/z=549 (М+Н)+
Пример 149А
Трет-бутил 4-(3-{3-[2-хлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
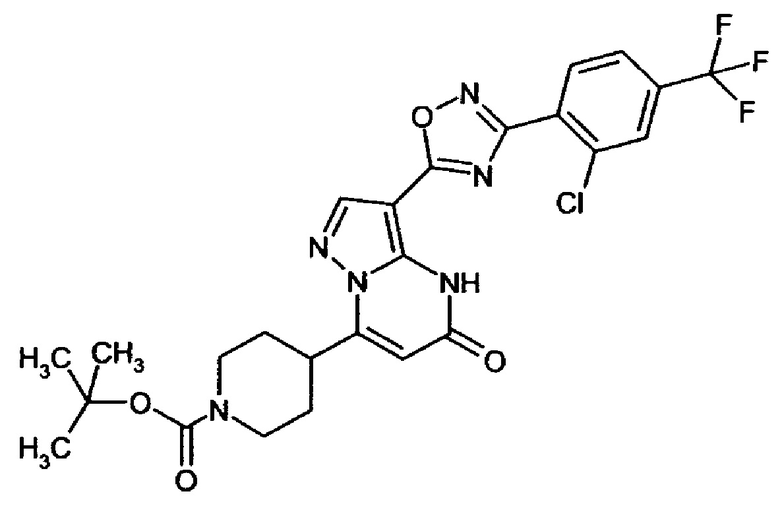
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 2-хлор-N’-гидрокси-4-(трифторметил)бензолкарбоксимидамид (164 мг, 0.55 ммоль, 80% чистота) добавили, и смесь перемешивали в течение 11 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 3 мл ацетонитрил и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (62 мг, 40% теоретический выход).
LC-MS (способ 1B): Rt=1.37 мин, m/z=565 (М+Н)+
Пример 150А
Трет-бутил 4-(3-{3-[2-фтор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
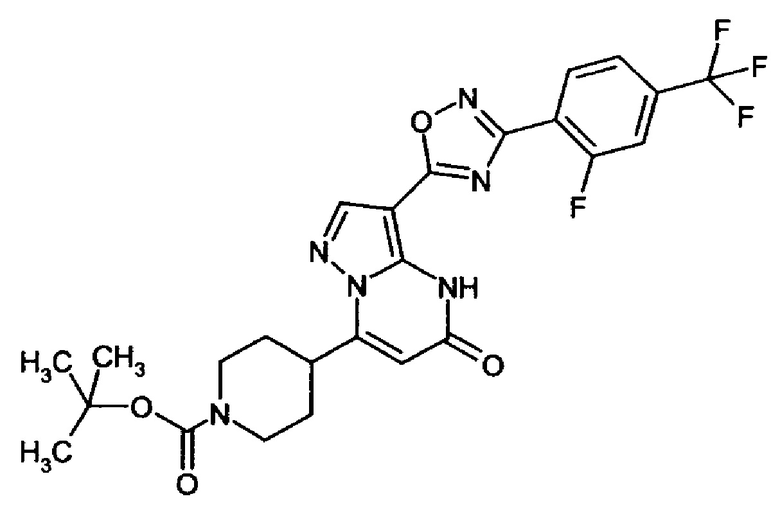
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 2-фтор-N’-гидрокси-4-(трифторметил)бензолкарбоксимидамид (134 мг, 0.55 ммоль, 91% чистота) добавили, и смесь перемешивали в течение 8 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 3 мл ацетонитрил и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (23 мг, 14% теоретический выход, 91% чистота).
LC-MS (способ 1B): Rt=1.14 мин, m/z=548 (М+Н)+
Пример 151А
Трет-бутил 4-{3-[3-(5-хлор-2-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
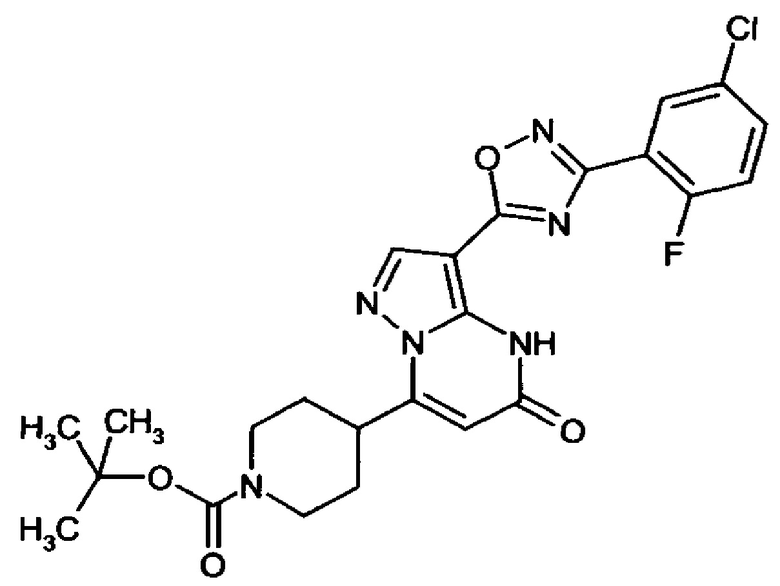
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 5-хлор-2-фтор-N’-гидроксибензолкарбоксимидамид (122 мг, 0.55 ммоль, 85% чистота) добавили, и смесь перемешивали в течение 11 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (19 мг, 13% теоретический выход).
LC-MS (способ 1B): Rt=1.32 мин, m/z=515 (М+Н)+
Пример 152А
Трет-бутил 4-{3-[3-(3-хлор-5-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
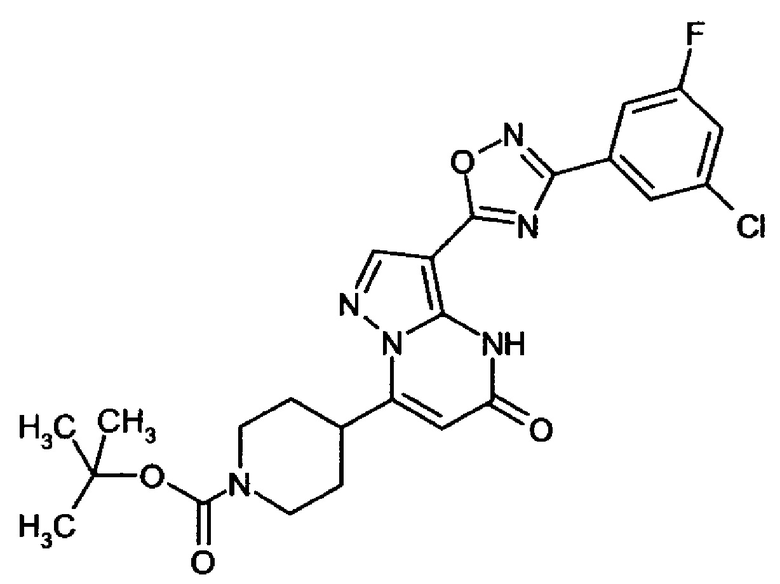
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3-хлор-5-фтор-N’-гидроксибензолкарбоксимидамид (115 мг, 0.55 ммоль, 90% чистота) добавили, и смесь перемешивали в течение 11 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (27 мг, 17% теоретический выход, 93% чистота).
LC-MS (способ 1B): Rt=1.31 мин, m/z=513 (М-Н)-
Пример 153А
Трет-бутил 4-(3-{3-[2-метил-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
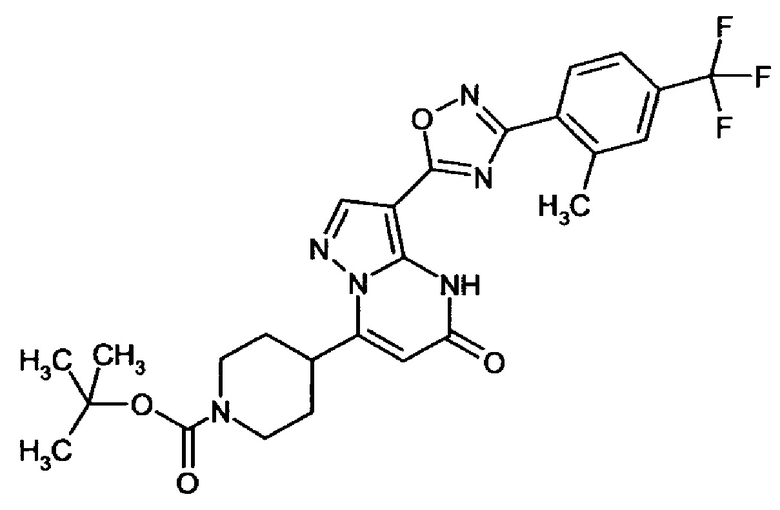
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (194 мг, 0.54 ммоль) в 4 мл диметилформамида добавили 1,1'-карбонилдиимидазол (174 мг, 1.07 ммоль), DBU (191 мг, 1.26 ммоль) и N,N-Диизопропилэтиламин (138 мг, 1.07 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени N’-гидрокси-2-метил-4-(трифторметил)бензолкарбоксимидамид (234 мг, 1.07 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (56 мг, 19% теоретический выход).
LC-MS (способ 1B): Rt=1.36 мин, m/z=545 (М+Н)+
Пример 154А
Трет-бутил 4-{3-[3-(3-хлор-2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
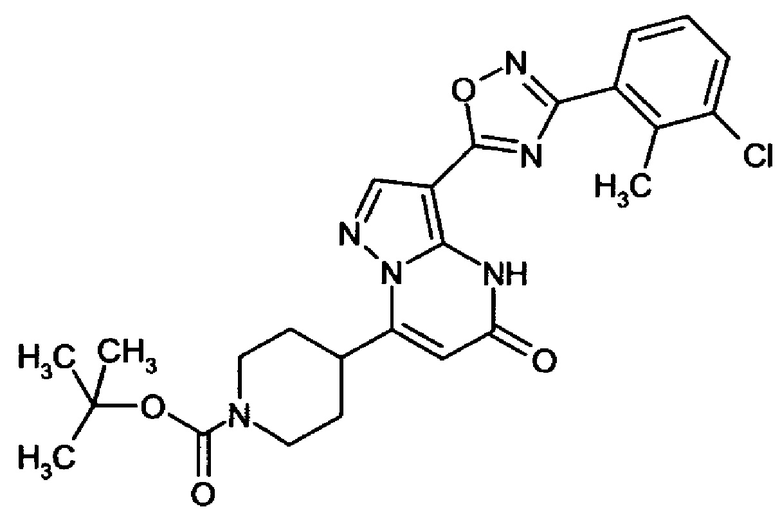
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 0.41 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (134 мг, 0.83 ммоль), DBU (148 мг, 0.97 ммоль) и N,N-Диизопропилэтиламин (107 мг, 0.837 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени 3-хлор-N’-гидрокси-2-метилбензолкарбоксимидамид (153 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (101 мг, 48% теоретический выход).
LC-MS (способ 1B): Rt=1.31 мин, m/z=511 (М+Н)+
Пример 155А
Трет-бутил 4-{3-[3-(5-хлор-2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
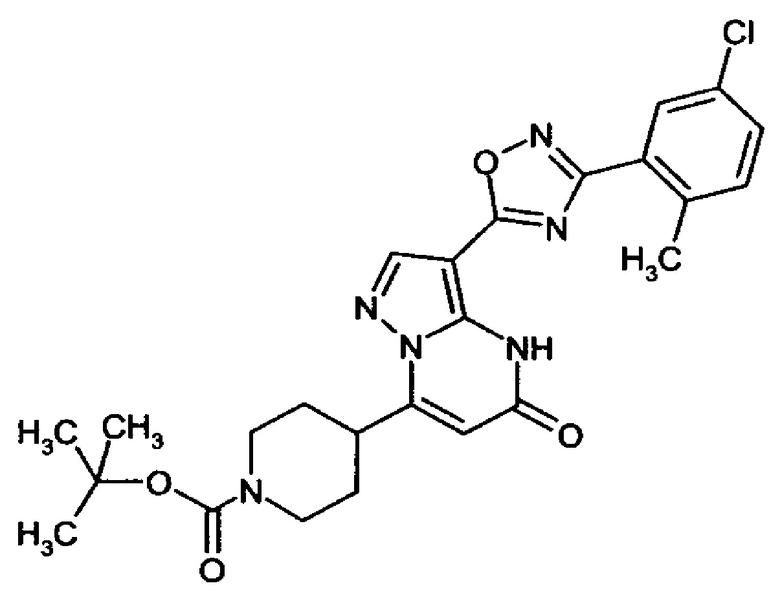
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (170 мг, 0.47 ммоль) в 3.4 мл диметилформамида добавили 1,1'-карбонилдиимидазол (152 мг, 0.94 ммоль), DBU (168 мг, 1.10 ммоль) и N,N-Диизопропилэтиламин (121 мг, 0.94 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени 5-хлор-N’-гидрокси-2-метилбензолкарбоксимидамид (173 мг, 0.94 ммоль) добавили, и смесь перемешивали в течение 10 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (45 мг, 19% теоретический выход).
LC-MS (способ 1B): Rt=1.33 мин, m/z=511 (М+Н)+
Пример 156А
Трет-бутил 4-{3-[3-(3-хлор-4-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
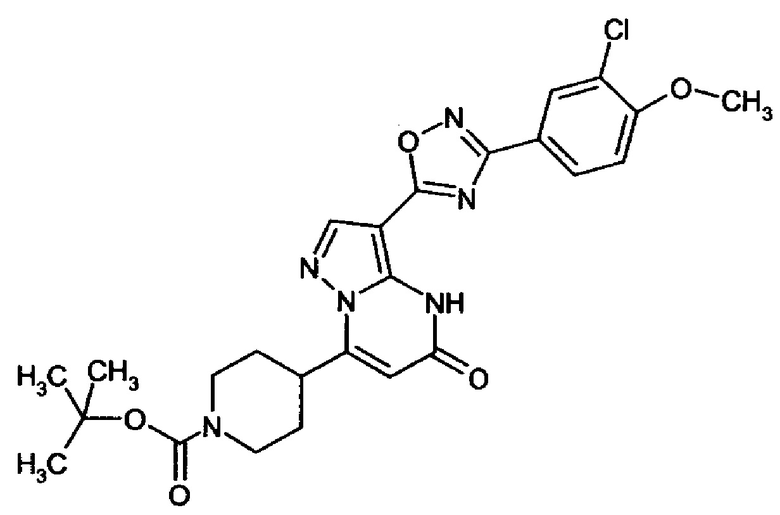
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (62 мг, 0.17 ммоль) в 2.4 мл диметилформамида добавили 1,1'-карбонилдиимидазол (55 мг, 0.34 ммоль), DBU (61 мг, 0.40 ммоль) и N,N-Диизопропилэтиламин (44 мг, 0.34 ммоль), и затем реакционную смесь перемешивали 3 ч при 90°C. После этого периода времени 3-хлор-N’-гидрокси-4-метоксибензолкарбоксимидамид (74 мг, 0.34 ммоль, 93% чистота) добавили, и смесь перемешивали в течение 10 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (37 мг, 41% теоретический выход).
LC-MS (способ 1B): Rt=1.26 мин, m/z=527 (М+Н)+
Пример 157А
Трет-бутил 4-{3-[3-(2,3-дихлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
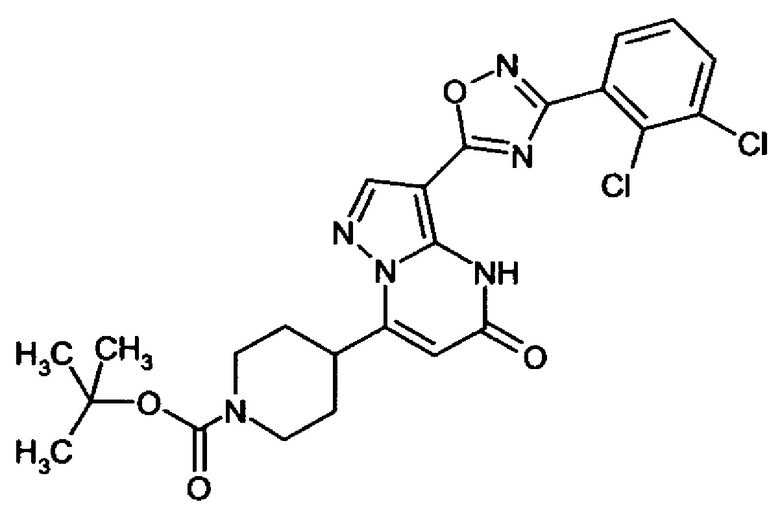
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2.8 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 3 ч при 90°C. После этого периода времени 2,3-дихлор-N’-гидроксибензолкарбоксимидамид (120 мг, 0.55 ммоль, 95% чистота) добавили, и смесь перемешивали в течение 10 ч при 110°C. После охлаждения до комнатной температуры, растворитель выпарили, и неочищенное вещество очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (63 мг, 43% теоретический выход).
LC-MS (способ 1B): Rt=1.33 мин, m/z=531 (М+Н)+
Пример 158А
Трет-бутил 4-{3-[3-(3-хлор-4-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
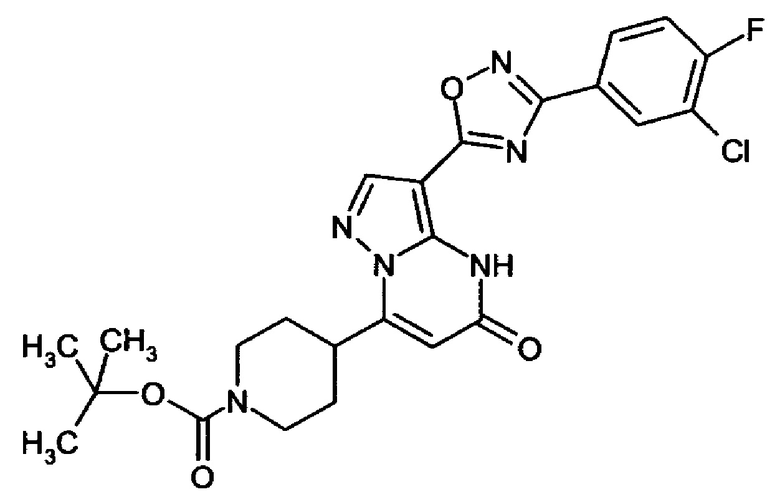
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2.8 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 2 ч при 90°C. После этого периода времени 3-хлор-4-фтор-N’-гидроксибензолкарбоксимидамид (104 мг, 0.55 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (76 мг, 51% теоретический выход).
LC-MS (способ 1B): Rt=1.34 мин, m/z=513 (М+Н)+
Пример 159А
Трет-бутил 4-(3-{3-[5-хлор-2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2.8 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 2 ч при 90°C. После этого периода времени 5-хлор-N’-гидрокси-2-(трифторметил)бензолкарбоксимидамид (132 мг, 0.55 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (54 мг, 34% теоретический выход).
LC-MS (способ 1B): Rt=1.35 мин, m/z=563 (М-Н)-
Пример 160А
Трет-бутил 4-(5-оксо-3-{3-[6-(трифторметил)пиридин-2-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
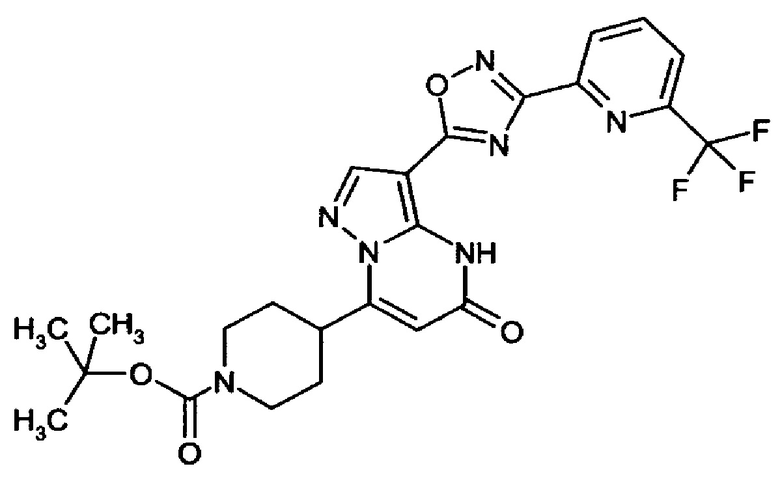
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (151 мг, 0.42 ммоль) в 4.2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (135 мг, 0.83 ммоль), DBU (149 мг, 0.98 ммоль) и N,N-Диизопропилэтиламин (108 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 2 ч при 90°C. После этого периода времени N’-гидрокси-6-(трифторметил)пиридин-2-карбоксимидамид (171 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (111 мг, 50% теоретический выход).
LC-MS (способ 1B): Rt=1.18 мин, m/z=532 (М+Н)+
Пример 161А
Трет-бутил 4-(5-оксо-3-{3-[4-(трифторметил)пиридин-2-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
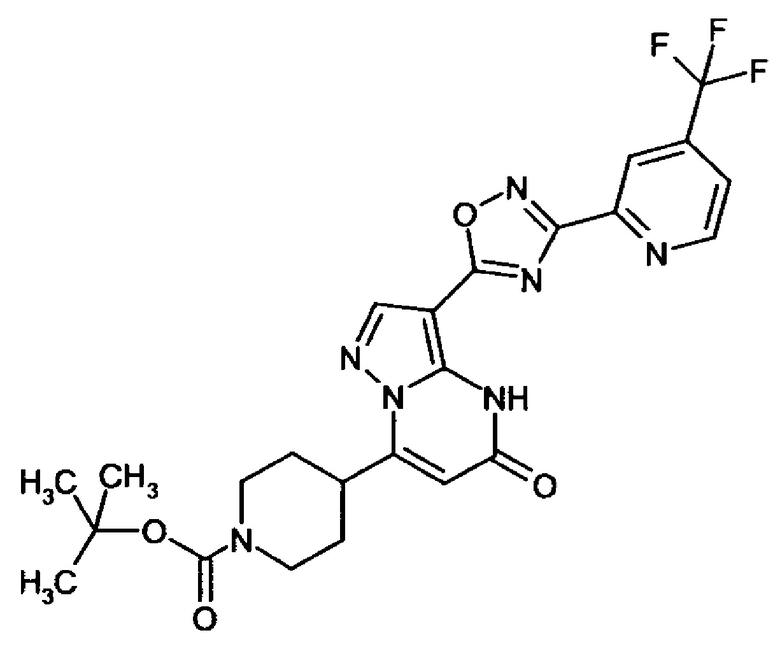
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (151 мг, 0.42 ммоль) в 4.2 мл диметилформамида добавили 1,1'-карбонилдиимидазол (135 мг, 0.83 ммоль), DBU (149 мг, 0.98 ммоль) и N,N-Диизопропилэтиламин (108 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 2 ч при 90°C. После этого периода времени N’-гидрокси-4-(трифторметил)пиридин-2-карбоксимидамид (171 мг, 0.83 ммоль) добавили, и смесь перемешивали в течение 12 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (104 мг, 47% теоретический выход).
LC-MS (способ 1B): Rt=1.20 мин, m/z=532 (М+Н)+
Пример 162А
Трет-бутил 4-{3-[3-(2-хлорпиридин-3-ил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
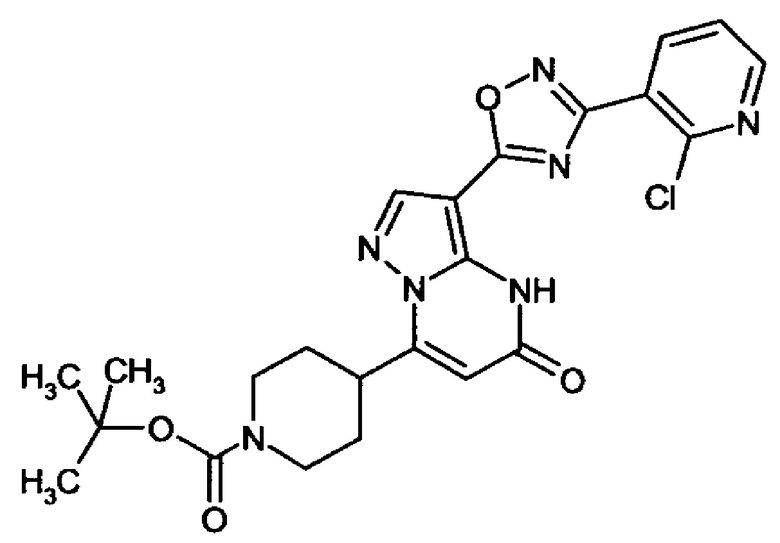
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (151 мг, 0.42 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (135 мг, 0.83 ммоль), DBU (149 мг, 0.98 ммоль) и N,N-Диизопропилэтиламин (108 мг, 0.83 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 2-хлор-N’-гидроксипиридин-3-карбоксимидамид (157 мг, 0.83 ммоль, 91% чистота) добавили, и смесь перемешивали в течение 8 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (42 мг, 20% теоретический выход).
LC-MS (способ IB): Rt=1.10 мин, m/z=498 (М+Н)+
Пример 163А
Трет-бутил 4-(3-{3-[3-хлор-4-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
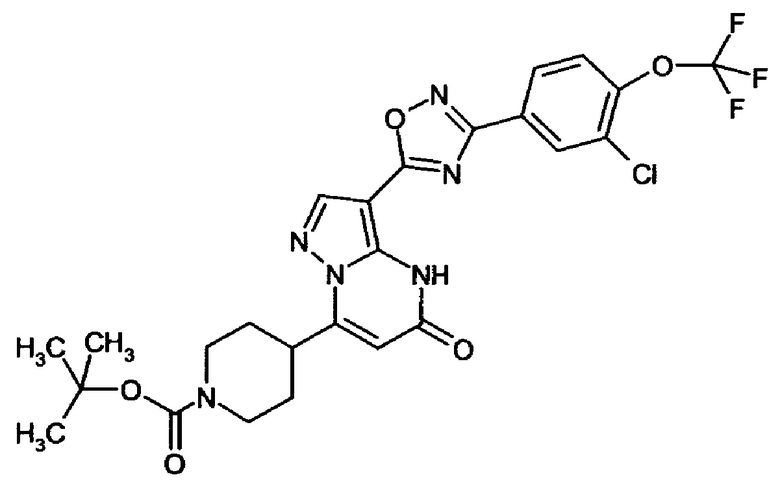
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 0.28 ммоль) в 2.8 мл диметилформамида добавили 1,1'-карбонилдиимидазол (89 мг, 0.55 ммоль), DBU (99 мг, 0.65 ммоль) и N,N-Диизопропилэтиламин (71 мг, 0.55 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3-хлор-N’-гидрокси-4-(трифторметокси)бензолкарбоксимидамид (216 мг, 0.55 ммоль, 65% чистота) добавили, и смесь перемешивали в течение 21 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили в 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (61 мг, 38% теоретический выход).
LC-MS (способ 1B): Rt=1.41 мин, m/z=581 (М+Н)+
Пример 164А
Трет-бутил 4-(3-{3-[2,6-дихлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
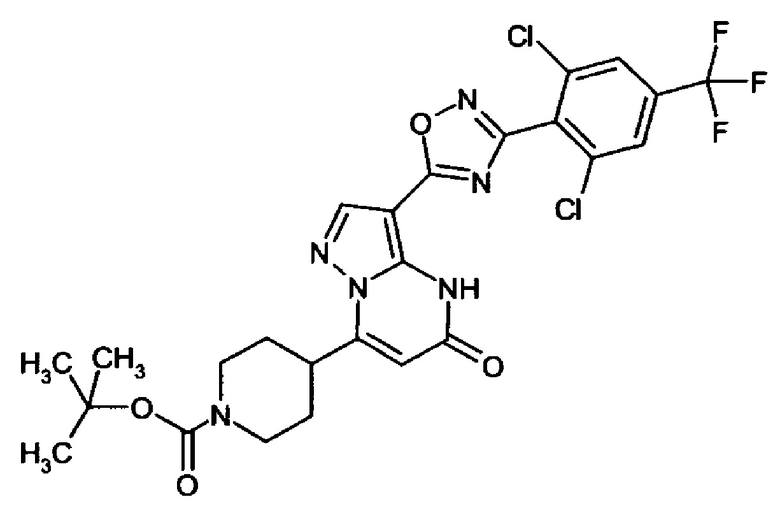
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (48 мг, 0.13 ммоль) в 1.0 мл диметилформамида добавили 1,1'-карбонилдиимидазол (43 мг, 0.26 ммоль), DBU (47 мг, 0.31 ммоль) и N,N-Диизопропилэтиламин (34 мг, 0.26 ммоль), и затем реакционную смесь перемешивали 2.5 ч при 90°C. После этого периода времени 2,6-дихлор-N’-гидрокси-4-(трифторметил)бензолкарбоксимидамид (372 мг, 0.26 ммоль, 19% чистота) добавили, и смесь перемешивали в течение 16 ч при 110°C, и затем оставили при комнатной температуре на выходные. Растворитель выпарили, и неочищенное вещество очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (11 мг, 14% теоретический выход).
LC-MS (способ 1B): Rt=1.32 мин, m/z=599 (М+Н)+
Пример 165А
Трет-бутил 4-{3-[3-(3,5-дихлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
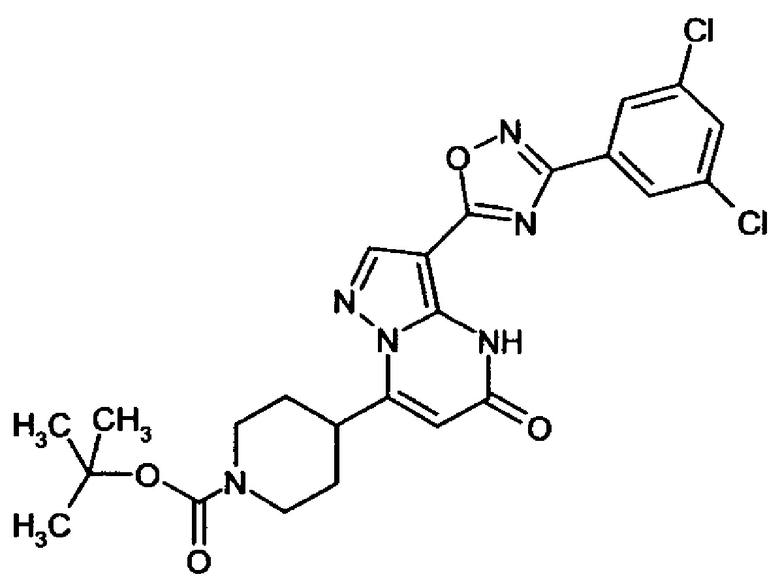
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (55 мг, 0.15 ммоль) в 1.5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (49 мг, 0.31 ммоль), DBU (55 мг, 0.36 ммоль) и N,N-Диизопропилэтиламин (39 мг, 0.31 ммоль), и затем реакционную смесь перемешивали 2.5 ч при 90°C. После этого периода времени 3,5-дихлор-N’-гидроксибензолкарбоксимидамид (108 мг, 0.30 ммоль, 58% чистота) добавили, и смесь перемешивали в течение 16 ч при 110°C, и затем оставили при комнатной температуре на выходные. Растворитель выпарили, и неочищенное вещество очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя получили продукт (20 мг, 25% теоретический выход).
LC-MS (способ 3В): Rt=2.91 мин, m/z=531 (М+Н)+
Пример 166А
Трет-бутил 4-(3-{3-[2,4-бис(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (187 мг, 0.52 ммоль) в 3.7 мл диметилформамида добавили 1,1'-карбонилдиимидазол (167 мг, 1.03 ммоль), DBU (185 мг, 1.21 ммоль) и N,N-Диизопропилэтиламин (133 мг, 1.03 ммоль), и затем реакционную смесь перемешивали 2.5 ч при 90°C. После этого периода времени N’-гидрокси-2,4-бис(трифторметил)бензолкарбоксимидамид (372 мг, 0.26 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C, и затем оставили при комнатной температуре на выходные. Растворитель выпарили, и неочищенное вещество очистили посредством препаративной ВЭЖХ (вода/ацетонитрил, 0.1% муравьиная кислота). После выпаривания растворителя продукт перекристаллизовали из ацетонитрила (21 мг, 7% теоретический выход).
LC-MS (способ 1B): Rt=1.31 мин, m/z=599 (М+Н)+
Пример 167А
Трет-бутил 4-{3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
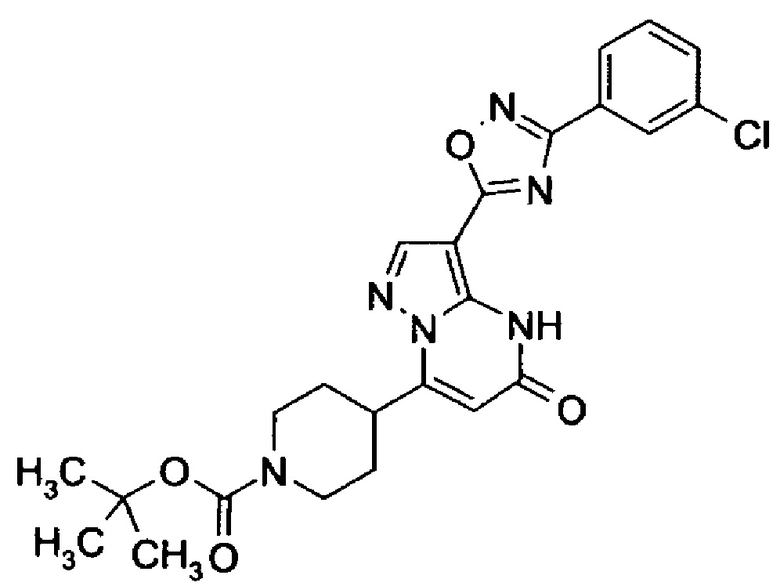
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (106 мг, 0.29 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (95 мг, 0.59 ммоль), N,N-диизопропилэтиламин (76 мг, 0.59 ммоль), 1,8-Диазабицикло(5.4.0)ундец-7-ен (105 мг, 0.70 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени 3-хлор-N’-гидроксибензолкарбоксимидамид (100 мг, 0.59 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А) с получением соединения, указанного в названии (66 мг, 45% теоретический выход).
LC-MS (Способ 1B): Rt=1.34 мин, MS (ESIPos): m/z=497 [М+Н]+
Пример 168А
Трет-бутил 4-{3-[3-(4-метокси-2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
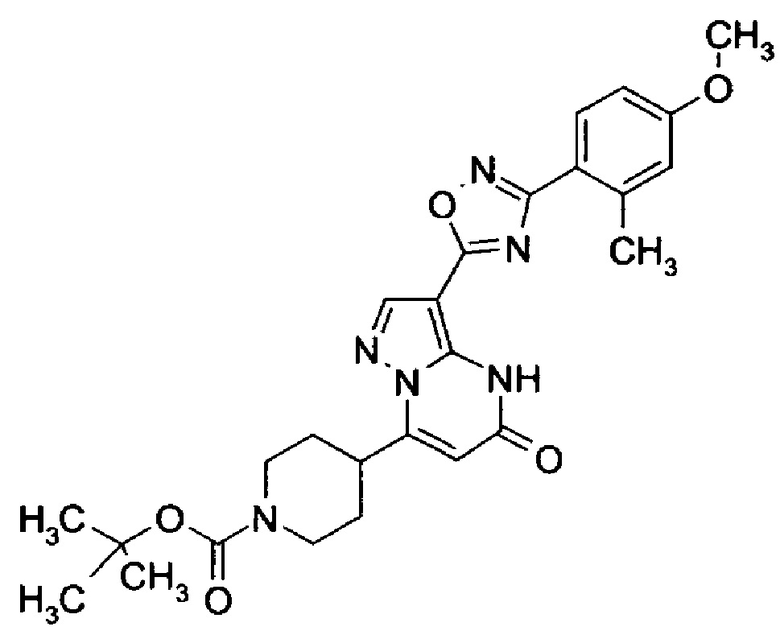
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (101 мг, 0.28 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (90 мг, 0.56 ммоль) и N,N-диизопропилэтиламин (72 мг, 0.56 ммоль), 1,8-Диазабицикло(5.4.0)ундец-7-ен (99 мг, 0.65 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени N’-гидрокси-4-метокси-2-метилбензолкарбоксимидамид (100 мг, 0.56 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А) с получением соединения, указанного в названии (67 мг, 48% теоретический выход).
LC-MS (Способ 1B): Rt=1.17 мин, MS (ESIPos): m/z=507 [М+Н]+
Пример 169А
Трет-бутил 4-(5-оксо-3-{3-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
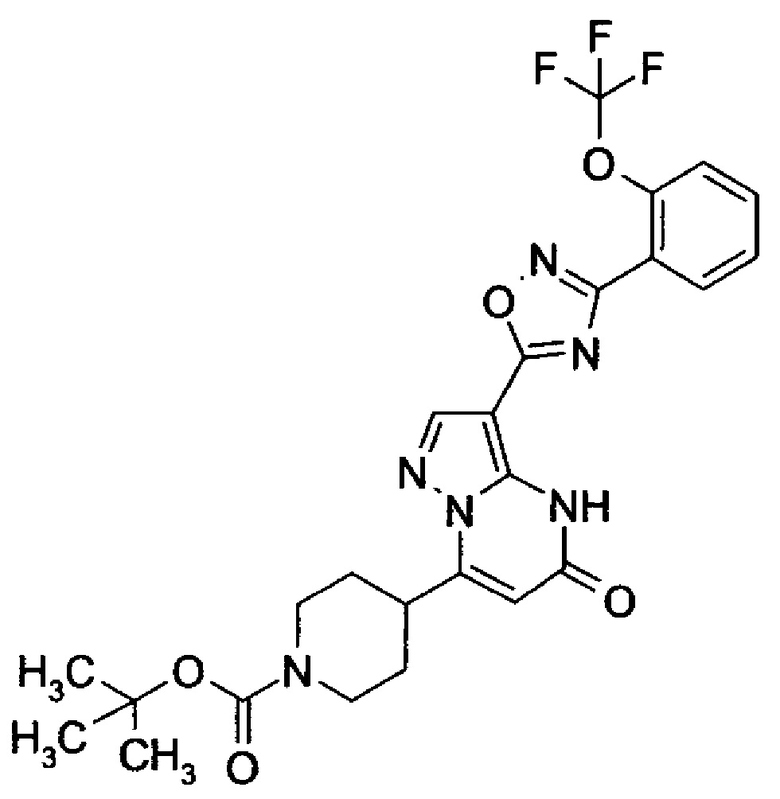
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (82 мг, 0.23 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (74 мг, 0.45 ммоль) и N,N-диизопропилэтиламин (59 мг, 0.45 ммоль), 1,8-Диазабицикло(5.4.0)ундец-7-ен (81 мг, 0.53 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени N’-гидрокси-2-(трифторметокси)бензолкарбоксимидамид (100 мг, 0.45 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А) с получением соединения, указанного в названии (57 мг, 46% теоретический выход).
LC-MS (Способ 1B): Rt=1.33 мин, MS (ESIPos): m/z=547 [М+Н]+
Пример 170А
Трет-бутил 4-{3-[3-(4-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
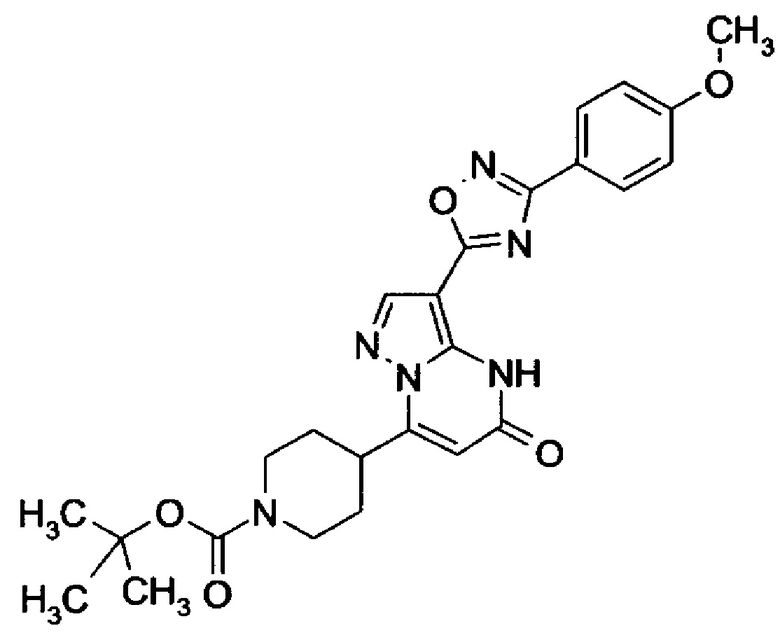
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (109 мг, 0.30 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (98 мг, 0.60 ммоль) и N,N-диизопропилэтиламин (98 мг, 0.60 ммоль), 1,8-Диазабицикло(5.4.0)ундец-7-ен (108 мг, 0.71 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени N’-гидрокси-4-метоксибензолкарбоксимидамид (100 мг, 0.60 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А) с получением соединения, указанного в названии (46 мг, 31% теоретический выход).
LC-MS (Способ 1B): Rt=1.24 мин, MS (ESIPos): m/z=493 [M+H]+
Пример 171A
Трет-бутил 4-{3-[3-(4-хлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
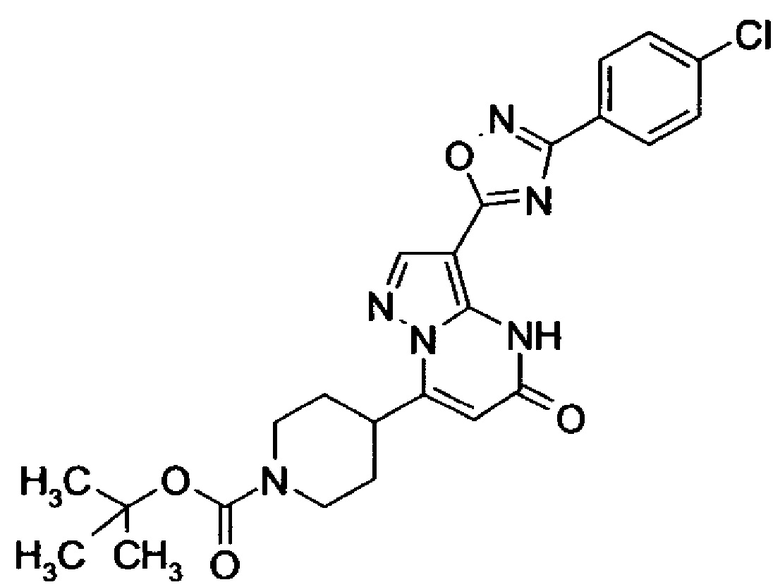
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (106 мг, 0.29 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (95 мг, 0.59 ммоль) и N,N-диизопропилзтиламин (76 мг, 0.59 ммоль), 1,8-Диазабицикло(5.4.0)ундец-7-ен (105 мг, 0.69 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени 4-хлор-N’-гидроксибензолкарбоксимидамид (100 мг, 0.60 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1 А) с получением соединения, указанного в названии (54 мг, 37% теоретический выход).
LC-MS (Способ 1B): Rt=1.34 мин, MS (ESIPos): m/z=497 [М+Н]+
Пример 172А
Трет-бутил 4-{3-[3-(2,4-дифторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (105 мг, 0.29 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (94 мг, 0.58 ммоль) и N,N-диизопропилэтиламин (75 мг, 0.58 ммоль), 1,8-Диазабицикло(5.4.0)ундец-7-ен (104 мг, 0.68 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени 2,4-дифтор-N’-гидроксибензолкарбоксимидамид (100 мг, 0.58 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А) с получением соединения, указанного в названии (39 мг, 27% теоретический выход).
LC-MS (Способ 1B): Rt=1.24 мин, MS (ESIPos): m/z=499 [М+Н]+
Пример 173А
Трет-бутил 4-{3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
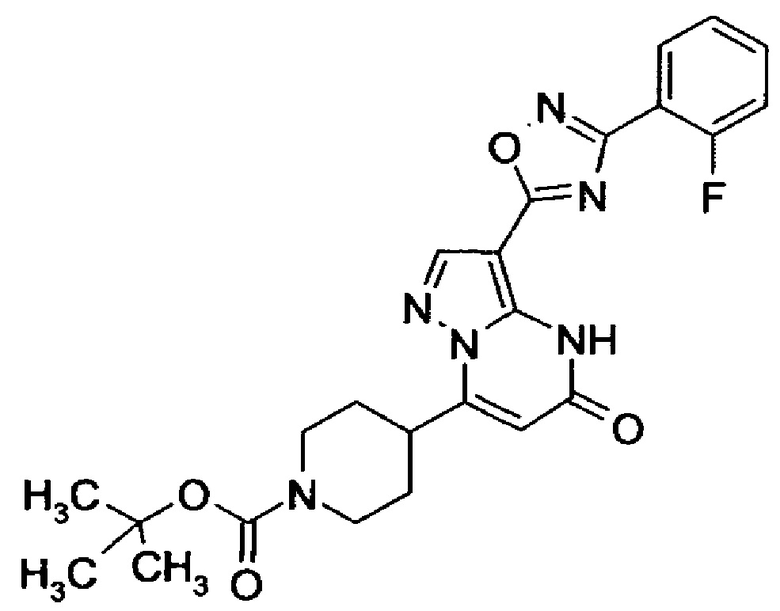
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (118 мг, 0.32 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (105 мг, 0.65 ммоль) и N,N-диизопропилэтиламин (84 мг, 0.65 ммоль), 1,8-Диазабицикло(5.4.0)ундец-7-ен (116 мг, 0.76 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени 2-фтор-N’-гидроксибензолкарбоксимидамид (100 мг, 0.65 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1 А) с получением соединения, указанного в названии (63 мг, 38% теоретический выход).
LC-MS (Способ 1B): Rt=1.21 мин, MS (ESIPos): m/z=481 [М+Н]+
Пример 174А
Трет-бутил 4-{3-[3-(2-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
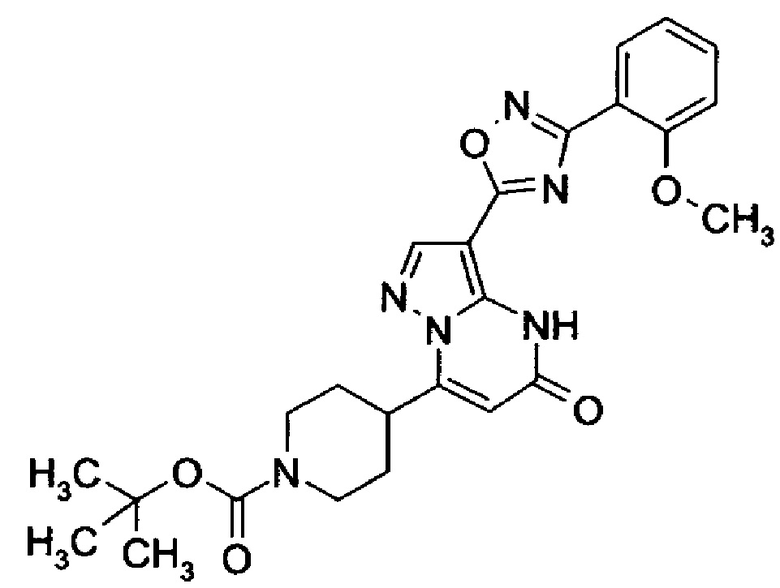
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (109 мг, 0.30 ммоль) в 3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (98 мг, 0.60 ммоль) и N,N-диизопропилэтиламин (78 мг, 0.60 ммоль), 1,8-Диазабицикло(5.4.0)ундец-7-ен (108 мг, 0.71 ммоль), и затем реакционную смесь перемешивали 4 ч при 90°C. После этого периода времени N’-гидрокси-2-метоксибензолкарбоксимидамид (100 мг, 0.60 ммоль) добавили, и смесь перемешивали в течение 16 ч при 110°C. После охлаждения до комнатной температуры, смесь разбавили 2 мл ацетонитрила и очистили посредством препаративной ВЭЖХ (Способ 1А) с получением соединения, указанного в названии (79 мг, 53% теоретический выход).
LC-MS (Способ 1B): Rt=1.16 мин, MS (ESIPos): m/z=493 [М+Н]+
Пример 175А
4-[4’-(трифторметил)бифенил-4-ил]-1Н-пиразол-5-амин
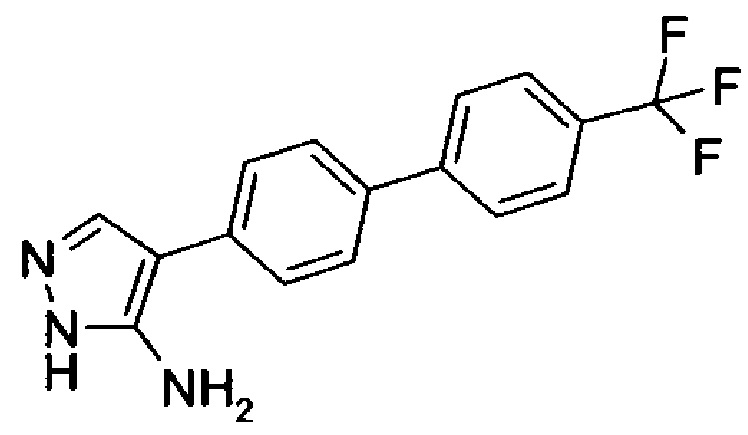
Согласно общей методике 2А, смесь [4-(трифторметил)фенил]бороновой кислоты (324 мг, 1.70 ммоль), 4-(4-хлорфенил)-1Н-пиразол-5-амина (300 мг, 1.55 ммоль), XPhos предкатализатора (131 мг, 0.16 ммоль), дегазированного диоксана (15 мл) и дегазированного 1М водного раствора К3РО4 (5.4 мл) перемешивали при 100°C в течение 16 ч. Посредством препаративной ВЭЖХ (Способ 1А) получили соединение, указанное в названии (101 мг, 22% теоретический выход).
LC-MS (Способ 1B): Rt=0.96 мин, MS (ESIPos): m/z=304 [М+Н]+
Пример 176А
Трет-бутил 4-{5-оксо-3-[4'-(трифторметил)бифенил-4-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
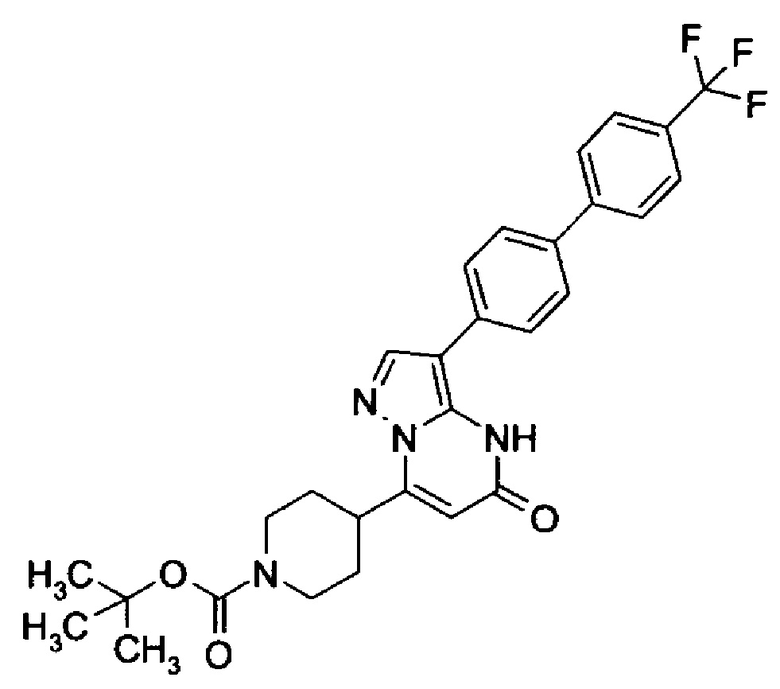
Согласно общей методике 1А, трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (117 мг, 0.33 ммоль) и 4-[4'-(трифторметил)бифенил-4-ил]-1Н-пиразол-5-амин (100 мг, 0.33 ммоль) прореагировали с получением соединения, указанного в названии (36 мг, 20% теоретический выход).
LC-MS (Способ 1B): Rt=1.32 мин, MS (ESINeg): m/z=537 [М-Н]-
Пример 177А
4-[4'-(трифторметил)бифенил-3-ил]-1Н-пиразол-5-амин

Согласно общей методике 2А, смесь [4-(трифторметил)фенил]бороновой кислоты (202 мг, 1.06 ммоль), 4-(3-бромфенил)-1Н-пиразол-5-амина (230 мг, 0.97 ммоль), XPhos предкатализатора (82 мг, 0.10 ммоль), дегазированного диоксана (10 мл) и дегазированного 1М водного раствора К3РО4 (3.4 мл) перемешивали при 100°C в течение 16 ч. Посредством препаративной ВЭЖХ (Способ 1А) получили соединение, указанное в названии (156 мг, 53% теоретический выход).
LC-MS (Способ 1B): Rt=0.95 мин, MS (ESIPos): m/z=304 [М+Н]+
Пример 178А
Трет-бутил 4-{5-оксо-3-[4'-(трифторметил)бифенил-3-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
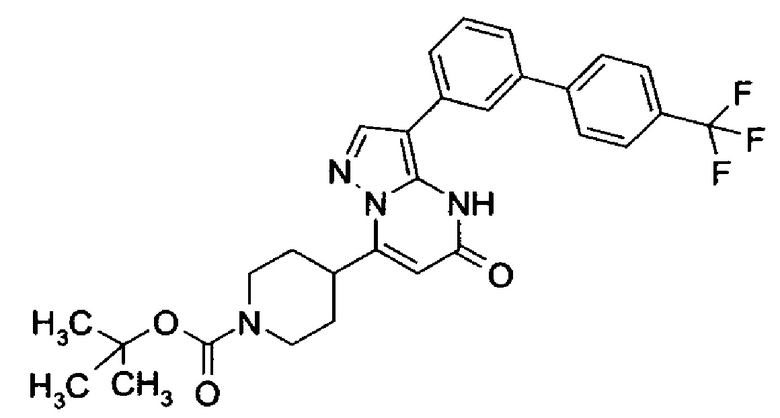
Согласно общей методике 1А, трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (276 мг, 0.78 ммоль) и 4-[4'-(трифторметил)бифенил-3-ил]-1Н-пиразол-5-амин (157 мг, 0.52 ммоль) прореагировали с получением соединения, указанного в названии (166 мг, 40% теоретический выход).
LC-MS (Способ 1B): Rt=1.32 мин, MS (ESINeg): m/z=537 [М-Н]-
Пример 179А
4-[4-(3-хлорфенил)-1,3-тиазол-2-ил]-1Н-пиразол-5-амин
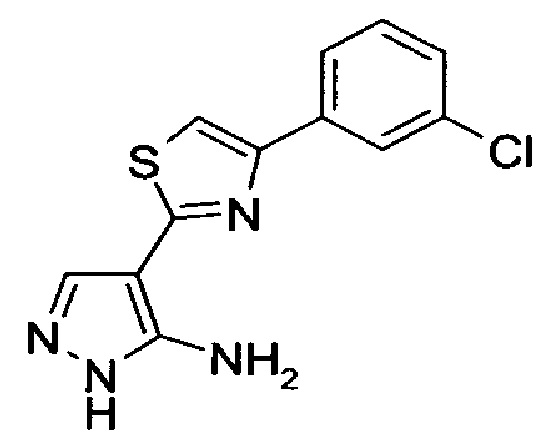
5-амино-1Н-пиразол-4-карботиоамид (200 мг, 1.41 ммоль) и 2-бром-1-(3-хлорфенил)этанон (328 мг, 1.41 ммоль) растворили в этаноле (4 мл) и нагревали с возвратом флегмы в течение 6 ч. Посредством препаративной ВЭЖХ (Способ 1А) получили соединение, указанное в названии (155 мг, 40% теоретический выход).
LC-MS (Способ 1B): Rt=0.92 мин, MS (ESIPos): m/z=277 [М+Н]+
Пример 180А
Трет-бутил 4-{3-[4-(3-хлорфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
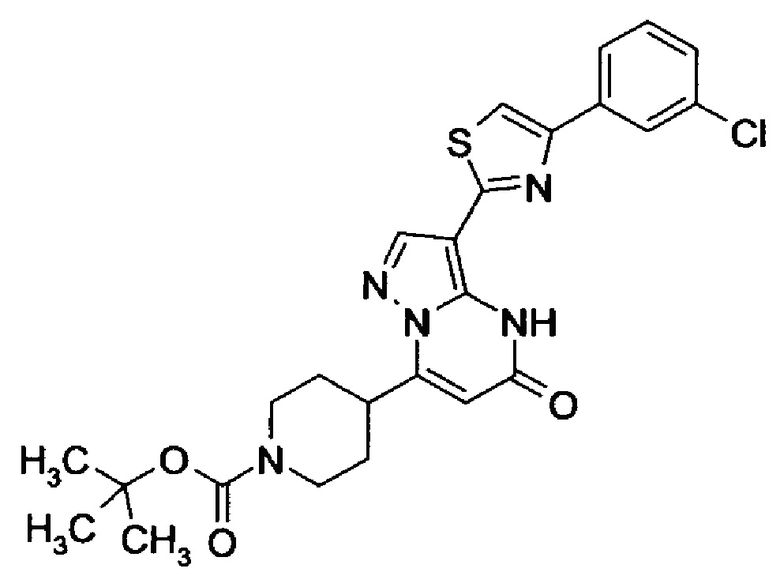
Согласно общей методике 1А, трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (299 мг, 0.84 ммоль) и 4-[4-(3-хлорфенил)-1,3-тиазол-2-ил]-1Н-пиразол-5-амин (155 мг, 0.56 ммоль) прореагировали с получением соединения, указанного в названии (173 мг, 40% теоретический выход).
LC-MS (Способ 1B): Rt=1.34 мин, MS (ESIPos): m/z=512 [М+Н]+
Пример 181А
4-{4-[4-(трифторметил)фенил]-1,3-тиазол-2-ил}-1Н-пиразол-5-амин
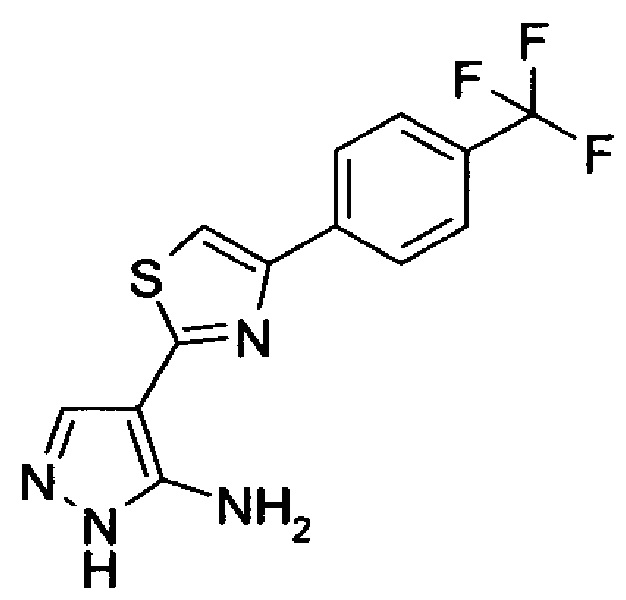
5-амино-1Н-пиразол-4-карботиоамид (200 мг, 1.41 ммоль) и 2-бром-1-[4-(трифторметил)фенил]этанон (376 мг, 1.41 ммоль) растворили в этаноле (4 мл) и нагревали с возвратом флегмы в течение 6 ч. Посредством препаративной ВЭЖХ (Способ 1А) получили соединение, указанное в названии (342 мг, 78% теоретический выход).
LC-MS (Способ 1B): Rt=0.97 мин, MS (ESIPos): m/z=311 [М+Н]+
Пример 182А
трет-бутил 4-(5-оксо-3-{4-[4-(трифторметил)фенил]-1,3-тиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
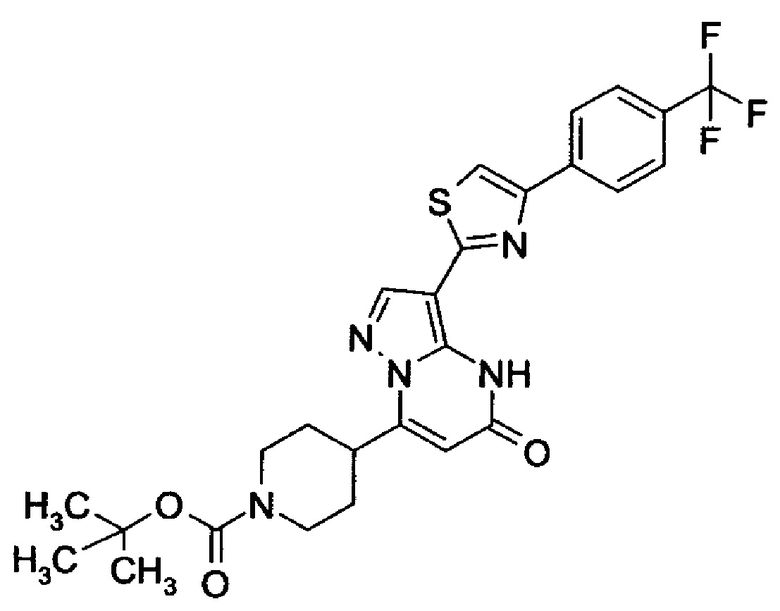
Согласно общей методике 1А, трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (588 мг, 1.65 ммоль) и 4-{4-[4-(трифторметил)фенил]-1,3-тиазол-2-ил}-1Н-пиразол-5-амин (342 мг, 1.10 ммоль) прореагировали с получением соединения, указанного в названии (88 мг, 10% теоретический выход).
LC-MS (Способ 1B): Rt=1.34 мин, MS (ESIPos): m/z=546 [М+Н]+
Пример 183А
трет-бутил 4-(3-{[2-(2,2-диметилпропаноил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
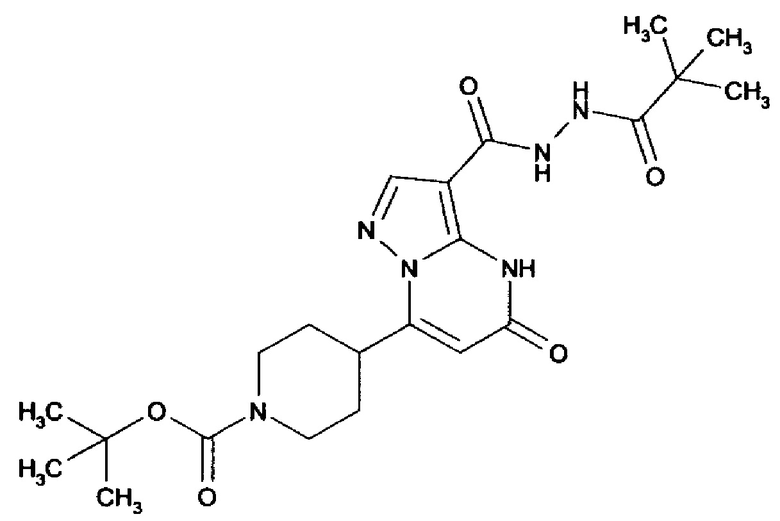
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.41 ммоль) и 2,2-диметилпропангидразид (72 мг, 0.6 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (55.4 мг, 25% теоретический выход).
LC-MS (Способ 5В): Rt=0.80 мин, MS (ESIPos): m/z=461.4 [М+Н]+
Пример 184А
трет-бутил 4-[3-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
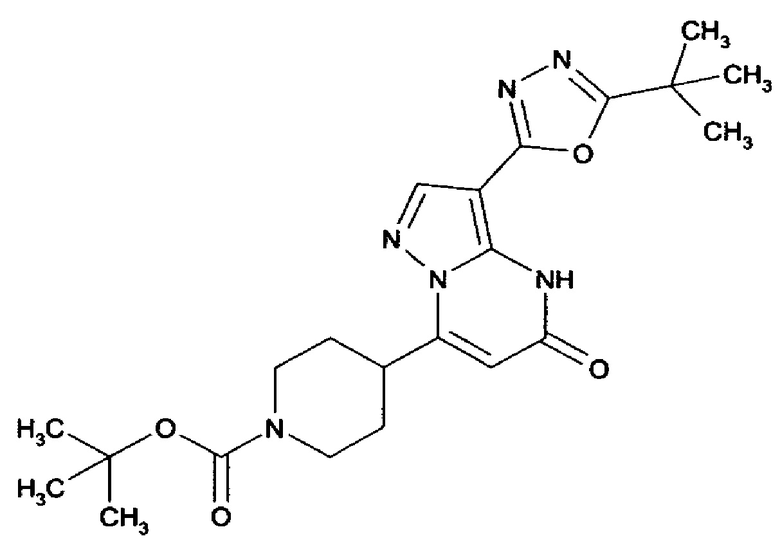
трет-бутил 4-(3-{[2-(2,2-диметилпропаноил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (147 мг, 0.32 ммоль) растворили в тетрагидрофуране (5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (92 мг, 0.4 ммоль) в течение 16 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамата (92 мг, 0.4 ммоль) и перемешивали в течение 2 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамата (Реагент Бургесса, 92 мг, 0.4 ммоль) и перемешивали в течение 1 ч при комнатной температуре. Чтобы остановить реакцию добавили воду, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (156 мг, 89% теоретический выход).
LC-MS (Способ 5В): Rt=1.01 мин, MS (ESIPos): m/z=443.3 [М+Н]+
Пример 185А
трет-бутил 4-[5-оксо-3-({2-[4-(трифторметил)бензоил]гидразино}карбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.41 ммоль) и 4-(трифторметил)бензогидразид (127 мг, 0.6 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Добавили воду, и полученный осадок отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (144.5 мг, 49.7% теоретический выход).
LC-MS (Способ 5В): Rt=0.92 мин, MS (ESIPos): m/z=549.3 [М+Н]+
Пример 186А
трет-бутил 4-(5-оксо-3-{5-[4-(трифторметил)фенил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
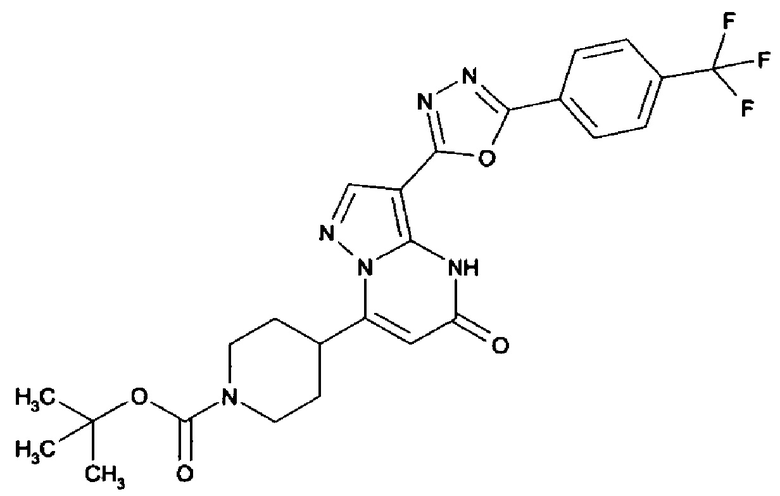
трет-бутил 4-[5-оксо-3-({2-[4-(трифторметил)бензоил]гидразино}карбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (103 мг, 0.19 ммоль) растворили в тетрагидрофуране (5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (53.5 мг, 0.2 ммоль) в течение 16 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамат (92 мг, 0.4 ммоль) и перемешивали в течение 2 ч при комнатной температуре. Воду (2 мл) добавили, чтобы остановить реакцию, и продукт экстрагировали этил ацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (109.5 мг, 51% теоретический выход).
LC-MS (Способ 5В): Rt=1.19 мин, MS (ESIPos): m/z=531.4 [М+Н]+
Пример 187А
трет-бутил 4-(3-{[2-(4-карбамоилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
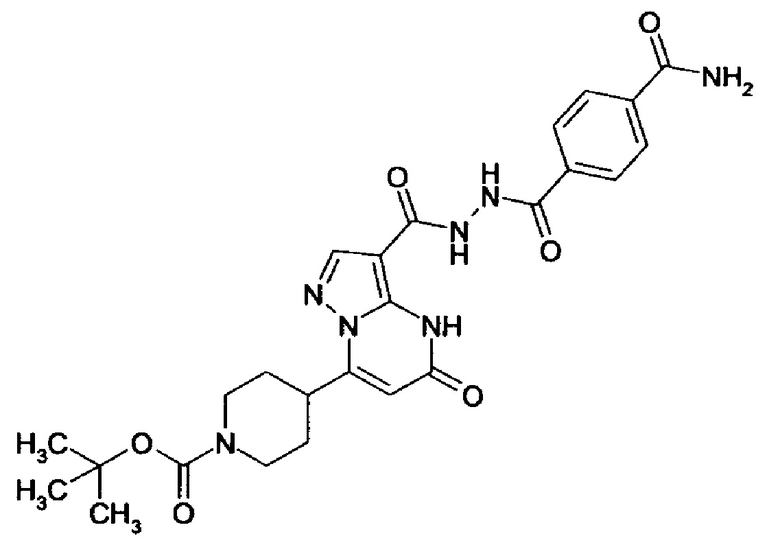
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.41 ммоль) и 4-(гидразинокарбонил)бензамид (111 мг, 0.6 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло [4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (92 мг, 39% теоретический выход).
LC-MS (Способ 5В): Rt=0.69 мин, MS (ESIPos): m/z=524.4 [М+Н]+
Пример 188А
трет-бутил 4-{3-[5-(4-цианофенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
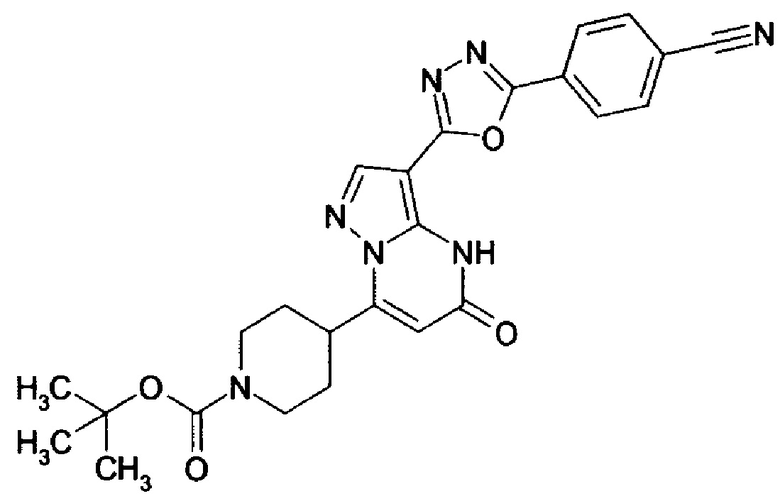
трет-бутил 4-(3-{[2-(4-карбамоилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (92 мг, 0.18 ммоль) растворили в тетрагидрофуране (5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (50.5 мг, 0.2 ммоль) в течение 16 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамат (50.5 мг, 0.2 ммоль) и перемешивали в течение 2 ч при комнатной температуре. Воду (2 мл) добавили, чтобы остановить реакцию, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (73 мг, 57% теоретический выход).
LC-MS (Способ 5В): Rt=1.04 мин, MS (ESIPos): m/z=488.4 [М+Н]+
Пример 189А
трет-бутил 4-[3-({2-[(1-метил-1Н-имидазол-5-ил)карбонил]гидразино}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
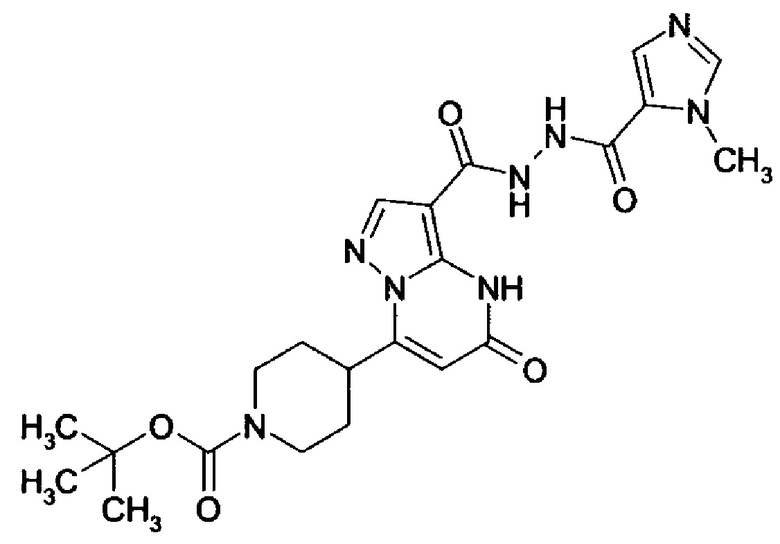
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 1-метил-1Н-имидазоле-5-карбогидразид (87 мг, 0.6 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (29.8 мг, 13% теоретический выход).
LC-MS (Способ 5В): Rt=0.65 мин, MS (ESIPos): m/z=485.3 [М+Н]+
Пример 190А
трет-бутил 4-{3-[5-(1-метил-1Н-имидазол-5-ил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
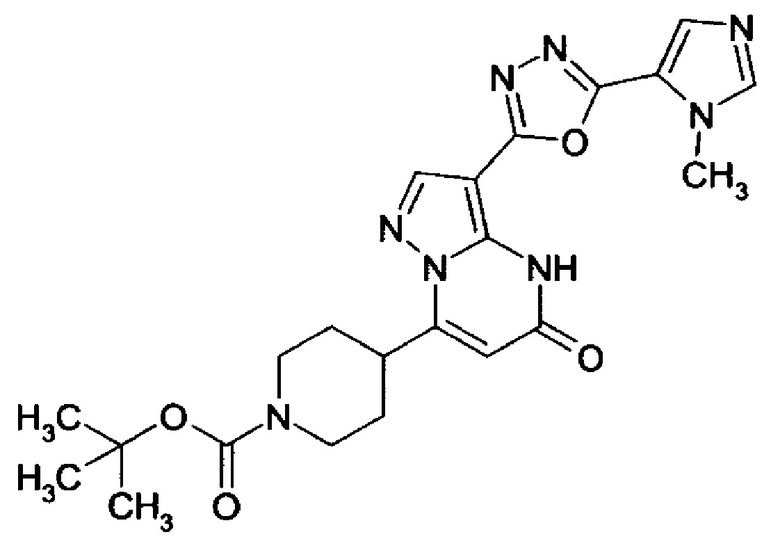
трет-бутил 4-[3-({2-[(1-метил-1Н-имидазол-5-ил)карбонил]гидразино}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (29.8 мг, 0.06 ммоль) растворили в тетрагидрофуране (1.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (17.6 мг, 0.07 ммоль) в течение 16 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамат (17.6 мг, 0.07 ммоль) и перемешивали в течение 1 ч при комнатной температуре. Воду (2 мл) добавили, чтобы остановить реакцию, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (39 мг, 84% теоретический выход).
LC-MS (Способ 5В): Rt=0.76 мин, MS (ESIPos): m/z=466.2 [М+Н]+
Пример 191А
трет-бутил 4-(3-{[2-(3-хлорбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
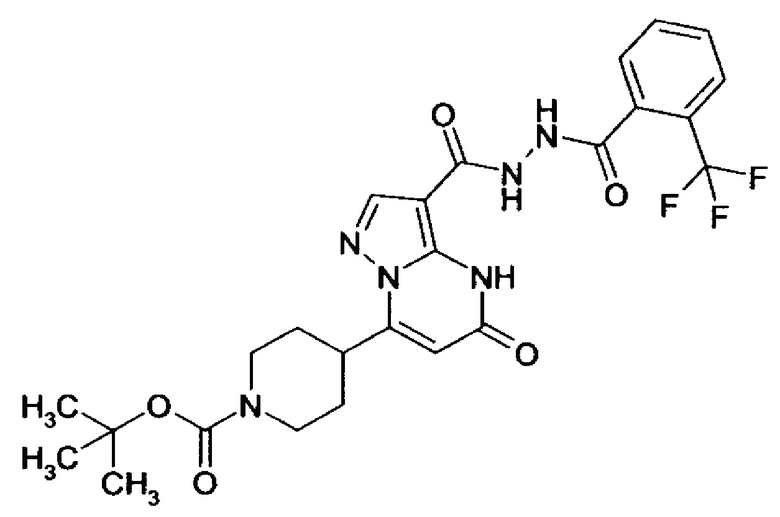
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 3-хлорбензогидразид (105 мг, 0.6 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (97 мг, 45% теоретический выход).
LC-MS (Способ 5В): Rt=0.88 мин, MS (ESIPos): m/z=515.4 [М+Н]+
Пример 192А
трет-бутил 4-{3-[5-(3-хлорфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
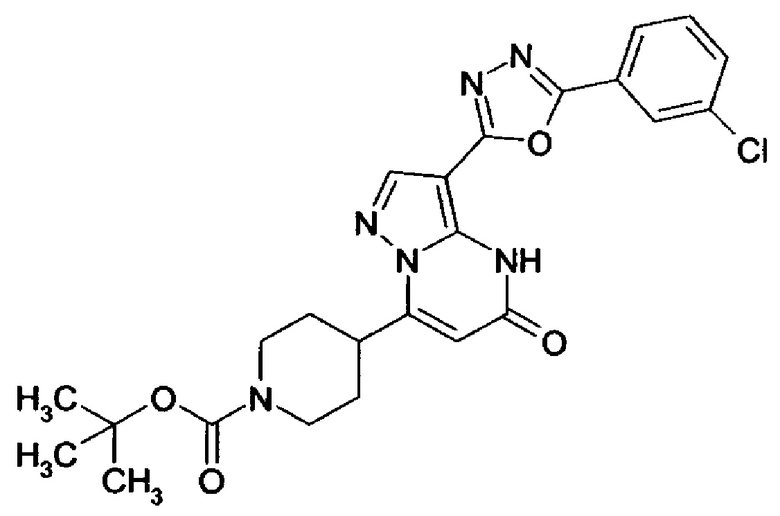
трет-бутил 4-(3-{[2-(3-хлорбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (93 мг, 0.2 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (60 мг, 0.25 ммоль) в течение 16 ч при комнатной температуре. Раствор лимонной кислоты (10% в воде) добавили, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (159 мг, количественный выход).
LC-MS (Способ 5В)): Rt=1.17 мин, MS (ESIPos): m/z=497.4 [М+Н]+
Пример 193А
трет-бутил 4-(3-{[2-(4-метилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
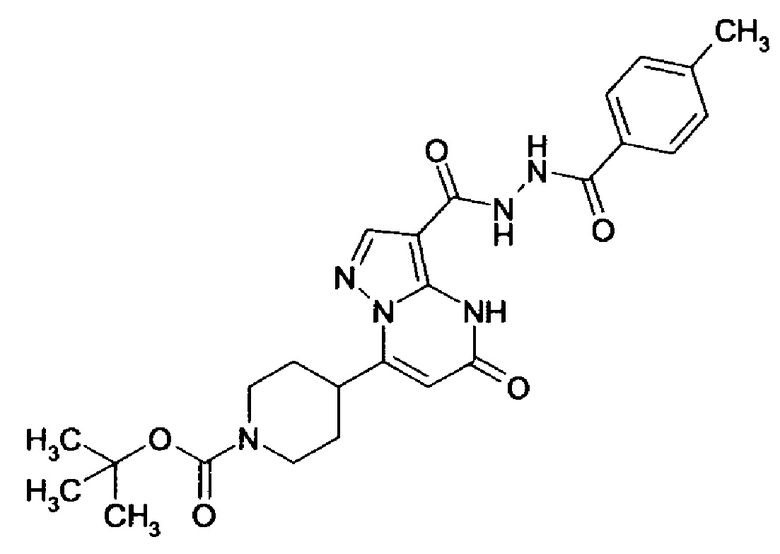
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 4-метилбензогидразид
(150 мг, 0.4 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (103 мг, 47% теоретический выход).
LC-MS (Способ 5В): Rt=0.86 мин, MS (ESIPos): m/z=495.5 [М+Н]+
Пример 194А
трет-бутил 4-(3-{[2-(2-метилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
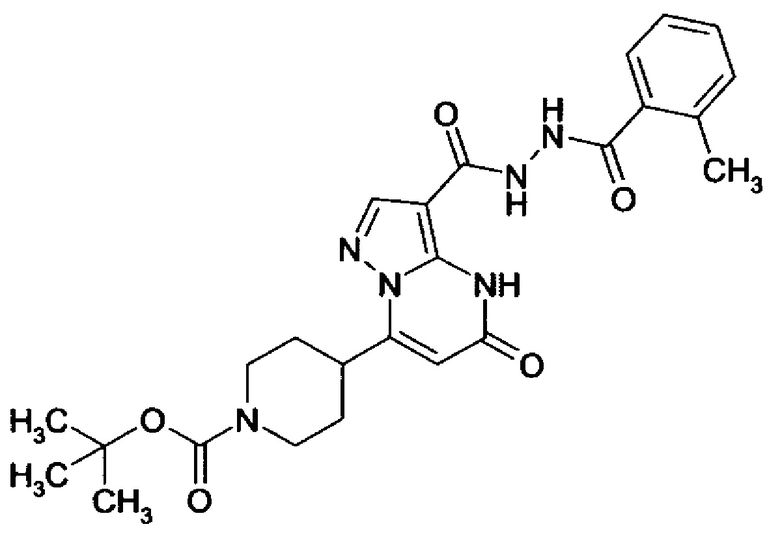
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-метилбензогидразид (93 мг, 0.6 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (117 мг, 56% теоретический выход).
LC-MS (Способ 5В): Rt=0.85 мин, MS (ESIPos): m/z=495.4 [М+Н]+
Пример 195А
трет-бутил 4-[5-оксо-3-({2-[2-(трифторметил)бензоил]гидразино}карбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-метилбензогидразид (127 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло [4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (106 мг, 44% теоретический выход).
LC-MS (Способ 5В): Rt=0.88 мин, MS (ESIPos): m/z=549.5 [М+Н]+
Пример 196А
трет-бутил 4-(3-{[2-(метоксиацетил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
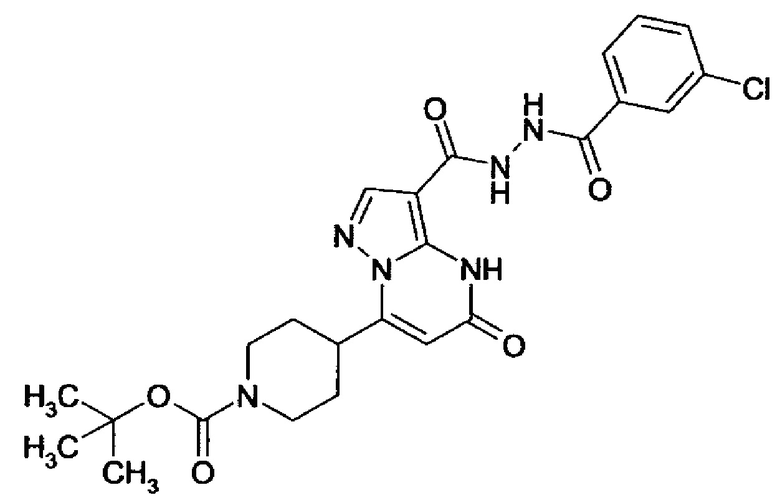
7-[1-{трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-метоксиацетогидразид (150 мг, 0.4 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (121 мг, 65% теоретический выход).
LC-MS (Способ 5В): Rt=0.69 мин, MS (ESIPos): m/z=449.4 [М+Н]+
Пример 197А
трет-бутил 4-{3-[5-(метоксиметил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
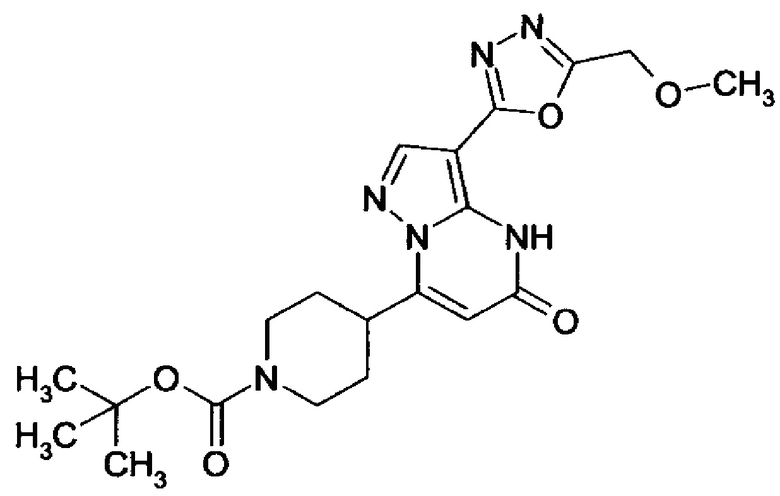
трет-бутил 4-(3-{[2-(метоксиацетил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (121 мг, 0.27 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (90 мг, 0.38 ммоль) в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% муравьиной кислотой). Растворители удалили в вакууме, что обеспечило соединение, указанное в названии (38 мг, 33% теоретический выход).
LC-MS (Способ 5В): Rt=0.86 мин, MS (ESIPos): m/z=431.4 [М+Н]+
Пример 198А
трет-бутил 4-(3-{[2-(циклопропилкарбонил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
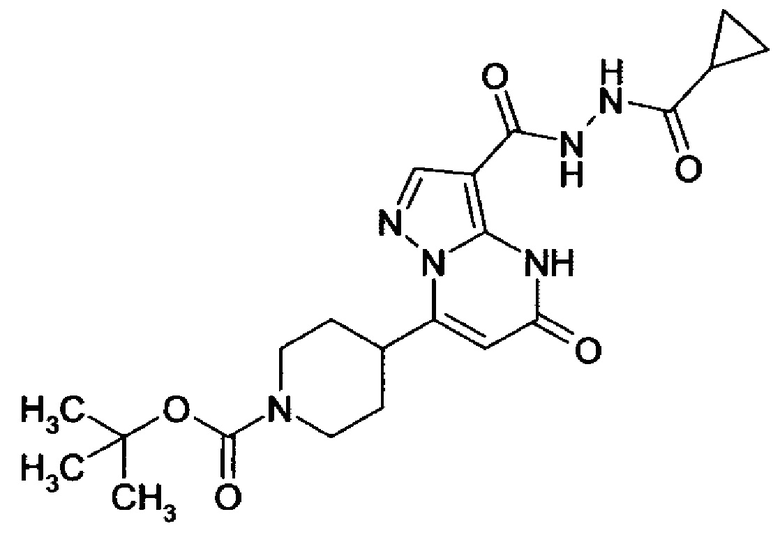
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и циклопропанкарбогидразид (62 мг, 0.6 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (80 мг, 40% теоретический выход).
LC-MS (Способ 5В): Rt=0.73 мин, MS (ESIPos): m/z=445.4 [М+Н]+
Пример 199А
трет-бутил 4-[3-(5-циклопропил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
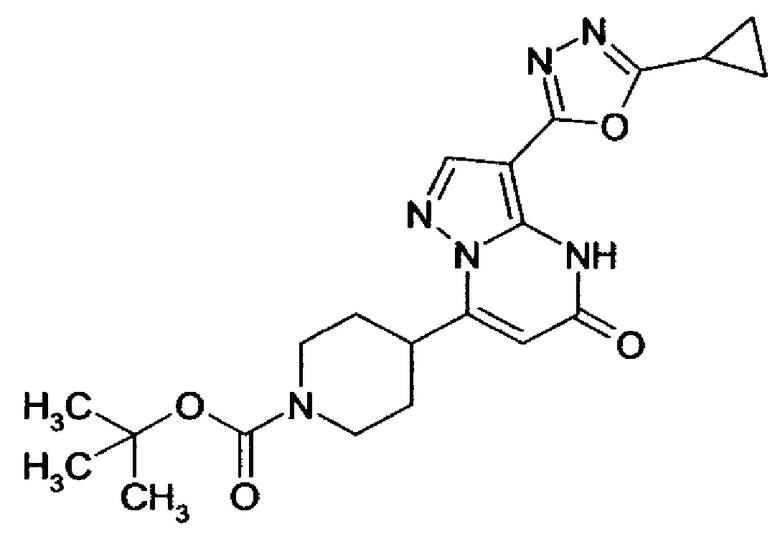
трет-бутил 4-(3-{[2-(циклопропилкарбонил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (80 мг, 0.18 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (60 мг, 0.25 ммоль) в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% муравьиной кислотой). Растворители удалили в вакууме, что обеспечило соединение, указанное в названии (46 мг, 56% теоретический выход).
LC-MS (Способ 6В): Rt=2.78 мин, MS (ESIPos): m/z=427.2 [М+Н]+
Пример 200А
трет-бутил 4-[5-оксо-3-({2-[3-(трифторметил)бензоил]гидразино}карбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
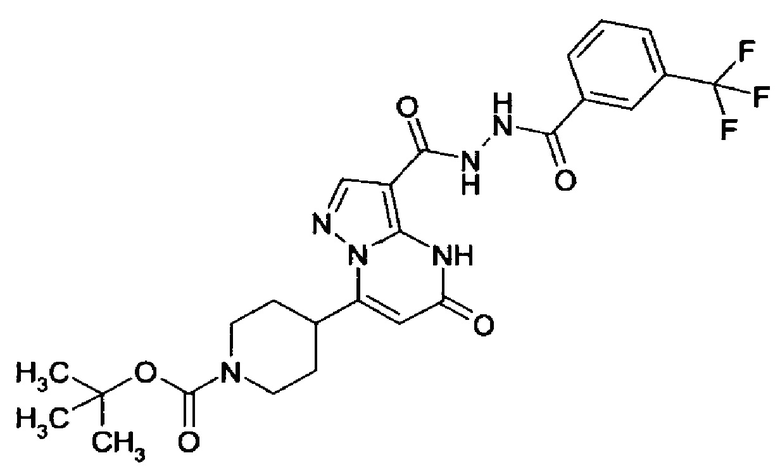
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 3-(трифторметил)бензогидразид (126 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (154 мг, 68% теоретический выход).
LC-MS (Способ 5В): Rt=0.93 мин, MS (ESIPos): m/z=549.5 [М+Н]+
Пример 201А
трет-бутил 4-(5-оксо-3-{5-[3-(трифторметил)фенил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
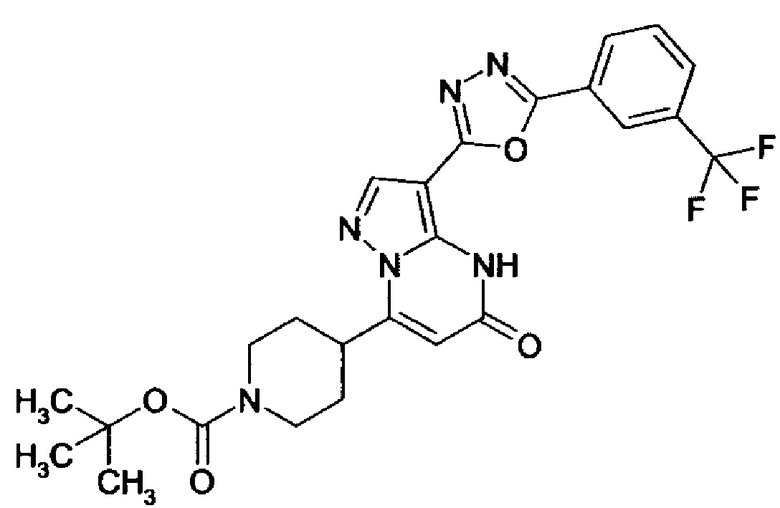
трет-бутил 4-[5-оксо-3-({2-[3-(трифторметил)бензоил]гидразино}карбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (102 мг, 0.19 ммоль) растворили в тетрагидрофуране (5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (53 мг, 0.22 ммоль) в течение 16 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамат (53 мг, 0.22 ммоль) и перемешивали в течение 1 ч при комнатной температуре. Воду (2 мл) добавили, чтобы остановить реакцию, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (121 мг, количественный выход).
LC-MS (Способ 6В): Rt=1.14 мин, MS (ESIPos): m/z=531.2 [М+Н]+
Пример 202А
трет-бутил 4-[3-({2-[(4-метоксифенил)ацетил]гидразино}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
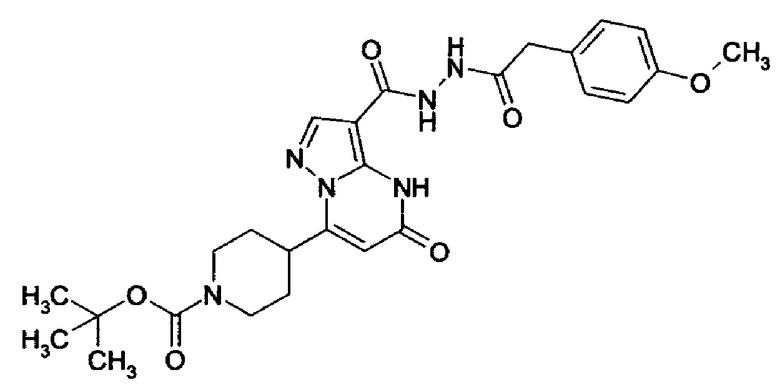
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (200 мг, 0.55 ммоль) и 2-(4-метоксифенил)ацетогидразид (119 мг, 0.66 ммоль) растворили в тетрагидрофуране (2 мл). N,N-Диизопропилэтиламин (0.24 мл, 1.38 ммоль) и (1-Циано-2-этокси-2-оксоэтилиденаминоокси)диметиламино-морфолино-карбения гексафторфосфат (266 мг, 0.66 ммоль) добавили, и смесь перемешивали в течение 2 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (113 мг, 37% теоретический выход).
LC-MS (Способ 5В): Rt=0.85 мин, MS (ESIPos): m/z=525.4 [М+Н]+
Пример 203А
трет-бутил 4-{3-[5-(4-метоксибензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

трет-бутип 4-[3-({2-[(4-метоксифенил)ацетил]гидразино}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (59 мг, 0.11 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (37 мг, 0.16 ммоль) в течение 16 ч при комнатной температуре. Раствор лимонной кислоты (10% в воде) добавили и продукт экстрагировали эти л ацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (195 мг, количественный выход).
LC-MS (Способ 6В): Rt=1.04 мин, MS (ESIPos): m/z=507.5 [М+Н]+
Пример 204A
трет-бутил 4-(3-{[2-(циклопентилкарбонил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и циклопентанкарбогидразид (79.5 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (112 мг, 57% теоретический выход).
LC-MS (Способ 5В): Rt=0.81 мин, MS (ESIPos): m/z=471.4 [М+Н]+
Пример 205А
трет-бутил 4-[3-(5-циклопентил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
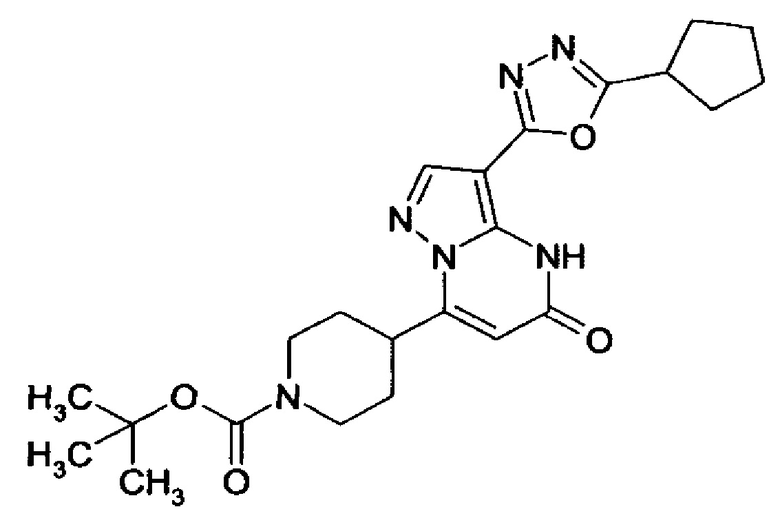
трет-бутил 4-(3-{[2-(циклопентилкарбонил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (55 мг, 0.12 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (38.6 мг, 0.16 ммоль) в течение 16 ч при комнатной температуре. Раствор лимонной кислоты (10% в воде) добавили, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (176 мг, количественный выход).
LC-MS (Способ 5В): Rt=1.07 мин, MS (ESIPos): m/z=455.4 [М+Н]+
Пример 206А
трет-бутил 4-(3-{[2-(2-фуроил)гидразино]карбонил}-92-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-фурогидразид (78.3 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (65 мг, 34% теоретический выход).
LC-MS (Способ 5В): Rt=0.75 мин, MS (ESIPos): m/z=471.4 [М+Н]+
Пример 207А
трет-бутил 4-{3-[5-(2-фурил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а] лиримидин-7-ил}пиперидин-1-карбоксилат
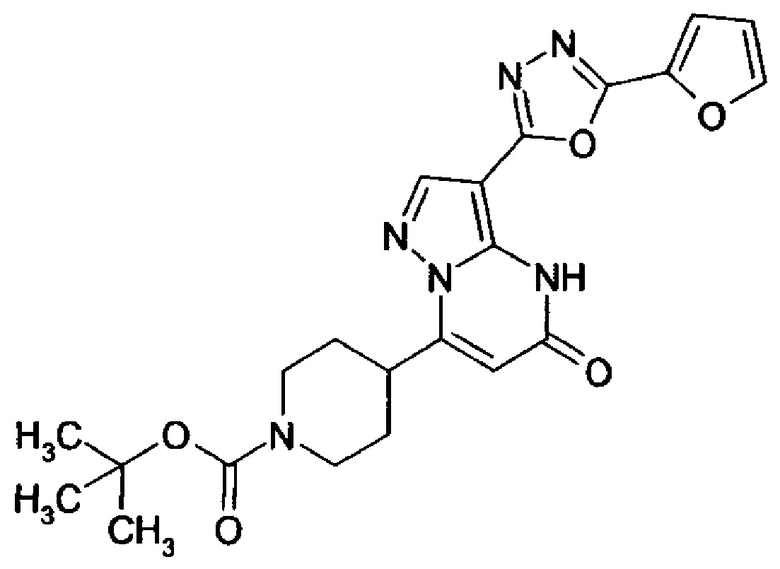
трет-бутил 4-(3-{[2-(2-фуроил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (64 мг, 0.14 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (45 мг, 0.19 ммоль) в течение 16 ч при комнатной температуре. Раствор лимонной кислоты (10% в воде) добавили, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (91 мг, количественный выход).
LC-MS (Способ 5В): Rt=0.98 мин, MS (ESIPos): m/z=453.3 [М+Н]+
Пример 208А
трет-бутил 4-(3-{[2-(4-трет-бутилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
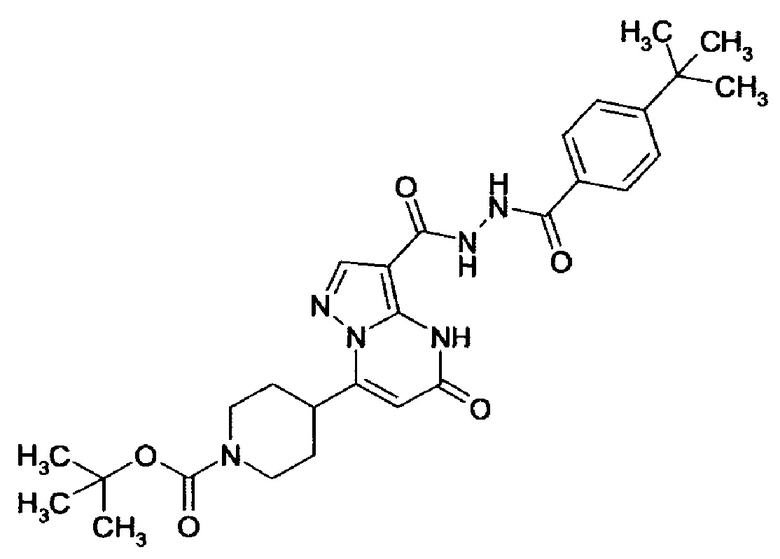
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 4-трет-бутилбензогидразид (119 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (119 мг, 54% теоретический выход).
LC-MS (Способ 5В): Rt=1.00 мин, MS (ESIPos): m/z=537.5 [М+Н]+
Пример 209А
трет-бутил 4-{3-[5-(4-трет-бутилфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
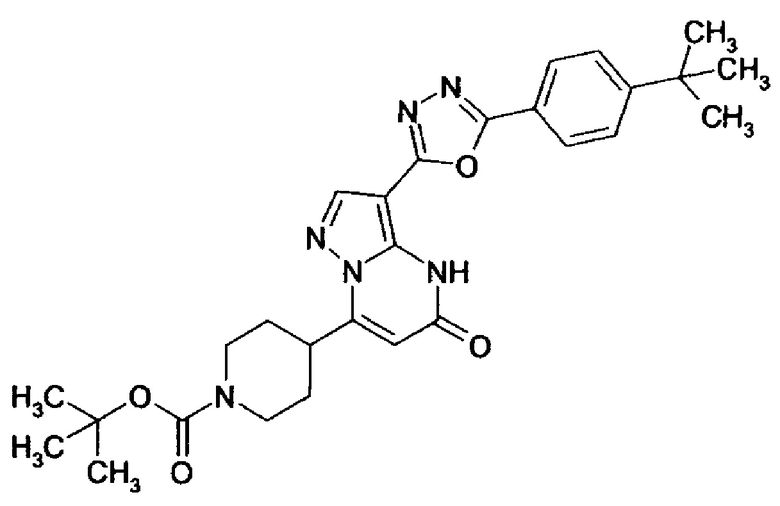
трет-бутил 4-(3-{[2-(4-трет-бутилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (119 мг, 0.22 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (73 мг, 0.31 ммоль) в течение 16 ч при комнатной температуре. Раствор лимонной кислоты (10% в воде) добавили, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (167 мг, 89% теоретический выход).
LC-MS (Способ 5В): Rt=1.31 мин, MS (ESIPos): m/z=519.5 [М+Н]+
Пример 210А
трет-бутил 4-(5-оксо-3-{[2-(фенилацетил)гидразино]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
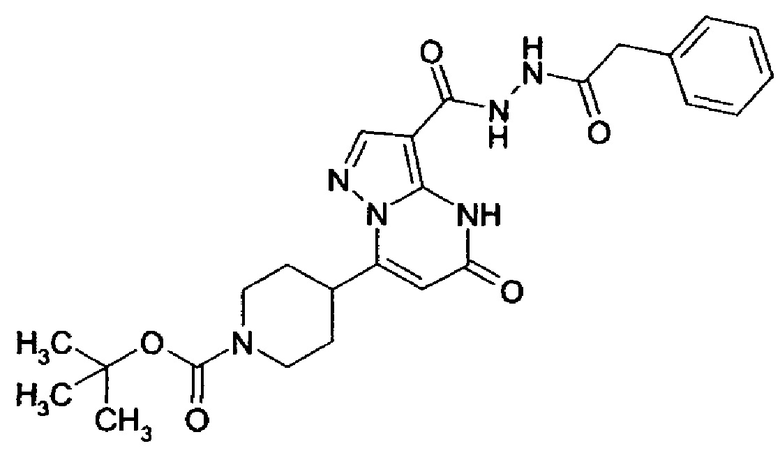
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-фенилацетогидразид (93 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (55 мг, 27% теоретический выход).
LC-MS (Способ 5В): Rt=0.84 мин, MS (ESIPos): m/z=495.5 [М+Н]+
Пример 211А
трет-бутил 4-[3-(5-бензил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
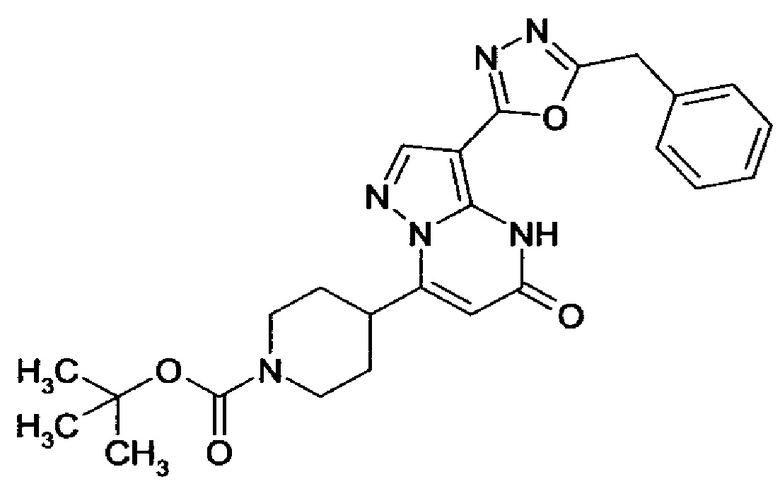
трет-бутил 4-(5-оксо-3-{[2-(фенилацетил)гидразино]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (100 мг, 0.28 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (67.7 мг, 0.28 ммоль) в течение 16 ч при комнатной температуре. Раствор лимонной кислоты (10% в воде) добавили и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (102 мг, 83% теоретический выход).
LC-MS (Способ 5В): Rt=1.05 мин, MS (ESIPos): m/z=477.4 [М+Н]+
Пример 212А
трет-бутил 4-(3-{[2-(4-метилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
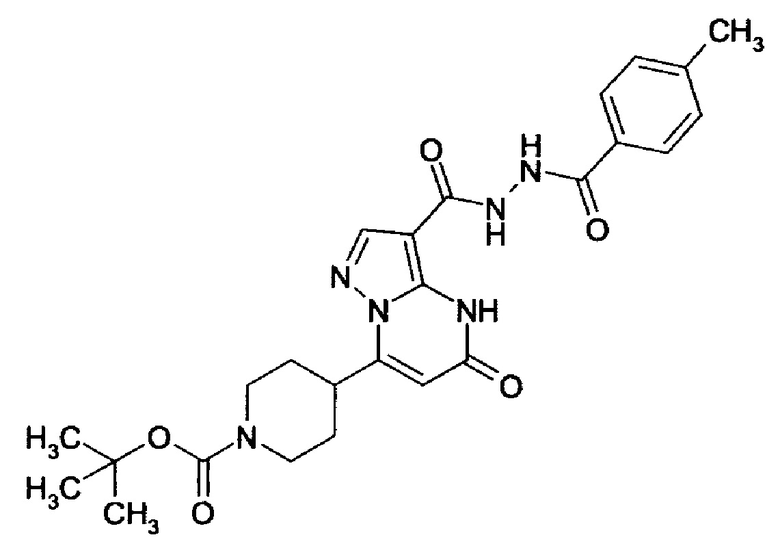
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 4-метилбензогидразид (150 мг, 0.41 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (265 мг, 1.2 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (103 мг, 47% теоретический выход).
LC-MS (Способ 5В): Rt=0.86 мин, MS (ESIPos): m/z=495.5 [М+Н]+
Пример 213А
трет-бутил 4-(3-{[2-(4-хлорбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
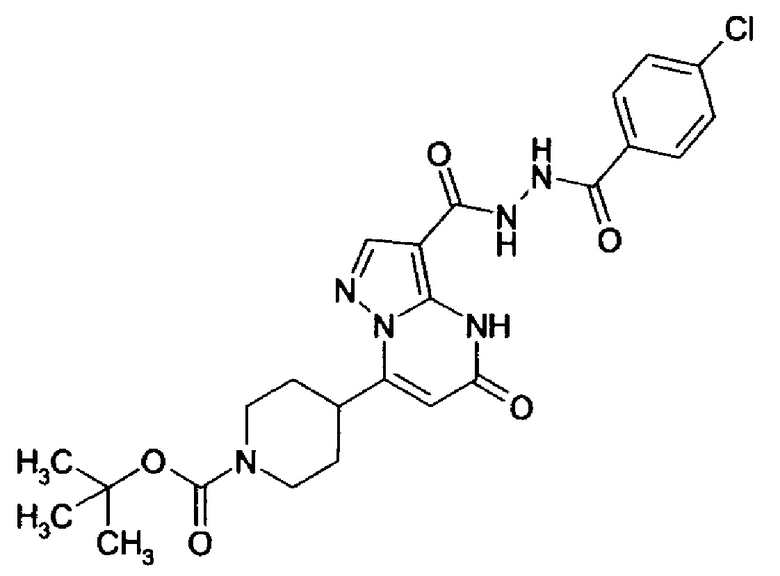
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 4-хлорбензогидразид (116 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (60 мг, 27% теоретический выход).
LC-MS (Способ 5В): Rt=0.88 мин, MS (ESIPos): m/z=459.4 [М+Н]+
Пример 214А
трет-бутил 4-{3-[5-(4-хлорфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
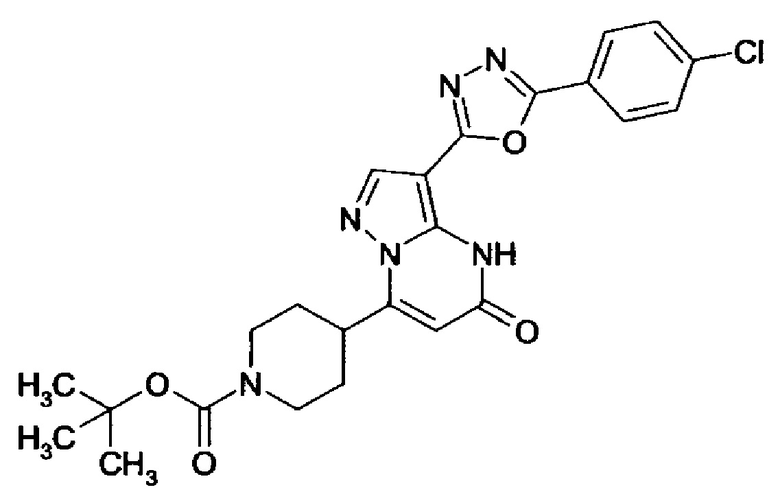
трет-бутил 4-(3-{[2-(4-хлорбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (60 мг, 0.12 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (39 мг, 0.16 ммоль) в течение 16 ч при комнатной температуре. Раствор лимонной кислоты (10% в воде) добавили и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (73 мг, количественный выход).
LC-MS (Способ 5В): Rt=1.17 мин, MS (ESIPos): m/z=497.4 [М+Н]+
Пример 215А
трет-бутил 4-(3-{[2-(циклогексилацетил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
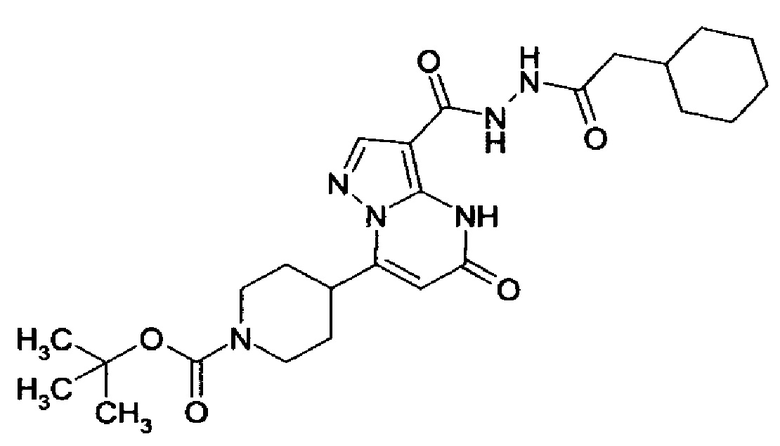
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-циклогексилацетогидразид (97 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (160 мг, 67% теоретический выход).
LC-MS (Способ 5В): Rt=0.90 мин, MS (ESIPos): m/z=501.4 [М+Н]+
Пример 216А
трет-бутил 4-{3-[5-(циклогексилметил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
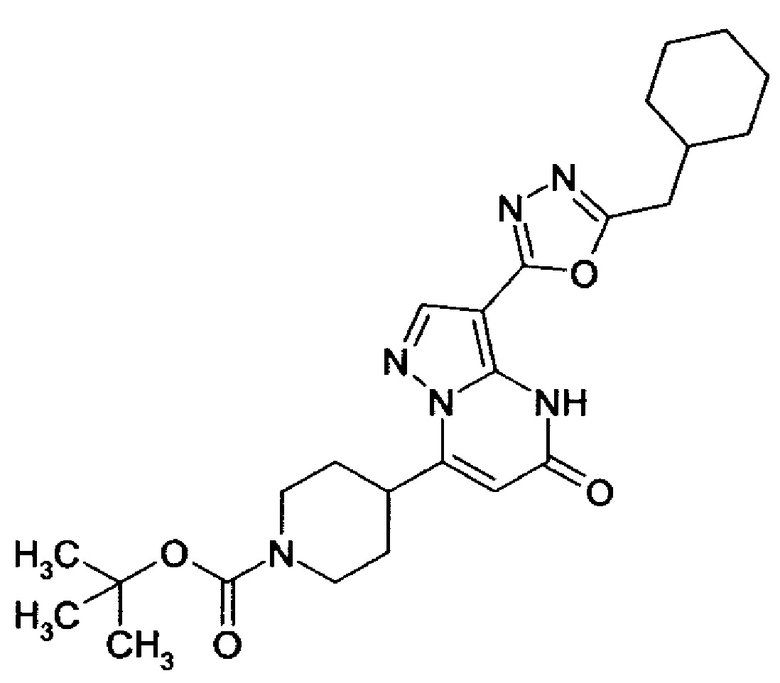
трет-бутил 4-(3-{[2-(циклогексилацетил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (155 мг, 0.31 ммоль) растворили в тетрагидрофуране (5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (103 мг, 0.43 ммоль) в течение 16 ч при комнатной температуре.
Чтобы остановить реакцию добавили воду, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (103 мг, 62% теоретический выход).
LC-MS (Способ 5B): Rt=1.24 мин, MS (ESIPos): m/z=483.4 [M+H]+
Пример 217A
трет-бутил 4-(3-{[2-(2-метилизоникотиноил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
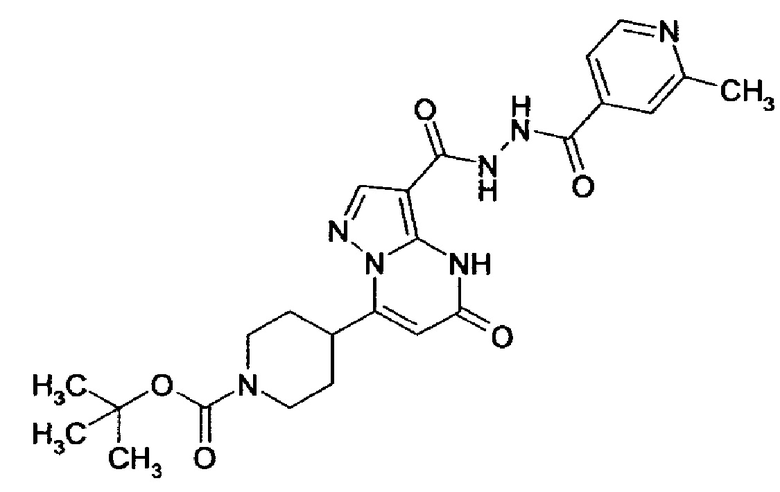
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-метилизоникотиногидразид (94 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (24 мг, 12% теоретический выход).
LC-MS (Способ 5В): Rt=0.67 мин, MS (ESIPos): m/z=495.2 [М+Н]+
Пример 218А
трет-бутил 4-{3-[5-(2-метилпиридин-4-ил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
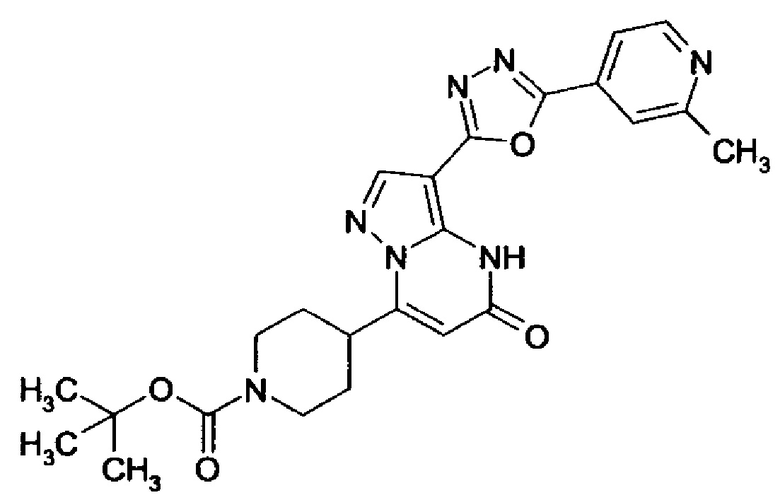
трет-бутил 4-(3-{[2-(2-метилизоникотиноил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (22 мг, 0.05 ммоль) растворили в тетрагидрофуране (1 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (15 мг, 0.06 ммоль) в течение 16 ч при комнатной температуре.
Чтобы остановить реакцию добавили воду, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (21 мг, 97% теоретический выход).
LC-MS (Способ 5В): Rt=0.92 мин, MS (ESIPos): m/z=478.4 [М+Н]+
Пример 219А
трет-бутил 4-(3-{[2-(2-метоксибензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
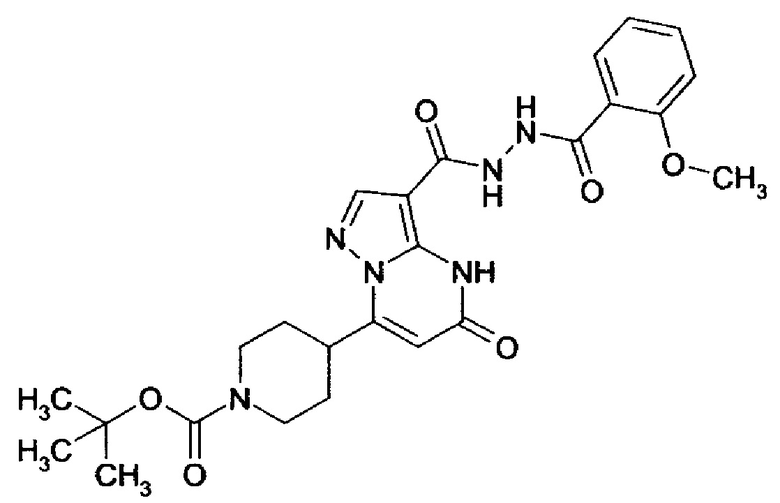
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-
а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-метоксибензогидразид (103 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (90 мг, 39% теоретический выход).
LC-MS (Способ 6В): Rt=2.61 мин, MS (ESIPos): m/z=511.3 [М+Н]+
Пример 220А
трет-бутил 4-{3-[5-(2-метоксифенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
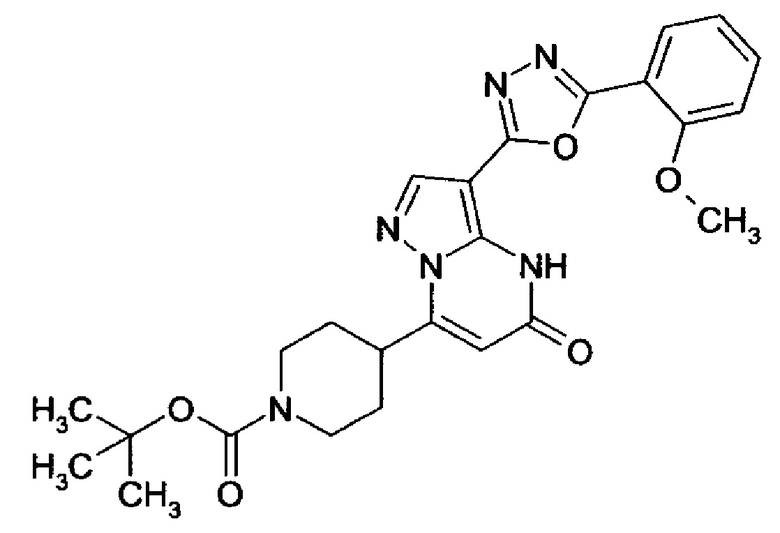
трет-бутил 4-(3-{[2-(2-метоксибензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (85 мг, 0.23 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (55.6 мг, 0.23 ммоль) в течение 16 ч при комнатной температуре. Добавили воду, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (56 мг, 68% теоретический выход).
LC-MS (Способ 5B): Rt=1.03 мин, MS (ESIPos): m/z=493.3 [M+H]+
Пример 221A
трет-бутил 4-{3-[(2-изоникотиноилгидразино)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
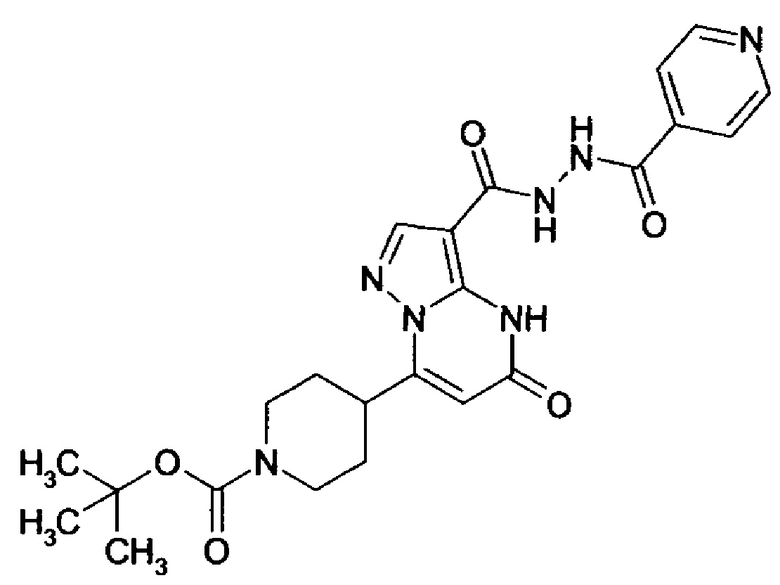
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и изоникотиногидразид (85 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (124 мг, 60% теоретический выход).
LC-MS (Способ 5В): Rt=0.69 мин, MS (ESIPos): m/z=482.4 [М+Н]+
Пример 222А
трет-бутил 4-{5-оксо-3-[5-(пиридин-4-ил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
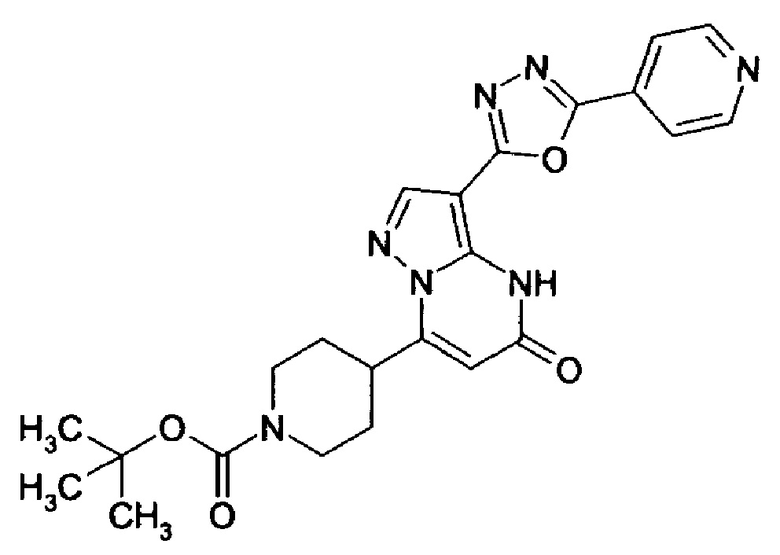
трет-бутил 4-{3-[(2-изоникотиноилги дразино)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (121 мг, 0.25 ммоль) растворили в тетрагидрофуране (3 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (83.8 мг, 0.35 ммоль) в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% муравьиной кислотой). Растворители удалили в вакууме, что обеспечило соединение, указанное в названии (73 мг, 53% теоретический выход).
LC-MS (Способ 5В): Rt=0.91 мин, MS (ESIPos): m/z=464.3 [М+Н]+
Пример 223А
трет-бутил 4-(3-{[2-(2-фторбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
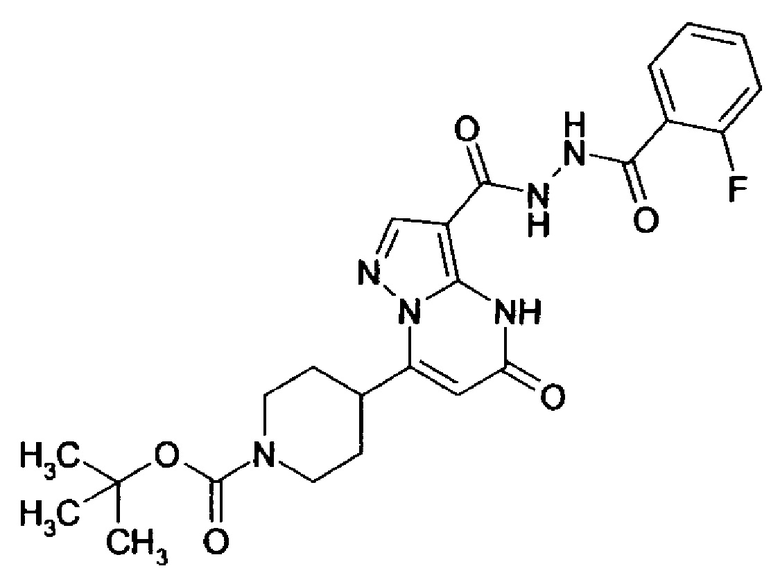
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-
а]пиримидин-3-карбоновую кислоту (150 мг, 0.42 ммоль) и 2-фторбензогидразид (96 мг, 0.62 ммоль) растворили в N,N-Диметилформамиде (1,5 мл). N,N-Диизопропилэтиламин (0.22 мл, 1.24 ммоль) и N-[(Диметиламино)(3H-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилиден]-N-метил-метанаминий-гексафторфосфат (266 мг, 0.62 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% трифторуксусной кислотой), что обеспечило соединение, указанное в названии (102 мг, 50% теоретический выход).
LC-MS (Способ 5В): Rt=0.81 мин, MS (ESIPos): m/z=499.3 [М+Н]+
Пример 224А
трет-бутил 4-{3-[5-(2-фторфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
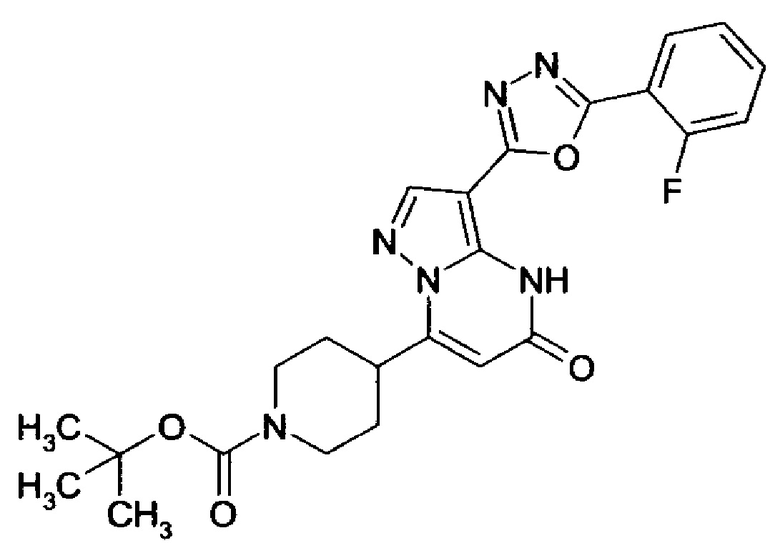
трет-бутил 4-(3-{[2-(2-фторбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (86 мг, 0.17 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (57 мг, 0.24 ммоль) в течение 16 ч при комнатной температуре. Добавили воду, и продукт экстрагировали этилацетатом. Органические фазы высушивали, что обеспечило соединение, указанное в названии (80 мг, 83% теоретический выход).
LC-MS (Способ 5B): Rt=1.09 мин, MS (ESIPos): m/z=481.3 [M+H]+
Пример 225A
трет-бутил 4-[3-(4-метил-2-фенил-1,3-тиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
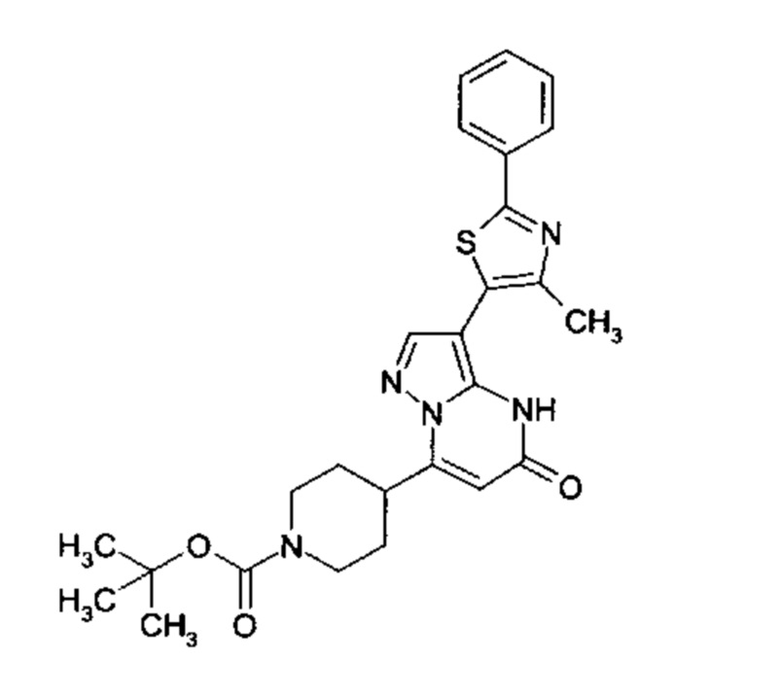
Согласно общей методике 2А, смесь 4-метил-2-фенил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-тиазола (227 мг, 0.76 ммоль), трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (200 мг, 0.50 ммоль), XPhos предкатализатора (85 мг, 0.10 ммоль), дегазированного ТГФ (10 мл) и дегазированного 1М водного раствора K3PO4 (1.5 мл) перемешивали при 70°C в течение 24 ч. Выход: 47 мг, 18% теоретический выход.
LC-MS (Способ 5В): Rt=1.17 мин, MS (ESIPos): m/z=492.3 [М+Н]+
Пример 226А
Трет-бутил 4-(5-оксо-3-{3-[6-(трифторметил)пиридин-3-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
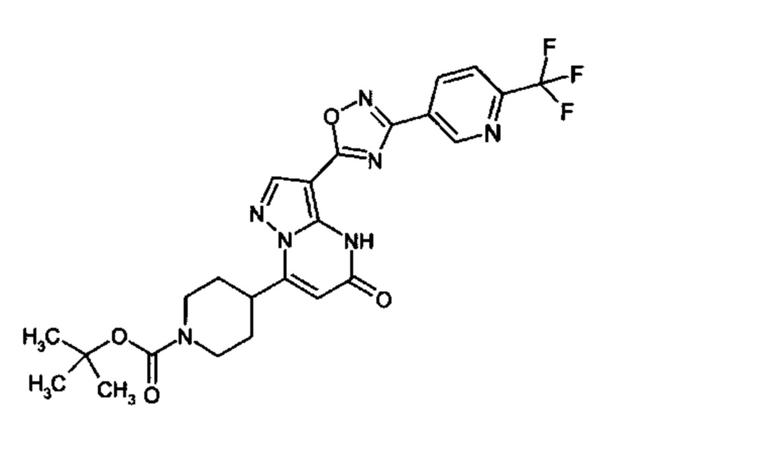
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N'-гидрокси-6-(трифторметил)пиридин-3-карбоксимидамид (226 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, твердое вещество отделили от раствора. Твердое вещество, которое отфильтровали, промыли 2 мл ацетонитрила и высушивали в вакууме, с получением ожидаемого продукта (165 мг, 56% теоретический выход). Фильтрат, который все еще содержал продукт, очистили посредством препаративной ВЭЖХ (градиент ацетонитрил / вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили еще соединение, указанное в названии (37 мг, 64% чистота, 8% теоретический выход).
LC-MS (Способ 8В): Rt=1.51 мин, MS (ESINeg): m/z=530 [М-Н]-
Пример 227А
Трет-бутил 4-(5-оксо-3-{3-[4-(трифторметил)пиридин-3-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
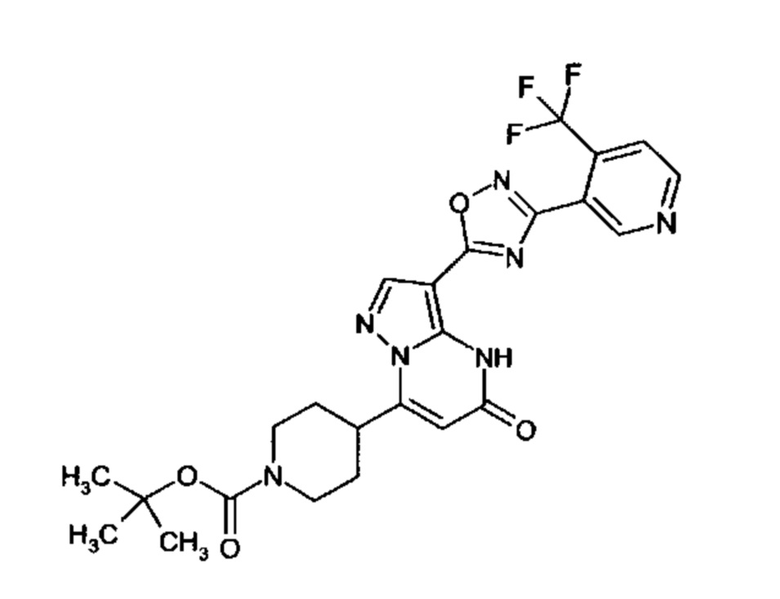
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N'-гидрокси-4-(трифторметил)пиридин-3-карбоксимидамид (226 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (119 мг, 41% теоретический выход).
LC-MS (Способ 8В): Rt=1.40 мин, MS (ESINeg): m/z=530 [М-Н]-
Пример 228А
Трет-трет-бутил4-{5-оксо-3-[3-(2,4,5-трифторфенил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
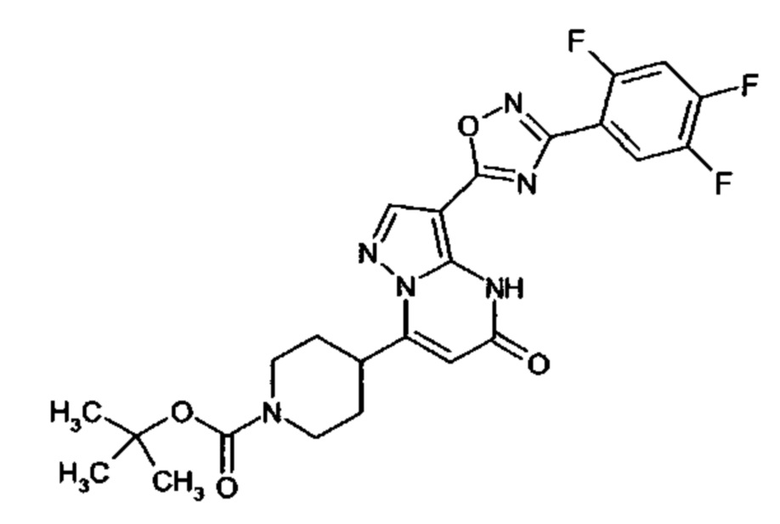
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 2,4,5-трифтор-N'-гидроксибензолкарбоксимидамид (210 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (71 мг, 25% теоретический выход).
LC-MS (Способ 8В): Rt=1.51 мин, MS (ESINeg): m/z=515 [М-Н]-
Пример 229А
Трет-бутил4-(3-{3-[(метилсульфонил)метил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а] пиримидин-7-ил)пиперидин-1-карбоксилат
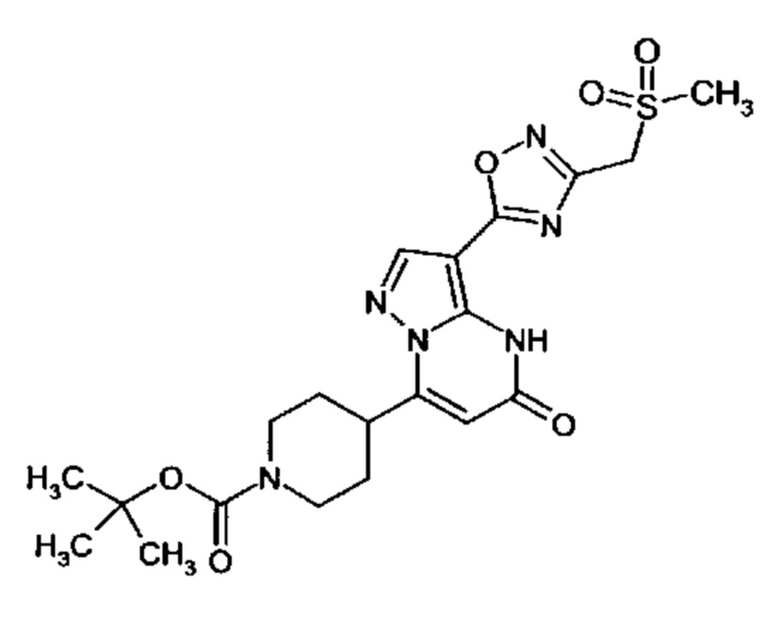
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-N'-гидрокси-2-(метилсульфонил)этанимидамид (168 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили две фракции соединения, указанного в названии (47 мг, 17% теоретический выход; и 81 мг, 28% чистота, 9% теоретический выход).
LC-MS (Способ 8В): Rt=1.12 мин, MS (ESINeg): m/z=477 [М-Н]-
Пример 230А
Трет-бутил 4-{5-оксо-3-[3-(4,4,4-трифторбутил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло [1,5-а] пиримидин-7-ил} пиперидин-1-карбоксилат
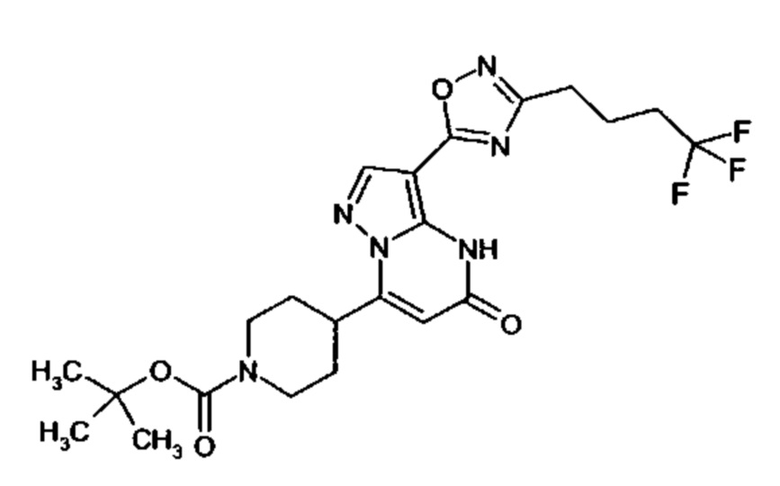
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-5,5,5-трифтор-N'-гидроксипентанимидамид (188 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (177 мг, 64% теоретический выход).
LC-MS (Способ 8В): Rt=1.43 мин, MS (ESINeg): m/z=495 [М-Н]-
Пример 231А
Трет-бутил 4-{3-[3-(1-циклопропилпиперидин-4-ил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат трифторацетатная соль
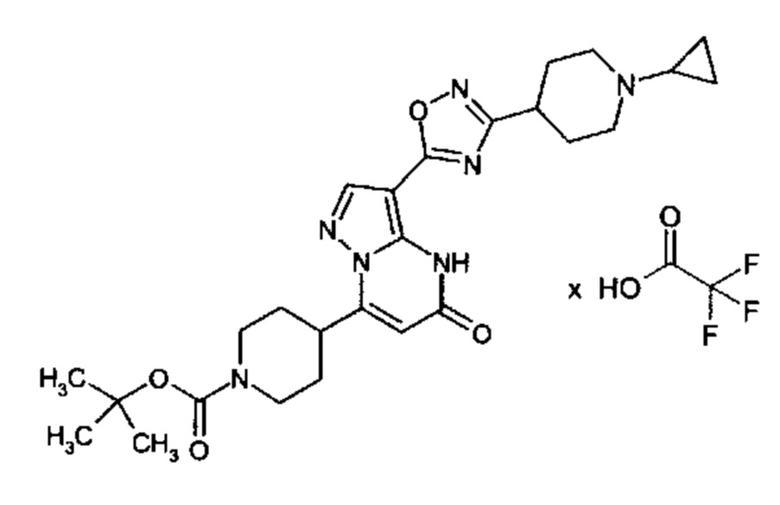
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 1-циклопропил-N'-гидроксипиперидин-4-карбоксимидамид (202 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (155 мг, 45% теоретический выход).
LC-MS (Способ 8В): Rt=0.93 мин, MS (ESINeg): m/z=508 [М-Н]-
Пример 232А
Трет-бутил 4-[3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил] пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-N'-гидрокси-2,2-диметилпропанимидамид (128 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (179 мг, 73% теоретический выход).
LC-MS (Способ 8В): Rt=1.45 мин, MS (ESINeg): m/z=441 [М-Н]-
Пример 233А
Трет-бутил 4-{3-[3-(2-хлор-4-фторбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
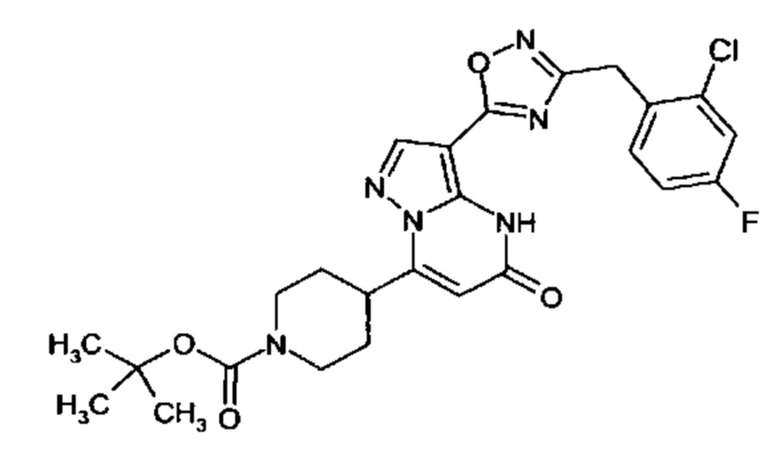
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-2-(2-хлор-4-фторфенил)-N'-гидроксиэтанимидамид (224 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (162 мг, 55% теоретический выход).
LC-MS (Способ 8В): Rt=1.50 мин, MS (ESINeg): m/z=527 [М-Н]-
Пример 234А
Трет-бутил 4-{3-[3-(4-трет-бутилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
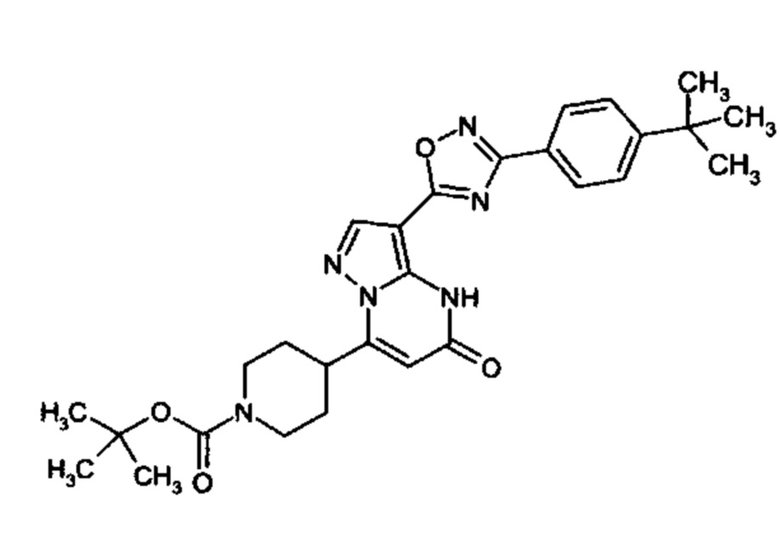
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 4-трет-бутил-N'-гидроксибензолкарбоксимидамид (212 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, суспензию отфильтровали. Полученное твердое вещество промыли простым диэтиловым эфиром и высушивали в вакууме с получением соединения, указанного в названии (115 мг, 40% теоретический выход).
LC-MS (Способ 5В): Rt=1.45 мин, MS (ESINeg): m/z=517 [М-Н]-
Пример 235А
Трет-бутил 4-(3-{3-[4-(диметиламино)-3-фторфенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидро пиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
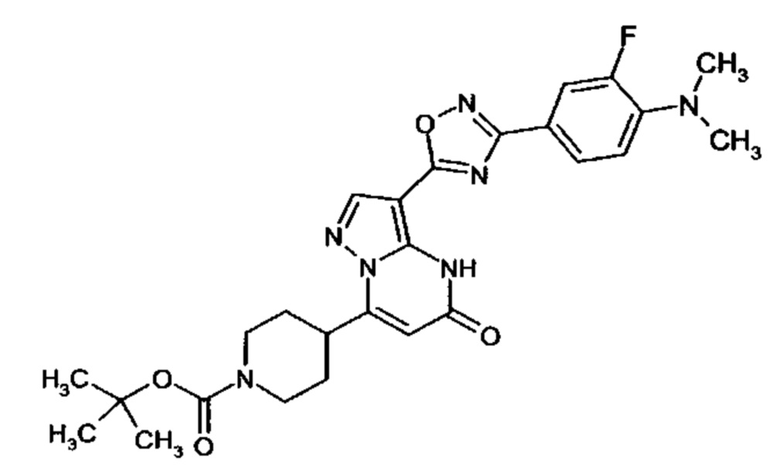
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 4-(диметиламино)-3-фтор-N'-гидроксибензолкарбоксимидамид (218 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (65 мг, 22% теоретический выход).
LC-MS (Способ 8В): Rt=1.57 мин, MS (ESINeg): m/z=524 [М+Н]+
Пример 236А
Трет-бутил 4-{3-[3-(2-метилбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин -7-ил}пиперидин-1-карбоксилат
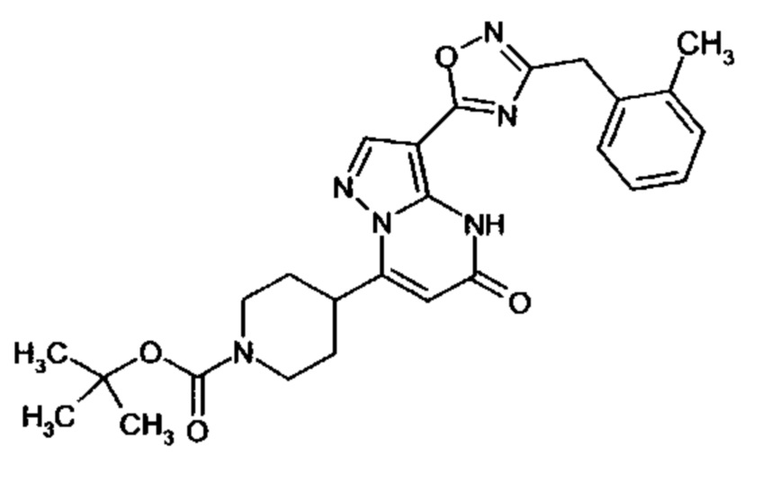
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-N'-гидрокси-2-(2-метилфенил)этанимидамид (181 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (161 мг, 59% теоретический выход).
LC-MS (Способ 8В): Rt=1.48 мин, MS (ESINeg): m/z=489 [М-Н]-
Пример 237А
Трет-бутил 4-[3-(3-этил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
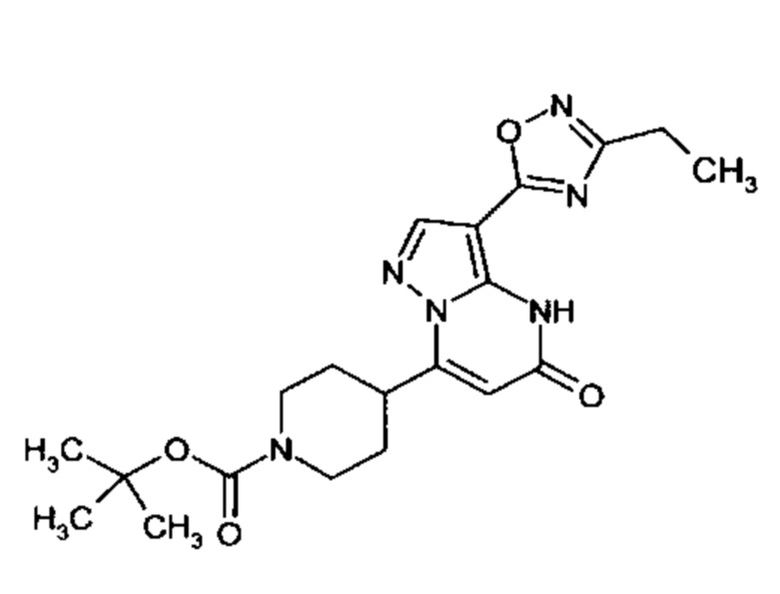
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (214 мг, 1.66 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-N'-гидроксипропанимидамид гидрохлорид (138 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (104 мг, 45% теоретический выход).
LC-MS (Способ 8В): Rt=1.32 мин, MS (ESINeg): m/z=413 [М-Н]-
Пример 238А
Трет-бутил 4-[3-(3-карбамоил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
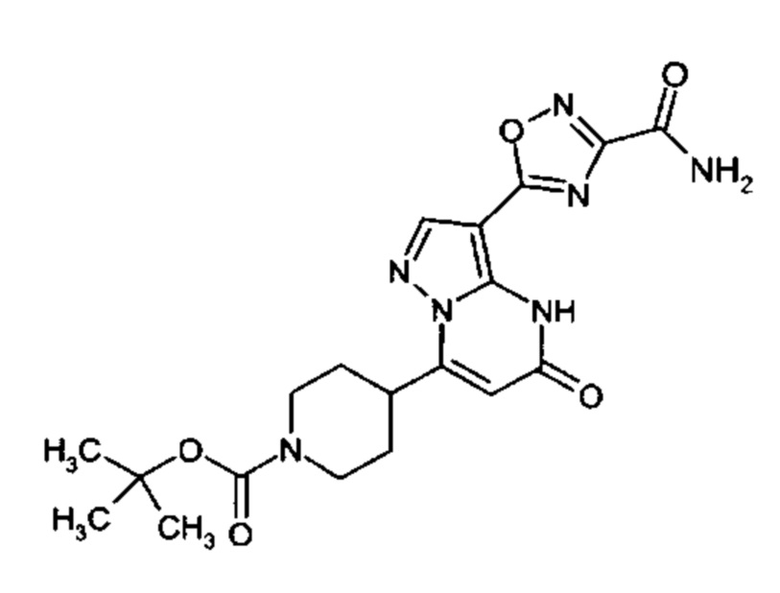
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (2Z)-2-амино -2-(гидроксиимино)ацетамид (114 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (125 мг, 94% чистота, 50% теоретический выход).
LC-MS (Способ 8В): Rt=1.09 мин, MS (ESINeg): m/z=428 [М-Н]-
Пример 239А
Трет-бутил 4-(3-{3-[(изопропилсульфонил)метил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
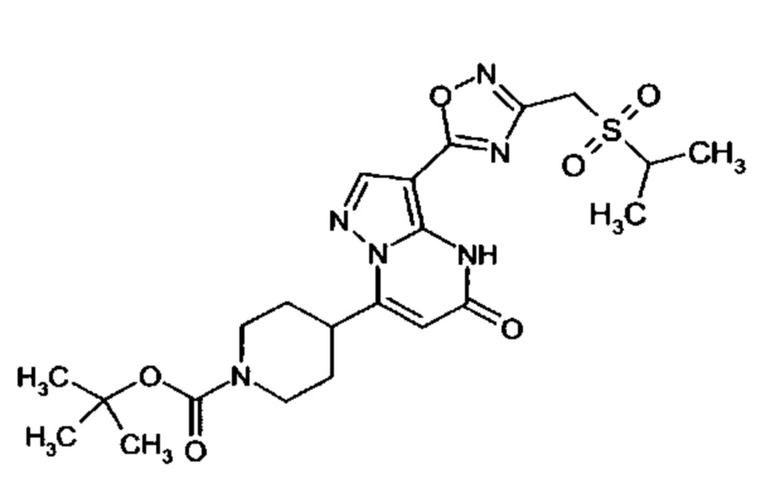
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-N'-гидрокси-2-(изопропилсульфонил)этанимидамид (199 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (24 мг, 93% чистота, 8% теоретический выход).
LC-MS (Способ 8В): Rt=1.23 мин, MS (ESINeg): m/z=505 [М-Н]-
Пример 240А
Трет-бутил 4-{3-[3-(3,5-дифторпиридин-2-ил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а] пиримидин-7-ил}пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3,5-дифтор-N'-гидроксипиридин-2-карбоксимидамид (191 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (25 мг, 9% теоретический выход).
LC-MS (Способ 8В): Rt=1.34 мин, MS (ESINeg): m/z=498 [М-Н]-
Пример 241А
Трет-бутил 4-(3-{3-[(1-метилпиперидин-4-ил)метил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (143 мг, 1.10 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-N'-гидрокси-2-(1-метилпиперидин-4-ил)этанимидамид (189 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (281 мг, 91% чистота, 93% теоретический выход).
LC-MS (Способ 8В): Rt=0.89 мин, MS (ESINeg): m/z=496 [М-Н]-
Пример 242А
Трет-бутил 4-(3-{3-[4-(метоксикарбонил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
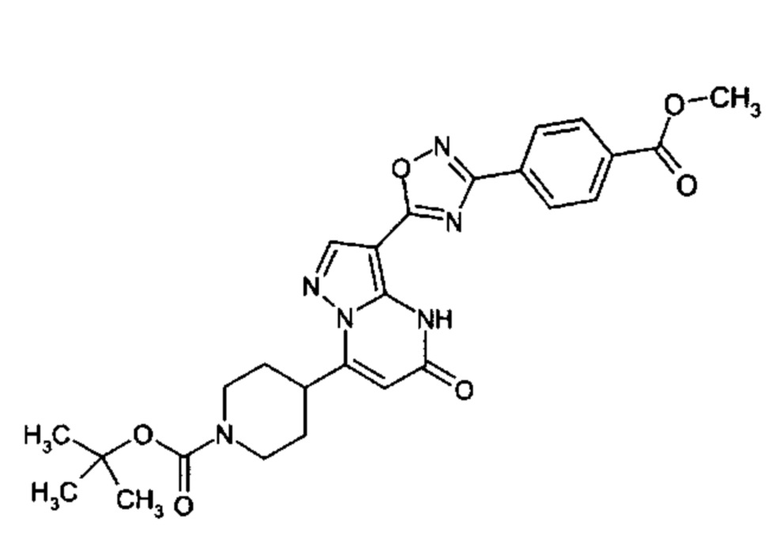
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (400 мг, 1.10 ммоль) в 10 мл диметилформамида добавили 1,1'-карбонилдиимидазол (358 мг, 2.21 ммоль) и N,N-диизопропилэтиламин (285 мг, 2.21 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени метил 4-(N'-гидроксикарбамимидоил)бензоат (429 мг, 2.21 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, твердое вещество отделили от раствора. Твердое вещество, которое отфильтровали и промыли 2 мл простого диэтилового эфира и высушивали в вакууме, обеспечило целевой продукт, который все еще содержал примеси. Смесь очистили посредством флеш-хроматографии на силикагеле (градиент дихлорметан/метанол). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (41 мг, 7% теоретический выход).
LC-MS (Способ 8В): Rt=1.52 мин, MS (ESINeg): m/z=519 [М-Н]-
Пример 243А
Трет-бутил 4-{3-[3-(3-нитрофенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1 -карбоксилат
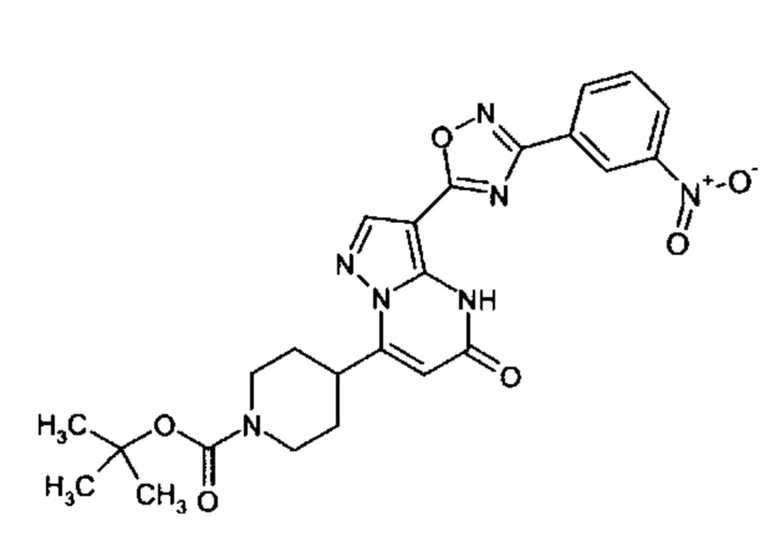
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (90 мг, 0.25 ммоль) в 2.3 мл диметилформамида добавили 1,1'-карбонилдиимидазол (81 мг, 0.50 ммоль) и N,N-диизопропилэтиламин (64 мг, 0.50 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N'-гидрокси-3-нитробензолкарбоксимидамид (90 мг, 0.50 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (62 мг, 47% теоретический выход).
LC-MS (Способ 8В): Rt=1.50 мин, MS (ESINeg): m/z=506 [М-Н]-
Пример 244А
Трет-бутил 4-{3-[3-(2-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а] пиримидин-7-ил}пиперидин-1-карбоксилат
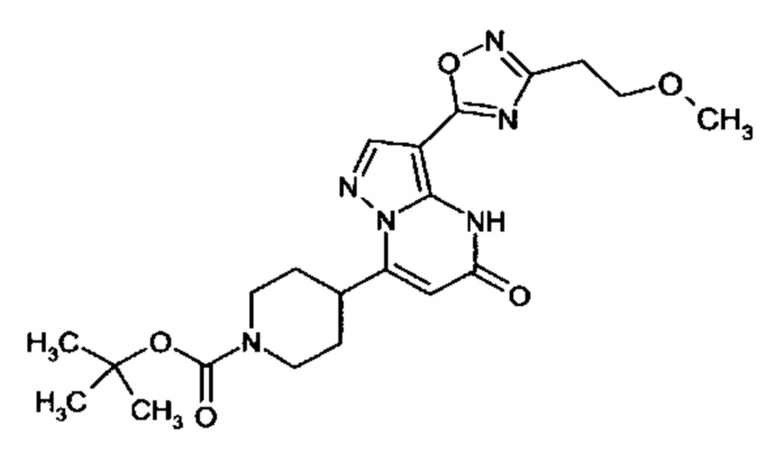
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (214 мг, 1.66 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-N'-гидрокси-3-метоксипропанимидамид (130 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (103 мг, 93% чистота, 39% теоретический выход).
LC-MS (Способ 8В): Rt=1.24 мин, MS (ESINeg): m/z=443 [М-Н]-
Пример 245А
Трет-бутил 4-{5-оксо-3-[3-(пиридин-4-ил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
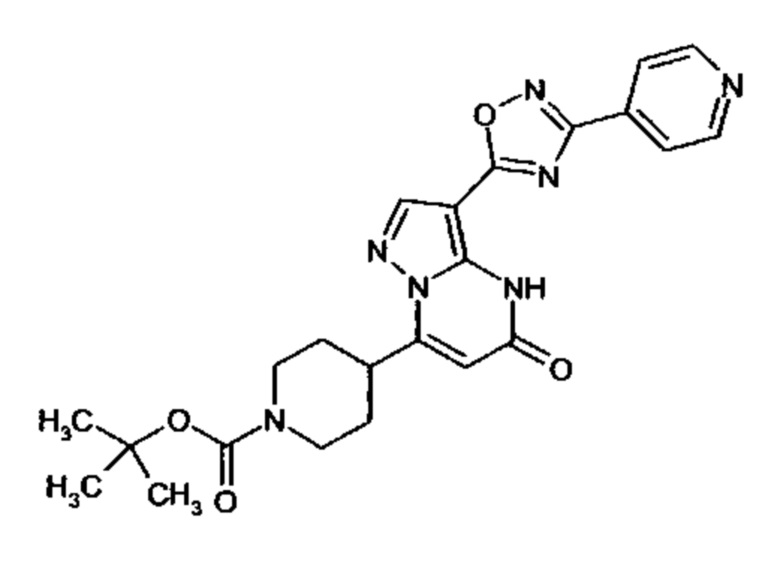
К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (214 мг, 1.66 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N'-гидроксипиридин-4-карбоксимидамид (151 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (174 мг, 65% теоретический выход).
LC-MS (Способ 8В): Rt=1.28 мин, MS (ESINeg): m/z=462 [М-Н]-
Пример 246А
Трет-бутил 4-{3-[3-(3-аминофенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

К раствору соединения 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 0.55 ммоль) в 5 мл диметилформамида добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и N,N-диизопропилэтиламин (214 мг, 1.66 ммоль), и затем реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени 3-амино-N'-гидроксибензолкарбоксимидамид (167 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (178 мг, 88% чистота, 59% теоретический выход).
LC-MS (Способ 8В): Rt=1.33 мин, MS (ESINeg): m/z=476 [М-Н]-
Пример 247А
Трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
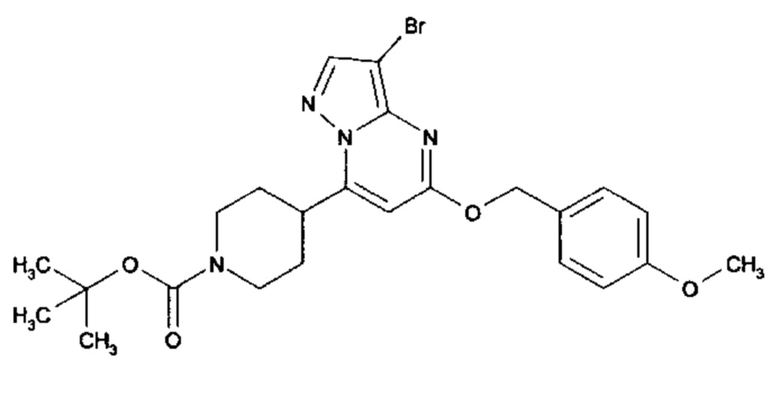
К раствору трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (10.0 г, 25.2 ммоль) в N,N-Диметилформамиде (200 мл, 1.1 ммоль) в атмосфере аргона добавили карбонат калия (6.96 г, 50.3 ммоль) и 1-(хлорметил)-4-метоксибензол (3.8 мл, 28 ммоль). Смесь перемешивали 1 ч при 45°C и затем перелили в 2 литра воды. Полученное твердое вещество, которое представляет собой 1/1 смесь кислород/азот РМВ-защищенного пиридона, отфильтровали и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 5.46 г (100% чистота, 42% теоретический выход).
LC-MS (Способ 8В): Rt=1.72 мин.
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.000 (2.08), 1.409 (16.00), 1.555 (0.14), 1.576 (0.36), 1.585 (0.37), 1.607 (0.40), 1.617 (0.37), 1.638 (0.16), 1.648 (0.13), 1.973 (0.49), 2.005 (0.42), 2.879 (0.17), 3.313 (1.32), 3.503 (0.16), 3.526 (0.19), 3.533 (0.31), 3.541 (0.18), 3.563 (0.15), 4.077 (0.29), 4.105 (0.28), 5.373 (2.73), 6.546 (1.69), 6.932 (0.18), 6.939 (1.44), 6.944 (0.50), 6.956 (0.53), 6.961 (1.54), 6.968 (0.18), 7.458 (0.19), 7.465 (1.45), 7.487 (1.34), 7.494 (0.16), 8.203 (1.71).
Пример 248А
Трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

К раствору трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (14.3 г, 71% чистота, 29.5 ммоль) в этаноле (300 мл) добавили гидрохлорид гидроксиламина (1:1) (3.08 г, 44.3 ммоль) и триэтиламин (5.3 мл, 38 ммоль). Смесь перемешивали всю ночь при 50°C перед разбавлением этилацетатом. Органическую фазу выделили, промыли водой и насыщенным водным раствором хлорида натрия, высушивали над сульфатом натрия, отфильтровали и концентрировали с получением соединения, указанного в названии. Несмотря на чистоту 53%, соединение могло применяться на следующей стадии без дальнейшей очистки.
Полученное количество составило 9.83 г (53% чистота, 47% теоретический выход).
LC-MS (Способ 8В): Rt=0.91 мин; MS (ESIneg): m/z=375 [М-Н]-
Пример 249А
Трет-бутил 4-{3-[3-(2-хлорбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
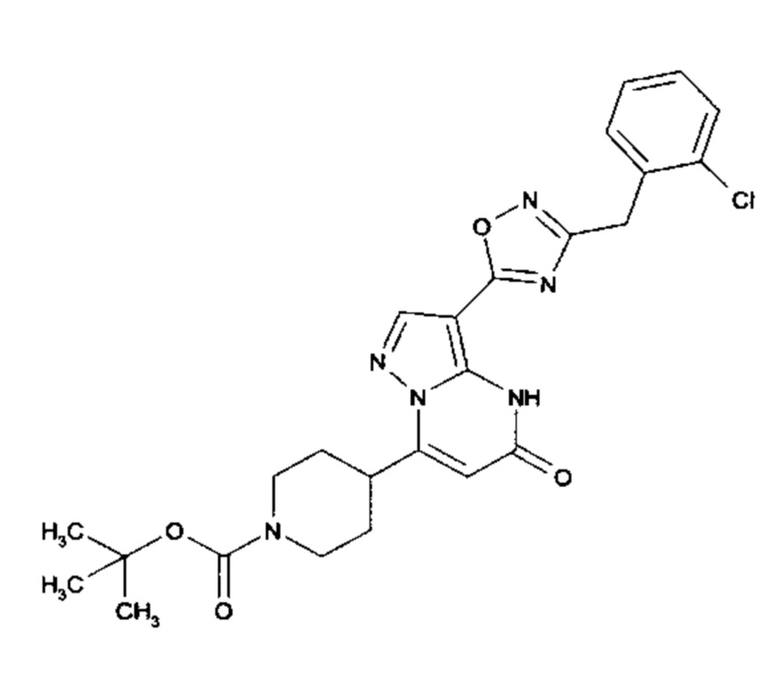
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (200 мг, 552 мкмоль) в N,N-Диметилформамиде (5.0 мл) в атмосфере аргона добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и этилдиизопропиламин (190 мкл, 1.13ммоль). Реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-2-(2-хлорфенил)-N'-гидроксиэтанимидамид (204 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 128 мг (92% чистота, 42% теоретический выход).
LC-MS (Способ 8В): Rt=1.51 мин; MS (ESIneg): m/z=509 [М-Н]-
Пример 250А
Трет-бутил 4-{3-[3-(4-хлорбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
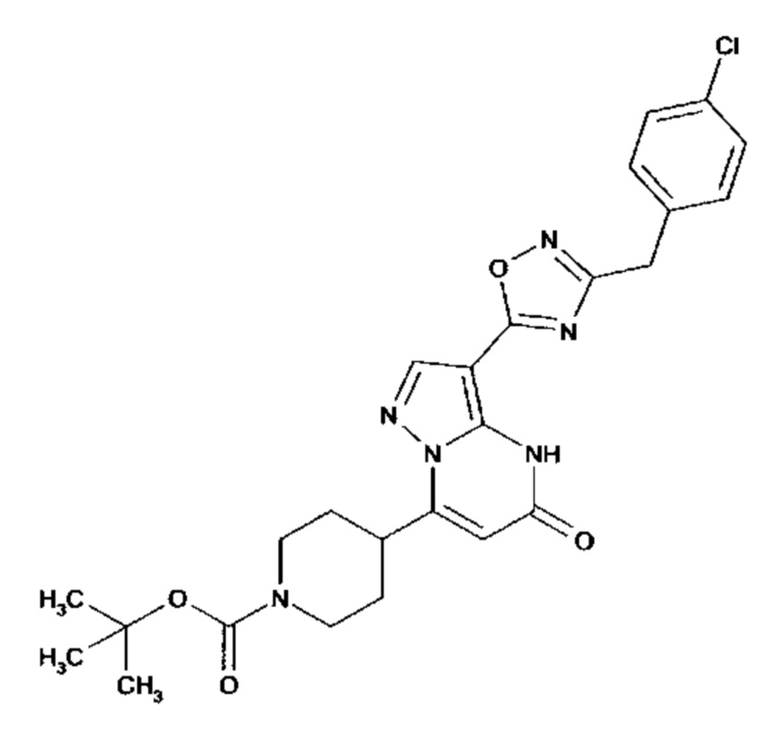
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 552 мкмоль)
(1Z)-2-(4-хлорфенил)-N'-гидроксиэтанимидамид (204 мг, 1.10 ммоль)
1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль)
Этилдиизопропиламин (190 мкл, 1.1 ммоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 117 мг (95% чистота, 39% теоретический выход).
LC-MS (Способ 8В): Rt=1.52 мин; MS (ESIneg): m/z=509 [М-Н]-
Пример 251А
Трет-бутил 4-{3-[3-(этоксикарбонил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
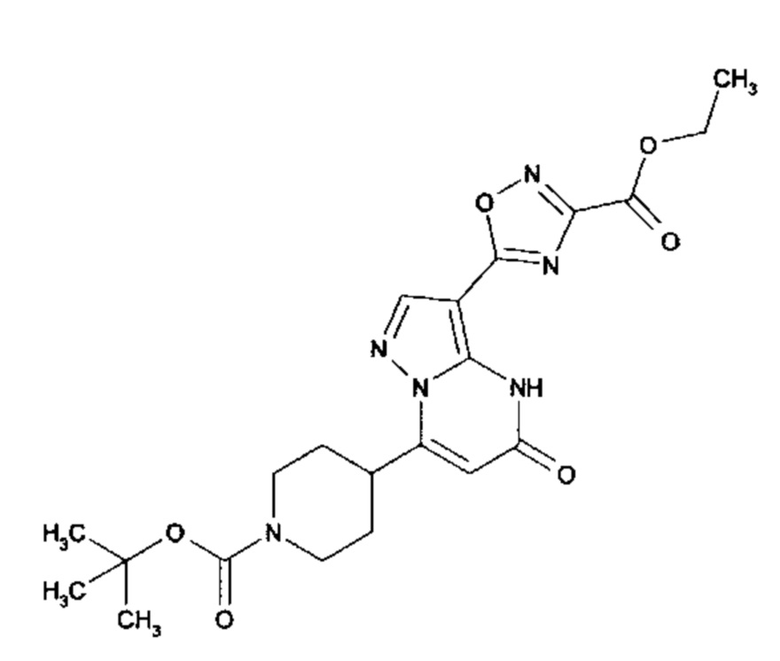
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 276 мкмоль)
этил (2Z)-амино(гидроксиимино)этаноат (365 мг, 2.76 ммоль)
1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль)
Этилдиизопропиламин (190 мкл, 1.1 ммоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 40.0 мг (98% чистота, 31% теоретический выход).
LC-MS (Способ 8В): Rt=1.31 мин; MS (ESIneg): m/z=457 [М-Н]-
Пример 252А
Трет-бутал 4-[3-(3-{[(трет-бутоксикарбонил)амино]метил}-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
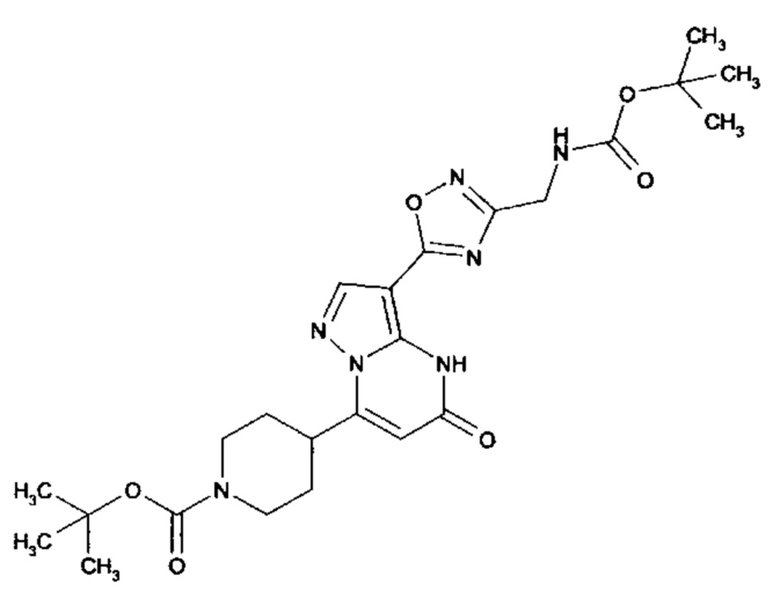
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (286 мг, 790 мкмоль) в N,N'-Диметилформамиде (5.0 мл) в атмосфере аргона добавили 1,1'-карбонилдиимидазол (256 мг, 1.58 ммоль) и этилдиизопропиламин (280 мкл, 1.6 ммоль). Реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени трет-бутил [(2Z)-2-амино-2-(гидроксиимино)этил]карбамат (318 мг, 94% чистота, 1.58 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. Новую порцию этилдиизопропиламина (140 мкл, 0.8 ммоль) добавили, смесь затем перемешивали еще одну ночь при 110°C и два дня при 130°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 158 мг (98% чистота, 38% теоретический выход).
LC-MS (Способ 8В): Rt=1.34 мин; MS (ESIneg): m/z=514 [М-Н]-
Пример 253А
Трет-бутил 4-{3-[3-(3,4-дихлорбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
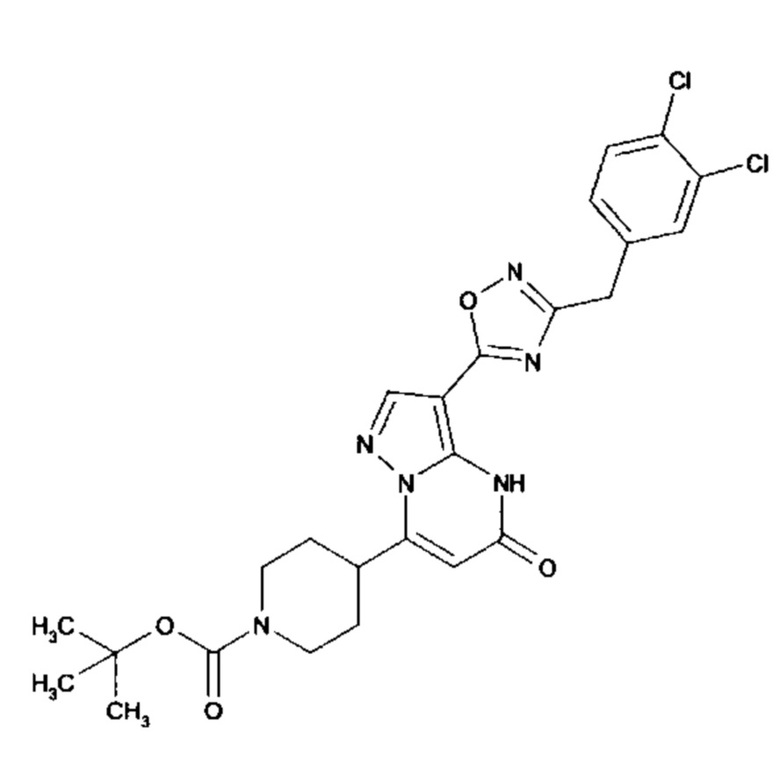
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (300 мг, 828 мкмоль)
(1Z)-2-(3,4-дихлорфенил)-N'-гидроксиэтанимидамид (363 мг, 1.66 ммоль)
1,1'-карбонилдиимидазол (268 мг, 1.66 ммоль)
Этилдиизопропиламин (290 мкл, 1.7 ммоль)
N,N-Диметилформамид (7.5 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 163 мг (100% чистота, 36% теоретический выход).
LC-MS (Способ 8В): Rt=1.58 мин; MS (ESIneg): m/z=543 [М-Н]-
Пример 254А
Трет-бутил 4-{3-[3-(4-метилбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
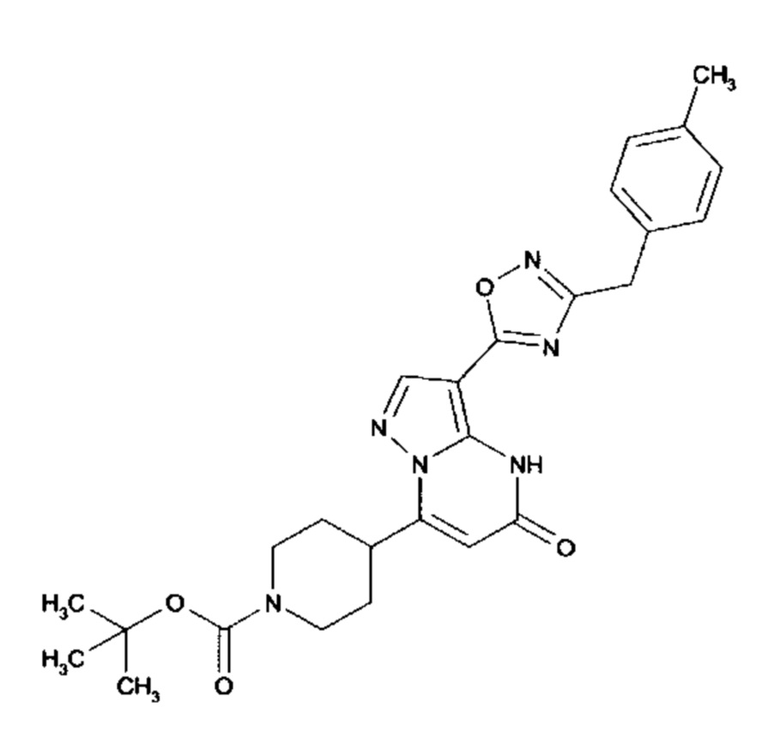
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 552 мкмоль)
(1Z)-N'-гидрокси-2-(4-метилфенил)этанимидамид (181 мг, 1.10 ммоль)
1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль)
Этилдиизопропиламин (190 мкл, 1.1 ммоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 130 мг (100% чистота, 48% теоретический выход).
LC-MS (Способ 8В): Rt=1.51 мин; MS (ESIneg): m/z=489 [М-Н]-
Пример 255А
Трет-бутил 4-{5-оксо-3-[3-(1-фенилэтил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 552 мкмоль)
(1Z)-N'-гидрокси-2-фенилпропанимидамид (181 мг, 1.10 ммоль)
1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль)
Этилдиизопропиламин (290 мкл, 1.7 ммоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 56.0 мг (100% чистота, 21% теоретический выход).
LC-MS (Способ 8В): Rt=1.51 мин; MS (ESIneg): m/z=489 [М-Н]-
Пример 256А
Трет-бутил 4-{3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
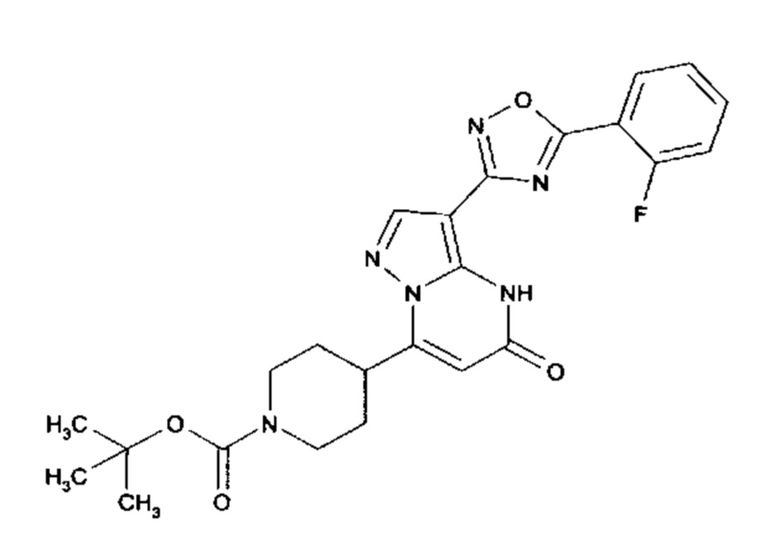
К раствору 2-фторбензойной кислоты (60.0 мг, 97% чистота, 415 мкмоль) в N,N-Диметилформамиде (5.0 мл) в атмосфере аргона добавили (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (262 мг, 99% чистота, 498 мкмоль) и этилдиизопропиламин (85 мкл, 500 мкмоль). Реакционную смесь перемешивали 1 ч при комнатной температуре. После этого периода времени трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (297 мг, 58% чистота, 457 мкмоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством флеш-хроматографии на силикагеле (градиент дихлорметан/метанол). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии, которое все еще не было чистым и могло применяться в таком виде на следующей стадии.
Полученное количество составило 345 мг (53% чистота, 83% теоретический выход).
LC-MS (Способ 8В): Rt=1.49 мин; MS (ESIneg): m/z=479 [М-Н]-
Пример 257А
Трет-бутил 4-{3-[5-(3-хлорбензил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

К раствору (3-хлорфенил)уксусной кислоты (50.0 мг, 293 мкмоль) в N,N-Диметилформамиде (5.2 мл) в атмосфере аргона добавили (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (183 мг, 352 мкмоль) и этилдиизопропиламин (61 мкл, 350 мкмоль). Реакционную смесь перемешивали 1 ч при комнатной температуре. После этого периода времени трет-бутия 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (209 мг, 58% чистота, 322 мкмоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 54.0 мг (92% чистота, 30% теоретический выход).
LC-MS (Способ 8В): Rt=1.51 мин; MS (ESIneg): m/z=509 [М-Н]-
Пример 258А
Трет-бутил 4-{3-[5-(3-хлор-2-фторфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
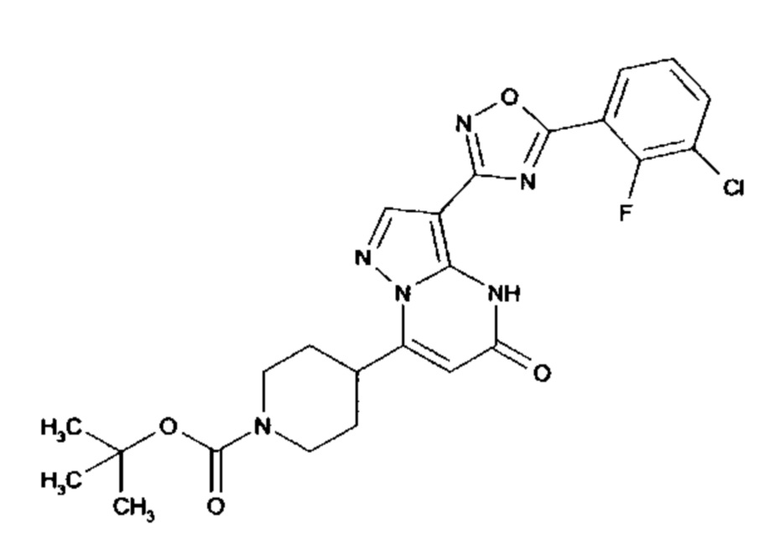
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (245 мг, 58% чистота, 378 мкмоль)
3-хлор-2-фторбензойная кислота (60.0 мг, 344 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (217 мг, 99% чистота, 412 мкмоль)
Этилдиизопропиламин (70 мкл, 410 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 82.0 мг (100% чистота, 42% теоретический выход).
LC-MS (Способ 8В): Rt=1.57 мин; MS (ESIneg): m/z=513 [М-Н]-
Пример 259А
Трет-бутил 4-{3-[5-(2-метоксифенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
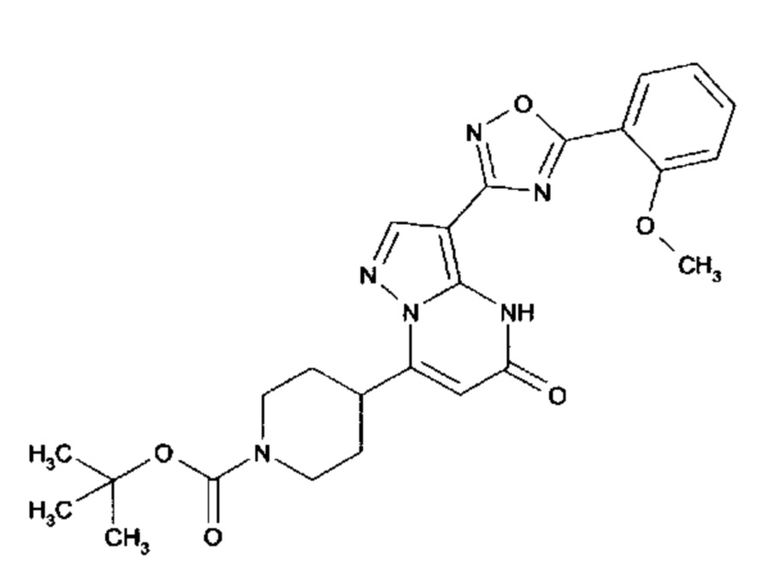
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (279 мг, 58% чистота, 429 мкмоль)
2-метоксибензойная кислота (60.0 мг, 99% чистота, 390 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (246 мг, 99% чистота, 468 мкмоль)
Этилдиизопропиламин (80 мкл, 470 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 39.0 мг (100% чистота, 18% теоретический выход).
LC-MS (Способ 8В): Rt=1.47 мин; MS (ESIneg): m/z=491 [М-Н]-
Пример 260А
Трет-бутил 4-{3-[5-(4-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
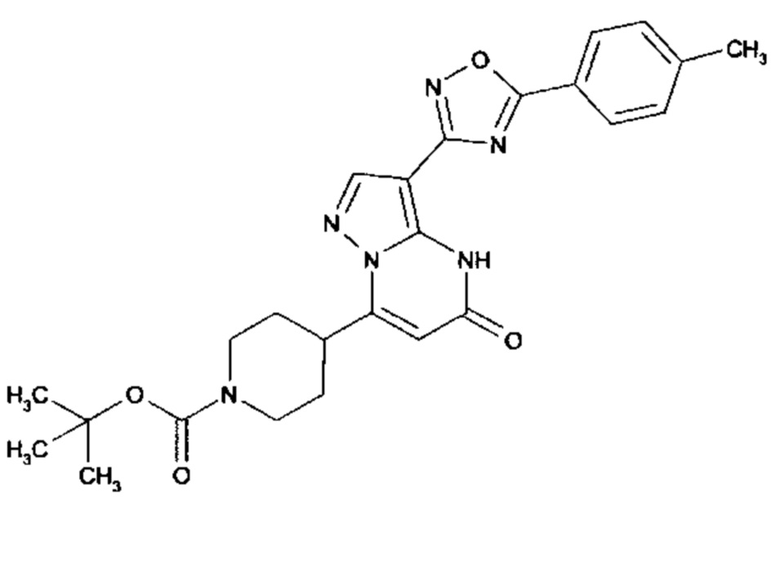
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (308 мг, 58% чистота, 475 мкмоль)
4-метилбензойная кислота (60.0 мг, 98% чистота, 432 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (272 мг, 99% чистота, 518 мкмоль)
Этилдиизопропиламин (88 мкл, 520 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 39.0 мг (94% чистота, 16% теоретический выход).
LC-MS (Способ 8В): Rt=1.57 мин; MS (ESIneg): m/z=475 [М-Н]-
Пример 261А
5-{7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил}-1,2,4-оксадиазол-3-карбоновая кислота
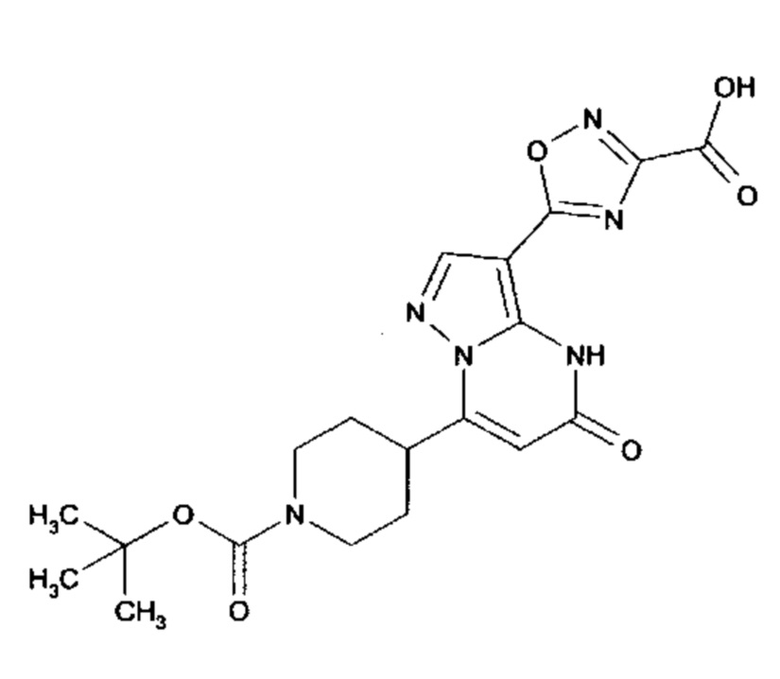
К раствору трет-бутил 4-{3-[3-(этоксикарбонил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (50.0 мг, 97% чистота, 106 мкмоль) в 1/1/1 смеси метанол/оксолан/вода (1.0 мл/1.0 мл/1.0 мл) добавили гидроксид лития (2.59 мг, 98% чистота, 106 мкмоль). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Вторую порцию гидроксида лития (2.59 мг, 98% чистота, 106 мкмоль), предварительно растворенную в воде, добавили, и перемешивание продолжали в течение 1 ч.
Смесь слегка подкислили, применяя 1.0 М водный раствор соляной кислоты, и экстрагировали три раза этилацетатом. Органическую фазу затем промыли водой, высушивали над сульфатом натрия и концентрировали.
Полученное количество составило 36.0 мг (99% чистота, 78% теоретический выход).
LC-MS (Способ 8В): Rt=0.95 мин; MS (ESIpos): m/z=375 [М+Н-(СН3)3]+
Пример 262А
Трет-бутил 4-(5-оксо-3-{3-[3-(трифторметил)бензил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
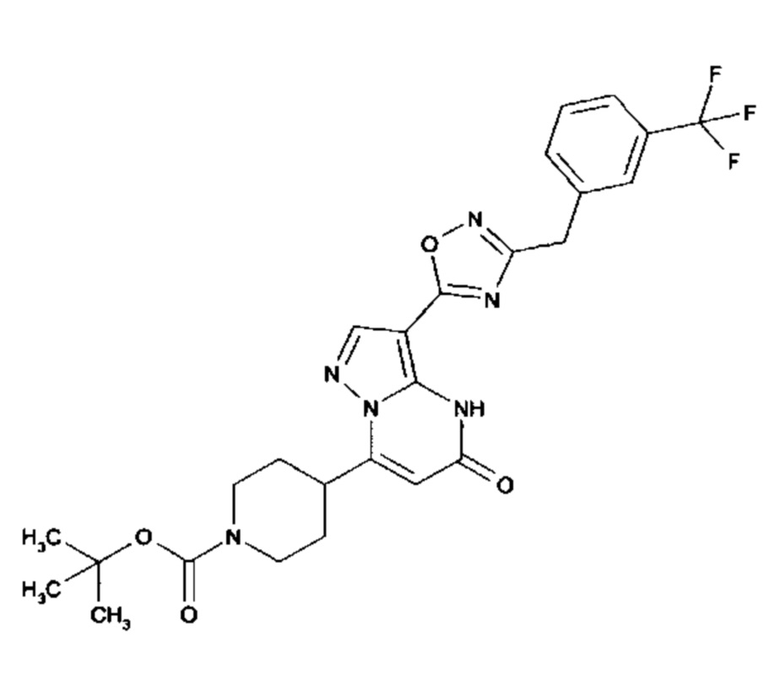
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (183 мг, 505 мкмоль)
(1Z)-N'-гидрокси-2-[3-(трифторметил)фенил]этанимидамид (380 мг, 58% чистота, 1.01 ммоль)
1,1'-карбонилдиимидазол (164 мг, 1.01 ммоль)
Этилдиизопропиламин (260 мкл, 1.5 ммоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 41.0 мг (100% чистота, 15% теоретический выход).
LC-MS (Способ 8В): Rt=1.53 мин; MS (ESIneg): m/z=543 [М-Н]-
Пример 263А
Трет-бутил 4-{5-оксо-3-[3-(2-фенилпропан-2-ил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
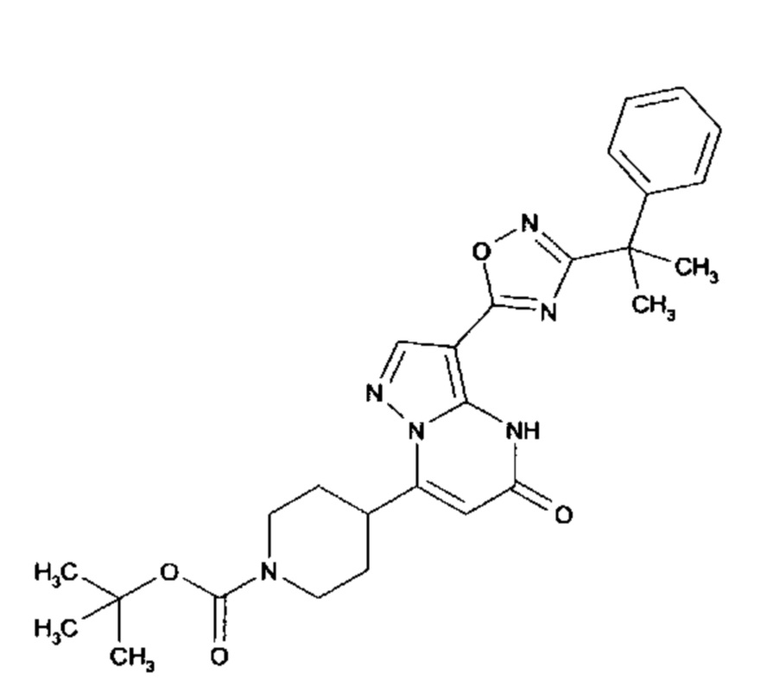
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (87.4 мг, 241 мкмоль)
(1Z)-N'-гидрокси-2-метил-2-фенилпропанимидамид (86.0 мг, 100% чистота, 483 мкмоль)
1,1'-карбонилдиимидазол (78.2 мг, 483 мкмоль)
Этилдиизопропиламин (130 мкл, 720 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 10.0 мг (100% чистота, 8% теоретический выход).
LC-MS (Способ 8В): Rt=1.55 мин; MS (ESIneg): m/z=503 [М-Н]-
Пример 264А
Трет-бутил 4-{3-[3-(4-фторбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
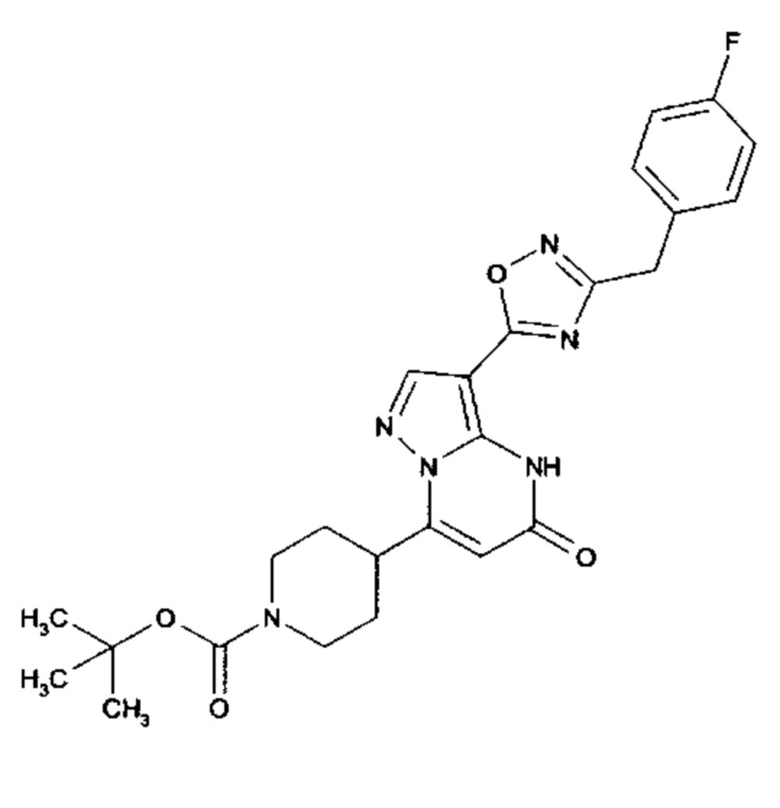
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (200 мг, 552 мкмоль)
(1Z)-2-(4-фторфенил)-N'-гидроксиэтанимидамид (186 мг, 1.10 ммоль)
1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль)
Этилдиизопропиламин (190 мкл, 1.1 ммоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 96.0 мг (98% чистота, 34% теоретический выход).
LC-MS (Способ 8В): Rt=1.45 мин; MS (ESIneg): m/z=493 [М-Н]-
Пример 265А
Трет-бутил 4-{3-[5-(2-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
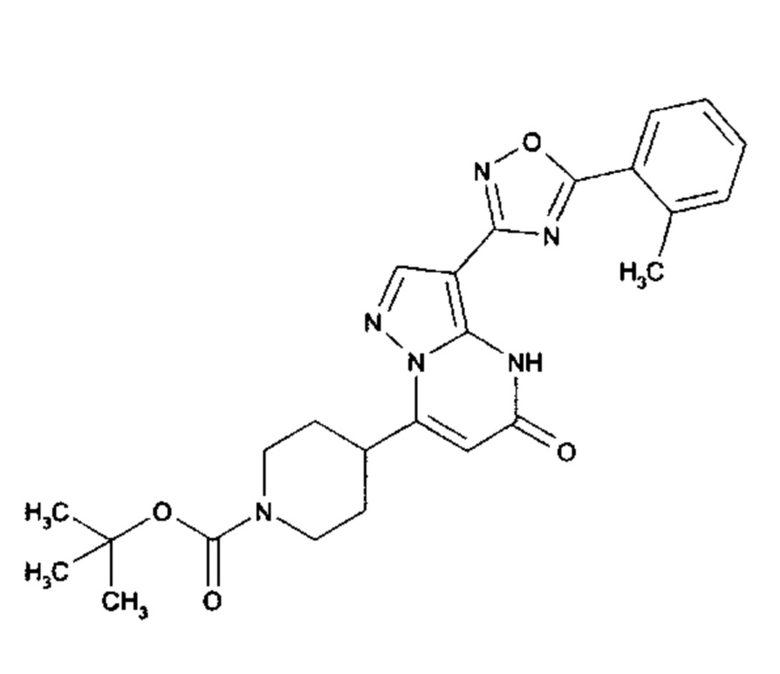
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (315 мг, 58% чистота, 485 мкмоль)
2-метилбензойная кислота (60.0 мг, 441 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (278 мг, 99% чистота, 529 мкмоль)
Этилдиизопропиламин (90 мкл, 530 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 58.0 мг (100% чистота, 25% теоретический выход).
LC-MS (Способ 8В): Rt=1.57 мин; MS (ESIneg): m/z=475 [М-Н]-
Пример 266А
Трет-бутил 4-{3-[5-(3-хлорфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил } пиперидин-1-карбоксилат
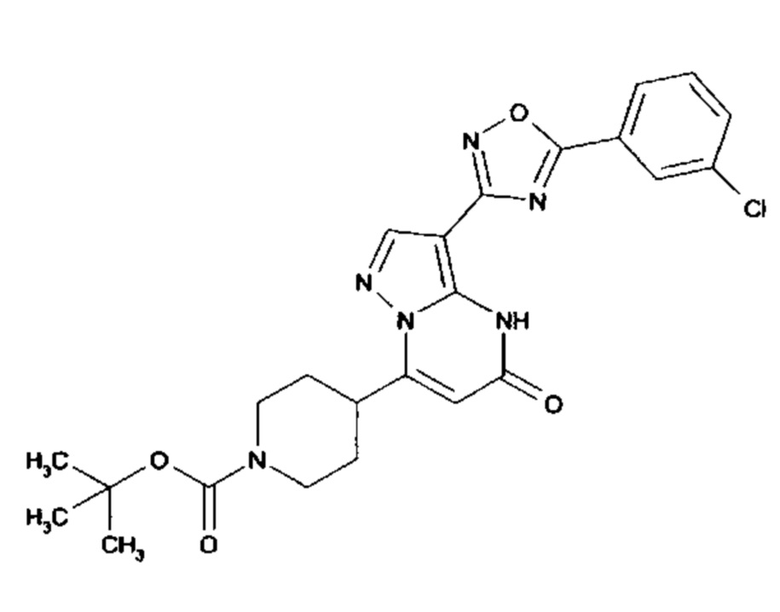
К раствору 3-хлорбензойной кислоты (60.0 мг, 383 мкмоль) в N,N-Диметилформамиде (5.0 мл) в атмосфере аргона добавили (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (242 мг, 99% чистота, 460 мкмоль) и этилдиизопропиламин (78 мкл, 460 мкмоль). Реакционную смесь перемешивали 1 ч при комнатной температуре. После этого периода времени трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (274 мг, 58% чистота, 422 мкмоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь концентрировали и применяли в таком виде на следующей стадии.
Полученное количество составило 649 мг (24% чистота, 74% теоретический выход).
LC-MS (Способ 8В): Rt=1.59 мин; MS (ESIneg): m/z=495 [М-Н]-
Пример 267А
Трет-бутил 4-(5-оксо-3-{5-[3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
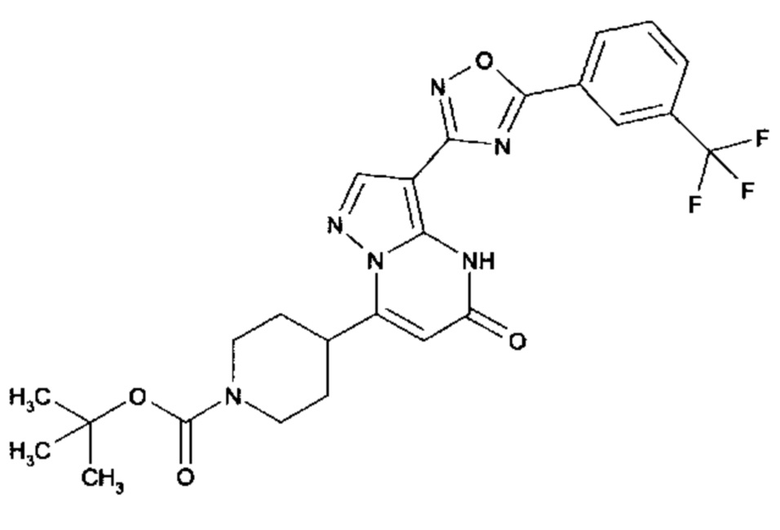
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (225 мг, 58% чистота, 347 мкмоль)
3-(трифторметил)бензойная кислота (60.0 мг, 316 мкмоль)
Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (199 мг, 99% чистота, 379 мкмоль)
Этилдиизопропиламин (64 мкл, 380 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 53.0 мг (99% чистота, 28% теоретический выход).
LC-MS (Способ 8В): Rt=1.60 мин; MS (ESIneg): m/z=529 [М-Н]-
Пример 268А
Трет-бутил 4-[3-(5-бензил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (311 мг, 58% чистота, 480 мкмоль)
фенилуксусная кислота (60.0 мг, 99% чистота, 436 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (275 мг, 99% чистота, 524 мкмоль)
Этилдиизопропиламин (89 мкл, 520 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 118 мг (86% чистота, 44% теоретический выход).
LC-MS (Способ 8В): Rt=1.45 мин; MS (ESIneg): m/z=475 [М-Н]-
Пример 269А
Трет-бутил 4-{3-[5-(3-хлор-2-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (251 мг, 58% чистота, 387 мкмоль)
3-хлор-2-метилбензойная кислота (60.0 мг, 352 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (222 мг, 99% чистота, 422 мкмоль)
Этилдиизопропиламин (72 мкл, 420 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 36.0 мг (100% чистота, 18% теоретический выход).
LC-MS (Способ 8В): Rt=1.65 мин; MS (ESIneg): m/z=509 [М-Н]-
Пример 270А
Трет-бутил 4-{3-[5-(5-хлор-2-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (251 мг, 58% чистота, 387 мкмоль)
5-хлор-2-метилбензойная кислота (60.0 мг, 352 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (222 мг, 99% чистота, 422 мкмоль)
Этилдиизопропиламин (72 мкл, 420 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 50.0 мг (100% чистота, 25% теоретический выход).
LC-MS (Способ 8В): Rt=1.65 мин; MS (ESIneg): m/z=509 [М-Н]-
Пример 271А
Трет-бутил 4-(5-оксо-3-{5-[4-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (225 мг, 58% чистота, 347 мкмоль)
4-(трифторметил)бензойная кислота (60.0 мг, 316 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (199 мг, 99% чистота, 379 мкмоль)
Этилдиизопропиламин (64 мкл, 380 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 57.0 мг (100% чистота, 31% теоретический выход).
LC-MS (Способ 8В): Rt=1.60 мин; MS (ESIneg): m/z=529 [М-Н]-
Пример 272А
Трет-бутил 4-(3-{5-[2-хлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
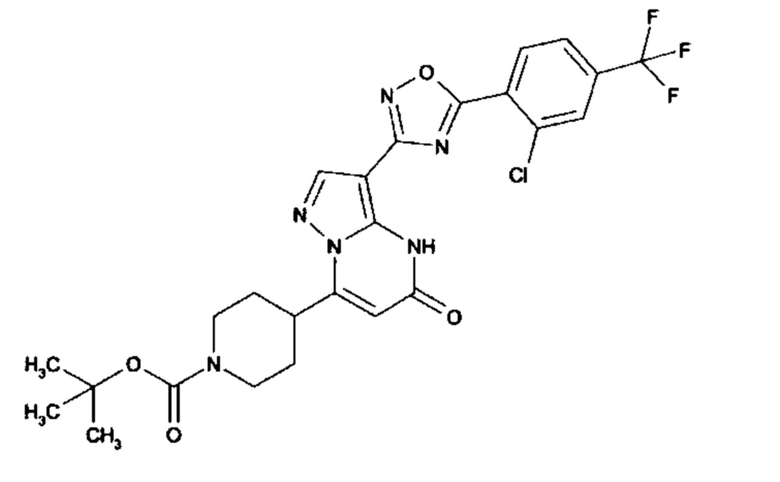
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (191 мг, 58% чистота, 294 мкмоль)
2-хлор-4-(трифторметил)бензойная кислота (60.0 мг, 267 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (169 мг, 99% чистота, 321 мкмоль)
Этилдиизопропиламин (55 мкл, 320 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 51.0 мг (99% чистота, 30% теоретический выход).
LC-MS (Способ 8В): Rt=1.67 мин; MS (ESIneg): m/z=563 [М-Н]-
Пример 273А
Трет-бутил 4-{3-[5-(4-хлорфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
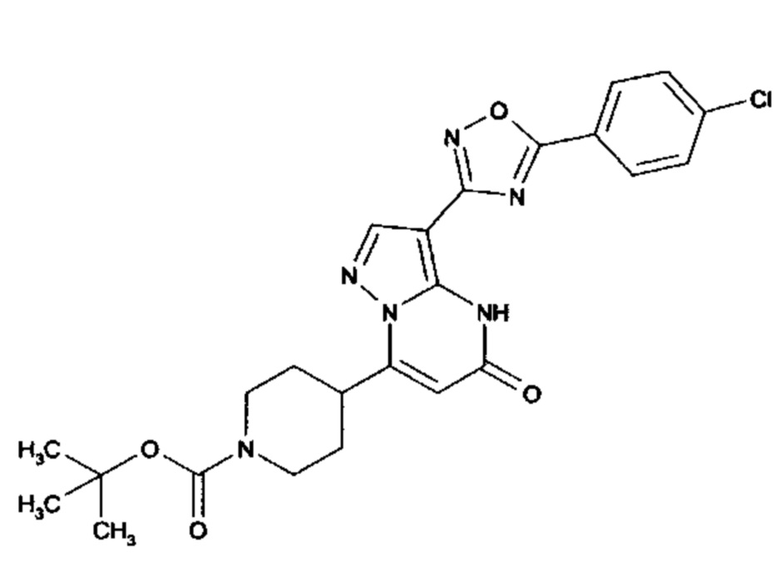
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (274 мг, 58% чистота, 422 мкмоль)
4-хлорбензойная кислота (60.0 мг, 383 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (242 мг, 99% чистота, 460 мкмоль)
Этилдиизопропиламин (78 мкл, 460 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 41.0 мг (96% чистота, 19% теоретический выход).
LC-MS (Способ 8В): Rt=1.59 мин; MS (ESIneg): m/z=495 [М-Н]-
Пример 274А
Трет-бутил 4-{3-[5-(3,5-дихлорфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
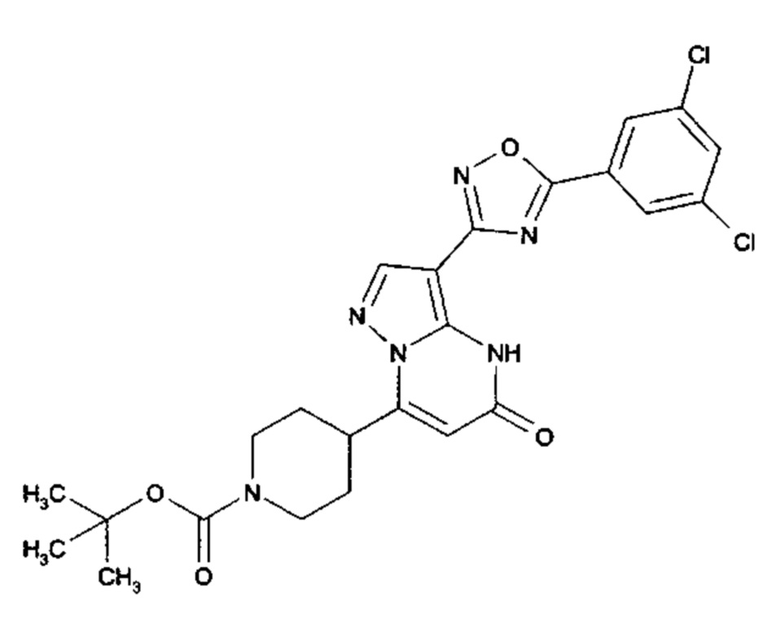
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (224 мг, 58% чистота, 346 мкмоль)
3,5-дихлорбензойная кислота (60.0 мг, 314 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (198 мг, 99% чистота, 377 мкмоль)
Этилдиизопропиламин (64 мкл, 380 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 25.0 мг (77% чистота, 10% теоретический выход).
LC-MS (Способ 1B): Rt=1.42 мин; MS (ESIneg): m/z=529 [M-H]-
Пример 275A
Трет-бутил 4-{3-[5-(5-хлор-2-фторфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
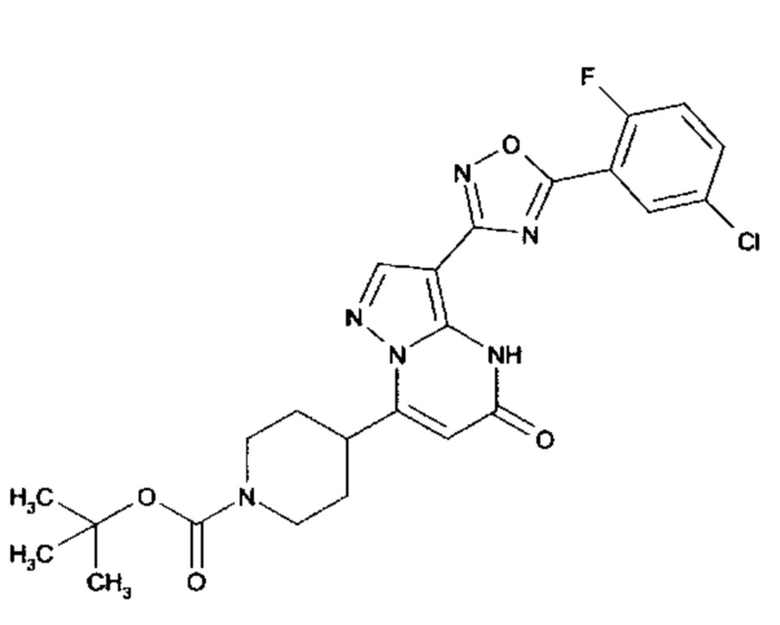
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (198 мг, 58% чистота, 306 мкмоль)
5-хлор-2-фторбензойная кислота (50.0 мг, 97% чистота, 278 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (175 мг, 99% чистота, 333 мкмоль)
Этилдиизопропиламин (57 мкл, 330 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 27.0 мг (87% чистота, 15% теоретический выход).
LC-MS (Способ 8 В): Rt=1.57 мин; MS (ESIneg): m/z=513 [М-Н]-
Пример 276А
Трет-бутил 4-(5-оксо-3-{5-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
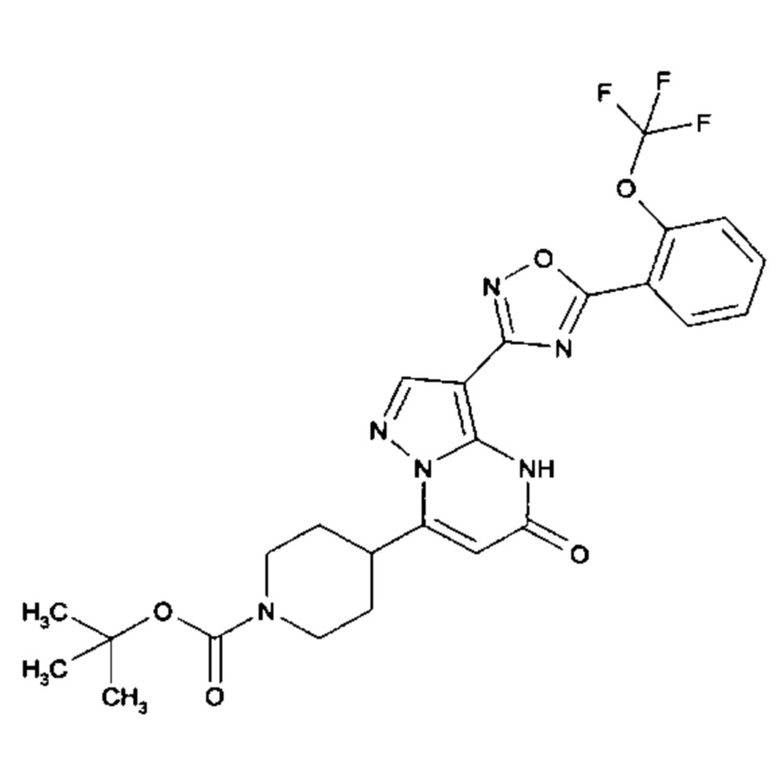
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (202 мг, 58% чистота, 311 мкмоль)
2-(трифторметокси)бензойная кислота (60.0 мг, 97% чистота, 282 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (178 мг, 99% чистота, 339 мкмоль)
Этилдиизопропиламин (58 мкл, 340 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 45.0 мг (93% чистота, 25% теоретический выход).
LC-MS (Способ 8В): Rt=1.59 мин; MS (ESIneg): m/z=545 [М-Н]-
Пример 277А
Трет-бутил 4-{3-[5-(3-хлор-4-метоксифенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
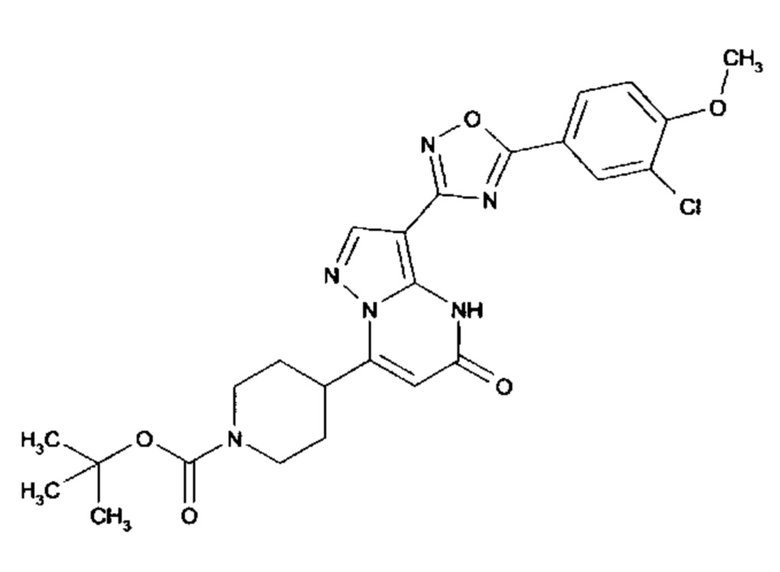
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (230 мг, 58% чистота, 354 мкмоль)
3-хлор-4-метоксибензойная кислота (60.0 мг, 322 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (203 мг, 99% чистота, 386 мкмоль)
Этилдиизопропиламин (66 мкл, 390 мкмоль)
N,N-Диметилформамид (5.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 257А.
Полученное количество составило 10.0 мг (72% чистота, 4% теоретический выход).
LC-MS (Способ 8В): Rt=1.57 мин; MS (ESIneg): m/z=525 [М-Н]-
Пример 278А
Трет-бутил 4-(3-{3-[гидрокси(фенил)метил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
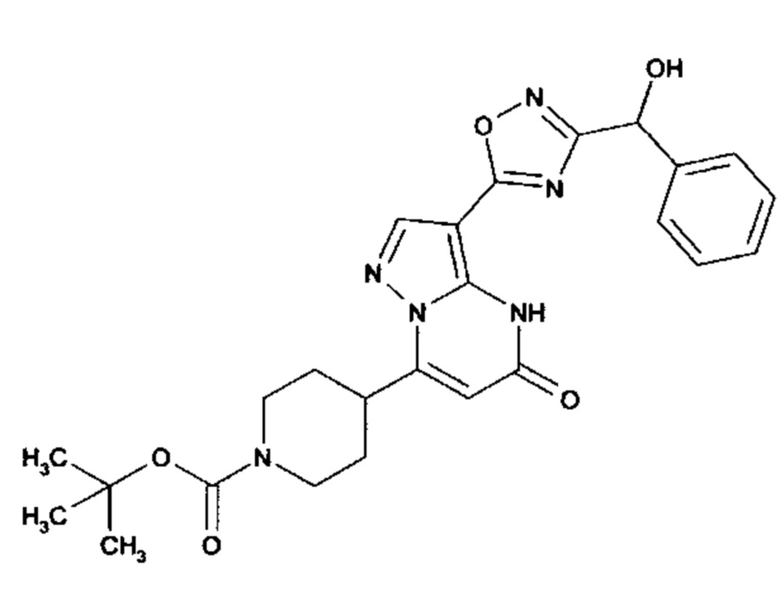
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (500 мг, 1.38 ммоль)
(1Z)-N',2-дигидрокси-2-фенилэтанимидамид (459 мг, 2.76 ммоль)
1,1'-карбонилдиимидазол (447 мг, 2.76 ммоль)/
Этилдиизопропиламин (720 мкл, 4.1 ммоль)
N,N-Диметилформамид (51 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 249А.
Полученное количество составило 64.0 мг (85% чистота, 8% теоретический выход).
LC-MS (Способ 8В): Rt=1.29 мин; MS (ESIneg): m/z=491 [М-Н]-
Пример 279А
Трет-бутил 4-(5-оксо-3-{5-[4-(трифторметокси)бензил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
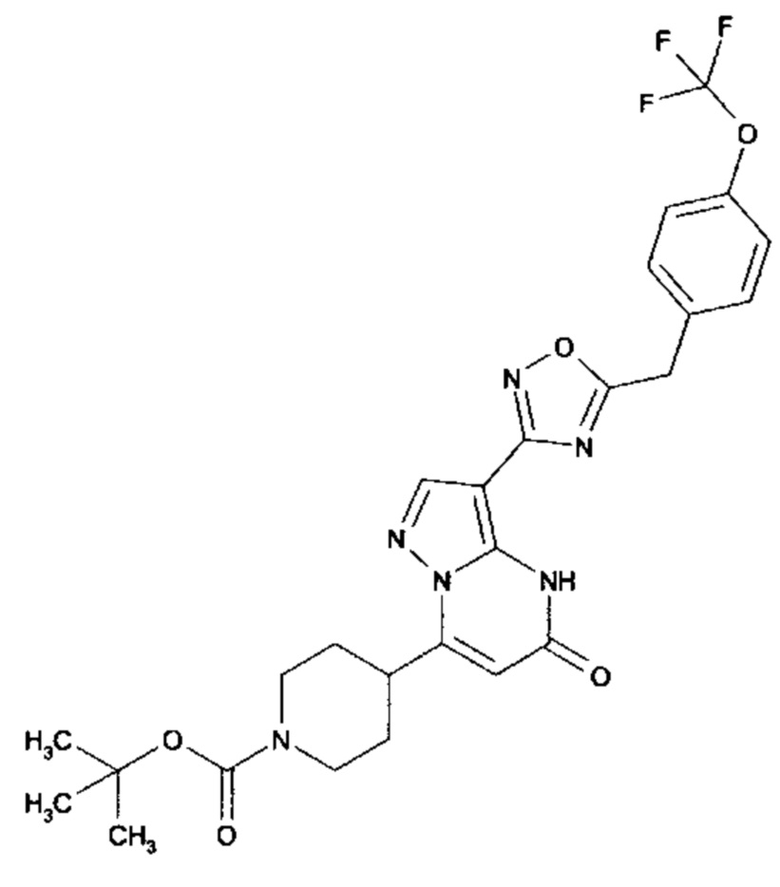
К раствору [4-(трифторметокси)фенил]уксусной кислоты (70.4 мг, 320 мкмоль) в N,N-Диметилформамиде (4.0 мл) в атмосфере аргона добавили (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль) и этилдиизопропиламин (67 мкл, 380 мкмоль). Реакционную смесь перемешивали 1 ч при комнатной температуре. После этого периода времени трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 66.0 мг (97% чистота, 32% теоретический выход).
LC-MS (Способ 8В): Rt=1.54 мин; MS (ESIneg): m/z=559 [М-Н]-
Пример 280А
Трет-бутил 4-{3-[5-(3,5-дифтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат

трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
(3,5-дифтор-4-метоксифенил)уксусная кислота (64.7 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 60.0 мг (100% чистота, 31% теоретический выход).
LC-MS (Способ 8В): Rt=1.47 мин; MS (ESIneg): m/z=541 [М-Н]-
Пример 281А
Трет-бутил 4-(3-{5-[rac-1-(4-метоксифенил)пропил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
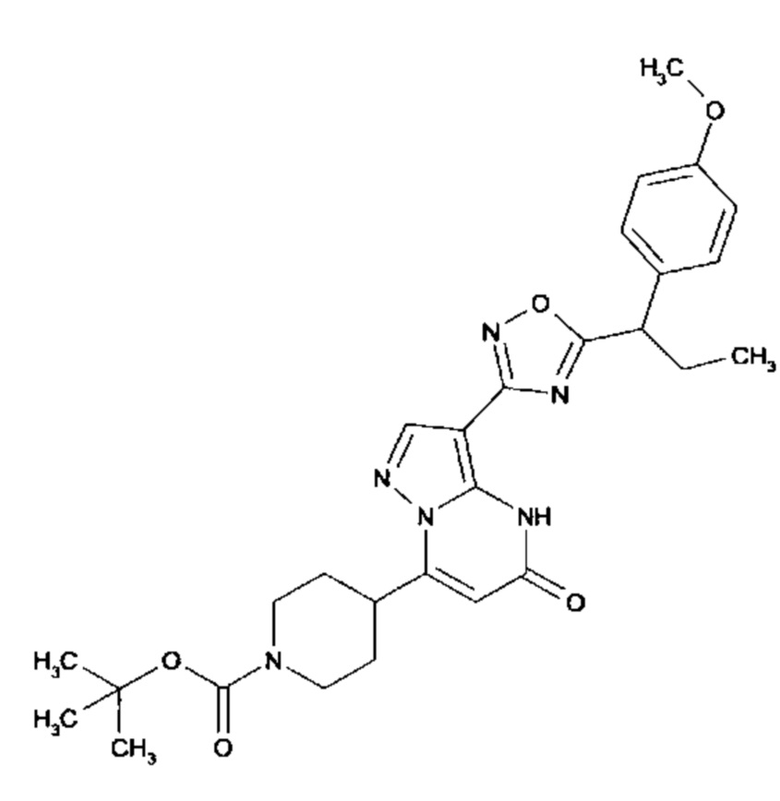
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
rac-2-(4-метоксифенил)бутановая кислота (62.2 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 43.0 мг (93% чистота, 21% теоретический выход).
LC-MS (Способ 8В): Rt=1.56 мин; MS (ESIneg): m/z=533 [М-Н]-
Пример 282А
Трет-бутил 4-(3-{5-[2-(4-метоксифенил)пропан-2-ил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат 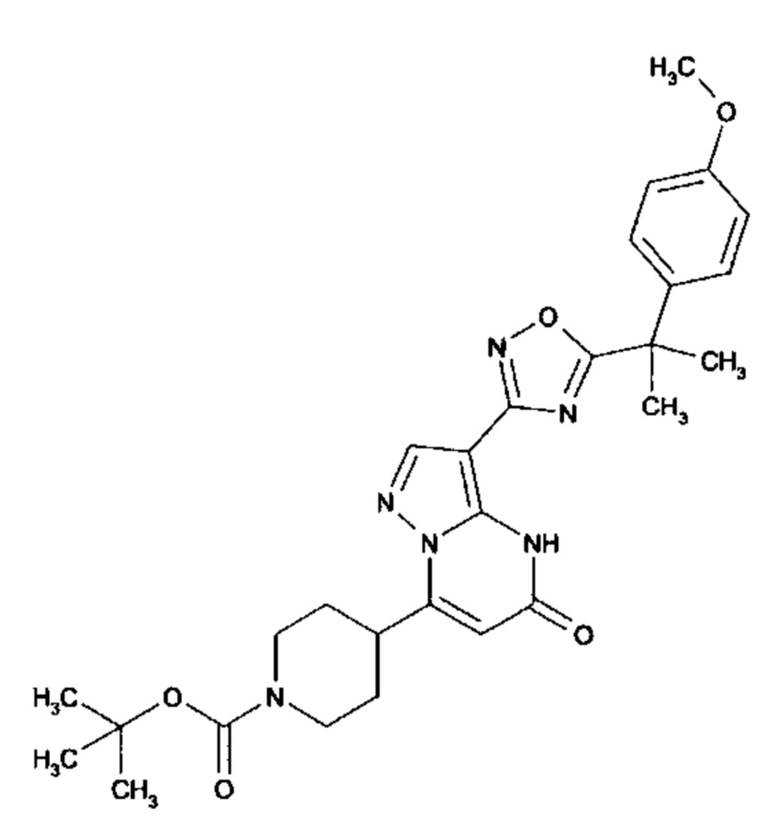
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
2-(4-метоксифенил)-2-метилпропановая кислота (62.2 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 32.0 мг (96% чистота, 16% теоретический выход).
LC-MS (Способ 8В): Rt=1.55 мин; MS (ESIneg): m/z=533 [М-Н]-
Пример 283А
Трет-бутил 4-{5-оксо-3-[5-(тетрагидро-2Н-пиран-4-ил)-1,2,4-оксадиазол-3-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат 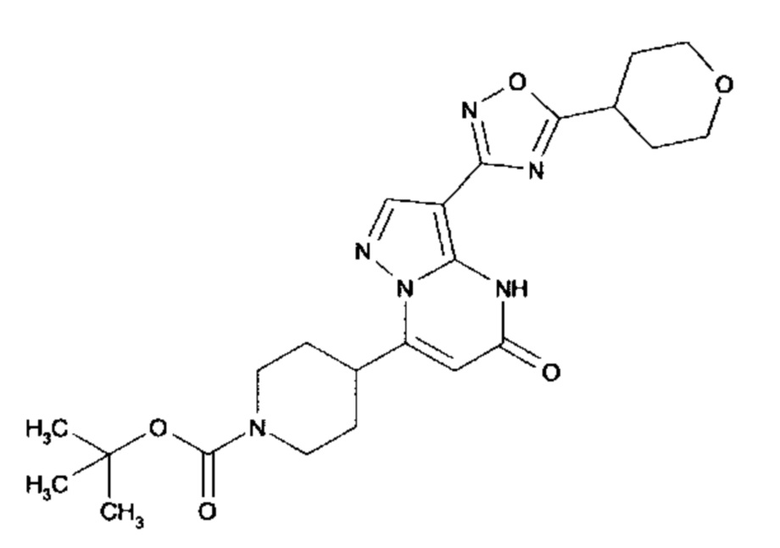
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
тетрагидро-2Н-пиран-4-карбоновая кислота (41.6 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 60.0 мг (94% чистота, 34% теоретический выход).
LC-MS (Способ 8В): Rt=1.28 мин; MS (ESIneg): m/z=469 [М-Н]-
Пример 284А
Трет-бутил 4-(3-{5-[4-(дифторметокси)бензил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
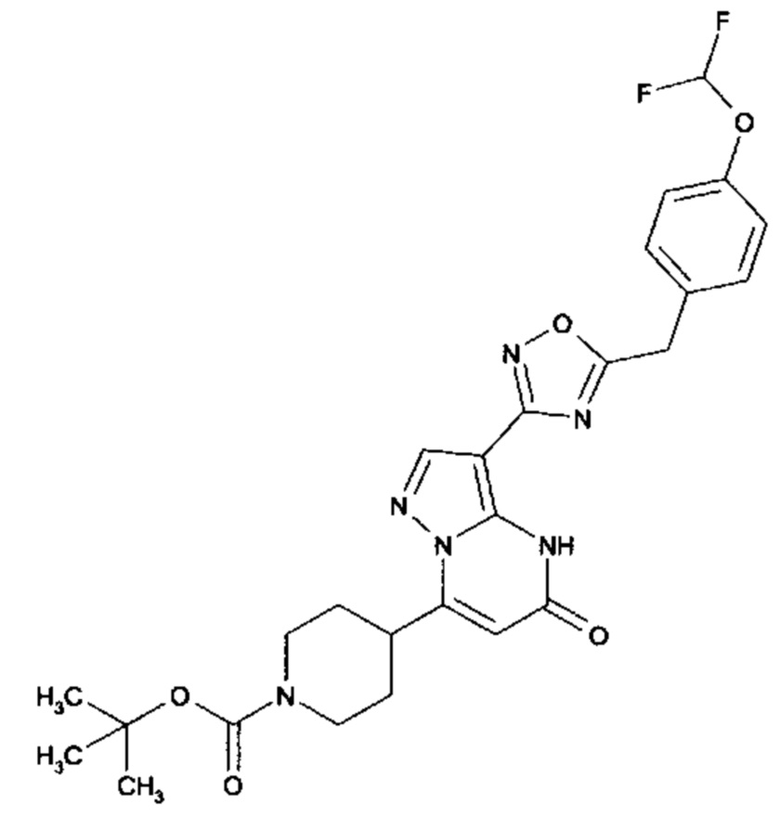
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
[4-(дифторметокси)фенил]уксусная кислота (64.7 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 40.0 мг (98% чистота, 21% теоретический выход).
LC-MS (Способ 8В): Rt=1.45 мин; MS (ESIneg): m/z=541 [М-Н]-
Пример 285А
Трет-бутил 4-(3-{5-[1-(4-метоксифенил)циклопропил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
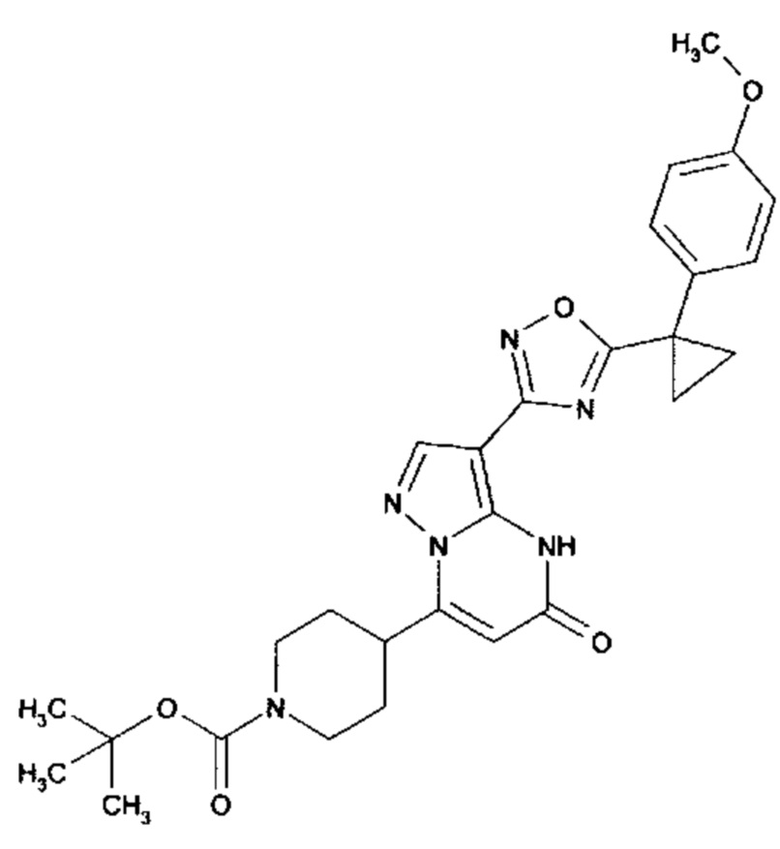
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
1-(4-метоксифенил)циклопропанкарбоновая кислота (61.5 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 43.0 мг (100% чистота, 23% теоретический выход).
LC-MS (Способ 8В): Rt=1.53 мин; MS (ESIneg): m/z=531 [М-Н]-
Пример 286А
Трет-бутил 4-{3-[5-(2-фтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
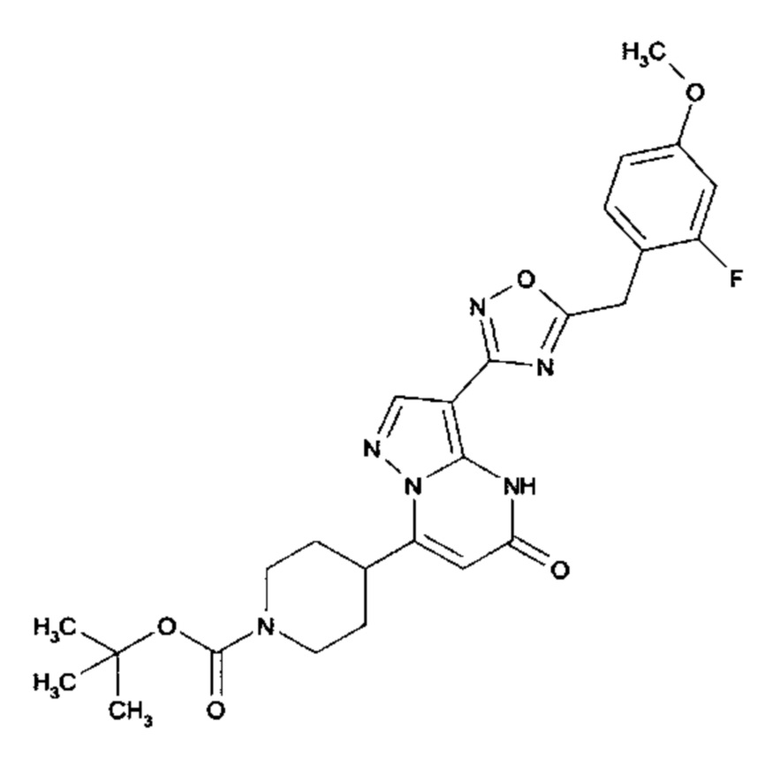
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
(2-фтор-4-метоксифенил)уксусная кислота (58.9 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279 А.
Полученное количество составило 65.0 мг (100% чистота, 35% теоретический выход).
LC-MS (Способ 8В): Rt=1.45 мин; MS (ESlneg): m/z=523 [М-Н]-
Пример 287А
Трет-бутил 4-{3-[5-(3-фтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
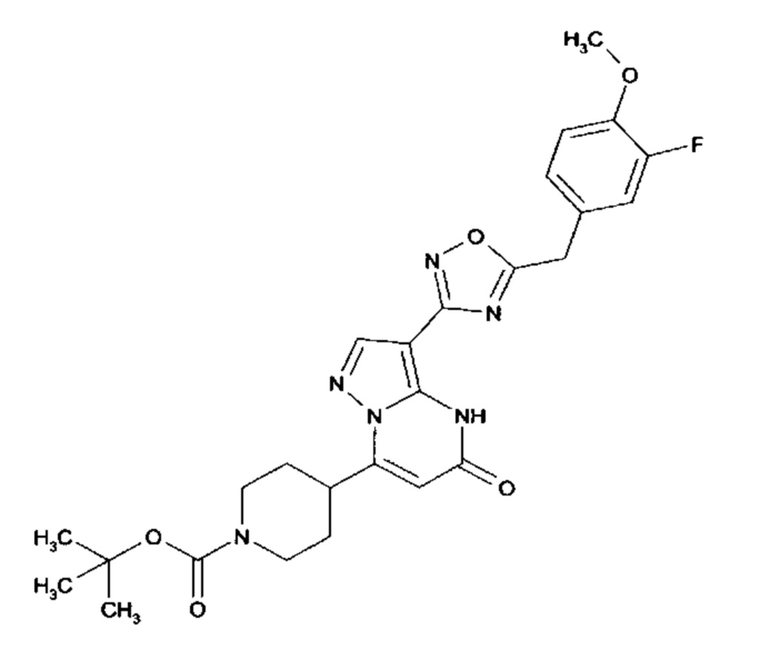
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
(3-фтор-4-метоксифенил)уксусная кислота (58.9 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 74.0 мг (97% чистота, 39% теоретический выход).
LC-MS (Способ 8В): Rt=1.43 мин; MS (ESIneg): m/z=523 [М-Н]-
Пример 288А
Трет-бутил 4-{3-[5-(3-хлор-4-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
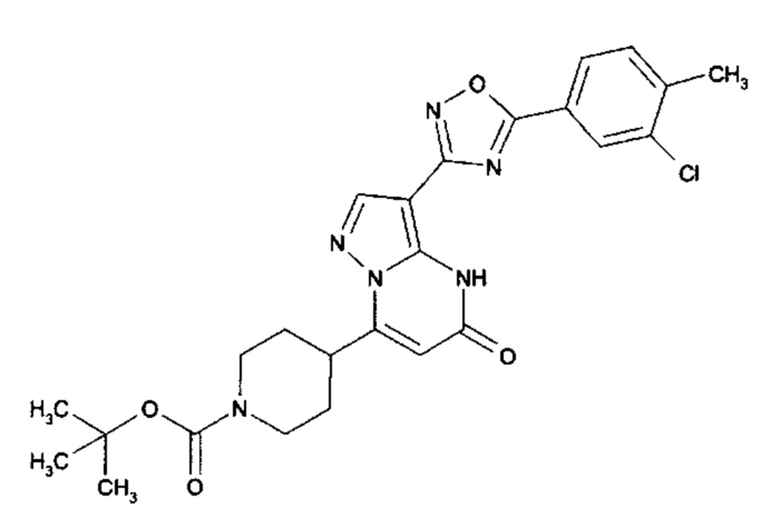
К раствору 3-хлор-4-метилбензойной кислоты (119 мг, 700 мкмоль) в N,N-Диметилформамиде (10 мл) в атмосфере аргона добавили (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (442 мг, 99% чистота, 840 мкмоль) и этилдиизопропиламин (140 мкл, 840 мкмоль). Реакционную смесь перемешивали 1 ч при комнатной температуре. После этого периода времени трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (500 мг, 58% чистота, 770 мкмоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой, затем чистый 2-метокси-2-метилпропан). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 85.0 мг (93% чистота, 20% теоретический выход).
LC-MS (Способ 8В): Rt=1.66 мин; MS (ESIneg): m/z=509 [М-Н]-
Пример 289А
Трет-бутил 4-(3-{5-[4-метил-2-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
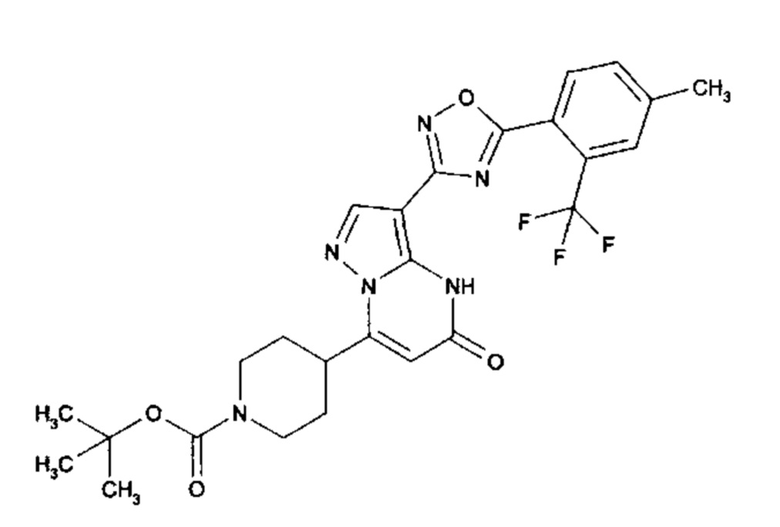
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (1.20 г, 58% чистота, 1.85 ммоль)
4-метил-2-(трифторметил)бензойная кислота (343 мг, 1.68 ммоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (1.06 г, 99% чистота, 2.02 ммоль)
Этилдиизопропиламин (340 мкл, 2.0 ммоль)
N,N-Диметилформамид (30 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 288А.
Полученное количество составило 35.0 мг (98% чистота, 3% теоретический выход).
LC-MS (Способ 8В): Rt=1.61 мин; MS (ESIneg): m/z=543 [М-Н]-
Пример 290А
Трет-бутил 4-{3-(2,4-диметил-1,3-тиазол-5-ил)-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
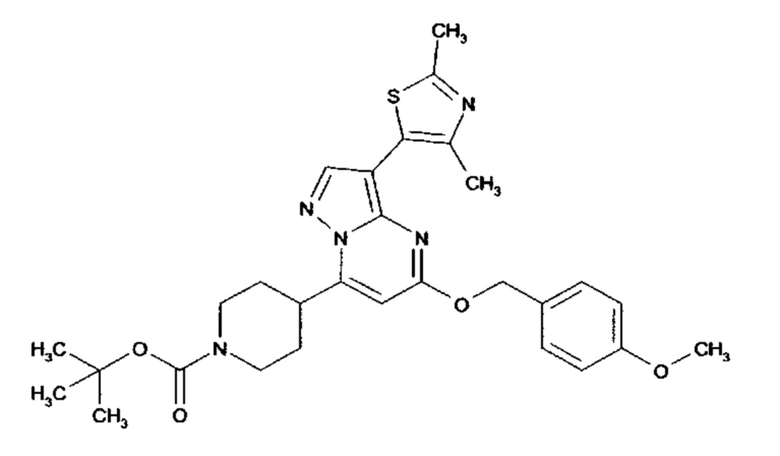
К суспензии трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилата (50.0 мг, 96.6 мкмоль) в 1,4-диоксане (1.0 мл) добавили 2,4-диметил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-тиазол (69.3 мг, 290 мкмоль) и трифосфат калия (390 мкл, 1.0 М в воде, 390 мкмоль). Смесь дегазировали аргоном 10 мин до добавления [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (10.6 мг, 14.5 мкмоль) и трициклогексилфосфина (8.13 мг, 29.0 мкмоль). Реакционную смесь перемешивали в течение 1 ч при 140°C в микроволновой печи. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 21.0 мг (98% чистота, 39% теоретический выход).
LC-MS (Способ 8В): Rt=1.66 мин; MS (ESIpos): m/z=550 [М+Н]+
Пример 291А
Трет-бутил 4-(3-{5-[(6-метоксипиридин-3-ил)метил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
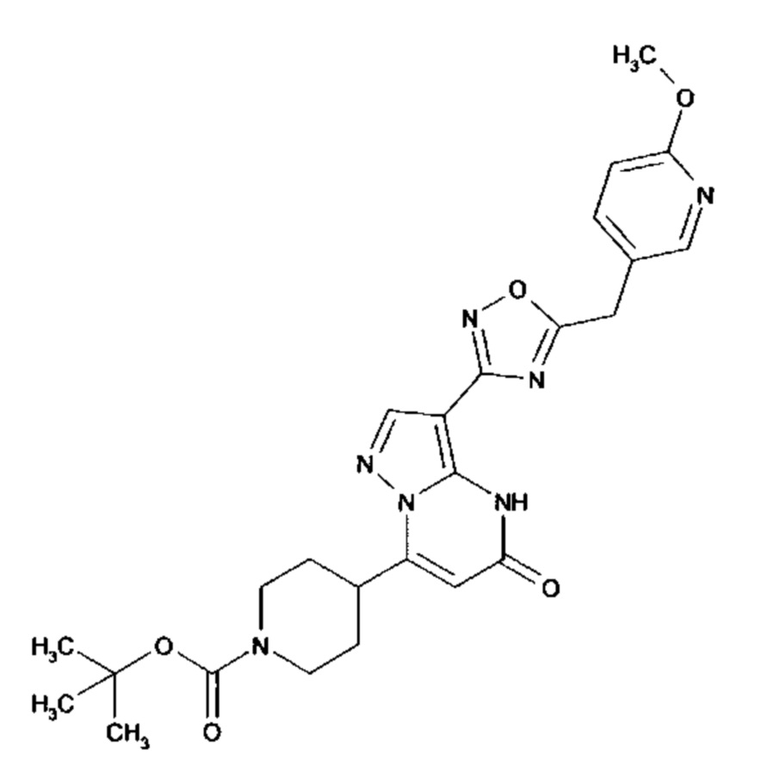
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
(6-метоксипиридин-3-ил)уксусная кислота (53.5 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 48.0 мг (100% чистота, 27% теоретический выход).
LC-MS (Способ 8В): Rt=1.35 мин; MS (ESIneg): m/z=506 [М-Н]-
Пример 292А
Трет-бутил 4-(5-оксо-3-{5-[4-(пропан-2-илокси)бензил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат 
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (250 мг, 53% чистота, 352 мкмоль)
[4-(пропан-2-илокси)фенил]уксусная кислота (62.2 мг, 320 мкмоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (200 мг, 384 мкмоль)
Этилдиизопропиламин (67 мкл, 380 мкмоль)
N,N-Диметилформамид (4.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 279А.
Полученное количество составило 56.0 мг (98% чистота, 29% теоретический выход).
LC-MS (Способ 8В): Rt=1.55 мин; MS (ESIneg): m/z=533 [М-Н]-
Пример 293А
Трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(2-метил-1,3-тиазол-5-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
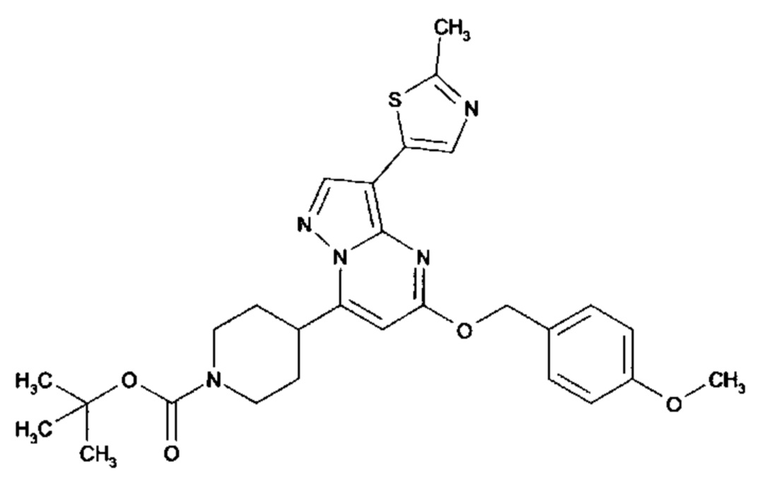
К суспензии трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (150 мг, 97% чистота, 281 мкмоль) в 1,4-диоксане (3.0 мл) добавили 2-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-тиазол (190 мг, 844 мкмоль) и трифосфат калия (1.1 мл, 1.0 М в воде, 1.1 ммоль). Смесь дегазировали аргоном 10 мин до добавления [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) (30.9 мг, 42.2 мкмоль) и трициклогексилфосфина (23.7 мг, 84.4 мкмоль). Реакционную смесь перемешивали в течение 1 ч при 140°C в микроволновой печи. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 36.0 мг (100% чистота, 24% теоретический выход).
LC-MS (Способ 8В): Rt=1.65 мин; MS (ESIpos): m/z=536 [М+Н]+
Пример 294А
Трет-бутил 4-{3-(бензоиламино)-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

Смесь трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (300 мг, 72% чистота, 417 мкмоль), бензамида (126 мг, 1.04 ммоль), трифосфата калия (124 мг, 584 мкмоль), [(2-ди-трет-бутилфосфино-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)-2-(2'-амино-1,1'-бифенил)]палладия(II) метансульфоната (=tBuBrettPhos Pd G3) (21.4 мг, 25.0 мкмоль), 2-(ди-трет-бутилфосфино)-2',4',6'- триизопропил-3,6-диметокси-1,1'-бифенила (=tBuBrettPhos) (12.1 мг, 25.0 мкмоль) добавили в колбу и продули аргоном до суспендирования в 3.0 мл трет-бутанола. Суспензию перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь отфильтровали и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 46.0 мг (100% чистота, 17% теоретический выход).
LC-MS (Способ 8В): Rt=1.56 мин; MS (ESIneg): m/z=556 [М-Н]-
Пример 295А
Трет-бутил 4-(3-{3-[2-(4-фторфенил)пропан-2-ил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
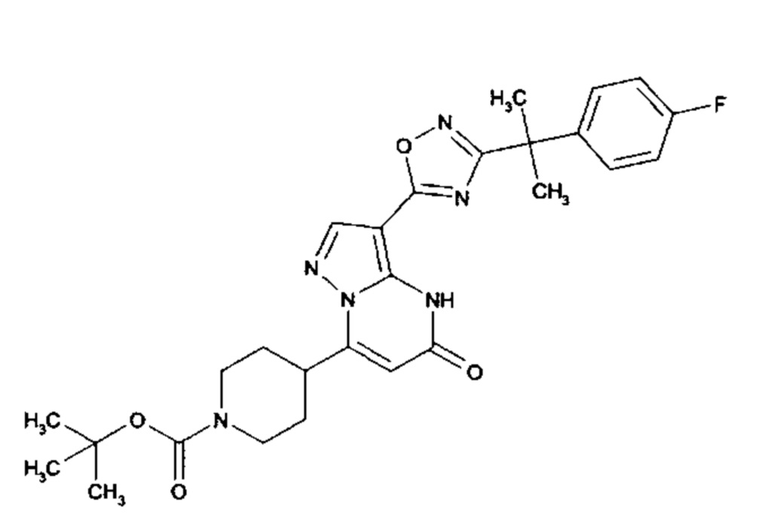
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (865 мг, 2.39 ммоль) в N,N-Диметилформамиде (23 мл) в атмосфере аргона добавили 1,1'-карбонилдиимидазол (774 мг, 4.78 ммоль) и этилдиизопропиламин (830 мкл, 4.8 ммоль). Реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени (1Z)-2-(4-фторфенил)-N'-гидрокси-2-метилпропанимидамид (956 мг, 98% чистота, 4.78 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь концентрировали и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 904 мг (94% чистота, 68% теоретический выход).
LC-MS (Способ 8В): Rt=1.56 мин; MS (ESIneg): m/z=521 [М-Н]-
Пример 296А
Трет-бутил 4-{5-оксо-3-[5-(пропан-2-ил)-1,2,4-оксадиазол-3-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
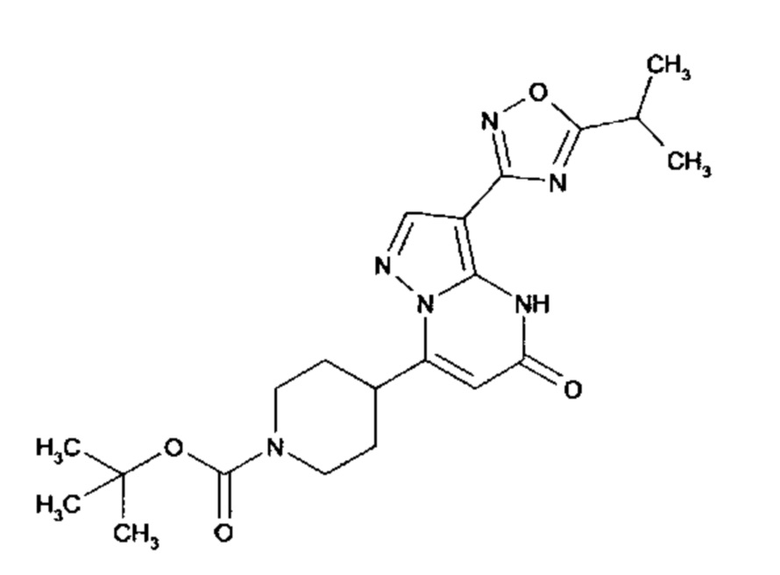
К раствору 2-метилпропановой кислоты (56.4 мг, 640 мкмоль) в N,N-Диметилформамиде (8.0 мл) в атмосфере аргона добавили (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (400 мг, 768 мкмоль) и этилдиизопропиламин (130 мкл, 770 мкмоль). Реакционную смесь перемешивали 1 ч при комнатной температуре. После этого периода времени трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (500 мг, 53% чистота, 704 мкмоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 48.0 мг (97% чистота, 15% теоретический выход).
LC-MS (Способ 1B): Rt=1.11 мин; MS (ESIneg): m/z=427 [М-Н]-
Пример 297А
Трет-бутил 4-[3-(5-трет-бутил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
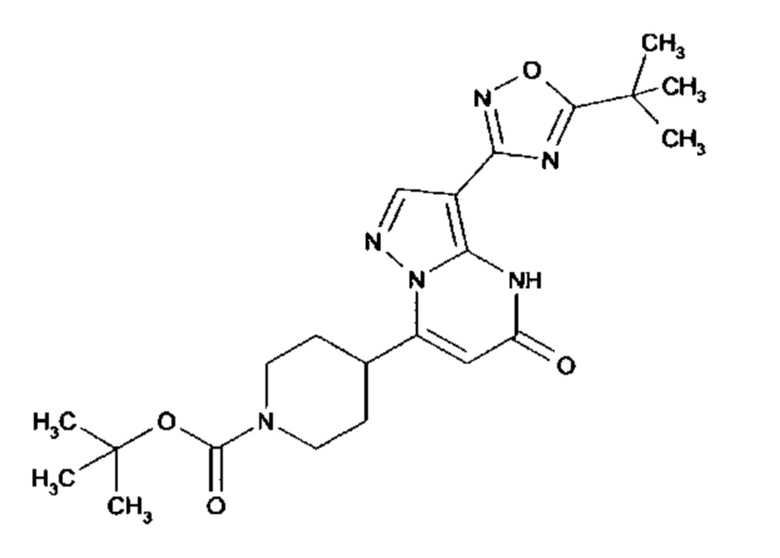
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (1.75 г, 64% чистота, 2.98 ммоль)
2,2-диметилпропановая кислота (276 мг, 2.70 ммоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (1.69 г, 3.25 ммоль)
Этилдиизопропиламин (570 мкл, 3.2 ммоль)
N,N-Диметилформамид (34 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 296А.
Полученное количество составило 255 мг (100% чистота, 19% теоретический выход).
LC-MS (Способ 8В): Rt=1.48 мин; MS (ESIneg): m/z=441 [М-Н]-
Пример 298А
Трет-бутил 4-{3-(2-этил-4-метил-1,3-тиазол-5-ил)-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
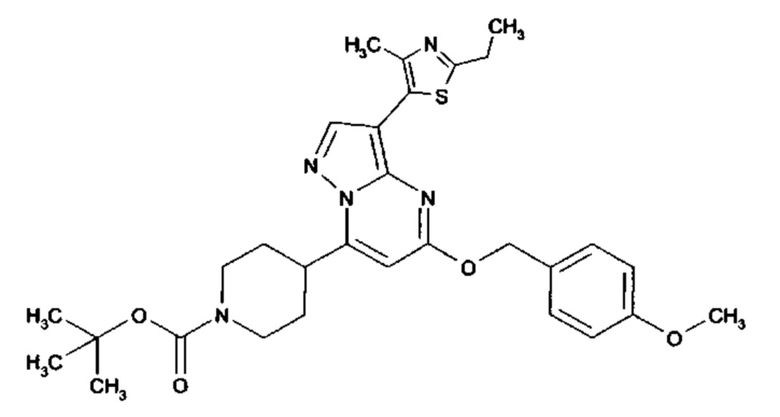
К суспензии трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилаты (75.0 мг, 145 мкмоль) в 1,4-диоксане (2.0 мл) добавили 2-этил-4-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-тиазол (44.0 мг, 174 мкмоль), трифосфат калия (435 мкл, 1.0 М в воде, 435 мкмоль) и XPhos Pd G3 (3.1 мг, 4 мкмоль). Смесь дегазировали аргоном 2 минуты и перемешивали в течение 1 ч при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 57 мг (98% чистота, 68% теоретический выход).
LC-MS (Способ 8В): Rt=1.74 мин; MS (ESIpos): m/z=564 [М+Н]+
Пример 299А
Трет-бутил 4-{5-[(4-метоксибензил)окси]-3-[4-метил-2-(пропан-2-ил)-1,3-тиазол-5-ил]пиразоло[1,5-а]пиримидин-7-ил } пиперидин-1-карбоксилат
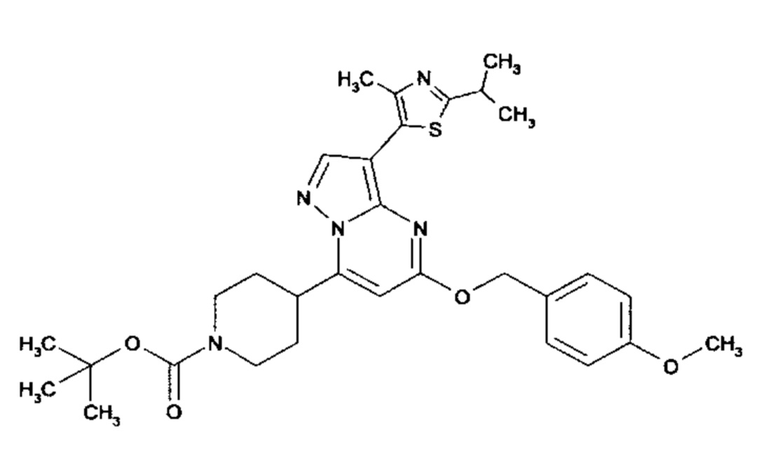
К суспензии трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (50.0 мг, 96.6 мкмоль) в 1,4-диоксане (1.5 мл) добавили 4-метил-2-(пропан-2-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-тиазол (31.0 мг, 116 мкмоль), трифосфат калия (290 мкл, 1.0 М в воде, 290 мкмоль) и XPhos Pd G3 (2.0 мг, 2 мкмоль). Смесь дегазировали аргоном 2 минуты и перемешивали всю ночь при 70°C. Новые порции 4-метил-2-(пропан-2-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-тиазола (31.0 мг, 116 мкмоль) и XPhos Pd G3 (2.0 мг, 2 мкмоль) добавили, и перемешивание продолжали в течение 1 ч при 110°C.
После охлаждения до комнатной температуры, смесь отфильтровали и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 52 мг (99% чистота, 92% теоретический выход).
LC-MS (Способ 8В): Rt=1.80 мин; MS (ESIpos): m/z=578 [М+Н]+
Пример 300A
Трет-бутил 4-(5-оксо-3-{3-[2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
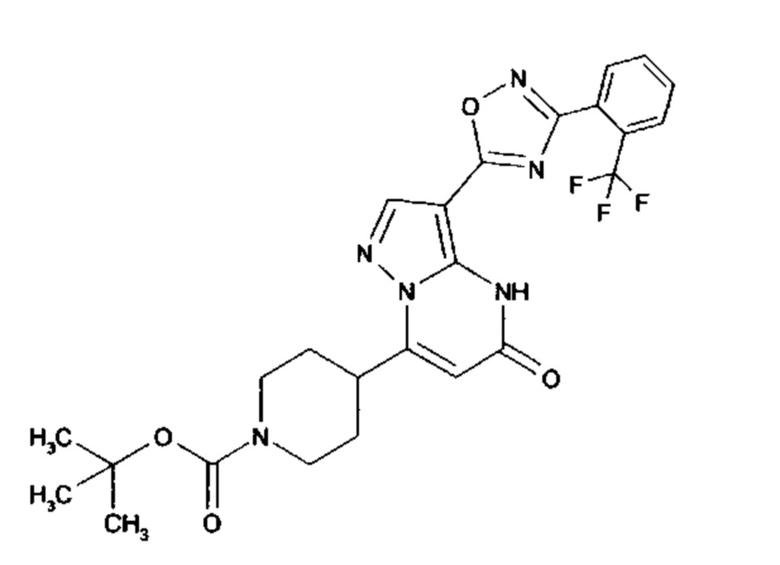
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (500 мг, 1.38 ммоль) в N,N-Диметилформамиде (13 мл) в атмосфере аргона добавили 1,1'-карбонилдиимидазол (268 мг, 1.66 ммоль). Реакционную смесь перемешивали 10 минуты при комнатной температуре. После этого периода времени N'-гидрокси-2-(трифторметил)бензолкарбоксимидамид (966 мг, 35% чистота, 1.66 ммоль) добавили. Смесь перемешивали в течение 2 ч при комнатной температуре, затем всю ночь при 60°C, 3.5 ч при 75°C, всю ночь при 110°C и наконец 4 ч при 130°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 305 мг (100% чистота, 42% теоретический выход).
LC-MS (Способ 8В): Rt=1.53 мин; MS (ESIpos): m/z=529 [М+Н]-
Пример 301А
Трет-бутил 4-{3-[5-(бицикло[2.2.2]окт-1-ил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
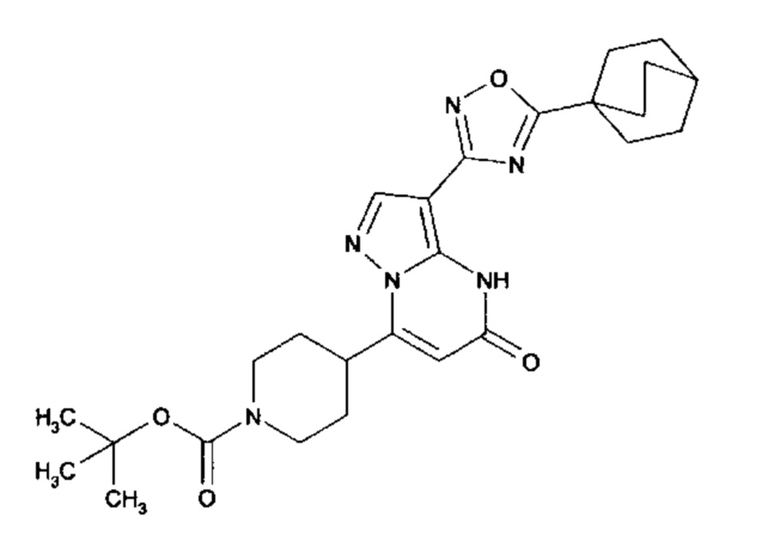
К раствору бицикло[2.2.2]октан-1-карбоновой кислоты (100 мг, 648 мкмоль) в N,N-Диметилформамиде (11 мл) в атмосфере аргона добавили (бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (409 мг, 99% чистота, 778 мкмоль) и этилдиизопропиламин (130 мкл, 780 мкмоль). Реакционную смесь перемешивали 1 ч при комнатной температуре. После этого периода времени трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (842 мг, 58% чистота, 1.30 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Смесь, выделенную после выпаривания объединенных фракций продукта, разбавили и перемешали с ацетонитрилом. Твердое вещество, которое образовалось, отфильтровали с получением соединения, указанного в названии.
Полученное количество составило 30 мг (97% чистота, 4% теоретический выход).
LC-MS (Способ 8В): Rt=1.67 мин; MS (ESIneg): m/z=493 [М-Н]-
Пример 302А
Трет-бутил 4-[3-(5-этил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
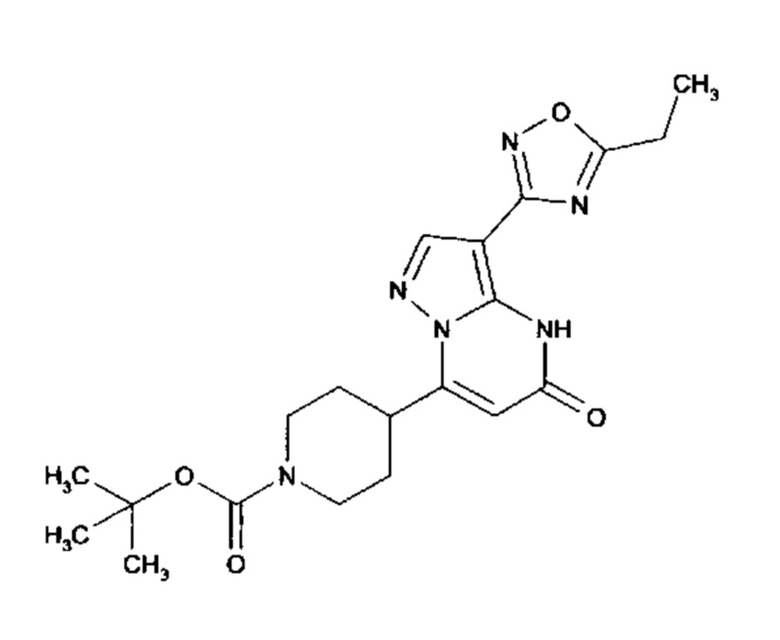
трет-бутил 4-[3-(N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (1.31 г, 58% чистота, 2.02 ммоль)
пропановая кислота (100 мкл, 1.3 ммоль)
(Бензотриазол-1-илокси)трипирролидинофосфония гексафторфосфат (851 мг, 99% чистота, 1.62 ммоль)
Этилдиизопропиламин (280 мкл, 1.6 ммоль)
N,N-Диметилформамид (24 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 296А.
Полученное количество составило 180 мг (95% чистота, 20% теоретический выход).
LC-MS (Способ 8В): Rt=1.31 мин; MS (ESIneg): m/z=413 [М-Н]-
Пример 303А
Трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(3-фенил-1,2-оксазол-5-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
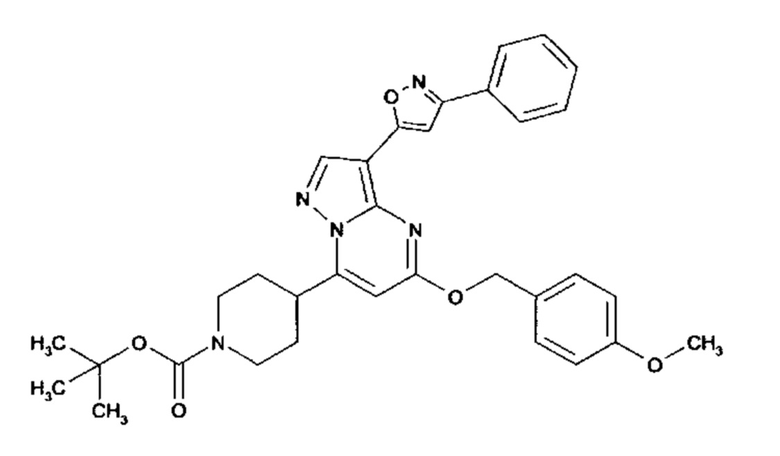
К суспензии трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (100 мг, 193 мкмоль) в 1,4-диоксане (3.0 мл) добавили 3-фенил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-оксазол (94.3 мг, 348 мкмоль), трифосфат калия (580 мкл, 1.0 М в воде, 580 мкмоль) и XPhos Pd G3 (4.1 мг, 5 мкмоль). Смесь дегазировали аргоном 2 минуты и перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь отфильтровали и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 43 мг (100% чистота, 38% теоретический выход).
LC-MS (Способ 6 В): Rt=5.09 мин; MS (ESIpos): m/z=582 [М+Н]+
Пример 304А
Трет-бутил 4-(5-оксо-3-{3-[1-(пропан-2-ил)пиперидин-4-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
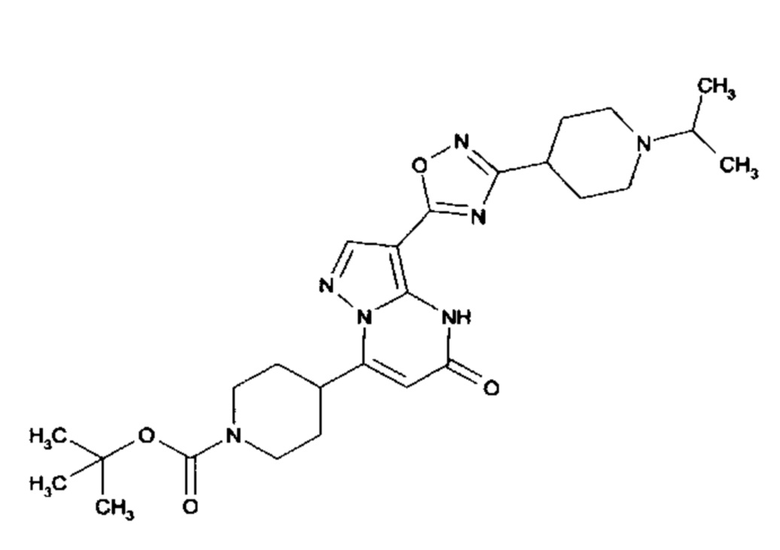
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (200 мг, 552 мкмоль) в N,N-Диметилформамиде (5.0 мл) в атмосфере аргона добавили 1,1'-карбонилдиимидазол (179 мг, 1.10 ммоль) и этилдиизопропиламин (190 мкл, 1.1 ммоль). Реакционную смесь перемешивали 1.5 ч при 90°C. После этого периода времени N'-гидрокси-1-(пропан-2-ил)пиперидин-4-карбоксимидамид (205 мг, 1.10 ммоль) добавили, и смесь перемешивали всю ночь при 110°C. После охлаждения до комнатной температуры, смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 174 мг (100% чистота, 62% теоретический выход).
LC-MS (Способ 8В): Rt=0.90 мин; MS (ESIpos): m/z=512 [М+Н]+
Пример 305А
Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
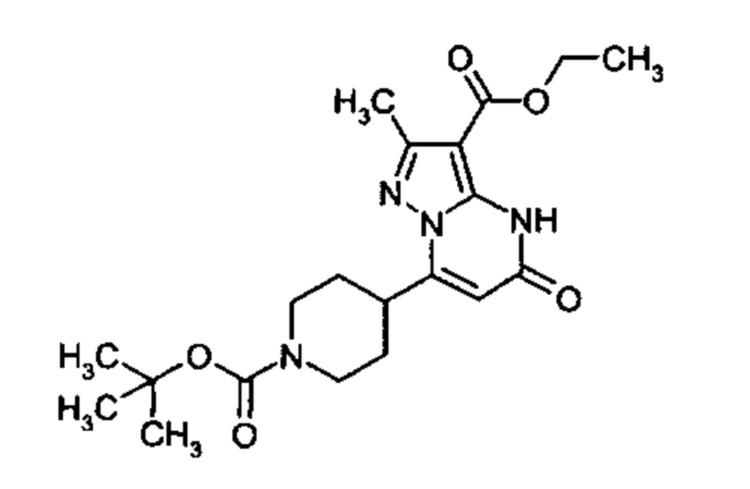
Этил-3-амино-5-метил-1Н-пиразол-4-карбоксилат (5 г, 30 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (10.5 г, 30 ммоль) нагревали в ацетонитриле (85 мл, 1791 ммоль) при 60°C в течение 1.5 ч. Триэтиламин (12.4 мл, 69 ммоль) добавили, и смесь нагревали с возвратом флегмы в течение 16 ч. Растворители удалили, и остаток распределили между водой и этилацетатом. Органическую фазу экстрагировали насыщенным водным раствором хлорида аммония, водой и соляным раствором. Органическую фазу обработали сульфатом натрия, отфильтровали и высушивали в вакууме с получением продукта. Полученное количество составило 11.3 г (94% теоретический выход).
LC-MS (Способ 1B): Rt=1.03 мин; MS (ESIneg): m/z=403 [М-Н]-
Пример 306А
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота
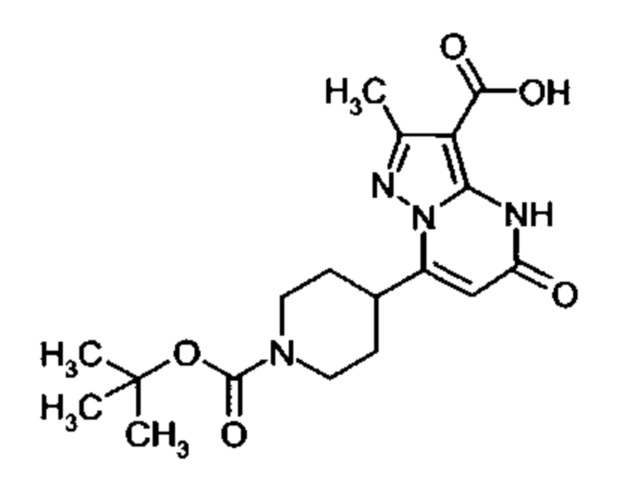
этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (11.3 г, 28.0 ммоль) и водный раствор гидроксида калия (50 мл, 2.0 М, 100 ммоль) перемешали в ТГФ (50 мл, 620 ммоль) в течение 16 ч при 65°C. Гидроксид лития (1.34 г, 56.0 ммоль) добавили, и смесь перемешивали в течение 2 ч при возврате флегмы. Добавили ацетонитрил, и полученный осадок отфильтровали, промыли ацетонитрилом и высушивали в вакууме. Остаток растворили в воде, и разбавленный водный раствор соляной кислоты добавили до достижения pH 3. Водную фазу экстрагировали три раза этилацетатом. Объединенные органические фазы высушивали сульфатом натрия и в вакууме с получением продукта. Полученное количество составило 4.44 г (93% чистота, 39% теоретический выход).
LC-MS (Способ 1B): Rt=0.81 мин; MS (ESIneg): m/z=375 [М-Н]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.389 (0.22), 1.416 (16.00), 1.490 (0.20), 1.512 (0.51), 1.520 (0.52), 1.543 (0.56), 1.551 (0.53), 1.572 (0.30), 1.934 (0.76), 1.965 (0.66), 2.407 (4.95), 2.857 (0.29), 3.310 (0.38), 3.337 (0.51), 3.368 (0.22), 4.063 (0.49), 4.092 (0.47), 5.966 (1.52), 10.699 (0.03), 12.695 (0.04).
Пример 307А
Трет-бутил 2-{[4-(дифторметокси)фенил]ацетил} гидразинкарбоксилат
[4-(дифторметокси)фенил]уксусную кислоту (270 мг, 1.33 ммоль) и трет-бутил гидразинкарбоксилат (264 мг, 2.00 ммоль) растворили в N,N-Диметилформамиде (2.0 мл, 26 ммоль). N,N-Диизопропилэтиламин (700 мкл, 4.0 ммоль) и HATU (760 мг, 2.00 ммоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Воду и этилацетат добавили, и органическую фазу промыли насыщенным водным раствором гидрокарбоната натрия, водой и водным раствором лимонной кислоты (10%). Органическую фазу обработали сульфатом натрия, отфильтровали и высушивали в вакууме с получением неочищенного продукта. Полученное количество составило 1114 мг.
LC-MS (Способ 1B): Rt=0.81 мин; MS (ESIneg): m/z=315 [М-Н]-
Пример 308А
Трет-бутил 2-(3-хлор-2-фторбензоил)гидразинкарбоксилат
3-хлор-2-фторбензойную кислоту (270 мг, 1.54 ммоль) и трет-бутил гидразинкарбоксилат (306 мг, 2.32 ммоль) растворили в N,N-Диметилформамиде (2.3 мл, 30 ммоль). N,N-Диизопропилэтиламин (810 мкл, 4.6 ммоль) и HATU (881 мг, 2.32 ммоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Воду и этилацетат добавили, и органическую фазу промыли насыщенным водным раствором гидрокарбоната натрия, водой и водным раствором лимонной кислоты (10%). Органическую фазу обработали сульфатом натрия, отфильтровали и высушивали в вакууме с получением неочищенного продукта. Полученное количество составило 1017 мг.
LC-MS (Способ 1B): Rt=0.81 мин; MS (ESIneg): m/z=287 [М-Н]-
Пример 309А
Трет-бутил 2-{[4-(трифторметокси)фенил]ацетил}гидразинкарбоксилат
[4-(трифторметокси)фенил]уксусную кислоту (250 мг, 1.14 ммоль) и трет-бутил гидразинкарбоксилат (225 мг, 1.70 ммоль) растворили в N,N-Диметилформамиде (2.0 мл, 26 ммоль). N,N-Диизопропилэтиламин (590 мкл, 3.4 ммоль) и HATU (648 мг, 1.70 ммоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Воду и этилацетат добавили, и органическую фазу промыли насыщенным водным раствором гидрокарбоната натрия, водой и соляным раствором. Органическую фазу обработали сульфатом натрия, отфильтровали и высушивали в вакууме с получением неочищенного продукта. Полученное количество составило 819 мг.
LC-MS (Способ 1B): Rt=0.94 мин; MS (ESIneg): m/z=333 [М-Н]-
Пример 310A
2-[4-(дифторметокси)фенил]ацетогидразид гидрохлорид
трет-бутил 2-{[4-(дифторметокси)фенил]ацетил}гидразинкарбоксилат (633 мг, 2.00 ммоль) растворили в 1,4-диоксане (5.0 мл, 58 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.0 мл, 4.0 М, 4.0 ммоль) при комнатной температуре в течение 4 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 478 мг (95% теоретический выход).
LC-MS (Способ 1B): Rt=0.52 мин; MS (ESIpos): m/z=217 [М+Н]+
Пример 311А
3 -хлор-2-фторбензогидразид гидрохлорид
трет-бутил 2-(3-хлор-2-фторбензоил)гидразинкарбоксилат (577 мг, 2.00 ммоль) растворили в 1,4-диоксане (5.0 мл, 58 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.0 мл, 4.0 М, 4.0 ммоль) при комнатной температуре в течение 4 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 161 мг (35% теоретический выход).
LC-MS (Способ 1B): Rt=0.48 мин; MS (ESIpos): m/z=189 [M+H]+
Пример 312A
2- [4-(трифторметокси)фенил]ацетогидразид гидрохлорид
трет-бутил 2-{[4-(трифторметокси)фенил]ацетил}гидразинкарбоксилат (380 мг, 1.14 ммоль) растворили в 1,4-диоксане (4.0 мл, 47 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.0 мл, 4.0 М, 4.0 ммоль) при комнатной температуре в течение 4 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 269 мг (87% теоретический выход).
LC-MS (Способ 10В): Rt=1.31 мин; MS (ESIpos): m/z=235 [М+Н]+
Пример 313А
Трет-бутил 4-[3-(4-трет-бутил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (60.0 мг, 159 мкмоль), N,N-Диизопропилэтиламин (140 мкл, 790 мкмоль), и 1-бром-3,3-диметилбутан-2-он (17 мкл, 130 мкмоль) перемешали в этаноле (2.4 мл, 41 ммоль) в течение 1 ч при 70°C. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 14.8 мг (100% чистота, 20% теоретический выход).
LC-MS (Способ 1B): Rt=1.36 мин; MS (ESIpos): m/z=458 [М+Н]+
1Н-ЯМР(400 МГц, DMSO-d6) delta [ppm]: 1.351 (15.01), 1.421 (16.00), 1.544 (0.15), 1.565 (0.37), 1.575 (0.42), 1.596 (0.39), 1.604 (0.36), 1.627 (0.16), 1.996 (0.45), 2.026 (0.39), 2.888 (0.21), 3.422 (0.10), 4.092 (0.36), 4.118 (0.34), 6.059 (0.07), 7.158 (0.72), 8.369 (0.10), 10.677 (0.06).
Пример 314А
Трет-бутил 4-(3-этил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (959 мг, 2.70 ммоль) и 4-Этил-1Н-пиразол-3-амин (300 мг, 2.70 ммоль) перемешали в ацетонитриле (10 мл, 210 ммоль) в течение 1.5 ч при 60°C. Растворитель удалили. 1-Метокси-2-пропанол (10 мл, 100 ммоль) и трифосфат калия (1.15 г, 5.40 ммоль) добавили, и смесь перемешивали в течение 1.5 ч при 110°C. Растворитель удалили, остаток распределили между водой и этилацетатом. Органическую фазу промыли насыщенным водным раствором хлорида аммония, водой и соляным раствором. Высушивание сульфатом натрия и в вакууме обеспечило продукт. Полученное количество составило 532 мг (100% чистота, 57% теоретический выход).
LC-MS (Способ 1B): Rt=0.92 мин; MS (ESIneg): m/z=345 [М-Н]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.000 (0.32), 1.092 (1.43), 1.111 (2.97), 1.129 (1.48), 1.415 (16.00), 1.468 (0.19), 1.478 (0.22), 1.500 (0.55), 1.509 (0.56), 1.531 (0.60), 1.540 (0.56), 1.562 (0.26), 1.571 (0.28), 1.948 (0.77), 1.979 (0.68), 2.449 (0.49), 2.468 (1.43), 2.487 (1.40), 2.507 (1.28), 2.847 (0.28), 3.323 (0.46), 3.342 (0.48), 3.372 (0.21), 4.066 (0.47), 4.094 (0.45), 5.766 (1.24), 7.686 (1.48), 11.970 (0.57).
Пример 315А
Трет-бутил 4-[5-оксо-3-(4-фенил-1,3-тиазол-2-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
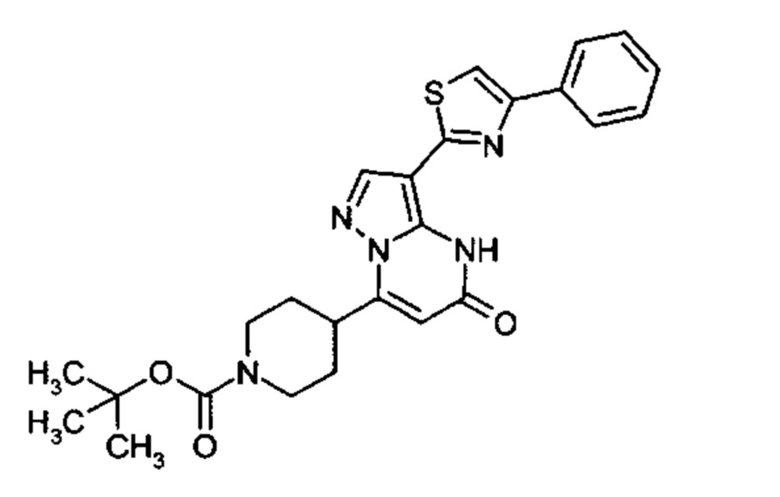
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (100 мг, 265 мкмоль), N,N-Диизопропилэтиламин (230 мкл, 1.3 ммоль), и 2-бром-1-фенилэтанон (52.7 мг, 265 мкмоль) перемешали в этаноле (4.0 мл, 69 ммоль) в течение 1 ч при 70°C. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 57.6 мг (96% чистота, 44% теоретический выход).
LC-MS (Способ 1B): Rt=1.29 мин; MS (ESIpos): m/z=478 [М+Н]+
Пример 316А
Трет-бутил 4-{3-[4-(2-фторфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
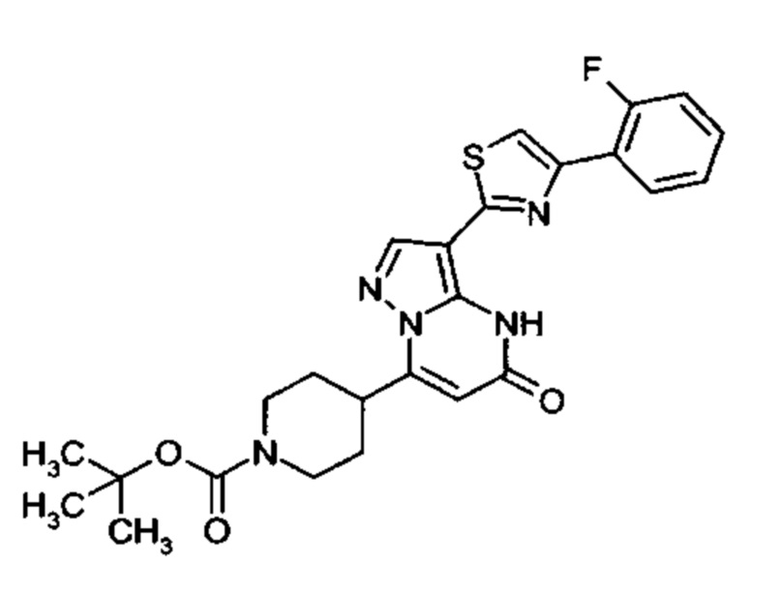
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (80.0 мг, 212 мкмоль), N,N-Диизопропилэтиламин (180 мкл, 1.1 ммоль), и 2-бром-1-фенилэтанон (29 мкл, 210 мкмоль) перемешали в этаноле (3.2 мл, 55 ммоль) в течение 1 ч при 70°C. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин=100%В, 22.75-25.00мин = 20%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 66.1 мг (99% чистота, 62% теоретический выход).
LC-MS (Способ 1B): Rt=1.33 мин; MS (ESIpos): m/z=496 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.426 (16.00), 1.557 (0.13), 1.566 (0.16), 1.587 (0.36), 1.596 (0.36), 1.618 (0.38), 1.627 (0.35), 1.647 (0.16), 1.658 (0.14), 2.022 (0.47), 2.051 (0.41), 2.903 (0.20), 3.489 (0.12), 4.104 (0.33), 4.132 (0.31), 6.239 (0.03), 7.323 (0.25), 7.343 (0.61), 7.362 (0.61), 7.371 (0.48), 7.380 (0.45), 7.406 (0.21), 7.410 (0.24), 7.419 (0.26), 7.424 (0.36), 7.430 (0.27), 7.436 (0.19), 7.443 (0.27), 7.457 (0.09), 7.461 (0.08), 7.911 (0.99), 7.916 (0.96), 8.328 (0.15), 8.346 (0.23), 8.365 (0.14), 11.222 (0.02).
Пример 317A
Трет-бутил 4-[3-(5-метил-4-фенил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
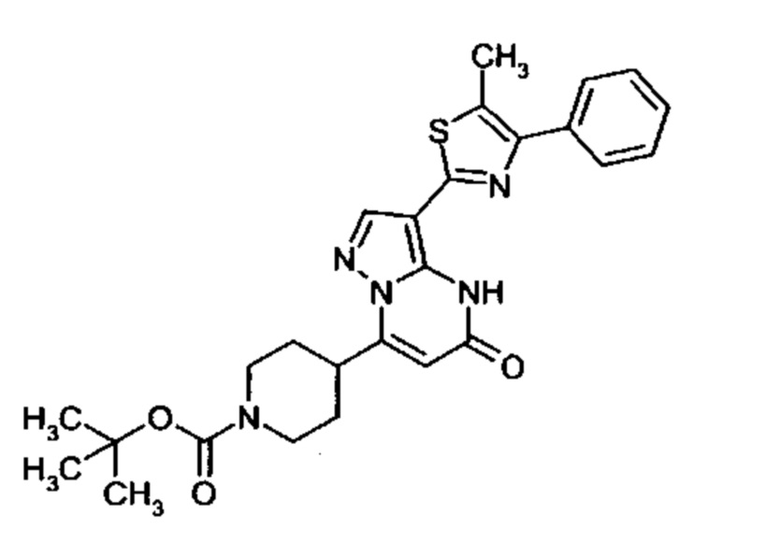
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (60.0 мг, 159 мкмоль), N,N-Диизопропилэтиламин (140 мкл, 790 мкмоль), и 2-бром-1-фенилэтанон (24 мкл, 160 мкмоль) перемешали в этаноле (2.4 мл, 41 ммоль) в течение 1 ч при 70°C. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00мин = 20%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 14.0 мг (100% чистота, 18% теоретический выход).
LC-MS (Способ 1B): Rt=1.36 мин; MS (ESIpos): m/z=492 [М+Н]+
Пример. 318А
Трет-бутил 4-{3-[4-(2-метилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
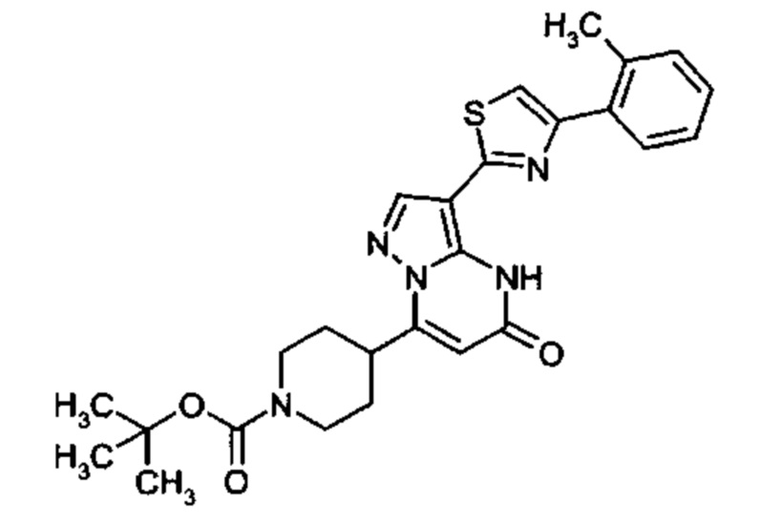
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (40.0 мг, 106 мкмоль), N,N-Диизопропилэтиламин (92 мкл, 530 мкмоль), и 2-бром-1-фенилэтанон (16 мкл, 110 мкмоль) перемешали в этаноле (1.6 мл, 27 ммоль) в течение 1 ч при 70°C. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00мин = 20%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 12.0 мг (96% чистота, 22% теоретический выход).
LC-MS (Способ 1B): Rt=1.37 мин; MS (ESIpos): m/z=492 [М+Н]+
Пример 319А
Трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
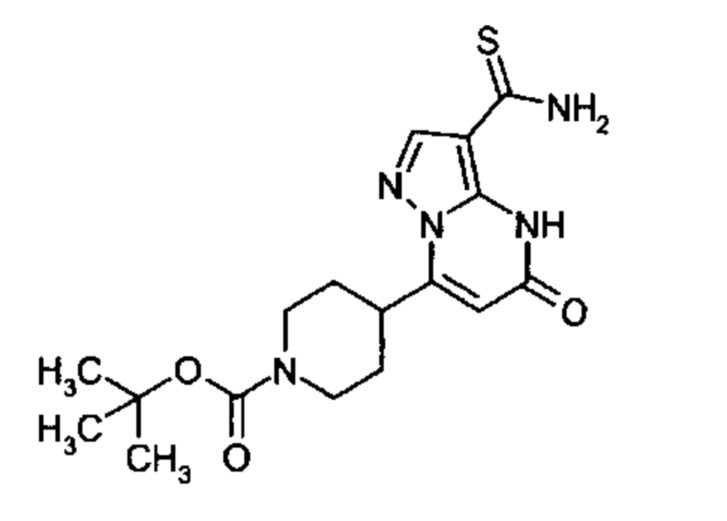
3-амино-1Н-пиразол-4-карботиоамид (550 мг, 1.55 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (200 мг, 1.41 ммоль) нагревали в ацетонитриле (3.3 мл, 63 ммоль) при 60°C в течение 3 ч. Растворители удалили, и остаток растворили в 1-метокси-2-пропанолее (3.3 мл, 34 ммоль). Трифосфат калия (597 мг, 2.81 ммоль) добавили, и смесь нагревали при 100°C в течение 2 ч. Растворители удалили, и остаток распределили между раствором лимонной кислоты (10%) и этилацетатом. Водный раствор экстрагировали два раза этилацетатом. Органическую фазу экстрагировали водой и соляным раствором. Органическую фазу обработали сульфатом натрия, отфильтровали и высушивали в вакууме с получением продукта. Полученное количество составило 2950 мг (95% чистота, 66% теоретический выход).
LC-MS (Способ 1B): Rt=0.878 мин; MS (ESIpos): m/z=378 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.385 (4.73), 1.414 (16.00), 1.511 (0.13), 1.518 (0.14), 1.541 (0.37), 1.550(0.36), 1.571 (0.45), 1.580 (0.36), 1.602 (0.17), 1.612 (0.14), 1.946 (0.52), 1.977 (0.44), 2.072 (2.84), 2.108 (1.56), 2.524 (0.17), 2.858 (0.22), 4.070 (0.35), 4.099 (0.34), 6.101 (0.22), 8.448 (1.60), 9.383 (0.19), 9.467 (0.50), 11.820 (0.17).
Пример 320А
Трет-бутил 4-(3-{[2-(3-хлор-2-фторбензоил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
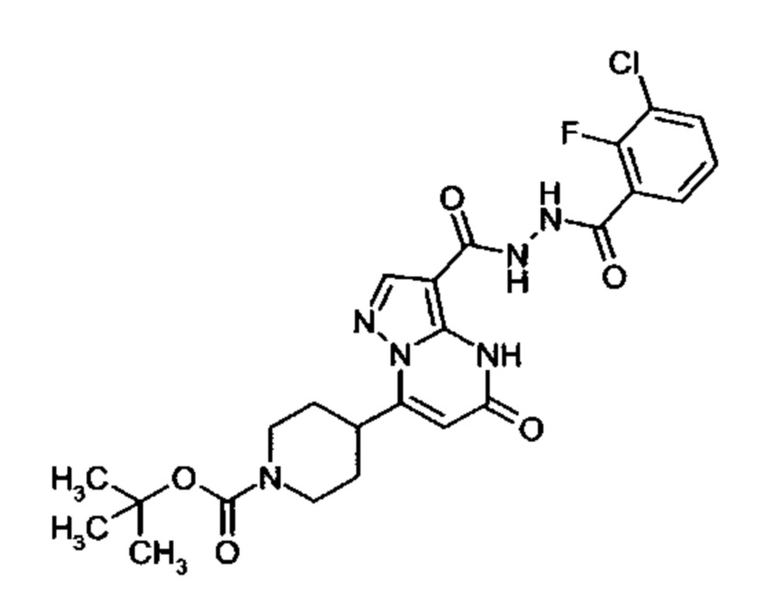
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту и 3-хлор-2-фторбензогидразид гидрохлорид (1:1) (117 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (236 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125x30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% трифторуксусной кислотой), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 64.5 мг (100% чистота, 29% теоретический выход).
LC-MS (Способ 1B): Rt=0.93 мин; MS (ESIpos): m/z=533 [М+Н]+
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.418 (16.00), 1.526 (0.15), 1.537 (0.16), 1.544 (0.24), 1.551 (0.30), 1.556(0.28), 1.576 (0.28), 1.600 (0.12), 1.944 (0.10), 1.975 (0.42), 2.000 (0.33), 2.863 (0.15), 3.375 (0.15), 4.089 (0.28), 6.045 (0.08), 7.359 (0.27), 7.374 (0.57), 7.390 (0.32), 7.577 (0.20), 7.580 (0.23), 7.592 (0.38), 7.605 (0.19), 7.608 (0.17), 7.770 (0.24), 7.773 (0.24), 7.787 (0.37), 7.800 (0.23), 7.804 (0.21), 8.396 (0.36), 10.458 (0.05), 10.528 (0.18), 10.918 (0.04).
Пример 321А
Трет-бутил 4-{3-[(2-{[4-(дифторметокси)фенил]ацетил}гидразинил)карбонил]-5-оксо-4,5 -дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
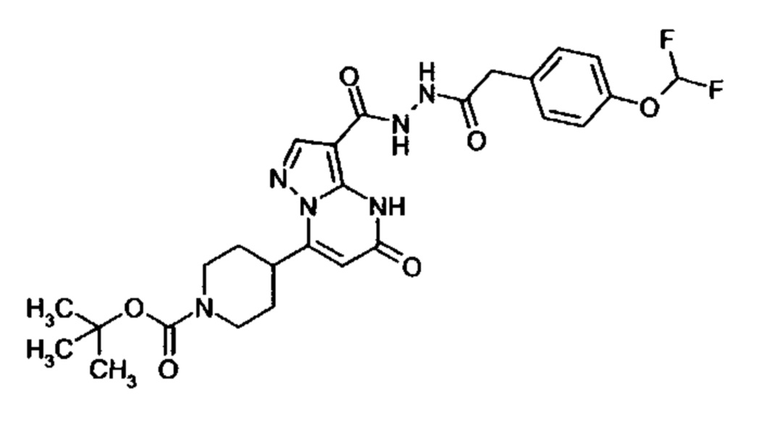
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-[4-(дифторметокси)фенил]ацетогидразид гидрохлорид (1:1) (134 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (236 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% трифторуксусной кислотой), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 93.0 мг (100% чистота, 40% теоретический выход).
LC-MS (Способ 1B): Rt=0.89 мин; MS (ESIneg): m/z=559 [М-Н]-
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.413 (16.00), 1.518 (0.12), 1.538 (0.32), 1.560 (0.28), 1.582 (0.13), 1.957 (0.38), 1.981 (0.34), 2.852 (0.14), 3.537 (1.96), 4.079 (0.26), 4.096 (0.25), 6.017 (0.12), 7.127 (1.17), 7.144 (1.30), 7.196 (1.12), 7.371 (1.20), 7.388 (1.03), 8.327 (0.20), 10.192 (0.20), 10.836 (0.09).
Пример 322А
Трет-бутил 4-{5-оксо-3-[(2-{[4-(трифторметокси)фенил]ацетил}гидразинил)карбонил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
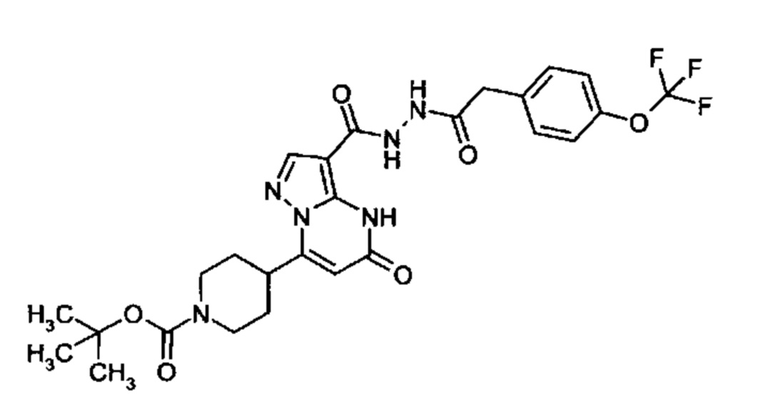
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-[4-(трифторметокси)фенил]ацетогидразид гидрохлорид (1:1) (145 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (236 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% трифторуксусной кислотой), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 199 мг (90% чистота, 675% теоретический выход).
LC-MS (Способ 1B): Rt=0.95 мин; MS (ESIpos): m/z=579 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.244 (1.62), 1.258 (2.09), 1.273 (1.12), 1.413 (16.00), 1.426 (12.43), 1.510 (0.35), 1.542 (0.63), 1.563 (0.81), 1.584 (0.76), 1.617 (0.55), 1.646 (0.23), 1.794 (0.11), 1.796 (0.11), 1.954 (0.81), 1.985 (0.77), 2.002 (0.78), 2.036 (0.56), 2.889 (2.21), 3.025 (0.73), 3.586 (1.90), 3.760 (0.17), 4.075 (0.70), 4.101 (0.96), 4.129 (0.61), 7.317 (0.95), 7.338 (1.22), 7.450 (1.16), 7.471 (0.86), 7.650 (0.40), 7.661 (0.42), 7.671 (0.43), 7.682 (0.40), 7.951 (0.31), 8.327 (0.42), 8.681 (0.09), 8.712 (0.40), 8.734 (0.63), 8.755 (0.63), 8.769 (0.16), 8.833 (0.62), 8.843 (0.61), 10.239 (0.32).
Пример 323А
Трет-бутил 4-[3-({2-[(3-хлорфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
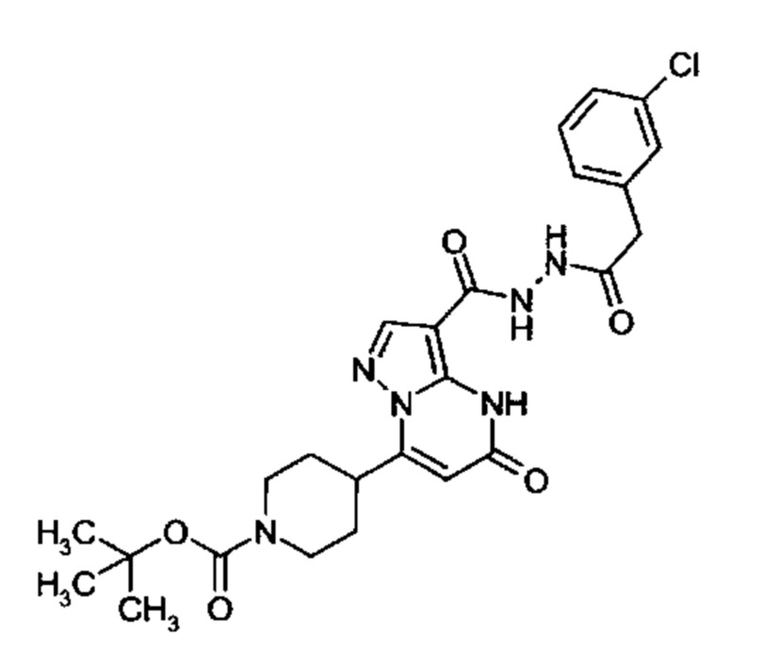
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(3-хлорфенил)ацетогидразид (115 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин=20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 64.2 мг (100% чистота, 29% теоретический выход).
LC-MS (Способ 1B): Rt=0.93 мин; MS (ESIpos): m/z=529 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.413 (16.00), 1.508 (0.16), 1.539 (0.32), 1.569 (0.35), 1.590 (0.14), 1.955 (0.43), 1.984 (0.36), 2.855 (0.20), 3.565 (1.96), 4.070 (0.34), 4.101 (0.32), 6.016 (0.15), 7.288 (0.32), 7.306 (0.68), 7.330 (0.63), 7.346 (0.75), 7.365 (0.57), 7.384 (0.20), 7.409 (0.63), 8.326 (0.25), 10.216 (0.25), 10.848 (0.10).
Пример 324A
Трет-бутил 4-[3-({2-[2-метил-2-(1Н-1,2,4-триазол-1-ил)пропаноил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
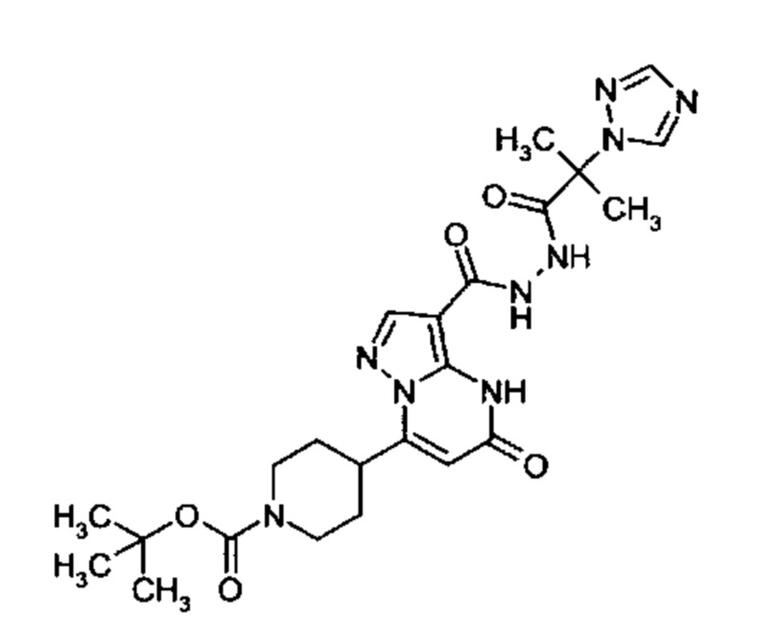
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-метил-2-(1Н-1,2,4-триазол-1-ил)пропангидразид (105 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 96.2 мг (100% чистота, 45% теоретический выход).
LC-MS (Способ 1B): Rt=0.70 мин; MS (ESIpos): m/z=514 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.415 (16.00), 1.507 (0.13), 1.537 (0.31), 1.569 (0.38), 1.599 (0.14), 1.837 (7.72), 1.954 (0.48), 1.983 (0.42), 2.850 (0.20), 4.072 (0.35), 4.102 (0.33), 6.014 (0.20), 8.002 (1.27), 8.338 (0.47), 8.719 (1.65), 9.881 (0.26), 10.207 (0.14), 10.901 (0.16).
Пример 325A
Трет-бутил 4-[3-({2-[(2-хлорфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
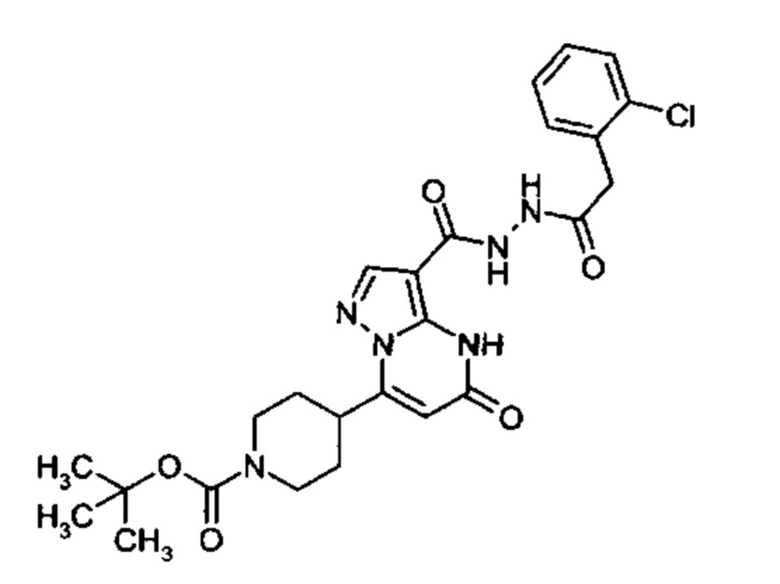
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(2-хлорфенил)ацетогидразид (115 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин=20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 92.6 мг (88% чистота, 37% теоретический выход).
LC-MS (Способ 1B): Rt=0.91 мин; MS (ESIpos): m/z=529 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.414 (16.00), 1.508 (0.16), 1.539 (0.33), 1.570 (0.37), 1.598 (0.13), 1.958 (0.46), 1.986 (0.37), 2.855 (0.21), 3.709 (2.13), 4.071 (0.35), 4.099 (0.32), 6.018 (0.18), 7.270 (0.16), 7.276 (0.22), 7.288 (0.40), 7.294 (0.50), 7.299 (0.45), 7.305 (0.92), 7.312 (0.52), 7.317 (0.49), 7.321 (0.48), 7.336 (0.16), 7.340 (0.10), 7.429 (0.54), 7.435 (0.50), 7.447 (0.33), 7.452 (0.41), 7.464 (0.39), 7.469 (0.34), 7.481 (0.31), 7.487 (0.29), 8.349 (0.37), 10.178 (0.21), 10.839 (0.16).
Пример 326A
Трет-бутил 4-[3-({2-[(5-метил-1,3-тиазол-2-ил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
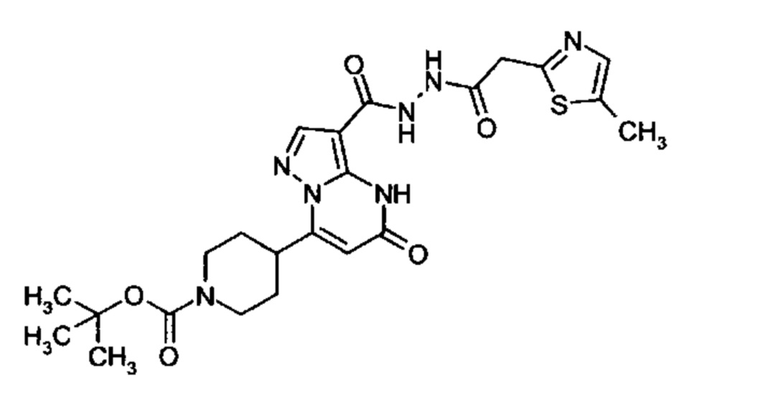
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(5-метил-1,3-тиазол-2-ил)ацетогидразид (106 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 161.4 мг (94% чистота, 71% теоретический выход).
LC-MS (Способ 1B): Rt=0.81 мин; MS (ESIpos): m/z=516 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.007 (0.32), 1.414 (16.00), 1.500 (0.12), 1.520 (0.20), 1.532 (0.32), 1.543 (0.30), 1.550 (0.29), 1.563 (0.35), 1.570 (0.35), 1.593 (0.16), 1.956 (0.47), 1.985 (0.42), 2.333 (3.48), 2.858 (0.21), 3.969 (1.95), 4.072 (0.35), 4.103 (0.33), 6.025 (0.20), 7.162 (0.76), 8.132 (0.29), 8.344 (0.33), 10.323 (0.16), 10.845 (0.09).
Пример 327A
Трет-бутил 4-[3-({2-[(2-хлор-6-фторфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(2-хлор-6-фторфенил)ацетогидразид (126 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилзтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 53.2 мг (91% чистота, 21% теоретический выход).
LC-MS (Способ 1B): Rt=091 мин; MS (ESIpos): m/z=547 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.413 (16.00), 1.506 (0.14), 1.537 (0.30), 1.568 (0.35), 1.588 (0.14), 1.956 (0.42), 1.982 (0.36), 2.854 (0.20), 3.762 (1.30), 4.070 (0.33), 4.098 (0.32), 6.012 (0.18), 7.207 (0.18), 7.213 (0.21), 7.224 (0.24), 7.230 (0.41), 7.250 (0.24), 7.253 (0.24), 7.326 (0.28), 7.341 (1.13), 7.354 (0.40), 7.360 (0.34), 7.374 (0.33), 8.338 (0.35), 10.229 (0.22), 10.859 (0.14).
Пример 328A
Трет-бутил 4-[3-({2-[(2-метоксифенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
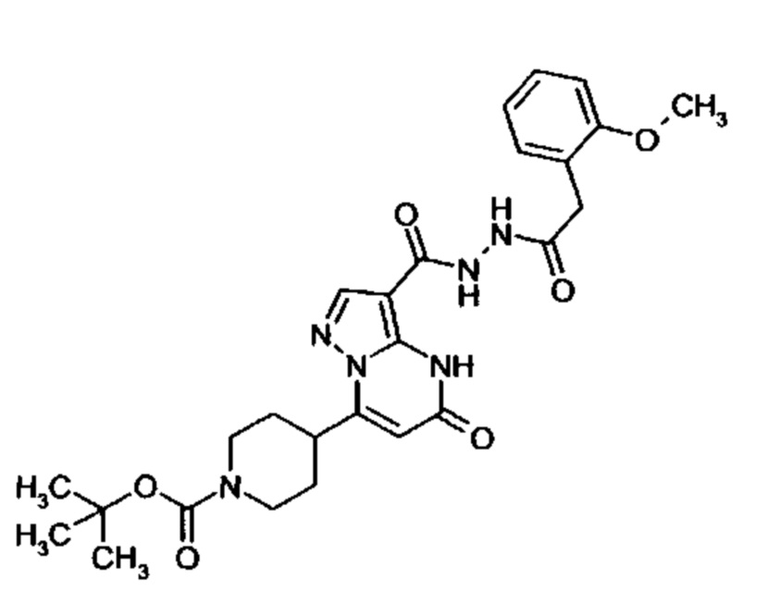
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(2-метоксифенил)ацетогидразид (112 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 94.8 мг (100% чистота,44% теоретический выход).
LC-MS (Способ 1B): Rt=0.89 мин; MS (ESIpos): m/z=525 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.410 (16.00), 1.507 (0.13), 1.537 (0.31), 1.565 (0.39), 1.591 (0.15), 1.955 (0.46), 1.984 (0.41), 2.850 (0.20), 3.504 (2.39), 3.778 (5.57), 4.069 (0.34), 4.095 (0.33), 6.011 (0.22), 6.874 (0.34), 6.893 (0.72), 6.911 (0.41), 6.954 (0.64), 6.975 (0.75), 7.213 (0.35), 7.232 (0.54), 7.258 (0.49), 7.277 (0.42), 8.341 (0.36), 9.984 (0.18), 10.173 (0.12), 10.818 (0.18).
Пример 329A
Трет-бутил 4-[3-({2-[2-метил-3-(морфолин-4-ил)пропаноил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-метил-3-(морфолин-4-ил)пропангидразид (116 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125x30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 119.6 мг (96% чистота, 52% теоретический выход).
LC-MS (Способ 1B): Rt=0.61 мин; MS (ESIpos): m/z=532 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.101 (0.90), 1.116 (0.86), 1.243 (7.56), 1.258 (7.24), 1.272 (4.40), 1.416 (16.00), 1.507 (0.12), 1.517 (0.14), 1.539 (0.35), 1.547 (0.36), 1.571 (0.44), 1.578 (0.38), 1.600 (0.16), 1.608 (0.14), 1.960 (0.53), 1.990 (0.46), 2.689 (2.40), 2.871 (1.07), 3.059 (0.75), 3.110 (0.27), 3.120 (0.30), 3.128 (0.67), 3.138 (0.66), 3.146 (0.67), 3.156 (0.61), 3.165 (0.28), 3.175 (0.23), 3.584 (0.47), 3.592 (0.44), 3.600 (0.58), 3.609 (0.55), 3.616 (0.67), 3.625 (0.66), 3.633 (0.57), 3.642 (0.56), 3.649 (0.41), 3.658 (0.43), 3.689 (0.44), 4.078 (0.34), 4.105 (0.32), 6.080 (0.19), 8.131 (0.76), 8.372(1.20), 10.115(0.18).
Пример 330А
Трет-бутил 4-[3-({2-[3-(морфолин-4-ил)пропаноил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
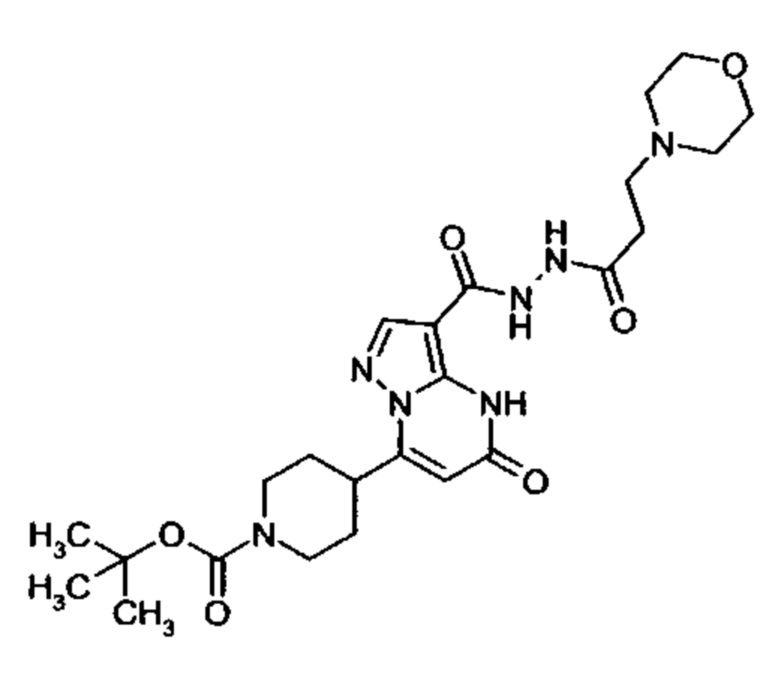
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 3-(морфолин-4-ил)пропангидразид (108 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин - 40%В, 17.0-19.75 мин=100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 165.1 мг (92% чистота, 71% теоретический выход).
LC-MS (Способ 1B): Rt=0.60 мин; MS (ESIpos): m/z=518 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.243 (16.00), 1.258 (15.24), 1.272 (9.70), 1.416(14.19), 1.510(0.10), 1.520 (0.12), 1.541 (0.29), 1.550 (0.31), 1.573 (0.36), 1.579 (0.31), 1.601 (0.13), 1.613 (0.12), 1.959 (0.41), 1.989 (0.36), 2.637 (0.30), 2.689 (4.17), 2.856 (0.33), 3.109 (0.54), 3.120 (0.61), 3.128 (1.42), 3.138 (1.42), 3.146 (1.44), 3.157 (1.36), 3.165 (0.59), 3.175 (0.52), 3.567 (0.09), 3.583 (0.36), 3.593 (0.42), 3.600 (0.85), 3.609 (0.89), 3.616 (1.14), 3.625 (1.12), 3.632 (0.91), 3.642 (0.84), 3.648 (0.45), 3.659 (0.39), 3.674 (0.17), 3.759 (0.21), 4.078 (0.28), 4.105 (0.28), 6.091 (0.13), 8.132 (0.70), 8.353 (0.88), 10.159(0.22).
Пример 331А
Трет-бутил 4-(5-оксо-3-{[2-(3-фенилпропаноил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
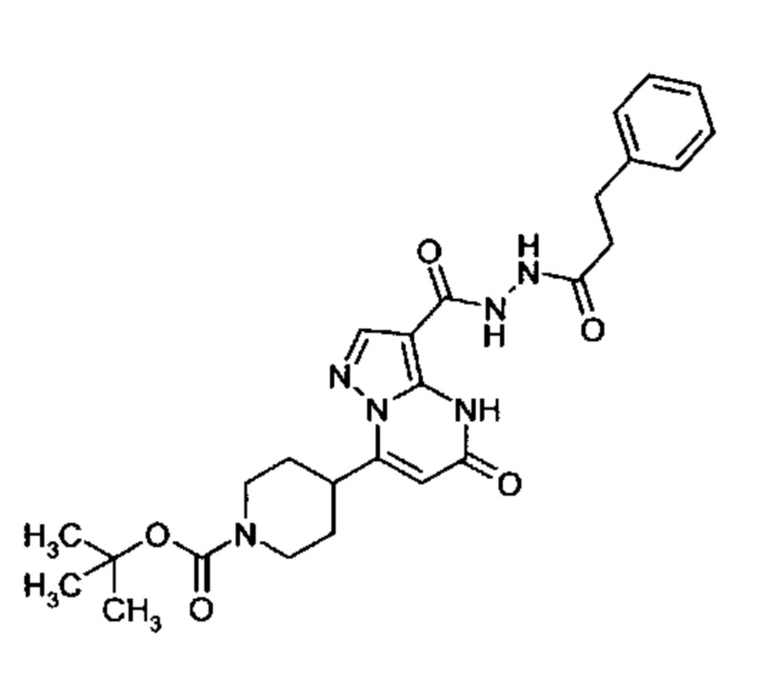
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 3-фенилпропангидразид (102 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), B = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 73.1 мг (96% чистота, 33% теоретический выход).
LC-MS (Способ 1B): Rt=0.90 мин; MS (ESIpos): m/z=509 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.411 (16.00), 1.507 (0.17), 1.539 (0.37), 1.568 (0.42), 1.593 (0.16), 1.957 (0.51), 1.985 (0.42), 2.524 (0.87), 2.849 (0.96), 2.869 (1.27), 2.888 (0.76), 4.071 (0.39), 4.099 (0.37), 6.016 (0.20), 7.170 (0.19), 7.188 (0.53), 7.206 (0.35), 7.238 (0.63), 7.255 (1.61), 7.272 (1.27), 7.289 (1.10), 7.309 (0.34), 8.342 (0.36), 9.913 (0.21), 10.127 (0.11), 10.810 (0.17).
Пример 332A
Трет-бутил 4-[3-({2-[(4-хлорфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
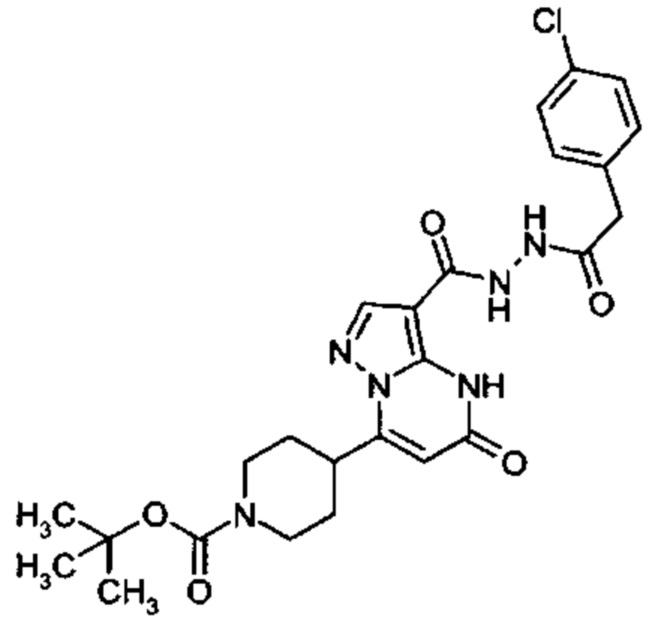
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(4-хлорфенил)ацетогидразид (115 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), B = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 34.8 мг (90% чистота, 35% теоретический выход).
LC-MS (Способ 1B): Rt=0.93 мин; MS (ESIpos): m/z=529 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.413 (16.00), 1.511 (0.16), 1.539 (0.37), 1.569 (0.43), 1.591 (0.17), 1.954 (0.54), 1.984 (0.47), 2.853 (0.23), 3.316 (0.37), 4.072 (0.39), 4.100 (0.37), 6.017 (0.16), 7.342 (0.62), 7.363 (2.03), 7.379 (2.09), 7.401 (0.56), 8.327 (0.33), 10.201 (0.32), 10.837 (0.14).
Пример 333A
Трет-бутил 4-(5-оксо-3-{[2-(пиридин-2-илацетил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
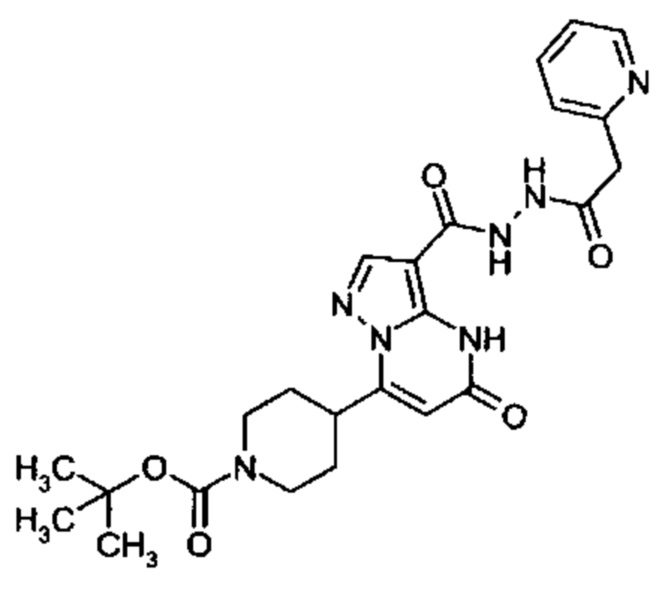
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(пиридин-2-ил)ацетогидразид (93.9 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), B = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 78.11 мг (100% чистота, 38% теоретический выход).
LC-MS (Способ 1B): Rt=0.66 мин; MS (ESIpos): m/z=496 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.414 (16.00), 1.503 (0.11), 1.514 (0.13), 1.535 (0.31), 1.544 (0.34), 1.567 (0.38), 1.574 (0.36), 1.596 (0.16), 1.606 (0.13), 1.956 (0.48), 1.988 (0.42), 2.876 (0.28), 3.367 (0.22), 4.072 (0.33), 4.101 (0.32), 6.058 (0.08), 7.423 (0.18), 7.435 (0.24), 7.449 (0.16), 7.564 (0.28), 7.583 (0.29), 7.930 (0.16), 7.950 (0.23), 7.966 (0.12), 8.347 (0.81), 8.582 (0.37), 8.593 (0.35), 10.288 (0.26).
Пример 334A
Трет-бутил 4-(3-{[2-(метоксикарбонил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
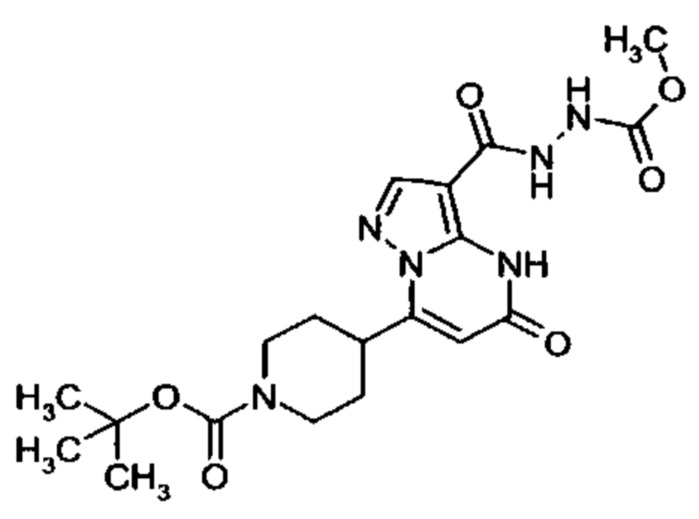
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и метил гидразинкарбоксилат (55.9 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 156.2 мг (94% чистота, 24% теоретический выход).
LC-MS (Способ 1B): Rt=0.73 мин; MS (ESIpos): m/z=435 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.408 (16.00), 1.495 (0.11), 1.504 (0.12), 1.525 (0.32), 1.535 (0.34), 1.556 (0.36), 1.565 (0.38), 1.587 (0.15), 1.597 (0.12), 1.953 (0.46), 1.984 (0.40), 2.850 (0.17), 3.485 (0.38), 3.622 (1.21), 4.067 (0.31), 4.097 (0.30), 6.064 (0.15), 8.310 (0.39), 9.216 (0.17), 10.042 (0.04), 10.891 (0.01).
Пример 335A
Трет-бутил 4-(5-оксо-3-{[2-(тиофен-2-илкарбонил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
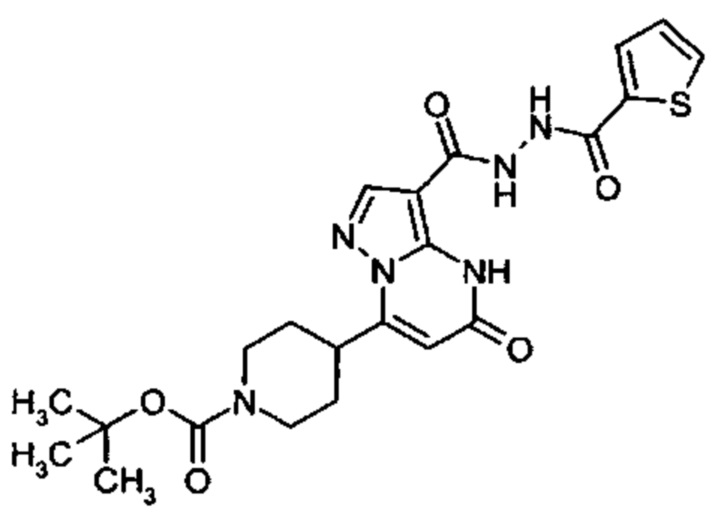
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и тиофен-2-карбогидразид (88.3 мг, 621 мкмоль) растворили N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 64.6 мг (100% чистота, 32% теоретический выход).
LC-MS (Способ 1B): Rt=0.84 мин; MS (ESIpos): m/z=487 [M+H]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.419 (16.00), 1.530 (0.11), 1.556 (0.27), 1.575 (0.28), 1.598 (0.13), 1.974 (0.38), 1.997 (0.33), 2.872 (0.14), 4.087 (0.27), 4.102 (0.25), 6.033 (0.14), 7.209 (0.47), 7.219 (0.58), 7.227 (0.48), 7.862 (0.61), 7.872 (0.60), 7.889 (0.57), 7.895 (0.56), 8.386 (0.25), 10.326 (0.09), 10.508 (0.15), 10.896 (0.10).
Пример 336A
Трет-бутил 4-(5-оксо-3-{[2-(3,3,3-трифторпропаноил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
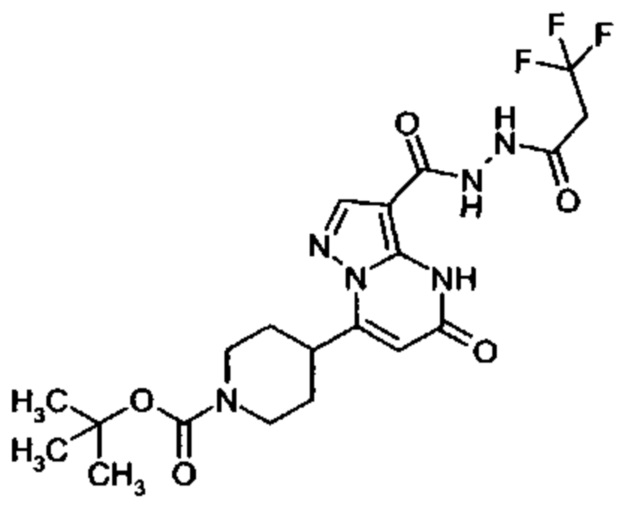
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 3,3,3-трифторпропангидразид (88.2 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Еще 3,3,3-трифторпропангидразид (1.5 эквивалента), N,N-Диизопропилэтиламин (3 эквивалента), и HATU (1 эквивалента) добавили. Смесь перемешивали в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 97.6 мг (60% чистота, 29% теоретический выход).
LC-MS (Способ 1B): Rt=0.83 мин; MS (ESIpos): m/z=487 [M+H]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.415 (16.00), 1.524 (0.15), 1.540 (0.33), 1.546 (0.31), 1.564 (0.29), 1.570 (0.28), 1.587 (0.13), 1.961 (0.41), 1.987 (0.70), 2.857 (0.15), 3.064 (0.07), 3.393 (0.26), 3.415 (0.60), 3.437 (0.56), 3.459 (0.19), 4.082 (0.28), 4.096 (0.27), 6.023 (0.13), 8.348 (0.24), 10.347 (0.17), 10.880 (0.08).
Пример 337A
Трет-бутил 4-(3-{[2-(2-хлорбензоил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
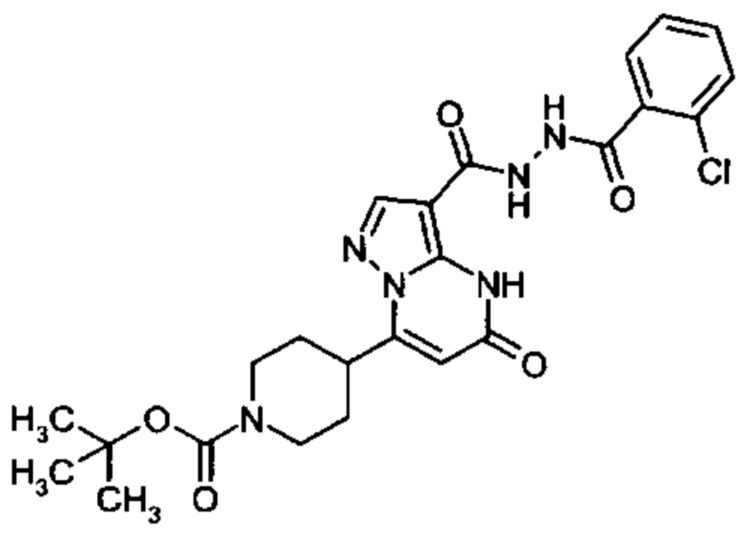
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-хлорбензогидразид (106 мг, 621 мкмоль) растворили N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 119.6 мг (100% чистота, 56% теоретический выход).
LC-MS (Способ 1B): Rt=0.89 мин; MS (ESIpos): m/z=515 [M+H]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.420 (16.00), 1.530 (0.11), 1.546 (0.25), 1.556 (0.25), 1.576 (0.26), 1.577 (0.25), 1.598 (0.12), 1.978 (0.36), 2.001 (0.32), 2.869 (0.13), 4.088 (0.25), 4.107 (0.24), 6.033 (0.15), 7.455 (0.20), 7.458 (0.21), 7.470 (0.55), 7.473 (0.58), 7.485 (0.47), 7.487 (0.51), 7.506 (0.26), 7.509 (0.36), 7.521 (0.43), 7.525 (0.71), 7.536 (0.84), 7.540 (0.73), 7.554 (1.01), 7.556 (0.98), 7.570 (0.38), 7.572 (0.35), 8.417 (0.50), 10.416 (0.25), 10.914 (0.13).
Пример 338A
Трет-бутил 4-(5-оксо-3-{[2-(пиперидин-1-илацетил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
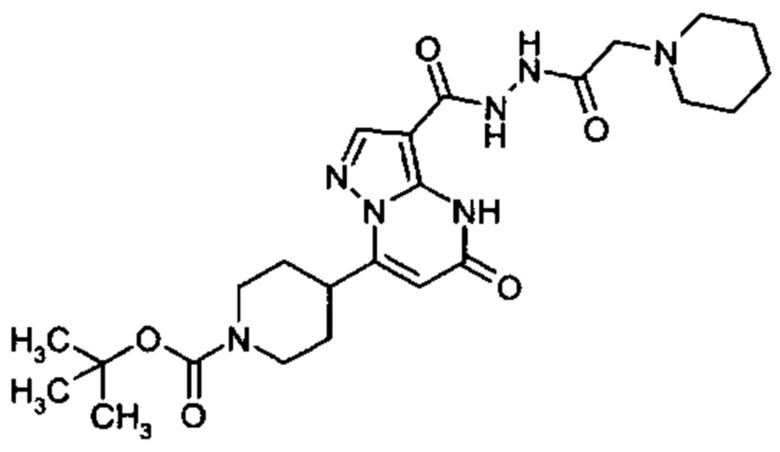
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(пиперидин-1-ил)ацетогидразид (97.6 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 111 мг (100% чистота, 53% теоретический выход).
LC-MS (Способ 1B): Rt=0.64 мин; MS (ESIpos): m/z=502 [M+H]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.416 (16.00), 1.525 (0.16), 1.532 (0.18), 1.549 (0.33), 1.556 (0.35), 1.574 (0.35), 1.580 (0.34), 1.598 (0.17), 1.605 (0.16), 1.754 (0.81), 1.962 (0.43), 1.985 (0.34), 2.855 (0.19), 2.889 (0.22), 3.057 (0.13), 3.949 (0.14), 3.986 (0.22), 4.085 (0.24), 4.104 (0.24), 6.092 (0.07), 8.351 (0.52), 10.347 (0.03), 10.524 (0.08).
Пример 339A
Трет-бутил 4-[5-оксо-3-({2-[(2-оксопирролидин-1-ил)ацетил]гидразинил}карбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
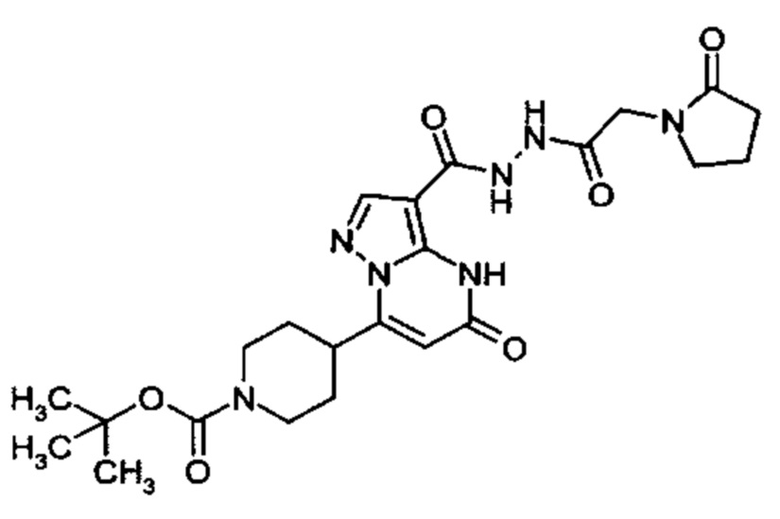
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(2-оксопирролидин-1-ил)ацетогидразид (97.6 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 105 мг (97% чистота, 49% теоретический выход).
LC-MS (Способ 1B): Rt=0.73 мин; MS (ESIpos): m/z=502 [M+H]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.415 (16.00), 1.540 (0.27), 1.565 (0.24), 1.947 (0.54), 1.962 (0.94), 1.978 (0.70), 1.991 (0.40), 2.237 (0.64), 2.253 (0.94), 2.269 (0.49), 2.874 (0.13), 3.408 (0.55), 3.422 (0.87), 3.436 (0.51), 3.952 (2.14), 4.088 (0.23), 6.020 (0.13), 8.333 (0.20), 10.042 (0.10), 10.189 (0.09), 10.852 (0.08).
Пример 340A
Трет-бутил 4-(3-{[2-(циклогексилкарбонил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
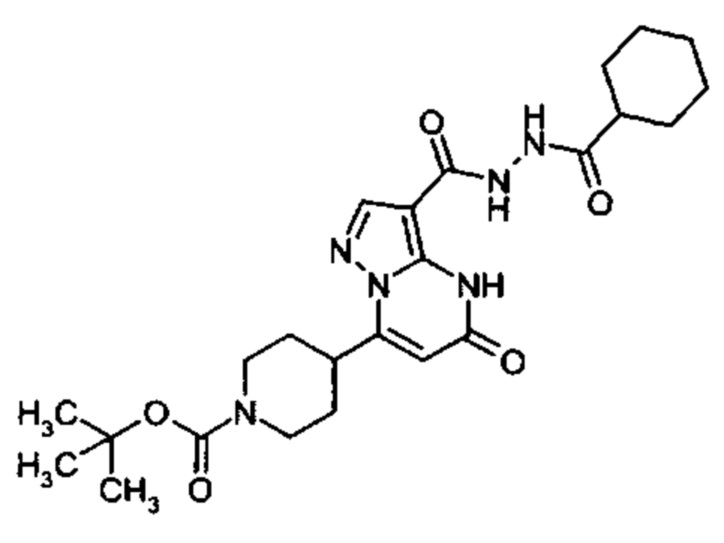
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и циклогексанкарбогидразид (88.3 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 128.9 мг (90% чистота, 58% теоретический выход).
LC-MS (Способ 1B): Rt=0.90 мин; MS (ESIpos): m/z=487 [M+H]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.150 (0.12), 1.157 (0.16), 1.181 (0.21), 1.206 (0.19), 1.216 (0.21), 1.240 (0.38), 1.246 (0.30), 1.261 (0.26), 1.266 (0.33), 1.287 (0.17), 1.352 (0.18), 1.376 (0.39), 1.415 (16.00), 1.442 (0.23), 1.445 (0.26), 1.519 (0.13), 1.540 (0.32), 1.562 (0.26), 1.585 (0.13), 1.620 (0.21), 1.644 (0.21), 1.725 (0.87), 1.746 (0.77), 1.960 (0.36), 1.983 (0.32), 2.219 (0.09), 2.225 (0.15), 2.231 (0.10), 2.242 (0.17), 2.248 (0.28), 2.254 (0.17), 2.265 (0.10), 2.271 (0.13), 2.276 (0.08), 2.859 (0.14), 4.079 (0.26), 4.095 (0.25), 6.011 (0.16), 8.337 (0.28), 9.766 (0.13), 10.083 (0.09), 10.821 (0.13).
Пример 341A
Трет-бутил 4-(3-{[2-(циклобутилкарбонил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и циклобутанкарбогидразид (70.9 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (236 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 120.7 мг (76% чистота, 48% теоретический выход).
LC-MS (Способ 1B): Rt=0.77 мин; MS (ESIpos): m/z=459 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.415 (16.00), 1.509 (0.20), 1.518 (0.21), 1.540 (0.38), 1.571 (0.40), 1.594 (0.14), 1.759 (0.09), 1.768 (0.12), 1.791 (0.25), 1.803 (0.22), 1.816 (0.30), 1.825 (0.18), 1.839 (0.16), 1.848 (0.09), 1.882 (0.10), 1.904 (0.24), 1.926 (0.45), 1.952 (0.65), 1.959 (0.51), 1.969 (0.50), 1.987 (0.42), 1.995 (0.42), 2.048 (0.38), 2.055 (0.36), 2.069 (0.65), 2.078 (0.52), 2.084 (0.83), 2.091 (0.58), 2.099 (0.43), 2.114 (0.28), 2.121 (0.26), 2.136 (0.33), 2.141 (0.32), 2.158 (0.66), 2.179 (0.64), 2.203 (0.30), 2.208 (0.32), 2.863 (0.21), 3.094 (0.13), 3.114 (0.37), 3.135 (0.51), 3.156 (0.33), 3.176 (0.10), 4.075 (0.35), 4.100 (0.36), 6.015 (0.18), 8.332 (0.29), 9.295 (0.11), 9.297 (0.11), 9.734 (0.21), 10.084 (0.11), 10.817 (0.15).
Пример 342A
Трет-бутил 4-{5-оксо-3-[(2-пентаноилгидразинил)карбонил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
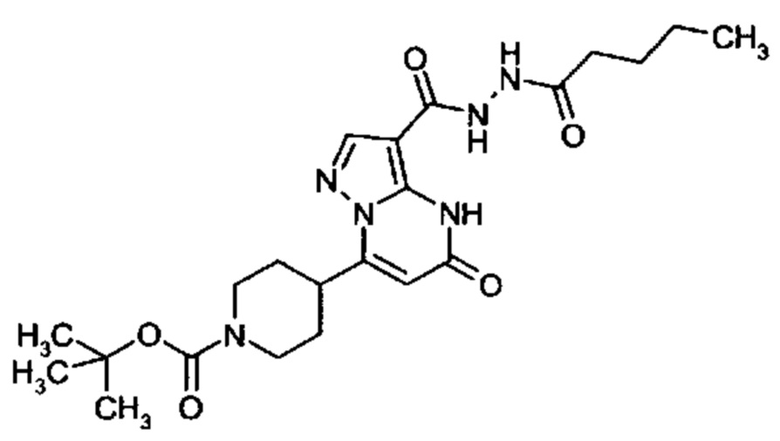
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (200 мг, 552 мкмоль) и пентангидразид (96.2 мг, 828 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (290 мкл, 1.7 ммоль) и HATU (315 мг, 828 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Еще пентангидразид (1.5 эквивалента), N,N-Диизопропилэтиламин (3 эквивалента), и HATU (1 эквивалента) добавили. Смесь перемешивали в течение 2 ч при комнатной температуре. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 28.7 мг (100% чистота, 15% теоретический выход).
LC-MS (Способ 1B): Rt=0.82 мин; MS (ESIpos): m/z=461 [M+H]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 0.874 (1.30), 0.889 (2.91), 0.904 (1.46), 1.291 (0.12), 1.306 (0.38), 1.321 (0.66), 1.336 (0.67), 1.351 (0.41), 1.365 (0.13), 1.415 (16.00), 1.501 (0.25), 1.516 (0.66), 1.531 (0.91), 1.546 (0.75), 1.561 (0.42), 1.962 (0.36), 1.986 (0.33), 2.164 (0.67), 2.178 (1.20), 2.193 (0.61), 2.857 (0.13), 4.080 (0.26), 4.099 (0.25), 6.014 (0.17), 8.341 (0.28), 9.824 (0.15), 10.811 (0.13).
Пример 343A
Трет-бутил 4-{3-[5-(3-хлор-2-фторфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

трет-бутил 4-(3-{[2-(3-хлор-2-фторбензоил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (62.3 мг, 117 мкмоль) растворили в ТГФ (2.0 мл, 25 ммоль) и перемешали с реагентом Бургесса (39.0 мг, 164 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 32.9 мг (100% чистота, 55% теоретический выход).
LC-MS (Способ 1B): Rt=1.19 мин; MS (ESIpos): m/z=515 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.424 (16.00), 1.541 (0.11), 1.550 (0.13), 1.573 (0.33), 1.581 (0.38), 1.603 (0.36), 1.613 (0.33), 1.634 (0.15), 1.645 (0.12), 2.001 (0.45), 2.032 (0.39), 2.881 (0.17), 3.415 (0.11), 3.446 (0.18), 3.477 (0.10), 4.098 (0.28), 4.126 (0.27), 6.187 (0.09), 7.489 (0.29), 7.508 (0.62), 7.528 (0.34), 7.873 (0.24), 7.877 (0.26), 7.894 (0.44), 7.911 (0.23), 7.915 (0.22), 8.206 (0.13), 8.222 (0.22), 8.242 (0.13), 8.497 (0.29), 12.267 (0.06).
Пример 344A
Трет-бутил 4-(3-{5-[4-(дифторметокси)бензил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
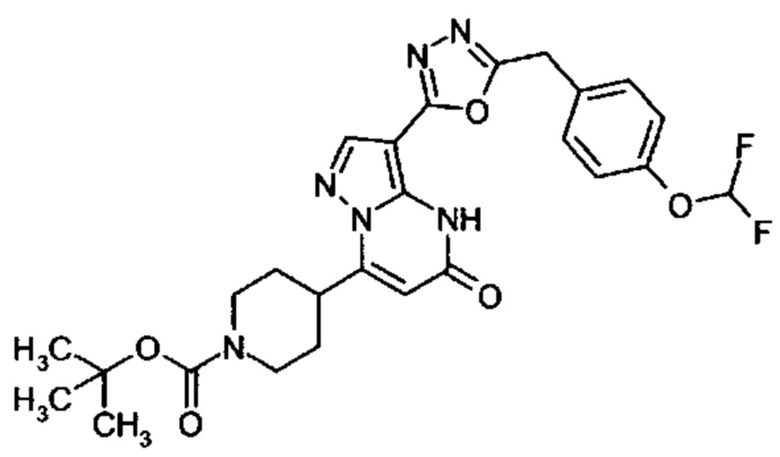
трет-бутил 4-{3-[(2-{[4-(дифторметокси)фенил]ацетил}гидразинил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (87.8 мг, 157 мкмоль) растворили в ТГФ (2.0 мл, 25 ммоль) и перемешали с реагентом Бургесса (52.3 мг, 219 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 50.6 мг (100% чистота, 60% теоретический выход).
LC-MS (Способ 1B): Rt=1.11 мин; MS (ESIpos): m/z=543 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.416 (16.00), 1.518 (0.10), 1.528 (0.12), 1.549 (0.29), 1.558 (0.30), 1.580 (0.33), 1.589 (0.30), 1.611 (0.14), 1.621 (0.11), 1.975 (0.41), 2.007 (0.36), 2.873 (0.16), 3.410 (0.15), 4.082 (0.27), 4.112 (0.26), 4.321 (2.30), 6.129 (0.06), 7.163 (1.12), 7.184 (1.31), 7.213 (1.11), 7.431 (1.25), 7.453 (1.07), 8.357 (0.17), 12.007 (0.07).
Пример 345A
Трет-бутил 4-(5-оксо-3-{5-[4-(трифторметокси)бензил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

трет-бутил 4-{5-оксо-3-[(2-{[4-(трифторметокси)фенил]ацетил}гидразинил)карбонил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (179 мг, 310 мкмоль) растворили в ТГФ (7.0 мл, 86 ммоль) и перемешали с реагентом Бургесса (103 мг, 434 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 40.4 мг (87% чистота, 20% теоретический выход).
LC-MS (Способ 1B): Rt=1.19 мин; MS (ESIpos): m/z=561 [M+H]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.416 (16.00), 1.441 (0.91), 1.455 (0.59), 1.530 (0.10), 1.540 (0.14), 1.554 (0.29), 1.561 (0.30), 1.578 (0.31), 1.586 (0.28), 1.603 (0.12), 1.611 (0.10), 1.978 (0.38), 2.002 (0.33), 2.872 (0.12), 3.411 (0.16), 4.088 (0.23), 4.105 (0.21), 4.373 (2.27), 6.137 (0.08), 7.361 (0.78), 7.377 (0.94), 7.389 (0.23), 7.516 (1.36), 7.534 (1.08), 8.365 (0.28).
Пример 346A
Трет-бутил 4-{3-[5-(3-хлорбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
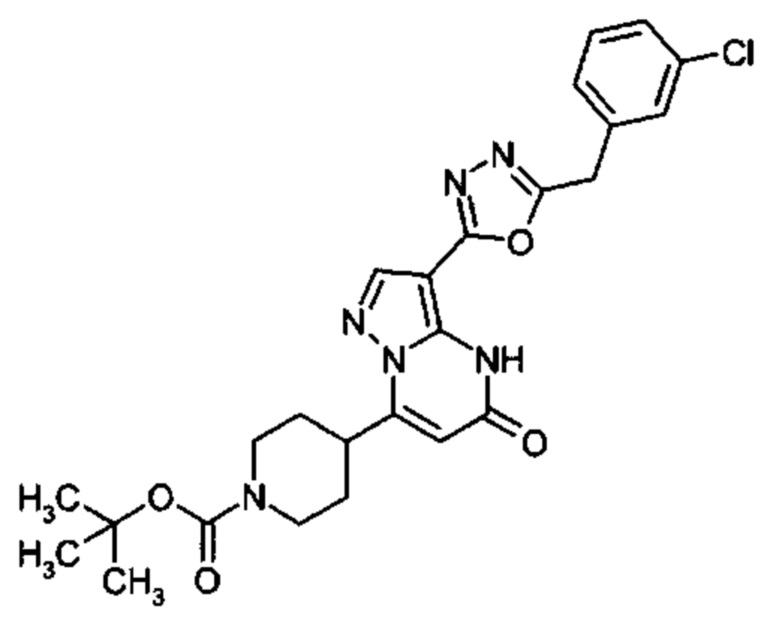
трет-бутил 4-[3-({2-[(3-хлорфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (64.2 мг, 121 мкмоль) растворили в ТГФ (2.0 мл) и перемешали с реагентом Бургесса (40.5 мг, 170 мкмоль) в течение 16 ч при комнатной температуре. 1 мл воды добавили, полученный остаток отфильтровали, промыли водой и высушивали в вакууме с получением продукта. Полученное количество составило 35.1 мг (95% чистота, 54% теоретический выход).
LC-MS (Способ 1B): Rt=1.14 мин; MS (ESIpos): m/z=511 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.413 (16.00), 1.525 (0.18), 1.546 (0.42), 1.551 (0.41), 1.555 (0.44), 1.576 (0.46), 1.586 (0.43), 1.607 (0.19), 1.974 (0.63), 2.003 (0.53), 2.862 (0.25), 3.406 (0.21), 4.079 (0.41), 4.106 (0.39), 4.347 (2.92), 6.125 (0.09), 7.342 (0.32), 7.360 (0.87), 7.375 (0.88), 7.385 (1.04), 7.402 (0.54), 7.422 (0.20), 7.492 (0.77), 8.362 (0.22), 12.022 (0.11).
Пример 347A
Трет-бутил 4-(5-оксо-3-{5-[2-(1H-1,2,4-триазол-1-ил)пропан-2-ил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
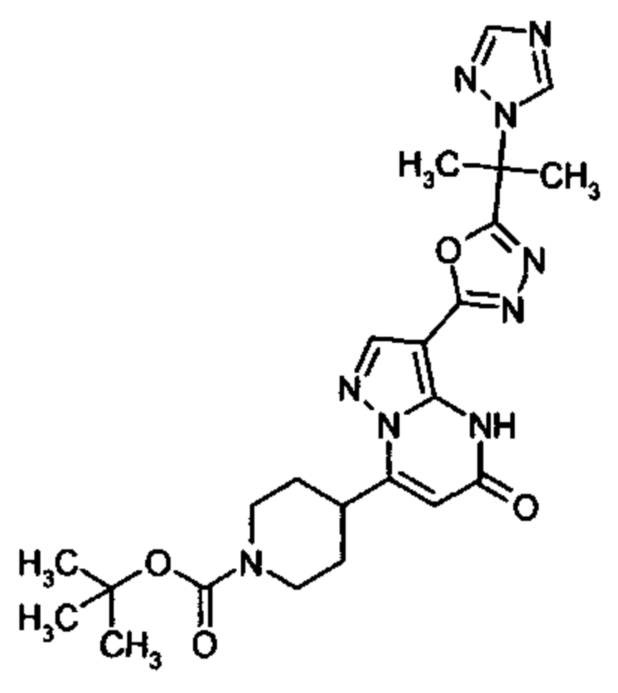
трет-бутил 4-[3-({2-[2-метил-2-(1H-1,2,4-триазол-1-ил)пропаноил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (96.2 мг, 187 мкмоль) растворили в ТГФ (2.0 мл, 25 ммоль) и перемешали с реагентом Бургесса (62.5 мг, 262 мкмоль) в течение 16 ч при комнатной температуре. Воду и этилацетат добавили, и органическую фазу отделили и высушивали посредством фильтрации через фильтр Extrelut NT3. Растворитель удалили, и смесь очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта после удаления растворителей в вакууме. Полученное количество составило 56 мг (100% чистота, 60% теоретический выход).
LC-MS (Способ 1B): Rt=0.83 мин; MS (ESIpos): m/z=496 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.415 (16.00), 1.508 (0.10), 1.519 (0.13), 1.540 (0.33), 1.549 (0.35), 1.571 (0.42), 1.580 (0.35), 1.602 (0.15), 1.611 (0.12), 1.968 (0.48), 1.998 (0.41), 2.113 (7.56), 2.871 (0.18), 3.378 (0.11), 3.409 (0.18), 3.433 (0.10), 4.078 (0.30), 4.106 (0.29), 6.139 (0.11), 8.018 (1.74), 8.353 (0.39), 8.874 (2.06), 12.160 (0.03).
Пример 348A
Трет-бутил 4-{3-[5-(2-хлорбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

трет-бутил 4-[3-({2-[(2-хлорфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (92.6 мг, 175 мкмоль) растворили в ТГФ (2.0 мл, 25 ммоль) и перемешали с реагентом Бургесса (58.4 мг, 245 мкмоль) в течение 16 ч при комнатной температуре. Воду и этилацетат добавили, и органическую фазу отделили и высушивали посредством фильтрации через фильтр Extrelut NT3. Растворитель удалили, и смесь очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта после удаления растворителей в вакууме. Полученное количество составило 55 мг (100% чистота, 61% теоретический выход).
LC-MS (Способ 1B): Rt=1.09 мин; MS (ESIpos): m/z=511 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.418 (16.00), 1.528 (0.14), 1.551 (0.32), 1.560 (0.35), 1.581 (0.37), 1.591 (0.35), 1.612 (0.16), 1.979 (0.48), 2.010 (0.43), 2.875 (0.20), 3.415 (0.15), 4.083 (0.33), 4.113 (0.31), 4.424 (2.93), 6.113 (0.07), 7.349 (0.15), 7.359 (1.10), 7.368 (0.96), 7.373 (0.99), 7.382 (1.43), 7.392 (0.25), 7.477 (0.10), 7.487 (0.56), 7.494 (0.46), 7.497 (0.48), 7.503 (0.87), 7.512 (0.72), 7.517 (0.50), 7.527 (0.46), 7.536 (0.09), 8.361 (0.22), 12.015 (0.08).
Пример 349A
Трет-бутил 4-(3-{5-[(5-метил-1,3-тиазол-2-ил)метил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
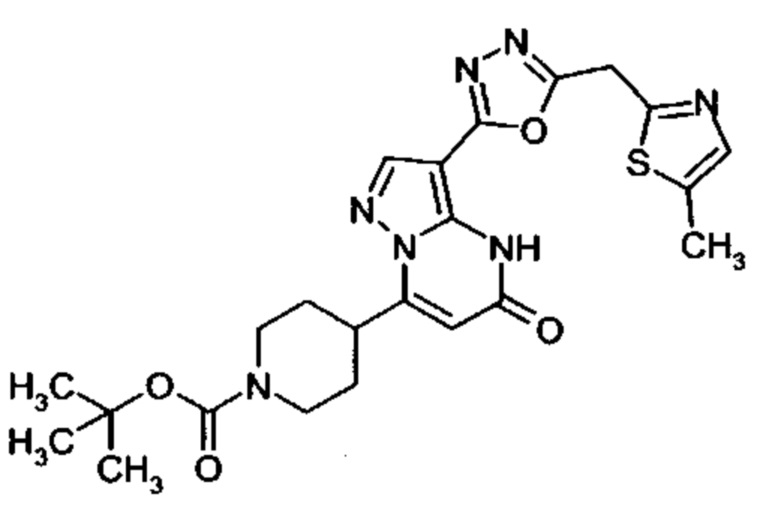
трет-бутил 4-[3-({2-[(2-хлорфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (161 мг, 313 мкмоль) растворили в ТГФ (3.0 мл, 37 ммоль) и перемешали с реагентом Бургесса (104 мг, 438 мкмоль) в течение 16 ч при комнатной температуре. Воду и этилацетат добавили, и органическую фазу отделили и высушивали посредством фильтрации через фильтр Extrelut NT3. Растворитель удалили, и смесь очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта после удаления растворителей в вакууме. Полученное количество составило 46 мг (100% чистота, 30% теоретический выход).
LC-MS (Способ 1B): Rt=0.92 мин; MS (ESIpos): m/z=498 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.417 (16.00), 1.521 (0.11), 1.531 (0.13), 1.552 (0.32), 1.562 (0.35), 1.583 (0.37), 1.593 (0.34), 1.614 (0.15), 1.622 (0.13), 1.981 (0.48), 2.011 (0.42), 2.330 (4.02), 2.332 (4.14), 2.870 (0.19), 3.417 (0.14), 4.084 (0.32), 4.115 (0.31), 4.732 (3.17), 6.129 (0.06), 7.254 (0.65), 7.256 (0.67), 8.388 (0.14), 11.994 (0.07).
Пример 350A
Трет-бутил 4-{3-[5-(2-хлор-6-фторбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
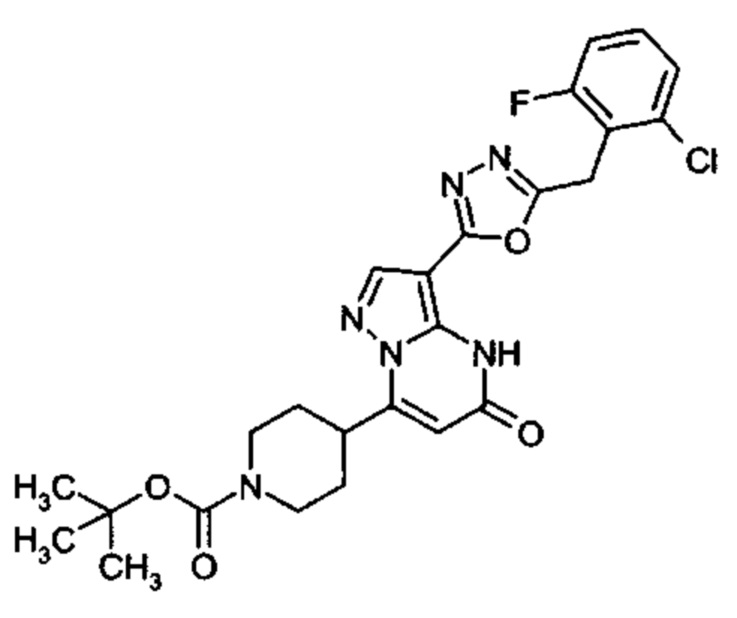
трет-бутил 4-[3-({2-[(2-хлор-6-фторфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (53.2 мг, 97.3 мкмоль) растворили в ТГФ (2.0 мл) и перемешали с реагентом Бургесса (32.4 мг, 136 мкмоль) в течение 16 ч при комнатной температуре. 1 мл воды добавили, полученный остаток отфильтровали, промыли водой и высушивали в вакууме с получением продукта. Полученное количество составило 32 мг (100% чистота, 61% теоретический выход).
LC-MS (Способ 1B): Rt=1.14 мин; MS (ESIpos): m/z=529 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.419 (16.00), 1.565 (0.33), 1.589 (0.34), 1.983 (0.46), 2.009 (0.39), 2.880 (0.17), 3.400 (0.13), 4.083 (0.37), 4.112 (0.30), 4.432 (1.79), 6.043 (0.09), 7.303 (0.18), 7.310 (0.23), 7.324 (0.37), 7.328 (0.59), 7.348 (0.34), 7.352 (0.38), 7.410 (0.34), 7.414 (0.35), 7.430 (1.08), 7.435 (0.85), 7.451 (0.46), 7.456 (0.37), 7.471 (0.42), 7.492 (0.20), 8.338 (0.12), 12.021 (0.16).
Пример 351A
Трет-бутил 4-{3-[5-(2-метоксибензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
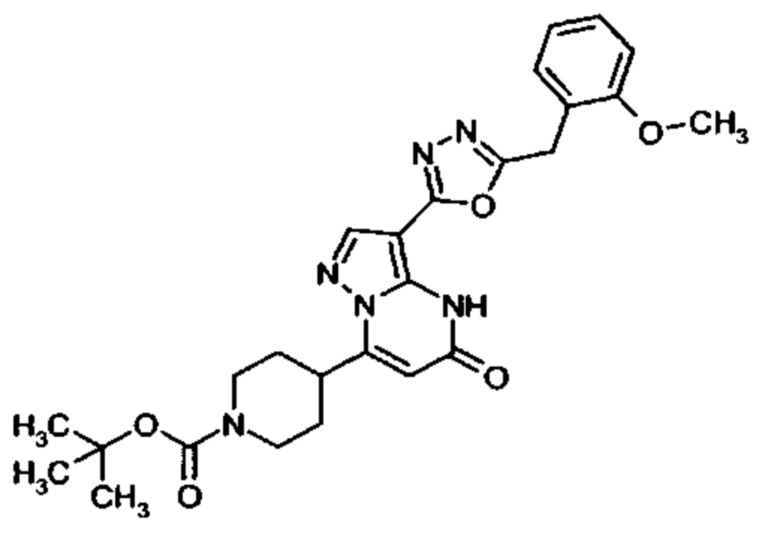
трет-бутил 4-[3-({2-[(2-хлор-6-фторфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (94.8 мг, 181 мкмоль) растворили в ТГФ (2.0 мл, 25 ммоль) и перемешали с реагентом Бургесса (60.3 мг, 253 мкмоль) в течение 16 ч при комнатной температуре. 1 мл воды добавили, полученный остаток отфильтровали, промыли водой и высушивали в вакууме с получением продукта. Полученное количество составило 77 мг (97% чистота, 81% теоретический выход).
LC-MS (Способ 1B): Rt=1.10 мин; MS (ESIpos): m/z=507 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.417 (16.00), 1.517 (0.11), 1.528 (0.14), 1.549 (0.33), 1.559 (0.34), 1.580 (0.37), 1.590 (0.34), 1.610 (0.15), 1.621 (0.12), 1.977 (0.48), 2.007 (0.41), 2.866 (0.18), 3.383 (0.12), 3.411 (0.17), 3.441 (0.10), 3.786 (6.42), 4.082 (0.31), 4.110 (0.29), 4.224 (2.62), 6.125 (0.08), 6.920 (0.32), 6.938 (0.69), 6.957 (0.41), 7.027 (0.62), 7.048 (0.74), 7.249 (0.54), 7.267 (0.48), 7.279 (0.37), 7.283 (0.30), 7.299 (0.50), 7.318 (0.27), 7.322 (0.22), 8.347 (0.27), 11.934 (0.09).
Пример 352A
Трет-бутил 4-(3-{5-[1-(морфолин-4-ил)пропан-2-ил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
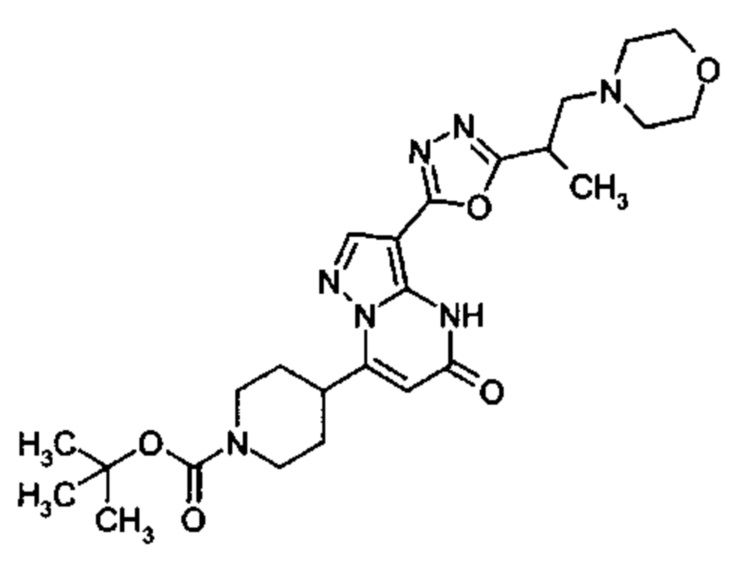
трет-бутил 4-[3-({2-[2-метил-3-(морфолин-4-ил)пропаноил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (114 мг, 215 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (71.6 мг, 300 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 27 мг (66% чистота, 16% теоретический выход).
LC-MS (Способ 1B): Rt=0.71 мин; MS (ESIpos): m/z=514 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.420 (16.00), 1.542 (0.20), 1.564 (0.36), 1.573 (0.43), 1.595 (0.35), 1.603 (0.33), 1.625 (0.14), 1.983 (0.51), 2.012 (0.42), 2.877 (0.24), 3.189 (0.27), 3.215 (0.27), 3.467 (1.03), 3.512 (0.45), 3.658 (0.33), 3.741 (0.21), 3.756 (0.27), 3.771 (0.31), 3.787 (0.30), 3.802 (0.24), 3.989 (0.19), 4.092 (0.38), 4.117 (0.33), 6.153 (0.09), 8.419 (0.25), 8.462 (0.15), 9.478 (0.07).
Пример 353A
Трет-бутил 4-(3-{5-[2-(морфолин-4-ил)этил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
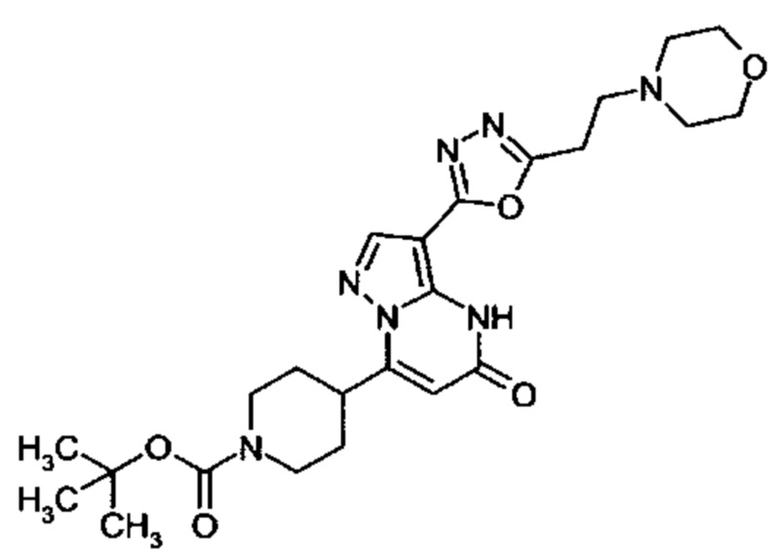
трет-бутил 4-[3-({2-[3-(морфолин-4-ил)пропаноил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (161 мг, 311 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (104 мг, 436 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 14.7 мг (91% чистота, 8.6% теоретический выход).
LC-MS (Способ 1B): Rt=0.67 мин; MS (ESIpos): m/z=500 [M+H]+
Пример 354A
Трет-бутил 4-{5-оксо-3-[5-(2-фенилэтил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
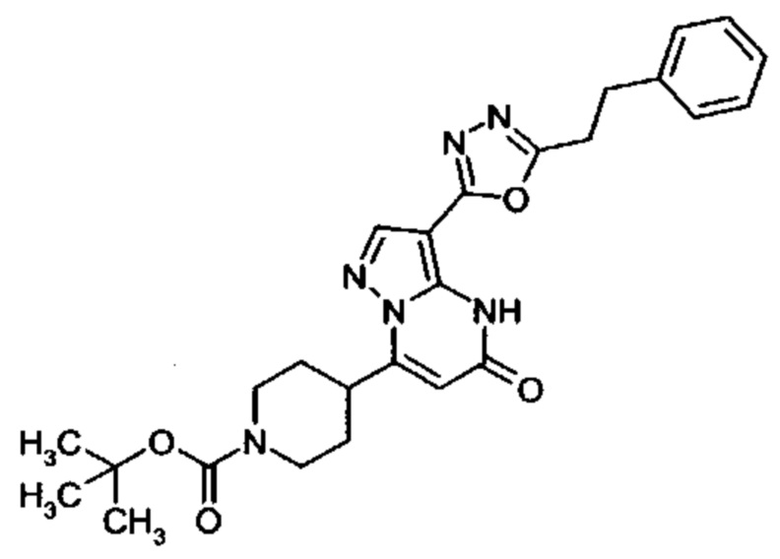
трет-бутил 4-(5-оксо-3-{[2-(3-фенилпропаноил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (70.7 мг, 139 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (46.4 мг, 195 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 42.8 мг (98% чистота, 62% теоретический выход).
LC-MS (Способ 1B): Rt=1.13 мин; MS (ESIpos): m/z=491 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.421 (16.00), 1.525 (0.13), 1.534 (0.16), 1.556 (0.40), 1.565 (0.42), 1.587 (0.45), 1.596 (0.42), 1.617 (0.18), 1.628 (0.15), 1.985 (0.57), 2.017 (0.50), 2.876 (0.21), 3.101 (0.39), 3.119 (1.01), 3.138 (0.95), 3.200 (0.98), 3.219 (1.04), 3.236 (0.39), 3.387 (0.16), 3.417 (0.26), 3.445 (0.13), 4.088 (0.36), 4.119 (0.34), 6.139 (0.22), 7.183 (0.08), 7.192 (0.18), 7.205 (0.35), 7.218 (0.32), 7.226 (0.23), 7.237 (0.07), 7.286 (4.41), 7.295 (1.59), 7.299 (1.61), 8.360 (0.64), 12.014 (0.09).
Пример 355A
Трет-бутил 4-{3-[5-(4-хлорбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

трет-бутил 4-[3-({2-[(4-хлорфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (78.6 мг, 149 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (49.6 мг, 208 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 47.8 мг (100% чистота, 63% теоретический выход).
LC-MS (Способ 1B): Rt=1.15 мин; MS (ESIpos): m/z=511 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.416 (16.00), 1.518 (0.16), 1.527 (0.19), 1.549 (0.46), 1.557 (0.49), 1.579 (0.53), 1.588 (0.47), 1.610 (0.21), 1.620 (0.17), 1.975 (0.68), 2.005 (0.59), 2.871 (0.27), 3.381 (0.18), 3.409 (0.27), 3.438 (0.15), 4.081 (0.44), 4.110 (0.42), 4.329 (3.20), 6.139 (0.15), 7.400 (0.30), 7.424 (5.31), 7.447 (0.31), 8.360 (0.49), 12.011 (0.12).
Пример 356A
Трет-бутил 4-{5-оксо-3-[5-(пиридин-2-илметил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
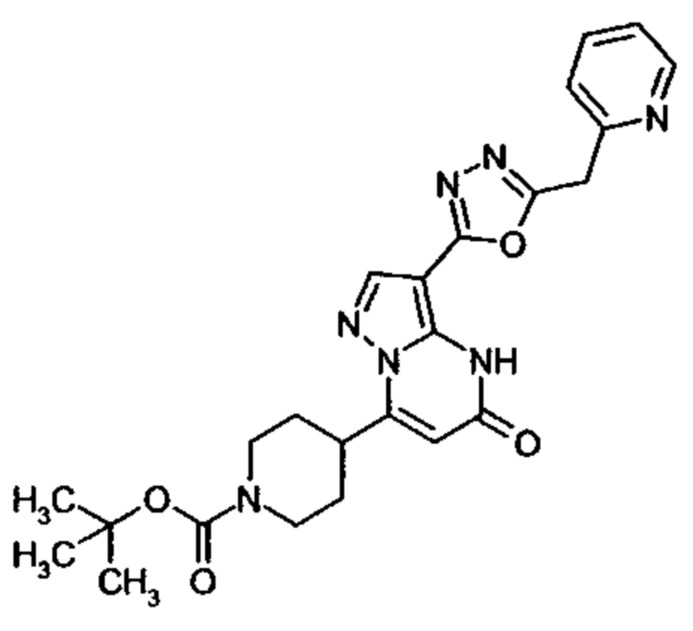
трет-бутил 4-[3-({2-[(4-хлорфенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (73.2 мг, 148 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (49.3 мг, 207 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 44.2 мг (100% чистота, 63% теоретический выход).
LC-MS (Способ 1B): Rt=0.89 мин; MS (ESIpos): m/z=478 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.416 (16.00), 1.519 (0.17), 1.527 (0.20), 1.549 (0.45), 1.558 (0.48), 1.579 (0.50), 1.589 (0.46), 1.610 (0.20), 1.620 (0.16), 1.978 (0.64), 2.008 (0.54), 2.869 (0.25), 3.385 (0.22), 3.415 (0.31), 3.444 (0.16), 4.083 (0.41), 4.108 (0.38), 4.494 (3.13), 6.146 (0.29), 7.303 (0.36), 7.315 (0.41), 7.321 (0.40), 7.334 (0.37), 7.459 (0.66), 7.478 (0.74), 7.792 (0.34), 7.797 (0.36), 7.811 (0.58), 7.816 (0.59), 7.831 (0.28), 7.835 (0.28), 8.365 (0.70), 8.495 (0.48), 8.505 (0.46), 12.087 (0.06).
Пример 357A
Трет-бутил 4-[3-(5-метокси-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
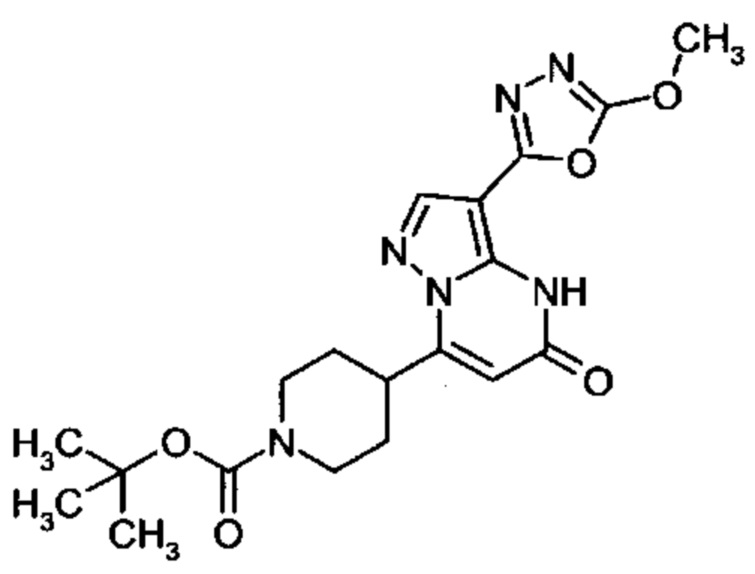
трет-бутил 4-(3-{[2-(метоксикарбонил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (106 мг, 244 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (81.4 мг, 342 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 39.8 мг (96% чистота, 38% теоретический выход).
LC-MS (Способ 1B): Rt=0.87 мин; MS (ESIpos): m/z=417 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.414 (16.00), 1.518 (0.15), 1.528 (0.18), 1.549 (0.42), 1.558 (0.43), 1.579 (0.45), 1.589 (0.41), 1.610 (0.18), 1.620 (0.14), 1.975 (0.59), 2.005 (0.50), 2.872 (0.20), 3.386 (0.31), 3.417 (0.32), 3.446 (0.18), 4.084 (0.35), 4.110 (0.34), 4.160 (5.46), 6.167 (0.18), 8.324 (0.52), 11.998 (0.07).
Пример 358A
Трет-бутил 4-{5-оксо-3-[5-(тиофен-2-ил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
трет-бутил 4-(5-оксо-3-{[2-(тиофен-2-илкарбонил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (63.0 мг, 129 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (43.2 мг, 181 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 50.2 мг (100% чистота, 82% теоретический выход).
LC-MS (Способ 1B): Rt=1.06 мин; MS (ESIpos): m/z=469 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.421 (16.00), 1.534 (0.18), 1.543 (0.21), 1.565 (0.52), 1.574 (0.56), 1.596 (0.55), 1.604 (0.50), 1.627 (0.21), 1.635 (0.17), 1.741 (0.07), 1.751 (0.09), 1.758 (0.14), 1.766 (0.07), 1.775 (0.04), 1.995 (0.73), 2.025 (0.62), 2.877 (0.28), 3.403 (0.20), 3.433 (0.34), 3.463 (0.17), 4.092 (0.47), 4.121 (0.43), 6.163 (0.48), 7.315 (0.52), 7.326 (0.82), 7.336 (0.49), 7.933 (0.82), 7.945 (0.76), 8.055 (0.61), 8.062 (0.60), 8.457 (0.91), 12.315 (0.11).
Пример 359A
Трет-бутил 4-{5-оксо-3-[5-(2,2,2-трифторэтил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
трет-бутил 4-(5-оксо-3-{[2-(3,3,3-трифторпропаноил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (95.0 мг, 195 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (65.2 мг, 273 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 61 мг (62% чистота, 41.6% теоретический выход).
LC-MS (Способ 1B): Rt=0.99 мин; MS (ESIpos): m/z=469 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.157 (0.90), 1.175 (1.88), 1.193 (0.91), 1.419 (16.00), 1.537 (0.20), 1.559 (0.36), 1.568 (0.42), 1.590 (0.37), 1.600 (0.35), 1.621 (0.14), 1.986 (0.54), 2.016 (0.39), 2.877 (0.22), 3.073 (0.18), 3.092 (0.48), 3.110 (0.47), 3.128 (0.15), 3.412 (0.33), 3.440 (0.30), 3.464 (1.29), 4.089 (0.35), 4.113 (0.33), 4.288 (0.36), 4.314 (1.04), 4.341 (1.00), 4.367 (0.32), 6.158 (0.06), 8.407 (0.20), 12.009 (0.04).
Пример 360A
Трет-бутил 4-{3-[5-(2-хлорфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
трет-бутил 4-(3-{[2-(2-хлорбензоил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (119 мг, 231 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (77.1 мг, 324 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 78.1 мг (95% чистота, 64% теоретический выход).
LC-MS (Способ 1B): Rt=1.11 мин; MS (ESIpos): m/z=497 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.423 (16.00), 1.540 (0.11), 1.551 (0.13), 1.572 (0.33), 1.581 (0.37), 1.603 (0.36), 1.613 (0.34), 1.634 (0.15), 1.644 (0.12), 2.000 (0.43), 2.032 (0.38), 2.890 (0.16), 3.417 (0.11), 3.446 (0.20), 3.476 (0.10), 4.096 (0.27), 4.124 (0.25), 6.189 (0.20), 7.588 (0.23), 7.591 (0.24), 7.606 (0.61), 7.610 (0.59), 7.625 (0.48), 7.629 (0.47), 7.639 (0.37), 7.644 (0.39), 7.659 (0.54), 7.663 (0.57), 7.677 (0.31), 7.682 (0.28), 7.728 (0.69), 7.731 (0.63), 7.748 (0.46), 7.752 (0.39), 8.147 (0.37), 8.151 (0.37), 8.166 (0.35), 8.170 (0.33), 8.486 (0.54), 12.197 (0.06).
Пример 361A
Трет-бутил 4-{5-оксо-3-[5-(пиперидин-1-илметил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
трет-бутил 4-(5-оксо-3-{[2-(пиперидин-1-илацетил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (109 мг, 217 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (72.5 мг, 304 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 33.5 мг (100% чистота, 32% теоретический выход).
LC-MS (Способ 1B): Rt=0.66 мин; MS (ESIpos): m/z=484 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.420 (16.00), 1.551 (0.16), 1.573 (0.35), 1.580 (0.36), 1.603 (0.39), 1.612 (0.38), 1.643 (0.29), 1.680 (0.30), 1.849 (0.18), 1.988 (0.42), 2.019 (0.36), 2.880 (0.19), 3.092 (0.17), 3.599 (0.17), 4.096 (0.28), 4.125 (0.28), 4.739 (0.19), 6.194 (0.06), 8.444 (0.25), 10.144 (0.07), 11.931 (0.02).
Пример 362A
Трет-бутил 4-(5-оксо-3-{5-[(2-оксопирролидин-1-ил)метил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

трет-бутил 4-[5-оксо-3-({2-[(2-оксопирролидин-1-ил)ацетил]гидразинил}карбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (104 мг, 207 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (69.2 мг, 290 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 49.7 мг (100% чистота, 50% теоретический выход).
LC-MS (Способ 1B): Rt=0.79 мин; MS (ESIpos): m/z=484 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.419 (16.00), 1.529 (0.10), 1.536 (0.11), 1.556 (0.26), 1.565 (0.29), 1.587 (0.30), 1.596 (0.29), 1.617 (0.13), 1.627 (0.10), 1.953 (0.18), 1.973 (0.71), 1.992 (0.99), 2.011 (0.88), 2.029 (0.30), 2.281 (0.76), 2.303 (1.15), 2.322 (0.65), 2.880 (0.15), 3.414 (0.11), 3.458 (0.82), 3.476 (1.22), 3.493 (0.75), 4.086 (0.27), 4.115 (0.25), 4.710 (2.92), 6.113 (0.04), 8.376 (0.12), 12.042 (0.05).
Пример 363A
Трет-бутил 4-[3-(5-циклогексил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

трет-бутил 4-(3-{[2-(циклогексилкарбонил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (125 мг, 257 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (85.7 мг, 360 мкмоль) в течение 16 ч при комнатной температуре. Добавление воды и ацетонитрила дало осадок, который отфильтровали, промыли водой и высушивали в вакууме с получением целевого продукта. Полученное количество составило 98.8 мг (70% чистота, 58% теоретический выход).
LC-MS (Способ 1B): Rt=1.16 мин; MS (ESIpos): m/z=469 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.147 (0.15), 1.157 (0.19), 1.176 (0.34), 1.181 (0.33), 1.193 (0.20), 1.209 (0.27), 1.235 (0.35), 1.270 (0.41), 1.300 (0.38), 1.330 (0.26), 1.355 (0.50), 1.418 (16.00), 1.551 (0.70), 1.561 (0.65), 1.580 (0.95), 1.611 (0.71), 1.642 (0.40), 1.688 (0.27), 1.721 (0.64), 1.758 (1.00), 1.789 (0.43), 1.982 (0.72), 2.010 (0.48), 2.053 (0.48), 2.059 (0.47), 2.085 (0.43), 2.866 (0.32), 2.945 (0.19), 2.954 (0.25), 2.963 (0.19), 2.973 (0.25), 2.982 (0.37), 2.991 (0.22), 2.999 (0.14), 3.009 (0.18), 3.017 (0.10), 3.379 (0.19), 3.412 (0.22), 3.439 (0.12), 4.086 (0.52), 4.106 (0.48), 6.012 (0.11), 6.117 (0.12), 8.338 (0.30), 8.357 (0.36), 9.771 (0.11), 12.015 (0.07).
Пример 364A
Трет-бутил 4-[3-(5-циклобутил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
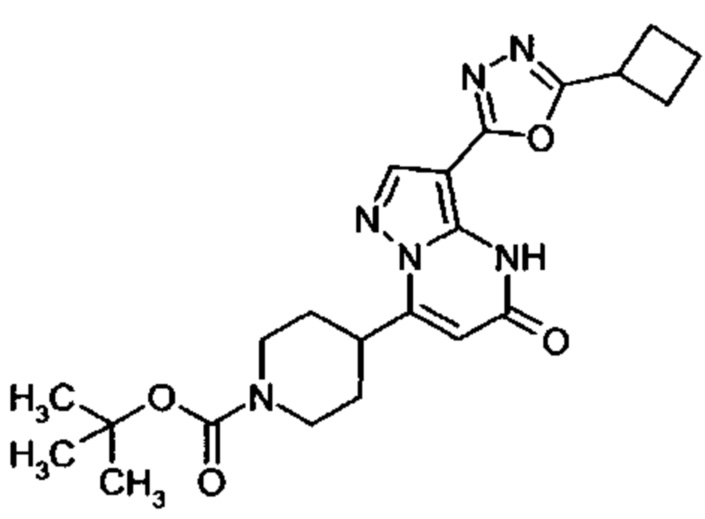
трет-бутил 4-(3-{[2-(циклобутилкарбонил)гидразинил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (121 мг, 263 мкмоль) растворили в ТГФ (2.5 мл, 31 ммоль) и перемешали с реагентом Бургесса (87.8 мг, 369 мкмоль) в течение 16 ч при комнатной температуре. Очистка посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 14.7 мг (88% чистота, 11% теоретический выход).
LC-MS (Способ 6B): Rt=3.14 мин; MS (ESIpos): m/z=441 [M+H]+
Пример 365A
Трет-бутил 4-[3-(5-бутил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
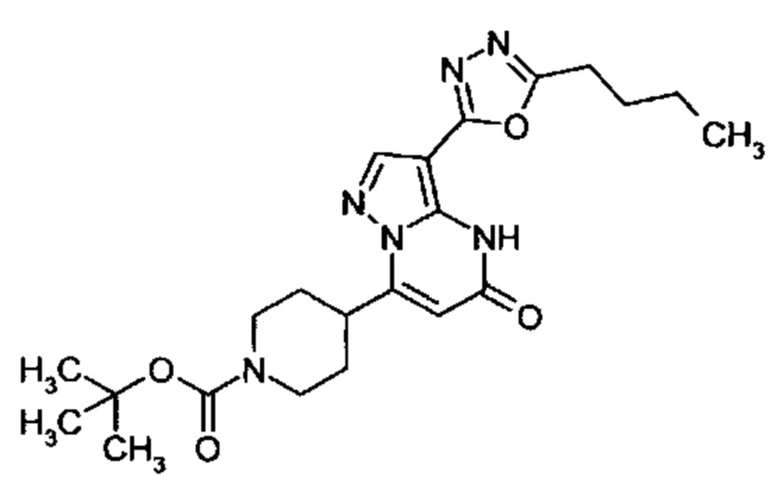
трет-бутил 4-{5-оксо-3-[(2-пентаноилгидразинил)карбонил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (37.0 мг, 80.3 мкмоль) растворили в ТГФ (2.5 мл) и перемешали с реагентом Бургесса (26.8 мг, 112 мкмоль) в течение 16 ч при комнатной температуре. Этилацетат добавили, и органическую фазу промыли водой и высушивали с помощью фильтра Extrelut NT3. Растворители удалили в вакууме с получением целевого продукта. Полученное количество составило 58.0 мг (78% чистота, 127% теоретический выход).
LC-MS (Способ 1B): Rt=1.08 мин; MS (ESIpos): m/z=443 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.906 (1.18), 0.925 (2.50), 0.943 (1.25), 1.157 (7.88), 1.175 (16.00), 1.193 (7.84), 1.418 (13.08), 1.746 (0.76), 2.870 (0.80), 2.888 (1.25), 2.907 (0.76), 3.069 (0.94), 3.086 (2.81), 3.097 (2.74), 3.104 (3.05), 3.115 (2.53), 3.133 (0.90), 3.465 (8.99), 4.119 (0.35), 8.834 (0.14).
Пример 366A
Трет-бутил 4-{3-[3-(2-метоксиэтил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
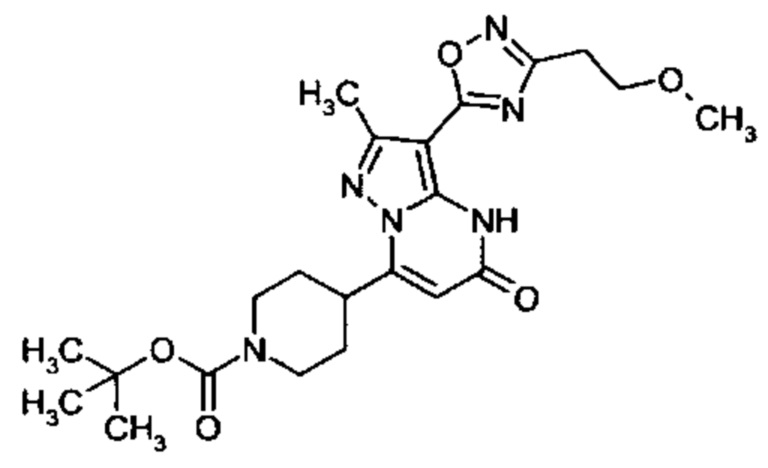
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (140 мкл, 800 мкмоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-N'-гидрокси-3-метоксипропанимидамид (94.2 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 71.8 мг (100% чистота, 39% теоретический выход).
LC-MS (Способ 1B): Rt=1.05 мин; MS (ESIpos): m/z=459 [M+H]+
Пример 367A
Трет-бутил 4-[3-(5-метил-4-фенил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
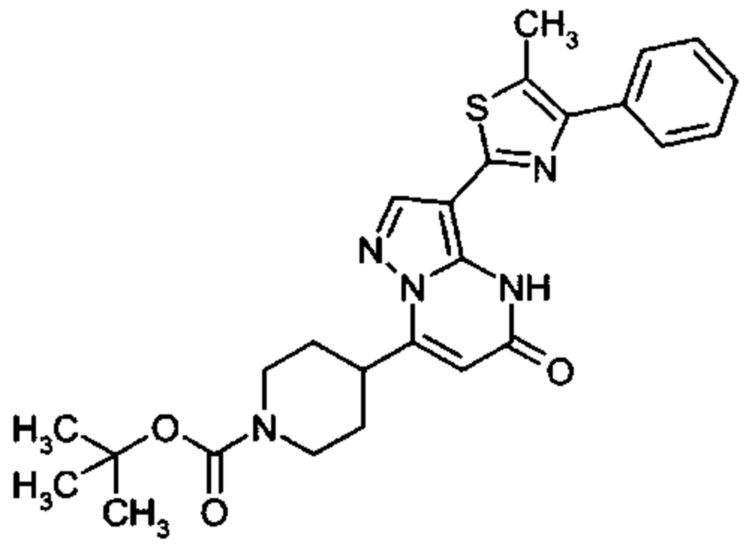
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (60.0 мг, 159 мкмоль), 2-бром-1-фенилпропан-1-он (24 мкл, 160 мкмоль) и N,N-Диизопропилэтиламин (140 мкл, 790 мкмоль) растворили в этаноле (2.4 мл, 41 ммоль) и перемешивали при 70°C в течение 1 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 14.0 мг (100% чистота, 18% теоретический выход).
LC-MS (Способ 1B): Rt=1.36 мин; MS (ESIpos): m/z=492 [M+H]+
Пример 368A
Трет-бутил 4-(3-{5-[1-(4-хлорфенил)циклопропил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
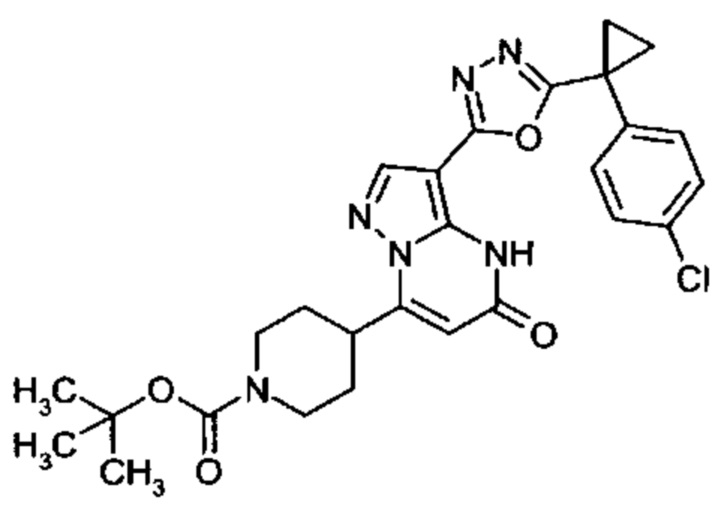
трет-бутил 4-{3-[(2-{[1-(4-хлорфенил)циклопропил]карбонил}гидразинил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (77.9 мг, 140 мкмоль) и реагент Бургесса (46.8 мг, 196 мкмоль) растворили в ТГФ (2.0 мл) и перемешивали при комнатной температуре в течение 16 ч. 1 мл воды добавили, и полученный осадок отфильтровали, промыли водой и высушивали в вакууме с получением продукта. Полученное количество составило 56.1 мг (100% чистота, 74% теоретический выход).
LC-MS (Способ 1B): Rt=1.23 мин; MS (ESIpos): m/z=537 [M+H]+
Пример 369A
Трет-бутил 4-[3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
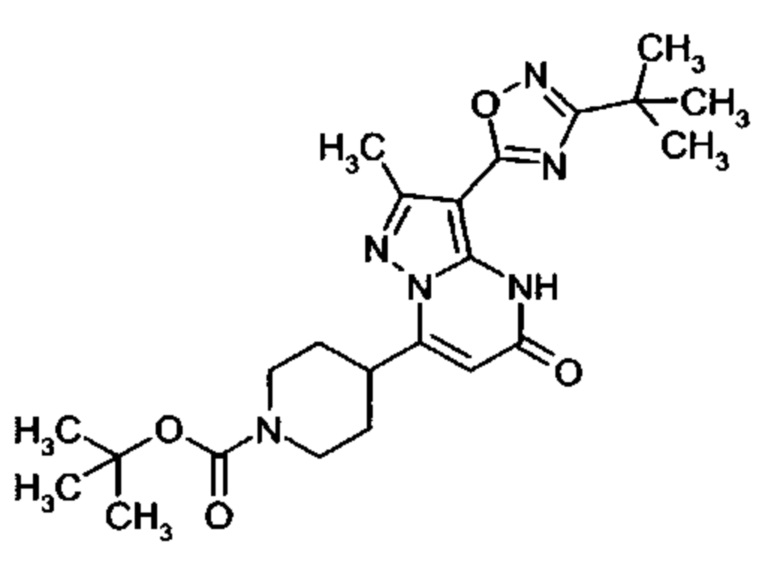
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (140 мкл, 800 мкмоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-N'-гидрокси-2,2-диметилпропанимидамид (92.6 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 111 мг (100% чистота, 61% теоретический выход).
LC-MS (Способ 1B): Rt=1.28 мин; MS (ESIpos): m/z=457 [M+H]+
Пример 370A
Трет-бутил 4-{3-[(2-{[1-(4-хлорфенил)циклопропил]карбонил}гидразинил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
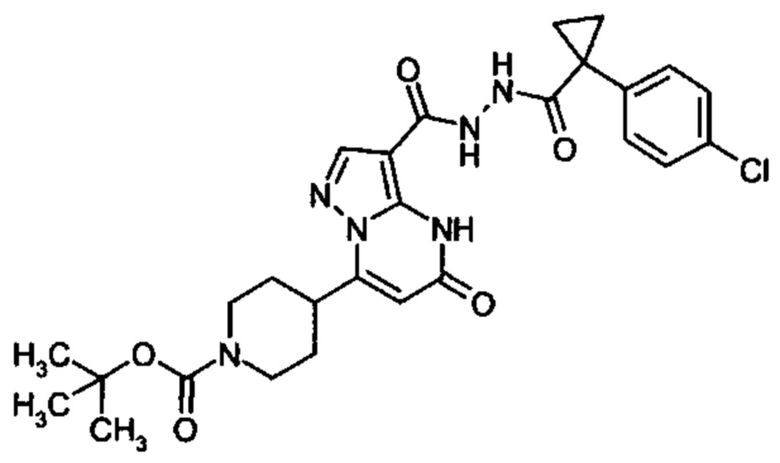
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 414 мкмоль) и 1-(4-хлорфенил)циклопропанкарбогидразид (131 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 77.9 мг (100% чистота, 34% теоретический выход).
LC-MS (Способ 1B): Rt=1.01 мин; MS (ESIpos): m/z=555 [M+H]+
Пример 371A
Трет-бутил 4-{3-[3-(4-фторбензил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
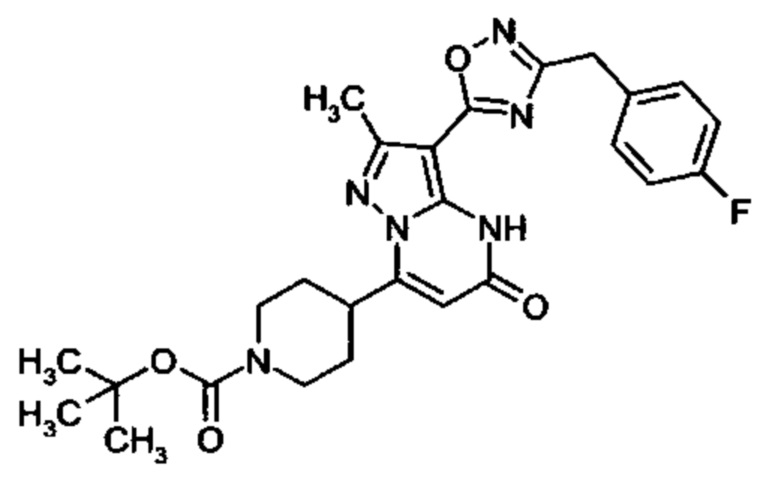
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-2-(4-фторфенил)-N'-гидроксиэтанимидамид (134 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 93.6 мг (100% чистота, 46% теоретический выход).
LC-MS (Способ 1B): Rt=1.20 мин; MS (ESIpos): m/z=509 [M+H]+
Пример 372A
Трет-бутил 4-[3-(3-этил-1,2,4-оксадиазол-5-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
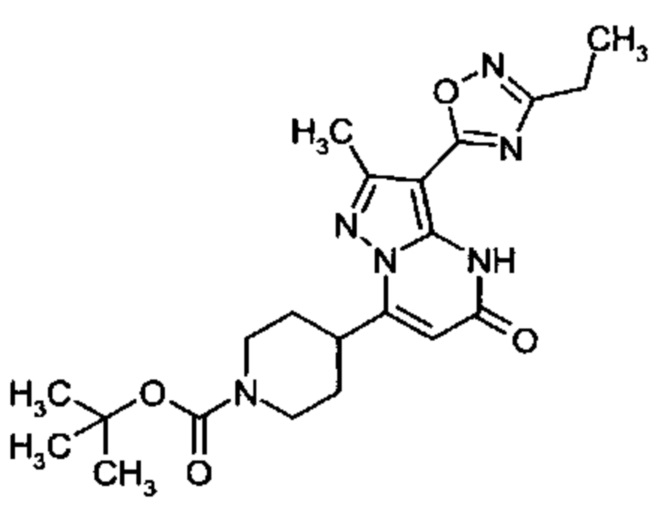
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-N'-гидроксипропанимидамид гидрохлорид (1:1) (99.3 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 101 мг (100% чистота, 59% теоретический выход).
LC-MS (Способ 11B): Rt=2.07 мин; MS (ESIneg): m/z=427 [M-H]-
Пример 373A
Трет-бутил 4-{2-метил-5-оксо-3-[3-(пропан-2-ил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
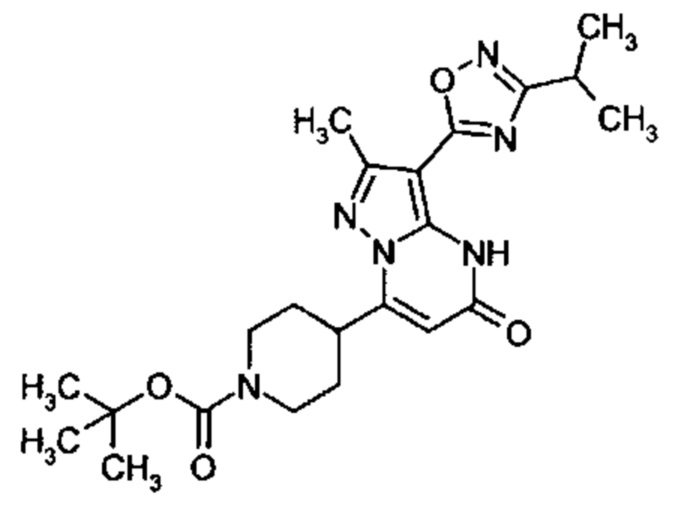
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (140 мкл, 800 мкмоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-N'-гидрокси-2-метилпропанимидамид (81.4 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 80.1 мг (100% чистота, 45% теоретический выход).
LC-MS (Способ 11B): Rt=2.22 мин; MS (ESIneg): m/z=441 [M-H]-
Пример 374A
Трет-бутил 4-{3-[3-(2-трет-бутоксиэтил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
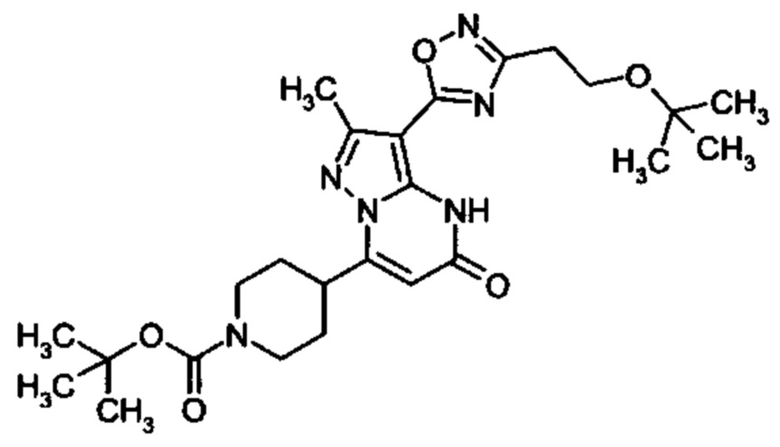
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (140 мкл, 800 мкмоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-3-трет-бутокси-N'-гидроксипропанимидамид (128 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 55.6 мг (100% чистота, 28% теоретический выход).
LC-MS (Способ 11B): Rt=2.27 мин; MS (ESIpos): m/z=501 [M+H]+
Пример 375A
Трет-бутил 4-[3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]-2-(2,2-диметилпропил)пиперидин-1-карбоксилат
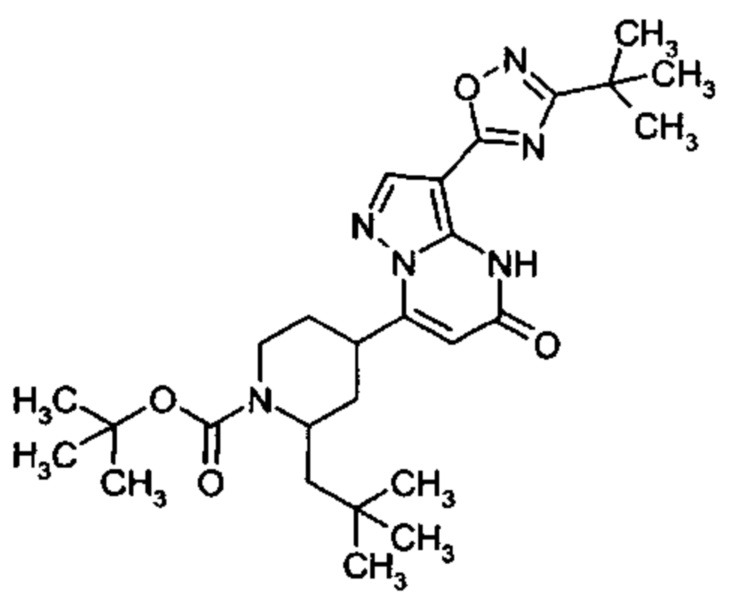
7-[1-(трет-бутоксикарбонил)-2-(2,2-диметилпропил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (75.0 мг, 173 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (60 мкл, 350 мкмоль) и 1,1'-Карбоилдиимидазолом (56.2 мг, 347 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-N'-гидрокси-3-метоксипропанимидамид (40.3 мг, 347 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 36.1 мг (100% чистота, 41% теоретический выход).
LC-MS (Способ 11B): Rt=2.77 мин; MS (ESIneg): m/z=511 [M-H]-
Пример 376A
Трет-бутил 4-{3-[4-(3-метилбутил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
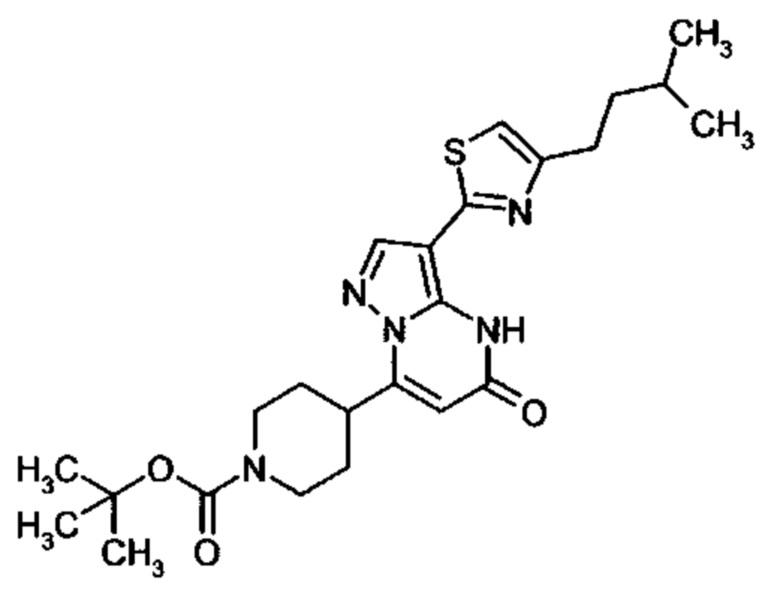
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 1-бром-5-метилгексан-2-он (61.4 мг, 318 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (4.8 мл, 82 ммоль) и перемешивали при 70°C в течение 1 ч и оставили отстаиваться на 3 дня при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 36.7 мг (100% чистота, 24% теоретический выход).
LC-MS (Способ 11B): Rt=2.64 мин; MS (ESIpos): m/z=472 [M+H]+
Пример 377A
Трет-бутил 4-(3-{5-[1-(4-метоксифенил)циклопропил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
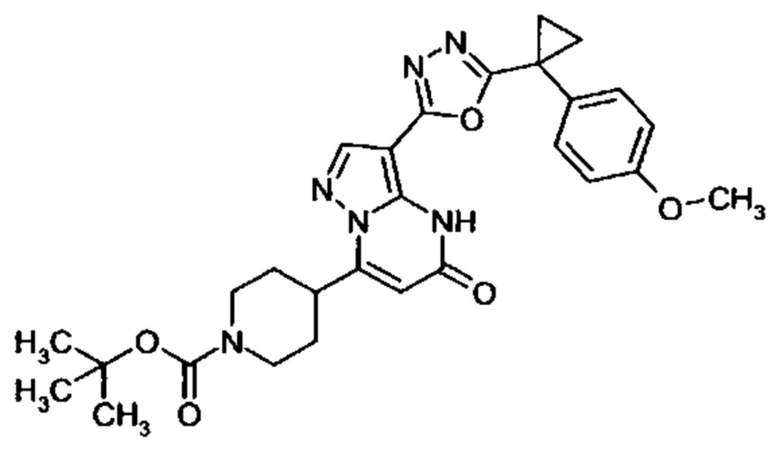
трет-бутил 4-{3-[(2-{[1-(4-метоксифенил)циклопропил]карбонил}гидразинил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (193 мг, 351 мкмоль) растворили в ТГФ (5.0 мл, 62 ммоль) и перемешали с реагентом Бургесса в течение 16 ч при комнатной температуре. Еще 1.4 эквивалента реагента Бургесса (117 мг, 491 мкмоль) добавили, и смесь перемешивали в течение 24 ч при комнатной температуре. Воду и смесь очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта после удаления растворителей в вакууме. Полученное количество составило 44.0 мг (91% чистота, 21% теоретический выход).
LC-MS (Способ 1B): Rt=1.11 мин; MS (ESIpos): m/z=533 [M+H]+
Пример 378A
Трет-бутил 4-{2-метил-3-[3-(4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
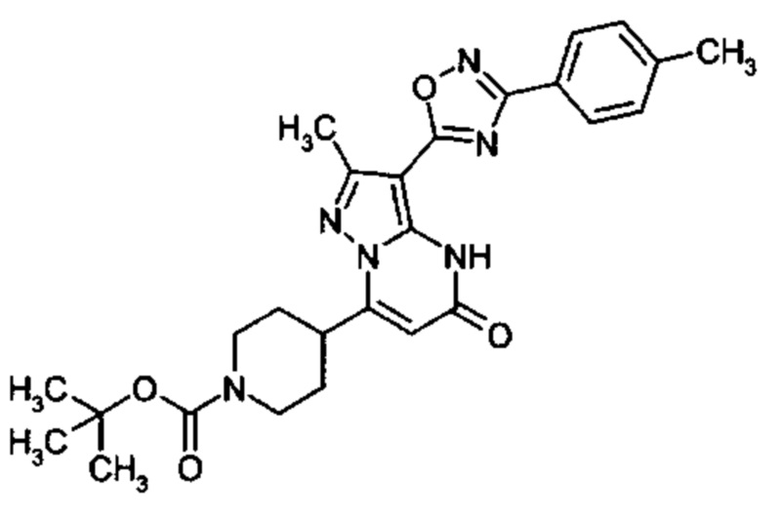
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. N'-гидрокси-4-метилбензолкарбоксимидамид (120 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 68.5 мг (100% чистота, 35% теоретический выход).
LC-MS (Способ 11B): Rt=2.51 мин; MS (ESIneg): m/z=489 [M-H]-
Пример 379A
Трет-бутил 4-{3-[4-(1,3-дифтор-2-метилпропан-2-ил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
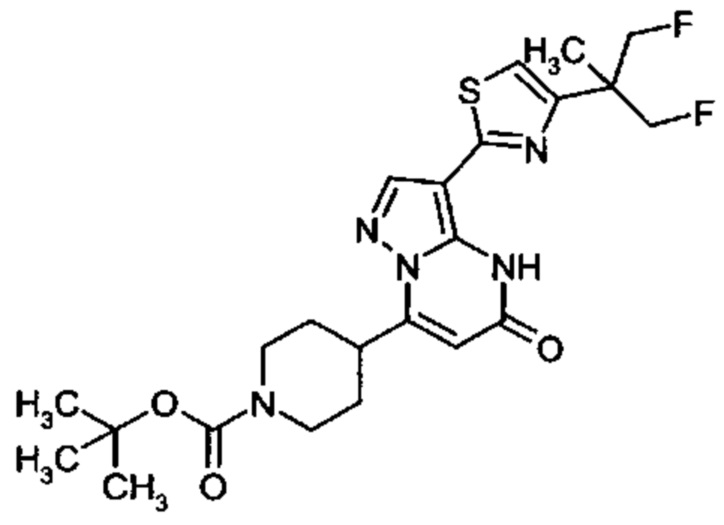
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (125 мг, 331 мкмоль), 1-бром-4-фтор-3-(фторметил)-3-метилбутан-2-он (71.2 мг, 331 мкмоль) и N,N-Диизопропилэтиламин (290 мкл, 1.7 ммоль) растворили в этаноле (5.0 мл, 86 ммоль) и перемешивали при 70°C в течение 1 ч и оставили отстаиваться на 3 дня при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 36.0 мг (100% чистота, 22% теоретический выход).
LC-MS (Способ 11B): Rt=2.22 мин; MS (ESIpos): m/z=494 [M+H]+
Пример 380A
Трет-бутил 4-[3-(4-этил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
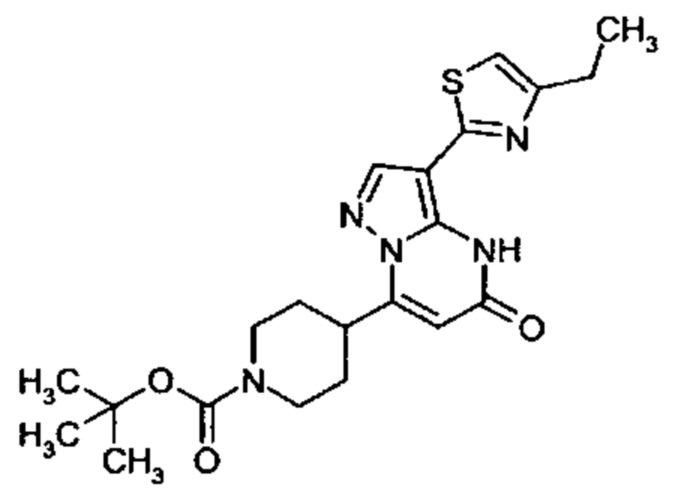
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 1-бромбутан-2-он (32 мкл, 320 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (4.8 мл, 82 ммоль) и перемешивали при 70°C в течение 1 ч и оставили отстаиваться на 3 дня при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 57.1 мг (100% чистота, 42% теоретический выход).
LC-MS (Способ 11B): Rt=2.25 мин; MS (ESIpos): m/z=430 [M+H]+
Пример 381A
Трет-бутил 4-{3-[4-(4-метилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
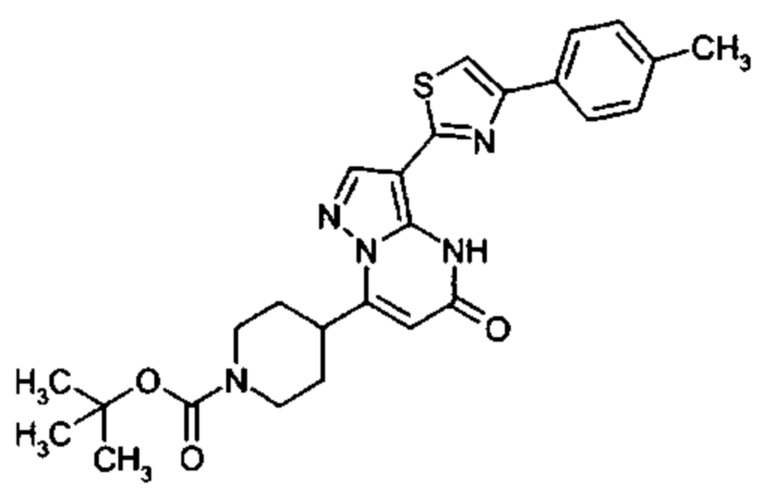
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 2-бром-1-(4-метилфенил)этанон (67.7 мг, 318 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (4.8 мл, 82 ммоль) и перемешивали при 70°C в течение 1 ч и оставили отстаиваться на 3 дня при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 62.2 мг (100% чистота, 40% теоретический выход).
LC-MS (Способ 11B): Rt=2.51 мин; MS (ESIpos): m/z=492 [M+H]+
Пример 382A
Трет-бутил 4-{5-оксо-3-[4-(пропан-2-ил)-1,3-тиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
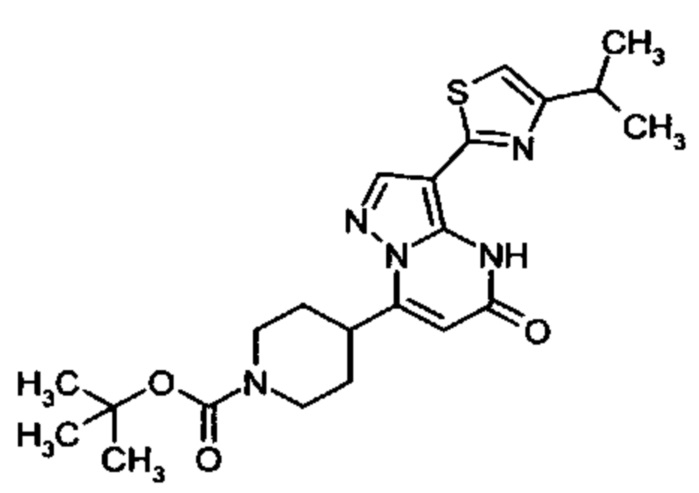
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 1-бром-3-метилбутан-2-он (52.5 мг, 318 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (4.8 мл, 82 ммоль) и перемешивали при 70°C в течение 1 ч и оставили отстаиваться на 3 дня при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 56.4 мг (100% чистота, 40% теоретический выход).
LC-MS (Способ 11B): Rt=2.41 мин; MS (ESIpos): m/z=444 [M+H]+
Пример 383A
Трет-бутил 4-[3-(4-циклопропил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
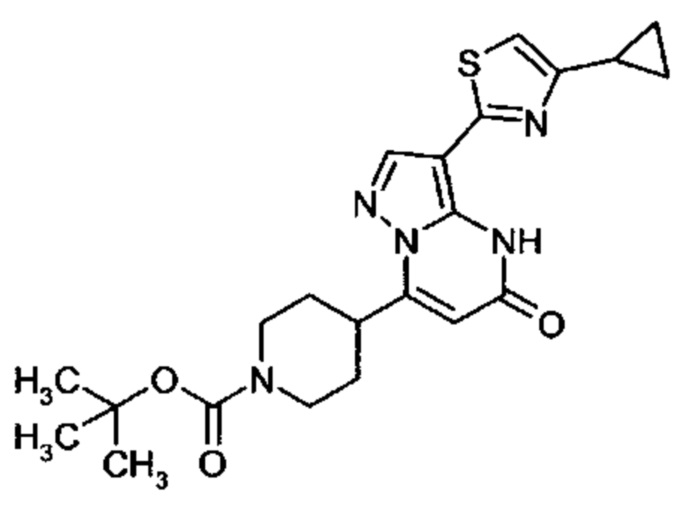
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 2-бром-1-циклопропилэтанон (51.8 мг, 318 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (4.8 мл, 82 ммоль) и перемешивали при 70°C в течение 1 ч и оставили отстаиваться на 3 дня при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 57.1 мг (100% чистота, 41% теоретический выход).
LC-MS (Способ 11B): Rt=2.28 мин; MS (ESIpos): m/z=442 [M+H]+
Пример 384A
Трет-бутил 4-{3-[4-(2,4-диметилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 2-бром-1-(2,4-диметилфенил)этанон (72.2 мг, 318 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (4.8 мл, 82 ммоль) и перемешивали при 70°C в течение 1 ч и оставили отстаиваться на 3 дня при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 52.2 мг (100% чистота, 32% теоретический выход).
LC-MS (Способ 1B): Rt=1.41 мин; MS (ESIpos): m/z=506 [M+H]+
Пример 385A
Трет-бутил 4-(3-{5-[1-(4-хлорфенил)циклопропил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
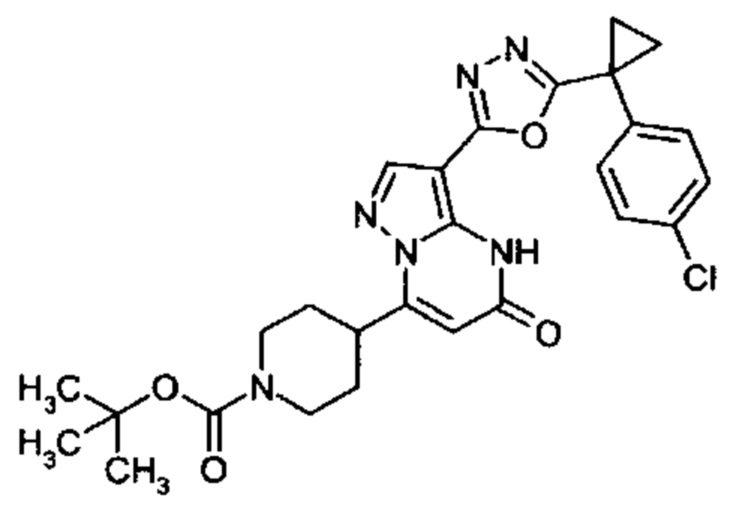
трет-бутил 4-{3-[(2-{[1-(4-хлорфенил)циклопропил]карбонил}гидразинил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (77.9 мг, 140 мкмоль) растворили в ТГФ (2.0 мл) и перемешали с реагентом Бургесса (46.8 мг, 196 мкмоль) в течение 16 ч при комнатной температуре. 1 мл воды добавили, полученный остаток отфильтровали, промыли водой и высушивали в вакууме с получением продукта. Полученное количество составило 56 мг (100% чистота, 74% теоретический выход).
LC-MS (Способ 1B): Rt=1.23 мин; MS (ESIpos): m/z=537 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.416 (16.00), 1.477 (0.42), 1.490 (1.23), 1.496 (1.20), 1.507 (0.56), 1.523 (0.18), 1.544 (0.41), 1.554 (0.41), 1.575 (0.46), 1.585 (0.39), 1.606 (0.17), 1.617 (0.14), 1.750 (0.45), 1.761 (1.10), 1.766 (1.05), 1.779 (0.37), 1.970 (0.54), 2.001 (0.46), 2.871 (0.20), 3.379 (0.13), 3.407 (0.23), 3.438 (0.12), 4.079 (0.34), 4.111 (0.32), 6.132 (0.17), 7.412 (0.54), 7.417 (0.29), 7.434 (2.70), 7.446 (2.56), 7.461 (0.28), 7.468 (0.53), 8.315 (0.47), 12.000 (0.10).
Пример 386A
Трет-бутил (4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]-2-(2,2-диметилпропил)пиперидин-1-карбоксилат
К раствору 1-(трет-бутоксикарбонил)-2-(2,2-диметилпропил)пиперидин-4-карбоновой кислоты (4.71 г, 15.7 ммоль) и 2,2-диметил-1,3-диоксан-4,6-диона (2.50 г, 17.3 ммоль) в дихлорметане (120 мл, 1.9 моль) добавили 4-диметиламинопиридин (2.88 г, 23.6 ммоль). После охлаждения смеси при 0°C, 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (4.22 г, 22.0 ммоль) добавили по частям, и затем реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь обработали водой, и затем слои разделили. Органический слой промыли водным раствором лимонной кислоты, и растворители удалили. Неочищенный продукт очистили посредством обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворитель: A = H2O (0,01% HCOOH), В = Ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением соединения, указанного в названии, 3.87 г (94% чистота, 54% теоретический выход).
LC-MS (Способ 11B): Rt=2.65 мин; MS (ESIneg): m/z=424 [M-H]-
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.000 (0.77), 0.865 (6.91), 0.869 (9.55), 0.882 (1.52), 0.897 (11.52), 0.907 (2.87), 1.398 (16.00), 1.415 (11.86), 1.687 (6.85), 2.086 (0.66), 2.148 (1.82), 2.300 (1.76), 3.577 (1.08), 3.582 (1.09).
Пример 387A
Этил 7-[1-(трет-бутоксикарбонил)-2-(2,2-диметилпропил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
этил 3-амино-1H-пиразол-4-карбоксилат (117 мг, 752 мкмоль) и трет-бутил-4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]-2-(2,2-диметилпропил)пиперидин-1-карбоксилат (352 мг, 827 мкмоль) нагревали в ацетонитриле (10 мл, 94 ммоль) при 60°C в течение 3 ч. Растворители удалили, и остаток растворили в 1-метокси-2-пропаноле (10 мл, 100 ммоль). Трифосфат калия (319 мг, 1.50 ммоль) добавили, и смесь нагревали при 100°C в течение 2 ч. Растворители удалили, и остаток распределили между раствором лимонной кислоты (10%) и этилацетатом. Водный раствор экстрагировали два раза этил ацетатом. Органическую фазу экстрагировали водой и соляным раствором. Органическую фазу обработали сульфатом натрия, отфильтровали и высушивали в вакууме. Остаток очистили посредством обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворитель: A = H2O (0,01% HCOOH), В = Ацетонитрил / градиент: 0.00-4.25 мин = 10%В, 4.50 мин = 20%В, 15.50 мин = 85%В, 16.00-18.50 мин = 100%В, 18.75.00-22.00 мин = 20%В) с получением продукта. Полученное количество составило 183 мг (95% чистота, 50% теоретический выход).
LC-MS (Способ 6B): Rt=4.35 мин; MS (ESIneg): m/z=459 [M-H]-
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (1.46), 0.918 (1.81), 0.940 (2.18), 1.249 (0.81), 1.265 (0.86), 1.279 (0.74), 1.408 (2.02), 1.428 (2.62), 3.285 (1.28), 3.293 (2.58), 3.309 (16.00).
Пример 388A
7-[(2S,4R)-1-(трет-бутоксикарбонил)-2-(2,2-диметилпропил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота
этил 7-[1-(трет-бутоксикарбонил)-2-(2,2-диметилпропил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (183 мг, 397 мкмоль) и водный раствор гидроксида лития (790 мкл, 1.0 М, 790 мкмоль) перемешивали в ТГФ (5.0 мл, 62 ммоль) в течение 2 ч при комнатной температуре. Водный раствор гидроксида лития (1.0 М, 2 эквивалента) добавили, и смесь перемешивали в течение 18 ч при 70°C. Добавили насыщенный раствор хлорида аммония и этилацетат. Водную фазу экстрагировали три раза этилацетатом. Объединенные органические фазы промыли водой, соляным раствором, высушивали сульфатом натрия и в вакууме с получением продукта. Полученное количество составило 165 мг (100% чистота, 96% теоретический выход).
LC-MS (Способ 1B): Rt=1.13 мин; MS (ESIneg): m/z=431 [M-H]-
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (13.56), 0.008 (10.95), 0.895 (3.35), 0.918 (11.46), 0.940 (13.50), 1.169 (2.44), 1.408 (12.43), 1.428 (16.00), 2.366 (2.44), 2.709 (2.38), 3.369 (11.63).
Пример 389A
Пропан-2-ил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
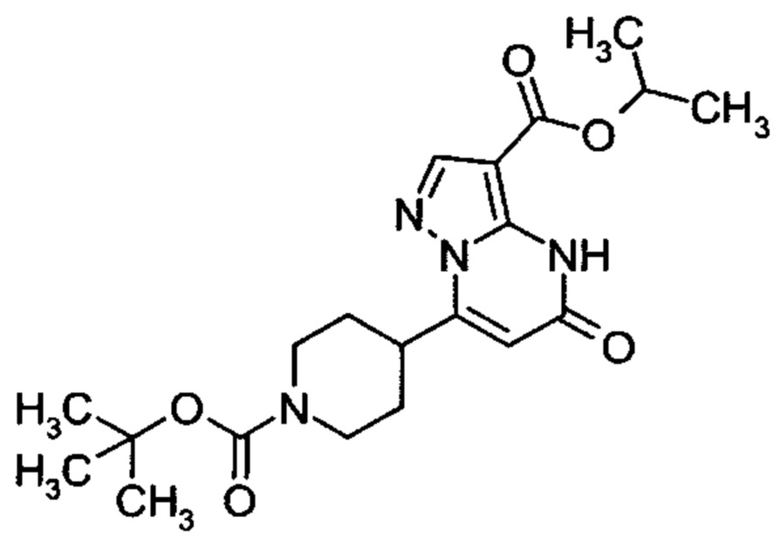
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (200 мг, 552 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль), и N,N'-Карбонилдиимидазол (179 мг, 1.10 ммоль) добавили. Смесь нагревали с возвратом флегмы в течение 1.5 ч. После охлаждения до комнатной температуры, пропан-2-ол (420 мкл, 5.5 ммоль) и гидрид натрия (60% дисперсия в минеральном масле) (24.3 мг, 60% чистота, 607 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 18 ч. Растворители удалили, и пропан-2-ол (5 мл) добавили. Смесь нагревали с возвратом флегмы в течение 18 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (132 мг, 100% чистота, 59% теоретический выход)
LC-MS (Способ 10B): Rt=1.90 мин; MS (ESIneg): m/z=403 [M-H]-
Пример 390A
Трет-бутил 4-(3-{метил[(5-метил-1,2-оксазол-3-ил)метил]карбамоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
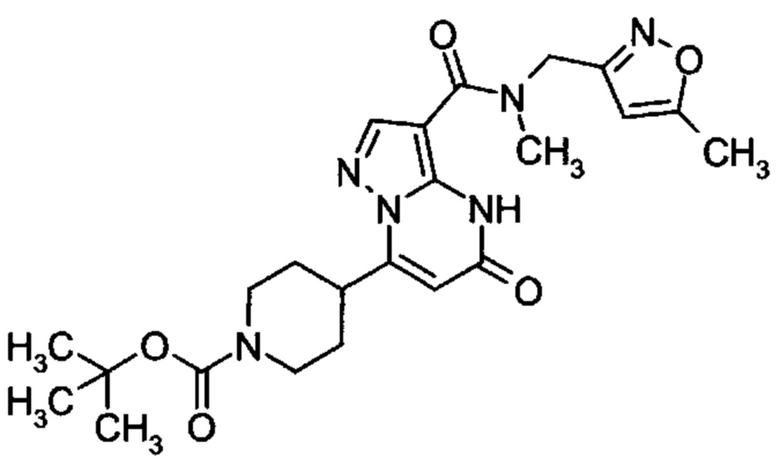
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 414 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (205 мг, 538 мкмоль) и N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль). Затем N-метил-1-(5-метил-1,2-оксазол-3-ил)метанамин (104 мг, 828 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (82.8 мг, 100% чистота, 43% теоретический выход).
LC-MS (Способ 1B): Rt=0.95 мин; MS (ESIpos): m/z=471 [M+H]+
Пример 391A
Трет-бутил 4-[3-(этилкарбамоил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
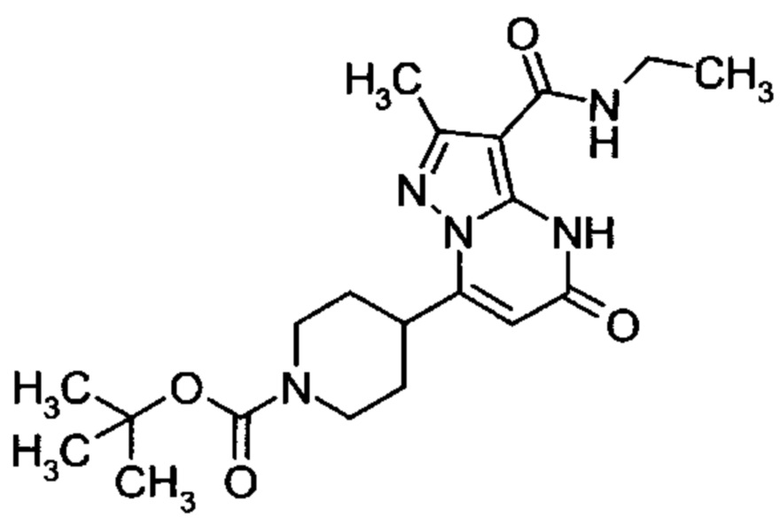
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 398 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили COMU (256 мг, 598 мкмоль) и N,N-Диизопропилэтиламин (420 мкл, 2.4 ммоль). Затем этанамин гидрохлорид (1:1) (130 мг, 1.59 ммоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще COMU (1.5 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (108 мг, 98% чистота, 66% теоретический выход).
LC-MS (Способ 11B): Rt=1.60 мин; MS (ESIneg): m/z=402 [M-H]-
Пример 392A
Трет-бутил 4-{3-[метил(пиридин-3-илметил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
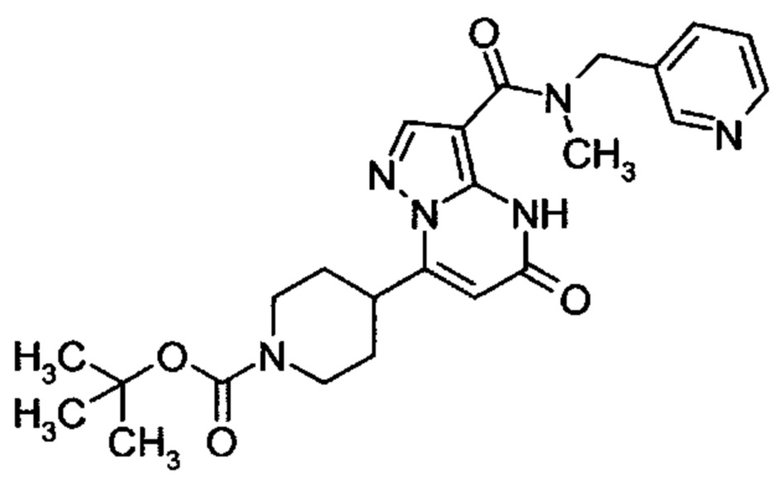
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 414 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (205 мг, 538 мкмоль) и N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль). Затем N-метил-1-(пиридин-3-ил)метанамин (101 мг, 828 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (49.6 мг, 100% чистота, 26% теоретический выход).
LC-MS (Способ 1B): Rt=0.75 мин; MS (ESIpos): m/z=467 [M+H]+
Пример 393A
Трет-бутил 4-[3-(диметилкарбамоил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 398 мкмоль) добавили HATU (197 мг, 518 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль). Затем N-метилметанамин гидрохлорид (1:1) (65.0 мг, 797 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (108 мг, 85% чистота, 57% теоретический выход).
LC-MS (Способ 11B): Rt=1.38 мин; MS (ESIpos): m/z=404 [M+H]+
Пример 394A
Трет-бутил 4-(3-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
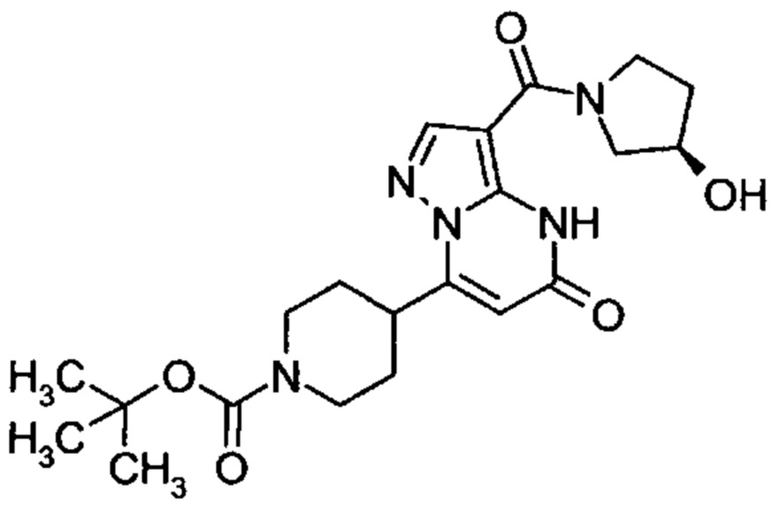
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 414 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (205 мг, 538 мкмоль) и N,N-Диизопропилэтиламин (290 мкл, 1.7 ммоль). Затем (3R)-пирролидин-3-ол гидрохлорид (1:1) (102 мг, 828 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (90.2 мг, 100% чистота, 51% теоретический выход).
LC-MS (Способ 11B): Rt=1.30 мин; MS (ESIpos): m/z=432 [M+H]+
Пример 395A
Трет-бутил 4-(3-{[(3R)-3-метилпирролидин-1-ил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат

К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 414 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (205 мг, 538 мкмоль) и N,N-Диизопропилэтиламин (290 мкл, 1.7 ммоль). Затем (3R)-3-метилпирролидин гидрохлорид (1:1) (101 мг, 828 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (129 мг, 93% чистота, 67% теоретический выход).
LC-MS (Способ 11B): Rt=1.80 мин; MS (ESIpos): m/z=430 [M+H]+
Пример 396A
Трет-бутил 4-[5-оксо-3-(пирролидин-1-илкарбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
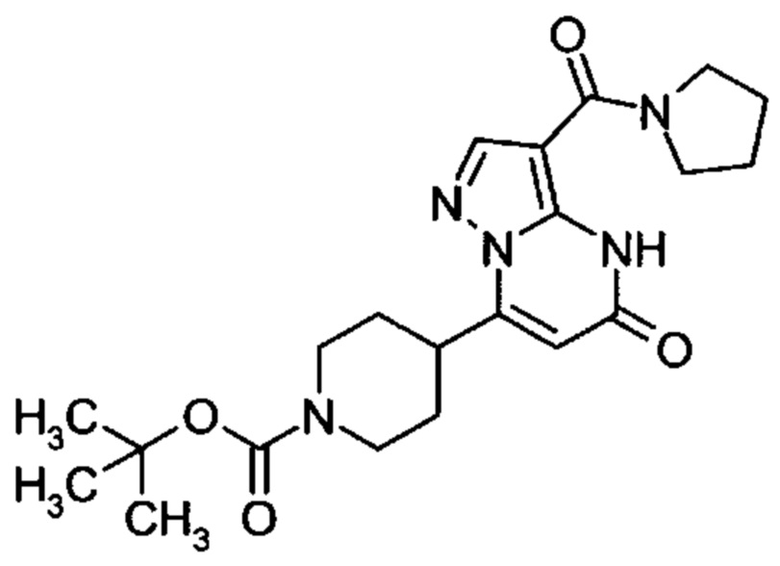
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (100 мг, 276 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (136 мг, 359 мкмоль) и N,N-Диизопропилэтиламин (140 мкл, 830 мкмоль). Затем Пирролидин (39.3 мг, 552 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Смесь очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (31.1 мг, 100% чистота, 27% теоретический выход).
LC-MS (Способ 10B): Rt=1.62 мин; MS (ESIneg): m/z=414 [M-H]-
Пример 397A
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота
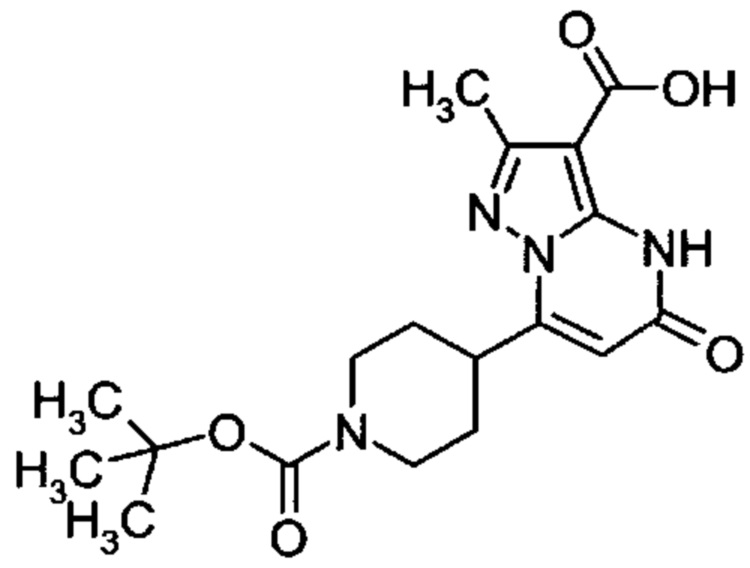
этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (6.94 г, 17.2 ммоль) растворили в тетрагидрофуране (30 мл, 370 ммоль) и растворе гидроксида калия (30 мл, 2.0 М в воде, 60 ммоль) и перемешивали в течение 16 ч при 65°C. Гидроксид лития (1.23 г, 51.5 ммоль) добавили, и смесь перемешивали в течение 20 ч при 65°C. Добавили ацетонитрил, и полученный осадок отфильтровали, промыли ацетонитрилом и высушивали в вакууме. Остаток обработали водой, и слегка подкислили водным раствором соляной кислоты до достижения значения pH 3. Водную фазу экстрагировали несколько раз этил ацетатом. Объединенные органические фазы высушивали сульфатом натрия и в вакууме с получением осадка. Его суспендировали в ацетонитриле, отфильтровали, промыли ацетонитрилом и высушивали в вакууме с получением целевого продукта (4.28 г, 97% чистота, 65% теоретический выход).
LC-MS (Способ 11B): Rt=1.48 мин; MS (ESIneg): m/z=375 [M-H]-
Пример 398A
Трет-бутил 4-{3-[(3,3-диметилпирролидин-1-ил)метил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
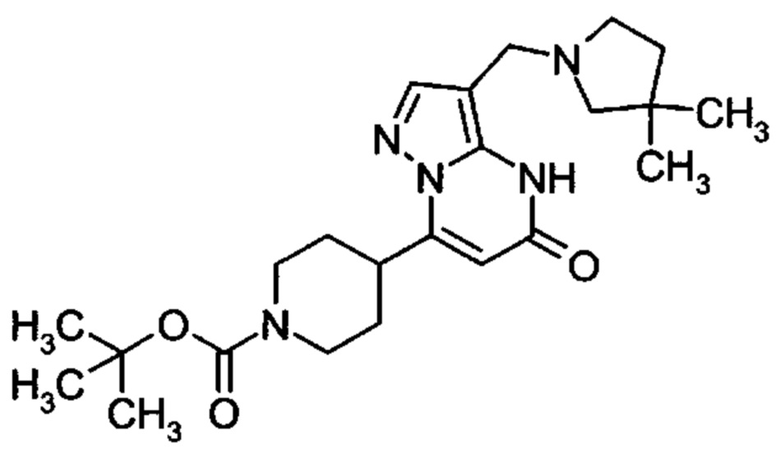
трет-бутил 4-[3-(гидроксиметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (150 мг, 431 мкмоль) и Трифенилфосфин (430 мкл, 1.0 М, 430 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль) и охладили до -18°C. N-Бромсукцинимид (76.6 мг, 431 мкмоль) добавили, и смесь перемешивали в течение 5 мин при -18°C. 3,3-диметилпирролидин (102 мг, 1.03 ммоль) добавили и перемешивали в течение 10 мин при комнатной температуре, и затем в течение 1 ч при 80°C. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (68.1 мг, 100% чистота, 37% теоретический выход).
LC-MS (Способ 10B): Rt=0.66 мин; MS (ESIpos): m/z=430 [M+H]+
Пример 399A
Трет-бутил 4-(3-{[(2R)-2-метилпирролидин-1-ил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
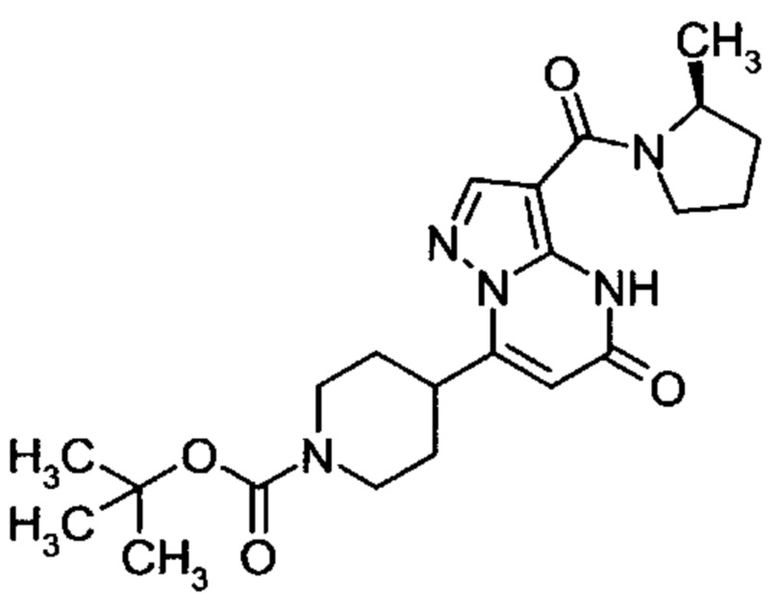
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (100 мг, 276 мкмоль) в диметилформамиде (1.0 мл, 13 ммоль) добавили HATU (136 мг, 359 мкмоль) и N,N-Диизопропилэтиламин (140 мкл, 830 мкмоль). Затем (2R)-2-метилпирролидин (47.0 мг, 552 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (44.0 мг, 82% чистота, 30% теоретический выход).
LC-MS (Способ 11B): Rt=1.84 мин; MS (ESIpos): m/z=430 [M+H]+
Пример 400A
Трет-бутил 4-{3-[(3,3-дифторазетидин-1-ил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
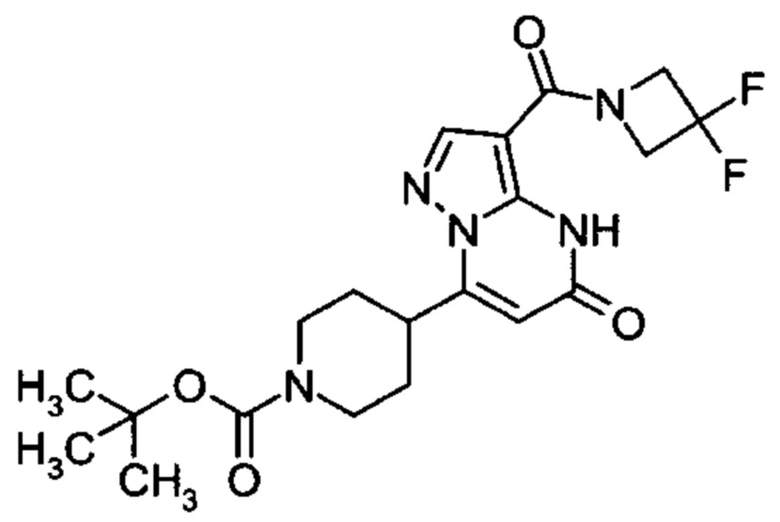
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (100 мг, 276 мкмоль) в диметилформамиде (1.0 мл, 13 ммоль) добавили HATU (136 мг, 359 мкмоль) и N,N-Диизопропилэтиламин (140 мкл, 830 мкмоль). Затем 3,3-дифторазетидине гидрохлорид (1:1) (71.5 мг, 552 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Добавили воду, полученный осадок отфильтровали, промыли водой, и высушивали в вакууме с получением соединения, указанного в названии (85.6 мг, 98% чистота, 69% теоретический выход).
LC-MS (Способ 11B): Rt=1.65 мин; MS (ESIneg): m/z=436 [M-H]-
Пример 401A
Трет-бутил 4-[5-оксо-3-(пиперидин-1-илкарбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
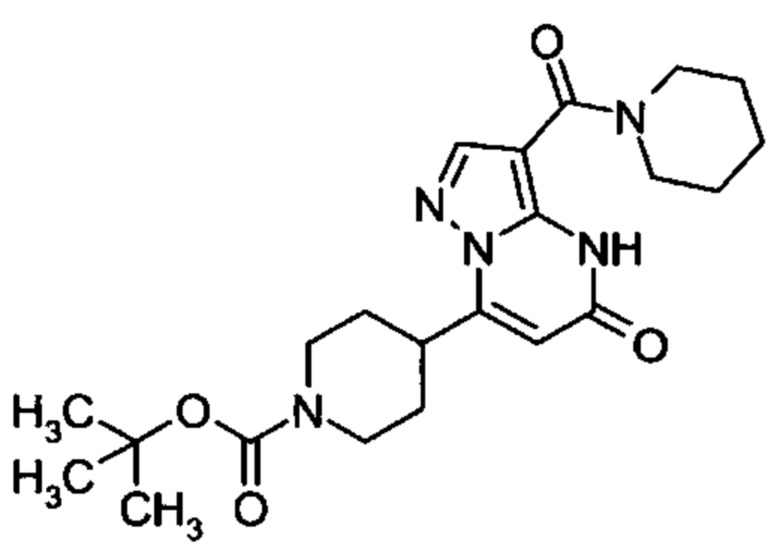
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (100 мг, 276 мкмоль) в диметилформамиде (1.0 мл, 13 ммоль) добавили HATU (136 мг, 359 мкмоль) и N,N-Диизопропилэтиламин (140 мкл, 830 мкмоль). Затем пиперидин (47.0 мг, 552 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Выпаривание двух фракций продукта дало соединение, указанное в названии (33.0 мг, 90% чистота, 25% выход и 36.6 мг, 87% чистота, 27% теоретический выход).
LC-MS (Способ 11B): Rt=1.80 мин; MS (ESIpos): m/z=430 [M+H]+
Пример 402A
Трет-бутил 4-(3-циклопропил-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
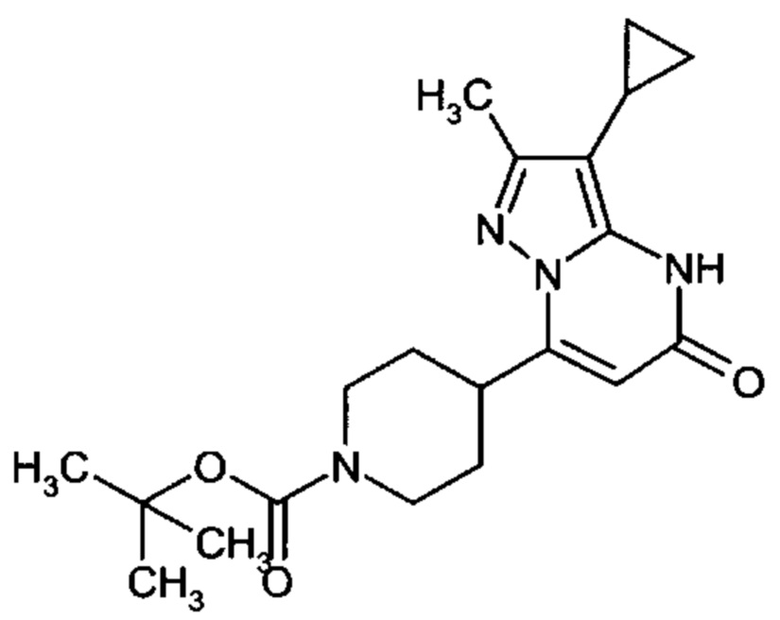
Смесь 4-циклопропил-3-метил-1H-пиразол-5-амина (500 мг, 3.64 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата (1.42 г, 4.01 ммоль) в ацетонитриле (30 мл) перемешивали в атмосфере аргона всю ночь при 60°C, и затем концентрировали. 1-Метокси-2-пропанол (30 мл) и трифосфат калия (1.55 г, 7.29 ммоль) добавили, и полученную смесь перемешивали в течение 2 ч при 110°C перед концентрированием. Выделенную неочищенную смесь перемешивали всю ночь в смеси ацетонитрила (25 мл) и диметил сульфоксида (10 мл). Полученное твердое вещество отфильтровали, тогда как фильтрат очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта, которые затем объединили с ранее отфильтрованным твердым веществом, получили соединение, указанное в названии. Полученное количество составило 758 мг (100% чистота, 56% теоретический выход).
LC-MS (Способ 8B): Rt=1.30 мин; MS (ESIneg): m/z=371 [M-H]-
Пример 403A
Трет-бутил 4-[3-(4,5-диметил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
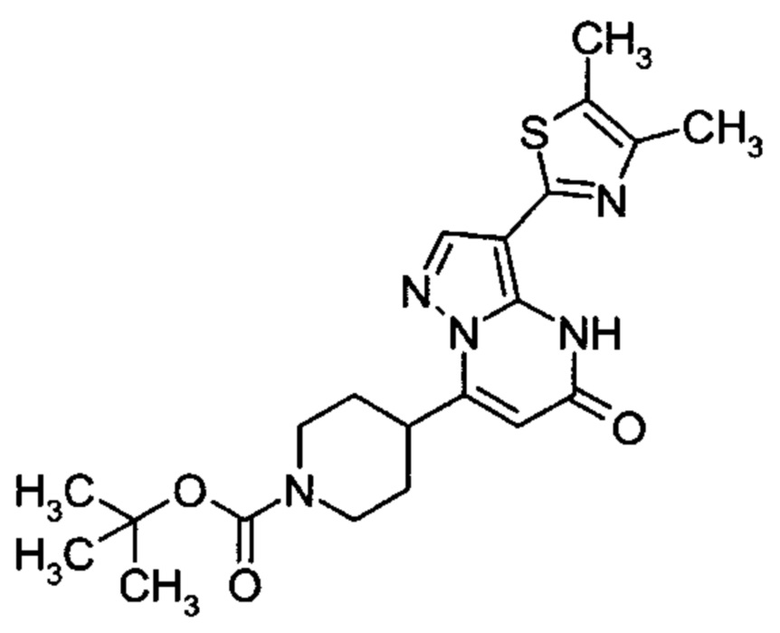
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (200 мг, 530 мкмоль), 3-хлорбутан-2-он (54 мкл, 530 мкмоль) и N,N-диизопропилэтиламин (460 мкл, 2.6 ммоль) растворили в этаноле (5.0 мл, 86 ммоль) и перемешивали при 70°C в течение 1 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 84.0 мг (97% чистота, 36% теоретический выход).
LC-MS (Способ 11B): Rt=2.26 мин; MS (ESIpos): m/z=430 [M+H]+
Пример 404A
Трет-бутил 4-{3-[4-(2,5-диметилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
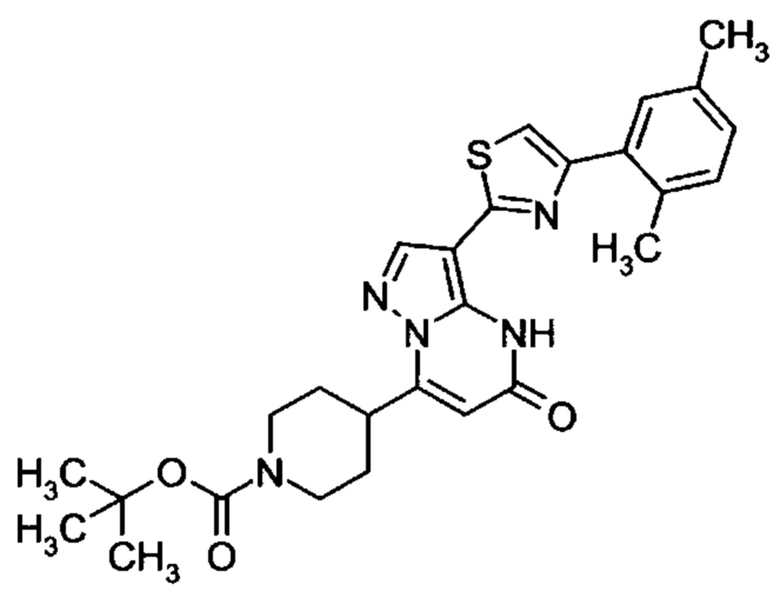
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (200 мг, 530 мкмоль), 2-хлор-1-(2,5-диметилфенил)этанон (96.8 мг, 530 мкмоль), N,N-Диизопропилэтиламин (460 мкл, 2.6 ммоль), и Тетра-н-бутиламмония иодид (196 мг, 530 мкмоль) растворили в этаноле (5.0 мл, 86 ммоль) и перемешивали при 70°C в течение 1 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 60.0 мг (97% чистота, 22% теоретический выход).
LC-MS (Способ 11B): Rt=2.67 мин; MS (ESIpos): m/z=506 [M+H]+
Пример 405A
Трет-бутил 4-{3-[(2,2-диметилморфолин-4-ил)метил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
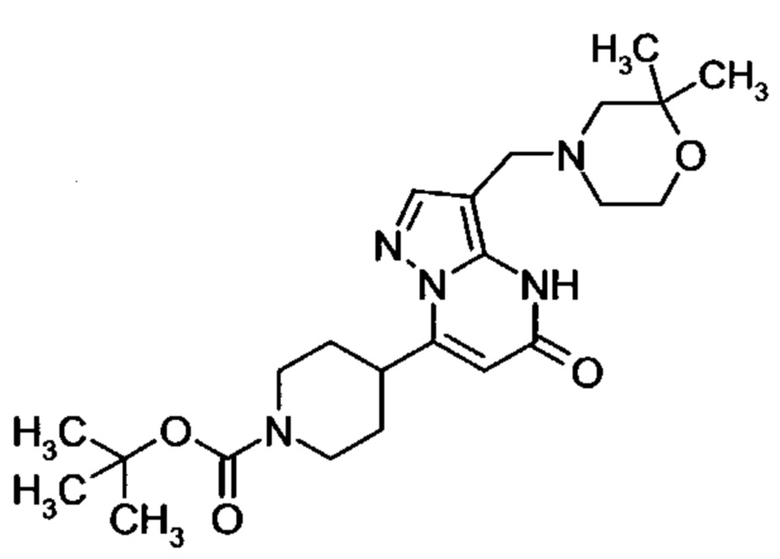
трет-бутил 4-[3-(гидроксиметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (150 мг, 431 мкмоль) и Трифенилфосфин (430 мкл, 1.0 М, 430 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль) и охладили до -18°C. N-Бромсукцинимид (76.6 мг, 431 мкмоль) добавили, и смесь перемешивали в течение 5 мин при -18°C. 2,2-диметилморфолин (119 мг, 1.03 ммоль) добавили и перемешивали в течение 10 мин при комнатной температуре, и затем в течение 1 ч при 80°C. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (118 мг, 99% чистота, 61% теоретический выход).
LC-MS (Способ 11B): Rt=1.02 мин; MS (ESIpos): m/z=446 [M+H]+
Пример 406A
Трет-бутил 4-(5-оксо-3-{[2-(пиридин-3-илацетил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
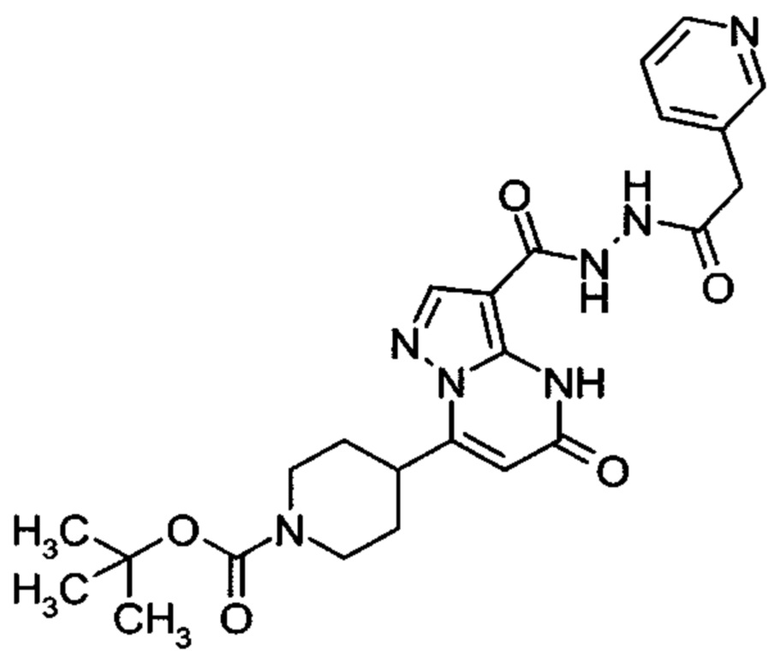
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(пиридин-3-ил)ацетогидразид (93.9 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (266 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 76.9 мг (100% чистота, 37% теоретический выход).
LC-MS (Способ 11B): Rt=0.64 мин; MS (ESIpos): m/z=496 [M+H]+
Пример 407A
Трет-бутил 4-{5-оксо-3-[5-(пиридин-3-илметил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
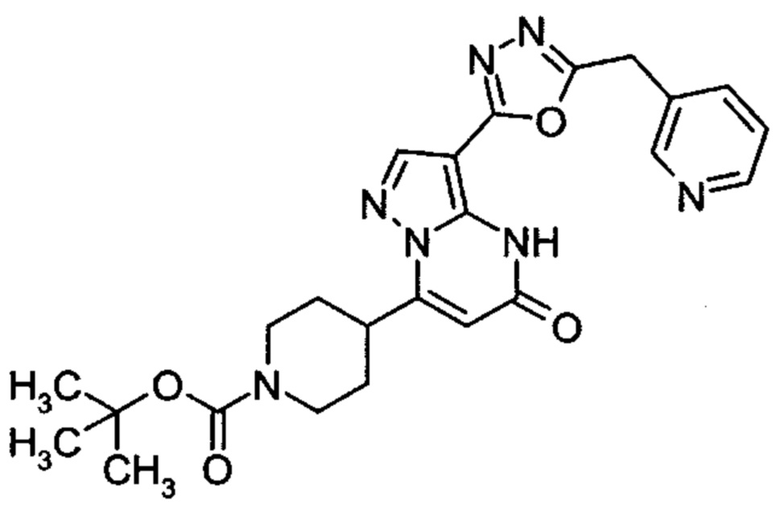
трет-бутил 4-(5-оксо-3-{[2-(пиридин-3-илацетил)гидразинил]карбонил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (75.0 мг, 151 мкмоль) растворили в ТГФ (2.3 мл) и перемешали с реагентом Бургесса (50.5 мг, 212 мкмоль) в течение 16 ч при комнатной температуре. Воду и этилацетат добавили, и органическую фазу отделили и высушивали посредством фильтрации через фильтр Extrelut NT3. Растворитель удалили, и смесь очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) с получением продукта после удаления растворителей в вакууме. Полученное количество составило 59 мг (100% чистота, 36% теоретический выход).
LC-MS (Способ 1B): Rt=1.04 мин; MS (ESIpos): m/z=488 [M+H]+
Пример 408A
Трет-бутил 4-{3-[(3,3-диметил-2-оксобутил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
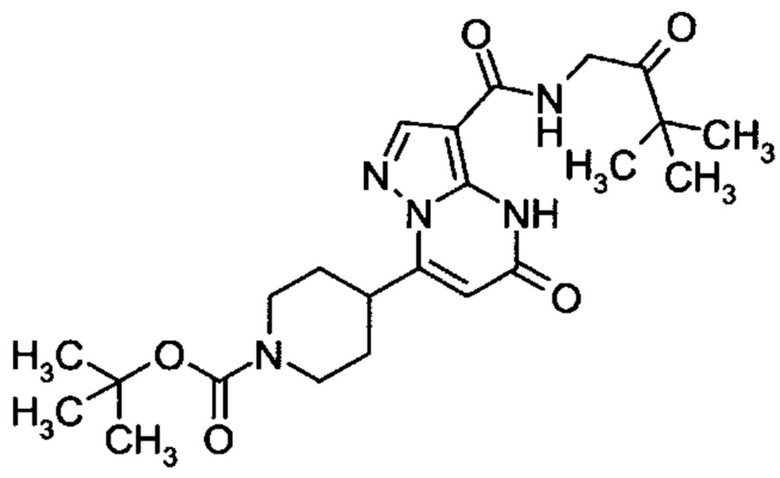
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (1.00 г, 2.76 ммоль) и 1-амино-3,3-диметилбутан-2-он гидрохлорид (1:1) (1.05 г, 6.90 ммоль) растворили в N,N-Диметилформамиде (5.0 мл, 65 ммоль). N,N-Диизопропилэтиламин (2.4 мл, 14 ммоль) и HATU (1.78 г, 4.69 ммоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Еще 1-амино-3,3-диметилбутан-2-он гидрохлорид (1:1) (2.5 эквивалента), N,N-Диизопропилэтиламин (5 эквивалента), и HATU (1.7 эквивалента) добавили, и смесь перемешивали при комнатной температуре в течение 3 ч. Добавили воду. Полученный осадок отфильтровали, промыли водой, и высушивали в вакууме. Диэтиловый простой эфир добавили, и полученный осадок отфильтровали, промыли водой, и высушивали в вакууме. Объединенное количество продукта составило 705 мг (97% чистота, 54% теоретический выход).
LC-MS (Способ 1B): Rt=0.93 мин; MS (ESIpos): m/z=460 [M+H]+
Пример 409A
Трет-бутил 4-(2-оксо-1,2,7,8,9,10-гексагидропиримидо[1,2-b]индазол-4-ил)пиперидин-1-карбоксилат
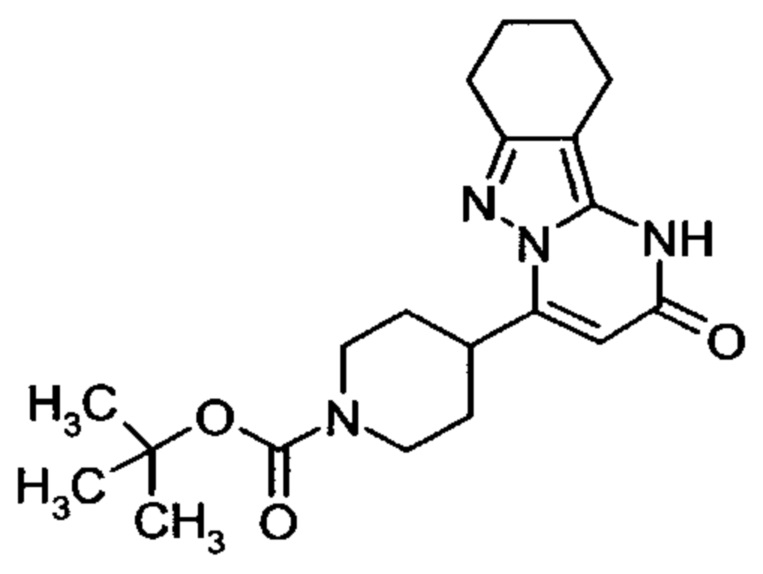
4,5,6,7-тетрагидро-2H-индазол-3-амин гидрохлорид (1:1) (150 мг, 864 мкмоль), трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (307 мг, 864 мкмоль), и N,N-Диизопропилэтиламин (180 мкл, 1.0 ммоль) нагревали в ацетонитриле (3.5 мл, 74 ммоль) при 60°C в течение 1.5 ч. Растворители удалили, и остаток растворили в (3.5 мл, 36 ммоль). Трифосфат калия (367 мг, 1.73 ммоль) добавили, и смесь нагревали при 110°C в течение 1.5 ч. Растворители удалили, и остаток распределили между водой и этилацетатом. Органическую фракцию промыли насыщенным раствором хлорида аммония (водным), водой и соляным раствором. Затем его высушивали сульфатом натрия и в вакууме. Остаток очистили посредством обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворитель: A = H2O (0,01% HCOOH), В = Ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 114 мг (100% чистота, 36% теоретический выход).
LC-MS (Способ 11B): Rt=1.75 мин; MS (ESIneg): m/z=371 [M-H]-
Пример 410A
Трет-бутил 4-{3-[5-метил-4-(трифторметил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
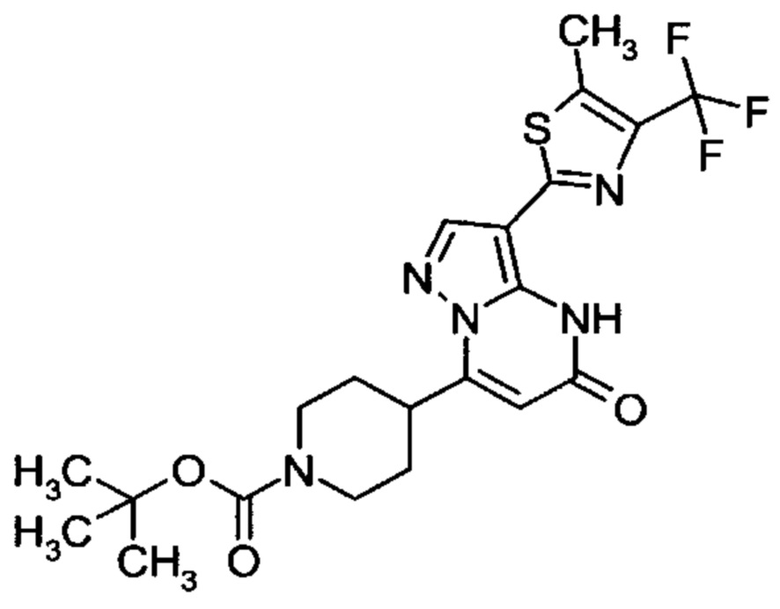
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 3-бром-1,1,1-трифторбутан-2-он (40 мкл, 320 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (4.8 мл, 82 ммоль) и перемешивали при 70°C в течение 1 ч. Толуол добавили, и смесь нагревали с возвратом флегмы в течение 2 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 57.0 мг (100% чистота, 36% теоретический выход).
LC-MS (Способ 1B): Rt=1.12 мин; MS (ESIpos): m/z=502 [M+H]+
Пример 411A
Трет-бутил 4-[3-(4-циклогексил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
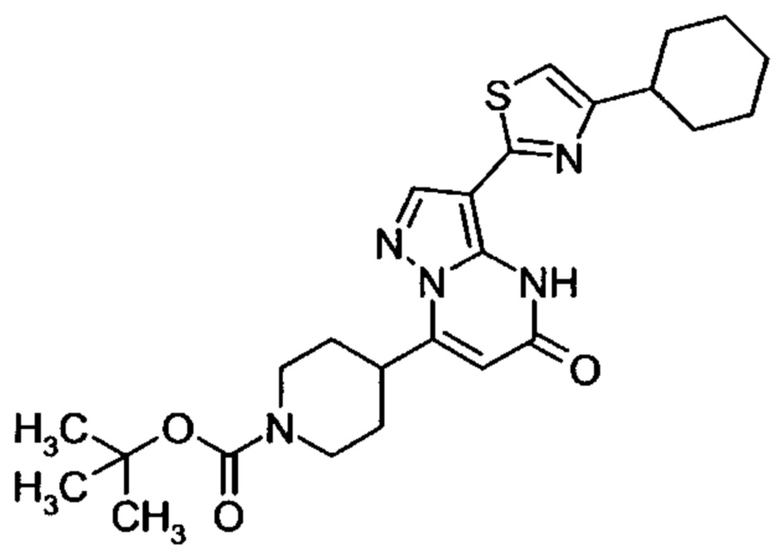
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 2-бром-1-циклогексилэтанон (65.2 мг, 318 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (3.0 мл, 52 ммоль) и перемешивали при 70°C в течение 1 ч. Добавили воду, полученный осадок отфильтровали, промыли водой, и высушивали в вакууме. Остаток обработали в метаноле/ацетонитриле (1:1), отфильтровали, и высушивали в вакууме. Полученное количество составило 60.6 мг (100% чистота, 39% теоретический выход).
LC-MS (Способ 10B): Rt=2.52 мин; MS (ESIpos): m/z=484 [M+H]+
Пример 412A
Трет-бутил 4-{3-[4-(1-хлорциклопропил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
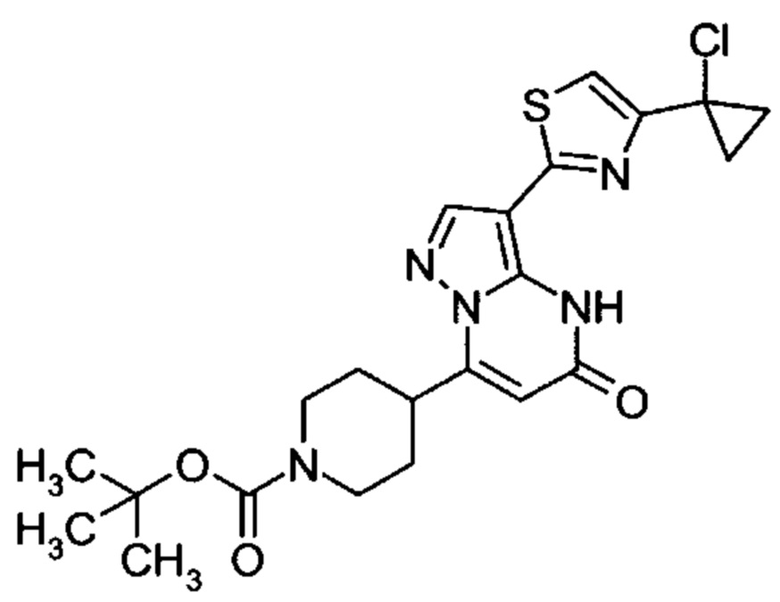
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 2-хлор-1-(1-хлорциклопропил)этанон (48.6 мг, 318 мкмоль), Тетра-н-бутиламмония иодид (117 мг, 318 мкмоль), и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (3.0 мл, 52 ммоль) и перемешивали при 70°C в течение 1 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 46.0 мг (100% чистота, 30% теоретический выход).
LC-MS (Способ 11B): Rt=2.38 мин; MS (ESIpos): m/z=476 [M+H]+
Пример 413A
Трет-бутил 4-(3-{4-[2-(дифторметокси)фенил]-1,3-тиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
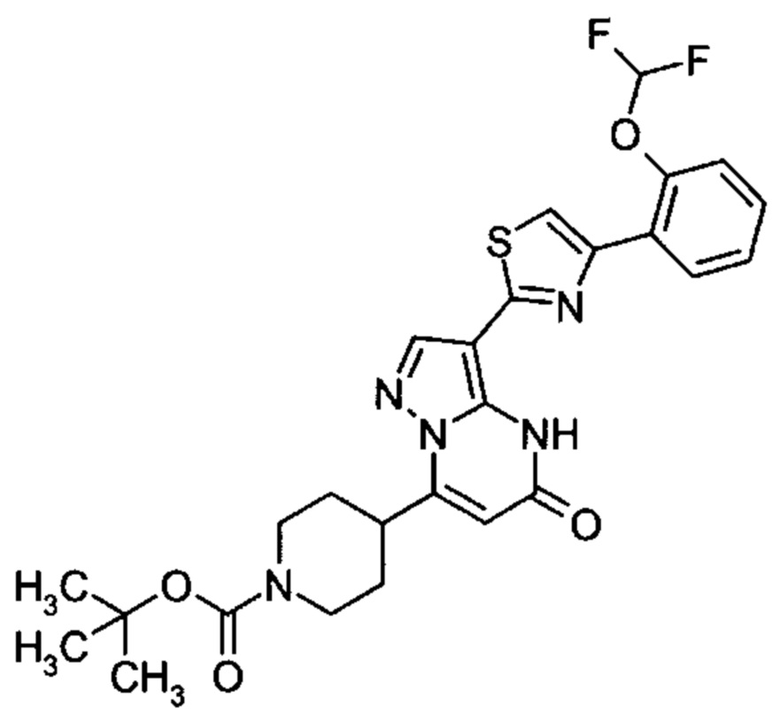
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 2-бром-1-[2-(дифторметокси)фенил]этанон (84.3 мг, 318 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (3.0 мл, 52 ммоль) и перемешивали при 70°C в течение 1 ч. Добавили воду; полученный осадок отфильтровали, промыли водой, и высушивали в вакууме. Остаток обработали в метаноле/ацетонитриле (1:1), отфильтровали, и высушивали в вакууме. Полученное количество составило 70.0 мг (100% чистота, 41% теоретический выход).
LC-MS (Способ 11H): Rt=2.44 мин; MS (ESIpos): m/z=544 [M+H]+
Пример 414A
Трет-бутил 4-(3-{[2-(2,2-диметилпропаноил)гидразинил]карбонил}-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
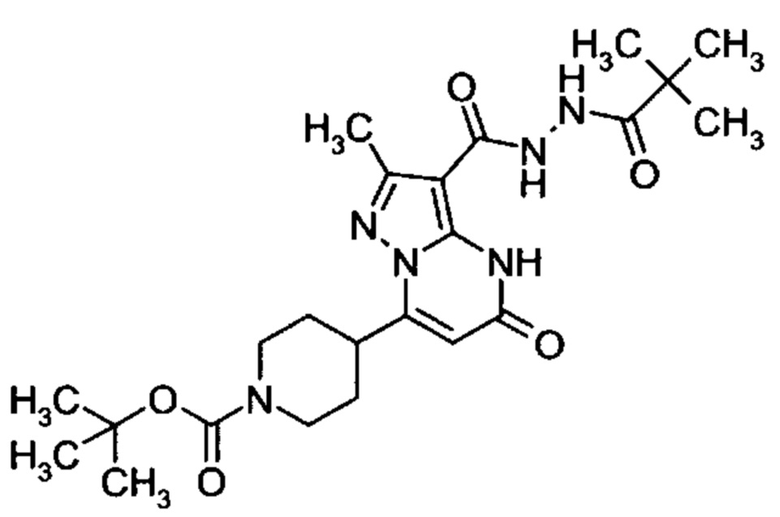
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) и 2,2-диметилпропангидразид (69.4 мг, 598 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (227 мг, 598 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.5 эквивалента) и 2,2-диметилпропангидразид (1.5 эквивалента) добавили, и смесь перемешивали при комнатной температуре в течение 18 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 106 мг (100% чистота, 56% теоретический выход).
LC-MS (Способ 11B): Rt=1.60 мин; MS (ESIneg): m/z=473 [M-H]-
Пример 415A
Трет-бутил 4-[3-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
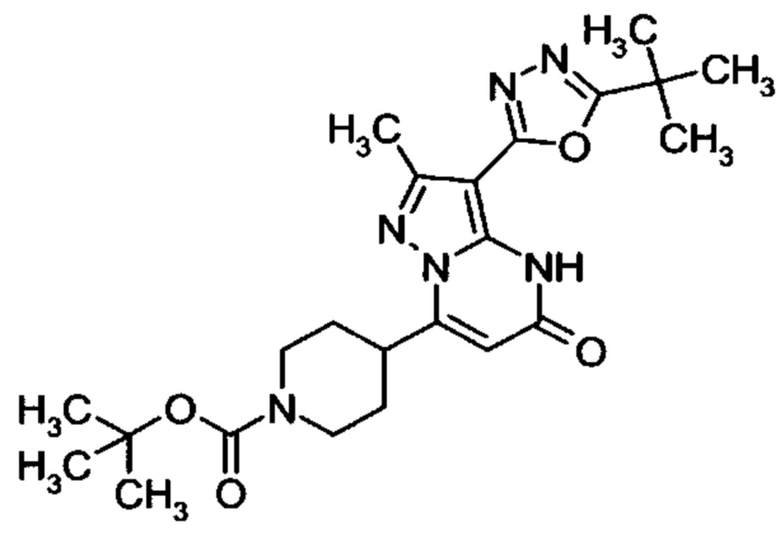
трет-бутил 4-(3-{[2-(2,2-диметилпропаноил)гидразинил]карбонил}-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (94.8 мг, 200 мкмоль) растворили в ТГФ (3.1 мл, 39 ммоль) и перемешали с реагентом Бургесса (57.1 мг, 240 мкмоль) в течение 16 ч при комнатной температуре. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент:: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (65.4 мг, 100% чистота, 72% теоретический выход).
LC-MS (Способ 11B): Rt=2.10 мин; MS (ESIpos): m/z=457 [M+H]+
Пример 416A
Трет-бутил 4-[2-метил-3-(3-метил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
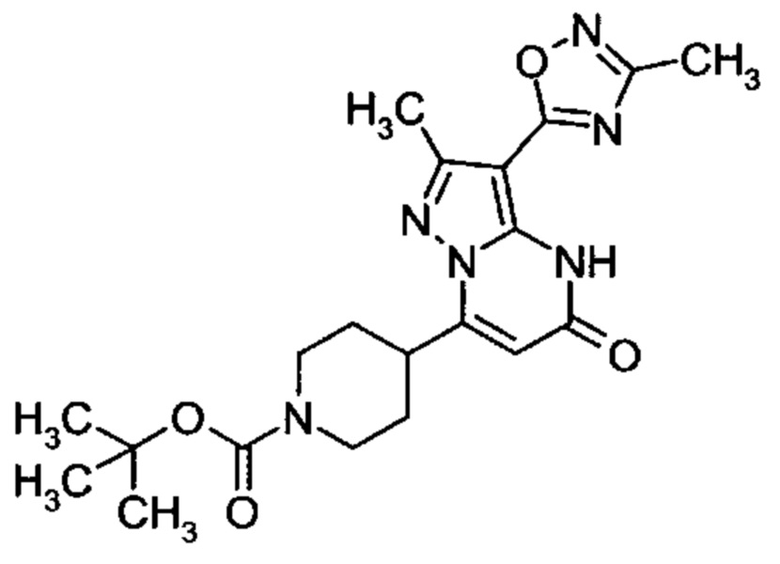
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (3.0 мл, 39 ммоль) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч, (1Z)-N'-гидроксиэтанимидамид гидрохлорид (1:1) (88.1 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 40.8 мг (91% чистота, 22% теоретический выход).
LC-MS (Способ 11B): Rt=1.97 мин; MS (ESIneg): m/z=413 [M-H]-
Пример 417A
Трет-бутил 4-(3-{[2-(циклобутилкарбонил)гидразинил]карбонил}-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
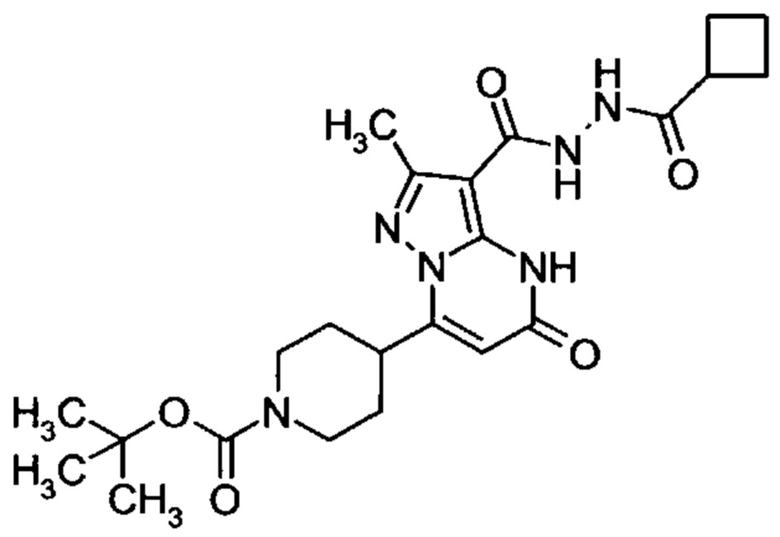
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) и циклобутанкарбогидразид (68.2 мг, 598 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (227 мг, 598 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.5 эквивалента) и циклобутанкарбогидразид (1.5 эквивалента) добавили, и смесь перемешивали при комнатной температуре в течение 18 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 127 мг (68% теоретический выход).
LC-MS (Способ 11B): Rt=1.55 мин; MS (ESIneg): m/z=471 [M-H]-
Пример 418A
Трет-бутил 4-[3-(5-циклобутил-1,3,4-оксадиазол-2-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
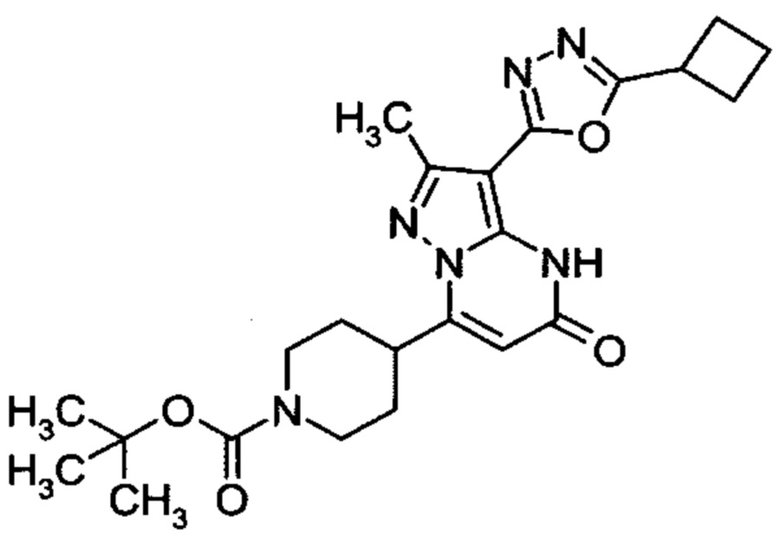
трет-бутил 4-(3-{[2-(циклобутилкарбонил)гидразинил]карбонил}-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (118 мг, 249 мкмоль) растворили в ТГФ (2.4 мл, 29 ммоль) и перемешали с реагентом Бургесса (83.1 мг, 349 мкмоль) в течение 16 ч при комнатной температуре. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (81.9 мг, 100% чистота, 72% теоретический выход).
LC-MS (Способ 11B): Rt=2.02 мин; MS (ESIpos): m/z=455 [M+H]+
Пример 419A
Трет-бутил 4-{2-метил-5-оксо-3-[3-(трифторметил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
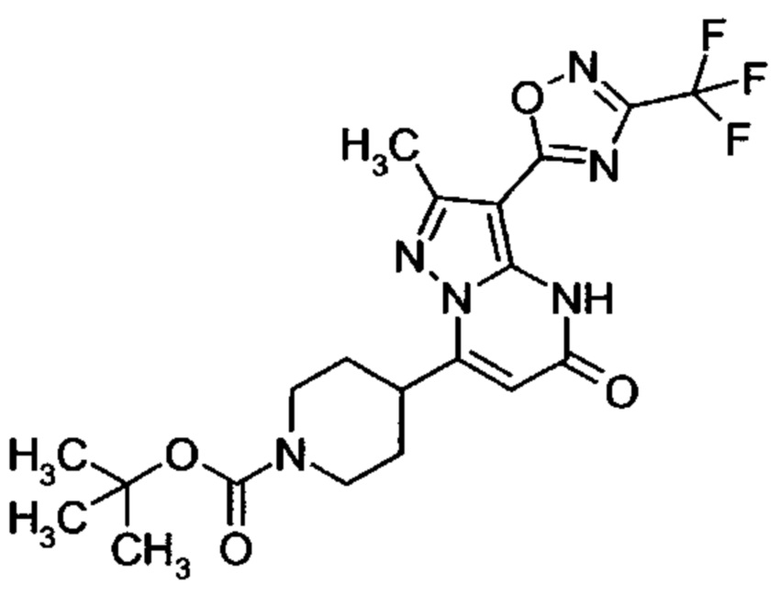
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (3.0 мл, 39 ммоль) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-2,2,2-трифтор-N'-гидроксиэтанимидамид (102 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 101 мг (100% чистота, 54% теоретический выход).
LC-MS (Способ 11B): Rt=2.22 мин; MS (ESIneg): m/z=467 [M-H]-
Пример 420A
Трет-бутил 4-{3-[(диметиламино)метил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
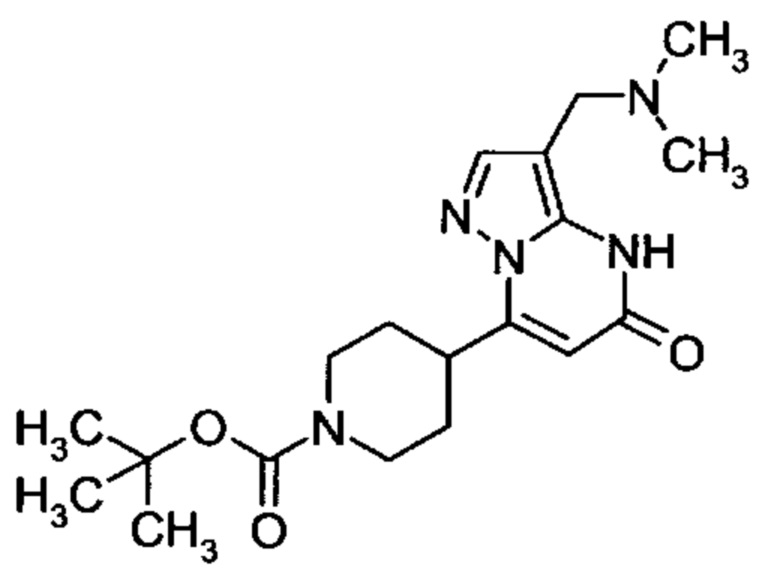
трет-бутил 4-[3-(гидроксиметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (150 мг, 431 мкмоль) и Трифенилфосфин (430 мкл, 1.0 М, 430 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль) и охладили до -18°C. N-Бромсукцинимид (76.6 мг, 431 мкмоль) добавили, и смесь перемешивали в течение 5 мин при -18°C. Диметиламин (520 мкл, 2.0 М, 1.0 ммоль) добавили и перемешивали в течение 10 мин при комнатной температуре, и затем в течение 1 ч при 80°C. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (45.8 мг, 93% чистота, 26% теоретический выход).
LC-MS (Способ 1B): Rt=0.87 мин; MS (ESIneg): m/z=374 [M-H]-
Пример 421A
Трет-бутил 4-[5-оксо-3-(пирролидин-1-илметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
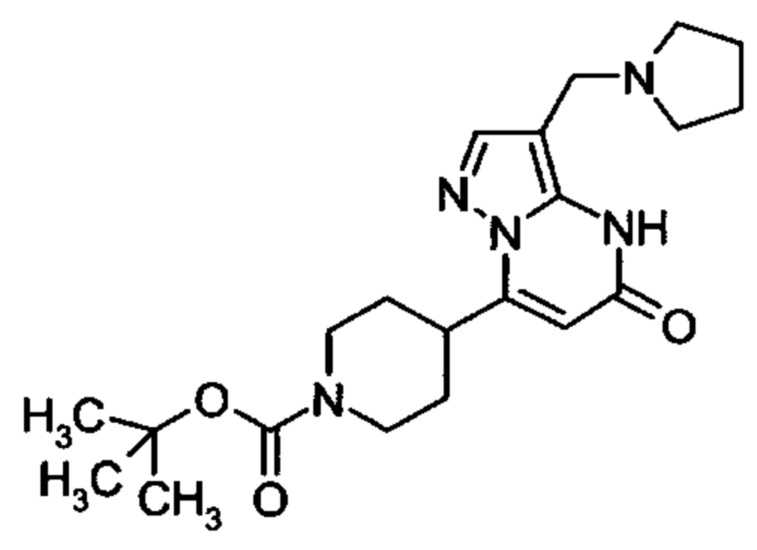
трет-бутил 4-[3-(гидроксиметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (150 мг, 431 мкмоль) и Трифенилфосфин (430 мкл, 1.0 М, 430 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль) и охладили до -18°C. N-Бромсукцинимид (76.6 мг, 431 мкмоль) добавили, и смесь перемешивали в течение 5 мин при -18°C. Пирролидин (86 мкл, 1.0 ммоль) добавили и перемешивали в течение 10 мин при комнатной температуре, и затем в течение 1 ч при 80°C. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (58.2 мг, 100% чистота, 34% теоретический выход).
LC-MS (Способ 1B): Rt=0.59 мин; MS (ESIpos): m/z=402 [M+H]+
Пример 422A
Трет-бутил 4-(3-циклопропил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
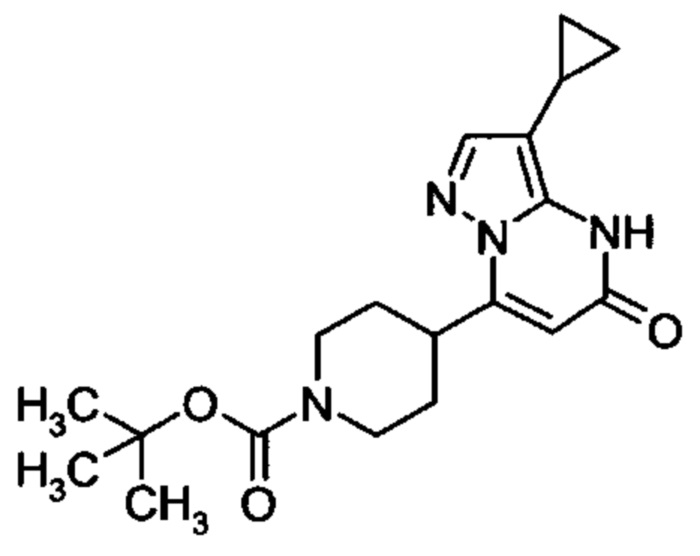
4-циклопропил-1H-пиразол-3-амин (300 мг, 2.44 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (866 мг, 2.44 ммоль) нагревали в ацетонитриле (9.0 мл, 190 ммоль) при 60°C в течение 1.5 ч. Растворители удалили, и остаток растворили в 1-метокси-2-пропаноле (9.0 мл, 92 ммоль). Трифосфат калия (1.03 г, 4.87 ммоль) добавили, и смесь нагревали при 110°C в течение 1.5 ч. Растворители удалили, и остаток распределили между водой и этилацетатом. Органическую фракцию промыли насыщенным раствором хлорида аммония (aqueous), водой и соляным раствором. Затем его высушивали сульфатом натрия и в вакууме. Остаток очистили посредством обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворитель: A = H2O (0,01% HCOOH), В = Ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 454 мг (100% чистота, 52% теоретический выход).
LC-MS (Способ 1B): Rt=0.91 мин; MS (ESIneg): m/z=357 [M-H]-
Пример 423A
Трет-бутил 4-{3-[(1,1-диоксидотиоморфолин-4-ил)метил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
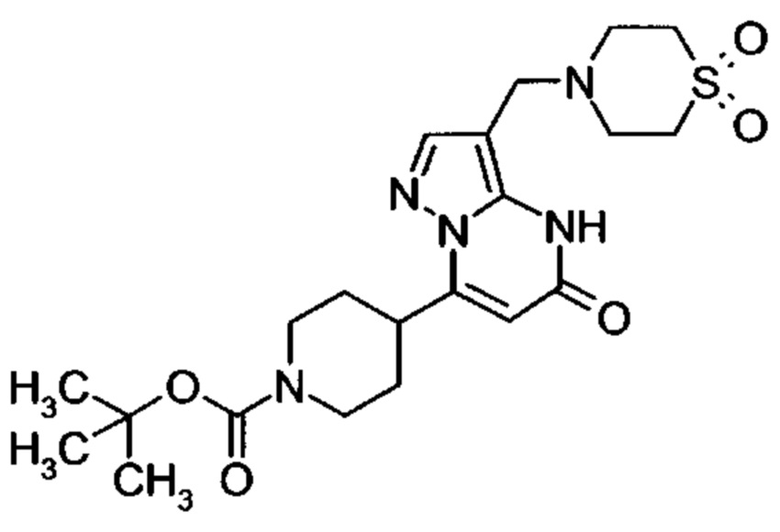
трет-бутил 4-[3-(гидроксиметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (150 мг, 431 мкмоль) и Трифенилфосфин (430 мкл, 1.0 М, 430 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль) и охладили до -18°C. N-Бромсукцинимид (76.6 мг, 431 мкмоль) добавили, и смесь перемешивали в течение 5 мин при -18°C. Тиоморфолин-1,1-диоксид (140 мг, 1.03 ммоль) добавили и перемешивали в течение 10 мин при комнатной температуре, и затем в течение 1 ч при 80°C. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (134 мг, 80% чистота, 54% теоретический выход).
LC-MS (Способ 1B): Rt=0.73 мин; MS (ESIneg): m/z=464 [M-H]-
Пример 424A
Трет-бутил 4-{3-[3-(2,2-диметилциклопропил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
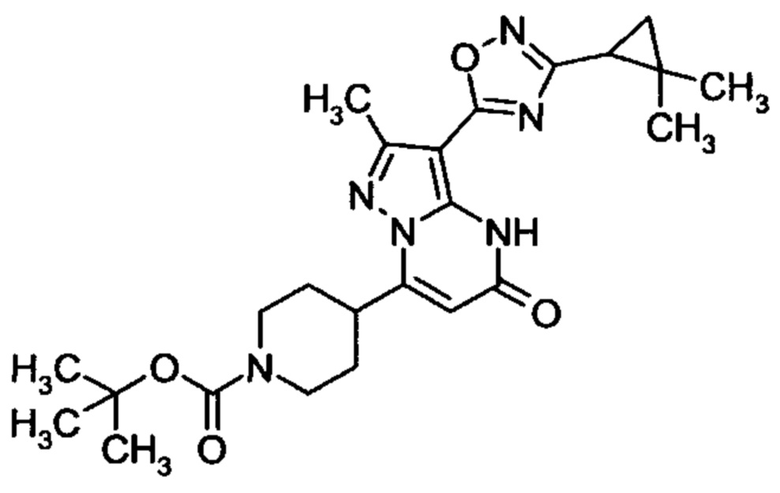
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (3.0 мл, 39 ммоль) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. N'-гидрокси-2,2-диметилциклопропанкарбоксимидамид (102 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 112 мг (100% чистота, 60% теоретический выход).
LC-MS (Способ 11B): Rt=2.41 мин; MS (ESIpos): m/z=469 [M+H]+
Пример 425A
Трет-бутил 4-(2-метил-5-оксо-3-{3-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
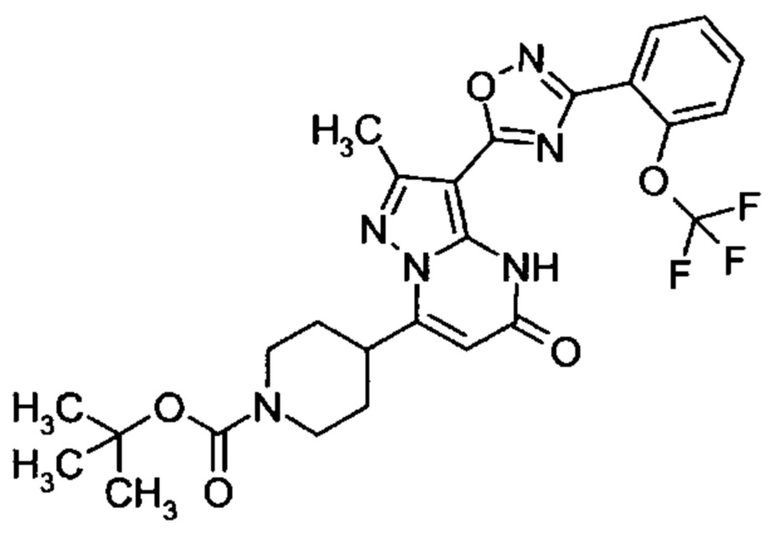
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (3.0 мл, 39 ммоль) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч N'-гидрокси-2-(трифторметокси)бензолкарбоксимидамид (175 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 109 мг (98% чистота, 48% теоретический выход).
LC-MS (Способ 11B): Rt=2.54 мин; MS (ESIpos): m/z=561 [M+H]+
Пример 426A
Трет-бутил 4-[3-(морфолин-4-илметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
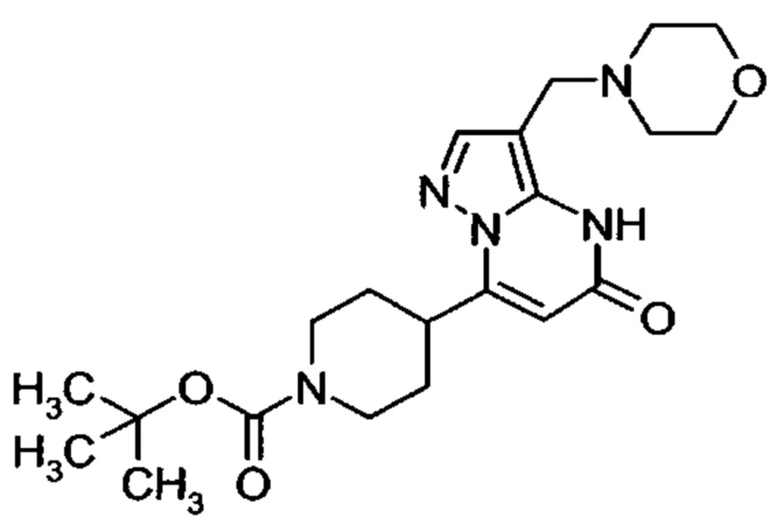
трет-бутил 4-[3-(гидроксиметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (150 мг, 431 мкмоль) и Трифенилфосфин (430 мкл, 1.0 М, 430 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль) и охладили до -18°C. N-Бромсукцинимид (76.6 мг, 431 мкмоль) добавили, и смесь перемешивали в течение 5 мин при -18°C. Морфолин (90 мкл, 1.0 ммоль) добавили и перемешивали в течение 10 мин при комнатной температуре, и затем в течение 1 ч при 80°C. Воду и насыщенный раствор карбоната натрия добавили до достижения значения pH 11. Водную фазу экстрагировали три раза дихлорметаном, высушивали сульфатом натрия и в вакууме. Объединенный остаток очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (117 мг, 95% чистота, 62% теоретический выход).
LC-MS (Способ 11B): Rt=0.57 мин; MS (ESIneg): m/z=416 [M-H]-
Пример 427A
Трет-бутил (2S,4R)-2-(2,2-диметилпропил)-4-{3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
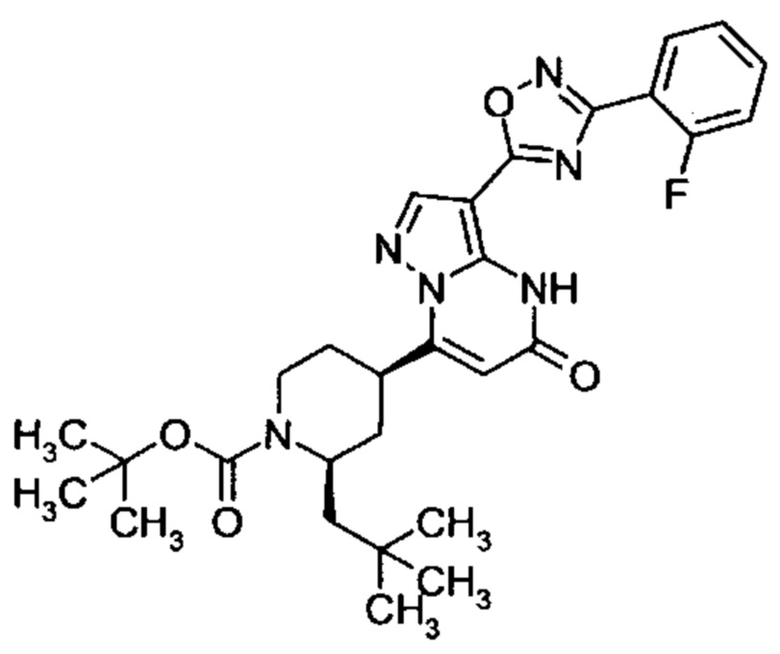
7-[(2S,4R)-1-(трет-бутоксикарбонил)-2-(2,2-диметилпропил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (87.7 мг, 203 мкмоль) растворили в N,N-Диметилформамиде (2.3 мл, 30 ммоль) и обработали N,N-Диизопропилэтиламином (71 мкл, 410 мкмоль) и 1,1'-Карбоилдиимидазолом (65.8 мг, 406 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. 2-фтор-N'-гидроксибензолкарбоксимидамид (62.5 мг, 406 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 32.6 мг (98% чистота, 29% теоретический выход).
LC-MS (Способ 11B): Rt=2.71 мин; MS (ESIneg): m/z=549 [M-H]-
Пример 428A
Трет-бутил 4-[3-(3-циклогексил-1,2,4-оксадиазол-5-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
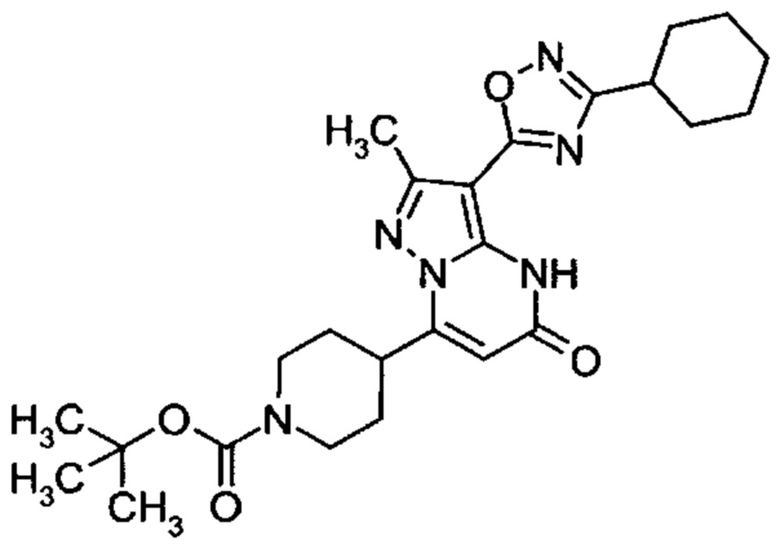
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (3.0 мл, 39 ммоль) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. N'-гидроксициклогексанкарбоксимидамид (113 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 116 мг (100% чистота, 60% теоретический выход).
LC-MS (Способ 1B): Rt=1.37 мин; MS (ESIpos): m/z=483 [M+H]+
Пример 429A
Трет-бутил 4-(5-оксо-3-{[(3,3,3-трифтор-2-оксопропил)сульфанил]карбонимидоил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
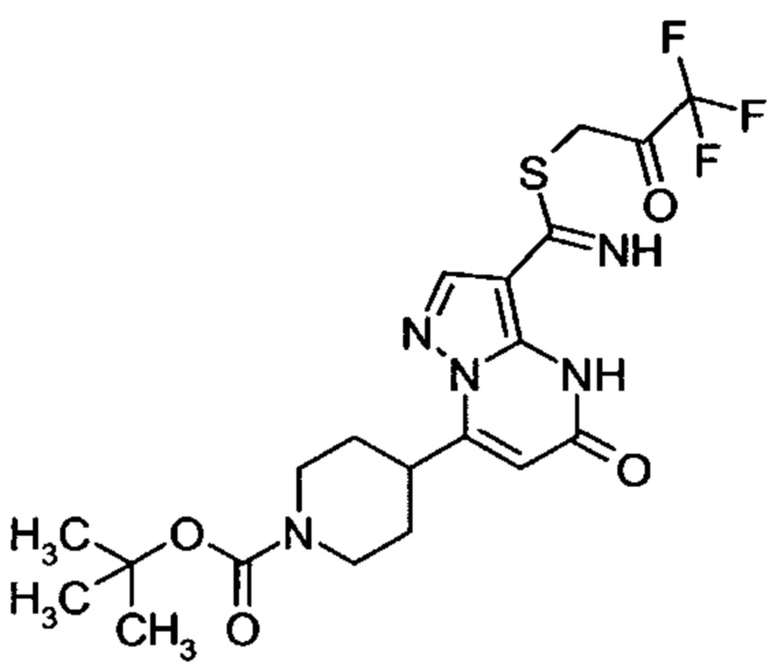
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (127 мг, 336 мкмоль), 3-бром-1,1,1-трифторпропан-2-он (35 мкл, 340 мкмоль), и N,N-Диизопропилэтиламин (290 мкл, 1.7 ммоль) растворили в этаноле (5.1 мл, 87 ммоль) и перемешивали при 70°C в течение 1 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 59.0 мг (100% чистота, 36% теоретический выход).
LC-MS (Способ 1B): Rt=1.04 мин; MS (ESIpos): m/z=488 [M+H]+
Пример 430A
Трет-бутил 4-{5-оксо-3-[4-(трифторметил)-1,3-тиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
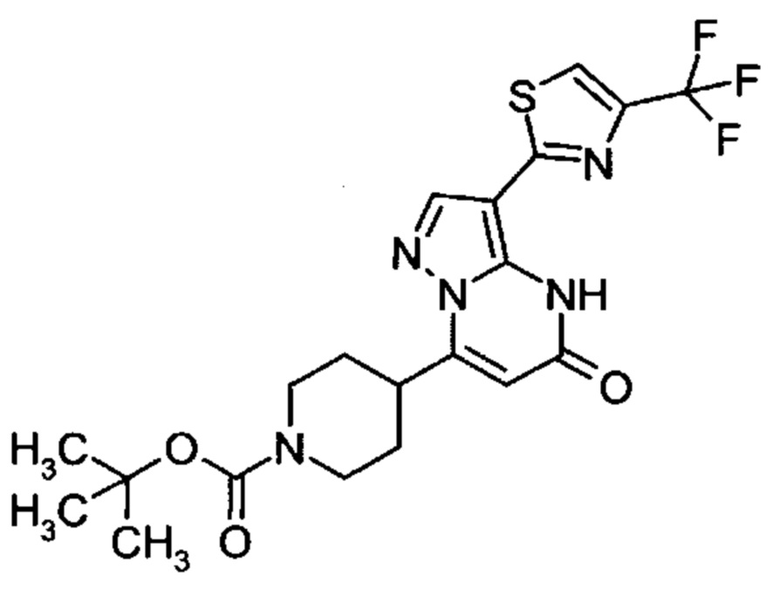
трет-бутил 4-(5-оксо-3-{[(3,3,3-трифтор-2-оксопропил)сульфанил]карбонимидоил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (58.0 мг, 119 мкмоль), реагент Бургесса (39.7 мг, 167 мкмоль) растворили в тетрагидрофуране (2.6 мл, 32 ммоль) и перемешивали при комнатной температуре в течение 2 дней. Смесь нагрели до 70°C в течение 1 ч. Еще реагента Бургесса (1 эквивалент) добавили, и смесь перемешивали при 70°C в течение 20 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 35.2 мг (100% чистота, 63% теоретический выход).
LC-MS (Способ 11B): Rt=2.15 мин; MS (ESIneg): m/z=468 [M-H]-
Пример 431A
Трет-бутил 4-[3-(1H-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
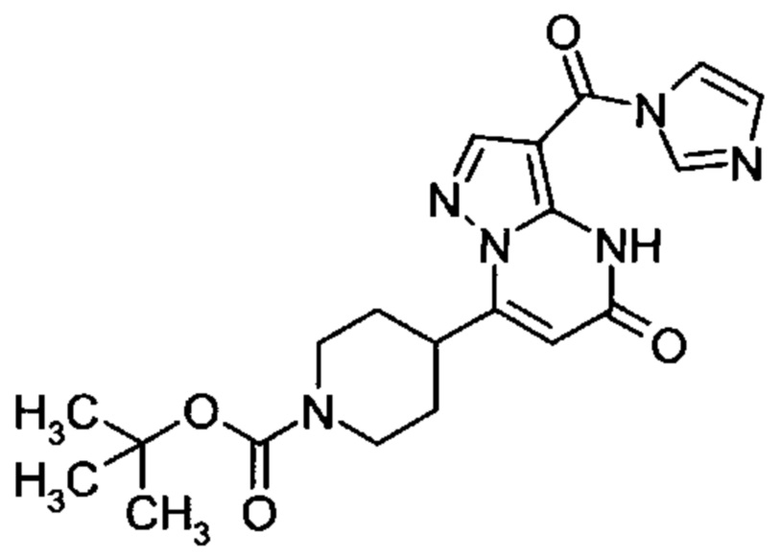
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (1.00 г, 2.76 ммоль) и ди-1H-имидазол-1-илметанон (895 мг, 5.52 ммоль) растворили в тетрагидрофуране (20 мл, 250 ммоль). Смесь перемешивали при 80°C в течение 30 мин. Этилацетат добавили, и полученный осадок отфильтровали, промыли этилацетатом и высушивали в вакууме с получением соединения, указанного в названии (746 мг, 100% чистота, 66% теоретический выход).
LC-MS (Способ 11B): Rt=1.42 мин; MS (ESIpos): m/z=413 [M+H]+
Пример 432A
3-фторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
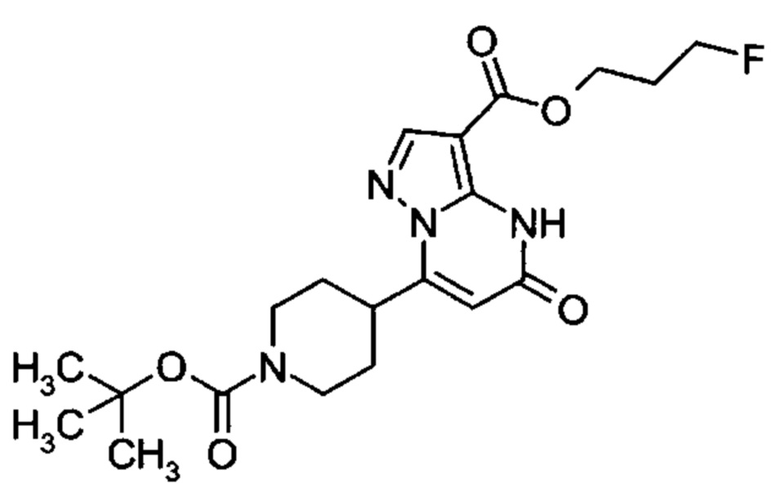
трет-бутил 4-[3-(1H-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 242 мкмоль) растворили в 3-фторпропан-1-оле (947 мг, 12.1 ммоль) и нагревали при 110°C в течение 1 ч. Растворитель удалили, и затем этилацетат и воду добавили. Органическую фазу промыли водой, высушивали посредством фильтрации (Extrelut NT3) и в вакууме. Объединенное количество продукта составило 88.2 мг (100% чистота, 86% теоретический выход).
LC-MS (Способ 11B): Rt=1.81 мин; MS (ESIneg): m/z=421 [M-H]-
Пример 433A
2,2-дифторэтил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
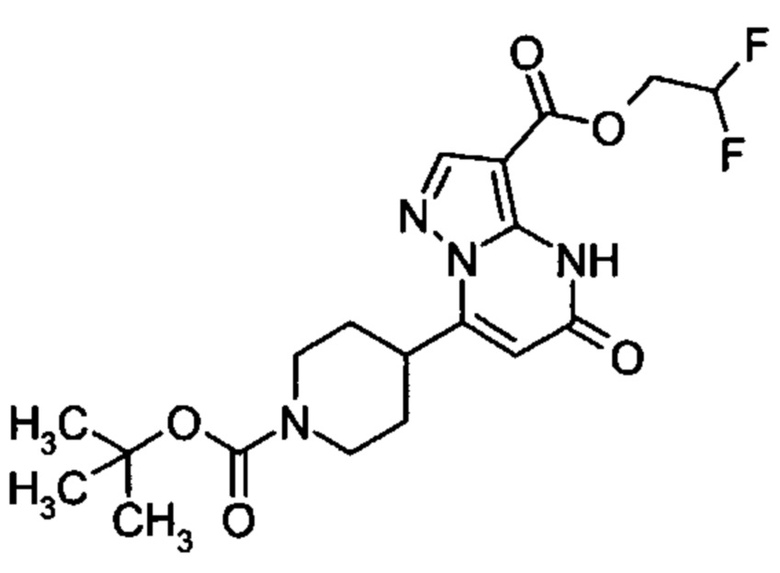
трет-бутил 4-[3-(1H-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 242 мкмоль) растворили в 2,2-дифторэтаноле (398 мг, 4.85 ммоль) и нагревали при возврате флегмы в течение 1 ч. Растворитель удалили, и затем этилацетат и воду добавили. Органическую фазу промыли водой, высушивали посредством фильтрации (Extrelut NT3) и в вакууме. Объединенное количество продукта составило 94.6 мг (100% чистота, 92% теоретический выход).
LC-MS (Способ 11B): Rt=1.81 мин; MS (ESIneg): m/z=425 [M-H]-
Пример 434A
2,2,2-трифторэтил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
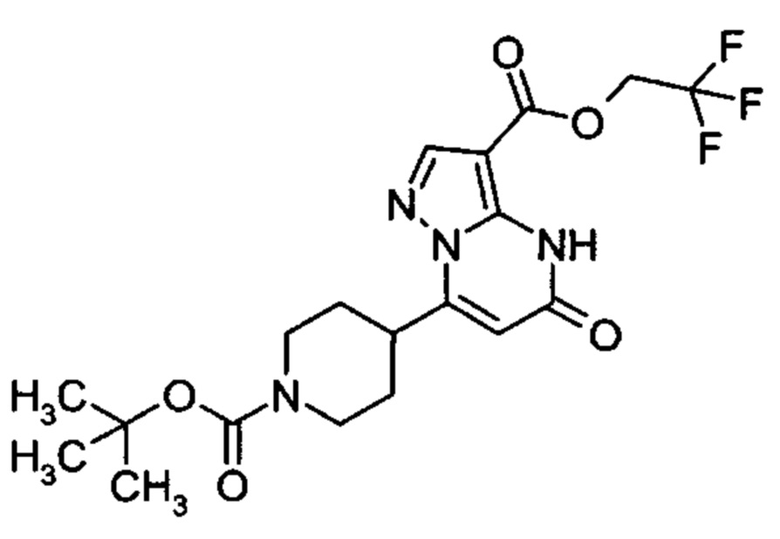
трет-бутил 4-[3-(1H-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 242 мкмоль) растворили в 2,2,2-трифторэтаноле (485 мг, 4.85 ммоль) и нагревали при возврате флегмы в течение 1 ч. Растворитель удалили, и затем этилацетат и воду добавили. Органическую фазу промыли водой, высушивали посредством фильтрации (Extrelut NT3) и в вакууме. Объединенное количество продукта составило 118 мг (90% чистота, 99% теоретический выход).
LC-MS (Способ 11B): Rt=1.94 мин; MS (ESIneg): m/z=443 [M-H]-
Пример 435A
3,3,3-трифторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
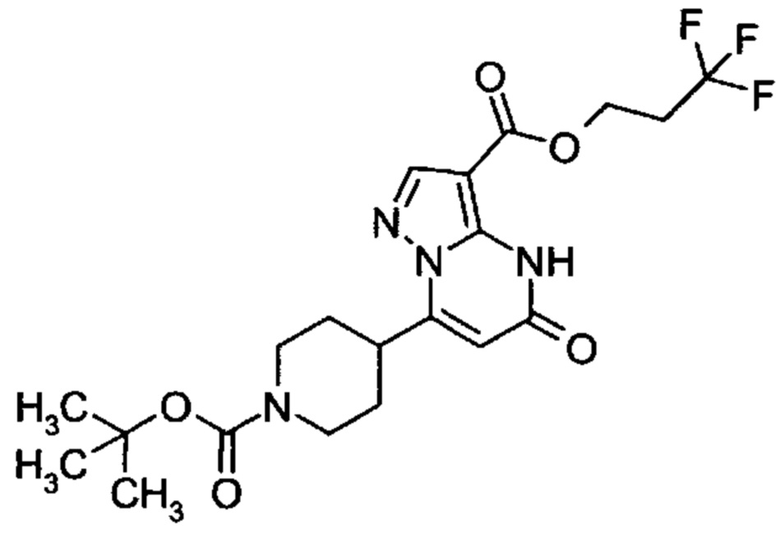
трет-бутил 4-[3-(1H-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 242 мкмоль) растворили в 3,3,3-трифторпропан-1-оле (553 мг, 4.85 ммоль) и нагревали при возврате флегмы в течение 1 ч. Растворитель удалили, и затем этилацетат и воду добавили. Органическую фазу промыли водой, высушивали посредством фильтрации (Extrelut NT3) и в вакууме. Объединенное количество продукта составило 79.7 мг (100% чистота, 72% теоретический выход).
LC-MS (Способ 11B): Rt=1.96 мин; MS (ESIneg): m/z=457 [M-H]-
Пример 436A
Циклобутил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат

трет-бутил 4-[3-(1H-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 242 мкмоль) растворили в циклобутаноле (950 мкл, 12 ммоль) и нагревали при 110°C в течение 1 ч. Растворитель удалили, и затем этилацетат и воду добавили. Органическую фазу промыли водой, высушивали посредством фильтрации (Extrelut NT3) и в вакууме. Объединенное количество продукта составило 131 мг (75% чистота, 97% теоретический выход).
LC-MS (Способ 11B): Rt=2.04 мин; MS (ESIneg): m/z=415 [M-H]-
Пример 437A
Метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
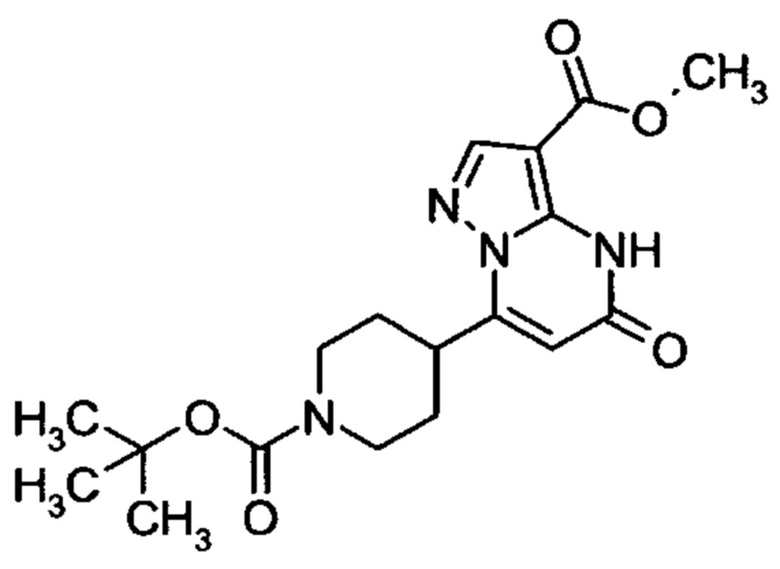
трет-бутил 4-[3-(1H-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 242 мкмоль) растворили в метаноле (5.0 мл, 120 ммоль) и нагревали при возврате флегмы в течение 16 ч. Осадок отфильтровали, промыли метанолом, и высушивали в вакууме. Объединенное количество продукта составило 83.7 мг (100% чистота, 92% теоретический выход).
LC-MS (Способ 11В): Rt=1.68 мин; MS (ESIneg): m/z=375 [M-H]-
Пример 438A
Пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
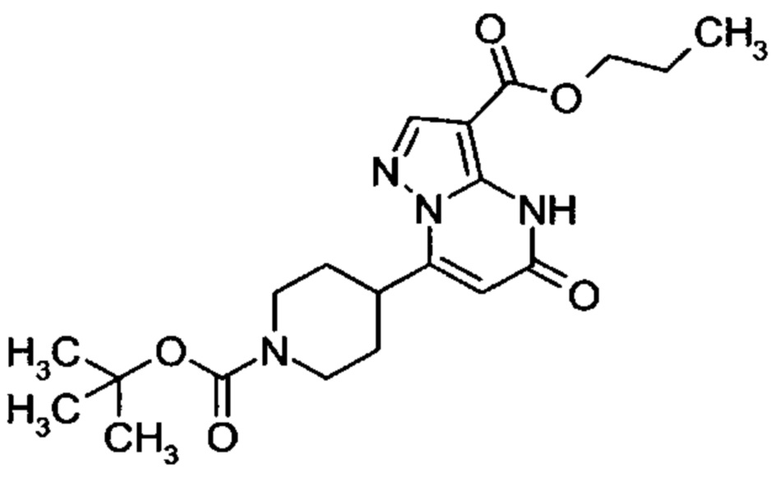
трет-бутил 4-[3-(1H-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 242 мкмоль) растворили в н-пропаноле (5.0 мл, 67 ммоль) и нагревали при возврате флегмы в течение 16 ч. Растворитель удалили, и затем этилацетат и воду добавили. Органическую фазу промыли водой, высушивали посредством фильтрации (Extrelut NT3) и в вакууме. Объединенное количество продукта составило 97.9 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 11B): Rt=2.00 мин; MS (ESIneg): m/z=403 [M-H]-
Пример 439A
Трет-бутил 4-[3-(7-окса-1-азаспиро[3.5]нон-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
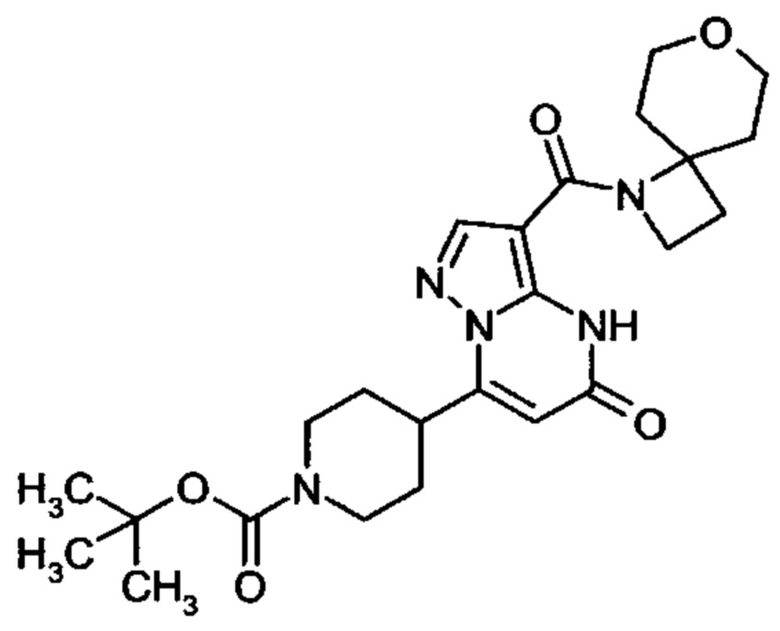
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 414 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (205 мг, 538 мкмоль) и N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль). Затем 7-окса-1-азаспиро[3.5]нонан (105 мг, 828 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавили воду, и смесь очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (66.1 мг, 98% чистота, 33% теоретический выход).
LC-MS (Способ 1B): Rt=0.94 мин; MS (ESIpos): m/z=472 [M+H]+
Пример 440A
Трет-бутил 4-(3-{метил[(1S)-1-фенилэтил]карбамоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
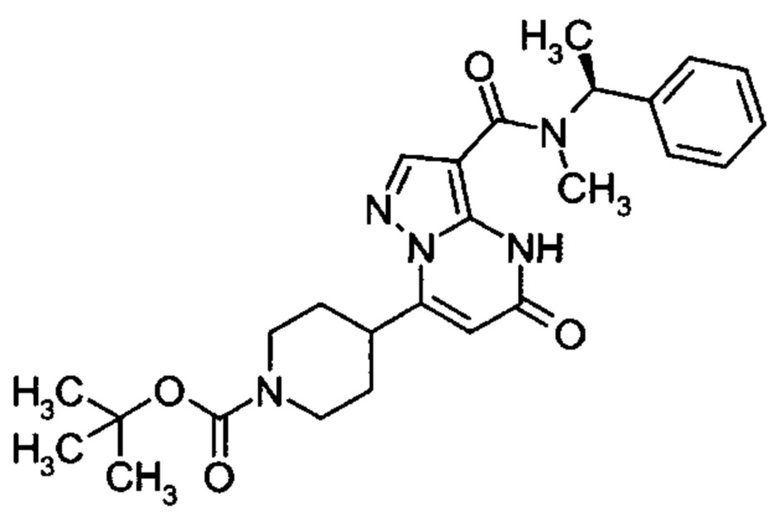
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 414 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (205 мг, 538 мкмоль) и N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль). Затем (1S)-N-метил-1-фенилэтанамин (112 мг, 828 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавили воду, и смесь очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: A = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (88.3 мг, 96% чистота, 43% теоретический выход).
LC-MS (Способ 1B): Rt=1.14 мин; MS (ESIpos): m/z=480 [M+H]+
Пример 441А
Трет-бутил 4-{3-[метил(пиридин-2-илметил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
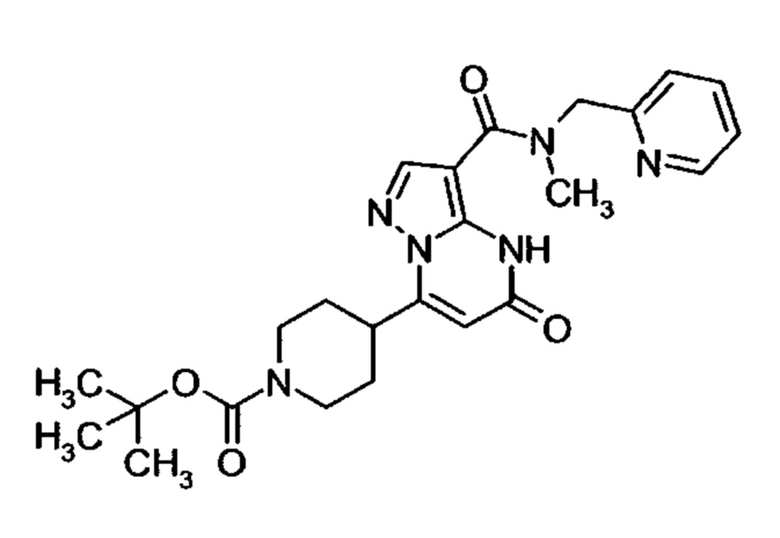
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 414 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (205 мг, 538 мкмоль) и N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль). Затем N-метил-1-(пиридин-2-ил)метанамин (101 мг, 828 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавили воду, и смесь очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (128 мг, 98% чистота, 65% теоретический выход).
LC-MS (Способ 1В): Rt=0.85 мин; MS (ESIpos): m/z=467 [M+H]+
Пример 442А
Трет-бутил 4-{3-[(4,4-дифторпиперидин-1-ил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
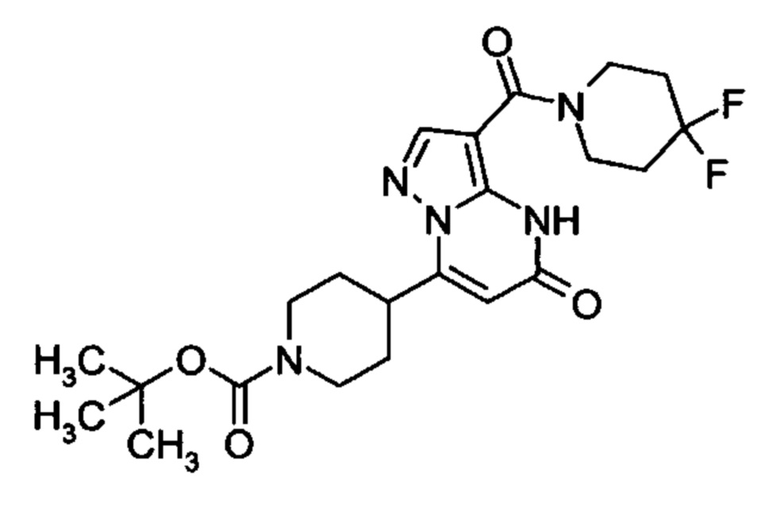
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (150 мг, 414 мкмоль) в диметилформамиде (1.5 мл, 19 ммоль) добавили HATU (205 мг, 538 мкмоль) и N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль). Затем 4,4-дифторпиперидин (100 мг, 828 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавили воду, и смесь очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-2.00 мин = 20%В, 2.20 мин = 60%В, 8.00-12.00 мин = 90%В, 12.10-13.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (40.7 мг, 92% чистота, 20% теоретический выход).
LC-MS (Способ 11B): Rt=1.73 мин; MS (ESIneg): m/z=464 [М-Н]-
Пример 443А
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4-(4-метоксибензил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота
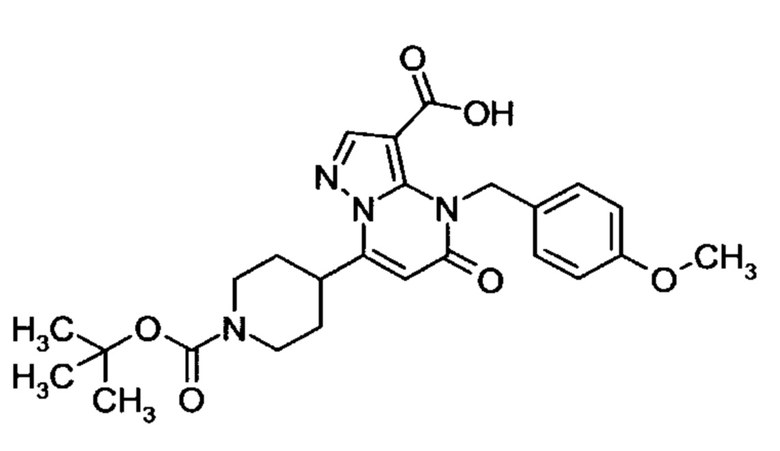
этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4-(4-метоксибензил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (90.0 мг, 176 мкмоль) и водный гидроксид лития (350 мкл, 1.0 М, 350 мкмоль) суспендировали в тетрагидрофуране (2.0 мл, 25 ммоль). Смесь перемешивали при комнатной температуре в течение 16 ч. Еще 2 эквивалента раствора гидроксида лития добавили, и смесь перемешивали в течение 3 дней. Еще 2 эквивалента раствора гидроксида лития добавили, и смесь перемешивали в течение 16 ч. Растворители удалили, затем воду и ацетонитрил добавили. Смесь очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 10%В, 4.50 мин = 20%В, 15.50 мин = 85%В, 16.00-18.50 мин = 100%В, 18.75.00-22.00 мин = 20%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (67.0 мг, 100% чистота, 79% теоретический выход).
LC-MS (Способ 1B): Rt=0.99 мин; MS (ESIpos): m/z=483 [М+Н]+
Пример 444А
Трет-бутил 4-(3-{[(2S)-2-метилпирролидин-1-ил]метил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
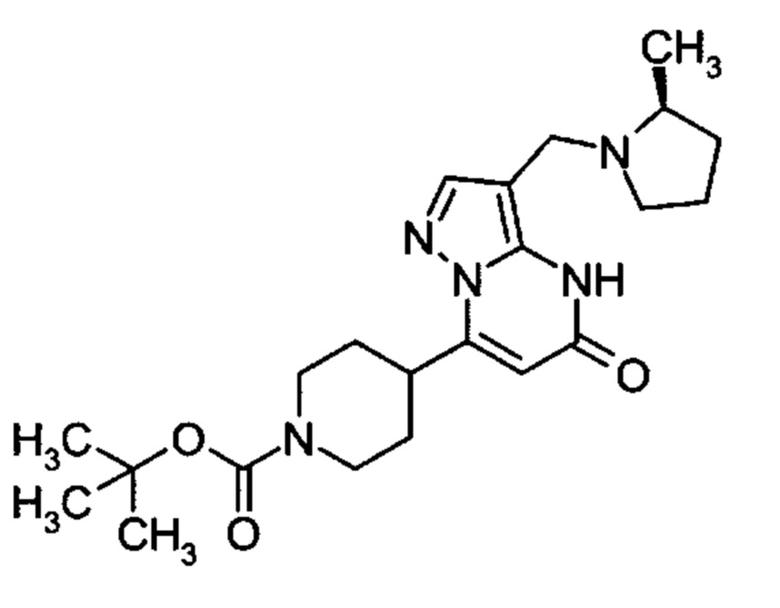
трет-бутил 4-[3-(гидроксиметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (150 мг, 431 мкмоль) и Трифенилфосфин (430 мкл, 1.0 М, 430 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль) и охладили до -18°C. N-Бромсукцинимид (76.6 мг, 431 мкмоль) добавили, и смесь перемешивали в течение 5 мин при -18°C. (2S)-2-метилпирролидин (88.0 мг, 1.03 ммоль) добавили и перемешивали в течение 10 мин при комнатной температуре, и затем в течение 1 ч при 80°C. Добавили воду, и очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (9.2 мг, 100% чистота, 5% теоретический выход).
MS (Способ 1B): Rt=0.67 мин; MS (ESIpos): m/z=416 [М+Н]+
Пример 445А
Циклобутил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
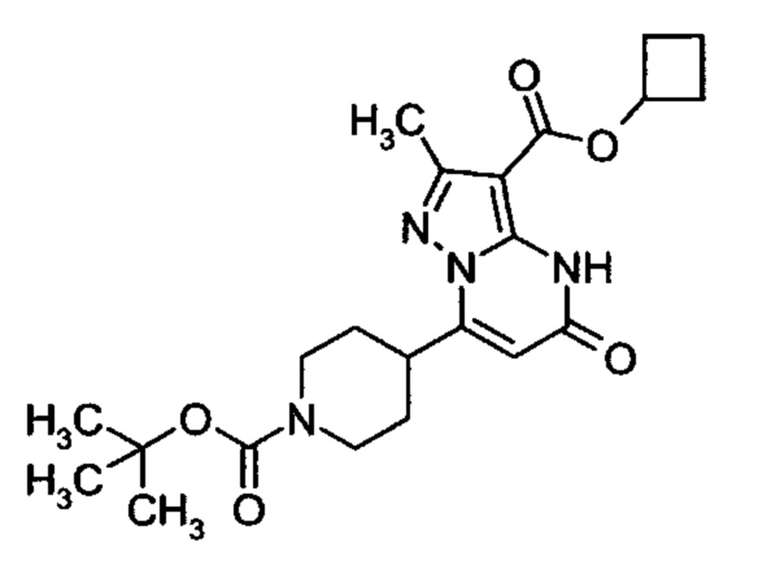
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль), и N,N'-Карбонилдиимидазол (86.2 мг, 531 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 15 мин. Растворители удалили в вакууме. Циклобутанол (95.8 мг, 1.33 ммоль) добавили, и смесь перемешивали при комнатной температуре в течение 18 ч. Растворители удалили, и пропан-2-ол (5 мл) добавили. Смесь нагревали при 105°C в течение 1 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (132 мг, 100% чистота, 59% теоретический выход)
LC-MS (Способ 11B): Rt=2.20 мин; MS (ESIneg): m/z - 429 [М-Н]-
Пример 446А
Пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (2.0 мл, 25 ммоль), и N,N'-Карбонилдиимидазол (86.2 мг, 531 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 15 мин. Растворители удалили в вакууме. Пропан-1-ол (79.8 мг, 1.33 ммоль) добавили, и смесь перемешивали при комнатной температуре в течение 18 ч. Растворители удалили, и пропан-2-ол (5 мл) добавили. Смесь нагревали при 105°C в течение 1 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (88.2 мг, 95% чистота, 75% Выход теоретический выход).
LC-MS (Способ 11B): Rt=2.14 мин; MS (ESIneg): m/z=417 [М-Н]-
Пример 447А
Пропан-2-ил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
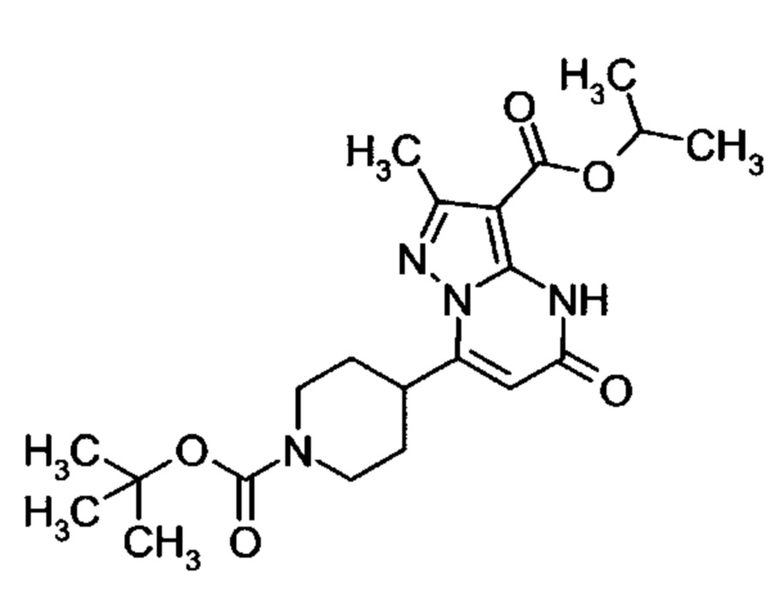
трет-бутил 4-[3-(1Н-имидазол-1-илкарбонил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (142 мг, 332 мкмоль) растворили в пропан-2-оле (510 мкл, 6.6 ммоль) и нагревали при 110°C в течение 1 ч. Смесь очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (72.9 мг, 100% чистота, 52% теоретический выход).
LC-MS (Способ 1B): Rt=1.16 мин; MS (ESIneg): m/z=417 [М-Н]-
Пример 448А
2,2,2-трифторэтил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
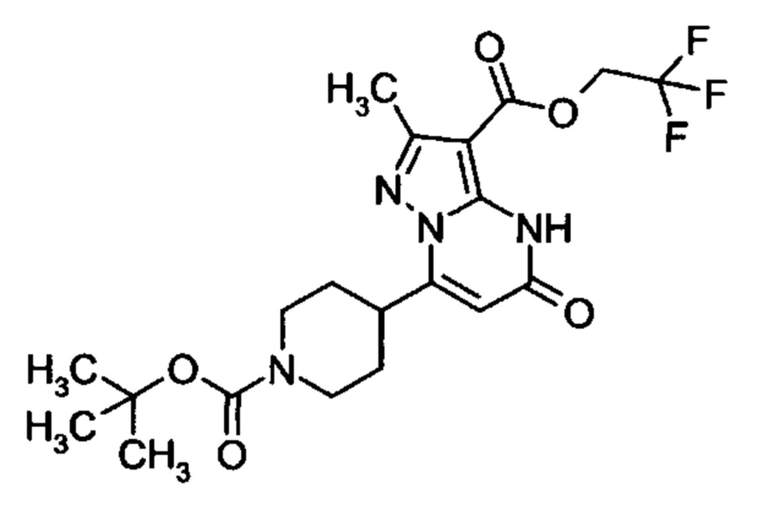
трет-бутил 4-[3-(1Н-имидазол-1-илкарбонил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (142 мг, 332 мкмоль) растворили в 2,2,2-трифторэтаноле (500 мкл, 6.6 ммоль) и нагревали при 110°C в течение 1 ч. Смесь очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (116 мг, 100% чистота, 76% теоретический выход).
LC-MS (Способ 1B): Rt=1.15 мин; MS (ESIneg): m/z=457 [М-Н]-
Пример 449А
Этил 4-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-оксо-1,2-дигидроимидазо[1,5-а]пиримидин-8-карбоксилат
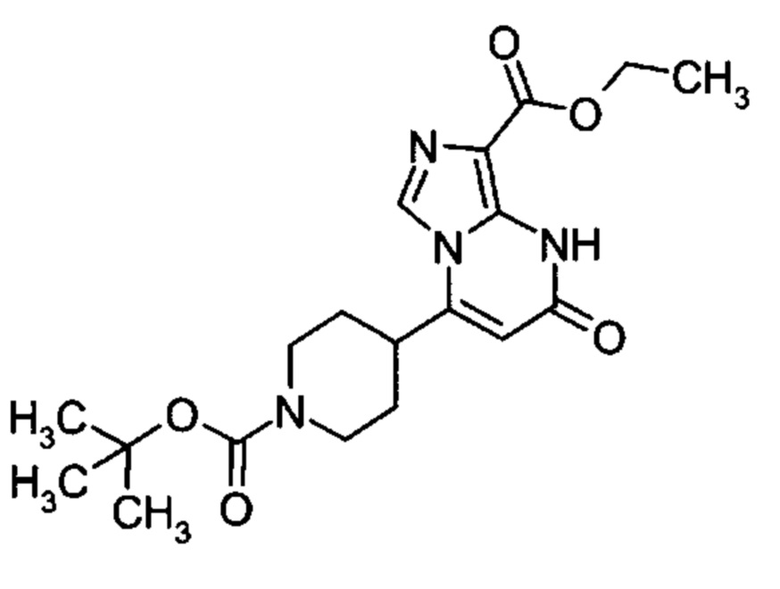
этил 5-амино-1Н-имидазоле-4-карбоксилат (808 мг, 5.21 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилат (1.85 г, 5.21 ммоль) нагревали в ацетонитриле (25 мл, 530 ммоль) при 60°C в течение 1.5 ч. Растворители удалили. 1-Метокси-2-пропанол (25 мл, 260 ммоль) и трифосфат калия (2.21 г, 10.4 ммоль) добавили, и смесь нагревали с возвратом флегмы в течение 2 дней. Растворители удалили, и остаток очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (109 мг, 89% чистота, 5% теоретический выход).
LC-MS (Способ 11B): Rt=1.42 мин; MS (ESIpos): m/z=391 [М+Н]+
Пример 450А
Трет-бутил 4-{3-[метокси(метил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
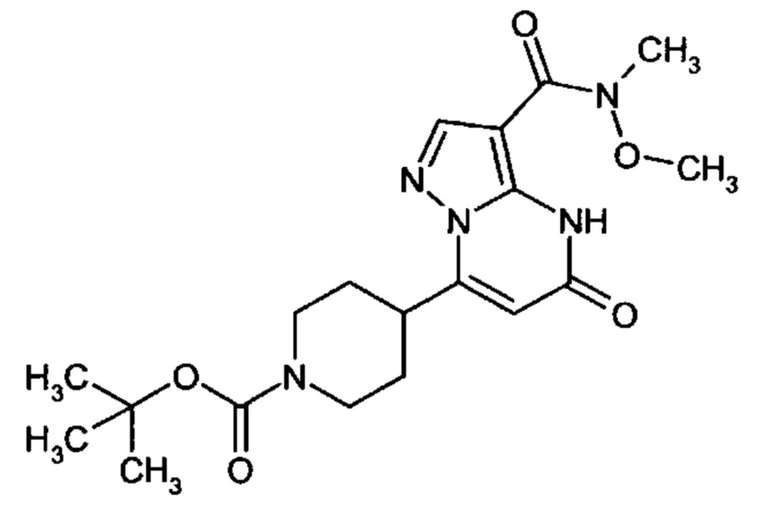
К раствору 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (10.0 г, 27.6 ммоль) в ацетонитриле (150 мл) добавили последовательно 4-диметиламинопиридин (135 мг, 1.10 ммоль), 1-гидроксибензотриазол гидрат (6.34 г, 41.4 ммоль), и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (7.94 г, 41.4 ммоль). Смесь перемешивали 15 мин при комнатной температуре перед добавлением раствора N-метоксиметанамин гидрохлорида (1:1) (6.73 г, 69.0 ммоль) и этилдиизопропиламина (14 мл, 83 ммоль) в ацетонитриле (20 мл) по каплям. Раствор перемешивали всю ночь при комнатной температуре, концентрировали и разбавили 500 мл дихлорметана. Органическую фазу промыли дважды насыщенным водным раствором гидрокарбоната натрия и 1Н водным раствором соляной кислоты перед высушиванием, высушивали над сульфатом натрия и концентрировали с получением соединения, указанного в названии. Полученное количество составило 10.5 г (91% чистота, 85% теоретический выход).
LC-MS (Способ 8В): Rt=1.18 мин; MS (ESIneg): m/z=404 [М-Н]-
Пример 451А
Трет-бутил 4-(3-ацетил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
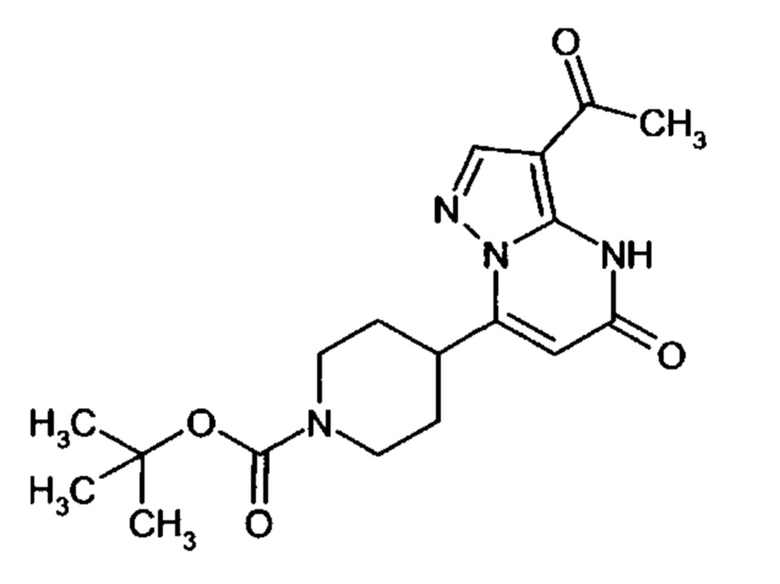
Раствор трет-бутил 4-{3-[метокси(метил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (1.00 г, 94% чистота, 2.32 ммоль) в ТГФ (10 мл) добавили по каплям в атмосфере аргона к раствору бром(метил)магния (3.9 мл, 3.0 М в простом диэтиловом эфире, 12 ммоль), который предварительно разбавили ТГФ (10 мл) и предварительно охладили до 0°C. Ледяную баню удалили, и смесь перемешивали всю ночь при комнатной температуре. Неочищенную смесь затем разбавили 200 мл этилацетата. Органическую фазу промыли одни раз с помощью 5% водного раствора гидрокарбоната натрия и дважды с помощью 1Н водного раствора соляной кислоты, перед высушиванием, высушивали над сульфатом натрия и концентрировали с получением соединения, указанного в названии. Полученное количество составило 690 мг (96% чистота, 79% теоретический выход).
LC-MS (Способ 11В): Rt=1.52 мин; MS (ESIneg): m/z=359 [М-Н]-
Пример 452А
Трет-бутил 4-[3-(2-бромпропаноил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
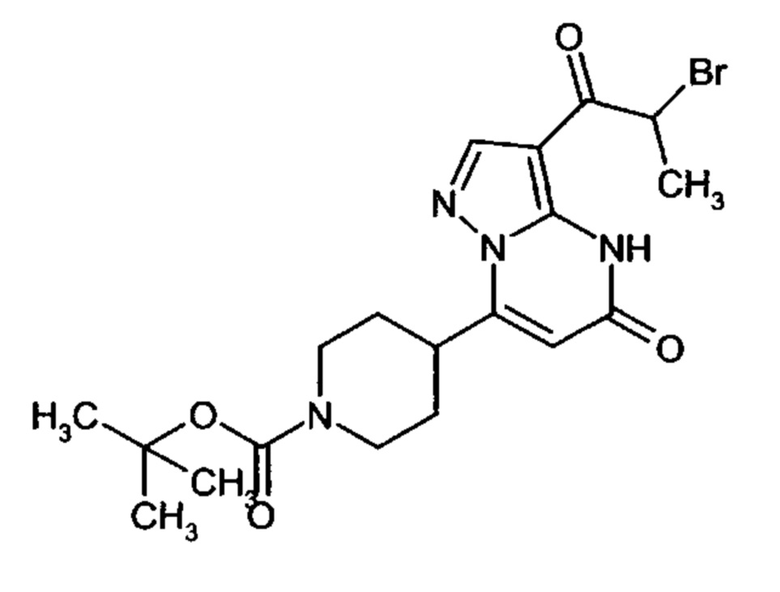
К раствору трет-бутил 4-(5-оксо-3-пропаноил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (100 мг, 267 мкмоль) в тетрагидрофуране (6.0 мл) при комнатной температуре добавили пиридиния трибромид (85.4 мг, 267 мкмоль). Смесь перемешивали 48 ч при комнатной температуре перед растворением в ацетонитриле (10 мл) и воде (1.0 мл). Раствор очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 44.0 мг (94% чистота, 34% теоретический выход).
LC-MS (Способ 1B): Rt=1.00 мин; MS (ESIneg): m/z=451 [М-Н]-
Пример 453А
Tpeт-бутил 4-(5-[(4-метоксибензил)окси]-3-{4-метил-2-[4-(трифторметил)фенил]-1,3-тиазол-5-ил}пиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
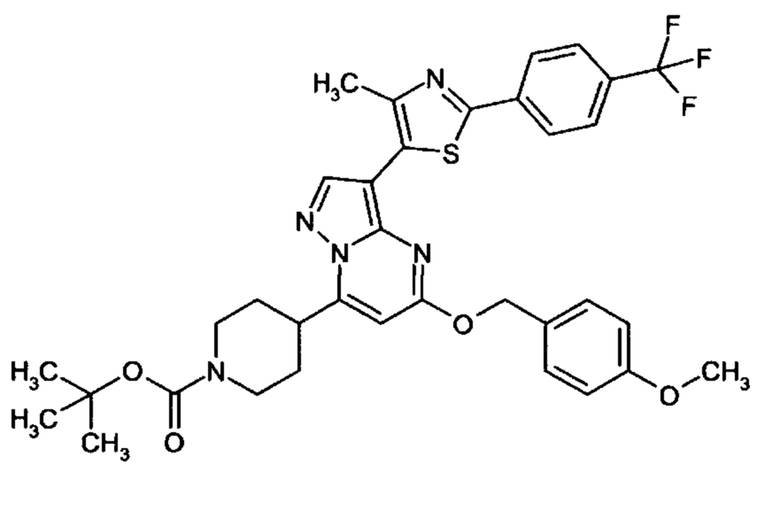
К суспензии трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (50.0 мг, 96.6 мкмоль) в 1,4-диоксане (2.0 мл) добавили 4-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2-[4-(трифторметил)фенил]-1,3-тиазол (42.8 мг, 116 мкмоль), трифосфат калия (290 мкл, 1.0 М в воде, 290 мкмоль) и XPhos Pd G3 (4.09 мг, 4.83 мкмоль). Смесь дегазировали аргоном 2 мин и перемешивали 1 ч при 110°C. После охлаждения до комнатной температуры смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 55.8 мг (100% чистота, 85% теоретический выход).
LC-MS (Способ 11B): Rt=3.17 мин; MS (ESIpos): m/z=680 [М+Н]+
Пример 454А
Трет-бутил 4-{3-ацетил-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
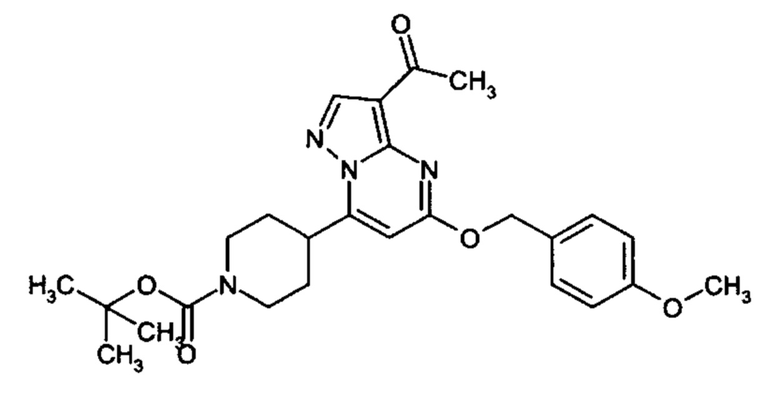
К раствору трет-бутил 4-(3-ацетил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (250 мг, 694 мкмоль) в N,N-Диметилформамиде (25 мл) в атмосфере аргона добавили карбонат калия (144 мг, 1.04 ммоль) и 1-(хлорметил)-4-метоксибензол (339 мкл, 694 мкмоль). Смесь перемешивали всю ночь при комнатной температуре и отфильтровали на микрофильтре перед очисткой посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 218 мг (100% чистота, 65% теоретический выход).
LC-MS (Способ 11В): Rt=2.35 мин; MS (ESIneg): m/z=479 [М-Н]-
Пример 455А
Трет-бутил 4-(5-оксо-3-пропаноил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
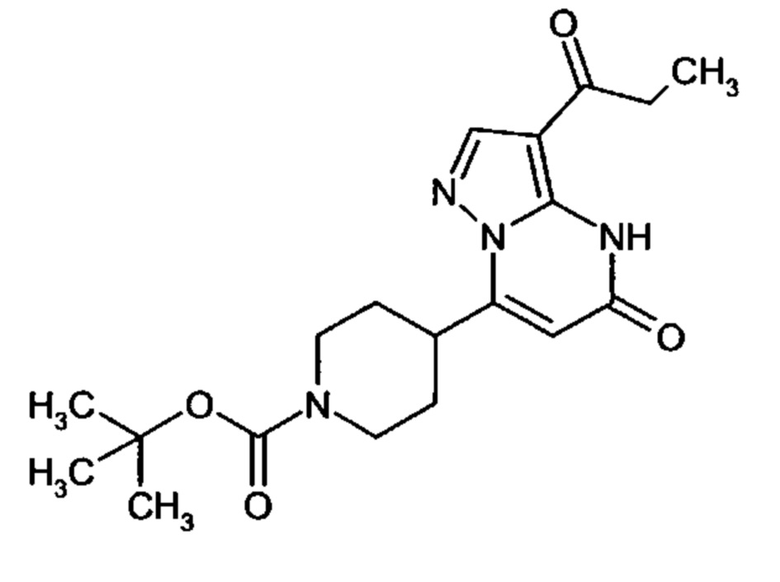
Раствор трет-бутил 4-{3-[метокси(метил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (1.00 г, 94% чистота, 2.32 ммоль) в ТГФ (10 мл) добавили по каплям в атмосфере аргона к раствору бром(этил)магния (7.0 мл, 1.0 М в ТГФ, 7.0 ммоль), который предварительно разбавили ТГФ (10 мл) и предварительно охладили до 0°C. Ледяную баню удалили, и смесь перемешивали всю ночь при комнатной температуре. Смесь снова охладили до 0°C, еще одну порцию бром(этил)магния (2.3 мл, 1.0 М в ТГФ, 2.3 ммоль) добавили по каплям, и перемешивание продолжали при комнатной температуре в течение 2 дней. Неочищенную смесь затем разбавили 200 мл этилацетата. Органическую фазу промыли одни раз с помощью 5% водного раствора гидрокарбоната натрия и дважды с помощью 1Н водного раствора соляной кислоты, перед высушиванием, высушивали над сульфатом натрия и концентрировали с получением соединения, указанного в названии. Полученное количество составило 570 мг (91% чистота, 60% теоретический выход).
LC-MS (Способ 11B): Rt=1.74 мин; MS (ESIneg): m/z=373 [М-Н]-
Пример 456А
Трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(2-фенил-1,3-оксазол-4-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
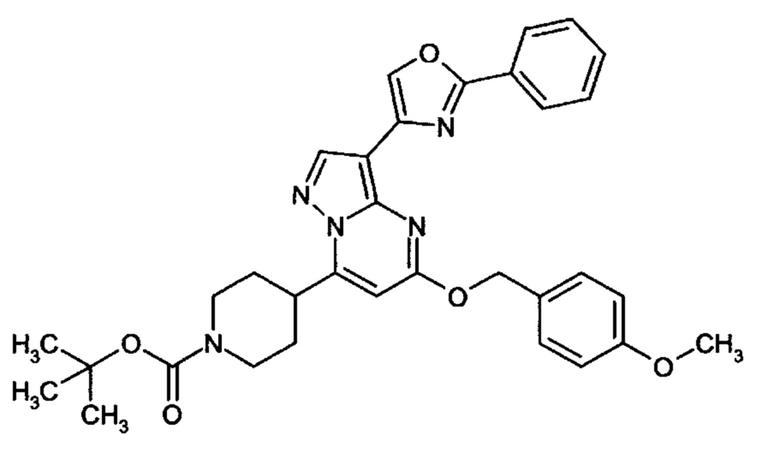
трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (200 мг, 387 мкмоль)
2-фенил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-оксазол (126 мг, 464 мкмоль)
XPhos Pd G3 (16.4 мг, 19.3 мкмоль)
1,4-диоксан (3.5 мл)
Трифосфат калия (1.2 мл, 1.0 М в воде, 1.2 ммоль)
Соединение, указанное в названии, получили согласно той же методике, как в примере 451А. Полученное количество составило 146 мг (100% чистота, 65% теоретический выход).
LC-MS (Способ 1B): Rt=1.52 мин; MS (ESIpos): m/z=582 [М+Н]+
Пример 457А
Трет-бутил 4-(2-бром-3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
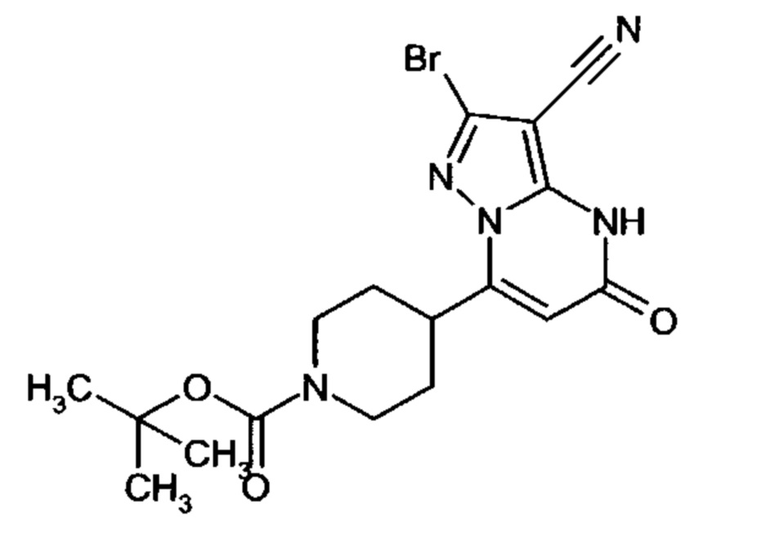
Смесь 5-амино-3-бром-1Н-пиразол-4-карбонитрила (3.00 г, 16.0 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата (6.27 г, 17.6 ммоль) в ацетонитриле (200 мл) перемешивали в атмосфере аргона всю ночь при 60°C, и затем концентрировали. 1-Метокси-2-пропанол (200 мл) и трифосфат калия (6.81 г, 32.1 ммоль) добавили, и полученную смесь перемешивали в течение 2 ч при 110°C перед концентрированием. Выделенную неочищенную смесь разбавили в смеси ацетонитрила и диметил сульфоксида, и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Выпаривание ацетонитрила из объединенных фракций продукта вызвало осаждение твердого вещества (в водной фазе), которое отфильтровали и высушивали под высоким вакуумом с получением соединения, указанного в названии. Полученное количество составило 5.35 г (100% чистота, 79% теоретический выход).
LC-MS (Способ 1B): Rt=0.97 мин; MS (ESIneg): m/z=420 [М-Н]-
Пример 458А
Трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(1,2-тиазол-5-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
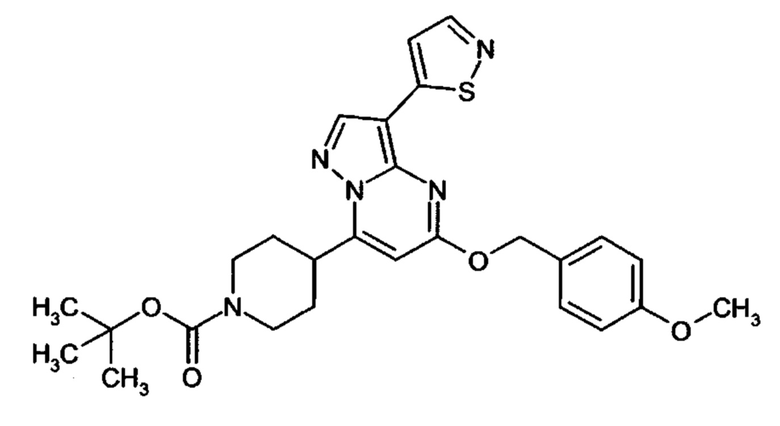
К суспензии трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (100 мг, 193 мкмоль) в 1,4-диоксане (4.0 мл) добавили 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-тиазол (81.6 мг, 387 мкмоль), трифосфат калия (970 мкл, 1.0 М в воде, 970 мкмоль) и XPhos Pd G3 (4.09 мг, 4.83 мкмоль). Смесь дегазировали аргоном 2 мин и перемешивали всю ночь при 110°C. Новую порцию 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-тиазола (81.6 мг, 387 мкмоль) и XPhos Pd G3 (4.09 мг, 4.83 мкмоль) добавили, и смесь перемешивали в течение 2 ч при 110°C. Последнюю порцию 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-тиазола (81.6 мг, 387 мкмоль) и XPhos Pd G3 (4.09 мг, 4.83 мкмоль) добавили, и смесь перемешивали всю ночь при 80°C и еще 1 час при 110°C. После охлаждения до комнатной температуры смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 26.0 мг (100% чистота, 26% теоретический выход).
LC-MS (Способ 8В): Rt=1.67 мин; MS (ESIpos): m/z=522 [М+Н]+
Пример 459А
Трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(1-метил-1Н-пиразол-5-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
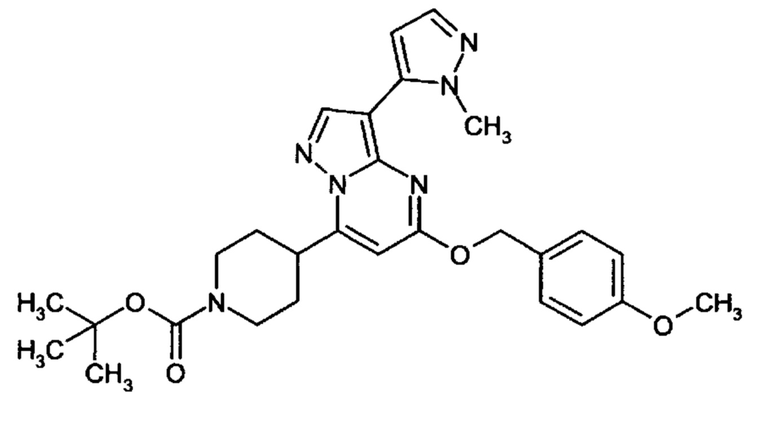
К суспензии трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (300 мг, 580 мкмоль) в 1,4-диоксане (12 мл) добавили 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-пиразол (145 мг, 696 мкмоль), трифосфат калия (1.7 мл, 1.0 М в воде, 1.7 ммоль) и XPhos Pd G3 (24.5 мг, 29.0 мкмоль). Смесь дегазировали аргоном 2 мин и перемешивали 1 ч при 100°C. После охлаждения до комнатной температуры смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 200 мг (97% чистота, 65% теоретический выход).
LC-MS (Способ 8В): Rt=1.57 мин; MS (ESIpos): m/z=519 [М+Н]+
Пример 460А
Трет-бутил 4-{5-[(4-метоксибензил)окси]-3-[2-(морфолин-4-ил)-1,3-тиазол-5-ил]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
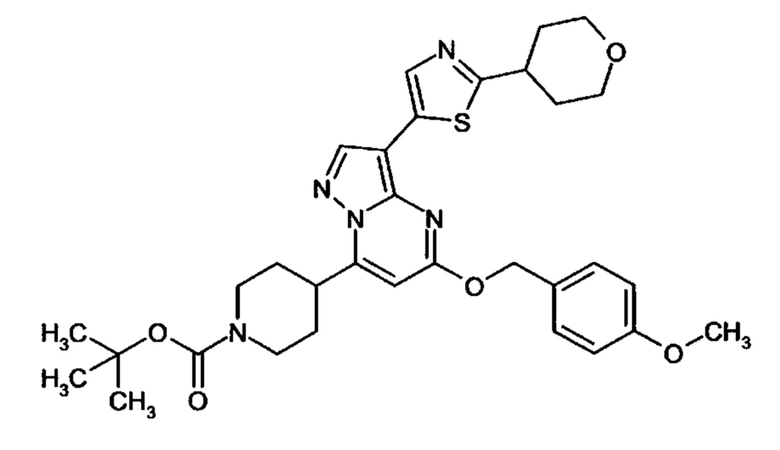
трет-бутил 4-{3-бром-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат (100 мг, 193 мкмоль)
4-[5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-тиазол-2-ил]морфолин (68.7 мг, 232 мкмоль)
XPhos Pd G3 (8.18 мг, 9.66 мкмоль)
1,4-диоксан (4.0 мл)
Трифосфат калия (580 мкл, 1.0 М в воде, 580 мкмоль)
Соединение, указанное в названии, получили согласно той же методике, как в примере 457А. Полученное количество составило 74.0 мг (100% чистота, 63% теоретический выход).
LC-MS (Способ 1B): Rt=1.40 мин; MS (ESIpos): m/z=607 [М+Н]+
Пример 461А
Трет-бутил 4-[3-(2,2-диметилбутанимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
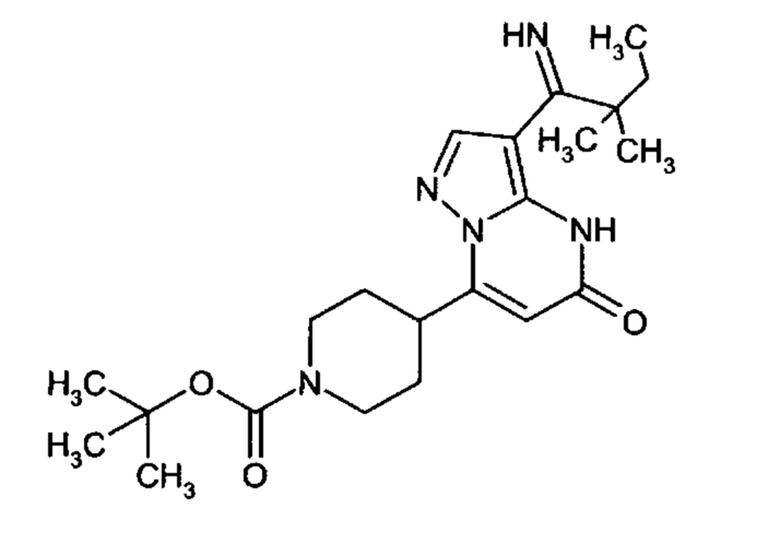
Раствор трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (200 мг, 582 мкмоль) и хлор(2-метилбутан-2-ил)магния (2.9 мл, 1.0 М в простом диэтиловом эфире, 2.9 ммоль) в тетрагидрофуране (1.0 мл) перемешивали всю ночь при комнатной температуре в атмосфере аргона. Реакционную смесь перемешивали при 40°C еще одну ночь перед разбавлением и перемешиванием с этилацетатом и соляной кислотой (1Н раствор в воде). Органическую фазу экстрагировали, высушивали над сульфатом натрия и концентрировали. Смесь очистили дважды посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Фракции, содержащие имин (соединение, указанное в названии) или соответствующий кетон, объединили, выпарили и применяли на следующей стадии (26.0 мг).
LC-MS (Способ 8В): Rt=1.15 мин; MS (ESIneg): m/z=414 [М-Н]-
Пример 462А
Трет-бутил 4-{3-[N'-гидрокси-N-(3-метилбутаноил)карбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
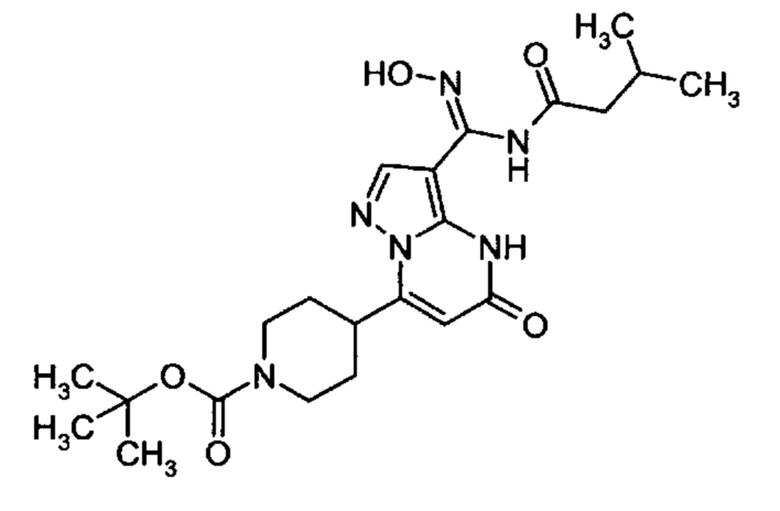
0.2 мл (1.16 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.13 мл (1.16 ммоль) 3-метилбутановой кислоты и 440 мг (1.16 ммоль) 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (10 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 600 мг (1.05 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Воду (25 мл) добавили, и смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 640 мг (0.96 ммоль; 91% теоретический выход; чистота: 69%) целевого соединения.
LC-MS (Способ 13 В): Rt=1.97 мин; m/z=459 (М-1)-
Пример 463А
Трет-бутил 4-[3-(N-гептаноил-N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
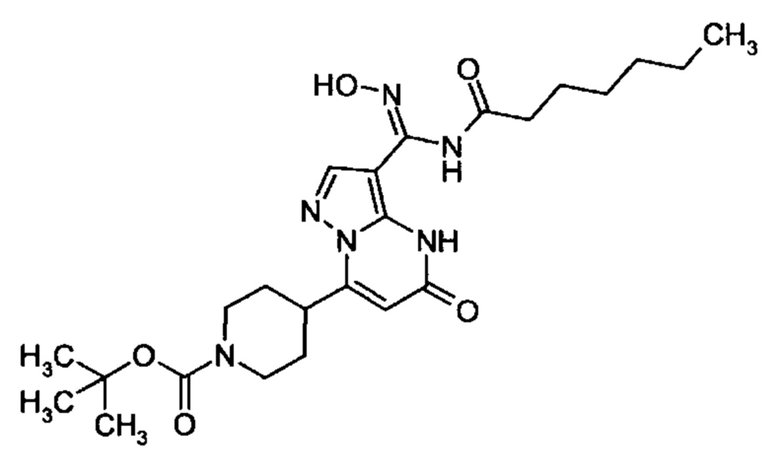
0.2 мл (1.16 ммоль) N,N-Диизопропилэтиламин добавили к смеси 0.15 г (1.16 ммоль) гептановой кислоты и 440 мг (1.16 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 600 мг (1.05 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Воду (25 мл) добавили, и смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 1.0 г (0.96 ммоль; 105% теоретический выход; чистота: 54%) целевого соединения.
LC-MS (Способ 13В): Rt=2.10 мин; m/z=487 (М-1)-
Пример 464А
Трет-бутил 4-{3-[N-(циклопропилкарбонил)-N'-гидроксикарбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
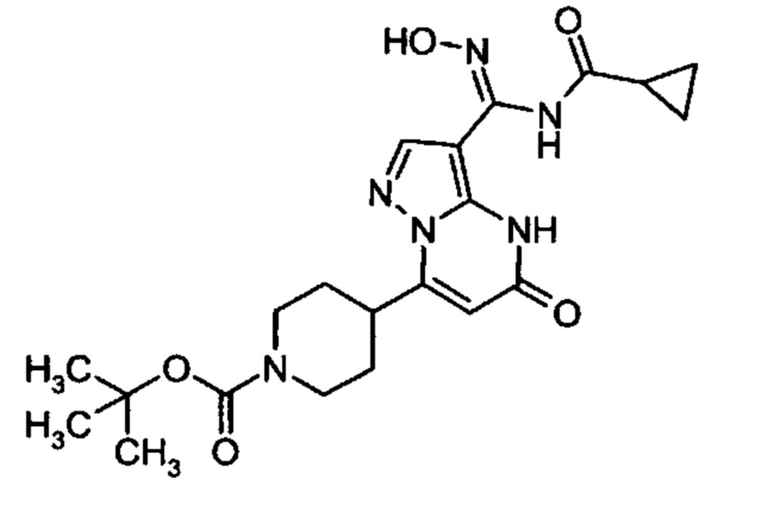
0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.11 г (1.25 ммоль) циклопропанкарбоновой кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 560 мг (1.0 ммоль; 88% теоретический выход; чистота: 80%) целевого соединения.
LC-MS (Способ 13В): Rt=1.88 мин; m/z=443 (М-1)-
Пример 465А
Rac-трет-бутил 4-(3-{N'-гидрокси-N-[(1-метилциклопропил)карбонил]карбамимидоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.13 г (1.25 ммоль) rac-1-метилциклопропанкарбоновой кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и мутную смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 575 мг (0.98 ммоль; 86% теоретический выход; чистота: 78%) целевого соединения.
LC-MS (Способ 13 В): Rt=1.94 мин; m/z=457 (М-1)-
Пример 466А
Трет-бутил rel-4-[3-(N'-гидрокси-N-{[(1R,2S)-2-метилциклопропил]карбонил}карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.13 г (1.25 ммоль) 2-метилциклопропанкарбоновой кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и мутную смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 760 мг (1.21 ммоль; 106% теоретический выход; чистота: 73%) целевого соединения.
LC-MS (Способ 13В): Rt=1.94 мин; m/z=459 (М+1)+
Пример 467А
Трет-бутил 4-{3-[N'-гидрокси-N-(3-метилбут-2-еноил)карбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.13 г (1.25 ммоль) 3-метилбут-2-еновой кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и мутную смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 944 мг (1.44 ммоль; 126% теоретический выход; чистота: 70%) целевого соединения.
LC-MS (Способ 13В): Rt=1.96 мин; m/z=457 (М-1)-
Пример 468А
Трет-бутил 4-{3-[N-(циклопентилиденацетил)-N'-гидроксикарбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.16 г (1.25 ммоль) 2-циклопентилиденуксусной кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и мутную смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 1.1 г (1.61 ммоль; 141% теоретический выход; чистота: 71%) целевого соединения.
LC-MS (Способ 13В): Rt=2.02 мин; m/z=483 (М-1)-
Пример 469А
Трет-бутил 4-{3-[N-(циклопентилкарбонил)-N'-гидроксикарбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.13 г (1.14 ммоль) циклопентанкарбоновой кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и мутную смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 1.1 г (1.89 ммоль; 165% теоретический выход; чистота: 81%) целевого соединения.
LC-MS (Способ 13 В): Rt=1.99 мин; m/z=471 (М-1)-
Пример 470А
Rac-трет-бутил 4-(3-{N'-гидрокси-N-[(1-метилциклопентил)карбонил]карбамимидоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
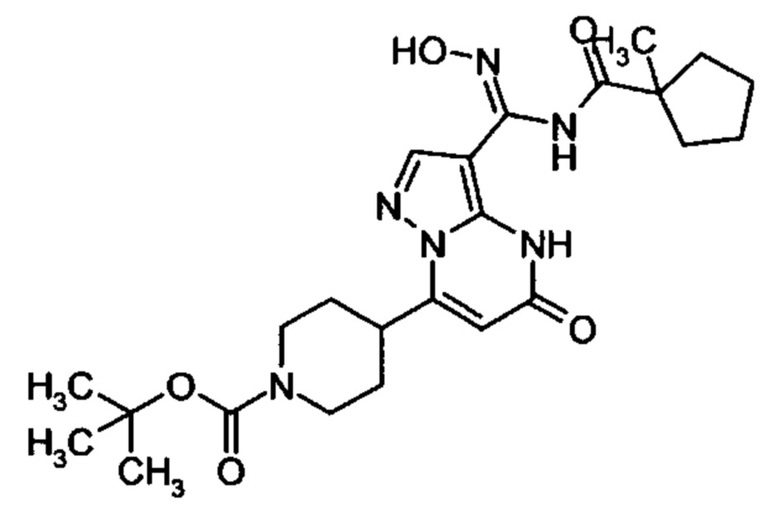
0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.15 г (1.14 ммоль) rac-1-метилциклопентанкарбоновой кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и мутную смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 930 мг (1.32 ммоль; 116% теоретический выход; чистота: 69%) целевого соединения.
LC-MS (Способ 13В): Rt=2.04 мин; m/z=485 (М-1)-
Пример 471А
Трет-бутил rel-4-[3-(N'-гидрокси-N-{[(1R,2S)-2-метилциклопентил]карбонил}карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
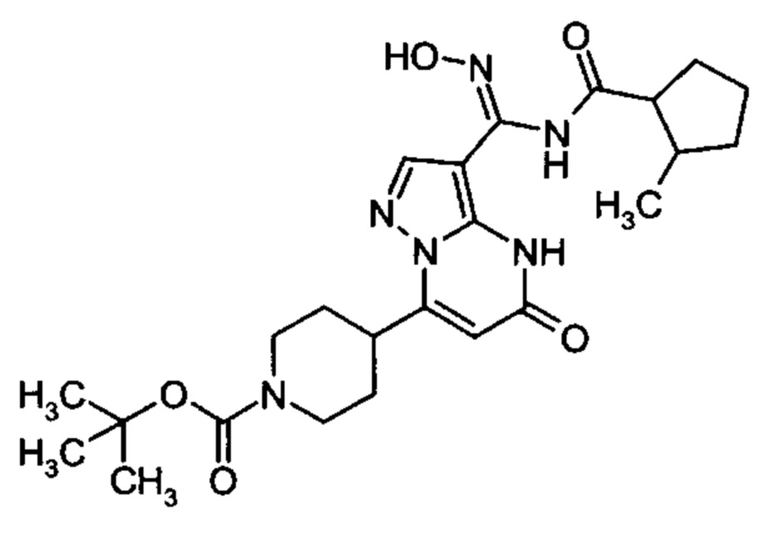
0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.15 г (1.14 ммоль) 2-метилциклопентанкарбоновой кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и мутную смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 960 мг (1.48 ммоль; 130% теоретический выход; чистота: 75%) целевого соединения.
LC-MS (Способ 13В): Rt=2.04 мин; m/z=485 (М-1)-
Пример 472А
Трет-бутил 4-{3-[N'-гидрокси-N-(3,3,3-трифторпропаноил)карбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

0.22 мл (1.25 ммоль) N,N-Диизопропилэтиламина добавили к смеси 0.15 г (1.14 ммоль) 3,3,3-трифторпропановой кислоты и 477 мг (1.25 ммоль) 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата в N,N-Диметилформамиде (7 мл). Смесь перемешивали в течение 10 минут при комнатной температуре. 650 мг (1.14 ммоль, 66%) трет-бутил 4-[3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата добавили, и смесь перемешивали при комнатной температуре в течение 16 часов. Насыщенный водный гидрокарбонат натрия (25 мл) добавили, и мутную смесь экстрагировали этилацетатом (50 мл). Органический слой промыли насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали с получением 816 мг (0.87 ммоль; 77% теоретический выход; чистота: 52%) целевого соединения.
LC-MS (Способ 13В): Rt=1.94 мин; m/z=485 (М-1)-
Пример 473А
Rac-трет-бутил 4-(5-оксо-3-(5-(тетрагидрофуран-2-ил)-1,2,4-оксадиазол-3-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
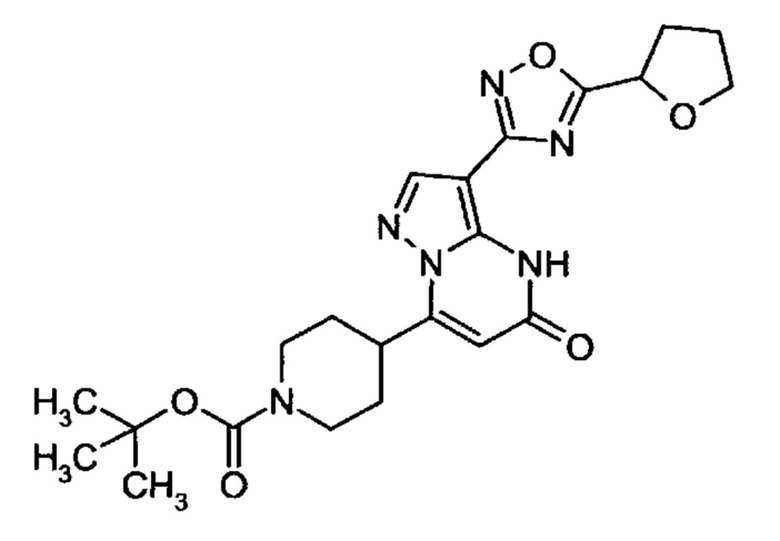
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 139 мг (1.200 ммоль, 0.119 мл) rac-тетрагидрофуран-2-карбоновой кислоты, 204 мг (1.260 ммоль) 1,1'-Карбонилдиимидазола и 4 мл (сухого) N-Метил-2-пирролидинона. Сосуд закрыли, и полученный раствор перемешивали при температуре окружающей среды в течение 10 минут. Обнаружили выделение газа, к этому добавили 342 мг (0.600 ммоль, 66%) трет-бутил 4-(3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата, и полученный прозрачный раствор перемешивали при 80°C, в течение 23 часов. Летучие соединения удалили на роторном испарителе (80°C / 10 мбар), и остаток разбавили 100 мл 0.5 М соляной кислоты и 50 мл дихлорметана. Слои разделили, и водный слой еще раз экстрагировали экстрагировали с помощью 2 частей 50 мл дихлорметана. Органические слои объединили, промыли 100 мл соляного раствора, высушивали сульфатом натрия, отфильтровали и концентрировали. 713 мг масла коричневого цвета получили, которое очистили (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-10% метанол). Фракции, содержащие продукт, объединили и концентрировали. 176 мг (0.370 ммоль; 61% теоретический выход, чистота: 96%) целевого соединения получили.
LC-MS (Способ 13В): Rt=1.96 мин; m/z=455 (М-1)-
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=8.33 (s, 1Н), 6.13 (s, 1H), 5.28 (dd, J=7.8, 5.3 Гц, 1H), 4.10 (d, J=12.7 Гц, 2H), 4.00-3.85 (m, 2H), 3.42 (t, J=12.1 Гц, 1H), 2.88 (s, 2H), 2.45-2.14 (m, 3Н), 2.09-1.81 (m, 4H), 1.58 (tt, J=12.1, 6.6 Гц, 2H), 1.42 (s, 6H)
Пример 474А
7-(1-(2,2,2-трифторацетил)пиперидин-4-ил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он
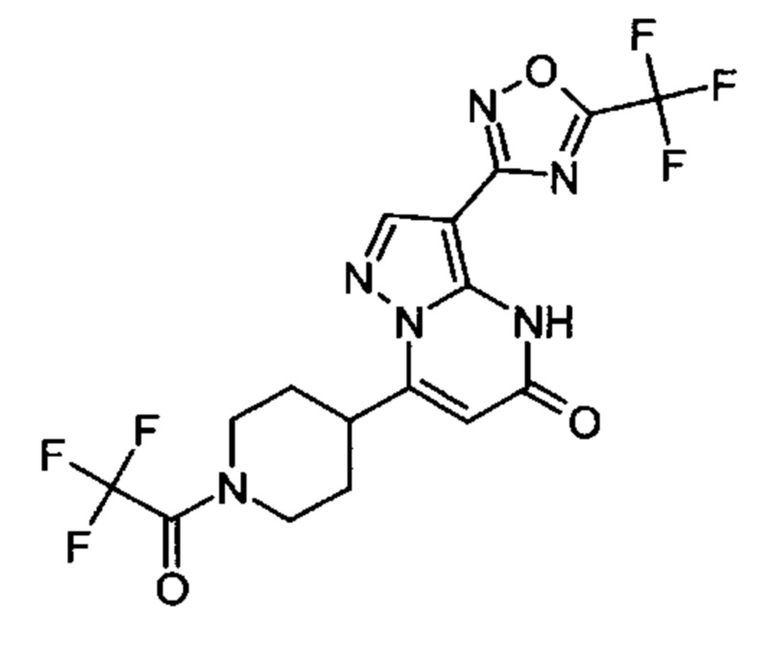
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 6301 мг (30.0 ммоль, 4173 мкл) 2,2,2-трифторуксусного ангидрида и 342 мг (0.600 ммоль, 66%) трет-бутил 4-(3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата. Сосуд закрыли, и полученную реакционную смесь перемешивали при комнатной температуре в течение 23 часов. LCMS показала, что реакция не завершена, температуру подняли до 40°C, и перемешивание продолжали в течение 8 часов. Летучие соединения удалили на роторном испарителе (40°C / 20 мбар). К оставшейся вязкой смоле желтого цвета добавили 75 мл DCM и 100 мл насыщенного бикарбоната натрия. Слои разделили, и водный слой еще раз экстрагировали экстрагировали с помощью 2 частей 50 мл дихлорметана. Органические слои объединили, высушивали сульфатом натрия и концентрировали. 197 мг твердого вещества слегка желтого цвета получили и очистили посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 1%-4% метанол). 169 мг (0.375 ммоль; 63% теоретический выход, чистота: 100%) целевого соединения получили.
LC-MS (Способ 13B): Rt=1.98 мин; m/z=449 (М-1)-
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=12.25 (s, 1Н), 8.49 (s, 1H), 6.29 (s, 1H), 4.47 (d, J=13.5 Гц, 2H), 4.01 (d, J=13.3 Гц, 1H), 3.68 (t, J=11.9 Гц, 1H), 3.48 (t, J=12.4 Гц, 1H), 3.08 (t, J=12.2 Гц, 1H), 2.17 (t, J=8.5 Гц, 2H), 1.77 (ddd, J=16.8, 8.5, 4.5 Гц, 2H)
Пример 475A
(Е)-трет-бутил 4-(3-(N'-гидрокси-N-(3,3,3-трифтор-2,2-диметилпропаноил)карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорид

В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 188 мг (1.208 ммоль) 3,3,3-трифтор-2,2-диметилпропановой кислоты, 163 мг (1.265 ммоль, 0.217 мл) N,N-Диизопропилэтиламина и 481 мг (1.265 ммоль) (1-[Бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата) в 2 мл (сухого) N,N-Диметилформамида. Полученный бесцветный раствор перемешивали в течение 10 минут при комнатной температуре, затем 656 мг (1.150 ммоль, 66%) трет-бутил 4-(3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата добавили, и перемешивание продолжали в течение 20 часов. Реакционную смесь затем разбавили 100 мл 0.5 М соляной кислоты и экстрагировали с помощью трех порций 30 мл дихлорметана. Объединенные органические слои высушивали сульфатом натрия, отфильтровали и концентрировали с получением 1236 мг полутвердого вещества желтого цвета, которое применяли в таком виде.
Пример 476А
(Е)-трет-бутил 4-(3-(N-(3,3-дифторциклобутанкарбонил)-N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорид
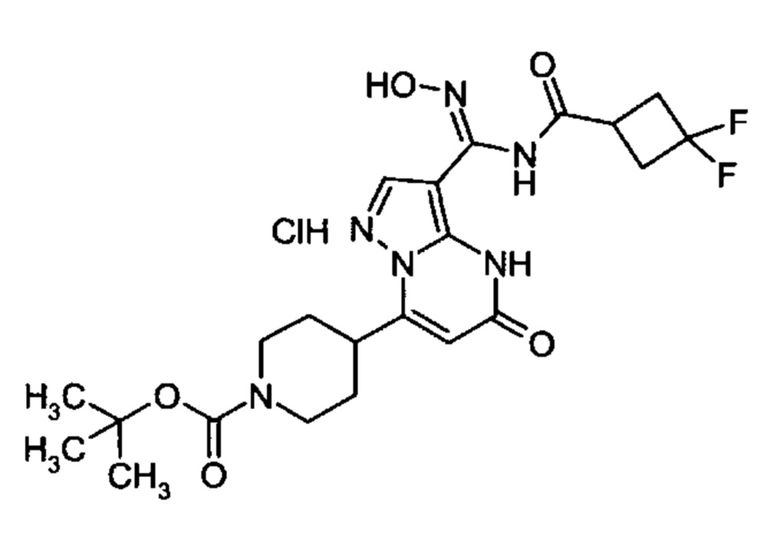
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 164 мг (1.208 ммоль) 3,3-дифторциклобутанкарбоновой кислоты, 163 мг (1.265 ммоль, 0.217 мл) N,N-Диизопропилэтиламина и 481 мг (1.265 ммоль) (1-[Бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата) в 2 мл (сухого) N,N-Диметилформамида. Полученный бесцветный раствор перемешивали в течение 10 минут при комнатной температуре, затем 656 мг (1.150 ммоль, 66%) трет-бутил 4-(3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата добавили, и смесь перемешивали еще в течение 20 часов. Разбавили 100 мл 0.5 М соляной кислоты и экстрагировали с помощью 3×30 мл дихлорметана. Объединенные органические слои высушивали сульфатом натрия, отфильтровали и концентрировали с получением 1188 мг полутвердого вещества желтого цвета, которое применяли в таком виде.
Пример 477А
(Е)-трет-бутил 4-(3-(N-(4,4-дифторциклогексанкарбонил)-N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорид
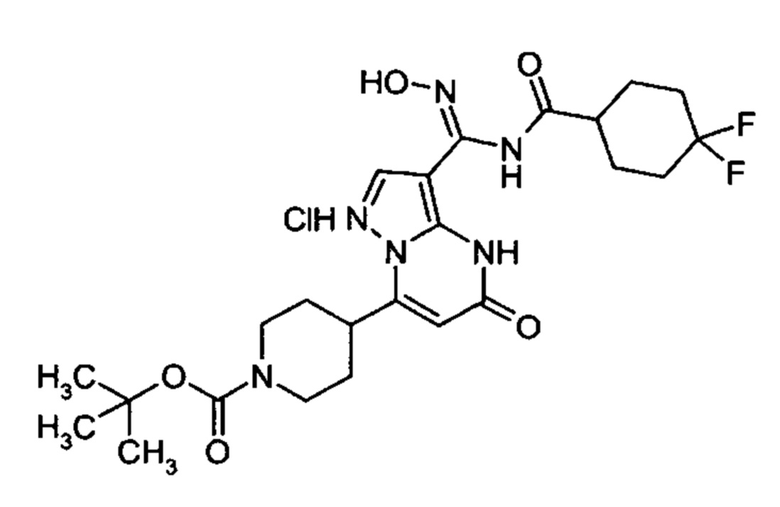
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 0.198 г (1.208 ммоль) 4,4-дифторциклогексанкарбоновой кислоты, 0.163 г (1.265 ммоль, 0.217 мл) N,N-Диизопропилэтиламина и 0.481 г (1.265 ммоль) (1-[Бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата) в 2 мл (сухого) N,N-Диметилформамида. Полученный бесцветный раствор перемешивали в течение 10 минут при температуре окружающей среды, затем 0.656 г (1.150 ммоль, 66%) трет-бутил 4-(3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат добавили, и смесь перемешивали еще в течение 20 часов. Разбавили с помощью 100 мл 0.5 М соляной кислоты и экстрагировали 3 раза с помощью 30 мл дихлорметана. Объединенные органические слои высушивали сульфатом натрия, отфильтровали и концентрировали с получением 1.254 г полутвердого вещества желтого цвета, которое применяли в таком виде.
Пример 478А
(Е)-трет-бутил 4-(3-(N'-гидрокси-N-(2-метоксиацетил)карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорид
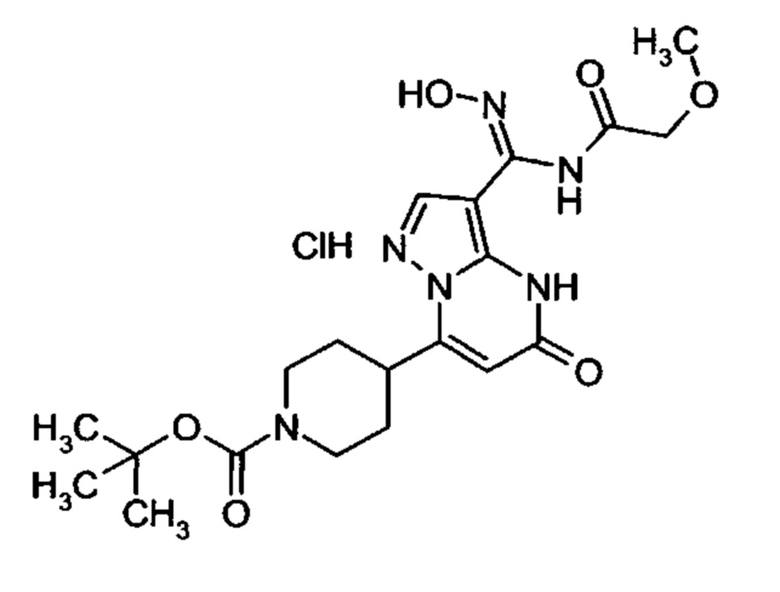
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 0.109 г (1.208 ммоль) 2-метоксиуксусной кислоты, 0.163 г (1.265 ммоль, 0.217 мл) N,N-Диизопропилэтиламина и 0.481 г (1.265 ммоль) (1-[Бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата) в 2 мл (сухого) N,N-Диметилформамида. Полученный бесцветный раствор перемешивали в течение 10 минут при комнатной температуре, затем 0.656 г (1.150 ммоль, 66%) трет-бутил 4-(3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат добавили, и смесь перемешивали еще в течение 20 часов. Реакционную смесь разбавили 100 мл 0.5 М соляной кислоты и экстрагировали с помощью 3 порций 30 мл дихлорметана. Объединенные органические слои высушивали сульфатом натрия, отфильтровали и концентрировали с получением 1.420 г полутвердого вещества желтого цвета, которое применяли в таком виде.
Пример 4.79А
(Е)-трет-бутил 4-(3-(N'-гидрокси-N-(4-метоксибутаноил)карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорид
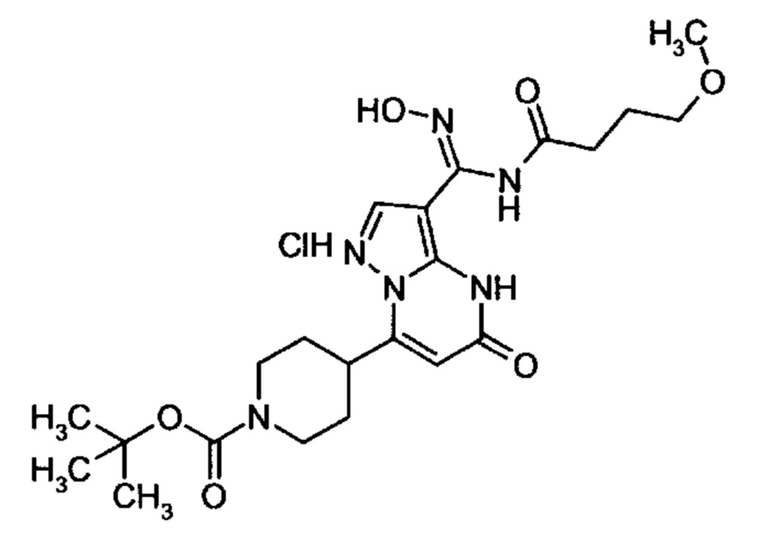
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 0.143 г (1.208 ммоль) 4-метоксибутановой кислоты, 0.163 г (1.265 ммоль, 0.217 мл) N,N-Диизопропилэтиламина и 0.481 г (1.265 ммоль) (1-[Бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфата) в 2 мл (сухого) N,N-Диметилформамида. Полученный бесцветный раствор перемешивали в течение 10 минут при температуре окружающей среды, затем 0.656 г (1.150 ммоль, 66%) трет-бутил 4-(3-(N-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата добавили, и смесь перемешивали еще в течение 20 часов. Реакционную смесь разбавили с помощью 100 мл 0.5М соляной кислоты и экстрагировали 3 раза с помощью 30 мл дихлорметана. Объединенные органические слои высушивали сульфатом натрия, отфильтровали и концентрировали с получением 1.100 г полутвердого вещества желтого цвета, которое применяли в таком виде.
Пример 480А
Трет-бутил 4-[3-(5-изобутил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
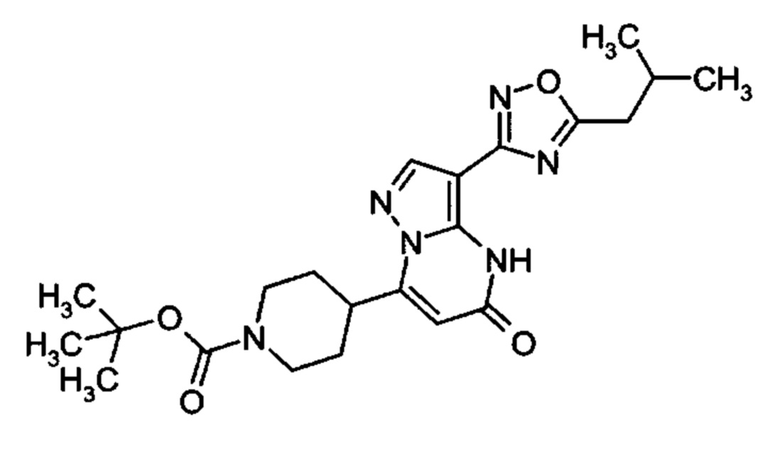
283 мг (0.430 ммоль, 69%) трет-бутил 4-{3-[N'-гидрокси-N-(3-метилбутаноил)карбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.03 мл (0.13 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 100°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 58 мг (0.13 ммоль; 30% теоретический выход, чистота: 95%) целевого соединения.
LC-MS (Способ 13В): Rt=2.12 мин; m/z=441 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.73 (s, 1H), 8.19 (s, 1Н), 5.93 (s, 1H), 4.46-4.16 (m, 2Н), 3.58-3.36 (m, 1H), 2.99-2.77 (m, 4Н), 2.36-2.21 (m, 1H), 2.11 (d, J=12.7 Гц, 2Н), 1.69-1.56 (m, 2Н), 1.48 (s, 9Н), 1.04 (d, J=6.7 Гц, 6Н)
Пример 481А
Трет-бутил 4-[3-(5-гексил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

514 мг (0.57 ммоль, 54%) трет-бутил 4-[3-(N-гептаноил-N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.03 мл (0.11 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 100°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 166 мг (0.35 ммоль; 62% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 13В): Rt=2.27 мин; m/z=469 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.72 (s, 1H), 8.20 (s, 1Н), 5.93 (s, 1Н), 4.28 (s, 2Н), 3.45 (t, J=11.9 Гц, 1H), 3.12-2.78 (m, 4Н), 2.12 (d, J=12.8 Гц, 2Н), 1.97-1.80 (m, 2Н), 1.69-1.27 (m, 17Н), 0.90 (t, 3Н)
Пример 482А
Трет-бутил 4-[3-(5-циклопропил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
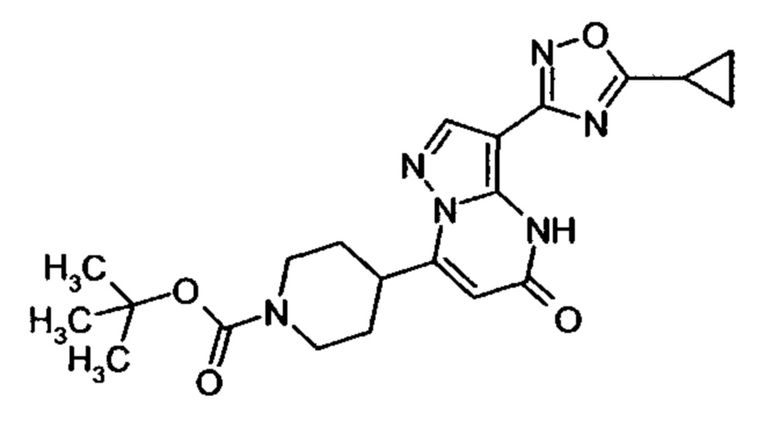
560 мг (1.0 ммоль, 80%) трет-бутил 4-{3-[N-(циклопропилкарбонил)-N'-гидроксикарбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.05 мл (0.20 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 122 мг (0.28 ммоль; 28% теоретический выход, чистота: 100%) целевого соединения.
LC-MS (Способ 13В): Rt=2.01 мин; m/z=425 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.67 (s, 1H), 8.17 (s, 1H), 5.93 (s, 1H), 4.32 (br. s, 2Н), 3.45 (t, J=11.8 Гц, 1Н), 2.90 (t, J=12.1 Гц, 2Н), 2.33-2.20 (m, 1Н), 2.12 (d, J=13.2 Гц, 2Н), 1.70-1.56 (m, 2Н), 1.49 (s, 9Н), 1.38-1.26 (m, 4Н)
Пример 483А
Rac-трет-бутил 4-{3-[5-(1-метилциклопропил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
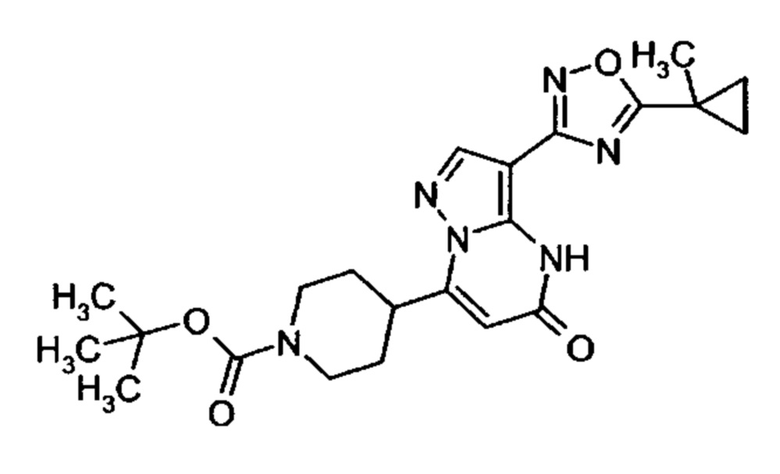
575 мг (0.98 ммоль, 78%) rac-трет-бутил 4-(3-{N'-гидрокси-N-[(1-метилциклопропил)карбонил]карбамимидоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.05 мл (0.20 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 90 мг (0.20 ммоль; 21% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 13В): Rt=2.08 мин; m/z=439 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.63 (s, 1H), 8.17 (s, 1Н), 5.92 (s, 1Н), 4.32 (br.s, 2Н), 3.44 (t, J=12.0 Гц, 1H), 2.89 (t, J=12.2 Гц, 2Н), 2.11 (d, J=10.4 Гц, 2Н), 1.61 (s, 3H), 1.48 (s, 11H), 1.18-0.88 (m, 2Н)
Пример 484А
Трет-бутил rel-4-(3-{5-[(1R,2S)-2-метилциклопропил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
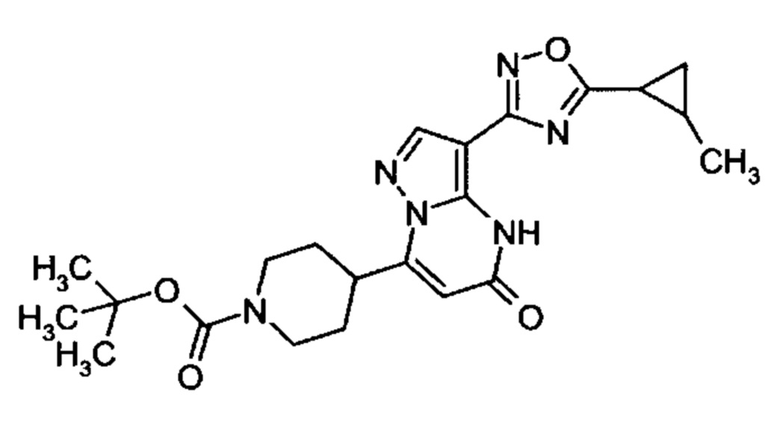
760 мг (1.21 ммоль, 73%) трет-бутил rel-4-[3-(N'-гидрокси-N-{[(1R,2S)-2-метилциклопропил]карбонил}карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.06 мл (0.24 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 84 мг (0.19 ммоль; 16% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 13В): Rt=2.08 мин; m/z=439 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.68 (s, 1Н), 8.16 (s, 1H), 5.92 (s, 1Н), 4.32 (s, 2Н), 3.56-3.31 (m, 1Н), 2.89 (t, J=12.6 Гц, 2Н), 2.11 (d, J=12.9 Гц, 2Н), 2.04-1.87 (m, 1Н), 1.73-1.59 (m, 3Н), 1.48 (s, 9Н), 1.26 (d, J=6.0 Гц, 3Н), 1.22-1.04 (m, 2Н)
Пример 485А
Трет-бутил 4-{3-[5-(2-метилпроп-1-ен-1-ил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
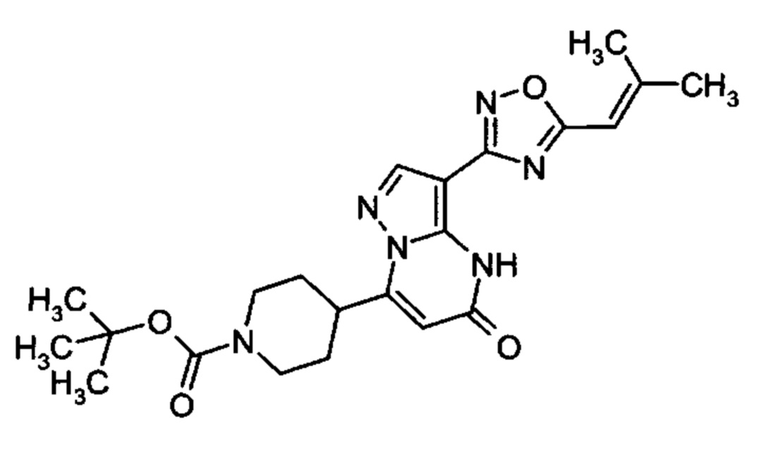
744 мг (1.14 ммоль, 70%) трет-бутил 4-{3-[N'-гидрокси-N-(3-метилбут-2-еноил)карбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.06 мл (0.24 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 19 мг (0.04 ммоль; 4% теоретический выход, чистота: 95%) целевого соединения.
LC-MS (Способ 13В): Rt=2.12 мин; m/z=439 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.71 (s, 1H), 8.20 (s, 1H), 6.44-6.20 (m, 1Н), 5.93 (s, 1H), 4.30 (d, J=9.7 Гц, 2Н), 3.56-3.38 (m, 1H), 2.97-2.80 (m, 2Н), 2.34 (d, J=0.9 Гц, 3Н), 2.09 (d, J=1.1 Гц, 5Н), 1.70-1.56 (m, 2Н), 1.48 (s, 9Н)
Пример 486А
Трет-бутил 4-{3-[5-(циклопентилиденметил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
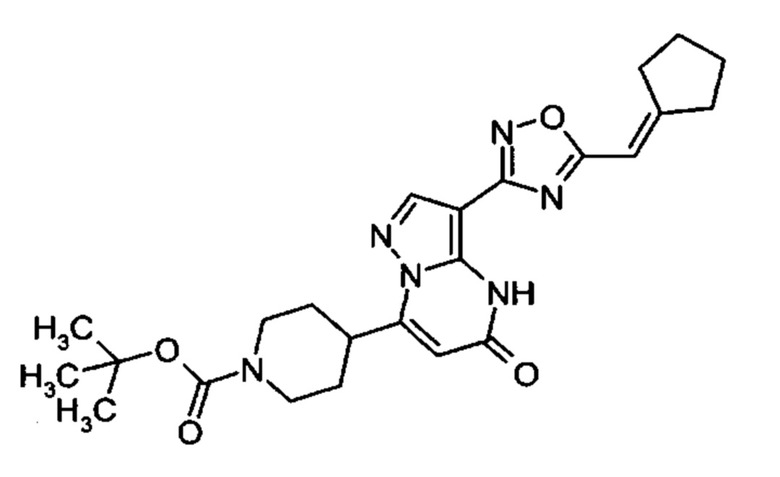
770 мг (1.13 ммоль, 71%) трет-бутил 4-{3-[N-(циклoпeнтилидeнaцeтил)-N'-гидроксикарбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.06 мл (0.24 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 73 мг (0.16 ммоль; 14% теоретический выход, чистота: 96%) целевого соединения.
LC-MS (Способ 13В): Rt=2.16 мин; m/z=465 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]= 9.74 (s, 1Н), 8.20 (s, 1H), 5.93 (s, 1Н), 5.60 (s, 1H), 4.32 (br. s, 2Н), 3.75 (s, 2Н), 3.64-3.29 (m, 1Н), 2.90 (t, J=12.2 Гц, 2Н), 2.36 (t, J=7.4 Гц, 4Н), 2.11 (d, J=12.6 Гц, 2Н), 2.04-1.85 (m, 2Н), 1.70-1.58 (m, 2Н), 1.48 (s, 9Н)
Пример 487А
Трет-бутил 4-[3-(5-циклопентил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
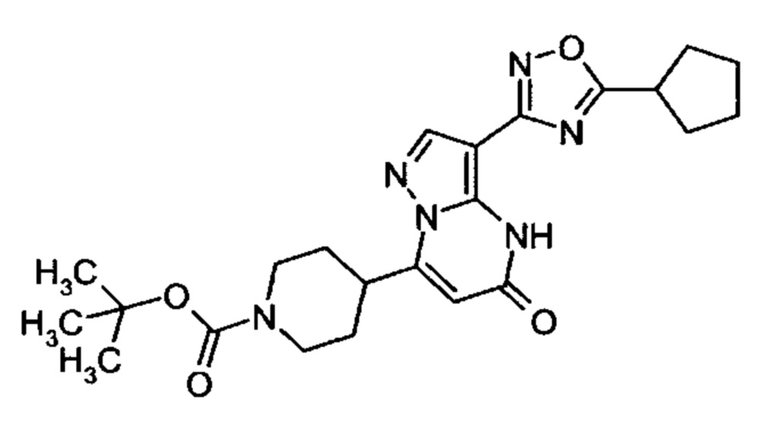
690 мг (1.18 ммоль, 81%) трет-бутил 4-{3-[N-(циклопентилкарбонил)-N'-гидроксикарбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.06 мл (0.24 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 147 мг (0.32 ммоль; 27% теоретический выход, чистота: 100%) целевого соединения.
LC-MS (Способ 13В): Rt=2.14 мин; m/z=453 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.71 (s, 1Н), 8.19 (s, 1Н), 5.92 (s, 1H), 4.31 (br. s, 2Н), 3.70-3.25 (m, 2Н), 3.19-2.70 (m, 2Н), 2.30-2.06 (m, 4Н), 2.05-1.69 (m, 6Н), 1.69-1.55 (m, 2Н), 1.48 (s, 9Н)
Пример 488А
Rac-трет-бутил 4-{3-[5-(1-метилциклопентил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
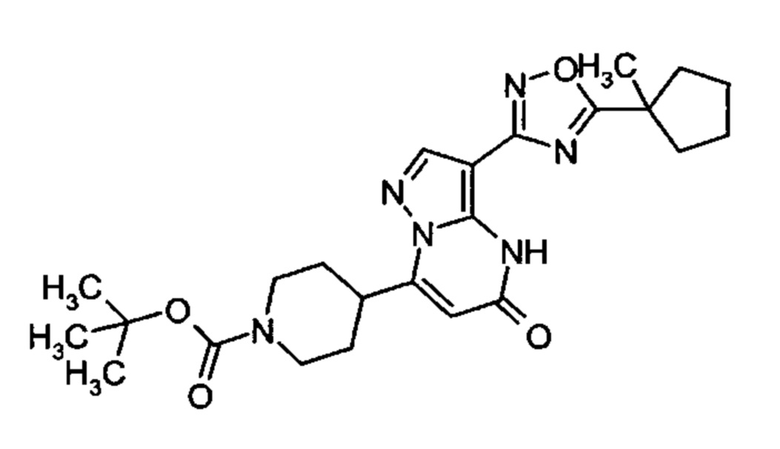
800 мг (1.13 ммоль, 69%) rac-трет-бутил 4-(3-{N'-гидрокси-N-[(1-метилциклопентил)карбонил]карбамимидоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.06 мл (0.24 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 111 мг (0.24 ммоль; 21% теоретический выход, чистота: 100%) целевого соединения.
LC-MS (Способ 13В): Rt=2.21 мин; m/z=467 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.68 (s, 1Н), 8.20 (s, 1H), 5.93 (s, 1H), 4.47-4.10 (m, 2Н), 3.60-3.36 (m, 1Н), 2.90 (t, J=12.9 Гц, 2Н), 2.39-2.19 (m, 2Н), 2.12 (d, J=12.9 Гц, 2Н), 1.87-1.75 (m, 6Н), 1.64-1.56 (m, 2Н), 1.51 (s, 3Н), 1.49 (s, 9Н)
Пример 489А
Трет-бутил rel-4-(3-{5-[(1R,2S)-2-метилциклопентил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
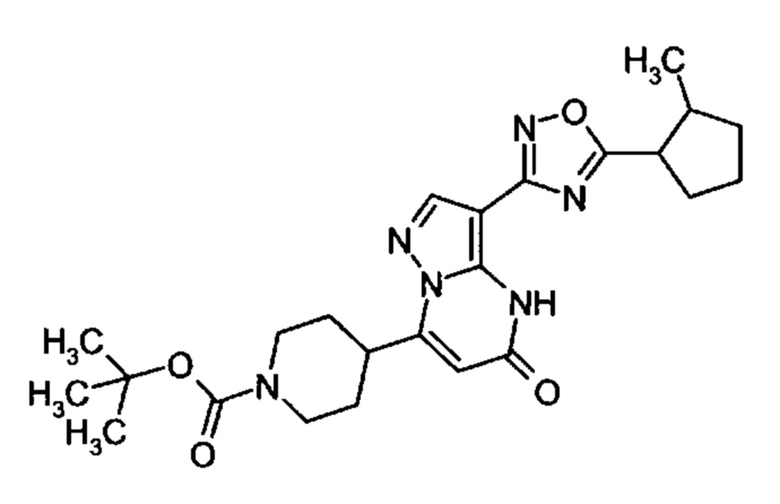
750 мг (1.16 ммоль, 75%) трет-бутил rel-4-[3-(N'-гидрокси-N-{[(1R,2S)-2-метилциклопентил]карбонил}карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.06 мл (0.24 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 171 мг (0.37 ммоль; 32% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 13В): Rt=2.21 мин; m/z=467 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): δ [ppm]=9.72 (s, 1H), 8.20 (s, 1H), 5.93 (s, 1Н), 4.29 (d, J=10.8 Гц, 2Н), 3.44 (s, 1H), 2.97-2.81 (m, 3Н), 2.41-1.97 (m, 5Н), 1.92-1.77 (m, 2Н), 1.67-1.53 (m, 3H), 1.48 (s, 9Н), 1.43-1.31 (m, 1H), 1.12 (d, J=6.6 Гц, 3Н)
Пример 490А
Трет-бутил 4-{5-оксо-3-[5-(2,2,2-трифторэтил)-1,2,4-оксадиазол-3-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
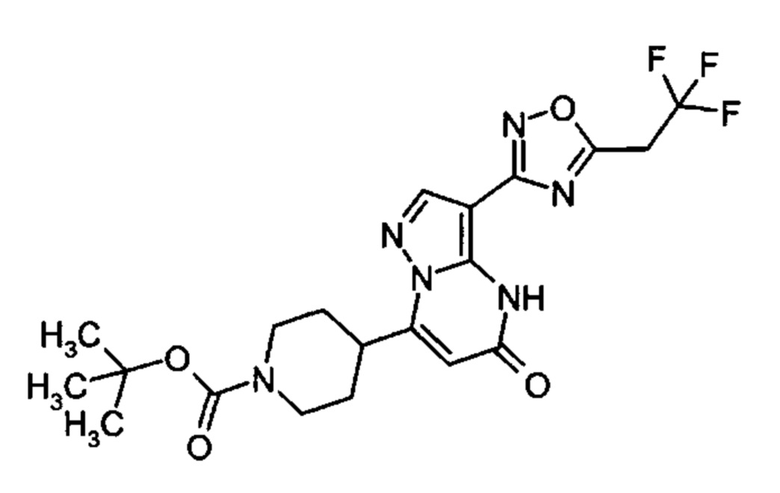
816 мг (0.87 ммоль, 52%) трет-бутил 4-{3-[N'-гидрокси-N-(3,3,3-трифторпропаноил)карбамимидоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата растворили в 1,4-диоксане (8 мл). 0.044 мл (0.17 ммоль) 4 М хлороводорода в 1,4-диоксане добавили, и смесь нагрели до 90°C в течение 16 часов. Органический слой разбавили этилацетатом, промыли насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия, высушивали сульфатом натрия и концентрировали. Очищение посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 0%-3% 7 М аммиак в метаноле) обеспечило 120 мг (0.26 ммоль; 29% теоретический выход, чистота: 98%) целевого соединения.
LC-MS (Способ 13В): Rt=2.03 мин; m/z=467 (М-1)-
1Н-ЯМР (300 МГц, Хлороформ-d): 5 [ppm]=9.59 (s, 1H), 8.21 (s, 1Н), 5.95 (s, 1Н), 5.29, 4.30 (d, J=9.0 Гц, 2Н), 3.85 (q, J=9.4 Гц, 2Н), 3.56-3.36 (m, 1H), 3.07-2.79 (m, 2Н), 2.11 (d, J=12.7 Гц, 2Н), 1.70-1.60 (m, 2Н), 1.48 (s, 9Н)
Пример 491А
Трет-бутил 4-(5-оксо-3-(5-(1,1,1-трифтор-2-метилпропан-2-ил)-1,2,4-оксадиазол-3-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
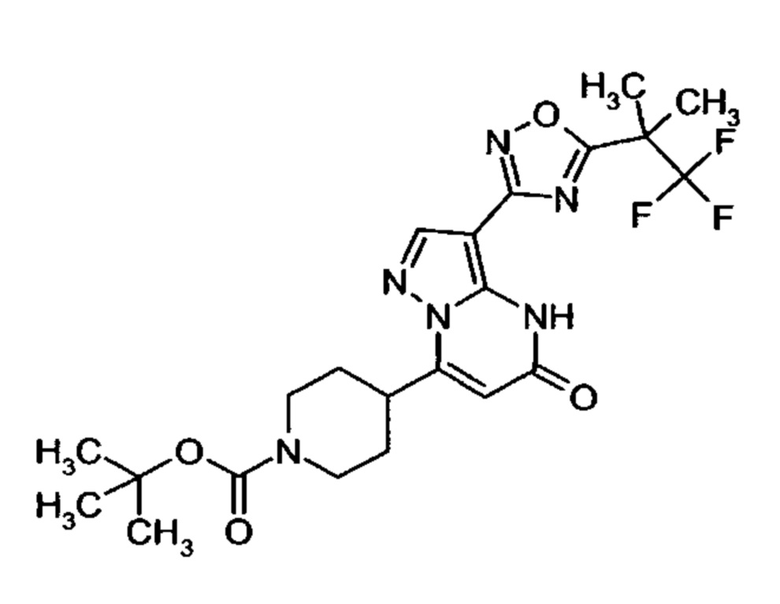
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 1236 мг (E)-трет-бутил 4-(3-(N'-гидрокси-N-(3,3,3-трифтор-2,2-диметилпропаноил)карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорида из Примера 28А и 6 мл (сухого) 1,4-диоксана. 0.04 мл (0.161 ммоль) соляной кислоты (4.0 М в диоксан) добавили, и прозрачный желтый раствор перемешивали при 90°C в течение 8 часов. Реакционную смесь разбавили 100 мл 0.5 М соляной кислоты и экстрагировали дихлорметаном (3×50 мл). Органические слои объединили, промыли 100 мл водного аммиака (15% мас./мас.), высушивали сульфатом натрия, отфильтровали и концентрировали. 352 мг твердого вещества желтого цвета получили и очистили посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 1% - 4% метанол). Фракции, содержащие продукт, объединили, концентрировали и совместно выпарили с 20 мл дихлорметана. 208 мг (0.412 ммоль; 36% теоретический выход за две стадии, чистота: 98%) целевого соединения получили в виде свободно-текучего порошка белого цвета.
LC-MS (Способ 13В): Rt=2.14 мин; m/z=495 (М-1)-
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=8.20 (s, 1H), 5.97 (s, 1H), 4.08 (d, J=11.9 Гц, 2H), 3.36 (t, J=11.9 Гц, 1H), 2.89 (br. s, 2H), 2.00 (d, J=12.2 Гц, 2H), 1.70 (s, 6H), 1.50 (dd, J=12.1, 3.8 Гц, 2H), 1.41 (s, 9H)
Пример 492A
Трет-бутил 4-(3-(5-(3,3-дифторциклобутил)-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
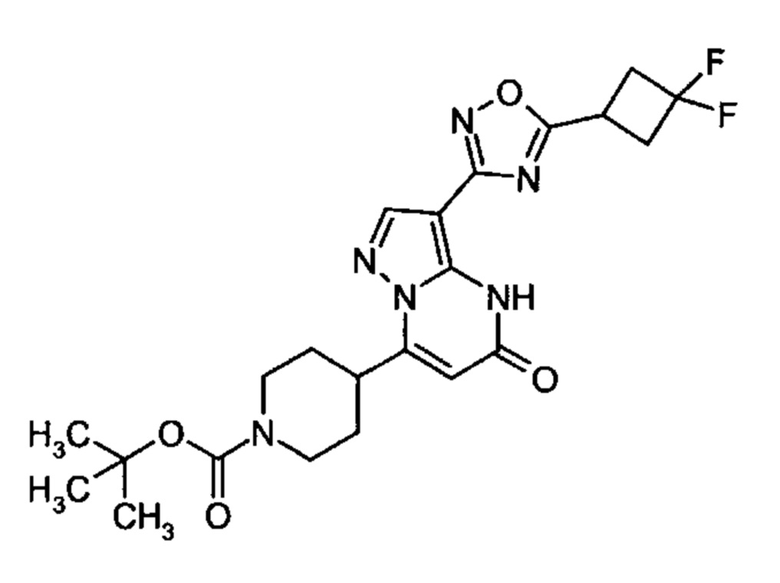
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 1188 мг (Е)-трет-бутил 4-(3-(N-(3,3-дифторциклобутанкарбонил)-N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорида и 6 мл (сухого) 1,4-диоксана. 0.04 мл (0.161 ммоль) соляной кислоты (4.0 М в диоксан) добавили, и прозрачный желтый раствор нагревали до 90°C в течение 8 часов. Реакционную смесь разбавили 100 мл 0.5 М соляной кислоты и экстрагировали 3 порциями 50 мл дихлорметана. Органические слои объединили, промыли 100 мл водного аммиака (15% мас./мас.), высушивали сульфатом натрия, отфильтровали и концентрировали: 303 мг твердого вещества желтого цвета получили и очистили (Способ 15В; 12 г картридж; дихлорметан, градиент, 1%-4% метанол). Фракции, содержащие продукт, объединили, концентрировали и совместно выпарили с 20 мл дихлорметана. 221 мг (0.444 ммоль; 38% теоретический выход за две стадии, чистота: 96%) целевого соединения получили в виде свободно-текучего порошка белого цвета.
LC-MS (Способ 13B): Rt=2.05 мин; m/z=475 (М-1)-
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=11.47 (s, 1H), 8.33 (s, 1H), 6.11 (s, 1H), 4.10 (d, J=12.4 Гц, 2H), 3.85 (td, J=8.6, 2.6 Гц, 1H), 3.42 (t, J=11.9 Гц, 1H), 3.22-3.09 (m, 4H), 2.87 (br. s, 2H), 2.00 (d, J=11.7 Гц, 2H), 1.57 (qd, J=12.3, 4.0 Гц, 2H), 1.42 (s, 9H)
Пример 493A
Трет-бутил 4-(3-(5-(4,4-дифторциклогексил)-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
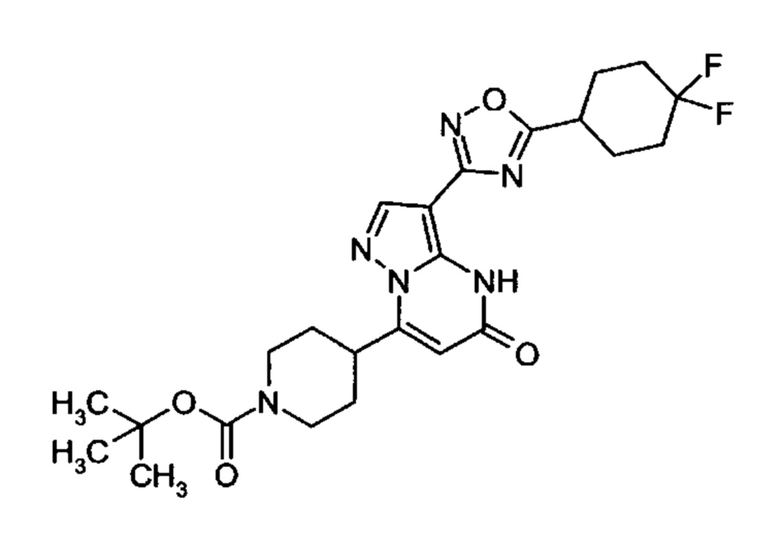
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 1.254 г (Е)-трет-бутил 4-(3-(N-(4,4-дифторциклогексанкарбонил)-N'-гидроксикарбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорида из Примера 32А и 6 мл (сухого) 1,4-диоксана. 0.40 мл (0.161 ммоль) соляной кислоты (4.0 М в диоксан) добавили, и прозрачный желтый раствор перемешивали в течение 8 часов при 90°C. Реакционную смесь разбавили 100 мл 0.5 М соляной кислоты и экстрагировали 3 порциями 50 мл дихлорметана. Органические слои объединили, промыли 100 мл водного аммиака (15% мас./мас.), высушивали сульфатом натрия, отфильтровали и концентрировали: 378 мг твердого вещества желтого цвета получили и очистили (Способ 15В; 12 г картридж; дихлорметан, градиент, 1%-4% метанол). Фракции, содержащие продукт, объединили, концентрировали и совместно выпарили с 20 мл дихлорметана. 252 мг (0.499 ммоль; 43% теоретический выход за две стадии, чистота: 100%) целевого соединения получили в виде свободно-текучего порошка белого цвета.
LC-MS (Способ 13В): Rt=2.11 мин; m/z=503 (М-1)-
1Н-ЯМР (300 МГц, DMSO-d6) δ 11.40 [ppm]=(br. s, 1H), 8.31 (s, 1H), 6.10 (s, 1H), 4.10 (d, J=12.6 Гц, 2H), 3.50-3.21 (m, 4H), 2.25-1.85 (m, 10H), 1.57 (qd, J=12.4, 4.1 Гц, 2H), 1.42 (s, 9H)
Пример 494A
Трет-бутил 4-(3-(5-(метоксиметил)-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
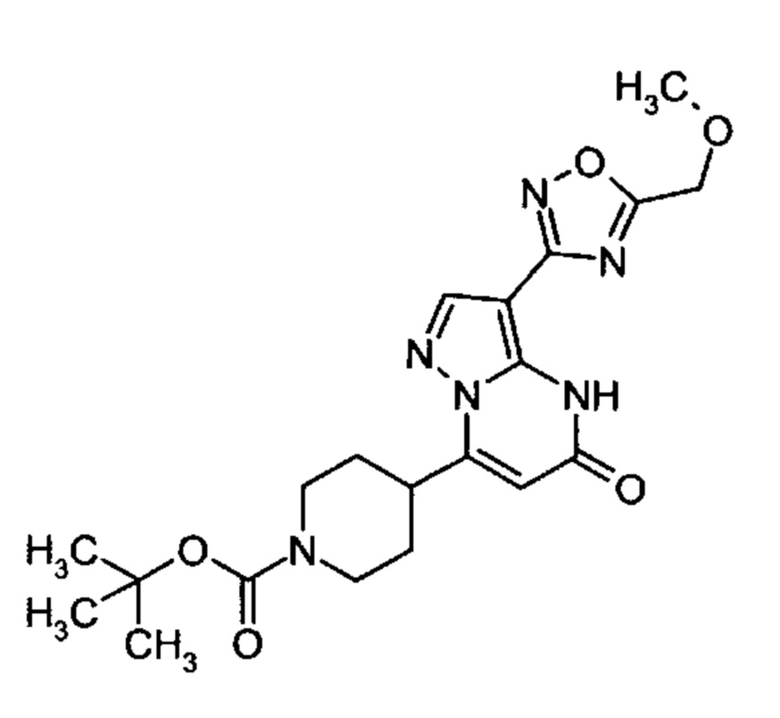
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 1.420 г (Е)-трет-бутил 4-(3-(N'-гидрокси-N-(2-метоксиацетил)карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорида из Примера 34А и 6 мл (сухого) 1,4-диоксана. 0.040 мл (0.161 ммоль) соляной кислоты (4.0 М в диоксан) добавили, и прозрачный желтый раствор перемешивали при 90°C в течение 8 часов. Реакционную смесь разбавили 100 мл 0.5 М соляной кислоты и экстрагировали 3 раза 50 мл дихлорметана. Органические слои объединили, промыли 100 млводного аммиака (15% мас./мас.), высушивали сульфатом натрия, отфильтровали и концентрировали. 207 мг твердого вещества желтого цвета получили и очистили посредством колоночной флеш-хроматографии (Способ 15В; 12 г картридж; дихлорметан, градиент, 1%-4% метанол). Фракции, содержащие продукт, объединили, концентрировали и совместно выпарили с 20 мл дихлорметана. 118 мг (0.241 ммоль; 15% теоретический выход за две стадии, чистота: 88%) целевого соединения получили.
LC-MS (Способ 13В): Rt=1.91 мин; m/z=429 (М-1)-
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=11.47 (br. s, 1H), 8.35 (s, 1H), 6.14 (s, 1H), 4.81 (s, 2H), 4.10 (d, J=12.5 Гц, 2H), 3.50-3.37 (m, 4H), 2.87 (s, 2H), 2.01 (d, J=12.5 Гц, 2H), 1.58 (qd, J=12.4, 4.1 Гц, 2H), 1.42 (s, 9H)
Пример 495A
Трет-бутил 4-(3-(5-(3-метоксипропил)-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
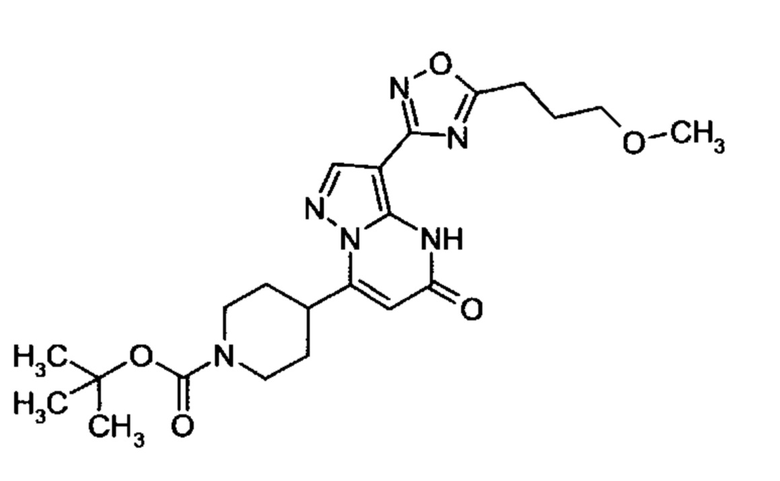
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 1.100 г (Е)-трет-бутил 4-(3-(N'-гидрокси-N-(4-метоксибутаноил)карбамимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а] пиримидин-7-ил)пиперидин-1-карбоксилат гидрохлорида из Примера 36А и 6 мл (сухого) 1,4-диоксана. 0.040 мл (0.161 ммоль) соляной кислоты (4.0 М в диоксан) добавили, и прозрачный желтый раствор перемешивали при 90°C в течение 24 часов. Реакционную смесь разбавили 100 мл 0.5 М соляной кислоты и экстрагировали 3 раза с помощью 50 мл дихлорметана. Органические слои объединили, промыли 100 мл водного аммиака (15% мас./мас.), высушивали сульфатом натрия, отфильтровали и концентрировали. 219 мг твердого вещества желтого цвета сохранили и очистили посредством колоночной флеш-хроматографии. (Способ 15В; 12 г картридж; дихлорметан, градиент, 1%-4% метанол). Фракции, содержащие продукт, объединили, концентрировали и совместно выпарили с 20 мл дихлорметана. 122 мг (0.263 ммоль; 22% теоретический выход за две стадии, чистота: 33%) целевого соединения получили.
LC-MS (Способ 13В): Rt=1.96 мин; m/z=457 (М-1)-
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm] 11.31 (br. s, 1H), 8.31 (s, 1H), 6.11 (s, 1H), 4.10 (d, J=12.2 Гц, 2H), 3.42 (t, J=6.2 Гц, 3H), 3.24 (s, 3H), 3.01 (t, J=7.5 Гц, 2H), 2.87 (br. s, 2H), 2.09-1.94 (m, 4H), 1.57 (qd, J=12.5, 4.1 Гц, 2H), 1.42 (s, 9H)
Пример 496A
Трет-бутил 4-{3-[3-(2-метоксифенил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
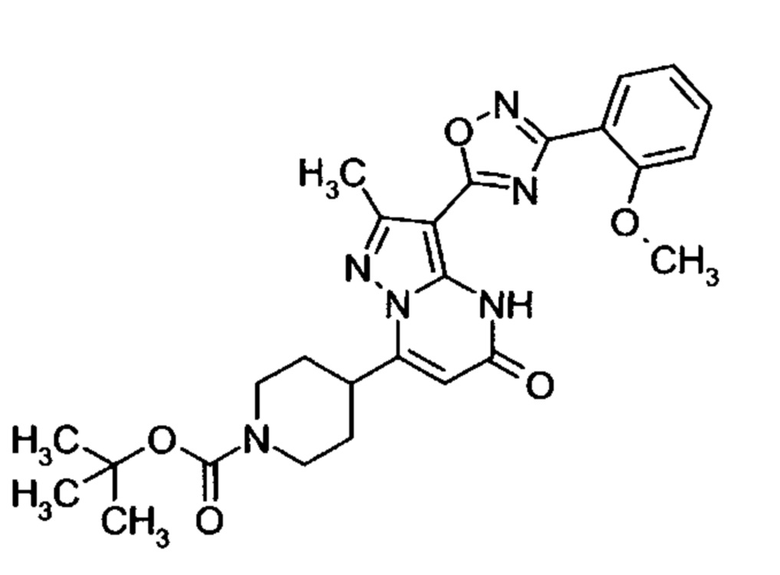
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. N'-гидрокси-2-метоксибензолкарбоксимидамид (132 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 94.0 мг (96% чистота, 45% теоретический выход).
LC-MS (Способ 11В): Rt=2.25 мин; MS (ESIneg): m/z=505 [М-Н]-
Пример 497А
Трет-бутил 4-{3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
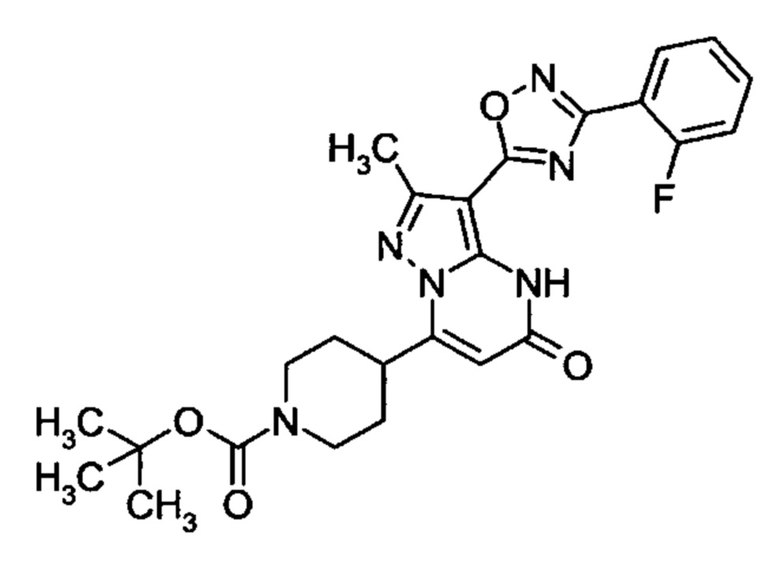
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. 2-фтор-N'-гидроксибензолкарбоксимидамид (123 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 92.7 мг (100% чистота, 47% теоретический выход).
LC-MS (Способ 11B): Rt=2.36 мин; MS (ESIpos): m/z=495 [М+Н]+
Пример 498А
Трет-бутил 4-{3-[3-(2-хлорбензил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
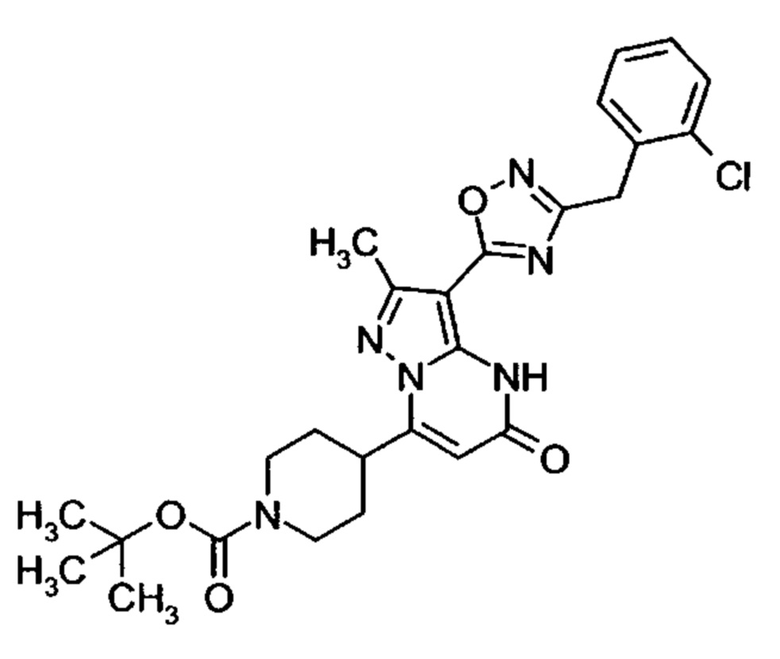
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-2-(2-хлорфенил)-N'-гидроксиэтанимидамид (147 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 42.4 мг (60% чистота, 12% теоретический выход).
LC-MS (Способ 11B): Rt=2.43 мин; MS (ESIpos): m/z=525 [М+Н]+
Пример 499А
Трет-бутил 4-{2-метил-3-[3-(2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
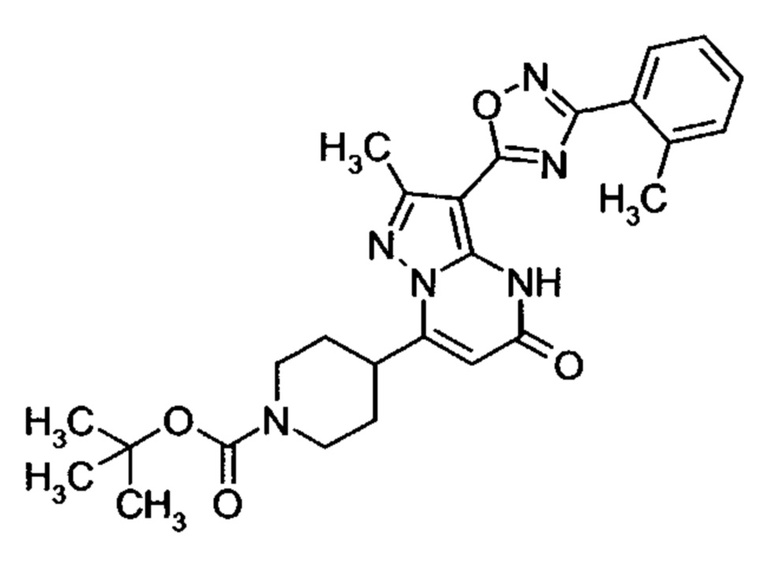
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. N'-гидрокси-2-метилбензолкарбоксимидамид (120 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 111 мг (93% чистота, 53% теоретический выход).
LC-MS (Способ 11B): Rt=2.53 мин; MS (ESIpos): m/z=491 [М+Н]+
Пример 500А
Трет-бутил 4-{3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
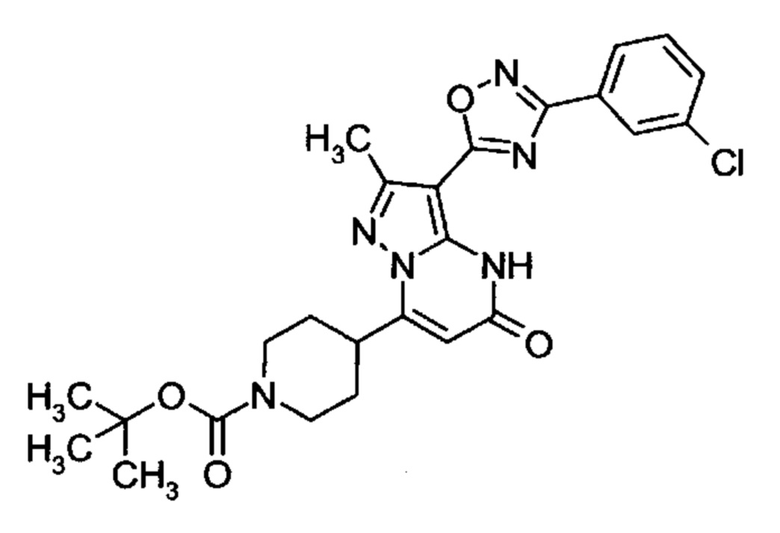
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. 3-хлор-N'-гидроксибензолкарбоксимидамид (136 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 83.7 мг (100% чистота, 41% теоретический выход).
LC-MS (Способ 11B): Rt=2.61 мин; MS (ESIneg): m/z=509 [M-H]-
Пример 501A
Трет-бутил 4-(2-метил-5-оксо-3-{3-[4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
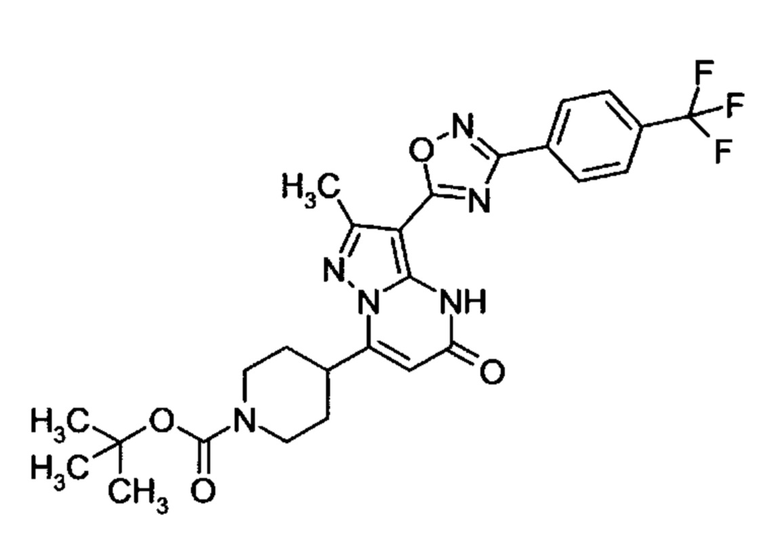
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. N'-гидрокси-4-(трифторметил)бензолкарбоксимидамид (163 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 52.7 мг (90% чистота, 22% теоретический выход).
LC-MS (Способ 11B): Rt=2.62 мин; MS (ESIneg): m/z=543 [M-H]-
Пример 502А
Трет-бутил 4-{3-[4-метил-5-(2-метилпропил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
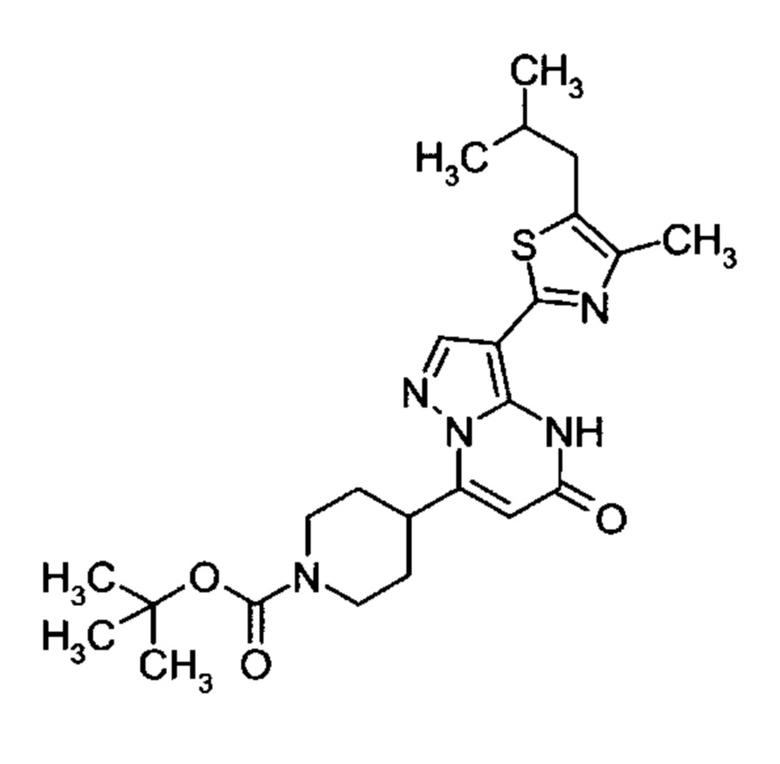
трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (120 мг, 318 мкмоль), 3-хлор-5-метилгексан-2-он (47.3 мг, 318 мкмоль) и N,N-Диизопропилэтиламин (280 мкл, 1.6 ммоль) растворили в этаноле (4.8 мл, 82 ммоль) и перемешивали при 70°C в течение 1 ч. Тетра-н-бутиламмония иодид (23.5 мг, 63.6 мкмоль) добавили, и смесь перемешивали при 70°C в течение 16 ч. Добавили воду, и смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 20%В, 4.50 мин = 30%В, 19.00-22.50 мин = 100%В, 22.75-25.00 мин = 20%В) с получением продукта. Полученное количество составило 32.0 мг (100% чистота, 21% теоретический выход).
LC-MS (Способ 11В): Rt=2.65 мин; MS (ESIpos): m/z=472 [М+Н]+
Пример 503А
Трет-бутил 4-{3-[5-(3,5-дифтор-4-метоксибензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
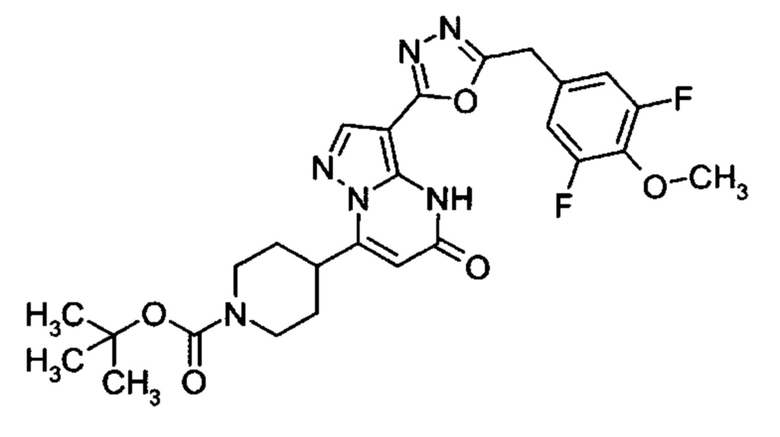
трет-бутил 4-[3-({2-[(3,5-дифтор-4-метоксифенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (50.0 мг, 89.2 мкмоль) растворили в ТГФ (2.0 мл, 25 ммоль) и перемешали с реагентом Бургесса (29.8 мг, 125 мкмоль) в течение 16 ч при комнатной температуре. Воду и этилацетат добавили, и смесь очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта после удаления растворителей в вакууме. Полученное количество составило 24.7 мг (100% чистота, 51% теоретический выход).
LC-MS (Способ 1B): Rt=1.10 мин; MS (ESIpos): m/z=543 [М+Н]+
Пример 504А
Трет-бутил 4-{3-[5-(2-фторфенил)-1,3,4-оксадиазол-2-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилат
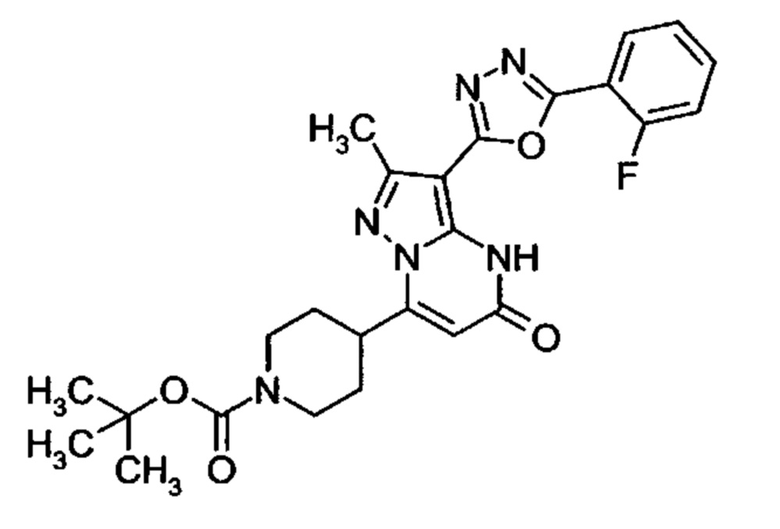
трет-бутил 4-(3-{[2-(2-фторбензоил)гидразинил]карбонил}-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (38.6 мг, 75.3 мкмоль) растворили в ТГФ (2.0 мл, 25 ммоль) и перемешали с реагентом Бургесса (25.1 мг, 105 мкмоль) в течение 16 ч при комнатной температуре. Воду и этилацетат добавили, и смесь очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта после удаления растворителей в вакууме. Полученное количество составило 29.5 мг (100% чистота, 79% теоретический выход).
LC-MS (Способ 1B): Rt=1.12 мин; MS (ESIpos): m/z=495 [М+Н]+
Пример 505А
Трет-бутил 4-{3-[3-(4-гидроксибензил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
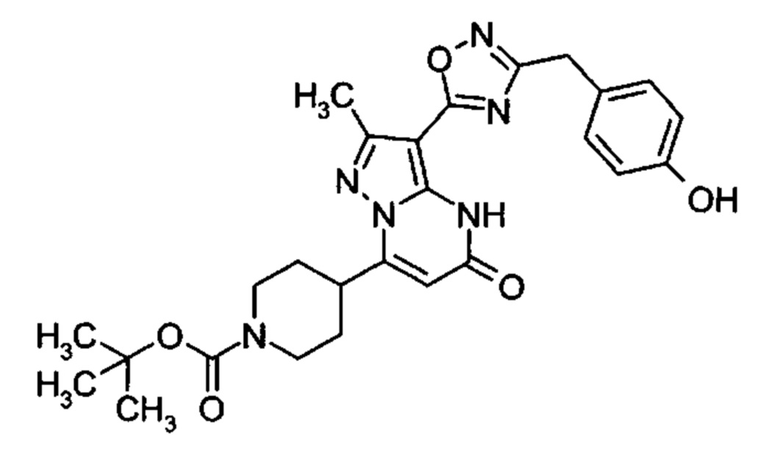
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) растворили в N,N-Диметилформамиде (2 мл) и обработали N,N-Диизопропилэтиламином (210 мкл, 1.2 ммоль) и 1,1'-Карбоилдиимидазолом (129 мг, 797 мкмоль). Смесь перемешивали при 90°C в течение 1.5 ч. (1Z)-N'-гидрокси-2-(4-метоксифенил)этанимидамид (144 мг, 797 мкмоль) растворили в N,N-Диметилформамиде (1 мл) и добавили по каплям. Смесь затем перемешивали при 110°C в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта. Полученное количество составило 84.6 мг (99% чистота, 41% теоретический выход).
LC-MS (Способ 1B): Rt=1.33 мин; MS (ESIpos): m/z=507 [М+Н]+
Пример 506А
Трет-бутил 4-{3-[5-(3-фтор-4-метоксибензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
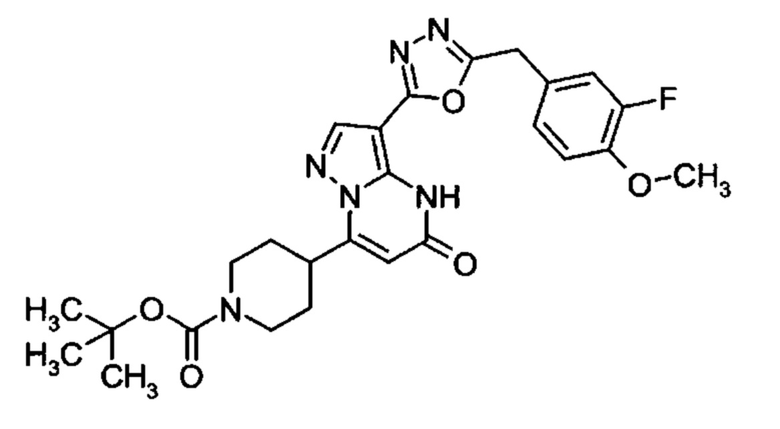
трет-бутил 4-[3-({2-[(3-фтор-4-метоксифенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (34.0 мг, 62.7 мкмоль) растворили в ТГФ (1.7 мл, 21 ммоль) и перемешали с реагентом Бургесса (20.9 мг, 87.7 мкмоль) в течение 16 ч при комнатной температуре. Добавили воду, и смесь очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта после удаления растворителей в вакууме. Полученное количество составило 10.1 мг (100% чистота, 31% теоретический выход).
LC-MS (Способ 11B): Rt=1.90 мин; MS (ESIpos): m/z=525 [М+Н]+
Пример 507А
Трет-бутил 4-{3-[4-(2-метилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат

трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (100 мг, 265 мкмоль), и 2-бром-1-(2-метилфенил)этанон (40 мкл, 260 мкмоль) растворили в этаноле (3.0 мл, 52 ммоль) и перемешивали при 70°C в течение 2 ч. Растворители удалили в вакууме с получением продукта. Полученное количество составило 12 мг (95% чистота, 22% теоретический выход).
LC-MS (Способ 1B): Rt=1.37 мин; MS (ESIpos): m/z=492 [М+Н]+
Пример 508А
Трет-бутил 4-[3-({2-[(3,5-дифтор-4-метоксифенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
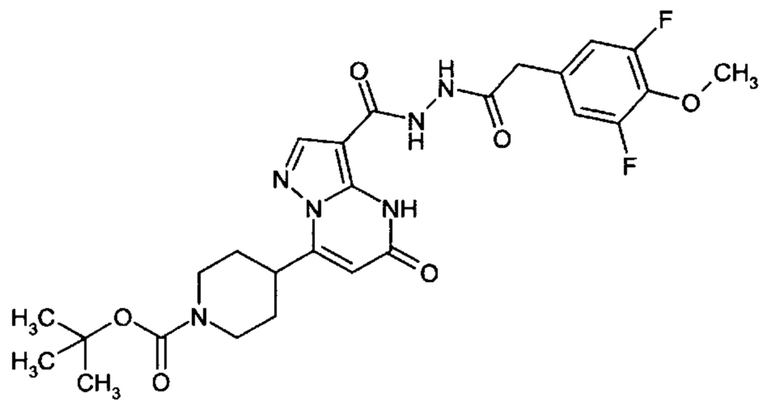
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(3,5-дифтор-4-метоксифенил)ацетогидразид (134 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (236 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% трифторуксусной кислотой), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин - 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 50.1 мг (22% теоретический выход).
LC-MS (Способ 1B): Rt=0.91 мин; MS (ESIneg): m/z=559 [М-Н]-
Пример 509А
Трет-бутил 4-(3-{[2-(2-фторбензоил)гидразинил]карбонил}-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат
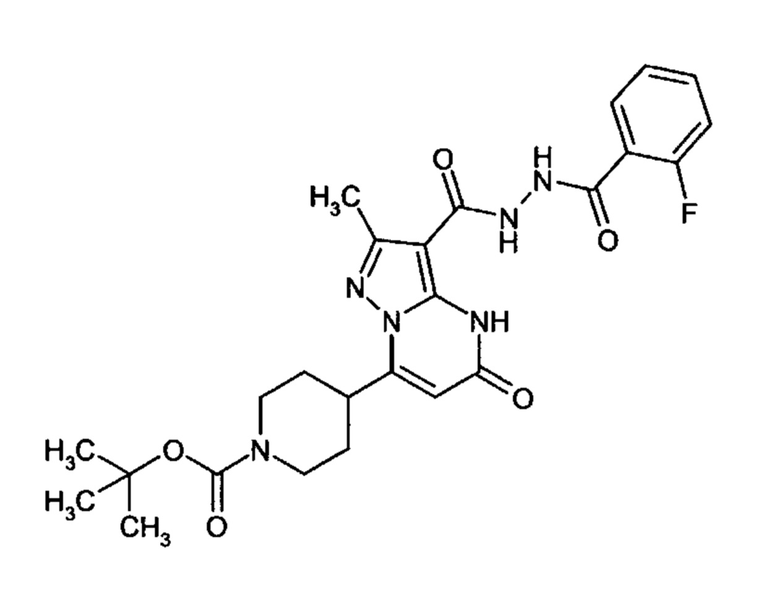
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 398 мкмоль) и 2-фторбензогидразид (92.1 мг, 598 мкмоль) растворили в N,N-Диметилформамиде (2.0 мл, 26 ммоль). N,N-Диизопропилэтиламин (210 мкл, 1.2 ммоль) и HATU (256 мг, 598 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% трифторуксусной кислотой), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 40.7 мг (100% чистота, 20% теоретический выход).
LC-MS (Способ 11B): Rt=1.73 мин; MS (ESIpos): m/z=513 [М+Н]+
Пример 510А
Трет-бутил 4-[3-({2-[(3-фтор-4-метоксифенил)ацетил]гидразинил}карбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат

7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (150 мг, 414 мкмоль) и 2-(3-фтор-4-метоксифенил)ацетогидразид (123 мг, 621 мкмоль) растворили в N,N-Диметилформамиде (1.5 мл, 19 ммоль). N,N-Диизопропилэтиламин (220 мкл, 1.2 ммоль) и HATU (236 мг, 621 мкмоль) добавили, и смесь перемешивали при комнатной температуре в течение 16 ч. Очистка посредством обращенно-фазовой ВЭЖХ (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% трифторуксусной кислотой), В = ацетонитрил / градиент:: 0.00-5.00 мин = 20%В, 6.50 мин = 40%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 40%В) обеспечила желаемый продукт после высушивания в вакууме. Полученное количество составило 34.0 мг (73% чистота, 11% теоретический выход).
LC-MS (Способ 11В): Rt=1.54 мин; MS (ESIneg): m/z=541 [M-H]-
Пример 511A
Трет-бутил 4-[3-(2-гидроксипропан-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
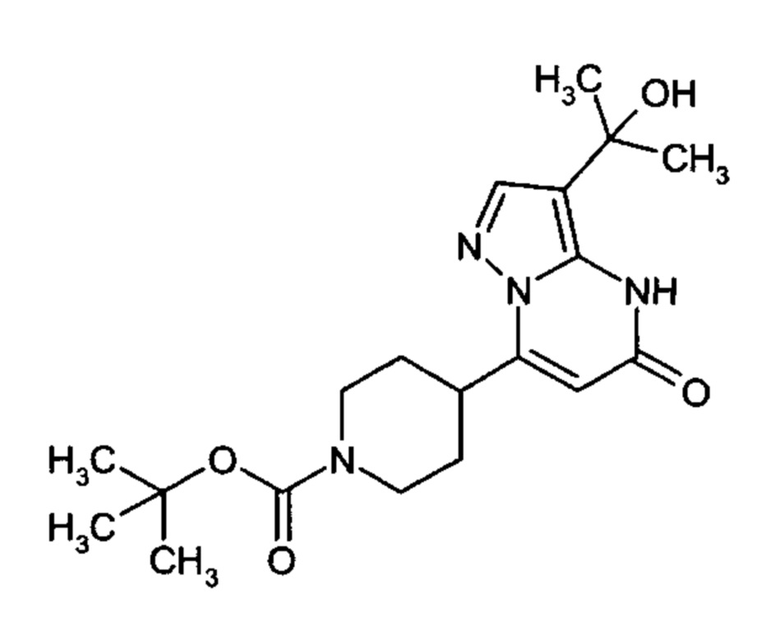
Раствор бром(метил)магния (1.4 мл, 1.0 М в простом диэтиловом эфире, 1.4 ммоль) в тетрагидрофуране (2.0 мл) в атмосфере аргона охладили до 0°C перед тем, как раствор этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (200 мг, 94% чистота, 482 мкмоль) в тетрагидрофуране (2.0 мл) добавили по каплям. Ледяную баню удалили, и смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь погасили соляной кислотой (1Н раствор в воде, 1.5 мл), растворили в воде (3.0 мл) и ацетонитриле (2.0 мл) перед очисткой посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта, которые затем лиофилизовали, получили соединение, указанное в названии. Полученное количество составило 125 мг (100% чистота, 69% теоретический выход).
LC-MS (Способ 11В): Rt=1.52 мин; MS (ESIneg): m/z=375 [М-Н]-
Пример 512А
Трет-бутил 4-[3-(5-метил-2-фенил-1,3-тиазол-4-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
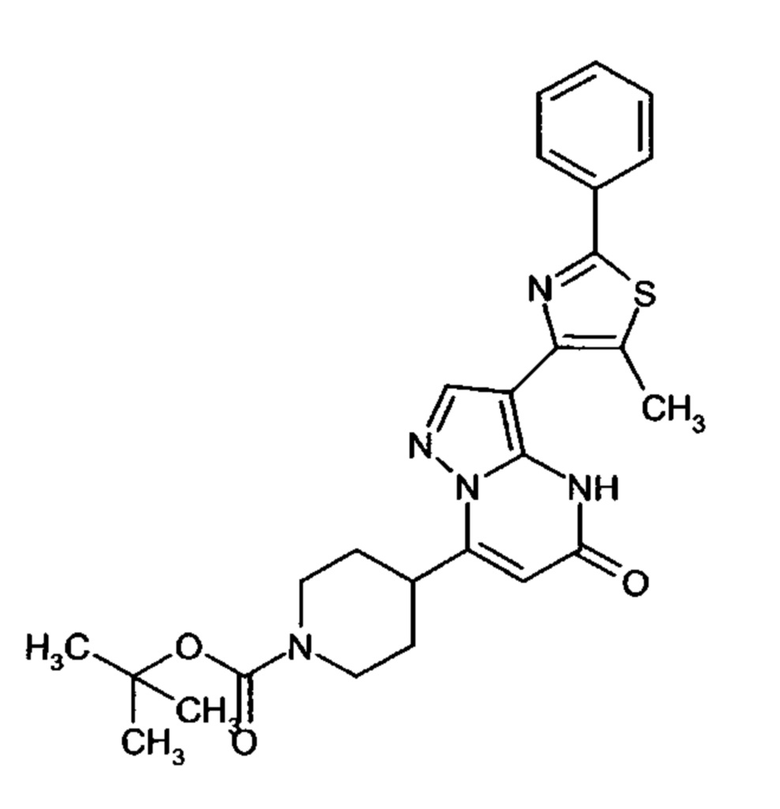
Раствор трет-бутил 4-[3-(2-бромпропаноил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (44.0 мг, 97.1 мкмоль), бензолкарботиоамида (13.3 мг, 97.1 мкмоль) и этилдиизопропиламина (85 мкл, 490 мкмоль) в этаноле (3.0 мл) перемешивали 1 ч при 70°C. Смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 7.50 мг (100% чистота, 16% теоретический выход).
LC-MS (Способ 1B): Rt=1.32 мин; MS (ESIpos): m/z=492 [М+Н]+
Пример 513А
Трет-бутил 4-[3-(циклопентилкарбонимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
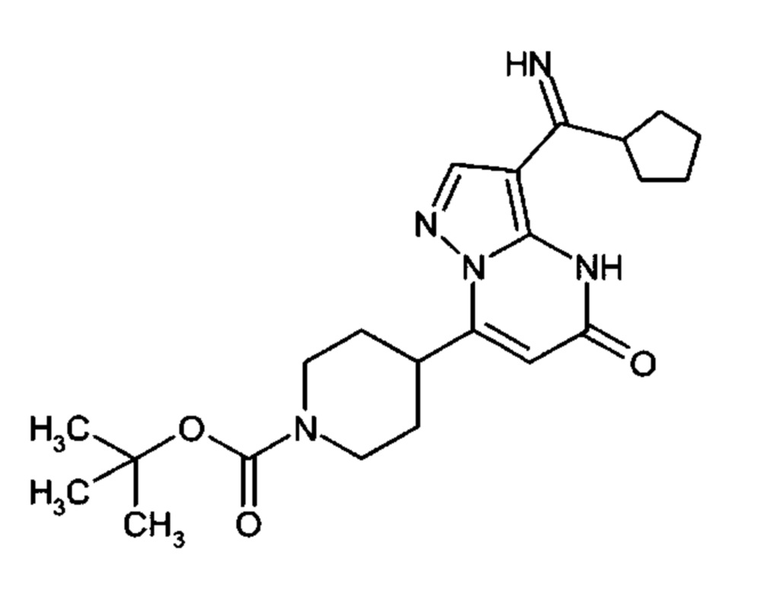
Раствор трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (400 мг, 1.16 ммоль) и бром(циклопентил)магния (2.9 мл, 2.0 М в простом диэтиловом эфире, 5.8 ммоль) в тетрагидрофуране (2.0 мл) перемешивали всю ночь при 60°C в атмосфере аргона перед перемешиванием с этилацетатом (100 мл) и соляной кислотой (1Н раствор в воде, 100 мл). Органическую фазу экстрагировали, высушивали над сульфатом натрия и концентрировали. Смесь растворили в смеси ацетонитрил/диметил сульфоксид, и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Фракции, содержащие имин (соединение, указанное в названии) или соответствующий кетон, объединили, выпарили и применяли на следующей стадии (147 мг).
LC-MS (Способ 11В): Rt=1.55 мин; MS (ESIpos): m/z=414 [М+Н]+
Пример 514А
Трет-бутил 4-[3-(2-метилбутанимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
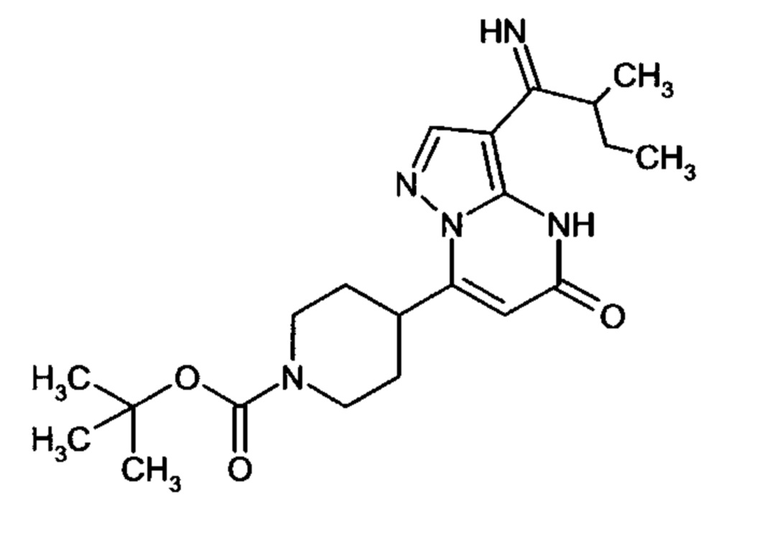
Раствор трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (50.0 мг, 146 мкмоль) и бром(бутан-2-ил)магния (730 мкл, 1.0 М в тетрагидрофуране, 730 мкмоль) в тетрагидрофуране (1.0 мл) перемешивали всю ночь при 60°C в атмосфере аргона перед перемешиванием с соляная кислотой (1Н раствор в воде). Смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Фракции, содержащие имин (соединение, указанное в названии) или соответствующий кетон, объединили, выпарили и применяли на следующей стадии (27.0 мг).
LC-MS (Способ 11 В): Rt=1.51 мин; MS (ESIpos): m/z=402 [М+Н]+
Пример 515А
Трет-бутил 4-[3-(циклопропилкарбонил)-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
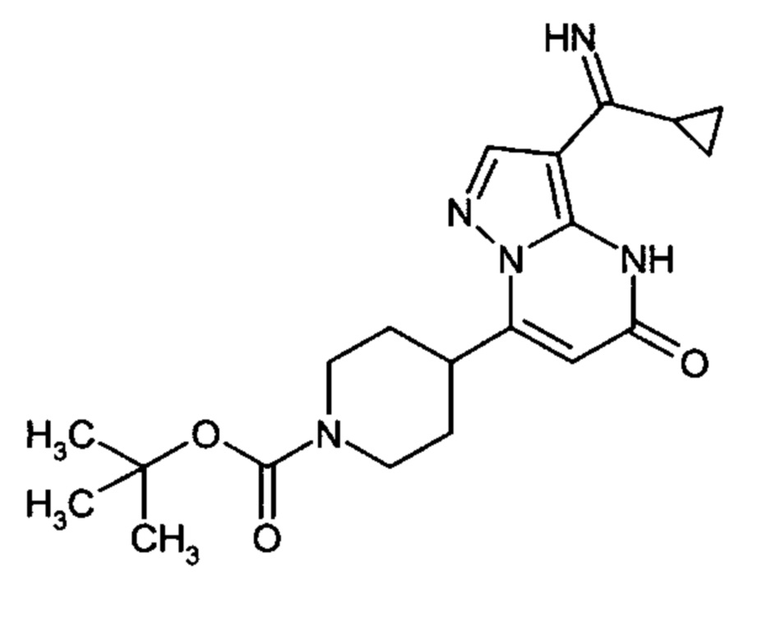
Раствор трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (300 мг, 874 мкмоль) и бром(циклопропил)магния (8.7 мл, 0.50 М в тетрагидрофуране, 4.4 ммоль) в тетрагидрофуране (7.5 мл) перемешивали всю ночь при 60°C в атмосфере аргона перед перемешиванием с этилацетатом и соляной кислотой (1Н раствор в воде). Органическую фазу экстрагировали, высушивали над сульфатом натрия и концентрировали. Смесь растворили в смеси ацетонитрил/диметил сульфоксид, и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Фракции, содержащие имин (соединение, указанное в названии) или соответствующий кетон, объединили, выпарили и применяли на следующей стадии (42 мг).
LC-MS (Способ 1B): Rt=0.79 мин; MS (ESIpos): m/z=386 [М+Н]+
Пример 516А
Метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло [1,5-а]пиримидин-3-карбоксилат
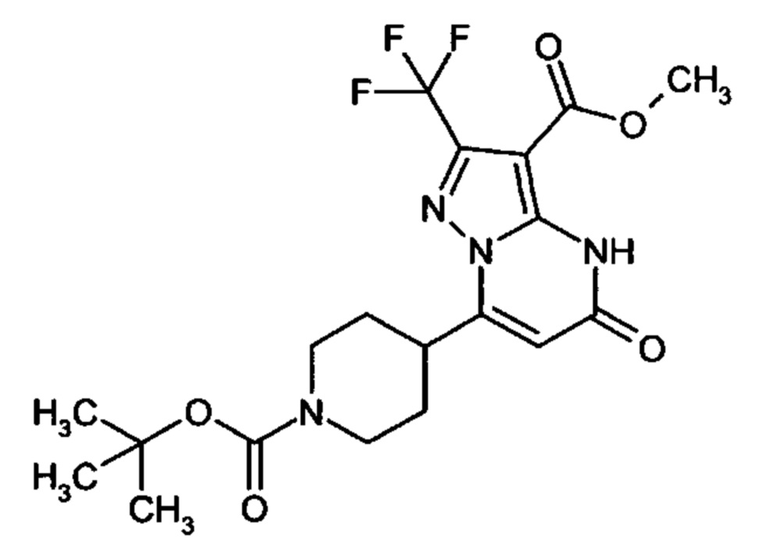
Смесь метил 5-амино-3-(трифторметил)-1Н-пиразол-4-карбоксилат (1.32 г, 6.29 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата (5.81 г, 16.4 ммоль) в ацетонитриле (65 мл) перемешивали в атмосфере аргона в течение 1 ч при возврате флегмы. Триэтиламин (2.6 мл, 19 ммоль) добавили, и перемешивание продолжали в течение 24 ч. Смесь разбавили 200 мл этилацетата и промыли три раза с соляной кислотой (1Н раствор в воде, 200 мл). Органическую фазу высушивали над сульфатом натрия, отфильтровали и концентрировали. Добавили смесь 1:1 ацетонитрил/вода, и вновь образовавшееся твердое вещество отфильтровали и высушивали в вакууме с получением продукта, указанного в названии. Полученное количество составило 1.34 г (96% чистота, 46% теоретический выход).
LC-MS (Способ 8В): Rt=1.38 мин; MS (ESIneg): m/z=443 [М-Н]-
Пример 517А
Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
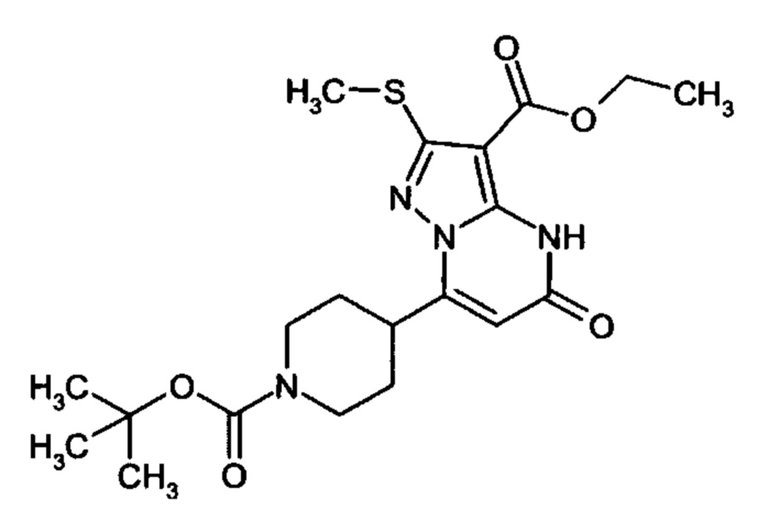
Смесь этил 5-амино-3-(метилсульфанил)-1Н-пиразол-4-карбоксилата (625 мг, 3.11 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата (2.87 г, 8.07 ммоль) в ацетонитриле (24 мл) перемешивали в атмосфере аргона всю ночь при возврате флегмы. Триэтиламин (1.3 мл, 9.3 ммоль) добавили, и перемешивание продолжали в течение 4 ч. Смесь подкислили соляной кислотой (1Н раствор в воде, 10 мл). Вновь образовавшееся твердое вещество отфильтровали и высушивали в вакууме. Фильтрат концентрировали, разбавили ацетонитрилом и водой, и полученную суспензию отфильтровали и высушивали в вакууме. Обе фракции твердого вещества объединили с получением соединения, указанного в названии. Полученное количество составило 1.17 г (100% чистота, 86% теоретический выход).
LC-MS (Способ 1B): Rt=1.16 мин; MS (ESIneg): m/z=435 [М-Н]-
Пример 518А
Трет-бутил 4-[3-(2,2-диметилпропаноил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
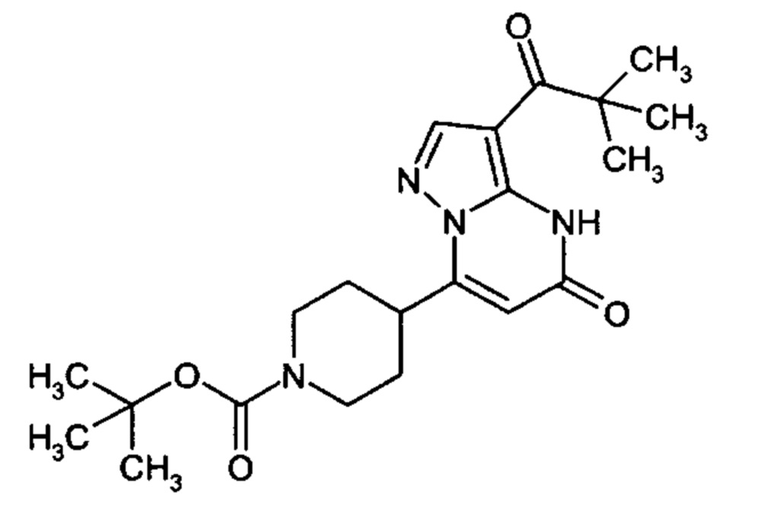
Раствор трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (200 мг, 582 мкмоль) и трет-бутил(хлор)магния (1.5 мл, 2.0 М, 2.9 ммоль) в тетрагидрофуране (4.0 мл) перемешивали всю ночь при 60°C в атмосфере аргона прежде чем погасить насыщенным водным раствором хлорида аммония, и разбавили этилацетатом. Органическую фазу экстрагировали, промыли дважды насыщенным водным раствором хлорида аммония и одни раз соляной кислотой (1Н раствор в воде) перед высушиванием, высушивали над сульфатом натрия и концентрировали. Полученную смесь перемешивали всю ночь со смесью ацетонитрил/муравьиная кислота (0.05% раствор в воде) и концентрировали. Твердое вещество отфильтровали и применяли в таком виде на следующей стадии. Полученное количество составило 54.8 мг (80% чистота).
LC-MS (Способ 11B): Rt=2.04 мин; MS (ESIneg): m/z=401 [М-Н]-
Пример 519А
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота
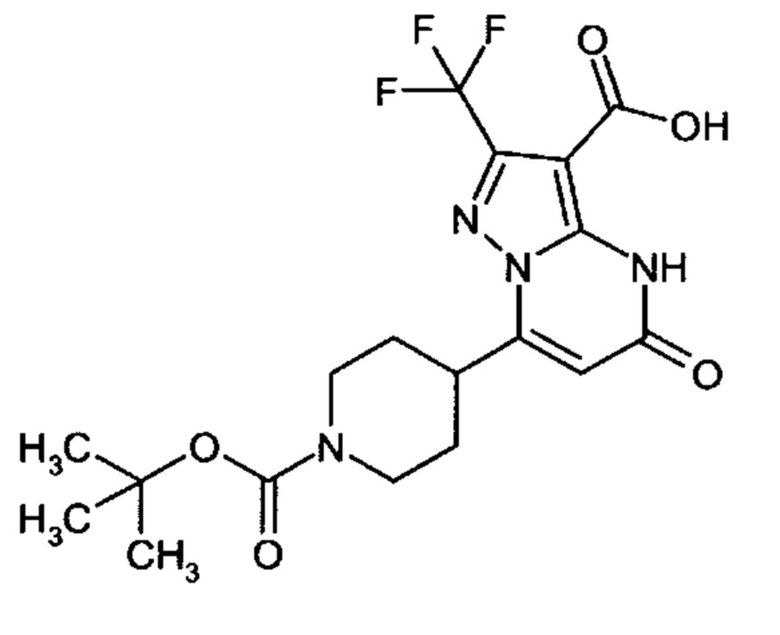
Смесь метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (1.34 г, 3.02 ммоль) и гидроксида лития (56 мкл, 30 ммоль) в метаноле (100 мл) и воде (50 мл) перемешивали в течение трех дней при 45°C. Метанол выпарили, и оставшийся водный раствор подкислили соляной кислотой (1H раствор в воде). Вновь образовавшееся твердое вещество отфильтровали и высушивали в вакууме с получением соединения, указанного в названии. Полученное количество составило 1.12 г (100% чистота, 86% теоретический выход).
LC-MS (Способ 11B): Rt=1.72 мин; MS (ESIneg): m/z=429 [M-H]-
Пример 520A
Трет-бутил 4-[3-(1Н-имидазол-1-илкарбонил)-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат
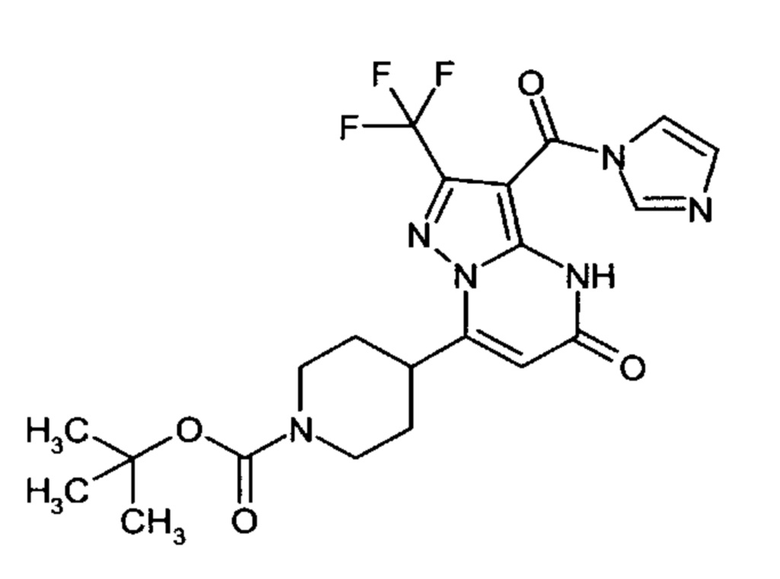
Соединение 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 232 мкмоль) разбавили в тетрагидрофуране (1.7 мл) перед добавлением 1,1'-карбонилдиимидазола (75.4 мг, 465 мкмоль). Смесь перемешивали в течение 2 ч при 80°C перед концентрированием и применяли в таком виде на следующей стадии.
LC-MS (Способ 8В): Rt=1.27 мин; MS (ESIneg): m/z=479 [М-Н]-
Пример 521А
Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло [1,5-а]пиримидин-3-карбоксилат

Соединение трет-бутил 4-[3-(1Н-имидазол-1-илкарбонил)-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (111 мг, 231 мкмоль) разбавили в этаноле (3.0 мл, 460 мкмоль). Смесь перемешивали в течение 2 ч при 80°C и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 85.0 мг (99% чистота, 79% теоретический выход).
LC-MS (Способ 8В): Rt=1.46 мин; MS (ESIneg): m/z=457 [М-Н]-
Пример 522А
Пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло [1,5-а]пиримидин-3-карбоксилат
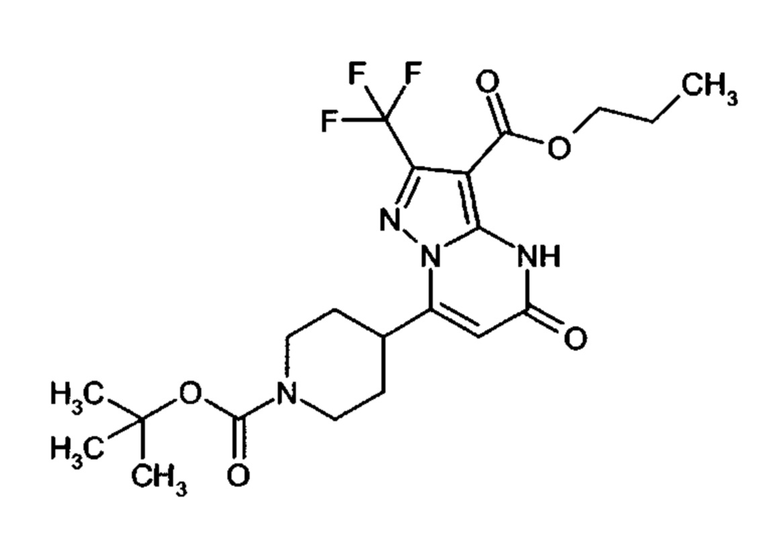
Соединение трет-бутил 4-[3-(1Н-имидазол-1-илкарбонил)-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (111 мг, 231 мкмоль) разбавили в пропан-1-оле (3.0 мл, 460 мкмоль). Смесь перемешивали в течение 2 ч при 100°C и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 98.0 мг (100% чистота, 90% теоретический выход).
LC-MS (Способ 8В): Rt=1.54 мин; MS (ESIneg): m/z=471 [М-Н]-
Пример 523А
Пропан-2-ил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
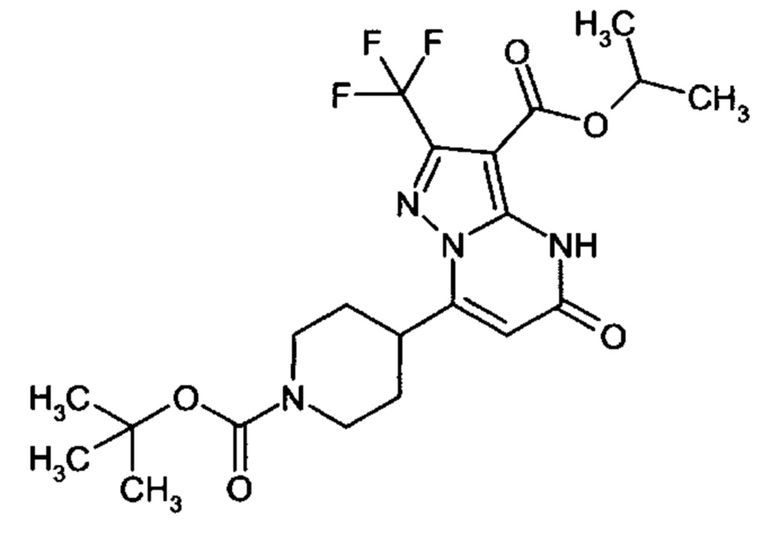
Соединение трет-бутил 4-[3-(1Н-имидазол-1-илкарбонил)-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (111 мг, 231 мкмоль) разбавили в пропан-2-оле (3.0 мл, 460 мкмоль). Смесь перемешивали в течение 2 ч при 80°C и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 73.0 мг (100% чистота, 67% теоретический выход).
LC-MS (Способ 8В): Rt=1.55 мин; MS (ESIneg): m/z=471 [М-Н]-
Пример 524А
2,2-дифторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а] пиримидин-3-карбоксилат
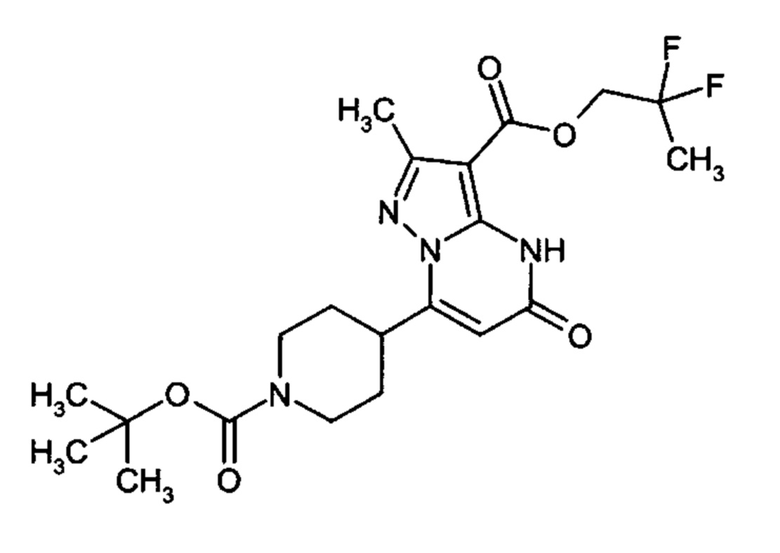
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль), и N,N'-Карбонилдиимидазол (86.2 мг, 531 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 1.5 ч. Растворители удалили, и 2,2-дифторпропан-1-ол (3.01 г, 31.4 ммоль) добавили. Смесь нагревали с возвратом флегмы в течение 18 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (105 мг, 99% чистота, 86% теоретический выход).
LC-MS (Способ 11В): Rt=2.03 мин; MS (ESIneg): m/z=453 [М-Н]-
Пример 525А
Трет-бутил 4-{3-[(3,3-диметилпирролидин-1-ил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат
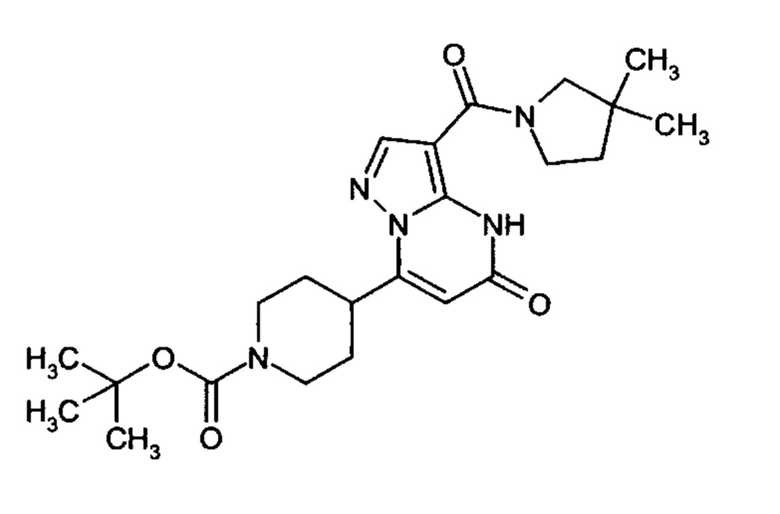
К 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоте (100 мг, 276 мкмоль) в диметилформамиде (1.0 мл, 13 ммоль) добавили HATU (136 мг, 359 мкмоль) и N,N-Диизопропилэтиламин (140 мкл, 830 мкмоль). Затем 3,3-диметилпирролидин (54.7 мг, 552 мкмоль) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Еще HATU (1.3 эквивалента) добавили, и реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Добавили воду, и полученный осадок отфильтровали, промыли водой, и высушивали в вакууме. Объединенное количество продукта составило 51.0 мг (93% чистота, 39% теоретический выход).
LC-MS (Способ 11B): Rt=1.92 мин; MS (ESIpos): m/z=444 [М+Н]+
Пример 526А
2,2-дифторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
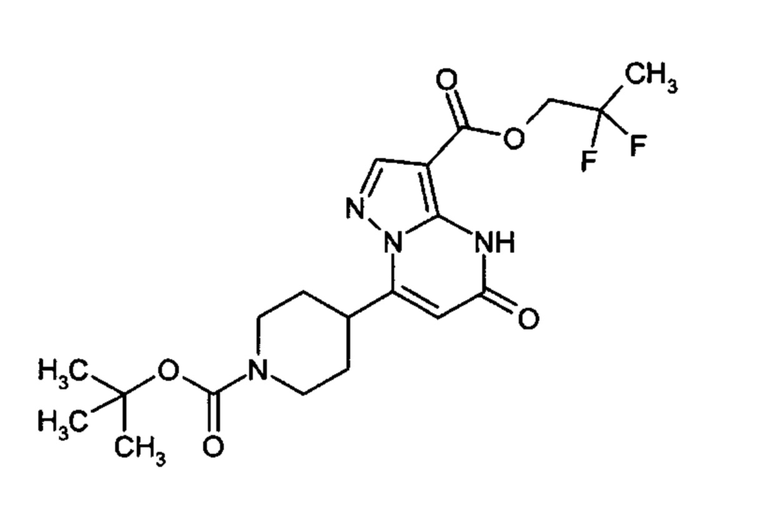
трет-бутил 4-[3-(1Н-имидазол-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 242 мкмоль) растворили в 2,2-дифторпропан-1-оле (466 мг, 4.85 ммоль) и нагревали при возврате флегмы в течение 1 ч. Растворитель удалили, и затем добавили этилацетат и воду. Органическую фазу промыли водой, высушивали посредством фильтрации (Extrelut NT3) и в вакууме. Остаток очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (83.0 мг, 100% чистота, 78% теоретический выход).
LC-MS (Способ 1B): Rt=1.00 мин; MS (ESIneg): m/z=439 [M-H]-
Пример 527A
3-фторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
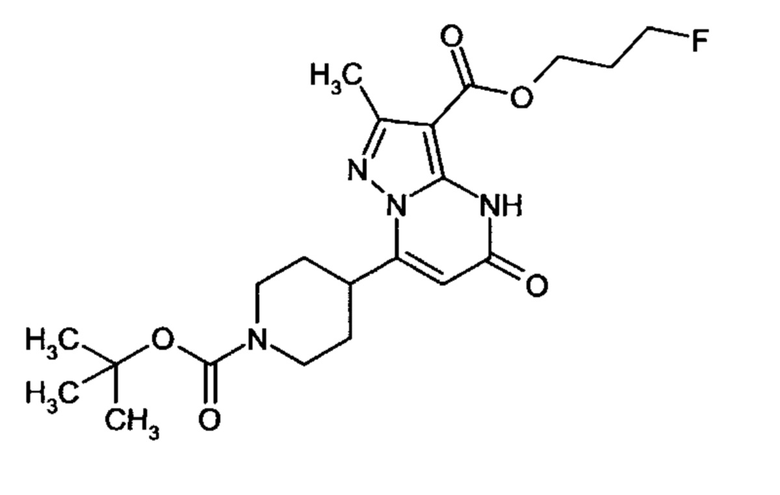
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль), и N,N'-Карбонилдиимидазол (86.2 мг, 531 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 1.5 ч. Растворители удалили, и 3-фторпропан-1-ол (500 мкл, 1.3 ммоль) добавили. Смесь нагревали с возвратом флегмы в течение 18 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (84.4 мг, 58% чистота, 42% теоретический выход).
LC-MS (Способ 10В): Rt=1.86 мин; MS (ESIneg): m/z=435 [М-Н]-
Пример 528А
2,2-дифторэтил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
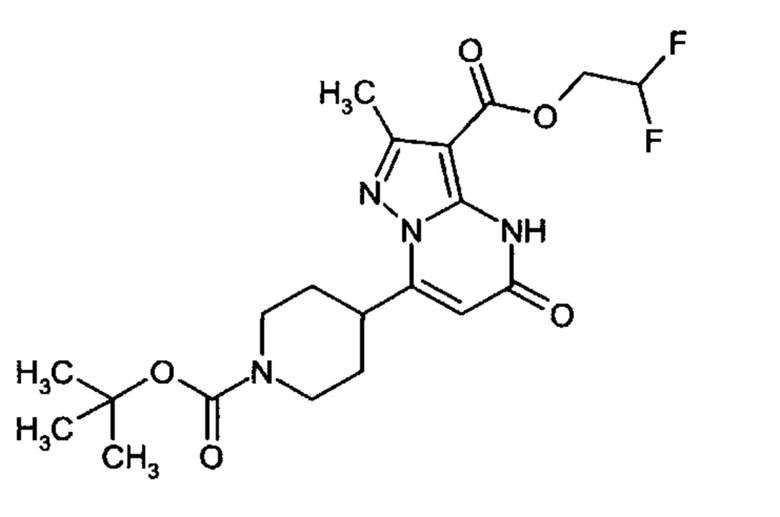
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль), и N,N'-Карбонилдиимидазол (86.2 мг, 531 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 1.5 ч. Растворители удалили, и 2,2-дифторэтанол (500 мкл, 31 ммоль) добавили. Смесь нагревали с возвратом флегмы в течение 18 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (93.8 мг, 100% чистота, 80% теоретический выход).
LC-MS (Способ 11B): Rt=1.93 мин; MS (ESIneg): m/z=439 [М-Н]-
Пример 529А
3,3,3-трифторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
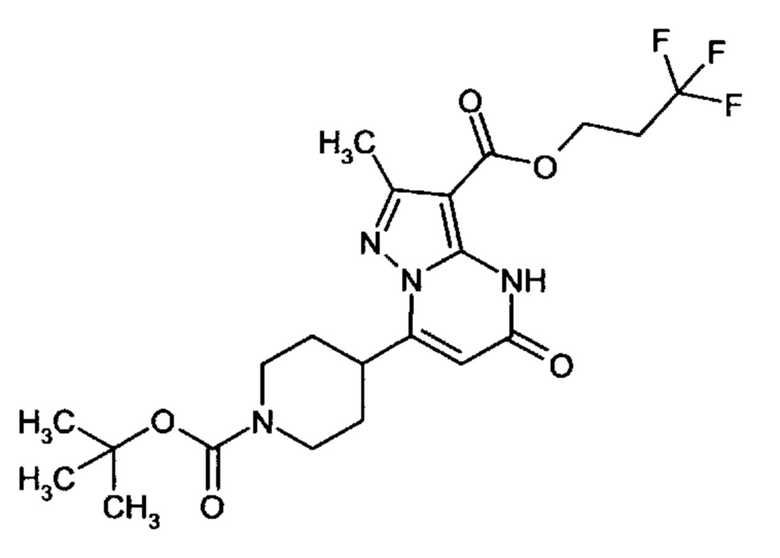
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль), и N,N'-Карбонилдиимидазол (86.2 мг, 531 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 1.5 ч. Растворители удалили, и 3,3,3-трифторпропан-1-ол (500 мкл, 530 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 18 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (94.9 мг, 99% чистота, 75% теоретический выход).
LC-MS (Способ 1B): Rt=1.12 мин; MS (ESIneg): m/z=471 [М-Н]-
Пример 530А
Пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
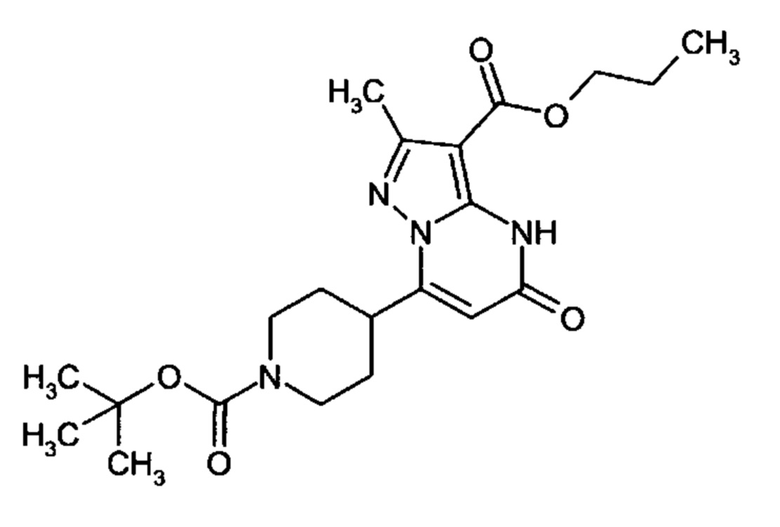
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль), и N,N'-Карбонилдиимидазол (86.2 мг, 531 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 1.5 ч. Растворители удалили, пропан-1-ол (79.8 мг, 1.33 ммоль) добавили. Смесь нагревали с возвратом флегмы в течение 18 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (88.2 мг, 95% чистота, 75% теоретический выход).
LC-MS (Способ 11B): Rt=2.14 мин; MS (ESIneg): m/z=417 [М-Н]-
Пример 531А
Циклобутил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
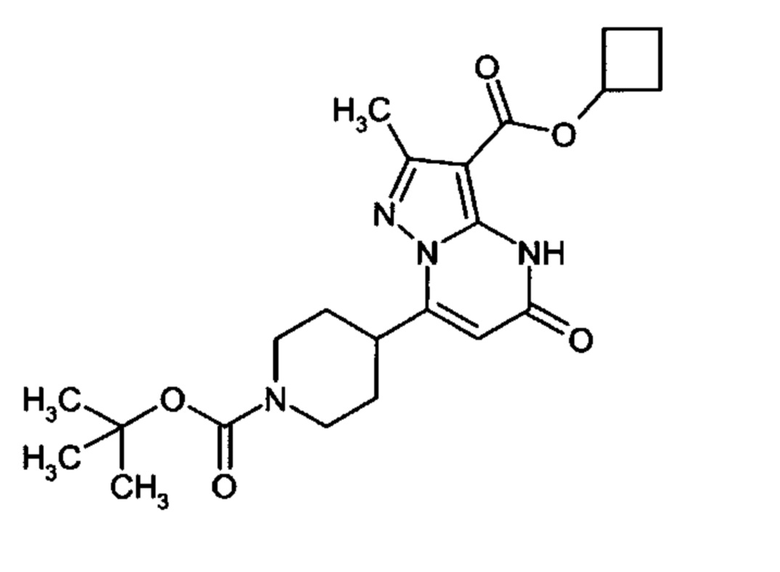
7-[1-(трет-бутоксикарбонил)пиперидан-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (5.0 мл, 62 ммоль), и N,N'-Карбонилдиимидазол (86.2 мг, 531 мкмоль) добавили. Смесь нагревали с возвратом флегмы в течение 1.5 ч. Растворители удалили, циклобутанол (95.8 мг, 1.33 ммоль) добавили. Смесь нагревали с возвратом флегмы в течение 18 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (98.7 мг, 95% чистота, 82% теоретический выход).
LC-MS (Способ 11B): Rt=2.20 мин; MS (ESIneg): m/z=429 [M-H]-
Пример 532A
Трет-бутил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
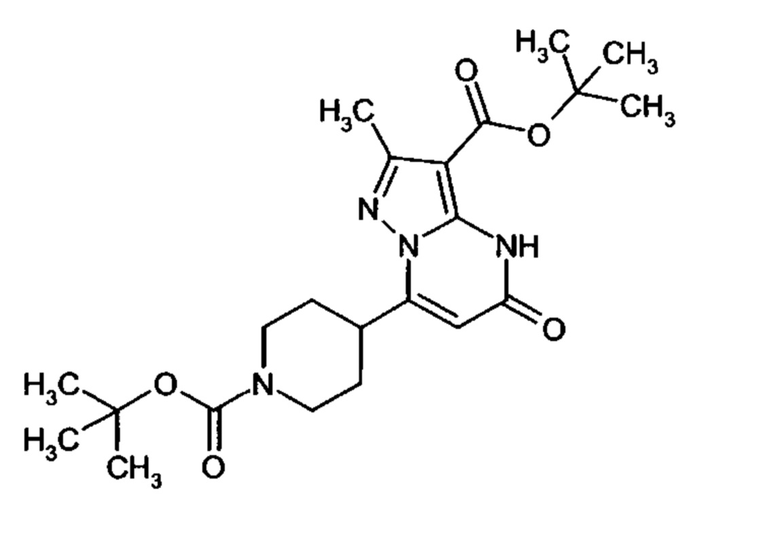
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 266 мкмоль) растворили в тетрагидрофуране (1.0 мл, 12 ммоль), Диэтилэфират трехфтористого бора (1.7 мкл, 13 мкмоль), и затем трет-бутил 2,2,2-трихлорэтанимидат (116 мг, 531 мкмоль) добавили. Смесь перемешивали при комнатной температуре в течение 18 ч, и затем очистили посредством препаративной ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии (87.8 мг, 96% чистота, 73% теоретический выход).
LC-MS (Способ 1B): Rt=1.24 мин; MS (ESIneg): m/z=431 [М-Н]-
Пример 433А
Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
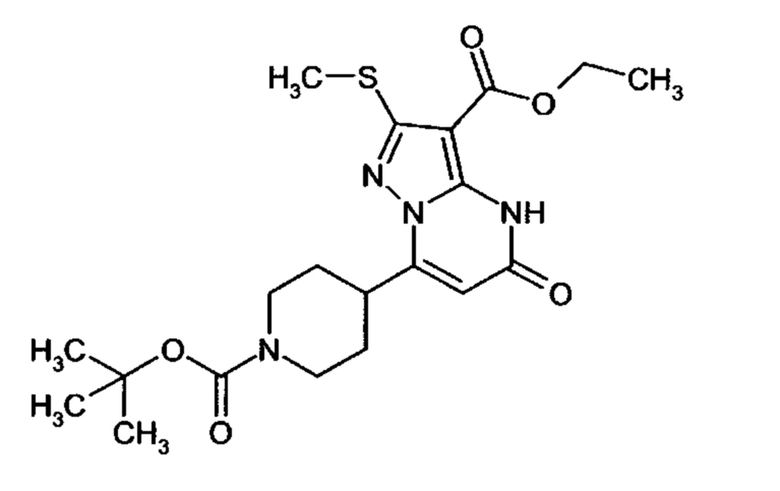
Смесь этил 5-амино-3-(метилсульфанил)-1Н-пиразол-4-карбоксилата (625 мг, 3.11 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата (2.87 г, 8.07 ммоль) в ацетонитриле (24 мл) перемешивали в атмосфере аргона всю ночь при возврате флегмы. Триэтиламин (1.3 мл, 9.3 ммоль) добавили, и перемешивание продолжали в течение 4 ч. Смесь подкислили соляной кислотой (1Н раствор в воде, 10 мл). Твердое вещество, которое выпало в осадок, отфильтровали и высушивали в вакууме. Маточную жидкость концентрировали и суспендировали в смеси воды и ацетонитрила. Вновь образовавшееся твердое вещество отфильтровали, высушивали в вакууме и объединили с полученным ранее с получением продукта, указанного в названии. Полученное количество составило 1.17 г (100% чистота, 86% теоретический выход).
LC-MS (Способ 6В): Rt=1.16 мин; MS (ESIneg): m/z=435 [М-Н]-
Пример 434А
Метил 5-амино-3-этил-1Н-пиразол-4-карбоксилат
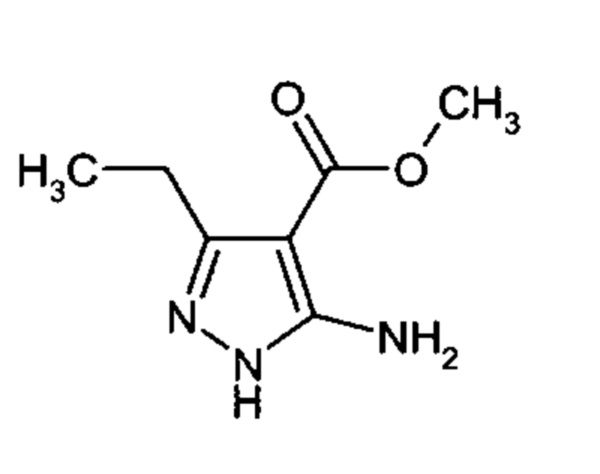
Метил (2Е)-2-циано-3-этоксипент-2-еноат (7.70 г, 42.0 ммоль) разбавили уксусной кислотой (77 мл) в атмосфере аргона перед тем, как гидразин гидрат (1:1) (2.5 мл, 50 ммоль) добавили. Смесь перемешивали в течение 1 ч при 80°C, и затем концентрировали. Неочищенное вещество растворили в ацетонитриле и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 4.40 г (100% чистота, 62% теоретический выход).
LC-MS (Способ 8В): Rt=0.65 мин; MS (ESIneg): m/z=168 [М-Н]-
Пример 435А
Метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-этил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
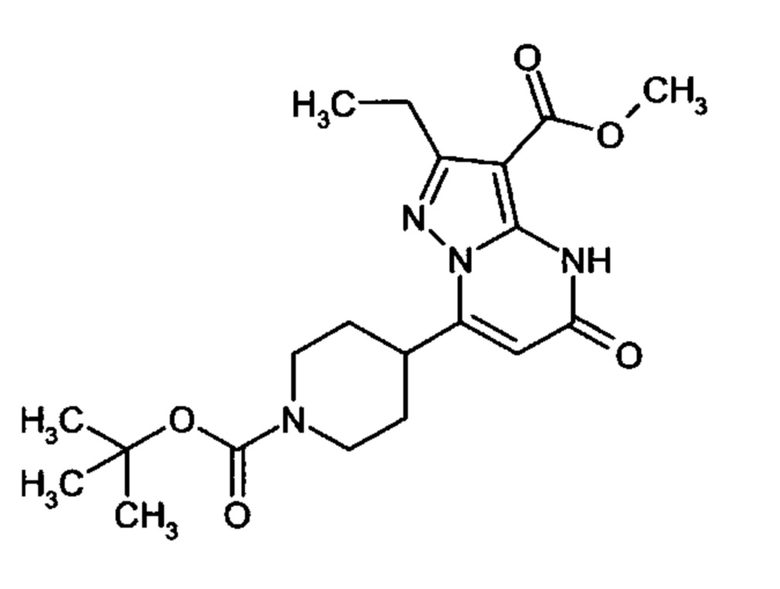
Смесь метил 5-амино-3-этил-1Н-пиразол-4-карбоксилата (1.00 г, 5.91 ммоль) и трет-бутил 4-[(2,2-диметил-4,6-диоксо-1,3-диоксан-5-ил)карбонил]пиперидин-1-карбоксилата (5.46 г, 15.4 ммоль) в ацетонитриле (61 мл) перемешивали в атмосфере аргона в течение 1 ч при возврате флегмы. Триэтиламин (2.5 мл, 18 ммоль) добавили, и перемешивание продолжали всю ночь. Новую порцию триэтиламина (2.5 мл, 18 ммоль) добавили, и перемешивание при возврате флегмы продолжалось всю ночь. Смесь разбавили 200 мл этилацетата и промыли три раза соляной кислотой (1Н раствор в воде, 200 мл). Органическую фазу высушивали над сульфатом натрия, отфильтровали и концентрировали. Добавили смесь 1:1 ацетонитрил/вода, и вновь образовавшееся твердое вещество отфильтровали и высушивали в вакууме с получением продукта, указанного в названии. Полученное количество составило 1.57 г (100% чистота, 66% теоретический выход).
LC-MS (Способ 8В): Rt=1.38 мин; MS (ESIneg): m/z=403 [M-H]-
Пример 436A
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-этил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота

Смесь метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-этил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (570 мг, 1.41 ммоль) и гидроксида лития (169 мг, 7.05 ммоль) в метаноле (7.0 мл) и воде (7.0 мл) перемешивали в течение двух дней при 50°C. Вновь образовавшееся твердое вещество отфильтровали и перемешали с соляная кислота (1Н раствор в воде) перед фильтрацией снова и высушивали в вакууме с получением соединения, указанного в названии. Полученное количество составило 500 мг (83% чистоты, 75% теоретический выход).
LC-MS (Способ 8В): Rt=1.19 мин; MS (ESIneg): m/z=389 [M-H]-
Пример 437А
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота
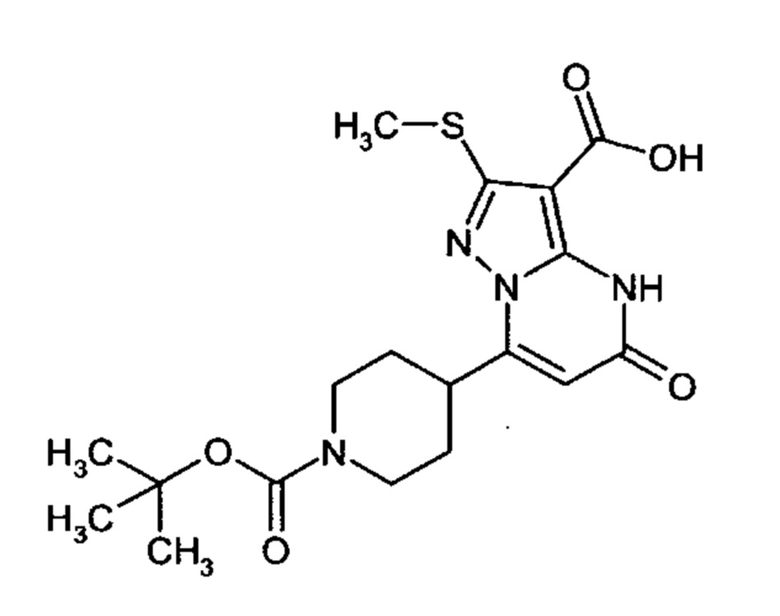
Смесь этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (1.50 г, 3.42 ммоль) и гидроксида лития (820 мг, 34.2 ммоль) в этаноле (60 мл) и воде (30 мл) перемешивали всю ночь при 50°C.Новую порцию гидроксида лития (410 мг, 17.1 ммоль) добавили, и перемешивание продолжали в течение еще одной ночи при 50°C. Смесь подкислили соляной кислотой (1Н раствор в воде) до достижения значения pH=3 и экстрагировали дважды этил ацетатом (150 мл). Органические фазы объединили, высушивали над сульфатом натрия, отфильтровали (фильтр промыли смесью 9:1 дихлорметана и метанола) и концентрировали с получением соединения, указанного в названии, которое хранили в холодильнике. Полученное количество составило 1.16 г (100% чистота, 82% теоретический выход).
LC-MS (Способ 8В): Rt=1.18 мин; MS (ESIneg): m/z=407 [М-Н]-
Пример 438А
Пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
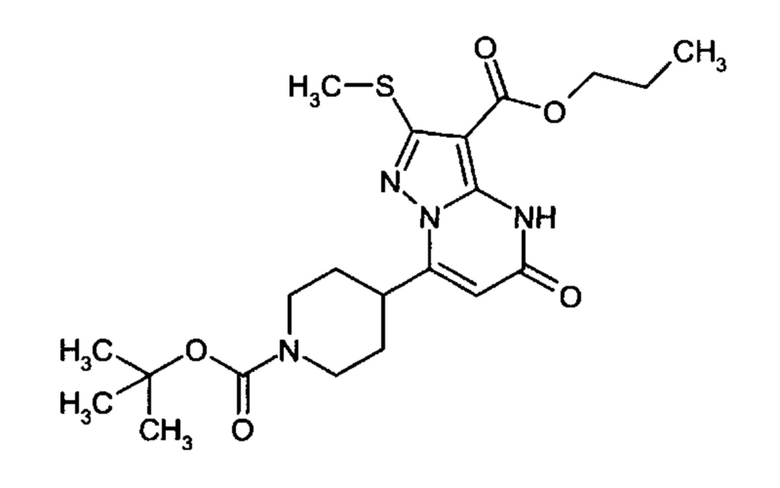
Соединение 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 245 мкмоль) разбавили в N,N-Диметилформамиде (10 мл) перед добавлением 1,1'-карбонилдиимидазола (79.4 мг, 490 мкмоль). Смесь перемешивали в течение 1.5 ч при 80°C перед добавлением пропан-1-ола (10 мл, 130 ммоль). Перемешивание продолжали всю ночь при 100°C. Смесь затем очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 84.6 мг (96% чистота, 74% теоретический выход).
LC-MS (Способ 8В): Rt=1.52 мин; MS (ESIneg): m/z=449 [М-Н]-
Пример 439А
Пропан-2-ил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
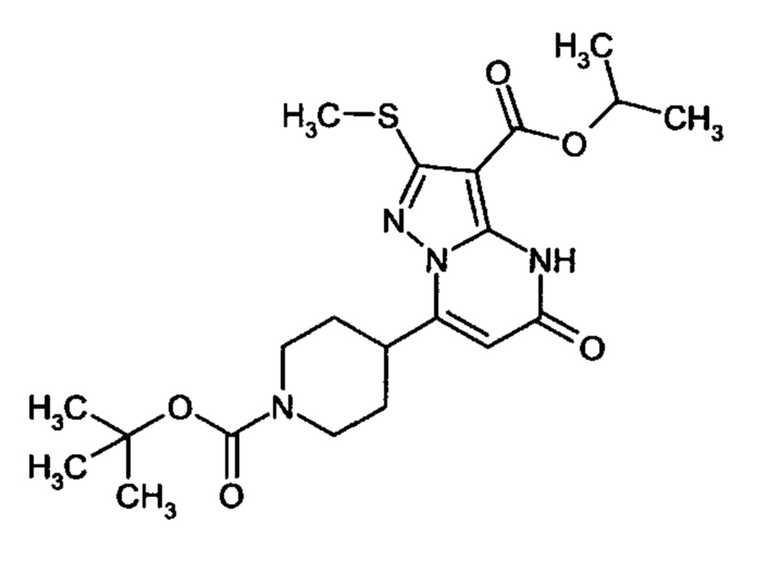
Соединение 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 245 мкмоль) разбавили в N,N-Диметилформамиде (10 мл) перед добавлением 1,1'-карбонилдиимидазола (79.4 мг, 490 мкмоль). Смесь перемешивали в течение 1.5 ч при 80°C перед добавлением пропан-1-ола (10 мл, 130 ммоль). Перемешивание продолжали всю ночь при 80°C. Смесь затем очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 43.5 мг (89% чистота, 35% теоретический выход).
LC-MS (Способ 8В): Rt=1.52 мин; MS (ESIneg): m/z=449 [М-Н]-
Пример 440А
Этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-этил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
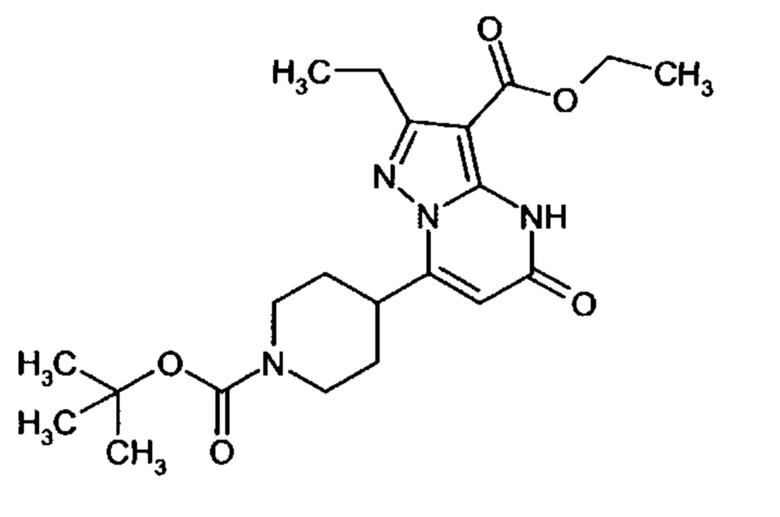
Соединение 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-этил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (100 мг, 256 мкмоль) разбавили в тетрагидрофуране (2.5 мл) перед добавлением 1,1'-карбонилдиимидазола (83.1 мг, 512 мкмоль). Смесь перемешивали в течение 2 ч при 80°C перед концентрированием. Оставшееся вещество разбавили этанолом (2.5 мл, 43 ммоль) и перемешивали в течение 2 ч при 80°C. Смесь затем очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 43.6 мг (100% чистота, 41% теоретический выход).
LC-MS (Способ 8В): Rt=1.47 мин; MS (ESIneg): m/z=417 [M-H]
Получение примеров соединений:
Пример 1
3-Фенил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

Трет-бутил 4-(5-оксо-3-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (12.2 мг, 0.03 ммоль) растворили в 4Н HCl в диоксан (1.3 мл), выпарили в вакууме. Остаток растворили в метаноле (2 мл), выпарили в вакууме и снова растворили в метаноле (0.5 мл) и воде (2 мл). Полученный раствор лиофилизовали с получением соединения, указанного в названии (9.6 мг, 92% теоретический выход).
LC-MS (Способ 1B): Rt=0.59 мин, MS (ESIPos): m/z=295 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.10 (br. s, 1Н), 8.87 (br. s, 1H), 8.66 (br. s, 1H), 7.79.7.44 (m, 2H), 7.40 (t, 2H), 7.29-7.19 (m, 1H), 5.95 (br. s, 1H), 4.12-3.95 (m, 2H), 3.72-3.53 (m, 1H), 3.12 (dd-подобный, 2H), 2.24 (br. d, 2H), 1.90 (q-подобный, 2H); 1 обменный протон не виден.
Пример 2
7-(Пиперидин-4-ил)-3-(пиридин-2-ил)пиразоло[1,5-а]пиримидин-5(4H)-он дигидрохлорид
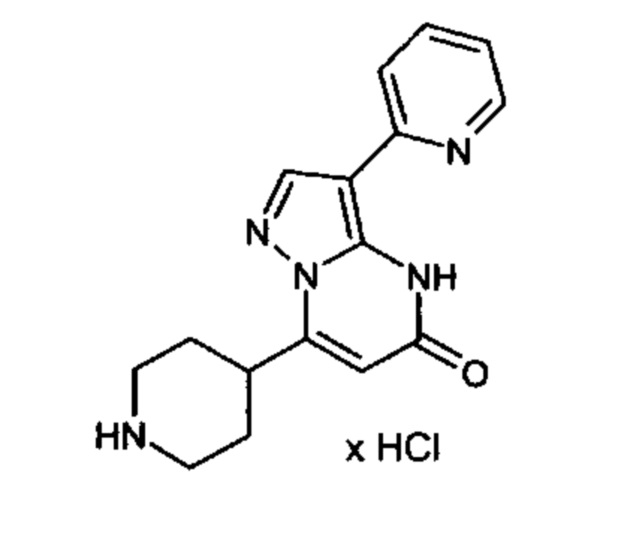
Трет-бутил 4-[7-оксо-3-(пиридин-2-ил)-4,7-дигидропиразоло[1,5-а]пиримидин-5-ил]пиперидин-1-карбоксилат (220 мг, 0.557 ммоль) растворили в метаноле (3 мл). 4Н HCl в диоксан (3 мл) добавили, и смесь облучали ультразвуком в течение 15 мин при комнатной температуре. Полученную суспензию отфильтровали, промыли диоксаном (2 мл) и высушивали в течение 16 ч при 50°C в вакууме с получением соединения, указанного в названии (197 мг, 96% теоретический выход).
LC-MS (Способ 2В): Rt=1.41 мин, MS (ESIPos): m/z=296 [М+Н]+
1Н-ЯМР (400 МГц, D2O): δ=8.64 (d, 1H), 8.41 (s, 1H), 8.37 (t, 1H), 8.06 (d, 1H), 7.69 (dd, 1H), 6.28 (s, 1H), 3.72-3.57 (m, 3H), 3.27 (dd, 2H), 2.42 (d, 2H), 2.00 (q-подобный, 2H).
Пример 3
2-(Метоксиметил)-3-(4-метоксифенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
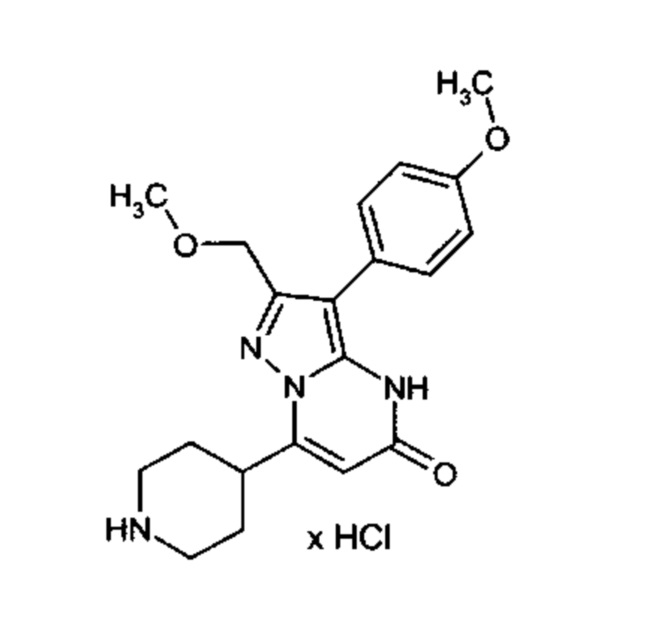
Трет-бутил 4-[2-(метоксиметил)-3-(4-метоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (66 мг, 0.14 ммоль) растворили в метаноле (1.5 мл). 4Н HCl в диоксан (1.5 мл) добавили, и смесь облучали ультразвуком в течение 15 мин при комнатной температуре. Смесь выпарили в вакууме, и добавили диоксан (2 мл). Полученную суспензию отфильтровали, промыли диоксаном (2 мл) и высушивали в течение 16 ч при 50°C в вакууме с получением соединения, указанного в названии (46 мг, 81% теоретический выход).
LC-MS (Способ 1B): Rt=0.55 мин, MS (ESIPos): m/z=369 [М+Н]+
1Н-ЯМР (400 МГц, D2O): δ=7.37 (d, 2Н), 7.11 (d, 2Н), 6.07 (s, 1H), 4.55 (s, 2H), 3.90 (s, 3Н), 3.69-3.59 (m, 3H), 3.37 (s, 3H), 3.29 (dd, 2H), 2.43 (d, 2H), 1.99 (dq-подобный, 2H).
Пример 4
3-(4-Фторфенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
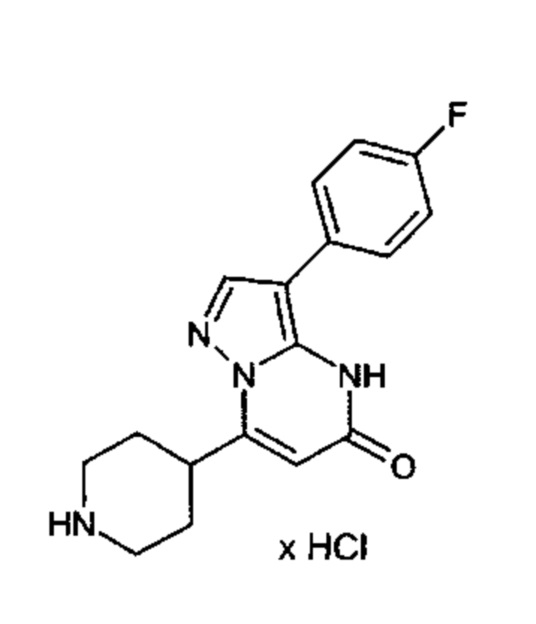
Трет-бутил 4-[3-(4-фторфенил)-7-оксо-4,7-дигидропиразоло[1,5-а]пиримидин-5-ил]пиперидин-1-карбоксилат (64 мг, 0.155 ммоль) растворили в метаноле (1.5 мл). 4Н HCl в диоксан (1.5 мл) добавили, и смесь облучали ультразвуком в течение 15 мин при комнатной температуре. Смесь выпарили в вакууме, и добавили диоксан (2 мл). Полученную суспензию отфильтровали, промыли диоксаном (2 мл) и высушивали в течение 16 ч при 50°C в вакууме с получением соединения, указанного в названии (47 мг, 85% теоретический выход).
LC-MS (Способ 2В): Rt=1.57 мин, MS (ESIPos): m/z=313 [М+Н]+
1Н-ЯМР (400 МГц, D2O): δ=8.09 (s, 1H), 7.50 (dd, 2Н), 7.23 (t, 2Н), 5.90 (s, 1Н), 3.60 (d, 2H), 3.17 (dd, 2H), 3.08 (t-подобный, 1H), 2.28 (d, 2H), 1.98 (dq-подобный, 2H).
Пример 5
7-(Пиперидин-4-ил)-3-(пиридин-3-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

Трет-бутил 4-[7-оксо-3-(пиридин-3-ил)-4,7-дигидропиразоло[1,5-а]пиримидин-5-ил]пиперидин-1-карбоксилат (9.5 мг, 0.24 ммоль) растворили в метаноле (0.5 мл) и 4Н HCl в диоксан (0.5 мл). Смесь облучали ультразвуком в течение 15 мин при комнатной температуре и выпарили в вакууме. Остаток растворили в метаноле (2 мл), выпарили в вакууме и растворили в воде (1 мл). Полученный раствор лиофилизовали с получением соединения, указанного в названии (9.1 мг, 99% теоретический выход).
LC-MS (Способ 2В): Rt=1.22 мин, MS (ESIPos): m/z=296 [М+Н]+
1Н-ЯМР (400 МГц, D2O): δ=8.93 (s, 1Н), 8.65 (d, 1H), 8.54 (d, 1H), 8.22 (s, 1H), 7.97 (dd, 1H), 6.17 (s, 1H), 3.71-3.60 (m, 3H), 3.27 (dd, 2H), 2.42 (d, 2H), 1.99 (qm-подобный, 2H).
Пример 6
3-(2-Метоксифенил)-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
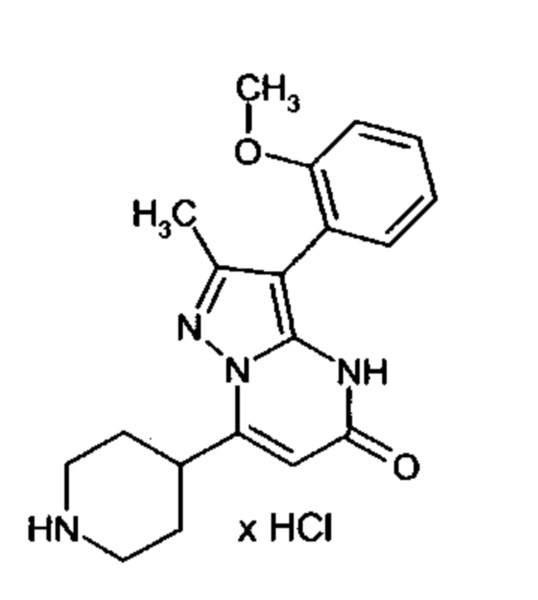
Трет-бутил 4-[3-(2-метоксифенил)-2-метил-7-оксо-4,7-дигидропиразоло[1,5-а]пиримидин-5-ил]пиперидин-1-карбоксилат (3.6 мг, 0.01 ммоль) растворили в метаноле (0.5 мл) и 4Н HCl в диоксан (0.5 мл). Через 3 ч раствор выпарили в вакууме. Остаток растворили в метаноле (2 мл), выпарили в вакууме и растворили в метаноле (0.5 мл) и воде (2 мл). Полученный раствор лиофилизовали с получением соединения, указанного в названии (2.9 мг, 99% теоретический выход).
LC-MS (Способ 1B): Rt=0.60 мин, MS (ESIPos): m/z=339 [М+Н]+
1Н-ЯМР (400 МГц, D2O): δ=7.42 (t, 1H), 7.26 (d, 1H), 7.13 (d, 1H), 7.07 (t, 1H), 5.93 (s, 1H), 3.80 (s, 3H), 3.56 (dd, 2H), 3.53 (t-подобный, 1H), 3.22 (dd, 2H), 2.35 (d, 2H), 2.22 (s, 3H), 1.91 (dq-подобный, 2H).
Пример 7
2-Метил-7-(пиперидин-4-ил)-3-[3-(трифторметил)фенил]пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
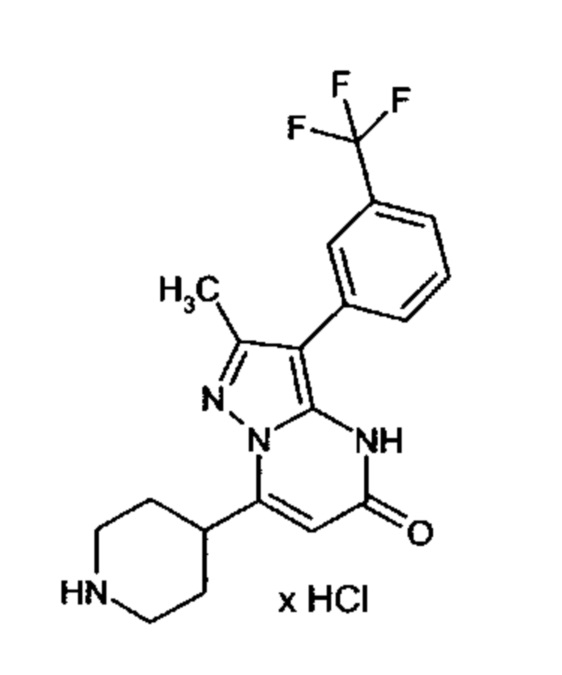
Трет-бутил 4-{2-метил-5-оксо-3-[3-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (0.9 мг, 0.01 ммоль) растворили в метаноле (0.5 мл) и 4Н HCl в диоксан (0.5 мл). Через 3 ч раствор выпарили в вакууме. Остаток растворили в метаноле (2 мл), выпарили в вакууме и растворили в метаноле (0.5 мл) и воде (2 мл). Полученный раствор лиофилизовали с получением соединения, указанного в названии (0.7 мг, 99% теоретический выход).
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.20 (br. s, 1H), 8.79 (br. s, 1H), 8.56 (br. s, 1H), 8.02-7.55 (m, 4H), 5.82 (br. s, 1H), 3.69-3.53 (m, 1H), 3.43 (d, 2H), 3.16 (dd, 2H), 2.40-2.17 (m, 5H), 1.88 (q-подобный, 2H).
Пример 8
2-Метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбонитрил трифторацетат
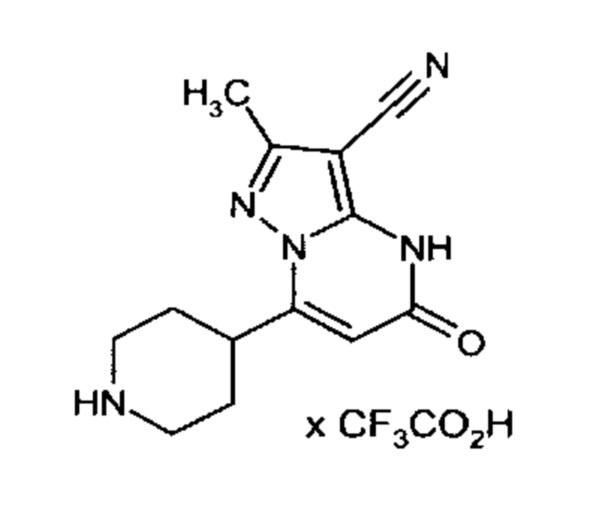
К раствору трет-бутил 4-(3-циано-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (47 мг, 0.13 ммоль) в дихлорметане (5 мл) добавили TFA (0.1 мл) и смесь перемешивали в течение 16 ч при комнатной температуре. Полученный раствор выпарили в вакууме, растворили в воде (15 мл) и лиофилизовали с получением соединения, указанного в названии (49 мг, 99% теоретический выход).
LC-MS (Способ 2В): Rt=1.13 мин, MS (ESIPos): m/z=258 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=13.19 (br. s, 1H), 8.75 (br. s, 1H), 8.45 (br. s, 1H), 6.10 (br. s, 1H), 3.51 (br. s, 1H), 3.40 (d, 2H), 3.11 (dd, 2H), 2.38 (s, 3H), 2.16 (d, 2H), 1.81 (q-подобный, 2H).
Пример 9
Этил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат трифторацетат
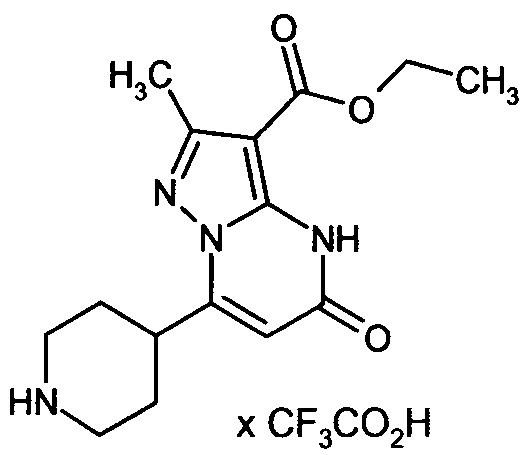
К раствору этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (47 мг, 0.13 ммоль) в дихлорметане (1.3 мл) добавили TFA (0.1 мл) и смесь перемешивали в течение 7 дней при комнатной температуре. Полученный раствор выпарили в вакууме, растворили в воде (15 мл) и лиофилизовали с получением соединения, указанного в названии (23.2 мг, 86% теоретический выход).
LC-MS (Способ 2В): Rt=1.39 мин, MS (ESIPos): m/z=305 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=11.41 (s, 1Н), 8.68 (br. s, 1H), 8.36 (br. s, 1H), 5.95 (s, 1H), 4.29 (q, 2H), 3.50 (t-подобный, 1H), 3.11 (dd, 2H), 2.42 (s, 3H), 2.16 (d, 2H), 1.78 (dq-подобный, 2H), 1.28 (t, 3H); 2 протона не видны из-за остаточного сигнала воды.
Пример 10
3-(4-Бромфенил)-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
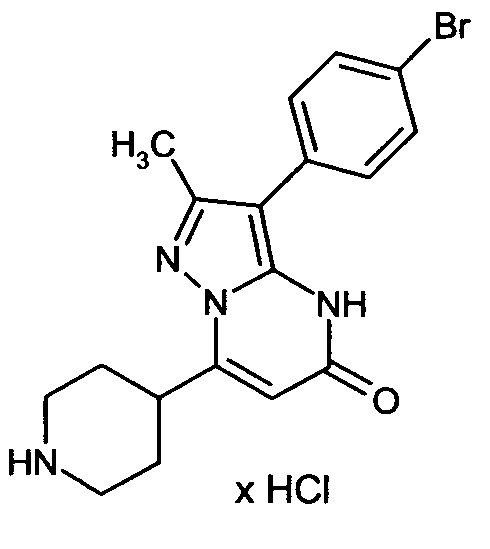
Трет-бутил 4-(3-циано-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (111 мг, 0.222 ммоль) растворили в метаноле (0.7 мл). 4Н HCl в диоксан (0.7 мл) добавили. Через 16 ч смесь облучали ультразвуком в течение 10 мин при комнатной температуре. Смесь выпарили в вакууме, и добавили диоксан (2 мл). Полученную суспензию отфильтровали, промыли диоксаном (2 мл) и высушивали в течение 16 ч при 50°C в вакууме с получением соединения, указанного в названии (39.6 мг, 42% теоретический выход).
LC-MS (Способ 1B): Rt=0.70 мин, MS (ESIPos): m/z=387 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=11.99 (br. s, 1H), 8.78 (br. s, 1H), 8.59 (br. s, 1H), 7.61 (d, 2H), 7.35 (br. s, 2H), 5.80 (br. s, 1H), 3.56 (br. s, 1H), 3.40 (d, 2H), 3.12 (dd, 2H), 2.39-2.14 (m, 5H, 1.84 (dq-подобный, 2H).
Пример 11
2-(Метоксиметил)-3-фенил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
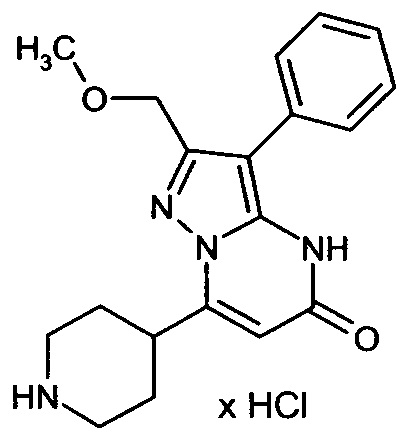
Трет-бутил 4-[2-(метоксиметил)-5-оксо-3-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (142 мг, 0.321 ммоль) растворили в метаноле (0.9 мл). 4Н HCl в диоксан (0.9 мл) добавили. Через 5 ч полученную суспензию отфильтровали, промыли метанолом (0.3 мл) и высушивали в течение 16 ч при 50°C в вакууме с получением соединения, указанного в названии (18.1 мг, 15% теоретический выход).
LC-MS (Способ 1B): Rt=0.58 мин, MS (ESIPos): m/z=339 [М+Н]+
Пример 12
3-[3-(Бензилокси)фенил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
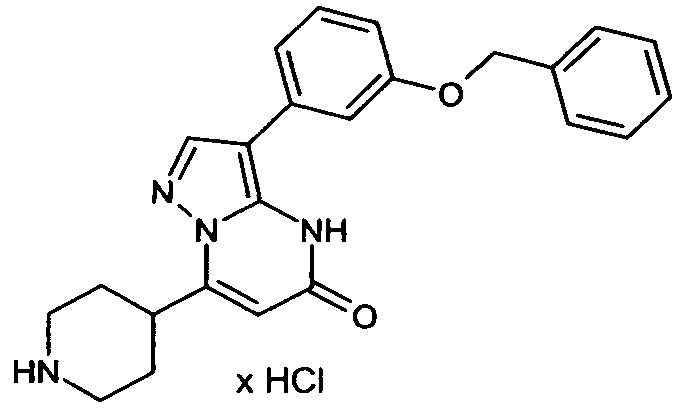
Трет-бутил 4-{3-[3-(бензилокси)фенил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (120 мг, 0.229 ммоль) растворили в метаноле (0.7 мл). 4Н HCl в диоксан (0.7 мл) добавили. Через 2 ч полученную суспензию отфильтровали, промыли метанолом (0.3 мл) и высушивали в течение 16 ч при 50°C в вакууме с получением соединения, указанного в названии (89 мг, 89% теоретический выход).
LC-MS (Способ 1B): Rt=0.77 мин, MS (ESIPos): m/z=401 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.13 (br. s, 1Н), 8.83 (br. s, 2H), 8.20 (br. s, 1H), 7.49 (d, 2H), 7.41 (dd, 2H), 7.34 (dd, 1H), 7.31 (dd, 1H), 7.31-7.04 (m, 2H), 5.91 (br. s, 1H), 6.89 (d, 1H), 5.17 (s, 2H), 3.61 (br. s, 1H), 3.41 (d, 2H), 3.11 (dd, 2H), 2.23 (d, 2H), 1.91 (q-подобный, 2H).
Пример 13
2-Метил-7-(пиперидин-4-ил)-3-[3-(трифторметил)фенил]пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
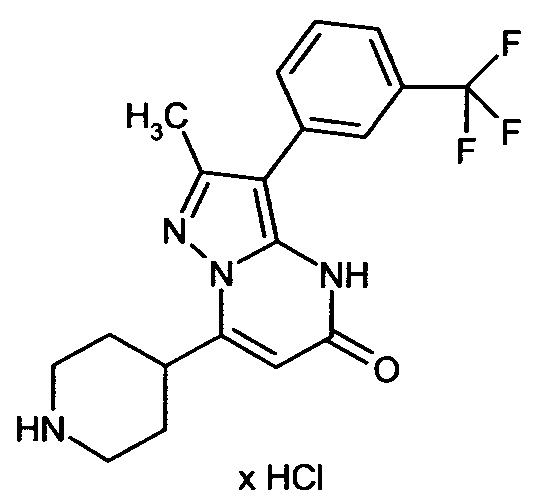
Раствор трет-бутил 4-{2-метил-5-оксо-3-[3-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (120 мг, 0.24 ммоль) в метаноле (0.70 мл) обработали 4Н HCl в диоксан (0.70 мл), и реакционную смесь оставили без перемешивания на 16 ч при комнатной температуре. Полученный осадок отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (84 мг, количественный выход).
LC-MS (Способ 1B): Rt=0.65 мин, MS (ESIPos): m/z=377 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.21 (br. s, 1Н), 8.80 (br. s, 1H), 8.58 (br. s, 1H), 7.75-7.55 (m, 4H), 5.81 (br. s, 1H), 3.58 (br. s, 1H), 3.20-3.07 (m, 2H), 2.39-2.15 (m, 4H), 1.93-1.75 (m, 2H).
Пример 14
5-Оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
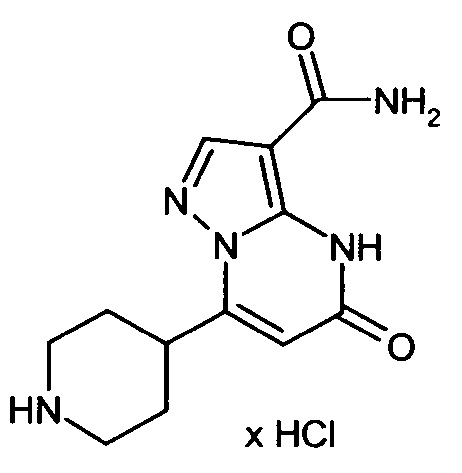
Суспензию трет-бутил 4-(3-карбамоил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (38 мг, 0.11 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обрабатывали ультразвуком в течение 15 мин при комнатной температуре и после этого 15 мин при 40°C. Полученный осадок отфильтровали, промыли диоксаном и высушивали под вакуумом 16 ч при 50°C с получением соединения, указанного в названии (14 мг, 45% теоретический выход).
LC-MS (Способ 1B): Rt=0.47 мин, MS (ESIPos): m/z=262 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.22 (s, 1H), 6.16 (s, 1H), 3.65-3.56 (m, 3H), 3.25 (dd, 2H), 2.38 (d, 2H), 2.01-1.91 (dd, 2H).
Пример 15
5-Оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбонитрил
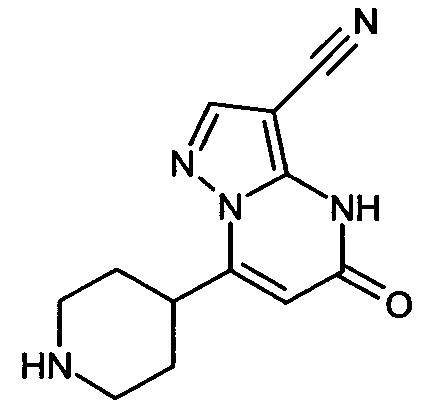
Суспензию трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (95 мг, 0.28 ммоль) в дихлорметане (1.00 мл) обработали с помощью трифторуксусной кислоты (0.11 мл), и затем реакционную смесь перемешивали в течение 16 ч при комнатной температуре. После этого периода времени трифторуксусную кислоту (0.11 мл) снова добавили, и смесь перемешивали в течение 2 ч при комнатной температуре. Растворитель выпарили под вакуумом, и остаток растворили в воде и обработали аммиаком до достижения значения рН=9. Полученный осадок отфильтровали и высушивали под вакуумом при 50°C всю ночь с получением соединения, указанного в названии (52 мг, 75% теоретический выход).
LC-MS (Способ 2В): Rt=0.95 мин, MS (ESIPos): m/z=244 [М+Н]+
1Н-ЯМР (400 МГц, TFA): δ=8.52 (s, 1Н), 7.87 (br. s, 1H), 7.43 (br. s, 1H), 6.84 (s, 1H), 4.15-4.07 (m, 3H), 3.76-3.70 (m, 2H), 2.75 (d, 2H), 2.56 (dd, 2H).
Пример 16
Этил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид

Суспензию соединения этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (10 мг, 0.03 ммоль) в метаноле (0.50 мл) обработали 4Н HCl в диоксан (0.50 мл). Реакционную смесь обработали ультразвуком в течение 15 мин при комнатной температуре. После выпаривания растворителя под вакуумом полученное твердое вещество высушивали под вакуумом всю ночь с получением соединения, указанного в названии (9 мг, количественный выход).
LC-MS (Способ 1B): Rt=0.38 мин, MS (ESIPos): m/z=291 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.25 (s, 1Н), 6.19 (s, 1H), 4.42-4.37 (q, 2H), 3.65-3.58 (m, 3H), 3.26 (dd, 2H), 2.39 (d, 2H), 1.98 (dd, 2H), 1.38 (t, 3H).
Пример 17
5-Оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты гидрохлорид
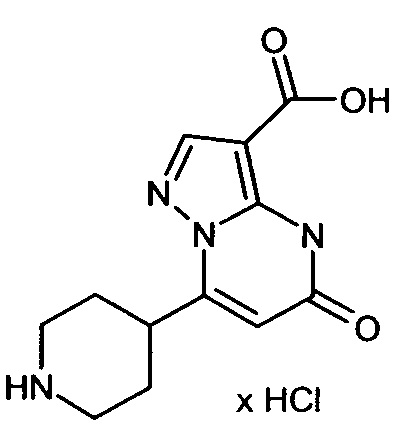
Суспензию соединения 7-[1-(трет-Бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновая кислота (19 мг, 0.05 ммоль) в метаноле (0.50 мл) обработали 4Н HCl в диоксан (0.50 мл). Реакционную смесь обработали ультразвуком в течение 15 мин при комнатной температуре. После выпаривания растворителя под вакуумом остаток перемешивали в растворе 2/1 диоксан/МеО. Полученный осадок отфильтровали, промыли 2 мл раствора 2/1 диоксан/метанол и высушивали всю ночь под вакуумом при 50°C с получением соединения, указанного в названии (8 мг, 50% теоретический выход).
LC-MS (Способ 2В): Rt=0.25 мин, MS (ESIPos): m/z=263 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.17 (s, 1H), 6.16 (s, 1H), 3.63 (d, 2H), 3.57 (dd, 1H), 3.25 (dd, 2H), 2.38 (d, 2H), 2.00-1.92 (q, 2H).
Пример 18
Бензил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид

Суспензию соединения бензил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (38 мг, 0.09 ммоль) в метаноле (1.00 мл) обработали 4Н HCl в диоксан (1.00 мл). Реакционную смесь обработали ультразвуком в течение 15 мин при комнатной температуре. После выпаривания растворителя под вакуумом неочищенный продукт перемешивали в диоксан. Полученный осадок отфильтровали, промыли диоксаном и высушивали всю ночь под вакуумом при 50°C с получением соединения, указанного в названии (27 мг, 83% теоретический выход).
LC-MS (Способ 1B): Rt=0.59 мин, MS (ESIPos): m/z=352 [M+H-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=11.87 (br. s, 1H), 8.72 (br. s, 1H), 8.24 (s, 1H), 7.44 (d, 2H), 7.42-7.30 (m, 3H), 6.02 (s, 1H), 5.33 (s, 2H), 3.51 (dd, 1H), 3.38 (d, 2H), 3.08 (dd, 2H), 2.17 (d, 2H), 1.85 (dd, 2H).
Пример 19
N-Этил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
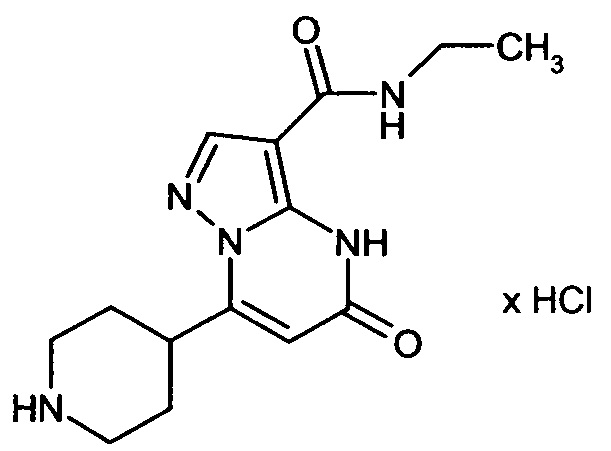
Суспензию соединения трет-бутил 4-[3-(этилкарбамоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (10 мг, 0.03 ммоль) в метаноле (0.25 мл) обработали 4Н HCl в диоксан (0.25 мл). Реакционную смесь обработали ультразвуком в течение 15 мин при комнатной температуре. После выпаривания растворителя под вакуумом неочищенный продукт перемешивали в 1 мл смеси 2/1 диоксан/метанол. Полученный осадок отфильтровали, промыли диоксаном и высушивали всю ночь под вакуумом при 50°C с получением соединения, указанного в названии (3 мг, 41% теоретический выход).
LC-MS (Способ 2В): Rt=1.05 мин, MS (ESIPos): m/z=290 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.13 (s, 1H), 6.10 (s, 1H), 3.59-3.52 (m, 3H), 3.31 (q, 2H), 3.20 (dd, 2H), 2.33 (d, 2H), 1.91 (dd, 2H), 1.15 (t, 3H).
Пример 20
3-(4-Хлорфенил)-7-(пиперидин-4-ил)-2-(трифторметил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
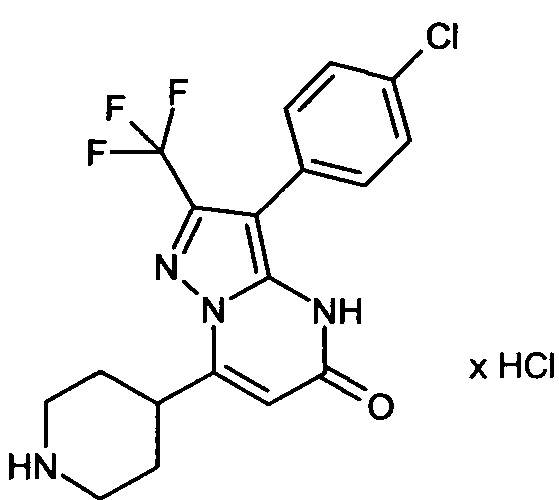
Суспензию соединения трет-бутил 4-[3-(этилкарбамоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (3.7 мг, 0.01 ммоль) в метаноле (0.02 мл) обработали 4Н HCl в диоксан (0.02 мл). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Полученный осадок отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии. Фильтрат выпарили под вакуумом с получением также соединения, указанного в названии. Общий выход (4 мг, количественный выход).
1Н-ЯМР (400 МГц, D2O): δ=7.48 (d, 4Н), 6.22 (s, 1H), 3.68-3.59 (m, 3Н), 3.28 (dd, 2H), 2.44 (d, 2H), 2.04-1.97 (m, 2H).
Пример 21
N-Изобутил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
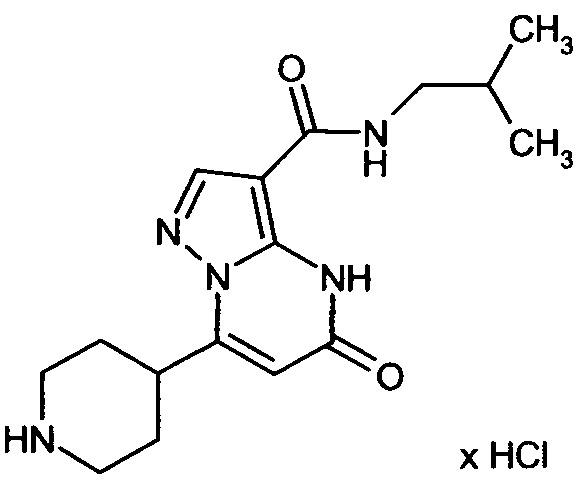
Суспензию соединения трет-бутил 4-[3-(изобутилкарбамоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (35 мг, 0.08 ммоль) в метаноле (0.50 мл) обработали 4Н HCl в диоксан (0.50 мл). Реакционную смесь обработали ультразвуком в течение 30 мин при комнатной температуре. После выпаривания растворителя под вакуумом неочищенный продукт перемешивали в 1 мл смеси 2/1 диоксан/метанол. Полученный осадок отфильтровали, промыли диоксаном и высушивали 2 ч под вакуумом при 50°C с получением соединения, указанного в названии (23 мг, 76% теоретический выход).
LC-MS (Способ 1B): Rt=0.47 мин, MS (ESIPos): m/z=318 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.21 (s, 1Н), 6.16 (s, 1H), 3.65-3.57 (m, 2H), 3.26 (dd, 3H), 3.16 (d, 2H), 2.39 (d, 2H), 2.01-1.92 (dd, 2H), 1.90-1.89 (m, 1H), 0.93 (d, 6H).
Пример 22
N-Бензил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
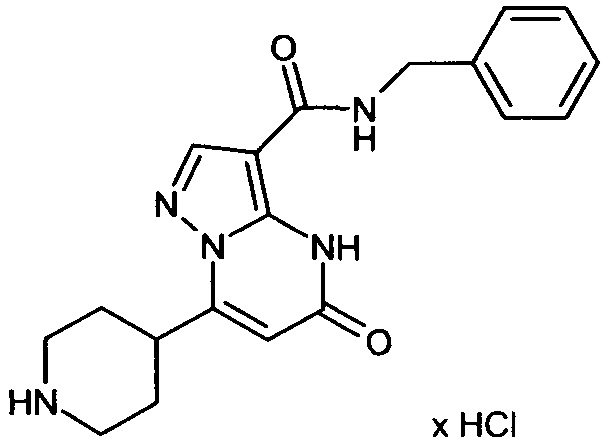
Суспензию соединения трет-бутил 4-[3-(бензилкарбамоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (42 мг, 0.09 ммоль) в метаноле (0.50 мл) обработали 4Н HCl в диоксан (0.50 мл). Реакционную смесь обработали ультразвуком в течение 30 мин при комнатной температуре. После выпаривания растворителя под вакуумом неочищенный продукт перемешивали с смесью диоксан/метанол 2/1. Полученный осадок отфильтровали, промыли диоксаном и высушивали 2 ч под вакуумом при 60°C с получением соединения, указанного в названии (24 мг, 65% теоретический выход).
LC-MS (Способ 1B): Rt=0.52 мин, MS (ESIPos): m/z=352 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.23 (s, 1Н), 7.41-7.32 (m, 5H), 6.15 (s, 1H), 4.55 (s, 2H), 3.62 (d, 2H), 3.56 (d, 1H), 3.24 (dd, 2H), 2.37 (d, 2H), 1.96 (dd, 2H).
Пример 23
3-(Морфолин-4-илкарбонил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
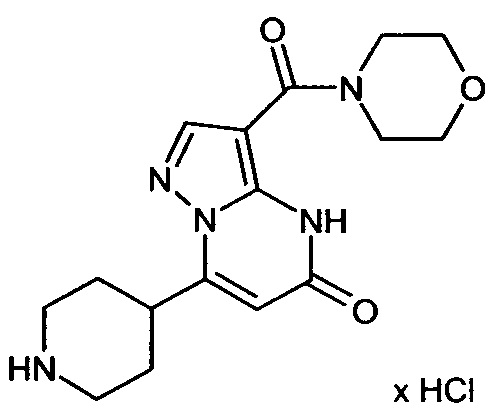
Суспензию соединения трет-бутил 4-[3-(морфолин-4-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (26 мг, 0.06 ммоль) в метаноле (0.50 мл) обработали 4Н HCl в диоксан (0.50 мл). Реакционную смесь обработали ультразвуком в течение 30 мин при комнатной температуре. Полученный осадок отфильтровали, промыли диоксаном и высушивали 2 ч под вакуумом при 60°C с получением соединения, указанного в названии (16 мг, 69% теоретический выход).
LC-MS (Способ 1B): Rt=0.21 мин, MS (ESIPos): m/z=331 [M+H-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.11 (s, 1H), 6.18 (s, 1H), 3.85-3.76 (m, 9H), 3.63 (d, 2H), 3.27 (dd, 2H), 2.40 (s, 2H), 2.00 (dd, 2H).
Пример 24
7-(Пиперидин-4-ил)-2-(трифторметил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
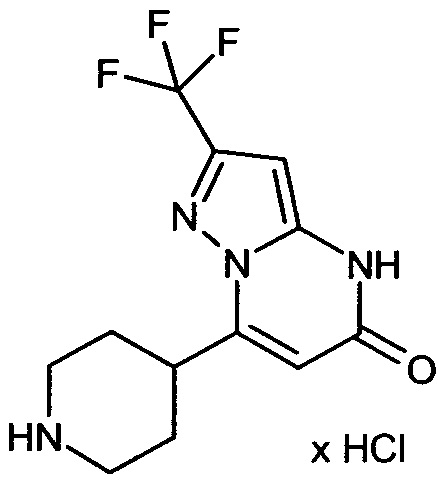
Суспензию соединения трет-бутил 4-[5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (66 мг, 0.17 ммоль) в метаноле (0.50 мл) обработали 4Н HCl в диоксан (0.50 мл). Реакционную смесь оставили без перемешивания на 2 ч при комнатной температуре, и затем обрабатывали ультразвуком в течение 10 минут при комнатной температуре. Полученный осадок отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии. Выход: 48 мг (88% теоретический выход).
LC-MS (Способ 1B): Rt=0.36 мин, MS (ESIPos): m/z=287 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.54 (s, 1H), 8.84 (br. s, 1H), 8.64 (br. s, 1H), 6.29 (s, 1H), 6.04 (s, 1H), 3.51 (dd, 1H), 3.37 (d, 2H), 3.14-3.05 (m, 2H), 2.15 (d, 2H), 1.84 (dd, 2H).
Пример 25
7-(Пиперидин-4-ил)-2-(2-тиенил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
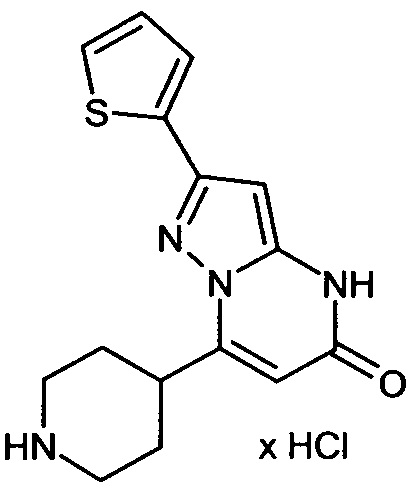
Суспензию соединения трет-бутил 4-[5-оксо-2-(2-тиенил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (44 мг, 0.11 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обработали ультразвуком в течение 15 минут при комнатной температуре. Полученный осадок отфильтровали, промыли диоксаном и высушивали всю ночь при 50°C под вакуумом с получением соединения, указанного в названии (33 мг, 87% теоретический выход).
LC-MS (Способ 1B): Rt=0.49 мин, MS (ESIPos): m/z=301 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.27 (br. s, 1H), 8.90 (br. s, 1H), 8.72 (br. s, 1H), 7.64 (dd, 1H), 7.60 (dd, 1H), 7.14 (dd, 1H), 6.26 (s, 1H), 5.80 (s, 1H), 3.52 (dd, 1H), 3.41 (d, 2H), 3.14 (dd, 2H), 2.22 (d, 2H), 1.85 (dd, 2H).
Пример 26
2-Циклопропил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
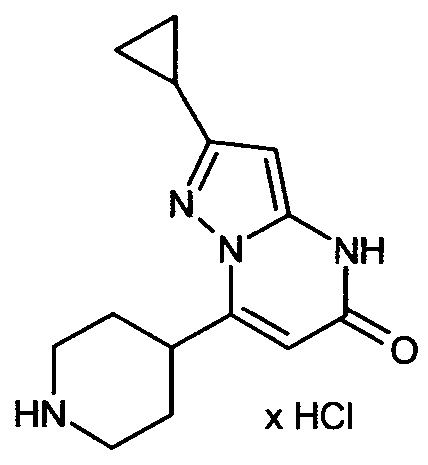
Суспензию соединения трет-бутил 4-(2-циклопропил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (77 мг, 0.21 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обработали ультразвуком в течение 15 минут при комнатной температуре. Полученный осадок отфильтровали, промыли диоксаном и высушивали всю ночь при 50°C под вакуумом с получением соединения, указанного в названии (66 мг, 99% теоретический выход).
LC-MS (Способ 1B): Rt=0.30 мин, MS (ESIPos): m/z=259 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=5.91 (s, 1Н), 5.71 (s, 1H), 3.62 (d, 2H), 3.51 (dd, 1H), 3.26 (dd, 2H), 2.36 (d, 2H), 2.02-1.97 (m, 1H), 1.93 (d, 2H), 1.09-1.05 (m, 2H), 0.80-0.77 (m, 2H).
Пример 27
2-(4-Фторфенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

Суспензию соединения трет-бутил 4-[2-(4-фторфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (109 мг, 0.27 ммоль) в метаноле (3.0 мл) обработали 4Н HCl в диоксан (3.0 мл). Реакционную смесь обработали ультразвуком в течение 15 минут при комнатной температуре. Полученный осадок отфильтровали, промыли диоксаном и высушивали всю ночь при 50°C под вакуумом с получением соединения, указанного в названии (86 мг, 93% теоретический выход).
LC-MS (Способ 1B): Rt=0.56 мин, MS (ESIPos): m/z=313 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.26 (s, 1H), 8.76 (br. s, 1H), 8.49 (br. s, 1H), 8.00 (dd, 2H), 7.30 (dd, 2H), 6.34 (s, 1H), 5.82 (s, 1H), 3.57 (dd, 1H), 3.42 (d, 2H), 3.20-3.07 (br. s, 2H), 2.24 (d, 2H), 1.89 (dd, 2H).
Пример 28
Метил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоксилат
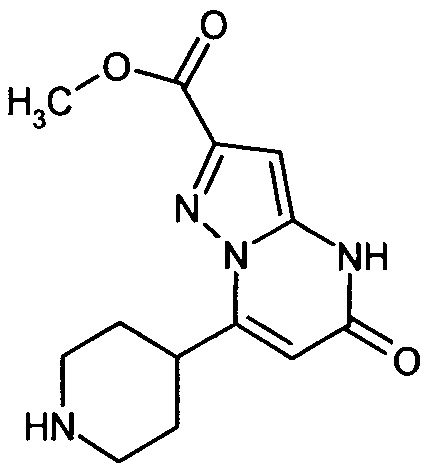
Раствор соединения метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоксилат (70 мг, 0.19 ммоль) в дихлорметане (1.0 мл) обработали с помощью трифторуксусной кислоты (0.16 мл). Реакционную смесь перемешивали 1 ч при комнатной температуре. После выпаривания растворителя под вакуумом неочищенный продукт обработали водой и лиофилизировали всю ночь. Затем неочищенный продукт очистили посредством препаративной ВЭЖХ (Способ 2А). Выход: (40 мг, 77% теоретический выход).
LC-MS (Способ 2В): Rt=1.07 мин, MS (ESIPos): m/z=277 [М+Н]+
1Н-ЯМР (400 МГц, TFA): δ=7.88 (br. s, 1Н), 7.39 (br. s, 1H), 7.15 (d, 1H), 6.86 (d, 1H), 4.23-4.10 (m, 3H), 3.74 (dd, 2H), 2.85 (d, 2H), 3.64 (s, 3H), 2.60-2.50 (m, 2H).
Пример 29
3-Бром-2-фенил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
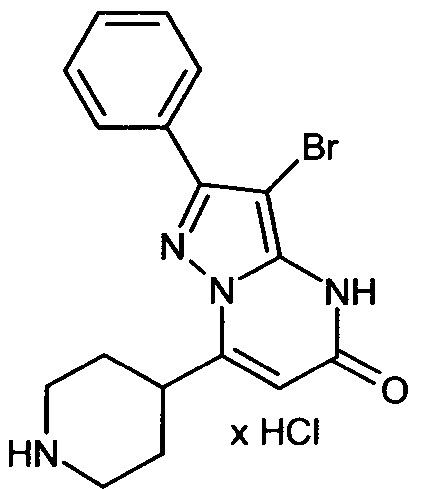
Суспензию соединения трет-бутил 4-(3-бром-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (68 мг, 0.14 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при комнатной температуре. Полученный осадок отфильтровали, промыли диоксаном и высушивали 2 ч при 60°C под вакуумом с получением соединения, указанного в названии (20 мг; 34% теоретический выход).
LC-MS (Способ 1B): Rt=0.67 мин, MS (ESIPos): m/z=373 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=7.73 (d, 2Н), 7.48-7.40 (m, 3H), 5.84 (s, 1H), 3.54 (d, 2H), 3.28 (dd, 1H), 3.12 (dd, 2H), 2.16 (d, 2H), 1.76 (dd, 2H).
Пример 30
4-(Пиперидин-4-ил)-1,7,8,9-тетрагидро-2H-циклопента[3,4]пиразоло[1,5-а]пиримидин-2-он гидрохлорид
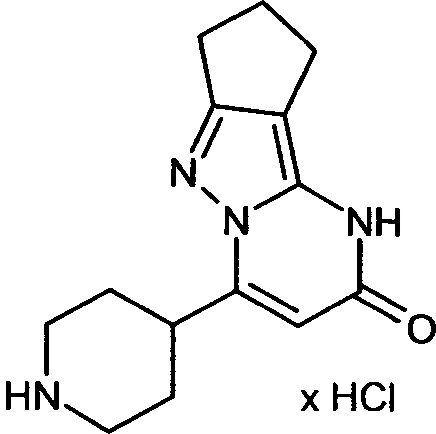
Суспензию соединения трет-бутил 4-(2-оксо-1,7,8,9-тетрагидро-2H-циклопента[3,4]пиразоло[1,5-а]пиримидин-4-ил)пиперидин-1-карбоксилат (41 мг, 0.12 ммоль) в метаноле (0.33 мл) обработали 4Н HCl в диоксан (0.33 мл). Реакционную смесь оставили без перемешивания на всю ночь при комнатной температуре. Полученный осадок отфильтровали и высушивали под вакуумом с получением соединения, указанного в названии (38 мг, количественный выход).
LC-MS (Способ 2В): Rt=1.30 мин, MS (ESIPos): m/z=259 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=9.07 (br. s, 1Н), 8.94 (br. s, 1H), 5.59 (s, 1H), 3.48 (dd, 1H), 3.36 (d, 2H), 3.05 (dd, 2H), 2.68 (dd, 2H), 2.59 (dd, 2H), 2.38-2.31 (m, 2H), 2.16 (d, 2H), 1.86 (dd, 2H).
Пример 31
3-Бром-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

Суспензию соединения трет-бутил 4-(3-бром-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (118 мг, 0.12 ммоль) в метаноле (2.0 мл) обработали 4Н HCl в диоксан (2.0 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при комнатной температуре. Полученный осадок отфильтровали, промыли диоксаном и высушивали 2 ч под вакуумом при 60°C с получением соединения, указанного в названии (85 мг, 82% теоретический выход).
LC-MS (Способ 1B): Rt=0.23 мин, MS (ESIPos): m/z=298 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=7.88 (s, 1Н), 6.05 (s, 1H), 3.63 (d, 2H), 3.55 (dd, 1H), 3.25 (dd, 2H), 2.38 (d, 2H), 1.95 (dd, 2H).
Пример 32
3-(3-Метил-1,2,4-оксадиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
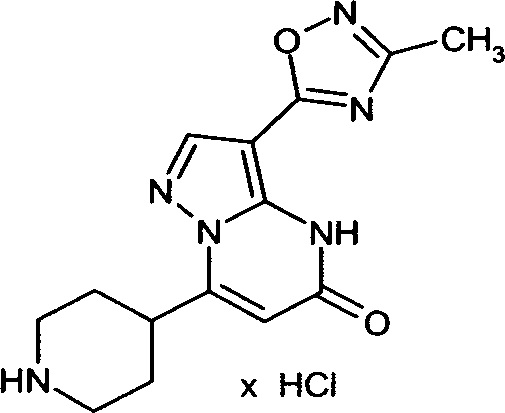
Суспензию соединения трет-бутил 4-[3-(3-метил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (8 мг, 0.02 ммоль) в метаноле (0.5 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при комнатной температуре. Растворитель выпарили под давлением, и неочищенный продукт растворили в воде и лиофилизировали всю ночь с получением соединения, указанного в названии (6 мг, 92% теоретический выход).
LC-MS (Способ 2В): Rt=1.20 мин, MS (ESIPos): m/z=301 [М+Н-xHCl]+
1H-ЯМР (400 МГц, D2O): δ=8.37 (s, 1H), 6.21 (s, 1H), 3.64 (d, 3H), 3.27 (dd, 2H), 2.44 (s, 3H), 2.41 (d, 2H), 1.99 (dd, 2H).
Пример 33
3-(3-Изопропил-1,2,4-оксадиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
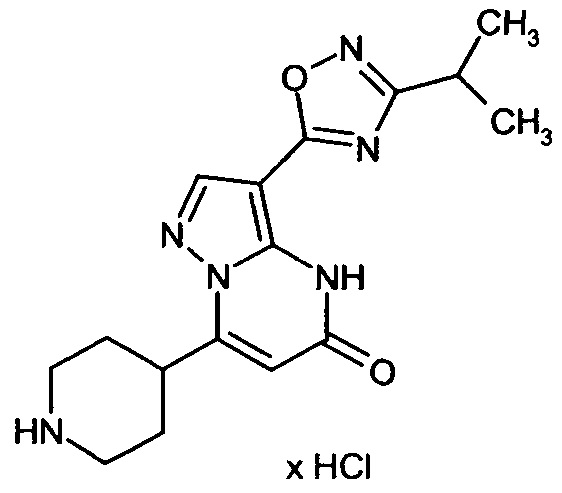
Суспензию соединения трет-бутил 4-[3-(3-изопропил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (92 мг, 0.21 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при комнатной температуре. Смесь разбавили в диоксане, и твердое вещество отфильтровали, промыли диоксаном и высушивали всю ночь под вакуумом при 60°C с получением соединения, указанного в названии (67 мг, 86% теоретический выход).
LC-MS (Способ 1B): Rt=0.54 мин, MS (ESIPos): m/z=329 [M+H-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.34 (s, 1H), 6.21 (s, 1H), 3.67-3.59 (m, 3H), 3.28 (dd, 2H), 3.19-3.13 (m, 1H), 2.42 (d, 2H), 2.00 (dd, 2H), 1.36 (d, 6H).
Пример 34
7-(Пиперидин-4-ил)-3-(3-пропил-1,2,4-оксадиазол-5-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
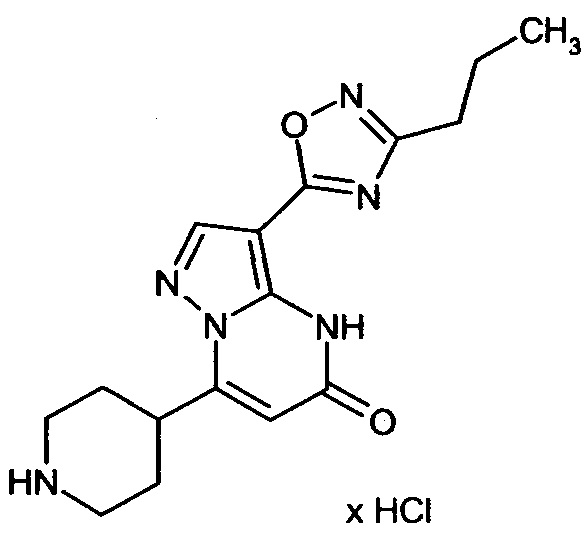
Суспензию соединения трет-бутил4-[5-оксо-3-(3-пропил-1,2,4-оксадиазол-5-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (59 мг, 0.14 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при комнатной температуре. Смесь разбавили в диоксане, и твердое вещество отфильтровали, промыли диоксаном и высушивали всю ночь под вакуумом при 60°C с получением соединения, указанного в названии (40 мг, 78% теоретический выход).
LC-MS (Способ 1B): Rt=0.54 мин, MS (ESIPos): m/z=329 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.36 (s, 1H), 6.22 (s, 1H), 3.65-3.59 (m, 3H), 3.27 (dd, 2H), 2.78 (t, 2H), 2.41 (d, 2H), 1.99 (dd, 2H), 1.82-1.75 (m, 2H), 0.97 (t, 3H).
Пример 35
3-(3-Фенил-1,2,4-оксадиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
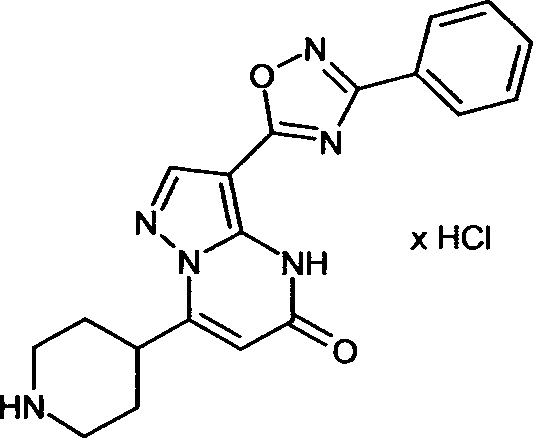
Суспензию соединения трет-бутил 4-[5-оксо-3-(3-фенил-1,2,4-оксадиазол-5-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (103 мг, 0.22 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при комнатной температуре. Смесь разбавили в диоксане, и твердое вещество отфильтровали, промыли диоксаном и высушивали 2 ч под вакуумом при 70°C с получением соединения, указанного в названии (85 мг, 92% теоретический выход).
LC-MS (Способ 1B): Rt=0.63 мин, MS (ESIPos): m/z=363 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.12 (s, 1Н), 7.56 (d, 2H), 7.37-7.34 (m, 1H), 7.28-7.25 (m, 2H), 5.96 (s, 1H), 3.63 (d, 2H), 3.21 (dd, 3H), 2.25 (d, 2H), 1.88 (dd, 2H).
Пример 36
N-[Метил(4-метилфенил)оксидо-лямбда6-сульфанилиден]-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
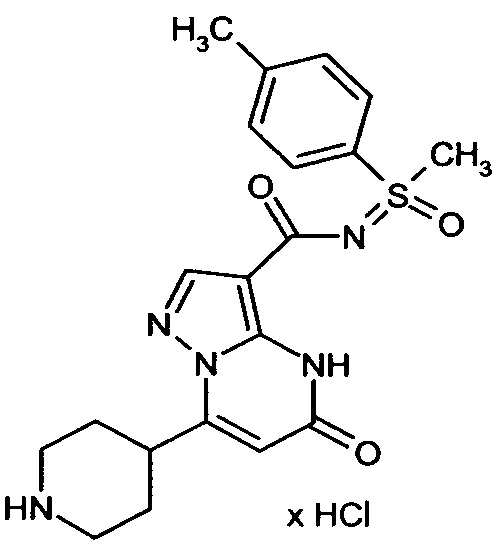
Суспензию соединения трет-бутил 4-(3-{[метил(4-метилфенил)оксидо-лямбда6-сульфанилиден]карбамоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (15 мг, 0.03 ммоль) в метаноле (0.5 мл) обработали 4Н HCl в диоксан (0.50 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при комнатной температуре. Смесь выпарили под вакуумом, и неочищенный продукт разбавили в воде и лиофилизировали всю ночь с получением соединения, указанного в названии (11 мг, 76% теоретический выход).
LC-MS (Способ 2В): Rt=1.51 мин, MS (ESIPos): m/z=414 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.19 (s, 1Н), 7.89 (d, 2H), 7.52 (d, 2H), 6.16 (s, 1H), 3.64-3.54 (m, 6H), 3.24 (dd, 2H), 2.45 (s, 3H), 2.38 (d, 2H), 1.96 (dd, 2H).
Пример 37
N-(4-Оксидо-1,4-лямбда4-оксатиан-4-илиден)-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид

Суспензию соединения трет-бутил 4-{3-[(4-оксидо-1,4лямбда4-оксатиан-4-илиден)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (66 мг, 0.14 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при комнатной температуре. Смесь выпарили под вакуумом, и неочищенный продукт перемешивали в смеси диоксан/метанол 3/1. Полученное твердое вещество отфильтровали, промыли диоксаном и высушивали при 60°C в течение 16 ч с получением соединения, указанного в названии (54 мг, 89% теоретический выход).
LC-MS (Способ 2В): Rt=3.79 мин, MS (ESIPos): m/z=380 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ=8.22 (s, 1H), 6.18 (s, 1H), 4.37-4.30 (m, 2H), 4.03-3.96 (m, 2H), 3.77-3.74 (m, 2H), 3.65 (d, 1H), 3.59 (dd, 2H), 3.27 (dd, 2H), 2.39 (d, 2H), 1.98 (dd, 2H).
Пример 38
Этил 5-оксо-2-фенил-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат трифторацетат
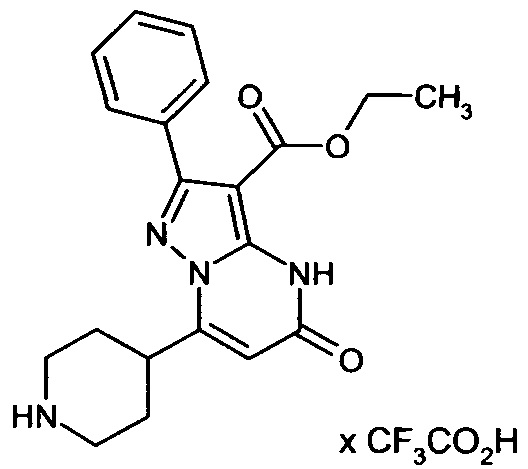
Суспензию соединения этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (40 мг, 0.08 ммоль) в дихлорметан (0.45 мл) обработали с помощью трифторуксусной кислоты (0.07 мл). Реакционную смесь оставили без перемешивания при комнатной температуре в течение 16 ч. Смесь выпарили под вакуумом, и неочищенный продукт перемешивали в диоксан. Твердое вещество отфильтровали, и высушивали под вакуумом с получением соединения, указанного в названии (29 мг, 71% теоретический выход).
LC-MS (Способ 1B): Rt=0.65 мин, MS (ESIPos): m/z=367 [M+H-xTFA]+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.67 (br. s, 1H), 8.36 (br. s, 1H), 7.71 (d, 1H), 7.70 (d, 1H), 7.47-7.44 (m, 3H), 6.06 (s, 1H), 4.26 (q, 2H), 3.56 (dd, 1H), 3.40 (d, 2H), 3.11 (dd, 2H), 2.22 (d, 2H), 1.83 (dd, 2H), 1.21 (t, 3H)
Пример 39
3-[3-(4-Метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-гидрохлорид
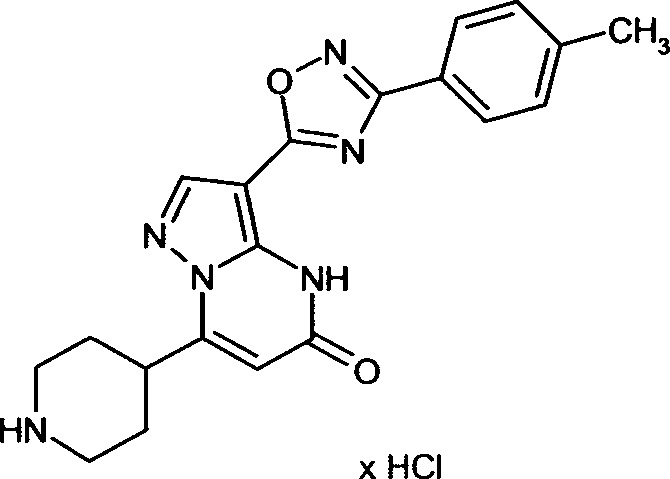
Суспензию соединения трет-бутил 4-{3-[3-(4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (46 мг, 0.10 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при 40°C. Смесь разбавили в 2 мл диоксана, и полученное твердое вещество отфильтровали, промыли диоксаном и высушивали при 60°C в течение 16 ч с получением соединения, указанного в названии (27 мг, 65% теоретический выход).
LC-MS (Способ 2B): Rt=1.76 мин, MS (ESIPos): m/z=377 [M+H-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.90 (s, 1H), 8.24 (d, 2H), 7.88 (br. s, 1H), 7.61 (d, 2H), 7.51 (br. s, 1H), 6.86 (s, 1H), 4.14-4.06 (m, 3H), 3.76-3.69 (m, 2H), 2.77 (d, 2H), 2.66 (s, 3H), 2.61-2.54 (m, 2H)
Пример 40
(-)-транс-3-Хлор-7-(2-метилпиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
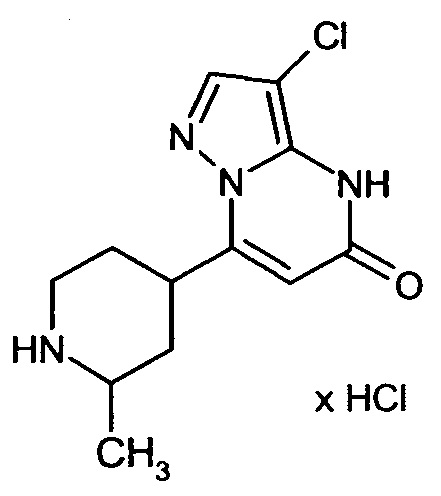
Суспензию соединения трет-бутил-4-(3-хлор-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)-2-метилпиперидин-1-карбоксилат (Пример 51А, энантиомерно чистый транс-изомер) (337 мг, 0.90 ммоль) в метаноле (2.5 мл) обработали 4Н HCl в диоксан (2.5 мл). Реакционную смесь оставили без перемешивания при комнатной температуре в течение 16 ч. Полученное твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом. После этого твердое вещество разбавили в воде и лиофилизировали с получением соединения, указанного в названии (140 мг, 52% теоретический выход).
LC-MS (Способ 2В): Rt=0.27 мин, MS (ESIPos): m/z=267 [М+Н-xHCl]+
[α]20=-8.657 (с. 0.335, метанол) WL=589 нм
1Н-ЯМР (400 МГц, DMSO-d6): δ 9.09 (br. s, 1H), 8.88 (br. s, 1H), 8.00 (s, 1H), 5.96 (s, 1H), 3.66-3.62 (m, 2H), 3.26-3.12 (m, 2H), 2.12-1.99 (m, 4H), 1.35 (d, 3H)
Пример 41
5-Оксо-2-фенил-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид трифторацетат
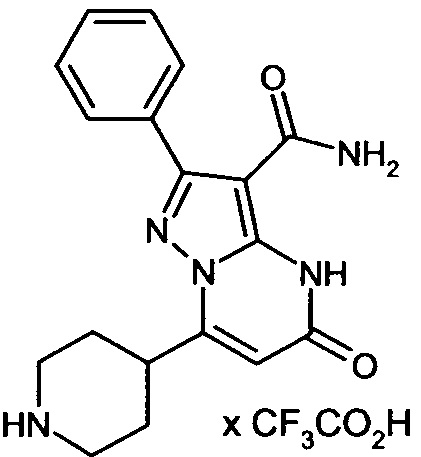
Раствор соединения трет-бутил 4-(3-карбамоил-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (15 мг, 0.03 ммоль) в дихлорметане (0.8 мл) обработали с помощью трифторуксусной кислоты (0.03 мл). Реакционную смесь перемешивали 6 ч при комнатной температуре и оставили на два дня при комнатной температуре без перемешивания. После этого растворитель выпарили под вакуумом, и неочищенный продукт растворили в воде и лиофилизировали всю ночь с получением соединения, указанного в названии (15 мг, 98% теоретический выход).
LC-MS (Способ 1B): Rt=0.34 мин, MS (ESIPos): m/z=338 [M+H-xTFA]+
Пример 42
N-Бензил-5-оксо-2-фенил-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид трифторацетат
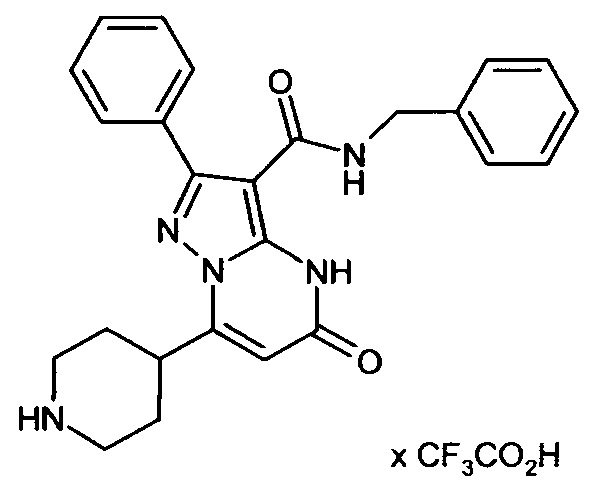
Раствор соединения трет-бутил 4-[3-(бензилкарбамоил)-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (15 мг, 0.03 ммоль) в дихлорметане (0.7 мл) обработали с помощью трифторуксусной кислоты (0.02 мл). Реакционную смесь перемешивали 6 ч при комнатной температуре и оставили на два дня при комнатной температуре без перемешивания. После этого растворитель выпарили под вакуумом, и неочищенный продукт растворили в воде и лиофилизировали всю ночь с получением соединения, указанного в названии (17 мг, количественный выход).
LC-MS (Способ 1B): Rt=0.66 мин, MS (ESIPos): m/z=428 [M+H-xTFA]+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.72 (br. s, 1H), 8.43 (br. s, 1H), 7.75 (s, 2H), 7.49-7.37 (m, 3H), 7.37-7.22 (m, 5H), 5.98 (br. s, 1H), 4.45 (s, 2H), 3.42 (d, 3H), 3.18-3.10 (m, 2H), 2.26 (d, 2H), 1.92-1.83 (m, 2H).
Пример 43
3-(Морфолин-4-илкарбонил)-2-фенил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он трифторацетат
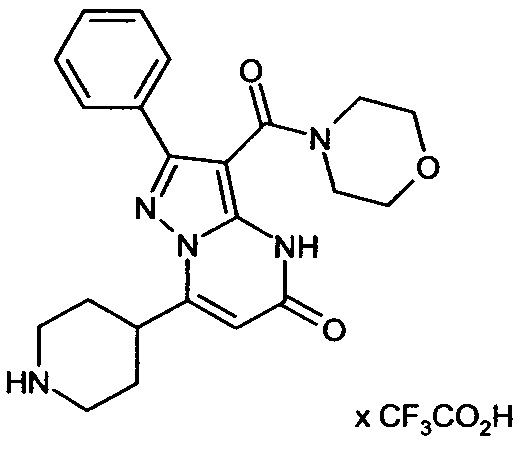
Раствор соединения трет-бутил 4-[3-(морфолин-4-илкарбонил)-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (12 мг, 0.02 ммоль) в дихлорметане (0.5 мл) обработали с помощью трифторуксусной кислоты (0.02 мл). Реакционную смесь перемешивали 6 ч при комнатной температуре и оставили на два дня при комнатной температуре без перемешивания. После этого растворитель выпарили под вакуумом, и неочищенный продукт растворили в воде и лиофилизировали всю ночь с получением соединения, указанного в названии (11 мг, 89% теоретический выход).
LC-MS (Способ 1B): Rt=0.47 мин, MS (ESIPos): m/z=408 [M+H-xTFA]+
1Н-ЯМР (400 МГц, DMSO-d6): δ 12.37 (br. s, 1H), 8.73 (br. s, 1H), 8.42 (br. s, 1H), 7.70 (d, 2H), 7.50-7.44 (m, 3H), 5.92 (br. s, 1H), 3.45-3.10 (m, 11H), 2.26 (d, 2H), 1.87 (dd, 2H).
Пример 44
N-(3-Метилбутил)-5-оксо-2-фенил-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид трифторацетат

Раствор соединения трет-бутил 4-[3-(изобутилкарбамоил)-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (10 мг, 0.02 ммоль) в дихлорметане (0.5 мл) обработали с помощью трифторуксусной кислоты (0.02 мл). Реакционную смесь перемешивали 6 ч при комнатной температуре и оставили на два дня при комнатной температуре без перемешивания. После этого растворитель выпарили под вакуумом, и неочищенный продукт растворили в воде и лиофилизировали всю ночь с получением соединения, указанного в названии (10 мг, количественный выход).
LC-MS (Способ 1B): Rt=0.63 мин, MS (ESIPos): m/z=394 [M+H-xTFA]+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.68 (br. s, 1H), 8.39 (br. s, 1H), 7.77 (s, 2H), 7.45 (s, 3H), 5.96 (br. s, 1H), 3.42 (d, 2H), 3.18-3.02 (m, 5H), 2.26 (d, 2H), 1.96-1.80 (m, 2H), 1.80-1.69 (m, 1H), 0.84 (d. 6H).
Пример 45
3-(4-Метилфенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
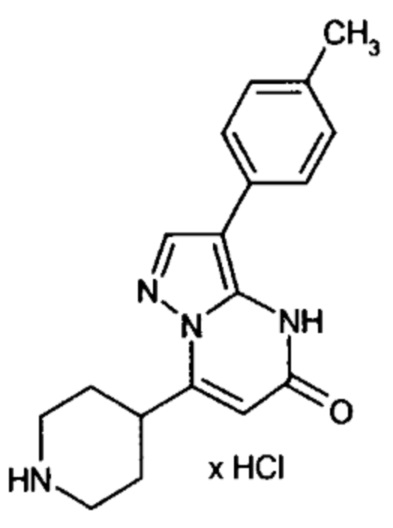
Суспензию соединения трет-бутил 4-[3-(4-метилфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (6 мг, 0.02 ммоль) в метаноле (0.5 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь обработали ультразвуком в течение 15 минут при комнатной температуре. Смесь выпарили под вакуумом, и затем неочищенный продукт разбавили в метаноле и выпарили снова. Неочищенный продукт наконец разбавили в воде и лиофилизировали всю ночь с получением соединения, указанного в названии (6 мг, 98% теоретический выход).
LC-MS (Способ 1B): Rt=0.57 мин, MS (ESIPos): m/z=309 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ 11.99 (br. s, 1Н), 8.90 (br. s, 1H), 8.23 (br. s, 1H), 7.21 (d, 4H), 5.98 (s, 1H), 3.66-3.54 (m, 1H), 3.41 (d, 2H), 3.11 (dd, 2H), 2.32 (s, 3H), 2.23 (d. 2H), 1.91 (dd, 2H):
Пример 46
5-Оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоновой кислоты гидрохлорид
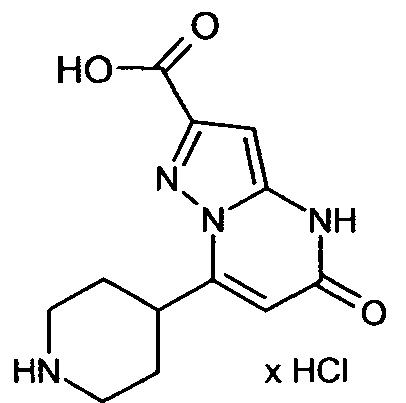
Суспензию 7-[1-(трет-Бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-2-карбоновой кислоты (46 мг, 0.13 ммоль) в метаноле (0.5 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь обработали ультразвуком в течение 30 минут при 40°C. Суспензию разбавили в диоксане, отфильтровали, и затем твердое вещество промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (31 мг, 78% теоретический выход).
LC-MS (Способ 1B): Rt=0.16 мин, MS (ESIPos): m/z=263 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 7.19 (s, 1Н), 6.90 (s, 1Н), 4.28-4.12 (d, 3Н), 3.83-3.69 (m, 2Н), 2.86 (d. 2Н), 2.66-2.52 (m, 2Н).
Пример 47
4-[5-Оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]бензонитрил трифторацетат
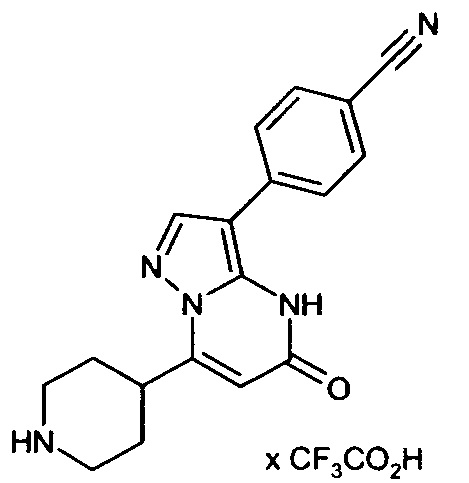
Суспензию соединения трет-бутил 4-[3-(4-цианофенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (42 мг, 0.10 ммоль) в метаноле (1.0 мл) обработали с помощью трифторуксусной кислоты (0.08 мл). Реакционную смесь оставили без перемешивания при комнатной температуре в течение 2.5 дней. Смесь выпарили под вакуумом и затем неочищенный продукт перемешивали с диоксаном. Полученное твердое вещество отфильтровали и промыли диоксаном и наконец высушивали под вакуумом при 70°C в течение 2.5 ч с получением соединения, указанного в названии (40 мг, 90% теоретический выход).
LC-MS (Способ 2B): Rt=0.16 мин, MS (ESIPos): m/z=320 [М+Н-xTFA]+
1Н-ЯМР (400 МГц, TFA): δ 8.67 (s, 1Н), 8.13 (s, 2H), 7.96 (s, 2H), 7.84 (br. s, 1H), 6.79 (s, 1H), 4.12-4.05 (m, 3H), 3.76 (s, 2H), 2.77 (s, 2H), 2.55 (s, 2H).
Пример 48
3-(3-Хлорфенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5 (4H)-он гидрохлорид
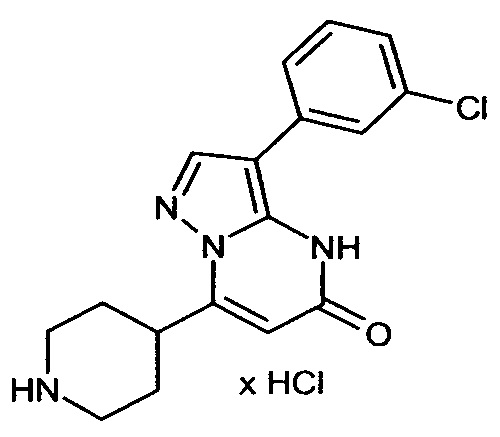
Суспензию соединения трет-бутил 4-[3-(3-хлорфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (34 мг, 0.08 ммоль) в метаноле (0.5 мл) обработали 4Н HCl (0.5 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Полученное твердое вещество отфильтровали и промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (20 мг, 66% теоретический выход).
LC-MS (Способ 1B): Rt=0.58 мин, MS (ESIPos): m/z=329 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.64 (s, 1H), 7.86 (br. s, 1Н), 7.71-7.65 (m, 3Н), 7.60 (d, 1H), 7.57 (br. s, 1H), 6.82 (s, 1H), 4.15 (d, 2H), 4.11-4.01 (m, 1H), 3.84-3.70 (m, 2H), 2.79 (d, 2H), 2.64-2.49 (m, 2H).
Пример 49
2-[5-Оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]бензонитрил трифторацетат
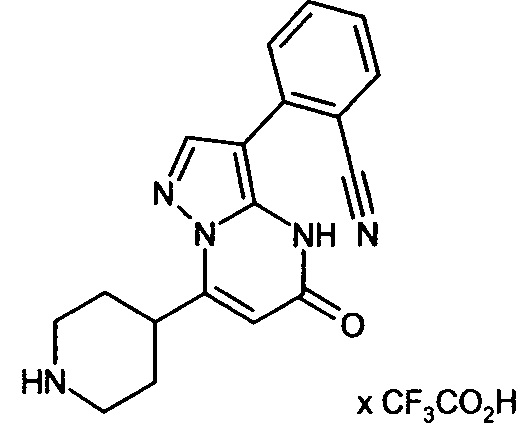
Суспензию соединения трет-бутил 4-[3-(2-цианофенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (25 мг, 0.06 ммоль) в метаноле (0.5 мл) обработали с помощью трифторуксусной кислоты (0.05 мл). Реакционную смесь оставили без перемешивания на 2.5 дня при комнатной температуре. Смесь выпарили под вакуумом и затем неочищенный продукт перемешивали с диоксаном. Полученное твердое вещество отфильтровали и промыли диоксаном и наконец высушивали под вакуумом при 60°C в течение 2.5 ч с получением соединения, указанного в названии (18 мг, 67% теоретический выход).
LC-MS (Способ 2В): Rt=1.45 мин, MS (ESIPos): m/z=320 [M+H-xTFA]+
1Н-ЯМР (400 МГц, TFA): δ 8.69 (s, 1H), 8.15 (d, 1H), 8.11-8.06 (m, 1H), 7.92-7.79 (m, 2H), 6.82 (s, 1H), 4.14-4.04 (m, 3H), 3.85-3.70 (m, 2H), 2.81 (d. 2H), 2.64-2.48 (m, 2H).
Пример 50
3-[5-Оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]бензонитрил трифторацетат

Суспензию соединения трет-бутил 4-[3-(3-цианофенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (29 мг, 0.07 ммоль) в метаноле (0.5 мл) обработали с помощью трифторуксусной кислотой (0.05 мл). Реакционную смесь оставили без перемешивания на 2.5 дня при комнатной температуре. Смесь выпарили под вакуумом, и затем неочищенный продукт перемешивали с диоксаном. Полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 70°C в течение 2.5 ч с получением соединения, указанного в названии (20 мг, 67% теоретический выход).
LC-MS (Способ 2В): Rt=1.48 мин, MS (ESIPos): m/z=320 [M+H-xTFA]+
1Н-ЯМР (400 МГц, TFA): δ 8.65 (s, 1H), 8.16 (s, 1H), 8.09-8.03 (m, 2H), 7.99-7.89 (m, 1H), 7.85 (br. s, 1H), 6.79 (s, 1H), 4.20-3.97 (m, 3H), 3.84-3.68 (m, 2H), 2.78 (d, 2H), 2.61-2.45 (m, 2H).
Пример 51
(-)-транс-7-(2-Метилпиперидин-4-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид трифторацетат
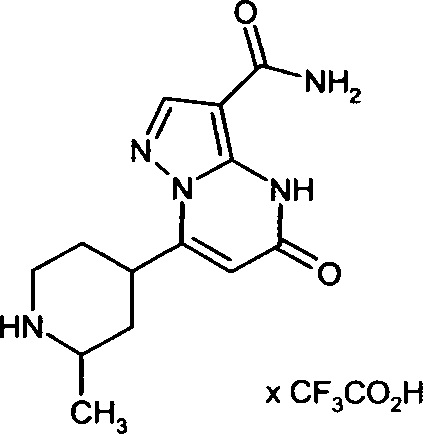
Раствор соединения транс-трет-Бутил 4-(3-карбамоил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)-2-метилпиперидин-1-карбоксилат (Пример 64А, энантиомерно чистый транс-изомер) (100 мг, 0.27 ммоль) в дихлорметане (6 мл) обработали с помощью трифторуксусной кислоты (0.2 мл). Реакционную смесь оставили без перемешивания при комнатной температуре в течение 4 дней. Метанол выпарили, и неочищенный продукт обработали с помощью диоксана. Полученное твердое вещество отфильтровали, промыли диоксаном и снова растворили в МеОН, выпарили и высушивали под вакуумом с получением соединения, указанного в названии (98 мг, 96% теоретический выход).
LC-MS (Способ 2В): Rt=0.77 мин, MS (ESINeg): m/z=276 [M-H-xTFA]-
[α]20=-4.225 (с.0.355, метанол) WL=546 нм
1Н-ЯМР (400 МГц, DMSO-d6): δ 10.72 (br. s, 1H), 8.68 (br. s, 1H), 8.51 (br. s, 1H), 8.29 (s, 1H), 7.78 (br. s, 1H), 7.32 (br. s, 1H), 6.08 (s, 1H), 3.34-3.15 (m, 4H), 2.18-1.89 (m, 4H), 1.34 (d, 3H).
Пример 52
3-(3-Фторфенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

Суспензию соединения трет-бутил 4-[3-(3-фторфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (20 мг, 0.05 ммоль) в метаноле (0.5 мл) обработали 4Н HCl (0.5 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 15 минут. Полученное твердое вещество отфильтровали и промыли диоксаном и наконец высушивали под вакуумом при 70°C всю ночь с получением соединения, указанного в названии (4 мг, 22% теоретический выход).
LC-MS (Способ 2В): Rt=1.52 мин, MS (ESIPos): m/z=313 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ 7.97 (s, 1H), 7.42 (s, 1H), 7.21-7.05 (m, 3H), 6.01 (m, 1H), 3.69-3.59 (m, 2H), 3.52-3.41 (m, 1H), 3.31-3.19 (m, 2H), 2.39-2.29 (m, 2H), 2.00-1.86 (m, 2H)
Пример 53
3-(4-Метоксифенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
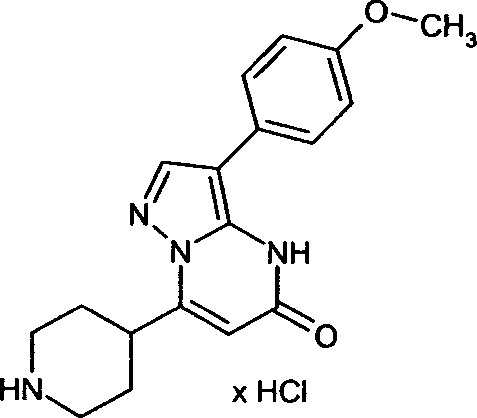
Суспензию соединения трет-бутил 4-[3-(4-метоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (17 мг, 0.04 ммоль) в метаноле (0.5 мл) обработали 4Н HCl (0.5 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Полученное твердое вещество отфильтровали и промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (11 мг, 78% теоретический выход).
LC-MS (Способ 1B): Rt=0.54 мин, MS (ESIPos): m/z=325 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.55 (s, 1H), 7.76 (br. s, 1H), 7.63 (d, 2H), 7.52 (br. s, 1H), 7.34 (d, 2H), 6.75 (s, 1H), 3.14 (s, 3H), 4.07 (d, 2H), 4.03-3.94 (m, 1H), 3.78-3.63 (m, 2H), 2.71 (d, 2H), 2.57-2.38 (m, 2H)
Пример 54
3-(3,4-диметоксифенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

Суспензию соединения трет-бутил 4-[3-(3,4-диметоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (29 мг, 0.06 ммоль) в метаноле (0.75 мл) обработали 4Н HCl (0.75 мл). Реакционную смесь обработали ультразвуком при 40°C в течение 30 минут. Полученное твердое вещество отфильтровали и промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (12 мг, 48% теоретический выход).
LC-MS (Способ 1B): Rt=0.50 мин, MS (ESIPos): m/z=355 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.61 (s, 1H), 7.77 (br. s, 1Н), 7.63 (br. s, 1H), 7.30 (d, 3H), 6.79 (s, 1H), 4.18 (s, 3H), 4.17 (s, 3H), 4.13-3.97 (m, 3H), 3.83-3.68 (m, 2H), 2.77-2.69 (m, 2H), 2.59-2.45 (m, 2H)
Пример 55
3-[4-(Метилсульфонил)фенил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
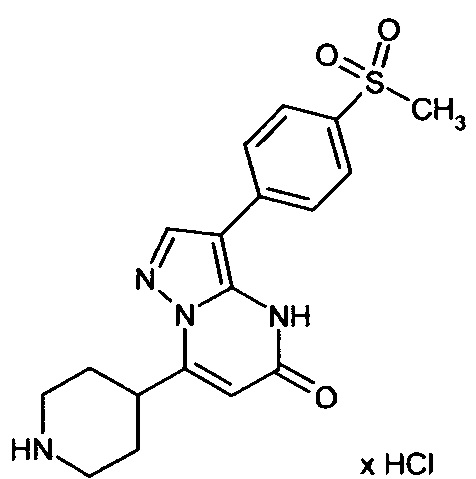
Суспензию соединения трет-бутил 4-{3-[4-(метилсульфонил)фенил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (53 мг, 0.11 ммоль) в метаноле (1.0 мл) обработали 4Н HCl (1.0 мл). Реакционную смесь обработали ультразвуком при 40°C в течение 30 минут. Полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (27 мг, 57% теоретический выход).
LC-MS (Способ 1B): Rt=0.41 мин, MS (ESIPos): m/z=373 [M+H-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.64 (s, 1H), 8.33 (d, 2H), 8.02 (d, 2H), 7.81 (br. s, 1H), 7.55 (br. s, 1H), 6.76 (s, 1H), 4.18-3.96 (m, 3H), 3.78-3.63 (m, 2H), 3.49 (s, 3H), 2.81-2.68 (m, 2H), 2.60-2.46 (m, 2H)
Пример 56
3-(2-Фторфенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
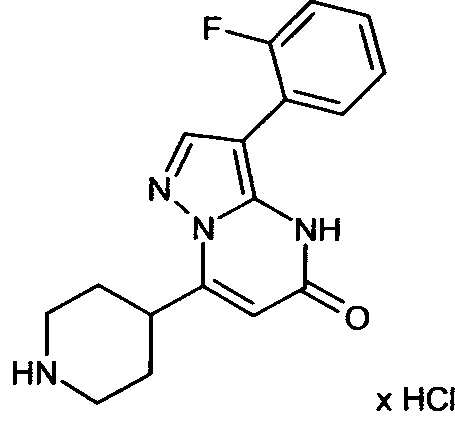
Суспензию соединения трет-бутил 4-[3-(2-фторфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (35 мг, 0.06 ммоль) в метаноле (0.5 мл) обработали 4Н HCl (0.5 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 15 минут. Полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 760°C всю ночь с получением соединения, указанного в названии (10 мг, 51% теоретический выход).
LC-MS (Способ 2В): Rt=1.53 мин, MS (ESIPos): m/z=313 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ 7.90 (s, 1H), 7.44-7.35 (m, 2H), 7.30-7.18 (m, 2H), 6.03 (s, 1H), 3.64 (d, 2H), 3.51 (dd, 1H), 3.25 (dd, 2H), 2.33 (d, 2H), 1.96-1.89 (m, 2H)
Пример 57
7-(Пиперидин-4-ил)-3-[4-(трифторметил)фенил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
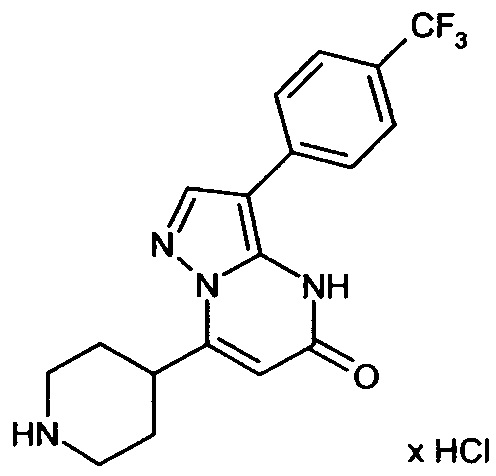
Суспензию соединения трет-бутил 4-{5-оксо-3-[4-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (38 мг, 0.08 ммоль) в метаноле (1.5 мл) обработали 4Н HCl (0.38 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 15 минут. Смесь выпарили, и неочищенный продукт перемешивали в диоксан. Полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 70°C всю ночь с получением соединения, указанного в названии (21 мг, 64% теоретический выход).
LC-MS (Способ 1B): Rt=0.69 мин, MS (ESIPos): m/z=363 [М+Н-xHCl]+
Пример 58
7-(Пиперидин-4-ил)-3-[3-(трифторметил)фенил]пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
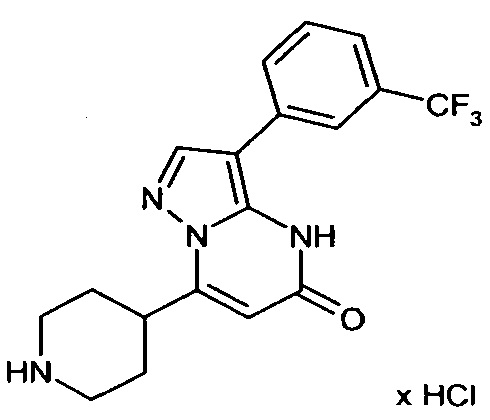
Суспензию трет-бутил 4-{5-оксо-3-[3-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (63 мг, 0.14 ммоль) в метаноле (1.0 мл) обработали 4Н HCl (1.0 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Смесь выпарили, и неочищенный продукт перемешивали в смеси диоксан/метанол (4/1). Полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (48 мг, 86% теоретический выход).
LC-MS (Способ 2В): Rt=1.74 мин, MS (ESIPos): m/z=363 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.58 (s, 1H), 7.91-7.86 (m, 2Н), 7.85-7.79 (m, 2Н), 7.77 (br. s, 1H), 7.50 (br. s, 1H), 6.73 (s, 1H), 4.11-4.03 (m, 2H), 4.04-3.94 (m, 1H), 3.74-3.61 (m, 2H), 2.74-2.66 (m, 2H), 2.54-2.43 (m, 2H).
Пример 59
7-(Пиперидин-4-ил)-3-(2-тиенил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
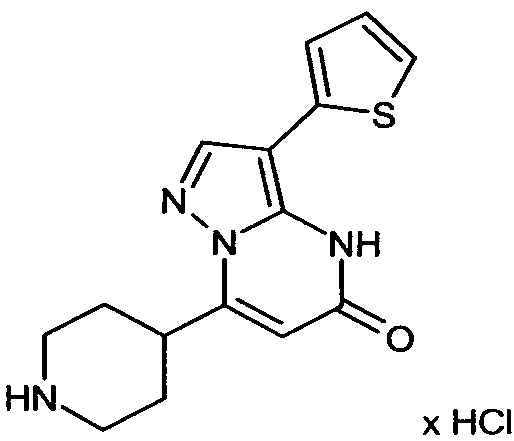
Суспензию трет-бутил 4-[5-оксо-3-(2-тиенил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (23 мг, 0.06 ммоль) в метаноле (0.5 мл) обработали 4Н HCl (0.5 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Смесь разбавили в диоксане, и полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (5 мг, 24% теоретический выход).
LC-MS (Способ 2В): Rt=1.41 мин, MS (ESIPos): m/z=301 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ 7.97 (s, 1H), 7.48-7.42 (m, 1H), 7.17 (d, 2H), 6.02 (s, 1H), 3.63 (d, 2H), 3.50 (dd, 1H), 3.24 (dd, 2H), 2.35 (d, 2H), 1.94 (dd, 2H).
Пример 60
3-(3-Метоксифенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
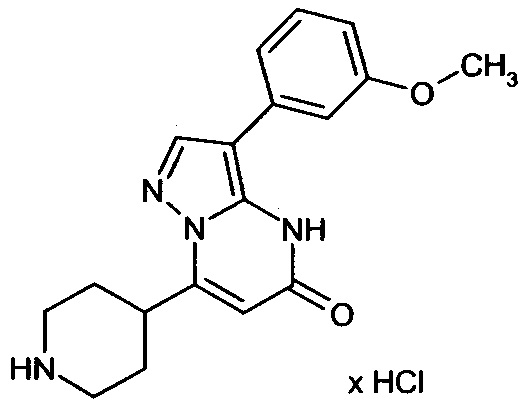
Суспензию соединения трет-бутил 4-[3-(3-метоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (38 мг, 0.09 ммоль) в метаноле (0.5 мл) обработали 4Н HCl (0.5 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Суспензию разбавили в диоксане, и полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (23 мг, 71% теоретический выход).
LC-MS (Способ 2В): Rt=1.51 мин, MS (ESIPos): m/z=325 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.61 (s, 1H), 7.79 (br. s, 1H), 7.71-7.68 (m, 1Н), 7.53 (br. s, 1H), 7.41-7.34 (m, 2H), 7.32 (d, 1H), 6.78 (s, 1H), 4.17-3.94 (m, 3H), 3.80-3.65 (m, 2H), 2.81-2.64 (m, 2H), 2.62-2.42 (m, 2H).
Пример 61
3-(2,3-Дигидро-1,4-бензодиоксин-6-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
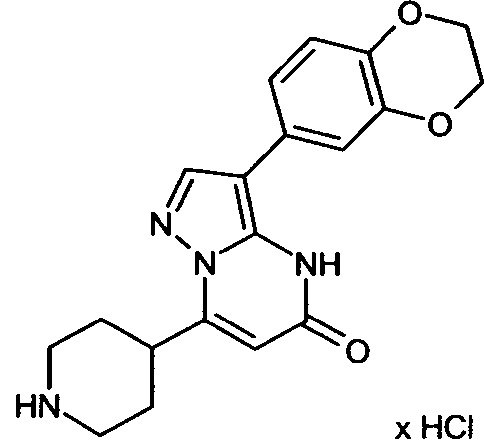
Суспензию трет-бутил 4-[3-(2,3-дигидро-1,4-бензодиоксин-6-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (13 мг, 0.03 ммоль) в метаноле (0.48 мл) обработали 4Н HCl (0.48 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Суспензию разбавили в диоксане, и полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (7 мг, 60% теоретический выход).
LC-MS (Способ 2В): Rt=1.49 мин, MS (ESIPos): m/z=353 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.55 (s, 1Н), 7.77 (br. s, 1Н), 7.45 (br. s, 1H), 7.36-7.11 (m, 3Н), 6.78 (s, 1H), 4.63 (s, 4H), 4.18-3.94 (m, 3H), 3.86-3.64 (m, 2H), 2.85-2.64 (m, 2H), 2.61-2.42 (m, 2H).
Пример 62
3-(2,5-диметоксифенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
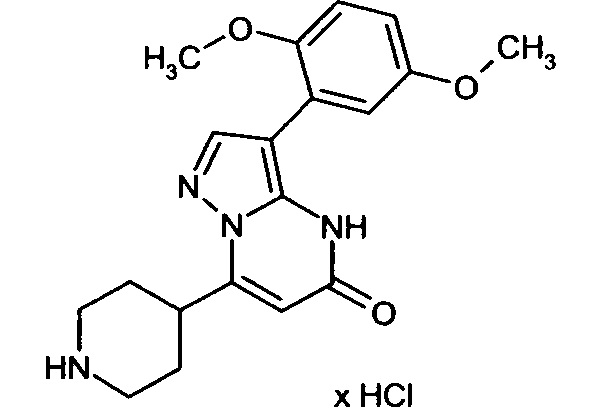
Суспензию трет-бутил 4-[3-(2,5-диметоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (20 мг, 0.04 ммоль) в метаноле (0.50 мл) обработали 4Н HCl (0.50 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Суспензию разбавили в диоксане, и полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (16 мг, 94% теоретический выход).
LC-MS (Способ 2В): Rt=1.66 мин, MS (ESIPos): m/z=355 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, TFA): δ 8.71 (s, 1Н), 7.84 (br. s, 1Н), 7.55 (br. s, 1H), 7.43-7.35 (m, 3H), 6.85 (s, 1H), 4.26 (s, 3H), 4.17 (s, 3H), 4.16-4.05 (m, 3H), 3.86-3.72 (m, 2H), 2.86-2.75 (m, 2H), 2.66-2.49 (m, 2H).
Пример 63
7-(Пиперидин-4-ил)-3-[2-(трифторметил)фенил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
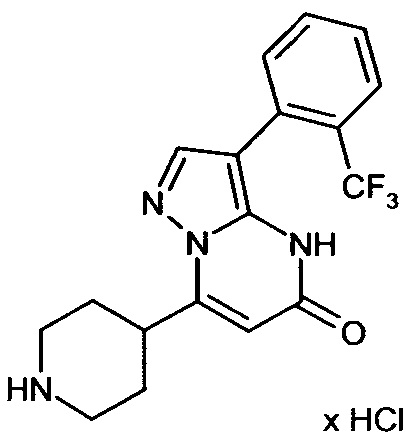
Суспензию соединения трет-бутил 4-{5-оксо-3-[2-(трифторметил)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (15 мг, 0.03 ммоль) в метаноле (0.50 мл) обработали 4Н HCl (0.50 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Смесь выпарили, и неочищенный продукт перемешивали в смеси диоксан/метанол 4/1. Полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (8 мг, 58% теоретический выход).
LC-MS (Способ 2В): Rt=1.69 мин, MS (ESIPos): m/z=363[М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): δ 7.94 (s, 1Н), 7.91 (d, 1H), 7.74-7.71 (m, 1H), 7.66-7.63 (m, 1H), 7.47 (d, 1H), 6.09 (s, 1H), 3.70-3.61 (m, 3H), 3.29 (dd, 2H), 2.43 (d, 2H), 2.00 (dd, 2H).
Пример 64
3-(4-Фторфенил)-2-фенил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
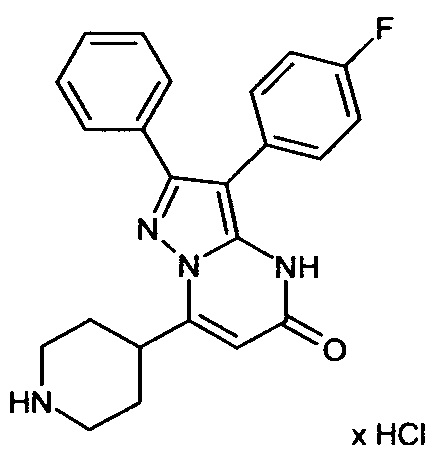
Суспензию трет-бутил 4-[3-(4-фторфенил)-5-оксо-2-фенил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (29 мг, 0.063 ммоль) в метаноле (1.5 мл) обработали 4Н HCl (0.37 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 15 минут. Полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 70°C всю ночь с получением соединения, указанного в названии (9 мг, 38% теоретический выход).
LC-MS (Способ 1B): Rt=0.74 мин, MS (ESIPos): m/z=389 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.84 (br. s, 1H), 8.62 (br. s, 1H), 7.46-7.38 (m, 2H), 7.38-7.32 (m, 3H), 7.31-7.24 (m, 2H), 7.24-7.17 (m, 2H), 5.88 (br. s, 1H), 3.71-3.56 (m, 1H), 3.42 (d, 2H), 3.15 (dd, 2H), 2.29 (d, 2H), 1.92 (dd, 2H).
Пример 65
(-)-транс-7-(2-Метилпиперидин-4-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбонитрил трифторацетат
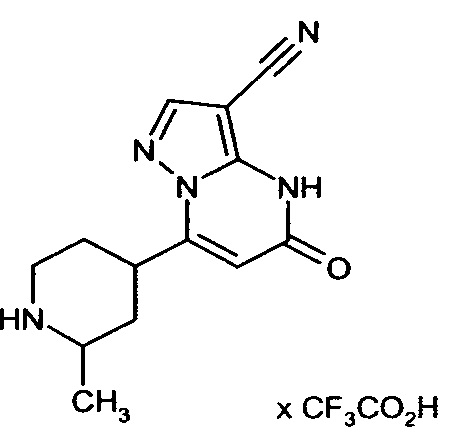
Раствор трет-бутил 4-(3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)-2-метилпиперидин-1-карбоксилата (Пример 78А, энантиомерно чистый транс-изомер) (200 мг, 0.56 ммоль) в дихлорметане (12.94 мл) обработали с помощью трифторуксусной кислоты (0.43 мл). Реакционную смесь оставили без перемешивания на один день при комнатной температуре. Смесь выпарили, и неочищенный продукт обработали с помощью диоксана. Полученное твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом. После этого неочищенный продукт растворили в воде и лиофилизировали с получением соединения, указанного в названии (139 мг, 67% теоретический выход).
LC-MS (Способ 1В): Rt=0.19 мин, MS (ESIPos): m/z=258 [М+Н-xTFA]+
[α]20=-6.00 (с.0.350, метанол) WL=578 нм
1Н-ЯМР (400 МГц, DMSO-d6): δ=8.68 (br. s, 1Н), 8.51 (br. s, 1H), 8.43 (s, 1H), 6.27 (br. s, 1H), 3.79-3.60 (m, 2H), 3.29-3.10 (m, 2H), 2.16-1.90 (m, 4H), 1.33 (d, 3H).
Пример 66
3-(4-Метил-2-тиенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидан-5(4H)-он гидрохлорид
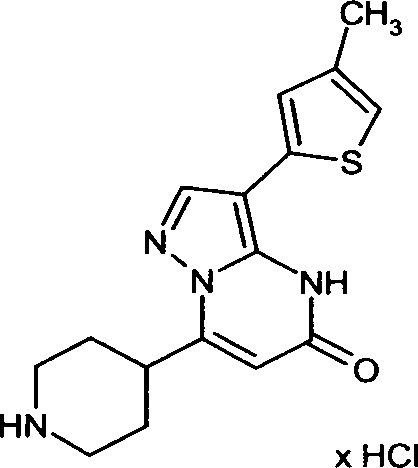
Суспензию трет-бутил 4-[3-(4-метил-2-тиенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (25 мг, 0.06 ммоль) в метаноле (0.34 мл) обработали 4Н HCl (0.34 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Суспензию разбавили в диоксане, и твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (7 мг, 34% теоретический выход).
LC-MS (Способ 2В): Rt=1.56 мин, MS (ESIPos): m/z=315 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): 7.89 (s, 1H), 6.98 (s, 1H), 6.94 (s, 1H), 5.99 (s, 1H), 3.68-3.57 (m, 2H), 3.53-3.41 (m, 1H), 3.28-3.17 (m, 2H), 2.35-2.29 (m, 2H), 2.26 (s, 3H), 1.99-1.82 (m, 2H).
Пример 67
3-(2-Метоксифенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
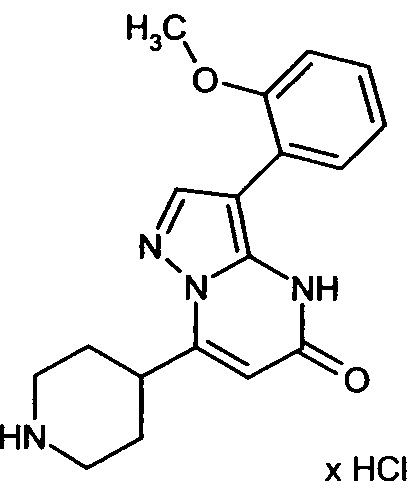
Суспензию трет-бутил 4-[3-(2-метоксифенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (44 мг, 0.10 ммоль) в метаноле (1.0 мл) обработали 4Н HCl (1.0 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Суспензию разбавили в диоксане, и твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (26 мг, 70% теоретический выход).
LC-MS (Способ 2В): Rt=1.68 мин, MS (ESIPos): m/z=325 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): 7.96 (s, 1H), 7.39 (dd, 1H), 7.33 (d, 1H), 7.12 (d, 1H), 7.05 (dd, 1H), 6.00 (s, 1H), 3.07 (s, 3H), 3.62 (d, 2H), 3.49 (dd, 1H), 3.24 (dd, 2H), 2.33 (d, 2H), 1.92 (dd, 2H).
Пример 68
5-[5-Оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]тиофен-3-карбонитрил трифторацетат
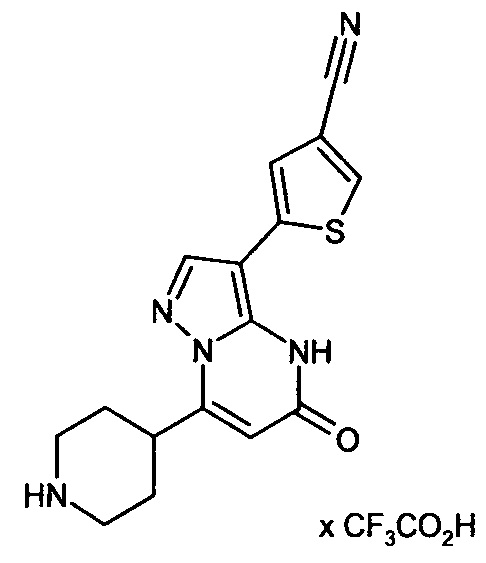
Суспензию трет-бутил 4-[3-(4-циано-2-тиенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (4 мг, 0.01 ммоль) в дихлорметане (0.67 мл) обработали с помощью трифторуксусной кислоты (0.01 мл). Реакционную смесь обработали ультразвуком при 40°C в течение 30 минут. Смесь выпарили под вакуумом, и затем неочищенный продукт разбавили в воде и лиофилизировали всю ночь с получением соединения, указанного в названии (4 мг, 89% теоретический выход).
LC-MS (Способ 2В): Rt=0.45 мин, MS (ESIPos): m/z=326 [M+H-xTFA]+
1Н-ЯМР (400 МГц, D2O): 8.20 (s, 1H), 8.03 (s, 1H), 7.39 (s, 1H), 6.09 (s, 1H), 3.69-3.51 (m, 3H), 3.26 (dd, 2H), 2.40 (d, 2H), 1.96 (dd, 2H).
Пример 69
3-(6-Метоксипиридин-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он

Суспензию трет-бутил 4-[3-(6-метоксипиридин-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (42 мг, 0.10 ммоль) в метаноле (1.0 мл) обработали 4Н HCl (1.0 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Реакционную смесь разбавили в диоксане, и полученную соль отфильтровали, промыли диоксаном и высушивали всю ночь под вакуумом. Остаток очистили посредством препаративной ВЭЖХ (Способ 2А). После выпаривания ацетонитрила из объединенных фракций продукта водную фракцию лиофилизировали всю ночь с получением соединения, указанного в названии (12 мг, 37% теоретический выход).
LC-MS (Способ 1B): Rt=0.42 мин, MS (ESIPos): m/z=326 [М+Н]+
1Н-ЯМР (400 МГц, TFA): 8.87 (d, 1Н), 8.73 (s, 1Н), 8.60 (s, 1H), 7.80 (d, 1H), 6.75 (s, 1H), 4.43 (s, 3Н), 4.07 (d, 2Н), 4.02 (dd, 1Н), 3.70 (dd, 2Н), 2.72 (d, 2Н), 2.50 (dd, 2Н).
Пример 70
7-(Пиперидин-4-ил)-3-[3-(трифторметокси)фенил]пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
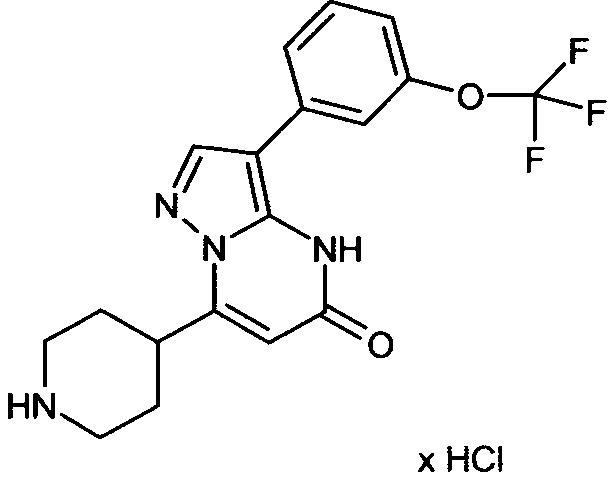
Суспензию трет-бутил 4-{5-оксо-3-[3-(трифторметокси)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (43 мг, 0.10 ммоль) в метаноле (1.0 мл) обработали 4Н HCl (1.0 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 15 минут. Реакционную смесь выпарили, и остаток растворили в диоксан и снова выпарили с получением соединения, указанного в названии (37 мг, 98% теоретический выход).
LC-MS (Способ 1B): Rt=0.71 мин, MS (ESIPos): m/z=379 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): 12.25 (s, 1Н), 8.93 (br. s, 1H), 8.76 (br. s, 1H), 7.53 (t, 1H), 7.25-7.15 (m, 1H), 3.71-3.58 (m, 1H), 3.42 (d, 2H), 3.21-3.03 (m, 2H), 2.22 (d, 2H), 1.99-1.83 (m, 2H)
Пример 71
7-(Пиперидин-4-ил)-3-[2-(трифторметокси)фенил]пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
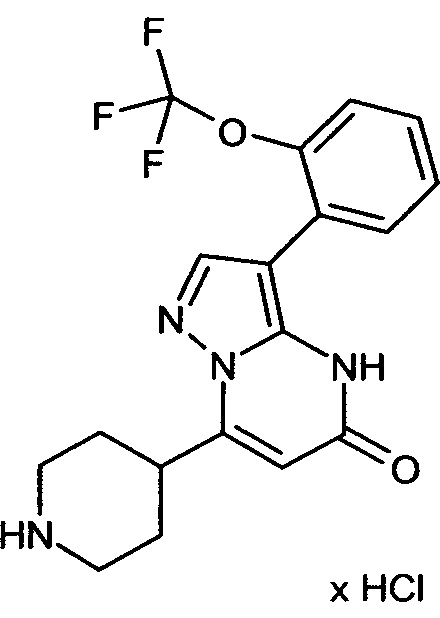
Суспензию трет-бутил 4-{5-оксо-3-[2-(трифторметокси)фенил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (44 мг, 0.10 ммоль) в метаноле (1.0 мл) обработали 4Н HCl (1.0 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 15 минут. Реакционную смесь выпарили, и остаток растворили в диоксане, и затем соль отфильтровали и высушивали всю ночь при 70°C с получением соединения, указанного в названии (32 мг, 81% теоретический выход).
LC-MS (Способ 1B): Rt=0.65 мин, MS (ESIPos): m/z=379 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): 12.08 (s, 1H), 8.90 (br. s, 1H), 8.72 (br. s, 1H), 7.99 (br. s, 1H), 7.56 (br. s, 1H), 7.45 (s, 3H), 5.88 (s, 1H), 3.45-3.37 (m, 2H), 3.18-3.02 (m, 2H), 2.30-2.16 (d, 2H), 2.00-1.77 (m, 2H).
Пример 72
3-(3-Хлор-4-фторфенил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
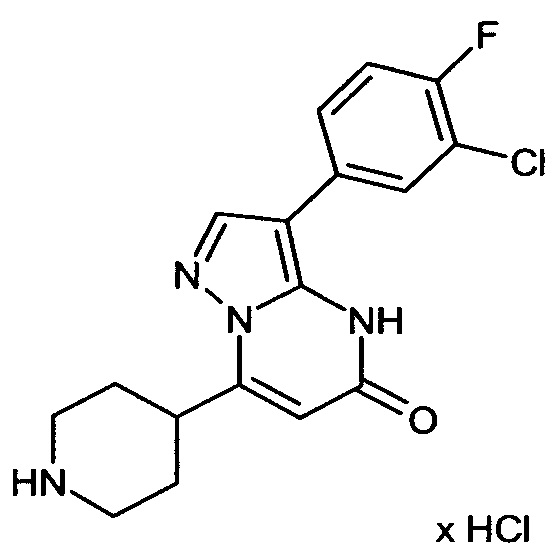
Суспензию трет-бутил 4-[3-(3-хлор-4-фторфенил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (29 мг, 0.07 ммоль) в метаноле (0.50 мл) обработали 4Н HCl (0.50 мл). Реакционную смесь обработали ультразвуком при комнатной температуре в течение 30 минут. Суспензию разбавили в диоксане, и твердое вещество отфильтровали, промыли диоксаном и наконец высушивали под вакуумом при 60°C всю ночь с получением соединения, указанного в названии (10 мг, 41% теоретический выход).
LC-MS (Способ 1B): Rt=0.60 мин, MS (ESIPos): m/z=347 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, D2O): 7.94 (s, 1H), 7.46 (s, 1H), 7.32 (s, 1H), 7.23 (s, 1H), 6.06 (br. s, 1H), 3.75-3.60 (m, 2H), 3.60-3.44 (m, 1H), 3.38-3.17 (m, 2H), 2.47-2.25 (m, 2H), 2.05-1.78 (m, 2H).
Пример 73
3-(Фенилсульфонил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
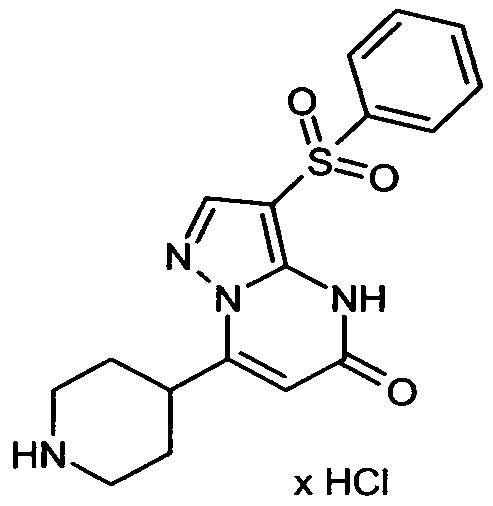
Трет-бутил 4-[5-оксо-3-(фенилсульфонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (0.82 г, 1.78 ммоль) растворили в 1,4-диоксане и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 4.4 мл, 17.8 ммоль). Смесь перемешивали при комнатной температуре в течение 16 ч. Полученное твердое вещество отфильтровали и промыли 1,4-диоксаном и простым диэтиловым эфиром с получением соединения, указанного в названии (640 мг, 83% теоретический выход).
LC-MS (Способ 3В): Rt=1.36 мин, MS (ESIPos): m/z=359 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6): δ=12.66 (br. s, 1Н), 8.90 (br. s, 1H), 8.69 (br. s, 1H), 8.39 (br. s, 1H), 8.12 (d, 1H), 7.72-7.53 (m, 4H), 6.30 (br. s, 1H), 3.37 (d, 3H), 3.07 (q, 2H), 2.14 (d, 2H), 1.95-1.77 (m, 2H)
Пример 74
3-[(2,4-Дихлорфенил)сульфонил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
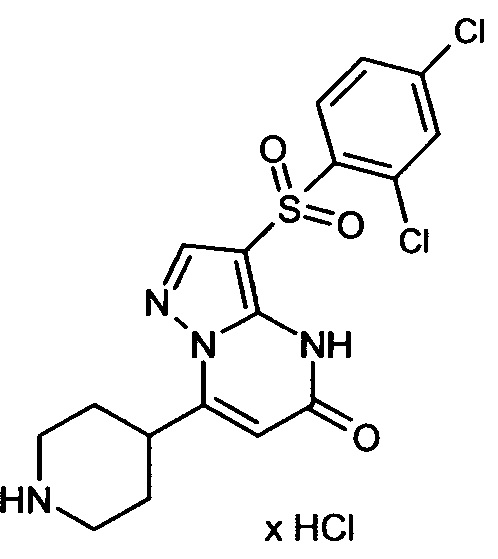
Трет-бутил 4-{3-[(2,4-дихлорфенил)сульфонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (0.61 г, 1.16 ммоль) растворили в 1,4-диоксане (12 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 2.9 мл, 11.6 ммоль). Смесь перемешивали при комнатной температуре в течение 16 ч. Полученное твердое вещество отфильтровали и промыли 1,4-диоксаном с получением соединения, указанного в названии (540 мг, 93% теоретический выход).
LC-MS (Способ 1B): Rt=0.62 мин, MS (ESIPos): m/z=427 [М+Н-xHCl]+
1Н-ЯМР (500 МГц, D2O): δ=8.35-8.13 (m, 2Н), 7.72-7.53 (m, 2Н), 6.23 (s, 1H), 3.69-3.48 (m, 3Н), 3.31-3.12 (m, 2H), 2.46-2.22 (m, 2H), 2.03-1.82 (m, 2H).
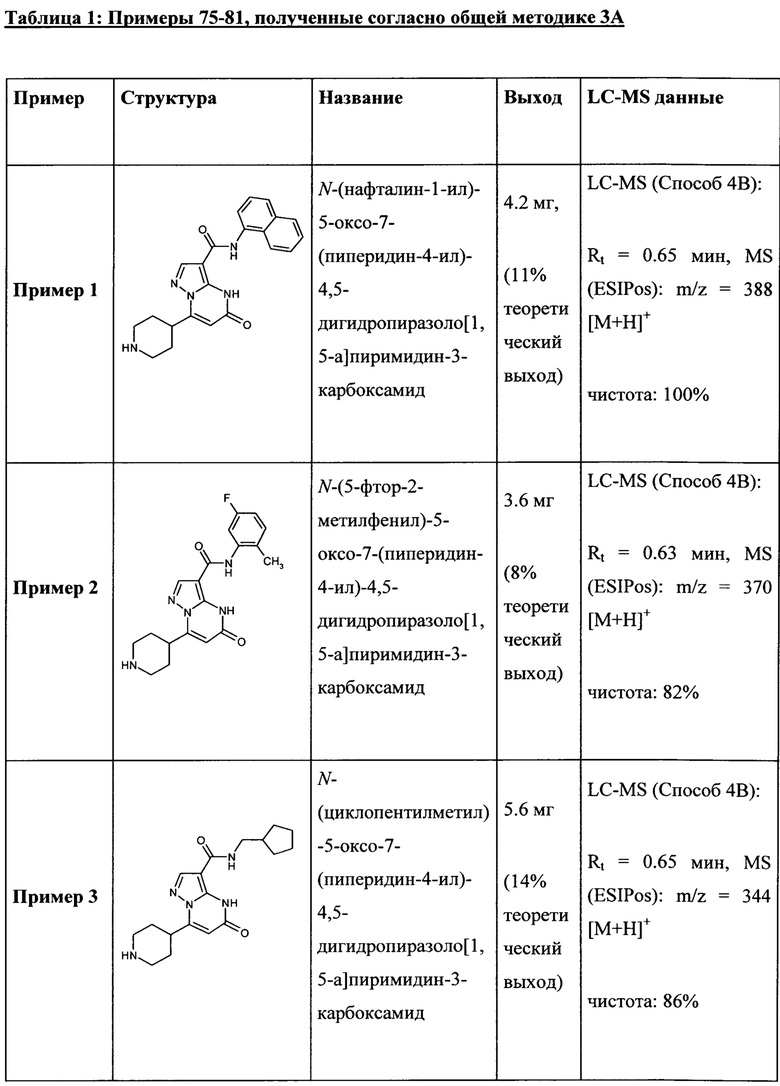
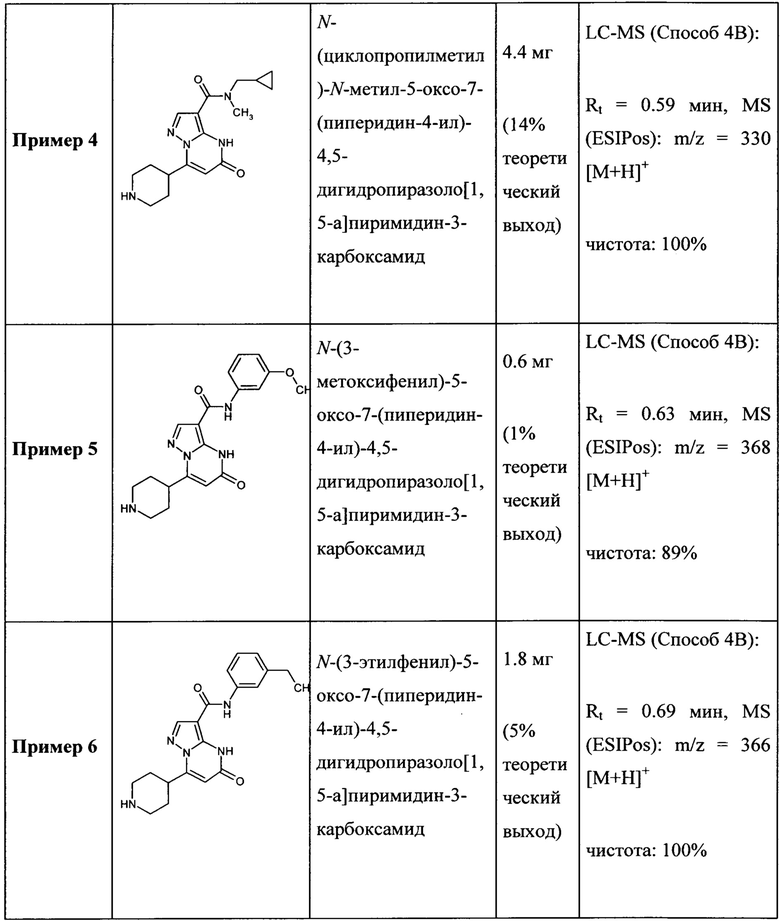
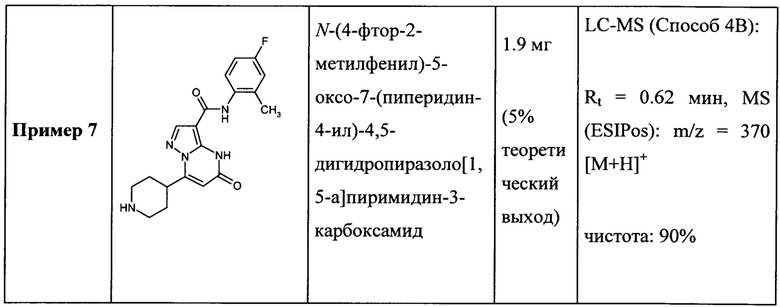
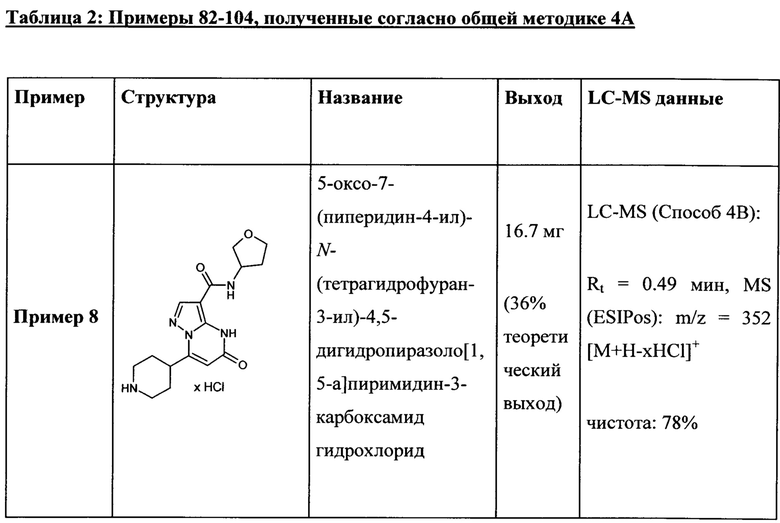
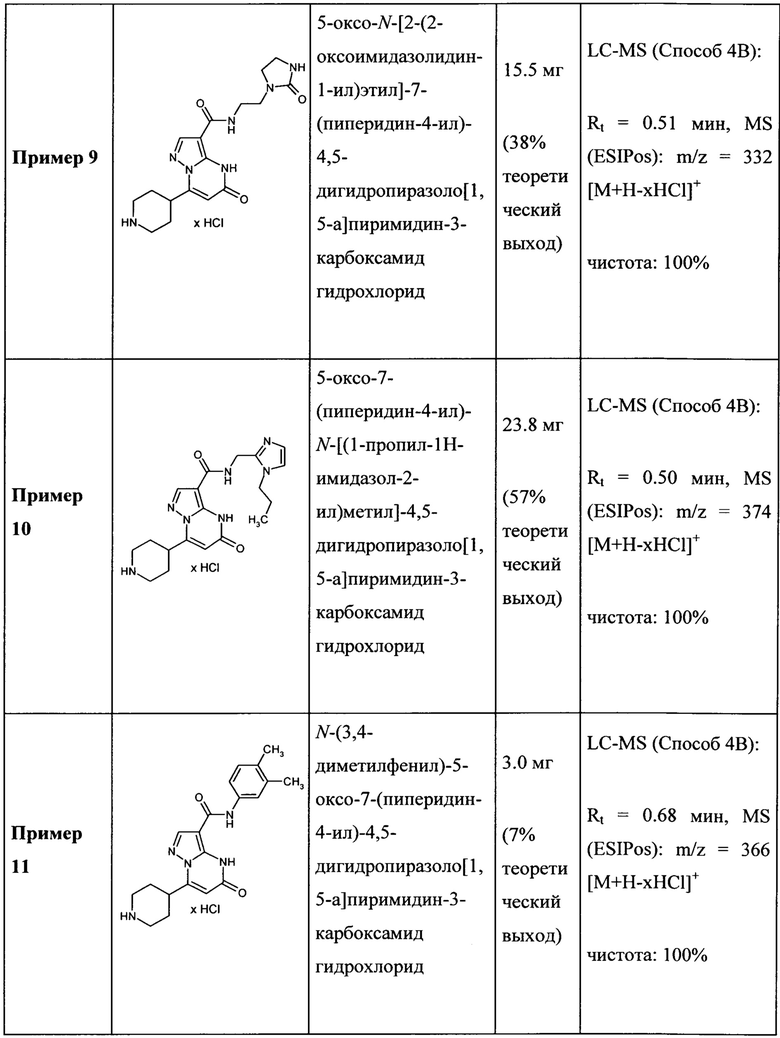
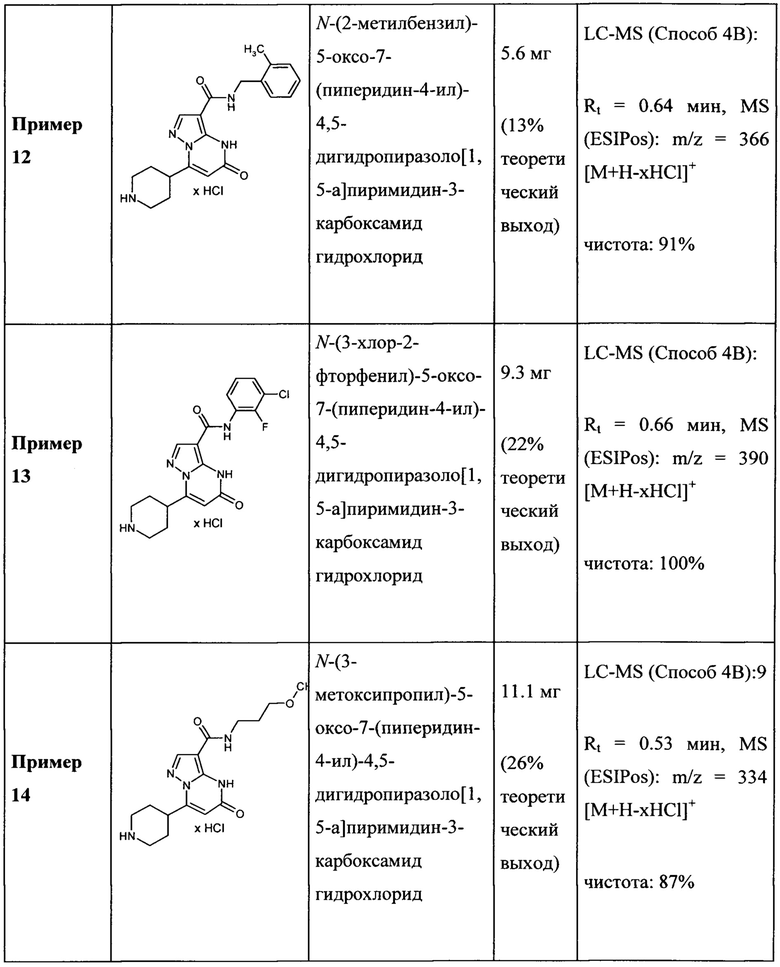

Пример 111
7-(Пиперидин-4-ил)-3-{3-[3-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
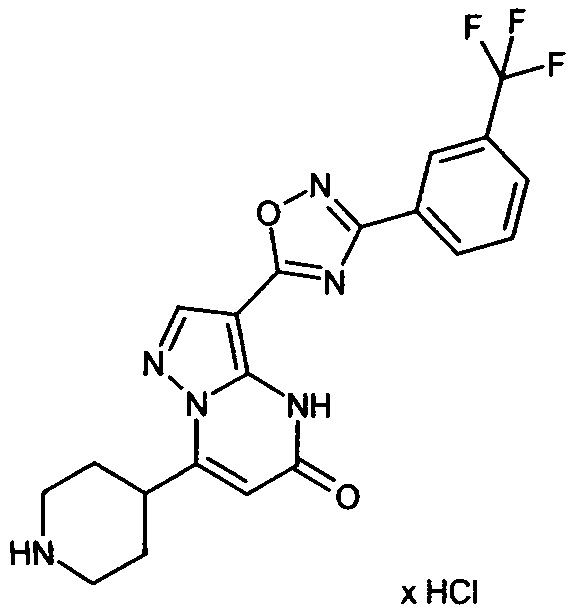
Суспензию трет-бутил 4-(5-оксо-3-{3-[3-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (55 мг, 0.10 ммоль) в метаноле (0.5 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь перемешивали 30 минут при 40°C. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (47 мг, 96% теоретический выход).
LC-MS (способ 1B): Rt=0.76 мин, m/z=431 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.53 (bs, 1Н), 8.51 (s, 1H), 8.48 (d, 1H), 7.92 (d, 1H), 7.80 (dd, 1H), 6.21 (s, 1H), 3.74 (dd, 1H), 3.61 (d, 2H), 3.28 (dd, 2H), 2.46 (d, 2H), 2.05 (dd, 2H).
Пример 112
3-[3-(3-Фторфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
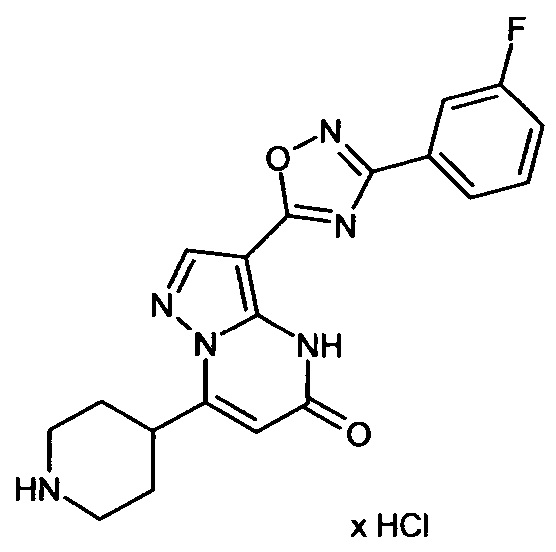
Суспензию трет-бутил 4-{3-[3-(3-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (82 мг, 0.17 ммоль) в метаноле (0.8 мл) обработали 4Н HCl в диоксан (0.8 мл). Реакционную смесь перемешивали 30 минут при 40°C. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (70 мг, 99% теоретический выход).
LC-MS (способ 1B): Rt=0.67 мин, m/z=381 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 7.18 (s, 1Н), 6.73 (d, 1H), 6.65 (d, 1H), 6.28 (dd, 1H), 6.04 (dd, 1H), 4.89 (s, 1H), 2.42 (dd, 1H), 2.30 (d, 2H), 1.97 (dd, 2H), 1.14 (d, 2H), 0.73 (dd, 2H).
Пример 113
7-(Пиперидин-4-ил)-3-{3-[4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
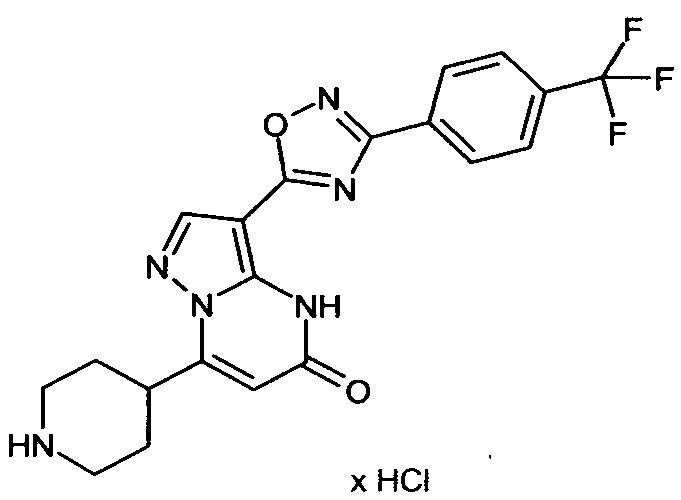
Суспензию соединения трет-бутил 4-(5-оксо-3-{3-[4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (258 мг, 0.49 ммоль) в метаноле (2.4 мл) обработали 4Н HCl в диоксан (2.4 мл). Реакционную смесь перемешивали 30 минут при 40°C. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (189 мг, 83% теоретический выход).
LC-MS (способ 1B): Rt=0.76 мин, m/z=431 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.38 (s, 1H), 8.30 (d, 2H), 7.78 (d, 2H), 6.09 (s, 1H), 3.62 (dd, 1H), 3.48 (d, 2H), 3.18 (dd, 2H), 2.33 (d, 2H), 1.93 (dd, 2H)
Пример 114
3-[3-(4-Бензилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

Суспензию трет-бутил 4-{3-[3-(4-бензилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (14 мг, 0.03 ммоль) в метаноле (0.14 мл) обработали 4Н HCl в диоксан (0.14 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и полученное твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (9 мг, 73% теоретический выход).
LC-MS (способ 1B): Rt=0.61 мин, m/z=377 (M+H-HCl)+
Пример 115
7-(Пиперидин-4-ил)-3-{3-[4-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
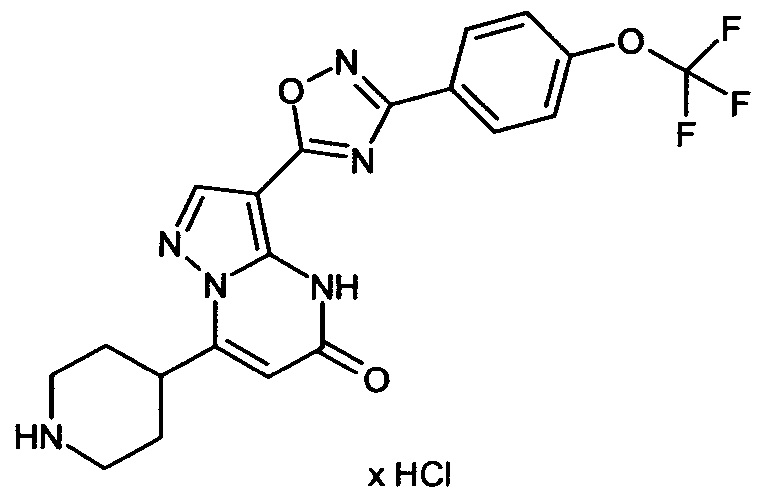
Суспензию трет-бутил 4-(5-оксо-3-{3-[4-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (104 мг, 0.20 ммоль) в метаноле (0.9 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь перемешивали 30 минут при 40°C. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (73 мг, 79% теоретический выход).
LC-MS (способ 1B): Rt=0.77 мин, m/z=447 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.36 (s, 1H), 8.21 (d, 2H), 7.38 (d, 2H), 6.08 (s, 1H), 3.61 (dd, 1H), 3.48 (d, 2H), 3.15 (dd, 2H), 2.32 (d, 2H), 1.93 (dd, 2H)
Пример 116
3-[3-(3-Метокси-4-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
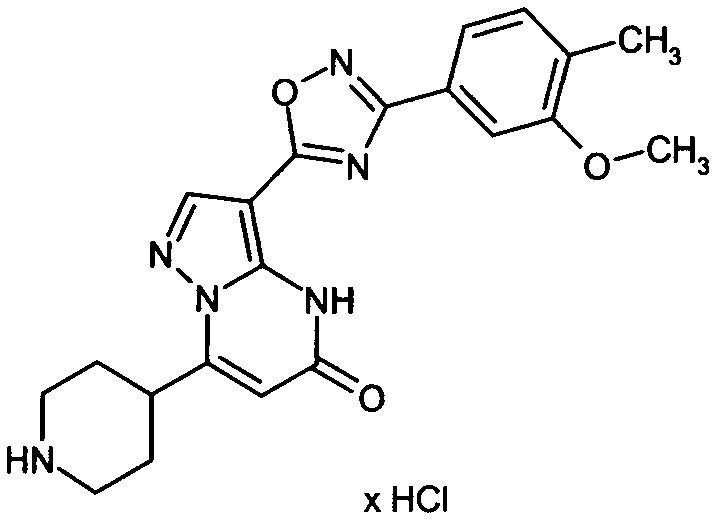
Суспензию трет-бутил 4-{3-[3-(3-метокси-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (21 мг, 0.04 ммоль) в метаноле (0.20 мл) обработали 4Н HCl в диоксан (0.20 мл). Реакционную смесь перемешивали 30 минут при 40°C. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч. Наконец продукт перемешали в метаноле и отфильтровали с получением соединения, указанного в названии (10 мг, 50% теоретический выход).
LC-MS (способ 1B): Rt=0.74 мин, m/z=407 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): 5 8.36 (s, 1Н), 8.08 (d, 1H), 7.58 (s, 1H), 7.20 (s, 1H), 6.07 (s, 1H), 3.66-3.63 (m, 1H), 3.56 (s, 3H), 3.48 (d, 2H), 2.34 (d, 2H), 2.17 (s, 2H), 1.93 (2H), 1.19 (s, 3H)
Пример 117
3-[3-(3-Фтор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
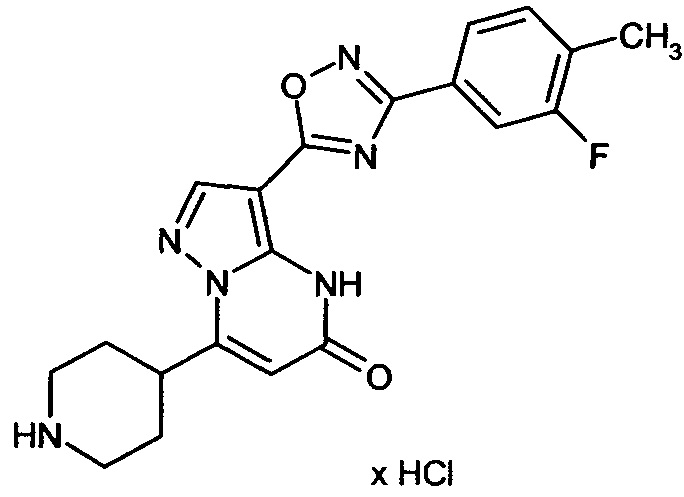
Суспензию трет-бутил 4-{3-[3-(3-фтор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (74 мг, 0.15 ммоль) в метаноле (0.7 мл) обработали 4Н HCl в диоксан (0.7 мл). Реакционную смесь перемешивали 30 минут при 40°C. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (62 мг, 95% теоретический выход).
LC-MS (способ 1B): Rt=0.72 мин, m/z=395 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.36 (s, 1Н), 7.79 (d, 1H), 7.75 (d, 1H), 7.33 (dd, 1H), 6.08 (s, 1H), 3.65 (dd, 1H), 3.48 (d, 2H), 3.15 (dd, 2H), 2.32 (d, 2H), 1.92 (dd, 2H), 1.19 (s, 3H)
Пример 118
3-{3-[4-Метил-3-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
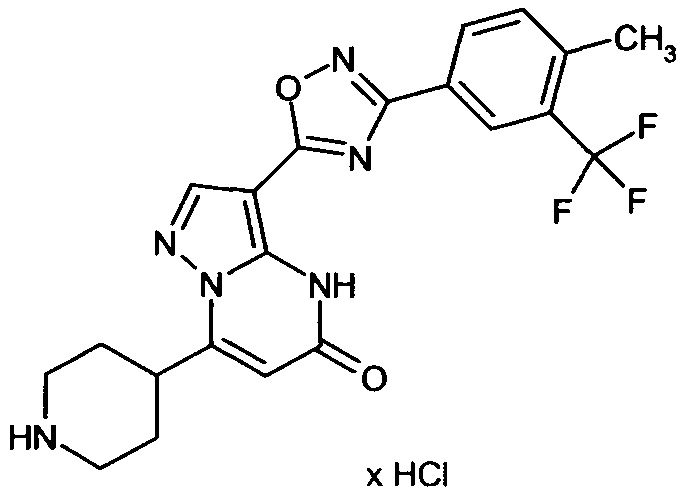
Суспензию трет-бутил 4-(3-{3-[4-метил-3-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (110 мг, 0.20 ммоль) в метаноле (0.9 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь перемешивали 30 минут при 40°C. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (85 мг, 88% теоретический выход).
LC-MS (способ 1B): Rt=0.78 мин, m/z=446 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.49 (s, 1H), 8.46 (s, 1Н), 8.32 (d, 1H), 7.61 (d, 1H), 6.20 (s, 1H), 3.73 (dd, 1H), 3.60 (d, 2H), 3.28 (dd, 2H), 2.60 (s, 3H), 2.45 (d, 2H), 2.05 (dd, 2H)
Пример 119
3-[3-(2-Метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
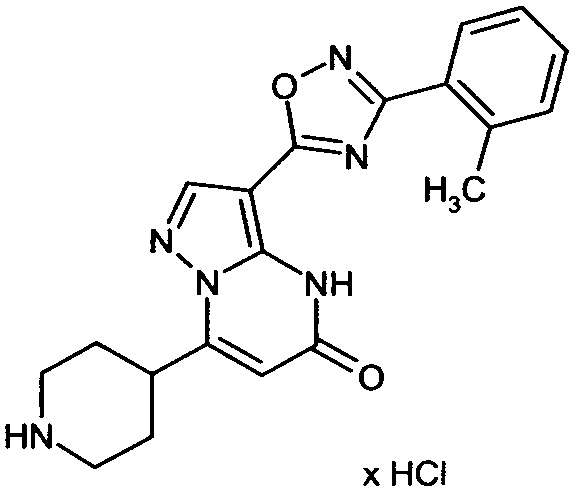
Суспензию трет-бутил 4-{3-[3-(2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (94 мг, 0.20 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (1.0 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (85 мг, 97% теоретический выход).
LC-MS (способ 1B): Rt=0.69 мин, m/z=377 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.75 (bs, 1H), 8.61 (bs, 1Н), 8.50 (bs, 1H), 8.20 (bs, 1H), 7.49 (dd, 2Н), 7.42 (d, 2Н), 6.21 (bs, 1H), 3.68-3.57 (m, 1H), 3.43 (d, 2Н), 3.13 (dd, 2Н), 2.61 (s, 3Н), 2.23 (d, 2Н), 1.90 (dd, 2Н)
Пример 120
3-[3-(3-Метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
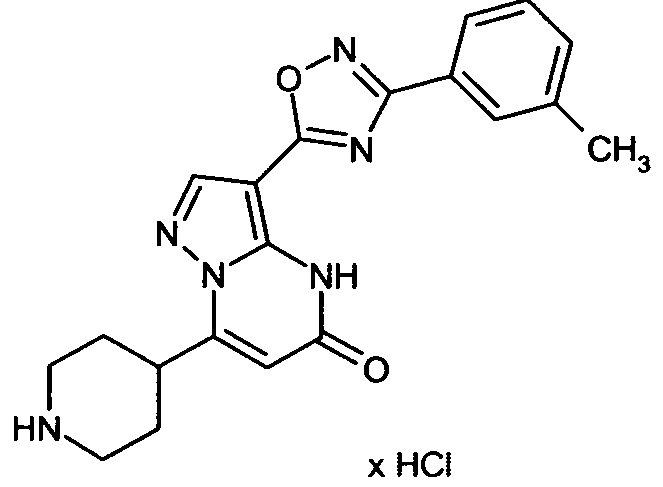
Суспензию трет-бутил 4-{3-[3-(3-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (54 мг, 0.11 ммоль) в метаноле (0.5 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушили под вакуумом с получением соединения, указанного в названии (43 мг, 88% теоретический выход).
LC-MS (способ 1B): Rt=0.70 мин, m/z=377 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.84 (bs, 1Н), 8.63 (bs, 1H), 7.98 (s, 2H), 7.50-7.42 (m, 2H), 6.22 (bs, 1H), 3.68-3.57 (m, 1H), 3.42 (m, 2H), 3.19-3.05 (m, 2H), 2.43 (s, 3H), 2.23 (d, 2H), 1.91 (dd, 2H)
Пример 121
3-[3-(2-Хлорфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

Суспензию трет-бутил 4-{3-[3-(2-хлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (89 мг, 0.18 ммоль) в метаноле (0.9 мл) обработали 4Н HCl в диоксан (0.9 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (81 мг, 97% теоретический выход).
LC-MS (способ 1B): Rt=0.67 мин, m/z=397 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.76 (bs, 1H), 8.63 (bs, 1H), 8.51 (bs, 1H), 8.20 (bs, 1H), 7.70 (d, 1H), 7.65-7.56 (m, 2H), 6.25 (bs, 1H), 3.70-3.57 (m, 1H), 3.42 (d, 2H), 3.13 (dd, 2H), 2.23 (d, 2H), 1.90 (dd, 2H)
Пример 122
3-[3-(3-Фтор-4-метоксифенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
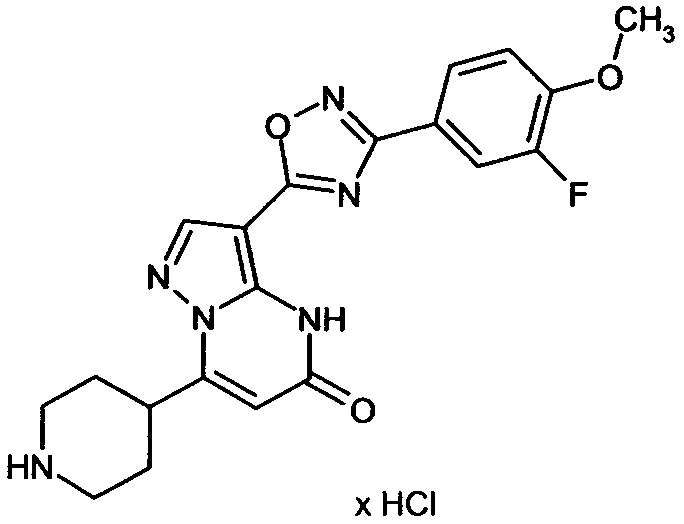
Суспензию трет-бутил 4-{3-[3-(3-фтор-4-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил} пиперидин-1-карбоксилата (69 мг, 0.14 ммоль) в метаноле (0.7 мл) обработали 4Н HCl в диоксан (0.7 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (65 мг, количественный выход).
LC-MS (способ 1B): Rt=0.67 мин, m/z=411 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.79 (bs, 1H), 8.61 (s, 1H), 8.09 (bs, 1H), 8.00 (d, 1H), 7.37 (dd, 1H), 6.19 (bs, 1H), 3.94 (s, 3H), 3.67-3.56 (m, 1H), 3.42 (d, 2H), 3.12 (dd, 2H), 2.23 (d, 2H), 1.90 (dd, 2H)
Пример 123
3-[3-(3-Хлор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
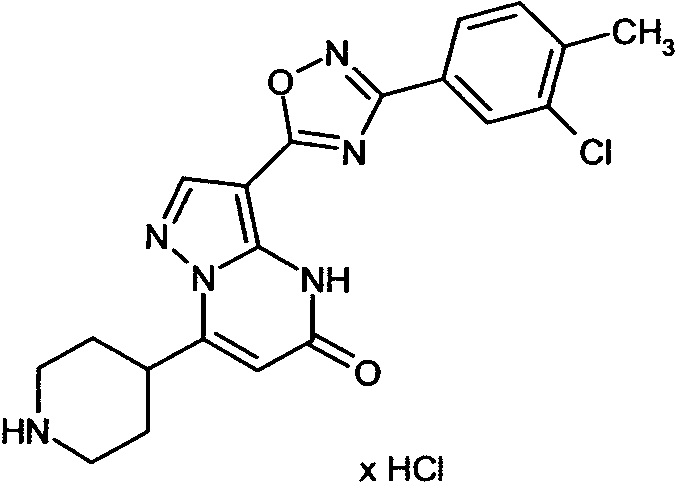
Суспензию трет-бутил 4-{3-[3-(3-хлор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (70 мг, 0.14 ммоль) в метаноле (0.7 мл) обработали 4Н HCl в диоксан (0.7 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (61 мг, 98% теоретический выход).
LC-MS (способ 1B): Rt=0.75 мин, m/z=411 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.86 (bs, 1H), 8.63 (s, 1H), 8.23 (s, 1H), 8.04 (d, 1H), 7.59 (d, 1H), 6.22 (bs, 1H), 3.66-3.58 (m, 1H), 3.42 (d, 2H), 3.12 (dd, 2H), 2.22 (d, 2H), 1.91 (dd, 2H)
Пример 124
7-(Пиперидин-4-ил)-3-{3-[3-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
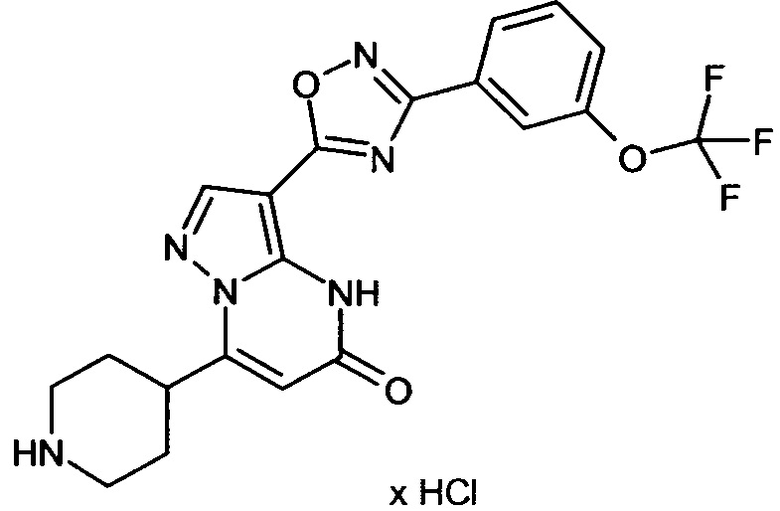
Суспензию трет-бутил 4-(5-оксо-3-{3-[3-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (53 мг, 0.10 ммоль) в метаноле (0.5 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (45 мг, 96% теоретический выход).
LC-MS (способ 1B): Rt=0.75 мин, m/z=447 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.65 (bs, 1H), 8.43 (bs, 1H), 8.22 (bs, 1H), 7.76 (dd, 1H), 7.65 (d, 1H), 6.18 (bs, 1H), 3.67-3.57 (m, 1H), 3.43 (d, 2H), 3.13 (dd, 2H), 2.23 (d, 2H), 1.89 (dd, 2H)
Пример 125
3-[3-(3-Метоксифенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
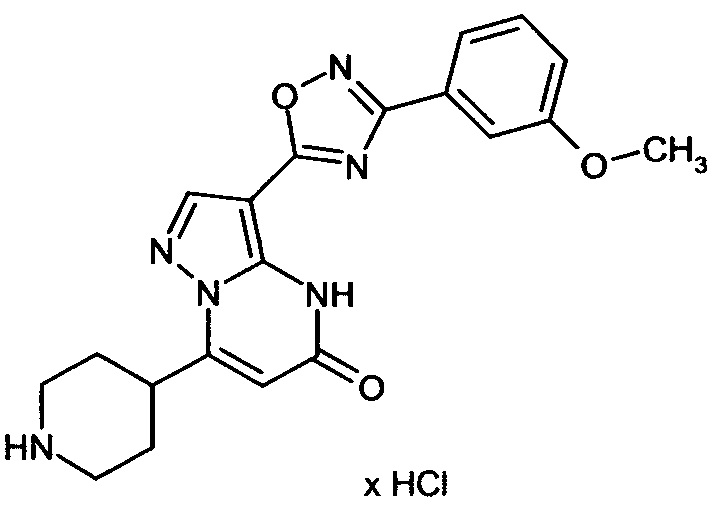
Суспензию трет-бутил 4-{3-[3-(3-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (60 мг, 0.12 ммоль) в метаноле (0.6 мл) обработали 4Н HCl в диоксан (0.6 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (43 мг, 83% теоретический выход).
LC-MS (способ 1B): Rt=0-65 мин, m/z=393 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.82 (bs, 1H), 8.63 (bs, 2Н), 7.78 (d, 1H), 7.70 (s, 1H), 7.51 (dd, 1Н), 7.20 (dd, 1H), 6.21 (bs 1H), 3.87 (s, 3Н), 3.66-3.57 (m, 1H), 3.42 (d, 2Н), 3.12 (dd, 2Н), 2.23 (d, 2Н), 1.90 (dd, 2Н)
Пример 126
3-[3-(4-Фторфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
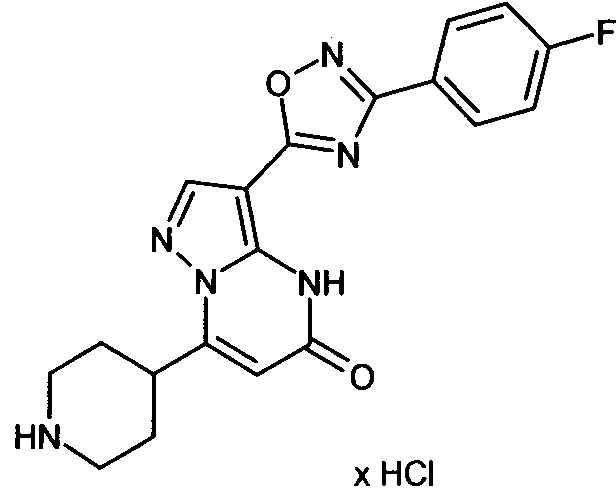
Суспензию трет-бутил 4-{3-[3-(4-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (27 мг, 0.06 ммоль) в метаноле (0.3 мл) обработали 4Н HCl в диоксан (0.3 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (20 мг, 87% теоретический выход).
LC-MS (способ 1B): Rt=0.65 мин, m/z=381 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.78 (bs, 1Н), 8.54 (bs, 1H), 7.35 (dd, 3H), 7.29-7.24 (m, 1H), 6.24 (bs, 1H), 3.66-3.58 (m, 1H), 3.40 (d, 2H), 3.11 (dd, 2H), 2.20 (d, 2H), 1.88 (dd, 2H)
Пример 127
3-[3-(2,4-Диметилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
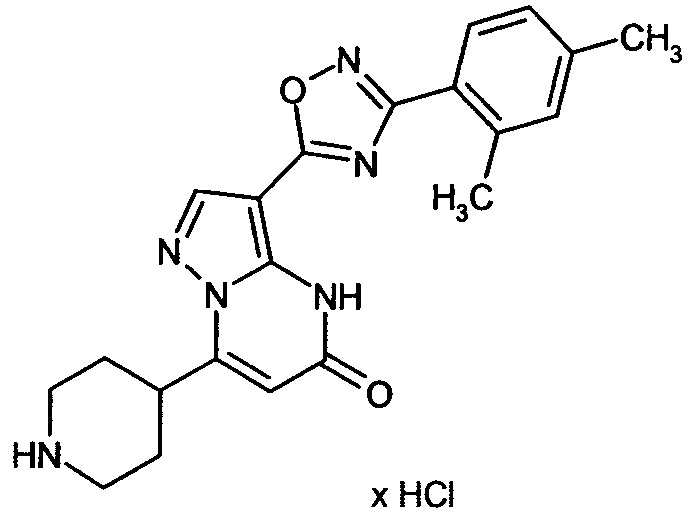
Суспензию трет-бутил 4-{3-[3-(2,4-диметилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (39 мг, 0.08 ммоль) в метаноле (0.4 мл) обработали 4Н HCl в диоксан (0.4 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (32 мг, 94% теоретический выход).
LC-MS (Способ 2В): Rt=0.72 мин, m/z=391 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.60 (bs, 1H), 8.41 (bs, 1H), 8.13 (bs, 1H), 7.23 (d, 2H), 3.68-3.55 (m, 1H), 3.43 (d, 2H), 3.13 (dd, 2H), 2.58 (s, 3H), 2.37 (s, 3H), 2.23 (d, 2H), 1.88 (dd, 2H)
Пример 128
3-{3-[4-Метил-2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
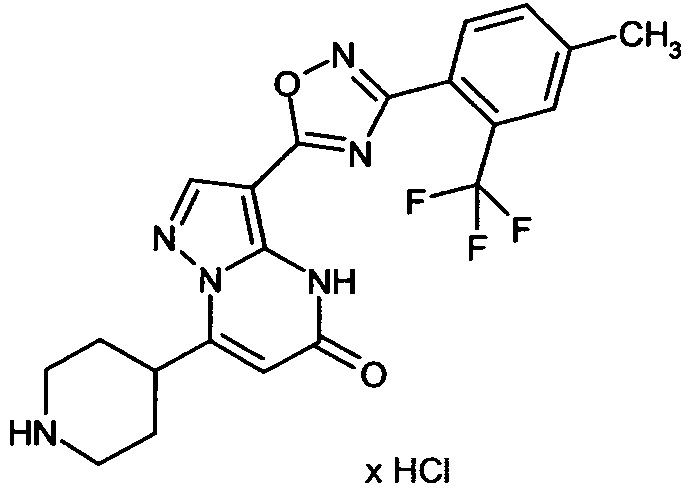
Суспензию трет-бутил 4-(3-{3-[4-метил-2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (47 мг, 0.09 ммоль) в метаноле (0.4 мл) обработали 4Н HCl в диоксан (0.4 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (37 мг, 89% теоретический выход).
LC-MS (способ 1B): Rt=0.73 мин, m/z=445 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.82 (bs, 1H), 8.61 (bs, 1H), 7.91 (bs, 1H), 7.82 (s, 1H), 7.70 (d, 1H), 6.26 (bs, 1H), 3.68-3.59 (m, 1H), 3.43 (d, 2H), 3.13 (dd, 2H), 2.24 (d, 2H), 1.90 (dd, 2H)
Пример 129
3-[3-(3,4-Диметилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
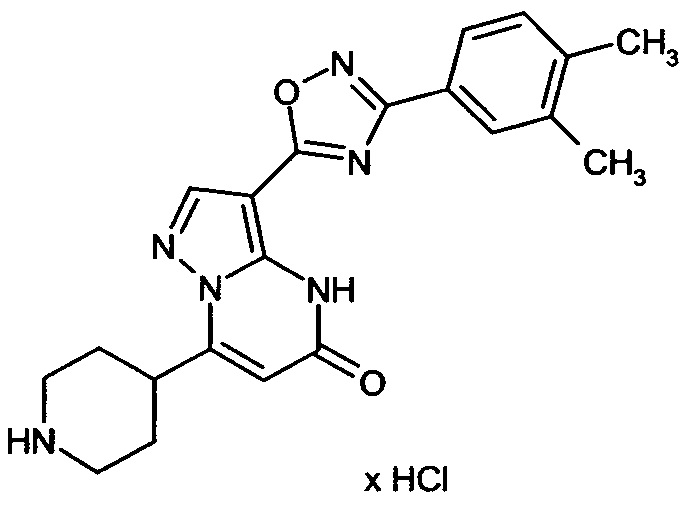
Суспензию трет-бутил 4-{3-[3-(3,4-диметилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (22 мг, 0.05 ммоль) в метаноле (0.2 мл) обработали 4Н HCl в диоксан (0.2 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (18 мг, 97% теоретический выход).
LC-MS (способ 2В): Rt=0.72 мин, m/z=391 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.79 (bs, 1H), 8.62 (bs, 1H), 8.55 (bs, 1H), 7.93 (s, 2H), 7.35 (dd, 1H), 6.20 (bs, 1H), 3.66-3.58 (m, 1H), 3.42 (d, 2H), 3.13 (dd, 2H), 2.34 (s, 3H), 2.32 (s, 3H), 2.24 (d, 2H), 1.90 (m, 2H)
Пример 130
3-[3-(2-Хлор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
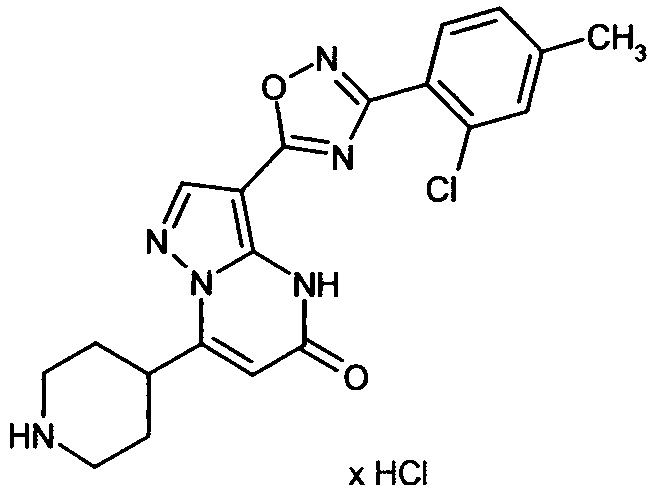
Суспензию трет-бутил 4-{3-[3-(2-хлор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (110 мг, 0.21 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (2.1 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (92 мг, 95% теоретический выход).
LC-MS (способ 2В): Rt=0.71 мин, m/z=411 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.75 (bs, 1H), 8.62 (bs, 1H), 8.49 (bs, 1H), 8.12 (bs, 1H), 7.54 (s, 1H), 7.39 (d, 1H), 6.25 (bs, 1H), 3.68-3.55 (m, 1H), 3.43 (d, 2H), 3.13 (d, 2H), 2.41 (s, 3H), 2.23 (d, 2H), 1.90 (dd, 2H)
Пример 131
3-[3-(2-Фтор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
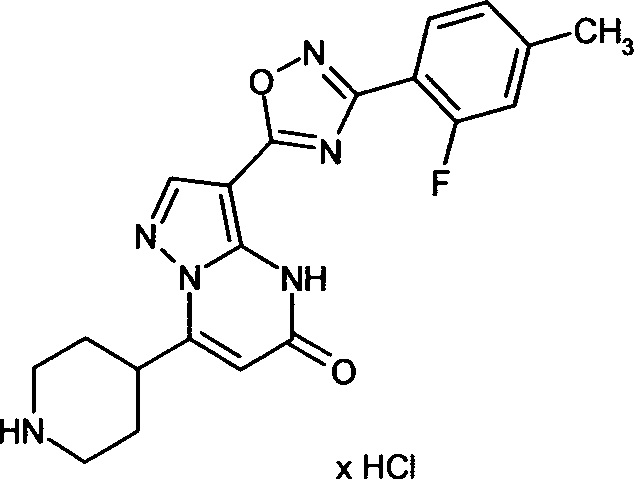
Суспензию трет-бутил 4-{3-[3-(2-фтор-4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (102 мг, 0.21 ммоль) в метаноле (1.0 мл) обработали 4Н HCl в диоксан (2.1 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (86 мг, 97% теоретический выход).
LC-MS (способ 1B): Rt=0.67 мин, m/z=395 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.82 (bs, 1H), 8.62 (bs, 1Н), 8.25 (bs, 1Н), 7.28 (dd, 2Н), 6.22 (bs, 1H), 3.68-3.58 (m, 1H), 3.42 (d, 2Н), 3.13 (dd, 2Н), 2.43 (s, 3Н), 2.23 (d, 2Н), 1.90 (dd, 2Н)
Пример 132
3-[3-(3-Хлор-2-фторфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
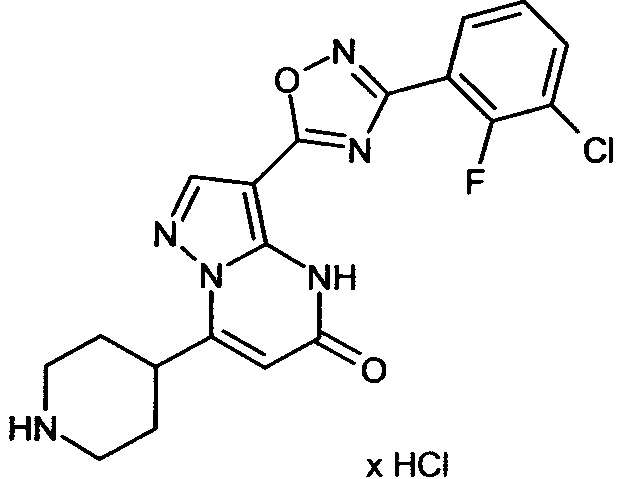
Суспензию трет-бутил 4-{3-[3-(3-хлор-2-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (82 мг, 0.16 ммоль) в метаноле (0.8 мл) обработали 4Н HCl в диоксан (0.8 мл). Реакционную смесь перемешивали 30 минут при комнатной температуре. Смесь разбавили в 2 мл диоксана, и твердое вещество отфильтровали, промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (66 мг, 92% теоретический выход).
LC-MS (способ 1B): Rt=0.72 мин, m/z=398 (М+Н-HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.64 (s, 1Н), 8.36 (bs, 1H), 7.87 (dd, 1H), 7.49 (dd, 1H), 6.23 (bs, 1H), 3.66-3.56 (m, 1H), 3.42 (d, 2H), 3.13 (dd, 2H), 2.23 (d, 2H), 1.90 (dd, 2H)
Пример 133
3-[3-(6-Хлорпиридин-2-ил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
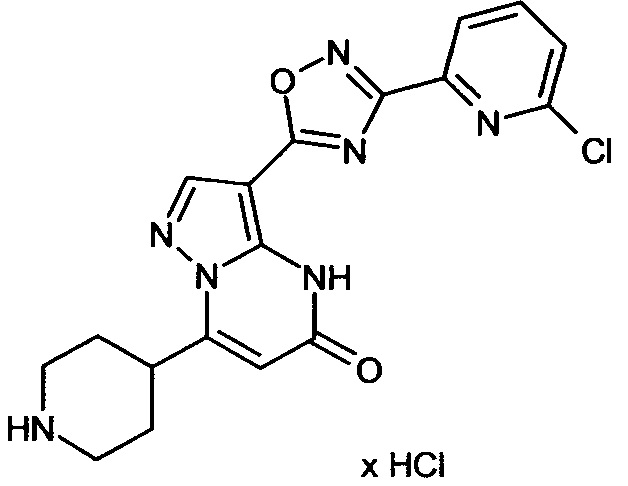
Суспензию трет-бутил 4-{3-[3-(6-хлорпиридин-2-ил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (29 мг, 0.06 ммоль) в диоксан (0.28 мл) обработали 4Н HCl в диоксан (0.14 мл). Реакционную смесь перемешивали 7 ч при комнатной температуре. Смесь отфильтровали, и твердое вещество отфильтровали, промыли диоксаном с получением соединения, указанного в названии (23 мг, 86% теоретический выход).
LC-MS (способ 1B): Rt=0.59 мин, m/z=398 (М+Н-2.HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.46 (s, 1Н), 8.25 (d, 1H), 8.06 (dd, 1H), 7.71 (d, 1H), 6.16 (s, 1H), 3.75.3.67 (m, 1H), 3.58 (d, 2H), 3.25 (dd, 2H), 2.43 (d, 2H), 2.01 (dd, 2H)
Пример 134
3-{3-[3-Фтор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
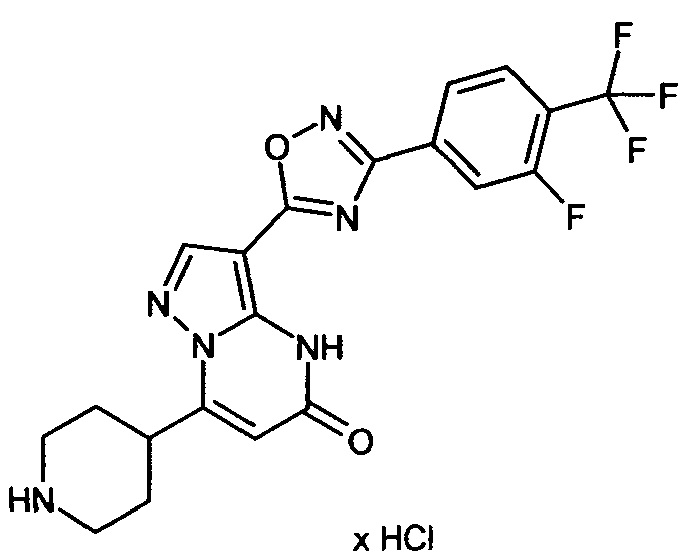
Суспензию трет-бутил 4-(3-{3-[3-фтор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (26 мг, 0.05 ммоль) в диоксан (0.4 мл) обработали 4Н HCl в диоксан (0.1 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (14 мг, 56% теоретический выход).
LC-MS (способ 1B): Rt=0.79 мин, m/z=449 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.50 (s, 1Н), 8.21 (d, 2H), 7.93 (dd, 1H), 6.21 (s, 1H), 3.73 (dd, 1H), 3.60 (d, 2H), 3.27 (dd, 2H), 2.45 (d, 2H), 2.04 (dd, 2H)
Пример 135
3-{3-[2-Фтор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
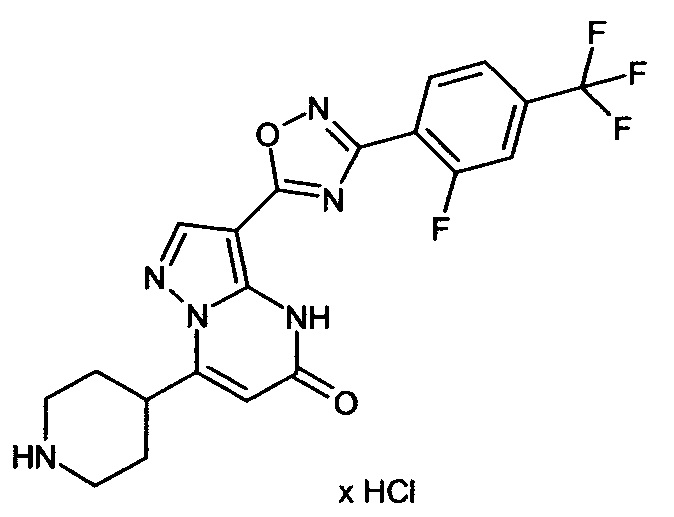
Суспензию трет-бутил 4-(3-{3-[2-фтор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (22 мг, 0.04 ммоль) в диоксан (0.4 мл) обработали 4Н HCl в диоксан (0.1 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (10 мг, 44% теоретический выход).
LC-MS (способ 1B): Rt=0.76 мин, m/z=448 (М+Н-2.HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.54-8.48 (m, 2Н), 7.75 (d, 2Н), 6.21 (s, 1Н), 3.73 (dd, 1H), 3.60 (d, 2H), 3.27 (dd, 2H), 2.44 (d, 2H), 2.03 (dd, 2H)
Пример 136
3-{3-[2-Хлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
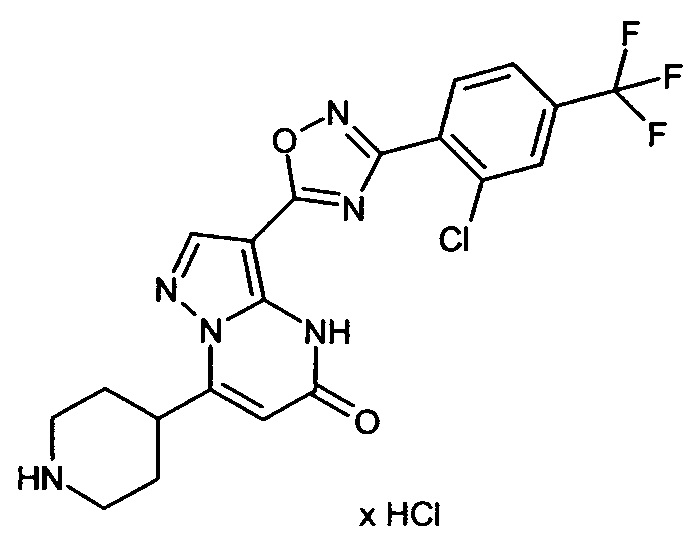
Суспензию трет-бутил 4-(3-{3-[2-хлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (56 мг, 0.10 ммоль) в диоксан (0.9 мл) обработали 4Н HCl в диоксан (0.25 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (36 мг, 71% теоретический выход).
LC-MS (способ 1B): Rt=0.79 мин, m/z=465 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.51 (s, 1Н), 8.34 (d, 1H), 8.00 (s, 1H), 7.86 (d, 1H), 6.21 (s, 1H), 3.73 (dd, 1H), 3.60 (d, 2H), 3.27 (dd, 2H), 2.44 (d, 2H), 2.04 (dd, 2H)
Пример 137
3-[3-(5-Хлор-2-фторфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
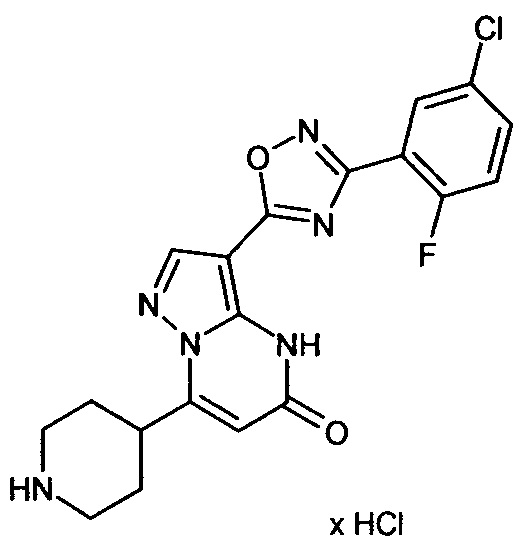
Суспензию соединения трет-бутил 4-{3-[3-(5-хлор-2-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (19 мг, 0.04 ммоль) в диоксан (0.3 мл) обработали 4Н HCl в диоксан (0.09 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (5 мг, 30% теоретический выход).
LC-MS (способ 1B): Rt=0.76 мин, m/z=415 (M+H-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 7.18 (s, 1H), 6.80 (s, 1H), 6.63 (s, 1H), 6.17 (s, 1H), 4.90 (s, 1H), 2.43 (dd, 1H), 2.29 (d, 2H), 1.96 (dd, 2H), 1.14 (d, 2H), 0.73 (dd, 2H)
Пример 138
3-[3-(3-Хлор-5-фторфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
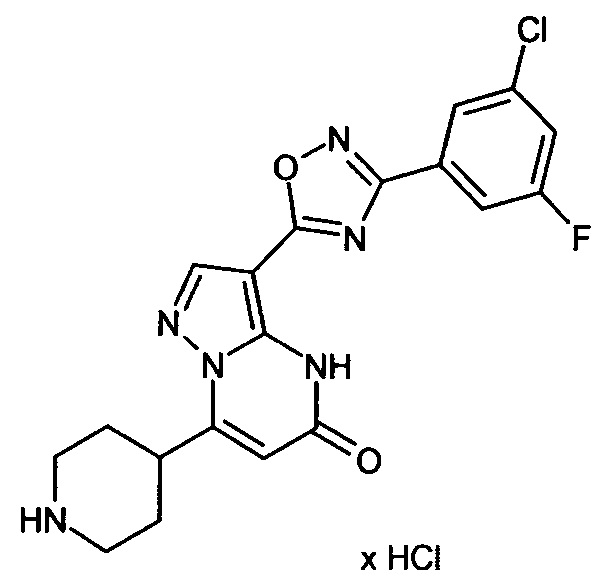
Суспензию соединения трет-бутил 4-{3-[3-(3-хлор-5-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (24 мг, 0.05 ммоль) в диоксан (0.4 мл) обработали 4Н HCl в диоксан (0.1 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (15 мг, 66% теоретический выход).
LC-MS (способ 2В): Rt=0.70 мин, m/z=415 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.50 (s, 1H), 8.41-8.32 (m, 1H), 7.68-7.59 (m, 1H), 7.38 (dd, 1H), 6.21 (s, 1H), 3.73 (dd, 1H), 3.60 (d, 2H), 3.27 (dd, 2H), 2.44 (d, 2H), 2.05 (dd, 2H)
Пример 139
3-{3-[2-Метил-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4- ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
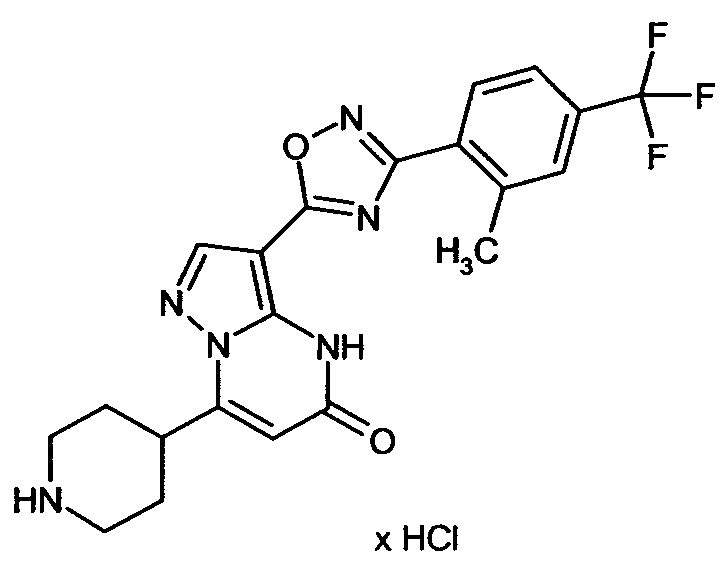
Суспензию трет-бутил 4-(3-{3-[2-метил-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (53 мг, 0.10 ммоль) в диоксан (0.9 мл) обработали 4Н HCl в диоксан (0.2 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч. Очистка посредством препаративной ВЭЖХ обеспечила соединение, указанное в названии (10 мг, 21% теоретический выход).
LC-MS (способ 1B): Rt=0.76 мин, m/z=445 (М+Н-2. HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.47 (s, 1H), 8.34 (d, 1H), 8.14 (s, 1H), 7.73-7.66 (m, 1H), 7.68 (d, 1H), 6.17 (s, 1H), 3.71 (dd, 1H), 3.57 (d, 2H), 3.25 (dd, 2H), 2.74 (s, 3H), 2.42 (d, 2H), 2.01 (dd, 2H)
Пример 140
3-[3-(3-Хлор-2-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиримидин-4-ил)пиразоло[1,5-a]пиперидин-5(4H)-он гидрохлорид
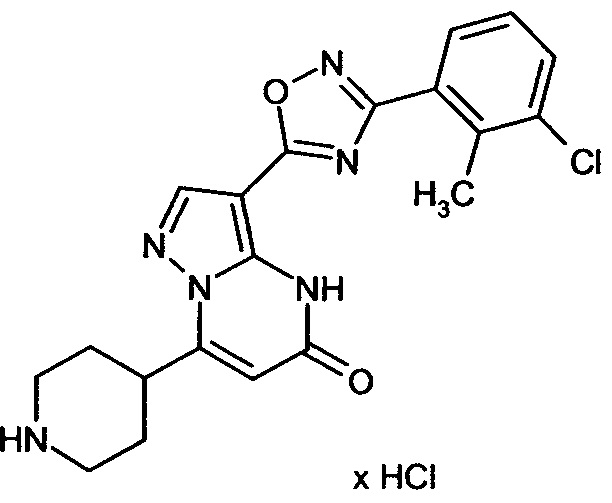
Суспензию трет-бутил 4-{3-[3-(3-хлор-2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (101 мг, 0.20 ммоль) в диоксан (1.8 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. После этого 4Н HCl в диоксан (0.5 мл) добавили снова, и смесь перемешивали при комнатной температуре в течение 5 ч. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (66 мг, 73% теоретический выход).
LC-MS (способ 1B): Rt=0.72 мин, m/z=411 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.46 (s, 1H), 7.93(d, 1H), 7.60 (d, 1H), 7.36 (dd, 1H), 6.17 (s, 1H), 3.71 (dd, 1H), 3.58 (d, 2H), 3.25 (dd, 2H), 2.42 (d, 2H), 2.02 (dd, 2H)
Пример 141
3-[3-(5-Хлор-2-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
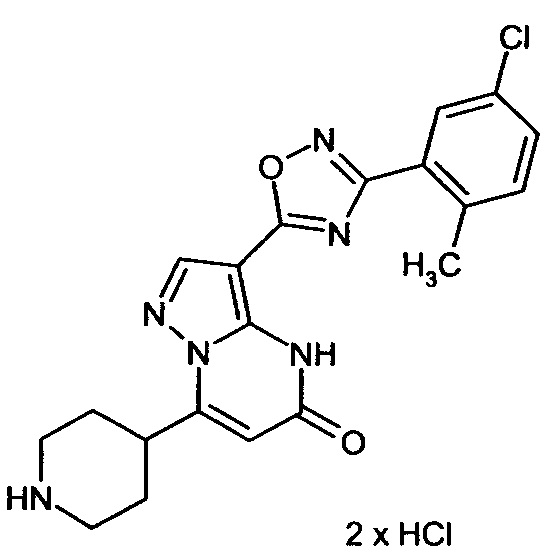
Суспензию трет-бутил 4-{3-[3-(5-хлор-2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (45 мг, 0.09 ммоль) в диоксан (0.8 мл) обработали 4Н HCl в диоксан (0.2 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (49 мг, количественный выход).
LC-MS (способ 1B): Rt=0.73 мин, m/z=411 (М+Н-2.HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.46 (s, 1H), 8.20 (d, 1H), 7.45 (d, 1H), 7.39 (d, 1H), 6.17 (s, 1H), 3.71 (dd, 1H), 3.58 (d, 2H), 3.25 (dd, 2H), 2.64 (s, 3H), 2.42 (d, 2H), 2.01 (dd, 2H)
Пример 142
3-[3-(3-Хлор-4-метоксифенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
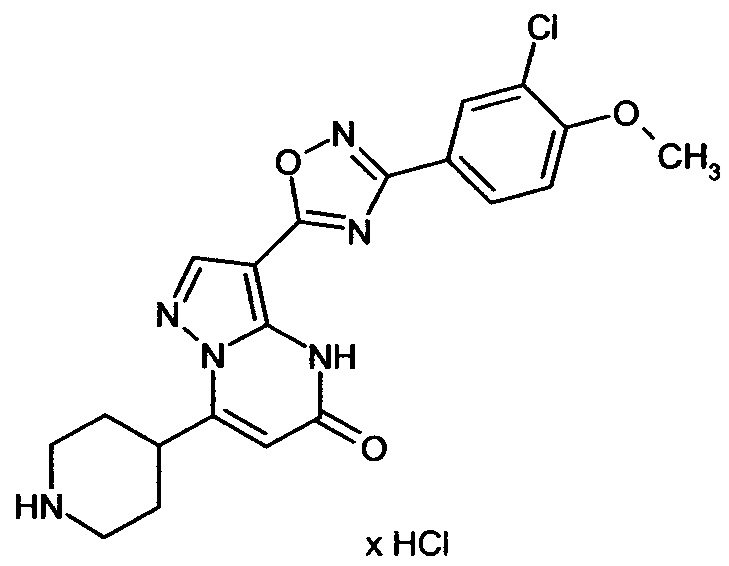
Суспензию трет-бутил 4-{3-[3-(3-хлор-4-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (34 мг, 0.07 ммоль) в диоксан (0.30 мл) обработали 4Н HCl в диоксан (0.16 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (25 мг, 84% теоретический выход).
LC-MS (способ 1B): Rt=0.72 мин, m/z=427 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): 8.35 (s, 1H), 8.10 (s, 1H), 8.01 (d, 1H), 7.15 (d, 1H), 6.07 (s, 1H), 3.89 (s, 3H), 3.61 (dd, 1H), 3.48 (d, 2H), 3.15 (dd, 2H), 2.33 (d, 2H), 1.91 (dd, 2H)
Пример 143
3-[3-(2,3-Дихлорфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
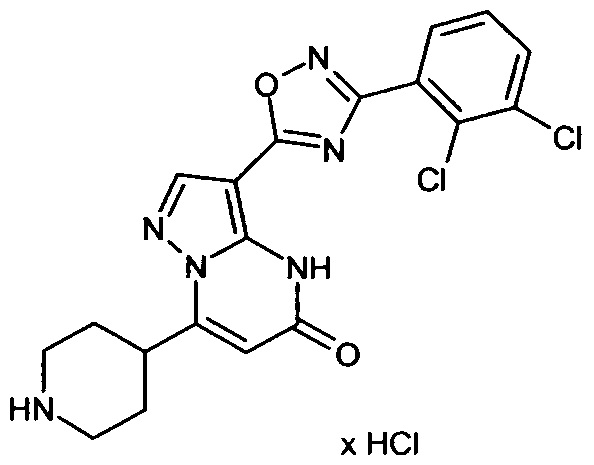
Суспензию трет-бутил 4-{3-[3-(2,3-дихлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (63 мг, 0.12 ммоль) в диоксан (0.6 мл) обработали 4Н HCl в диоксан (0.3 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном с получением соединения, указанного в названии (55 мг, 99% теоретический выход).
LC-MS (способ 1B): Rt=0.75 мин, m/z=431 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.38 (s, 1Н), 7.86 (d, 1H), 7.69 (d, 1H), 7.40 8dd, 1H), 6.08 (s, 1H), 3.61 (dd, 1H), 3.47 (d, 2H), 3.15 (dd, 2H), 2.32 (d, 2H), 1.91 (dd, 2H)
Пример 144
3-[3-(3-Хлор-4-фторфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
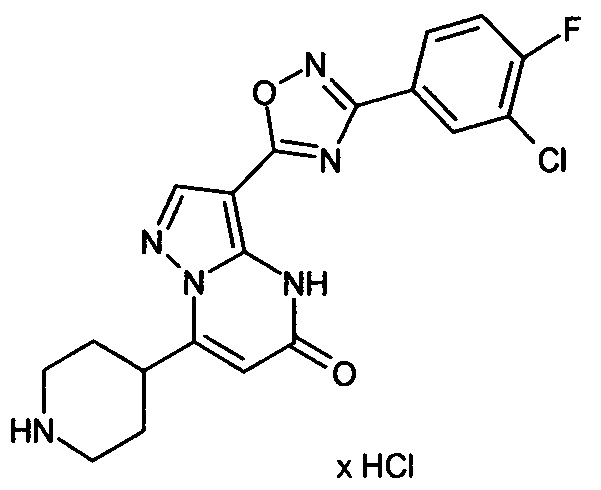
Суспензию трет-бутил 4-{3-[3-(3-хлор-4-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (68 мг, 0.13 ммоль) в диоксан (1.2 мл) обработали 4Н HCl в диоксан (0.3 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. После этого 4Н HCl в диоксан (0.3 мл) добавили снова, и смесь далее перемешивали 5 ч. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (60 мг, 60% теоретический выход).
LC-MS (способ 1B): Rt=0.71 мин, m/z=414 (M+H-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.46 (s, 1H), 8.36 (d, 2H), 8.18-8.15 (m, 1H), 7.45 (dd, 1H), 6.17 (s, 1H), 3.71 (dd, 1H), 3.57 (d, 2H), 3.25 (dd, 2H), 3.42 (d, 2H), 2.01 (dd, 2H)
Пример 145
3-{3-[5-Хлор-2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
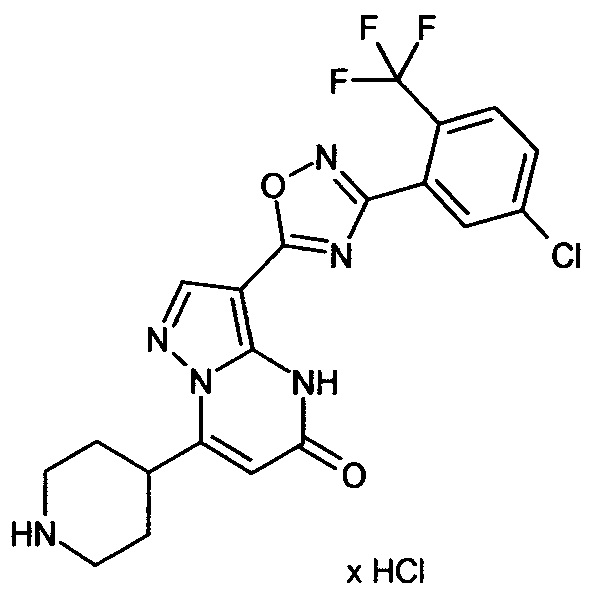
Суспензию трет-бутил 4-(3-{3-[5-хлор-2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (54 мг, 0.10 ммоль) в диоксан (0.8 мл) обработали 4Н HCl в диоксан (0.2 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. После этого 4Н HCl в диоксан (0.2 мл) добавили снова, и смесь далее перемешивали 3 ч. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (34 мг, 71% теоретический выход).
LC-MS (способ 1B): Rt=0.77 мин, m/z=465 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.47 (s, 1H), 8.00 (d, 2Н), 7.88 (dd, 1H), 6.19 (s, 1H), 3.72 (dd, 1H), 3.60 (d, 2H), 3.26 (dd, 2H), 2.43 (d, 2H), 2.04 (dd, 2H)
Пример 146
7-(Пиперидин-4-ил)-3-{3-[6-(трифторметил)пиридин-2-ил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
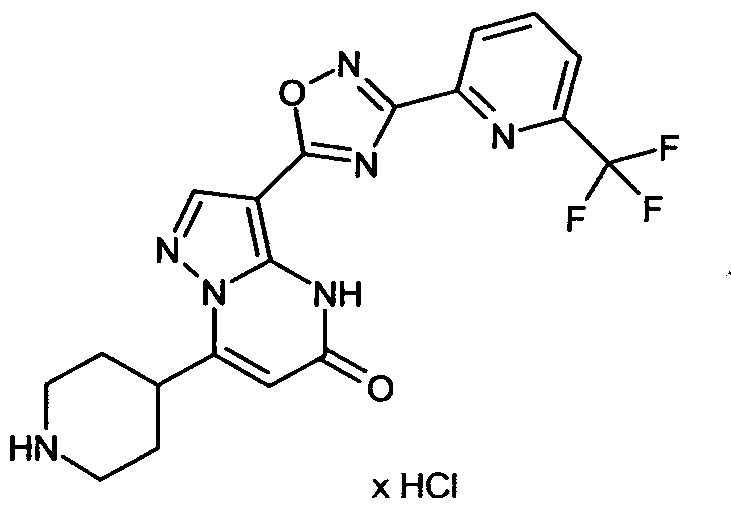
Суспензию трет-бутил 4-(5-оксо-3-{3-[6-(трифторметил)пиридин-2-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-a]пиримидин-7-ил)пиперидин-1-карбоксилата (106 мг, 0.2 ммоль) в диоксан (1.8 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. После этого 4Н HCl в диоксан (0.5 мл) добавили снова, и смесь обработали ультразвуком 1 ч при 45°C. Суспензию отфильтровали, и полученное твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (90 мг, 93% теоретический выход).
LC-MS (способ 1B): Rt=0.61 мин, m/z=432 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.54 (d, 1Н), 8.49 (s, 1H), 8.30 (dd, 1H), 8.06 (d, 1H), 6.17 (s, 1H), 3.71 (dd, 1H), 3.58 (d, 2H), 3.25 (dd, 2H), 2.42 (d, 2H), 2.001 (dd, 2H)
Пример 147
7-(пиперидин-4-ил)-3-{3-[4-(трифторметил)пиридин-2-ил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
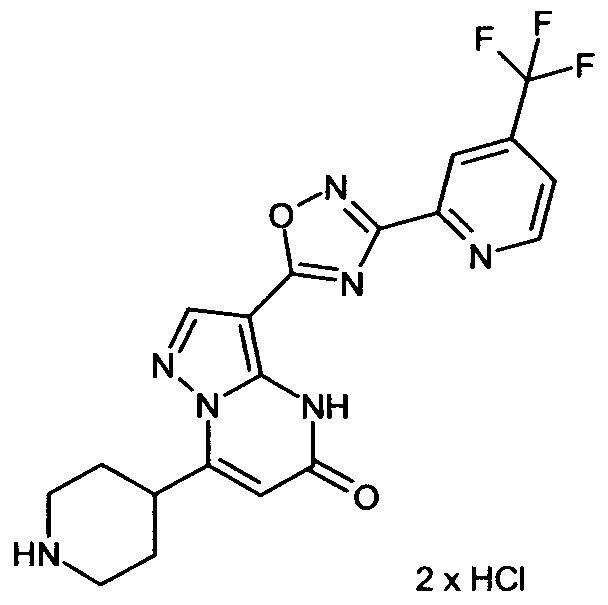
Суспензию трет-бутил 4-(5-оксо-3-{3-[4-(трифторметил)пиридин-2-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (104 мг, 0.2 ммоль) в диоксан (1.8 мл) обработали 4Н HCl в диоксан (0.5 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь После этого 4Н HCl в диоксан (0.5 мл) добавили снова, и смесь перемешивали 1 ч. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (107 мг, количественный выход).
LC-MS (способ 1B): Rt=0.66 мин, m/z=432 (М+Н-2.HCl)+
1H-ЯМР (400 МГц, MeOD): δ 9.05 (d, 1H), 8.59 (s, 1H), 8.50 (s, 1H), 7.97 (d, 1H), 6.19 (s, 1H), 3.73 (dd, 1H), 3.60 (d, 2H), 3.27 (dd, 2H), 2.44 (s, 2H), 2.04 (dd, 2H)
Пример 148
3-[3-(2-Хлорпиридин-3-ил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
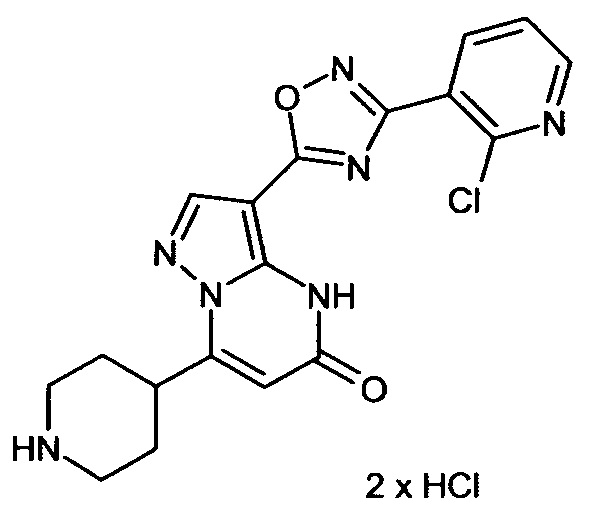
Суспензию трет-бутил 4-{3-[3-(2-хлорпиридин-3-ил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (37 мг, 0.1 ммоль) в диоксан (0.6 мл) обработали 4Н HCl в диоксан (0.2 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (33 мг, количественный выход).
LC-MS (способ 1B): Rt=0.53 мин, m/z=398 (М+Н-2. HCl)+
1Н-ЯМР (400 МГц, DMSO-d6): δ 8.94 (bs, 1H), 8.75 (bs, 1H), 8.65 (dd, 1H), 7.70 (dd, 1H), 6.24 (bs, 1H), 3.62 (dd, 1H), 3.12 (dd, 2H), 2.23 (d, 2H), 1.93 (dd, 2H)
Пример 149
3-{3-[3-Хлор-4-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
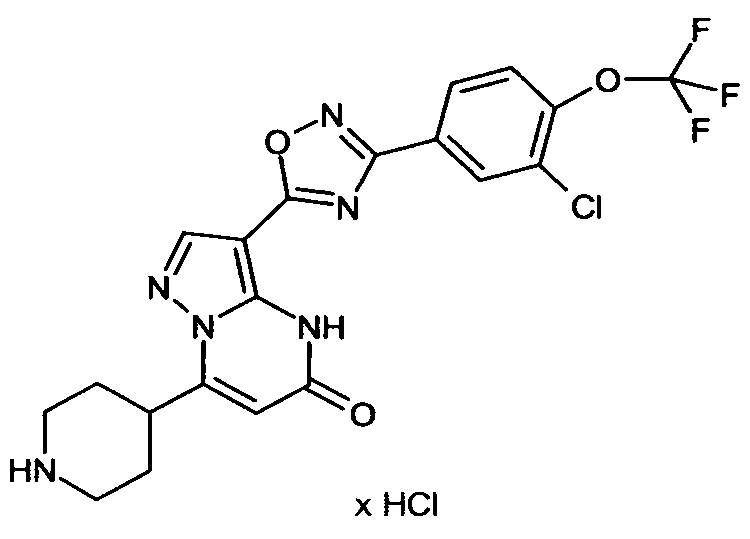
Суспензию трет-бутил 4-(3-{3-[3-хлор-4-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (56 мг, 0.1 ммоль) в диоксан (0.8 мл) обработали 4Н HCl в диоксан (0.2 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (14 мг, 27% теоретический выход).
LC-MS (Способ 1B): Rt=0.84 мин, m/z=481 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.45 (s, 1H), 8.43 (d, 1Н), 8.22 (dd, 1H), 7.63 (dd, 1H), 6.18 (s, 1H), 3.71 (dd, 1H), 3.58 (d, 2H), 3.25 (dd, 2H), 2.42 (d, 2H), 2.02 (dd, 2H)
Пример 150
3-{3-[2,6-Дихлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
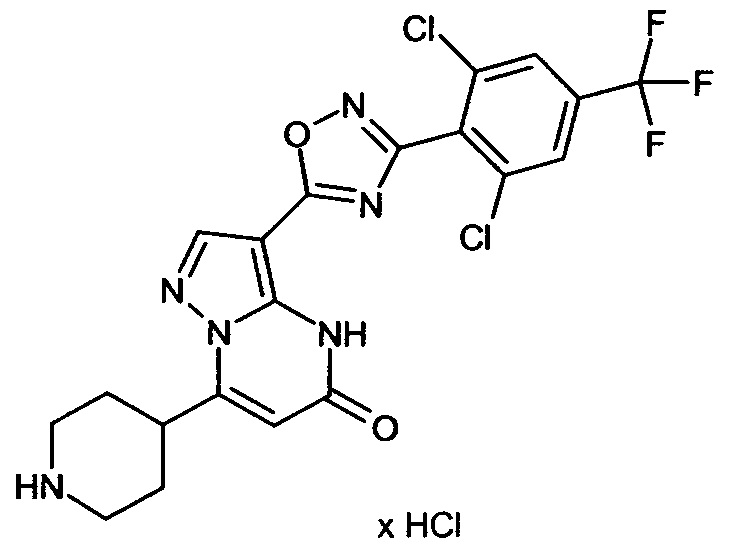
Суспензию трет-бутил 4-(3-{3-[2,6-дихлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (10 мг, 0.02 ммоль) в диоксан (0.1 мл) обработали 4Н HCl в диоксан (0.04 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь. Суспензию отфильтровали, и полученное твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (6 мг, 66% теоретический выход).
LC-MS (способ 1B): Rt=0.77 мин, m/z=499 (M+H-HCl)+
Пример 151
3-[3-(3,5-Дихлорфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
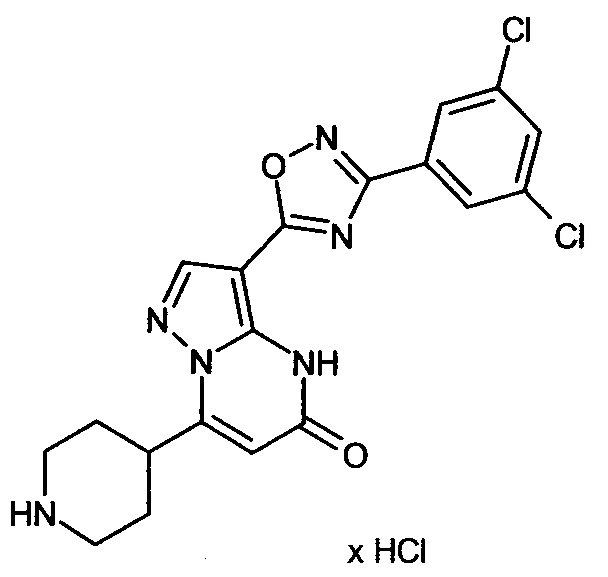
Суспензию трет-бутил 4-{3-[3-(3,5-дихлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (16 мг, 0.03 ммоль) в диоксан (0.3 мл) обработали 4Н HCl в диоксан (0.08 мл). Реакционную смесь перемешивали при комнатной температуре всю ночь, затем обработали ультразвуком 1 ч и наконец дополнительно перемешивали при комнатной температуре в течение 16 ч. Суспензию отфильтровали, и полученное твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (13 мг, 88% теоретический выход).
LC-MS (способ 1B): Rt=0.81 мин, m/z=431 (М+Н-HCl)+
1Н-ЯМР (400 МГц, MeOD): δ 8.41 (s, 1Н), 8.26 (s, 3Н), 8.22 (dd, 1H), 7.85 (s, 1H), 7.54 (s, 1H), 6.24 (s, 1H), 3.69-3.54 (m, 3H), 3.34-3.22 (m, 2H), 2.47-2.37 (m, 2H), 2.06-1.92 (m, 2H)
Пример 152
3-{3-[2,4-бис(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4- ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
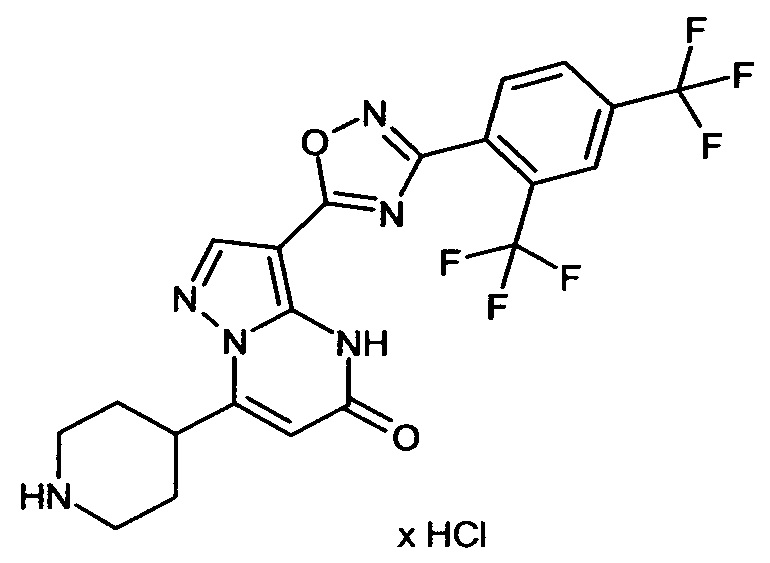
Суспензию трет-бутил 4-(3-{3-[2,4-бис(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата (21 мг, 0.04 ммоль) в диоксан (0.3 мл) обработали 4Н HCl в диоксан (0.09 мл), и реакционную смесь перемешивали при комнатной температуре всю ночь. После этого 0.09 мл 4Н HCl в диоксан добавили снова, и смесь перемешивали дополнительно 16 ч. Суспензию отфильтровали, и полученное твердое вещество промыли диоксаном и высушивали под вакуумом в течение 16 ч с получением соединения, указанного в названии (15 мг, 81% теоретический выход).
LC-MS (способ 1B): Rt=0.77 мин, m/z=499 (М+Н-HCl)+
1Н-ЯМР (400 МГц, D2O): δ 8.48 (s, 1Н), 8.33 (s, 3Н), 8.16 (d, 1H), 8.05 (d, 1H), 6.25 (s, 1H), 3.69-3.59 (m, 3H), 3.26 (dd, 2H), 2.40 (d, 2H), 1.99 (dd, 2H).
Пример 153
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
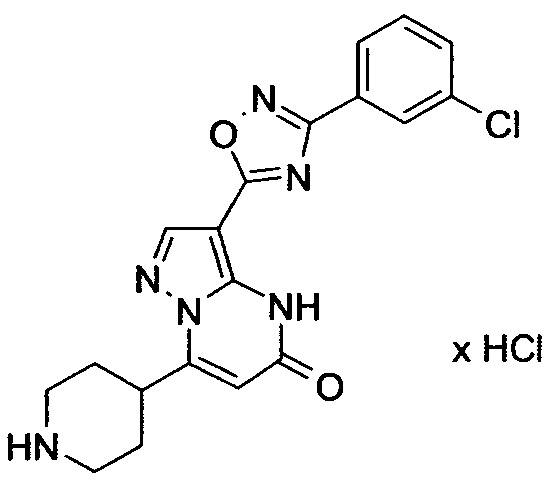
Трет-бутил 4-{3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (57.3 мг, 0.12 ммоль) растворили в диоксан (1 мл) и обработали соляной кислотой (4M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (40 мг, 74% теоретический выход).
LC-MS (Способ 5В): Rt=0.94 мин, MS (ESIPos): m/z=397 [М+Н-xHCl]+
1Н-ЯМР (500 МГц, D2O): d [ppm]=8.29 (s, 1H), 7.72 (m, 2Н), 7.45-7.33 (m, 2Н), 6.15 (s, 1H), 3.66 (d, 2H), 3.46 (t, 1H), 3.26 (t, 2H), 2.38 (d, 2H), 1.97 (dd, 2H)
Пример 154
3-[3-(4-метокси-2-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
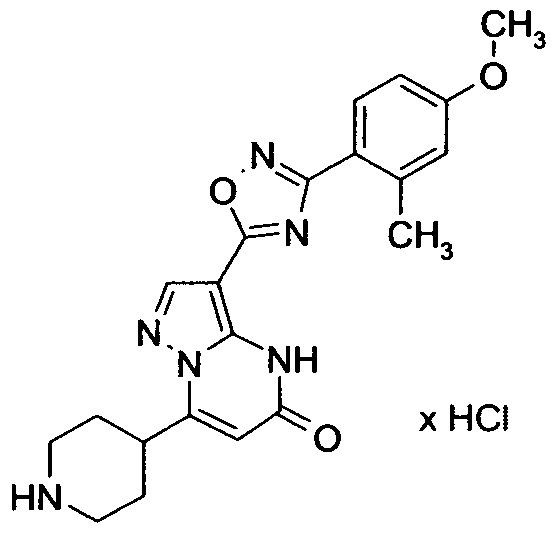
Трет-бутил 4-{3-[3-(4-метокси-2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (55.8 мг, 0.12 ммоль) растворили в диоксан (1 мл) и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (47 мг, 89% теоретический выход).
LC-MS (Способ 1B): Rt=0.72 мин, MS (ESIPos): m/z=407 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O): d [ppm]=8.27 (s, 1Н), 7.70 (d, 1H), 6.77-6.69 (m, 1H), 6.58 (s, 1H), 6.12 (s, 1H), 3.79 (s, 3H), 3.70-3.62 (m, 1H), 3.47-3.36 (m, 2H), 3.26 (dd, 2H), 2.39-2.31 (m, 2H), 2.28 (s, 3H), 1.96 (dd, 2H)
Пример 155
7-(пиперидин-4-ил)-3-{3-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
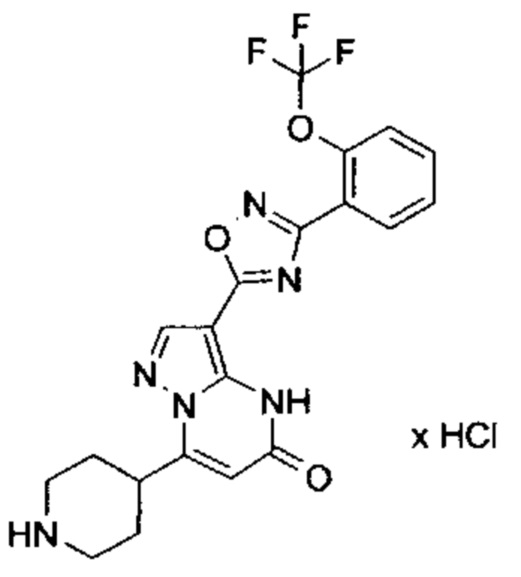
Трет-бутил 4-(5-оксо-3-{3-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (49.7 мг, 0.09 ммоль) растворили в диоксан (1 мл) и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (47 мг, 99% теоретический выход).
LC-MS (Способ 5B): Rt=0.94 мин, MS (ESIPos): m/z - 447 [M+H-xHCl]+
1H-ЯМР (500 МГц, D2O): d [ppm]=8.30 (s, 1H), 7.96 (d, 1H), 7.64-7.59 (m, 1H), 7.46 (br. s, 2H), 6.16 (s, 1H), 3.48 (t, 1H), 3.25 (t, 2H), 3.65 (d, 2H), 3.65 (d, 2H), 2.01-1.92 (m, 2H)
Пример 156
3-[3-(4-метоксифенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
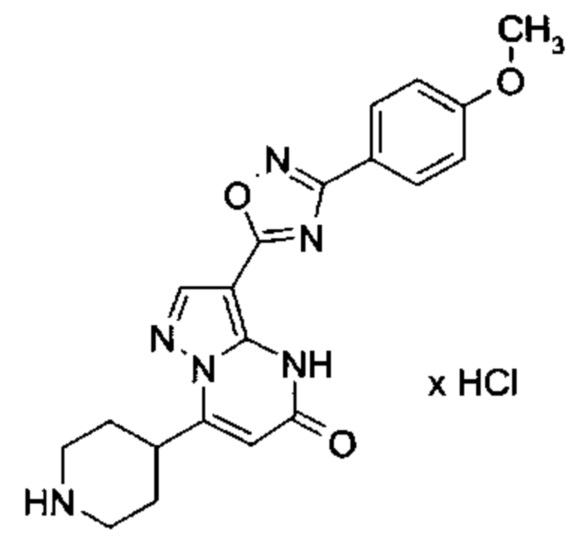
Трет-бутил 4-{3-[3-(4-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (37.4 мг, 0.08 ммоль)растворили в диоксан (1 мл) и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (35 мг, 98% теоретический выход).
LC-MS (Способ 5В): Rt=0.86 мин, MS (ESIPos): m/z=393 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O): d [ppm]=8.18 (s, 1H), 7.49 (d, 2H), 6.72 (d, 2H), 6.05 (s, 1H), 3.79-3.73 (m, 3H), 3.66 (d, 2H), 3.36 (t, 1H), 3.25 (t, 2H), 2.33 (d, 2H), 1.93 (q, 2H)
Пример 157
3-[3-(4-хлорфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
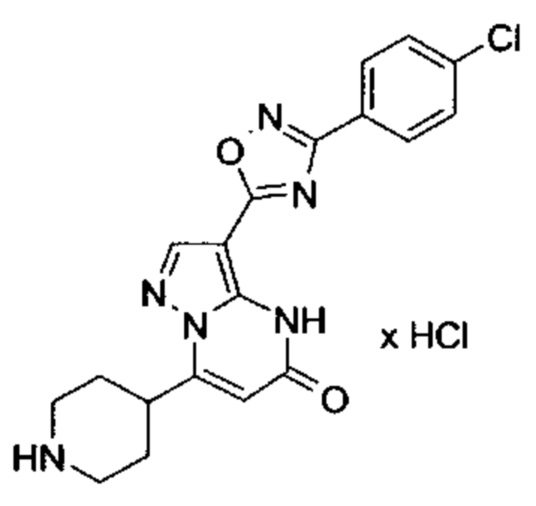
Трет-бутил 4-{3-[3-(4-хлорфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (49.0 мг, 0.10 ммоль) растворили в диоксан (1 мл) и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (19 мг, 37% теоретический выход).
LC-MS (Способ 1B): Rt=0.72 мин, MS (ESIPos): m/z=397 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6): d [ppm]=12.31 (br. s, 1H), 9.05-8.68 (m, 2H), 8.68-8.55 (m, 1H), 8.22 (d, 2H), 7.73-7.61 (m, 2H), 6.22 (br. s, 1H), 3.66-3.58 (m, 1H), 3.42 (d, 2H), 3.20-3.02 (m, 2H), 2.22 (d, 2H), 2.02-1.82 (m, 2H)
Пример 158
3-[3-(2,4-дифторфенил)-4,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
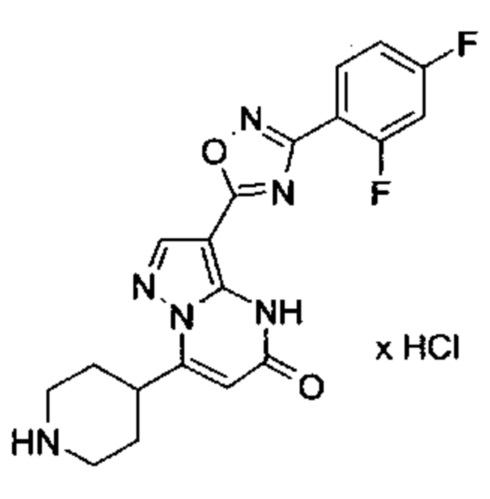
Трет-бутил 4-{3-[3-(2,4-дифторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (36.2 мг, 0.07 ммоль) растворили в диоксан (1 мл) и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (34 мг, 98% теоретический выход).
LC-MS (Способ 5В): Rt=0.85 мин, MS (ESIPos): m/z=399 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O): d [ppm]=8.36 (br. s, 1H), 7.98 (d, 1H), 7.12-7.06 (m, 2H), 6.18 (s, 1H), 3.66 (d, 2H), 3.53 (t, 1H), 3.27 (t, 2H), 2.39 (d, 2H), 2.03-1.93 (m, 2H)
Пример 159
3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

Трет-бутил 4-{3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (52.9 мг, 0.11 ммоль) растворили в диоксан (1 мл) и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (45 мг, 89% теоретический выход).
LC-MS (Способ 5В): Rt=0.82 мин, MS (ESIPos): m/z=381 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O): d [ppm]=8.30 (s, 1H), 7.88 (t, 1H), 7.55-7.50 (m, 1H), 7.29-7.25 (m, 1H), 7.22-7.17 (m, 1H), 6.09 (s, 1H), 3.65 (d, 2H), 3.41 (t, 1H), 3.25 (t, 2H), 2.34 (d, 2H), 1.99-1.90 (m, 2H)
Пример 160
3-[3-(5-метоксифенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
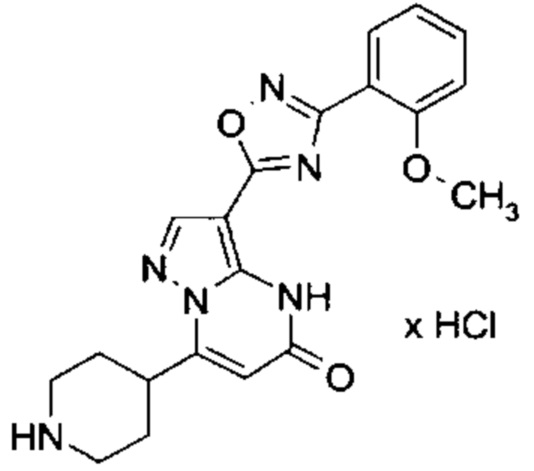
Трет-бутил 4-{3-[3-(2-метоксифенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (54.5 мг, 0.11 ммоль) растворили в диоксан (1 мл) и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (51 мг, 98% теоретический выход).
LC-MS (Способ 5В): Rt=0.8 мин, MS (ESIPos): m/z=393 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O): d [ppm]=8.20 (s, 1H), 7.71 (d, 1H), 7.33 (t, 1H), 6.94-6.89 (m, 2H), 6.05 (s, 1H), 3.82 (s, 3H), 3.69-3.62 (m, 2H), 3.34-3.20 (m, 2H), 2.31 (d, 2H), 1.97-1.88 (m, 2H)
Пример 161
7-(пиперидин-4-ил)-3-[4'-(трифторметил)бифенил-4-ил]пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
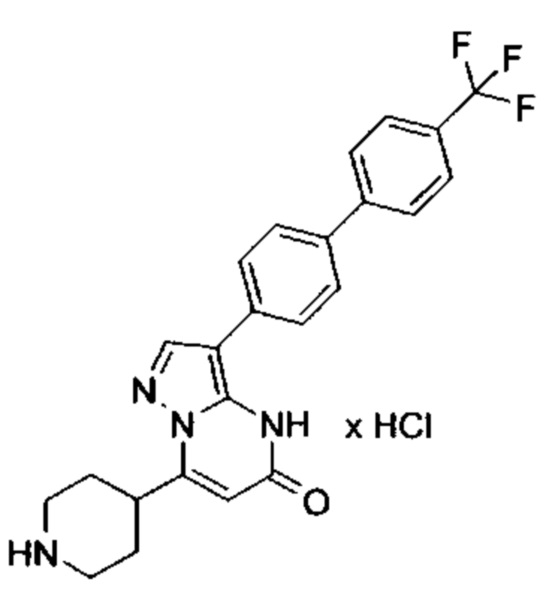
Трет-бутил 4-{5-оксо-3-[4'-(трифторметил)бифенил-4-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (34.0 мг, 0.06 ммоль) растворили в дихлорметане и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Полученное твердое вещество промыли дихлорметаном и подвергли препаративной ВЭЖХ (способ 1А). Фракции продукта обработали соляной кислотой (4 M в диоксан).
Посредством выпаривания растворителя получили соединение, указанное в названии (20 мг, 64% теоретический выход).
LC-MS (Способ 1B): Rt=0.79 мин, MS (ESIPos): m/z=439 [М+Н-xHCl]+
Пример 162
7-(пиперидин-4-ил)-3-[4'-(трифторметил)бифенил-3-ил]пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

Трет-бутил 4-{5-оксо-3-[4'-(трифторметил)бифенил-3-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (155.0 мг, 0.29 ммоль) растворили в дихлорметане и обработали соляной кислотой (4 M в диоксане, 4 мл) в течение 16 ч при комнатной температуре. Полученное твердое вещество промыли дихлорметаном и подвергли препаративной ВЭЖХ (способ 1А). Фракции продукта обработали соляной кислотой (4 M в диоксан). Посредством выпаривания растворителя получили соединение, указанное в названии (132 мг, 92% теоретический выход).
LC-MS (Способ 1B): Rt=0.77 мин, MS (ESIPos): m/z=439 [М+Н-xHCl]+
Пример 163
3-[4-(3-хлорфенил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,8-а]пиримидин-5(4H)-он гидрохлорид
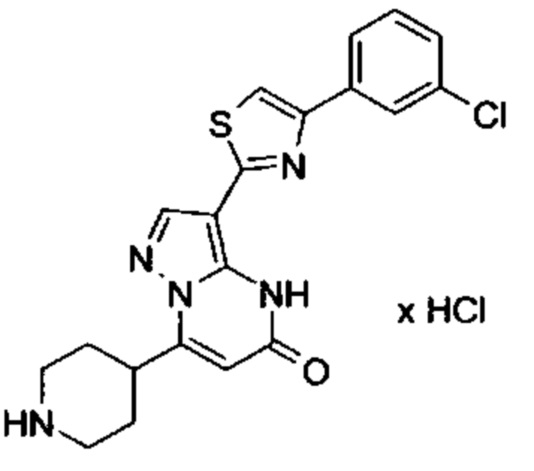
Трет-бутил 4-{3-[4-(3-хлорфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (120.0 мг, 0.23 ммоль) растворили в дихлорметане и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (115 мг, количественный выход).
LC-MS (Способ 1B): Rt=0.76 мин, MS (ESIPos): m/z=412 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6): d [ppm]=8.88 (br. s, 1H), 8.67 (br. s, 1H), 8.54 (br. s, 1H), 8.25-8.13 (m, 2H), 8.05 (d, 1H), 7.51 (t, 1H), 7.43 (dd, 1H), 6.24 (br. s, 1H), 3.57 (s, 1H), 3.53-3.38 (m, 2H), 3.19-3.07 (m, 2H), 2.25 (d, 2H), 1.99-1.87 (m, 2H)
Пример 164
7-(пиперидин-4-ил)-3-{4-[4-(трифторметил)фенил]-1,3-тиазол-2-ил}пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
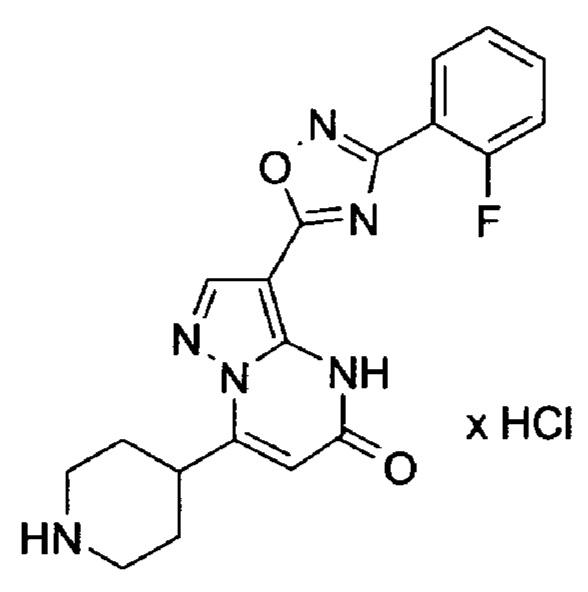
Трет-бутил 4-(5-оксо-3-{4-[4-(трифторметил)фенил]-1,3-тиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (50.0 мг, 0.09 ммоль) растворили в дихлорметане и обработали соляной кислотой (4 M в диоксане, 2 мл) в течение 16 ч при комнатной температуре. Посредством выпаривания растворителя получили соединение, указанное в названии (46 мг, 98% теоретический выход).
LC-MS (Способ 1B): Rt=0.79 мин, MS (ESIPos): m/z=446 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6): d [ppm]=8.88 (br. s, 1H), 8.69 (br. s, 1H), 8.56 (br. s, 1H), 8.32 (d, 2H), 8.26 (s, 1H), 7.84 (d, 2H), 6.25 (br. s, 1H), 3.57 (s, 1H), 3.52-3.39 (m, 2H), 3.20-3.07 (m, 2H), 2.25 (d, 2H), 1.99-1.87 (m, 2H)
Пример 165
3-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
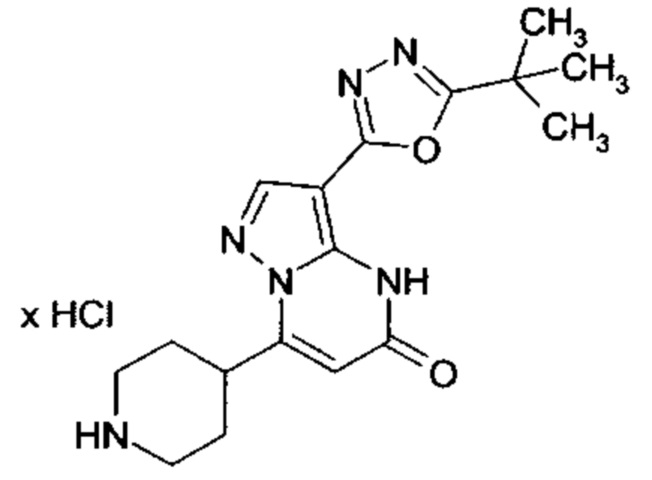
трет-бутил 4-[3-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (145.6 мг, 0.11 ммоль) растворили в 1,4-диоксане (5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 1.65 мл, 6.6 ммоль) в течение 2 ч при комнатной температуре. Еще соляной кислоты (4 М раствор в 1,4-диоксане, 1.65 мл, 6.6 ммоль) добавили и оставили на 6 дней при комнатной температуре. Полученное твердое вещество отфильтровали и промыли ацетонитрилом с получением соединения, указанного в названии (77.6 мг, 59% теоретический выход).
LC-MS (Способ 5В): Rt=0.50 мин, MS (ESIPos): m/z=343 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6): δ=ppm 8.78 (br. s, 1H), 8.53 (br. s, 1H), 8.37 (s, 1H), 5.94-6.26 (m, 1H), 3.42 (br. s, 1H), 2.99-3.19 (m, 3H), 2.11-2.28 (m, 2H), 1.75-1.98 (m, 2H), 1.43 (s, 9H).
Пример 166
7-(пиперидин-4-ил)-3-{5-[4-(трифторметил)фенил]-1,3,4-оксадиазол-2-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
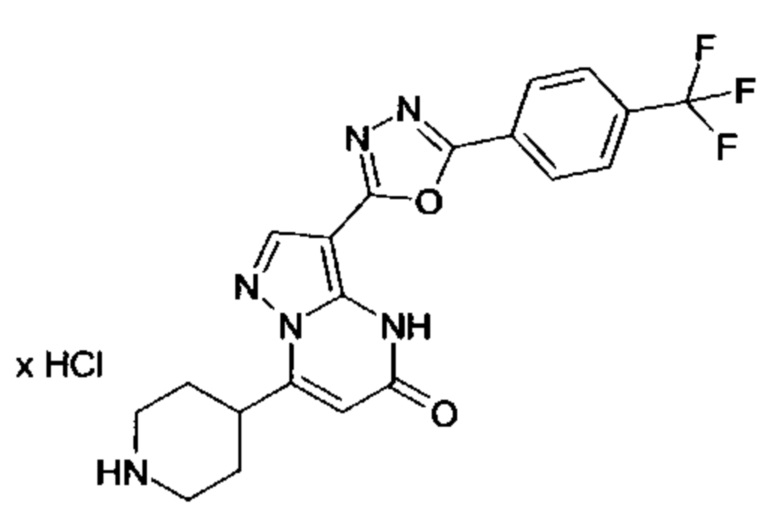
трет-бутил 4-(5-оксо-3-{5-[4-(трифторметил)фенил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (109 мг, 0.21 ммоль) растворили в 1,4-диоксане (2 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.77 мл, 3.1 ммоль) в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% муравьиной кислотой). Полученный остаток обработали 1,4-диоксаном (2 мл) и соляной кислотой (4 М раствор в 1,4-диоксане, 0.77 мл, 3.1 ммоль). Растворитель удалили в вакууме, что обеспечило соединение, указанное в названии (37.3 мг, 37% теоретический выход).
LC-MS (Способ 5В): Rt=0.66 мин, MS (ESIPos): m/z=431 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6): δ=ppm 12.58 (br. s, 1H), 8.83 (br. s, 1H), 8.63 (br. s, 1H), 8.54 (s, 1H), 8.37-8.47 (m, 2H), 7.99-8.06 (m, 2H), 6.15 (br. s, 1H), 3.56-3.67 (m, 1H), 3.38-3.48 (m, 2H), 3.06-3.20 (m, 2H), 2.11-2.31 (m, 2H), 1.77-2.03 (m, 2H).
Пример 167
4-{5-[5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]-1,3,4-оксадиазол-2-ил}бензонитрил гидрохлорид
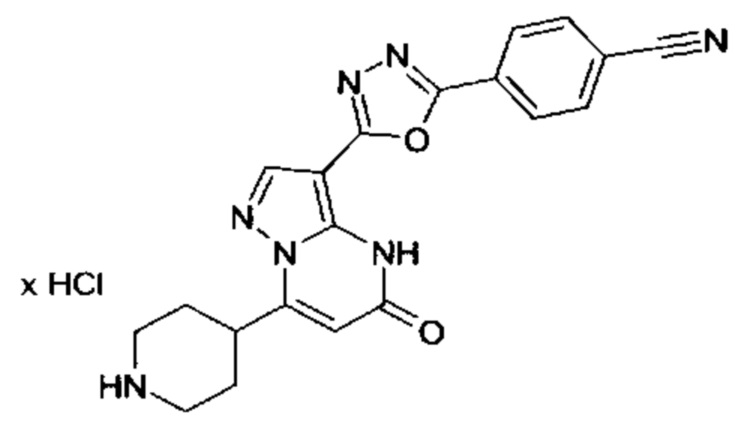
трет-бутил 4-{3-[5-(4-цианофенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (72 мг, 0.21 ммоль) растворили в 1,4-диоксане (2 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.55 мл, 2.2 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали. Остаток очистили посредством обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% муравьиной кислотой). Полученный остаток обработали 1,4-диоксаном (2 мл) и соляной кислотой (4 М раствор в 1,4-диоксане, 0.77 мл, 3.1 ммоль). Растворитель удалили в вакууме, что обеспечило соединение, указанное в названии (32 мг, 51% теоретический выход).
LC-MS (Способ 5В): Rt=0.50 мин, MS (ESIPos): m/z=388.2 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6): δ=ppm 9.04 (br. s, 2Н), 8.82 (br. s, 1Н), 8.55 (s, 1H), 8.40 (d, 2Н), 8.13 (d, 2Н), 6.14 (br. s, 1H), 3.58-3.65 (m, 1H), 3.32-3.45 (m, 2H), 3.12 (dd, 2H), 2.22 (m, 2H), 1.93 (m, 3H).
Пример 168
3-[5-(1-метил-1Н-имидазол-5-ил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
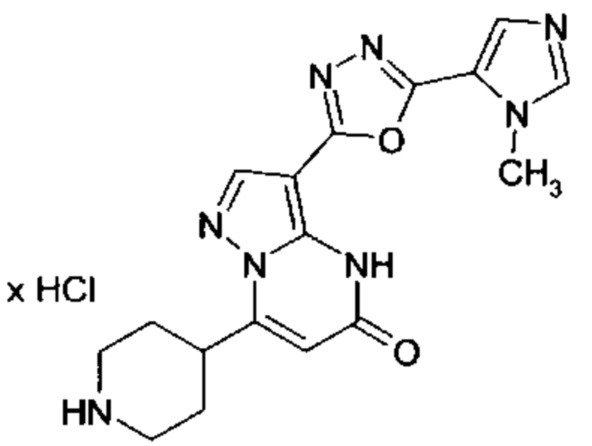
трет-бутил 4-{3-[5-(1-метил-1Н-имидазол-5-ил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (39 мг, 0.08 ммоль) растворили в 1,4-диоксане (2 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.313 мл, 1.3 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрил ом и высушивали с получением соединения, указанного в названии (25 мг, 67% теоретический выход).
LC-MS (Способ 7В): Rt=1.25 мин, MS (ESIPos): m/z=367.1 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O) δ=ppm 12.06 (s, 1Н), 8.43 (s, 1Н), 8.36 (s, 1Н), 6.25 (s, 1H), 4.28 (s, 3Н), 3.61-3.71 (m, 3Н), 3.21-3.32 (m, 2Н), 2.38-2.47 (m, 2Н), 1.94 -2.07 (m, 2Н).
Пример 169
3-[5-(3-хлорфенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
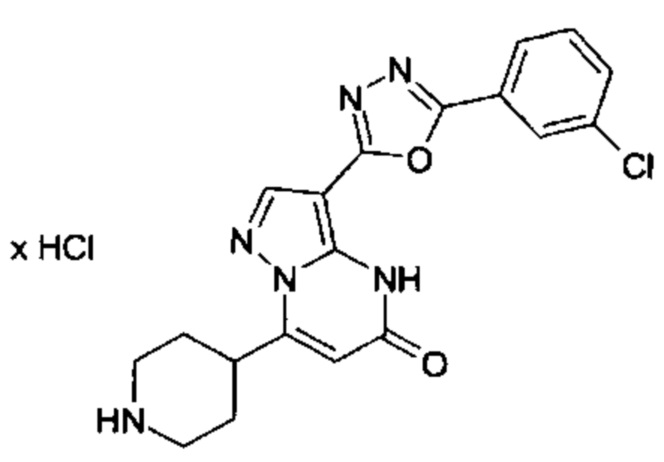
трет-бутил 4-{3-[5-(3-хлорфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (150 мг, 0.3 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 1.13 мл, 4.5 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (25 мг, 67% теоретический выход).
LC-MS (Способ 5В): Rt=0.61 мин, MS (ESIPos): m/z=397.3 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) δ=ppm 9.15 (br. s, 1H), 8.99 (br. s, 1H), 8.54 (s, 1H), 8.27 (s, 1H), 8.17 (d, 1H), 7.63-7.75 (m, 2H), 6.13 (s, 1H), 3.55-3.64 (m, 1H), 3.41 (m, 2H), 2.99-3.18 (m, 2H), 2.22 (m, 2H), 1.81-2.03 (m, 2H).
Пример 170
3-[5-(4-метилфенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
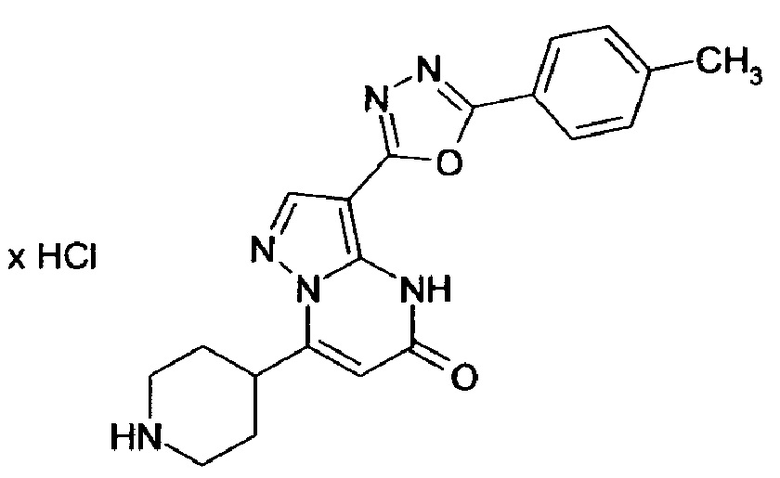
трет-бутил 4-(3-{[2-(4-метилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (100 мг, 0.2 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (67.6 мг, 0.28 ммоль) в течение 16 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамат (67.6 мг, 0.28 ммоль) и перемешивали в течение 1 ч при комнатной температуре. Соляную кислоту (4 М раствор в 1,4-диоксане, 0.76 мл, 3.0 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% муравьиной кислотой). Полученный остаток обработали 1,4-диоксаном (2 мл) и соляной кислотой (4 М раствор в 1,4-диоксане, 1 мл). Растворитель удалили в вакууме, что обеспечило соединение, указанное в названии (8 мг, 10% теоретический выход).
LC-MS (Способ 5В): Rt=0.60 мин, MS (ESIPos): m/z=377.3 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) δ=ppm 12.50 (br. s, 1H), 8.86 (br. s, 1H), 8.64 (br. s, 1H), 8.50 (s, 1H), 8.09 (d, 2H), 7.41 (d, 2H), 6.11 (br. s, 1H), 3.54-3.65 (m, 1H), 3.38-3.46 (m, 2H), 3.03-3.19 (m, 2H), 2.42 (s, 3H), 2.18-2.27 (m, 2H), 1.81-1.99 (m, 2H).
Пример 171
3-[5-(2-метилфенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

трет-бутил 4-(3-{[2-(2-метилбензоил)гидразино]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (112 мг, 0.23 ммоль) растворили в тетрагидрофуране (2.5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (75.8 мг, 0.32 ммоль) в течение 16 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамат (75.8 мг, 0.32 ммоль) и перемешивали в течение 1 ч при комнатной температуре. Соляную кислоту (4 М раствор в 1,4-диоксане, 0.85 мл, 3.4 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% муравьиной кислотой). Полученный остаток обработали 1,4-диоксаном (2 мл) и соляной кислотой (4 М раствор в 1,4-диоксане, 1 мл). Растворитель удалили в вакууме, что обеспечило соединение, указанное в названии (46 мг, 49% теоретический выход).
LC-MS (Способ 5В): Rt=0.58 мин, MS (ESIPos): m/z=377.2 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) δ=ppm 8.98 (s, 1Н), 8.78 (br. s, 1Н), 8.52 (s, 1Н), 8.09-8.19 (m, 1Н), 7.38-7.58 (m, 3Н), 6.15 (br. s, 1H), 3.36-3.45 (m, 3H), 3.04-3.16 (m, 2H), 2.68 (s, 3H), 2.16-2.27 (m, 2H), 1.83-2.01 (m, 2H).
Пример 172
7-(пиперидин-4-ил)-3-{5-[2-(трифторметил)фенил]-1,3,4-оксадиазол-2-ил}пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
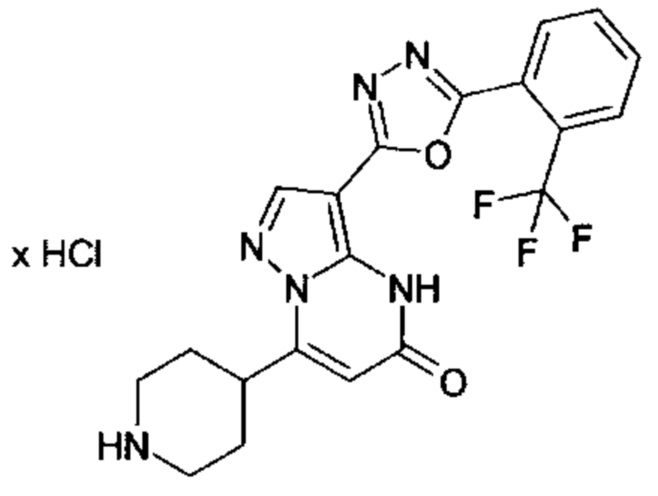
трет-бутил 4-[5-оксо-3-({2-[2-(трифторметил)бензоил]гидразино}карбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (106 мг, 0.2 ммоль) растворили в тетрагидрофуране (5 мл) и обработали метил N-(триэтиламмониосульфонил)карбаматом (55.2 мг, 0.23 ммоль) в течение 16 ч при комнатной температуре. Добавили еще метил N-(триэтиламмониосульфонил)карбамат (55.2 мг, 0.23 ммоль) и перемешивали в течение 1 ч при комнатной температуре. Соляную кислоту (4 М раствор в 1,4-диоксане, 0.72 мл, 2.9 ммоль) добавили, и смесь перемешивали в течение 16 ч при комнатной температуре. Смесь очистили посредство обращенно-фазовой ВЭЖХ (градиент ацетонитрил/вода с 0.01% муравьиной кислотой). Полученный остаток обработали 1,4-диоксаном (2 мл) и соляной кислотой (4 М раствор в 1,4-диоксане, 1 мл). Растворитель удалили в вакууме, что обеспечило соединение, указанное в названии (45 мг, 50% теоретический выход).
LC-MS (Способ 5В): Rt=0.59 мин, MS (ESIPos): m/z=431.2 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) δ=ppm 8.68 (br. s, 1H), 8.48 (s, 1H), 8.37 (br. s, 1H), 8.17 (d, 1H), 8.04 (d, 1H), 7.86-8.00 (m, 2H), 6.18 (s, 1H), 3.61-3.67 (m, 1H), 3.38-3.48 (m, 2H), 3.06-3.20 (m, 2Н), 2.18-2.28 (m, 2H), 1.80-1.96 (m, 2H).
Пример 173
3-[5-(метоксиметил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

трет-бутил 4-{3-[5-(метоксиметил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (35 мг, 0.08 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.3 мл, 1.2 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрил ом и высушивали с получением соединения, указанного в названии (24 мг, 75% теоретический выход).
LC-MS (Способ 5В): Rt=0.21 мин, MS (ESIPos): m/z=331.3 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) δ=ppm 9.03 (br. s, 1H), 8.78 (br. s, 1H), 8.46 (s, 1H), 6.16 (br. s, 1H), 4.70 (s, 2H), 3.52-3.64 (m, 4H), 3.32-3.40 (m, 2H), 2.98-3.17 (m, 2H), 2.13-2.27 (m, 2H), 1.80-1.98 (m, 2H).
Пример 174
3-(5-циклопропил-1,3,4-оксадиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
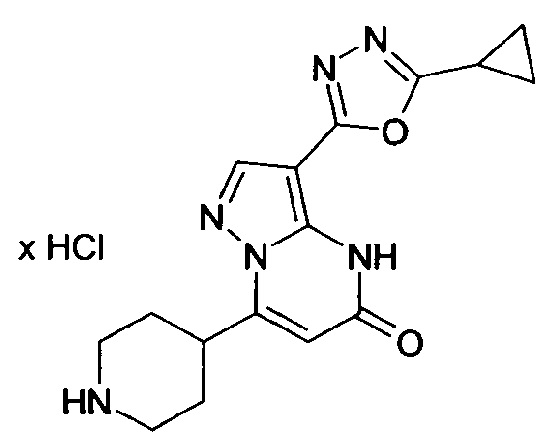
трет-бутл 4-[3-(5-циклопропил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (43 мг, 0.08 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.38 мл, 1.5 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (33 мг, 86% теоретический выход).
LC-MS (Способ 5В): Rt=0.37 мин, MS (ESIPos): m/z=327.3 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) δ=ppm 8.86-9.32 (m, 2H), 8.37 (s, 1H), 6.09 (br. s, 1H), 3.51-3.65 (m, 1H), 3.39 (m, 2H), 3.09 (m, 2H), 2.24-2.31 (m, 1H), 2.19 (m, 2H), 1.94 (m, 2H), 1.08-1.18 (m, 4H).
Пример 175
7-(пиперидин-4-ил)-3-{5-[3-(трифторметил)фенил]-1,3,4-оксадиазол-2-ил}пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

трет-бутил 4-(5-оксо-3-{5-[3-(трифторметил)фенил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (113.5 мг, 0.21 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 1.07 мл, 4.3 ммоль) в течение 2 ч при комнатной температуре. Еще соляной кислоты (4 М раствор в 1,4-диоксане, 1.07 мл, 4.3 ммоль) добавили и перемешивали в течение 4 ч при комнатной температуре. Растворители удалили в вакууме, и полученный остаток промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (50 мг, 47% теоретический выход).
LC-MS (Способ 5В): Rt=0.63 мин, MS (ESIPos): m/z=431.2 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) δ=ppm 9.16 (br. s, 1H), 8.97 (br. s, 1H), 8.42-8.59 (m, 3H), 8.03 (d, 1H), 7.84-7.95 (m, 1H), 6.13 (br. s, 1H), 3.60 (t, 1H), 3.41 (m, 2H), 3.11 (m, 2H), 2.22 (m, 2H), 1.95 (m, 2H).
Пример 176
3-[5-(4-метоксибензил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
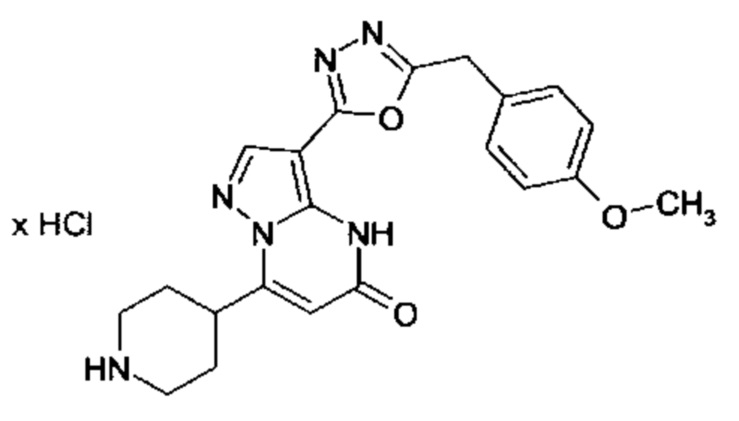
трет-бутил 4-{3-[5-(4-метоксибензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (190 мг, 0.38 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 1.41 мл, 5.6 ммоль) в течение 16 ч при комнатной температуре.
Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (34 мг, 18% теоретический выход).
LC-MS (Способ 5В): Rt=0.54 мин, MS (ESIPos): m/z=407.4 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O) δ=ppm 8.01 (s, 1H), 7.14 (d, 2H), 6.74 (d, 2H), 6.16 (s, 1H), 4.07 (s, 1H), 3.61-3.76 (m, 5H), 3.46-3.58 (m, 1H), 3.21-3.36 (m, 2H), 2.39 (m, 2H), 1.92-2.10 (m, 2H).
Пример 177
3-(5-циклопентил-1,3,4-оксадиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

трет-бутил 4-[3-(5-циклопентил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (170 мг, 0.37 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 1.4 мл, 4.3 ммоль) в течение 2 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (34 мг, 18% теоретический выход).
LC-MS (Способ 5В): Rt=0.52 мин, MS (ESIPos): m/z=355.3 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O) δ=ppm 8.19 (s, 1H), 6.18 (s, 1H), 3.71 (m, 2H), 3.52-3.62 (m, 1H), 3.37-3.45 (m, 1H), 3.31 (m, 2H), 2.84-3.11 (m, 1H), 2.43 (m, 2H), 2.14-2.24 (m, 2H), 2.03 (m, 2H), 1.72-1.95 (m, 6H).
Пример 178
3-[5-(2-фурил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
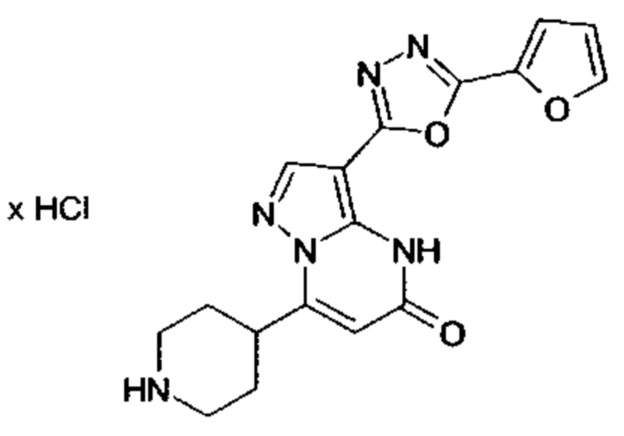
трет-бутил 4-{3-[5-(2-фурил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (90 мг, 0.20 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.75 мл, 2.9 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (38 мг, 45% теоретический выход).
LC-MS (Способ 5В): Rt=0.44 мин, MS (ESIPos): m/z=353.3 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O) δ=ppm 9.11 (br. s, 1H), 8.87 (br. s, 1H), 8.49 (s, 1H), 8.08 (d, 1H), 7.49 (d, 1H), 6.83 (dd, 1H), 6.15 (br. s, 1H), 3.58 (m, 1H), 3.41 (m, 2H), 3.11 (m, 2H), 2.22 (m, 2H), 1.93 (m, 2H).
Пример 179
3-[5-(4-трет-бутилфенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
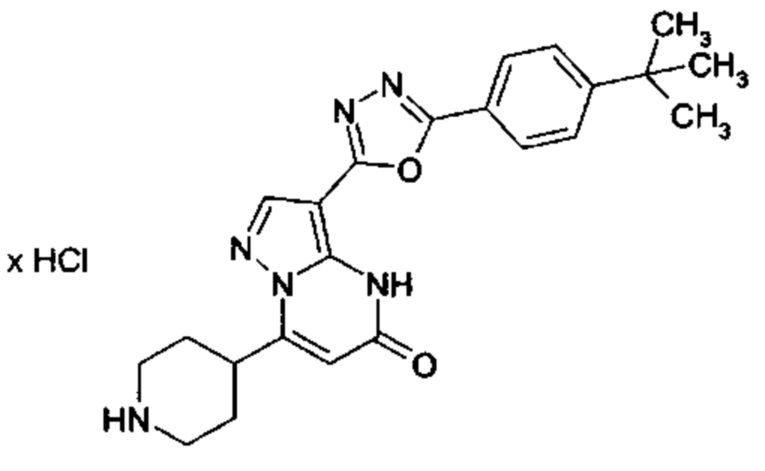
трет-бутип 4-{3-[5-(4-трет-бутилфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (160 мг, 0.31 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 1.16 мл, 4.6 ммоль) в течение 16 ч при комнатной температуре.
Еще соляной кислоты (4 М раствор в 1,4-диоксане, 1.16 мл, 4.6 ммоль) добавили и перемешивали в течение 4 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (86.7 мг, 62% теоретический выход).
LC-MS (Способ 5В): Rt=0.72 мин, MS (ESIPos): m/z=419.3 [М+Н-хНСl]+
1H-ЯМР (500 МГц, D2O) δ=ppm 9.16 (br. s, 1H), 8.94 (br. s, 1H), 8.51 (s, 1H), 8.11 (d, 2H), 7.65 (d, 2H), 6.12 (br. s, 1H), 3.57-3.64 (m, 1H), 3.41 (m, 2H), 3.11 (m, 3H), 2.22 (m, 2H), 1.95 (m, 2H), 1.33 (s, 9H).
Пример 180
3-(5-бензил-1,3,4-оксадиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

трет-бутил 4-[3-(5-бензил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 0.21 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.79 мл, 3.2 ммоль) в течение 16 ч при комнатной температуре. Еще соляной кислоты (4 М раствор в 1,4-диоксане, 0.79 мл, 3.2 ммоль) добавили и перемешивали в течение 20 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (40 мг, 42% теоретический выход).
LC-MS (Способ 5В): Rt=0.51 мин, MS (ESIPos): m/z=377.2 [М+Н-xHCl]+
1H-ЯМР (500 МГц, D2O) δ=ppm 9.09 (br. s, 1H), 8.92 (br. s, 1H), 8.39 (s, 1H), 7.25-7.43 (m, 5H), 6.11 (br. s, 1H), 4.32 (s, 2H), 3.51-3.63 (m, 1H), 3.39 (m, 2H), 3.00-3.19 (m, 2H), 2.19 (m, 2H), 1.82-2.01 (m, 2H).
Пример 181
3-[5-(4-хлорфенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
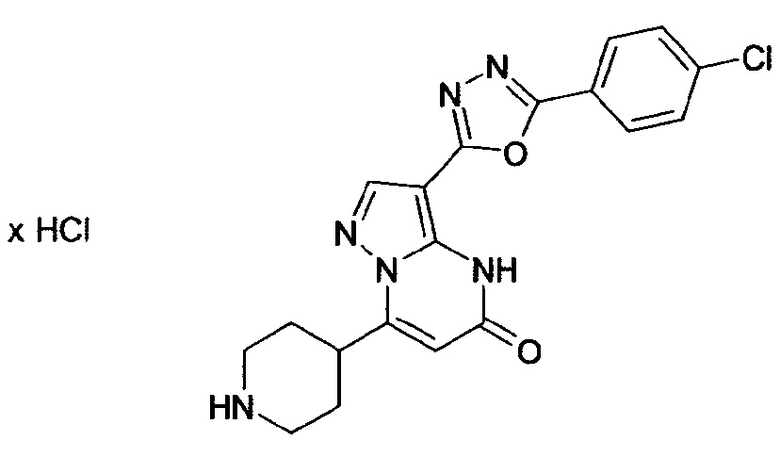
трет-бутил 4-{3-[5-(4-хлорфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (70 мг, 0.14 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.53 мл, 2.1 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (25 мг, 37% теоретический выход).
LC-MS (Способ 5В): Rt=0.60 мин, MS (ESIPos): m/z=397.3 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) δ=ppm 8.99 (br. s, 1H), 8.77 (br. s, 1H), 8.52 (s, 1H), 8.23 (d, 2H), 7.72 (d, 2H), 6.13 (s, 1H), 3.53-3.65 (m, 1H), 3.36-3.45 (m, 2H), 3.02-3.17 (m, 2H), 2.22 (m, 2H), 1.78-2.00 (m, 2H).
Пример 182
3-[5-(циклогексилметил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
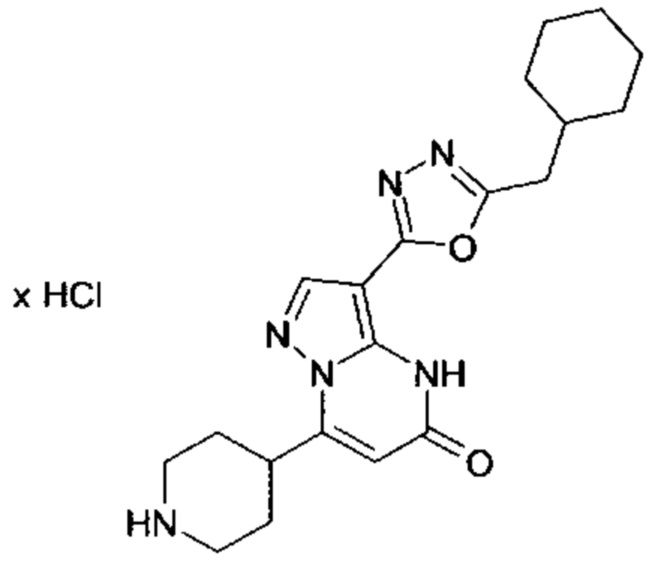
трет-бутил 4-{3-[5-(циклогексилметил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (96 мг, 0.20 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.74 мл, 2.9 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (82 мг, 99% теоретический выход).
LC-MS (Способ 5В): Rt=0.63 мин, MS (ESIPos): m/z=383.4 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) δ=ppm 9.14 (m, 1H), 9.01 (m, 1H), 8.39 (s, 1H), 6.09 (br. s, 1H), 3.53-3.63 (m, 1H), 3.39 (d, 2H), 3.02-3.14 (m, 2H), 2.79 (d, 2H), 2.20 (m, 2H), 1.78-2.01 (m, 3Н), 1.57-1.74 (m, 5H), 1.10-1.27 (m, 3H), 0.98-1.09 (m, 2H).
Пример 183
3-[5-(2-метилпиридин-4-ил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
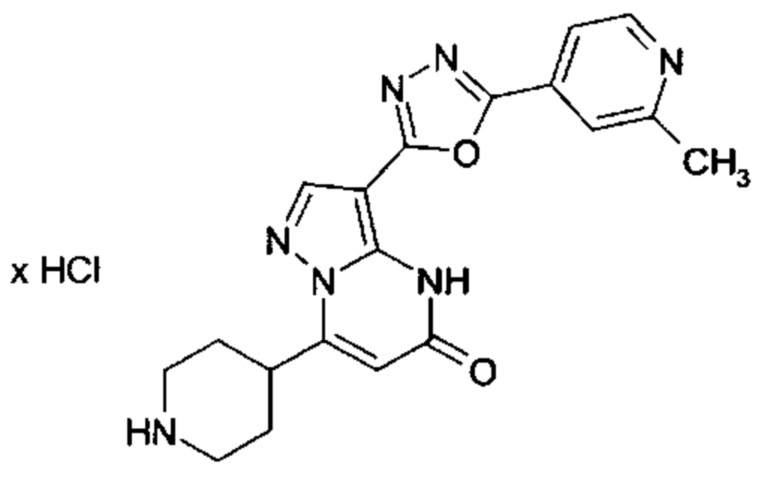
трет-бутил 4-{3-[5-(2-метилпиридин-4-ил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (21 мг, 0.04 ммоль) растворили в 1,4-диоксане (1 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.02 мл, 0.65 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (20 мг, 99% теоретический выход).
LC-MS (Способ 5В): Rt=0.39 мин, MS (ESIPos): m/z=378.3 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) δ=ppm 11.99-12.39 (m, 1H), 9.00-9.12 (m, 1H), 8.89-8.98 (m, 1H), 8.86 (d, 1H), 8.59 (s, 1H), 8.19-8.32 (m, 2H), 6.17 (br. s, 1H), 3.59 (m, 1H), 3.34-3.44 (m, 2H), 3.00-3.17 (m, 2H), 2.73 (s, 3H), 2.22 (d, 2H), 1.94 (m, 2Н).
Пример 184
3-[5-(2-метоксифенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
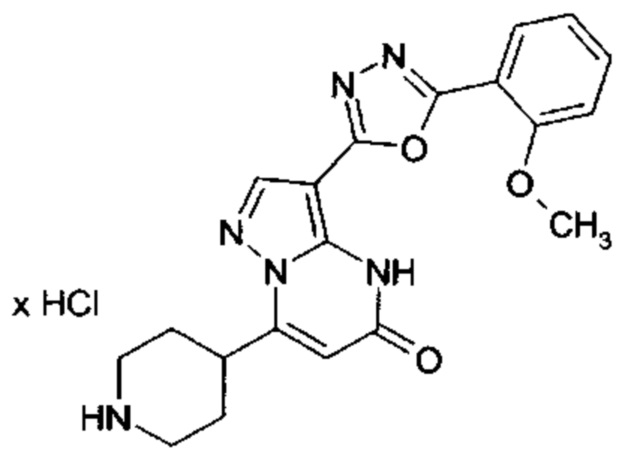
трет-бутил 4-{3-[5-(2-метоксифенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (52 мг, 0.11 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.39 мл, 1.58 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (46 мг, количественный выход).
LC-MS (Способ 5В): Rt=0.53 мин, MS (ESIPos): m/z=393.3 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) δ=ppm 9.19 (m, 1H), 9.06 (m, 1H), 8.48 (s, 1H), 7.97 (dd, 1H), 7.62 (ddd, 1H), 7.29 (d, 1H), 7.13-7.20 (m, 1H), 6.14 (s, 1H), 3.92 (s, 3H), 3.55-3.65 (m, 1H), 3.40 (m, 2H), 3.04-3.16 (m, 2H), 2.22 (m, 2H), 1.89-2.01 (m, 2H).
Пример 185
7-(пиперидин-4-ил)-3-[5-(пиридин-4-ил)-1,3,4-оксадиазол-2-ил]пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид

трет-бутил 4-{5-оксо-3-[5-(пиридин-4-ил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (63 мг, 0.14 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.51 мл, 2.03 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (54 мг, 94% теоретический выход).
LC-MS (Способ 5В): Rt=0.39 мин, MS (ESIPos): m/z=364.3 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) δ=ppm 9.01-9.11 (m, 1H), 8.96 (d, 2H), 8.81-8.94 (m, 1H), 8.58 (s, 1H), 8.33 (d, 2H), 6.16 (br. s, 1H), 3.58 (m, 1H), 3.41 (m, 2H), 3.11 (m, 2H), 2.22 (m, 2H), 1.94 (m, 2H).
Пример 186
3-[5-(2-фторфенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
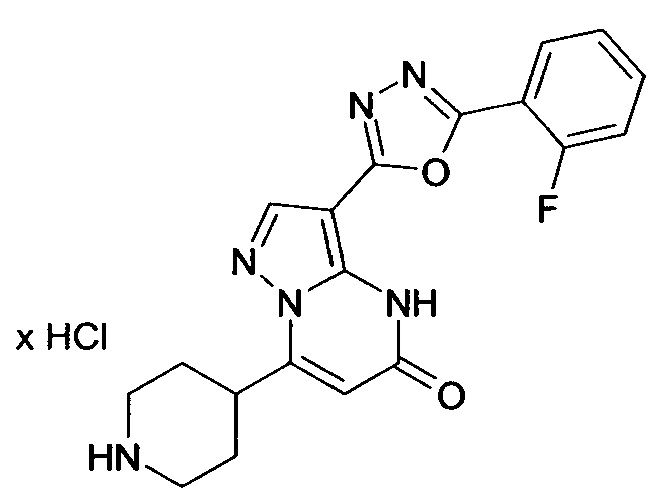
трет-бутил 4-{3-[5-(2-фторфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (74 мг, 0.15 ммоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.58 мл, 2.3 ммоль) в течение 16 ч при комнатной температуре. Ацетонитрил добавили к смеси, и полученный остаток отфильтровали, промыли ацетонитрилом и высушивали с получением соединения, указанного в названии (56 мг, 87% теоретический выход).
LC-MS (Способ 5В): Rt=0.53 мин, MS (ESIPos): m/z=381.3 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) δ=ppm 9.00 (m, 1H), 8.83 (m, 1H), 8.51 (s, 1H), 8.23 (t, 1H), 7.63-7.76 (m, 1H), 7.40-7.56 (m, 2H), 6.15 (br. s, 1H), 3.56-3.65 (m, 1H), 3.03-3.17 (m, 2H), 2.22 (m, 2H), 1.86-1.99 (m, 2H) (один сигнал скрыт ниже пика растворителя).
Пример 187
3-(4-метил-2-фенил-1,3-тиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
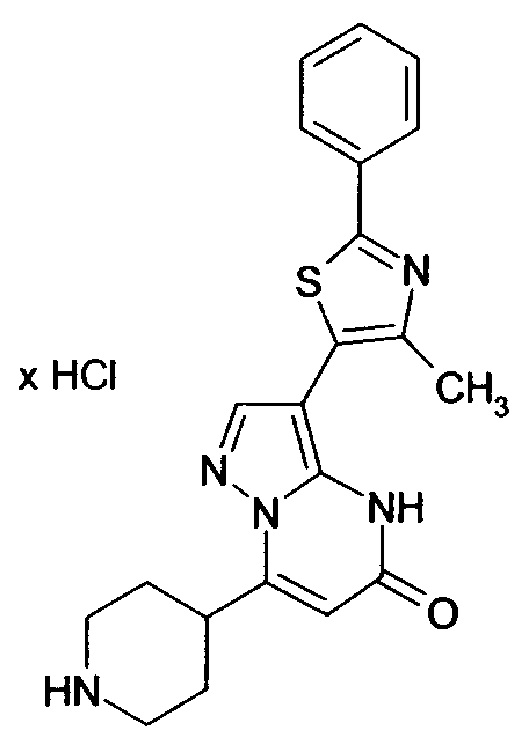
трет-бутил 4-[3-(4-метил-2-фенил-1,3-тиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (45 мг, 0.09 ммоль) растворили в 1,4-диоксане (2 мл) и обработали соляной кислотой (4 М раствор в 1,4-диоксане, 0.46 мл, 1.8 ммоль) в течение 16 ч при комнатной температуре. Растворители удалили в вакууме с получением соединения, указанного в названии (44 мг, 98% теоретический выход).
LC-MS (Способ 5В): Rt=0.61 мин, MS (ESIPos): m/z=392.3 [М+Н-xHCl]+
1H-ЯМР (400 МГц, D2O-d6) δ=ppm 7.90-8.00 (m, 1H), 7.78-7.86 (m, 2H), 7.44-7.64 (m, 3H), 5.95-6.12 (m, 1H), 3.55-3.69 (m, 2H), 3.41-3.51 (m, 1H), 3.12-3.29 (m, 2H), 2.27-2.38 (m, 5H), 1.75-2.03 (m, 2H).
Пример 188
7-(пиперидин-4-ил)-3-{3-[6-(трифторметил)пиридин-3-ил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
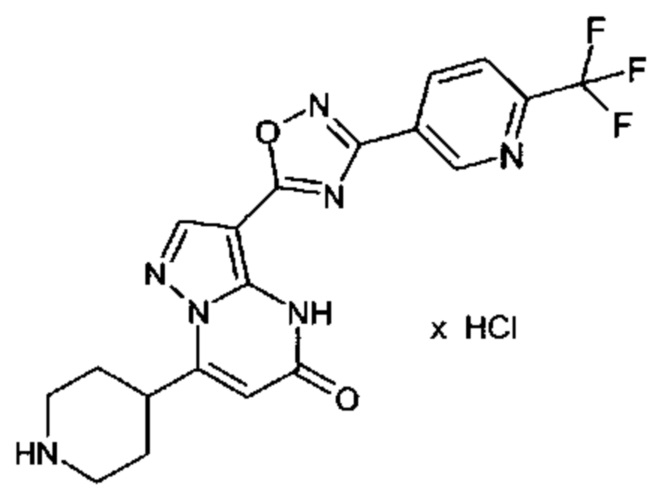
Суспензию соединения трет-бутил 4-(5-оксо-3-{3-[6-(трифторметил)пиридин-3-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (200 мг, 0.38 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию отфильтровали, промыли метанолом (2.0 мл) и высушивали в вакууме всю ночь с получением соединения, указанного в названии (125 мг, 94% чистота, 67% теоретический выход).
LC-MS (Способ 8В): Rt=0.82 мин, MS (ESINeg): m/z=430 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=12.44 (bs, 1H), 9.56 (s, 1H), 8.94-8.81 (m, 1H), 8.75 (bs, 1H), 8.67 (s, 1H), 8.50 (bs, 1H), 8.17 (d, 1H), 6.23 (bs, 1H), 3.68-3.54 (m, 1H), 3.43 (d, 2H), 3.13 (t, 2H), 2.23 (d, 2H), 1.90 (q, 2H).
Пример 189
7-(пиперидин-4-ил)-3-{3-[4-(трифторметил)пиридин-3-ил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
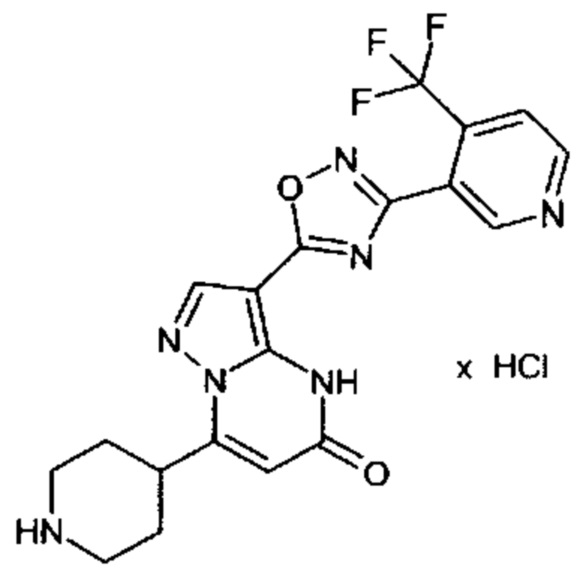
Суспензию соединения трет-бутил 4-(5-оксо-3-{3-[4-(трифторметил)пиридин-3-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (110 мг, 0.21 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию отфильтровали, промыли простым диэтиловым эфиром (5.0 мл) и высушивали в вакууме всю ночь с получением соединения, указанного в названии (80 мг, 82% теоретический выход).
LC-MS (Способ 8В): Rt=0.77 мин, MS (ESINeg): m/z=430 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=12.37 (bs, 1H), 9.39 (bs, 1H), 9.11 (d, 1H), 8.85 (bs, 1H), 8.72-8.51 (m, 2H), 8.05 (d, 1H), 6.28 (bs, 1H), 3.74-3.56 (m, 1H), 3.54-3.29 (m, 2H), 3.13 (q, 2H), 2.23 (d, 2H), 1.91 (q, 2H).
Пример 190
7-(пиперидин-4-ил)-3-[3-(2,4,5-трифторфенил)-1,2,4-оксадиазол-5-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
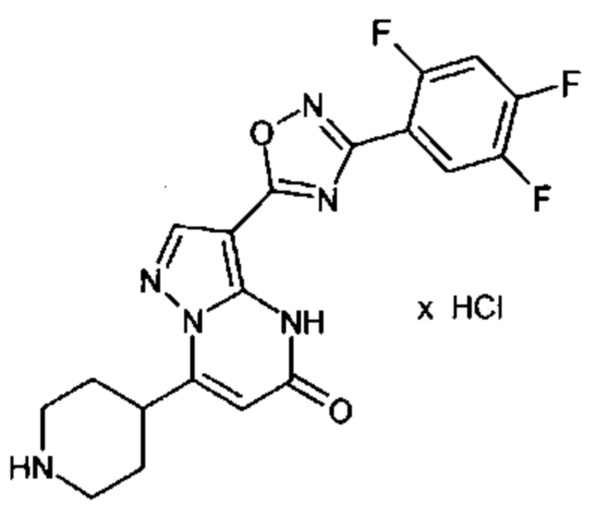
Суспензию соединения трет-трет-бутил 4-{5-оксо-3-[3-(2,4,5-трифторфенил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (65 мг, 0.13 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (3.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию отфильтровали, промыли простым диэтиловым эфиром (5.0 мл) и высушивали в вакууме всю ночь с получением соединения, указанного в названии (46 мг, 81% теоретический выход).
LC-MS (Способ 8В): Rt=0.87 мин, MS (ESINeg): m/z=415 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=12.29 (bs, 1H), 8.90-8.43 (m, 4H), 7.86 (dt, 1H), 6.19 (bs, 1H), 3.65-3.53 (m, 1H), 3.42 (d, 2H), 3.13 (q, 2H), 2.22 (d, 2H), 1.89 (q, 2H).
Пример 191
3-{3-[(метилсульфонил)метил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
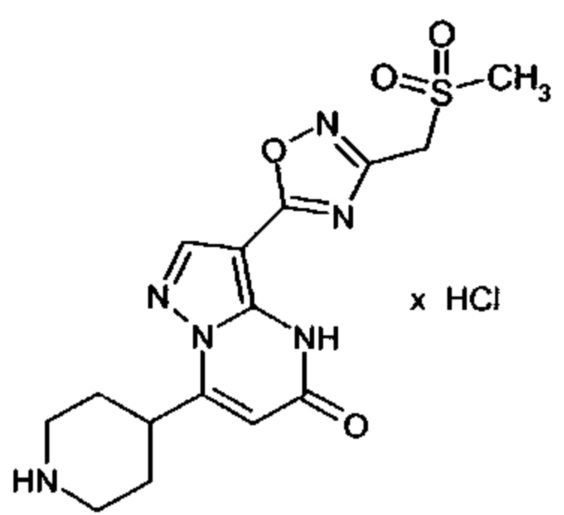
Суспензию соединения трет-бутил 4-(3-{3-[(метилсульфонил)метил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (40 мг, 0.08 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (34 мг, 95% теоретический выход).
LC-MS (Способ 8В): Rt=0.22 мин, MS (ESINeg): m/z=377 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=8.86 (bs, 1H), 8.62 (bs, 2H), 6.31 (bs, 1H), 4.86 (s, 2H), 3.74-3.53 (m, 1H), 3.42 (d, 2H), 3.25 (s, 3H), 3.12 (q, 2H), 2.22 (d, 2H), 1.91 (q, 2H).
Пример 192
7-(пиперидин-4-ил)-3-[3-(4,4,4-трифторбутил)-1,2,4-оксадиазол-5-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
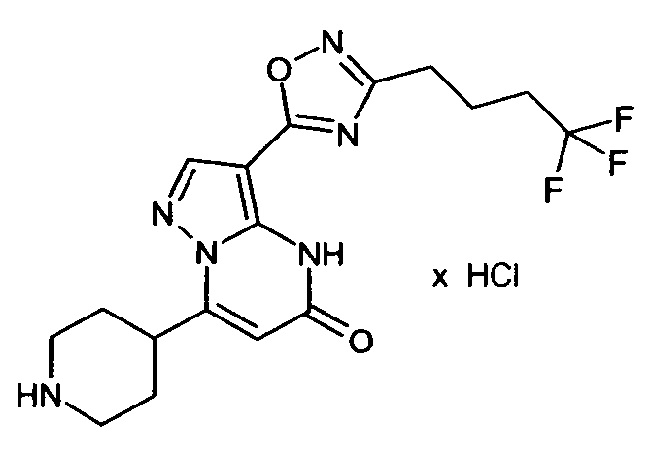
Суспензию соединения трет-бутил 4-{5-оксо-3-[3-(4,4,4-трифторбутил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (170 мг, 0.34 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (148 мг, 100% теоретический выход).
LC-MS (Способ 8В): Rt=0.77 мин, MS (ESINeg): m/z=395 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=13.46-11.54 (m, 1H), 9.06 (bs, 1H), 8.91 (bs, 1H), 8.56 (s, 1H), 6.24 (bs, 1H), 3.61 (d, 1H), 3.52-3.28 (m, 2H), 3.10 (q, 2H), 2.86 (t, 2H), 2.47-2.33 (m, 2H), 2.21 (d, 2H), 2.01-1.86 (m, 4H).
Пример 193
3-[3-(1-циклопропилпиперидин-4-ил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
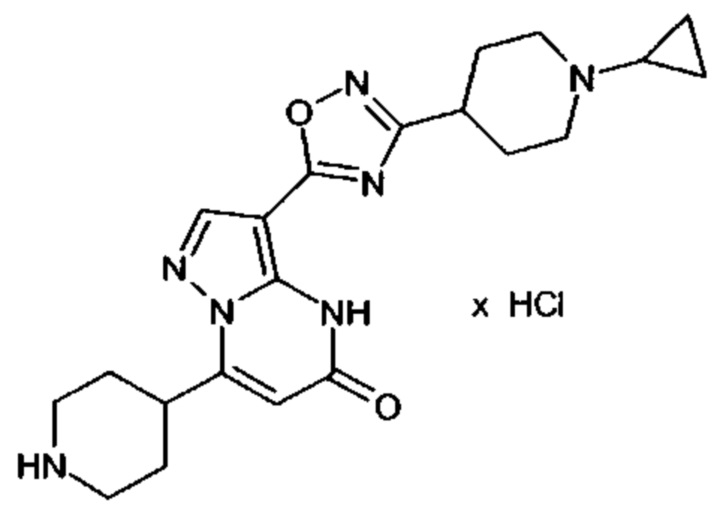
Суспензию соединения трет-бутил 4-{3-[3-(1-циклопропилпиперидин-4-ил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат трифторацетатная соль (148 мг, 0.29 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (101 мг, 72% теоретический выход).
LC-MS (Способ 7В): Rt=1.58 мин, MS (ESINeg): m/z=408 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=13.29-11.66 (m, 1H), 10.57 (bs, 1H), 9.03 (bs, 1H), 8.88 (bs, 1H), 8.65-8.49 (m, 1H), 6.22 (bs, 1H), 3.65-3.33 (m, 6H), 3.21-3.03 (m, 3H), 2.79 (bs, 1H), 2.40-2.03 (m, 6H), 1.93 (q, 2H), 1.15 (bs, 2H), 0.95-0.74 (m, 2H).
Пример 194
3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
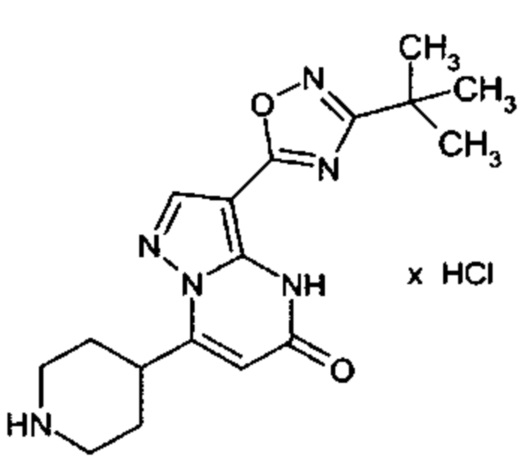
Суспензию соединения трет-бутил 4-[3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил] пиперидин-1-карбоксилат (173 мг, 0.39 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.6 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (138 мг, 93% теоретический выход).
LC-MS (Способ 8B): Rt=0.74 мин, MS (ESINeg): m/z=341 [M-H-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=13.30-11.65 (m, 1H), 9.04 (bs, 1H), 8.89 (bs, 1H), 8.52 (s, 1H), 6.20 (bs, 1H), 3.60 (t, 1H), 3.40 (d, 2H), 3.10 (q, 2H), 2.21 (d, 2H), 1.93 (q, 2H),1.37(s, 9H).
Пример 195
3-[3-(2-хлор-4-фторбензил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
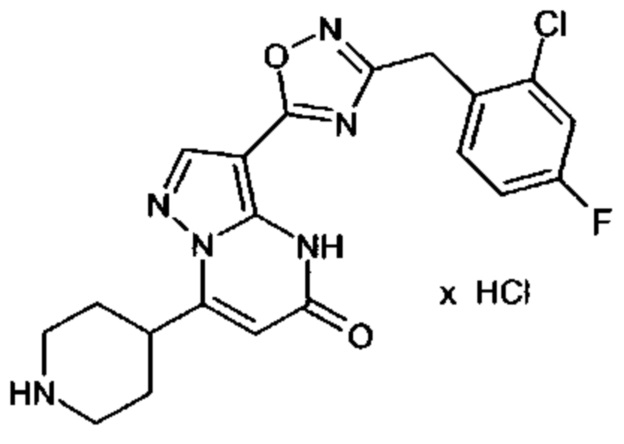
Суспензию соединения трет-бутил 4-{3-[3-(2-хлор-4-фторбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (158 мг, 0.30 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (3.5 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (109 мг, 79% теоретический выход).
LC-MS (Способ 8В): Rt=0.90 мин, MS (ESINeg): m/z=427 [M-H-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=13.28-11.68 (m, 1H), 8.98-8.84 (m, 1H), 8.78-8.64 (m, 1H), 8.54 (s, 1H), 7.55 (dd, 1H), 7.50 (dd, 1H), 7.26 (dt, 1H), 6.26 (bs, 1H), 4.24 (s, 2H), 3.67-3.53 (m, 1H), 3.41 (d, 2H), 3.10 (q, 2H), 2.21 (d, 2H), 1.90 (q, 2H).
Пример 196
3-[3-(4-трет-бутилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
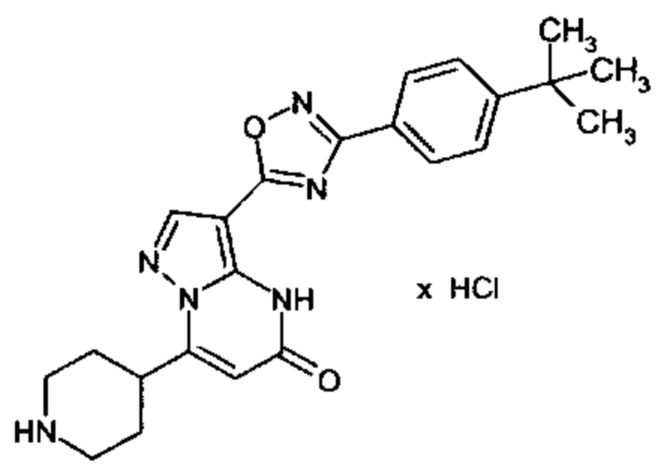
Суспензию соединения трет-бутил 4-{3-[3-(4-трет-бутилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а] пиримидин-7-ил}пиперидин-1-карбоксилат (110 мг, 0.21 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (2.5 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (78 мг, 82% теоретический выход).
LC-MS (Способ 8В): Rt=1.03 мин, MS (ESINeg): m/z=417 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=13.30-11.88 (m, 1H), 9.12-8.67 (m, 2H), 8.62 (s, 1H), 8.10 (d, 2H), 7.61 (d, 2H), 6.22 (bs, 1H), 3.62 (t, 1H), 3.42 (d, 2H), 3.12 (t, 2H), 2.23 (d, 2H), 1.93 (q, 2H), 1.34 (s, 9H).
Пример 197
3-{3-[4-(диметиламино)-3-фторфенил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
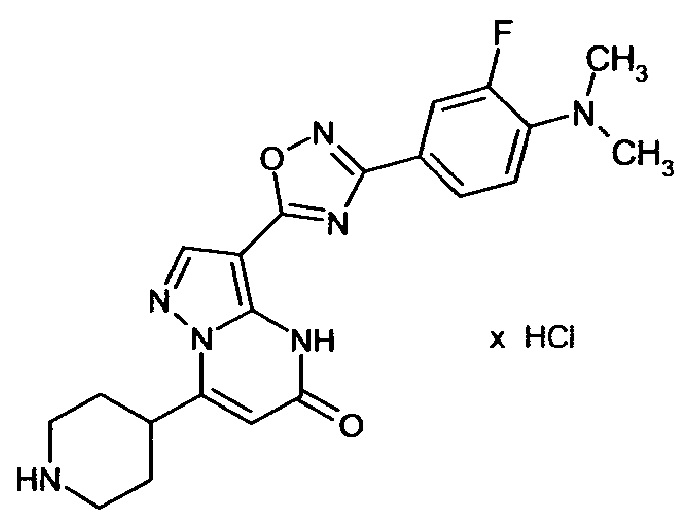
Суспензию соединения трет-бутил 4-(3-{3-[4-(диметиламино)-3-фторфенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидро пиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (65 мг, 0.12 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (1.5 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (56 мг, количественный выход).
LC-MS (Способ 8В): Rt=0.90 мин, MS (ESINeg): m/z=422 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=12.19 (bs, 1H), 9.04 (bs, 1H), 8.85 (bs, 1H), 8.60 (s, 1H), 7.92 (d, 1H), 7.85 (d, 1H), 7.07 (t, 1H), 6.20 (bs, 1H), 3.70-3.53 (m, 1H), 3.41 (d, 2H), 3.11 (q, 2H), 2.93 (s, 6H), 2.22 (d, 2H), 1.93 (q, 2H).
Пример 198
3-[3-(2-метилбензил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
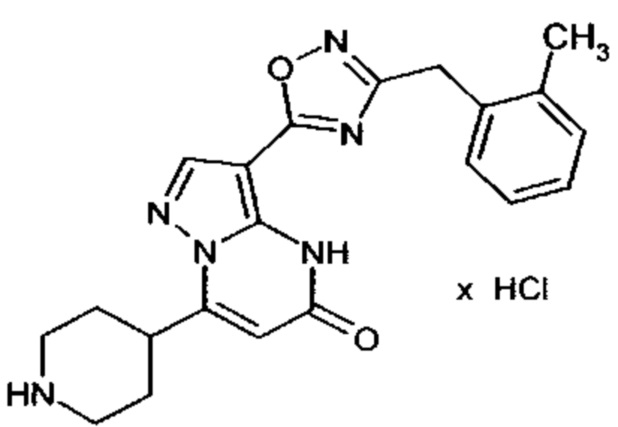
Суспензию соединения трет-бутил 4-{3-[3-(2-метилбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (155 мг, 0.31 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (3.7 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (118 мг, 86% теоретический выход).
LC-MS (Способ 8В): Rt=0.85 мин, MS (ESINeg): m/z=389 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=13.43-11.47 (m, 1H), 9.04 (bs, 1H), 8.99 (bs, 1H), 8.82 (bs, 1H), 8.52 (s, 1H), 7.27-7.11 (m, 4H), 6.24 (bs, 1H), 4.11 (s, 2H), 3.60 (t, 1H), 3.40 (d, 2H), 3.10 (q, 2H), 2.33 (s, 3H), 2.20 (d, 2H), 1.91 (q, 2H).
Пример 199
3-(3-этил-1,2,4-оксадиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
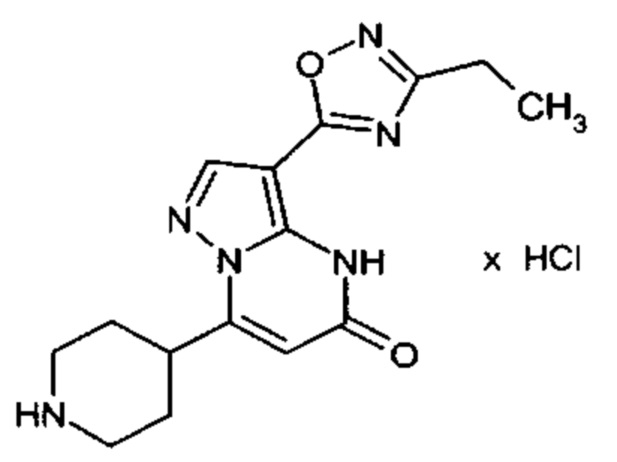
Суспензию соединения трет-бутил 4-[3-(3-этил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил] пиперидин-1-карбоксилат (101 мг, 0.24 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (80 мг, 94% теоретический выход).
LC-MS (Способ 8B): Rt=0.53 мин, MS (ESINeg): m/z=313 [M-H-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=11.95 (bs, 1H), 8.80 (bs, 1H), 8.55 (bs, 2H), 6.23 (bs, 1H), 3.61 (bs, 1H), 3.42 (d, 2H), 3.11 (q, 2H), 2.76 (q, 2H), 2.22 (d, 2H), 1.89 (q, 2H), 1.29 (t, 3H).
Пример 200
5-[5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]-1,2,4-оксадиазол-3-карбоксамид гидрохлорид
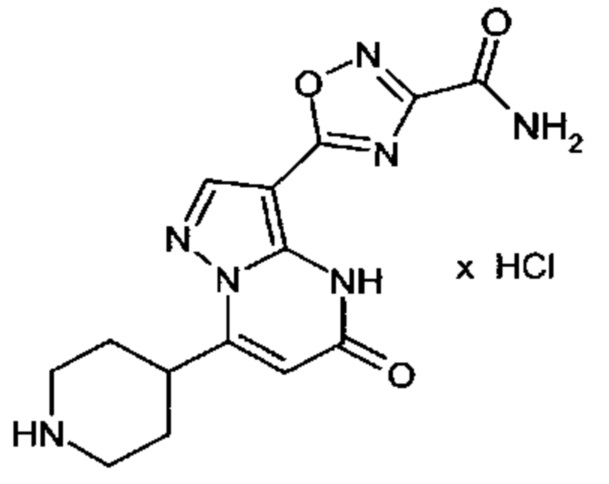
Суспензию соединения трет-бутил 4-[3-(3-карбамоил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (120 мг, 94% чистота, 0.26 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (86 мг, 90% чистота, 81% теоретический выход).
LC-MS (Способ 9В): Rt=3.44 мин, MS (ESIPos): m/z=330 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO): δ=11.96 (bs, 1Н), 9.02 (bs, 1H), 8.94-8.68 (m, 2H), 8.60 (s, 1H), 8.20 (s, 1H), 6.15 (bs, 1H), 3.57 (t, 1H), 3.40 (d, 2H), 3.10 (q, 2H), 2.21 (d, 2H), 1.92 (q, 2H).
Пример 201
3-{3-[(изопропилсульфонил)метил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
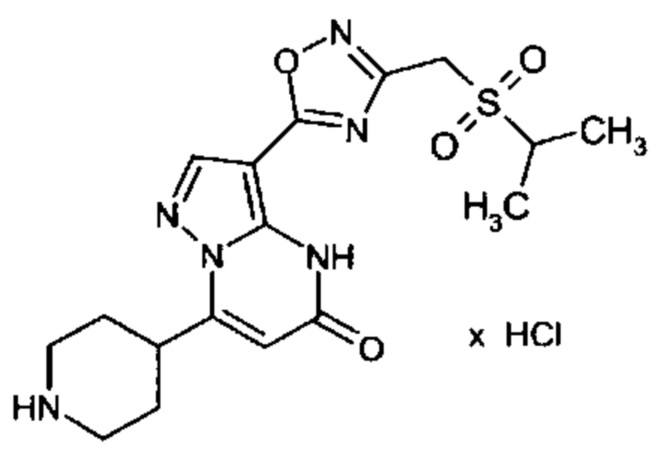
Суспензию соединения трет-бутил 4-(3-{3-[(изопропилсульфонил)метил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (24 мг, 93% чистота, 0.044 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (20 мг, 93% чистота, количественный выход).
LC-MS (Способ 8В): Rt=0.51 мин, MS (ESINeg): m/z=405 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=8.88 (bs, 1H), 8.77-8.54 (m, 2H), 6.32 (bs, 1H), 4.83 (s, 2H), 3.74-3.29 (m, 4H), 3.12 (q, 2H), 2.22 (d, 2H), 1.91 (q, 2H), 1.34 (d, 6H).
Пример 202
3-[3-(3,5-дифторпиридин-2-ил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
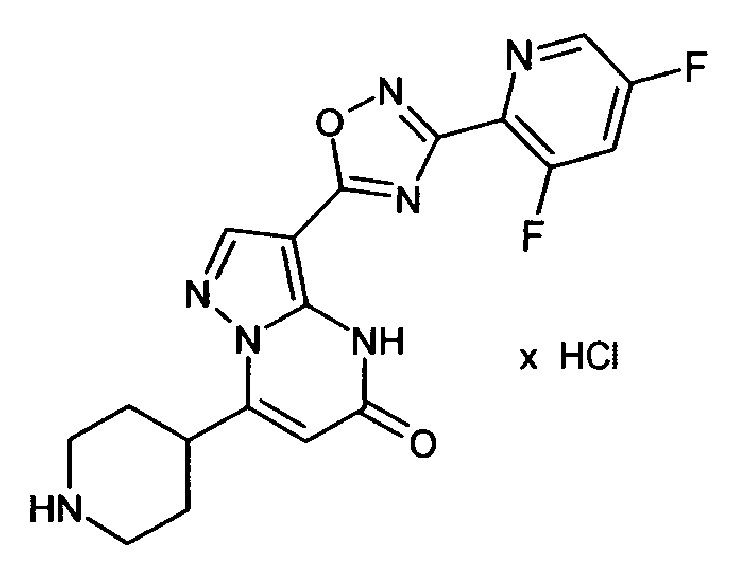
Суспензию соединения трет-бутил 4-{3-[3-(3,5-дифторпиридин-2-ил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (25 мг, 0.050 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (22 мг, количественный выход).
LC-MS (Способ 8В): Rt=0.70 мин, MS (ESINeg): m/z=398 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=8.94 (bs, 1H), 8.78 (d, 1H), 8.82-8.63 (m, 1H), 8.69 (s, 1H), 8.30-8.23 (m, 1H), 6.33 (bs, 1H), 4.01-3.56 (m, 1H), 3.42 (d, 2H), 3.12 (q, 2H), 2.24 (d, 2H), 1.94 (q, 2H).
Пример 203
3-{3-[(1-метилпиперидин-4-ил)метил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
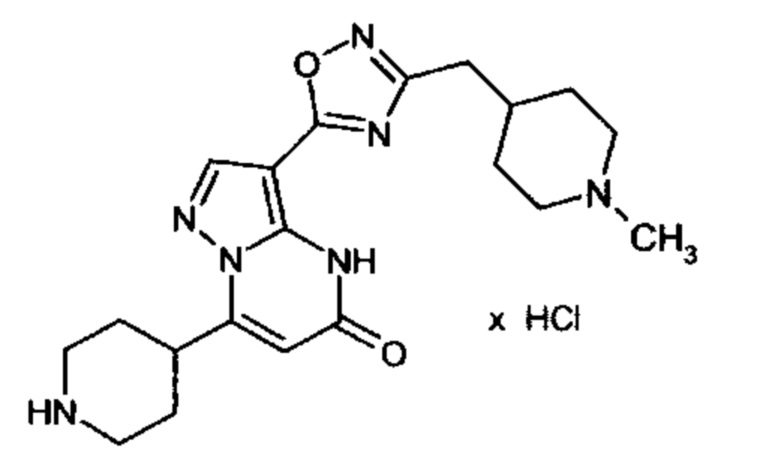
Суспензию соединения трет-бутил 4-(3-{3-[(1-метилпиперидин-4-ил)метил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (281 мг, 91% чистота, 0.51 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (189 мг, 90% чистота, 70% теоретический выход).
LC-MS (Способ 9В): Rt=3.47 мин, MS (ESIPos): m/z=398 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO): δ=10.61-10.25 (m, 1H), 9.14 (bs, 1H), 9.03 (bs, 1H), 8.55 (s, 1H), 6.26 (bs, 1H), 3.61 (t, 1H), 3.39 (t, 4H), 3.10 (q, 2H), 2.98-2.86 (m, 2H), 2.72 (d, 2H), 2.69 (d, 3H), 2.21 (d, 2H), 1.95 (q, 2H), 1.86 (d, 2H), 1.60 (q, 2H). Один протон пропущен, полагают, что он находится ниже сигнала воды.
Пример 204
Метил 4-{5-[5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]-1,2,4-оксадиазол-3-ил}бензоат гидрохлорид
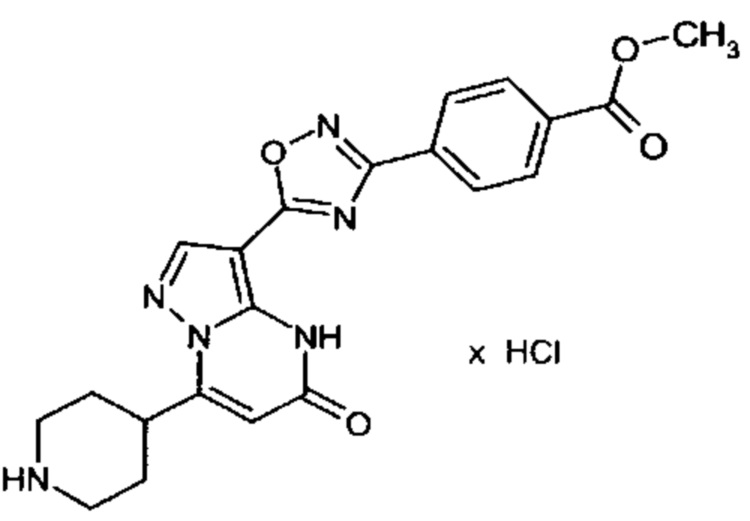
Суспензию соединения трет-бутил 4-(3-{3-[4-(метоксикарбонил)фенил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло [1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (41 мг, 0.079 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, и соединение, указанное в названии, получили путем перекристаллизации из смеси воды и ацетонитрила (10 мг, 92% чистота, 26% теоретический выход).
LC-MS (Способ 8В): Rt=0.85 мин, MS (ESINeg): m/z=419 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=12.40 (bs, 1H), 8.79 (bs, 1H), 8.65 (s, 1H), 8.54 (bs, 1H), 8.38-8.31 (m, 2H), 8.29-8.14 (m, 2H), 6.24 (bs, 1H), 3.91 (s, 3H), 3.74-3.57 (m, 1H), 3.43 (d, 2H), 3.13 (q, 2H), 2.24 (d, 2H), 1.90 (q, 2H).
Пример 205
3-[3-(3-нитрофенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
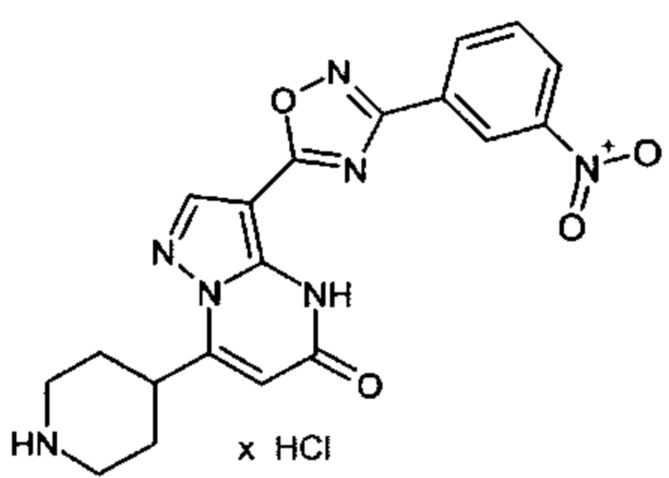
Суспензию соединения трет-бутил 4-{3-[3-(3-нитрофенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (59 мг, 0.11 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (45 мг, 89% теоретический выход).
LC-MS (Способ 8В): Rt=0.79 мин, MS (ESINeg): m/z=406 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=12.47 (bs, 1H), 8.98-8.81 (m, 2H), 8.76-8.57 (m, 3H), 8.47 (d, 1H), 7.92 (t, 1H), 6.25 (bs, 1H), 3.67-3.56 (m, 1H), 3.43 (d, 2H), 3.13 (q, 2H), 2.24 (d, 2H), 1.92 (q, 2H).
Пример 206
3-[3-(2-метоксиэтил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
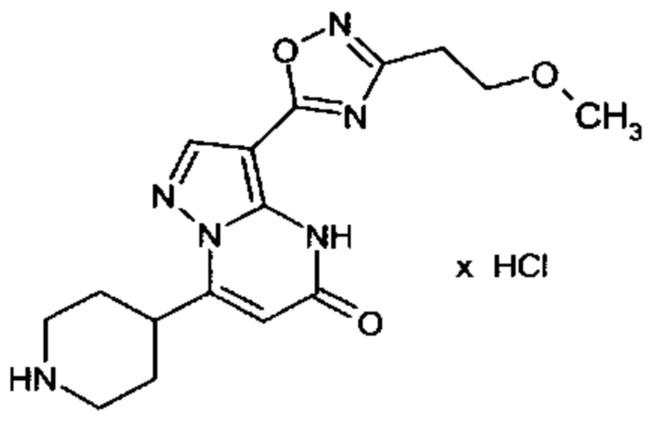
Суспензию соединения трет-бутил 4-{3-[3-(2-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (100 мг, 93% чистота, 0.21 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (77 мг, 94% теоретический выход).
LC-MS (Способ 8В): Rt=0.52 мин, MS (ESINeg): m/z=343 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=13.35-11.52 (m, 1H), 8.96 (bs, 1H), 8.77 (bs, 1H), 8.55 (s, 1H), 6.24 (bs, 1H), 3.75 (t, 2H), 3.66-3.55 (m, 1H), 3.41 (d, 2H), 3.26 (s, 3H), 3.11 (q, 2H), 2.98 (t, 2H), 2.22 (d, 2H), 1.92 (q, 2H).
Пример 207
7-(пиперидин-4-ил)-3-[3-(пиридин-4-ил)-1,2,4-оксадиазол-5-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
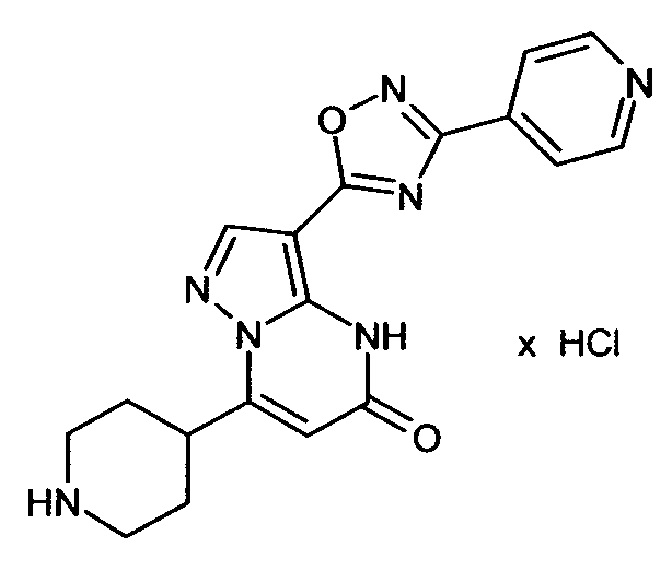
Суспензию соединения трет-бутил 4-{5-оксо-3-[3-(пиридин-4-ил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (170 мг, 0.35 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (109 мг, 87% чистота, 62% теоретический выход).
LC-MS (Способ 9В): Rt=3.57 мин, MS (ESIPos): m/z=364 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO): δ=9.11-8.72 (m, 2Н), 8.91 (bs, 2Н), 8.67 (s, 1Н), 8.28 (bs, 2Н), 6.25 (bs, 1H), 3.83-3.46 (m, 1H), 3.45-3.34 (m, 2Н), 3.18-3.02 (m, 2Н), 2.27-2.13 (m, 2Н), 2.01-1.81 (q, 2Н).
Пример 208
3-[3-(3-аминофенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
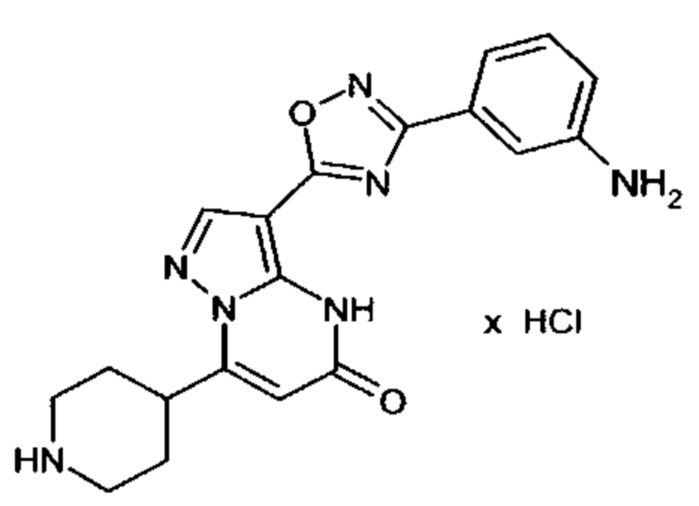
Суспензию соединения трет-бутил 4-{3-[3-(3-аминофенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (173 мг, 88% чистота, 0.32 ммоль) в 1,4-диоксане (2.0 мл) обработали 4Н HCl в 1,4-диоксане (4.0 мл). Реакционную смесь перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии (98 мг, 74% теоретический выход).
LC-MS (Способ 8В): Rt=0.66 мин, MS (ESINeg): m/z=376 [M-H-xHCl]-
1H-ЯМР (400 МГц, DMSO): δ=9.25-8.89 (m, 2H), 8.63 (s, 1H), 8.00-7.78 (m, 2H), 7.59-7.49 (m, 1H), 7.35 (bs, 1H), 6.25 (s, 1H), 3.62 (t, 1H), 3.41 (d, 2H), 3.11 (q, 2H), 2.22 (d, 2H), 1.96 (q, 2H).
Пример 209
3-[3-(2-хлорбензил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
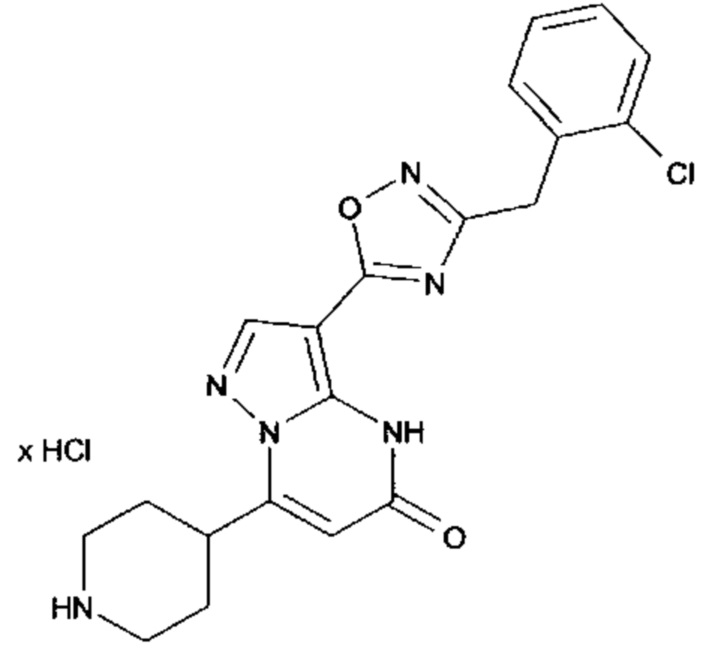
Соединение трет-бутил 4-{3-[3-(2-хлорбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (128 мг, 92% чистота, 230 мкмоль) растворили в 1,4-диоксане (2.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (4.0 мл).
Суспензию отфильтровали, промыли простым диэтиловым эфиром (2.0 мл) и высушивали в вакууме с получением соединения, указанного в названии.
Полученное количество составило 71.0 мг (99% чистота, 68% теоретический выход).
LC-MS (Способ 8В): Rt=0.84 мин; MS (ESIpos): m/z=411 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: -0.007 (0.49), -0.000 (10.25), 1.890 (0.58), 1.898 (0.71), 1.918 (1.87), 1.924 (1.85), 1.942 (2.02), 1.950 (1.89), 1.968 (0.90), 1.977 (0.70), 2.185 (2.67), 2.187 (2.77), 2.214 (2.35), 3.057 (0.78), 3.077 (1.72), 3.083 (2.09), 3.104 (2.17), 3.109 (1.88), 3.130 (0.89), 3.381 (2.75), 3.407 (2.38), 3.568 (6.73), 3.584 (0.88), 3.608 (1.45), 3.631 (0.94), 4.255 (16.00), 6.254 (0.84), 7.327 (0.70), 7.336 (3.25), 7.339 (3.87), 7.341 (3.25), 7.347 (6.25), 7.352 (3.49), 7.355 (4.73), 7.357 (4.79), 7.367 (0.91), 7.457 (0.42), 7.463 (2.78), 7.468 (1.69), 7.474 (2.32), 7.477 (2.11), 7.483 (5.07), 7.488 (2.16), 7.491 (2.39), 7.493 (1.97), 7.497 (1.62), 7.502 (2.60), 8.537 (3.69), 8.936 (0.73), 8.960 (0.78), 9.084 (1.00), 9.109 (0.81).
Пример 210
3-[3-(4-хлорбензил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
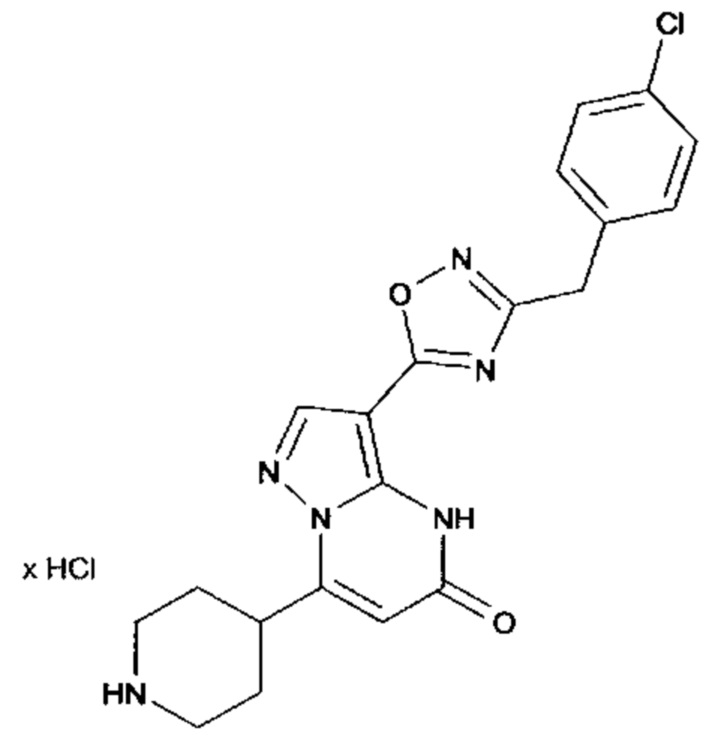
Соединение трет-бутил 4-{3-[3-(4-хлорбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (117 мг, 95% чистота, 218 мкмоль) растворили в 1,4-диоксане (2.0 мл) и перемешивали 2 ч при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (4.0 мл). Суспензию отфильтровали, промыли простым диэтиловым эфиром (2.0 мл) и высушивали в вакууме с получением соединения, указанного в названии.
Полученное количество составило 45.0 мг (98% чистота, 45% теоретический выход).
LC-MS (Способ 8В): Rt=0.85 мин; MS (ESIpos): m/z=411 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 0.007 (0.70), 1.148 (0.26), 1.235 (0.39), 1.885 (1.20), 1.908 (1.27), 1.932 (0.55), 2.192 (1.81), 2.219 (1.53), 2.363 (0.30), 2.637 (0.30), 3.068 (0.52), 3.093 (1.42), 3.115 (1.44), 3.140 (0.57), 3.394 (2.18), 3.418 (1.79), 3.568 (16.00), 4.141 (11.14), 6.290 (0.17), 7.377 (1.48), 7.395 (6.91), 7.403 (11.33), 7.416 (1.20), 7.421 (2.03), 8.540 (0.57), 8.657 (0.54), 8.857 (0.68).
Пример 211
Этил 5-[5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]-1,2,4-оксадиазол-3-карбоксилат гидрохлорид
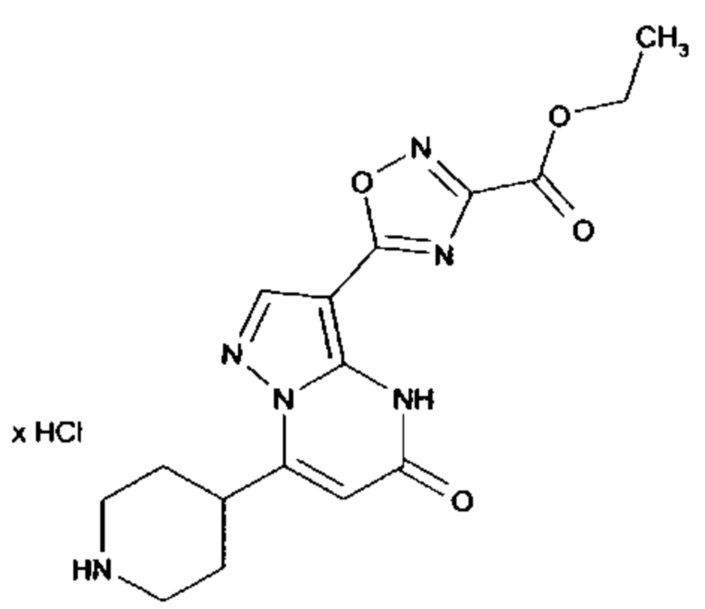
трет-бутил 4-{3-[3-(этоксикарбонил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (107 мг, 100% чистота, 233 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 210.
Полученное количество составило 56.0 мг (100% чистота, 61% теоретический выход).
LC-MS (Способ 8В): Rt=0.64 мин; MS (ESIpos): m/z=359 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.000 (0.74), 0.016 (0.68), 1.197 (0.17), 1.345 (3.59), 1.362 (7.71), 1.380 (3.67), 1.894 (0.26), 1.924 (0.70), 1.949 (0.77), 1.981 (0.33), 2.218 (1.09), 2.251 (0.88), 3.114 (0.75), 3.144 (0.79), 3.411 (1.15), 3.442 (0.93), 3.576 (16.00), 3.656 (0.40), 4.419 (1.02), 4.437 (3.24), 4.455 (3.21), 4.473 (1.00), 6.388 (0.19), 8.712 (0.81), 8.907 (0.34).
Пример 212
3-[3-(аминометил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
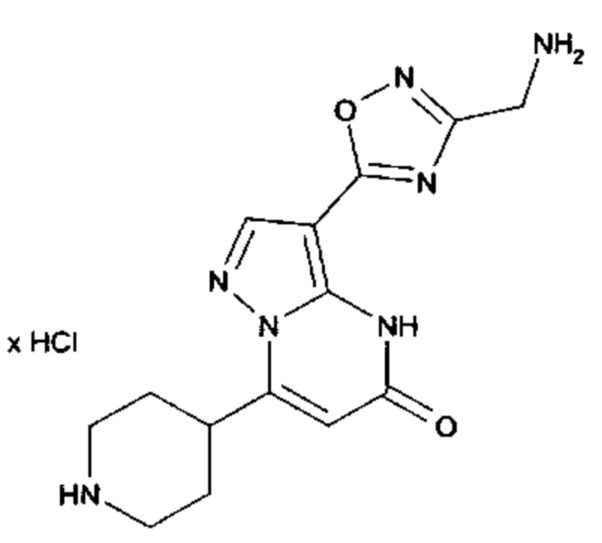
трет-бутил 4-[3-(3-{[(трет-бутоксикарбонил)амино]метил}-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (158 мг, 98% чистота, 300 мкмоль)
4Н соляная кислота в 1,4-диоксане (6.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 89.0 мг (98% чистота, 83% теоретический выход).
LC-MS (Способ 9В): Rt=3.15 мин; MS (ESIpos): m/z=316 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: -0.007 (0.65), 0.000 (16.00), 0.006 (0.54), 1.927 (0.96), 1.934 (1.16), 1.953 (3.02), 1.959 (3.08), 1.979 (3.35), 1.984 (3.21), 2.004 (1.43), 2.011 (1.22), 2.188 (4.59), 2.214 (3.66), 3.055 (1.27), 3.080 (3.40), 3.102 (3.44), 3.127 (1.36), 3.381 (4.45), 3.406 (3.76), 3.568 (12.09), 3.596 (1.81), 3.618 (1.01), 4.057 (4.56), 4.126 (2.56), 4.305 (2.54), 4.317 (6.94), 4.328 (6.74), 4.339 (2.32), 6.249 (0.73), 8.597 (7.90), 8.854 (6.55), 9.166 (1.22), 9.186 (1.39), 9.246 (1.84).
Пример 213
3-[3-(3,4-дихлорбензил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
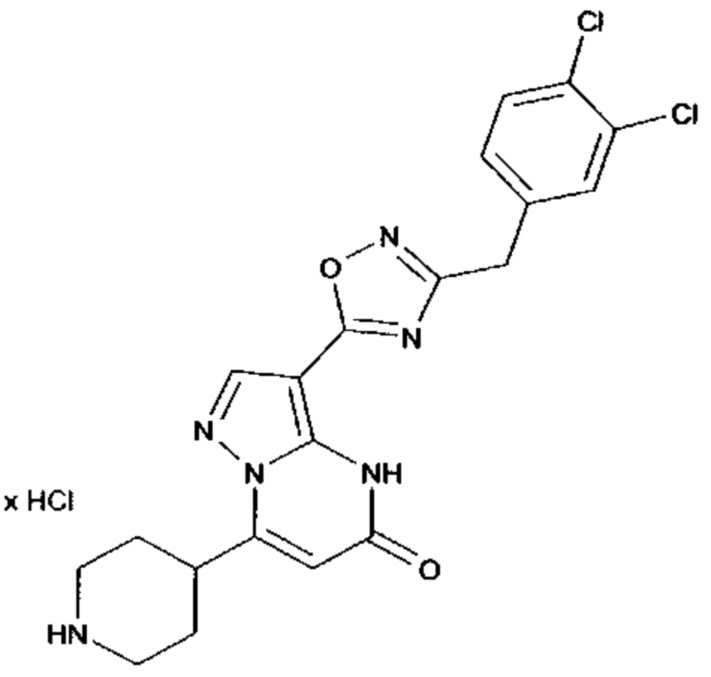
трет-бутил 4-{3-[3-(3,4-дихлорбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (163 мг, 100% чистота, 299 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 210.
Полученное количество составило 102 мг (100% чистота, 71% теоретический выход).
LC-MS (Способ 8В): Rt=0.91 мин; MS (ESIpos): m/z=445 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.893 (1.30), 1.923 (1.41), 2.189 (2.00), 2.222 (1.62), 3.088 (1.48), 3.117 (1.54), 3.568 (16.00), 4.181 (9.99), 7.364 (1.55), 7.385 (1.81), 7.608 (4.43), 7.629 (3.79), 7.673 (2.99), 8.547 (0.97), 8.740 (0.51), 8.936 (0.63).
Пример 214
3-[3-(4-метил бензил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
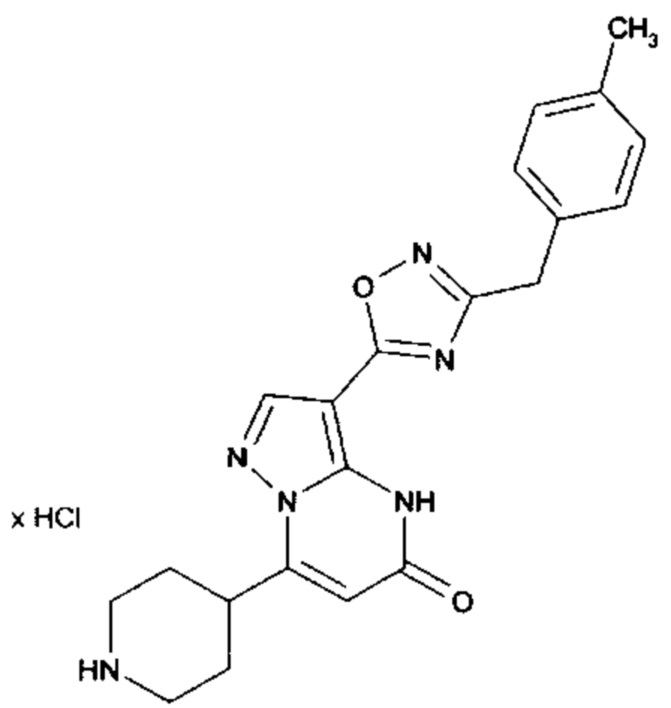
трет-бутил 4-{3-[3-(4-метилбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (130 мг, 100% чистота, 265 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 210.
Полученное количество составило 75.0 мг (100% чистота, 66% теоретический выход).
LC-MS (Способ 8В): Rt=0.85 мин; MS (ESIpos): m/z=391 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (1.29), 0.008 (1.26), 1.875 (1.07), 1.905 (1.17), 2.189 (1.69), 2.222 (1.39), 2.272 (16.00), 3.089 (1.23), 3.118 (1.29), 3.390 (1.94), 3.422 (1.53), 3.568 (2.83), 4.065 (8.86), 7.133 (3.33), 7.153 (5.41), 7.217 (4.61), 7.237 (2.96), 8.535 (0.55), 8.851 (0.48).
Пример 215
3-[3-(1-фенилэтил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
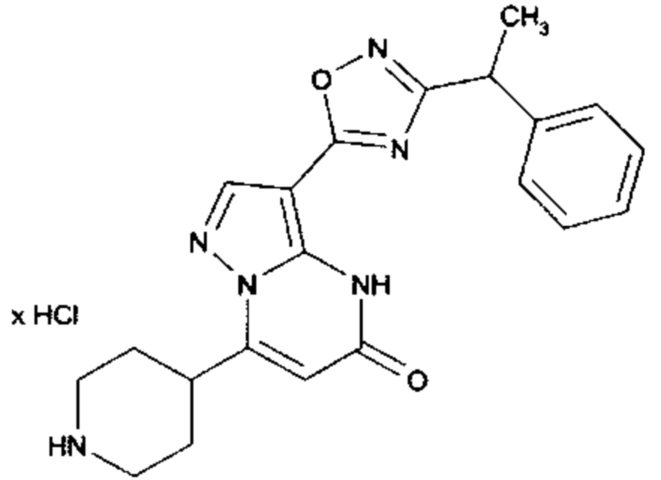
трет-бутил 4-{5-оксо-3-[3-(1-фенилэтил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (56.0 мг, 100% чистота, 114 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 210.
Полученное количество составило 36.0 мг (97% чистота, 72% теоретический выход).
LC-MS (Способ 8В): Rt=0.82 мин; MS (ESIpos): m/z=391 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (0.41), 0.008 (0.44), 1.416 (0.32), 1.596 (0.16), 1.644 (1.89), 1.662 (1.91), 1.846 (0.10), 1.878 (0.29), 1.909 (0.31), 1.936 (0.13), 2.185 (0.44), 2.218 (0.36), 3.057 (0.12), 3.087 (0.33), 3.115 (0.34), 3.146 (0.15), 3.388 (0.58), 3.568 (16.00), 4.342 (0.15), 4.360 (0.53), 4.378 (0.52), 4.396 (0.15), 6.232 (0.06), 7.234 (0.17), 7.251 (0.49), 7.269 (0.38), 7.320 (0.51), 7.340 (1.19), 7.358 (0.88), 7.376 (0.99), 7.394 (0.45), 8.530 (0.19), 8.661 (0.10), 8.869 (0.13).
Пример 216
3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло [1,5-а]пиримидин-5(4Н)-он гидрохлорид

Соединение трет-бутил 4-{3-[5-(2-фторфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (345 мг, 53% чистота, 381 мкмоль) растворили в 1,4-диоксане (4.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (4.0 мл). Суспензию отфильтровали, промыли простым диэтиловым эфиром (2.0 мл), перекристаллизовали из смеси метанола и простого диэитлового эфира, отфильтровали и высушивали в вакууме с получением соединения, указанного в названии.
Полученное количество составило 50.0 мг (100% чистота, 32% теоретический выход).
LC-MS (Способ 8В): Rt=0.81 мин; MS (ESIpos): m/z=381 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (10.47), 0.008 (9.50), 1.892 (6.96), 1.924 (7.51), 2.137 (4.55), 2.216 (10.29), 2.249 (8.49), 3.103 (7.73), 3.132 (7.82), 3.200 (2.35), 3.248 (2.35), 3.403 (13.16), 3.435 (9.80), 3.600 (4.76), 6.102 (3.42), 7.497 (6.87), 7.515 (14.38), 7.534 (9.19), 7.549 (8.24), 7.577 (7.51), 7.785 (3.11), 7.799 (5.74), 7.819 (5.59), 7.833 (2.72), 8.441 (16.00), 8.680 (2.05), 8.894 (2.60).
Пример 217
3-[5-(3-хлорбензил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
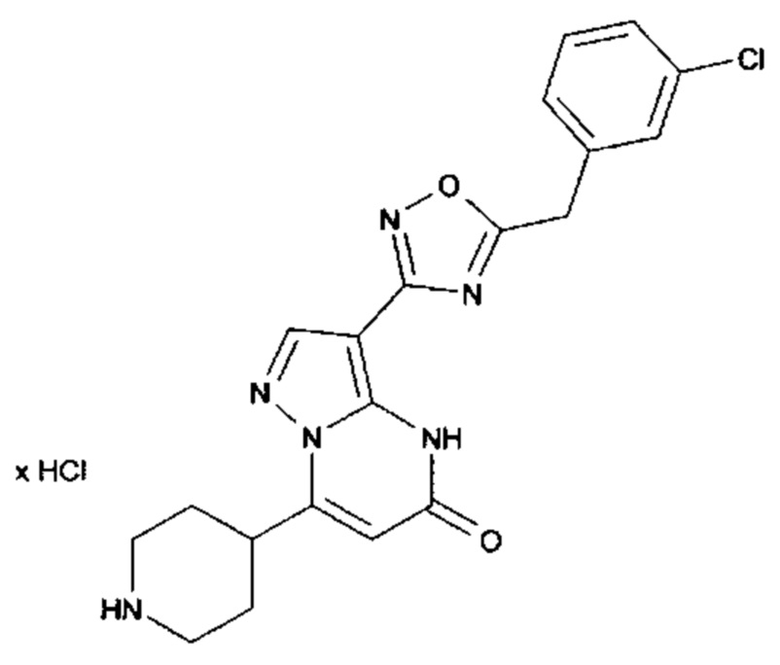
трет-бутил 4-{3-[5-(3-хлорбензил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (52.0 мг, 92% чистота, 93.6 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 35.0 мг (89% чистота, 74% теоретический выход).
LC-MS (Способ 8В): Rt=0.83 мин; MS (ESIneg): m/z=409 [M-H-xHCl]-
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.854 (1.22), 1.235 (12.31), 1.356 (2.66), 1.868 (2.20), 1.898 (2.35), 2.192 (3.40), 2.226 (2.70), 2.671 (0.60), 3.112 (2.06), 3.389 (3.92), 3.420 (3.15), 3.474 (0.87), 3.594 (2.21), 3.681 (1.36), 3.701 (1.56), 3.916 (4.15), 4.469 (16.00), 5.755 (0.69), 6.081 (0.47), 7.149 (0.76), 7.264 (1.22), 7.317 (1.27), 7.335 (0.96), 7.400 (6.99), 7.406 (7.40), 7.410 (7.95), 7.427 (2.31), 7.447 (1.13), 7.520 (5.21), 8.339 (2.08), 8.610 (0.70), 8.839 (0.87), 11.295 (0.55).
Пример 218
3-[5-(3-хлор-2-фторфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-{3-[5-(3-хлор-2-фторфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (80.0 мг, 100% чистота, 155 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 61.0 мг (100% чистота, 87% теоретический выход).
LC-MS (Способ 8В): Rt=0.87 мин; MS (ESIneg): m/z=413 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.141 (0.06), 0.000 (0.55), 0.016 (0.50), 0.154 (0.06), 1.118(0.12), 1.604 (0.07), 1.890 (0.17), 1.921 (0.18), 2.226 (0.27), 2.259 (0.22), 2.336 (0.06), 2.678 (0.06), 3.116 (0.18), 3.144 (0.19), 3.416 (0.28), 3.445 (0.23), 3.576 (16.00), 6.111 (0.05), 7.526 (0.20), 7.546 (0.41), 7.566 (0.22), 7.985 (0.15), 7.989 (0.17), 8.007 (0.27), 8.023 (0.15), 8.027 (0.14), 8.456 (0.26), 8.822 (0.07), 11.646 (0.06).
Пример 219
3-[5-(2-метоксифенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
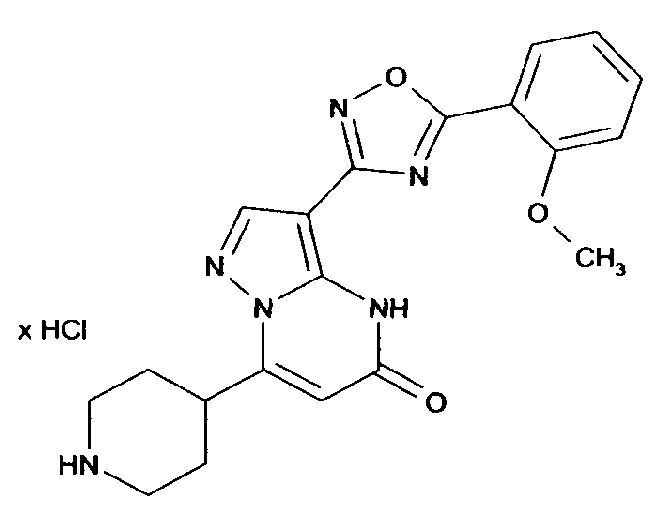
трет-бутил 4-{3-[5-(2-метоксифенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (37.0 мг, 100% чистота, 75.1 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 22.0 мг (99% чистота, 68% теоретический выход).
LC-MS (Способ 8В): Rt=0.81 мин; MS (ESIneg): m/z=391 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.08), 0.000 (16.00), 0.008 (0.56), 1.882 (0.16), 1.913 (0.17), 2.215 (0.25), 2.247 (0.20), 2.328 (0.08), 2.670 (0.09), 3.104 (0.19), 3.131 (0.19), 3.968 (2.52), 6.078 (0.09), 7.178 (0.17), 7.197 (0.34), 7.216 (0.18), 7.319 (0.32), 7.340 (0.36), 7.679 (0.16), 7.701 (0.24), 7.719 (0.13), 8.263 (0.10), 8.409 (0.32), 8.605 (0.05), 8.830 (0.07).
Пример 220
3-[5-(4-метилфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
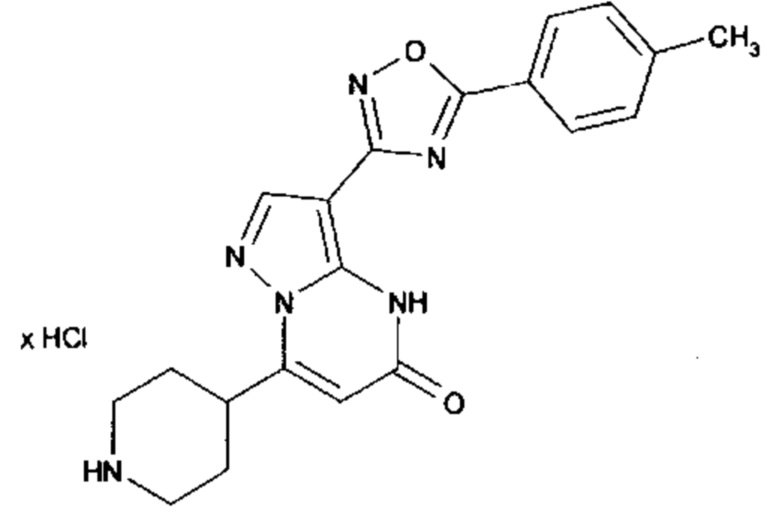
трет-бутил 4-{3-[5-(4-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (37.0 мг, 94% чистота, 73.0 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 25.0 мг (96% чистота, 80% теоретический выход).
LC-MS (Способ 8В): Rt=0.91 мин; MS (ESIpos): m/z=377 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.880 (1.51), 1.912 (1.60), 2.216 (2.35), 2.248 (2.07), 2.444 (16.00), 3.105 (1.78), 3.133 (1.94), 3.245 (2.30), 3.568 (4.79), 6.090 (0.62), 7.473 (4.96), 7.494 (5.27), 8.180 (3.27), 8.199 (3.07), 8.426 (2.38), 8.593 (0.52), 8.822 (0.59).
Пример 221
5-[5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]-1,2,4-оксадиазол-3-карбоновой кислоты гидрохлорид
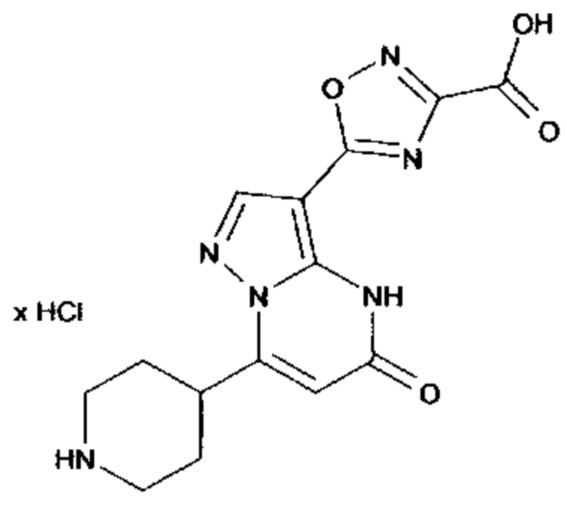
5-{7-[1-(тирет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил}-1,2,4-оксадиазол-3-карбоновая кислота (36.0 мг, 99% чистота, 82.8 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 27.0 мг (94% чистота, 84% теоретический выход).
LC-MS (Способ 1B): Rt=0.16 мин; MS (ESIpos): m/z=331 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.073 (1.11), 1.091 (2.23), 1.108(1.13), 1.884 (0.64), 1.915 (1.09), 1.945 (1.10), 2.208 (1.56), 2.242 (1.23), 3.101 (1.37), 3.128 (1.40), 3.375 (3.69), 3.393 (4.73), 3.568 (16.00), 3.639 (0.68), 6.054 (0.37), 6.350 (0.34), 8.669 (1.25), 8.937 (0.45).
Пример 222
7-(пиперидин-4-ил)-3-{3-[3-(трифторметил)бензил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
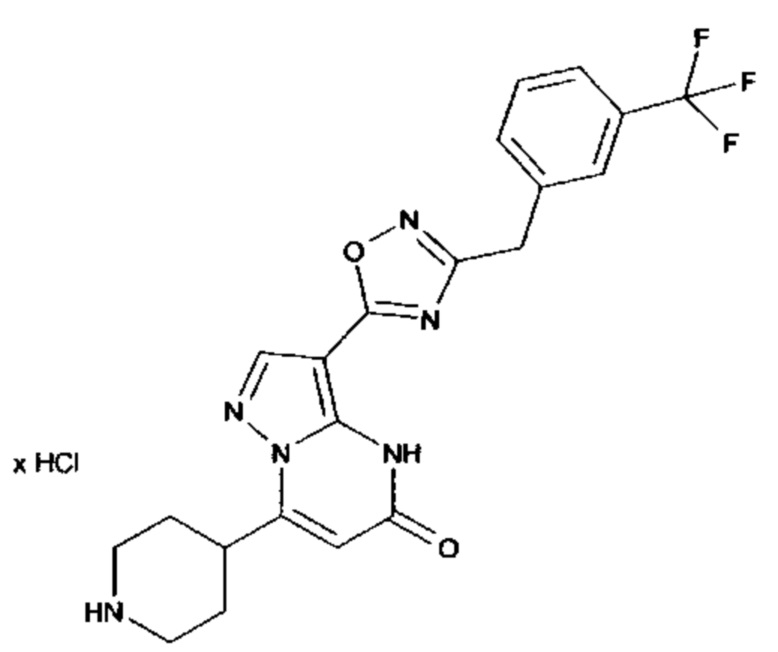
Соединение трет-бутил 4-(5-оксо-3-{3-[3-(трифторметил)бензил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (41.0 мг, 100% чистота, 75.3 мкмоль) растворили в 1,4-диоксане (2.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (2.0 мл). Суспензию концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии.
Полученное количество составило 38.0 мг (95% чистота, количественный выход)
LC-MS (Способ 8В): Rt=0.90 мин; MS (ESIpos): m/z=445 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.09), -0.008 (0.90), 0.000 (16.00), 0.008 (0.41), 0.146 (0.07), 1.870 (0.08), 1.901 (0.08), 2.189 (0.11), 2.223 (0.09), 3.094 (0.09), 3.123 (0.09), 4.278 (0.60), 7.577 (0.05), 7.597 (0.15), 7.616 (0.15), 7.646 (0.15), 7.673 (0.12), 7.692 (0.09), 7.752 (0.18), 8.546 (0.06), 8.804 (0.04).
Пример 223
3-[3-(2-фенилпропан-2-ил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
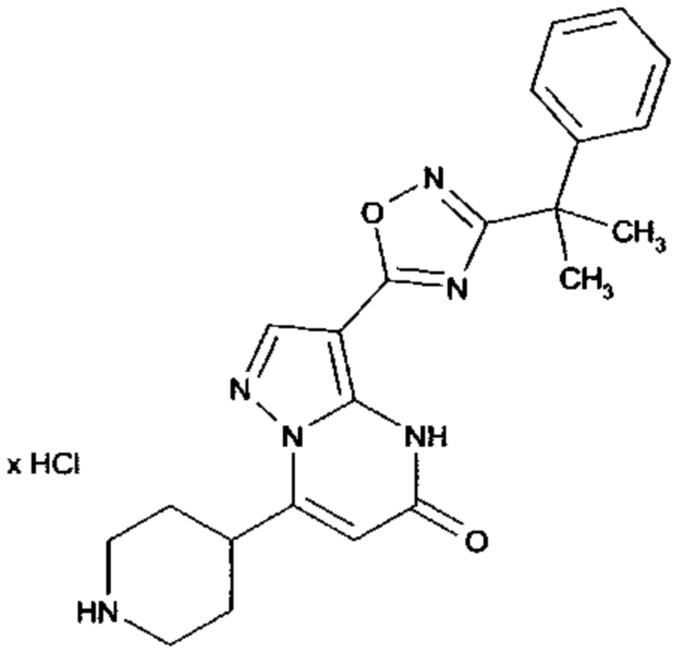
трет-бутил 4-{5-оксо-3-[3-(2-фенилпропан-2-ил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (10.0 мг, 100% чистота, 19.8 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 8.00 мг (100% чистота, 92% теоретический выход).
LC-MS (Способ 8В): Rt=0.89 мин; MS (ESIpos): m/z=405 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.25), -0.008 (2.46), 0.008 (2.07), 0.146 (0.25), 1.235 (0.33), 1.752 (16.00), 1.874 (0.71), 1.906 (0.81), 2.179 (1.16), 2.212 (0.94), 3.083 (0.85), 3.112 (0.89), 3.390 (4.59), 3.492 (0.53), 3.508 (0.45), 3.593 (0.44), 3.699 (0.23), 4.020 (0.27), 4.318 (0.21), 6.222 (0.13), 7.230 (0.91), 7.245 (0.74), 7.251 (0.54), 7.305 (0.72), 7.326 (3.37), 7.341 (6.91), 8.507 (0.57), 8.708 (0.21), 8.904 (0.29).
Пример 224
3-[3-(4-фторбензил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
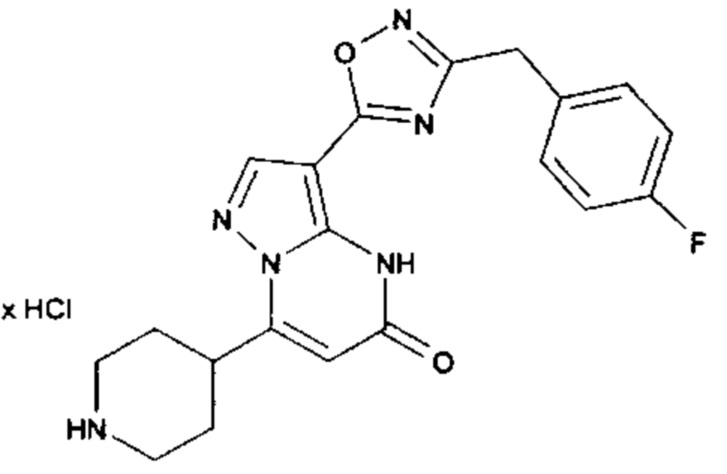
трет-бутил 4-{3-[3-(4-фторбензил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (96.0 мг, 98% чистота, 190 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 67.0 мг (99% чистота, 81% теоретический выход).
LC-MS (Способ 8В): Rt=0.78 мин; MS (ESIpos): m/z=395 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.59), -0.008 (5.80), 0.008 (4.56), 0.146 (0.58), 1.091 (0.34), 1.861 (0.78), 1.892 (2.08), 1.919 (2.25), 1.948 (0.97), 2.188 (3.20), 2.221 (2.60), 2.367 (0.36), 2.711 (0.39), 3.087 (2.27), 3.115 (2.36), 3.387 (3.58), 3.419 (2.79), 3.568 (6.33), 3.601 (1.01), 4.128 (16.00), 6.244 (0.34), 7.149 (4.64), 7.171 (9.88), 7.194 (5.65), 7.384 (3.75), 7.398 (4.47), 7.405 (4.02), 7.419 (3.18), 8.541 (1.24), 8.734 (0.84), 8.917 (1.04).
Пример 225
3-[5-(2-метилфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-{3-[5-(2-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (56.0 мг, 100% чистота, 118 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 44.0 мг (100% чистота, 91% теоретический выход).
LC-MS (Способ 8B): Rt=0.89 мин; MS (ESIpos): m/z=377 [M+H-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (1.63), 0.008 (1.70), 1.894 (1.15), 1.925 (1.27), 2.216 (1.87), 2.250 (1.53), 2.328 (0.22), 2.443 (0.59), 2.671 (0.23), 2.716 (16.00), 3.105 (1.28), 3.134 (1.35), 3.403 (2.01), 3.433 (1.61), 3.601 (0.91), 6.097 (0.92), 7.456 (0.90), 7.475 (2.15), 7.495 (2.77), 7.515 (2.41), 7.591 (1.37), 7.608 (1.89), 7.626 (0.74), 8.221 (1.41), 8.239 (1.36), 8.425 (2.77), 8.665 (0.24), 8.880 (0.31), 11.483 (0.31).
Пример 226
3-[5-(3-хлорфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
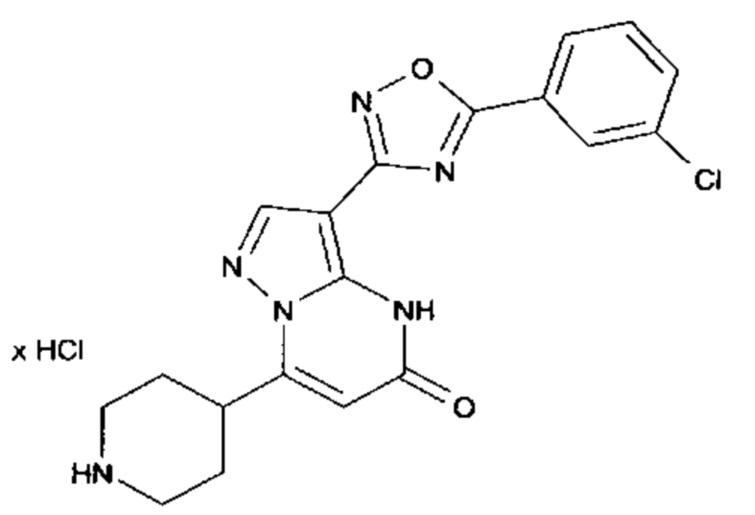
Соединение трет-бутил 4-{3-[5-(3-хлорфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (649 мг, 24% чистота, 313 мкмоль) растворили в 1,4-диоксане (4.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (4.0 мл). Суспензию отфильтровали, промыли простым диэтиловым эфиром (4.0 мл), перекристаллизовали из смеси метанола и простого диэитлового эфира, растворили в воде/ацетонитриле и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% трифторуксусной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 12.0 мг (100% чистота, 9% теоретический выход).
LC-MS (Способ 8В): Rt=0.96 мин; MS (ESIpos): m/z=397 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.881 (7.46), 1.912 (8.18), 2.215 (11.39), 2.249 (9.49), 3.104 (8.41), 3.133 (8.50), 3.405 (13.38), 3.436 (10.67), 3.592 (4.97), 6.087 (3.44), 7.686 (7.05), 7.706 (16.00), 7.726 (10.40), 7.816 (10.67), 7.833 (7.77), 8.239 (8.05), 8.258 (7.64), 8.447 (11.98), 8.838 (3.53), 11.716 (2.12).
Пример 227
7-(пиперидин-4-ил)-3-{5-[3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
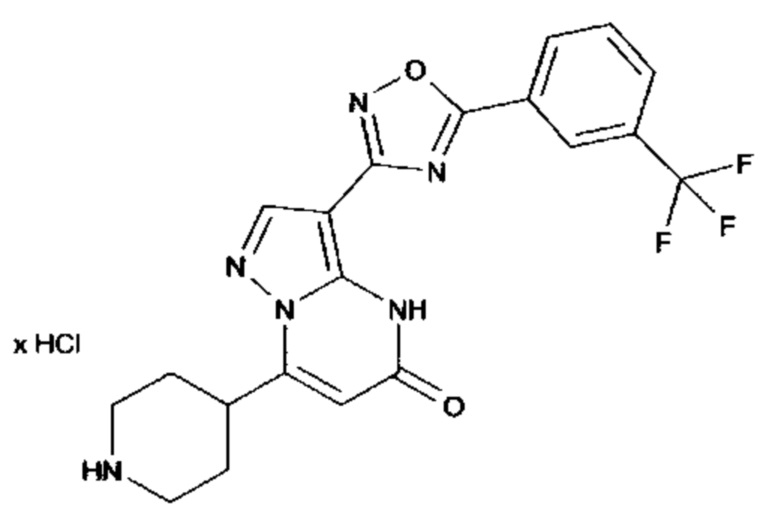
трет-бутил 4-(5-оксо-3-{5-[3-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (51.0 мг, 99% чистота, 95.2 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 31.0 мг (100% чистота, 70% теоретический выход).
LC-MS (Способ 8В): Rt=0.98 мин; MS (ESIpos): m/z=431 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.008 (13.57), 1.091 (4.58), 1.886 (7.73), 1.920 (8.36), 2.219 (12.67), 2.252 (10.61), 3.104 (8.36), 3.133 (8.63), 3.407 (13.48), 3.437 (11.06), 3.568 (7.91), 3.597 (5.03), 6.093 (2.88), 7.912 (7.19), 7.931 (16.00), 7.951 (9.35), 8.122 (12.31), 8.141 (10.52), 8.469 (8.81), 8.591 (9.35), 8.612 (13.66), 8.855 (2.34), 11.737 (3.15).
Пример 228
3-(5-бензил-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
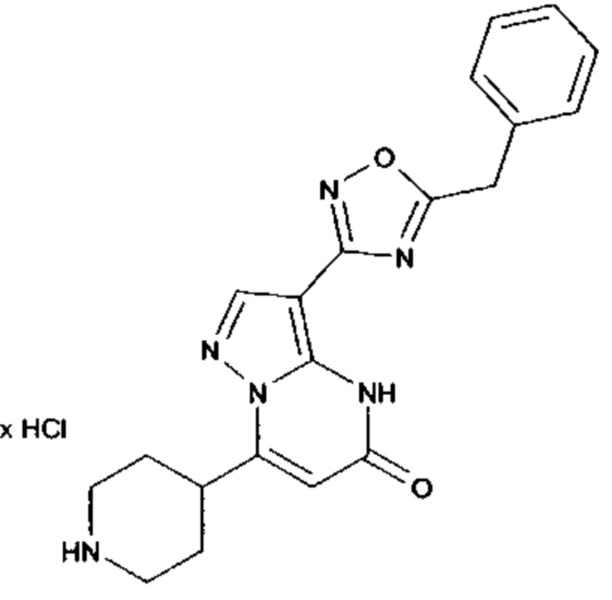
трет-бутил 4-[3-(5-бензил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (116 мг, 86% чистота, 209 мкмоль)
4Н соляная кислота в 1,4-диоксане (3.0 мл)
1,4-диоксан (3.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 89.0 мг (97% чистота, количественный выход)
LC-MS (Способ 8В): Rt=0.80 мин; MS (ESIpos): m/z=377 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (0.82), 0.000 (16.00), 0.008 (0.74), 1.091 (0.16), 1.417 (0.18), 1.596 (0.23), 1.730 (0.17), 1.876 (0.41), 1.906 (0.44), 2.137 (0.50), 2.191 (0.65), 2.224 (0.52), 2.671 (0.11), 3.081 (0.49), 3.110 (0.49), 3.205 (0.37), 3.414 (0.70), 3.568 (3.27), 4.427 (3.81), 6.075 (0.13), 7.298 (0.26), 7.314 (0.52), 7.322 (0.39), 7.330 (0.51), 7.335 (0.38), 7.361 (0.54), 7.381 (1.86), 7.393 (1.96), 7.398 (3.75), 7.413 (0.35), 8.341 (0.49), 8.721 (0.11), 8.908 (0.13), 11.261 (0.07).
Пример 229
3-[5-(3-хлор-2-метилфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
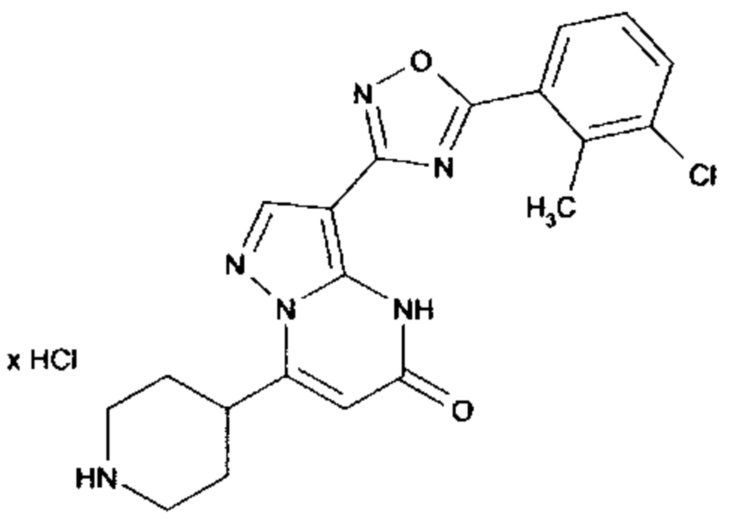
трет-бутил 4-{3-[5-(3-хлор-2-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (36.0 мг, 100% чистота, 70.5 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 31.0 мг (99% чистота, 97% теоретический выход).
LC-MS (Способ 8В): Rt=0.96 мин; MS (ESIpos): m/z=411 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.885 (1.16), 1.918 (1.25), 2.216 (1.88), 2.251 (1.61), 2.328 (0.43), 2.367 (0.39), 2.670 (0.40), 2.709 (0.50), 2.730 (16.00), 3.081 (0.51), 3.104 (1.33), 3.138 (1.43), 3.163 (0.59), 3.402 (2.42), 3.434 (1.76), 3.567 (10.80), 3.602 (0.83), 6.110 (0.67), 7.486 (1.24), 7.505 (2.64), 7.525 (1.44), 7.801 (2.34), 7.821 (2.12), 8.130 (1.33), 8.148 (1.33), 8.433 (2.37), 8.837 (0.39), 11.577 (0.35).
Пример 230
3-[5-(5-хлор-2-метилфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
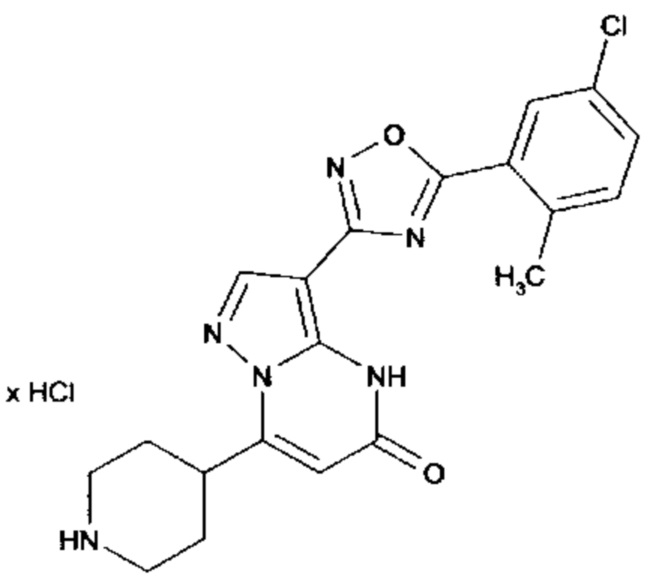
трет-бутил 4-{3-[5-(5-хлор-2-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (50.0 мг, 100% чистота, 97.9 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 26.0 мг (100% чистота, 59% теоретический выход).
LC-MS (Способ 8В): Rt=0.97 мин; MS (ESIpos): m/z=411 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.40), 0.008 (3.26), 0.146 (0.41), 1.894 (1.29), 1.926 (1.41), 2.215 (1.96), 2.248 (1.59), 2.686 (16.00), 3.103 (1.43), 3.131 (1.45), 3.425 (6.89), 3.568 (5.03), 3.599 (1.01), 6.101 (1.06), 7.532 (2.22), 7.553 (2.96), 7.665 (1.94), 7.670 (1.95), 7.685 (1.43), 7.691 (1.44), 8.342 (1.45), 8.438 (3.05), 8.714 (0.42), 8.919 (0.56), 11.634 (0.23).
Пример 231
7-(пиперидин-4-ил)-3-{5-[4-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
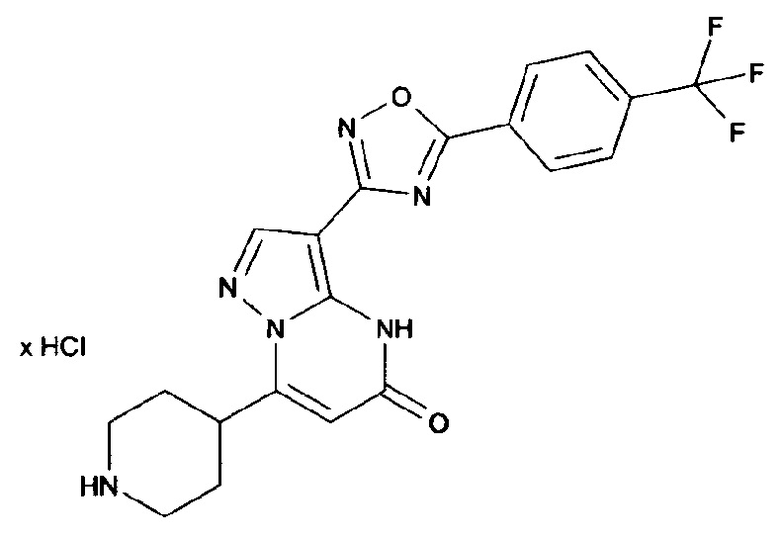
трет-бутил 4-(5-оксо-3-{5-[4-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (57.0 мг, 100% чистота, 107 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 38.0 мг (98% чистота, 74% теоретический выход).
LC-MS (Способ 8В): Rt=0.91 мин; MS (ESIneg): m/z=429 [М-Н-xHCl]-
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.11), 0.146 (0.12), 1.909 (0.71), 1.941 (0.79), 1.971 (0.32), 2.215 (1.17), 2.248 (0.95), 3.100 (0.76), 3.128 (0.79), 3.400 (1.19), 3.431 (0.95), 3.568 (16.00), 3.598 (0.56), 6.098 (0.51), 8.044 (2.11), 8.064 (2.33), 8.457 (1.41), 8.520 (1.61), 8.540 (1.49), 8.827 (0.18), 8.994 (0.23), 11.738 (0.26).
Пример 232
3-{5-[2-хлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
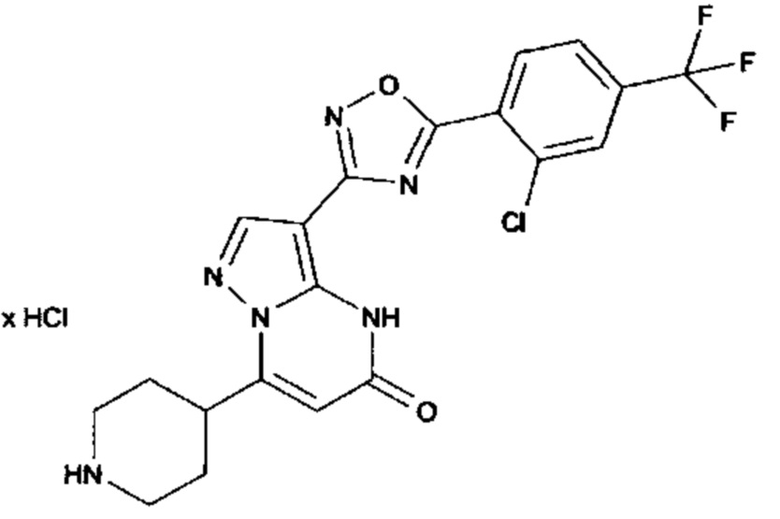
трет-бутил 4-(3-{5-[2-хлор-4-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (51.0 мг, 99% чистота, 89.4 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 32.0 мг (98% чистота, 70% теоретический выход).
LC-MS (Способ 8В): Rt=0.98 мин; MS (ESIpos): m/z=465 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (1.00), 0.000 (16.00), 0.008 (0.55), 1.426 (0.18), 1.868 (0.10), 1.894 (0.26), 1.926 (0.28), 1.957 (0.12), 2.215 (0.40), 2.248 (0.32), 3.072 (0.12), 3.101 (0.29), 3.131 (0.29), 3.160 (0.12), 3.375 (0.16), 3.404 (0.43), 3.434 (0.33), 3.568 (5.27), 3.593 (0.17), 6.096 (0.11), 8.154 (0.54), 8.175 (0.61), 8.431 (0.27), 8.451 (0.26), 8.470 (0.36), 8.694 (0.23), 8.912 (0.12), 11.773 (0.09).
Пример 233
3-[5-(4-хлорфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
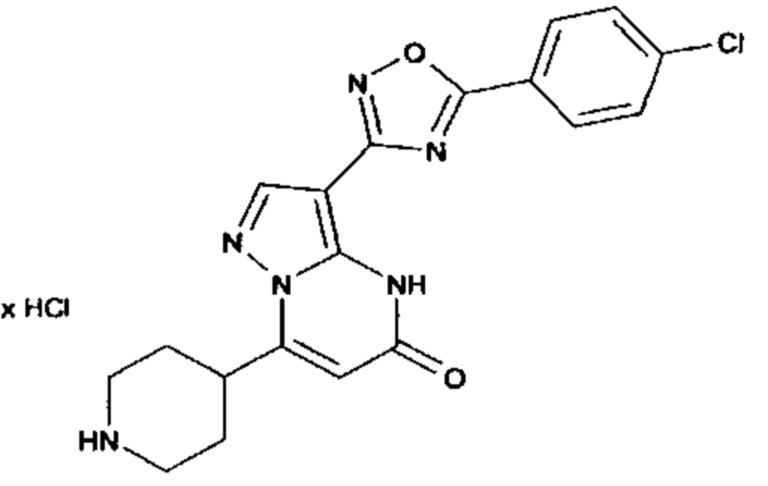
трет-бутил 4-{3-[5-(4-хлорфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (41.0 мг, 96% чистота, 79.2 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 27.0 мг (96% чистота, 76% теоретический выход).
LC-MS (Способ 8В): Rt=0.93 мин; MS (ESIpos): m/z=397 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.08), -0.008 (1.00), 0.000 (16.00), 0.008 (0.55), 0.146 (0.07), 1.091 (0.08), 1.426 (0.18), 1.596 (0.08), 1.894 (0.26), 1.926 (0.28), 1.957 (0.12), 2.215 (0.40), 2.248 (0.32), 3.101 (0.29), 3.131 (0.29), 3.404 (0.43), 3.434 (0.33), 3.568 (5.27), 3.593 (0.17), 6.096 (0.11), 8.154 (0.54), 8.175 (0.61), 8.431 (0.27), 8.451 (0.26), 8.470 (0.36), 8.694 (0.23), 8.912 (0.12), 11.773 (0.09).
Пример 234
3-[5-(3,5-дихлорфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
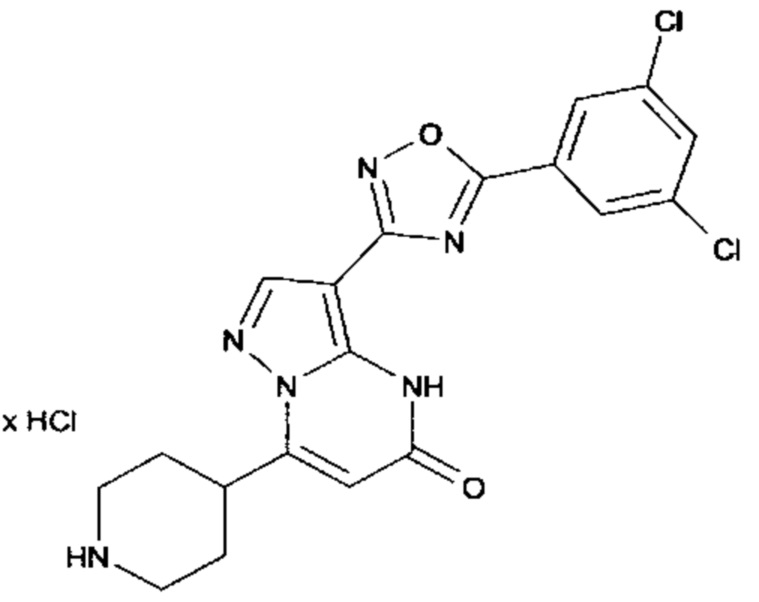
трет-бутил 4-{3-[5-(3,5-дихлорфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (25.0 мг, 77% чистота, 36.2 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 18.2 мг (93% чистота, количественный выход)
LC-MS (Способ 8B): Rt=1.00 мин; MS (ESIpos): m/z=431 [M+H-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.47), 0.008 (4.34), 0.146 (0.48), 1.425 (0.35), 1.884 (1.06), 1.915 (1.16), 2.214 (1.66), 2.248 (1.37), 3.102 (1.20), 3.130 (1.28), 3.403 (1.90), 3.434 (1.48), 3.568 (16.00), 6.079 (0.42), 8.037 (2.25), 8.387 (1.22), 8.454 (1.20), 8.642 (0.30), 8.859 (0.39), 11.742 (0.42).
Пример 235
3-[5-(5-хлор-2-фторфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
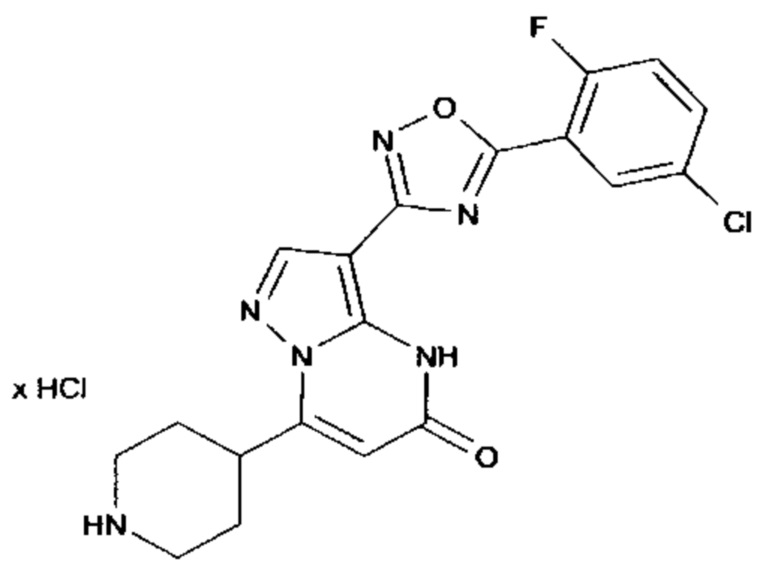
Соединение трет-бутил 4-{3-[5-(5-хлор-2-фторфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (27.0 мг, 87% чистота, 45.6 мкмоль) растворили в 1,4-диоксане (2.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (2.0 мл). Суспензию отфильтровали и промыли простым диэитловым эфиром (2.0 мл). Восстановленное твердое вещество разбавили ацетонитрилом (2.0 мл), суспензию отфильтровали, и фильтрат концентрировали с получением соединения указанного в названии.
Полученное количество составило 12.0 мг (90% чистота, 52% теоретический выход).
LC-MS (Способ 8В): Rt=0.87 мин; MS (ESIneg): m/z=413 [М-Н-xHCl]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.892 (5.22), 1.925 (5.58), 2.074 (9.05), 2.214 (7.82), 2.246 (6.29), 2.739 (15.79), 3.101 (5.89), 3.130 (5.85), 3.402 (10.12), 3.483 (16.00), 6.099 (2.93), 7.598 (4.35), 7.621 (6.87), 7.646 (5.04), 7.861 (4.09), 7.883 (3.52), 8.455 (8.59), 8.585 (2.05), 8.910 (2.45), 11.686 (0.87).
Пример 236
7-(пиперидин-4-ил)-3-{5-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-3-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
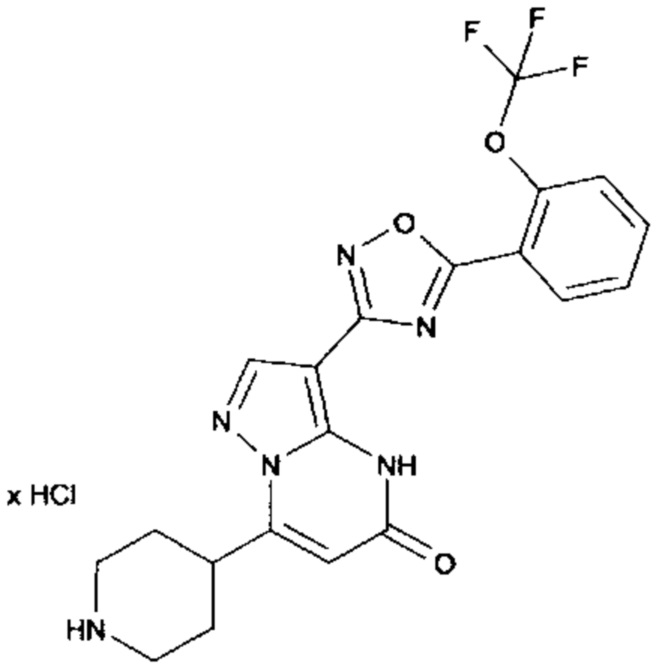
трет-бутил 4-(5-оксо-3-{5-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (45.0 мг, 93% чистота, 76.6 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 34.0 мг (100% чистота, 92% теоретический выход).
LC-MS (Способ 8B): Rt=0.90 мин; MS (ESIpos): m/z=447 [M+H-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.893 (0.80), 1.923 (0.89), 2.215 (1.26), 2.249 (1.05), 3.103 (0.84), 3.132 (0.88), 3.402 (1.30), 3.433 (1.06), 3.568 (16.00), 3.597 (0.53), 6.098 (0.32), 7.712 (1.70), 7.731 (3.17), 7.750 (1.09), 7.875 (0.93), 7.880 (0.93), 7.896 (1.24), 7.915 (0.62), 7.919 (0.61), 8.429 (1.56), 8.553 (0.45), 8.690 (0.25), 8.893 (0.31), 11.539(0.32).
Пример 237
3-[5-(3-хлор-4-метоксифенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
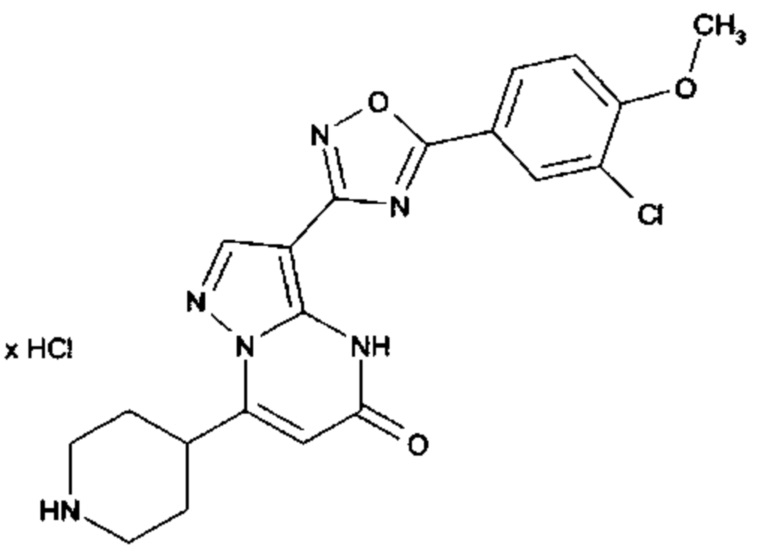
трет-бутил 4-{3-[5-(3-хлор-4-метоксифенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (10.0 мг, 72% чистота, 13.7 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 5.00 мг (100% чистота, 79% теоретический выход).
LC-MS (Способ 8В): Rt=0.89 мин; MS (ESIpos): m/z=427 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.885 (1.19), 1.911 (1.28), 2.213 (1.80), 2.247 (1.47), 3.102 (1.25), 3.130 (1.29), 3.402 (1.87), 3.433 (1.50), 3.585 (0.74), 4.004 (16.00), 6.076 (0.50), 7.407 (2.74), 7.429 (2.94), 8.225 (1.17), 8.247 (1.12), 8.425 (2.45), 8.631 (0.45), 8.843 (0.52), 11.656 (0.54).
Пример 238
3-{3-[гидрокси(фенил)метил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
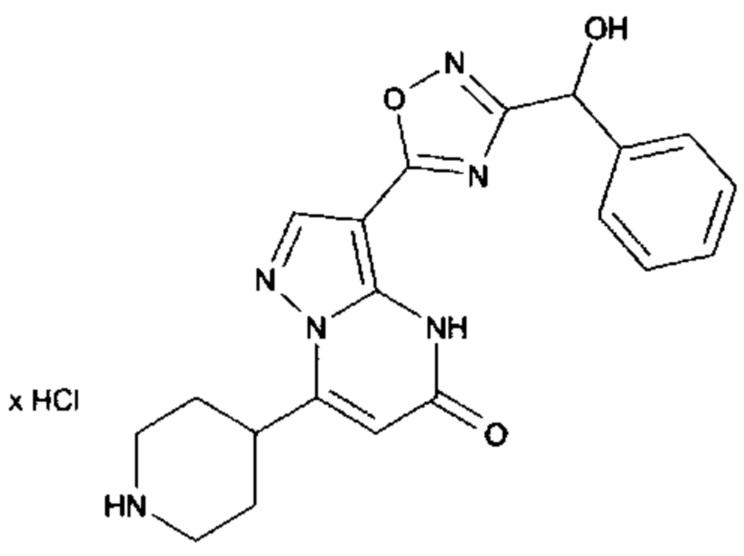
трет-бутил 4-(3-{3-[гидрокси(фенил)метил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (25.0 мг, 85% чистота, 43.1 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 15.0 мг (92% чистота, 75% теоретический выход).
LC-MS (Способ 8В): Rt=0.67 мин; MS (ESIpos): m/z=393 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.08), 0.000 (16.00), 0.146 (0.08), 1.898 (0.09), 2.188 (0.13), 2.220 (0.11), 3.089 (0.11), 3.119 (0.11), 3.568 (0.08), 5.900 (0.34), 6.418 (0.03), 7.282 (0.06), 7.300 (0.18), 7.319 (0.14), 7.355 (0.24), 7.374 (0.40), 7.392 (0.19), 7.485 (0.28), 7.503 (0.22), 8.543 (0.06), 8.811 (0.04).
Пример 239
7-(пиперидин-4-ил)-3-{5-[4-(трифторметокси)бензил]-1,2,4-оксадиазол-3-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
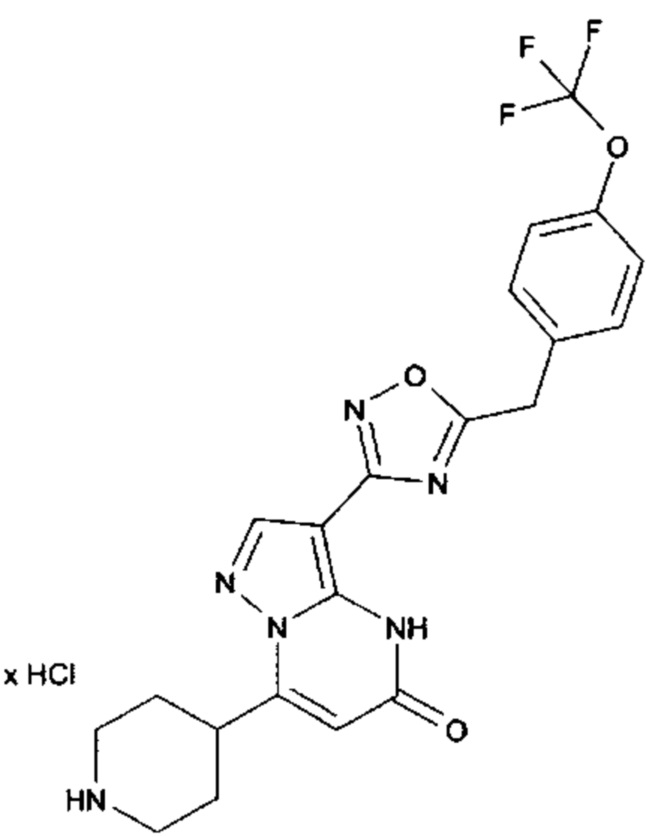
трет-бутил 4-(5-оксо-3-{5-[4-(трифторметокси)бензил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (64.0 мг, 97% чистота, 111 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 58.0 мг (95% чистота, количественный выход)
LC-MS (Способ 8В): Rt=0.95 мин; MS (ESIpos): m/z=461 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.36), -0.008 (3.62), 0.008 (3.43), 0.146 (0.39), 1.235 (1.98), 1.861 (0.72), 1.893 (2.00), 1.918 (2.21), 1.950 (1.02), 2.137 (1.00), 2.188 (3.09), 2.221 (2.51), 2.712 (0.34), 3.080 (2.10), 3.108 (2.19), 3.380 (3.94), 3.413 (2.85), 3.577 (1.30), 3.595 (1.22), 3.633 (0.65), 3.682 (0.37), 3.701 (0.44), 3.949 (0.60), 4.494 (16.00), 6.084 (0.75), 7.295 (1.08), 7.379 (5.58), 7.399 (6.97), 7.545 (9.17), 7.567 (7.16), 8.338 (3.66), 8.804 (0.71), 8.986 (0.88), 11.286 (0.44).
Пример 240
3-[5-(3,5-дифтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиргшидин-5(4Н)-он гидрохлорид
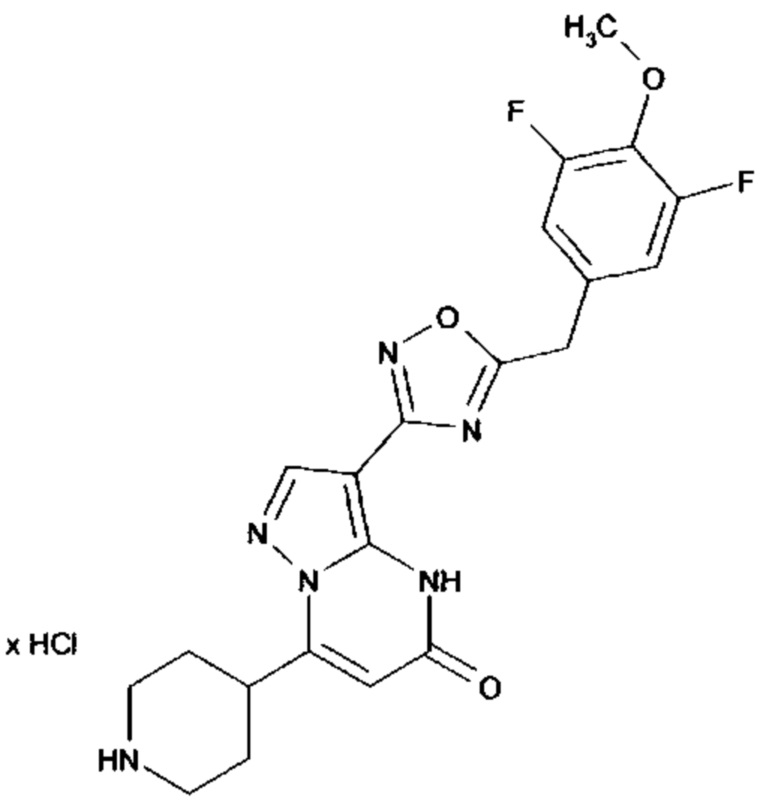
трет-бутил 4-{3-[5-(3,5-дифтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (58.0 мг, 100% чистота, 107 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 53.0 мг (96% чистота, 99% теоретический выход).
LC-MS (Способ 8В): Rt=0.85 мин; MS (ESIpos): m/z=443 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.07), 0.000 (16.00), 0.146 (0.09), 0.853 (0.08), 1.171 (0.09), 1.234 (0.78), 1.469 (0.10), 1.874 (0.28), 1.903 (0.77), 1.932 (0.84), 1.962 (0.37), 2.137 (0.12), 2.188 (1.19), 2.221 (0.93), 2.370 (0.06), 2.674 (0.07), 2.714 (0.07), 3.078 (0.83), 3.106 (0.85), 3.136 (0.36), 3.412 (1.12), 3.476 (0.43), 3.493 (0.42), 3.548 (0.47), 3.577 (0.72), 3.595 (0.50), 3.682 (0.16), 3.702 (0.18), 3.857 (0.10), 3.894 (0.38), 3.918 (8.91), 4.099 (0.06), 4.420 (5.00), 4.648 (0.06), 6.081 (0.44), 7.240 (0.42), 7.254 (2.33), 7.277 (2.32), 7.291 (0.33), 8.340 (1.72), 8.896 (0.27), 9.056 (0.36), 11.300 (0.09).
Пример 241
3-{5-[rас-1-(4-метоксифенил)пропил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
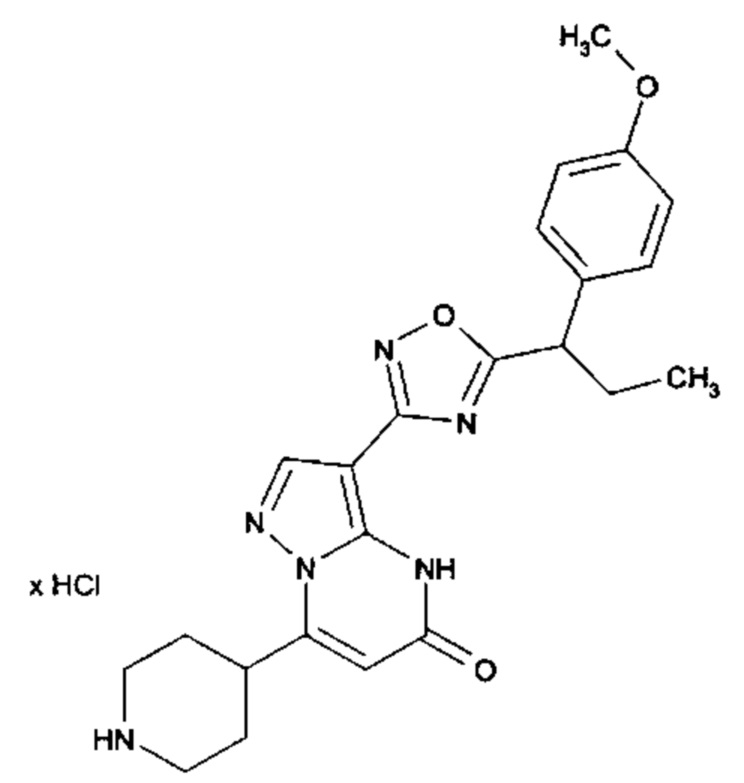
трет-бутил 4-(3-{5-[rас-1-(4-метоксифенил)пропил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (41.0 мг, 93% чистота, 71.3 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 34.0 мг (92% чистота, 93% теоретический выход).
LC-MS (Способ 8В): Rt=0.93 мин; MS (ESIpos): m/z=435 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.08), -0.008 (0.84), 0.000 (16.00), 0.146 (0.07), 0.788 (0.07), 0.806 (0.16), 0.824 (0.08), 0.858 (0.87), 0.877 (1.93), 0.895 (0.90), 1.148 (0.05), 1.235 (0.43), 1.625 (0.05), 1.880 (0.29), 1.910 (0.32), 1.940 (0.17), 2.004 (0.12), 2.023 (0.20), 2.038 (0.21), 2.057 (0.24), 2.076 (0.15), 2.137 (0.41), 2.190 (0.45), 2.226 (0.50), 2.245 (0.29), 2.263 (0.24), 2.279 (0.20), 2.297 (0.12), 2.368 (0.04), 2.674 (0.06), 2.712 (0.05), 3.085 (0.31), 3.113 (0.32), 3.415 (0.50), 3.463 (0.11), 3.474 (0.11), 3.492 (0.10), 3.574 (0.18), 3.594 (0.23), 3.681 (0.09), 3.701 (0.11), 3.727 (0.59), 3.736 (5.47), 4.313 (0.29), 4.332 (0.60), 4.352 (0.27), 4.647 (0.04), 6.068 (0.09), 6.866 (0.08), 6.888 (0.09), 6.919 (1.16), 6.941 (1.28), 7.181 (0.10), 7.202 (0.08), 7.329 (1.10), 7.350 (0.99), 7.968 (0.06), 8.343 (0.32), 8.739 (0.08), 8.955 (0.15), 11.349 (0.07).
Пример 242
3-{5-[2-(4-метоксифенил)пропан-2-ил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
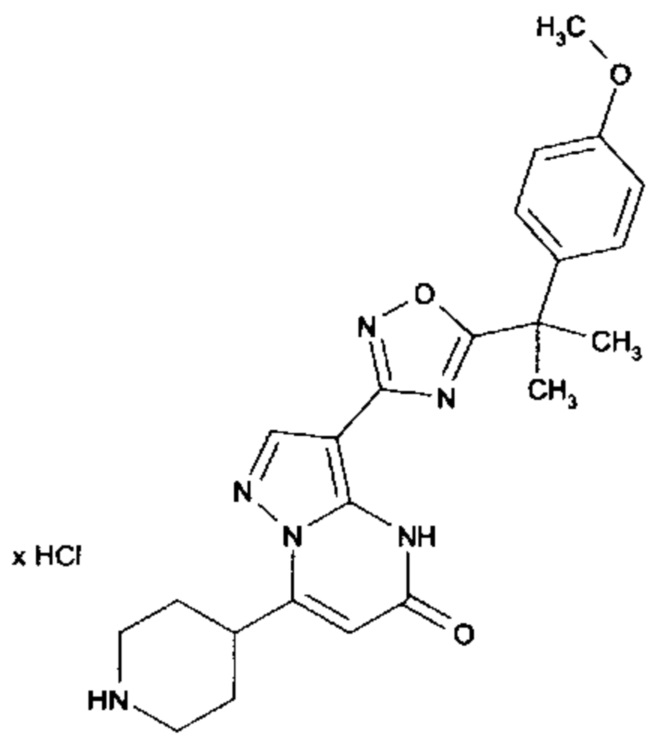
трет-бутил 4-(3-{5-[2-(4-метоксифенил)пропан-2-ил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (30.0 мг, 96% чистота, 53.9 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике как в примере 222.
Полученное количество составило 26.0 мг (99% чистота, количественный выход)
LC-MS (Способ 8В): Rt=0.97 мин; MS (ESIpos): m/z=435 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.17), -0.008 (1.72), 0.008 (1.64), 0.146 (0.17), 1.239 (0.22), 1.254 (0.17), 1.440 (1.52), 1.815 (15.65), 1.884 (0.81), 1.913 (0.87), 1.942 (0.46), 1.975 (0.17), 2.137 (1.08), 2.193 (1.19), 2.227 (0.97), 3.057 (0.30), 3.086 (0.83), 3.115 (0.86), 3.145 (0.37), 3.258 (0.17), 3.418 (1.15), 3.463 (0.25), 3.474 (0.27), 3.491 (0.24), 3.503 (0.21), 3.551 (0.37), 3.579 (0.52), 3.593 (0.65), 3.667 (0.17), 3.671 (0.18), 3.681 (0.22), 3.701 (0.27), 3.713 (0.24), 3.729 (2.04), 3.734 (16.00), 6.065 (0.31), 6.868 (0.22), 6.890 (0.32), 6.895 (0.38), 6.903 (3.29), 6.908 (1.21), 6.920 (1.23), 6.925 (3.76), 6.933 (0.48), 7.243 (0.27), 7.265 (0.27), 7.285 (3.17), 7.307 (2.94), 8.339 (1.03), 8.748 (0.25), 8.955 (0.39), 11.394 (0.20).
Пример 243
7-(пиперидин-4-ил)-3-[5-(тетрагидро-2Н-пиран-4-ил)-1,2,4-оксадиазол-3-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
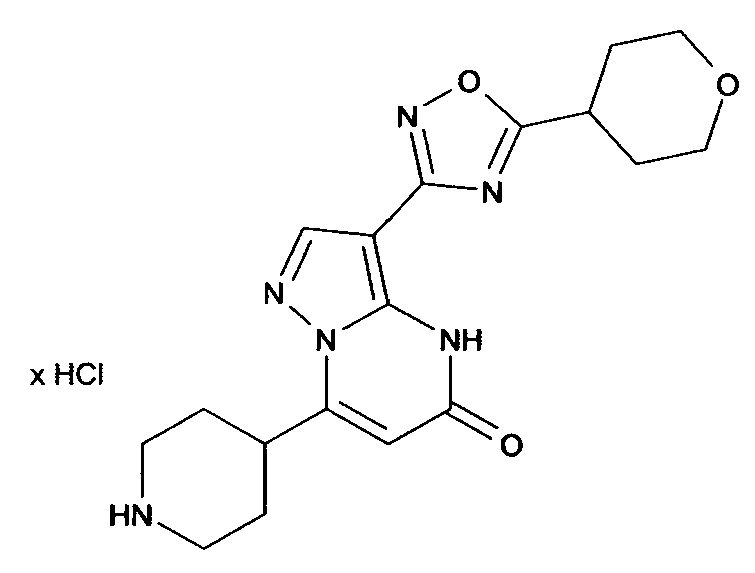
трет-бутил 4-{5-оксо-3-[5-(тетрагидро-2Н-пиран-4-ил)-1,2,4-оксадиазол-3-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (58.0 мг, 94% чистота, 116 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 46.0 мг (100% чистота, 98% теоретический выход).
LC-MS (Способ 1B): Rt=0.46 мин; MS (ESIpos): m/z=371 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (13.67), 0.008 (12.31), 1.806 (2.33), 1.817(2.64), 1.840 (6.22), 1.845 (7.62), 1.868 (9.69), 1.879(11.11), 1.895 (7.76), 1.907 (6.85), 1.918 (6.39), 1.947 (2.76), 1.999 (9.63), 2.004 (9.83), 2.031 (6.79), 2.037 (6.48), 2.137 (1.53), 2.195 (8.84), 2.229 (7.22), 3.055 (2.30), 3.085 (6.34), 3.113 (6.54), 3.143 (2.67), 3.357 (2.30), 3.367 (4.80), 3.385 (12.02), 3.395 (14.10), 3.405 (7.87), 3.413 (8.47), 3.422 (10.06), 3.470 (7.25), 3.475 (9.35), 3.498 (15.80), 3.504 (16.00), 3.527 (9.46), 3.532 (8.44), 3.548 (3.61), 3.578 (5.94), 3.608 (5.31), 3.656 (5.83), 3.667 (6.37), 3.681 (6.42), 3.699 (5.91), 3.709 (5.09), 3.713 (5.09), 3.899 (6.85), 3.907 (10.74), 3.915 (8.27), 3.927 (7.22), 3.935 (9.32), 3.944 (6.00), 6.076 (3.75), 8.346 (13.10), 8.761 (1.56), 8.952 (1.99), 11.331 (0.40).
Пример 244
3-{5-[4-(дифторметокси)бензил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
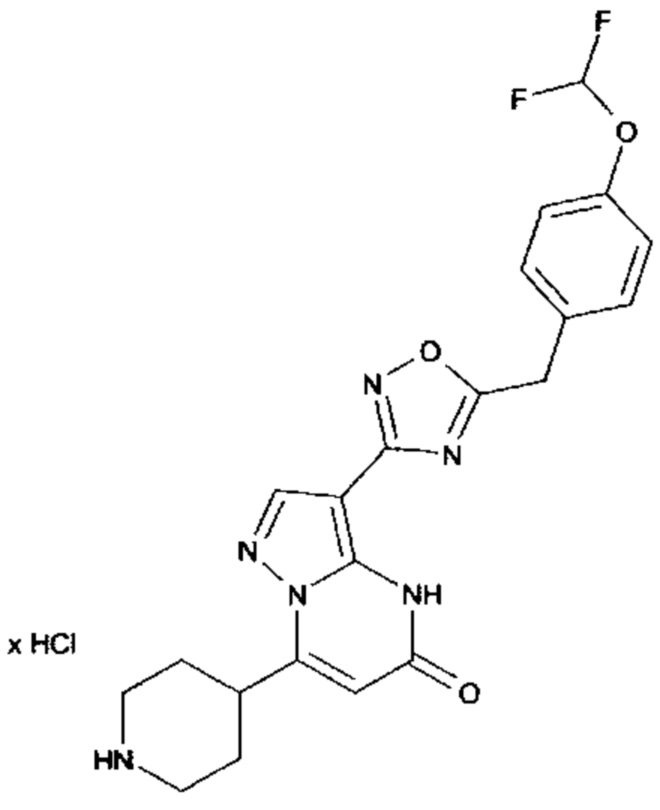
трет-бутил 4-(3-{5-[4-(дифторметокси)бензил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (38.0 мг, 98% чистота, 68.6 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 33.0 мг (100% чистота, количественный выход)
LC-MS (Способ 8B): Rt=0.90 мин; MS (ESIpos): m/z=443 [M+H-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.860 (0.81), 1.890 (2.36), 1.920 (2.66), 1.949 (1.20), 2.189 (3.56), 2.222 (3.05), 3.051 (0.93), 3.078 (2.55), 3.108 (2.74), 3.125 (1.75), 3.137 (1.27), 3.410 (4.85), 3.463 (0.71), 3.475 (0.68), 3.492 (0.61), 3.503 (0.52), 3.546 (0.95), 3.575 (1.57), 3.595 (1.67), 3.682 (0.51), 3.701 (0.56), 4.439 (16.00), 6.083 (0.84), 7.049 (2.89), 7.182 (7.15), 7.203 (8.62), 7.234 (5.86), 7.419 (2.92), 7.460 (8.12), 7.482 (7.25), 8.336 (2.89), 8.802 (0.73), 8.988 (0.98), 11.284 (0.36).
Пример 245
3-{5-[1-(4-метоксифенил)циклопропил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4H)-он гидрохлорид
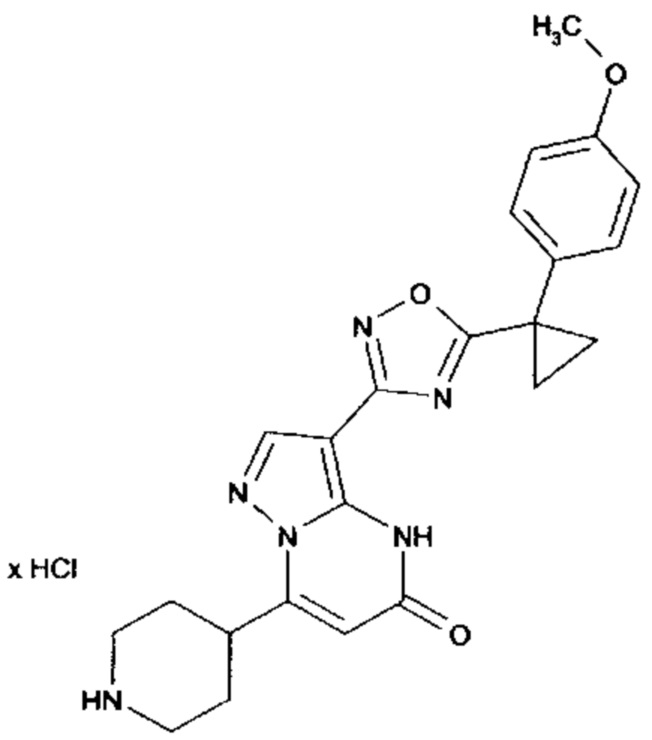
трет-бутил 4-(3-{5-[1-(4-метоксифенил)циклопропил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (41.0 мг, 100% чистота, 77.0 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 36.0 мг (100% чистота, количественный выход)
LC-MS (Способ 8В): Rt=0.95 мин; MS (ESIpos): m/z=433 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (0.81), 0.000 (16.00), 0.008 (0.74), 1.531 (0.64), 1.543 (1.77), 1.549 (1.76), 1.560 (0.78), 1.820 (0.67), 1.830 (1.59), 1.836 (1.55), 1.847 (0.76), 1.876 (0.58), 1.882 (0.59), 1.908 (0.63), 1.939 (0.29), 1.946 (0.24), 2.179 (0.87), 2.212 (0.71), 3.046 (0.21), 3.074 (0.57), 3.103 (0.60), 3.131 (0.25), 3.378 (0.94), 3.409 (0.74), 3.531 (0.23), 3.560 (0.42), 3.593 (0.41), 3.775 (10.71), 6.044 (0.46), 6.937 (0.28), 6.945 (2.32), 6.961 (0.90), 6.966 (2.58), 6.974 (0.33), 7.392 (0.32), 7.399 (2.59), 7.403 (0.91), 7.416 (0.85), 7.421 (2.35), 7.428 (0.30), 8.270 (1.48), 8.801 (0.19), 8.955 (0.22), 8.971 (0.25), 11.288 (0.21).
Пример 246
3-[5-(2-фтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ид)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
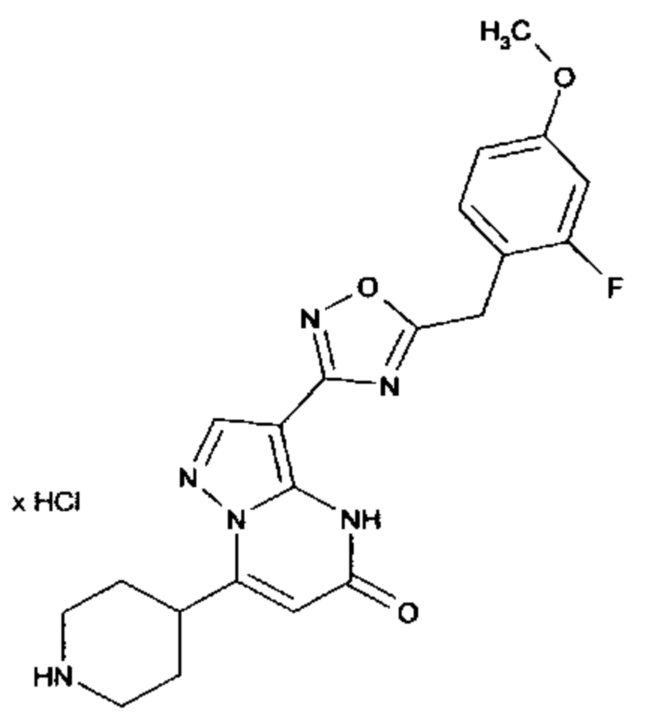
Соединение трет-бутил 4-{3-[5-(2-фтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (63.0 мг, 100% чистота, 120 мкмоль) растворили в 1,4-диоксане (2.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (4.0 мл). Суспензию концентрировали, растворили в воде и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 1.0% 1Н водной соляной кислотой). Лиофилизация объединенных фракций продукта обеспечила соединение, указанное в названии.
Полученное количество составило 36.0 мг (100% чистота, 65% теоретический выход).
LC-MS (Способ 8В): Rt=0.82 мин; MS (ESIpos): m/z=425 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (0.54), 0.008 (0.48), 1.841 (0.22), 1.872 (0.62), 1.903 (0.68), 1.934 (0.28), 2.188 (1.07), 2.222 (0.88), 2.524 (0.30), 3.052 (0.28), 3.082 (0.76), 3.111 (0.80), 3.141 (0.33), 3.573 (0.39), 3.591 (0.31), 3.774 (16.00), 4.374 (4.72), 6.079 (0.18), 6.807 (0.90), 6.813 (1.02), 6.828 (0.95), 6.834 (1.12), 6.872 (1.16), 6.878 (0.94), 6.902 (1.13), 6.909 (0.98), 7.385 (0.90), 7.407 (1.64), 7.429 (0.85), 8.326 (0.63), 8.642 (0.14), 8.872 (0.18), 11.242 (0.12).
Пример 247
3-[5-(3-фтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
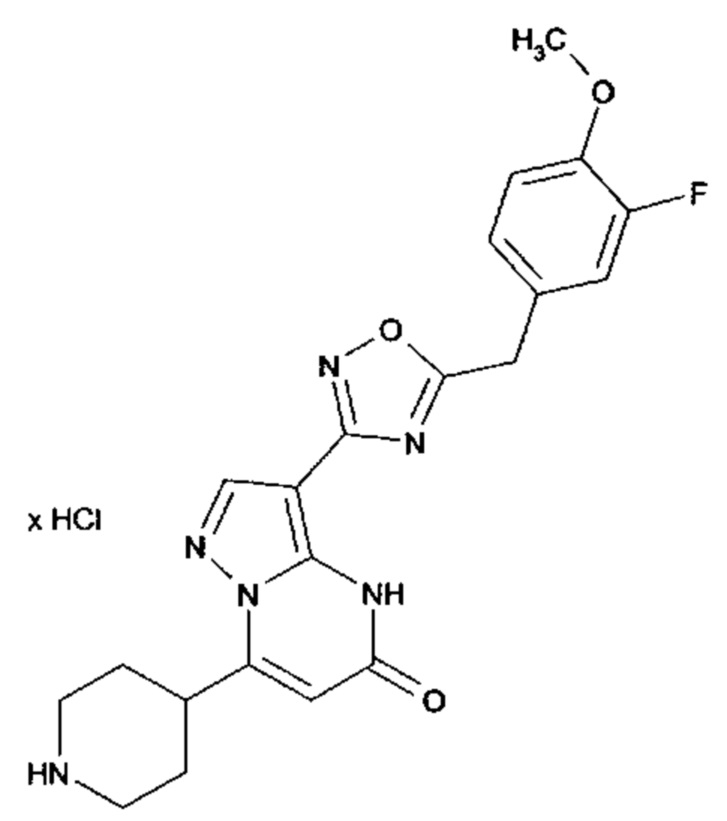
трет-бутил 4-{3-[5-(3-фтор-4-метоксибензил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (71.0 мг, 97% чистота, 131 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 246.
Полученное количество составило 42.0 мг (100% чистота, 69% теоретический выход).
LC-MS (Способ 8B): Rt=0.79 мин; MS (ESIpos): m/z=425 [M+H-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.891 (1.71), 1.923 (1.86), 2.188 (2.74), 2.221 (2.19), 3.077 (1.90), 3.105 (1.98), 3.381 (2.64), 3.412 (2.14), 3.574 (1.30), 4.371 (16.00), 6.083 (1.40), 7.141 (1.11), 7.162 (4.02), 7.180 (8.75), 7.286 (2.62), 7.319 (2.99), 8.336 (5.38), 8.801 (0.46), 8.995 (0.57).
Пример 248
3-[5-(3-хлор-4-метилфенил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
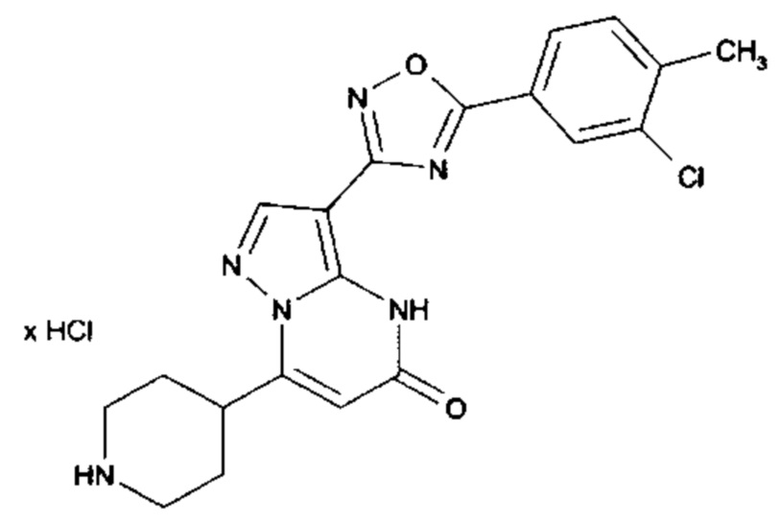
трет-бутил 4-{3-[5-(3-хлор-4-метилфенил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (82.0 мг, 93% чистота, 149 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 51.0 мг (94% чистота, 72% теоретический выход).
LC-MS (Способ 8B): Rt=0.96 мин; MS (ESIpos): m/z=411 [M+H-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (3.19), 0.008 (4.10), 1.899 (2.14), 1.926 (2.38), 1.956 (1.33), 2.213 (2.92), 2.246 (2.46), 2.465 (16.00), 2.525 (2.09), 3.099 (2.38), 3.129 (2.53), 3.156 (1.43), 3.399 (3.41), 3.429 (2.99), 3.509 (1.45), 3.585 (8.32), 3.733 (1.65), 3.744 (1.49), 4.003 (1.22), 6.086 (1.15), 7.651 (2.85), 7.671 (3.27), 8.139 (1.84), 8.159 (1.79), 8.378 (1.97), 8.435 (3.27), 8.742 (0.68), 8.938 (1.05).
Пример 249
3-{5-[4-метил-2-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ид)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
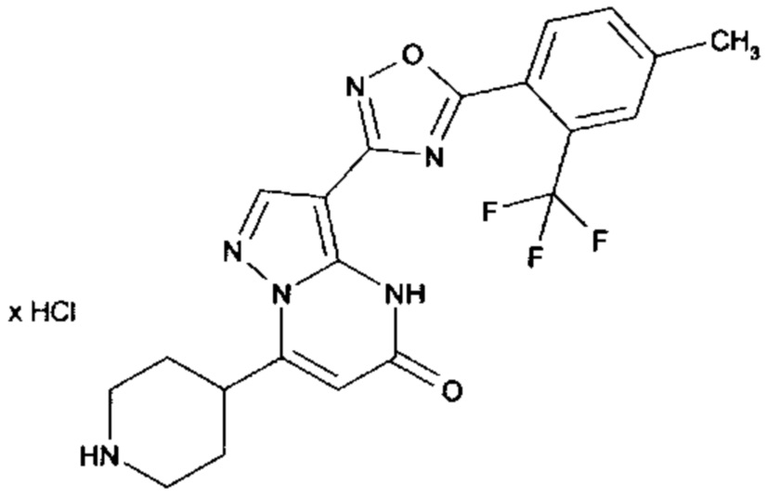
трет-бутил 4-(3-{5-[4-метил-2-(трифторметил)фенил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (33.0 мг, 98% чистота, 59.4 мкмоль)
4Н соляная кислота в 1,4-диоксане (11 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 209.
Полученное количество составило 28.0 мг (100% чистота, 98% теоретический выход).
LC-MS (Способ 8В): Rt=0.96 мин; MS (ESIpos): m/z=445 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (7.75), 0.008 (8.06), 1.861 (1.91), 1.890 (5.50), 1.921 (6.11), 1.952 (2.63), 2.138 (2.18), 2.214 (8.48), 2.248 (6.99), 3.074 (2.29), 3.103 (6.11), 3.133 (6.30), 3.161 (2.71), 3.401 (9.39), 3.433 (7.60), 3.568 (15.96), 3.598 (3.36), 6.099 (1.72), 7.783 (7.45), 7.802 (8.21), 7.912 (16.00), 8.231 (2.86), 8.247 (2.83), 8.432 (6.87), 8.671 (1.72), 8.883 (2.25), 11.485 (1.49).
Пример 250
3-(2,4-диметил-1,3-тиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
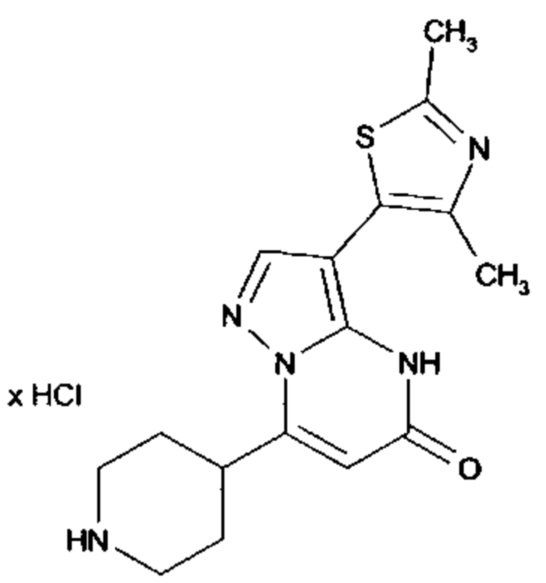
трет-бутил 4-{3-(2,4-диметил-1,3-тиазол-5-ил)-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (18.0 мг, 98% чистота, 32.1 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 13.0 мг (89% чистота, количественный выход)
LC-MS (Способ 8В): Rt=0.42 мин; MS (ESIpos): m/z=330 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (0.68), -0.008 (6.30), 0.008 (5.46), 0.146 (0.66), 1.907 (3.27), 1.939 (3.66), 1.969 (1.49), 2.193 (5.54), 2.226 (4.67), 2.271 (9.72), 2.368 (0.93), 2.696 (16.00), 3.080 (3.84), 3.109 (3.87), 3.138 (1.59), 3.378 (5.17), 3.409 (4.20), 3.578 (2.21), 5.783 (1.36), 6.018 (1.63), 8.033 (1.55), 8.928 (0.99), 9.066(1.36).
Пример 251
3-{5-[(6-метоксипиридин-3-ил)метил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
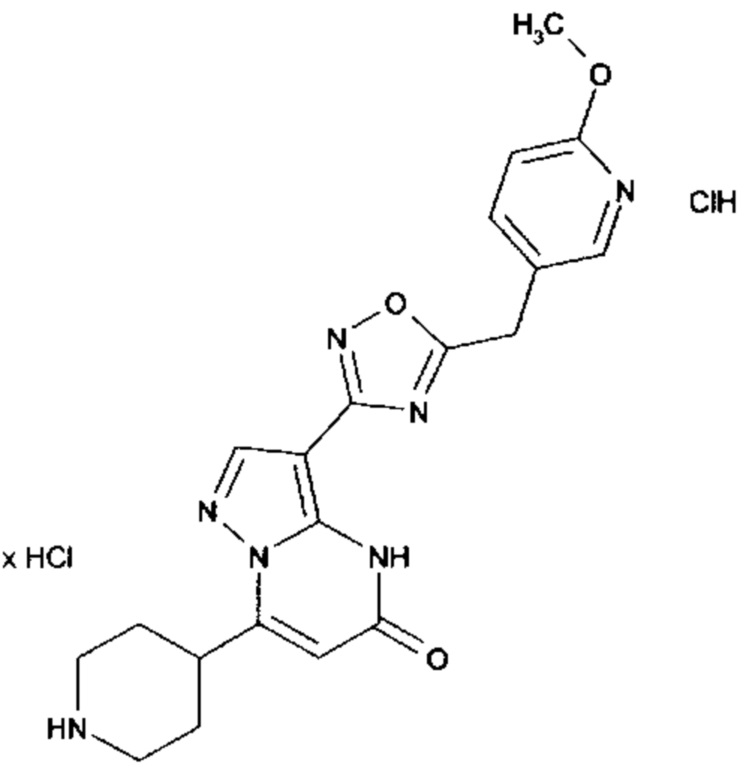
трет-бутил 4-(3-{5-[(6-метоксипиридин-3-ил)метил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (46.0 мг, 100% чистота, 90.6 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 222.
Полученное количество составило 44.0 мг (100% чистота, количественный выход)
LC-MS (Способ 7В): Rt=1.06 мин; MS (ESIpos): m/z=408 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.873 (0.69), 1.901 (1.93), 1.932 (2.13), 1.962 (0.88), 2.183 (3.08), 2.216 (2.44), 3.041 (0.78), 3.070 (2.13), 3.100 (2.18), 3.130 (0.89), 3.374 (2.90), 3.389 (2.74), 3.405 (2.41), 3.463 (0.85), 3.475 (1.08), 3.492 (1.17), 3.503 (0.94), 3.545 (0.90), 3.574 (1.62), 3.604 (0.79), 3.667 (0.87), 3.681 (1.02), 3.701 (0.99), 3.713 (0.77), 4.392 (16.00), 5.011 (1.45), 6.078 (2.79), 6.846 (4.79), 6.868 (5.08), 7.761 (3.05), 7.768 (3.14), 7.783 (2.95), 7.789 (3.02), 8.237 (4.14), 8.243 (4.06), 8.328 (5.91), 8.934 (0.57), 9.085 (0.75).
Пример 252
7-(пиперидин-4-ил)-3-{5-[4-(пропан-2-илокси)бензил]-1,2,4-оксадиазол-3-ид}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
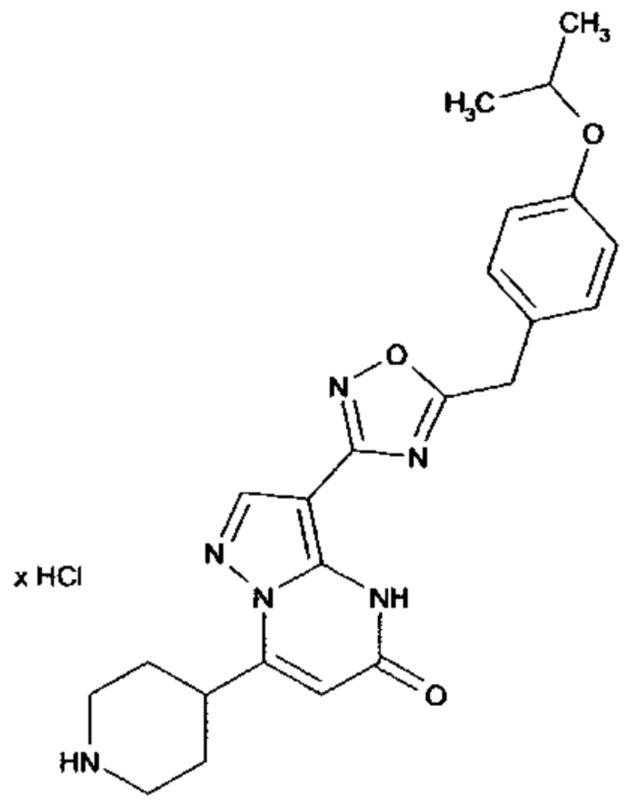
трет-бутил 4-(5-оксо-3-{5-[4-(пропан-2-илокси)бензил]-1,2,4-оксадиазол-3-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (54.0 мг, 98% чистота, 99.0 мкмоль)
4Н соляная кислота в 1,4-диоксане (4.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 246.
Полученное количество составило 32.0 мг (100% чистота, 69% теоретический выход).
LC-MS (Способ 8В): Rt=0.96 мин; MS (ESIpos): m/z=435 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.240 (15.93), 1.255 (16.00), 1.881 (0.95), 1.913 (1.03), 2.189 (1.54), 2.222 (1.25), 3.079 (1.06), 3.108 (1.12), 3.138 (0.45), 3.351 (3.16), 3.573 (0.62), 4.327 (7.17), 4.555 (0.47), 4.570 (1.17), 4.585 (1.55), 4.600 (1.14), 4.615 (0.45), 6.076 (0.35), 6.892 (3.69), 6.914 (4.07), 7.277 (3.74), 7.298 (3.37), 8.338 (1.14), 8.759 (0.20), 8.945 (0.26), 11.260 (0.19).
Пример 253
3-(2-метил-1,3-тиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
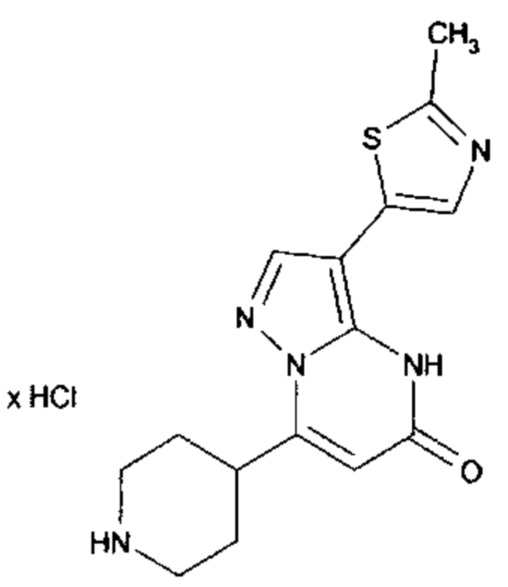
Соединение трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(2-метил-1,3-тиазол-5-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (33.0 мг, 100% чистота, 61.6 мкмоль) перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (4.0 мл). Раствор концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии.
Полученное количество составило 22.8 мг (95% чистота, количественный выход)
LC-MS (Способ 8В): Rt=0.40 мин; MS (ESIpos): m/z=316 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (1.21), 0.008 (1.16), 1.876 (0.52), 1.906 (1.43), 1.936 (1.56), 1.964 (0.64), 2.196 (2.24), 2.228 (1.80), 2.681 (16.00), 3.060 (0.63), 3.089 (1.64), 3.118 (1.66), 3.148 (0.65), 3.415 (1.80), 3.576 (0.56), 3.594 (1.51), 3.604 (1.00), 3.729 (0.82), 4.406 (1.63), 4.646 (0.88), 6.127 (0.37), 7.945 (1.61), 8.226 (0.37), 8.849 (0.46), 9.006 (0.62).
Пример 254
N-[5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-ил]бензамид гидрохлорид
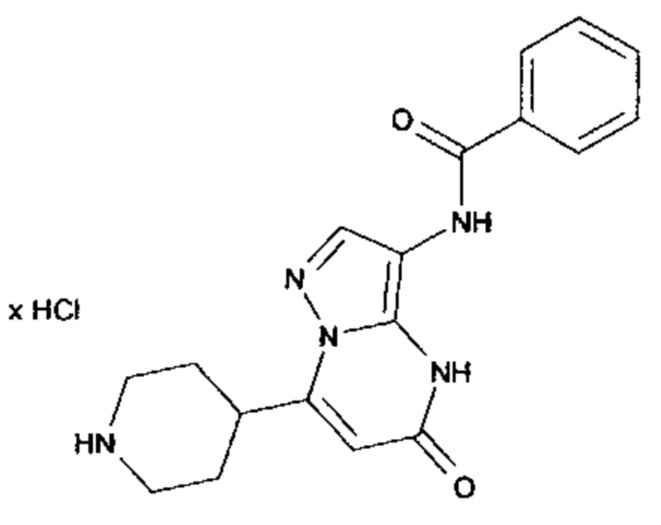
Соединение трет-бутил 4-{3-(бензоиламино)-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (43.0 мг, 100% чистота, 77.1 мкмоль) перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (4.0 мл). Раствор концентрировали и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 1.0% 1Н водной соляной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии.
Полученное количество составило 20.0 мг (100% чистота, 69% теоретический выход).
LC-MS (Способ 8В): Rt=0.52 мин; MS (ESIpos): m/z=338 [М+Н-xHCl]+
1H-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 0.000 (12.41), 1.915 (7.55), 2.183 (9.71), 3.080 (8.15), 5.802 (7.88), 7.528 (13.84), 7.588 (7.39), 8.030 (16.00), 8.176 (13.58), 8.920 (3.40), 9.074 (3.91), 10.075 (13.43), 12.097 (4.51).
Пример 255
3-{3-[2-(4-фторфенил)пропан-2-ил]-1,2,4-оксадиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
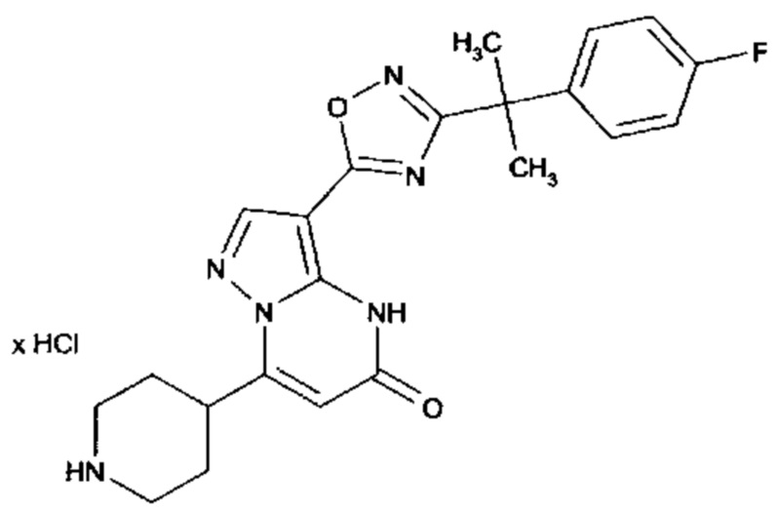
Соединение трет-бутил 4-(3-{3-[2-(4-фторфенил)пропан-2-ил]-1,2,4-оксадиазол-5-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (600 мг, 1.15 ммоль) растворили в 1,4-диоксане (4.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (10 мл). Раствор концентрировали с получением соединения, указанного в названии.
Полученное количество составило 480 мг (100% чистота, 91% теоретический выход).
LC-MS (Способ 8В): Rt=0.91 мин; MS (ESIpos): m/z=423 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.000 (4.73), 1.750 (16.00), 1.882 (0.30), 1.910 (0.92), 1.942 (0.95), 1.972 (0.39), 2.177 (1.39), 2.209 (1.09), 3.047 (0.35), 3.077 (0.95), 3.106 (0.98), 3.135 (0.40), 3.377 (1.35), 3.392 (1.04), 3.408 (1.11), 3.565 (0.41), 3.594 (0.67), 3.623 (0.41), 6.212 (0.38), 7.125 (1.47), 7.147 (3.21), 7.169 (1.77), 7.377 (1.64), 7.391 (1.87), 7.399 (1.70), 7.413 (1.39), 8.506 (1.40), 8.969 (0.23), 9.111 (0.31).
Пример 256
7-(пиперидин-4-ил)-3-[5-(пропан-2-ил)-1,2,4-оксадиазол-3-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
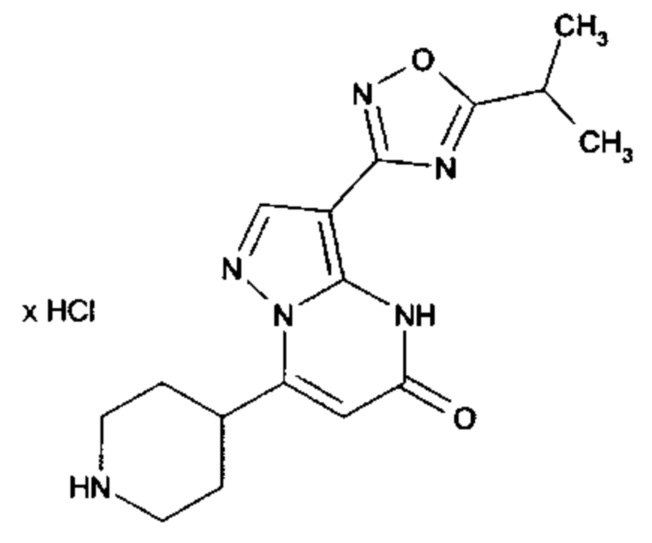
Соединение трет-бутил 4-{5-оксо-3-[5-(пропан-2-ил)-1,2,4-оксадиазол-3-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (48.0 мг, 112 мкмоль) растворили в 1,4-диоксане (2.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (2.0 мл). Раствор концентрировали, высушивали в вакууме, растворили в воде и лиофилизировали с получением соединения, указанного в названии.
Полученное количество составило 41 мг (100% чистота, количественный выход)
LC-MS (Способ 11B): Rt=0.75 мин; MS (ESIpos): m/z=329 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.210 (3.63), 1.226 (3.56), 1.377 (16.00), 1.395 (15.91), 1.840 (0.30), 1.875 (0.88), 1.905 (0.91), 1.935 (0.41), 2.197 (1.33), 2.232 (1.01), 3.060 (0.41), 3.089 (0.98), 3.118 (1.06), 3.148 (0.44), 3.362 (1.82), 3.392 (1.69), 3.423 (1.33), 3.482 (0.44), 3.550 (0.67), 3.568 (1.06), 6.069 (0.27), 8.344 (1.12), 8.641 (0.30), 8.860 (0.35), 11.277 (0.18).
Пример 257
3-(5-трет-бутил-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
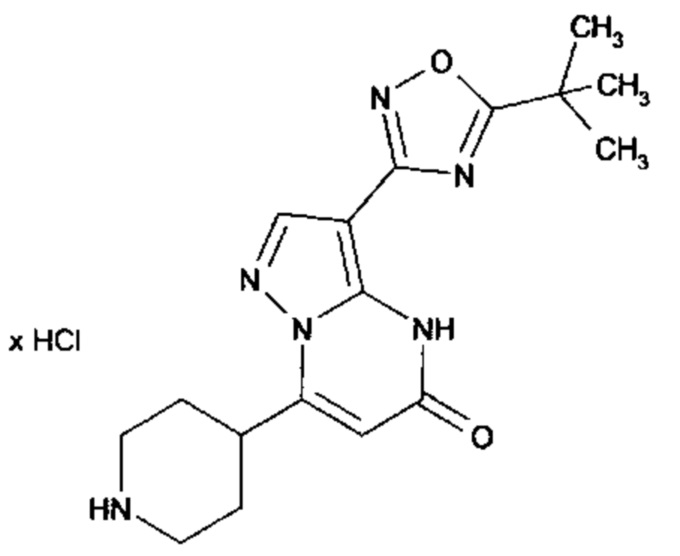
трет-бутил 4-[3-(5-трет-бутил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (35.0 мг, 79.1 мкмоль)
4Н соляная кислота в 1,4-диоксане (2.0 мл)
1,4-диоксан (2.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 256.
Полученное количество составило 28.5 мг (100% чистота, 95% теоретический выход).
LC-MS (Способ 11B): Rt=0.89 мин; MS (ESIpos): m/z=343 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.091 (0.13), 1.450 (16.00), 1.856 (0.12), 1.887 (0.33), 1.914 (0.36), 1.944 (0.16), 1.953 (0.14), 2.195 (0.51), 2.228 (0.42), 3.086 (0.31), 3.113 (0.33), 3.168 (0.14), 3.392 (0.56), 3.419 (0.44), 3.548 (0.13), 3.578 (0.23), 3.606 (0.12), 6.067 (0.22), 8.333 (0.83), 8.763 (0.11), 8.941 (0.14), 11.311 (0.12).
Пример 258
3-(2-этил-4-метил-1,3-тиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
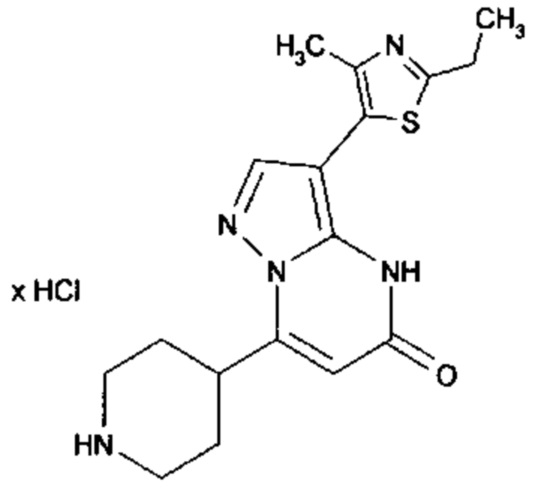
Соединение трет-бутил 4-{3-(2-этил-4-метил-1,3-тиазол-5-ил)-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (114 мг, 202 мкмоль) перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (3.0 мл). Раствор концентрировали, растворили в воде/ацетонитриле и лиофилизовали перед перемешиванием с 1/2 смесью метанол/простой диэтиловый эфир. Суспензию затем отфильтровали и высушивали в вакууме с получением соединения, указанного в названии.
Полученное количество составило 73.5 мг (100% чистота, 96% теоретический выход).
LC-MS (Способ 10В): Rt=0.96 мин; MS (ESIpos): m/z=344 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.008 (1.70), 1.291 (7.55), 1.310 (16.00), 1.329 (7.76), 1.865 (0.67), 1.895 (1.79), 1.920 (1.94), 1.952 (0.85), 2.198 (2.97), 2.245 (5.62), 2.944 (2.01), 2.962 (5.99), 2.981 (5.84), 3.000 (1.90), 3.052 (0.70), 3.082 (1.94), 3.110 (2.01), 3.142 (0.86), 3.383 (2.71), 3.413 (2.25), 3.544 (0.58), 3.571 (1.03), 3.601 (0.57), 4.516 (1.63), 5.979 (0.42), 7.995 (0.71), 8.810 (0.64), 8.968 (0.86).
Пример 259
3-[4-метил-2-(пропан-2-ил)-1,3-тиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
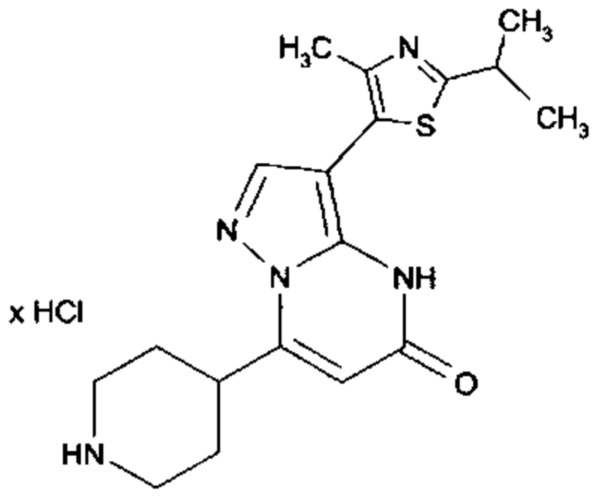
трет-бутил 4-{5-[(4-метоксибензил)окси]-3-[4-метил-2-(пропан-2-ил)-1,3-тиазол-5-ил]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (110 мг, 190 мкмоль)
4Н соляная кислота в 1,4-диоксане (3.0 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 258.
Полученное количество составило 57.0 мг (98% чистота, 74% теоретический выход).
LC-MS (Способ 10В): Rt=1.07 мин; MS (ESIpos): m/z=358 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.326 (15.73), 1.344 (16.00), 1.842 (0.29), 1.878 (0.86), 1.908 (0.91), 1.939 (0.37), 2.204 (1.69), 2.234 (2.97), 3.055 (0.36), 3.086 (0.93), 3.115 (0.99), 3.142 (0.40), 3.208 (0.44), 3.225 (1.08), 3.243 (1.45), 3.260 (1.03), 3.277 (0.40), 3.387 (1.37), 3.419 (1.11), 3.531 (0.23), 3.565 (0.44), 3.593 (0.26), 5.947 (0.17), 7.983 (0.26), 8.665 (0.29), 8.882 (0.37).
Пример 260
7-(пиперидин-4-ил)-3-{3-[2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
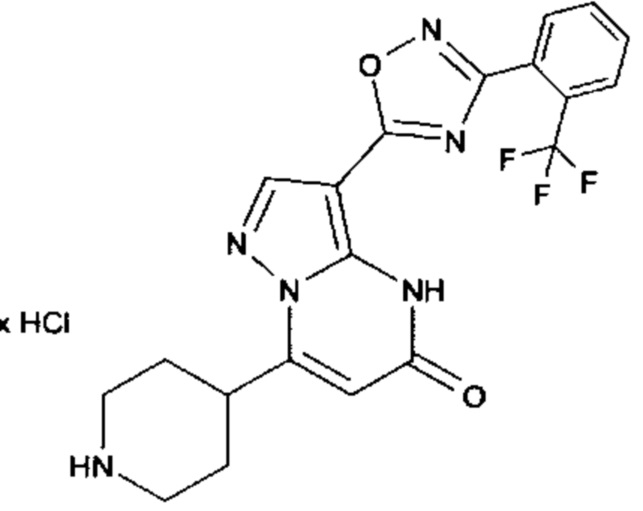
Соединение трет-бутил 4-(5-оксо-3-{3-[2-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (300 мг, 565 мкмоль) перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (5.0 мл). Раствор концентрировали, растворили в воде/ацетонитриле и лиофилизировали с получением соединения, указанного в названии.
Полученное количество составило 262 мг (100% чистота, 99% теоретический выход).
LC-MS (Способ 8В): Rt=0.87 мин; MS (ESIpos): m/z=431 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.008 (9.20), 0.008 (8.86), 1.855 (2.15), 1.866 (2.67), 1.897 (7.40), 1.923 (8.00), 1.952 (3.44), 1.962 (2.84), 2.216 (11.44), 2.249 (9.38), 3.098 (4.47), 3.125 (8.09), 3.156 (4.90), 3.409 (13.08), 3.441 (10.67), 3.601 (2.41), 3.628 (3.53), 3.657 (2.15), 6.276 (1.12), 7.838 (3.70), 7.857 (10.75), 7.876 (9.98), 7.888 (8.86), 7.906 (12.22), 7.923 (5.16), 7.994 (16.00), 8.012 (14.37), 8.633 (5.85), 8.826 (2.49).
Пример 261
3-[5-(бицикло[2.2.2]окт-1-ил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
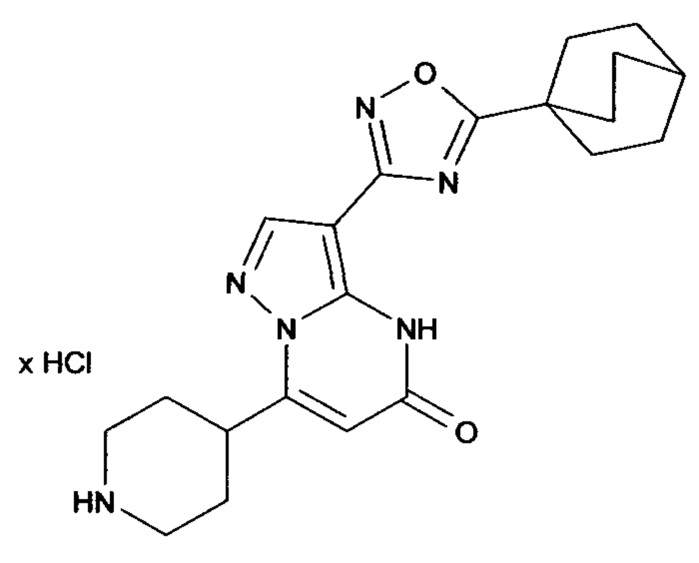
Соединение трет-бутил 4-{3-[5-(бицикло[2.2.2]окт-1-ил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (65.0 мг, 131 мкмоль) перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (2.0 мл). Смесь разбавили простым диэтиловым эфиром и перемешивали 10 мин при комнатной температуре. Суспензию отфильтровали, высушивали в вакууме, растворили в воде/ацетонитриле и лиофилизировали с получением соединения, указанного в названии.
Полученное количество составило 47.0 мг (100% чистота, 83% теоретический выход).
LC-MS (Способ 8В): Rt=0.95 мин; MS (ESIpos): m/z=395 [M+H-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.149 (1.96), 0.008 (16.00), 0.146 (1.96), 1.652 (6.16), 1.672 (8.65), 1.707 (3.22), 1.714 (2.86), 1.722 (1.67), 1.809 (0.69), 1.843 (1.96), 1.876 (2.20), 1.916 (10.90), 1.927 (7.84), 1.937 (9.63), 1.955 (7.67), 2.195 (2.90), 2.229 (2.41), 3.076 (1.22), 3.106 (2.41), 3.140 (1.31), 3.396 (3.47), 3.429 (2.90), 3.565 (0.98), 6.026 (0.61), 8.313 (1.55), 8.481 (0.53), 8.703 (0.53), 11.269 (0.45).
Пример 262
3-(5-этил-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
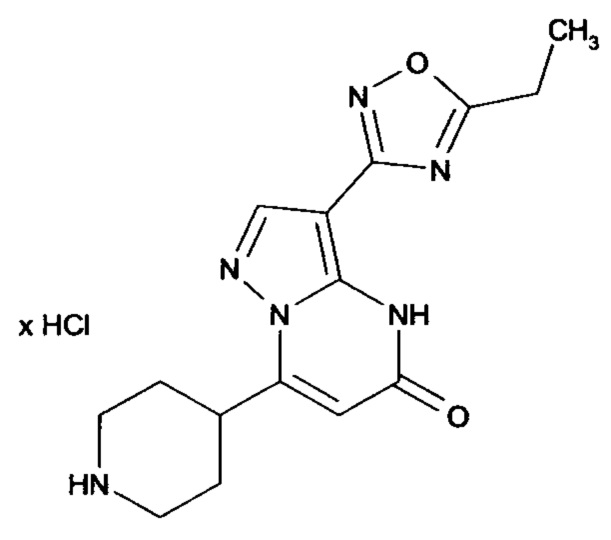
Соединение трет-бутил 4-[3-(5-этил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (180 мг, 434 мкмоль) перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (3.0 мл). Смесь хранили в течение 5 мин на ультразвуковой ванне перед фильтрацией. Твердое вещество затем промыли простым диэтиловым эфиром и высушивали в вакууме с получением соединения, указанного в названии.
Полученное количество составило 146 мг (92% чистота, 88% теоретический выход).
LC-MS (Способ 8В): Rt=0.60 мин; MS (ESIpos): m/z=315 [M+H-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.000 (16.00), 0.008 (0.66), 1.330 (0.35), 1.349 (0.73), 1.368 (0.35), 1.827 (0.03), 1.857 (0.08), 1.890 (0.09), 1.920 (0.04), 2.201 (0.12), 2.234 (0.10), 2.976 (0.11), 2.995 (0.30), 3.013 (0.29), 3.032 (0.09), 3.063 (0.04), 3.094 (0.09), 3.121 (0.09), 3.149 (0.04), 3.392 (0.15), 3.429 (0.10), 3.568 (0.26), 6.052 (0.02), 8.348 (0.06), 8.497 (0.03), 8.740 (0.06), 11.249 (0.04).
Пример 263
3-(3-фенил-1,2-оксазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
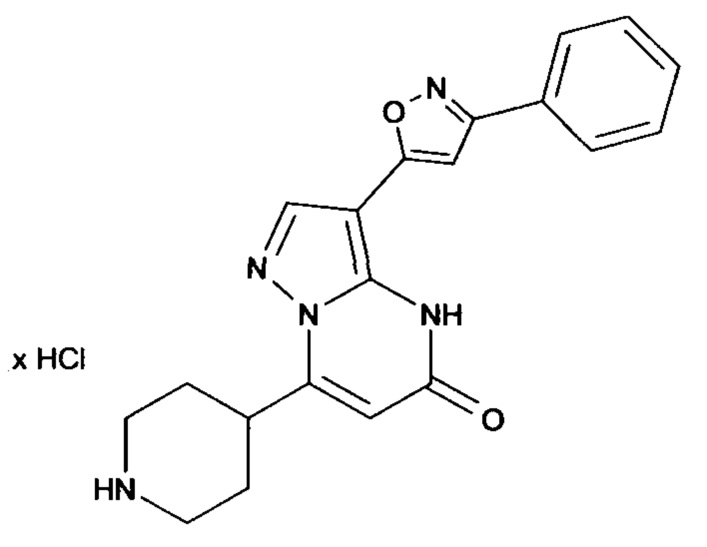
Соединение трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(3-фенил-1,2-оксазол-5-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (60.0 мг, 103 мкмоль) перемешивали в течение 4 ч при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (2.6 мл). Смесь разбавили 150 мл простого диэтилового эфира, и перемешивание продолжали в течение 30 мин. Полученное твердое вещество отфильтровали, растворили в воде/ацетонитриле и лиофилизировали с получением соединения, указанного в названии.
Полученное количество составило 39 мг (100% чистота, 95% теоретический выход).
LC-MS (Способ 11В): Rt=0.95 мин; MS (ESIpos): m/z=362 [M+H-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.859 (0.20), 1.889 (0.58), 1.919 (0.62), 1.949 (0.26), 2.207 (0.88), 2.240 (0.73), 2.502 (16.00), 3.073 (0.24), 3.103 (0.67), 3.132 (0.70), 3.162 (0.30), 3.400 (1.04), 3.431 (0.83), 3.600 (0.30), 6.043 (0.11), 7.533 (0.66), 7.548 (2.89), 7.567 (1.97), 7.868 (1.85), 7.883 (1.55), 8.414 (0.31), 8.662 (0.22), 8.883 (0.28), 12.364 (0.16).
Пример 264
7-(пиперидин-4-ил)-3-{3-[1-(пропан-2-ил)пиперидин-4-ил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
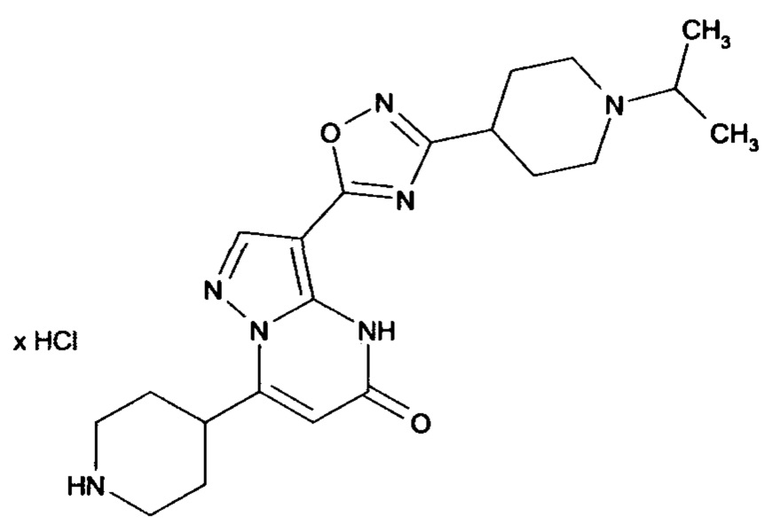
Соединение трет-бутил 4-(5-оксо-3-{3-[1-(пропан-2-ил)пиперидин-4-ил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (174 мг, 99% чистота, 337 мкмоль) растворили в 1,4-диоксане (2.0 мл) и перемешивали всю ночь при комнатной температуре с 4Н соляной кислотой в 1,4-диоксане (4.0 мл). Суспензию концентрировали, растворили в воде, лиофилизовали и очистили [Колонка: Kinetex, 5 мкм С18, 100×21.2 мм, Элюент: 95-50% вода / 0-45% ацетонитрил / 5% (ацетонитрил/вода 80/20 + 2% муравьиная кислота). Поток: 60 мл/мин. Обнаружение: 210 нм]. Объединенные фракции продукта концентрировали, растворили 2Н водной HCl/ацетонитрилом и лиофилизировали с получением соединения, указанного в названии.
Полученное количество составило 14.0 мг (95% чистота, 9% теоретический выход).
LC-MS (Способ 9В): Rt=3.45 мин; MS (ESIpos): m/z=412 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.431 (15.77), 1.447 (16.00), 1.754 (3.38), 1.888 (2.02), 1.919 (2.23), 1.995 (2.91), 2.161 (5.69), 2.191 (3.95), 3.038 (0.92), 3.067 (2.33), 3.098 (2.45), 3.128 (1.11), 3.252 (1.45), 3.289 (2.96), 3.317 (1.66), 3.383 (3.60), 3.410 (3.35), 3.566 (10.22), 3.897 (3.28), 3.927 (2.93), 3.943 (2.33), 3.961 (1.79), 4.045 (1.27), 6.086 (0.34), 8.614 (3.16), 8.860 (0.75), 9.001 (1.00).
Пример 265
3-этил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
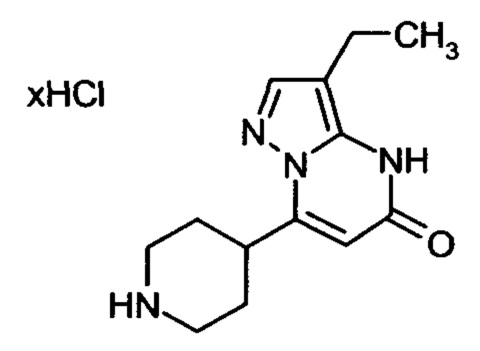
трет-бутил 4-(3-этил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (335 мг, 967 мкмоль) растворили в 1,4-диоксане (5.0 мл, 58 ммоль) и обработали соляной кислотой в 1,4-диоксане (3.6 мл, 4.0 М, 15 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 280 мг (97% чистота, 99% теоретический выход).
LC-MS (Способ 11В): Rt=0.49 мин; MS (ESIpos): m/z=247 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.086 (7.25), 1.105 (16.00), 1.123 (7.56), 1.860 (0.56), 1.869 (0.68), 1.893 (1.85), 1.901 (1.89), 1.925 (2.14), 1.933 (2.08), 1.957 (0.96), 1.966 (0.83), 2.128 (3.00), 2.161 (2.26), 2.449 (2.14), 2.992 (0.72), 3.023 (2.03), 3.050 (2.08), 3.081 (0.84), 3.356 (2.28), 3.459 (0.89), 3.489 (1.67), 3.519 (0.80), 3.559 (5.70), 5.697 (8.00), 7.709 (8.93), 9.261 (0.81), 9.315 (1.11).
Пример 266
3-(4-фенил-1,3-тиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
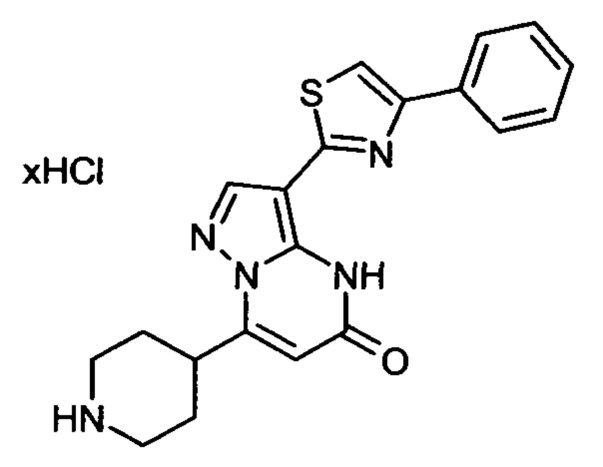
трет-бутил 4-[5-оксо-3-(4-фенил-1,3-тиазол-2-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (57.0 мг, 119 мкмоль) растворили в 1,4-диоксане (2.3 мл) и обработали соляной кислотой в 1,4-диоксане (600 мкл, 4.0 М, 2.4 ммоль) при комнатной температуре в течение 16 ч. В результате высушивания в вакууме получили продукт. Полученное количество составило 53.5 мг (90% чистота, 90% теоретический выход).
LC-MS (Способ 7В): Rt=1.31 мин; MS (ESIpos): m/z=378 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.927 (1.11), 1.952 (2.82), 1.959 (2.89), 1.983 (3.16), 1.991 (3.00), 2.015 (1.37), 2.215 (4.38), 2.248 (3.49), 3.059 (1.09), 3.092 (3.01), 3.120 (3.11), 3.150 (1.26), 3.385 (4.36), 3.417 (3.38), 3.561 (8.02), 3.612 (1.11), 3.641 (1.97), 3.671 (1.06), 6.225 (1.91), 7.326 (2.11), 7.346 (2.58), 7.365 (4.94), 7.383 (3.43), 7.456 (6.70), 7.474 (10.60), 7.493 (5.21), 7.616 (1.36), 7.648 (1.47), 7.667 (1.24), 7.984 (1.22), 8.017 (16.00), 8.065 (9.27), 8.083 (8.26), 8.535 (5.82), 9.066 (1.08), 9.091 (1.24), 9.175 (1.69), 9.199 (1.22).
Пример 267
3-[4-(2-фторфенил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
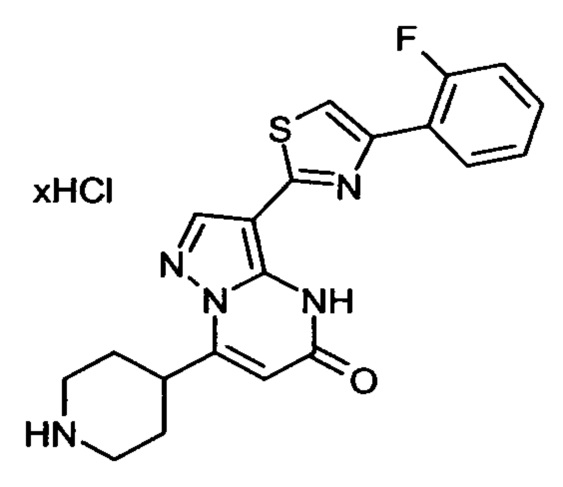
трет-бутил 4-{3-[4-(2-фторфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (58.0 мг, 117 мкмоль) растворили в 1,4-диоксане (2.3 мл) и обработали соляной кислотой в 1,4-диоксане (590 мкл, 4.0 М, 2.3 ммоль) при комнатной температуре в течение 16 ч. В результате высушивания в вакууме получили продукт. Полученное количество составило 54.0 мг (100% чистота, 99% теоретический выход).
LC-MS (Способ 1В): Rt=0.70 мин; MS (ESIpos): m/z=396 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.907 (0.82), 1.916 (0.94), 1.940 (2.40), 1.947 (2.49), 1.972 (2.69), 1.978 (2.62), 2.004 (1.14), 2.010 (0.97), 2.223 (3.79), 2.256 (2.98), 3.072 (0.98), 3.103 (2.73), 3.132 (2.81), 3.161 (1.11), 3.397 (3.77), 3.429 (3.05), 3.565 (16.00), 3.619 (0.82), 3.648 (1.38), 3.676 (0.82), 6.237 (0.65), 7.321 (1.67), 7.324 (1.82), 7.344 (5.06), 7.351 (2.23), 7.354 (2.40), 7.362 (4.73), 7.374 (3.72), 7.379 (4.30), 7.407 (1.60), 7.412 (1.79), 7.420 (1.86), 7.425 (2.86), 7.431 (1.96), 7.437 (1.46), 7.444 (2.17), 7.458 (0.78), 7.463 (0.69), 7.918 (8.35), 7.924 (8.25), 8.327 (1.38), 8.345 (2.62), 8.363 (1.34), 8.557 (2.38), 8.951 (0.92), 9.084 (1.20).
Пример 268
3-[5-(3-хлор-2-фторфенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
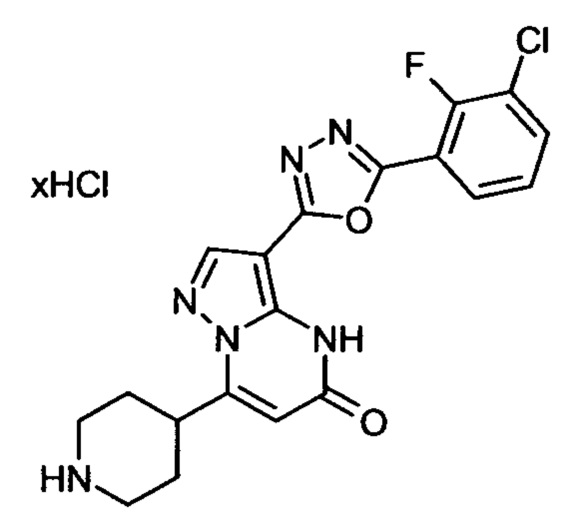
трет-бутил 4-{3-[5-(3-хлор-2-фторфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (31.9 мг, 61.9 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (230 мкл, 4.0 М, 930 мкмоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 22.9 мг (98% чистота, 80% теоретический выход).
LC-MS (Способ 1В): Rt=0.58 мин; MS (ESIpos): m/z=415 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.880 (3.68), 1.911 (9.44), 1.942 (9.96), 1.968 (4.23), 2.208 (13.67), 2.241 (10.95), 2.712 (1.34), 3.073 (4.06), 3.101 (10.02), 3.130 (10.21), 3.160 (4.39), 3.428 (16.00), 3.568 (9.69), 3.604 (6.12), 3.634 (3.21), 6.157 (4.34), 7.495 (6.28). 7.514 (12.79), 7.534 (7.03), 7.884 (5.85), 7.902 (10.32), 7.920 (5.35), 8.207 (4.53), 8.223 (7.57), 8.240 (4.45), 8.526 (14.00), 8.795 (3.13), 8.970 (4.17), 12.369 (0.85).
Пример 269
3-{5-[4-(дифторметокси)бензил]-1,3,4-оксадиазол-2-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
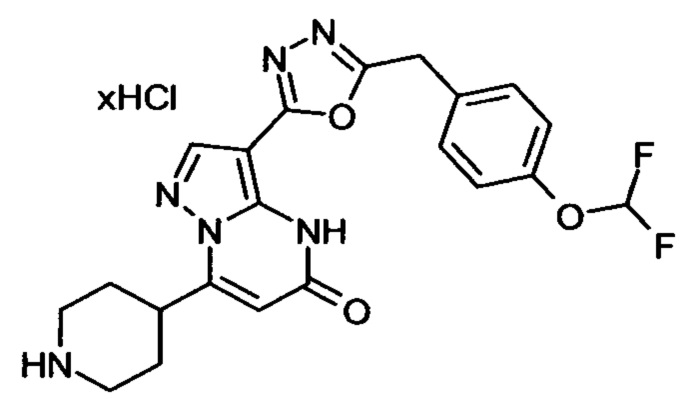
трет-бутил 4-(3-{5-[4-(дифторметокси)бензил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (49.4 мг, 91.1 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (340 мкл, 4.0 М, 1.4 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 35.0 мг (97% чистота, 78% теоретический выход).
LC-MS (Способ 1В): Rt=0.58 мин; MS (ESIpos): m/z=443 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.862 (0.76), 1.890 (2.04), 1.922 (2.25), 1.950 (0.94), 2.177 (3.24), 2.209 (2.61), 3.043 (0.87), 3.075 (2.32), 3.104 (2.38), 3.134 (1.00), 3.377 (4.25), 3.539 (1.12), 3.566 (2.98), 3.599 (0.80), 4.325 (16.00), 6.101 (0.72), 7.166 (8.12), 7.187 (9.35), 7.218 (8.17), 7.403 (3.99), 7.432 (9.38), 7.453 (7.88), 8.388 (2.97), 8.865 (0.67), 9.021 (0.86), 12.123 (0.12).
Пример 270
7-(пиперидин-4-ил)-3-{5-[4-(трифторметокси)бензил]-1,3,4-оксадиазол-2-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
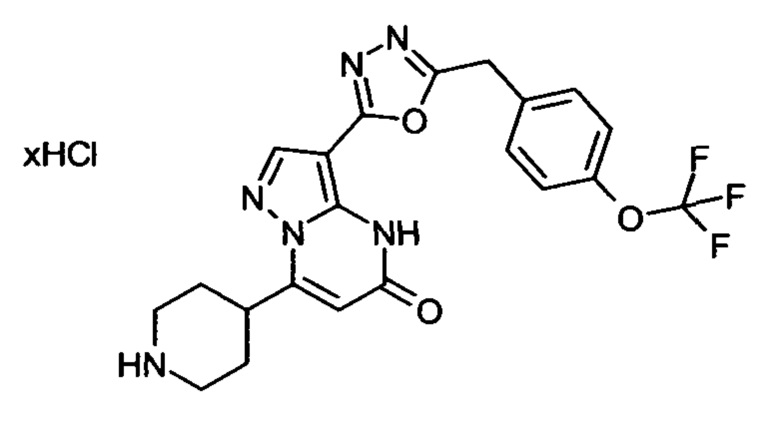
трет-бутил 4-(5-оксо-3-{5-[4-(трифторметокси)бензил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (34.3 мг, 61.2 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (230 мкл, 4.0 М, 920 мкмоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 28.7 мг (92% чистота, 87% теоретический выход).
LC-MS (Способ 1В): Rt=0.66 мин; MS (ESIpos): m/z=461 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.872 (0.88), 1.900 (2.39), 1.931 (2.59), 1.962 (1.11), 2.175 (3.73), 2.208 (3.01), 3.042 (1.05), 3.072 (2.66), 3.101 (2.79), 3.130 (1.28), 3.371 (4.14), 3.388 (2.66), 3.405 (3.36), 3.539 (1.13), 3.565 (10.68), 3.596 (1.20), 4.377 (16.00), 6.105 (1.81), 7.361 (5.73), 7.381 (7.23), 7.515 (9.45), 7.536 (7.23), 8.394 (5.98), 8.935 (0.83), 9.079 (1.08).
Пример 271
3-(4-трет-бутил-1,3-тиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
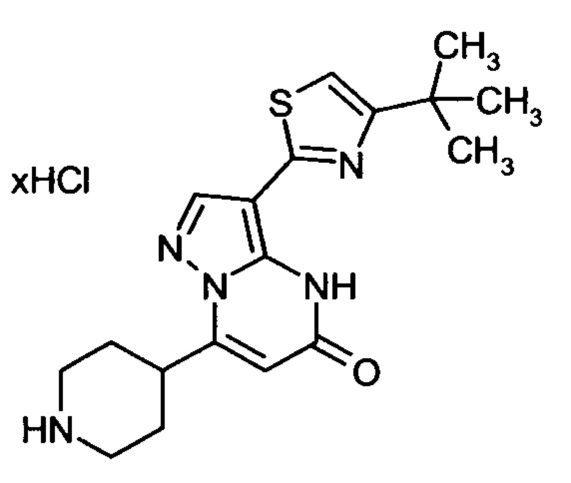
трет-бутил 4-[3-(4-трет-бутил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (14.5 мг, 31.7 мкмоль) растворили в 1,4-диоксане (620 мкл) и обработали соляной кислотой в 1,4-диоксане (160 мкл, 4.0 М, 630 мкмоль) при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 14.0 мг (100% чистота, 103% теоретический выход).
LC-MS (Способ 7В): Rt=1.41 мин; MS (ESIpos): m/z=358 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.359 (16.00), 1.882 (0.12), 1.908 (0.34), 1.940 (0.36), 1.971 (0.16), 2.202 (0.51), 2.234 (0.41), 3.067 (0.15), 3.096 (0.37), 3.123 (0.37), 3.154 (0.15), 3.390 (0.52), 3.422 (0.41), 3.613 (0.18), 6.169 (0.08), 7.185 (0.96), 8.475 (0.16), 8.831 (0.07), 8.996 (0.11).
Пример 272
3-(5-метил-4-фенил-1,3-тиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
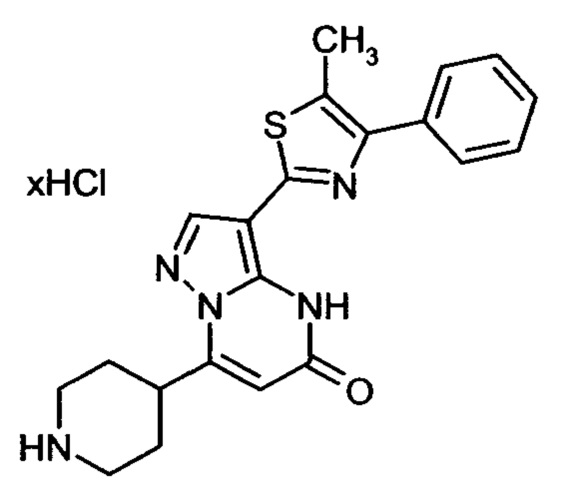
трет-бутил 4-[3-(5-метил-4-фенил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (13.5 мг, 27.5 мкмоль) растворили в 1,4-диоксане (540 мкл) и обработали соляной кислотой в 1,4-диоксане (140 мкл, 4.0 М, 550 мкмоль) при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 12.7 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 1В): Rt=0.73 мин; MS (ESIpos): m/z=392 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.885 (0.37), 1.917 (1.06), 1.943 (1.14), 1.974 (0.49), 2.217 (1.63), 2.250 (1.32), 2.584 (16.00), 3.072 (0.43), 3.102 (1.19), 3.130 (1.23), 3.160 (0.51), 3.398 (1.69), 3.428 (1.36), 3.592 (0.42), 3.623 (0.66), 3.652 (0.38), 6.199 (0.28), 7.381 (0.75), 7.400 (2.13), 7.418 (1.53), 7.483 (2.69), 7.503 (4.41), 7.521 (2.09), 7.767 (3.35), 7.785 (2.90), 8.457 (0.85), 8.762 (0.36), 8.949 (0.47).
Пример 273
3-[4-(2-метилфенил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
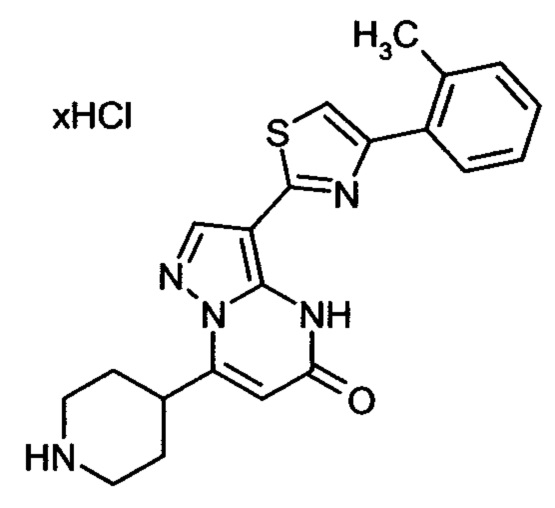
трет-бутил 4-{3-[4-(2-метилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (11.5 мг, 23.4 мкмоль) растворили в 1,4-диоксане (460 мкл) и обработали соляной кислотой в 1,4-диоксане (120 мкл, 4.0 М, 470 мкмоль) при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 10.8 мг (100% чистота, 99% теоретический выход).
LC-MS (Способ 1В): Rt=0.71 мин; MS (ESIpos): m/z=392 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.892 (0.37), 1.924 (1.00), 1.950 (1.11), 1.982 (0.49), 2.222 (1.59), 2.255 (1.27), 2.469 (16.00), 3.079 (0.40), 3.106 (1.11), 3.135 (1.17), 3.165 (0.49), 3.401 (1.57), 3.431 (1.29), 3.607 (0.38), 3.636 (0.61), 3.665 (0.39), 6.211 (0.21), 7.283 (0.38), 7.292 (1.54), 7.299 (1.69), 7.309 (2.73), 7.315 (4.77), 7.321 (3.22), 7.335 (0.95), 7.347 (0.31), 7.683 (5.70), 7.699 (1.18), 7.708 (1.35), 7.721 (1.06), 8.521 (1.41), 8.780 (0.38), 8.956 (0.48).
Пример 274
3-[5-(3-хлорбензил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
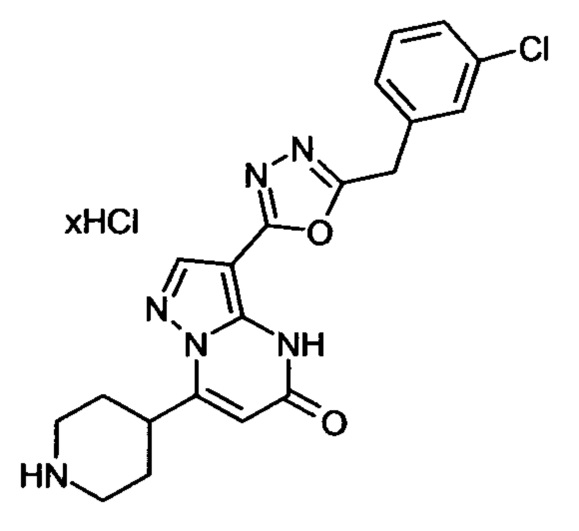
трет-бутил 4-{3-[5-(3-хлорбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (27.8 мг, 54.4 мкмоль) растворили в 1,4-диоксане (1.3 мл, 16 ммоль) и обработали соляной кислотой в 1,4-диоксане (200 мкл, 4.0 М, 820 мкмоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 24.5 мг (97% чистота, 97% теоретический выход).
LC-MS (Способ 1В): Rt=0.60 мин; MS (ESIpos): m/z=411 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.844 (0.29), 1.875 (0.71), 1.903 (0.74), 1.933 (0.31), 2.182 (1.09), 2.215 (0.83), 3.059 (0.31), 3.084 (0.73), 3.111 (0.74), 3.141 (0.31), 3.388 (1.32), 3.415 (0.93), 3.566 (16.00), 4.355 (5.55), 6.090 (0.15), 7.347 (0.68), 7.365 (1.59), 7.378 (1.29), 7.382 (1.81), 7.392 (2.09), 7.410 (1.11), 7.428 (0.39), 7.497 (1.48), 8.396 (0.47), 8.691 (0.24), 8.897 (0.31), 12.134 (0.09).
Пример 275
7-(пиперидин-4-ил)-3-{5-[2-(1Н-1,2,4-триазол-1-ил)пропан-2-ил]-1,3,4-оксадиазол-2-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-(5-оксо-3-{5-[2-(1Н-1,2,4-триазол-1-ил)пропан-2-ил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (46.8 мг, 94.4 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (350 мкл, 4.0 М, 1.4 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 42.5 мг (100% чистота, 104% теоретический выход).
LC-MS (Способ 1В): Rt=0.30 мин; MS (ESIpos): m/z=396 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.844 (0.30), 1.853 (0.30), 1.883 (0.75), 1.914 (0.81), 1.941 (0.35), 1.950 (0.35), 2.117 (16.00), 2.168 (1.23), 2.200 (0.94), 3.044 (0.32), 3.075 (0.85), 3.102 (0.85), 3.132 (0.34), 3.373 (1.19), 3.404 (0.93), 6.109 (0.49), 8.028 (3.80), 8.385 (1.88), 8.895 (3.75), 9.013 (0.34).
Пример 276
3-[5-(2-хлорбензил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
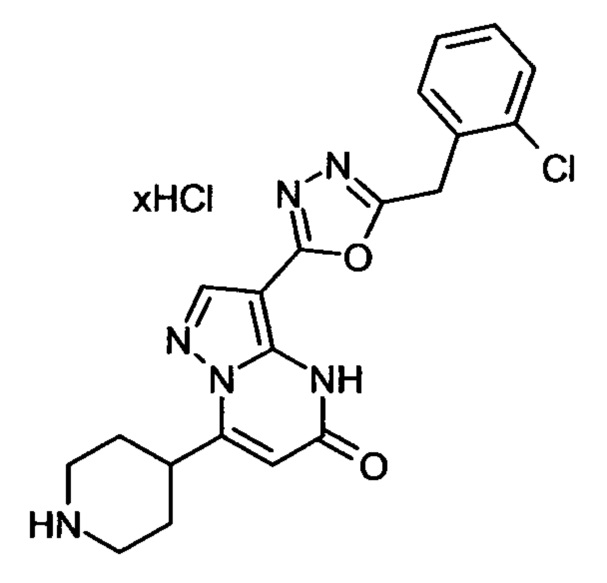
трет-бутил 4-{3-[5-(2-хлорбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (41.5 мг, 81.2 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (300 мкл, 4.0 М, 1.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 36.1 мг (100% чистота, 99% теоретический выход).
LC-MS (Способ 1В): Rt=0.57 мин; MS (ESIpos): m/z=411 [М+Н]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.878 (0.52), 1.887 (0.65), 1.912 (1.73), 1.918 (1.79), 1.943 (1.96), 1.950 (1.92), 1.974 (0.87), 1.983 (0.75), 2.174 (2.80), 2.207 (2.18), 3.037 (0.69), 3.068 (1.94), 3.096 (2.00), 3.126 (0.80), 3.399 (2.18), 3.542 (0.80), 3.549 (0.67), 3.564 (9.79), 3.595 (0.55), 3.601 (0.70), 4.426 (16.00), 6.104 (2.82), 7.348 (0.69), 7.358 (5.06), 7.367 (4.65), 7.373 (4.82), 7.382 (6.84), 7.391 (1.05), 7.480 (0.52), 7.489 (3.17), 7.502 (4.86), 7.511 (3.96), 7.524 (2.35), 7.533 (0.34), 8.389 (7.21), 9.049 (0.66), 9.164 (0.86).
Пример 277
3-{5-[(5-метил-1,3-тиазол-2-ил)метил]-1,3,4-оксадиазол-2-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
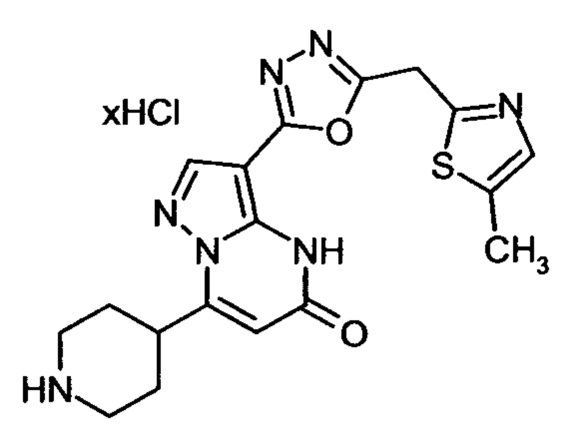
трет-бутил 4-(3-{5-[(5-метил-1,3-тиазол-2-ил)метил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат(43.0 мг, 86.4 мкмоль) растворили в 1,4-диоксане (1.8 мл, 21 ммоль) и обработали соляной кислотой в 1,4-диоксане (320 мкл, 4.0 М, 1.3 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 37.4 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 1В): Rt=0.43 мин; MS (ESIpos): m/z=398 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.894 (0.60), 1.925 (1.49), 1.956 (1.56), 1.981 (0.72), 2.175 (2.25), 2.207 (1.76), 2.330 (15.16), 2.332 (16.00), 2.350 (1.63), 3.041 (0.60), 3.067 (1.58), 3.095 (1.63), 3.124 (0.70), 3.369 (2.60), 3.386 (1.94), 3.397 (1.88), 3.545 (0.74), 3.562 (11.51), 3.574 (1.25), 3.604 (0.53), 4.741 (10.90), 6.114 (1.98), 7.264 (3.46), 7.266 (3.66), 8.415 (4.71), 9.091 (0.55), 9.204 (0.76).
Пример 278
3-{5-[1-(4-хлорфенил)циклопропил]-1,3,4-оксадиазол-2-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
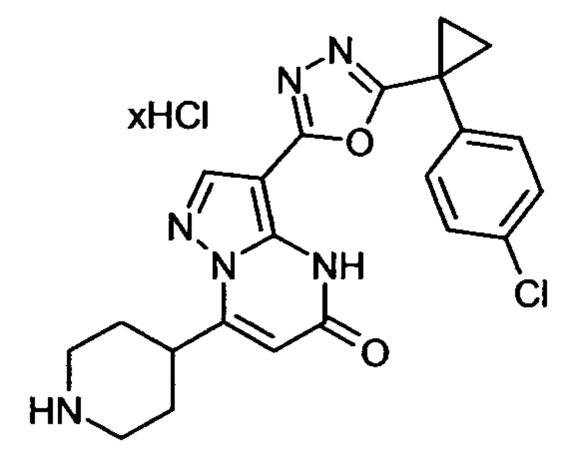
трет-бутил 4-(3-{5-[1-(4-хлорфенил)циклопропил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (56.1 мг, 104 мкмоль) растворили в 1,4-диоксане (2.0 мл) и обработали соляной кислотой в 1,4-диоксане (390 мкл, 4.0 М, 1.6 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 38.5 мг (96% чистота, 75% теоретический выход).
LC-MS (Способ 1В): Rt=0.66 мин; MS (ESIpos): m/z=437 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.001 (16.00), 1.485 (0.64), 1.497 (1.91), 1.503 (1.85), 1.514 (0.83), 1.748 (0.71), 1.759 (1.74), 1.764 (1.69), 1.776 (0.67), 1.843 (0.22), 1.873 (0.58), 1.903 (0.63), 1.931 (0.28), 2.174 (0.94), 2.207 (0.77), 3.055 (0.26), 3.081 (0.61), 3.108 (0.63), 3.138 (0.28), 3.356 (0.47), 3.373 (1.34), 3.391 (1.16), 3.408 (0.97), 3.536 (0.23), 3.566 (0.83), 3.595 (0.21), 6.095 (0.22), 7.414 (0.99), 7.421 (0.53), 7.437 (4.24), 7.447 (4.00), 7.463 (0.54), 7.468 (0.79), 8.343 (0.60), 8.726 (0.14), 8.917 (0.18), 12.110 (0.10).
Пример 279
3-[5-(2-хлор-6-фторбензил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
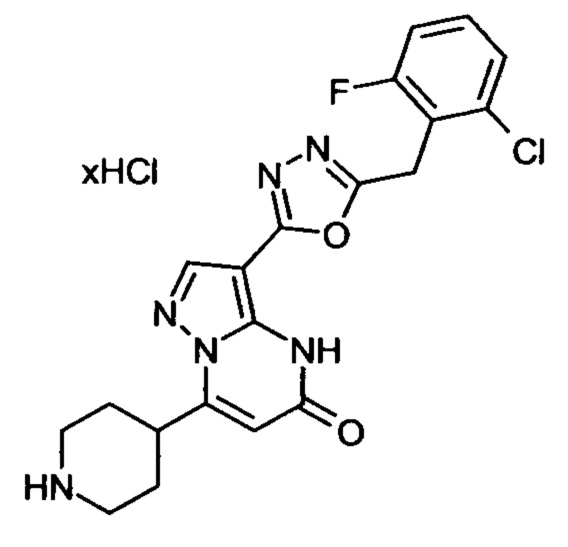
трет-бутил 4-{3-[5-(2-хлор-6-фторбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (31.6 мг, 59.7 мкмоль) растворили в 1,4-диоксане (2.0 мл) и обработали соляной кислотой в 1,4-диоксане (220 мкл, 4.0 М, 900 мкмоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 19.8 мг (100% чистота, 71% теоретический выход).
LC-MS (Способ 1В): Rt=0.58 мин; MS (ESIpos): m/z=429 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.856 (1.00), 1.885 (2.83), 1.917 (3.07), 1.946 (1.35), 2.186 (4.29), 2.218 (3.50), 3.087 (2.66), 3.106 (2.72), 3.373 (3.97), 3.390 (5.54), 3.415 (3.97), 3.566 (13.60), 4.436 (16.00), 6.104 (0.75), 7.306 (1.75), 7.310 (1.84), 7.330 (4.28), 7.351 (2.83), 7.353 (2.83), 7.415 (2.42), 7.432 (7.91), 7.453 (3.64), 7.458 (3.40), 7.473 (3.41), 7.493 (1.18), 8.382 (3.11), 8.777 (0.85), 8.958 (1.09), 12.131 (0.38).
Пример 280
3-[5-(2-метоксибензил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
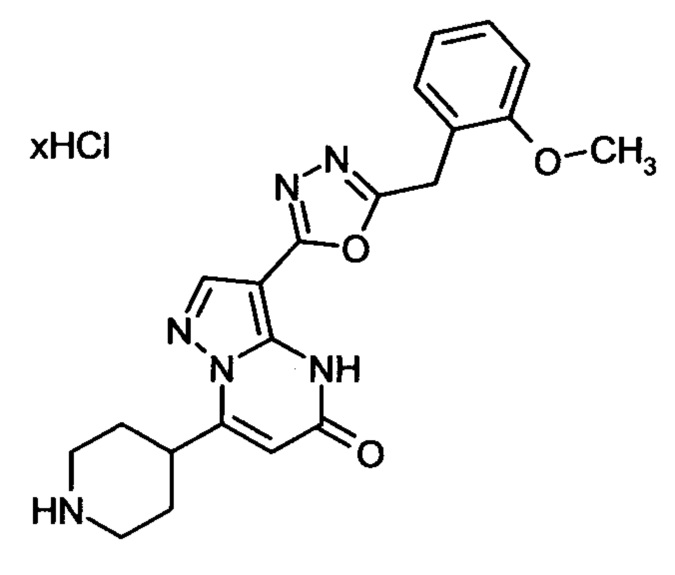
трет-бутил 4-{3-[5-(2-метоксибензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (66.2 мг, 131 мкмоль) растворили в 1,4-диоксане (2.1 мл) и обработали соляной кислотой в 1,4-диоксане (490 мкл, 4.0 М, 2.0 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 61.3 мг (85% чистота, 90% теоретический выход).
LC-MS (Способ 1В): Rt=0.57 мин; MS (ESIpos): m/z=407 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.874 (0.43), 1.907 (1.00), 1.934 (1.01), 1.963 (0.42), 2.174 (1.47), 2.207 (1.12), 3.040 (0.42), 3.070 (1.05), 3.097 (1.04), 3.125 (0.41), 3.372 (1.51), 3.400 (1.22), 3.785 (16.00), 4.226 (6.46), 6.102 (1.08), 6.894 (0.26), 6.920 (0.83), 6.938 (1.73), 6.957 (1.19), 6.977 (0.28), 7.028 (1.54), 7.049 (1.80), 7.237 (0.33), 7.244 (1.31), 7.248 (1.53), 7.263 (1.36), 7.266 (1.43), 7.279 (1.04), 7.283 (0.90), 7.300 (1.26), 7.318 (0.65), 7.322 (0.56), 8.375 (3.01), 8.961 (0.33), 9.098 (0.45).
Пример 281
3-{5-[1-(морфолин-4-ил)пропан-2-ил]-1,3,4-оксадиазол-2-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
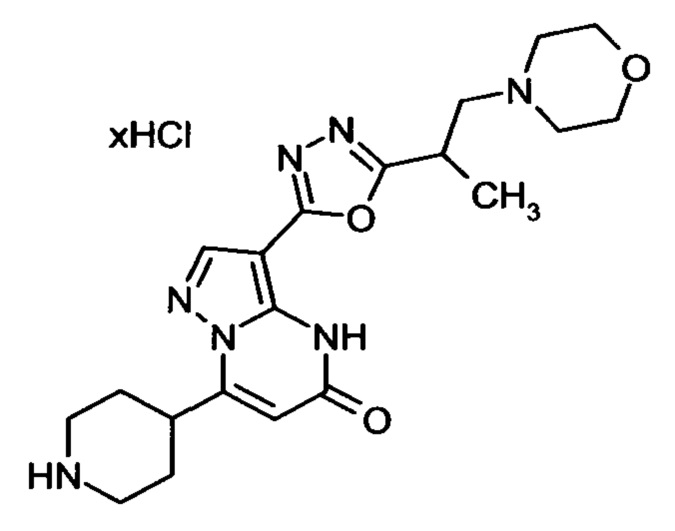
трет-бутил 4-(3-{5-[-1-(морфолин-4-ил)пропан-2-ил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (24.1 мг, 46.9 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль) и обработали соляной кислотой в 1,4-диоксане (180 мкл, 4.0 М, 700 мкмоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. Остаток очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Растворители удалили, и остаток обработали соляной кислотой в 1,4-диоксане (4М, 0.5 мл) и растворитель удалили в вакууме с получением продукта. Полученное количество составило 5.80 мг (100% чистота, 25% теоретический выход).
LC-MS (Способ 7В): Rt=0.83 мин; MS (ESIpos): m/z=414 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.455 (0.40), 1.471 (0.39), 1.858 (0.07), 1.886 (0.17), 1.914 (0.18), 1.944 (0.07), 2.187 (0.26), 2.220 (0.19), 3.062 (0.09), 3.087 (0.23), 3.116 (0.26), 3.146 (0.17), 3.566 (16.00), 3.807 (0.18), 3.835 (0.15), 3.928 (0.10), 3.958 (0.13), 3.990 (0.08), 6.079 (0.03), 8.429 (0.09), 8.777 (0.06), 8.923 (0.08), 10.734 (0.03).
Пример 282
3-{5-[2-(морфолин-4-ил)этил]-1,3,4-оксадиазол-2-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
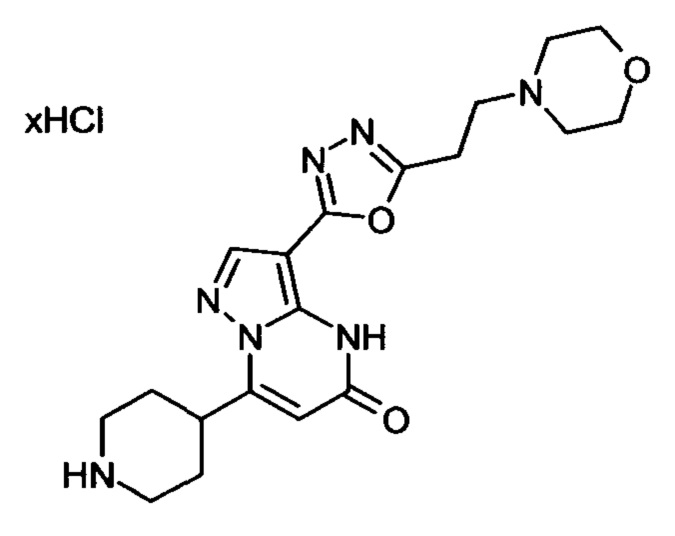
трет-бутил 4-(3-{5-[2-(морфолин-4-ил)этил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (13.4 мг, 26.8 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль) и обработали соляной кислотой в 1,4-диоксане (100 мкл, 4.0 М, 400 мкмоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 13.2 мг (95% чистота, 99% теоретический выход).
LC-MS (Способ 7В): Rt=0.75 мин; MS (ESIpos): m/z=400 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.861 (1.77), 1.870 (2.27), 1.901 (5.32), 1.927 (5.51), 1.958 (2.31), 1.965 (1.93), 2.188 (7.90), 2.221 (5.94), 3.054 (3.01), 3.083 (6.67), 3.111 (6.94), 3.150 (4.90), 3.182 (4.47), 3.387 (10.60), 3.416 (7.44), 3.501 (9.56), 3.529 (16.00), 3.548 (14.27), 3.613 (7.79), 3.630 (7.67), 3.650 (5.24), 3.796 (4.28), 3.827 (8.02), 3.858 (5.59), 3.983 (9.14), 4.017 (6.40), 6.132 (3.62), 8.429 (11.14), 8.851 (1.97), 8.992 (2.54), 11.553 (1.50).
Пример 283
3-[5-(2-фенилэтил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
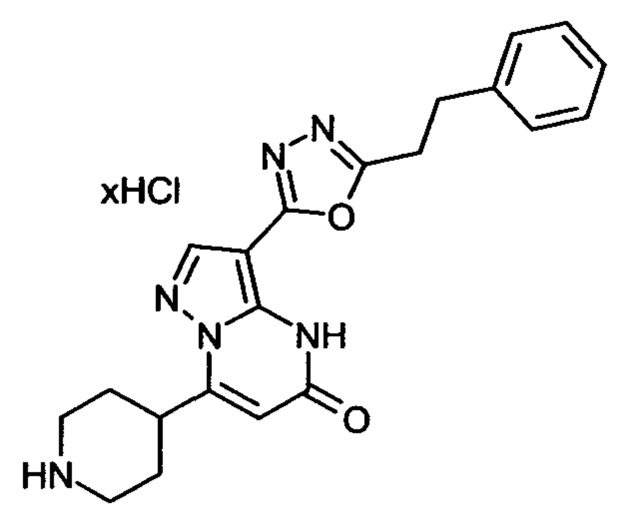
трет-бутил 4-{5-оксо-3-[5-(2-фенилэтил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (35.6 мг, 72.6 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль)и обработали соляной кислотой в 1,4-диоксане (270 мкл, 4.0 М, 1.1 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 34.6 мг (95% чистота, 106% теоретический выход).
LC-MS (Способ 1В): Rt=0.57 мин; MS (ESIpos): m/z=391 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.846 (0.38), 1.855 (0.45), 1.879 (1.14), 1.886 (1.16), 1.911 (1.25), 1.917 (1.20), 1.942 (0.53), 1.951 (0.44), 2.188 (1.79), 2.221 (1.38), 3.053 (0.52), 3.085 (1.36), 3.103 (1.88), 3.120 (3.97), 3.139 (3.25), 3.203 (2.91), 3.222 (3.19), 3.239 (1.22), 3.387 (1.88), 3.418 (1.45), 6.099 (0.52), 7.175 (0.18), 7.183 (0.35), 7.191 (0.65), 7.200 (0.81), 7.205 (1.17), 7.209 (0.98), 7.213 (0.96), 7.219 (1.08), 7.226 (0.99), 7.239 (0.25), 7.250 (0.25), 7.272 (1.14), 7.285 (16.00), 7.293 (4.93), 7.299 (4.81), 7.318 (0.47), 8.388 (2.07), 8.745 (0.43), 8.933 (0.54).
Пример 284
3-[5-(4-хлорбензил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
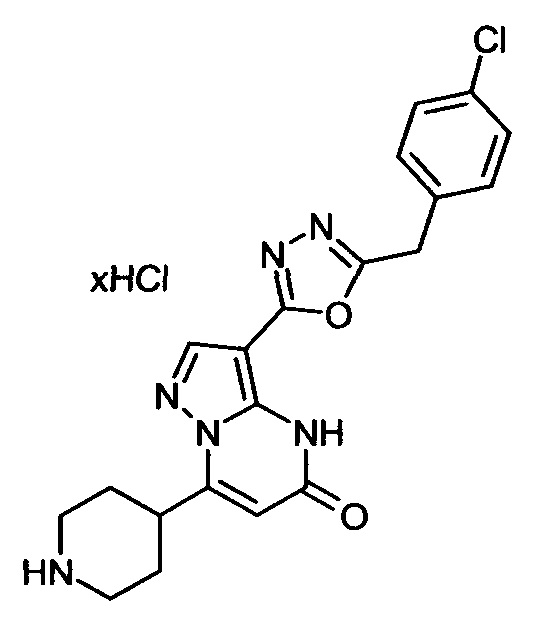
трет-бутил 4-{3-[5-(4-хлорбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (34.3 мг, 67.1 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль) и обработали соляной кислотой в 1,4-диоксане (250 мкл, 4.0 М, 1.0 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 31.7 мг (95% чистота, 100% теоретический выход).
LC-MS (Способ 1В): Rt=0.61 мин; MS (ESIpos): m/z=411 [М+Н]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.831 (0.62), 1.859 (1.65), 1.889 (1.76), 1.921 (0.70), 2.177 (2.52), 2.210 (2.01), 3.052 (0.73), 3.080 (1.94), 3.108 (1.93), 3.139 (0.78), 3.383 (3.14), 3.414 (3.02), 3.468 (2.81), 4.328 (14.38), 6.090 (0.39), 7.397 (1.78), 7.404 (1.32), 7.419 (15.34), 7.424 (16.00), 7.439 (0.99), 7.446 (1.43), 8.384 (1.23), 8.621 (0.54), 8.845 (0.68).
Пример 285
7-(пиперидин-4-ил)-3-[5-(пиридин-2-илметил)-1,3,4-оксадиазол-2-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он тригидрохлорид
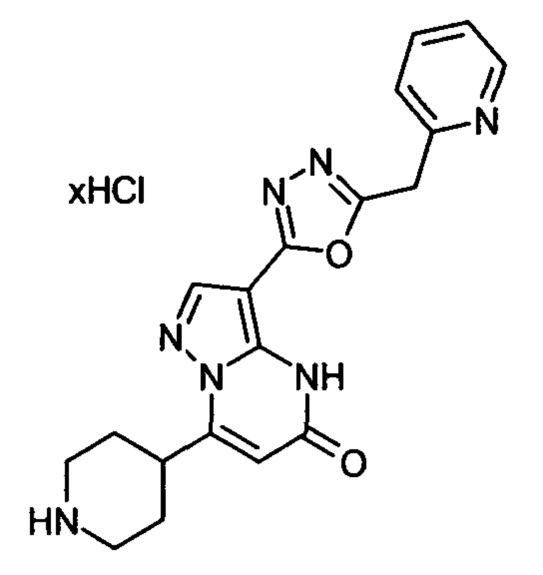
трет-бутил 4-{3-[5-(4-хлорбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (37.2 мг, 77.9 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль) и обработали соляной кислотой в 1,4-диоксане (290 мкл, 4.0 М, 1.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 39.9 мг (95% чистота, 100% теоретический выход).
LC-MS (Способ 1В): Rt=0.34 мин; MS (ESIneg): m/z=376 [M-H]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.866 (2.08), 1.898 (5.66), 1.928 (6.03), 1.959 (2.42), 2.180 (9.02), 2.212 (6.85), 3.045 (2.37), 3.075 (6.40), 3.105 (6.50), 3.135 (2.56), 3.378 (8.57), 3.408 (6.92), 4.620 (10.69), 6.118 (6.28), 7.539 (2.87), 7.672 (3.22), 8.055 (2.58), 8.413 (16.00), 8.638 (4.54), 8.885 (1.59), 9.042 (2.09).
Пример 286
3-(5-гидрокси-1,3,4-оксадиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
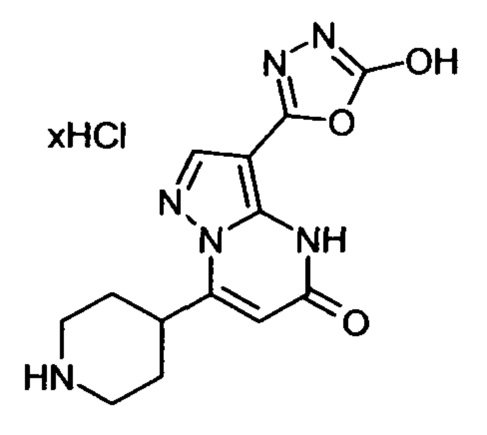
трет-бутил 4-{3-[5-(4-хлорбензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (38.9 мг, 93.4 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль) и обработали соляной кислотой в 1,4-диоксане (350 мкл, 4.0 М, 1.4 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 32.5 мг (95% чистота, 98% теоретический выход).
LC-MS (Способ 1В): Rt=0.17 мин; MS (ESIpos): m/z=303 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) d ppm = 12.42 (s, 1 H), 9.02 (br. s, 1 H), 8.85 (br. s, 1 H), 8.29 (s, 1 H), 6.14 (br. s, 1 H), 3.51-3.63 (m, 1 H), 3.36-3.42 (m, 2 H), 3.09 (q, 2 H), 2.20 (d, 2H), 1.91 (q, 2 H).
Пример 287
5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карботиоамид гидрохлорид

трет-бутил 4-(3-карбамотиол-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (50.0 мг, 132 мкмоль) растворили в 1,4-диоксане (2.6 мл) и обработали соляной кислотой в 1,4-диоксане (660 мкл, 4.0 М, 2.6 ммоль) при комнатной температуре в течение 16 ч. В результате высушивания в вакууме получили продукт. Полученное количество составило 42.5 мг (90% чистота, 82% теоретический выход).
LC-MS (Способ 7В): Rt=0.61 мин; MS (ESIpos): m/z=278 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.544 (0.22), 1.555 (0.24), 1.576 (0.51), 1.583 (0.65), 1.610 (0.82), 1.619 (0.59), 1.639 (0.33), 1.649 (0.32), 1.834 (0.53), 1.862 (1.44), 1.892 (1.59), 1.936 (1.10), 1.975 (0.83), 1.981 (0.79), 2.135 (10.31), 2.153 (2.26), 2.185 (1.77), 2.839 (0.28), 2.869 (0.73), 2.896 (0.76), 2.926 (0.36), 3.037 (0.62), 3.066 (1.73), 3.095 (1.79), 3.125 (0.76), 3.226 (0.89), 3.259 (0.88), 3.401 (2.60), 3.513 (0.86), 3.566 (16.00), 6.058 (0.76), 8.499 (5.89), 8.711 (0.53), 8.916 (0.73), 9.435 (0.67), 9.497 (2.10), 11.857 (0.59).
Пример 288
7-(пиперидин-4-ил)-3-[5-(тиофен-2-ил)-1,3,4-оксадиазол-2-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-{5-оксо-3-[5-(тиофен-2-ил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (49.0 мг, 105 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (390 мкл, 4.0 М, 1.6 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 40.3 мг (100% чистота, 95% теоретический выход).
LC-MS (Способ 1В): Rt=0.50 мин; MS (ESIpos): m/z=369 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) d ppm = 9.09 (br. s, 1 H), 8.91 (br. s, 1 H), 8.49 (s, 1 H), 8.06 (d, 1 H), 7.95 (dd, 1 H), 7.33 (dd, 1 H), 6.13 (br. s, 2 H), 3.52-3.65 (m, 1 H), 3.40 (m, 2 H), 3.11 (m, 2 H), 2.22 (m, 2 H), 1.82-2.00 (m, 2 H).
Пример 289
7-(пиперидин-4-ил)-3-[5-(2,2,2-трифторэтил)-1,3,4-оксадиазол-2-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
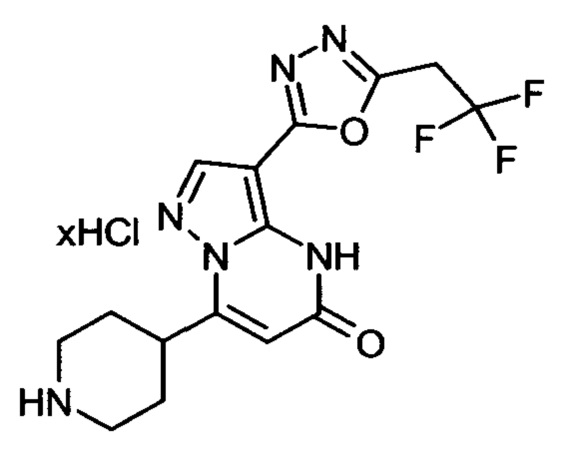
трет-бутил 4-{5-оксо-3-[5-(2,2,2-трифторэтил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (70.0 мг, 149 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (560 мкл, 4.0 M, 2.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 41.2 мг (98% чистота, 67% теоретический выход).
LC-MS (Способ 1В): Rt=0.43 мин; MS (ESIpos): m/z=369 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.870 (2.19), 1.901 (5.23), 1.931 (5.25), 1.961 (2.08), 2.188 (7.77), 2.220 (5.86), 3.056 (2.46), 3.083 (5.57), 3.111 (5.44), 3.140 (2.22), 3.382 (9.75), 3.414 (7.22), 3.565 (8.77), 3.582 (2.75), 4.294 (5.43), 4.320 (16.00), 4.347 (15.39), 4.373 (4.85), 6.139 (1.22), 8.435 (5.14), 8.865 (1.54), 9.023 (2.08), 12.129(0.35).
Пример 290
3-[5-(2-хлорфенил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
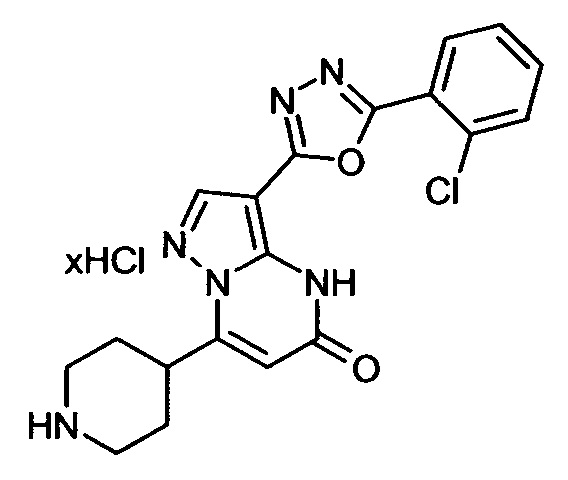
трет-бутил 4-{3-[5-(2-хлорфенил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (76.3 мг, 154 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (580 мкл, 4.0 М, 2.3 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 60.8 мг (100% чистота, 91% теоретический выход).
LC-MS (Способ 1В): Rt=0.58 мин; MS (ESIpos): m/z=397 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.892 (1.63), 1.901 (1.98), 1.926 (5.17), 1.933 (5.20), 1.957 (5.77), 1.964 (5.41), 1.989 (2.46), 1.997 (2.04), 2.199 (7.99), 2.232 (6.14), 3.061 (2.05), 3.090 (4.96), 3.117 (4.97), 3.146 (2.14), 3.386 (8.32), 3.416 (6.38), 3.564 (4.14), 3.573 (2.32), 3.603 (4.01), 3.633 (1.90), 6.147 (5.71), 7.589 (3.61), 7.592 (3.90), 7.607 (9.24), 7.611 (9.20), 7.626 (7.29), 7.630 (7.30), 7.640 (5.60), 7.645 (5.92), 7.660 (8.35), 7.664 (8.70), 7.679 (4.74), 7.683 (4.16), 7.728 (11.20), 7.730 (10.67), 7.748 (7.08), 7.751 (6.34), 8.145 (7.74), 8.149 (7.79), 8.164 (6.97), 8.168 (6.60), 8.510 (16.00), 8.999 (1.80), 9.122 (2.34).
Пример 291
7-(пиперидин-4-ил)-3-[5-(пиперидин-1-илметил)-1,3,4-оксадиазол-2-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
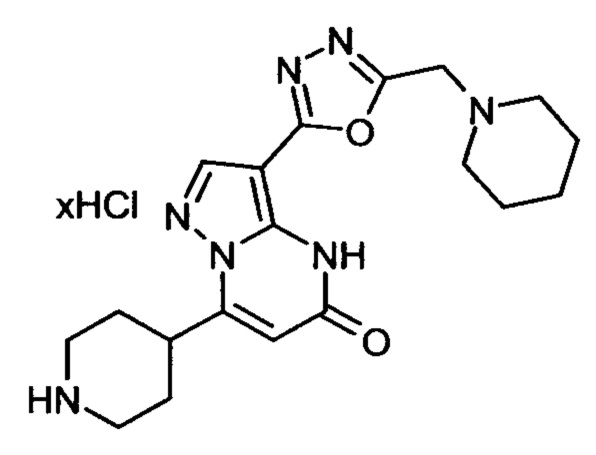
трет-бутил 4-{5-оксо-3-[5-(пиперидин-1-илметил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (33.3 мг, 68.9 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (260 мкл, 4.0 М, 1.0 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 31.9 мг (95% чистота, 96% теоретический выход).
LC-MS (Способ 7В): Rt=0.92 мин; MS (ESIpos): m/z=384 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.512 (0.46), 1.776 (1.77), 1.789 (2.04), 1.801 (1.37), 1.878 (0.33), 1.900 (0.82), 1.934 (0.78), 1.964 (0.34), 2.072 (16.00), 2.184 (1.08), 2.217 (0.79), 3.053 (0.50), 3.082 (0.93), 3.110 (0.93), 3.140 (0.56), 3.387 (1.43), 3.413 (0.89), 3.566 (3.46), 3.581 (0.66), 4.610 (0.98), 6.148 (1.76), 8.468 (3.23), 8.915 (0.24), 9.042 (0.32).
Пример 292
3-{5-[(2-оксопирролидин-1-ил)метил]-1,3,4-оксадиазол-2-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
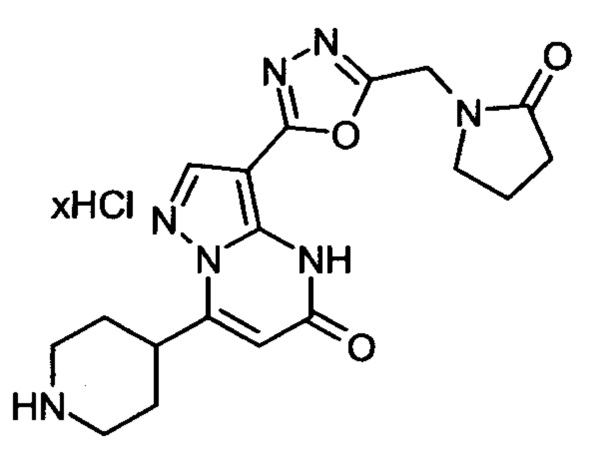
трет-бутил 4-(5-оксо-3-{5-[(2-оксопирролидин-1-ил)метил]-1,3,4-оксадиазол-2-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (48.2 мг, 99.7 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (370 мкл, 4.0 М, 1.5 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 42.2 мг (95% чистота, 96% теоретический выход).
LC-MS (Способ 7В): Rt=0.71 мин; MS (ESIpos): m/z=384 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.859 (0.62), 1.890 (1.66), 1.922 (1.82), 1.956 (1.60), 1.975 (2.78), 1.994 (3.98), 2.013 (3.00), 2.031 (1.09), 2.072 (12.56), 2.186 (2.65), 2.219 (2.10), 2.283 (4.13), 2.303 (6.18), 2.323 (3.24), 3.056 (0.75), 3.083 (1.86), 3.112 (1.90), 3.141 (0.76), 3.387 (2.66), 3.414 (2.25), 3.461 (4.21), 3.478 (6.67), 3.496 (4.07), 3.566 (3.79), 4.714 (16.00), 6.120 (0.80), 8.411 (2.43), 8.770 (0.37), 8.963 (0.47).
Пример 293
3-(5-циклогексил-1,3,4-оксадиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
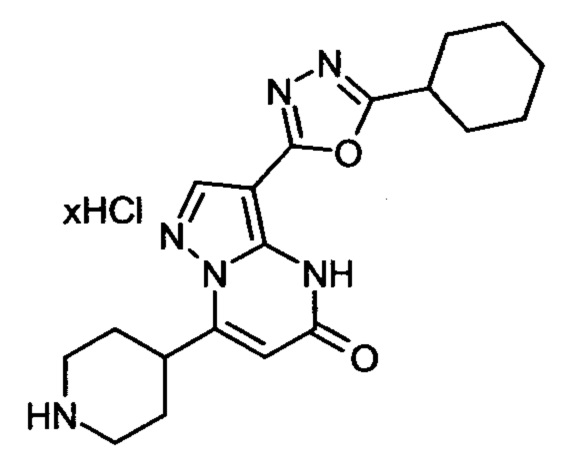
трет-бутил 4-[3-(5-циклогексил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-a]-пиримидин-7-ил]пиперидин-1-карбоксилат (98.8 мг, 211 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (790 мкл, 4.0 М, 3.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. Остаток растворили в ацетонитриле и воде и очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Растворители удалили, и добавили 1 мл соляной кислоты в 1,4-диоксане (4М). В результате высушивания в вакууме получили продукт. Полученное количество составило 45.5 мг (96% чистота, 51% теоретический выход).
LC-MS (Способ 1В): Rt=0.56 мин; MS (ESIpos): m/z=369 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.229 (1.20), 1.238 (1.13), 1.247 (0.81), 1.261 (1.69), 1.268 (2.91), 1.277 (1.70), 1.291 (2.26), 1.298 (3.97), 1.305 (2.24), 1.320 (1.65), 1.328 (2.65), 1.348 (2.21), 1.354 (2.96), 1.361 (2.07), 1.384 (6.36), 1.415 (6.22), 1.436 (1.52), 1.444 (2.57), 1.542 (2.55), 1.550 (2.63), 1.574 (6.11), 1.578 (6.20), 1.602 (6.02), 1.609 (5.81), 1.632 (2.59), 1.639 (3.25), 1.655 (3.35), 1.664 (2.71), 1.676 (2.39), 1.687 (2.93), 1.747 (5.30), 1.755 (7.00), 1.764 (5.49), 1.778 (4.95), 1.787 (5.65), 1.796 (3.79), 1.886 (1.77), 1.911 (4.83), 1.943 (5.36), 1.974 (2.22), 2.051 (6.53), 2.058 (6.52), 2.070 (3.87), 2.083 (5.81), 2.090 (5.41), 2.176 (7.55), 2.209 (5.83), 2.945 (1.47), 2.954 (2.82), 2.963 (1.77), 2.973 (3.01), 2.981 (5.35), 2.991 (2.85), 3.000 (1.70), 3.009 (2.65), 3.018 (1.44), 3.039 (1.93), 3.069 (5.22), 3.097 (5.31), 3.128 (2.08), 3.370 (7.17), 3.400 (5.78), 6.083 (9.31), 8.384 (16.00), 9.046 (1.57), 9.161 (2.07).
Пример 294
3-(5-циклобутил-1,3,4-оксадиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
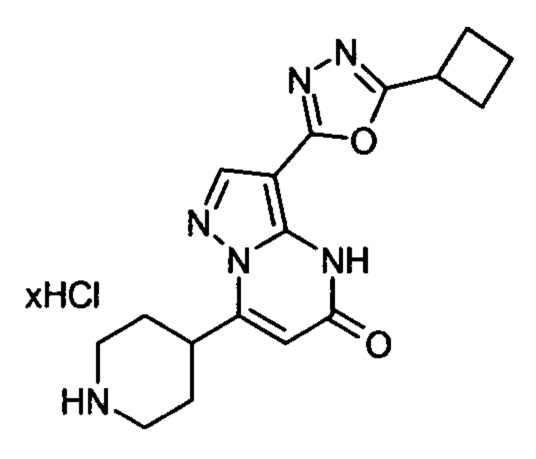
трет-бутил 4-[3-(5-циклобутил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (14.7 мг, 33.4 мкмоль) растворили в 1,4-диоксане (1.0 мл) и обработали соляной кислотой в 1,4-диоксане (130 мкл, 4.0 М, 500 мкмоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 13.1 мг (90% чистота, 94% теоретический выход).
LC-MS (Способ 1В): Rt=0.48 мин; MS (ESIpos): m/z=341 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.844 (1.96), 1.853 (2.23), 1.878 (4.85), 1.883 (4.73), 1.909 (5.15), 1.917 (4.97), 1.942 (3.65), 1.951 (4.34), 1.972 (3.27), 1.979 (3.36), 1.992 (2.58), 2.000 (2.05), 2.012 (1.04), 2.015 (1.03), 2.031 (1.12), 2.053 (3.52), 2.074 (5.93), 2.081 (3.29), 2.097 (5.20), 2.102 (4.99), 2.118 (2.74), 2.125 (4.07), 2.146 (2.12), 2.187 (6.35), 2.221 (6.09), 2.373 (5.82), 2.379 (8.48), 2.387 (8.11), 2.400 (11.82), 2.407 (13.08), 2.417 (5.91), 2.426 (9.88), 2.448 (3.31), 3.055 (1.96), 3.085 (4.83), 3.113 (5.29), 3.143 (2.74), 3.420 (12.50), 3.460 (13.58), 3.566 (16.00), 3.763 (1.61), 3.782 (4.62), 3.784 (4.42), 3.803 (6.42), 3.806 (6.04), 3.824 (4.07), 3.827 (3.91), 3.846 (1.17), 6.101 (1.72), 8.399 (5.56), 8.740 (1.52), 8.919 (2.27).
Пример 295
3-(5-бутил-1,3,4-оксадиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-[3-(5-бутил-1,3,4-оксадиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (35.6 мг, 80.3 мкмоль) растворили в 1,4-диоксане (2.0 мл) и обработали соляной кислотой в 1,4-диоксане (300 мкл, 4.0 М, 1.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 17.0 мг (95% чистота, 53% теоретический выход).
LC-MS (Способ 1В): Rt=0.52 мин; MS (ESIpos): m/z=343 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.906 (7.17), 0.924 (16.00), 0.943 (7.94), 1.348 (0.65), 1.367 (2.26), 1.385 (3.79), 1.404 (3.77), 1.423 (2.26), 1.441 (0.60), 1.709 (1.20), 1.728 (3.10), 1.747 (4.12), 1.766 (2.98), 1.784 (1.03), 1.869 (0.54), 1.877 (0.69), 1.903 (1.63), 1.908 (1.72), 1.934 (1.80), 1.940 (1.75), 1.965 (0.78), 1.973 (0.66), 2.182 (2.78), 2.214 (1.98), 2.872 (4.28), 2.891 (7.08), 2.909 (4.03), 3.049 (0.78), 3.075 (1.85), 3.104 (1.88), 3.132 (0.85), 3.407 (2.66), 3.542 (0.91), 3.565 (6.26), 3.601 (0.73), 6.092 (1.34), 8.390 (4.31), 8.943 (0.58), 9.088 (0.78).
Пример 296
3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
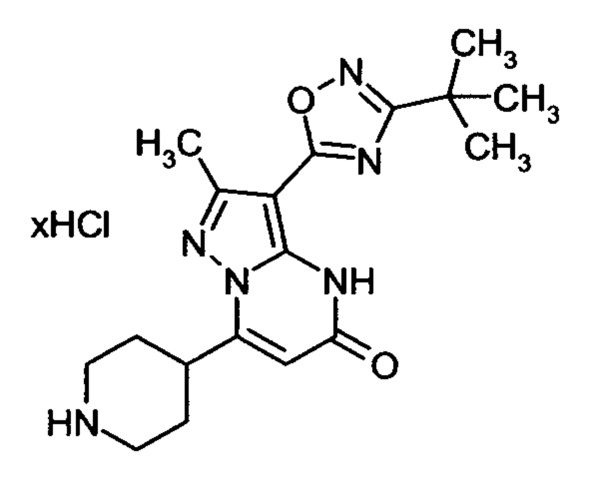
трет-бутил 4-[3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (104 мг, 228 мкмоль) растворили в 1,4-диоксане (3.9 мл, 46 ммоль) и обработали соляной кислотой в 1,4-диоксане (860 мкл, 4.0 М, 3.4 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 90.3 мг (100% чистота, 101% теоретический выход).
LC-MS (Способ 11В): Rt=0.99 мин; MS (ESIpos): m/z=357 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.376 (16.00), 1.835 (0.10), 1.844 (0.11), 1.868 (0.32), 1.875 (0.32), 1.900 (0.35), 1.906 (0.34), 1.931 (0.15), 1.940 (0.13), 2.177 (0.50), 2.210 (0.40), 2.566 (2.49), 3.082 (0.18), 3.112 (0.35), 3.141 (0.21), 3.313 (3.03), 3.379 (0.54), 3.411 (0.43), 6.098 (0.12), 8.820 (0.08), 8.938 (0.10), 11.555 (0.04).
Пример 297
3-[3-(2-метоксиэтил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
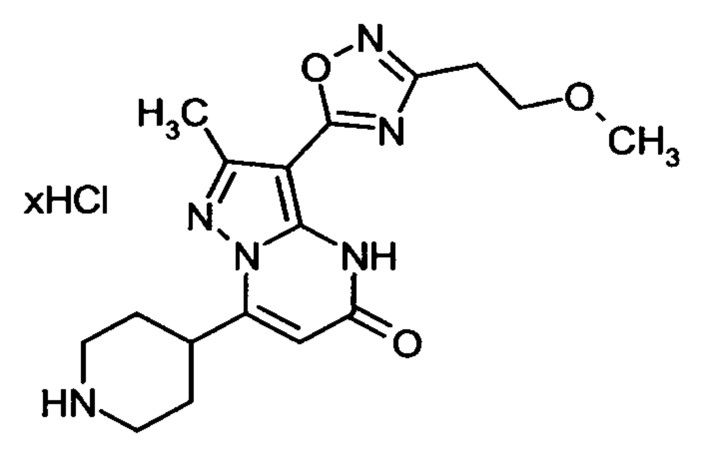
трет-бутил 4-{3-[3-(2-метоксиэтил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (66.9 мг, 146 мкмоль) растворили в 1,4-диоксане (2.5 мл, 29 ммоль) и обработали соляной кислотой в 1,4-диоксане (550 мкл, 4.0 М, 2.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 47.8 мг (100% чистота, 83% теоретический выход).
LC-MS (Способ 11В): Rt=0.65 мин; MS (ESIpos): m/z=359 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.833 (0.24), 1.866 (0.64), 1.896 (0.70), 1.927 (0.28), 2.184 (1.09), 2.215 (0.88), 2.576 (4.24), 2.966 (1.62), 2.983 (3.50), 2.998 (1.77), 3.083 (0.45), 3.120 (0.79), 3.151 (0.46), 3.260 (16.00), 3.391 (1.23), 3.416 (0.98), 3.566 (1.84), 3.743 (1.69), 3.759 (3.44), 3.775 (1.57), 6.139 (0.13), 8.714 (0.13), 8.881 (0.19), 11.546 (0.06).
Пример 298
Этил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
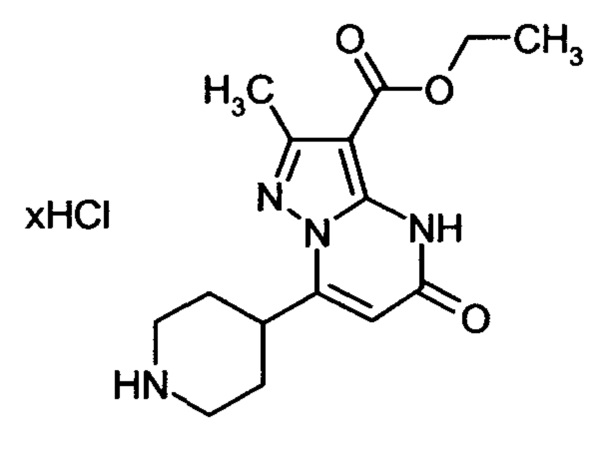
этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (75.0 мг, 185 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (700 мкл, 4.0 М, 2.8 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 43.0 мг (100% чистота, 68% теоретический выход).
LC-MS (Способ 1В): Rt=0.45 мин; MS (ESIpos): m/z=305 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.263 (4.62), 1.281 (10.09), 1.298 (4.73), 1.825 (0.35), 1.857 (1.07), 1.889 (1.19), 1.921 (0.48), 2.131 (1.83), 2.161 (1.38), 2.421 (16.00), 3.031 (0.41), 3.059 (1.06), 3.086 (1.09), 3.113 (0.47), 3.378 (1.42), 3.467 (0.52), 3.474 (0.37), 3.490 (0.62), 3.496 (0.97), 3.503 (0.61), 3.519 (0.35), 3.526 (0.47), 4.258 (1.33), 4.276 (4.18), 4.293 (4.12), 4.311 (1.28), 5.910 (2.79), 9.071 (0.51), 11.348 (0.88).
Пример 299
3-[3-(4-фторбензил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
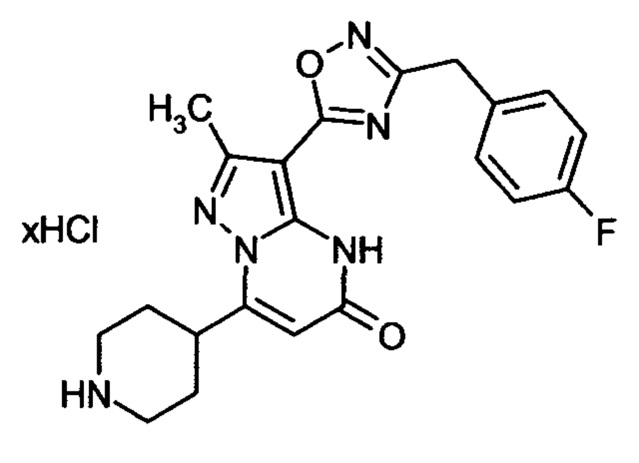
трет-бутил 4-{3-[3-(4-фторбензил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (80.3 мг, 158 мкмоль) растворили в 1,4-диоксане (2.5 мл, 29 ммоль) и обработали соляной кислотой в 1,4-диоксане (590 мкл, 4.0 М, 2.4 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 50.1 мг (100% чистота, 71% теоретический выход).
LC-MS (Способ 7В): Rt=1.27 мин; MS (ESIpos): m/z=409 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.837 (0.74), 1.867 (2.17), 1.898 (2.37), 1.931 (0.95), 2.171 (3.59), 2.204 (2.90), 3.067 (0.91), 3.097 (2.24), 3.123 (2.30), 3.152 (1.04), 3.376 (3.85), 3.407 (3.02), 3.566 (12.82), 4.139 (16.00), 6.149 (0.56), 7.147 (4.21), 7.169 (8.81), 7.192 (4.98), 7.403 (4.45), 7.417 (5.27), 7.424 (4.75), 7.439 (3.76), 8.791 (0.56), 8.931 (0.77).
Пример 300
3-(3-этил-1,2,4-оксадиазол-5-ил)-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
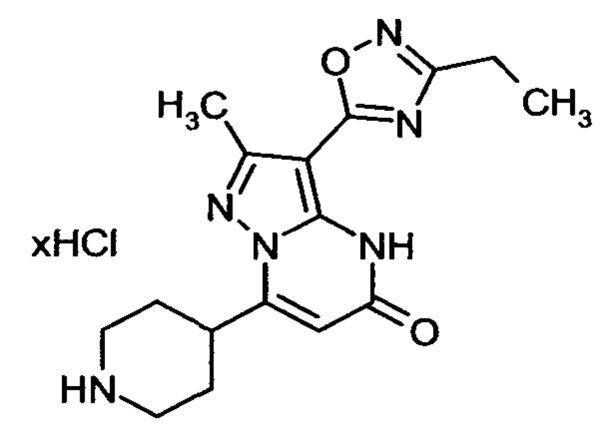
трет-бутил 4-[3-(3-этил-1,2,4-оксадиазол-5-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (91.1 мг, 213 мкмоль) растворили в 1,4-диоксане (2.5 мл, 29 ммоль) и обработали соляной кислотой в 1,4-диоксане (800 мкл, 4.0 М, 3.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 58.3 мг (100% чистота, 75% теоретический выход).
LC-MS (Способ 7В): Rt=0.99 мин; MS (ESIpos): m/z=329 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.271 (6.97), 1.290 (14.47), 1.309 (6.93), 1.850 (0.68), 1.876 (1.72), 1.906 (1.85), 1.938 (0.75), 2.180 (2.66), 2.213 (2.09), 2.575 (14.12), 2.737 (2.42), 2.756 (6.61), 2.775 (6.32), 2.794 (1.97), 3.087 (1.08), 3.115 (1.85), 3.144 (1.08), 3.380 (2.84), 3.411 (2.19), 3.566 (16.00), 3.591 (1.09), 3.618 (0.55), 6.137 (0.75), 8.811 (0.45), 8.936 (0.57).
Пример 301
2-метил-7-(пиперидин-4-ил)-3-[3-(пропан-2-ил)-1,2,4-оксадиазол-5-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
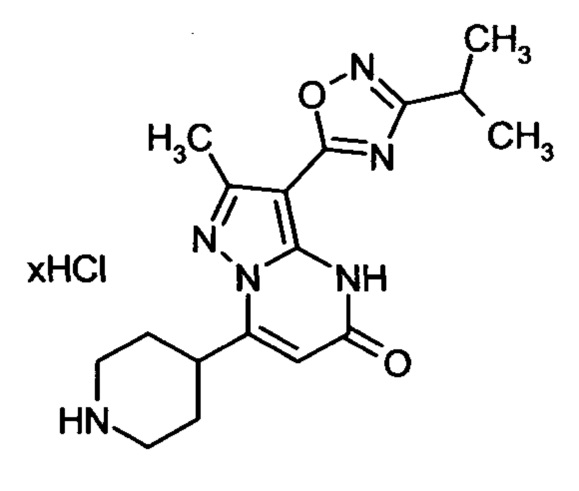
трет-бутил 4-{2-метил-5-оксо-3-[3-(пропан-2-ил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (71.6 мг, 162 мкмоль) растворили в 1,4-диоксане (2.5 мл, 29 ммоль) и обработали соляной кислотой в 1,4-диоксане (610 мкл, 4.0 М, 2.4 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 51.3 мг (100% чистота, 84% теоретический выход).
LC-MS (Способ 7В): Rt=1.12 мин; MS (ESIpos): m/z=343 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.315 (16.00), 1.333 (16.00), 1.858 (0.36), 1.889 (0.94), 1.916 (1.01), 1.946 (0.41), 2.176 (1.46), 2.209 (1.12), 2.570 (8.28), 3.071 (0.94), 3.089 (1.68), 3.106 (2.44), 3.123 (1.66), 3.140 (0.97), 3.376 (1.54), 3.408 (1.19), 3.556 (0.37), 3.585 (0.61), 3.615 (0.30), 6.120 (0.50), 8.909 (0.26), 8.995 (0.34).
Пример 302
3-[3-(2-трет-бутоксиэтил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-{3-[3-(2-трет-бутоксиэтил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (42.0 мг, 83.9 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (310 мкл, 4.0 М, 1.3 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 30.6 мг (100% чистота, 83% теоретический выход).
LC-MS (Способ 7В): Rt=1.19 мин; MS (ESIpos): m/z=401 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.113 (16.00), 1.837 (0.12), 1.864 (0.32), 1.896 (0.35), 1.927 (0.14), 2.181 (0.50), 2.215 (0.40), 2.578 (1.82), 2.878 (0.64), 2.895 (1.26), 2.910 (0.61), 3.122 (0.32), 3.383 (0.55), 3.414 (0.43), 3.587 (0.16), 3.720 (0.65), 3.736 (1.27), 3.752 (0.58), 6.131 (0.07), 8.708 (0.09), 8.879 (0.12).
Пример 303
3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-7-[2-(2,2-диметилпропил)пиперидин-4-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
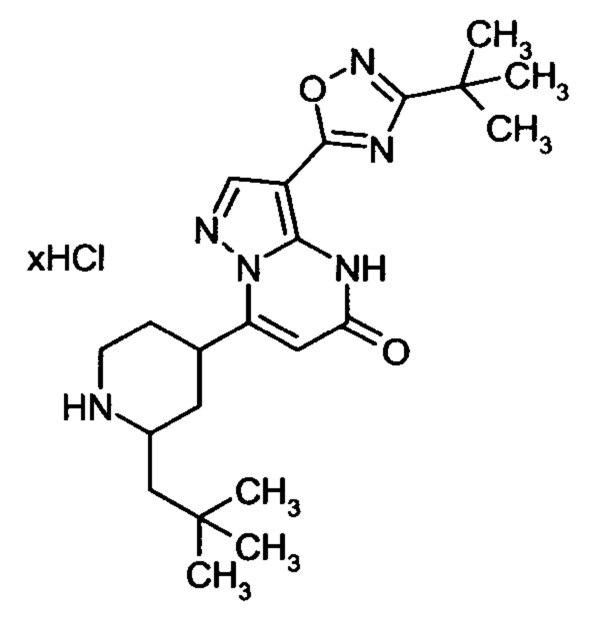
трет-бутил 4-[3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]-2-(2,2-диметилпропил)пиперидин-1-карбоксилат (36.1 мг, 70.4 мкмоль) растворили в 1,4-диоксане (2.1 мл, 24 ммоль) и обработали соляной кислотой в 1,4-диоксане (260 мкл, 4.0 М, 1.1 ммоль) при комнатной температуре в течение 16 ч. Смесь обработали в течение 1 ч при комнатной температуре в ультразвуковой ванне. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 29.7 мг (97% чистота, 91% теоретический выход).
LC-MS (Способ 11В): Rt=1.24 мин; MS (ESIneg): m/z=411 [M-H]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.947 (10.09), 1.369 (16.00), 1.525 (0.29), 1.558 (0.28), 1.796 (0.19), 1.817 (0.21), 1.831 (0.17), 1.853 (0.16), 1.961 (0.05), 1.986 (0.12), 2.013 (0.14), 2.041 (0.07), 2.115 (0.45), 2.128 (0.44), 3.186 (0.13), 3.231 (0.23), 3.264 (0.12), 3.566 (7.38), 3.743 (0.13), 6.208 (0.05), 8.513 (0.23), 8.718 (0.09), 8.936 (0.07).
Пример 304
3-[4-(3-метилбутил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-{3-[4-(3-метилбутил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (35.0 мг, 74.2 мкмоль) растворили в 1,4-диоксане (1.5 мл) и обработали соляной кислотой в 1,4-диоксане (370 мкл, 4.0 М, 1.5 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили в вакууме. Остаток очистили посредством обращенно-фазовой хроматографии (Способ: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,01% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 10%В, 4.50 мин = 20%В, 15.50 мин = 85%В, 16.00-18.50 мин = 100%В, 18.75.00-22.00 мин = 20%В). Растворители удалили, и остаток обработали соляной кислотой в 1,4-диоксане (4М, 0.5 мл), и растворитель удалили в вакууме с получением продукта. Полученное количество составило 24.0 мг (70% чистота, 51% теоретический выход).
LC-MS (Способ 11В): Rt=1.28 мин; MS (ESIneg): m/z=370 [M-H]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.931 (16.00), 0.944 (14.71), 0.948 (10.95), 1.584 (1.98), 1.599 (3.34), 1.613 (1.85), 1.886 (0.55), 1.918 (1.58), 1.950 (1.70), 1.975 (0.71), 2.205 (2.39), 2.238 (1.93), 2.349 (6.44), 2.656 (1.86), 2.674 (1.95), 2.756 (1.53), 2.774 (2.06), 2.792 (1.50), 3.063 (0.60), 3.094 (1.70), 3.123 (1.77), 3.152 (0.73), 3.393 (2.37), 3.424 (1.96), 3.621 (1.01), 6.213 (0.44), 6.259 (0.33), 7.224 (2.94), 8.526 (0.60), 8.581 (0.24), 8.828 (0.55), 8.976 (0.73).
Пример 305
3-{5-[1-(4-метоксифенил)циклопропил]-1,3,4-оксадиазол-2-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
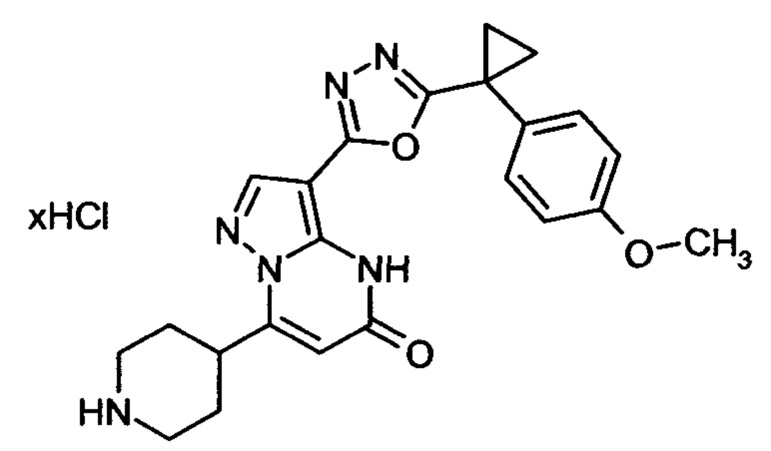
трет-бутил 4-(3-{5-[1-(4-метоксифенил)циклопропил]-1,3,4-оксадиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (42.0 мг, 78.9 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (300 мкл, 4.0 М, 1.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 30.6 мг (100% чистота, 83% теоретический выход).
LC-MS (Способ 11В): Rt=1.05 мин; MS (ESIpos): m/z=433 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.399 (3.75), 1.412 (11.44), 1.418 (10.99), 1.429 (4.65), 1.681 (4.48), 1.691 (11.29), 1.698 (10.60), 1.709 (4.06), 1.876 (1.20), 1.908 (3.41), 1.934 (3.87), 1.965 (1.84), 2.165 (5.19), 2.197 (4.38), 3.035 (1.28), 3.065 (3.64), 3.093 (3.85), 3.122 (1.66), 3.364 (4.98), 3.395 (4.20), 3.534 (1.47), 3.564 (3.96), 3.594 (1.62), 6.086 (6.17), 6.905 (14.25), 6.927 (15.88), 7.345 (16.00), 7.367 (14.42), 8.323 (12.39), 9.029 (1.13), 9.144 (1.56).
Пример 306
2-метил-3-[3-(4-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
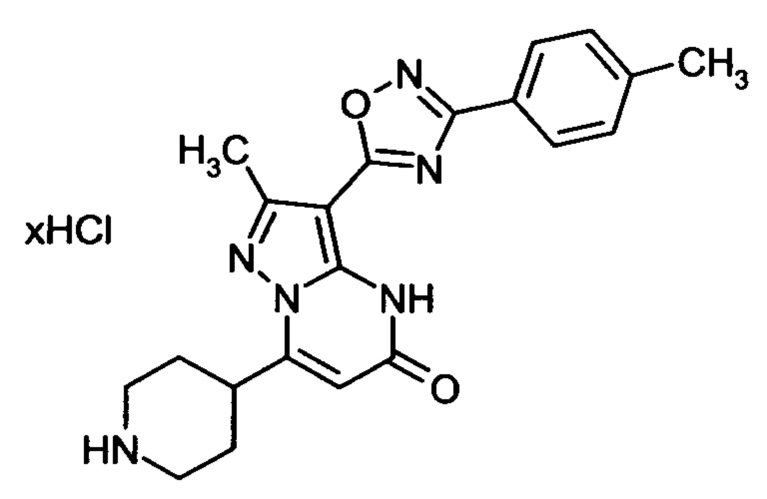
трет-бутил 4-{2-метил-3-[3-(4-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (60.7 мг, 124 мкмоль) растворили в 1,4-диоксане (2.5 мл, 29 ммоль) и обработали соляной кислотой в 1,4-диоксане (460 мкл, 4.0 М, 1.9 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 44.9 мг (100% чистота, 85% теоретический выход).
LC-MS (Способ 7В): Rt=1.38 мин; MS (ESIpos): m/z=391 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.855 (0.51), 1.887 (1.42), 1.918 (1.53), 1.950 (0.61), 2.195 (2.34), 2.227 (1.87), 2.406 (16.00), 2.638 (14.14), 3.085 (0.64), 3.114 (1.36), 3.132 (1.37), 3.165 (0.67), 3.389 (2.63), 3.420 (2.00), 3.566 (3.67), 3.595 (1.10), 3.625 (0.54), 6.132 (1.21), 7.388 (4.79), 7.408 (4.95), 8.074 (4.16), 8.094 (3.81), 8.794 (0.32), 8.930 (0.47).
Пример 307
3-[4-(1,3-дифтор-2-метилпропан-2-ил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
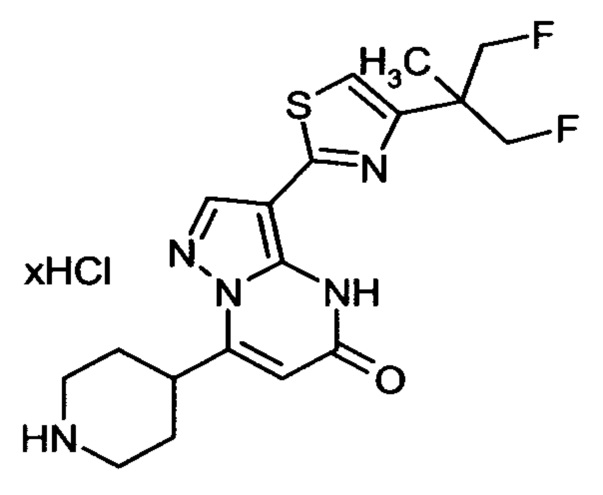
трет-бутил 4-{3-[4-(1,3-дифтор-2-метилпропан-2-ил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (35.5 мг, 71.9 мкмоль) растворили в 1,4-диоксане (1.4 мл) и обработали соляной кислотой (360 мкл, 4.0 М, 1.4 ммоль) в 1,4-диоксане при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 33.5 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 11В): Rt=1.05 мин; MS (ESIpos): m/z=394 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.407 (16.00), 1.857 (0.86), 1.888 (2.12), 1.919 (2.21), 1.950 (0.94), 2.202 (3.20), 2.235 (2.50), 3.065 (1.03), 3.097 (2.52), 3.126 (2.50), 3.156 (1.00), 3.393 (3.68), 3.422 (3.01), 4.674 (1.59), 4.699 (4.38), 4.709 (4.60), 4.730 (1.30), 4.797 (1.58), 4.817 (4.24), 4.827 (4.49), 4.849 (1.15), 7.425 (13.81), 8.423 (1.15), 8.728 (0.74), 8.918 (1.00).
Пример 308
3-(4-этил-1,3-тиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
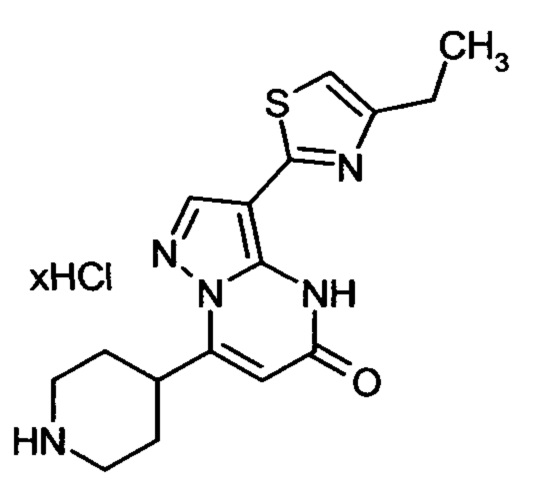
трет-бутил 4-[3-(4-этил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (54.0 мг, 126 мкмоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой в 1,4-диоксане (630 мкл, 4.0 М, 2.5 ммоль) при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 50.5 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 11В): Rt=0.95 мин; MS (ESIpos): m/z=330 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.261 (7.76), 1.280 (16.00), 1.299 (7.64), 1.898 (0.78), 1.925 (1.93), 1.957 (2.07), 1.986 (0.86), 2.206 (3.04), 2.239 (2.31), 2.772 (1.99), 2.791 (5.11), 2.809 (4.88), 2.828 (1.60), 3.065 (0.89), 3.094 (2.13), 3.123 (2.14), 3.150 (0.84), 3.389 (2.96), 3.422 (2.32), 3.601 (0.76), 3.629 (1.31), 3.656 (0.68), 6.250 (0.97), 7.245 (3.34), 8.590 (0.96), 8.902 (0.68), 9.029 (0.86).
Пример 309
3-[4-(4-метилфенил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
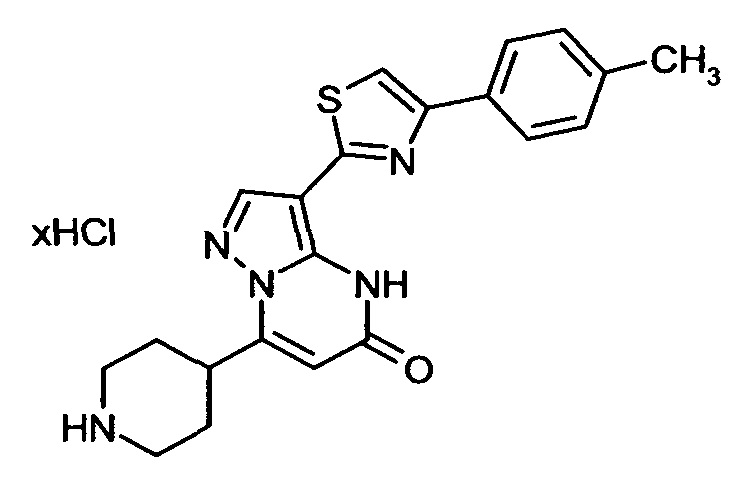
трет-бутил 4-{3-[4-(4-метилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (57.6 мг, 117 мкмоль) растворили в 1,4-диоксане (2.3 мл) и обработали соляной кислотой в 1,4-диоксане (590 мкл, 4.0 М, 2.3 ммоль) при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 57.2 мг (95% чистота, 100% теоретический выход).
LC-MS (Способ 1В): Rt=0.76 мин; MS (ESIpos): m/z=392 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.894 (0.57), 1.925 (1.52), 1.956 (1.60), 1.985 (0.62), 2.224 (2.40), 2.258 (1.94), 2.354 (16.00), 3.078 (0.69), 3.109 (1.67), 3.135 (1.73), 3.165 (0.70), 3.404 (2.38), 3.433 (1.87), 3.641 (0.80), 6.217 (0.36), 7.274 (4.86), 7.295 (5.05), 7.942 (8.80), 7.956 (5.19), 7.976 (4.67), 8.529 (1.05), 8.785 (0.36), 8.954 (0.44).
Пример 310
7-(пиперидин-4-ил)-3-[4-(пропан-2-ил)-1,3-тиазол-2-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
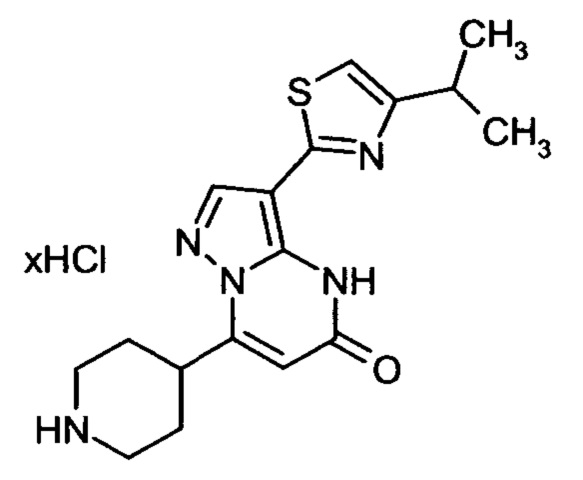
трет-бутил 4-{5-оксо-3-[4-(пропан-2-ил)-1,3-тиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (49.5 мг, 112 мкмоль) растворили в 1,4-диоксане (2.2 мл) и обработали соляной кислотой в 1,4-диоксане (560 мкл, 4.0 М, 2.2 ммоль) при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 46.4 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 1В): Rt=0.67 мин; MS (ESIpos): m/z=343 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.299 (16.00), 1.316 (15.66), 1.897 (0.39), 1.924 (0.98), 1.954 (1.06), 1.985 (0.44), 2.203 (1.54), 2.236 (1.18), 3.069 (0.48), 3.091 (1.34), 3.105 (1.36), 3.122 (2.00), 3.139 (0.98), 3.155 (0.63). 3.387 (1.54), 3.419 (1.18), 3.595 (0.41), 3.625 (0.65), 3.654 (0.33), 6.230 (0.43), 7.220 (1.73), 8.573 (0.37), 8.906 (0.34), 9.039 (0.44).
Пример 311
3-(4-циклопропил-1,3-тиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
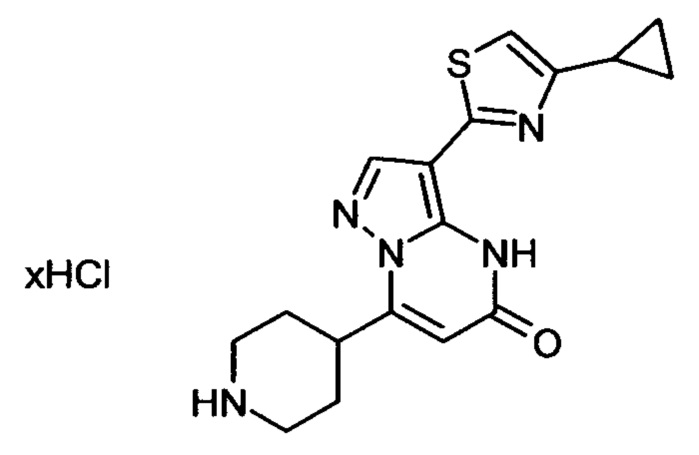
трет-бутил 4-[3-(4-циклопропил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (51.0 мг, 116 мкмоль) растворили в 1,4-диоксане (2.3 мл) и обработали соляной кислотой в 1,4-диоксане (580 мкл, 4.0 М, 2.3 ммоль) при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 47.8 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 1B): Rt=0.62 мин; MS (ESIpos): m/z=342 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.916 (14.53), 0.936 (8.94), 1.872 (1.11), 1.906 (2.95), 1.930 (3.19), 1.963 (1.27), 2.100 (1.05), 2.119 (2.00), 2.133 (3.37), 2.147 (1.90), 2.166 (1.10), 2.198 (4.41), 2.232 (3.42), 3.062 (1.24), 3.092 (3.06), 3.121 (3.17), 3.151 (1.22), 3.388 (4.37), 3.420 (3.38), 3.579 (1.14), 3.606 (1.74), 3.636 (0.89), 6.171 (0.97), 7.164 (16.00), 8.431 (2.87), 8.786 (1.02), 8.962 (1.22).
Пример 312
3-[4-(2,4-диметилфенил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
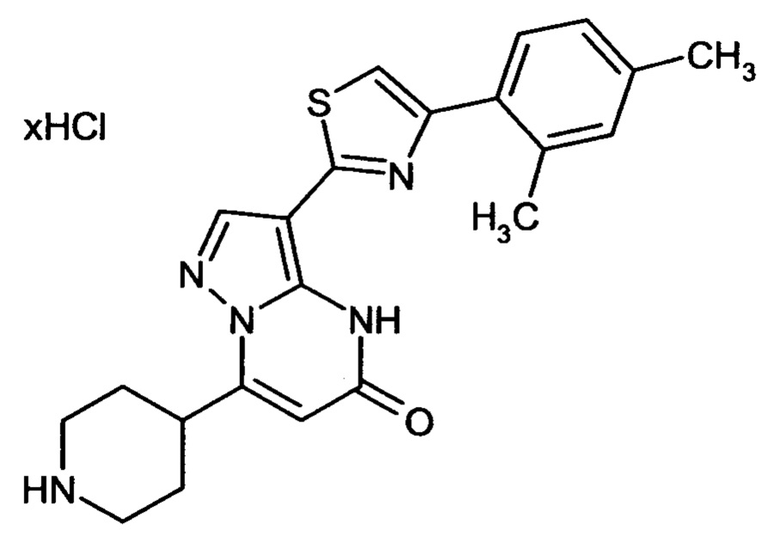
трет-бутил 4-{3-[4-(2,4-диметилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (47.7 мг, 94.3 мкмоль) растворили в 1,4-диоксане (1.9 мл) и обработали соляной кислотой в 1,4-диоксане (470 мкл, 4.0 М, 1.9 ммоль) при комнатной температуре в течение 16 ч. Растворитель удалили в вакууме с получением продукта. Полученное количество составило 46.0 мг (100% чистота, 102% теоретический выход).
LC-MS (Способ 7В): Rt=1.52 мин; MS (ESIpos): m/z=406 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.899 (0.43), 1.930 (1.20), 1.956 (1.32), 1.987 (0.58), 2.217 (1.86), 2.250 (1.53), 2.325 (13.28), 2.437 (16.00), 3.072 (0.46), 3.101 (1.30), 3.130 (1.35), 3.160 (0.55), 3.397 (1.85), 3.427 (1.49), 3.602 (0.40), 3.633 (0.68), 3.664 (0.38), 6.208 (0.34), 7.099 (1.59), 7.119 (1.78), 7.141 (3.23), 7.604 (2.67), 7.623 (8.66), 8.516 (1.61), 8.838 (0.41), 8.862 (0.44), 9.006 (0.61), 9.029 (0.50).
Пример 313
3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он
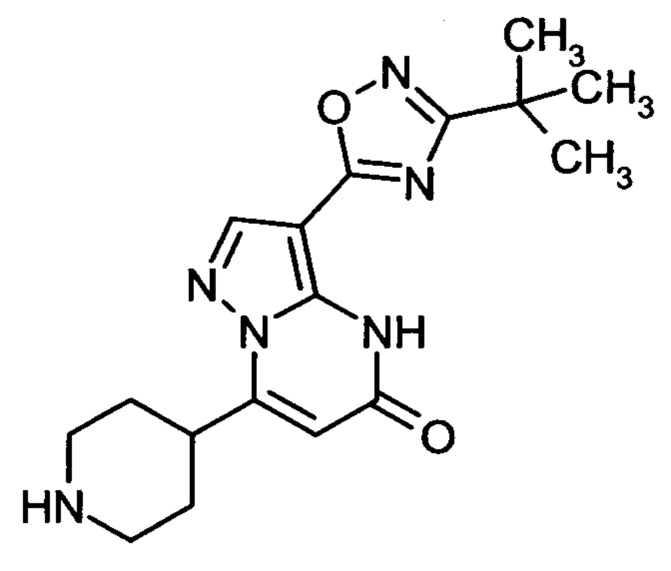
3-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он дигидрохлорид (7.70 г, 18.5 ммоль) растворили в воде (45 мл). Водный раствор гидроксида натрия (30 мл, 1.0 М, 30 ммоль) добавили до достижения значения pH около 9. Полученный осадок отфильтровали, промыли водой и высушивали в вакууме. Полученное количество составило 5.98 г (100% чистота, 94% теоретический выход).
LC-MS (Способ 10В): Rt=1.10 мин; MS (ESIpos): m/z=343 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.150 (0.13), -0.009 (1.27), 0.007 (1.04), 0.145 (0.11), 1.147 (0.19), 1.172 (0.08), 1.333 (16.00), 1.694 (0.12), 1.727 (0.32), 1.763 (0.36), 1.791 (0.15), 2.124 (0.50), 2.156 (0.43), 2.327 (0.18), 2.366 (0.16), 2.669 (0.16), 2.709 (0.18), 2.969 (0.25), 3.002 (0.48), 3.034 (0.25), 3.376 (0.78), 3.567 (0.06), 5.718 (0.51), 8.160 (1.11), 8.509 (0.06), 8.588 (0.07).
Пример 314
Этил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат
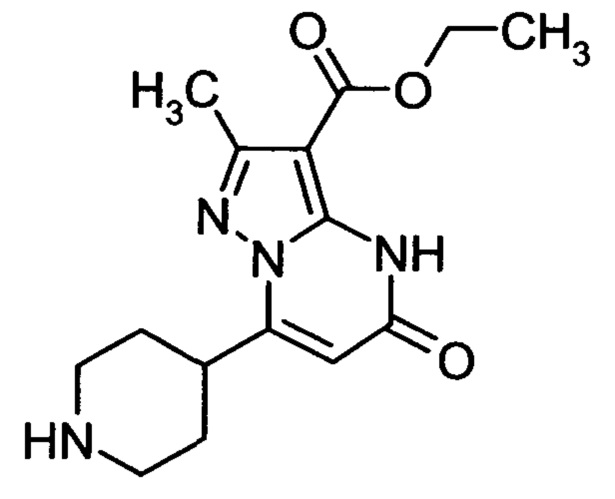
этил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид (100 мг, 293 мкмоль) растворили в воде (1 мл). Водный раствор гидроксида натрия (500 мкл, 1.0 М, 500 мкмоль) добавили до достижения значения pH около 9. Полученный осадок отфильтровали, промыли водой и высушивали в вакууме. Полученное количество составило 62.0 мг (100% чистота, 69% теоретический выход).
LC-MS (Способ 10В): Rt=0.95 мин; MS (ESIpos): m/z=305 [М+Н]+
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: -0.120 (1.12), -0.007 (10.41), 0.006 (9.29), 0.116 (1.12), 0.854 (0.22), 1.147 (2.01), 1.235 (1.34), 1.259 (1.79), 1.273 (3.80), 1.287 (1.68), 1.455 (0.22), 1.480 (0.45), 1.499 (0.45), 1.505 (0.45), 1.876 (0.56), 1.901 (0.56), 2.357 (1.34), 2.361 (1.79), 2.365 (1.34), 2.401 (5.59), 2.601 (0.45), 2.631 (1.57), 2.635 (1.90), 2.638 (1.45), 3.030 (0.56), 3.053 (0.56), 3.223 (0.45), 3.286 (16.00), 3.567 (0.90), 4.233 (0.45), 4.247 (1.12), 4.261 (1.12), 4.275 (0.34), 5.824 (0.34).
Пример 315
Пропан-2-ил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид

пропан-2-ил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (127 мг, 313 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.2 мл, 4.0 М, 4.7 ммоль) при комнатной температуре в течение 3 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 51.9 мг (100% чистота, 49% теоретический выход).
LC-MS (Способ 10В): Rt=1.02 мин; MS (ESIpos): m/z=305 [M+H]+
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: -0.122 (0.08), -0.009 (0.81), 0.114 (0.08), 1.146 (0.09), 1.177 (0.08), 1.189 (0.08), 1.233 (0.08), 1.305 (16.00), 1.317 (15.98), 1.430 (0.07), 1.442 (0.08), 1.825 (0.32), 1.832 (0.38), 1.851 (1.00), 1.857 (1.02), 1.877 (1.09), 1.883 (1.07), 1.902 (0.47), 1.909 (0.41), 2.072 (0.43), 2.146 (1.51), 2.172 (1.26), 2.361 (0.07), 2.635 (0.08), 3.048 (0.59), 3.072 (1.14), 3.096 (0.64), 3.365 (1.60), 3.390 (1.35), 3.486 (0.39), 3.510 (0.73), 3.534 (0.37), 3.566 (4.43), 5.085 (0.07), 5.097 (0.44), 5.110 (1.18), 5.122 (1.61), 5.135 (1.17), 5.147 (0.44), 5.160 (0.07), 6.006 (0.99), 8.168 (3.13), 8.814 (0.21), 8.980 (0.26), 11.495 (0.24).
Пример 316
N-метил-N-[(5-метил-1,2-оксазол-3-ил)метил]-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
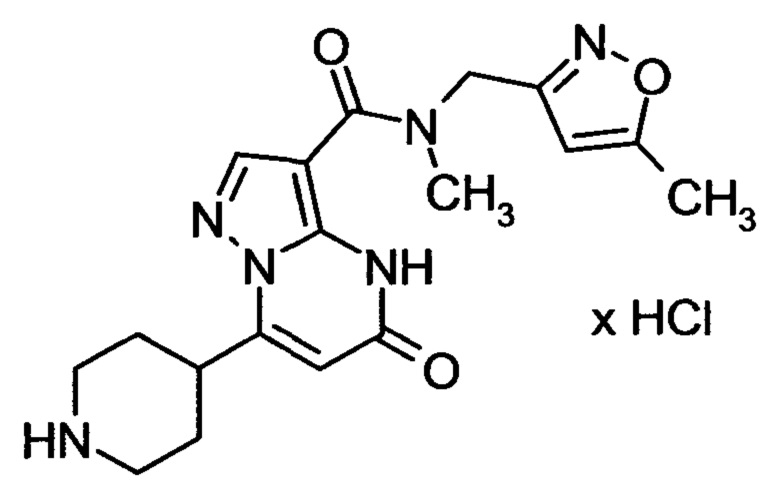
трет-бутил 4-(3-{метил[(5-метил-1,2-оксазол-3-ил)метил]карбамоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (74.0 мг, 157 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (590 мкл, 4.0 М, 2.4 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 49.2 мг (100% чистота, 77% теоретический выход).
LC-MS (Способ 10В): Rt=0.89 мин; MS (ESIpos): m/z=371 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.860 (0.67), 1.891 (0.73), 1.921 (0.36), 2.069 (0.31), 2.077 (0.28), 2.161 (1.03), 2.193 (0.86), 2.378 (3.76), 2.384 (3.54), 2.706 (0.34), 3.121 (1.46), 3.314 (16.00), 3.321 (14.49), 3.367 (1.42), 3.399 (1.11), 3.517 (0.56), 3.563 (2.43), 3.570 (2.23), 4.648 (1.25), 5.978 (0.56), 6.235 (0.98), 7.960 (0.06), 8.167 (0.40), 8.759 (0.26), 8.949 (0.29), 11.380 (0.31).
Пример 317
N-этил-2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
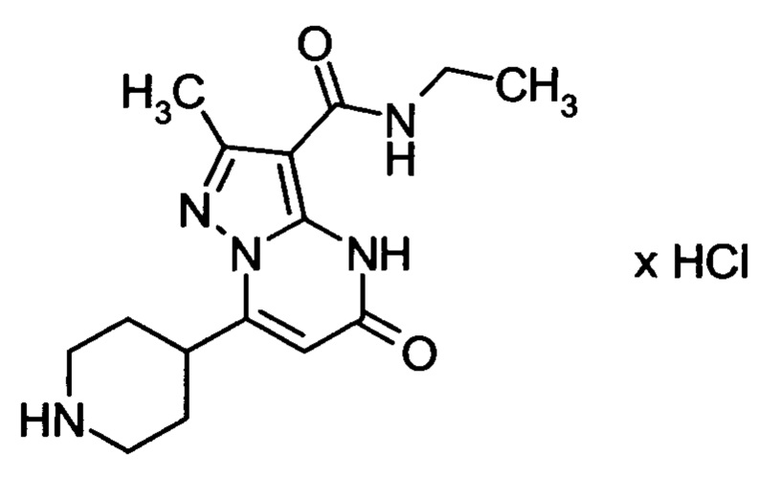
трет-бутил 4-[3-(этилкарбамоил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (95.8 мг, 237 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (890 мкл, 4.0 М, 3.6 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 76.2 мг (100% чистота, 94% теоретический выход).
LC-MS (Способ 10В): Rt=0.69 мин; MS (ESIpos): m/z=304 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.12), -0.010 (1.16), 0.005 (0.96), 0.143 (0.11), 0.974 (0.09), 1.116 (7.30), 1.134 (16.00), 1.152 (7.56), 1.754 (0.15), 1.844 (0.58), 1.874 (1.65), 1.905 (1.79), 1.935 (0.74), 2.072 (0.53), 2.166 (2.76), 2.199 (2.17), 2.327 (0.17), 2.365 (0.22), 2.411 (0.72), 2.668 (0.16), 2.709 (0.20), 3.062 (0.73), 3.090 (1.93), 3.119 (1.98), 3.148 (0.82), 3.264 (0.92), 3.281 (2.74), 3.298 (3.40), 3.313 (2.63), 3.331 (0.94), 3.369 (2.88), 3.400 (2.38), 3.566 (15.00), 3.604 (4.27), 4.054 (0.11), 5.904 (0.13), 6.146 (0.28), 7.795 (0.35), 8.966 (0.74).
Пример 318
N-метил-5-оксо-7-(пиперидин-4-ил)-N-(пиридин-3-илметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
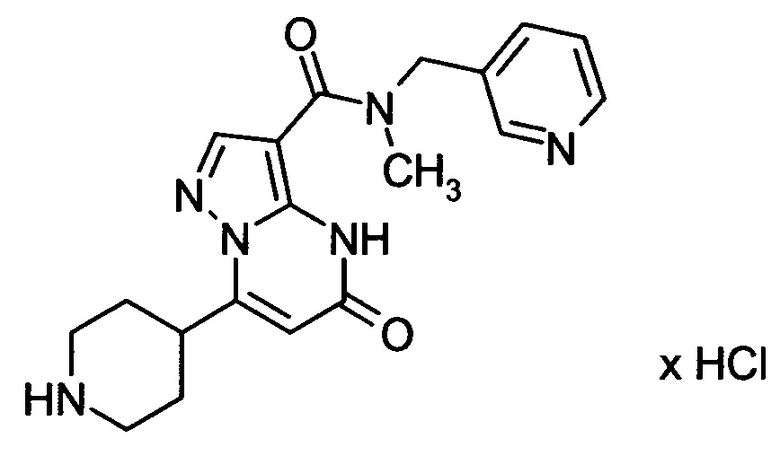
трет-бутил 4-{3-[метил(пиридин-3-илметил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (45.8 мг, 98.2 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (370 мкл, 4.0 М, 1.5 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 39.7 мг (100% чистота, 92% теоретический выход).
LC-MS (Способ 10В): Rt=0.82 мин; MS (ESIpos): m/z=367 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.35), 0.005 (2.72), 0.143 (0.35), 1.593 (0.20), 1.857 (1.88), 1.890 (5.24), 1.920 (5.74), 1.946 (2.26), 2.072 (7.82), 2.153 (8.29), 2.186 (6.42), 2.326 (0.51), 2.366 (0.60), 2.411 (1.23), 2.670 (0.45), 2.709 (0.68), 3.027 (2.64), 3.058 (6.25), 3.086 (6.69), 3.117 (3.84), 3.177 (6.85), 3.361 (8.73), 3.391 (7.33), 3.492 (3.32), 3.522 (5.11), 3.729 (2.02), 4.346 (0.64), 4.462 (0.47), 4.510 (0.43), 4.809 (16.00), 5.985 (9.81), 7.891 (3.42), 8.205 (2.22), 8.361 (1.85), 8.776 (6.18), 8.818 (4.58), 8.972 (1.52), 9.117 (1.97), 11.449 (0.44).
Пример 319
N,N,2-триметил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
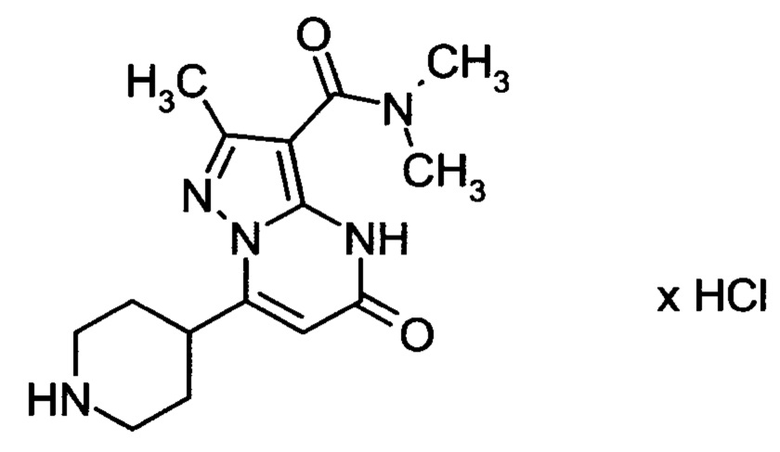
трет-бутил 4-[3-(диметилкарбамоил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (100 мг, 249 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (930 мкл, 4.0 М, 3.7 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 63.2 мг (100% чистота, 75% теоретический выход).
LC-MS (Способ 10В): Rt=0.69 мин; MS (ESIpos): m/z=304 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.144 (0.04), 1.758 (0.14), 1.840 (0.28), 1.871 (0.73), 1.899 (0.79), 1.928 (0.31), 2.066 (0.08), 2.142 (1.15), 2.175 (0.93), 2.228 (7.88), 2.326 (0.04), 2.365 (0.05), 2.386 (0.05), 2.449 (0.18), 2.709 (0.04), 2.740 (0.08), 2.914 (16.00), 3.033 (0.31), 3.063 (0.78), 3.090 (0.80), 3.121 (0.33), 3.158 (0.08), 3.348 (1.08), 3.379 (0.86), 3.480 (0.33), 3.511 (0.61), 3.540 (0.38), 5.128 (0.19), 5.665 (0.05), 5.797 (1.50), 9.079 (0.40).
Пример 320
3-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
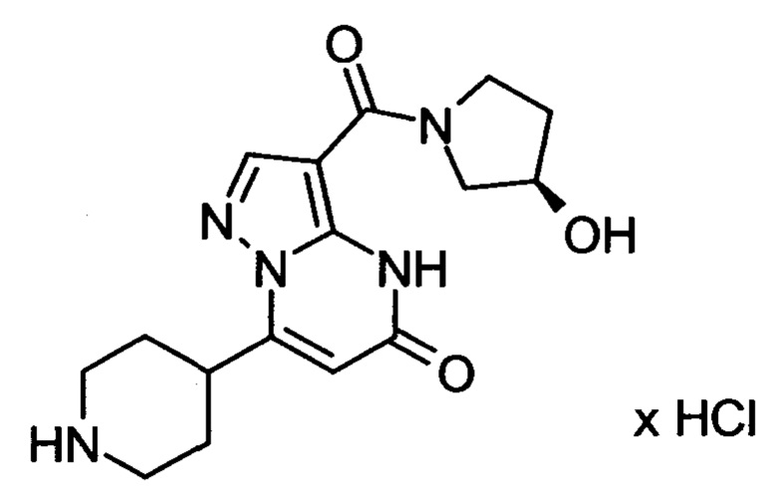
трет-бутил 4-(3-{[(3R)-3-гидроксипирролидин-1-ил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (85.1 мг, 197 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (740 мкл, 4.0 М, 3.0 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 63.3 мг (100% чистота, 87% теоретический выход).
LC-MS (Способ 10В): Rt=0.67 мин; MS (ESIpos): m/z=332 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.146 (0.89), 1.752 (0.87), 1.833 (5.90), 1.865 (10.78), 1.896 (13.04), 1.927 (7.89), 2.009 (2.57), 2.072 (2.80), 2.165 (14.75), 2.199 (11.71), 2.327 (0.80), 2.365 (0.89), 2.669 (0.75), 2.710 (0.93), 2.916 (0.69), 3.045 (3.99), 3.069 (9.73), 3.098 (10.00), 3.125 (4.24), 3.160 (1.03), 3.371 (16.00), 3.403 (12.56), 3.497 (8.75), 3.528 (12.20), 3.555 (10.07), 3.566 (15.86), 3.813 (6.02), 4.310 (4.13), 4.395 (3.65), 4.938 (0.46), 5.021 (2.19), 5.066 (2.23), 5.997 (13.86), 8.214 (5.93), 8.274 (6.09), 8.782 (2.60), 9.000 (3.21), 10.908 (3.62).
Пример 321
3-{[(3R)-3-метилпирролидин-1-ил]карбонил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
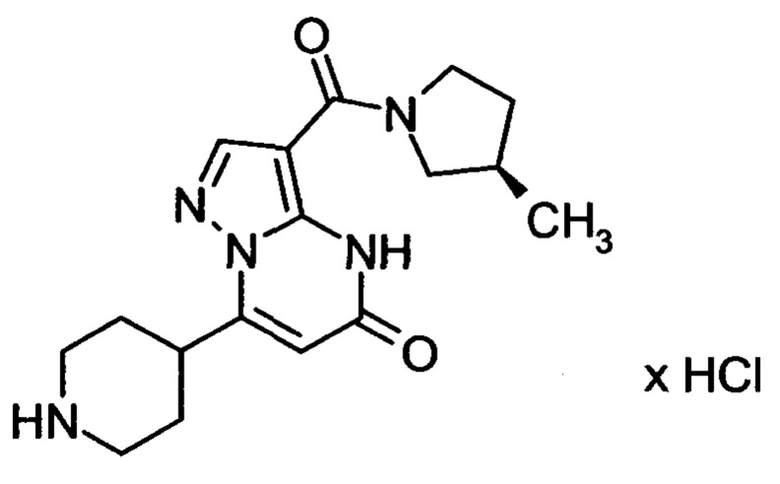
трет-бутил 4-(3-{[(3R)-3-метилпирролидин-1-ил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (112 мг, 260 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (970 мкл, 4.0 М, 3.9 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 69.6 мг (92% чистота, 67% теоретический выход).
LC-MS (Способ 10В): Rt=0.97 мин; MS (ESIpos): m/z=330 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.055 (5.51), 1.066 (5.75), 1.149 (0.42), 1.478 (0.56), 1.502 (0.56), 1.609 (0.53), 1.820 (0.79), 1.851 (2.10), 1.877 (2.32), 1.909 (0.97), 2.006 (0.62), 2.108 (0.61), 2.167 (3.27), 2.200 (2.81), 2.328 (0.77), 2.671 (0.42), 2.690 (0.42), 2.711 (0.38), 3.005 (0.81), 3.080 (2.28), 3.107 (2.25), 3.260 (1.21), 3.377 (3.71), 3.409 (3.27), 3.497 (1.05), 3.528 (1.67), 3.568 (16.00), 3.696 (1.24), 3.712 (1.09), 3.806 (0.81), 3.843 (0.76), 3.862 (0.86), 6.003 (3.20), 8.143 (0.59), 8.228 (4.86), 8.648 (0.75), 8.881 (0.92), 10.948 (1.02).
Пример 322
7-(пиперидин-4-ил)-3-(пирролидин-1-илкарбонил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-[5-оксо-3-(пирролидин-1-илкарбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (28.0 мг, 67.4 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль) и обработали соляной кислотой в 1,4-диоксане (250 мкл, 4.0 М, 1.0 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 24.9 мг (95% чистота, 100% теоретический выход).
LC-MS (Способ 10В): Rt=0.86 мин; MS (ESIpos): m/z=316 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.235 (0.93), 1.853 (11.26), 1.877 (7.64), 1.911 (3.68), 1.967 (6.37), 2.166 (7.84), 2.199 (6.39), 3.074 (5.34), 3.102 (5.38), 3.377 (8.68), 3.406 (7.03), 3.480 (9.00), 3.524 (4.87), 3.567 (11.52), 3.701 (8.04), 6.002 (7.69), 8.233 (16.00), 8.659 (1.94), 8.888 (2.31), 10.942 (4.92).
Пример 323
2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты гидрохлорид
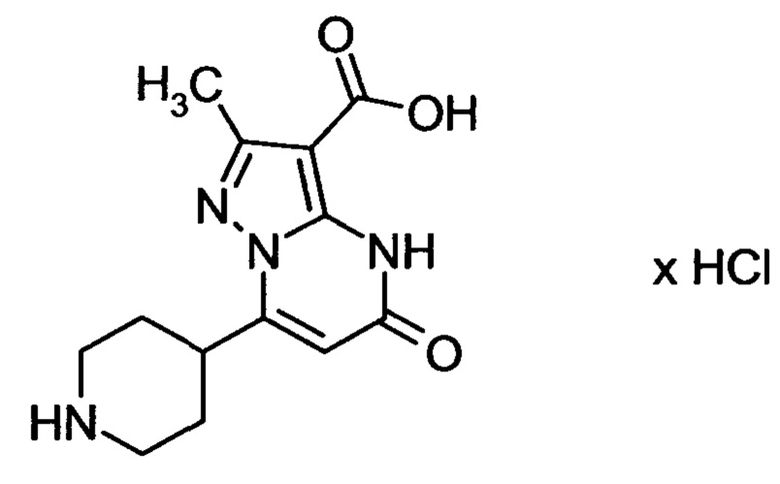
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (100 мг, 267 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.0 мл, 4.0 М, 4.0 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 83.2 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 10В): Rt=0.31 мин; MS (ESIpos): m/z=277 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.150 (0.26), 0.145 (0.25), 1.109 (0.46), 1.147 (0.34), 1.233 (0.63), 1.282 (0.18), 1.355 (0.26), 1.595 (1.06), 1.783 (0.59), 1.813 (1.59), 1.840 (1.81), 1.870 (0.76), 2.145 (2.43), 2.178 (2.05), 2.326 (0.26), 2.366 (0.56), 2.413 (16.00), 2.669 (0.33), 2.709 (0.60), 3.047 (0.64), 3.079 (1.73), 3.108 (1.83), 3.136 (0.78), 3.388 (2.73), 3.462 (0.93), 3.472 (1.17), 3.500 (1.60), 3.529 (0.72), 3.567 (15.15), 3.666 (0.35), 3.679 (0.47), 3.699 (0.43), 3.711 (0.37), 5.917 (2.10), 8.623 (0.64), 8.820 (0.77), 10.836 (0.96), 12.793 (0.30).
Пример 324
3-[(3,3-диметилпирролидин-1-ил)метил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
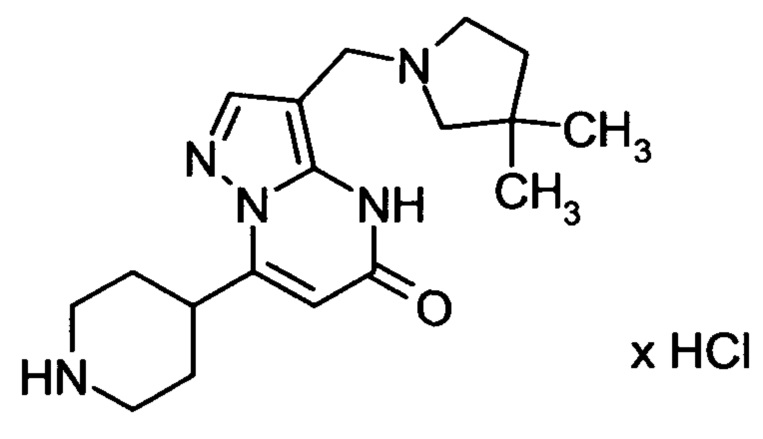
трет-бутил 4-{3-[(3,3-диметилпирролидин-1-ил)метил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (66.6 мг, 155 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (580 мкл, 4.0 М, 2.3 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 30.3 мг (100% чистота, 53% теоретический выход).
LC-MS (Способ 10В): Rt=0.62 мин; MS (ESIneg): m/z=328 [M-H]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.272 (0.64), 1.303 (16.00), 1.335 (0.56), 1.525 (0.35), 1.566 (15.21), 1.798 (0.97), 1.818 (0.93), 1.845 (0.60), 1.930 (2.73), 1.954 (5.08), 2.141 (2.48), 2.175 (1.92), 3.020 (0.61), 3.049 (1.67), 3.079 (1.75), 3.108 (0.71), 3.248 (2.08), 3.353 (2.29), 3.383 (1.92), 3.479 (0.71), 3.509 (1.37), 3.539 (0.71), 3.565 (12.15), 4.056 (0.61), 4.086 (0.98), 4.113 (0.83), 4.312 (1.76), 4.344 (1.41), 4.989 (0.39), 5.856 (2.51), 8.112 (3.43), 9.149 (0.68), 10.470 (0.41).
Пример 325
3-{[(2R)-2-метилпирролидин-1-ил]карбонил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-(3-{[(2R)-2-метилпирролидин-1-ил]карбонил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (44.0 мг, 102 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (380 мкл, 4.0 М, 1.5 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 31.3 мг (100% чистота, 84% теоретический выход).
LC-MS (Способ 10В): Rt=0.93 мин; MS (ESIpos): m/z=330 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.011 (2.13), 1.186 (8.99), 1.200 (8.74), 1.577 (1.26), 1.881 (5.01), 1.910 (5.33), 1.941 (2.39), 2.012 (2.51), 2.072 (1.61), 2.155 (5.53), 2.190 (4.44), 2.709 (0.47), 3.029 (1.82), 3.057 (3.89), 3.087 (4.09), 3.117 (1.73), 3.361 (5.35), 3.393 (4.57), 3.492 (1.93), 3.522 (3.61), 3.551 (1.93), 3.565 (6.32), 3.636 (1.32), 3.802 (1.26), 4.224 (1.28), 4.783 (1.46), 5.983 (11.52), 8.153 (0.97), 8.212 (16.00), 8.477 (0.44), 8.964 (1.06), 9.128 (1.40).
Пример 326
3-[(3,3-дифторазетидин-1-ил)карбонил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
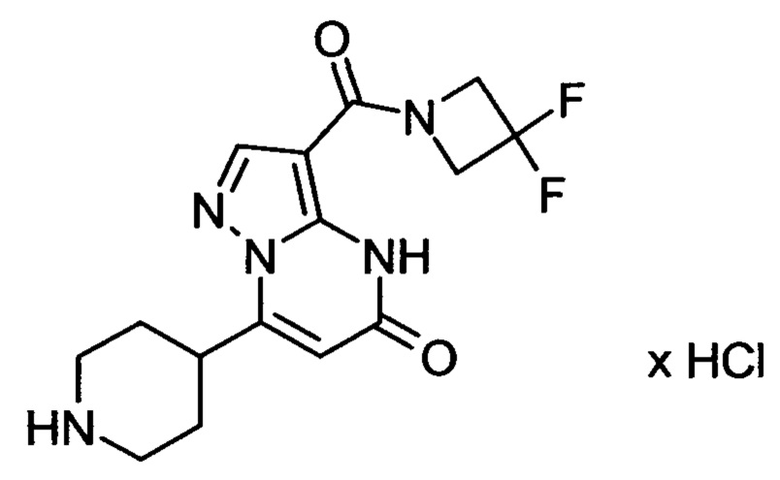
трет-бутил 4-{3-[(3,3-дифторазетидин-1-ил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (63.8 мг, 146 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (550 мкл, 4.0 М, 2.2 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 52.7 мг (100% чистота, 97% теоретический выход).
LC-MS (Способ 10В): Rt=0.79 мин; MS (ESIpos): m/z=338 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.150 (1.84), -0.038 (0.68), -0.009 (16.00), 0.007 (13.28), 0.145 (1.84), 1.146 (2.33), 1.234 (0.39), 1.414 (0.39), 1.595 (0.29), 1.818 (1.84), 1.853 (2.04), 2.072 (1.26), 2.163 (2.91), 2.195 (2.52), 2.322 (1.26), 2.327 (1.75), 2.331 (1.26), 2.365 (2.62), 2.523 (3.98), 2.579 (0.58), 2.664 (1.36), 2.669 (1.84), 2.674 (1.45), 2.689 (0.48), 2.709 (2.72), 3.069 (1.36), 3.098 (2.52), 3.131 (1.55), 3.275 (2.33), 3.352 (1.16), 3.386 (3.68), 3.416 (2.91), 3.508 (1.16), 3.567 (12.51), 4.705 (1.07), 6.031 (1.55), 8.132 (1.75), 8.438 (0.58), 8.688 (0.58), 11.011 (0.48).
Пример 327
7-(пиперидин-4-ил)-3-(пиперидин-1-илкарбонил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
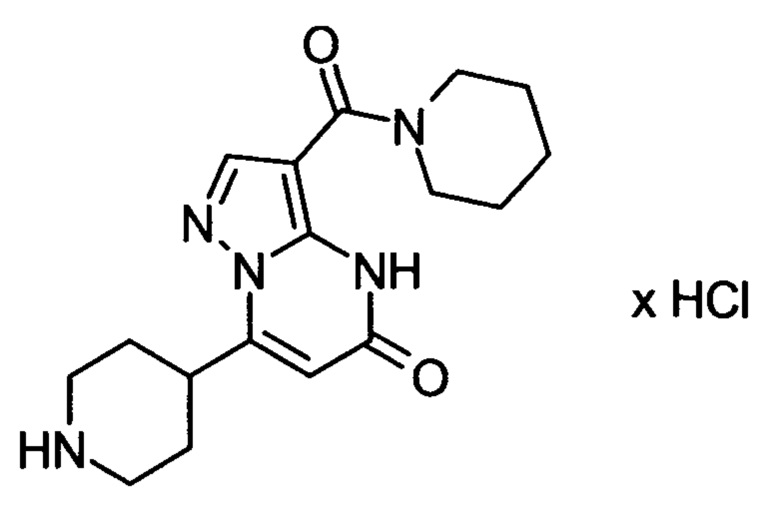
трет-бутил 4-[5-оксо-3-(пиперидин-1-илкарбонил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (60.6 мг, 141 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (530 мкл, 4.0 М, 2.1 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 46.5 мг (91% чистота, 82% теоретический выход).
LC-MS (Способ 10В): Rt=0.88 мин; MS (ESIpos): m/z=330 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.010 (0.76), 0.006 (0.65), 1.513 (1.65), 1.523 (1.42), 1.612 (0.81), 1.624 (0.80), 1.839 (0.22), 1.862 (0.58), 1.893 (0.67), 1.924 (0.27), 2.072 (6.73), 2.160 (0.90), 2.194 (0.71), 2.365 (0.13), 3.027 (0.30), 3.059 (0.73), 3.087 (0.72), 3.117 (0.30), 3.364 (0.90), 3.393 (0.73), 3.482 (0.34), 3.517 (2.09), 3.530 (2.43), 3.544 (1.91), 3.566 (16.00), 4.417 (0.57), 5.930 (1.67), 5.960 (0.16), 8.031 (3.50), 8.142 (0.29), 8.832 (0.23), 9.021 (0.26).
Пример 328
3-(4,5-диметил-1,3-тиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
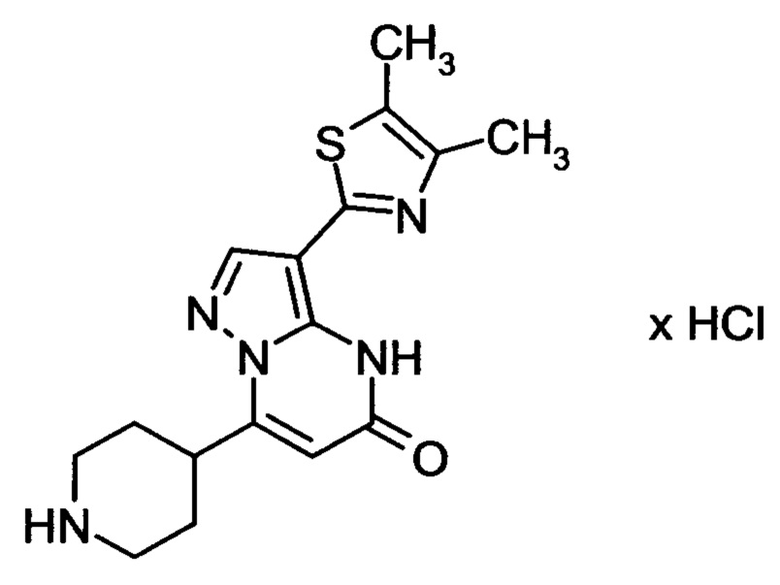
трет-бутил 4-[3-(4,5-диметил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (83.0 мг, 193 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (720 мкл, 4.0 М, 2.9 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 81.5 мг (95% чистота, 100% теоретический выход).
LC-MS (Способ 10В): Rt=1.08 мин; MS (ESIpos): m/z=330 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.011 (1.32), 1.573 (0.78), 1.591 (0.78), 1.907 (0.71), 1.939 (1.64), 1.970 (1.84), 2.000 (0.85), 2.200 (2.72), 2.233 (2.29), 2.279 (0.39), 2.314 (1.80), 2.354 (12.88), 2.387 (16.00), 2.719 (0.93), 3.061 (0.72), 3.092 (1.94), 3.120 (2.04), 3.150 (0.87), 3.387 (2.85), 3.418 (2.21), 3.488 (0.34), 3.565 (8.88), 3.606 (0.72), 3.636 (1.22), 3.664 (0.80), 3.697 (0.33), 4.017 (0.51), 4.234 (0.51), 4.321 (0.55), 4.327 (0.54), 6.343 (0.66), 6.737 (0.34), 8.712 (0.38), 8.983 (0.53), 9.092 (0.72), 10.087 (0.39).
Пример 329
3-[4-(2,5-диметилфенил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
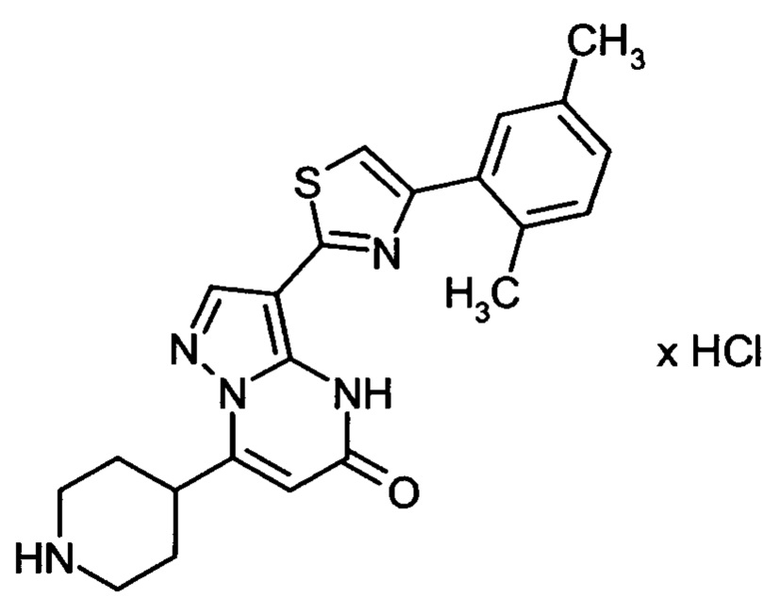
трет-бутил 4-{3-[4-(2,5-диметилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (59.0 мг, 117 мкмоль) растворили в 1,4-диоксане (3.0 мл) и обработали соляной кислотой в 1,4-диоксане (440 мкл, 4.0 М, 1.8 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 59.0 мг (96% чистота, 100% теоретический выход).
LC-MS (Способ 11В): Rt=1.32 мин; MS (ESIpos): m/z=406 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.43), -0.009 (3.47), 0.007 (3.31), 0.145 (0.40), 1.146 (0.44), 1.233 (0.32), 1.885 (0.44), 1.910 (1.12), 1.945 (1.26), 1.973 (0.52), 2.057 (0.41), 2.095 (0.16), 2.170 (0.24), 2.223 (2.36), 2.251 (1.92), 2.296 (0.61), 2.313 (0.69), 2.332 (15.59), 2.365 (0.59), 2.410 (16.00), 2.664 (0.33), 2.669 (0.39), 2.709 (0.49), 3.080 (0.47), 3.110 (1.30), 3.141 (1.33), 3.168 (0.57), 3.404 (1.84), 3.435 (1.52), 3.473 (0.23), 3.490 (0.20), 3.501 (0.23), 3.637 (0.68), 3.665 (0.53), 3.698 (0.32), 3.711 (0.28), 3.980 (2.66), 6.213 (0.25), 7.092 (0.17), 7.112 (1.30), 7.131 (2.06), 7.154 (0.24), 7.198 (3.38), 7.217 (2.18), 7.293 (0.17), 7.496 (3.25), 7.653 (7.91), 8.521 (1.37), 8.712 (0.41), 8.897 (0.52).
Пример 330
3-[(2,2-диметилморфолин-4-ил)метил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
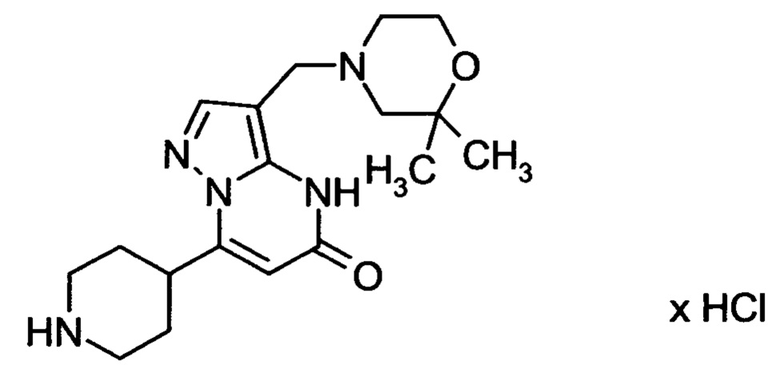
трет-бутил 4-{3-[(2,2-диметилморфолин-4-ил)метил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (107 мг, 240 мкмоль) растворили в 1,4-диоксане (4.0 мл, 47 ммоль) и обработали соляной кислотой в 1,4-диоксане (900 мкл, 4.0 М, 3.6 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 72.9 мг (100% чистота, 79% теоретический выход).
LC-MS (Способ 10В): Rt=0.82 мин; MS (ESIneg): m/z=344 [M-H]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.11), -0.011 (1.00), 0.005 (0.93), 0.143 (0.12), 1.145 (0.24), 1.182 (16.00), 1.240 (0.14), 1.250 (0.15), 1.322 (0.17), 1.339 (0.13), 1.400 (14.79), 1.428 (0.40), 1.557 (0.13), 1.862 (0.65), 1.886 (1.60), 1.917 (1.77), 1.950 (0.71), 2.072 (2.50), 2.144 (2.53), 2.176 (1.98), 2.327 (0.10), 2.366 (0.16), 2.523 (0.22), 2.669 (0.11), 2.709 (0.21), 2.750 (0.91), 2.778 (1.64), 2.807 (1.12), 2.830 (0.46), 2.850 (0.85), 2.880 (0.84), 2.904 (0.42), 2.914 (0.34), 3.030 (0.65), 3.060 (1.78), 3.089 (1.86), 3.118 (0.77), 3.170 (0.14), 3.232 (1.77), 3.261 (2.99), 3.290 (1.37), 3.359 (2.50), 3.389 (2.09), 3.478 (0.94), 3.508 (1.84), 3.538 (2.12), 3.730 (0.12), 3.742 (0.12), 3.753 (0.13), 3.779 (0.70), 3.788 (0.86), 3.811 (1.89), 3.821 (1.70), 3.842 (1.39), 3.871 (1.55), 3.902 (0.55), 4.255 (0.27), 4.266 (0.35), 4.299 (3.35), 4.329 (0.32), 4.342 (0.26), 5.877 (2.01), 7.616 (0.13), 8.075 (3.52), 8.137 (0.30), 8.990 (0.57), 9.105 (0.75), 10.786 (0.59), 12.457 (1.07).
Пример 331
7-(пиперидин-4-ил)-3-[5-(пиридин-3-илметил)-1,3,4-оксадиазол-2-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
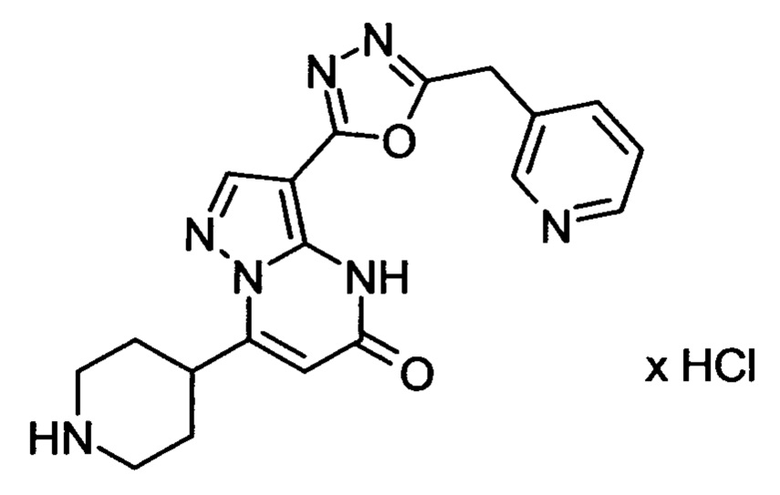
трет-бутил 4-{5-оксо-3-[5-(пиридин-3-илметил)-1,3,4-оксадиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (18.6 мг, 39.0 мкмоль) растворили в 1,4-диоксане (1.0 мл) и обработали соляной кислотой в 1,4-диоксане (49 мкл, 4.0 М, 190 мкмоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 72.9 мг (100% чистота, 79% теоретический выход).
LC-MS (Способ 10В): Rt=0.78 мин; MS (ESIneg): m/z=376 [M-H]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.012 (1.63), 1.416 (0.28), 1.889 (0.97), 1.914 (2.49), 1.921 (2.57), 1.946 (2.79), 1.952 (2.70), 1.977 (1.22), 1.985 (1.03), 2.072 (1.50), 2.177 (3.95), 2.209 (3.05), 2.365 (0.21), 2.709 (0.22), 3.040 (1.00), 3.071 (2.78), 3.099 (2.84), 3.129 (1.17), 3.373 (3.81), 3.403 (3.12), 3.544 (1.21), 3.573 (2.57), 3.603 (1.02), 3.872 (0.41), 4.556 (16.00), 6.120 (4.66), 7.879 (1.51), 7.897 (2.24), 7.912 (1.67), 8.407 (2.42), 8.420 (11.29), 8.789 (3.28), 8.802 (3.29), 8.943 (4.89), 9.054 (0.93), 9.143 (1.32).
Пример 332
3-(5-трет-бутил-1,3-оксазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
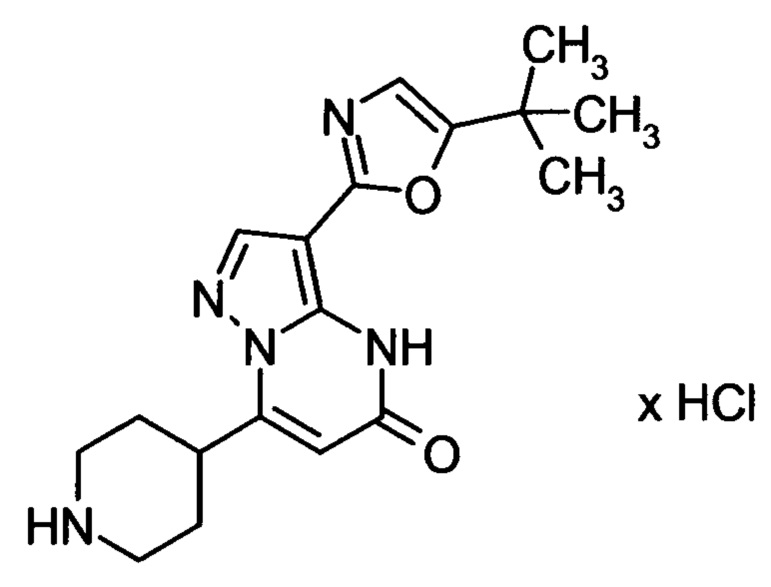
трет-бутил 4-{3-[(3,3-диметил-2-оксобутил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (200 мг, 435 мкмоль) растворили в толуоле (5.0 мл, 47 ммоль) и обработали фосфорилхлоридом (160 мкл, 1.7 ммоль) при возврате флегмы в течение 4 ч. Добавили воду бережно, растворители удалили. Осадок очистили посредством обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil C18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта, после добавления соляной кислоты в 1,4-диоксане. Полученное количество составило 73.2 мг (100% чистота, 45% теоретический выход).
LC-MS (Способ 11В): Rt=0.97 мин; MS (ESIpos): m/z=342 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.138 (0.03), 1.161 (0.08), 1.173 (0.04), 1.227 (0.03), 1.322 (16.00), 1.478 (0.07), 1.883 (0.14), 1.911 (0.40), 1.942 (0.44), 1.973 (0.18), 2.172 (0.63), 2.204 (0.49), 3.035 (0.16), 3.065 (0.44), 3.093 (0.45), 3.123 (0.18), 3.365 (0.60), 3.396 (0.49), 3.442 (0.02), 3.447 (0.02), 3.459 (0.04), 3.470 (0.05), 3.487 (0.06), 3.498 (0.05), 3.528 (0.19), 3.563 (0.83), 3.588 (0.16), 3.663 (0.04), 3.676 (0.06), 3.696 (0.06), 3.705 (0.04), 5.753 (0.03), 6.008 (1.23), 6.926 (1.52), 7.439 (0.02), 8.140 (0.07), 8.308 (1.43), 9.072 (0.13), 9.186 (0.17).
Пример 333
4-(пиперидин-4-ил)-7,8,9,10-тетрагидропиримидо[1,2-b]индазол-2(1Н)-он гидрохлорид
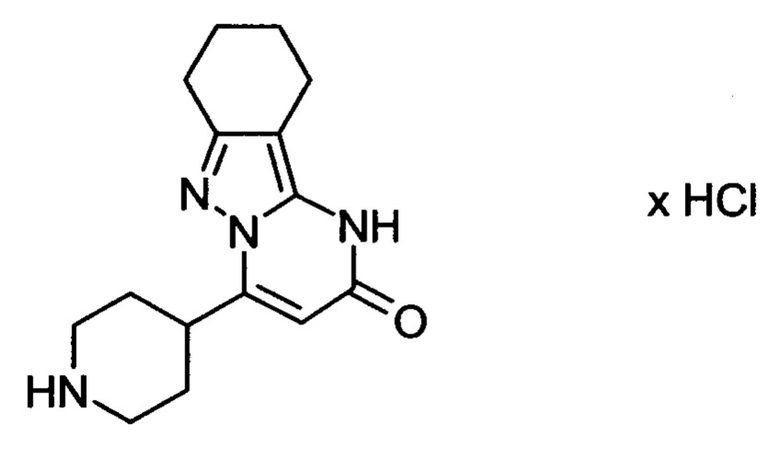
трет-бутил 4-(2-оксо-1,2,7,8,9,10-гексагидропиримидо[1,2-b]индазол-4-ил)пиперидин-1-карбоксилат (106 мг, 284 мкмоль) растворили в 1,4-диоксане (3.0 мл, 35 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.1 мл, 4.0 М, 4.3 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 72.7 мг (100% чистота, 83% теоретический выход).
LC-MS (Способ 10В): Rt=0.88 мин; MS (ESIpos): m/z=273 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.010 (5.43), 0.006 (3.04), 1.108 (0.53), 1.145 (0.61), 1.594 (0.95), 1.672 (6.92), 1.688 (7.91), 1.735 (7.78), 1.751 (7.16), 1.816 (4.94), 1.849 (5.32), 1.881 (2.15), 2.129 (7.80), 2.163 (6.21), 2.327 (0.62), 2.365 (0.73), 2.428 (7.55), 2.597 (8.05), 2.613 (14.14), 2.628 (6.47), 2.669 (0.69), 2.709 (0.62), 3.029 (2.06), 3.058 (5.36), 3.088 (5.44), 3.117 (2.20), 3.346 (7.81), 3.376 (7.10), 3.444 (16.00), 3.492 (13.40), 5.631 (8.86), 8.879 (1.45), 12.009 (2.74).
Пример 334
3-[5-метил-4-(трифторметил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
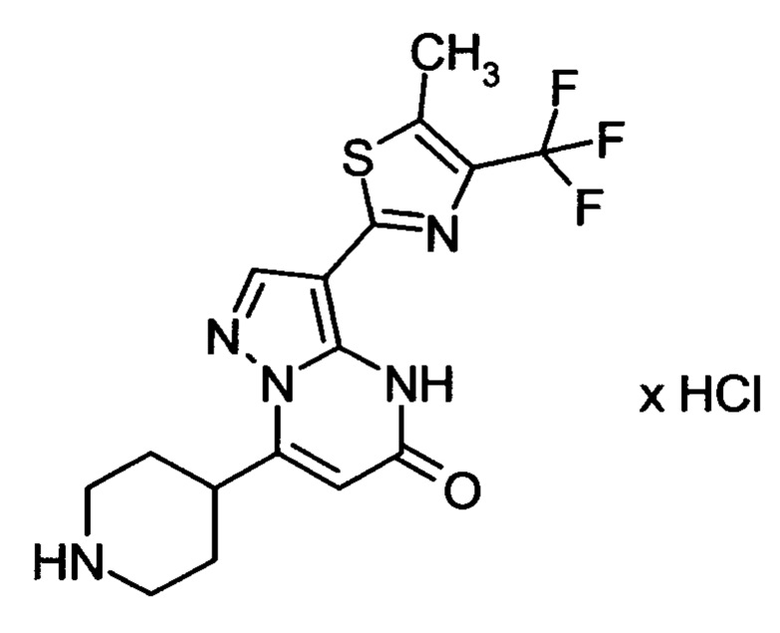
трет-бутил 4-{3-[5-метил-4-(трифторметил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (4.90 мг, 10.1 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль) и обработали соляной кислотой в 1,4-диоксане (38 мкл, 4.0 М, 150 мкмоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 3.30 мг (100% чистота, 71% теоретический выход).
LC-MS (Способ 11В): Rt=1.01 мин; MS (ESIneg): m/z=382 [M-H]-
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: -0.064 (0.13), 0.836 (0.28), 0.853 (1.37), 1.145 (0.31), 1.166 (0.19), 1.177 (0.23), 1.191 (0.28), 1.228 (2.35), 1.352 (5.69), 1.383 (1.80), 1.391 (1.42), 1.420 (16.00), 1.544 (0.15), 1.589 (0.44), 1.608 (0.46), 1.632 (0.21), 1.862 (0.14), 1.919 (1.20), 1.944 (3.18), 1.966 (3.46), 1.989 (1.60), 2.040 (0.57), 2.107 (0.63), 2.133 (0.15), 2.180 (0.94), 2.218 (4.79), 2.244 (4.01), 2.361 (0.23), 2.726 (0.19), 2.905 (0.22), 3.115 (3.56), 3.137 (2.12), 3.399 (5.37), 3.424 (4.54), 3.506 (0.50), 3.565 (0.77), 3.628 (0.92), 3.666 (1.75), 3.863 (0.15), 4.109 (0.39), 6.386 (0.75), 6.632 (0.35), 6.867 (0.52), 8.521 (3.33), 8.732 (0.12), 8.897 (0.88), 9.017 (1.12), 9.120 (0.15), 12.577 (0.18).
Пример 335
3-(4-циклогексил-1,3-тиазол-2-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
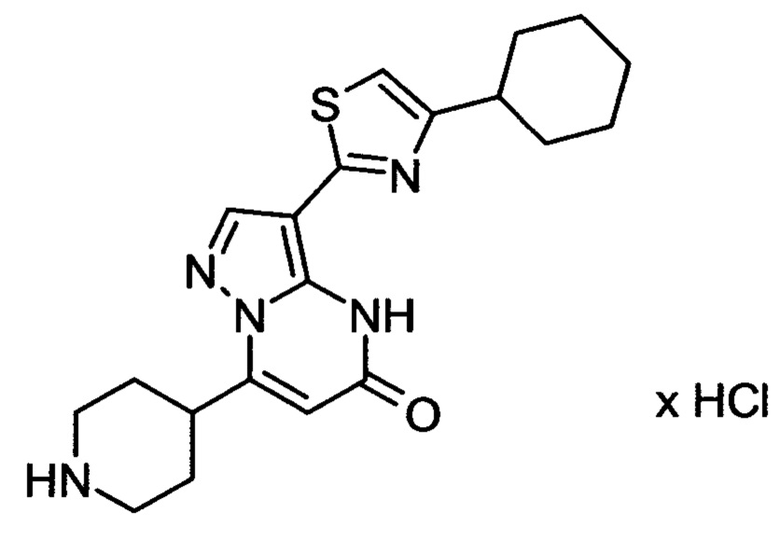
трет-бутил 4-[3-(4-циклогексил-1,3-тиазол-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (54.0 мг, 112 мкмоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой в 1,4-диоксане (420 мкл, 4.0 М, 1.7 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 50.9 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 10В): Rt=1.51 мин; MS (ESIpos): m/z=384 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.010 (5.84), 1.230 (2.91), 1.259 (3.40), 1.268 (2.91), 1.282 (2.02), 1.290 (1.99), 1.298 (1.83), 1.342 (2.35), 1.373 (5.78), 1.405 (12.05), 1.434 (12.41), 1.465 (5.78), 1.495 (1.89), 1.698 (3.76), 1.728 (3.56), 1.782 (6.37), 1.806 (6.79), 1.812 (7.41), 1.882 (2.02), 1.913 (5.00), 1.939 (5.36), 1.945 (5.32), 1.970 (2.42), 2.045 (8.62), 2.071 (5.94), 2.205 (7.44), 2.237 (6.01), 2.365 (1.44), 2.709 (1.44), 2.756 (1.83), 2.783 (3.62), 2.803 (1.89), 2.811 (1.86), 3.064 (1.99), 3.094 (5.36), 3.123 (5.55), 3.153 (2.22), 3.388 (7.77), 3.422 (6.04), 3.566 (8.00), 3.591 (2.35), 3.615 (3.04), 3.644 (1.57), 4.321 (1.47), 4.516 (2.42), 4.637 (1.76), 4.654 (1.86), 6.194 (1.63), 7.181 (16.00), 8.513 (2.48), 8.795 (1.76), 8.818 (1.86), 8.964 (2.48).
Пример 336
3-[4-(1-хлорциклопропил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
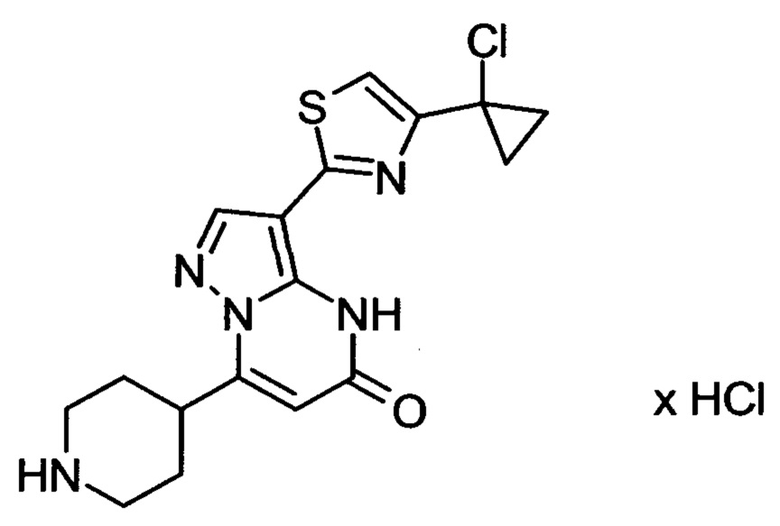
трет-бутил 4-{3-[4-(1-хлорциклопропил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (45.0 мг, 94.5 мкмоль) растворили в 1,4-диоксане (3.1 мл) и обработали соляной кислотой в 1,4-диоксане (350 мкл, 4.0 М, 1.4 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 45.0 мг (100% чистота, 106% теоретический выход).
LC-MS (Способ 10В): Rt=1.22 мин; MS (ESIpos): m/z=376 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.156 (0.36), -0.014 (3.34), 0.140 (0.39), 1.141 (0.64), 1.229 (0.52), 1.248 (0.27), 1.264 (0.23), 1.275 (0.20), 1.325 (0.34), 1.341 (0.20), 1.423 (0.23), 1.441 (0.32), 1.462 (3.55), 1.476 (9.77), 1.482 (9.41), 1.495 (4.73), 1.536 (0.59), 1.570 (0.50), 1.584 (0.48), 1.591 (0.64), 1.598 (0.59), 1.668 (3.00), 1.729 (0.61), 1.736 (0.57), 1.750 (0.34), 1.779 (0.27), 1.793 (0.39), 1.800 (0.36), 1.814 (0.20), 1.867 (0.93), 1.898 (2.45), 1.925 (2.64), 1.956 (1.14), 2.198 (3.75), 2.231 (3.00), 2.322 (0.43), 2.361 (0.89), 2.561 (0.20), 2.665 (0.43), 2.669 (0.36), 2.705 (0.91), 3.063 (1.00), 3.093 (2.77), 3.121 (2.89), 3.151 (1.16), 3.389 (4.00), 3.419 (3.18), 3.468 (0.23), 3.484 (0.25), 3.496 (0.20), 3.581 (1.05), 3.614 (1.16), 3.674 (0.36), 3.693 (0.25), 3.727 (0.30), 3.738 (0.27), 3.749 (0.27), 4.324 (3.11), 4.487 (0.57), 4.665 (0.20), 6.216 (0.34), 7.524 (16.00), 8.114 (0.48), 8.432 (1.82), 8.759 (0.93), 8.914 (1.30).
Пример 337
3-{4-[2-(дифторметокси)фенил]-1,3-тиазол-2-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
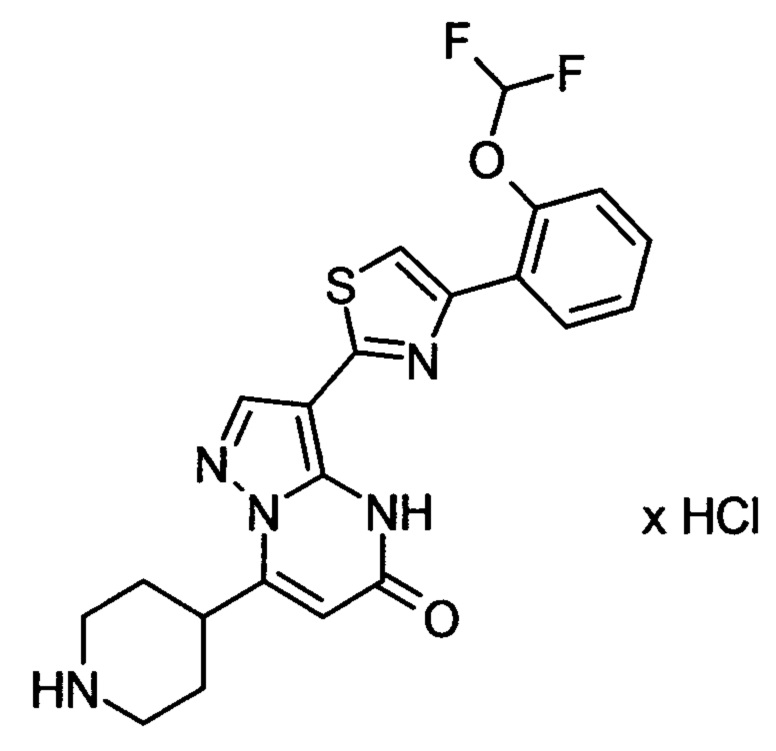
трет-бутил 4-(3-{4-[2-(дифторметокси)фенил]-1,3-тиазол-2-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (66.0 мг, 121 мкмоль) растворили в 1,4-диоксане (3.0 мл) и обработали соляной кислотой в 1,4-диоксане (460 мкл, 4.0 М, 1.8 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 62.5 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 10В): Rt=1.39 мин; MS (ESIpos): m/z=444 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.010 (2.46), 1.145 (0.42), 1.904 (0.99), 1.934 (2.62), 1.960 (2.85), 1.992 (1.22), 2.226 (4.03), 2.258 (3.24), 2.327 (0.35), 2.365 (0.59), 2.669 (0.34), 2.709 (0.59), 3.076 (1.03), 3.106 (2.87), 3.135 (2.98), 3.165 (1.23), 3.401 (4.04), 3.432 (3.26), 3.566 (1.90), 3.647 (1.34), 4.923 (0.91), 6.225 (0.56), 7.178 (3.97), 7.313 (3.96), 7.333 (5.30), 7.362 (8.11), 7.384 (2.01), 7.401 (4.62), 7.420 (3.40), 7.441 (3.16), 7.446 (3.45), 7.461 (3.50), 7.465 (3.71), 7.480 (1.51), 7.484 (1.41), 7.547 (3.85), 7.911 (16.00), 8.317 (3.44), 8.321 (3.72), 8.336 (3.43), 8.340 (3.44), 8.549 (1.93), 8.852 (0.95), 8.998 (1.26).
Пример 338
3-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
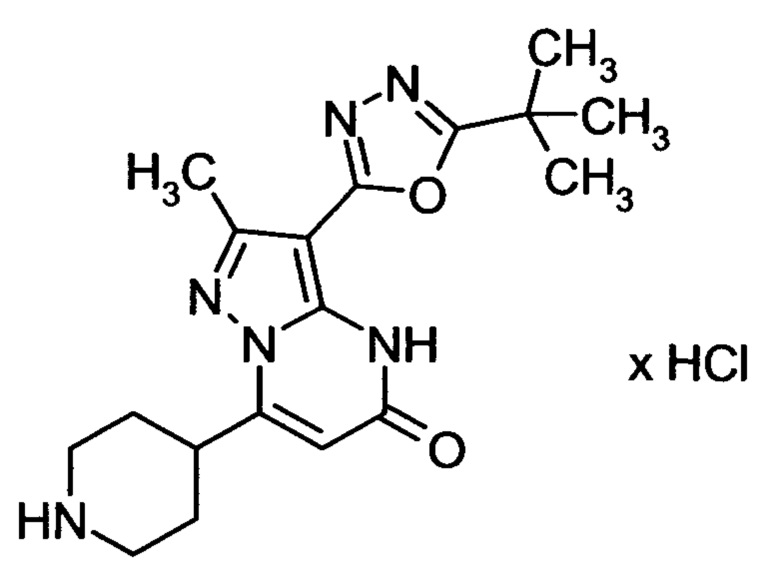
трет-бутил 4-[3-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (61.1 мг, 134 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (500 мкл, 4.0 М, 2.0 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 49.4 мг (100% чистота, 94% теоретический выход).
LC-MS (Способ 10В): Rt=1.06 мин; MS (ESIpos): m/z=357 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.156 (0.02), -0.014 (0.21), 0.140 (0.02), 1.142 (0.03), 1.178 (0.06), 1.189 (0.03), 1.208 (0.03), 1.263 (0.07), 1.425 (16.00), 1.582 (0.07), 1.818 (0.09), 1.826 (0.11), 1.851 (0.28), 1.858 (0.29), 1.883 (0.32), 1.889 (0.31), 1.914 (0.14), 1.923 (0.12), 2.169 (0.44), 2.202 (0.36), 2.322 (0.03), 2.327 (0.03), 2.361 (0.04), 2.385 (0.02), 2.407 (0.02), 2.424 (0.02), 2.570 (0.03), 2.655 (0.02), 2.665 (0.03), 2.705 (0.04), 3.106 (0.28), 3.373 (0.48), 3.405 (0.38), 3.458 (0.02), 3.468 (0.02), 3.528 (0.10), 3.562 (1.48), 3.583 (0.10), 3.661 (0.01), 3.674 (0.02), 3.693 (0.02), 3.706 (0.01), 5.990 (0.11), 8.776 (0.08), 8.917 (0.10), 11.913 (0.05), 12.008 (0.02).
Пример 339
2-метил-3-(3-метил-1,2,4-оксадиазол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
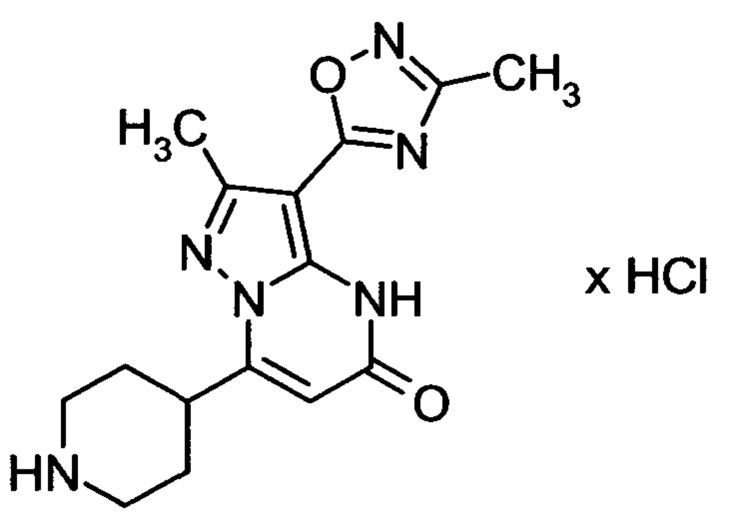
трет-бутил 4-[2-метил-3-(3-метил-1,2,4-оксадиазол-5-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (40.8 мг, 98.4 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (370 мкл, 4.0 М, 1.5 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 36.1 мг (90% чистота, 94% теоретический выход).
LC-MS (Способ 10В): Rt=0.84 мин; MS (ESIpos): m/z=315 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.145 (0.07), 1.176 (0.07), 1.194 (0.14), 1.212 (0.08), 1.229 (0.10), 1.263 (0.39), 1.281 (0.84), 1.298 (0.40), 1.353 (0.10), 1.371 (0.09), 1.388 (0.05), 1.418 (0.88), 1.428 (0.22), 1.821 (0.04), 1.875 (0.46), 1.906 (1.12), 1.932 (1.21), 1.963 (0.53), 2.129 (0.18), 2.174 (1.80), 2.207 (1.39), 2.254 (0.07), 2.327 (0.08), 2.387 (16.00), 2.420 (1.43), 2.572 (11.76), 2.669 (0.08), 2.709 (0.09), 2.731 (0.07), 3.108 (1.11), 3.373 (1.95), 3.404 (1.49), 3.460 (0.16), 3.470 (0.19), 3.489 (0.16), 3.498 (0.16), 3.565 (13.11), 3.594 (0.81), 3.624 (0.40), 3.665 (0.11), 3.678 (0.13), 3.697 (0.13), 3.710 (0.10), 3.721 (0.05), 4.258 (0.11), 4.275 (0.34), 4.293 (0.34), 4.310 (0.11), 4.327 (0.04), 4.450 (0.04), 5.913 (0.29), 6.148 (0.80), 9.047 (0.51), 11.491 (0.07), 12.759 (0.04).
Пример 340
3-(5-циклобутил-1,3,4-оксадиазол-2-ил)-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-[3-(5-циклобутил-1,3,4-оксадиазол-2-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (77.3 мг, 170 мкмоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой в 1,4-диоксане (640 мкл, 4.0 М, 2.6 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 40.6 мг (100% чистота, 61% теоретический выход).
LC-MS (Способ 10В): Rt=1.00 мин; MS (ESIpos): m/z=355 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.078 (0.03), 0.071 (5.45), 0.217 (0.03), 1.219 (0.07), 1.491 (0.02), 1.914 (0.24), 1.939 (0.68), 1.971 (0.77), 2.005 (0.42), 2.027 (0.33), 2.054 (0.42), 2.066 (0.32), 2.075 (0.24), 2.088 (0.13), 2.099 (0.11), 2.121 (0.37), 2.143 (0.68), 2.166 (0.55), 2.192 (0.32), 2.214 (0.15), 2.245 (1.06), 2.277 (0.86), 2.401 (0.07), 2.424 (0.10), 2.453 (1.11), 2.478 (1.99), 2.522 (0.54), 2.575 (11.88), 2.612 (16.00), 2.737 (0.06), 2.782 (0.08), 3.135 (0.27), 3.164 (0.73), 3.194 (0.77), 3.221 (0.32), 3.447 (1.04), 3.477 (0.85), 3.603 (0.30), 3.640 (3.52), 3.662 (0.30), 3.840 (0.40), 3.861 (0.90), 3.882 (1.23), 3.903 (0.99), 3.924 (0.60), 6.068 (0.55), 8.928 (0.22), 9.044 (0.31), 9.445 (0.03), 9.888 (0.02).
Пример 341
2-метил-7-(пиперидин-4-ил)-3-[3-(трифторметил)-1,2,4-оксадиазол-5-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
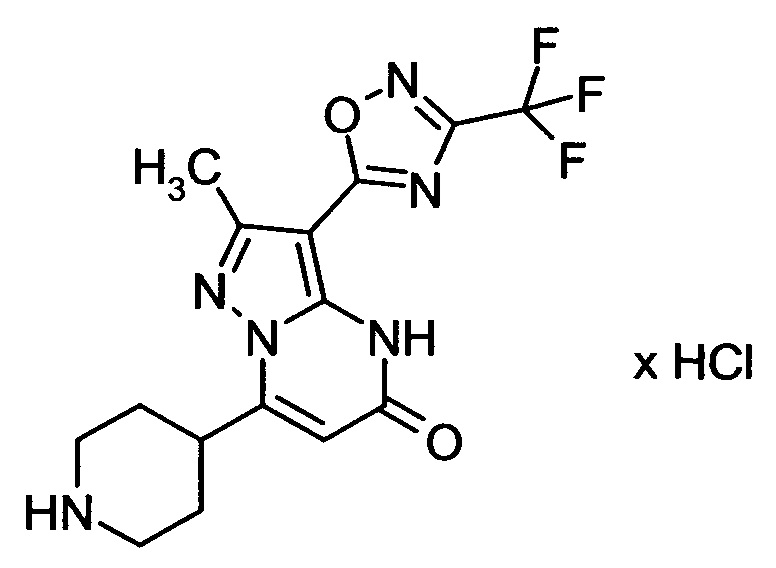
трет-бутил 4-{2-метил-5-оксо-3-[3-(трифторметил)-1,2,4-оксадиазол-5-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (99.5 мг, 212 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (800 мкл, 4.0 М, 3.2 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 86.1 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 10В): Rt=1.12 мин; MS (ESIpos): m/z=369 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.09), 0.143 (0.10), 1.147 (0.13), 1.229 (0.09), 1.421 (0.76), 1.875 (0.48), 1.908 (1.46), 1.940 (1.62), 1.970 (0.67), 2.191 (2.42), 2.225 (1.94), 2.327 (0.11), 2.366 (0.17), 2.457 (0.08), 2.590 (0.24), 2.622 (13.14), 2.669 (0.21), 2.709 (0.20), 2.781 (0.09), 3.132 (1.41), 3.388 (2.53), 3.419 (2.01), 3.461 (0.14), 3.471 (0.14), 3.488 (0.10), 3.566 (16.00), 3.618 (0.55), 3.647 (0.93), 3.665 (0.52), 3.676 (0.54), 3.706 (0.11), 6.337 (0.54), 8.969 (0.50), 12.850 (0.09).
Пример 342
3-[(диметиламино)метил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
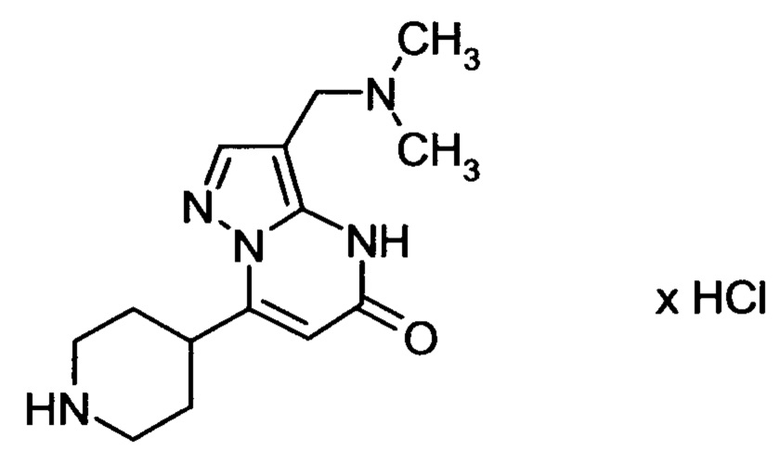
трет-бутил 4-{3-[(диметиламино)метил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (45.8 мг, 122 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (460 мкл, 4.0 М, 1.8 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 40.5 мг (100% чистота, 95% теоретический выход).
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.06), 0.007 (0.52), 0.145 (0.06), 1.145 (0.08), 1.413 (0.06), 1.594 (1.78), 1.838 (0.18), 1.869 (0.46), 1.895 (0.49), 1.926 (0.22), 2.149 (0.68), 2.182 (0.54), 2.365 (0.11), 2.610 (0.12), 2.645 (0.39), 2.656 (0.46), 2.663 (0.44), 2.689 (4.63), 2.701 (4.61), 2.795 (0.19), 2.842 (0.11), 2.942 (0.10), 2.955 (0.16), 3.032 (0.19), 3.061 (0.49), 3.091 (0.53), 3.121 (0.21), 3.245 (0.07), 3.367 (0.82), 3.507 (0.45), 3.566 (16.00), 3.678 (0.06), 4.088 (0.06), 4.099 (0.06), 4.244 (1.29), 4.256 (1.28), 5.887 (0.59), 7.535 (0.18), 7.564 (0.05), 7.596 (0.05), 7.614 (0.06), 7.625 (0.07), 7.985 (0.90), 8.851 (0.18), 8.874 (0.19), 8.994 (0.24), 10.313 (0.26), 11.087 (0.09), 12.478 (0.40).
Пример 343
7-(пиперидин-4-ил)-3-(пирролидин-1-илметил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
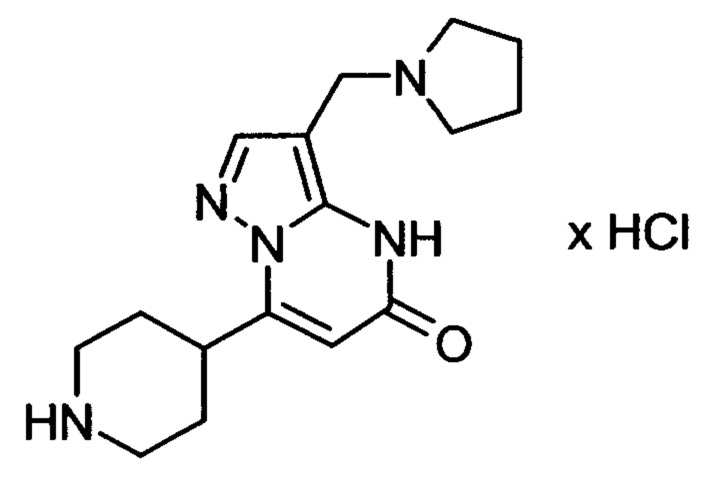
трет-бутил 4-[5-оксо-3-(пирролидин-1-илметил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (58.2 мг, 145 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане(540 мкл, 4.0 М, 2.2 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 54.2 мг (100% чистота, 100% теоретический выход).
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.144 (0.19), 1.146 (0.31), 1.387 (0.19), 1.413 (4.33), 1.434 (0.19), 1.536 (0.31), 1.566 (0.59), 1.594 (11.04), 1.702 (0.28), 1.732 (0.25), 1.777 (0.25), 1.867 (4.08), 1.885 (3.03), 1.922 (1.12), 1.984 (2.20), 2.002 (2.57), 2.146 (2.39), 2.179 (1.90), 2.327 (0.21), 2.366 (0.36), 2.604 (0.38), 2.645 (0.40), 2.669 (0.32), 2.689 (0.22), 2.709 (0.51), 2.790 (0.39), 2.814 (0.41), 2.899 (0.23), 3.032 (2.43), 3.053 (2.63), 3.091 (2.14), 3.116 (1.04), 3.166 (0.21), 3.247 (0.59), 3.369 (4.86), 3.386 (4.46), 3.397 (4.88), 3.438 (16.00), 3.504 (1.75), 3.614 (0.37), 3.678 (0.27), 3.698 (0.24), 3.732 (0.31), 3.743 (0.30), 3.753 (0.24), 4.126 (0.20), 4.138 (0.22), 4.159 (0.40), 4.173 (0.36), 4.194 (0.36), 4.208 (0.37), 4.228 (0.23), 4.242 (0.20), 4.319 (4.38), 4.332 (4.27), 4.394 (0.34), 5.878 (1.83), 5.931 (0.18), 7.572 (1.29), 8.003 (0.29), 8.035 (3.05), 8.844 (0.70), 8.985 (0.83), 10.597 (0.85), 11.099 (0.67), 12.487 (1.21).
Пример 344
3-циклопропил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-(3-циклопропил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (443 мг, 1.24 ммоль) растворили в 1,4-диоксане (15 мл, 180 ммоль) и обработали соляной кислотой в 1,4-диоксане (4.6 мл, 4.0 М, 19 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 350 мг (90% чистота, 86% теоретический выход).
LC-MS (Способ 10В): Rt=0.84 мин; MS (ESIpos): m/z=259 [M+H]+
1Н-ЯМР (500 МГц, Оксид дейтерия) delta [ppm]: -0.056 (4.69), 0.451 (0.24), 0.471 (2.71), 0.480 (8.84), 0.483 (8.41), 0.490 (8.41), 0.493 (8.53), 0.501 (2.64), 0.521 (0.21), 0.795 (0.21), 0.812 (0.38), 0.825 (2.80), 0.833 (7.40), 0.837 (7.52), 0.841 (4.12), 0.846 (4.01), 0.850 (7.63), 0.854 (7.38), 0.862 (2.40), 1.193 (0.33), 1.206 (0.45), 1.522 (1.15), 1.532 (2.24), 1.538 (2.43), 1.548 (4.08), 1.558 (2.26), 1.565 (1.98), 1.575 (0.92), 1.684 (0.28), 1.689 (0.21), 1.706 (0.35), 1.712 (0.47), 1.736 (0.54), 1.744 (0.45), 1.759 (0.28), 1.767 (0.28), 1.841 (1.34), 1.849 (1.48), 1.869 (3.56), 1.875 (3.58), 1.894 (3.82), 1.900 (3.68), 1.920 (1.70), 1.928 (1.53), 2.132 (0.52), 2.155 (0.49), 2.233 (6.10), 2.282 (5.37), 2.311 (4.62), 2.825 (0.21), 2.840 (0.24), 2.847 (0.42), 2.855 (0.21), 2.870 (0.21), 3.023 (0.33), 3.048 (0.68), 3.072 (0.38), 3.174 (2.78), 3.178 (3.04), 3.200 (5.87), 3.204 (5.87), 3.226 (3.20), 3.230 (2.95), 3.342 (0.75), 3.400 (0.99), 3.406 (1.74), 3.412 (1.18), 3.424 (2.33), 3.430 (3.96), 3.436 (2.36), 3.448 (1.46), 3.454 (2.19), 3.520 (0.24), 3.530 (0.28), 3.573 (5.75), 3.599 (5.00), 3.719 (1.30), 5.913 (15.01), 7.571 (16.00).
Пример 345
3-[(1,1-диоксидотиоморфолин-4-ил)метил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
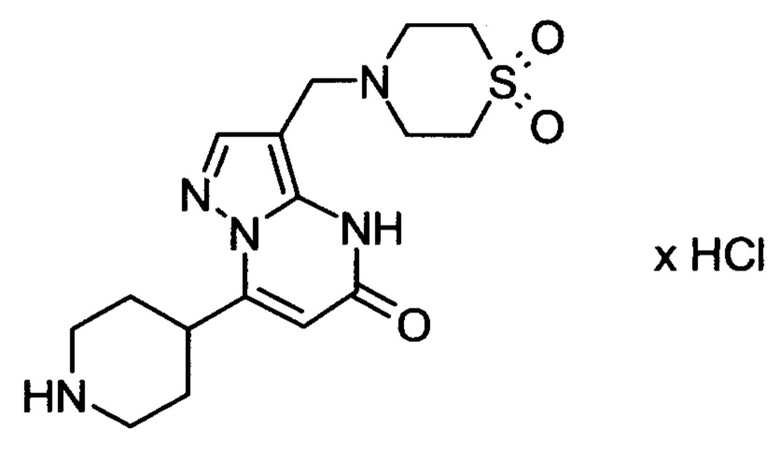
трет-бутил 4-{3-[(1,1-диоксидотиоморфолин-4-ил)метил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (134 мг, 288 мкмоль) растворили в 1,4-диоксане (3.0 мл, 35 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.1 мл, 4.0 М, 4.3 ммоль) при комнатной температуре в течение 16 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта, после добавления соляной кислоты в 1,4-диоксане. Полученное количество составило 105 мг (100% чистота, 83% теоретический выход).
LC-MS (Способ 10В): Rt=0.67 мин; MS (ESIpos): m/z=366 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.68), 0.144 (0.74), 1.146 (0.68), 1.235 (0.42), 1.257 (1.44), 1.274 (1.56), 1.290 (1.06), 1.305 (0.94), 1.570 (0.56), 1.609 (0.38), 1.718 (0.40), 1.744 (0.34), 1.851 (2.36), 1.879 (5.53), 1.910 (5.75), 1.940 (2.44), 2.044 (0.40), 2.145 (8.45), 2.177 (6.61), 2.327 (0.48), 2.365 (0.76), 2.563 (2.98), 2.603 (0.84), 2.642 (1.34), 2.669 (0.86), 2.710 (1.22), 2.781 (0.66), 2.873 (0.40), 3.033 (2.76), 3.061 (6.23), 3.090 (6.35), 3.115 (2.86), 3.153 (0.62), 3.239 (0.96), 3.358 (8.47), 3.387 (7.73), 3.478 (4.39), 3.507 (6.77), 3.555 (8.99), 3.565 (5.79), 3.622 (5.39), 3.678 (5.03), 3.697 (4.83), 3.723 (5.71), 4.189 (4.03), 4.414 (10.97), 4.534 (0.84), 4.863 (1.84), 5.268 (0.30), 5.301 (0.30), 5.751 (1.58), 5.851 (0.48), 5.889 (8.35), 7.555 (1.30), 7.668 (0.48), 7.687 (1.06), 7.706 (0.92), 7.716 (1.24), 7.734 (0.72), 7.752 (3.68), 7.790 (0.74), 7.809 (0.42), 7.851 (0.30), 7.870 (0.42), 7.947 (0.68), 7.989 (16.00), 8.054 (0.42), 8.942 (1.50), 9.065 (2.18), 11.015 (0.40), 12.370 (1.12).
Пример 346
3-[3-(2,2-диметилциклопропил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
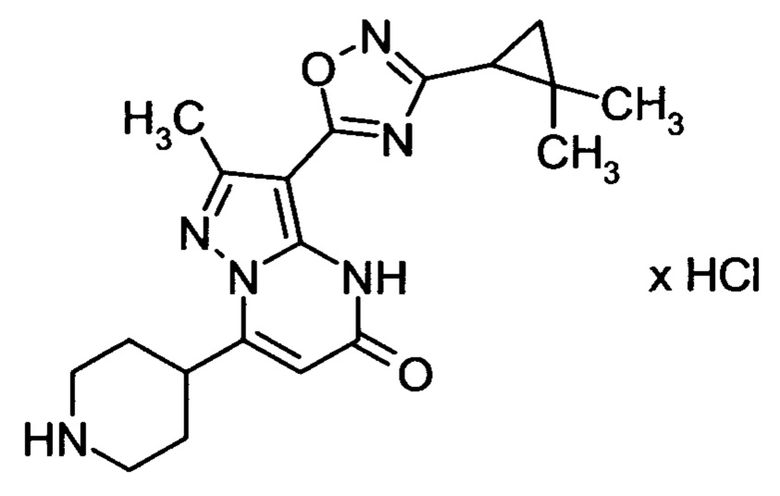
трет-бутил 4-{3-[3-(2,2-диметилциклопропил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (102 мг, 218 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (820 мкл, 4.0 М, 3.3 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 63.1 мг (100% чистота, 71% теоретический выход).
LC-MS (Способ 11В): Rt=1.05 мин; MS (ESIpos): m/z=369 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.06), -0.011 (0.56), 0.005 (0.49), 0.143 (0.06), 0.947 (0.08), 1.030 (1.07), 1.040 (1.37), 1.051 (1.25), 1.061 (1.29), 1.074 (0.16), 1.106 (16.00), 1.145 (0.13), 1.197 (0.74), 1.208 (1.17), 1.233 (14.12), 1.262 (0.15), 1.388 (0.07), 1.417 (0.07), 1.849 (0.31), 1.878 (0.93), 1.908 (1.03), 1.938 (0.43), 1.960 (1.45), 1.974 (1.54), 1.981 (1.53), 1.995 (1.26), 2.173 (1.50), 2.206 (1.21), 2.322 (0.06), 2.327 (0.07), 2.365 (0.14), 2.396 (0.05), 2.669 (0.09), 2.709 (0.16), 2.719 (0.05), 3.081 (0.57), 3.109 (1.11), 3.141 (0.65), 3.376 (1.62), 3.407 (1.30), 3.566 (11.93), 3.583 (0.61), 3.610 (0.31), 6.125 (0.32), 8.861 (0.24), 8.961 (0.30), 11.579 (0.09), 11.695 (0.04), 12.820 (0.04).
Пример 347
2-метил-7-(пиперидин-4-ил)-3-{3-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
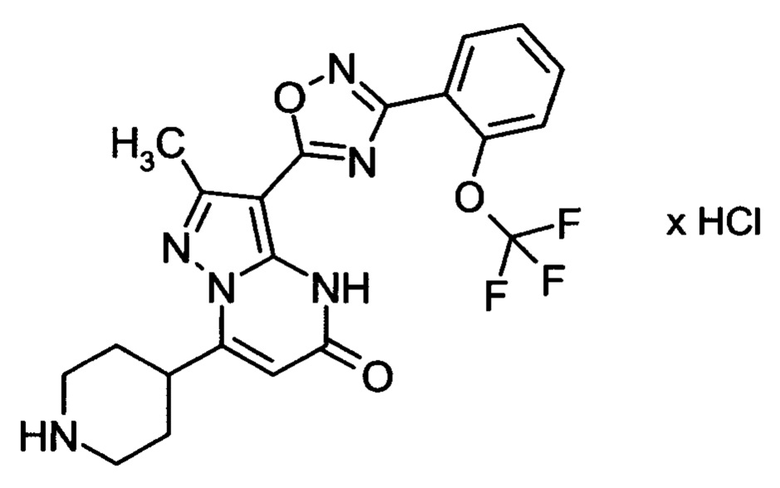
трет-бутил 4-(2-метил-5-оксо-3-{3-[2-(трифторметокси)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (100 мг, 179 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (670 мкл, 4.0 М, 2.7 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 46.2 мг (100% чистота, 52% теоретический выход).
LC-MS (Способ 11В): Rt=1.25 мин; MS (ESIpos): m/z=461 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.09), 0.143 (0.08), 1.145 (0.16), 1.875 (0.56), 1.899 (1.68), 1.931 (1.87), 1.963 (0.75), 2.195 (2.78), 2.228 (2.25), 2.327 (0.13), 2.365 (0.24), 2.643 (16.00), 2.709 (0.27), 2.803 (0.11), 3.097 (1.05), 3.125 (2.02), 3.154 (1.18), 3.389 (2.89), 3.420 (2.33), 3.566 (2.31), 3.577 (0.68), 3.607 (1.18), 3.636 (0.61), 6.160 (0.91), 7.616 (1.97), 7.640 (2.94), 7.662 (3.25), 7.681 (2.05), 7.745 (1.76), 7.749 (2.00), 7.768 (2.56), 7.784 (1.00), 7.787 (1.05), 8.424 (0.98), 8.976 (0.54), 11.934 (0.15).
Пример 348
3-(морфолин-4-илметил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
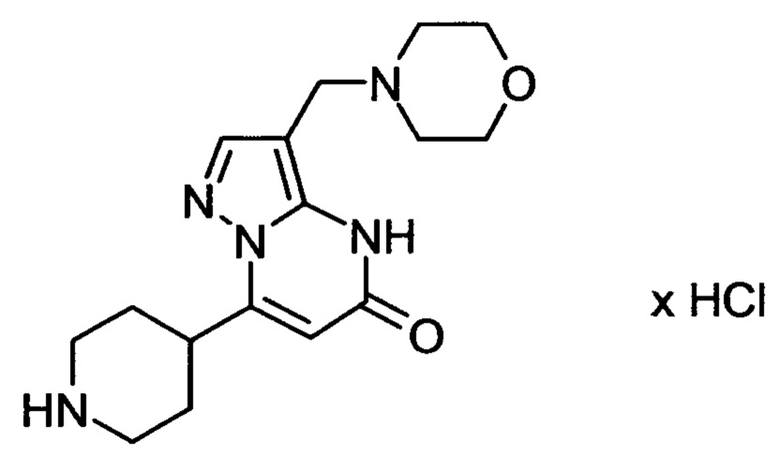
трет-бутил 4-[3-(морфолин-4-илметил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (117 мг, 280 мкмоль) растворили в 1,4-диоксане (10 мл, 120 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.0 мл, 4.0 М, 4.2 ммоль) при комнатной температуре в течение 1 ч. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 108 мг (100% чистота, 99% теоретический выход).
LC-MS (Способ 10В): Rt=0.67 мин; MS (ESIneg): m/z=316 [M-H]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.009 (4.31), 0.007 (3.73), 1.146 (0.71), 1.236 (0.81), 1.253 (0.97), 1.270 (0.92), 1.280 (0.89), 1.296 (0.81), 1.414 (0.92), 1.594 (12.37), 1.834 (1.26), 1.865 (3.36), 1.890 (3.49), 1.922 (1.52), 2.145 (4.86), 2.178 (3.94), 2.365 (1.02), 2.709 (1.02), 2.982 (1.44), 3.003 (3.26), 3.034 (4.60), 3.066 (4.62), 3.094 (3.76), 3.124 (1.94), 3.308 (6.15), 3.338 (5.57). 3.369 (7.51), 3.400 (16.00), 3.474 (2.08), 3.506 (3.02), 3.537 (1.73), 3.599 (0.81), 3.607 (0.74), 3.692 (3.23), 3.720 (6.07), 3.750 (3.63), 3.947 (5.89), 3.975 (4.52), 4.306 (7.67), 4.317 (7.41), 5.893 (4.05), 7.549 (1.50), 7.994 (7.36), 8.135 (2.86), 8.802 (1.23), 8.824 (1.23), 8.956 (1.58), 10.929 (1.52), 11.063 (0.71), 12.443 (2.18).
Пример 349
7-[(2S,4R)-2-(2,2-диметилпропил)пиперидин-4-ил]-3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
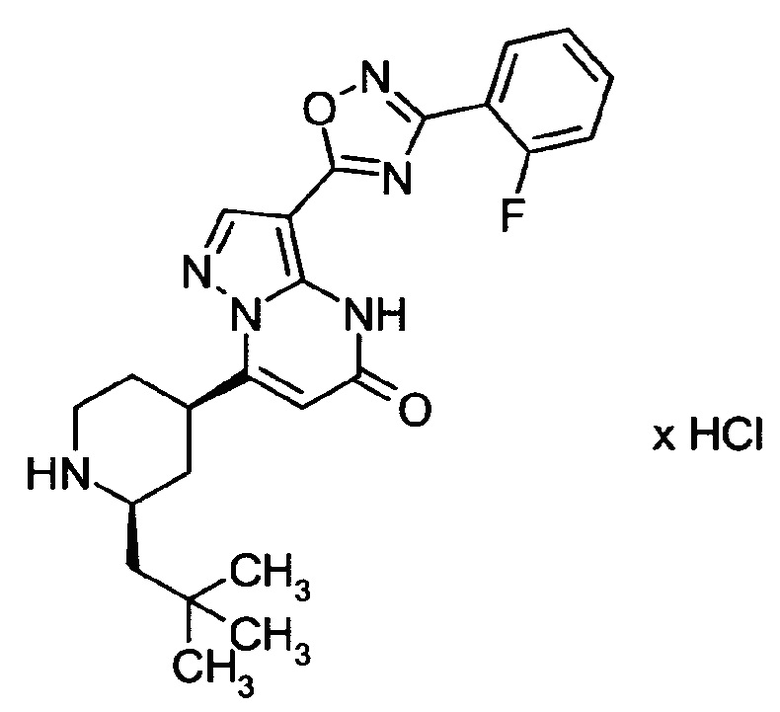
трет-бутил (2S,4R)-2-(2,2-диметилпропил)-4-{3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (36.1 мг, 65.6 мкмоль) растворили в 1,4-диоксане (1.9 мл, 22 ммоль) и обработали соляной кислотой в 1,4-диоксане (250 мкл, 4.0 М, 980 мкмоль) при комнатной температуре в течение 3 дней. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 30.7 мг (100% чистота, 96% теоретический выход).
LC-MS (Способ 11В): Rt=1.31 мин; MS (ESIneg): m/z=449 [M-H]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.13), 0.007 (1.03), 0.145 (0.13), 0.802 (0.07), 0.960 (16.00), 1.114 (0.09), 1.145 (0.20), 1.232 (0.17), 1.517 (0.49), 1.552 (0.50), 1.815 (0.35), 1.836 (0.38), 1.851 (0.31), 1.871 (0.28), 1.995 (0.22), 2.021 (0.24), 2.129 (0.83), 2.327 (0.14), 2.365 (0.27), 2.669 (0.18), 2.709 (0.29), 3.204 (0.31), 3.255 (0.66), 3.567 (1.07), 3.618 (0.39), 3.756 (0.24), 6.226 (0.09), 7.436 (1.07), 7.456 (1.57), 7.475 (0.65), 7.484 (0.58), 7.651 (0.25), 7.655 (0.26), 7.668 (0.45), 7.689 (0.41), 7.703 (0.19), 7.707 (0.19), 8.401 (0.10), 8.627 (0.45), 8.770 (0.19), 12.290 (0.06).
Пример 350
3-(3-циклогексил-1,2,4-оксадиазол-5-ил)-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
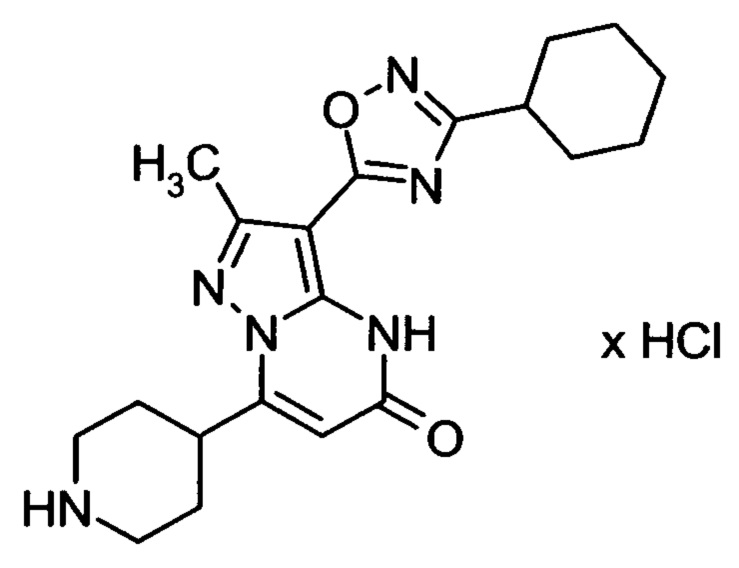
трет-бутил 4-[3-(3-циклогексил-1,2,4-оксадиазол-5-ил)-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (106 мг, 220 мкмоль) растворили в 1,4-диоксане (2.5 мл) и обработали соляной кислотой в 1,4-диоксане (830 мкл, 4.0 М, 3.3 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 38.7 мг (100% чистота, 42% теоретический выход).
LC-MS (Способ 1В): Rt=0.70 мин; MS (ESIpos): m/z=383 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.156 (0.08), -0.015 (0.75), -0.006 (16.00), 0.140 (0.07), 1.141 (0.18), 1.221 (0.15), 1.230 (0.27), 1.238 (0.19), 1.252 (0.47), 1.260 (0.86), 1.268 (0.46), 1.282 (0.64), 1.290 (1.18), 1.298 (0.62), 1.312 (0.46), 1.320 (0.75), 1.349 (0.82), 1.356 (0.57), 1.379 (1.93), 1.387 (1.24), 1.410 (1.92), 1.432 (0.48), 1.440 (0.79), 1.448 (0.47), 1.517 (0.73), 1.525 (0.76), 1.549 (1.81), 1.554 (1.77), 1.578 (1.72), 1.584 (1.69), 1.607 (0.64), 1.615 (0.65), 1.667 (0.98), 1.687 (0.69), 1.697 (0.90), 1.747 (1.55), 1.754 (2.05), 1.763 (1.59), 1.777 (1.47), 1.786 (1.72), 1.795 (1.18), 1.835 (0.53), 1.866 (1.39), 1.892 (1.52), 1.923 (0.67), 1.974 (1.94), 1.980 (1.94), 2.006 (1.71), 2.068 (0.06), 2.173 (2.14), 2.206 (1.73), 2.322 (0.15), 2.361 (0.20), 2.398 (0.08), 2.560 (10.95), 2.665 (0.17), 2.705 (0.23), 2.718 (0.08), 2.787 (0.45), 2.796 (0.86), 2.805 (0.53), 2.815 (0.93), 2.824 (1.65), 2.833 (0.86), 2.843 (0.51), 2.852 (0.80), 2.860 (0.36), 3.080 (0.85), 3.109 (1.66), 3.139 (0.97), 3.375 (2.38), 3.406 (1.88), 3.562 (13.87), 3.605 (0.45), 3.739 (0.04), 6.109 (0.47), 8.773 (0.31), 8.912 (0.39), 11.327 (0.03), 11.507 (0.12), 12.721 (0.04).
Пример 351
7-(пиперидин-4-ил)-3-[4-(трифторметил)-1,3-тиазол-2-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
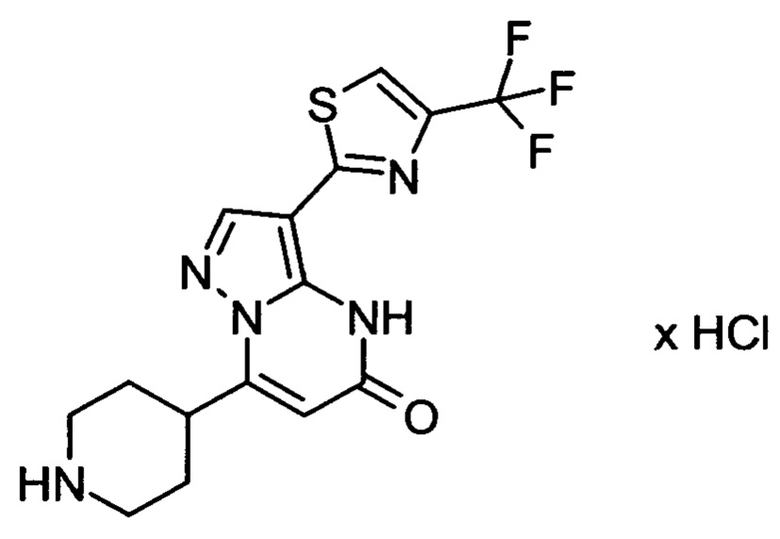
трет-бутил 4-{5-оксо-3-[4-(трифторметил)-1,3-тиазол-2-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (34.5 мг, 73.5 мкмоль) растворили в 1,4-диоксане (3 мл) и обработали соляной кислотой в 1,4-диоксане (180 мкл, 4.0 М, 730 мкмоль)) при комнатной температуре в течение 16 ч. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 35.0 мг (100% чистота, 108% теоретический выход).
LC-MS (Способ 10В): Rt=1.07 мин; MS (ESIpos): m/z=370 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.146 (0.70), 1.230 (1.37), 1.945 (8.44), 1.972 (9.26), 2.222 (12.83), 2.252 (10.78), 2.327 (1.23), 2.365 (1.26), 2.666 (1.26), 2.710 (1.03), 3.106 (9.23), 3.131 (9.61), 3.400 (13.57), 3.427 (11.87), 6.411 (2.68), 8.369 (16.00), 8.599 (10.97), 8.874 (3.72), 9.011 (4.64), 12.650 (0.63).
Пример 352
3-фторпропил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
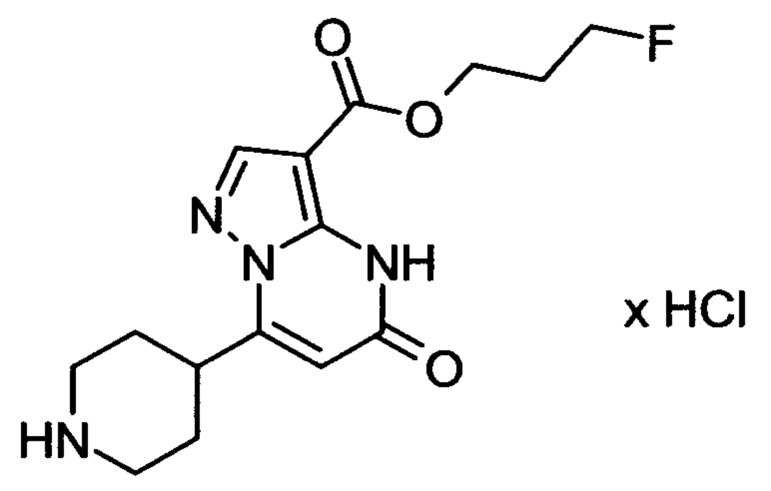
3-фторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (88.0 мг, 208 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (780 мкл, 4.0 М, 3.1 ммоль) при комнатной температуре в течение 3 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 65.8 мг (100% чистота, 88% теоретический выход).
LC-MS (Способ 10В): Rt=0.86 мин; MS (ESIpos): m/z=323 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.150 (0.65), -0.009 (5.54), 0.007 (5.13), 0.145 (0.67), 1.109 (0.14), 1.146 (0.53), 1.236 (0.14), 1.412 (0.65), 1.594 (1.13), 1.752 (0.14), 1.839 (2.80), 1.871 (3.06), 1.901 (1.25), 2.030 (1.11), 2.045 (3.88), 2.060 (5.98), 2.075 (4.07), 2.091 (1.37), 2.096 (1.30), 2.112 (3.98), 2.127 (6.27), 2.142 (7.88), 2.181 (4.07), 2.327 (0.43), 2.366 (0.84), 2.523 (1.18), 2.584 (0.14), 2.664 (0.36), 2.669 (0.46), 2.674 (0.36), 2.709 (0.87), 3.065 (2.92), 3.091 (3.06), 3.370 (4.99), 3.401 (4.02), 3.481 (1.28), 3.512 (2.24), 3.541 (1.16), 3.566 (8.65), 4.324 (7.76), 4.340 (16.00), 4.356 (7.57), 4.502 (5.08), 4.517 (9.78), 4.531 (4.84), 4.620 (4.99), 4.635 (9.78), 4.650 (4.92), 6.014 (2.72), 8.234 (5.88), 8.707 (0.60), 8.911 (0.75), 11.696 (1.45).
Пример 353
2,2-дифторэтил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
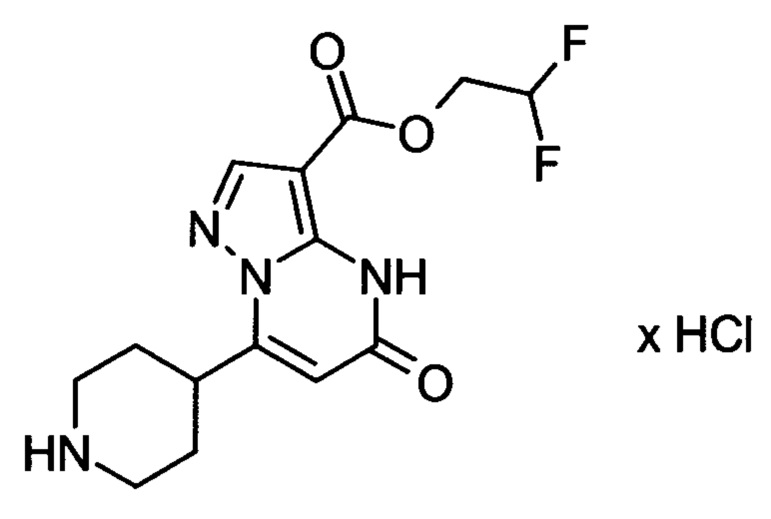
2,2-дифторэтил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (83.3 мг, 195 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (730 мкл, 4.0 М, 2.9 ммоль) при комнатной температуре в течение 3 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 68.7 мг (100% чистота, 97% теоретический выход).
LC-MS (Способ 11В): Rt=0.57 мин; MS (ESIpos): m/z=327 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.155 (0.16), -0.013 (1.49), 0.141 (0.15), 1.143 (0.22), 1.591 (0.48), 1.876 (1.48), 1.902 (4.25), 1.908 (4.27), 1.934 (4.87), 1.964 (2.12), 2.134 (7.11), 2.167 (5.38), 2.327 (0.21), 2.331 (0.16), 2.365 (0.35), 2.585 (0.09), 2.664 (0.14), 2.669 (0.19), 2.673 (0.13), 2.709 (0.36), 3.040 (4.00), 3.067 (4.13), 3.092 (1.91), 3.160 (0.14), 3.372 (7.91), 3.486 (1.91), 3.516 (3.40), 3.545 (1.74), 3.563 (7.31), 4.487 (5.26), 4.496 (5.79), 4.524 (10.87), 4.533 (11.27), 4.561 (5.40), 4.570 (5.13), 6.017 (3.95), 6.246 (1.63), 6.255 (3.37), 6.264 (1.58), 6.383 (3.15), 6.392 (6.75), 6.401 (3.23), 6.520 (1.43), 6.529 (3.07), 6.538 (1.55), 7.676 (15.12), 7.679 (16.00), 7.927 (0.08), 8.258 (12.93), 8.497 (0.09), 9.115 (6.78), 9.221 (1.43), 9.288 (1.91), 11.918 (0.16), 14.592 (0.21).
Пример 354
2,2,2-трифторэтил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид

2,2,2-трифторэтил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (110 мг, 247 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (930 мкл, 4.0 М, 3.7 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 86.2 мг (100% чистота, 92% теоретический выход).
LC-MS (Способ 11В): Rt=0.68 мин; MS (ESIpos): m/z=345 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.153 (0.04), 0.143 (0.05), 1.070 (0.02), 1.088 (0.04), 1.105 (0.02), 1.145 (0.06), 1.593 (0.11), 1.859 (0.26), 1.885 (0.76), 1.916 (0.84), 1.948 (0.34), 2.072 (0.13), 2.141 (1.24), 2.173 (0.95), 2.327 (0.05), 2.365 (0.08), 2.590 (0.02), 2.669 (0.06), 2.709 (0.09), 3.035 (0.59), 3.065 (1.12), 3.096 (0.63), 3.353 (1.53), 3.385 (1.10), 3.492 (0.33), 3.522 (0.60), 3.565 (16.00), 3.640 (0.02), 3.730 (0.04), 3.741 (0.03), 3.774 (0.05), 4.885 (0.90), 4.908 (2.53), 4.930 (2.39), 4.953 (0.73), 6.054 (0.44), 7.434 (0.02), 8.288 (1.57), 8.851 (0.03), 9.101 (0.21), 12.050 (0.06).
Пример 355
3,3,3-трифторпропил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
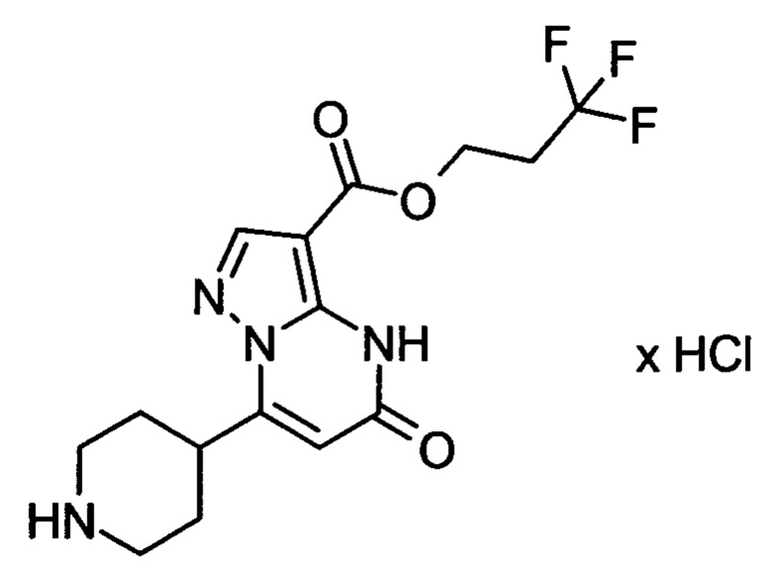
3,3,3-трифторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (72.1 мг, 157 мкмоль) растворили в 1,4-диоксане (1.5 мл, 18 ммоль) и обработали соляной кислотой в 1,4-диоксане (590 мкл, 4.0 М, 2.4 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 59.2 мг (100% чистота, 95% теоретический выход).
LC-MS (Способ 11В): Rt=0.72 мин; MS (ESIpos): m/z=359 [M+H]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.153 (0.12), -0.012 (1.15), 0.143 (0.14), 0.918 (0.15), 1.070 (0.41), 1.088 (0.86), 1.105 (0.43), 1.145 (0.16), 1.753 (0.39), 1.833 (1.01), 1.842 (1.24), 1.867 (3.34), 1.874 (3.43), 1.898 (3.79), 1.906 (3.70), 1.930 (1.68), 1.939 (1.43), 2.142 (5.35), 2.175 (4.23), 2.327 (0.16), 2.366 (0.20), 2.669 (0.17), 2.674 (0.13), 2.710 (0.22), 2.776 (0.93), 2.791 (1.90), 2.804 (3.33), 2.819 (5.53), 2.834 (4.86), 2.848 (5.42), 2.863 (3.42), 2.876 (1.82), 2.892 (0.95), 3.065 (3.47), 3.093 (2.04), 3.174 (0.08), 3.356 (5.72), 3.371 (2.40), 3.389 (4.98), 3.479 (1.45), 3.509 (2.65), 3.538 (1.33), 3.565 (4.45), 3.590 (0.10), 4.269 (0.08), 4.445 (8.23), 4.461 (16.00), 4.476 (7.98), 4.646 (0.08), 6.013 (4.22), 8.214 (14.71), 8.948 (0.93), 9.079 (1.14), 11.729 (1.15).
Пример 356
Циклобутил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
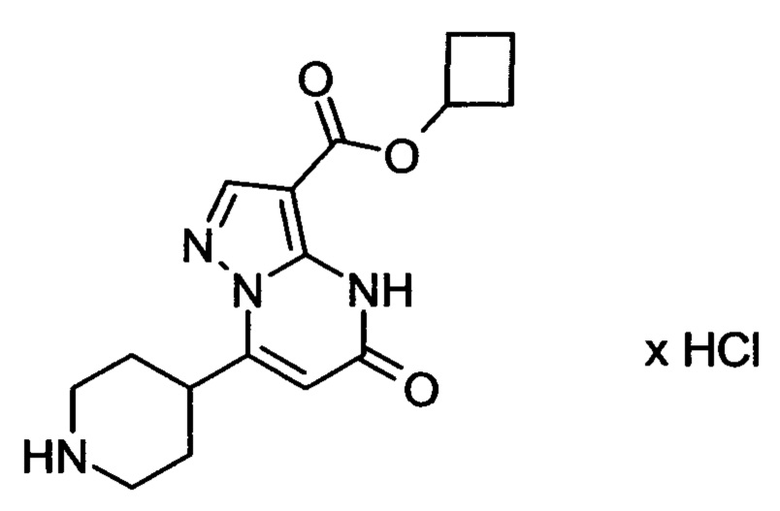
циклобутил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (120 мг, 288 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.1 мл, 4.0 М, 4.3 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 70.7 мг (100% чистота, 70% теоретический выход).
LC-MS (Способ 11В): Rt=0.75 мин; MS (ESIpos): m/z=317 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.61), -0.010 (5.64), 0.006 (6.12), 0.144 (0.69), 0.344 (0.26), 0.359 (0.29), 0.516 (0.24), 0.536 (0.21), 1.146 (0.71), 1.567 (0.58), 1.594 (2.19), 1.613 (4.24), 1.639 (4.88), 1.660 (2.77), 1.665 (2.19), 1.685 (1.08), 1.738 (1.42), 1.744 (1.08), 1.763 (3.82), 1.787 (3.69), 1.805 (2.27), 1.813 (2.69), 1.837 (4.85), 1.869 (5.38), 1.901 (2.24), 2.072 (0.55), 2.147 (7.70), 2.180 (6.27), 2.219 (3.87), 2.224 (3.95), 2.244 (6.75), 2.249 (6.38), 2.269 (7.12), 2.274 (7.01), 2.281 (5.25), 2.294 (7.96), 2.299 (8.28), 2.313 (4.88), 2.320 (5.98), 2.343 (1.71), 2.366 (1.03), 2.664 (0.50), 2.669 (0.61), 2.674 (0.47), 2.709 (0.98), 3.065 (4.27), 3.086 (4.40), 3.368 (7.93), 3.399 (6.48), 3.480 (2.06), 3.509 (3.74), 3.538 (1.92), 3.566 (16.00), 4.074 (0.45), 4.092 (0.47), 4.292 (0.21), 5.076 (1.24), 5.095 (4.72), 5.114 (6.93), 5.133 (4.61), 5.151 (1.19), 5.793 (0.21), 5.867 (0.18), 6.015 (5.11), 7.800 (0.21), 8.194 (12.02), 8.718 (1.13), 8.904 (1.40), 11.656 (1.98).
Пример 357
Метил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
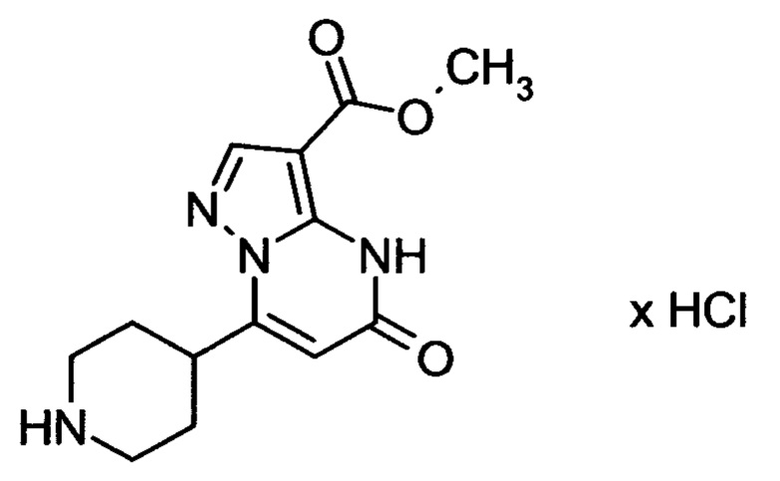
метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (127 мг, 336 мкмоль) растворили в 1,4-диоксане (2.1 мл, 25 ммоль) и обработали соляной кислотой в 1,4-диоксане (1.3 мл, 4.0 М, 5.0 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 56.8 мг (100% чистота, 54% теоретический выход).
LC-MS (Способ 10В): Rt=0.71 мин; MS (ESIpos): m/z=277 [M+H]+
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: -0.122 (0.03), -0.009 (0.26), 0.114 (0.03), 1.089 (0.02), 1.146 (0.08), 1.176 (0.02), 1.191 (0.05), 1.206 (0.02), 1.232 (0.08), 1.829 (0.30), 1.836 (0.36), 1.856 (0.93), 1.862 (0.94), 1.881 (1.02), 1.887 (0.98), 1.907 (0.44), 1.914 (0.37), 2.012 (0.01), 2.150 (1.39), 2.176 (1.16), 2.358 (0.05), 2.361 (0.07), 2.635 (0.07), 2.638 (0.05), 3.032 (0.36), 3.057 (1.00), 3.079 (1.05), 3.104 (0.40), 3.365 (1.63), 3.387 (1.68), 3.448 (0.05), 3.460 (0.08), 3.483 (0.38), 3.506 (0.68), 3.530 (0.34), 3.625 (0.09), 3.653 (0.02), 3.665 (0.04), 3.668 (0.03), 3.677 (0.04), 3.700 (0.04), 3.710 (0.04), 3.722 (0.02), 3.775 (16.00), 3.826 (0.02), 3.920 (0.08), 4.018 (0.03), 6.002 (0.76), 8.227 (2.42), 8.804 (0.32), 8.822 (0.33), 8.983 (0.42), 9.000 (0.36), 11.798 (0.45).
Пример 358
Пропил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
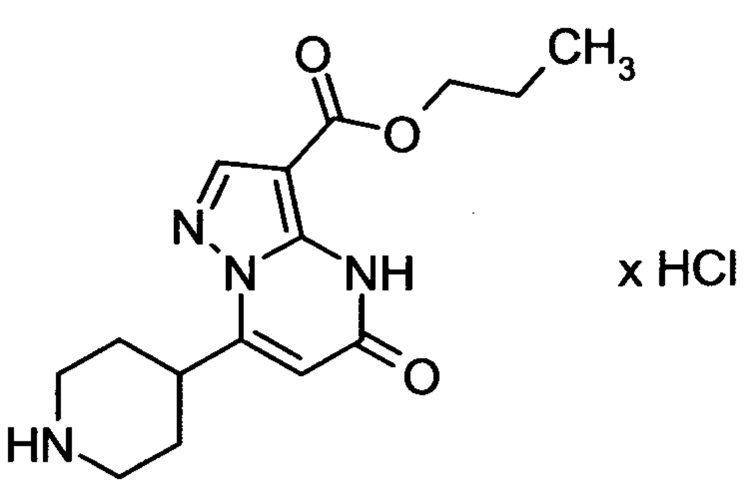
пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (84.0 мг, 208 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (780 мкл, 4.0 М, 3.1 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 68.8 мг (100% чистота, 97% теоретический выход).
LC-MS (Способ 1B): Rt=0.46 мин; MS (ESIpos): m/z=305 [М+Н]+
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: -0.121 (0.04), -0.008 (0.38), 0.115 (0.04), 0.777 (0.02), 0.792 (0.03), 0.807 (0.02), 0.853 (0.02), 0.870 (0.02), 0.905 (2.87), 0.920 (6.40), 0.935 (3.09), 1.028 (0.02), 1.043 (0.03), 1.058 (0.02), 1.089 (0.02), 1.146 (0.13), 1.234 (0.11), 1.412 (0.02), 1.663 (0.25), 1.678 (1.05), 1.692 (2.02), 1.706 (2.02), 1.721 (0.97), 1.735 (0.22), 1.753 (0.04), 1.813 (0.22), 1.820 (0.26), 1.840 (0.69), 1.846 (0.70), 1.865 (0.74), 1.871 (0.72), 1.890 (0.32), 1.898 (0.27), 1.934 (0.02), 2.002 (0.02), 2.018 (0.02), 2.072 (2.05), 2.152 (1.02), 2.179 (0.87), 2.321 (0.05), 2.343 (0.03), 2.358 (0.08), 2.361 (0.12), 2.365 (0.08), 2.631 (0.09), 2.635 (0.12), 2.639 (0.09), 3.067 (0.60), 3.088 (0.62), 3.110 (0.28), 3.218 (0.04), 3.372 (1.08), 3.397 (0.90), 3.430 (0.06), 3.486 (0.26), 3.510 (0.45), 3.534 (0.25), 3.566 (16.00), 3.698 (0.02), 3.707 (0.02), 3.715 (0.02), 3.737 (0.02), 4.018 (0.04), 4.045 (0.02), 4.142 (0.02), 4.180 (1.68), 4.194 (3.49), 4.208 (1.65), 4.274 (0.02), 4.339 (0.02), 6.011 (0.49), 6.167 (0.02), 7.061 (0.02), 7.163 (0.02), 7.267 (0.02), 7.669 (0.48), 8.209 (1.53), 8.680 (0.21), 8.884 (0.26), 9.045 (0.17), 11.662 (0.11).
Пример 359
3-(7-окса-1-азаспиро[3.5]нон-1-илкарбонил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он трифторацетат
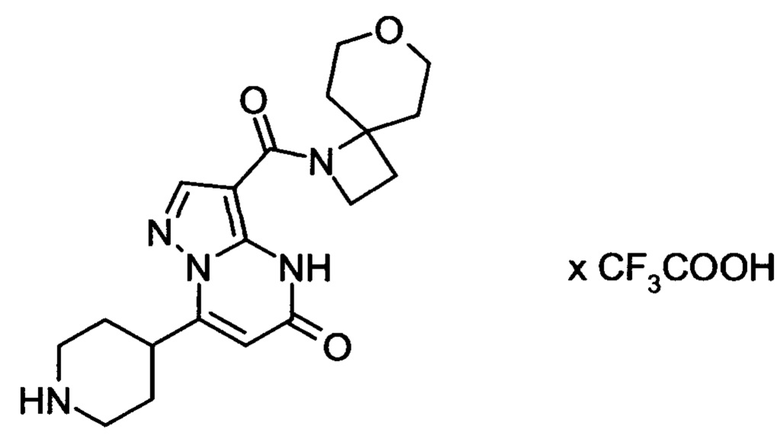
трет-бутил 4-[3-(7-окса-1-азаспиро[3.5]нон-1-илкарбонил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилат (57.9 мг, 123 мкмоль) растворили в дихлорметане (1.0 мл) и обработали трифторуксусной кислотой (47 мкл, 610 мкмоль) при комнатной температуре в течение 16 ч. Еще 250 мкл трифторуксусной кислоты добавили, и смесь перемешивали при комнатной температуре в течение 6 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В). Остаток растворили в дихлорметане (1.0 мл), и 250 мкл трифторуксусной кислоты добавили. Растворители удалили в вакууме с получением продукта. Полученное количество составило 14.3 мг (90% чистота, 22% теоретический выход).
LC-MS (Способ 10В): Rt=0.80 мин; MS (ESIpos): m/z=372 [M+H]+
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: -0.121 (1.15), -0.008 (10.23), 0.006 (10.60), 0.116 (1.15), 0.853 (0.32), 1.146 (1.36), 1.235 (2.35), 1.258 (1.02), 1.298 (0.37), 1.351 (0.80), 1.602 (0.37), 1.814 (1.39), 1.821 (1.74), 1.840 (4.49), 1.847 (4.91), 1.853 (4.09), 1.865 (7.13), 1.873 (7.51), 1.882 (7.16), 1.891 (6.06), 1.901 (5.53), 1.910 (3.74), 2.013 (5.16), 2.041 (3.77), 2.182 (9.75), 2.196 (11.99), 2.207 (10.20), 2.358 (0.83), 2.361 (1.18), 2.365 (0.85), 2.635 (1.50), 2.638 (1.23), 2.890 (0.32), 3.087 (2.11), 3.112 (5.13), 3.134 (5.29), 3.160 (2.43), 3.415 (7.99), 3.440 (7.35), 3.582 (6.54), 3.606 (8.31), 3.629 (6.94), 3.679 (11.35), 3.691 (16.00), 3.703 (11.06), 3.718 (7.67), 3.726 (10.07), 3.741 (9.22), 3.750 (12.13), 3.758 (7.99), 3.810 (7.37), 3.814 (8.04), 3.833 (10.18), 3.852 (5.56), 3.857 (5.26), 4.376 (0.43), 5.753 (14.80), 6.385 (3.63), 8.439 (1.55), 8.458 (1.68), 8.590 (6.46), 8.727 (2.06), 8.750 (1.90).
Пример 360
N-метил-5-оксо-N-[(1S)-1-фенилэтил]-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
трет-бутил 4-(3-{метил[(1S)-1-фенилэтил]карбамоил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (79.7 мг, 166 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (620 мкл, 4.0 М, 2.5 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 15.1 мг (95% чистота, 21% теоретический выход).
LC-MS (Способ 1В): Rt=0.57 мин; MS (ESIpos): m/z=380 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -1.264 (0.07), -0.150 (0.75), -0.023 (0.14), -0.020 (0.27), -0.015 (0.75), -0.009 (6.58), 0.007 (6.92), 0.015 (0.88), 0.018 (0.61), 0.021 (0.47), 0.026 (0.34), 0.030 (0.27), 0.052 (0.20), 0.145 (0.81), 0.212 (0.07), 0.885 (0.27), 1.127 (0.27), 1.146 (1.02), 1.234 (0.54), 1.355 (5.83), 1.563 (7.73), 1.579 (7.86), 1.751 (0.14), 1.834 (2.64), 1.865 (2.92), 1.897 (1.22), 2.169 (4.14), 2.202 (3.46), 2.322 (0.54), 2.327 (0.75), 2.331 (0.54), 2.366 (1.29), 2.522 (2.17), 2.524 (2.03), 2.560 (0.95), 2.567 (0.68), 2.578 (0.47), 2.582 (0.47), 2.665 (0.75), 2.669 (0.95), 2.674 (0.75), 2.709 (1.49), 2.847 (4.34), 3.075 (2.64), 3.104 (2.85), 3.202 (0.07), 3.263 (0.27), 3.359 (1.63), 3.379 (5.15), 3.410 (4.34), 3.445 (0.75), 3.450 (0.81), 3.455 (0.81), 3.461 (1.90), 3.473 (2.44), 3.489 (2.51), 3.514 (2.37), 3.544 (1.15), 3.567 (4.88), 3.624 (0.27), 3.640 (0.47), 3.650 (0.54), 3.654 (0.75), 3.661 (0.81), 3.666 (1.63), 3.670 (1.29), 3.677 (1.76), 3.680 (2.10), 3.698 (1.97), 3.700 (1.83), 3.707 (1.22), 3.711 (1.63), 3.716 (0.81), 3.723 (0.75), 3.728 (0.47), 3.810 (0.20), 3.838 (0.20), 3.860 (0.20), 4.018 (1.15), 4.141 (0.14), 4.187 (0.20), 4.208 (0.14), 4.233 (0.14), 4.310 (0.14), 4.436 (0.14), 4.608 (0.27), 5.415 (0.07), 5.561 (0.14), 5.682 (0.20), 5.835 (0.41), 5.923 (0.27), 5.989 (5.08), 6.348 (0.27), 6.632 (0.27), 6.869 (0.41), 7.150 (0.07), 7.271 (1.42), 7.288 (4.14), 7.305 (2.92), 7.309 (2.64), 7.333 (3.46), 7.350 (11.80), 7.357 (16.00), 7.374 (9.22), 7.394 (2.58), 7.565 (0.07), 8.147 (0.81), 8.537 (0.88), 8.794 (1.08), 11.389 (0.61), 17.644 (0.07).
Пример 361
N-метил-5-оксо-7-(пиперидин-4-ил)-N-(пиридин-2-илметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксамид гидрохлорид
трет-бутил 4-{3-[метил(пиридин-2-илметил)карбамоил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (111 мг, 239 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (900 мкл, 4.0 М, 3.6 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 20.2 мг (95% чистота, 18% теоретический выход).
LC-MS (Способ 10В): Rt=0.82 мин; MS (ESIpos): m/z=367 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.010 (0.26), 0.006 (0.41), 1.146 (0.23), 1.234 (0.24), 1.354 (1.90), 1.833 (0.39), 1.865 (1.10), 1.891 (1.22), 1.922 (0.52), 1.986 (0.10), 2.001 (0.07), 2.158 (1.70), 2.190 (1.40), 2.327 (0.19), 2.365 (0.26), 2.669 (0.25), 2.709 (0.31), 2.737 (0.07), 3.036 (0.66), 3.058 (1.63), 3.063 (1.56), 3.090 (1.56), 3.123 (0.88), 3.166 (4.32), 3.297 (0.51), 3.368 (2.45), 3.387 (2.58), 3.400 (2.49), 3.449 (2.59), 3.460 (3.55), 3.473 (4.61), 3.491 (6.45), 3.501 (7.48), 3.544 (10.54), 3.566 (16.00), 3.645 (2.78), 3.654 (2.39), 3.660 (2.17), 3.665 (2.39), 3.669 (2.15), 3.679 (2.26), 3.697 (1.90), 3.699 (1.86), 3.706 (1.50), 3.711 (1.61), 3.715 (1.21), 3.722 (1.11), 3.727 (1.00), 3.839 (0.52), 3.858 (0.51), 4.018 (0.21), 4.131 (0.33), 4.186 (0.31), 4.207 (0.28), 4.327 (0.09), 4.851 (4.29), 5.966 (0.46), 5.985 (3.56), 6.346 (0.31), 6.868 (0.15), 7.565 (0.95), 8.061 (0.56), 8.141 (0.93), 8.163 (1.48), 8.665 (1.24), 8.677 (1.16), 8.770 (0.37), 8.956 (0.46).
Пример 362
3-[(4,4-дифторпиперидин-1-ил)карбонил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
трет-бутил 4-{3-[(4,4-дифторпиперидин-1-ил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (39.0 мг, 83.8 мкмоль) растворили в 1,4-диоксане (1.0 мл, 12 ммоль) и обработали соляной кислотой в 1,4-диоксане (310 мкл, 4.0 М, 1.3 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 5.60 мг (100% чистота, 17% теоретический выход).
LC-MS (Способ 11В): Rt=0.62 мин; MS (ESIpos): m/z=366 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.009 (2.41), 0.007 (1.75), 0.145 (0.22), 1.146 (1.32), 1.234 (0.66), 1.801 (0.66), 1.830 (1.97), 1.856 (2.19), 1.888 (1.10), 2.000 (2.41), 2.018 (3.51), 2.033 (4.38), 2.048 (3.51), 2.068 (2.41), 2.167 (3.29), 2.201 (2.85), 2.248 (0.22), 2.327 (1.10), 2.331 (0.88), 2.366 (1.75), 2.405 (0.22), 2.523 (2.19), 2.569 (0.44), 2.575 (0.44), 2.586 (0.22), 2.660 (0.44), 2.669 (1.10), 2.673 (0.88), 2.709 (1.53), 3.064 (1.75), 3.091 (3.29), 3.125 (1.97), 3.194 (0.22), 3.234 (0.44), 3.262 (0.66), 3.272 (1.53), 3.294 (10.30), 3.363 (1.97), 3.382 (4.60), 3.414 (3.51), 3.510 (1.32), 3.566 (16.00), 3.592 (1.10), 3.635 (6.14), 3.649 (8.77), 3.663 (6.14), 3.699 (0.66), 4.645 (0.44), 5.941 (1.97), 8.054 (2.41), 8.683 (0.44), 11.773 (0.44).
Пример 363
3-{[(2S)-2-метилпирролидин-1-ил]метил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
трет-бутил 4-(3-{[(2S)-2-метилпирролидин-1-ил]метил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (12.8 мг, 30.8 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (120 мкл, 4.0 М, 460 мкмоль). Растворители удалили в вакууме с получением продукта. Полученное количество составило 9.30 мг (95% чистота, 82% теоретический выход).
LC-MS (Способ 10В): Rt=0.55 мин; MS (ESIpos): m/z=316 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.150 (0.10), -0.009 (0.97), 0.007 (0.71), 0.145 (0.09), 1.146 (0.18), 1.235 (0.12), 1.266 (0.07), 1.293 (0.24), 1.310 (0.24), 1.362 (0.23), 1.389 (2.06), 1.405 (2.06), 1.436 (0.09), 1.505 (0.05), 1.571 (0.13), 1.595 (0.30), 1.605 (0.20), 1.614 (0.29), 1.626 (0.27), 1.637 (0.20), 1.646 (0.28), 1.669 (0.14), 1.820 (0.29), 1.851 (0.73), 1.873 (0.72), 1.883 (0.74), 1.906 (0.50), 2.064 (0.07), 2.150 (0.68), 2.185 (0.63), 2.206 (0.33), 2.225 (0.27), 2.239 (0.18), 2.327 (0.16), 2.365 (0.21), 2.669 (0.12), 2.674 (0.09), 2.709 (0.16), 2.796 (0.06), 2.825 (0.06), 3.065 (0.62), 3.093 (0.74), 3.375 (0.81), 3.400 (0.80), 3.473 (0.21), 3.504 (0.33), 3.534 (0.18), 3.567 (16.00), 3.666 (0.04), 3.679 (0.06), 3.698 (0.06), 4.139 (0.24), 4.156 (0.27), 4.174 (0.31), 4.191 (0.30), 4.304 (0.04), 4.347 (0.05), 4.449 (0.33), 4.457 (0.33), 4.483 (0.28), 4.492 (0.26), 5.889 (0.67), 7.571 (0.09), 7.583 (0.08), 8.036 (0.83), 8.734 (0.15), 8.903 (0.17), 10.165 (0.10), 11.106 (0.05), 12.468 (0.06), 12.518 (0.50).
Пример 364
Циклобутил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид

циклобутил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (92.7 мг, 215 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (810 мкл, 4.0 М, 3.2 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 61.1 мг (100% чистота, 77% теоретический выход).
LC-MS (Способ 11В): Rt=0.88 мин; MS (ESIpos): m/z=331 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.15), -0.010 (1.41), 0.006 (1.24), 0.144 (0.15), 0.349 (0.05), 0.353 (0.04), 0.362 (0.05), 0.506 (0.04), 0.530 (0.04), 0.924 (0.06), 1.146 (0.09), 1.569 (0.12), 1.594 (0.41), 1.616 (0.92), 1.642 (1.00), 1.663 (0.60), 1.688 (0.22), 1.712 (0.04), 1.735 (0.16), 1.742 (0.31), 1.758 (0.38), 1.767 (0.76), 1.774 (0.57), 1.791 (0.87), 1.831 (0.92), 1.861 (0.99), 1.893 (0.39), 2.072 (0.83), 2.133 (1.64), 2.166 (1.33), 2.213 (0.22), 2.218 (0.20), 2.237 (0.81), 2.242 (0.86), 2.261 (1.71), 2.266 (1.63), 2.281 (1.88), 2.286 (2.35), 2.294 (2.03), 2.299 (1.81), 2.303 (1.78), 2.312 (1.37), 2.321 (1.24), 2.365 (0.15), 2.422 (16.00), 2.436 (0.55), 2.582 (0.12), 2.664 (0.07), 2.669 (0.09), 2.709 (0.13), 3.051 (0.70), 3.081 (1.43), 3.113 (0.81), 3.356 (1.77), 3.388 (1.40), 3.466 (0.49), 3.496 (0.90), 3.526 (0.44), 3.566 (1.75), 4.078 (0.08), 4.097 (0.08), 5.076 (0.26), 5.095 (1.03), 5.114 (1.53), 5.132 (1.01), 5.151 (0.25), 5.933 (1.90), 8.922 (0.25), 11.211 (0.17).
Пример 365
Пропил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
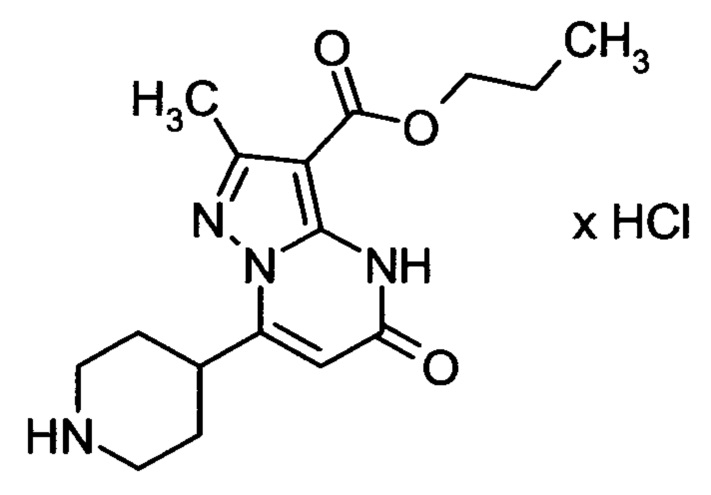
пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (78.3 мг, 187 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (700 мкл, 4.0 М, 2.8 ммоль) при комнатной температуре в течение 16 ч. Добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 49.2 мг (100% чистота, 74% теоретический выход).
LC-MS (Способ 11В): Rt=0.85 мин; MS (ESIpos): m/z=319 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.21), -0.010 (1.79), 0.006 (1.69), 0.144 (0.22), 0.765 (0.05), 0.906 (4.55), 0.924 (10.38), 0.943 (5.04), 1.072 (0.14), 1.079 (0.06), 1.089 (0.27), 1.107 (0.13), 1.146 (0.13), 1.412 (0.05), 1.594 (0.05), 1.658 (0.38), 1.676 (1.60), 1.693 (3.17), 1.712 (3.10), 1.729 (1.51), 1.747 (0.35), 1.827 (0.82), 1.856 (0.88), 1.887 (0.35), 2.072 (0.06), 2.137 (1.59), 2.170 (1.29), 2.263 (0.08), 2.327 (0.11), 2.331 (0.08), 2.365 (0.17), 2.427 (16.00), 2.523 (0.26), 2.525 (0.27), 2.570 (0.09), 2.579 (0.08), 2.585 (0.13), 2.664 (0.09), 2.669 (0.12), 2.673 (0.09), 2.709 (0.18), 3.054 (0.73), 3.085 (1.52), 3.117 (0.85), 3.358 (1.72), 3.391 (1.50), 3.469 (0.48), 3.498 (0.87), 3.528 (0.44), 3.566 (1.60), 4.184 (2.58), 4.201 (5.36), 4.217 (2.53), 5.929 (1.63), 8.857 (0.20), 11.258 (0.10).
Пример 366
Пропан-2-ил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
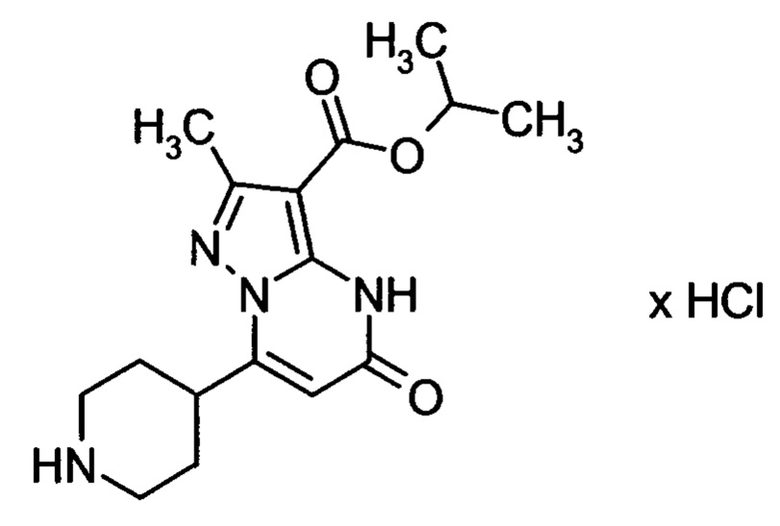
пропан-2-ил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (66.8 мг, 160 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (600 мкл, 4.0 М, 2.4 ммоль) при комнатной температуре в течение 3 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 55.1 мг (100% чистота, 97% теоретический выход).
LC-MS (Способ 11B): Rt=0.79 мин; MS (ESIpos): m/z=319 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.010 (0.48), 0.006 (0.50), 1.315 (15.80), 1.330 (16.00), 1.796 (0.25), 1.827 (0.81), 1.859 (0.89), 1.890 (0.36), 2.072 (0.95), 2.134 (1.35), 2.168 (1.09), 2.366 (0.14), 2.419 (14.50), 2.578 (0.12), 2.709 (0.14), 3.038 (0.33), 3.068 (0.90), 3.098 (0.94), 3.126 (0.39), 3.387 (1.15), 3.467 (0.41), 3.497 (0.76), 3.526 (0.37), 5.084 (0.43), 5.100 (1.14), 5.116 (1.55), 5.131 (1.13), 5.147 (0.41), 5.931 (1.74), 8.790 (0.22), 8.936 (0.29), 11.027 (0.75).
Пример 367
2,2,2-трифторэтил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
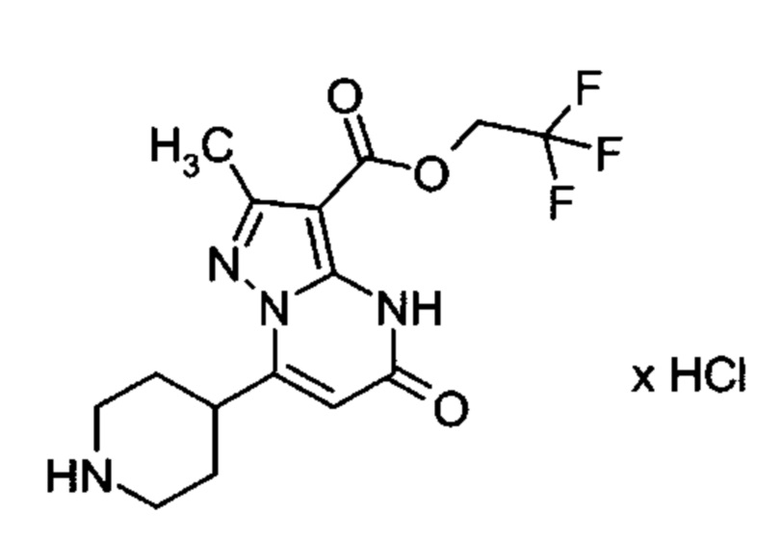
2,2,2-трифторэтил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (109 мг, 237 мкмоль) растворили в 1,4-диоксане (2.4 мл, 28 ммоль) и обработали соляной кислотой в 1,4-диоксане (890 мкл, 4.0 М, 3.6 ммоль) при комнатной температуре в течение 3 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 93.4 мг (100% чистота, 100% теоретический выход).
LC-MS (Способ 11B): Rt=0.80 мин; MS (ESIpos): m/z=359 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.010 (1.33), 0.006 (0.78), 1.145 (0.14), 1.832 (1.31), 1.863 (1.37), 2.072 (0.27), 2.136 (2.31), 2.170 (1.81), 2.327 (0.15), 2.366 (0.27), 2.431 (16.00), 2.518 (0.83), 2.709 (0.19), 3.073 (1.48), 3.101 (1.47), 3.129 (0.62), 3.360 (2.37), 3.390 (1.80), 3.474 (0.59), 3.503 (0.98), 3.532 (0.52), 3.566 (3.73), 4.884 (1.79), 4.907 (4.96), 4.929 (4.62), 4.952 (1.39), 5.976 (1.08), 8.754 (0.30), 8.912 (0.43), 11.645 (0.94).
Пример 368
3-цикл опропил-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
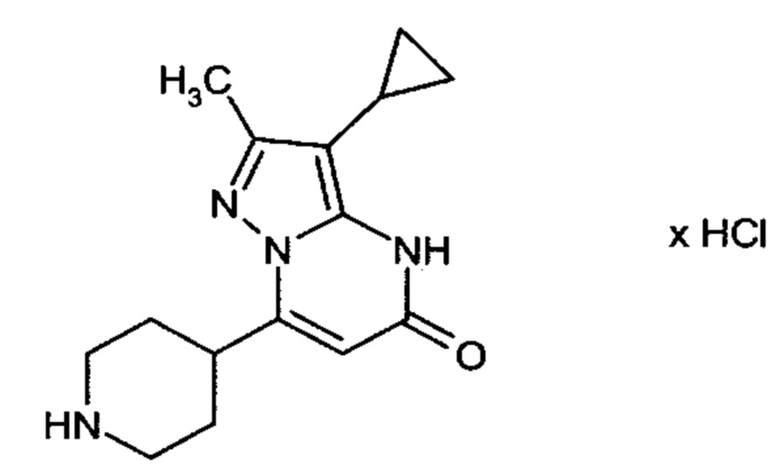
Соединение трет-бутил 4-(3-циклопропил-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (758 мг, 2.04 ммоль) перемешивали всю ночь при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 15 мл). Смесь разбавили простым диэтиловым эфиром (15 мл) и отфильтровали. Выделенное твердое вещество растворили в воде и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 639 мг (98% чистота, 100% теоретический выход).
LC-MS (Способ 8В): Rt=0.53 мин; MS (ESIneg): m/z=271 [М-Н-xHCl]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.447 (0.60), 0.458 (2.19), 0.462 (2.16), 0.471 (2.34), 0.474 (2.20), 0.485 (0.72), 0.778 (0.82), 0.789 (2.21), 0.793 (2.18), 0.799 (1.14), 0.804 (1.14), 0.809 (2.33), 0.814 (2.17), 0.825 (0.78), 1.450 (0.33), 1.463 (0.67), 1.470 (0.70), 1.475 (0.47), 1.483 (1.25), 1.491 (0.45), 1.496 (0.65), 1.504 (0.61), 1.517 (0.28), 1.805 (0.30), 1.831 (0.90), 1.862(1.02), 1.892 (0.41), 2.115 (1.45), 2.146(1.16), 2.229 (16.00), 3.020 (0.36), 3.051 (1.00), 3.078 (1.03), 3.110 (0.41), 3.336 (1.39), 3.366 (1.13), 3.440 (0.25), 3.446 (0.45), 3.453 (0.31), 3.469 (0.53), 3.476 (0.87), 3.484 (0.51), 3.498 (0.31), 3.506 (0.43), 3.514 (0.25), 5.635 (3.30), 8.969 (0.33), 9.030 (0.46), 11.774 (0.04).
Пример 369
3-{4-метил-2-[4-(трифторметил)фенил]-1,3-тиазол-5-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
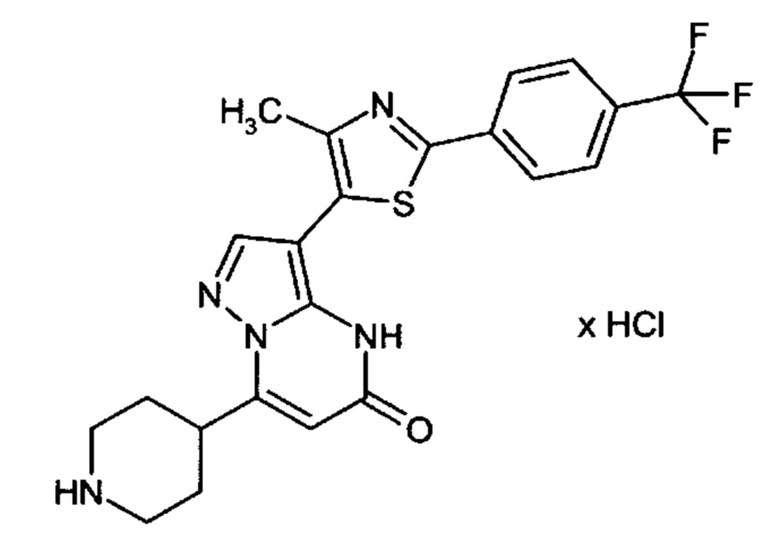
Соединение трет-бутил 4-(5-[(4-метоксибензил)окси]-3-{4-метил-2-[4-(трифторметил)фенил]-1,3-тиазол-5-ил}пиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (115 мг, 169 мкмоль) перемешивали всю ночь при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 4.0 мл). Другую порцию соляной кислоты (4Н раствор в 1,4-диоксане, 4.0 мл) добавили, и перемешивание продолжали. Смесь разбавили простым диэтиловым эфиром (16 мл) и отфильтровали. Выделенное твердое вещество перемешивали всю ночь с 1/2 смесью метанола/простого диэтилового эфира, и отфильтровали снова перед растворением в воде, и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 58.9 мг (100% чистота, 70% теоретический выход).
LC-MS (Способ 8В): Rt=0.96 мин; MS (ESIpos): m/z=460 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.844 (1.46), 1.881 (3.92), 1.912 (4.51), 1.941 (2.12), 2.224 (5.84), 2.256 (5.31), 3.081 (1.86), 3.111 (4.71), 3.138 (4.91), 3.170 (2.32), 3.572 (2.12), 5.921 (1.13), 7.864 (14.01), 7.885 (16.00), 8.123 (14.87), 8.144 (12.22), 8.522 (1.86), 8.787 (2.32), 12.222 (1.33).
Пример 370
3-ацетил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
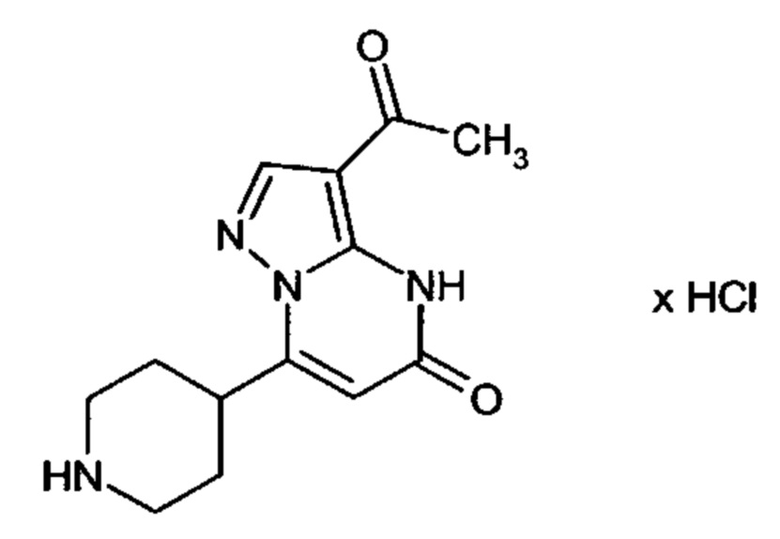
Соединение трет-бутил 4-{3-ацетил-5-[(4-метоксибензил)окси]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (72.0 мг, 150 мкмоль) перемешивали всю ночь при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 2.0 мл). Смесь разбавили и перемешали с простым диэтиловым эфиром (10 мл) и метанолом (1.0 мл) перед фильтрацией. Полученное твердое вещество высушивали в вакууме с получением соединения, указанного в названии. Полученное количество составило 39.0 мг (100% чистота, 88% теоретический выход).
LC-MS (Способ 10В): Rt=0.64 мин; MS (ESIpos): m/z=261 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.800 (0.73), 1.833 (2.43), 1.866 (2.57), 1.898 (1.22), 2.157 (3.90), 2.193 (3.06), 2.435 (8.77), 3.048 (0.83), 3.080 (2.78), 3.110 (2.78), 3.135 (1.25), 3.380 (4.28), 3.410 (3.34), 3.524 (1.29), 6.049 (1.22), 8.431 (16.00), 8.542 (0.83), 8.782 (1.08), 11.413 (0.97).
Пример 371
7-(пиперидин-4-ил)-3-пропаноилпиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
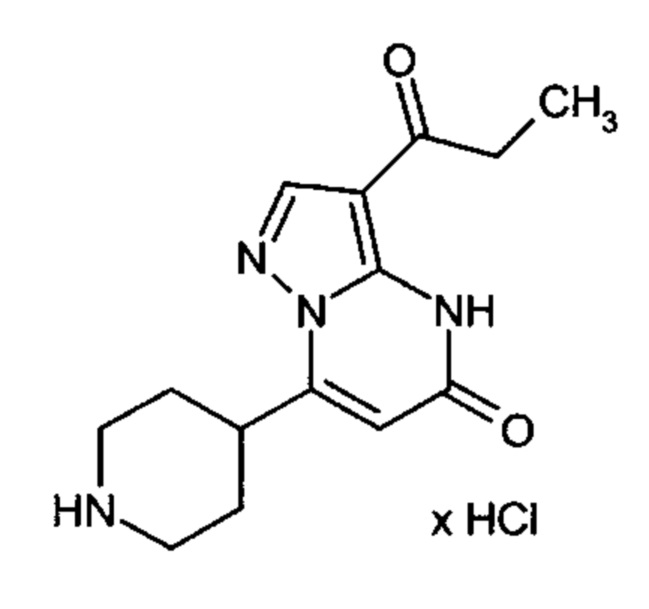
Соединение трет-бутил 4-(5-оксо-3-пропаноил-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (85.0 мг, 227 мкмоль) перемешивали всю ночь при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 4.3 мл). Смесь разбавили и перемешивали в течение 30 мин с простым диэтиловым эфиром (30 мл) и метанолом (1.0 мл) перед фильтрацией. Полученное твердое вещество высушивали в вакууме с получением соединения, указанного в названии. Полученное количество составило 66.0 мг (99% чистота, 93% теоретический выход).
LC-MS (Способ 10В): Rt=0.75 мин; MS (ESIpos): m/z=275 [М+Н-xHCl]+
1Н-ЯМР (500 МГц, DMSO-d6) delta [ppm]: 1.062 (7.32), 1.077 (16.00), 1.092 (7.76), 1.821 (0.54), 1.828 (0.66), 1.848 (1.67), 1.853 (1.74), 1.873 (1.86), 1.878 (1.80), 1.897 (0.79), 1.904 (0.69), 2.159 (2.43), 2.185 (2.15), 2.851 (1.39), 3.090 (1.80), 3.113 (1.10), 3.377 (3.22), 3.403 (2.62), 3.500 (0.60), 3.522 (0.92), 3.541 (0.57), 6.029 (0.88), 8.439 (10.64), 8.626 (0.50), 8.864 (0.60), 11.389 (0.28).
Пример 372
3-(2-фенил-1,3-оксазол-4-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

Соединение трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(2-фенил-1,3-оксазол-4-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (168 мг, 289 мкмоль) перемешивали всю ночь при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 5.0 мл). Смесь разбавили простым диэтиловым эфиром (16 мл) и отфильтровали. Полученное твердое вещество высушивали в вакууме с получением соединения, указанного в названии. Полученное количество составило 91.3 мг (100% чистота, 79% теоретический выход).
LC-MS (Способ 8В): Rt=0.84 мин; MS (ESIpos): m/z=362 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.832 (1.07), 1.864 (2.90), 1.896 (3.09), 1.929 (1.26), 2.210 (4.28), 2.240 (3.09), 3.071 (1.45), 3.103 (3.40), 3.134 (3.21), 3.161 (1.32), 3.401 (5.17), 3.433 (4.54), 5.945 (1.32), 7.551 (2.77), 7.560 (16.00), 7.566 (14.80), 7.574 (9.26), 7.578 (9.39), 7.587 (2.77), 8.081 (6.55), 8.086 (7.24), 8.095 (6.80), 8.097 (5.86), 8.105 (5.80), 8.259 (3.34), 8.549 (1.20), 8.648 (1.64), 8.779 (1.39), 11.755 (0.63).
Пример 373
7-(пиперидин-4-ил)-3-(1,2-тиазол-5-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
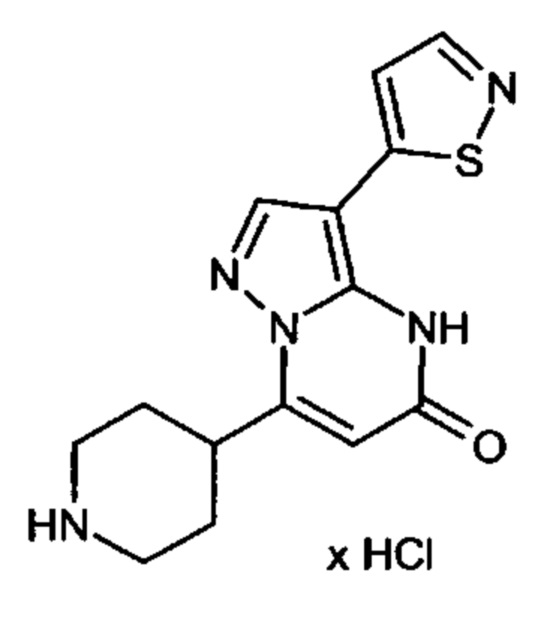
трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(1,2-тиазол-5-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (58.0 мг, 111 мкмоль)
Соляная кислота (4Н раствор в 1,4-диоксане, 2.1 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 371. Полученное количество составило 36.0 мг (100% чистота, 96% теоретический выход).
LC-MS (Способ 10В): Rt=0.75 мин; MS (ESIpos): m/z=302 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.856 (3.26), 1.886 (7.34), 1.917 (7.78), 1.948 (3.42), 2.176 (10.59), 2.208 (8.48), 3.032 (3.43), 3.064 (7.81), 3.092 (7.88), 3.123 (4.39), 3.356 (10.71), 3.384 (8.69), 3.594 (3.22), 3.630 (3.95), 3.650 (2.95), 6.276 (2.66), 7.708 (13.45), 8.468 (16.00), 8.807 (3.03), 8.954 (3.78).
Пример 374
2-бром-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбонитрил гидрохлорид
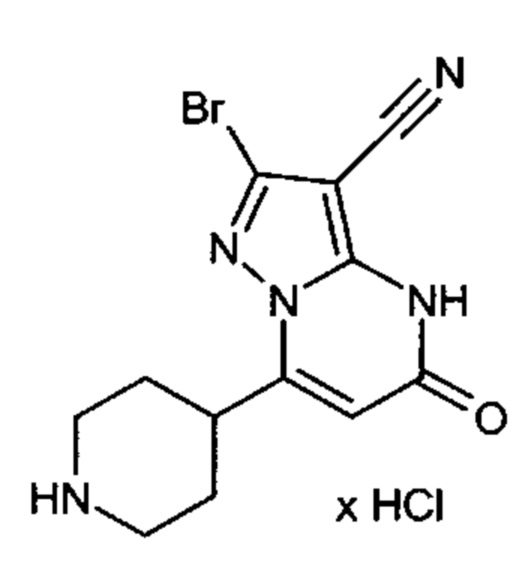
трет-бутил 4-(2-бром-3-циано-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (200 мг, 474 мкмоль)
Соляная кислота (4Н раствор в 1,4-диоксане, 1.2 мл)
Соединение, указанное в названии, получили согласно той же методике, как в примере 373. Полученное количество составило 169 мг (99% чистота, 98% теоретический выход).
LC-MS (Способ 8В): Rt=0.25 мин; MS (ESIpos): m/z=322 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.789 (3.04), 1.818 (8.83), 1.851 (9.63), 1.881 (4.05), 2.118 (14.19), 2.149 (11.37), 3.062 (3.62), 3.095 (9.27), 3.122 (10.21), 3.150 (4.27), 3.369 (16.00), 3.399 (12.52), 3.482 (3.55), 3.510 (6.08), 3.543 (4.34), 6.284 (3.26), 8.544 (2.90), 8.793 (4.42), 13.455 (2.97).
Пример 375
3-(1-метил-1Н-пиразол-5-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
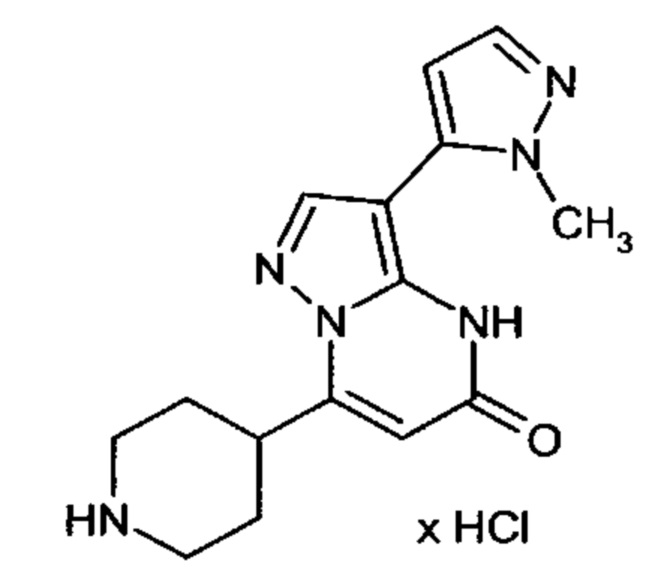
Соединение трет-бутил 4-{5-[(4-метоксибензил)окси]-3-(1-метил-1Н-пиразол-5-ил)пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (210 мг, 405 мкмоль) перемешивали всю ночь при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 9.6 мл) и 1,4-диоксаном (5.0 мл). Смесь разбавили простым диэтиловым эфиром (16 мл), перемешивали и отфильтровали. Полученное твердое вещество высушивали в вакууме с получением соединения, указанного в названии. Полученное количество составило 148 мг (86% чистота, 93% теоретический выход).
LC-MS (Способ 1B): Rt=0.22 мин; MS (ESIpos): m/z=299 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.903 (0.33), 1.912 (0.43), 1.936 (1.07), 1.944 (1.11), 1.968 (1.22), 1.975 (1.19), 2.000 (0.55), 2.008 (0.47), 2.188 (1.75), 2.221 (1.33), 3.039 (0.46), 3.070 (1.22), 3.098 (1.23), 3.129 (0.49), 3.365 (1.65), 3.396 (1.34), 3.577 (0.73), 3.584 (0.98), 3.607 (0.34), 3.614 (0.46), 3.772 (16.00), 5.983 (1.76), 6.405 (2.80), 7.506 (3.25), 8.062 (3.45), 9.161 (0.43), 9.255 (0.54).
Пример 376
3-[2-(морфолин-4-ил)-1,3-тиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
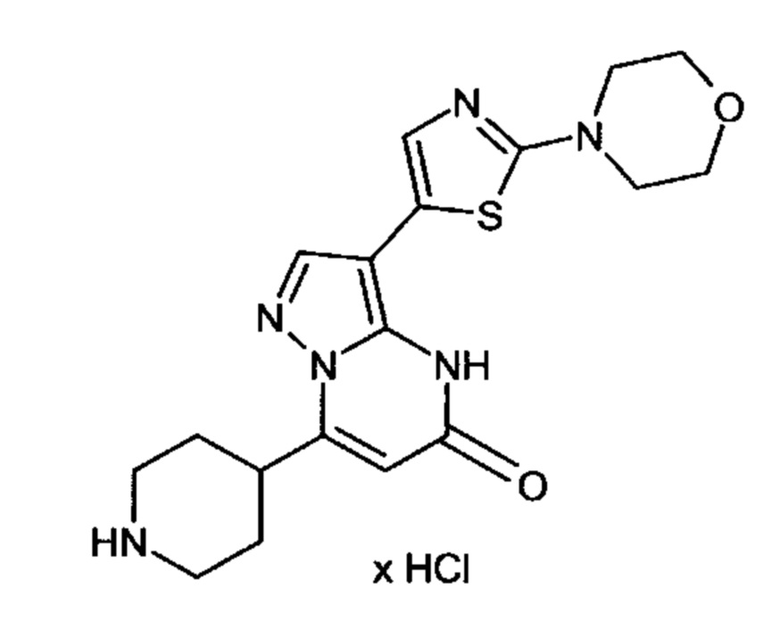
Соединение трет-бутил 4-{5-[(4-метоксибензил)окси]-3-[2-(морфолин-4-ил)-1,3-тиазол-5-ил]пиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата (139 мг, 229 мкмоль) перемешивали всю ночь при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 4.0 мл). Другую порцию соляной кислоты (4Н раствор в 1,4-диоксане, 4.0 мл) добавили, и перемешивание продолжали. Смесь разбавили простым диэтиловым эфиром (16 мл) и отфильтровали. Выделенное твердое вещество растворили в воде и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 103 мг (93% чистота, 99% теоретический выход).
LC-MS (Способ 8В): Rt=0.58 мин; MS (ESIneg): m/z=385 [М-Н-xHCl]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.836 (1.00), 1.868 (3.03), 1.900 (3.00), 1.933 (1.17), 2.185 (4.00), 2.217 (3.47), 3.058 (1.10), 3.086 (3.27), 3.116 (3.53), 3.142 (1.40), 3.384 (5.00), 3.422 (12.17), 3.431 (13.40), 3.445 (10.30), 3.566 (3.17), 3.728 (12.70), 3.741 (16.00), 3.752 (10.63), 6.045 (0.80), 7.485 (2.00), 8.058 (0.87), 8.665 (1.17), 8.859(1.80).
Пример 377
3-(2,2-диметилбутаноил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

Смесь трет-бутил 4-[3-(2,2-диметилбутанимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (26.0 мг, 62.6 мкмоль), соляной кислоты (1Н раствор в воде, 130 мкл) и ацетонитрила (520 мкл) перемешивали всю ночь при 40°С. Реакционную смесь очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Объединенные фракции продукта концентрировали, разбавили соляной кислотой (1Н раствор в воде, 1.0 мл) и лиофилизовали. Из-за присутствия хлорида аммония вещество разбавили в воде, довели до рН=7 с помощью насыщенного раствора гидрокарбоната натрия в воде, и снова очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Объединенные фракции продукта выпарили, растворили в соляной кислоте (4Н раствор в 1,4-диоксане, 50 мкл) и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 15.0 мг (100% чистота, 68% теоретический выход).
LC-MS (Способ 1B): Rt=0.57 мин; MS (ESIpos): m/z=317 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 11.02 (bs, 1H), 8.88 (bs, 1H), 8.67 (bs, 1H), 8.58 (s, 1H), 6.05 (s, 1H), 3.51 (t, 1H), 3.39 (d, 2H), 3.09 (t, 2H), 2.17 (d, 2H), 1.93-1.83 (m, 2H), 1.79 (q, 2H), 1.23 (s, 6H), 0.75 (t, 3H).
Пример 378
3-(5-Изобутил-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
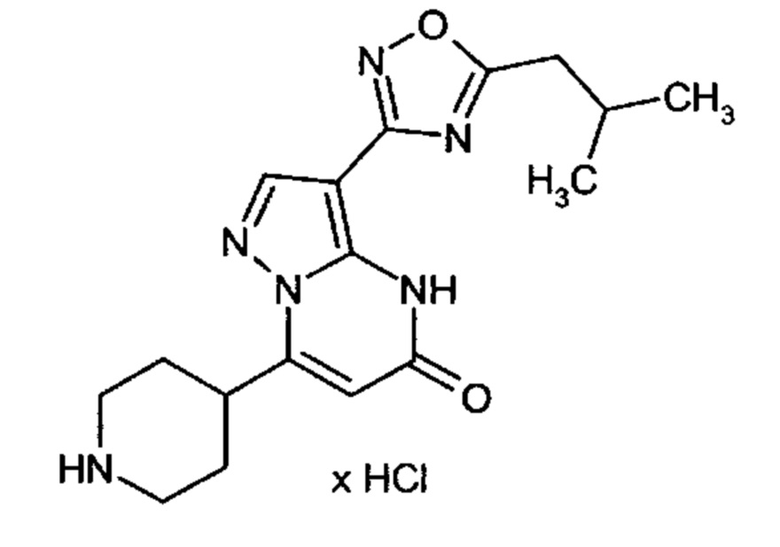
65 мг (0.15 ммоль) трет-бутил 4-[3-(5-изобутил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата обработали с помощью 3 мл (12.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 4 дней при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали воздухом с получением 45 мг (0.12 ммоль; 81% теоретический выход, чистота: 98%) целевого соединения.
LC-MS (Способ 14В): Rt=2.24 мин; m/z=343 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=8.35 (s, 1Н), 6.08 (s, 1H), 3.68-3.50 (m, 1H), 3.41 (d, J=12.1 Гц, 2H), 3.10 (t, J=12.3 Гц, 2H), 2.89 (d, J=6.9 Гц, 2H), 2.29 -2.10 (m, 3H), 1.89 (d, J=11.7 Гц, 2H),0.99 (d, J=6.4 Гц, 6H).
Пример 379
3-(5-Гексил-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
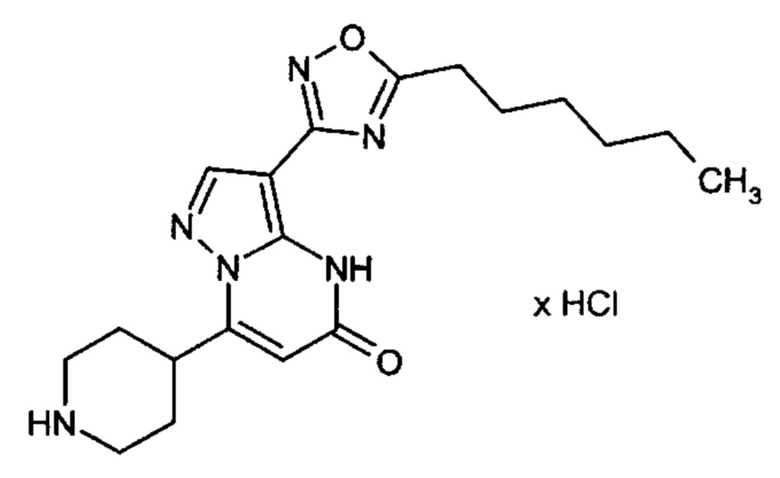
166 мг (0.35 ммоль) трет-бутил 4-[3-(5-гексил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата обработали с помощью 8 мл (32.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 4 дней при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали воздухом с получением 93 мг (0.23 ммоль; 65% теоретический выход, чистота: 100%) целевого соединения.
LC-MS (Способ 14В): Rt=2.60 мин; m/z=371 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.32 (s, 2Н), 8.32 (s, 1H), 6.06 (s, 1H), 3.55 (t, J=11.4 Гц, 1H), 3.38 (d, J=12.5 Гц, 2H), 3.09 (d, J=12.9 Гц, 2H), 2.96 (t, J=7.5 Гц, 2H), 2.19 (d, J=12.5 Гц, 2H), 1.99-1.58 (m, 4H), 1.42-1.20 (m, 6H), 0.86 (t, 3H).
Пример 380
3-(5-Циклопропил-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
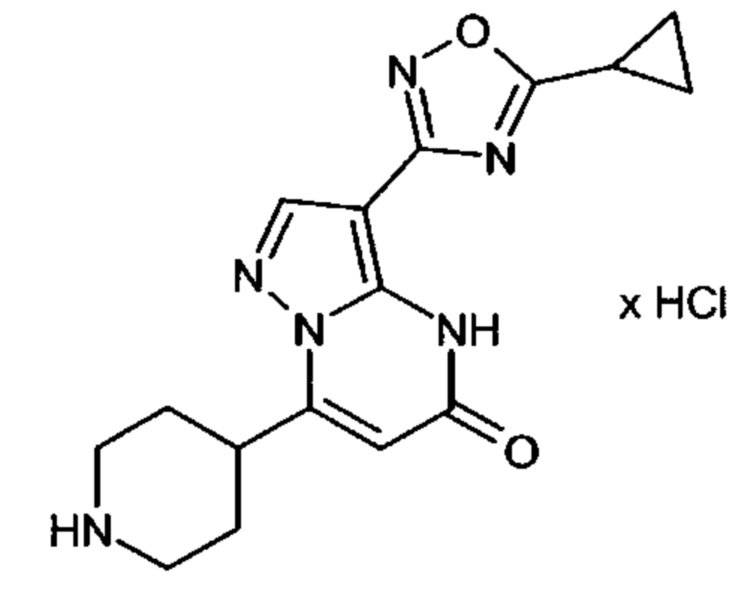
122 мг (0.29 ммоль) трет-бутил 4-[3-(5-циклопропил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата обработали с помощью 6 мл (24.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали в вакуумной печи при 40°С в течение 16 часов с получением 95 мг (0.26 ммоль; 92% теоретический выход, чистота: 98%) целевого соединения.
LC-MS (Способ 14В): Rt=1.92 мин; m/z=327 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.26 (br. s, 2H), 8.30 (s, 1H), 6.05 (s, 1H), 3.57 (t, J=11.8 Гц, 1H), 3.39 (d, J=12.6 Гц, 2H), 3.09 (t, J=12.0 Гц, 2H), 2.45-2.32 (m, 1H), 2.20 (d, J=13.7 Гц, 2H), 2.03-1.81 (m, 2H), 1.36-1.18 (m, 4H).
Пример 381
Rac-3-[5-(1-Метилциклопропил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
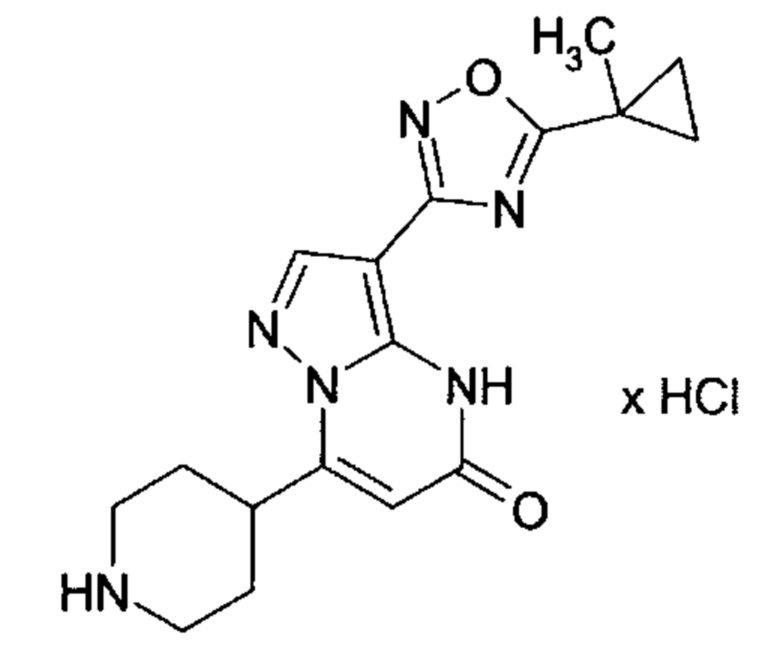
90 мг (0.20 ммоль) rac-трет-бутил 4-{3-[5-(1-метилциклопропил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата обработали с помощью 5 мл (20.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали в вакуумной печи при 40°С в течение 16 часов с получением 60 мг (0.16 ммоль; 78% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 14В): Rt=2.15 мин; m/z=341 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.59 (br. s, 2H), 8.30 (s, 1H), 6.04 (s, 1H), 3.57 (t, J=11.9 Гц, 1H), 3.39 (d, J=13.1 Гц, 2H), 3.09 (t, J=11.7 Гц, 2H), 2.20 (d, J=12.6 Гц, 2H), 2.03-1.79 (m, 2H), 1.56 (s, 3H), 1.52-1.33 (m, 2H), 1.27-0.99 (m, 2H).
Пример 382
Rel-3-{5-[(1R,2S)-2-метилциклопропил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
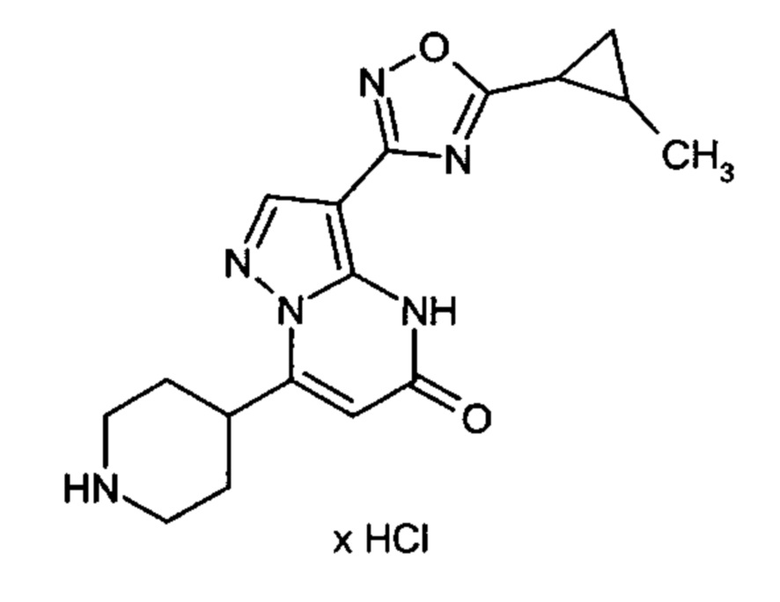
84 мг (0.19 ммоль) трет-бутил rel-4-(3-{5-[(1R,2S)-2-метилциклопропил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата обработали с помощью 5 мл (20.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали в вакуумной печи при 40°С в течение 16 часов с получением 56 мг (0.15 ммоль; 78% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 14В): Rt=2.15 мин; m/z=341 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.37 (br. s, 2H), 8.60-8.07 (m, 1H), 6.04 (s, 1H), 3.65-3.49 (m, 1H), 3.39 (d, J=12.6 Гц, 2H), 3.09 (t, J=12.0 Гц, 2H), 2.29-2.07 (m, 3H), 2.06-1.79 (m, 2H), 1.78-1.58 (m, 1H), 1.51-1.35 (m, 1H), 1.21 (d, J=6.0 Гц, 3H), 1.17-1.08 (m, 1H).
Пример 383
3-[5-(2-Метилпроп-1-ен-1-ил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
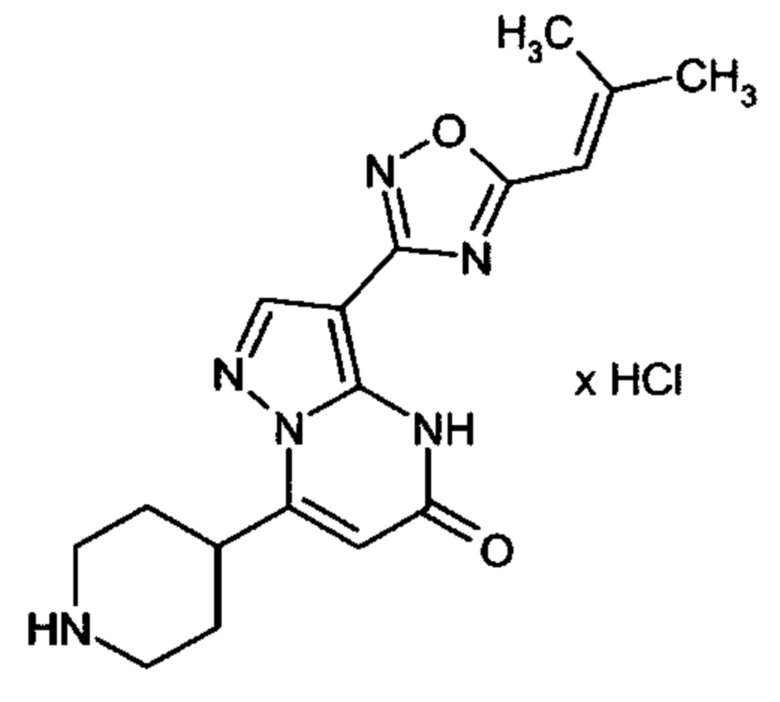
19 мг (0.04 ммоль) трет-бутил 4-{3-[5-(2-метилпроп-1-ен-1-ил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата обработали с помощью 1 мл (4.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали в вакуумной печи при 40°С в течение 16 часов с получением 12 мг (0.03 ммоль; 74% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 14В): Rt=2.24 мин; m/z=341 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.56 (br. s, 2H), 8.34 (s, 1H), 6.44 (s, 1H), 6.07 (s, 1H), 3.75-3.51 (m, 1H), 3.40 (d, J=12.2 Гц, 2H), 3.10 (t, J=11.9 Гц, 2H), 2.32 (s, 3H), 2.21 (d, J=12.8 Гц, 2H), 2.07 (s, 3H), 2.04-1.76 (m, 2H).
Пример 384
3-[5-(Циклопентилиденметил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
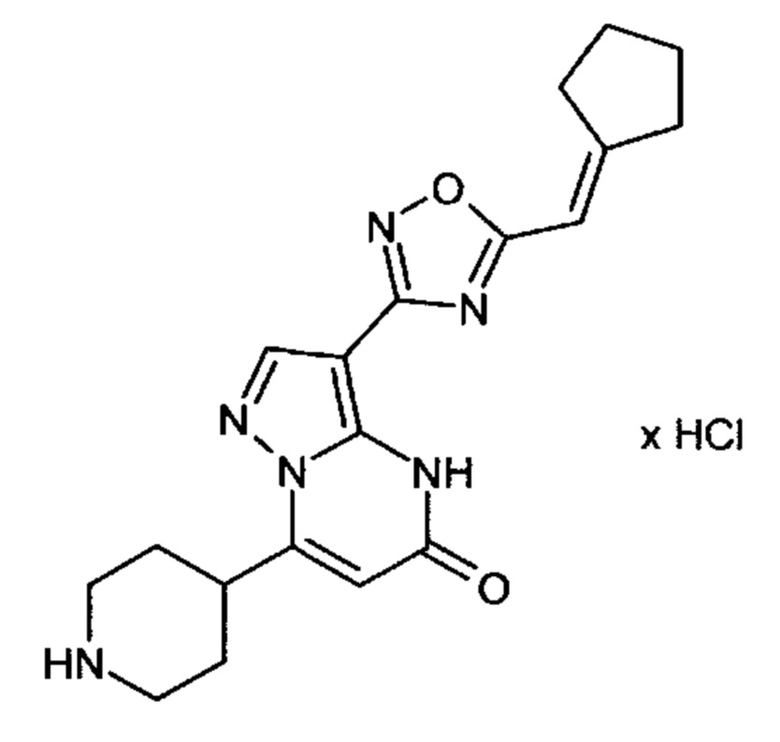
73 мг (0.16 ммоль) трет-бутил 4-{3-[5-(циклопентилиденметил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата обработали с помощью 5 мл (20.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, добавили измельченный дихлорметан (4 мл) и горячий метанол (3 мл), отфильтровали, промыли простым диэтиловым эфиром и высушивали воздухом с получением 43 мг (0.11 ммоль; 68% теоретический выход, чистота: 96%) целевого соединения.
LC-MS (Способ 14В): Rt=2.40 мин; m/z=367 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.48 (br. s, 2H), 8.35 (s, 1H), 6.08 (s, 1H), 5.60 (s, 1H), 3.86 (s, 2H), 3.71-3.49 (m, 1H), 3.40 (d, J=12.2 Гц, 2H), 3.10 (t, J=11.9 Гц, 2H), 2.32 (t, J=7.4 Гц, 4H), 2.21 (d, J=14.3 Гц, 2H), 2.04-1.76 (m, 4H).
Пример 385
3-(5-Циклопентил-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
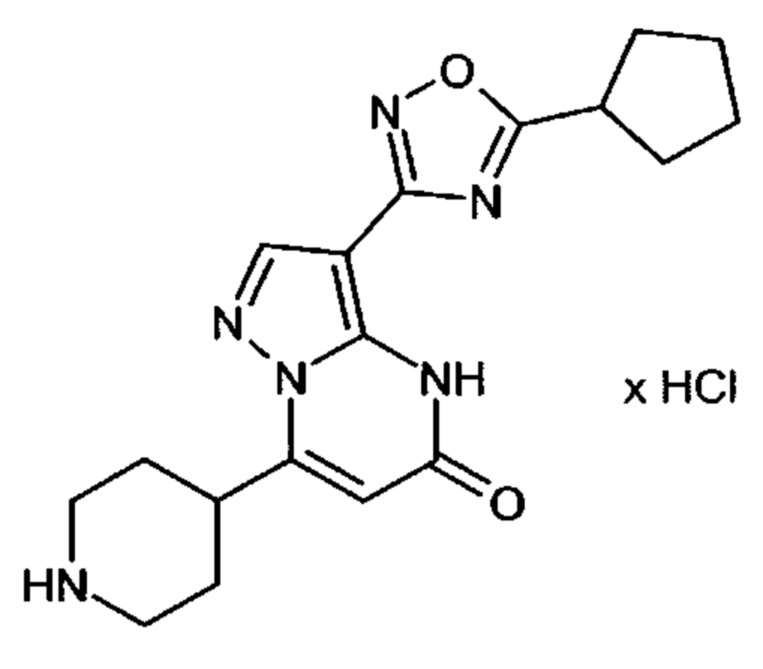
147 мг (0.32 ммоль) трет-бутил 4-[3-(5-циклопентил-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата обработали с помощью 6 мл (24.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали в вакуумной печи при 40°С в течение 16 часов с получением 109 мг (0.28 ммоль; 86% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 14В): Rt=2.40 мин; m/z=355 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.48 (br. s, 2H), 8.33 (s, 1H), 6.07 (s, 1H), 3.65-3.37 (m, 4H), 3.09 (t, J=11.8 Гц, 2H), 2.29-2.04 (m, 4H), 2.02-1.83 (m, 4H), 1.83-1.60 (m, 4H).
Пример 386
Rac-3-[5-(1-Метилциклопентил)-1,2,4-оксадиазол-3-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
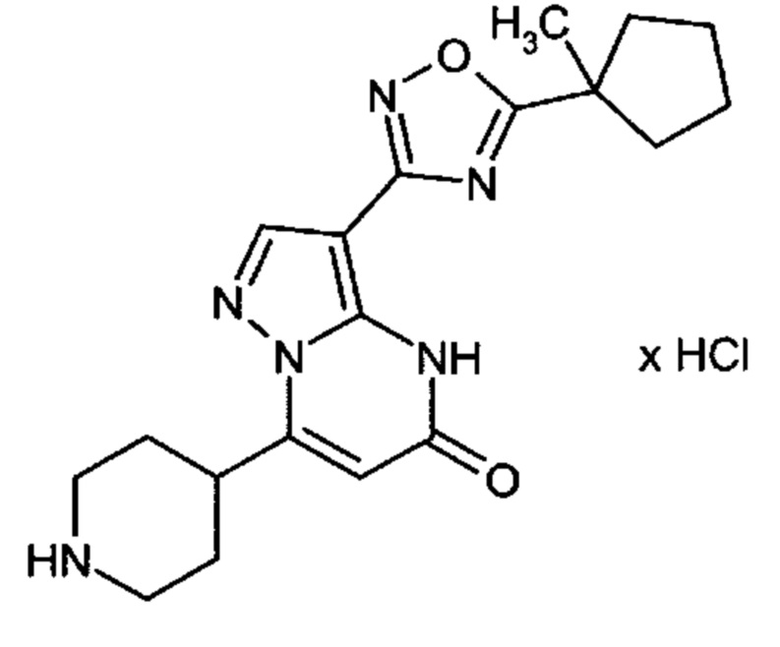
112 мг (0.24 ммоль) rac-трет-бутил 4-{3-[5-(1-метилциклопентил)-1,2,4-оксадиазол-3-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата обработали с помощью 5 мл (20.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали в вакуумной печи при 40°С в течение 16 часов. Твердые вещества суспендировали в ацетонитриле (3 мл), и воду (5 мл) добавили, получили чистый раствор, который лиофилизовали в течение 20 часов с получением 79 мг (0.20 ммоль; 82% теоретический выход, чистота: 100%) целевого соединения.
LC-MS (Способ 14В): Rt=2.43 мин; m/z=369 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.58 (s, 2Н), 8.33 (s, 1Н), 6.06 (s, 1H), 3.64-3.50 (m, 1H), 3.40 (d, J=12.5 Гц, 2H), 3.19-3.01 (m, 2H), 2.35-2.12 (m, 4H), 2.00-1.83 (m, 2H), 1.83-1.70 (m, 6H), 1.47 (s, 3H).
Пример 387
Rel-3-{5-[(1R,2S)-2-метилциклопентил]-1,2,4-оксадиазол-3-ил}-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
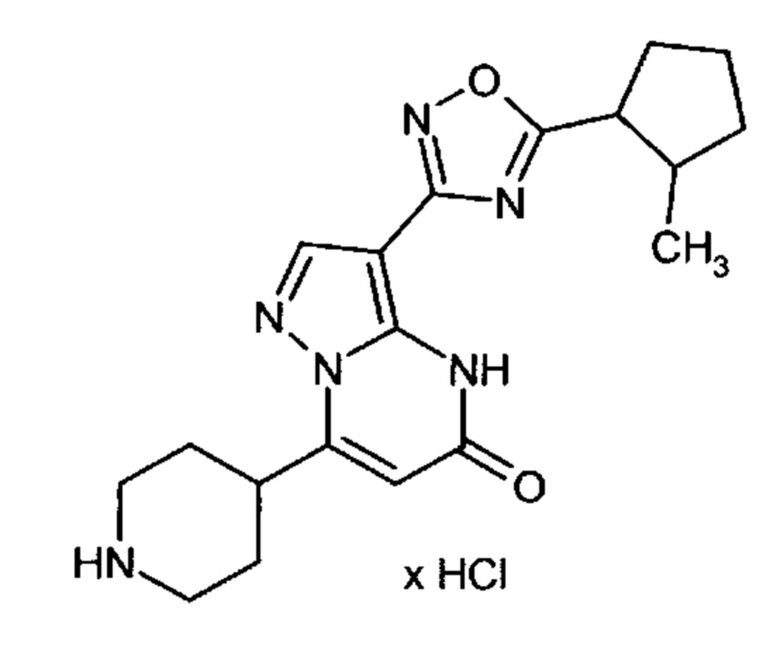
171 мг (0.37 ммоль) трет-бутил rel-4-(3-{5-[(1R,2S)-2-метилциклопентил]-1,2,4-оксадиазол-3-ил}-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата обработали с помощью 8 мл (32.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали в вакуумной печи при 40°С в течение 16 часов с получением 133 мг (0.33 ммоль; 90% теоретический выход, чистота: 99%) целевого соединения.
LC-MS (Способ 14В): Rt=2.45 мин; m/z=369 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.58 (br. s, 2H), 8.34 (s, 1H), 6.07 (s, 1H), 3.69-3.50 (m, 1H), 3.40 (d, J=12.3 Гц, 2H), 3.17-2.94 (m, 3H), 2.39-2.10 (m, 4H), 2.08-1.84 (m, 4H), 1.83-1.69 (m, 2H), 1.45-1.22 (m, 1H), 1.09 (d, J=6.6 Гц, 3H).
Пример 388
7-(Пиперидин-4-ил)-3-[5-(2,2,2-трифторэтил)-1,2,4-оксадиазол-3-ил]пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
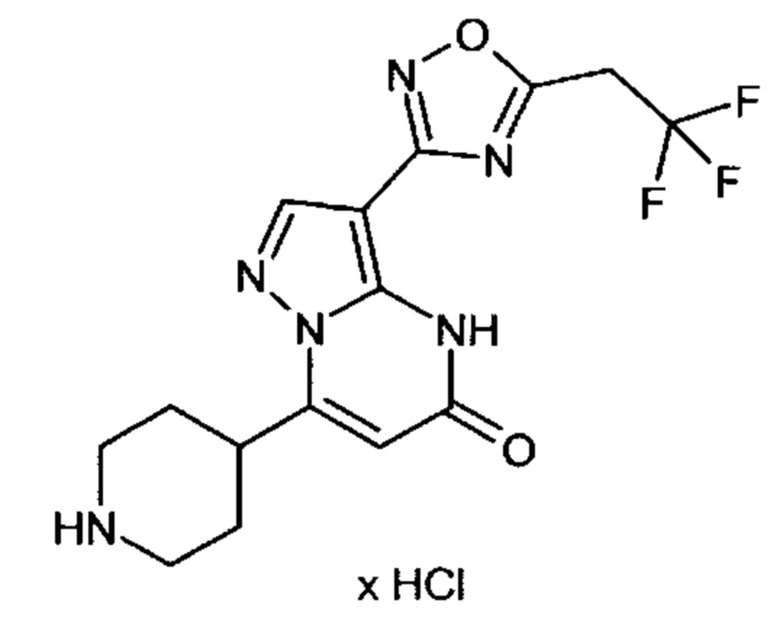
120 мг (0.26 ммоль) трет-бутил 4-{5-оксо-3-[5-(2,2,2-трифторэтил)-1,2,4-оксадиазол-3-ил]-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилата обработали с помощью 5 мл (20.0 ммоль) 4 М хлороводорода в 1,4-диоксане. Реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Твердые вещества отфильтровали, промыли простым диэтиловым эфиром и высушивали в вакуумной печи при 40°С в течение 16 часов с получением 91 мг (0.23 ммоль; 88% теоретический выход, чистота: 100%) целевого соединения.
LC-MS (Способ 14В): Rt=1.99 мин; m/z=369 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6): δ [ppm]=9.01 (br. s, 2H), 8.39 (s, 1H), 6.14 (s, 1H), 4.52 (q, J=10.7 Гц, 2H), 3.72-3.52 (m, 1H), 3.40 (d, J=12.4 Гц, 2H), 3.10 (t, J=11.8 Гц, 2H), 2.22 (d, J=13.0 Гц, 2H), 2.05-1.80 (m, 2H).
Пример 389
Rac-7-(пиперидин-4-ил)-3-(5-(тетрагидрофуран-2-ил)-1,2,4-оксадиазол-3-ип)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
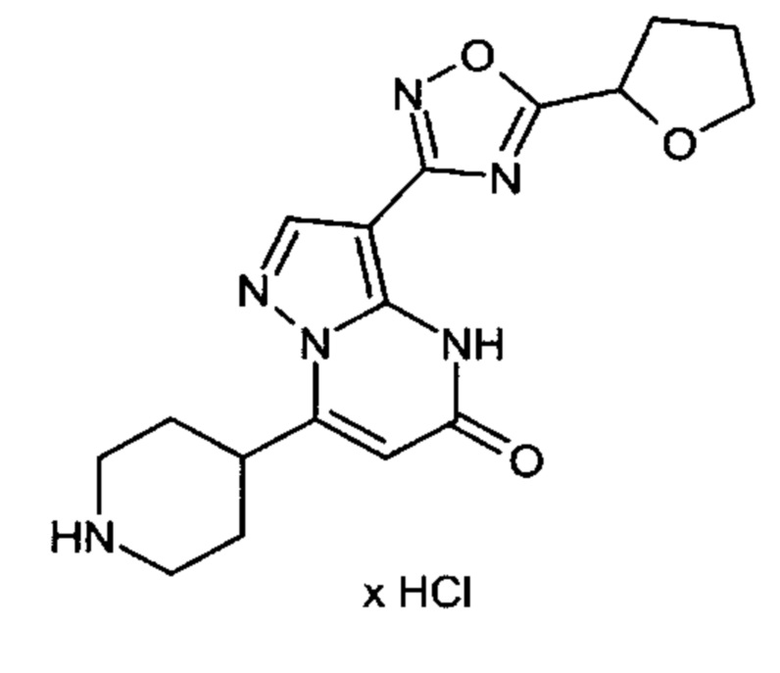
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 169 мг (0.370 ммоль) rac-трет-бутил 4-(5-оксо-3-(5-(тетрагидрофуран-2-ил)-1,2,4-оксадиазол-3-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата и 4625 мкл (18.50 ммоль) соляной кислоты (4.0 М в диоксан). Сосуд закрыли, и полученную суспензию перемешивали при комнатной температуре в течение 3 часов. Осадок собрали на стеклянном фильтре (Пора 3) и высушивали в течение 18 часов в вакуумной печи (40°С / 20 мбар). 101 мг (0.247 ммоль, 66% теоретический выход, чистота: 96%) соединения, указанного в названии, выделили в виде порошка светло-желтого цвета.
LC-MS (Способ 16В): Rt=2.15 мин; m/z=357 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=9.19 (br. s, 2H), 8.35 (s, 1H), 6.08 (s, 1H), 5.28 (dd, J=7.9, 5.3 Гц, 1H), 4.06-3.81 (m, 2H), 3.65-3.52 (m, 2H), 3.44-3.28 (m, 2H), 3.16-3.00 (m, 2H), 2.46-2.14 (m, 4H), 2.13-1.85 (m, 4H).
Пример 390
7-(пиперидин-4-ил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
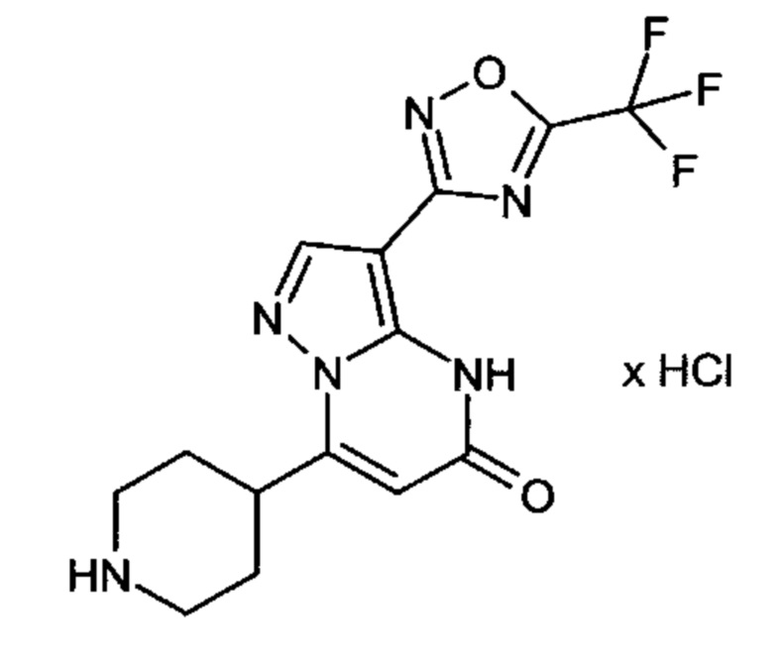
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 135 мг (0.3 ммоль) 7-(1-(2,2,2-трифторацетил)пиперидин-4-ил)-3-(5-(трифторметил)-1,2,4-оксадиазол-3-ил)пиразоло[1,5-а]пиримидин-5(4Н)-она и 7500 мкл (30.0 ммоль) соляной кислоты (4.0 М в диоксан). Сосуд закрыли, и бесцветный раствор перемешивали при 80°С в течение 19 часов. При охлаждении до комнатной температуры осуществили кристаллизацию/осаждение. Реакционную смесь разбавили с помощью 30 мл простого диэтилового эфира и перемешивали в течение 30 минут. Осадок собрали на стеклянном фильтре (пора 3) и высушивали в течение 3 часов в вакуумной печи (40°С / 20 мбар). 114 мг (0.292 ммоль, 97% теоретический выход, чистота: 100%) соединения, указанного в названии, получили в виде свободно-текучего порошка белого цвета.
LC-MS (Способ 16В): Rt=2.41 мин; m/z=355 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=12.30 (br. s, 1H), 9.17 (br. s, 2H), 8.50 (s, 1H), 6.23 (s, 1H), 3.62 (t, J=11.9 Гц, 1H), 3.40 (d, J=12.5 Гц, 2H), 3.10 (t, J=12.0 Гц, 2H), 2.22 (d, J=13.1 Гц, 2H), 1.96 (qd, J=13.2, 3.6 Гц, 2H).
Пример 391
7-(пиперидин-4-ил)-3-(5-(1,1,1-трифтор-2-метилпропан-2-ил)-1,2,4-оксадиазол-3-ип)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
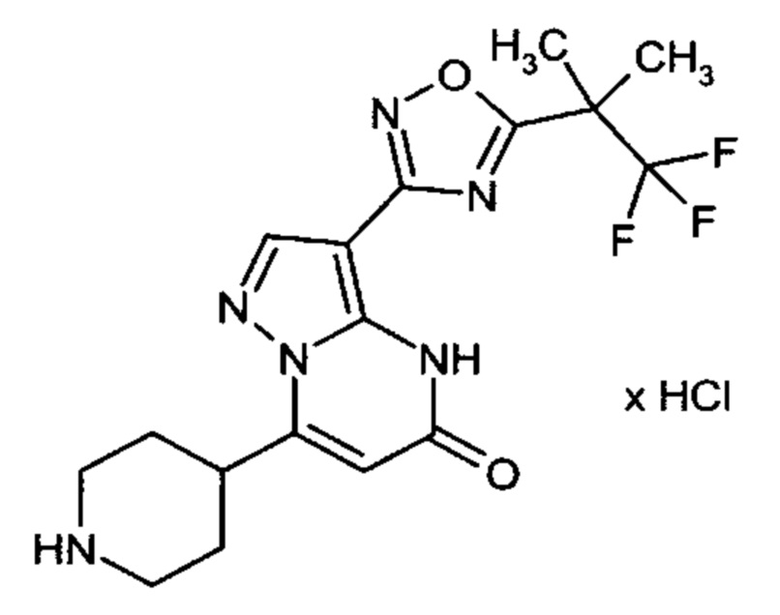
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 199 мг (0.400 ммоль) трет-бутил 4-(5-оксо-3-(5-(1,1,1-трифтор-2-метилпропан-2-ил)-1,2,4-оксадиазол-3-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата и 5 мл (20.00 ммоль) соляной кислоты (4.0 М в диоксан). Сосуд закрыли, и полученную суспензию перемешивали при температуре окружающей среды в течение 2.5 часов. 4 мл Диэтилового простого эфира добавили в реакционную смесь, которую затем перемешивали в течение еще 2 часов. Осадок собрали на стеклянном фильтре (пора 31), промыли два раза с помощью 5 мл простого диэтилового эфира и высушивали в вакуумной печи в течение 48 часов (40°С / 15 мбар). 171 мг (0.395 ммоль; 99% теоретический выход, чистота: 100%) соединения, указанного в названии, получили в виде порошка белого цвета.
LC-MS (Способ 16В): Rt=2.66 мин; m/z=397 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=9.48-9.12 (m, 2Н), 8.37 (s, 1H), 6.09 (s, 1H), 3.65-3.57 (m, 1H), 3.38 (d, J=12.3 Гц, 2H), 3.08 (q, J=12.4 Гц, 2H), 2.20 (d, J=12.6 Гц, 2H), 2.05-1.88 (m, 2H), 1.72 (s, 6H).
Пример 392
3-(5-(3,3-дифторциклобутил)-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиргтидин-5(4Н)-он гидрохлорид
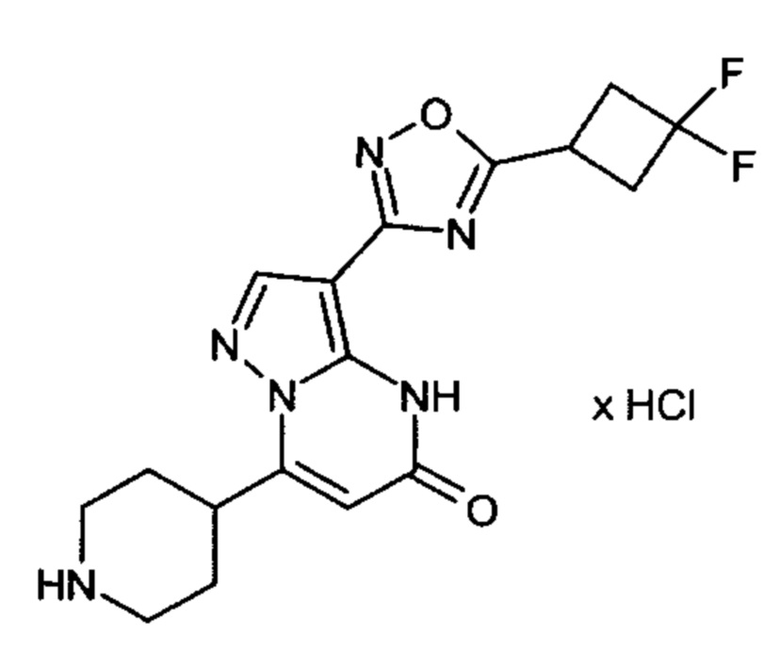
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 233 мг (0.490 ммоль) трет-бутил 4-(3-(5-(3,3-дифторциклобутил)-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата и 6125 мкл (24.50 ммоль) соляной кислоты (40М в диоксан). Сосуд закрыли, и полученную суспензию перемешивали при комнатной температуре в течение 2.5 часов. 4 мл простого диэтилового эфира добавили, и перемешивание продолжали в течение 2 часов. Осадок затем собрали на стеклянном фильтре (пора 31), промыли два раза с помощью 5 мл простого диэтилового эфира и высушивали в вакуумной печи в течение 48 часов (40°С /15 мбар). 166 мг (0.398 ммоль; 81% теоретический выход, чистота: 99%) соединения, указанного в названии, выделили в виде порошка белого цвета.
LC-MS (Способ 16В): Rt=2.39 мин; m/z=377 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=11.42 (br. s, 1H), 9.19 (br. s, 2H), 8.35 (s, 1H), 6.06 (s, 1H), 3.85 (pd, J=8.3, 2.3 Гц, 1H), 3.56 (s, 1H), 3.39 (d, J=12.8 Гц, 2H), 3.25-3.00 (m, 6H), 2.20 (d, J=13.2 Гц, 2H), 1.94 (qd, J=13.2, 3.6 Гц, 2H).
Пример 393
3-(5-(4,4-дифторциклогексил)-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 247 мг (0.490 ммоль) трет-бутил 4-(3-(5-(4,4-дифторциклогексил)-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата и 6125 мкл (24.50 ммоль) соляной кислоты (4.0 М в диоксан). Сосуд закрыли, и полученную суспензию перемешивали при температуре окружающей среды в течение 2.5 часов. 4 мл простого диэтилового эфира добавили в реакционную смесь, и перемешивание продолжали в течение 2 часов. Осадок собрали на стеклянном фильтре (пора 3), промыли два раза с помощью 5 мл простого диэтилового эфира и высушивали в вакуумной печи в течение 48 часов (40°С /15 мбар). 187 мг (0.416 ммоль, 85% теоретический выход, чистота: 98%) соединения, указанного в названии, выделили в виде порошка белого цвета.
LC-MS (Способ 16В): Rt=2.61 мин; m/z=405 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm] 11.35 (br. s, 1H), 9.15 (br. s, 2H), 8.33 (s, 1H), 6.06 (s, 1H), 3.65-3.51 (m, 1H), 3.44-3.27 (m, 3H), 3.08 (t, J=11.7 Гц, 2H), 2.26-1.82 (m, 12H).
Пример 394
3-(5-(метоксиметил)-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиргшидин-5(4Н)-он гидрохлорид
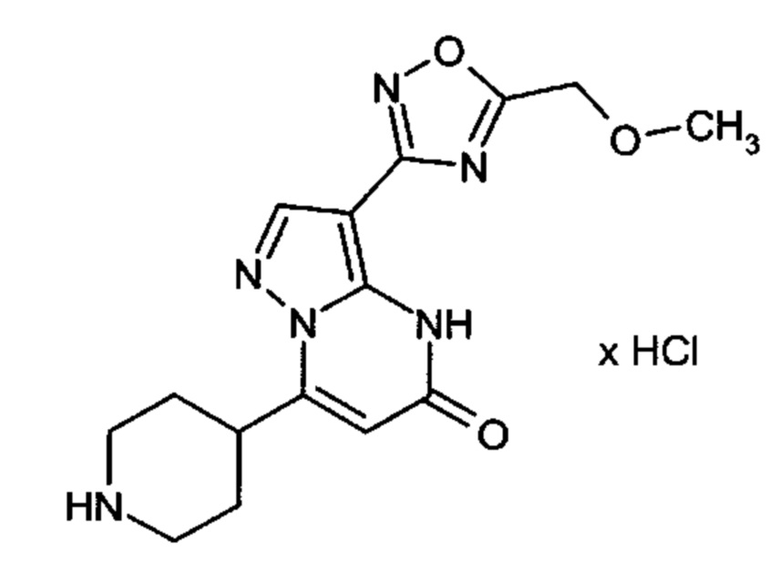
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили 99 мг (0.230 ммоль) трет-бутил 4-(3-(5-(метоксиметил)-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата и 2875 мкл (11.50 ммоль) соляной кислоты (4.0 М в диоксан). Сосуд закрыли, и полученную суспензию перемешивали при комнатной температуре в течение 2.5 часов. 4 мл простого диэтилового эфира добавили в реакционную смесь, и перемешивание продолжали в течение 2 часов. Осадок собрали на стеклянном фильтре (пора 31), промыли два раза с помощью 5 мл простого диэтилового эфира и высушивали в вакуумной печи в течение 48 часов (40°С /15 мбар). 85 мг (0.225 ммоль; 98% теоретический выход, чистота: 97%) соединения, указанного в названии, получили в виде порошка белого цвета.
LC-MS (Способ 16В): Rt=1.91 мин; m/z=331 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=9.29 (br. s, 3Н), 8.38 (s, 1H), 6.10 (s, 1H), 4.82 (s, 2H), 3.57 (d, J=7.1 Гц, 1H), 3.47-3.28 (m, 5H), 3.16-3.01 (m, 2H), 2.21 (d, J=13.3 Гц, 2H), 2.05-1.83 (m, 2H).
Пример 395
3-(5-(3-метоксипропил)-1,2,4-оксадиазол-3-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
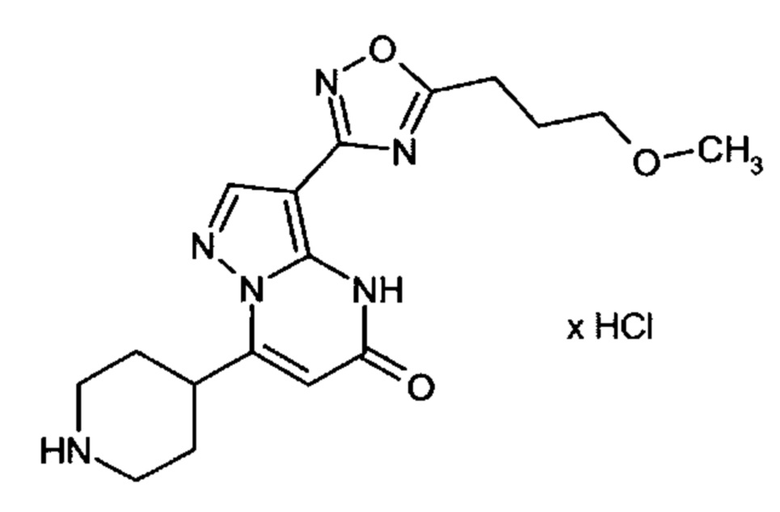
В сосуд с навинчивающейся крышкой, объемом 8 мл, оборудованный мешалкой, поместили трет-бутил 105 мг (0.230 ммоль) 4-(3-(5-(3-метоксипропил)-1,2,4-оксадиазол-3-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилата и 2875 мкл (11.50 ммоль) соляной кислоты (4.0 М в диоксан). Сосуд закрыли, и полученную суспензию перемешивали при температуре окружающей среды в течение 2.5 часов. 4 мл простого диэтилового эфира добавили, и перемешивание продолжали в течение еще 2 часов. Осадок затем собрали на стеклянном фильтре (пора 3), промыли два раза с помощью 5 мл простого диэтилового эфира и высушивали в вакуумной печи в течение 48 часов (40°С / 15 мбар). 88 мг (0.221 ммоль; 96% теоретический выход, чистота: 99%) соединения, указанного в названии, получили в виде порошка белого цвета.
LC-MS (Способ 16В): Rt=2.17 мин; m/z=359 (М+1)+
1Н-ЯМР (300 МГц, DMSO-d6) δ [ppm]=9.30 (br. s, 3Н), 8.34 (s, 1H), 6.06 (s, 1H), 3.66-3.51 (m, 1H), 3.47-3.28 (m, 5H), 3.24 (s, 3H), 3.15-2.96 (m, 4H), 2.20 (d, J=12.8 Гц, 2H), 2.10-1.85 (m, 4H).
Пример 396
Этил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
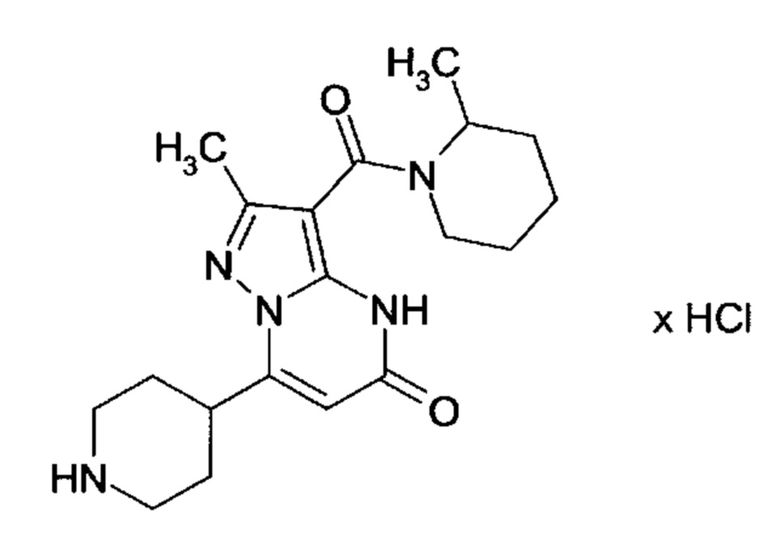
7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновую кислоту (37.6 мг, 0.1 ммоль) растворили в 0.4 мл DMF и добавили к 1 экв. 2-метилпиперидина (9.9 мг, 0.1 ммоль) на 96-луночном планшете, а затем раствор HATU (57.0 мг, 0.15 ммоль) в 0.4 мл DMF и 4-метилморфолин (46.0 мг, 0.46 ммоль). Планшет запаяли и встряхивали при 40°С всю ночь, и затем выпарили до сухости. Остаток обработали с помощью 0.6 мл TFA и встряхивали при комнатной температуре всю ночь. Смесь выпарили до сухости, и неочищенный продукт обработали с помощью 0.6 мл DMF, отфильтровали, и фильтрат очистили посредством LC-MS с помощью методики 5А.
Фракции, содержащие продукт, обработали 100 мкл aq. HCl (36%) и выпарили в вакууме на центрифужной сушке, растворили в 0.6 мл DMSO, затем объединили и выпарили снова с получением конечного продукта.
Полученное количество составило 6.9 мг (89% чистота, 16% теоретический выход).
Аналогичным образом были синтезированы Примеры, показанные в Таблице 4.
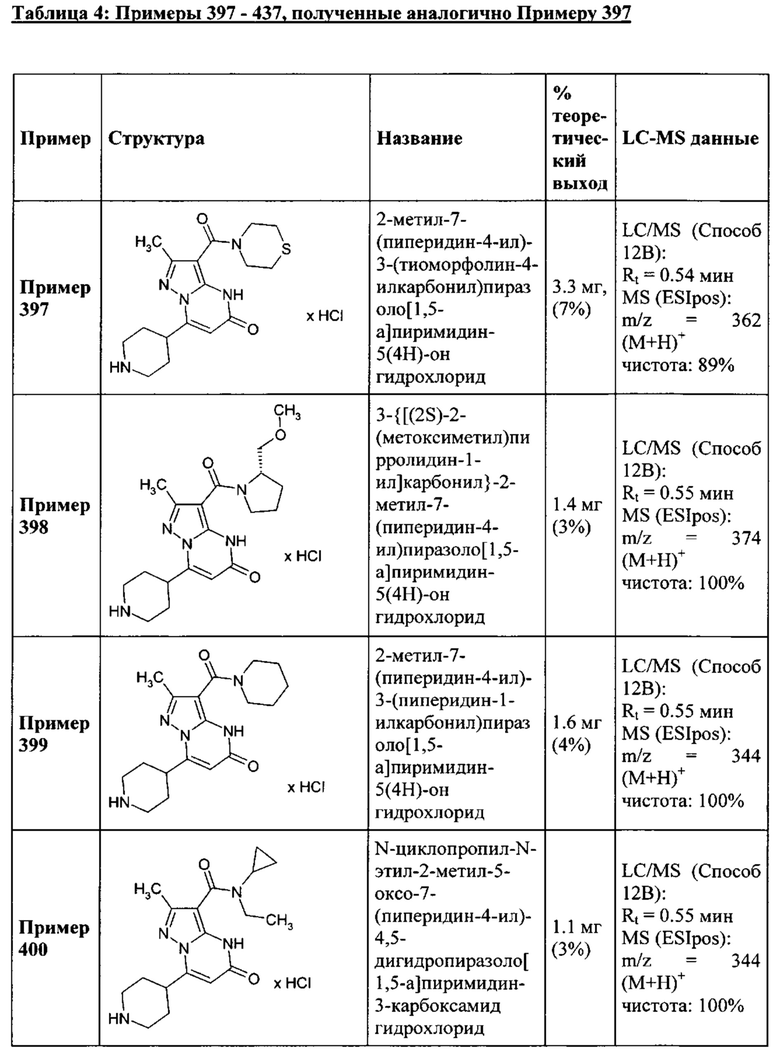
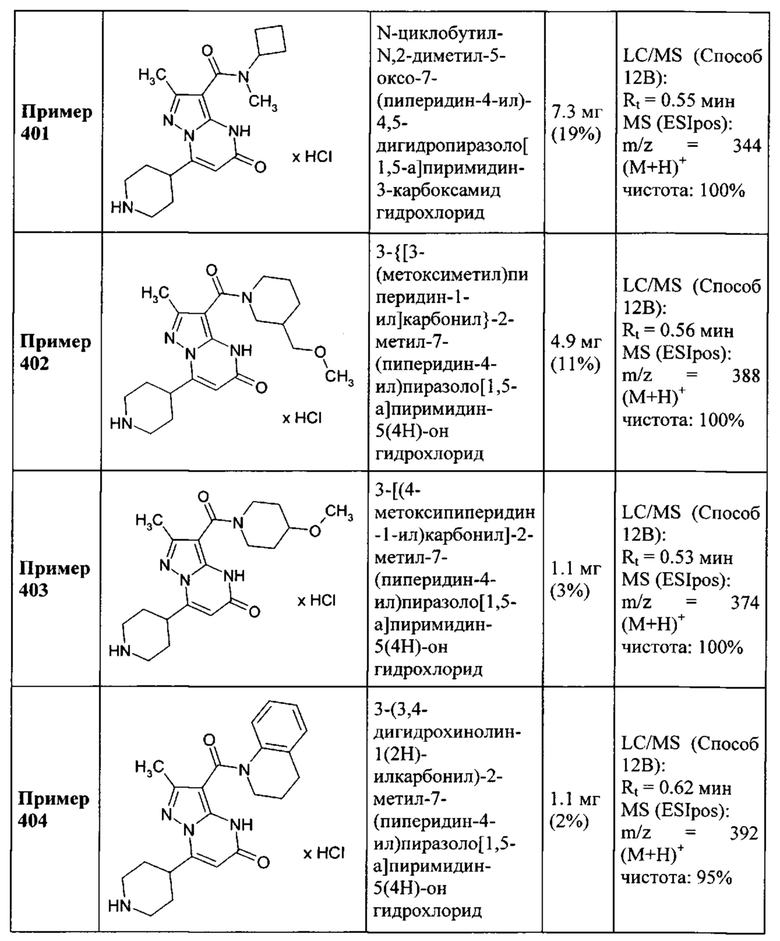
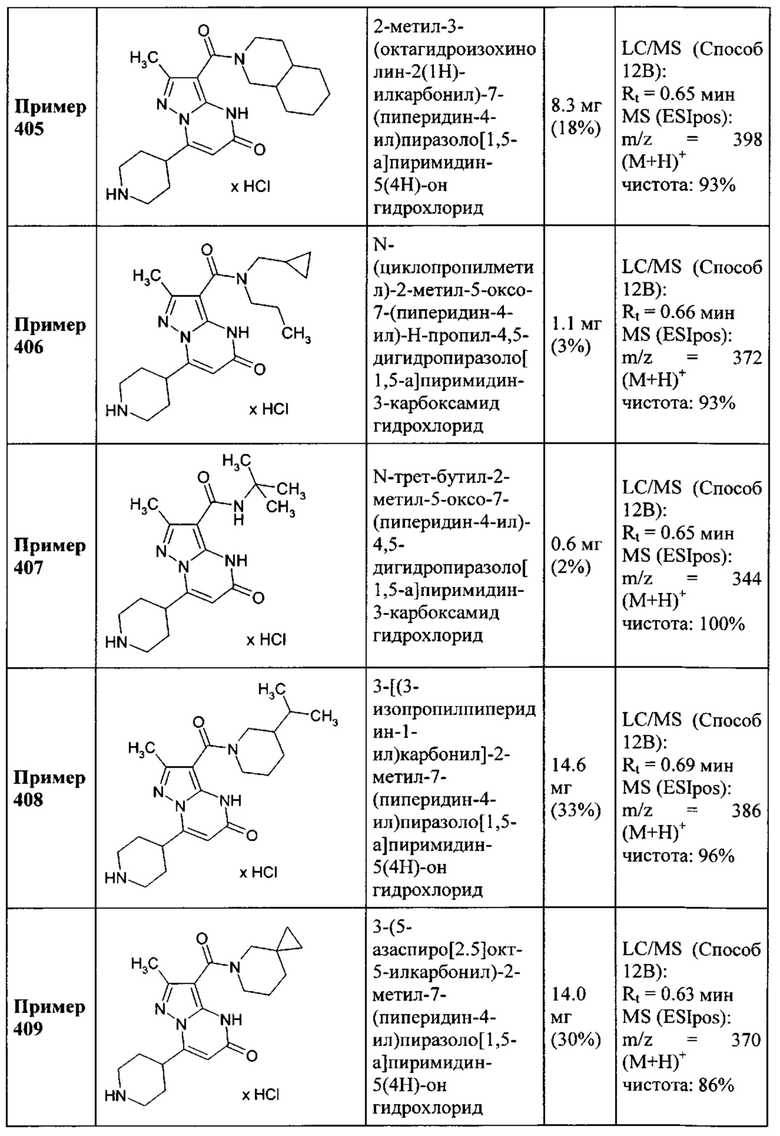

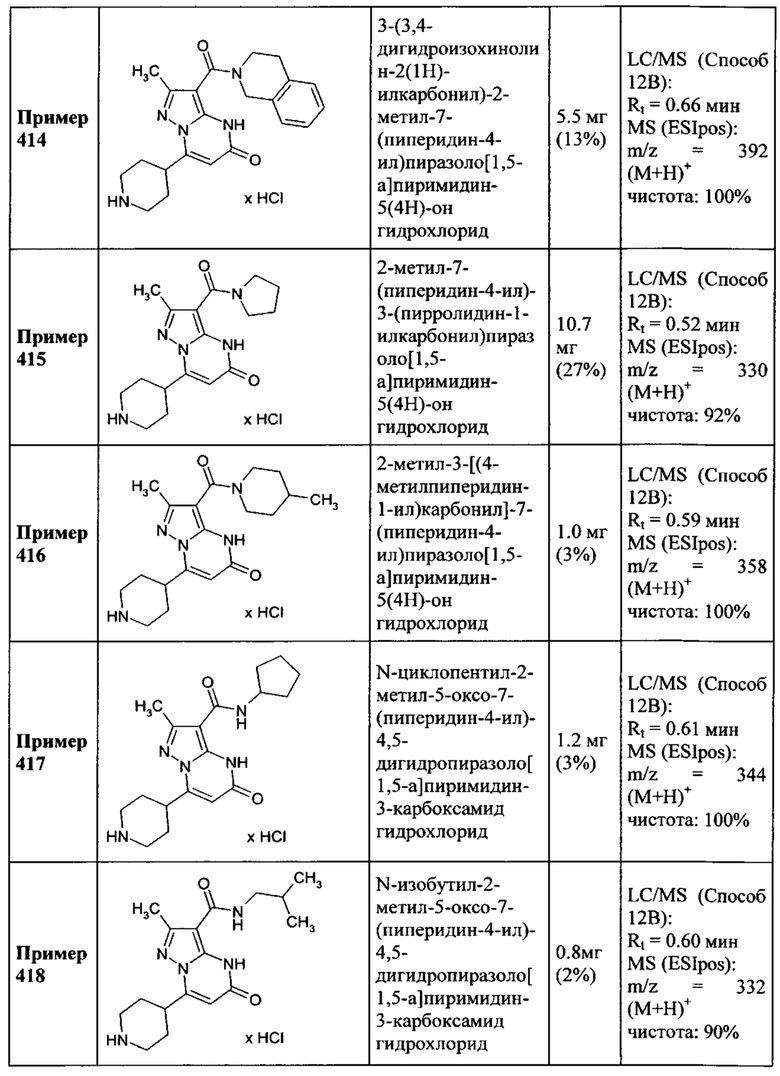
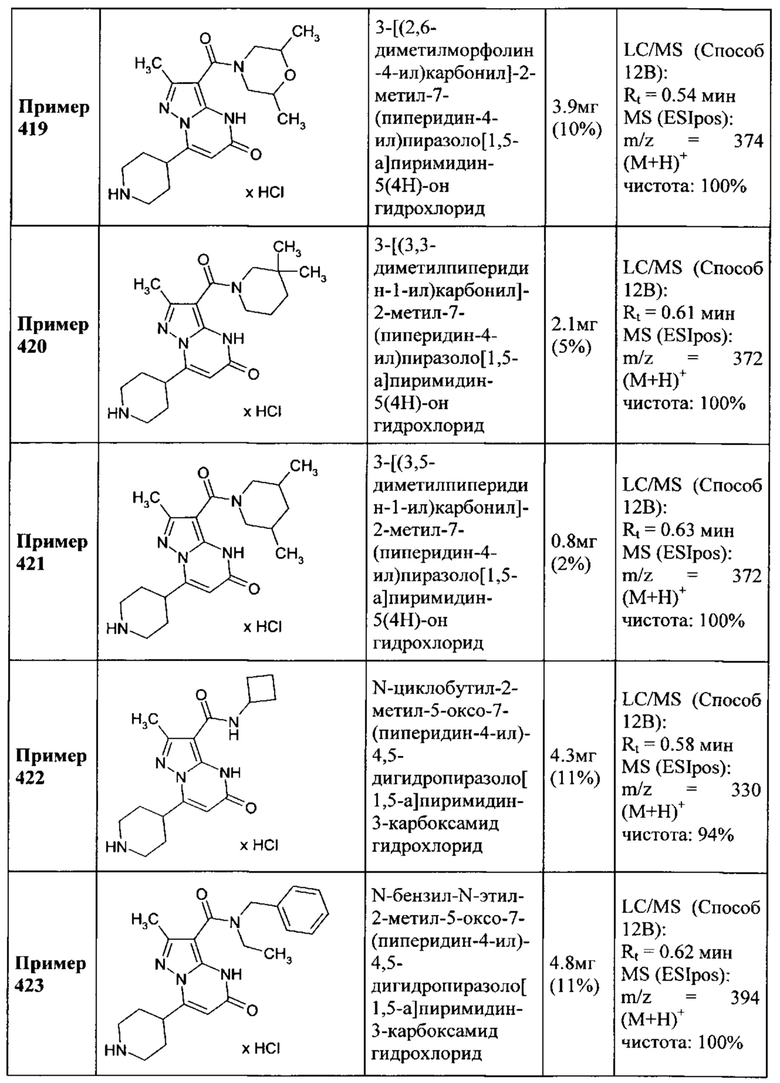
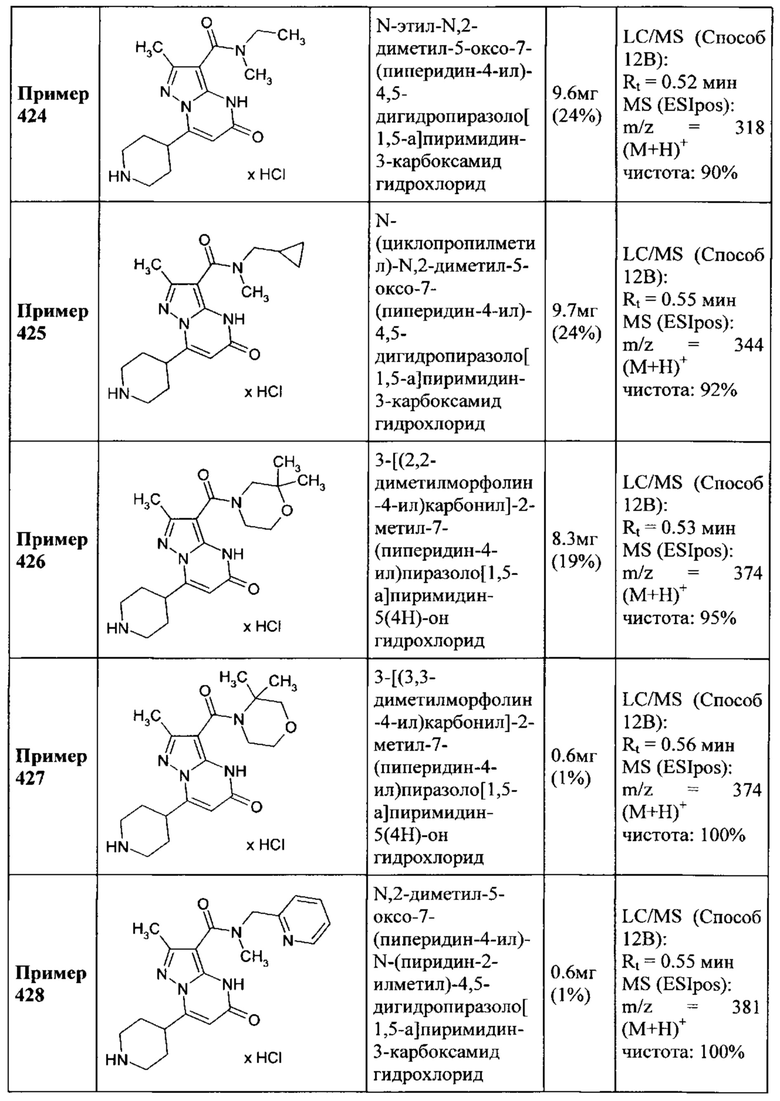
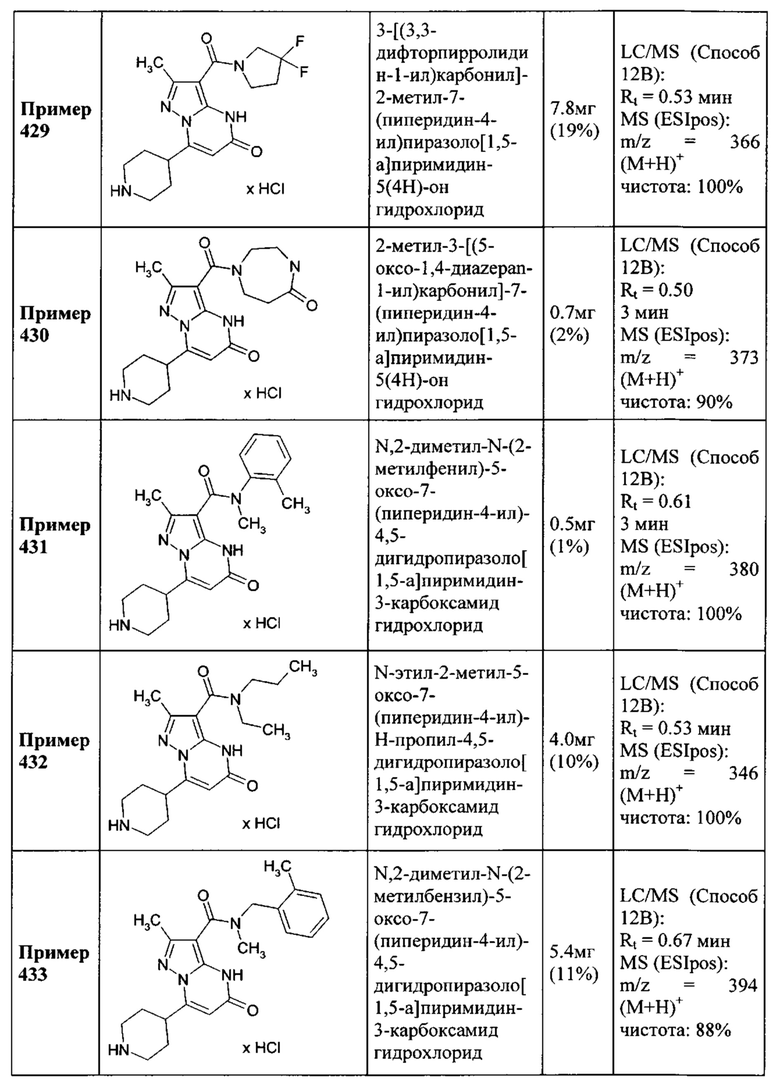
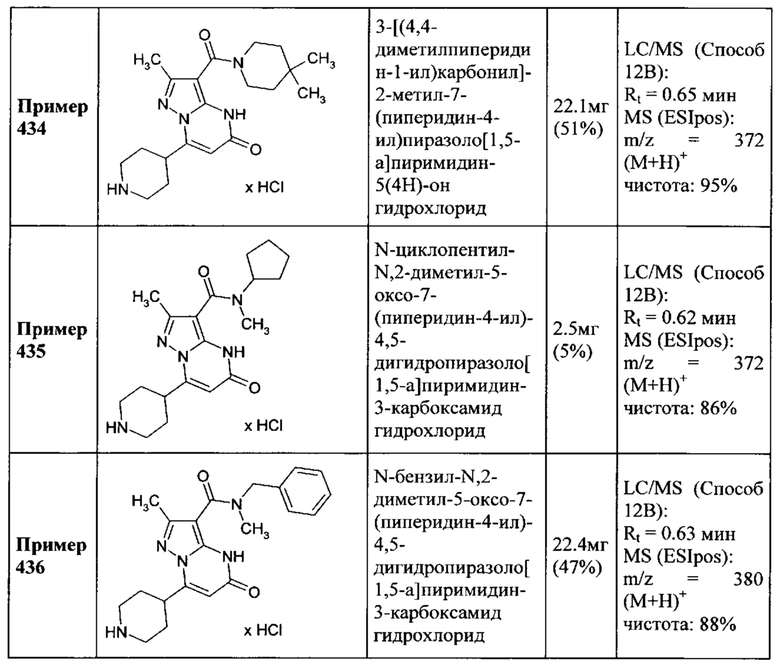
Пример 437
3-[3-(2-метоксифенил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
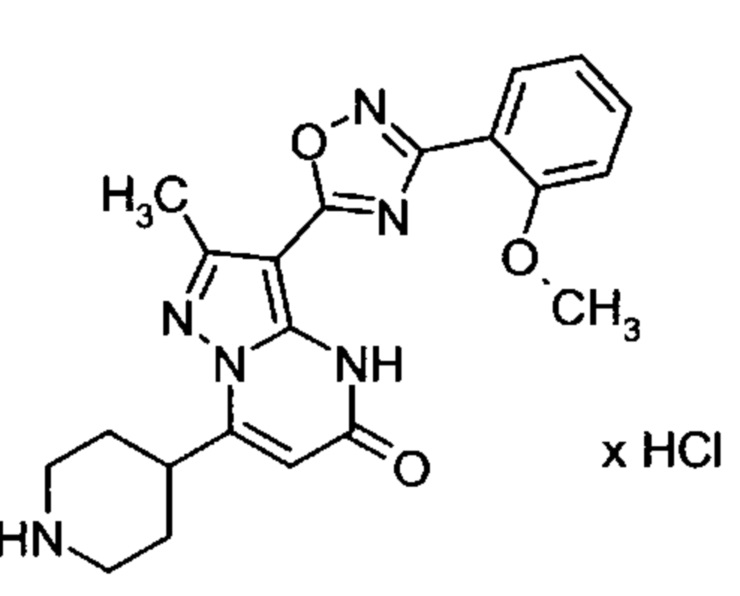
трет-бутил 4-{3-[3-(2-метоксифенил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (89.9 мг, 177 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (670 мкл, 4.0 М, 2.7 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 82.8 мг (100% чистота, 105% теоретический выход).
LC-MS (Способ IB): Rt=0.60 мин; MS (ESIpos): m/z=407 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.145 (0.13), 1.867 (0.31), 1.899 (0.94), 1.931 (1.03), 1.963 (0.42), 2.072 (0.18), 2.191 (1.50), 2.224 (1.19), 2.322 (0.08), 2.327 (0.11), 2.365 (0.20), 2.461 (0.12), 2.591 (0.10), 2.624 (10.69), 2.664 (0.10), 2.669 (0.12), 2.709 (0.18), 3.074 (0.37), 3.104 (1.00), 3.132 (1.05), 3.161 (0.43), 3.384 (1.52), 3.414 (1.16), 3.596 (0.75), 3.626 (0.38), 3.710 (0.14), 3.730 (0.15), 3.742 (0.15), 3.753 (0.13), 3.828 (0.15), 3.838 (0.15), 3.894 (16.00), 4.073 (1.04), 4.115 (1.06), 6.120 (0.94), 7.081 (0.06), 7.125 (1.01), 7.144 (2.07), 7.163 (1.14), 7.229 (1.88), 7.250 (2.14), 7.551 (0.78), 7.555 (0.81), 7.573 (1.36), 7.591 (0.65), 7.594 (0.65), 8.131 (0.72), 8.149 (0.70), 9.027 (0.34).
Пример 438
3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
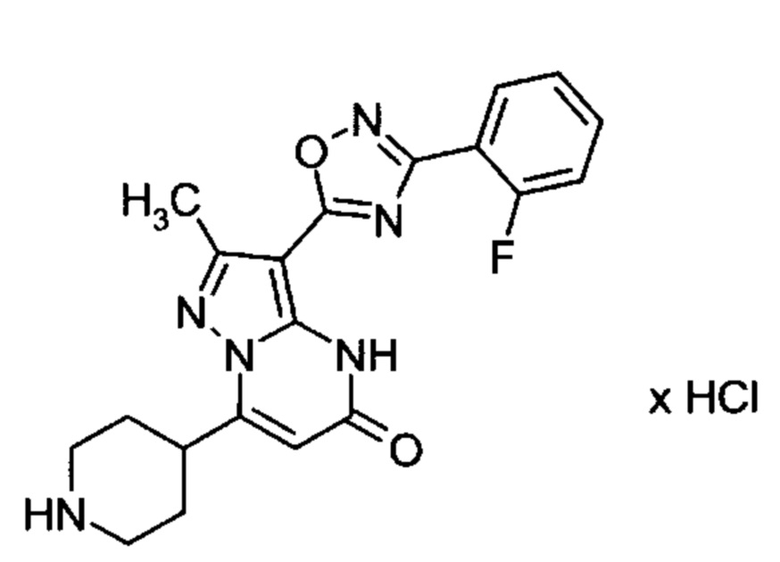
трет-бутил 4-{3-[3-(2-фторфенил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (88.5 мг, 179 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (670 мкл, 4.0 М, 2.7 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 70.3 мг (100% чистота, 91% теоретический выход).
LC-MS (Способ IB): Rt=0.61 мин; MS (ESIpos): m/z=395 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.153 (0.03), -0.012 (0.32), 0.142 (0.03), 1.145 (0.05), 1.193 (0.06), 1.227 (0.04), 1.352 (0.05), 1.423 (0.13), 1.871 (0.25), 1.880 (0.31), 1.905 (0.82), 1.912 (0.84), 1.936 (0.92), 1.944 (0.89), 1.968 (0.40), 1.977 (0.34), 2.072 (1.97), 2.192 (1.28), 2.225 (1.02), 2.326 (0.04), 2.366 (0.07), 2.475 (0.10), 2.638 (10.34), 2.709 (0.08), 2.798 (0.06), 3.109 (0.73), 3.133 (0.75), 3.386 (1.33), 3.417 (1.05), 3.472 (0.04), 3.490 (0.03), 3.565 (16.00), 3.598 (0.65), 3.628 (0.32), 3.664 (0.03), 3.679 (0.03), 3.730 (0.03), 6.144 (0.98), 7.429 (1.85), 7.449 (3.10), 7.469 (1.14), 7.476 (1.03), 7.642 (0.41), 7.647 (0.45), 7.655 (0.49), 7.661 (0.75), 7.667 (0.65), 7.677 (0.66), 7.681 (0.70), 7.686 (0.38), 7.694 (0.33), 7.699 (0.30), 8.346 (0.40), 8.364 (0.70), 8.382 (0.39), 8.952 (0.29), 9.031 (0.40), 11.933 (0.09).
Пример 439
3-[3-(2-хлорбензил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
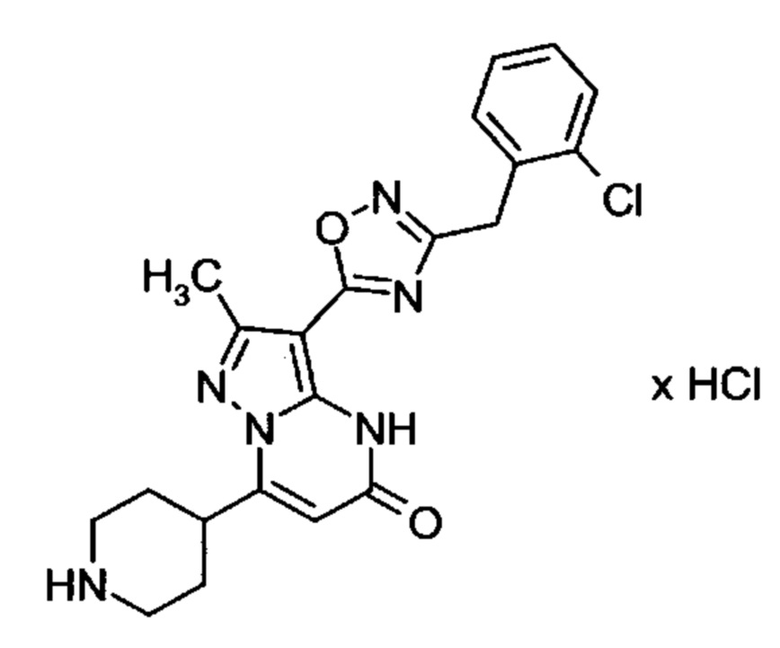
трет-бутил 4-{3-[3-(2-хлорбензил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (44.2 мг, 84.2 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (320 мкл, 4.0 М, 1.3 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 32.3 мг (95% чистота, 79% теоретический выход).
LC-MS (Способ 11B): Rt=1.15 мин; MS (ESIpos): m/z=425 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.13), -0.009 (1.72), 0.007 (1.23), 0.145 (0.15), 1.146 (0.32), 1.234 (0.16), 1.753 (0.54), 1.827 (0.84), 1.858 (1.98), 1.883 (2.08), 1.915 (0.87), 2.175 (2.95), 2.207 (2.29), 2.276 (0.11), 2.327 (0.29), 2.366 (0.55), 2.409 (1.43), 2.639 (0.25), 2.664 (0.27), 2.669 (0.28), 2.709 (0.55), 3.114 (1.89), 3.379 (3.22), 3.410 (2.48), 3.462 (0.23), 3.474 (0.25), 3.566 (1.97), 3.585 (0.92), 3.665 (0.20), 3.678 (0.20), 3.697 (0.19), 3.711 (0.16), 4.261 (16.00), 4.425 (0.08), 5.411 (0.71), 5.962 (0.20), 6.145 (0.39), 7.312 (0.46), 7.319 (0.88), 7.331 (4.86), 7.337 (3.40), 7.342 (5.15), 7.348 (3.85), 7.354 (6.03), 7.367 (1.10), 7.373 (0.39), 7.382 (0.34), 7.473 (3.27), 7.483 (4.97), 7.490 (3.18), 7.494 (4.13), 7.506 (2.61), 7.519 (0.24), 8.679 (0.60), 8.859 (0.76), 11.500 (0.16).
Пример 440
2-метил-3-[3-(2-метилфенил)-1,2,4-оксадиазол-5-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
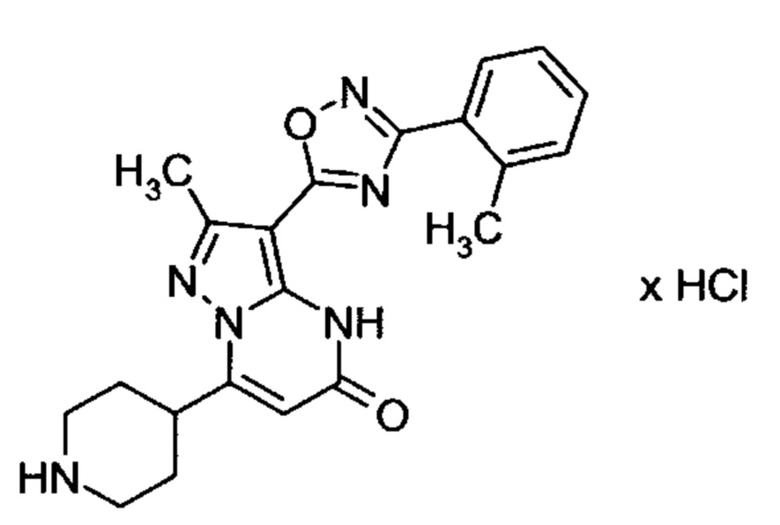
трет-бутил 4-{2-метил-3-[3-(2-метилфенил)-1,2,4-оксадиазол-5-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (104 мг, 211 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (790 мкл, 4.0 М, 3.2 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 81.1 мг (98% чистота, 88% теоретический выход).
LC-MS (Способ 1B): Rt=0.68 мин; MS (ESIpos): m/z=391 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.06), -0.011 (0.52), 0.005 (0.49), 0.144 (0.06), 1.108 (0.13), 1.146 (0.10), 1.228 (0.05), 1.424 (0.78), 1.593 (0.10), 1.859 (0.35), 1.868 (0.43), 1.892 (1.11), 1.900 (1.15), 1.924 (1.25), 1.931 (1.20), 1.956(0.55), 1.965 (0.46), 2.072 (0.08), 2.197 (1.73), 2.230 (1.39), 2.322 (0.06), 2.327 (0.08), 2.331 (0.06), 2.365 (0.16), 2.455 (0.10), 2.616 (16.00), 2.644 (13.66), 2.669 (0.20), 2.709 (0.16), 2.774 (0.09), 2.803 (0.08), 3.125 (1.04), 3.390 (1.80), 3.421 (1.44), 3.566 (2.20), 3.575 (0.46), 3.605 (0.82), 3.635 (0.40), 6.150 (0.99), 7.393 (0.74), 7.413 (2.74), 7.432 (3.41), 7.468 (1.66), 7.472 (1.73), 7.487 (1.76), 7.505 (0.61), 7.509 (0.59), 8.171 (1.01), 8.189 (1.01), 8.847 (0.33), 8.968 (0.42), 11.869 (0.11).
Пример 441
3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
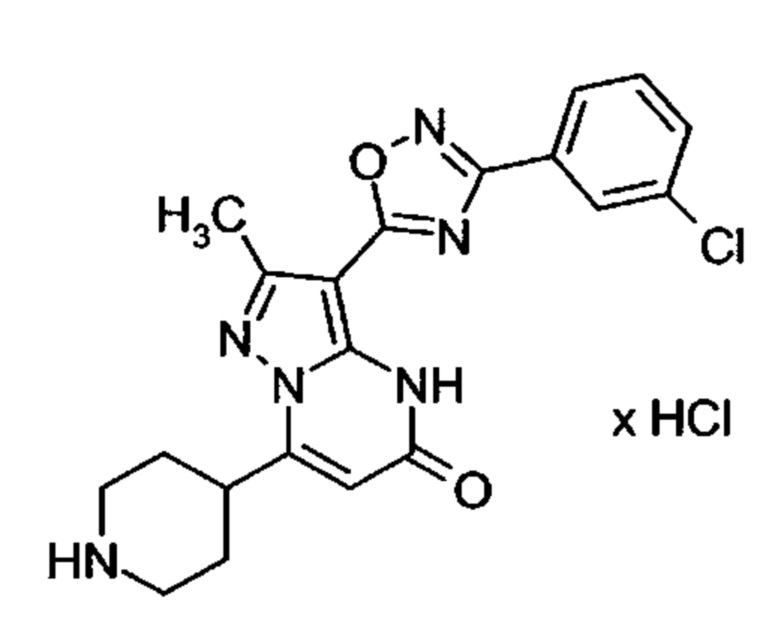
трет-бутил 4-{3-[3-(3-хлорфенил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (76.6 мг, 150 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (560 мкл, 4.0 М, 2.2 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 56.9 мг (97% чистота, 82% теоретический выход).
LC-MS (Способ 1B): Rt=0.72 мин; MS (ESIpos): m/z=411 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.17), -0.010 (1.46), 0.006 (1.44), 0.144 (0.20), 1.146 (0.25), 1.229 (0.09), 1.424 (2.84), 1.594 (0.23), 1.855 (0.65), 1.885 (1.81), 1.912 (1.99), 1.944 (0.83), 2.015 (0.09), 2.072 (2.28), 2.195 (2.85), 2.229 (2.31), 2.327 (0.24), 2.366 (0.38), 2.522 (0.53), 2.524 (0.50), 2.574 (0.13), 2.639 (16.00), 2.668 (0.42), 2.709 (0.39), 2.799 (0.09), 3.139 (1.63), 3.392 (2.93), 3.424 (2.37), 3.566 (3.29), 3.592 (1.19), 3.622 (0.60), 6.140 (1.00), 7.610 (2.21), 7.630 (5.28), 7.649 (4.10), 7.682 (2.66), 7.684 (3.31), 7.686 (3.23), 7.690 (2.87), 7.702 (1.51), 7.707 (1.82), 7.710 (1.47), 8.142 (2.46), 8.161 (2.27), 8.273 (1.85), 8.769 (0.55), 8.917 (0.70), 12.007 (0.25).
Пример 442
2-метил-7-(пиперидин-4-ил)-3-{3-[4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
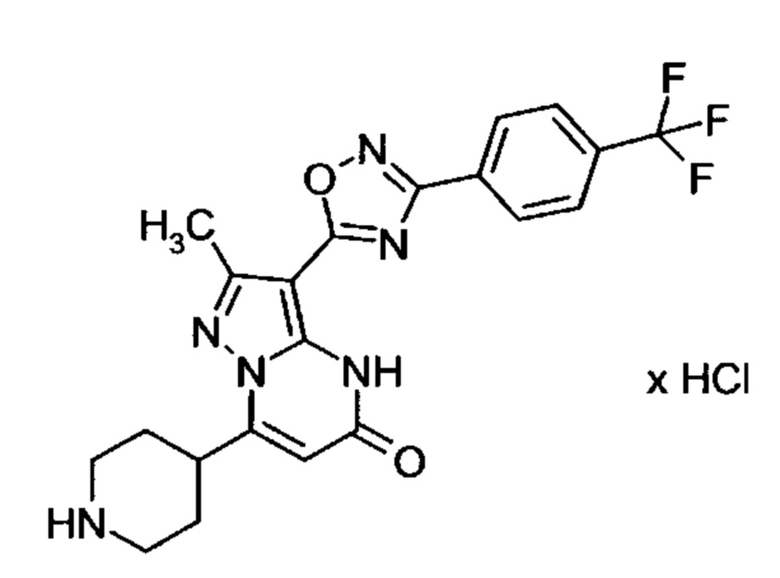
трет-бутил 4-(2-метил-5-оксо-3-{3-[4-(трифторметил)фенил]-1,2,4-оксадиазол-5-ил}-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил)пиперидин-1-карбоксилат (48.5 мг, 89.1 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (330 мкл, 4.0 М, 1.3 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 39.5 мг (93% чистота, 86% теоретический выход).
LC-MS (Способ 1B): Rt=0.75 мин; MS (ESIpos): m/z=445 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.011 (0.89), 1.145 (0.18), 1.424 (8.00), 1.577 (0.17), 1.593 (0.23), 1.870 (0.60), 1.903 (1.65), 1.927 (1.81), 1.958 (0.80), 1.968 (0.71), 2.011 (0.22), 2.072 (0.73), 2.195 (2.56), 2.228 (2.07), 2.327 (0.15), 2.365 (0.23), 2.650 (16.00), 2.709 (0.28), 3.113 (1.47), 3.138 (1.51), 3.392 (2.65), 3.422 (2.15), 3.566 (1.24), 3.599 (1.17), 3.628 (0.58), 4.089 (0.16), 4.122 (0.15), 6.152 (1.21), 6.205 (0.27), 7.962 (5.43), 7.983 (5.89), 8.416 (4.11), 8.436 (3.74), 8.865 (0.56), 8.980 (0.72), 12.022 (0.19).
Пример 443
3-[4-метил-5-(2-метилпропил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
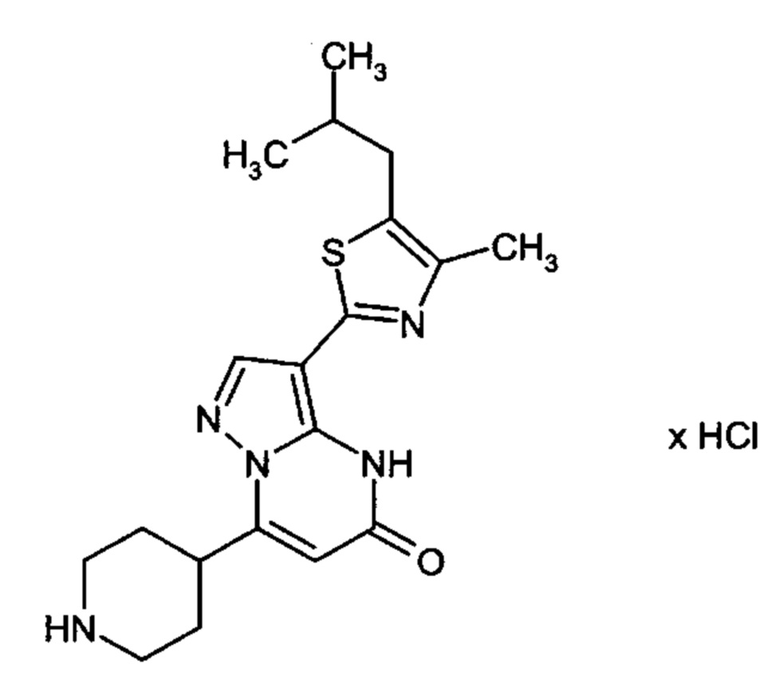
трет-бутил 4-{3-[4-метил-5-(2-метилпропил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (31.5 мг, 66.8 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (330 мкл, 4.0 М, 1.3 ммоль) при комнатной температуре в течение 16 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 45 мл/мин / растворители: А = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 10%В, 4.50 мин = 20%В, 15.50 мин = 85%В, 16.00-18.50 мин = 100%В, 18.75.00-22.00 мин = 20%В) с получением продукта, после добавления соляной кислоты в 1,4-диоксане. Полученное количество составило 16.5 мг (95% чистота, 53% теоретический выход).
LC-MS (Способ 10 В): Rt=1.46 мин; MS (ESIpos): m/z=372 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.18), -0.010 (1.98), 0.006 (1.72), 0.144 (0.18), 0.805 (0.20), 0.822 (0.20), 0.832 (0.16), 0.849 (0.16), 0.933 (15.68), 0.949 (16.00), 0.987 (0.17), 1.045 (0.18), 1.062 (0.18), 1.149 (0.62), 1.166 (0.53), 1.780 (0.14), 1.796 (0.45), 1.812 (0.87), 1.829 (1.10), 1.846 (0.86), 1.863 (0.45), 1.897 (0.45), 1.929 (1.20), 1.954 (1.32), 1.985 (0.56), 2.203 (1.81), 2.237 (1.42), 2.356 (13.27), 2.382 (0.27), 2.401 (0.46), 2.660 (3.71), 2.678 (3.57), 2.692 (0.60), 2.709 (0.26), 3.063 (0.45), 3.092 (1.27), 3.121 (1.30), 3.150 (0.54), 3.390 (1.78), 3.421 (1.44), 3.566 (2.55), 3.599 (0.48), 3.629 (0.81), 3.656 (0.45), 3.699 (0.15), 6.288 (0.53), 8.594 (0.23), 8.628 (0.44), 8.908 (0.43), 9.023 (0.59).
Пример 444
3-[5-(3,5-дифтор-4-метоксибензил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
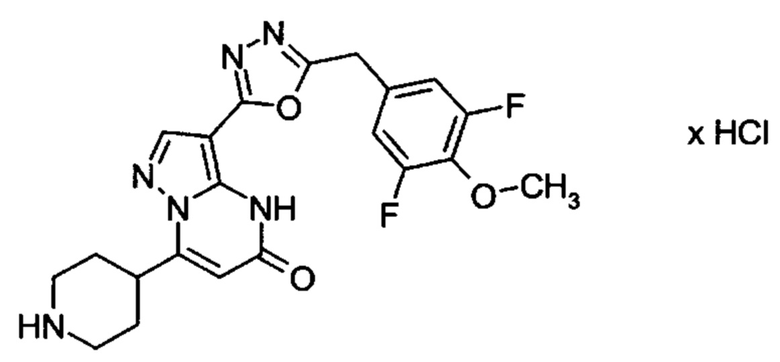
трет-бутил 4-{3-[5-(3,5-дифтор-4-метоксибензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (24.0 мг, 44.2 мкмоль) растворили в 1,4-диоксане (10 мл, 120 ммоль) и обработали соляной кислотой в 1,4-диоксане (170 мкл, 4.0 М, 660 мкмоль) при комнатной температуре в течение 1 ч. Растворители удалили. В результате высушивания в вакууме получили продукт. Полученное количество составило 14.0 мг (100% чистота, 66% теоретический выход).
LC-MS (Способ 10В): Rt=1.13 мин; MS (ESIpos): m/z=443 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.39), -0.009 (3.50), 0.007 (3.24), 0.145 (0.39), 1.146 (0.33), 1.233 (0.26), 1.417 (0.32), 1.843 (0.44), 1.876 (1.18), 1.905 (1.24), 1.937 (0.51), 2.184 (1.79), 2.217 (1.39), 2.327 (0.29), 2.365 (0.33), 2.669 (0.25), 2.709 (0.36), 3.054 (0.47), 3.084 (1.25), 3.112 (1.29), 3.142 (0.54), 3.387 (1.83), 3.417 (1.46), 3.541 (0.52), 3.566 (1.28), 3.600 (0.53), 3.711 (0.37), 3.882 (0.82), 3.905 (16.00), 3.994 (0.86), 4.085 (0.68), 4.306 (9.65), 6.109 (0.56), 7.193 (0.27), 7.201 (0.53), 7.215 (4.08), 7.238 (4.25), 7.252 (0.52), 7.260 (0.31), 8.405 (2.12), 8.696 (0.31), 8.902 (0.41).
Пример 445
3-[5-(2-фторфенил)-1,3,4-оксадиазол-2-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

трет-бутил 4-{3-[5-(2-фторфенил)-1,3,4-оксадиазол-2-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (29.5 мг, 59.7 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (220 мкл, 4.0 М, 890 мкмоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 16.3 мг (99% чистота, 62% теоретический выход).
LC-MS (Способ 1B): Rt=0.55 мин; MS (ESIpos): m/z=395 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.862 (0.39), 1.894 (1.19), 1.926 (1.32), 1.957 (0.55), 2.190 (1.89), 2.222 (1.49), 2.365 (0.21), 2.574 (16.00), 2.709 (0.21), 3.073 (0.47), 3.102 (1.28), 3.132 (1.31), 3.161 (0.54), 3.384 (1.84), 3.413 (1.47), 3.565 (5.51), 3.585 (1.01), 3.616 (0.49), 4.510 (0.33), 6.048 (2.05), 7.461 (1.25), 7.481 (2.84), 7.499 (1.77), 7.506 (1.59), 7.512 (1.27), 7.534 (1.36), 7.683 (0.61), 7.697 (1.06), 7.717 (0.98), 7.731 (0.44), 7.735 (0.41), 8.180 (0.85), 8.184 (0.88), 8.199 (1.67), 8.202 (1.70), 8.218 (0.88), 8.222 (0.84), 8.921 (0.34), 9.019 (0.48).
Пример 446
3-[3-(4-гидроксибензил)-1,2,4-оксадиазол-5-ил]-2-метил-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
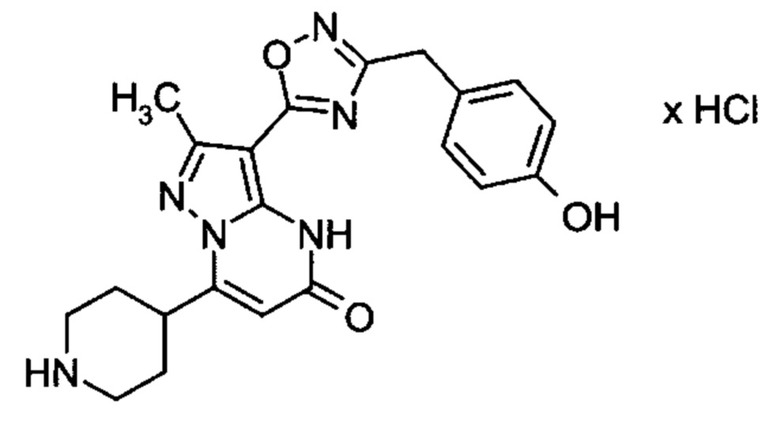
трет-бутил 4-{3-[3-(4-гидроксибензил)-1,2,4-оксадиазол-5-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (74.8 мг, 148 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (550 мкл, 4.0 М, 2.2 ммоль) при комнатной температуре в течение 16 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 50 мл/мин / растворители: А = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-5.00 мин = 10%В, 6.50 мин = 20%В, 17.0-19.75 мин = 100%В, 19.75.00-23.00 мин = 90%В) с получением продукта, после добавления соляной кислоты в 1,4-диоксане. Полученное количество составило 31.5 мг (100% чистота, 48% теоретический выход).
LC-MS (Способ IB): Rt=0.67 мин; MS (ESIpos): m/z=407 [M+H]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.05), -0.010 (0.48), 0.006 (0.48), 0.144 (0.05), 1.146 (0.08), 1.861 (0.30), 1.891 (0.84), 1.917 (0.90), 1.948 (0.39), 2.193 (1.28), 2.226 (1.03), 2.327 (0.07), 2.366 (0.11), 2.633 (8.03), 2.709 (0.13), 3.093 (0.53), 3.124 (1.03), 3.154 (0.60), 3.388 (1.38), 3.420 (1.11), 3.564 (0.32), 3.592 (0.59), 3.622 (0.29), 3.670 (0.08), 3.739 (0.06), 3.853 (16.00), 4.032 (0.07), 5.753 (1.12), 6.124 (0.63), 7.116 (3.63), 7.139 (3.78), 8.119 (2.40), 8.141 (2.26), 8.937 (0.24), 11.871 (0.07).
Пример 447
3-[5-(3-фтор-4-метоксибензил)-1,3,4-оксадиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
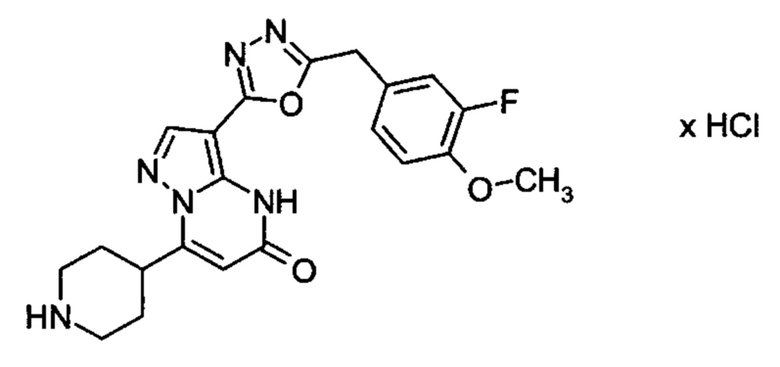
трет-бутил 4-{3-[5-(3-фтор-4-метоксибензил)-1,3,4-оксадиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (10.5 мг, 20.0 мкмоль) растворили в 1,4-диоксане (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (75 мкл, 4.0 М, 300 мкмоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 9.80 мг (92% чистота, 98% теоретический выход).
LC-MS (Способ 11В): Rt=0.91 мин; MS (ESIpos): m/z=425 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.150 (0.55), -0.009 (5.23), 0.007 (4.36), 0.145 (0.58), 1.146 (0.78), 1.234 (0.58), 1.250 (0.41), 1.266 (0.44), 1.416 (11.24), 1.833 (0.73), 1.862 (1.86), 1.893 (1.95), 1.922 (0.84), 1.977 (0.38), 2.183 (2.82), 2.215 (2.24), 2.322 (0.44), 2.327 (0.61), 2.331 (0.44), 2.365 (1.02), 2.523 (1.54), 2.665 (0.55), 2.669 (0.67), 2.709 (1.07), 3.056 (0.75), 3.086 (2.00), 3.114 (2.09), 3.145 (0.93), 3.387 (3.22), 3.419 (2.47), 3.480 (0.64), 3.567 (1.83), 3.599 (1.60), 3.707 (7.23), 3.732 (6.94), 3.998 (0.41), 4.090 (0.38), 4.236 (0.41), 4.261 (16.00), 6.113 (0.67), 7.124 (0.61), 7.145 (5.98), 7.153 (5.58), 7.158 (7.67), 7.173 (0.52), 7.254 (2.70), 7.287 (2.82), 8.361 (0.44), 8.389 (1.92), 8.615 (0.64), 8.830 (0.84).
Пример 448
3-[4-(2-метилфенил)-1,3-тиазол-2-ил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он ацетат
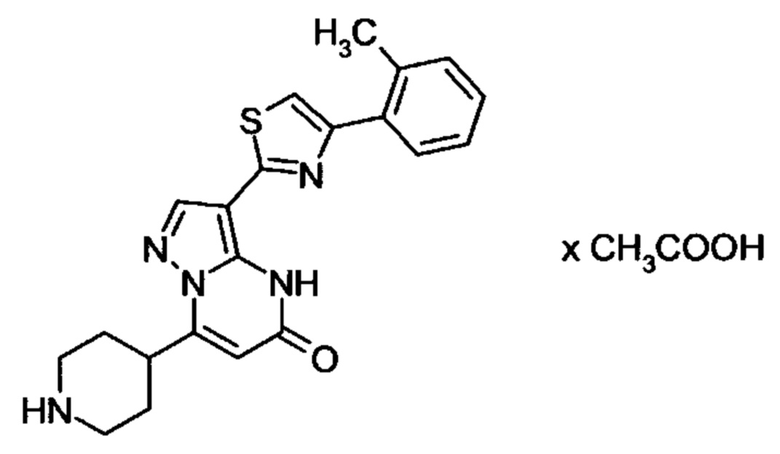
трет-бутил 4-{3-[4-(2-метилфенил)-1,3-тиазол-2-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (140 мг, 285 мкмоль) растворили в 1,4-диоксане (5.6 мл, и обработали бромистоводородной кислотой в воде (32 мкл, 48%, 280 мкмоль) при комнатной температуре в течение 16 ч. Смесь очистили посредство обращенно-фазовой ВЭЖХ (Способ: колонка: Reprosil С18; 10 мкм; 125×30 мм/поток: 45 мл/мин / растворители: А = вода (0,1% муравьиная кислота), В = ацетонитрил / градиент: 0.00-4.25 мин = 10%В, 4.50 мин = 20%В, 15.50 мин = 85%В, 16.00-18.50 мин = 100%В, 18.75.00-22.00 мин = 20%В) с получением продукта, после добавления уксусной кислоты и удаления растворителей. Полученное количество составило 47.4 мг (100% чистота, 37% теоретический выход).
LC-MS (Способ 11В): Rt=1.18 мин; MS (ESIpos): m/z=392 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.147 (0.27), 1.813 (0.56), 1.842 (1.39), 1.869 (1.60), 1.908 (12.50), 2.072 (0.20), 2.208 (2.06), 2.240 (1.69), 2.327 (0.28), 2.365 (0.44), 2.464 (16.00), 2.669 (0.30), 2.709 (0.37), 3.072 (1.35), 3.101 (2.41), 3.132 (1.55), 3.309 (3.65), 3.397 (3.25), 3.430 (2.44), 3.513 (0.87), 3.542 (1.23), 3.570 (0.67), 5.995 (2.28), 7.269 (2.15), 7.278 (2.71), 7.284 (3.25), 7.292 (5.23), 7.300 (3.60), 7.559 (4.38), 7.681 (1.49), 7.690 (1.63), 7.703 (1.28), 8.180 (2.13), 8.369 (3.50).
Пример 449
7-(пиперидин-4-ил)-3-(проп-1-ен-2-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
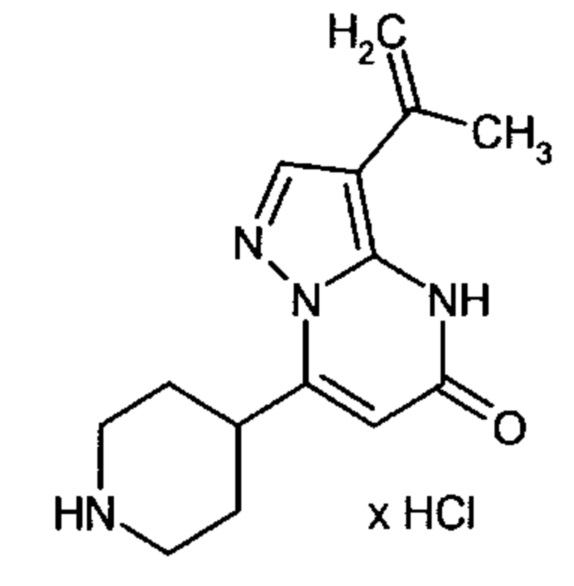
Соединение трет-бутил 4-[3-(2-гидроксипропан-2-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (124 мг, 329 мкмоль) перемешивали всю ночь при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 2.1 мл). Смесь перемешивали с простым диэтиловым эфиром (10 мл) и метанолом (0.5 мл) перед фильтрацией. Выделенное твердое вещество обеспечило соединение, указанное в названии. Полученное количество составило 71.3 мг (100% чистота, 73% теоретический выход).
LC-MS (Способ 11B): Rt=0.57 мин; MS (ESIpos): m/z=259 [M+H-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 11.88 (bs, 1H), 8.93 (bs, 1H), 8.84-8.66 (m, 1H), (7.85, 7.61, s x 2, 1H), (5.76, 5.64, s x 2, 1H), 3.59-3.25 (m, 3H), 3.17-3.01 (m, 2H), 2.26-1.76 (m x 2, 6H), (1.37, 1.11, s x 2, 3H).
Пример 450
3-(5-метил-2-фенил-1,3-тиазол-4-ил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
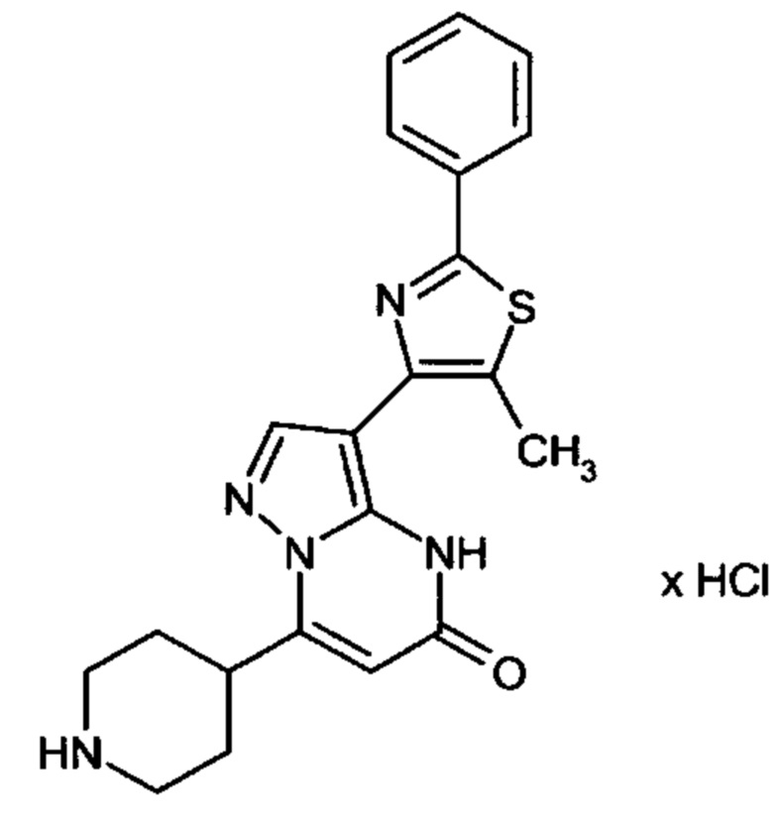
Соединение трет-бутил 4-[3-(5-метил-2-фенил-1,3-тиазол-4-ил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (7.50 мг, 15.3 мкмоль) перемешивали в течение 2 ч при комнатной температуре с соляной кислотой (4Н раствор в 1,4-диоксане, 2.0 мл). Смесь разбавили водой и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 7.00 мг (95% чистота, количественный выход).
LC-MS (Способ 1B): Rt=0.72 мин; MS (ESIpos): m/z=392 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 11.33 (s, 1H), 8.80-8.69 (m, 1H), 8.55-8.41 (m, 1H), 8.21 (s, 1H), 7.96-7.92 (m, 2H), 7.56-7.47 (m, 3H), 5.95 (s, 1H), 3.59 (t, 1H), 3.43 (d, 2H), 3.13 (q, 2H), 2.56 (s, 3H), 2.25 (d, 2H), 1.89 (q, 2H).
Пример 451
3-(циклопентилкарбонил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
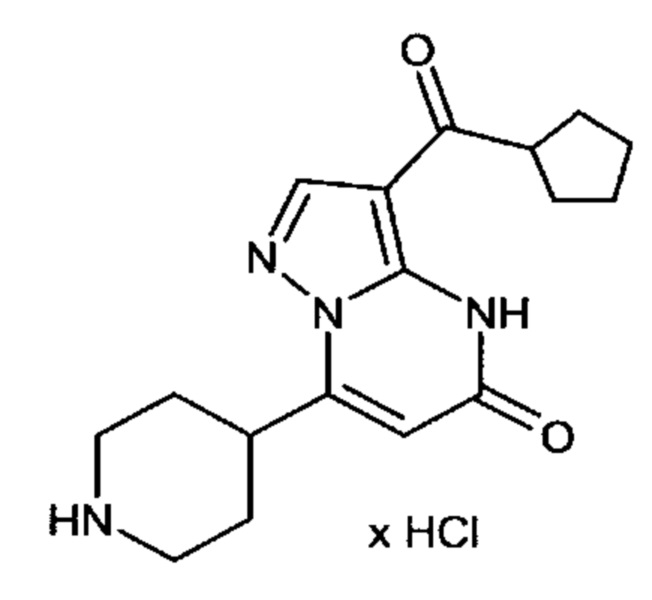
Смесь трет-бутил 4-[3-(циклопентилкарбонимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (147 мг, 355 мкмоль) и соляной кислоты (1Н раствор в воде, 23 мл) в ацетонитриле (23 мл) перемешивали всю ночь при 40°С. Реакционную смесь затем заморозили и лиофилизовали. Из-за присутствия хлорида аммония вещество растворили в воде и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Объединенные фракции продукта выпарили, растворили в соляной кислоте (1Н раствор в воде, 3.0 мл) и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 109 мг (100% чистота, 87% теоретический выход).
LC-MS (Способ 1B): Rt=0.50 мин; MS (ESIpos): m/z=315 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 11.33 (bs, 1H), 8.98 (bs, 1H), 8.80 (bs, 1H), 8.48 (s, 1H), 6.03 (s, 1H), 3.61-3.46 (m, 2H), 3.38 (d, 2H), 3.08 (t, 2H), 2.17 (d, 2H), 1.95-1.82 (m, 4H), 1.80-1.69 (m, 2H), 1.68-1.56 (m, 4H).
Пример 452
3-(2-метилбутаноил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
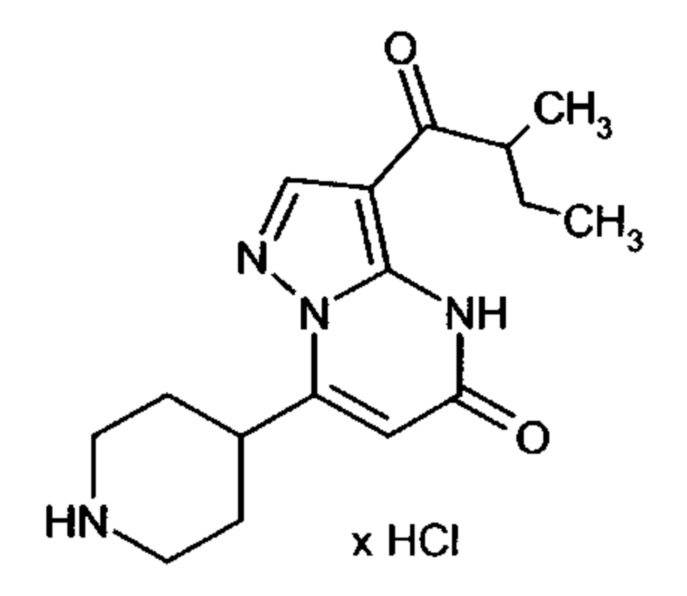
Смесь трет-бутил 4-[3-(2-метилбутанимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (144 мг, 359 мкмоль) и соляной кислоты (1Н раствор в воде, 11 мл) в ацетонитриле (11 мл) перемешивали всю ночь при 40°С. Реакционную смесь затем заморозили и лиофилизовали. Из-за присутствия хлорида аммония вещество растворили в воде и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Объединенные фракции продукта выпарили, растворили в соляной кислоте (1Н раствор в воде, 3.0 мл) и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 105 мг (100% чистота, 86% теоретический выход).
LC-MS (Способ 1B): Rt=0.47 мин; MS (ESIpos): m/z=303 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 11.35 (bs, 1H), 8.87 (bs, 1H), 8.67 (bs, 1H), 8.50 (s, 1H), 6.04 (bs, 1H), 3.58-3.46 (m, 1H), 3.39 (d, 2H), 3.24-3.03 (m, 1H), 3.09 (t, 2H), 2.17 (d, 2H), 1.87 (q, 2H), 1.75-1.62 (m, 1H), 1.42 (sept, 1H), 1.08 (d, 3H), 0.86 (t, 3H).
Пример 453
3-(циклопропилкарбонил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
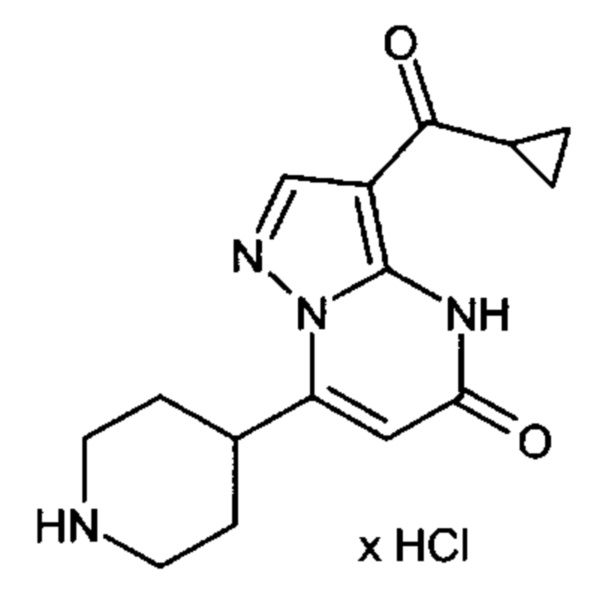
Смесь трет-бутил 4-[3-(циклопропилкарбонимидоил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (44.0 мг, 114 мкмоль) и соляной кислоты (1Н раствор в воде, 3.4 мл) в ацетонитриле (3.4 мл) перемешивали всю ночь при 40°С. Реакционную смесь затем очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Объединенные фракции продукта выпарили, растворили в соляной кислоте (1Н раствор в воде, 2.0 мл) и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 32.0 мг (93% чистота, 81% теоретический выход).
LC-MS (Способ 11B): Rt=0.51 мин; MS (ESIpos): m/z=287 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 11.29 (bs, 1H), 8.88 (bs, 1H), 8.79-8.53 (m, 1H), 8.64 (s, 1H), 6.05 (bs, 1H), 3.54 (t, 1H), 3.45-3.29 (d, 2H, под сигналом воды), 3.09 (q, 2H), 2.75-2.59 (m, 1H), 2.18 (d, 2H), 1.87 (q, 2H), 1.03-0.95 (m, 4H).
Пример 454
Метил 5-оксо-7-(пиперидин-4-ил)-2-(трифторметил)-4,5-дигидропиразоло[1,5-a]пиримидин-3-карбоксилат гидрохлорид
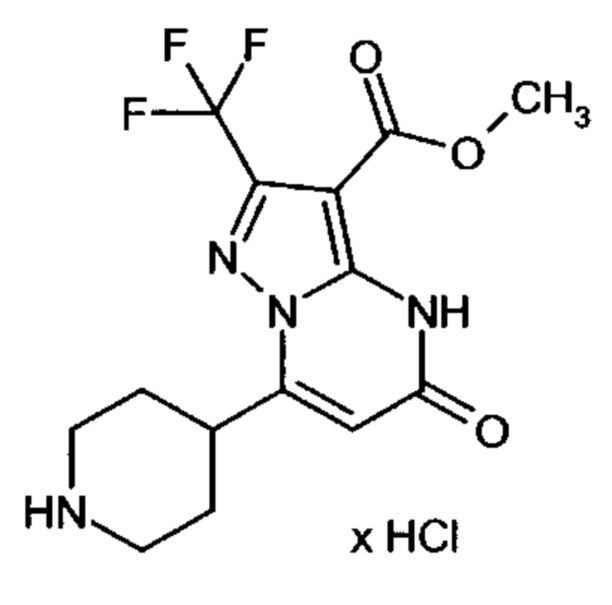
К раствору метил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (50.0 мг, 113 мкмоль) в ацетонитриле (5.0 мл) добавили соляную кислоту (1Н раствор в воде, 5.0 мл). Смесь перемешивали всю ночь при 40°С. Вещество очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Посредством выпаривания объединенных фракций продукта получили соединение, указанное в названии. Полученное количество составило 36.0 мг (95% чистота, 80% теоретический выход).
LC-MS (Способ 8В): Rt=0.65 мин; MS (ESIpos): m/z=345 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.009 (5.09), 0.007 (4.66), 1.776 (0.28), 1.813 (0.76), 1.843 (0.88), 1.871 (0.38), 2.129 (1.35), 2.165 (1.09), 3.073 (0.31), 3.102 (0.88), 3.132 (0.90), 3.160 (0.38), 3.371 (1.49), 3.402 (1.14), 3.455 (0.36), 3.485 (0.62), 3.515 (0.33), 3.817 (16.00), 6.188 (0.76), 8.547 (0.19), 8.792 (0.28), 12.008 (0.26).
Пример 455
Этил 2-(метилсульфанил)-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
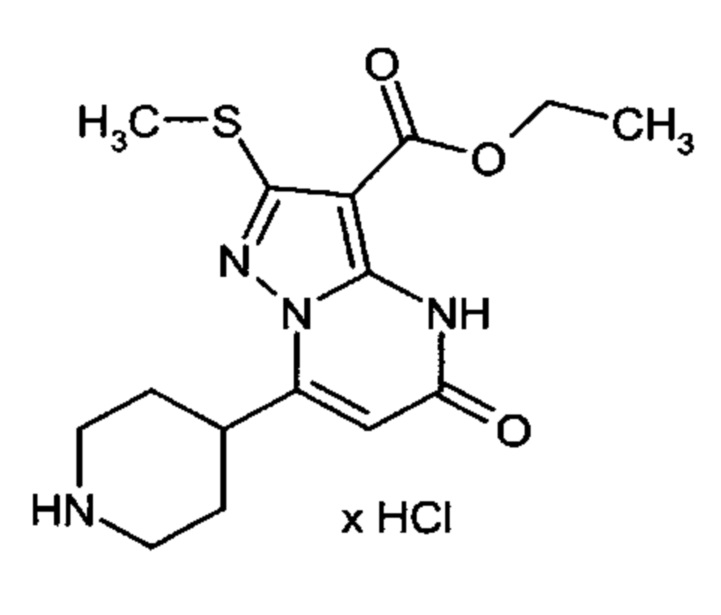
К раствору этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (50.0 мг, 115 мкмоль) в ацетонитриле (2.0 мл) добавили соляную кислоту (1Н раствор в воде, 1.0 мл). Смесь перемешивали всю ночь при 40°С перед лиофилизацией. Вещество затем очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой) и объединенные фракции продукта лиофилизовали с получением соединения, указанного в названии. Полученное количество составило 23.6 мг (100% чистота, 55% теоретический выход).
LC-MS (Способ 8В): Rt=0.72 мин; MS (ESIpos): m/z=337 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.009 (1.10), 0.007 (0.99), 1.253 (3.77), 1.271 (8.60), 1.289 (3.90), 1.798 (0.25), 1.831 (0.77), 1.863 (0.83), 1.894 (0.33), 2.167 (1.18), 2.200 (0.97), 2.512 (16.00), 3.025 (0.27), 3.054 (0.71), 3.081 (0.74), 3.109 (0.32), 3.372 (1.25), 3.404 (1.05), 3.450 (0.61), 3.472 (0.30), 3.480 (0.31), 4.246 (1.01), 4.264 (3.30), 4.281 (3.26), 4.299 (0.99), 5.917 (0.77), 8.641 (0.19), 8.895 (0.24), 11.512 (0.43).
Пример 456
3-(2,2-диметилпропаноил)-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид

Смесь трет-бутил 4-[3-(2,2-диметилпропаноил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил]пиперидин-1-карбоксилата (68.5 мг, 81% чистота, 137 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 340 мкл) перемешивали всю ночь при комнатной температуре. Реакционную смесь растворили в воде/ацетонитриле и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Объединенные фракции продукта выпарили с получением соединения, указанного в названии. Полученное количество составило 16.3 мг (100% чистота, 35% теоретический выход).
LC-MS (Способ 11В): Rt=0.76 мин; MS (ESIpos): m/z=303 [М+Н-xHCl]+
1H-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.009 (1.41), 0.007 (0.86), 1.292 (16.00), 1.617 (0.09), 1.650 (0.29), 1.653 (0.29), 1.681 (0.32), 1.714 (0.13), 2.006 (0.43), 2.037 (0.36), 2.798 (0.24), 2.829 (0.47), 2.860 (0.27), 3.189 (0.66), 3.220 (0.73), 5.971 (1.17), 8.236 (0.62), 8.501 (1.44). Один протон не виден и, как полагают, находится ниже пика воды
Пример 457
5-оксо-7-(пиперидин-4-ил)-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты гидрохлорид
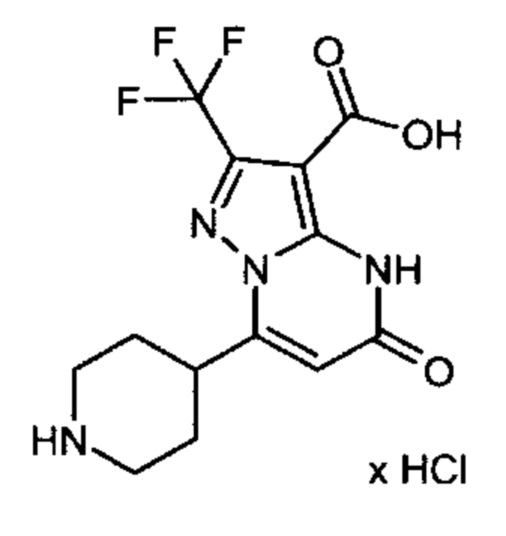
Смесь 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (50.0 мг, 116 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 500 мкл) в 1,4-диоксане (1.0 мл) перемешивали всю ночь при комнатной температуре. Реакционную смесь разбавили водой (5.0 мл) и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 42.0 мг (100% чистота, 99% теоретический выход).
LC-MS (Способ 8В): Rt=0.25 мин; MS (ESIpos): m/z=331 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.007 (6.07), 1.787 (2.71), 1.796 (3.04), 1.827 (8.53), 1.855 (9.27), 1.885 (3.94), 1.893 (3.45), 2.132 (13.21), 2.165 (10.58), 3.071 (3.20), 3.098 (8.45), 3.127 (9.11), 3.157 (4.02), 3.367 (16.00), 3.400 (11.73), 3.459 (3.53), 3.488 (6.15), 3.517 (3.28), 6.171 (6.97), 8.631 (2.87), 8.840 (3.53), 11.369 (1.39), 13.354 (1.23).
Пример 458
Этил 5-оксо-7-(пиперидин-4-ил)-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
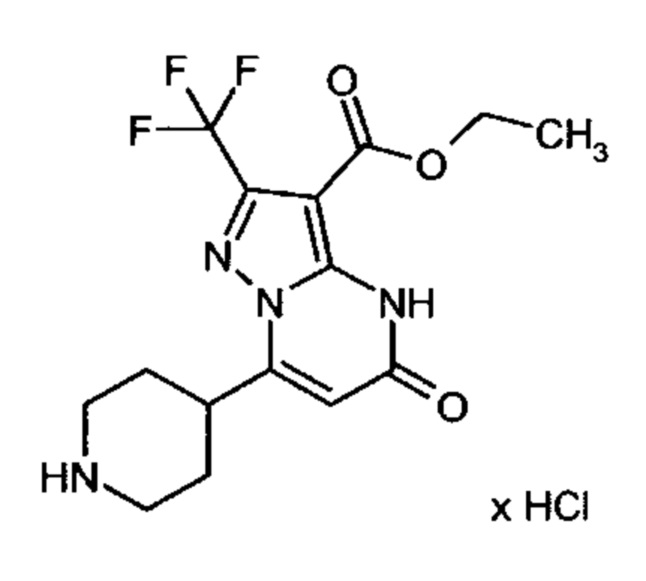
Смесь этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (85.0 мг, 185 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 1.0 мл) в 1,4-диоксане (1.0 мл) перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь лиофилизовали с получением соединения, указанного в названии. Полученное количество составило 74.0 мг (95% чистота, 96% теоретический выход).
LC-MS (Способ 8В): Rt=0.74 мин; MS (ESIneg): m/z=357 [М-Н-xHCl]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.265 (7.13), 1.282 (16.00), 1.300 (7.28), 1.804 (0.48), 1.836 (1.46), 1.868 (1.59), 1.901 (0.64), 2.123 (2.30), 2.156 (1.82), 3.064 (0.54), 3.093 (1.51), 3.122 (1.59), 3.151 (0.68), 3.364 (2.70), 3.395 (1.96), 3.457 (0.68), 3.487 (1.22), 3.507 (0.85), 4.298 (1.89), 4.315 (6.23), 4.333 (6.15), 4.351 (1.89), 6.183 (1.51), 8.738 (0.37), 8.907 (0.62), 11.876 (0.32).
Пример 459
Пропил 5-оксо-7-(пиперидин-4-ил)-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
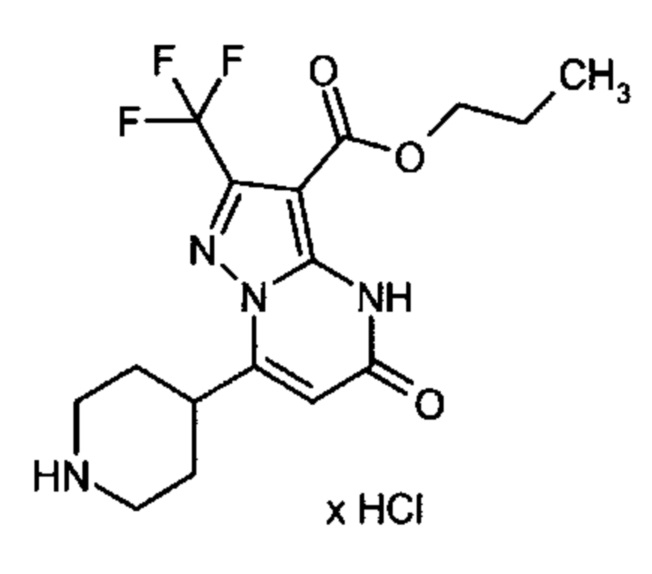
Смесь пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (98.0 мг, 207 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 1.0 мл) в 1,4-диоксане (1.0 мл) перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь лиофилизовали с получением соединения, указанного в названии. Полученное количество составило 85.0 мг (99% чистота, 99% теоретический выход).
LC-MS (Способ 8В): Rt=0.82 мин; MS (ESIneg): m/z=371 [М-Н-xHCl]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.902 (6.97), 0.920 (16.00), 0.939 (7.64), 1.652 (0.57), 1.669 (2.36), 1.687 (4.68), 1.705 (4.60), 1.722 (2.20), 1.740 (0.51), 1.803 (0.45), 1.813 (0.55), 1.845 (1.54), 1.869 (1.68), 1.901 (0.72), 1.909 (0.63), 2.124 (2.39), 2.157 (1.89), 3.064 (0.55), 3.092 (1.51), 3.121 (1.59), 3.147 (0.68), 3.364 (2.67), 3.394 (2.00), 3.461 (0.93), 3.473 (0.81), 3.489 (1.46), 3.517 (0.67), 4.221 (3.95), 4.238 (8.36), 4.255 (3.86), 6.188 (1.51), 8.766 (0.51), 8.909 (0.68), 11.802 (0.34).
Пример 460
Пропан-2-ил 5-оксо-7-(пиперидин-4-ил)-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид

Смесь пропан-2-ил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-2-(трифторметил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (73.0 мг, 155 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 1.0 мл) в 1,4-диоксане (1.0 мл) перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь лиофилизовали с получением соединения, указанного в названии. Полученное количество составило 63.0 мг (98% чистота, 98% теоретический выход).
LC-MS (Способ 8В): Rt=0.82 мин; MS (ESIneg): m/z=371 [M-H-xHCl]-
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.010 (0.37), 0.006 (0.34), 1.303 (15.90), 1.318 (16.00), 1.796 (0.23), 1.804 (0.29), 1.829 (0.77), 1.835 (0.80), 1.860 (0.88), 1.867 (0.86), 1.892 (0.38), 1.901 (0.33), 2.123 (1.25), 2.156 (1.00), 3.064 (0.30), 3.093 (0.78), 3.121 (0.83), 3.150 (0.36), 3.364 (1.36), 3.396 (1.05), 3.459 (0.35), 3.488 (0.62), 3.507 (0.31), 3.517 (0.30), 5.087 (0.06), 5.103 (0.40), 5.118 (1.07), 5.134 (1.47), 5.150 (1.06), 5.165 (0.39), 5.180 (0.07), 6.194 (0.77), 8.733 (0.26), 8.889 (0.37), 11.640 (0.14).
Пример 461
2,2-дифторпропил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
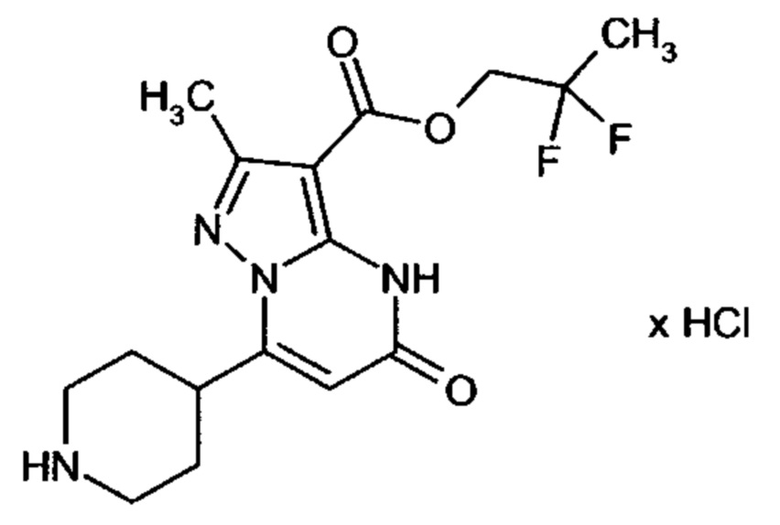
2,2-дифторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (83.5 мг, 184 мкмоль) добавили в 1,4-диокеан (160 мкл, 1.9 ммоль) и обработали соляной кислотой в 1,4-диоксане (690 мкл, 4.0 М, 2.8 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 72.3 мг (100% чистота, 101% теоретический выход).
LC-MS (Способ 1B): Rt=0.51 мин; MS (ESIpos): m/z=355 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.12), -0.009 (1.03), 0.006 (1.01), 0.145 (0.11), 1.146 (0.20), 1.664 (4.34), 1.712 (8.68), 1.760 (3.97), 1.830 (1.18), 1.861 (1.27), 2.072 (0.29), 2.140 (2.19), 2.174 (1.79), 2.327 (0.18), 2.365 (0.30), 2.437 (16.00), 2.597 (0.15), 2.669 (0.18), 2.709 (0.30), 3.095 (1.35), 3.363 (2.34), 3.394 (1.85), 3.475 (0.58), 3.505 (1.01), 3.536 (0.54), 3.566 (3.33), 4.521 (2.38), 4.555 (4.72), 4.588 (2.22), 4.852 (0.21), 4.869 (0.14), 4.887 (0.24), 5.970 (1.17), 8.899 (0.32), 11.332 (0.61).
Пример 462
3-[(3,3-диметилпирролидин-1-ил)карбонил]-7-(пиперидин-4-ил)пиразоло[1,5-а]пиримидин-5(4Н)-он гидрохлорид
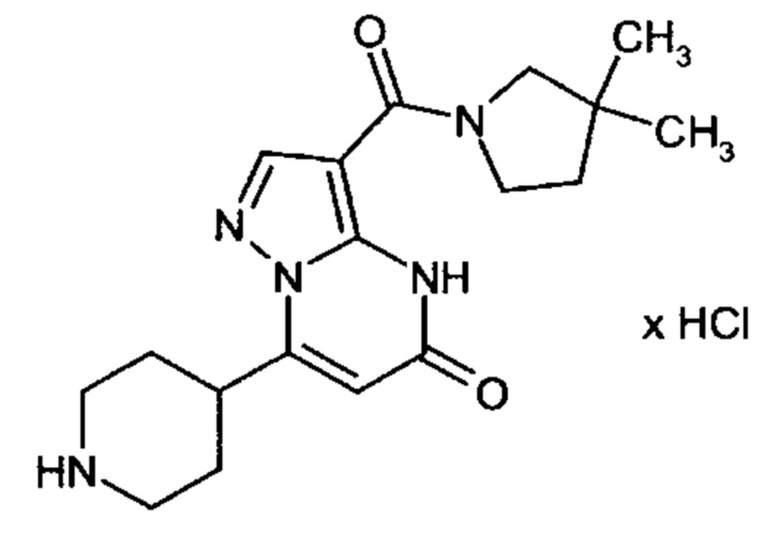
трет-бутил 4-{3-[(3,3-диметилпирролидин-1-ил)карбонил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-7-ил}пиперидин-1-карбоксилат (35.5 мг, 80.0 мкмоль) добавили в 1,4-диоксан (72 мкл, 840 мкмоль) и обработали соляной кислотой в 1,4-диоксане (300 мкл, 4.0 М, 1.2 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 30.2 мг (100% чистота, 99% теоретический выход).
LC-MS (Способ 1B): Rt=0.49 мин; MS (ESIpos): m/z=344 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.06), -0.010 (0.63), 0.006 (0.63), 0.145 (0.08), 0.922 (0.08), 1.081 (16.00), 1.146 (0.13), 1.236 (0.11), 1.414 (0.06), 1.594 (0.12), 1.653 (0.49), 1.671 (0.91), 1.688 (0.53), 1.777 (0.48), 1.794 (0.87), 1.812 (0.55), 1.858 (0.82), 1.890 (0.89), 1.920 (0.36), 2.072 (0.06), 2.161 (1.34), 2.194 (1.08), 2.327 (0.09), 2.365 (0.18), 2.669 (0.10), 2.709 (0.19), 3.060 (0.59), 3.087 (1.04), 3.119 (0.59), 3.259 (1.95), 3.372 (1.44), 3.404 (1.19), 3.460 (1.53), 3.495 (0.42), 3.524 (0.74), 3.542 (0.70), 3.558 (1.16), 3.566 (2.39), 3.576 (0.55), 3.797 (0.49), 3.815 (0.86), 3.832 (0.48), 5.995 (0.97), 8.141 (0.31), 8.198 (1.11), 8.255 (1.17), 8.752 (0.17), 8.944 (0.19), 10.913 (0.19), 10.945 (0.18).
Пример 463
2,2-дифторпропил 5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
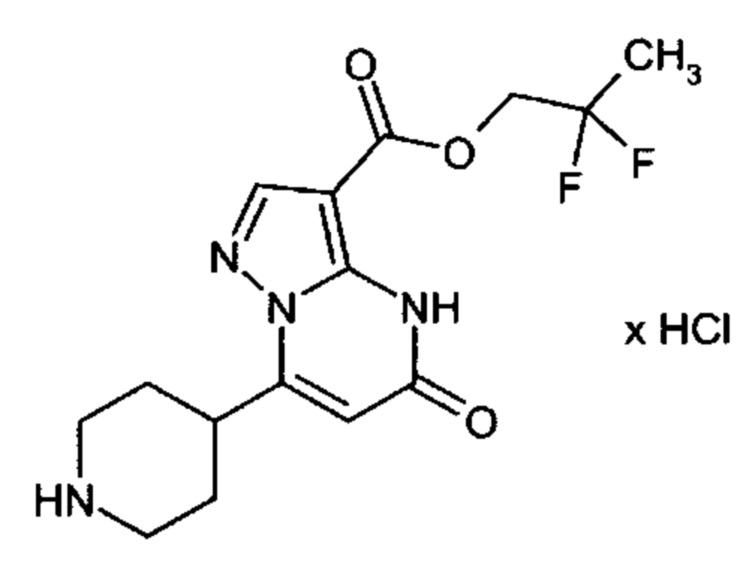
2,2-дифторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (70.3 мг, 160 мкмоль) добавили в 1,4-диоксан (140 мкл, 1.7 ммоль) и обработали соляной кислотой в 1,4-диоксане (600 мкл, 4.0 М, 2.4 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 58.3 мг (100% чистота, 97% теоретический выход).
LC-MS (Способ 1B): Rt=0.45 мин; MS (ESIpos): m/z=341 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.31), -0.010 (2.53), 0.007 (2.43), 0.144 (0.27), 1.147 (0.43), 1.413 (0.16), 1.670 (7.97), 1.718 (16.00), 1.766 (7.25), 1.813 (0.82), 1.846 (2.35), 1.877 (2.66), 1.908 (1.08), 2.072 (1.29), 2.153 (3.84), 2.187 (3.11), 2.322 (0.29), 2.327 (0.35), 2.332 (0.31), 2.365 (0.72), 2.669 (0.39), 2.709 (0.74), 3.057 (1.45), 3.085 (2.82), 3.114 (1.63), 3.373 (4.11), 3.404 (3.33), 3.495 (0.88), 3.523 (1.45), 3.548 (0.86), 3.566 (6.48), 4.507 (4.37), 4.541 (8.70), 4.574 (4.01), 4.847 (0.45), 4.883 (0.49), 4.902 (0.18), 4.921 (0.22), 6.047 (1.19), 8.276 (3.27), 8.707 (0.49), 8.894 (0.57), 11.764 (0.55).
Пример 464
3-фторпропил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид

3-фторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (83.5 мг, 191 мкмоль) добавили в 1,4-диоксан (170 мкл, 2.0 ммоль) и обработали соляной кислотой в 1,4-диоксане (720 мкл, 4.0 М, 2.9 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 58.2 мг (100% чистота, 82% теоретический выход).
LC-MS (Способ 10В): Rt=0.99 мин; MS (ESIpos): m/z=337 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.150 (0.40), -0.009 (3.41), 0.007 (3.23), 0.145 (0.42), 1.147 (0.34), 1.282 (0.21), 1.595 (0.24), 1.769 (0.35), 1.801 (1.01), 1.833 (1.12), 2.036 (0.37), 2.051 (1.36), 2.066 (2.11), 2.081 (1.42), 2.097 (0.45), 2.103 (0.44), 2.118 (1.46), 2.133 (3.28), 2.148 (2.68), 2.175 (1.49), 2.322 (0.20), 2.327 (0.30), 2.331 (0.21), 2.366 (0.41), 2.427 (16.00), 2.523 (0.61), 2.587 (0.17), 2.665 (0.23), 2.669 (0.30), 2.674 (0.23), 2.709 (0.41), 3.097 (1.12), 3.366 (1.90), 3.397 (1.50), 3.470 (0.48), 3.500 (0.89), 3.530 (0.44), 3.567 (1.94), 4.333 (2.72), 4.349 (5.66), 4.365 (2.68), 4.500 (1.76), 4.514 (3.40), 4.529 (1.70), 4.618 (1.74), 4.633 (3.38), 4.647 (1.68), 5.940 (1.55), 8.577 (0.22), 8.786 (0.29), 11.328 (0.65).
Пример 465
2,2-дифторэтил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилатгидрохлорид
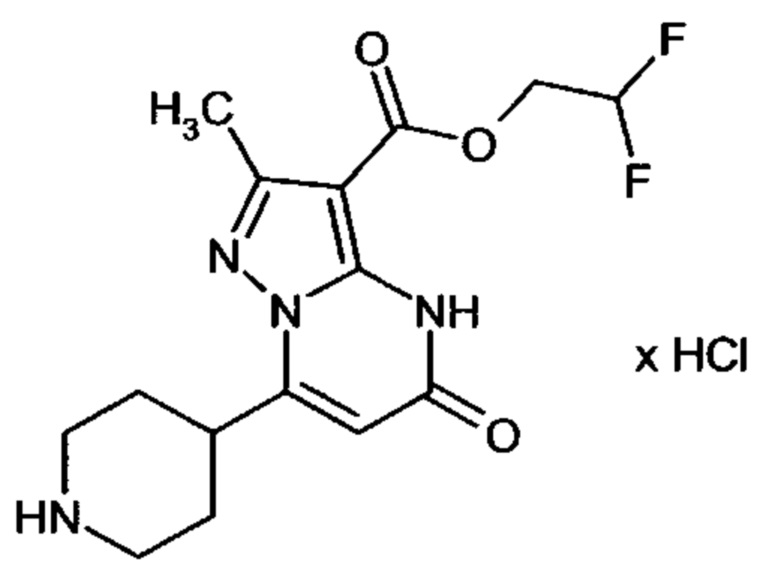
2,2-дифторэтил 7-[1-(трет-бутоксикарбонил)пиперидан-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (86.0 мг, 195 мкмоль) добавили в 1,4-диоксан (2.4 мл, 28 ммоль) и обработали соляной кислотой в 1,4-диоксане (730 мкл, 4.0 М, 2.9 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 72.8 мг (100% чистота, 99% теоретический выход).
LC-MS (Способ 10В): Rt=0.98 мин; MS (ESIpos): m/z=341 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.15), -0.011 (1.25), 0.005 (1.14), 0.143 (0.14), 1.281 (0.17), 1.299 (0.08), 1.412 (0.35), 1.593 (0.41), 1.677 (0.22), 1.680 (0.40), 1.683 (0.23), 1.805 (0.31), 1.814 (0.38), 1.839 (1.03), 1.846 (1.05), 1.870 (1.16), 1.878 (1.12), 1.902 (0.49), 1.911 (0.42), 2.133 (1.64), 2.166 (1.32), 2.267 (0.09), 2.327 (0.08), 2.366 (0.12), 2.431 (16.00), 2.590 (0.10), 2.709 (0.10), 3.081 (0.99), 3.356 (1.76), 3.387 (1.39), 3.473 (0.46), 3.503 (0.82), 3.532 (0.41), 3.566 (7.39), 4.489 (1.24), 4.498 (1.34), 4.526 (2.55), 4.535 (2.62), 4.563 (1.26), 4.572 (1.17), 4.647 (0.08), 5.954 (1.37), 6.258 (0.39), 6.267 (0.81), 6.276 (0.36), 6.395 (0.75), 6.404 (1.63), 6.413 (0.76), 6.533 (0.34), 6.542 (0.73), 6.551 (0.36), 8.877 (0.31), 8.980 (0.39), 11.543 (0.46).
Пример 466
3,3,3-трифторпропил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
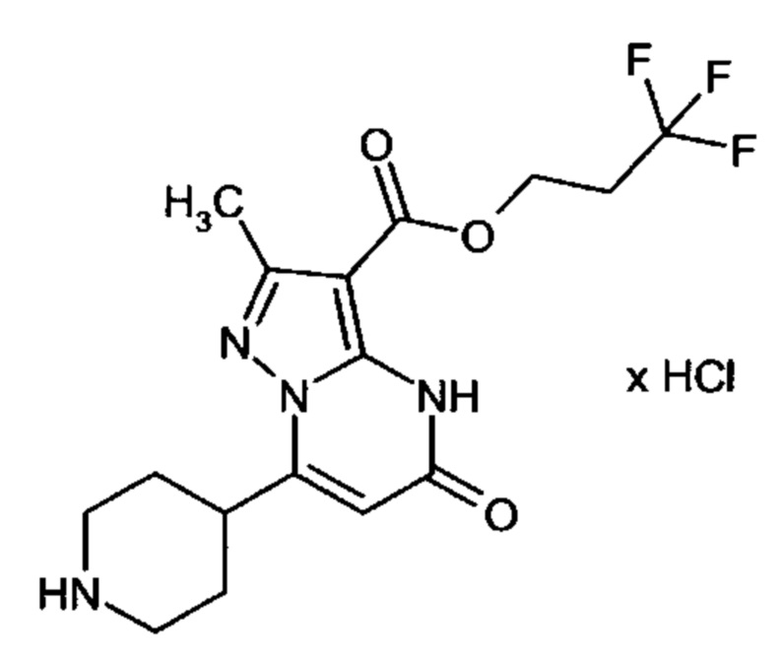
3,3,3-трифторпропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (75.0 мг, 159 мкмоль) добавили в 1,4-диоксан (1.9 мл, 22 ммоль) и обработали соляной кислотой в 1,4-диоксане (600 мкл, 4.0 М, 2.4 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 57.0 мг (100% чистота, 88% теоретический выход).
LC-MS (Способ 10В): Rt=1.12 мин; MS (ESIpos): m/z=373 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.152 (0.12), -0.011 (1.03), 0.143 (0.11), 1.146 (0.06), 1.264 (0.03), 1.281 (0.07), 1.299 (0.03), 1.593 (0.04), 1.816 (0.32), 1.847 (0.94), 1.875 (1.03), 1.905 (0.42), 2.072 (0.04), 2.131 (1.52), 2.164 (1.22), 2.258 (0.08), 2.327 (0.06), 2.366 (0.10), 2.422 (16.00), 2.582 (0.10), 2.669 (0.06), 2.710 (0.09), 2.780 (0.27), 2.795 (0.57), 2.808 (0.99), 2.823 (1.64), 2.838 (1.43), 2.852 (1.60), 2.867 (1.00), 2.880 (0.53), 2.895 (0.28), 3.048 (0.78), 3.075 (1.52), 3.080 (1.51), 3.108 (0.89), 3.352 (1.71), 3.384 (1.36), 3.468 (0.45), 3.497 (0.83), 3.527 (0.41), 3.566 (2.74), 4.277 (0.03), 4.294 (0.03), 4.445 (2.34), 4.460 (4.57), 4.475 (2.28), 5.937 (2.16), 8.958 (0.23), 11.379 (0.08).
Пример 467
Пропил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло [1,5-а]пиримидин-3-карбоксилат гидрохлорид
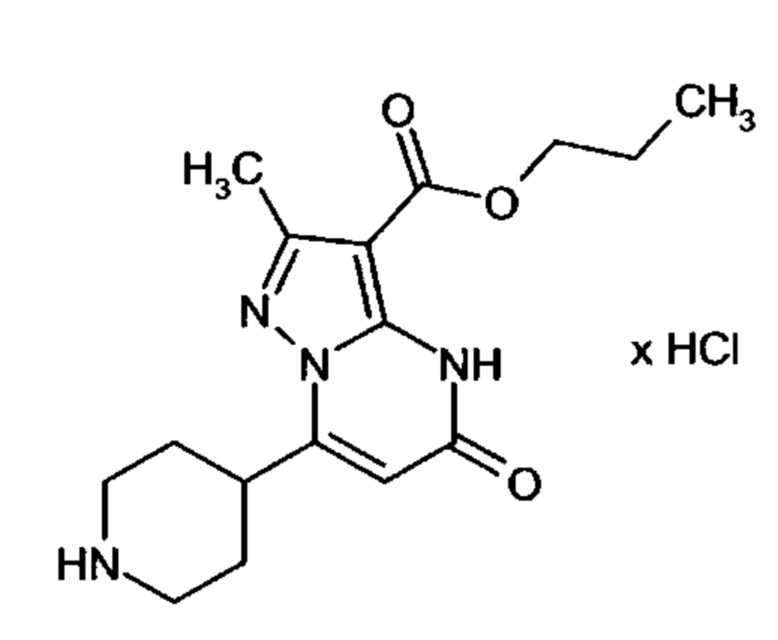
3 пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (78.3 мг, 187 мкмоль) добавили в 1,4-диоксан (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (700 мкл, 4.0 М, 2.8 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. В результате высушивания в вакууме получили продукт. Полученное количество составило 49.2 мг (100% чистота, 74% теоретический выход).
LC-MS (Способ 11B): Rt=0.85 мин; MS (ESIpos): m/z=319 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.21), -0.010 (1.79), 0.006 (1.69), 0.144 (0.22), 0.765 (0.05), 0.906 (4.55), 0.924 (10.38), 0.943 (5.04), 1.072 (0.14), 1.079 (0.06), 1.089 (0.27), 1.107 (0.13), 1.146 (0.13), 1.412 (0.05), 1.594 (0.05), 1.658 (0.38), 1.676 (1.60), 1.693 (3.17), 1.712 (3.10), 1.729 (1.51), 1.747 (0.35), 1.827 (0.82), 1.856 (0.88), 1.887 (0.35), 2.072 (0.06), 2.137 (1.59), 2.170 (1.29), 2.263 (0.08), 2.327 (0.11), 2.331 (0.08), 2.365 (0.17), 2.427 (16.00), 2.523 (0.26), 2.525 (0.27), 2.570 (0.09), 2.579 (0.08), 2.585 (0.13), 2.664 (0.09), 2.669 (0.12), 2.673 (0.09), 2.709 (0.18), 3.054 (0.73), 3.085 (1.52), 3.117 (0.85), 3.358 (1.72), 3.391 (1.50), 3.469 (0.48), 3.498 (0.87), 3.528 (0.44), 3.566 (1.60), 4.184 (2.58), 4.201 (5.36), 4.217 (2.53), 5.929 (1.63), 8.857 (0.20), 11.258 (0.10).
Пример 468
Трет-бутил 2-метил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
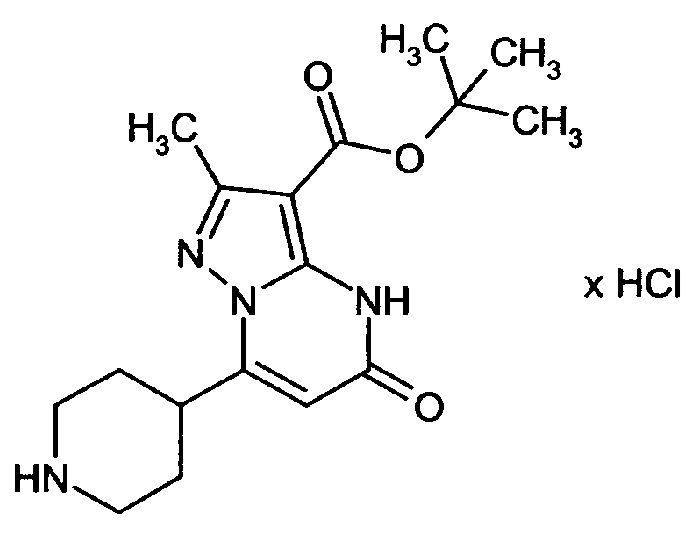
трет-бутил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-метил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат (82.5 мг, 191 мкмоль) добавили в 1,4-диоксан (2.0 мл, 23 ммоль) и обработали соляной кислотой в 1,4-диоксане (720 мкл, 4.0 М, 2.9 ммоль) при комнатной температуре в течение 16 ч. Растворители удалили, добавили ацетонитрил, и полученный осадок отфильтровали и промыли ацетонитрилом. После высушивания в вакууме остаток растворили в метаноле, отфильтровали через колонку PL-НСО3 MP, и высушивали в вакууме. Остаток добавили в 1,4-диоксане (5.0 мл) и обработали соляной кислотой в 1,4-диоксане (200 мкл, 4.0 М). В результате высушивания в вакууме получили продукт. Полученное количество составило 25.8 мг (95% чистота, 35% теоретический выход).
LC-MS (Способ 10В): Rt=1.22 мин; MS (ESIpos): m/z=333 [М+Н]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.151 (0.09), -0.010 (0.79), 0.007 (0.76), 0.145 (0.09), 0.853 (0.01), 1.146 (0.05), 1.234 (0.11), 1.384 (0.06), 1.412 (0.02), 1.545 (16.00), 1.701 (0.06), 1.778 (0.11), 1.810 (0.32), 1.841 (0.34), 1.868 (0.14), 2.135 (0.50), 2.168 (0.41), 2.235 (0.03), 2.323 (0.03), 2.327 (0.04), 2.331 (0.03), 2.366 (0.06), 2.398 (5.62), 2.523 (0.11), 2.525 (0.11), 2.586 (0.02), 2.664 (0.04), 2.669 (0.05), 2.673 (0.03), 2.709 (0.06), 3.056 (0.22), 3.087 (0.45), 3.117 (0.26), 3.361 (0.57), 3.393 (0.47), 3.461 (0.17), 3.490 (0.28), 3.520 (0.14), 3.566 (10.63), 3.665 (0.03), 3.669 (0.02), 3.680 (0.03), 3.698 (0.03), 3.707 (0.02), 3.712 (0.03), 3.732 (0.02), 3.743 (0.02), 3.754 (0.02), 4.328 (0.02), 5.929 (0.72), 7.481 (0.04), 7.500 (0.08), 7.519 (0.06), 7.605 (0.03), 7.608 (0.02), 7.623 (0.04), 7.642 (0.01), 7.932 (0.07), 7.935 (0.08), 7.953 (0.07), 8.683 (0.05), 8.825 (0.06), 10.658(0.06).
Пример 469
2-(метилсульфанил)-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты гидрохлорид
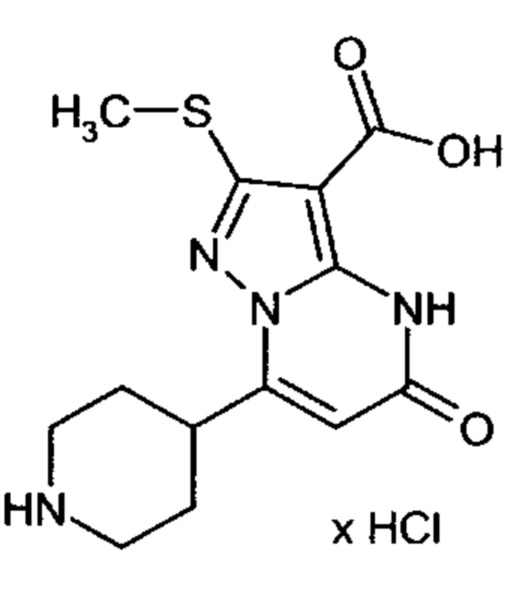
Смесь 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоновой кислоты (50.0 мг, 122 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 2.0 мл) в 1,4-диоксане (1.0 мл) перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали и суспендировали в простом диэтиловом эфире. Твердое вещество отфильтровали и затем лиофилизовали с получением соединения, указанного в названии. Полученное количество составило 35.6 мг (100% чистота, 84% теоретический выход).
LC-MS (Способ 8В): Rt=0.21 мин; MS (ESIpos): m/z=309 [М+Н-xHCl]+
1Н-ЯМР (500 МГц, Оксид дейтерия) delta [ppm]: -0.014 (2.48), 1.874 (0.68), 1.899 (2.03), 1.923 (2.03), 1.946 (0.90), 2.393 (2.70), 2.421 (2.48), 2.502 (16.00), 3.196 (1.58), 3.221 (2.93), 3.246 (1.58), 3.503 (0.90), 3.527 (1.35), 3.550 (0.90), 3.587 (2.93), 3.612 (2.70), 4.576 (0.68), 4.579 (0.68), 4.600 (0.68), 4.610 (0.90), 4.621 (0.90), 4.872 (1.13), 4.874 (1.13), 4.895 (0.68), 4.902 (0.68), 4.910 (0.68), 6.004 (5.18).
Пример 470
Пропил 2-(метилсульфанил)-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
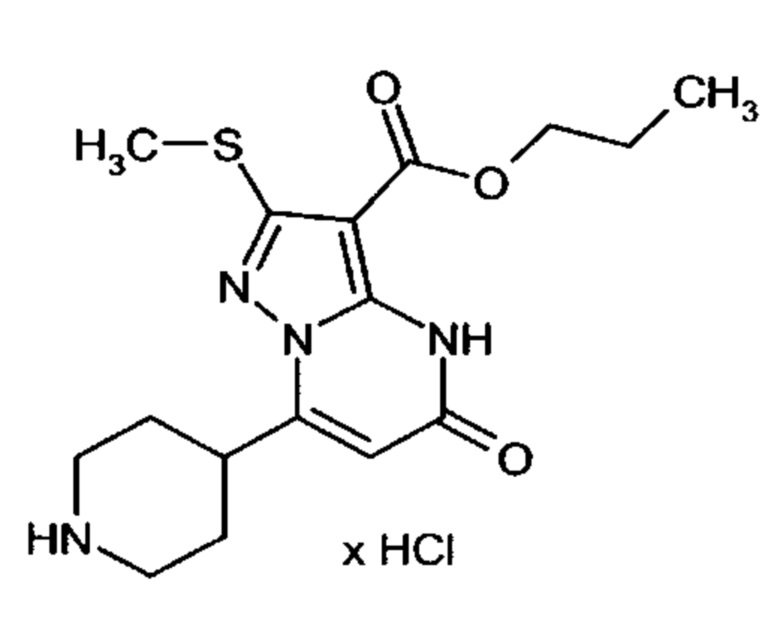
Смесь пропил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (84.6 мг, 188 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 1.0 мл) в 1,4-диоксане (1.0 мл) перемешивали 4 ч при комнатной температуре. Реакционную смесь концентрировали и суспендировали в простом диэтиловом эфире. Твердое вещество отфильтровали и затем лиофилизовали с получением соединения, указанного в названии. Полученное количество составило 26.9 мг (100% чистота, 37% теоретический выход).
LC-MS (Способ 8В): Rt=0.80 мин; MS (ESIpos): m/z=351 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 0.912 (3.28), 0.931 (6.89), 0.949 (3.70), 1.648 (0.42), 1.665 (1.45), 1.682 (2.70), 1.700 (2.69), 1.718 (1.40), 1.734 (0.39), 1.814 (0.53), 1.846 (1.46), 1.878 (1.58), 1.906 (0.69), 2.137 (0.49), 2.168 (2.22), 2.200 (1.85), 2.519 (16.00), 2.617 (0.29), 3.068 (1.64), 3.371 (2.43), 3.402 (2.07), 3.452 (1.14), 3.471 (0.56), 3.480 (0.62), 4.172 (2.26), 4.188 (4.27), 4.205 (2.20), 5.924 (1.56), 8.669 (0.29), 8.691 (0.36), 8.700 (0.35), 8.705 (0.36), 8.708 (0.35), 8.710 (0.35), 8.722 (0.35), 8.727 (0.35), 8.729 (0.34), 8.742 (0.32), 8.750 (0.31), 8.905 (0.35), 8.925 (0.45), 8.931 (0.44), 8.942 (0.42), 8.953 (0.41), 8.962 (0.38), 8.971 (0.34), 8.978 (0.30), 11.410 (0.32), 11.414(0.34), 11.422 (0.33), 11.428 (0.34), 11.438 (0.32), 11.451 (0.28).
Пример 471
Пропан-2-ил 2-(метилсульфанил)-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
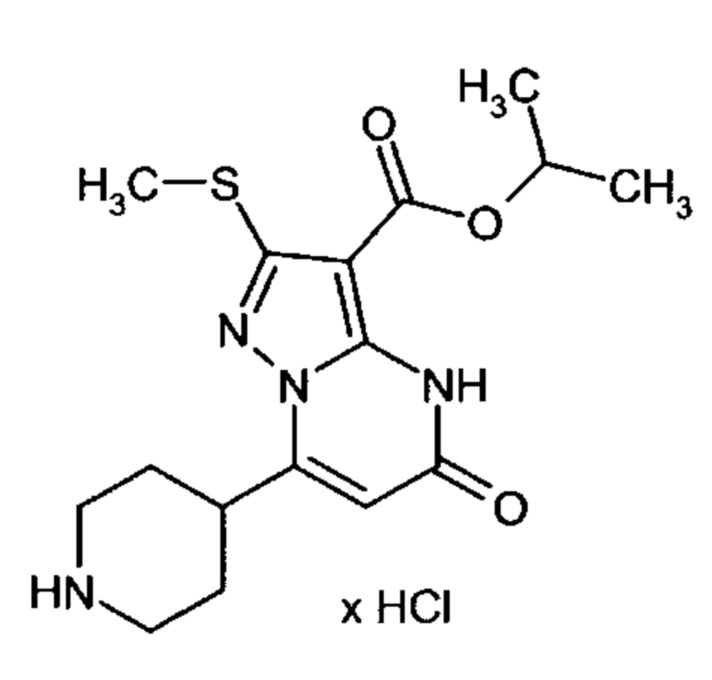
Смесь пропан-2-ил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-(метилсульфанил)-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (35.1 мг, 77.9 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 1.0 мл) в 1,4-диоксане (1.0 мл) перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали и суспендировали в простом диэтиловом эфире. Твердое вещество отфильтровали и очистили посредством препаративной ВЭЖХ (градиент ацетонитрил/вода с 0.1% муравьиной кислотой). Фракции, содержащие продукт, объединили, разбавили соляной кислотой (1Н раствор в воде) и концентрировали с получением соединения, указанного в названии. Полученное количество составило 14.9 мг (100% чистота, 49% теоретический выход).
LC-MS (Способ 8B): Rt=0.79 мин; MS (ESIpos): m/z=351 [M+H-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: 1.304 (15.93), 1.319 (16.00), 1.853 (0.96), 1.884 (1.04), 1.916 (0.42), 2.158 (1.48), 2.191 (1.21), 3.028 (0.71), 3.058 (1.43), 3.089 (0.81), 3.363 (1.66), 3.394 (1.35), 3.450 (0.81), 3.480 (0.40), 5.073 (0.43), 5.089 (1.16), 5.104 (1.59), 5.120 (1.15), 5.136 (0.43), 5.918 (1.52), 8.979 (0.17).
Пример 472
Этил 2-этил-5-оксо-7-(пиперидин-4-ил)-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилат гидрохлорид
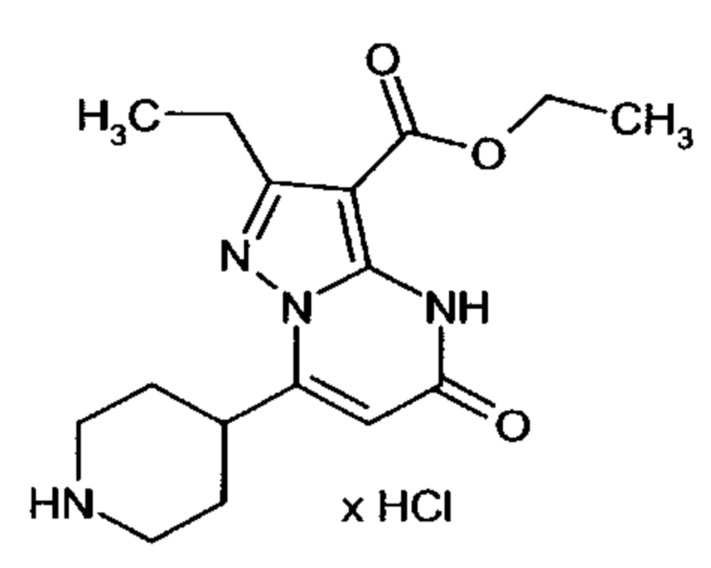
Смесь этил 7-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-2-этил-5-оксо-4,5-дигидропиразоло[1,5-а]пиримидин-3-карбоксилата (43.0 мг, 103 мкмоль) и соляной кислоты (4Н раствор в 1,4-диоксане, 2.0 мл) в 1,4-диоксане (2.0 мл) перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, растворили в воде и лиофилизировали с получением соединения, указанного в названии. Полученное количество составило 38.0 мг (95% чистота, 99% теоретический выход).
LC-MS (Способ 8В): Rt=0.70 мин; MS (ESIpos): m/z=319 [М+Н-xHCl]+
1Н-ЯМР (400 МГц, DMSO-d6) delta [ppm]: -0.009 (1.65), 0.007 (1.30), 1.146 (0.26), 1.191 (6.98), 1.210 (15.99), 1.229 (7.34), 1.265 (7.02), 1.283 (16.00), 1.300 (7.19), 1.787 (0.53), 1.820 (1.44), 1.843 (1.57), 1.875 (0.68), 2.150 (2.19), 2.183 (1.80), 2.366(0.45), 2.710 (0.45), 2.821 (1.79), 2.839 (5.50), 2.858 (5.39), 2.877 (1.66), 3.067 (1.07), 3.095 (2.06), 3.126 (1.21), 3.366 (2.51), 3.397 (2.02), 3.461 (0.69), 3.491 (1.29), 3.566 (0.58), 3.592 (1.09), 3.684 (0.31), 3.699 (0.30), 3.732 (0.35), 4.018 (0.21), 4.266 (1.93), 4.284 (6.30), 4.302 (6.25), 4.319 (1.93), 4.645 (0.42), 5.933 (2.86), 8.778 (0.27).
В. Оценка фармакологической активности
Применяются следующие аббревиатуры:

Фармакологический эффект соединений формулы (I-A) или (I-B) согласно настоящему изобретению может быть показан в следующих анализах:
В-1. Biacore анализ
Описание анализа поверхностного плазмонного резонанса Plasminogen Inh.
Определения
Термин «поверхностный плазмонный резонанс», используемый в настоящей заявке, относится к оптическому явлению, которое позволяет анализировать обратимые ассоциации биологических молекул в реальном времени в матрице биосенсора, например, с использованием системы Biacore® (GE Healthcare Biosciences, Uppsala, Швеция). Biacore® использует оптические свойства поверхностного плазмонного резонанса (SPR) для обнаружения изменений в показателе преломления буфера, который изменяется, когда молекулы в растворе взаимодействуют с мишенью, иммобилизованной на поверхности. Вкратце, белки ковалентно связаны декстрановой матрицей при известной концентрации, и лиганд для белка впрыскивается через декстрановую матрицу. Ближний инфракрасный свет, направленный на противоположную сторону поверхности сенсорного чипа, отражается и индуцирует затухающую волну в золотой пленке, которая, в свою очередь, вызывает падение интенсивности в отраженном свете под определенным углом, известным как угол резонанса. Если показатель преломления поверхности сенсорного чипа изменен (например, в результате связывания соединения с белком, связанным с поверхностью) происходит сдвиг в угле резонанса. Этот сдвиг угла можно измерить. Эти изменения отображаются по времени вдоль оси у сенсограммы, которая отображает ассоциацию и диссоциацию любой биологической реакции. Дальнейшие описания смотрите в Jonsson U et al al, 1993 Ann Biol Clin.; 51(1):19-26.; Johnsson В et al, Anal Biochem. 1991; 198(2):268-77.; Day Y et al, Protein Science, 2002; 11, 1017-1025; Myskza DG, Anal Biochem, 2004; 329, 316-323
Термин "KD", как применяется в настоящей заявке, предназначен для обозначения константы диссоциации конкретного комплекса соединения/целевого белка.
Биологическая активность
Биологическую активность (например, в качестве ингибиторов плазминогена) соединений согласно настоящему изобретению можно измерить с использованием анализов, приведенных в Примерах ниже, например, экспериментах поверхностного плазмонного резонанса (SPR), описанных в примере 1. Уровень активности, проявляемый данным соединением в анализе SPR, может быть определено в значения KD.
Пример 1
Способность соединений согласно настоящему изобретению связывать белок плазминогена человека может быть определена с использованием поверхностного плазмонного резонанса (SPR). Значения KD могут быть измерены с использованием устройства Biacore® Т200 или Biacore® 4000 (GE Healthcare, Uppsala, Sweden).
Клонирование, экспрессия и очистка домена kringle 1 рекомбинантного человеческого плазминогена выполняются в соответствии с протоколом, основанным на опубликованных способах (Menhart et al, Biochemistry, 1991, 30, 1948-1957) со следующими модификациями: Вкратце, экспрессионная конструкция E.coli, кодирующая аминокислотную последовательность аминокислоты
 за которой следуют аминокислоты 101-181 последовательности домена kringle 1 человеческого плазминогега (нумерация основана на Uniprot асе №Р00747) и стоп-кодон, синтезируется (GeneArt, Regensburg, Germany) и клонируется в модифицированный вектор pET22b (Novagen, Darmstadt, Germany), обеспечивая периплазматическую экспрессию в E.coli и иммобилизованную аффинную хроматографию на ионах металлов с использованием дека-гистидиновой метки. Клетки Е. coli BL21DE3 (Novagen) трансформируют, выращивают и собирают, и их периплазматическую фракцию выделяют с использованием буфера, содержащего 50 мМ Трис рН 8 и 500 мМ сахарозы (модифицированный на основе Menhart et al, Biochemistry, 1991, 30, 1948-1957). Затем периплазматическую фракцию отфильтровывают, используя 8 мкм, 3 мкм и 1,2 мкм фильтры на основе нитрата целлюлозы (Sartorius Stedim,
за которой следуют аминокислоты 101-181 последовательности домена kringle 1 человеческого плазминогега (нумерация основана на Uniprot асе №Р00747) и стоп-кодон, синтезируется (GeneArt, Regensburg, Germany) и клонируется в модифицированный вектор pET22b (Novagen, Darmstadt, Germany), обеспечивая периплазматическую экспрессию в E.coli и иммобилизованную аффинную хроматографию на ионах металлов с использованием дека-гистидиновой метки. Клетки Е. coli BL21DE3 (Novagen) трансформируют, выращивают и собирают, и их периплазматическую фракцию выделяют с использованием буфера, содержащего 50 мМ Трис рН 8 и 500 мМ сахарозы (модифицированный на основе Menhart et al, Biochemistry, 1991, 30, 1948-1957). Затем периплазматическую фракцию отфильтровывают, используя 8 мкм, 3 мкм и 1,2 мкм фильтры на основе нитрата целлюлозы (Sartorius Stedim,  Germany), и фильтрат, подвергают хроматографии Ni-сефароза HP (GE Healthcare) в соответствии с инструкциями производителя. Полученный элюат затем наносят на колонку Desalting Hi Prep 26/10 (GE Healthcare), уравновешенную буфером (100 мМ фосфата натрия рН 8, 300 мМ NaCl) с последующей стадией хроматографии на сефарозе 4В с лизином (GE Healthcare) в соответствии с инструкциями производителя. Полученные фракции высокоочищенного белка при концентрациях около 0,5 мг/мл подвергают замене буфера относительно буфера (100 мМ фосфата натрия рН 8, 300 мМ NaCl) и хранят при -80°С.
Germany), и фильтрат, подвергают хроматографии Ni-сефароза HP (GE Healthcare) в соответствии с инструкциями производителя. Полученный элюат затем наносят на колонку Desalting Hi Prep 26/10 (GE Healthcare), уравновешенную буфером (100 мМ фосфата натрия рН 8, 300 мМ NaCl) с последующей стадией хроматографии на сефарозе 4В с лизином (GE Healthcare) в соответствии с инструкциями производителя. Полученные фракции высокоочищенного белка при концентрациях около 0,5 мг/мл подвергают замене буфера относительно буфера (100 мМ фосфата натрия рН 8, 300 мМ NaCl) и хранят при -80°С.
Для измерений SPR kringle 1 рекомбинантного белка плазминогена человека иммобилизуют, используя стандартное связывание амина (Johnsson В et al, Anal. Biochem, 1991, Nov. 1, 198 (2): 268-77). Кратко, карбоксиметилированные декстрановые биосенсорные чипы (СМ5, GE Healthcare) активируются с помощью N-этил-N'-(3-диметиламинопропил)-карбодиимид гидрохлорида (EDC) и N-гидроксисукцинимида (NHS) в соответствии с инструкциями производителя. Очищенный kringle 1 рекомбинантного белка плазминогена человека разбавили в 10 мм ацетата натрия до рН 4,5 до 10 мкг/мл и впрыснули на активированную поверхность чипа. Затем вводят 1 М этаноламин-HCl (GE Healthcare), чтобы блокировать непрореагировавшие группы, с получением около 400 единиц ответа (RU) иммобилизованного белка. Контрольную поверхность получают обработкой NHS-EDC и этаноламином-HCl. Соединения растворили в водном 1% об./об. растворе уксусной кислоты до концентрации 20 мм, затем добавили 1 объем 100% диметилсульфоксида (DMSO, Sigma-Aldrich, Germany), с получением концентрации соединения 10 мм, и впоследствии разбавили в подвижном буфере (PBS, рН 7,4, 0,05% об./об. Surfactant Р-20 (GE Healthcare), 1% об./об. DMSO). Для измерений аффинности впрыскивали пятикратные серийные разведения соединения (от 0,64 нм до 10 мкм) над иммобилизованным белком. Полученные сенсограммы дважды сравнили с контрольной поверхности, а также с впрыскиванием среды. Результаты двойного контроля, полученные в установившемся режиме, нанесли на график относительно концентрации тестового соединения, и получили соответствие, применяя уравнение Результат = Rmax*[соединение]/([соединение]+KD) + смещение. Параметры Rmax (результат при насыщении), KD (константа диссоциации) и смещение вычисляются с использованием нелинейного приближения методом наименьших квадратов, как применяется в программном обеспечении для оценки Biacore® (GE Healthcare).
В-2. Анализ растворения тромба на основе плазмы (5%)
Система тестирования для определения растворения тромба конфигурирует кинетику образования и разрушения тромба in vitro и позволяет количественно модулировать процесс выбранными тестовыми соединениями.
Тестовые соединения растворили в 1% уксусной кислоте и дополнительно дополнили равным объемом DMSO. Полученные сток-растворы серийно разбавили в 0,5% уксусной кислоты/50% DMSO. Аликвоты, объемом 1 мкл, этих растворов поместили на 384-луночные микропланшеты (Greiner, черный, прозрачное дно), а затем добавили 30 мкл разбавленной цитратной плазмы человека (не обогащена тромбоцитами, конечная концентрация: 5%, дополнена фибриногеном, конечная концентрация: 3 мкм; буфер для разведения: 20 мм HEPES, 150 мм NaCl, 0,01% Brij (рН 7)). Реакции запустили путем добавления 20 мкл CaCl2 (конечная концентрация: 10 мм) и tPA (тканевый активатор плазминогена, конечная концентрация: 0,2 нм) в буфере для разведения, а затем добавили дополнительный объем 20 мкл буфера для разведения для улучшения смешивания. Реакции инкубировали при 37°С. Образование и разрушение тромбов контролировали спектрофотометрически с помощью кинетических измерений оптической плотности при 405 нм. Значение IC50 определили путем сравнения полученных временных ходов с временным ходом пустой контрольной реакции.
Результаты В-2.

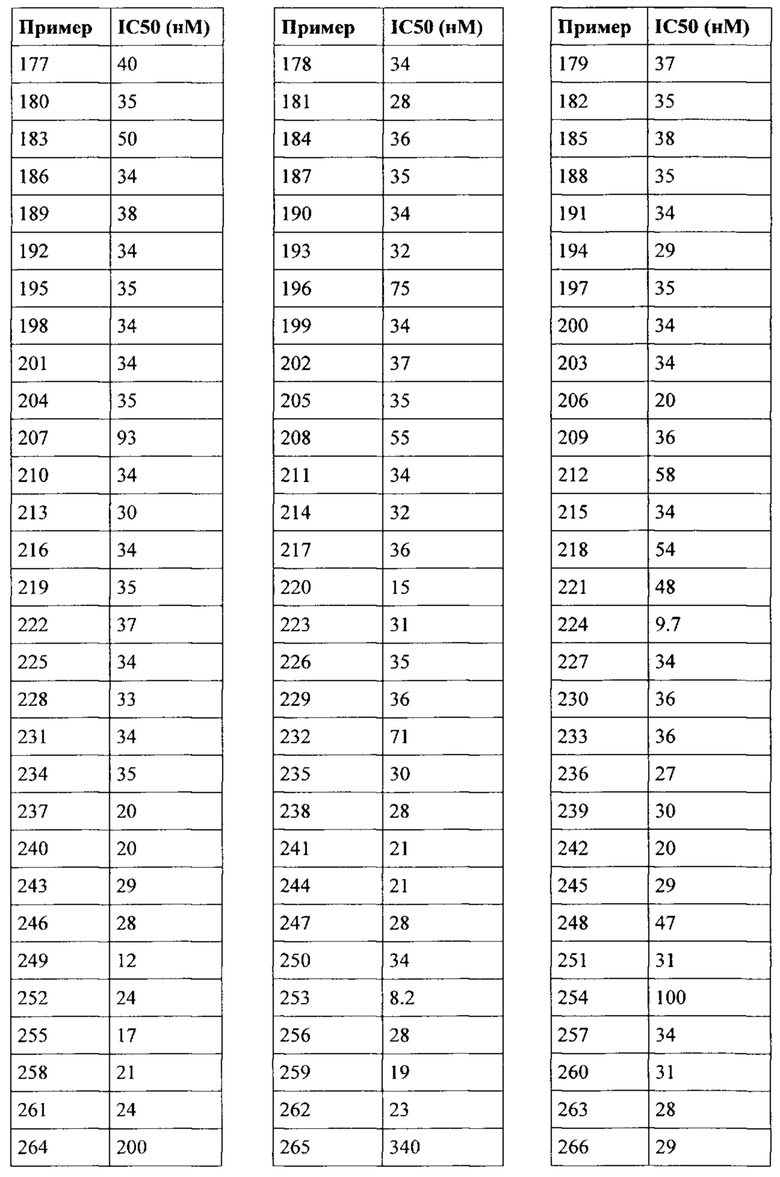
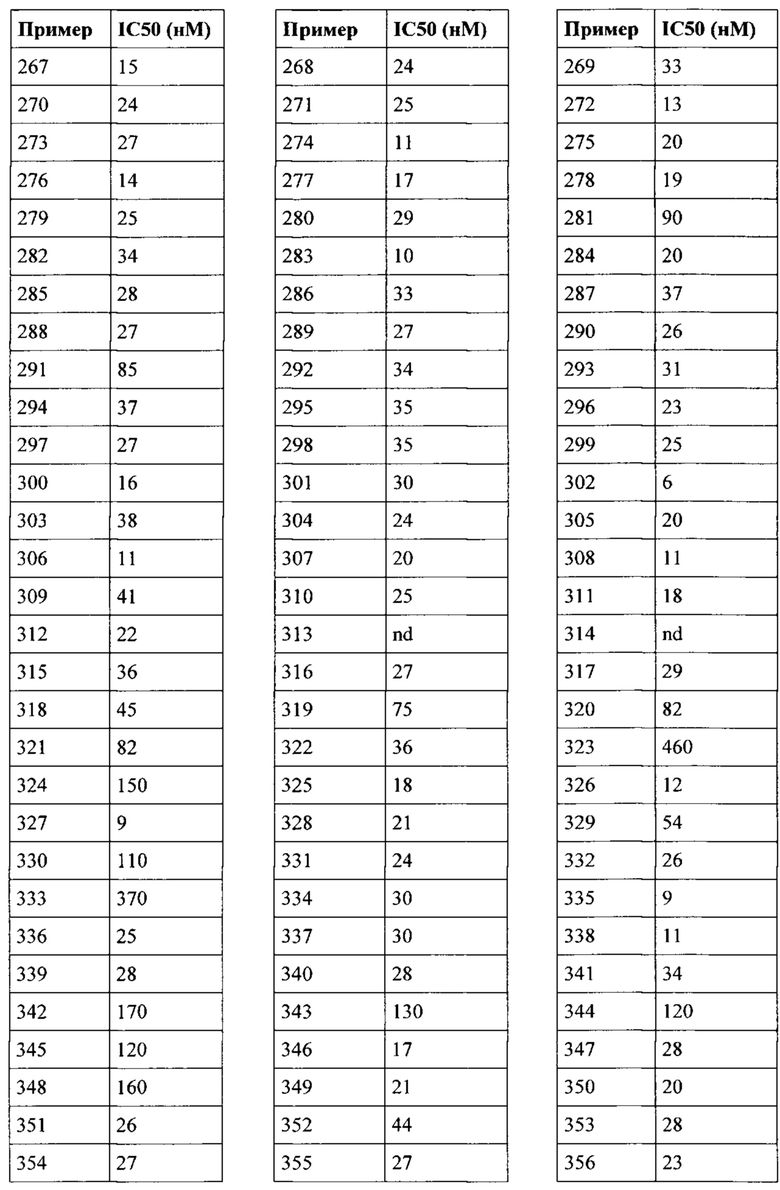

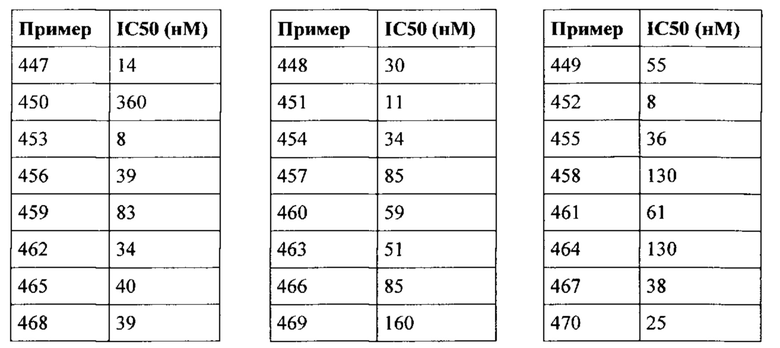
В-3. Анализ растворения тромба на основе плазмы (85%)
Для индукции образования сгустка (тромба) и последующего лизиса сгустка (фибринолиза) смесь тканевого фактора (1 пМ) и активатора тканевого плазминогена (tPA, 0,04 мкм) добавили в плазму человека (конечная концентрация 85%). Тестовые соединения или контроли на основе физиологического раствора добавили одновременно к TF и tPA. Функциональная активность запускается с помощью CaCl2 (12,5 мм) и контролируется путем измерения оптической плотности при 405 нм (OD405). Фибринолиз оценивали как относительное уменьшение OD после максимального образования сгустка. (Sperzel М, Huetter J, 2007, J Thromb Haemost 5 (10): 2113-2118).
B-4. Тромбоэластометрия
Измерения тромбоэластометрия цельной крови проводятся для подтверждения эффективности соединений в ингибировании фибринолиза и повышении стойкости сгустков (как видно в анализах на основе плазмы), например, с использованием системы ROTEM® (Tem International GmbH, Мюнхен, Германия). Система ROTEM® является диагностическим (вязкоупругим) методом, который предоставляет информацию о гемостазе. Он включает в себя четырехканальное устройство, компьютер, активаторы и одноразовые чашки и стержни. Кинетические изменения в образце крови обнаруживаются оптически (отражение света), и данные, полученные из отраженного света, затем обрабатываются в графический вид интегрированным компьютером. Получают характерные кривые и числовые параметры. Тромбоэластографические параметры гемостатической системы ROTEM® включают: Время свертывания (СТ), которое отражает время реакции (время, необходимое для получения амплитуды 2 мм после начала сбора данных), чтобы инициировать свертывание крови; время образования сгустка (CFT), дает информацию о кинетике образования сгустка; угол альфа, чтобы отразить распространение свертывания. Максимальная прочность сгустка (MCF) определяется как максимальная амплитуда, которая отражает стойкость сгустка (качество сгустка), и Максимальный лизис (мл) указывает на фибринолиз. Для индукции образования сгустка и последующего лизиса (растворения) сгустка смесь тканевого фактора (TF) и тканевого активатора плазминогена (tPA) добавляется к 300 мкл свежесобранной цитратной цельной крови. Может применяться кровь пациентов с нарушениями коагуляции и антителами против факторов коагуляции (например, для нейтрализации активности FVIII и воспроизведения гемофилии). Концентрации TF и tPA корректируются в зависимости от различных условий и видов, из которых извлекается цельная кровь. Данные собираются в течение 2 часов, используя систему ROTEM® с компьютерным управлением.
Для индукции образования сгустка и последующего лизиса сгустка в цельной крови человека или человеческой цельной крови, обедненной фактором VIII, смесь тканевого фактора (конечная концентрация 0,5 пМ) и тканевого активатора плазминогена (tPA, конечная концентрация 10 нм) добавляют к 300 мкл цитратной человеческой цельной крови. Тестовые соединения или контроли добавляются одновременно к TF и tPA.
Для индукции образования сгустка и последующего лизиса сгустка (фибринолиза) в цельной крови крыс, смесь тканевого фактора (конечная концентрация 1 пМ) и тканевого активатора плазминогена (tPA, конечная концентрация 50 нм) добавляют к 300 мкл цитратной цельной крови крыс. Тестовые соединения или контроли добавляются одновременно к TF и tPA. Или в случае экспериментов ex vivo тестовые соединения дозируются животному, кровь отбирается в различные моменты времени после введения и добавляется в тестовую чашку.
Для индукции образования сгустка и последующего лизиса сгустка (фибринолиза) в плазме или цельной крови собаки с гемофилией А, смесь тканевого фактора (TF) и тканевого активатора плазминогена (tPA) добавляют к 300 мкл цитратной цельной крови или плазмы собаки с гемофилией А. Концентрации TF и tPA титруют и корректируют в соответствии с текущими потребностями и техническими требованиями. Различные концентрации rFVIII добавляют в тестовую систему in vitro (1-100%). Тестовые соединения или контроли добавляются одновременно к TF и tPA. В случае экспериментов ex vivo тестовые соединения дозируются животному, кровь отбирается в различные моменты времени после введения и добавляется в тестовую чашку.
В-5. In vivo анализ
Для определения защитного влияния соединений на стабильность сгустка и кровопотерю in vivo используются различные модели кровотечений различных видов. Животные могут быть антикоагулированы различными антикоагулянтами, чтобы вызвать тенденцию к кровотечению. Могут быть использованы генетически модифицированные животные для имитации нарушения свертываемости крови, или могут быть введены антитела для нейтрализации активности различных факторов свертываемости крови. Соединения согласно настоящему изобретению вводят перорально или парентерально при различных указанных дозах в ходе различных временных промежутков до травмы. Травмы и конечные точки могут варьироваться в зависимости от состояния имитируемой болезни.
В-5.1 Кровотечение при надрезе хвоста у гиперфибринолитических крыс
У анестезированных крыс гиперфибринолиз индуцируется непрерывной инфузией tPA (8 мг/кг/ч) в течение двадцати пяти минут через правую яремную вену. Правая яремная вена обнажена и канюлирована заполненными физиологическим раствором полиэтил енированными катетерами. Катетер соединяют со шприцевым насосом (Braun, Melsungen, Germany) в ходе инфузии tPA. Гемостатическую эффективность оценивали на модели кровотечения у крыс, где непрерывно вводили 8 мг/кг/ч tPA, чтобы продлить время кровотечения выше контрольных значений. Тестовые соединения или носитель вводили через желудочный зонд в различные моменты времени до вводного наркоза или внутривенно через второй катетер в контралатеральную яремную вену, начиная с 10 минут после начала инфузии tPA. Все инфузии прекращали через двадцать пять минут после начала введения tPA. Через 20 минут после начала инфузии tPA хвост крысы полностью перерезается на расстоянии 2 мм от кончика хвоста. Хвост погружали в физиологический раствор с температурой 37°С, и кровотечение наблюдали в течение 30 минут. Время кровотечения определяли как интервал между первоначальным перерезанием и визуальным прекращением кровотечения. Значение 30 минут присваивается тем животным, у которых кровотечение не прекращается в течение всего периода наблюдения.
В-5.2 Кровотечение при надрезе хвоста у крыс, антикоагулированных дабигатраном
Животных обрабатывают перорально в разные моменты времени до индукции кровотечения. У анестезированных, антикоагулированных крыс кровотечение индуцируется болюсом и непрерывной инфузией (яремной вены) ингибитора тромбина Дабигатрана (болюс 1 мг/кг с последующей инфузией 0,3 мг/кг/мл/ч) в течение 15 минут. Через 15 минут после инфузии Дабигатрана хвост крысы полностью перерезается на 2 мм от кончика хвоста. Кровотечение наблюдается в течение 30 минут после погружения хвоста в физиологический раствор с температурой 37°С. Потеря крови оценивается визуально с 30-секундными интервалами с использованием системы оценки (0 = отсутствие кровотока, 1 = слабое, отсутствие кровотока, 2 = снижение кровотока, 3 = непрерывный кровоток, 4 = сильный непрерывный кровоток). Оценивается начальное время кровотечения до первого визуального прекращения кровотечения, а также совокупное время кровотечения в течение всего периода наблюдения, равного 30 минут.
С. Примерные варианты выполнения фармацевтических композиций
Соединения формулы (I-A) или (I-B) согласно настоящему изобретению могут быть превращены в фармацевтические препараты следующими путями:
Таблетка:
Композиция:
100 мг соединения согласно настоящему изобретению, 50 мг лактозы (моногидрат), 50 мг кукурузного крахмала (немодифицированный), 10 мг поливинилпирролидона (PVP 25) (от BASF, Ludwigshafen, Germany) и 2 мг стеарата магния.
Масса таблетки 212 мг, диаметр 8 мм, радиус кривизны 12 мм.
Получение:
Смесь соединения согласно настоящему изобретению, лактозы и крахмала гранулировали с 5% раствором (мас./мас.) PVP в воде. Гранулы высушивали и затем смешивали со стеаратом магния в течение 5 минут. Эту смесь спрессовали в стандартном таблеточном прессе (смотрите выше для формата таблетки). Сжимающее усилие для сжатия составляет 15 кН.
Суспензия, которая может вводиться перорально:
Состав:
1000 мг соединения согласно настоящему изобретению, 1000 мг этанола (96%), 400 мг Rhodigel® (ксантановая камедь от FMC, Pennsylvania, USA) и 99 г воды.
10 мл пероральной суспензии соответствуют разовой дозе 100 мг соединения согласно настоящему изобретению.
Получение:
Rhodigel суспендировали в этаноле, и соединение согласно настоящему изобретению добавили к суспензии. Добавляют воду при перемешивании. Смесь перемешивают в течение около 6 часов, пока набухание Rhodigel не завершается.
Раствор, который может быть введен перорально:
Состав:
500 мг соединения согласно настоящему изобретению, 2,5 г полисорбата и 97 г полиэтиленгликоля 400. 20 г перорального раствора соответствуют разовой дозе 100 мг соединения согласно настоящему изобретению.
Получение:
Соединение согласно настоящему изобретению суспендируют в смесь полиэтиленгликоля и полисорбата при перемешивании. Процесс перемешивания продолжается до тех пор, пока соединение согласно настоящему изобретению не будет полностью растворено.
Внутривенный раствор:
Соединение согласно настоящему изобретению растворили при концентрации ниже растворимости при насыщении в физиологически приемлемом растворителе (например, изотонический раствор, 5% раствор глюкозы и/или 30% раствор ПЭГ 400). Полученный раствор стерилизовали путем фильтрации и применяли для заполнения стерильных и не содержащих пироген контейнеров для инъекций.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ ДИГИДРОПИРАЗОЛОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ HIF-ПРОЛИЛ-4-ГИДРОКСИЛАЗЫ | 2009 |
|
RU2509080C9 |
| ЗАМЕЩЕННЫЕ ДИГИДРОПИРАЗОЛОНЫ ДЛЯ ЛЕЧЕНИЯ КАРДИОВАСКУЛЯРНЫХ И ГЕМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ, ИХ ПРИМЕНЕНИЕ, ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ | 2012 |
|
RU2611012C2 |
| НОВЫЕ ПИРАЗОЛПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2769448C2 |
| ПРОИЗВОДНЫЕ 5-ОКСА-2-АЗАСПИРО[3.4]ОКТАНА В КАЧЕСТВЕ АГОНИСТОВ M4 | 2020 |
|
RU2820477C1 |
| НОВЫЕ АНТИГЕЛЬМИНТНЫЕ ХИНОЛИН-3-КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ | 2017 |
|
RU2772283C2 |
| ПРОИЗВОДНОЕ БЕНЗИМИДАЗОЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2832200C1 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ДИГИДРОПИРИМИДИНКАРБОКСАМИДА В КАЧЕСТВЕ ИНГИБИТОРОВ RHO-КИНАЗЫ | 2017 |
|
RU2778478C2 |
| НОВЫЕ АЗАХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2018 |
|
RU2773290C2 |
| НОВЫЕ АНТИГЕЛЬМИНТНЫЕ СОЕДИНЕНИЯ | 2019 |
|
RU2828007C2 |
| ДИПЕПТИДНОЕ ПРОЛЕКАРСТВО, ЕГО ПРИМЕНЕНИЕ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2013 |
|
RU2629558C2 |
Настоящее изобретение относится к новым замещенным пиперидинилпиразолопиримидинонам, имеющим структурную формулу (I-А), в которой радикалы и символы имеют определения, приведенные в формуле изобретения, к способам их получения, лекарственным средствам на их основе, их применению в способе лечения и/или профилактики заболеваний. В частности, они могут применяться для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, включающей тяжелое менструальное кровотечение, послеродовое кровотечение, геморрагический шок, геморрагический цистит, желудочно-кишечное кровотечение, травму, хирургическое вмешательство, трансплантацию, инсульт, заболевания печени, наследственный ангионевротический отек, кровотечение из носа и синовит и повреждение хряща после гемартроза. 4 н. и 14 з.п. ф-лы, 4 табл., 472 пр.
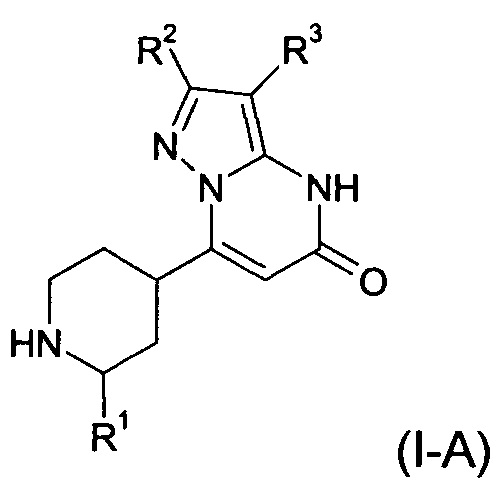
1. Соединение формулы (I-A)

в которой
R1 выбран из водорода и С1-С5 алкила;
R2 выбран из водорода, С1-С4 алкила, С3-С6 циклоалкила, С1-С4 галоалкила, карбоксила, С1-С4 алкилового сложного эфира, С1-С4 алкокси-С1-С4 алкила, галогена, метилсульфанила, фенила,
причем фенил необязательно замещен галогеном,
и
5-членного гетероарила, содержащего гетероатом серы;
R3 выбран из водорода, галогена, циано, С1-С4 алкила, причем алкил необязательно замещен ди-С1-С4 алкиламино, С1-С4 алкенила, С1-С4 алкилового сложного эфира, причем С1-С4 алкиловый сложный эфир необязательно замещен одним, двумя, тремя, четырьмя или пятью заместителями галоген, С3-С4 циклоалкилового сложного эфира, С3-С4 циклоалкила, карбоксила, -CO-NH2, бензилового сложного эфира, -NH-CO-фенила, -CS-NH2,
фенилсульфонила, причем фенилсульфонил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена,
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена и С1-С4 алкокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо,
или причем фенил необязательно замещен одним или двумя заместителями, выбранными из С1-С4 алкила, С1-С4 галоалкила, С1-С4 галоалкокси, циано, бензилокси, метилсульфонила и фенила,
причем фенил необязательно замещен С1-С4 галоалкилом,
5-6-членного гетероциклил-С1-С4 алкила, где гетероциклоалкил содержит 1 или 2 гетероатома, выбранных из азота, кислорода и серы, причем 5-6-членный гетероциклильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила и оксо;
5-6-членного гетероарила, содержащего 1-3 гетероатома, выбранных из азота, кислорода и серы, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из
С1-С6 алкила, С2-С6 алкенила, C1-C6 галоалкила, C1-C4 аминоалкила, C1-C4 алкилового сложного эфира, C1-C4 алкокси, С1-С4 галоалкокси, С1-С4 алкокси-С-1-С4 алкила, циано, гидроксила, карбоксила, С1-С4 алкил-SO2-С1-С4 алкила и -CO-NH2,
или 5-6-членный гетероарил необязательно замещен одним С3-С6 циклоалкильным заместителем,
причем С3-С6 циклоалкил необязательно замещен одним, двумя или тремя заместителями галоген или метил, или фенилом, причем фенил необязательно замещен С1-С4 алкокси или галогеном,
или 5-6-членный гетероарил необязательно замещен одним заместителем, выбранным из
метилбицикло-[2,2,1]-октила, бицикло-[3,3,0]-октила, бицикло-[2,2,2]-октила или бицикло-[3,2,1]-октила,
С3-С6 циклоалкил-С1-С4 алкила, С3-C6 циклоалкил-С1-С4 алкенила,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила, галогена, С1-С4 галоалкила, С1-С4 алкокси, С1-С4 галоалкокси, С1-С4-алкилового сложного эфира, нитро, амино, ди-С1-С4 алкиламина и циано,
фенил-С1-С4 алкила, причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, С1-C4 алкила, С1-С4 галоалкила, С1-С4 алкокси, С1-С4 галоалкокси и гидроксила,
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из C1-C4 алкила и гидроксила,
5-6-членного гетероциклоалкила, содержащего 1-2 гетероатома, причем 5-6-членный гетероциклоалкил необязательно замещен С3-С6 циклоалкилом или С1-C4 алкилом,
5-6-членного гетероциклоалкил-С1-С4 алкила, где гетероциклоалкил содержит 1-2 гетероатома, выбранных из азота и кислорода,
причем 5-6-членный гетероциклоалкильный фрагмент необязательно замещен С1-С4 алкилом или оксо,
причем С1-C4 алкильный фрагмент необязательно замещен С1-C4 алкилом,
5-6-членного гетероарила, содержащего 1-2 гетероатома, выбранных из азота, кислорода и серы, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из галогена, С1-C4 алкила и С1-С4 галоалкила,
и
5-6-членного гетероарил-С1-С4 алкила, где гетероарил содержит 1-3 гетероатома, выбранных из азота, кислорода и серы,
причем 5-6-членный гетероарильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С4 алкокси и С1-С4 алкила,
причем С1-С4 алкильный фрагмент необязательно замещен одним или двумя метильными заместителями;
-CO-R4, где
R4 выбран из группы С1-C4 алкила, где С1-С4 алкил необязательно замещен 1 или 2 метилами, и С3-С6 циклоалкила;
-CO-N(R5R7), где
R5 выбран из водорода и С1-С4 алкила;
R7 выбран из водорода, С1-С6 алкила, С1-С6 галоалкила, С1-С4-алкокси-С1-С4 алкила, амино-оксо-С1-С4 алкила, нафтила,
С3-С6 циклоалкила, причем С3-С6 циклоалкил необязательно замещен одним или двумя заместителями, выбранными из С1-С4 алкила,
С3-С6 циклоалкил-С1-С4 алкила, 5-6-членного гетероциклила, содержащего гетероатом кислорода, оксоимидазолидинил-С1-С4 алкила,
бензила, причем фенильный фрагмент бензила необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила, причем метильный фрагмент бензила необязательно замещен С1-С4 алкилом;
бензил-С3-С6 циклоалкила,
имидазолил-С1-С4 алкила, причем имидазолил-С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила,
оксазолил-С1-С4 алкила, причем оксазолил-С1-С4 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила,
оксазолидинон-С1-С4 алкила,
пиридинил-С1-С4 алкила,
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила, галогена и С1-C4 алкокси;
или
- N(R5R7) выбран из группы 5-7-членных циклических аминов, которые содержат один или два кольцевых атомов азота, ноль или один кольцевой атом кислорода и ноль или один кольцевой атом серы и присоединены через кольцевой атом азота, причем 5-7-членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из С1-С4 алкокси, С1-С4 алкокси С1-C4 алкила, оксо, гидроксила, галогена и C1-C4 алкила; или
- N(R5R7) выбран из группы двух конденсированных, частично насыщенных или насыщенных колец, каждое из которых является 5-7-членным и каждое содержит один или два кольцевых атомов азота и присоединены через кольцевой атом азота;
или
- N(R5R7) выбран из азаспиро[2,5]окт-5-ила и окса-азаспиро[3.5]нон-1-ила;
или
R2 и R3 вместе образуют С5-С6 циклоалкильное кольцо;
и его физиологически приемлемые соли.
2. Соединение формулы (I-В) по п. 1
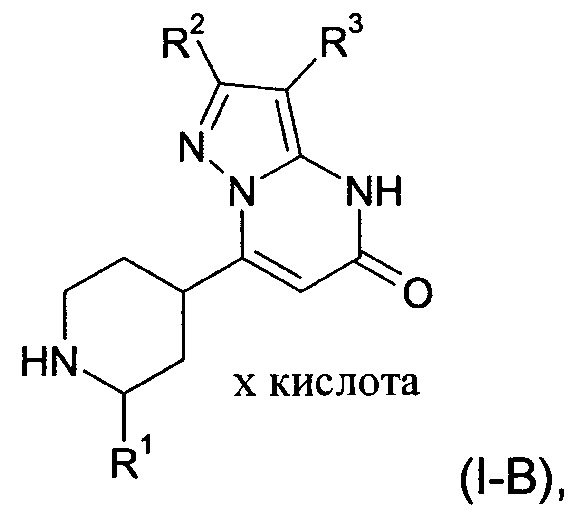
в которой R1, R2 и R3 имеют значения, как определено в п. 1, и кислотой является любая кислота, образующая физиологически приемлемую соль.
3. Соединение формулы (I-А) или (I-В) по п. 1 или 2, в котором
R1 выбран из водорода и С1-С5 алкила;
R2 выбран из водорода, С1-С2 алкила, С3-С4 циклоалкила, С1-С2 галоалкила, карбоксила, С1-С2 алкилового сложного эфира, С1-С2 алкокси- С1-С2 алкила, галогена, метилсульфанила, фенила,
причем фенил необязательно замещен заместителем,
выбранным из фтора и хлора,
и 5-членного гетероарила, содержащего гетероатом серы;
R3 выбран из водорода, брома, хлора, циано, метила, причем метил необязательно замещен ди-С1-С4 алкиламино, этила, С1-С4 алкенила, С1-С4 алкилового сложного эфира, причем С1-С4 алкиловый сложный эфир необязательно замещен одним, двумя или тремя заместителями фтор, С3-С4 циклоалкилового сложного эфира, С3-С4 циклоалкила, карбоксила, -CO-NH2, бензилового сложного эфира, -NH-CO-фенила, -CS-NH2,
фенилсульфонила, причем фенилсульфонил необязательно замещен одним или двумя заместителями, выбранными из хлора и фтора,
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из брома, хлора, фтора, этокси и метокси, где две соседние метокси группы необязательно могут образовывать диоксановое кольцо,
или причем фенил необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила, С1-С2 фторалкила, С1-С2 фторалкокси и циано,
или причем фенил необязательно замещен одним заместителем, выбранным из бензилокси, метилсульфонила и фенила,
причем фенил необязательно замещен С1-С2 фторалкилом,
пиролидинил-, морфолинил- или тиоморфолинил-С1-С2 алкила, причем пиролидинил-, морфолинил- или тиоморфолинил-фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила и оксо;
5-6-членного гетероарила, содержащего 1, 2 или 3 гетероатома, выбранных из кислорода, азота и серы, причем 5-6-членный гетероарил необязательно замещен одним или двумя заместителями, выбранными из
С1-С6 алкила, С2-С6 алкенила, С1-С4 галоалкила, С1-С2 аминоалкила, С1-С2 алкилового сложного эфира, С1-С2 алкокси, С1-C2 галоалкокси, С1-С2 алкокси-С1-С4 алкила, циано, гидроксила, карбоксила, С1-С2 алкил-SO2-С1-С2 алкила и -CO-NH2,
или 5-6-членный гетероарил необязательно замещен одним С3-С6 циклоалкильным заместителем,
причем С3-С6 циклоалкил необязательно замещен одним, двумя или тремя заместителями хлор, фтор или метил, или фенилом, причем фенил необязательно замещен С1-С2 алкокси, хлором или фтором,
или 5-6-членного гетероарила, необязательно замещенного одним заместителем, выбранным из
метилбицикло-[2,2,1]-октила, бицикло-[3,3,0]-октила, бицикло-[2,2,2]-октила или бицикло-[3,2,1]-октила,
С3-С6 циклоалкил-С1-С2 алкила, С3-С6 циклоалкил-С1-С4 алкенила,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила, хлора, фтора, С1-С2 фторалкила, С1-С2 алкокси, С1-C2 фторалкокси, С1-С2-алкилового сложного эфира, нитро, амино, ди-С1-С2 алкиламино и циано, фенил-С1-С2 алкила,
причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С2 алкила, С1-С2 фторалкила, С1-С2 алкокси, С1-С2 фторалкокси и гидроксила,
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила и гидроксила,
5-6-членного гетероциклоалкила, содержащего 1-2 гетероатома, причем 5-6-членный гетероциклоалкил необязательно замещен С3-С5 циклоалкилом или С1-С3 алкилом,
5-6-членного гетероциклоалкил-С1-С2 алкила, где гетероциклоалкил содержит 1-2 гетероатома, выбранных из азота и кислорода,
причем 5-6-членный гетероциклоалкильный фрагмент необязательно замещен С1-C2 алкилом или оксо,
причем С1-С2 алкильный фрагмент необязательно замещен С1-С2 алкилом,
5-6-членного гетероарила, содержащего 1-2 гетероатома, выбранных из азота, кислорода и серы, причем 5-6-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С3 алкила и С1-C2 фторалкила,
и
5-6-членного гетероарил-С1-С4 алкила, где гетероарил содержит 1-3 гетероатома, выбранных из азота, кислорода и серы,
причем 5-6-членный гетероарильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкокси и С1-С2 алкила,
причем С1-С2 алкильный фрагмент необязательно замещен одним или двумя метильными заместителями;
CO-R4, где
R4 выбран из группы С1-С4 алкила, где С1-С4 алкил необязательно замещен 1 или 2 метильными заместителями, и С3-С6 циклоалкила;
и
CO-N(R5R7), где
R5 выбран из водорода и С1-С4 алкила;
R7 выбран из С1-С4 алкила, С1-С4 галоалкила, С1-С2-алкокси-С1-С4 алкила, амино-оксо-С1-С4 алкила, нафтила,
С3-С6 циклоалкила, причем С3-С6 циклоалкил необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила,
С3-С6 циклоалкил-С1-С2 алкила, 5-6-членного гетероциклила, содержащего атом кислорода, оксоимидазолидинил-С1-С2 алкила,
бензила, причем фенильный фрагмент бензила необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила, причем метильный фрагмент бензила необязательно замещен С1-С2 алкилом;
бензил-С3-С4 циклоалкила,
имидазолил-С1-С2 алкила, причем имидазолил-С1-С2 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-C2 алкила,
оксазолил-С1-С2 алкила, причем оксазолил-С1-С2 алкил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила,
оксазолидинон-С1-С2 алкила,
пиридинил-С1-С2 алкила,
и
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С2 алкила, галогена и С1-С2 алкокси;
или
- N(R5R7) выбран из группы 5-7-членных циклических аминов, которые содержат один или два кольцевых атома азота, ноль или один кольцевой атом кислорода и ноль или один кольцевой атом серы и присоединены через кольцевой атом азота, причем 5-7-членные циклические амины необязательно замещены одним, двумя или тремя заместителями, выбранными из С1-С4 алкокси, С1-C2 алкокси С1-С2 алкила, оксо, гидроксила, галогена и С1-С3 алкила; или
- N(R5R7) выбран из группы, состоящей из октагидроизохинолина, 1,3-дигидро-2Н-изоиндола, гексагидропироло[1,2-а]пиразина, 2,3-дигидро-1Н-индола, октагидро-2Н-изоиндола, 3,4-дигидроизохинолина,
или
- N(R5R7) выбран из азаспиро[2.5]окт-5-ила и окса-азаспиро[3.5]нон-1-ила,
или
R2 и R3 вместе образуют С5-С6 циклоалкильное кольцо;
и его физиологически приемлемые соли.
4. Соединение формулы (I-А) или (I-В) по п. 1 или 2, в котором
R1 выбран из водорода и С1-С5 алкила;
R2 выбран из водорода, метила, этила, трифторметила и метилсульфанила;
R3 выбран из С1-С4 алкилового сложного эфира, причем С1-С4 алкиловый сложный эфир необязательно замещен одним, двумя или тремя заместителями фтор, С3-С4 циклоалкилового сложного эфира, С3-С4 циклоалкила,
5-членного гетероарила, содержащего 1, 2 или 3 гетероатома, выбранных из кислорода, азота и серы, причем 5-членный гетероарил необязательно замещен одним или двумя заместителями, выбранными из
C1-С6 алкила, С2-С6 алкенила, С1-С4 галоалкила, С1-С2 аминоалкила, С1-С2 алкилового сложного эфира, С1-С2 алкокси, С1-C2 галоалкокси, С1-С2 алкокси-С1-С4 алкила, циано, гидроксила, карбоксила, С1-С2 алкил-SO2-С1-С2 алкила и -CO-NH2,
или причем 5-членный гетероарил необязательно замещен одним С3-С6 циклоалкильным заместителем,
причем С3-С6 циклоалкил необязательно замещен одним, двумя или тремя заместителями хлор, фтор или метил, или фенилом, причем фенил необязательно замещен С1-С2 алкокси, хлором или фтором,
или 5-членного гетероарила, необязательно замещенного одним заместителем, выбранным из метилбицикло-[2,2,1]-октила, бицикло-[3,3,0]-октила, бицикло-[2,2,2]-октила или бицикло-[3,2,1]-октила,
С3-С6 циклоалкил-С1-С2 алкила, С3-С6 циклоалкил-С1-С4 алкенила,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из С1-С4 алкила, хлора, фтора, С1-С2 фторалкила, С1-С2 алкокси, С1-С2 фторалкокси, С1-С2-алкилового сложного эфира, нитро, амино, ди-С1-С2 алкиламино и циано, фенил-С1-С2 алкила,
причем фенильный фрагмент необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С2 алкила, С1-C2 фторалкила, С1-С2 алкокси, С1-С2 фторалкокси и гидроксила,
причем алкильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкила и гидроксила,
5-членного гетероциклоалкила, содержащего 1-2 гетероатома, причем 5-членный гетероциклоалкил необязательно замещен С3-С5 циклоалкилом или С1-С3 алкилом,
5-членного гетероциклоалкил-С1-С2 алкила, где гетероциклоалкил содержит 1-2 гетероатома, выбранных из азота и кислорода,
причем 5-членный гетероциклоалкильный фрагмент необязательно замещен С1-C2 алкилом или оксо,
причем С1-С2 алкильный фрагмент необязательно замещен С1-С2 алкилом,
5-членного гетероарила, содержащего 1-2 гетероатома, выбранных из азота, кислорода и серы, причем 5-членный гетероарил необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора, С1-С3 алкила и C1-C2 фторалкила,
и
5-членного гетероарил-С1-С4 алкила, где гетероарил содержит 1-3 гетероатома, выбранных из азота, кислорода и серы,
причем 5-6-членный гетероарильный фрагмент необязательно замещен одним или двумя заместителями, выбранными из С1-С2 алкокси и С1-C2 алкила,
причем С1-С2 алкильный фрагмент необязательно замещен одним или двумя метильными заместителями;
или
R2 и R3 вместе образуют C5-С6 циклоалкильное кольцо;
и его физиологически приемлемые соли.
5. Соединение формулы (I-А) или (I-В) по п. 1 или 2,
в котором
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из
1,2,4-оксадиазол-5-ила формулы
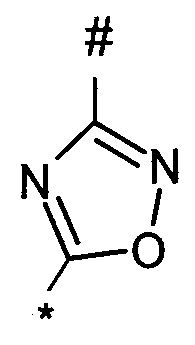 ,
,
или 1,3,4-оксадиазол-5-ила формулы
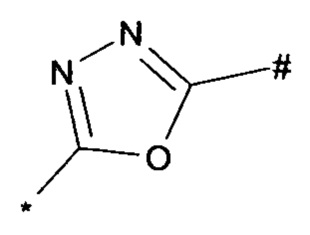 ,
,
или 1,2,4-оксадиазол-3-ила формулы
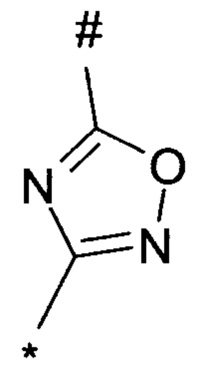 ,
,
где * означает положение связывания с пиразолпиримидоном и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен заместителем, выбранным из
C1-С6 алкила, С2-С6 алкенила, С1-С4 фторалкила, С1-С2 фторалкокси, метокси-С1-С4 алкила, трет-бутокси-этила, С1-С2 алкилового сложного эфира, Сз-С6 циклоалкила,
причем С3-С6 циклоалкил необязательно замещен одним, двумя или тремя хлором, фтором или метилом, или фенилом, причем фенил необязательно замещен хлором или метокси,
оксанила,
оксопирролидинилметила,
пиперидинила, причем пиперидинил замещен циклопропилом или изопропилом,
пиперидинилметила, причем пиперидинилметил необязательно замещен метилом,
морфолинилэтила, причем этильный фрагмент необязательно замещен метилом,
тетрагидрофуранила,
фенила, причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из
С1-С4 алкила, фтора, хлора, трифторметила, метокси, трифторметокси, метилового сложного эфира, нитро, амино, диметиламино и циано,
и
бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями фтор и одним заместителем метокси, или
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метокси и гидроксила,
или фенильный фрагмент необязательно замещен одним заместителем, выбранным из фтора, хлора, метила, трифторметила, метокси, изопропилокси, трифторметокси и дифторметокси,
причем метильный фрагмент бензила необязательно замещен гидроксилом, этилом, или одним или двумя метильными заместителями,
1,2-оксазолила, причем 1,2-оксазолил замещен фенилом,
тиофенила, причем тиофенил необязательно замещен заместителем, выбранным из метила и циано,
1,3-тиазолила,
причем 1,3-тиазолил необязательно замещен одним заместителем, выбранным из С1-С4 алкила, С1-С4 галоалкила, циклопропила и фенила,
причем фенил необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метила и трифторметила,
или причем 1,3-тиазолил необязательно замещен двумя заместителями, выбранными из метила, этила и изопропила, или причем указанный тиазолил необязательно замещен фенилом и метилом;
пиридинила, причем пиридинил необязательно замещен одним или двумя заместителями, выбранными из фтора, хлора, метила и трифторметила,
и его физиологически приемлемые соли.
6. Соединение формулы (I-А) или (I-В) по п. 1 или 2,
в котором
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из 1,2,4-оксадиазол-5-ила формулы
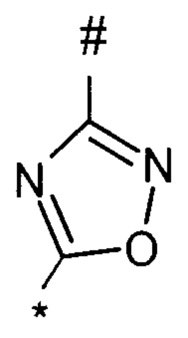 ,
,
или 1,3,4-оксадиазол-5-ила формулы
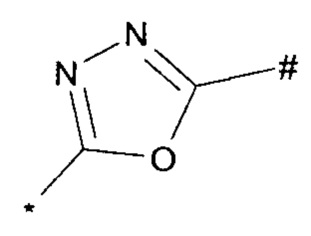 ,
,
или 1,2,4-оксадиазол-3-ила формулы
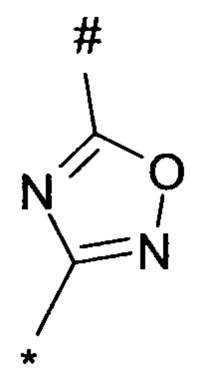 ,
,
где * означает положение связывания с пиразолпиримидоном и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен одним заместителем, выбранным из
метила, этила, пропила, изопропила, трет-бутила, гексила, трифторметила, трифторэтила, трифторбутила, метоксиметила, метоксипропила, метоксиизобутила, этилового сложного эфира, С3-С6 циклоалкила, бензила,
причем фенильный фрагмент бензила необязательно замещен одним или двумя заместителями, выбранными из метила, метокси, изопропилокси, фтора, хлора, трифторметила, трифторметокси и дифторметокси, или
пиридинила, причем пиридинил необязательно замещен метилом или трифторметилом,
и его физиологически приемлемые соли.
7. Соединение формулы (I-А) или (I-В) по п. 1 или 2,
в котором
R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой 1,2,4-оксадиазол-5-ил формулы
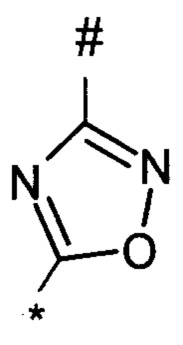 ,
,
где * означает положение связывания с пиразолпиримидоном и # означает необязательное связывание с другим заместителем, причем оксадиазолил замещен трет-бутилом,
и его физиологически приемлемые соли.
8. Соединение формулы (I-А) или (I-В) по п. 1 или 2,
в котором
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из 1,2,4-оксадиазол-5-ила формулы
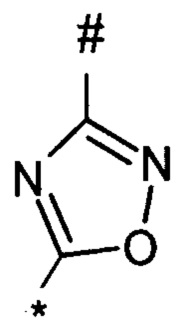 ,
,
или 1,3,4-оксадиазол-5-ила формулы
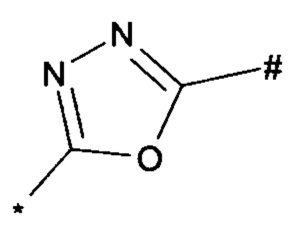 ,
,
или 1,2,4-оксадиазол-3-ила формулы
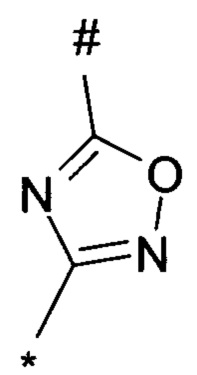 ,
,
где * означает положение связывания с пиразолпиримидоном и # означает необязательное связывание с другим заместителем, причем оксадиазолил необязательно замещен одним заместителем, выбранным из
метила, этила, изопропила, трет-бутила, трифторметила, метоксиэтила, трет-бутоксиэтила, С3-С6 циклоалкила,
причем С3-С6 циклоалкил необязательно замещен одним или двумя метильными заместителями,
бензила,
причем фенильный фрагмент бензила необязательно замещен одним, двумя или тремя заместителями, выбранными из фтора, хлора и гидроксила,
фенила,
причем фенил необязательно замещен одним, двумя или тремя заместителями, выбранными из метила, фтора, хлора, метокси, трифторметила и трифторметокси,
и его физиологически приемлемые соли.
9. Соединение формулы (I-А) или (I-В) по п. 1 или 2,
в котором
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из метилового сложного эфира, этилового сложного эфира, пропилового сложного эфира, изопропилового сложного эфира, причем этиловый сложный эфир и пропиловый сложный эфир необязательно замещены одним, двумя или тремя заместителями фтор, и циклобутилового сложного эфира,
и его физиологически приемлемые соли.
10. Соединение формулы (I-А) или (I-В) по п. 1 или 2,
в котором
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из этилового сложного эфира, пропилового сложного эфира, изопропилового сложного эфира, трет-бутилового сложного эфира, причем этиловый сложный эфир и пропиловый сложный эфир необязательно замещены одним, двумя или тремя заместителями фтор, и циклобутилового сложного эфира,
и его физиологически приемлемые соли.
11. Соединение формулы (I-А) или (I-В) по п. 1 или 2,
в котором
R1 представляет собой водород;
R2 представляет собой метил;
R3 представляет собой этиловый сложный эфир или его соли,
и его физиологически приемлемые соли.
12. Соединение формулы (I-А) или (I-В) по п. 1 или 2,
в котором
R1 представляет собой водород;
R2 выбран из трифторметила, этила и метилсульфанила,
R3 выбран из С1-С4 алкилового сложного эфира, причем С1-С4 алкиловый сложный эфир необязательно замещен одним, двумя или тремя заместителями фтор, и С3-С4 циклоалкилового сложного эфира,
и его физиологически приемлемые соли.
13. Способ получения соединения формулы (IV)
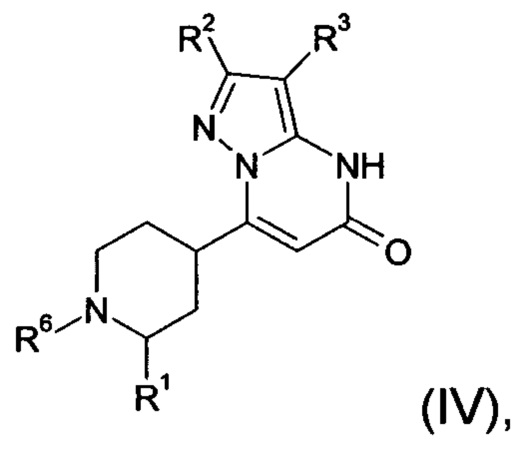
в которой R1, R2 и R3 каждый имеет значение, как определено в любом из пп. 1-12, и R6 представляет собой защитную группу, выбранную из группы, состоящей из трет-бутоксикарбонила, бензилоксикарбонила, метил- или этилкарбамата, триметилсилилэтилкарбамата, р-метоксибензилкарбамата, 9-флуоренилметилкарбамата и необязательно замещенного бензила и бензиламина, где
[А] соединение формулы (II-А)
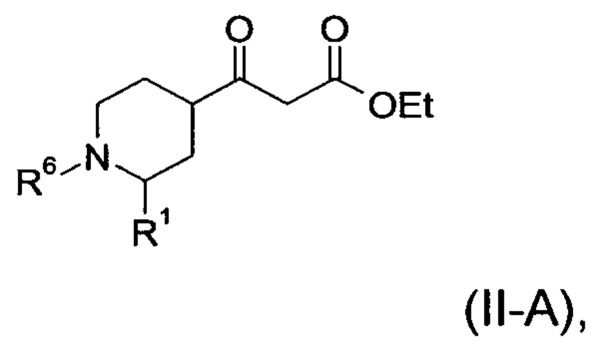
в которой R1 имеет значение, как определено в любом из пп. 1-11, и R6 представляет собой амино-защитную группу, подвергают реакции с соединением формулы (III)
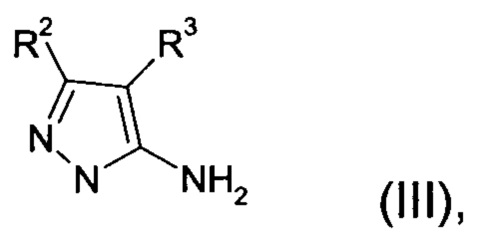
в которой R2 и R3 каждый имеет значение, как определено в любом из пп. 1-11, в инертном растворителе, необязательно в присутствии основания, с получением соединения формулы (IV)
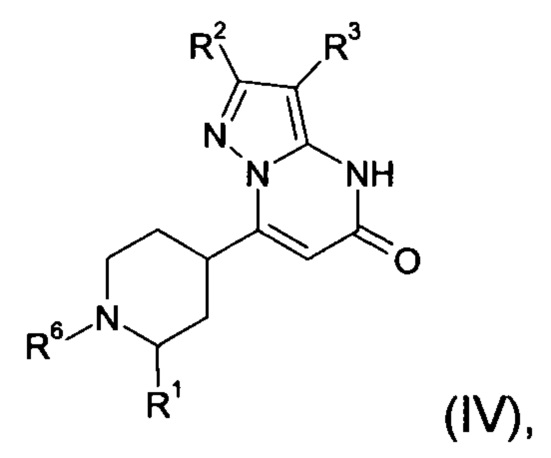
в которой R1, R2 и R3 каждый имеет значение, как определено в любом из пп. 1-12, и R6 представляет собой амино-защитную группу,
или
[В] соединение формулы (II-В)
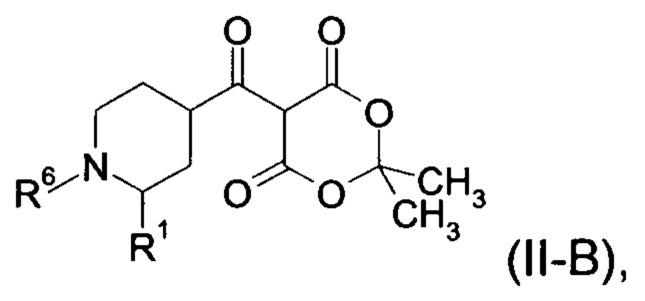
в которой R1 имеет значение, как определено в любом из пп. 1-11, и R6 представляет собой амино-защитную группу, подвергают реакции с соединением формулы (III)
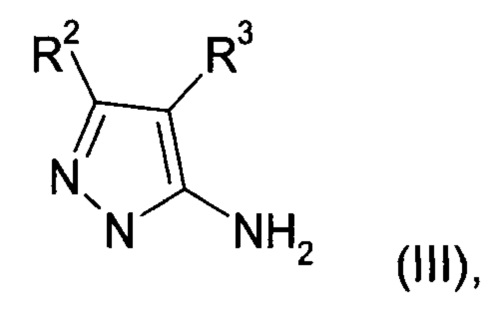
в которой R2 и R3 каждый имеет значение, как определено в любом из пп. 1-11, в инертном растворителе необязательно в присутствии основания, с получением соединения формулы (IV)

в которой R1, R2 и R3 каждый имеет значение, как определено в любом из пп. 1-12, и R6 представляет собой амино-защитную группу.
14. Применение соединения формулы (I-А) или (I-В), как определено в любом из пп. 1 или 2, для приготовления лекарственного средства для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них.
15. Применение по п. 14, где кровотечение связано с заболеванием или медицинским вмешательством, выбранным из группы, состоящей из тяжелого менструального кровотечения, послеродового кровотечения, геморрагического шока, геморрагического цистита, желудочно-кишечного кровотечения, травмы, хирургического вмешательства, инсульта, заболеваний печени, наследственного ангионевротического отека, кровотечения из носа и синовита и повреждения хряща после гемартроза.
16. Применение по п. 15, где хирургическим вмешательством является вмешательство, выбранное из отоларингологического хирургического вмешательства, зубного хирургического вмешательства, ортопедического хирургического вмешательства, хирургического вмешательства в мочевыделительную систему, хирургического вмешательства в предстательную железу, гинекологического хирургического вмешательства, сердечно-сосудистого хирургического вмешательства, хирургического вмешательства в позвоночник, трансплантации печени или легкого.
17. Лекарственное средство для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них, содержащее соединение формулы (I-A) или (I-В), как определено в любом из пп. 1-12, в комбинации с инертным, нетоксичным, фармацевтически приемлемым вспомогательным средством.
18. Лекарственное средство по п. 17 для лечения и/или профилактики острого и рецидивного кровотечения у пациентов с лежащими в основе наследственными или приобретенными гемостатическими нарушениями или без них.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ПРОИЗВОДНОЕ ПИРАЗОЛ[1,5-a]ПИРИМИДИНА | 2006 |
|
RU2390523C2 |
Авторы
Даты
2020-02-11—Публикация
2015-10-30—Подача