ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способу определения витамина D и тому подобное.
УРОВЕНЬ ТЕХНИКИ
Известно, что витамины группы D (далее по тексту просто в сокращенном обозначении витамин D) тесно связываются со связывающим белком (DBP: витамин D-связывающий белок, также относится к глобулину Gc) в крови. Таким образом, для точного количественного определения витамина D способом на основе образования комплекса антиген-антитело, необходимо высвободить витамин D из DBP (предварительная обработка). В качестве такой предварительной обработки используется обработка органическим растворителем (например, этанолом, метанолом, ДМСО) в дополнении к денатурирующему агенту (например, кислоте, денатурирующему белок агенту, поверхностно-активному веществу, гидролитическому ферменту) (патентные документы 1-7).
ЛИТЕРАТУРА ПРЕДШЕСТВУЮЩЕГО УРОВНЯ
Патентная литература
Патентный документ 1: WO03/104820
Патентный документ 2: WO07/039194
Патентный документ 3: WO02/046746
Патентный документ 4: WO04/063704
Патентный документ 5: WO08/092917
Патентный документ 6: WO02/057795
Патентный документ 7: WO07/140962
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ ИЗОБРЕТЕНИЕМ
Настоящее изобретение относится к способу определения витамина D и тому подобное.
СРЕДСТВА РЕШЕНИЯ ПРОБЛЕМЫ
В результате интенсивных исследований заявители настоящего изобретения обнаружили, что витамин D можно точно определять обработкой пробы, содержащей витамин D, поверхностно-активным веществом, имеющим стероидный скелет, и тому подобное, и осуществили настоящее изобретение.
Следовательно, настоящее изобретение представляет следующее.
[1] Способ определения витамина D, включающий:
(1) обработку пробы поверхностно-активным веществом, имеющим стероидный скелет; и
(2) детектирование витамина D в обработанной пробе.
[2] Способ по п.[1], где поверхностно-активное вещество представляет желчную кислоту, или ее производное, или ее соль.
[3] Способ по п.[1] или [2], где поверхностно-активное вещество имеет стероидный скелет, не содержащий гидроксильной группы в положении 7.
[4] Способ по одному из пунктов [1]-[3], где поверхностно-активное вещество представляет дезоксихолевую кислоту, или тауродезоксихолевую кислоту, или их соль.
[5] Способ по одному из пунктов [1]-[4], дополнительно включающий обработку пробы другим денатурирующим агентом, который отличается от поверхностно-активного вещества.
[6] Способ по п. [5], где другой денатурирующий агент представляет поверхностно-активное вещество, содержащее гидрофобную группу, состоящую из углеродной цепи и гидрофильной группы.
[7] Способ по одному из пунктов [1]-[6], где обработка пробы проводится только смешиванием.
[8] Способ по одному из пунктов [1]-[7], включающий:
(1’) обработку пробы реакционным раствором, содержащим поверхностно-активное вещество, имеющее стероидный скелет, и соединение, обладающее сродством к витамину D; и
(2’) детектирование витамина D в обработанной пробе.
[9] Способ по одному из пунктов [1]-[7], включающий:
(1”) обработку пробы раствором для предварительной обработки, содержащим денатурирующий агент;
(2”) обработку пробы, обработанной на стадии (1”) выше, раствором для разведения, содержащим поверхностно-активное вещество, имеющее стероидный скелет; и
(3”) детектирование витамина D в пробе, обработанной на стадии (2”) выше.
[10] Способ по одному из пунктов [1]-[9], где проба получена от человека.
[11] Способ по одному из пунктов [1]-[10], где проба представляет пробу, относящуюся к крови.
[12] Набор для определения витамина D, включающий:
(1) поверхностно-активное вещество, имеющее стероидный скелет; и
(2) соединение, обладающее сродством к витамину D, и/или стандарт витамина D.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Настоящее изобретение является пригодным для определения витамина D. Согласно настоящему изобретению витамин D можно определить быстро и просто.
Набор по настоящему изобретению является пригодным, например, для легкого практического применения способа по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1 представляет график, показывающий высокую корреляцию (R2=0,8993) между определенными значениями, полученными обработкой проб сыворотки крови дезоксихолатом натрия и определенными значениями, полученными методом Diasorin RIA.
Фиг.2 представляет график, показывающий низкую корреляцию (R2=0,8327) между определенными значениями, полученными обработкой проб сыворотки крови органическим растворителем и определенными значениями, полученными методом Diasorin RIA.
Фиг.3 представляет график, показывающий высокую корреляцию (R2=0,9881) между определенными значениями, полученными обработкой проб сыворотки крови реакционным раствором, содержащим дезоксихолат натрия, SDS и антитело, и определенными значениями, полученными методом Diasorin RIA.
На фиг.4 показаны фракции, содержащие 25-ОН витамин D, когда пробу сыворотки крови человека элюировали контрольным буфером (Трис-HCl) гель-хроматографией. DC Na: дезоксихолат натрия (то же - далее).
На фиг.5 показаны фракции, содержащие витамин D-связывающий белок, полученные вестерн-блоттингом.
На фиг.6 показаны фракции витамина D в сыворотке крови человека и свободного витамина D, элюированные раствором дезоксихолата натрия гель-хроматографией.
Фиг.7 представляет график, показывающий высвобождение 25-ОН витамина D3 из комплекса витамин D-связывающий белок и 25-ОН витамина D3. Экспериментальные условия для 1-4 см. в таблице 8.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
А. Способ определения витамина D
Настоящее изобретение относится к способу определения витамина D.
Способ по настоящему изобретению включает:
(1) обработку пробы поверхностно-активным веществом, имеющим стероидный скелет; и
(2) детектирование витамина D в обработанной пробе.
А-1. Стадия 1
Вначале, пробу обрабатывают поверхностно-активным веществом, имеющим стероидный скелет.
Проба, использованная для способа по настоящему изобретению, представляет пробу, содержащую или с подозрением на содержание витамина D или его метаболита, как описано ниже. Примеры метаболита витамина D могут включать 25-ОН витамин D2, 25-ОН витамин D3, 1,25-(ОН)2 витамин D2 и 1,25-(ОН)2 витамин D3, которые являются производными, в которых гидроксильная группа(ы) добавляется(ются) к молекуле витамина D. В том смысле, в котором здесь используется термин «витамин D», если не указано иначе, он предназначен для собирательного включения витамина D2 и витамина D3, лекарственных препаратов, аналогичных витамину D2 и витамину D3, а также их метаболитов.
[Химическое соединение 1]
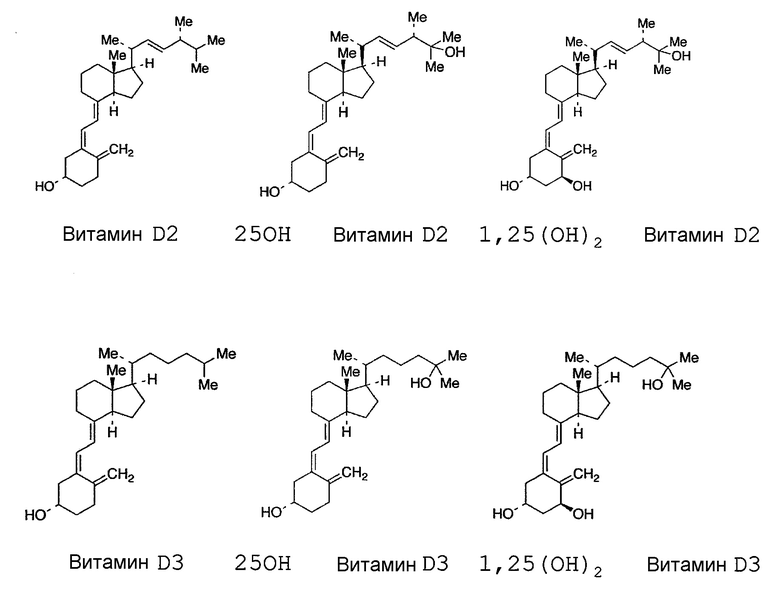
Источник пробы особым образом не ограничивается, и она может представлять биологическую пробу, полученную из организма, или пробу из окружающей среды или тому подобное. Примеры организма, из которого получена биологическая проба, могут включать животных, таких как млекопитающие (например, люди, обезьяны, мыши, крысы, кролики, крупный рогатый скот, свиньи, лошади, козы, овцы), и птицы (например, куры), насекомых, микроорганизмы, растения, бактерии и рыбы, и предпочтительно включают млекопитающих, бактерий и рыб, более предпочтительно млекопитающих, и еще более предпочтительно людей. Биологическая проба также может представлять саму пробу крови или пробу, относящуюся к крови, которая является пробой, полученной из крови (например, цельная кровь, сыворотка, плазма), слюну, мочу, молоко, экстракт ткани или клеточный экстракт, или их смесь, и проба, относящаяся к крови, является предпочтительной. Проба из окружающей среды может включать пробы, полученные из почвы, морской воды и пресноводной воды.
Проба, использованная в способе по настоящему изобретению, предпочтительно представляет пробу, содержащую комплекс витамина D и молекулы, обладающей способностью с ним связываться. Способ по настоящему изобретению обладает преимуществом, заключающемся в том, что витамин D можно определить точно даже, когда молекула, обладающая способностью сильно связываться с витамином D (белок), находится в пробе. Например, известно, что витамин D прочно связывается с DBP, находящимся в сыворотке крови человека, и сообщалось, что константа диссоциации равняется Kd = 5×10-8 (смотри патентный документ 4). Однако согласно способу по настоящему изобретению витамин D в пробе можно точно определить даже, когда белок, обладающий такой высокой связывающей способностью, находится в пробе. Следовательно, полагается, что согласно способу по настоящему изобретению витамин D можно точно определить даже, если другая молекула, чем DBP, обладающая способностью связываться с витамином D (например, молекула, потенциально обладающая способностью связываться с витамином D), находится в пробе. Примеры другой молекулы, обладающей способностью связываться с витамином D, могут включать альбумин и липиды. В частности, примеры пробы, содержащей комплекс витамина D и молекулы, обладающей способностью связываться с ним, могут включать пробы, относящиеся к крови (например, цельная кровь, сыворотка, плазма).
Согласно способу по настоящему изобретению витамин D в пробе можно определить независимо от присутствия или отсутствия молекулы, обладающей способностью связываться с витамином D, в пробе, типа молекулы и типа пробы. То есть, с помощью способа по настоящему изобретению можно определить витамин D в пробе даже, когда в пробе присутствует неизвестная молекула, обладающая способностью связываться с витамином D, без предварительной подтверждающей информации по природе этих веществ. Таким образом, способ по настоящему изобретению может использоваться в качестве стандартного способа, который можно широко использовать для определения витамина D.
В способе по настоящему изобретению проба может подвергнуться другой обработке перед обработкой поверхностно-активным веществом, имеющим стероидный скелет. Такая обработка может включать центрифугирование, экстракцию, фильтрацию, осаждение, нагревание, замораживание, охлаждение и перемешивание.
Объем пробы, предназначенной для обработки поверхностно-активным веществом, имеющим стероидный скелет, особым образом не ограничивается, при условии что можно провести анализ витамин D, и он составляет, например, от 0,1 до 1000 мкл, предпочтительно от 0,5 до 100 мкл и более предпочтительно от 1 до 50 мкл.
Поверхностно-активное вещество, имеющее стероидный скелет, представляет соединение, имеющее стероидный скелет в качестве самостоятельной циклической структуры (т.е. стероидный скелет не конденсирован с другим циклом), или его соль. Стерическая структура в положении 5 может находиться в α-форме или β-форме в поверхностно-активном веществе, имеющем стероидный скелет.
Поверхностно-активное вещество, имеющее стероидный скелет, может представлять соединение, имеющее стероидный скелет в виде гидрофобной группы и гидрофильной группы, или его соль. Примеры гидрофильной группы могут включать анионную группу (например, сульфонат (-SO3-), карбоксилат (-СОО-) и фосфонат )-POO2-), катионную группу (например, четвертичный аммоний и четвертичный фосфоний, которые могут быть замещены 1-4 углеводородными группами), неионную гидрофильную группу (например, многочисленные простые эфиры) и группы, содержащие их (например, углеводородная группа, содержащая гидрофильную группу). Таким образом, поверхностно-активное вещество, имеющее стероидный скелет, может представлять анионогенное поверхностно-активное вещество, катионогенное поверхностно-активное вещество, амфотерное поверхностно-активное вещество или неионогенное поверхностно-активное вещество, в зависимости от типа гидрофильной группы. Примеры вышеуказанной углеводородной группы могут включать метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил (лаурил), тетрадецил (миристил), гексадецил (цетил), гептадецил, октадецил (стеарил), циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, фенил и нафталенил. Предпочтительно углеводородная группа представляет углеводородную группу, содержащую 1-10 атомов углерода и более предпочтительно алкил, содержащий 1-6 атомов углерода.
Стероидный скелет может содержать 1-6 заместителей (предпочтительно 1, 2, 3 или 4 заместителя) в дополнении к гидрофильной группе. Такой заместитель особым образом не ограничивается, при условии что свойства (например, гидрофобность) стероидного скелета существенно не изменяются, и его примеры могут включать углеводородную группу, содержащую 1-10 атомов углерода, гидроксильную группу, гидроксильную группу, замещенную углеводородной группой, содержащей 1-10 атомов углерода (например, алкилокси), углеводородную группу, содержащую 1-10 атомов углерода-карбонилокси (например, алкилкарбонилокси), оксогруппу, формил, углеводородную группу, содержащую 1-10 атомов углерода-оксикарбонил (например, алкилоксикарбонил), атом галогена (например, атом фтора, атом хлора, атом брома, атом йода) и циано.
В том смысле, в котором в данном документе используется термин «соль», он означает любую соль, и ее примеры могут включать неорганическую соль, органическую соль и внутримолекулярную соль. Примеры неорганической соли могут включать соль металла, галогенированную соль, кислотно-аддитивную соль и соль аммония. Примеры соли металла могут включать соль щелочного металла (например, лития, натрия, калия) и соли щелочноземельного металла (например, магния, кальция). Примеры атома галогена в галогенированной соли могут включать атом фтора, брома, хлора и йода. Примеры кислотно-аддитивной соли, которая является неорганической солью, могут включать соли неорганической кислоты, такой как соляная кислота, азотная кислота и серная кислота. Примеры органической соли могут включать соли органического основания, такого как триметиламин, триэтиламин и пиридин, а также соли органической кислоты, такой как щавелевая кислота.
Поверхностно-активное вещество, имеющее стероидный скелет, предпочтительно представляет желчную кислоту, или ее производное, или ее соль. Примеры желчной кислоты могут включать дезоксихолевую кислоту, хенодезоксихолевую кислоту, урсодезоксихолевую кислоту, гиодезоксихолевую кислоту, холевую кислоту, гликохолевую кислоту, таурохолевую кислоту, гиохолевую кислоту, 5α-ципринол, литохолевую кислоту, тауродезоксихолевую кислоту и таурохолевую кислоту. Примеры производного желчной кислоты могут включать CHAPS, BIGCHAP и дезокси-BIGCHAP.
Более предпочтительно поверхностно-активное вещество, имеющее стероидный скелет, может иметь стероидный скелет, не содержащий гидроксильной группы в положении 7. Примеры поверхностно-активного вещества, имеющего стероидный скелет, не содержащий гидроксильной группы в положении 7, могут включать поверхностно-активное вещество, имеющее стероидный скелет, содержащий группу иную, чем гидроксильная группа (например, вышеуказанный заместитель, исключая гидроксильную группу) в положении 7, и поверхностно-активное вещество, имеющее стероидный скелет, не содержащий заместителя в положении 7 (иными словами атом углерода в положении 7 связан с атомом водорода). Особенно предпочтительно, когда поверхностно-активное вещество, имеющее стероидный скелет, не содержащий гидроксильной группы в положении 7, представляет поверхностно-активное вещество, имеющее стероидный скелет, не содержащий заместителя в положении 7. Примеры поверхностно-активного вещества, имеющего стероидный скелет, не содержащий заместителя в положении 7, могут включать дезоксихолевую кислоту, тауродезоксихолевую кислоту, литохолевую кислоту и 5α-ципринол, а также их соли.
Обработку пробы можно проводить с использованием одного или нескольких (например, двух или трех) вышеуказанных поверхностно-активных веществ. Концентрация вышеуказанного поверхностно-активного вещества особым образом не ограничивается, при условии что концентрация является эффективной для определения витамина D. Концентрацию можно соответствующим образом довести, и она может составлять, например, от 0,001% (мас./об.) до 10% (мас./об.).
В частности, концентрация такого поверхностно-активного вещества, когда проба обрабатывается поверхностно-активным веществом, имеющим стероидный скелет, особым образом не ограничивается, при условии что его действие проявляется в смешанном растворе из реакционного раствора и пробы, когда проба обрабатывается способом с использованием реакционного раствора, описанного ниже, и может составлять, например, от 0,001% (мас./об.) до 5% (мас./об.). В этом случае концентрация поверхностно-активного вещества, имеющего стероидный скелет, может предпочтительно составлять 0,005% (мас./об.) или выше, более предпочтительно 0,01% (мас./об.) и еще более предпочтительно 0,02% (мас./об.) или выше. Концентрация поверхностно-активного вещества, имеющего стероидный скелет, также может предпочтительно составлять 1% (мас./об.) или ниже, более предпочтительно 0,8% (мас./об.) или ниже, еще более предпочтительно 0,6% (мас./об.) или ниже, и особенно предпочтительно 0,5% (мас./об.) или ниже. В том случае, когда используется несколько поверхностно-активных веществ, то концентрация каждого поверхностно-активного вещества также представляет концентрацию, описанную выше.
Кроме того, концентрация такого поверхностно-активного вещества, когда проба обрабатывается поверхностно-активным веществом, имеющим стероидный скелет, особым образом не ограничивается, при условии что его действие проявляется в смешанном растворе из раствора для предварительной обработки и пробы, когда проба обрабатывается способом с использованием раствора для предварительной обработки, как описано ниже, и может составлять, например, от 0,001% (мас./об.) до 10% (мас./об.). В этом случае концентрация поверхностно-активного вещества, имеющего стероидный скелет, может предпочтительно составлять 0,005% (мас./об.) или выше, более предпочтительно 0,01% (мас./об.) и еще более предпочтительно 0,02% (мас./об.) или выше. Концентрация поверхностно-активного вещества, имеющего стероидный скелет, также может предпочтительно составлять 1% (мас./об.) или ниже, более предпочтительно 0,8% (мас./об.) или ниже, еще более предпочтительно 0,6% (мас./об.) или ниже, и особенно предпочтительно 0,5% (мас./об.) или ниже. В том случае, когда используется несколько поверхностно-активных веществ, то концентрация каждого поверхностно-активного вещества представляет концентрацию, описанную выше.
Кроме того, концентрация такого поверхностно-активного вещества, когда проба обрабатывается поверхностно-активным веществом, имеющим стероидный скелет, особым образом не ограничивается, при условии что его действие проявляется в смешанном растворе из раствора для предварительной обработки, раствора для разведения и пробы, когда проба обрабатывается способом с использованием раствора для предварительной обработки и раствора для разведения, как описано ниже, и может составлять, например, от 0,001% (мас./об.) до 10% (мас./об.). В этом случае концентрация поверхностно-активного вещества, имеющего стероидный скелет, может предпочтительно составлять 0,005% (мас./об.) или выше, более предпочтительно 0,01% (мас./об.) и еще более предпочтительно 0,02% (мас./об.) или выше. Концентрация поверхностно-активного вещества, имеющего стероидный скелет, также может предпочтительно составлять 1% (мас./об.) или ниже, более предпочтительно 0,8% (мас./об.) или ниже, еще более предпочтительно 0,6% (мас./об.) или ниже и особенно предпочтительно 0,5% (мас./об.) или ниже. В том случае, когда используется несколько поверхностно-активных веществ, то концентрация каждого поверхностно-активного вещества также представляет концентрацию, описанную выше.
В одном варианте осуществления обработку пробы можно проводить в комбинации с другим денатурирующим агентом, который отличается от поверхностно-активного вещества, имеющего стероидный скелет, в дополнении к поверхностно-активному веществу, имеющему стероидный скелет. Таким образом, способ по настоящему изобретению может дополнительно включать обработку пробу другим денатурирующим агентом. Обработка пробы поверхностно-активным веществом, имеющим стероидный скелет, и обработка пробы другим денатурирующим агентом могут проводиться одновременно или по отдельности, и предпочтительно проводятся одновременно. Примеры такого денатурирующего агента могут включать поверхностно-активное вещество (например, анионогенное поверхностно-активное вещество, катионогенное поверхностно-активное вещество, амфотерное поверхностно-активное вещество или неионогенное поверхностно-активное вещество), хаотропный агент и восстанавливающий агент. Можно использовать один денатурирующий агент или несколько денатурирующих агентов (например, два или три). Такой денатурирующий агент может использоваться в концентрации, эффективной для проявления денатурирующего эффекта, и может использоваться в концентрации, эффективной для проявления эффекта, иного чем денатурирующий эффект, с предположением эффекта иного, чем денатурирующий эффект. Например, концентрация другого денатурирующего агента, когда проба обрабатывается другим денатурирующим агентом, может быть такой же, как вышеуказанная концентрация поверхностно-активного вещества, имеющего стероидный скелет.
Примеры анионогенного поверхностно-активного вещества, используемого в качестве другого денатурирующего агента, который отличается от поверхностно-активного вещества, имеющего стероидный скелет, могут включать гексилсерную кислоту, октилсерную кислоту, децилсерную кислоту, додецилсерную кислоту, тетрадецилсерную кислоту, гексадецилсерную кислоту, додецилфосфоновую кислоту, додецилбензолсульфоновую кислоту, N-лауроилсаркозин и N-додеканоилсаркозиновую кислоту и их соли (например, вышеуказанные соли, такие как соли натрия).
Примеры катионогенного поверхностно-активного вещества, используемого в качестве другого денатурирующего агента, который отличается от поверхностно-активного вещества, имеющего стероидный скелет, могут включать соединения четвертичного аммония и соединения четвертичного фосфония (например, замещенные 1-4 углеводородными группами, описанными выше), а также их соли (например, галогенированные соединения). Конкретные примеры катионогенного поверхностно-активного вещества могут включать цетилметилэтиламмоний, гексадецилтриметиламмоний и миристилтриметиламмоний, а также их галогенированные производные (например, бромид).
Примеры амфотерного поверхностно-активного вещества, используемого в качестве другого денатурирующего агента, который отличается от поверхностно-активного вещества, имеющего стероидный скелет, могут включать цвиттергент, ASB-14, ASB-14-4, C7Bz0, поверхностно-активное вещество EMPIGEN BB, 3-(N-(N,N-диметилоктиламмонио)пропансульфоновую кислоту, 3-н(N,N-диметилоктиламмонио)пропансульфоновую кислоту, 3-(децилдиметиламмонио)пропансульфоновую кислоту, N-додецил-N,N-диметил-3-аммонио-1-пропансульфоновую кислоту, 3-(N,N-диметилмиристиламмонио)пропансульфоновую кислоту, 3-(N,N-диметилпальмитиламмонио)пропансульфоновую кислоту и 3-(N,N-диметилоктадециламмонио)пропансульфоновую кислоту, а также их соли (например, вышеуказанные соли, такие как внутримолекулярные соли).
Примеры неионогенного поверхностно-активного вещества, используемого в качестве другого денатурирующего агента, который отличается от поверхностно-активного вещества, имеющего стероидный скелет, могут включать Brij35, Brij56, сапонин, полученный из коры растений, относящихся к роду Quillaja, TritonX-0405, TritonX-N 101, TritonX-N 100, TritonX-705-70, TritonX-305, твин-20, твин-40, твин-60, твин-80, MEGA-8, MEGA-10 и NP40.
Примеры хаотропного поверхностно-активного вещества, используемого в качестве другого денатурирующего агента, который отличается от поверхностно-активного вещества, имеющего стероидный скелет, могут включать гуанидин, мочевину и тиосерную кислоту, а также их соли (например, вышеуказанные соли, такие как кислотно-аддитивные соли, такие как гидрохлорид, и соли металлов, такие как соли калия).
Примеры восстанавливающего агента, используемого в качестве другого денатурирующего агента, который отличается от поверхностно-активного вещества, имеющего стероидный скелет, могут включать дитиотреитол (DDT), дитиоэритритол (DTE), 2-меркаптоэтиламин (2МЕА), 2-меркаптоэтанол (2МЕ), трис-2-карбоксиэтилфосфин гидрохлорид (TCEP-HCl), L-цистеин, N-ацетил-L-цистеин и аскорбиновую кислоту.
В предпочтительном варианте осуществления другой денатурирующий агент, который отличается от поверхностно-активного вещества, имеющего стероидный скелет, представляет поверхностно-активное вещество (включая соль), содержащее гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы.
Гидрофобная группа в другом денатурирующем агенте состоит из углеводородной цепи. Углеводородная цепь представляет углеводородную группу с прямой или разветвленной цепью, как правило, содержащую 8-60 атомов углерода. Поверхностно-активное вещество, содержащее гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, должно иметь, по меньшей мере, одну такую углеводородную цепь. Углеводородная цепь предпочтительно содержит 10 или более атомов углерода. Углеводородная цепь предпочтительно содержит 40 или менее, более предпочтительно 30 или менее и еще более предпочтительно 20 или менее атомов углерода с точки зрения возможности простого синтеза или доступности. Углеводородная цепь особенно предпочтительно содержит 10 или 11 атомов углерода.
Углеводородная группа с прямой цепью может включать алкил, который представляет насыщенную углеводородную группу с прямой цепью и ненасыщенную углеводородную группу с прямой цепью (например, алкенил или алкинил). Примеры алкильных групп, содержащих 8-60 атомов углерода, могут включать октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, нонадецил и икозил. Примеры ненасыщенных углеводородных групп с прямой цепью, содержащих 8-60 атомов углерода, могут включать группы, содержащие 1-4 (предпочтительно 1 или 2) ненасыщенных связи (двойная связь или тройная связь).
Примеры углеводородных групп с разветвленной цепью могут включать группы, полученные замещением атома водорода в вышеуказанной углеводородной группе с прямой или разветвленной цепью 1-4 (предпочтительно 1 или 2) углеводородными группами, содержащими 1-10 атомов углерода. Углеводородные группы, содержащие 1-10 атомов углерода, могут включать метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, фенил и нафталенил.
Углеводородная цепь, которая содержит гидрофобную группу, предпочтительно представляет углеводородную группу с прямой цепью и более предпочтительно углеводородную группу с прямой цепью, содержащую 10 или 11 атомов углерода.
Примеры гидрофильной группы в другом денатурирующем агенте могут включать анионную гидрофильную группу и катионную гидрофильную группу. Поверхностно-активное вещество, содержащее гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, может содержать одну, или две, или более гидрофильных групп и могут содержать анионную гидрофильную группу и катионную гидрофильную группу. Примеры анионной гидрофильной группы могут включать сульфонат (-SO3-), карбоксилат (-СОО-) и фосфонат (-POO2-). Примеры катионной гидрофильной группы могут включать аммониевую группу (N+) и фосфониевую группу (P+). Гидрофильная группа предпочтительно представляет сульфонат (-SO3-), карбоксилат (-СОО-), аммониевую группу (N+) и фосфониевую группу (P+), более предпочтительно сульфонат (-SO3-), карбоксилат (-СОО-) и аммониевую группу (N+), еще более предпочтительно сульфонат (-SO3-) и карбоксилат (-СОО-), в частности, предпочтительно сульфонат (-SO3-).
Поверхностно-активное вещество, содержащее гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, может содержать другую группу (например, между гидрофобной группой и гидрофильной группой) в дополнении к гидрофобной группе, состоящей из углеводородной цепи и гидрофильной группы. Примеры другой группы включают циклические группы (например, циклоалкил, арил, гетероциклическую группу) и ациклические группы (например, аминогруппу, карбонил, карбониламино).
В частности, примеры поверхностно-активного вещества, содержащего гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, могут включать гексилсерную кислоту, октилсерную кислоту, децилсерную кислоту, додецилсерную кислоту, тетрадецилсерную кислоту, гексадецилсерную кислоту, додецилфосфоновую кислоту, додецилбензолсульфоновую кислоту, N-лауроилсаркозин и N-додеканоилсаркозиновую кислоту и их соли.
Обработку пробы можно проводить с использованием одного или нескольких (например, 2 или 3) других денатурирующих агентов. Концентрация другого денатурирующего агента особым образом не ограничивается и может быть соответственно доведена, при условии что концентрация является эффективной для определения витамина D. Например, когда поверхностно-активное вещество, содержащее гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, используется в качестве другого денатурирующего агента, то концентрация такого поверхностно-активного вещества может составлять, например, от 0,001% (мас./об.) до 10% (мас./об.).
В частности, концентрация поверхностно-активного вещества, содержащего гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, когда проба обрабатывается таким поверхностно-активным веществом, особым образом не ограничивается, при условии что его действие проявляется в смешанном растворе из реакционного раствора. Когда проба обрабатывается способом с использованием реакционного раствора, описанного ниже, то концентрация может составлять, например, от 0,005% (мас./об.) до 5% (мас./об.). В этом случае концентрация поверхностно-активного вещества, содержащего гидрофобную группу, состоящую из углеродной цепи и гидрофильной группы, может предпочтительно составлять 0,01% (мас./об.) или выше, более предпочтительно 0,02% (мас./об.) или выше. Также концентрация поверхностно-активного вещества, содержащего гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, может предпочтительно составлять 1% (мас./об.) или ниже, более предпочтительно 0,8% (мас./об.) или ниже, еще более предпочтительно 0,6% (мас./об.) или ниже, и особенно предпочтительно 0,5% (мас./об.) или ниже. В том случае, когда используется несколько поверхностно-активных веществ, то концентрация каждого поверхностно-активного вещества представляет концентрацию, описанную выше.
Концентрация поверхностно-активного вещества, содержащего гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, когда проба обрабатывается таким поверхностно-активным веществом, особым образом не ограничивается, при условии, его действие проявляется в смешанном растворе из раствора для предварительной обработки. Когда проба обрабатывается способом с использованием раствора для предварительной обработки, как описано ниже, то концентрация может составлять, например, от 0,001% (мас./об.) до 10% (мас./об.). В этом случае концентрация поверхностно-активного вещества, содержащего гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, может предпочтительно составлять 0,01% (мас./об.) или выше, более предпочтительно 0,02% (мас./об.) или выше, и еще более предпочтительно 0,03% (мас./об.) или выше. Также концентрация поверхностно-активного вещества, содержащего гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы, может предпочтительно составлять 1% (мас./об.) или ниже, более предпочтительно 0,8% (мас./об.) или ниже, еще более предпочтительно 0,6% (мас./об.) или ниже, и особенно предпочтительно 0,5% (мас./об.) или ниже. В том случае, когда используется несколько поверхностно-активных веществ, то концентрация каждого поверхностно-активного вещества также представляет концентрацию, описанную выше.
Обработку пробы можно проводить в присутствии другого компонента. Примеры таких компонентов могут включать соединение, обладающее сродством к витамину D, альбумин (например, бычий сывороточный альбумин, человеческий сывороточный альбумин), желатин и обезжиренное молоко.
Соединение, обладающее сродством к витамину D, относится к соединению, которое обладает способностью связываться с витамином D, и его примеры могут включать антитело и аптапер к витамину D. Антитело может быть поликлональным антителом или моноклональным антителом. Также антитело может представлять фрагмент антитела (например, Fab, F(ab’)2) или рекомбинантное антитело (например, scFv). Также антитело может дополнительно представлять антителоподобную молекулу (например, аффитело, антикалин, DARPины, монотело), полученные методами молекулярной биологии, такими как метод фагового дисплея и/или метод генной инженерии белков с использованием существующего белкового мотива.
Обработка пробы включает (а) смешивание пробы с водным раствором (например, буфером), содержащим компонент, описанный выше, с получением смешанного раствора и (b) инкубацию смешанного раствора.
Примеры буфера могут включать Трис-буфер (Трис-HCl буфер, ТЕ-буфер, ТАЕ-буфер, ТВЕ-буфер, забуференный Трис-буфером физиологический раствор), фосфатный буфер (например, забуференный фосфатом физиологический раствор), карбонатный буфер (например, натриево-карбонатный/бикарбонатный буфер), буфер GOOD (буфер MES, ADA, PIPES, ACES, холамин гидрохлорид, BES, HEPES, ацетамид глицин, трицин, глицин амид, бицин). Обработку пробы можно проводить в нейтральных условиях, кислых условиях или щелочных условиях, и предпочтительно ее проводят в нейтральных условиях. Таким образом, значение рН, используемое при обработке пробы, например, равняется от 4,0 до 9,5, предпочтительно от 5,0 до 9,0, предпочтительно от 5,5 до 8,5 и более предпочтительно от 6,0 до 8,0. Значение рН при обработке пробы можно довести с использованием буфера, соединения с кислотными свойствами и соединения с щелочными свойствами.
Температура при обработке пробы (например, на вышеуказанных стадиях (а) и (b)) особым образом не ограничивается, при условии что она подходит для того, чтобы поверхностно-активное вещество, имеющее стероидный скелет, проявляло свое действие, и составляет, например, от 15° до 60°С, предпочтительно от 20° до 50°С и более предпочтительно от 20° до 45°С. Период времени, необходимый для приготовления смешанного раствора на стадии (а), как правило, составляет 30 сек или меньше, предпочтительно 20 сек или меньше, более предпочтительно 15 сек или меньше, и еще более предпочтительно 10 сек или меньше. Время инкубации на стадии (b) составляет, например, 60 мин или меньше, предпочтительно 30 мин или меньше и более предпочтительно 10 мин или меньше. С точки зрения снижения времени обработки, необходимого для анализа, то время инкубации может предпочтительно составлять 5 мин или меньше, особенно предпочтительно 3 мин или меньше, 2 мин или меньше, 1 мин или меньше, 50 сек или меньше, 40 сек или меньше, 30 сек или меньше, 20 сек или меньше, 10 сек или меньше или 5 сек или меньше. Таким образом, с точки зрения снижения времени обработки, необходимой для анализа, то время обработки пробы (например, общее время на стадии (а) и (b) выше) может составлять 3 мин или меньше, 2 мин или меньше, 1 мин или меньше, 50 сек или меньше, 40 сек или меньше, 30 сек или меньше или 15 сек или меньше.
Обработку пробы можно проводить только смешиванием. То, что обработка пробы проводится «только смешиванием» означает, что обработка пробы проводится на стадии (а) выше и не проводится на стадии (b) выше (т.е. инкубация не является обязательной). С точки зрения быстрого и простого анализа, то обработку пробы проводят только смешиванием.
А-1-1. Применение реакционного раствора
В предпочтительном варианте осуществления вышеуказанную стадию (1) можно проводить обработкой пробы реакционным раствором, содержащим поверхностно-активное вещество, имеющее стероидный скелет, и соединение, обладающее сродством к витамину D.
Реакционный раствор содержит поверхностно-активное вещество, имеющее стероидный скелет, и соединение, обладающее сродством к витамину D. Реакционный раствор также может содержать один или несколько (2 или 3 или более) других компонентов, описанных выше, включая другое поверхностно-активное вещество, которое отличается от поверхностно-активного вещества, имеющего стероидный скелет (анионогенное поверхностно-активное вещество, катионогенное поверхностно-активное вещество, амфотерное поверхностно-активное вещество или неионогенное поверхностно-активное вещество), хаотропный агент и восстанавливающий агент, а также поверхностно-активное вещество, содержащее гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы.
Концентрация поверхностно-активного вещества, имеющего стероидный скелет, в реакционном растворе особым образом не ограничивается, при условии что его действие проявляется в смешанном растворе из реакционного раствора и пробы, и представляет, например, концентрацию, при которой может достигаться вышеуказанная концентрация в смешанном растворе из реакционного раствора и пробы (концентрация поверхностно-активного вещества, имеющего стероидный скелет, когда проба обрабатывается поверхностно-активным веществом, имеющим стероидный скелет). Таким образом, концентрацию поверхностно-активного вещества, имеющего стероидный скелет, в реакционном растворе можно соответствующим образом определить, основываясь на объемах пробы и реакционного раствора так, чтобы достигалась вышеуказанная концентрация.
Реакционный раствор содержит вещество, описанное выше, в водном растворе (например, в буфере, описанном выше). Реакционный раствор может быть нейтральным раствором, кислым раствором или щелочным раствором, и предпочтительно является нейтральным раствором. Таким образом, значение рН реакционного раствора, например, равняется от 4,0 до 9,5, предпочтительно от 5,0 до 9,0, предпочтительно от 5,5 до 8,5 и более предпочтительно от 6,0 до 8,0.
Объем реакционного раствора можно соответствующим образом определить в зависимости от объема и типа пробы, а также цели анализа (например, качественный или количественный анализ), и он составляет по отношению к объему пробы, например, от 0,1 до 100 раз, предпочтительно от 0,5 до 50 раз и более предпочтительно от 1 до 10 раз.
Обработку пробы реакционным раствором соответственно проводят адекватным образом для проявления действия компонента, такого как поверхностно-активное вещество, имеющее стероидный скелет, входящее в состав реакционного раствора. Например, обработку пробы реакционным раствором можно проводить аналогично обработке пробы, как описано выше, и она может включать (а1) смешивание реакционного раствора с пробой с получением смешанного раствора и (b1) инкубацию смешанного раствора. Условия в отношении температуры и продолжительности времени на стадии (a1) и (b1) являются аналогичными описанным выше для стадий (a) и (b).
А-1-2. Применение раствора для предварительной обработки и раствора для разведения
В еще одном предпочтительном варианте осуществления вышеуказанную стадию (1) можно проводить (i) обработкой пробы раствором для предварительной обработки, содержащим денатурирующий агент, и (ii) обработкой пробы, обработанной раствором для предварительной обработки, раствором для разведения, содержащим поверхностно-активное вещество, имеющее стероидный скелет.
Стадия i
Раствор для предварительной обработки содержит денатурирующий агент. Примеры денатурирующего агента могут включать поверхностно-активное вещество, имеющее стероидный скелет, и другое поверхностно-активное вещество, которое отличается от поверхностно-активного вещества, имеющего стероидный скелет (например, анионогенное поверхностно-активное вещество, катионогенное поверхностно-активное вещество, амфотерное поверхностно-активное вещество или неионогенное поверхностно-активное вещество), хаотропный агент и восстанавливающий агент. В состав раствора для предварительной обработки может входить один или несколько (например, 2 или 3 или больше) денатурирующих агентов. Раствор для предварительной обработки может содержать одинаковые типы одного или двух или более (например, 1-3) поверхностно-активных веществ (например, поверхностно-активное вещество, имеющее стероидный скелет и другое поверхностно-активное вещество) в качестве поверхностно-активных веществ, входящих в состав раствора для разведения. Раствор для предварительной обработки также может содержать другой компонент, описанный выше.
Концентрация поверхностно-активного вещества, имеющего стероидный скелет, в растворе для предварительной обработки особым образом не ограничивается, при условии что его действие проявляется в смешанном растворе из раствора для предварительной обработки и пробы, и представляет, например, концентрацию, при которой может достигаться вышеуказанная концентрация в смешанном растворе из раствора для предварительной обработки и пробы (концентрация поверхностно-активного вещества, имеющего стероидный скелет, когда проба обрабатывается поверхностно-активным веществом, имеющим стероидный скелет). Таким образом, концентрацию поверхностно-активного вещества, имеющего стероидный скелет, в растворе для предварительной обработки можно соответствующим образом определить, основываясь на объемах пробы и раствора для предварительной обработки так, чтобы достигалась вышеуказанная концентрация.
Раствор для предварительной обработки содержит вещество, описанное выше, в водном растворе (например, в буфере, описанном выше). Раствор для предварительной обработки может быть нейтральным раствором, кислым раствором или щелочным раствором, и предпочтительно является нейтральным раствором. Таким образом, значение рН раствора для предварительной обработки, например, равняется от 4,0 до 9,5, предпочтительно от 5,0 до 9,0, предпочтительно от 5,5 до 8,5 и более предпочтительно от 6,0 до 8,0.
Объем раствора для предварительной обработки можно соответствующим образом определить в зависимости от объема и типа пробы, а также цели анализа (например, качественный или количественный анализ), и по отношению к объему пробы он составляет, например, от 0,5 до 100 раз, предпочтительно от 1 до 10 раз и более предпочтительно от 1 до 5 раз.
Обработку пробы раствором для предварительной обработки соответственно проводят адекватным образом для проявления действия компонента, входящего в состав раствора для предварительной обработки. Например, обработку пробы раствором для предварительной обработки можно проводить аналогично обработке пробы, как описано выше, и она может включать (а2-1) смешивание раствора для предварительной обработки с пробой с получением первого смешанного раствора и (b2-1) инкубацию первого смешанного раствора. Условия в отношении температуры и продолжительности времени на стадии (a2-1) и (b2-1) являются аналогичными описанным выше для стадий (a) и (b). Обработку пробы раствором для предварительной обработки можно проводить только смешиванием, как описано выше.
Стадия ii
Раствор для разведения содержит поверхностно-активное вещество, имеющее стероидный скелет. В способе по настоящему изобретению посредством применения раствора для разведения, содержащего поверхностно-активное вещество, имеющее стероидный скелет, можно повысить чувствительность детектирования витамина D. Раствор для разведения также может содержать один или несколько (например, 2 или 3 или более) других компонентов, включая такие как другое поверхностно-активное вещество, которое отличается от поверхностно-активного вещества, имеющего стероидный скелет (например, анионогенное поверхностно-активное вещество, катионогенное поверхностно-активное вещество, амфотерное поверхностно-активное вещество или неионогенное поверхностно-активное вещество), хаотропный агент и восстанавливающий агент. Раствор для разведения также может содержать другие компоненты, как описано выше (например, соединение, обладающее сродством к витамину D, альбумин).
Концентрация поверхностно-активного вещества, имеющего стероидный скелет, в растворе для разведения особым образом не ограничивается, при условии что его действие проявляется в смешанном растворе из раствора для предварительной обработки, раствора для разведения и пробы, и представляет, например, концентрацию, при которой может достигаться вышеуказанная концентрация в смешанном растворе из раствора для предварительной обработки, раствора для разведения и пробы (концентрация поверхностно-активного вещества, имеющего стероидный скелет, когда проба обрабатывается поверхностно-активным веществом, имеющим стероидный скелет). Таким образом, концентрацию поверхностно-активного вещества, имеющего стероидный скелет, в растворе для разведения можно соответствующим образом определить, основываясь на объемах пробы, раствора для предварительной обработки и раствора для разведения так, чтобы достигалась вышеуказанная концентрация.
Раствор для разведения содержит соединение, описанное выше, в водном растворе (например, в буфере, описанном выше). Раствор для разведения может быть нейтральным раствором, кислым раствором или щелочным раствором, и предпочтительно является нейтральным раствором. Таким образом, значение рН раствора для разведения, например, равняется от 4,0 до 9,5, предпочтительно от 5,0 до 9,0, предпочтительно от 5,5 до 8,5 и более предпочтительно от 6,0 до 8,0.
Объем раствора для разведения можно соответствующим образом определить в зависимости от объема и типа пробы, а также цели анализа (например, качественный или количественный анализ), и его можно использовать в большем объеме, чем общий объем пробы и раствора для предварительной обработки. В частности, объем раствора для разведения по отношению к объему пробы и раствора для предварительной обработки составляет, например, от 1 до 20 раз, предпочтительно от 1 до 5 раз и более предпочтительно от 1 до 5 раз.
Обработку пробы раствором для разведения соответственно проводят адекватным образом для проявления действия поверхностно-активного вещества, имеющего стероидный скелет, входящего в состав раствора для разведения. Например, обработку пробы раствором для разведения можно проводить аналогично обработке пробы раствором для предварительной обработки, и она может включать (а2-2) смешивание пробы, обработанной раствором для предварительной обработки, с раствором для разведения с получением второго смешанного раствора и (b2-2) инкубацию второго смешанного раствора. Условия в отношении температуры и продолжительности времени на стадии (a2-2) и (b2-2) являются аналогичными описанным для стадий (a) и (b).
А-2. Стадия 2
Витамин D детектируется в пробе, обработанной, как описано выше. Детектирование витамина D проводится качественно или количественно. В том случае, когда используется вышеуказанное соединение, обладающее сродством к витамину D, то данная стадия может включать добавление к обработанной пробе соединения, имеющего сродство к витамину D.
Детектирование витамина D можно проводить любым методом, и можно проводить, например, при использовании соединения, имеющего сродство к витамину D,. Детектирование витамина D также можно проводить с использованием иммунологического метода. Примеры такого иммунологического метода могут включать ферментный иммуноанализ (EIA), прямой конкурентный ELISA, непрямой конкурентный ELISA, ELISA сэндвич-типа), радиоиммуноанализ (RIA), флуоресцентный иммуноанализ (FIA), метод с магнитными частицами, иммунохроматографический метод, люминесцентный иммуноанализ, спиновый иммуноанализ и метод на основе латекс-аггрегации. Примеры метода, иного, чем вышеуказанные методы, с помощью которого можно детектировать витамин D, могут включать ЖХ-МС.
В том случае, если в качестве соединения, имеющего сродство к витамину D, используется антитело, то затем можно использовать вторичное антитело. Вторичное антитело может представлять антитело к фрагменту первичного антитела (первичного антитела) к витамину D или антитело к комплексу витамина D и первичного антитела. Антитело, такое как вторичное антитело, может быть связано с соединением, позволяющим проводить детектирование. Примеры соединения для детектирования могут включать ферменты (например, пероксидазу из хрена, щелочную фосфатазу), аффинные вещества (например, стрептавидин, биотин), флуоресцентные соединения (например, флуоресцеин, флуоресцеин изотиоцианат, родамин), люминесцентные соединения (например, люциферин, акварин) и радиоактивные вещества (например, 3Н, 14С, 32Р, 35S, 125I). Антитело, такое как вторичное антитело, может быть иммобилизовано на подложке. Примеры подложки могут включать частицу (например, магнитную частицу), мембрану (например, нитроцеллюлезную мемебрану), стекло, пластик, металл, планшет (например, мультилуночный планшет) и устройство. Антитело может быть обеспечено в виде антитела, погруженного в среду, такую как фильтровальная бумага.
В. Набор для определения витамина D
Настоящее изобретение также относится к набору для определения витамина D.
Набор по настоящему изобретению содержит следующее:
поверхностно-активное вещество, имеющее стероидный скелет; и
соединение, обладающее сродством к витамину D, и/или стандарт витамина D.
В том случае, когда соединение, обладающее сродством к витамину D, представляет первичное антитело, то набор по настоящему изобретению может содержать вторичное антитело.
В предпочтительном варианте осуществления набор по настоящему изобретению содержит реакционный раствор, содержащий поверхностно-активное вещество, имеющее стероидный скелет, и соединение, обладающее сродством к витамину D.
В еще одном предпочтительном варианте осуществления набор по настоящему изобретению содержит:
раствор для предварительной обработки, содержащий денатурирующий агент;
раствор для разведения, содержащий поверхностно-активное вещество, имеющее стероидный скелет; и
соединение, обладающее сродством к витамину D, и/или стандарт витамина D.
Подробное описание вышеуказанных составляющих компонентов, входящих в состав набора по настоящему изобретению (например, активный ингредиент и его концентрация, и предпочтительные примеры), представляют описанные выше в способе по настоящему изобретению. Реакционный раствор и раствор для предварительной обработки, и раствор для разведения могут дополнительно содержать компоненты и/или соединения, описанные выше в способе по настоящему изобретению. Стандарт витамина D представляет водный раствор, содержащий (один или несколько) витамин D в определенной концентрации или порошок витамина D, и используется в качестве контроля.
В наборе по настоящему изобретению каждый составляющий компонент может находиться в форме, в которой каждый составляющий компонент размещается в индивидуальном разном контейнере (например, пробирке, планшете). Альтернативно набор по настоящему изобретению может находиться в виде устройства. В частности, набор может находиться в форме, в которой все составляющие компоненты размещаются в устройстве. Альтернативно набор может находиться в форме, в которой части составляющих компонентов размещаются в устройстве, и остальные не располагаются в устройстве (например, располагаются в других контейнерах). В этом случае составляющий компонент не расположенный в устройстве, может использоваться при его введении в устройство, когда определяется анализируемое соединение. Примеры структуры устройства могут включать: (1) устройство, содержащее первую секцию для смешивания поверхностно-активного вещества, имеющего стероидный скелет, с пробой с приготовлением смешанного раствора, и вторую секцию для контактирования приготовленного смешенного раствора с соединением, обладающим сродством к витамину D, для детектирования витамина D; (2) устройство, содержащее секцию для смешивания пробы, поверхностно-активного вещества, имеющего стероидный скелет, и соединения, обладающего сродством к витамину D, для детектирования витамина D; и (3) устройство, включающее проточный канал, способствующий смешиванию пробы с вышеуказанными составляющими компонентами (например, реакционным раствором, раствором для предварительной обработки и раствором для разведения), и секцию для детектирования витамина D.
Далее будут описаны примеры настоящего изобретения, но настоящее изобретение не ограничивается ими.
ПРИМЕРЫ
В последующих примерах использовали первичное антитело, которое распознает 25-ОН витамин D2 и 25-ОН витамин D3 (далее по тексту 25-ОН витамин D2 и 25-ОН витамин D3 в совокупности обозначены как 25-ОН витамин D, в зависимости от того, что требуется), для иммунологического метода определения витамина D. Таким образом, значения, определенные в последующих примерах, могут соответствовать общим количествам 25-ОН витамина D2 и 25-ОН витамина D3.
[Химическое соединение 2]
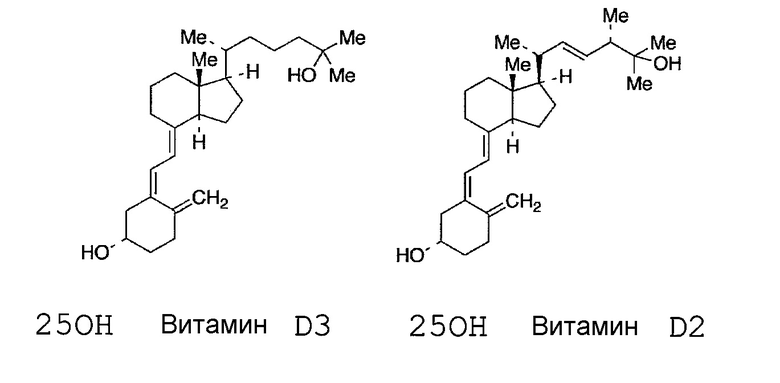
Пример 1: определение 25-ОН витамина D в пробе, обработанной поверхностно-активным веществом
Сыворотку крови человека обрабатывали раствором для предварительной обработки, содержащим поверхностно-активное вещество, и раствором для разведения, содержащим поверхностно-активное вещество или органический растворитель (этанол), в комбинации в течение времени и затем определяли концентрации 25-ОН витамина D в сыворотке человека иммунологическим методом.
Способ проводили следующим образом.
(1) К одной и той же сыворотке крови (10 мкл), отобранной у одного и того же человека, добавляли раствор для предварительной обработки в объеме, превышающем объем пробы в 4 раза (40 мкл) [0,3% (мас./об.) SDS/0,1 М Трис-HCl буфер] (рН 7,6) плюс 0,1% поверхностно-активного вещества, описанного ниже] с получением первого смешанного раствора (50 мкл) из сыворотки крови и раствора для предварительной обработки. Концентрация каждого компонента в первом смешанном растворе была следующей: 0,24% (мас./об.) SDS/0,1 М Трис-HCl буфер плюс 0,8% (мас./об.) поверхностно-активного вещества, описанного ниже.
(2) Первый смешанный раствор инкубировали при комнатной температуре (25°С) в течение 10 мин.
(3) К инкубированному первому смешанному раствору добавляли раствор для разведения, объем которого превышал объем первого в 3 раза (150 мкл) [0,1% (мас./об.) BSA/0,1 М Трис-HCl буфер] (рН 7,6), 0,1% (мас./об. поверхностно-активного вещества, описанного ниже, или 10% (об./об.) этанола) с получением второго смешанного раствора (200 мкл) из первого смешанного раствора и раствора для разведения. Концентрация поверхностно-активного вещества, описанного ниже, во втором смешанном растворе составляла 0,95% (мас./об.).
(4) Второй смешанный раствор смешивали с раствором магнитных частиц, связанных с анти-25-ОН витамин D-антителом, в равных объемах.
(5) Раствор, полученный на стадии (4) выше, инкубировали при 37°С в течение 10 мин.
(6) После инкубации магнитные частицы в пробе собирали на магнитной пластине и три раза промывали.
(7) Добавляли раствор меченного щелочной фосфатазой антитела (антитело к иммунокомплексу 25-ОН витамина D и анти-25 ОН витамин D-антитела) к магнитным частицам после удаления раствора для промывания.
(8) Раствор, полученный на стадии (7) выше, инкубировали при 37°С в течение 10 мин.
(9) После инкубации магнитные частицы в растворе собирали на магнитной пластине и три раза промывали.
(10) К раствору, содержащему магнитные частицы, добавляли хромогенный субстрат (AMPPD).
(11) Раствор, полученный на стадии (10) выше, инкубировали при 37°С в течение 5 мин.
(12) Определяли интенсивность люминесцентных сигналы с использованием ридера меток (ARVO: Perkin Elmer).
Полученные результаты представлены в таблице 1 ниже. В таблице 1 интенсивность люминесцентных сигналов, полученных с сывороткой крови человека, обработанной раствором для предварительной обработки, содержащим поверхностно-активное вещество, и раствором для разведения без поверхностно-активного вещества, устанавливали на 100 (контроль) и определенные люминесцентные сигналы в различных условиях выражали в виде процента относительно контроля.
Твин 20: полиоксиэтилена сорбитан монолаурат (20)
Сапонин: сапонин, полученный из коры растений, относящихся к роду Quillaja (SIGMA S7900)
CHAPS: 3-(3-холамидопроил)диметиламмонио-1-пропансульфонат
DC Na: дезоксихолат натрия
В результате наблюдали, что интенсивность сигнала (люминесцентного сигнала), определенного с использованием раствора для предварительной обработки, содержащего CHAPS или дезоксихолат натрия (DC Na), который представлял поверхностно-активное вещество, имеющее стероидный скелет, была выше, чем определенного с использованием поверхностно-активного вещества, не имеющего стероидного скелета (раствор для предварительной обработки) (таблица 1). Интенсивность сигнала (люминесцентного сигнала), измеренного с использованием раствора для разведения, содержащего CHAPS или дезоксихолат натрия (DC Na), который представлял поверхностно-активное вещество, имеющее стероидный скелет, была существенно выше, чем измеренная с использованием поверхностно-активного вещества, не имеющего стероидного скелета (раствор для разведения) (таблица 1). Таким образом, было показано, что анализируемое соединение можно детектировать с высокой чувствительностью с использованием реагента, содержащего поверхностно-активное вещество, имеющее стероидный скелет, и в частности, анализируемое соединение можно детектировать с высокой чувствительностью с использованием раствора для разведения, содержащего поверхностно-активное вещество, имеющее стероидный скелет.
Пример 2: определение 25-ОН витамина D в пробе, обработанной раствором для предварительной обработки, содержащим хаотропный агент, и раствором для разведения, содержащим поверхностно-активное вещество, имеющее стероидный скелет, в комбинации в течение времени
Сыворотку крови человека обрабатывали раствором для предварительной обработки, содержащим хаотропный агент, и раствором для разведения, содержащим поверхностно-активное вещество или органический растворитель (этанол), в комбинации в течение времени, и затем определяли концентрации 25-ОН витамина D в сыворотке человека иммунологическим методом.
Способ проводили следующим образом.
(1) К одной и той же сыворотке крови (10 мкл), отобранной у одного и того же человека, добавляли раствор для предварительной обработки в объеме, превышающем объем пробы в 4 раза (40 мкл) [7,5 М гуанидина гидрохлорида/РВ (фосфатный буфер) (рН 7,6) плюс 0,1% поверхностно-активного вещества, описанного ниже] с получением первого смешанного раствора (50 мкл) из сыворотки крови и раствора для предварительной обработки. Концентрация каждого компонента в первом смешанном растворе была следующей: 6 М гуанидина гидрохлорида; 0,08% (мас./об.) поверхностно-активного вещества, описанного ниже.
(2) Первый смешанный раствор инкубировали при комнатной температуре (25°С) в течение 10 мин.
(3) К инкубированному первому смешанному раствору добавляли раствор для разведения, объем которого превышал объем первого в 3 раза (150 мкл) [0,1% (мас./об.) BSA/0,1 М Трис-HCl буфер] (рН 7,6), 0,1% (мас./об.) поверхностно-активного вещества, описанного ниже, или 10% (об./об.) этанола] с получением второго смешанного раствора (200 мкл) из первого смешанного раствора и раствора для разведения. Концентрация поверхностно-активного вещества, описанного ниже, во втором смешанном растворе составляла 0,95% (мас./об.).
(4) Последующие процедуры были аналогичными описанным на стадиях (4)-(12) в примере 1.
Полученные результаты представлены в таблице 2 ниже. В таблице 2 интенсивность люминесцентных сигналов в сыворотке крови человека, обработанной раствором для предварительной обработки, содержащим хаотропный агент (гуанидин гидрохлорид), без поверхностно-активного вещества, и раствором для разведения без поверхностно-активного вещества, устанавливали на 100 (контроль), и определенные люминесцентные сигналы в различных условиях, выражали в виде процента относительно контроля.
Как показано в таблице 2, интенсивность сигналов, определенных с использованием раствора для разведения, содержащего дезоксихолат натрия, даже когда сыворотку крови обрабатывали раствором для предварительной обработки, содержащим хаотропный агент, была выше, чем измеренные с использованием раствора для разведения, содержащего органический растворитель или другое поверхностно-активное вещество (твин 20). Таким образом, было подтверждено, что с помощью способа по настоящему изобретению можно детектировать анализируемое соединение с высокой чувствительностью, в частности, не будучи ограниченными типом раствора для предварительной обработки.
Пример 3: сравнение коэффициентов корреляции между определенными значениями количества анализируемого соединения, полученными способом по настоящему изобретению с использованием раствора для предварительной обработки и раствора для разведения, в комбинации в течение времени, и определенными значениями, полученными существующим способом
Для верификации точности определения анализируемого соединения с использованием способа по настоящему изобретению сравнивали коэффициенты корреляции между определенными значениями количества анализируемого соединения, полученными способом по настоящему изобретению, с использованием раствора для предварительной обработки и раствора для разведения в комбинации, и определенными значениями, полученными существующим способом на основе другой методологии.
(3-1) Определение с использованием способа по настоящему изобретению
Способ проводили следующим образом. В целом использовали 15 проб, состоящих из 14 проб сыворотки крови человека плюс одна проба обогащенной сыворотки, обработанной углем, в качестве проб для анализа.
(1) К сыворотке крови (10 мкл) добавляли раствор для предварительной обработки в объеме, превышающем объем пробы в 4 раза (40 мкл) [7,5 М гуанидина гидрохлорида и 4 мМ DTT/0,1 М Трис-буфер (рН 7,6) плюс 0,1% (мас./об.) дезоксихолата натрия или 5% (об./об.) этанола и 5% ДМСО] с получением первого смешанного раствора (50 мкл).
(2) Первый смешанный раствор инкубировали при комнатной температуре (25°С) в течение 10 мин.
(3) К инкубированному первому смешанному раствору добавляли раствор для разведения, объем которого превышал объем первого в 3 раза (150 мкл) [0,1% (мас./об.) BSA/0,1 М фосфатный буфер (рН 7,6) плюс 0,1% (мас./об.) дезоксихолата натрия или 5% (об./об.) этанола и 0,5% (об./об.) ДМСО] с получением второго смешанного раствора из первого смешанного раствора и раствора для разведения.
(4) Последующие процедуры были аналогичными описанным на стадиях (4)-(12) в примере 1.
(3-2) Определение существующим методом
В качестве существующего метода на основе другой методологии использовали радиоиммунологический метод DiaSorin-RIA, в котором применяется радиоактивное соединение, как описано ниже. Анализ DiaSorin-RIA проводили с использованием промышленно доступного набора (набор для радиоиммунологического определения RIA 125I 25-гидроксивитамина D производства DiaSorin).
В частности, анализ DiaSorin-RIA проводили процедурами (I) и (II), как описано ниже. В качестве пробы для анализа в целом использовали 15 проб, состоящих из 14 проб сыворотки крови человека плюс одна проба с обогащенной сывороткой, обработанной углем, как описано в пункте (3-1) выше.
Процедура предварительной обработки
(а) Готовят стеклянные пробирки.
(b) В каждую пробирку вносят 500 мкл ацетонитрила.
(с) В каждую пробирку добавляют 50 мкл калибратора, контроль или пробу (сыворотку крови или тому подобное).
(d) Раствор пробы перемешивают в течение 10 сек.
(e) Раствор пробы центрифугируют при 1200×g в течение 10 мин при комнатной температуре.
(f) Супернатант используют в качестве пробы для анализа.
Процедура анализа
(a) Смешивают 25 мкл вышеуказанной пробы, 50 мкл 125I 25-ОН витамина D и 1 мл раствора анти-25-ОН витамина D-антитела.
(a) Смешанный раствор инкубируют при комнатной температуре в течение 90 сек.
(b) К инкубированному смешанному раствору добавляют 500 мкл ослиного анти-козьего антитела.
(c) Полученный раствор инкубируют при комнатной температуре в течение 25 мин.
(d) Добавляют 500 мкл NSB/буфер для добавления к инкубированному раствору.
(e) Полученный раствор центрифугируют при 1800×g в течение 20 мин при комнатной температуре.
(f) Полностью удаляют супернатант из отцентрифугированного раствора.
(g) Проводят анализ с использованием сцинтилляционного счетчика гамма-лучей.
(3-3) Результаты
Определенные значения, полученные способом по настоящему изобретению, с использованием раствора для разведения, содержащего дезоксихолат натрия, имели высокую корреляцию с определенными значениями, полученными радиоиммунологическим методом DiaSorin-RIA (фиг.1, R2=0,8993). С другой стороны, определенные значения, полученные с использованием раствора для разведения, содержащего этанол и ДМСО, имели низкую корреляцию с определенными значениями, полученными радиоиммунологическим методом DiaSorin-RIA (фиг.1, R2=0,8327). Таким образом, полагается, что настоящее изобретение является пригодным для анализа витамина D.
Пример 4: исследование времени обработки поверхностно-активным веществом
Исследовали время обработки поверхностно-активным веществом, которое требуется для определения 25-ОН витамина D с высокой чувствительностью.
Способ проводили следующим образом.
(1) К 10 мкл одной и той же сыворотки крови, полученной от одного и того же человека, добавляли 40 мкл раствора для предварительной обработки [Трис-HCl буфер (рН 7,6) плюс 0,1% (мас./об.) дезоксихолата натрия] с получением первого смешанного раствора (50 мкл) из сыворотки крови и раствора для предварительной обработки смешиванием при перемешивании. Концентрация каждого компонента в первом смешанном растворе была следующей: 0,8% (мас./об.) дезоксихолата натрия. Время, необходимое для смешивания при перемешивании, составляло примерно 3 сек.
(2) Первый смешанный раствор инкубировали при комнатной температуре (25°С) (в течение 10 мин, 5 мин или 1 мин). Первый смешанный раствор, полученный только смешиванием при перемешивании, подвергали последующей процедуре без инкубации (время инкубации: 0 мин).
(3) К раствору, полученному на стадии (2) выше, добавляли 150 мкл раствора для разведения [PBS (рН 7,6) плюс 0,1% (мас./об.) дезоксихолата натрия и 0,1% (мас./об.) BSA] с получением второго смешанного раствора (200 мкл) из первого смешанного раствора и раствора для разведения. Концентрация дезоксихолата натрия во втором смешанном растворе составляла 0,28% (мас./об.).
(4) Последующие процедуры были аналогичными описанным на стадиях (4)-(12) в примере 1.
Полученные результаты представлены в таблице 3 ниже. В таблице 3 интенсивность люминесцентных сигналов, определенных в условиях со временем инкубации 10 мин, с обработкой раствором для предварительной обработки, содержащим 0,14% (мас./об.) дезоксихолата натрия, устанавливали на 100 (контроль), и интенсивность люминесцентных сигналов, измеренных в условиях со временем инкубации, равным 0 мин, 1 мин и 5 мин, выражали относительно контроля.
В результате даже в случае использования только смешивания (время инкубации: 0 мин) относительная интенсивность люминесцентных сигналов была близко сравнимой с таковой для случая инкубации в течение 10 мин. Это указывает, что инкубация на вышеуказанной стадии (1) не должна проводиться обязательно, и 25-ОН витамин D высвобождается из DBP в сыворотке крови уже только в результате смешивания сыворотки с раствором для предварительной обработки. Таким образом, было показано, что в способе по настоящему изобретению можно сократить время, необходимое для определения анализируемого соединения.
Ссылочный пример 1: время, необходимое для предварительной обработки с использованием существующего продукта
Время, необходимое для предварительной обработки пробы сыворотки крови, с использованием существующего продукта представлено ниже согласно инструкциям изготовителя. Наборы DiaSorin-RIA (производства DiaSorin) и DiaSorin-Liaison (производства DiaSorin) использовали в качестве существующих продуктов.
DiaSorin-Liaison: 510(К) номер К071480
Пример 5: определение витамина D с использованием поверхностно-активного вещества, имеющего стероидный скелет, и анионогенного, катионогенного или амфотерного поверхностно-активного вещества
Сыворотку крови обрабатывали реакционным раствором, содержащим поверхностно-активное вещество, имеющее стероидный скелет (дезоксихолат натрия), и антителом к витамину D, и затем определяли концентрацию 25-ОН витамина D в сыворотке иммунологическим методом. Также оценивали комбинированный эффект поверхностно-активного вещества, имеющего стероидный скелет, и другого поверхностно-активного вещества.
В частности, способ проводили следующим образом.
(1) К 3,75 мкл обогащенной из расчета 100 нг/мл лошадиной сыворотки крови добавляли 146,25 мкл реакционного раствора [Трис-HCl буфер (рН 7,6), 0,03% (мас./об.) или 0,1% (мас./об.) поверхностно-активного вещества, описанного ниже, 0.04% (мас./об.) дезоксихолата натрия, 0,04% (мас./об.) BSA, раствор магнитных частиц, связанных с анти-25 ОН витамин D-антителом] с получением смешанного раствора (150 мкл) из сыворотки крови и реакционного раствора. Концентрация каждого компонента в смешанном растворе была следующей: примерно 0,03% (мас./об.) или примерно 0,1% (мас./об.) поверхностно-активного вещества, описанного ниже; примерно 0,04% (мас./об.) дезоксихолата натрия; примерно 0,04% (мас./об.) BSA.
(2) Смешанный раствор инкубировали при 37°С в течение 10 мин.
(3) После инкубации собирали магнитные частицы в пробе на магнитной пластине, и магнитные частицы промывали три раза.
(4) К магнитным частицам после удаления и промывания добавляли меченное щелочной фосфатазой антитело (антитело к комплексу 25-ОН витамина D и анти-25 ОН витамин D-антитела), суспендированное в MES буфере.
(5) Раствор, полученный на стадии (4) выше, инкубировали при 37°С в течение 10 мин.
(6) После инкубации магнитные частицы в пробе собирали на магнитной пластине и магнитные частицы три раза промывали.
(7) Добавляли люминесцентный субстрат (AMPPD) к магнитным частицам после удаления раствора для промывания.
(8) Раствор, содержащий магнитные частицы и люминесцентный субстрат, инкубировали при 37°С в течение 10 мин.
(9) Определяли интенсивность люминесцентных сигналов с использованием ридера меток (ARVO: Perkin Elmer).
Полученные результаты представлены в таблице 5 ниже. В таблице 5 интенсивность люминесцентных сигналов сыворотки, определенных в условиях без добавления вышеуказанного поверхностно-активного вещества [0,03% (мас./об.) или 0,1% (мас./об.)], устанавливали на 100 (контроль) и интенсивность люминесцентных сигналов сыворотки, измеренных в условиях, когда добавляли поверхностно-активное вещество, имеющее стероидный скелет, выражали по отношению к контролю.
0,10%
12496
286
1721
8548
6215
2021
198
334
Реакционный раствор содержал 0,03% (мас./об.) или 0,1% (мас./об.) поверхностно-активного вещества: (а) дезоксихолат натрия, (b) холат натрия, (c) SDS, (d) N-лауроилсаркозин, (е) N-додеканоилсаркозиновая кислота, (f) бромид цетилдиметилэтиламмония, (g) CHAPS или (h) цвиттергент, в дополнении к 0,04% (мас./об.) дезоксихолата натрия (поверхностно-активное вещество, имеющее стероидный скелет).
В результате наблюдали, что все, анионогенное поверхностно-активное вещество, катионогенное поверхностно-активное вещество и амфотерное поверхностно-активное вещество, повышали интенсивность люминесцентных сигналов в комбинации с поверхностно-активным веществом, имеющим стероидный скелет (дезоксихолат натрия). Дезоксихолат натрия, SDS, N-лауроилсаркозин и N-додеканоилсаркозиновая кислота, которые представляют анионогенные поверхностно-активные вещества, а также бромид цетилдиметилэтиламмония, который представляет катионогенное поверхностно-активное вещество, повышали интенсивность люминесцентных сигналов. В частности, дезоксихолат натрия показывал существенное повышение интенсивности люминесцентного сигнала.
Кроме того, заявители достигли цели при анализе витамина D в пробе, обработанной реакционным раствором, содержащим поверхностно-активное вещество, имеющее стероидный скелет (дезоксихолат натрия), и антитело к витамину D (смотри стадию (1)). Это указывает, что даже несмотря на то что поверхностно-активное вещество, имеющее стероидный скелет, может высвобождать витамин D из комплекса витамин D-белок, находящегося в сыворотке, оно не оказывает отрицательного влияния на детектирование витамина D антителом. Следовательно, согласно настоящему изобретению было показано, что витамин D можно было легко определить с использованием реакционного раствора, содержащего поверхностно-активное вещество, имеющее стероидный скелет, и антитела к витамину D, без использования сложной методики, в которой пробу обрабатывают по отдельности поверхностно-активным веществом, имеющим стероидный скелет, и антителом к витамину D.
Пример 6: исследование влияния обработки пробы поверхностно-активным веществом, содержащим или не содержащим гидроксильной группы в положении 7 стероидного скелета, на определение витамина D
В примере 5 было показано, что дезоксихолат натрия повышал интенсивность сигналов более существенно, чем холат натрия и CHAPS (таблица 5). В данном случае дезоксихолат натрия представляет поверхностно-активное вещество, в котором отсутствует гидроксильная группа в положении 7 в стероидном скелете, в то время как холат натрия и CHAPS являются поверхностно-активными веществами, содержащими гидроксильную группу в положении 7 стероидного скелета. На основании этого можно предположить, что вероятно, присутствие или отсутствие гидроксильной группы в положении 7 в стероидном скелете оказывает влияние на интенсивность сигналов. Таким образом, оценивали влияние обработки пробы поверхностно-активным веществом с или без гидроксильной группы в положении 7 в стероидном скелете на определение витамина D.
В частности, способ проводили следующим образом.
(1) К 3,75 мкл обогащенной из расчета 100 нг/мл лошадиной сыворотки крови добавляли 146,25 мкл реакционного раствора [Трис-HCl буфер (рН 7,6), 0% (мас./об.), 0,1% (мас./об.), 0,2% (мас./об.) или 0,4% (мас./об.) поверхностно-активного вещества, имеющего стероидный скелет, описанного ниже, 0,04% (мас./об.) BSA, раствор частиц, связанных с анти-25 ОН витамин D-антителом] с получением смешанного раствора (150 мкл) из сыворотки крови и реакционного раствора. Концентрация каждого компонента в смешанном растворе была следующей: 0% (мас./об.), примерно 0,1% (мас./об.), примерно 0,2% (мас./об.) или примерно 0,4% (мас./об.) поверхностно-активного вещества, имеющего стероидный скелет, описанного ниже; примерно 0,04% (мас./об.) BSA. Дезоксихолат натрия и тауродезоксихолат натрия использовали в качестве поверхностно-активного вещества без гидроксильной группы в положении 7 в стероидном скелете, в то время как таурохолат натрия, холат натрия и CHAPS использовали в качестве поверхностно-активного вещества, содержащего гидроксильную группу в положении 7 в стероидном скелете.
(2) Последующие стадии проводили аналогично тому, как описано на стадиях (2)-(9) в примере 5.
Полученные результаты представлены в таблице 6 ниже. В таблице 6 интенсивность люминесцентных сигналов сыворотки, определенных в условиях, где вышеуказанное поверхностно-активное вещество [0,1% (мас./об.), 0,2% (мас./об.) или 0,4% (мас./об.)] не добавляли, устанавливали на 100 (контроль), и интенсивность люминесцентных сигналов сыворотки, измеренная в условиях, когда добавляли поверхностно-активное вещество, содержащее гидроксильную группу в положении 7 стероидного скелета, или поверхностно-активное вещество, не содержащее гидроксильной группы в положении 7 стероидного скелета, выражали по отношению к контролю.
В результате интенсивность сигналов, определенных в пробе, обработанной дезоксихолатом натрия или тауродезоксихолатом натрия, которые не содержат гидроксильной группы в положении 7 в стероидном скелете, была существенно выше по сравнению с интенсивностью сигналов, измеренных в пробе, обработанной холатом натрия или таурохолатом натрия, которые содержат гидроксильную группу в положении 7 в стероидном скелете. Следовательно, в данном примере и примере 1 было показано, что поверхностно-активное вещество, имеющее стероидный скелет, является эффективным для определения витамина D, и что поверхностно-активное вещество, не содержащее гидроксильной группы в положении 7 в стероидном скелете, является особенно пригодным для определения витамина D.
Пример 7: определение витамина D с использованием реакционного раствора, содержащего поверхностно-активное вещество, имеющее стероидный скелет, SDS и антитело
Определяли концентрацию 25-ОН витамина D в сыворотке крови человека с использованием реакционного раствора, содержащего поверхностно-активное вещество, имеющее стероидный скелет, и SDS, для определения витамина D.
В частности, способ проводили следующим образом.
(1) К 3,75 мкл сыворотки крови человека (№ 1 до 16) из различных источников или сыворотки крови человека, обработанной углем (контроль 1), добавляли 146,25 мкл реакционного раствора [Трис-HCl буфер (рН 7,6), 0,14% (мас./об.) дезоксихолата натрия, 0,015% (мас./об.) SDS, 0,04% (мас./об.) BSA и раствор частиц, связанных с анти-25 ОН витамин D-антителом], с получением смешанного раствора (150 мкл) из сыворотки крови и реакционного раствора.
(2) Последующие стадии проводили аналогично тому, как описано на стадиях (2)-(9) в примере 5. Полученные определенные значения сравнивали с определенными значениями, полученными радиоиммунологическим методом DiaSorin-RIA. Метод DiaSorin-RIA проводили, как описано в примере 3-2.
Полученные результаты представлены в таблице 7 и на фиг.3. В таблице 7 интенсивность люминесцентных сигналов, полученных с сывороткой крови человека, обработанной углем, устанавливали на 100 (контроль), и измеренную интенсивность люминесцентных сигналов сыворотки крови выражали по отношению к контролю.
+ 0,015% DSD
В результате определенные значения, полученные способом по настоящему изобретению, с использованием реакционного раствора, содержащего поверхностно-активное вещество, имеющее стероидный скелет, и SDS, имели высокую корреляцию с измеренными значениями, полученными радиоиммунологическим методом DiaSorin-RIA (фиг.3, R2=0,9881). Следовательно, полагается, что настоящее изобретение является пригодным для определения витамина D.
Пример 8: определение 25-ОН витамина D, высвобожденного из комплекса витамин D-связывающий белок, и сыворотки крови человека, обработкой поверхностно-активным веществом, имеющим стероидный скелет
(8-1) Обработка фракции поверхностно-активным веществом, имеющим стероидный скелет
Фракцию (контрольную фракцию), полученную элюированием сыворотки человека, обработанной контрольным буфером (Трис-HCl) гель-хроматографией, подвергали анализу с использованием анти-25-ОН витамин D-антитела. Кроме того, контрольную фракцию обрабатывали дезоксихолатом натрия, и подвергали анализу с использованием анти-25-ОН витамин D-антитела.
В частности, способ проводили следующим образом.
(1) К сыворотке крови человека (50 мкл) добавляли 0,1М Трис-HCl буфер (рН 7,8) в объеме, превышающем объем пробы в 4 раза (200 мкл). Смешанный раствор готовили только смешиванием при перемешивании (примерно в течение 3 сек) (т.е. без инкубации).
(2) Зависимые от молекулярной массы фракции получали элюированием смешанного раствора 0,1М Трис-HCl буфером с использованием гель-хроматографии (GE Healthcare: AKTA explorer) и на колонке для гель-хроматографии (0,25-1 объем колонки).
(3) Фракцию, полученную на стадии (2) выше, смешивали с раствором магнитных частиц, связанных с анти-25 ОН-витамин D-антителом, содержащим 0,4% (мас./об.) соли дезоксихолата Na в равных объемах (условия в присутствии дезоксихолата Na). С другой стороны, для обеспечения условий с отсутствием дезоксихолата Na фракцию смешивали с раствором магнитных частиц, связанных с анти-25 ОН-витамин D-антителом, не содержащим дезоксихолата Na, в равных объемах.
(4) Последующие процедуры проводили аналогично тому, как описано на стадиях (5)-(12) в примере 12.
В результате, когда фракцию не обрабатывали дезоксихолатом, то не детектировали высокую интенсивность люминесцентных сигналов, и количество 25-ОН витамина D было невозможно определить (фиг.4). С другой стороны, когда фракцию обрабатывали дезоксихолатом и определяли концентрацию 25-ОН витамина D, то детектировали сильные люминесцентные сигналы во фракциях № 15 до № 17.
(8-2) Детектирование комплекса витамин D-связывающий белок в контрольной фракции вестерн-блоттингом
Исследовали, насколько фракция детектированного витамина D соответствовала или нет фракции комплекса витамин D-связывающий белок.
В частности, способ проводили следующим образом.
(1) К контрольной фракции (фракция, полученная на стадии (8-1) выше, 30 мкл), добавляли буфер для проб NuPAGE LSD (Invitrogen) в объеме, составляющем 1/3, и DTT в конечной концентрации 1 мМ, с получением смешанного раствора.
(2) Смешанный раствор кипятили в ультрачистой воде при 100°С в течение 5 мин.
(3) Полученный раствор наносили на 4-10% акриламидный гель.
(4) Проводили электрофорез SDS-PAGE при напряжении 200 В в течение 25 мин.
(5) Полученный гель переносили на мембрану PVDF с использованием iBlot (Invitrogen).
(6) Мембрану, на которую были перенесены полосы, помещали в 5% раствор обезжиренного молока, и встряхивали при комнатной температуре в течение 1 ч.
(7) Раствор меняли на PBSt, и мембрану с перенесенными полосами встряхивали в течение 5 мин для промывания.
(8) Затем вышеописанную процедуру повторяли дважды и затем раствор меняли на 5% раствор обезжиренного молока.
(9) Античеловеческий витамин D-связывающий белок-антитело (Abcam), которое использовали в качестве первичного антитела в конечной концентрации 1 мкг/мл, добавляли к 5% раствору обезжиренного молока и мембрану с перенесенными полосами встряхивали при 4°С в течение ночи.
(10) Раствор меняли на PBSt и мембрану с перенесенными полосами встряхивали в течение 5 мин для промывания.
(11) Затем вышеописанную процедуру повторяли дважды и затем раствор меняли на 5% раствор обезжиренного молока.
(12) Антимышиное Ig-антитело-HRT, которое использовали в качестве вторичного антитела в разведении в 100 раз, добавляли к 5% раствору обезжиренного молока и мембрану встряхивали при комнатной температуре в течение 1 ч.
(13) Раствор меняли на PBSt и мембрану встряхивали в течение 5 мин для промывания.
(14) Затем вышеописанную процедуру повторяли дважды. Затем PBSt меняли на ультрачистую воду.
(15) Мембрану с перенесенными полосами промывали один раз ультрачистой водой.
(16) Раствор меняли на раствор люминесцентного соединения (ECL select; GE Healthcare).
(17) Мембрану с перенесенными полосами фотографировали с использованием LAS3000 MINWIN (FUJIFILM).
В результате фракции № 15-17, в которых детектировался комплекс витамин D-связывающий белок, соответствовали фракциям, в которых детектировался 25-ОН витамин D в примере 8-1 (фиг.5). Следовательно, когда пробу обрабатывали и элюировали 0,1 Трис-HCl буфером, то было сделано предположение, что 25-ОН витамин D извлекается в состоянии, связанном с комплексом витамин D-связывающий белок.
(8-3) Высвобождение витамина D из комплекса витамин D-связывающий белок под действием поверхностно-активного вещества, имеющего стероидный скелет
Исследовали, насколько 25-ОН витамин D высвобождается или нет из сыворотки крови человека в результате обработки дезоксихолатом.
В частности, способ проводили следующим образом.
(1) К сыворотке крови человека или 1% раствору BSA/PBS, в который вносили 143 нг/мл 25-ОН витамина D (50 мкл), добавляли 0,4% раствор (мас./об.) дезоксихолата в объеме, превышающем объем пробы в 4 раза (200 мкл) с получением смешанного раствора. Смешанный раствор готовили только смешиванием при перемешивании (примерно в течение 3 сек) (т.е. без инкубации).
(2) Зависимые от молекулярной массы фракции получали элюированием смешанного раствора 0,1М Трис-HCl буфером с использованием гель-хроматографии (GE Healthcare: AKTA explorer) и на колонке для гель-хроматографии (Superdex200 10/30). Затем собирали объемы 0,25-1 от объема колонки.
(3) Пробу, обработанную, как описано выше, смешивали с раствором магнитных частиц, связанных с анти-25 ОН витамин D-антителом, не содержащим дезоксихолата, в равных объемах.
(4) Последующие процедуры проводили аналогично тому, как описано на стадиях (5)-(12) в примере 1.
В результате 25-ОН витамин D детектировали во фракциях № 22-28, которые соответствовали фракциям с меньшей молекулярной массой, чем фракции № 15-17, в которых был детектирован комплекс витамин D-связывающий белок в примере 8-1 (фиг.6). Фракции № 22-28, в которых детектировали 25-ОН витамин D, когда элюировался дезоксихолатом, идентичны фракциям № 22-28, в которых элюировался свободный 25-ОН витамин D, на основании чего можно предположить, что 25-ОН витамин D высвобождается в результате обработки дезоксихолатом.
(8-4) Высвобождение 25-ОН витамина D из комплекса витамин D-связывающий белок и сыворотки обработкой поверхностно-активным веществом, имеющим стероидный скелет
Исследовали, насколько 25-ОН витамин D высвобождается или нет из комплекса витамин D-связывающий белок и 25-ОН витамина D3 обработкой поверхностно-активным веществом, имеющим стероидный скелет.
В частности, способ проводили следующим образом.
(1) Пробы готовили, как показано в таблице 8. В частности, 2,82 мкл раствора 1 мг/мл 25-ОН витамина D3 (Tronto chemical reagent) (+/-) добавляли к 17,2 мкл раствора 1,64 мг/мл очищенного комплекса витамин D-связывающий белок (Abcam) (+ или -) с получением пробы. Затем полученную пробу инкубировали в течение 10 мин.
(2) К 3,75 мкл вышеуказанной пробы добавляли 146,25 мкл раствора, показанного в таблице 8 (рН 7,6, Трис-HCl буфер, 0,138% (мас./об.) дезоксихолата натрия плюс 0,038% BSA плюс раствор магнитных частиц, связанных с анти-25-ОН витамин D-антителом) с получением смешанного раствора.
(3) Последующие процедуры проводили аналогично тому, как описано на стадиях (5)-(12) в примере 1.
В результате, когда образовывался комплекс витамин D-связывающий белок и 25-ОН витамин D3 с использованием промышленно доступного витамин D-связывающего белка и 25-ОН витамина D3, то невозможно было детектировать 25-ОН витамин D3 (см. фиг.7 и № 2 в таблице 8). С другой стороны, когда комплекс обрабатывали дезоксихолатом, то 25-ОН витамин D3 можно было детектировать (см. фиг.7 и № 3 в таблице 8). В этом случае измеренные сигналы составляли 88% от сигналов, измеренных в № 1 (фиг.7 и таблица 8).
Как описано выше, было показано, что 25-ОН витамин D высвобождается из комплекса витамин D-связывающий белок и 25-ОН витамин D3 и высвобожденный 25-ОН витамин D можно анализировать с высокой чувствительностью обработкой поверхностно-активным веществом, имеющим стероидный скелет.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Способ и набор по настоящему изобретению являются пригодными для определения витамина D.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕАГЕНТ ДЛЯ ВЫСВОБОЖДЕНИЯ ВИТАМИНА D | 2011 |
|
RU2579312C2 |
| АНТИТЕЛО, НАБОР И СПОСОБ ОПРЕДЕЛЕНИЯ АМИЛОИДНЫХ ПЕПТИДОВ | 2012 |
|
RU2571213C2 |
| УСТРОЙСТВО, СОДЕРЖАЩЕЕ ШАРИКИ, ДЛЯ ДИАГНОСТИКИ IN VITRO И ЕГО ПРИМЕНЕНИЯ | 2019 |
|
RU2818259C2 |
| СВЯЗАННЫЕ СО СТРЕПТАВИДИНОМ МАГНИТНЫЕ ЧАСТИЦЫ И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 2012 |
|
RU2608656C2 |
| СПОСОБЫ И РЕАГЕНТЫ ДЛЯ УЛУЧШЕНИЯ ДЕТЕКТИРОВАНИЯ АМИЛОИДНЫХ БЕТА-ПЕПТИДОВ | 2010 |
|
RU2554774C2 |
| УСТРОЙСТВО ДЛЯ ДИАГНОСТИКИ IN VITRO И ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2685416C2 |
| ВОДОРАСТВОРИМАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ВИДЕ ИОННОГО КОМПЛЕКСА И ЕЕ ПРИМЕНЕНИЕ | 1999 |
|
RU2180855C2 |
| ИММУНОЛОГИЧЕСКИЙ АНАЛИЗ НА СВОБОДНЫЙ ВИТАМИН D | 2011 |
|
RU2592229C2 |
| ИММУНОЛОГИЧЕСКИЙ АНАЛИЗ ЧЕЛОВЕЧЕСКОГО МЕДУЛЛАЗИНА И ДИАГНОСТИКА РАССЕЯННОГО СКЛЕРОЗА С ЕГО ПОМОЩЬЮ | 2000 |
|
RU2210074C2 |
| УСИЛИТЕЛЬ ВЫРАБОТКИ ТЕСТОСТЕРОНА | 2007 |
|
RU2431475C2 |
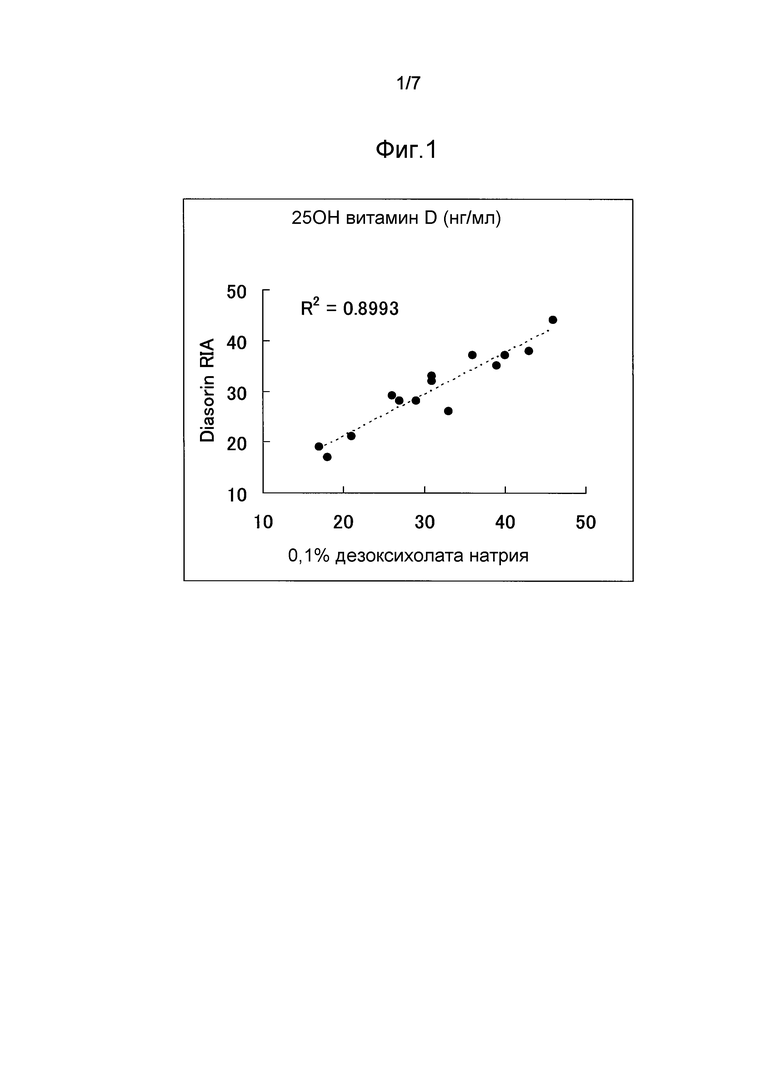
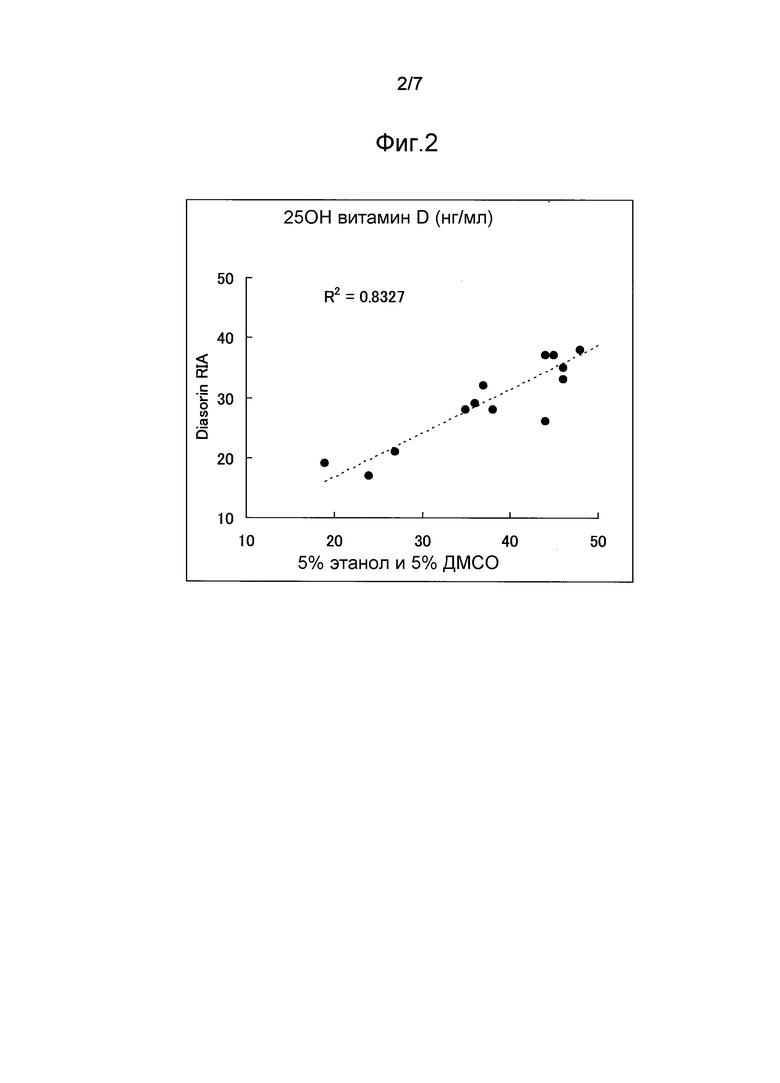
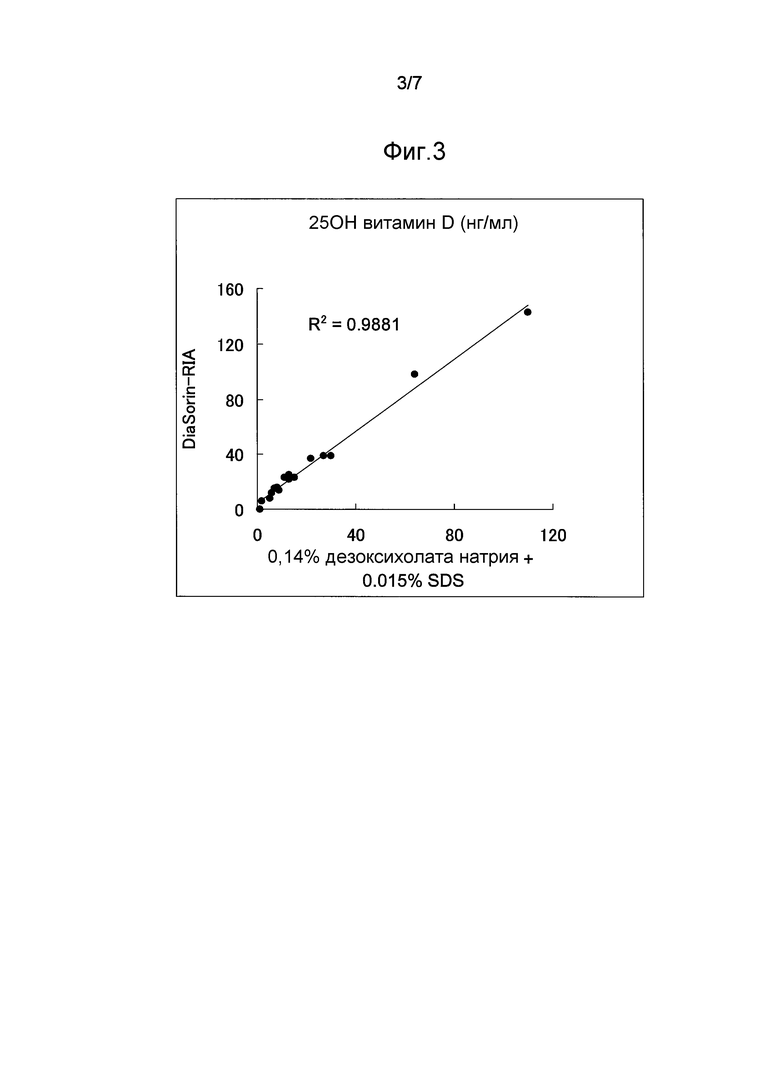
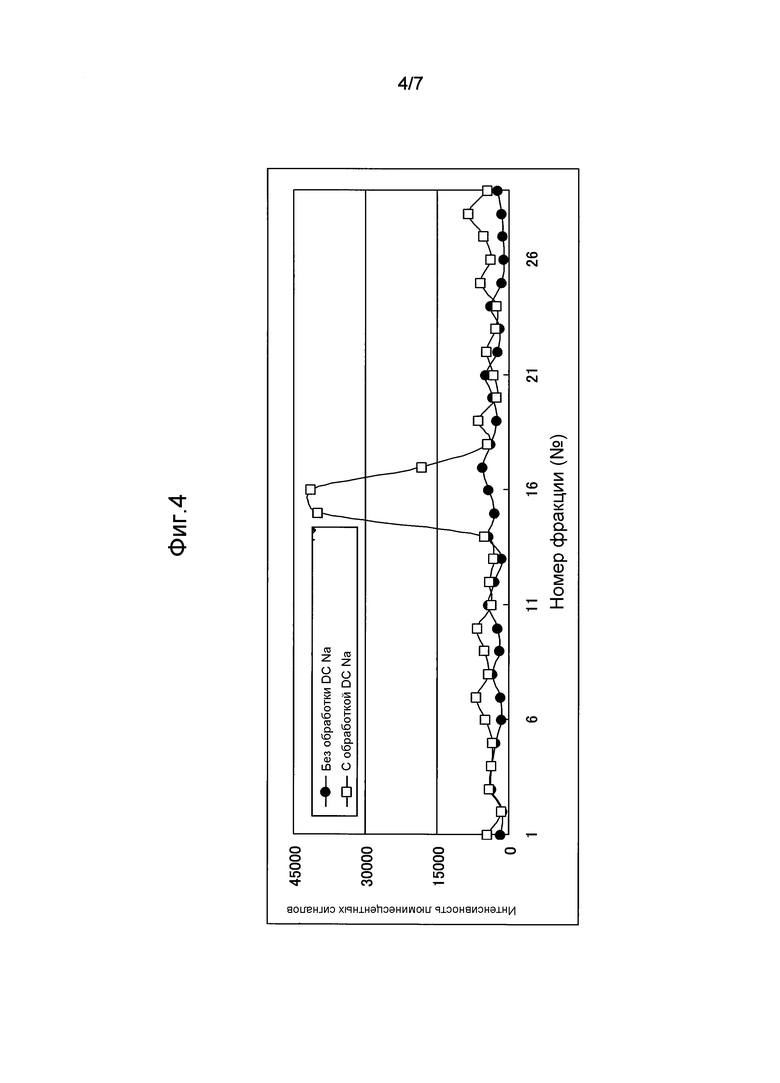
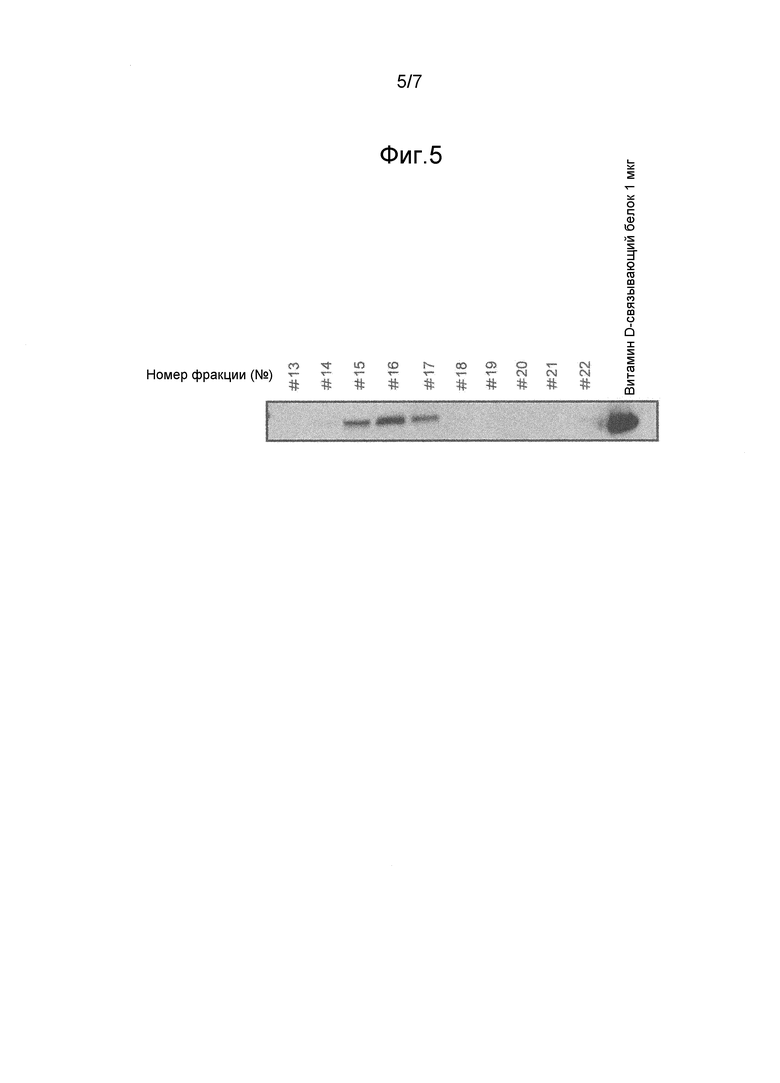
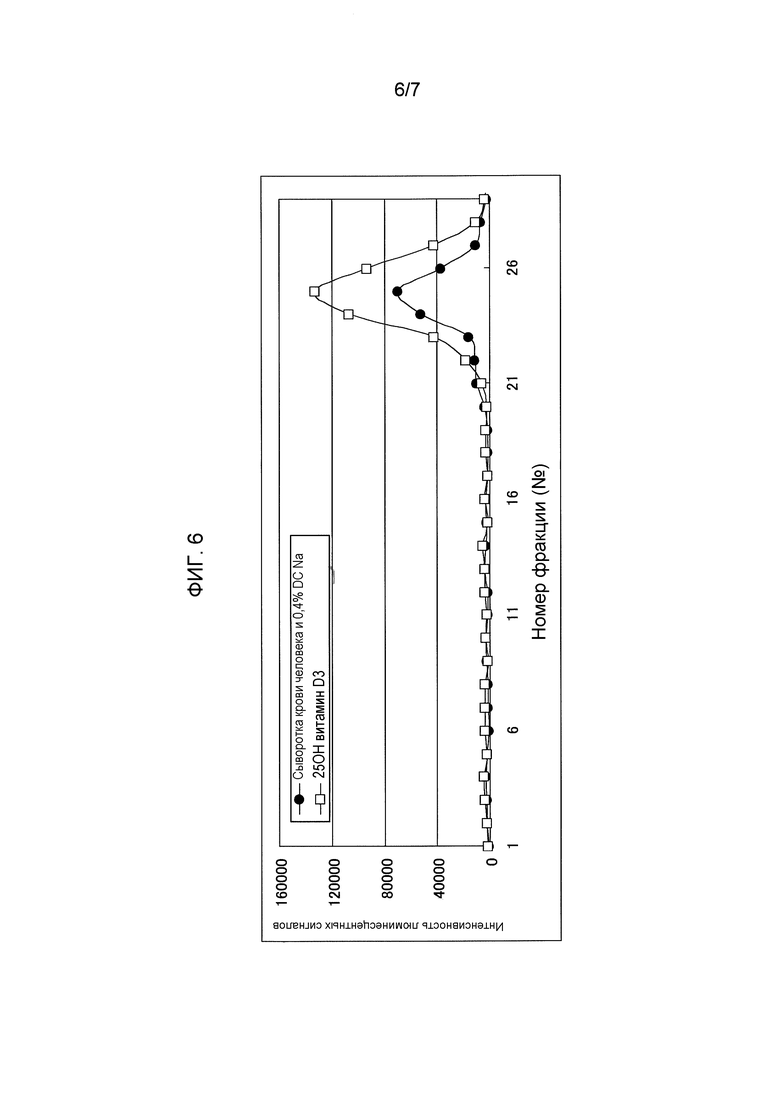
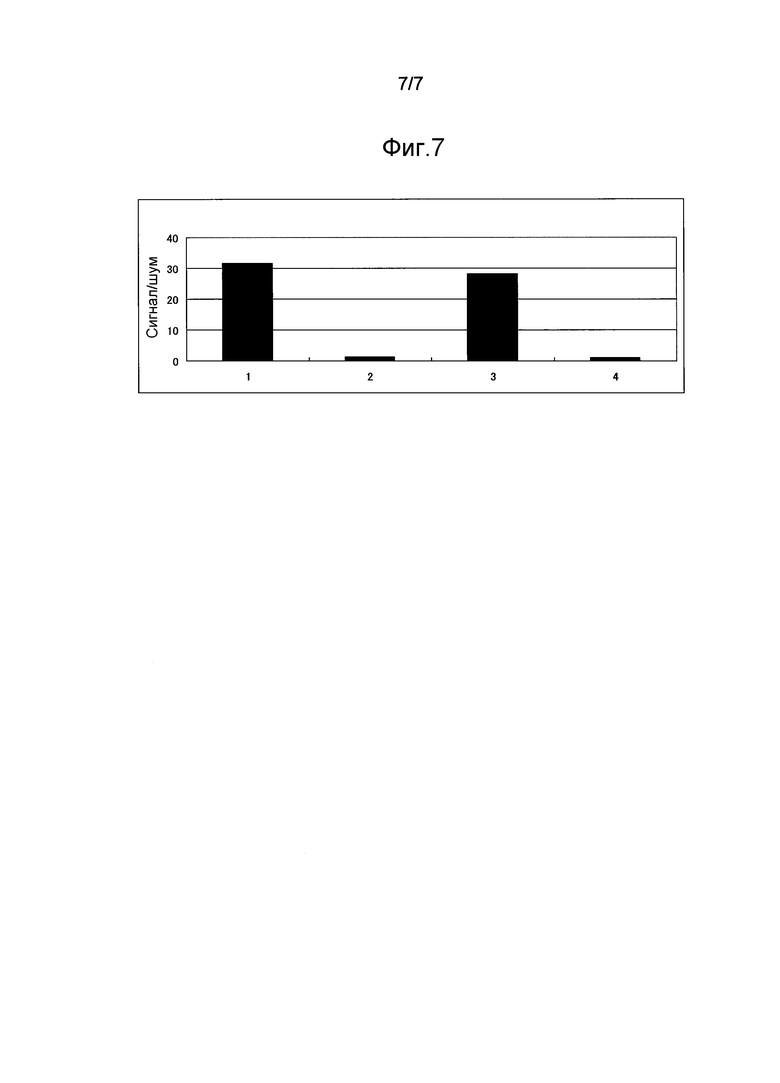
Изобретение относится к способу и набору определения витамина D. Сущность способа заключается в том, что проводят обработку пробы поверхностно-активным веществом, имеющим стероидный скелет, не имеющий гидроксильной группы в положении 7, и представляющим собой желчную кислоту или ее производное. Далее проводят детектирование витамина D в обработанной пробе. Набор по настоящему изобретению включает в себя поверхностно-активное вещество, имеющее стероидный скелет, и соединение, обладающее сродством к витамину D, и/или стандарт витамина D. Использование способа и набора позволяет с высокой точностью определять витамин D. 2 н. и 9 з.п. ф-лы, 7 ил., 8 табл., 8 пр.
1. Способ определения витамина D, включающий:
(1) обработку пробы поверхностно-активным веществом, имеющим стероидный скелет, не имеющий гидроксильную группу в положении 7, где поверхностно-активное вещество представляет собой желчную кислоту, или ее производное, или ее соль; и
(2) детектирование витамина D в обработанной пробе.
2. Способ по п. 1, где поверхностно-активное вещество имеет стероидный скелет, не содержащий заместителя в положении 7.
3. Способ по п. 1, где поверхностно-активное вещество представляет дезоксихолевую кислоту, или тауродезоксихолевую кислоту, или их соль.
4. Способ по п. 1, дополнительно включающий обработку образца другим денатурирующим агентом, который отличается от поверхностно-активного вещества.
5. Способ по п. 4, где другой денатурирующий агент представляет собой поверхностно-активное вещество, содержащее гидрофобную группу, состоящую из углеводородной цепи и гидрофильной группы.
6. Способ по п. 1, где обработка пробы проводится только смешиванием.
7. Способ по п. 1, включающий:
(1') обработку пробы реакционным раствором, содержащим поверхностно-активное вещество, имеющее стероидный скелет, и соединение, обладающее сродством к витамину D; и
(2') детектирование витамина D в обработанной пробе.
8. Способ по п. 1, включающий:
(1ʺ) обработку пробы раствором для предварительной обработки, содержащим денатурирующий агент;
(2ʺ) обработку пробы, обработанной на стадии (1ʺ) выше, раствором для разведения, содержащим поверхностно-активное вещество, имеющее стероидный скелет; и
(3ʺ) детектирование витамина D в пробе, обработанной на стадии (2ʺ) выше.
9. Способ по п. 1, где проба получена от человека.
10. Способ по одному из пп. 1-9, где проба представляет собой пробу, относящуюся к крови.
11. Набор для определения витамина D, включающий:
(1) поверхностно-активное вещество, имеющее стероидный скелет, не имеющий гидроксильной группы в положении 7, где поверхностно-активное вещество представляет собой желчную кислоту, или ее производное, или ее соль; и
(2) соединение, обладающее сродством к витамину D, и/или стандарт витамина D.
| WO 2012091569 A1, 05.07.2012 | |||
| WO 2011052620 A1, 05.05.2011 | |||
| WO 2011122948 A1, 06.10.2011 | |||
| Способ определения метаболитов витамина д в сыворотке крови | 1983 |
|
SU1140039A1 |
| WO 2011122948 A1 06.10.2011. | |||
Авторы
Даты
2017-05-31—Публикация
2014-01-20—Подача