Предлагаемая группа изобретений относится к области биомедицины, к разработке мультимодальных противораковых препаратов, касается порфиразина, порфиразинового комплекса гадолиния и их применения для фотодинамической терапии (ФДТ) злокачественных новообразований в качестве фотосенсибилизаторов и одновременно в качестве оптических сенсоров внутриклеточной вязкости.
Измерение внутриклеточной вязкости в ходе фотодинамического воздействия на раковые клетки позволяет проводить мониторинг процедуры фотодинамической терапии (ФДТ) в режиме реального времени.
Многие из тетрапиррольных красителей нашли широкое применение в биомедицине, поскольку они часто обладают яркой флуоресценцией и способны избирательно накапливаться в раковой опухоли, обеспечивая тем самым возможность ее детектирования. Кроме того, под действием света с подходящей длиной волны они способны продуцировать синглетный кислород, который вызывает гибель раковых клеток. Эта концепция лежит в основе фотодинамической терапии (ФДТ) онкологических заболеваний.
К настоящему времени описан обширный ряд фотосенсибилизаторов (ФС) для фотодинамической терапии (ФДТ) на основе хлоринов, порфиринов, фталоцианинов и некоторых других тетрапирролов. Порфиразины, имеющие подобно всем тетрапиррольным пигментам уникальную макросистему пи-сопряжения, также перспективны в качестве агентов ФДТ [Е.R. Trivedi, A.S. Harney, М.В. Olive, I. Podgorski, К. Moin, В.F. Sloane, A.G.M. Barrett, T.J. Meade, and В.M. Hoffman. Chiral porphyrazine near-IR optical imaging agent exhibiting preferential tumor accumulation // PNAS. - 2010. - V. 107. - №4. - Р1284-1288].
Для некоторых флуорофоров наблюдается различная степень свободы внутримолекулярного движения фрагментов светоизлучающей молекулы в средах с различной вязкостью [М.A. Haidekker, Е.A. Theodorakis. Environment-sensitive behavior of fluorescent molecular rotors // J. of Biol. Eng. - 2010 - V.4. - P. 1-14.  T. Effect of viscosity on the fluorescence quantum yield of some dye systems / T.
T. Effect of viscosity on the fluorescence quantum yield of some dye systems / T.  G. Hoffmann // J. Phys Chem. - 1971. - V. 75. - P. 63-76].
G. Hoffmann // J. Phys Chem. - 1971. - V. 75. - P. 63-76].
Высоковязкие среды затрудняют внутримолекулярное движение (вращение или скручивание вокруг отдельных химических связей) и связанную с этим диссипацию энергии возбужденного состояния. Это приводит к сильному возрастанию интенсивности флуоресценции. Поскольку зависимость параметров флуоресценции от вязкости среды может быть описана простыми математическими уравнениями такие соединения могут быть использованы в качестве зондов локальной вязкости [ , Т. Effect of viscosity on the fluorescence quantum yield of some dye systems / T. Forster, G. Hoffmann// J. Phys Chem. - 1971. - V. 75. - Р. 63-76].
, Т. Effect of viscosity on the fluorescence quantum yield of some dye systems / T. Forster, G. Hoffmann// J. Phys Chem. - 1971. - V. 75. - Р. 63-76].
Известно, что внутриклеточная вязкость сильно возрастает в процессе фотоиндуцированной гибели клетки [M. Kuimova, S. Butchway, A. Parker, H.Anderson, P.Ogiby Nature Chemistry, 1, 2009, 69-73]. Это создает основу для непосредственного контроля за процессом фотодинамического воздействия по изменению параметров флуоресценции фотосенсибилизатора, количественно связанных со значениями внутриклеточной вязкости.
Такой подход впервые успешно осуществлен на клеточных культурах с использованием ранее полученного и описанного тетра(4-фторфенил)тетрацианопорфиразина (III) [М.A. Izquierdo, A. Vysniauskas, S.A. Lermontova, I.S. Grigoryev, N.Y. Shilyagina, I.V. Balalaeva, Larisa G. Klapshina and M.K. Kuimova. Dual use of porphyrazines as sensitizers and viscosity markers in photodynamic therapy // J. Mater.Chem B, 2015, 3, 1089-1096]. Было показано, что порфиразин III (фиг. 1) является не только сенсибилизатором фотодинамического воздействия на раковые клетки, но и высокочувствительным сенсором внутриклеточной вязкости, позволяющим проводить ее количественную оценку в различные моменты процесса фотодинамической терапии.
Однако недостатком порфиразина III является чрезвычайно низкий квантовый выход красной флуоресценции в низковязких средах. Поскольку вязкость внутри живой клетки меняется в широком диапазоне от 1-2 до 140 сП эффективность порфиразина III как фотосенсибилизатора при локализации в клеточных компартментах с низкой вязкостью может быть сильно понижена.
В задачу изобретения положено создание новых порфиризинов и порфиразиновых комплексов гадолиния, обеспечивших желаемую настройку фотофизических свойств макроцикла.
Техническим результатом от использования изобретения является повышение фотодинамической активности.
Это достигается тем, что порфиразин представлен общей формулой:
 ,
,
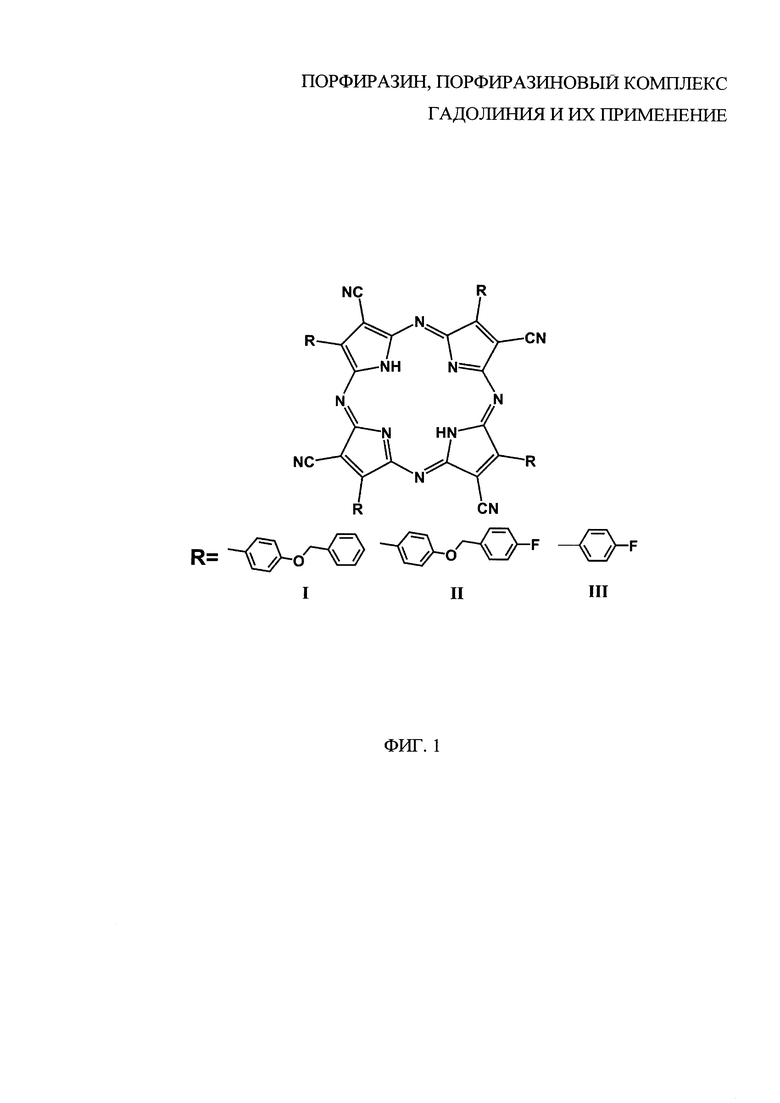
где R - заместитель, R=BnOPh (4-бензилоксифенил), 4FBnOPh (4-(4-фторбензилокси)фенил); при R=BnOPh (4-бензилоксифенил) представляет собой тетра(4-бензилоксифенил)тетрацианопорфиразин; при R=4FBnOPh (4-(4-фторбензилокси)фенил) представляет собой тетра(4-(4-фторбензилокси)фенил)тетрацианопорфиразин.
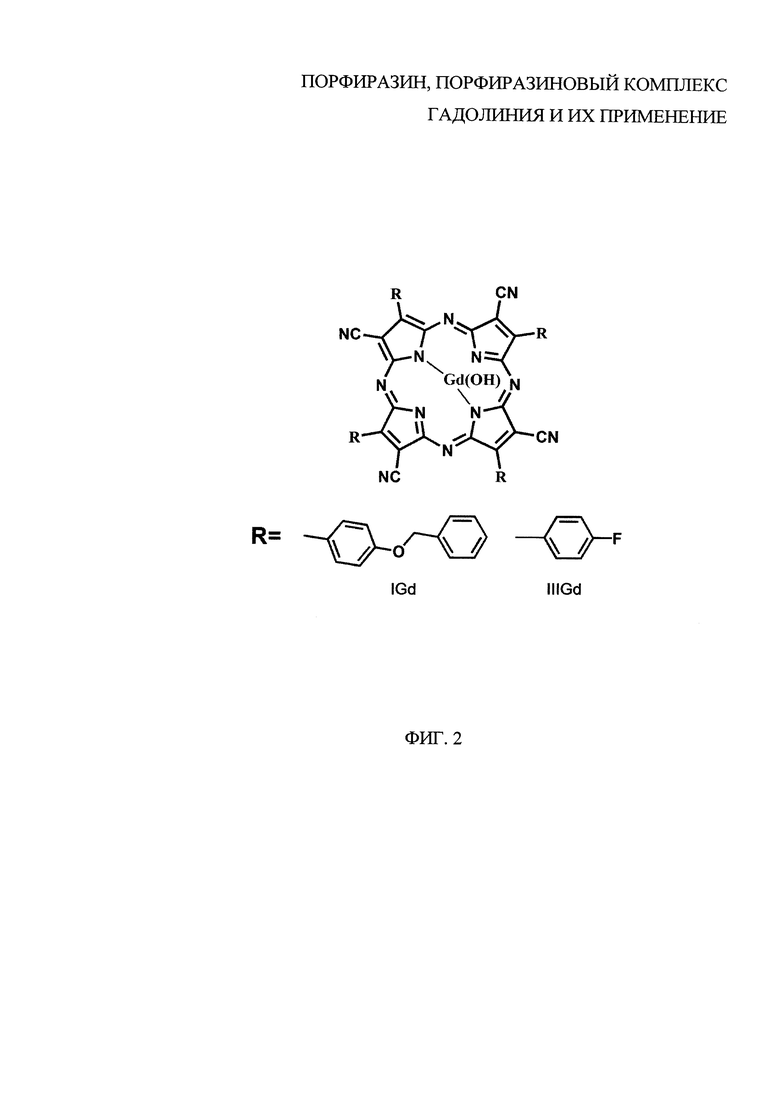
Поставленная задача достигается также тем, что порфиразиновый комплекс гадолиния представлен общей формулой:
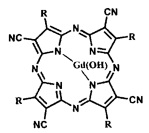
где R - заместитель, R=BnOPh (4-бензилоксифенил), 4FPh (4-фторфенил); при R=BnOPh (4-бензилоксифенил) представляет собой тетра(4-бензилоксифенил) тетрацианопорфиразинат гадолиния; при R=4FPh (4-фторфенил) представляет собой тетра(4-фторфенил)тетрацианопорфиразинат гадолиния.
Поставленная задача достигается также тем, что указанные соединения применяют в качестве мультимодальных агентов фотодинамической терапии злокачественных новообразований, а именно в качестве фотосенсибилизаторов и одновременно в качестве оптических сенсоров внутриклеточной вязкости.
На фиг. 1 представлена общая формула порфиразинов I и II и порфиразина III, где R=BnOPh (I, 4-бензилоксифенил), 4FBnOPh (II, 4-(4-фторбензилокси)фенил), 4FPh (III, 4-фторфенил).
На фиг. 2 представлена общая формула порфиразиновых комплексов гадолиния IGd и IIIGd, где R- заместитель, R=BnOPh (IGd, 4-бензилоксифенил), 4FPh (IIIGd, 4-фторфенил).
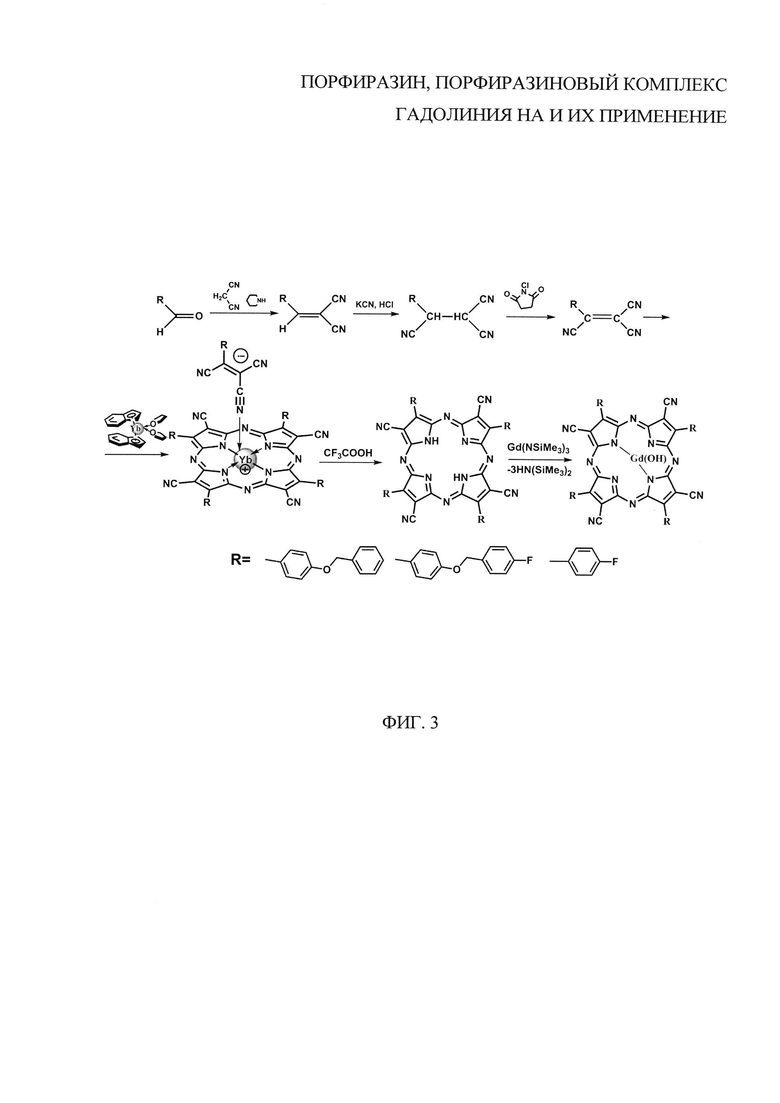
На фиг. 3 представлена схема синтеза порфиразинов в виде свободных оснований I и II, III и металлокомплексов IGd и IIIGd.
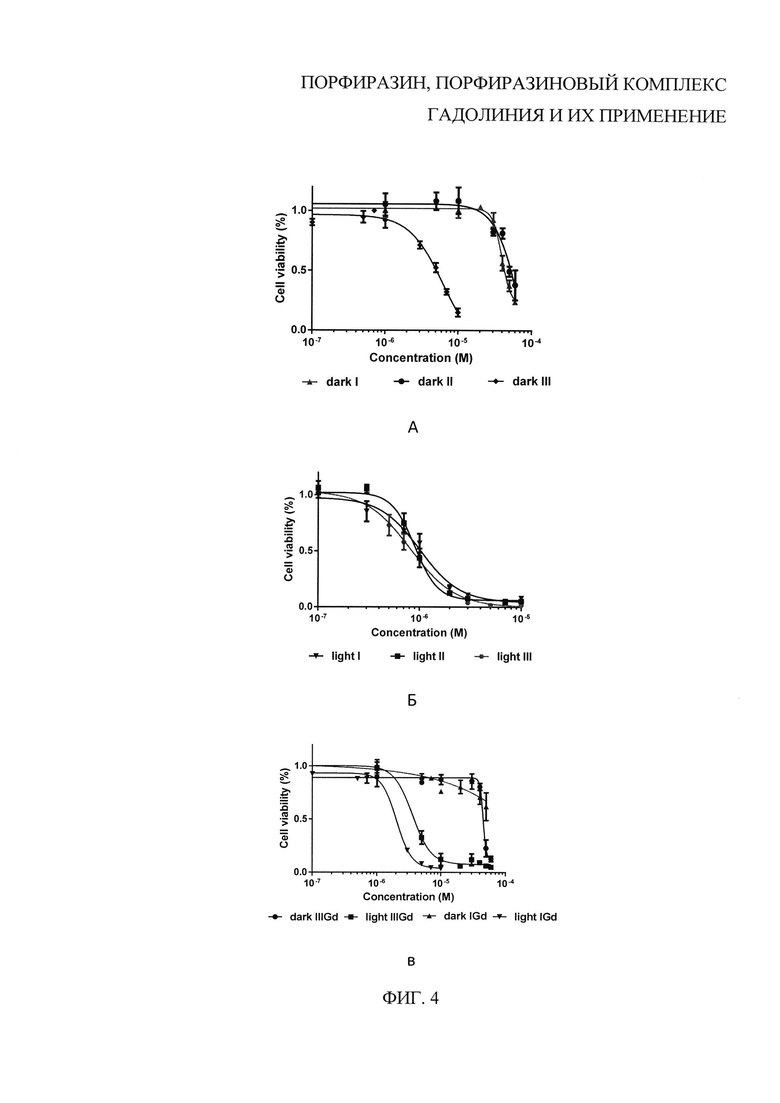
На фиг. 4 представлена зависимость жизнеспособности клеток А431 от концентрации в среде фотосенсибилизатора, где: (А) - в среде порфиразин I-III, инкубация клеток линии А431 в среде с красителем в темноте; (Б) - в среде порфиразин I-III, инкубация клеток линии А431 в среде с облучением светом 635 нм в дозе 20 Дж/см2; (В) - в среде порфиразин IGd и IIIGd, инкубация клеток линии А431 в среде с красителем в темноте и с облучением светом 635 нм в дозе 20 Дж/см2.
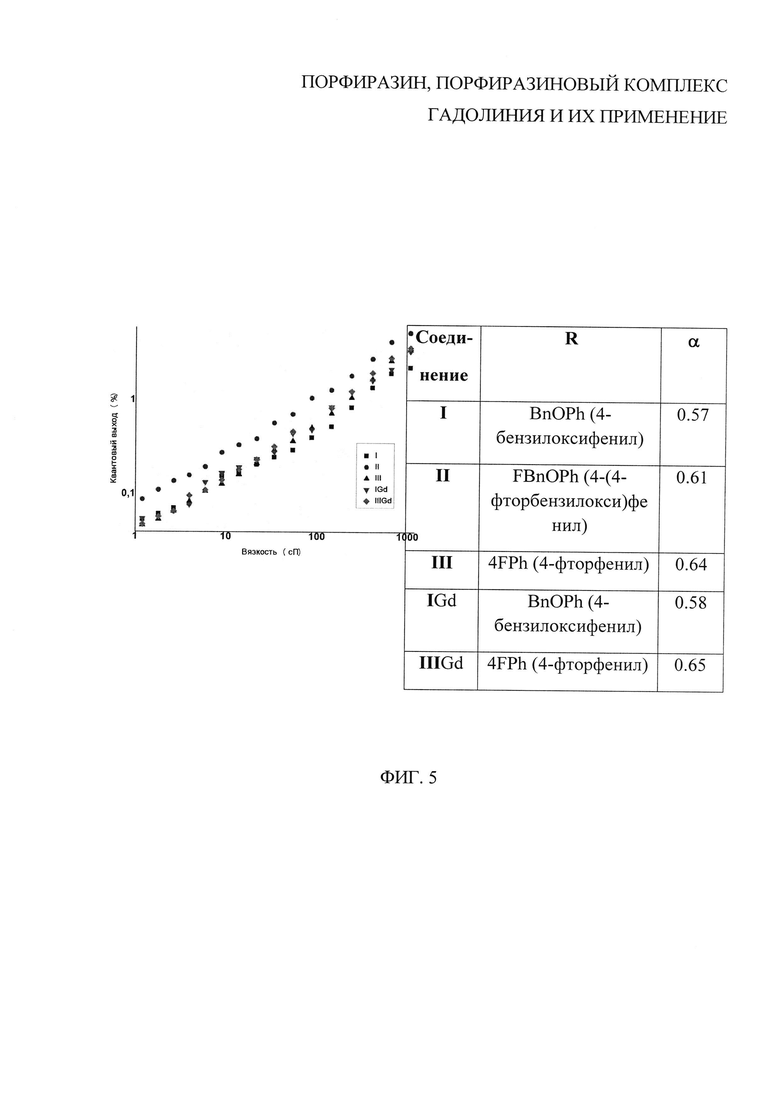
На фиг. 5 представлена зависимость квантового выхода флюоресценции порфиразинов от вязкости растворителя (спиртово-глицериновые смеси), где  - для порфиразина I;
- для порфиразина I;  - для порфиразина II;
- для порфиразина II;  - для порфиразина III;
- для порфиразина III;  - для порфиразинового комплекса гадолиния IGd; ♦ - для порфиразинового комплекса гадолиния IIIGd.
- для порфиразинового комплекса гадолиния IGd; ♦ - для порфиразинового комплекса гадолиния IIIGd.
Была осуществлена химическая модификация периферийного обрамления порфиразинов. Это было достигнуто варьированием ароматических альдегидов, являющихся стартовыми материалами при синтезе порфиразинов (фиг. 3).
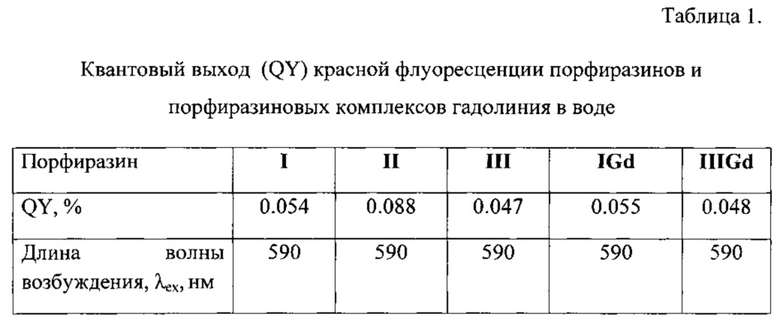
Замена 4-фторфенильных заместителей на 4-бензилоксифенильный и 4(4-фторбензилокси)фенильный заместители привела к существенному повышению квантового выхода (QY) красной флуоресценции порфиразинов в воде (Таблица 1).
Синтез порфиразина осуществляют следующим образом
Синтез тетра(4-бензилоксифенил)тетрацианопорфиразина (I).
Процедуру синтеза осуществляют в соответствии с фиг. 3. В качестве стартового материала используют 4-бензилоксибензальдегид. На первой стадии при взаимодействии 4-бензилоксибензальдегида с малононитрилом в присутствии пиперидина образуется 2-(4-бензилоксифенил)-1,1-дицианоэтилен, который под действием цианистого калия в кислой среде превращается в 2-(4-бензилоксифенил)-1,1,2-трицианоэтан (вторая стадия). На третьей стадии происходит дегидрирование в присутствии N-хлорсукцидимида с образованием замещенного 2-(4-бензилоксифенил)-1,1,2-трицианоэтилена.
Металлокомплекс получают реакцией 2-(4-бензилоксифенил)-1,1,2-трицианоэтилена с бис(инденил) иттербием в вакууме при мольном соотношении реагентов 5:1. На следующей стадии тетра(4-бензилоксифенил)тетрацианопорфиразинат иттербия растворяют в 2 мл трифторуксусной кислоты и перемешивают при комнатной температуре в течение 30 мин. Далее добавляют ~30 мл воды, наблюдают выпадение темно-синего осадка, отцентрифугировывают, тщательно промывают водой до нейтральной среды. Очищают продукт с помощью колоночной хроматографии (силикагель 60, 40-60 μm, элюент THF). Выход целевого продукта 83%. ИК-спектр (KBr, λmax/см-1): 3400 (N-H); 2205 (C≡N); 1687, 1678 (C≡N), 1600 (С=С); 1218, 1025 (Car-О- Cal). УФ/видимый спектр (ТГФ, λmax/нм): 361, 397 (полоса Соре); 617 (Q-полоса). Элементный анализ. Вычислено: С - 75.64%; Н - 4.06%; О - 5.6%; N - 14.70%. Найдено: С -76.70%, Н - 4.16%, О - 5.4%; N- 14,02%.
Синтез тетра(4-(4-фторбензилокси)фенил)тетрацианопорфиразин (II).
Процедуру синтеза осуществляют в соответствии с фиг. 3. В качестве стартового материала используют 4-(4-фторбензил)оксибензальдегид. На первой стадии при взаимодействии 4-(4-фторбензил)оксибензальдегида с малононитрилом в присутствии пиперидина образуется 2-(4-(4-фторбензил)оксифенил)-1,1-дицианоэтилен, который под действием цианистого калия в кислой среде превращается в 2-(4-(4-фторбензил)оксифенил)-1,1,2-трицианоэтан (вторая стадия). На третьей стадии происходит дегидрирование в присутствии N-хлорсукцидимида с образованием замещенного 2-(4-(4-фторбензил)оксифенил)-1,1,2-трицианоэтилена.
Металлокомплекс получают реакцией 2-(4-(4-фторбензил)оксифенил)-1,1,2-трицианоэтилена с бис(инденил) иттербием в вакууме при мольном соотношении реагентов 5:1. На следующей стадии тетра(4-(4-фторбензилокси)фенил)тетрацианопорфиразинат иттербия растворяют в 2 мл трифторуксусной кислоты и перемешивают при комнатной температуре в течение 30 мин. Далее добавляют ~30 мл воды, наблюдают выпадение темно-синего осадка, отцентрифугировывают, тщательно промывают водой до нейтральной среды. Очищают продукт с помощью колоночной хроматографии (силикагель 60, 40-60 μm, элюент THF). Выход целевого продукта 69%. ИК-спектр (KBr, λmax/см-1): 3403 (N-H); 2201 (C≡N); 1681 (C≡N), 1603 (С=С); 1218, 1038 (Car -О- Cal); 1164, 1102 (Car -F). УФ/видимый спектр (ТГФ, λmax/нм): 356, 397 (полоса Соре); 610 (Q-полоса). Вычислено: С - 71.16%; Н - 3.48%; О - 5.27%; F - 6,25%; N - 13.83%. Найдено: С - 72.16%, Н - 3.56%, О - 4.97%; F - 6.11%; N- 13,19%.
Синтез порфиразиных коплексов гадолиния осуществляют следующим образом.
Синтез тетра(4-бензилоксифенил)тетрацианопорфиразината гадолиния (IGd)
Тетра(4-бензилоксифенил)тетрацианопорфиразин (13.5 мг, 0.010 ммоль) растворили в ТГФ, далее добавили трис[N,N-бис(триметилсилил)амид] гадолиния (20 мг, 0.029 ммоль) в инертной атмосфере. Через 24 ч реакционную смесь открыли на воздух. Осадок отфильтровали и после тщательного удаления ТГФ и гексаметилдисилазана в вакууме был получен продукт синего цвета GdPz⋅2H2O (выход 75%). ИК-спектр (KBr, λmax/см-1): 2203 (C≡N); 1686, 1675 (C=N), 1600 (С=С); 1218, 1023 (Car -О- Cal)MALDI: m/z=1351. Элементный анализ. Вычислено для C72H49N12O7Gd: С - 63.99%, Н-3.65%, N-12.44%, Gd-11.64%. Найдено: С -63.19%, Н- 3.18%,N- 11.95%, Gd- 12.79%.
Синтез тетра(4-фторфенил)тетрацианопорфиразината гадолиния (IIIGd).
Тетра(4-фторфенил)тетрацианопорфиразин (8 мг, 0.010 ммоль) растворили в ТГФ, далее добавили трис[N,N-бис(триметилсилил)амид] гадолиния (20 мг, 0.029 ммоль) в инертной атмосфере. Через 24 ч реакционную смесь открыли на воздух. Осадок отфильтровали и после тщательного удаления ТГФ и гексаметилдисилазана в вакууме был получен продукт синего цвета GdPz⋅2H2O (8 мг, 0.008 ммоль, выход 80%). ИК-спектр (KBr, λmax/см-1): 2925, 2202, 1600, 1505, 1455, 1417, 1394, 1303, 1262, 1218, 1157, 1128 1103. MALDI: m/z=998. Элементный анализ. Вычислено для C44H21F4N12O3Gd: С - 52.91%, Н-2.10%, F-7.62%, N-16.83%, Gd-15.73%. Найдено: С - 52.25%, Н - 2.80%, F - 8.12%, N - 17.30%, Gd - 16.15%.
Аналогично может быть получен порфиразиновый комплекс гадолиния на основе порфиразина II. Процедура синтеза может быть осуществлена по схеме, представленной на фиг. 3. Полученное соединение будет обладать такими же свойствам, что и представленные в заявке соединения.
Фотодинамическая активность фотосенсибилизаторов I, II, IGd, IIIGd в системе in vitro.
Красители обладают высокой фотоиндуцированной активностью в отношении опухолевых клеток А431 при варьировании концентрации раствора красителя от 0,1 до 10 мкМ и времени инкубации до светового воздействия 4 часа. Исследование световой активности проводилось с использованием специально разработанного светодиодного излучателя для получения равномерного светового потока в стандартных 96-луночных планшетах. Доза облучения составляла 20 Дж/см2 при плотности мощности 20 мВт/см2 [Н.Ю. Шилягина, В.И. Плеханов, И.В. Шкунов, П.А. Шилягин, Л.В. Дубасова, А.А. Брилкина, Е.А. Соколова, И.В. Турчин, И.В. Балалаева. Светодиодный излучатель для исследования in vitro световой активности препаратов для фотодинамической терапии // Современные технологии медицине. 2014, Т. 6, №2, С. 15-24]. Жизнеспособность клеточной культуры оценивали через 24 часа после облучения с помощью микротитрационного теста для анализа метаболической активности (МТТ-тест), позволяющего определить ингибирующую концентрацию IC50 - концентрацию соединения, вызывающую снижение роста клеток на 50% (или их гибель). Результаты оценки жизнеспособности клеток А431 после облучения с применением фотосенсибилизаторов I-III, IGd и IIIGd представлены на фиг. 4. Величины IC50 приведены в таблице 2.

Как видно из приведенных данных, эффективность фотодинамического действия фотосенсибилизаторов I, II, IGd и IIIGd не уступает таковой для порфиразина III. Однако, для порфиразина III наблюдается более высокая темновая токсичность, чем для порфиразинов I, II, и порфиразиновых комплексов гадолиния IGd и IIIGd.
Исследование вязкостной чувствительности квантового выхода красной флуоресценции порфиразинов I, II, III, и порфиразиновых комплексов гадолиния IGd, IIIGd
Наблюдается существенное возрастание интенсивности флуоресценции порфиразинов I-III, и порфиразиновых комплексов гадолиния IGd, IIIGd с увеличением вязкости на примере этанол-глицериновых смесей.
Величина тангенса угла наклона прямых, приведенных на фиг. 5, характеризует «степень» вязкостной чувствительности параметров флюоресценции.
При более высоком квантовом выходе красной флуоресценции порфиразины I, II, и порфиразиновые комплексы гадолиния IGd, IIIGd практически не уступают III по вязкостной чувствительности квантового выхода.
Фотодинамическая терапия опухоли с использованием порфиразиновых комплексов гадолиния IGd и IIIGd в качестве фотосенсибилизаторов.
Исследование выполнено на мышах линии Balb/c, самках, в количестве 15 животных. Животных содержали в стандартных условиях вивария с 12-ти часовым световым ритмом и свободным доступом к корму и воде. Опухоль СТ26 (колоректальный рак мышей) прививали путем подкожной инъекции 200 тыс. клеток в 100 мкл соляно-фосфатного буфера PBS в левое бедро. Непосредственно перед экспериментом животные были случайным образом разделены на 3 группы по 5 мышей: ФДТ с IIIGd, ФДТ с IGd и контроль. Препараты IIIGd и IGd вводили внутривенно в хвостовую вену в дозе 12 мг/кг. Контролем служили животные с аналогичными опухолями без воздействий. ФДТ проводили на 10-11 день роста, когда опухоли достигали размера 5-6 мм. Облучение опухолей проводили с помощью лазера (MGL, Changchun New Industries Optoelectronics Tech. Co., Ltd. Китай) с длиной волны 593 нм при плотности мощности 100 мВт/см2 в течение 20 мин, доставляя таким образом плотность энергии 120 Дж/см2, однократно. Мощность лазера контролировали с помощью измерителя РМ100А (Thorlabs, Германия). Замер размеров опухолевых узлов выполняли 3 раза в неделю с помощью штангенциркуля, измеряя опухолевые узлы по двум взаимно перпендикулярным направлениям. Объем опухолей вычисляли по формуле V=A×B×B/2, где А - длина опухоли, В - ширина. Коэффициент ТРО рассчитывали по формуле TPO=(Vк-Vo)/Vк ×100%, где Vк и Vo - средний объем опухолей в контрольной и опытной группах соответственно.
В результате ФДТ было достигнуто торможение опухолевого роста у 5 животных из 5 в группе IGd. Объем опухолей в данной группе на 21 день роста (10 дней после ФДТ) составлял 838±265 мм. Коэффициент торможения роста опухоли (ТРО) в группе IGd составил 63%. В группе IIIGd средний объем 5-ти опухолей составлял 2506±816 мм3.
В контрольной группе 5 опухолей из 5 достигали объема в среднем 2252±710 мм3. Полученный результат показывает, что при использовании в качестве фотосенсибилизатора IIIGd мы не наблюдаем уменьшения размера опухоли по сравнению с контрольной группой животных, не подвергшихся ФДТ, тогда как в случае использования IGd мы наблюдаем значительное уменьшение объема опухоли после процедуры ФДТ. Таким образом, проведенное исследование позволяет сделать вывод о существенно более высокой фотодинамической активности комплекса IGd и перспективности его применения в качестве фотосенсибилизатора для ФДТ.
Представленные примеры демонстрируют методы получения порфиразинов I и II, и порфиразиновых комплексов гадолиния IGd, IIIGd, а также достижение существенно большей их эффективности в качестве сенсибилизаторов ФДТ по сравнению с ранее известным порфиразином III. При этом порфиризины I, II, и порфиразиновые комплексы гадолиния IGd, IIIGd не уступают порфиризину III по уровню вязкостной чувствительности параметров флуоресценции. Уникальной особенностью порфиразинов I, II, и порфиразиновых комплексов гадолиния IGd и IIIGd является сочетание их высокой фотодинамической активности с аномально сильной зависимостью флуоресцентных параметров (квантового выхода и времени жизни флюоресценции) от вязкости среды.
Таким образом, полученные соединения могут быть основой для более эффективных мультимодальных противораковых препаратов, чем ранее известный порфиразин III.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИАНОПОРФИРАЗИНОВОЕ СВОБОДНОЕ ОСНОВАНИЕ И ЕГО ПРИМЕНЕНИЕ | 2017 |
|
RU2665471C1 |
| Способ фотодинамической терапии с контролем эффективности в режиме реального времени | 2017 |
|
RU2672806C1 |
| Тетра(пирен-1-ил)тетрацианопорфиразин как мультифункциональный агент терапии злокачественных новообразований | 2019 |
|
RU2725641C1 |
| Тетра(бензотиофен-2-ил)тетрацианопорфиразин как мультимодальный агент фотодинамической терапии | 2018 |
|
RU2684623C1 |
| СПОСОБ ОЦЕНКИ СОДЕРЖАНИЯ ПЕРОКСИДА ВОДОРОДА В ОПУХОЛЕВЫХ КЛЕТКАХ ПРИ ФОТОДИНАМИЧЕСКОМ ВОЗДЕЙСТВИИ | 2018 |
|
RU2700421C1 |
| ПРОИЗВОДНОЕ ЦИНКОВОГО МЕТАЛЛОКОМПЛЕКСА ХЛОРИНА-e И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2691754C1 |
| СПОСОБ ПОЛУЧЕНИЯ НЕСИММЕТРИЧНЫХ ПОРФИРАЗИНОВ | 1997 |
|
RU2139289C1 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2012 |
|
RU2476218C1 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2012 |
|
RU2479585C1 |
| НИЗКОМОЛЕКУЛЯРНЫЕ ПРОИЗВОДНЫЕ КАРБОКСАМИДНЫХ ГАЛОГЕНИРОВАННЫХ ПОРФИРИНОВ, А ИМЕННО ХЛОРИНОВ И БАКТЕРИОХЛОРИНОВ, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2718923C2 |
Изобретение относится к порфиразину общей формулы
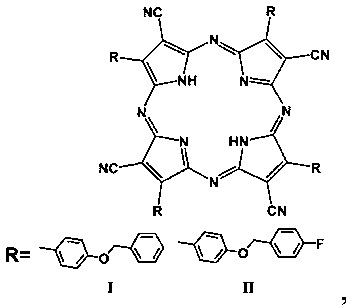
в которой R представляет собой BnOPh (4-бензилоксифенил), 4FBnOPh (4-(4-фторбензилокси)фенил). Изобретение также относится к порфиразиновому комплексу гадолиния и к применению порфиразина и порфиразинового комплекса гадолиния в качестве мультимодального агента фотодинамической терапии злокачественных новообразований. Технический результат: получены новые порфиразины с высокой фотодинамической активностью. 3 н. и 4 з.п. ф-лы, 5 ил., 2 табл.
1. Порфиразин общей формулы
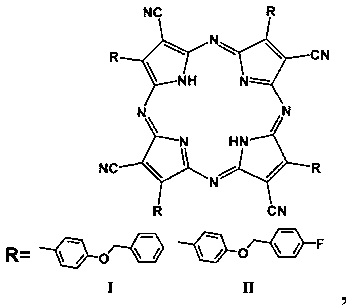
где R - заместитель, R=BnOPh (4-бензилоксифенил), 4FBnOPh (4-(4-фторбензилокси)фенил).
2. Порфиразин по п. 1, отличающийся тем, что при R=BnOPh (4-бензилоксифенил) представляет собой тетра(4-бензилоксифенил)тетрацианопорфиразин.
3. Порфиразин по п. 1, отличающийся тем, что при R=4FBnOPh (4-(4-фторбензилокси)фенил) представляет собой тетра(4-(4-фторбензилокси)фенил)тетрацианопорфиразин.
4. Порфиразиновый комплекс гадолиния общей формулы
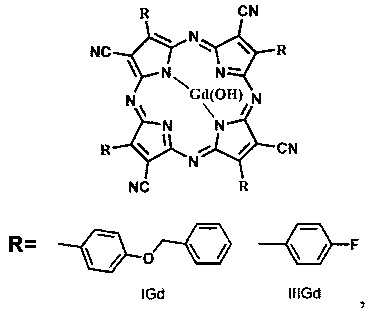
где R - заместитель, R=BnOPh (4-бензилоксифенил), 4FPh (4-фторфенил).
5. Порфиразиновый комплекс гадолиния по п. 4, отличающийся тем, что при R=BnOPh (4-бензилоксифенил) представляет собой тетра(4-бензилоксифенил)тетрацианопорфиразинат гадолиния.
6. Порфиразиновый комплекс гадолиния по п. 4, отличающийся тем, что при R=4FPh (4-фторфенил) представляет собой тетра(4-фторфенил)тетрацианопорфиразинат гадолиния.
7. Применение порфиразина и порфиразинового комплекса гадолиния по пп. 1-6 в качестве мультимодального агента фотодинамической терапии злокачественных новообразований, а именно в качестве фотосенсибилизатора и одновременно в качестве оптического сенсора внутриклеточной вязкости.
| Лермонтова С | |||
| А | |||
| "Новые флюоресцентные порфиразиновые свободные основания и металлокомплексы для применения в фотонике и биофотонике" Диссертация на соискание учёной степени кандидата химических наук, Нижнй Новгород, 2014, 164 с | |||
| Шилягина Н | |||
| Ю | |||
| "Исследование тетраарилтетрацианопорфиразинов в качестве потенциальных фотосенсибилизаторов для фотодинамической терапии и флуоресцентной диагностики" Автореферат диссертации на соискание учёной степени кандидата биологических наук, Воронеж, 2014, 24 с | |||
| Лермонтова С.А | |||
| и др | |||
| "Новые порфиразиновые макроциклы с высокой вязкостной чувствительностью флуоресцентных параметров" Журнал Общей Химии, т.26, N6, 2016, 1000-1009 | |||
| M | |||
| A | |||
| Izquierdo et al | |||
| "Dual use of porphyrazines as sensitizers and viscosity markers in photodynamic therapy" Journal of materials Chemistry B, 3, 2015, 1089-1096. |
Авторы
Даты
2017-06-07—Публикация
2016-08-23—Подача