Изобретение относится к получению несимметричных порфиразинов, сочетающих в молекуле два дифенилпиррольных и два изоиндольных фрагмента.
Известен способ получения несимметричных порфиразиновых металлокомплексов, заключающийся во взаимодействии различных порфиразиногенов с ацетатом цинка или хлоридом кобальта [Kobayashi Nagao, Achida Thohru, OsaTutsuo, Konami Hideo//Jnorg. Chem. - 1994. - Vol. 33, N 9. - P. 1735-1740]. В качестве порфиразиногенов используют дифенилмалеинодинитрил и 2,3-дициано-1,4-дифенилнафталин. Взаимодействие проводят при температуре 250 - 260oC в атмосфере сухого аргона по следующей схеме:
Высокая температура синтеза в данном случае обусловливает образование значительного количества примесей. Выход же целевых продуктов при этом составляет 2% для цинкового комплекса и 2,5% для кобальтового комплекса.
Наиболее близким аналогом заявляемого способа является способ конденсации дифенилмалеинодинитрила с 3,6-дифенилфталодинитрилом в присутствии соли цинка при температуре 250 - 260oC. [Kobagashi Nagao, Ashido Tohru, Hiroyakou, Osa Tutsuo//Chem. Lett. - 1992. - N 8. - P. 1576-1570].

Выход комплекса цинка с несимметричным порфиразиновым лигандом в этом способе не превышает 6%. Образующиеся примеси, помимо снижения выхода, усложняют процесс выделения и очистки целевого продукта. Достаточно высокая температура синтеза требует значительных энергетических затрат. Кроме того, по этому способу невозможно получить соответствующие безметальные соединения.
Таким образом, не известен способ получения несимметричных порфиразиновых металлокомплексов и соответствующих им безметальных соединений при условиях, уменьшающих или исключающих образование продуктов побочных реакций, которые снижают выход целевых продуктов.
Изобретательской задачей являлся поиск способа получения несимметричных порфиразиновых металлокомплексов и безметальных соединений, сочетающих в молекуле два дифенилпиррольных и два изоиндольных фрагмента, который позволил бы снизить количество образующих примесей, энергетические затраты, повысить выход целевого продукта и позволял бы получать не только металлокомплексы, но и соответствующие им безметальные соединения.
Поставленная задача решена способом получения несимметричных порфиразинов путем взаимодействия порфиразиногенов, в котором в качестве порфиразиногенов используют 2-имино-5-амино-3,4-дифенил-2H-пиррол и хлоргидраты 1,1-дихлор-3-амино-1H-изоиндолов и взаимодействие проводят в ацетоне сначала при комнатной температуре в присутствии триэтиламина, затем в условиях кипящего ацетона в присутствии хлорида меди и/или гидрохинона и метилата натрия.

Отличительными признаками способа являются использование новых исходных веществ и условия взаимодействия между ними.
Совокупность именно этих отличительных признаков позволила получить следующие преимущества:
- повысить выход целевых продуктов до 12 - 44%;
- снизить энергетические затраты;
- появилась возможность получать как несимметричные порфиразиновые металлокомплексы (IV-VI), так и соответствующие им безметальные соединения (I-III).
Необходимый для осуществления способа 2-имино-5-амино- 3,4-дифенил-2H-пиррол получен путем обработки дифенилмалеинодинитрила аммиаком в среде метанольного раствора метилата натрия по методике, аналогичной методике получения аминоиминоизоиндоленина [Bauman F. , Bienert B. , Rosch G u. a//Angew. Chem. - 1956. - Bd. 68, N 4. - s. 133-149].
В трехгорловую колбу, снабженную мешалкой, обратным холодильником, термометром и барботером, заливают метанольный раствор метилата натрия, полученный из 0,26 г (11,2 ммоль) натрия и 80 мл метанола. Добавляют 1,84 г (8 ммоль) дифенилмалеинодинитрила и полученную смесь охлаждают до 0oC. При перемешивании реакционной смеси пропускают осушенный аммиак. Через 20 - 30 минут температура повышается до 20 - 25oC, образуется раствор желтого цвета. При этой температуре продолжают пропускать аммиак в течение трех часов. После этого часть метанола удаляют испарением при комнатной температуре до образования желтого осадка, который отфильтровывают и сушат в вакуум-эксикаторе над хлористым кальцием. Выход: 1,82 г (92%).
2-имино-5-амино-3,4-дифенил-2H-пиррол - порошок желтого цвета, не растворяется в воде, растворяется в метаноле, этаноле, диметилформамиде. Не плавится при нагревании до 200oC, при дальнейшем повышении температуры разлагается с выделением аммиака.
Найдено, %: C 77,5; H 5,0; N 17,1.
C16H13N3
Вычислено, %: C 77,7; H 5,3; N 17,0.
ИК-спектр: 3000 - 3500 см-1 ( ν NH).
Хлоргидраты 1,1-дихлор-3-амино-1H-изоиндола и его галогензамещенных получают из соответствующих фталодинитрилов по известной методике путем обработки их осушенным хлористым водородом в безводном хлороформе. [Bartlett R.K., Renny Z.V., Chаnn K.K.//J. Chem. Soc. - 1969. - P. 129].
1,1-дихлор-3-амино-1H-изоиндол хлоргидрат
В трехгорловую колбу, снабженную мешалкой с гидрозатвором, обратным холодильником и барботером, помещают 12,8 г (0,1 моль) фталодинитрила, растворенного в 150 мл безводного хлороформа. Через этот раствор при постоянном перемешивании барботируют сухой хлористый водород в течение 12 часов. По истечении этого времени выпадает белый осадок, который отфильтровывают, промывают небольшим количеством охлажденного до 5oC хлороформа, отжимают на фильтре и сушат при комнатной температуре в эксикаторе над пятиокисью фосфора.
Выход 7,24 г (30,5%).
Найдено, %: C 40,7; H 2,9; N 11,6; Cl 44,5.
C8H7N2Cl3
Вычислено, %: C 40,4; H 2,9; N 11,9; Cl 44,8.
ИК-спектр: 2900 - 3100 см-1 (ν NH в RNH3 +); 800 - 850 (ν C-Cl)
1,1-дихлор-3-амино-5/6-хоор-1H-изоиндол хлоргидрат
Получают по приведенной выше методике получения 1,1-дихлор-3-амино-1H-изоиндола хлоргидрата, используя 15,85 г (0,1 моль) 4/5-хлорфталодинитрила. Выход 4,08 г (15%).
Найдено, %: C 35,2; H 2,0; N 10,8; Cl 49,0.
C8H6N2Cl4
Вычислено, %: C 35,3; H 2,2; N 10,3; Cl 50,2.
ИК-спектр: 2900 - 3100 (ν NH в RNH3 +) 800 - 850 (ν C-Cl).
1,1-дихлор-3-амино-5/6-бром-1H-изоиндол хлоргидрат
Получают по приведенной выше методике получения 1,1-дихлор-3-амино-1H-изоиндола хлоргидрата, используя 20,7 г (0,1 моль) 4/5-бромфталодинитрила. Выход 6,49 г (20,5%).
Найдено, %: C 30,3; H 1,7; N 8,3; (Cl + Br) 57,1.
C8H6N2Cl3Br
Вычислено. %: C 30,4; H 1,9; N 8,8; Cl 33,7; Br 25,3.
ИК-спектр: 2900 - 3100 см-1 (ν NH в RNH3 +); 800 - 850 см-1 (ν C-Cl); 600 - 680 см-1 (ν C-Br).
Способ получения несимметричных порфиразинов с использованием в качестве порфиразиногенов 2-имино-5-амино-3,4-дифенил-2H-пиррола и хлоргидратов 1,1-дихлор-3-амино-1H-изоиндола осуществляют взаимодействием исходных соединений в несколько стадий: сначала при комнатной температуре в среде осушенного ацетона с последующим добавлением триэтиламина. После отделения осадка гидрохлорида триэтиламина в реакционную смесь для получения безметальных соединений (I-III) добавляют гидрохинон и метилат натрия, а для получения комплексов меди (IV-VI) - дополнительно хлорид одновалентной меди. Образование соединений (I-VI) происходит в кипящем ацетоне при температуре 56oC.
Получение безметальных соединений (I-III)
Общая методика
В трехгорловую колбу, снабженную капельной воронкой, термометром и гидрозатвором помещают суспензию 2 ммоль хлоргидрата 1,1-дихлор-3-амино-1H-изоиндола или его галогензамещенного в 50 мл осушенного ацетона, к которому затем в течение 20 минут прикапывают суспензию 0,49 г (2 ммоль) 2-имино-5-амино-3,4-дифенил-2H-пиррола в 10 мл осушенного ацетона. Полученную смесь выдерживают 1 час при комнатной температуре, постоянно перемешивая. Затем добавляют 1,01 г (10 ммоль) триэтиламина и выдерживают еще 1 час. Выпавший осадок гидрохлорида триэтиламина отфильтровывают, фильтрат возвращают в реакционную колбу, добавляют 0,32 г (6 ммоль) метилата натрия и 0,23 г (2,35 ммоль) гидрохинона. Полученную смесь выдерживают 4 часа в кипящем ацетоне (56oC). Горячую реакционную массу переносят в выпарительную чашку и ацетон удаляют испарением. Сухой остаток последовательно промывают сначала горячей водой, затем 10%-ной соляной кислотой до бесцветных фильтратов и снова водой до нейтральной среды и отсутствия в фильтрате хлорид-ионов. Целевые продукты (I-III) экстрагируют бензолом в аппарате Сокслета. Бензол из экстракта удаляют испарением на водяной бане. Дальнейшую очистку осуществляют колоночной хроматографией на силикагеле с использованием в качестве элюента смеси бензол: этанол в соотношении 10:1 и последующей термовакуумной обработкой (остаточное давление 10-3 Па) при температуре 200 - 250oС в течение двух часов.
Идентификацию соединений (I-III) проводят с использованием данных элементного анализа, электронной и колебательной спектроскопии.
Соединения (I-III) представляют собой порошки темно-фиолетового цвета, не растворимые в воде, растворимые в бензоле, хлороформе и других органических растворителях. В концентрированной серной кислоте уже при комнатной температуре происходит их деструкция с образованием бесцветных растворов.
Дибензотетрафенилтетраазапорфин (I)
Получают по общей методике, используя 0,48 г (2 ммоль) хлоргидрата 1,1-дихлор-3-амино-1H-изоиндола. Выход 0,215 г (30,1%).
Найдено, %: C 79,7; H 4,0; N 15,1.
C48H30N8
Вычислено, %: C 80,2; H 4,2; N 15,6.
ЭСП,  нм: в бензоле 695 сл., 670, 630 сл., 608, 575 сл.
нм: в бензоле 695 сл., 670, 630 сл., 608, 575 сл.
Ди(хлорбензо)тетрафенилтетраазапорфин (II).
Получают по общей методике, используя 0,544 г (2 ммоль) хлоргидрата 1,1-дихлор-3-амино-5/6-хлор-1H-изоиндола.
Выход 0,12 г (15,2%).
Найдено: %: C 73,0; H 3,5, N 14,0, Cl 8,3.
C48H28N8Cl2
Вычислено, %: C 73,2; H 3,6; N 14,2; Cl 9,0.
ЭСП, λmax, нм: в бензоле 696 пл., 675, 630 сл., 615, 581 сл.
Ди(бромбензо)тетрафенилтетраазопорфин (III).
Получают по общей методике, используя 0,633 г (2 ммоль) хлоргидрата 1,1-дихлор-3-амино-5/6-бром-1H-изоиндола.
Выход 0,128 г (14,6%).
Найдено, %: C 65,2; H 3,0; N 12,3; Br 17,5.
C48H28N8Br2
Вычислено, %: C 65,8; H 3,2; N 12,8; Br 18,2.
ЭСП, λmax, нм: в бензоле 696 сл., 675, 630 пл., 615, 583 сл.
Комплексы меди (IV-VI)
Общая методика
До стадии отделения выпавшего осадка гидрохлорида триэтиламина процесс проводят так же, как и при получении безметальных соединений (I-III).
В фильтрат после отделения осадка гидрохлорида триэтиламина добавляют 0,199 г (2 ммоль) хлорида меди, выдерживают 1 час при комнатной температуре, затем добавляют 0,216 г (4 ммоль) метилата натрия и 0,248 г (2,25 ммоль) гидрохинона и выдерживают 4 часа в кипящем ацетоне (56oC). Горячую реакционную массу переносят в выпарительную чашку и ацетон удаляют испарением. Сухой остаток последовательно промывают сначала горячей водой, затем 10%-ной соляной кислотой до бесцветных фильтратов, снова водой до нейтральной среды и отсутствия в фильтрате хлорид-ионов. Целевые продукты (IV-VI) экстрагируют бензолом в аппарате Сокслета. Бензол из экстракта удаляют испарением на водяной бане. Дальнейшую очистку осуществляют колоночной хроматографией на силикагеле L 40/100 с использованием в качестве элюента смеси бензол:этанол в соотношении 10: 1 и последующей термовакуумной обработкой (остаточное давление 10-3 Па) при температуре 200 - 250oC в течение двух часов.
Идентификацию комплексов (IV-VI) проводят с использованием данных элементного анализа, электронной и колебательной спектроскопии.
Комплексы (IV-VI) представляют собой порошки темно-фиолетового цвета, не растворимые в воде, растворимые в бензоле, хлороформе и других органических растворителях. Растворяются без разложения в концентрированной серной кислоте.
Дибензотетрафенилтетраазапорфин меди (IV)
Получают по общей методике, используя 0,475 г (2 ммоль) хлоргидрата 1,1-дихлор-3-амино-1H-изоиндола. Выход 0,094 г (12,1%).
Найдено, %: C 73,6; H 3,8; N 14,2; Cu 7,7.
C48H28N8Cu
Вычислено, %: C 73,7; H 3,9; N 14,3; Cu 8,1.
ЭСП, λmax, нм: в бензоле 688 сл., 648 в 18 М H2SO4 748, 684 пл.
Ди(хлорбензо)тетрафенилтетраазапорфин меди (V)
Получают по общей методике, используя 0,544 г (2 ммоль) хлоргидрата 1,1-дихлор-3-амино-5/6-хлор-1H-изоиндола.
Выход 0,160 г (18,8%).
Найдено, %: C 67,8; H 3,0; N 12,8; Cl 7,9; Cu 7,0.
C48H26N8Cu
Вычислено, %: C 67,9; H 3,1; N 13,1; Cl 8,4; Cu 7,5.
ЭСП, λmax, нм: в бензоле 685 сл., 652; в 18 М H2SO4 750.
Ди(бромбензо)тетрафенилтетраазапорфин меди (VI)
Получают по общей методике, используя 0,633 г (2 ммоль) хлоргидрата 1,1-дихлор-3-амино-5/6-1H-изоиндола.
Выход 0,419 г (44,8%).
Найдено, %: C 61,4; H 2,7; N 11,3; Br 16,4; Cu 6,0.
C48H26N8Br2Cu
Вычислено, %: C 61,5; H 2,8; N 11,8; Br 17,1; Cu 6,8.
ЭСП, λmax, нм: в бензоле 685 сл., 653; в 18 М H2SO4 759.
В ИК-спектрах (фиг. 1, ИК-спектры: 1 - ди(хлорбензо) тетрафенилтетраазапорфин, 2 - ди(хлорбензо) тетрафенилтетраазапорфин меди) несимметричных порфиразинов (I-VI) можно выделить ряд характеристических полос поглощения. Так в области 1350-1500 см-1 имеется поглощение, относящееся к скелетным колебаниям пиррольных колец порфиразинового макроцикла. Более интенсивное поглощение в интервале 1700-1800 см-1 относится к валентным колебаниям связи C-C в бензольных кольцах. Кроме того, в ИК-спектрах галогензамещенных соединений (II, III, V, VI) наблюдаются дополнительные полосы в области 800 - 850 см-1 (для II, V) и 500 - 600 см-1 (для III, VI), что характерно для валентных колебаний связи C-Cl и C-Br соответственно [Порфирины: структура, свойства, синтез//К. А. Аскаров, Б.Д. Березин, Р.П. Евстигнеева и др. - М.: Наука, 1985. - С. 85 - 87. Дайер Д.Р. Приложения абсорбционной спектроскопии органических соединений. М.: Химия. 1970. - С. 31-65].
В ИК-спектрах безметальных соединений (I-III) отсутствует интенсивная полоса при 1000 см-1, которая характерна для безметального фталоцианина [Сидоров А. Н., Котляр И.П. Оптика и спектроскопия. - 1961. - Т. II, N 2. - С. 175-184], что указывает на отсутствие примесей этого соединения.
В электронных спектрах поглощения безметальных соединений (I-III) в бензоле (фиг. 2, электронные спектры поглощения: 1 - дибензо тетрафенилтетраазапорфин, 2 - дибензо тетрафенилтетраазапорфин меди) в длинноволновой области имеется большее число полос по сравнению с симметричными производными порфиразина, в частности с фталоцианином и октафенилтетраазапорфином. Кроме того, первая длинноволновая полоса в спектре соединения (I), например, смещена гипсохромно по сравнению с первой полосой в спектре трет.-бутилзамещенного фталоцианина, растворимого в бензоле [Электронные спектры фталоцианинов и родственных соединений. Каталог/ Бундина Н.И., Гальперн М.Г., и др. Под ред. Е.А.Лукьянца. - Черкассы: 1989. - 93 с.] и батохромно по сравнению с соответствующей полосой в спектре октафенилтетраазапорфина [Порфирины: структура, свойства, синтез//Аскаров К.А., Березин Б.Д., Естигнеева Р.П. и др. - М. : Наука: - 1985. - 333 с.]. Имеются также различия в положении и относительной интенсивности других полос. У галогензамещенных безметальных соединений (II, III) характер спектра аналогичный спектру соединения (I). В то же время наблюдается смещение некоторых полос на 5-7 нм.
При переходе к металлокомплексам (IV-VI), так же, как и в ряду фталоцианинов и октафенилтетраазапорфинов [Березин Б.Д. Координационные соединения порфиринов и фталоцианина. - М.: Наука, - 1978. - 280 с. Порфирины: структура, свойства, синтез//Аскаров К.А., Березин Б.Д., Евстигнеева Р.П. и др. - М.: Наука. - 1985. - 333 с.] наблюдается существенное изменение спектра, однако характер этого изменения не повторяет спектральные проявления при комлексообразовании с симметрично конденсированными порфиразинами, металлокомплексы которых в длинноволновой области имеют одну интенсивную полосу. Спектры несимметричных порфиразиновых комплексов меди (IV-VI) характеризуются двумя полосами, одна из которых (более длинноволновая) имеет слабую интенсивность (фиг. 2).
Отмеченная особенность ЭСП является следствием понижения симметрии распределения π-электронной плотности в порфиразиновом макрокольце в результате несимметричного замещения атомов водорода пиррольных колец и является убедительным подтверждением предполагаемой структуры синтезированных соединений, так как эта особенность характерна и для других производных порфиразина несимметричного строения [Кулинич В.П., Шапошников Г.П., Майзлиш В.Е. и др. Журнал общей химии. - 1996. - Т. 66, N 9. - С. 1560-1563].
Кроме изменения характера спектров комплексов (IV-VI), существенное различие наблюдается и в положении интенсивных длинноволновых полос в сравнении с симметрично замещенными и симметрично конденсированными порфиразиновыми комплексами. Например, в спектре комплекса IV в бензоле отмечено батохромное смещение положения длинноволновой полосы на 23 нм по сравнению с октафенилтетраазапорфином меди и гипсохромное смещение на 27 нм по сравнению с тетра(трет.-бутил)фталоцианином меди, обладающим растворимостью в бензоле.


Изобретение относится к получению несимметричных порфиразинов, сочетающих в молекуле два дифенилпиррольных или два изоиндольных фрагмента. Сущностью изобретения является способ получения несимметричных порфиразинов путем взаимодействия порфиразиногенов, в котором в качестве порфиразиногенов используют 2-имино-5-амино-3,4-дифенил-2Н-пиррол и хлоргидраты 1,1-дихлор-3-амино-1Н-изоиндолов общей формулы (I), где Х = Н, Сl, Вr, и взаимодействие проводят в ацетоне сначала при комнатной температуре в присутствии триэтиламина, затем в условиях кипящего ацетона в присутствии хлорида меди и/или гидрохинона и метилата натрия. Описанный способ позволяет получать несимметричные порфиразиновые металлокомплексы и соответствующие им безметальные соединения при условиях, уменьшающих или исключающих образование продуктов побочных реакций, которые снижают выход целевых продуктов. 2 ил.
Способ получения несимметричных порфиразинов путем взаимодействия порфиразиногенов, отличающийся тем, что в качестве порфиразиногенов используют 2-имино-5-амино-3,4-дифенил-2Н-пиррол и хлоргидраты 1,1-дихлор-3-амино-1Н-изоиндолов общей формулы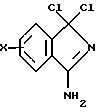
где Х - Н, Сl, Вr,
и взаимодействие проводят в ацетоне сначала при комнатной температуре в присутствии триэтиламина, затем в условиях кипящего ацетона в присутствии хлорида меди и/или гидрохинона и метилата натрия.
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 4882428 A,21.11.89 | |||
| Kobayashi Nagao, Achida Thohru, Hiroya Kou, Osa Tutsuo, Chem | |||
| Lett | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| Kobayashi Nagao, Achida Thohru, Osa Tutsuo, Konami Hideo, Jnorg | |||
| Chem | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Гэрбэлэу Н.В., Арион В.Б | |||
| Темплатный синтез макроциклических соединений | |||
| -Кишенев: Штиинца, 1990, с.122-127. | |||
Авторы
Даты
1999-10-10—Публикация
1997-09-08—Подача