Группа изобретений относится к области микрогетерогенного катализа и может быть использована для получения оптически активной аминокислоты или ее эфира путем асимметрического гидрирования двойной С=С связи в ненасыщенных аминокислотах.
Заявляемая группа изобретений относится к приоритетному направлению развития науки и техники «Индустрия наносистем» [Указ Президента Российской Федерации №899 от 7 июля 2011 г.].
Существует ряд различных катализаторов асимметрического гидрирования, получаемых путем добавления оптически активных модификаторов или лигандов к катализатору.
Известен катализатор асимметрического гидрирования двойных С=С в ациламидоакриловых кислотах и С=O связей в α,β-кетокислотах и их солях, представляющий собой комплекс переходного металла 8 группы периодической системы с лигандом, представляющим собой оптически активное тетрасульфированное дифосфиновое соединение. Металл выбирают из группы, состоящей из рутения, родия, палладия и иридия [Michel Lalonde, Rudolf Schmid. Tetrasulfonated diphosphine compounds and metal complexes thereof for asymmetric catalytic reactions. Патент US 005536858 A, 1996].
Признаками, совпадающими с существенными признаками заявляемого катализатора, являются:
- использование металлов платиновой группы, в частности палладия как катализатора;
- использование оптически активного соединения в качестве модификатора.
Недостатками аналога-катализатора являются:
- использование тетрасульфированных дифенилфосфиновых соединений, имеющих ряд недостатков, среди которых их рН-чувствительность и высокое накопление заряда в координационной сфере комплекса металла, что приводит к снижению стабильности комплекса из-за значительного кулоновского межлигандного отталкивания;
- невысокие избытки энантиомеров при гидрировании некоторых субстратов, например для α-ацетамидокоричной кислоты в метаноле избыток S-энантиомера продукта не превышает 75% при 100% конверсии субстрата, при использовании воды как растворителя избыток S-энантиомера не превышает 82% при конверсии субстрата 45%;
- сложность извлечения и повторного использования катализатора.
Метод получения гомогенного катализатора гидрирования заключается в добавлении метанольного раствора тетрасульфированного дифосфинового соединения к метанольному раствору комплекса металла и последующем перемешивании при температуре 0-100°С в течение 4-22 часов. [Michel Lalonde, Rudolf Schmid. Tetrasulfonated diphosphine compounds and metal complexes thereof for asymmetric catalytic reactions. Патент US 005536858 A, 1996].
Признаками способа-аналога, совпадающими с существенными признаками заявляемого способа, являются:
- использование металлов платиновой группы, в частности палладия как катализатора;
- индукция хиральности путем добавления оптически активного соединения.
Недостатком этого метода является:
- длительный, многостадийный и дорогой способ получения тетрасульфированного оптически активного дифосфинового соединения.
Известен гомогенный катализатор асимметрического гидрирования α,β-замещенных-α-ациламидо-акриловых кислот и/или их солей, эфиров и амидов, представляющий собой металлокомплекс, где металл выбран из группы, состоящей из родия, иридия и рутения, окруженный бис-фосфиновым лигандом [William S. Knowles, Milton J. Sabacky, Billy D. Vineyard. Asymmetric Catalysis. Патент US 004220590 A, 1980].
Признаками аналога, совпадающими с существенными признаками заявляемого катализатора, являются:
- использование металлов платиновой группы;
- использование оптически активного соединения в качестве индуктора хиральности
Недостатками данного гомогенного катализатора являются:
- сложность извлечения и повторного использования катализатора;
- высокая стоимость оптически активного лиганда и катализатора.
Метод получения такого катализатора заключается в смешивании метанольных растворов комплекса металла и бис-фосфинового лиганда и перемешивании при температуре - 20-110°С. При использовании α-ацетамидокоричной кислоты как субстрата избыток S-энантиомера составил более 91,8% [William S. Knowles, Milton J. Sabacky, Billy D. Vineyard. Asymmetric Catalysis. Патент US 004220590 A, 1980].
Признаками способа-аналога, совпадающими с существенными признаками заявляемого способа, являются:
- использование металлов платиновой группы в качестве катализатора;
- индукция хиральности путем добавления оптически активного соединения.
Недостатком этого метода является:
- сложный и многостадийный способ получения оптически активного бис-фосфинового лиганда.
Катализаторы, используемые в вышеописанных методах, являются гомогенными катализаторами, в них используются дорогие металлы, например родий, а также крайне дорогостоящие оптически активные Р,Р-лиганды.
Известен катализатор асимметрического гидрирования, представляющий собой порошок по крайней мере одного из металлов 8-10 групп периодической системы или металл 8-10 групп периодической системы на подложке, содержащий оптически активное пептидное соединение. Металл выбирают из группы, состоящей из никеля, рутения, родия, иридия, палладия и платины. Асимметрическому гидрированию двойной С=С-связи с помощью катализатора асимметрического гидрирования подвергались α,β-ненасыщенные карбонильные соединения:
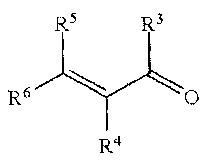
кетоны и альдегиды, в том числе гераниаль и нераль [Shinya Yamada, Hironori Maeda, Yoji Hori. Catalyst for asymmetric hydrogenation and method for manufacturing optically active carbonyl compound using the same. Патент US 8674144 B2, 2014].
Признаками аналога, совпадающими с существенными признаками заявляемого катализатора, являются:
- использование металлов 8-10 групп, в частности палладия;
- гидрирование С=С-связи;
- использование оптически активного соединения;
Недостатками данного катализатора являются:
- невысокие значения конверсии субстрата - не более 64,1%;
- невысокие значения избытка энантиомера - не более 61,6%.
Метод получения катализатора заключается в последовательном введении к металлу на подложке оптически активного пептидного соединения и органической или неорганической кислоты с последующим перемешиванием в атмосфере водорода под давлением 0,1-10 МПа при температуре - 78-100°С. [Shinya Yamada, Hironori Maeda, Yoji Hori. Catalyst for asymmetric hydrogenation and method for manufacturing optically active carbonyl compound using the same. Патент US 8674144 B2, 2014].
Признаками способа-аналога, совпадающими с существенными признаками заявляемого способа, являются:
- использование металлов платиновой группы как катализатора;
- индукция хиральности путем добавления оптически активного соединения;
- использование молекулярного водорода под давлением.
Недостатком этого метода является:
- сложность и многостадийность метода получения оптически активного пептида;
- применяется высокое давление газообразного водорода.
Известен катализатор асимметрического гидрирования α,β-ненасыщенных карбонильных соединений, представляющий собой порошок по крайней мере одного металла 8-10 групп периодической системы или металл 8-10 групп периодической системы на подложке, а также содержащий оптически активное циклическое азотсодержащее соединение и кислоту [Hironori Maeda, Yoji Hori. Catalyst for asymmetric hydrogenation. Патент US 20100324338 A1, 2010].
Признаками аналога, совпадающими с существенными признаками заявляемого катализатора, являются:
- использование металлов 8-10 групп, в частности палладия;
- гидрирование С=С-связи;
- использование оптически активного соединения для индукции хиральности;
Недостатком данного катализатора является:
- жесткие условия процесса: высокое давление водорода (0.1-10 МПа) и температура (78-100°С).
Метод получения заключается в последовательном добавлении к металлу на подложке оптически активного циклического азотсодержащего соединения и кислоты с последующим перемешиванием в атмосфере водорода под давлением 0,1-10 МПа при температуре - 78-100°С. [Hironori Maeda, Yoji Hori. Catalyst for asymmetric hydrogenation. Патент US 20100324338 A1, 2010].
Признаками способа-аналога, совпадающими с существенными признаками заявляемого способа, является:
- использование металлов платиновой группы как катализатора;
- индукция энантиоселективности путем добавления оптически активного соединения;
- использование молекулярного водорода под давлением.
Недостатками этого метода являются:
- дороговизна и многостадийность способа получения оптически активного циклического азотсодержащего соединения, ответственного за перенос хиральности;
- высокое давление водорода (0.1-10 МПа) и температура (78-100°С), необходимые для получения катализатора.
Известен палладиевый катализатор гидрирования α,β - ненасыщенных кислот с получением до 53% избытка R-энантиомера 2,3-диметилбутановой кислоты [Baiker A., Borszeky K., Mallat Т. Enantioselective hydrogenation of α,β-unsaturated acids. Substrate-modifier interaction over cinchonidine modified Pd/Al2O3, Tetrahedron: Asymmetry, 1997, Vol 8. No 22, pp. 3745-3753].
Признаками аналога, совпадающими с существенными признаками заявляемого катализатора, являются:
- использование палладия;
- гидрирование С=С-связи;
- использование (-)-цинхонидина в качестве модификатора.
Недостатком данного катализатора является:
- невысокая энантиомерная чистота продукта.
Метод получения заключается в смешивании Pd/Al2O3 и цинхонидина в гексане с последующим перемешиванием при 6 МПа [Baiker A., Borszeky K., Mallat Т. Enantioselective hydrogenation of α,β-unsaturated acids. Substrate-modifier interaction over cinchonidine modified Pd/Al2O3, Tetrahedron: Asymmetry, 1997. Vol 8. No 22. P. 3745-3753].
Признаками способа-аналога, совпадающими с существенными признаками заявляемого способа, является:
- использование палладия как катализатора;
- индукция энантиоселективности путем добавления (-)-цинхонидина;
- использование молекулярного водорода под давлением.
Недостатком этого метода является:
- необходимость работы с высокими давлениями газообразного водорода (6 МПа).
Известен гетерогенный палладиевый катализатор гидрирования α,β-ненасыщенных карбоксильных кислот с получением до 57% избытка S-энантиомера 2,3-дифенилпропионовой кислоты [ G., Niwa S-I., Hanaoka Т-А., Mizukami F. Enantioselective Hydrogenation of α,β-unsaturated carboxylic acids over cinchonidine-modified Pd catalysts: effect of substrate structure on the adsorption mode. J. Mol. Cat. A: Chem. 2005. Vol 230. No 1-2. P. 91-95].
G., Niwa S-I., Hanaoka Т-А., Mizukami F. Enantioselective Hydrogenation of α,β-unsaturated carboxylic acids over cinchonidine-modified Pd catalysts: effect of substrate structure on the adsorption mode. J. Mol. Cat. A: Chem. 2005. Vol 230. No 1-2. P. 91-95].
Признаками аналога, совпадающими с существенными признаками заявляемого катализатора, являются:
- использование металла палладия;
- использование (-)-цинхонидина в качестве модификатора.
Недостатками данного катализатора являются:
- невысокая энантиомерная чистота продукта;
- неполная конверсия (60%) при гидрировании 2,3-дифенил акриловой кислоты как субстрата.
Метод получения катализатора заключается в перемешивании палладиевого катализатора на подложке с (-)-цинхонидином в течение часа под давлением 0,1-5 МПа при температуре 23°С [ G., Niwa S-I., Hanaoka Т-А., Mizukami F. Enantioselective Hydrogenation of α,β-unsaturated carboxylic acids over cinchonidine-modified Pd catalysts: effect of substrate structure on the adsorption mode. J. Mol. Cat. A: Chem., 2005. Vol 230. No 1-2. P. 91-95].
G., Niwa S-I., Hanaoka Т-А., Mizukami F. Enantioselective Hydrogenation of α,β-unsaturated carboxylic acids over cinchonidine-modified Pd catalysts: effect of substrate structure on the adsorption mode. J. Mol. Cat. A: Chem., 2005. Vol 230. No 1-2. P. 91-95].
Признаками способа-аналога, совпадающими с существенными признаками заявляемого способа, являются:
- использование палладия как катализатора;
- индукция энантиоселективности путем добавления (-)-цинхонидина;
- использование молекулярного водорода под давлением.
Недостатком этого метода является:
- необходимость работы с относительно высокими давлениями газообразного водорода для приготовления катализатора.
Известен катализатор гидрирования N-ацетилдегидроаминокислот, способный обеспечивать до 60% избытка энантиомеров, представляющий собой палладий на носителе, модифицированный соединением из ряда хинных алкалоидов [ М.,
М.,  G.,
G.,  Е. Enantioselective hydrogenation of N-acetyldehydroamino acids over supported palladium catalysis, Adv. Synth. Catal., 2007. Vol 349. P. 405-410].
Е. Enantioselective hydrogenation of N-acetyldehydroamino acids over supported palladium catalysis, Adv. Synth. Catal., 2007. Vol 349. P. 405-410].
Признаками аналога, совпадающими с существенными признаками заявляемого катализатора, являются:
- использование металла палладия в качестве катализатора;
- использование хинных алкалоидов в качестве модификаторов;
Недостатком данного катализатора является:
- невысокая энантиомерная чистота продукта - N-ацетилфенилаланина.
Метод получения катализатора заключается в обработке катализатора на носителе в течение 0,5 часа под давлением водорода 0,1-5 МПа при температуре 24°C с последующим добавлением модификатора из ряда хинных алкалоидов [ М.,
М.,  G.,
G.,  Е. Enantioselective hydrogenation of N-acetyldehydroamino acids over supported palladium catalysis, Adv. Synth. Catal., 2007, Vol 349, pp. 405-410].
Е. Enantioselective hydrogenation of N-acetyldehydroamino acids over supported palladium catalysis, Adv. Synth. Catal., 2007, Vol 349, pp. 405-410].
Признаками способа-аналога, совпадающими с существенными признаками заявляемого способа, являются:
- использование палладия как катализатора;
- индукция хиральности путем добавления соединения из ряда хинных алкалоидов;
- использование молекулярного водорода под давлением.
Недостатком этого метода является:
- необходимость работы с относительно высокими давлениями газообразного водорода для приготовления катализатора.
За прототип принят катализатор асимметрического гидрирования α,β-ненасыщенных альдегидов, представляющий собой металлический катализатор на подложке, где в качестве металла выступают металлы 8-10 групп периодической системы, а именно: никель, рутений, родий, палладий и платина, с добавлением оптически активного соединения: органическое основание, соль органической кислоты или неорганическое основание [Hironori Maeda, Yoji Hori. Asymmetric hydrogenation catalyst. Патент ЕР 2353714 A1, 2011].
Признаками аналога, совпадающими с существенными признаками заявляемого катализатора, являются:
- использование металла палладия;
- использование оптически активных соединений, в частности (-)-цинхонидина, в качестве модификатора;
- использование молекулярного водорода в качестве гидрирующего реагента.
Недостатком данного катализатора является:
- низкое значение избытка энантиомера полученного продукта, например при использовании в качестве оптически активного компонента (-)-цинхонидина (0,5 вес. %) избыток предпочтительного S-энантиомера продукта не превышает 5,3%;
- использование высокого давления водорода 0.1-10 МПа в процессе гидрирования субстратов.
Метод получения катализатора заключается в добавлении оптически активного вещества к гетерогенному металлическому катализатору на носителе и последующему перемешиванию в атмосфере водорода под давлением 0,1-10 МПа при температуре 0-100°С. [Hironori Maeda, Yoji Hori. Asymmetric hydrogenation catalyst. Патент ЕР 2353714 A1, 2011].
Признаками способа-аналога, совпадающими с существенными признаками заявляемого способа, являются:
- использование палладия как катализатора;
- индукция энантиоселективности путем добавления оптически активного соединения;
- использование молекулярного водорода под давлением.
Недостатком этого метода является:
- применение высокого давления водорода (до 10 МПа) и температуры (до 100°С) для получения катализатора.
Изобретение направленно на решение задачи создания эффективного катализатора, получаемого технологичным способом, позволяющим увеличить энантиомерную чистоту продукта гидрирования и снизить стоимость катализатора.
Технический результат заявляемого изобретения заключается в повышении эффективности катализатора асимметрического гидрирования дегидроаминокислот путем получения в метаноле или метанол-толуольной смеси дисперсии наноразмерных частиц палладия, модифицированных природным оптически активным хинным алкалоидом (-)-цинхонидином, и применения их в качестве катализаторов гидрирования двойной С=С связи в ненасыщенных кислотах с высоким оптическим выходом продукта гидрирования.
В настоящем изобретении оптически активное соединение (-)-цинхонидин, которое служит в качестве модификатора, индуцирующего энантиоселективность, используется в качестве компонента катализатора асимметрического гидрирования. Это соединение является природным, добывается из коры хинного дерева, стоимость его значительно меньше стоимости синтетических оптически активных фосфорорганических лигандов, синтезируемых в несколько стадий и применяемых в комплексах переходных металлов для асимметрического гидрирования дегидроаминокислот.
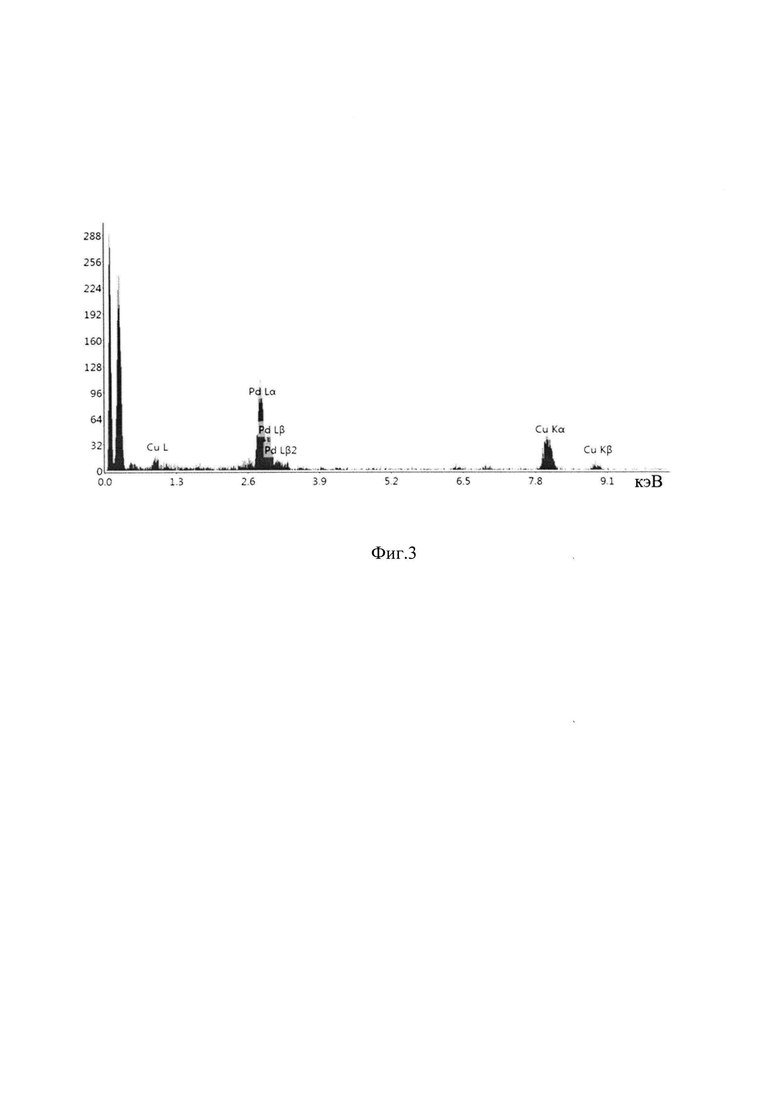
На фиг. 1 представлены снимки просвечивающего электронного микроскопа высокого разрешения (ПЭМ BP) полученного катализатора, на которых наблюдаются индивидуальные наночастицы. Элементный анализ наночастиц палладия на аморфной пленке поливинилформаля был выполнен с применением энергодисперсионной рентгеноскопии (EDX) (фиг. 2). Можно видеть, что наночастицы, имеющие кристаллическую структуру, состоят из атомов или ионов палладия.
Технический результат заявляемого изобретения достигается тем, что в способе получения катализатора асимметрического гидрирования, включающем восстановление палладия из его соединений с последующей модификацией, согласно изобретению восстановлению подвергают метанольный или толуол-метанольный раствор бис-ацетилацетоната палладия (II), а в качестве восстановителя используют молекулярный водород под давлением 0.5 МПа. В качестве модифицирующего агента используют (8S,9R)-(-)-цинхонидин при мольном соотношении модификатора (mod) к палладию 0.5-4.
Другими словами, суть заявляемого изобретения заключается в получении дисперсии катализатора асимметрического гидрирования двойной С=С связи в дегидроаминокислотах путем восстановления в токе молекулярного водорода бис-ацетилацетоната палладия (II) в метанольном или метанол-толуольном растворе, содержащем растворенный модификатор, представляющий собой (8S,9R)-(-)-цинхонидин. Первоначально в атмосфере аргона биоацетилацетонат палладия (II) (0.02-0.1 ммоль) полностью растворяют в метаноле или толуол-метанольной смеси, после чего вносят в раствор 0.03-0.4 ммоль модификатора, всю смесь помещают в автоклав, создают давление молекулярного водорода 0.5 МПа и перемешивают в течение 10-30 мин.
Отличие от аналогов заключается в том, что восстановление металла с образованием его дисперсии происходит из бис-ацетилацетоната палладия в модификаторсодержащем растворе при мольном отношении модификатора к палладию 0.5-4.
Преимущество катализатора перед аналогами заключается в относительной простоте получения и меньшей себестоимости, обусловленной использованием природного алкалоида (-)-цинхонидина в качестве модификатора и палладия, в качестве материала катализатора, а также в повышении энантиомерной чистоты продукта гидрирования.
Группа изобретений поясняется графическими материалами,
где на фиг. 1 представлена микрофотография ПЭМ BP катализатора, полученного заявляемым способом, при отношении (-)-цинхонидина к палладию равном 1 (размерная линейка равна 5 нм);
на фиг. 2 представлена микрофотография ПЭМ BP катализатора, полученного заявляемым способом, при отношении (-)-цинхонидина к палладию равном 1 (размерная линейка равна 50 нм);
на фиг. 3 - элементный анализ наночастиц палладия, полученного заявляемым способом, при отношении (-)-цинхонидина к палладию равном 1.
Осуществление изобретения
Для определения продуктов реакции был использован метод газовой хроматографии и ГХ-МС. Анализ проб проводили на хроматомасс-спектрометре Shimadzu GCMS-QP2010 Plus, использовали пламенно-ионизационный детектор и капиллярную колонку Equity 5 (30 м 0.25 мм, 95% диметилполисилоксана, 5% дифенилполисилоксана). Избыток энантиомера продуктов гидрирования - N-ацетил L-фенилаланина и метилового эфира N-ацетил L-фенилаланина определяли путем измерения удельного вращения раствора на поляриметре B+S ADP 410 (желтая линия натрия).
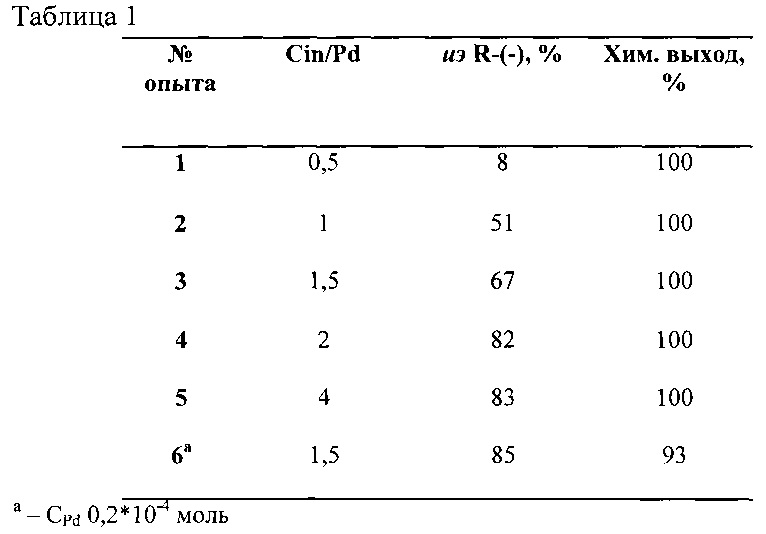
Опыт 1
В 10 мл метанола в атмосфере аргона растворяли последовательно навески Pd(acac)2 (1⋅10-4 моль) и цинхонидина (0,5⋅10-4 моль), затем помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0,5 МПа. После образования нанокластеров Pd(0) (индукционный период ~ 30-50 минут) вносили субстрат - смесь N-ацетил α-амидокоричной кислоты (0,37⋅10-3 моль) и ее метилового эфира (0,56⋅10-3 моль), растворенные в 10 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - метилового эфира N-ацетил фенилаланина - составила 8% (R-изомер).
Опыт 2
В 10 мл метанола в атмосфере аргона растворяли последовательно навески Pd(acac)2 (1⋅10-4 моль) и цинхонидина (1⋅10-4 моль), затем помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0.5 МПа. После образования нанокластеров Pd(0) вносили субстрат - смесь N-ацетил-α-амидокоричной кислоты (0.37⋅10-3 моль) и ее метилового эфира (0.56⋅10-3 моль), - растворенные в 10 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - метилового эфира N-ацетил фенилаланина - составила 51% (R-изомер).
Опыт 3
В 10 мл метанола в атмосфере аргона растворяли последовательно навески Pd(acac)2 (1⋅10-4 моль) и цинхонидина (1,5⋅10-4 моль), затем помещали этот раствор в сосуд автоклава и подавалили в систему при постоянном перемешивании водород под давлением 0.5 МПа. После образования нанокластеров Pd(0) вносили субстрат - смесь N-ацетил α-амидокоричной кислоты (0,37⋅10-3 моль) и ее метилового эфира (0,56⋅10-3 моль), растворенные в 10 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - метилового эфира N-ацетил фенилаланина - составила 67% (R-изомер).
Опыт 4
В 10 мл метанола в атмосфере аргона растворяли последовательно навески Pd(acac)2 (1⋅10-4 моль) и цинхонидина (2⋅10-4 моль), затем помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0,5 МПа. После образования нанокластеров Pd(0) вносили субстрат - смесь N-ацетил α-амидокоричной кислоты (0,37⋅10-3 моль) и ее метилового эфира (0,56⋅10-3 моль), растворенные в 10 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - метилового эфира N-ацетил фенилаланина - составила 82% (R-изомер).
Опыт 5
В 10 мл метанола в атмосфере аргона растворяли последовательно навески Pd(acac)2 (1⋅10-4 моль) и цинхонидина (4⋅10-4 моль), затем помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 5 бар. После образования нанокластеров Pd(0) вносили субстрат - смесь N-ацетил α-амидокоричной кислоты (0,37⋅10-3 моль) и ее метилового эфира (0,56⋅10-3 моль), растворенные в 10 мл метанола, и гидрировали молекулярным водородом под давлением 0,5 МПа при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - метилового эфира N-ацетил фенилаланина - составила 83% (R-изомер).
Опыт 6
В 10 мл метанола в атмосфере аргона растворяли последовательно навески Pd(acac)2 (0,2⋅10-4 моль) и цинхонидина (0,3⋅10-4 моль), затем помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0,5 МПа. После образования нанокластеров Pd(0) вносили субстрат - смесь N-ацетил α-амидокоричной кислоты (0,074⋅10-3 моль) и ее метилового эфира (0,112⋅10-3 моль), растворенные в 10 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 93%, оптическая чистота продукта - метилового эфира N-ацетил фенилаланина - составила 85% (R-изомер).
Ниже, в таблице 1, приведены результаты опытов 1-6.
Опыт 7
В смеси 3 мл толуола и 3 мл метанола в атмосфере аргона растворяли навеску Pd(acac)2 (1⋅10-4 моль), после полного растворения вносили навеску цинхонидина (0,5⋅10-4 моль), растворенного в 8 мл метанола. Помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0,5 МПа. После образования нанокластеров Pd(0) вносили субстрат - N-ацетил α-амидокоричную кислоту (4,8⋅10-3 моль), растворенную в 5 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - N-ацетил фенилаланина - составила 34% (R-изомер).
Опыт 8
В смеси 3 мл толуола и 3 мл метанола в атмосфере аргона растворяли навеску Pd(acac)2 (1⋅10-4 моль), после полного растворения вносили навеску цинхонидина (1⋅10-4 моль), растворенного в 8 мл метанола. Помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0,5 МПа. После образования нанокластеров Pd(0) вносили субстрат - N-ацетил α-амидокоричную кислоту (4,8⋅10-3 моль), растворенную в 5 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - N-ацетил фенилаланина - составила 82% (R-изомер).
Опыт 9
В смеси 3 мл толуола и 3 мл метанола в атмосфере аргона растворяли навеску Pd(acac)2 (1⋅10-4 моль), после полного растворения вносили навеску цинхонидина (2⋅10-4 моль), растворенного в 8 мл метанола. Помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0,5 МПа. После образования нанокластеров Pd(0) вносили субстрат - N-ацетил α-амидокоричную кислоту (4,8⋅10-3 моль), растворенную в 5 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - N-ацетил фенилаланина - составила 60% (R-изомер).
Опыт 10
В смеси 3 мл толуола и 3 мл метанола в атмосфере аргона растворяли навеску Pd(acac)2 (1⋅10-4 моль), после полного растворения вносили навеску цинхонидина (6⋅10-4 моль), растворенного в 8 мл метанола. Помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0,5 МПа. После образования нанокластеров Pd(0) вносили субстрат - N-ацетил α-амидокоричную кислоту (4,8⋅10-3 моль), растворенную в 5 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%, оптическая чистота продукта - N-ацетил фенилаланина - составила 26% (R-изомер).
Ниже, в таблице 2, приведены результаты опытов 7-9.

Опыт 11
В смеси 3 мл толуола и 3 мл метанола в атмосфере аргона растворяли навеску Pd(acac)2 (1⋅10-4 моль, 0,0304 г), после полного растворения вносили навеску протонированного цинхонидина (1⋅10-4 моль), растворенного в 8 мл метанола. Помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0,5 МПа. После образования нанокластеров Pd(0) вносили субстрат - N-ацетил-α-амидокоричную кислоту (4,8⋅10-3 моль), растворенную в 5 мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Конверсия составила 100%. Избыток R-энантиомера полученного продукта -N-ацетил фенилаланина, составил 22,9%.
Опыт 12
В смеси 3 мл толуола и 3 мл метанола в атмосфере аргона растворяли навеску Pd(acac)2 (1⋅10-4 моль), после полного растворения вносили навеску дипротонированного цинхонидина (1⋅10-4 моль), растворенного в 8 мл метанола. Помещали этот раствор в сосуд автоклава и подавали в систему при постоянном перемешивании водород под давлением 0.5 МПа. После образования нанокластеров Pd(0) вносили субстрат - N-ацетил α-амидокоричную кислоту (4,8⋅10-3 моль), растворенную в 5. мл метанола, и гидрировали молекулярным водородом под давлением 5 бар при перемешивании при температуре 25°С. Полученный продукт - смесь 78,9% N-ацетил фенилаланина и 21,1% метилового эфира N-ацетил фенилаланина, с помощью диазометана переводили в метиловый эфир N-ацетил фенилаланина для измерения оптического выхода. Избыток R-энантиомера составил 9,6%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ O-ХЛОРАНИЛИНА | 2015 |
|
RU2606394C1 |
| СПОСОБ ПОЛУЧЕНИЯ О-ХЛОРАНИЛИНА (ВАРИАНТЫ) | 2014 |
|
RU2556222C1 |
| Способ гидрирования ацетиленовых спиртов (варианты) | 2020 |
|
RU2734459C1 |
| ПАЛЛАДИЕВЫЙ КАТАЛИЗАТОР ГИДРИРОВАНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2323776C2 |
| КАТАЛИЗАТОР ГИДРИРОВАНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2304464C1 |
| СПОСОБ ПОЛУЧЕНИЯ α АРИЛПРОПИОНОВЫХ КИСЛОТ | 1990 |
|
RU2086532C1 |
| Катализатор для асимметрического гидрирования замещенных акриловых кислот | 1974 |
|
SU526279A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРЕКИСИ ВОДОРОДА | 2018 |
|
RU2687449C1 |
| Способ получения палладийсодержащего катализатора гидрирования ацетиленовых соединений | 2022 |
|
RU2814116C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО АСПАРТАМА, ПРИГОДНОГО В КАЧЕСТВЕ ПОДСЛАЩИВАЮЩЕГО СРЕДСТВА | 1995 |
|
RU2138510C1 |

Изобретение относится к дисперсии наноразмерных частиц палладия, модифицированного (-)-цинхонидином, в метаноле или метанол-толуольной смеси в качестве катализатора асимметрического гидрирования двойной С=С связи в ненасыщенных дегидроаминокислотах. Изобретение также относится к способу получения дисперсии наноразмерных частиц палладия, модифицированного (-)-цинхонидином, в метаноле или метанол-толуольной смеси, который включает восстановление палладия из его раствора бис-ацетилацетонатной соли в модификатор-содержащем растворителе при мольном отношении модификатора к палладию 0,5-6,0. Использование этого катализатора в гидрировании N-ацетил α-амидокоричной кислоты позволяет получить до 85% избытка энантиомера N-ацетил фенилаланина. 2 н.п. ф-лы, 3 ил., 2 табл., 12 пр.
1. Дисперсия наноразмерных частиц палладия, модифицированного (-)-цинхонидином, в метаноле или метанол-толуольной смеси в качестве катализатора асимметрического гидрирования двойной С=С связи в ненасыщенных дегидроаминокислотах.
2. Способ получения дисперсии наноразмерных частиц палладия, модифицированного (-)-цинхонидином, в метаноле или метанол-толуольной смеси, включающий восстановление палладия из его бис-ацетилацетонатной соли с последующей модификацией, отличающийся тем, что восстановление палладия проводят из раствора его бис-ацетилацетонатной соли в модификаторсодержащем растворителе при мольном отношении модификатора к палладию 0,5-6,0, оптимальный диапазон 1-4.
| ДЕТАЛИ, ПОКРЫТЫЕ АЛЮМИНИЙ-МАГНИЕВЫМ СПЛАВОМ | 2004 |
|
RU2353714C2 |
| SZOLLOSI G | |||
| et al., Enantioselective hydrogenation of α , β -unsaturated carboxylic acids over cinchonidine-modified Pd catalysts: effect of substrate structure on the adsorption mode, Journal of Molecular Catalysis A, Chemical, 2005, v.230, p.91-95 | |||
| BORSZEKY K | |||
| et al., Enantioselective hydrogenation of a,b-unsaturated acids | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| КАТАЛИЗАТОР ГИДРИРОВАНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2304464C1 |
Авторы
Даты
2017-06-07—Публикация
2016-05-24—Подача