Перекрестная ссылка на родственные заявки
Данная заявка заявляет приоритет по дате подачи первоначальной заявки на патент США 61/449337, поданной 4 марта 2011 года, описание которой включено в данный документ путем ссылки.
Область техники
Диабет представляет собой синдром нарушенного метаболизма, обычно вследствие комбинации наследственных и внешних факторов, приводя в результате к чрезмерно высоким уровням сахара в крови (гипергликемия). Уровни глюкозы в крови контролируются в организме сложным взаимодействием многочисленных химических соединений и гормонами, включая гормон инсулин, продуцируемый в бета-клетках поджелудочной железы. Сахарный диабет относится к группе заболеваний, которая приводит к высоким уровням глюкозы в крови вследствие дефектов или секреции инсулина, или действия инсулина в организме.
Диабет развивается вследствие сниженной выработки инсулина (в типе 1) или устойчивости к его воздействиям (в типе 2 и при гестационном диабете). Оба приводят к гипергликемии, которая главным образом вызывает острые признаки диабета, а именно избыточное мочеотделение, приводя в результате к компенсаторной жажде и повышенному приему жидкости, нечеткости зрения, необъяснимой потере веса, сонливости и изменениям в энергетическом обмене.
Инъекции посредством шприца, инсулиновой помпы или шприца-ручки с инсулином разносят инсулин, что является основным лечением диабета типа 1. Диабетом 2 типа управляют комбинацией диетического лечения, гимнастики, лекарственных средств и добавки инсулина. Все формы диабета стали поддаваться лечению, так как инсулин стал доступным с медицинской точки зрения, но лекарства все еще не существует.
Согласно отчету Всемирной организации здравоохранения в 2000 году по меньшей мере 171 миллион людей во всем мире страдали от диабета или 2,8% населения. Частота возникновения данного заболевания быстро растет, однако оценивают, что к 2030 году эта цифра почти удвоится. Сахарный диабет встречается по всему миру, но является более распространенным (особенно 2 тип) в более развитых странах. Однако предполагают, что самое значительное увеличение в распространении наблюдается в Азии и Африке, где вероятно к 2030 году будет найдено большинство пациентов.
О глюкагоноподобном пептиде (GLP-1), гастроингибиторном пептиде (GIP), глюкагоне и грелине сообщалось как о пептидных биомаркерах нарушений метаболизма, таких как диабет. Главный источник GLP-1 в организме найден в кишечнике. Типичная нормальная концентрация GLP-1 в кровотоке находится в интервале 3-85 пикомоль/л. GLP-1 обладает несколькими физиологическими свойствами, которые делают его объектом интенсивного изучения в качестве потенциального лечения диабета. Gautier, et al., Diabetes Met. 37: 233-42 (2005). Известно, что GLP-1 повышает секрецию инсулина из поджелудочной железы, снижает секрецию глюкагона из поджелудочной железы, увеличивает массу бета-клеток и экспрессию генов инсулина, подавляет секрецию кислоты и опорожнение желудка и уменьшает прием пищи путем увеличения чувства насыщения. Baggio, et al., J. Gastroenterol. 732: 2131-57 (2007). Оказавшись в кровотоке, однако, GLP-1, как сообщалось, демонстрирует короткий биологический период полужизни, составляющий примерно 1,5-5 минут (Hui, et al., Eur. J. Endocrinol. 146: 863-9 (2002)), вследствие протеолитического распада, вызванного протеазами, включая дипептидилпептидазу (DPP)-IV.
Активная форма GIP представляет собой попипептид из 42 аминокислот, представленный последовательностью: YAEGTFISDYSIAMDKIHQQDFVNWLLAQKGKKNDKHNITGQ ("GIP(1-42)"). GIP(1-42) синтезируется K клетками, которые найдены в слизистой оболочке двенадцатиперстной кишки и тонкой кишки желудочно-кишечного тракта. Полагают, что GIP(1-42) вызывает секрецию инсулина через механизм, который включает взаимодействие GIP с 7 трансмембранными GIP(1-42) рецепторами на бета-клетках поджелудочной железы. Обычная концентрация GIP(1-42) в плазме натощак составляет примерно 6-12 пкмоль/л, тогда как нормальная концентрация не натощак составляет примерно 80-300 пкмоль/л. GIP(1-42), как сообщалось, демонстрирует период полужизни в кровотоке, составляющий примерно 5 минут.
Глюкагон, пептид из 29 аминокислот, включен в метаболизм углеводов. Вырабатываемый поджелудочной железой он высвобождается, когда уровень глюкозы в крови является низким (гипогликемия). Он связывается с рецепторами на клетках печени (гепатоциты), вызывая превращение, осуществляемое печенью, запасного гликогена в глюкозу и затем высвобождение глюкозы в кровоток. Так как данные запасы становятся истощенными, глюкагон затем стимулирует синтез дополнительной глюкозы в печени. Действие глюкагона, таким образом, является обратным действию инсулина, который "дает указания" клеткам организма поглощать глюкозу из крови. Глюкагон также регулирует скорость образования глюкозы посредством процесса, известного как липолиз. Типичная нормальная концентрация глюкагона в крови в кровотоке составляет 11-17 пикомоль/л. Оказавшись в кровотоке, глюкагон имеет период полужизни, составляющий 8-18 минут.
Грелин представляет собой гормон, вырабатываемый главным образом P/D1 клетками, выстилающими дно желудка человека, и эпсилон-клетками поджелудочной железы, что возбуждает аппетит. Типичная нормальная концентрация в крови находится также в пикомолярном диапазоне. Грелин представляет собой пептид из 28 аминокислот, имеющий последовательность NH2-GSSFLSPEHQRVQQRKESKKPPAKLQPR-COOH. Одна из биологически активных форм данного пептида, известная как ацилированный грелин, содержит н-октаноиловую группу на Ser3 (т.е. -СН3(СН2)6СОО-). Данный пептид оказывает гормональные действия, такие как стимуляция высвобождения гормона роста (GH) из гипофиза, и различные физиологические воздействия, такие как стимулирование ожирения (увеличение жировой ткани) и увеличение массы тела вследствие воздействий, стимулирующих аппетит, и усиленного приема пищи, стимуляция секреции кислоты желудочного сока и сократительной способности. Kojima, et al., Trends Endocrinol. Metab. 12: 118-122 (2001); Kojima, et al., Physiol. Rev. 85: 495-532 (2005). Таким образом, в дополнение к диабету, ацилированный грелин представляет собой известный метаболический биомаркер близких состояний, таких как вызванная диетой потеря массы и голодание. Другая форма пептида грелин известна как дезацил-грелин, который представляет собой метаболически неактивную форму, имеющую свои собственные функции, включая модуляцию пролиферации клеток (Baldanzi, et al., J. Cell Biol. 159: 1029-37 (2002); Ariyasu, et al., Endocrinol. 2005: 355-64 (2005)) и липогенез (Muccioli, et al., Eur. J. Pharmacol. 498: 27-35 (2004)). Нормальная концентрация грелина в плазме, включая как активные, так и неактивные формы, варьирует в интервале от примерно 300 до примерно 700 пкг/мл (или примерно от 0,08 до примерно 0,19 нМ, или примерно от 0,09 до примерно 0,19 фемтомоль/мкл) и колеблется со временем. Главной циркулирующей формой грелина является декацил-грелин [Hosoda, et al., Biochim. Biophys. Res. Comm. 279: 909-13 (2000)], и таким образом большая часть этого количества не находится в форме более точного метаболического биомаркера. Оказавшись в кровотоке, грелин имеет период полужизни, составляющий примерно 30 минут.
В Yi, et al., J. Proteome Res. 6(5): 1768-81 (2007), например, сообщают, что протеолитический распад белков сыворотки и плазмы, вызванный внутренними протеазами, происходит в течение первых минут сбора образцов и обращения с ними (что предполагает быстрый протеолитический распад ex vivo). В более поздней публикации Yi et al., J. Proteome Res. 7(12): 5112-8 (2008) сообщается о том, что несмотря на то что открытие маркеров заболевания в жидкости крови продолжает развиваться, так как методы в области протеомики становятся как более впечатляющими, так и более широкодоступными, достигнут значительно меньший успех в переносе данных открытий в область клинического применения, пробуждая растущий интерес к пониманию барьеров для данного перехода. Кроме коротких периодов полужизни и сравнительно небольших концентраций GLP-1, GIP, глюкагона и грелина (и в частности их биологически активных форм) в плазме, возникают сложности вследствие вариабельности перед началом анализа, главным образом в течение сбора крови и ранней обработки образцов. Yi (2008) также сообщает, что в случае некоторых пептидных биомаркеров протеолитический распад происходит в считанные секунды.
Краткое описание изобретения
Такие биомаркеры, как GLP-1, GIP, глюкагон и грелин, имеют весьма небольшие концентрации и короткие периоды полувыведения, а также склонны к протеолитической деградации в плазме, что приводит к нестабильности в преаналитическом этапе при сборе крови и первичной обработке образцов. Настоящее изобретение обеспечивает относительно более длительную стабильность крови или ее компонента при хранении (например, включая стабильность по меньшей мере присутствующих в ней ацилированных пептидов или ацилированных белков) для проведения достоверного клинического тестирования, такого как измерение количества указанных типов биомаркеров, таких как грелин.
Грелин содержит основную пептидную цепь и боковую цепь, содержащую сложноэфирную группу из 8 атомов углерода, которые являются чувствительными к эндогенным протеазам и эстеразам соответственно, которые присутствуют в плазме человека. Как показано в демонстрационных примерах, заявители открыли, что грелин может быть более эффективно стабилизирован в собранных образцах крови или жидкого компонента (например, сыворотка или плазма) посредством включения ингибитора лизофосфолипазы (LysoPLA), по сравнению с ингибитором протеазы или эстеразы. В действительности, данные заявителей показывают, что дополнительное присутствие ингибитора эстеразы уменьшало или ослабляло стабильность грелина in vitro. Кроме того факта, что боковая цепь грелина представляет собой "сложноэфирную" группу, данные открытия являются удивительными и неожиданными, особенно в виду сообщений, что активность LysoPLA обнаруживается в желудке и кишечнике, но не в плазме. Таким образом, согласно настоящему изобретению обеспечивается стабильность крови или ее компонента при относительно более длительном хранении в целях проведения надежного клинического испытания, такого как анализ биомаркеров, таких как грелин.
В связи с этим первый аспект настоящего изобретения направлен на устройство для сбора и стабилизации цельной крови или ее компонента, которое включает первый конец и второй конец, и по меньшей мере одну внутреннюю стенку, образуя резервуар, где резервуар содержит стабилизирующий агент, который включает ингибитор лизофосфолипазы (LysoPLA). В некоторых воплощениях стабилизирующий агент также включает по меньшей мере один ингибитор другого типа фермента, который обычно присутствует в крови и который разрушает диагностические маркеры нарушений метаболизма. Данные ферменты включают эстеразы и протеазы. Таким образом, в других воплощениях устройство для сбора крови может также включать ингибитор эстеразы, такой как ингибитор бутилхолинэстеразы (БХЭ) или ацетилхолинэстеразы (АХЭ), и/или ингибитор протеазы (например, ингибитор сериновой протеазы, ингибитор эндопротеазы, ингибитор экзопептидазы, ингибитор дипептидилпептидазы и комбинации двух или более чем двух из них).
Также предложены способы получения и применения устройств в целях сбора и хранения цельной крови или ее компонента(ов).
Еще один аспект настоящего изобретения направлен на способ диагностирования заболевания или контроля лечения индивидуума с заболеванием, таким как нарушение метаболизма (например, диабет), при котором в течение продолжительного периода (или по меньшей мере в одно условленное время или временной интервал) оценивают наличие или количество одного или более чем одного маркера заболевания, включая биологически (метаболически) активный грелин, в образце крови или ее компоненте, собранном у пациента, используя устройство для сбора крови по изобретению. В некоторых воплощениях способ также включает анализ по меньшей мере одного дополнительного маркера нарушения метаболизма, выбранного из глюкагона, GIP, грелина и GLP-1 (который включает GLP-1-(7-36)NH2 и GLP-1-(7-37)) и комбинации двух или более чем двух из них. В частности, предложен способ диагностирования нарушения метаболизма пациента, при котором оценивают количество грелина в образце крови или ее компонента, где кровь у пациента собрана в устройство для сбора крови по изобретению, где измеренное количество, являющееся большим, чем в контроле, свидетельствует о наличии нарушения метаболизма. Кроме того, предложен способ контролирования лечения пациента с нарушением метаболизма, при котором оценивают количество грелина в образце крови или ее компонента, где кровь у пациента собрана в устройство для сбора крови по изобретению, и сравнивают оцененное количество с контролем для определения эффективности терапии.
Еще один другой аспект настоящего изобретения направлен на способ контроля уровней пролекарства в крови, содержащего боковую группу сложного эфира алифатического ряда (например, ацильная группа), у индивидуума, которому вводили пролекарство, который включает сбор образца крови у пациента с использованием устройства для сбора крови по изобретению и оценивание наличия или количества пролекарства и/или его активного метаболита в образце крови или ее компонента. Можно оценивать наличие или количество пролекарства и активного метаболита пролекарства. Оценивание уровней пролекарства и/или метаболита в крови можно проводить более одного раза, например, с заданными временными интервалами. В частности, предложен способ обнаружения наличия пролекарства и/или его активного метаболита в крови или ее компоненте, при котором обнаруживают наличие пролекарства, которое содержит группу сложного эфира алифатического ряда, и/или его активного метаболита, в образце крови или ее жидкого компонента у пациента, которому вводили пролекарство, где кровь или ее жидкий компонент собрана в устройство для сбора крови по изобретению. Кроме того, предложен способ определения количества пролекарства и/или его активного метаболита в крови или ее компоненте, при котором измеряют количество пролекарства, которое содержит группу сложного эфира алифатического ряда, и/или его активного метаболита, в образце крови или ее жидкого компонента у пациента, которому вводили пролекарство, где кровь или ее жидкий компонент собрана в устройство для сбора крови по изобретению.
Краткое описание
Фиг. 1 представляет собой вид в перспективе обычного устройства для сбора крови по настоящему изобретению.
Фиг. 2 представляет собой график, на котором изображено сравнение стабильности ацил-грелина на протяжении 30 ч в четырех разных пробирках для сбора крови, содержащих: 1) ингибитор LysoPLA метиларахидонилфторфосфонат (MAFP), ЭДТА (этилендиаминтетрауксусная кислота), ингибитор эстеразы, такрин, и ингибиторы протеазы, L-трео-изолейцилтиазолидид, бестатин и лейпептин (стабилизирующий агент по изобретению «ISA», обозначенный на фигуре как ▲); 2) другой стабилизирующий агент по изобретению, который включал антикоагулянт ЭДТА и MAFP (обозначенный на фигуре как х); 3) ЭДТА и ингибитор эстеразы и ингибиторы протеаз (сравнительный стабилизирующий агент «CSA», обозначенный на фигуре как ♦); и 4) только ЭДТА (обозначенный на фигуре как ■), с последующим введением 1 пкг/мкл ацил-грелина.
Фиг. 3 представляет собой график, на котором показана стабильность грелина в образце крови, собранном натощак у обследуемого человека, в течение продолжительного периода, и собранном и хранящемся как в пробирках с ЭДТА как с введением (♦), так и без введения (■), и пробирках для сбора образцов, содержащих репрезентативный стабилизирующий агент (включающий MAFP в качестве ингибитора LysoPLA) по настоящему изобретению (как с введением (▲), так и без введения (х)).
Подробное описание изобретения
Устройства для сбора образцов по настоящему изобретению применяют для сбора и стабилизации цельной крови или ее компонента, такого как эритроцитные концентраты, тромбоцитные концентраты, лейкоцитарные концентраты и жидкие компоненты крови, включая плазму и сыворотку.
В целом, устройства для сбора образцов крови по настоящему изобретению могут охватывать любое устройство для сбора образцов, включая пробирки, такие как пробирки и центрифужные пробирки; устройства для сбора крови закрытой системы, такие как пакеты для сбора образцов; шприцы, в частности предварительно заполненные шприцы; катетеры; титрационные микропланшеты и другие многолуночные планшеты; панели; трубки; лабораторные сосуды, такие как колбы, вращающиеся колбы, вращающиеся флаконы, пузырьки, предметные стекла, наборы предметных стекол, покровные стекла, пленки и пористые вещества и наборы; пипетки и микродозаторы; контейнеры для сбора образца ткани и другого биологического образца; и любой другой контейнер, подходящий для держания биологического образца, а также контейнеры и элементы, включенные в транспортировку образцов. Примеры и иллюстрации нескольких таких устройств раскрыты в Патенте США 7309468, находящемся в общем владении с Stevens et al.
На Фиг. 1, который также проиллюстрирован в патенте США 7309468, показано обычное устройство для сбора крови 10, полезное в настоящем изобретении, которое включает контейнер 12, образующий внутреннюю камеру или резервуар 14. В проиллюстрированном воплощении контейнер 12 представляет собой тонкостенную пробирку, имеющую боковую стенку 16, сплошной нижний конец 18 и открытый верхний конец 20. Возможно, разделяющий элемент 13 предложен в пределах камеры-контейнера 14. Разделяющий элемент 13 служит для способствования разделению компонентов образца крови, например, посредством центрифугирования. Контейнер 12 откалиброван для сбора соответствующего объема крови. Закрывающие средства 22 для покрытия открытого конца 20 для того, чтобы закрыть контейнер 12, являются необходимыми, когда требуется стерильный продукт. В некоторых воплощениях пробирке придана конфигурация для завинчивающейся крышки. В воплощениях, где пробирка является вакуумной, однако, как и в случае, когда резервуар содержит ингибитор BChE, а не ингибитор протеазы, обычно для удерживания вакуума в течение требующихся периодов хранения используют плотно прилегающую эластомерную пробку. Предпочтительно, крышка 22 формирует герметичную крышку, способную эффективно закрывать контейнер 12 и сохранять биологический образец в камере 14. Крышка 22 может быть одной из множества форм, включающих, но не ограничивающихся резиновыми крышками, крышками HEMOGUARD™, металлическими герметичными крышками, резиновыми герметичными крышками, окаймленными металлом, и герметичными крышками, сделанными из разных полимеров, и разных конструкции. Защитный слой 24 может покрывать крышку 22.
Контейнер 12 может быть сделан из любого материала, подходящего для лабораторных сосудов, включая, например, пластик (например, полиолефины, полиамиды, полиэстеры, кремнийорганические материалы, полиуретаны, эпоксидные смолы, акрилы, полиакрилаты, полиэстеры, полисульфоны, полиметакрилаты, PEEK (полиэфирэфиркетон), полиимид и фторполимеры) и стеклянные продукты, включая кварцевое стекло. Предпочтительно, контейнер 12 является прозрачным. Примеры подходящих прозрачных термопластичных материалов для контейнера 12 включают поликарбонаты, полиэтилен, полипропилен и полиэтилентерефталат. Пластмассы могут представлять собой непроницаемые для кислорода материалы или могут содержать непроницаемый или полупроницаемый для кислорода слой. В качестве альтернативы, контейнер 12 может быть сделан из водо- и воздухопроницаемой пластмассы.
Давление в камере 14 выбирают для того, чтобы в камеру 14 собрать заранее установленный объем биологического образца. Предпочтительно, крышка 22 сделана из упругого материала, который способен поддерживать разность внутреннего давления между атмосферным давлением и давлением, ниже атмосферного. Крышка 22 представляет собой такую, что ее можно прокалывать иглой 26 или другой канюлей для введения биологического образца в контейнер 12, как известно из уровня техники. Предпочтительно, крышка 22 является повторно герметизируемой. Подходящие материалы для крышки 22 включают, например, силоксановый каучук, натуральный каучук, бутадиен-стирольный каучуки, сополимеры этилена и пропилена и полихлоропрен.
Подходящие примеры контейнера 12 включают пробирки с однослойными и многослойными стенками. Более конкретный пример подходящего контейнера 12 раскрыт в Патенте США 5860937.
Контейнер 12 может также содержать сепаратор, такой как гель, механический сепаратор или другой тип разделяющего элемента (например, фильтровальная бумага или тому подобное). Сепараторы являются полезными для получения плазмы крови, конкретно для выделения плазмы из цельной крови человека или животного. Гель желательно представляет собой по составу тиксотропный полимерный гель. Гель может представлять собой гомополимер или сополимер и может включать гели на основе кремния, такие как, например, полисилоксаны, или гели на основе органических углеводородов, такие как, например, полиакрилики, полиэстеры, полиолефины, окисленные цис-полибутадиены, полибутены, смеси эпоксидированного масла соевых бобов и содержащих хлор углеводородов, сополимеры двухосновных кислот и пропандиолов, гидрогенизированные циклопентадиены и сополимеры альфа-олефинов и диалкилмалеатов. Примеры механических сепараторов, которые могут быть полезными в настоящем изобретении, описаны в Патентах США 6516953; 6406671; 6409528; 6497325.
Контейнер 12 может быть также приспособлен для отделения центрифугированием лимфоцитов и моноцитов от более тяжелых фаз образца цельной крови. В таких воплощениях устройства могут также содержать жидкую среду градиента плотности и средства для предотвращения смешивания жидкой среды градиента плотности с образцом крови перед центрифугированием. Пример подходящей пробирки для сбора лимфоцитов/моноцитов раскрыт в Патенте США 5053134.
Помимо воплощения, проиллюстрированного на Фиг. 1, другие коммерчески доступные пробирки для сбора крови, подходящие для применения по настоящему изобретению, включают следующее, все из которых продаются Becton, Dickinson and Company, Franklin Lakes, N.J., со всеми зарегистрированными правами и торговыми знаками, принадлежащими Becton, Dickinson and Company: VACUTAINER® гематологические пробирки (например, номера по каталогу 367650-1, 367661, 6405, 6385, 6564, 367653, 367665, 367658, 367669, 6450-8, 6535-37 и 367662); VACUTAINER® вакуумные пробирки с K2ЭДТА (например, номера по каталогу 367841-2, 367856 и 367861); VACUTAINER® пробирки PST (например, номера по каталогу 367793-4, 6698, 6595 и 6672); VACUTAINER® пробирки СРТ (например, номера по каталогу 362753 и 362760-1); VACUTAINER® пробирки SST (например, номера по каталогу 367782-89, 6509-17 и 6590-92); и VACUTAINER® пробирки ACD (например, номера по каталогу 367756, 364012 и 4816), и невакуумные пробирки BD Microtainer® с крышкой BD Microgard™ (например, 365987, 365965, и 365974) или общепринятые пробирки BD Microtainer® (например, 365956, 365957, 365958, 365959, 365971, и 365973). Многие коммерчески пробирки для сбора крови имеют стандартные объемы, обычно находящиеся в интервале от 250 микролитров до, и включая, примерно 10,0 мл, и в некоторых случаях вплоть до 16 мл. Обычные объемы включают 250, 400 и 500 микролитров, а также 2,0 мл, 3,5 мл, 4,0 мл, 5,0 мл, 8,0 мл, 8,5 мл и 10,0 мл.
В других воплощениях устройство может содержать резервуар, объединенный с испытательным картриджем, резервуаром, способным удерживать объем цельной крови в интервале от 2 до 200 микролитров, более предпочтительно 50-150 микролитров. Такие картриджи продают, например, под торговым названием i-STAT Point of Care System Abbott Laboratories (Abbott Park, Illinois), и могут использоваться с ручным анализатором, способным взаимодействовать с картриджем с помощью интерфейса. Примеры таких картриджей и ручных анализаторов, используемых по настоящему изобретению, включают картридж i-STAT СНЕМ8+ и i-STAT® 1 ручной анализатор соответственно. О таких устройствах сообщают, например, в Патентах США 5096669, 5112455, 5821399, 5628961, 7419821, 6750053 и США D337164.
Лизофосфолипазы (LysoPLA) представляют собой ферменты, которые гидролизуют лизофосфолипиды (LysoPL) и специфично по связям сложных эфиров карбоновых кислот, которые являются подобными детергентам промежуточными соединениями в метаболизме фосфолипидов и играют существенную роль во многих физиологических и патологических процессах. Лизофосфатидилхолин (LysoPC), обычный компонент клеточных мембран, и который, как полагают, действует в качестве липидного мессенджера, участвующего в трансдукции сигналов, инициированных от мембранных рецепторов, представляет собой эндогенный субстрат для LysoPLA. Аминокислотные последовательности и соответствующие последовательности нуклеиновых кислот человеческих LysoPLA известны из уровня техники. См., например, Патенты США 5858756; 6004792 и 7294496. Согласно одному доказательству, представленному в Патенте США 7294496, мРНК (матричная рибонуклеиновая кислота) LysoPLA широко распространена во многих тканях, причем сердце, плацента и скелетная мышца являются тканями с наибольшим распространением, после чего следует печень, поджелудочная железа, почка, мозг и легкое, и по другому доказательству (в котором содержались мессенджеры из большего количества тканей) наблюдали похожие картины, хотя относительная интенсивность для нескольких тканей была изменена в том, что плацента и семенник являются источниками с наибольшим распространением hLysoPLA, после чего следует надпочечные и слюнные железы, печень, сердце, скелетная мышца и трахея. Также сообщают, что лизофосфолипазы встречаются в многочисленных изоформах.
Типичные примеры ингибиторов LysoPLA, которые могут быть подходящими для применения по настоящему изобретению, включают этилоктилфосфонофторидат, изопропилдодецилфосфонофторидат, н-додецил-бензодиоксафосфорин-2-оксид, пальмитоилкарнитин, броменоллактон, пальмитилтрифторметилкетон и метиларахидонилфторфосфонат (MAFP). Другие ингибиторы могут быть идентифицированы с использованием методов, известных из уровня техники. См., например, Патент США 7294496.
Ингибитор LysoPLA присутствует в устройстве для сбора образцов в эффективном количестве для стабилизации разных эндогенных белков, которые могут присутствовать в биологическом образце, например грелина, и других белков и пептидов, которые для биологической активности требуют группу сложных эфиров алифатического ряда. Таким образом, помимо грелина, который является маркером нарушений метаболизма, таких как диабет, устройства для сбора образцов обеспечивают стабилизацию других нейропептидов. Ингибиторы LysoPLA функционируют посредством ингибирования расщепления группы сложного эфира алифатического ряда. Определение количества ингибитора LysoPLA, необходимого для включения в устройство для сбора крови, зависит от нескольких факторов, включая активность, растворимость в воде, объем устройства для сбора крови, и природу и степень неспецифических взаимодействий (например, вследствие наличия других белков в крови, таких как сывороточный альбумин). В соответствие с этим, в целях настоящего изобретения количество ингибитора LysoPLA (и количества дополнительных стабилизирующих агентов, которые могут присутствовать) для большего удобства выражают в виде интервала концентрации (из которого можно легко рассчитать фактическое количество ингибитора). Концентрация ингибитора LysoPLA обычно варьирует в интервале от примерно 0,1 мкМ до примерно 10 мМ, и в некоторых воплощениях от примерно 10 мкМ до примерно 1 мМ, и в некоторых воплощениях от примерно 100 мкМ до примерно 1 мМ (например, 10000000 нМ). Все поддиапазоны в пределах данных интервалов также включены. Термин "примерно", используемый в связи со всеми значениями концентраций, раскрытыми в данном документе, относится к варьированию (плюс/минус значение), составляющему 50%.
Хоть не намереваясь быть связанными теорией, полагают, что ингибитор LysoPLA может обеспечивать двойное преимущество, заключающееся в том, что при защите группы сложного эфира алифатического ряда от расщепления LysoPLA, внутренние протеазы, которые обычно находят в крови, могут быть стерически затрудненными в отношении распада аминокислотной цепи пептида. В зависимости от таких факторов, как природа аналита, формат анализа и схема работы (т.е. обработка и хранение отобранного образца крови перед анализом), устройства для сбора крови по настоящему изобретению могут обеспечивать стабильность биохимических маркеров, таких как грелин, в течение часов или даже одного или более чем одного дня, дольше, чем похожие устройства, которые не содержат ингибитора LysoPLA.
В некоторых воплощениях контейнер для сбора крови по изобретению может включать по меньшей мере один дополнительный стабилизирующий агент, такой как ингибитор эстеразы, например карбоксиэстераз, таких как бутилхолинэстераза и ацетилхолинэстераза. Данные стабилизирующие агенты могут обеспечивать дополнительную защиту от ex-vivo распада белков и пептидов, которые для биологической активности требуют группу сложного эфира алифатического ряда. Таким образом, помимо грелина, который является маркером нарушений метаболизма, таких как диабет, ингибиторы эстераз могут обеспечивать повышенную стабильность других нейропептидов. В некоторых воплощениях, однако, стабилизирующий агент (и устройство в целом) не включает ингибитора эстеразы.
Полагают, что бутилхолинэстераза (БХЭ) (Е.С. 3.1.1.8), также известная как холинэстераза сыворотки или плазмы, играет роль в способности организма метаболизировать кокаин и другие лекарственные средства, такие как сукцинилхолин и аспирин. См. Lockridge, "Genetic Variants of Human Serum Butyrylcholinesterase influence the metabolism of the muscle relaxant succinylcholine." В Kalow (ed.) Pharmacogenetics of Drug Metabolism New York: Pergamon Press, Inc, at pp. 15-50. БХЭ обычно находится в плазме человека в количестве, составляющем примерно 5 мг/л (или примерно 5 U (единиц)/мл). Ингибиторы БХЭ, полезные в настоящем изобретении, имеют значение Ki (константа ингибирования) не выше примерно 0,5 мкМ (500 нМ), или в некоторых воплощениях Ki не выше примерно 0,05 мкМ (50 нМ), или в еще других воплощениях Ki не выше примерно 0,010 мкМ (10 нМ) (и включая все их подинтервалы). Ki представляют собой кинетические переменные (по сравнению с физическими свойствами, такими как молекулярная масса, точки плавления и кипения и т.д.) и в связи с этим могут подлежать варьированию в относительно широких пределах, особенно в зависимости от методологии, используемой для определения этой величины. Таким образом, термин "примерно", используемый в данном документе, в связи со значениями Ki, относится к варьированию (т.е. плюс/минус значение), составляющему 50%.
Ингибитор БХЭ, полезный по настоящему изобретению, представляет собой соединение 9-амино-1,2,3,4-тетрагидроакридин, также известный как такрин (и его производные). См. Патент США 4816456. Такрин представляет собой ингибитор холинэстеразы центрального действия, одобренный FDA (Управление по контролю качества пищевых продуктов и лекарственных средств), для лечения болезни Альцгеймера. Он поставляется на рынок Sciele Pharma под торговым названием COGNEX. О типичных примерах производных такрина, которые могут быть подходящими для применения по настоящему изобретению, сообщают в Патенте США 4754050, как показано в следующей формуле:
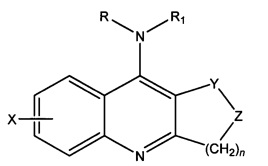
где n представляет собой 1, 2 или 3; X представляет собой водород, низший алкил, низший алкоки, галоген, гидрокси, нитро, трифторметил, NHCOR2, где R2 представляет собой низший алкил, или NR3R4, где R3 и R4 независимо представляют собой водород или низший алкил; R представляет собой водород или низший алкил; R1 представляет собой водород, низший алкил, ди-низший алкиламино-низший алкил, арил-низший алкил, диарил-низший алкил, фурил-низший алкил, тиенил-низший алкил, арил-низший алкил с кислородными мостиками, диарил-низший алкил с кислородными мостиками, фурил-низший алкил с кислородными мостиками или тиенил-низший алкил с кислородными мостиками; Y представляет собой С=O или CR5OH, где R5 представляет собой водород или низший алкил; Z представляет собой СН2 или C=CR6R7, где R6 и R7 независимо представляют собой водород или низший алкил; или Y и Z в своей совокупности представляют собой CR5=CH, где CR5 и СН соответствуют Y и Z соответственно; его оптический антипод или его фармацевтически приемлемая соль присоединения кислоты.
Конкретные производные такрина, охваченные данной формулой, включают следующее:
9-амино-3,4-дигидроакридин-1(2Н)-он; 9-амино-3,4-дигидро-6-метилакридин-1(2Н)-он; 9-амино-3,4-дигидро-6-метоксиакридин-1(2Н)-он; 9-амино-3,4-дигидро-6-фторакридин-1(2Н)-он; 9-амино-6-хлор-3,4-дигидроакридин-1(2Н)-он; 9-амино-7-хлор-3,4-дигидроакридин-1(2Н)-он; 9-амино-3,4-дигидро-6-трифторметилакридин-1(2Н)-он; 9-амино-3,4-дигидро-7-нитроакридин-1(2Н)-он; 7,9-диамино-3,4-дигидроакридин-1(2Н)-он; N-[9-амино-3,4-дигидро-1(2Н)-оксоакридин-7-ил]ацетамид; 3,4-дигидро-9-метиламиноакридин-1(2Н)-он; 3,4-дигидро-9-метиламино-7-нитроакридин-1(2Н)-он; 3,4-дигидро-9-пропиламиноакридин-1(2Н)-он; 3,4-дигидро-9-[2-(диметиламино)этил]аминоакридин-1(2Н)-он; 9-бензиламино-3,4-дигидроакридин-1(2Н)-он; 9-бензиламино-3,4-дигидро-6-метилакридин-1(2Н)-он; 9-бензиламино-3,4-дигидро-6-фторакридин-1(2Н)-он; 9-бензиламино-6-хлор-3,4-дигидроакридин-1(2Н)-он; 9-бензиламино-3,4-дигидро-6-фторметилакридин-1(2Н)-он; 3,4-дигидро-9-(2-метилбензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(3-метилбензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(4-метилбензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(2-метоксибензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(3-метоксибензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(4-метоксибензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(2-фторбензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(3-фторбензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(4-фторбензиламино)акридин-1(2Н)-он; 6-хлор-3,4-дигидро-9-(4-фторбензиламино)акридин-1(2Н)-он; 9-(2-хлорбензиламино)-3,4-дигидроакридин-1(2Н)-он; 9-(3-хлорбензиламино)-3,4-дигидроакридин-1(2Н)-он; 9-(4-хлорбензиламино)-3,4-дигидроакридин-1(2Н)-он; 3,4-дигидро-9-[(2,3,4,5,6-пентафторбензил)амино]акридин-1(2Н)-он; 3,4-дигидро-9-(2-трифторметилбензиламино)акридин-1(2Н)-он; 3,4-дигидро-6-фтор-9-(2-трифторметилбензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(3-трифторметилбензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-(4-трифторметилбензиламино)акридин-1(2Н)-он; 3,4-дигидро-9-фенетиламиноакридин-1(2Н)-он; 3,4-дигидро-9-(4,4-дифенилбутил)аминоакридин-1(2Н)-он; 3,4-дигидро-9-(4,4-дифенилбутиламино)-6-трифторметилакридин-1(2Н)-он; 9-[4,4-бис(3-фторфенил)бутиламино]-3,4-дигидроакридин-1(2Н)-он; 9-[4,4-бис(4-фторфенил)бутиламино]-3,4-дигидроакридин-1(2Н)-он; 3,4-дигидро-9-(3-феноксипропиламино)акридин-1(2Н)-он; 9-[2-[бис(4-фторфенил)метокси]этиламино-3,4-дигидроакридин-1(2Н)-он; 9-[4-(бензилокси)бензиламино]-3,4-дигидроакридин-1(2Н)-он; 3,4-дигидро-9-[(2-тиенил)метиламино]акридин-1(2Н)-он; 9-амино-2,3-дигидро-циклопента[b]хинолин-1-он; 9-амино-1,2,3,4-тетрагидроакридин-1-ол; 9-амино-6-хлор-1,2,3,4-тетрагидроакридин-1-ол; 9-амино-7-хлор-1,2,3,4-тетрагидроакридин-1-ол; 9-амино-6-метокси-1,2,3,4-тетрагидроакридин-1-ол; 9-амино-6-фтор-1,2,3,4-тетрагидроакридин-1-ол; 9-амино-1,2,3,4-тетрагидро-6-трифторметилакридин-1-ол; 9-метиламино-1,2,3,4-тетрагидроакридин-1-ол; 9-пропиламино-1,2,3,4-тетрагидроакридин-1-ол; 9-[2-(диметиламино)этил]амино-1,2,3,4-тетрагидроакридин-1-ол; 9-бензиламино-1,2,3,4-тетрагидроакридин-1-ол; 9-бензиламино-6-метил-1,2,3,4-тетрагидроакридин-1-ол; 9-бензиламино-6-фтор-1,2,3,4-тетрагидроакридин-1-ол; 9-бензиламино-6-хлор-1,2,3,4-тетрагидроакридин-1-ол; 9-бензиламино-1,2,3,4-тетрагидро-6-трифторметилакридин-1-ол; 9-(2-метилбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(3-метилбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(4-метилбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(2-метоксибензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(3-метоксибензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(4-метоксибензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(2-фторбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(3-фторбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(4-фторбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 6-хлор-9-(4-фторбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(2-хлорбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(3-хлорбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-(4-хлорбензиламино)-1,2,3,4-тетрагидроакридин-1-ол; 1,2,3,4-тетрагидро-9-(2-трифторметилбензил)аминоакридин-1-ол; 6-фтор-1,2,3,4-тетрагидро-9-(2-трифторметилбензиламино)акридин-1-ол; 1,2,3,4-тетрагидро-9-(3-трифторметилбензиламино)акридин-1-ол; 1,2,3,4-тетрагидро-9-(4-трифторметилбензиламино)акридин-1-ол; 9-[(2,3,4,5,6-пентафторбензил)амино]-1,2,3,4-тетрагидроакридин-1-ол; 9-фенетиламино-1,2,3,4-тетрагидроакридин-1-ол; 9-(4,4-дифенилбутил)амино-1,2,3,4-тетрагидроакридин-1-ол; 9-[4,4-бис(3-фторфенил)бутиламино]-1,2,3,4-тетрагидроакридин-1-ол; 9-[4,4-бис(4-фторфенил)бутиламино]-1,2,3,4-тетрагидроакридин-1-ол; 9-(3-феноксипропиламино)-1,2,3,4-тетрагидроакридин-1-ол; 9-[[2-[бис(4-фторфенил)метокси]этил]амино]-1,2,3,4-тетрагидроакридин-1-ол; 9-[4-(бензилокси)бензиламино]-1,2,3,4-тетрагидроакридин-1-ол; 9-[(2-тиенил)метиламино]-1,2,3,4-тетрагидроакридин-1-ол; 9-амино-3,4-дигидроакридин; 9-амино-1-метил-1,2,3,4-тетрагидроакридин-1-ол; 9-амино-3,4-дигидро-2-метиленакридин-1(2Н)-он; 9-амино-1,2,3,4-тетрагидро-циклопента[b]хинолин-1-ол; 2-(3-оксоциклогексен-1-ил)аминобензонитрил; и 4-хлор-2-(3-оксоциклогексен-1-ил)аминобензонитрил.
Другие ингибиторы бутирилхолинэстеразы, которые могут быть подходящими для применения по настоящему изобретению, включают димеры такрина, такие как этопропазин (т.е. N,N,N-диэтил-α-метил-10Н-фенотиазин-10-этанамин; 10-(2-диэтиламино-2-метилэтил)фенотиазин; или фенопропазин), и его производные. См., например, Патенты США 2607773 и 4833138. Этопропазин, хлористоводородная соль, был одобрен FDA для применения при лечении болезни Паркинсона.
Еще другие ингибиторы бутирилхолинэстеразы включают гибриды такрина и (-)-гуперзина А (который представляет собой энантиомерный алкалоид типа ликодина, выделенный из плауна булавовидного Huperzia serrata вида Lycopodium, Huperziaceae). Примеры гибридов Гуперзин А - такрин известны из уровня техники, как соединения 5а, 5b и 5с, и Гуприн X. Их соответствующие химические названия выглядят следующим образом:
((9Е)-N1-(7-(1,2,3,4-тетрагидроакридин-9-иламино)гептил)-9-этилиден-4,4,7-триметилбицикло[3.3.1]нон-6-ен-1,3-диамин) (5а); ((9E)-N1-(7-(1,2,3,4-тетрагидроакридин-9-иламино)гептил)-9-этилиден-47-метилбицикло[3.3.1]нон-6-ен-1,3-диамин) (5b); ((9Е)-N1-(7-(1,2,3,4-тетрагидроакридин-9-иламино)гептиламино)-9-этилиден-3-метилбицикло[3.3.1]нон-3-ен-1-метиловый эфир карбоновой кислоты) (5с); и (1S)-7-хлор-15-этил-10-азатетрацикло[11.3.1.0^{2,11}.0^{4,9}]гептадека-2(11),3,5,7,9,14-гексаен-3-амин) (Гуприн X). Способы синтеза этих соединений раскрыты в Gemma, et al., J. Med. Chem. 49(11): 3421-25 (2006) (5a, 5b и 5c) и Camps, et al., Mol. Pharmacol. 57: 409-17 (2000) (Гуприн Х).
Концентрация БХЭ обычно варьирует в интервале от примерно 5 мкМ до примерно 500 мМ (т.е. 5×108 нМ) и в некоторых воплощениях варьирует в интервале от примерно 0,5 мкМ до примерно 50 мМ, и в еще других воплощениях - от примерно 0,1 мкМ до примерно 10 мМ. Все поддиапазоны в пределах данных интервалов также рассматривают. Как в случае значений Ki, термин "примерно", используемый в связи со всеми значениями концентраций, раскрытыми в данном документе, относится к варьированию (плюс/минус значение), составляющему 50%.
Стабилизирующий агент может также включать ингибитор другого типа сывороточной эстеразы, и в частности ингибитор другой В-эстеразы (членом которой является БХЭ). Данные эстеразы включают ацетилхолинэстеразу (АХЭ) (ЕС 3.1.1.7) и неспецифическую карбоксилэстеразу (ЕС 3.1.1.1.). Ингибиторы АХЭ действуют на холинэстеразу и подавляют осуществляемое ею разрушение ацетилхолина, который функционирует в организме в качестве нейромедиатора. Некоторые ингибиторы БХЭ, такие как такрин и гуперазин А, как известно, подавляют также ацетилхолинэстеразу. Такрин имеет описанную в литературе Ki для АХЭ, равную 6,9 нМ (Bencharit, et al., Chem. Biol. 10: 341-9 (2003)). Гуперзин А имеет описанную в литературе Ki для АХЭ, равную 47 нМ (Gemma, et al., J. Med. Chem. 49: 3421-5 (2006)). При условии, что БХЭ составляет значительную долю общей активности эстераз в человеческой сыворотке (т.е. примерно 5 мг/л БХЭ, по сравнению с 0,008 мг/г для АХЭ), включение ингибиторов в пробирку для сбора крови является возможным.
Ki ингибиторов АХЭ, подходящих для применения по настоящему изобретению, обычно составляют примерно 500 нМ или меньше, и в других воплощениях, менее чем примерно 400 нМ, 300 нМ, 200 нМ, 100 нМ, 50 нМ или 10 нМ. Как описано в данном документе, значения Ki для данного ингибитора АХЭ можно определять согласно стандартным методикам анализа.
Таким образом, другие ингибиторы АХЭ, которые могут быть полезными по настоящему изобретению, включают следующее:
гуприн X ((1S)-7-хлор-15-этил-10-азатетрацикло[11.3.1.0^{2,11}.0^{4,9}]гептадека-2(11),3,5,7,9,14-гексаен-3-амин) (Ki 0,026 нМ); димер такрина 4а (метилбис[3-(1,2,3,4-тетрагидроакридин-9-иламино)пролил]амин) (Ki 0,06 нМ); димер такрина 4d (2-{бис[3-(1,2,3,4-тетрагидроакридин-9-иламино)пролил]амино}этан-1-ол ⎜ N,N-Бис[3-[(1,2,3,4-тетрагидроакридин-9-ил)амино]пролил]-N-гидроксиэтиламин) (Ki 0,65 нМ); производное такрина 2 (6,8-дихлор-1,2,3,4-тетрагидроакридин-9-амин) (Ki 1,0 нМ); димер такрина 3b (гомодимерный аналог такрина 3b ⎜ N-[7-(1,2,3,4-тетрагидроакридин-9-иламино)гептил]-1,2,3,4-тетрагидроакридин-9-амин ⎜ гомобивалентное соединение такрина 3а) (Ki 1,3 нМ); димер такрина 4с (N,N-бис[3-[(1,2,3,4-тетрагидроакридин-9-ил)амино]пропил]-N-аллиламин ⎜ проп-2-ен-1-илбис[3-(1,2,3,4-тетрагидроакридин-9-иламино)пропил]амин) (Ki 1,6 нм); димер такрина 3с (гомодимерный аналог такрина 3с ⎜ N-[8-(1,2,3,4-тетрагидроакридин-9-иламино)октил]-1,2,3,4-тетрагидроакридин-9-амин) (Ki 1,9 нМ); димер такрина 4b (N,N-Бис[3-[(1,2,3,4-тетрагидроакридин-9-ил)амино]пропил]-N-этиламин ⎜ этилбис[3-(1,2,3,4-тетрагидроакридин-9-иламино)пропил]амин) (Ki 2,8 нМ); гетеробивалентное соединение такрина 3с (N-{7-[(6,8-дихлор-1,2,3,4-тетрагидроакридин-9-ил)амино]гептил}-1,2,3,4-тетрагидроакридин-9-амин) (Ki 6,0 нМ); гибрид гуперзин А-такрин 5с ((9Е)-7-(7-(1,2,3,4-тетрагидроакридин-9-иламино)гептиламино)-9-этилиден-3-метилбицикло[3.3.1]нон-3-ен-1-метиловый эфир карбоновой кислоты ⎜ метил (1S)-9-этилиден-3-метил-7-{[7-(1,2,3,4-тетрагидроакридин-9-иламино)гептил]амино}бицикло[3.3.1]нон-3-ен-1-карбоксилат) (Ki 6,4 нМ); димер такрина 4j (N-метил-N-(1,2,3,4-тетрагидроакридин-9-ил)-N-[3-(1,2,3,4-тетрагидроакридин-9-илсульфанил)пропил]-1,3-пропандиамин ⎜ метил[3-(1,2,3,4-тетрагидроакридин-9-иламино)пропил][3-(1,2,3,4-тетрагидроакридин-9-илсульфанил)пропил]амин) (Ki 9,1 нМ); гибрид гуперзин А-такрин 5b ((9Е)-N1-(7-(1,2,3,4-тетрагидроакридин-9-иламино)гептил)-9-этилиден-7-метилбициклобицикло[3.3.1]нон-6-ен-1,3-диамин ⎜ N-(7-{[(1S)-1-амино-9-этилиден-7-метилбицикло[3.3.1]нон-6-ен-3-ил]амино}гептил)-1,2,3,4-тетрагидроакридин-9-амин) (Ki 15,70 нМ); гибрид гуперзин А-такрин 5а (9Е)-N1-(7-(1,2,3,4-тетрагидроакридин-9-иламино)гептил)-9-этилиден-4,4,7-триметилбицикло[3.3.1]нон-6-ен-1,3-диамин ⎜ N-(7-{[(1S)-1-амино-9-этилиден-4,4,7-триметилбицикло[3.3.1]нон-6-ен-3-ил]амино}гептил)-1,2,3,4-тетрагидроакридин-9-амин) (Ki 16,50 нМ); АР2238 3-(4-{[бензил(метил)амино]метил}-фенил)-6,7-диметокси-2Н-2-хроменон ⎜ 3-(4-{[бензил(метил)амино]метил}фенил)-6,7-диметокси-2Н-хромен-2-он) (Ki 21,70 нМ); димер такрина 4i (N-(1,2,3,4-тетрагидроакридин-9-ил)-N-[8-(1,2,3,4-тетрагидроакридин-9-ил)окт-1-ил]амин ⎜ N-[8-(1,2,3,4-тетрагидроакридин-9-ил)октил]-1,2,3,4-тетрагидроакридин-9-амин) (Ki 30 нМ); гетеробивалентное соединение такрина 3г (6,8-дихлор-N-[7-(1,2,3,4-тетрагидроакридин-9-илсулфанил)гептил]-1,2,3,4-тетрагидроакридин-9-амин) (Ki 41 нМ); димер такрина 4m (N-[3-(1,2,3,4-тетрагидроакридин-9-иламино)пропил]-N-[4-(1,2,3,4-тетрагидроакридин-9-илсульфанил)бутил]ацетамид) (Ki 47 нМ); 9-амино-6-хлор-2-метоксиакридин (6-хлор-2-метоксиакридин-9-амин) (Ki 49 нМ); димер такрина 4k (N-[3-(1,2,3,4-тетрагидроакридин-9-иламино)пропил]-N-[3-(1,2,3,4-тетрагидроакридин-9-илсульфанил)пропил]ацетамид) (Ki 50 нМ); гетеробивалентное соединение такрина 3i (N-[6-(1,2,3,4-тетрагидроакридин-9-илсульфанил)гексил]-1,2,3,4-тетрагидроакридин-9-амин) (Ki 100 нМ); гомобивалентное соединение такрина 3b (6,8-дихлор-N-{7-[(6,8-дихлор-1,2,3,4-тетрагидроакридин-9-ил)амино]гептил}-1,2,3,4-тетрагидроакридин-9-амин) (Ki 150 нМ); димер такрина 3а (N-[5-(1,2,3,4-тетрагидроакридин-9-иламино)пентил]-1,2,3,4-тетрагидроакридин-9-амин) (Ki 210 нМ); димер такрина 4g (N-[8-(1,2,3,4-тетрагидроакридин-9-илсульфанил)октил]-1,2,3,4-тетрагидроакридин-9-амин) (Ki 250 нМ); гетеробивалентное соединение такрина 3f (N-{7-[(6,8-дихлор-1,2,3,4-тетрагидроакридин-9-ил)сульфанил]гептил}-1,2,3,4-тетрагидроакридин-9-амин) (Ki 290 нМ); соединение на основе 1,2-диона, 8 (1,2-дигидронафталин-1,2-дион ⎜ 1,2-нафтохинон) (Ki 320 нМ); димер такрина 4f (N-[7-(1,2,3,4-тетрагидроакридин-9-илсульфанил)гептил]-1,2,3,4-тетрагидроакридин-9-амин ⎜ гетеробивалентное соединение такрина 3е) (Ki 340 нМ); и 6,9-диамино-2-этоксиакридин (7-этоксиакридин-3,9-диамин) (Ki 490 нМ). О значениях Ki, раскрытых в данном документе для вышеупомянутых ингибиторов АХЭ, сообщают в Gemma, et al., J. Med. Chem. 49: 3421-5 (2006); Campiani, et al., J. Med. Chem. 48: 1919-29 (2005); Wong, et al., J. Am. Chem. Soc. 125: 363-73 (2003); Savini, et al., Bioorg. Med. Chem. Lett. 11: 1779-82 (2001); Piazzi, et al., J. Med. Chem. 46: 2279-82 (2003); Bencharit, supra.; и Hyatt, et al., J. Med. Chem. 50: 5727-34 (2007).
Даже дополнительные примеры ингибиторов АХЭ, которые могут быть полезными по настоящему изобретению, включают следующее: органофосфаты (например, метрифонат, эхотиофат, диизопропилфторфосфаты, циклозарин, диметоат, зарин, зоман, табун, VX, VE, VG, VM, диазинон, малатион и паратион); карбаматы (например, физостигмин, неостигмин, пиридостигмин, амбенониум, демаркариум, ривастигмин, алдикарб, бендиокарб, буфенкарб, карбарил, карбендазим, карбетамид, карбофуран, хлорбуфам, хлоропрофам, этиофенкарб, форметанат, метиокарб, метомил, оксамил, фенмедифам, пинмикарб, пиримикарб, пропамокарб, профам и пропоксур); производные пенантрена (например, галантамин); пиперидины (например, донепезил (Е2020) (Ki 2,9 нМ); эдрофониум; и природные соединения (например, галантамин и онхидал).
Так как некоторые ингибиторы БХЭ также проявляют возможную ингибирующую активность по отношению к АХЭ, воплощения настоящего изобретения могут включать единственный ингибитор эстеразы, который обладает как ингибирующей активностью по отношению к БХЭ, так и ингибирующей способностью по отношению к АХЭ.
Концентрация дополнительного ингибитора эстеразы сыворотки, который может находиться в устройстве для сбора крови, обычно варьирует в интервале от примерно 0,1 мкМ до примерно 70 мМ и в некоторых воплощениях от примерно 1 мМ до примерно 7 мМ.
Стабилизирующий агент может также включать ингибитор протеаз. Ингибиторы протеаз, полезные по настоящему изобретению, проявляют ингибирующую активность относительно одного или более чем одного класса протеаз, включая, например, сериновые протеазы, эндопротеазы, экзопептидазы и дипептидилпептидазы. Таким образом, устройство может содержать смесь двух или более чем двух таких ингибиторов, включая, например, ингибитор сериновой протеазы и ингибитор экзопептидазы, ингибитор сериновой протеазы и ингибитор дипептидилпептидазы, ингибитор экзопептидазы и ингибитор дипептидилпептидазы, и ингибитор сериновой протеазы, ингибитор экзопептидазы и ингибитор дипептидилпептидазы. См., например, Патент США 7309468, с Stevens, et al.
Типичные примеры ингибиторов сериновых протеаз включают антипэйн (antipain), апротинин, антитромбин, химостатин, DFP, эластатинал, APMSF, фенилметилсульфонилфторид (PMSF), AEBSF, TLCK, TPCK, лейпептин, ингибитор трипсина и трипсина соевых бобов. Концентрации ингибиторов сериновых протеаз обычно варьируют в интервале от примерно 0,1 мкМ до примерно 100 мкМ.
Типичные примеры экзопептидаз, которые могут быть полезными по настоящему изобретению, включают амастатин, бестатин, дипротин А и дипротин Б. Концентрации экзопептидаз обычно варьируют в интервале от примерно 0,01 мМ до примерно 1 мМ.
Активность дипептидилпептидаз (которая включает DPP-IV (дипептидилпепдидаза IV) и DPP-IV-подобную активности), присутствующая в кровотоке, является высокоспецифичной в высвобождении дипептидов от N-концевой области биологически активных пептидов с пролином или аланином в предпоследнем положении N-концевой последовательности пептидного субстрата. Глюкозозависимые инсулинотропные полипептиды GIP1-42 и GIP-I7-36 делают возможным секрецию инсулина из поджелудочной железы в ответ на глюкозу (инкретины), являются субстратами DPP-IV. Фермент DPP-IV высвобождает дипептиды тирозинил-аланин и гистидил-аланин соответственно из N-концов данных пептидов как in vitro, так и in vivo. Mentlein, et al., Eur. J. Biochem. 214, 829 (1993). Типичные примеры ингибиторов дипептидилпептидазы IV (DPP-IV), которые могут быть полезными по настоящему изобретению, включают вилдаглиптин, ситаглиптин, саксаглиптин, линаглиптин и алоглиптин. Другие ингибиторы DPP-IV включают дипептидные соединения, образованные из аминокислоты, такой как изолейцин, Asn, Asp, Glu, His, Pro и Val, и группы тиазолидина или пирролидина, и стериоизомеры, например их L-трео- и L-алло- формы, и их неорганические соли (например, фосфат, сульфат, ацетат, тартрат, сукцинат и фумарат). Конкретные примеры соединений дипептидов включают L-трео-изолейцилтиазолидид, L-алло-изолейцилтиазолидид, L-трео-изолейцилпирролидид и L-алло-изолейцилпирролидид. Концентрации ингибитора дипептидилпептидазы обычно варьируют в интервале от примерно 0,01 мМ до примерно 1 мМ.
Стабилизирующий агент может дополнительно содержать ингибиторы других классов протеаз. Таким образом, в еще одних воплощениях устройства для сбора крови могут также содержать ингибитор цистеиновой протеазы (например, IAA (индолилуксусная кислота) и Е-64), сериновой/цистеиновой протеазы (например, лейпептин, TPCK, PLCK-HCL, 2-гептанон-HCL и антипэйн-HCl), аспарагиновой протеазы (например, пепстатин и VdLPFFVdL), металлопротеазы (например, ЭДТА, бестатин, 1,10-фенантролин и фосфорамодон), тиоловой протеазы, аспарагиновой протеазы/кальпаина (например, пепстатин, N-ацетил-лей-лей-норлейцинал и N-ацетил-лей-лей-метионинал), каспазы, эндопептидазы (например, α2-макроглобулин (называется универсальным ингибитором эндопептидазы), α1-анти-трипсин и тиорфан), и комбинации двух или более чем двух из них. Дополнительные примеры ингибиторов протеаз включают ингибитор трипсина соевых бобов или лимской фасоли, ингибитор протеаз поджелудочной железы, овостатин яичного белка и цистатин яичного белка. Специалисты в области протеомики понимают, что данный ингибитор может проявлять ингибирующую активность относительно одной или более чем одной протеазы того же самого класса протеаз, а также ингибирующую активность относительно одной или более чем одной протеазы разных классов протеаз. Бестатин и амастатин, например, проявляют ингибирующую активность относительно металлопротеаз, а также экзопептидаз.
Воплощения настоящего изобретения, в которых используется множество стабилизирующих агентов, например, дополнительно к ингибитору LysoPLA, ингибитор протеазы, или ингибитор БХЭ и ингибитор протеазы) также называют в данном документе смесью стабилизирующих агентов.
Стабилизирующий агент может находиться в любой подходящей форме, включая жидкости (например, растворы и суспензии) и твердые формы (например, пеллет, таблетка, капсула, высушенный распылением материал, порошок, частица, кристаллы и лиофилизированный материал) и полутвердые формы (например, гель). Лиофилизация может быть особенно полезной тем, что она обеспечивает хорошую стабильность (например, с точки зрения максимального увеличения срока хранения стабилизирующего агента) и также дает возможность для последующей стерилизации. Например, стабилизирующий агент можно вводить в контейнер устройства в форме жидкой композиции и затем лиофилизировать стандартными методиками. Лиофильная сушка, например, включает в себя замораживание жидкой композиции и затем медленное нагревание после замораживания по мере применения в то же самое время вакуума, так что в устройстве для сбора образцов остается лиофилизированный порошок. К жидкой композиции перед лиофилизацией можно добавлять разные добавки, такие как PVP (поливинилпирролидон) или трегалоза, для облегчения грануляции стабилизирующего агента и восстановления лиофилизированных агентов при контакте с кровью. Можно также применять сушку в вакууме после добавления жидкой композиции. В других воплощениях стабилизирующий агент превращается в жидкий или твердый аэрозоль и распыляется на одну или более чем одну поверхность внутреннего пространства контейнера. Заключение в капсулу или приготовление стабилизирующего агента в форме таблетки защищает его от воздействия света и предотвращает от других нежелательных взаимодействий между ингибиторами и другими элементами в контейнере. Материалы для включения в капсулу и эксципиенты, полезные при получении таблеток и капсул, которые растворяются при сборе образцов, хорошо известны из уровня техники.
В дополнение к размещению в резервуаре, стабилизирующий агент может быть расположен на любой поверхности устройства для сбора образцов, которая соприкасается с собранной кровью. Например, стабилизирующий агент может быть также расположен на пробках и герметичных крышках для закрывания устройства или на механических или других вкладышах, помещенных внутрь устройства.
В дополнение к стабилизирующему агенту устройство по настоящему изобретению может также содержать среды-носители (например, вода или спирт), стабилизирующие или восстанавливающие среды (например, поливинилпирролидон, трегалоза, маннит и т.д.) и/или одну или более чем одну добавку для обработки биологического образца. Типичные добавки включают фенол, смеси фенол/хлороформ, спирты, альдегиды, кетоны, органические кислоты, соли органических кислот, соли галогенидов с щелочными металлами, органические хелатирующие агенты, флуоресцентные красители, антитела, связующие агенты, антикоагулянты, такие как цитрат натрия, гепарин, ЭДТА и ее соли (например, ЭДТА калия), антиоксиданты, восстанавливающие агенты и буферизующие агенты. Предпочтительно, носитель и добавки не разрушают белки. Когда ингибиторы находятся в форме таблеток, при желании можно включать фармацевтические вещества, дезинтегрирующие таблетки, которые известны специалистам в данной области.
Полезный способ изготовления для устройства по настоящему изобретению включает получение контейнера для сбора образцов, такого как пробирка; добавление в контейнер стабилизирующего агента (например, ингибитор LysoPLA и ингибитор протеазы); лиофилизацию ингибиторов; создание вакуума в контейнере; и стерилизацию контейнера. В контейнер, при желании, может быть добавлен разделяющий элемент. Пример подходящего способа лиофилизации/создания вакуума выглядит следующим образом: контейнер замораживают при температуре примерно - 40°С при давлении, составляющем примерно 760 мм примерно в течение 6-8 часов; контейнер сушат, когда температура поднимается от - 40°С до примерно 25°С, при давлении примерно 0,05 мм, в течение 8-10 часов; и в контейнере затем создают вакуум при температуре примерно 25°С и при давлении примерно 120 мм в течение примерно 0,1 часа. Предпочтительно, методику стерилизации осуществляют с использованием излучения кобальта-60.
Цельную кровь или ее компонент(ты) могут быть собраны у пациента непосредственно в устройство для сбора крови, без каких-либо промежуточных стадий процесса. Обнаружили, что сбор цельной крови непосредственно у пациента и введение образца непосредственно в устройство, содержащее стабилизирующий агент, в значительной степени предотвращает распад и/или фрагментацию белков, которая иным образом происходит, когда образец хранят перед объединением его со стабилизирующим агентом. Способ по настоящему изобретению является полезным, как с открытыми устройствами для сбора образцов, так и с закрытыми устройствами для сбора образцов, когда отверстие закрыто закрывающими средствами.
В предпочтительном воплощении устройство для сбора образцов представляет собой пробирку, которую применяют для сбора образца цельной крови непосредственно у пациента, для стабилизации белков сразу же в момент сбора образцов. Пробирка для сбора образцов может представлять собой вакуумную систему для сбора крови. В качестве альтернативы, пробирка может представлять собой частично-вакуумную или невакуумную систему для сбора крови. Подходящим примером вакуумной системы является закрытая пробирка. Сбор образцов вручную с помощью шприца представляет собой подходящий пример как частично вакуумной, так и невакуумной системы. Невакуумные системы могут также включать автоматические системы сбора образцов. Вакуумные системы особенно предпочтительны.
Устройства для сбора крови по настоящему изобретению в частности подходят для стабилизации белков, которые содержат боковые цепи сложных эфиров алифатического ряда, таких как грелин, и в воплощениях, которые включают ингибитор протеазы, дополнительные белковые биомаркеры заболевания, например GLP-1, GIP и глюкагон, которые также являются биомаркерами нарушений метаболизма, таких как диабет. Таким образом, устройства для сбора образцов можно использовать для обеспечения надежных стандартов, при этом для облегчения планирования анализов, таких как ELISA (твердофазный иммуноферментный анализ), что создаст возможность для обнаружения данных белков в интервале 10-9-10-11 М, который включает уровни данных белков в кровотоке у здоровых индивидуумов, а также терапевтические уровни. Таким образом, в дополнение к способам диагностирования заболевания, такого как нарушение метаболизма (где повышенные уровни маркера относительно контроля (такого как установленные медицинские критерии и/или интервал концентраций, полученный для статистически значимой выборки доноров без патологии), свидетельствуют о наличии заболевания), они могут обеспечить способы контролирования терапии у пациента, страдающего от заболеваний, таких как нарушения метаболизма, где восстановление нормы (или тенденция к восстановлению нормы) количества данных белков свидетельствует об успешной терапии.
Устройства для сбора крови по настоящему изобретению можно также использовать в целях сбора и хранения крови у пациентов, которые принимают внутрь пролекарства, которые ацилированы (также называются в данном документе пролекарствами, несущими боковые цепи сложных эфиров алифатического ряда), в терапевтических целях, например, как часть схемы лечения заболевания или состояния воспаления. Под пролекарством обычно понимают активный лекарственный агент, который на самом деле является формой предшественника лекарственного средства, которая терапевтически неактивна или в значительной степени менее активна, чем активная группировка агента (которая может быть метаболитом). При введении, таком как пероральный прием внутрь, многие пролекарства превращаются в активное лекарственное средство/метаболит посредством расщепления сложноэфирной связи посредством внутренних лизофосфолипаз. Например, эналаприл превращается в активный метаболит эналаприлат, а пролекарство валацикловир превращается в активное лекарственное средство/метаболит ацикловир. Героин деацетилируется в активное лекарственное средство/метаболит морфин. В клинических установках и в определенных клинических испытаниях полезно следить за уровнями пролекарства в крови, а также активного метаболита у пациентов со временем, например, с одной или более чем одной точки зрения безопасности, эффективности, биологической активности и биоэквивалентности.
Например, в исследованиях биологической активности, в которых оценивают скорость и степень, до которой активный ингредиент или активная группировка абсорбируется из готового лекарственного средства и становится доступной в месте действия, рекомендуется определять концентрацию и активность как исходного лекарственного средства, так и метаболита. В исследованиях биоэквивалентности (в которых изучают степень различия в скорости и степени, до которой ингредиент или активная группировка в фармацевтических эквивалентах или альтернативных вариантах становится доступной в месте действия лекарственного средства, при введении в той же самой молярной дозе в похожих условиях) обычно рекомендуется оценивание исходной (пролекарство) формы (за исключением ситуаций, в которых уровни исходного лекарственного средства являются слишком низкими, чтобы позволить надежное аналитическое измерение в крови, сыворотке или плазме в течение адекватного периода времени, или когда метаболит значительно способствует безопасности и/или эффективности, при этом измеряют концентрацию и активность как пролекарства, так и метаболита).
Качественный и количественный анализ крови, собранной у пациентов, которые проходили такую терапию (который включает пациентов, которые в настоящее время проходят такую терапию) с использованием устройств для сбора крови по изобретению увеличивает точность любого такого анализа, поскольку распад пролекарства ex vivo, катализируемый эстеразами, в собранной крови ингибируется в течение хранения. Обработку образцов крови, например, экстракцию плазмы из собранной крови, и разделение пролекарства и активного метаболита, и последующий анализ данных объектов можно проводить согласно стандартным методикам. Например, пролекарство и активный метаболит можно разделять с помощью обращенно-фазовой ВЭЖХ (высокоэффективная жидкостная хроматография). Обнаружение присутствия или относительных количеств пролекарства и активного метаболита можно проводить согласно стандартным методикам, таким как масс-спектрометрия, с последующим анализом результатов, например посредством взвешенной квадратической или линейной регрессии. См., например, Wiltshire, et al., J. Chromatogr. B745: 373-88 (2000) (и ссылки, приведенные в ней). Контроли, с которыми можно сравнивать измеренные значения, включают калибровочные образцы и образцы контроля качества (указанные у Wiltshire, выше, как калибровочные кривые).
Сейчас настоящее изобретение будет описано путем ссылки на следующие неограничивающие примеры. Если особо не указано иное, все доли и проценты представлены в расчете на массу.
Пример 1 - Сравнительная стабильность грелина в образцах плазмы
Кровь собирали в 4 отдельные пробирки, содержащие 1) ингибитор LysoPLA метиларахидонилфторфосфонат (MAFP), ЭДТА, ингибитор эстеразы, такрин и ингибиторы протеаз, L-трео-изолейцилтиазолидид, бестатин и лейпептин (стабилизирующий агент по изобретению «ISA», обозначаемый на фигуре как ▲); 2) другой стабилизирующий агент по изобретению, который включает антикоагулянт ЭДТА и MAFP (обозначаемый на фигуре как х); 3) ЭДТА и ингибитор эстеразы, и ингибиторы протеаз (сравнительный стабилизирующий агент «CSA», обозначаемый на фигуре, как ♦); только ЭДТА (обозначаемый на фигуре как ■), с последующим введением 1пкг/мкл ацил-грелина. Во все четыре пробирки кровь брали непосредственно у одного и того же объекта для данного эксперимента и обрабатывали идентично. Данные, проиллюстрированные на Фиг. 2, ясно показывают, что в пробирках 3 и 4 ацил-грелин распадался со временем. Однако две пробирки (№№1 и 2), содержащие MAFP, показывали стабилизацию в течение 30 ч периода инкубирования плазмы. Пробирка 2, которая содержала MAFP и ЭДТА, превосходила пробирку 1, которая содержала ингибитор эстеразы и ингибиторы протеаз.
В эксперименте с разделением у объекта брали кровь натощак в пробирки ЭДТА и ЭДТА + MAFP. Конечная концентрация MAFP в пробирке в данном эксперименте составляла 0,1 мМ. Плазму из каждой пробирки разделяли на два отдельных пузырька. В один пузырек вводили 1 пкг/мкл грелина, в то время как в другой не вводили. Плазму с введением и без введения грелина, как из пробирки «ЭДТА», так и «ЭДТА + MAFP», инкубировали при комнатной температуре в течение 30 часов. На Фиг. 3 показаны измеренные уровни грелина в конкретные временные интервалы. Данные ясно показывают более высокую стабильность ацил-грелина в пробирках, содержащих MAFP.
Все публикации патентов и публикации непатентов свидетельствуют об уровне компетентности специалистов в данной области, к которой принадлежит это изобретение. Все эти публикации включены в данный документ путем ссылки в той же самой степени, как если бы каждая индивидуальная публикация конкретно и индивидуально была показана как включенная путем ссылки.
Хотя изобретение в данном документе было описано со ссылкой на определенные воплощения, следует понимать, что данные воплощения только иллюстрируют принципы и применения настоящего изобретения. Поэтому следует понимать, что могут быть сделаны многочисленные модификации относительно иллюстративных воплощений и что могут быть придуманы другие мероприятия, без отступления от сущности и объема настоящего изобретения, как определено прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 9-АМИНОАКРИДИНА ИЛИ ИХ СОЛИ С ОРГАНИЧЕСКИМИ ИЛИ НЕОРГАНИЧЕСКИМИ КИСЛОТАМИ, ПРОЯВЛЯЮЩИЕ ПСИХОТРОПНУЮ, АНТИАМНЕСТИЧЕСКУЮ И ЛИПИДРЕГУЛИРУЮЩУЮ АКТИВНОСТЬ | 1991 |
|
RU2024509C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ КАРБОНИЛСОДЕРЖАЩЕГО ПРОИЗВОДНОГО АКРИДИНА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ КИСЛОТНО-АДДИТИВНОЙ СОЛИ | 1991 |
|
RU2069659C1 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОАКРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ПРОИЗВОДНЫЕ ТЕТРАГИДРОАКРИДИНОНА, ПРОИЗВОДНОЕ ДИГИДРОБЕНЗОКСАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ СПОСОБНОСТЬ ОБЛЕГЧЕНИЯ ИЛИ УСТРАНЕНИЯ ДИСФУНКЦИИ ПАМЯТИ | 1992 |
|
RU2083564C1 |
| Мультифункциональные конъюгаты ипидакрина с 2-замещенными фенолами, способ их получения и применение для лечения нейродегенеративных заболеваний | 2023 |
|
RU2836319C1 |
| ПРОИЗВОДНЫЕ 4-АМИНОПИРИДИНА | 1992 |
|
RU2039058C1 |
| Мультифункциональные конъюгаты такрина и его аналогов с производными 1,2,4-тиадиазола, способ их синтеза и применение для лечения нейродегенеративных заболеваний | 2017 |
|
RU2675794C1 |
| ПРИМЕНЕНИЕ АДАМАНТАНСОДЕРЖАЩИХ ИНДОЛОВ И ИХ ГИДРОХЛОРИДОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗ И БЛОКАТОРОВ NMDA-РЕЦЕПТОРОВ | 2016 |
|
RU2621348C1 |
| ПРОИЗВОДНЫЕ ТАКРИНА В КАЧЕСТВЕ ИНГИБИТОРОВ АЦЕТИЛХОЛИНЭСТЕРАЗЫ | 2004 |
|
RU2402545C2 |
| 4'-АЗИДОНУКЛЕОЗИДЫ, АКТИВНЫЕ В ОТНОШЕНИИ HCV | 2011 |
|
RU2556991C2 |
| ПРИМЕНЕНИЕ ОБРАТНЫХ АГОНИСТОВ ИЛИ АНТАГОНИСТОВ РЕЦЕПТОРА ГРЕЛИНА ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ СНА | 2013 |
|
RU2600895C2 |






Группа изобретений относится к области взятия и стабилизации цельной крови или ее компонентов. Устройство для сбора и стабилизации цельной крови или ее компонента содержит первый конец и второй конец и по меньшей мере одну внутреннюю стенку, образующую резервуар. При этом резервуар включает стабилизирующий агент, содержащий ингибитор лизофосфолипазы (LysoPLA), и антикоагулянт. Также раскрывается способ сбора и стабилизации цельной крови или ее компонента, способ диагностирования нарушения метаболизма пациента, способ обнаружения наличия пролекарства и/или его активного метаболита в крови или ее компоненте, способ контролирования лечения пациента с нарушением метаболизма, а также способ определения количества пролекарства и/или его активного метаболита в крови или ее компоненте. Группа изобретений обеспечивает относительно более длительную стабильность крови или ее компонента при хранении для проведения достоверного клинического тестирования. 6 н. и 18 з.п. ф-лы, 3 ил.
1. Устройство для сбора и стабилизации цельной крови или ее компонента, содержащее первый конец и второй конец и по меньшей мере одну внутреннюю стенку, образующую резервуар, где резервуар включает стабилизирующий агент, содержащий ингибитор лизофосфолипазы (LysoPLA), который стабилизирует ацилированные белки и ацилированные пептиды, которые могут присутствовать в крови, причем устройство дополнительно содержит антикоагулянт.
2. Устройство по п. 1, которое представляет собой пробирку.
3. Устройство по п. 2, где пробирка дополнительно содержит крышку, прокалываемую иглой для подачи крови в резервуар.
4. Устройство по п. 3, где пробирка представляет собой по меньшей мере частично вакуумную пробирку.
5. Устройство по п. 4, где пробирка является стерильной.
6. Устройство по п. 1, где внутренняя стенка содержит пластик или стекло.
7. Устройство по п. 1, где резервуар содержит разделяющий элемент.
8. Устройство по любому из пп. 1-7, где ингибитор LysoPLA представляет собой метиларахидонилфторфосфонат (MAFP).
9. Устройство по любому из пп. 1-7, где ингибитор LysoPLA выбран из группы, состоящей из броменоллактона, этилоктилфосфонофторидата, изопропилдодецилфосфонофторидата, н-додецил-бензодиоксафосфорин-2-оксида, броменоллактона, пальмитилтрифторметилкетона и пальмитоилкарнитина.
10. Устройство по любому из пп. 1-7, где стабилизирующий агент дополнительно содержит ингибитор бутилхолинэстеразы (БХЭ), ингибитор ацетилхолинэстеразы (АХЭ) или их комбинацию.
11. Устройство по п. 10, где ингибитор БХЭ представляет собой такрин или его производное.
12. Устройство по п. 1, где стабилизирующий агент дополнительно содержит ингибитор протеазы.
13. Устройство по п. 12, где ингибитор протеазы представляет собой ингибитор сериновой протеазы, ингибитор эндопротеазы, ингибитор экзопептидазы, ингибитор дипептидилпептидазы или комбинацию двух или более чем двух из них.
14. Устройство по п. 1, где стабилизирующий агент лиофилизирован.
15. Устройство по п. 1, где антикоагулянтом является ЭДТА (этилендиаминтетрауксусная кислота) или ее соль или гепарин.
16. Устройство по п. 15, где антикоагулянт наносят или подвергают распылительной сушке по меньшей мере на участке внутренней стенки.
17. Устройство по любому из пп. 1-7, где стабилизирующий агент исключает ингибитор эстеразы.
18. Способ сбора и стабилизации цельной крови или ее компонента, при котором кровь у пациента отбирают в устройство по п. 1.
19. Способ по п. 18, при котором кровь или ее компонент получают у больного диабетом, а компонентом являются эритроцитные концентраты, тромбоцитные концентраты, лейкоцитарные концентраты, плазма, сыворотка и комбинации двух или более чем двух из них.
20. Способ по п. 18 или 19, при котором компонентом крови является плазма.
21. Способ диагностирования нарушения метаболизма пациента, при котором оценивают количество грелина в образце крови или ее компонента, где кровь у пациента собрана в устройство для сбора крови по п. 1, где измеренное количество, являющееся большим, чем в контроле, свидетельствует о наличии нарушения метаболизма.
22. Способ обнаружения наличия пролекарства и/или его активного метаболита в крови или ее компоненте, при котором обнаруживают наличие пролекарства, которое содержит группу сложного эфира алифатического ряда и/или его активного метаболита, в образце крови или ее жидкого компонента у пациента, которому вводили пролекарство, где кровь или ее жидкий компонент собрана в устройство для сбора крови по п. 1.
23. Способ контролирования лечения пациента с нарушением метаболизма, при котором оценивают количество грелина в образце крови или ее компонента, где кровь у пациента собрана в устройство для сбора крови по п. 1, и сравнивают оцененное количество с контролем для определения эффективности терапии.
24. Способ определения количества пролекарства и/или его активного метаболита в крови или ее компоненте, при котором измеряют количество пролекарства, которое содержит группу сложного эфира алифатического ряда и/или его активного метаболита, в образце крови или ее жидкого компонента у пациента, которому вводили пролекарство, где кровь или ее жидкий компонент собрана в устройство для сбора крови по п. 1.
| WO 2010008315 A1, 21.01.2010 | |||
| Вертикальный пресс для двухстороннего прессования изделий из порошковых материалов | 1983 |
|
SU1113269A1 |
| WO 2008147245 A2, 04.12.2008 | |||
| Yuka Shanado, Motohiko Kometani, Hidefumi Uchiyama, Shinichi Koizumi, Naoki Teno "Lysophospholipase I identified as a ghrelin deacylation enzyme in rat stomach", Biochemical and Biophysical Research Communications, Volume 325, Issue 4, 24 December 2004, Pages 1487-1494 | |||
| Мищенкова Т.В., Звенигородская Л.А | |||
| и др | |||
| "Роль гормонов и типов пищевого поведения в развитии метаболического синдрома" | |||
| Экспериментальная и клиническая гастроэнтерология, 7, 2010. | |||
Авторы
Даты
2017-06-21—Публикация
2012-03-02—Подача