Область техники, к которой относится изобретение.
Изобретение относится к биотехнологии и медицине и касается способа оценки защитной активности коклюшных вакцин при интраназальном заражении животных вирулентными бактериями Bordetella.
Уровень техники
Известны различные способы оценки эффективности коклюшных вакцин. Так, van der Ark А. с соавт. ("Коклюшный серологический тест, как альтернатива внутримозговому тесту для оценки иммуногенной активности коклюшных вакцин". Develop, in Biol. Stand. 1996, v. 86. p. 271-281) предлагают оценивать защитную активность коклюшных вакцин по уровню антител к основным протективным антигенам - коклюшному токсину (КТ) и филаментозному гемагглютинину (ФГА) B. pertussis на 4-5 неделе после введения их экспериментальным животным. Известен способ оценки иммуногенности коклюшных вакцин по очищению верхних дыхательных путей лабораторных мышей от вирулентных бактерий B. pertussis на 7-10 день после заражения (Mills КН., et al. "Мышиная модель, в которой иммуногенные свойства коклюшных вакцин, коррелирует с их эффективностью у детей". Inf. and Immun. 1998. vol. 66, №2. p. 594-602). Syukuda Y. с соавт. ("Тест аэрозольного инфицирования для оценки иммуногенности коклюшных вакцин". Tokai J. Exp. Clin. Med. 1988, vol. 13, Suppl. 2. p. 71-72) предложили оценивать защитную активность коклюшных вакцин по уровню специфических антител и количеству бактерий в легких после аэрозольного заражения вакцинированных мышей вирулентным бактериями B. pertussis.
Однако описанные способы оценки иммуногенности коклюшных вакцин сложны, требуют использования большого количества лабораторных животных, длительных сроков исследования, а также отличаются высокой вариабельностью.
Метод оценки защитных свойств коклюшных вакцин, описанный в "Инструкции по отбору, проверке и хранению производственных штаммов коклюшных бактерий" (М., 1987, стр. 18-28), основан на модели внутримозгового заражения мышей. Метод заключается в следующем: белых беспородных мышей массой 10-12 г внутрибрюшинно иммунизируют испытуемой коклюшной вакциной в дозе, составляющей прививочную дозу для человека. Через 2 недели проводят внутримозговое заражение экспериментальных животных нейротропным штаммом бактерий В. pertussis 18323, в дозах, вызывающих 100% гибель интактных животных. Доза вирулентного штамма должна составлять не менее 100 ЛД50 (ЛД50 - летальная доза, при которой погибают 50% животных, взятых в опыт). Для вычисления ЛД50 параллельно с основным опытом заражают интактных мышей используемой вирулентной культурой четырьмя дозами с пятикратным шагом. После заражения наблюдение за экспериментальными животными проводят в течение 14-17 суток, ежедневно учитывая гибель и паралич мышей. По окончании опыта высчитывают процент выживших животных. Эффективными считаются вакцины, защищающие не менее 70% животных, взятых в опыт. Главным недостатком метода является заражение вакцинированных животных не естественным для коклюша путем. Внутримозговое заражение не может моделировать патогенез коклюша и, следовательно, корректно характеризовать защитную активность вакцины. Полученные с помощью этого метода результаты лишь коррелируют с защитной активность вакцины у человека. Этому способу также свойственны такие недостатки, как длительность срока исследования, значительное количество экспериментальных животных и низкая и воспроизводимость результатов.
Модель интраназального заражения мышей была использована для оценки защитной активности цельноклеточных коклюшных вакцин Quinvaxem, Easyfive and Pentavac (Anne Marie Queenan et. al. The mouse intranasal challenge model for potency testing of whole-cell pertussis vaccines. Expert Review of Vaccines. 2014, Vol. 13, No. 10, p. 1265-1270). Эффективность вакцин определялась на основании определения КОЕ в легких через пять дней после интраназального заражения вакцинированных мышей вирулентным штаммом Bordetella pertussis. Выявлены различия в эффективности тестируемых вакцин.
В патенте РФ 2231793 предложен способ оценки защитной активности коклюшных вакцин по количественному содержанию в них коклюшного токсина. Использование в качестве индикатора иммуногенных свойств коклюшных вакцин количества содержащегося в них коклюшного токсина (КТ) обусловлено тем, что КТ является основным протективным антигеном, обеспечивающим активную защиту организма против коклюшной инфекции ("Коклюш" ААР 2000, Red Book; Report the Committee on Infetions Diseases, 25 th, Copyrigth; 2000 American Academy Pediatrics, p. 439; Wendy A. Keitell M.D. "Новые вакцины и новые вакцинные технологии" Infect. Dis. Clin of Noth America. 1999, v. 13, №1, p. 83-84). В предлагаемом способе оценки иммуногенности коклюшные вакцины, содержащие низкое количество КТ, например 8, 40, 81 и 10, 20, 45 мкг/мл, защищали всего 20-40% животных, взятых в опыт, а коклюшные вакцины, содержащие 220 и 241 мкг/мл, защищали от 90% до 95% экспериментальных животных.
В публикации WO 2007104451 описан метод оценки эффективности живой вакцины, содержащей аттенуированные бактерии Bordetella pertussis BPZE1, и бесклеточной коклюшной вакцины aPv с последующим интраназальным заражением вакцинированных мышей вирулентным штаммом В. pertussis. Balb/C мыши интраназально вакцинировались 1×106 бактерий BPZE1. При вакцинации aPv (Tetravac; Aventis-Pasteur, France) мышей иммунизировали внутрибрюшинно в количестве 20% от дозы для человека. Спустя одну, две, три или четыре недели после вакцинации BPZE1 или aPv мышей заражали интраназально вирулентными бактериями В. pertussis BPSM/betA-lacZ, через неделю удаляли легкие и определяли КОЕ. Вакцинация BPZE1 в отличие от aPV обеспечивает полную защиту от интраназальной инфекции вирулентным штаммом B. pertussis (наблюдается полный бактериальный клиренс в легких спустя неделю после инфекции и статистически значимое уменьшение бактериальной загрузки через 3 часа после инфекции по сравнению c). При вакцинации aPV отмечено присутствие бактерий B. pertussis в легких животных спустя неделю после инфекции.
Иммуногенность вакцины против возбудителя коклюша в патенте РФ 2455024 оценивалась по смертности мышей после интрацеребрального заражения бактериями высоковирулентного штамма В. pertussis 18323. При интраназальной иммунизации мышам вводили от 4 до 500 млн. живых микробных клеток в 25 мкл однократно. Через 14 дней после иммунизации мышей заражали интрацеребрально высоковирулентным штаммом В. pertussis 18323. В качестве положительного контроля использовали препарат ОСО-3 (Отраслевой стандартный образец корпускулярной коклюшной вакцины, ГИСК им. Л.А. Тарасевича), который вводили мышам внутрибрюшинно в количестве 10 MOE. После интрацеребрального заражения мышей высоковирулентным штаммом В. pertussis 18323 наблюдали защиту от гибели от 80 до 100% в зависимости от количества бактерий, использованных для вакцинации.
В исследованиях роли протективных антигенов Bordetella bronchiseptica Zhao Z. с соавт. ("Irnmunogenicity of recombinant protective antigen and efficacy against intranasal challenge with Bordetella bronchiseptica". Vaccine. 2009, (18): 2523-8) продемонстрировали эффективность подкожной иммунизации мышей рекомбинантным белком rF1P2, состоящим из иммунодоминантного протективного домена типа I (F1) FHA (филаментозного гемагглютинина) и высокоиммуногенной области домена II (P2) пертактина, на модели интраназальной инфекции В. bronchiseptica. Иммунизация rF1P2 обеспечивала защиту животных от последующей интраназальной инфекции различными штаммами В. bronchiseptica в летальных дозах по сравнению с контролем (мыши, иммунизированные адьювантом Фрейнда).
Paul В. Mann и Eric Т. Harvill с соавт. ("Comparative Toll-Like Receptor 4-Mediated Innate Host Defense to Bordetella Infection". Infect Immun. 2005, 73 (12): 8144-8152) изучали TLR4 (Toll-подобный рецептор) - опосредованный иммунитет на модели мышей, инфицированых интраназально В. bronchiseptica и В. pertussis в дозе 5000 КОЕ с последующей количественной оценкой колонизации в легких, как описано в публикации Harvill, E.T. с соавт. (Pregenomic comparative analysis between Bordetella bronchiseptica RB50 and Bordetella pertussis Tohama I in murine models of respiratory tract infection. Infect. Immun. 1999. 67: 6109-6118). У TLR4-дефектных мышей интраназальная инфекция В. bronchiseptica в дозе 5×105 КОЕ приводила к летальному исходу в течение 96 часов. Однако, при интраназальной инфекции В. pertussis в той же дозе, у TLR4-дефектных мышей не было выявлено симптомов болезни. Бактериальный рост в легких измерялся в 0, 2, 6, 12, 24, 48 и 72 часа после инфекции. Легкие инфицированных WT-мышей (дикого типа) содержали приблизительно 106 КОЕ B. bronchiseptica, в то время как легкие инфицированных TLR4-дефектных мышей содержали приблизительно 109 КОЕ бактерий.
Экспериментальная модель интраназальной инфекции мышей была использована при анализе in vivo роли бактерий В. bronchiseptica, отличающихся повышенной вирулентностью для человека, с последующей количественной оценкой колонизации в легких ("Phenotypic and Genomic Analysis of Hypervirulent Human-associated Bordetella bronchiseptica". Umesh Ahuja et. al. BMC Microbiol. 2012, 12: 167). Мышей линии C57B L/6NCr инфицировали интраназально и изучали колонизацию бактерий в легких. При интраназальном инфицировании мышей C57B L/6NCr бактериями В. bronchiseptica RB50 комплекса IV в дозе 5×105 КОЕ и спустя 3 дня в легких регистрировали в 10 до 30 раз больше КОЕ, чем после инфекции менее вирулентными для человека бактериями В. bronchiseptica комплекса I (p<0.001).
Бактерии B. bronchiceptica, отличающиеся по уровню вирулентности, использовали для достижения гибели мышей при интраназальном заражении ("Replacement of Adenylate Cyclase Toxin in a Lineage of Bordetella bronchiseptica". Anne M. Buboltz, Eric T. Harvill et. al. J Bacteriol. 2008, 190(15): 5502-5511). При инокуляции мышей гипервирулентным штаммом В. bronchiseptica (RB50) в дозах 106.1, 106.3 или 106.6 КОЕ количество выживших мышей составляло 100%, 50% и 0% соответственно. При инокуляции мышей гиповирулентным штаммом В. bronchiseptica (253) в дозах 106.5, 107.3 или 107.5 КОЕ количество выживших мышей составляло 100%, 50% и 33% соответственно. Полученные результаты указывают на то, что LD50 для гиповирулентного штамма 253 в 10 раз выше (на 17.9 млн. КОЕ), чем для гипервирулентного штамма RB50. Увеличение LD50 для штамма 253 коррелировало с уменьшением бактериальной загрузки респираторного тракта мышей. При заражении мышей бактериями RB50 или 253 в дозе 105.7 КОЕ количество бактерий штамма RB50 в легких составляло 104.9, 106.3, 104.3, 103.5 и 10 (ниже предела обнаружения) КОЕ на 3, 7, 14, 28 и 56 день после заражения соответственно. Количество бактерий штамма 253 в легких составляло 105.6, 105.7, 103.8, 101.5 КОЕ и было ниже предела обнаружения на 3, 7, 14, 28 и 56 день после заражения соответственно.
Использование интраназального заражения Bordetella bronchiseptica при оценке иммуногенных композиций Bordetella bronchiseptica описано в патенте РФ 255448. Собак вакцинировали подкожно соответствующей вакциной в сутки 0 и 21. На 42-е сутки собак из всех групп обработки подвергали интраназальному заражению Bordetella bronchiseptica посредством распыления аэрозоля в плексигласовой камере в течение 30 минут. Эффективность оценивали по сокращению продолжительности кашля и выделения из носа.
В настоящее время защитные свойства коммерческих коклюшных вакцин, выпускаемых в серийное производство, определяют по выживаемости вакцинированных мышей после внутримозгового введения вирулентных бактерий В. pertussis. Метод не отражает реальной картины противококлюшного иммунитета и определяет параметры, коррелирующие с защитной активностью вакцин у человека.
Нормативные документы РФ и рекомендации ВОЗ предусматривают возможность определения защитной активности по изменению бактериальной нагрузки в легких вакцинированных мышей после их интраназального (аэрозольного) заражения вирулентными бактериями В. pertussis. Однако метод подсчета колоний в легких инфицированных мышей в разные сроки после их заражения вирулентными бактериями трудоемок и не позволяет надежно определить количественные характеристики защитной активности.
Методы определения защитной активности коклюшных вакцин в результате регистрации выживаемости мышей после интраназального заражения вирулентными бактериями B. pertussis в настоящее время не разработаны.
Таким образом, простых и надежных способов оценки иммуногенных свойств, адекватно отражающих защитную активность коклюшных вакцин, выпускаемых в массовую вакцинопрофилактику, не существует. Метод определения защитной активности вакцин по выживаемости мышей при внутримозговом заражении коррелирует с защитной активностью корпускулярной коклюшной вакцины (ККВ) у людей, но не обеспечивает адекватного моделирования противококлюшного иммунитета у человека. Возможность его применения для оценки живых и бесклеточных KB не установлена. Поэтому разработка новых методов контроля и оценки защитных свойств коклюшных вакцин, в том числе производственных серий, является актуальной задачей современной вакцинопрофилактики. Модель интраназального заражения мышей более адекватна из-за использования естественного способа заражения животных и может рассматриваться как перспективная при разработке новых методов определения защитной активности коклюшных вакцин.
Исследования последнего десятилетия показали, что циркулирующие в настоящее время в разных странах штаммы бактерий B. pertussis содержат последовательности ptx, fga, prn, отличные от последовательностей, ранее циркулирующих, и вакцинных штаммов B. pertussis (Mooi FR. Bordetella pertussis and vaccination: the persistence of a genetically monomorphic pathogen. Infect Genet Evol. 2010, v. 10. N 1. p. 36-49). Предполагают, что рост заболеваемости коклюшем связан именно с циркуляцией бактерий «нового» генотипа, в связи с чем рассматривается возможность замены «старых» вакцинных штаммов на «новые» для производства современных вакцин.
Большинство выявленных мутаций в последовательности ptx, кодирующей основной протективный антиген возбудителя коклюша (КТ), расположены в области, ответственной за формирование структур протективных эпитопов КТ. Получены данные, указывающие на роль некоторых мутаций в повышении вирулентности новых генотипов бактерий и изменении эффективности «старых» вакцин по отношению к бактериям «новых» генотипов. Проведено изучение вирулентности бактерий недавно появившегося в большинстве стран генотипа бактерий. Бактерии B. pertussis ptxP3 содержат мутацию в опероне ptx, увеличивающую транскрипцию и экспрессию КТ. В экспериментах in vitro продукция токсина бактериями B. pertussis генотипа ptxP3 возрастает в несколько раз. In vivo продемонстрирована возросшая вирулентность бактерий «нового» генотипа, что, как полагают, обусловлено более высоким уровнем продукции КТ (Komatsu E., Yamaguchi F., Abe A., et al. Weiss AA, Watanabe M. Synergic effect of genotype changes in pertussis toxin and pertactin on adaptation to an acellular pertussisvaccine in the murine intranasal challenge model. Clin Vaccine Immunol. 2010, v. 17. N. 5, p. 807-812). В других экспериментах прямо продемонстрирована сниженная эффективность зашиты животных, вакцинированных убитыми бактериями старого генотипа ptxA1, prn1 от бактерий B. pertussis «нового» генотипа или ptxA2 и prn2 (Higgs R, Higgins S.C., Ross P.J., Mills K.H. Immunity to the respiratory pathogen Bordetella pertussis. Mucosal Immunol. 2012, 5: 485-500).
Эти результаты делают актуальным разработку технологии определения защитной активности аттенуированных бактерий «новых» генотипов, сконструированных на основе аттенуированных бактерий.
Раскрытие изобретения
Авторами настоящего изобретения впервые предложен способ определения защитной активности коклюшных вакцин, основанный на определении ЛД50 при интраназальном заражения мышей вирулентными бактериями В. bronchiseptica, В. parapertussis и В. pertussis, обеспечивающий простую и надежную оценку защитной активности коклюшных вакцин в процессе их разработки и контроля производственных серий, выпускаемых для массовой вакцинопрофилактики.
Предложенный способ предусматривает вакцинацию мышей коклюшными вакцинами с последующим заражением вирулентными бактериями В. pertussis, В. bronchiseptica, В. parapertussis и отличается тем, что осуществляют интраназальное заражение вирулентными бактериями В. bronchiseptica, В. parapertussis и В. pertussis в летальных дозах и определяют выживаемость вакцинированных животных.
В одном из предпочтительных вариантов в качестве вирулентного штамма используют штамм В. bronchiseptica 8220-17.
В качестве тестируемых вакцин согласно предложенному способу используют цельноклеточные вакцины, состоящие из живых или инактивированных бактерий.
Осуществление изобретения
Настоящее изобретение впервые обеспечивает способ определения защитной активности коклюшных вакцин, предусматривающий вакцинацию мышей коклюшными вакцинами с последующим интраназальным заражением вирулентными бактериями В. pertussis, В. bronchiseptica и B. parapertussis в летальных дозах и определением выживаемости вакцинированных животных.
В соответствии с предложенным способом были использованы вирулентные бактерии B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 и B. parapertussis 504.
Штамм B. pertussis 475 является одним из вакцинных штаммов, используемых в России для производства корпускулярных коклюшных вакцин.
В. bronchiseptica 8220 - штамм бактерий, выделенный от свиней, больных бронхосептикозом (Коллекция штаммов ФГБУ ФНИЦЭМ им Н.Ф. Гамалеи Минздрава России).
В. bronchiseptica 8220-17 представляют собой рекомбинантные бактерии, продуцирующие коклюшный токсин B. pertussis (Говорун В.М., Иванова В.Ф., Кирилов М.Ю. и др. Особенности экспрессии оперона коклюшного токсина под контролем собственного и гетерологичного промоторов в клетках Bordetella pertussis. Молекулярная генетика, микробиология, вирусология. 1993, №2. стр. 21-27). Рекомбинантные бактерии B. bronchoseptica 8220-17 продуцируют коклюшный токсин, обладающий всеми свойствами КТ бактерий B. pertussis. Интраназальная инокуляция В. bronchiseptica 8220-17 макакам резус сопровождается развитием лейкоцитоза и выработкой специфических антител к КТ (результаты не представлены).
В. parapertussis 504 выделен от больного паракоклюшем Коллекция штаммов ФГБУ ФНИЦЭМ им Н.Ф. Гамалеи Минздрава России).
Для интраназальной вакцинации мышей использовали аттенуированные бактерии B. pertussis 4MKS (живая коклюшная вакцин-ЖКВ), имеющие генотип ptxP3 (результаты конструирования не представлены), и бактерии штамма B. pertussis 4М, имеющие генотип ptxP1 (Синяшина Л.Н., Синяшина Л.С., Семин Е.Г., Амелина И.П., Каратаев Г.И. Конструирование генетически аттенуированных бактерий Bordetella pertussis, утративших активность дермонекротического токсина и продуцирующих измененную нетоксичную форму коклюшного токсина. Молек. генетика, Микробиология 2010, №3, стр. 31-36), и коммерческий препарат АКДС С1252/ААП/15ФГУП «НПО «Микроген».
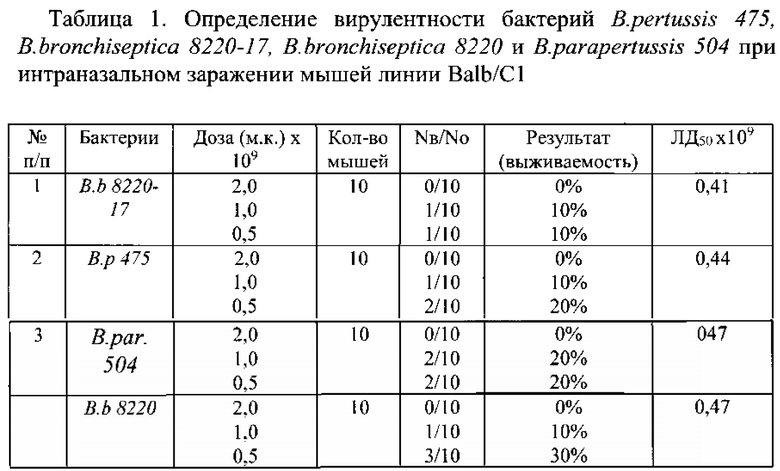
Результаты изучения летальности интраназального инфицирования лабораторных мышей вирулентными бактериями B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 и B. parapertussis 504 представлены в примере 1 (табл. 1). Гибель животных имеет дозозависимый характер. В течение первых 17 дней погибло 100% животных, инфицированных бактериями B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 или B. parapertussis 504 в дозе 2×109, и 70-90% животных, инфицированных 1×109 бактерий. При инфицирующей дозе 0,5×109 погибло около 50% животных.
Определение количества КОЕ в легких животных через час после инокуляции показало, что при интраназальном введении 5×108-2×109 бактерий в легких регистрируется 105-106 бактерий B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 или B. parapertussis 504.
Приведенные в табл. 1 результаты показывают, что вирулентные штаммы бактерий B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 и B. parapertussis 504 обеспечивают гибель инфицированных интраназально животных при инокуляции 5×108-2×109.
Интраназальное заражение лабораторных мышей бактериями B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 и B. parapertussis 504 приводит к развитию легочной инфекции, гибели животных в первые 17 дней и/или к значительной потере веса, всклокоченности шерсти и нарушению активности животных.
Использованные для анализа бактерии рода Bordetella отличаются друг от друга продукцией коклюшного токсина. B. pertussis 475, В. bronchiseptica 8220-17 продуцируют КТ, а у бактерий В. bronchiseptica 8220 и B. parapertussis 504 КТ отсутствует. Тем не менее мыши, инфицированные всеми использованными штаммами бактерий, гибнут примерно в одни сроки и имеют характерные клинические проявления заболевания. Общим для всех штаммов является способность продуцировать аденилатциклазный токсин, дермонекротический токсин, гемагглютинин, пертактин и некоторые другие факторы вирулентности. Можно предположить, что наблюдаемый патологический процесс у мышей может быть связан с действием токсинов бактерий рода Bordetella.
Защитную активность вакцин определяли по выживаемости лабораторных мышей после интраназального заражения бактериями B. pertussis 475, В. bronchiseptica 8220-17 или B. parapertussis 504 (пример 2, табл. 3).
Данные определения вирулентности бактерий B. pertussis 475 и В. bronchiseptica 8220-17, использованных для интраназального заражения вакцинированных и нативных мышей, представлены в табл. 2 (пример 2).
Представленные в табл. 3 результаты показывают, что ЖКВ защищает животных от интраназального заражения бактериями B. pertussis 475 и В. bronchiseptica 8220-17 в дозе, обеспечивающей 100% гибель мышей в первые 17 дней после инфекции (8-10 ЛД50). Зависимость защитной активности от количества аттенуированых бактерий при интраназальном заражении близка к параметрам, полученным при внутримозговом заражении мышей бактериями B. pertussis 18323. Однако выявлены и некоторые количественные отличия. При интраназальном заражении бактериями B. pertussis 475 и В. bronchiseptica 8220-17 70% защита животных обеспечивается при дозе аттенуированных бактерий, равной 0,03×109, что в 5 раз меньше, чем при использовании теста внутримозгового заражения мышей вирулентными бактериями B. pertussis 18323 (табл. 3).
В соответствии с предложенным способом пригодные для использования в качестве коклюшных вакцин штаммы бактерий В. pertussis должны обеспечивать 70% защиту от интраназального заражения вирулентными бактериями в дозе, составляющей 8-10 ЛД50 (табл. 2, 3).
Не было выявлено существенной разницы в результатах тестирования ЖКВ, полученных при использовании бактерий B. pertussis 475 и В. bronchiseptica 8220-17. Вариант предложенного способа с использованием рекомбинантных бактерий В. bronchiseptica 8220-17 является хорошей альтернативой используемому в настоящее время и требующему высокой квалификации методу внутримозгового заражения мышей бактериями B. pertussis 18323. Дополнительным преимуществом предлагаемого способа является простота работы с бактериями В. bronchiseptica 8220-17 по сравнению с медленно растущими и требующими стандартных сред и крови бактериями B. pertussis 475 и B. pertussis 18323.
Сравнительное изучение защитной активности аттенуированных бактерий «старого» генотипа ptxP1 B. pertussis 4М и нового ptxP3 B. pertussis 4MKS осуществлялось в экспериментах по определению выживаемости вакцинированных лабораторных мышей после интраназального заражения бактериями B. pertussis 475 (Пример 3, табл. 4).
Использование предложенного способа позволит экономить время, средства при оценке защитной активности противококлюшных вакцин, в том числе полученных из нативных и рекомбинантных бактерий B. pertussis «нового» генотипа, в процессе их экспериментальной проверки и тестирования производственных серий.
Изобретение иллюстрируется следующими примерами
Пример 1. Изучение летальности интраназального инфицирования лабораторных мышей вирулентными бактериями B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 или B. parapertussis 504.
В эксперименте использовали мышей линии Balb/C1 весом 10-12 гр. Бактерии выращивали на среде КУА с кровью в течение 24 и 12 часов для B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 и B. parapertussis 504 соответственно.
Культуру собирали с чашки, суспендировали в физрастворе до концентрации 80 MOE (8×1010 бактерий в мл) и 25 мкл суспензии в соответствующих разведениях вводили мышам. Для инокуляции использовали исходную культуру и два ее 2-кратных разведения, содержащих соответственно 2×109, 109 и 5×108 бактерий. На каждую дозу использовали по 10 животных. Контролем служили животные, которым интраназально вводили 25 мкл физраствора. За животными наблюдали в течение 30 дней. Препараты вводили интраназально в объеме 10-30 мкл под наркозом, поднося шприц к ноздре животного и добиваясь проникновения препарата без пузырей и разбрызгивания. Перед заражением мышам вводили 0,03 мл золетила в концентрации 4 мг/мл. Результаты эксперимента представлены в табл. 1.
ЛД50 рассчитывали по методу Кербра (Приложение 2 "Инструкции по отбору, проверке и хранению производственных штаммов коклюшных бактерий" М., 1987).
Из данных, представленных в табл. 1, следует, что 100% животных погибло после инфекции бактериями B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 и B. parapertussis 504 в дозе 2×109 и погибло 70-90% животных при инфицирующей дозе 1×109 бактерий. При инфицирующей дозе 0,5×109 погибло более 50% животных. Расчетное значение ЛД50 для разных видов бактерий рода Bordetella в данном эксперименте составило (0,41-0,47)×109 инокулированных бактерий. Инфицированные животные теряли в весе, имели выраженные изменения в шерстяном покрове (взъерошенная шерсть) и значительно сниженную активность (сбивались в кучу и сидели без движения). После 20-го дня гибели животных не наблюдали. Состояние выживших мышей приходило в норму, наблюдался прирост веса животных.
Определение количества КОЕ в легких животных через час после инокуляции показало, что при интраназальном введении 5×108-2×109 бактерий в легких регистрируется около 105-106 бактерий B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 или B. parapertussis 504. Таким образом, количество бактерий в легких инфицированных животных меньше количества бактерий, введенных интраназально.
Приведенные в табл. 1 результаты показывают, что штаммы бактерий B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 и B. parapertussis 504 имеют высокую вирулентность, обеспечивающую гибель инфицированных интраназально мышей в дозах, равных или меньше 106 бактерий.
Таким образом, интраназальное заражение лабораторных мышей бактериями B. pertussis 475, В. bronchiseptica 8220-17, В. bronchiseptica 8220 и B. parapertussis 504 приводит к развитию легочной инфекции и гибели животных в первые 17 дней при инокуляции в дозе 5×108-2×109 и регистрации в легких 105-106 бактерий.
Разница в количестве введенных интраназально и зарегистрированных в легких бактерий сразу после инфекции указывает, вероятно, на попадание в легкие только малой части инокулируемых бактерий.
Пример 2. Изучение защитной активности вакцин способом определения выживаемости лабораторных мышей после интраназального заражения бактериями B. pertussis 475, В. bronchiseptica 8220-17 и B. parapertussis 504.
Для интраназальной вакцинации использовались мыши линии Balb/C1 весом 10-12 гр. Вакцинацию проводили тремя сериями ЖКВ в приведенных в таблице дозах, содержащихся в 25 мкл суспензии. Для интраназального заражения контрольных мышей и определения ЛД50 использовали 25 мкл суспензии, содержащей 3×109, 1×109 и 0,3×109 бактерий B. pertussis 475, В. bronchiseptica 8220-17 или B. parapertussis 504. В таблице 2 приведены результаты определения вирулентности (ЛД50) использованных в эксперименте штаммов бактерий рода Bordetella. Для интраназального заражения вакцинированных животных использовали разрешающую дозу 3×109 бактерий, вызывающую 100% гибель нативных животных и составляющую примерно 8-10 ЛД50 (табл. 2).

Результаты изучения защитной активности ЖКВ при интраназальном заражении мышей живыми бактериями B. pertussis 475, В. bronchiseptica 8220-17 и B. parapertussis 504 представлены в табл.3
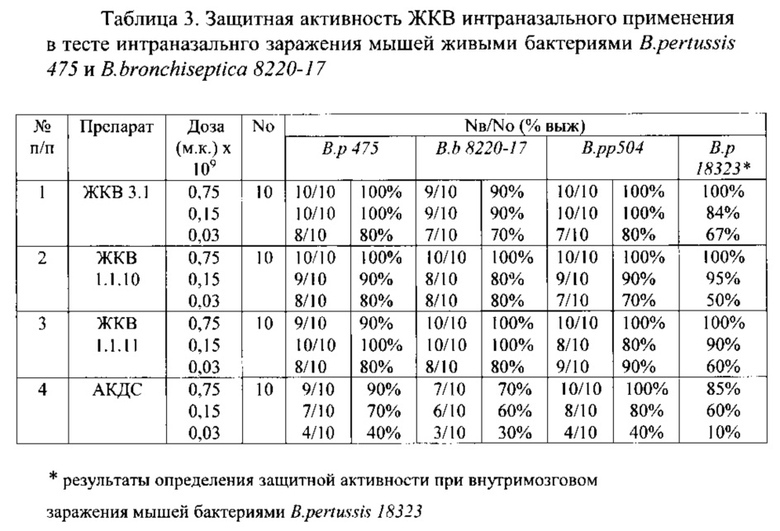
Для сравнения приведены данные защитной активности трех серий ЖКВ и АКДС, определенные в тесте выживаемости вакцинированных мышей после внутримозгового введения около 300 ЛД50 вирулентных бактерий B. pertussis 18323 (Методы контроля. Биологические и микробиологические факторы. Отбор, проверка и хранение производственных штаммов коклюшных, паракоклюшных и бронхисептикозных бактерий. Методические указания МУК 4.2.2317-08).
Представленные в табл. 3 результаты показывают, что все серии ЖКВ защищают животных от интраназального заражения бактериями B. pertussis 475 и В. bronchiseptica 8220-17 в дозе, обеспечивающей 100% гибель (примерно 10 ЛД50). Зависимость защитной активности от количества аттенуированых бактерий при интраназальном заражении близка к параметрам, полученным при внутримозговом заражении мышей бактериями B. pertussis 18323.
При интраназальном заражении бактериями B. pertussis 475 и В. ronchiseptica 8220-17 70% защита животных обеспечивается при дозе аттенуированных бактерий, равной 0,03×109, что в 5 раз меньше, чем при внутримозговом заражении мышей вирулентными бактериями B. pertussis 18323. Эти данные могут означать, что эффективность вакцин при использовании интраназального заражения несколько выше, чем при внутримозговом заражении.
Не было выявлено существенной разницы в результатах тестирования ЖКВ, полученных при использовании бактерий B. pertussis 475 и В. bronchiseptica 8220-17.
Таким образом, в соответствии с предложенным способом защитная активность коклюшных вакцин может быть оценена путем определения выживаемости мышей после их вакцинации и последующего интраназального заражения вирулентными бактериями B. pertussis 475, В. bronchiseptica 8220-17 и B. parapertussis 504 в дозах, составляющих 8-10 ЛД50.
Вариант предложенного способа с использованием рекомбинантных бактерий В. bronchiseptica 8220-17 является хорошей альтернативой используемому в настоящее время, требующему высокой квалификации методу внутримозгового заражения мышей бактериями B. pertussis 18323. Дополнительным преимуществом предлагаемого способа является простота работы с бактериями В. bronchiseptica 8220-17 по сравнению с медленно растущими и требующими стандартных сред и крови бактериями B. pertussis 475 и B. pertussis 18323.
Пример 3. Сравнительное изучение защитной активности аттенуированных бактерий B. pertussis 4М и B. pertussis 4MKS (ЖКВ) при интраназальной инфекции лабораторных мышей вирулентными бактериями B. pertussis 475.
Результаты сравнительного изучения защитной активности аттенуированных бактерий «старого» генотипа ptxP1 B. pertussis 4М и нового ptxP3 B. pertussis 4MKS в тесте выживаемости вакцинированных лабораторных мышей после интраназального заражения бактериями B. pertussis 475 представлены в табл. 4. При вакцинации использовано интраназальное введение аттенуированных бактерий (ЖКВ).
Для заражения использованы вирулентные бактерии B. pertussis 475 в дозе 3×109 в 25 мкл суспензии на мышь, соответствующей 8-10 ЛД50.
Представленные в табл. 4 результаты показывают возможность использования метода интраназального заражения вакцинированных мышей вирулентными бактериями B. pertussis для оценки защитной активности кандидатных живых вакцин, независимо от генотипа аттенуированных бактерий. Отмечена тенденция увеличения защитной активности ЖКВ при использовании бактерий B. pertussis 4MKS по сравнению с B. pertussis 4М.
Предложенный способ позволяет экономить время и средства при оценке защитной активности противококлюшных вакцин, независимо от генотипа бактерий, использованных при их создании. Способ может быть полезен для оценки эффективности вакцин со «старым» генотипом для защиты животных от заражения вирулентными бактериями «новых» генотипов и определения целесообразности замены вакцинных штаммов на «новые» при производстве современных коклюшных вакцин.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лиофильного высушивания аттенуированных бактерий B. pertussis, аттенуированная бактерия B. pertussis, штамм аттенуированных бактерий B. Pertussis, вакцина, лиофилизированный вакцинный препарат | 2017 |
|
RU2709657C2 |
| Способы оценки защитной активности и иммуногенности коклюшных вакцин у человека, применение живой коклюшной рекомбинантной вакцины ГамЖВК | 2021 |
|
RU2799018C2 |
| АТТЕНУИРОВАННЫЕ БАКТЕРИИ BORDETELLA PERTUSSIS, ВАКЦИНА ПРОТИВ ВОЗБУДИТЕЛЯ КОКЛЮША | 2010 |
|
RU2455024C1 |
| ПОЛИПЕПТИД, РЕКОМБИНАНТНЫЙ ПОЛИНУКЛЕОТИД, ВАКЦИНА | 1993 |
|
RU2129611C1 |
| ПОЛИНУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, КОДИРУЮЩАЯ СКОНСТРУИРОВАННЫЙ БЕЛОК ПЕРТАКТИН, ВЕКТОР, ВКЛЮЧАЮЩИЙ ТАКУЮ ПОСЛЕДОВАТЕЛЬНОСТЬ, И ВАКЦИННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ БЕЛОК ПЕРТАКТИНА ИЛИ ВЕКТОР | 2008 |
|
RU2499046C2 |
| СПОСОБ ОЦЕНКИ ИММУНОГЕННОСТИ КОКЛЮШНЫХ ВАКЦИН | 2003 |
|
RU2231793C1 |
| ВАКЦИНЫ С ЖИВЫМИ БАКТЕРИАЛЬНЫМИ ИЗОЛЯТАМИ ДЛЯ СИСТЕМНОГО ВВЕДЕНИЯ | 2011 |
|
RU2593953C2 |
| Свежевыделенный штамм бактерий Bordetella pertussis - продуцент комплекса протективных антигенов для производства бесклеточной коклюшной вакцины | 2018 |
|
RU2689903C1 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ Bordetella bronchiseptica | 2012 |
|
RU2554480C2 |
| СПОСОБ ПОЛУЧЕНИЯ АТТЕНУИРОВАННОГО ШТАММА БАКТЕРИЙ SALMONELLA И ВАКЦИНА | 1992 |
|
RU2126447C1 |
Изобретение относится к медицине и биотехнологии и касается определения защитной активности коклюшных вакцин. Для этого осуществляют интраназальное введение коклюшных вакцин с последующим интраназальным заражением вирулентными бактериями В. bronchiseptica, или В. parapertussis, или В. pertussis в летальных дозах и определяют выживаемость вакцинированных животных. Способ обеспечивает реальную картину противококлюшного иммунитета и надежное определение количественных характеристик защитной активности. 3 з.п. ф-лы, 3 пр., 4 табл.
1. Способ определения защитной активности коклюшных вакцин, предусматривающий вакцинацию мышей коклюшными вакцинами с последующим интраназальным заражением вирулентными бактериями В. pertussis, или В. bronchiseptica, или В. parapertussis, отличающийся тем, что осуществляют интраназальное введение коклюшных вакцин с последующим интраназальным заражением вирулентными бактериями В. bronchiseptica, или В. parapertussis, или В. pertussis в летальных дозах и определяют выживаемость вакцинированных животных.
2. Способ по п. 1, отличающийся тем, что в качестве вирулентного штамма используют штамм В. bronchiseptica 8220-17.
3. Способ по п. 1, отличающийся тем, что в качестве тестируемых вакцин используют цельноклеточные вакцины, состоящие из живых бактерий.
4. Способ по. 1, отличающийся тем, что вирулентные бактерии интраназально вводят мышам в дозе, составляющей не менее 8-10 ЛД50.
| ZHAO Z | |||
| et al | |||
| Immunogenicity of recombinant protective antigen and efficacy against intranasal challenge with Bordetella bronchiseptica | |||
| Vaccine, 2009, (18): 2523-8 | |||
| АТТЕНУИРОВАННЫЕ БАКТЕРИИ BORDETELLA PERTUSSIS, ВАКЦИНА ПРОТИВ ВОЗБУДИТЕЛЯ КОКЛЮША | 2010 |
|
RU2455024C1 |
| СПОСОБ ОЦЕНКИ ИММУНОГЕННОСТИ КОКЛЮШНЫХ ВАКЦИН | 2003 |
|
RU2231793C1 |
| WO 2007104451 A, 20.09.2007 | |||
| CN 101074442 A, 21.11.2007 | |||
| US 8465754 B2, 18.06.2013 | |||
| Коклюш: симптомы, лечение, профилактика 12.02.2012 http://antivakcina.org/koklyush-simptomy-lechenie-profilaktika/. | |||
Авторы
Даты
2017-06-23—Публикация
2015-11-09—Подача