Это изобретение относится к соединениям и композициям, которые являются ингибиторами MAPK p38, полезными в качестве противовоспалительных агентов в лечении, среди прочего, заболеваний дыхательного тракта.
Предшествующий уровень техники
Митоген-активируемые протеинкиназы (MAPK) составляют семейство пролин-направляемых серин/треонинкиназ, которые активируют свои субстраты посредством двойного фосфорилирования. Существуют четыре известные человеческие изоформы MAP-киназы p38: p38α, p38β, p38γ и p38δ. P38-киназы, которые также известны как белки, связывающие противовоспалительные лекарственные средства, подавляющие цитокины (CSBP), стресс-активируемые протеинкиназы (SAPK) и RK, обуславливают фосфорилирование (Stein et al., Ann. Rep. Med Chem., 1996, 31, 289-298) и активацию факторов транскрипции (таких как ATF-2, MAX, CHOP и C/ERPb), а также других киназ (таких как MAPKAP-K2/3 или MK2/3), а сами активируются посредством физического и химического стресса (например, ультрафиолетом (UV), осмотическим стрессом), провоспалительными цитокинами и бактериальными липополисахаридами (LPS) (Herlaar Е. & Brown Z., Molecular Medicine Today, 1999, 5, 439-447). Было показано, что продукты фосфорилирования p38 опосредуют продуцирование воспалительных цитокинов, включая фактор некроза опухоли альфа (TNF-α) и интерлейкин-1 (IL-1) и циклооксигеназу-2 (COX-2). Также известно, что IL-1 и TNF-α стимулируют продуцирование других провоспалительных цитокинов, таких как IL-6 и IL-8.
IL-1 и TNF-α являются биологическими веществами, продуцируемыми различными клетками, такими как моноциты или макрофаги. Было показано, что IL-1 опосредует различные виды биологических активностей, которые, как полагали, являются важными при иммунорегуляции и других физиологических состояниях, таких как воспаление (например, Dinarello et al., Rev. Infect. Disease, 1984, 6, 51). Избыточное или неконтролируемое продуцирование TNF (в частности, TNF-α) связано с опосредованием или обострением ряда заболеваний, и полагают, что TNF может вызывать или вносить вклад в воспалительные эффекты в целом. IL-8 является хемотаксическим фактором, продуцируемым некоторыми видами клеток, включая мононуклеарные клетки, фибробласты, эндотелиальные клетки и кератиноциты. Его продуцирование эндотелиальными клетками индуцирует IL-1, TNF или липополисахарид (LPS). IL-8 стимулирует ряд функций in vitro. Было показано, что он обладает свойствами хемоаттрактанта для нейтрофилов, T-лимфоцитов и базофилов. Увеличение продуцирования IL-8 также обуславливает хемотаксис нейтрофилов к месту воспаления in vivo.
Предполагают, что ингибирование передачи сигнала через p38, которая помимо IL-1, TNF и IL-8, описанных выше, также необходима для синтеза и/или действия некоторых дополнительных провоспалительных белков (например, IL-6, GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор), COX-2, коллагеназы и стромелизина), является высокоэффективным механизмом регулирования избыточной и деструктивной активации иммунной системы. Это предположение подтверждается сильнодействующими и разнообразными механизмами противовоспалительной активности, описанными для ингибиторов p38-киназы (Badger et al., J. Pharm. Exp. Thera., 1996, 279, 1453-1461; Griswold et al., Pharmacol. Comm., 1996, 7, 323-229). В частности, ингибиторы p38-киназы описаны в качестве сильнодействующих агентов для лечения ревматоидного артрита. Помимо связей между активацией p38 и хроническим воспалением и артритом, имеются также данные, дающие основание предполагать роль p38 в патогенезе заболеваний дыхательных путей, в частности хронической обструктивной болезни легких (COPD) и астмы. Стрессовые стимулы (включая табачный дым, инфекции или продукты окисления) могут вызывать воспаление в легких. Ингибиторы p38, как было показано, ингибируют LPS и индуцированные овальбумином TNF-α, IL-1β, IL-6, IL-4, IL-5 и IL-13 в дыхательных путях (Haddad et al, Br. J. Pharmacol., 2001, 132 (8), 1715-1724; Underwood et al., Am. J. Physiol. Lung Cell. Mol. 2000, 279, 895-902; Duan et al., 2005 Am. J. Respir. Crit. Care Med., 171, 571-578; Escort et al. Br. J. Pharmacol., 2000, 131, 173-176; Underwood et al., J. Pharmacol. Exp. Ther. 2000, 293, 281-288). Кроме того, они значительно ингибируют нейтрофилию и высвобождение матриксной металлопротеиназы-9 (ММР-9) в животных моделях, подвергнутых воздействию LPS, озона или сигаретного дыма. Имеется также значительное количество данных доклинических исследований, подчеркивающих потенциальные преимущества ингибирования p38-киназы, что может быть существенным в легких (Lee et al., Immunopharmacology, 2000, 47, 185-200). Таким образом, терапевтическое ингибирование активации p38 может быть важным в регуляции воспаления дыхательных путей.
Роль пути p38MAPK при различных заболеваниях рассмотрена P. Chopra et al. (Expert Opinion on Investigational Drugs, 2008, 17(10), 1411-1425). Полагают, что соединения по настоящему изобретению могут быть использованы для лечения заболеваний, опосредованных p38, таких как хроническая обструктивная болезнь легких (COPD), астма, хронический или острый бронхостеноз, бронхит, острое повреждение легких и бронхоэктаз, легочная артериальная гипертензия, туберкулез, рак легких, воспаление вообще (например, воспалительное заболевание кишечника), артрит, нейровоспаление, боль, лихорадка, фиброзирующие заболевания, легочные расстройства и заболевания (например, гипероксическое альвеолярное повреждение), сердечно-сосудистые заболевания, постишемическое реперфузионное повреждение и застойная сердечная недостаточность, кардиомиопатия, инсульт, ишемия, реперфузионное повреждение, реперфузионное повреждение почек, отек головного мозга, нейротравма и травма головного мозга, нейродегенеративные расстройства, расстройства центральной нервной системы, заболевание печени и нефрит, желудочно-кишечные заболевания, язвенные болезни, болезнь Крона, глазные заболевания, офтальмологические заболевания, глаукома, острое повреждение тканей глаза и глазные травмы, диабет, диабетическая нефропатия, кожные заболевания, миалгии вследствие инфекции, гриппа, эндотоксический шок, синдром токсического шока, аутоиммунное заболевание, отторжение трансплантата, заболевания, сопровождающиеся резорбцией костной ткани, рассеянный склероз, псориаз, экзема, расстройства женской репродуктивной системы, патологические (но незлокачественные) состояния, такие как гемангиома, ангиофиброма носоглотки и аваскулярный некроз кости, доброкачественные и злокачественные опухоли/неоплазия, включая рак, лейкоз, лимфому, системную красную волчанку (SLE), ангиогенез, включая неоплазию, кровотечение, свертывание, лучевое поражение и/или метастаз. Продолжительное высвобождение активного TNF может вызывать кахексию и анорексию, и TNF может представлять опасность для жизни. TNF также связан с инфекционными заболеваниями. Они включают, например, малярию, микобактериальную инфекцию и менингит. Они также включают, среди прочего, вирусные инфекции, такие как HIV (вирус иммунодефицита человека), вирус гриппа и вирус герпеса, включая вирус простого герпеса 1 типа (HSV-1), вирус простого герпеса 2 типа (HSV-2), цитомегаловирус (CMV), вирус ветряной оспы (VZV), вирус Эпштейна-Барр, вирус герпеса человека 6 типа (HHV-6), вирус герпеса человека 7 типа (HHV-7), вирус герпеса человека 8 типа (HHV-8), ложное бешенство и ринотрахеит.
Известные ингибиторы p38-киназы рассмотрены G. J. Hanson (Expert Opinions on Therapeutic Patents, 1997, 7, 729-733), J Hynes et al. (Current Topics in Medicinal Chemistry, 2005, 5, 967-985), C. Dominguez et al (Expert Opinions on Therapeutics Patents, 2005, 15, 801-816) и L.H. Pettus & R.P. Wurtz (Current Topics in Medicinal Chemistry, 2008, 8, 1452-1467). Ингибиторы p38-киназы, содержащие триазолопиридиновый мотив, известны в данной области техники, например, из WO 07/091152, WO 04/072072, WO 06/018727.
В WO 2010/094956 раскрыты производные триазолопиридина формулы (I) в качестве ингибиторов MAP-киназы p38:
 .
.
В этих соединениях А представляет собой возможно замещенный двухвалентный ариленовый радикал, гетероариленовый радикал, двухвалентный (С3-С6)циклоалкиленовый радикал, содержащий 5 или 6 кольцевых атомов, или пиперидиниленовый радикал.
Эти соединения охарактеризованы как полезные в качестве противовоспалительных агентов в лечении заболеваний дыхательного тракта.
Задачей настоящего изобретения является идентификация новых и эффективных ингибиторов митоген-активируемой протеинкиназы p38, которые полезны в лечении воспалительных и обструктивных заболеваний дыхательного тракта.
В задачу настоящего изобретения также входит идентификация новых эффективных ингибиторов митоген-активируемой протеинкиназы p38, которые демонтстрируют подходящий профиль развития при ингаляционном введении, для эффективного лечения респираторных обструктивных или воспалительных заболеваний. Следует понимать, что такой профиль может быть достигнут различными путями посредством модулирования специфических свойств; в качестве примера, он может быть достигнут посредством введения низкой эффективной дозы лекарственного средства, тем самым лимитируя побочные эффекты, или как результат длительного действия в легких, что может снизить частоту введения.
Краткое описание изобретения
Соединения по настоящему изобретению являются ингибиторами митоген-активируемой протеинкиназы p38 ("p38 MAPK", "p38-киназа" или "p38"), включая p38α-киназу, и являются ингибиторами продуцирования цитокинов и хемокинов, включая продуцирование TNF-α и IL-8. Они имеют ряд терапевтических применений при лечении воспалительных заболеваний, в частности аллергических и неаллергических заболеваний дыхательных путей, более конкретно обструктивных или воспалительных заболеваний дыхательных путей, таких как хроническая обструктивная болезнь легких ("COPD") и астма. Поэтому они особенно подходят для доставки в легкие посредством ингаляции через нос или рот.
Краткое изложение сущности изобретения
Согласно изобретению предложено соединение формулы (I) или его фармацевтически приемлемая соль:
 ,
,
где
W представляет собой гетероатом, выбранный из N или О, где N замещен водородом, C1-C6алкилом или С3-С5циклоалкилом;
Y выбран из группы, состоящей из группы -S(O)p-, где p равен 0, 1 или 2; группы -O(CR3R4)n-; группы -(CR5R6)n-; группы -NR7-; группы -OC(O)-; группы -OC(O)NH- и группы -OC(O)O-;
каждый из R3, R4, R5 и R6 независимо представляет собой водород, фтор или C1-C6 алкил; или, соответственно, R3 и R4 или R5 и R6 могут образовывать, вместе с атомом углерода, к которому они присоединены, 3-6-членное насыщенное карбоциклическое моноциклическое кольцо, возможно замещенное группой C1-C6 алкил, гидроксил или галоген;
n равен 0, 1, 2 или 3;
R7 представляет собой водород, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил или C3-C7циклоалкил возможно замещен группой C1-C3алкил, С3-С6циклоалкил, гидроксил, циано или галоген;
R1 представляет собой группу, выбранную из (IIa)-(IIc):
 ,
,
где
R8 представляет собой -(C1-C6алкилен)-NRARB, -(C3-C7циклоалкилен)-NRARB, -NRARB, -N(RC)-(C2-C6алкилен)-NRARB, -N(RC)-(C3-C7циклоалкилен)-NRARB или -RC;
RA и RB в каждом случае независимо представляют собой водород, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил, возможно замещен группой C1-C3алкил, C3-C7циклоалкил, -ORD, -SRD, -NRERF, -CN или галоген; альтернативно RA и RB могут образовывать, вместе с атомом азота, к которому они присоединены, 5-11-членное насыщенную моноциклическую или бициклическую гетероциклическую кольцевую систему, в которой указанное 5-11-членное насыщенное моноциклическое или бициклическое гетероциклическое кольцо возможно замещено одной или более группами -ORD, -CN, галоген, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил возможно замещен группой C1-C3 алкил, C3-C7циклоалкил, -ORD, -CN или галоген; и где возможно указанное 5-11-членное насыщенное моноциклическое или бициклическое гетероциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-C6алкилом или С3-С6циклоалкилом, где любой такой C1-C6алкил или С3-С6циклоалкил может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, -ORD, -CN или галоген;
RC в каждом случае независимо представляет собой водород, C1-C6алкил или С3-С6циклоалкил, где такой C1-C6алкил и С3-С6циклоалкил возможно замещен группой C1-C3алкил, ORD, CN или галоген;
RD в каждом случае независимо представляет собой водород, -CH3 или -C2H5;
RE и RF в каждом случае независимо представляют собой водород, C1-C6 алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил возможно замещен группой C1-C3алкил, C3-C7циклоалкил, -ORD, -SRD, -CN или галоген; и/или RE и RF могут образовывать, вместе с атомом азота, к которому они присоединены, 5-7-членную насыщенную гетероциклическую кольцевую систему, в которой указанное 5-7-членное насыщенное гетероциклическое кольцо возможно замещено одной или более группами -ORD, -CN, галоген, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил возможно замещен группой C1-C3алкил, C3-C7циклоалкил, -ORD, -CN или галоген; и где возможно указанное 5-7-членное насыщенное гетероциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-C6алкилом или С3-С6 циклоалкилом, где любой такой C1-C6алкил или С3-С6циклоалкил может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, -ORD, -CN или галоген;
R26 представляет собой водород, -CH3 или -C2H5;
каждый из X1 и X2 независимо представляет собой группу -(CH)- или атом азота;
R9 и R10 независимо представляет собой C1-C6алкил, C3-C6циклоалкил, фенил, который возможно является замещенным, 5- или 6-членный моноциклический гетероарил, который возможно является замещенным, или радикал формулы (IIIa) или (IIIb)
 ;
;
где q равен 1 или 2; и R24 и R25 независимо представляют собой водород или C1-C6алкил, или R24 и R25, взятые вместе с азотом, к которому они присоединены, образуют 6-членное гетероциклическое кольцо, возможно содержащее дополнительный гетероатом, выбранный из N и О;
R11, R12 и R13 независимо представляют собой водород, C1-C6алкил или галоген;
A представляет собой двухвалентный циклоалкиленовый радикал, имеющий 5, 6 или 7 кольцевых атомов; где указанное циклоалкиленовое кольцо присоединено к W и Y и конденсировано с фенильным кольцом или с моноциклическим гетероарильным кольцом, имеющим 5 или 6 кольцевых атомов, где такое фенильное или гетероарильное кольцо возможно замещено одной или двумя группами R27;
R27 в каждом случае независимо выбрана из группы, состоящей из C1-C6алкила, галогена и циано;
R2 представляет собой радикал формулы (IVa), (IVb) или (IVc):
 ;
;
где
R14 выбран из группы, состоящей из -F, -CH2OMe и -CF2CF3;
R15 и R16 независимо представляют собой -CH3 или -C2H5;
R17 выбран из группы, состоящей из одиночной электронной пары, водорода, -CF3, -NRE1RF1, групп -(C3-C7циклоалкил), -(C3-C7гетероциклоалкил), арил или гетероарил, где любой такой -(C3-C7циклоалкил), -(C3-C7гетероциклоалкил), арил или гетероарил может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил или галоген; или
R17 представляет собой группу общей формулы (V)
 ,
,
где
R20 выбран из группы, состоящей из -F, -CH3, -C2H5, -CH2OH, -CH2OMe, -CF2CF3, -CH2SCH3, -SCH3 и -SC2H5;
R21 представляет собой -CH3 или -C2H5;
или
R20 и R21, как они определены выше, могут образовывать, вместе с атомом углерода, к которому они присоединены, 3-7-членное моноциклическое кольцо;
каждый из RE1 и RF1 независимо представляет собой C1-C6 алкил, возможно замещенный группой C1-C3алкил, -ORG, -CN или галоген; альтернативно RE1 и RF1 могут также образовывать, вместе с атомом азота, к которому они присоединены, 5-11-членную насыщенную моноциклическую или бициклическую гетероциклическую кольцевую систему, в которой указанное 5-11-членное насыщенное моноциклическое или бициклическое гетероциклическое кольцо возможно замещено одной или более группами -ORG, -CN, галоген, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил возможно замещен группой C1-C3алкил, C3-C7циклоалкил, -ORG, -CN или галоген; и где возможно указанное 5-11-членное насыщенное моноциклическое или бициклическое гетероциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-C6алкилом или С3-С6циклоалкилом;
RG в каждом случае независимо представляет собой водород, -CH3 или -C2H5;
R18 выбран из группы, состоящей из одиночной электронной пары, водорода, арила, гетероарила, группы -(C1-C6алкил), -(C3-C7циклоалкил), -(C3-C7гетероциклоалкил), (C5-C7гетероциклоалкил)-(C1-C6алкил) и (C5-C7гетероциклоалкил)-(С3-С6циклоалкил); где любой такой арил, гетероарил, -(C1-C6алкил), -(C3-C7циклоалкил), -(C3-C7гетероциклоалкил), (C5-C7гетероциклоалкил)-(C1-C6алкил) или (C5-C7гетероциклоалкил)-(C3-C6циклоалкил) может быть возможно замещен группой -CN, -ОН, галоген, -COORM, C1-C6алкил, С3-С6циклоалкил, -O-(C1-C6алкил), -O-(С3-С6циклоалкил), -S-(C1-C6алкил), -S-(С3-С6циклоалкил), -NRHRJ, -N(RL)(C2-C6алкилен)-NRHRJ, -N(RL)(C3-C7циклоалкилен)-NRHRJ, -(C1-C6алкилен)-NRHRJ, -(C3-C7циклоалкилен)-NRHRJ, -O-(C2-C6алкилен)-NRHRJ, -O-(C3-C7циклоалкилен)-NRHRJ, -S-(C2-C6алкилен)-NRHRJ, -S-(C3-C7циклоалкилен)-NRHRJ, -N(RL)C(O)-(C1-C6алкилен)-NRHRJ, -N(RL)C(O)-(C3-C7циклоалкилен)-NRHRJ, -C(O)N(RL)-(C2-C6алкилен)-NRHRJ, -C(O)N(RL)-(C3-C7циклоалкилен)-NRHRJ, -C(O)N(RL)-(C2-C6алкилен)-ORM, -С(O)N(RL)-(C3-C7циклоалкилен)-ORM, -N(RL)C(O)N(RHRJ), -C(O)N(RHRJ), -N(RL)C(O)N(RL)-(C2-C6алкилен)-NRHRJ, -N(RL)C(O)N(RL)-(C3-C7циклоалкилен)-NRHRJ, -O-(C2-C6алкилен)-ORM, -O-(C3-C7циклоалкилен)-ORM, -S-(C2-C6алкилен)-ORM, -S-(C3-C7циклоалкилен)-ORM, -N(RL)S(O)2-(C1-C6алкилен)-NRHRJ, -N(RL)S(O)2-(C3-C7циклалкилен)-NRHRJ, -S(O)2N(RL)-(C2-C6алкилен)-NRHRJ, -S(O)2N(RL)-(C3-C7циклоалкилен)-NRHRJ, -S(O)2N(RL)-(C2-C6алкилен)-ORM, -S(O)2N(RL)-(C3-C7циклоалкилен)-ORM, -N(RL)S(O)2-(C2-C6алкилен)-ORM, -N(RL)S(O)2-(C3-C7циклоалкилен)-ORM, -S(O)2N(RHRJ), -N(RL)S(O)2RL, -N(RL)C(O)RL, ORL, SRL, -(C3-C7гетероциклоалкил), (C5-C7гетероциклоалкил)-(C1-C6алкил) и (C5-C7гетероциклоалкил)-(С3-С6циклоалкил); где любой фрагмент, представляющий собой C1-C6алкил, С3-С6циклоалкил, -(C2-C6алкилен)-, -(C3-C7циклоалкилен)-, -(C3-C7гетероциклоалкил), (C5-C7гетероциклоалкил)-(C1-C6алкил), (C5-C7гетероциклоалкил)-(С3-С6циклоалкил) и (C5-C7гетероциклоалкил)карбонил, в вышеперечисленных группах может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, -ORM или галоген;
RH и RJ в каждом случае независимо представляют собой водород, C1-C6алкил или С3-С6циклоалкил, где такой C1-C6алкил или С3-С6циклоалкил возможно замещен группой C1-C3алкил, -ORM, -CN или галоген; альтернативно RH и RJ могут также образовывать, вместе с атомом азота, к которому они присоединены, 5-11-членную насыщенную моноциклическую или бициклическую гетероциклическую кольцевую систему, в которой указанное 5-11-членное насыщенное моноциклическое или бициклическое гетероциклическое кольцо возможно замещено одной или более группами -ORM, -CN, галоген, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил возможно замещен группой C1-C3алкил, C3-C7циклоалкил, -ORM, -CN или галоген; и где возможно указанное 5-11-членное насыщенное моноциклическое или бициклическое гетероциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-C6алкилом или С3-С6циклоалкилом, где любой такой C1-C6алкил или С3-С6циклоалкил может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, -ORM, -CN или галоген; и/или RH и RJ могут быть связаны с одним атомом углерода фрагмента -(C2-C6алкилен)- или -(C3-C7циклоалкилен)- в группе, соединенной с азотом, к которому они присоединены, с образованием насыщенного цикла из вплоть до 6 кольцевых атомов;
RL в каждом случае независимо представляет собой водород, C1-C6алкил или С3-С6циклоалкил, где такой C1-C6алкил или С3-С6циклоалкил возможно замещен группой C1-C3алкил, -ORM, -CN или галоген;
RM в каждом случае независимо представляет собой водород, C1-C4алкил или С3-С6циклоалкил, где такой C1-C4алкил или С3-С6циклоалкил возможно замещен группой гидроксил, -CN или галоген;
R19 выбран из группы, состоящей из водорода, групп -CF3, -NRERF, -(C3-C7циклоалкил), -(C3-C7гетероциклоалкил), арил и гетероарил, где любой такой -(C3-C7циклоалкил), -(C3-C7гетероциклоалкил), арил или гетероарил может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил или галоген; или
R19 представляет собой группу общей формулы (V)
 ,
,
где R20, R21, RE и RF являются такими, как определено выше;
z1, z2, z3 и z4 независимо выбраны из группы, состоящей из С, N, S, О, группы -CH- и группы -NH-, в такой комбинации, что полученное кольцо представляет собой ароматическую систему;
T представляет собой -N= или -CR28=;
R28 представляет собой H, галоген, -CH3 или -CN;
R22 представляет собой H, галоген, -CH3 или -CN;
при условии, что:
когда z1 представляет собой -CH-, z2 представляет собой -C-, z3 представляет собой -О-, z4 представляет собой -N-, R18 представляет собой одиночную электронную пару, R17 представляет собой группу общей формулы (V), и R21 представляет собой -CH3 или -C2H5; тогда R20 представляет собой -F, -CH2OMe или -CF2CF3;
когда z1 представляет собой -CH-, z2 представляет собой -C-, z3 представляет собой -N-, z4 представляет собой -N-, R17 представляет собой группу общей формулы (V), R21 представляет собой -CH3 или -C2H5, и R20 представляет собой -CH3, -C2H5; -CH2OH, -CH2SCH3, -SCH3 или -SC2H5, и R18 представляет собой фенильное кольцо;
тогда такое фенильное кольцо замещено группой, которая выбрана из группы, состоящей из -CN, -COORM, С3-С6циклоалкила, группы -O-(C1-C6алкил), -O-(С3-С6циклоалкил), -S-(C1-C6алкил), -S-(С3-С6циклоалкил), -NRHRJ, -N(RL)(C2-C6алкилен)-NRHRJ, -N(RL)(C3-C7циклоалкилен)-NRHRJ, -(C3-C7циклоалкилен)-NRHRJ, -O-(C3-C7циклоалкилен)-NRHRJ, -S-(C2-C6алкилен)-NRHRJ, -S-(C3-C7циклоалкилен)-NRHRJ, -N(RL)C(O)-(C1-C6алкилен)-NRHRJ, -N(RL)C(O)-(C3-C7циклоалкилен)-NRHRJ, -С(O)N(RL)(C2-C6алкилен)-NRHRJ, -C(O)N(RL)-(C3-C7циклоалкилен)-NRHRJ, -C(O)N(RL)-(C2-C6алкилен)-ORM, -C(O)N(RL)-(C3-C7циклоалкилен)-ORM, -N(RL)C(O)NRHRJ, -C(O)NRHRJ, -N(RL)C(O)N(RL)-(C2-C6алкилен)-NRHRJ, -N(RL)C(O)N(RL)-(C3-C7циклоалкилен)-NRHRJ, -O-(C2-C6алкилен)-ORM, -O-(C3-C7циклоалкилен)-ORM, -S-(C2-C6алкилен)-ORM, -S-(C3-C7циклоалкилен)-ORM, -N(RL)S(O)2-(C1-C6алкилен)-NRHRJ, -N(RL)S(O)2-(C3-C7циклоалкилен)-NRHRJ, -S(O)2N(RL)-(C2-C6алкилен)-NRHRJ, -S(O)2N(RL)-(C3-C7циклоалкилен)-NRHRJ, -S(O)2N(RL)-(C2-C6алкилен)-ORM, -S(o)2N(RL)-(C3-C7циклоалкилен)-ORM, -N(RL)S(O)2-(C2-C6алкилен)-ORM, -N(RL)S(O)2-(C3-C7циклоалкилен)-ORM, -S(O)2N(RHRJ), -N(RL)S(O)2RL, -N(RL)C(O)RL, SRL, -(C3-C7гетероциклоалкил), (C5-C7гетероциклоалкил)-(C1-C6алкил) и (C5-C7гетероциклоалкил)-(С3-С6циклоалкил); где любой такой фрагмент. представляющий собой C1-C6алкил, С3-С6циклоалкил, -(C2-C6алкилен)-, -(C3-C7циклоалкилен)-, -(C3-C7гетероциклоалкил), (C5-C7гетероциклоалкил)-(C1-C6алкил), (C5-C7гетероциклоалкил)-(С3-С6циклоалкил) и (C5-C7гетероциклоалкил)карбонил, в вышеперечисленных группах может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, -ORM или галоген;
или такое фенильное кольцо замещено группой, которая представляет собой -(C1-C6алкилен)-NRHRJ,) или -O-(C2-C6алкилен)-NRHRJ, где RH и RJ, которые не являются оба водородом, в каждом случае независимо представляют собой водород, C1-C6алкил или С3-С6циклоалкил, где такой C1-C6алкил или С3-С6циклоалкил замещен группой -ORM, -CN или галоген; альтернативно RH и RJ могут образовывать, вместе с атомом азота, к которому они присоединены, 5-11-членную насыщенную гетероциклическую моноциклическую или бициклическую кольцевую систему, в которой указанное 5-11-членное насыщенное гетероциклическое моноциклическое или бициклическое кольцо замещено одной или более группами -ORM, -CN, галоген, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил возможно замещен группой C1-C3алкил, C3-C7циклоалкил, -ORM, -CN или галоген; и где возможно указанное 5-11-членное насыщенное моноциклическое или бициклическое гетероциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-C6алкилом или С3-С6циклоалкилом, где любой такой C1-C6алкил или C3-C6циклоалкил может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, -ORM, -CN или галоген;
или такое фенильное кольцо замещено группой (С5-C7гетероциклоалкил)-(C1-C6алкил), которая замещена группой C1-C6алкил, C3-C7циклоалкил, -ORM или галоген;
или такое фенильное кольцо замещено группой -ORL, где RL представляет собой C1-C6алкил или С3-С6циклоалкил, где такой C1-C6алкил или С3-С6циклоалкил возможно замещен группой C1-C3алкил, -ORM, -CN или галоген;
или такое фенильное кольцо замещено группой C1-C6алкил, которая замещена группой C3-C7циклоалкил, ORM или галоген;
и
когда R19 представляет собой морфолиновое кольцо, и Т представляет собой -CR28= или -N=; тогда R22, если он присутствует в орто-положении относительно группы Т ароматического кольца, представляет собой -CH3 или -CN.
В другом аспекте изобретение включает фармацевтические композиции, содержащие соединение по изобретению вместе с одним или более чем одним фармацевтически приемлемым носителем и/или эксципиентом. Особенно предпочтительными являются композиции, изготовленные с возможностью ингаляции для легочного введения.
В другом аспекте изобретение включает применение соединения по изобретению для лечения заболеваний или состояний, при которых полезно ингибирование активности MAP-киназы p38. Лечение обструктивных или воспалительных заболеваний дыхательных путей является предпочтительным применением. Все формы обструктивных или воспалительных заболеваний дыхательных путей являются потенциально излечимыми с помощью соединений по настоящему изобретению, в частности обструктивное или воспалительное заболевание дыхательных путей, которое является представителем, выбранным из группы, состоящей из хронической эозинофильной пневмонии, астмы, COPD, COPD, которая включает хронический бронхит, эмфизему легких или одышку, ассоциированные или не ассоциированные с COPD, COPD, которая характеризуется необратимой прогрессирующей обструкцией дыхательных путей, респираторного дистресс-синдрома взрослых (ARDS), обострения гиперреактивности дыхательных путей после терапии другими лекарственными средствами и заболевания дыхательных путей, которое ассоциировано с легочной гипертензией, хронических воспалительных заболеваний, включая муковисцидоз, бронхоэктаз и фиброз легких (идиопатический). Эффективность прогнозируется, когда ингибиторы p38-киназы вводят либо местно в легкие (например, посредством ингаляции и интраназальной доставки), либо посредством системных путей введения (например, пероральной, внутривенной и подкожной доставки).
Терминология
Использованные здесь термины "галоген" или "галогено" включают атомы фтора, хлора, брома и иода.
Использованный здесь термин "(Cx-Cy)алкил", где x и y представляют собой целые числа, относится к алкильному радикалу с прямой или разветвленной цепью, имеющему от x до y атомов углерода. Таким образом, когда x равен 1, и y равен 6, например, термин включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил.
Использованный здесь термин "(Cx-Cy)алкилен", где x и y представляют собой целые числа, относится к Cx-Cyалкильному радикалу, имеющему всего две ненасыщенные валентности, такому как двухвалентный метиленовый или этиленовый радикал.
Использованный здесь термин "карбоциклический" относится к моно-, би- или трициклическому радикалу, имеющему вплоть до 16 кольцевых атомов, каждый из которых представляет собой углерод, и включает арил и циклоалкил.
Использованный здесь термин "Cz-Ckциклоалкил", где z и k представляют собой целые числа, относится к моноциклическому насыщенному карбоциклическому радикалу, имеющему от z до k атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Термином "Cz-Ckциклоалкил" охватываются радикалы, имеющие две ненасыщенные валентности на том атоме углерода, который связан с любой группой Cx-Cyалкил, Cx-Cyалкилен, Cz-Ckциклоалкил, Cz-Ckциклоалкилен, Cz-Сkгетероциклоалкил, Cz-CkгетероциклоалкилCx-Cyалкил, Cz-CkгетероциклоалкилCz-Ckциклоалкил или (Cz-Ck)гетероциклоалкилкарбонил посредством замены двух атомов водорода, расположенных на том же самом углероде. В такой ситуации этот радикал образует гем-дизамещенную или спиро-систему вместе с такой группой Cx-Cyалкил, Cx-Cyалкилен Cz-Ckциклоалкил, Cz-Ckциклоалкилен, Cz-Ckгетероциклоалкил, Cz-CkгетероциклоалкилCx-Cyалкил, Cz-CkгетероциклоалкилCz-Ckциклоалкил или (Cz-Ck)гетероциклоалкилкарбонил, с которой он связан.
Термин "Cz-Ckциклоалкиленовый радикал" относится к Cz-Ckциклоалкильному радикалу, имеющему две ненасыщенные валентности на разных атомах углерода в цикле, такому как 1,3-циклопентилен, 1,4-циклогексилен и 1,4-циклогептилен, которые указаны ниже:
 .
.
Использованный здесь неограниченный термин "арил" относится к моно- или бициклическому карбоциклическому ароматическому радикалу и включает радикалы, имеющие два моноциклических карбоциклических ароматических кольца, которые непосредственно соединены ковалентной связью. Примерами таких радикалов являются фенил, бифенил и нафтил.
Использованный здесь неограниченный термин "гетероарил" относится к моно- или бициклическому ароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N и О, и включает радикалы, имеющие два таких моноциклических кольца или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые сконденсированы посредством общей связи. Иллюстративными примерами 5,6-членного гетероарила являются тиенил, фурил, пирролил, имидазолил, тиазолил, изотиазолил, пиразолил, оксазолил, изоксазолил, изотиазолил, триазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил и триазинил. Иллюстративными примерами 8,10-членного гетероарила являются бензотиенил, бензофурил, бензимидазолил, бензотиазолил, бензизотиазолил, бензоксазолил, бензизоксазолил, бензотриазолил, индолил и индазолил.
Использованный здесь неограниченный термин "гетероциклил" или "гетероциклический" относится к насыщенному моно-, би- или трициклическому неароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N и О. В частности, термин "Cz-Ckгетероциклоалкил" относится к моноциклическим (Cz-Ck)циклоалкильным группам, в которых по меньшей мере один кольцевой атом углерода заменен гетероатомом (например, N, NH, S или О). Примеры (Cz-Ck)гетероциклоалкила включают пирролидинил, тиазолидинил, пиперазинил, пиперидинил, морфолинил, тиоморфолинил.
Аналогично, термин "Cz-Ckгетероциклоалкилен" относится к двухвалентному Cz-Ckгетероциклоалкильному радикалу, где Cz-Сkгетероциклоалкил является таким, как определено выше.
Термин "Cz-CkгетероциклоалкилCx-Cyалкил" относится к определенной выше группе "Cx-Cyалкил", где один или более атомов водорода заменены одной или более группами "Cz-Ckгетероциклоалкил". Термин "Cz-CkгетероциклоалкилCx-Cyалкил" охватывает системы, где два атома водорода, связанные с одним и тем же атомом углерода в группе "Cz-Cyалкил", заменены одной группой "Cz-Ckгетероциклоалкил". Такой радикал таким образом образует гем-дизамещенную систему "Cz-CkгетероциклоалкилCx-Cyалкил", такую как 1,2-диметил-пирролидин-2-ильный радикал.
Термин "Cz-CkгетероциклоалкилCz-Ckциклоалкил" относится к определенной выше группе "Cz-Ckциклоалкил", где один или более атомов водорода заменены одной или более группами "Cz-Ckгетероциклоалкил".
Выражение "(Cz-Ck)циклоалкилкарбонил" относится к группам (Cz-Ck)циклоалкил-CO-, где группа "(Cz-Ck)циклоалкил" имеет определенное выше значение.
Выражение "(Cz-Ck)гетероциклоалкилкарбонил" относится к группам (Cz-Ck)гетероциклоалкил-СО-, где группа "(Cz-Ck)гетероциклоалкил" имеет определенное выше значение.
Если не оговорено особо в контексте, в котором он встречается, термин "замещенный", который использован здесь в отношении любой арильной или гетероарильной группировки, означает замещенный по меньшей мере одним заместителем, например, выбранным из (C1-C6)алкила, (C1-C6)фторалкила, (C1-C6)алкокси (включая замещение метилендиокси и этилендиокси по смежным атомам углерода ароматического кольца), (C1-C6)фторалкокси, групп (C1-C6)алкокси-(C1-C6)алкил, бензилокси-(C1-C6)алкил, (C1-C6)алкокси-(C1-C6)алкокси, бензилокси-(C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкил, гидрокси(C1-C6)алкокси, гидрокси(C1-C6)алкилтио, меркапто, меркапто(C1-C6)алкил, (C1-C6)алкилтио, циклопропил, галоген (включая фтор и хлор), O-бензил, нитро, нитрил (циано), -СООН, тетразолил, -COORa, -CORb, -SO2Ra, -CONH2, -SO2NH2, -CONHRa, -SO2NHRa, -CONRaRb, -SO2NRaRb, -NH2, -NHRa, -NRaRb, -OCONH2, -OCONHRa, -OCONRaRb, -NHCORa, -NHCOORa, -NRbCOORa, -NHSO2ORa, -NRbSO2ORa, -NRaCONH2, -NHCONHRb, -NRaCONHRb, -NHCONRaRb или -NRaCONRaRb, где Ra и Rb независимо представляют собой группу (C1-C4)алкил, или Ra и Rb, когда они присоединены к одному и тому же атому азота, могут образовывать вместе с этим атомом азота циклическую аминогруппу, такую как морфолинильная, пиперидинильная или пиперазинильная группа. "Возможный заместитель" может представлять собой одну из замещающих групп, включенных в вышеприведенное описание.
Соединения по изобретению могут существовать в одной или более чем одной геометрической, оптической, энантиомерной, диастереомерной и таутомерной форме, включая, без ограничения ими, цис- и транс-формы, Е- и Z-формы, R-, S- и мезо-формы, кето- и енольные формы. Если не оговорено особо, ссылка на конкретное соединение включает все такие изомерные формы, в том числе их рацемические и другие смеси. Когда это целесообразно, такие изомеры могут быть выделены из их смесей путем использования или адаптации известных способов (например, хроматографических методик и методик перекристаллизации). Когда это целесообразно, такие изомеры могут быть получены путем использования или адаптации известных способов (например, ассиметрического синтеза).
В данном описании использование звездочки "*" в определении структурной формулы указывает на точку присоединения для группы радикалов к остальной части молекулы.
Использованный здесь термин "соль" включает соли присоединения оснований, соли присоединения кислот и соли аммония. Как кратко упомянуто выше, соединения по изобретению, которые являются кислотными, могут образовывать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроксиды щелочных металлов, например гидроксиды натрия и калия; гидроксиды щелочноземельных металлов, например гидроксиды кальция, бария и магния; с органическими основаниями, например N-метил-D-глюкамином, холином, трис(гидроксиметил)аминометаном, L-аргинином, L-лизином, N-этилпиперидином, дибензиламином и им подобными. Те соединения по изобретению, которые являются основными, могут образовывать соли, включая фармацевтически приемлемые соли, с неорганическими кислотами, например с галогенводородными кислотами, такими как соляная или бромистоводородная кислоты, серной кислотой, азотной кислотой или фосфорной кислотой и им подобными, и с органическими кислотами, например с муравьиной, уксусной, трифторуксусной, винной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфоновой, пара-толуолсульфоновой, бензойной, бензолсульфоновой, глутаминовой, молочной и миндальной кислотами и им подобными. Те соединения (I), которые имеют основной азот, могут также образовывать четвертичные аммониевые соли с фармацевтически приемлемым противоионом, таким как аммоний, хлорид, бромид, ацетат, формиат, пара-толуолсульфонат, сукцинат, гемисукцинат, нафталин-бис-сульфонат, метансульфонат, трифторацетат, ксинафоат и им подобные. Для обзора солей см. Handbook of Pharmaceutical Salts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002).
Полагают, что соединения по изобретению могут быть получены в форме гидратов и сольватов. Любая ссылка здесь, включая формулу изобретения, на "соединения, к которым относится изобретение", или "соединения по изобретению", или "настоящие соединения" и тому подобное включает ссылку на гидраты солей и сольваты таких соединений. Термин "сольват" использован здесь для описания молекулярного комплекса, содержащего соединение по изобретению и стехиометрическое количество одной или более чем одной молекулы фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" используют, когда указанный растворитель представляет собой воду.
Отдельные соединения по изобретению могут существовать в нескольких полиморфных формах и могут быть получены в различных формах кристаллов и сокристаллов, и все они включены в значение термина «соединения по изобретению».
Соединения также могут быть введены в форме пролекарств. Таким образом, некоторые производные соединений, которые могут быть активны сами по себе или могут сами иметь небольшую активность или не иметь фармакологической активности вообще, могут при введении в организм или нанесении на тело превращаться в соединения по изобретению, имеющие требуемую активность, посредством, например, гидролитического расщепления. Такие производные называют "пролекарствами". Дополнительную информацию по применению пролекарств можно найти в Prodrugs as Novel Delivery Systems. Vol.14, ACS Symposium Series (T. Higuchi and V.J. Stella) и Bioreversible Carriers in Drug Design. Pergamon Press, 1987 (ed. E. B. Roche, American Pharmaceutical Association; C.S. Larsen and J. ∅stergaard, Design and application of prodrugs, In Textbook of Drug Design and Discovery, 3rd Edition, 2002, Taylor and Francis).
Пролекарства согласно изобретению могут быть получены, например, посредством замены соответствующих функциональных групп, присутствующих в соединениях формулы (I), определенными группировками, известными специалистам в данной области техники в качестве "про-группировок", как описано, например, в Design of Prodrugs by H. Bundgaard (Elsevier, 1985). Такие примеры могут представлять собой пролекарства карбоксильной группы (например, -CO-О-CH2-O-CO-tBu, использованное в пивампициллине, пролекарстве ампициллина), амид (-CO-NH-CH2-NAlk2) или амидин (-C(=N-O-CH3)-NH2).
Воплощения изобретения
Следует понимать, что все предпочтительные раскрытые ниже в данном описании группы или воплощения для соединений формулы (I) могут быть скомбинированы между друг другом и применимы также к соединениям формулы (IA), (IB), (Ia), (Ib) или (Ic), как определено ниже, при внесении необходимых изменений.
В одном воплощении предложены соединения формулы (Ia), которые представляют собой соединения формулы (I), как они определены выше, где углеродный стереогенный центр на циклоалкиленовой части кольца A, которая связана с группой W и обозначена цифрой (1) ниже, обладает абсолютной конфигурацией, представленной ниже:

В другом воплощении предложены соединения формулы (Ib), которые представляют собой соединения формулы (I), как определено выше, где углеродные стереогенные центры на циклоалкиленовой части кольца A, которые связаны с группами W и Y и обозначены, соответственно, цифрами (1) и (2) ниже, обладают абсолютной конфигурацией, представленной ниже:

В другом воплощении предложены соединения формулы (Ic), которые представляют собой соединения формулы (I), как определено выше, где углеродные стереогенные центры на циклоалкиленовой части кольца A, которые связаны с группами W и Y и обозначены, соответственно, цифрами (1) и (2) ниже, обладают абсолютной конфигурацией, представленной ниже:

В одном воплощении W представляет собой NH или O. В другом воплощении W представляет собой NH.
В одном воплощении Y представляет собой группу -S(O)p-, группу -O(CR3R4)n-, группу -(CR5R6)n- или группу -NR7-; p равен нулю, и n равен 0, 1 или 2. В другом воплощении Y представляет собой группу -S(O)p- или группу -O(CR3R4)n; р равен нулю, и n равен 0 или 1. В дополнительном воплощении Y представляет собой группу -O(CR3R4)n-, и n равен 0.
В одном воплощении каждый из R3, R4, R5 и R6 независимо представляет собой водород, фтор или C1-C6алкил. В дополнительном воплощении R3, R4, R5 и R6 представляют собой водород.
В одном воплощении R7 представляет собой водород, C1-C6алкил или C3-C7циклоалкил.
В одном воплощении R7 представляет собой водород.
В одном воплощении A представляет собой двухвалентный циклоалкиленовый радикал, имеющий 5 или 6 кольцевых атома; где указанное циклоалкиленовое кольцо присоединено к W и Y и конденсировано с фенильным кольцом или с моноциклическим гетероарильным кольцом, имеющим 5 или 6 кольцевых атома, и такое фенильное или гетероарильное кольцо возможно замещено одной или двумя группами R24.
В дополнительном воплощении A представляет собой группу, выбранную из группы, состоящей из:

 .
.
В еще одном воплощении A представляет собой группу:

В дополнительном воплощении A представляет собой группу:
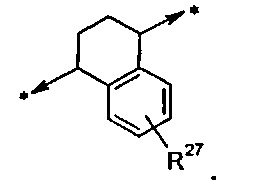
В одном воплощении R27 отсутствует либо, если он присутствует, то в каждом случае независимо выбран из группы, состоящей из C1-C2алкила, -F, -Cl и циано; в дополнительном воплощении R27 отсутствует либо, если он присутствует, то в каждом случае независимо представляет собой метил или -F. В дополнительном воплощении R27 отсутствует.
В одном воплощении R1 представляет собой группу формулы (IIa):
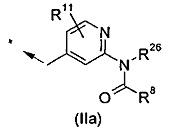 .
.
В одном воплощении R11 представляет собой водород.
В одном воплощении R26 представляет собой водород, -CH3 или -C2H5; в другом воплощении R26 представляет собой водород или -CH3; в дополнительном воплощении R26 представляет собой водород.
В одном воплощении R8 представляет собой -(C1-C6алкилен)-NRARB, -N(RARB), -N(RC)-(C2-C6алкилен)-NRARB, -N(RC)-(C3-C7циклоалкилен)-NRARB или -RC; в другом воплощении R8 представляет собой -RC.
В одном воплощении R8 представляет собой -CH2-ОМе.
В другом воплощении R1 представляет собой группу формулы (IIb):
 .
.
В одном воплощении X1 представляет собой атом азота или группу -CH-; в другом воплощении X1 представляет собой атом азота; в другом воплощении X1 представляет собой группу -CH-.
В одном воплощении R12 представляет собой водород.
В одном воплощении R9 представляет собой C1-C6алкил, С3-С6циклоалкил, фенил, который является возможно замещенным, 5- или 6-членный моноциклический гетероарил, который является возможно замещенным. В дополнительном воплощении R9 представляет собой C1-C6алкил, С3-С6циклоалкил. В еще одном дополнительном воплощении R9 представляет собой C1-C6алкил, например изопропил. В другом воплощении R9 представляет собой фенил, который возможно замещен одним или двумя атомами галогена, например хлора.
В другом воплощении R9 представляет собой радикал формулы (IIIa) или (IIIb)
 .
.
В другом воплощении R1 представляет собой группу формулы (IIc):
 .
.
В одном воплощении X2 представляет собой атом азота или группу -CH-;
в другом воплощении X2 представляет собой группу -CH-.
В одном воплощении R13 представляет собой водород.
В одном воплощении R10 представляет собой C1-C6алкил, С3-С6циклоалкил, фенил, который является возможно замещенным, 5- или 6-членный моноциклический гетероарил, который является возможно замещенным. В дополнительном воплощении R10 представляет собой C1-C6алкил, С3-С6циклоалкил. В еще одном дополнительном воплощении R10 представляет собой C1-C6алкил.
В другом воплощении R10 представляет собой радикал формулы (IIIa) или (IIIb)
 .
.
В одном воплощении R2 представляет собой радикал формулы (IVa):
 .
.
В одном воплощении R14 выбран из группы, состоящей из -F, -CH2OMe и -CF2CF3.
В одном воплощении R15 и R16 независимо представляют собой -CH3 или -C2H5; в другом воплощении R15 и R16 представляют собой -CH3.
В другом воплощении R2 представляет собой радикал формулы (IVb):
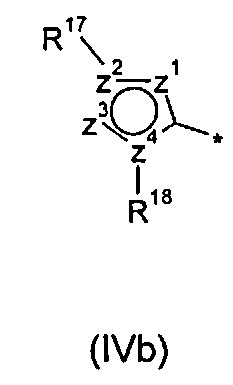 .
.
В одном воплощении R17 выбран из группы, состоящей из одиночной электронной пары, водорода, -CF3, -NRE1RF1, групп -(С3-С6циклоалкил), -(C4-C6гетероциклоалкил), арил или гетероарил, где любой такой -(C3-C7циклоалкил), -(C4-C6гетероциклоалкил), арил или гетероарил может быть возможно замещен группой метил, изопропил или галоген. В другом воплощении R17 выбран из группы, состоящей из одиночной электронной пары, водорода, -CF3, морфолина, циклогексила, фенила или пиридила.
В другом воплощении R17 представляет собой группу общей формулы (IV)
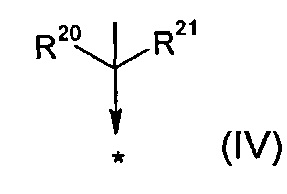 .
.
В одном воплощении R20 выбран из группы, состоящей из -F, -CH3, -CH2OH, -CH2OMe и -CH2SCH3; в другом воплощении R20 выбран из группы, состоящей из -CH3, -CH2OH и -CH2OMe. В другом воплощении R20 представляет собой -CH3.
В одном воплощении R21 представляет собой -CH3.
В другом воплощении R20 и R21, как они определены выше, могут образовывать вместе с атомом углерода, к которому они присоединены, циклогексановое или циклопропильное кольцо; в другом воплощении R20 и R21, как они определены выше, могут образовывать вместе с атомом углерода, к которому они присоединены, циклопропильное кольцо.
В одном воплощении каждый из RE1 и RF1 независимо представляет собой C1-C3алкил, возможно замещенный группой C1-C2алкил, -ORG, CN или галоген. В дополнительном воплощении каждый из RE1 и RF1 независимо представляет собой C1-C3алкил.
В другом воплощении RE1 и RF1 вместе с атомом азота, к которому они присоединены, образуют 5-6-членную насыщенную моноциклическую или бициклическую кольцевую систему, возможно содержащую дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-C2алкилом или C3-C7циклоалкилом. В дополнительном воплощении RE1 и RF1 вместе с атомом азота, к которому они присоединены, образуют морфолин, пиран, фуран, пиперидин, пирролидин или пиперазин, в котором, когда возможно, атом азота возможно замещен метилом.
В одном воплощении R18 представляет собой фенил, который возможно замещен группой -CN, ОН, галоген, COORM, C1-C6алкил, С3-С6циклоалкил, -О-(C1-C6алкил), -О-(С3-С6циклоалкил), -S-(C1-C6алкил), -S-(С3-С6циклоалкил), -NRHRJ, -N(RL)(C2-C6алкилен)-NRHRJ, -N(RL)(C3-C7циклоалкилен)-NRHRJ, -(C1-C6алкилен)-NRHRJ, -(C3-C7циклоалкилен)-NRHRJ, -O-(C2-C6алкилен)-NRHRJ, -О-(C3-C7циклоалкилен)-NRHRJ, -S-(C2-C6алкилен)-NRHRJ, -S-(C3-C7циклоалкилен)-NRHRJ, -N(RL)C(O)-(C1-C6алкилен)-NRHRJ, -N(RL)С(O)-(C3-C7циклоалкилен)-NRHRJ, -C(O)N(RL)-(C2-C6алкилен)-NRHRJ, С(O)N(RL)-(C3-C7циклоалкилен)-NRHRJ, -C(O)N(RL)-(C2-C6алкилен)-ORM, -C(O)N(RL)-(C3-C7циклоалкилен)-ORM, -N(RL)C(O)N(RHRJ), -C(O)N(RHRJ), -N(RL)C(O)N(RL)-(C2-C6алкилен)-NRHRJ, -N(RL)C(O)N(RL)-(C3-C7циклоалкилен)-NRHRJ, -O-(C2-C6алкилен)-ORM, -O-(C3-C7циклоалкилен)-ORM, -S-(C2-C6алкилен)-ORM, -S-(C3-C7циклоалкилен)-ORM, -N(RL)S(O)2-(C1-C6алкилен)-NRHRJ, -N(RL)S(O)2-(C3-C7циклоалкилен)-NRHRJ, -S(O)2N(RLHC2-C6алкилен)-NRHRJ, -S(O)2N(RL)-(C3-C7циклоалкилен)-NRHRJ, -S(О)2N(RL)-(C2-C6алкилен)-ORM, -S(O)2N(RL)-(C3-C7циклоалкилен)-ORM, -N(RL)S(O)2-(C2-C6алкилен)-ORM, -N(RL)S(O)2-(C3-C7циклоалкилен)-ORM, -S(O)2N(RHRJ), -N(RL)S(O)2RL, -N(RL)C(O)RL, ORL, SRL, -(C3-C7гетероциклоалкил), (C5-C7гетероциклоалкил)-(C1-C6алкил) и (C5-C7гетероциклоалкил)-(С3-С6циклоалкил), где любой такой фрагмент, представляющий собой C1-C6алкил, С3-С6циклоалкил, -(C2-C6алкилен)-, -(C3-C7циклоалкилен)-, -(C3-C7гетероциклоалкил), (C5-C7гетероциклоалкил)-(C1-C6алкил), (C5-C7гетероциклоалкил)-(С3-С6циклоалкил) и (C5-C7гетероциклоалкил)карбонил, в вышеперечисленных группах может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, -ORM или галоген.
В другом воплощении R18 представляет собой -(C1-C6алкил) или -(C3-C7циклоалкил).
В одном воплощении z1 представляет собой -CH-, z2 представляет собой C, z3 и z4 представляют собой N; в другом воплощении z1 представляет собой O, z2 представляет собой C, z3 и z4 представляют собой N; в другом воплощении z1 представляет собой -CH-, z2 и z3 представляют собой N, и z4 представляет собой -CH-; в дополнительном воплощении z1 представляет собой N, z2 представляет собой C, z3 представляет собой N, и z4 представляет собой O; в еще одном воплощении z1 представляет собой N, z2 представляет собой С, z3 представляет собой O, и z4 представляет собой N.
В дополнительном воплощении R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой O, z2 представляет собой С, z3 представляет собой N, z4 представляет собой N, R18 представляет собой одиночную пару, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, и R21 представляет собой -CH3.
В другом воплощении R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой N, z2 представляет собой С, z3 представляет собой N, z4 представляет собой O, R18 представляет собой одиночную пару, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, и R21 представляет собой -CH3.
В дополнительном воплощении R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой -CH-, z2 представляет собой N, z3 представляет собой N, z4 представляет собой -C-, R18 представляет собой водород, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, и R21 представляет собой -CH3.
В дополнительном воплощении R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой -CH-, z2 представляет собой N, z3 представляет собой N, z4 представляет собой -C-, R18 представляет собой водород, и R17 представляет собой арил, который возможно замещен группой (C1-C6)алкил.
В дополнительном воплощении R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой -CH-, z2 представляет собой С, z3 и z4 представляют собой N, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, и R21 представляет собой -CH3.
В другом воплощении R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой -CH-, z2 представляет собой C, z3 и z4 представляют собой N, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, R21 представляет собой -CH3, и где
R18 представляет собой фенил, который замещен группой, представляющей собой -(C1-C6алкилен)-NRHRJ или -О-(C2-C6алкилен)-NRHRJ, где RH и RJ, которые не являются оба водородом, в каждом случае независимо представляют собой водород, C1-C6алкил или С3-С6циклоалкил, где такой C1-C6алкил или С3-С6циклоалкил замещен группой ORM, CN или галоген; альтернативно RH и RJ вместе с атомом азота, к которому они присоединены, могут образовывать 5-11-членную насыщенную моноциклическую или бициклическую гетероциклическую кольцевую систему, в которой указанное 5-11-членное насыщенное моноциклическое или бициклическое кольцо замещено одной или более группами ORM, CN, галоген, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил возможно замещен группой C1-C3алкил, C3-C7циклоалкил, ORM, CN или галоген; и где возможно указанное 5-11-членное насыщенное моноциклическое или бициклическое гетероциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-C6алкилом или С3-С6циклоалкилом, где любой такой алкил или циклоалкил может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, ORM, CN или галоген;
или где R18 представляет собой фенил, который замещен группой (C5-C7гетероциклоалкил)-(C1-C6алкил), которая замещена группой C1-C6алкил, C3-C7циклоалкил, ORM или галоген;
или где R18 представляет собой фенил, который замещен группой C1-C6алкил, который замещен группой C3-C7циклоалкил, -ORM или галоген;
или где R18 представляет собой фенил, который замещен группой -CN, -О-(C1-C6алкил), -NRHRJ, -O-(C2-C6алкилен)-ORM, -S-(C2-C6алкилен)-ORM, -(C3-C7гетероциклоалкил), где любой такой фрагмент, представляющий собой C1-C6алкил, -(C2-C6алкилен)-, -(C3-C7гетероциклоалкил), вышеперечисленных групп может быть возможно замещена группой C1-C6алкил, C3-C7циклоалкил, ORM или галоген.
В дополнительном воплощении R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой -CH-, z2 представляет собой С, z3 и z4 представляют собой N, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, и R21 представляет собой -CH3,. и R18 представляет собой гетероарильной кольцо, которое возможно замещено группой (C5-C7гетероциклоалкил)-(C1-C6алкил), которая возможно замещена группой C1-C6алкил, C3-C7циклоалкил, ORM или галоген; или R18 представляет собой гетероарильное кольцо, которое возможно замещено группой -(C1-C6алкилен)-NRHRJ или -O-(C2-C6алкилен)-NRHRJ.
В дополнительном воплощении R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой -CH-, z2 представляет собой С, z3 и z4 представляют собой N, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, и R21 представляет собой -CH3, и R18 представляет собой группу -(C1-C6алкил), возможно замещенную группой -ОН, галоген или -NRHRJ; или группу (C5-C7гетероциклоалкил) или (C5-C7гетероциклоалкил)-(C1-C6алкил), которая может быть возможно замещена группой C1-C6алкил, галоген или -OH.
В дополнительном воплощении R2 представляет собой радикал формулы (IVc):
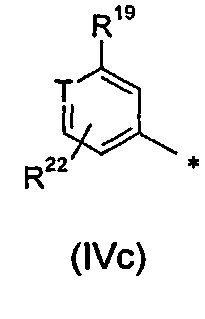 .
.
В одном воплощении R19 выбран из группы, состоящей из водорода, -CF3, -NRERF, групп -(С3-С6циклоалкил), -(С3-С6гетероциклоалкил), арил и гетероарил, где любой такой -(С3-С6циклоалкил), -(С3-С6 гетероциклоалкил), арил или гетероарил может быть возможно замещен группой C1-C2алкил, С3-С6циклоалкил или галоген. В другом воплощении R19 выбран из группы, состоящей из водорода, -CF3, морфолина, циклогексила, фенила или пиридила, где любой такой морфолин, циклогексил, фенил или пиридил может быть возможно замещен группой метил, -F или -Cl.
В другом воплощении R19 представляет собой группу общей формулы (V)
 .
.
В одном воплощении T представляет собой -N=. В другом воплощении T представляет собой -CR28=.
В одном воплощении R22 представляет собой H, F, -Cl, -CH3 или -CN; в другом воплощении R22 представляет собой H или F.
В одном воплощении R23 представляет собой H, F, -Cl, -CH3 или -CN; в другом воплощении R23 представляет собой -Cl.
В одном воплощении предложены соединения формулы (IA), где W представляет собой NH, Y представляет собой группу -O(CR3R4)n-, и равен 0, A представляет собой группу:
 ,
,
R1 представляет собой группу формулы (IIb):
 ,
,
где X1 представляет собой группу -CH-; R12 представляет собой водород; R9 представляет собой C1-C6алкил, С3-С6циклоалкил, фенил, который является возможно замещенным, или 5- или 6-членный моноциклический гетероарил, который является возможно замещенным;
R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой -CH-, z2 представляет собой C, z3 и z4 представляют собой N, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, и R21 представляет собой -CH3,. и R18 представляет собой группу -(C1-C6алкил), возможно замещенную группой -OH, галоген или -NRHRJ; или группу (C5-C7гетероциклоалкил) или (C5-C7гетероциклоалкил)-(C1-C6алкил), которая может быть возможно замещена группой C1-C6алкил, галоген или -ОН.
В одном воплощении предложены соединения формулы (IB), где W представляет собой NH, Y представляет собой группу -O(CR3R4)n-, и n равно 0, A представляет собой группу:
 ,
,
R1 представляет собой группу формулы (IIb):
 ,
,
где X1 представляет собой группу -CH-; R12 представляет собой водород; R9 представляет собой C1-C6алкил, С3-С6циклоалкил, фенил, который является возможно замещенным, или 5- или 6-членный моноциклический гетероарил, который является возможно замещенным;
R2 представляет собой радикал формулы (IVb):
 ;
;
где z1 представляет собой -CH-, z2 представляет собой С, z3 и z4 представляют собой N, и R17 представляет собой группу общей формулы (V)
 ,
,
где R20 представляет собой -CH3 или -CH2OH, и R21 представляет собой -CH3; и где
R18 представляет собой фенил, который замещен группой, которая представляет собой -(C1-C6алкилен)-NRHRJ или -O-(C2-C6алкилен)-NRHRJ, где RH и RJ, которые не являются оба водородом, в каждом случае независимо представляют собой водород, C1-C6алкил или С3-С6циклоалкил, где такой C1-C6алкил или С3-С6циклоалкил замещен группой ORM, CN или галоген; альтернативно RH и RJ могут образовывать, вместе с атомом азота, к которому они присоединены, 5-11-членную насыщенную моноциклическую или бициклическую кольцевую систему, в которой указанное 5-11-членное насыщенное моноциклическое или бициклическое кольцо замещено одной или более группами ORM, CN, галоген, C1-C6алкил или C3-C7циклоалкил, где такой C1-C6алкил и C3-C7циклоалкил возможно замещен группой C1-C3алкил, C3-C7циклоалкил, ORM, CN или галоген; и где возможно указанное 5-11-членное насыщенное моноциклическое или бициклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-C6алкилом или С3-С6циклоалкилом, где любой такой алкил или циклоалкил может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, ORM, CN или галоген;
или где R18 представляет собой фенил, который замещен группой (C5-C7гетероциклоалкил)-(C1-C6алкил), которая замещена группой C1-C6алкил, C3-C7циклоалкил, ORM или галоген;
или где R18 представляет собой фенил, который замещен группой C1-C6алкил, которая замещена группой C3-C7циклоалкил, -ORM или галоген;
или где R18 представляет собой фенил, который замещен группой -CN, -O-(C1-C6алкил), -NRHRJ, -O-(C2-C6алкиле)-ORM, -S-(C2-C6алкилен)-ORM, -(C3-C7гетероциклоалкил), где любой такой фрагмент, представляющий собой C1-C6алкил, -(C2-C6алкилен)-, -(C3-C7гетероциклоалкил), вышеперечисленных групп может быть возможно замещен группой C1-C6алкил, C3-C7циклоалкил, ORM или галоген.
В одном воплощении соединение формулы (I) выбрано из перечня, состоящего из следующих соединений:
1-(5-трет-бутил-2-(4-метокси-фенил)-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(5-трет-бутил-2-метил-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-{5-трет-бутил-2-[3-(2-гидроксиэтилсульфанил)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-{5-трет-бутил-2-[3-(2-гидрокси-этокси)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(5-трет-бутил-[1,3,4]оксадиазол-2-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-3-(1-п-толил-1Н-пиразол-4-ил)-мочевина;
1-(4-хлор-3-трифторметил-фенил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(3-трет-бутил-[1,2,4]оксадиазол-5-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(4-гидроксиметил-фенил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-{5-трет-бутил-2-[3-(4,4-дифтор-пиперидин-1-илметил)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина и
1-(5-трет-бутил-2-{4-[2-(4-метил-пиперазин-1-ил)-этокси]-фенил}-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
или их фармацевтически приемлемой соли.
В другом воплощении соединение формулы (I) выбрано из перечня, состоящего из следующих соединений:
1-(5-трет-бутил-2-(4-метокси-фенил)-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(5-трет-бутил-2-метил-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-{5-трет-бутил-2-[3-(2-гидроксиэтилсульфанил)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-{5-трет-бутил-2-[3-(2-гидрокси-этокси)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(5-трет-бутил-[1,3,4]оксадиазол-2-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-3-(1-п-толил-1Н-пиразол-4-ил)-мочевина;
1-(4-хлор-3-трифторметил-фенил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(3-трет-бутил-[1,2,4]оксадиазол-5-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(4-гидроксиметил-фенил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-{5-трет-бутил-2-[3-(4,4-дифтор-пиперидин-1-илметил)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина и
1-(5-трет-бутил-2-{4-[2-(4-метил-пиперазин-1-ил)-этокси]-фенил}-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(4-циано-фенил)-2Н-пиразол-3-ил]-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(4-гидроксиметил-фенил)-2Н-пиразол-3-ил]-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(5-трет-бутил-2-пиперидин-4-ил-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(1-метил-пиперидин-4-ил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(2-морфолин-4-ил-этил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(5-трет-бутил-2-метил-2Н-пиразол-3-ил)-3-[(1S,4R)-7-фтор-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-3-(2-p-толил-2Н-пиразол-3-ил)-мочевина;
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-[(1S,4R)-7-фтор-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(5-трет-бутил-2-{3-[2-(4-гидрокси-пиперидин-1-ил)-этокси]-фенил}-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(3-морфолин-4-ил-фенил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-{5-трет-бутил-2-[1-(2-морфолин-4-ил-этил)-1Н-индазол-6-ил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-{5-трет-бутил-2-[2-(2-морфолин-4-ил-этил)-2Н-индазол-6-ил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина;
1-[5-трет-бутил-2-(2-морфолин-4-ил-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина;
1-[5-трет-бутил-2-(2-диметиламино-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина;
1-[5-трет-бутил-2-(2-пиперидин-1-ил-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина;
1-{5-трет-бутил-2-[2-(4-метил-пиперазин-1-ил)-этил]-2Н-пиразол-3-ил}-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина;
1-[5-трет-бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2-хлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина;
1-[5-трет-бутил-2-(2-морфолин-4-ил-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2-хлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина;
1-(5-трет-бутил-2-метил-2Н-пиразол-3-ил)-3-{(1S,4R)-4-[3-(2,6-дихлорфенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидронафталин-1-ил]-мочевина;
1-[5-трет-бутил-2-(2-морфолин-4-ил-этил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-циклогексил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина;
1-(5-трет-бутил-2-(3-гидрокси-пропил)-2Н-пиразол-3-ил)-3-{(1S,4R)-4-[3-(2,6-дихлорфенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидронафталин-1-ил]-мочевина;
или их фармацевтически приемлемой соли.
Применение
Как упомянуто выше, соединения по изобретению являются ингибиторами p38MAPK и поэтому могут быть использованы для лечения заболеваний или состояний, при которых полезно ингибирование фермента p38. Такие заболевания и состояния известны из литературы, и некоторые были упомянуты выше. Однако соединения в общем применяют в качестве противовоспалительных агентов, в частности для использования в лечении респираторного заболевания. В частности, соединения могут быть использованы в лечении хронической обструктивной болезни легких (COPD), хронического бронхита, фиброза легких, пневмонии, острого респираторного дистресс-синдрома (ARDS), эмфиземы легких или эмфиземы, вызванной курением, эндогенной (неаллергической) астмы и экзогенной (аллергической) астмы, легкой астмы, умеренной астмы, тяжелой астмы, стероид-резистентной астмы, нейтрофильной астмы, бронхиальной астмы, астмы, вызванной физическоой нагрузкой, профессиональной астмы и астмы, вызванной бактериальной инфекцией, муковисцидоза, легочного фиброза и бронхоэктаза.
В настоящем изобретении предложено применение соединений по изобретению для предупреждения и/или лечения любого заболевания или состояния, при котором полезно ингибирование фермента p38.
В дополнительном аспекте настоящего изобретения предложено применение соединений по изобретению для изготовления лекарственного средства для предупреждения и/или лечения любого заболевания или состояния, при котором полезно ингибирование фермента p38.
Кроме того, в настоящем изобретении предложен способ предупреждения и/или лечения любого заболевания или состояния, при котором полезно ингибирование фермента p38, включающий введение нуждающемуся в таком лечении пациенту терапевтически эффективного количества соединения по изобретению.
Композиции
Как упомянуто выше, соединения, к которым относится изобретение, являются ингибиторами p38-киназы и полезны в лечении некоторых заболеваний, например воспалительных заболеваний дыхательного тракта. Примеры таких заболеваний названы выше и включают астму, ринит, аллергический синдром дыхательных путей, бронхит и хроническую обструктивную болезнь легких.
Следует понимать, что конкретная доза для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного используемого соединения, возраста, массы тела, общего состояния здоровья, пола, питания, времени введения, пути введения, скорости выведения, комбинации лекарственных средств и тяжести конкретного заболевания, подвергаемого лечению. Оптимальные дозы и частота дозирования будут определены клиническим испытанием, как требуется в области фармацевтики. В целом, диапазон суточной дозы для перорального введения будет находиться в пределах от примерно 0,001 мг до примерно 100 мг на кг массы тела человека, часто от 0,01 мг до примерно 50 мг на кг, например от 0,1 до 10 мг на кг, в виде однократной или в виде разделенных доз. В целом, диапазон суточной дозы для ингаляционного введения будет находиться в пределах от примерно 0,1 мкг до примерно 1 мг на кг массы тела человека, предпочтительно от 0,1 мкг до 50 мкг на кг, в виде однократной или в виде разделенных доз. С другой стороны, в некоторых случаях может быть необходимо использование дозировок вне этих пределов. Для задачи данного изобретения ингаляционное введение является предпочтительным.
Соединения, к которым относится изобретение, могут быть получены для введения посредством любого пути в соответствии с их фармакокинетическими свойствами. Перорально вводимые композиции могут находиться в форме таблеток, капсул, порошков, гранул, лепешек, жидких или гелеобразных препаратов, таких как пероральные, местные или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для перорального введения могут находиться в виде стандартной лекарственной формы и могут содержать традиционные эксципиенты, такие как связующие агенты, например сироп, аравийская камедь, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающее вещество для таблетирования, например стеарат магния, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например картофельный крахмал, или приемлемые увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой согласно способам, хорошо известным в обычной фармацевтической практике. Пероральные жидкие препараты могут находиться в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для разведения водой или другим подходящим носителем перед применением. Такие жидкие препараты могут содержать традиционные вспомогательные вещества, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлоза, крахмальная патока, желатин, гидрированные пищевые жиры; эмульгирующие агенты, например лецитин, сорбитанмоноолеат или аравийская камедь; неводные носители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, сложные эфиры жирных кислот и, например, глицерина, пропиленгликоля или этилового спирта; консерванты, например метил- или пропил-пара-гидроксибензоат или сорбиновая кислота, и при необходимости традиционные ароматизаторы или красители.
Для местного применения на кожу лекарственное средство может быть приготовлено в виде крема, лосьона или мази. Композиции в виде крема или мази, которые могут быть использованы для лекарственного средства, являются традиционными композициями, хорошо известными в данной области техники, например, такими как описано в стандартных пособиях по фармацевтике, таких как Британская Фармакопея.
Активный ингредиент также можно вводить парентерально в стерильной среде. В зависимости от применяемого носителя и концентрации лекарственное средство может быть либо суспендировано, либо растворено в носителе. Предпочтительно в носителе могут быть растворены адъюванты, такие как анестетик местного действия, консервант и буферные агенты.
Однако, для лечения воспалительного заболевания дыхательного тракта соединения по изобретению могут также быть приготовлены в виде препарата для ингаляции, например в виде назального спрея или ингаляторов сухого порошка или аэрозольных ингаляторов. Для доставки посредством ингаляции активное соединение предпочтительно находится в форме микрочастиц. Они могут быть приготовлены различными методами, включая сушку распылением, лиофильную сушку и микронизацию. Получение аэрозоля может быть осуществлено с использованием, например, струйных аэрозольных ингаляторов под давлением или ультразвуковых аэрозольных ингаляторов, предпочтительно при использовании дозированных аэрозолей на основе пропеллента или введения микронизированных активных соединений без пропеллента, например из капсул для ингаляции или других систем доставки "сухого порошка".
В качестве примера, композиция по изобретению может быть приготовлена в виде суспензии для доставки с помощью небулайзера или в виде аэрозоля в жидком пропелленте, например для использования в дозирующем ингаляторе под давлением (PMDI). Пропелленты, подходящие для использования в PMDI, известны специалисту в данной области техники и включают CFC-12 (хлорфторуглерод), HFA-134a (гидрофторалкан), HFA-227, HCFC-22 (CCl2F2) (гидрофторхлоруглерод) и HFA-152 (CH4F2 и изобутан).
В предпочтительном воплощении изобретения композиция по изобретению находится в форме сухого порошка для доставки при использовании ингалятора сухого порошка (DPI). Известно много типов DPI.
Микрочастицы для доставки посредством введения могут быть приготовлены в виде препарата с эксципиентами, которые способствуют доставке и высвобождению. Например, в препарате сухого порошка микрочастицы могут быть приготовлены вместе с крупными частицами носителя, которые способствуют переносу из DPI в легкое. Подходящие частицы носителей известны и включают частицы лактозы; они могут иметь масс-медианный аэродинамический диаметр более чем 90 мкм.
Примером препарата на основе аэрозоля является следующий:
Активные соединения можно дозировать, как описано, в зависимости от используемой системы ингалятора. Помимо активных соединений лекарственные формы могут дополнительно содержать эксципиенты, такие как, например, пропелленты (например, Фриген в случае дозированных аэрозолей), поверхностно-активные вещества, эмульгаторы, стабилизаторы, консерванты, ароматизаторы, наполнители (например, лактозу в случае порошковых ингаляторов) или, при необходимости, дополнительные активные соединения.
Для целей ингаляции доступно большое количество систем, с помощью которых могут быть получены и введены аэрозоли с оптимальным размером частиц при использовании ингаляционного метода, который подходит для пациента. Помимо использования переходников (спейсеры, расширители) и грушевидных контейнеров (например, Nebulator®, Volumatic®) и автоматических устройств, распыляющих спрей (Autohaler®), для дозированных аэрозолей, в частности в случае порошковых ингаляторов, в наличии имеется ряд технических решений (например, Diskhaler®, Rotadisk®, Turbohaler® или ингаляторы, например, как описано в EP-А-0505321). Кроме того, соединения по изобретению можно доставлять в многокамерных устройствах, тем самым делая возможной доставку комбинаций агентов.
Комбинации
Другие соединения можно объединять с соединениями, к которым относится изобретение, для предупреждения и лечения воспалительных заболеваний, в частности респираторных заболеваний. Таким образом, настоящее изобретение также относится к фармацевтическим композициям, содержащим терапевтически эффективное количество соединения по изобретению и одного или более чем одного другого терапевтического агента. Подходящие терапевтические агенты для комбинированной терапии с соединениями по изобретению включают, без ограничения ими: (1) кортикостероиды, такие как пропионат флутиказона, фуроат флутиказона, фуроат мометазона, дипропионат беклометазона, циклесонид, будесонид, GSK 685698, GSK 870086, QAE 397, QMF 149, TPI-1020; (2) агонисты β2-адренорецепторов, такие как сальбутамол, альбутерол, тербуталин, фенотерол, и агонисты β2-адренорецепторов длительного действия, такие как салметерол, индакатерол, формотерол (включая фумарат формотерола), арформотерол, кармотерол, GSK 642444, GSK 159797, GSK 159802, GSK 597501, GSK 678007, AZD3199; (3) комбинированные продукты кортикостероид/β2-агонист длительного действия, такие как салметерол/пропионат флутиказона (адваир/серетид), формотерол/будесонид (симбикорт), формотерол/пропионат флутиказона (флутиформ), формотерол/циклесонид, формотерол/фуроат мометазона, формотерол/дипропионат беклометазона, индакатерол/фуроат мометазона, индакатерол/QAE 397, GSK 159797/GSK 685698, GSK 159802/GSK 685698, GSK 642444/GSK 685698, GSK 159797/GSK 870086, GSK 159802/GSK 870086, GSK 642444/GSK 870086, арформотерол/циклесонид; (4) антихолинергические агенты, например антагонисты мускариновых рецепторов 3 типа (М3), такие как ипратропия бромид, тиотропия бромид, аклидиний (LAS-34273), NVA-237, GSK 233705, даротропий, GSK 573719, GSK 961081, QAT 370, QAX 028, ЕР-101; (5) агенты двойного фармакологического действия М3-антихолинергические агенты/агонисты β2-адренорецепторов, такие как GSK961081, AZD2115 и LAS190792; (6) модуляторы лейкотриенов, например антагонисты лейкотриенов, такие как монтелукаст, зафирлукаст или пранлукаст, или ингибиторы биосинтеза лейкотриенов, такие как зилейтон или BAY-1005, или антагонисты LTB4, такие как амелубант, или ингибиторы FLAP (белка, активирующего 5-липоксигеназу), такие как GSK 2190914, АМ-103; (7) ингибиторы фосфодиэстеразы-IV (PDE-IV) (пероральные или ингаляционные), такие как рофлумиласт, циломиласт, оглемиласт, ONO-6126, тетомиласт, тофимиласт, UK 500001, GSK 256066; (8) антигистамины, например селективные антагонисты Н1-гистаминовых рецепторов, такие как фексофенадин, цетиризин, лоратадин или астемизол, или двойные антагонисты рецепторов Н1/Н3, такие как GSK 835726, GSK 1004723, или селективные антагонисты гистаминовых рецепторов-4 (Н4), такие как ZPL3893787; (9) противокашлевые агенты, такие как кодеин или декстроморфан; (10) муколитический агент, например N-ацетилцистеин или фудостеин; (11) отхаркивающее средство/мукокинетический модулятор, например амброксол, гипертонические растворы (например, физиологический раствор или маннит) или сурфактант; (12) муколитический агент, воздействующий на пептиды, например рекомбинантная человеческая дезоксирибонуклеаза I (дорназа альфа и рчДНКаза) или гелицидин; (13) антибиотики, например азитромицин, тобрамицин и азтреонам; (14) неселективные ингибиторы COX-1/COX-2 (циклооксигеназа), такие как ибупрофен или кетопрофен; (15) ингибиторы COX-2, такие как целекоксиб и рофекоксиб; (16) антагонисты VLA-4 (очень позднего антигена 4), как описано в WO 97/03094 и WO97/02289; (17) ингибиторы ТАСЕ (TNF-альфа-превращающего фермента) и ингибиторы TNF-α, например анти-TNF моноклональные антитела, такие как ремикад и CDP-870, и, TNF рецепторные иммуноглобулиновые молекулы, такие как энбрел; (18) ингибиторы матриксной металлопротеазы, например ММР-12; (19) ингибиторы нейтрофильной эластазы человека, такие как ONO-6818 или такие, которые описаны в WO 2005/026124, WO 2003/053930 и WO 06/082412; (20) антагонисты A2b (аденозиновых рецепторов), как описано в WO 2002/42298; (21) модуляторы функции хемокиновых рецепторов, например антагонисты CCR3 и CCR8; (22) соединения, которые модулируют действие других простаноидных рецепторов, например антагонист тромбоксана А2; антагонисты DP1, такие как МК-0524, антагонисты CRTH2, такие как ODC9101 и AZD1981, и смешанные антагонисты DP1/CRTH2, такие как AMG 009 и AMG853; (23) агонисты PPAR (рецепторов, активируемых пролифераторами пероксисом), включая агонисты PPAR-альфа (такие как фенофибрат), агонисты PPAR-дельта, агонисты PPAR-гамма, такие как пиоглитазон, розиглитазон и балаглитазон; (24) метилксантины, такие как теофиллин или аминофиллин, и комбинации метилксантин/кортикостероид, такие как теофиллин/будесонид, теофиллин/пропионат флутиказона, теофиллин/циклесонид, теофиллин/фуроат мометазона и
теофиллин/дипропионат беклометазона; (25) агонисты А2а, как описано в ЕР 1052264 и ЕР 1241176; (26) антагонисты CXCR2 или IL-8, такие как SCH 527123 или GSK 656933; (27) модуляторы сигнального каскада IL-R (рецептора интерлейкина), такие как кинерет и ACZ 885; (28) антагонисты МСР-1 (моноцитарного хемотаксического белка-1), такие как ABN-912.
Изобретение также относится к набору, содержащему фармацевтические композиции соединений по изобретению самих по себе или в комбинации или в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами и устройство, которое может представлять собой однодозовый или многодозовый ингалятор сухого порошка, дозирующий ингалятор или небулайзер.
Способы синтеза
В одном аспекте настоящего изобретения предложен способ получения соединения по изобретению согласно общим путям синтеза, раскрытым в данном разделе. На следующих далее реакционных схемах, если не указано иное, упомянутые группы имеют такое же значение, как и значения, указанные для соединения формулы (I).
Специалист в данной области может осуществить, где это целесообразно, подходящие изменения в условиях, конкретно раскрытых в экспериментальной части, для того, чтобы адаптировать пути синтеза для получения дополнительных соединений по изобретению. Такие изменения могут включать, без ограничения указанным, использование соответствующих исходных материалов для получения разных соединений, замен растворителя и изменения температуры реакций, замены реагентов с аналогичной химической функцией, введение или удаление стадий введения/снятия защиты функциональных групп, чувствительных к реакционным условиям и реагентам, а также введение или удаление специфических стадий синтеза, ориентированных на дополнительную функционализацию химического остова.
Способы, которые могут быть использованы, и которые описаны и раскрыты в Примерах и на реакционных Схемах, не следует рассматривать как ограничивающие объем способов синтеза, доступных для получения соединений по изобретению.
Описанный способ является особенно приемлемым, поскольку он подходит для того, чтобы быть должным образом смодулированным любым известным специалисту в данной области образом для получения любого целевого соединения по изобретению. Такие варианты входят в объем настоящего изобретения.
Из всего вышеизложенного для специалиста должно быть очевидно, что любые из описанных групп могут присутствовать как таковые или в соответствующим образом защищенной форме.
В частности, функциональные группы, присутствующие в промежуточном соединении и соединениях, и которые могут вызывать нежелательные побочные реакции и образование нежелательных побочных продуктов, должны быть соответствующим образом защищены до того, как будет проведено алкилирование, ацилирование, сочетание или сульфонилирование. Аналогично, после завершения указанных реакций может следование снятие защиты с тех же самых защищенных групп.
В настоящем изобретении, если не указано иное, термин "защитная группа" означает защитную группу, предназначенную для сохранения функции группы, с которой она савязана. Обычно защитные группы используют для защиты функций амино, гидроксила или карбоксила. Соответствующие защитные группы могут, таким образом, включать, например, бензил, бензилоксикарбонил, трет-бутоксикарбонил, алкиловые или бензиловые сложные эфиры или тому подобное [смотри, в качестве общей ссылки, T.W. Green; Protective Groups in Organic Synthesis (Wiley, N.Y. 1981)].
Аналогично, селективное введение и снятие защиты с любой из указанных групп, например включающих карбонильные, гидроксильные или аминогруппы, может быть осуществлено согласно очень хорошо известным методам, широко используемым в химии органического синтеза.
Возможное образование солей соединения формулы (I) или N-оксидов по его пиридиновому кольцу может быть осуществлено посредством соответствующего превращения любой из свободных кислотных или аминогрупп в соответствующие фармацевтически приемлемые соли. В этом случае также все реакционные условия, используемые для возможного образования солей соединений по изобретению, находятся в компетенции среднего специалиста в данной области.
Из всего вышеизложенного должно быть очевидно, что вышеописанный способ, включая любой его вариант для получения подходящих соединений по изобретению, может быть удобным образом модифицирован таким образом, чтобы адаптировать реакционные условия к конкретным потребностям, например, посредством выбора соответствующих конденсирующих агентов, растворителей и защитных групп, как целесообразно.
Например, соединения по изобретению формулы (I) могут быть получены в соответствии с путем синтеза, проиллюстрированным на Схеме 1:

Соединения общей формулы (I) могут быть получены из соединений общей формулы (1b) посредством взаимодействия с соединением общей формулы (1с1) или (1с2) в подходящем растворителе, таком как диметилсульфоксид, 1,4-диоксан, DMF или ацетонитрил, в присутствии основания, такого как диизопропилэтиламин или гидроксид натрия, в диапазоне температур, предпочтительно между комнатной температурой и 100°C.
Соединения общей формулы (1c1) и (1c2) либо известны из литературы, либо могут быть получены из аминов общей формулы (1d) в соответствии с известными из литературы методиками (например, WO 2006009741, ЕР 1609789, WO 2008033999).
Альтернативно соединения общей формулы (1d) либо известны из литературы, либо могут быть синтезированы специалистом в данной области посредством адаптирования соответствующих известных из литературы способов (например, WO 2010077836, WO 2006009741, WO 2008125014, J. Med Chem., 2007, 50, 4016, Bulletin des Societes Chimiques Beiges, 1987, 96, 675-709, Organic & Biomolecular Chemistry, 2006, 4, 4158-4164).
Соединения общей формулы (1da), то есть соединения формулы (1d), где R2 представляет собой группу формулы (IVb), и R17, R18, z1, z2, z3 и z4 являются такими, как определено выше, могут быть получены из соединений формулы (1e)

с использованием подходящего восстанавливающего агента, такого как хлорид олова (II), железо или газообразный водород, с подходящим катализатором, таким как палладий на углероде, в подходящем растворителе, таком как метанол, этанол или уксусная кислота, в диапазоне температур, предпочтительно между комнатной температурой и 100°С.
Соединения общей формулы (1е) либо известны из литературы, либо могут быть получены специалистом в данной области с помощью известных из литературы способов (например, WO 2008034008, WO 20110189167, WO 2010068258).
Альтернативно соединения общей формулы (1da), как они определены выше, могут быть получены из соединений формулы (1f), где R17, R18, z1, z2, z3 и z4 являются такими, как определено выше, и где PG представляет собой подходящую совместимую защитную группу, известную специалистам в данной области, такую как бензил, бензилкарбамат или трет-бутилкарбамат,

с использованием подходящих условий снятия защиты, таких как соляная кислота, трифторуксусная кислота или водород, катализируемых, например, палладием на углероде, в подходящем растворителе, таком как дихлорметан, метанол, этанол или уксусная кислота, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединения общей формулы (1f) могут быть получены посредством взаимодействия соединений формулы (1g), описанных ниже, где R17, R18, z1, z2, z3 и z4 являются такими, как определено выше,

с соединениями формулы (1h), как описано выше, где PG представляет собой подходящую защитную группу, известную специалисту в данной области, такую как бензил, бензилкарбамат или трет-бутилкарбамат, с использованием подходящих условий, таких как в присутствии основания, такого как карбонат калия или диизопропилэтиламин, или в условиях реакции Бучвальда (с таким катализатором, как Pd(OAc)2, лигандом, таким как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, и основанием, таким как трет-бутоксид натрия), в подходящем растворителе, таком как толуол или тетрагидрофуран, в диапазоне температур, предпочтительно между комнатной температурой и 150°С.
Соединения общих формул (1g) и (1h) известны из литературы или могут быть получены специалистами в данной области посредством адаптирования соответствующих известных из литературы способов (например, WO 2011042389, Chemistry-A European Journal, 2011, 17, 6606-6609, S6606/1-S6606/38).
Соединения общей формулы (1b) могут быть получены в соответствии со способом, проиллюстрированным на Схеме 2.

Соединения общей формулы (1b) могут быть получены из соединений общей формулы (2a) посредством взаимодействия с соединением общей формулы (2b), (2c) или (2d), где G представляет собой подходящую химическую группу, известную специалистам в данной области и выбранную таким образом, чтобы она могла способствовать осуществлению подходящей реакции сочетания, такой как нуклеофильное замещение или катализируемое металлом перекрестное сочетание. Например, в тех случаях, когда Y представляет собой -О-, -S- или -NR7-, примеры G могут включать галоген или подходящую уходящую группу, такую как мезилат или трифлат, присоединенную либо непосредственно, либо посредством группы -(CR3R4)n-. Примеры используемых условий сочетания могут включать использование основания, такого как гидрид натрия или трет-бутоксид калия и 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинон, в подходящем растворителе, таком как N,N-диметилформамид, толуол, 1,4-диоксан или ацетонитрил, в диапазоне температур, предпочтительно между комнатной температурой и 150°С. Например, в тех случаях, когда Y представляет собой -О-, и G представляет собой -ОН или -SH, способ для осуществления этого сочетания может включать условия реакции Мицунобу (диэтилазодикарбоксилат/трифенилфосфин) в подходящем растворителе, таком как тетрагидрофуран или 1,4-диоксан, в диапазоне температур, предпочтительно между -10°С и 100°С. Например, в тех случаях, когда Y представляет собой -О-, -S- или -NR7-, и G представляет собой такую группу, как галоген, трифлат или бороновая кислота/сложный эфир, способ для осуществления этого сочетания может представлять собой условия катализируемого металлом (например, палладием или медью) сочетания в присутствии подходящего лиганда, такого как Xantphos или 1,10-фенантролин, в присутствии основания, такого как карбонат цезия, в подходящем растворителе, таком как тетрагидрофуран, 1,4-диоксан или N,N-диметилформамид, в диапазоне температур, предпочтительно между -10°С и 150°С. Например, в тех случаях, когда Y представляет собой -О-, и G представляет собой такую группу, как -COOMe, -СООН, изоцианат, -OCOCl или -NHCOOCH2CCl3, примеры условий для осуществления этого сочетания могут включать использование основания, такого как гидрид натрия или триэтиламин, или агента сочетания, такого как HATU, в подходящем растворителе, таком как дихлорметан, тетрагидрофуран, 1,4-диоксан или N,N-диметилформамид, в диапазоне температур, предпочтительно между -10°С и 150°С.
Соединения формулы (2b) известны из литературы или могут быть получены специалистами в данной области посредством адаптирования соответствующих известных из литературы способов (например, WO 2006133006).
Соединения формулы (2с) могут быть получены согласно способу, представленному на Схеме 3:

Соединения общей формулы (2c) могут быть получены из соединений общей формулы (3e), как описано выше, путем использования подходящего окислителя, такого как хлорамин T, тетраацетат свинца или фенилиод(III) диацетат, в подходящем растворителе, таком как дихлорметан или этанол, в диапазоне температур, предпочтительно между комнатной температурой и 100°С.
Соединения общей формулы (3е) могут быть получены из соединений общей формулы (3а) посредством взаимодействия с альдегидом общей формулы (3c) в подходящем растворителе, таком как этанол или тетрагидрофуран, в диапазоне температур, предпочтительно между комнатной температурой и 80°С.
Соединения формулы (3а) и (3c) известны из литературы или могут быть получены известными из литературы способами специалистами в данной области.
Альтернативно соединения формулы (2c) могут быть получены из соединений формулы (3d) посредством использования подходящего дегидратирующего агента, такого как реагент Бургесса (Burgess'), трифенилфосфин и гексахлорэтан, оксихлорид фосфора, уксусная кислота или условия реакции Мицунобу (диэтилазодикарбоксилат/трифенилфосфин/ триметилсилилазид), в отсутствие или в присутствии подходящего растворителя, такого как тетрагидрофуран, толуол или NMP (N-метилпирролидон), в диапазоне температур, предпочтительно между комнатной температурой и 120°С.
Соединения формулы (3d) могут быть получены из соединений формулы (3а) посредством взаимодействия с соединением общей формулы (3b1), используя подходящий ацилирующий/дегидратирующий агент, такой как трифенилфосфин/трихлорацетонитрил/HOBt (гидроксибензотриазол)/гексафторфосфат 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония или 1-этил-3-(3-диметиламинопропил)карбодиимид, в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан или ацетонитрил, в диапазоне температур, предпочтительно между комнатной температурой и 150°С.
Альтернативно соединения формулы (3d) могут быть получены из соединений формулы (3а) посредством взаимодействия с соединением общей формулы (3b2) в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан или THF, в диапазоне температур, предпочтительно между -10°С и температурой кипения растворителя.
Соединения формул (3b1) и (3b2) известны из литературы или могут быть получены посредством адаптирования подходящих известных из литературы способов специалистами в данной области.
Соединения формулы (2d) могут быть получены согласно способу, представленному на Схеме 4:

Соединения общей формулы (2d) могут быть получены из соединений общей формулы (4е) посредством использования подходящего окислителя, такого как хлорамин T, тетраацетат свинца или фенилиод(III) диацетат, в подходящем растворителе, таком как дихлорметан или этанол, в диапазоне температур, предпочтительно между комнатной температурой и 100°С.
Соединения общей формулы (4е) могут быть получены из соединений общей формулы (4а) посредством взаимодействия с альдегидом общей формулы (4c) в подходящем растворителе, таком как этанол или тетрагидрофуран, в диапазоне температур, предпочтительно между комнатной температурой и 80°С.
Соединения формулы (4а) и (4c) известны из литературы или могут быть получены известными из литературы способами специалистами в данной области.
Альтернативно соединения формулы (2d) могут быть получены из соединений формулы (4d) посредством использования подходящего дегидратирующего агента, такого как реагент Бургесса (Burgess'), трифенилфосфин и гексахлорэтан, оксихлорид фосфора, уксусная кислота или условия реакции Мицунобу (диэтилазодикарбоксилат/трифенилфосфин/ триметилсилилазид), в отсутствие или в присутствии подходящего растворителя, такого как тетрагидрофуран, толуол или NMP, в диапазоне температур, предпочтительно между комнатной температурой и 120°С.
Соединения формулы (4d) могут быть получены из соединений формулы (4a) посредством взаимодействия с соединением общей формулы (4b1), используя подходящий ацилирующий/дегидратирующий агент, такой как трифенилфосфин/трихлорацетонитрил/HOBt/гексафторфосфат 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония или 1-этил-3-(3-диметиламинопропил)карбодиимид, в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан или ацетонитрил, в диапазоне температур, предпочтительно между комнатной температурой и 150°С.
Альтернативно соединения формулы (4d) могут быть получены из соединений формулы (4a) посредством взаимодействия с соединением общей формулы (4b2) в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан или THF, в диапазоне температур, предпочтительно между -10°С и температурой кипения растворителя.
Соединения формул (4b1) и (4b2) известны из литературы или могут быть получены посредством адаптирования подходящих известных из литературы способов специалистами в данной области.
Альтернативно соединения формулы (2c) могут быть получены согласно способу, представленному на Схеме 5:

Соединения общей формулы (2c) могут быть получены посредством взаимодействия соединения общей формулы (5b), где G2 представляет собой такую группу, как галоген, с соединениями общей формулы (5c), где G3 представляет собой такую группу, как галоген, бороновая кислота, сложный эфир бороновой кислоты или органостаннан, используя метод перекрестного сочетания, такой как использование подходящего катализатора, такого как тетракис(трифенилфосфин)палладий(0) или ацетат палладия(II), в присутствии основания, такого как карбонат цезия или трет-бутоксид натрия, в подходящем растворителе, таком как толуол или DMF, в диапазоне температур, предпочтительно между комнатной температурой и 150°С.
Соединения формулы (5b) могут быть получены из соединений общей формулы (5а), используя, например, подходящий галогенирующий агент, такой как N-бромсукцинимид или N-иодсукцинимид, в растворителе, таком как DMF или тетрагидрофуран, в диапазоне температур, предпочтительно между комнатной температурой и 100°С.
Соединения формулы (5а) могут быть получены из соединений общей формулы (3а), используя такой реагент, как триэтилортоформиат, в отсутствие или в присутствии растворителя, такого как этанол, в нейтральных, основных или кислотных условиях в диапазоне температур, предпочтительно от комнатной температуры до 100°С. Соединения формулы (3а) могут быть получены так, как описано выше.
Следует понимать, что способы, описанные на Схеме 5, могут быть адаптированы специалистами для получения соединений формулы (2d) с использованием соединений формулы (4а).
Соединения общей формулы (2аа), то есть соединения формулы (2а), где Y представляет собой O, и W представляет собой NH, могут быть получены согласно способу, проиллюстрированному на Схеме 6:
Например, соединения общей формулы (2аа) могут быть получены, как описано в WO 2008/043019. Соединения общей формулы (2аа) могут быть получены из соединений общей формулы (6а1) или (6а2), где PG представляет собой подходящую защитную группу (такую как трифторацетат или трет-бутилкарбамат), известную специалистам в данной области, используя подходящие условия снятия защиты, такие как гидроксид натрия в метаноле и воде или трифторуксусная кислота в дихлорметане.
Соединения общих формул (6а1) и (6а2) могут быть получены из соединений общей формулы (6b).
Соединения общей формулы (6а1), где PG представляет собой амид, предпочтительно трифторацетамид, могут быть получены из соединения общей формулы (6b), как описано в WO 2008/043019, используя RuCl[S,S-Tsdpen(пара-цимен)] ([N-[(1S,2S)-2-(амино-κN)-1,2-дифенилэтил]-4-метилбензолсульфон-амидато-κN]хлоро[(1,2,3,4,5,6-η)-1-метил-4-(1-метилэтил)бензол]-рутений).
Соединения общей формулы (6а2), где PG представляет собой амид, предпочтительно трифторацетамид, могут быть получены из соединений общей формулы (6b), как описано в WO 2008/043019, используя RuCl[R,R-Tsdpen(пара-цимен)]. Следует понимать, что соединения формулы (6b) могут быть гомохиральными, как проиллюстрировано, или представлять собой зеркальный энантиомер или рацемическую смесь.
Специалисту в данной области будет очевидно, что может быть получена любая комбинация стереоцентров в (2а) с помощью обоих энантиомеров (6b) и с использованием RuCl[R,R-Tsdpen(пара-цимен)] или RuCl[S,S-Tsdpen(пара-цимен)]. Соединение (2аа) представлено без определенных стереоцентров, но любая их комбинация может быть получена так, как проиллюстрировано на Схеме 2.
Соединения формулы (6b) могут быть получены из соединений формулы (6с)

используя подходящий окислитель, такой как перманганат калия и сульфат магния, в подходящем растворителе метанол/вода в диапазоне температур, предпочтительно между комнатной температурой и температурой кипения растворителя. Следует понимать, что соединения формулы (6c) могут быть гомохиральными, как проиллюстрировано, или представлять собой зеркальный энантиомер или рацемическую смесь.
Соединения формулы (6c) могут быть получены из соединений формулы (6d), где PG представляет собой подходящую защитную группу, такую как трифторацетат или трет-бутилкарбонат:

используя этилтрифторацетат или ди-трет-бутилдикарбонат в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как метанол или дихлорметан, в диапазоне температур, предпочтительно между 0°С и температурой кипения растворителя. Следует понимать, что соединения формулы (6d) могут быть гомохиральными, как проиллюстрировано, или представлять собой зеркальный энантиомер или рацемическую смесь.
Соединения формулы (6d) известны из литературы и могут быть получены специалистом в данной области посредством адаптирования известных из литературы способов (например, для S-(+)-1-амино-1,2,3,4-тетрагидронафталина смотри Journal of Chemical Society, Perkin Transactions 1: 1985, 2039-44, для (S)-(+)-8-амино-5,6,7,8-тетрагидрохинолина смотри Journal of Organic Chemistry, 2007, 72, 669-671, и для 1-аминоиндана смотри TeTpahedron Letters, 2011, 52, 1310-1312).
Соединения формулы (Ib), то есть соединения формулы (I), где Y представляет собой NR7, и W представляет собой NH, и A, R1, R2 и R7 являются такими, как определено выше, могут быть получены согласно способу, проиллюстрированному на Схеме 7.

Соединения общей формулы (1b), как они определены выше, могут быть получены из соединений общей формулы (7b), где Y представляет собой NR7, и W представляет собой NH, посредством взаимодействия с соединением общей формулы (1c1) в подходящем растворителе, таком как диметилсульфоксид, 1,4-диоксан, DMF или ацетонитрил, в присутствии основания, такого как диизопропилэтиламин или гидроксид натрия, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединения общей формулы (7b) могут быть получены из соединений общей формулы (7а), где Y представляет собой NR7, и W представляет собой NH, и где PG представляет собой подходящую защитную группу, такую как трифторацетамид, трет-бутилкарбамат или бензилкарбамат, используя подходящие условия снятия защиты, такие как гидроксид натрия в метаноле, трифторуксусная кислота в дихлорметане или водород, катализируемый посредством, например, палладия на углероде в этаноле, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединения общей формулы (7а), могут быть получены из соединений общих формул (7d) и (6b), используя подходящий восстанавливающий агент, такой как триацетоксиборогидрид натрия или борогидрид натрия, в подходящем растворителе, таком как 1,2-дихлорэтан, метанол или уксусная кислота, в диапазоне температур, предпочтительно между 0°С и 100°С.
Альтернативно соединения общей формулы (7а) могут быть получены из соединений общей формулы (7d) и (7g), где PG представляет собой подходящую защитную группу, известную специалистам в данной области, такую как трифторацетамид, трет-бутилкарбамат и бензилкарбамат, и G6 представляет собой подходящую химическую группу, известную специалистам в данной области, выбранную таким образом, чтобы она могла способствовать протеканию взаимодействия, такого как нуклеофильное замещение, например атом галогена или кислорода, который имеет подходящий заместитель, такой как мезилат или трифлат, посредством использования подходящего основания, такого как диизопропилэтиламин или карбонат калия, в подходящем растворителе, таком как DMF, тетрагидрофуран или ацетонитрил, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединения формулы (7g) могут быть получены из соединения формулы (6a), используя такие условия, как четырехбромистый углерод и трифенилфосфин или метансульфонилхлорид и диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан или ацетонитрил, в диапазоне температур, предпочтительно между 0°С и 100°С.
Альтернативно соединения формулы (7а) могут быть получены из соединений общей формулы (7h) посредством взаимодействия с (2b), (2c) и (2d), возможно в присутствии катализатора, такого как йодид меди(I) или трис(дибензилиденацетон)дипалладий(0), возможно в присутствии лиганда, такого как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, используя основание, такое как диизопропилэтиламин, трет-бутоксид натрия или гидрид натрия, в растворителе, таком как DMF, толуол или тетрагидрофуран, в диапазоне температур, предпочтительно между комнатной температура и 150°С.
Соединения формулы (7h) могут быть получены из соединений формулы (7k) посредством взаимодействия с соединениями формулы (6b), где PG представляет собой подходящую защитную группу, известную специалистам в данной области, такую как трифторацетамид, трет-бутилкарбамат и бензилкарбамат, используя подходящий восстанавливающий агент, такой как триацетоксиборогидрид натрия или борогидрид натрия, в подходящем растворителе, таком как 1,2-дихлорэтан, метанол или уксусная кислота, в диапазоне температур, предпочтительно между 0°С и 100°С.
Альтернативно соединения формулы (7h) могут быть получены из соединений формулы (7k), используя соединения формулы (7g), где PG представляет собой подходящую защитную группу, известную специалистам в данной области, такую как трифторацетамид, трет-бутилкарбамат и бензилкарбамат, и G6 представляет собой подходящую химическую группу, известную специалистам в данной области, выбранную таким образом, чтобы она могла способствовать протеканию реакции нуклеофильного замещения, такую как атом галогена или кислорода, который имеет подходящий заместитель, такой как мезилат или трифлат, посредством использования подходящего основания, такого как диизопропилэтиламин или карбонат калия, в подходящем растворителе, таком как DMF, тетрагидрофуран или ацетонитрил, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединения общей формулы (7d) могут быть получены из соединений общих формул (7e) и (7f), где G4 представляет собой подходящую химическую группу, известную специалистам в данной области, выбранную таким образом, чтобы она могла способствовать протеканию реакции нуклеофильного замещения, такую как атом галогена или кислорода, который имеет подходящий заместитель, такой как мезилат или трифлат, посредством использования подходящего основания, такого как диизопропилэтиламин или карбонат калия, в подходящем растворителе, таком как DMF, тетрагидрофуран или ацетонитрил, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединения формул (7е) и (7f) известны из литературы или могут быть получены специалистом в данной области, используя известные из литературы методики (например, Organic Letters, 2002, 4, 3423-3426).
Соединения формулы (1ba), то есть соединения формулы (1b), где Y представляет собой (CR5R6)n, и W представляет собой NH, могут быть получены согласно способу, проиллюстрированному на Схеме 8.

Соединения формулы (1ba) могут быть получены из соединений формулы (8c), где PG представляет собой подходящую защитную группу, известную специалистам в данной области, такую как трифторацетамид, трет-бутилкарбамат и бензилкарбамат, посредством использования подходящих условий снятия защиты, таких как гидроксид натрия в метаноле, трифторуксусная кислота в дихлорметане или газообразный водород, катализируемый, например, палладием на углероде в этаноле, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединения формулы (8c) могут быть получены из соединений формулы (8b), где PG представляет собой подходящую защитную группу, известную специалистам в данной области, такую как трифторацетамид, трет-бутилкарбамат и бензилкарбамат, посредством использования газообразного водорода в присутствии катализатора, такого как палладий на углероде, в подходящем растворителе, таком как метанол или этанол, в присутствии или в отсутствие кислоты, такой как HCl, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединения формулы (8b) могут быть получены из соединений формул (8а) и (8f) посредством такого взаимодействия, как перекрестное сочетание, используя подходящий катализатор, такой как тетракис(трифенилфосфин)палладий(0) или ацетат палладия, и основание, такое как диизопропилэтиламин, трет-бутоксид натрия или карбонат цезия, в подходящем растворителе, таком как NMP, толуол или DMF, в диапазоне температур, предпочтительно между 0°С и 100°С. Альтернативно (8b) могут быть получены посредством адаптированных известных из литературы методик (например, тех, которые раскрыты в WO 2009022633).
Соединения формулы (8f) известны из литературы или могут быть получены специалистами в данной области посредством адаптированных известных из литературы методик (например, WO 2008063287).
Соединения формулы (8а) могут быть получены из соединений формулы (6b), используя трифлирующий агент, такой как трифликовый ангидрид, в присутствии подходящего основания, такого как пиридин или 2,6-бис(трет-бутил)-4-метилпиридин, в растворителе, таком как дихлорметан или хлороформ, в диапазоне температур, предпочтительно между 0°С и температурой кипения растворителя. Альтернативно (8а) могут быть получены посредством адаптированных известных из литературы методик (например, тех, которые раскрыты в WO 2009022633).
Соединения по изобретению формулы (Id), то есть соединения формулы (I), где Y представляет собой O, и W представляет собой O, и R1, R2 и A являются такими, как определено выше, могут быть получены согласно способу, проиллюстрированному на Схеме 9.

Соединения общей формулы (Id) могут быть получены из соединений общей формулы (9b), где Y представляет собой O, и W представляет собой O, и (9d), где G7 представляет собой подходящую химическую группу, такую как галоген или алкокси, используя подходящее основание, такое как диизопропилэтиламин, карбонат калия или гидрид натрия, в подходящем растворителе, таком как DMF, тетрагидрофуран или ацетонитрил, в диапазоне температур, предпочтительно между 0°С и 100°С.
Соединение формулы (9b) может быть получено из соединений формулы (9а) и (2b), (2c) или (2d). Соединения формулы (9а) известны из литературы и могут быть получены специалистами в данной области посредством адаптированных известных из литературы способов (например, Angewandte Chemie, International Edition, 2006, 45, 98-101, и Chimia, 2007, 61, 169-171).
Соединения формулы (9d) известны из литературы и могут быть получены специалистами в данной области, используя известные из литературы способы. Альтернативно соединения формулы (9d) могут быть получены из соединений формулы (1d), используя алкилхлорформиат, диалкилангидрид или фосген, возможно в присутствии основания, такого как гидроксид натрия или диизопропилэтиламин, в растворителе, таком как дихлорметан, диоксан или тетрагидрофуран, в диапазоне температур, предпочтительно между 0°С и температурой кипения растворителя.
Соединения по изобретению формулы (Ie), то есть соединения формулы (I), где Y представляет собой S, и W представляет собой NH, могут быть получены согласно способу, проиллюстрированному на схеме 10:

Соединения общей формулы (Ie) могут быть получены из соединений общей формулы (10h), где Y представляет собой S, и W представляет собой NH, используя соединения формулы (1c1) или (1c2) в подходящем растворителе, таком как диметилсульфоксид, 1,4-диоксан, N,N-диметилформамид или ацетонитрил, в присутствии основания, такого как диизопропилэтиламин, в диапазоне температур, предпочтительно между комнатной температурой и 100°С.
Соединения формулы (10h), где Y представляет собой S, и W представляет собой NH, могут быть получены из соединений формулы (10g), используя условия снятия защиты, такие как гидразин в метаноле, в диапазоне температур, предпочтительно между комнатной температурой и температурой кипения растворителя.
Соединения формулы (10g), где Y представляет собой S, могут быть получены из соединений формулы (10f) посредством взаимодействия с соединениями формул (2b), (2c) или (2d). Примеры используемых условий сочетания могут включать использование основания, такого как гидрид натрия или трет-бутоксид калия, и 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинона в подходящем растворителе, таком как N,N-диметилформамид, толуол, 1,4-диоксан или ацетонитрил, в диапазоне температур, предпочтительно между комнатной температурой и 150°С. Альтернативные способы для осуществления этого сочетания могут включать условия реакции Мицунобу (диэтилазодикарбоксилат/трифенилфосфин) или условия сочетания, катализируемого металлом (например, палладием), в подходящем растворителе, таком как тетрагидрофуран или 1,4-диоксан, в диапазоне температур, предпочтительно между -10°С и 150°С.
Соединения формулы (10f) могут быть получены из соединений формулы (10e) с использованием дитиотреитола, фосфата монокалия, карбоната калия в растворителе, таком как метанол, в присутствии уксусной кислоты, в диапазоне температур, предпочтительно между комнатной температурой и температурой кипения растворителя.
Соединения формулы (10e) могут быть получены из соединений формулы (10d) с использованием 2-нитробензолсульфенилхлорида в уксусной кислоте в диапазоне температур, предпочтительно между комнатной температурой и 100°С.
Соединения формулы (10d) могут быть получены из соединений формулы (10c) с использованием фталимида, трифенилфосфина и диизопропилазодикарбоксилата в растворителе, таком как тетрагидрофуран, в диапазоне температур, предпочтительно между 0°С и температурой кипения растворителя.
Соединения формулы (10c) могут быть получены из соединений формулы (10b) с помощью восстанавливающего агента, такого как борогидрид натрия, в растворителе, таком как метанол, в диапазоне температур, предпочтительно между 0°С и температурой кипения растворителя.
Соединения формулы (10b) могут быть получены из соединений формулы (10а) с использованием трет-бутантиола в присутствии основания, такого как диизопропилэтиламин, в растворителе, таком как тетрагидрофуран, в диапазоне температур, предпочтительно между 0°С и температурой кипения растворителя.
Соединения формулы (10а) известны из литературы и могут быть получены специалистами в данной области посредством известных из литературы способов (например, в отношении 3-бром-индан-1-она смотри WO 2010108058).
Альтернативно соединения общей формулы (1bb), то есть соединения формулы (1b), где Y представляет собой CH2, и W представляет собой NH, могут быть получены согласно способу, проиллюстрированному на схеме 11:

Соединения общей формулы (1bb) могут быть получены из соединений общей формулы (11b) посредством удаления защитной группы PG с помощью известных методов, таких как водный гидроксид натрия в растворителе, таком как метанол, в диапазоне температур, предпочтительно между комнатной температурой и 100°С.
Соединения формулы (11b) могут быть получены из соединений общей формулы (11а) посредством взаимодействия с подходящим восстанавливающим агентом, например газообразным водородом в присутствии подходящего катализатора, такого как палладий на активированном угле, в подходящем растворителе, таком как этанол, в диапазоне температур между комнатной температурой и 70°С, и при давлении между атмосферным и 4 бар.
Соединения формулы (11а) могут быть получены из соединений общей формулы (6а) посредством взаимодействия, такого как реакция Виттига (Wittig) (или одного из близкородственных вариантов, таких как реакция Хорнера-Вадсворта-Эммонса (Horner-Wadsworth-Emmons)) с подходящим субстратом, таким как R1-CH2-P(O)(OMe)2, в присутствии подходящего основания, такого как гидрид натрия, в подходящем растворителе, таком как тетрагидрофуран, в диапазоне температур, предпочтительно между -10°С и 100°С.
Такие соединения, как R1-CH2-P(O)(OMe)2, могут быть синтезированы из соединений общей формулы R1-CH2-Hal, где Hal представляет собой галоген, такой как -Br или -Cl, посредством взаимодействия с таким соединением, как триметилфосфит, в диапазоне температур, предпочтительно между 0°С и 100°С.
Такие соединения, как R1-CH2-Hal, могут быть синтезированы из соединений формулы R1-CH3 посредством такого взаимодействия, как радиальное галогенирование, используя такой реагент, как N-бромсукцинимид, в присутствии катализатора, такого как AIBN, в подходящем растворителе, таком как четыреххлористый углерод, в диапазоне температур, предпочтительно между 0°С и 80°С. Такие соединения, как R1-CH2-Hal, также могут быть синтезированы из соединений формулы R1-CH2-OH посредством использования условий галогенирования, таких как четырехбромистый углерод и трифенилфосфин в дихлорметане, или активирующих условий, таких как метилсульфонилхлорид в дихлорметане в присутствии основания, такого как диизопропиламин.
Такие соединения, как R1-CH3 и R1-CH2-OH, могут быть получены способами, раскрытыми выше для соединений (2b), (2c) и (2d).
Основные подробности эксперимента
Сокращения, использованные в экспериментальном разделе: АсОН - уксусная кислота; водн. - водный; DCM - дихлорметан; DIAD -диизопропилазодикарбоксилат; DIPEA - диизопропилэтиламин; DMAP - N,N-диметиламинопиридин; DMF - N,N-диметилформамид; DMSO диметилсульфоксид; EDC - гидрохлорид 1-этил-3-(3'-диметиламинопропил)карбодиимида; EtOAc - этилацетат; EtOH - этанол; Et2O - диэтиловый эфир; Et3N - триэтиламин; EtNiPr2 - диизопропилэтиламин; FCC - флэш-колоночная хроматография; ч - час; HATU - гексафторфосфат 2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония; HOBt - 1-гидрокси-бензотриазол; ВЭЖХ - высокоэффективная жидкостная хроматография; IMS - промышленный метилированный спирт; ЖХ-МС - жидкостная хроматография с масс-спектрометрией; NaOH - гидроксид натрия; MeCN - ацетонитрил; МеОН -МеОН; мин - минуты; NH3 - аммиак; ЯМР - ядерный магнитный резонанс; КТ - комнатная температура; Rt - время удерживания; насыщ. - насыщенный; SCX-2 - хроматография на сильнокатионном ионообменнике; TFA - трифторуксусная кислота; THF - тетрагидрофуран; H2O - вода; IMS - промышленный метилированный спирт; Xantphos - 4,5-бис(дифенилфосфино)-9,9-диметилксантен; X-Select - колонка для ВЭЖХ Waters X-select; IPA - пропан-2-ол; LDA - диизопропиламид лития; MDAP - масс-направленная автоматизированная очистка; МеОН - метанол; Ph3P - трифенилфосфин; TBAF - фторид тетрабутиламмония.
В описанных ниже методиках, после каждого исходного материала обычно дана ссылка на номер Промежуточного соединения/Примера. Это указано просто для помощи специалисту-химику. Исходный материал необязательно может быть получен из партии, на которую ссылаются.
При ссылке на использование "подобной" или "аналогичной" методики, как подходит для специалиста в данной области техники, такая методика может включать незначительные вариации, например, температуры реакции, количества реагента/растворителя, времени реакции, условий обработки или условий хроматографической очистки.
Номенклатуру структур устанавливали с использованием программного обеспечения Autonom 2000 Name от MDL Inc. В случаях когда номенклатура структур не могла быть присвоена с помощью Autonom, использовали часть ACD/Name программного продукта ACD/Labs Release 12.00 версии 12.5 (Build 45133, 16 декабря 2010). Присвоение стереохимических названий соединений основано на сравнениях с данными, изложенными в WO 2008/043019 для ключевых промежуточных соединений. Все реакции осуществляли в безводных условиях и атмосфере азота или аргона, если не указано иное. Все превращения, если не указано иное, осуществляли при температуре окружающей среды (комнатной температуре).
Спектры ЯМР регистрировали на спектрометре Varian Unity Inova 400 с 5-мм датчиком тройного резонанса с инверсным детектированием с рабочей частотой 400 МГц, или на спектрометре Bruker Avance DRX 400 с 5-мм TXI датчиком тройного резонанса с инверсным детектированием с рабочей частотой 400 МГц, или на спектрометре Bruker Avance DPX 300 со стандартным 5-мм двухчастотным датчиком с рабочей частотой 300 МГц. Химические сдвиги даны в м.д. относительно тетраметилсилана (δ равен 0 м.д.) Значения J везде указаны в герцах (Гц). Спектры ЯМР устанавливали с использованием DataChord Spectrum Analyst версии 4.0.b21 или SpinWorks версии 3.
В тех случаях, когда продукты очищали посредством колоночной флэш-хроматографии, "флэш-силикагель" относится к силикагелю для хроматографии с размером частиц от 0,035 до 0,070 мм (от 220 до 440 меш) (например, силикагель 60 Fluka) и приложенному давлению азота до 10 фунт/кв. дюйм (69 кПа), которое ускоряло элюирование из колонки, или использованию системы очистки CombiFlash® Companion либо использованию системы очистки Biotage SP1. Все растворители и товарные реагенты использовали в том виде, как они приобретены.
Соединения, очищаемые посредством препаративной ВЭЖХ, очищали с использованием колонки с обращенной фазой С18 (колонка Genesis 100×22,5 мм (внутренний диаметр) с размером частиц 7 мкм) или колонки с фазой Фенил-Гексил (колонка Gemini 250×21,2 мм (внутренний диаметр) с размером частиц 5 мкм), УФ-детектирования при длине волны от 220 до 254 нм, потока 5-20 мл/мин, при элюировании градиентами от 100-0 до 0-100% смеси вода/ацетонитрил (содержащей 0,1% ТФУ или 0,1% муравьиной кислоты) или вода/МеОН (содержащей 0,1% ТФУ или 0,1% муравьиной кислоты), или колонки С18 с обращенной фазой (19×250 мм, XBridge OBD, с размером частиц 5 мкм), элюируя градиентами смеси от 100-0 до 0-100% вода/ацетонитрил (содержащей 0,1% NH4OH); или колонки ChiralPak IC (10×250 мм внутренний диаметр, с размером частиц 5 мкм), если не указано иное. Фракции, содержащие требуемый продукт (определяемый посредством анализа ЖХМС), объединяли, органический растворитель удаляли посредством выпаривания, а остающийся водный остаток лиофилизировали с получением конечного продукта. Продукты, очищаемые посредством препаративной ВЭЖХ, выделяли в виде свободного основания, формиатов или солей ТФУ, если не оговорено особо.
Использованные системы жидкостной хроматографии с масс-спектроскопией (ЖХМС) и ВЭЖХ представляют собой:
Способ 1
Квадрупольный масс-спектрометр Waters Platform LC с колонкой с обращенной фазой С18 (Phenomenex Luna 30×4,6 мм с размером частиц 3 мкм), элюирование с использованием А: вода + 0,1% муравьиной кислоты; B: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Детектирование - МС, ELS (спектроскопия энергетических потерь электронов), УФ (200 мкл, расщепляемые в МС со встроенным НР1100 DAD-детектором). Способ ионизации МС - электроспрей (в режиме положительного и отрицательного иона).
Способ 2
Квадрупольный масс-спектрометр Waters ZMD с колонкой с обращенной фазой С18 (Phenomenex Luna 30×4,6 мм с размером частиц 3 мкм), элюирование с использованием А: вода + 0,1% муравьиной кислоты; В: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Детектирование - МС, ELS, УФ (200 мкл, расщепляемые в МС со встроенным 996 DAD-детектором). Способ ионизации МС - электроспрей (в режиме положительного и отрицательного иона).
Способ 3
Квадрупольный масс-спектрометр Waters ZMD с колонкой с обращенной фазой С18 (Phenomenex Luna 30×4,6 мм с размером частиц 3 мкм), элюирование с использованием А: вода + 0,1% муравьиной кислоты; В: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Детектирование - МС, ELS, УФ (200 мкл, расщепляемые в МС со встроенным НР1100 DAD-детектором). Способ ионизации МС - электроспрей (в режиме положительного и отрицательного иона).
Способ 4
Квадрупольный масс-спектрометр VG Platform II с колонкой с обращенной фазой С18 (Phenomenex Luna 30×4,6 мм с размером частиц 3 мкм), элюирование с использованием А: вода + 0,1% муравьиной кислоты; В: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Детектирование - МС, ELS, УФ (200 мкл, расщепляемые в ИЭР источнике со встроенным НР1050 DAD-детектором). Способ ионизации МС - электроспрей (в режиме положительного и отрицательного иона).
Способ 5
Квадрупольный масс-спектрометр Waters micromass ZQ2000 с Acquity ВЕН С18 1,7 мкм 100×2,1 мм, Acquity ВЕН Shield RP18 1,7 мкм 100×2,1 мм или Acquity HSST3 1,8 мкм 100×2,1 мм, поддерживаемыми при 40°С. Элюирование с использованием A: вода + 0,1% муравьиной кислоты; В: ацетонитрил + 0,1% муравьиной кислоты. Градиент:
Детектирование - МС, УФ PDA. Способ ионизации МС - электроспрей (в режиме положительного и отрицательного иона).
Способ 6
Колонка Phenomenex Gemini С18 с обращенной фазой (250×21,20 мм, размер частиц 5 мкм), элюирование с использованием А: вода + 0,1% муравьиной кислоты; В: CH3CN+0,1% муравьиной кислоты. Градиент - от 90% А/10% В до 2% А/98% В за 20 мин - скорость потока 18 мл/мин. Детектирование - установки встроенного УФ-детектора при длине волны 254 нм.
Способ 7
Система очистки Agilent 1260 infinity. Колонка: XSELECT CSH Prep С18 OBD, размер частиц 5 мкм, 30×150 мм, КТ. Элюирование с использованием А: вода + 0,1% муравьиной кислоты; В: CH3CN+0,1% муравьиной кислоты. Градиент - от 90% А/10% В до 2% А/95% В за 22 мин - скорость потока 60 мл/мин. Детектирование - встроенный квадрупольный масс-спектрометр Agilent 6100 series single Quadrupole LC/MC.
Специалисту в данной области техники следует понимать, что при использовании выражения "частичная формиатная соль", его следует интерпретировать как идентифицирующее производные, где только часть основного соединения превращена в формиатную соль, и тем самым содержащие менее одного эквивалента формиатного противоиона. Точное соотношение соль/свободное основание обеспечивается ассоциированным NMS-анализом.
Пример 1
1-(5-трет-Бутил-2-(4-метокси-фенил)-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. 2,2,2-Трифтор-N-(S)-1,2,3,4-тетрагидро-нафталин-1-ил-ацетамид (Промежуточное соединение 1a)

Этилтрифторацетат (24,2 мл, 204 ммоль) добавляли по каплям к раствору (S)-(1,2,3,4-тетрагидро-нафталин-1-ил)амина (Alfa Aesar; 25,0 г, 170 ммоль) и триэтиламина (35,5 мл, 255 ммоль) в МеОН (250 мл) при КТ и перемешивали в течение 18 ч. Смесь концентрировали до приблизительно 1/3 ее объема и затем распределяли между DCM (200 мл) и водой (200 мл). Водный слой экстрагировали DCM (3х) и объединенные органические слои промывали рассолом, сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения (41,1 г, 169 ммоль, 99%). 1Н ЯМР (400 МГц, CDCl3): 1.80-1.95 (3H, m), 2.05-2.15 (1Н, m), 2.75-2.90 (2Н, m), 5.18-5.25 (1Н, q, J 5,0 Гц), 6.38-6.48 (1Н, br s), 7.12-7.16 (1Н, m), 7.20-7.26 (3Н, m).
b. 2,2,2-Трифтор-N-((S)-4-оксо-1,2,3,4-тетрагидро-нафталин-1-ил)-ацетамид (Промежуточное соединение 1b)

Моногидрат сульфата магния (46,6 г, 338 ммоль) в воде (500 мл) добавляли к охлажденному на льду раствору Промежуточного соединения 1а (41,1 г, 169 ммоль) в ацетоне (1,0 л). Перманганат калия (80,1 г, 507 ммоль) добавляли порциями (порции по 10,0 г) в течение периода времени 45 мин. Смесь затем перемешивали в течение 18 ч. Добавляли пентагидрат тиосульфата натрия (126 г, 510 ммоль) в воде (400 мл) и реакционную смесь перемешивали в течение 30 мин. Смесь концентрировали до приблизительно 300 мл, затем последовательно добавляли воду (1,0 л), целит (60 г) и EtOAc (1,0 л). Смесь интенсивно перемешивали и затем фильтровали через набивку целита. Водный слой экстрагировали EtOAc (3х) и объединенные органические слои промывали рассолом, сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения (36,6 г, 142 ммоль, 84%). 1Н ЯМР (400 МГц, CDCl3): 2.20-2.30 (1Н, dddd, J 13,3, 10,0, 8,8, 4,5 Гц), 2.43-2.52 (1Н, dddd, J 13,3, 7,2, 4,6, 4,6 Гц), 2.67-2.77 (1Н, ddd, J 17,4, 10,1, 4,6 Гц), 2.78-2.88 (1Н, ddd, J 17,4, 7,1, 4,6 Гц), 5.39-5.47 (1Н, td, 8,5, 4,5 Гц), 7.32-7.37 (1Н, d, J 7,7 Гц), 7.44-7.49 (1Н, t, J 7,6 Гц), 7.59-7.64 (1Н, td, J 7,6, 1,4 Гц), 8.03-8.07 (1Н, dd, J 7,7, 1,4 Гц).
c. 2,2,2-Трифтор-N-((1S,4R)-4-гидрокси-1,2,3,4-тетрагидро-нафтал ин-1-ил)-ацетамид (Промежуточное соединение 1c)

Дегазированный DMF (обрызгиваемый аргоном, 100 мл) добавляли к Промежуточному соединению 1b (8,00 г, 31,3 ммоль) и [N-[(1R,2R)-2-(амино-κN)-1,2-дифенилэтил]-4-метилбензолсульфонамидато-κN]хлор[(1,2,3,4,5,6-η)-1-метил-4-(1-метилэтил)бензол]-рутению (Strem Chemicals Inc.; 594 мг, 0,93 ммоль). Триэтиламин (8,66 мл, 62,6 ммоль) медленно добавляли к охлажденной на льду муравьиной кислоте (2,34 мл, 62,6 ммоль) и перемешивали в течение 20 мин, эту смесь затем добавляли к DMF раствору. Реакционную смесь нагревали до 60°С в течение 18 ч. После охлаждения смесь распределяли между DCM (200 мл) и водой (600 мл). Водный слой экстрагировали DCM (3х) и объединенные органические слои промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. В результате очистки посредством FCC с использованием 0-100% EtOAc в циклогексане получили указанное в заголовке соединение (7,10 г, 27,4 ммоль, 88%). 1Н ЯМР (400 МГц, CDCl3): 1.88-1.92 (1Н, d, J 4,8 Гц), 1.98-2.18 (4Н, m), 4.80-4.88 (1Н, m), 5.165-5.24 (1Н, m), 6.70-6.80 (1Н, br s), 7.25-7.30 (1Н, m), 7.30-7.40 (2Н, m), 7.45-7.50 (1Н, m).
d. (1R,4S)-4-Амино-1,2,3,4-тетрагидро-нафталин-1-ол (Промежуточное соединение 1d)
Гидроксид натрия (2,10 г, 53,0 ммоль) добавляли к охлажденному на льду раствору Промежуточного соединения 1 с (3,43 г, 13,2 ммоль) в смеси МеОН/вода (2:1, 50 мл) и перемешивали в течение 3,5 ч. Смесь загружали на картридж SCX-2, элюируя МеОН, затем 2М NH3 в МеОН с получением указанного в заголовке соединения (2,30 г, 13,2 ммоль, 99%). 1Н ЯМР (400 МГц, d6-DMSO): 1.66-1.90 (4Н, m), 3.71-3.77 (1Н, t, J 5,4 Гц), 4.46-4.54 (1Н, t, J 5,4 Гц), 7.14-7.22 (2Н, m), 7.32-7.38 (1Н, m), 7.40-7.46 (1Н, m).
e. N'-(5-Фтор-пиридин-2-ил)-гидразид изомасляной кислоты (Промежуточное соединение 1e)
К раствору 5-фтор-2-гидразинил-пиридина (для ссылки см. WO 2010022076; 2,08 г, 16,4 ммоль), изомасляной кислоты (1,82 мл, 19,6 ммоль) и гидрата HOBt (251 мг, 1,64 ммоль) в DCM (50 мл) добавляли EDC (3,76 г, 19,6 ммоль) и полученный оранжевый раствор перемешивали при комнатной температуре в течение 18 ч. Добавляли насыщенный водный NaHCO3 (50 мл) и смесь интенсивно перемешивали в течение 15 мин. Органическую фазу промывали насыщенным водным NaHCO3 (50 мл), пропускали через гидрофобную фритту и концентрировали под вакуумом с получением бледно-коричневого твердого вещества. Это твердое вещество суспендировали в Et2O (50 мл) и фильтровали, промывая Et2O (25 мл), с получением белого твердого вещества (1,48 г, 46%). Эфирные промывки концентрировали под вакуумом и остаток суспендировали в Et2O (10 мл), фильтровали, промывали Et2O (2×2 мл) с получением белого твердого вещества (330 мг, 10%). Твердые вещества объединяли (1,81 г, 56%). 1Н ЯМР (400 МГц, CDCl3): 1.23 (6Н, d), 2.50 (1Н, sept), 6.65 (1Н, dd), 6.80 (1Н, d), 7.29 (1Н, ddd), 7.77 (1Н, br s), 8.01 (1Н, d).
f. 6-Фтор-3-изопропил-[1,2,4]триазоло[4,3-а]пиридин (Промежуточное соединение 1f)

К раствору Промежуточного соединения 1е (1,81 г, 9,18 ммоль), трифенилфосфина (4,83 г, 18,4 ммоль) и триэтиламина (5,12 мл, 36,7 ммоль) в THF (25 мл) при 0°С добавляли гексахлорэтан (4,36 г, 18,4 ммоль) в двух порциях с 1-минутным интервалом. Полученный бледно-коричневый раствор оставляли нагреваться до КТ, затем перемешивали в течение 2 ч. Полученную желтую суспензию фильтровали, промывая THF (2×25 мл). Объединенные органические фазы очищали с использованием картриджа SCX-2 (промывали DCM-MeOH (1:1, 100 мл) и МеОН (50 мл) и затем продукт элюировали 2М NH3 в МеОН) с получением бледно-желтого твердого вещества (1,60 г, 97%, загрязнено приблизительно 2,5% Ph3P=O). 1Н ЯМР (400 МГц, CDCl3): 1.53 (6Н, d), 3.32 (1Н, sept), 7.15 (1Н, ddd), 7.75 (1Н, ddd), 7.84 (1Н, m).
g. (1S,4R)-4-(3-Изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-цис-1,2,3,4-тетрагидро-нафталин-1-иламин (Промежуточное соединение 1g)

Промежуточное соединение 1d (634 мг, 3,88 ммоль) добавляли порциями к суспензии гидрида натрия (60%-ная в минеральном масле, 466 мг, 11,65 ммоль) в безводном DMF (5 мл) и смесь перемешивали при КТ в течение 20 мин. Промежуточное соединение 1f (535 мг, 2,99 ммоль) затем добавляли порциями и смесь нагревали при 60°С в течение 4 ч. Реакционную смесь охлаждали, гасили водой и экстрагировали EtOAc (3х). Объединенные органические экстракты промывали рассолом и сушили (Na2SO4), упаривали и очищали с помощью SCX-2, элюируя МеОН, затем 2М NH3 в МеОН, с получением указанного в заголовке соединения (274 мг, 79%). ЖХ-МС (Способ 1): Rt 1,76 мин, m/z 180 [MH+].
h. 1-(5-трет-Бутил-2-(4-метокси-фенил)-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 1)
Раствор Промежуточного соединения 1g (87 мг, 0,27 ммоль), DIPEA (318 мкл, 1,86 ммоль) и 2,2,2-трихлор-этилового эфира [5-трет-бутил-2-(4-метокси-фенил)-2Н-пиразол-3-ил]-карбаминовой кислоты (для ссылки см. WO 2001004115; 260 мг, 0,62 ммоль) в DMF (5 мл) нагревали при 60°С в течение 2 ч. После охлаждения раствор пропускали через картридж SCX-2, элюируя МеОН, затем 2М NH3 в МеОН, с получением неочищенного указанного в заголовке соединения. В результате последующей очистки посредством ВЭЖХ (55-98% Н2О в MeCN (0,1% NH3)) получили указанное в заголовке соединение в виде бесцветного порошка (35 мг, 9,5%). ЖХ-МС (Способ 5): Rt 4,46 мин, m/z 594 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.21 (9Н, s), 1.31-1.35 (6Н, dd, J 5,8), 1.76-1.93 (3Н, m), 2.01-2.08 (2Н, m), 3.47-3.57 (1Н, m), 3.75 (3Н, s), 4.75-4.81 (1Н, m), 5.48 (1Н, t, J 3,9), 6.26 (1Н, s), 6.98-7.05 (3Н, m), 7.09-7.13 (1Н, m), 7.09-7.13 (6Н, m), 7.62-7.65 (1Н, d, J 9,98).
Пример 2

1-(5-трет-Бутил-2-метил-2H-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
Диизопропилэтиламин (54 мкл, 0,31 ммоль) добавляли к раствору Промежуточного соединения 1g (100 мг, 0,31 ммоль) и 2,2,2-трихлор-этилового эфира (5-трет-бутил-2-метил-2Н-пиразол-3-ил)-карбаминовой кислоты (для ссылки см. US 2004/192653; 102 мг, 0,31 ммоль) в 1,4-диоксане (3,0 мл). Реакционную смесь нагревали до 100°С в течение 18 ч. После охлаждения смесь распределяли между EtOAc (50 мл) и водой (50 мл). Водный слой экстрагировали EtOAc (3х) и объединенные органические слои промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. В результате очистки посредством FCC, используя 0-10% [2М NH3 в МеОН] в DCM, с последующей ВЭЖХ (10-98% MeCN в H2O, 0,1% муравьиной кислоты) получили указанное в заголовке соединение (63 мг, 0,13 ммоль, 41%). ЖХ-МС (Способ 5: Rt 3,71 мин, m/z 502 [MH+]. 1Н ЯМР (400 МГц, CDCl3): 1.24 (9Н, s), 1.41-1.44 (3Н, d, J 6,9), 1.45-1.48 (3Н, d, J 6,9), 1.90-2.00 (1Н, m), 2.04-2.17 (2Н, m), 2.22-2.30 (1Н, m), 3.18-3.29 (1Н, sp, J 6,9), 3.72 (3Н, s), 5.08-5.15 (1H, td, J 8,8, 5,2), 5.16-5.21 (1H, t, J 3,8), 5.45-5.55 (1H, br d, J 7,4), 6.02 (1H, s), 6.60-6.68 (1H, br s), 6.99-7.04 (1H, dd, J 9,9, 2,1), 7.24-7.28 (2H, m), 7.30-7.36 (1H, m), 7.36-7.44 (2H, m), 7.56-7.60 (1H, d, J 9,9).
Пример 3
1-{5-трет-Бутил-2-[3-(2-гидроксиэтилсульфанил)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

а. Ди-трет-бутил-1-{3-[(2-{[трет-бутил(диметил)силил]окси}этил)-сульфанил]фенил}гидразин-1,2-дикарбоксилат (Промежуточное соединение 3а)
Смесь 3-бромтиофенола (1,00 г, 5,29 ммоль), бромэтоксидиметилсилилового эфира (1,36 мл, 6,35 ммоль) и карбоната калия (1,46 г, 10,58 ммоль) в ацетоне (15 мл) перемешивали при КТ в течение ночи. Смесь фильтровали, упаривали, остаток сушили под вакуумом и затем растворяли в безводном THF (15 мл). nBuLi (1.6М в гексанах, 4,5 мл, 7,28 ммоль) добавляли по каплям при -78°С и перемешивали в течение 10 мин. Добавляли в виде одной порции при -78°С ди-трет-бутил-азодикарбоксилат (1,54 г, 6,68 ммоль) и перемешивали в течение 20 мин. Смесь затем оставляли нагреваться до КТ в течение 2 ч. Смесь распределяли между насыщенным раствором хлорида аммония (15 мл) и этилацетатом (3×15 мл). Объединенные органические экстракты промывали рассолом (20 мл), сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали посредством FCC, используя 0-20% этилацетата в пентане, с получением указанного в заголовке соединения в виде бледно-желтого масла (1,68 г, 64%). 1Н ЯМР (400 МГц, CDCl3): 0.04 (6Н, s), 0.84 (9Н, s), 1.48 (18Н, m), 3.04 (2Н, t), 3.79 (2Н, t), 7.14-7.24 (2Н, m), 7.42 (1Н, s).
b. 2-[3-(5-Амино-3-трет-бутил-пиразол-1-ил)фенилсульфанил]-этанол (Промежуточное соединение 3b)

Смесь Промежуточного соединения 3а (1,68 г, 3,37 ммоль), пивалоилацетонитрила (0,42 г, 3,37 ммоль) и концентрированного раствора HCl (1,7 мл) в этаноле (10 мл) кипятили с обратным холодильником в течение 3 ч. После охлаждения значение pH доводили до приблизительно 7 (используя водный насыщенный NaHCO3) и смесь распределяли между водой (20 мл) и EtOAc (3×20 мл). Объединенные органические экстракты промывали рассолом (20 мл), сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали посредством FCC, элюируя 20-80% EtOAc в пентане с получением указанного в заголовке соединения в виде бледно-желтого масла (458 мг, 47%). ЖХ-МС (Способ 1): Rt 2,35 мин, m/z 292 [MH+].
c. 2,2,2-Трихлор-этиловый эфир {5-трет-бутил-2-[3-(2-гидрокси-этилсульфанил)-фенил]-2Н-пиразол-3-ил}-карбаминовой кислоты (Промежуточное соединение 3c)

Трихлорэтилхлорформиат (0,1 мл, 0,78 ммоль) добавляли к раствору Промежуточного соединения 3b (176 мг, 0,60 ммоль) и DIPEA (0,31 мл, 1,81 ммоль) в THF (10 мл) и смесь перемешивали в течение 3 ч. Смесь затем распределяли между водой (15 мл) и EtOAc (3x20 мл) и объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме. Остаток растирали (циклогексан) и фильтровали с получением указанного в заголовке соединения в виде желтого твердого вещества (280 мг, 100%). ЖХ-МС (Способ 1): Rt 3,93 мин, m/z 466/468 [MH+].
d. 1-{5-трет-Бутил-2-[3-(2-гидрокси-этилсульфанил)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 3)
Раствор Промежуточного соединения 1g (100 мг, 0,31 ммоль) в DMF (2 мл) с DIPEA (165 мкл, 0,97 ммоль) и Промежуточного соединения 3c (145 мг, 0,31 ммоль) нагревали при 60°С в течение 2 ч. После охлаждения смесь загружали на картридж SCX-2, элюируя МеОН, затем 2М NH3 в МеОН с получением неочищенного продукта. В результате дополнительной очистки посредством FCC, элюируя 0-10% [2М NH3 в МеОН] в DCM, с последующей ВЭЖХ (элюирование 30-95% MeCN в H2O (0,1% HCO2H)) получили указанное в заголовке соединение в виде бесцветного порошка (45 мг). ЖХ-МС (Способ 5): Rt 4,22 мин, m/z 640 [MH+]. 1Н ЯМР (400 МГц, CDCl3): 1.33 (9Н, s), 1.42-1.47 (6Н, m), 1.89-1.97 (1Н, m), 2.04-2.13 (2Н, m), 2.21-2.28 (1Н, m), 3.09 (2Н, m), 3.24 (1Н, m), 3.73 (2H, m), 5.08 (1H, m), 5.19 (1H, m,), 5.78 (1H, m), 6.38 (1H, s), 6.92 (1H, br s), 7.01 (1H, dd, J 1,92, 9,77), 7.24-7.34 (6H, m), 7.40-7.43 (2H, m), 7.54-7.75 (2H, m).
Пример 4
1-{5-трет-Бутил-2-[3-(2-гидрокси-этокси)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. 5-трет-Бутил-2-{3-[2-(тетрагидро-пиран-2-илокси)-этокси]-фенил}-2Н-пиразол-3-иламин (Промежуточное соединение 4а)

DIAD (847 мкл, 4,32 ммоль) медленно добавляли к раствору 3-(5-амино-3-трет-бутил-1Н-пиразол-1-ил)фенола (для ссылки на методику см. US 2006/35922; 500 мг, 2,16 ммоль), 2-(тетрагидро-пиран-2-илокси)-этанола (439 мкл, 3,25 ммоль) и трифенилфосфина (1,13 г, 4,32 ммоль) в THF (10,0 мл) и перемешивали в течение 72 ч. Реакционную смесь распределяли между EtOAc (75 мл) и Н2О (75 мл) и водный слой экстрагировали EtOAc (3х). Объединенные органические слои сушили (MgSO4), фильтровали и упаривали в вакууме. В результате очистки посредством FCC с использованием 5-60% EtOAc в циклогексане получили чистое указанное в заголовке соединение (1,26 г, которое использовали на следующей реакционной стадии без дополнительной очистки. ЖХ-МС (Способ 4): Rt 2,77, m/z 360 [MH+].
b. 2,2,2-Трихлор-этиловый эфир (5-трет-бутил-2-{3-[2-(тетрагидро-пиран-2-илокси)-этокси]-фенил}-2Н-пиразол-3-ил)-карбаминовой кислоты
(Промежуточное соединение 4b)

Указанное в заголовке соединение получали из 2,2,2-трихлорэтилхлорформиата и Промежуточного соединения 4а с использованием методики, аналогичной описанной в Примере 3, стадия c. ЖХ-МС (Способ 4): Rt 3,85, m/z 536 [MH+].
c. 1-(5-трет-Бутил-2-{3-[2-(тетрагидро-пиран-2-илокси)-этокси]-фенил}-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
(Промежуточное соединение 4c)
Указанное в заголовке соединение получали из Промежуточного соединения 4b и Промежуточного соединения 1g с использованием методики, аналогичной описанной в Примере 1, стадия h. ЖХ-МС (Способ 1): Rt 3,63 минут, m/z=708 [MH+].
d. 1-{5-трет-Бутил-2-[3-(2-гидрокси-этокси)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-a]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 4)
п-Толуолсульфонат пиридиния (44,0 мг, 0,17 ммоль) добавляли к Промежуточному соединению 4c (124 мг, 0,17 ммоль) в MeOH (3,0 мл). Через 2 ч добавляли дополнительное количество п-толуолсульфоната пиридиния (100 мг, 0,39 ммоль) и реакционную смесь перемешивали в течение 12 ч. Реакционную смесь затем нагревали до 55°С в течение 2 ч, затем охлаждали и объем растворителя снижали в вакууме до приблизительно 1/3 от его объема. Остаток распределяли между EtOAc (50 мл) и насыщенным NaHCO3 (50 мл). Водный слой экстрагировали EtOAc (3х), затем объединенные органические слои промывали рассолом, сушили (MgSO4) и упаривали в вакууме. Продукт очищали посредством FCC, используя 0-10% МеОН в DCM, затем дополнительно очищали посредством ВЭЖХ (колонка С18 X-select, 10-98% MeCN в Н2О, 0,1% муравьиной кислоты) с получением указанного в заголовке соединения (50,0 мг, 0,08 ммоль, 47%). ЖХ-МС (Способ 5): Rt 4,04 мин, m/z 624 [MH+]. 1Н ЯМР (400 МГц, CDCl3): 1.30 (9Н, s), 1.40-1.44 (3Н, d, J 6,9 Гц), 1.44-1.47 (3Н, d, J 6,9 Гц), 1.84-1.98 (1Н, m), 2.00-2.10 (2Н, m), 2.18-2.26 (1Н, m), 3.16-3.26 (1Н, sp, J 6,9 Гц), 3.87-3.92 (2Н, m), 4.03-4.07 (2Н, m), 5.01-5.09 (1Н, td, J 8,9, 5,3 Гц), 5.14-5.17 (1Н, t, J 4,0 Гц), 5.47-5.52 (1Н, br d, J 8,7 Гц), 6.29 (1Н, s) 6.60 (1Н, br s), 6.80-6.84 (1Н, m), 6.96-7.00 (1Н, dd, J 9,9, 2,1 Гц), 7.07-7.11 (2Н, m), 7.23-7.30 (5Н, m), 7.38-7.40 (1Н, d, J 1,6 Гц), 7.53-7.57 (1H, d, J 9,9 Гц).
Пример 5
1-(5-трет-Бутил-[1,3,4]оксадиазол-2-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

а. 2,2,2-Трифтор-N-((1S,4S)-4-гидрокси-1,2,3,4-тетрагидро-нафталин-1-ил)-ацетамид (Промежуточное соединение 5а)

Аргон барботировали через раствор Промежуточного соединения 1b (8,00 г, 31,1 ммоль) и [N-[(1S,2S)-2-(амино-κN)-1,2-дифенилэтил]-4-метилбензолсульфонамидато-κN]хлор[(1,2,3,4,5,6-η)-1-метил-4-(1-метилэтил)-бензол]-рутения (Strem Chemicals Inc.; 0,06 г, 0,93 ммоль) в безводном DMF (100 мл) в течение 10 мин. Добавляли предварительно смешанную комбинацию муравьиной кислоты (2,4 мл, 62,2 ммоль) и Et3N (8,60 мл, 62,2 ммоль) и смесь перемешивали при 50°С в течение 24 ч. Смесь охлаждали до комнатной температуры и концентрировали до приблизительно 25 мл. Добавляли воду (70 мл) и полученный осадок отфильтровывали и промывали DCM (3×30 мл) и диэтиловым эфиром (30 мл) с получением твердого вещества (4,75 г). Фильтрат сливали, оставляя темное твердое вещество. В результате последующей очистки посредством FCC с использованием 0-30% EtOAc в циклогексане получили твердое вещество. Это твердое вещество объединяли с первым полученным твердым веществом с получением бежевого твердого вещества (5,93 г, 74%). 1Н ЯМР (400 МГц, d6-DMSO): 1.60-1.83 (2Н, m), 2.06-2.17 (2Н, m), 4.60 (1Н, m), 5.08 (1Н, m), 5.28 (1Н, d), 7.07 (1Н, m), 7.25 (1Н, ddd), 7.28 (1Н, ddd), 7.50 (1H,dd), 9.78 (1H,d).
b. (1S,4S)-4-Амино-1,2,3,4-тетрагидро-нафталин-1-ол (Промежуточное соединение 5b)

К серому раствору Промежуточного соединения 5a (5,55 г, 21,4 ммоль) в МеОН (50 мл) добавляли NaOH (1,28 г, 32,1 ммоль) в воде (15 мл) и смесь перемешивали при комнатной температуре в течение 3 суток. Добавляли дополнительное количество NaOH (1,28 г, 32,1 ммоль) и коричневый раствор перемешивали в течение 5 ч. Этот раствор наносили непосредственно на колонку SCX-2, промывая МеОН и элюируя 2М NH3 в МеОН, и концентрировали под вакуумом с получением серого твердого вещества. Это твердое вещество суспендировали в DCM (50 мл) при обработке ультразвуком, затем фильтровали и сушили под вакуумом с получением бледно-серого твердого вещества (2,93 г, 84%). 1Н ЯМР (400 МГц, d6-DMSO): 1.41-1.64 (2Н, m), 2.02-2.13 (2Н, m), 3.82 (1Н, dd), 4.55 (1Н, dd), 5.08 (1Н, br s), 7.13-7.22 (2Н, m), 7.35-7.49 (2Н, m).
c. (1S,4S)-4-(3-Изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-иламин (Промежуточное соединение 5 с)

К суспензии гидрида натрия (60%-ная в минеральном масле, 1,07 г, 26,8 ммоль) в безводном DMF (20 мл) при комнатной температуре под азотом добавляли порциями в течение 2 мин Промежуточное соединение 5b (1,89 г, 11,6 ммоль) и полученный коричневый раствор перемешивали в течение 20 мин. Добавляли промежуточное соединение 1f (1,60 г, 8,93 ммоль) и раствор перемешивали при 60°С в течение 2 ч. Темно-коричневый раствор охлаждали до комнатной температуры и концентрировали под вакуумом. Остаток очищали с помощью SCX-2, промывая МеОН (200 мл) и элюируя 2М NH3 в МеОН с получением темно-коричневой пены (3,21 г). В результате дополнительной очистки посредством FCC, используя 2-10% [2М NH3 в МеОН] в DCM, получили коричневую пену (2,11 г, 76%). 1Н ЯМР (400 МГц, d6-DMSO): 1.37 (3Н, d), 1.39 (3Н, d), 1.59 (1Н, m), 1.91 (1Н, m), 2.11 (1Н, m), 2.33 (1Н, m), 3.58 (1Н, sept), 3.96 (1Н, dd), 5.55 (1Н, dd), 7.18-7.37 (4Н, m), 7.51 (1Н, d), 7.68 (1Н, d), 8.20 (1Н, d).
d. 2,2,2-Трихлор-этиловый эфир (5-трет-бутил-[1,3,4]оксадиазол-2-ил)-карбаминовой кислоты (Промежуточное соединение 5d)

К суспензии 5-трет-бутил-[1,3,4]оксадиазол-2-иламина (Atlantic, 141 мг, 1,00 ммоль) и Et3N (279 мкл, 2,00 ммоль) в MeCN (2 мл) добавляли в 4 порциях за 1 минуту при КТ 2,2,2-трихлорэтилхлорформиат (207 мкл, 1,50 ммоль) (осторожно: экзотермический эффект до приблизительно 40°С). Полученную суспензию перемешивали в течение 1 ч. Суспензию фильтровали, промывая твердое вещество MeCN (3 мл), и концентрировали с получением желто-коричневой пасты. В результате очистки посредством FCC, используя 0-2,5% МеОН в DCM, получили темно-желтую пену (232 мг, 73%). 1Н ЯМР (400 МГц, CDCl3): 1.42 (9Н, s), 4.86 (2Н, s).
e. 1-(5-трет-Бутил-[1,3,4]оксадиазол-2-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 5)
Раствор Промежуточного соединения 5d (83,1 мг, 0,263 ммоль), Промежуточного соединения 5c (80,6 мг, 0,250 ммоль) и DIPEA (54,4 мкл, 0,313 ммоль) в DMF (2 мл) перемешивали при 125°С в течение 45 мин. После охлаждения смесь концентрировали в вакууме с получением коричневого масла. Его суспендировали в воде (5 мл) и экстрагировали DCM (2×5 мл). Объединенные органические фазы пропускали через гидрофобную фритту и концентрировали под вакуумом с получением коричневого масла. В результате очистки посредством FCC, используя 0-8% МеОН в EtOAc, с последующим растиранием (диэтиловый эфир) получили темно-желтое твердое вещество (99,6 мг). В результате дополнительной очистки посредством ВЭЖХ (10-98% MeCN в H2O, 0,1% HCO2H) получили указанное в заголовке соединение в виде хлопьевидного белого твердого вещества (25,9 мг, 21%). ЖХ-МС (Способ 5): Rt 3,77 мин, m/z 490 [MH+]. 1Н ЯМР (400 МГц, CDCl3): 1.39 (9Н, s), 1.52 (3Н, d), 1.55 (3Н, d), 2.00 (1Н, m), 2.21-2.36 (2Н, m), 2.43 (1Н, m), 3.32 (1Н, sept), 5.28-5.34 (2Н, m), 7.12 (1Н, dd), 7.30-7.38 (3Н, m), 7.47-7.50 (2Н, m), 7.73 (1Н, d), 8.35 (1Н, brs), 8.49 (1Н, brd).
Пример 6
1-[(1S,4S)-4-(3-Изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-3-(1-п-толил-1Н-пиразол-4-ил)-мочевина

а. 4-Нитро-1-п-толил-1Н-пиразол (Промежуточное соединение 6а)

К 4-толилбороновой кислоте (544 мг, 4,00 ммоль), 4-нитропиразолу (226 мг, 2,00 ммоль), ацетату меди(II) (545 мг, 3,00 ммоль) и молекулярным ситам 4Å (1,5 г) в DCM (15 мл) добавляли пиридин (0,32 мл, 4 ммоль) при КТ и перемешивали в течение 5 ч. Смесь фильтровали через целит, промывая DCM, затем упаривали досуха. Остаток очищали посредством FCC, элюируя 0-30% этилацетата в циклогексане с получением указанного в заголовке соединения в виде белого твердого вещества (126 мг, 31%). ЖХ-МС (Способ 3): Rt 3,93 мин, m/z 204,1 [MH-].
b. 4-Амино-1-п-толил-1Н-пиразол (Промежуточное соединение 6b)

Промежуточное соединение 6а (212 мг, 1,04 ммоль) растворяли в этаноле (20 мл), затем гидрировали над 10%-ным палладием на углероде в течение 4 ч в атмосфере водорода. Смесь затем фильтровали через целит, промывая этанолом, и упаривали досуха. Остаток очищали посредством FCC, элюируя 0-10% МеОН в DCM, с получением указанного в заголовке соединения в виде бледно-коричневого твердого вещества (154 мг, 86%). ЖХ-МС (Способ 3): Rt 1,92 мин, m/z 174,1 [MH-].
c. 2,2,2-Трихлор-этиловый эфир (1-п-толил-1Н-пиразол-4-ил)-карбаминовой кислоты (Промежуточное соединение 6c)

Промежуточное соединение 6b (150 мг, 0,87 ммоль), растворенное в DCM (10 мл), охлаждали, используя ледяную баню, и затем обрабатывали последовательно триэтиламином (0,18 мл, 1,30 ммоль) и трихлорэтилхлорформиатом (0,15 мл, 1,08 ммоль). Смесь перемешивали при охлаждении в течение 45 мин, затем упаривали досуха. Остаток очищали посредством FCC, элюируя 0-30% этилацетата в циклогексане, с получением указанного в заголовке соединения в виде бежевого твердого вещества (286 мг, 95%). ЖХ-МС (Способ 3): Rt 4,25 мин, m/z 348/350/352 [MH+].
d. 1-[(1S,4S)-4-(3-Изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-3-(1-п-толил-1Н-пиразол-4-ил)-мочевина (Пример 6)
Раствор Промежуточного соединения 6 с (65,0 мг, 0,19 ммоль), Промежуточного соединения 5 с (50,0 мг, 0,155 ммоль) и DIPEA (0,127 мл, 0,8 ммоль) в DMF (1 мл) нагревали при 110°С в течение 75 мин и 50°С в течение 64 ч. После охлаждения смесь концентрировали досуха и остаток очищали посредством FCC, элюируя 0-10% МеОН в DCM, с получением загрязненного продукта (63 мг). В результате дополнительной очистки посредством ВЭЖХ (Способ 6) получили указанное в заголовке соединение в виде белого твердого вещества (45 мг, 56%). ЖХ-МС (Способ 5): Rt 4,06 мин, m/z 522,1 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.36-1.41 (6Н, m), 1.76-1.85 (1Н, m), 1.98-2.08 (1Н, m), 2.13-2.28 (2Н, m), 2.33 (3Н, s), 3.59 (1Н, квинтет, J 6.8), 4.96-5.03 (1Н, m), 5.62 (1Н, t, J 4,6), 6.74 (1Н, d, J 8,5), 7.24 (1Н, dd, J 9,9, 2,1), 7.26-7.46 (6H, m), 7.62-7.66 (2H, m), 7.68 (1H, s), 7.70 (1H, dd, J 9,9, 0,8), 8.24 (1H, br d), 8.26 (1H, s), 8.31 (1H, s).
Пример 7

1-(4-Хлор-3-трифторметил-фенил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
Указанное в заголовке соединение получали из 4-хлор-3-(трифторметил)анилина (Aldrich) с использованием методик, аналогичных описанным для Примера 5. ЖХ-МС (Способ 5): Rt 4,72 мин, m/z 544 [MH+]; 1Н ЯМР (400 МГц, d6-DMSO): 1.38 (3Н, d), 1.40 (3Н, d), 1.83 (1Н, m), 2.04 (1Н, m), 2.21 (2Н, m), 3.58 (1Н, sept), 5.00 (1Н, m), 5.62 (1Н, m), 6.84 (1Н, d), 7.24 (1Н, dd), 7.30-7.41 (3Н, m), 7.44 (1Н, d), 7.56 (1Н, d), 7.58 (1Н, d), 7.70 (1Н, d), 8.13 (1Н, m), 8.24 (1Н, d), 8.83 (1H,s).
Пример 8
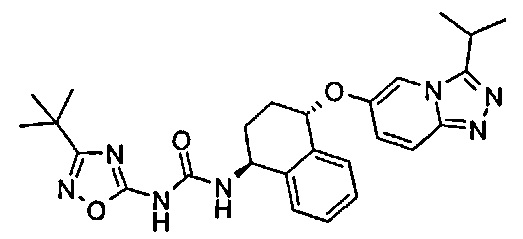
1-(3-трет-Бутил-[1,2,4]оксадиазол-5-ил)-3-[[1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
Указанное в заголовке соединение получали из 3-трет-бутил-1,2,4-оксадиазол-5-амина (Enamine) с использованием методик, аналогичных описанным для Примера 5. ЖХ-МС (Способ 5): Rt 4,12 мин, m/z 490 [MH+]; 1Н ЯМР (400 МГц, CDCl3): 1.25 (9Н, s), 1.50 (3Н, d), 1.54 (3Н, d), 1.99 (1Н, m), 2.22-2.34 (2Н, m), 2.52 (1Н, m), 3.29 (1Н, sept), 5.27 (1Н, ddd), 5.36 (1Н, dd), 7.16 (1Н, dd), 7.32-7.41 (3Н, m), 7.49 (1Н, d), 7.52 (1Н, d), 7.75 (1Н, dd), 8.64 (1Н, d), 8.76 (1Н, s).
Пример 9
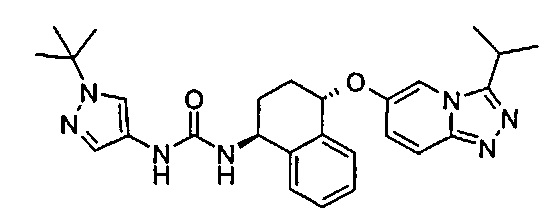
1-(1-трет-Бутил-1Н-пиразол-4-ил)-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
Указанное в заголовке соединение получали из 1-трет-бутил-1Н-пиразол-4-амина (Enamine) с использованием методик, аналогичных описанным для Примера 5. ЖХ-МС (Способ 5): Rt 3,50 мин, m/z 488 [MH+]; 1Н ЯМР (400 МГц, CDCl3): 1.46 (3Н, d), 1.49 (3Н, d), 1.56 (9Н, s), 1.89 (1Н, m), 2.10-2.27 (2Н, m), 2.38 (1Н, m), 3.28 (1Н, sept), 5.22 (1Н, ddd), 5.28 (1Н, dd), 5.49 (1Н, br s), 6.63 (1Н, br s), 7.14 (1Н, dd), 7.26-7.36 (3Н, m), 7.39 (1Н, d), 7.45 (1Н, d), 7.48 (1Н, m), 7.60 (1Н, d), 7.71 (1Н, s).
Пример 10
1-[5-трет-Бутил-2-(2-гидрокси-этил)-2H-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. 2-(5-Амино-3-трет-бутил-пиразол-1-ил)-этанол (Промежуточное соединение 10a)

Раствор 4,4-диметил-3-оксо-пентаннитрила (5,00 г, 40,0 ммоль), концентрированной HCl (0,1 мл) и 2-гидразиноэтанола (2,98 мл, 44,0 ммоль) в этаноле (40 мл) кипятили с обратным холодильником в течение 20 ч. Реакционную смесь затем концентрировали в вакууме. Полученное маслянистое твердое вещество промывали циклогексаном (30 мл) и растворяли в МеОН (5 мл) и H2O (5 мл) и лиофилизировали с получением указанного в заголовке соединения в виде белого порошка (7,13 г, 97%). ЖХ-МС (Способ 3): Rt 0,43 мин, m/z 184 [MH+].
b. 5-трет-Бутил-2-[2-(трет-бутил-диметил-силанилокси)-этил]-2Н-пиразол-3-иламин (Промежуточное соединение 10b)

Раствор Промежуточного соединения 10а (1,00 г, 5,46 ммоль), трет-бутил-диметил-хлорсилана (823 мг, 5,46 ммоль) и имидазола (774 мг, 11,38 ммоль) в DMF (9 мл) перемешивали при КТ в атмосфере азота в течение 18 ч. К этой реакционной смеси добавляли дополнительное количество трет-бутил-диметил-хлорсилана (823 мг, 5,46 ммоль) и имидазола (774 мг, 11,38 ммоль) и перемешивали в течение 6 ч. Реакционную смесь разбавляли насыщенным водным раствором NH4Cl (10 мл) и DCM (10 мл). Слои разделяли и водный слой экстрагировали DCM (3×10 мл). Объединенные органические слои сушили (MgSO4), фильтровали, концентрировали в вакууме и очищали посредством FCC, используя 0-50% EtOAc в циклогексане, с получением указанного в заголовке соединения (1,15 г, 70%). ЖХ-МС (Способ 3): Rt 3,06, 3,23 мин, m/z 298 [MH+].
с. 2,2,2-Трихлор-этиловый эфир {5-трет-бутил-2-[2-(трет-бутил-диметил-силанилокси)-этил]-2Н-пиразол-3-ил}-карбаминовой кислоты (Промежуточное соединение 10c)

К раствору Промежуточного соединения 10b (1,14 г, 3,85 ммоль) и Et3N (0,80 мл, 5,77 ммоль) в THF (38 мл) добавляли по каплям при 0°С 2,2,2-трихлорхлорформиат (583 мкл, 4,23 ммоль) и затем нагревали до КТ в течение 1 ч. Реакционную смесь оставляли стоять в течение дополнительных 18 ч. Смесь разбавляли насыщенным водным раствором NH4Cl (10 мл) и DCM (10 мл). Слои разделяли и водный слой экстрагировали DCM (3×10 мл). Объединенные органические слои сушили (MgSO4), фильтровали, концентрировали в вакууме и очищали три раза посредством FCC, используя 0-30% EtOAc в циклогексане, с получением указанного в заголовке соединения в виде желтого масла (354 мг, 19%). Rf=0,6 (50% EtOAc в циклогексане); 1Н ЯМР (300 МГц, CDCl3): 0.02 (s, 6Н), 0.81 (s, 9Н), 1.23 (s, 9Н), 3.88 (t, J=4,5 Гц, 2Н), 4.15 (t, J=4,5 Гц, 2Н), 4.77 (s, 2Н), 6.16 (s, 1Н), 8.30 (br s, 1Н).
d. 1-{5-трет-Бутил-2-[2-(трет-6утил-диметил-силанилокси)-этил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Промежуточное соединение 10d)

Раствор Промежуточного соединения 10 с (176 мг, 0,37 ммоль), Промежуточного соединения 1g (100 мг, 0,31 ммоль) и DIPEA (0,16 мл, 0,93 ммоль) в THF (2 мл) нагревали при 60°С в течение 19 ч. Реакционную смесь разбавляли H2O (5 мл) и DCM (5 мл). Слои разделяли и водный слой экстрагировали DCM (3×5 мл). Объединенные органические слои сушили (MgSO4), фильтровали, концентрировали в вакууме и затем очищали посредством FCC, используя 0-5% [2М NH3 в МеОН] в DCM, с получением указанного в заголовке соединения в виде белого порошка (108 мг, 19%). Rf=0,4 (5% [2М NH3 в МеОН] в DCM); ЖХ-МС (Способ 3): Rt 4,27 мин, m/z 646 [MH+].
e. 1-[5-трет-Бутил-2-(2-гидрокси-этил)-2H-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 10)
К раствору Промежуточного соединения 10d (100 мг, 0,15 ммоль) в THF (2 мл), TBAF (1М в THF, 0,23 мл, 0,23 ммоль) добавляли при КТ и перемешивали в течение 10 мин. Реакционную смесь разбавляли H2O (5 мл) и DCM (5 мл). Слои разделяли и водный слой экстрагировали DCM (3×5 мл). Объединенные органические слои сушили (MgSO4), фильтровали, концентрировали в вакууме и затем очищали посредством FCC, используя 0-5% [2М NH3 в МеОН] в DCM). Остаток промывали водой и очищали посредством ВЭЖХ (30%-100% MeCN в Н2О, 0,1% муравьиной кислоты) с получением указанного в заголовке соединения в виде белого порошка (47 мг, 57%). Rf=0,2 (5% [2М NH3 в МеОН] в DCM) ЖХ-МС (Способ 5): Rt 3,59 мин, m/z 532 [MH+]. 1Н ЯМР (400 МГц, CDCl3): 1Н ЯМР (300 МГц, CDCl3): 1.25 (s, 9Н), 1.43 (d, J=6,9 Гц, 3Н), 1.46 (d, J=6,9 Гц, 3Н), 1.92-2.30 (m, 4Н), 3.25 (р, J=6,9 Гц, 1Н), 3.95 (t, J=4,7 Гц, 2Н), 4.15 (dd, J=5,3, 3,5 Гц, 2Н), 5.09-5.16 (m, 1Н), 5.92 (d, J=8,0 Гц, 1Н), 6.12 (s, 1Н), 6.92 (dd, J=9,8, 1,9 Гц, 1Н), 7.22-7.27 (m, 2Н), 7.33 (td, J=5,8, 3,0 Гц, 1Н), 7.40 (s, 1Н), 7.43 (br s, 2Н), 7.47 (d, J=7,8 Гц, 1Н), 7.70 (s, 1Н).
Пример 11

1-[5-трет-Бутил-2-(4-гидроксиметил-фенил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
Указанное в заголовке соединение получали из [4-(5-амино-3-трет-бутил-1Н-пиразол-1-ил)фенил]метанола (для ссылки на методику см. WO 2011070368) с использованием методик, аналогичных описанным для Примера 3. ЖХ-МС (Способ 5): Rt 4,01 мин, m/z 594,2 [MH+]; 1H ЯМР (400 МГц, CDCl3): 1.30 (9Н, s), 1.37-1.40 (3Н, d, J 6,9 Гц), 1.40-1.43 (3Н, d, J 6,9 Гц), 1.84-1.96 (1Н, m), 2.00-2.10 (2Н, m), 2.16-2.25 (1Н, m), 3.17-3.24 (1Н, sp, J 6,9 Гц), 4.60 (2Н, s), 5.01-5.09 (1Н, td, J 9,0, 5,6 Гц), 5.14-5.19 (1Н, t, J 3,9 Гц), 5.70-5.78 (1Н, br s), 6.32 (1Н, s), 6.86 (1Н, br s), 6.95 (1Н, dd, J 9,8, 2,0 Гц), 7.23-7.31 (5Н, m), 7.39-7.46 (4Н, m).
Пример 12
1-{5-трет-Бутил-2-[3-(4,4-дифтор-пиперидин-1-илметил)-фенил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. 1-(3-Бром-бензил)-4,4-дифтор-пиперидин (Промежуточное соединение 12а)
Смесь 3-бромбензилбромида (3,43 г, 13,73 ммоль), гидрохлорида 4,4-дифтор-пиперидина (2,20 г, 13,97 ммоль) и карбоната калия (4,82 г, 34,86 ммоль) в ацетонитриле (50 мл) перемешивали при КТ в течение 16 ч. Смесь фильтровали и упаривали и остаток распределяли между водой (30 мл) и EtOAc (3×30 мл). Объединенные органические экстракты промывали водой (2×50 мл) и сушили (Na2SO4). Растворитель выпаривали с получением указанного в заголовке соединения в виде бесцветного масла (3,96 г, 99%). ЖХ-МС (Способ 1): Rt 1,89 мин, m/z 290/292 [MH+].
b. Ди-трет-бутил-1-{3-[(4,4-дифторпиперидин-1-ил)метил]фенил}-гидразин-1,2-дикарбоксилат (Промежуточное соединение 12b)
н-Бутиллитий (1,6 М в гексанах, 4,5 мл, 7,28 ммоль) добавляли по каплям к перемешиваемому раствору Промежуточного соединения 12а (1,98 г, 6,82 ммоль) в безводном THF (15 мл) при -78°С под азотом. Смесь перемешивали при -78°С в течение 10 мин, затем добавляли в виде одной порции ди-трет-бутилазодикарбоксилат (1,73 г, 7,51 ммоль). Смесь перемешивали при -78°С в течение 20 мин, затем оставляли нагреваться до КТ в течение 20 мин. Смесь затем распределяли между насыщенным раствором хлорида аммония (15 мл) и этилацетатом (3×20 мл). Объединенные органические экстракты промывали рассолом (20 мл) и сушили (Na2SO4). Растворитель выпаривали и остаток очищали посредством FCC, элюируя 0-100% EtOAc в пентане, с получением указанного в заголовке соединения в виде бледно-желтого масла (1,30 г, 43%). ЖХ-МС (Способ 1): Rt 2,54 мин, m/z 442 [MH+].
c. 5-трет-Бутил-2-[3-(4,4-дифтор-пиперидин-1-илметил)-фенил]-2Н-пиразол-3-иламин (Промежуточное соединение 12c)

Смесь Промежуточного соединения 12b (1,30 г, 2,94 ммоль), пивалоилацетонитрила (0,37 г, 2,94 ммоль) и концентрированной HCl (1,5 мл) в этаноле (10 мл) кипятили с обратным холодильником в течение 3 ч. Значение pH охлажденной смеси доводили до приблизительно 7 водным насыщенным NaHCO3 и смесь распределяли между водой (15 мл) и EtOAc (3×15 мл). Объединенные органические экстракты промывали рассолом (20 мл) и сушили (Na2SO4). Растворитель выпаривали и остаток очищали посредством FCC, элюируя 0-100% EtOAc в пентане, с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (450 мг, 43%). ЖХ-МС (Способ 1): Rt 1,93 мин, m/z 349 [MH+].
d. 2,2,2-Трихлор-этиловый эфир {5-трет-бутил-2-[3-(4,4-дифтор-пиперидин-1-илметил)-фенил]-2Н-пиразол-3-ил}-карбаминовой кислоты (Промежуточное соединение 12d)

2,2,2-Трихлорэтилхлорформиат (0,077 мл, 0,57 ммоль) добавляли к раствору Промежуточного соединения 12c (200 мг, 0,57 ммоль) и DIPEA (0,31 мл, 1,81 ммоль) в THF (5 мл) и смесь перемешивали в течение 3 ч. Смесь затем распределяли между водой (10 мл) и EtOAc (3×15 мл) и объединенные органические экстракты сушили (Na2SO4). Растворитель выпаривали и остаток растирали в пентане и отфильтровывали с получением указанного в заголовке соединения в виде желтого твердого вещества (215 мг, 72%). ЖХ-МС (Способ 1): Rt 2,89 мин, m/z 523/525 [MH+]
e. 1-{5-трет-Бутил-2-[3-(4,4-дифтор-пиперидин-1-илметил)-фенил]-2H-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-a]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 12)
Указанное в заголовке соединение получали с использованием Промежуточного соединения 12d и Промежуточного соединения 1g с использованием методики, аналогичной описанной для Примера 1, стадия h. ЖХ-МС (Способ 5): Rt 2,52 мин, m/z 697 [MH+]; 1Н ЯМР (300 МГц, CDCl3): 1.33 (9Н, s), 1.48 (6Н, dd, J 7,0, 13,0 Гц), 1.90-2.15 (8Н, m), 2.24-2.31 (1Н, m), 2.56 (4Н, br s), 3.21-3.31 (1Н, m), 3.59 (2Н, br s), 5.06-5.13 (1Н, m), 5.18-5.21 (1Н, m), 5.34 (1H, br s), 6.30 (1H, br s), 6.36 (1 H, br s), 7.03-7.06 (1H, m), 7.29 (4H, br s), 7.39-7.47 (3H, m), 7.53 (1H, br s), 7.62-7.65 (1H, m).
Пример 13
1-(5-трет-Бутил-2-{4-[2-(4-метил-пиперазин-1-ил)-этокси]-фенил}-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина, соль муравьиной кислоты

а. 5-трет-Бутил-2-(4-метокси-фенил)-2Н-пиразол-3-иламин (Промежуточное соединение 13а)

4,4-Диметил-3-оксо-пентаннитрил (14,28 г, 114 ммоль) и 4-метоксифенил-гидразин (19,89 г, 114 ммоль) растворяли в смеси абсолютного этанола (170 мл) и ледяной уксусной кислоты (5,0 мл), затем кипятили с обратным холодильником в течение 3 ч, а затем оставляли стоять в течение ночи при КТ. Полученное красно-коричневое твердое вещество отфильтровывали и фильтрат затем разбавляли водой (500 мл) и подщелачивали 880 аммиачным раствором до pH=5. Этот водный раствор экстрагировали диэтиловым эфиром (3х). Объединенные органические фазы сушили (MgSO4) и упаривали в вакууме с получением коричневого масла. В результате растирания (пентан) получили указанное в заголовке соединение в виде светло-пурпурного/коричневого твердого вещества (23,07 г, 94,1 ммоль, 82%). ЖХ-МС (Способ 1): Rt 2,87 мин, m/z 246/247 [MH+].
b. 4-(5-Амино-3-трет-бутил-пиразол-1-ил)-фенол (Промежуточное соединение 13b)

Промежуточное соединение 13а (10,0 г, 40,8 ммоль) растворяли в DCM (80,0 мл) и добавляли порциями трихлорид алюминия (28,0 г, 204,0 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 4 ч. Добавляли порциями дополнительное количество трихлорида алюминия (28,0 г, 204,0 ммоль) и реакционную смесь кипятили с обратным холодильником в течение ночи. После охлаждения смесь осторожно добавляли порциями к насыщенному водному NaHCO3 (300 мл). Смесь экстрагировали этилацетатом (300 мл) и разделяли. Водный слой фильтровали в вакууме и подкисляли 1 н. HCl до pH=7. Этот водный слой затем снова экстрагировали этилацетатом и органические экстракты сушили (MgSO4) и упаривали в вакууме. В результате очистки посредством FCC с использованием 0-40% EtOAc в DCM получили указанное в заголовке соединение (5,0 г, 21,6 ммоль, 53%). ЖХ-МС (способ 1): Rt 2,77 мин, m/z 232/233 [MH+].
c. 5-трет-Бутил-2-{4-[2-(4-метил-пиперазин-1-ил)-этокси]-фенил}-2Н-пиразол-3-иламин (Промежуточное соединение 13c)

К раствору Промежуточного соединения 13b (1,15 г, 5,0 ммоль), 2-(4-метил-пиперазин-1-ил)-этанола (864 мг, 6,0 ммоль) и трифенилфосфина (2,62 г, 10,0 ммоль) в THF (10 мл) добавляли по каплям диизопропилазодикарбоксилат (2,0 г, 10,0 ммоль) и перемешивали в течение 75 мин. Смесь разбавляли диэтиловым эфиром (50 мл) и экстрагировали 10%-ным водным раствором лимонной кислоты (2х). Объединенные водные слои подщелачивали твердым карбонатом калия до pH=9. Водный слой затем экстрагировали этилацетатом (3х). Объединенные этилацетатные слои промывали рассолом, сушили (NaSO4) и упаривали в вакууме. Очищали посредством FCC с использованием 0-12% [9:1 МеОН/880 аммиак] в DCM. Полученный продукт кристаллизовали (диэтиловый эфир) с получением указанного в заголовке соединения (270 мг, 0,756 ммоль, 15%). ЖХ-МС (Способ 1): Rt 2,31, 1,72 мин, m/z 358/359 [MH+].
d. 2,2,2-Трихлор-этиловый эфир (5-трет-бутил-2-{4-[2-(4-метил-пиперазин-1-ил)-этокси]-фенил}-2Н-пиразол-3-ил)-N,N-бис-карбаминовой кислоты (Промежуточное соединение 13d)
Трихлорэтилхлорформиат (144 мг, 0,68 ммоль) добавляли по каплям к раствору Промежуточного соединения 13 с (115 мг, 0,34 ммоль) и диизопропилэтиламина (129 мг, 1,0 ммоль) в THF (4 мл) и перемешивали в течение 2 ч. Эту смесь разбавляли этилацетатом (25 мл) и промывали водой, рассолом и сушили (MgSO4) и упаривали в вакууме с получением указанного в заголовке соединения (240 мг, 0,34 ммоль, 100%). ЖХ-МС (способ 1): Rt 3,02 мин, m/z 708 [MH+].
e. 1-(5-трет-Бутил-2-{4-[2-(4-метил-пиперазин-1-ил)-этокси]-фенил}-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина, соль муравьиной кислоты (Пример 13)
Промежуточное соединение 1g (95 мг, 0,295 ммоль) и Промежуточное соединение 13d (175 мг, 0,33 ммоль) в смеси DMF (0,50 мл) и диизопропилэтиламина (110 мг, 0,85 ммоль) нагревали до 60°С в течение 3 ч. Раствор загружали на картридж SCX-2, промывая МеОН и элюируя 2М NH3 в МеОН. Полученный остаток очищали посредством ВЭЖХ (колонка С18 X-select, 10-30% MeCN в H2O, 0,1% муравьиной кислоты) с получением указанного в заголовке соединения (15 мг, 6,4%). ЖХ-МС (Способ 5): Rt 3,34 мин, m/z=706,4 [MH+]. 1Н ЯМР (400 МГц, CDCl3): 1.34 (9Н, s), 1.48 (6Н, dd, J 7,0, 16,4 Гц), 1.90-2.30 (4Н, m), 2.40 (3Н, s), 2.75 (8Н, br s), 2.91 (2Н, t, J 5,3 Гц), 3.28 (1Н, m), 4.11 (2Н, t, J 5,3 Гц), 5.10 (1Н, m), 5.20 (1Н, t, J 4,0 Гц), 6.16 (1Н, br d), 6.39 (1Н, s), 6.89 (2Н, d, J 9,0 Гц), 7.04 (1Н, dd, J 2,1, 10,0 Гц), 7.18 (1Н, br s), 7.25-7.34 (2Н, m), 7.36-7.40 (3Н, m), 7.47 (1Н, m), 7.60 (1Н, d, J 10,1 Гц), 8.14 (1Н, br s).
Пример 14
1-[5-трет-Бутил-2-(4-циано-фенил)-2Н-пиразол-3-ил]-3-[(1S,4S)-4-{3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. 4-(5-Амино-3-трет-бутил-пиразол-1-ил)-бензонитрил (Промежуточное соединение 14а)

Кремовую суспензию гидрохлорида 4-цианофенилгидразина (1,70 г, 10,0 ммоль) и 4,4-диметил-3-оксопентаннитрила (1,31 г, 10,5 ммоль) в EtOH (25 мл) перемешивали при кипячении с обратным холодильником в течение 4 ч, затем при КТ в течение 64 ч и вновь при кипячении с обратным холодильником в течение 24 ч. Раствор охлаждали при КТ, концентрировали в вакууме и распределяли между водой (50 мл) и EtOAc (75 мл). Органические фазы промывали рассолом (50 мл), сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением оранжевого твердого вещества (2,28 г, 95%). ЖХ-МС (Способ 3): Rt 3,45 мин, m/z 241 [MH+].
b. 2,2,2-Трихлор-этиловый эфир [5-трет-бутил-2-(4-циано-фенил)-2Н-пиразол-3-ил]-карбаминовой кислоты (Промежуточное соединение 14b)

К суспензии Промежуточного соединения 14а (2,28 г, 9,49 ммоль) в EtOAc (25 мл) и водного раствора NaOH (1М, 23,7 мл, 23,7 ммоль) добавляли по каплям в течение 2 мин 2,2,2-трихлорэтилхлорформиат (1,57 мл, 11,4 ммоль). Образовался осадок, который снова растворяли через 15 мин, затем оранжевый раствор перемешивали при КТ в течение 90 мин. Добавляли 2,2,2-трихлорэтилхлорформиат (0,391 мл, 2,85 ммоль) и оранжевую смесь перемешивали при КТ в течение 16 ч. Слои разделяли и водный слой экстрагировали EtOAc (25 мл). Объединенные органические фазы промывали рассолом (25 мл), сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением оранжево-красного масла. В результате перекристаллизации из циклогексана получили не совсем белое твердое вещество (3,12 г, 79%). ЖХ-МС (Способ 3): Rt 4,46 мин, m/z 415, 417 [MH+].
с. 1-[5-трет-Бутил-2-(4-циано-фенил)-2Н-пиразол-3-ил]-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 14)
Раствор Промежуточного соединения 14b (61,6 мг, 0,148 ммоль), Промежуточного соединения 5 с (43,4 мг, 0,135 ммоль) и DIPEA (0,029 мл, 0,169 ммоль) в диоксане-DMF (3:1, 2,0 мл) перемешивали при 60°С в течение 18 ч. Добавляли воду (3 мл), затем смесь экстрагировали DCM-MeOH (9:1, 2×3 мл). Объединенные органические фазы пропускали через гидрофобную фритту и концентрировали в вакууме с получением оранжевого масла. В результате FCC с использованием 2-8% МеОН в DCM получили указанное в заголовке соединение в виде белого твердого вещества после лиофильной сушки (35,0 мг, 44%). ЖХ-МС (Способ 5): Rt 4,46 мин, m/z 589 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.28 (9Н, s), 1.37 (3Н, d, J 7,1), 1.39 (3Н, d, J 7,1), 1.75 (1Н, m), 2.01 (1Н, m), 2.09-2.22 (2Н, m), 3.57 (1Н, sept, J 6,9), 4.88 (1H, m), 5.58 (1H, t, J 4,5), 6.38 (1H, s), 7.06 (1H, d, J 8,2), 7.23 (1H, dd, J 9,9, 2,2), 7.27 (1H, d, J 7,3), 7.29-7.38 (2Н, m), 7.42 (1H, d, J 7,5), 7.69 (1H, dd, J 9,9, 0,9), 7.75 (2H, d, J 8,9), 7.96 (2H, d, J 8,7), 8.21 (2H, s).
Пример 15

1-[5-трет-Бутил-2-(4-гидроксиметил-фенил)-2Н-пиразол-3-ил]-3-[(1S,4S)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
Указанное в заголовке соединение получали из [4-(5-амино-3-трет-бутил-1Н-пиразол-1-ил)фенил]метанола (для ссылки на методику см. WO 2011070368) с использованием методик, аналогичных описанным в Примере 5. ЖХ-МС (Способ 5): Rt 4,01 мин, m/z 594,2 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.27 (9Н, s), 1.37 (3Н, d, J 7,2), 1.38 (3Н, d, J 7,2), 1.74 (1H, m), 2.01 (1Н, m), 2.11-2.16 (2Н, m), 3.56 (1Н, m), 4.55 (2Н, d, J 3,1), 4.89 (1H, m), 5.29 (1H, s), 5.57 (1H, t, J 3,9), 6.33 (1H, s), 7.04 (1H, d, J 8,1), 7.22 (1H, dd, J 9,9, 2,1), 7.35-7.44 (8H, m), 7.68 (1H, m), 8.02 (1H, s), 8.21 (1H, d, J 2,0).
Пример 16
1-(5-трет-Бутил-2-пиперидин-4-ил-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

а. Бензиловый эфир 4-гидразино-пиперидин-1-карбоновой кислоты (Промежуточное соединение 16а)

Раствор 1-CBZ-4-пиперидона (2,92 г, 12,5 ммоль) и гидрата гидразина (2,01 мл, 18,8 ммоль) в МеОН (25 мл) перемешивали при 50°С в течение 30 мин, затем охлаждали при КТ и добавляли NaBH4 (1,18 г, 31,3 ммоль) (ОСТОРОЖНО: выделение газа и экзотермический эффект до примерно 45°С). Раствор перемешивали при КТ в течение 30 мин, затем при 50°С в течение 18 ч. Охлажденный раствор концентрировали в вакууме, суспендировали в воде (25 мл) и экстрагировали DCM (2×25 мл). Объединенные органические фазы пропускали через гидрофобную фритту и концентрировали в вакууме с получением прозрачного масла. В результате FCC с использованием 0-10% [2Н NH3 в МеОН] в DCM получили указанное в заголовке соединение в виде прозрачного масла (1,80 г, 58%). ЖХ-МС (Способ 3): Rt 2,03 мин, m/z 250 [MH+].
b. Бензиловый эфир 4-(5-амино-3-трет-бутил-пиразол-1-ил)-пиперидин-1-карбоновой кислоты (Промежуточное соединение 16b)

Желтый раствор Промежуточного соединения 16а (1,80 г, 7,22 ммоль), 4,4-диметил-3-оксопентаннитрила (1,08 г, 8,66 ммоль) и HCl (4М в диоксане, 2,70 мл, 10,8 ммоль) в EtOH (25 мл) перемешивали при кипячении с обратным холодильником в течение 4 ч. Охлажденный раствор наносили на картридж SCX-2 (50 г), промывали МеОН (100 мл). Продукт элюировали 2М NH3 в МеОН (100 мл); концентрирование в вакууме дало желтое масло (772 мг). В результате FCC с использованием 0-5% МеОН в DCM получили указанное в заголовке соединение в виде желтой смолы (550 мг, 21%). ЖХ-МС (Способ 3): Rt 2,88 мин, m/z 357 [MH+].
c. Бензиловый эфир 4-[3-трет-бутил-5-(2,2,2-трихлор-этоксикарбониламино)-пиразол-1-ил]-пиперидин-1-карбоновой кислоты (Промежуточное соединение 16 с)

К раствору Промежуточного соединения 16b (550 мг, 1,54 ммоль) в водном растворе NaOH (1М, 3,85 мл, 3,85 ммоль) и EtOAc (5 мл) при КТ добавляли 2,2,2-трихлорэтилхлорформиат (0,32 мл, 2,31 ммоль) в течение 2 мин, затем смесь интенсивно перемешивали в течение 30 мин. Водный слой экстрагировали EtOAc (10 мл), затем объединенные органические фазы промывали рассолом (10 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме с получением желто-коричневого масла. В результате FCC с использованием 0-30% EtOAc в циклогексане получили указанное в заголовке соединение в виде белой пены (337 мг, 41%). ЖХ-МС (Способ 3): Rt 4,81 мин, m/z 531, 533 [MH+].
d. Бензиловый эфир 4-(3-трет-бутил-5-{3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-уреидо}-пиразол-1-ил)-пиперидин-1-карбоновой кислоты (Промежуточное соединение 16d)
Коричневый раствор Промежуточного соединения 16 с (337 мг, 0,634 ммоль), Промежуточного соединения 1g (195 мг, 0,603 ммоль) и DIPEA (0,131 мл, 0,754 ммоль) в DMF (5 мл) перемешивали при 100°С в течение 90 мин. Охлажденный раствор концентрировали в вакууме, суспендировали в воде (5 мл) и экстрагировали DCM (2×5 мл). Объединенные органические фазы пропускали через гидрофобную фритту и концентрировали в вакууме с получением коричневой смолы. В результате FCC с использованием 4,5% МеОН в DCM получили указанное в заголовке соединение в виде желтого-коричневого масла (364 мг, 86%). ЖХ-МС (Способ 3): Rt 3,96 мин, m/z 705 [MH+].
e. 1-(5-трет-Бутил-2-пиперидин-4-ил-2H-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло-[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 16)
Суспензию Промежуточного соединения 16d (165 мг, 0,234 ммоль), Pd/C (10%, 16 мг) и 2М NH3 в МеОН (0,117 мл, 0,234 ммоль) в EtOH (5 мл) в атмосфере N2 вакуумировали и дважды продували H2, затем перемешивали при КТ в течение 8 ч. Суспензию фильтровали через целит, затем осадок на фильтре промывали EtOH (10 мл). Объединенные органические фазы концентрировали в вакууме до объема приблизительно 0,5 мл, затем наносили на картридж SCX-2 (5 г) и промывали МеОН (5 мл). Продукт элюировали 2М NH3 в МеОН (25 мл); концентрирование в вакууме дало бледно-желтое твердое вещество, которое растирали с диэтиловым эфиром (10 мл) с получением темно-желтого твердого вещества (121 мг). Половину этого вещества очищали посредством ВЭЖХ (XBridge С18, 25-98% MeCN в H2O, 0,1% NH4OH) с получением указанного в заголовке соединения в виде белого твердого вещества после лиофильной сушки (20,0 мг, 15%). ЖХ-МС (Способ 5): Rt 3,16 мин, m/z 571 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.16 (9Н, s), 1.33 (3Н, d, J 6,8), 1.35 (3Н, d, J 6,8), 1.68 (2Н, m), 1.79 (2Н, m), 1.91 (2Н, m), 2.09 (2Н, m), 2.47 (2Н, m), 2.98 (2Н, d, J 12,3), 3.50 (1H, sept, J 6,8), 3.92 (1H, m), 4.82 (1H, m), 5.51 (1H, t, J 4,5), 5.97 (1H, s), 6.88 (1H, d, J 8,6), 7.14 (1H, dd, J 9,9, 2,1), 7.26 (1H, m), 7.31-7.38 (3H, m), 7.65 (1H, dd, J 9,8, 0,8), 8.07 (1H, br s), 8.18 (1H, d, J 2,0).
Пример 17

1-[5-трет-Бутил-2-(1-метил-пиперидин-4-ил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
Смесь соединения Примера 16 (половина неочищенного вещества, примерно 64,8 мг, 0,114 ммоль) и формальдегида (37% в воде, 0,092 мл, 1,14 ммоль) в DCM (2 мл) перемешивали при КТ в течение 10 мин, затем последовательно добавляли АсОН (0,013 мл, 0,227 ммоль) и NaBH(OAc)3 (48,1 мг, 0,227 ммоль) и раствор перемешивали при КТ в течение 3 ч. Раствор концентрировали в вакууме до объема приблизительно 0,5 мл, наносили на картридж SCX-2 (2 г) и промывали МеОН (15 мл). Продукт элюировали 2М NH3 в МеОН (10 мл); концентрирование в вакууме дало бледно-желтое твердое вещество (82,6 мг). В результате ВЭЖХ (XBridge С18, 30-98% MeCN в H2O, 0,1% NH4OH) получили указанное в заголовке соединение в виде белого твердого вещества после лиофильной сушки (30,8 мг, 46%). ЖХ-МС (Способ 5): Rt 3,18 мин, m/z 585 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.21 (9Н, s), 1.38 (Н, d, J 6,8), 1.40 (3Н, d, J 6,8), 1.75 (2Н, t, J 12,2), 1.91-2.04 (6H, m), 2.07-2.17 (2H, m), 2.18 (3Н, s), 2.87 (2H, d, J 10,6), 3.58 (1H, sept, J 6,8), 3.88 (1H, m), 4.88 (1H, m), 5.56 (1H, t, J 4,7), 6.02 (1H, s), 6.89 (1H, d, J 8,6), 7.19 (1H, dd, J 9,8, 2,1), 7.31 (1H, m), 7.36-7.43 (3H, m), 7.70 (1H, d, J 9,8), 8.06 (1H, s), 8.22 (1H, d, J 2,0).
Пример 18

1-[5-трет-Бутил-2-(2-морфолин-4-ил-этил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
К перемешиваемому раствору соединения Примера 10 (136 мг, 0,26 ммоль) и Et3N (0,11 мл, 0,77 ммоль) в DCM (2,5 мл) добавляли мезилхлорид (31 мкл, 0,31 ммоль) при 0°С в атмосфере N2. Через 15 мин реакционную смесь нагревали до КТ. Через 15 мин добавляли H2O (5 мл) и DCM (5 мл). Слои разделяли и водный слой экстрагировали DCM. Объединенные органические фазы сушили, фильтровали и концентрировали в вакууме. Полученный остаток растворяли в THF (2,5 мл), затем последовательно добавляли DIPEA (49 мкл, 0,28 ммоль) и морфолин (67 мкл, 0,77 ммоль). Полученную смесь кипятили с обратным холодильником в течение 21 ч. Реакционную смесь охлаждали до КТ, затем добавляли H2O (5 мл) и DCM (5 мл). Слои разделяли и водный слой экстрагировали DCM (3×5 мл). Объединенные органические фазы сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали посредством FCC с использованием 0-10% [2М NH3 в МеОН] в DCM и затем препаративной ВЭЖХ (колонка Gemini С18, 20%-98% MeCN в H2O, 0,1% HCO2H, 20 мин) с получением указанного в заголовке соединения в виде белого порошка после лиофильной сушки (64 мг, 41%). ЖХ-МС (Способ 5): Rt 3,21 мин, m/z 601 [MH+]. 1Н ЯМР (400 МГц, CDCl3): 1.22 (9Н, s), 1.47 (3Н, d, J 6,9), 1.50 (3Н, d, J 6,9), 2.00-2.12 (3Н, m), 2.25-2.31 (1Н, m), 2.53-2.56 (4Н, m), 2.68-2.70 (2Н, m), 3.28 (1Н, m), 3.80 (4H, t, J 4,7), 4.16 (2H, t, J 4,7), 5.12-5.15 (1H, m), 5.20 (1H, d, J 4,2), 5.46 (1H, d, J 8,8), 5.89 (1H, s), 7.09 (1H, dd), 7.27-7.30 (2H, m), 7.36-7.40 (1H, m), 7.45 (1H, d, J 2,0), 7.47 (1H, d, J 7,9), 7.67 (1H, dd, J 9,9, 0,8), 9.43 (1H, s).
Пример 19
1-(5-трет-Бутил-2-метил-2Н-пиразол-3-ил)-3-[(1S,4R)-7-фтор-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. (1R,4S)-4-Амино-6-фтор-1,2,3,4-тетрагидро-нафталин-1-ол (Промежуточное соединение 19а)

К раствору 2,2,2-трифтор-N-((1S,4R)-7-фтор-4-гидрокси-1,2,3,4-тетрагидро-нафталин-1-ил)-ацетамида (синтезированного способом, аналогичным описанному в WO 2009/048474) (2,31 г, 8,34 ммоль) в МеОН (22,5 мл) добавляли раствор гидроксида натрия (0,834 г, 20,8 ммоль) в воде (15 мл) и смесь перемешивали при КТ в течение 65 ч. Смесь концентрировали в вакууме, затем наносили на картридж SCX-2 (50 г), промывая метанолом, затем элюируя основные компоненты 0,2-1 М аммиака в метаноле. Фракции, содержащие продукт, объединяли и концентрировали в вакууме. Остаток очищали посредством FCC с использованием 0-10% [2М NH3 в МеОН] в DCM с получением указанного в заголовке соединения (1,29 г, 86%). 1Н ЯМР (300 МГц, d6-DMSO): 1.60-2.15 (6Н, m), 3.62-3.71 (1Н, m), 4.49 (1Н, t, J 4,7), 5.15 (1Н, br s), 6.98 (1Н, dt, J 8,6, 2,8), 7.28 (1H, dd, J 10,7, 2,8), 7.36 (1H, dd, J 8,6, 6,2).
b. (1S,4R)-7-Фтор-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидронафталин-1-иламин (Промежуточное соединение 19b)

Промежуточное соединение 19а (837 мг, 4,62 ммоль) растворяли в безводном DMF (15 мл) в атмосфере Ar, затем добавляли NaH (60% в минеральном масле, 556 мг, 13,9 ммоль) и смесь перемешивали в течение 15 мин. Добавляли Промежуточное соединение 1f (893 мг, 4,99 ммоль) и реакционную смесь нагревали при 60°С в течение 2 ч. Реакционную смесь охлаждали, гасили добавлением воды и экстрагировали DCM (4×30 мл). Объединенные органические слои промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали посредством FCC, элюируя 0-20% [2М NH3 в МеОН] в DCM с получением указанного в заголовке соединения (429 мг, 27%). ЖХ-МС (Способ 3): Rt 1,96, m/z 363 [MNa+].
c. 1-(5-трет-Бутил-2-метил-2Н-пиразол-3-ил)-3-[(1S,4R)-7-фтор-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 19)
Промежуточное соединение 19b (85,0 мг, 0,250 ммоль) и 2,2,2-трихлор-этиловый эфир (5-трет-бутил-2-метил-2Н-пиразол-3-ил)-карбаминовой кислоты (US 2004/192653, 99 мг, 0,300 ммоль) растворяли в 1,4-диоксане (3 мл) и DIPEA (70 мкл, 0,400 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 1,75 ч, затем добавляли дополнительное количество 2,2,2-трихлор-этилового эфира (5-трет-бутил-2-метил-2Н-пиразол-3-ил)-карбаминовой кислоты (35 мг, 0,100 ммоль) и DIPEA (3 капли). Через дополнительные 4 часа смесь концентрировали в вакууме. Остаток очищали посредством FCC с использованием 0-15% МеОН в DCM с получением неочищенного продукта (82 мг). В результате двукратной очистки посредством ВЭЖХ (колонка С18 X-select, 40-98% MeCN в H2O, 0,1% HCO2H) получили указанное в заголовке соединение в виде белого порошка после лиофильной сушки (44 мг, 34%). ЖХ-МС (Способ 5): Rt 3,83 мин, m/z 520,1 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.21 (9Н, s), 1.35-1.43 (6Н, m), 1.85-2.25 (4Н, m), 3.51-3.62 (4Н, m), 4.80-4.91 (1Н, m), 5.50-5.57 (1Н, m), 6.02 (1Н, s), 7.09 (1Н, d, J 8,8), 7.11-7.17 (2Н, m), 7.20 (1Н, dd, J 9,6, 2,2), 7.44-7.50 (1H, m), 7.69 (1H, d, J 9,6), 8.22 (1H, brd), 8.40 (1H, s).
Пример 20
1-[(1S,4R)-4-(3-Изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-3-(2-п-толил-2Н-пиразол-3-ил)-мочевина

a. 2,2,2-Трихлор-этиловый эфир (2-п-толил-2Н-пиразол-3-ил)-карбаминовой кислоты (Промежуточное соединение 20а)

NaOH (107 мг, 2,67 ммоль) добавляли к перемешиваемому раствору 2-п-толил-2Н-пиразол-3-иламина (для ссылки на методику см. WO 2009/150614, 346 мг, 2,00 ммоль) в воде (1 мл) и EtOAc (4 мл). Смесь охлаждали до 0°С и добавляли 2,2,2-трихлорэтилхлорформиат (385 мкл, 2,80 ммоль). Перемешивание продолжали в течение 30 мин при 0°С и затем в течение 2 ч при КТ. Смесь распределяли между водой и EtOAc. Органическую фазу промывали рассолом и концентрировали досуха в вакууме с получением указанного в заголовке соединения в виде оранжевого остатка. ЖХ-МС (Способ 3): Rt 3,90 мин, m/z 348, 350 [MH+].
b. 1-[(1S,4R)-4-(3-Изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-3-(2-п-толил-2Н-пиразол-3-ил)-мочевина (Пример 20)
Смесь Промежуточного соединения 1g (50,0 мг, 0,16 ммоль), Промежуточного соединения 20а (54,0 мг, 0,16 ммоль) и DIPEA (54,0 мкл, 0,31 ммоль) в DMF (2,5 мл) нагревали до 100°С в течение 1 ч. После охлаждения смесь распределяли между EtOAc и водой и затем экстрагировали EtOAc (3х). Объединенные органические экстракты промывали насыщенным водным раствором NaHCO3, рассолом и упаривали в вакууме. Остаток очищали посредством FCC с использованием 0-10% [2М NH3 в МеОН] в DCM с получением бежевого твердого вещества (30 мг). В результате дополнительной очистки посредством ВЭЖХ (5-98% MeCN в H2O, 0,1% HCO2H) получили указанное в заголовке соединение в виде белого твердого вещества после лиофильной сушки (17 мг, 20%). ЖХ-МС (Способ 5): Rt 3,68 мин, m/z 522 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.35-1.40 (6Н, m), 1.81-1.98 (2Н, m), 2.02-2.15 (2Н, m), 2.37 (3Н, s), 3.57 (1Н, sept, J 6,6), 4.83 (1Н, m), 5.52 (1Н, t, J 4,2), 6.40 (1Н, d, J 1,8), 7.16 (1Н, dd, J 9,6, 2,2), 7.21-7.42 (8H, m), 7.51 (1H, d, J 1,8), 7.67 (1H, d, J 9,6), 8.20 (1H, m), 8.29 (1H, m), 8.45 (1H, br s).
Пример 21

1-(1-трет-Бутил-1Н-пиразол-4-ил)-3-[(1S,4R)-7-фтор-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина
Указанное в заголовке соединение получали из 1-трет-бутил-1Н-пиразол-4-амина (Enamine) и Промежуточного соединения 19b с использованием методик, аналогичных описанным для Примера 5. ЖХ-МС (Способ 5): Rt 3,65 мин, m/z 506.2 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.36-1.42 (6Н, m), 1.49 (9Н, s), 1.84-2.25 (4Н, m), 3.57 (1Н, sept, J 7,0), 4.80-4.89 (1Н, m), 5.50-5.55 (1Н, m), 6.72 (1Н, d, J 8,8), 7.09-7.21 (3Н, m), 7.37 (1Н, d, J 0,8), 7.43-7.49 (1Н, m), 7.69 (1Н, d), 7.77 (1Н, d), 8.14 (1Н, s), 8.21 (1Н, d).
Пример 22
Формиатная соль 1-(5-трет-бутил-2-{3-[2-(4-гидрокси-пиперидин-1-ил)-этокси]-фенил}-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-з]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевины

a. 5-трет-Бутил-2-(3-триизопропилсиланилокси-фенил)-2Н-пиразол-3-иламин (Промежуточное соединение 22а)

Триизопропилсилилхлорид (1,02 мл, 3,96 ммоль) добавляли к раствору 3-(5-амино-3-трет-бутил-пиразол-1-ил)-фенола (915 мг, 3,96 ммоль) и имидазола (646 мг, 9,50 ммоль) в DMF (15 мл) при 0°С. Реакционную смесь перемешивали при КТ в течение выходных, затем распределяли между EtOAc и водой. Водный слой затем экстрагировали EtOAc (3х). Объединенные органические слои промывали рассолом, сушили (MgSO4), фильтровали и упаривали в вакууме. Остаток очищали посредством FCC с использованием 0-40% EtOAc в циклогексане с получением указанного в заголовке соединения (1,53 г, 99%). ЖХ-МС (Способ 4): Rt 4,78 мин, m/z 388 [MH+].
b. 2,2,2-Трихлор-этиловый эфир [5-трет-бутил-2-(3-триизопропилсиланилокси-фенил)-2Н-пиразол-3-ил]-карбаминовой кислоты (Промежуточное соединение 22b)

2,2,2-Трихлорэтилхлорформиат (1,09 мл, 7,92 ммоль) добавляли к раствору Промежуточного соединения 22а (1,53 г, 3,96 ммоль) и DIPEA (2,75 мл, 15,8 ммоль) в THF (40 мл) при 0°С. Реакционную смесь перемешивали при КТ в течение 3 ч, затем распределяли между EtOAc и водой. Водный слой затем экстрагировали EtOAc (3х). Объединенные органические слои промывали рассолом, сушили (MgSO4), фильтровали и упаривали в вакууме. Остаток очищали посредством FCC с использованием 0-50% EtOAc в циклогексане с получением указанного в заголовке соединения (2,22 г, 99%). ЖХ-МС (Способ 4): Rt 5,55 мин, m/z 560, 562 [MH+].
c. 1-[5-трет-Бутил-2-(3-триизопропилсиланилокси-фенил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Промежуточное соединение 22c)
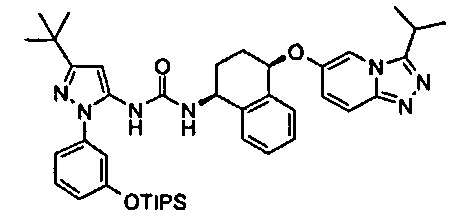
Промежуточное соединение 22b (390 мг, 0,69 ммоль) добавляли к раствору Промежуточного соединения 1g (223 мг, 0,69 ммоль) и DIPEA (240 мкл, 1,38 ммоль) в 1,4-диоксане (6,0 мл). Реакционную смесь нагревали до 60°С в течение 3 ч и нагревали при 45°С в течение ночи. Реакционную смесь охлаждали и распределяли между EtOAc и водой. Водный слой затем экстрагировали EtOAc (3х). Объединенные органические слои промывали рассолом, сушили (MgSO4), фильтровали и упаривали в вакууме. Остаток очищали посредством FCC с использованием 0-10% МеОН в DCM с получением указанного в заголовке соединения (258 мг, 50%). ЖХ-МС (Способ 2): Rt 4,93 мин, m/z 736 [MH+].
d. 1-[5-трет-Бутил-2-(3-гидрокси-фенил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Промежуточное соединение 22d)

TBAF (1М в THF, 350 мкл, 0,35 ммоль) добавляли к раствору Промежуточного соединения 22c (258 мг, 0,35 ммоль) в THF (5,0 мл) при 0°С. Реакционную смесь перемешивали в течение 1 ч, затем распределяли между EtOAc и водой. Водный слой затем экстрагировали EtOAc (3х). Объединенные органические слои промывали рассолом, сушили (MgSO4), фильтровали и упаривали в вакууме. Остаток очищали посредством FCC с использованием 0-10% МеОН в DCM с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (150 мг, 75%). ЖХ-МС (Способ 1): Rt 4,11 мин, m/z 580 [MH+]. 1Н ЯМР (400 МГц, d4-MeOD): 1.30 (9Н, s), 1.42 (3Н, d, J 6,9), 1.45 (3Н, d, J 6,9), 1.88-2.16 (3Н, m), 2.20-2.30 (1Н, m), 3.51 (1Н, sept, J 6,9), 4.90 (1Н, dd, J 8,9, 5,6), 5.45 (1H, t, J 4,1), 6.33 (1H, s), 6.84 (1H, ddd, J 8,3, 2,6, 0,8), 6.88-6.94 (2H, m), 7.19-7.26 (2H, m), 7.26-7.33 (4H, m), 7.61 (1H, d, J 10,0), 8.01 (1H, s).
e. Формиатная соль 1-(5-трет-бутил-2-{3-[2-(4-гидрокси-пиперидин-1-ил)-этокси]-фенил}-2Н-пиразол-3-ил)-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевины (Пример 22)
DIAD (51,0 мкл, 0,260 ммоль) добавляли к раствору Промежуточного соединения 22d (75,0 мг, 0,13 ммоль), 4-гидрокси-1-пиперидин-этанола (28,0 мг, 0,19 ммоль) и Ph3P (68,0 мг, 0,26 ммоль) в THF (1,5 мл) при 0°С. Реакционную смесь перемешивали при КТ в течение выходных, затем распределяли между EtOAc и водой. Водный слой экстрагировали EtOAc (3х). Объединенные органические слои промывали рассолом, сушили (MgSO4), фильтровали и упаривали в вакууме. Остаток очищали посредством FCC с использованием 0-10% [2М NH3 в МеОН] в DCM. В результате дополнительной очистки посредством ВЭЖХ (колонка С18 X-select, 25-98% MeCN в H2O, 0,1% HCO2H) получили указанное в заголовке соединение в виде белого порошка после лиофильной сушки (57 мг, 62%). ЖХ-МС (Способ 5): Rt 3,32 мин, m/z 707,4 [MH+]. 1Н ЯМР (400 МГц, d4-MeOD): 1.31 (9Н, s), 1.42 (3Н, d, J 6,8), 1.45 (3Н, d, J 6,8), 1.62-1.72 (2Н, m), 1.86-2.04 (4Н, m), 2.04-2.14 (1Н, m), 2.21-2.30 (1Н, m), 2.69-2.79 (2Н, m), 3.11- 3.19 (4Н, m), 3.51 (1Н, sept, J 6,9), 3.70-3.78 (1H, m), 4.26 (2H, t, J 5,3), 4.89 (1H, dd, J 8,9, 5,8), 5.45 (1H, t, J 4,1), 6.33 (1H, s), 7.05 (1H, ddd, J 8,4, 2,7, 0,8), 7.09-7.13 (2H, m), 7.19-7.25 (3H, m), 7.26-7.33 (2H, m), 7.42 (1H, t, J 8.1), 7.61 (1H, dd, J 9,7, 0,6), 8.01 (1H, d, J 1,7), 8.42 (1H, br s).
Пример 23
1-[5-трет-Бутил-2-(3-морфолин-4-ил-фенил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. 2-(3-Бром-фенил)-5-трет-бутил-2Н-пиразол-3-иламин (Промежуточное соединение 23а)

Смесь гидрохлорида 3-бромфенилгидразина (5,00 г, 22,4 ммоль) и 4,4-диметил-3-оксо-пентаннитрила (4,29 г, 33,6 ммоль) в абсолютном этаноле (55 мл) перемешивали при кипячении с обратным холодильником в течение 18 ч и охлаждали, затем концентрировали в вакууме. Остаток суспендировали в насыщенном водном NaHCO3 (50 мл) и экстрагировали EtOAc (3×50 мл). Объединенные органические фазы сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали посредством FCC, используя 0-5% [2М NH3 в МеОН] в DCM, с получением указанного в заголовке соединения (3,56 г, 54%). ЖХ-МС (Способ 1): Rt 3,33 мин, m/z 294, 296 [MH+].
b. Ди-трет-бутил(1-(3-бромфенил)-3-трет-бутил-1Н-пиразол-5-ил]имидодикарбонат (Промежуточное соединение 23b)

К раствору Промежуточного соединения 23а (1,50 г, 5,10 ммоль) и N,N-диметил-4-аминопиридина (31 мг, 0,26 ммоль) в DCM (30 мл) добавляли ди-трет-бутилдикарбонат (3,33 г, 15,3 ммоль) и смесь перемешивали при КТ в течение 20 ч. Смесь разбавляли DCM, промывали водой, затем сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали посредством FCC, используя 0-2,5% МеОН в DCM, с получением указанного в заголовке соединения (1,97 г, 78%). 1Н ЯМР (400 МГц, d4-MeOH): 1.33 (27Н, s), 6.13 (1Н, s), 7.25 (1Н, d J 3,9), 7.28 (1Н, d J 8,0), 7.35-7.40 (1Н, m), 7.41-7.47 (1Н, m).
c. трет-Бутиловый эфир [5-трет-бутил-2-(3-морфолин-4-ил-фенил)-2Н-пиразол-3-ил]-карбаминовой кислоты (Промежуточное соединение 23 с)

Смесь Промежуточного соединения 23b (900 мг, 1,80 ммоль), морфолина (240 мг, 2,70 ммоль), трет-бутоксида калия (303 мг, 2,70 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенила (87 мг, 0,18 ммоль) и трис(дибензилиденацетон)дипалладия(0) (81 мг, 0,09 ммоль) в THF (9 мл) облучали в микроволновой печи при 100°С в течение 20 мин. Реакционную смесь разбавляли водой и экстрагировали EtOAc (×2). Объединенные органические фазы промывали рассолом, сушили (MgSO4), фильтровали и упаривали в вакууме. Остаток очищали посредством FCC, используя 0-100% EtOAc в циклогексане, с получением указанного в заголовке соединения (290 мг, 40%). ЖХ-МС (Способ 7): Rt 3,94 мин, m/z 401 [MH+].
d. 5-трет-Бутил-2-(3-морфолин-4-ил-фенил)-2Н-пиразол-3-иламин (Промежуточное соединение 23d)

Раствор Промежуточного соединения 23c (290 мг, 0,725 ммоль) и TFA (3 мл) в DCM (4 мл) перемешивали при КТ в течение 1 ч. Реакционную смесь наносили на картридж SCX-2 (10 г) и промывали МеОН. Продукт элюировали 2М NH3 в МеОН; в результате концентрирования в вакууме получили указанное в заголовке соединение (190 мг, 86%). ЖХ-МС (Способ 1): Rt 2,29 мин, m/z 301 [MH+].
e. 2,2,2-Трихлор-этиловый эфир [5-трет-бутил-2-(3-морфолин-4-ил-фенил)-2Н-пиразол-3-ил]-карбаминовой кислоты (Промежуточное соединение 23е)
2,2,2-Трихлорэтилхлорформиат (175 мг, 0,82 ммоль) добавляли по каплям к раствору Промежуточного соединения 23d (190 мг, 0,63 ммоль) и DIPEA (244 мг, 1,89 ммоль) в THF (10 мл) и смесь перемешивали при КТ в течение 1,5 ч. Смесь разбавляли водой и экстрагировали EtOAc (×2). Объединенные органические слои промывали рассолом, сушили (MgSO4), фильтровали и упаривали в вакууме. Остаток очищали посредством FCC, используя 0-50% EtOAc в циклогексане, с получением указанного в заголовке соединения (140 мг, 46%). ЖХ-МС (Способ 4): Rt 3,94, m/z 475 [MH+].
f. 1-[5-трет-Бутил-2-(3-морфолин-4-ил-фенил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-a]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 23)
Раствор Промежуточного соединения 1g (64 мг, 0,20 ммоль), Промежуточного соединения 23е (140 мг, 0,29 ммоль) и DIPEA (103 мг, 0,80 ммоль) в DMF (2 мл) перемешивали при 60°С в течение 1 ч. Реакционную смесь наносили на картридж SCX-2 (25 г) и промывали МеОН. Продукт элюировали 2М NH3 в МеОН; в результате концентрирования в вакууме получили остаток, который очищали посредством FCC, используя 0-10% [2М NH3 в МеОН] в DCM, с последующей ВЭЖХ (колонка С6-Ph, 10-70% MeCN в H2O, 0,1% HCO2H) с получением указанного в заголовке соединения в виде белого порошка после лиофильной сушки (46 мг, 38%). ЖХ-МС (Способ 5): Rt 4,39 мин, m/z 649,2 [MH+]. 1Н ЯМР (400 МГц, d4-MeOH): 1.30 (9Н, s), 1.44 (6Н, m), 1.85-2.05 (2Н, m), 2.05-2.16 (1Н, m), 2.19-2.29 (1Н, m), 3.15 (4Н, t, J 3,8), 3.47-3.56 (1Н, m), 3.76 (4Н, t, J 4,9), 4.86-4.92 (1Н, m), 5.44 (1Н, t, J 4,3), 6.32 (1Н, s), 6.91 (1Н, d, J 8,1), 7.00-7.05 (2Н, m), 7.19-7.38 (6Н, m), 7.60 (1Н, d, J 9,5), 8.00 (1Н, d, J 1,6).
Пример 24
1-{5-трет-Бутил-2-[1-(2-морфолин-4-ил-этил)-1Н-индазол-6-ил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. 5-трет-Бутил-2-[1-(2-морфолин-4-ил-этил)-1Н-индазол-6-ил]-2Н-пиразол-3-иламин (Промежуточное соединение 24а) и 5-трет-Бутил-2-[2-(2-морфолин-4-ил-этил)-2Н-индазол-6-ил]-2Н-пиразол-3-иламин (Промежуточное соединение 24b)

Готовили раствор 5-трет-бутил-2-(1H-индазол-6-ил)-2Н-пиразол-3-иламина (US 2008/113967, 200 мг, 0,78 ммоль) в DMF (10 мл). Добавляли соль гидрохлорид 4-(2-хлорэтил)морфолина (160 мг, 0,86 ммоль) и K2CO3 (276 мг, 2,0 ммоль) и смесь нагревали при 50°С в течение ночи. Смесь оставляли охлаждаться до КТ, затем распределяли между EtOAc/водой и экстрагировали EtOAc. Объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали в вакууме. В результате очистки посредством FCC с использованием 0-10% МеОН в EtOAc получили два продукта. Первое элюирование: 5-трет-бутил-2-[1-(2-морфолин-4-ил-этил)-1H-индазол-6-ил]-2Н-пиразол-3-иламин (Промежуточное соединение 24а; 134 мг, 57%) в виде желтого твердого вещества. ЖХ-МС (Способ 1): Rt 1,81, m/z 369 [MH+]. Второе элюирование: 5-трет-бутил-2-[2-(2-морфолин-4-ил-этил)-2Н-индазол-6-ил]-2Н-пиразол-3-иламин (Промежуточное соединение 24b; 86 мг, 30%) в виде желтого твердого вещества. ЖХ-МС (Способ 1): Rt 1,68, m/z 369 [MH+]. Для подтверждения структуры региоизомера использовали 1Н ЯМР nOe.
b. 2,2,2-Трихлор-этиловый эфир {5-трет-бутил-2-[1-(2-морфолин-4-ил-этил)-1Н-индазол-6-ил]-2Н-пиразол-3-ил}-карбаминовой кислоты (Промежуточное соединение 24c)

Готовили раствор Промежуточного соединения 24а (134 мг, 0,36 ммоль) в THF (10 мл). Добавляли DIPEA (125 мкл, 0,72 ммоль) с последующим добавлением по каплям раствора 2,2,2-трихлорэтилхлорформиата (50 мкл, 0,36 ммоль) в THF (2 мл). Смесь перемешивали при КТ в течение 4 ч, затем распределяли между EtOAc/водой и экстрагировали EtOAc. Объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали в вакууме. В результате очистки посредством FCC с использованием 0-10% МеОН в EtOAc получили указанное в заголовке соединение (200 мг, 99%) в виде бесцветной пленки. ЖХ-МС (Способ 4): Rt 2,59, m/z 543, 545 [MH+].
с. 1-{5-трет-Бутил-2-[1-(2-морфолин-4-ил-этил)-1H-индазол-6-ил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 24)
Указанное в заголовке соединение получили в виде не совсем белого твердого вещества (65 мг, 50%) с использованием Промежуточного соединения 1g (71 мг, 0,22 ммоль) и Промежуточного соединения 24 с (100 мг, 0,18 ммоль) посредством методики, подобной Примеру 1. ЖХ-МС (Способ 5): Rt 3,40 мин, m/z 717 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.30 (9Н, s), 1.37 (3Н, d, J 6,9), 1.38 (3Н, d, J 6,9), 1.80-1.97 (2Н, m), 2.05-2.10 (2Н, m), 2.41 (4Н, br s), 2.75 (2H, br s), 3.49 (4H, br s), 3.56 (1H, sept, J 6,9), 4.52 (2H, m), 4.79-4.85 (1H, m), 5.52 (1H, t, J 4,5), 6.40 (1H, s), 7.06 (1H, d, J 8,5), 7.13 (1H, dd, J 9,7, 2,0), 7.22-7.29 (4H, m), 7.36-7.39 (1H, m), 7.68 (1H, d, J 9,7), 7.83 (1H, s), 7.87 (1H, d, J 8,5), 8.13-8.19 (3H, m).
Пример 25
1-{5-трет-Бутил-2-[2-(2-морфолин-4-ил-этил)-2Н-индазол-6-ил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина

a. 2,2,2-Трихлор-этиловый эфир {5-трет-бутил-2-[2-(2-морфолин-4-ил-этил)-2Н-индазол-6-ил]-2Н-пиразол-3-ил}-карбаминовой кислоты (Промежуточное соединение 25а)

К раствору Промежуточного соединения 24b (86 мг, 0,23 ммоль) в THF (10 мл) добавляли DIPEA (80 мкл, 0,46 ммоль) с последующим добавлением по каплям раствора 2,2,2-трихлорэтилхлорформиата (32 мкл, 0,23 ммоль) в THF (2 мл). Смесь перемешивали при КТ в течение 4 ч, затем распределяли между EtOAc/водой и экстрагировали EtOAc. Объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали в вакууме. В результате очистки посредством FCC с использованием 0-20% МеОН в EtOAc получили указанное в заголовке соединение (32 мг, 26%) в виде желтого твердого вещества. ЖХ-МС (Способ 4): Rt 2,64, m/z 543, 545 [MH+].
b. 1-{5-трет-Бутил-2-[2-(2-морфолин-4-ил-этил)-2Н-индазол-6-ил]-2Н-пиразол-3-ил}-3-[(1S,4R)-4-(3-изопропил-[1,2,4]триазоло[4,3-а]пиридин-в-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Пример 25)
Указанное в заголовке соединение получили в виде не совсем белого твердого вещества (16 мг, 47%) с использованием Промежуточного соединения 1g (23 мг, 0,07 ммоль) и Промежуточного соединения 25а (32 мг, 0,06 ммоль) методикой, подобной Примеру 1. ЖХ-МС (Способ 5): Rt 3,43 мин, m/z 717 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.29 (9Н, s), 1.37 (3Н, d, J 6,1), 1.38 (3Н, d, J 6,1), 1.81-1.97 (2Н, m), 2.03-2.13 (2H, m), 2.42 (4H, t, J 4,3), 2.85 (2H, t, J 6,3), 3.50-3.60 (5H, m), 4.56 (2H, t, J 6,3), 4.80-4.86 (1H, m), 5.52 (1H, t, J 4,3), 6.36 (1H, s), 7.11 (1H, d, J 8,5), 7.14-7.19 (2H, m), 7.25-7.30 (3H, m), 7.36-7.39 (1H, m), 7.65 (1H, m), 7.68 (1H, d, J 9,8), 7.83 (1H, d, J 9,0), 8.16 (1H, s), 8.20 (1H, m), 8.48 (1H, s).
Пример 26
1-[5-трет-Бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина

a. 2,2,2-Трихлор-этиловый эфир [5-трет-бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-карбаминовой кислоты (Промежуточное соединение 26а)

К смеси Промежуточного соединения 10а (367 мг, 2,0 ммоль) в воде (1 мл) и EtOAc (4 мл) добавляли NaOH (107 мг, 2,67 ммоль) с последующим добавлением 2,2,2-трихлорхлорформиата (385 мкл, 2,80 ммоль). Реакционную смесь перемешивали при КТ в течение 2 ч и затем разбавляли дополнительным количеством EtOAc. Органический слой промывали водой, затем рассолом, сушили и концентрировали в вакууме. Полученный остаток очищали посредством FCC с использованием 0-80% EtOAc в DCM с получением указанного в заголовке соединения (466 мг, 65%) в виде бесцветного масла, которое затвердевало при стоянии.
ЖХ-МС (Способ 3): Rt 3,73 мин, m/z 358, 360 [MH+].
b. N'-(5-Фтор-пиридин-2-ил)-гидразид 2,6-дихлор-бензойной кислоты (Промежуточное соединение 26b)

DIPEA (2,73 мл, 15,7 ммоль) добавляли по каплям к раствору (5-фтор-пиридин-2-ил)-гидразина (для ссылки на методику см. WO 2010022076; 1,0 г, 7,87 ммоль) и 2,6-дихлор-бензоила (1,65 г, 7,87 ммоль) в DCM (50 мл). Реакционную смесь перемешивали при КТ в течение 30 мин и затем суспендировали в DCM и воде. Полученную суспензию фильтровали и твердое вещество собирали фильтрованием, промывали водой и сушили на воздухе с получением указанного в заголовке соединения (1,66 г, 71%) в виде белого твердого вещества. ЖХ-МС (Способ 3): Rt 3,04 мин, m/z 300, 302 [MH+].
c. 3-(2,6-Дихлор-фенил)-6-фтор-[1,2,4]триазоло[4,3-а]пиридин (Промежуточное соединение 26 с)

Гексахлорэтан (2,60 г, 11,0 ммоль) добавляли порциями в течение 5 мин при КТ к перемешиваемой смеси Промежуточного соединения 26b (1,65 г, 5,50 ммоль), трифенилфосфина (2,88 г, 11,0 ммоль) и триэтиламина (3,06 мл, 22,0 ммоль) в THF (50 мл). Реакционную смесь перемешивали при КТ в течение 18 ч и затем оставляли стоять при КТ в течение 72 ч. Полученную суспензию фильтровали и фильтрат концентрировали в вакууме и очищали посредством FCC, используя картридж SCX-2. Картридж промывали МеОН и продукт элюировали 2М NH3 в МеОН с получением указанного в заголовке соединения (1,44 г, 93%) в виде бежевого твердого вещества. ЖХ-МС (Способ 3): Rt 3,08 мин, m/z 282, 284 [MH+].
d. (1S,4R)-4-[3-(2,6-Дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-иламин (Промежуточное соединение 26d)

Промежуточное соединение 1d (404 мг, 2,48 ммоль) добавляли к перемешиваемому раствору гидрида натрия (60%-ная в минеральном масле, 298 мг, 7,44 ммоль) в безводном DMF (15 мл) при КТ в атмосфере аргона. Реакционную смесь перемешивали при КТ в течение 15 мин, затем добавляли Промежуточное соединение 26 с (0,70 г, 2,48 ммоль) и перемешивание при 60°С продолжали в течение 1 ч. После охлаждения реакционную смесь гасили осторожным добавлением насыщенного водного раствора NH4Cl и воды (1:1) и экстрагировали EtOAc (×3). Объединенные органические слои промывали насыщенным водным раствором NaHCO3, а затем рассолом, сушили и концентрировали в вакууме. Полученный остаток очищали посредством FCC с использованием 0-20% [2М NH3 в МеОН] в DCM с получением указанного в заголовке соединения (345 мг, 33%) в виде коричневого остатка. ЖХ-МС (Способ 3): Rt 2,34 мин, m/z 425, 427. [MH+].
е. 1-[5-трет-Бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина (Пример 26)
Смесь Промежуточного соединения 26а (100 мг, 0,279 ммоль), Промежуточного соединения 26d (108 мг, 0,254 ммоль) и DIPEA (73 мкл, 0,419 ммоль) в диоксане (2.5 мл) перемешивали при 60°С в течение 42 ч и затем оставляли стоять при КТ в течение 72 ч. Летучие вещества концентрировали в вакууме и полученный остаток очищали посредством FCC с использованием 0-10% МеОН в DCM с последующим MDAP (Способ 7) с получением указанного в заголовке соединения (23 мг, 14%) в виде белого твердого вещества. ЖХ-МС (Способ 5): Rt 4,19 мин, m/z 634 [MH+]. 1Н ЯМР (400 МГц, DMSO): 1.21 (9Н, s), 1.79-2.16 (4Н, m), 3.62-3.70 (2Н, m), 3.94 (2Н, t, J=6,0 Гц), 4.78-4.88 (1Н, m), 4.99 (1Н, br s), 5.55 (1Н, t, J=4,2 Гц), 6.05 (1H, s), 7.07 (1Н, d, J=8,6 Гц), 7.23-7.30 (1H, m), 7.31-7.38 (4Н, m), 7.70-7.74 (1Н, m), 7.74-7.80 (2Н, m), 7.91 (1Н, d, J=9,9 Гц), 7.98 (1H, d, J=2,1 Гц), 8.19 (1H, s).
Пример 27

Формиатная соль 1-[5-трет-бутил-2-(2-морфолин-4-ил-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевины
К перемешиваемому раствору соединения Примера 26 (38 мг, 0,06 ммоль) и метансульфонилхлорида (7,0 мкл, 0,09 ммоль) в DCM (1 мл) добавляли DIPEA (31 мкл, 0,18 ммоль). Реакционную смесь перемешивали при КТ в течение 1 ч, затем разбавляли DCM, промывали водой, а затем насыщенным водным раствором NaHCO3 и рассолом, сушили и концентрировали в вакууме. Полученный остаток растворяли в THF (2 мл) и обрабатывали морфолином (26 мкл, 0,30 ммоль). Реакционную смесь нагревали при 60°С в течение 18 ч, затем летучие вещества концентрировали в вакууме. Полученный остаток распределяли между DCM и водой. Органический слой промывали рассолом, сушили и концентрировали в вакууме. Полученный остаток очищали с использованием MDAP (Способ 7) с получением указанного в заголовке соединения (13 мг, 30%) в виде не совсем белого твердого вещества. ЖХ-МС (Способ 5): Rt 3,56 мин, m/z 703 [MH+]. 1Н ЯМР (400 МГц, DMSO): 1.20 (9Н, s), 2.15-1.82 (4Н, m), 2.41-2.35 (4Н, m), 2.61 (2Н, t, J=7,1 Гц), 3.53 (4Н, t, J=4,6 Гц), 3.98 (2Н, t, J=7,1 Гц), 4.79-4.88 (1Н, m), 5.55 (1Н, t, J=4,2 Гц), 6.02 (1Н, s), 6.95 (1Н, d, J=8,6 Гц), 7.24-7.30 (1Н, m), 7.31-7.39 (4Н, m), 768-7.80 (3Н, m), 7.91 (1Н, d, J=9,9 Гц), 7.98 (1Н, d, J=2,1 Гц), 8.24 (2Н, s).
Пример 28
Формиатная соль 1-[5-трет-бутил-2-(2-диметиламино-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[413-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевины
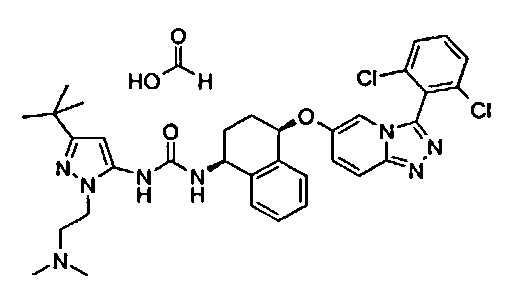
a. 2-[3-трет-Бутил-5-(3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-уреидо)-пиразол-1-ил]-этиловый эфир метансульфоновой кислоты (Промежуточное соединение 28а)

Смесь соединения Примера 26 (350 мг, 0,55 ммоль), метансульфонилхлорида (55 мкл, 0,72 ммоль) и DIPEA (288 мкл, 1,65 ммоль) в DCM (4 мл) перемешивали при КТ в течение 45 мин. Добавляли дополнительное количество метансульфонилхлорида (15 мкл) и перемешивание продолжали в течение 30 мин. Добавляли дополнительное количество метансульфонилхлорида (15 мкл) и перемешивание продолжали в течение 20 мин. Реакционную смесь распределяли между DCM и водой. Органический слой промывали рассолом, сушили через фазоразделитель и концентрировали в вакууме с получением указанного в заголовке соединения (0,33 г, 84%) в виде бледно-желтого твердого вещества. ЖХ-МС (Способ 3): Rt 3,77 мин, m/z 712, 714. [MH+].
b. 1-[5-трет-Бутил-2-(2-диметиламино-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-a]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина (Пример 28)
Смесь Промежуточного соединения 28а (110 мг, 0,15 ммоль) и диметиламина (2,0М в THF, 1,54 мл, 3,09 ммоль) в безводном THF (2 мл) перемешивали при 60°С в течение 18 ч в герметично закрытом флаконе. Летучие вещества концентрировали в вакууме и полученный остаток очищали с с ипользованием MDAP (Способ 7) с получением указанного в заголовке соединения (44 мг, 43%). ЖХ-МС (Способ 5): Rt 3,50 мин, m/z 661 [MH+]. 1Н ЯМР (400 МГц, DMSO): 1.19 (9Н, s), 1.83-2.14 (4Н, m), 2.18 (6Н, s), 2.59 (2Н, t, J=6,9 Гц), 3.96 (2Н, t, J=6,9 Гц), 4.79-4.87 (1Н, m), 5.53 (1Н, t, J=4,0 Гц), 6.01 (1Н, s), 6.92 (1Н, d, J=8,7 Гц), 7.22-7.28 (1Н, m), 7.30-7.38 (4Н, m), 7.68-7.78 (3Н, m), 7.90 (1Н, dd, J=9,9, 0,8 Гц), 7.96 (1Н, d, J=2,0 Гц), 8.15 (1Н, s), 8.44 (1Н, s).
Пример 29

Формиатная соль 1-[5-трет-бутил-2-(2-пиперидин-1-ил-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевины
Указанное в заголовке соединение получали из Промежуточного соединения 28а и пиперидина с использованием методик, аналогичных описанным в Примере 28. ЖХ-МС (Способ 5): Rt 3,73 мин, m/z 701 [MH+]. 1Н ЯМР (400 МГц, DMSO): 1.20 (9Н, s), 1.30-1.39 (2Н, m), 1.51-1.41 (4Н, m), 1.81-2.16 (4Н, m), 2.34-2.43 (4Н, m), 2.60 (2Н, t, J=7,1 Гц), 3.97 (2Н, t, J=7,1 Гц), 4.79-4.88 (1Н, m), 5.55 (1Н, t, J=4,2 Гц), 6.02 (1Н, s), 6.92 (1Н, d, J=8,6 Гц), 7.20-7.31 (1Н, m), 7.31-7.39 (4Н, m), 7.69-7.79 (3Н, m), 7.91 (1Н, dd, J=9,9, 0,8 Гц), 7.97 (1Н, d, J=2,0 Гц), 8.16 (1.5Н, s), 8.28 (1Н, s).
Пример 30

Формиатная соль 1-{5-трет-бутил-2-[2-(4-метил-пиперазин-1-ил)-этил]-2H-пиразол-3-ил}-3-{(1S,4R)-4-[3-(2,6-дихлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевины
Указанное в заголовке соединение получали из Промежуточного соединения 28а и 1-метил-пиперазина с использованием методик, аналогичных описанным в Примере 28. ЖХ-МС (Способ 5): Rt 3,41 мин, m/z 716,5 [MH+]. 1Н ЯМР (400 МГц, DMSO): 1.20 (9Н, s), 1.82-2.12 (4Н, m), 2.14 (3Н, s), 2.25-2.45 (8Н, m), 2.60 (2Н, t, J=7,15 Гц), 3.96 (2Н, t, J=7,1 Гц), 4.79-4.88 (1Н, m), 5.55 (1Н, t, J=4,2 Гц), 6.02 (1Н, s), 6.90 (1Н, d, J=8,6 Гц), 7.24-7.30 (1Н, m), 7.31-7.40 (4Н, m), 7.68-7.79 (3Н, m), 7.91 (1Н, d, J=9,9 Гц), 7.98 (1Н, d, J=2,0 Гц), 8.16 (1.5Н, s), 8.22 (1H, s).
Пример 31
1-[5-трет-Бутил-2-(2-гидрокси-этил)-2H-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2-хлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина

а. N'-(5-Фтор-пиридин-2-ил)-гидразид 2-хлор-бензойной кислоты (Промежуточное соединение 31а

К раствору (5-фтор-пиридин-2-ил)-гидразина (для ссылки на методику см. WO 2010022076; 1,0 г, 7,87 ммоль) и 2-хлор-бензоилхлорида (1 мл, 7,87 ммоль) в DCM (50 мл) добавляли по каплям DIPEA (2,74 мл, 15,75 ммоль). Реакционную смесь перемешивали при КТ в течение 1 ч, затем промывали водой. Органический слой сушили через фазоразделитель и затем концентрировали в вакууме с получением указанного в заголовке соединения (1,95 г, 93%) в виде коричневого твердого вещества. ЖХ-МС (Способ 3): Rt 2,82 мин, m/z 266 [MH+].
b. 3-(2-Хлор-фенил)-6-фтор-[1,2,4]триазоло[4,3-а]пиридин (Промежуточное соединение 31b)

Гексахлорэтан (3,47 г, 14,68 ммоль) добавляли порциями при КТ к перемешиваемой смеси Промежуточного соединения 31а (1,95 г, 7,34 ммоль), трифенилфосфина (3,85 г, 14,68 ммоль) и триэтиламина (4,12 мл, 29,36 ммоль) в безводном THF (60 мл). Реакционную смесь перемешивали при КТ в течение 3,5 ч. Полученную суспензию фильтровали, промывая твердое вещество Et2O. Фильтрат концентрировали в вакууме и полученный остаток очищали посредством FCC, используя картридж SCX-2. Картридж промывали МеОН и продукт элюировали 2М NH3 в МеОН с получением указанного в заголовке соединения (1,81 г, количественно) в виде желтовато-коричневого твердого вещества. ЖХ-МС (Способ 3): Rt 2,96 мин, m/z 248 [MH+].
c. (1S,4R)-4-[3-(2-Хлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-иламин (Промежуточное соединение 31c)
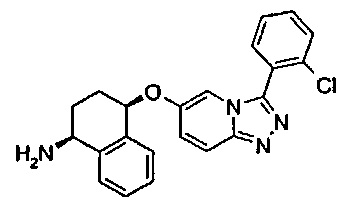
Гидрид натрия (60%-ная в минеральном масле, 840 мг, 21,9 ммоль) добавляли порциями к перемешиваемому раствору Промежуточного соединения 1d (1,19 г, 7,31 ммоль) в безводном DMF (30 мл) при КТ в атмосфере аргона. Затем добавляли Промежуточное соединение 31b (1,81 г, 7,31 ммоль) и перемешивание при 60°С продолжали в течение 1,5 ч. После охлаждения реакционную смесь гасили осторожным добавлением насыщенного водного раствора NH4Cl и экстрагировали EtOAc (x2). Объединенные органические слои промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Полученный остаток очищали посредством FCC с использованием 0-10% МеОН в DCM с получением указанного в заголовке соединения (1,48 г, 52%) в виде коричневой пены. ЖХ-МС (Способ 3): Rt 0,42 и 2,33 мин, m/z 391. [MH+].
d. 1-[5-трет-Бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2-хлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевина (Пример 31)
Смесь Промежуточного соединения 26а (340 мг, 0,95 ммоль), Промежуточного соединения 31 с (372 мг, 0,95 ммоль) и DIPEA (248 мкл, 1,43 ммоль) в диоксане (5 мл) перемешивали при 70°С в течение 18 ч. После охлаждения до КТ реакционную смесь распределяли между DCM и водой. Органический слой сушили через фазоразделитель и затем концентрировали в вакууме. Полученный остаток очищали посредством FCC с использованием 0-10% МеОН в DCM с получением указанного в заголовке соединения (536 мг, 94%) в виде коричневого твердого вещества. Аликвоту полученного таким образом соединения (100 мг) дополнительно очищали с использованием MDAP (Способ 7) с получением указанного в заголовке соединения (45 мг). ЖХ-МС (Способ 5): Rt 4,08 мин, m/z 600 [MH+]. 1Н ЯМР (400 МГц, DMSO): 1.20 (9Н, s), 1.81-2.19 (4Н, m), 3.66 (2Н, d, J=6,1 Гц), 3.93 (2Н, t, J=6,0 Гц), 4.78-4.84 (1Н, m), 4.98 (1Н, br s), 5.51 (1Н, t, J=4,3 Гц), 6.05 (1Н, s), 7.06 (1Н, d, J=8,6 Гц), 7.23-7.30 (1Н, m), 7.32-7.38 (4Н, m), 7.60 (1Н, td, J=7,5, 1,3 Гц), 7.68 (1Н, td, J=7,7, 1,9 Гц), 7.73 (2Н, td, J=7,5, 1,3 Гц), 7.82-7.92 (2Н, m), 8.17 (1Н, s).
Пример 32

Формиатная соль 1-[5-трет-бутил-2-(2-морфолин-4-ил-этил)-2Н-пиразол-3-ил]-3-{(1S,4R)-4-[3-(2-хлор-фенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидро-нафталин-1-ил}-мочевины
Смесь соединения Примера 31 (100 мг, 0,17 ммоль), метансульфонилхлорида (38 мкл, 0,33 ммоль) и DIPEA (87 мкл, 0,50 ммоль) в DCM (1 мл) перемешивали при КТ в течение 45 мин. Добавляли дополнительное количество метансульфонилхлорида (20 мкл) и перемешивание при КТ продолжали в течение 20 мин. Реакционную смесь разбавляли DCM, промывали водой (х2), а затем рассолом, сушили через фазоразделитель и концентрировали в вакууме. Полученный остаток растворяли в THF (1 мл) и обрабатывали морфолином (73 мкл, 0,83 ммоль). Добавляли дополнительное количество морфолина (73 мкл, 0,83 ммоль) и добавляли THF (1 мл) и реакционную смесь нагревали при 60°С в течение 18 ч. После охлаждения летучие вещества концентрировали в вакууме и полученный остаток очищали посредством MDAP (Способ 7) с получением указанного в заголовке соединения (46 мг, 41%) в виде не совсем белого твердого вещества. ЖХ-МС (Способ 5): Rt 3,50 мин, m/z 669 [MH+]. 1Н ЯМР (400 МГц, DMSO): 1.20 (9Н, s), 1.83-2.19 (4Н, m), 2.35-2.41 (4Н, m), 2.61 (2Н, t, J=7,1 Гц), 3.54 (4Н, t, J=4,6 Гц), 3.99 (2Н, t, J=7,1 Гц), 4.79-4.88 (1Н, m), 5.52 (1Н, t, J=4,2 Гц), 6.03 (1Н, s), 6.94 (1Н, d, J=8,6 Гц), 7.24-7.31 (1Н, m), 7.32-7.39 (4Н, m), 7.69 (1Н, td, J=7,7, 1,8 Гц), 7.68 (1Н, td, J=7,7, 1,8 Гц), 7.72-7.78 (2Н, m), 7.84-7.92 (2Н, m), 8.18 (1Н, s), 8.22 (1Н, s).
Пример 33
1-(5-трет-Бутил-2-метил-2Н-пиразол-3-ил)-3-{(1S,4R)-4-[3-(2,6-дихлорфенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидронафталин-1-ил]-мочевина

а. 2,2,2-Трихлор-этиловый эфир (5-трет-бутил-2-метил-2Н-пиразол-3-ил)-карбаминовой кислоты (Промежуточное соединение 33а)

Раствор 5-трет-бутил-2-метил-2Н-пиразол-3-иламина (0,5 г, 3,26 ммоль) в EtOAc (10 мл) обрабатывали водным NaOH (1М, 5,87 ммоль), а затем 2,2,2-трихлорэтилхлорформиатом (0,54 мл, 3,92 ммоль) и реакционную смесь перемешивали при КТ в течение 1 ч. Смесь распределяли между EtOAc (10 мл) и водой (2×10 мл). Органический слой сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали посредством FCC с использованием 0-100% EtOAc в циклогексане с получением указанного в заголовке соединения в виде бледно-оранжевой смолы (0,915 г, 86%). ЖХ-МС (Способ 3): Rt 3,88 мин, m/z 328/330 [MH+].
b. 1-(5-трет-Бутил-2-метил-2Н-пиразол-3-ил)-3-{(1 S,4R)-4-[3-((S)-2-метил-пиперидин-1-ил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидронафталин-1-ил]-мочевина (Пример 33)
Раствор промежуточного соединения 33а (70 мг, 0,21 ммоль), промежуточного соединения 26d (90 мг, 0,21 ммоль) и DIPEA (55 мкл, 0,32 ммоль) в диоксане (1 мл) нагревали при 70°С в течение 18 ч. Смесь концентрировали в вакууме и остаток очищали посредством MDAP (Способ 7) с получением указанного в заголовке соединения в виде стекловидного твердого вещества (38 мг, 29%). ЖХ-МС (Способ 5): Rt 4,37 мин, m/z 604,2 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.20 (9Н, s), 1.83-2.15 (4Н, m), 3.56 (3Н, s), 4.79-4.88 (1Н, m), 5.55 (1Н, t, J 4,6 Гц), 6.01 (1Н, s), 6.86 (1Н, d, J 8,5 Гц), 7.23-7.29 (1Н, m), 7.31-7.37 (4Н, m), 7.69-7.79 (3Н, m), 7.91 (1Н, dd, J 9,7, 0,9 Гц), 7.98 (1Н, d, J 2,2 Гц), 8.23 (1H, s).
Пример 34
Частичная формиатная соль 1-[5-трет-бутил-2-(2-морфолин-4-ил-этил)-2H-пиразол-3-ил]-3-[(1S,4R)-4-(3-циклогексил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевины

а. N'-(5-Фтор-пиридин-2-ил)-гидразид циклогексанкарбоновой кислоты (Промежуточное соединение 34а)

К раствору 5-фтор-2-гидразинил-пиридина (для ссылки на методику см. WO 2010022076; 1,00 г, 7,87 ммоль), циклогексанкарбоновой кислоты (1,21 г, 9,44 ммоль) и HOBt.H2O (166 мг, 0,787 ммоль) при 0°С под N2 добавляли EDC (1,81 г, 9,44 ммоль), затем смесь перемешивали при 0°С в течение 15 мин и при КТ в течение 17 ч. Добавляли воду, затем органические фазы выделяли, охлаждали до 0°С, затем полученную суспензию фильтровали с получением указанного в заголовке соединения в виде белого твердого вещества (1,16 г, 62%). 1Н ЯМР (400 МГц, CDCl3): 1.21-1.38 (3Н, m), 1.45-1.55 (2Н, m), 1.66-1.73 (1Н, m), 1.80-1.96 (4Н, m), 2.22 (1Н, tt, J 11,6, 3,5 Гц), 6.62-6.66 (2Н, m), 7.29 (1Н, ddd, J 9,2, 7,9, 3,1 Гц), 7.55 (1Н, d, J 4,2 Гц), 8.03 (1Н, d, J 2,9 Гц).
b. 3-Циклогексил-6-фтор-[1,2,4]триазоло[4,3-а]пиридин (Промежуточное соединение 34b)

К раствору Промежуточного соединения 34а (1,15 г, 4,83 ммоль), трифенилфосфина (2,54 г, 9,67 ммоль) и триэтиламина (2,68 мл, 19,3 ммоль) в безводном THF (17 мл) при 0°С под N2 добавляли гексахлорэтан (2,28 г, 9,67 ммоль) и смесь перемешивали при 0°С в течение 15 мин и при КТ в течение 6 ч. Добавляли воду, затем органические фазы промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. В результате флэш-хроматографии (силикагель, 0-100% EtOAc в циклогексане) получили указанное в заголовке соединение в виде не совсем белого твердого вещества (330 мг, 31%). 1Н ЯМР (400 МГц, CDCl3): 1.36-1.55 (3Н, m), 1.78-2.00 (5Н, m), 2.05-2.14 (2Н, m), 2.97 (1Н, tt, J=11,5, 3,5 Гц), 7.16 (1Н, ddd, J=10,0, 7,5, 2,3 Гц), 7.76 (1Н, dd, J=10,0, 4,9, 0,9 Гц), 7.85 (1Н, ddd, J=3,5, 2,2, 0,9 Гц).
c. (1S,4R)-4-(3-Циклогексил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-иламин (Промежуточное соединение 34c)

Опалесцирующий коричневый раствор Промежуточного соединения 1d (171 мг, 1,05 ммоль) и гидрид натрия (60%-ная дисперсия в масле, 120 мг, 3,0 ммоль) в безводном DMF (2 мл) перемешивали при КТ под аргоном в течение 30 мин. Добавляли промежуточное соединение 34b (219 мг, 1,00 ммоль) и полученный темный раствор перемешивали при 60°С в течение 2 ч. Охлажденный раствор концентрировали в вакууме, перерастворяли в МеОН (2 мл), наносили на картридж SCX-2 и промывали МеОН. Продукт элюировали 2М NH3 в МеОН; после концентрирования в вакууме получили коричневое масло. В результате флэш-хроматографии (диоксид кремния 25 г, 2-10% [2М NH3 в МеОН] в DCM) получили желтое масло. После лиофильной сушки из MeCN-вода (1:2, 3 мл) получили указанное в заголовке соединение в виде бледно-желтого твердого вещества (203 мг, 56%). ЖХ-МС (Способ 3): Rt 2,29 мин, m/z 363 [MH+].
d. 1-[5-трет-Бутил-2-(2-гидрокси-этил)-2Н-пиразол-3-ил]-3-[(1S,4R)-4-(3-циклогексил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевина (Промежуточное соединение 34d)

Коричневый раствор Промежуточного соединения 26а (94,2 мг, 0,263 ммоль), Промежуточного соединения 34c (90,6 мг, 0,250 ммоль) и DIPEA (0,054 мл, 0,31 ммоль) в безводном диоксане (3 мл) перемешивали при 75°С в течение 16 ч. Охлажденный раствор концентрировали в вакууме, суспендировали в воде (3 мл) и экстрагировали DCM (2×3 мл). Объединенные органические фазы пропускали через гидрофобную фритту и концентрировали в вакууме с получением темно-коричневого масла. В результате флэш-хроматографии (силикагель, 3-9% МеОН в DCM) получили бледно-желтое твердое вещество. С помощью MDAP (Способ 7) получили не совсем белое твердое вещество (72 мг, 50%). ЖХ-МС (Способ 5): Rt 3,98 мин, m/z 572,4 [MH+].
e. Частичная формиатная соль 1-[5-трет-бутил-2-(2-морфолин-4-ил-этил)-2H-пиразол-3-ил]-3-[(1S,4R)-4-(3-циклогексил-[1,2,4]триазоло[4,3-а]пиридин-6-илокси)-1,2,3,4-тетрагидро-нафталин-1-ил]-мочевины (Пример 34)
Раствор Промежуточного соединения 34d (71 мг, 0,12 ммоль), мезилхлорида (29 мг, 0,25 ммоль) и DIPEA (0,065 мл, 0,37 ммоль) в DCM (2 мл) перемешивали при 0°С в течение 30 мин. Добавляли воду (2 мл) и насыщенный водный раствор NaHCO3 (2 мл). Водную фазу экстрагировали DCM (2 мл), затем объединенные органические фазы пропускали через гидрофобную фритту и концентрировали под вакуумом с получением бледно-желтой смолы.
Эту смолу растворяли в DMF (1 мл) и добавляли морфолин (0,054 мл, 0,62 ммоль) и затем перемешивали при 75°С в течение 16 ч. Охлажденный раствор концентрировали в вакууме, перерастворяли в МеОН (1 мл), наносили на картридж SCX-2 (5 г) и промывали МеОН. Продукт элюировали 2М NH3 в МеОН; в результате концентрирования в вакууме получили желтую смолу. В результате препаративной ВЭЖХ (Gemini С18, 10-60% MeCN в воде, 0,1% HCO2H, 20 мин) и лиофильной сушки целевых фракций получили белое твердое вещество (14,9 мг, 19%). ЖХ-МС (Способ 5): Rt 3,46 мин, m/z 641,4 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO: 1.20 (9Н, s), 1.27-1.38 (1Н, m), 1.44-1.55 (2Н, m), 1.58-1.77 (3Н, m), 1.80-1.86 (2Н, m), 1.92-2.21 (6Н, m), 2.39 (4Н, t, J=4,4 Гц), 2.62 (2Н, t, J=7,1 Гц), 3.29 (1Н, tt, J=11,3, 3,7 Гц), 3.54 (4Н, t, J=4,5 Гц), 4.00 (2Н, t, J=7,1 Гц), 4.88 (1Н, td, J=8,4, 5,7 Гц), 5.59 (1Н, t, J=4,3 Гц), 6.03 (1Н, s), 7.03 (1Н, d, J=8,6 Гц), 7.18 (1Н, dd, J=9,8, 2,1 Гц), 7.31 (1Н, td, J=7,1, 2,0 Гц), 7.35-7.43 (3Н, m), 7.69 (1Н, dd, J=9,8, 0,8 Гц), 8.23 (1Н, d, J=2,0 Гц), 8.31 (1Н, s), 8.33 (0.3 Н, s).
Пример 35
1-(5-трет-Бутил-2-(3-гидрокси-пропил)-2Н-пиразол-3-ил)-3-{(1S,4R)-4-[3-(2,6-дихлорфенил)-[1,2,4]триазоло[4,3-a]пиридин-6-илокси]-1,2,3,4-тетрагидронафталин-1-ил]-мочевина

а. 3-(5-Амино-3-трет-бутил-пиразол-1-ил)-пропан-1-ол
(Промежуточное соединение 35а)

Раствор 4,4-диметил-3-оксо-пентаннитрила (0,7 г, 5,58 ммоль) в этаноле (категории IMS, 5 мл) обрабатывали дигидрохлоридом 3-гидразино-пропан-1-ола (1 г, 6,13 ммоль), а затем конц. HCl (0,05 мл) и реакционную смесь кипятили с обратным холодильником в течение 18 ч. Смесь концентрировали в вакууме и остаток очищали посредством FCC с использованием 0-10% [2М NH3 в МеОН] в DCM с получением указанного в заголовке соединения в виде белого смолянистого твердого вещества (0,94 г, 85%). ЖХ-МС (Способ 3): Rt 0,42 мин, m/z 198 [MH+].
b. 2,2,2-Трихлорэтиловый эфир [5-трет-бутил-2-(3-гидрокси-пропил)-2Н-пиразол-3-ил]-карбаминовой кислоты (Промежуточное соединение 35b)
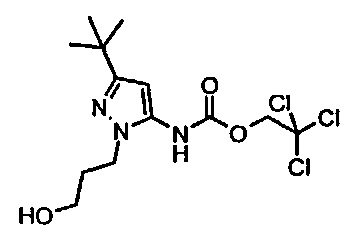
Раствор Промежуточного соединения 35а (0,94 г, 4,76 ммоль) в EtOAc (15 мл) обрабатывали водным NaOH (1М, 8,58 ммоль), а затем 2,2,2-трихлорэтилхлорформиатом (0,79 мл, 5,72 ммоль) и перемешивали при КТ в течение 1,5 ч. Два слоя разделяли и органический слой промывали водой (2×10 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (1,12 г, 63%). ЖХ-МС (Способ 3): Rt 3,72 мин, m/z 372/374 [MH+].
с. 1-(5-трет-Бутил-2-(3-гидрокси-пропил)-2Н-пиразол-3-ил)-3-{(1S,4R)-4-[3-(2,6-дихлорфенил)-[1,2,4]триазоло[4,3-а]пиридин-6-илокси]-1,2,3,4-тетрагидронафталин-1-ил]-мочевина (Пример 35)

Смесь Промежуточного соединения 35b (200 мг, 0,54 ммоль), Промежуточного соединения 26d (228 мг, 0,54 ммоль) и DIPEA (140 мкл, 0,80 ммоль) в диоксане (2 мл) перемешивали при 70°С в течение 18 ч. Реакционную смесь охлаждали при КТ, разбавляли DCM (10 мл) и промывали водой (2×10 мл). Водный слой экстрагировали DCM и объединенные органические фазы пропускали через фазоразделитель и концентрировали в вакууме и полученный остаток очищали посредством FCC с использованием 0-5% [2М NH3 в МеОН] в DCM с получением указанного в заголовке соединения (270 мг, 76%). Образец 50 мг этого соединения очищали путем MDAP (Способ 7) с получением указанного в заголовке соединения в виде стекловидного твердого вещества (17 мг). ЖХ-МС (Способ 5): Rt 4,24 мин, m/z 648,4 [MH+]. 1Н ЯМР (400 МГц, d6-DMSO): 1.20 (9Н, s), 1.79-1.87 (2Н, m), 1.88-2.14 (4Н, m), 3.41 (2Н, t, J=5,9 Гц), 3.91 (2Н, t, J=7,2 Гц), 4.58 (1Н, br s), 4.79-4.87 (1Н, m), 5.55 (1Н, t, J=4,2 Гц), 6.03 (1Н, s), 6.93 (1Н, d, J=8,8 Гц), 7.23-7.29 (1Н, m), 7.32-7.38 (4Н, m), 7.69-7.79 (3Н, m), 7.91 (1Н, dd, J=9,6 Гц, 0,9 Гц), 7.98 (1Н, d, J=1,7 Гц), 8.17 (1Н, s).
Биологические анализы
Анализ ингибирования фермента Р38альфа
Ингибиторную активность соединений определяли с использованием анализа киназной активности на основе Alphascreen® (Perkin Elmer). Реакционная смесь для киназы состояла из 25 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) с pH 7,5, 10 мМ MgCl2, 100 мкМ Na3VO4, 2 мМ DTT (дитиотрейтол), 0,05 мг/мл Твин 20, 100 пМ p38альфа (Invitrogen, PV3304), 1% DMSO и 0,3 мкг/мл слитого белка ATF-2 (активирующий транскрипционный фактор 2) (New England Biolabs, 9224). Соединения инкубировали в этих условиях в течение 2 часов при 25°С, а затем инициировали киназную активность добавлением 250 мкМ ATP (аденозинтрифосфат). Реакционные объемы составляли 20 мкл. Через 1 ч при 25°С реакции останавливали посредством добавления 10 мкл 25 мМ HEPES с pH 7,5, содержащей 62,5 мМ EDTA (этилендиаминтетрауксусная кислота), 0,05% Triton Х-100 (неионное ПАВ), 10% BSA (бычий сывороточный альбумин) и 0,83 нг/мкл анти-фосфо-АТР2 антитела (Abcam, ab28812). Детектирование проводили посредством измерения люминесценции после добавления гранул Alphascreen Donor (Perkin Elmer 6765300) и гранул Alphascreen Acceptor с протеином A (Perkin Elmer 6760137), обоих в конечной концентрации 20 мкг/мл. Значения IC50 определяли по кривым концентрация-эффект.
Результаты показаны в следующей таблице:
В приведенной выше таблице эффективности связывания p38α (значения IC50) обозначают следующее: 7000-500 нМ "+"; 500-100 нМ "++"; 100-10 нМ "+++"; менее 10 нМ "++++".
Анализ высвобождения TNFα в LPS-стимулированных PBMS
Мононуклеарные клетки периферической крови (PBMS) выделяли из крови здоровых добровольцев с использованием стандартной методики центрифугирования в градиенте плотности. Цитратную кровь наслаивали на раствор Histopaque™ и центрифугировали. PBMS отбирали с границы раздела фаз и промывали в забуференном фосфатом физиологическом растворе (PBS). МКПК суспендировали в среде RPMI 1640 (без сыворотки), распределяли в лунки 96-луночного планшета и инкубировали при 37°С в течение 3 ч во влажной камере. После инкубирования среду заменяли (на среду, содержащую 1% фетальной бычьей сыворотки) и планшет инкубировали при 37°С в течение 1 ч в присутствии исследуемого соединения или соответствующего носителя. Затем к клеткам добавляли LPS (10 нг/мл) или контроль соответствующего носителя и планшет возвращали во влажную камеру на 18 ч. Бесклеточные супернатанты отбирали и анализировали уровни TNFα с использованием набора для твердофазного иммуноферментного анализа (ELISA) от R&D Systems.
Строили кривую зависимости «доза-эффект» для каждого исследуемого соединения и эффективность соединения в каждом эксперименте выражали в виде процента ингибирования от контрольного высвобождения TNFα. Строили кривые зависимости «доза-эффект» и определяли эффективность соединений (IC50). Соединения тестировали по меньшей мере в трех отдельных экспериментах.
Результаты показаны в следующей таблице:
В приведенной выше таблице эффективности связывания p38α (значения IC50) обозначают следующее: более 1000 нМ "+"; 1000-100 нМ "++"; 100-10 нМ "+++"; менее 10 нМ "++++". Все исследуемые соединения демонстрировали значения IC50 менее 1000 нМ.
Доклиническая мышиная модель COPD - индуцированного табачным дымом воспаления легких
В предшествующих исследованиях установлено, что количество воспалительных клеток, выделенных посредством бронхоальвеолярного лаважа (BAL), значительно повышается через 24 часа после последнего воздействия табачного дыма (TS) при ежедневном воздействии TS в течение четырех суток подряд. Этот момент времени использовали в представленных здесь исследованиях.
Протоколы воздействия TS на мышей, получения жидкости бронхоальвеолярного лаважа (BALF) и приготовления цитоспиновых препаратов для дифференциального подсчета клеток соответствуют приведенным ниже описаниям.
Ежедневное воздействие TS на мышей в течение 4 суток подряд
Согласно этому протоколу воздействия мышей подвергали воздействию в группах по 5 особей в отдельных прозрачных камерах из поликарбоната (27 см × 16 см × 12 см). TS от сигарет давали проникнуть в камеры для воздействия со скоростью потока 100 мл/мин. Для минимизации любых возможных проблем, вызванных многократным воздействием высокого уровня TS, воздействие TS на мышей увеличивали постепенно на протяжении всего периода воздействия, доводя его до максимума 6 сигарет. График воздействия, используемый в течение четырех суток, был следующим:
1 сутки: 5 сигарет (воздействие приблизительно 25 мин)
2 сутки: 7 сигарет (воздействие приблизительно 35 мин)
3 сутки: 9 сигарет (воздействие приблизительно 45 мин)
4 сутки: 9 сигарет (воздействие приблизительно 45 мин)
Дополнительную группу мышей ежедневно подвергали воздействию воздуха в течение эквивалентных промежутков времени в качестве контроля (без воздействия TS).
Анализ бронхоальвеолярного лаважа (BAL)
Бронхоальвеолярный лаваж проводили следующим образом: трахею канюлировали, используя канюлю длиной 10 мм из нержавеющей стали с фитингом с фиксатором Люэра. Забуференный фосфатом физиологический раствор (PBS) использовали в качестве смывной жидкости. Объем 0,4 мл трижды осторожно вливали и откачивали с использованием шприца объемом 1 мл и затем помещали в пробирку и хранили на льду до последующих определений.
Подсчет клеток:
Смывную жидкость отделяли от клеток посредством центрифугирования и супернатант декантировали и замораживали для последующего анализа. Клеточный осадок ресуспендировали в известном объеме PBS и общее количество клеток вычисляли посредством подсчета в окрашенной (краситель Turks) аликвоте под микроскопом с использованием гемоцитометра.
Дифференциальный подсчет клеток проводили следующим образом:
Оставшийся клеточный осадок разводили до концентрации приблизительно 105 клеток на мл. Объем 500 мкл помещали в лунку предметного стекла для приготовления цитоспиновых препаратов и центрифугировали в течение 6 мин при 800 об/мин, RCF (относительное центробежное ускорение) равно 72,26×g (Shandon Cytospin 3). Стекло сушили на воздухе и окрашивали с использованием красителя Райта-Гимза согласно инструкциям правообладателя. После сушки и покрытия покровным стеклом подсчет дифференциальных клеток проводили с использованием световой микроскопии. Объективный оператор подсчитывал приблизительно четыреста клеток с использованием световой микроскопии. Клетки дифференцировали с использованием стандартных морфометрических методов.
Введение лекарственного средства
Грызуны, такие как мыши и крысы, обладают облигатным носовым дыханием, поэтому пероральная доставка исследуемых веществ (таких как терапевтические агенты) для ингаляции не будет оказывать надлежащего воздействия на легкие. Вследствие этого, доставку терапевтических агентов в легкие грызунов в основном осуществляют интраназально, интратрахеально или посредством ингаляции путем воздействия аэрозоля либо через нос, либо на весь организм.
При способах воздействия аэрозоля только через нос или на весь организм используют большое количество исследуемого вещества, и они в основном предназначены для исследований токсичности вдыхаемого воздуха, а не для более рутинных исследований фармакологической эффективности. Интратрахеальное введение представляет собой весьма эффективный способ доставки, поскольку почти все исследуемое вещество доставляется в легкие, но оно является инвазивным методом. Для исследований конкретно на мыши это также является технически трудной задачей, поскольку диаметр трахеи мал. Интраназальный путь является менее инвазивным по сравнению с интратрахеальным путем и поэтому особенно подходит для исследований с неоднократным введением, таких как описанная четырехсуточная мышиная модель. После интраназального введения приблизительно 50% введенной дозы доставляется в легкие (Eyles JE, Williamson ED and Alpar HO. 1999, Int J Pharm, 189(1):75-9).
В качестве способа применения, заменяющего ингаляцию через рот, мышам осуществляли интраназальное введение носителя (0,2% Твин 80 в физиологическом растворе), содержащего исследуемое соединение. Контрольная группа мышей получала носитель за 1 час до того, как ее подвергали воздействию воздуха или TS.
Контроль и статистический анализ данных:
Все результаты представлены в виде отдельных значений для каждого животного, и среднее значение рассчитывали для каждой группы. Поскольку тесты на нормальность распределения были положительными, данные подвергали однофакторному дисперсионному анализу (ANOVA) с последующей поправкой Бонферрони для множественных сравнений для тестирования статистически значимых различий между группами, подвергнутыми лечению. Считали, что значение «р» <0,05 является статистически значимым. Процент ингибирования рассчитывали автоматически для данных в ячейках электронной таблицы Excel с использованием приведенной ниже формулы:

Данные ингибирования для других параметров рассчитывали вручную с использованием указанной выше формулы.
Соединения по изобретению могут быть тестированы в описанной модели индуцированного табачным дымом воспаления легких для оценки их противовоспалительного эффекта в животной модели COPD.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ КИНАЗЫ | 2013 |
|
RU2637944C2 |
| ПРОИЗВОДНЫЕ 4-ГИДРОКСИ-1,2,3,4-ТЕТРАГИДРОНАФТАЛИН-1-ИЛ-МОЧЕВИНЫ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ, СРЕДИ ПРОЧЕГО, ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНОГО ТРАКТА | 2011 |
|
RU2586333C1 |
| ПРОИЗВОДНЫЕ МОЧЕВИНЫ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ, СРЕДИ ПРОЧЕГО, ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНОГО ПУТИ | 2011 |
|
RU2586223C2 |
| ДИГИДРОПИРИДОФТАЛАЗИНОНОВЫЕ ИНГИБИТОРЫ ПОЛИ(АДФ-РИБОЗА)ПОЛИМЕРАЗЫ | 2009 |
|
RU2514937C2 |
| НОВЫЕ СОЕДИНЕНИЯ, КОТОРЫЕ ЯВЛЯЮТСЯ ИНГИБИТОРАМИ ERK | 2013 |
|
RU2660429C2 |
| АМИНОТРИАЗОЛОПИРИДИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2009 |
|
RU2552642C2 |
| Ингибитор ДНК-зависимой протеинкиназы | 2020 |
|
RU2835434C2 |
| ПРОИЗВОДНЫЕ ПИРИДАЗИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ RORc | 2017 |
|
RU2757571C2 |
| ИНГИБИТОРЫ АКТИВНОСТИ АКТ | 2010 |
|
RU2579513C2 |
| ИНГИБИТОРЫ mTOR КИНАЗЫ ДЛЯ ОНКОЛОГИЧЕСКИХ ПОКАЗАНИЙ И ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С mTOR/PI3K/AKT ПУТЕМ МЕТАБОЛИЗМА | 2009 |
|
RU2546658C2 |
Изобретение относится к соединениям формулы (I) или их фармацевтически приемлемым солям, которые обладают ингибирующей активностью в отношении МАР-киназы р38. В формуле (I) W представляет собой NH, Y выбран из группы -O(CR3R4)n-, где n равен 0, R1 представляет собой группу (IIb), X1 представляет собой -(СН)-, R9 представляет собой C1-С6алкил, С3-С6циклоалкил или фенил, который возможно замещен атомами галогена, R12 представляет собой водород, А представляет собой двухвалентный циклоалкиленовый радикал, имеющий 5, 6 или 7 кольцевых атомов, где указанное циклоалкиленовое кольцо присоединено к W и Y и конденсировано с фенильным кольцом, где такое фенильное кольцо возможно замещено одной или двумя группами R27, R27 выбран из галогена, R2 представляет собой радикал формулы (IVb) или (IVc), где R17 выбран из одиночной электронной пары, водорода или арила, где любой такой арил может быть возможно замещен группой С1-С6алкил или С3-С7циклоалкил; или R17 представляет собой группу общей формулы (V), R20 выбран из группы, состоящей из -СН3 или -С2Н5; R21 представляет собой -СН3 или -С2Н5; R18 выбран из группы, состоящей из одиночной электронной пары, водорода, арила, гетероарила, группы -(C1-С6алкил), -(С3-С7циклоалкил), -(С3-С7гетероциклоалкил), (С5-С7гетероциклоалкил)-(С1-С6алкил) и (С5-С7гетероциклоалкил)-(С3-С6циклоалкил), R19 выбран из -CF3, z1, z2, z3 и z4 независимо выбраны из группы, состоящей из С, N, О, группы -СН- и группы -NH-, в такой комбинации, что полученное кольцо представляет собой ароматическую систему, Т представляет собой -CR28=; R28 представляет собой галоген; R22 представляет собой Н или галоген. Изобретение относится также к фармацевтической композиции, содержащей указанные соединения, способу лечения заболеваний, при которых полезно ингибирование активности МАР-киназы р38, и их применению для изготовления лекарственного средства для лечения таких заболеваний. 4 н. и 10 з.п. ф-лы, 2 табл., 35 пр.




1. Соединение формулы (I) или его фармацевтически приемлемая соль:
 ,
,
где
W представляет собой гетероатом, выбранный из N, где N замещен водородом;
Y выбран из группы -O(CR3R4)n-, где n равен 0;
R1 представляет собой группу (IIb):

X1 представляет собой группу -(СН)-;
R9 представляет собой C1-С6алкил, С3-С6циклоалкил или фенил, который возможно замещен атомами галогена;
R12 представляет собой водород;
А представляет собой двухвалентный циклоалкиленовый радикал, имеющий 5, 6 или 7 кольцевых атомов, где указанное циклоалкиленовое кольцо присоединено к W и Y и конденсировано с фенильным кольцом, где такое фенильное кольцо возможно замещено одной или двумя группами R27;
R27 выбран из галогена;
R2 представляет собой радикал формулы (IVb) или (IVc):

где R17 выбран из группы, состоящей из одиночной электронной пары, водорода или арила, где любой такой арил может быть возможно замещен группой С1-С6алкил или С3-С7циклоалкил; или
R17 представляет собой группу общей формулы (V)

где
R20 выбран из группы, состоящей из -СН3 или -С2Н5;
R21 представляет собой -СН3 или -С2Н5;
R18 выбран из группы, состоящей из одиночной электронной пары, водорода, арила, гетероарила (где гетероарил относится к 8-10-членному бициклическому ароматическому радикалу, содержащему один или более гетероатомов, выбранных из N, который включает одно моноциклическое кольцо и одно моноциклическое арильное кольцо, сконденсированные посредством общей связи), группы -(C1-С6алкил), -(С3-С7циклоалкил), -(С3-С7гетероциклоалкил), (С5-С7гетероциклоалкил)-(С1-С6алкил) и (С5-С7гетероциклоалкил)-(С3-С6циклоалкил) (где указанный гетероциклоалкил содержит в качестве гетероатомов один или более атомов, выбранных из N и О); где любой такой арил, гетероарил, -(C1-С6алкил), -(С3-С7циклоалкил), -(С3-С7гетероциклоалкил), (С5-С7гетероциклоалкил)-(С1-С6алкил) или (С5-С7гетероциклоалкил)-(С3-С6циклоалкил) может быть возможно замещен группой -CN, -ОН, C1-С6алкил, С3-С6циклоалкил, -О-(С1-С6алкил), -O-(С3-С6циклоалкил), -NRHRJ, -(C1-С6алкилен)-NRHRJ, -(С3-С7циклоалкилен)-NRHRJ, -O-(C2-С6алкилен)-NRHRJ, -O-(C3-С7циклоалкилен)-NRHRJ, -O-(С2-С6алкилен)-ORM, -O-(С3-С7циклоалкилен)-ORM, -S-(C2-С6алкилен)-ORM, -S-(C3-С7циклоалкилен)-ORM, -(С3-С7гетероциклоалкил), (С5-С7гетероциклоалкил)-(С1-С6алкил) и (С5-С7гетероциклоалкил)-(С3-С6циклоалкил); где любой фрагмент, представляющий собой C1-С6алкил, С3-С6циклоалкил, -(С3-С7гетероциклоалкил), (С5-С7гетероциклоалкил)-(С1-С6алкил) и (С5-С7гетероциклоалкил)-(С3-С6циклоалкил) в вышеперечисленных группах, может быть возможно замещен группой -ORM или галоген;
RH и RJ представляют собой C1-С6алкил или С3-С6циклоалкил;
альтернативно RH и RJ могут также образовывать вместе с атомом азота, к которому они присоединены, 5-11-членную насыщенную моноциклическую кольцевую систему, в которой указанное 5-11-членное насыщенное моноциклическое кольцо возможно замещено одной или более группами -ORM; и где возможно указанное 5-11-членное насыщенное моноциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-С6алкилом или С3-С6циклоалкилом;
RM представляет собой водород;
R19 выбран из -CF3;
z1, z2, z3 и z4 независимо выбраны из группы, состоящей из С, N, О, группы -СН- и группы -NH-, в такой комбинации, что полученное кольцо представляет собой ароматическую систему;
Т представляет собой -CR28=;
R28 представляет собой галоген;
R22 представляет собой Н или галоген;
при условии, что:
когда z1 представляет собой -СН-, z2 представляет собой -С-, z3 представляет собой -N-, z4 представляет собой -N-, R17 представляет собой группу общей формулы (V), R21 представляет собой -СН3 или -С2Н5, и R20 представляет собой -СН3 или -С2Н5; и R18 представляет собой фенильное кольцо;
тогда такое фенильное кольцо замещено группой, которая выбрана из группы, состоящей из -CN, С3-С6циклоалкила, группы -O-(С1-С6алкил), -O-(С3-С6циклоалкил), -NRHRJ, -(С3-С7циклоалкилен)-NRHRJ, -O-(С3-С7циклоалкилен)-NRHRJ, -O-(C2-С6алкилен)-ORM, -O-(С3-С7циклоалкилен)-ORM, -S-(С2-С6алкилен)-ORM, -S-(С3-С7циклоалкилен)-ORM, -(С3-С7гетероциклоалкил), (С5-С7гетероциклоалкил)-(С1-С6алкил) и (С5-С7гетероциклоалкил)-(С3-С6циклоалкил); где любой такой фрагмент, представляющий собой С1-С6алкил, С3-С6циклоалкил, -(С3-С7гетероциклоалкил), (С5-С7гетероциклоалкил)-(С1-С6алкил) и (С5-С7гетероциклоалкил)-(С3-С6циклоалкил), в вышеперечисленных группах может быть возможно замещен группой -ORM или галоген;
или такое фенильное кольцо замещено группой, которая представляет собой -(С1-С6алкилен)-NRHRJ или -O-(С2-С6алкилен)-NRHRJ, где RH и RJ представляют собой С1-С6алкил или С3-С6циклоалкил; альтернативно RH и RJ могут образовывать вместе с атомом азота, к которому они присоединены, 5-11-членную насыщенную моноциклическую кольцевую систему, в которой указанное 5-11-членное насыщенное моноциклическое кольцо замещено одной или более группами -ORM; и где возможно указанное 5-11-членное насыщенное моноциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-С6алкилом или С3-С6циклоалкилом;
или такое фенильное кольцо замещено группой (С5-С7гетероциклоалкил)-(С1-С6алкил), которая замещена группой -ORM или галоген;
или такое фенильное кольцо замещено группой C1-С6алкил, которая замещена группой ORM или галоген.
2. Соединение формулы (I) по п.1, которое представляет собой соединение формулы (Ia), где углеродный стереогенный центр на циклоалкиленовой части кольца А, который связан с группой W и обозначен цифрой (1) ниже, обладает абсолютной конфигурацией, представленной ниже:

или его фармацевтически приемлемая соль.
3. Соединение формулы (I) по п.1, которое представляет собой соединение формулы (Ib), где углеродные стереогенные центры на циклоалкиленовой части кольца А, которые связаны с группами W и Y и обозначены соответственно цифрами (1) и (2) ниже, обладают абсолютной конфигурацией, представленной ниже:

или его фармацевтически приемлемая соль.
4. Соединение формулы (I) по п.1, где А представляет собой группу, выбранную из группы, состоящей из:
 ,
,
или его фармацевтически приемлемая соль.
5. Соединение формулы (I) по п.1, где R2 представляет собой радикал формулы (IVb):

где z1 представляет собой -СН-, z2 представляет собой С, z3 и z4 представляют собой N и R17 представляет собой группу общей формулы (V)

где R20 представляет собой -СН3, R21 представляет собой -СН3, и где
R18 представляет собой фенил, который замещен группой, представляющей собой -(С1-С6алкилен)-NRHRJ или -O-(С2-С6алкилен)-NRHRJ, где RH и RJ представляют собой С1-С6алкил или С3-С6циклоалкил; альтернативно RH и RJ вместе с атомом азота, к которому они присоединены, могут образовывать 5-11-членную насыщенную моноциклическую кольцевую систему, в которой указанное 5-11-членное насыщенное моноциклическое кольцо замещено одной или более группами ORM; и где возможно указанное 5-11-членное насыщенное моноциклическое кольцо содержит дополнительный гетероатом, который представляет собой кислород или азот, где указанный атом азота возможно замещен C1-С6алкилом или С3-С6циклоалкилом;
или где R18 представляет собой фенил, который замещен группой (С5-С7гетероциклоалкил)-(С1-С6алкил), которая замещена группой ORM или галоген;
или где R18 представляет собой фенил, который замещен группой C1-С6алкил, который замещен группой -ORM или галоген;
или где R18 представляет собой фенил, который замещен группой -CN, -O-(С1-С6алкил), -NRHRJ, -O-(С2-С6алкилен)-ORM, -S-(С2-С6алкилен)-ORM, -(С3-С7гетероциклоалкил), где любой такой фрагмент, представляющий собой C1-С6алкил и -(С3-С7гетероциклоалкил), вышеперечисленных групп может быть возможно замещен группой ORM или галоген.
6. Соединение формулы (I) по п.1, где R2 представляет собой радикал формулы (IVb):

где z1 представляет собой -СН-, z2 представляет собой С, z3 и z4 представляют собой N и R17 представляет собой группу общей формулы (V)

где R20 представляет собой -СН3, и R21 представляет собой -СН3, и R18 представляет собой гетероарильное кольцо, которое возможно замещено группой (С5-С7гетероциклоалкил)-(С1-С6алкил), которая возможно замещена группой ORM или галоген; или R18 представляет собой гетероарильное кольцо, которое возможно замещено группой -(С1-С6алкилен)-NRHRJ или -O-(С2-С6алкилен)-NRHRJ.
7. Соединение формулы (I) по п.1, где R2 представляет собой радикал формулы (IVb):

где z1 представляет собой -СН-, z2 представляет собой С, z3 и z4 представляют собой N и R17 представляет собой группу общей формулы (V)

где R20 представляет собой -СН3, и R21 представляет собой -СН3, и R18 представляет собой группу -(C1-С6алкил), возможно замещенную группой -ОН или -NRHRJ; или группу (С3-С7гетероциклоалкил) или (С5-С7гетероциклоалкил)-(C1-С6алкил), которая может быть возможно замещена группой C1-С6алкил или -ОН.
8. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении МАР-киназы (митоген-активируемая протеинкиназа) р38, содержащая соединение по любому из пп.1-7 в эффективном количестве вместе с одним или более фармацевтически приемлемых носителей.
9. Соединение по любому из пп.1-7 для применения в лечении заболеваний или состояний, при которых полезно ингибирование активности МАР-киназы (митоген-активируемая протеинкиназа) р38.
10. Соединение по любому из пп.1-7 для применения в лечении заболеваний или состояний, при которых полезно ингибирование активности МАР-киназы р38, где эти заболевания или состояния представляют собой хроническую эозинофильную пневмонию, астму, COPD (хроническая обструктивная болезнь легких), респираторный дистресс-синдром взрослых (ARDS), обострение гиперреактивности дыхательных путей после терапии другими лекарственными средствами или заболевание дыхательных путей, которое ассоциировано с легочной гипертензией.
11. Способ лечения заболеваний или состояний у субъекта-человека, при которых полезно ингибирование активности МАР-киназы р38, включающий введение такому нуждающемуся в этом субъекту соединения по любому из пп.1-7.
12. Способ по п.11, где заболевание или состояние представляет собой хроническую эозинофильную пневмонию, астму, COPD (хроническая обструктивная болезнь легких), респираторный дистресс-синдром взрослых (ARDS), обострение гиперреактивности дыхательных путей после терапии другими лекарственными средствами или заболевание дыхательных путей, которое ассоциировано с легочной гипертензией.
13. Применение соединения по любому из пп.1-7 в изготовлении лекарственного средства для лечения заболеваний или состояний, при которых полезно ингибирование активности МАР-киназы р38.
14. Применение по п.13, где заболевание или состояние представляет собой хроническую эозинофильную пневмонию, астму, COPD (хроническая обструктивная болезнь легких), респираторный дистресс-синдром взрослых (ARDS), обострение гиперреактивности дыхательных путей после терапии другими лекарственными средствами или заболевание дыхательных путей, которое ассоциировано с легочной гипертензией.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| ИНГИБИТОРЫ Р38 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2357957C2 |
Авторы
Даты
2017-06-29—Публикация
2012-12-05—Подача