По настоящей заявке испрашивается приоритет предварительных заявок на патенты США № 61/545863, поданной 11 октября 2011 г., № 61/546503, поданной 12 октября 2011 г., № 61/560704, поданной 16 ноября 2011 г., и № 61/676837, поданной 27 июля 2012 г. Все вышеуказанные предварительные заявки на патенты включены в настоящее описание изобретения в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение относится к усовершенствованным способам сборки гетеромультимерных белков, таких как биспецифические антитела, и композициям, используемым при их осуществлении.
Уровень техники
Моноклональные антитела типа IgG содержат два идентичных антигенсвязывающих домена и константный домен (Fc). В природе обычно отсутствуют антитела с разной специфичностью антигенсвязывающих доменов, поэтому такие антитела должны быть созданы химическими методами (например, при помощи перекрестного сшивания химическими методами и т.д.), методами рекомбинантных ДНК и/или методами клеточной гибридизации.
Биспецифические антитела могут одновременно связываться с двумя разными антигенами. Данное свойство позволяет разрабатывать методы лечения, осуществление которых невозможно при использовании обычных моноклональных антител. Большая панель созданных биспецифических антител свидетельствует о большом интересе, проявляемом к указанным молекулам. См. публикации Berg J., Lotscher E., Steimer K.S. et al., “Bispecific antibodies that mediate killing of cells infected with human immunodeficiency virus of any strain,” Proc. Natl. Acad. Sci. USA (1991), 88(11): 4723-4727 и Fischer N. and Leger O., “Biospecific Antibodies: Molecules That Enable Novel Therapeutic Strategies, “Pathobiology (2007) 74: 3-14.
Другим классом мультиспецифических молекул являются рекомбинантные слитые белки. Рекомбинантные слитые белки, состоящие из внеклеточного домена иммунорегуляторных белков и константного (Fc) домена иммуноглобулина (Ig), представляют собой постоянно увеличивающийся класс лекарственных средств, предназначенных для лечения человека. Иммуноадгезины объединяют связывающую область белковой последовательности, обладающую требуемой специфичностью, с эффекторным доменом антитела. Иммуноадгезины обладают двумя важными свойствами, определяющими эффективность терапевтических средств: целенаправленной специфичностью и фармакокинетической устойчивостью (время полужизни in vivo, сравнимое с аналогичным показателем антител). Иммуноадгезины могут быть использованы в качестве антагонистов, ингибирующих или блокирующих вредные взаимодействия, или в качестве агонистов, имитирующих или усиливающих физиологические реакции. См. публикацию Chamow S.M., Zhang D.Z., Tan X.Y., et al., “A humanized, bispecific immunoadhesin-antibody that retargets CD3+ effectors to kill HIV-1-infected cells,” J. Hematother. 1995; 4(5): 439-446.
В научных публикациях рассмотрены другие мультиспецифические молекулы. Примеры таких публикаций включают, не ограничиваясь ими, публикацию Fisher et al., Pathology (2007) 74: 3-14 (обзор разных биспецифических антител); патент США № 6660843, выданный 9 декабря 2003 г. Feige et al. (пептитела); патент США № 2002-004587, опубликованный 10 января 2002 г. (мультиспецифические антитела); патент США № 7612181, выданный 3 ноября 2009 г. Wu et al. (антитело с двумя вариабельными доменами); патент США № 6534628, Nord K. et al., Prot Eng. (1995) 8: 601-608, Nord K. et al., Nat. Biotech. (1997) 15:772-777 и Gronwall et al., Biotеchnol. Appl. Biochem. (2008) Jun; 50(Pt 2): 97-112 (аффитела); Martens et al., Clin. Cancer Res. (2006), 12: 6144-6152 и Jin et al., Cancer Res. (2008) 68(11): 4360-4368 (антитела с одним плечом); Bostrom et al., Science (2009) 323: 1610-1614 (Fab-фрагмент двойного действия, антитела со смешанной валентностью). Специалистам в данной области должны быть известны другие антитела.
Для создания клинических препаратов требуются новые антитела и, в частности, вышеописанные мультиспецифические молекулы. Как было указано выше, существует много путей создания молекул со смешанными антигенсвязывающими доменами, то есть с антигенсвязывающими доменами, отличными друг от друга. Но каждый из указанных методов характеризуется своими недостатками.
Перекрестное сшивание химическими методами является трудоемким процессом, так как соответствующие части необходимо очистить от гомодимеров и других нежелательных побочных продуктов. Кроме того, стадии химической модификации могут изменить целостность белков, что ухудшает их устойчивость. Таким образом, указанный метод часто оказывается неэффективным и может привести к утрате активности антитела.
Метод клеточной гибридизации (например, получение гибридом) представляет собой произвольную сборку двух тяжелых и двух легких цепей, в результате чего образуется 10 комбинаций антител. Требуемые гетеромультимерные антитела составляют небольшую часть полученных таких образом антител. Выделение требуемых гетеромультимерных белков существенно уменьшает выход продукта и увеличивает производственные затраты.
Методы рекомбинантных ДНК используют для создания разных гетеромультимерных антител, например, одноцепочечных Fv фрагментов, диател и т.д., не содержащих Fc домен. Основным недостатком молекулы антитела такого типа является отсутствие Fc домена и, следовательно, неспособность такого антитела запускать эффекторную функцию (такую как, например, активация комплемента, связывание с Fc-рецептором и т.д.). Таким образом, необходимо биспецифическое антитело, содержащее функциональный Fc домен.
Методы рекомбинантных ДНК также используют для создания биспецифических антител, соединяемых по типу ”выступ в углубление”. См. заявку на патент США № 20030078385 (Arathoon et al. - Genentech). Одним фактором, ограничивающим применение данного метода, является то, что легкие цепи двух исходных антител должны быть идентичными для предотвращения ошибочного спаривания и образования нежелательных и/или неактивных молекул при экспрессии в одной клетке.
Кроме того, одним фактором, ограничивающим применение данного метода, является окислительно-восстановительная эффективность процесса во время гибридизации и очистки. Окисленный гетеродимер обычно составляет только 70-80% белка после выполнения данной стадии (BioAnalyzer и MS-TOF). Остальные 20-30% составляют димерные антитела, у которых отсутствует способность ковалентного связывания (SEC-LLS). Такие антитела могут быть удалены, что значительно снижает общий выход продукта. Таким образом, существует потребность в увеличении общего выхода продукта при получении антител, в частности, гетеродимеров. В настоящем описании изобретения представлены методы, которые позволяют увеличить выход биспецифических антител, гетеродимеров и подобных антител. Вышеуказанные и другие объекты и преимущества настоящего изобретения будут очевидны из приведенного ниже описания изобретения.
Сущность изобретения
Получение гетеромультимерных белков, собранных из двух или более шарнирсодержащих полипептидов, например, получение мультиспецифических антител из двух или большего числа половинных антител при помощи современных методов, характеризуется рядом недостатков, которые наряду с прочими недостатками включают получение смеси продуктов, низкий выход требуемого продукта и ослабленную/отсутствующую эффекторную функцию. Кроме того, во время получения каждого шарнирсодержащего полипептида, а также сборки или гибридизации гетеромультимеров часто происходит агрегация и осаждение белка. Агрегация и осаждение белка могут значительно уменьшать выход требуемого гетеромультимера. Таким образом, необходим метод, обеспечивающий более эффективное получение гетеромультимерных белков и на более высоких уровнях.
Настоящее изобретение относится к эффективным способам/методам экономичного получения гетеромультимерных белков, например, мультиспецифических антител, на основе использования или изменения одного или нескольких следующих элементов, которые включают, не ограничиваясь ими, стабилизатор, солюбилизатор, восстановительные условия, выбранное значение рН, выбранную температуру и т.д. Способы по настоящему изобретению характеризуются меньшей потерей белка в результате осаждения и/или агрегации и более высоким выходом гетеромультимерного белка, такого как биспецифические антитела.
Одним объектом изобретения является способ образования или получения гетеромультимерного белка, который включает:
а. получение первого шарнирсодержащего полипептида при значении рН 4-9, предпочтительно, 5-9, в присутствии первого солюбилизатора, при этом первый шарнирсодержащий полипептид содержит домен гетеромультимеризации;
b. получение второго шарнирсодержащего полипептида при значении рН 4-9, предпочтительно, 5-9, в присутствии второго солюбилизатора, при этом второй шарнирсодержащий полипептид содержит домен гетеромультимеризации;
с. смешивание первого и второго шарнирсодержащих полипептидов в восстановительных условиях с образованием смеси для сборки белка; и
d. инкубацию смеси для сборки белка с образованием или получением гетеромультимерного белка, содержащего первый и второй шарнирсодержащие полипептиды, в котором первый шарнирсодержащий полипептид взаимодействует со вторым шарнирсодержащим полипептидом в домене гетеромультимеризации.
В определенных вариантах осуществления данного объекта изобретения стадии а и/или стадии b предшествует стадия очистки первого и/или второго шарнирсодержащего полипептида. В определенных вариантах осуществления изобретения первый и/или второй шарнирсодержащий полипептид очищают протеином А.
Другим объектом изобретения является способ образования или получения биспецифического антитела, который включает:
а. получение первого половинного антитела при значении рН 4-9, предпочтительно, 5-9, в присутствии первого солюбилизатора, при этом первое половинное антитело содержит домен гетеромультимеризации;
b. получение второго половинного антитела при значении рН 4-9, предпочтительно, 5-9, в присутствии второго солюбилизатора, при этом второе половинное антитело содержит домен гетеромультимеризации;
с. смешивание первого и второго половинных антител в восстановительных условиях с образованием смеси для сборки белка; и
d. инкубацию смеси для сборки белка с образованием или получением биспецифического антитела, содержащего первое и второе половинные антитела, в котором первое половинное антитело взаимодействует со вторым половинным антителом в домене гетеромультимеризации.
В некоторых вариантах осуществления данного объекта изобретения стадии а и/или стадии b предшествует стадия очистки первого и/или второго половинного антитела. В определенных конкретных вариантах осуществления изобретения первое и/или второе половинное антитело очищают протеином А.
Другим объектом изобретения является способ получения гетеромультимера, который включает получение аргининсодержащей смеси шарнирсодержащих полипептидов при значении рН 4-9, предпочтительно, 5-9, добавление слабого восстановителя и инкубацию в условиях, обеспечивающих получение гетеромультимера.
Другим объектом изобретения является способ получения гетеромультимерного белка, который включает:
а. получение первого шарнирсодержащего полипептида, очищенного протеином А;
b. получение второго шарнирсодержащего полипептида, очищенного протеином А;
с. доведение значения рН каждого половинного антитела до 4-9;
d. смешивание первого и второго шарнирсодержащих полипептидов с получением смеси для сборки белка;
е. добавление в смесь для сборки белка молярного избытка слабого восстановителя; и
f. инкубацию смеси для сборки белка с образованием гетеромультимерного белка, содержащего первый и второй шарнирсодержащие полипептиды.
Другим объектом изобретения является способ получения гетеромультимерного белка, который включает:
а. получение первого шарнирсодержащего полипептида, очищенного протеином А;
b. получение второго шарнирсодержащего полипептида, очищенного протеином А;
с. доведение значения рН каждого шарнирсодержащего полипептида до 4-9 в присутствии L-аргинина;
d. смешивание первого и второго шарнирсодержащих полипептидов с получением смешанного пула шарнирсодержащих полипептидов; и
е. инкубацию с образованием гетеромультимерного белка, содержащего первый и второй шарнирсодержащие полипептиды.
В некоторых вариантах осуществления данного объекта изобретения смешанный пул шарнирсодержащих полипептидов инкубируют в восстановительных условиях. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид содержит половинное антитело, иммуноадгезин или их функциональный фрагмент. В других определенных вариантах осуществления изобретения аргинин присутствует в концентрации 20 мМ - 1 М, 20 мМ - 200 мМ или 50 мМ - 200 мМ. В других определенных вариантах осуществления изобретения на стадии d или стадии е добавляют PVP. В определенных вариантах осуществления изобретения значение рН регулируют после смешивания.
Авторы настоящего изобретения неожиданно обнаружили, что фиксация среднего значения рН шарнирсодержащего полипептида, такого как половинное антитело, может стимулировать изменение конформации белка, которое усиливает последующую сборку шарнирсодержащих полипептидов. В определенных вариантах осуществления изобретения среднее значение рН равно рН 4-9, предпочтительно, 5-9, по меньшей мере рН 5, по меньшей мере рН 5,5, по меньшей мере рН 5,7, больше рН 5, больше рН 5,5, больше рН 5,7, 5-9, 5-8, 5,5-8, 5,5-9, 5,7-8, 5,7-9, 6-8, 6-9, 7-8, 7,5-8,5 или 7-8,5. Солюбилизатор может быть добавлен для предотвращения или минимизации осаждения шарнирсодержащего полипептида, вызываемого показателем рН. В некоторых вариантах осуществления изобретения солюбилизатор добавляют до фиксации среднего значения рН. В определенных вариантах осуществления изобретения первый и второй солюбилизаторы выбирают из группы, состоящей из аргинина, гистидина и сахарозы, предпочтительно, из аргинина и/или гистидина. В других определенных вариантах осуществления изобретения аргинин является солью аргинина и/или гистидин является солью гистидина. В других определенных вариантах осуществления изобретения аргинин является производным аргинина и/или гистидин является производным гистидина. В других определенных вариантах осуществления изобретения аргинин или гистидин является L-аргинином или L-гистидином. В других определенных вариантах осуществления изобретения аргинин или гистидин является гидрохлоридом аргинина или гидрохлоридом гистидина. В других определенных вариантах осуществления изобретения аргинин или гистидин является фосфатом аргинина или фосфатом гистидина. В определенных вариантах осуществления изобретения первый и второй солюбилизаторы являются разными; в то время как в других вариантах осуществления изобретения первый и второй солюбилизаторы являются одинаковыми. В определенных предпочтительных вариантах осуществления изобретения первый и второй солюбилизаторы содержат аргинин. В других вариантах осуществления изобретения аргинин присутствует в концентрации от 20 мМ до 1 М, от 20 мМ до менее 1 М, от 20 мМ до 100 мМ, от 20 мМ до 200 мМ, от 20 мМ до 300 мМ, от 20 мМ до 400 мМ, от 50 мМ до 100 мМ, от 50 мМ до 150 мМ, от 50 мМ до 200 мМ, от 50 мМ до 250 мМ или от 50 мМ до 300 мМ, предпочтительно, от 20 мМ до 200 мМ. В других вариантах осуществления изобретения солюбилизатор содержит производное аргинина, которым является, не ограничиваясь им, ацетиларгинин. В других вариантах осуществления изобретения первый и второй солюбилизаторы содержат гистидин, присутствующий в концентрации от 20 мМ до 1 М, от 20 мМ до менее 1 М, от 20 мМ до менее 500 мМ, от 20 мМ до 100 мМ, от 20 мМ до 200 мМ, от 20 мМ до 300 мМ, от 20 мМ до 400 мМ, от 50 мМ до 100 мМ, от 50 мМ до 150 мМ, от 50 мМ до 200 мМ, от 50 мМ до 250 мМ, от 50 мМ до 300 мМ, от 50 мМ до 400 мМ, от 50 мМ до 500 мМ или от 50 мМ до 600 мМ. В определенных предпочтительных вариантах осуществления изобретения солюбилизатор добавляют в концентрации 50 мМ. В других определенных вариантах осуществления изобретения солюбилизатор добавляют в концентрации 200 мМ. В определенных конкретных вариантах осуществления изобретения аргинин или гистидин добавляют в концентрации 20 мМ, 50 мМ, 100 мМ или 200 мМ. В других определенных вариантах осуществления изобретения первый и/или второй шарнирсодержащие полипептиды получают в присутствии как аргинина, так и гистидина. В других вариантах осуществления изобретения аргинин и гистидин присутствуют в концентрации от 20 мМ до 1 М, от 20 мМ до менее 1 М, от 20 мМ до 100 мМ, от 20 мМ до 200 мМ, от 20 мМ до 300 мМ, от 20 мМ до 400 мМ, от 50 мМ до 100 мМ, от 50 мМ до 150 мМ, от 50 мМ до 200 мМ, от 50 мМ до 250 мМ или от 50 мМ до 300 мМ, предпочтительно, от 50 мМ до 200 мМ.
В определенных вариантах осуществления изобретения первый и второй шарнирсодержащие полипептиды смешивают до фиксации среднего значении рН (то есть до регулирования значения рН). В других определенных вариантах осуществления изобретения первый и второй шарнирсодержащие полипептиды смешивают после раздельного регулирования значения рН в первом и втором шарнирсодержащих полипептидах. В определенных вариантах осуществления изобретения солюбилизатор добавляют до регулирования значения рН.
В определенных вариантах осуществления изобретения первый и второй шарнирсодержащие полипептиды отдельно очищают до смешивания, в то время как в других вариантах осуществления изобретения первый и второй шарнирсодержащие полипептиды очищают вместе после смешивания. В определенных конкретных вариантах осуществления изобретения шарнирсодержащий полипептид содержит половинное антитело. В определенных вариантах осуществления изобретения собранный гетеромультимерный белок может быть подвергнут дальнейшей очистке.
Белки могут быть очищены любыми приемлемыми методами, которые включают, не ограничиваясь ими, очистку при помощи хроматографии на колонке с протеином А, хроматографии на колонке с протеином G, гидрофобной хроматографии (HIC), фракционирования на иммуноаффинной колонке, осаждения этанолом, хроматографии с обращенной фазой на диоксиде кремния или ионообменной смоле, такой как DEAE, хроматофокусирования, SDS-PAGE, осаждения сульфатом аммония и гель-фильтрации с использованием, например, сефадекса G-75, других подобных методов очистки и их комбинаций.
В определенных вариантах осуществления изобретения шарнирсодержащий полипептид, такой как половинное антитело, очищают при помощи хроматографии на колонке с протеином А или протеином G. В другом варианте осуществления изобретения первый и второй шарнирсодержащие полипептиды смешивают до очистки протеином А и совместно очищают протеином А. В определенных вариантах осуществления изобретения значение рН регулируют после смешивания полипептидов, очищенных протеином А. В других вариантах осуществления изобретения значение рН регулируют до смешивания полипептидов, очищенных протеином А. В определенных вариантах осуществления изобретения солюбилизатор добавляют до регулирования значения рН.
В других определенных вариантах осуществления изобретения шарнирсодержащий полипептид очищают при помощи гидрофобной хроматографии или ионообменной хроматографии. Специалист в данной области может выбрать приемлемые методы очистки. Например, шарнирсодержащий полипептид может быть очищен хроматографией на колонке с протеином А с последующим выполнением ионообменной хроматографии; шарнирсодержащий полипептид может быть также очищен хроматографией на колонке с протеином А с последующим выполнением гель-фильтрации и/или гидрофобной хроматографии. В других примерах шарнирсодержащий полипептид может быть очищен на одной или нескольких ионообменных колонках до очистки на колонке с протеином А. В определенных вариантах осуществления изобретения промывочные и/или элюирующие буферы, используемые на любых стадиях очистки шарнирсодержащих полипептидов, не содержат аргинин и/или гистидин.
В других вариантах осуществления изобретения половинное антитело, элюированное из колонки с протеином А или из другой колонки при кислотном значении рН, доводят до среднего значения рН. Последующее регулирование значения рН (также определяемое как фиксация среднего значения рН) может вызвать осаждение шарнирсодержащего полипептида, такого как половинное антитело, и, таким образом, уменьшить выход собранного гетеромультимерного белка. Поэтому в определенных вариантах осуществления изобретения к половинному антителу, элюированному из колонки с протеином А или протеином G с кислотным значением рН, добавляют солюбилизатор до регулирования значения рН. Если стадия регулирования значения рН является необязательной, в определенных вариантах осуществления изобретения солюбилизатор, предпочтительно, добавляют к очищенному шарнирсодержащему полипептиду для предотвращения или уменьшения осаждения и/или агрегации.
Помимо фиксации среднего значения рН, авторы настоящего изобретения неожиданно обнаружили, что нагревание может усиливать изменение конформации и/или улучшать сборку шарнирсодержащих полипептидов, таких как половинные антитела. Поэтому в определенных вариантах осуществления изобретения одну, несколько или все стадии а-d способов по настоящему изобретению выполняют, нагревая шарнирсодержащие полипептиды при температуре 15°С-39°С, 15°С-42°С, 18°С-37°С, 20°С-42°С, 20°С-25°С, 25°С-42°С, 25°С-35°С, 25°С-39°С, 30°С-35°С, 32°С-35°С или 32°С-37°С, предпочтительно, 35°С-37°С, в течение по меньшей мере 30 минут. В определенных вариантах осуществления изобретения время инкубации составляет до 72 часов при комнатной температуре. В некоторых вариантах осуществления изобретения время инкубации равно 3 часам при 35°С. В других определенных вариантах осуществления изобретения температура равна примерно 30°С, 35°С или 37°С.
Однако нагревание также может увеличивать агрегацию и/или осаждение. Поэтому в определенных конкретных вариантах осуществления изобретения к половинному антителу, элюированному из колонки с протеином А или протеином G, до нагревания добавляют солюбилизатор.
В определенных вариантах осуществления изобретения шарнирсодержащий полипептид содержит половинное антитело, иммуноадгезин или их функциональный фрагмент. В определенных конкретных вариантах осуществления изобретения шарнирсодержащий полипептид содержит Fc компонент.
В определенных конкретных вариантах осуществления изобретения первый и/или второй шарнирсодержащий полипептид содержит половинное антитело. В определенных вариантах осуществления изобретения половинное антитело является половинным антителом IgG. В определенных конкретных вариантах осуществления изобретения половинное антитело IgG относится к изотипу IgG1, IgG4 или IgG2. В определенных предпочтительных вариантах осуществления изобретения сохраняется сигнальный пептид молекулы иммуноглобулина для облегчения секреции половинного антитела, особенно при продуцировании в клетке млекопитающего. В определенных вариантах осуществления изобретения способ по настоящему изобретению включает получение первого и второго половинного антитела при рН 5-9 в присутствии аргинина в концентрации примерно 50 мМ и альтернативно или дополнительно гистидина в концентрации примерно 200 мМ. В определенных вариантах осуществления изобретения первое и/или второе половинное антитело включает антигенсвязывающий домен, специфичный к другому антигену или другому эпитопу того же антигена, при этом собранное полное антитело является биспецифическим антителом. В других определенных вариантах осуществления изобретения первое и второе половинные антитела относятся к одному изотипу, в то время как в других вариантах осуществления изобретения первое и второе половинные антитела относятся к разным изотипам.
Половинное антитело может включать VL домен, VH домен, шарнирную область, СН2 домен и/или СН3 домен. Половинное антитело также может быть одноцепочечным полипептидом, дополнительно содержащим связующее звено, где указанный одноцепочечный полипептид содержит домены, расположенные относительно друг друга в направлении от N-конца к С-концу в следующем порядке: VL-связующее звено-VH-шарнирная область-СН2-СН3. В других определенных вариантах осуществления изобретения половинное антитело далее содержит СL домен и СН1 домен, и в других вариантах осуществления изобретения половинное антитело может быть одноцепочечным полипептидом, содержащим связующее звено, где указанный одноцепочечный полипептид содержит домены, расположенные относительно друг друга в направлении от N-конца к С-концу в следующем порядке: VL-CL-связующее звено-VH-CH1-шарнирная область-СН2-СН3.
Связующее звено может содержать один или несколько остатков глицина (G) и серина (S). В других вариантах осуществления изобретения связующее звено содержит повторы GGS. Связующее звено, например, состоит из 15-50 аминокислот. В конкретном варианте осуществления изобретения связующее звено включает от 20 до 32 аминокислот, например, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 или 32 аминокислоты. В определенных вариантах осуществления изобретения связующее звено расщепляется. В других вариантах осуществления изобретения связующее звено может отщепляться или не отщепляться от белка. В определенных предпочтительных вариантах осуществления изобретения связующее звено расщепляется в положении двух сайтов у N- и С-конца одним и тем же ферментом. В одном варианте осуществления изобретения связующее звено содержит сайт расщепления протеазами, такими как фурин. В другом варианте осуществления изобретения связующее звено расщепляется фурином в положении сайта расщепления RXRXRR (SEQ ID NO:1), где Х является любой аминокислотой. В некоторых вариантах осуществления изобретения первый шарнирсодержащий полипептид является половинным антителом и второй шарнирсодержащий полипептид является одноцепочечным половинным антителом.
Другой вариант осуществления изобретения относится к белку, содержащему комплекс из связующего звена и Fc компонента, в котором связующее звено может отщепляться или не отщепляться от белка.
В других вариантах осуществления изобретения первый и второй шарнирсодержащие полипептиды содержат домен гетеромультимеризации. Домен гетеромультимеризации может представлять собой мутацию ”выступ в углубление”, лейциновую застежку-молнию, электростатик и тому подобные. Первый шарнирсодержащий полипептид может иметь выступ и второй шарнирсодержащий полипептид может иметь углубление. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид является половинным антителом, при этом первое половинное антитело имеет выступ и второе половинное антитело имеет углубление.
В некоторых вариантах осуществления изобретения способы по настоящему изобретению включают добавление аргинина до конечной концентрации от 20 мМ до 1 М до регулирования значения рН. В некоторых вариантах осуществления изобретения аргинин добавляют до конечной концентрации 50 мМ - 600 мМ. В некоторых вариантах осуществления изобретения аргинин добавляют до конечной концентрации 50 мМ - 100 мМ.
В определенных вариантах осуществления изобретения способ по настоящему изобретению включает инкубацию каждого пула шарнирсодержащих полипептидов, очищенных протеином А, при рН 5-8 до смешивания первого и второго половинных антител. В других вариантах осуществления изобретения пулы, очищенные протеином А, сначала смешивают и затем регулируют значение рН до 5-8.
В некоторых вариантах осуществления изобретения способы по настоящему изобретению включают инкубацию смешанного пула половинных антител или смешанного пула шарнирсодержащих полипептидов при температуре 15°С-39°С, предпочтительно, 18°С-37°С, более предпочтительно, 20°С-25°С, еще предпочтительнее 32°С-37°С, в течение по меньшей мере 30 минут.
Шарнирсодержащие полипептиды могут быть продуцированы, например, в бактериальной клетке, дрожжевой клетке, бакуловирусе, клетке насекомого или клетке млекопитающего. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид продуцируют в бактериальной клетке, в частности, E.coli. В других определенных вариантах осуществления изобретения шарнирсодержащий полипептид продуцируют в клетке млекопитающего, в частности, в клетке СНО. В конкретных вариантах осуществления изобретения шарнирсодержащий полипептид содержит половинное антитело.
Шарнирсодержащие полипептиды могут взаимодействовать с образованием димера или мультимера при помощи домена гетеродимеризации. В определенных вариантах осуществления изобретения взаимодействие между первым и вторым шарнирсодержащими полипептидами в области контакта доменов гетеродимеризации является взаимодействием “выпуклость в полость”, гидрофобным взаимодействием и/или электростатическим взаимодействием. В других определенных вариантах осуществления изобретения домен гетеромультимеризации содержит выступ (например, выпуклость), углубление (например, полость), лейциновую застежку-молнию, скрученную спираль или полярный аминокислотный остаток, способный вызывать электростатическое взаимодействие, или их комбинации. В определенных вариантах осуществления изобретения первый шарнирсодержащий полипептид имеет выступ и второй шарнирсодержащий полипептид имеет углубление. В других определенных вариантах осуществления изобретения взаимодействие является гидрофобным взаимодействием и электростатическим взаимодействием. В определенных типичных вариантах осуществления изобретения домен гетеромультимеризации первого и второго шарнирсодержащих полипептидов имеет выступ или углубление и аминокислотный остаток, способный вызывать электростатическое взаимодействие. Специалисту в данной области должно быть понятно, что домен гетеромультимеризации может характеризоваться несколькими взаимодействиями, например, взаимодействием по типу “выступ и углубление” (K&H) и гидрофобным взаимодействием, K&H и лейциновой застежкой-молнией и т.д. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид дополнительно содержит связующее звено. В конкретных вариантах осуществления изобретения шарнирсодержащий полипептид содержит половинное антитело.
В определенных конкретных вариантах осуществления изобретения смесь для сборки белка находится в восстановительных условиях, предпочтительно, в слабых восстановительных условиях, и имеет окислительный потенциал от -50 до -600 мВ, от -100 до -600 мВ, от -200 до -600 мВ, от -100 до -500 мВ, от -150 до -300 мМ, более предпочтительно, от -300 до -500 мВ, наиболее предпочтительно, около -400 мВ, которые стимулируют сборку гетеромультимерных белков при рН 7-9 и температуре от 15°С до 39°С. В определенных вариантах осуществления изобретения восстановитель добавляют на стадии с или стадии d для создания требуемых восстановительных условий в процессе сборки. В других определенных вариантах осуществления изобретения восстановитель выбирают из группы, состоящей из дитиотреита (DTT), трис(2-карбоксиэтил)фосфина (ТСЕР), тиогликолевой кислоты, аскорбиновой кислоты, тиолуксусной кислоты, глутатиона (GSH), бета-меркаптоэтиламина, цистеина/цистина, глутатиона (GSH), цистеамина/цистамина, глицилцистеина и бета-меркаптоэтанола, предпочтительно, GSH. В определенных предпочтительных вариантах осуществления изобретения восстановитель, предпочтительно, является слабым восстановителем, выбираемым из группы, состоящей из глутатиона (GSH), бета-меркаптоэтиламина, цистеина/цистина, глутатиона (GSH)/глутатиондисульфида (GSSG), цистеамина/цистамина, глицилцистеина и бета-меркаптоэтанола, предпочтительно, GSH. В определенных вариантах осуществления изобретения восстановитель не является DTT.
В других определенных вариантах осуществления изобретения восстановитель добавляют в смесь для сборки белка в 2-600-кратном, 2-200-кратном, 2-300-кратном, 2-400-кратном, 2-500-кратном, 2-20-кратном, 2-8-кратном, 20-50-кратном, 50-600-кратном, 50-200-кратном или 100-300-кратном молярном избытке, предпочтительно, 5-400-кратном, более предпочтительно, 100-300-кратном и, наиболее предпочтительно, 200-кратном молярном избытке по отношению к общему количеству шарнирсодержащих полипептидов. В определенных вариантах осуществления изобретения смесь для сборки белка имеет значение рН 7-9, предпочтительно, рН 8,5. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид является половинным антителом.
В некоторых вариантах осуществления изобретения восстановитель добавляют к первому и второму шарнирсодержащим полипептидам до смешивания. Добавление, предпочтительно, производят менее, чем за 1 час, более предпочтительно, менее, чем за 15 минут, наиболее предпочтительно, менее, чем за 5 минут до смешивания.
В определенных вариантах осуществления изобретения способ по настоящему изобретению далее включает добавление стабилизатора в реакционную смесь на одной или нескольких стадиях, включающих, не ограничиваясь ими, стадию фиксации среднего значения рН и стадию сборки с нагреванием или без нагревания. Например, стабилизатор может быть добавлен к шарнирсодержащему полипептиду для предотвращения или уменьшения агрегации. В других примерах стабилизатор может быть добавлен в смесь для сборки белка для предотвращения или уменьшения агрегации в процессе сборки гетеромультимерного белка. В определенных конкретных вариантах осуществления изобретения шарнирсодержащий полипептид является половинным антителом.
В определенных конкретных вариантах осуществления изобретения стабилизатор выбирают из группы, состоящей из аргинина, гистидина и поливинилпирролидона (PVP). В определенных вариантах осуществления изобретения аргинин или гистидин является солью аргинина или солью гистидина. В других определенных вариантах осуществления изобретения аргинин или гиститид является производным аргинина или производным гистидина. В других определенных вариантах осуществления изобретения аргинин или гистидин является гидрохлоридом аргинина или гидрохлоридом гистидина. В определенных вариантах осуществления изобретения аргинин не является фосфатом аргинина.
В других определенных вариантах осуществления изобретения способ по настоящему изобретению далее включает стадию инкубации смеси для сборки белка в присутствии PVР. В родственных вариантах осуществления изобретения PVP добавляют в количестве до 40% (мас./об.). В других определенных вариантах осуществления изобретения PVP присутствует в смеси для сборки белка в концентрации 2%-6% (мас./об.), 10%-20%, 2%-10%, 1%, 1,3%, 1,7%, 2%, 2,3%, 2,7%, 3%, 3,3%, 3,7% или 4%, предпочтительно, 0,1%-10%, более предпочтительно, 2%-6% и, наиболее предпочтительно, 4%. В определенных вариантах осуществления изобретения молекулярная масса PVP составляет не более 100 кДа, не более 30 кДа и, предпочтительно, равна 10 кДа. В других определенных вариантах осуществления изобретения РVP присутствует в количестве менее 10% (мас./об.) или менее 5% (мас./об.).
В некоторых вариантах осуществления изобретения стабилизатор является аргинином, присутствующим в концентрации от 20 мМ до 1 М, от 20 мМ до менее 1 М, от 20 мМ до 100 мМ, от 20 мМ до 200 мМ, от 20 мМ до 300 мМ, от 20 мМ до 400 мМ, от 20 мМ до 50 мМ, от 50 мМ до 100 мМ, от 50 нМ до 150 мМ, от 50 мМ до 200 мМ, от 50 мМ до 250 мМ или от 50 мМ до 300 мМ. В других вариантах осуществления изобретения стабилизатор является гистидином, присутствующим в концентрации от 20 мМ до 1 М, от 20 мМ до менее 1 М, от 20 мМ до 100 мМ, от 20 мМ до 200 мМ, от 20 мМ до 300 мМ, от 20 мМ до 400 мМ, от 20 мМ до 50 мМ, от 50 мМ до 100 мМ, от 50 нМ до 150 мМ, от 50 мМ до 200 мМ, от 50 мМ до 250 мМ или от 50 мМ до 300 мМ. В определенных предпочтительных вариантах осуществления изобретения аргинин или гистидин добавляют в концентрации 50 мМ или 200 мМ. В других определенных вариантах осуществления изобретения аргинин и/или гистидин добавляют в концентрации от 20 мМ до 200 мМ, от 20 мМ до 100 мМ, от 50 мМ до 200 мМ или от 50 мМ до 100 мМ. В других определенных вариантах осуществления изобретения шарнирсодержащий полипептид содержит половинное антитело.
Другим объектом настоящего изобретения является клетка-хозяин, экспрессирующая шарнирсодержащий полипептид. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид является половинным антителом.
Другим объектом настоящего изобретения является способ получения биспецифического антитела, который включает стадии: (а) культивирование первой клетки-хозяина, созданной для экспрессии первого половинного антитела, специфичного к первому антигену или первому эпитопу антигена; (b) культивирование второй клетки-хозяина, созданной для экспрессии второго половинного антитела, специфичного ко второму антигену или второму эпитопу того же антигена; (с) выделение первого половинного антитела из культуры на стадии а при значении рН 4-9, предпочтительно, 5-9, в присутствии первого солюбилизатора; (d) выделение второго половинного антитела из культуры на стадии b при значении рН 4-9, предпочтительно, 5-9, в присутствии второго солюбилизатора; (е) смешивание первого и второго половинных антител в восстановительных условиях с образованием смеси для сборки белка и (f) инкубацию смеси для сборки белка с образованием биспецифического антитела, содержащего первое и второе половинные антитела.
В некоторых вариантах осуществления изобретения первую клетку-хозяина и вторую клетку-хозяина культивируют в отдельных культурах, при этом первое половинное антитело и второе половинное антитело отдельно очищают от культур первой и второй клеток-хозяев до смешивания. В определенных вариантах осуществления изобретения первую и вторую клетки-хозяева культивируют в отдельных культурах, после чего культуры объединяют, клетки осаждают, необязательно гомогенизируют и/или лизируют и первое и второе половинные антитела совместно очищают любыми приемлемыми методами. В определенных вариантах осуществления изобретения первое и второе половинные антитела совместно очищают протеином А. В других вариантах осуществления изобретения первую и вторую клетки-хозяева совместно культивируют в смешанной культуре и совместно очищают первое и второе половинные антитела.
Клетка-хозяин может быть, например, бактериальной клеткой, дрожжевой клеткой, растительной клеткой, клеткой насекомого или клеткой млекопитающего. В определенных конкретных вариантах осуществления изобретения шарнирсодержащий полипептид или половинное антитело продуцируют в клетке млекопитающего, такой как клетка СНО. В других определенных вариантах осуществления изобретения клетка-хозяин является бактериальной клеткой, в частности, клеткой E.coli.
В определенных дополнительных вариантах осуществления изобретения способы по настоящему изобретению далее включают стадию выделения гетеромультимерного белка или биспецифического антитела, образованного на стадии (d). Собранный гетеромультимерный белок может быть далее очищен методами, описанными в настоящей заявке на патент, или приемлемыми методами, известными в данной области.
Еще одним объектом настоящего изобретения являются композиции, содержащие шарнирсодержащий полипептид и солюбилизатор, в которых значение рН равно рН 4-9, предпочтительно, рН 5-9. В определенных вариантах осуществления изобретения значение рН композиции равно по меньшей мере рН 5, по меньшей мере рН 5,5, по меньшей мере рН 5,7, больше рН 5, больше рН 5,5, больше рН 5,7, 5-9, 5-8, 5,5-8, 5,5-9, 5,7-8, 5,7-9, 6-8, 6-9, 7-8, 7,5-8,5 или 7-8,5. В определенных вариантах осуществления изобретения солюбилизатор выбирают из группы, состоящей из аргинина, гистидина и сахарозы, предпочтительно, из аргинина и/или гистидина. В других определенных вариантах осуществления изобретения аргинин является солью аргинина и/или гистидин является солью гистидина. В других определенных вариантах осуществления изобретения аргинин является производным аргинина и/или гистидин является производным гистидина. В других определенных вариантах осуществления изобретения аргинин или гистидин является L-аргинином или L-гистидином. В других определенных вариантах осуществления изобретения аргинин или гистидин является гидрохлоридом аргинина или гидрохлоридом гистидина.
В определенных конкретных вариантах осуществления изобретения солюбилизатор является аргинином или гистидином. В других определенных вариантах осуществления изобретения аргинин или гистидин присутствует в концентрации 20 мМ, 50 мМ, 200 мМ, 400 мМ, от 20 мМ до 1 М, от 20 мМ до менее 1 М, от 20 мМ до 200 мМ, от 20 мМ до 400 мМ, от 20 мМ до 100 мМ, от 50 мМ до 100 мМ, от 50 мМ до 200 мМ, от 50 мМ до 300 мМ или от 50 мМ до 400 мМ. В определенных конкретных вариантах осуществления изобретения композиция по настоящему изобретению включает как аргинин, так и гистидин, каждый из которых присутствует в концентрации 20 мМ, 50 мМ, 200 мМ, 400 мМ, от 20 мМ до 1 М, от 20 мМ до менее 1 М, от 20 мМ до 200 мМ, от 20 мМ до 400 мМ, от 20 мМ до 100 мМ, от 50 мМ до 100 мМ, от 50 мМ до 200 мМ, от 50 мМ до 300 мМ или от 50 мМ до 400 мМ. В других определенных вариантах осуществления изобретения композиция по настоящему изобретению не включает гидрохлорид гуанидина или мочевину. В определенных вариантах осуществления изобретения композиция альтернативно или дополнительно включает стабилизатор.
В определенных конкретных вариантах осуществления изобретения шарнирсодержащий полипептид содержит половинное антитело. В других конкретных вариантах осуществления изобретения композиция содержит шарнирсодержащий полипептид или половинное антитело только одного типа. В определенных вариантах осуществления изобретения композиция содержит половинное антитело только одного типа, которое является половинным антителом с выступом. В других определенных вариантах осуществления изобретения композиция содержит половинное антитело только одного типа, которое является половинным антителом с углублением.
В определенных конкретных вариантах осуществления изобретения композиция дополнительно содержит второй шарнирсодержащий полипептид, при этом первый шарнирсодержащий полипептид имеет выступ и второй шарнирсодержащий полипептид имеет углубление. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид содержит половинное антитело. В определенных конкретных вариантах осуществления изобретения шарнирсодержащий полипептид является половинным антителом. В других определенных вариантах осуществления изобретения половинное антитело относится к изотипу IgG1, IgG2 или IgG4.
Все варианты осуществления изобретения, рассмотренные в настоящем описании изобретения, могут быть объединены, если из контекста не следует обратное. Кроме того, все вышеописанные варианты осуществления изобретения относятся к любому объекту изобретения, если из контекста не следует обратное.
Другие объекты, признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения. Однако следует отметить, что подробное описание изобретения и конкретные примеры, описывающие предпочтительные варианты осуществления изобретения, приведены только в качестве иллюстрации, так как из подробного описания изобретения специалисту в данной области станут очевидны разные изменения и модификации, не выходящие за пределы объема и сущности настоящего изобретения.
Краткое описание чертежей
На фигуре 1А показано полностью окисленное половинное антитело. На данной фигуре не показан “выступ”, “углубление” или другие домены гетеродимеризации. Половинное антитело, изображенное на данной фигуре, относится к изотипу IgG1. Специалисту в данной области должно быть понятно, что в качестве половинных антител могут быть использованы иммуноглобулины других изотипов, имеющие соответствующие межцепочечные и внутрицепочечные связи. В интактном антителе цистеины шарнирной области образуют межцепочечные дисульфидные связи.
На фигуре 1В показано полноразмерное биспецифическое антитело с доменом гетеромультимеризации. На данной фигуре не показаны дисульфидные связи между тяжелыми цепями в шарнирной области. Показанный домен гетеромультимеризации представляет собой соединение по типу “выступ в углубление”.
На фигуре 1С представлено графическое изображение биспецифического антитела, содержащего домен гетеромультимеризации (по типу “выступ в углубление”), расщепляемое фурином связующее звено и необязательную дополнительную дисульфидную связь (S354). Также показаны дисульфидные связи между тяжелыми цепями в шарнирной области. Расщепляемые фурином сайты обозначены треугольниками. Хотя расщепляемое фурином связующее звено показано в половинном антителе, включающем выступ, такое связующее звено может быть также использовано в половинном антителе с углублением или в половинных антителах, имеющих как выступ, так и углубление.
На фигурах 2А-В представлены вытеснительные хроматограммы композита, показывающие влияние значения рН на изменение конформации половинных антител. На фигуре 2А показано, что более высокое значение рН вызывает изменение конформации половинного антитела с углублением, приводящее к увеличению гидродинамического радиуса. Такое изменение конформации увеличивает гетеродимеризацию в процессе сборки. На фигуре 2В показано, что более высокое значение рН стимулирует образование нековалентно связанного гомодимера половинного антитела с выступом. Такое изменение конформации способствует образованию биспецифического антитела в процессе сборки. Ссылка сделана на пример 2.
На фигурах 3А-3В приведены результаты, показывающие, что солюбилизатор, такой как гидрохлорид аргинина (фигуры 3А и В) или гидрохлорид гистидина (фиг. 3В), уменьшает осаждение половинных антител с выступом, вызываемое средним значением рН.
На фигурах 4А-В представлены хроматограммы композита, показывающие влияние восстановителя, такого как глутатион, на агрегацию и сборку биспецифического антитела. Глутатион добавляют в 2-200-кратном молярном избытке. Ссылка сделана на пример 3.
На фигуре 5А изображен график, иллюстрирующий влияние температуры на скорость образования (сборки) биспецифического антитела IgG1. На фигуре 5В показано, что повышенная температура стимулирует сборку биспецифического антитела IgG1 по типу “выступ в углубление” в присутствии 200-кратного молярного избытка глутатиона при фиксации или без фиксации среднего значения рН, о чем свидетельствуют результаты анализа методом хроматографии с обращенной фазой. На фигуре 5В также показано, что оптимизация значения рН пулов половинных антител с целью изменения конформации до сборки белка повышает скорость и эффективность сборки. Ссылка сделана на пример 4.
На фигуре 6А показано влияние стабилизатора, такого как PVP, на стабилизацию образовавшегося биспецифического антитела и уменьшение агрегации.
На фигуре 6В показано, что PVP и гистидин при повышенной температуре стимулируют сборку биспецифического антитела IgG4 по типу ”выступ в углубление”, о чем свидетельствуют результаты хроматографии с обращенной фазой. Нижняя кривая: сборка при комнатной температуре с соотношением 300-кратного молярного избытка глутатиона:антитела, рН=8,5, ~400 мМ аргинина; верхняя кривая: сборка при нагревании с соотношением 200-кратного молярного избытка глутатиона:антитела, рН=8,0, 4% PVP, 50 мМ аргинина, 100 мМ гистидина при 35°С.
На фигуре 6С показано, что PVP уменьшает агрегацию биспецифического антитела IgG4, собираемого по типу ”выступ в углубление”, в процессе сборки с нагреванием при 37°С и рН 8 в течение 6 часов. Ссылка сделана на пример 5.
На фигуре 7 показано, что гистидин уменьшает вызываемую нагреванием агрегацию половинных антител IgG4 с углублением при сборке, выполняемой при 37°С и рН 8 в течение 3 часов.
Подробное описание изобретения
Ниже приведено подробное описание изобретения с использованием следующих определений терминов и примеров. Все патенты и публикации, в том числе все последовательности, приведенные в таких патентах и публикациях, включены в настоящее описание изобретения в качестве ссылки.
За исключением особо оговоренных случаев все технические и научные термины, использованные в настоящем описании изобретения, известны специалистам в данной области, к которой относится настоящее изобретение. Общий словарь многих терминов, использованных в настоящем изобретении, приведен в публикациях Singleton, et al., Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, New York (1994) и Halе & Marham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991). Хотя при осуществлении или тестировании настоящего изобретения могут быть использованы любые методы и материалы, подобные или эквивалентные представленным в настоящем описании изобретения, ниже приведены предпочтительные методы и материалы. В диапазоны числовых значений входят все числа, указанные в таком диапазоне. За исключением особо оговоренных случаев нуклеиновые кислоты представлены слева направо от 5'- к 3'-концу; аминокислотные последовательности представлены слева направо от аминоконца к карбоксильному концу. Для ознакомления с определениями и терминами, используемыми в данной области, предлагаем обратиться к публикациям Sambrook et al., 1989, и Ausubel FM et al., 1993. Следует отметить, что настоящее изобретение не ограничено представленными конкретными методами, процессами и реагентами, которые могут изменяться.
В диапазоны числовых значений входят все числа, указанные в таком диапазоне.
За исключением особо оговоренных случаев нуклеиновые кислоты представлены слева направо от 5'- к 3'-концу; аминокислотные последовательности представлены слева направо от аминоконца к карбоксильному концу.
Как используется в настоящем описании, значения формы единственного числа включают формы множественного числа, если из контекста не следует обратное. Например, ”клетка-хозяин” означает одну или несколько клеток-хозяев.
Заголовки, приведенные в настоящем описании изобретения, не ограничивают разные объекты или варианты осуществления изобретения, которые могут быть отнесены к описанию изобретения в целом. Поэтому приведенные ниже термины могут быть более полно определены со ссылкой на описание изобретения в целом.
Все варианты осуществления изобретения, рассмотренные в настоящем описании изобретения, могут быть объединены, если из контекста не следует обратное. Кроме того, все варианты осуществления изобретения, описанные ниже, относятся к любому и каждому объекту изобретения, если из контекста не следует обратное.
I. Определения терминов
Настоящее изобретение относится к способам получения гетеромультимерного белка, содержащего первый шарнирсодержащий полипептид и второй шарнирсодержащий полипептид. Термин ”шарнирсодержащий полипептид” в использованном в настоящем описании значении означает полипептид, содержащий по меньшей мере одну шарнирную область. В определенных вариантах осуществления изобретения шарнирная область соединяет несколько доменов, например, связывающий домен и эффекторный домен, и сообщает полипептиду некоторую структурную гибкость, необходимую для димеризации или мультимеризации. В качестве примера можно указать, что связывающий домен может быть антигенсвязывающим доменом антитела или лигандсвязывающим доменом рецептора и эффекторный домен может быть Fc компонентом антитела. В определенных вариантах осуществления изобретения первый шарнирсодержащий полипептид отличается от второго шарнирсодержащего полипептида, при этом полученный димер или мультимер является гетеродимером или гетеромультимером. В определенных конкретных вариантах осуществления изобретения первый шарнирсодержащий полипептид и второй шарнирсодержащий полипептид связываются с двумя разными эпитопами одного и того же белка-мишени. В других определенных вариантах осуществления изобретения первый шарнирсодержащий полипептид обладает специфичностью связывания с мишенью, отличной от аналогичного показателя второго шарнирсодержащего полипептида, поэтому полученный гетеродимер или гетеромультимер связывается с двумя или большим числом разных белков-мишеней. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид содержит природный или искусственный домен гетеродимеризации. В определенных конкретных вариантах осуществления изобретения шарнирсодержащий полипептид содержит один или несколько остатков цистеина в шарнирной области, способных образовывать одну или несколько дисульфидных связей с другим шарнирсодержащим полипептидом.
Шарнирсодержащий полипептид содержит, не ограничиваясь ими, половинное антитело, иммуноадгезин и их функциональный фрагмент. Термин ”функциональный фрагмент” как используется в настоящем описании, означает фрагмент, то есть часть полноразмерного шарнирсодержащего полипептида, которая все же сохраняет требуемую функцию, например, целенаправленную или антигенсвязывающую активность, активность Fc эффектора и/или способность димеризации/мультимеризации. В определенных конкретных вариантах осуществления изобретения первый шарнирсодержащий полипептид и второй шарнирсодержащий полипептид являются половинными антителами, обладающими разной антигенсвязывающей специфичностью, и полученный димер или мультимер является биспецифическим или мультиспецифическим антителом. В определенных вариантах осуществления изобретения полученный гетеромультимерный белок содержит половинное антитело и иммуноадгезин.
Термин ”мультиспецифическое антитело” использован в самом широком значении и означает антитело, обладающее полиэпитопной специфичностью. Такие мультиспецифические антитела включают, не ограничиваясь ими, антитело, содержащее вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), в котором структурная единица VНVL обладает полиэпитопной специфичностью, антитела, имеющие два или больше VL и VH доменов, в которых каждая структурная единица VHVL связывается с разным эпитопом, антитела, имеющие два или больше отдельных вариабельных доменов, в которых каждый отдельный вариабельный домен связывается с разными эпитопом, полноразмерные антитела, фрагменты антител, такие как Fab, Fv, dsFv, scFv, диатела, биспецифические диатела и триатела, ковалентно или нековалентно связанные фрагменты антител. Термин ”полиэпитопная специфичность” означает способность специфически связываться с двумя или более разными эпитопами на одной и той же или разных мишенях. Термин ”моноспецифический” означает способность связываться только с одним эпитопом. В соответствии с одним вариантом осуществления изобретения мультиспецифическое антитело является антителом IgG, которое связывается с каждым эпитопом с аффинностью от 5 мкМ до 0,001 пМ, от 3 мкМ до 0,001 пМ, от 1 мкМ до 0,001 пМ, от 0,5 мкМ до 0,001 пМ или от 0,1 мкМ до 0,001 пМ.
Природное основное 4-цепочечное антитело является гетеротетрамерным гликопротеином, состоящим из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей (антитело IgM состоит из 5 основных гетеротетрамерных структурных единиц наряду с дополнительным полипептидом, именуемым J-цепью, и поэтому содержит 10 антигенсвязывающих центров, при этом секретированные антитела IgA могут полимеризоваться с образованием поливалентных структур, содержащих 2-5 основных 4-цепочечных структурных единиц наряду с J-цепью). В случае антител IgG молекулярная масса 4-цепочечной структурной единицы обычно равна примерно 150000 дальтон. Каждая L-цепь связана с Н-цепью одной ковалентной дисульфидной связью, в то время как две Н цепи связаны друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа Н цепи. Каждая Н и L цепь также имеет расположенные на одинаковом расстоянии друг от друга внутрицепочечные дисульфидные мостики. Каждая Н цепь имеет у N-конца вариабельный домен (VН), за которым следуют три константных домена (СН) для каждой из α- и γ-цепей и четыре СН домена для μ и ε изотипов. Каждая L цепь имеет у N-конца вариабельный домен (VL), за которым следует константный домен (СL) у С-конца. VL совмещается с VH и СL совмещается с первым константным доменом тяжелой цепи (СH1). Считается, что определенные аминокислотные остатки образуют область контакта между вариабельными доменами легкой цепи и тяжелой цепи. В результате спаривания VН и VL образуется один антигенсвязывающий центр. Для ознакомления со структурой и свойствами антител, относящихся к разным классам, см., например, публикацию Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, page 71 and Chapter 6.
Легкая (L) цепь любого вида позвоночных может быть отнесена к одному из двух разных типов, именуемых каппа и лямбда, на основании аминокислотных последовательностей константных доменов. В зависимости от аминокислотной последовательности константного домена тяжелых цепей (СН) иммуноглобулины могут быть отнесены к разным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, тяжелые цепи которых обозначены, соответственно, α, δ, ω, γ и μ. γ и α классы далее делятся на подклассы на основании относительно небольших различий в СН последовательности и выполняемой функции, например, у человека имеются следующие подклассы: IgG1, IgG2, IgG3, IgA1 и IgA2.
Термин ”вариабельный” означает, что определенные сегменты вариабельных доменов имеют последовательности, значительно отличающиеся у разных антител. Вариабельный (V) домен опосредует связывание с антигеном и определяет специфичность конкретного антитела к конкретному антигену. Однако вариабельность распределена неравномерно среди 110 аминокислот вариабельных доменов. Вариабельные области состоят из относительно невариабельных участков, именуемых остовными областями (FR), состоящими из 15-30 аминокислот, разделенных более короткими областями, обладающими высокой вариабельностью, которые именуются ”гипервариабельными участками” и состоят из 9-12 аминокислот. Вариабельные домены нативных тяжелых и легких цепей включают четыре остовные области, имеющие главным образом бета-складчатую конформацию, соединенную тремя гипервариабельными участками, которые образуют петли, соединяющие и в некоторых случаях образующие часть бета-складчатой структуры. Гипервариабельные участки в каждой цепи удерживаются в непосредственной близости друг от друга остовными областями и вместе с гипервариабельными участками из другой цепи образуют антигенсвязывающий область антител (см. публикацию Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Beghesda, MD (1991)). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но выполняют разные эффекторные функции, такие как участие антитела в антителозависимой клеточно-опосредованной цитотоксичности (ADCC).
Термин “гипервариабельный участок”, “HVR” или “HV”, как используется в настоящем описании, означает области вариабельного домена антитела, имеющие гипервариабельную последовательность и/или образующие цепи с определенной структурой. Антитела обычно имеют шесть гипервариабельных участков; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В нативных антителах Н3 и L3 характеризуются наибольшей вариабельностью из шести гипервариабельных участков, в частности, считается, что Н3 играет уникальную роль, сообщая точную специфичность антителам. См., например, публикации Xu et al., Immunity 13: 37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248: 1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Действительно, природные антитела верблюдовых, состоящие только из тяжелой цепи, являются функциональными и устойчивыми при отсутствии легкой цепи. См., например, публикации Hamers-Casterman et al., Nature 363: 446-448 (1993); Sheriff et al., Nature Struct. Biol. 3: 733-736 (1996).
Существует несколько классификаций гипервариабельных участков, которые рассмотрены в настоящем описании изобретения. Наиболее часто используются определяющие комплементарность области Кабата (CDR), классифицируемые на основании вариабельности последовательностей (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Классификация Хотиа основана на локализации структурных петель (Chothia and Lesk J. Mol. Biol. 196: 901-917 (1987)). Гипервариабельные участки AbM представляют компромисс между гипервариабельными участками Кабата и структурными петлями Хотиа и используются в программном обеспечении моделирования антител AbM Oxford Molecular. “Контактные” гипервариабельные участки классифицированы на основании анализа существующих сложных кристаллических структур. Ниже приведены остатки указанных гипервариабельных участков.
(Нумерация Кабата)
(Нумерация Хотиа)
Гипервариабельные участки могут содержать следующие “удлиненные HVR”: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (Н1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH. Остатки вариабельного домена пронумерованы для каждой из указанных классификаций в соответствии с приведенной выше публикацией Kabat et al.
“Остовные области” (FR) включают остатки вариабельных доменов, не являющиеся остатками СDR. Каждый вариабельный домен обычно имеет четыре остовные области, определяемые как FR1, FR2, FR3 и FR4. При определении CDR в соответствии с классификацией Кабата остатки остовных областей легкой цепи расположены примерно в положении остатков 1-23 (LCFR1), 35-49 (LCFR2), 57-88 (LCFR3) и 98-107 (LCFR4) и остатки остовных областей тяжелой цепи расположены примерно в положении остатков 1-30 (HCFR1), 36-49 (HCFR2), 66-94 (HCFR3) и 103-113 (HCFR4) тяжелой цепи. Если CDR содержат аминокислотные остатки из гипервариабельных петель, то остатки остовных областей легкой цепи расположены примерно в положении остатков 1-25 (LCFR1), 33-49 (LCFR2), 53-90 (LCFR3) и 97-107 (LCFR4) легкой цепи и остатки остовных областей тяжелой цепи расположены примерно в положении остатков 1-25 (HCFR1), 33-52 (HCFR2), 56-95 (HCFR3) и 102-113 (НСFR4) тяжелой цепи. В некоторых случаях, когда CDR содержит аминокислоты как из CDR по классификации Кабата, так и из гипервариабельной петли, остатки остовной области корректируются соответствующим образом. Например, когда остатки CDRH1 содержат аминокислоты Н26-Н35, остатки FR1 тяжелой цепи находятся в положениях 1-25 и остатки FR2 находятся в положениях 36-49.
Термин ”консенсусная остовная область человека” означает остовную область, включающую наиболее часто встречающиеся аминокислотные остатки, при выборе остовных последовательностей VL или VH иммуноглобулина человека. Последовательности VL или VH иммуноглобулина человека обычно выбирают из подгруппы последовательностей вариабельного домена. Указанная подгруппа последовательностей обычно является подгруппой по классификации Кабата. В одном варианте осуществления изобретения подгруппа для VL является подгруппой каппа I по классификации Кабата. В одном варианте осуществления изобретения подгруппа для VH является подгруппой III по классификации Кабата.
Одним примером ”интактного” антитела является антитело, содержащее антигенсвязывающий центр, а также СL и по меньшей мере константные домены тяжелой цепи СН1, СН2 и СН3. Константные домены могут быть константными доменами нативной последовательности (например, константными доменами нативной последовательности человека) или их вариантом аминокислотной последовательности.
Термин ”фрагменты антитела” означает часть интактного антитела, предпочтительно, антигенсвязывающий центр или вариабельную область интактного антитела. Примеры фрагментов антитела включают Fab, Fab', F(ab')2 и Fv фрагменты; диатела (Db); тандемные диатела (taDb), линейные антитела (например, патент США № 5641870, пример 2; публикация Zapata et al., Protein Eng. 8(10): 1057-1062 (1995)); антитела с одним плечом, антитела с одним вариабельным доменом, минитела, одноцепочечные антитела и мультиспецифические антитела, образованные из фрагментов антител (например, включающие, но не ограничивающиеся ими, Db-Fc, taDb-Fc, taDb-CH3 и (scFV)4-Fc).
Термин “половинное антитело”, как используется в настоящем описании, означает одну тяжелую цепь иммуноглобулина, связанную с одной легкой цепью иммуноглобулина. Типичное половинное антитело показано на фигуре 1А. Специалисту в данной области должно быть понятно, что половинное антитело может включать фрагмент антитела и может иметь антигенсвязывающий домен, состоящий из одного вариабельного домена, например, выделенный у представителя верблюдовых.
Авторы настоящего изобретения неожиданно обнаружили, что оптимизация или регулирование значения рН половинных антител, элюированных из колонки с протеином А или другой матрицы с низким значением рН, вызывает изменение конформации шарнирсодержащих полипептидов, таких как половинные антитела. Оптимизация рН до среднего значения рН, иногда определяемая в настоящем описании изобретения как фиксация значения рН или фиксация среднего значения рН, может вызывать осаждение или агрегацию половинных антител. Таким образом, в определенных вариантах осуществления изобретения способ получения гетеромультимерного белка включает стадию получения первого или второго шарнирсодержащего полипептида при рН 5-9 в присутствии первого или второго солюбилизатора.
Термин “солюбилизатор”, как используется в настоящем описании, означает реагент, который предотвращает или уменьшает осаждение шарнирсодержащего полипептида, такого как половинное антитело. Приемлемый солюбилизатор включает, не ограничиваясь ими, аргинин и гистидин либо их соль или производное и сахарозу. В определенных вариантах осуществления изобретения солюбилизатор является аргинином и/или гистидином. В определенных вариантах осуществления изобретения солюбилизатор предотвращает или уменьшает осаждение, вызванное фиксацией среднего значения рН и/или нагреванием. В определенных конкретных вариантах осуществления изобретения солюбилизатор добавляют до фиксации среднего значения рН (то есть до доведения рН до среднего значения) и/или нагревания. В определенных вариантах осуществления изобретения аргинин или гистидин является солью аргинина или солью гистидина. В других определенных вариантах осуществления изобретения аргинин или гистидин является производным аргинина или производным гистидина. Уменьшение осаждения может привести к более высокому выходу требуемого собранного конечного продукта.
Для солюбилизации белка с целью его получения и очистки обычно использовали имидазол и гуанидин. Однако было установлено, что имидазол и гуанидин, используемые без гистидина или аргинина, недостаточно увеличивали общий выход собранного гетеромультимерного белка по настоящему изобретению, такого как биспецифическое антитело. В определенных вариантах осуществления изобретения имидазол и гуанозин могут денатурировать белки.
Аналогичным образом для уменьшения агрегации/осаждения обычно используют гидрохлорид гуанидина и мочевину, но указанные детергенты могут полностью денатурировать белок. Таким образом, в определенных вариантах осуществления изобретения солюбилизатор предотвращает или уменьшает осаждение, не денатурируя представляющий интерес белок. В определенных вариантах осуществления изобретения солюбилизатор не является гидрохлоридом гуанидина, гуанидином, имидазолом или мочевиной. В других определенных вариантах осуществления изобретения композиции по настоящему изобретению не включают гидрохлорид гуанидина или мочевину. В других определенных вариантах осуществления изобретения солюбилизатор не является твином или полиэтиленгликолем (РEG).
Кроме того, на стадии фиксации среднего значения рН каждого половинного антитела либо в процессе сборки или сразу же после смешивания шарнирсодержащих полипептидов или половинных антител может быть добавлен стабилизатор. Стабилизатор может быть добавлен в реакционную смесь на одной, нескольких или всех стадиях способов по настоящему изобретению для предотвращения или уменьшения агрегации шарнирсодержащих полипептидов или половинных антител до, во время и/или после сборки белка.
Агрегаты могут быть обнаружены в виде высокомолекулярных продуктов и в случае половинных антител в виде высокомолекулярных продуктов с молекулярной массой более 150 кДа. Агрегаты могут быть обнаружены и количественно определены, например, при помощи вытеснительной хроматографии или других приемлемых методов. В других определенных вариантах осуществления изобретения агрегаты, обнаруженные при помощи вытеснительной хроматографии, могут проходить через стерилизующий фильтр с размером ячеек 0,2 мкм. Осажденные белки, с другой стороны, могут состоять из денатурированных белков или агрегированных белков, которые могут образовывать очень большой комплекс. Было испытано несколько реагентов, которые были признаны неэффективными или неприемлемыми для использования в качестве стабилизаторов, например, имидазол, 3-(N-морфолино)пропансульфоновая кислота (MOPS), 2-(N-морфолино)-этансульфоновая кислота (MES), циклодекстрин, CuSO4 и NaOAc. Таким образом, в определенных вариантах осуществления изобретения в качестве стабилизатора не могут быть использованы неорганические соли или переходные металлы. Приемлемые стабилизаторы включают, не ограничиваясь ими, PVP, гистидин и аргинин. Уменьшение агрегации может способствовать увеличению выхода требуемого собранного конечного продукта.
PVP является водорастворимым незаряженным полимером, имеющим пирролидоновую группу. В определенных вариантах осуществления изобретения в качестве приемлемых стабилизаторов могут быть использованы другие незаряженные полярные полимеры, другие реагенты или соединения, в частности, соединения, характеризующиеся такой же структурой и свойствами, что и приемлемые стабилизаторы, рассмотренные в настоящем описании изобретения. Специалист в данной области может определить приемлемый стабилизатор, анализируя влияние соединения на уровни агрегации при помощи методов, известных в данной области, включая методы, рассмотренные в настоящем описании изобретения.
Реагент может быть исследован в отношении применения как солюбилизатора, так и стабилизатора. Например, аргинин может быть использован в качестве солюбилизатора для уменьшения осаждения половинных антител на стадии фиксации среднего значения рН и/или нагревания, а также в качестве стабилизатора для уменьшения агрегации на стадии сборки. Аналогичным образом гистидин может быть использован в качестве солюбилизатора для уменьшения осаждения, а также в качестве стабилизатора для уменьшения агрегации половинных антител на стадии фиксации среднего значения рН и/или нагревания. Не прибегая к каким-либо конкретным механизмам, можно отметить, что в определенных вариантах осуществления изобретения как солюбилизатор, так и стабилизатор могут предотвращать взаимодействие гидрофобных участков на поверхностях белков, которые могут вызывать агрегацию. В других вариантах осуществления изобретения солюбилизатор и стабилизатор могут функционировать, образуя клатраты, предотвращающие нежелательное взаимодействие белков.
Термин ”одноцепочечное половинное антитело” как используется в настоящем описании означает одноцепочечный полипептид, содержащий VL домен, необязательно CL домен, связующее звено, VН домен, необязательно СН1 домен, шарнирную область, СН2 домен и СН3 домен, в котором указанные домены расположены относительно друг друга в направлении от N-конца к С-концу в следующем порядке: VL-связующее звено-VH-шарнирная область-СН2-СН3 или VL-CL-связующее звено-VH-СН1-шарнирная область-СН2-СН3.
Выражение ”однодоменные антитела” (sdAb) или ”антитела с одним вариабельным доменом” (SVD) обычно означает антитела, в которых один вариабельных домен (VH или VL) может обеспечивать связывание с антигеном. Другими словами, один вариабельный домен не требует взаимодействия с другим вариабельным доменом для распознавания антигена-мишени. Примеры однодоменных антител включают антитела, выделенные у верблюдовых (лам и верблюдов) и хрящевых рыб (например, у акул-нянек), а также антитела, полученные методами рекомбинантных ДНК из антител человека и мыши (Nature (1989) 341: 544-546; Dev. Comp. Immunol. (2006) 30: 43-56; Trend Biochem. Sci. (2001) 26: 230-235; Trends Biotechnol. (2003) 21: 484-490; WO 2005/035572; WO 03/035694; Febs Lett. (1994) 339: 285-290; WO 00/29004; WO 02/051870).
Выражение ”линейные антитела” обычно означает антитела, описанные в публикации Zapata et al., Protein Eng. 8(10):1057-1062 (1995). В кратком изложении указанные антитела содержат два тандемных Fd сегмента (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют две антигенсвязывающие области. Линейные антитела могут быть биспецифическими или моноспецифическими.
Термин ”выступ в углубление” или метод ”KnH”, рассмотренный в настоящем описании изобретения, означает метод спаривания двух полипептидов друг с другом in vitro или in vivo путем введения выпуклости (выступа), имеющейся в одном полипептиде, в полость (углубление), имеющуюся в другом полипептиде в области их взаимодействия. Например, метод KnH используют в областях связывания Fc:Fc, CL:CH1 или VH/VL антител (см., например, US 2007/0178552, WO 96/027011, WO 98/050431 и публикацию Zhu et al. (1997) Protein Science 6: 781-788). Указанный метод особенно пригоден для спаривания двух разных тяжелых цепей в процессе производства мультиспецифических антител. Например, мультиспецифические антитела, имеющие KnH в Fc областях, могут далее включать отдельные вариабельные домены, связанные с каждой Fc-областью, или включать другие вариабельные домены тяжелых цепей, которые спариваются с одинаковыми или разными вариабельными доменами легких цепей. Метод KnH может быть также использован для спаривания внеклеточных доменов двух разных рецепторов или последовательностей любых других полипептидов, содержащих последовательности распознавания разных мишеней (например, включая аффитела, пептитела и другие Fc-гибриды).
В результате расщепления антител папаином образуются два идентичных антигенсвязывающих фрагмента, именуемых “Fab” фрагментами, и остаточный ”Fc” фрагмент, в названии которого отражена способность легко кристаллизироваться. Fab фрагмент состоит из всей L цепи вместе с вариабельным доменом Н цепи (VH) и первым константным доменом тяжелой цепи (СН1). В результате обработки антитела пепсином образуется один большой F(ab')2 фрагмент, который примерно соответствует двум Fab фрагментам, связанным дисульфидной связью, обладает двухвалентной антигенсвязывающей активностью и способен перекрестно связываться с антигеном. Fab' фрагменты отличаются от Fab фрагментов наличием нескольких дополнительных остатков у карбоксильного конца СН1 домена, включающих один или несколько остатков цистеина из шарнирной области антигена. Fab'-SH означает в настоящем описании изобретения Fab' фрагмент, в котором один или несколько остатков цистеина в константных доменах содержат свободную тиоловую группу. F(ab')2 фрагменты антител первоначально были получены в виде пар Fab' фрагментов, между которыми расположены остатки цистеина шарнирной области. Также известны другие методы химического связывания фрагментов антител.
Fc фрагмент содержит карбоксиконцевые части обеих Н цепей, удерживаемые вместе при помощи дисульфидных связей. Эффекторные функции антител определяются последовательностями в Fc области; указанная область также является частью, распознаваемой Fc рецепторами (FcR), обнаруженными на клетках определенных типов.
“Fv” состоит из димера вариабельного домена одной тяжелой и одной легкой цепей, связанных нековалентной связью. В результате укладки цепи двух указанных доменов образуются шесть гипервариабельных петель (по 3 петли из каждой Н и L цепи), которые предоставляют аминокислотные остатки для связывания антигена и сообщают антигенсвязывающую специфичность антителу. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичные к антигену) обладает способностью распознавать и связываться с антигеном, хотя часто с более низкой аффинностью по сравнению с полным антигенсвязывающим центром.
Термин “одноцепочечный Fv”, также сокращенно определяемый как ”sFv” или “scFv”, означает фрагменты антитела, содержащие VН и VL домены антитела, соединенные в одну полипептидную цепь. Полипептид, содержащий sFv-фрагмент, далее предпочтительно, содержит полипептидный линкер между VН и VL доменами, который позволяет sFv образовывать требуемую структуру для связывания с антигеном. Для ознакомления с фрагментом sFv см. публикации Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rodenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Malmborg et al., J. Immunol. Methods 183: 7-13, 1995.
Термин “диатела” означает небольшие фрагменты антитела, полученные путем создания sFv фрагментов (см. предыдущий абзац) с короткими линкерами (примерно 5-10 остатков) между VН и VL доменами, благодаря чему достигается межцепочечное, а не внутрицепочечное спаривание V доменов, что позволяет получить двухвалентный фрагмент, то есть фрагмент, имеющий два антигенсвязывающих центра. Биспецифические диатела являются гетеродимерами двух ”кроссинговерных” sFv фрагментов, в которых VН и VL домены двух антител присутствуют в разных полипептидных цепях. Диатела более полно описаны, например, в ЕР 404097, WO 93/11161 и публикации Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993).
Термин ”антитело с одним плечом” или ”антитела с одним плечом” означает антитело, содержащее (1) вариабельный домен, связанный пептидной связью с полипептидом, содержащим СН2 домен, СН3 домен или СН2-СН3 домен, и (2) второй СН2, СН3 или СН2-СН3 домен, в котором вариабельный домен не связан при помощи пептидной связи с полипептидом, включающим второй СН2, СН3 или СН2-СН3 домен. В одном варианте осуществления изобретения, антитело с одним плечом содержит 3 полипептида, из которых (1) первый полипептид содержит вариабельный домен (например, VH), СН1, СН2 и СН3, (2) второй полипептид содержит вариабельный домен (например, VL) и CL домен и (3) третий полипептид содержит СН2 и СН3 домен. В одном варианте осуществления изобретения третий полипептид не имеет вариабельного домена. В другом варианте осуществления изобретения антитело с одним плечом имеет неполную шарнирную область, содержащую два остатка цистеина, которые образуют дисульфидные связи, соединяющие константные домены тяжелых цепей. В одном варианте осуществления изобретения вариабельные домены антитела с одним плечом образуют антигенсвязывающую область. В другом варианте осуществления изобретения вариабельный домен антитела с одним плечом является отдельным вариабельным доменом, при этом каждый отдельный вариабельный домен представляет собой антигенсвязывающую область.
Антитела по настоящему изобретению могут быть ”химерными” антителами, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, выделенных из определенного вида или принадлежащих к определенному классу или подклассу антител, в то время как остальная часть цепи идентична или гомологична соответствующим последовательностям в антителах, выделенных из другого вида или принадлежащих к другому классу или подклассу антител; в определение данного термина также входят фрагменты таких антител при условии, что такие фрагменты обладают требуемой биологической активностью (патент США № 4816567 и публикация Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)). Химерные антитела, представляющие интерес в свете настоящего изобретения, включают антитела, содержащие антигенсвязывающие последовательности вариабельного домена, выделенные у примата кроме человека (например, у мартышек, обезьян и т.д.), и последовательности константной области человека.
“Гуманизированные” формы антител, отличных от человеческих, (например, грызунов) являются химерными антителами, содержащими минимальную последовательность, выделенную из антитела, отличного от человеческого. Гуманизированные антитела в основном являются иммуноглобулинами человека (реципиентное антитело), в которых остатки из гипервариабельного участка реципиента заменены остатками из гипервариабельного участка вида, отличного от человека (донорское антитело), такого как мышь, крыса, кролик или примат кроме человека, которые обладают требуемой специфичностью, аффинностью и антигенсвязывающей способностью. В некоторых случаях остатки остовной области (FR) иммуноглобулина человека заменяют соответствующими остатками, отличными от человеческих. Кроме того, гуманизированные антитела могут содержать остатки, отсутствующие в реципиентном антителе или донорском антителе. Указанные модификации выполняют для дальнейшего улучшения характеристик антитела. Как правило, гуманизированное антитело содержит по существу все вариабельные домены, за исключением по меньшей мере одного и обычно двух доменов, в которых все или по существу все гипервариабельные петли соответствуют петлям иммуноглобулина, отличного от человеческого, и все или по существу все остовные области имеют последовательность человеческого иммуноглобулина. Гуманизированное антитело также необязательно содержит по меньшей мере часть константной области (Fc) иммуноглобулина, обычно константной области иммуноглобулина человека. Для более полного ознакомления с гуманизированными антителами см. публикации Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992).
Термин “комплекс” или “комплексный” в использованном в настоящем описании значении означает ассоциацию двух или более молекул, взаимодействующих друг с другом благодаря наличию связей и/или сил (например, ван-дер-ваальсовых, гидрофобных, гидрофильных сил), которые не являются пептидными связями. В одном варианте осуществления изобретения указанный комплекс является гетеромультимерным. Следует отметить, что термин ”белковый комплекс” или ”полипептидный комплекс”, как используется в настоящем описании, означает комплексы, в которых небелковая молекула конъюгирована с белком с образованием белкового комплекса (которые, например, включают, не ограничиваясь ими, химические молекулы, такие как токсин или детектирующий агент).
Термин “гетеромультимер” или “гетеромультимерный” как используется в настоящем описании, означает два или более полипептидов, взаимодействующих друг с другом благодаря наличию непептидной ковалентной связи (например, дисульфидной связи) и/или нековалентного взаимодействия (например, при помощи водородных связей, ионных связей, ван-дер-ваальсовых сил и гидрофобных взаимодействий), при этом по меньшей мере две молекулы имеют разные последовательности.
Как используется в настоящем описании, термин “домен гетеромультимеризации” означает внесение изменений или добавлений в биологическую молекулу, стимулирующих образование гетеромультимера и препятствующих образованию гомомультимера. В объем настоящего изобретения входит любой домен гетеродимеризации, способствующий образованию гетеродимеров. Иллюстративные примеры включают, не ограничиваясь ими, например, заявку на патент США 20030078385 (Arathoon et al. - Genetech; описание метода соединения по типу ”выступ в углубление”); WO 2007147901 (Kjargaard et al. - Novo Nordisk; описание ионных взаимодействий); WO 2009089004 (Kannan et al. - Amgen; описание электростатический эффектов); WO 2010/034605 (Christensen et al. - Genentech; описание скрученных спиралей). См. также, например, публикации Pack, P. & Plueckthun, A., Biochemistry 31, 1579-1584 (1992), в которой описана лейциновая застежка-молния, или Pack et al., Bio/Technology 11, 1271-1277 (1993), в которой описан фрагмент “спираль-виток-спираль”. Термины “домен гетеромультимеризации” и “домен гетеродимеризации” имеют взаимозаменяемые значения. В определенных вариантах осуществления изобретения шарнирсодержащий полипептид содержит один или несколько доменов гетеродимеризации.
Как используется в настоящем описании, термин “иммуноадгезин” означает молекулы, сочетающие специфичность связывания гетерологичного белка (”адгезина”) с эффекторными функциями константных доменов иммуноглобулина. В структурном отношении иммуноадгезины представляют собой гибрид аминокислотной последовательности, обладающей требуемой специфичностью связывания, которая не является антигенузнающим и антигенсвязывающим центром антитела (то есть является “гетерологичной” по сравнению с константной областью антитела), с последовательностью константного домена иммуноглобулина (например, последовательность СН2 и/или СН3 иммуноглобулина IgG). Типичные последовательности адгезина включают смежные аминокислотные последовательности, которые содержат часть рецептора или лиганда, связывающуюся с представляющим интерес белком. Последовательности адгезина также могут быть последовательностями, связывающимися с представляющим интерес белком, а не с последовательностями рецептора или лиганда (например, последовательности адгезина в пептителах). Такие полипептидные последовательности могут быть выбраны или идентифицированы разными методами, включая методы отображения на фаге и высокопроизводительные методы сортировки. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, относящегося к подтипам IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включая IgA-1 и IgA-2), IgE, IgD или IgM.
Антитело по настоящему изобретению, “которое связывается” с представляющим интерес антигеном, является антителом, которое связывается с антигеном с достаточной степенью аффинности, благодаря чему указанное антитело может быть использовано в качестве диагностического и/или терапевтического средства, направленно воздействующего на белок, клетку или ткань, экспрессирующие данный антиген, и не взаимодействующего в значительной степени с другими белками. В таких вариантах осуществления изобретения степень связывания антитела с белком, не являющимся мишенью, составляет менее примерно 10% связывания антитела с конкретным белком-мишенью при определении методом сортировки клеток с возбуждением флуоресценции (FACS), радиоиммуноанализа (RIA) или ELISA. Применительно к связыванию антитела с молекулой-мишенью термин ”специфическое связывание”, ”специфически связывается” или “специфичный к” определенному полипептиду или эпитопу конкретного полипептида-мишени означает связывание, которое на измеряемом уровне отличается от неспецифического взаимодействия (например, неспецифическое взаимодействие может быть связыванием с бычьим сывороточным альбумином или казеином). Специфическое связывание может быть измерено, например, путем определения связывания молекулы в сравнении со связыванием контрольной молекулы. Например, специфическое связывание может быть определено путем конкурентного связывания с контрольной молекулой, аналогичной мишени, например, с избытком немеченой мишени. Специфическое связывание имеет место в том случае, если связывание меченой мишени с зондом полностью ингибируется избытком немеченой мишени. Термин ”специфическое связывание”, ”специфически связывается” или “специфичный к” определенному полипептиду или эпитопу конкретного полипептида-мишени в использованном в настоящем описании значении может относиться, например, к молекуле, имеющей значение Kd в отношении мишени, равное по меньшей мере примерно 200 нМ, альтернативно по меньшей мере примерно 150 нМ, альтернативно по меньшей мере примерно 100 нМ, альтернативно по меньшей мере примерно 60 нМ, альтернативно по меньшей мере примерно 50 нМ, альтернативно по меньшей мере примерно 40 нМ, альтернативно по меньшей мере примерно 30 нМ, альтернативно по меньшей мере примерно 20 нМ, альтернативно по меньшей мере примерно 10 нМ, альтернативно по меньшей мере примерно 8 нМ, альтернативно по меньшей мере примерно 6 нМ, альтернативно по меньшей мере примерно 4 нМ, альтернативно по меньшей мере примерно 2 нМ, альтернативно по меньшей мере примерно 1 нМ или больше. В одном варианте осуществления изобретения термин ”специфическое связывание” означает связывание, в соответствии с которым молекула связывается с конкретным полипептидом или эпитопом определенного полипептида, по существу не связываясь с любым другим полипептидом или эпитопом полипептида.
Термин “аффинность связывания”, как правило, означает силу суммарных нековалентных взаимодействий между одним связывающим сайтом молекулы (например, антитела) и его партнером связывания (например, антигеном). За исключением особо оговоренных случаев термин “аффинность связывания” в использованном в настоящем описании значении означает аффинностью связывания, отражающую взаимодействие в отношении 1:1 членов связывающейся пары (например, антитела и антигена). Аффинность молекулы Х к партнеру Y может быть выражена константой диссоциации (Kd). Например, значение Kd может быть равно примерно 200 нМ, 150 нМ, 100 нМ, 60 нМ, 50 нМ, 40 нМ, 30 нМ, 20 нМ, 10 нМ, 8 нМ, 6 нМ, 4 нМ, 2 нМ, 1 нМ или больше. Аффинность может быть измерена обычными способами, известными в данной области, включая способы, рассмотренные в настоящем описании изобретения. Низкоаффинные антитела обычно медленно связываются с антигеном и легко диссоциируют, в то время как высокоаффинные антитела обычно связываются с антигеном быстрее и остаются связанными в течение более длительного времени. В данной области известны разные методы измерения аффинности связывания, и любые из них могут быть использованы в соответствии с целями настоящего изобретения.
В одном из вариантов осуществления изобретения “Kd” или “значение Kd” измеряют методом резонанса поверхностных плазмонов в устройстве BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С на чипах с иммобилизованным антигеном СМ5 на уровне ~10 резонансных единиц (RU). Биосенсорные чипы из карбоксиметилированного декстрана (СМ5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разводят 10 мМ ацетата натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) и вводят со скоростью потока 5 мкл/минуту до достижения примерно 10 резонансных единиц (RU) связанного белка. После введения антигена вводят 1 М раствор этаноламина для блокирования непрореагировавших групп. Для измерения кинетических параметров вводят двукратные серийные титры Fab (например, от 0,78 нМ до 500 нМ) в РBS с 0,05% твина 20 (PBST) при 25°С со скоростью потока, равной примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляют, используя простую модель связывания “один к одному” Ленгмюра (программное обеспечение анализа BIAcore, версия 3.2), путем одновременного сопоставления сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляют в виде соотношения koff/kon. См., например, публикацию Chen et al., J. Mol. Biol. 293: 865-881 (1999). Если скорость ассоциации превышает 106 М-1 S-1 по результатам анализа методом резонанса поверхностных плазмонов, тогда скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерить увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) 20 нМ антитела против антигена (в виде Fab-фрагмента) в PBS, рН 7,2, при 25°С в присутствии возрастающих концентраций антигена, при выполнении измерения в спектрометре, таком как спектрометр, оснащенный устройством прерывания потока, (Aviv Instruments) или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic), оснащенный перемешиваемой кюветой.
”Скорость ассоциации” или “kon” по настоящему изобретению может быть также определена методом резонанса поверхностных плазмонов, описанным выше в связи с использованием устройства BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ), который выполняют при 25°С на чипах с иммобилизованным антигеном СМ5 на уровне ~10 резонансных единиц (RU). Биосенсорные чипы из карбоксиметилированного декстрана (СМ5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разводят 10 мМ ацетата натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) и вводят со скоростью потока 5 мкл/минуту до достижения примерно 10 резонансных единиц (RU) связанного белка. После введения антигена вводят 1 М раствор этаноламина для блокирования непрореагировавших групп. Для измерения кинетических параметров вводят двукратные серийные титры Fab (например, от 0,78 нМ до 500 нМ) в РBS с 0,05% твина 20 (PBST) при 25°С со скоростью потока, равной примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляют, используя простую модель связывания “один к одному” Ленгмюра (программное обеспечение анализа BIAcore, версия 3.2), путем одновременного сопоставления сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляют в виде соотношения koff/kon. См., например, публикацию Chen et al., J. Mol. Biol. 293:865-881 (1999). Однако, если скорость ассоциации превышает 106 М-1 S-1 по результатам вышеописанного анализа методом резонанса поверхностных плазмонов, тогда скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерить увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) 20 нМ антитела против антигена (в виде Fab-фрагмента) в PBS, рН 7,2, при 25°С в присутствии возрастающих концентраций антигена, при выполнении измерения в спектрометре, таком как спектрометр, оснащенный устройством прерывания потока, (Aviv Instruments) или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic), оснащенный перемешиваемой кюветой.
Термины “биологически активный”, “биологическая активность” и “биологические характеристики” применительно к полипептиду по настоящему изобретению, такому как антитело, его фрагмент или производное, означают способность связываться с биологической молекулой, за исключением особо оговоренных случаев.
Термин “пептитело” или “пептитела” означает гибрид произвольно созданных пептидов с Fc доменом. См. патент США № 6660843, выданный 9 декабря 2003 г. на имя Feige et al. (включен в настоящее описание изобретения в качестве ссылки в полном объеме). Пептитела включают один или несколько пептидов, связанных с N-концом, С-концом, боковыми цепями аминокислот или с несколькими указанными сайтами. Способ создания пептител позволяет получать терапевтические средства, включающие пептиды, направленно воздействующие на один или несколько лигандов или рецепторов, хоминг-пептидов опухоли, пептидов, проникающих через мембрану, и тому подобных. Технология создания пептител была признана пригодной для получения ряда таких молекул, включая линейные пептиды и пептиды, связанные дисульфидными связями, “тандемные пептидные мультимеры” (то есть наличие нескольких пептидов в одной цепи Fc домена). См., например, патент США № 6660843, заявку на патент США № 2003/0195156, опубликованную 16 октября 2003 г. (соответствующую заявке WO 02/092620, опубликованной 21 ноября 2002 г.), заявку на патент США № 2003/0176352, опубликованную 18 сентября 2003 г. (соответствующую заявке WO 03/031589, опубликованной 17 апреля 2003 г.), заявку на патент США № 09/422838, поданную 22 октября 1999 г. (соответствующую заявке WO 00/24770, опубликованной 4 мая 2000 г.), заявку на патент США № 2003/0229023, опубликованную 11 декабря 2003 г., WO 03/057134, опубликованную 17 июля 2003 г., заявку на патент США № 2003/0236193, опубликованную 25 декабря 2003 г. (соответствующую заявке РСТ/US04/010989, поданной 8 апреля 2004 г.), заявку на патент США № 10/666480, поданную 18 сентября 2003 г. (соответствующую заявке WO 04/026329, опубликованной 1 апреля 2004 г.), которые включены в настоящее описание изобретения в качестве ссылки в полном объеме.
Термин ”аффитела” или ”аффитело” означает белок, связанный пептидной связью с Fc областью, который использован в качестве остова для создания поверхности связывания для молекулы-мишени. Указанный белок часто является природным белком, таким как протеин А стафилококка, IgG-связывающий домен В, выделенный из него протеин Z (см. публикацию Nilsson et al. (1987), Prot. Eng. 1, 107-133 и патент США № 5143844), его фрагмент или производное. Например, аффитела могут быть созданы из вариантов протеинов Z с измененной аффинностью связывания к молекуле-мишени, в которых один сегмент протеина Z был мутирован путем неспецифического мутагенеза с целью создания библиотеки вариантов, способных связываться с молекулой-мишенью. Примеры аффител представлены в патенте США № 6534628, публикациях Nord K. et al., Prot. Eng. 8: 601-608 (1995) и Nord K. et al., Nat. Biotech. 15: 772-777 (1997), Biotechnol. Appl. Biochem. 2008, Jun; 50 (Pt 2): 97-112.
“Выделенный” гетеромультимер или комплекс является гетеромультимером или комплексом, отделенным и/или выделенным из компонента его естественного окружения в культуре клеток. Загрязняющими компонентами естественного окружения являются вещества, препятствующие диагностическому или терапевтическому использованию данного гетеромультимера, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления изобретения гетеромультимер должен быть очищен (1) более чем на 95 мас.% белка по результатам определения методом Лоури и, более предпочтительно, более чем на 99 мас.%, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности, при помощи секвенатора с центрифужной чашей или (3) до гомогенного состояния методом SDS-PAGE в восстановительных или невосстановительных условиях при окрашивании кумассии голубым или, предпочтительно, серебром.
Гетеромультимеры по настоящему изобретению обычно очищают до гомогенного состояния. Фразы ”по существу гомогенный”, “по существу гомогенная форма” или “значительная гомогенность” означают, что продукт по существу не содержит побочных продуктов, образовавшихся из нежелательных комбинаций полипептидов (например, гомомультимеров).
С точки зрения чистоты термин “значительная гомогенность” означает, что количество побочных продуктов не превышает 10 мас.%, 9 мас.%, 8 мас.%, 7 мас.%, 6 мас.%, 4 мас.%, 3 мас.%, 2 мас.% или 1 мас.% или составляет менее 1 мас.%. В одном из вариантов осуществления изобретения побочный продукт составляет менее 5%.
Термин “биологическая молекула” означает нуклеиновую кислоту, белок, углевод, липид и их комбинации. В одном варианте осуществления изобретения биологическая молекула существует в природе.
Термин “выделенный”, использованный для описания разных антител по настоящему изобретению, означает антитело, которое было идентифицировано и отделено и/или выделено из клетки или культуры клеток, в которой данное антитело было экспрессировано. Загрязняющие компоненты естественного окружения являются веществами, которые обычно препятствуют диагностическому или терапевтическому применению полипептида, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления изобретения антитело должно быть очищено (1) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности, при помощи секвенатора с центрифужной чашей или (2) до гомогенного состояния методом SDS-PAGE в невосстановительных или восстановительных условиях при окрашивании кумассии голубым или, предпочтительно, серебром. Выделенное антитело включает антитела in situ в рекомбинантных клетках, так как отсутствует по меньшей мере один компонент естественного окружения полипептида. Однако выделенный полипептид обычно получают при выполнении по меньшей мере одной стадии очистки.
Термин “связанный” или “связывает”, как используется в настоящем описании, означает прямую пептидную связь между первой и второй аминокислотной последовательностью или связь, включающую третью аминокислотную последовательность, которая представляет собой пептид, присоединенный к первой и второй аминокислотным последовательностям или между указанными последовательностями. Например, линкерный пептид, присоединенный к С-концу одной аминокислотной последовательности и N-концу другой аминокислотной последовательности.
Термин “линкер”, как используется в настоящем описании, означает аминокислотную последовательность, состоящую из двух или более аминокислот. Линкер может состоять из нейтральных полярных или неполярных аминокислот. Линкер может иметь длину, равную, например, 2-100 аминокислотам, в частности, 2-50 аминокислотам, например, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислотам. Линкер может быть ”расщепляемым”, например, авторасщепляемым или расщепляемым ферментами или химическими веществами. Сайты расщепления в аминокислотных последовательностях, а также ферменты и химические вещества, расщепляющие последовательности на таких сайтах, хорошо известны в данной области и рассмотрены в настоящем описании изобретения.
Термин “связующее звено”, как используется в настоящем описании, означает аминокислотный линкер, который соединяет две другие аминокислотные последовательности. Связующее звено по настоящему изобретению может соединять N-конец вариабельного домена тяжелой цепи иммуноглобулина с С-концом константного домена легкой цепи иммуноглобулина. В конкретных вариантах осуществления изобретения связующее звено состоит из 15-50 аминокислот, например, из 20-26 аминокислот (например, 20, 21, 22, 23, 24, 25 или 26 аминокислот). Связующее звено может быть ”расщепляемым”, например, авторасщепляемым или расщепляемым ферментами или химическими веществами при помощи стандартных методов и реагентов, используемых в данной области. В определенных конкретных вариантах осуществления изобретения связующее звено содержит повторы Gly-Gly-Ser.
Ферментативное расщепление ”линкера” или “связующего звена” может включать использование эндопептидазы, такой как, например, Lys-C, Asp-N, Arg-C, V8, Glu-C, химотрипсина, трипсина, пепсина, папаина, тромбина, гененазы, фактора Ха, TEV (цистеинпротеазы вируса гравировки табака), энтерокиназы, HRV C3 (С3-протеазы риновируса человека), кининогеназы, а также субтилизинподобных конвертаз пропротеина (например, фурина (РС1), РС2 или РС3) или двухосновной конвертазы N-аргинина. Химическое расщепление может включать использование, например, гидроксиамина, N-хлорсукцинимида, N-бромсукцинимида или бромида цианогена.
“Сайт расщепления эндопептидазой Lys-C”, как используется в настоящем описании, означает остаток лизина в аминокислотной последовательности, который может быть расщеплен у С-конца эндопептидазой Lys-C. Эндопептидаза Lys-C расщепляет С-конец остатка лизина. В определенных вариантах осуществления изобретения половинное антитело дополнительно содержит мутацию К222А в шарнирной области для удаления эндогенного сайта расщепления эндопептидазой Lys-C с целью сохранения структуры половинного антитела или собранного биспецифического антитела при расщеплении связующего звена эндопептидазой Lys-C.
“Шарнирная область” обычно расположена от Glu216 до Pro230 IgG1 человека (Burton, Molec. Immunol. 22: 161-206 (1985)). Шарнирные области других изотипов IgG могут быть сравнены с последовательностью IgG1 путем введения в аналогичные положения первого и последнего остатков цистеина, образующих связи S-S между тяжелыми цепями.
“Нижняя шарнирная область” Fc-области обычно определяется в виде фрагмента остатков от С-конца до шарнирной области, то есть в виде остатков 233-239 Fc-области. До настоящего изобретения связывание FcγR обычно приписывалось аминокислотным остаткам в нижней шарнирной области Fc-области IgG.
“СН2 домен” Fc-области IgG человека обычно расположен примерно в положении остатков 231-340 IgG. СН2 домен является уникальным в том отношении, что он не спаривается непосредственно с другим доменом. Наоборот между двумя СН2 доменами интактной нативной молекулы IgG расположены две N-связанные разветвленные углеводные цепи. Предполагается, что углевод может заменять спаривание двух доменов и помогать стабилизировать СН2 домен. Burton, Molec. Immunol. 22:161-206 (1985).
“СН3 домен” содержит фрагмент остатков от С-конца до СН2 домена в Fc-области (то есть примерно от аминокислотного остатка 341 до аминокислотного остатка 447 IgG).
Термин “Fc-область”, как используется в настоящем описании, означает С-концевую область тяжелой цепи иммуноглобулина, включающую Fc области и вариантные Fc-области нативной последовательности. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут изменяться, Fc-область тяжелой цепи IgG человека обычно определяется фрагментом от аминокислотного остатка в положении Cys226 или Pro230 до карбоксильного конца. С-концевой лизин (остаток 447 по системе нумерации EU) Fc-области может быть удален, например, во время продуцирования или очистки антитела или путем создания методами рекомбинантных ДНК нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Таким образом, интактные антитела могут содержать популяции антител с удаленными остатками К447, популяции антител, в которых остатки К447 не удалены, и популяции антител, состоящие из смеси антител с остатком К447 и без указанного остатка.
“Функциональная Fc-область” обладает “эффекторной функцией” Fc-области нативной последовательности. Типичные ”эффекторные функции” включают связывание С1q, CDC, связывание Fc-рецептора, ADCC, фагоцитоз, уменьшение числа рецепторов на поверхности клетки (например, В-клеточного рецептора, BCR) и т.д. Такие эффекторные функции обычно необходимы для объединения Fc области со связывающим доменом (например, с вариабельным доменом антитела) и могут быть оценены при помощи разных анализов, рассмотренных в настоящем описании изобретения.
“Fc-область нативной последовательности” содержит аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, встречающейся в природе. Fc-области нативной последовательности человека включают Fc область нативной последовательности IgG1 человека (аллотипы не-А и А), Fc-область нативной последовательности IgG2 человека, Fc-область нативной последовательности IgG3 человека и Fc-область нативной последовательности IgG4 человека, а также их природные варианты.
“Вариантная Fc-область” содержит аминокислотную последовательность, отличающуюся от Fc-области нативной последовательности заменой по меньшей мере одной аминокислоты, предпочтительно, заменой одной или нескольких аминокислот. Вариантная Fc область, предпочтительно, имеет по меньшей мере одну замену аминокислоты по сравнению с Fc-областью нативной последовательности или с Fc-областью исходного полипептида, например, от около одной до около десяти замен аминокислот и, предпочтительно, от около одной до около пяти замен аминокислот в Fc-области нативной последовательности или в Fc области исходного полипептида. Вариантная Fc-область по настоящему изобретению, предпочтительно, по меньшей мере примерно на 80% гомологична Fc области нативной последовательности и/или Fc-области исходного полипептида, более предпочтительно, гомологична по меньшей мере примерно на 90% и, наиболее предпочтительно, гомологична по меньшей мере примерно на 95%.
Термин “Fc-комплекс”, как используется в настоящем описании, означает два СН2 домена Fc-области, взаимодействующие друг с другом, и/или два СН3 домена Fc-области, взаимодействующие друг с другом, при этом СН2 домены и/или СН3 домены взаимодействуют благодаря наличию связей и/или сил (например, ван-дер-ваальсовых, гидрофобных, гидрофильных сил), которые не являются пептидными связями.
Термин “Fc компонент”, как используется в настоящем описании, означает шарнирную область, СН2 домен или СН3 домен Fc области.
Термин “Fc компонент константного домена тяжелой цепи” или “FcCH”, как используется в настоящем описании, означает полипептид, содержащий СН2 домен, СН3 домен или СН2 и СН3 домены Fc-области.
“Эффекторные функции” антитела представляют собой биологические активности, приписываемые Fc-области (Fc-области нативной последовательности или вариантной Fc-области аминокислотной последовательности) антитела, которые могут изменяться в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание С1q и комплементзависимую цитотоксичность, связывание Fc-рецептора, антителозависимую клеточно-опосредованную цитотоксичность (ADCC), фагоцитоз, уменьшение числа рецепторов на поверхности клетки (например, В-клеточных рецепторов) и активацию В-клеток.
В настоящем изобретении ”восстановительные условия” определяются на основании окислительно-восстановительного потенциала реакционной смеси (например, смеси для сборки белка), который является отрицательным (-). Окислительно-восстановительный потенциал реакционной смеси в восстановительных условиях, предпочтительно, составляет от около -50 до -600 мВ, от -100 до -600 мВ, от -200 до -600 мВ, от -100 до -500 мВ, от -150 до -300 мВ, более предпочтительно, от около -300 до -500 мВ, наиболее предпочтительно, около -400 мВ.
Требуемые восстановительные условия могут быть созданы любыми приемлемыми методами. Например, требуемые восстановительные условия могут быть созданы путем добавления в реакционную смесь (такую как смесь для сборки белка по настоящему изобретению) восстановителя/восстанавливающего агента. Приемлемые восстановители включают, не ограничиваясь ими, дитиотреит (DTT), трис(2-карбоксиэтил)фосфин (ТСЕР), тиогликолевую кислоту, аскорбиновую кислоту, тиолуксусную кислоту, глутатион (GSH), бета-меркаптоэтиламин, цистеин/цистин, GSH/дисульфид глутатиона (GSSG), цистеамин/цистамин, глицилцистеин и бета-меркаптоэтанол, предпочтительно, GSH. В определенных конкретных вариантах осуществления изобретения восстановитель является слабым восстановителем, который включает, не ограничиваясь ими, GSH, бета-меркаптоэтиламин, цистеин/цистин, GSH/GSSG, цистеамин/цистамин, глицилцистеин и бета-меркаптоэтанол, предпочтительно, GSH. В определенных предпочтительных вариантах осуществления изобретения восстановитель является GSH. Специалист в данной области обладает необходимыми знаниями, позволяющими выбрать приемлемые восстановители в требуемых концентрациях и в приемлемых экспериментальных условиях для создания в реакционной смеси требуемых восстановительных условий. Например, введение 10 мМ восстановленного L-глутатиона в раствор с концентрацией белка биспецифического антитела, равной 10 г/л, при 20°С обеспечивает исходный окислительно-восстановительный потенциал около -400 мВ. Специалист в данной области может использовать любые методы для измерения окислительно-восстановительного потенциала в данной реакционной смеси.
Восстановительные условия реакционной смеси могут быть определены и измерены любыми приемлемыми методами, известными в данной области. Например, восстановительные условия могут быть измерены при помощи резазуринового индикатора (который из синего становится бесцветным в восстановительных условиях). Более точное измерение может быть произведено с помощью измерителя окислительно-восстановительного потенциала (такого как электрод ORP компании Broadley James®).
Альтернативно восстановительные условия могут быть созданы в результате удаления растворенных газов, в частности, растворенного кислорода, при пониженном давлении, равном примерно 10 мм Hg или меньше, предпочтительно, примерно 5 мм Hg или меньше, более предпочтительно, примерно 3 мм Hg или меньше, в течение примерно 1-60 минут, предпочтительно, примерно 5-40 минут.
В настоящем изобретении желательно, чтобы восстановительные условия были созданы сразу же после смешивания первого и второго шарнирсодержащих полипептидов (таких как половинные антитела) и сохранены на протяжении всей стадии сборки. В определенных вариантах осуществления изобретения реакционная смесь или смесь для сборки белка находится в восстановительных условиях, предпочтительно, в течение примерно 50% или более, более предпочтительно, в течение примерно 70% или более, еще предпочтительнее в течение примерно 90% или более времени реакции. Особенно предпочтительно, чтобы окислительно-восстановительный потенциал реакционной среды поддерживался на уровне от около -200 до -600 мВ, более предпочтительно, от -300 до -500 мВ, наиболее предпочтительно, около -400 мВ, в течение примерно 50% или более, более предпочтительно, в течение примерно 70% или более, еще предпочтительнее в течение примерно 90% или более времени реакции.
В определенных конкретных вариантах осуществления изобретения восстановительные условия являются слабыми восстановительными условиями. Термин “слабый восстановитель” или “слабые восстановительные условия”, как используется в настоящем описании, означает восстановитель или восстановительные условия, созданные восстановителем с отрицательным окислительным потенциалом при 25°С. Окислительный потенциал восстановителя, предпочтительно, составляет от -50 до -600 мВ, от -100 до -600 мВ, от -200 до -600 мВ, от -100 до -500 мВ, от -150 до -300 мВ, более предпочтительно, от около -300 до -500 мВ, наиболее предпочтительно, около -400 мВ, когда значение рН равно 7-9 и температура находится в интервале от 15°С до 39°С. Специалист в данной области обладает необходимыми знаниями, позволяющими выбрать приемлемые восстановители для создания требуемых восстановительных условиях. Квалифицированному исследователю должно быть известно, что сильный восстановитель, то есть восстановитель с большим отрицательным окислительным потенциалом, чем у вышеуказанных восстановителей, при аналогичной концентрации, значении рН и температуре может быть использован в более низкой концентрации. В предпочтительном варианте осуществления изобретения белки могут образовывать дисульфидные связи в присутствии восстановителя при инкубации в вышеуказанных условиях. Примеры слабых восстановителей включают, не ограничиваясь ими, глутатион, бета-меркаптоэтиламин, цистин/цистеин, GSH/GSSG, цистеамин/цистамин, глицилцистеин и бета-меркаптоэтанол. В определенных вариантах осуществления изобретения в качестве эталона для слабых восстановительных условий может быть использован окислительный потенциал, аналогичный 200-кратному молярному соотношению GSH:антитела, при котором может быть произведена эффективная сборка с использованием других восстановителей.
“Смесь для сборки белка” представляет собой раствор, содержащий первый шарнирсодержащий полипептид и второй шарнирсодержащий полипептид. В определенных вариантах осуществления изобретения смесь для сборки белка находится в восстановительных условиях. В некоторых вариантах осуществления изобретения смесь для сборки белка находится в слабых восстановительных условиях. В других определенных вариантах осуществления изобретения смесь для сборки белка дополнительно содержит слабый восстановитель. Окислительный потенциал смеси для сборки белка составляет от -50 до -600 мВ, от -100 до -600 мВ, от -200 до -600 мВ, от -100 до -500 мВ, от -150 до -300 мВ, более предпочтительно, от около -300 до -500 мВ, наиболее предпочтительно, около -400 мВ, когда значение рН равно 7-9 и температура находится в интервале от 15°С до 39°С.
Коммерчески доступные реагенты, указанные в разделе ”Примеры”, были использованы в соответствии с инструкциями производителей за исключением особо оговоренных случаев. Клетки, указанные в нижеследующих примерах и в описании изобретения под номерами доступа АТСС, представлены в Американской коллекции типовых культур, Manassas, VA. За исключением особо оговоренных случаев в настоящем изобретении использованы стандартные методы рекомбинантных ДНК, аналогичные описанным выше и в следующих публикациях: Sambrook et al., supra; Ausubel et al., Current Protocols in Molecular Biology (Green Publishing Associates and Wiley Interscience, NY, 1989); Innis et al., PCR Protocols: A Guide to Methods and Applications (Academic Press, Inc., NY, 1990); Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Press, Cold Spring Harbor, 1988); Gait, Oligonucleotide Synthesis (IRL Press, Oxford, 1984); Freshney, Animal Cell Culture, 1987; Coligan et al., Current Protocols in Immunology, 1991.
В настоящем описании изобретения и формуле изобретения слово “содержать” или его грамматические формы “содержит” или “содержащий” означают, что данное определение предполагает включение указанного целого числа или группы целых чисел и не исключает любое другое целое число или группу целых чисел.
II. Создание гетеромультимерных белков
Гетеромультимерные белки по настоящему изобретению обычно содержат значительную часть Fc области антитела. Однако в соответствии с другими объектами изобретения тяжелая цепь содержит только часть СН1, СН2 и/или СН3 доменов.
Домены гетеромультимеризации
Гетеромультимерные белки содержат домен гетеромультимеризации. Для получения по существу гомогенной популяции гетеродимерных молекул домен гетеродимеризации должен, предпочтительно, стимулировать образование гетеродимеров по сравнению с гомодимерами. Хотя гетеромультимерные белки по настоящему изобретению получают методом “выступ в углубление” для облегчения гетеромультимеризации, специалистам в данной области должны быть известны другие домены гетеромультимеризации, подходящие для использования в настоящем изобретении.
Метод “выступ в углубление”
Метод “выступ в углубление” в качестве метода создания мультиспецифических антител хорошо известен в данной области. См. патент США № 5731168, выданный 24 марта 1998 г. компании Genentech, публикацию заявки РСТ № WO2009089004 от 16 июля 2009 г. компании Amgen и публикацию патента США № 20090182127 от 16 июля 2009 г. компании Novo Nordisk A/S. См. также публикации Marvin and Zhu, Acta Pharmacologica Sincia (2005) 26(6): 649-658 и Kontermann (2005) Acta Pharmacol. Sin., 26: 1-9. В настоящем описании изобретения приведено краткое описание данного метода.
“Выступ” представляет собой по меньшей мере одну боковую цепь аминокислоты, которая выступает из области контакта первого полипептида и может быть размещена в компенсирующей полости смежной области контакта (то есть в области контакта второго полипептида), что стабилизирует гетеромультимер и способствует образованию гетеромультимеров по сравнению с образованием гомомультимеров. Выступ может существовать в исходной области контакта или может быть создан искусственным путем (например, путем изменения нуклеиновой кислоты, кодирующей указанную область контакта). Нуклеиновую кислоту, кодирующую область контакта первого полипептида, изменяют с возможностью кодирования указанного выступа. С указанной целью нуклеиновую кислоту, кодирующую по меньшей мере один ”исходный” аминокислотный остаток в области контакта первого полипептида, заменяют нуклеиновой кислотой, кодирующей по меньшей мере один ”импортный” аминокислотный остаток, в котором боковая цепь имеет большую длину по сравнению с исходным аминокислотным остатком. Следует отметить, что может быть использовано несколько исходных и соответствующих импортных остатков. Верхний предел числа заменяемых исходных остатков равен общему числу остатков в области контакта первого полипептида. Длины боковых цепей разных аминокислотных остатков показаны в нижеследующей таблице.
Свойства аминокислотных остатков
b Приведенные значения взяты из публикации A.A. Zamyatnin, Prog. Biophys. Mol. Biol. 24:107-123, 1972.
с Приведенные значения взяты из публикации C. Chotia, J. Mol. Biol. 105:1-14, 1975. Доступная площадь поверхности представлена на фигурах 6-20 указанной публикации.
Предпочтительные импортные остатки, используемые для образования выступа, обычно являются природными аминокислотными остатками, которые, предпочтительно, выбирают из аргинина (R), фенилаланина (F), тирозина (Y) и триптофана (W). Наиболее предпочтительными остатками являются триптофан и тирозин. В одном варианте осуществления изобретения исходный остаток, используемый для образования выступа, имеет боковую цепь небольшой длины и представляет собой аланин, аспарагин, аспарагиновую кислоту, глицин, серин, треонин или валин. Типичные замены аминокислот в СН3 домене, выполняемые для образования выступа, включают, не ограничиваясь ими, замену Т366W.
Термин ”полость” означает по меньшей мере одну боковую цепь аминокислоты, расположенную в области контакта второго полипептида, в которую входит соответствующий выступ в смежной области контакта первого полипептида. Указанная полость может существовать в исходной области контакта или может быть создана искусственным путем (например, путем изменения нуклеиновой кислоты, кодирующей область контакта). Нуклеиновую кислоту, кодирующую область контакта второго полипептида, обычно изменяют с возможностью кодирования полости. С указанной целью нуклеиновую кислоту, кодирующую по меньшей мере один ”исходный” аминокислотный остаток в области контакта второго полипептида заменяют ДНК, кодирующей по меньшей мере один ”импортный” аминокислотный остаток, имеющий боковую цепь меньшей длины по сравнению с исходным аминокислотным остатком. Следует отметить, что может быть использовано несколько исходных и соответствующих импортных остатков. Верхний предел числа заменяемых исходных остатков равен общему числу остатков в области контакта второго полипептида. Длины боковых цепей разных аминокислотных остатков показаны в приведенной выше таблице 1. Предпочтительные импортные остатки, используемые для образования полости, обычно являются природными аминокислотными остатками, которые, предпочтительно, выбирают из аланина (А), серина (S), треонина (Т) и валина (V). Наиболее предпочтительными остатками являются серин, аланин или треонин. В одном варианте осуществления изобретения исходный остаток, используемый для образования полости, имеет боковую цепь большой длины и представляет собой тирозин, аргинин, фенилаланин или триптофан. Типичные замены аминокислот в СН3 домене, выполняемые с целью создания полости, включают, не ограничиваясь ими, замены T366S, L368A, V407A, Y407T и Y407V. В определенных вариантах осуществления изобретения половинное антитело с выступом включает замену Т366W и половинное антитело с углублением включает замены T366S/L368A/Y407V.
“Исходный” аминокислотный остаток является остатком, заменяемым ”импортным” остатком, который может иметь боковую цепь меньшей или большей длины по сравнению с исходным остатком. Импортный аминокислотный остаток может быть природным или неприродным аминокислотным остатком, но предпочтительно является природным аминокислотным остатком. “Природными” аминокислотными остатками являются остатки, кодированные генетическим кодом и приведенные в таблице 1. “Неприродным” аминокислотным остатком является остаток, не кодированный генетическим кодом, но способный ковалентно связываться со смежным аминокислотным остатком в полипептидной цепи. Примерами неприродных аминокислотных остатков являются норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, например, приведенные в публикации Ellman et al., Meth. Enzym. 202: 301-336 (1991). Такие неприродные аминокислотные остатки могут быть созданы методами, описанными в публикациях Noren et al., Science 244: 182 (1989) и Ellman et al., см. выше. В кратком изложении указанный метод включает химическую активацию супрессорной тРНК с неприродным аминокислотным остатком с последующим выполнением транскрипции и трансляции указанной РНК in vitro. Метод по настоящему изобретению включает замену по меньшей мере одного исходного аминокислотного остатка, но могут быть заменены несколько исходных остатков. В области контакта первого или второго полипептида могут быть заменены все исходные аминокислотные остатки. Заменяемые исходные остатки обычно являются ”погруженными” остатками. ”Погруженный” остаток является остатком, по существу недоступным для растворителя. Импортный остаток не является цистеином для предотвращения возможного окисления и ошибочного спаривания дисульфидных связей.
Выступ пригоден для введения в полость, если пространственная локализация выступа и полости в области контакта соответственно первого полипептида и второго полипептида и размеры выступа и полости позволяют ввести выступ в полость, не мешая в значительной степени нормальной ассоциации первого и второго полипептидов в области контакта. Так как выступы, такие как Tyr, Phe и Trр, обычно расположены не перпендикулярно оси области контакта и имеют предпочтительные конформации, то совмещение выступа с соответствующей полостью моделируют в виде пары выступа/полости на основе трехмерной структуры при помощи рентгеновской кристаллографии или ядерного магнитного резонанса (ЯМР). Подобное моделирование может быть выполнено методами, широко применяемыми в данной области.
Термин ”исходная или матричная нуклеиновая кислота” означает нуклеиновую кислоту, кодирующую представляющий интерес полипептид, который может быть ”изменен” (то есть генетически создан или мутирован) с возможностью кодирования выступа или полости. Исходная нуклеиновая кислота может быть природной нуклеиновой кислотой или может включать нуклеиновую кислоту, которая была предварительно изменена (например, фрагмент гуманизированного антитела). Термин ”изменение” нуклеиновой кислоты означает, что исходная нуклеиновая кислота мутирована путем инсерции, делеции или замены по меньшей мере одного кодона, кодирующего представляющий интерес аминокислотный остаток. Кодон, кодирующий исходный остаток, обычно заменяют кодоном, кодирующим импортный остаток. Методы генетической модификации ДНК рассмотрены в публикации Mutagenesis: a Practical Approach, M.J. McPherson, Ed., (IRL Press, Oxford, UK. (1991) и включают, например, сайтнаправленный мутагенез, кластерный мутагенез и мутагенез при помощи полимеразной цепной реакции (ПЦР). В результате мутации исходной/матричной нуклеиновой кислоты соответствующим образом изменяется исходный/матричный полипептид, кодированный исходной/матричной нуклеиновой кислотой.
Выступ или полость могут быть “образованы” в области контакта первого или второго полипептида искусственно, например, методами рекомбинантных ДНК, методами синтеза пептидов in vitro, ранее описанными методами введения неприродных аминокислотных остатков, методами ферментативного или химического связывания пептидов или какой-либо комбинацией указанных методов. Таким образом, образованный выступ или полость является “неприродным” или “ненативным”, то есть несуществующим в природе или в исходном полипептиде (например, гуманизированное моноклональное антитело).
Импортный аминокислотный остаток, используемый для образования выступа, имеет относительно небольшое число ”ротамеров” (например, примерно 3-6). “Ротамер” является энергетически благоприятной конформацией боковой цепи аминокислоты. Число ротамеров разных аминокислотных остатков указано в публикации Ponders and Richards, J. Nol. Biol. 193: 775-791 (1987).
III. Векторы, клетки-хозяева и методы рекомбинантных ДНК
Для рекомбинантного продуцирования гетеромультимерного белка (например, биспецифического антитела) по настоящему изобретению кодирующую нуклеиновую кислоту выделяют и вводят в реплицирующий вектор для последующего клонирования (амплификации ДНК) или экспрессии. ДНК, кодирующую антитело, легко выделяют и секвенируют стандартными методами (например, используя олигонуклеотидные зонды, способные специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Существует много векторов. Выбор вектора частично зависит от используемой клетки-хозяина. Предпочтительными клетками-хозяевами являются прокариотические или эукариотические клетки (обычно клетки млекопитающих, а также грибные клетки (например, дрожжевые клетки), клетки насекомых, растительные клетки и ядросодержащие клетки из других многоклеточных организмов). Следует отметить, что для указанной цели могут быть использованы константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, которые могут быть получены у любого человека или вида животного. В определенных вариантах осуществления изобретения константную область получают из IgG, в частности, из IgG1, IgG2 или IgG4.
Клетку-хозяина создают с возможностью экспрессии шарнирсодержащего полипептида, содержащего домен гетеродимеризации, при этом указанная клетка-хозяин не экспрессирует шарнирсодержащий полипептид, содержащий второй домен гетеродимеризации.
а. Создание гетеромультимерных белков с использованием прокариотических клеток-хозяев
i. Создание вектора
Полинуклеотидные последовательности, кодирующие полипептидные компоненты гетеромультимерных белков (например, антитела) по настоящему изобретению, могут быть получены при помощи стандартных методов рекомбинантных ДНК. Требуемые полинуклеотидные последовательности могут быть выделены и секвенированы из антителопродуцирующих клеток, таких как клетки гибридом. Альтернативно полинуклеотиды могут быть синтезированы в синтезаторе нуклеотидов или методами ПЦР. Полученные последовательности, кодирующие полипептиды, вводят в рекомбинантный вектор, способный реплицировать и экспрессировать гетерологичные полинуклеотиды в прокариотических клетках-хозяевах. В соответствии с целями настоящего изобретения могут быть использованы многие существующие векторы, известные в данной области. Выбор соответствующего вектора зависит главным образом от размера нуклеиновых кислот, вводимых в вектор, и конкретной клетки-хозяина, трансформируемой вектором. Каждый вектор содержит разные компоненты в зависимости от выполняемой им функции (амплификация или экспрессия гетерологичного полинуклеотида или обе функции) и совместимости с конкретной клеткой-хозяином. Компоненты вектора обычно включают, не ограничиваясь ими, ориджин репликации, селектируемый ген-маркер, промотор, сайт связывания рибосомы (RBS), сигнальную последовательность, вставку гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
В указанных клетках-хозяевах, как правило, используются плазмидные векторы, содержащие репликон и регуляторные последовательности, выделенные из вида, совместимого с клеткой-хозяином. Вектор обычно содержит сайт репликации, а также маркерные последовательности, способные производить фенотипический отбор в трансформированных клетках. Например, E.coli обычно трансформируют плазмидой pBR322, выделенной из вида E.coli. Плазмида pBR322 содержит гены, кодирующие устойчивость к ампициллину (Amp) и тетрациклину (Tet), благодаря чему можно легко идентифицировать трансформированные клетки. Плазмида pBR322, ее производные или другие микробные плазмиды или бактериофаги могут также содержать промоторы или могут быть модифицированы с возможностью содержания промоторов, которые могут быть использованы микробным организмом для экспрессии эндогенных белков. Производные плазмиды pBR322, используемые для экспрессии конкретных антител, подробно описаны в публикации Carter et al., патент США № 5648237.
Кроме того, в качестве векторов, трансформирующих указанные клетки-хозяева, могут быть использованы фаговые векторы, содержащие репликон и регуляторные последовательности, совместимые с микроорганизмом-хозяином. Например, бактериофаг, такой как λGEM.TM.-11, может быть использован для создания рекомбинантного вектора, предназначенного для трансформации приемлемых клеток-хозяев, таких как E.coli LE392.
Вектор экспрессии по настоящему изобретению может содержать две или большее число пар промотор-цистрон, кодирующих компоненты полипептида. Промотор является нетранслируемой регуляторной последовательностью, расположенной вверху (5') от цистрона, модулирующего его экспрессию. Прокариотические промоторы обычно делятся на два класса: индуцибельные и конститутивные. Индуцибельный промотор является промотором, инициирующим повышенную транскрипцию цистрона под своим контролем в ответ на изменение состояния культуры, например, наличие или отсутствие питательного вещества или изменение температуры.
Известно большое число промоторов, распознаваемых разными потенциальными клетками-хозяевами. Выбранный промотор может быть функционально связан с ДНК цистрона, кодирующей, например, легкую или тяжелую цепь, путем удаления промотора из исходной ДНК в результате расщепления рестрикционным ферментом и введения выделенной промоторной последовательности в вектор по настоящему изобретению. Для управления амплификацией и/или экспрессией генов-мишеней могут быть использованы нативные промоторные последовательности и многие гетерологичные промоторы. В некоторых вариантах осуществления изобретения использованы гетерологичные промоторы, так как такие промоторы обычно обеспечивают большую транскрипцию и более высокий выход экспрессированного гена-мишени по сравнению с нативным промотором полипептида-мишени.
Промоторы, подходящие для использования в прокариотических клетках-хозяевах, включают промотор PhoA, системы промоторов β-галактамазы и лактозы, систему промоторов триптофана (trp) и гибридные промоторы, такие как tac или trc промотор. Однако могут быть использованы другие промоторы, функционирующие в бактериальных клетках (например, другие известные бактериальные или фаговые промоторы). Нуклеотидные последовательности указанных промоторов опубликованы в научной литературе, поэтому квалифицированный специалист может функционально лигировать такие промоторы в цистроны, кодирующие гены гетеромультимерного белка, например, легкие и тяжелые цепи-мишени (Siebenlist et al., (1980) Cell 20: 269), используя линкеры или адапторы для введения любых требуемых сайтов рестрикции.
В соответствии с одним объектом изобретения такой цистрон в рекомбинантном векторе содержит сигнальную последовательность секреции, которая управляет перемещением экспрессированных полипептидов через мембрану. Как правило, сигнальная последовательность может быть компонентом вектора или может быть частью ДНК полипептида-мишени, введенной в вектор. Сигнальная последовательность, выбираемая в соответствии с целями настоящего изобретения, должна быть распознана и процессирована (то есть расщеплена сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не узнают и не процессируют сигнальные последовательности гетерологичных полипептидов, нативную сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбираемой, например, из группы, состоящей из щелочной фосфатазы, пенициллиназы, lpp или лидерных последовательностей теплостойкого энтеротоксина II (STII), LamB, PhoЕ, PelB, OmpA и МВР. В одном варианте осуществления изобретения сигнальные последовательности, используемые в обоих цистронах экспрессирующей системы, являются сигнальными последовательностями STII или их вариантами.
В соответствии с другим объектом изобретения иммуноглобулины по настоящему изобретению могут быть продуцированы в цитоплазме клетки-хозяина и поэтому не требуют наличия сигнальных последовательностей секреции в каждом цистроне. Поэтому легкие и тяжелые цепи иммуноглобулина экспрессируют, укладывают и собирают с образованием функциональных иммуноглобулинов в цитоплазме. Цитоплазма определенных штаммов-хозяев (например, штаммы E.coli trxB-) является благоприятной для образования дисульфидных связей, что позволяет производить правильную укладку и сборку экспрессированных субъединиц белка. См. публикацию Proba and Pluckthun Gene, 159: 203 (1995).
Прокариотические клетки-хозяева, пригодные для экспрессии гетеромультимерных белков (например, антител) по настоящему изобретению, включают Archaebacteria и Eubacteria, такие как грамотрицательные или грамположительные организмы. Примеры приемлемых бактерий включают Escherichia (например, E.coli), Bacilli (например, B. subtilis), Enterobacteria, Pseudomonas species (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном варианте осуществления изобретения использованы грамотрицательные клетки. В одном варианте осeществления изобретения в качестве клеток-хозяев по настоящему изобретению использованы клетки E.coli. Примеры штаммов E.coli включают штамм W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, D.C.: American Society for Microbiology, 1987), pp. 1190-1219; депозит АТСС № 27325) и его производные, в том числе штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA) ptr3 lac lq lacL8 ΔompTΔ(nmpc-fepE) degP41 kanR (патент США № 5639635). Также могут быть использованы другие штаммы и их производные, такие как E.coli 294 (АТСС 31446), E.coli B, E.coliλ 1776 (АТСС 31537) и E.coli RV308 (АТСС 31608). В одном варианте осуществления изобретения особенно пригодным является штамм E.coli Δlpp. Приведенные примеры являются иллюстративными и не ограничивают объем изобретения. Методы создания производных вышеуказанных бактерий, имеющих указанные генотипы, известные в данной области и описаны, например, в публикации Bass et al., Proteins, 8: 309-314 (1990). При выборе соответствующих бактерий обычно необходимо учитывать возможность репликации репликона в клетках бактерии. Например, E.coli, Serratia или Salmonella могут быть использованы в качестве хозяев, когда репликон предоставляют такие хорошо известные плазмиды как pBR322, pBR325, pACYC177 или pKN410. Обычно клетка-хозяин должна секретировать минимальные количества протеолитических ферментов, поэтому в культуру клеток могут быть введены дополнительные ингибиторы протеазы.
ii. Продуцирование полипептидов
Клетки-хозяева трансформируют вышеуказанными векторами экспрессии и культивируют в стандартных питательных средах, модифицированных соответствующим образом для индуцирования промоторов, отбора трансформантов и амплификации генов, кодирующих требуемые последовательности.
Трансформация предполагает введение ДНК в прокариотическую клетку-хозяина с возможностью репликации ДНК в виде внехромосомного элемента или элемента, встроенного в хромосому. В зависимости от используемой клетки-хозяина трансформацию производят стандартными методами, пригодными для таких клеток. Бактериальные клетки, имеющие барьеры из клеточной стенки, обычно обрабатывают хлоридом кальция. В другом методе трансформации используют полиэтиленгликоль/ДМСО. Еще одним обычно используемым методом является электропорация.
Прокариотические клетки, используемые для продуцирования полипептидов по настоящему изобретению, выращивают в средах, известных в данной области и пригодных для культивирования выбранных клеток-хозяев. Примеры приемлемых сред включают бульон Луриа (LB), содержащий необходимые питательные добавки. В некоторых вариантах осуществления изобретения среда также содержит селектирующий агент, выбираемый с учетом конструкции вектора экспрессии, который избирательно позволяет расти прокариотическим клеткам, содержащим вектор экспрессии. Например, в среду для роста клеток, экспрессирующий ген, устойчивый к ампициллину, добавляют ампициллин.
Помимо углерода, азота и неорганического фосфата в среду могут быть добавлены любые необходимые добавки в соответствующих концентрациях, которые вводят отдельно или в виде смеси с другой добавкой или средой, такой как комплексный источник азота. Культуральная среда может необязательно содержать один или несколько восстановителей, выбираемых из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритрита и дитиотреита.
Прокариотические клетки-хозяева культивируют при соответствующей температуре. Предпочтительная температура для выращивания E.coli, например, находится в интервале от около 20°С до около 39°С, более предпочтительно, от около 25°С до около 37°С, еще предпочтительнее температура равна примерно 30°С. Показатель рН среды может иметь любое значение от около 5 до около 9 и зависит главным образом от организма-хозяина. Для E.coli значение рН, предпочтительно, находится в пределах от около 6,8 до около 7,4 и, более предпочтительно, равно примерно 7,0.
Если в векторе экспрессии по настоящему изобретению использован индуцибельный промотор, экспрессию белка индуцируют в условиях, приемлемых для активации промотора. В соответствии с одним объектом изобретения для регулирования транскрипции полипептидов использованы промоторы PhoA. Таким образом, трансформированные клетки-хозяева культивируют в индуцирующей среде с ограниченным содержанием фосфата. Средой с ограниченным содержанием фосфата, предпочтительно, является среда C.R.A.P (см., например, публикацию Simmons et al., J. Immunol. Methods (2002), 263: 133-147). Как известно в данной области, могут быть использованы разные другие индукторы с учетом конструкции применяемого вектора.
В одном из вариантов осуществления изобретения клетки-хозяева, включающие первый и второй шарнирсодержащие полипептиды, культивируют отдельно, и экспрессированные полипептиды по настоящему изобретению, секретируемые в периплазму, отдельно выделяют из периплазмы клеток-хозяев. Во втором варианте осуществления изобретения клетки-хозяева, включающие первый и второй шарнирсодержащие полипептиды, культивируют отдельно и до выделения шарнирсодержащих полипептидов две культуры клеток-хозяев смешивают и клетки осаждают центрифугированием. В третьем варианте осуществления изобретения клетки-хозяева, содержащие первый и второй шарнирсодержащие полипептиды, культивируют отдельно, центрифугируют и ресуспендируют отдельно и затем смешивают до выделения шарнирсодержащих полипептидов. В четвертом варианте осуществления изобретения клетки-хозяева, включающие первый и второй шарнирсодержащие полипептиды, культивируют вместе в одном сосуде для культивирования. Выделение белка обычно предполагает разрушение клеточной мембраны микроорганизма такими методами как осмотический шок, обработка ультразвуком или лизис. После разрушения клеток клеточный дебрис или целые клетки можно удалить центрифугированием или фильтрацией. Белки могут быть далее очищены, например, при помощи аффинной хроматографии. Альтернативно белки могут быть перенесены или секретированы в культуральную среду и выделены из нее. Рекомбинантные белки, экспрессированные с экзогенной меткой последовательности (или меткой эпитопа), могут облегчить процесс очистки. Методика клонирования и очистки белков, содержащих экзогенную метку последовательности (включая, но не ограничиваясь ими, His метку и GST метку), хорошо известна в данной области. Клетки удаляют из культуры, после чего супернатант культуры фильтруют и концентрируют для дальнейшей очистки продуцированных белков. Экспрессированные полипептиды могут быть затем выделены и идентифицированы известными методами, такими как электрофорез в полиакриламидном геле (PAGE) или анализ методом вестерн-блоттинга. Выделенные полипептиды используют для получения гетеромультимерных белков.
В соответствии с одним объектом изобретения гетеромультимерный белок (например, антитело) получают в большом количестве методом ферментации. Существуют разные промышленные методы ферментации для получения рекомбинантных белков. Емкость промышленных ферментеров равна по меньшей мере 1000 литров, предпочтительно, примерно 1000-100000 литрам. Указанные ферментеры оснащены перемешивающими импеллеры для распределения кислорода и питательных веществ, в частности, глюкозы (предпочтительный источник углерода/энергии). В лабораторных условиях ферментацию обычно выполняют в ферментере, объемная емкость которого не превышает примерно 100 литров и может составлять от около 1 литра до около 100 литров.
В процессе ферментации экспрессия белка обычно индуцируется после выращивания клеток в приемлемых условиях до требуемой плотности, например, OD550 около 180-220, когда клетки находятся на ранней стационарной фазе роста. Как известно в данной области и описано выше, могут быть использованы разные индукторы в зависимости от конструкции используемого вектора. Клетки могут быть выращены в течение более коротких периодов времени до индукции. Клетки обычно индуцируют в течение примерно 12-50 часов, хотя индукция может быть произведена в течение более длительных или более коротких периодов времени.
Для увеличения выхода продукции и улучшения качества полипептидов по настоящему изобретению условия ферментации могут быть изменены. Например, для улучшения сборки и укладки цепи секретированных гетеромультимерных белков (например, антител) прокариотические клетки-хозяева могут быть котрансформированы дополнительными векторами, сверхэкспрессирующими белки-компаньоны, такие как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил-цис,транс-изомераза, обладающая активностью белка-компаньона). Установлено, что белки-компаньоны облегчают укладку цепи и улучшают растворимость гетерологичных белков, продуцированных бактериальными клетками-хозяевами. Chen et al. (1999) J. Bio. Chem. 274: 19601-19605; Georgiou et al., патент США № 6083715; Georgiou et al., патент США № 6027888; Bothmann and Pluckthun (2000) J. Biol. Chem. 275: 17100-17105; Ramm and Pluckthun (2000) J. Biol. Chem. 275: 17106-17113; Arie et al. (2001) Mol. Microbiol. 39: 199-210.
Чтобы свести к минимуму протеолиз экспрессированных гетерологичных белков (особенно белков, подверженных протеолизу), в настоящем изобретении могут быть использованы определенные штаммы клеток-хозяев, не содержащие протеолитических ферментов. Например, штаммы клеток-хозяев могут быть модифицированы с получением генетических мутаций в генах, кодирующих известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их комбинации. Существуют некоторые штаммы E.coli с отсутствием протеазы, которые описаны, например, в публикациях Joly et al. (1998), Proc. Natl. Acad. Sci. USA 95: 2773-2777; Georgiou et al., патент США № 5264365; Georgiou et al., патент США № 5508192, Hara et al., Microbial Drug Resistance, 2: 63-72 (1996).
В одном из вариантов осуществления изобретения в качестве клеток-хозяев в экспрессирующей системе по настоящему изобретению использованы штаммы E.coli с отсутствием протеолитических ферментов, которые трансформированы плазмидами, сверхэкспрессирующими один или несколько белков-компаньонов. Во втором варианте осуществления изобретения в штамме E.coli отсутствует липопротеин наружной мембраны (Δlpp).
iii. Очистка гетеромультимерных белков
В одном из вариантов осуществления изобретения продуцированный гетеромультимерный белок подвергают дальнейшей очистке для получения по существу гомогенных препаратов, предназначенных для выполнения последующих анализов и других применений. Могут быть использованы стандартные методы очистки белков, известные в данной области. Ниже приведены типичные методы очистки: фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на диоксиде кремния или ионообменной смоле, такой как DEAE, хроматофокусирование, SDS-PAGE, осаждение сульфатом аммония и гель-фильтрация с использованием, например, сефадекса G-75.
В соответствии с одним объектом изобретения для иммуноаффинной очистки половинного антитела или полного антитела по настоящему изобретению используют протеин А, иммобилизованный на твердой фазе. Протеин А является белком клеточной стенки с молекулярной массой 41 кДа, получаемый из Staphylococcus aureus, который связывается с высокой аффинностью с Fc-областью антител. Lindmark et al. (1983) J. Immunol. Meth. 62: 1-13. Твердая фаза, на которой иммобилизуют протеин А, предпочтительно, является колонкой с поверхностью из стекла или диоксида кремния, более предпочтительно, колонкой со стеклом, имеющим определенный размер пор, или колонкой с кремниевой кислотой. В некоторых случаях колонку покрывают реагентом, таким как глицерин, для предотвращения неспецифического сцепления загрязняющих примесей.
На первой стадии очистки препарат, выделенный из культуры клеток вышеописанным методом, наносят на твердую фазу, содержащую иммобилизованный белок А, для специфического связывания представляющего интерес антитела с протеином А. Твердую фазу затем промывают для удаления загрязняющих примесей, неспецифически связанных с твердой фазой. Гетеромультимерный белок (например, антитело) выделяют из твердой фазы элюированием.
b. Создание гетеромультимерных белков с использованием эукариотических клеток-хозяев
Вектор обычно включает, не ограничиваясь ими, один или несколько следующих компонентов: сигнальную последовательность, ориджин репликации, один или несколько генов-маркеров, энхансер, промотор и последовательность терминации транскрипции.
i. Сигнальная последовательность
Вектор, предназначенный для использования в эукариотической клетке-хозяине, может содержать сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления у N-конца зрелого белка или представляющего интерес полипептида. Предпочтительно, выбирают гетерологичную сигнальную последовательность, которая может быть распознана и процессирована (то есть расщеплена сигнальной пептидазой) клеткой-хозяином. Для экспрессии в клетке млекопитающего могут быть использованы сигнальные последовательности млекопитающего, а также вирусные секреторные лидерные последовательности, например, сигнальная последовательность вируса простого герпеса gD. ДНК такой области лигируют в рамке считывания с ДНК, кодирующей требуемый гетеромультимерный белок (например, антитело).
ii. Ориджин репликации
Ориджин репликации обычно не требуется для векторов экспрессии млекопитающих. Например, может быть использован ориджин SV40, но только потому, что он содержит ранний промотор.
iii. Селектируемый ген
Экспрессирующие и клонирующие векторы могут содержать селектируемый ген, также называемый селектируемый маркер. Типичные селектируемые гены кодируют белки, которые (а) сообщают устойчивость к антибиотикам или другим токсинам, например, устойчивость к ампициллину, неомицину, метотрексату или тетрациклину, (b) определяют недостаточность ауксотрофного комплемента там, где это имеет место, или (с) предоставляют необходимые питательные вещества, отсутствующие в комплексной среде.
В качестве одного примера схемы отбора можно привести лекарственное средство, блокирующее рост клетки-хозяина. Клетки, которые были успешно трансформированы гетерологичным геном, продуцируют белок, сообщающий лекарственную устойчивость, и, таким образом, выживают в процессе отбора. В качестве примеров такого доминантного отбора можно привести такие лекарственные средства как неомицин, микофеноловую кислоту и гигромицин.
Другим примером приемлемых селектируемых маркеров для клеток млекопитающих являются маркеры, которые позволяют идентифицировать клетки, способные поглощать нуклеиновую кислоту антитела, такие как DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно, гены металлотионеина приматов, аденозиндеаминаза, орнитиндекарбоксилаза и т.д.
Например, клетки, трансформированные селектируемым геном DHFR, сначала идентифицируют путем культивирования всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), который является конкурентным антагонистом DHFR. Соответствующей клеткой-хозяином при использовании DHFR дикого типа является клетка яичника китайского хомячка (СНО) с отсутствием активности DHFR (например, АТСС CRL-9096).
Альтернативно, клетки-хозяева (в частности, клетки-хозяева дикого типа, содержащие эндогенный DHFR), трансформированные или котрансформированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3'-фосфотрансфераза (АРН), могут быть отобраны на основании роста клеток в среде, содержащей селектирующий агент для селектируемого маркера, такой как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См., например, патент США № 4965199.
iv. Промотор
Экспрессирующие и клонирующие векторы обычно содержат промотор, распознаваемый организмом-хозяином и функционально связанный с нуклеиновой кислотой требуемого шарнирсодержащего полипептида (например, антитела). Известны промоторные последовательности для эукариотических клеток. Фактически все гены эукариотических клеток имеют АТ-содержащую область, расположенную на расстоянии примерно 25-30 оснований вверху от сайта инициации транскрипции. Другая последовательность, расположенная на расстоянии 70-80 оснований вверху от начала транскрипции многих генов, представляет собой область CNCAAT, где N может быть любым нуклеотидом. У 3'-конца большинства генов эукариотических клеток находится последовательность ААТААА, которая может быть сигналом для добавления поли-А концевого сегмента к 3'-концу кодирующей последовательности. Все указанные последовательности могут быть вставлены в векторы экспрессии для эукариотических клеток.
Транскрипцию требуемого шарнирсодержащего полипептида (например, половинного антитела) из векторов в клетках-хозяевах млекопитающих контролируют промоторы, полученные из геномов вирусов, таких как, например, вирус полиомы, поксвирус, аденовирус (такой как аденовирус 2), бычий вирус папилломы, птичий вирус саркомы, цитомегаловирус, ретровирус, вирус гепатита В и вакуолизирующий обезьяний вирус (SV40), из гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, из промоторов теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 обычно получают в виде рестрикционного фрагмента SV40, который также содержит ориджин репликации вируса SV40. Предранний промотор цитомегаловируса человека обычно получают в виде рестрикционного фрагмента HindIII E. Система, предназначенная для экспрессии ДНК в клетках-хозяевах млекопитающих с использованием бычьего вируса папилломы в качестве вектора, описана в патенте США № 4419446. Модификация указанной системы описана в патенте США № 4601978. См. также публикацию Reyes et al., Nature 297:598-601 (1982) для ознакомления с экспрессией кДНК β-интерферона человека в мышиных клетках под контролем промотора тимидинкиназы, выделенного из вируса простого герпеса. Альтернативно в качестве промотора может быть использован длинный концевой повтор вируса саркомы Рауса.
v. Энхансерный элемент
Транскрипцию ДНК, кодирующей требуемый шарнирсодержащий полипептид (например, антитело), в высших эукариотических клетках можно увеличить путем введения в вектор энхансерных последовательностей. В настоящее время известны многие энхансерные последовательности из генов млекопитающих (например, гены глобина, эластазы, альбумина, α-фетопротеина и инсулина). Кроме того, может быть использован энхансер из вируса эукариотических клеток. В качестве примера можно привести энхансер SV40 на поздней стороне ориджина репликации (пары оснований 100-270), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы на поздней стороне ориджина репликации и энхансеры аденовируса. См. также публикацию Yaniv, Nature 297: 17-18 (1982) для ознакомления с описанием элементов, используемых для усиления активации промоторов для эукариотических клеток. Энхансер может быть введен в вектор в положении 5'- или 3'-конца последовательности, кодирующей полипептид антитела, при условии достижения усиления транскрипции, но обычно энхансер вводят в положении сайта 5'-конца от промотора.
vi. Компонент терминации транскрипции
Векторы экспрессии, используемые в эукариотических клетках-хозяевах, обычно также содержат последовательности, необходимые для терминации транскрипции и стабилизации мРНК. Такие последовательности обычно находятся у 5'-конца и иногда у 3'-конца нетранслированных областей ДНК или кДНК эукариотических или вирусных клеток. Указанные области содержат нуклеотидные сегменты, транскрибированные в виде полиаденилированных фрагментов в нетранслированной части мРНК, кодирующей антитело. Одним приемлемым компонентом терминации транскрипции является область полиаденилирования бычьего гормона роста. См. WO 94/11026 и вектор экспрессии, рассмотренный в настоящем описании изобретения.
vii. Отбор и трансформация клеток-хозяев
Клетки-хозяева, подходящие для клонирования или экспрессии ДНК в векторах по настоящему изобретению, включают высшие эукариотические клетки, рассмотренные в настоящем описании изобретения, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (культура ткани) является стандартной процедурой. В качестве примеров приемлемых линий клеток-хозяев млекопитающих можно привести линию клеток почки обезьяны CV1, трансформированную SV40 (COS-7, ATCC CRL 1651), линию эмбриональных клеток почки человека (293 или клетки 293, субклонированные для выращивания в суспензионной среде, Graham et al., J. Gen. Virol. 36: 59 (1977), клетки почки детеныша хомячка (ВНК, АТСС CCL 10), клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)), клетки мыши Сертоли (ТМ4, Mather, Biol. Reprod, 23: 243-251 (1980)), клетки почки обезьяны (CV1 ATCC CCL 70), клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587), клетки карциномы шейки матки человека (HELA, ATCC CCL 2), клетки почки собаки (MDCK, ATCC CCL 34), клетки печени буйволовой крысы (BRL 3A, ATCC CRL 1442), клетки легкого человека (W138, ATCC CCL 75), клетки печени человека (Hep G2, HB 8065), мышиные клетки опухоли молочной железы (ММТ 060562, АТСС CCL51), клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982)), клетки MRC 5, клетки FS4 и линию клеток гепатомы человека (Hep G2).
Клетки-хозяева трансформируют вышеописанными экспрессирующими или клонирующими векторами для продуцирования требуемого шарнирсодержащего полипептида (например, антитела) и культивируют в стандартной питательной среде, модифицированной соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих требуемых последовательности.
viii. Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования требуемого шарнирсодержащего полипептида (например, антитела) по настоящему изобретению, могут быть культивированы в разных средах. Для культивирования клеток-хозяев пригодны коммерчески доступные среды, такие как среда Хэма F10 (Sigma), минимальная поддерживающая среда ((МЕМ), (Sigma), RPМI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM, Sigma). Кроме того, в качестве культуральной среды для клеток-хозяев могут быть использованы любые среды, описанные в публикациях Ham et al., Meth. Enz. 58: 44 (1979), Barnes et al., Anal. Biochem. 102: 255 (1980), патенты США №№ 4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или патент США Re. 30985. Любые указанные среды при необходимости могут быть дополнены гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, фосфат кальция и магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство гентамицин™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. В среду могут быть введены любые другие необходимые добавки в соответствующих концентрациях, известных специалистам в данной области. Условия культивирования, такие как температура, рН и тому подобные, аналогичные ранее указанным для клеток-хозяев, отбираемых для экспрессии, и должны быть известны квалифицированному специалисту.
ix. Очистка гетеромультимерных белков
При использовании методов рекомбинантных ДНК шарнирсодержащие полипептиды могут быть продуцированы внутри клетки или секретированы непосредственно в среду. Если шарнирсодержащий полипептид продуцирован внутри клетки, на первой стадии удаляют дебрис, клетки-хозяева или лизированные фрагменты, например, при помощи центрифугирования или ультрафильтрации. Если шарнирсодержащий полипептид секретирован в среду, супернатанты из таких экспрессирующих систем сначала концентрируют, используя коммерчески доступный фильтр для концентрации белков, например, ультрафильтрующее устройство Amicon или Millipore Pellicon. На любой из вышеуказанных стадий может быть добавлен ингибитор протеазы, такой как PMSF, для ингибирования протеолиза и антибиотики для предотвращения роста вредных загрязняющих примесей.
Полученная из клеток композиция гетеромультимера может быть очищена, например, при помощи ионообменной хроматографии, гидрофобной хроматографии, хроматографии на гидроксиапатите, гель-электрофореза, диализа и аффинной хроматографии, при этом аффинная хроматография является предпочтительным методом очистки. Также могут быть использованы комбинации вышеуказанных методов. Пригодность протеина А в качестве аффинного лиганда зависит от вида и изотипа Fc домена любого иммуноглобулина, присутствующего в антителе. Протеин А может быть использован для очистки антител, созданных на основе γ1, γ2 или γ4 тяжелых цепей человека (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Протеин G рекомендован для всех изотипов мыши и γ3 человека (Guss et al., EMBO J. 5: 15671575 (1986)). Матрица, с которой связывают аффинный лиганд, чаще всего является агарозой, но могут быть использованы и другие матрицы. Механически устойчивые матрицы, такие как стекло с определенным размером пор или полистиролдивинилбензол, позволяют увеличить скорость потока и сократить время обработки по сравнению с использованием агарозы. Если антитело содержит СН3 домен, то для очистки может быть использована смола Bakerbond ABX™ (J.T. Baker, Phillipsburg, NJ). В зависимости от выделяемого антитела также могут быть использованы другие методы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на диоксиде кремния, хроматография на гепарине Sepharose™, хроматография на анионообменной или катионообменной смоле (например, на колонке с полиаспарагиной кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония.
После стадии предварительной очистки смесь, включающая представляющее интерес антитело и загрязняющие примеси, может быть подвергнута гидрофобной хроматографии с низким значением рН при использовании элюирующего буфера с рН около 2,5-4,5, которую, предпочтительно, выполняют при низкой концентрации соли (например, около 0-0,25 М соли). Получение гетеромультимерных белков может альтернативно или дополнительно (к любому из вышеуказанных методов) включать диализ раствора, включающего смесь полипептидов.
х. Получение антител с использованием бакуловируса
Рекомбинантный бакуловирус может быть создан путем котрансфекции плазмиды, кодирующей антитело или фрагмент антитела и ДНК вируса BaculoGoldTM (Pharmingen), в клетку насекомого, такую как клетка Spodoptera frugiperda (например, клетки Sf9, ATCC CRL 1711) или клетка Drosophila melanogaster S2 при использовании, например, липофектина (компании GIBCO-ВRL). В конкретном примере последовательность антитела гибридизируют вверху от метки эпитопа, находящейся в векторе экспрессии на основе бакуловируса. Такие метки эпитопа включают поли-His метки. Могут быть использованы разные плазмиды, в том числе плазмиды, полученные из коммерчески доступных плазмид, таких как pVL 1393 (Novagen) или pAcGP67B (Pharmingen). Последовательность, кодирующая антитело или его фрагмент, может быть амплифицирована при помощи ПЦР с использованием затравок, комплементарных 5'- и 3'-концевым областям. 5'-концевая затравка может включать фланкирующие (выбранные) сайты рестрикционного фермента. Затем продукт может быть расщеплен выбранными рестрикционными ферментами и субклонирован в вектор экспрессии.
Клетки-хозяева, трансфицированные вектором экспрессии, (например, клетки Sf9) инкубируют в течение 4-5 дней при 28°С, выделенный вирус собирают и используют для дальнейшей амплификации. Инфицирование вирусом и экспрессия белка могут быть выполнены в соответствии с описанием, приведенным в публикации O'Reilley et al. (Baculovirus exрression vectors: A Laboratory Manual. Oxford: Oxford University Press (1994)).
Экспрессированное антитело, меченное поли-His меткой, затем очищают, например, при помощи аффинной хроматографии на Ni2+ хелате следующим образом. Из клеток Sf9, инфицированных рекомбинантным вирусом, могут быть получены экстракты в соответствии с описанием, приведенным в публикации Rupert et al. (Nature 362: 175-179 (1993)). Клетки Sf9 промывают, ресуспендируют в буфере для обработки ультразвуком (25 мл HEPES, рН 7,9, 12,5 мМ MgCl2, 0,1 мМ EDTA, 10% глицерина, 0,1% NP-40, 0,4 М KCl) и дважды обрабатывают ультразвуком на льду в течение 20 секунд. Продукты, полученные в результате обработки ультразвуком, очищают центрифугированием, супернатант разводят в 50 раз в наполняющем буфере (50 мМ фосфата, 300 мМ NaCl, 10% глицерина, рН 7,8) и фильтруют через 0,45 мкм фильтр. Колонку с агарозой Ni2+-NTA (компании Qiagen), образующей слой объемом 5 мл, промывают 25 мл воды и уравновешивают 25 мл наполняющего буфера. Фильтрованный клеточный экстракт вводят в колонку со скоростью 0,5 мл/минуту. Колонку промывают до нулевой линии А280 наполняющим буфером и начинают сбор фракций. Затем колонку промывают вспомогательным промывочным буфером (50 мМ фосфата, 300 мМ NaCl, 10% глицерина, рН 6,0), который элюирует неспецифически связанный белок. После повторного достижения нулевой линии А280 колонку проявляют градиентом имидазола от 0 до 500 мМ в вспомогательном промывочном буфере. Одномиллилитровые фракции собирают и анализируют при помощи SDS-PAGE, окрашивания серебром или вестерн-блоттинга, используя Ni2+-NTA, конъюгированную с щелочной фосфатазой (Qiagen). Фракции, содержащие элюированное His10-меченное антитело, собирают и диализируют против наполняющего буфера.
Альтернативно, антитело может быть очищено известными хроматографическими методами, которые включают, например, хроматографию на колонке с протеином А или протеином G. В одном варианте осуществления изобретения представляющее интерес антитело может быть выделено из твердой фазы колонки путем элюирования в раствор, содержащий хаотропный агент или слабый детергент. Типичные хаотропные агенты и слабые детергенты включают, не ограничиваясь ими, гидрохлорид гуанидина, мочевину, перклорат лития, аргинин, гистидин, SDS (додецилсульфат натрия), твин, тритон и NP-40, которые являются коммерчески доступными веществами.
IV. Молекулы-мишени
Примеры молекул, на которые может направленно воздействовать гетеромультимерный белок по настоящему изобретению, включают, не ограничиваясь ими, растворимые сывороточные белки, их рецепторы и другие мембраносвязанные белки (например, адгезины). См. публикацию WO 2011/133886, которая включена в настоящее описание изобретения в качестве ссылки в полном объеме.
В другом варианте осуществления изобретения гетеромультимерный белок по настоящему изобретению способен связываться с одним, двумя или большим числом цитокинов, белков, родственных цитокинам, и рецепторов цитокинов, выбираемых из группы, состоящей из BMPI, BMP2, BMP3B (GDFIO), BMP4, BMP6, BMP8, CSFI (M-CSF), CSF2 (GM-CSF), CSF3 (G-CSF), EPO, FGFI (aFGF), FGF2 (bFGF), FGF3 (int-2), FGF4 (HST), FGF5, FGF6 (HST-2), FGF7 (KGF), FGF9, FGF10, FGF11, FGF12, FGF12B, FGF14, FGF16, FGF17, FGF19, FGF20, FGF21, FGF23, IGF1, IGF2, IFNAI, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNBI, IFNG, IFNWI, FELI, FELI (EPSELON), FELI (ZETA), IL1A, IL1B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL11, IL12A, IL12B, IL13, IL14, IL15, IL16, IL17, IL17B, IL18, IL19, IL20, IL22, IL23, IL24, IL25, IL26, IL27, IL28A, IL28B, IL29, IL30, PDGFA, PDGFB, TGFA, TGFB1, TGFB2, TGFB3, LTA (TNF-b), LTB, TNF (TNF-a), TNFSF4 (лиганд ОХ40), TNFSF5 (лиганд CD40), TNFSF6 (FasL), TNFSF7 (лиганд CD27), TNFSF8 (лиганд CD30), TNFSF9 (лиганд 4-1 BB), TNFSFIO (TRAIL), TNFSF11 (TRANCE), TNFSF12 (APO3L), TNFSF13 (April), TNFSF13B, TNFSF14 (HVEM-L), TNFSF15 (VEGI), TNFSF18, HGF (VEGFD), VEGF, VEGFB, VEGFC, ILIR1, IL1 R2, IL1 RL1, IL1RL2, IL2RA, IL2RB, IL2RG, IL3RA, IL4R, IL5RA, IL6R, IL7R, IL8RA, IL8RB, IL9R, ILI0RA, ILI0RB, IL11RA, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL15RA, IL17R, IL18R1, IL20RA, IL21 R, IL22R, IL1 HY1, IL1 RAP, IL1 RAPL1, IL1 RAPL2, IL1 RN, IL6ST, IL18BP, IL18RAP, IL22RA2, AIFI, HGF, LEP (лептин), PTN и ТНРО.
В другом варианте осуществления изобретения молекула-мишень является хемокином, рецептором хемокина или белком, родственным хемокину, выбираемым из группы, состоящей из CCL1 (I-309), CCL2 (MCP-1/MCAF), CCL3 (MIP-Ia), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (MCP-3), CCL8 (mcp-2), CCLH (эотаксин), CCL13 (MCP-4), CCL15 (MIP-Id), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19 (MDP-3b), CCL20 (MIP-3a), CCL21 (SLC/эксодус-2), CCL22 (MDC/STC-I), CCL23 (MPIF-I), CCL24 (MPIF-2/эотаксин-2), CCL25 (TECK), CCL26 (эотаксин-3), CCL27 (CTACK/ILC), CCL28, CXCL1 (GROI), CXCL2 (GRO2), CXCL3 (GR03), CXCL5 (ENA-78), CXCL6 (GCP-2), CXCL9 (MIG), CXCL10 (IP10), CXCL11 (I-TAC), CXCL12 (SDFI), CXCL13, CXCL14, CXCL16, PF4 (CXCL4), PPBP (CXCL7), CX3CL1 (SCYDI), SCYEI, XCL1 (лимфотактин), XCL2 (SCM-lb), BLRI (MDR15), CCBP2 (D6/JAB61), CCR1 (CKRI/HM145), CCR2 (mcp-IRB/RA), CCR3 (CKR3/CMKBR3), CCR4, CCR5 (CMKBR5/ChemR13), CCR6 (CMKBR6/CKR-L3/STRL22/DRY6), CCR7 (CKR7/EBII), CCR8 (CMKBR8/TERI/CKR-LI), CCR9 (GPR-9-6), CCRLI (VSHKI), CCRL2 (L-CCR), XCRI (GPR5/CCXCRI), CMKLRI, CMKORI (RDCI), CX3CR1 (V28), CXCR4, GPR2 (CCRIO), GPR31, GPR81 (FKSG80), CXCR3 (GPR9/CKR-L2), CXCR6 (TYMSTR/STRL33/Bonzo), HM74, IL8RA (IL8Ra), IL8RB (IL8Rb), LTB4R (GPR16), TCPIO, CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, BDNF, C5R1, CSF3, GRCCIO (CIO), EPO, FY (DARC), GDF5, HDFIA, DL8, PRL, RGS3, RGS13, SDF2, SLIT2, TLR2, TLR4, TREMI, TREM2 и VHL.
В другом варианте осуществления изобретения гетеромультимерные белки по настоящему изобретению способны связываться с одной или несколькими мишенями, выбираемыми из группы, состоящей из ABCFI, ACVRI, ACVRIB, ACVR2, ACVR2B, ACVRLI, AD0RA2A, агрекан, AGR2, AICDA, AIFI, AIGI, AKAPI, AKAP2, AMH, AMHR2, ANGPTI, ANGPT2, ANGPTL3, ANGPTL4, ANPEP, APC, APOCI, AR, AZGPI (цинк-а-гликопротеин), B7.1, B7.2, BAD, BAFF (BLys), BAGI, BAH, BCL2, BCL6, BDNF, BLNK, BLRI (MDR15), BMP1, BMP2, BMP3B (GDFIO), BMP4, BMP6, BMP8, BMPRIA, BMPRIB, BMPR2, BPAGI (плектин), BRCAI, C19orfIO (IL27w), C3, C4A, C5, C5R1, CANTI, CASP1, CASP4, CAVI, CCBP2 (D6/JAB61), CCLI (1-309), CCLII (эотаксин), CCL13 (MCP-4), CCL15 (MIP-ld), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19 (MIP-3b), CCL2 (MCP-1), MCAF, CCL20 (MIP-3a), CCL21 (MTP-2), SLC, эксодус-2, CCL22 (MDC/STC-I), CCL23 (MPIF-1), CCL24 (MPIF-2/эотаксин-2), CCL25 (TECK), CCL26 (эотаксин-3), CCL27 (CTACK/ILC), CCL28, CCL3 (MTP-Ia), CCL4 (MDP-Ib), CCL5 (RANTES), CCL7 (MCP-3), CCL8 (mcp-2), CCNAI, CCNA2, CCNDI, CCNE1, CCNE2, CCR1 (CKRI/HM145), CCR2 (mcp-IRB/RA), CCR3 (CKR3/CMKBR3), CCR4, CCR5 (CMKBR5/ChemR13), CCR6 (CMKBR6/CKR-L3/STRL22/DRY6), CCR7 (CKR7/EBII), CCR8 (CMKBR8/TERI/CKR-LI), CCR9 (GPR-9-6), CCRL1 (VSHKI), CCRL2 (L-CCR), CD164, CD19, CDIC, CD20, CD200, CD22, CD24, CD28, CD3, CD37, CD38, CD3E, CD3G, CD3Z, CD4, CD40, CD40L, CD44, CD45RB, CD52, CD69, CD72, CD74, CD79A, CD79B, CD8, CD80, CD81, CD83, CD86, CDH1 (E-кадгерин), CDH10, CDH12, CDH13, CDH18, CDH19, CDH20, CDH5, CDH7, CDH8, CDH9, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK9, CDKNIA (p21Wapl/Cipl), CDKNIB (p27Kipl), CDKNIC, CDKN2A (P16INK4a), CDKN2B, CDKN2C, CDKN3, CEBPB, CERI, CHGA, CHGB, хитиназа, CHST10, CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, CLDN3, CLDN7 (клаудин-7), CLN3, CLU (кластерин), CMKLRI, CMKORI (RDCI), CNRI, COL18A1, COLIAI, COL4A3, COL6A1, CR2, CRP, CSF1 (M-CSF), CSF2 (GM-CSF), CSF3 (GCSF), CTLA4, CTNNBI (b-катенин), CTSB (катепсин В), CX3CL1 (SCYDI), CX3CR1 (V28), CXCLI (GROI), CXCL10 (IP-10), CXCLII (I-TAC/IP-9), CXCL12 (SDFI), CXCL13, CXCL14, CXCL16, CXCL2 (GRO2), CXCL3 (GRO3), CXCL5 (ENA-78/LIX), CXCL6 (GCP-2), CXCL9 (MIG), CXCR3 (GRP9/CKR-L2), CXCR4, CXCR6 (TYMSTR/STRL33/Bonzo), CYB5, CYCI, CYSLTRI, DAB2IP, DES, DKFZp451 J01 18, DNCLI, DPP4, E2F1, ECGFI, EDGI, EFNAI, EFNA3, EFNB2, EGF, EGFR, ELAC2, ENG, ENO1, ENO2, ENO3, EPHB4, EPO, ERBB2 (Her-2), EREG, ERK8, ESRI, ESR2, F3 (TF), FADD, FasL, FASN, FCERIA, FCER2, FCGR3A, FGF, FGFI (aFGF), FGF10, FGF11, FGF12, FGF12B, FGF13, FGF14, FGF16, FGF17, FGF18, FGF19, FGF2 (bFGF), FGF20, FGF21, FGF22, FGF23, FGF3 (int-2), FGF4 (HST), FGF5, FGF6 (HST-2), FGF7 (KGF), FGF8, FGF9, FGFR3, FIGF (VEGFD), FELI (эпсилон), FILI (зета), FLJ12584, FLJ25530, FLRTI (фибронектин), FLTI, FOS, FOSLI (FRA-I), FY (DARC), GABRP (GABAa), GAGEBI, GAGECI, GALNAC4S-6ST, GATA3, GDF5, GFI1, GGT1, GM-CSF, GNASI, GNRHI, GPR2 (CCRIO), GPR31, GPR44, GPR81 (FKSG80), GRCCIO (CIO), GRP, GSN (гелсолин), GSTPI, HAVCR2, HDAC4, HDAC5, HDAC7A, HDAC9, HGF, HIFIA, HDPI, гистамин и рецепторы гистамина, HLA-A, HLA-DRA, HM74, HMOXI, HUMCYT2A, ICEBERG, ICOSL, ID2, IFN-a, IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNB1, IFN-гамма, DFNWI, IGBPI, IGFI, IGFIR, IGF2, IGFBP2, IGFBP3, IGFBP6, IL-1, IL10, IL10RA, IL10RB, IL11, IL11RA, IL-12, IL12A, IL12B, IL12RB1, IL12RB2, IL13, IL13RA1, IL13RA2, IL14, IL15, IL15RA, IL16, IL17, IL17B, IL17C, IL17R, IL18, IL18BP, IL18R1, IL18RAP, IL19, IL1A, IL1B, ILIF10, IL1 F5, IL1 F6, IL1 F7, IL1 F8, IL1 F9, IL1 HYI, IL1 RI, IL1 R2, IL1 RAP, IL1 RAPL1, IL1 RAPL2, IL1 RL1, IL1 RL2, ILIRN, IL2, IL20, IL20RA, IL21R, IL22, IL22R, IL22RA2, IL23, IL24, IL25, IL26, IL27, IL28A, IL28B, IL29, IL2RA, IL2RB, IL2RG, IL3, IL30, IL3RA, IL4, IL4R, IL5, IL5RA, IL6, IL6R, IL6ST (гликопротеин 130), EL7, EL7R, EL8, IL8RA, DL8RB, IL8RB, DL9, DL9R, DLK, INHA, INHBA, INSL3, INSL4, IRAKI, ERAK2, ITGA1, ITGA2, ITGA3, ITGA6 (интегрин а6), ITGAV, ITGB3, ITGB4 (интегрин b4), JAGI, JAKI, JAK3, JUN, K6HF, KAII, KDR, KITLG, KLF5 (GC Box BP), KLF6, KLKIO, KLK12, KLK13, KLK14, KLK15, KLK3, KLK4, KLK5, KLK6, KLK9, KRT1, KRT19 (кератин 19), KRT2A, KHTHB6 (волососпецифический кератин типа Н), LAMAS, LEP (лептин), Lingo-p75, Lingo-Troy, LPS, LTA (TNF-b), LTB, LTB4R (GPR16), LTB4R2, LTBR, MACMARCKS, MAG или Omgp, MAP2K7 (c-Jun), MDK, MIBI, мидкин, MEF, MIP-2, MKI67 (Ki-67), MMP2, MMP9, MS4А1, MSMB, MT3 (металлотионектин-III), MTSSI, MUCI (муцин), MYC, MYD88, NCK2, нейрокан, NFKBI, NFKB2, NGFB (NGF), NGFR, NgR-Lingo, NgR-Nogo66 (Nogo), NgR-p75, NgR-Troy, NMEI (NM23A), N0X5, NPPB, NROBI, NR0B2, NRIDI, NR1 D2, NR1 H2, NR1 H3, NR1 H4, NR1 I2, NR1 I3, NR2C1, NR2C2, NR2E1, NR2E3, NR2F1, NR2F2, NR2F6, NR3C1, NR3C2, NR4A1, NR4A2, NR4A3, NR5A1, NR5A2, NR6A1, NRP1, NRP2, NT5E, NTN4, ODZI, OPRDI, P2RX7, PAP, PARTI, PATE, PAWR, PCA3, PCNA, PDGFA, PDGFB, PECAMI, PF4 (CXCL4), PGF, PGR, фосфакан, PIAS2, PIK3CG, PLAU (uPA), PLG, PLXDCI, PPBP (CXCL7), PPID, PRI, PRKCQ, PRKDI, PRL, PROC, PROK2, PSAP, PSCA, PTAFR, PTEN, PTGS2 (COX-2), PTN, RAC2 (p21 Rac2), RARB, RGSI, RGS13, RGS3, RNFIIO (ZNF144), ROBO2, S100A2, SCGB1 D2 (липофилин В), SCGB2A1 (маммаглобин 2), SCGB2A2 (маммаглобин 1), SCYEI (эндотелиальный цитокин, активирующий моноциты), SDF2, SERPINAI, SERPINA3, SERP1 NB5 (маспин), SERPINEI (PAI-I), SERPDMF1, SHBG, SLA2, SLC2A2, SLC33A1, SLC43A1, SLIT2, SPPI, SPRRIB (Sprl), ST6GAL1, STABI, STAT6, STEAP, STEAP2, TB4R2, TBX21, TCPIO, TDGFI, TEK, TGFA, TGFBI, TGFBIII, TGFB2, TGFB3, TGFBI, TGFBRI, TGFBR2, TGFBR3, THIL, THBSI (тромбоспондин-1), THBS2, THBS4, THPO, TIE (Tie-1), TMP3, тканевый фактор, TLRIO, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TNF, TNF-a, TNFAEP2 (B94), TNFAIP3, TNFRSFIIA, TNFRSFIA, TNFRSFIB, TNFRSF21, TNFRSF5, TNFRSF6 (Fas), TNFRSF7, TNFRSF8, TNFRSF9, TNFSFIO (TRAIL), TNFSF11 (TRANCE), TNFSF12 (APO3L), TNFSF13 (April), TNFSF13B, TNFSF14 (HVEM-L), TNFSF15 (VEGI), TNFSF18, TNFSF4 (лиганд OX40), TNFSF5 (лиганд CD40), FNFSF6 (FasL), TNFSF7 (лиганд CD27), TNFSF8 (лиганд CD30), TNFSF9 (лиганд 4-1 ВВ), TOLLIP, Toll-подобные рецепторы, TOP2A (топоизомераза Еа), TP53, TPM1, TPM2, TRADD, TRAF1, TRAF2, TRAF3, TRAF4, TRAF5, TRAF6, TREM1, TREM2, TRPC6, TSLP, TWEAK, VEGF, VEGFB, VEGFC, версикан, VHL C5, VLA-4, XCL1 (лимфотактин), XCL2 (SCM-Ib), XCRI (GPR5/CCXCRI), YYI и ZFPM2.
Предпочтительные молекулы-мишени для антител по наcтоящему изобретению включают белки CD, такие как CD3, CD4, CD8, CD16, CD19, CD20, CD34, CD64, CD200 семейства рецепторов ErbB, таких как рецептор EGF, рецептор HER2, HER3 или HER4, молекулы клеточной адгезии, такие как LFA-1, Mad, p150.95, VLA-4, ICAM-1, VCAM, альфа4/бета7 интегрин и альфа5/бета3 интегрин, включая его альфа или бета субъединицы (например, антитела против CD11a, CD18 или CD11b), факторы роста, такие как VEGF-A, VEGF-C, тканевый фактор (TF), альфа-интерферон (альфа-IFN), TNFальфа, интерлейкин, такой как IL-1 бета, IL-3, IL-4, IL-5, IL-8, IL-9, IL-13, IL17A/F, IL-18, IL-13Rальфа1, IL13Rальфа2, IL-4R, IL-5R, IL-9R, IgE, антигены групп крови, рецептор flk2/flt3, рецептор ожирения (ОВ), рецептор mpl, CTLA-4, RANKL, RANK, протеин RSVF, протеин С и т.д.
В одном из вариантов осуществления изобретения гетеромультимерные белки по настоящему изобретению связываются с белком, родственным рецептору липопротеина низкой плотности (LRP)-1 или LRP-8, или с рецептором трансферрина и по меньшей мере с одной мишенью, выбираемой из группы, состоящей из 1) бета-секретазы (ВАСЕ1 или ВАСЕ2), 2) альфа-секретазы, 3) гамма-секретазы, 4) tau-секретазы, 5) амилоидного белка-предшественника (АРР), 6) некрозного рецептора 6 (DR6), 7) амилоидного бета-пептида, 8) альфа-синуклеина, 9) паркина, 10) гантингтина, 11) p75 NTR и 12) каспазы-6.
В одном из вариантов осуществления изобретения гетеромультимерные белки по настоящему изобретению связываются по меньшей мере с двумя молекулами-мишенями, выбираемыми из группы, состоящей из: IL-1 альфа и IL-1 бета, IL-12 и IL-18, IL-13 и IL-9, IL-13 и IL-4, IL-13 и IL-5, IL-5 и IL-4, IL-13 и IL-1 бета, IL-13 и IL-25, IL-13 и TARC, IL-13 и MDC, IL-13 и MEF, IL-13 и TGF-β, IL-13 и агонист LHR, IL-12 и TWEAK, IL-13 и CL25, IL-13 и SPRR2a, IL-13 и SPRR2b, IL-13 и ADAM8, IL-13 и PED2, IL17A и IL17F, CD3 и CD19, CD138 и CD20, CD138 и CD40, CD19 и CD20, CD20 и CD3, CD38 и CD138, CD38 и CD20, CD38 и CD40, CD40 и CD20, CD-8 и IL-6, CD20 и BR3, TNFальфа и TGF-бета, TNFальфа и IL-1 бета, TNFальфа и IL-2, TNFальфа и IL-3, TNFальфа и IL-4, TNFальфа и IL-5, TNFальфа и IL-6, TNFальфа и IL-8, TNFальфа и IL-9, TNFальфа и IL-10, TNFальфа и IL-11, TNFальфа и IL-12, TNFальфа и IL-13, TNFальфа и IL-14, TNFальфа и IL-15, TNFальфа и IL-16, TNFальфа и IL-17, TNFальфа и IL-18, TNFальфа и IL-19, TNFальфа и IL-20, TNFальфа и IL-23, TNFальфа и IFNальфа, TNFальфа и CD4, TNFальфа и VEGF, TNFальфа и MIF, TNFальфа и ICAM-1, TNFальфа и PGE4, TNFальфа и PEG2, TNFальфа и лиганд RANK, TNFальфа и Te38, TNFальфа и BAFF, TNFальфа и CD22, TNFальфа и CTLA-4, TNFальфа и GP130, TNFa и IL-12p40, VEGF и HER2, VEGF-A и HER2, VEGF-A и PDGF, HER1 и HER2, VEGF-A и VEGF-C, VEGF-C и VEGF-D, HER2 и DR5, VEGF и IL-8, VEGF и MET, VEGFR и рецептор МЕТ, VEGFR и EGFR, HER2 и CD64, HER2 и CD3, HER2 и CD16, HER2 и HER3, EGFR(HER1) и HER2, ЕGFR и HER3, EGFR и HER4, IL-13 и CD40L, IL-4 и CD40L, TNFR1 и IL-1R, TNFR1 и IL-6R, TNFR1 и IL-18R, EpCAM и CD3, MAPG и CD28, EGFR и CD64, CSPGs и RGM A, CTLA-4 и BTNO2, IGF1 и IGF2, IGF1/2 и Erb2B, MAG и RGM A, NgR и RGM A, NogoA и RGM A, OMGp и RGM A, PDL-I и CTLA-4, RGM A и RGM B.
В качестве иммуногенов для создания антител могут быть использованы растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами. В качестве иммуногена для трансмембранных молекул, таких как рецепторы, могут быть использованы фрагменты рецепторов (например, внеклеточный домен рецептора). Альтернативно в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Такие клетки могут быть выделены из природного источника (например, линии раковых клеток) или могут представлять собой клетки, трансформированные методами рекомбинантных ДНК для экспрессии трансмембранной молекулы. Специалистам в данной области должны быть известны другие антигены и их формы, пригодные для получения антител.
V. Варианты осуществления изобретения
Настоящее изобретение относится к дополнительным вариантам осуществления, описанным ниже. Первый вариант осуществления изобретения относится к способу получения гетеромультимерного белка, который включает получение первого шарнирсодержащего полипептида, очищенного протеином А; получение второго шарнирсодержащего полипептида, очищенного протеином А; доведение значения рН каждого половинного антитела до 4-9; смешивание первого и второго шарнирсодержащих полипептидов с получением смешанного пула шарнирсодержащих полипептидов; добавление в смешанный пул шарнирсодержащих полипептидов молярного избытка слабого восстановителя и инкубирование смеси шарнирсодержащих полипептидов со слабым восстановителем с образованием гетеромультимерного белка, содержащего первый и второй шарнирсодержащие полипептиды.
Во втором варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения первый и второй шарнирсодержащие полипептиды могут быть выбраны из половинного антитела, иммуноадгезина и их фрагментов. В третьем варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения первый шарнирсодержащий полипептид является половинным антителом. В четвертом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения второй шарнирсодержащий полипептид является Fc компонентом. В пятом варианте осуществления изобретения и в соответствии с третьим вариантом осуществления изобретения половинное антитело содержит VL домен, CL домен, VH домен, СН1 домен, шарнирную область, СН2 домен и СН3 домен. В шестом варианте осуществления изобретения и в соответствии с пятым вариантом осуществления изобретения половинное антитело представляет собой одноцепочечный полипептид, содержащий связующее звено, в котором указанные домены расположены относительно друг друга в направлении от N-конца к С-концу в следующем порядке: VL-CL-связующее звено-VH-CH1-шарнирная область-СН2-СН3. В седьмом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения первый и второй шарнирсодержащие полипептиды смешивают до очистки протеином А и совместно очищают протеином А. В восьмом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения первый и второй шарнирсодержащие полипептиды содержат домен гетеромультимеризации. В девятом варианте осуществления изобретения и в соответствии с восьмым вариантом осуществления изобретения домен гетеромультимеризации выбирают из мутации ”выступ в углубление”, лейциновой застежки-молнии, электростатика и т.д. В десятом варианте осуществления изобретения и в соответствии с девятым вариантом осуществления изобретения первый шарнирсодержащий полипептид имеет выступ и второй шарнирсодержащий полипептид имеет углубление. В одиннадцатом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения значение рН регулируют после смешивания. В двенадцатом варианте осуществления изобретения и в соответствии с первым или одиннадцатым вариантом осуществления изобретения указанный способ далее включает добавление L-аргинина до конечной концентрации от 20 мМ до 1 М до регулирования значения рН. В тринадцатом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения указанный способ далее включает инкубацию смешанного пула при температуре 15°С-39°С в течение по меньшей мере 30 минут. В четырнадцатом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения смесь для сборки белка характеризуется окислительным потенциалом от -200 до -600 мВ, более предпочтительно, от -300 до -500 мВ, наиболее предпочтительно, около -400 мВ. В пятнадцатом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения слабый восстановитель выбирают из GSH, бета-меркаптоэтиламина, цистеина/цистина, GSH/GSSG, цистеамина/цистамина, глицилцистеина и бета-меркаптоэтанола. В шестнадцатом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения слабый восстановитель добавляют в 50-600-кратном молярном избытке. В семнадцатом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения слабый восстановитель добавляют до смешивания. В восемнадцатом варианте осуществления изобретения и в соответствии с семнадцатым вариантом осуществления изобретения восстановитель добавляют менее, чем за один час до смешивания. В девятнадцатом варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения стадию инкубации смеси для сборки белка выполняют при температуре 15°С-39°С в присутствии поливинилпирролидона (PVP). В двадцатом варианте осуществления изобретения и в соответствии с девятнадцатым вариантом осуществления изобретения гистидин добавляют до, одновременно или после добавления PVP. В двадцать первом варианте осуществления изобретения и в соответствии с девятнадцатым вариантом осуществления изобретения PVP добавляют в количестве до 40% (мас./об.).
Двадцать второй вариант осуществления изобретения относится к способу получения биспецифического антитела, который включает:
а. получение первого половинного антитела, очищенного протеином А;
b. получение второго половинного антитела, очищенного протеином А;
с. добавление к каждому половинному антителу раствора L-аргинина;
d. доведение значения рН каждого половинного антитела до 4-9;
е. смешивание пулов первого и второго половинных антител с получением смешанного пула половинных антител;
f. добавление к смешанному пулу половинных антител молярного избытка слабого восстановителя;
g. инкубацию смешанного пула половинных антител при температуре 15°С-39°С в присутствии PVP;
в результате чего получают биспецифическое антитело, содержащее первое и второе половинные антитела.
Двадцать третий вариант осуществления изобретения относится к способу получения гетеромультимера, который включает: (а) получение L-аргининсодержащей смеси по меньшей мере двух разных шарнирсодержащих полипептидов, в которой значение рН равно 7-9, (b) добавление молярного избытка слабого восстановителя и (с) инкубацию смеси в условиях продуцирования гетеромультимера.
В двадцать четвертом варианте осуществления изобретения и в соответствии с двадцать вторым вариантом осуществления изобретения первое половинное антитело является одноцепочечным полипептидом, содержащим (а) полноразмерную легкую цепь, содержащую VL домен и CL домен, (b) связующее звено, (с) полноразмерную тяжелую цепь, содержащую VH домен, СН1 домен, шарнирную область, СН2 домен и СН3 домен; при этом указанный полипептид содержит домены легкой и тяжелой цепей, расположенные относительно друг друга в направлении от N-конца к С-концу в следующем порядке: VL-CL-связующее звено CL/VH-VH-CH1-шарнирная область-СН2-СН3. В двадцать пятом варианте осуществления изобретения и в соответствии с двадцать четвертым вариантом осуществления изобретения одноцепочечный полипептид далее содержит домен гетеромультимеризации. В двадцать шестом варианте осуществления изобретения и в соответствии с двадцать пятым вариантом осуществления изобретения домен гетеромультимеризации представляет собой углубление (например, полость) или выступ (например, выпуклость). В двадцать седьмом варианте осуществления изобретения и в соответствии с двадцать шестым вариантом осуществления изобретения второе половинное антитело имеет углубление, когда первое половинное антитело имеет выступ. В двадцать восьмом варианте осуществления изобретения и в соответствии с двадцать шестым вариантом осуществления изобретения второе половинное антитело имеет выступ, когда первое половинное антитело имеет углубление. В двадцать девятом варианте осуществления изобретения и в соответствии с двадцать четвертым вариантом осуществления изобретения связующее звено включает повторы GGS. В тридцатом варианте осуществления изобретения и в соответствии с двадцать четвертым вариантом осуществления изобретения связующее звено состоит из 15-50 аминокислот.
Тридцать первый вариант осуществления изобретения относится к способу получения гетеромультимерного белка, который включает: (а) получение первого шарнирсодержащего полипептида, очищенного протеином А; (b) получение второго шарнирсодержащего полипептида, очищенного протеином А; (с) доведение значения рН каждого шарнирсодержащего полипептида до 4-9 в присутствии L-аргинина; (d) смешивание первого и второго шарнирсодержащих полипептидов с получением смешанного пула половинных антител и инкубацию с образованием гетеромультимерного белка, содержащего первый и второй шарнирсодержащие полипептиды.
В тридцать втором варианте осуществления изобретения и в соответствии с первым или тридцать первым вариантом осуществления изобретения по меньшей мере одно из половинных антител является одноцепочечным полипептидом, содержащим: (а) полноразмерную легкую цепь, содержащую VL домен и CL домен; (b) связующее звено; (с) полноразмерную тяжелую цепь, содержащую VH домен, СН1 домен, шарнирную область, СН2 домен и СН3 домен.
В тридцать третьем варианте осуществления изобретения и в соответствии с первым вариантом осуществления изобретения первый шарнирсодержащий полипептид является одноцепочечным полипептидом, содержащим домены легкой и тяжелой цепей, расположенные относительно друг друга в направлении от N-конца к С-концу в следующем порядке: VL-CL-VH-CH1-шарнирная область-СН2-СН3. В тридцать четвертом варианте осуществления изобретения и в соответствии с тридцать третьим вариантом осуществления изобретения полипептидная цепь далее содержит связующее звено, при этом указанные домены расположены относительно друг друга в направлении от N-конца к С-концу в следующем порядке: VL-CL-связующее звено-VH-СН1-шарнирная область-СН2-СН3.
Тридцать пятый вариант осуществления изобретения относится к способу получения гетеромультимера, который включает получение L-аргининсодержащей смеси шарнирсодержащих полипептидов, в которой значение рН равно 4-9, добавление слабого восстановителя и инкубацию в соответствующих условиях с продуцированием гетеромультимера.
Тридцать шестой вариант осуществления изобретения относится к клетке-хозяину, созданной для экспрессии половинного антитела, которое является одноцепочечным полипептидом, содержащим связующее звено, VL домен, CL домен, VH домен, СН1 домен, шарнирную область, СН2 домен и СН3 домен, при этом указанные домены расположены относительно друг друга в направлении от N-конца к С-концу в следующем порядке: VL-CL-связующее звено-VH-CH1-шарнирная область-СН2-СН3. В тридцать седьмом варианте осуществления изобретения и в соответствии с тридцать шестым вариантом осуществления изобретения одноцепочечный полипептид дополнительно содержит домен гетеродимеризации. В тридцать восьмом варианте осуществления изобретения и в соответствии с тридцать шестым или тридцать седьмым вариантом осуществления изобретения клетку-хозяина выбирают из прокариотических клеток, эукариотических клеток, клеток млекопитающих или растительных клеток. В тридцать девятом варианте осуществления изобретения и в соответствии с тридцать восьмым вариантом осуществления изобретения клетка-хозяин является прокариотической клеткой. В сороковом варианте осуществления изобретения и в соответствии с тридцать девятым вариантом осуществления изобретения прокариотическая клетка является клеткой E.coli. В сорок первом варианте осуществления изобретения и в соответствии с сороковым вариантом осуществления изобретения в клетке E.coli отсутствует lpp. В сорок втором варианте осуществления изобретения и в соответствии с тридцать восьмым вариантом осуществления изобретения клетка-хозяин является клеткой млекопитающего. В сорок третьем варианте осуществления изобретения и в соответствии с сорок первым вариантом осуществления изобретения клетка млекопитающего является клеткой СНО. В сорок четвертом варианте осуществления изобретения и в соответствии с тридцать шестым или тридцать седьмым вариантом осуществления изобретения клетка-хозяин содержит вектор, кодирующий одноцепочечное половинное антитело. В сорок пятом варианте осуществления изобретения и в соответствии с тридцать шестым или тридцать седьмым вариантом осуществления изобретения половинное антитело дополнительно содержит домен гетеродимеризации. В сорок шестом варианте осуществления изобретения и в соответствии с сорок пятым вариантом осуществления изобретения домен гетеродимеризации выбирают из выступа, углубления, одной или нескольких заряженных аминокислот в области контакта, которые электростатически не благоприятны для образования гомодимера и электростатически благоприятны для образования гетеродимера, при этом одну или несколько аминокислот изменяют для усиления внутримолекулярного ионного взаимодействия, скрученной спирали и лейциновой застежки-молнии.
Сорок седьмой вариант осуществления изобретения относится к смеси клеток-хозяев, содержащей первую клетку-хозяина, созданную для экспрессии первого одноцепочечного половинного антитела, и вторую клетку-хозяина, созданную для экспрессии Fc компонента. В сорок восьмом варианте осуществления изобретения и в соответствии с тридцать шестым вариантом осуществления изобретения половинное антитело, продуцированное клеткой-хозяином, содержит домен гетеродимеризации.
В нижеследующем экспериментальном разделе использованы следующие аббревиатуры: экв. (эквиваленты), М (молярный), мкМ (микромолярный), н. (нормальный), моль (моли), ммоль (миллимоли), мкмоль (микромоли), нмоль (наномоли), г (граммы), мг (миллиграммы), кг (килограммы), мкг (микрограммы), л (литры), мл (миллилитры), мкл (микролитры), см (сантиметры), мм (миллиметры), мкм (микрометры), нм (нанометры), °С (градусы по шкале Цельсия), ч (часы), мин (минуты), сек (секунды), мсек (миллисекунды).
Примеры
Настоящее изобретение далее более подробно описано в следующих примерах, которые никоим образом не ограничивают объем заявленного изобретения. Прилагаемые чертежи считаются неотъемлемой частью описания изобретения. Все публикации, приведенные в настоящем изобретении, включены в настоящее описание изобретения в качестве ссылки в полном объеме.
Пример 1. Экспрессия и очистка
Данный пример иллюстрирует экспрессию и очистку половинных антител.
С типичными методами создания и экспрессии половинных антител в E.coli можно ознакомиться, например, в совместно рассматриваемой заявке на патент США 2011/0287009, которая включена в настоящее описание изобретения в качестве ссылки в полном объеме. Специалист в данной области обладает необходимыми знаниями для соответствующей модификации культуры и условий экспрессии.
Экспрессия половинных антител в клетках E.coli
Создание экспрессирующих плазмид
ДНК, кодирующие последовательности тяжелых и легких цепей, были клонированы в экспрессирующей плазмиде, содержащей отдельные промоторные элементы для каждой из последовательностей и обладающей устойчивостью к антибиотикам для отбора бактериальных клеток, содержащих указанную экспрессирующую плазмиду. Векторы также кодируют сигнальную последовательность секреции теплостойкого энтеротоксина II (STII) (Picken et al., 1983, Infect. Immun. 42: 269-275 and Lee et al., 1983, Infect. Immun. 42: 264-268) для переноса полипептидов антитела в периплазматическое пространство бактериальной клетки. Транскрипцию каждой цепи контролирует промотор phoA (Kikuchi et al., 1981, Nucleic Acids Res., 9: 5671-5678), и трансляцию контролируют ранее описанные варианты сигнальной последовательности STII, соответствующие измеренной относительной силе трансляции, которые включают изменения молчащего кодона в области инициации трансляции (TIR) (Simmons and Yansura, 1996, Nature Biotechnol. 14: 629-634 and Simmons et al., 2002, J. Immunol. Methods, 263: 133-147).
Каждое половинное антитело имеет выступ (выпуклость) или углубление (полость), созданные в тяжелой цепи в соответствии с описанием, приведенным в патенте США № 7642228. Сначала был создан мутант с выступом в СН3 домене. Затем была создана библиотека мутантов с выступом в СН3 домене путем рандомизации остатков 366, 368 и 407, расположенных в непосредственной близости от выступа в партнере СН3 домена. В следующим примерах выступ имел мутацию Т366W и углубление имело мутации Т366S, L368A и Y407V в остове IgG1 или IgG4. Специалист в данной области может произвести аналогичные мутации в других изотипах иммуноглобулина. Специалисту в данной области должно быть понятно, что желательно, чтобы два половинных антитела, используемых для получения биспецифического антитела, относились к одному изотипу.
Экспрессия и очистка
Половинные антитела, содержащие мутации в виде выступа или углубления, были созданы в отдельных культурах путем экспрессии конструкций, состоящих из тяжелых и легких цепей, в бактериальной клетке-хозяине, например, E.coli. Экспрессирующие плазмиды были введение в штаммы клеток-хозяев E.coli 33D3 (Ridgway et al. (1999) 59 (11): 2718) или 64В4 (W3110.DELTA.fhuA.DELTA.phoA ilvG+.DELTA.prc spr43H1.DELTA.degP.DELTA.manA lacI.sup.q.DELTA.ompT), и трансформанты отбирали на чашках со средой LB, содержащей карбенициллин. Затем трансформанты инкубировали в исходной культуральной среде LB, содержащей карбенициллин, и выращивали в течение ночи, встряхивая при 30°С. Исходную среду разводили в 100 раз в среде с ограниченным содержанием фосфата C.R.A.P. (Simmons et al., 2002, J. Immunol. Methods, 263:133-147), содержащей карбенициллин, и культуру выращивали в течение 24 часов, встряхивая при 30°С. Культуры центрифугировали и клеточный дебрис замораживали до стадии очистки антитела. Дебрис оттаивали и ресуспендировали в экстрагирующем буфере, содержащем 25 мМ трис-буфера с основанием, в котором значение рН было доведено до 7,5 путем добавления хлористоводородной кислоты, 125 мМ NaCl и 5 мМ EDTA (TEB или экстрагирующий трис-буфер) при отношении объема к массе, равном 100 мл ТЕВ на 5 граммов клеточного дебриса, и экстрагировали, разрушая клетки микрофлюидами в результате трехкратного прохождения ресуспендированной смеси через микрофлюидизатор модели 110F корпорации Microfluidics (Newton, Mass.). Экстракт бактериальных клеток очищали центрифугированием в течение 20 минут с ускорением 15000Хg, супернатант собирали и фильтровали через ацетатный фильтр с размером ячеек 0,22 микрона до стадии очистки.
Каждое половинное антитело очищали отдельно при помощи аффинной хроматографии на колонке с протеином А. Очищенные клеточные экстракты из половинного антитела с выступом вводили в 1 мл колонку HiTrap MABSELECT SURE™ компании GE Healthcare (Piscataway, N.J.) со скоростью 2 мл/мин. Загруженную колонку промывали 40 мМ цитрата натрия, рН 6,0, 125 мМ хлорида натрия и 5 мМ EDTA, соответствующими 10 объемам колонки (CV), затем 20 мМ цитрата натрия при рН 6,0, соответствующими 5 объемам колонки, чтобы облегчить улавливание в катионообменной колонке. Половинные антитела, захваченные в колонке для аффинной хроматографии, элюировали 0,2 мМ уксусной кислоты (рН 2-3), соответствующими 10 объемам колонки (CV).
Экспрессия половинных антител в клетках СНО
Создание экспрессирующих плазмид
Экспрессию кДНК тяжелых и легких цепей регулировали промотором и энхансером предраннего гена цитомегаловируса (CMV). После каждого сайта начала транскрипции CMV были расположены донорские и акцепторные сплайсирующие последовательности, определяющие интроны, удаляемые из конечных транскриптов (Lucas et al., High-level production of recombinant proteins in CHO cells using a dicistronic DHFR intron expression vector. Nucl. Acid. Res. (1996) 24: 1774-9). Фермент глутаминсинтетазу (GS) использовали в качестве селектируемого маркера для создания устойчивой линии клеток (Sanders et al., Amplification and cloning of the Chinese hamster glutamine synthetase gene. The EMBO J. (1984) 3: 65-71) и транскрипцию контролировали при помощи промотора и энхансера раннего гена SV40.
Культура клеток
Клетки СНО культивировали в соответствующей среде на основе DMEM/F12 в встряхиваемых колбах при 37°С и 5% СО2. Клетки пассировали с плотностью посева 3×105/мл через каждые три-четыре дня.
Устойчивая трансфекция
Клетки СНО трансфицировали липофектамином 2000 CD в соответствии с рекомендациями производителя (Invitrogen, Carlsbad, CA). Трансфицированные клетки центрифугировали и высевали в избирательную среду (без глутамина) на основе DMEM/F-12, содержащую метионинсульфоксимин (MSX) в разных концентрациях. Примерно через три недели после посева отдельные колонии переносили на 96-луночные планшеты. Перенесенные колонии оценивали в отношении продуцирования антитела, подвергая супернатант анализу методом ELISA. Лучшие колонии размножали и оценивали на основании титров антител, благоприятного метаболизма (в основном потребление лактата) и признаков приемлемого качестве продукта.
Экспрессия
Каждое половинное антитело экспрессировали в клетках СНО. Культуры объемом 2 л выращивали и собирали.
Очистка половинных антител
Каждое половинное антитело улавливали на колонке MABSELECT SURE™. Затем колонку промывали следующими буферами, соответствующими 4 объемам колонки: уравновешивающий буфер, состоящий из 50 мМ трис-буфера, рН 8,0, 150 мМ NaCl, и промывочный буфер, состоящий из 0,4 М фосфата калия, рН 7,0. Каждое плечо элюировали в 0,15 М ацетата натрия при рН 2,9.
Вышеописанные методы экспрессии и очистки половинных антител обычно пригодны для IgG, относящимся к разным изотипам.
Пример 2. Солюбилизатор и фиксация значения рН
В нижеследующем примере подробно описано, как инкубация половинных антител при среднем значении рН вызывает изменение конформации и повышает эффективность сборки и как добавление солюбилизатора, такого как аргинин и гистидин, уменьшает осаждение половинных антител при среднем значении рН.
Пулы половинных антител, очищенных протеином А, являются неустойчивыми из-за доступной внутренней поверхности СН2 и СН3 доменов, которые, по-видимому, содержат гидрофобные участки, обычно находящиеся на недоступной для растворителя поверхности антитела. Таким образом, при увеличении значения рН выше 4 пулы половинных антител, очищенных протеином А, имеют тенденцию осаждаться. Авторы настоящего изобретения обнаружили, что в присутствии L-аргинина в минимальной концентрации (в определенных примерах ≥50 мМ) происходила стабилизация половинных антител, которые оставались в растворе в процессе регулирования значения рН. Добавление солюбилизатора, такого как аргинин, удерживало половинное антитело в растворе, уменьшало мутность в процессе регулирования значения рН и повышало эффективность сборки биспецифического антитела. См. фигуру 3. Аргинин также защищал биспецифические половинные антитела и очищенные биспецифические антитела от агрегации во время замораживания. Аналогичное уменьшение осаждения также имело место при использовании гистидина.
Белок, выделенный из колонок с протеином А в примере 1, был использован в качестве исходного вещества в данном примере.
L-аргинин (1 М, рН 9) добавляли к белку, очищенному протеином А, до конечной концентрации, равной 50-600 мМ. Затем раствор при необходимости титровали до более высокого значения рН, используя 1,5 М трис-буфер с основанием, рН 11. Стадия увеличения показателя рН до среднего значения после элюирования кислотой из колонки с протеином А определяется как фиксация среднего значения рН.
Благодаря наличию мутаций “выступ в углубление” в СН3 домене биспецифические антитела имеют другую степень гибкости по сравнению со стандартными антителами. Вследствие такой уникальной гибкости и доступным внутренним поверхностям СН2 и СН3 доменов в половинных антителах, по-видимому, происходит изменение конформации при регулировании значения рН. См. фигуру 2. В данном эксперименте при увеличении значения рН выше 4 выступ из мономера превратился в нековалентно связанный гомодимер. См. фигуру 2В. В результате изменения конформации увеличился гидродинамический радиус углублений, о чем свидетельствуют результаты времени удерживания вытеснительной хроматографии. Изменение началось при рН 5 и закончилось при рН ≥7. См. фигуру 2А.
Вытеснительную хроматографию (SEC) с целью определения агрегации и олигомерного состояния антител выполняли при помощи ВЭЖХ. Антитела, очищенные протеином А, вводили в колонку Tosoh TSKgel SW2000 системы ВЭЖХ 1200 Agilent. Белок (половинное антитело IgG1, продуцированное в E.coli) элюировали 0,2 М K3РО4, 0,25 М KCl, рН 6,2, при скорости потока 0,5 мл/мин. Производили количественное определение элюированного белка на основании поглощения УФ-излучения и интеграции площадей пиков. См. фигуры 2А и В. Изменение конформации может представлять собой промежуточную укладку цепи, индуцированную изменением значения рН, что сообщает половинным антителам большую гибкость, в частности, половинным антителам, имеющим выступ и углубление вследствие мутаций в СН3 домене.
Однако фиксация среднего значения рН может привести к осаждению половинных антител. Как показано на фигуре 3А, присутствие аргинина уменьшает рН-индуцированную мутность половинных антитело IgG1 с выступом, очищенных протеином А. В данном эксперименте был использован 1 М аргинина для титрования рН в пулах половинных антител IgG1, очищенных протеином А, которые были продуцированы в E.coli. Конечная концентрация аргинина была равна примерно 50 мМ при титровании рН до 5,5, примерно 200 мМ при рН 7,5 и примерно 400 мМ при рН 8,5 (см. фигуру 3А). Присутствие аргинина также повышало на 15% эффективность сборки ”выступ в углубление” биспецифического антитела (данные не показаны).
Аналогичными образом гистидин уменьшал рН-индуцированную мутность вследствие осаждения. Половинное антитело IgG1 c ”выступом” было выделено из гомогената E.coli на колонке MABSELECT SURE™, в результате чего был получен пул половинных антител, очищенных протеином А, с концентрацией 12 г/л. Дополнительно добавляли четвертую часть объема гидрохлорида аргинина или гидрохлорида гистидина до конечной концентрации, равной 200 мМ, и эквивалентный объем очищенной воды. Значение рН в образце увеличивали, по каплям добавляя концентрированный раствор гидроксида натрия (50% раствор NaOH (мас./об.) или 19,1 н. раствор). Значение рН измеряли при помощи микрозонда Orion Ross 81-03. Мутность раствора измеряли при помощи лабораторного измерителя мутности Hach 2100.
Данные, представленные на фигуре 3В, показывают, что как аргинин (200 мМ), так и гистидин (200 мМ) уменьшают рН-индуцированное осаждение IgG1, выделенного из E.coli. Из вышеизложенного следует, что среднее значение рН вызывает изменение конформации половинного антитела, благоприятное для сборки биспецифического антитела, и добавление солюбилизатора на стадии фиксации среднего значения рН уменьшает осаждение, происходящее при среднем значении рН.
Пример 3. Восстановление
В нижеследующем примере подробно описано, каким образом использование восстановительных условий уменьшает агрегацию, в результате чего происходит образование требуемого гетеромультимера, например, биспецифического антитела. Например, глутатион, добавляемый в смесь для сборки белка, создает слабо восстановительные условия, которые являются благоприятными для сборки биспецифического антитела по типу ”выступ в углубление”. Другие восстановители подобного класса, такие как ВМЕА (бета-меркаптоэтиламин), могут оказывать такое же действие.
Во время сборки половинных антител, имеющих выступы и углубления, с образованием биспецифических антител может происходить агрегация антител. Повышение уровней глутатиона сводит к минимуму агрегацию в процессе сборки. В отличие от этого сильные восстановители, такие как DTT, используемые в высоких концентрациях, могут иногда увеличивать агрегацию. Не прибегая к каким-либо конкретным механизмам, можно предположить, что глутатион, по-видимому, не уменьшает число дисульфидных связей, а перемещает дисульфидные связи, действуя в качестве катализатора образования соответствующих дисульфидных связей. При сборке белка с использованием глутатиона не нужно производить буферный обмен с целью создания дисульфидных связей в шарнирной области представляющего интерес биспецифического продукта, как это необходимо для повторного окисления при использовании сильного восстановителя. Добавление химического реоксиданта не требуется при использовании слабого восстановителя, такого как глутатион.
Концентрации глутатиона могут быть выражены в виде молярности или молярного отношения к количеству шарнирсодерожащих полипептидов или половинных антител, присутствующих в смеси для сборки белка. Использование восстановителя в молярном отношении позволяет контролировать концентрацию белка в смеси для сборки белка, что предотвращает чрезмерное или недостаточное восстановление вследствие изменяющихся концентраций белка.
В данном примере глутатион добавляли в смесь половинных антител в 2-200-кратном молярном избытке. Образцы инкубировали при комнатной температуре в течение 46 часов. При выполнении высокоэффективной жидкостной хроматографии с обращенной фазой (ВЭЖХ) все образцы разбавляли 0,1% трифторуксусной кислотой до максимальной концентрации 1,0 мг/мл. Концентрацию белка определяли при помощи фотометрических измерений, выполняемых при 280 нм. Четыре образца 0,1% трифторуксусной кислоты вводили до анализа образцов. Благодаря этому было гарантировано полное уравновешивание колонки. Половинные антитела IgG1, очищенные протеином А, которые были продуцированы в E.coli, вводили в колонку Poros R2/20 с диаметром 2,1 мм × длиной 20 мм системы ВЭЖХ 1200 Agilent. Белок элюировали в линейным градиенте от 38-49% буфера А до 0,09% трифторуксусной кислоты, 80% ацетонитрила (буфер В) в течение 20 минут при скорости потока 0,5 мл/мин. Производили количественное определение элюированного белка на основании поглощения УФ-излучения и интеграции площадей пиков. Как показано на фигуре 4А, образование биспецифических антител увеличивалось при увеличении молярного соотношения глутатиона:антитела. См. фигуру 4А.
Вытеснительную хроматографию (SEC) выполняли с целью определения агрегации и олигомерного состояния антител. Половинные антитела, очищенные протеином А, которые были продуцированы в E.coli, вводили в колонку Tosoh TSKgel SW2000 системы ВЭЖХ 1200 Agilent. Белок элюировали 0,2 М K3РО4, 0,25 М KCl, рН 6,2, при скорости потока 0,5 мл/мин. Производили количественное определение элюированного белка на основании поглощения УФ-излучения и интеграции площадей пиков. Было установлено, что пик, равный 150 кДа, соответствовал образованию биспецифического антитела. См. фигуру 4В.
Как показано на фигуре 4, имеет место сдвиг пиков от нежелательных мономеров (то есть половинных антител, имевших выступ или углубление) и гомодимеров к гетеромультимеру, то есть биспецифическому антителу (фигура 4А и В). Из вышеизложенного следует, что увеличение молярного соотношения глутатиона и половинных антител уменьшает агрегацию и улучшает образование биспецифических антител (фигура 4В).
Пример 4. Температура
Данный пример иллюстрирует влияние температуры на устойчивость половинных антител и сборку гетеромультимера.
Температура раствора половинных антител оказывает сильное влияние на скорость сборки. Один пример более интенсивной сборки половинных антител IgG1, продуцированных в E.coli, при более высокой температуре показан на фигуре 5А.
Другой пример, показывающий влияние температуры на сборку биспецифических антител, представлен на фигуре 5В. В данном эксперименте два половинных антитела IgG1 были продуцированы в E.coli и очищены протеином А в соответствии с описанием, приведенным в примере 1. Половинные антитела объединяли и делили на четыре аликвоты для исследования сборки биспецифических антител в разных условиях при нагревании или без нагревания и/или фиксации среднего значения рН.
Как показано на фигуре 5В, 200-кратный молярный избыток глутатиона в разных условиях увеличивал скорость образования биспецифического антитела IgG1. В контрольных условиях (комнатная температура около 20°С, рН 4 половинного антитела, без фиксации среднего значения рН) сборка биспецифического антитела происходили с более низкой скоростью. Фиксация среднего значения рН (рН 5 для половинного антитела с выступом; рН 7 для половинного антитела с углублением) и выдерживание половинных антител, очищенных протеином А, в течение 16 часов при комнатной температуре увеличивало интенсивность образования биспецифического антитела без повышения температуры (как показано на фиг. 5В, смесь для сборки белка имела оптимизированное значения рН 8,5). Повышение температуры до 37°С без стадии фиксации среднего значения рН увеличивало скорость сборки биспецифического антитела по сравнению с контрольными условиями, которая была выше по сравнению со стадией фиксации среднего значения рН и сборкой при комнатной температуре. Однако еще более высокая скорость сборки имела место, когда половинные антитела, очищенные протеином А, выдерживали при среднем значении рН (как было указано выше) и затем собирали при рН 8,5 и повышенной температуре (то есть 37°С). В указанных условиях всего за 6 часов было собрано примерно 80% биспецифических антител (фигура 5В). Из вышеизложенного следует, что скорость сборки увеличивается в результате нагревания, фиксации значения рН, при этом нагревание оказывает синергическое воздействие на сборку.
Было установлено, что при нагревании сборка биспецифического антитела IgG4 также является более интенсивной. Данные, приведенные на фигуре 6В, показывают, что при нагревании в присутствии PVP и гистидина результаты сборки половинных антител IgG4, продуцированных в культуре E.coli, были аналогичны результатам сборки половинных антител IgG1, продуцированных в E.coli. Количество биспецифических антител анализировали при помощи ВЭЖХ с обращенной фазой в соответствии с приведенным выше описанием. Вместе взятые полученные данные показывают, что нагревание облегчает образование биспецифических антител.
Пример 5. Стабилизаторы
В нижеследующем примере подробно описано, каким образом стабилизаторы позволяют уменьшить агрегацию в результате нагревания и/или повышения значения рН в процессе сборки и/или фиксации среднего значения рН.
Поливинилпирролидон (PVP) является водорастворимым незаряженным полимером, включающим пирролидоновую группу. PVP уменьшал агрегацию во время сборки белка при нагревании. Не прибегая к каким-либо конкретными механизмам, можно отметить, что PVP позволяет стабилизировать укладку цепи биспецифического антитела или защитить половинные антитела от агрегации, вероятно, благодаря взаимодействию с гидрофобными участками биспецифического антитела.
Воздействие PVP на образование агрегатов анализировали при помощи SEC в условиях, описанных в примере 3. Содержание высокомолекулярных соединений (HMWS), присутствующих в пуле собранного белка, уменьшалось на 12% при добавлении 4% PVP (мас./об.) по сравнению с 4% без добавления PVP. См. фигуру 6А. Все образцы представляли собой IgG1, продуцированный в E.coli, который нагревали в присутствии 200 мМ аргинина.
Затем анализировали сборку биспецифического антитела IgG4. Как показано на фигуре 6В, нагревание смеси для сборки белка в присутствии PVP и гистидина значительно увеличивало выход биспецифического антитела IgG4, продуцированного в E.coli, до уровней, характерных для сборки IgG1, продуцированного в E.coli, при нагревании, как показано на фигуре 5А. Аргинин присутствовал в качестве солюбилизатора и титранта рН при выполнении сборки как при нагревании, так и при комнатной температуре. Помимо PVP, до выполнения стадии фиксации среднего значения рН и нагревания для стабилизации половинного антитела на данной стадии добавляли гистидин в качестве другого стабилизатора. Полученные результаты показывают, что PVP и гистидин повышали сборку биспецифического антитела IgG4 до уровней, характерных для сборки биспецифического антитела IgG1 (сравните фигуры 6В и 5В).
На фигуре 6С представлен еще один пример, в котором PVP сводит к минимуму образование HMWS во время сборки биспецифического антитела IgG4 при нагревании.
Нагревание пулов половинных антител, очищенных протеином А, ускоряет изменение конформации половинных антител при инкубации при среднем значении рН. Но нагревание может вызвать агрегацию особенно в случае сборки биспецифических антител IgG4 по типу ”выступ в углубление” из половинных антител IgG4, продуцированных в E.coli. Таким образом, во время сборки половинных антител IgG4 при нагревании добавляют дополнительный солюбилизатор и/или стабилизаторы.
Изменение конформации половинного антитела IgG4 с углублением, продуцированного в E.coli, было обнаружено после инкубации в течение 48 часов при комнатной температуре. Когда половинные антитела IgG4 с углублением инкубировали при 37°С, изменение конформации было обнаружено примерно через три часа (данные не показаны). Однако нагревание увеличивало агрегацию, о чем свидетельствовали результаты анализа SEC. См. фигуру 7, левый блок. В данном эксперименте при выполнении стадии фиксации среднего значения рН с нагреванием добавляли гистидин для исследования его влияния на уменьшение агрегации половинных антител. Как показано на фигуре 7, присутствие гистидина во время нагревания уменьшает агрегацию с 11% высокомолекулярных соединений (HMWS, без гистидина) до 6% HMWS (200 мМ гистидина), не влияя при этом на изменение конформации половинных антител. Полученные результаты показывают, что стабилизатор уменьшает образование агрегатов как во время сборки биспецифических антител, так и на стадии фиксации среднего значения рН половинных антител.
Пример 6. Сборка
В данном примере описана сборка иммуноглобулинов двух типичных изотипов, то есть IgG1 и IgG4. Половинные антитела была продуцированы в двух разных клетках-хозяевах, то есть в E.coli или СНО. Следует отметить, что методы, рассмотренные в настоящем описании изобретения, могут быть использованы для получения антител других изотипов, продуцированных в тех же или других источниках. Специалист в данной области может внести изменения в описанные методы путем обычного экспериментирования на основании данных, приведенных в научной литературе и представленных в настоящей заявке на патент.
Следует отметить, что антитело, содержащее половинное антитело, продуцированное в первой клетке-хозяине (например, СНО), может быть собрано с комплементарным половинными антителом, продуцированным во второй клетке-хозяине (например, E.coli) (данные не показаны). Таким образом, например, половинное антитело с выступом, продуцированное в СНО, может быть собрано с половинным антителом с углублением, продуцированным в E.coli, или наоборот.
Все четыре метода сборки, описанные в данном примере, позволили получить собранные антитела, которые были стабилизированы через 4 часа, образовали менее 10% агрегата и характеризовались минимальной агрегацией во время сборки.
А. IgG1 из E.coli
Изменение конформации половинных антител. Если значение рН пулов половинных антител, очищенных протеином А, было меньше 7, показатель рН обоих пулов половинных антител доводили до рН 7, используя 1 М аргинин (рН 9), после чего оба пула инкубировали при 37°С в течение 3 часов. Альтернативно пулы инкубировали при комнатной температуре в течение 48 часов. Если пулы уже имели значение рН 7 в течение 48 часов или более продолжительного периода времени, данную стадию пропускали. Производили количественное определение количества аргинина, добавляемого для получения раствора с рН 7.
Все еще теплые пулы объединяли и значение рН доводили до 8,5, добавляя 1 М аргинина (рН 9). Производили количественное определение количества аргинина, добавляемого на данной стадии.
Добавляли 2 М аргинина (рН 8,5) до достижения конечной концентрации аргинина, равной 0,5 М.
Добавляли 200 мМ восстановленного глутатиона (GSH) в 0,5 М аргинина (конечное значение рН 8,5) до достижения 200-кратного соотношения GSH:антитела (например, добавляли 6,88 мкл раствора глутатиона на каждый мг половинного антитела).
Половинное антитело в растворе глутатиона инкубировали при 37°С в течение 4 часов, в результате чего происходила сборка биспецифического антитела из половинных антител.
В. IgG1 из СНО
Сборку выполняли в соответствии с описанием, приведенным выше для E.coli. Значение рН можно не увеличивать до рН 7 или выше для фиксации среднего значения рН. Время сборки после добавления глутатиона может составлять 2 часа.
С. IgG4 из СНО
Сборку выполняли в вышеописанных условиях (IgG1 из СНО). Добавление гистидина и PVP является необязательным.
D. IgG4 из E.coli
Сборка IgG4, продуцированного в E.coli, вышеописанными методами вызывала образование большого количества агрегатов, то есть ~35%. Такой результат потребовал изменения условий сборки.
Было установлено, что приемлемые результаты могут быть получены при использовании пула половинных антител, очищенных протеином А, содержащего 0,2 М гистидина и 50 мМ аргинина (данные не показаны). Таким образом, было исследовано несколько способов достижения приемлемого конечного результата.
В первом методе во время очистки протеином А были изменены составы элюирующего буфера (рН 3) и промывочного буфера (рН 7), в которые было добавлено 0,2 М His и 50 мМ Arg. В результате этого конечный пул, очищенный протеином А, содержал 0,2 М His и 50 мМ Arg и имел значение рН 4, которое затем титровали до рН 8, добавляя 1,5 М трис-буфера с основанием. (рН 11).
Во втором альтернативном методе был использован 0,8 М раствор гидрохлорида гистидина (с растворимостью 0,8 М). В пул, очищенный протеином А, добавляли третью часть объема гидрохлорида гистидина до конечной концентрации 0,2 М His. Затем добавляли 1/40 часть объема 2 М Arg.
В третьем альтернативном методе был изменен состав буфера для пулов, очищенных протеином А, который содержал 0,2 М His и 50 мМ Arg (предпочтительно, при рН 8).
В последнем альтернативном методе гистидин добавляли непосредственно в пул, очищенный протеином А, (31,03 г/л), после чего добавляли 1/40 часть объема 2 М Arg.
К пулу, очищенному протеином А, добавляли четвертую часть объема 20% мас./об. раствора PVP K-15 Spectrum в 0,2 М гистидина и 50 мМ Arg.
Было отмечено, что PVP также сводил к минимуму агрегацию во время сборки IgG1 в условиях низкого содержания глутатиона.
Изменение конформации половинных антител. Значение рН пула, очищенного протеином А, доводили до рН 8,0, добавляя 1,5 М трис-буфера с основанием, содержащего 0,2 М гистидина, 50 мМ Arg и 4% PVP K-15 (рН 11), и инкубировали при 37°С в течение 3 часов. Альтернативно пул можно инкубировать при комнатной температуре в течение 48 часов.
Добавляли 200 мМ восстановленного глутатиона (GSH) в 0,2 М гистидина, 4% PVP, 50 мМ аргинина, конечное значение рН 8,0, до достижения 200-кратного соотношения GSH:антитела (например, добавляли 6,88 мкл раствора глутатиона на каждый мг половинного антитела). Если пулы половинных антител не были объединены ранее, то их объединяли на данной стадии.
Объединенные половинные антитела инкубировали при 37°С в течение 4 часов с образованием биспецифического антитела. В указанный период времени стабилизировался выход биспецифического антитела в процентном выражении.
После стабилизации количества биспецифического антитела раствор можно хранить при низкой температуре или довести до более низкого значения рН для выполнения последующих стадий хроматографической очистки.
Методы, рассмотренные в настоящем описании изобретения, находят применение при производстве терапевтических белков, таких как биспецифические антитела.
Следует отметить, что примеры и варианты осуществления изобретения, представленные в настоящем описании изобретения, приведены только в качестве иллюстрации и допускают возможность разных модификаций или изменений со стороны специалистов в данной области, при этом все модификации и изменения входят в объем заявки на патент и прилагаемой формулы изобретения. Все публикации, патенты и заявки на патенты, приведенные в настоящей заявке на патент, включены в настоящее описание изобретения в качестве ссылки в полном объеме.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ ГЕТЕРОМУЛЬТИМЕРНЫХ БЕЛКОВ | 2011 |
|
RU2624027C2 |
| ПОЛУЧЕНИЕ ГЕТЕРОМУЛЬТИМЕРНЫХ БЕЛКОВ С ИСПОЛЬЗОВАНИЕМ КЛЕТОК МЛЕКОПИТАЮЩИХ | 2015 |
|
RU2727012C2 |
| СОДЕРЖАЩИЕ СУПЕРСПИРАЛЬ И/ИЛИ ПРИВЯЗКУ БЕЛКОВЫЕ КОМПЛЕКСЫ И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2573915C2 |
| ОДНОЦЕПОЧЕЧНЫЕ АНТИТЕЛА И ДРУГИЕ ГЕТЕРОМУЛЬТИМЕРЫ | 2013 |
|
RU2644341C2 |
| СПОСОБ ПОЛИПЕПТИДНОЙ МОДИФИКАЦИИ ДЛЯ ОЧИСТКИ ПОЛИПЕПТИДНЫХ МУЛЬТИМЕРОВ | 2010 |
|
RU2606264C2 |
| ВЫСОКОКОНЦЕНТРИРОВАННЫЕ КОМПОЗИЦИИ АНТИТЕЛ И БЕЛКОВ | 2004 |
|
RU2332986C2 |
| БИСПЕЦИФИЧЕСКИЕ АСИММЕТРИЧНЫЕ ГЕТЕРОДИМЕРЫ, СОДЕРЖАЩИЕ АНТИ-CD3 КОНСТРУКЦИИ | 2013 |
|
RU2650868C2 |
| ПОЛУЧЕНИЕ БЕЛКОВ В КУЛЬТУРАЛЬНЫХ СРЕДАХ БЕЗ ГЛУТАМИНА | 2010 |
|
RU2639288C2 |
| СОСТАВЫ СО СНИЖЕННЫМ ОКИСЛЕНИЕМ | 2014 |
|
RU2707092C2 |
| РАЗРАБОТКА СТАБИЛЬНОГО ГЕТЕРОДИМЕРНОГО АНТИТЕЛА С МУТАЦИЯМИ В ДОМЕНЕ Fc | 2012 |
|
RU2675319C2 |

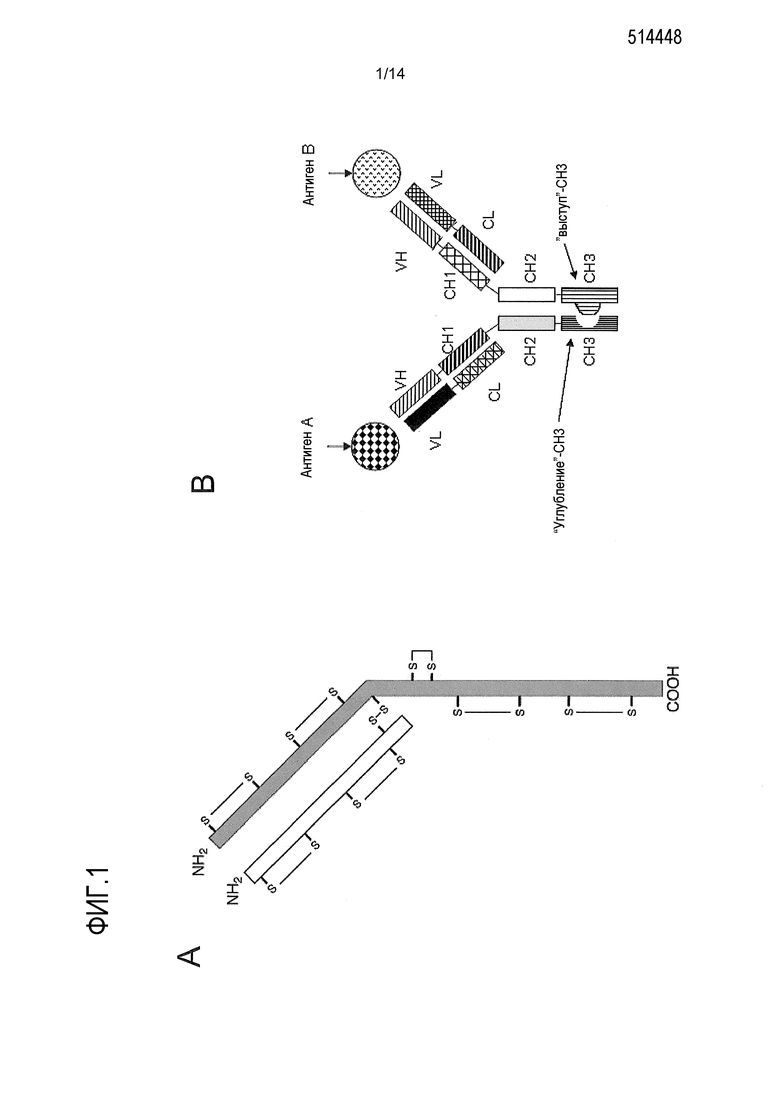
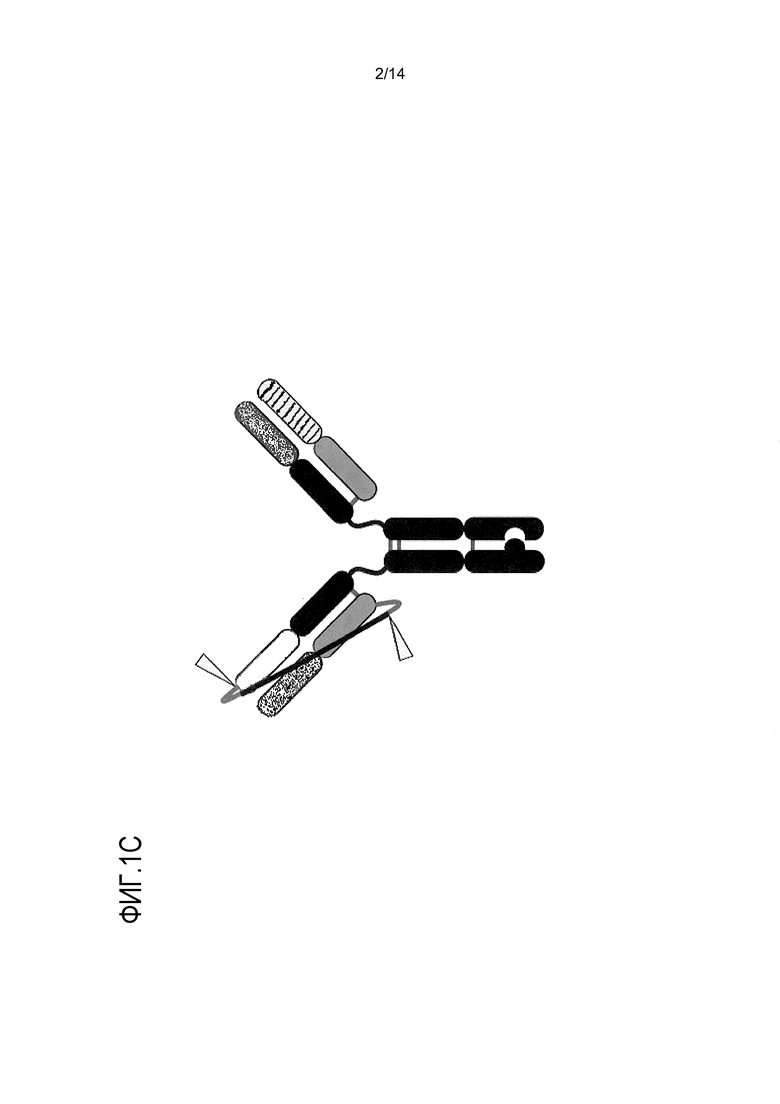
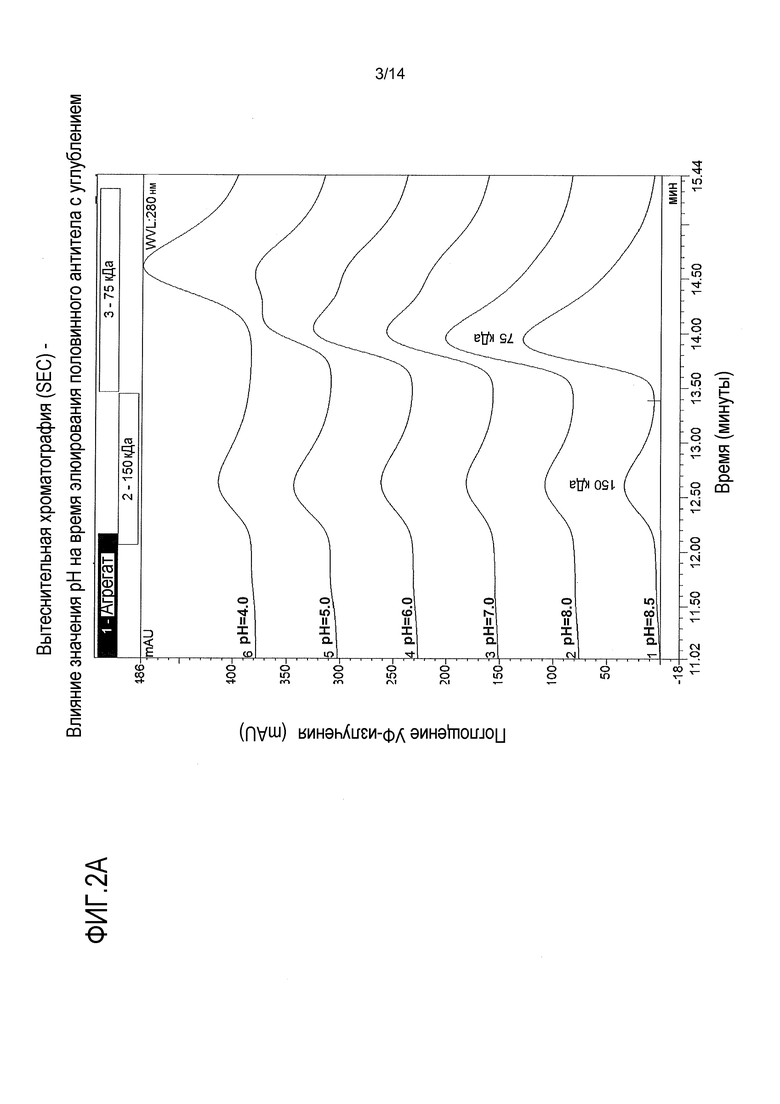
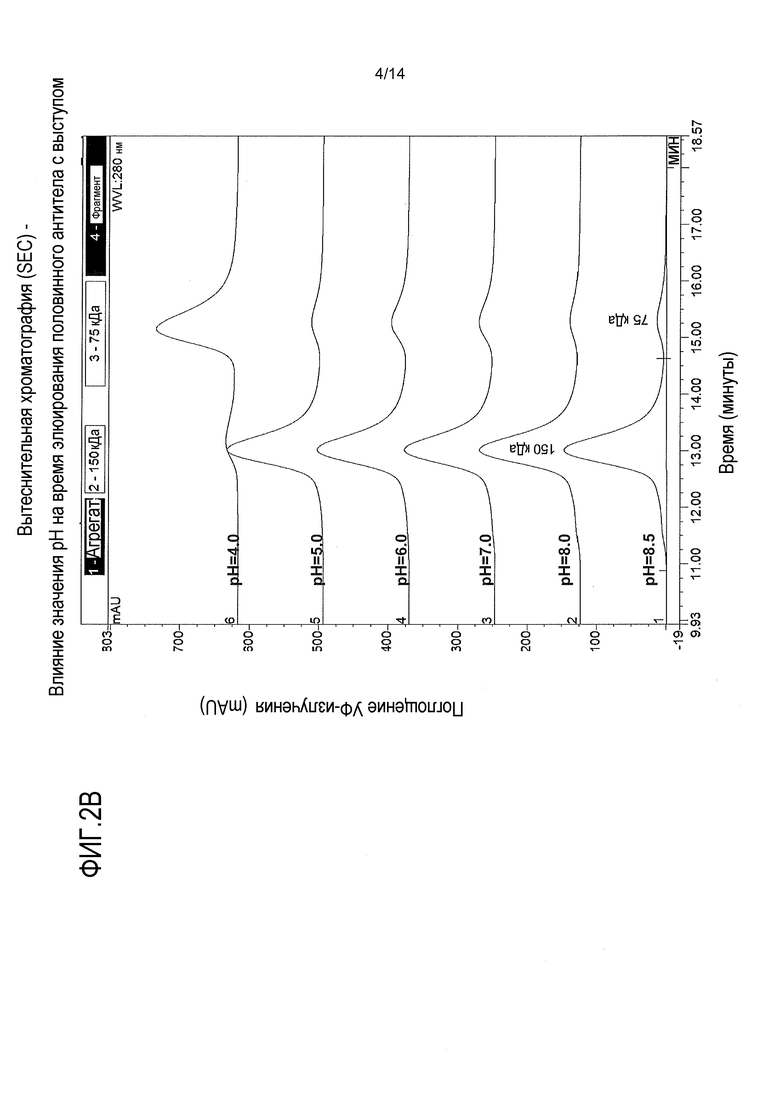

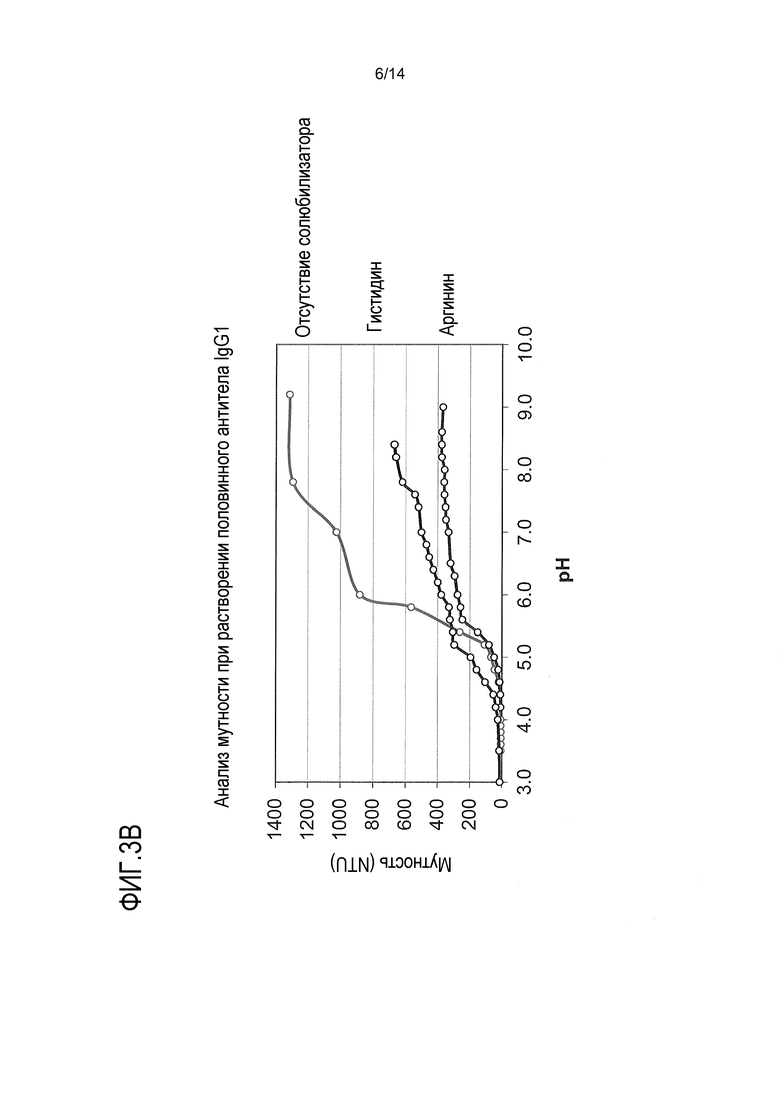
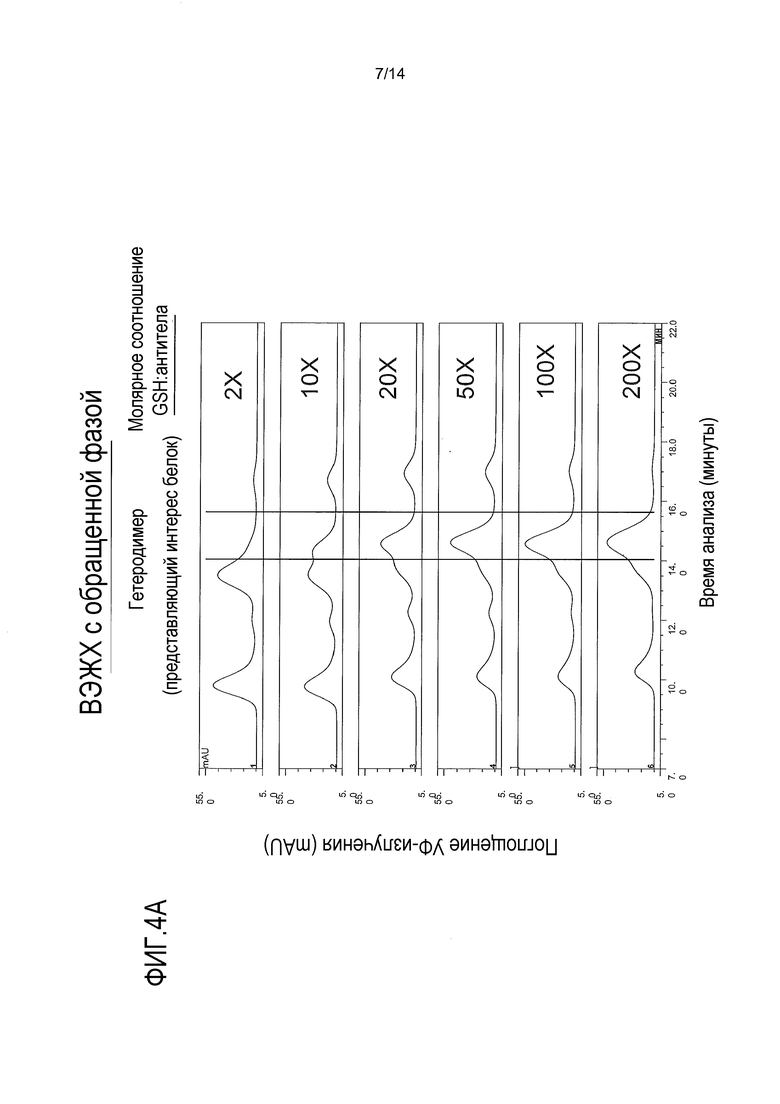
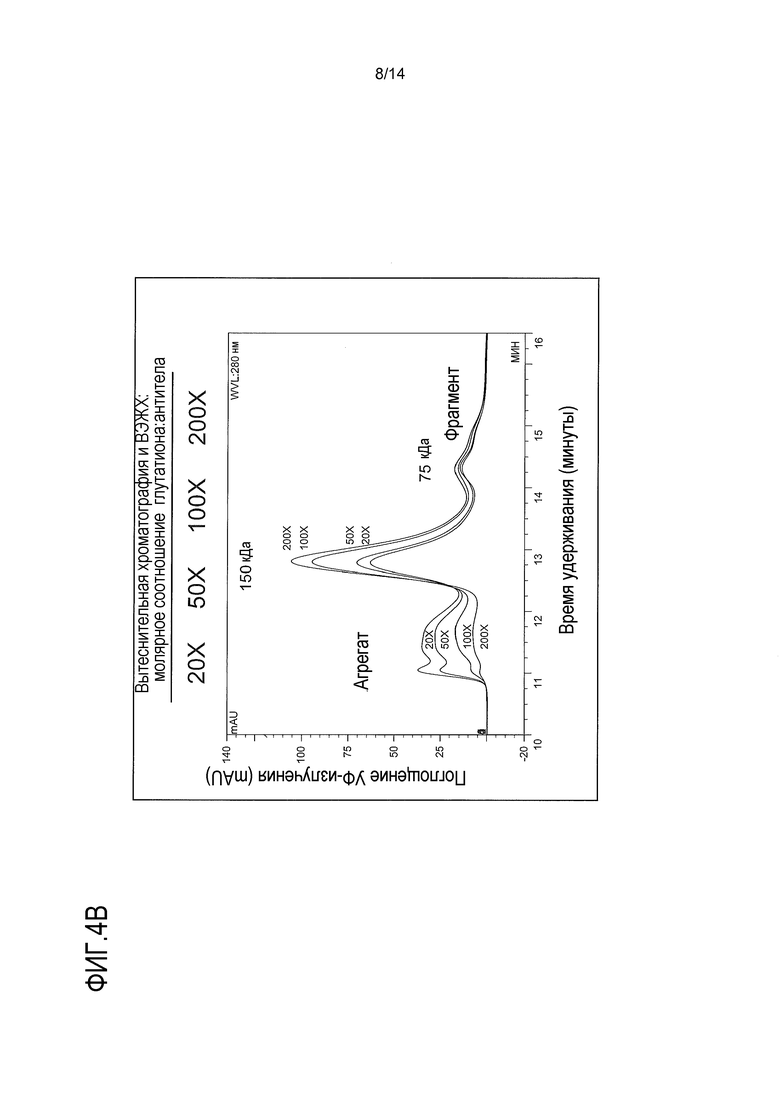
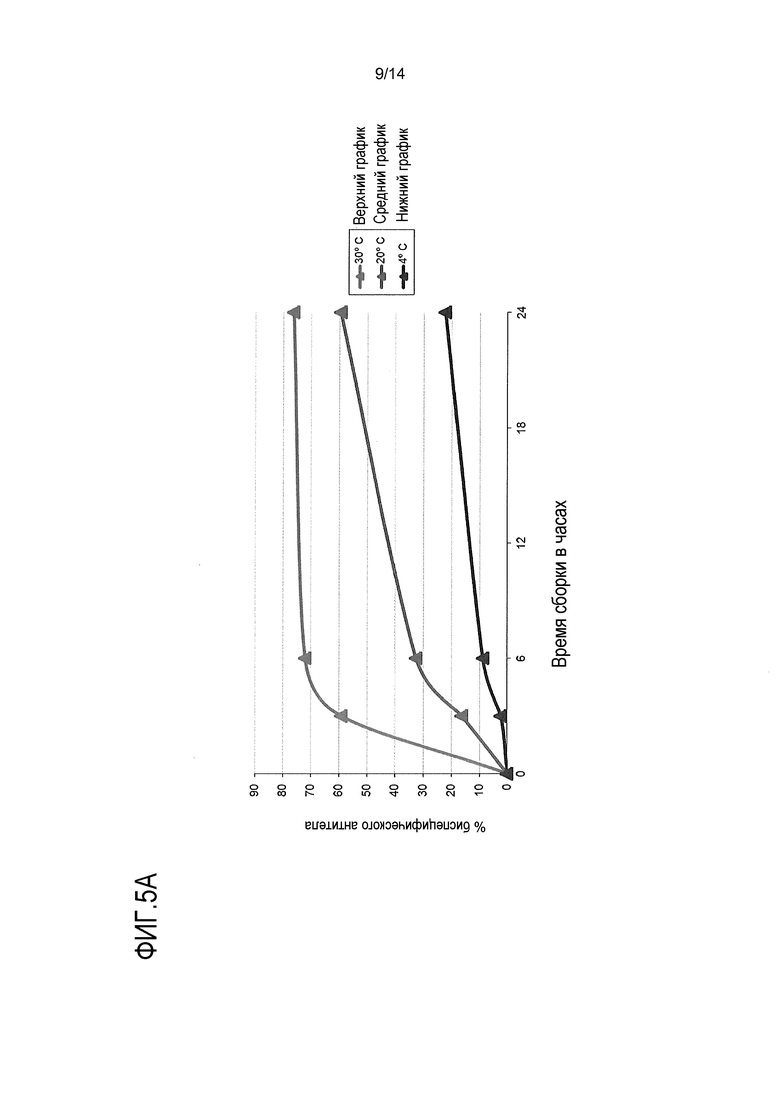
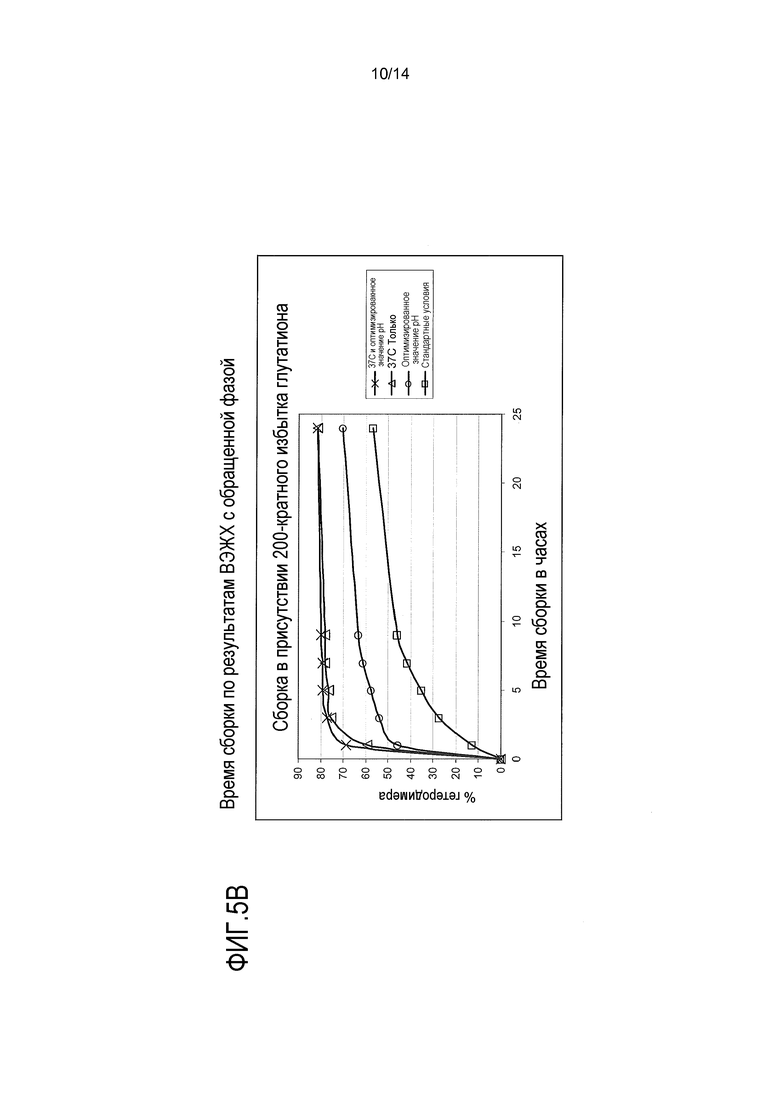
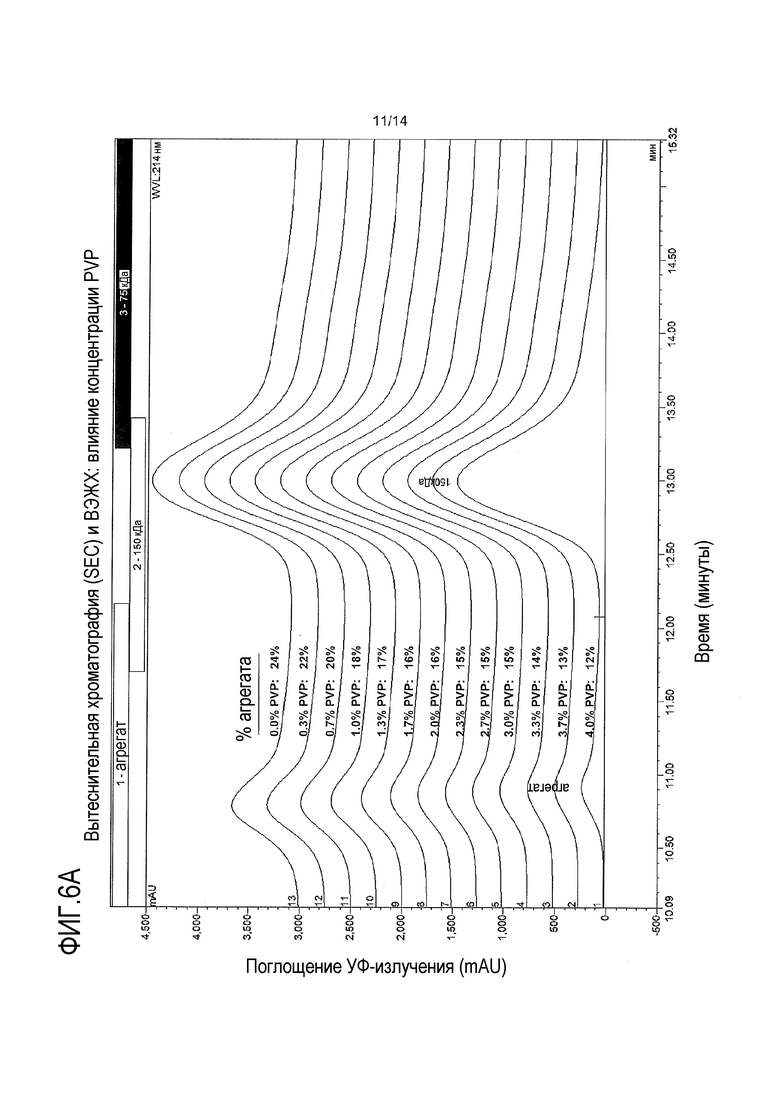
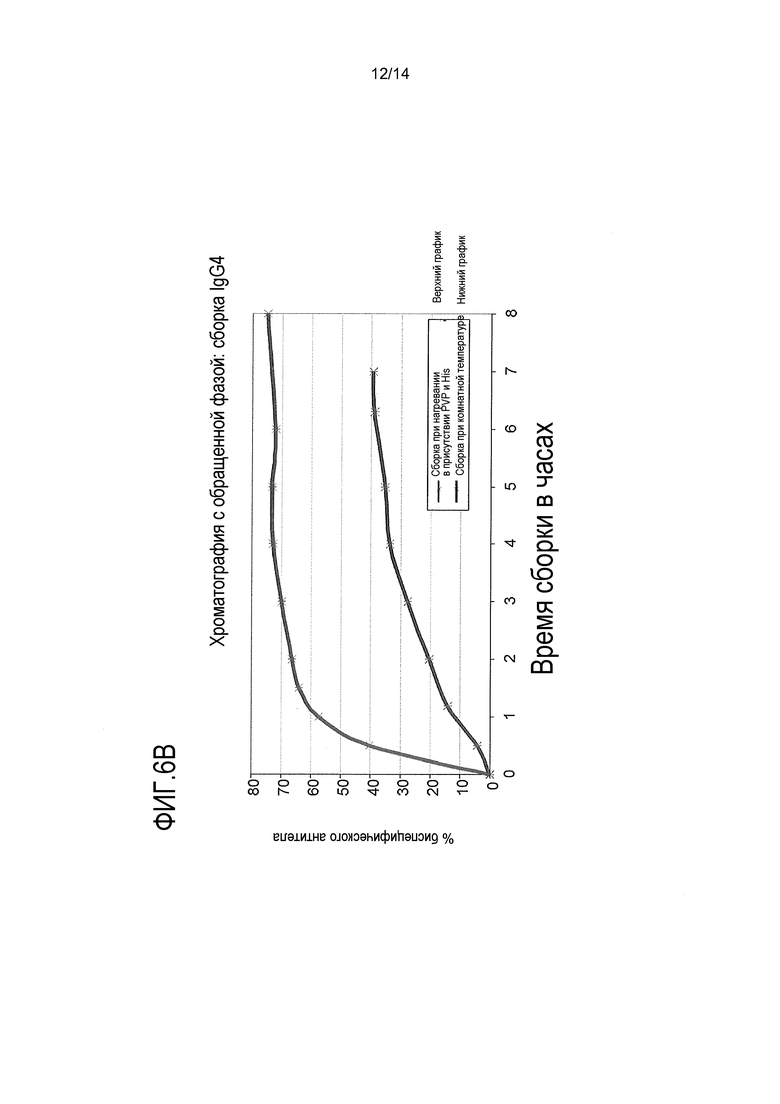
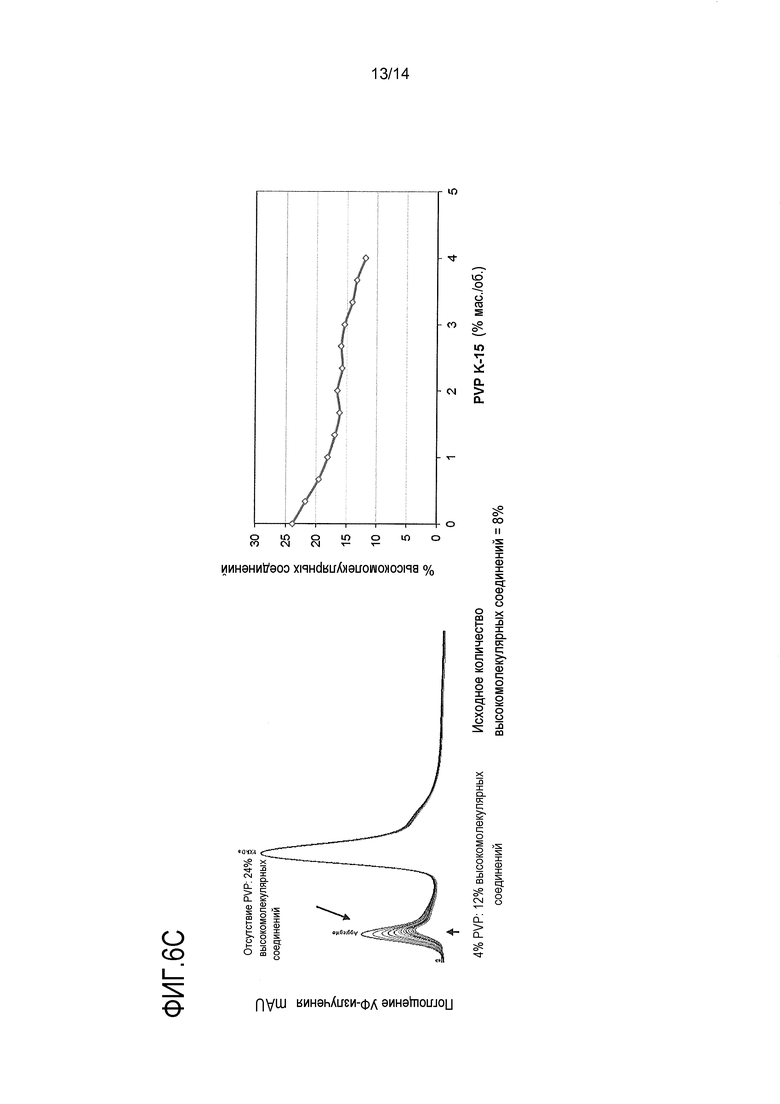
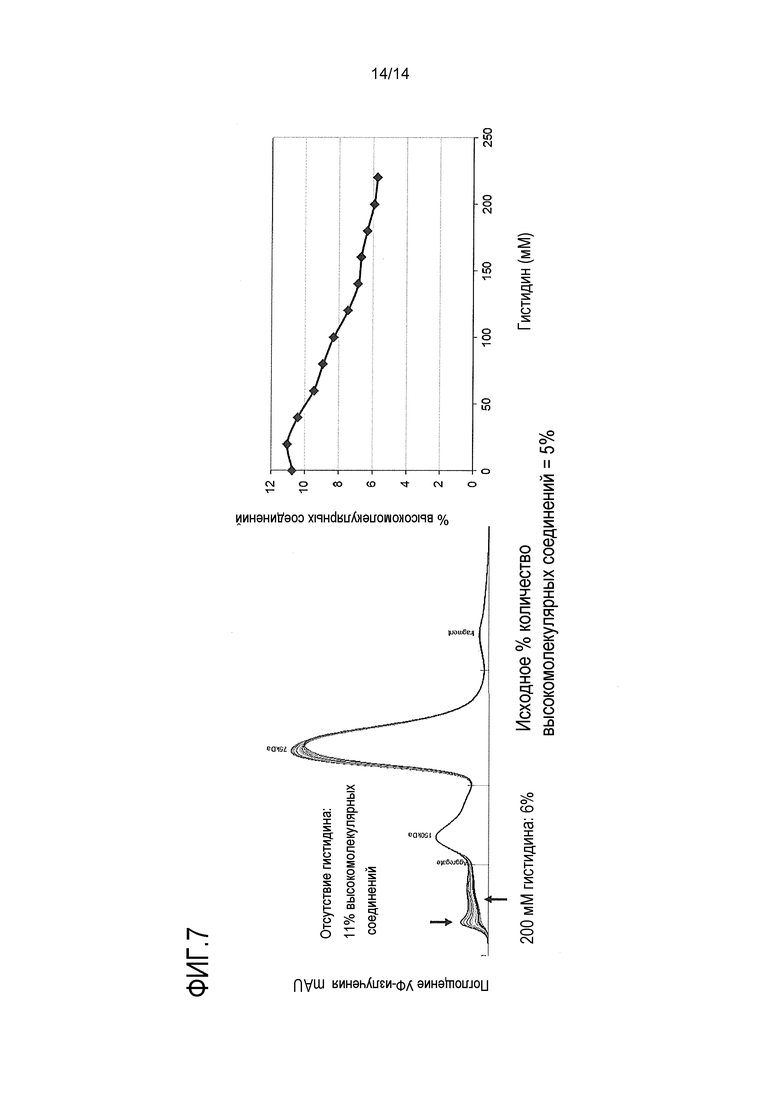
Изобретение относится к области биохимии, в частности к способу получения биспецифического антитела, который включает получение первого и второго половинных антител, доведение значения рН первого и второго половинных антител до рН 5-9; смешивание первого и второго половинных антител с образованием смеси для сборки белка, в которую добавляют избыток глутатиона, и инкубацию полученной смеси для сборки белка с образованием биспецифического антитела. Также раскрыт способ получения биспецифического антитела, который включает получение первого и второго половинных антител при pH 5-9 в присутствии аргинина или гистидина, смешивание первого и второго половинных антител с образованием смеси для сборки белка в восстановительных условиях и инкубацию смеси для сборки белка с образованием биспецифического антитела. Изобретение позволяет осуществлять улучшенную сборку гетеромультимерных белков, таких как биспецифические антитела, с более высоким выходом и эффективностью. 2 н. и 31 з.п. ф-лы, 7 ил., 1 табл., 6 пр.
1. Способ получения биспецифического антитела, который включает:
a) получение очищенного белком А первого половинного антитела, содержащего домен VL, домен VH и Fc-домен, где первое половинное антитело содержит выступ в Fc-домене;
b) получение очищенного белком А второго половинного антитела, содержащего домен VL, домен VH и Fc-домен, где второе половинное антитело содержит углубление в Fc-домене;
c) доведение значения рН каждого половинного антитела до pH 5-9;
d) смешивание первого и второго половинных антител с образованием смеси для сборки белка,
e) добавление в смесь для сборки белка 50-400-кратного молярного избытка глутатиона (GSH) по отношению к общему количеству половинных антител и
f) инкубацию смеси для сборки белка с образованием биспецифического антитела, содержащего первое и второе половинные антитела.
2. Способ по п.1, где на стадии c) pH первого и/или второго половинного антитела доводят до значения рН 5-9 в присутствии солюбилизатора.
3. Способ по п.2, где значение pH каждого половинного антитела на стадии с) доводят до pH 5-8.
4. Способ по п.1, где дополнительно pH доводят после смешивания.
5. Способ по п.3, дополнительно включающий инкубирование смеси для сборки белка при температуре от 15 до 39°C, предпочтительно 37°C, по меньшей мере 30 минут.
6. Способ по п.5, где смесь для сборки белка инкубируют при pH 8.
7. Способ по п.1, где смесь для сборки белка на стадии f) имеет окислительный потенциал от -200 до -600 мВ, более предпочтительно от -300 до -500 мВ, более предпочтительно приблизительно -400 мВ.
8. Способ по любому из пп.1-7, где GSH добавляют в смесь для сборки белка в 50-200-кратном молярном избытке.
9. Способ по любому из пп.1-7, где GSH добавляют в смесь для сборки белка в 100-300-кратном молярном избытке.
10. Способ по п.9, где смесь для сборки белка инкубируют при температуре от 15 до 39°C, предпочтительно при 37°C в присутствии стабилизатора, который представляет собой аргинин, гистидин или поливинилпирролидон (PVP).
11. Способ по п.10, где стабилизатор представляет собой PVP, добавленный до 40% (масс./об.).
12. Способ по любому из пп.1-7, где половинное антитело получают с помощью бактериальных клеток, дрожжевых клеток, бакуловируса или клеток млекопитающего.
13. Способ по п.12, где половинное антитело получают с помощью бактериальных клеток, предпочтительно клеток E. coli.
14. Способ по п.2, где солюбилизатор выбран из группы, состоящей из аргинина, гистидина и сахарозы.
15. Способ по п.2, где солюбилизатор представляет собой аргинин, соль аргинина или производное аргинина.
16. Способ по п.2, где солюбилизатор представляет собой гистидин, соль гистидина или производное гистидина.
17. Способ по п.14, где солюбилизатор присутствует в концентрации от 20 мM до 1 M.
18. Способ по п.14, где солюбилизатор присутствует в концентрации от 20 до 400 мМ.
19. Способ получения биспецифического антитела, который включает стадии:
a) получение первого половинного антитела, содержащего домен VL, домен VH и Fc-домен, при pH 5-9 в присутствии аргинина или гистидина, где первое половинное антитело содержит выступ в Fc-домене;
b) получение второго половинного антитела, содержащего домен VL, домен VH и Fc-домен, при pH 5-9 в присутствии аргинина или гистидина, где второе половинное антитело содержит углубление в Fc-домене;
c) смешивание первого и второго половинных антител с образованием смеси для сборки белка в восстановительных условиях, включающих 50-400-кратный молярный избыток глутатиона (GSH) по отношению к общему количеству половинных антител, и
d) инкубацию смеси для сборки белка с образованием биспецифического антитела, содержащего первое и второе половинные антитела, где первое половинное антитело взаимодействует со вторым половинным антителом в Fc-домене.
20. Способ по п.19, где аргинин или гистидин присутствует в концентрации от 20 до 400 мМ.
21. Способ по п.19, где первое половинное антитело и второе половинное антитело очищают до смешивания.
22. Способ по п.19, где первое и второе половинные антитела получают с помощью бактериальных клеток, дрожжевых клеток, бакуловируса или клеток млекопитающего.
23. Способ по п.22, где первое и второе половинные антитела получают с помощью клеток млекопитающего, предпочтительно клеток CHO.
24. Способ по п.22, где первое и второе половинные антитела получают с помощью бактериальных клеток, предпочтительно клеток E. coli.
25. Способ по п.19, где первое или второе половинные антитела представляет собой изотип IgG1, IgG2 или IgG4.
26. Способ по п.19, где одну или несколько стадий из a)-d) проводят при нагреве при температуре от 25 до 42°C, предпочтительно от 32 до 37°C.
27. Способ по п.26, где GSH добавляют в 50-200-кратном молярном избытке в смесь для сборки белка.
28. Способ по п.26, где GSH добавляют в 100-300-кратном молярном избытке в смесь для сборки белка.
29. Способ по п.19, 26, 27 или 28, дополнительно включающий стабилизацию на одной или нескольких стадиях из a)-d).
30. Способ по п.29, где стабилизатор добавляют на стадии c) или на стадии d).
31. Способ по п.30, где стабилизатор представляет собой аргинин, гистидин и/или PVP.
32. Способ по п.19, 26, 27 или 28, дополнительно включающий стадию выделения биспецифического антитела.
33. Способ по п.32, где стадия выделения биспецифического антитела включает очистку биспецифического антитела.
| WO 2007147901 A1, 27.12.2007 | |||
| US 7642228 B2, 05.01.2010 | |||
| ORCUT KELLY DAVIS, et al., A modular IgG-scFv bispecific antibody topology, Protein Eng Des Sel., 2010, 23(4), рр.221-228 | |||
| RU 94028282 А, 20.07.1996. |
Авторы
Даты
2018-05-21—Публикация
2012-10-11—Подача