Изобретение относится к области медицины, а именно к гинекологии и репродуктологи, эмбриологии, и может быть использовано в программах экстракорпорального оплодотворения (ЭКО) и переноса эмбрионов (ПЭ) с целью прогнозирования их исходов.
Современные знания и накопленный за последние два десятилетия опыт лечения бесплодия при стремительном прогрессе вспомогательных репродуктивных технологий (ВРТ) позволили достичь значительных успехов в этом направлении. Это стало возможным благодаря внедрению в программу ЭКО усовершенствованных индукторов суперовуляции, позволяющих достичь увеличения количества ооцитов, а также в результате улучшения качества культуральных сред.
В то же время репродуктологи неудовлетворены результатами программ экстракорпорального оплодотворения: частота наступления беременности после применения ЭКО и ПЭ даже в лучших клиниках мира не превышает 30% в расчете на один перенос эмбрионов и 10-15% на один стимулированный цикл (В.И. Кулаков, Б.В. Леонов, 1998).
По всей видимости эти мероприятия позволили приблизиться к определенному порогу эффективности, в связи с чем весьма актуален поиск новых путей, приводящих к улучшению результативности программ ЭКО и ПЭ.
Одним из путей дальнейшего повышения эффективности программ ЭКО может явиться разработка способов объективного контроля над отбором наиболее полноценных и перспективных эмбрионов для дальнейшей имплантации в матку.
Раннее выявление наиболее перспективных для имплантации эмбрионов имеет решающее значение, поскольку перенос ранних (дробящихся) эмбрионов в материнский организм повышает частоту имплантации и беременности.
Как известно, через 24-36 часов после оплодотворения происходит первое деление зиготы и с этого момента оплодотворенный ооцит становится 2-клеточным эмбрионом. Клетки эмбриона на этой стадии называются бластомерами.
На этой стадии можно оценить качество эмбриона по степени деформации, вакуолизации, фрагментации (объему эмбриона, занимаемому безъядерными фрагментами цитоплазмы), чем их больше - тем ниже считается потенциал этого эмбриона к имплантации и дальнейшему развитию. Помимо этих данных оцениваются форма и относительные размеры бластомеров.
Наиболее общепринятая классификация дробящихся эмбрионов по качеству - а - ab - b, где а - самый лучший, b - самый худший.
На 2-е сутки развития эмбрион человека состоит из 2-х, 3-х или 4-х бластомеров.
Еще через сутки эмбрион в норме уже состоит из 6-8 бластомеров, однако допускается и 4 бластомера, если на 2-е сутки эмбрион был 2-клеточным. До 8-клеточной стадии все клетки эмбриона человека тотипотентны, т.е. каждая из них может дать начало целому организму.
На 4-е сутки развития эмбрион человека состоит уже, как правило, из 8-16 клеток, начинается стадия морулы. Именно на этой стадии in vivo эмбрион попадает из маточной трубы в полость матки. Морулы также различаются между собой по степени компактизации бластомеров (С1 - С2 - С3 - С4).
К концу 4-х суток развития внутри морулы постепенно образуется полость - начинается процесс кавитации.
С того момента, как полость внутри морулы достигает 50% ее объема, эмбрион называется бластоцистой. Чем больше полость бластоцисты и лучше развита внутренняя клеточная масса и трофобласт, тем больше ее потенциал к имплантации.
На этой стадии также можно оценить качество эмбриона по степени деформации, вакуолизации, фрагментации. Кроме этого, оценивается форма и относительные размеры бластомеров.
Наиболее общепринятая классификация дробящихся эмбрионов на 5 дне развития по качеству - А - В - С, где А - самый лучший, С - самый худший. Применяется двухбуквенное обозначение - одна для трофобласта, другая - для эмбриобласта.
В дальнейшем эмбрион начинает увеличиваться в размерах. При этом бластомеры продолжают делиться.
Когда полость бластоцисты достигает значительного размера, истончившаяся за счет растяжения блестящая оболочка разрывается и начинается процесс хэтчинга (выклева) эмбриона из блестящей оболочки.
Только после окончания этого процесса бластоциста способна имплантироваться (прикрепиться) в эндометрий матки. Имплантация происходит, как правило, на 6-7 день развития эмбриона, считая день оплодотворения нулевым.
Иногда бывает невозможно установить резкие разграничительные линии между теми или иными вариантами развития эмбриона. Поэтому вышеприведенная классификация относительна, приблизительна.
Из уровня техники известен способ определения перспективности эмбрионов по изменению светопроницаемости активных зон эмбриона, связанных со спонтанным делением отдельных бластомеров [1].
Известны способы, при которых перспективных эмбрионов выбирают на основании времени деления [2], экспрессии эмбрионом одного или более микроРНК [3], на основании измерения уровня экспрессии 45 генов, вследствие чего прогнозируют скорость последующей имплантации [7], на основании количества и размера бластомеров на второй или третий день, а также по проценту фрагментации и наличию мультинуклеации в стадии 4-х или 8-ми клеток [8].
Наиболее близким (прототипом) к предлагаемому способу мы считаем способ определения in vitro перспективных эмбрионов для последующей имплантации в матку при проведении процедуры экстракорпорального оплодотворения (ЭКО), основанный на определении пространственного распределения бластомеров (J Cell Sci. 2005 Feb 1; 118 (Pt 3): 505-15. Epub 2005 Jan 18., Down regulation of Par3 and aPKC function directs cells towards the ICM in the preimplantation mouse embryo., Plusa B1, Frankenberg S, Chalmers A, Hadjantonakis AK, Moore CA, Papalopulu N, Papaioannou VE, Glover DM, Zernicka-Goetz M.).
Однако в данном источнике информации отсутствуют сведения о возможности выбора перспективных эмбрионов в соответствии с тем, в какой плоскостной последовательности осуществляется второе деление дробления бластомеров на стадии 2-клеточного эмбриона. Кроме того, данный способ был осуществлен на мышах. Мы же предлагаем методику определения in vitro перспективных эмбрионов для последующей имплантации в матку при проведении процедуры экстракорпорального оплодотворения (ЭКО) у человека.
Далее решение поясняется ссылками на чертежи, на которых приведено следующее:
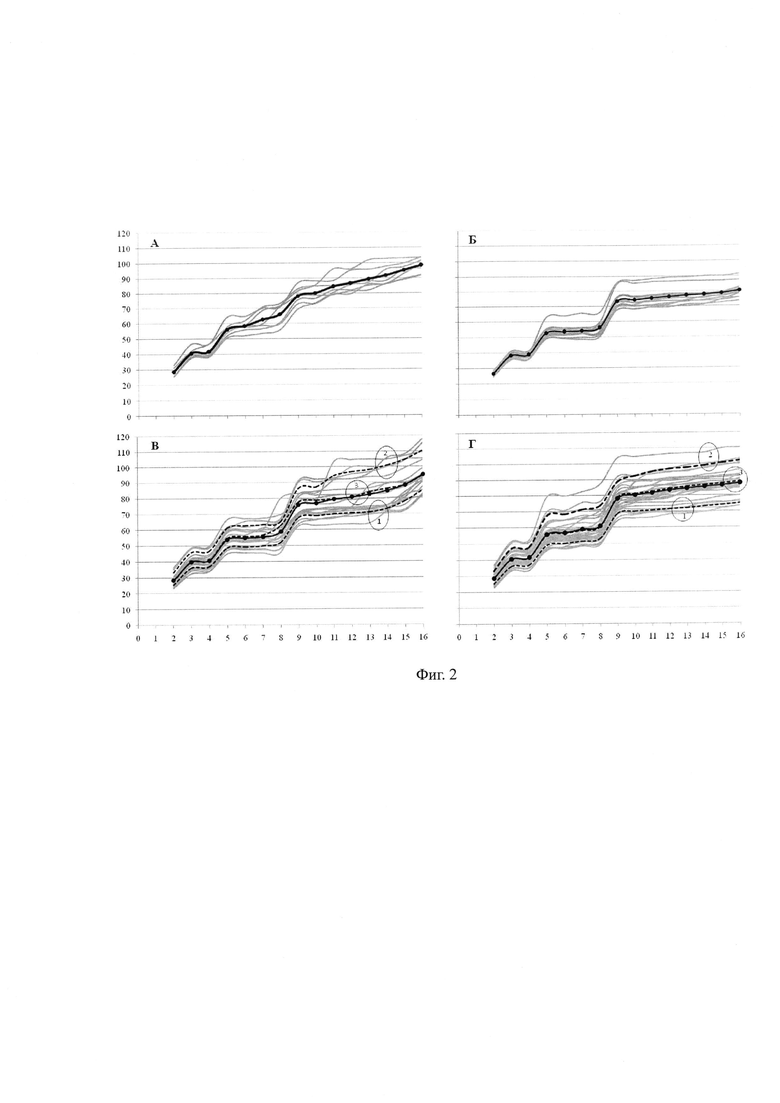
На фиг. 1. показано становление универсальной тетраэдрической формы 4-клеточных эмбрионов в результате последовательных экваториальных (А), меридиональных (Б) и меридионального и экваториального (В) делений во втором цикле дробления. Вариант экваториального и меридионального деления (не представлен) отличается от варианта ME только последовательностью делений. Время после внутриклеточной инъекции сперматозоида (ч : мин) указано в поле изображений. Звездочкой обозначено второе полярное тельце.
На фиг. 2 показаны траектории развития отдельных зародышей (линии серого цвета), сгруппированные в соответствии с порядком и ориентацией плоскостей деления во втором цикле дробления: последовательные экваториальные и меридиональные (А и Б), меридиональное и экваториальное (В) и экваториальное и меридиональное (Г) деления бластомеров 2-клеточных зародышей. Сплошные контрастные линии с маркерами - усредненные траектории развития. Эллипсы на фиг. В и Г указывают группировку траекторий отдельных зародышей в соответствии с темпами развития: 1 - высоким, 2 - низким, 3 - промежуточным. Пунктирные контрастные линии - усредненные траектории развития для каждой из различающихся темпом развития групп. Горизонтальная ось - число бластомеров в зародыше (порядок появления бластомеров); вертикальная ось - время post-ICSI., ч.
В таблице 1 одинаковыми надстрочными цифрами указаны статистически значимые различия средних значений (критерий Ван дер Вардена, Р<0,05).
1) В - стадия бластоцисты; М - стадия морулы; цифрами указаны градации эмбрионов на стадии бластоцисты; в скобках указана численность эмбрионов, достигших указанной стадии.
2) Значения средних времен между последовательными делениями бластомеров различаются между собой так же (и с той же значимостью), как продолжительности периодов делений бластомеров.
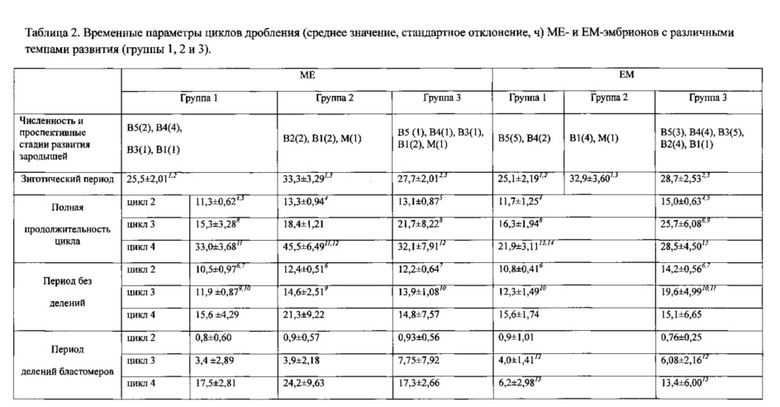
В таблице 2 обозначения те же, что в таблице 1.
Способ осуществляют следующим образом.
Этические нормы и юридические ограничения позволяют использование только неинвазивных методов исследования концептусов, т.е. только микроскопические наблюдения (исключая вмешательства при необходимости генетического анализа эмбриона). В этой связи анализируются цейтраферные видеорегистрации развития эмбрионов человека (например, при использовании микроскопа Primo Vision, помещенного в термостат Thermo; возможно использование иных промышленно выпускаемых устройств - EmbryoScope, Eeva и т.д.), полученные в рамках стандартного протокола культивирования.
Анализ цейтраферной видеозаписи развития эмбрионов человека при стандартных (общепринятых) условиях культивировании in vitro. В частности, определение вариантов делений бластомеров 2-клеточных зародышей. Для этого на последовательных кадрах определяют: 1) положение второго направительного тельца, т.е. анимальный полюс зиготы, 2) ориентацию плоскости первого деления дробления, которую в норме полагают меридионально направленной, т.е. рассекающей зиготу от анимального к вегетативному полюсам; 3) определяют плоскость дробления каждого из двух бластомеров: горизонтальная (экваториальная - Е) или вертикальная (меридиональная - М); 4) определяют последовательность вторых делений дробления в этих плоскостях, которые могут быть: последовательные экваториальные (ЕЕ), последовательные меридиональные (ММ), меридиональное затем экваториальное (ME), экваториальное затем меридиональное (ЕМ) (фиг. 1).
Если последовательность вторых делений дробления в этих плоскостях соответствует (ЕМ) или (ММ), то такие эмбрионы считают перспективными для последующей имплантации в матку при проведении процедуры ЭКО.
ЕЕ, MM, ME и ЕМ варианты второго деления встречаются у 10.3, 19.1, 27.9 и 42.6% эмбрионов соответственно, развивавшихся без структурных аномалий (N=68). Частоты встречаемости ЕЕ, ММ, ME и ЕМ вариантов у эмбрионов со структурными дефектами равны 30.3, 15.2, 24.2 и 30.3% соответственно (N=33). Частота EE-вариантов деления у аномальных эмбрионов имеет явную тенденцию к превышению (почти втрое) таковой у нормальных эмбрионов (x2= 4.30, Р=0.038; Р с поправкой Йеитса равно 0.072). Таким образом, EE-эмбрионы склонны к органическим нарушениям развития в большей мере, чем эмбрионы с иными вариантами вторых делений дробления.
Соответственно, эмбрионы с ЕЕ вариантом второго деления дробления следует полагать наименее перспективными для переноса и как минимум должны быть предметом особого внимания врача-эмбриолога.
Хорошо известно, что в целом для имплантационно-успешных бластоцист характерен высокий темп дробления [23]. Однако из практики культивирования эмбрионов следует, что морфологически (и генетически) безупречные, быстро дробящиеся эмбрионы отнюдь не всегда формируют безупречную бластоцисту; и наоборот - дробящиеся в умеренном темпе эмбрионы нередко превращаются в хрестоматийно идеальную бластоцисту. Динамика развития эмбрионов человека с разными вариантами второго деления дробления существенно отличается как параметрами циклов дробления, так и продолжительностями циклов бластомеров (фиг. 2).
Для EE-эмбрионов характерна сглаженная «волнообразная» временная траектория развития. У MM-, ME- и ЕМ-эмбрионов ярче выражена «ступенеобразная» траектория (фиг. 2). Усредненные временные траектории (см. фиг. 2) различаются между собой (парный критерий Вилкоксона; значимости различий (Р) между ЕЕ- и ММ-, ЕЕ- и ЕМ-, ММ- и МЕ-, ММ- и ЕМ-вариантами равны 0.001; значимости различий между ЕЕ- и ЕМ- - 0.002; между ME- и ЕМ-вариантами - 0.023).
Различия продолжительности циклов дробления становятся явными в третьем цикле и усугубляются в 4-м цикле дробления. Наиболее продолжительны циклы у ЕЕ-, наименее - у ММ-эмбрионов. ЕМ- и МЕ-эмбрионы занимают промежуточное положение. Удлинение полных циклов дробления связано, главным образом, с удлинением периодов клеточных делений. Соответственно, частота делений максимальна у ММ- и минимальна у EE-эмбрионов (табл. 1). ММ-эмбрионы достигают стадии 16 клеток через 80.5±4.85 ч (среднее и стандартное отклонение); ЕМ-эмбрионы - через 87.7±9.47 ч, a ME- и EE-эмбрионы - через 94.8±11,29 и 98.1±5,05 ч (различия средних величин статистически значимы, за исключением таковых для ЕЕ и ME групп (Р=0.197); критерий Ван дер Вардена).
Таким образом, в соответствии со снижением темпов дробления эмбрионы с разными вариантами второго деления дробления можно ранжировать следующим образом: MM, ЕМ, ME, ЕЕ.
Однако частоты превращения эмбрионов с различными вариантами второго деления дробления в имплантационно-компетентные бластоцисты не различаются.
Причина последнего кроется в вариабельности траекторий развития у ME- и ЕМ-эмбрионов, которая заметнее, чем у ЕЕ- и ММ-эмбрионов (см. фиг. 2; сравните соответствующие значения стандартных отклонений, представленные в табл. 1).
ME- и ЕМ-эмбрионы возможно распределить в три группы в соответствии со сходством траекторий (фиг. 2, В, Г). Усредненные траектории развития как МЕ-, так и ЕМ-эмбрионов из разных групп значимо различаются между собой (Р=0.0007 для всех вариантов сравнений, парный критерий Вилкоксона). Эмбрионы второй группы отличаются большей продолжительностью циклов. Циклы дробления у эмбрионов третьих групп могут быть сравнимыми или превышать по продолжительности соответствующие циклы эмбрионов из первых групп, а в отдельных случаях - циклы эмбрионов из вторых групп (см. детали в табл. 2).
МЕ-эмбрионы первой, второй и третьей групп достигают 16-клеточной стадии развития через 85.1±4.28 (среднее значение ± стандартной отклонение), 110.5±6.10 и 94.6±2.57 ч; ЕМ-эмбрионы - через 74.9±3.10, 102.1±5.20 и 88.8±3.05 ч соответственно. Различия этих показателей статистически достоверны (критерий Ван дер Вардена, Р=0.001, 0.024 и 0.001). В то же время усредненные траектории развития ME- и ЕМ-эмбрионов первой, второй и третьей групп не различаются (парный критерий Вилкоксона; Р=0.256, 0.158 и 0.112 соответственно).
К завершению срока регистрации эмбрионы из разных групп достигли разных стадий развития (табл. 2). Первые группы объединяют эмбрионы, сформировавшие развитые бластоцисты (градации 4 и 5). Вторые группы включают медленно развивавшихся эмбрионов, которые достигли стадии морулы или начинающей кавитировать бластоцисту. Третьи группы разнородны, поскольку к концу наблюдений составляющие их эмбрионы демонстрируют весь спектр градаций бластоцист, хотя большую часть составляют бластоцисты 2-й и 3-й градаций (табл. 2).
Сопоставление альтернативных распределений (численности эмбрионов, достигших градаций 5 и 4, с численностью более ранних эмбрионов в конце срока регистраций) демонстрирует явное доминирование продвинутых в развитии как МЕ-, так и ЕМ-эмбрионов в группе 1 и, соответственно, доминирование отстающих в развитии зародышей в группе 2 (двусторонний точный критерий Фишера, Р=0.021 и 0.001). Такое же сопоставление для групп 1 и 3 показало значимое различие альтернативных распределений у ЕМ-эмбрионов (Р=0.019), но сходство у МЕ-эмбрионов (Р=0.277).
Срок развития ММ-эмбрионов до 16-клеточной стадии занимает промежуточное положение между соответствующими показателями для ME- и ЕМ-эмбрионов из первых групп, значимо короче первого (критерий Ван дер Вардена, Р=0.017), но длиннее второго (Р=0.001) показателя. Усредненная траектория дробления ММ-эмбрионов отличается от таковых у ME- и ЕМ-эмбрионов из первых групп (парный критерий Вилкоксона, Р=0.001 и 0.000 соответственно).
Альтернативное распределение (продвинутые против отстающих в развитии) в группе ММ не отличается от аналогичных распределений в первых группах МЕ-и ЕМ-эмбрионов (точный критерий Фишера, Р=0.590 и 0.148), но отличается от распределений во вторых группах (Р=0.015 для обоих сравнений).
Представленный выше анализ позволяет полагать, что эмбрионы с ЕМ- и ММ-вариантами второго деления дробления более успешны (приблизительно в два раза) в формировании развитой бластоцисты, в сравнении с эмбрионами с ME- и ЕЕ- вариантами дробления. Иными словами, дифференциация вариантов второго деления дробления позволяет выявить a priori зародыши, наиболее перспективные для формирования имплантационно-компетентых бластоцист.
На основании проведенных нами исследований, технический результат предлагаемого изобретения заключается в наиболее раннем и точном определении самых качественных, а соответственно, наиболее перспективных для формирования имплантационно-компетентных бластоцист для последующей имплантации в матку в рамках протокола ЭКО за счет того, что эмбрионы с последовательностью вторых делений дробления в плоскостях: экваториальное затем меридиональное (ЕМ) или последовательное меридиональное (ММ) менее всего склонны к органическим нарушениям, а следовательно, позволят получить желаемую беременность и в последующем приведут к рождению здорового ребенка.
Пример 1
Больная Г-р, поступила в Центр репродукции человека с целью проведения ей программы ЭКО и ПЭ. Больная предъявляет жалобы на бесплодие в течение 11 лет. Из анамнеза известно, что больная в 1989 г. перенесла операцию по поводу СПКЯ (без эффекта), а в 1998 г. лапароскопию по поводу спаечного процесса органов малого таза 3-4 степени, двустороннего сальпингита. Несмотря на проведенный объем операции - разъединение спаек органов малого таза и брюшной полости, сальпингоовариолизиса, восстановить проходимость маточных труб не удалось.
При дополнительном обследовании эндокринологом выявлены: гипоталамический синдром; гипофункция яичников; галакторрея. Проведена коррекция эндокринных нарушений.
На этапе обследования перед программой ЭКО выявлен уреаплазмоз, проведено противовоспалительное лечение (с эффектом).
На фоне стимуляции суперовуляции (Хумегон 75ЕД+75ЕД 12 ампул, кломифенцитрат по 100 мг в сутки 5 дней) момент назначения ХГ определяли в зависимости от срока достижения лидирующим фолликулом диаметра не менее 18 мм или 2-3 фолликулами не менее 17 мм. Овуляторная доза Претила составила 10 тысяч ЕД.
При УЗ-исследовании на момент проведения пункции фолликулов было зарегистрировано 5 лидирующих фолликулов в левом яичнике и 2 в правом. Толщина эндометрия составила 9 мм.
Аспирацию ооцитов и фолликулярной жидкости производят через 36 часов после введения овуляторной дозы ХГ раздельно из правого и левого яичников. С целью получения ооцитов и фолликулярной жидкости из фолликулов яичников производят трансвагинальную пункцию с помощью влагалищного пункционного датчика с частотой 5 МГц ультразвукового аппарата Aloka SSD-500.
Больной была произведена пункция фолликулов и аспирация преовуляторных ооцитов и фолликулярной жидкости. При пункции фолликулов из левого яичника было получено 3 ооцита, из правого яичника 1.
Полученные преовуляторные ооциты из правого и левого яичников культивируют в специальных термостатах при температуре 37°C при смеси 5% CO2 в воздухе в питательной среде Менезо В2.
В фолликулярной жидкости, аспирированной в момент пункции правого и левого яичников, определяют активность протеолитических ферментов (кислых пептид-гидролаз) по нарастанию кислоторастворимых фолинположительных соединений. Субстратом для определения активности ферментов служит лиофилизированный гемоглобин.
Фолликулярную жидкость наливают в 2 пробирки по 1 мл (контрольную и опытную) и в них добавляют по 0,5 мл 1% раствора лиофилизированного коммерческого гемоглобина, приготовленного на ацетатном буфере (0,2 М СН3 COONA и 0,2 М СН3 СООН) рН 4,2. После этого в контрольную пробу приливают 1,5 мл 10% раствора ТХУ, а опытную помещают в термостат при температуре 37°C на 1 час и по окончании инкубации прибавляют 1,5 мл 10% ТХУ. Затем пробы центрифугируют в течение 10 минут при 3000 об/мин. По 1,5 мл центрифугата переносят в опытную и контрольную пробирки, куда добавляют по 0,16 мл 10% раствора NaOH, после чего отбирают по 0,4 мл содержимого, в котором определяют концентрацию кислоторастворимых продуктов (тирозина) протеолитического гидролиза гемоглобина. К нейтрализованному центрифугату в каждую пробирку приливают по 2 мл рабочего раствора реагента, который представляет собой смесь 0,25 л 2% раствора карбоната натрия в 0,1 М раствора гидроксида натрия и 0,01 л 0,5% раствора сульфата меди в 1% растворе цитрата натрия (данная смесь готовится перед анализом).
Перемешанное содержимое выдерживают при комнатной температуре (18-25°C) в течение 10 минут, после чего приливают 0,2 раствора Фолина-Чокальтеу и опять после тщательного перемешивания пробы выдерживают в течение 20 минут при комнатной температуре (18-25°C).
Измерение оптической опытной пробы проводят против контрольной пробы в кювете с толщиной слоя 1 см при длине волны 750 нм на спектрофотометре или фотоэлектроколориметре.
Сперму подвергают флотированию и центрифугированию, после чего оценивают ее фертильность и производят инсеминацию ооцитов.
Было получено 3 эмбриона.
Посредством цейтраферной видеозаписи у эмбрионов на стадии дробления 2-х клеток определяли последовательность вторых делений дробления. Последовательность вторых делений дробления в плоскостях у двух эмбрионов соответствовала (ЕЕ), один эмбрион (ЕМ).
Был осуществлен перенос одного эмбриона с последовательностью вторых делений дробления (ЕМ) на стадии 8-ми бластомеров с помощью специального одноразового катетера для трудного подведения фирмы "COOK" (Австралия) через цервикальный канал в полость матки.
Результатом проведенной программы ЭКО и ПЭ явилась беременность, подтвержденная УЗ и гормональным исследованиями.
Пример 2
Больная К-а поступила в Центр репродукции человека с целью проведения ей программы ЭКО и ПЭ. Больная предъявляла жалобы на бесплодие в течение 19 лет. Из анамнеза известно, что больной в 1988 г. была произведена лапароскопическая операция, не выявившая патологии со стороны маточных труб. Учитывая данные лапароскопии и выявленную в результате обследования гипофункцию яичников (гиперэстрогению), негативный ПКТ, больной после предварительной гормональной коррекции были произведены 5 попыток ИИСМ (без эффекта).
Отсутствие эффекта от проводимой терапии потребовало дальнейшего углубленного обследования. При повторной лапароскопии в 1998 г. был установлен диагноз: эндометриоз 2 степени. Произведена коагуляция эндометриоидных гетеротопий, проведено лечение дановалом в течение 1/2 года. При отсутствии эффекта от проводимой терапии больной рекомендована программа ЭКО и ПЭ.
Стимуляция суперовуляции проводилась Декапептилом по 0,1 мг со 2 по 10 день менструального цикла, Хумегоном 75 ЕД + 75 ЕД 24 ампулы со 2 по 7 день МЦ. При достижении зрелости фолликулами на 10 день МЦ был назначен Претил 10000 ЕД.
При УЗ-исследовании на момент проведения пункции фолликулов было зарегистрировано 4 лидирующих фолликула в левом яичнике и 3 в правом. Толщина эндометрия составила 11 мм.
Больной была произведена пункция фолликулов и аспирация преовуляторных ооцитов и фолликулярной жидкости. При пункции фолликулов из левого яичника было получено 3 ооцита, из правого яичника 1.
Было получено 2 эмбриона.
Посредством цейтраферной видеозаписи у эмбрионов на стадии дробления 2-х клеток определяли плоскость дробления и последовательность вторых делений дробления в этих плоскостях. Последовательность вторых делений дробления у одного эмбриона соответствовала (ME), второго эмбриона (ЕЕ).
Был осуществлен перенос двух эмбрионов на стадии 8-ми бластомеров с помощью специального одноразового катетера для трудного подведения фирмы "COOK" (Австралия) через цервикальный канал в полость матки.
Результатом описанной попытки ЭКО и ПЭ явилось отсутствие факта наступления беременности у данной пациентки.
Нами было проведено исследование 100 женщин (100%), которым был выполнен протокол ЭКО. Из них 25 женщинам была произведена ПЭ с последовательностью второго деления дробления (ЕЕ) и 25 женщинам ПЭ с последовательностью второго деления дробления (ME). В результате у 2-х женщин зафиксирован факт наступления беременности.
Женщинам, которым был произведен ПЭ с последовательностями второго деления дробления (ЕМ) - 25 человек и (ММ) - 25 человек, беременность наступила в 11-ти случаях.
Таким образом, исследование, проведенное нами, свидетельствует о возможности выявления наиболее перспективных эмбрионов in vitro уже на стадии 2-клеточного эмбриона.
Проанализированные источники информации
1) SU 1768153 А1, 15.10.1992.
2) WO 2013181549 А2, 05.12.2013.
3) WO 2013056002 А1, 18.04. 2013.
4) WO 2013005012 A1, 10.01. 2013
5) US 8754014 B2, 17.06.2014.
6) CN 104450904 A, 25.03.2015.
7) US 20140148363 A1, 29.05.2014
8) J. Fenwick, P. Platteaul, A.P. Murdoch and M. Herbert, Time from insemination to first cleavage predicts developmental competence of human preimplantation embryos in vitro, Oxford Journals, Medicine & Health, Human Reproduction, Volume 17, Issue 2, Pp. 407-412, 2001.
9) J Assist Reprod Genet. 2014 Apr; 31 (4): 427-34. doi: 10.1007/s10815-014-0185-4. Epub 2014 Feb 13, Developmental capacity and pregnancy rate of tetrahedral-versus non-tetrahedral-shaped 4-cell stage human embryos., Cauffman G1, Verheyen G, Tournaye H, Van de Velde H.
10) Reprod Biomed Online. 2003 Mar; 6 (2): 201-14., Pronuclear scoring as a predictor of embryo development., Scott L.
11) Development. 2008 Mar; 135 (5): 953-62. doi: 10.1242/dev.014316. Epub 2008 Jan 30., Formation of the embryonic-abembryonic axis of the mouse blastocyst: relationships between orientation of early cleavage divisions and pattern of symmetric/asymmetric divisions., Bischoff M1, Parfitt DE, Zernicka-Goetz M.
12) Pribenszky C., Losonczi E., Molnar M., Lang Z., Matyas S., Rajczy K., Molnar K., Kovacs P., Nagy P. Conceicao J., Vajta G. 2010. Prediction of in-vitro developmental competence of early cleavage-stage mouse embryos with compact time-lapse equipment. Reproductive BioMedicine Online, 20, 371-379.
13) Montag, M, Liebenthron J.,  M. 2011. Which morphological scoring system is relevant in human embryo development? Placenta. 32, Suppl. 3: 252-256.
M. 2011. Which morphological scoring system is relevant in human embryo development? Placenta. 32, Suppl. 3: 252-256.
14) Meseguer M., Herrero J., Tejera A., Hilligsoe K.M., Ramsing N.B., Remoh J. 2011. The use of morphokinetics as a predictor of embryo implantation. Human Reproduction, Vol. 26, No. 10 pp. 2658-2671.
15) Cruz M., Garrido N., Herrero J., Perez-Cano I., Munoz M., Meseguer M. 2012. Timing of cell division in human cleavage-stage embryos is linked with blastocyst formation and quality. Reproductive BioMedicine Online, 25, 371-381.
16) Dal Canto M., Coticchio G., Renzini M.M., De Ponti E., Novara P.V., Brambillasca F., Comi R., Fadini R. 2012. Cleavage kinetics analysis of human embryos predicts development to blastocyst and implantation. Reproductive BioMedicine Online, 25, 474-480.
17) Kirkegaard K., Agerholm I.E., Ingerslev H.J. 2012. Time-lapse monitoring as a tool for clinical embryo assessment. Hum Reprod., 27(5): 1277-85.
18) Herrero J., Meseguer M. 2013. Selection of high potential embryos using time-lapse imaging: the era of morphokinetics. Fertil. Steril., _99: 1030-4.
19) Herrero J., Tejera A., Albert C., Vidal C., de los Santos M.J., Meseguer M. 2013. A time to look back: analysis of morphokinetic characteristics of human embryo development. Fertil. Steril., 100: 1602-9.
20) Wong C., Chen A.A., Behr D., Shen S. 2013. Time-lapse microscopy and image analysis in basic and clinical embryo development research. Reproductive BioMedicine Online, 26, 120-129.
21) Kaser D.J., Racowskv C. 2014. Clinical outcomes following selection of human preimplantation embryos with time-lapse monitoring: a systematic review. Hum Reprod Update, 20 (5): 617-31.
22) Lechniak D., Pers-Kamczyc E., Pawlak P. 2008. Timing of the first zygotic cleavage as a marker of developmental potential of mammalian embryos. Reproductive Biology, v.8, №1, pp 23-41.
23) Edwards RG, Fishel SB, Cohen J, Fehilly CB, Purdy JM, Slater JM, Steptoe PC, Webster JM. 1984. Factors influencing the success of in vitro fertilization for alleviating human infertility. J In Vitro Fertil Embryo Transfer 1 pp: 3-23.
24) Van den Bergh M., Ebner Т., Elder K. 2012. Atlas of oocytes, zygotes and embryos in reproductive medicine. Cambridge University Press, 237 pp. 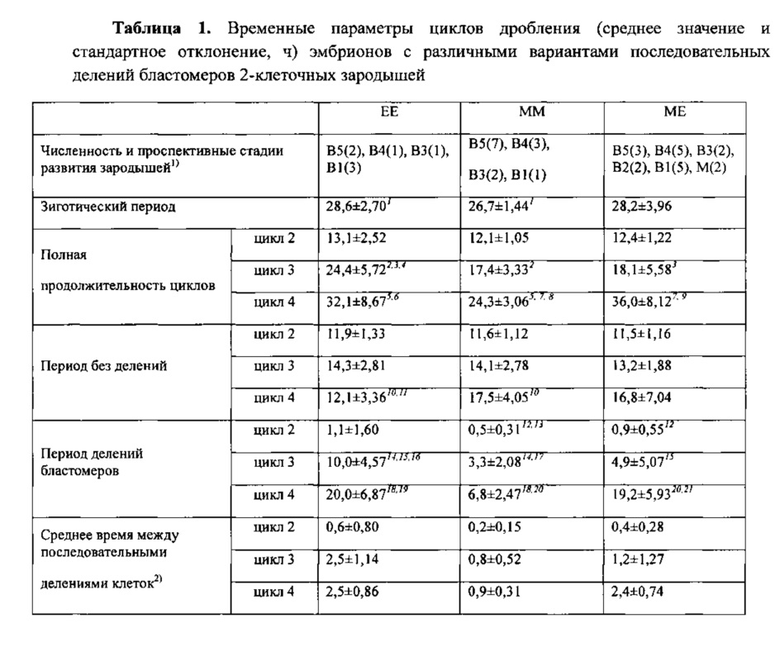
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РЕГУЛИРОВАНИЯ СТЕПЕНИ ЗИГОТНОСТИ БЕРЕМЕННОСТИ В ПРОГРАММАХ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ И ПЕРЕНОСА ЭМБРИОНОВ | 2015 |
|
RU2593740C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАСТУПЛЕНИЯ КЛИНИЧЕСКОЙ БЕРЕМЕННОСТИ В ЦИКЛАХ ЭКО У ПАЦИЕНТОК С ПРОГНОЗИРУЕМЫМ СУБОПТИМАЛЬНЫМ ОТВЕТОМ НА КОНТРОЛИРУЕМУЮ ОВАРИАЛЬНУЮ СТИМУЛЯЦИЮ | 2022 |
|
RU2784576C1 |
| Способ получения эмбрионов крупного рогатого скота in vitro | 2023 |
|
RU2818068C1 |
| КУЛЬТУРАЛЬНАЯ СРЕДА | 2016 |
|
RU2739619C2 |
| Метод биопсии клеток трофобласта при множественных клетках, не участвующих в компактизации на стадии бластоцисты в программах преимплантационного генетического скрининга эмбрионов человека | 2015 |
|
RU2613788C1 |
| СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ДОИМПЛАНТАЦИОННЫХ ЭМБРИОНОВ КОЗ IN VITRO | 2008 |
|
RU2396344C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭМБРИОНОВ ОТЛИЧНОГО КАЧЕСТВА У ЖЕНЩИН В ПРОГРАММАХ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ | 2024 |
|
RU2841153C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАСТУПЛЕНИЯ БЕРЕМЕННОСТИ В ПРОГРАММЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ ПРИ СЕЛЕКТИВНОМ ПЕРЕНОСЕ ЭМБРИОНОВ ПУТЕМ ОЦЕНКИ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО ПРОФИЛЯ ГАМЕТ С ПОМОЩЬЮ ПЦР-РВ | 2014 |
|
RU2550965C1 |
| Способ получения биологического материала, передаваемого на генетическое исследование в программах преимплантационного генетического тестирования эмбрионов человека | 2019 |
|
RU2718903C1 |
| Способ прогнозирования наступления беременности в программе экстракорпорального оплодотворения | 2016 |
|
RU2648839C1 |

Изобретение относится к медицине, а именно к гинекологии, репродуктологии, эмбриологии, и может быть использовано для определения in vitro перспективных эмбрионов для последующей имплантации в матку при проведении процедуры экстракорпорального оплодотворения (ЭКО). Для этого посредством цейтраферной видеозаписи у 2-клеточных эмбрионов определяют последовательность и ориентацию плоскостей делений (горизонтальная/экваториальная - Е, вертикальная/меридиональная - М) каждого бластомера. При этом учитывают, что такие плоскости могут быть: последовательными экваториальными (ЕЕ), последовательными меридиональными (ММ), меридиональным, затем экваториальным (ME), экваториальным, затем меридиональным (ЕМ). И в случае, если последовательности делений в этих плоскостях соответствуют вариантам (ЕМ) или (ММ), то такие эмбрионы считают перспективными для последующей имплантации в матку при проведении процедуры ЭКО. Способ обеспечивает раннее выявление и перенос наиболее перспективных для имплантации эмбрионов, что повышает частоту имплантации и беременности. 2 ил., 2 табл., 2 пр.
Способ определения in vitro перспективных эмбрионов для последующей имплантации в матку при проведении процедуры экстракорпорального оплодотворения (ЭКО), отличающийся тем, что посредством цейтраферной видеозаписи у 2-клеточных эмбрионов определяют последовательность и ориентацию плоскостей делений (горизонтальная/экваториальная - Е, вертикальная/меридиональная - М) каждого бластомера, которые могут быть: последовательными экваториальными (ЕЕ), последовательными меридиональными (ММ), меридиональным, затем экваториальным (ME), экваториальным, затем меридиональным (ЕМ), и в случае если последовательности делений в этих плоскостях соответствуют вариантам (ЕМ) или (ММ), то такие эмбрионы считают перспективными для последующей имплантации в матку при проведении процедуры ЭКО.
| PLUSA B et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| J Cell Sci | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КАЧЕСТВА ЭМБРИОНОВ В ПРОГРАММЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ | 2011 |
|
RU2474823C1 |
| СПОСОБ УПРАВЛЕНИЯ КАЧЕСТВОМ ООЦИТОВ И КОМПОЗИЦИЯ ДЛЯ ДОБАВЛЕНИЯ В СРЕДУ КУЛЬТИВИРОВАНИЯ ООЦИТОВ | 2005 |
|
RU2281777C1 |
| WO 2013181549 A2, 05.12.2013 | |||
| US 8754014 B2, 17.06.2014 | |||
| САВЕЛЬЕВ С | |||
| В | |||
| Моделирование аномалий развития при помощи нарушения первых этапов дробления оплодотворенных эмбриональных яйцеклеток | |||
| Актуальные проблемы общей и частной патологии | |||
| Сб | |||
| научных трудов, 1993, с | |||
| Кулисный парораспределительный механизм | 1920 |
|
SU177A1 |
| DI CASTRO STRINGHER P et al | |||
| The mouse test | |||
| Correlation between the segmentation of murine embryos and the fertilization and segmentation of human ovocytes and pre-embryos | |||
| Ginecol Obstet Mex | |||
| Циркуль-угломер | 1920 |
|
SU1991A1 |
| HERRERO J | |||
| et al | |||
| A time to look back: analysis of morphokinetic characteristics of human embryo development | |||
| Fertil | |||
| Steril., 2013, 100: 1602-9. | |||
Авторы
Даты
2017-07-18—Публикация
2016-04-11—Подача