Настоящее изобретение относится к способу, основанному на технологии рекомбинантной ДНК, для получения пептидов поверхностно-активного белка C (SP-C-пептиды). Настоящее изобретение также относится к генетическим конструкциям, векторам и клеткам-хозяевам для применения в этом способе.
Уровень техники
Легочный сурфактант снижает поверхностное натяжение на поверхности раздела “жидкость-воздух” альвеолярной выстилки, предотвращая коллапс легких в конце выдоха.
Дефицит легочного сурфактанта является расстройством у недоношенных детей и вызывает респираторный дистресс-синдром (РДС), который можно эффективно лечить с помощью природных сурфактантов, извлеченных из легких животных (см. Fujiwara, T. and Robertson B. (1992) In: Robertson, B., van Golde, L.M.G. and Batenburg, B. (eds) Pulmonary Surfactant: From Molecular Biology to Clinical Practice Amsterdam, Elsevier, pp. 561-592).
Основными компонентами этих препаратов сурфактантов являются фосфолипиды, такие как 1,2-дипальмитоил-Sn-глицеро-3-фосфохолин (ДПФХ), фосфатидилглицерин (PG) и гидрофобные поверхностно-активные белки В и С (SP-B и SP-C).
Белки SP-B и SP-C составляют лишь около 1-2% поверхностно-активного вещества, однако они способны значительно улучшить поверхностную активность по сравнению с препаратами, содержащими только липиды. (см. Curstedt, T. et al. (1987) Eur. J. Biochem. 168, 255-262;).
SP-C представляет собой липопротеин, состоящий из 35 аминокислотных остатков с альфа-спиральным доменом между остатками 9-34 (см. Johansson, J. et al. (1994) Biochemistry 33, 6015-6023).
Спираль состоит, в основном, из валил-остатков и встраивается в липидный бислой и ориентируется параллельно с ацильными цепями липидов (см. Vandenbussche, et al. (1992) Eur. J. Biochem. 203, 201-209).
Две пальмитоильные группы ковалентно связаны с остатками цистеина в положениях 5 и 6 в N-терминальной части пептида (см. Curstedt, T. et al. (1990) Proc. Natl. Acad. Sci. U.S.A. 87, 2985-2989).
Два консервативных положительно заряженных остатка, аргинин и лизин, в положениях 11 и 12, возможно, взаимодействуют с отрицательно заряженными концевыми группами липидной мембраны, повышая, таким образом, ее жесткость.
Жесткость липидно-пептидного взаимодействия может быть понижена ближе к C-терминальному концу, так как он содержит небольшие или гидрофобные остатки, что делает эту часть потенциально более подвижной в фосфолипидном бислое.
Поскольку препараты сурфактантов, полученные из тканей животных, могут обладать некоторыми недостатками, такими как их доступность в ограниченном количестве и вероятность того, что они содержат инфекционные агенты и вызывают иммунологические реакции, были предприняты попытки создать искусственные поверхностно-активные вещества, обычно состоящие из синтетических липидов и синтетических аналогов SP-C и/или SP-B белков.
Тем не менее, относительно рассматриваемого синтетического SP-C белка, предыдущая работа показала, что он не может сворачиваться, подобно отрицательно заряженному пептиду в альфа-спиральную конформацию, необходимую для оптимальной поверхностной активности (см. Johansson, J. et al. (1995) Biochem. J. 307, 535-541), и, следовательно, не может взаимодействовать соответствующим образом с поверхностно-активными липидами.
Для решения этой проблемы, для модификации последовательности, было осуществлено несколько попыток, например, замена всех спиральных остатков Val в нативном SP-C на Leu, который обуславливает высокую альфа-спиральную конформацию. Соответствующий трансмембранный аналог SP-C (Leu) показал хорошее распространение на границе раздела воздух-жидкость в сочетании с подходящими фосфолипидными смесями.
В WO 2008/044109 описан пептидный аналог SP-C белка, который обозначен как SP-C33 (Leu), имеющий следующую one-code аминокислотную последовательность.
IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ ID NO:1).
Этот пептид может быть получен методами синтеза. Обычные методы синтеза описаны, например, в Schroeder et al., ‘The peptides’, vol. 1, Academic Press, 1965; Bodanszky et al., 'Peptide synthesis', Interscience Publisher, 1996; Baramy & Merrifield, 'The peptides; Analysis, Synthesis, Biology’, vol. 2, chapter 1, Academic Press, 1980.
Указанные методы включают синтез пептидов в твердой фазе, в растворе, методы органического синтеза или любое их сочетание.
Продукция синтетических пептидов, таких как пептид SP-C33 (Leu) обычными методами зависит от их высоких гидрофобных свойств, ограничивающих их растворимость в воде.
Способ по настоящему изобретению устраняет указанный недостаток.
Определение
Термин "SP-C пептид" обозначает пептиды, структурно аналогичные нативному поверхностно-активному белку SP-C, включая пептиды, имеющие аминокислотную последовательность, в которой, по сравнению с нативным белком, одна или несколько аминокислот замещены и/или отсутствуют до тех пор, пока указанные пептиды, в смеси с липидным носителем, показывают аналогичную активность легочного сурфактанта.
Описание изобретения
Объектом настоящего изобретения является рекомбинантный способ биосинтеза SP-C пептида, который устраняет недостатки, связанные с обычными способами, и позволяет получить продукт с высокой чистотой и удовлетворительным выходом. Способ по изобретению основан на экспрессии гибридного белка, в котором пептид SP-C слит с мальтоза-связывающим белком (MBP) путем введения между ними линкера, несущего сайт расщепления протеазой.
В одном из вариантов осуществления изобретение относится к экспрессионной кассете, содержащей полинуклеотидную последовательность, кодирующую SP-C пептид, белок MBP и линкерный пептид, расположенный между ними, несущий сайт расщепления протеазой, где указанная кодирующая полинуклеотидная последовательность функционально связана с промоторной последовательностью, подходящей для экспрессии в прокариотической клетке.
В одном из вариантов осуществления SP-C пептидом является SP-C33 (Leu) (SEQ ID NO: 1), и кодирующей последовательностью, является SEQ ID NO: 3. В другом варианте осуществления МВР идентифицируется SEQ ID NO: 2, и его кодирующей последовательностью является SEQ ID NO: 4. По сравнению с MBP дикого типа, то есть продуцируемым в природе E. Coli, мальтоза-связывающий белок SEQ ID NO: 2 обеспечивает мутации, которые придают повышенное сродство к амилозе и лучшее сворачивание SP-C пептида. Повышенное сродство к амилозе является важным для очистки гибридного белка, продуцируемого с помощью бактериальных клеток, как описано ниже.
В последовательности кодирующие MBP и SP-C предпочтительно расположены на N- и С-конце экспрессионной кассеты, соответственно. Было установлено, что это облегчает правильное сворачивание гибридного SP-C пептида.
В еще одном варианте осуществления линкерный пептид составляет в длину от 10 до 50, предпочтительно от 20 до 40 аминокислот и содержит сайт протеолиза, распознаваемый энтерокиназой. Последняя представляет собой специфическую серинпротеазу, которая осуществляет расщепление после лизина на специфическом участке рестрикции. Кроме того, последовательность, кодирующая линкер, может содержать один или несколько сайтов рестрикции эндонуклеазой для клонирования и подходящей обработки генетической конструкции. В предпочтительном варианте осуществления изобретения линкерный пептид и его кодирующая последовательность идентифицированы SEQ ID NO: 5 и 6, соответственно.
В соответствии с изобретением может быть использован любой промотор, подходящий для регуляции экспрессии гетерологичных белков в прокариотической клетке. Предпочтительно используется индуцируемый промотор и, в частности, tac-промотор, который активируется изопропил-бета-D-1-тиогалактопиранозидом (IPTG).
Экспрессионная кассета может дополнительно включать компоненты, которые модулируют экспрессию рекомбинантного белка, такие как энхансеры транскрипции, терминаторы, инициаторы и другие элементы генетического контроля или элементы, придающие аффинность связывания или антигенность рекомбинантному белку.
В другом варианте осуществления настоящее изобретение относится к вектору экспрессии, содержащему экспрессионную кассету, описанную выше. Предпочтительно, вектор является плазмидой, и более предпочтительно, плазмидой pBR32, которая может дополнительно содержать маркеры отбора, например, последовательности, кодирующие резистентность к антибиотикам, сигналы секреции, направляющие рекомбинантный белок в секреторный путь, и соответствующие сайты рестрикции, чтобы обеспечить вставку гетерологичных последовательностей.
В еще одном варианте осуществления изобретение относится к способу получения SP-C пептида, который включает следующие стадии:
i) получение вектора, несущего экспрессионную кассету, где экспрессионная кассета содержит полинуклеотидную последовательность, кодирующую гибридный белок, состоящий из SP-C пептида, МВР и линкерного пептида между ними, несущего сайт расщепления протеазой, как определено выше;
ii) введение указанного вектора в прокариотическую клетку и поддержание клетки в условиях, допускающих экспрессию гибридного белка;
iii) очистка гибридного белка;
iv) расщепление гибридного белка соответствующей протеазой и выделение SPC белка.
Для экспрессии SPC пептида обычно используют бактериальные клетки и, в частности, клетки E.coli. Штаммы Е.coli, содержащие генетические мутации, фенотипически выбранные для придания устойчивости к токсичным белкам, являются особенно предпочтительными.
После экспрессии гибридного белка клетки разрушают и клеточный лизат центрифугируют, чтобы отделить клеточные фракции, включающие гибридный белок.
Очистку гибридного белка предпочтительно осуществляют с помощью аффинной хроматографии с использованием MBP лигандсвязанной смолы. Предпочтительно, неочищенный клеточный экстракт загружают в колонку, содержащую агарозную смолу, дериватизированную амилозой, и элюируют буферным раствором, содержащим подходящее количество мальтозы, чтобы удалить гибридный белок из смолы.
Конечное расщепление гибридного белка высвобождает SP-C пептид, который затем выделяют с использованием обычных методов. Протеазу энтерокиназу предпочтительно используют для расщепления гибридного белка в линкерной области, где присутствуют соответствующие сайты расщепления протеазой.
В отличие от других белковых меток, испытанных в аналогичных рекомбинантных системах, МВР оказался особенно эффективным для экспрессии и последующей очистки слитого с ним SP-C пептида.
Экспериментальная часть
Стратегия клонирования для гибридного белка MBP
SP-C33 (Leu) экспрессировали в бактерию в виде гибридного белка с мальтоза-связывающим белком (МВР). Вектор экспрессии pMALc5e (New England Biolabs) кодирует МВР и обеспечивает сайт расщепления (5') AvaI и (3') BamHI для клонирования в рамке считывания фрагмента ДНК, кодирующего SpC33Leu. Вектор экспрессии содержит ген устойчивости к ампициллину и является производным pBR322. MBP и SpC33Leu соединены вместе с помощью пептидного линкера, содержащего сайт протеолиза, узнаваемый энтерокиназой, специфическую серинпротеазу, которая расщепляет после лизина в специфическом сайте расщепления (Asp-Asp-Asp-Asp-Lys↓). Коммерчески доступная последовательности МВР-линкера состоит из мальтоза-связывающего белка E.coli с предшествующим метионином и с конечными 4 аминокислотами, замененными 21 остатками, кодируемыми полилинкером PMAL-C5E, плюс С-концевой глицин.
Оригинальный коммерческий полилинкер был модифицирован для включения нескольких новых сайтов эндонуклеазы рестрикции (SEQ ID NO: 5 и 6).
Нуклеотидную последовательность SP-C33 (Leu) синтезировали и клонировали в подходящем “челночном” векторе с помощью GeneArt® Gene Synthesis service. Нуклеотидную последовательность оптимизировали GeneArt® Gene Synthesis service в соответствии с частотой использования кодонов в E.coli. Оптимизация кодонов изменяет только последовательность нуклеиновой кислоты, а не кодируемую аминокислотную последовательность. Для генетического дизайна и стратегии оптимизации использовали запатентованное программное обеспечение GeneOptimizer® (WO-A-04/059556 and WO-A-06/013103) [Raab D., Graf M., Notka F., Schödl T. and Wagner R. “The GeneOptimizer Algorithm: using a sliding window approach to cope with the vast sequence space in multi-parameter DNA sequence optimization” Syst Synth Biol. 2010; 4: 215-225; Maertens B., Spriestersbach A., von Groll U., Roth U., Kubicek J., Gerrits M., Graf M., Liss M., Daubert D., Wagner R., and Schafer F. “Gene optimization mechanisms: A multi-gene study reveals a high success rate of full-length human proteins expressed in Escherichia coli” Protein Science 2010; 19: 1312-1326]. Параметры оптимизации включают использование кодонов, мотивы ДНК, такие как сайт связывания рибосомы, содержание GC и избежание (обратных) повторов. Последовательность кодирует I) AvaI-специфичный 5', II) BamHI-специфичный 3' конец для последующего субклонирования, III) сайт расщепления энтерокиназой перед SpC33Leu последовательностью, и обеспечивает стоп-кодон ТАА для прекращения трансляции рибосомами. AvaI и BamHI являются эндонуклеазами рестрикции. AvaI узнает CYCGRG двухцепочечную нуклеотидную последовательность (где Y=T/C и R=A/G) и расщепляет после C-1. BamHI узнает последовательности GGATCC и расщепляет после G-1. Оба фермента продуцируют “липкий” конец. Оптимизированные гены затем собирали с помощью синтетических олигонуклеотидов (синтез генов de novo), клонировали в PMA-T вектора с использованием сайтов клонирования SFiI и SFiI. Последняя конструкция является подтвержденной последовательностью.
Получение плазмиды для экспрессии SpC33Leu, амплификацию ДНК, выделение плазмиды, очистку и преобразование в электрокомпетентные клетки E.coli выполняли с использованием обычных протоколов технологии рекомбинантной ДНК, которые в основном рассмотрены в Sambrook and Russel, Molecular Cloning: A Laboratory Manual, CSHL Press 2001.
Для субклонирования последовательность SpC33Leu обрабатывали AvaI и BamHI для получения выступающих одноцепочечных концов. Включение в вектор имеет место после обработки вектора AvaI/BamHI, дефосфорилирования, очистки требуемого векторного фрагмента ДНК электрофорезом на агарозном геле и гибридизации фрагмента SpC33Leu и векторного фрагмента с помощью липких концов. Впоследствии два фрагмента ковалентно связывали сшиванием с использованием ДНК-лигазы Т4 (New England BIOLAB), с последующим преобразованием в клетки бактерии-хозяина. Выбор клеток, содержащих плазмиду, проводили путем посева на чашках с агаром LB с ампициллином. Плазмидную ДНК выделяли из полученных, устойчивых к ампициллину колоний и анализировали с помощью соответствующих ферментов рестрикции. Выбирали клоны с ожидаемой рестрикционной картой ДНК. Полное секвенирование плазмидной последовательности по BMR Genomics (Университет Падуи) подтверждает правильность вставки последовательности SpC33Leu.
Штамм-продуцент
Штаммы-продуценты E.coli C41 (DE3) и C43 (DE3), которые используют для экспрессии SP-C33 (leu), получают из E.coli BL21 (DE3) и могут быть приобретены у компании Lucigen. Известно, что эти штаммы эффективны в сверхэкспрессии токсичных и мембранных белков вирусов, эубактерий, архей, растений, дрожжей, дрозофил или млекопитающих, так как эти штаммы имеют, по крайней мере, одну неохарактеризованную мутацию, что предотвращает гибель клеток, связанную с экспрессией множества рекомбинантных токсичных белков.
Экспрессия белков
Рекомбинантная плазмида обеспечивает экспрессию гибридного белка MBP-SpC33Leu под контролем tac-промотора. Рекомбинантный гибридный белок получают в растворимой форме в клетках-хозяевах после индукции изопропил-β-D-1-тиогалактопиранозидом (IPTG).
1 мл прекультуры или стартовой культуры (среда Луриа-Бертани: 10 г/л триптона, 5 г/л дрожжевого экстракта и 10 г/л NaCl в присутствии 10 мМ глюкозы) инокулировали культурой с глицерином, посеянной на чашку с LB-арагом, и инкубировали под сильным селекционным давлением с ампициллином при 37°C при встряхивании в течение ночи. Культуру использовали для инокуляции 5 мл культуры. Рост бактерий продолжался до тех пор, пока не достиг оптической плотности около 0,6 при 600 нм. Затем культуру индуцировали добавлением IPTG. После индукции рост продолжался в течение 4-5 часов до тех пор, пока клетки не собирали центрифугированием при 4°C. Влажные биомассы ресуспендировали в 20 мМ NH4HCO3 буфере, pH 7,5. Клеточную суспензию на льду разрушали ультразвуком. После лизиса бактерий для оценки общего содержания белка экспрессирующую смесь проверяли посредством восстанавливающего SDS-PAGE в 12% геле Laemmli. Тождественность новой полоски гибридному белку подтверждали иммуноблоттингом с применением кроличьей анти-MBP антисыворотки (NEB). Блоттинг с использованием нитроцеллюлозных мембран проводили на аппарате для “полусухого” блоттинга при 10В в течение 40 минут. В качестве блокирующего буфера использовали Трис-забуференный раствор, pH 8,0, 3% обезжиренное молоко. Первичное антитело разводили 1:10000 в блокирующем буфере и инкубировали в течение 1 часа при комнатной температуре. Для детекции использовали конъюгат кроличьего анти-IgG и пероксидазы в качестве вторичного антитела в сочетании с субстратом пероксидазы хрена, 3,3',5,5'-тетраметилбензидином (ТМБ), (все реагенты для иммуноблоттинга были приобретены у компании Sigma Aldrich). После индукции новую доминирующую полосу подходящего молекулярного веса гибридного белка, соответствующего сочетанию MBP и фрагмента SpC33Leu, определяли как с помощью SDS-PAGE, так и иммуноблоттинга.
Очистка гибридного белка
Выделение гибридного белка из экспрессирующей смеси осуществляли посредством MBP аффинной хроматографии. Неочищенный клеточный экстракт загружали в колонку, содержащую агарозную смолу, дериватизированную амилозой (pMAL гибридный белок и система очистки, New England Biolabs). При прохождении по колонке, гибридный белок связывается вследствие сродства MBP к амилозе, и его элюируют 20 мМ NH4HCO3 буфером, pH 7,5, который содержит 10 мМ мальтозы. Элюат, содержащий представляющий интерес гибридный белок, анализировали посредством восстанавливающего SDS-PAGE с 12% гелем Laemmli и определяли с помощью иммуноблота с использованием анти-МВР сыворотки.
Выход гибридного белка MBP-SpC33Leu составлял 50-80 мг с литра культуры.
Последующее расщепление энтерокиназой для разделения MBP и SP-C33 (Leu) происходит между Lys-393 и Ile-394 в MBP-SpC33Leu. Ile-394 соответствует первой аминокислоте в пептиде SP-C33 (Leu).
Расщепление гибридных белков
Для расщепления гибридного белка по Lys-393 соединения аминокислоты в раствор добавляли 0,02 единиц энтерокиназы на мг гибридного белка. В раствор для расщепления добавляли 1% (объем/вес) Тритон Х-100 для поддержания растворимости ферментативно расщепляемого гидрофобного продукта SpC33Leu. Раствор оставляли в течение 16 часов при спокойном перемешивании при комнатной температуре.
Масс-спектрометрическая характеристика белкового продукта SpC33Leu
Для характеристики продукта ферментативного расщепления гибридного белка MBP-SpC33Leu применяли две различные процедуры. Метод MALDI(лазерная десорбция/ионизация, индуцированная с помощью матрицы)-MS(масс-спектрометрия) высокого разрешения был направлен на определение моноизотопного молекулярного веса продукта и оценки экспрессии необходимой последовательности и необходимого расщепления гибридного белка посредством энтерокиназы. Метод ВЭЖХ-ЭРМС был выбран в качестве предпочтительного метода для предварительной оценки состава включений рекомбинантного продукта по отношению к контрольному образцу и оценки воспроизводимости проб.
Описание фигур
Фигура 1. Анализ спектра MALDI показал, что SP-C33 (Leu) присутствует в растворе при ферментативном расщеплении. Вычисленная моноизотопная масса составляет 3594,52 Да, которая находится в пределах 22 частей на миллион относительно теоретически вычисленной моноизотопной массы аминокислотной последовательности.
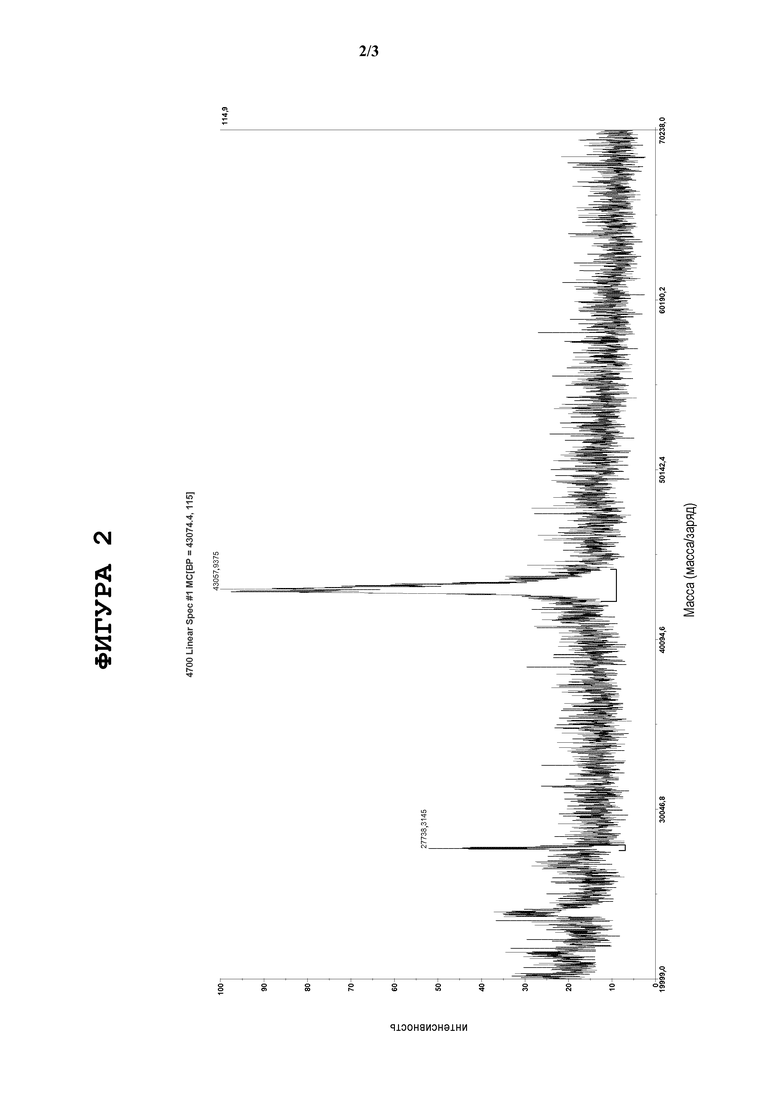
Фигура 2. Присутствие MBP-линкера (MWave~43206 Да) определяли методом MALDI-MS с низким разрешением. Не наблюдали определяемые количества MBP-линкер-SP-C33 (Leu), что свидетельствует о том, что применяемые протеолитические условия реакции обеспечивают процесс с количественной характеристикой.
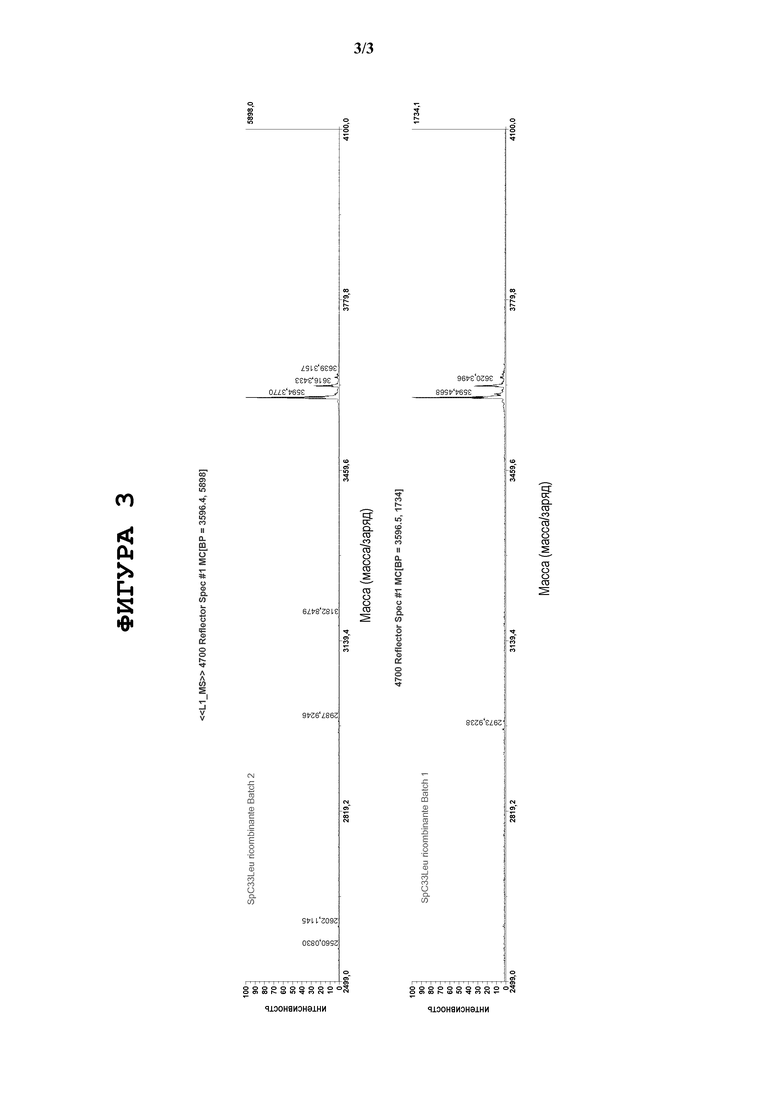
Фигура 3. Предварительную оценку включений осуществляли также методами MALDI-MS и ВЭЖХ-ESIMS(масс-спектрометрия с ионизацией электрораспылением) между двумя пробами, обозначенными 1 и 2, полученными независимо друг от друга. Они показали сопоставимый уровень чистоты. Выполняли количественную оценку продукта SP-C33 (Leu) методом ЖХ-МС относительно контрольного образца SP-C33 (Leu). Были измерены две пробы, полученные независимо друг от друга, и был определен выход белка (таблица).
на литр культуры
Проба 1
Проба 2









Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению белков, и может быть использовано для получения поверхностно-активных белков. Конструируют экспрессионную кассету, содержащую последовательность, кодирующую SP-C33(Leu)-пептид, кодирующую линкер с сайтом расщепления протеазой, и кодирующую белок МВР, причем указанные последовательности последовательно слиты в полинуклеотид, и полинуклеотид функционально связан с промоторной последовательностью, подходящей для экспрессии в прокариотической клетке. Экспрессионную кассету используют для получения вектора экспрессии, который вводят в клетки Е. coli, культивируют их в условиях, обеспечивающих экспрессию гибридного белка, проводят очистку указанного белка с последующим расщеплением гибридного белка с помощью соответствующей протеазы и выделением SP-C33(Leu)-пептида. Изобретение позволяет повысить эффективность рекомбинантного получения SP-C33(Leu)-пептида. 3 н. и 10 з.п. ф-лы, 3 ил., 1 табл.
1. Экспрессионная кассета, содержащая полинуклеотид, состоящий из следующих последовательностей:
(i) SEQ ID NO: 3, кодирующая SP-C33(Leu)-пептид,
(ii) SEQ ID NO: 6, кодирующая линкер, несущий сайт расщепления протеазой, и
(iii) SEQ ID NO: 4, кодирующая белок МВР,
причем указанные последовательности последовательно слиты в полинуклеотид, и полинуклеотид функционально связан с промоторной последовательностью, подходящей для экспрессии в прокариотической клетке.
2. Экспрессионная кассета по п. 1, где указанный SP-C33(Leu) определен SEQ ID NO: 1.
3. Экспрессионная кассета по п. 1, где белок МВР определен SEQ ID NO: 2.
4. Экспрессионная кассета по п. 1, где указанный линкерный пептид, несущий сайт расщепления протеазой, идентифицирован SEQ ID NO: 5.
5. Экспрессионная кассета по п. 1, где МВР- и SP-C33(Leu)-кодирующие последовательности расположены на N- и С-конце, соответственно.
6. Экспрессионная кассета по п. 1, где указанный промотор является индуцируемым tac-промотором.
7. Вектор для экспрессии в клетках Е. coli, содержащий экспрессионную кассету по любому из пп. 1-6.
8. Вектор экспрессии по п. 7, который представляет собой плазмиду.
9. Экспрессирующий вектор по п. 8, который представляет собой плазмиду на основе pBR32.
10. Способ получения SP-C-пептида, который включает следующие стадии:
i) получение вектора, несущего экспрессионную кассету, кодирующую гибридный белок, как определено в пп. 1-6;
ii) введение указанного вектора в клетку Е. coli и содержание клетки в условиях, обеспечивающих экспрессию гибридного белка;
iii) очистка гибридного белка;
iv) расщепление гибридного белка с помощью соответствующей протеазы и выделение SP-C-пептида.
11. Способ по п. 10, где указанная прокариотическая клетка является бактериальной клеткой Е. coli.
12. Способ по п. 10, где очистка гибридного белка осуществляется с помощью аффинной хроматографии с использованием МВР лигандсвязанной смолы.
13. Способ по п. 10, где протеазу энтерокиназу используют для расщепления гибридного белка.
| BAATZ J.E | |||
| et al., High-yield purification of long surfactant proteins SP-B and SP-C and the effects on surface activity, Protein expression and purification, 2001, v | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Переносный кухонный очаг | 1919 |
|
SU180A1 |
| WAUGH D.S | |||
| et al., A generic protocol for the expression and purification of recombinant proteins in Escherichia coli using a combinatorial His6-maltose binding protein fusion tag, Nature Protocols, 2007, v | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Передвижная комнатная печь | 1922 |
|
SU383A1 |
| Передвижная комнатная печь | 1922 |
|
SU383A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОВНОСТЬЮ, И ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ | 2006 |
|
RU2512525C2 |
Авторы
Даты
2017-08-14—Публикация
2013-04-16—Подача