Область техники, к которой относится изобретение
Данное изобретение относится к новым гуманизированным антителам против человеческого CTLA4 для лечения и профилактики заболеваний у людей, а также к способам лечения или профилактики заболеваний у людей при помощи таких антител.
Уровень техники
Иммунная система позвоночных требует множественных молекулярных и клеточных взаимодействий для достижения оптимальных иммунных ответов. В частности, активация Т-лимфоцитов (Т-клеток) является очень важным компонентом многих таких ответов. Антигенпредставляющие клетки (АРС) могут активировать Т-клетки путем представления антигенов через пептиды, переносимые молекулами главного комплекса гистосовместимости (МНС) к Т-клеточным рецепторам (TCR). Для такой активации также необходима дополнительная стимуляция антигенпредставляющими клетками. Для доставки неспецифического костимулирующего сигнала к Т-клеткам также требуется присутствие по меньшей мере двух гомологичных членов семейства В7 в антигенпредставляющей клетке, В7-1 (также именуемый В7, В7.1, или CD80) и В7-2 (также именуемый В7.2 или CD86), оба из которых могут передавать костимулирующие сигналы при связывании с антигеном CD28 в Т-клетках, что приводит к активации Т-клетки. CD28 является гомодимерным гликопротеиновым членом суперсемейства иммуноглобулинов (Ig) с одной внеклеточной вариабельной областью и присутствует в большинстве зрелых Т-клеток.
Гомолог CD28, который был назван CTLA4 (антиген 4 цитотоксических Т-лимфоцитов, Cytotoxic Lymphocyte Associated Antigen; также был назван CD152) был открыт в 1987 г. (Brunet et al., (1987) Nature 328:267-270), и была выявлена его особая связь с цитотоксическими Т-клетками. Так же как и CD28, CTLA4 является членом суперсемейства иммуноглобулинов и содержит один внеклеточный домен Ig. Однако основной ролью CTLA4 является ингибирование активации Т-клеток, и это было доказано на мышах с дефицитом CTLA4 (Chambers et al., (1997) Immunity. 7:8855-8959), у которых наблюдалась тяжелая лимфопролиферация. Кроме этого, была продемонстрирована блокада CTLA4 для усиления ответов Т-клеток in vitro (Walunas et al., (1994) Immunity. 1:405-413) и in vivo (Keamey (1995) J. Immunol. 155:1032-1036), а также для повышения противоопухолевого иммунитета (Leach (1996) Science. 271:1734-1736). Следовательно, блокада CTLA4 может стать новым подходом в лечении заболеваний, особенно заболеваний человека, где может быть полезной иммуностимуляция, таком как лечение различных видов рака и инфекционных заболеваний.
При разработке блокаторов функции CTLA4 внимание было сосредоточено на использовании моноклональных антител, особенно антител, полученных из трансгенных мышей, которым были внедрены гены, кодирующие человеческие иммуноглобулины (и с дефицитом генов иммуноглобулина мыши-хозяина). Продолжаются клинические испытания с такими антителами, в том числе с ипилимумабом (Keler et al., J Immunol 171:6251-6259(2003)), который является изотипом IgG1, и тремелимумабом (Ribas et al., Oncologist 12: 873-883(2005)), который является изотипом IgG2. В то время как иммуногенность (индукция антител против введенных человеческих моноклональных антител), по сообщениям, достаточно низка, ученые обеспокоены, что такие человеческие антитела, благодаря соматическим мутациям и перераспределению в последовательностях вариабельной области (которые могут привести к эпитопам Т-клеток), могут вызвать иммуногенность у некоторых пациентов, что приведет к нежелательным эффектам и отсутствию терапевтического эффекта. Таким образом, необходимо усовершенствовать моноклональные антитела к CTLA4 с потенциально низкой иммуногенностью, чтобы обеспечить более эффективное лечение заболеваний человека.
Раскрытие изобретения
Данное изобретение относится к принципиально новым гуманизированным антителам, которые специфически связываются с человеческим CTLA4. Изобретение также относятся к антителам, у которых связывание с человеческим CTLA4 ингибирует связывание человеческого CTLA4 с человеческим В 7. Изобретение также относится к гуманизированным антителам, которые связываются с человеческим CTLA4 с равновесной константой диссоциации (Kd), равной по меньшей мере 10-8 М. Также изобретение относится к гуманизированным антителам, которые специфически связываются с человеческим CTLA4, которые блокируют связывание человеческого CTLA4 с человеческим В7 по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 99%, или 100%. Также изобретение относится к гуманизированным антителам, которые специфически связываются с человеческим CTLA4, при этом тяжелая цепь антитела либо является изотипом IgG1, IgG2, IgG3 или IgG4, либо имеет мутировавшую IgG константную область, например, для ингибирования связывания с Fc рецепторами или для ингибирования связывания с комплементом. Изобретение также относится к гуманизированным антителам, в которых легкая цепь антител представляет собой легкую цепь каппа. Гуманизированное антитело может быть кодировано нуклеиновыми кислотами тяжелой цепи и легкой цепи каппа человеческого IgG, которые кодируют последовательности белков в их вариабельных областях, как в последовательностях от SEQ ID NO:31 до SEQ ID NO:50. В предпочтительном варианте настоящего изобретения гуманизированное антитело содержит вариабельные области от последовательности SEQ ID NO:45 до SEQ ID NO:49 (иначе именуемыми ʺVH5:VK4').
Изобретение также предлагает гуманизированные антитела, которые специфически связываются с CTLA4, за счет чего были отобраны или модифицированы вариабельные области антител для исключения одного или больше эпитопов человеческих CD4+ Т-клеток. Также изобретение относится к человеческим антителам, специфически связывающимся с человеческим CTLA4, за счет чего были сформированы вариабельные области антител в основном слиянием сегментов последовательностей из существующих последовательностей вариабельных областей человеческих антител.
Данное изобретение также относится к гуманизированным антителам, содержащим аминокислотные последовательности CDR1, CDR2 и CDR3 с тяжелыми цепями, "DYNMD" (SEQ ID No.9), "NINPNSESTSYNQKFKG" (SEQ ID No.10) и "DGNRYDAWFAY" (SEQ ID No.11) соответственно, и аминокислотные последовательности CDR1, CDR2 и CDR3 с легкими цепями, "SASSSVTYMH" (SEQ ID No.12), "STSILAS" (SEQ ID No.13) и "QQRTSYPLT" (SEQ ID No.14) соответственно.
Данное изобретение также относится к гуманизированным антителам, содержащим аминокислотные последовательности CDR1, CDR2 и CDR3 с тяжелыми цепями, "SYWIN" (SEQ ID No.15), "RIAPGSGTTYYNEVFKG" (SEQ ID No.16) и "GDYGSY" (SEQ ID No.17) соответственно, и аминокислотные последовательности CDR1, CDR2 и CDR3 с легкими цепями, "SASSSISYMH" (SEQ ID No.18), "DTSKLAS" (SEQ ID No.19), и "HQRTSYPLT" (SEQ ID No.20) соответственно.
Гуманизированные антитела по изобретению могут состоять из любой из вышеперечисленных последовательностей CDR от SEQ ID No.9 до SEQ ID No.20 и минорных вариантов данных последовательностей CDR, где альтерация одной или более аминокислот не меняет в значительной мере связывание с человеческим CTLA4. Гуманизированные антитела могут быть созданы соединением последовательностей CDR с последовательностями из каркаса человеческой вариабельной области, где такие последовательности с каркасными участками получают из одной или нескольких других последовательностей с каркасными участками и вариабельными областями человеческого антитела. Обычно такие человеческие каркасные последовательности вариабельных областей включают в себя одну или более мутаций, которые способствуют оптимальному или улучшенному связыванию гуманизированных антител с CTLA4. В предпочтительном варианте данного изобретения такие человеческие каркасные последовательности вариабельных областей в гуманизированных антителах получают полностью из последовательностей других вариабельных областей человеческих антител, согласно способу, раскрытому в документе ЕР 1844074 (Antitope Ltd). Данные последовательности содержат соединенные сегменты последовательностей из других вариабельных областей человеческих антител, а также человеческих константных областей. В частности такие Гуманизированные антитела также содержат последовательности CDR, полученные из последовательностей CDR, каркасных последовательностей или частично каркасных/CDR-последовательностей из других вариабельных областей человеческих антител с человеческими константными областями, создавая таким образом гуманизированные антитела, в которых последовательности вариабельных областей получены полностью из последовательностей других вариабельных областей человеческих антител с человеческими константными областями, создавая таким образом «полностью человеческое» антитело.
Также изобретение относится к гуманизированным антителам, специфически связывающимся с человеческим CTLA4, где указанное гуманизированное антитело продуцируется линией клеток млекопитающего, особенно клетками СНО или NS0. Также изобретение относится к гуманизированному антителу, особым образом связывающемуся с человеческим CTLA4, который является фрагментом Fab или одноцепочечным Fv-фрагментом (scFv). Изобретение также относится к мультиспецифическим антителам (две или более разных молекулы антител, соединенных вместе для образования двух или более разных специфичностей), включая по меньшей мере одно гуманизированное антитело из последовательностей от SEQ ID NOS:31 до 35 для тяжелой цепи и от SEQ ID NOS:36 до 40 для легкой цепи для антитела 3В10; или гуманизированное антитело из последовательностей от SEQ ID NOS:41 до 45 для тяжелой цепи и от SEQ ID NOS:46 до 50 для легкой цепи для антитела 8Н5, каждое из которых специфически связывается с человеческим CTLA4. В предпочтительном варианте изобретение относится к мультиспцифическим антителам с вариабельными областями, состоящими из SEQ ID NOS:45 для тяжелой цепи и SEQ ID NOS:49 для легкой цепи. Разные антитела, входящие в состав каждого мультиспецифического антитела, могут быть соединены друг с другом либо ковалентно, либо нековалентно.
Изобретение также относится к фармацевтической композиции, содержащей гуманизированное антитело, которое специфически связывается с человеческим CTLA4, и фармацевтически приемлемый носитель. Фармацевтическая композиция может также содержать агент, эффективный для индуцирования иммунного ответа на целевой антиген, или один или более химиотерапевтический агент.
Изобретение относится к способу индуцирования, усиления или продления иммунного ответа на антиген у пациента, при котором пациенту вводят эффективную дозу гуманизированного антитела, которое специфически связывается с человеческим CTLA4, при этом антитело блокирует связывание человеческого CTLA4 с человеческим В7. Антиген может представлять собой опухолевый антиген, антиген, ассоциированный с патогеном, антиген, ассоциированный с заболеваниями центральной нервной системы (ЦНС), антиген, ассоциированный с заболеваниями кровеносной системы, в том числе гипертензией и атеросклерозом, антиген, ассоциированный с воспалительными заболеваниями, в том числе ревматоидным артритом и аутоиммунными заболеваниями, или антиген, ассоциированный с аллергией. Опухолевыми антигенами могут являться один или более антигенов на поверхности клетки опухоли, одна или более молекул, которые взаимодействуют с опухолью, один или более комплексов МНС (главный комплекс гистосовместимости) пептидов, производных от опухолевых антигенов, или антигены, прямо не ассоциированные с опухолями, но для которых иммунные реакции на антиген будет оказывать нежелательное воздействие на опухоль, такие как антигены, ассоциированные с сосудистой сетью опухоли. Патогенами могут являться вирусы, бактерии, грибы или паразиты. Антигены, ассоциированные с заболеваниями ЦНС, включают в себя бета-амилоид, ассоциированный с накоплением гемолитических бляшек при болезни Альцгеймера. Антигены, ассоциированные с заболеваниями кровеносной системы, включают в себя интегрины и адгезины, а также антигены, ассоциированные с накоплением гемолитических бляшек при атеросклерозе. Антигены, ассоциированные с воспалительными заболеваниями, включают в себя цитокины и цитокиновые рецепторы. Антигенами, ассоциированными с аллергией, являются антигены, связанные с едой, растениями, химическими аллергенами и аллергенами, находящимися в окружающей среде. Способ по изобретению также может включать в себя введение пациенту антигена или его фрагмента, или его аналога, в результате чего антиген в сочетании с гуманизированным антителом индуцирует, усиливает и продлевает иммунный ответ.
Изобретение также относится к способу подавления иммунного ответа у пациента, что подразумевает введение пациенту эффективной дозы поливалентного препарата, содержащего по меньшей мере два гуманизированных антитела к человеческому CTLA4, соединенных друг с другом, что приводит, например, к индукции регуляторных Т-клеток или понижающей регуляции CTLA4. Изобретение также относится к способу подавления иммунного ответа у пациента, что подразумевает введение пациенту эффективной дозы поликлонального препарата, содержащего по меньшей мере два гуманизированных антитела к человеческому CTLA4.
Изобретение также относится к гуманизированным моноклональным антителам, которые специфически связываются с человеческим CTLA4, а также к композициям, содержащим одно антитело или комбинацию таких антител. Некоторые из гуманизированных антител по изобретению могут быть охарактеризованы связыванием с человеческим CTLA4 с высокой аффинностью и/или блокированием взаимодействия человеческого CTLA4 с его лигандом, молекулами человеческого В7-1 и В7-2. Соответственно, такие гуманизированные антитела по изобретению могут быть использованы в качестве диагностических или терапевтических веществ in vivo и in vitro.
Гуманизированные антитела по изобретению могут охватывать различные изотипы антител или их комбинации, такие как IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgAsec, IgD, IgE или мутировавшие формы данных IgG, такие как мутации, ослабляющие или устраняющие связывание с Fc-рецепторами. Обычно они включают в себя IgG4 (например, IgG4k) и IgG1 (например, IgG1k). Гуманизированные антитела могут иметь полную длину (например, антитело IgG4 или IgG1) или могут включать в себя только участок связывания с антигеном (например, фрагменты Fab, F(ab')2, Fv или scFv).
Некоторые гуманизированные антитела к CTLA4 по изобретению могут быть охарактеризованы одним или более из следующих свойств: а) специфичность по отношению к человеческому CTLA4 (специфическое связывание с человеческим CTLA4); б) сродство с человеческим CTLA4 с равновесной константой диссоциации (Kd) по меньшей мере 10-8 М.
В другом аспекте изобретение относится к молекулам нуклеиновых кислот, кодирующим гуманизированные антитела (или участки связывания с антигеном) по изобретению. Соответственно, рекомбинантные экспрессионные векторы, включающие в себя нуклеиновые кислоты, кодирующие антитело по изобретению, и клетки-хозяева, трансфицированные такими векторами, также охватываются изобретением, а также способы получения антител по изобретению посредством культивирования таких клеток-хозяев.
Гуманизированные моноклональные антитела к человеческому CTLA4 по изобретению или участки связывания с антигеном таких антител (например, Fab) могут быть дериватизированы или соединены с другой функциональной молекулой, например, другим пептидом или белком (например, Fab'-фрагмент). Например, антитело (или участок связывания с антигеном гуманизированного антитела) по изобретению может быть функционально связано (например, посредством химического связывания, генетического слияния, нековалентной ассоциации или другим способом) с одной или более молекулярными частицами. Например, гуманизированное антитело к CTLA4 (или участок связывания с антигеном указанного антитела) может быть конъюгировано с терапевтическим компонентом, например, цитотоксическим лекарственным средством, энзиматически активным токсином или его фрагментом, радиоактивными изотопами, терапевтической нуклеиновой кислотой или низкомолекулярным противораковым препаратом. Антитела по изобретению также могут быть конъюгированы с цитотоксическими фармацевтическими препаратами, например, мечеными радиоактивным изотопом цитотоксическими веществами, такими как 131I, или могут быть связаны с белком, инактивирующим рибосому, например, экзотоксином pseudomonas (фрагментом РЕ38, растительными или бактериальными токсинами, такими как рицин, α-цепь рицина, сапорин, антивирусный белок лаконоса, дифтерийный токсин или экзотоксин A Pseudomonas (Kreitman and Pastan (1998) Adv. Drug Delivery Rev. 31:53.).
В другом аспекте изобретение относится к композициям, например, фармацевтическим и диагностическим композициям, содержащим фармацевтически приемлемый носитель и по меньшей мере одно гуманизированное моноклональное антитело по изобретению (или участок связывания с антигеном данного антитела), которое специфически связывается с человеческим CTLA4. В состав некоторых композиций также может входить комбинация гуманизированных антител (или участков связывания с антигеном) по изобретению. Такие композиции также могут содержать комбинации с одной или несколькими другими биологически активными молекулами, например, комбинация по меньшей мере одного гуманизированного моноклонального антитела по изобретению с другой биологически активной молекулой, или может сочетать комбинации с одной или несколькими другими биологически активными молекулами в одной молекуле, например, как биспецифическая или мультиспецифическая молекула либо как комбинация двух или более гуманизированных антител по изобретению, либо как комбинация с одной или несколькими другими биологически активными молекулами.
Для методов исследования in vivo антитело (или участок связывания с антигеном данного антитела, или биспецифическая или мультиспецифическая молекула по изобретению) может быть введено пациенту с заболеванием, связанным с Т-клетками, или заболеванием, которое не может быть облегчено или предупреждено путем индуцирования, усиления, продления или подавления иммунного ответа.
Композиции с гуманизированным моноклональным антителом по изобретению также могут применять в сочетании с другими известными терапиями, например, противораковой терапией. Соответственно, изобретение относится к способу лечения рака у пациентов, при котором пациенту вводят терапевтически эффективное количество гуманизированного антитела вместе с фармацевтическим носителем. Некоторые из таких способов включают в себя комбинацию с вакциной. Некоторыми из таких вакцин являются вакцина против опухолевых клеток, вакцина против опухолевых клеток с модифицированным гранулоцит-макрофаг колониестимулирующим фактором (GM-CSF), вакцина на основе нуклеиновой кислоты (такой как ДНК) и антиген, ассоциированный с опухолью, или вакцина на основе дендритных клеток, несущая антиген.
Гуманизированные антитела к человеческому CTLA4 могут быть использованы при лечении способами, предусматривающими либо стимуляцию иммунного ответа, либо его подавление. Стимуляции можно добиться при помощи антител, которые блокируют связывание человеческого CTLA4 с человеческим В7, а заболевания, поддающиеся лечению путем стимуляции и продления иммунного ответа, включают в себя различные виды рака: рак простаты, почек, толстого кишечника, легких или груди; патогенные инфекции; заболевания, ассоциированные с ЦНС, например, амилоидогенетические заболевания, в том числе болезнь Альцгеймера; заболевания с воспалительными и аллергическими компонентами. Подавление иммунитета также может быть достигнуто при помощи гуманизированных антител к человеческому CTLA4, например, путем индукции регуляторных Т-клеток (Coquerelle et al., Gut 2009; 58:1363-1373). Заболевания, поддающиеся лечению, включают в себя заболевания «трансплантат против хозяина», «хозяин против трансплантата», аллергия, аутоиммунные заболевания и другие воспалительные заболевания.
Согласно еще одному аспекту изобретение относится к способу применения антител по изобретению для выявления in vitro или in vivo присутствия человеческого антигена CTLA4 в образце, например, для диагностирования заболеваний, связанных с человеческим CTLA4. В некоторых способах это может быть достигнуто путем взаимодействия тестируемого образца (вместе с контрольным образцом) с гуманизированным моноклональным антителом по изобретению (или участком связывания с антигеном указанного антитела, или биспецифической или мультиспецифической молекулой) в условиях, которые допускают формирование комплекса между антителом и человеческим CTLA4. Формирование комплекса затем выявляется (например, методом иммуноферментного анализа, ELISA) в тестовых образцах, и любое статистически значимое повышение в формировании комплексов между тестовым и контрольным образцами указывает на присутствие человеческого антигена CTLA4 в тестовом образце.
Специалистам в данной области техники будет понятно, что гуманизированные антитела по изобретению будут иметь дополнительные применения и композиции, помимо уже описанных выше, во всех случаях, где гуманизированное антитело связывается с человеческим антигеном CTLA4. Следовательно, можно считать, что такие применения и композиции находятся в рамках данного изобретения. Специалистам в данной области техники будет понятно, что последовательности вариабельных областей гуманизированных антител по изобретению (от SEQ ID NO:31 до SEQ ID NO:50) или последовательности CDR гуманизированных антител по изобретению (от SEQ ID NO:9 до SEQ ID NO:20) могут варьироваться без существенных изменений свойств гуманизированных антител по изобретению, следовательно, такие варианты также находятся в рамках данного изобретения. Кроме того, такие вариации либо в рамках_вариабельной области, либо последовательности CDR гуманизированных антител, должны входить в объем данного изобретения, если последовательности вариабельных областей таких вариантов имеют значительное сходство (гомологию) с гуманизированными последовательностями по изобретению. Например, может быть определено, что вариантная нуклеиновая кислота входит в объем данного изобретения, если она включает в себя последовательности, содержащие или идентичные по существу последовательностям от SEQ ID NO:21 до SEQ ID NO:30, что установлено по ее способности к гибридизации при строгих условиях в нуклеиновую кислоту по изобретению. В одном варианте воплощения изобретения может быть установлено, что нуклеиновая кислота входит в объем изобретения (например, она по существу идентична последовательностям от SEQ ID NO:21 до SEQ ID NO:30), за счет ее способности гибридизировать в строгих условиях в нуклеиновую кислоту, входящую в объем изобретения (такие как SEQ ID NO:21-SEQ ID NO:30). Термин «гибридизировать» означает связывание, дублирование или гибридизацию молекулы в определенную нуклеотидную последовательность в строгих условиях гибридизации, если данная последовательность присутствует в сложных смесях (например, общей клеточной или геномной ДНК или РНК), в которых определенная нуклеотидная последовательность может быть выявлена с фоном по меньшей мере в 10 раз. Будут выбраны строгие условия гибридизации, например, температура должна быть на 5-10°С ниже, чем температурная точка плавления (Tm) для определенной последовательности при определенной ионной силе рН.
Краткое описание чертежей
Далее приведены примеры воплощения изобретения, которые не должны рассматриваться как ограничивающие объем изобретения. Фигуры и таблицы относятся к приведенным ниже примерам и иллюстрируют следующее:
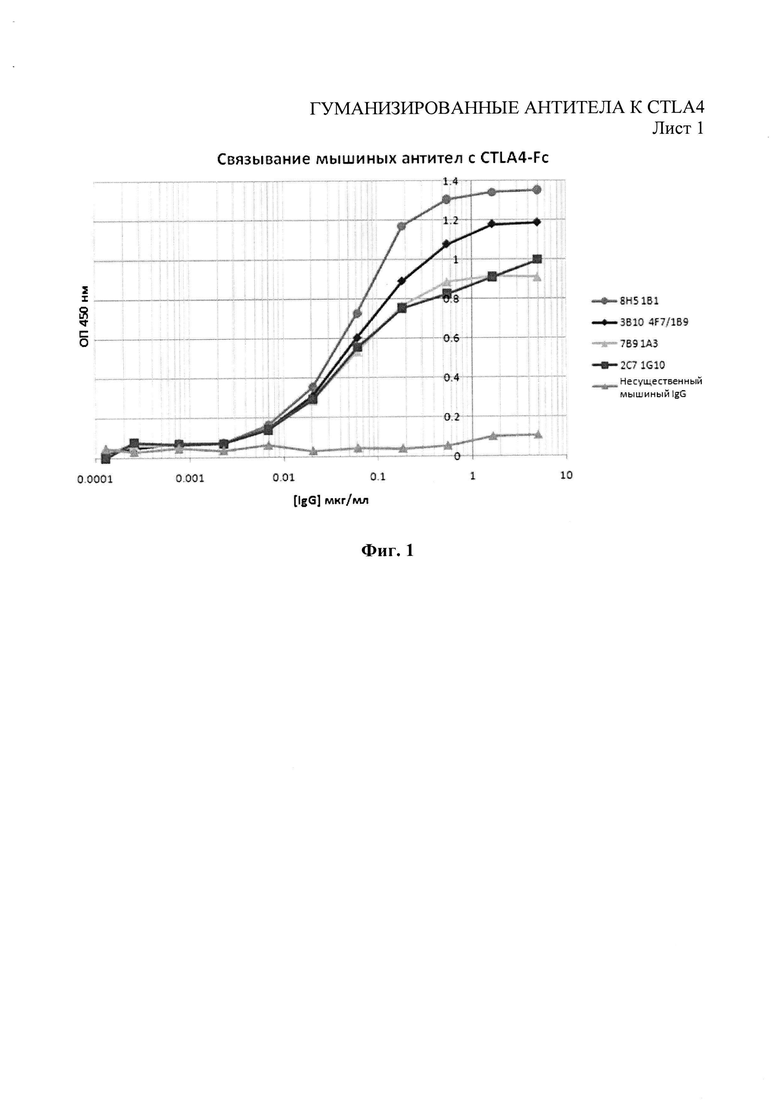
Фиг.1 - связывание мышиных антител с CTLA4-Fc.
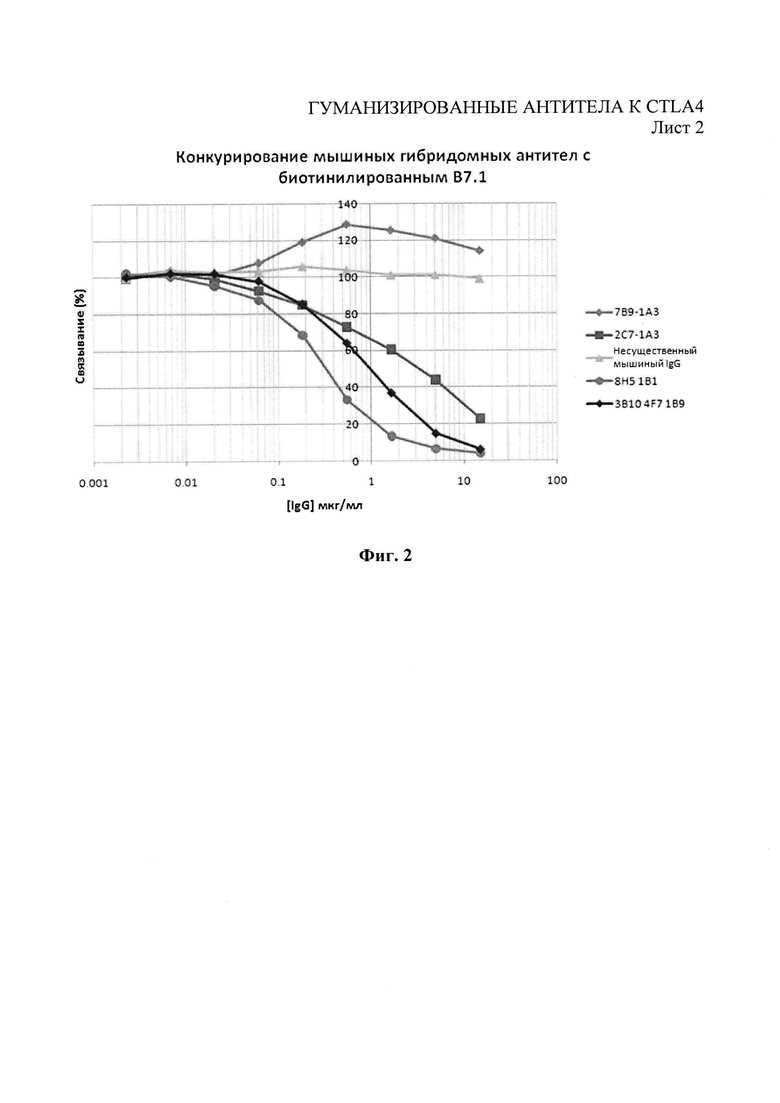
Фиг.2 - иммуноферментный анализ (ELISA) конкуренции мышиных антител за право связывания с CTLA4-Fc против биотинилированного В 7.1.
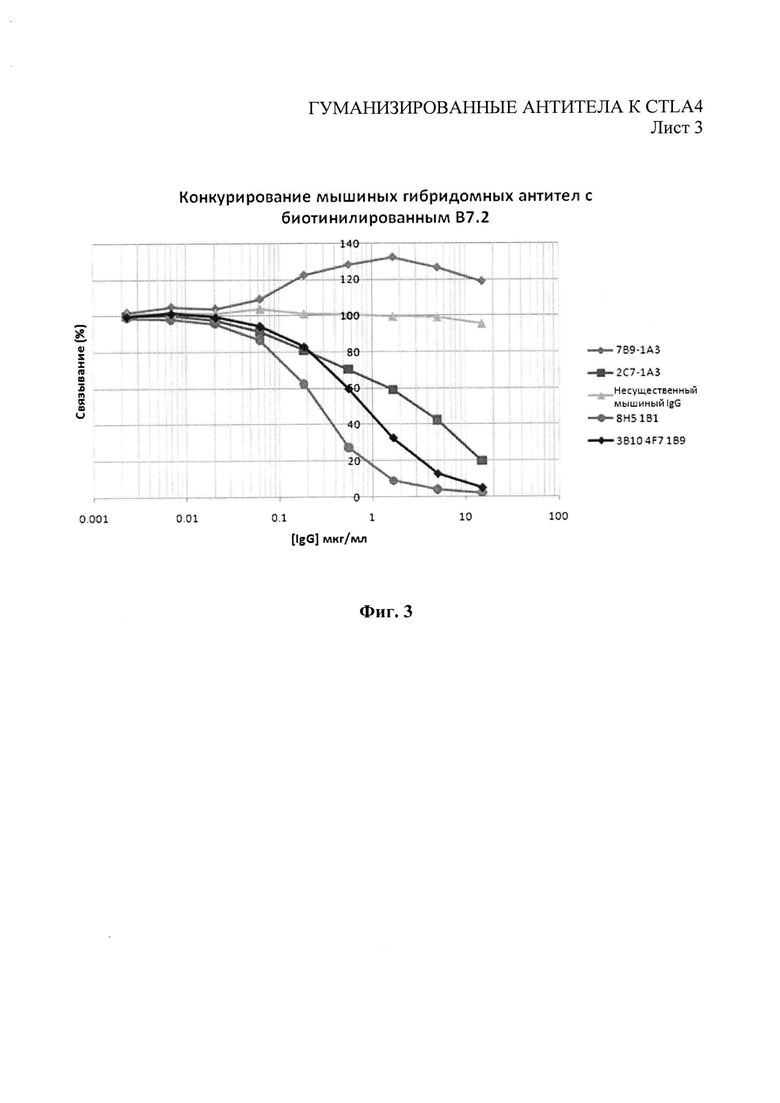
Фиг.3 - иммуноферментный анализ (ELISA) конкуренции мышиных антител за право связывания с CTLA4-Fc против биотинилированного В7.2.
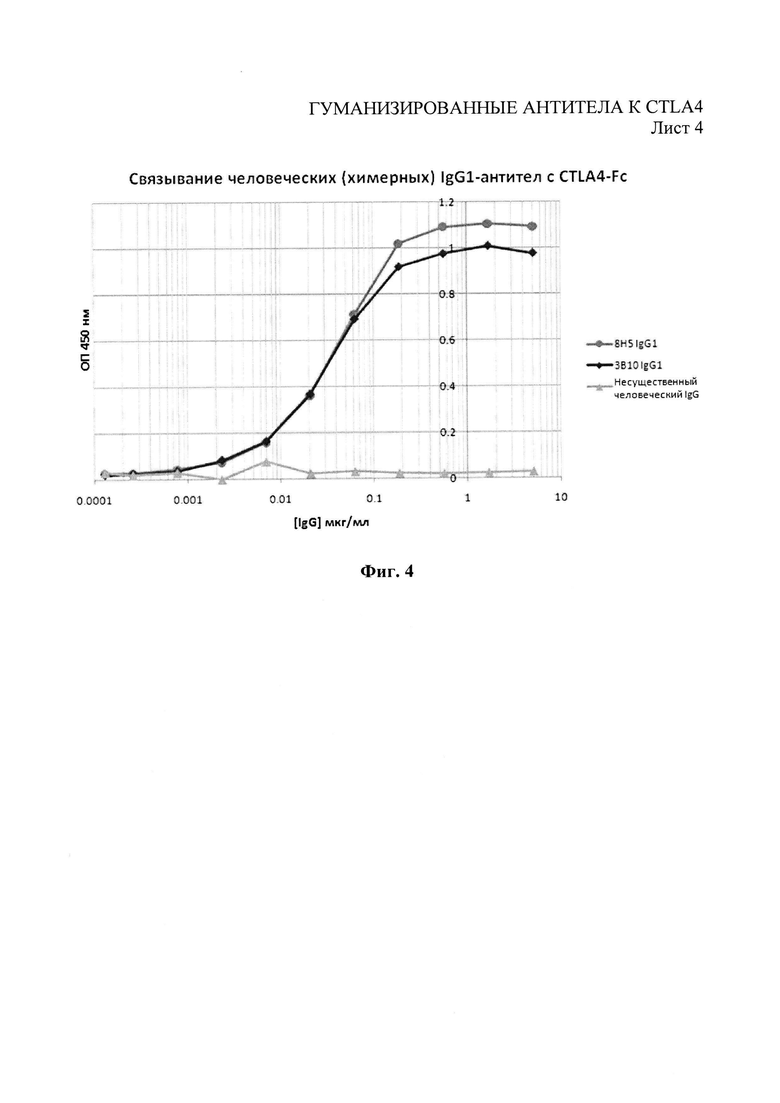
Фиг.4 - связывание антител химерного ЗВ10 и 8Н5 человеческого IgG1 с CTLA4-Fc.
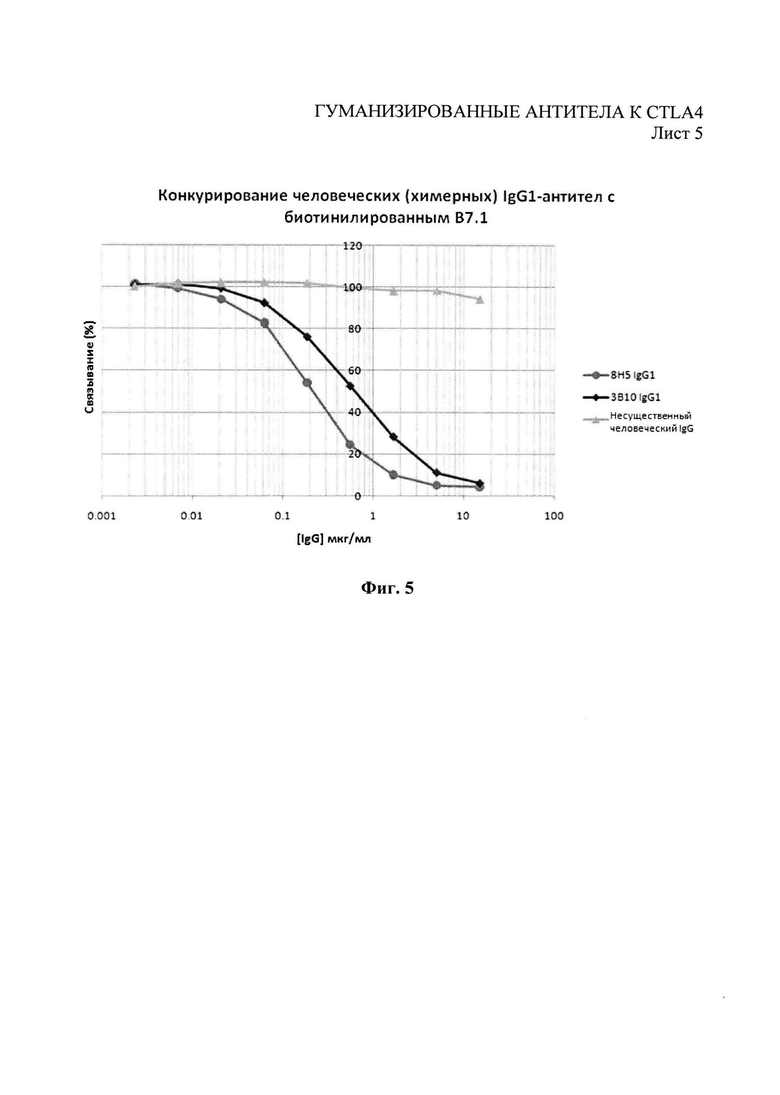
Фиг.5 - иммуноферментный анализ (ELISA) конкуренции антител химерного 3В10 и 8Н5 человеческого IgG1 за право связывания с CTLA4-Fc против биотинилированного В 7.1.
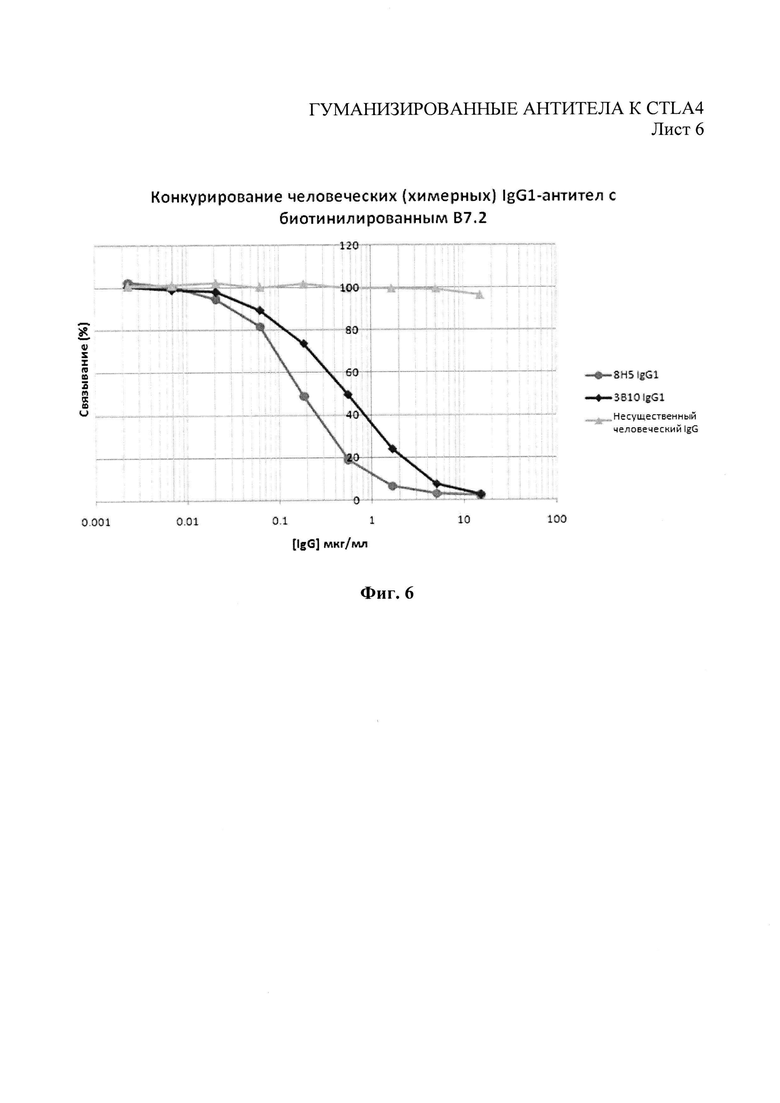
Фиг.6 - иммуноферментный анализ (ELISA) конкуренции антител химерного ЗВ10 и 8Н5 человеческого IgG1 за право связывания с CTLA4-Fc против биотинилированного В7.2.
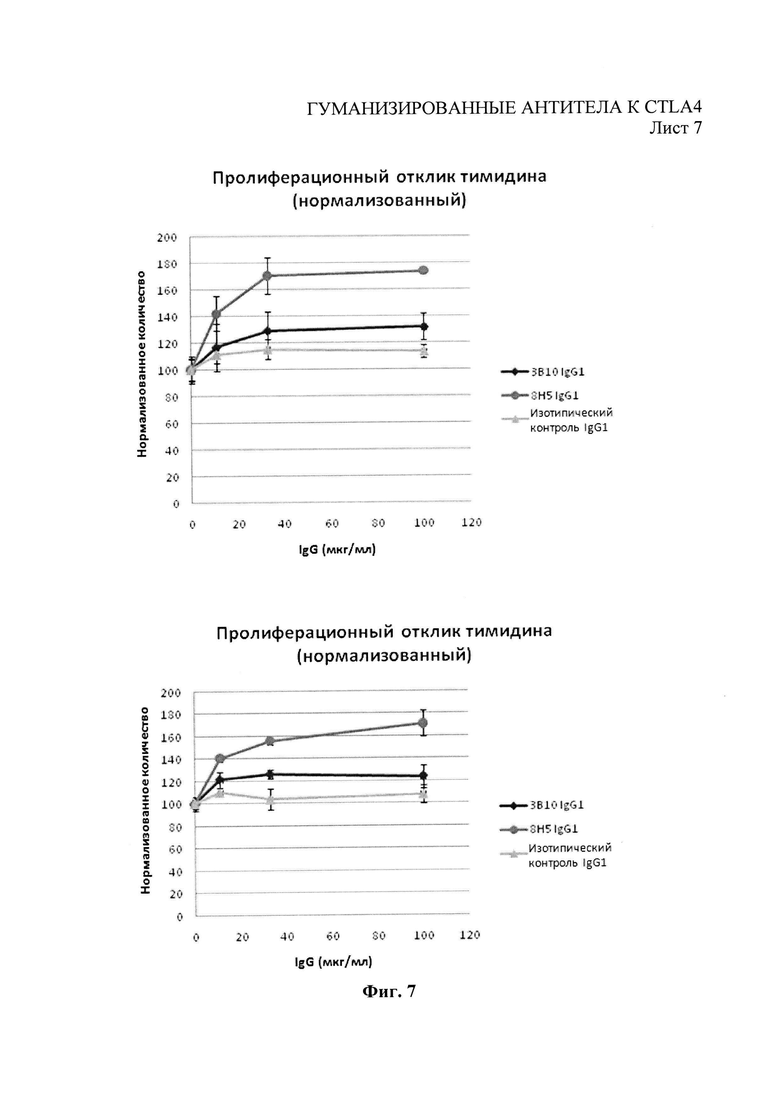
Фиг.7 - пролиферация Т-клеток человеческих мононуклеарных клеток периферической крови в ответ на антитела химерного ЗВ10 и 8Н5 человеческого IgGl.
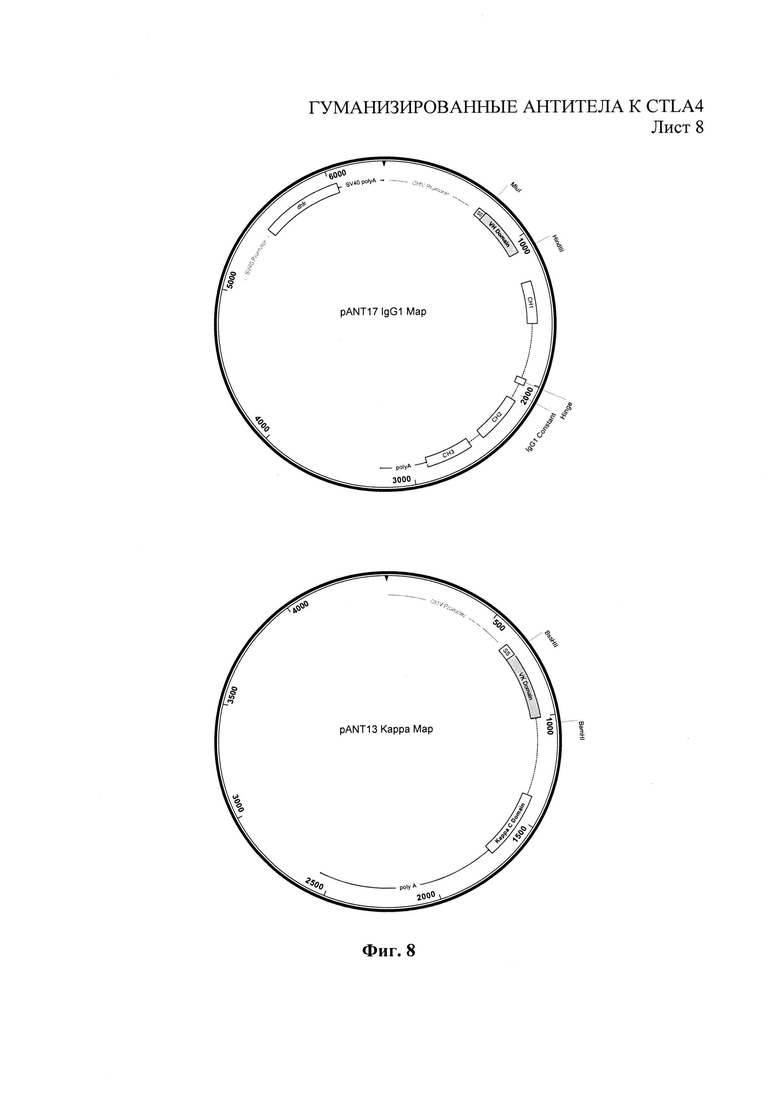
Фиг.8 - карты экспрессионных векторов антител pANT.
Фиг.9 - вариабельная область 3В10 (VH и VK) последовательностей ДНК.
Фиг.10 - последовательности ДНК 8Н5 VH и VK.
Фиг.11 - последовательности аминокислот 3В10 VH и VK.
Фиг.12 - последовательности аминокислот 8Н5 VH и VK.
Фиг.13 - гуманизированные последовательности аминокислот 3B10VH.
Фиг.14 - гуманизированные последовательности аминокислот 3B10VK.
Фиг.15 - гуманизированные последовательности аминокислот 8Н5 VH.
Фиг.16 - гуманизированные последовательности аминокислот 8Н5 VK.
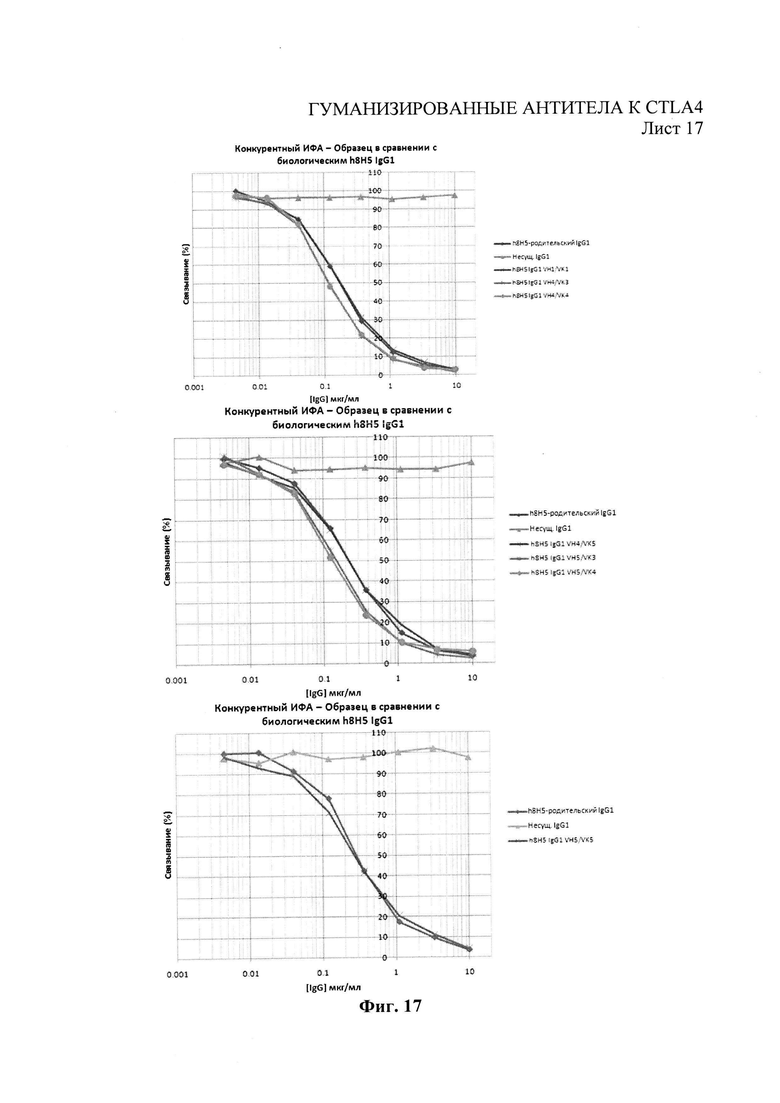
Фиг.17 - иммуноферментный анализ (ELISA) конкуренции гуманизированных антител 8Н5 за право связывания с CTLA4-Fc против биотинилированного химерного 8Н5 человеческого IgG1 (=ʺIgG1 родительский h8H5ʺ).
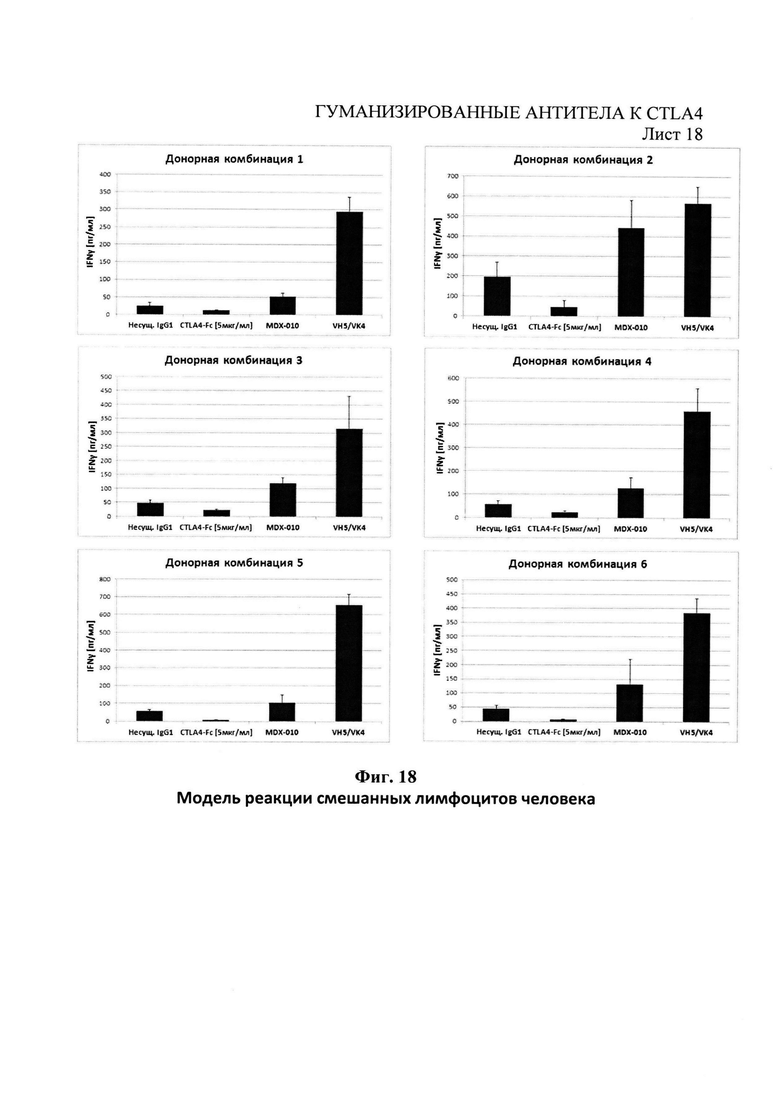
Фиг.18 - секреция интерферона-χ доминантным гуманизированным VH5/VK4, направленным против CTLA4 и MDX0101, в реакции человеческой смешанной культуры лимфоцитов с парами доноров.
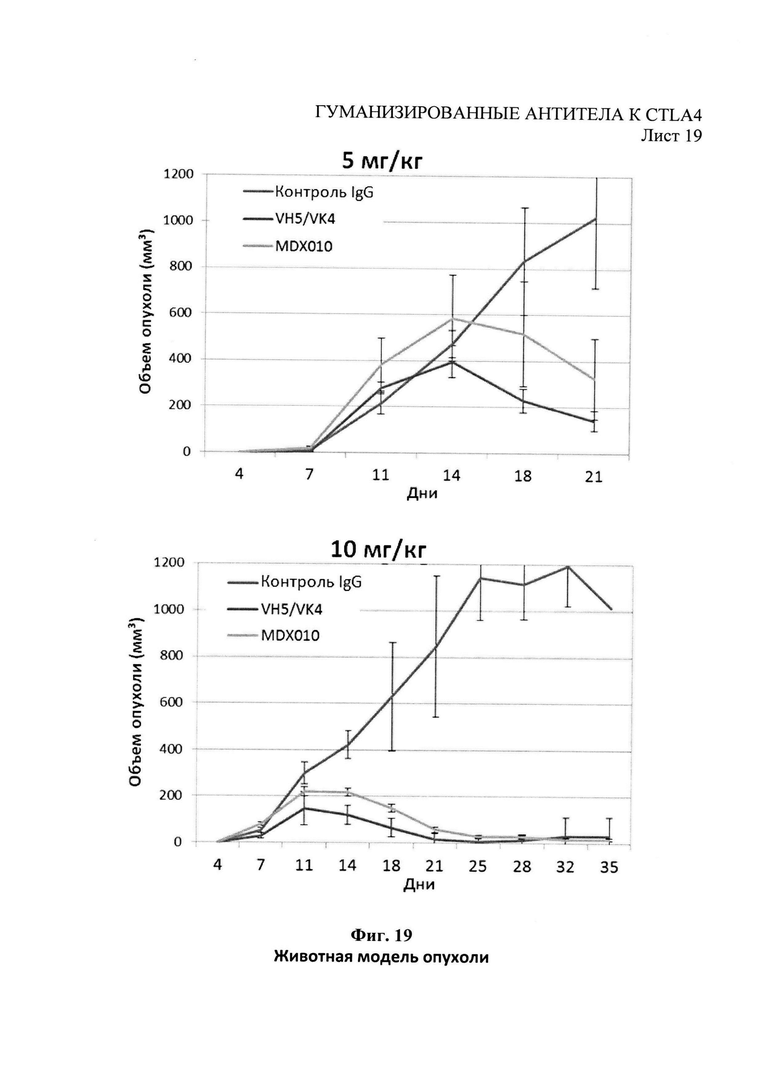
Фиг.19 - рост опухоли МС38 у мышей с внедренным человеческим CTLA4 с еженедельными дозами антител начиная с дня 2.
Осуществление изобретения
Далее в примерах указаны коммерчески доступные реагенты, которые были использованы в соответствии с инструкциями производителя, если только не указано иное. Источником клеток, идентифицированных в примерах и по всему описанию с помощью учетных номеров ЕСАСС, является Европейское собрание клеточных культур (European Collection of Cell Cultures (ЕСАСС)), Солсбери, Англия. Если не указано иное, все используемые технические и научные термины имеют значение, понимаемое средним специалистом в области техники, к которой принадлежит данное изобретение. Методики и материалы, приводимые в качестве примеров, описаны ниже, однако в процессе реализации или испытания данного изобретения также могут быть использованы методики и материалы, похожие или равнозначные описанным. Материалы, методики и примеры приведены только для пояснения и не могут считаться ограничивающими объем изобретения.
Пример 1 - Генерация мышиных моноклональных антител
Рекомбинантный слитый белок CTLA4, содержащий внеклеточный домен человеческого CTLA4, слившегося с константным доменом человеческого IgG1, был приобретен у R&D Systems (Оксфорд, Великобритания). Внеклеточный фрагмент CTLA4 был получен путем протеолитического расщепления слитого CTLA4-Fc белка фактором Ха (Qiagen, Кроли, Великобритания), затем было произведено последующее удаление протеазы при помощи смолы для удаления фактора Ха (Qiagen) и удаление расщепленного фрагмента Fc при помощи агарозы белка А, чтобы оставить только внеклеточный домен CTLA4.
Мыши-самки Balb/c были иммунизированы подкожно с помощью 200 мкл эмульсии 1:1 Freunds Complete Adjuvant (Sigma-Aldrich, Дорсет, Великобритания) с содержанием 20 мкг рекомбинантного белка CTLA4-Fc. После этого иммунизированным мышам вводили примерно каждые 3 недели до трех внутрибрюшинных бу стер-инъекций эмульсии 1:1 Freunds Incomplete Adjuvant (Sigma-Aldrich) с содержанием 20 мкг CTLA4-Fc. За три дня до слияния миеломы две мыши, у которых оказался самый высокий титр антител, получили внутриселезеночно бустер-инъекцию либо целого антигена, либо внеклеточного домена CTLA4.
Селезенки были извлечены и гомогенизированы для получения клеточной суспензии с отдельными клетками. 1×108 клеток селезенки были слиты с 5×107 NSO клетками мышиной миеломы (соотношение 2:1) при помощи полиэтиленгликоля (ПЭГ). Слившиеся клетки были повторно растворены в 200 мл DMEM/20% FCS/5% ВМ Condimed H1 (Roche, Бергес Хилл, Великобритания) с содержанием агентов селекционных гибридомы азасерина и гипоксантина - «среда HAZA» - и внесены пипеткой в объеме по 200 мкл в 10×96-луночных микропланшетов. Микропланшеты выдерживали при 37°С в 5% CO2, и половину объема (100 мкл) из каждой лунки с культурами заменяли через сутки на новую среду HAZA с содержанием 2.5% ВМ Condimed H1. После 12 дней выдерживания, 100 мкл затраченной среды из каждой лунки были перенесены в 96-луночный микропланшет для хранения и были протестированы на присутствие выделенных антител к рекомбинантному белку CTLA4 при помощи иммуноферментного анализа (ELISA) рекомбинантного белка CTLA4, как описано ниже. Иммунопозитивные культуры были расширены путем переноса в 1 мл «Н-среду» (DMEM/20% FCS/гипоксантин) в 24-луночный микропланшет, и их рост позволил продолжать исследование на протяжении 5-7 дней. Позитивные культуры были затем субклонированы методом предельного разведения, расширены и протестированы путем иммуноферментного анализа (ELISA) слитого CTLA4 белка. Кроме того, позитивные культуры были протестированы методом сортировки флуоресцентно-активированных клеток (FACS), как описано ниже.
Для предельного разведения было установлено число клеток при помощи счетной камеры, и клетки были разведены серийно в среде, содержащей 2.5% ВМ Condimed H1, пока не была достигнута плотность клеток в 5-15 клеток на мл. Для каждой гибридомы пипеткой было внесено 200 мкл клеточного раствора в 48 лунок с плотностью 1-3 клетки на лунку. Культуры сохранялись при 37°С в 5% CO2 на протяжении 2 недель с дополнительной подпиткой среды в размере половины объема после 1 недели. Среда с культурой была протестирована на наличие антител, специфических для слитого белка к CTLA4, путем иммуноферментного анализа (ELISA). Клоны, позитивные по результатам иммуноферментного анализа, были отобраны и расширены до 10 мл культур в DMEM/20% FCS/2.5% ВМ Condimed H1. Затем клоны были заморожены в среде с содержанием 10% ДМСО и хранились в жидком N2, и также были далее расширены для очистки антител. Две гибридомы, названные 3В10 и 8Н5, были субклонированы, а субклоны затем были заморожены и использованы в дальнейших исследованиях для производства моноклонального антитела.
Чтобы идентифицировать гибридомы, которые выделяют CTLA4-специфические мышиные антитела к человеческому CTLA4, микропланшеты для иммуноферментного анализа (ELISA) (VWR, Латтеруорф, Великобритания) покрыли на ночь при 4°С 100 мкл на микропланшет либо рекомбинантным слитым CTLA4 белком, либо человеческим IgG1 (Sigma-Aldrich, Пул, Великобритания) при плотности 0.5 мкг/мл в фосфатном буфере (PBS). Микропланшеты были промыты и заблокированы 150 мкл на микропланшет фосфатным буфером (PBS) с содержанием 2% бычьего сывороточного альбумина (BSA). Супернатанты клеточной культуры или очищенные антитела были разведены в фосфатном буфере с 2% бычьим сывороточным альбумином, и к каждому микропланшету добавили 100 мкл, затем выдерживали в течение 1 часа при комнатной температуре. Микропланшеты промывали трижды фосфатным буфером с содержанием вещества твин (0.05%) и выдерживались на протяжении 1 часа с ЮОмкл на микропланшет козьих антител к Ig мыши (Fab-специфических), конъюгированных с пероксидазой хрена (Sigma-Aldrich). Микропланшеты трижды промывали фосфатным буфером с содержанием вещества твин, затем добавили субстрат ортофенилендиамин SigmaFast OPD (Sigma-Aldrich) и выдерживали при комнатной температуре в темном месте в течение 4 минут. Реакция прекращалась добавлением 50 мкл 3М HCl. Затем микропланшеты читали на расстоянии 490 нм при помощи оборудования для чтения планшетов Dynex (Dynex, Уэртинг, Великобритания).
При помощи набора для быстрого иммуноферментного анализа на изотипы мышиных антител Rapid ELISA Mouse Antibody Isotyping Kit (Perbio, Крэмлингтон, Великобритания) были получены изотипы моноклональных антител. Антитела были очищены на 1 мл колонке с белком А-сефарозой (GE Healthcare, Литл Чалфонт, Великобритания). До очищения, и пробирки, и колонки с белком А были депирогенизированы при помощи 0,4М NaOH. Колонки были заново уравновешены с помощью 20 CV фосфатно-солевого буфера 1× (рН 7,4). Супернатанты клеточной культуры гибридомы были собраны, приспособлены к фосфатно-солевому буферу 1× (рН 7,4) при помощи фосфатно-солевого буфера 10х и стерилизованы фильтрованием. Отфильтрованный супернатант закачивали через колонку при скорости 0,5 мл/мин. Колонку промывали фосфатно-солевым буфером 1× (рН 7,4), и IgG вымыли при помощи стерильного 0.1М натрия цитрата рН 3, фракции 0,9 мл собирали и нейтрализовали при помощи 0,1 мл стерильного 1М трис-HCl с рН 9. В стерильных условиях продукт был помещен в фосфатно-солевой буфер с рН 7,4 для удаления любого элюирующего буфера и концентрирования образца. После концентрирования антитела подсчитывали с помощью OD280HM с использованием коэффициента экстинкции, Ее (0.1%) равного 1,4. Очищенные тела анализировали путем электрофореза белков в полиакриламидом геле в присутствии додецилсульфата натрия (SDS-PAGE) при помощи системы элетрофореза Novex NuPAGE и 4-12% геля NuPage (Invitrogen, Пейсли, Великобритания) и подвижного буфера 2-(N-морфолино)этансульфоновая кислоты (MES). 1 мкг антитела получали при помощи буфера для образцов 4xNuPAGE плюс бета-меркаптоэтанол и нагревали. Гель окрашивали окрашивающим раствором «мгновенный синий» InstantBlue (Expedeon, Кембридж, Великобритания), молекулярный размер оценивали путем сравнения окрашенных полос с предварительно окрашенными белками PageRuler™ Plus Prestained Protein Ladder (Fermentas, Йорк, Великобритания). Две полосы были идентифицированы для каждого антитела без выявленной контаминации.
Чтобы оценить связывание антител с CTLA4 и блокирование взаимодействия между лигандами CTLA4 - В7.1 и В7.2, был проведен иммуноферментный анализ конкурентный методом. Лиганды B7.1-Ig и B7.2-Ig (R&D Systems) биотинилировали при помощи набора для биотинилизации Biotin Tag™ Micro Biotinylation kit (Sigma-Aldrich). 96-луночные микропланшеты MaxiSorp (Nunc) были покрыты 0,5 мкг/мл рекомбинантного человеческого CTLA4-Ig (IgG1) (R&D Systems) в фосфатно-солевом буфере Дульбекко (РАА Laboratories, Йовил, Великобритания) (конечный объем 80 мкл) при 4°С в течение ночи. CTLA4-Ig удаляли, а микропланшеты блокировали с помощью фосфатно-солевого буфера Дульбекко - 2% бычьего сывороточного альбумина на протяжении 1 часа при комнатной температуре. Микропланшеты трижды промывали промывочным буфером (0,05% твин-20 в фосфатно-солевом буфере Дульбекко). Тестируемые антитела в разных концентрациях предварительно смешивали либо с биотинилированным B7.1-Ig (конечная концентрация 0,36 мкг/мл), либо с биотинилированным B7.2-Ig (конечная концентрация 0,65 мкг/мл), а затем были добавлены в микропланшет с CTLA4-Ig (конечный объем 80 мкл). Все образцы тестировали в двух параллельных испытаниях. Микропланшеты выдерживали на протяжении 1 часа при комнатной температуре и трижды промывали промывочным буфером. Добавляли 80 мкл раствора 1 к 500 стрептавидин-пероксидазе хрена (Sigma-Aldrich) и выдерживали на протяжении 1 часа при комнатной температуре. Микропланшеты трижды промывали промывочным буфером, добавляли 80 мкл субстрата о-фенилендиамин-дигидрохлорида SigmaFast OPD (Sigma-Aldrich, Кат. №Р9187) и выдерживали при комнатной температуре в темном месте на протяжении 4 минут. Реакцию прекращали добавлением 50 мкл 3М HCl. Затем микропланшеты читали на расстоянии 490 нм при помощи оборудования для чтения планшетов Dynex. Субклоны 8Н5-1 В1, 3B10-4F7, 7 В9-1А3 и 2C7-1G10 отбирали в качестве производителей доминантных моноклональных антител, основываясь на связывании с CTLA4 (Фиг.1). Было показано, что все эти субклоны, кроме 7 В9-1А3, конкурировали с биотинилированным В7.1 (Фиг.2) и биотинилированным В7.2 (Фиг.3) за право связывания с человеческим CTLA4.
Чтобы установить, экспрессировали ли доминантные моноклональные антитела, связанные с CTLA4, на поверхности Т-клеток, проводили проточный цитометрический анализ. Изолировали человеческие периферийные Т-клетки из человеческих мононуклеарных клеток периферической крови (РВМС) и стимулировали их для усиления экспрессии CTLA4. Клетки CD4+ очищали от мононуклеарных клеток периферической крови при помощи набора для изоляции Т-клеток CD4+ «CD4+ Т Cell Isolation Kit» (Miltenyi Biotec, Бизли, Великобритания), размещали в 24-луночные микропланшеты (1×106 клеток на микропланшет) в среде AIM-V Medium (Invitrogen, Пейсли, Великобритания) и выдержали при 37°С в течение ночи. Клетки стимулировали иономицином (1 мкг/мл) и форбол-12-миристат-13-ацетатом (50 нг/мл) и выдерживали 4 часа при 37°С. Клетки промывали один раз в среде AIM-V, закрепляли в фосфатно-солевом буфере с содержанием 2% формальдегида на 15 минут, затем повторно растворяли в буфере FACS (фосфатно-солевой буфер Дульбекко с содержанием 1% бычьего сывороточного альбумина, 0,05% азида натрия и 0,1% сапонин) при плотности 2×х106 клеток/мл и выдерживали 30 мин при 4°С.
2×105 клеток окрашивали при помощи либо раствора 1 к 10 антитела к CTLA4, конъюгированного с фикоэритрином (РЕ) (BNI3) (Abeam, Кембридж, Великобритания), в качестве позитивного контроля, либо 5 мкг/мл отдельных моноклональных антител к CTLA4 вместе с 1 к 50 раствора антител к мышиному IgG, конъюгированного с фикоэритрином (РЕ) (Sigma). Мышиный IgG (Sigma) также был включен как отдельный контроль для разных мышиных изотипов, присутствующих в доминантных моноклональных антителах. Клетки окрашивали в течение 1 часа при 4°С. Контроль только антитела к мышиному IgG, конъюгированного с фикоэритрином (РЕ), также учитывали. Клетки промывали дважды буфером FACS и факультативно окрашивали в течение 1 часа в темном месте при 4°С либо раствором 1 к 40 мышиного антитела к человеческому CD4, конъюгированного с флуоресцеин изотиоцианатом (FITC) (Caltag, Бакингем, Великобритания), либо мышиным антителом IgG2a, конъюгированного с флуоресцеин изотиоцианатом (FITC) (Caltag). После двух промываний буфером FACS, клетки повторно растворяли в буфере FACS, и проводили проточный цитометрический_анализ при помощи проточного цитофлуориметра Becton Dickinson FACSCalibur (Becton Dickinson, Оксфорд, Великобритания). Параметры настройки устанавливали на основании анализа релевантных изотипических контролей. Основываясь на наблюдаемом связывании с CTLA4, моноклональные антитела 8Н5 и 3В10 были назначены как первичные и вторичные доминантные моноклональные антитела соответственно.
Пример 2 - Секвенсирование вариабельных областей генов
Субклоны 3B10-4F7, 3В10-6Е3, 8Н5-1А1 и 8Н5-1 В1, продуцирующие доминантные моноклональные антитела 8Н5 и 3В10, подвергали секвенсированию вариабельных областей (V-областей). Общую РНК извлекали из 3-1×106 клеток гибридомы при помощи набора RNAqueous-4PCR Kit (Ambion, Уоррингтон, Великобритания) и использовали для синтеза кДНК. Фрагменты V-областей тяжелых и легких каппа цепей мышиного иммуноглобулина амплифицировали полимеразной цепной реакцией (PCR) при помощи вырожденных мышиных праймеров с лидерной последовательностью (Sigma) и уникальных праймеров с константными доменами (Sigma), как показано в Таблице 1. Фрагменты, полученные в результате полимеразной цепной реакции, субклонировали в векторную систему pGEM-T Easy I (Promega, Саутгемптон, Великобритания), а также секвенсировали вставки при помощи вектор-специфического праймера M13Forward (Sigma). Вся работа с определением последовательностей в ДНК была проведена компанией Geneservice Ltd, Кембридж, Великобритания. Уникальные последовательности V-областей нуклеотидов были получены для ЗВ10 (SEQ ID Nos 1 и 2) и 8Н5 (SEQ ID Nos 5 и 6).
Последовательности гипервариабельных областей (CDR) 3B10 и 8Н5 были определены следующим образом:
SEQ ID No.93B10CDRH1 DYNMD
SEQ ID No.103B10CDRH2 NINPNSESTSYNQKFKG
SEQ ID No.11 3B10 CDRH3 DGNRYDAWFAY
SEQ ID No.12 3B10 CDRL1 SASSSVTYMH
SEQ ID No.13 3B10 CDRL2 STSILAS
SEQ ID No.14 3B10 CDRL3 QQRTSYPLT
SEQ ID No.15 8Н5 CDRH1 SYWIN
SEQ ID No.16 8Н5 CDRH2 RIAPGSGTTYYNEVFKG
SEQ ID No.17 8Н5 CDRH3 GDYGSY
SEQ ID No.18 8Н5 CDRL1 SASSSISYMH
SEQ ID No.19 8Н5 CDRL2 DTSKLAS
SEQ ID No.20 8Н5 CDRL3 HQRTSYPLT
Пример 3 - Генерация химерных антител
Последовательности вариабельных доменов тяжелых и легких цепей доминантных моноклональных антител 3B10 и 8Н5 амплифицировали полимеразной цепной реакцией (PCR) и субклонировали в экспрессионные векторы антител pANT (Фиг.8), в которых V-области тяжелых и легких цепей клонировали в pANT 17 и pANT13 соответственно. Гены с вариабельными областями тяжелых цепей клонировали в pANT17 через участки МЫ и HindIII в рамках либо человеческого гена тяжелой цепи γ1 (аллотип Glm3 (Glm(f))), либо челоческого гена тяжелой цепи γ4, а ген с вариабельными областями легких цепей клонировали в pANT13 через участки BssHII и BamHI в рамках гена с константной областью легкой цепи каппа (аллотип Km3).
Транскрипцию генов тяжелых и легких цепей проводили под контролем цитомегаловирусного (CMV) IE-промотора (см. документы US 5168062 и US 5385839, Университет Айовы), а плазмида pANT17 содержала мутантный миниген dhfr (Simonsen & Levinson 1983, PNAS 80:2495-2499) под контролем промотора SV40 и поли (А) последовательности для отбора эукариотических клеток. И pANT17, и pANT13 содержали ген β-лактатмазы (ApR) для прокариотического отбора и точку начала репликации рМВ1 для размножения в прокариотических клетках. Все плазмиды были воспроизведены в Е. coli XL1-blue (Stratagene Cat. No.200130). Праймеры, использовавшиеся для амплификации генов с V-областями для клонирования в экспрессионные векторы pANT, показаны в таблице 2.
Экспрессирующие конструкции тяжелых и легких цепей затем совместно трансфицировали либо кратковременно в клетки НЕК293 путем трансфекции, основанной на фосфате кальция, либо стабильно трансфицировали в клетки NSO путем электропортации. Отобранное антитело очищали от супернатантов клеточной культуры с помощью храматографии на белке А. С помощью иммуноферментного анализа (ELISA) связывания с CTLA4 (Фиг.4), иммуноферментного анализа (ELISA) конкуренции CTLA4 против В7.1 и В7.2 (Фиг.5 и 6) и с помощью связывания с CTLA4, экспрессированного на Т-клетках поточной цитометрией, как в Примере 1, было выявлено, что оба химерных антитела (ЗВ10 и 8Н5) сохраняют связывание с CTLA4 начальных моноклональных антител.
Пример 4 - Анализ пролиферации Т-клеток
Мононуклеарные клетки периферической крови (РВМС) активировали при помощи гранул, покрытых антителами к человеческому CD2, к человеческому CD3 и к человеческому CD28 (Miltenyi Biotec, Бизли, Суррей). 5×105 клеток помещали в каждую лунку 96-луночного микропланшета в среде AIM-V с гранулами, добавляемыми к клеткам в соотношении 1 гранула на каждую клетку. Тестовые антитела или изотипические контроли, как полагается, разводили в среде AIM-V и в объеме 50 мкл на лунку были добавлены к клеткам с конечным объемом 200 мкл. Также учитывали контроли, содержащие только среду (без антител). Микропланшеты выдерживали на протяжении 4 дней при 37°С, затем клетки активировали 0,75 μCi [3Н]-тимидином (Perkin Elmer, Биконсфилд, Великобритания) в культурной среде AIM-V® и выдерживали еще 18 часов перед тем, как их собриали на плоский фильтр (Perkin Elmer) при помощи клеточного харвестера TomTec Mach III (Хэмден, штат Коннектикут, США). Число импульсов в минуту (срт) для каждой лунки устанавливали сцинтилляционным подсчетом Meltilex™ (Perkin Elmer) на жидком сцинтилляционном счетчике 1450 Microbeta Wallac Trilux (Perkin Elmer) при счете с низким фоном. Число импульсов в минуту для каждого образца антитела было нормализовано до контроля, содержащего только среду. В ходе двух отдельных исследований было показано, что химерные антитела изменяют на противоположное ингибирование пролиферации Т-клеток, вызванное CTLA4, как видно по начальным моноклональным антителам (Фиг.7).
Пример 5 - Генерация гуманизированных антител
Гуманизированные антитела генерировали при помощи способов, описанных в документе ЕР 1844074 (Antitope Ltd). Структурные модели мышиных V-областей получали с использованием швейцарской белковой базы данных Swiss PDB и анализировали, чтобы идентифицировать важные аминокислоты из V-областей 3В10 и 8Н5, которые, вероятно, являются важными для свойств антитела, ассоциированных со связыванием с CTLA4 («сдерживающие остатки»).
База данных человеческих последовательностей V-областей была использована для идентификации сегментов человеческих последовательностей V-областей, содержащих каждый из сдерживающих остатков, который будет использоваться как гуманизированное антитело. Обычно для обеспечения каждого сдерживающего остатка использовали два или более альтернативных сегмента последовательности с V-областями, что выразилось в большом количестве возможных последовательностей гуманизированных последовательностей V-областей против CTLA4 для 8Н5 и 3В10. Эти последовательности анализировали для прогнозирования связывания пептидов МНС класса II незародышевой линии путем анализа in silico согласно описанию в Fothergill et al. (WO 9859244, Eclagen Ltd), а также для известных эпитопов Т-клеток CD4+ при помощи баз данных, в том числе Базы данных эпитопов и ресурса для анализирования "The Immune Epitope Database and Analysis Resource", http://www.immuneepitope.org/. Последовательности V-областей с прогнозируемыми связывающими пептидами МНС класса II незародышевой линии или со значительными попаданиями по базе данных эпитопов Т-клеток не рассматривали. Это привело к сокращению ряда последовательностей V-областей. Отобранные комбинации сегментов последовательностей V-областей затем объединяли для производства аминокислотных последовательностей V-областей тяжелых и легких цепей. Пять тяжелых цепей и пять последовательностей легких цепей (обозначенных VH1-VH5 и VK1-VK5 соответственно) были отобраны для каждого из 8Н5 (SEQ ID Nos 41-45 и 46-50 соответственно) и 3В10 (SEQ ID Nos 31-35 и 36-40 соответственно).
Кодирующие ДНК V-области гуманизированного варианта синтезировали и субклонировали в экспрессионные векторы pANT17 и pANT13, как в Примере 3. Все комбинации гуманизированных цепей VH и VK (т.е., общим количеством 25 пар для каждого из 8Н5 и 3В10) временно трансфицировали в HEK293, а также трансфицировали в клетки NSO, а антитело было очищено хроматографией на белок А от супернатантов культур, как в Примере 3.
Пример 6 - Анализ гуманизированных антител
Связывание гуманизированных вариантов 8Н5 и 3В10, полученных из HEK и NS0, с рекомбинантным CTLA4 изучали с помощью иммуноферментного анализа конкурентным методом с соответствующим родительским гибридным антителом. Родительские гибридные антитела 8Н5 и 3В10 были биотинилированы при помощи набора для биотинилизации Biotin Tag™ Micro Biotinylation kit (Sigma-Aldrich). 96-луночные микропланшеты MaxiSorp (Nunc) были покрыты 0,5 мкг/мл рекомбинантного человеческого CTLA4-Ig в фосфатном буфере Дульбекко (конечный объем 100 мкл) при 4°С в течение ночи. CTLA4-Ig отбрасывали, а микропланшеты блокировали фосфатным буфером Дульбекко/2% бычьим сывороточным альбумином на 1 час при комнатной температуре. Микропланшеты трижды промывали промывочным буфером (0,05% твин-20 в фосфатном буфере Дульбекко). Тестовые гуманизированные антитела в разных концентрациях предварительно смешивали с биотинилированным родительским гибридным антителом (конечная концентрация 200 мкг/мл), а затем добавляли к микропланшету с CTLA4-Ig (конечный объем 100 мкл). Все образцы тестировали в параллельных испытаниях. Микропланшеты выдерживали 1 час при комнатной температуре и трижды промывали промывочным буфером. Добавдяили 100 мкл раствора 1 к 500 стрептавидина-пероксидазы хрена (Sigma-Aldrich) и выдерживали на протяжении 1 часа при комнатной температуре. Микропланшеты трижды промывали промывочным буфером, и добавляли 100 мкл субстрата SigmaFast OPD (Sigma-Aldrich, Кат. №Р9187) и выдерживали при комнатной температуре в темном месте на протяжении 4 минут. Реакцию прекращали добавлением 50 мкл ЗМ НС1. Микропланшеты читали на расстоянии 490 нм при помощи оборудования для чтения планшетов Dynex.
Все доминантные гуманизированные варианты 8Н5 показали профили конкурирующего связывания, схожие с гибридными антителами 8Н5, однако варианты, содержащие каппа цепь VK5, показали слегка пониженную способность связываться по сравнению с другими вариантами (Фиг.17). Аналогичным образом, все доминантные гуманизированные варианты 3В10 показали конкурирующие профили связывания, схожие с гибридными антителами 3В10. Кроме того, все варианты доминантных гуманизированных 8Н5 и 3В10 при конкурентном иммуноферментном анализе CTLA4 с В7.1 и В7.2 (Пример 3) дали профили конкурирующего связывания, очень схожие с гибридными антителами, показанными на Фиг.5 и 6, в соответствии с которыми >90% связывания В7.1 или В7.2 ингибировалось при максимальных концентрациях доминантных гуманизированных вариантов. Доминантный гуманизированный вариант VH5/VK4 (SEQ ID Nos 45 и 39 соответственно) был выбран в качестве доминантного антитела для дальнейших исследований.
Пример 7 - Генерация фрагментов scFv и Fab
Гуманизированные варианты 8Н5 и 3В10 из Примера 6 переводили в одноцепочечные фрагменты scFv и клонировали в фаговые векторы М13, как описано в Benhar I. and Reiter Y., Current Protocols in Immunology, Unit 10.19B, Wiley Online Library, May 2002 (http://www.currentprotocols.com/protocol/im1019b) при помощи экспрессионного модуля pCANTAB5E вектора RPAS (Amersham Pharmacia Biotech, Литл Чалфонт, Великобритания). Гуманизированные гены VH и VK амплифицировали при помощи праймеров, которые обеспечили терминальные рестрикционные сайты SfiI и NotI, внутренний Gly4Ser линкер и терминальную С метку his6. Конструкции scFv были вставлены в вектор pCANTAB5E как фрагменты SfiI-NotI и трансформированы в E.coli HB2151, в результате чего scFv был экспортирован в периплазму и частично в среду роста. Фрагменты scFv очищали от среды роста с помощью аффинной никель-хелатной хроматографии с использованием картриждей HIS-Select HF (Sigma-Aldrich). Очищенные scFv тестировали в испытании на конкуренцию между B7.1-Ig и B7.2-Ig, как описано в Примере 1, и все Гуманизированные scFv показали конкурирующее связывание с CTLA4. Гуманизированные варианты 8Н5 and ЗВ10 из Примера 6 также конвертировали в Fab при помощи способа, использованного для scFv, за исключением того, что амплифицированные Гуманизированные гены VH и VK далее амплифицировали генами с константными областями СН1 и Сκ для формирования фрагментов VH-CH1 и VK-Сκ, которые далее амплифицировали праймерами для соединения данных фрагментов с лидерной pelB последовательностью с 22 аминокислотами (Lei S.P., Lin Н.С., Wang S.S., Callaway J., and Wilcox G., J Bacteriol. 169 (1987) p4379-4383) между фрагментами генов VH-CH1 выше по потоку и VK- Ск ниже по потоку, что в результате привело к образованию дицистронного гена с Fab-фрагментом. Фрагменты Fab из вариантов гуманизированных антител генерировали и очищали способом, описанным для фрагментов scFv, и тестировали в испытании на конкуренцию между B7.1-Ig и B7.2-Ig, как описано в Примере 1. Все гуманизированные фрагменты Fab показали конкурирующее связывание с CTLA4.
Пример 8 - Анализ ответов Т-клеток CD4+
Мононуклеарные клетки периферической крови (МКПК, англ. РВМС) изолировали из здоровой лейкоцитарной пленки донора (из крови, взятой в течение 24 часов), которую получили из Национальной службы Великобритании по переливанию крови (UK National Blood Transfusion Service, госпиталь Адденбрук, Кембридж, Великобритания) согласно полученному разрешению Местного комитета по этике исследований госпиталя Адденбрук (Addenbrooke's Hospital Local Research Ethics Committee). Мононуклеарные клетки периферической крови изолировали из лейкоцитарной пленки с помощью центрифугирования в градиенте плотности аппаратом Lymphoprep (Axis-shield, Данди, Великобритания), а Т-клетки CD8+ деплетировали при помощи CD8+ RosetteSep™ (StemCell Technologies Inc, Лондон, Великобритания). Доноры характеризовали путем идентифицирования гаплотипов HLA-DR с использованием набора для тканевого типирования HLA SSP-PCR (Biotest, Солихалл, Великобритания). Также были определены ответы Т-клеток на контрольные антигены, включая токсин диагностического антигена тетануса (KLH Pierce, Крамлингтон, Великобритания, а пептиды получены из вирусов гриппа А и Эпштейна-Барр). Затем Мононуклеарные клетки периферической крови заморозили и хранили в жидком азоте, пока они не потребовались.
Чтобы получить дендритные клетки (DC), произведенные из моноцитов, отбирали 50 разных доноров мононуклеарных клеток периферической крови для распределения с частотностью аллотипов HLA-DR и HLA-DQ, схожей с частотностью у всего населения в мире. Мононуклеарные клетки периферической крови были восстановлены в культурной среде AIM-V®, а клетки CD14+ изолировали при помощи микрогранул Miltenyi CD 14 и колонок LS (Miltenyi Biotech, Оксфорд, Великобритания). Моноциты заново растворяли в AIM-V®, в которую добавили 1000 ед/мл IL-4 и 1000 ед/мл GM-CSF («среда дендритных клеток») для 4-6×106 МКПК/мл, а затем распределяли по 24-луночным микропланшетам (конечный объем культуры 2 мл). Клетки получили питание на день 2 путем замены половины объема культурной среды для дендритных клеток. Ко дню 3 моноциты изменились на полузрелые дендритные клетки, которые предварительно выдерживали либо со 40 мкг/мл тестового гуманизированного или химерного антитела, 100 мкг/мл KLH, либо только со средой. Полузрелые дендритные клетки выдерживали с антигеном на протяжении 24 часов, после чего избыток тестового антитела удаляли двойным промыванием клеток и повторным разведением в культурной среде для дендритных клеток, куда было добавлено 50 нг/мл фактора некроза опухоли α (TNF-α) (Peprotech, Лондон, Великобритания). Дендритные клетки питали путем замены половины объема культурной среды для дендритных клеток (с добавлением 50 нг/мл фактора некроза опухоли α) перед тем, как были собраны зрелые дендритные клетки на день 8. Собранные зрелые дендритные клетки подсчитывали, и оценивали их жизнеспособность путем исключения трипанового синего. Затем дендритные клетки подвергали воздействию γ-лучей (4000 рад) и повторно разводили в среде AIM-V с плотностью 2×105 клеток на мл перед тем, как использовать в анализе по технологии ELISpot и исследовании на пролиферацию. Кроме того, на день 8 также изготовили свежие Т-клетки CD4+. Для очищения Т-клеток CD4+ мононуклеарные клетки периферической крови восстанавливали в культурной среде AIM-V®, а клетки CD4+ изолировали при помощи микрогранул Miltenyi CD4 и колонок LS (Miltenyi Biotech, Оксфорд, Великобритания) и повторно разводили в среде AIM-V® с плотностью 2×106 клеток на мл.
На день 8 были установлены исследования на пролиферацию Т-клеток, в соответствии с которыми 1×105 аутологичных Т-клеток CD4+ добавили к 1×104 дендритным клеткам, нагруженным гуманизированным или гибридным антителом (соотношение 10:1), в 96-луночных микропланшетах с U-образным дном, в которые добавлена среда AIM-V® до конечного объема 200 мкл на лунку. На день 14 микропланшеты получали импульс luCi [3H] (Perkin Elmer, Биконсфилд, Великобритания) на лунку в 25 мкл AIMV на протяжении 6 часов перед тем, как были собраны на плоский фильтр (Perkin Elmer) при помощи клеточного харвестера TomTec Mach III (Хэмден, штат Коннектикут, США). Все препараты антител параллельно испытывали в шести культурах. Число импульсов в минуту для каждой лунки устанавливали с помощью сцинтилляционного счета на жидком сцинтилляционном счетчике 1450 Microbeta Wallac Trilux (Perkin Elmer) с paralux счетом с низким фоном. За норму было принято число импульсов в минуту для каждого образца антитела только со средой AIM V®.
Для исследований по технологии ELISpot микропланшеты ELISpot (Millipore, Уотфорд, Великобритания) покрывали 100 мкл на лунку IL-2 иммобилизованного антитела (R&D Systems, Абингтон, Великобритания) в фосфатном буфере (PBS). Затем микропланшеты дважды промывали в фосфатном буфере, выдерживали в течение ночи в блокирующем буфере (1% бычьего сывороточного альбумина (Sigma) в фосфатном буфере) и промывали в среде AIM V®. На день 8 1×105 аутологических Т-клеток CD4+ добавили к 1×104 дендритным клеткам, нагруженным антигеном (соотношение 10:1), в 96-луночных микропланшетах ELISpot. Все препараты антител параллельно испытывали в шести культурах. Для каждой донорской мононуклеарной клетки периферической крови также учитывали негативный контроль (только среда AIM V®), контроль на отсутствие клеток и позитивный контроль на фитогемагглютинин (РНА, 10 мкг/мл).
После последующего семидневного инкубационного периода микропланшеты ELISpot три раза последовательно промывали в dH2O и фосфатном буфере перед добавлением 100 мл фильтрованного биотинилизированного идентифицирующего антитела (R&D Systems, Абингтон, Великобритания) в фосфатном буфере с 1% бычьим сывороточным альбумином. После выдерживания при 37°С в течение 1,5 часов микропланшеты трижды промывали в фосфатном буфере, и добавили 100 мкл фильтрованного стрептавидина, меченого щелочной фосфатазой (R&D Systems) в фосфатный буфер с 1% бычьим сывороточным альбумином на 1 час (выдерживание при комнатной температуре). Стрептавидин, меченый щелочной фосфатазой, удалили, а микропланшеты промывали четыре раза в фосфатном буфере. Добавили смесь реактивов BCIP/NBT (R&D Systems) в каждую лунку и выдерживали 30 минут при комнатной температуре. Образование зон локализации было остановлено промыванием лунок и обратной стороны лунок трижды с помощью dH2O. Высушенные микропланшеты сканировали на анализаторе Immunoscan™ и установили количество пятен на лунку при помощи программного обеспечения Immunoscan™ версии 4.
Для исследований пролиферации и IL-2 ELISpot результаты выразили в виде индекса стимуляции (SI), который определяется как соотношение числа импульсов в минуту (исследование пролиферации) или зон локализации (исследование ELISpot) для каждого тестового антитела против контроля, содержащего только среду, порог индекса стимуляции был равен или больше 2 (SI≥2.0) для положительных ответов Т-клеток. Данные показали, что Т-клетки, индуцированные гибридными антителами 8Н5 и 3В10 давали ответы в 8 или более из 50 протестированных донорских мононуклеарных клеток периферической крови (>=16%), в то время как ни одна из Т-клеток, индуцированных гуманизированными антителами 8Н5 и 3В10 не давала ответа у более, чем 2 из 50 доноров (<=4%, в среднем 2%+-2%), что демонстрирует эффективность процесса гуманизации при удалении ответов Т-клеток из V-областей. В параллельном исследовании были синтезированы ДНК с последовательностями V-областей из полностью человеческих антител к CTLA4 MDX010 (ипилимумаб) (Keler et al., ibid) и тремелимумаб (Ribas et al., ibid), и использованы для производства рекомбинантных форм IgG1/каппа этих антител способами, описанными в Примере 5. Препараты этих антител, полученных из NS0, тестировали с использованием мононуклеарных клеток периферической крови тех же 50 доноров, что и раньше, чтобы индуцировать ответ Т-клеточных хелперов CD4+ в шести параллельно исследуемых культурах. Ответы Т-клеток были выявлены в среднем у 4 доноров для ипилимумаба (8%+-2%) и у 5 доноров для версии IgG1/κ тремелимумаба (10%+-2%). Таким образом, только гуманизированные антитела к CTLA4 по изобретению при тестировании in vitro на индукцию ответов Т-клеточных хелперов CD4+ на 50 образцах человеческой крови были способны вызвать ответ от Т-клеточных хелперов у<=4% доноров.
Пример 9 - Модель с использованием реакции смешанной культуры человеческих лимфоцитов
Исследование на реакцию смешанной культуры лимфоцитов применяли для измерения влияния блокирования пути CTLA4 при выделении интерферона-γ как меру активации человеческих Т-клеток. Свежую кровь нескольких доноров (полученную у Национальной службы Великобритании по переливанию крови, Пример 8) разводили 1:1 с фосфатным буфером/2% человеческой сывороткой и наслаивали на раствор Lymphoprep (Nycomed) для центрифугирования при 900 г. Мононуклеарные клетки периферической крови были удалены, промыты и повторно разведены в среде AIM-V (Invitrogen). Мононуклеарные клетки периферической крови, полученные из разных несовпадающих донорских пар затем объединяли в соотношении 1:1 и поместили в 96-луночный микропланшет для получения 2.5×105 мононуклеарных клеток периферической крови на лунку с образцом. Добавили фитогемагглютинин (Sigma Aldrich) до конечной концентрации 2 мкг/мл, чтобы стимулировать пролиферацию популяций Т-клеток. Либо антитело к CTLA4 с доминантными VH5/VK4, контрольное антитело MDX010 к CTLA4 (Пример 8), либо изотипический контроль IgG добавили до конечной концентрации 150 мкг/мл. В качестве контроля использовали 5 мкг/мл CTLA4-Fc вместо антитела, чтобы продемонстрировать ингибирование выделения интерферона-γ. Общий конечный объем на лунку составил 150 мкл, каждое антитело было протестировано пять раз на каждую комбинацию доноров. 96-луночные микропланшеты выдерживали в нормальных для культуры условиях в течение 72 часов, после чего 100 мкл супернатанта брали на пробу для измерения интерферона-7 с помощью иммуноферментного анализа (Thermo scientific, ESS0002) с соблюдением рекомендованного производителем протокола. По данным Фиг.19, антитело с доминантными VH5/VK4 показало более высокую активацию Т-клеток, чем контрольное антитело MDX010 к CTLA4, для всех комбинаций доноров со средним ростом более чем в 2 раза у активации Т-клеток для VH5/VK4 по сравнению с MDX010.
Пример 10 - Исследования опухолей на животных Модель исследования опухолей на животных применяли для анализа антител к человеческому CTLA4 т vivo при ингибировании роста опухоли. В рамках этой модели клетки МС38 мышиной опухоли толстого кишечника (Corbett et al., (1975) Cancer Res 35:2434-2439, поставленные компанией Oncolmmune, Inc., Энн-Арбор, США) были выращены в мышах с внедренным человеческим CTLA4 (Oncolmmune, Inc.).
Мышам с внедренным человеческим CTLA4 (возраст 7-10 недель, самцы и самки распределены в равных пропорциях по группам) вводили подкожно в бок 5×105 опухолевых клеток МС38 в объеме 0,1 мл. Либо антитело к CTLA4 с доминантными VH5/VK4, MDX010 (Пример 8), либо изотипически сходное антитело вводили в дозе либо 5 мг/кг, либо 10 мг/кг (объем дозы 10 мл/кг) еженедельно начиная со следующего после введения опухолевых клеток дня («День 2»). Измерения опухоли проводили раз в две недели в течение эксперимента штангенциркулем, выражали его в кубическом объеме (мм3). За животными следили, либо пока объем опухоли не достигал 2000 мм3, либо по 45 день после введения опухолевых клеток. Результаты, показанные на Фиг.19, демонстрируют, что ингибирование роста опухоли улучшилось благодаря антителу к CTLA4 с доминантными VH5/VK4 по сравнению с MDX010.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К СD52 | 2012 |
|
RU2605307C2 |
| ЧЕЛОВЕЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ AILIM, КОСТИМУЛИРУЮЩЕЙ МОЛЕКУЛЫ ПЕРЕДАЧИ СИГНАЛА, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2001 |
|
RU2262511C2 |
| АНТИТЕЛА ПРОТИВ ГЛОБУЛОМЕРА Аβ, ИХ АНТИГЕНСВЯЗЫВАЮЩИЕ ЧАСТИ, СООТВЕТСТВУЮЩИЕ ГИБРИДОМЫ, НУКЛЕИНОВЫЕ КИСЛОТЫ, ВЕКТОРЫ, КЛЕТКИ-ХОЗЯЕВА, СПОСОБЫ ПОЛУЧЕНИЯ УКАЗАННЫХ АНТИТЕЛ, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ АНТИТЕЛА, ПРИМЕНЕНИЯ УКАЗАННЫХ АНТИТЕЛ И СПОСОБЫ ИСПОЛЬЗОВАНИЯ УКАЗАННЫХ АНТИТЕЛ | 2006 |
|
RU2442793C2 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИТИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2799436C1 |
| АНТИТЕЛА ПРОТИВ IL2 | 2006 |
|
RU2425054C2 |
| ТЕРАПЕВТИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2002 |
|
RU2328506C2 |
| АНТИТЕЛО К BLYS | 2013 |
|
RU2613422C2 |
| АНТИТЕЛО ПРОТИВ LAG-3, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2757813C2 |




























Изобретение относится к области биохимии. Описана группа изобретений, включающая антитело к CTLA4 (варианты) и мультиспецифическое антитело (варианты), которые характеризуются ингибированием связывания CTLA4 с человеческим В7, полинуклеотиды, кодирующие вышеуказанные антитела или мультиспецифические антитела, вектор экспрессии антитела к CTLA4, клетку-хозяина для экспрессии антитела к CTLA4, композицию для лечения заболеваний, связанных с CTLA4, композицию для диагностики заболеваний, связанных с CTLA4, способ лечения заболевания, связанного с человеческим CTLA4, способ лечения рака, применение вышеуказанных антител или мультиспецифических антител для выявления in vitro или in vivo присутствия человеческого антигена CTLA4 для диагностирования заболеваний, связанных с человеческим CTLA4, применение вышеуказанных антител или мультиспецифических антител для лечения заболеваний, связанных с человеческим CTLA4. Изобретение расширяет арсенал антител к CTLA4. 16 н. и 15 з.п. ф-лы, 18 ил., 2 табл., 10 пр.
1. Антитело к CTLA4, которое характеризуется ингибированием связывания CTLA4 с человеческим В7 и содержит вариабельные области, имеющие последовательности CDR из:
(i) CDRH1, содержащий последовательность SYWIN (SEQ ID NO: 15);
(ii) CDRH2, содержащий последовательность RIAPGSGTTYYNEVFKG (SEQ ID NO: 16);
(iii) CDRH3, содержащий последовательность GDYGSY (SEQ ID NO: 17);
(iv) CDRL1, содержащий последовательность SASSSISYMH (SEQ ID NO: 18);
(v) CDRL2, содержащий последовательность DTSKLAS (SEQ ID NO: 19); и
(vi) CDRL3, содержащий последовательность HQRTSYPLT (SEQ ID NO: 20).
2. Антитело к CTLA4 по п. l, которое содержит вариабельные области тяжелой цепи, имеющие последовательности, выбранные из группы, содержащей SEQ ID NOS: 41-45, в сочетании с вариабельными областями легкой цепи, имеющими последовательности, выбранные из группы, содержащей SEQ ID NOS: 46-50.
3. Антитело к CTLA4 по п. 2, которое содержит SEQ ID NO: 45 в вариабельной области тяжелой цепи в сочетании с SEQ ID NO: 49 в вариабельной области легкой цепи.
4. Антитело к CTLA4 по п. 1, которое при проверке in vitro на индукцию ответов Т-клеток хелперов CD4+ по меньшей мере в 50 образцах человеческой крови с распределением аллотипов HLA-DR у человеческой популяции характеризуется увеличением количества ответов Т-клеток на <=4%.
5. Антитело по п. 1, в котором последовательности вариабельных областей полностью получены из последовательностей вариабельных областей человеческих антител.
6. Антитело по п. 1, которое содержит вариабельные области вместе с константной областью тяжелой цепи либо изотипов IgG1, IgG2, IgG3 или IgG4, либо с константной областью мутировавшего IgG, и константной областью легкой цепи изотипа каппа, например, в котором человеческие константные области представляют собой IgG1 и каппа или IgG4 и каппа.
7. Антитело по п. 1, в котором антитело представляет собой scFv или Fab.
8. Мультиспецифическое антитело, которое характеризуется ингибированием связывания CTLA4 с человеческим В7, содержащее по меньшей мере одно антитело по любому из пп. 1-7.
9. Полинуклеотид, который кодирует антитело по любому из пп. 1-7.
10. Полинуклеотид, который кодирует мультиспецифическое антитело по п. 8.
11. Антитело к CTLA4, которое характеризуется ингибированием связывания CTLA4 с человеческим В7 и содержит вариабельные области, имеющие последовательности CDR из:
(i) CDRH1, содержащий последовательность DYNMD (SEQ ID NO: 9);
(ii) CDRH2, содержащий последовательность NINPNSESTSYNQKFKG (SEQ ID NO: 10);
(iii) CDRH3, содержащий последовательность DGNRYDAWFAY (SEQ ID NO: 11);
(iv) CDRL1, содержащий последовательность SASSSVTYMH (SEQ ID NO: 12);
(v) CDRL2, содержащий последовательность STSILAS (SEQ ID NO: 13); и
(vi) CDRL3, содержащий последовательность QQRTSYPLT (SEQ ID NO: 14).
12. Антитело к CTLA4 по п. 11, которое содержит вариабельные области тяжелой цепи, имеющие последовательности, выбранные из группы, содержащей SEQ ID NOS: 31-35, в сочетании с вариабельными областями легкой цепи, имеющими последовательности, выбранные из группы, содержащей SEQ ID NOS: 36-40.
13. Антитело к CTLA4 по п. 11, которое при проверке in vitro на индукцию ответов Т-клеток хелперов CD4+ по меньшей мере в 50 образцах человеческой крови с распределением аллотипов HLA-DR у человеческой популяции характеризуется увеличением количества ответов Т-клеток на <=4%.
14. Антитело по п. 11, в котором последовательности вариабельных областей полностью получены из последовательностей вариабельных областей человеческих антител.
15. Антитело по п. 11, которое содержит вариабельные области вместе с константной областью тяжелой цепи либо изотипов IgG1, IgG2, IgG3 или IgG4, либо с константной областью мутировавшего IgG, и константной областью легкой цепи изотипа каппа, например, в котором человеческие константные области представляют собой IgG1 и каппа или IgG4 и каппа.
16. Антитело по п. 11, в котором антитело представляет собой scFv или Fab.
17. Мультиспецифическое антитело, которое характеризуется ингибированием связывания CTLA4 с человеческим В7, содержащее по меньшей мере одно антитело по любому из пп. 11-16.
18. Полинуклеотид, который кодирует антитело по любому из пп. 11-16.
19. Полинуклеотид, который кодирует мультиспецифическое антитело по п. 17.
20. Вектор для экспрессии антитела к CTLA4, ингибирующего связывание CTLA4 с человеческим В7, который содержит полинуклеотид по любому из пп. 9, 10, 18, 19.
21. Клетка-хозяин для экспрессии антитела к CTLA4, ингибирующего связывание CTLA4 с человеческим В7, которая содержит вектор по п. 20.
22. Композиция для лечения заболеваний, связанных с CTLA4, которая содержит эффективное количество антитела к CTLA4 по любому из пп. 1-7 и пп. 11-16 или мультиспецифического антитела по п. 8 или 17.
23. Композиция для диагностики заболеваний, связанных с CTLA4, которая содержит эффективное количество антитела к CTLA4 по любому из пп. 1-7 и пп. 11-16 или мультиспецифического антитела по п. 8 или 17.
24. Способ лечения заболевания, связанного с человеческим CTLA4, в котором пациенту, нуждающемуся в таком лечении, вводят эффективную дозу антитела по любому из пп. 1-7 и пп. 11-16 или мультиспецифического антитела по п. 8 или 17.
25. Способ по п. 24, в котором заболеванием, связанным с человеческим CTLA4, является рак, нарушение клеточной пролиферации, заболевание центральной нервной системы (ЦНС), заболевание кровеносной системы, воспалительное заболевание, инфекционное заболевание, аллергия, заболевание, связанное с Т-клетками, реакция «трансплантат против хозяина» или реакция «хозяин против трансплантата».
26. Способ по п. 24 или 25, в котором параллельно вводят эффективную дозу химиотерапевтического вещества.
27. Способ по п. 24 или 25, в котором параллельно вводят фармацевтический носитель, включающий вакцину.
28. Способ лечения рака, выбранного из рака простаты, почки, толстой кишки, легких или груди, в котором пациенту, нуждающемуся в таком лечении, вводят эффективную дозу антитела по любому из пп. 1-7 и пп. 11-16 или мультиспецифического антитела по п. 8 или 17.
29. Применение антитела по любому из пп. 1-7 и пп. 11-16 или мультиспецифического антитела по п. 8 или 17 для выявления in vitro или in vivo присутствия человеческого антигена CTLA4 для диагностирования заболеваний, связанных с человеческим CTLA4.
30. Применение антитела по любому из пп. 1-7 и пп. 11-16 или мультиспецифического антитела по п. 8 или 17 для лечения заболеваний, связанных с человеческим CTLA4.
31. Применение по п. 30, в котором заболеванием, связанным с человеческим CTLA4, является рак, например рак простаты, почки, толстой кишки, легких или груди, нарушения клеточной пролиферации, заболевания центральной нервной системы (ЦНС), заболевания кровеносной системы, воспалительные заболевания, инфекционные заболевания, аллергия, заболевания, связанные с Т-клетками, реакцию «трансплантат против хозяина» или реакция «хозяин против трансплантата».
| WO 2001054732 A1, 02.08.2001 | |||
| WO 2012140627 A1, 18.10.2012 | |||
| WO 2012156018 A1, 22.11.2012 | |||
| US 20080279865 A1, 13.11.2008 | |||
| СПОСОБ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТОГО ЗАБОЛЕВАНИЯ С ПРИМЕНЕНИЕМ РАСТВОРИМОГО CTLA4 | 2004 |
|
RU2353384C2 |
Авторы
Даты
2017-09-06—Публикация
2012-03-09—Подача