Изобретение относится к области медицины, а именно к генетике, молекулярной диагностике и онкологии, и касается способа выявления генных мутаций в опухолях человека для использования таргетной терапии.
При многих онкологических заболеваниях, в частности при раке легких, толстой кишки, меланоме, обязательными объектами выявления генных мутаций являются гены KRAS, NRAS, BRAF. С этой целью используют секвенирование по Сэнгеру - «золотой стандарт» клинической генодиагностики.
Недостатки способа: невысокая чувствительность, трудоемкость, риск перекрестного загрязнения клинических образцов.
Известен способ выявления генных мутаций посредством плавления ДНК (DNA Melting Analysis, DMA), реализуемый иногда в режиме высокого разрешения (High Resolution Melting Analysis, HRMA) (Erali and Wittwer, High resolution melting analysis for gene scanning. Methods, 2010, 50, 250-261; Krypuy et al., High resolution melting analysis for the rapid and sensitive detection of mutations in clinical samples: KRAS codon 12 and 13 mutations in non-small cell lung cancer. BMC Cancer, 2006, 6, 295).
Недостатки способа: относительно невысокая чувствительность, необходимость дорогостоящего оборудования.
Известен способ выявления генных мутаций с применением в процессе ПЦР блокирующих агентов - пептидных нуклеиновых кислот, способных избирательно подавлять амплификацию аллелей дикого типа и тем самым повышать чувствительность определения мутаций (Guha et al., DISSECT Method Using PNA-LNA Clamp Improves Detection of T790m Mutation. PLoS ONE, 2013, 8, e67782).
Недостатки способа: необходимость независимой идентификации мутантного алле-ля, дорогостоящий химический синтез.
Прототипом заявляемого способа является способ выявления генных мутаций посредством DMA с использованием зондов TaqMan (Huang et al., Multiplex fluorescence melting curve analysis for mutation detection with dual-labeled, self-quenched probes. PLoS ONE, 2011, 6, e19206). Прототип включает следующие приемы: а) выделение ДНК из образца опухолевой ткани; б) амплификацию определенного фрагмента гена в асимметричной ПЦР в реальном времени с использованием флуоресцентного зонда TaqMan; в) использование зонда TaqMan также на этапе плавления ДНК. Характерные изменения пиков плавления дуплексов зонда с однонитевой ДНК позволяют обнаружить в анализируемой последовательности мутацию.
Недостаток способа: невысокая чувствительность выявления генных мутаций в небольших опухолевых клонах, обусловливающих лекарственную резистентность опухоли.
Задачей заявляемого изобретения является создание нового, более чувствительного способа выявления генных мутаций BRAF в опухолях человека.
Технический результат: заявляемый способ обладает высокой чувствительностью выявления генных мутаций BRAF, превышающей в 10 и более раз чувствительность прототипа, при сохранении простоты исполнения, реализации 2-часового теста в одной пробирке без промежуточных или дополнительных процедур с однократной регистрацией результатов и без риска перекрестного загрязнения образцов ДНК операционного материала и опухолевой ткани, заключенной в парафиновые блоки.
Сущность заявляемого способа заключается в выявлении в ДНК опухоли мутаций BRAF, ассоциированных с чувствительностью опухоли к таргетной терапии, с использованием асимметричной ПЦР в реальном времени с двумя флуоресцентными зондами TaqMan, применяемыми в качестве агентов, блокирующих синтез аллелей дикого типа, и пост-амплификационным плавлением дуплексов зонд-однонитевая ДНК. Анализ результатов плавления осуществляют с помощью стандартного модуля плавления (DNA Melting Analysis) аппарата ПЦР (Bio-Rad CFX-96).
Расположенные по ходу движения Taq полимеразы гибридизованные с матрицей олигонуклеотиды, в частности зонды TaqMan, замедляют работу фермента (Montgomery et al., The Influence of Nucleotide Sequence and Temperature on the Activity of Thermostable DNA Polymerases. The Journal of Molecular Diagnostics, 2014, 16, 305-313). В специально подобранных условиях ПЦР зонды TaqMan подавляют амплификацию аллеля дикого типа сильнее, чем мутантного аллеля из-за неспаренного в последнем случае основания, существенно ослабляющего структуру дуплекса. За счет преимущественной амплификации мутантного аллеля существенно возрастает чувствительность способа.
Заявляемый способ включает следующие этапы: амплификацию исследуемого фрагмента гена BRAF посредством асимметричной ПЦР в реальном времени с двумя зондами TaqMan (смысловым и антисмысловым); плавление дуплекса зонд-однонитевая ДНК; построение пиков плавления встроенной программой Bio-Rad CFX Manager. Способ осуществляют в одном приборе и одной пробирке без вмешательства оператора.
Заявляемый способ осуществляют следующим образом.
а) Получение биологического материала - опухолевой ткани, замороженной в жидком азоте или фиксированной формальдегидом и заключенной в парафиновые блоки.
б) Выделение ДНК из опухолевой ткани депротеинизацией фенолом и хлороформом, а из парафиновых блоков - с использованием коммерческого набора QIAamp DNA FFPE Tissue Kit (Qiagen).
в) Амплификация фрагмента гена BRAF в двух реакциях ПЦР, в первой синтезируется преимущественно антисмысловая нить ампликона (соотношение прямого и обратного праймеров - 1:15), во второй - смысловая нить ампликона (соотношение прямого и обратного праймеров - 15:1), что позволяет выявлять мутации BRAF в обеих нитях ампликона. Реакцию проводили в 96-луночных планшетах на приборе CFX96 (Bio-Rad Laboratories, США). Инкубационная смесь (25 мкл) содержала 50 мМ Трис-HCl, рН 8,8; 50 мМ KC1; 0,01% Tween-20; 3 мМ MgCl2; по 0,25 мМ каждого из дезоксинуклеозидтрифосфатов; 0,2 х EvaGreen (Biotium, USA); 0,1 мг/мл БСА; 1 мМ DTT; праймеры: прямой - 5'-gagatctactgttttcctttactt, обратный - 5'-ggccaaaaatttaatcagt (0,4 мкМ прямого праймера и 0,027 мкМ обратного праймера - для преимущественного синтеза смысловой нити ампликона; 0,4 мкМ обратного праймера и 0,027 мкМ прямого праймера - для преимущественного синтеза антисмысловой нити ампликона); по 0,25 мкМ двух зондов TaqMan (BRAF-15-sense - 5'-ROX-aggtgattttggtctagctacagtgaaatc-BHQ2 и BRAF-15-antisense 5'-Су5-acccactccatcgagatttcactgta-BHQ2), блокирующих синтез обеих нитей ампликона дикого типа; 0,63 ед. Hot-rescue Taq полимеразы; 5 мкл раствора ДНК в воде. Условия ПЦР: начальная денатурация - 5 мин при t = 95°C, после чего 80-100 циклов - 13 с при t = 95°C, 2 с при t = 57°C с регистрацией флуоресценции. Присутствующие в инкубационной среде оба зонда (смысловой и антисмысловой) функционируют в качестве блокирующих агентов, замедляющих синтез обеих нитей ампликона дикого типа.
г) Плавление дуплексов однонитевой ДНК с зондами TaqMan: продукты реакции денатурировали 1 мин при t = 95°С, прогревали 2 мин при t = 55°C, после чего повышали температуру до t = 85°C с шагом 0,4°С (выдержка 6 с); данные анализировали с помощью программы Bio-Rad CFX Manager (version 1.6). В процессе плавления ДНК участвует только один из двух присутствующих в инкубационной среде зондов TaqMan (комплементарный той нити ампликона, которая была преимущественно синтезирована в ПЦР). Обнаружение мутации в обеих нитях ампликона повышает надежность и чувствительность анализа.
Продолжительность ПЦР и плавления ДНК составляет 2 ч.
Способ иллюстрирован фиг. 1 (А, В, С), 2 (А, В, С), 3 (А и В), 4 (А и В).
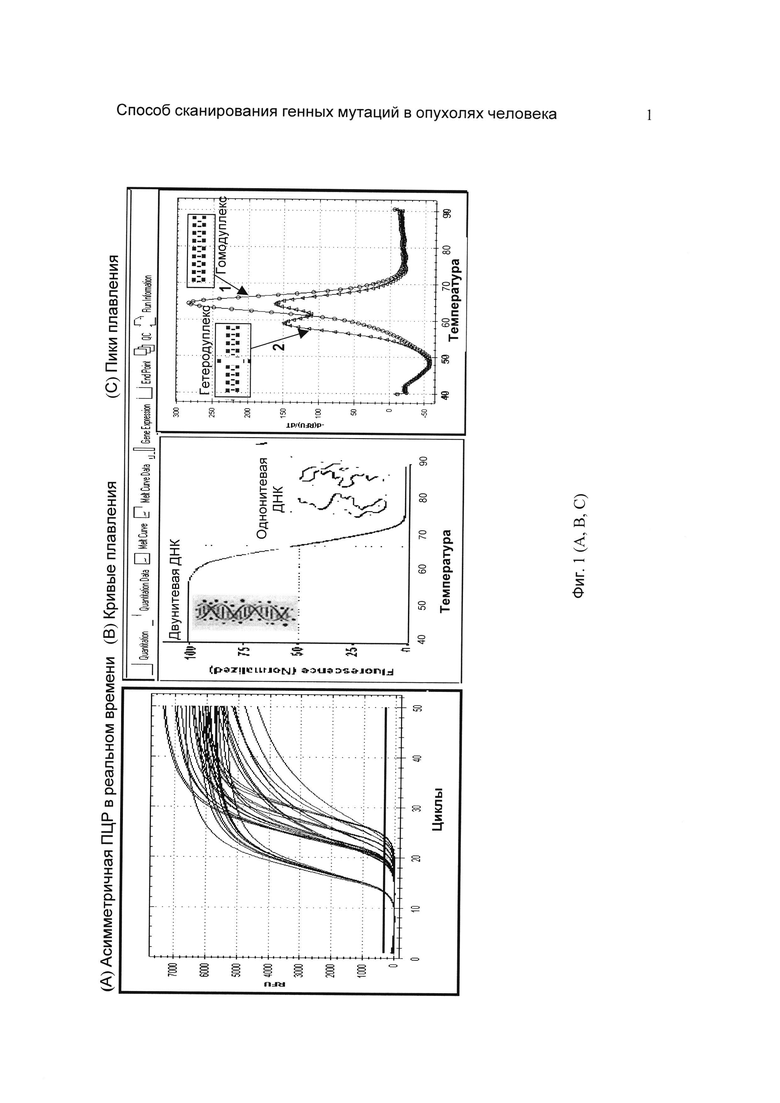
На фиг. 1 (А, В, С) представлены этапы выявления генных мутаций BRAF методом асимметричной ПЦР в реальном времени с последующим плавлением ДНК с зондами TaqMan в приборе Bio-Rad CFX96: на фиг. 1(A) - асимметричная ПЦР в реальном времени с зондами TaqMan (гидролиз зонда во время реакции сопровождается «разгоранием» флуоресценции, что позволяет в реальном времени судить о ходе реакции); на фиг. 1(B) - плавление ДНК приводит к фазовому переходу ДНК из двунитевой в однонитевую форму, что сопровождается падением флуоресценции; на фиг. 1(C) - пики плавления (отрицательные первые производные кривых плавления по температуре): симметричный пик, гомодуплекс (кривая 1) свидетельствует о присутствии только аллеля дикого типа, тогда как дополнительный пик слева, гетеродуплекс (кривая 2) свидетельствует о присутствии мутантного аллеля.
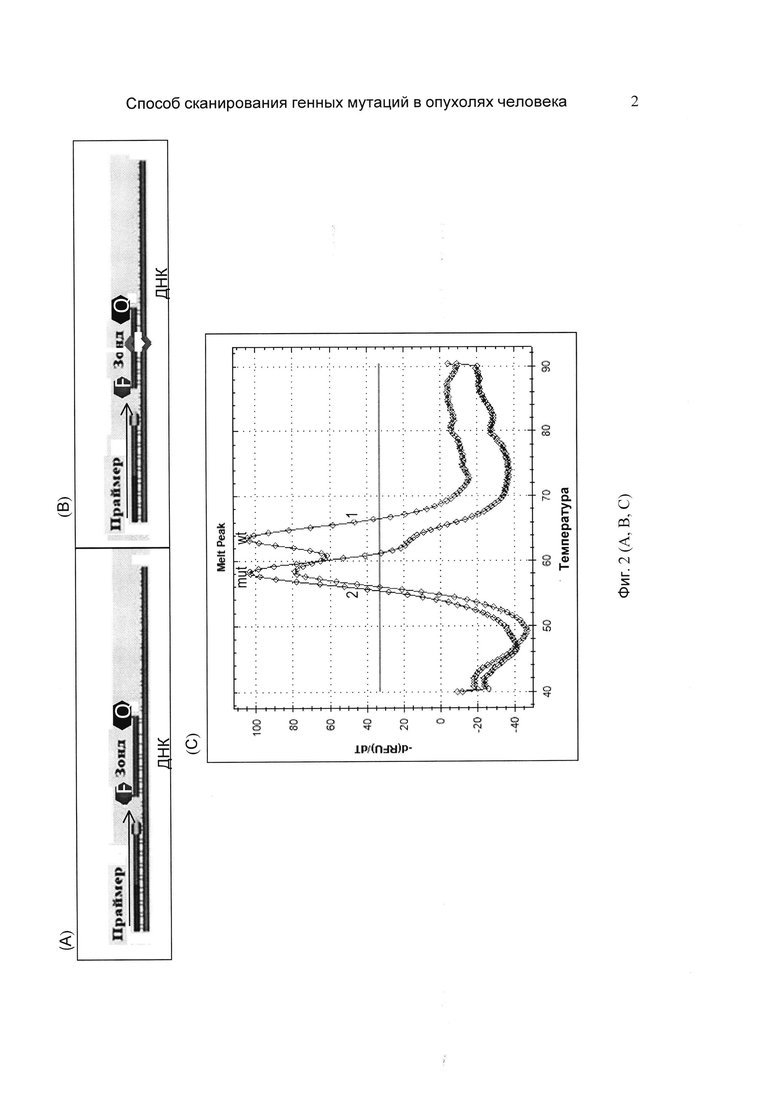
На фиг. 2 (А, В, С) представлена схема заявляемого способа преимущественной амплификации мутантных аллелей с использованием зондов TaqMan в качестве блокирующих агентов. Фермент Taq полимераза, удлиняющая праймер на матрице ДНК, наталкивается на сгибридизованный с матрицей зонд TaqMan и вынуждена устранить его со своего пути, используя 5'-3'-экзонуклеазную активность. На фиг. 2(A) представлена схема амплификации аллеля дикого типа, направление движения Taq полимеразы обозначено стрелкой; F - флуорофор на 5'-конце зонда, Q (quencher) - гаситель на 3'-конце зонда; зонд TaqMan полностью комплементарен последовательности ДНК дикого типа. На фиг. 2(В) - амплификация мутантного аллеля, при гибридизации зонда с мутантной ДНК возникает неспаренное основание, резко ослабляющее структуру комплекса и облегчающее движение Taq полимеразы. На фиг. 2(C) представлен сравнительный анализ образца ДНК рака легкого по способу прототипа (1) и по заявляемому способу (2). При применении заявляемого способа наблюдалось подавление амплификации аллеля дикого типа (wt) и возрастание доли мутантного аллеля (mut).
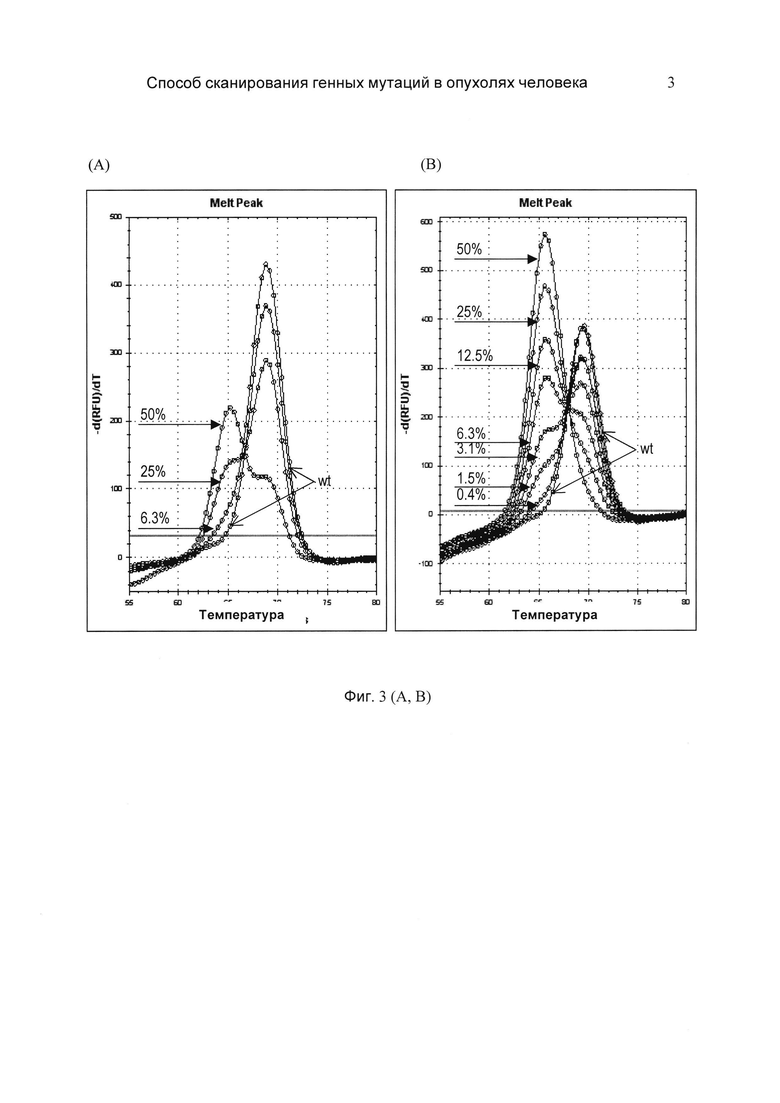
На фиг. 3 (А и В) представлено определение чувствительности (предела обнаружения мутантных аллелей BRAF) по способу прототипа и по заявляемому способу посредством серийного разведения ДНК клеток RKO (мутация V600E) в ДНК дикого типа. (А) - прототип; (В) - заявляемый способ. Дополнительные пики плавления, расположенные слева от основного (дикий тип, wt), обусловлены присутствием мутантных аллелей, так как температура плавления гетеродуплекса ниже температуры плавления гомодуплекса. Стрелки указывают процентное содержание мутантной ДНК в образце. Пределы обнаружения мутантного аллеля V600E по прототипу и заявляемому способу составляют 6,3% и 0,4%, соответственно. Показано, что чувствительность заявляемого способа в 15 раз превышает чувствительность способа прототипа.
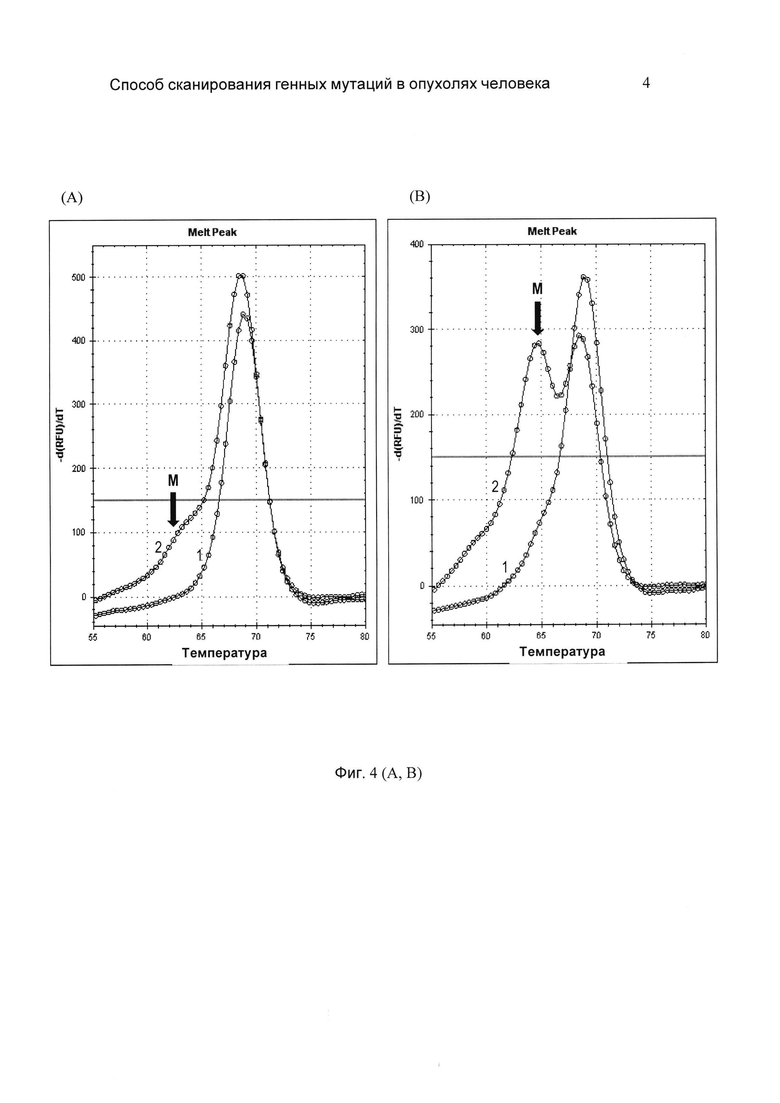
На фиг. 4 (А и В) представлены сравнительные результаты выявления мутаций по прототипу и заявляемому способу образцов ДНК рака легкого (А) и меланомы (В). Пики плавления: 1 - прототип; 2 - заявляемый способ. Стрелками обозначен идентифицирующий мутацию признак - асимметрия пика плавления слева, выявляемый только заявляемым способом.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ сканирования генных мутаций в опухолях человека | 2016 |
|
RU2650862C2 |
| СПОСОБ ДЕТЕКЦИИ ДЕЛЕЦИИ У КРЫС ЛИНИИ DAT | 2023 |
|
RU2811140C1 |
| Панель последовательностей олигонуклеотидов для определения мутации Q61R гена NRAS в опухолевых образованиях щитовидной железы | 2019 |
|
RU2688189C1 |
| Способ диагностики мукополисахаридоз-плюс синдрома | 2022 |
|
RU2798695C1 |
| Способ анализа соматических мутаций в генах BRAF, NRAS и KIT с использованием LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2017 |
|
RU2674338C1 |
| Способ анализа терминальных мутаций в генах BRCA1, BRCA2, ATM и PALB2 с использованием мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2020 |
|
RU2729360C1 |
| Способ анализа соматических мутаций в генах GNAQ и GNA11 с использованием LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2017 |
|
RU2674687C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ОПУХОЛИ ЛЕГКОГО К ТЕРАПИИ ИНГИБИТОРАМИ ТИРОЗИНКИНАЗ | 2012 |
|
RU2499994C1 |
| СПОСОБ АНАЛИЗА СОМАТИЧЕСКИХ МУТАЦИЙ В ГЕНЕ PI3K С ИСПОЛЬЗОВАНИЕМ LNA-БЛОКИРУЮЩЕЙ МУЛЬТИПЛЕКСНОЙ ПЦР И ПОСЛЕДУЮЩЕЙ ГИБРИДИЗАЦИЕЙ С ОЛИГОНУКЛЕОТИДНЫМ БИОЛОГИЧЕСКИМ МИКРОЧИПОМ (БИОЧИПОМ) | 2013 |
|
RU2549682C1 |
| Способ диагностики варианта SOPH c.5741G>A в гене NBAS | 2024 |
|
RU2819985C1 |
Изобретение относится к области медицины, а именно к генетике и онкологии, и касается способа выявления генных мутаций BRAF в опухолях человека. Осуществляют амплификацию исследуемого фрагмента гена BRAF посредством асимметричной ПЦР в реальном времени с двумя зондами TaqMan: BRAF-15-sense – 5'-ROX-aggtgattttggtctagctacagtgaaatc-BHQ2 и BRAF-15-antisense – 5'-Су5-acccactccatcgagatttcactgta-BHQ2 и праймерами: прямой – 5'-gagatctactgttttcctttactt, обратный – 5'-ggccaaaaatttaatcagt. Этап отжига праймеров и зондов составляет 2 с, число циклов амплификации - 80-100, концентрация Taq-полимеразы - 0,63 ед., температура отжига праймеров и зондов - 57°С. Далее осуществляют плавление дуплекса зонд-однонитевая ДНК и построение пиков плавления. Идентифицируют мутации по асимметрии пиков плавления. Способ обладает высокой чувствительностью, от 10 до 15 раз превышающей чувствительность прототипа, прост в исполнении, реализуется в течение 2 ч в одной пробирке с однократной регистрацией результатов, снижает риск перекрестного загрязнения образцов. 4 ил.
Способ выявления мутаций BRAF в опухолях человека, включающий амплификацию исследуемого фрагмента гена в подобранных условиях асимметричной ПЦР в реальном времени; плавление дуплекса зонд-однонитевая ДНК; построение пиков плавления; идентификацию мутаций по асимметрии пиков плавления, отличающийся тем, что в качестве блокирующих агентов используют два подобранных зонда TaqMan: BRAF-15-sense – 5'-ROX-aggtgattttggtctagctacagtgaaatc-BHQ2 и BRAF-15-antisense – 5'-Су5-acccactccatcgagatttcactgta-BHQ2 и праймеры: прямой – 5'-gagatctactgttttcctttactt, обратный – 5'-ggccaaaaatttaatcagt, этап отжига праймеров и зондов составляет 2 с, число циклов амплификации - 80-100, концентрация Taq-полимеразы - 0,63 ед., подобранная температура отжига праймеров и зондов составляет 57°С.
| BOTEZATU I | |||
| V | |||
| et al | |||
| "Optimization of melting analysis with Taqman probes for detection of KRAS, NRAS and BRAF mutations", Anal | |||
| Biochem | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| GUHA et al | |||
| Способ закалки паровозных и вагонных рессор | 1920 |
|
SU790A1 |
| КОНДРАТОВА В | |||
| Н | |||
| "Генодиагностика рака: оптимизация методов выявления мутантных аллелей в ДНК тканей и биологических жидкостей организма", Автореферат 24.07.2015, Москва, 25 с | |||
| HUANG et al | |||
| "Multiplex fluorescence melting curve analysis for mutation detection with dual-labeled, self-quenched probes", PLoS ONE, 2011, v.6, el9206. | |||
Авторы
Даты
2017-09-26—Публикация
2016-04-12—Подача